Антагоністи c5ar
Номер патенту: 112514
Опубліковано: 26.09.2016
Автори: Пауерс Джей, Цзен Ібінь, Лі Яндон, Танака Хіроко, Ян Цзюй, Фан Пінчень, Лелеті Манмохан Реді, рінман Кевін Лойд
Формула / Реферат
1. Сполука, яка має формулу
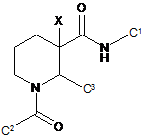 , (І)
, (І)
або її фармацевтично прийнятна сіль, гідрат або ротамер; де
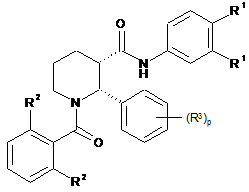
С1 являє собою феніл, необов'язково заміщений від 1 до 3 замісниками R1;
С2 являє собою феніл, необов'язково заміщений від 1 до 3 замісниками R2;
С3 являє собою феніл, необов'язково заміщений від 1 до 3 замісниками R3;
кожний R1 незалежно вибирають із групи, яка складається із галогену, -CN, -Rc, -CO2Ra, -CONRaRb, -C(O)Ra, -OC(O)NRaRb, -NRbC(O)Ra, -NRbC(O)2Rc, -NRa-C(O)NRaRb, -NRaC(O)NRaRb, -NRaRb, -ORa і -S(O)2NRaRb; де кожний Ra і Rb незалежно вибирають з-поміж водню, С1-8алкілу й С1-8галогеналкілу, або при приєднанні до того ж самого атома азоту вони можуть бути об'єднані з атомом азоту з утворенням п'яти- або шестичленного кільця, яке має від 0 до 2 додаткових гетероатомів у кільці, вибраних з-поміж N, O або S; кожний Rc незалежно вибирають із групи, яка складається із С1-8алкілу, С1-8галогеналкілу, С3-6циклоалкілу і піролідину, і де аліфатична й циклічна частини Ra, Rb і Rc є необов'язково додатково заміщеними від одного до трьох галогенами, гідроксигрупами, метилами, аміногрупами, С1-8алкіламіногрупами й діС1-8алкіламіногрупами; і необов'язково, коли два замісники R1 знаходяться на суміжних атомах, вони об'єднуються з утворенням конденсованого п'яти- або шестичленного карбоциклічного кільця;
кожний R2 незалежно вибирають із групи, яка складається із галогену, -CN, -Rf, -CO2Rd, -CONRdRe, -C(O)Rd, -OC(O)NRdRe, -NReC(O)Rd, -NReC(O)2Rf, -NRdC(O)NRdRe, -NRdRe, -ОRd і -S(O)2NRdRe; де кожний Rd і Re незалежно вибирають з-поміж водню, С1-8алкілу й С1-8галогеналкілу, або при приєднанні до того ж самого атома азоту вони можуть бути об'єднані з атомом азоту з утворенням п'яти- або шестичленного кільця, яке має від 0 до 2 додаткових гетероатомів в кільці, вибраних з-поміж N, O або S; кожний Rf незалежно вибирають із групи, яка складається із С1-8алкілу, С1-8галогеналкілу, С3-6циклоалкілу, морфолінілу, піролідинілу і піразолілу, і де аліфатична й циклічна частини Rd, Re і Rf є необов'язково додатково заміщеними від одного до трьох галогенами, гідроксигрупами, метилами, аміно, С1-8алкіламіно й діС1-8алкіламіногрупами;
кожний R3 незалежно вибирають із групи, яка складається із галогену, -CN, -Ri, -CO2Rg, -CONRgRh, -C(O)Rg, -OC(O)NRgRh, -NRhC(O)Rg, -NRhC(O)2Ri, -NRgC(O)NRgRh, -NRgRh, -ORg, -S(O)2NRgRh, -X4-Rj, -X4-NRgRh, -X4-CONRgRh, -X4-NRhC(O)Rg, -NHRj і -NHCH2Rj, де X4 є С1-4алкіленом; кожний Rg і Rh незалежно вибирають з-поміж водню, С1-8алкілу, С3-6циклоалкілу й С1-8галогеналкілу, або при приєднанні до того ж самого атома азоту вони можуть бути об'єднані з атомом азоту з утворенням п'яти- або шестичленного кільця, яке має від 0 до 2 додаткових гетероатомів у кільці, вибраних з-поміж N, O або S, і необов'язково заміщеного однією або двома оксогрупами; кожний Ri незалежно вибирають із групи, яка складається із С1-8алкілу, С1-8галогеналкілу, С3-6циклоалкілу, морфолінілу, піролідинілу, піперидинілу, тетрагідрофуранілу, піразолілу і піролілу; і кожний Rj вибирають із групи, яка складається із С3-6циклоалкілу, піролінілу, піперидинілу, морфолінілу, тетрагідрофуранілу й тетрагідропіранілу, і де аліфатична й циклічна частини Rg, Rh, Ri та Rj є необов'язково додатково заміщеними від одного до трьох галогенами, метилами, CF3, гідрокси, аміно, С1-8алкіламіно й діС1-8алкіламіногрупами; і
X є воднем або СН3.
2. Сполука за п. 1, у якій X є воднем.
3. Сполука за п. 1, яка має формулу:
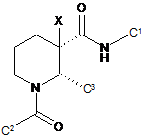 (Іа).
(Іа).
4. Сполука за п. 1, яка має формулу:
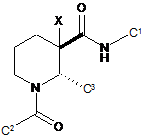 (Іb).
(Іb).
5. Сполука за п. 1, яка має формулу:
 .
.
6. Сполука за п. 1, яка має формулу:
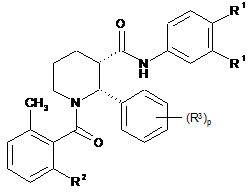 .
.
7. Сполука за п. 1, яка має формулу:
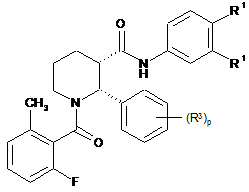 .
.
8. Сполука за п. 1, яка має формулу:
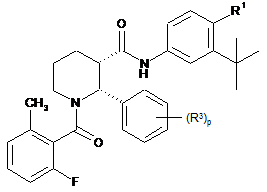 .
.
9. Сполука за п. 1, яка має формулу:
 .
.
10. Сполука за п. 1, яка має формулу:
 ,
,
де R3 вибирають із групи, яка складається із -NRgRh, -NHRj і -NHCH2Rj.
11. Сполука за п. 1, яка має формулу:
 ,
,
де R3 вибирають із групи, яка складається із -X4-NRgRh, -X4-Rj і -X4-NRhCORg.
12. Сполука за п. 1, де кожний R1 незалежно вибирають із групи, яка складається із галогену, -CN, -Rc, -NRaRb і -ORa, і де кожний Ra і Rb незалежно вибирають з-поміж водню, С1-8алкілу й С1-8галогеналкілу, або при приєднанні до того ж самого атома азоту вони можуть бути об'єднані з атомом азоту з утворенням піролідинового кільця; кожний Rc незалежно вибирають із групи, яка складається із С1-8алкілу, С1-8галогеналкілу й С3-6циклоалкілу, і де аліфатична й циклічна частини Ra, Rb і Rc необов'язково є додатково заміщеними від однієї до трьох гідроксигрупами, метилами, аміногрупами, С1-8алкіламіногрупами й діС1-8алкіламіногрупами; і необов'язково, коли два замісники R1 знаходяться на суміжних атомах, вони об’єднуються з утворенням конденсованого п'яти- або шестичленного карбоциклічного кільця.
13. Сполука за п. 1, де кожний R2 незалежно вибирають із групи, яка складається із галогену, -Rf i -ORd; де кожний Rd незалежно вибирають з-поміж водню, С1-8алкілу й С1-8галогеналкілу; кожний Rf незалежно вибирають із групи, яка складається із С1-8алкілу, С1-8галогеналкілу, С3-6циклоалкілу, морфолінілу, піролідинілу і піразолілу, і де аліфатична й циклічна частини Rd і Rf необов'язково є додатково заміщеними від одного до трьох галогенами, гідроксигрупами, метилами, аміно, С1-8алкіламіно й діС1-8алкіламіногрупами.
14. Сполука за п. 1, де кожний R3 незалежно вибирають із групи, яка складається із галогену, -Rі, -CO2Rg; -CONRgRh, -NRhC(O)Rg; -NRhC(O)2Ri, -NRgRh, -ORg; -X4-Rj, -X4-NRgRh, -X4-CONRgRh, -X4-NRhC(O)Rg; -NHRj і -NHCH2R3, де X4 є С1-3алкіленом; кожний Rg і Rh незалежно вибирають з-поміж водню, С1-8алкілу, С3-8циклоалкілу й С1-8галогеналкілу, або при приєднанні до того ж самого атома азоту вони можуть бути об'єднані з атомом азоту з утворенням п'яти- або шестичленного кільця, яке має від 0 до 1 додаткового гетероатома у кільці, вибраного з-поміж N, О або S, і необов'язково заміщеного однією або двома оксогрупами; кожний Ri незалежно вибирають із групи, що складається з С1-8алкілу, С1-8галогеналкілу, С3-6циклоалкілу, морфолінілу, піролідинілу, піперидинілу, тетрагідрофуранілу, піразолілу і піролілу; і кожний Rj вибирають із групи, яка складається із С3-6циклоалкілу, піролінілу, піперидинілу, морфолінілу, тетрагідрофуранілу й тетрагідропіранілу, і де аліфатична й циклічна частини Rg, Rh, R1 і Rj є необов'язково додатково заміщеними від одного до трьох галогенами, метилами, CF3, гідрокси, аміно, С1-8алкіламіно й діС1-8алкіламіногрупами.
15. Сполука за п. 13, де С2 вибирають із групи, яка складається із:
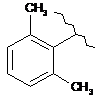 ,
, 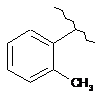 ,
, 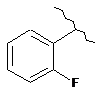 ,
,  ,
, 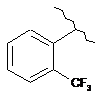 ,
,
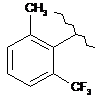 ,
,  ,
,  ,
, 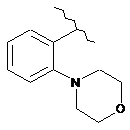 ,
,  ,
,
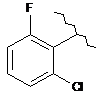 ,
,  ,
,  ,
,  ,
, 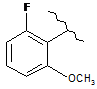 ,
,
 ,
,  ,
, 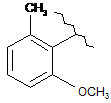 ,
, 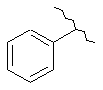 i
i  .
.
16. Сполука за п. 12, де С1 вибирають із групи, яка складається із:
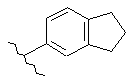 ,
, 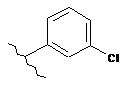 ,
,  ,
, 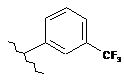 ,
, 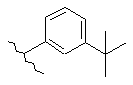 ,
,
 ,
, 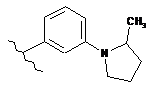 ,
, 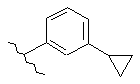 ,
,  ,
,
 ,
, 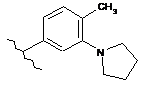 ,
,  ,
, 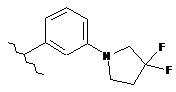 ,
,
 ,
,  ,
,  ,
, 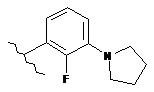 ,
,
 ,
, 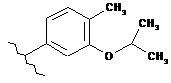 ,
, 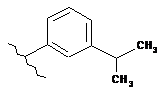 ,
,  ,
,
 ,
, 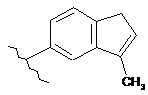 i
i 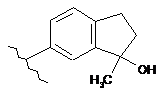 .
.
17. Сполука за п. 1, де С3 вибирають із групи, яка складається із:
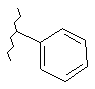 ,
,  ,
, 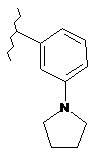 ,
, 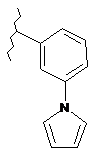 ,
,
 ,
,  ,
, 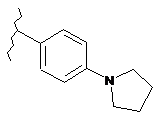 ,
,  ,
,
 ,
,  ,
, 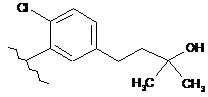 ,
,
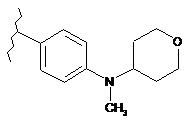 ,
, 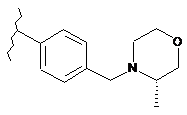 ,
,  ,
,
 ,
,  i
i  .
.
18. Сполука за п. 1, де С3 вибирають із групи, яка складається із:
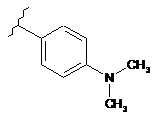 ,
,  ,
, 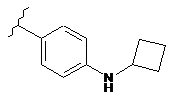 ,
,
 ,
, 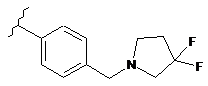 ,
,  ,
,
 ,
,  ,
,  ,
,
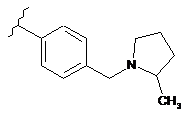 ,
,  ,
, 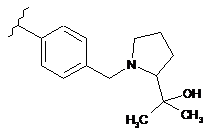 ,
,
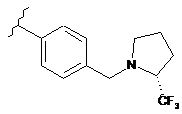 ,
, 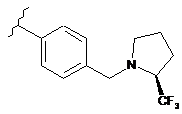 ,
,  ,
,
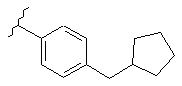 ,
, 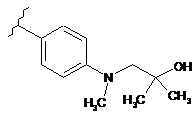 i
i  .
.
19. Сполука за п. 1, де вказану сполуку вибирають з групи, яка складається із:
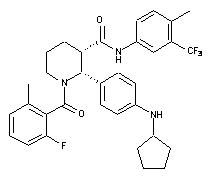 ,
, 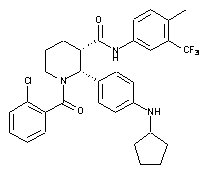 та
та 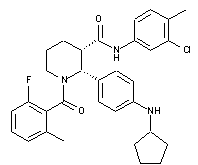 ,
,
або її фармацевтично прийнятна сіль.
20. Сполука за п. 1, де вказана сполука являє собою
 ,
,
або її фармацевтично прийнятна сіль.
21. Сполука за п. 1, де вказана сполука являє собою
 ,
,
або її фармацевтично прийнятна сіль.
22. Сполука за п. 1, де вказана сполука являє собою
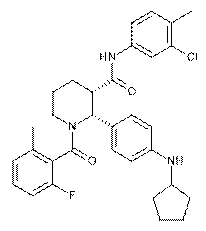 ,
,
або її фармацевтично прийнятна сіль.
23. Фармацевтична композиція, що має інгібіторну активність відносно С5аR, яка містить фармацевтично прийнятний носій і сполуку за п. 1.
24. Спосіб лікування ссавця, який страждає на або є сприйнятливим до хвороби або розладу, при яких відбувається патологічна активація С5а, за яким ссавцеві вводять ефективну кількість сполуки за п. 1.
25. Спосіб інгібування клітинного хемотаксису, опосередкованого С5а-рецептором, який передбачає контактування лейкоцитів ссавця з певною кількістю сполуки, яка модулює С5а-рецептор, за п. 1.
26. Спосіб за п. 24, який відрізняється тим, що хвороба або розлад є такими хворобою або розладом як запалення.
27. Спосіб за п. 26, який відрізняється тим, що хворобу або розлад вибирають із групи, яка складається із нейтропенії, сепсису, септичного шоку, хвороби Альцгеймера, розсіяного склерозу, інсульту, запальної хвороби кишечнику, хронічного легеневого обструктивного захворювання, запалення, пов'язаного з важким опіком, ушкодження легенів, остеоартриту, атопічного дерматиту, хронічної кропивниці, ішемічно-реперфузійного ушкодження, синдрому гострої дихальної недостатності в дорослих, синдрому системної запальної реакції, поліорганної недостатності, відторгнення тканинного трансплантата й гіпергострого відторгнення трансплантованих органів.
28. Спосіб за п. 27, який відрізняється тим, що хвороба або розлад є серцево-судинним або церебрально-васкулярним розладом.
29. Спосіб за п. 28, який відрізняється тим, що хворобу або розлад вибирають із групи, яка складається із інфаркту міокарда, тромбозу коронарних артерій, оклюзії судини, післяопераційної судинної реоклюзії, атеросклерозу, травматичного ушкодження центральної нервової системи й ішемічної хвороби серця.
30. Спосіб за п. 24, який відрізняється тим, що хвороба або розлад є аутоімунним розладом.
31. Спосіб за п. 30, який відрізняється тим, що хворобу або розлад вибирають із групи, яка складається із ревматоїдного артриту, системного червоного вовчака, синдрому Гійєна-Баре, панкреатиту, вовчакового нефриту, вовчакового гломерулонефриту, псоріазу, хвороби Крона, васкуліту, спастичного коліту, дерматоміозиту, розсіяного склерозу, бронхіальної астми, пухирчатки, пемфігоїду, склеродерми, важкої псевдопаралітичної міастенії, аутоімунного гемолітичного й тромбоцитопенічного стану, синдрому Гудпасчера, імуноваскуліту, відторгнення тканинного трансплантата, гіпергострого відторгнення трансплантованих органів.
32. Спосіб за п. 24, який відрізняється тим, що хвороба або розлад є патологічним ускладненням, пов'язаним із групою, що складається з інсулінозалежного цукрового діабету, вовчакової нефропатії, нефриту Хеймана, мембранозного нефриту, гломерулонефриту, відповідної контактної чутливості й запалення в результаті контакту крові зі штучними поверхнями.
Текст
Реферат: Пропонуються сполуки, які є модуляторами рецептора С5а. Сполуки є заміщеними піперидинами й використовуються у фармацевтичних композиціях, способах лікування хвороб і розладів, при яких відбувається патологічна активація рецепторів С5а. UA 112514 C2 (12) UA 112514 C2 UA 112514 C2 5 10 15 20 25 30 35 40 45 50 55 60 Попередній рівень техніки Система комплементу відіграє центральну роль у виведенні (кліренсі) імунних комплексів і в імунних відповідях на інфекційні агенти, чужорідні антигени, клітини, інфіковані вірусом, і пухлинні клітини. Неадекватна або надлишкова активація системи комплементу може призводити до шкідливих і навіть потенційно небезпечних для життя наслідків внаслідок важкого запалення та руйнування тканини, яке в результаті цього відбувається. Ці наслідки клінічно проявляються при різних порушеннях, включаючи септичний шок, міокардіальне, а також кишкове ішемічно-реперфузійне ушкодження, відторгнення трансплантата, недостатність органів; нефрит; патологічне запалення й аутоімунні хвороби. Система комплементу складається із групи білків, які в нормі присутні в сироватці в неактивному стані. Активація системи комплементу включає в основному три різні шляхи, тобто класичний, альтернативний і лектиновий шлях (V. M. Holers, In Clinical Immunology: Principles і Practice, ed. R. R. Rich, Mosby Press; 1996, 363-391): 1) Класичний шлях представлено кальцій/магній-залежним каскадом, який у нормі активується при утворенні комплексів антигенантитіло. Також він може активуватися антитіло-незалежним чином при зв'язуванні Cреактивного білка, пов'язаного з лігандом, і за допомогою багатьох патогенів, включаючи грамнегативні бактерії. 2) Альтернативним шляхом є магній-залежний каскад, який активується при депонуванні й активації C3 на певних чутливих поверхнях (наприклад, полісахариди клітинної стінки дріжджів і бактерій, і деякі біополімерні матеріали). 3) Лектиновий шлях передбачає початкове зв'язування лектину, який зв'язує манозу, і наступну активацію C2 і C4, які є спільними для класичного шляху (Matsushita, M. et al., J. Exp. Med. 176: 1497-1502 (1992); Suankratay, C. et al., J. Immunol. 160: 3006-3013 (1998)). Активація шляху комплементу породжує біологічно активні фрагменти білків комплементу, наприклад, C3a, C4a і C5a анафілатоксини й C5b-9 атакуючий мембрану комплекс (MAC), які опосередковують запальні відповіді шляхом впливу на хемотаксис лейкоцитів; активацію макрофагів, нейтрофілів, тромбоцитів, гладких клітин і ендотеліальних клітин; і шляхом збільшення проникності судин, цитолізу й ушкодження тканини. Комплемент C5a є одним з найбільш сильних прозапальних медіаторів системи комплементу. (Анафілактичний пептид C5a є в 100 раз більш сильним, на молярній основі, при викликанні запальних відповідей, ніж C3a.) C5a є активованою формою C5 (190 kD, молекулярна маса). C5a є присутнім у сироватці людини в кількості приблизно 80 мкг/мл (Kohler, P. F. et al., J. Immunol. 99: 1211-1216 (1967)). Він складається із двох поліпептидних ланцюгів, α і β, з молекулярною масою приблизно 115 kD і 75 kD, відповідно (Tack, B. F. et al., Biochemistry 18: 1490-1497 (1979)). Біосинтезований як одноланцюгова промолекула C5 ферментативно розщеплюється до дволанцюгової структури під час процесингу й секреції. Після розщеплення два ланцюги утримуються разом за допомогою, щонайменше, одного дисульфідного зв'язку, а також нековалентних взаємодій (Ooi, Y. M. et al., J. Immunol. 124: 2494-2498(1980)). C5 розщеплюється на фрагменти C5a і C5b під час активації шляхів комплементу. Конвертазні ферменти, які відповідають за активацію C5, є комплексами з багатьох субодиниць C4b, C2a і C3b для класичного шляху й з (C3b)2, Bb і P для альтернативного шляху (Goldlust, M. B. et al., J. Immunol. 113: 998-1007 (1974); Schreiber, R. D. et al, Proc. Natl. Acad. Sci. 75: 39483952 (1978)). C5 активується при розщепленні в положенні 74-75 (Arg-Leu) в α-ланцюгові. Після активації з аміно-кінцевої частини α-ланцюга вивільняється пептид C5a, який складається з 74 амінокислот, вагою 11,2 kD. І C5a і C3a є ефективними стимуляторами нейтрофілів і моноцитів (Schindler, R. et al., Blood 76: 1631-1638 (1990); Haeffner-Cavaillon, N. et al., J. Immunol. 138: 794700 (1987); Cavaillon, J. M. et al., Eur. J. Immunol. 20: 253-257 (1990)). На додачу до його анафілотоксичних властивостей C5a викликає хемотаксичну міграцію нейтрофілів (Ward, P. A. et al., J. Immunol. 102: 93-99 (1969)), еозинофілів (Kay, A. B. et al., Immunol. 24: 969-976 (1973)), базофілів (Lett-Brown, M. A. et al., J. Immunol. 117: 246-252 1976)) і моноцитів (Snyderman, R. et al., Proc. Soc. Exp. Biol. Med. 138: 387-390 1971)). І C5a і C5b-9 активують ендотеліальні клітини до експресії молекул адгезії, необхідних для секвестрації активованих лейкоцитів, які опосередковують запалення й ушкодження тканин (Foreman, K. E. et al., J. Clin. Invest. 94: 1147-1155 (1994); Foreman, K. E. et al., Inflammation 20: 1-9 (1996); Rollins, S. A. et al., Transplantation 69: 1959-1967 (2000)). C5a також опосередковує запальні реакції, викликаючи скорочення гладенької мускулатури, збільшуючи проникність судин, викликаючи дегрануляцію базофілів і гладких клітин і викликаючи вивільнення лізосомальних протеаз і окисних вільних радикалів (Gerard, C. et al., Ann. Rev. Immunol. 12: 775-808 (1994)). Більше того, C5a модулює експресію гена гострої фази в печінці й збільшує загальну імунну відповідь шляхом збільшення вироблення TNF-α, IL-1-β, IL-6, IL-8, простагландинів і лейкотриєнів (Lambris, J. D. et al., In: The Human Complement System in Health і Disease, Volanakis, J. E. ed., 1 UA 112514 C2 5 10 15 20 25 30 35 40 45 50 55 60 Marcel Dekker, New York, pp. 83-118). Уважаються, що анафілактичні й хемотаксичні ефекти C5a опосередковують через його взаємодію з рецептором C5a. Людський рецептор C5a (C5aR) є мембрано-зв'язаним рецептором, сполученим з G-білком, вагою 52 kD, який експресується на нейтрофілах, моноцитах, базофілах, еозинофілах, гепатоцитах, клітинах гладеньких м'язів легенів, ендотеліальних клітинах і гломерулярними тканинами нирок (Van-Epps, D. E. et al., J. Immunol. 132: 2862-2867 (1984); Haviland, D. L. et al., J. Immunol. 154:1861-1869 (1995); Wetsel, R. A., Immunol. Leff. 44: 183-187 (1995); Buchner, R. R. et al., J. Immunol. 155: 308-315 (1995); Chenoweth, D. E. et al., Proc. Natl. Acad. Sci. 75: 3943-3947 (1978); Zwirner, J. et al., Mol. Immunol. 36:877-884 (1999)).Ліганд-з′єднувальна ділянка C5aR є комплексом і складається, щонайменше, із двох фізично окремих доменів зв'язування. Один зв'язує C5a аміно-кінець (амінокислоти 1-20) і дисульфід-зв'язаний центр (амінокислоти 21-61), тоді як другий зв'язує C5a карбокси-кінцевий залишок (амінокислоти 62-74) (Wetsel, R. A., Curr. Opin. Immunol. 7: 48-53 (1995)). C5a відіграє важливу роль у запаленні й ушкодженні тканин. При штучному кровообігу й гемодіалізі C5a утворюється в результаті активації альтернативного шляху комплементу, коли кров людини контактує зі штучною поверхнею апарата кровообігу або установки для ниркового діалізу (Howard, R. J. et al., Arch. Surg. 123: 1496-1501 (1988); Kirklin, J. K. et al., J. Cardiovasc. Surg. 86: 845-857 (1983); Craddock, P. R. et al., N. Engl. J. Med. 296: 769-774 (1977)). C5a викликає підвищену проникність капілярів і набряк, бронхоконстрикцію (звуження просвіту бронхів), легеневу вазоконстрикцію (звуження судин), активацію лейкоцитів і тромбоцитів і інфільтрацію в тканини, зокрема в легені (Czermak, B. J. et al., J. Leukoc. Biol. 64: 40-48 (1998)). Показано, що введення анти-C5a моноклональних антитіл зменшує серцево-легеневий кровообіг і спричинену кардіоплегією коронарну ендотеліальну дисфункцію (Tofukuji, M. et al., J. Thorac. Cardiovasc. Surg. 116: 1060-1068 (1998)). C5a також залучений у синдром гострої дихальної недостатності (ARDS), хронічну обструктивну хворобу легенів (COPD) і поліорганну недостатність (MOF) (Hack, C. E. et al., Am. J. Med. 1989: 86: 20-26; Hammerschmidt DE et al. Lancet 1980; 1: 947-949; Heideman M. et al. J. Trauma 1984; 4: 1038-1043; Marc, MM, et al., Am. J. Respir. Cell і Mol. Biol., 2004: 31: 216-219). C5a збільшує вироблення моноцитами двох важливих прозапальних цитокінів TNF-α і IL-1. Також було показано, що C5a відіграє важливу роль при розвитку ушкодження тканин і, зокрема, ушкодження легенів, на моделі септичного шоку у тварин (Smedegard G et al. Am. J. Pathol. 1989; 135: 489-497; Markus, S., et al., FASEB Journal (2001), 15: 568-570). На моделі сепсису з використанням пацюків, свиней і приматів, крім людини, анти-C5a антитіла, уведені тваринам до обробки ендотоксином або E. Coli, приводили до меншого ушкодження тканин, а також зниженого вироблення IL-6 (Smedegard, G. et al., Am. J. Pathol. 135: 489-497 (1989); Hopken, U. et al., Eur. J. Immunol. 26: 1103-1109 (1996); Stevens, J. H. et al., J. Clin. Invest. 77: 1812-1816 (1986)). Що ще більш важливо, було показано, що блокада C5a за допомогою антиC5a поліклональних антитіл значно поліпшує рівні виживання на моделі сепсису з перев'язкою/пункцією сліпої кишки в пацюків (Czermak, B.J. et al., Nat. Med. 5: 788-792 (1999)). Ця модель пов'язана з багатьма аспектами клінічного прояву сепсису в людей (Parker, S.J. et al., Br. J. Surg. 88: 22-30 (2001)). Було показано, що при такій моделі сепсису анти-C5a антитіла інгібують апоптоз тимоцитів (Guo, R.F. et al., J. Clin. Invest. 106: 1271-1280 (2000)) і запобігають поліорганній недостатності (MOF) (Huber-Lang, M. et al., J. Immunol. 166: 1193-1199 (2001)). Також анти-C5a антитіла були протективними на моделі ушкодження легенів фактором отрути кобри в пацюків і при ушкодженні легенів, спричиненому імунним комплексом (Mulligan, M. S. et al. J. Clin. Invest. 98: 503-512 (1996)). Значення C5a при ушкодженні легенів, викликаному імунним комплексом, пізніше було підтверджено в мишей (Bozic, C. R. et al., Science 26: 11031109 (1996)). Виявлене, що C5a є головним медіатором при міокардіальному ішемічно-реперфузійному ушкодженні. Виснаження комплементу зменшувало розмір інфаркту міокарда в мишей (Weisman, H. F. et al., Science 249: 146-151 (1990)), а обробка анти-C5a антитілами зменшувало ушкодження на щурячій моделі ішемії-реперфузії на задній кінцівці (Bless, N. M. et al., Am. J. Physiol. 276: L57-L63 (1999)). Реперфузійне ушкодження під час інфаркту міокарда також помітно зменшувалося у свиней, які були повторно оброблені моноклональним анти-C5a Igg (Amsterdam, E. A. et al., Am. J. Physiol. 268:H448-H457 (1995)). Рекомбінантний людський антагоніст C5aR зменшує розмір інфаркту на свинячій моделі хірургічної реваскуляризації (Riley, R. D. et al., J. Thorac. Cardiovasc. Surg. 120: 350-358 (2000)). C5 a-керовані нейтрофіли також сприяють багатьом бульозним хворобам (наприклад, бульозний пемфігоїд (пузирчатка), вульгарна пузирчатка й листоподібна пузирчатка). Існують хронічні й повторювані розлади, які клінічно характеризуються стерильними пухирями, які 2 UA 112514 C2 5 10 15 20 25 30 35 40 45 50 55 60 з'являються в субепідермальній області шкіри й слизової. У той час як, уважаються, що в основі відділення епідермальних базальних кератиноцитів від залягаючої нижче базальної мембрани лежать аутоантитіла до кератиноцитів, розташованих у шкірних базальних мембранах, пухирі також характеризуються нагромадженням нейтрофілів і у верхніх шарах шкіри й у порожнинах пухирів. В експериментальних моделях зменшення нейтрофілів або відсутність комплементу (загального або C 5-селективного) може інгібувати утворення субепідермальних пухирів, навіть при наявності високих титрів аутоантитіл. Рівні комплементу є підвищеними в пацієнтів з ревматоїдним артритом (Jose, P. J. et al., Ann. Rheum. Dis. 49: 747-752 (1990); Grant, E.P., et al., J. of Exp. Med., 196(11): 1461-1471, (2002)), вовчанковим нефритом (Bao, L., et al., Eur. J. of Immunol., 35(8), 2496-2506, (2005)) і системним червоним вовчаком (SLE) (Porcel, J. M. et al., Clin. Immunol. Immunopathol. 74: 283288 (1995)). Рівні C5a корелюють із тяжкістю хворобливого стану. Колаген-індукований артрит у мишей і пацюків є подібним до ревматоїдним артритом у людини. Миші, дефіцитні за рецептором C5a, демонстрували повний захист від артриту, спричиненого ін'єкцією моноклональних анти-колаген антитіл (Banda, N.K., et al., J. of Immunol., 2003, 171: 2109-2115). Отже, інгібування C5a і/або C5a рецептора (C5aR) може бути корисним при лікуванні цих хронічних хвороб. Уважаються, що система комплементу є активованою в пацієнтів із запальним захворюванням кишечника (IBD), і припускають, що вона відіграє роль у патогенезі хвороби. Активовані продукти комплементу були виявлені на поверхні епітеліальних клітин з боку просвіту, а також у м'язовій пластинці слизової оболонки й у підслизистих кровоносних судинах у пацієнтів з IBD (Woodruff, T.M., et al., J of Immunol., 2003, 171: 5514-5520). C5aR-експресія є активованою на реактивних астроцитах, у мікроглії й ендотеліальних клітинах у збудженій центральній нервовій системі (Gasque, P. et al., Am. J. Pathol. 150: 31-41 (1997)). C5a може бути залучений у нейродегенеративні хвороби, такі як хвороба Альцгеймера (Mukherjee, P. et al., J. Neuroimmunol. 105: 124-130 (2000); O'Barr, S. et al., J. Neuroimmunol. (2000) 105: 87-94; Farkas, I., et al. J. Immunol. (2003) 170:5764-5771), хвороба Паркінсона, хвороба Піка й передавані губчасті енцефалопатії. Активація нейронного C5aR може індукувати апоптоз (Farkas I et al. J. Physiol. 1998; 507: 679-687). Отже, інгібування C5a і/або C5aR також повинне бути корисним при лікуванні нейродегенеративних хвороб. Існує певний доказ того, що вироблення C5a погіршує запалення, пов'язане з атопічним дерматитом (Neuber, K., et al., Immunology 73:83-87, (1991)) і хронічною кропивницею (Kaplan, A.P., J. Allergy Clin. Immunol. 114; 465-474, (2004). Тепер відомо, що псоріаз є хворобою, опосередкованою T-клітинами (Gottlieb, E. L. et al., Nat. Med. 1: 442-447 (1995)). Однак нейтрофіли й гладкі клітини також можуть бути пов'язані з патогенезом цієї хвороби (Terui, T. et al., Exp. Dermatol. 9: 1-10; 2000); Werfel, T. et al., Arch. Dermatol. Res. 289: 83-86 (1997)). Нагромадження нейтрофілів під роговим шаром спостерігали в сильно збуджених ділянках псоріазних бляшок, а екстракти із псоріазних вогнищ (лусочок) містять сильно підвищені рівні C5a і проявляють сильну хемотаксичну активність у відношенні до нейтрофілів, ефект, який може бути інгібованим за допомогою додавання C5a антитіл. Tклітини й нейтрофіли є C5a-хемозалученими (Nataf, S. et al., J. Immunol. 162: 4018-4023 (1999); Tsuji, R. F. et al., J. Immunol. 165: 1588-1598 (2000); Cavaillon, J. M. et al., Eur. J. Immunol. 20: 253257 (1990)). Крім того, була продемонстрована експресія C5aR у плазмоцитоїдних дендритних клітинах (pDC), виділених з вогнищ шкірного червоного вовчака, і було показано, що ці клітини проявляють хемотаксичну поведінку стосовно C5a, що вказує на те, що блокада C5aR на pDC може бути ефективною при зниженні інфільтрації pDC у збуджену шкіру й при системному червоному вовчаку (SLE) і при псоріазі. Отже, C5a може бути важливою терапевтичною мішенню для лікування псоріазу. Імунні комплекси (IC), які містять імуноглобулін G, вносять вклад у патофізіологію в цілому ряді аутоімунних хвороб, таких як системний червоний вовчак, ревматоїдний артрит, хвороба Серджена, синдром Гудпасчера й гіперчутливий пневмоніт (Madaio, M. P., Semin. Nephrol. 19: 48-56 (1999); Korganow, A. S. et al., Immunity 10: 451-459 (1999); Bolten, W. K., Kidney Int. 50: 1754-1760 (1996); Ando, M. et al., Curr. Opin. Pulm. Med. 3: 391-399 (1997)). Ці хвороби є досить різнорідними й в основному стосуються одного або більше з поміж наступних органів: шкіри, кровоносних судин, суглобів, нирок, серця, легень, нервової системи й печінки (включаючи цироз і фіброз печінки). Класичною моделлю на тваринах запальної відповіді при цих IC хворобах є феномен Артюса, який відрізняється інфільтрацією поліморфно-ядерних клітин, крововиливом і ексудацією плазми (надходження через пори) (Arthus, M., C.R. Soc. Biol. 55: 817824 (1903)). Недавні дослідження показують, що дефіцитні за C5aR миші є захищеними від ушкодження тканин, викликаного IC (Kohl, J. et al., Mol. Immunol. 36: 893-903 (1999); Baumann, U. 3 UA 112514 C2 5 10 15 20 25 30 35 40 45 50 55 et al., J. Immunol. 164: 1065-1070 (2000)). Ці результати відповідати спостереженням про те, що невеликий пептидний анти-C5aR антагоніст інгібує запальну відповідь, спричинену відкладанням IC (Strachan, A. J. et al., J. Immunol. 164: 6560-6565 (2000)). Разом з його рецептором C5a відіграє важливу роль у патогенезі IC хвороб. Інгібітори C5a і C5aR можуть бути корисними при лікуванні цих хвороб. Опис «спорідненого» рівня техніки Тільки недавно непептидні антагоністи рецептора C5a були описані в літературі (наприклад, Sumichika, H., et al., J. Biol. Chem. (2002), 277, 49403-49407). Непептидний антагоніст рецептора C5a був описаний як такий, що є ефективним для лікування ендотоксичного шоку в пацюків (Stracham, A.J., et al., J. of Immunol. (2000), 164(12): 6560-6565); і для лікування IBD на щурячих моделях (Woodruff, T.M., et al., J of Immunol., 2003, 171: 5514-5520). Непептидні модулятори рецептора C5a також описані в патентній літературі Neurogen Corporation, (наприклад, WO2004/043925, WO2004/018460, WO2005/007087, WO03/082826, WO03/08828, WO02/49993, WO03/084524); Dompe S.P.A. (WO02/029187); і Університету Квінсленда (WO2004/100975). У літературі існує значна кількість експериментальних доказів, які стосуються підвищених рівнів C5a при деяких хворобах і розладах, зокрема при аутоімунних і запальних хворобах і розладах. Таким чином, у даній галузі зберігається необхідність у нових невеликих органічних молекулярних модуляторах, наприклад, агоністах, переважно антагоністах, часткових агоністах рецептора C5a (C5aR), які придатні для інгібування патогенних явищ, наприклад, хемотаксису, пов'язаного з підвищеними рівнями активності анафілотоксина. Даний винахід задовольняє цю й інші потреби. Сутність винаходу В одному аспекті даний винахід пропонує сполуки, які мають формулу: O X C1 N H N C3 C2 O (I); та їх фармацевтично прийнятні солі, гідрати й ротамери; де 1 C обирають із групи, яка складається із арилу й гетероарилу, де гетероарильна група має 1-3 гетероатоми у кільці, обрані з поміж N, O і S; і де зазначені арильна й гетероарильна групи є 1 необов'язково заміщеними від 1 до 3 замісниками R ; 2 C обирають із групи, яка складається із арилу й гетероарилу, де гетероарильна група має 1-3 гетероатоми у кільці, обрані з поміж N, O і S; і де зазначені арильна й гетероарильна групи є 2 необов'язково заміщеними від 1 до 3 замісниками R ; 3 C обирають із групи, яка складається із C1-8 алкілу, C3-8 циклоалкілу, C3-8 циклоалкіл-C1-4 алкілу, арилу, арил-C1-4 алкілу, гетероарилу, гетероарил-C1-4 алкілу, гетероциклоалкілу або гетероциклоалкіл-C1-4 алкілу, де гетероциклоалкільна група або частина має 1-3 гетероатомів, обраних з поміж N, O і S, і де гетероарильна група має 1-3 гетероатоми у кільці, обраних з поміж 3 3 N, O і S, причому кожний C є необов'язково заміщеним 1-3 замісниками R ; 1 c a кожний R незалежно обирають із групи, яка складається із галогену, -CN, -R , -CO2R , a b a a b b a b c a a b a a b CONR R , -C(O)R , -OC(O)NR R , -NR C(O)R , -NR C(O)2R , -NR -C(O)NR R , -NR C(O)NR R , a b a a b a b NR R , -OR і -S(O)2NR R ; де кожний R і R незалежно вибирають з поміж водню, C1-8 алкілу й C1-8 галоалкілу, або при приєднанні до того ж самого атому азоту може бути об'єднаний з атомом азоту з утворенням п'яти- або шестичленного кільця, яке має від 0 до 2 додаткових c гетероатомів у кільці, обраних з поміж N, O або S; кожний R незалежно обирають із групи, яка складається із C1-8 алкілу, C1-8 галоалкілу, C3- 6 циклоалкілу, гетероциклоалкілу, арилу й a b c гетероарилу, і де аліфатична й циклічна частини R , R і R є необов'язково додатково заміщеними від одного до трьох галогенами, гідроксигрупами, метилами, аміногрупами, 1 алкіламіногрупами й диалкіламіногрупами; і необов'язково, коли два замісники R перебувають на суміжних атомах, вони об'єднуються з утворенням конденсованого п'яти- або шестичленного карбоциклічного кільця; 2 f d кожний R незалежно обирають із групи, яка складається із галогену, -CN, -R , -CO2R , d e d d e e d e f d d e d d e CONR R , -C(O)R , -OC(O)NR R , -NR C(O)R , -NR C(O)2R , -NR С(O)NR R , -NR С(O)NR R , d e d d e d e NR R , -OR і -S(O)2NR R ; де кожний R і R незалежно обирають з поміж водню, C1-8 алкілу й C1-8 галоалкілу, або при приєднанні до того ж самого атому азоту вони можуть бути об'єднані з атомом азоту з утворенням п'яти- або шестичленного кільця, яке має від 0 до 2 додаткових f гетероатоми в кільці, обраних з поміж N, O або S; кожний R незалежно обирають із групи, яка складається із C1-8 алкілу, C1-8 галоалкілу, C3-6 циклоалкілу, гетероциклоалкілу, арилу й 4 UA 112514 C2 d 5 10 15 20 25 30 35 40 45 50 55 60 e f гетероарилу, і де аліфатична й циклічна частини R , R і R є необов'язково додатково заміщеними від одного до трьох галогенами, гідроксигрупами, метилами, аміно, алкіламіно й диалкіламіно групами; 3 i g кожний R незалежно обирають із групи, яка складається із галогену, -CN, -R , -CO2R , g h g g h h g h i g g h g h g CONR R , -C(O)R , -OC(O)NR R , -NR C(O)R , -NR C(O)2R , -NR C(O)NR R , -NR R , -OR , g h 4 j 4 g h 4 g h 4 h g j j 4 S(O)2NR R , -X -R , -X -NR R , -X -CONR R , -X -NR C(O)R , -NHR і -NHCH2R , де X є C1-4 g h алкіленом; кожний R і R незалежно обирають з поміж водню, C1-8 алкілу, C3-6 циклоалкілу й C1-8 галоалкілу, або при приєднанні до того ж самого атому азоту вони можуть бути об'єднані з атомом азоту з утворенням п'яти- або шестичленного кільця, яке має від 0 до 2 додаткових гетероатомів у кільці, обраних з поміж N, O або S, і необов'язково заміщеного однією або двома i оксогрупами; кожний R незалежно обирають із групи, яка складається із C1-8 алкілу, C1-8 j галоалкілу, C3-6 циклоалкілу, гетероциклоалкілу, арилу й гетероарилу; і кожний R обирають із групи, яка складається із C3-6 циклоалкілу, піролінілу, піперидинілу, морфолінілу, g h i j тетрагідрофуранілу й тетрагідропіранілу, і де аліфатична й циклічна частини R , R , R та R є необов'язково додатково заміщеними від одного до трьох галогенами, метилами, CF 3, гідрокси, аміно, алкіламіно й диалкіламіно групами; і X є воднем або CH3. На додачу до сполук, представлених в описі, даний винахід додатково пропонує фармацевтичні композиції, які містять одну або більше з поміж цих сполук, а також способи застосування цих сполук у терапевтичних методиках, у першу чергу для лікування хвороб, пов'язаних із сигнальною активністю C5a. У ще одному аспекті даний винахід пропонує способи діагностування хвороби в індивідуума. У цих способах сполуки, запропоновані в описі, уводяться суб'єктові в міченій формі, з наступною діагностичною візуалізацією для визначення наявності або відсутності C5aR. У близькому аспекті спосіб діагностування хвороби здійснюють шляхом контакту зразка тканини або крові з міченою сполукою, запропонованою в описі, і визначення наявності, відсутності або кількості C5aR у зразку. Короткий опис креслень Фігура 1 показує структури й активність конкретних сполук даного винаходу. Як правило, сполуки були отримані способами, в основному описаними нижче, а також способами, наданими в Прикладах. Здійснення винаходу I. Скорочення й визначення Термін «алкіл», сам як такий або як частина іншого замісника, означає, якщо не вказано інакше, вуглеводневий радикал із прямим або розгалуженим ланцюгом, який включає певне число атомів вуглецю ( тобто C1-8 означає від одного до восьми атомів вуглецю). Приклади алкільних груп включають метил, етил, н-пропіл, ізопропіл, н-бутил, т-бутил, ізобутил, вторбутил, н-пентил, н-гексил, н-пентил, н-октил тощо. Термін «алкеніл» відноситься до ненасиченої алкільної групи, яка має один або більше подвійних зв'язків. Подібним чином, термін «алкиніл» відноситься до ненасиченої алкільної групи, яка має один або більше потрійних зв'язків. Приклади таких ненасичених алкільних груп включають вініл, 2-пропеніл, кротил, 2-ізопентенил, 2-(бутадієніл), 2,4-пентадієніл, 3-(1,4-пентадієніл), етиніл, 1- і 3-пропиніл, 3-бутиніл і вищі аналоги й ізомери. Термін «циклоалкіл» відноситься до вуглеводневих кілець, які мають певне число атомів у кільці (наприклад, C3-6циклоалкіл), що і є повністю насиченими, або чому, що мають не більш, один подвійний зв'язок між верхівками кілець. «Циклоалкіл» призначає для згадування біциклічних і поліциклічних вуглеводневих кілець, таких як, наприклад, біцикло[2.2.1]гептан, біцикло[2.2.2]октан тощо. Термін «гетероциклоалкіл» відноситься до циклоалкільної групи, яка містить від одного до п'яти гетероатомів, обраних з поміж N, O, і S, у якій атоми азоту й сірки є необов'язково окисленими і атом(и) азоту є необов'язково кватернізованими. Гетероциклоалкіл може бути моноциклічною, біциклічною або поліциклічною кільцевою системою. Необмежуючі приклади гетероциклоалкільних груп включають піролідин, імідазолідин, піразолідин, бутиролактам, валеролактам, імідазолідинон, гідантоїн, диоксолан, фталімід, піперидин, 1,4-диоксан, морфолін, тіоморфолін, тіоморфолін-S-оксид, тіоморфолінS,S-оксид, піперазин, піран, піридон, 3-піролін, тіопіран, пірон, тетрагідрофуран, тетрагідротіофен, квінуклідин та інше. Гетероциклоалкільна група може приєднуватися до залишку молекули через вуглець у кільці або гетероатом. Термін «алкілен», сам як такий або як частина іншого замісника, означає двовалентний радикал, отриманий з алкану, прикладом яких є -CH2CH2CH2CH2-. Звичайно, алкільна (або алкіленова) група має від 1 до 24 атомів вуглецю, причому групи, які мають 10 або менше атомів вуглецю, є кращими в даному винаході. «нижчий алкіл» або «нижчий алкілен» є 5 UA 112514 C2 5 10 15 20 25 30 35 40 45 50 55 60 алкільною або алкіленовою групою з більш коротким ланцюгом, як правило, який має чотири або менше атомів вуглецю. Подібним чином, «алкенілен» і «алкинілен» відноситься до ненасичених форм «алкілену», які мають подвійний або потрійний зв'язок, відповідно. Термін «гетероалкіл», сам як такий або в комбінації з іншим терміном, означає, якщо не вказано інакшого, стійкий (насичений) прямий або розгалужений ланцюг, або циклічний вуглеводневий радикал, або їх комбінації, які складаються із певного числа атомів вуглецю й з від одного до трьох гетероатомів, обраних із групи, яка складається з O, N, Si і S, і в якій атоми азоту й сірки необов'язково можуть бути окисленими, а гетероатом азоту може необов'язково бути кватернізованим. Гетероатом(и) O, N і S можуть розташовуватися на будь-якому внутрішньому положенні гетероалкільної групи. Гетероатом Si може розташовуватися в будьякому положенні гетероалкільної групи, включаючи положення, при якому алкільна група приєднується до залишку молекули. Приклади включають -CH2-CH2-O-CH3, -CH2-CH2-NH-CH3, CH2-CH2-N(CH3)-CH3, -CH2-S-CH2-CH3, -CH2-CH2,-S(O)-CH3, -CH2-CH2-S(O)2-CH3, -CH=CH-O-CH3, -Si(CH3)3, -CH2-CH=N-OCH3, і -CH=CH-N(CH3)-CH3. Не більше двох гетероатомів можуть бути послідовними (йти один за одним), наприклад, -CH2-NH-OCH3 і -CH2-o-Si(CH3)3. Подібним чином, терміни «гетероалкеніл» і «гетероалкиніл», сам як такий або в комбінації з іншим терміном, позначають, якщо не вказано інакше, алкенільну групу або алкинільну групу, відповідно, яка містить певну кількість атомів вуглецю та яка має від одного до трьох гетероатомів, обраних із групи, яка складається з O, N, Si і S, і в якій атоми азоту й сірки необов'язково можуть бути окисленими, а гетероатом азоту може необов'язково бути кватернізованим. Гетероатом(и) O, N і S можуть розташовуватися на будь-якому внутрішньому положенні гетероалкільної групи. Термін «гетероалкілен», сам як такий або як частина іншого замісника, означає двовалентний радикал, насичений або ненасичений або поліненасичений, отриманий з гетероалкілу, наприклад -CH2-CH2-S-CH2CH2- і -CH2-S-CH2-CH2-NH-CH2-, -O-CH2- CH=CH-, -CH2CH=C(H)CH2-O-CH2- і –S-CH2-C≡C-. По відношенню до гетероалкіленових груп, гетероатоми також можуть займати будь-який або обидва кінці ланцюга (наприклад, алкіленокси, алкілендиокси, алкіленаміно, алкілендиаміногрупи тощо). Терміни «алкокси», «алкіламіно» і «алкілтіо» (або тіоалкокси) використовуються в їхньому звичайному значенні й відносяться до алкільних груп, які приєднуються до залишку молекули через атом кисню, аміногрупу або атом сірки, відповідно. Крім того, у відношенні диалкіламіногруп, алкільні частини можуть бути однаковими або різними й також можуть об'єднуватися з утворенням 7-членного кільця з атомом азоту, до якого кожна приєднується. a b Відповідно до цього, група, представлена як -NR R , включає піперидиніл, піролідиніл, морфолініл, азетидиніл тощо. Терміни «гало» або «галоген», сам як такий або як частина іншого замісника, позначають, якщо не вказано інакше, атом фтору, хлору, брому або йоду. Крім того, такі терміни як «галоалкіл», призначені включати моногалоалкіл і полігалоалкіл. Наприклад, термін «C 1-4 галоалкіл» включає трифторметил, 2,2,2-трифторетил, 4-хлорбутил, 3-бромпропіл тощо. Термін «арил» означає, якщо не вказано інакше, поліненасичену, як правило, ароматичну, вуглеводневу групу, яка може бути одиночним кільцем або кількома кільцями ( до трьох кілець), які об'єднані разом або ковалентно зв'язані. Термін «гетероарил» відноситься до арильних груп (або кілець), які містять від одного до п'яти гетероатомів, обраних з поміж N, O, і S, у яких атоми азоту й сірки необов'язково є окисленими, а атом(и) азоту необов'язково є кватернізованими. Гетероарильна група може приєднуватися до залишку молекули через гетероатом. Необмежуючі приклади арильних груп включають феніл, нафтил і біфеніл, у той час як необмежуючий приклади гетероарильних груп включають піридил, піридазиніл, піразиніл, піриміндиніл, триазиніл, хінолініл, хіноксалініл, хіназолініл, цинолініл, фталазиніл, бензотриазиніл, піриніл, бензимідазоліл, бензопіразоліл, бензотриазоліл, бензизоксазоліл, ізобензофурил, ізоіндоліл, індолізиніл, бензотриазиніл, тієнопіридиніл, тієнопіримідиніл, піразолпіримідиніл, імідазопіридини, бензотіаксоліл, бензофураніл, бензотієніл, індоліл, хіноліл, ізохіноліл,ізотіазоліл, піразоліл, індазоліл, птеридиніл, імідазоліл, триазоліл, тетразоліл, оксазоліл, ізоксазоліл, тіадіазоліл, піроліл, тіазоліл, фурил, тієніл тощо. Замісники для кожної з наведених вище арильних і гетероарильних кільцевих систем обирають із групи прийнятних замісників, описаних нижче. Для стислості, термін «арил» при використанні в комбінації з іншими термінами (наприклад, арилокси, арилтіокси, арилалкіл) включає й арильні й гетероарильні кільця, як визначено вище. Таким чином, термін «арилалкіл» включає ті радикали, у яких арильна група приєднується до алкільної групи (наприклад, бензил, фенетил, піридилметил тощо). Вищевказані терміни (наприклад, «алкіл», «арил» і «гетероарил») у деяких варіантах здійснення будуть включати й насичені й ненасичені форми зазначених радикалів. Кращі 6 UA 112514 C2 5 10 15 20 25 30 35 40 45 50 55 60 замісники для кожного типу радикала надаються нижче. Для стислості, терміни арил і гетероарил будуть відноситися до заміщених або незаміщеним варіантів, як установлено нижче, тоді як термін «алкіл» і споріднені аліфатичні радикали охоплює незаміщений варіант, якщо не зазначене, що він є заміщеним. Замісники для алкільних радикалів (включаючи групи, які часто згадуються як алкілен, алкеніл, алкиніл і циклоалкіл) можуть бути різними групами, обраними з поміж галогену, -OR’, NR’R”, -SR’, -SiR’R”R”’, -OC(O)R’, -C(O)R’, -CO2R’, -CONR’R”, -OC(O)NR’R”, -NR”C(O)R’, - NR'C(O)NR”R”’, -NR”C(O)2R’, -NH-C(NH2)=NH, -NR’C(NH2)=NH, -NH-C(NH2)=NR’, -S(O)R’, -S(O)2R’, S(O)2NR’R”, -NR’S(O)2R”, -CN і -NO2 у кількості в межах від нуля до (2 m’+1), де m’ є загальне число атомів вуглецю в такому радикалові. R’, R” і R”’ кожний незалежно позначає водень, незаміщений C1-8 алкіл, незаміщений гетероалкіл, незаміщений арил, арил, заміщений 1-3 галогенами, незаміщений C1-8 алкіл, C1-8 алкоксигрупу або C1-8 тіоалкоксигрупу або незаміщені арил-C1-4 алкільні групи. Коли R’ і R” приєднуються до того самого атому азоту, вони можуть об'єднуватися з атомом азоту з утворенням 3-, 4-, 5-, 6- або 7-членного кільця. Наприклад, NR’R” включає 1-піролідинил і 4-морфолінил. Термін «ацил» коли він використовується окремо або як частина іншої групи відноситься до алкільного радикала, у якому два замісники на вуглеці, який є найближчим до точки приєднання радикала, заміняються на замісник =O (наприклад, -C(O)CH3, -C(O)CH2CН2OR’ тощо.). Подібним чином, замісники для арильних і гетероарильних груп варіюють та в основному їх обирають з поміж галогену, -OR’, -OC(O)R’, -NR’R”, -SR’, -R’, -CN, -NO2, -CO2R’, -CONR’R”, C(O)R’, -OC(O)NR’R”, -NR”C(O)R’, -NR”C(O)2R’, -NR'-C(O)NR”R”’, -NH-C(NH2)=NH, NR’C(NH2)=NH, -NH-C(NH2)=NR’, -S(O)R’, -S(O)2R’, -S(O)2NR’R”, -NR’S(O)2R”, -N3, перфтор(C1-C4) алкоксигрупи й перфтор(C1-C4)алкілу, у кількості від нуля до загального числа відкритих валентностей на ароматичній системі кілець; і де R’, R” і R”’ незалежно обирають з поміж водню, C1-8 алкілу, C3-6 циклоалкілу, C2-8 алкенілу, C2-8 алкинілу, незаміщеного арилу й гетероарилу, (незаміщеного арил)-C1-4 алкілу й незаміщеного арилокси-C1-4 алкілу. Інші придатні замісники включають кожний з вищенаведених арильних замісників, приєднаний до кільцевого атома при межі алкілену 1 - 4 атомів вуглецю. Два із замісників на суміжних атомах арильного або гетероарильного кільця можуть необов'язково бути заміщеними замісником формули -T-C(O)-(CH2)q-U-, де T і U незалежно представлені -NH-, -O-, -CH2- або одинарним зв'язком, і q є цілим числом від 0 до 2. Альтернативно, двоє із замісників на суміжних атомах арильного або гетероарильного кільця необов'язково можуть бути заміщені замісником формули -A-(CH2)r-В-, де A і B представлені незалежно -CH2-, -O-, -NH-, -S-, -S(O)-, -S(O)2-, -S(O)2NR’- або одинарним зв'язком, а r є цілим числом від 1 до 3. Один із одинарних зв'язків нового кільця, сформованого таким чином, необов'язково може бути замінений на подвійний зв'язок. Альтернативно, двоє із замісників на суміжних атомах арильного або гетероарильного кільця необов'язково можуть бути заміщені замісником формули -(CH2)s-X-(CH2)t-, де s і t є незалежно цілими числами від 0 до 3, і X є -O-, NR’-, -S-, -S(O)-, -S(O)2- або -S(O)2NR’-. замісник R’ в -NR’- і -S(O)2NR’- обирають з поміж водню або незаміщеного C1-6 алкілу. При використанні в описі термін «гетероатом» включає кисень (O), азот (N), сірку (S) і кремній (Si). Термін «іонна рідина» відноситься до будь-якої рідини, яка головним чином містить іони. Переважно, у даному винаході «іонна рідина» відноситься до солей, температура плавлення яких є відносно низкою (наприклад, нижче 250 °C). Приклади іонних рідин, включають, але не обмежуються названими, 1-бутил-3-метилімідазолію тетрафторборат, 1-гексил-3метилімідазолію тетрафторборат, 1-октил-3-метилімідазолію тетрафторборат, 1-ноніл-3метилімідазолію тетрафторборат, 1-децил-3-метилімідазолію тетрафторборат, 1-гексил-3метилімідазолію гексафторфосфат і 1-гексил-3-метилімідазолію бромід тощо. Термін «фармацевтично прийнятні солі» включає солі активних сполук, які отримані із відносно нетоксичних кислот або основами, залежно від конкретних замісників, які знаходяться на сполуках, описаних тут. Коли сполуки даного винаходу містять відносно кислотні функціональності, солі приєднання основи можна одержати взаємодією нейтральних форм таких сполук із достатньою кількістю необхідної основи, або без домішок, або в придатному інертному розчиннику. Приклади солей, отриманих з фармацевтично прийнятних неорганічних основ, включають солі алюмінію, амонію, кальцію, мідні, залізні, солі заліза, солі літію, магнію, марганцю, марганцюватисті солі, солі калію, натрію, цинку тощо. Солі, отримані з фармацевтично прийнятних органічних основ, включають солі первинних, вторинних і третинних амінів, включаючи заміщені аміни, циклічні аміни, природні аміни та подібні до них, такі як аргінін, бетаїн, кофеїн, холін, N,N'-дибензилетилендиамін, диетиламін, 2 7 UA 112514 C2 5 10 15 20 25 30 35 40 45 50 55 диетиламінетанол, 2-диметиламінетанол, етаноламін, етилендіамін, N-етилморфолін, Nетилпіперидин, глюкамін, глюкозамін, гістидин, гідрабамін, ізопропіламін, лізин, метилглюкамін, морфолін, піперазин, піперадин, поліамінові смоли, прокаїн, пурини, теобромін, триетиламін, триметиламін, трипропіламін, трометамін і такі інші. Коли сполуки даного винаходу містять відносно оснóвні функціональності, солі приєднання кислоти можна одержати при взаємодії нейтральних форм таких сполук із достатньою кількістю бажаної кислоти, або без домішок, або в придатному інертному розчиннику. Приклади фармацевтично прийнятних солей приєднання кислоти включають солі, отримані з неорганічних кислот, подібних до хлористоводневої, бромистоводневої, азотної, вугільної, моногідрогенвугільної, фосфорної, моногідрогенфосфорної, дигідрогенфосфорної, сірчаної, моногідрогенсірчаної, йодистоводневої або фосфористої кислот тощо, а також солі, отримані з відносно нетоксичних органічних кислот, подібних до оцтової, пропіонової, ізомасляної, малонової, бензойної, бурштинової, суберинової, фумарової, мигдальної, фталевої, бензолсульфонової, p-толуолсульфонової, лимонної, винної, метансульфонової тощо. Також включаються солі амінокислот, такі як аргінат і такі інші та солі органічних кислот, подібні до глюкуронової або галактуронової кислот тощо (дивися, наприклад, Berge, S.M., et al, “Pharmaceutical Salts”, Journal of Pharmaceutical Science, 1977, 66, 1-19). Окремі конкретні сполуки даного винаходу містять як основні так і кислотні функціональності, які дозволяють сполукам перетворюватися на солі приєднання або кислоти або основи. Нейтральні форми сполук можуть бути відновлені шляхом взаємодії солі з основою або кислотою й виділення вихідної сполуки звичайним чином. Вихідна форма сполуки відрізняється від різних солей за певними фізичними властивостями, такими як, розчинність у полярних розчинниках, а в іншому солі є еквівалентними вихідній формі сполуки в контексті даного винаходу. На додачу до форм у вигляді солей, даний винахід пропонує сполуки, які перебувають у формі проліків. Проліки сполук, описаних тут, є сполуками, які легко зазнають хімічних змін за фізіологічних умов, з одержанням сполук даного винаходу. Крім того, проліки можуть перетворюватися на сполуки даного винаходу за допомогою хімічних і біохімічних методів у середовищі ex vivo. Наприклад, проліки можуть повільно перетворюватися на сполуки даного винаходу при розміщенні в резервуарі трансдермального (крізшкірного) пластиру з придатним ферментом або хімічним реактивом. Певні сполуки даного винаходу можуть перебувати в несольватованих формах, а також у сольватованих формах, включаючи гідратні форми. Загалом, сольватовані форми є еквівалентними несольватованим формам і включаються в рамки даного винаходу. Певні сполуки даного винаходу можуть перебувати в численних кристалічних і аморфних формах. Загалом, усі фізичні форми є рівноцінними для використання, яке передбачається даним винаходом, і включені в рамки даного винаходу. Певні сполуки даного винаходу мають асиметричні атоми вуглецю (оптичні центри) або подвійні зв'язки; рацемати, діастереомери, геометричні ізомери, регіоізомери й окремі ізомери (наприклад, окремі енантіомери), усі включені в рамки даного винаходу. Сполуки даного винаходу також можуть містити неприродні частки атомних ізотопів одного або більше атомів, які становлять такі сполуки. Наприклад, сполуки можуть бути мічені радіоактивними ізотопами, 3 125 14 такими як, наприклад тритій ( H), йод-125 ( I) або вуглець-14 ( C). Усі ізотопні варіанти сполук даного винаходу, радіоактивні або ні, включаються в рамки даного винаходу. II. Сполуки В одному аспекті даний винахід пропонує сполуки, які мають формулу I: O X C1 N H N C3 C2 O (I); та їх фармацевтично прийнятні солі, гідрати й ротамери; де 1 C обирають із групи, яка складається із арилу й гетероарилу, де гетероарильна група має 1-3 гетероатоми у кільці, обраних з поміж N, O і S; і де зазначені арильна й гетероарильна групи 1 є необов'язково заміщеними від 1 до 3 замісниками R ; 2 C обирають із групи, яка складається із арилу й гетероарилу, де гетероарильна група має 1-3 гетероатоми у кільці, обраних з поміж N, O і S; і де зазначені арильна й гетероарильна групи 2 є необов'язково заміщеними від 1 до 3 замісниками R ; 3 C обирають із групи, яка складається із C1-8 алкілу, C3-8 циклоалкілу, C3-8 циклоалкіл-C1-4 алкілу, арилу, арил-C1-4 алкілу, гетероарилу, гетероарил-C1-4 алкілу, гетероциклоалкілу або 8 UA 112514 C2 5 10 15 20 25 30 35 40 45 50 гетероциклоалкіл-C1-4 алкілу, де гетероциклоалкільна група або частина має 1-3 гетероатомів, обраних з поміж N, O і S, і де гетероарильна група має 1-3 гетероатоми у кільці, обраних з поміж 3 3 N, O і S, причому кожний C є необов'язково заміщеним 1-3 замісниками R ; 1 c a кожний R незалежно обирають із групи, яка складається із галогену, -CN, -R , -CO2R , a b a a b b a b c a a b a a b CONR R , -C(O)R , -OC(O)NR R , -NR C(O)R , -NR C(O)2R , -NR -C(O)NR R , -NR C(O)NR R , a b a a b a b NR R , -OR і -S(O)2NR R ; де кожний R і R незалежно обирають з поміж водню, C1-8 алкілу й C1-8 галоалкілу, або при приєднанні до того ж самого атому азоту вони можуть бути об'єднані з атомом азоту з утворенням п'яти- або шестичленного кільця, яке має від 0 до 2 додаткових c гетероатомів у кільці, обраних з поміж N, O або S; кожний R незалежно обирають із групи, яка складається із C1-8 алкілу, C1-8 галоалкілу, C3-6 циклоалкілу, гетероциклоалкілу, арилу й a b c гетероарилу, і де аліфатична й циклічна частини R , R і R є необов'язково додатково заміщеними від одного до трьох галогенами, гідроксигрупами, метилами, аміногрупами, 1 алкіламіногрупами й диалкіламіногрупами; і необов'язково, коли два замісники R знаходяться на суміжних атомах, вони об'єднуються з утворенням конденсованого п'яти- або шестичленного карбоциклічного кільця; 2 f d кожний R незалежно обирають із групи, яка складається із галогену, -CN, -R , -CO2R , d e d d e e d e f d d e d d e CONR R , -C(O)R , -OC(O)NR R , -NR C(O)R , -NR C(O)2R , -NR С(O)NR R , -NR С(O)NR R , d e d d e d e NR R , -OR і -S(O)2NR R ; де кожний R і R незалежно обирають з поміж водню, C1-8 алкілу й C1-8 галоалкілу, або при приєднанні до того ж самого атому азоту вони можуть бути об'єднані з атомом азоту з утворенням п'яти- або шестичленного кільця, яке має від 0 до 2 додаткових f гетероатомів у кільці, обраних з поміж N, O або S; кожний R незалежно обирають із групи, яка складається із C1-8 алкілу, C1-8 галоалкілу, C3-6 циклоалкілу, гетероциклоалкілу, арилу й d e f гетероарилу, і де аліфатична й циклічна частини R , R і R є необов'язково додатково заміщеними від одного до трьох галогенами, гідроксигрупами, метилами, аміно, алкіламіно й диалкіламіно групами; 3 i g кожний R незалежно обирають із групи, яка складається із галогену, -CN, -R , -CO2R , g h g g h h g h i g g h g h g CONR R , -C(O)R , -OC(O)NR R , -NR C(O)R , -NR C(O)2R , -NR C(O)NR R , -NR R , -OR , g h 4 j 4 g h 4 g h 4 h g j j 4 S(O)2NR R , -X -R , -X -NR R , -X -CONR R , -X -NR C(O)R , -NHR і -NHCH2R , де X є C1-4 g h алкіленом; кожний R і R незалежно обирають з поміж водню, C1-8 алкілу, C3-6 циклоалкілу й C1-8 галоалкілу, або при приєднанні до того ж самого атому азоту вони можуть бути об'єднані з атомом азоту з утворенням п'яти- або шестичленного кільця, яке має від 0 до 2 додаткових гетероатомів у кільці, обраних з поміж N, O або S, і необов'язково заміщеного однією або двома i оксогрупами; кожний R незалежно обирають із групи, яка складається із C1-8 алкілу, C1-8 j галоалкілу, C3- 6 циклоалкілу, гетероциклоалкілу, арилу й гетероарилу; і кожний R обирають із групи, яка складається із C3-6 циклоалкілу, піролінілу, піперидинілу, морфолінілу, g h i j тетрагідрофуранілу й тетрагідропіранілу, і де аліфатична й циклічна частини R , R , R та R є необов'язково додатково заміщеними від одного до трьох галогенами, метилами, CF 3, гідрокси, аміно, алкіламіно й диалкіламіногрупами; і X є воднем або CH3. 1 У формулі I замісник C в одному варіанті здійснення обирають із групи, яка складається із фенілу, піридилу, індолілу й триазолілу, кожний з яких необов'язково є заміщеним 1-3 1 1 замісниками R . Бажано, кожний R незалежно обирають із групи, яка складається із галогену, c a b a a b CN, -R , -NR R і -OR , і де кожний R і R незалежно обирають з поміж водню, C1-8 алкілу й C1-8 галоалкілу, або при приєднанні до того ж самого атому азоту вони можуть бути об'єднані з c атомом азоту з утворенням піролідинового кільця; кожний R незалежно обирають із групи, яка складається із C1-8 алкілу, C1-8 галоалкілу й C3-6 циклоалкілу, і де аліфатична й циклічна частини a b c R , R і R є необов'язково додатково заміщеними від однієї до трьох гідроксигрупами, метилами, аміногрупами, алкіламіно й диалкіламіно групами; і необов'язково, коли два 1 замісники R знаходяться на суміжних атомах, вони об′єднуються з утворенням конденсованого 1 п'яти- або шестичленного карбоциклічного кільця. У деяких варіантах здійснення винаходу C вибирають із: 9 UA 112514 C2 NC NC Cl Cl NC Cl NC CF3 Cl Cl Cl CF3 Cl Cl CF3 CF3 CH3 CH3 N CH3 N CH3 CH3 N CH3 N N N CH3 CH3 CH3 CH3 CH3 CH3 N N CH3 CH3 CH3 CH3 CH CH3 N 3 CH CH3 3 CF 3 N CF3 CH3 CH3 CH CH3 3 CH CH3 3 CH N N N CF CF3 3 CH3 N N N N N N F F F Cl ClCl F F F CH2CH3 CH2CH3 Cl CH2CH3 N N N NN N N NN N N N N F F F CH3 CH CH3 CH3 CH CH3 CH3 CH3 3 CH3 CH CH CH3 3 3 F O O O F FF FF F F F . F CH2CH3 F F F F 3 N N NF N Cl Cl Cl Cl CH3 CH3 CH3 CH 3 CH O 3 CH3 CH3 CH3 CH3 CH3 CH3 CH3 OH OH OH CH H3C CH3 H C H3C C 3 3 CH H 3 3 OH CH3 CH3 CH3 CH3CH3 and and Cl Cl CH CH3 3 Cl Cl 5 10 and and H3C H3C OH OH OH OH H3C H3C і 2 Вертаючись до формули I, замісник C в одному варіанті здійснення обирають із групи, яка складається із фенілу, нафтилу, піридилу й індолілу, кожний з яких необов'язково є заміщеним 2 2 від 1 до 3 R замісниками. Бажано, кожний R незалежно обирають із групи, яка складається із f d d галогену, -R і -OR ; де кожний R незалежно обирають з поміж водню, C1-8 алкілу й C1-8 f галоалкілу; кожний R незалежно обирають із групи, яка складається із C 1-8 алкілу, C1-8 галоалкілу, C3-6 циклоалкілу, гетероциклоалкілу й гетероарилу, і де аліфатична й циклічна d f частини R і R є необов'язково додатково заміщеними від одного до трьох галогенами, гідроксигрупами, метилами, аміно, алкіламіно й диалкіламіно групами. У деяких варіантах 2 здійснення винаходу C обирають із групи, яка складається із: CH CH3 CH3 3 CH 3 CH3 CH3 CH CH3 3 F F Cl CF CF3 3 Cl CH 3 CH 3 F N N N N F F F F NN F F CH 3 CH 3 F F FF H3 FF H 3CC CH 33 CH NN OO CH CH 33 Cl Cl F F CH H H 3 CH3 3 3C C OCH OCH 3 3 CHCH 3 3 CH 3 3 CH 10 and and Cl Cl F F OCH 3 3 OCH F F CH 3 F F F CH 3 F UA 112514 C2 Cl Cl F F CH CH 33 CH3 H 3C F H 3C CH CH 3 3 OCH 3 CH3 H 3C F H 3C OCH 3 CH 3 CH 3 CH CH 3 3 and and Cl Cl OCH OCH 3 3 і 3 Замісників C у деяких варіантах здійснення обирають із групи, яка складається із C3-6 алкілу, C3-6 циклоалкілу, C3-6 циклоалкіл C1-2 алкілу, фенілу, піридинілу, піразолілу, піперидинілу, піролідинілу, піперидинілметилу й піролідинилметилу, кожний з яких є необов'язково заміщеним 3 3 від 1 до 3 R замісниками. Бажано, кожний R незалежно обирають із групи, яка складається із i g g h h g h i g h g 4 j 4 g h 4 галогену, -R , -CO2R , -CONR R , -NR C(O)R , -NR C(O)2R , -NR R , -OR , -X -R , -X -NR R , -X g h 4 h g j j 4 g h CONR R , -X -NR C(O)R , -NHR і -NHCH2R , де X є C1-3 алкіленом; кожний R і R незалежно обирають з поміж водню, C1-8 алкілу, C3- 6 циклоалкілу й C1- 8 галоалкілу, або при приєднанні до того ж самого атому азоту вони можуть об'єднуватися з атомом азоту з утворенням п'яти- або шестичленного кільця, яке має від 0 до 1 додаткових гетероатомів у кільці, обраних з поміж N, O i або S, і необов'язково заміщеного однією або двома оксогрупами; кожний R незалежно обирають із групи, яка складається із C1-8 алкілу, C1-8 галоалкілу, C3- 6 циклоалкілу, j гетероциклоалкілу, арилу й гетероарилу; і кожний R обирають із групи, яка складається із C3-6 циклоалкілу, піролінілу, піперидинілу, морфолінілу, тетрагідрофуранілу й тетрагідропіранілу, і g h i j де аліфатична й циклічна частини R , R , R та R є необов'язково додатково заміщеними від одного до трьох галогенами, метилами, CF3, гідрокси, аміно, алкіламіно й диалкіламіногрупами. 3 У деяких варіантах здійснення винаходу C обирають із групи, яка складається із: CH 3 F F 5 10 15 N CH3 N N CH 3 N CH 3 N CH3 CHCH 3 N 3 N N CH3 N N N O N NO O H N H3 C H3 C H3 C H3 C N N N N CH 3 CH 3 CH 3 CH 3 H 3C N CH 3 NN HH N H N N N H C N CH 3 CH H 33C 3 N H 3C CH 3 N O O F F F OH O N O N N N N N N N OH HOH CH 3 3C O OH CH H3 H 3CC CH 3 3 H 3C CH 3 OEt OEt OEtO O O O CO22 Et CO Et CO2 Et O O O O N N N N CH CH3 3 CH33 CH O O N N N NN N N HH H H OH OH H OH 3C CH 3 HH 3C CH 3 3 CH 3C H 3C CH 3 O O O O O N O O O 20 OH OEt CO2 Et N N N HH FF H F F O N N N N H H H H N H O O O and and and and N NN N H H HH і 3 В інших варіантах здійснення C обирають із групи, яка складається із: 11 O O UA 112514 C2 CH N CH3 N CH 3 CH N 3 3 CH3 CH3 Et Et Et N H N N H H OH CH OH 3 N OH Et CH Et 3 Et F OH FF Et F Et F N F N N N H N N H H O O O F FF F F OF N N N H N F F N N H O O O F N N N O CF3 CF3 CF3 N CF3 N CF3 CF3 CF3 CF3 CH3 CH CH3 3 O O O CH3 O O O O CH3 CH CH33 O N H N N H H N H CH3 N NN OH OH OH CH3 H3C CH N HCC CH3 3 HOH 33 H3C N N N N N N N CF3 CF3 CF CF3 3 OH OH OH and and N OH and N and N N H C 3C CH3 H3C HH3C CH3 H33C H33CCH33 і C H C CH H3 5 Et Et Et N N N Et N F N N H N N H H N H CH3 N NN OH H HH N H N H OH OH OH N NN H HH Вертаючись до формули I, X є переважно H. Підформули формули I: В одному варіанті здійснення сполуки формули I мають підформулу Ia: O X C1 N H 3 N C C2 O (Ia). У другому варіанті здійснення сполуки формули I мають підформулу Ib: O X C1 N H N C3 10 C2 O (Ib). У третьому варіанті здійснення винаходу сполуки формули I мають підформулу Ic: 12 UA 112514 C2 O X N H C3 N X 2 O (R 2) m 5 X (R1 )n 1 (Ic) 1 1 де X обирають із групи, яка складається із N, CH і CR ; індекс n є цілим числом від 0 до 2; 2 2 X обирають із групи, яка складається із N, CH і CR ; і індекс m є цілим числом від 0 до 2. У четвертому варіанті здійснення винаходу сполуки формули I мають підформулу Id: O X1 N H C3 N X 2 O (R 2) m 10 (Id) 1 1 де X обирають із групи, яка складається із N, CH і CR ; індекс n є цілим числом від 0 до 2; 2 2 X обирають із групи, яка складається із N, CH і CR ; і індекс m є цілим числом від 0 до 2. У п'ятому варіанті здійснення винаходу сполуки формули I мають підформулу Ie: O N H N X2 X (R1 )n 1 (R 3 )p O (R 2) m 15 (R1 )n (Ie) 1 1 де індекс p є цілим числом від 0 до 3; X обирають із групи, яка складається із N, CH і CR ; 2 2 індекс n є цілим числом від 0 до 2; X обирають із групи, яка складається із N, CH і CR ; і індекс m є цілим числом від 0 до 2. В інших вибраних варіантах здійснення сполуками запропонованими винаходом є: O R2 N (R3)p 1 CH3 N (R3)p O O O R2 R2 R1 N H CH3 N (R 3 )p R1 O R1 N H R1 N H R1 O R1 F 2 3 (Ie ) (Ie ) (Ie ) 1 2 3 де замісники R , R і R , і індекс p приймають значення, приведені в посиланні на формулу I. У наступних варіантах здійснення сполуками запропонованими винаходом є: R1 O (R3)p 20 25 4 F R1 CH3 N R1 N H CH3 N O O R1 O N H N H CH3 N R1 O R3 O F R3 F 5 (Ie ) (Ie ) (If) 1 3 де замісники R і R і індекс p приймають значення, приведені з посиланням на формулу I. В особливо кращій групі варіантів здійснення сполуки запропоновані винаходом 5 3 g h j представлені формулою (Ie ), де R обирають із групи, яка складається із -NR R , -NHR і j g h j NHCH2R , і кожний R , R і R приймає значення, приведені з посиланням на формулу I. 13 UA 112514 C2 5 10 15 20 В інший особливо кращій групі варіантів здійснення сполуки запропонованої винаходом 5 3 4 g h 4 j 4 представлені формулою (Ie ), де R обирають із групи, яка складається із -X -NR R , -X -R і -X h g 4 g h j NR COR , і кожний з X , R , R і R приймає значення, подані з посиланням на формулу I. Сполуки запропоновані винаходом, які мають формулу I, можуть перебувати в різних 1 2 діастереоізомерних формах, наприклад, замісники C і C у підформулах Ia і Ic можуть бути в цис-положенні один відносно одного або транс-положенні один відносно одного. Терміни «цис» або «транс» використовуються в описі в їх звичайному в галузі хімії сенсі, тобто, посилаючись на положення замісників відносно один одного відносно умовної площини, наприклад, подвійного зв'язку або системи кілець, такої як кільцева система декалінового типу або гідрохінолонова кільцева система: у цис-ізомері замісники знаходяться з однієї і тієї ж сторони умовної площини, у транс-ізомері замісники знаходяться з протилежних сторін. Крім того, даним винаходом розглядаються різні конформери, а також різні ротамери. Конформери є конформаційними ізомерами, які можуть відрізнятися поворотами навколо одного або більше σ зв'язків. Ротамери є конформерами, які відрізняються поворотом навколо тільки одного σ зв'язку. Одержання сполук Фахівцям у даній галузі техніки зрозуміло, що існує ряд доступних способів синтезу молекул, представлених у пунктах формули винаходу. Загалом, придатні способи для синтезу сполук, представлених у пунктах формули винаходу, складаються із чотирьох частин, які можуть бути O O здійснені в будь-якому порядку: формування піперидинового кільця, формування двох амідних 1 2 3 O зв'язків і формування й/або модифікація функціональних груп на C , C і C . OR OR H O O R3PhB(OH)2 заявлених сполук 2проілюстровані нижче (рівняння 1-6). Деякі способи одержання OR O O eq. 1 N N N N N N N N N 25 N N H2N 3 H2N C H2N C3 C3 O O O halo OR OR OR halo halo halo O M R3PhB(OH)2 R3PhB(OH)2 R3PhB(OH)2 M M M 1 Z-B(OH)2 O NHC O M O halo 1 Z-B(OH)2 NHC1 Z-B(OH)2 NHC 1 Z-B(OH)2 NHC M halo M M halo halo O 3 1 C -MgCl O NHC O O 3M X NHC1 C3 -MgCl 3 1 C -MgCl C -MgCl NHC 1 NHC M X M M X OH base MsCl MsCl MsCl base base base N N N O N N N N N N N N C1 N O O H 1 O C Z NC11 N C H N H Z H Z Z O C1 O N O H 1 O3 C C NC11 C N H N H C3H C33 C 35 N NH N H H R3 R3 3O R M H2 H2 H2 M M M H2 M H2 H22 H M M M Cl O 1) TBSCl C3 C3 C3 C3 Cl 3 2) Cl 1) TBSClCl Cl 1) TBSCl 1) TBSCl Br base 3 2) 3 2) 2) Cl 3 Br Cl Br Cl base Br base base O NH O O O NH NH NH O OR O O C3 OR OR OR eq. 1 eq. 1 eq. 1 1 Cрів. 1 O N eq. 2 O H 1 C N O N1 Z C 1 H eq. 2 NN C H eq. 2 2 HH eq. N Z NH ZZ N H O H рів. 2 C1 O N O H 1 eq. 3 O3 C N C N 11 CC H eq. 3 NN H eq. 3 3 eq. H N C3H 3 NH CC3 N рів. 3 H H H2 O N H 30 O OR OR OR R3 N H M H2 H2 H2 M M M OR OR OR R3 R3 R33 RO MsCl O OH OH OH O O N C3 NO O O TBS N eq. 4 C3 NN TBS 3 C3 TBS C TBS + 1) H eq. eq. 4 eq. 4 4 2) base 1) H+ 1) + + 1) HH 2) base 2) base 2) base рів. 4 3 де: base - основа N 3 C N CC3 N H H Рівняння 1-4 показують деякі способи утворення піперидинового кільця. Зв'язування в 2H положенні піридинового кільця може бути виконане через зв'язок, опосередкований перехідним металом, як показано в рівнянні 1-2, або шляхом додавання, каталізованого металом, органометалічних видів, таких як цинкат або магнієва сіль (рів. 3). Після зв'язування в 2положенні, опосередкована перехідним металом гідрогенізація піридинового кільця дає піперидинову кільцеву систему (рів. 1-3). Інший спосіб призводить до переформування βамінокислоти в піперидинове кільце, як описано в рівнянні 4. Фахівцям у даній галузі техніки буде зрозуміло, що багато методів синтезу можуть давати заміщені піперидини, включаючи C-C 14 UA 112514 C2 5 10 15 20 25 30 35 40 45 або C-N циклізацію ациклічних попередників через алкілювання або перестановку із закриттям циклу. Відносна стереохімія може бути встановлена різними методами, включаючи фаціальну селективність під час стадії гідрогенізації. Абсолютна стереохімія також може бути встановлена різними методами за допомогою використання хіральних лігандів або хіральних допоміжних речовин, поділу хіральних діастереоізомерів, використання хіральних вихідних матеріалів або класичного поділу. Сполуки з 2,3-транс-стереохімією можуть мати відносну стереохімічну конфігурацію під час формування піперидину або можуть бути отримані за допомогою епімеризації 2,3-цис-піперидину, як показано в рівнянні 5. O O 1 C C1 N N base H H eq. 5 3 N C N C3 рів. 5 C2 O C2 O де: base - основа Ацилювання піперидинового кільця описується в рівнянні 6. У випадку рівняння 6, X може бути обраний з відповідної групи, наприклад OH, Cl і F, або з будь-якої групи, здатної активувати карбонільну групу для приєднання аміну (наприклад, OSu, імідазол тощо.). Такі сполуки можна здійснити, використовуючи неорганічні або органічні основи, активуючі речовини, такі як HBTU, а також за допомогою каталізаторів, зокрема за допомогою каталізаторів, відомих у даній галузі техніки, які сприяють формуванню амідних зв'язків, таких як DMAP, HOBT тощо. Придатні сполучні партнери включають карбонову кислоту й піперидин, фторангідрид карбонової кислоти й амін тощо. Фахівцям у даній галузі техніки буде зрозумілим, що існують інші можливі комбінації, які в результаті також будуть давати цільовий продукт. X O O C O OR OR eq. 6 C3 N N C3 H C2 O рів. 6 Для одержання сполук запропонованих винаходом використовується ряд методів, представлених вище, деякі з яких описані в Прикладах. Родина конкретних сполук, які представляють особливий інтерес, і які мають формулу I, складається із сполук, їх фармацевтично прийнятних солей, гідратів і ротамерів, як показано на Фігурі 1. III. Фармацевтичні композиції На додачу до сполук, приведених вище, композиції для модулювання активності C5a у людей і тварин будуть, як правило, містити фармацевтичний носій або розріджувач. Термін «композиція» при використанні в описі включає продукт, який містить установлені інгредієнти в точно визначених кількостях, а також будь-який продукт, який утворюється, прямо або побічно, з комбінації встановлених інгредієнтів у точно визначених кількостях. Під «фармацевтично прийнятним» маємо на увазі носій, розріджувач або ексципієнт (допоміжну речовину), який повинен бути сумісним з іншими інгредієнтами композиції й не шкідливим для його реципієнта. Фармацевтичні композиції для введення сполук даного винаходу можуть бути зручно представлені в стандартній лікарській формі й можуть бути приготовлені будь-якими способами, добре відомими в галузі фармації й доставки лікарських засобів. Усі способи включають етап з'єднання активного інгредієнта з носієм, яким є один або більше додаткових інгредієнтів. Загалом, фармацевтичні композиції одержують шляхом рівномірного й ретельного введення активного інгредієнта в асоціацію (зв'язок) з рідким носієм або дрібнозмеленим твердим носієм або ними обома, і потім, за необхідності, формування продукту в бажану композицію. До фармацевтичної композиції активна сполука включається в кількості, достатній для одержання бажаного впливу на процес або перебіг хвороби. Фармацевтичні композиції, які містять активний інгредієнт можуть перебувати у формі, яка є придатною для перорального застосування, такою як, наприклад, таблетки, пастилки, таблетки для разсмоктування, водні або олійні суспензії, дисперговані порошки або гранули, емульсії й самоемульсифікатори, як описано в патентній заявці США 2002-0012680, тверді або м'які капсули, сиропи, еліксири, розчини, щічні пластирі, гель для рота, жувальна гумка, жувальні таблетки, порошок сухого шипучого напою й таблетки сухого шипучого напою. Композиції, 15 UA 112514 C2 5 10 15 20 25 30 35 40 45 50 55 60 призначені для перорального застосування, можна одержати відповідно до будь-якого способу, відомого в даній галузі техніки для виробництва фармацевтичних композицій, причому такі композиції можуть містити одну або більше речовин, обраних із групи, яка складається з підсолоджувачів, смакових речовин, барвників, антиоксидантів, консервантів, для того щоб забезпечити фармацевтично вишукані й приємні препарати. Таблетки містять активний інгредієнт у суміші з нетоксичними фармацевтично прийнятними ексципієнтами, придатними для виробництва таблеток. Ці ексципієнти можуть бути, наприклад, інертними розріджувачами, такими як целюлоза, діоксид кремнію, окис алюмінію, карбонат кальцію, карбонат натрію, глюкоза, манітол, сорбітол, лактоза, фосфат кальцію або фосфат натрію; гранулюючими і дезінтегруючими речовинами, наприклад, кукурудзяним крохмалем або альгіновою кислотою; з′єднувальними речовинами, наприклад, PVP, целюлозою, PEG, крохмалем, желатином або гуміарабіком речовинами, а також змащувальними речовинами, наприклад стеаратом магнію, стеариновою кислотою або тальком. Таблетки можуть бути непокритими, або вони можуть бути покриті ентеросолюбильною оболонкою або іншим способом, за допомогою відомих методів, щоб відтермінувати руйнування й абсорбцію в шлунково-кишковому тракті й тим самим забезпечити пролонговану дію протягом більш тривалого періоду часу. Наприклад, можна використовувати матеріал, який дає затримку вивільнення за часом, такий як гліцерил моностеарат або гліцерил дистеарат. Також таблетки можна покрити за допомогою методів, описаних у патенті США № 4,256,108; 4,166,452 і 4,265,874, для створення осмотичних терапевтичних таблеток з контрольованим вивільненням. Композиції для перорального застосування також можуть бути представлені у вигляді твердих желатинових капсул, у яких активний інгредієнт змішується з інертним твердим розріджувачем, наприклад, карбонатом кальцію, фосфатом кальцію або каоліном, або у вигляді м'яких желатинових капсул, у яких активний інгредієнт змішується з водним або олійним середовищем, наприклад арахісовою олією, рідким парафіном або маслиновою олією. Крім того, емульсії можна приготувати з неводним інгредієнтом, здатним змішуватися, таким як олія, і стабілізувати поверхнево-активними речовинами, такими як моногліцериди, ПЕГ-ефіри тощо. Водні суспензії містять активні матеріали в суміші з ексципієнтами, придатними для виробництва водної суспензії. Такі ексципієнти є суспендуючими речовинами, наприклад натрій карбоксиметилцелюлозою, метилцелюлозою, гідрокси-пропілметилцелюлозою, альгінатом натрію, полівініл-піролідоном, трагакантовою камеддю і гуміарабіком; диспергуючі або зволожуючі речовини можуть бути природними фосфатидами, наприклад лецитином, або продуктами конденсації алкіленоксиду з жирними кислотами, наприклад поліоксиетиленстеаратом, або продуктами конденсації алкіленоксиду із довголанцюговими аліфатичними спиртами, наприклад гептадекаетиленоксицетанолом, або продуктами конденсації алкіленоксида з неповними ефірами, отриманими з жирних кислот і гекситолу, наприклад, поліоксиетилен сорбітол моноолеат, або продуктами конденсації алкіленоксида з неповними ефірами, отриманими з жирних кислот і ангідридів гекситу, наприклад, поліоксиетилен сорбітан моноолеат. Водні суспензії також можуть містити один або більше консервантів, наприклад етил, або н-пропіл, p-гідроксибензоат, один або більше барвників, одну або більше ароматизуючу речовину і один або більше підсолоджувачів, таких як сахароза або сахарин. Олійні суспензії можна одержати шляхом суспендування активного інгредієнта в рослинній олії, наприклад, арахісовій олії, маслиновій олії, кунжутній олії або кокосовій олії, або в мінеральній олії, такій як рідкий парафін. Олійні суспензії можуть містити загущувач, наприклад, віск, твердий парафін або цетиловий спирт. Щоб забезпечити смачний пероральний препарат, можна додати підсолоджувачі, такі як наведені вище, і ароматизуючі речовини. Ці композиції можна зачистити шляхом додавання антиоксидантів, наприклад, аскорбінової кислоти. Дисперговані порошки й гранули, придатні для приготування водних суспензій додаванням води, надають активний інгредієнт у суміші з диспергуючою або зволожуючою речовиною, суспендуючою речовиною й одним або більше консервантом. Придатні диспергуючі або змочувальні речовини й суспендуючі речовини представлені прикладами, які вже наводилися вище. Також можуть бути присутніми додаткові ексципієнти, наприклад підсолоджувачі, ароматизуючи речовини та барвники. Фармацевтичні композиції запропоновані винаходом також можуть бути у формі емульсій олії-у-воді. Олійна фаза може бути рослинною олією, наприклад маслиновою олією або арахісовою олією, або мінеральною олією, наприклад рідким парафіном або їх сумішами. Придатні емульгуючі речовини можуть бути природними камедями, наприклад, гуміарабіком або трагакантовою камеддю, природними фосфатидами, наприклад соєвими бобами, лецитином і складними ефірами або неповними ефірами, отриманими з жирних кислот і ангідридів гекситу, 16 UA 112514 C2 5 10 15 20 25 30 35 40 45 50 55 60 наприклад, сорбітан моноолеат, і продукти конденсації зазначених неповних ефірів з етиленоксидом, наприклад, поліоксиетилен сорбітан моноолеат. Емульсії також можуть містити підсолоджувачі й барвники. Сиропи й еліксири можуть бути включені до складу композиції з підсолоджувачами, наприклад, гліцерином, пропіленгліколем, сорбітом або сахарозою. Такі композиції також можуть містити заспокійливі, консерванти, ароматизуючі й барвники. Пероральні розчини можуть бути приготовлені в комбінації, наприклад, із циклодекстрином, ПЕГ і поверхневоактивними речовинами. Фармацевтичні композиції можуть бути у формі стерильних водних або олійних суспензій для ін'єкцій. Ці суспензії можуть бути створені згідно з відомим рівнем техніки з використанням тих придатних диспергуючих або зволожуючих речовин і суспендуючих речовин, які були згадані вище. Стерильний препарат для ін'єкцій також може бути стерильним розчином для ін'єкцій або суспензією в нетоксичному парентерально-прийнятному розріджувачі або розчиннику, наприклад такому, як розчин в 1,3-бутандоїлі. До числа прийнятних переносників і розчинників, які можна використовувати, входять вода, розчин Рінгера й ізотонічний розчин хлориду натрію. Крім того, як розчинник або суспендуюче середовище зазвичай використовуються стерильні жирні олії. З цією метою можна використовувати будь-яку м'яку жирну олію, включаючи синтетичні моно або дигліцериди. Крім цього, при готуванні препаратів для ін'єкцій знаходять застосування жирні кислоти, наприклад олеїнова кислота. Сполуки даного винаходу також можуть бути введені у формі супозиторіїв для ректального застосування лікарського засобу. Ці композиції можна приготувати, змішуючи лікарський засіб з придатним ексципієнтом, який не викликає подразнення, і який є твердим за кімнатної температури, але стає рідким за ректальної температури й, отже, буде плавитися в прямій кишці з вивільненням лікарського засобу. Такі матеріали включають масло какао й поліетиленгліколі. Крім того, сполуки можуть бути введені за допомогою очного введення за допомогою розчинів або мазей. Більше того, трансдермальна доставка заявлених сполук може здійснюватися за допомогою іонофоретичних пластирів тощо. Для місцевого застосування використовуються креми, мазі, желе, розчини або суспензії тощо, які містять сполуки даного винаходу. Місцеве застосування, як це використовується в описі включає також використання рідин і полоскань для рота. Сполуки даного винаходу також можуть бути об'єднані з носієм, який є придатним полімером як направляючим носієм лікарських засобів. Такі полімери можуть включати полівінілпіролідон, співполімери пірану, пропіл-метакриламід-фенол, полігідроксиетиласпартамід-фенол або поліетиленоксид-полілізин, заміщений залишками пальмітоїлу. Крім того, сполуки запропоновані винаходом можуть бути об'єднані з носієм, який представляє клас полімерів, здатних до біодеградації, придатних для досягнення контрольованого вивільнення лікарського засобу, наприклад, полімолочна кислота, полігліколева кислота, співполімери полімолочної й полігліколевої кислот, поліепсилон-капролактон, полігідроксимасляна кислота, поліортоефіри, поліацеталі, полігідропірани, поліціанакрилати й поперечно-зв'язані або амфіпатичні блок-співполімери гідрогелів. Полімери й напівпроникні полімерні матриці можуть бути сформовані в профільовані вироби, такі як клапани, стенти, трубки, протези й таке інше. В одному варіанті здійснення винаходу сполуки запропоновані винаходом з'єднуються з полімером або напівпроникною полімерною матрицею, яка сформована як стент або стентграфт обладнання. IV. Способи лікування хвороб і розладів, модульованих C5a Сполуки запропоновані винаходом можуть бути використані як агоністи, (бажано) антагоністи, часткові агоністи, зворотні агоністи рецепторів C5a у різних випадках і in vitro і in vivo. В одному варіанті здійснення сполуки запропоновані винаходом є антагоністом C5aR, який можна використовувати для того, щоб інгібувати зв'язування ліганду рецептора C5a (наприклад, C5a) з рецептором C5a in vitro або in vivo. Загалом, такі способи містять стадію контактування рецептора C5a з достатньою кількістю одного або більше модуляторів рецептора C5a, як передбачено тут, у присутності ліганду рецептора C5a у водному розчині і за умов, в інших випадках придатних для зв'язування ліганду з рецептором C5a. Рецептор C5a може бути присутнім у суспензії (наприклад, в ізольованій мембрані або клітинному препараті), у культивованій або ізольованій клітині або в тканині або органі. Переважно, кількість модулятора рецептора C5a, що контактує з рецептором, повинна бути достатньою, щоб інгібувати зв'язування C5a з рецептором C5a in vitro, що визначається, наприклад, шляхом аналізу зв'язування радіоліганду, аналізу мобілізації кальцію або аналізу хемотаксису, як описано тут. В одному варіанті здійснення винаходу C5 a-модулятори винаходу використовують, щоб 17 UA 112514 C2 5 10 15 20 25 30 35 40 45 50 55 60 модулювати, переважно інгібувати, активність, пов'язану із трансдукцією сигналу, рецептора C5a, наприклад, шляхом контактування одного або більше сполук(и) винаходу з рецептором C5a (або in vitro або in vivo) за умов, придатних для зв'язування модулятора(ів) з рецептором. Рецептор може бути присутнім у розчині або суспензії, у культивованому або ізольованому клітинному препараті або в організмі пацієнта. Будь-яку зміну активності, пов'язаної із трансдукцією сигналу, можна оцінити шляхом виявлення впливу на мобілізацію іонів кальцію або шляхом визначення впливу на клітинний хемотаксис, опосередкований C5a рецептором. Загалом, ефективною кількістю модулятора(ів) C5a є кількість, достатня для того, щоб модулювати C5a-рецепторну активність, пов'язану із трансдукцією сигналу, у рамках методу аналізу мобілізації кальцію in vitro, або клітинний хемотаксис, опосередкований рецептором C5a, у рамках методу аналізу міграції. Коли сполуки запропоновані винаходом використовуються, щоб інгібувати опосередкований рецептором C5a клітинний хемотаксис, переважно хемотаксис лейкоцитів (наприклад, нейтрофілів), при аналізі хемотаксису in vitro, такі способи включають контактування лейкоцитів (зокрема, лейкоцитів приматів, особливо лейкоцитів людини) з однією або більше сполукою винаходу. Переважно концентрація є достатньої, щоб інгібувати хемотаксис лейкоцитів при аналізі хемотаксису in vitro, так що рівні хемотаксису, які спостерігаються в контрольній пробі, є значно більш високими, як описано вище, ніж рівні, які спостерігаються в пробі, до якої були додані сполуки запропоновані винаходом. В іншому варіанті здійснення сполуки даного винаходу додатково можуть використовуватися для лікування пацієнтів, які страждають від станів, які реагують на зміну (модулювання) рецептора C5a. Термін «лікування», як він використовується в описі включає й хворобомодифікуюче лікування і симптоматичне лікування й, кожне з яких може бути профілактичним (тобто, до початку симптомів, для того, щоб запобігти, відтермінувати або зменшити тяжкість симптомів) або терапевтичним ( тобто, після початку симптомів, для того, щоб зменшити тяжкість й/або тривалість симптомів). При використанні в описі вважається, що стан «реагує на модулювання рецептора C5a», якщо модулювання активності рецептора C5a призводить до зниження неадекватної активності рецептора C5a. При використанні в описі термін «пацієнти» включає приматів (зокрема, людей), свійських тварин (таких як собаки, кішки, коні тощо.) і сільськогосподарських тварин (таких як велика рогата худоба, свині, вівці тощо), при використанні дозувань, як описано тут. Стани, які можна лікувати, модулюючи C5a: Аутоімунні хвороби – наприклад, ревматоїдний артрит, системний червоний вовчак, синдром Гієна-Баре, панкреатит, вовчанковий нефрит, вовчанковий гломерулонефрит, псоріаз, хвороба Крона, васкуліт, спастичний коліт, дерматоміозит, розсіяний склероз, бронхіальна астма, пузирчатка, пемфігоїд, склеродерма, важка псевдопаралітична міастенія, аутоімунні гемолітичні й тромбоцитопенічні стани, синдром Гудпасчера (і пов'язаний з ним гломерулонефрит і легенева кровотеча), імуноваскуліт, відторгнення тканинного трансплантата, гіпергостре відторгнення трансплантованих органів тощо. Запальні порушення й споріднені стани - наприклад, нейтропенія, сепсис, септичний шок, хвороба Альцгеймера, розсіяний склероз, інсульт, запальна хвороба кишечнику (IBD), запалення, пов'язане з важким опіком, ушкодження легенів, ішемічно-реперфузійне ушкодження, остеоартрит, а також синдром гострої дихальної недостатності в дорослих (ARDS), хронічне легеневе обструктивне захворювання (COPD), синдром системної запальної реакції (SIRS), атопічний дерматит, псоріаз, хронічна кропивниця і поліорганна недостатність (MODS). Також включаються патологічні ускладнення, пов'язані з інсулінозалежним цукровим діабетом (включаючи діабетичну ретинопатію), вовчанкову нефропатію, нефрит Хеймана, мембранозний нефрит і інші форми гломерулонефриту, відповідна контактна чутливість і запалення в результаті контакту крові зі штучними поверхнями, що може викликати активацію комплементу, як відбувається, наприклад, під час штучного кровообігу (наприклад, під час гемодіалізу або в апараті штучного кровообігу, наприклад, у зв'язку із судинною хірургією, такою як аортокоронарне шунтування або заміна серцевого клапана), або у зв'язку з контактом з іншою штучною судиною або поверхнями контейнера (наприклад, допоміжна шлуночкова система, обладнання «штучне серце», трубки для переливання крові, контейнери для консервації крові, плазмоферез, тромбоцитоферез тощо.). Також включаються хвороби, пов'язані з ішемічнореперфузійним ушкодженням, такі як ті, які є результатом трансплантації, включаючи трансплантацію цілих органів, і такі синдроми, як ішемічне реперфузійне ушкодження, ішемічний коліт і серцева ішемія. Сполуки даного винаходу також можуть бути придатними для лікування вікової дегенерації жовтої плями (Hageman et al, P.N.A.S.102: 7227-7232, 2005). Серцево-судинні й церебрально-васкулярні порушення - наприклад, інфаркт міокарда, 18 UA 112514 C2 5 10 15 20 25 30 35 40 45 50 55 60 тромбоз коронарних артерій, оклюзія судини, післяопераційна судинна реоклюзія, атеросклероз, травматичне ушкодження центральної нервової системи й ішемічна хвороба серця. В одному варіанті здійснення ефективна кількість сполуки запропонованої винаходом може бути введена пацієнтові, який має ризик щодо інфаркту міокарда або тромбозу ( тобто, пацієнтові, який має один або більше визнаних факторів ризику інфаркту міокарда або тромбозу, таких як, але не обмежуючись цим, ожиріння, паління, високий тиск крові, гіперхолестеринемія, попередня або спадкова історія інфаркту міокарда або тромбозу) для того, щоб знизити ризик інфаркту міокарда або тромбозу. Запальні хвороби судин - васкуліти характеризуються запаленням кровоносних судин. Інфільтрація лейкоцитів призводить до руйнування стінок судин, і як уважаються, шлях комплементу відіграє основну роль в ініціації міграції лейкоцитів, а також одержаному в результаті ушкодженні, яке виявляється на місці запалення (Vasculitis, Second Edition, Edited by Ball і Bridges, Oxford University Press, pp 47-53, 2008). Сполуки, запропоновані даним винаходом, можна використовувати для лікування лейкокластичного васкуліту, гранулематоза Вегенера, мікроскопічної ангіопатії, синдрому Черджа-Строса, пурпури Шенлейна-Геноха, нодозного (вузликового) артериїта, швидкопрогресуючого гломерулонефриту (RPGN), кріоглобулінемії, гігантоклітинного артеріїту (GCA), хвороби Бехчета й артериїта Такаясу (TAK). ВІЛ інфекція й СНІД – модулятори рецептора C5a, приведені в описі, можуть використовуватися, щоб інгібувати Віл-інфекції, затримувати розвиток СНІДу або зменшувати тяжкість симптомів ВІЛ-інфекції й СНІДу. Нейродегенеративні розлади й споріднені хвороби – У додаткових аспектах антагоністи C5a, надані в описі, можна використовувати для лікування хвороби Альцгеймера, розсіяного склерозу й погіршення когнітивної функції, пов'язаного з операцією за умов штучного кровообігу й пов'язаних із цим процедур. В одному варіанті здійснення винаходу сполуки запропоновані винаходом можна використовувати для лікування хвороб, обраних із групи, яка складається із сепсису (і споріднених розладів), COPD, ревматоїдного артриту, вовчанкового нефриту й розсіяного склерозу. Способи лікування, наведені в описі, включають, в основному, уведення пацієнтові ефективної кількості однієї або більше сполук, наданих тут. Перелік придатних пацієнтів включає пацієнтів, які страждають від або є сприйнятливими до (тобто, профілактичне лікування) розладу або хвороби, описаної тут. Типові пацієнти, як описано тут, включають ссавців, зокрема приматів, особливо людей. Перелік інших придатних пацієнтів включає свійських тварин, таких як собаки, кішки, коні тощо, або сільськогосподарських тварин, таких як велика рогата худоба, свині, вівці тощо. Загалом, способи лікування, наведені в описі, включають уведення пацієнтові ефективної кількості сполук, приведених тут. У кращому варіанті здійснення сполуку(и) винаходу переважно вводять пацієнтові (наприклад, людині) перорально або місцево. Ефективна кількість може бути кількістю, достатньою для модулювання активності рецептора C5a і/або кількістю, достатньою для зниження або полегшення симптомів, демонстрованих пацієнтом. Бажано, введена кількість є достатньою, щоб одержати концентрацію сполуки в плазмі (або її активного метаболіту, якщо сполуки є проліками), досить високу, щоб помітно інгібувати хемотаксис лейкоцитів (наприклад, нейтрофілів) in vitro. Режими лікування можуть змінюватися залежно від використаної сполуки й конкретного стану, який потрібно лікувати; для лікування більшості розладів кращою є частота введень 4 рази на день або менше. Загалом, режим дозування 2 рази на день є кращим, причому дозування один раз на день є найкращим. Однак слід розуміти, що конкретний рівень дозування й режим лікування для будь-якого конкретного пацієнта буде залежати від ряду факторів, включаючи активність певної використаної сполуки, вік, вага тіла, загальний стан здоров'я, стать, дієту, час уведення, шлях уведення, швидкість виведення, лікарську комбінацію (тобто, коли інші препарати також уводяться пацієнтові) і тяжкість конкретної хвороби, яка потребує лікування, а також від думки лікаря. Загалом, кращим є застосування мінімальної дози, достатньої, щоб забезпечити ефективне лікування. Як правило, можна проконтролювати терапевтичну ефективність у пацієнтів, використовуючи медичні або ветеринарні критерії, відповідні до стану, який лікують або запобігають. Рівні дозування порядку приблизно від 0,1 мг до 140 мг на кілограм ваги тіла на день використовуються при лікуванні або запобіганні станів, які мають відношення до патогенної активності C5a (приблизно від 0,5 мг до 7 г на пацієнта-людини на день). Дана кількість активного інгредієнта, яку можна об'єднати з матеріалами-носіями для виготовлення окремої лікарської форми, буде змінюватися залежно від «хазяїна», якого лікують і конкретного способу введення. Стандартна лікарська форма, як правило, буде містити приблизно від 1 мг до 500 мг 19 UA 112514 C2 5 10 15 20 25 30 35 40 45 50 55 60 активного інгредієнта. Для сполук, які вводяться перорально, трансдермально, внутрішньовенно або підшкірно, кращим є введення відповідної кількості сполуки для досягнення в сироватці концентрації 5 нг (нанограм)/мл-10 мкг (мікрограм)/мл сироватки, ще кращим є введення відповідної кількості сполуки для досягнення концентрації в сироватці 20 нг1 мкг/мл сироватки, найкращим є введення відповідної кількості сполуки для досягнення концентрації в сироватці 50 нг/мл-200 нг/мл. При прямій ін'єкції в синовіальну оболонку (для лікування артриту) повинна бути введена відповідна кількість сполуки для досягнення приблизно 1 мікромолярної місцевої концентрації. Частота дозування також може змінюватися залежно від застосованої сполуки й конкретної хвороби, яку лікують. Однак, для лікування більшості розладів режим дозування 4 рази на день, три рази на день або менше є кращим, причому режим дозування один раз на день або 2 рази на день є найкращим. Однак слід розуміти, що конкретний рівень дозування для будь-якого конкретного пацієнта буде залежати від ряду факторів, включаючи активність певної використаної сполуки, вік, вага тіла, загальний стан здоров'я, стать, дієту, час уведення, шлях уведень, швидкість виведення, лікарську комбінацію (тобто, коли інші препарати також уводяться пацієнтові) і тяжкість конкретної хвороби, яка піддається лікуванню, а також від думки лікаря. В іншому аспекті винаходу сполуки запропоновані винаходом можуть бути використані в ряді нефармацевтичних in vitro і in vivo застосувань. Наприклад, сполуки запропоновані винаходом можна позначити й використовувати як зонди для виявлення й установлення локалізації рецептора C5a (клітинні препарати або зразки зрізів тканин). Сполуки запропоновані винаходом також можна використовувати як позитивні контролі при дослідженнях активності рецептора C5a, тобто, як стандарти для встановлень здатності речовин-кандидатів зв'язуватися з рецептором C5a, або як радіоактивні індикатори для візуалізації за допомогою позитронноемісійної томографії (PET) або однофотонної емісійної комп'ютерної томографії (SPECT). Такі методи можна використовувати для того, щоб охарактеризувати рецептори C5a у живих суб'єктів. Наприклад, модулятор рецептора C5a можна позначити за допомогою кожного із цілого ряду добре відомих методів (наприклад, мічення радіоактивним ізотопом, таким як тритій), і інкубувати зі зразком протягом відповідного часу інкубації (наприклад, визначеного за допомогою першого аналізу залежності зв'язування від часу). Після інкубації незв'язані сполуки видаляють (наприклад, відмиванням), а зв'язані сполуки визначають, використовуючи будь-який метод, придатний для роботи з міткою (наприклад, радіоавтографію або сцинтиляційний метод підрахунку мічених радіоактивними ізотопами сполук; для виявлення люмінесцентних і флуоресцентних груп можна використовувати спектроскопічні методи). Як контроль можна брати, оброблені аналогічним чином, еквівалентні зразки, які містять мічені сполуки й більшу (наприклад, в 10 раз більшу) кількість неміченої сполуки. Більша, ніж у контролі, кількість визначеної мітки, яка залишилася у дослідному зразку, указує на наявність рецептора C5a у зразку. Виявлення, включаючи рецепторну радіоавтографію (рецепторне картування) рецептора C5a у культивованих клітинах або зразках тканини, можна здійснити, як описано Kuhar у розділах 8.1.1 - 8.1.9 Current Protocols in Pharmacology (1998) John Wiley & Sons, New York. Сполуки, приведені в описі, також можна використовувати в цілому ряді добре відомих методів поділу клітин. Наприклад, модулятори можуть бути пов'язані із внутрішньою поверхнею чашки для культури тканин або іншою основою для використання як афінних лігандів для іммобілізації й у такий спосіб відділення C5a рецепторів (наприклад, відділення рецепторекспресуючих клітин) in vitro. В одному кращому застосуванні модулятор, пов'язаний із флуоресцентним маркером, наприклад, флуоресцеїном, контактує із клітинами, які потім аналізують (або відокремлюють) за допомогою методу флуоресцентного сортування клітин (FACS). На Фігурі 1 представлена структура й активність репрезентативних сполук, описаних тут. Активність надається в наступному вигляді для аналізу зв'язування, як описано тут: +, 500 нМ ≤ IC50 < 2000 нМ; ++, 50 нМ ≤ IC50 < 500 нМ; +++, 5 нМ ≤ IC50 < 50 нМ; і ++++, IC50 < 5 нМ. V. Приклади Наступні приклади пропонуються для ілюстрації, але не для обмеження заявленого винаходу. Реактиви й розчинники, використані нижче, можна одержати з комерційних джерел, таких як 1 Aldrich Chemical Co. (Мілуоки, Вісконсин, США). H-ЯМР-спектри реєстрували на ЯМРспектрометрі Varian Mercury 400 Мгц. Значимі піки надані відносно TMS і представлені в наступному порядку: мультиплетність (s, сінглет; d, дублет; t, триплет; q, квартет; m, мультиплет) і число протонів. Результати мас-спектрометрії наводяться як відношення маси до 20 UA 112514 C2 5 10 15 20 25 30 заряду, за яким іде відносна поширеність кожного іона (у дужках). У Прикладах окреме значення m/e наводяться для M+H (або, як відзначається, M-H) іона, який містить найпоширеніші атомні ізотопи. Ізотопні діаграми відповідали очікуваній формулі у всіх випадках. Мас-спектроскопію з іонізацією електророзпилюванням (ESI) проводили на мас-спектрометрі з електророзпилюванням Hewlett-Packard MSD, використовуючи HP1100 ВЕРХ для подачі проб. Звичайно аналіт розчиняли в метанолі при 0,1 мг/мл і 1 мікролітр вливали в розчинник для подачі в мас-спектрометр, який проводив сканування від 100 до 1500 дальтон. Усі сполуки можна проаналізувати в позитивному ESI методі, використовуючи ацетонітрил/вода з 1% мурашиною кислотою як розчинник для подачі. Сполуки, приведені нижче, також можна проаналізувати негативним ESI методом, використовуючи 2 мM NH 4ОАс у системі доставки ацетонітрил /вода. У Прикладах і протягом усього опису винаходу використовуються наступні скорочення: EtOH: етанол EtONa: етилат натрію ТГФ: тетрагідрофуран ТШХ: тонкошарова хроматографія MeOH: метанол Сполуки в рамках цього винаходу можна синтезувати, як описано нижче, використовуючи цілий ряд реакцій, відомих кваліфікованим фахівцям. Фахівцеві в даній галузі зрозуміло, що можна використовувати альтернативні методи для синтезу цільових сполук цього винаходу, і що підходи, описані в головній частині цього документа, не є вичерпними, але забезпечують широко застосовні й практичні шляхи отримання сполук, які представляють інтерес. Деякі молекули, заявлені в цьому патенті, можуть перебувати в різних енантіомерних і діастереомерних формах, і всі подібні варіанти цих сполук є заявленими. Докладний опис експериментальних методів, використаних для синтезу ключових сполук у цьому тексті, призводить до молекул, які описуються за допомогою фізичних даних, які їх ідентифікують, а також структурними зображеннями, пов'язаними з ними. Фахівцям у даній галузі також відомо, що в органічній хімії під час стандартних процедур виділення часто використовуються кислоти й основи. Іноді під час експериментальних процедур, описаних у рамках цього патенту, одержують солі вихідних сполук, якщо вони мають необхідну власну кислотність або основність. Приклад 1 Синтез цис-1-(2-фтор-6-метилбензоїл)-2-фенілпіперидин-3- карбонової кислоти (3трифторметилфеніл)аміду O OEt N Cl PhB(OH) 2 Pd(PPh 3) 4 K2C03 O O PtO2, H2 HCl/EtOH OEt N step a OEt N H step b X O OH O OEt N F N LAH O O step d F step c Et3 N, CH 2Cl2 F CrO3 O O step e OH H2 N N H CF3 N F CF3 N O 35 X = OH X = Cl T3P Et 3 N O step f F де: step - стадія a) Pd(PРh3)4 (3,0 г; 2,6 ммоль) додали до розчину 2-хлор-3-карбоксиетилпіридину (25 г; 134.7 21 UA 112514 C2 5 10 15 20 25 30 35 40 45 50 55 ммоль), фенілборонової кислоти (21,04 г; 172,6 ммоль) і K2CO3 (55,1 г; 399 ммоль) в 1,4диоксані (200 мл) і воді (200 мл). Реакційну суміш нагрівали при 100 C протягом 2 годин. Потім розчин охолоджували до кімнатної температури, і діоксан вилучали за зниженого тиску. Отриманий водний шар екстрагували з етилацетатом, а об'єднані органічні шари висушували (Na2SO4), фільтрували крізь целіт і концентрували за зниженого тиску. Осад очистили за допомогою флеш-хроматографії (SiO2, 10-100% ЕtOAc/гексани) з одержанням похідного 2фенілпіридину з виходом 91% (27,98 г). LC-MS Rt (час утримання): 2,45 хв.; MS: (ES) m/z 228 + (M+H ). b) PtО2 (800 мг; 3,52 ммоль) додали до розчину етилового ефіру феніл- нікотинової кислоти (20 г; 88 ммоль, отриманого на стадії a) вище) в ЕtOН (60 мл) і концентрованої HСl (15 мл). Реакційну суміш гідрогенізували за допомогою шейкера Парра при 40-45 псі, протягом 1 години. Потім реакційну суміш профільтрували крізь целіт, промили ЕtOН, а фільтрат концентрували за зниженого тиску. Осад розбавили CH2Cl2 і промили насиченим NaHCO3. Очищення за допомогою флеш-хроматографії (SiO2, 0-20% MeOH/CH2Cl2) дала цільовий продукт із виходом + 85% (17,4 г). LC-MS Rt (час утримання): 1,73 хв, MS: (ES) m/z 234 (M+H ). c) Оксаліл хлорид (3,2 мл; 30,75 ммоль) додали до розчину 2-фтор-6-метилбензойної кислоти (3,79 г; 24,6 ммоль) в CH 2Cl2 (20 мл) у реакційну колбу за кімнатної температури, а потім додали каталітичну кількість ДМФА. Реакцію проводили при перемішуванні протягом 2 годин за кімнатної температури. Розчинник і надлишок оксаліл хлориду вилучили під вакуумом і осад висушили за умов високого вакууму протягом 20 хв. Отриманий хлорангідрид розчинили в безводному CH2Cl2 (20 мл) і охолоджували до 0ºC, а потім додали піперидин, отриманий на стадії b) (5,56 г; 20,5 ммоль) і Et 3N (8,6 мол; 61,5 ммоль). Потім дали суміші нагрітися до кімнатної температури й перемішували протягом ночі. Реакційну суміш розвели CH2Cl2 і додали воду. Шари розділили, причому водний шар екстрагували CH 2Cl2. Об'єднані органічні шари висушили (MgSO4) і концентрували за зниженого тиску. Осад очистили за допомогою флешхроматографії (SiO2, 10-35% ЕtOAc/гексани) з одержанням 7,47 г цільової сполуки, вихід 99%). + LC-MS Rt (час утримання): 2,50 хв. і 2,58 хв. (два ротамера), MS: (ES) m/z 370 (M+H ). d) Розчин алюмогідриду літію (2,0 M у ТГФ; 8,2 мл; 16,4 ммоль) додали до розчину ефіру від стадії c) (2,98 г; 8,06 ммоль) у ТГФ (100 мл) при 0ºC. Отриманий розчин перемішували при 0ºC протягом 2 годин, за цей час реакція завершувалася. Додали по краплях 15% водний NaОН (625 мкл) для погашення реакції, а потім Н2O (625 мкл). До каламутної колоїдної суміші додали додаткову воду (1,85 мл), і перемішували суміш протягом 1 години за кімнатної температури. Потім суміш фільтрували крізь целітову пробку, а фільтрат концентрували за зниженого тиску. Очищення за допомогою флеш-хроматографії (SiO2, 33-67% ЕtOAc/гексани) давало 2,46 г цільового продукту (вихід 93%). LC-MS: Rt (час утримання): 1,90 хв. і 2,09 хв. (два ротамера), + MS: (ES) m/z 328 (M+H ). e) Розчин спирту зі стадії d) (1,42 г; 4,33 ммоль) в оцтовій кислоті (65 мл) додали до кашки CrО3 (2,61 г; 26,1 ммоль) в Н2O (16 мл) за кімнатної температури. Отриману суміш перемішували за кімнатної температури до завершення реакції (90 хв). Потім суміш фільтрували через целитову пробку, а фільтрат концентрували за зниженого тиску. Очищення за допомогою флеш-хроматографії (SiO2, 3-10% CH2Cl2:MeОН, а потім 50-67% ЕtOAc/гексани) давало 1,03 г цільового продукту (вихід 70%). LC-MS: Rt (час утримання): 1,88 хв. і 2,12 хв. (два + ротамера), MS: (ES) m/z 342 (M+H ). f) 3-трифторметиланілін (16,2 мг; 0,1 ммоль; 1,0 екв.) додали до розчину кислоти, отриманої вище (34,2 мг; 0,1 ммоль), і триетиламіну (6 екв.) в CH 2Cl2 (1 мл). Потім повільно додали T3P (95,5 мг; 0,15 ммоль), і перемішували розчин за кімнатної температури протягом 1,5 годин. Реакційну суміш розбавили CH2Cl2 (1 мл), промили 1 N водної HСl, а потім насиченим водним NaHCO3. Органічний шар відокремили, висушили над безводним Mg 2SO4 і концентрували за зниженого тиску. Очищення за допомогою флеш-хроматографії (SiO2, 5-40% ЕtOAc/гексани) 1 дало 35 мг (вихід 73%) продукту у вигляді білої твердої речовини. H ЯМР (400 МГц, CDCl3) δ 1.22-2.45 (m, 8 H), 2.93-3.32 (m, 3 H), 6.77-7.82 (m, 12 H), 9.10 (s, 0.38 H), 9.30 (s, 0.62 H). LC-MS: + Rt (час утримання) = 2,88 хв, MS: (ES) m/z 485 (M+H ). Приклад 2 Синтез N-(3-трет-бутилфеніл)-1-(5-хлор-3-метилпіколіноїл)-2-фенілпіперидин-3карбоксаміду 22 UA 112514 C2 H 2N O O CH 2Cl2, K2 CO3 Cl N N H step a Cl N Cl step b O PhB(OH) 2 Pd(PPh 3) 4 K2 CO3 O PtO2, H2 HCl/EtOH N H step c N H N H N OH O Cl O N HCTU iPr 2EtN N H N step d O Cl 5 10 15 20 25 30 35 N де: step - стадія a) 2-хлорнікотиноїл хлорид (1,05 екв.), розчинений у безводному дихлорметані (0,5 M), додавали до розчину 3-трет-бутиланіліну (1 екв.) і 2 M водного K2CO3 (2,2 екв.) у безводному дихлорметані (0,5 M) при 0ºC протягом 30 хв., і реакційну суміш перемішували за кімнатної температури протягом додаткових 1,5 годин. Шари розділили, при цьому водний шар екстрагували дихлорметаном. Об'єднаний органічний шар промили розсолом, висушили (Mg2SO4), профільтрували й концентрували з одержанням цільового аміду у вигляді піноутворювальної твердої речовини, яка була використана «як є» у наступній стадії без + подальшого очищення. MS: (ES) m/z 289,1 (M+ H ). b) Pd(PPH3)4 (2-5 мол%) додали до розчину вищевказаного піридинаміду (1 eq), фенілборонової кислоти (1,4 екв.) і 2 M водного K2CO3 (2,4 екв.) у толуолі (0,7 M), і реакційну суміш нагрівали при 100ºC протягом ночі (~12 годин). Після охолодження до кімнатної температури реакційну суміш фільтрували крізь целіт, а целітову пробку промили ЕtOAc. Фільтрат розвели водою й екстрагували ЕtOAc, висушили (Mg 2SO4), профільтрували й концентрували за зниженого тиску. Осад очистили за допомогою автоматизованої флешхроматографії (SiO2, 10% до 100% градієнт ЕtOAc-гексани) і висушили під вакуумом з + одержанням 2-феніл-3-карбоксиамідпіридину з виходом 60-75%, MS: (ES) m/z 331,2 (M+ H ). c) PtO2 (10 мол%) додали до розчину похідного 2-фенілпіридину, отриманого вище (1 екв.), в ЕtOН і концентрованої HСl (надлишок, у відношенні 4:1), і реакційну суміш гідрогенізували, використовуючи шейкер Парра при 40-45 псі протягом 1,5 годин. Суміш профільтрували крізь целіт, промили ЕtOН, а фільтрат концентрували. Осад розбавили CH 2Cl2 і промили насиченим водним NaHCO3. Потім осад очистили за допомогою автоматизованої флеш-хроматографії (SiO2, 1% до 30% градієнт CH2Cl2-MeOH) і висушили під вакуумом з одержанням титульної + сполуки з виходом ~85% у вигляді піноподібної твердої речовини. MS: (ES) m/z 337,2 (M+ H ). d) 5-хлор-3-метилпіколінову кислоту (30 мг; 0,16 ммоль) і N-(3-трет-бутилфеніл)-2фенілпіперидин-3-карбоксамід (50 мг; 0,15ммоль, отриманий на стадії c) вище) розчинили в безводному ДМФА (1 мл). Додали N,N-диізопропілетиламін (0,15 мл) за кімнатної температури, а потім HCTU (67 мг; 0,16 ммоль). Після перемішування 2 години за температури навколишнього середовища визначили завершення реакції за допомогою LC-MS і ТШХ. Реакційну суміш розвели ЕtOAc (50 мл) і промили 1 N HСl (20 мл), насиченим NaHCO 3 (30 мл) і розсолом (30 мл), а отриманий розчин концентрували за зниженого тиску. Осад очистили за допомогою препаративної ВЕРХ (20 → 95% градієнт MeCN-Н2O з 0,1% ТФОК) і чисті фракції ліофілізували з одержанням титульної сполуки (50 мг, вихід 67%). ВЕРХ час утримання = 2,88 1 хвилин. H ЯМР (400 МГц, CDCl3) δ 8.42 (d, 1 H, J = 0.8 Гц), 7.97 (br, 1 H), 7.59 (d, 1 H, J = 0.8 Гц), 7.56 (d, 1 H, J = 7.6 Гц), 7.34 (m, 3 H), 7.20 (m, 3 H), 7.10 (d, 1 H, J = 7.6 Гц), 6.61 (дві серії br, 1 H), 3.12 (дві серії m, 2 H), 2.94 (три серії m, 1 H), 2.36 (s, 3 H), 2.20 (дві серії br, 2 H), 1.74 (br + комплекс, 2 H), 1.29 (s, 9 H). MS: (ES) m/z 490.2 (M+ H ). 23 UA 112514 C2 Приклад 3 Синтез (3-трет-бутилфеніл)аміду карбонової кислоти ArB(OH)2 Pd(PPh 3) 4 K2C03 O N H N цис-1-(2-метилбензоіл)-2-(3-фторфеніл)піперидин-3 step a Cl O N H N PtO2, H2 HCl/EtOH step b F O Cl O N H O N H N O N H Et 3 N, CH 2Cl2 F step c F 5 10 15 20 25 30 35 де: step - стадія a) До суміші N-(3-трет-бутилфеніл)-2-хлорнікотинаміду (570,2 мг; 2 ммоль), 3фторфенілборонової кислоти (401,2 мг; 2,8 ммоль), 3 мл толуолу й 1 мл 2 N карбонату калію у воді додали тетракис(трифенілфосфин)паладій(0) (234,5 мг; 0,2 ммоль). Потім суміш нагрівали при 90 C протягом 3 годин в атмосфері азоту, перед тем як вона була охолоджена до кімнатної температури. Потім реакційну суміш розбавили 30 мл води й 150 мл ЕtOAc. Органічний шар відокремили, промили розсолом і висушили (Na2SO4). Органічний розчинник вилучили за зниженого тиску й осад очистили за допомогою колонки із силікагелем (40% ЕtOAc у гексані) з одержанням N-(3-трет-бутилфеніл)-2-(3-фторфеніл)нікотинаміду (691,4 мг, 99%). MS: (ES) m/z + 394.5 (M+H ). b) Суміш N-(3-трет-бутилфеніл)-2-(3-фторфеніл)нікотинаміду (501,2 мг; 1,4 ммоль), двоокису платини (51,9 мг; 0,21 ммоль) і концентрованої HСl (400 мкл; 5,2 ммоль) в 5 мл етанолу енергійно перемішували в атмосфері азоту протягом ночі. Суміш профільтрували, і тверді речовини промили 25 мл метанолу три рази. Об'єднаний розчин висушили за зниженого тиску. До осаду додали 30 мл насиченого бікарбонату натрію й 150 мл ЕtOAc. Органічний шар відокремили й висушили над сульфатом натрію. Випаровування розчинника дало сирий (3-третбутилфеніл)амід 2-(3-фторфеніл)піперидин-3-карбонової кислоти у вигляді бурої твердої + речовини, яка була взята безпосередньо в наступну стадію. MS: (ES) m/z 355.7 (M+H ). c) До розчину (3-трет-бутилфеніл)аміду 2-(3-фторфеніл) піперидин-3-карбонової кислоти (отриманого вище, 177, 3 мг; 0,5 ммоль) в 2 мл дихлорметану додали Et 3N (100 мкл, надлишок) і 2-метилбензоіл хлорид (92,3 мг; 0,6 ммоль) за кімнатної температури. Потім отриманий розчин перемішували за цієї температури до завершення реакції (10 хв.). Потім реакційну суміш завантажили в силикагелеву колонку й очистили за допомогою ISCO (30% ЕtOAc у гексані) з одержанням кінцевого продукту (3-трет-бутилфеніл)аміду 2-(3-фторфеніл)-1-(21 метилбензоіл)піперидин-3-карбонової кислоти (151,2 мг, вихід 64%). H ЯМР (400 МГЦ, CDCl3, суміш ротомерів): δ 7.91 (s, 0.6 H), 7.85 (s, 0.4 H), 7.18-7.46 (m, 9 H), 7.11 (m, 1 H), 6.95 (m, 1 H), 6.67 (d, J = 1.2 Гц, 1 H), 3.36 (d, J = 1.6 Гц, 0.4 H), 3.26 (d, J = 1.6 Гц, 1 H), 3.05 (m, 1 H), 2.89 (t, J = 1.2 Гц, 1 H), 2.45 (s, 1 H), 2.02-2.40 (m, 4 H), 1.70-1.84 (m, 3 H), 1.44-1.64 (s, 1 H), 1.32 (s, 6 H), + 1.25 (s, 1 H). MS: (ES) m/z 473.2 (M+H ). Приклад 4 Синтез (3-трет-бутилфеніл)аміду цис-1-(2-метилбензоіл)-2-(2,2-диметилпропіл)піперидин-3карбонової кислоти 24 UA 112514 C2 H 2N O O CH 2Cl2, EDCI OH N N H step a Br N Br step b MgCl CuCN O O PtO2, H2 HCl/EtOH N H step c N H N H N Cl O O DMAP CHCl3 /pyridine step d N H N O 5 10 15 20 25 30 35 де: step - стадія; piridine - піридин a) До розчину 2-бромнікотинової кислоти (1,01г; 5 ммоль) розчиненої в безводному дихлорметані (8 мл), при перемішуванні, додали EDCI (1,34 г; 7 ммоль) і 3-трет-бутиланілін (0,74 г; 5 ммоль) за кімнатної температури, потім реакційну суміш перемішували протягом 12 годин. Потім суміш розбавили дихлорметаном, а потім промили насиченим бікарбонатом натрію й водою. Шар дихлорметану висушили над безводним сульфатом магнію, профільтрували й концентрували за зниженого тиску. Осад очистили за допомогою флеш-хроматографії з одержанням 2-бром-N-(3-трет-бутилфеніл)нікотинаміду з виходом 59% (950 мг). Rt: 2,44 хв. (20+ 100-5 метод). MS: (ES) m/z 333, 335 (M+H ). b) 2,2-диметилпропілмагній хлорид (1 M-диетилефір; 4,8 мл; 4,8 ммоль) додали до суспензії ціаніду міді (215 мг; 2,40 ммоль) у ТГФ (6 мл) при -78˚C. Після перемішування за тієї ж самої температури протягом 1 години 2-бром-N-(3-трет-бутилфеніл)нікотинамід (200 мг; 0,601 ммоль) був доданий увесь відразу у вигляді твердої речовини. Реакційну суміш поступово нагріли до кімнатної температури й перемішували протягом ночі. Додали насичений розчин хлориду амонію й етилацетату, реакційну суміш профільтрували крізь целіт і сполоснули етилацетатом. Шари розділили, і продукт ще раз екстрагували з етилацетатом. Об'єднані органічні шари промили розсолом і висушили над безводним сульфатом натрію. Після видалення розчинника за зниженого тиску сирий матеріал очистили за допомогою колонкової хроматографії на силікагелі з використанням градієнта 20% - 50% етилацетату в гексанах з виходом N-(3-третбутилфеніл)-2-(2,2-диметилпропіл) нікотинаміду (168 мг; 0,517 ммоль, 86%). Rf = 0.45 (толуол: етилацетат = 2:1). c) N-(3-трет-бутилфеніл)-2-(2,2-диметилпропіл)нікотинамід (168 мг; 0,517 ммоль) розчинили в етанолі (5 мл). Додали оксид платини (11,6 мг; 0,0511 ммоль), а потім концентровану соляну кислоту (250 мкл). Реакційну суміш гідрогенізували, використовуючи шейкер Парра, протягом 1,5 годин при 45 псі. Аналіз реакційної суміші показав неповну конверсію, і цикл був повторений ще раз. Оксид платини відфільтрували, а розчинники вилучили за зниженого тиску. Сиру речовину нейтралізували за допомогою насиченого розчину бікарбонату натрію й екстрагували етилацетатом. Потім органічний шар промили розсолом і висушили над безводним сульфатом магнію. Видалення розчинника за зниженого тиску давало сирий (3-трет-бутилфеніл)амід 2,3цис-2-(2,2-диметилпропіл)піперидин-3 карбонової кислоти (153 мг), який використовували в наступній стадії без додаткового очищення. d) До розчину (3-трет-бутилфеніл)аміду 2,3-цис-2-(2,2-диметилпропіл) піперидин-3карбонової кислоти (84,8 мг; 0,257 ммоль) у піридині (415 мкл; 5,13 ммоль) за кімнатної температури додали 2-метилбензоіл хлорид (81,6 мг; 0,528 ммоль) у хлороформі (415 мкл). Для посилення реакції додали каталітичну кількість (не зважену) диметиламінопіридину, а суміш перемішували протягом трьох днів. Потім до реакційної суміші додали етилацетат і воду, і продукт екстрагували з етилацетатом три рази. Об'єднані органічні шари висушили над 25 UA 112514 C2 5 10 безводним сульфатом магнію. Після видалення розчинника за зниженого тиску сиру речовину очистили за допомогою силікагель-хроматографії, використовуючи 10% - 20% етилацетат у гексанах з одержанням (3-трет-бутилфеніл)аміду 2,3-цис-2-(2,2-диметилпропіл)-1-(2метилбензоіл) піперидин-3- карбонової кислоти (47,0 мг; 0,105 ммоль, 41%). Rf = 0,6 (гексани: етилацетат = 2:1). Rt = 3,16 хв., 3,26 хв. (сполука існує у вигляді суміші декількох конформерів 1 20-100-5 метод.). H ЯМР (CDCl3) δ 9.68 (s, 1 H), 9.43 (s, 1 H), 8.33 (s, 1 H), 8.28 (s, 1 H)), 6.977.79 (m, 8 H), 5.48 (br, 1 H), 5.39 (dd, J = 4, 10 Гц, 1 H), 5.33 (dd, J = 6, 6 Гц, 1 H), 3.38 (ddd, J = 4, 14, 14 Гц, 2 H), 3.25 (dd, J = 13, 13 Гц, 2H), 2.66 (dd, J = 4, 8.4 Гц, 1 H), 2.63 (ddd, J = 2.8, 2.8, 8 Гц, 1 H), 2.50 (s, 9 H), 2.40 (s, 9 H), 2.25 (s, 9 H), 2.13 (s, 9 H), 1.79-1.99 (m, 2 H), 1.23-1.56 (m, 2 + H), 1.32 (s, 9 H), 1.07 (s, 9 H), 1.06 (s, 9 H), 0.97 (s, 9 H), 0.95 (s, 9 H). MS: (ES) m/z 449 (M+H ). Приклад 5 Синтез (3-трет-бутилфеніл)аміду цис-2-циклопентил-1-(2-метилбензоіл) піперидин-3карбонової кислоти ZnBr O O OMe OMe N Cl O CuI, Pd(dppf)Cl2 DMA, 70 oC step a N H 2N N H n-BuLi,THF, -78 to 0 o C N step b PtO2 , H2 HCl/EtOH step c Cl O O O N H N O 15 20 25 30 35 40 Et3 N, CH 2Cl2 N H N H step d де: step - стадія; THF - ТГФ a) Циклопентилцинк бромід (0,5 M; 6,5 мл; 3,26 ммоль) додали до розчину, який перемішувався за кімнатної температури, складного метилового ефіру 2-хлорнікотинової кислоти (400 мг; 2,33 ммоль), Cui (19 мг; 0,1 ммоль) і Pd(dppf)Cl2 (42 мг; 0,06 ммоль) у безводному диметилацетаміді (1,7 мл) під азотом. Реакційну суміш нагрівали до 70 C протягом 3,5 годин, охолоджували до кімнатної температури, відфільтрували крізь целіт, а фільтраційний осад промили етилацетатом. Фільтрат промили водою, розсолом, висушили (Mg 2SO4), профільтрували й концентрували за зниженого тиску. Осад очистили за допомогою флешхроматографії (SiO2, 10-100% ЕtOAc/гексани) з одержанням цільової сполуки з виходом 83% + (400 мг). LC-MS Rt (час утримання): 1,87 хв; MS: (ES) m/z 206 (M+H ). b) н-BuLi (1,47 мл; 3,68 ммоль) додали до 3-трет-бутиланіліну (580 мг; 3,89 ммоль) при -78 C у безводному ТГФ (2 мл) під азотом, і перемішували розчин при 0 C протягом 10 хвилин. Реакційну суміш удруге охолоджували до -78 C і до неї додали складний метиловий ефір циклопентил-нікотинової кислоти (400 мг; 1,94 ммоль), розчинений у безводному ТГФ (2 мл). Реакційної суміші давали досягти 0 C протягом 2 годин, гасили насиченим водним NH 4Cl і екстрагували етилацетатом. Об'єднані органічні шари висушували (Mg 2SO4), фільтрували й концентрували за зниженого тиску. Осад очистили за допомогою флеш-хроматографії (SiO2, 10100% ЕtOAc/гексани) з одержанням чистої сполуки з виходом 91% (572 мг). LC-MS Rt (час + утримання): 2,61 хв.; MS: (ES) m/z 323 (M+H ). c) До розчину N-(3-трет-бутилфеніл)-2-циклопентилнікотинаміду (570 мг; 1,77 ммоль) в етанолі (10 мл), що містить концентровану HСl (1 мл), додали оксид платини (40 мг; 0,17 ммоль), і розчин гідрогенізували, використовуючи шейкер Парра при 40 псі протягом 1,5 годин. Реакційну суміш профільтрували крізь целіт, фільтраційний осад промили етанолом. Фільтрат концентрували, а осад висушили за умов високого вакууму протягом 2 годин з одержанням кількісного виходу цільового піперидину у вигляді HСl солі. LC-MS Rt (час утримання): 1,97 хв; + MS: (ES) m/z 329 (M+H ). d) До розчину (3-трет-бутил-феніл)аміду цис-2-циклопентилпіперидин-3-карбонової кислоти, отриманого вище (123 мг; 0,34 ммоль), у безводному CH2Cl2 (1 мл), який містить Et3N (142 мкл; 1,02 ммоль), додали 2-метилбензоіл хлорид (53 мг; 0,34 ммоль), і суміш перемішували за кімнатної температури протягом 2 годин. Потім реакційну суміш розбавили етилацетатом (20 26 UA 112514 C2 5 10 мл), промили 1 N водної HСl, водою й розсолом. Органічний шар висушили (Mg 2SO4), профільтрували й концентрували за зниженого тиску. Осад очистили за допомогою оберненофазової препаративної ВЕРХ (20-95% градієнт CH3CN-Н2O) і висушили (ліофілізатор) з 1 одержанням титульної сполуки з виходом 65% (109 мг). H ЯМР (400 МГц, CDCl3): δ 1.22-1.48 (m, 11 H), 1.56-1.80 (m, 5 H), 1.84-2.06 (m, 4 H), 2.10-2.23 (m, 1 H), 2.30 (s, 1.6 H), 2.39 (s, 1.4 H), 2.41-2.50 (m, 1 H), 2.71-2.76 (m, 1 H), 3.02-3.09 (m, 1 H), 3.25-3.39 (m, 1 H), 5.11 (bs, 1 H), 7.057.30 (m, 6 H), 7.47-7.55 (m, 2 H), 8.32 (bs, 1 H). LC-MS Rt (час утримання): 3,16 хв; MS: (ES) m/z + 447 (M+H) . LC-MS метод: Agilent Zorbax SB-C18, 2.1( 50 мм, 5µ, 35 (C, 1 мл/хв. швидкість потоку, 2,5 хв. градієнт 20% до 100% B із промиванням 1,0 хв. при 100% B; A= 0,1% мурашина кислота/ 5% ацетонітрил / 94,9 вода, B = 0,1% мурашина кислота / 5% вода/ 94,9 ацетонітрил. Приклад 6 Синтез (3-хлор-4-метилфеніл)аміду (2R,3S)-2-(4-циклопентиламінофеніл)-1-(2метилбензоіл) піперидин-3-карбонової кислоти HO B HO NHBoc Pd(PPh3)4 K2C03, Tol: H2O O OEt N PtO2, H2 HCl/EtOH OEt * N * H racemic step b N step a Cl O O NHBoc classical resolution step c O O N step e O O 4 N HCl dioxane OEt Cl NHBoc 1) di-toluoyl-L-tartaric acid crystallization THF/TBME 2) saturated aq.NaHCO3 O N H (2R, 3S) N O NHBoc OEt OEt NH2 OEt step d NHBoc 30%, 97% ee NaBH(OAc)3 step f O O O OEt H2N N Cl AlMe3, DCE O N H N H Cl N step g O N H (2R, 3S) 15 20 25 30 35 де: step - стадія; racemic - рацемічний; classical resolution - класичний поділ; di-toluoyl-l-tartaric acid - толуоїл-l-винна кислота; cristallization - кристалізація; saturated aq. - насичений водний; dioxane - діоксан b) етиловий ефір цис-2-(4-трет-бутоксикарбоніламінофеніл) піперидин-3- карбонової кислоти був синтезований аналогічно, як проілюстровано в Прикладі 1. c:1): етиловий ефір цис-2-(тре-бутоксикарбоніламіно-феніл)піперидин-3-карбонової кислоти (61 г; 174,8 ммоль) і ди-р-толуол-L-винну кислоту (62 г; 174,8 ммоль) розчинили в ЕtOН (500 мл). Чистий розчин концентрували й викачали насухо. Потім отриману білу сіль розчинили в 250 мл етилацетату з одержанням прозорого розчину. До цього розчину повільно додали 500 мл TBME. Отриманий розчин залишили за кімнатної температури (непорушеним) протягом 3 днів. За цей час утворилося багато білих кристалів. Потім їх відфільтрували й промили 100 мл TBME, щоб одержати білу тверду речовину (60 г). Вищезгадану сіль знову розчинили в етанолі, концентрували й викачали насухо. Отриману сіль розчинили в 500 мл ТГФ, а потім додали TBME (500 мл). Отриманий розчин залишили за кімнатної температури (недоторканим) протягом 2,5 днів. Отримані білі кристали відфільтрували з одержанням 20,5 г (збагачення 64:1) солі. c:2) до суспензії солі (16,7 г) в CH2Cl2 (150 мл), що перемішуються при 0 C додавали насичений водний розчин NaHCO3 (100 мл), і перемішували реакційну суміш за кімнатної температури протягом 30 хвилин. Шари розділили, і водний шар екстрагували з CH 2Cl2 (50 мл). Об'єднаний органічний шар промили насиченим водним NaHCO 3 (2 100 мл), висушили й концентрували з одержанням етилового ефіру (2R,3S)-2-(4-трет-бутоксикарбоніламінофеніл) 27 UA 112514 C2 5 10 15 20 25 30 35 40 45 піперидин-3- карбонової кислоти з її виходом 90% і ~с 97%. d) до розчину (0C) етилового ефіру (2R,3S)-2-(4-трет-бутоксикарбоніламінофеніл)піперидин-3- карбонової кислоти, отриманого вище (600 мг; 1,72 ммоль) у безводному CH 2Cl2 (5 мл), що містить Et3N (480 мкл; 3,44 ммоль), додали 2-метилбензоіл хлорид (266 мг;1,72 ммоль), і суміш перемішували за кімнатної температури протягом ночі. Потім реакційну суміш розвели CH2Cl2 (20 мл), промили 1 N водної HСl, водою й розсолом. Органічний шар висушили (Mg2SO4), профільтрували й концентрували за зниженого тиску з одержанням етилового ефіру (2R,3S)-2(4-трет-бутоксикарбоніламінофеніл)-1-(2-метилбензоіл) піперидин-3-карбонової кислоти з кількісним виходом і сирий продукт використовували «як є» у наступній стадії. e) 4N HСl в 1,4-диоксані ( 5 мл; 20 ммоль) повільно додали до розчину ( 0C) вищезгаданого сирого продукту етилового ефіру (2R,3S)-2-(4-трет-бутоксикарбоніламінофеніл)-1-(2метилбензоіл) піперидин-3- карбонової кислоти (840 мг; 1,72 ммоль) у безводному CH2Cl2 (4 мл). Після додавання HСl давали реакційної суміші досягнути кімнатної температури й перемішували протягом 1 години. Суміш розбавили CH 2Cl2 (30 мл), охолоджували до 0C і нейтралізували насиченим водним NaHCO3 з одержанням етилового ефіру (2R,3S)-2-(4амінофеніл)-1-(2-метилбензоіл) піперидин-3- карбонової кислоти (612 мг) з виходом 97% за дві стадії. f) Na(OAC)3BH (495 мг; 2,33 ммоль) додали до розчину етилового ефіру (2R,3S)-2-(4амінофеніл)-1-(2-метилбензоіл) піперидин-3-карбонової кислоти (612 мг; 1,67 ммоль), циклопентанону (140 мг; 1,67 ммоль) і оцтової кислоти (100 мг; 1,67 ммоль) у безводному дихлоретані за кімнатної температури, реакційну суміш нагрівали до 50 C за 4 години й перемішували протягом 48 годин. Потім суміш розбавили CH2Cl2 (30 мл), промили насиченим водним розчином NaHCO3, висушили й концентрували під вакуумом. Осад очистили за допомогою ISCO флеш-колонки з використанням етилацетату й гексанів як мобільної фази (40 г колонка, 0-40% градієнт) з одержанням етилового ефіру (2R,3S)-2-(4-циклопентиламінофеніл)1-(2-метилбензоіл) піперидин-3- карбонової кислоти (450 мг). r) Me3Al (290 мкл; 0,57 ммоль, 2M у толуолі) додали до розчину 3-хлор-4-метилфеніламіну (65 мг; 0,46 ммоль) у безводному дихлоретані (1 мл) за кімнатної температури. Перемішували протягом 20 хвилин, потім до нього додали етиловий ефір (2R,3S)-2-(4циклопентиламінофеніл)-1-(2-метилбензоіл) піперидин-3- карбонової кислоти (100 мг; 0,23 ммоль), розчинений у безводному дихлоретані (1 мл). Потім реакційну суміш нагрівали до 85 C протягом 3 годин, охолоджували до кімнатної температури, розбавили CH 2Cl2 (20 мл), промили насиченим водним розчином NaHCO3. Водний шар екстрагували з CH2Cl2 (20 мл), а об'єднаний органічний шар висушили (Mg2SO4) і концентрували. Осад очистили за допомогою оберненофазової препаративної ВЕРХ (20-95% градієнт CH3CN-Н2O з 0,1% ТФОК як добавка), фракції, які містять продукт, об'єднали разом і концентрували. Осад розвели з CH 2Cl2 (30 мл), промили насиченим водним розчином NaHCO3. Шар CH2Cl2 висушили (Mg2SO4) і концентрували з одержанням чистого (3-хлор-4-метилфеніл)аміду (2R,3S)-2-(4-циклопентиламінофеніл)-1-(2метилбензоіл) піперидин-3- карбонової кислоти з виходом 50 %. 1 H ЯМР (400 МГц, CDCl3) δ 8.4(bs, 1H), 7.55 (s, 1H), 7.37-7.05 (m, 9H), 6.55-6.52 (m, 2H), 3.77-3.70(m, 1H), 3.30-3.16 (m, 1H), 3.04-2.91 (m, 2H), 2.43-1.94 (m, 8H), 1.71-1.46 (m, 11H). Приклад 7 Наступні сполуки є репрезентативними сполуками, отриманими й установленими за допомогою методів, подібних до методів, представлених у Прикладах. Характеристики сполук надані нижче. Біологічна оцінка цих та інших сполук, отриманих, як описано тут, показано на Фігурі 1. (4-метил-3-трифторметилфеніл)амід (2R,3S)-2-(4-циклопентиламінофеніл)-1-(2-фтор-6метилбензоіл) піперидин-3- карбонової кислоти O N H CF3 N O NH F 50 1 H ЯМР (400 МГц, Tfa-d) δ 7.91 (d, J = 8.6 Гц, 1 H), 7.84 (d, J = 8.6 Гц, 1 H), 7.58-6.82 (m, 8 H), 6.75 (t, J = 8.6 Гц, 1 H), 4.10-4.00 (m, 1H), 3.60-3.47 (m, 1H), 3.45-3.41 (m, 1H), 3.33-3.25 (m, 1H), 28
ДивитисяДодаткова інформація
Назва патенту англійськоюC5ar antagonists
Автори російськоюFan, Pingchen, Greenman, Kevin Lloyd, Leleti, Manmohan Reddy, Li, Yandong, Powers, Jay, Tanaka, Hiroko, Yang, Ju, Zeng, Yibin
МПК / Мітки
МПК: A01N 43/42
Мітки: антагоністи
Код посилання
<a href="https://ua.patents.su/58-112514-antagonisti-c5ar.html" target="_blank" rel="follow" title="База патентів України">Антагоністи c5ar</a>
Попередній патент: Спосіб за рибаком виконання складових конструктивних елементів та монтажу просторової мобільної каркасно-модульної торгівельно-виставкової системи
Наступний патент: Спосіб виявлення присутності двох або більше білків, що становлять інтерес, в зразках рослинного походження
Випадковий патент: Сифон (варіанти)












