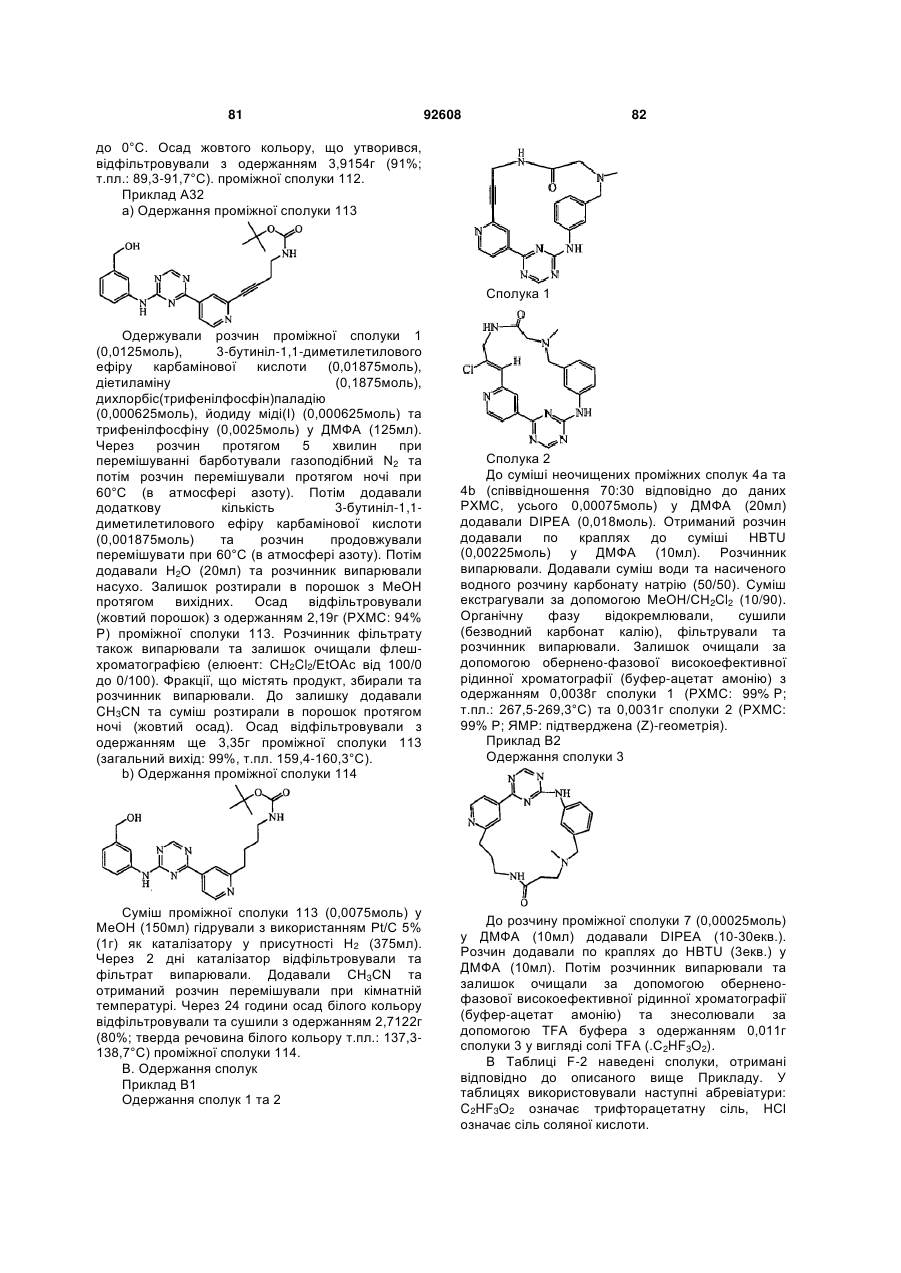
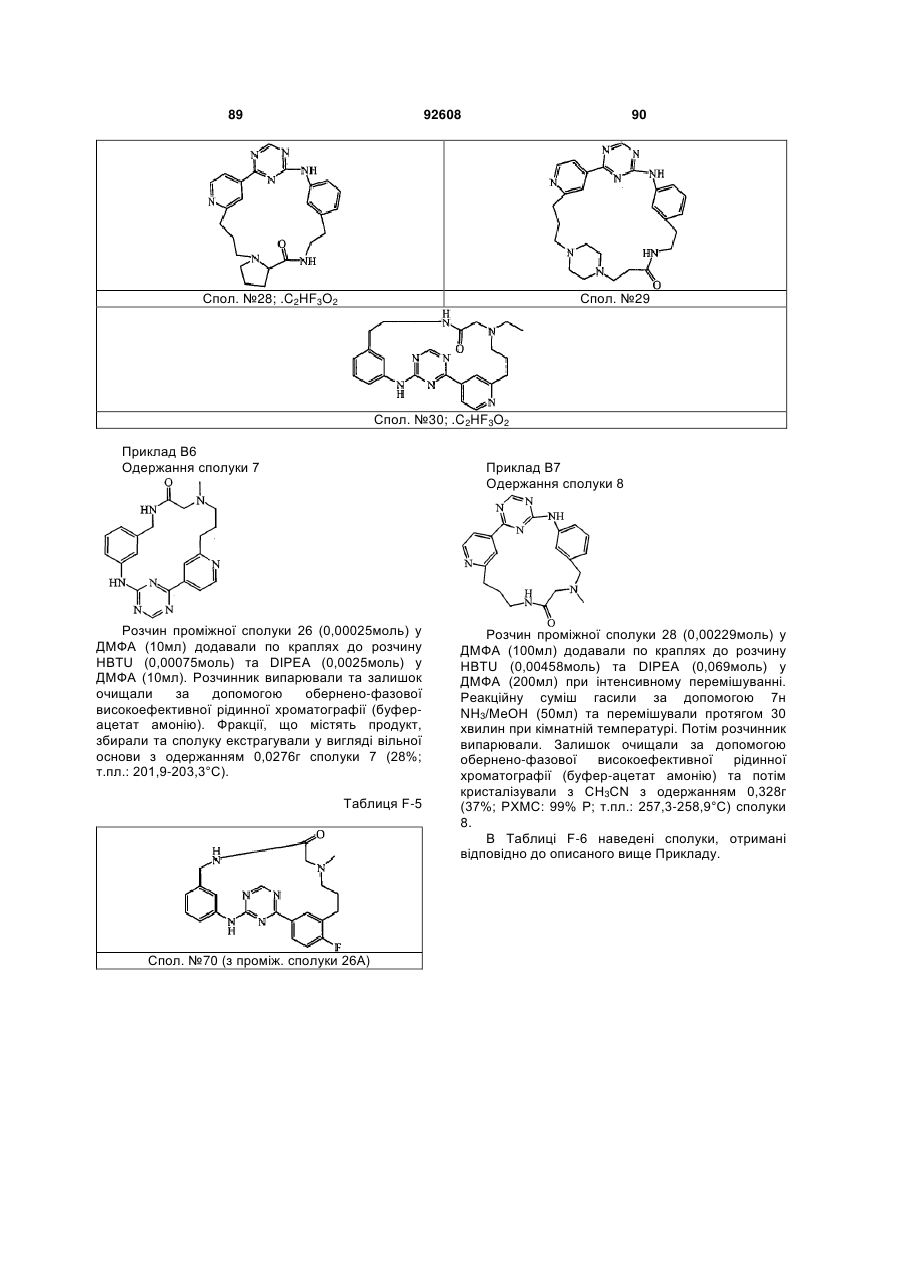
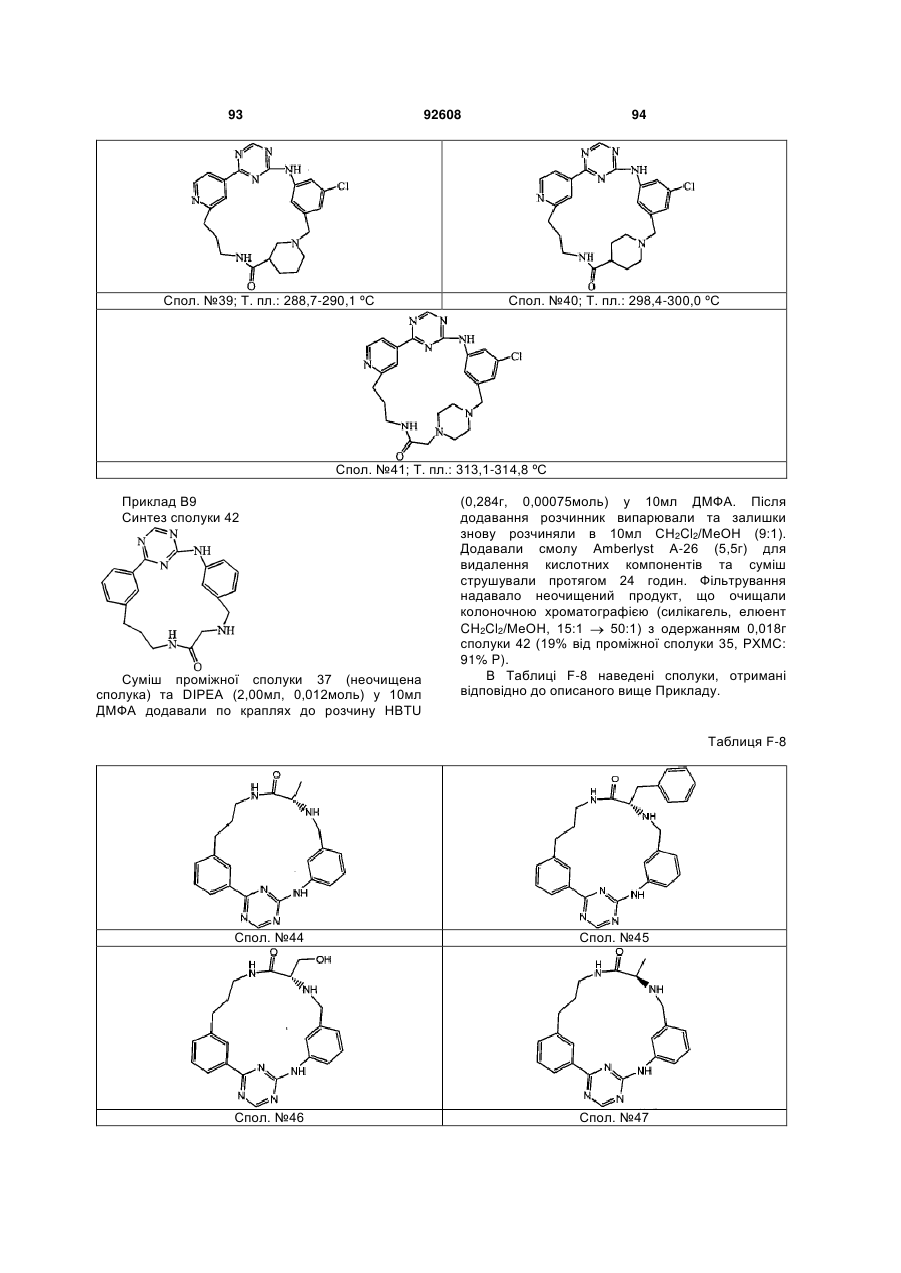
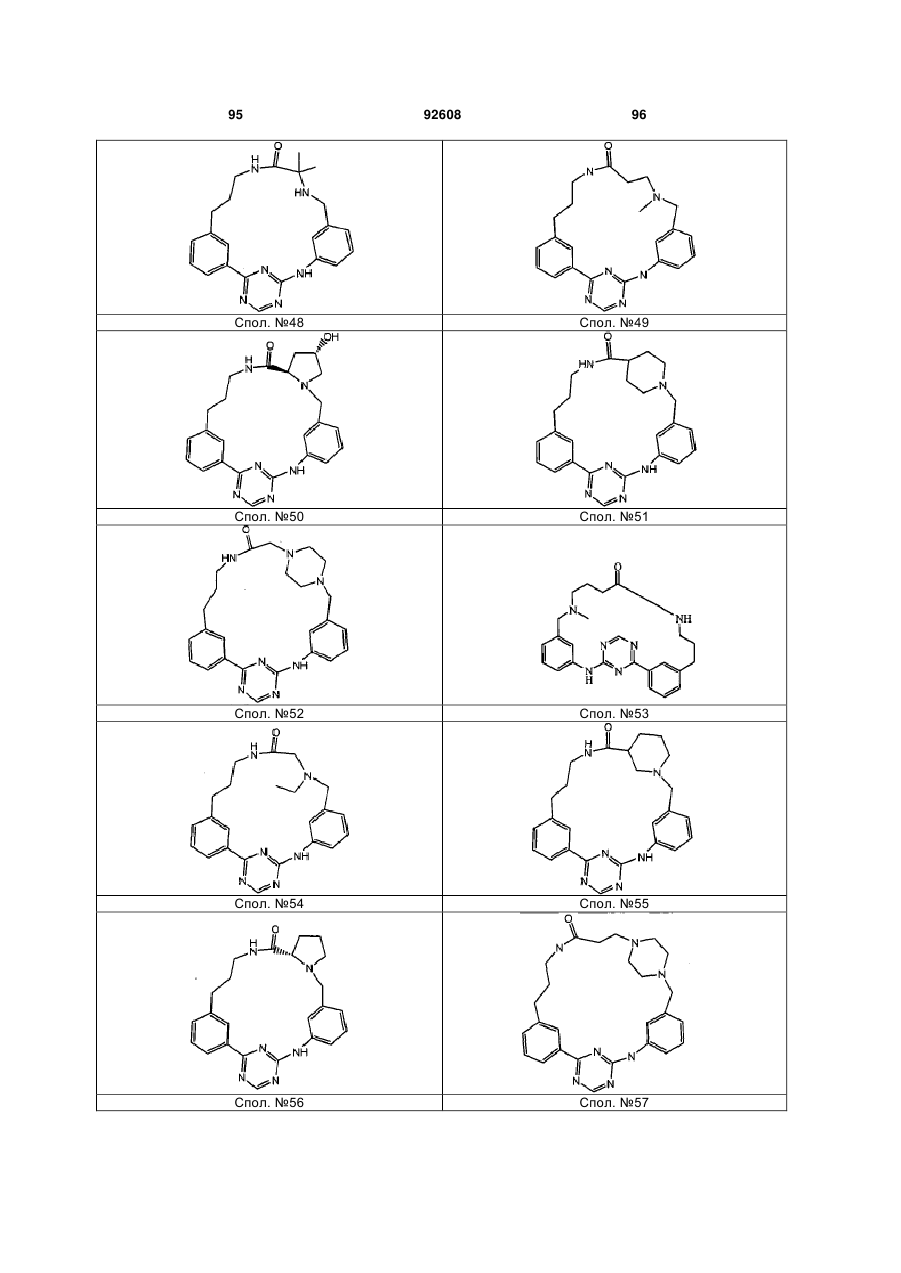
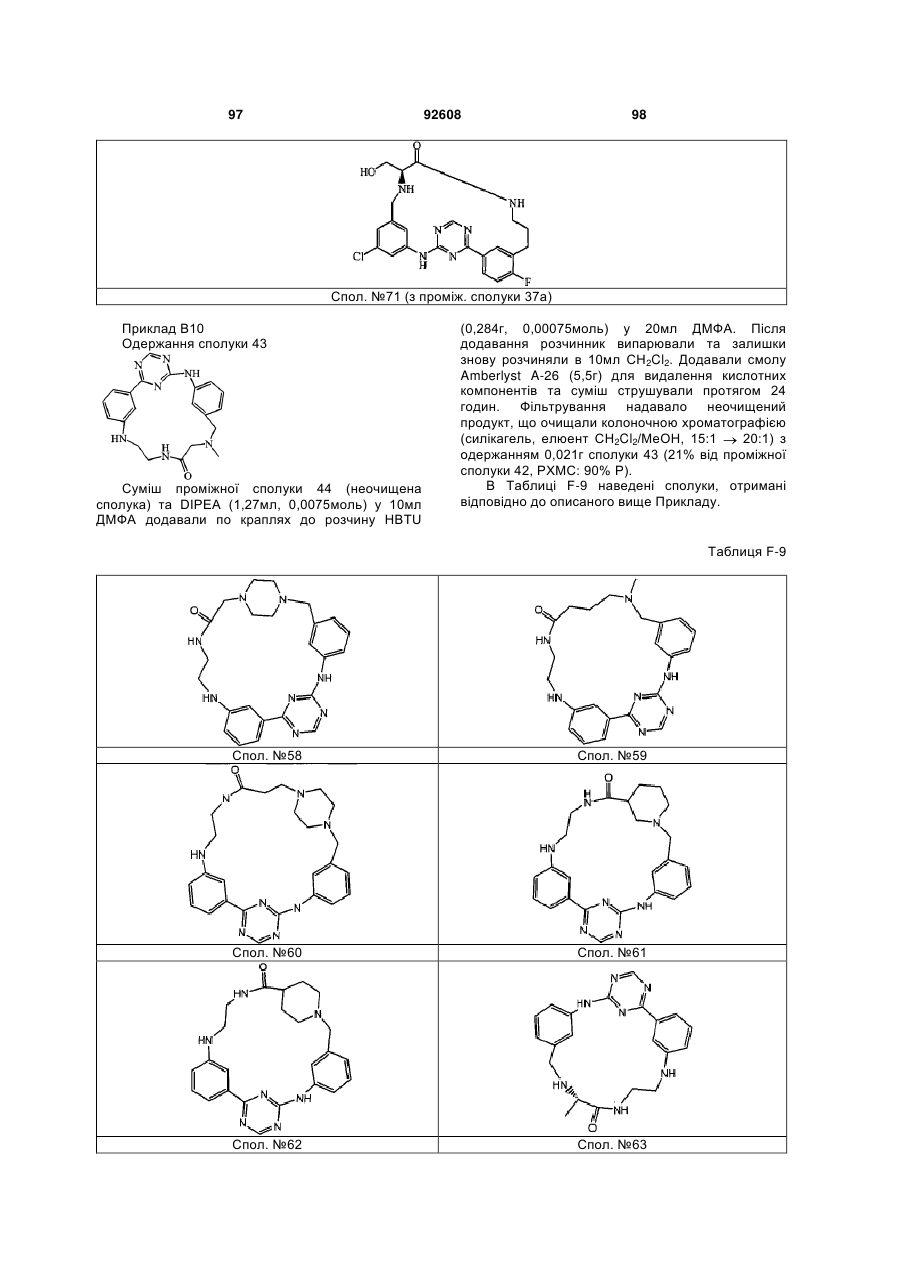
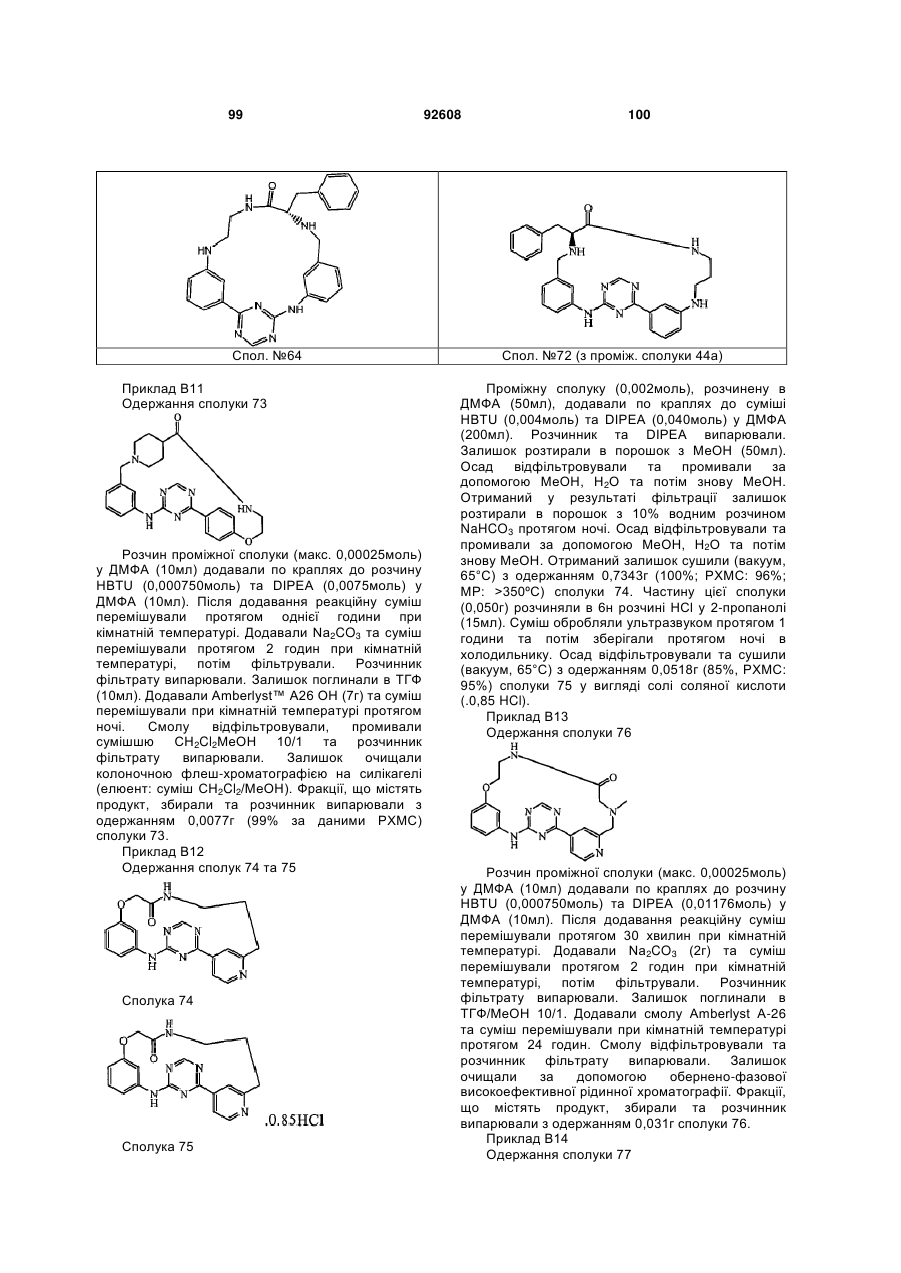
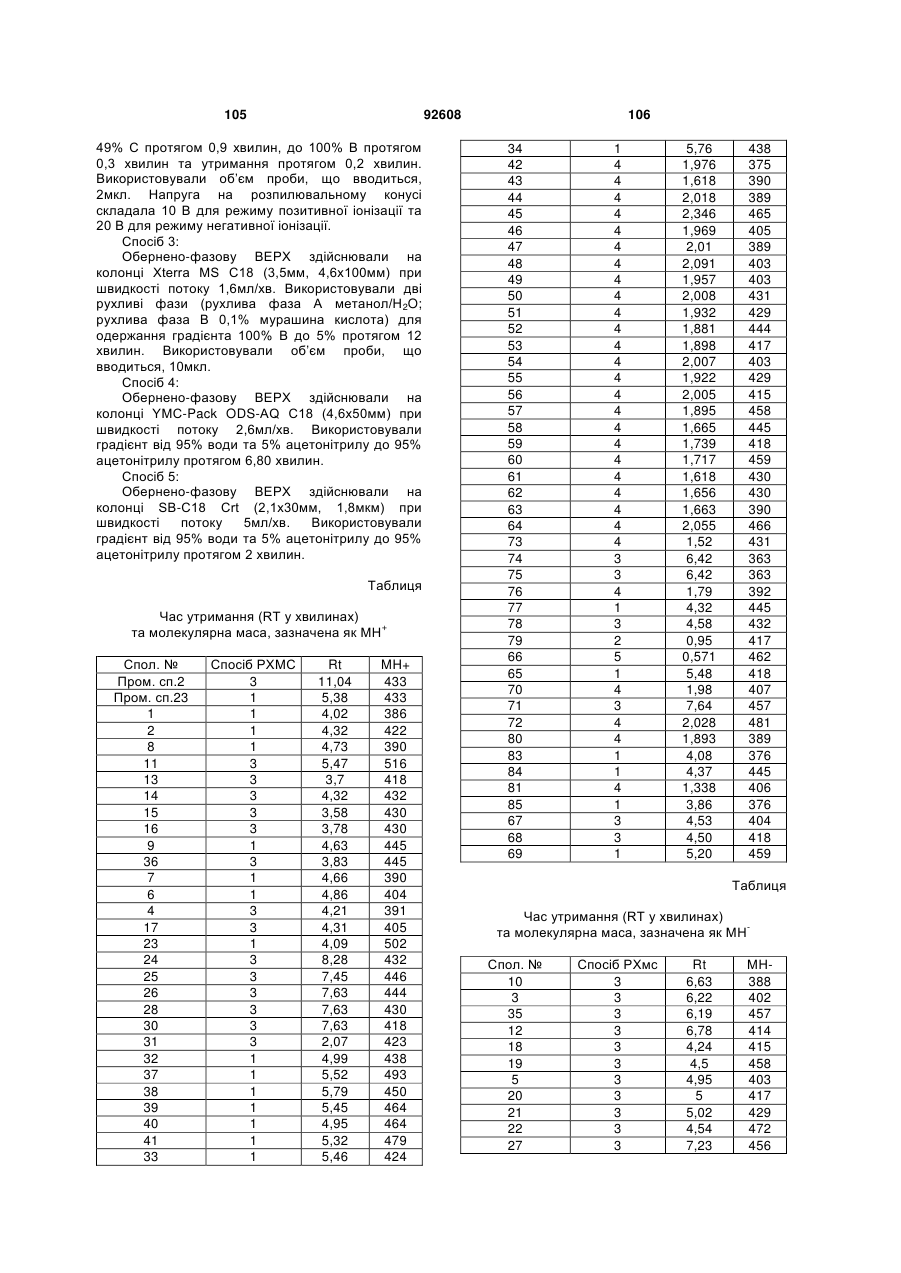
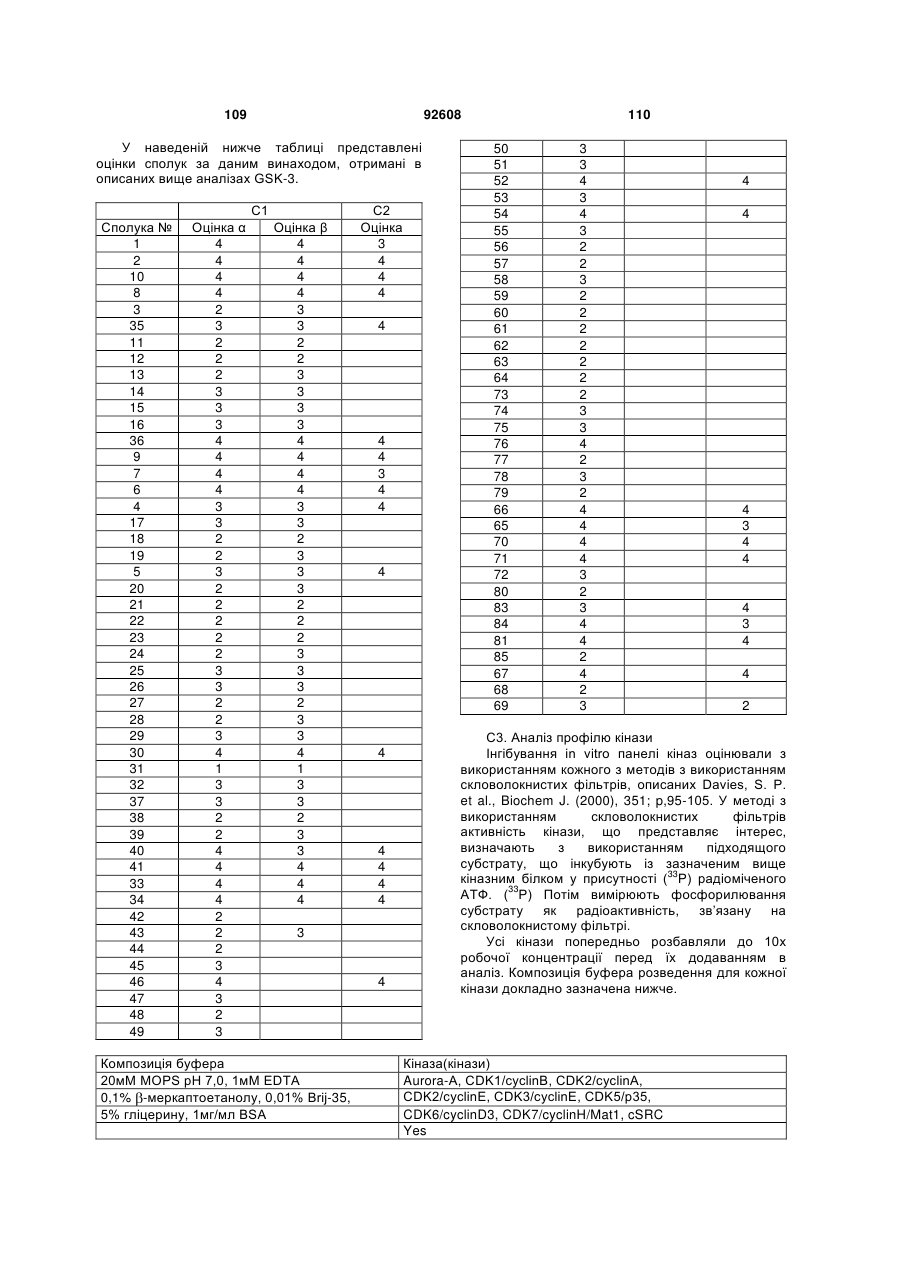
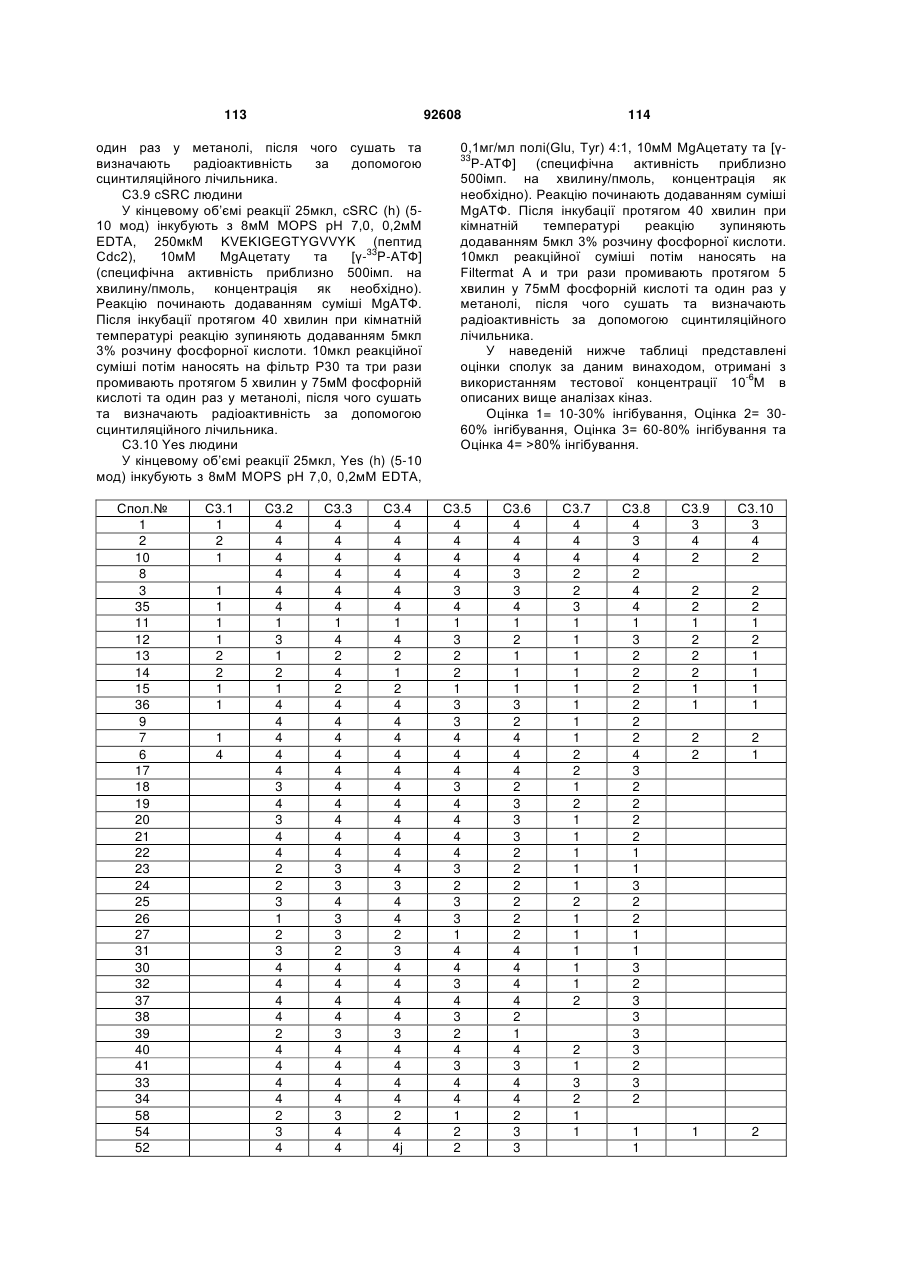
Циклічні анілінопіридинотриазини
Номер патенту: 92608
Опубліковано: 25.11.2010
Автори: Ромбутс Фредерік Ян Ріта, ван Брандт Свен Францискус Анна, Ву Тонгфей, Лав Крістофер Джон, ван Емелен Крістоф
Формула / Реферат
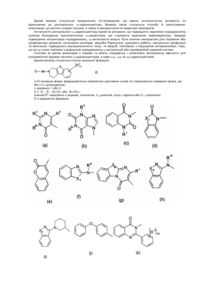
1. Сполука формули (І)
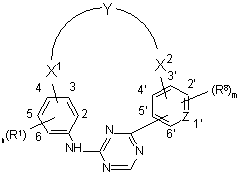 , (I)
, (I)
її N-оксидні форми, фармацевтично прийнятні адитивні солі та стереохімічно ізомерні форми, де
m означає ціле число, що має значення від 1 до 4;
n означає ціле число, що має значення від 1 до 4;
Z являє собою N або С;
Y являє собою -NR2-C1-6aлкіл-CO-NR4-, -С1-4aлкіл-NR9-C1-4алкіл-, С1-6алкіл-СО-Het10-, -Het11CO-C1-6алкіл-, -Het12-C1-6алкіл-, -CO-Het13-C1-6алкіл-, -CO-NR10-C1-6алкіл-, -Het1-C1-6aлкіл-CO-NR5- або -Het2-CO-NR6-, де -С1-6алкільний лінкер у -NR2-C1-6aлкіл-СО-NR4- або -Het1-C1-6aлкіл-CO-NR5- необов'язково заміщений одним або, якщо це можливо, двома або більше замісниками, вибраними з гідрокси, метокси, амінокарбонілу, галогену, фенілу, індолілу, метилсульфіду, тіолу, гідроксифенілу, ціанофенілу, аміно та гідроксикарбонілу;
X1 являє собою простий зв'язок, С1-4алкіл, C1-4алкілокси-, С1-4алкіл-СО-, С2-4алкеніл, С2-4алкініл або С1-4алкіл-NR3-, де зазначений С1-4алкіл або С2-4алкеніл необов'язково заміщений одним або, якщо це можливо, двома або більше галогеновими замісниками;
X2 являє собою простий зв'язок, С1-4алкіл, С1-4алкілокси, С1-4алкіл-СО-, С1-4алкеніл, С2-4алкініл або С1-4алкіл-NR7-, де зазначений С1-4алкіл або С2-4алкеніл необов'язково заміщений одним або, якщо це можливо, двома або більше галогеновими замісниками;
R1 та R8, кожен незалежно, являють собою водень, Het14, ціано, галоген, гідрокси, С1-6алкокси-, С1-6алкіл-, моно- або ді(С1-4алкіл)амінокарбоніл-, моно- або ді(С1-4алкіл)аміносульфоніл, С1-6алкокси-, заміщений галогеном, або R1 являє собою С1-6алкіл, заміщений одним або, якщо це можливо, двома або більше замісниками, вибраними з гідрокси або галогену;
R2 та R9, кожен незалежно, являють собою водень, С1-4алкіл, С2-4алкеніл, Het3, Het4-C1-4алкіл-, Het5-C1-4алкілкарбоніл-, моно- або ді(С1-4алкіл)аміно-С1-4алкілкарбоніл- або феніл, необов'язково заміщений одним або, якщо це можливо, двома або більше замісниками, вибраними з водню, гідрокси, аміно або С1-4алкілокси-;
R3 та R7, кожен незалежно, являють собою водень, С1-4алкіл, Het6, Het7-С1-4алкіл-, С2-4алкенілкарбоніл-, необов'язково заміщений групою Het8-С1-4алкіламінокарбоніл-, С1-4алкенілсульфоніл-, С1-4алкілоксі-С1-4алкіл- або феніл, необов'язково заміщений одним або, якщо це можливо, двома або більше замісниками, вибраними з водню, гідрокси, аміно або С1-4алкілокси-;
R4, R5, R6 та R10, кожен незалежно, являють собою водень або С1-4алкіл, необов'язково заміщений гідрокси, Het9 або С1-4алкілокси;
Het1 та Het2, кожен незалежно, являє собою гетероцикл, вибраний з піролідинілу, піперидинілу, піперазинілу, піридинілу, піримідинілу, піразинілу, імідазолідинілу або піразолідинілу, де зазначені Het1 та Het2 необов'язково заміщені аміно, гідрокси, С1-4алкілом, групою гідроксі-С1-4алкіл-, фенілом, групою феніл-С1-4алкіл-, групою С1-4алкілоксі-С1-4алкіл-, моно- або ді(С1-4алкіл)аміно- або групою амінокарбоніл-;
Het3 та Het6, кожен незалежно, являють собою гетероцикл, вибраний з піролідинілу або піперидинілу, де зазначені Het3 та Het6 необов'язково заміщені одним або, якщо це можливо, двома або більше замісниками, вибраними з С1-4алкілу, С3-6циклоалкілу, групи гідроксі-С1-4алкіл-, С1-4алкілоксі-С1-4алкіл- або групи полігідроксі-С1-4алкіл-;
Het4, Het7 та Het9, кожен незалежно, являють собою гетероцикл, вибраний з морфолінілу, піролідинілу, піперазинілу або піперидинілу, де зазначені Het4, Het7 та Het9 необов'язково заміщені одним або, якщо це можливо, двома або більше замісниками, вибраними з С1-4алкілу, С3-6циклоалкілу, групи гідроксі-С1-4алкіл-, групи С1-4алкілоксі-С1-4алкіл або групи полігідроксі-С1-4алкіл-;
Het5 являє собою гетероцикл, вибраний з морфолінілу, піролідинілу, піперазинілу або піперидинілу, де зазначений Het5 необов'язково заміщений одним або, якщо це можливо, двома або більше замісниками, вибраними з С1-4алкілу, С3-6циклоалкілу, групи гідроксі-С1-4алкіл-, С1-4алкілоксі-С1-4алкілу або групи полігідроксі-С1-4алкіл-;
Het10, Het11 та Het13, кожен незалежно, являють собою гетероцикл, вибраний з піролідинілу, піперидинілу, піперазинілу, піридинілу, піримідинілу, піразинілу, імідазолідинілу або піразолідинілу, де зазначені Het10, Het11 та Het13необов'язково заміщені аміно, гідрокси, С1-4алкілом, групою гідроксі-С1-4алкіл-, фенілом, групою феніл-С1-4алкіл-, групою С1-4алкілоксі-С1-4алкіл-, групою амінокарбоніл- або групою моно- або ді(С1-4алкіл)аміно-;
Het12 являє собою гетероцикл, вибраний з піролідинілу, піперидинілу, піперазинілу, піридинілу, піримідинілу, піразинілу, імідазолідинілу або піразолідинілу, де зазначений Het12 необов'язково заміщений аміно, гідрокси, С1-4алкілом, групою гідроксі-С1-4алкіл-, фенілом, групою феніл-С1-4алкіл-, групою С1-4алкілоксі-С1-4алкіл-; групою моно- або ді(С1-4алкіл)аміно- або групою амінокарбоніл-;
Het14 являє собою гетероцикл, вибраний з морфолінілу, піролідинілу, піперазинілу, імідазолілу, піролілу, 2,3,4-триазапіролілу, 1,2,3-триазолілу, піразолілу або піперидинілу, де зазначений Het14 необов'язково заміщений одним або, якщо це можливо, двома або більше замісниками, вибраними з С1-4алкілу, С3-6циклоалкілу, групи гідроксі-С1-4алкіл-, С1-4алкілоксі-С1-4алкілу або групи полігідроксі-С1-4алкіл-.
2. Сполука за п. 1, де m означає 1; n означає 1; Z являє собою N або С, зокрема N;
Y являє собою -NR2-C1-6алкіл-CO-NR4-, -С1-4алкіл-NR9-С1-4алкіл-, C1-6алкіл-СО-Het10-, -Het11-CO-C1-6алкіл-, -Het12-C1-6алкіл-, -CO-Het13-C1-6алкіл-, -CO-NR10-C1-6алкіл-, -Het1-C1-6алкіл-CO-NR5-, -Het2-CO-NR6-, де -C1-6алкільний лінкер у групі -NR2-C1-6алкіл-CO-NR4- або -Het2-C1-6алкіл-CO-NR5- необов'язково заміщений одним або, якщо це можливо, двома або більше замісниками, вибраними з гідрокси, метокси, амінокарбонілу, галогену, ціанофенілу та фенілу;
X1 являє собою простий зв'язок, -С1-4алкіл-, С1-4алкілокси- або С1-4алкіл-NR3;
X2 являє собою простий зв'язок, С1-4алкіл, С1-4алкілокси-, С1-4алкіл-СО-, С1-4алкеніл, С2-4алкініл або С1-4алкіл-NR7-, де зазначений С2-4алкеніл необов'язково заміщений одним або, якщо це можливо, двома або більше галогеновими замісниками;
R1 являє собою водень, Het14 або галоген;
R2 являє собою водень, С1-4алкіл, С2-4алкеніл або Het4-С1-4алкіл-;
R3 та R7, кожен незалежно, являють собою водень або С1-4алкіл;
R8 являє собою водень;
R9 являє собою водень або С1-4алкіл; зокрема R9 являє собою, водень, метил, етил або ізопропіл; більш конкретно водень, метил або етил;
R4, R5, R6 та R10, кожен незалежно, являють собою водень або С1-4алкіл;
Het1та Het2, кожен незалежно, являють собою піролідиніл, піперидиніл або піперазиніл, де зазначений Het1 або Het2 необов'язково заміщений гідрокси; зокрема Het1 являє собою піролідиніл або піперазиніл, a Het2 являє собою піперидиніл, піперазиніл або піролідиніл, де зазначений піролідиніл необов'язково заміщений гідрокси;
Het4 являє собою піперазиніл, необов'язково заміщений С1-4алкілом;
Het10, Het11, Het12та Het13, кожен незалежно, являють собою піролідиніл, піперидиніл або піперазиніл, де зазначені Het10, Het11, Het12 та Het13необов'язково заміщені гідрокси; зокрема Het10, Het11, Het12та Het13являють собою піперазиніл;
Het14 являє собою морфолініл, піролідиніл, піроліл, 1,2,3-триазоліл, 2,3,4-триазапіроліл, піперидиніл або піперазиніл, де зазначений Het14 необов'язково заміщений С1-4алкілом.
3. Сполука за пп. 1 або 2, де:
m означає 1; n означає 1; Z являє собою N або С, зокрема N;
Y являє собою -NR2-C1-6алкіл-CO-NR4-, -Het11-СО-C1-6алкіл-, -CO-Het13-C1-6алкіл-, -CO-NR10-C1-6алкіл-, -Het1-C1-6алкіл-CO-NR5- або -Het2-CO-NR6-, де -C1-6алкільний лінкер у групі -NR2-C1-6алкіл-CO-NR4- або -Het1-C1-6алкіл-CO-NR5- необов'язково заміщений гідрокси;
X1 являє собою -С1-4алкіл-, -С1-4алкілокси- або С1-4алкіл-NR3;
X2 являє собою простий зв'язок, С1-4алкіл, С1-4алкілокси або С1-4алкіл-NR7-;
R1 являє собою водень або галоген;
R8 являє собою водень або галоген;
R2 являє собою водень, С1-4алкіл або Het4 -С1-4алкіл-;
R3 та R7, кожен незалежно, являють собою водень або С1-4алкіл;
R4, R5, R6 та R10, кожен незалежно, являють собою водень або С1-4алкіл;
Het1 та Het2, кожен незалежно, являють собою піролідиніл, піперидиніл або піперазиніл, де зазначений Het1 або Het2 необов'язково заміщений гідрокси;
Het4 являє собою піперазиніл, необов'язково заміщений С1-4алкілом;
Het11 являє собою піперидиніл або піперазиніл, зокрема піперазиніл;
Het13 являє собою піперидиніл або піперазиніл, зокрема піперазиніл.
4. Сполука за п. 1, де:
m означає 1; n означає 1; Z являє собою N або С;
Y являє собою -С1-4алкіл-NR9-С1-4алкіл-, -NR2-С1-4алкіл-CO-NR4-, -Het1-C1-6алкіл-CO-NR5- або Het2-CO-NR6-, де C1-6алкільний лінкер у -Y- необов'язково заміщений одним або, якщо це можливо, двома або більше замісниками, вибраними з гідрокси, галогену або фенілу;
X1 являє собою С1-4алкіл або С1-4алкілокси-, зокрема етил або етокси;
X2 являє собою С1-4алкіл, С1-4алкілокси, -NR7-С1-4алкіл-, зокрема пропіл, -NR7-eтил- або NR7-пропіл-;
R1 являє собою водень, хлор, фтор або бром;
R2 являє собою водень, С1-4алкіл або С2-4алкеніл;
R4 являє собою водень;
R5 являє собою водень або С1-4алкіл;
R6 являє собою водень або С1-4алкіл;
R7 являє собою водень або С1-4алкіл;
R8 являє собою водень, хлор, фтор або бром;
R9 являє собою водень або С1-4алкіл;
Het1 являє собою піперазиніл або піперидиніл;
Het2 являє собою піролідиніл, піперидиніл або піперазиніл, де зазначений Het2 необов'язково заміщений гідрокси.
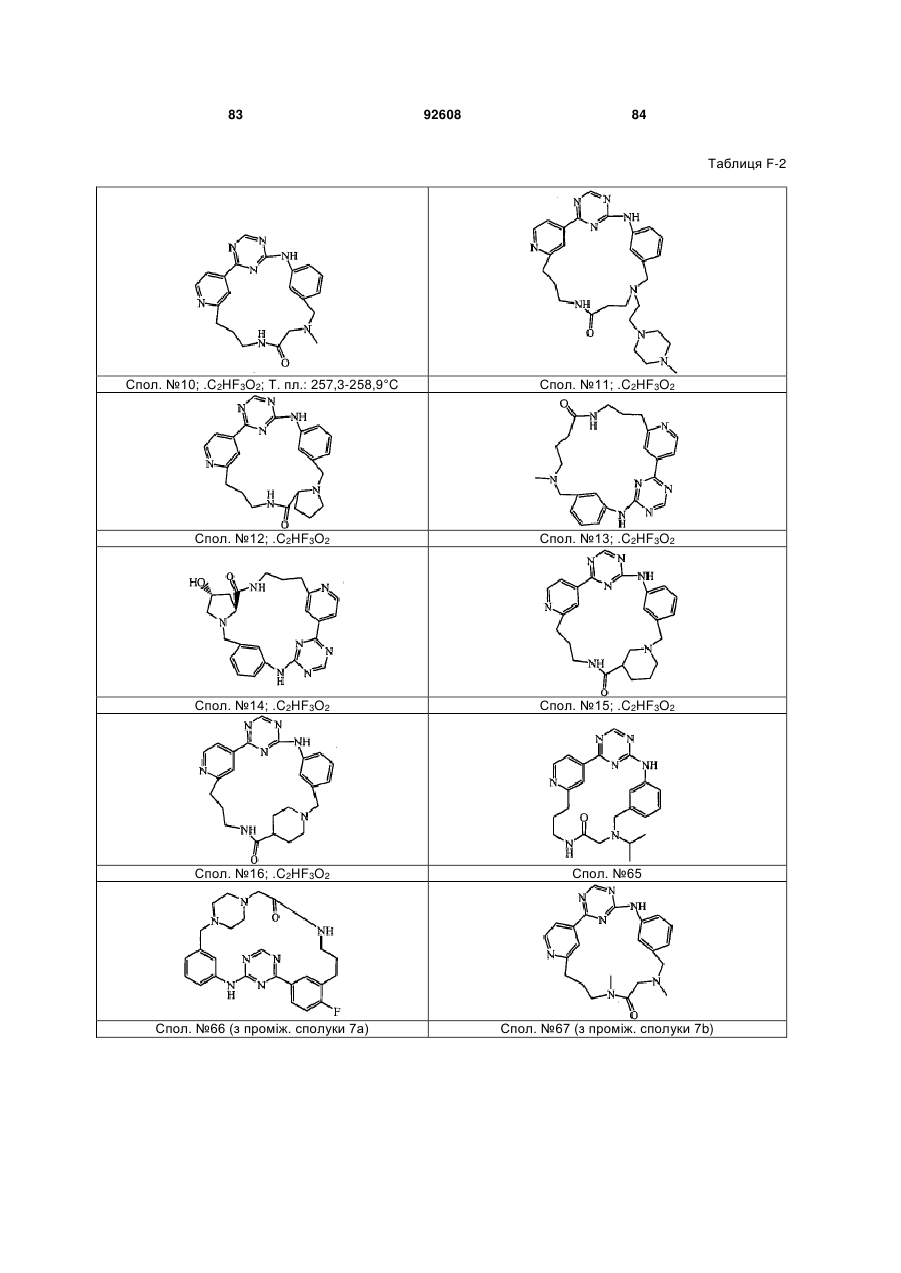
5. Сполука за п. 1, де зазначена сполука вибрана з групи, що включає:
14-метил-3,5,7,14,17,22,27-гептаазатетрацикло-[19.3.1.1~2,6~.1-8,12~]гептакоза-1(25),2(27),3,5,8(26),9,11,21,23-нонаєн-19-ін-16-он;
(19Z)-19-хлор-14-метил-3,5,7,14,17,22,27-гептаазатетрацикло[19.3.1.1~2,6~.1~8,12~]гептакоза-1(25),2(27),3,5,8(26),9,11,19,21,23-декаєн-16-он;
14-метил-3,5,7,14,17,22,27-гептаазатетрацикло-[19.3.1.1~2,6~.1-8,12~]гептакоза-1(25),2(27),3,5,8(26),9,11,21,23-нонаєн-16-он;
1,8,10,12,17,22,26,32-октаазапентацикло-[24.2.2.1~3,7~.1-9,13-.1-14,18~]тритриаконта-3(33),4,6,9(32),10,12,14(31),15,17-нонаєн-23-он;
1,8,10,12,17,22,25,31-октаазапентацикло-[23.2.2.1~3,7~1~9,13~.1~14,18~]дотриаконта-3(32),4,6,9(31),10,12,14(30),15,17-нонаєн-23-он;
17-метил-3,5,7,14,17,22,27-гептаазатетрацикло-[19.3.1.1~2,6~.1-8,12~]гептакоза-1(25),2(27),3,5,8(26),9,11,21,23-нонаєн-15-он;
18-метил-3,5,7,15,18,23,28-гептаазатетрацикло-[20.3.1.1~2,6~.1-8,12~]октакоза-1(26),2(28),3,5,8(27),9,11,22,24-нонаєн-16-он;
14-метил-3,5,7,14,17,20,22,27-октаазатетрацикло-[19.3.1.1~2,6~.1~8,12~]гептакоза-1(25),2(27),3,5,8(26),9,11,21,23-нонаєн-16-он;
14-метил-3,5,7,14,17,21,23,28-октаазатетрацикло-[20.3.1.1~2,6~.1~8,12~]октакоза-1(26),2(28),3,5,8(27),9,11,22,24-нонаєн-16-он;
18-етил-3,5,7,15,18,23,28-гептаазатетрацикло-[20.3.1.1~2,6~.1~8,12~]октакоза-1(26),2(28),3,5,8(27),9,11,22,24-нонаєн-16-он;
5-хлор-1,8,10,12,17,22,30-гептаазапентацикло-[22.2.2.1~3,7~.1-14,18-]-гентриаконта-3(31),4,6,9(30),10,12,14(29),15,17-нонаєн-23-он;
5-хлор-1,8,10,12,17,22,25,31-октаазапентацикло-[23.2.2.1~3,7-.1~9,13~.1~14,18~]дотриаконта-3(32),4,6,9(31),10,12,14(30),15,17-нонаєн-23-он;
10-хлор-14-метил-3,5,7,14,17,22,27-гептаазатетрацикло-[19.3.1.1~2,6~.1~8,12~]гептакоза-1(25),2(27),3,5,8(26),9,11,21,23-нонаєн-16-он;
10-хлор-14-етил-3,5,7,14,17,22,27-гептаазатетрацикло-[19.3.1.1~2,6~.1~8,12~]гептакоза-1(25),2(27),3,5,8(26),9,11,21,23-нонаєн-16-он;
включаючи їх N-оксидні форми, фармацевтично прийнятні адитивні солі та їх стереохімічно активні ізомерні форми.
6. Сполука за п. 1, де зазначена сполука вибрана із солей трифтороцтової кислоти:
18-етил-3,5,7,15,18,23,28-гептаазатетрацикло-[20.3.1.1~2,6~.1~8,12~]октакоза-1(26),2(28),3,5,8(27),9,11,22,24-нонаєн-16-он;
14-метил-3,5,7,14,17,21,23,28-октаазатетрацикло[20.3.1.1~2,6~.1~8,12~]октакоза-1(26),2(28),3,5,8(27),9,11,22,24-нонаєн-16-он;
1,8,10,12,17,22,25,31-октаазапентацикло-[23.2.2.1~3,7~.1~9,13~.1~14,18~]дотриаконта-3(32),4,6,9(31),10,12,14(30),15,17-нонаєн-23-он;
14-метил-3,5,7,14,17,20,22,27-октаазатетрацикло[19.3.1.1~2,6~.1~8,12~]гептакоза-1(25),2(27),3,5,8(26),9,11,21,23-нонаєн-16-он;
14-метил-3,5,7,14,17,22,27-гептаазатетрацикло[19.3.1.1~2,6~.1~8,12~]гептакоза-1(25),2(27),3,5,8(26).9 11,21,23-нонаєн-16-он або
1,8,10,12,17,22,26,32-октаазапентацикло-[24.2.2.1~3,7~.1-9,13~.1~14,18~]тритриаконта-3(33),4,6,9(32),10,12,14(31),15,17-нонаєн-23-он.
7. Сполука за будь-яким з пп. 1-6 для застосування як лікарського засобу.
8. Застосування сполуки за будь-яким з пп. 1-6 для одержання лікарського засобу для профілактики або лікування захворювань, опосередкованих активністю GSK-3.
9. Фармацевтична композиція, що містить сполуку за будь-яким з пп. 1-7 як активне начало.
10. Проміжна сполука формули (XI)
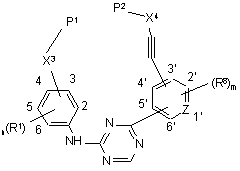 , (XI)
, (XI)
її фармацевтично прийнятні адитивні солі та їх стереохімічно ізомерні форми, де n означає ціле число, що має значення від 1 до 4; m означає ціле число, що має значення від 1 до 4;
Z являє собою N або С;
Р1 та Р2, кожен незалежно, являють собою гідрокси, галоген, гідроксикарбоніл-, галогенкарбоніл-, C1-6алкілоксикарбоніл- або C1-6алкілоксикарбоніл-С1-4алкіл-;
X3 являє собою C1-6алкіл або C1-6алкіл-NR20;
X4 являє собою C1-6алкіл або C1-6алкіл-NR21;
R1 та R8, кожен незалежно, являють собою водень, ціано, галоген, гідрокси, C1-6алкокси-, C1-6алкіл-, моно- або ді(С1-4алкіл)амінокарбоніл-, моно- або ді(С1-4алкіл)аміносульфоніл-, C1-6алкокси-, заміщений галогеном, або R1 являє собою C1-6алкіл, заміщений одним або, якщо це можливо, двома або більше замісниками, вибраними з гідрокси або галогену;
R20 та R21, кожен незалежно, являють собою водень, С1-4алкіл, Het20, Het21-С1-4алкіл-, С2-4алкенілкарбоніл, необов'язково заміщений групою Het22-С1-4алкіламінокарбоніл-, С2-4алкенілсульфоніл, С1-4алкілоксі-С1-4алкіл- або феніл, необов'язково заміщений одним або, якщо це можливо, двома або більше замісниками, вибраними з водню, гідрокси, аміно або С1-4алкілокси-;
Het20 являє собою гетероцикл, вибраний з морфолінілу, піролідинілу, піперазинілу або піперидинілу, де зазначений Het20 необов'язково заміщений групою -С1-4алкіл-, С3-6циклоалкіл, гідроксі-С1-4алкіл-, С1-4алкілоксіС1-4алкіл- або полігідроксі-С1-4алкіл-;
Het21 являє собою гетероцикл, вибраний з морфолінілу, піролідинілу, піперазинілу або піперидинілу, де зазначений Het21 необов'язково заміщений групою С1-4алкіл, С3-6циклоалкіл, гідроксі-С1-4алкіл- або полігідроксі-С1-4алкіл-;
Het22 являє собою гетероцикл, вибраний з морфолінілу, піролідинілу, піперазинілу або піперидинілу, де зазначений Het22 необов'язково заміщений групою С1-4алкіл, С3-6циклоалкіл, гідроксі-С1-4алкіл-, С1-4алкілоксіС1-4алкіл- або полігідроксі-С1-4алкіл-.
11. Проміжна сполука за п. 10, де
n означає 1; m означає 1; Z являє собою N або С, зокрема N;
Р1 та Р2, кожен незалежно, являють собою гідрокси, С1-6алкілоксикарбоніл або C1-6алкілоксикарбоніл-С1-4алкіл-;
X3 являє собою -С1-4алкіл- або С1-4алкіл-NR20-;
X4 являє собою -С1-4алкіл- або С1-4алкіл-NR21-;
R1 являє собою водень; або
R8 являє собою водень;
R20 та R21, кожен незалежно, являють собою водень або С1-4алкіл.
12. Проміжна сполука за пп. 10 або 11 для застосування як лікарського засобу.
13. Застосування проміжної сполуки за пп. 10 або 11 для одержання лікарського засобу для профілактики або лікування захворювань, опосередкованих активністю GSK-3.
14. Фармацевтична композиція, що містить проміжну сполуку за будь-яким з пп. 10-11 як активний інгредієнт.
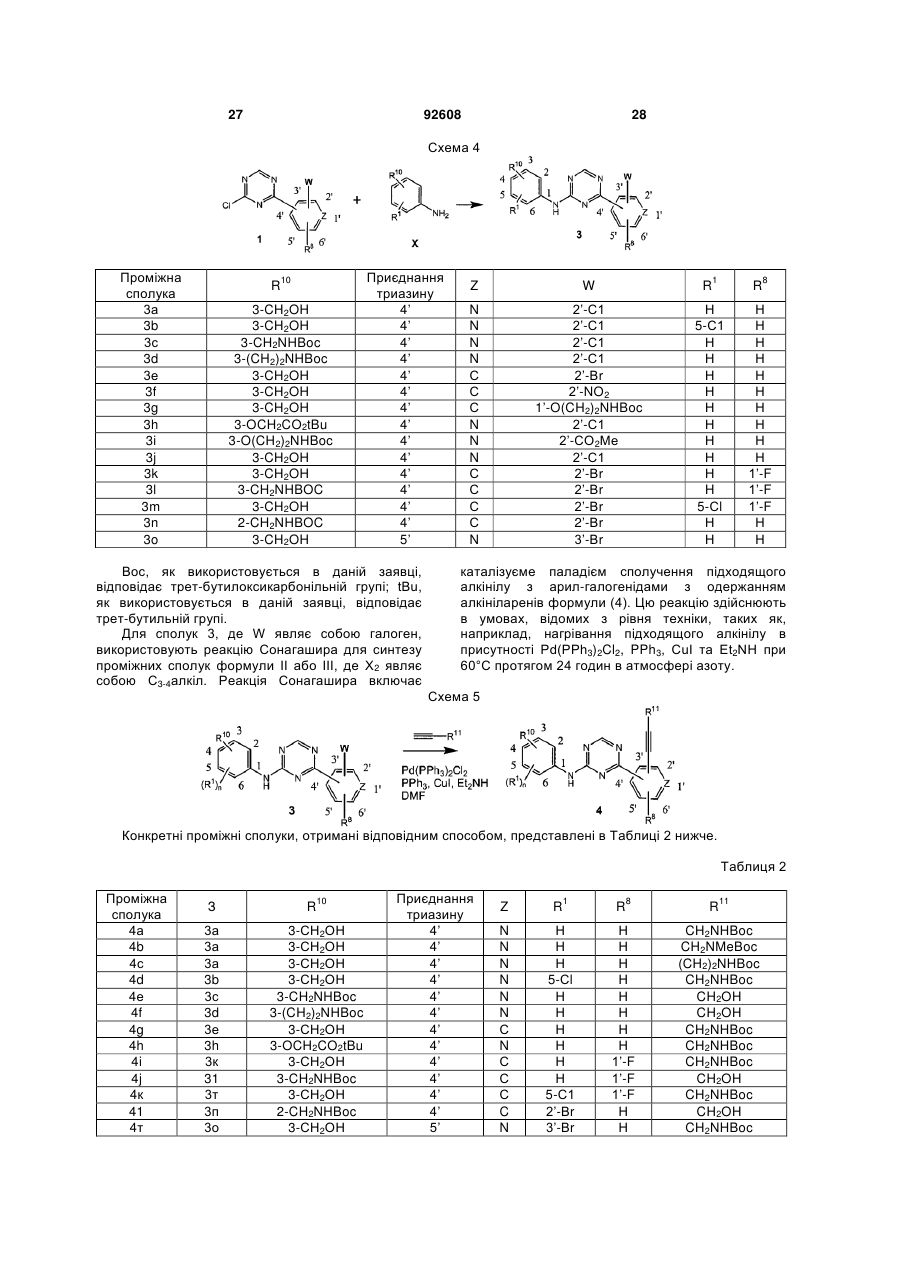
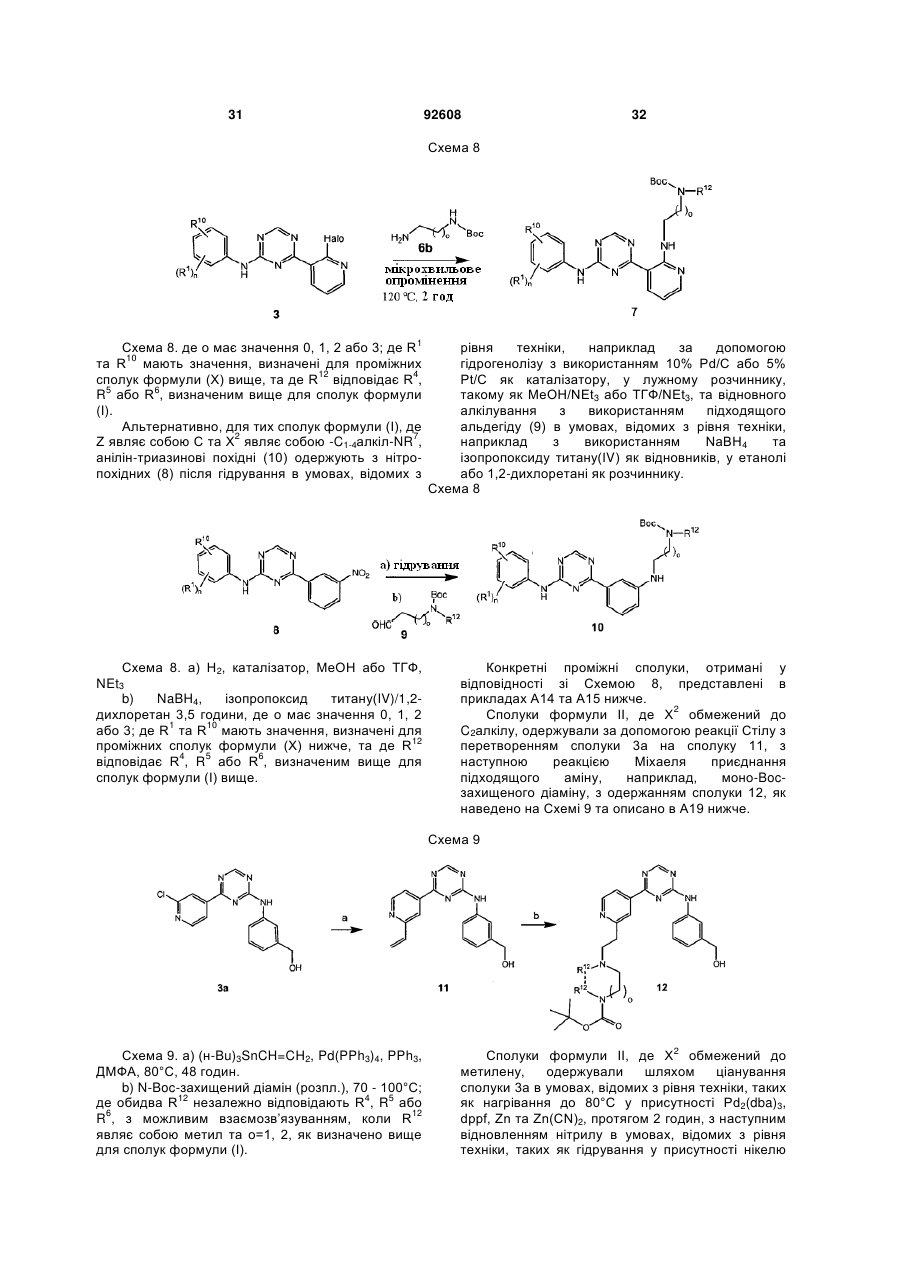
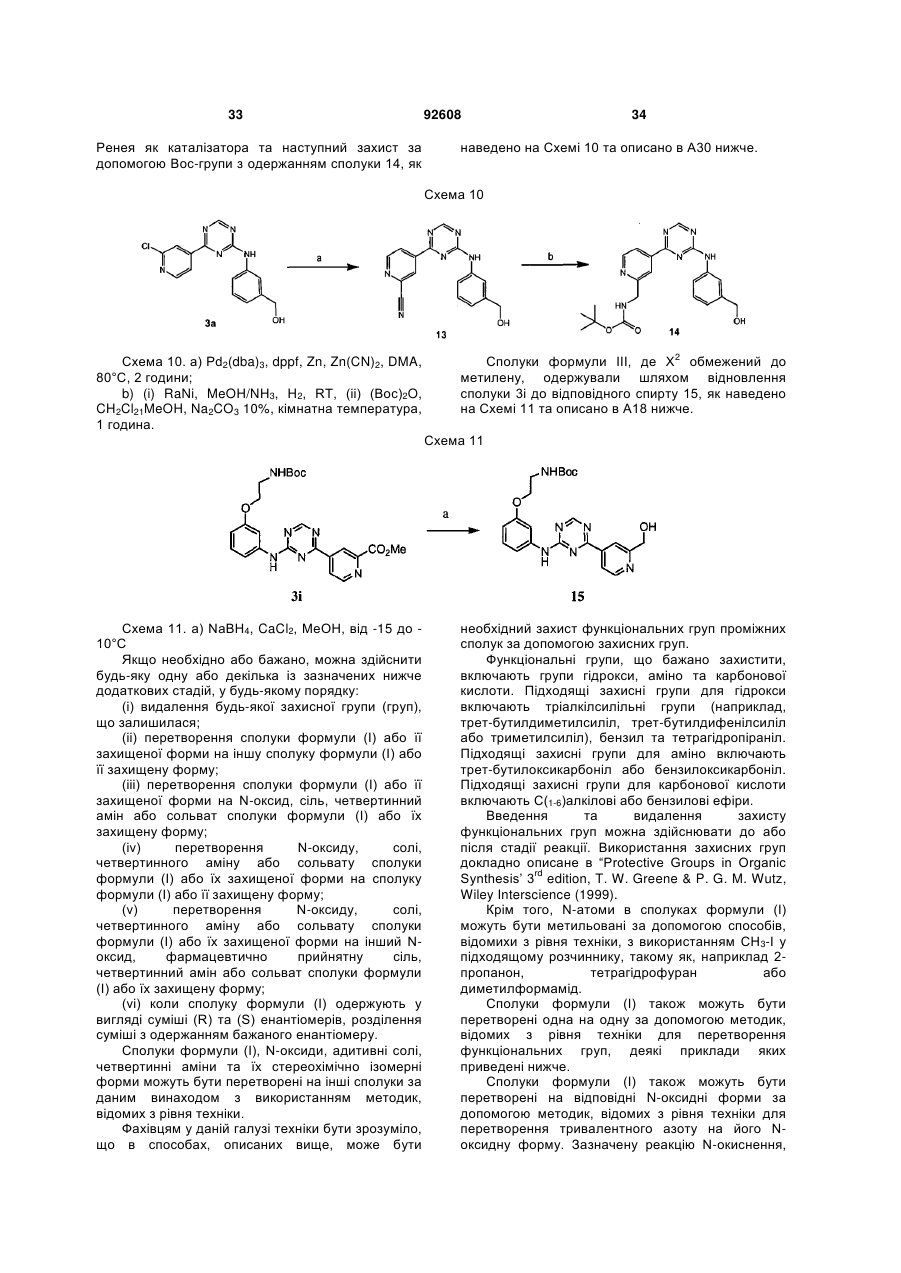
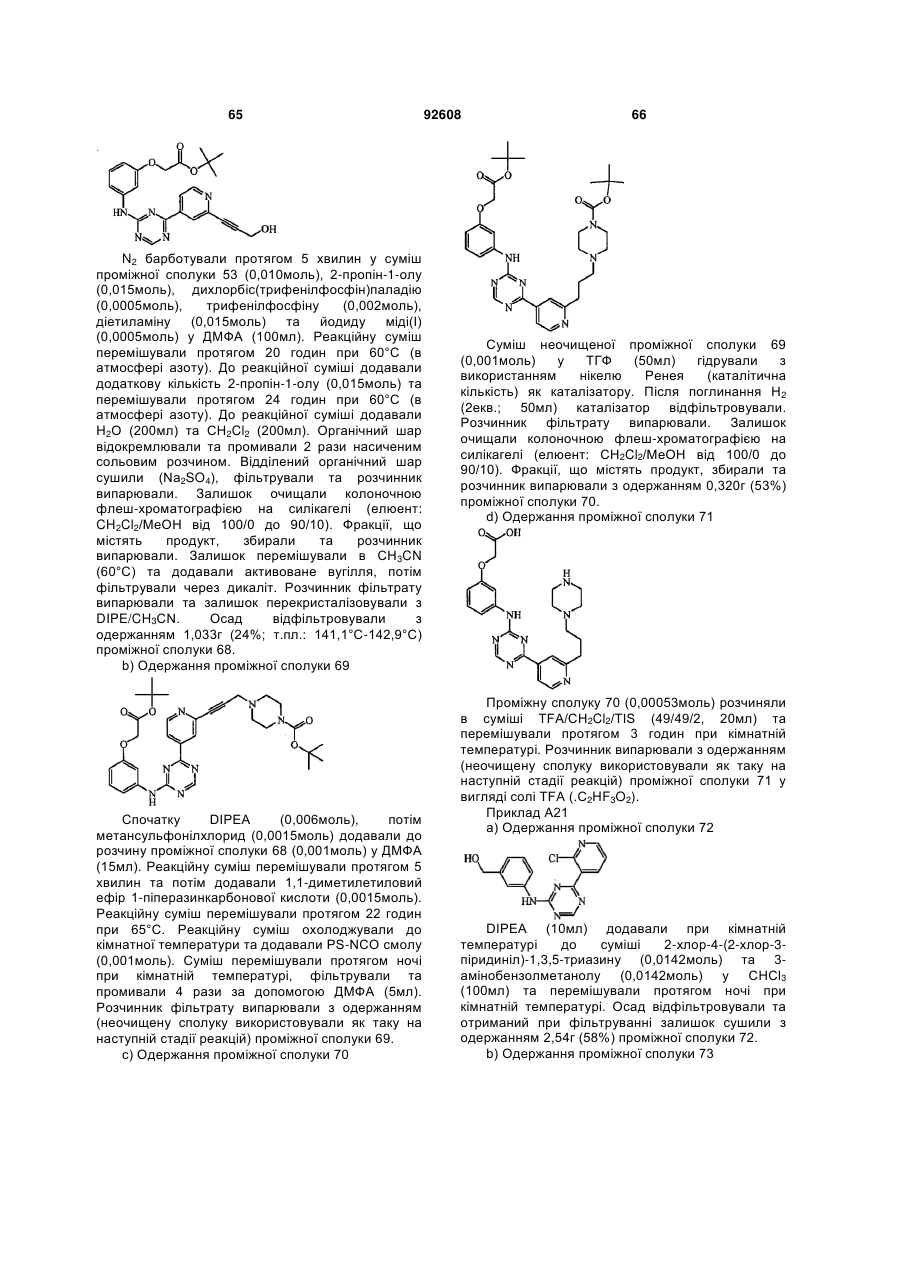
Текст
1. Сполука формули (І) Y 2 (19) 1 3 групою Het8-С1-4алкіламінокарбоніл-, С1алкенілсульфоніл-, С1-4алкілоксі-С1-4алкіл- або 4 феніл, необов'язково заміщений одним або, якщо це можливо, двома або більше замісниками, вибраними з водню, гідрокси, аміно або С14алкілокси-; R4, R5, R6 та R10, кожен незалежно, являють собою водень або С1-4алкіл, необов'язково заміщений гідрокси, Het9 або С1-4алкілокси; Het1 та Het2, кожен незалежно, являє собою гетероцикл, вибраний з піролідинілу, піперидинілу, піперазинілу, піридинілу, піримідинілу, піразинілу, імідазолідинілу або піразолідинілу, де зазначені Het1 та Het2 необов'язково заміщені аміно, гідрокси, С1групою гідроксі-С1-4алкіл-, фенілом, 4алкілом, групою феніл-С1-4алкіл-, групою С1-4алкілоксі-С14алкіл-, моно- або ді(С1-4алкіл)аміно- або групою амінокарбоніл-; Het3 та Het6, кожен незалежно, являють собою гетероцикл, вибраний з піролідинілу або піперидинілу, де зазначені Het3 та Het6 необов'язково заміщені одним або, якщо це можливо, двома або більше замісниками, вибраними з С1-4алкілу, С3-6циклоалкілу, групи гідроксі-С1-4алкіл-, С1-4алкілоксі-С1-4алкіл- або групи полігідроксі-С1-4алкіл-; Het4, Het7 та Het9, кожен незалежно, являють собою гетероцикл, вибраний з морфолінілу, піролідинілу, піперазинілу або піперидинілу, де зазначені Het4, Het7 та Het9 необов'язково заміщені одним або, якщо це можливо, двома або більше замісниками, вибраними з С1-4алкілу, С3-6циклоалкілу, групи гідроксі-С1-4алкіл-, групи С1-4алкілоксі-С1-4алкіл або групи полігідроксі-С14алкіл-; Het5 являє собою гетероцикл, вибраний з морфолінілу, піролідинілу, піперазинілу або піперидинілу, де зазначений Het5 необов'язково заміщений одним або, якщо це можливо, двома або більше замісниками, вибраними з С1-4алкілу, С3-6циклоалкілу, групи гідроксі-С1-4алкіл-, С14алкілоксі-С1-4алкілу або групи полігідроксі-С14алкіл-; Het10, Het11 та Het13, кожен незалежно, являють собою гетероцикл, вибраний з піролідинілу, піперидинілу, піперазинілу, піридинілу, піримідинілу, піразинілу, імідазолідинілу або піразолідинілу, де зазначені Het10, Het11 та Het13необов'язково заміщені аміно, гідрокси, С1групою гідроксі-С1-4алкіл-, фенілом, 4алкілом, групою феніл-С1-4алкіл-, групою С1-4алкілоксі-С14алкіл-, групою амінокарбоніл- або групою моноабо ді(С1-4алкіл)аміно-; Het12 являє собою гетероцикл, вибраний з піролідинілу, піперидинілу, піперазинілу, піридинілу, піримідинілу, піразинілу, імідазолідинілу або піразолідинілу, де зазначений Het12 необов'язково заміщений аміно, гідрокси, С1-4алкілом, групою гідроксі-С1-4алкіл-, фенілом, групою феніл-С1-4алкіл-, групою С1-4алкілоксі-С14алкіл-; групою моно- або ді(С1-4алкіл)аміно- або групою амінокарбоніл-; Het14 являє собою гетероцикл, вибраний з морфолінілу, піролідинілу, піперазинілу, 92608 4 імідазолілу, піролілу, 2,3,4-триазапіролілу, 1,2,3триазолілу, піразолілу або піперидинілу, де зазначений Het14 необов'язково заміщений одним або, якщо це можливо, двома або більше замісниками, вибраними з С1-4алкілу, С3групи гідроксі-С1-4алкіл-, С16циклоалкілу, 4алкілоксі-С1-4алкілу або групи полігідроксі-С14алкіл-. 2. Сполука за п. 1, де m означає 1; n означає 1; Z являє собою N або С, зокрема N; Y являє собою -NR2-C1-6алкіл-CO-NR4-, С1-4алкіл-NR9-С1-4алкіл-, C1-6алкіл-СО-Het10-, Het11-CO-C1-6алкіл-, -Het12-C1-6алкіл-, -CO-Het13C1-6алкіл-, -CO-NR10-C1-6алкіл-, -Het1-C1-6алкілCO-NR5-, -Het2-CO-NR6-, де -C1-6алкільний лінкер у групі -NR2-C1-6алкіл-CO-NR4- або -Het2-C1-6алкілCO-NR5- необов'язково заміщений одним або, якщо це можливо, двома або більше замісниками, вибраними з гідрокси, метокси, амінокарбонілу, галогену, ціанофенілу та фенілу; X1 являє собою простий зв'язок, -С1-4алкіл-, С13 4алкілокси- або С1-4алкіл-NR ; 2 X являє собою простий зв'язок, С1-4алкіл, С14алкілокси-, С1-4алкіл-СО-, С1-4алкеніл, С2-4алкініл або С1-4алкіл-NR7-, де зазначений С2-4алкеніл необов'язково заміщений одним або, якщо це можливо, двома або більше галогеновими замісниками; R1 являє собою водень, Het14 або галоген; R2 являє собою водень, С1-4алкіл, С2-4алкеніл або Het4-С1-4алкіл-; 3 7 R та R , кожен незалежно, являють собою водень або С1-4алкіл; R8 являє собою водень; R9 являє собою водень або С1-4алкіл; зокрема R9 являє собою, водень, метил, етил або ізопропіл; більш конкретно водень, метил або етил; R4, R5, R6 та R10, кожен незалежно, являють собою водень або С1-4алкіл; Het1та Het2, кожен незалежно, являють собою піролідиніл, піперидиніл або піперазиніл, де зазначений Het1 або Het2 необов'язково заміщений гідрокси; зокрема Het1 являє собою піролідиніл або піперазиніл, a Het2 являє собою піперидиніл, піперазиніл або піролідиніл, де зазначений піролідиніл необов'язково заміщений гідрокси; Het4 являє собою піперазиніл, необов'язково заміщений С1-4алкілом; Het10, Het11, Het12та Het13, кожен незалежно, являють собою піролідиніл, піперидиніл або піперазиніл, де зазначені Het10, Het11, Het12 та Het13необов'язково заміщені гідрокси; зокрема Het10, Het11, Het12та Het13являють собою піперазиніл; Het14 являє собою морфолініл, піролідиніл, піроліл, 1,2,3-триазоліл, 2,3,4-триазапіроліл, піперидиніл або піперазиніл, де зазначений Het14 необов'язково заміщений С1-4алкілом. 3. Сполука за пп. 1 або 2, де: m означає 1; n означає 1; Z являє собою N або С, зокрема N; Y являє собою -NR2-C1-6алкіл-CO-NR4-, -Het11-СОC1-6алкіл-, -CO-Het13-C1-6алкіл-, -CO-NR10-C1алкіл-, -Het1-C1-6алкіл-CO-NR5- або -Het2-CO6 5 NR6-, де -C1-6алкільний лінкер у групі -NR2-C14 або -Het1-C1-6алкіл-CO-NR56алкіл-CO-NR необов'язково заміщений гідрокси; X1 являє собою -С1-4алкіл-, -С1-4алкілокси- або С13 4алкіл-NR ; 2 X являє собою простий зв'язок, С1-4алкіл, С17 4алкілокси або С1-4алкіл-NR -; 1 R являє собою водень або галоген; R8 являє собою водень або галоген; R2 являє собою водень, С1-4алкіл або Het4 -С14алкіл-; R3 та R7, кожен незалежно, являють собою водень або С1-4алкіл; R4, R5, R6 та R10, кожен незалежно, являють собою водень або С1-4алкіл; Het1 та Het2, кожен незалежно, являють собою піролідиніл, піперидиніл або піперазиніл, де зазначений Het1 або Het2 необов'язково заміщений гідрокси; Het4 являє собою піперазиніл, необов'язково заміщений С1-4алкілом; Het11 являє собою піперидиніл або піперазиніл, зокрема піперазиніл; Het13 являє собою піперидиніл або піперазиніл, зокрема піперазиніл. 4. Сполука за п. 1, де: m означає 1; n означає 1; Z являє собою N або С; Y являє собою -С1-4алкіл-NR9-С1-4алкіл-, -NR2-С14 1 5 2 4алкіл-CO-NR -, -Het -C1-6алкіл-CO-NR - або Het 6 CO-NR -, де C1-6алкільний лінкер у -Yнеобов'язково заміщений одним або, якщо це можливо, двома або більше замісниками, вибраними з гідрокси, галогену або фенілу; X1 являє собою С1-4алкіл або С1-4алкілокси-, зокрема етил або етокси; X2 являє собою С1-4алкіл, С1-4алкілокси, -NR7-С17 7 4алкіл-, зокрема пропіл, -NR -eтил- або NR пропіл-; R1 являє собою водень, хлор, фтор або бром; R2 являє собою водень, С1-4алкіл або С2-4алкеніл; 4 R являє собою водень; R5 являє собою водень або С1-4алкіл; R6 являє собою водень або С1-4алкіл; R7 являє собою водень або С1-4алкіл; R8 являє собою водень, хлор, фтор або бром; R9 являє собою водень або С1-4алкіл; Het1 являє собою піперазиніл або піперидиніл; Het2 являє собою піролідиніл, піперидиніл або піперазиніл, де зазначений Het2 необов'язково заміщений гідрокси. 5. Сполука за п. 1, де зазначена сполука вибрана з групи, що включає: 14-метил-3,5,7,14,17,22,27-гептаазатетрацикло[19.3.1.1~2,6~.1-8,12~]гептакоза1(25),2(27),3,5,8(26),9,11,21,23-нонаєн-19-ін-16он; (19Z)-19-хлор-14-метил-3,5,7,14,17,22,27гептаазатетрацикло[19.3.1.1~2,6~.1~8,12~]гептак оза-1(25),2(27),3,5,8(26),9,11,19,21,23-декаєн-16он; 14-метил-3,5,7,14,17,22,27-гептаазатетрацикло[19.3.1.1~2,6~.1-8,12~]гептакоза1(25),2(27),3,5,8(26),9,11,21,23-нонаєн-16-он; 92608 6 1,8,10,12,17,22,26,32-октаазапентацикло[24.2.2.1~3,7~.1-9,13-.1-14,18~]тритриаконта3(33),4,6,9(32),10,12,14(31),15,17-нонаєн-23-он; 1,8,10,12,17,22,25,31-октаазапентацикло[23.2.2.1~3,7~1~9,13~.1~14,18~]дотриаконта3(32),4,6,9(31),10,12,14(30),15,17-нонаєн-23-он; 17-метил-3,5,7,14,17,22,27-гептаазатетрацикло[19.3.1.1~2,6~.1-8,12~]гептакоза1(25),2(27),3,5,8(26),9,11,21,23-нонаєн-15-он; 18-метил-3,5,7,15,18,23,28-гептаазатетрацикло[20.3.1.1~2,6~.1-8,12~]октакоза1(26),2(28),3,5,8(27),9,11,22,24-нонаєн-16-он; 14-метил-3,5,7,14,17,20,22,27-октаазатетрацикло[19.3.1.1~2,6~.1~8,12~]гептакоза1(25),2(27),3,5,8(26),9,11,21,23-нонаєн-16-он; 14-метил-3,5,7,14,17,21,23,28-октаазатетрацикло[20.3.1.1~2,6~.1~8,12~]октакоза1(26),2(28),3,5,8(27),9,11,22,24-нонаєн-16-он; 18-етил-3,5,7,15,18,23,28-гептаазатетрацикло[20.3.1.1~2,6~.1~8,12~]октакоза1(26),2(28),3,5,8(27),9,11,22,24-нонаєн-16-он; 5-хлор-1,8,10,12,17,22,30-гептаазапентацикло[22.2.2.1~3,7~.1-14,18-]-гентриаконта3(31),4,6,9(30),10,12,14(29),15,17-нонаєн-23-он; 5-хлор-1,8,10,12,17,22,25,31-октаазапентацикло[23.2.2.1~3,7-.1~9,13~.1~14,18~]дотриаконта3(32),4,6,9(31),10,12,14(30),15,17-нонаєн-23-он; 10-хлор-14-метил-3,5,7,14,17,22,27гептаазатетрацикло[19.3.1.1~2,6~.1~8,12~]гептакоза1(25),2(27),3,5,8(26),9,11,21,23-нонаєн-16-он; 10-хлор-14-етил-3,5,7,14,17,22,27гептаазатетрацикло[19.3.1.1~2,6~.1~8,12~]гептакоза1(25),2(27),3,5,8(26),9,11,21,23-нонаєн-16-он; включаючи їх N-оксидні форми, фармацевтично прийнятні адитивні солі та їх стереохімічно активні ізомерні форми. 6. Сполука за п. 1, де зазначена сполука вибрана із солей трифтороцтової кислоти: 18-етил-3,5,7,15,18,23,28-гептаазатетрацикло[20.3.1.1~2,6~.1~8,12~]октакоза1(26),2(28),3,5,8(27),9,11,22,24-нонаєн-16-он; 14-метил-3,5,7,14,17,21,23,28октаазатетрацикло[20.3.1.1~2,6~.1~8,12~]октакоз а-1(26),2(28),3,5,8(27),9,11,22,24-нонаєн-16-он; 1,8,10,12,17,22,25,31-октаазапентацикло[23.2.2.1~3,7~.1~9,13~.1~14,18~]дотриаконта3(32),4,6,9(31),10,12,14(30),15,17-нонаєн-23-он; 14-метил-3,5,7,14,17,20,22,27октаазатетрацикло[19.3.1.1~2,6~.1~8,12~]гептако за-1(25),2(27),3,5,8(26),9,11,21,23-нонаєн-16-он; 14-метил-3,5,7,14,17,22,27гептаазатетрацикло[19.3.1.1~2,6~.1~8,12~]гептак оза-1(25),2(27),3,5,8(26).9 11,21,23-нонаєн-16-он або 1,8,10,12,17,22,26,32-октаазапентацикло[24.2.2.1~3,7~.1-9,13~.1~14,18~]тритриаконта3(33),4,6,9(32),10,12,14(31),15,17-нонаєн-23-он. 7. Сполука за будь-яким з пп. 1-6 для застосування як лікарського засобу. 8. Застосування сполуки за будь-яким з пп. 1-6 для одержання лікарського засобу для профілактики або лікування захворювань, опосередкованих активністю GSK-3. 7 92608 9. Фармацевтична композиція, що містить сполуку за будь-яким з пп. 1-7 як активне начало. 10. Проміжна сполука формули (XI) P2 X4 P1 X3 4 5 1 n(R ) 6 3' 3 4' 5' 2 N NH 2' Z 6' (R8)m 1' N N , (XI) її фармацевтично прийнятні адитивні солі та їх стереохімічно ізомерні форми, де n означає ціле число, що має значення від 1 до 4; m означає ціле число, що має значення від 1 до 4; Z являє собою N або С; Р1 та Р2, кожен незалежно, являють собою гідрокси, галоген, гідроксикарбоніл-, галогенкарбоніл-, C1-6алкілоксикарбоніл- або C16алкілоксикарбоніл-С1-4алкіл-; X3 являє собою C1-6алкіл або C1-6алкіл-NR20; X4 являє собою C1-6алкіл або C1-6алкіл-NR21; R1 та R8, кожен незалежно, являють собою водень, ціано, галоген, гідрокси, C1-6алкокси-, C16алкіл-, моно- або ді(С1-4алкіл)амінокарбоніл-, моно- або ді(С1-4алкіл)аміносульфоніл-, C11 являє 6алкокси-, заміщений галогеном, або R собою C1-6алкіл, заміщений одним або, якщо це можливо, двома або більше замісниками, вибраними з гідрокси або галогену; R20 та R21, кожен незалежно, являють собою водень, С1-4алкіл, Het20, Het21-С1-4алкіл-, С2необов'язково заміщений 4алкенілкарбоніл, групою Het22-С1-4алкіламінокарбоніл-, С2С1-4алкілоксі-С1-4алкіл- або 4алкенілсульфоніл, феніл, необов'язково заміщений одним або, якщо це можливо, двома або більше замісниками, Кіназа-3 глікогенсинтази (GSK-3) являє собою серин/треонінпротеїнкіназу, вперше виявлену як одну з численних кіназ, здатних до фосфорилювання на інактивування глікогенсинтази, ферменту, що регулює синтез глікогену у ссавців (Embi. et al., Eur.J.Biochem., 107, 519-527 (1980)). Існуючи в двох ізоформах, GSK-3α та GSK-3β, GSK-3 фосфорилює широкий ряд різних білків in vitro. Різноманітність цих білків вказує на ролі GSK-3 у контролі клітинного метаболізму, росту та розвитку. Діабет типу I характеризується нестачею інсуліну в результаті руйнування інсулінпродукуючих клітин у підшлунковій залозі. Діабет типу II характеризується порушенням секреції та дії інсуліну. Зв‟язування інсуліну з його рецептором ініціює каскад подій, що призводять до фосфорилювання та інгібування GSK-3, що сприяє інсулін-індукованій стимуляції синтезу глікогену та білка. Інгібітори GSK-3, як було показано, імітують дію інсуліну (Coghlan et al., 8 вибраними з водню, гідрокси, аміно або С14алкілокси-; Het20 являє собою гетероцикл, вибраний з морфолінілу, піролідинілу, піперазинілу або 20 піперидинілу, де зазначений Het необов'язково заміщений групою -С1-4алкіл-, С3-6циклоалкіл, гідроксі-С1-4алкіл-, С1-4алкілоксіС1-4алкілабо полігідроксі-С1-4алкіл-; Het21 являє собою гетероцикл, вибраний з морфолінілу, піролідинілу, піперазинілу або піперидинілу, де зазначений Het21 необов'язково заміщений групою С1-4алкіл, С3-6циклоалкіл, гідроксі-С1-4алкіл- або полігідроксі-С1-4алкіл-; Het22 являє собою гетероцикл, вибраний з морфолінілу, піролідинілу, піперазинілу або піперидинілу, де зазначений Het22 необов'язково заміщений групою С1-4алкіл, С3-6циклоалкіл, гідроксі-С1-4алкіл-, С1-4алкілоксіС1-4алкілабо полігідроксі-С1-4алкіл-. 11. Проміжна сполука за п. 10, де n означає 1; m означає 1; Z являє собою N або С, зокрема N; Р1 та Р2, кожен незалежно, являють собою гідрокси, С1-6алкілоксикарбоніл або C16алкілоксикарбоніл-С1-4алкіл-; X3 являє собою -С1-4алкіл- або С1-4алкіл-NR20-; X4 являє собою -С1-4алкіл- або С1-4алкіл-NR21-; R1 являє собою водень; або R8 являє собою водень; R20 та R21, кожен незалежно, являють собою водень або С1-4алкіл. 12. Проміжна сполука за пп. 10 або 11 для застосування як лікарського засобу. 13. Застосування проміжної сполуки за пп. 10 або 11 для одержання лікарського засобу для профілактики або лікування захворювань, опосередкованих активністю GSK-3. 14. Фармацевтична композиція, що містить проміжну сполуку за будь-яким з пп. 10-11 як активний інгредієнт. Chem. Biol., 7, 793-803, (2000)), включаючи здатність до зниження рівнів глюкози в крові in vivo (Norman, Drug News Perspect., 14, 242-247 (2001)). Ці останні відкриття говорять про те, що інгібітори GSK-3 мають потенціал для лікування діабету. Хвороба Альцгеймера характеризується зв‟язаним з мікротрубочками білком Tau, що існує в аномально гіперфосфорильованому стані (Cohen and Frame, Nature Reviews: Molecular Cell Biology, 2, 769-776 (October 2001)). GSK-3 фосфорилює безліч гіперфосфорильованих ділянок у Tau in vitro, запобігаючи його зв‟язування з мікротрубочками, що робить його доступним до аберантної зборки структури філамента, що може лежати в основі деградації нейронів, що спостерігається при хворобі Альцгеймера та інших неврологічних розладів. Було показано, що інгібітори GSK-3, такі як інсулін та іони літію, індукують часткове дефосфорилювання Tau у нервових клітинах (Cross et al., J. Neurochem., 77, 94-102 (2001)). Ці 9 відкриття говорить про те, що інгібітори GSK-3 відіграють істотну роль у лікуванні нейродегенеративних розладів, таких як хвороба Альцгеймера. Ріст волосся регулюється сигнальним шляхом Wnt, зокрема, Wnt-3. У модельних системах з використанням культури тканин шкіри експресія мутантів β-катеніну, що не руйнуються, приводить до величезного збільшення популяції передбачуваних стовбурних клітин, що мають величезний потенціал до проліферації. Така популяція стовбурних клітин експресує більш високий рівень не зв‟язаного з кадерином βкатеніну, що може сприяти їх більш високому проліферативному потенціалу. Більш того, у трансгенних мишей, у шкірі яких спостерігається надекспресія усіченого β-катеніну, має місце de novo морфогенез волосяних фолікул, що у нормальних умовах встановлений тільки у фазі ембріогенезу. Щодо β-катеніну, відомо, що він фосфорилюється під дією GSK-3, отже, ектопічне застосування інгібіторів GSK-3 може бути терапевтично корисним для лікування облисіння та для відновлення росту волосся після індукованої хіміотерапією алопеції. Один з наступних білків, регульованих фосфорилюванням GSK-3β, являє собою сигнальний білок NF-κB. Дослідження фібробластів, отриманих від мишей з виключеним GSK-3β, показують, що інгібування GSK-3 може бути корисним при лікуванні запальних розладів або захворювань через негативну регуляцію активності NF-κB. Такі захворювання включають аутоімунні захворювання та запальні захворювання, такі як алергії та астма, розсіяний склероз (MS), ревматоїдний артрит (RA), артеріосклероз, артрит або запальне захворювання кишечнику (IBD). Хоча GSK-3 була споконвічно ідентифікована як пролін-направлена серин/треонінкіназа, що фосфорилює глікогенсинтазу, до даного часу було продемонстровано, що GSK-3 фосфорилює різні білки in vitro, такі як субодиниця-11 cAMP-залежної протеїнкінази, G-субодиниця фосфатази-1, АТФцитратліаза, ацетил-кофермент A карбоксилаза, основний білок мієліну, зв‟язаний з мікротрубочками білок, нейрофіламентний білок, молекула клітинної адгезії N-CAM, рецептор фактора росту нервів, фактор транскрипції c-Jun, фактор транскрипції Jun, фактор транскрипції cMyb, фактор транскрипції c-Myc, фактор транскрипції L-Myc, білок Tau та β-катенін. Така різноманітність білків, що можуть бути фосфорильовані за допомогою GSK-3, припускає, що GSK-3 бере участь у різних метаболічних та регуляторних процесах у клітинах. Тому, інгібітори GSK-3 можуть бути корисними для профілактики або лікування захворювань, опосередкованих активністю GSK-3, таких як біполярні розлади (зокрема, маніакальна депресія), діабет, хвороба Альцгеймера, лейкопенія, FTDP-17 (фронто-темпоральна деменція, пов‟язана з хворобою Паркінсона), 92608 10 кортико-базальна дегенерація, прогресивний супрануклеарний параліч, розсіяна системна атрофія, хвороба Піка, хвороба Німана-Піка типу C, деменція боксерів, деменція, що характеризується тільки станом заплутаності мислення, деменція, що характеризується станом заплутаності мислення та кальцифікацією, синдром Дауна, міотична дистрофія, гуамський комплекс аміотрофічного бічного склерозу та деменції при хворобі Паркінсона, деменція, пов‟язана зі СНІДом, постенцефалічний паркінсонізм, пріонове захворювання, що характеризуються станом заплутаності мислення, підгострий склерозуючий лейкоенцефаліт, дегенерація лобових часток (FLD), аргирія, підгострий склерозуючий лейкоенцефаліт (SSPE) (пізнє ускладнення вірусних інфекцій у центральній нервовій системі), запальні захворювання, депресія, рак, дерматологічні розлади, такі як облисіння, нейрозахист, шизофренія, біль, зокрема, невропатичний біль. Інгібітори GSK3 також можна використовувати для інгібування рухливості сперматозоїдів, та тому їх можна використовувати як чоловічі контрацептиви. Зокрема, сполуки за даним винаходом є корисними для профілактики або лікування хвороби Альцгеймера; діабету, зокрема, діабету типу 2 (інсулін-незалежні діабети); біполярних розладів; рака; болю, зокрема невропатичного болю; депресії; запальних захворювань, включаючи алергії та астму, MS, RA, артеріосклерозу, артриту або IBD. Більш конкретно, сполуки за даним винаходом є корисними для профілактики або лікування діабету, зокрема, діабету типу 2 (інсулін-незалежні діабети); болю, зокрема невропатичного болю; депресії; запальних захворювань, включаючи MS, RA або IBD. Даний винахід відноситься до макроциклів на основі аніліно-(піридино)триазинів формули (I), що, як було виявлено, мають активність інгібування кінази та, наприклад, можуть бути корисними для лікування клітиннопроліферативних розладів, включаючи рак, псоріаз, доброякісну гіперплазію передміхурової залози, артеріосклероз та рестеноз. Зокрема, було виявлено, що сполуки за даним винаходом мають активність інгібування GSK3 та, відповідно, є корисними в способах лікування людини або тварин, наприклад для одержання лікарських засобів для застосування для профілактики або лікування захворювань, опосередкованих активністю GSK-3 supra. Даний винахід також відноситься до способів одержання зазначених похідних аніліно(піридино)триазинів, до фармацевтичних композицій, що містять такі похідні, та до їх застосування для одержання лікарських засобів, що застосовуються для профілактики або лікування захворювань, опосередкованих активністю GSK-3. Даний винахід відноситься до сполук формули (I) 11 , N-оксидних форм, фармацевтично прийнятних адитивних солей та стереохімічно ізомерних форм таких сполук, де m означає ціле число, що має значення від 1 до 4; n означає ціле число, що має значення від 1 до 4; Z являє собою N або C; Y являє собою -NR2-C1-6алкіл-CO-NR4-, -C19 10 11 4алкіл-NR -C1-4алкіл-, C1-6алкіл-CO-Het -, -Het CO-C1-6алкіл-, -Het12-C1-6алкіл-, -CO-Het13-C1-6алкіл, -CO-NR10-C1-6алкіл-, -Het1-C1-6алкіл-CO-NR5- або Het2-CO-NR6-, де -C1-6алкільний лінкер у -NR2-C14 або -Het1-C1-6алкіл-CO-NR56алкіл-CO-NR необов‟язково заміщений одним або, якщо це можливо, двома або більше замісниками, вибраними з гідрокси, метокси, амінокарбонілу, галогену, фенілу, індолілу, метилсульфіду, тіолу, гідроксифенілу, ціанофенілу, аміно та гідроксикарбонілу; X1 являє собою простий зв‟язок, C1-4алкіл, C14алкілокси-, C1-4алкіл-CO-, C2-4алкеніл, C2-4алкініл 3 або C1-4алкіл-NR -, де зазначений C1-4алкіл або C24алкеніл, необов‟язково заміщений одним або, якщо це можливо, двома або більше галогеновими замісниками; X2 являє собою простий зв‟язок, C1-4алкіл, C1алкілокси, C1-4алкіл-CO-, C2-4алкеніл, C2-4алкініл 4 або C1-4алкіл-NR7-, де зазначений C1-4алкіл або C24алкеніл необов‟язково заміщений одним або, якщо це можливо, двома або більше галогеновими замісниками; R1 та R8, кожен незалежно, являє собою водень, Het14, ціано, галоген, гідрокси, C1-6алкокси, C1-6алкіл-, моно- або ді(C1-4алкіл)амінокарбоніл-, моноабо ді(C1-4алкіл)аміносульфоніл, C11 являє 6алкокси-, заміщений галогеном, або R собою C1-6алкіл, заміщений одним або, якщо це можливо, двома або більше замісниками, вибраними з гідрокси або галогену; R2 та R9, кожен незалежно, являє собою водень, C1-4алкіл, C2-4алкеніл, Het3, Het4-C1-4алкіл-, Het5-C1-4алкілкарбоніл-, моноабо ді(C1або феніл, 4алкіл)аміно-C1-4алкілкарбонілнеобов‟язково заміщений одним або, якщо це можливо, двома або більше замісниками, вибраними з водню, гідрокси, аміно або C14алкілокси-; R3 та R7, кожен незалежно, являє собою 6 7 водень, C1-4алкіл, Het , Het -C1-4алкіл-, C2необов‟язково заміщений 4алкенілкарбоніл-, групою Het8-C1-4алкіламінокарбоніл-, C2C1-4алкілоксіC1-4алкіл- або 4алкенілсульфоніл-, феніл, необов‟язково заміщений одним або, якщо це можливо, двома або більше замісниками, 92608 12 вибраними з водню, гідрокси, аміно або C14алкілокси-; R4, R5, R6 та R10, кожен незалежно, являє собою водень або C1-4алкіл, необов‟язково 9 заміщений гідрокси, Het або C1-4алкілокси; 1 2 Het та Het , кожен незалежно, являють собою гетероцикл, вибраний з піролідинілу, піперидинілу, піперазинілу, піридинілу, піримідинілу, піразинілу, імідазолідинілу або піразолідинілу, де зазначені Het1 та Het2 необов‟язково заміщені аміно, гідрокси, C1-4алкілом, групою гідроксі-C1-4алкіл-, фенілом, групою феніл-C1-4алкіл-, групою C14алкіл-оксі-C1-4алкіл- моно- або ді(C1-4алкіл)аміноабо групою амінокарбоніл-; Het3 та Het6, кожен незалежно, являє собою гетероцикл, вибраний з піролідинілу або піперидинілу, де зазначені Het3 та Het6 необов‟язково заміщені одним або, якщо це можливо, двома або більше замісниками, вибраними з C1-4алкілу, C3-6циклоалкілу, групи гідроксі-C1-4алкіл-, C1-4алкілоксіC1-4алкіл- або групи полігідроксі-C1-4алкіл-; Het4, Het7 та Het9, кожен незалежно, являє собою гетероцикл, вибраний з морфолінілу, піролідинілу, піперазинілу або піперидинілу, де зазначені Het4, Het7 та Het9 необов‟язково заміщені одним або, якщо це можливо, двома або більше замісниками, вибраними з C1-4алкілу, C36циклоалкілу, групи гідроксі-C1-4алкіл-, групи C1або групи полігідроксі-C14алкілоксіC1-4алкіл4алкіл-; 5 Het являє собою гетероцикл, вибраний з морфолінілу, піролідинілу, піперазинілу або піперидинілу, де зазначений Het5 необов‟язково заміщений одним або, якщо це можливо, двома або більше замісниками, вибраними з C1-4алкілу, C3-6циклоалкілу, групи гідроксі-C1-4алкіл-, групи C1або групи полігідроксі-C14алкілоксіC1-4алкіл4алкіл-; Het10, Het11 та Het13, кожен незалежно, являє собою гетероцикл, вибраний з піролідинілу, піперидинілу, піперазинілу, піридинілу, піримідинілу, піразинілу, імідазолідинілу або піразолідинілу, де зазначені Het10, Het11 та Het13 необов‟язково заміщені аміно, гідрокси, C1групою гідроксі-C1-4алкіл-, фенілом, 4алкілом, групою феніл-C1-4алкіл-, групою C1-4алкіл-оксі-C14алкіл-, групою амінокарбоніл- або групою моноабо ді(C1-4алкіл)аміно-; Het12 являє собою гетероцикл, вибраний з піролідинілу, піперидинілу, піперазинілу, піридинілу, піримідинілу, піразинілу, імідазолідинілу або піразолідинілу, де зазначений Het12 необов‟язково заміщений аміно, гідрокси, C1групою гідроксі-C1-4алкіл-, фенілом, 4алкілом, групою феніл-C1-4алкіл-, групою C1-4алкіл-оксі-C14алкіл-; групою моно- або ді(C1-4алкіл)аміно- або групою амінокарбоніл-; Het14 являє собою гетероцикл, вибраний з морфолінілу; піролідинілу; піперазинілу; імідазолілу; піролілу; 2,3,4-триазапіролілу; 1,2,3триазолілу; піразолілу; або піперидинілу, де зазначений Het14 необов‟язково заміщений одним або, якщо це можливо, двома або більше замісниками, вибраними з C1-4алкілу, C3 13 6циклоалкілу, групи гідроксі-C1-4алкіл-, C1або групи полігідроксі-C114 являє собою гетероцикл, 4алкіл-; зокрема, Het вибраний з морфолінілу; піролідинілу; піролілу; 2,3,4-триазапіролілу; піперазинілу або піперидинілу, де зазначений Het14 необов‟язково заміщений одним або, якщо це можливо, двома або більше замісниками, вибраними з C1-4алкілу, C3-6циклоалкілу, групи гідроксі-C1-4алкіл-, C1або групи полігідроксі-C14алкілоксіC1-4алкілу 14 являє собою 4алкіл-; більш конкретно, Het гетероцикл, вибраний з морфолінілу; піролідинілу; піперазинілу або піперидинілу, де зазначений Het14 необов‟язково заміщений одним або, якщо це можливо, двома або більше замісниками, вибраними з C1-4алкілу, C3-6циклоалкілу, групи гідроксі-C1-4алкіл-, C1-4алкілоксіC1-4алкілу або групи полігідроксі-C1-4алкіл-. Як використовується в представлених вище визначеннях та надалі, - галоген є родовою назвою для фтору, хлору, брому та йоду; - C1-4алкіл означає насичені вуглеводневі радикали з прямим або розгалуженим ланцюгом, що містять від 1 до 4 атомів вуглецю, такі як, наприклад, метил, етил, пропіл, бутил, 1метилетил, 2-метилпропіл, 2,2-диметилетил та т.п.; - C1-6алкіл, як мається на увазі, повинен включати C1-5алкіл та його вищі гомологи, що містять 6 атомів вуглецю, такі як, наприклад гексил, 1,2-диметилбутил, 2-метилпентил та т.п.; - C2-4алкеніл означає вуглеводневі радикали з прямим або розгалуженим ланцюгом, що містять один подвійний зв‟язок та містять від 2 до 4 атомів вуглецю, такі як, наприклад, вініл, 2-пропеніл, 3бутеніл, 2-бутеніл та т.п.; - C2-6алкініл означає вуглеводневі радикали з прямим або розгалуженим ланцюгом, що містять один потрійний зв‟язок та містять від 2 до 6 атомів вуглецю, такі як, наприклад, етиніл, 2-пропініл, 3бутиніл, 2-бутиніл, 2-пентиніл, 3-пентиніл, 3-метил2-бутиніл, 3-гексиніл та т.п.; - C3-6циклоалкіл є родовою назвою для циклопропілу, циклобутилу, циклопентилу та циклогексилу; - C1-4алкілокси означає насичені вуглеводневі радикали з прямим або розгалуженим ланцюгом, такі як метокси, етокси, пропілокси, бутилокси, 1метилетилокси, 2-метилпропілокси та т.п.; - C1-6алкілокси, як мається на увазі, повинен включати C1-4алкілокси та вищі гомологи, такі як метокси, .етокси, пропілокси, бутилокси, 1метилетилокси, 2-метилпропілокси та т.п.; - полігідроксі-C1-4алкіл є родовою назвою для C1-4алкілу, визначеного вище, що містить два, три або, якщо це можливо, більшу кількість гідроксизамісників, такого як, наприклад, тригідроксиметил; - полігалоген-C1-4алкіл є родовою назвою для C1-4алкілу, визначеного вище, що містить два, три або, якщо це можливо, більшу кількість галогензамісників, такого як, наприклад, трифторметил; 4алкілоксіC1-4алкілу 92608 14 Гетероцикли, зазначені у визначеннях, представлених вище та надалі, як мається на увазі, повинні включати всі можливі ізомерні форми, наприклад, піроліл також включає 2Hпіроліл; триазоліл включає 1,2,4-триазоліл та 1,3,4-триазоліл; оксадіазоліл включає 1,2,3оксадіазоліл, 1,2,4-оксадіазоліл, 1,2,5-оксадіазоліл та 1,3,4-оксадіазоліл; тіадіазоліл включає 1,2,3тіадіазоліл, 1,2,4-тіадіазоліл, 1,2,5-тіадіазоліл та 1,3,4-тіадіазоліл; піраніл включає 2H-піраніл та 4Hпіраніл. Крім того, гетероцикли, зазначені у визначеннях, представлених вище та надалі, можуть приєднуватися до іншої частини молекули формули (I) через будь-який підходящий кільцевий атом вуглецю або гетероатом. Так, наприклад, коли гетероцикл являє собою імідазоліл, він може бути 1-імідазолілом, 2-імідазолілом, 3імідазолілом, 4-імідазолілом та 5-імідазолілом; коли він являє собою тіазоліл, він може бути 2тіазолілом, 4-тіазолілом та 5-тіазолілом; коли він являє собою триазоліл, він може бути 1,2,4триазол-1-ілом, 1,2,4-триазол-3-ілом, 1,2,4триазол-5-ілом, 1,3,4-триазол-1-ілом та 1,3,4триазол-2-ілом; коли він являє собою бензотіазоліл, він може бути 2-бензотіазолілом, 4бензотіазолілом, 5-бензотіазолілом, 6бензотіазолілом та 7-бензотіазолілом. Фармацевтично прийнятні адитивні солі, зазначені вище, як мається на увазі, включають терапевтично активні нетоксичні форми кислотноадитивних солей, які можуть утворювати сполуки формули (I). Останні легко можна одержати шляхом обробки основної форми такою підходящою кислотою. Підходящі кислоти включають, наприклад, неорганічні кислоти, такі як галогенводневі кислоти, наприклад, соляна або бромистоводнева кислота; сірчана; азотна; фосфорна та т.п. кислоти; або органічні кислоти, такі як, наприклад, оцтова, пропанова, гідроксіоцтова, трифтороцтова, молочна, піровиноградна, щавлева, малонова, бурштинова (тобто бутандіонова кислота), малеїнова, фумарова, яблучна, винна, лимонна, метансульфонова, етансульфонова, бензолсульфонова, п-толуолсульфонова, цикламова, саліцилова, п-аміносаліцилова, памова та т.п. кислоти. Фармацевтично прийнятні адитивні солі, зазначені вище, як мається на увазі, включають терапевтично активні нетоксичні форми основноадитивних солей, які можуть утворювати сполуки формули (I). Приклади основно-адитивних солей, наприклад, включають собою солі натрію, калію, кальцію, а також солі з фармацевтично прийнятними амінами, такими як, наприклад, аміак, алкіламіни, бензатин, N-метил-D-глюкамін, гідрабамін, амінокислоти, наприклад, аргінін, лізин. І навпаки, зазначені сольові форми можуть бути перетворені шляхом обробки підходящою основою або кислотою на вільну кислотну або основну форму. Термін адитивная сіль, як використовується вище, також включає сольвати, що можуть утворювати сполуки формули (I), а також їх солі. 15 Такі сольвати, наприклад, являють собою гідрати, алкоголяти та т.п. Термін стереохімічно ізомерні форми, як використовується вище, означає можливі різні ізомерні, а також конформаційні форми, які можуть мати сполуки формули (I). Якщо не вказано або не зазначено інше, хімічна назва сполук означає суміш усіх можливих стереохімічно та конформаційно ізомерних форм, при цьому зазначені суміші містять усі діастереомери, енантіомери та/або конформери основної молекулярної структури. Усі стереохімічно ізомерні форми сполук формули (I), як у чистій формі, так і в суміші одна з одною, входять в обсяг даного винаходу. Деякі зі сполук формули (I) також можуть існувати в їх таутомерних формах. Такі форми, хоча вони конкретно не зазначені в представленій вище формулі, входять в обсяг даного винаходу. N-оксидні форми сполук формули (I), як мається на увазі, включають ті сполуки формули (I), де один або декілька атомів азоту є окисненими до так називаного N-оксиду. Перша група сполук за даним винаходом складається з тих сполук формули (I), де використовують одне або більше з наступних обмежень; m означає ціле число, що має значення від 1 до 4; n означає ціле число, що має значення від 1 до 4; Z являє собою N або C; Y являє собою -NR2-C1-6алкіл-CO-NR4-, -Het15 2 6 C1-6алкіл-CO-NR - або -Het -CO-NR -, де -C1алкільний лінкер у групі -NR2-C1-6алкіл-CO-NR46 або -Het1-C1-6алкіл-CO-NR5необов‟язково заміщений одним або, якщо це можливо, двома або більше замісниками, вибраними з гідрокси, галогену, фенілу, індоліла, метилсульфіду, тіолу, гідроксифенілу, аміно та гідроксикарбонілу; X1 являє собою простий зв‟язок, C1-4алкіл, C2C2-4алкініл або C1-4алкіл-NR3-, де 4алкеніл, зазначений C1-4алкіл або C2-4алкеніл необов‟язково заміщений одним або, якщо це можливо, двома або більше галогеновими замісниками; X являє собою простий зв‟язок, C1-4алкіл, C2C2-4алкініл або C1-4алкіл-NR7-, де 4алкеніл, зазначений C1-4алкіл або C2-4алкеніл необов‟язково заміщений одним або, якщо це можливо, двома або більше галогеновими замісниками; R1 та R8, кожен незалежно, являє собою водень, ціано, галоген, гідрокси, C1-6алкокси-, C1моно- або ді(C1-4алкіл)амінокарбоніл-, 6алкіл-, моноабо ді(C1-4алкіл)аміно-сульфоніл, C11 являє 6алкокси-, заміщений галогеном, або R собою C1-6алкіл, заміщений одним або, якщо це можливо, двома або більше замісниками, вибраними з гідрокси або галогену; R2 являє собою водень, C1-4алкіл, Het3, Het4C1-4алкіл-, Het5-C1-4алкілкарбоніл-, моно- або ді(C1або феніл, 4алкіл)аміно-C1-4алкілкарбонілнеобов‟язково заміщений одним або, якщо це можливо, двома або більше замісниками, вибраними з водню, гідрокси, аміно або C14алкілокси-; 92608 16 R3 та R7, кожен незалежно, являє собою водень, C1-4алкіл, Het6, Het7-C1-4алкіл-, C2необов‟язково заміщений 4алкенілкарбоніл-, групою Het8-C1-4алкіламінокарбоніл-, C2C1-4алкілоксиC1-4алкіл- або 4алкенілсульфоніл-, феніл, необов‟язково заміщений одним або, якщо це можливо, двома або більше замісниками, вибраними з водню, гідрокси, аміно або C14алкілокси-; R4, R5 та R6, кожен незалежно, являє собою водень або C1-4алкіл, необов‟язково заміщений гідрокси, Het9 або C1-4алкілокси; Het1 та Het2, кожен незалежно, являє собою гетероцикл, вибраний з піролідинілу, піперидинілу, піперазинілу, піридинілу, піримідинілу, піразинілу, імідазолідинілу або піразолідинілу, де зазначений Het1 необов‟язково заміщений аміно, гідрокси, C1групою гідроксі-C1-4алкіл-, фенілом, 4алкілом, групою феніл-C1-4алкіл-, групою C1-4алкіл-оксі-C14алкіл- моно- або ді(C1-4алкіл)аміно- або групою амінокарбоніл-; Het3, Het6 та Het9, кожен незалежно, являє собою гетероцикл, вибраний з морфолінілу, піролідинілу, піперазинілу або піперидинілу, де зазначені Het3, Het6 та Het9 необов‟язково заміщені одним або, якщо це можливо, двома або більше замісниками, вибраними з C1-4алкілу, C3групи гідроксі-C1-4алкіл-, C16циклоалкілу, або групи полігідроксі-C14алкілоксіC1-4алкілу 4алкіл-; Het4 та Het7, кожен незалежно, являє собою гетероцикл, вибраний з морфолінілу, піролідинілу, піперазинілу або піперидинілу, де зазначені Het4 та Het7 необов‟язково заміщені одним або, якщо це можливо, двома або більше замісниками, вибраними з C1-4алкілу, C3-6циклоалкілу, групи гідроксі-C1-4алкіл-, C1-4алкілоксіC1-4алкілу або групи полігідроксі-C1-4алкіл-; Het5 являє собою гетероцикл, вибраний з морфолінілу, піролідинілу, піперазинілу або піперидинілу, де зазначений гетероцикл необов‟язково заміщений одним або, якщо це можливо, двома або більше замісниками, вибраними з C1-4алкілу, C3-6циклоалкілу, групи гідроксі-C1-4алкіл-, групи C1-4алкілоксіC1-4алкіл- або групи полігідроксі-C1-4алкіл-. Друга група сполук за даним винаходом складається з тих сполук формули (I), в яких використовують одне або більше з наступних обмежень; m означає 1; n означає 1; Z являє собою N або C, зокрема, N; Y являє собою -NR2-C1-6алкіл-CO-NR4-, -C1алкіл-NR9-C1-4алкіл-, C1-6алкіл-CO-Het10-, -Het114 CO-C1-6алкіл-, -Het12-C1-6алкіл-, -CO-Het13-C1-6алкіл, -CO-NR10-C1-6алкіл-, -Het1-C1-6алкіл-CO-NR5-, Het2-CO-NR6-, де -C1-6алкільний лінкер у групі NR2-C1-6алкіл-CO-NR4- або -Het1-C1-6алкіл-CO-NR5необов‟язково заміщений одним або, якщо це можливо, двома або більше замісниками, вибраними з гідрокси, метокси, амінокарбонілу, галогену, ціанофенілу та фенілу; X1 являє собою простий зв‟язок, -C1-4алкіл-, C13 4алкілокси або C1-4алкіл-NR ; 2 X являє собою простий зв‟язок, C1-4алкіл, C14алкілокси-, C1-4алкіл-CO-, C2-4алкеніл, C2-4алкініл 17 або C1-4алкіл-NR7-, де зазначений C2-4алкеніл необов‟язково заміщений одним або, якщо це можливо, двома або більшt галогеновими замісниками; 1 14 R являє собою водень, Het або галоген; 2 R являє собою водень, C1-4алкіл, C2-4алкеніл або Het4-C1-4алкіл-; R3 та R7, кожен незалежно, являє собою водень або C1-4алкіл; R8 являє собою водень; R9 являє собою водень або C1-4алкіл; зокрема, 9 R являє собою, водень, метил, етил або ізопропіл; більш конкретно, водень, метил або етил; R4, R5, R6 та R10, кожен незалежно, являє собою водень або C1-4алкіл; Het1 та Het2, кожен незалежно, являє собою піролідиніл, піперидиніл або піперазиніл, де зазначений Het1 або Het2 необов‟язково заміщений гідрокси; зокрема, Het1 являє собою піролідиніл або піперазиніл, а Het2 являє собою піперидиніл, піперазиніл або піролідиніл, де зазначений піролідиніл необов‟язково заміщений гідрокси; Het4 являє собою піперазиніл, необов‟язково заміщений C1-4алкілом; Het10, Het11, Het12 та Het13, кожен незалежно, являє собою піролідиніл, піперидиніл або піперазиніл, де зазначені Het10, Het11, Het12 та Het13 необов‟язково заміщені гідрокси; зокрема, Het10, Het11, Het12 та Het13 являють собою піперазиніл; Het14 являє собою морфолініл; піролідиніл; піроліл; 1,2,3-триазоліл; 2,3,4-триазапіроліл; піперидиніл або піперазиніл, де зазначений Het14 необов‟язково заміщений C1-4алкілом; зокрема, Het14 являє собою морфолініл; піролідиніл; піперидиніл або піперазиніл; більш конкретно, Het14 являє собою морфолініл. Третя група сполук за даним винаходом складається з тих сполук формули (I), в яких використовують одне або більше з наступних обмежень; m означає 1; n означає 1; Z являє собою N або C, зокрема, N; Y являє собою -NR2-C1-6алкіл-CO-NR4-, -Het1C1-6алкіл-CO-NR5-, -Het2-CO-NR6-, де -C12 4 6алкільний лінкер у групі -NR -C1-6алкіл-CO-NR 1 5 або -Het -C1-6алкіл-CO-NR необов‟язково заміщений одним або, якщо це можливо, двома або більше замісниками, вибраними з гідрокси, галогену та фенілу; X1 являє собою -C1-4алкіл- або C1-4алкіл-NR3; X2 являє собою C1-4алкіл, C2-4алкеніл, C27 4алкініл або C1-4алкіл-NR -, де зазначений C2алкеніл необов‟язково заміщений одним або, 4 якщо це можливо, двома або більше галогеновими замісниками; R1 являє собою водень або галоген; R8 являє собою водень; R2 являє собою водень, C1-4алкіл або Het4-C14алкіл-; R3 та R7, кожен незалежно, являє собою водень або C1-4алкіл; R4, R5 та R6, кожен незалежно, являє собою водень або C1-4алкіл; Het1 та Het2, кожен незалежно, являє собою піролідиніл, піперидиніл або піперазиніл, де 92608 18 зазначений Het1 або Het2 необов‟язково заміщений гідрокси; Het4 являє собою піперазиніл, необов‟язково заміщений C1-4алкілом. Наступна група сполук за даним винаходом складається з тих сполук формули (I), в яких використовують одне або більше з наступних обмежень; -X1- являє собою C1-4алкіл, зокрема, метил; -X2- являє собою -C1-4алкіл- або -C1-4алкіл-NR7, зокрема, пропіл, -етил-NR7- або -пропіл-NR7-; -Y- являє собою-NR2-C1-6алкіл-CO-NR4-, -Het1C1-6алкіл-CO-NR5- або -Het2-CO-NR6- та, де -C12 4 6алкільний лінкер у групі -NR -C1-6алкіл-CO-NR 1 5 або -Het -C1-6алкіл-CO-NR необов‟язково заміщений одним або, якщо це можливо, двома або більше замісниками, вибраними з гідрокси, галогену та фенілу; R1 являє собою водень, хлор, фтор або бром; R2 являє собою -C1-4алкіл-, зокрема, етил або метил; R7 являє собою водень; R8 являє собою водень; R4, R5 та R6 являють собою водень; Het1 вибраний з піперазинілу або піперидинілу, зокрема, являє собою -піперазиніл; Het2 вибраний з піролідинілу або піперидинілу, зокрема, піролідинілу, де зазначений піролідиніл необов‟язково заміщений гідрокси. Четверта група сполук за даним винаходом складається з тих сполук формули (I), в яких використовують одне або більше з наступних обмежень; m означає 1; n означає 1; Z являє собою N або C, зокрема, N; Y являє собою -NR2-C1-6алкіл-CO-NR4-, -Het11CO-C1-6алкіл-, -CO-Het13-C1-6алкіл-, -CO-NR10-C11 5 2 6 6алкіл-, -Het -C1-4алкіл-CO-NR - або -Het -CO-NR -, де -C1-6алкільний лінкер у групі -NR2-C1-6алкіл-CONR4- або -Het1-C1-6алкіл-CO-NR5- необов‟язково заміщений гідрокси; 1 X являє собою -C1-4алкіл-, C1-4алкілокси- або C1-4алкіл-NR3; X2 являє собою простий зв‟язок, C1-4алкіл, C17 4алкілокси або C1-4алкіл-NR -; 1 R являє собою водень або галоген; R8 являє собою водень або галоген; R2 являє собою водень або Het4-C1-4алкіл-; R3 та R7, кожен незалежно, являє собою водень або C1-4алкіл; R4, R5, R6 та R10, кожен незалежно, являє собою водень або C1-4алкіл; Het1 та Het2, кожен незалежно, являє собою піролідиніл, піперидиніл або піперазиніл, де зазначений Het1 або Het2 необов‟язково заміщений гідрокси; Het4 являє собою піперазиніл, необов‟язково заміщений C1-4алком; Het11 являє собою піперидиніл або піперазиніл; зокрема, піперазиніл; Het13 являє собою піперидиніл або піперазиніл; зокрема, піперазиніл. Метою даного винаходу також є забезпечення сполук формули (I), в яких використовують одне або більше з наступних обмежень; m означає 1; n означає 1; Z являє собою N або C; 19 Y являє собою -C1-4алкіл-NR9-C1-4алкіл-, -NR2C1-6алкіл-CO-NR4-, -Het1-C1-6алкіл-CO-NR5- або Het2-CO-NR6-, де C1-6алкільний лінкер у -Yнеобов‟язково заміщений одним або, якщо це можливо, двома або більше замісниками, вибраними з гідрокси, галогену або фенілу; X1 являє собою C1-4алкіл або C1-4алкілокси-; зокрема, етил або етокси; X2 являє собою C1-4алкіл, C1-4алкілокси, або 7 NR -C1-4алкіл, зокрема, пропіл, -NR7-етил- або NR7-пропіл-; R1 являє собою водень, хлор, фтор або бром; R2 являє собою водень, C1-4алкіл або C2алкеніл; 4 R4 являє собою водень; R5 являє собою водень або C1-4алкіл; R6 являє собою водень або C1-4алкіл; R7 являє собою водень або C1-4алкіл; R8 являє собою водень, хлор, фтор або бром; R9 являє собою водень або C1-4алкіл; Het1 являє собою піперазиніл або піперидиніл; Het2 являє собою піролідиніл, піперидиніл або піперазиніл, де зазначений Het2 необов‟язково заміщений гідрокси. У наступному варіанті втілення даного винаходу сполуки формули (I) вибрані з групи, що включає: 14-метил-3,5,7,14,17,22,27гептаазатетрацикло[19.3.1.1~2,6~.1~8,12~]гептако за-1(25),2(27),3,5,8(26),9,11,21,23-нонаєн-19-ін-16он; (19Z)-19-хлор-14-метил-3,5,7,14,17,22,27гептаазатетрацикло[19.3.1.1~2,6~.1~8,12~]гептако за-1(25),2(27),3,5,8(26),9,11,19,21,23-декаєн-16-он; 14-метил-3,5,7,14,17,22,27гептаазатетрацикло[19.3.1.1~2,6~.1~8,12~]гептакоза1(25),2(27),3,5,8(26),9,11,21,23-нонаєн-16-он; 1,8,10,12,17,22,26,32-октаазапентацикло[24.2.2.1~3,7~.1~9,13~.1~14,18~]тритриаконта3(33),4,6,9(32),10,12,14(31),15,17-нонаєн-23-он; 1,8,10,12,17,22,25,31-октаазапентацикло[23.2.2.1~3,7~.1~9,13~.1~14,18~]дотриаконта3(32),4,6,9(31),10,12,14(30),15,17-нонаєн-23-он; 17-метил-3,5,7,14,17,22,27гептаазатетрацикло[19.3.1.1~2,6~.1~8,12~]гептако за-1(25),2(27),3,5,8(26),9,11,21,23-нонаєн-15-он; 18-метил-3,5,7,15,18,23,28гептаазатетрацикло[20.3.1.1~2,6~.1~8,12~]октакоза1(26),2(28),3,5,8(27),9,11,22,24-нонаєн-16-он; 14-метил-3,5,7,14,17,20,22,27октаазатетрацикло[19.3.1.1~2,6~.1~8,12~]гептакоза1(25),2(27),3,5,8(26),9,11,21,23-нонаєн-16-он; 14-метил-3,5,7,14,17,21,23,28октаазатетрацикло[20.3.1.1~2,6~.1~8,12~]октакоза1(26),2(28),3,5,8(27),9, 11,22,24-нонаєн-16-он; 18-етил-3,5,7,15,18,23,28-гептаазатетрацикло[20.3.1.1~2,6~.1~8,12~]октакоза1(26),2(28),3,5,8(27),9,11,22,24-нонаєн-16-он; 5-хлор-1,8,10,12,17,22,30гептаазапентацикло[22.2.2.1~3,7~.1~14,18~] 92608 20 гентриаконта-3(31),4,6,9(30),10,12,14(29),15,17нонаєн-23-он; 5-хлор-1,8,10,12,17,22,25,31октаазапентацикло[23.2.2.1~3,7~.1~9,13~.1~14,18~]дотриаконта3(32),4,6,9(31),10,12,14(30),15,17-нонаєн-23-он; 10-хлор-14-метил-3,5,7,14,17,22,27гептаазатетрацикло[19.3.1.1~2,6~.1~8,12~]гептакоза1(25),2(27),3,5,8(26),9,11,21,23-нонаєн-16-он; 10-хлор-14-етил-3,5,7,14,17,22,27гептаазатетрацикло[19.3.1.1~2,6~.1~8,12~]гептакоза1(25),2(27),3,5,8(26),9,11,21,23-нонаєн-16-он; 22-окса-3,5,7,14,19,31-гексаазапентацикло[21.2.2.2~14,17~.1~2,6~.1~8,12~]гентриаконта2,4,6(31),8,10,12(30),23,25,26-нонаєн-18-он; 13-окса-3,5,7,16,21,26-гексаазатетрацикло[18.3.1.1~2,6~.1~8,12~]гексакоза1(24),2,4,6(26),8,10,12(25),20,22-нонаєн-15-он; 13-окса-3,5,7,16,19,22,27-гептаазатетрацикло[19.3.1.1~2,6~.1~8,12~]гептакоза1(25),2,4,6(27),8,10,12(26),21,23-нонаєн-17-он, 19метил-; 1,5,10,12,14,21,24,30-октаазапентацикло[22.2.2.1~4,8~.1~9,13~.1~15,19~]гентриаконта4,6,8(31),9,11,13(30),15,17,19(29)-нонаєн-23-он, 21метил-; 21-окса-1,6,11,13,15,24,30гептаазапентацикло[22.2.2.1~5,9~.1~10,14~.1~16,20~]гентриаконта5,7,9(31),10,12,14(30),16,18,20(29)-нонаєн-23-он; 13,9-метено-19,15-нітрило-14H-піридо[3,2-g][1,3,5,9,12,15]гексаазациклогенейкозин-5(6H)він,1,2,3,4,7,8-гексагідро-7-(2-пропеніл)-; 1,8,10,12,22,25,31-гептаазапентацикло[23.2.2.1~3,7~.1~9,13~.1~14,18~]дотриаконта3,5,7(32),9,11,13(31),14,16,18(30)-нонаєн-23-он, 17фтор-; 3,5,7,14,17,22,27гептаазатетрацикло[19.3.1.1~2,6~.1~8,12~]гептако за-1(25),2,4,6(27),8,10,12(26),21,23-нонаєн-16-он, 14-(1-метилетил)-; 3,5,7,14,17,27-гексаазатетрацикло[19.3.1.1~2,6~.1~8,12~]гептакоза1(25),2,4,6(27),8,10,12(26),21,23-нонаєн-15-он, 22фтор-17-метил-; 3,5,7,14,17,27-гексаазатетрацикло[19.3.1.1~2,6~.1~8,12~]гептакоза1(25),2,4,6(27),8,10,12(26),21,23-нонаєн-16-он, 10хлор-22-фтор-15-(гідроксиметил)-, (15S)-; 3,5,7,14,17,21,28гептаазатетрацикло[20.3.1.1~2,6~.1~8,12~]октакоз а-1(26),2,4,6(28),8,10,12(27),22,24-нонаєн-16-он, 15-(фенілметил)-, (15S)-; 11,7-метено-6,2-нітрило-1H-1,3,5,15,18бензопентаазациклогенейкозин-17(12H)-он, 13,14,15,16,18,19-гексагідро-16-метил-, (16R)-; 3,5,7,14,17,23,27-гептаазатетрацикло[19.3.1.1~2,6~.1~8,12~]гептакоза1(25),2,4,6(27),8,10,12(26),21,23-нонаєн-16-он; 1,8,10,12,16,22,25,31-октаазапентацикло[23.2.2.1~3,7~.1~9,13~.1~14,18~]дотриаконта3,5,7(32),9,11,13(31),14,16,18(30)-нонаєн-23-он; 21 3,5,7,14,17,23,27-гептаазатетрацикло[19.3.1.1~2,6~.1~8,12~]гептакоза1(25),2,4,6(27),8,10,12(26),21,23-нонаєн-16-он, 15(гідроксиметил)-, ( 15S)-; 3,5,7,14,18,21,26-гептаазатетрацикло[18.3.1.1~2,6~.1~8,12~]гексакоза1(24),2,4,6(26),8,10, 12(25),20,22-нонаєн-17-он, 14метил-; 3,5,7,14,17,22,27-гептаазатетрацикло[19.3.1.1~2,6~.1~8,12~]гептакоза-1 (25),2,4,6(27),8,10,12(26),21,23-нонаєн-16-он, 14,17-диметил-; 3,5,7,14,18,24,29гептаазатетрацикло[21.3.1.1~2,6~.1~8, 12~]нонакоза-1(27),2,4,6(29),8,10,12(28),23,25нонаєн-17-он, 14-метил- (HCl-сіль); 3,5,7,14,17,22,27-гептаазатетрацикло[19.3.1.1~2,6~.1~8,12~]гептакоза1(25),2,4,6(27),8,10, 12(26),21,23-нонаєн-16-он, 15(гідроксиметил)-, (15S)-; включаючи їх N-оксидні форми, фармацевтично прийнятні адитивні солі та стереохімічно активні форми. Ще в одному варіанті втілення сполуки формули (I) вибрані із солей трифтороцтової кислоти наступних сполук; 18-етил-3,5,7,15,18,23,28-гептаазатетрацикло[20.3.1.1~2,6~.1~8,12~]октакоза1(26),2(28),3,5,8(27),9,11,22,24-нонаєн-16-он; 14-метил-3,5,7,14,17,21,23,28октаазатетрацикло[20.3.1.1~2,6~.1~8,12~]октакоза1(26),2(28),3,5,8(27),9,11,22,24-нонаєн-16-он; 1,8,10,12,17,22,25,31октаазапентацикло[23.2.2.1~3,7~.1~9,13~.1~14,18~ ]дотриаконта-3(32),4,6,9(31),10,12,14(30),15,17нонаєн-23-он; 14-метил-3,5,7,14,17,20,22,27октаазатетрацикло[19.3.1.1~2,6~.1~8,12~]гептакоза1(25),2(27),3,5,8(26),9,11,21,23-нонаєн-16-он; 14-метил-3,5,7,14,17,22,27гептаазатетрацикло[19.3.1.1~2,6~.1~8,12~]гептакоза1(25),2(27),3,5,8(26),9,11,21,23-нонаєн-16-он; 1,8,10,12,22,25,31-гептаазапентацикло[23.2.2.1~3,7~.1~9,13~.1~14,18~]дотриаконта3,5,7(32),9,11,13(31),14,16,18(30)-нонаєн-23-он, 17фтор-; 3,5,7,14,17,22,27-гептаазатетрацикло[19.3.1.1~2,6~.1~8,12~]гептакоза1(25),2,4,6(27),8,10,12(26),21,23-нонаєн-16-он, 14(1-метилетил)-; 3,5,7,14,17,27-гексаазатетрацикло[19.3.1.1~2,6~.1~8,12~]гептакоза1(25),2,4,6(27),8,10, 12(26),21,23-нонаєн-15-он, 22фтор-17-метил-; 3,5,7,14,17,27-гексаазатетрацикло[19.3.1.1~2,6~.1~8,12~]гептакоза1(25),2,4,6(27),8,10, 12(26),21,23-нонаєн-16-он, 10хлор-22-фтор-15-(гідроксиметил)-, (15S)-; 3,5,7,14,17,23,27-гептаазатетрацикло[19.3.1.1~2,6~.1~8,12~]гептакоза1(25),2,4,6(27),8,10, 12(26),21,23-нонаєн-16-он; 92608 22 1,8,10,12,16,22,25,31-октаазапентацикло[23.2.2.1~3,7~.1~9,13~.1~14,18~]дотриаконта3,5,7(32),9,11,13(31),14,16, 18(30)-нонаєн-23-он; 3,5,7,14,17,23,27-гептаазатетрацикло[19.3.1.1~2,6~.1~8,12~]гептакоза1(25),2,4,6(27),8,10,12(26),21,23-нонаєн-16-он, 15(гідроксиметил)-, (15S)-; або 1,8,10,12,17,22,26,32-октаазапентацикло[24.2.2.1~3,7~.1~9,13~.1~14,18~]тритриаконта3(33),4,6,9(32), 10,12,14(31),15,17-нонаєн-23-он. Інша особлива група сполук являє собою: - сполуки формули (I), де -X1- являє собою C14алкіл, зокрема, метил; - сполуки формули (I), де -X1- являє собою -C14алкілокси-, зокрема, етокси або пропілокси; - сполуки формули (I), де -X2- являє собою -C14алкіл-, зокрема, пропіл; - сполуки формули (I), де -X2- являє собою -C1алкілокси-, зокрема, етокси або пропілокси; 4 - сполуки формули (I), де -X2- являє собою -C1алкіл-NR7-, зокрема, -етил-NR7- та -пропіл-NR7-; 4 - сполуки формули (I), де Y являє собою C19 9 4алкіл-NR -C1-4алкіл-, та R являє собою водень або етил; - сполуки формули (I), де -Y- являє собою NR2-C1-6алкіл-CO-NR4-, де зазначений C16алкільний лінкер необов‟язково заміщений одним або, якщо це можливо, двома або більше замісниками, вибраними з гідрокси, галогену та фенілу; зокрема, ті сполуки формули (I), де -Yявляє собою-NR2-C1-6алкіл-CO-NR4-; де R2 являє собою водень, етил, ізопропіл, 2-пропеніл або метил, та де R4 являє собою водень або метил; більш конкретно, ті сполуки формули (I), де -Yявляє собою -NR2-C1-6алкіл-CO-NR4-; R2 являє собою водень, етил або метил, та де R4 являє собою водень або метил; - сполуки формули (I), де -Y- являє собою Het1-C1-6алкіл-CO-NR5-, де Het1 вибраний з піперазинілу або піперидинілу; R5 являє собою водень або метил, та де C1-6алкільний лінкер необов‟язково заміщений одним або, якщо це можливо, двома або більше замісниками, вибраними з гідрокси, галогену та фенілу; зокрема, Y являє собою -піперазиніл-етил-СОNR5-; - сполуки формули (I), де -Y- являє собою Het2-CO-NR6-, де Het2 вибраний з піролідинілу, піперазинілу або піперидинілу, а R6 вибраний з водню або метилу, зокрема, Het2 являє собою піролідиніл, де зазначений піролідиніл необов‟язково заміщений гідрокси; - сполуки формули (I), де Het1 являє собою піперазиніл або піперидиніл; - сполуки формули (I), де Het2 являє собою піролідиніл, піперидиніл або піперазиніл, де зазначений Het2 необов‟язково заміщений гідрокси; - сполуки формули (I), де R1 являє собою водень, хлор, фтор або бром; - сполуки формули (I), де R8 являє собою водень, хлор, фтор або бром; - сполуки формули (I), де R2 являє собою водень, -C1-4алкіл або C2-4алкеніл, зокрема, водень, етил, метил або 2-пропеніл, або R2 являє 23 собою водень або -C1-4алкіл, більш конкретно водень, етил або метил; - сполуки формули (I), де -C1-6алкільний лінкер у групі -Y- необов‟язково заміщений одним або, якщо це можливо, двома або більше замісниками, вибраними з гідрокси та фенілу. У наступному варіанті втілення даного винаходу замісник X1 знаходиться в положенні 3, замісник R1 являє собою водень або галоген та знаходиться в положенні 5, триазинове кільце приєднане до Z-вмісного кільця в положенні 4‟, та замісник X2 знаходиться в положенні 2‟ структури формули (I). У наступному варіанті втілення даного винаходу, для тих сполук формули (I), де Z являє собою C, замісник X1 знаходиться в положенні 3, замісник R1 являє собою водень або галоген та знаходиться в положенні 5, триазинове кільце приєднане до Z-вмісного кільця в положенні 4‟, замісник X2 знаходиться в положенні 2‟, та замісник R8 знаходиться в положенні 1‟. У наступному варіанті втілення даного винаходу замісник X1 знаходиться в положенні 3, замісник R1 являє собою водень або галоген та знаходиться в положенні 5, триазинове кільце приєднане до Z-вмісного кільця в положенні 5‟, та замісник X2 знаходиться в положенні 3‟ структури формули (I). Ще в одному варіанті втілення даного винаходу, для тих сполук формули (I), де Z являє собою C, замісник X1 знаходиться в положенні 3, замісник R1 являє собою водень або галоген та знаходиться в положенні 5, триазинове кільце приєднане до Z-вмісного кільця в положенні 5‟, замісник X2 знаходиться в положенні 3‟, та замісник R8 знаходиться у положенні 1‟. Сполуки за даним винаходом можуть бути отримані за допомогою будь-якого з декількох стандартних способів синтезу, що звичайно використовуються фахівцями в галузі органічної хімії, та які включають хімічні способи, що проводять як у рідкій фазі, так і у твердій фазі. Як більш докладно наведено далі за допомогою прикладів, сполуки за даним винаходом, як правило, одержують з анілін-4-піридилтриазинів формули II або III у 3-стадійній реакції, що включає: Схема 1 92608 24 де Z, n, X1, X2 та R1 мають значення, зазначені вище для сполук формули (I). i) на першій стадії проводять перетворення спирту на групу, що краще видаляється, наприклад, шляхом мезилування за допомогою MeSO2Cl (MsCl) з одержанням відповідних мезилатів формул IV та V. Цю реакцію мезилування звичайно здійснюють у підходящому реакційно-інертному розчиннику, такому як, наприклад, CH3CN або ДМФА, у присутності основи, такої як піридин або N,Nдіізопропілетиламін (DIPEA), шляхом перемішування реакційної суміші протягом 5 - 30 хвилин, зокрема 5 - 15 хвилин, при кімнатній температурі; ii) амінування такого отриманого мезилату за допомогою підходящого ефіру амінокислоти загальної формули (V) надає проміжні сполуки загальних формул VI або VII. Цю реакцію амінування звичайно здійснюють у реакційноінертному розчиннику, такому як, наприклад, CH3CN або ДМФА, у присутності основи, такої як диметиламін або N,N-діізопропілетиламін (DIPEA), та при перемішуванні зазначеної реакційної суміші протягом ночі при підвищеній температурі в межах 50 - 70°C, типово 60 - 65°C. Надлишок аміну наприкінці видаляють з реакційної суміші з використанням нанесених на полімерну підкладку акцепторів аміну, таких як нанесений на полімерну підкладку ізоціанат (PS-NCO) або нанесений на полімерну підкладку метил-Nкарбоксіантраніловий ангідрид (PM-MIA); Схема 2 де n, Z, X1, X2 та R1 мають значення, зазначені вище для сполук формули (I), та, де x означає 0, 1, 2 або 3; P являє собою захисну групу, таку як, наприклад, метилкарбонільна, трет-бутильна, метильна, етильна, бензильна або тріалкілсилільна групи; R являє собою R2, що має значення, зазначене вище для сполук формули (I), або разом з атомом азоту, до якого він приєднаний, утворює гетероцикли Het1 або Het2, визначені для сполук формули (I). iii) видалення захисту та циклізація проміжних сполук формул VII або VIII наприкінці забезпечують сполуки за даним винаходом. 25 Реакцію видалення захисту звичайно здійснюють з використанням TFA в умовах, відомих з рівня техніки, наприклад у TFA/DCM/TIS (49:49:2), необов‟язково з використанням триметилсилілтрифлату (TMSOTf), наприклад, 1 M TMSOTf, 1,5 M 2,6-лутидину в DCM. Кінцеву циклізацію або реакцію макролактамізації здійснюють з використанням умов, відомих з рівня техніки, таких як, наприклад, повільне додавання незамкнутого попередника до реакційної суміші, що містить агент пептидного зв‟язування Oбензотриазол-N,N,N‟,N‟тетраметилуронійгексафторфосфат (HBTU), та перемішування зазначеної реакційної суміші протягом, щонайменше, 1 години при кімнатній температурі. Схема 3 де n, Z, X1, X2 та R1 мають значення, зазначені вище для сполук формули (I), та де x означає 0, 1, 2 або 3; P являє собою захисну групу, таку як, наприклад, метилкарбонільна, трет-бутильна, метильна, етильна, бензильна або тріалкілсилільна групи; R являє собою R2, що має значення, зазначені вище для сполук формули (I), або разом з атомом азоту, до якого він приєднаний, утворює гетероцикли Het1 або Het2, визначені для сполук формули (I). Анілін-триазини для використання за даним винаходом одержують: - для тих сполук, де Z являє собою N та триазинове кільце приєднане до Z-вмісного кільця в положенні 4‟, та замісник X2 знаходиться в положенні 2‟ структури формули (I), виходячи з описаного раніше 2-хлор-4-(2-хлор-4-піридиніл) 1,3,5-триазину [333737-06-7] та 92608 26 - для інших сполук, де Z являє собою N та триазинове кільце приєднане до Z-вмісного кільця в положенні 4‟, та замісник X2 знаходиться в положенні 2‟ структури формули (I), виходячи з метилового ефіру 4-(4-хлор-[1,3,5]триазин-2-іл)піридин-2-карбонової кислоти, що одержують з комерційно доступного метилового ефіру 4-ціанопіридин-2-карбонової кислоти, як наведено в прикладі A18 далі, та - для тих сполук, де Z являє собою N та триазинове кільце приєднане до Z-вмісного кільця в положенні 3‟, та замісник X2 знаходиться в положенні 2‟ структури формули (I), виходячи з описаного раніше 2-хлор-4-(2-хлор-піридин-3-іл)[1,3,5]триазину [333736-95-1], та - для тих сполук, де Z являє собою N та триазинове кільце приєднане до Z-вмісного кільця в положенні 5‟, та замісник X2 знаходиться в положенні 3‟ структури формули (I), виходячи з 2(5-бром-піридин-3-іл)-4-хлор-[1,3,5]триазину, що одержують з комерційно доступного 5бромнікотинонітрилу, як наведено в прикладі A26 далі, та - для тих сполук, де Z являє собою C, X2 являє собою C1-4алкіл-, та триазинове кільце приєднане до Z-вмісного кільця в положенні 4‟, та замісник X2 знаходиться в положенні 2‟ структури формули (I), виходячи з 2-хлор-4-(2-бромфеніл)1,3,5-триазину або 2-(3-бром-4-фторфеніл)-4-хлор[1,3,5]триазину, що одержують з комерційно доступного 3-бромбензонітрилу або 3-бром-4фторбензонітрилу, як наведено, відповідно, у прикладі A9 або A22 далі, та - для тих сполук, де Z являє собою C, X2 являє собою C1-4алкіл-NH-, де NH безпосередньо зв‟язаний із триазиновим кільцем, триазинове кільце приєднане до Z-вмісного кільця в положенні 4‟, та X2 знаходиться в положенні 2‟ структури формули (I), виходячи з 2-хлор-4-(3-нітрофеніл)[1,3,5]триазину, що одержують з комерційно доступного 1-ціано-3-нітробензолу, як наведено, відповідно, у прикладі A12 далі, та - для тих сполук, де Z являє собою C, X2 являє собою C1-4алкілокси-, де O безпосередньо зв‟язаний із триазиновим кільцем, та триазинове кільце приєднане до Z-вмісного кільця в положенні 4‟, та X2 знаходиться в положенні 1‟ структури формули (I), виходячи з трет-бутилового ефіру {2[4-(4-хлор-[1,3,5]триазин-2іл)феноксі]етил}карбамінової кислоти, що одержують з комерційно доступного 4гідроксибензонітрилу, як наведено, відповідно, у прикладі A16 далі, та шляхом введення підходящого аніліну загальної формули (X) по високореактивному хлору в триазині, в умовах, відомих з рівня техніки, наприклад шляхом перемішування в CHCl3 у присутності 2 екв. DIPEA, з одержанням аніліноарилтриазинів формули (3) 27 92608 28 Схема 4 Проміжна сполука 3а 3b 3с 3d 3е 3f 3g 3h 3i 3j 3k 3l 3m 3n 3o R10 3-CH2OH 3-CH2OH 3-CH2NHBoc 3-(CH2)2NHBoc 3-CH2OH 3-CH2OH 3-CH2OH 3-OCH2CO2tBu 3-O(CH2)2NHBoc 3-CH2OH 3-CH2OH 3-CH2NHBOC 3-CH2OH 2-CH2NHBOC 3-CH2OH Приєднання триазину 4‟ 4‟ 4‟ 4‟ 4‟ 4‟ 4‟ 4‟ 4‟ 4‟ 4‟ 4‟ 4‟ 4‟ 5‟ Boc, як використовується в даній заявці, відповідає трет-бутилоксикарбонільній групі; tBu, як використовується в даній заявці, відповідає трет-бутильній групі. Для сполук 3, де W являє собою галоген, використовують реакцію Сонагашира для синтезу проміжних сполук формули II або III, де X2 являє собою C3-4алкіл. Реакція Сонагашира включає Z W R1 R8 N N N N С С С N N N С С С С N 2‟-С1 2‟-С1 2‟-С1 2‟-С1 2‟-Вr 2‟-NO2 1‟-O(CH2)2NHBoc 2‟-С1 2‟-СО2Ме 2‟-С1 2‟-Вr 2‟-Вr 2‟-Вr 2‟-Вr 3‟-Вr Н 5-С1 Н Н Н Н Н Н Н Н Н H 5-Сl Н Н Н Н Н Н Н Н Н Н Н Н 1‟-F 1‟-F 1‟-F Н Н каталізуєме паладієм сполучення підходящого алкінілу з арил-галогенідами з одержанням алкініларенів формули (4). Цю реакцію здійснюють в умовах, відомих з рівня техніки, таких як, наприклад, нагрівання підходящого алкінілу в присутності Pd(PPh3)2Cl2, PPh3, CuІ та Et2NH при 60°C протягом 24 годин в атмосфері азоту. Схема 5 Конкретні проміжні сполуки, отримані відповідним способом, представлені в Таблиці 2 нижче. Таблиця 2 Проміжна сполука 4а 4b 4с 4d 4е 4f 4g 4h 4i 4j 4к 41 4т З R10 3а 3а 3а 3b 3с 3d 3е 3h 3к 31 3т 3п 3о 3-СН2ОН 3-СН2ОН 3-СН2ОН 3-СН2ОН 3-CH2NHBoc 3-(CH2)2NHBoc 3-СН2ОН 3-OCH2CO2tBu 3-СН2ОН 3-CH2NHBoc 3-СН2ОН 2-CH2NHBoc 3-СН2ОН Приєднання триазину 4‟ 4‟ 4‟ 4‟ 4‟ 4‟ 4‟ 4‟ 4‟ 4‟ 4‟ 4‟ 5‟ Z R1 R8 R11 N N N N N N С N С С С C N Н Н Н 5-Сl Н Н Н Н Н Н 5-С1 2‟-Вr 3‟-Вr Н Н Н Н Н Н Н Н 1‟-F 1‟-F 1‟-F Н Н CH2NHBoc CH2NMeBoc (CH2)2NHBoc CH2NHBoc CH2OH CH2OH CH2NHBoc CH2NHBoc CH2NHBoc CH2OH CH2NHBoc CH2OH CH2NHBoc 29 92608 Для тих сполук, де X2 додатково обмежений до C3-4 алкілу, отримані в такий спосіб сполуки загальної формули (4) відновлювали в умовах, відомих з рівня техніки, звичайно з використанням 30 гідрогенолізу з 10% Pd/C або 5% Pt/C як каталізатором, у лужному розчиннику, такому як MeOH/NEt3 або ТГФ/NEt3, до сполук загальної формули (5). Схема 6 Конкретні проміжні сполуки, отримані відповідним способом, представлені в Таблиці 3. Таблиця 3 Проміжна сполука 5а 5b 5b 5с 5f 5h 5i 5i 5k 5l З 4a 4b 4c 4d 4g 4i 4j 4k 4l 4m 3-CH2OH 3-CH2OH 3-CH2OH 3-CH2OH 3-CH2OH 3-CH2OH 3-CH2NHBос 3-CH2OH 2-CH2NHBoc 3-CH2OH Приєднання триазину 4‟ 4‟ 4‟ 4‟ 4‟ 4‟ 4‟ 4‟ 4‟ 5‟ Амінове заміщення для тих сполук формули II, де триазинове кільце приєднане до Z-вмісного кільця в положенні 4‟ та X2 являє собою -C1-4алкілNR7 у положенні 2‟, можна, наприклад, одержати шляхом перемішування 2-хлорпіридилу (3a) у підходящому аміні (6a) як розчиннику в умовах Z R1 R8 R11 N N N N С С С с с N Н Н Н 5-С1 Н Н Н 5-С1 Н н Н Н Н Н Н 1‟-F 1‟-F 1‟-F Н Н CH2NHBoc CH2NMeBoc (CH2)2NHBoc CH2NHBoc CH2NHBoc CH2NHBoc CH2OH CH2NHBoc CH2OH CH2NHBoc кип‟ятіння зі зворотним холодильником, як наприклад протягом періоду часу від 1 години до протягом ночі при 100 - 180°C, більш конкретні умови реакції зазначені в представлених нижче прикладах. Схема 7 Схема 7. a) R12-HN(CH2)nCH2NH2 (розч.), кип‟ятіння зі зворотним холодильником, протягом ночі (o=1) або 160°C, 1 година (o=2) b) Bo2O, DCM/MeOH, 4 години, де o має значення 0, 1, 2 або 3; де R1 та R10 мають значення, визначені для проміжних сполук формули (X) вище, та де R12 відповідає R4, R5 або R6, визначеним для сполук формули (I) вище. Подібним чином, сполуки формули II, де триазинове кільце приєднане до Z-вмісного кільця в положенні 3‟ та X2 являє собою -C1-4алкіл-NR7 у положенні 2‟, можна, наприклад, одержати шляхом перемішування 2-хлорпіридилу (3k) у підходящому аміні (6b) як розчиннику в умовах мікрохвильового опромінення, як наприклад протягом періоду часу від 1 - 3 годин до протягом ночі, при 100 - 140°C, більш конкретні умови реакції зазначені в представлених нижче прикладах. 31 92608 32 Схема 8 Схема 8. де o має значення 0, 1, 2 або 3; де R1 та R10 мають значення, визначені для проміжних сполук формули (X) вище, та де R12 відповідає R4, R5 або R6, визначеним вище для сполук формули (I). Альтернативно, для тих сполук формули (I), де Z являє собою C та X2 являє собою -C1-4алкіл-NR7, анілін-триазинові похідні (10) одержують з нітропохідних (8) після гідрування в умовах, відомих з рівня техніки, наприклад за допомогою гідрогенолізу з використанням 10% Pd/C або 5% Pt/C як каталізатору, у лужному розчиннику, такому як MeOH/NEt3 або ТГФ/NEt3, та відновного алкілування з використанням підходящого альдегіду (9) в умовах, відомих з рівня техніки, наприклад з використанням NaBH4 та ізопропоксиду титану(ІV) як відновників, у етанолі або 1,2-дихлоретані як розчиннику. Схема 8 Схема 8. a) H2, каталізатор, MeOH або ТГФ, NEt3 b) NaBH4, ізопропоксид титану(IV)/1,2дихлоретан 3,5 години, де o має значення 0, 1, 2 або 3; де R1 та R10 мають значення, визначені для проміжних сполук формули (X) нижче, та де R12 відповідає R4, R5 або R6, визначеним вище для сполук формули (I) вище. Конкретні проміжні сполуки, отримані у відповідності зі Схемою 8, представлені в прикладах A14 та A15 нижче. Сполуки формули II, де X2 обмежений до C2алкілу, одержували за допомогою реакції Стілу з перетворенням сполуки 3a на сполуку 11, з наступною реакцією Міхаеля приєднання підходящого аміну, наприклад, моно-Bocзахищеного діаміну, з одержанням сполуки 12, як наведено на Схемі 9 та описано в A19 нижче. Схема 9 Схема 9. a) (н-Bu)3SnCH=CH2, Pd(PPh3)4, PPh3, ДМФА, 80°C, 48 годин. b) N-Boc-захищений діамін (розпл.), 70 - 100°C; де обидва R12 незалежно відповідають R4, R5 або R6, з можливим взаємозв‟язуванням, коли R12 являє собою метил та o=1, 2, як визначено вище для сполук формули (I). 2 Сполукиформули II, де X обмежений до метилену, одержували шляхом ціанування сполуки 3a в умовах, відомих з рівня техніки, таких як нагрівання до 80°C у присутності Pd2(dba)3, dppf, Zn та Zn(CN)2, протягом 2 годин, з наступним відновленням нітрилу в умовах, відомих з рівня техніки, таких як гідрування у присутності нікелю 33 Ренея як каталізатора та наступний захист за допомогою Boc-групи з одержанням сполуки 14, як 92608 34 наведено на Схемі 10 та описано в A30 нижче. Схема 10 Схема 10. a) Pd2(dba)3, dppf, Zn, Zn(CN)2, DMA, 80°C, 2 години; b) (i) RaNi, MeOH/NH3, H2, RT, (ii) (Boс)2O, CH2Cl21MeOH, Na2CO3 10%, кімнатна температура, 1 година. Сполуки формули III, де X2 обмежений до метилену, одержували шляхом відновлення сполуки 3i до відповідного спирту 15, як наведено на Схемі 11 та описано в A18 нижче. Схема 11 Схема 11. a) NaBH4, CaCl2, MeOH, від -15 до 10°C Якщо необхідно або бажано, можна здійснити будь-яку одну або декілька із зазначених нижче додаткових стадій, у будь-якому порядку: (і) видалення будь-якої захисної групи (груп), що залишилася; (ii) перетворення сполуки формули (I) або її захищеної форми на іншу сполуку формули (I) або її захищену форму; (iii) перетворення сполуки формули (I) або її захищеної форми на N-оксид, сіль, четвертинний амін або сольват сполуки формули (I) або їх захищену форму; (iv) перетворення N-оксиду, солі, четвертинного аміну або сольвату сполуки формули (I) або їх захищеної форми на сполуку формули (I) або її захищену форму; (v) перетворення N-оксиду, солі, четвертинного аміну або сольвату сполуки формули (I) або їх захищеної форми на інший Nоксид, фармацевтично прийнятну сіль, четвертинний амін або сольват сполуки формули (I) або їх захищену форму; (vi) коли сполуку формули (I) одержують у вигляді суміші (R) та (S) енантіомерів, розділення суміші з одержанням бажаного енантіомеру. Сполуки формули (I), N-оксиди, адитивні солі, четвертинні аміни та їх стереохімічно ізомерні форми можуть бути перетворені на інші сполуки за даним винаходом з використанням методик, відомих з рівня техніки. Фахівцям у даній галузі техніки бути зрозуміло, що в способах, описаних вище, може бути необхідний захист функціональних груп проміжних сполук за допомогою захисних груп. Функціональні групи, що бажано захистити, включають групи гідрокси, аміно та карбонової кислоти. Підходящі захисні групи для гідрокси включають тріалкілсилільні групи (наприклад, трет-бутилдиметилсиліл, трет-бутилдифенілсиліл або триметилсиліл), бензил та тетрагідропіраніл. Підходящі захисні групи для аміно включають трет-бутилоксикарбоніл або бензилоксикарбоніл. Підходящі захисні групи для карбонової кислоти включають C(1-6)алкілові або бензилові ефіри. Введення та видалення захисту функціональних груп можна здійснювати до або після стадії реакції. Використання захисних груп докладно описане в “Protective Groups in Organic Synthesis‟ 3rd edition, T. W. Greene & P. G. M. Wutz, Wiley Interscience (1999). Крім того, N-атоми в сполуках формули (I) можуть бути метильовані за допомогою способів, відомихи з рівня техніки, з використанням CH3-I у підходящому розчиннику, такому як, наприклад 2пропанон, тетрагідрофуран або диметилформамід. Сполуки формули (I) також можуть бути перетворені одна на одну за допомогою методик, відомих з рівня техніки для перетворення функціональних груп, деякі приклади яких приведені нижче. Сполуки формули (I) також можуть бути перетворені на відповідні N-оксидні форми за допомогою методик, відомих з рівня техніки для перетворення тривалентного азоту на його Nоксидну форму. Зазначену реакцію N-окиснення, 35 як правило, здійснюють шляхом взаємодії вихідної речовини формули (I) з 3-феніл-2(фенілсульфоніл)оксазиридином або з підходящим органічним або неорганічним пероксидом. Підходящі неорганічні пероксиди включають, наприклад, пероксид водню, пероксиди лужних металів або лужноземельних металів, наприклад, пероксид натрію, пероксид калію; підходящі органічні пероксиди можуть включати пероксикислоти, такі як, наприклад, бензолкарбопероксикислота або галоген-заміщена бензолкарбопероксикислота, наприклад, 3хлорбензолкарбопероксикислота, пероксоалканові кислоти, наприклад, пероксооцтова кислота, алкілгідропероксиди, наприклад, третбутилгідропероксид. Підходящими розчинниками, наприклад, є вода, нижчі алканоли, наприклад, етанол та т.п., вуглеводні, наприклад, толуол, кетони, наприклад, 2-бутанон, галогеновані вуглеводні, наприклад, дихлорметан, та суміші таких розчинників. Деякі сполуки формули (I) та деякі проміжні сполуки за даним винаходом можуть містити асиметричний атом вуглецю. Чисті стереохімічно ізомерні форми зазначених сполук та зазначених проміжних сполук можна одержати за допомогою методик, відомих з рівня техніки. Наприклад, діастереоізомери можна розділити такими фізичними способами, як селективна кристалізація, або хроматографічними методами, наприклад, протиточний розподіл, рідинна хроматографія та т.п. методи. Енантіомери можуть бути отримані з рацемічних сумішей спочатку шляхом перетворення зазначених рацемічних сумішей за допомогою підходящих агентів розділення, таких як, наприклад, хіральні кислоти, на суміші діастереомерних солей або сполук; потім шляхом фізичного розділення зазначених сумішей діастереомерних солей або сполук, наприклад, за допомогою селективної кристалізації або хроматографічними методами, наприклад, методами рідинної хроматографії та т.п.; та, нарешті, перетворення зазначених розділених діастереомерних солей або сполук на відповідні енантіомери. Чисті стереохімічно ізомерні форми також можуть бути отримані з чистих стереохімічно ізомерних форм підходящих проміжних сполук та вихідних речовин, за умови, що супутні реакції відбуваються стереоселективно. Альтернативний спосіб розділення енантіомерних форм сполук формули (I) та проміжних сполук включає рідинну хроматографію, зокрема, рідинну хроматографію з використанням хіральної стаціонарної фази. Деякі з проміжних сполук та вихідних речовин, що використовуються у методиках реакцій, зазначених вище, являють собою відомі сполуки та можуть бути комерційно доступними або можуть бути отримані відповідно до методик, відомих з рівня техніки. Проте при синтезі сполук формули (I) даний винахід також забезпечує; a) проміжні сполуки формули (X) 92608 36 , їх фармацевтично прийнятні адитивні солі та стереохімічно ізомерні форми, де n означає ціле число, що має значення від 1 до 4; R1 являє собою водень, ціано, галоген, гідрокси, C1-6алкокси-, C1-6алкіл-, моно- або ді(C1моноабо ді(C14алкіл)амінокарбоніл-, C1-6алкокси-, заміщений 4алкіл)аміносульфоніл, галогеном, або R1 являє собою C1-6алкіл, заміщений одним або, якщо це можливо, двома або більше замісниками, вибраними з гідрокси або галогену; R10 являє собою водень, ціано, галоген, гідрокси, C1-6алкокси-, C1-6алкіл- або C1-6алкіл, заміщений одним або, якщо це можливо, двома або більше залишками, вибраними з гідрокси та NR13R14; R13 та R14, кожен незалежно, являє собою водень, C1-6алкіл, C1-6алкілоксикарбоніл або C16алкілоксикарбонілC1-4алкіл-. Зокрема, проміжні сполуки формули (X), в яких використовують одне або більше з наступних обмежень; i) n означає 1; ii) R1 являє собою водень або галоген, зокрема, водень або хлор; iii) R1 являє собою C1-6алкіл, заміщений одним або, якщо це можливо, двома або більше залишками, вибраними з гідрокси та NR13R14; iv) R13 та R14, кожен незалежно, являє собою водень, C1-6алкіл, C1-6алкілоксикарбоніл або C16алкілоксикарбонілC1-4алкіл-. b) проміжні сполуки формули (XI) , їх фармацевтично прийнятні адитивні солі та стереохімічно ізомерні форми, де n означає ціле число, що має значення від 1 до 4; m означає ціле число, що має значення від 1 до 4; Z являє собою N або C; P1 та P2, кожен незалежно, являє собою гідрокси, галоген, гідроксикарбоніл-, галогенкарбоніл-, C1-6алкілоксикарбоніл- або C16алкілоксикарбоніл-C1-4алкіл-; 3 20 X являє собою C1-6алкіл або C1-6алкіл-NR ; 4 X являє собою C1-6алкіл або C1-6алкіл-NR21; R1 та R8, кожен незалежно, являє собою водень, ціано, галоген, гідрокси, C1-6алкокси-, C1моно- або ді(C1-4алкіл)амінокарбоніл-, 6алкіл-, моно-, ді(C1-4алкіл)аміносульфоніл, або C11 являє 6алкокси-, заміщений галогеном, або R 37 собою C1-6алкіл, заміщений одним або, якщо це можливо, двома або більше замісниками, вибраними з гідрокси або галогену; R20 та R21, кожен незалежно, являє собою 20 21 водень, C1-4алкіл, Het , Het -C1-4алкіл-, необов‟язково заміщений групою Het22-C1C1-4алкоксіC1-4алкіл- або 4алкіламінокарбоніл-, феніл, необов‟язково заміщений одним або, якщо це можливо, двома або більше замісниками, вибраними з водню, гідрокси, аміно, або C14алкілокси-; Het20 являє собою гетероцикл, вибраний з піролідинілу або піперидинілу, де зазначений Het20 необов‟язково заміщений групою C1-4алкіл, C36циклоалкіл, гідроксі-C1-4алкіл- або полігідроксі-C14алкіл-; Het21 являє собою гетероцикл, вибраний з піролідинілу або піперидинілу, де зазначений Het21 необов‟язково заміщений групою C1-4алкіл, C36циклоалкіл, гідроксі-C1-4алкіл- або C1-4алкілоксіC14алкіл, полігідроксі-C1-4алкіл-; Het22 являє собою гетероцикл, вибраний з морфолінілу, піролідинілу, піперазинілу або піперидинілу, де зазначений Het22 необов‟язково заміщений групою C1-4алкіл, C3-6циклоалкіл, гідроксі-C1-4алкіл-, C1-4алкілоксіC1-4алкілабо полігідроксі-C1-4алкіл-. В іншому варіанті втілення даний винахід забезпечує проміжні сполуки формули (XI), в яких використовують одне або більше з наступних обмежень; n означає 1; m означає 1; Z являє собою N або C, зокрема, N; P1 та P2, кожен незалежно, являє собою гідрокси, C1-6алкілоксикарбоніл або C16алкілоксикарбоніл-C1-4алкіл-; X3 являє собою -C1-4алкіл- або C1-4алкіл-NR20-; X4 являє собою -C1-4алкіл- або C1-4алкіл-NR21-; R1 являє собою водень, полігалогенC1-4алкіл або галоген; зокрема, водень, трифторметил, фтор, хлор або йод; R8 являє собою водень, полігалогенC1-4алкіл або галоген; більш конкретно, водень; R20 та R21, кожен незалежно, являє собою водень або C1-4алкіл. Інші групи спеціальних проміжних сполук включають: - проміжні сполуки формули (XI), де Z являє собою N - проміжні сполуки формули (XI), де X3 являє собою метил, етил-NR20 або метил-NR20; - проміжні сполуки формули (XI), де X4 являє собою метил, етил-NR21 або метил-NR21; - проміжні сполуки формули (XI), де P1 являє собою гідрокси, C1-6алкілоксикарбоніл або C16алкілоксикарбоніл-C1-4алкіл-, зокрема, гідрокси, трет-бутилоксикарбоніл, третбутилоксикарбонілметил-; - проміжні сполуки формули (XI), де P2 являє собою гідрокси, C1-6алкілоксикарбоніл або C14алкілоксикарбоніл-C1-4алкіл-, зокрема, гідрокси, трет-бутилоксикарбоніл, третбутилоксикарбонілметил-; - проміжні сполуки формули (XI), де R20 являє собою водень або метил; 92608 38 - проміжні сполуки формули (XI), де R21 являє собою водень або метил; - проміжні сполуки формули (XI), де R1 являє собою водень, хлор, фтор або бром; 8 - проміжні сполуки формули (XI), де R являє собою водень. Особливий інтерес представляють ті проміжні сполуки формули (XI), де замісник X3 знаходиться в положенні 3, замісник R1 являє собою водень або галоген та знаходиться в положенні 5, триазинове кільце приєднане до Z-вмісного кільця в положенні 4‟ та алкініл знаходиться в положенні 2‟ проміжної сполуки формули (XI). Для тих проміжних сполук формули (XI), де Z являє собою C, замісник R8 знаходиться в положенні 1‟, замісник X3 знаходиться в положенні 3, замісник R1 являє собою водень або галоген та знаходиться в положенні 5, триазинове кільце приєднане до Z-вмісного кільця в положенні 4‟ та алкініл знаходиться в положенні 2‟ проміжної сполуки формули (XI). Було виявлено, що проміжні сполуки формули (XI) мають ефект інгібування GSK-3 та, відповідно, застосовуються як лікарський засіб, зокрема, для профілактики або лікування захворювань, опосередкованих активністю GSK-3 supra. Також метою даного винаходу є застосування проміжних сполук формули (X), (XI) у синтезі макроциклічного інгібітору кінази, наприклад, для одержання сполук формули (I). Як описано нижче в експериментальній частині, ефект інгібування кінази та ефект інгібування GSK-3 сполук за даним винаходом був продемонстрований in vitro в аналізах фосфорилювання з використанням підходящого пептидного субстрату та радіоміченого АТФ, як показано більш докладно нижче в прикладах C1 та C3. Крім ферментних аналізів, клітинна активність сполук за даним винаходом була продемонстрована в аналізі, що базується на здатності GSK-3 інактивувати глікогенсинтазу в клітинах печінки. У цьому аналізі, приклад C2 нижче, було показано, що сполуки за даним винаходом підвищують включення 14C-D глюкози в глікоген клітин Chang. Відповідно, даний винахід забезпечує сполуки формули (I), проміжні сполуки формули (VI) та їх фармацевтично прийнятні N-оксиди, адитивні солі, четвертинні аміни та стереохімічно ізомерні форми для застосування в терапії. Більш конкретно, для лікування або профілактики захворювань, опосередкованих серин/тирозинкіназою. Сполуки формули (I), проміжні сполуки формули (VI) та їх фармацевтично прийнятні N-оксиди, адитивні солі, четвертинні аміни та стереохімічно ізомерні форми далі можуть бути зазначені як сполуки за даним винаходом. Розлади, при яких сполуки за даним винаходом є особливо корисними, включають зазначені вище клітинно-проліферативні розлади, діабетичні ускладнення, хворобу Альцгеймера, аутоімунні захворювання та запальні захворювання, включаючи алергії та астму, розсіяний склероз (MS), ревматоїдний артрит (RA), 39 артеріосклероз, артрит або запальне захворювання кишечнику (IBD). Приймаючи до уваги корисність сполук за даним винаходом, забезпечено спосіб лікування клітинно-проліферативних захворювань, діабетичних ускладнень, хвороби Альцгеймера, аутоімунних захворювань та запальних захворювань, включаючи алергії та астму, розсіяний склероз (MS), ревматоїдний артрит (RA), артеріосклероз, артрит або запальне захворювання кишечнику (IBD), при цьому спосіб включає введення тварині, що потребує такого лікування, наприклад, ссавцю, включаючи людину, терапевтично ефективної кількості сполуки за даним винаходом. Зазначений спосіб включає системне або місцеве введення ефективної кількості сполуки за даним винаходом тварині, включаючи людину. Фахівцям у даній галузі техніки буде зрозуміло, що терапевтично ефективна кількість інгібіторів кінази за даним винаходом являє собою кількість, достатню для індукції ефекту інгібування кінази, та що ця кількість змінюється в залежності від, серед іншого, концентрації сполуки в терапевтичній композиції та стану пацієнта. Як правило, кількість інгібітору кінази, необхідну для введення як терапевтичного засобу для лікування клітиннопроліферативних розладів, таких як атеросклероз, рестеноз та рак, визначає лікуючий лікар у кожному конкретному випадку. Як правило, підходяща доза являє собою дозу, яка забезпечує концентрацію інгібітору кінази в місці лікування в межах від 0,5нМ до 200мкМ, та більш звичайно від 5нМ до 10мкМ. Для одержання таких концентрацій пацієнту, що потребує такого лікування, імовірно, варто вводити дозу в межах від 0,01мг/кг до 500мг/кг маси тіла, зокрема, від 10мг/кг до 250мг/кг маси тіла. Як зазначено вище, ці кількості можуть змінюватися в залежності від конкретної ситуації. У зазначених способах лікування сполуки за даним винаходом, переважно, виготовляють у вигляді суміші перед прийомом. Як описано нижче, підходящі фармацевтичні композиції одержують за допомогою відомих методик з використанням широко відомих та легко доступних інгредієнтів. Ще в одному аспекті даний винахід забезпечує застосування сполук за даним винаходом для одержання лікарського засобу для лікування будьяких з перерахованих вище клітиннопроліферативних розладів або показань. Кількість сполуки за даним винаходом, також зазначеної як активний інгредієнт, яка необхідна для досягнення терапевтичного ефекту, звичайно, змінюється в залежності від конкретної сполуки, способу введення, віку та стану реципієнта та конкретного розладу або захворювання, що підлягає лікуванню. Підходяща добова доза повинна складати від 0,01мг/кг до 500мг/кг маси тіла, зокрема, від 10мг/кг до 250мг/кг маси тіла. Спосіб лікування також може включати введення активного інгредієнта за схемою в межах від одного до чотирьох прийомів на день. Хоча можливим є введення тільки активного інгредієнта, але переважним є, коли він 92608 40 представлений у фармацевтичній композиції. Відповідно, даний винахід також забезпечує фармацевтичну композицію, що містить сполуку за даним винаходом разом з фармацевтично прийнятним носієм або розріджувачем. Носій або розріджувач повинен бути "прийнятним" у тому сенсі, що він повинен бути сумісний з іншими інгредієнтами композиції та не здійснювати шкідливої впливу на реципієнта. Фармацевтичні композиції за даним винаходом можуть бути отримані будь-якими способами, добре відомими в галузі фармацевтики, наприклад, з використанням способів, описаних у Gennaro et al. Remington‟s Pharmaceutical Sciences (18th ed., Mack Publishing Company, 1990, зокрема, див. Частина 8: Pharmaceutical preparations and their Manufacture). Терапевтично ефективну кількість конкретної сполуки, у формі основи або у формі адитивної солі, як активний інгредієнт поєднують з одержанням суміші з фармацевтично прийнятним носієм, що може приймати різні форми в залежності від форми препарату, бажаного для введення. Такі фармацевтичні композиції бажано виготовляють в стандартній лікарській формі, що підходить, переважно, для системного введення, такого як пероральне, крізьшкірне або парентеральне введення; або місцевого введення, такого як введення за допомогою інгаляції, назального спрею, очних крапель або з використанням крема, гелю, шампуню або т.п. Наприклад, при одержанні композицій у формі для перорального введення, можна використовувати будь-яке звичайне фармацевтичне середовище, таке як, наприклад, вода, гліколі, олії, спирти та т.п., у випадку пероральних рідких препаратів, таких як суспензії, сиропи, еліксири та розчини; або тверді носії, такі як крохмалі, цукри, каолін, змазуючі речовини, зв‟язуючі речовини, агенти дезинтеграції та т.п., у випадку порошків, пігулок, капсул та таблеток. Через простоту введення, таблетки та капсули є найбільш кращими пероральними лікарськими формами, у цьому випадку очевидне використання твердих фармацевтичних носіїв. Для парентеральних композицій носій звичайно включає стерильну воду, щонайменше, більшу його частину, хоча можуть бути включені й інші інгредієнти, наприклад, речовини, що сприяють розчиненню. Можуть бути отримані, наприклад, розчини для ін‟єкцій, де носій включає фізіологічний розчин, розчин глюкози або суміш фізіологічного розчину та розчину глюкози. Також можуть бути отримані суспензії для ін‟єкцій, у цьому випадку можна використовувати підходящі рідкі носії, суспендуючі речовини та т.п. У композиціях, що підходять для крізьшкірного введення, носій, необов‟язково, включає засіб для посилення проникнення усередину лікарського засобу та/або підходящу змочувальну речовину, необов‟язково в сполученні з підходящими добавками будь-якої природи в невеликих пропорціях, при цьому такі добавки не повинні здійснювати будь-якого істотного шкідливого впливу на шкіру. Зазначені добавки можуть полегшувати введення в шкіру та/або 41 можуть сприяти одержанню бажаних композицій. Такі композиції можна вводити різними способами, наприклад, у вигляді трансдермального пластиру, шляхом локального нанесення або у вигляді мазі. Особливо переважним є одержання зазначених вище фармацевтичних композицій у стандартній лікарській формі для простоти введення та рівномірного дозування. Стандартна лікарська форма, як використовується в даному описі та формулі винаходу, відноситься до фізично дискретних одиниць, що підходять для разового застосування, при цьому кожна одиниця містить попередньо визначену кількість активного інгредієнта, розраховану для одержання бажаного терапевтичного ефекту, у сполученні з необхідним фармацевтичним носієм. Прикладами таких стандартних лікарських форм є таблетки (включаючи таблетки з насічкою або таблетки з покриттям), капсули, пігулки, пакетики з порошком, облатки, розчини або суспензії для ін‟єкцій, препарати для дозування чайними ложками, столовими ложками та т.п. та їх різні різновиди. Експериментальна частина Далі, термін „P‟ означає продукт, „MP-NCO‟ означає макропористу ізоціанатну смолу, „DIPEA‟ означає N-етил-N-(1-метилетил)-2-пропанамін, „ДМФА‟ означає N,N-диметилформамід, „CH2Cl2‟ означає дихлорметан, „CH3CN‟ означає ацетонітрил, „TIS‟ означає трис(1метилетил)силан, „TFA‟ означає трифтороцтову кислоту, „Et3N‟ означає триетиламін, „ΕtOAc‟ означає етилацетат, „HBTU‟ означає 1[біс(диметиламіно)метилен]-1Hбензотриазолійгексафторфосфат(1-)3-оксид, „MeOH‟ означає метанол, „MgSO4‟ означає сульфат магнію, „DIPE‟ означає діізопропіловий ефір, „NaBH4‟ означає тетрагідроборат(-1) натрію, „Cs2CO3‟ означає карбонат цезію, „NaOCH3‟ означає метанол, натрієву сіль, „H2N-CN‟ означає метандіімін, „CaCl2‟ означає хлорид кальцію, „Pd(OAc)2‟ означає паладієву(2+) сіль оцтової кислоти, „NaHCO3‟ означає мононатрієву сіль вугільної кислоти, „Na2CO3‟ означає динатрієву сіль вугільної кислоти, „NaCl‟ означає хлорид натрію. A. Одержання проміжних сполук Приклад A1 a) Одержання проміжної сполуки 1 Розчин 2-хлор-4-(2-хлор-4-піридиніл)-1,3,5триазину (0,02моль) та 3-амінобензолметанолу (0,02моль) у трихлорметані (100мл) перемішували при кімнатній температурі. Додавали DIPEA (0,04моль) та отриману реакційну суміш перемішували протягом 5 годин при 60°C (відбувалося утворення осаду жовтого кольору). Додавали DIPEA (100мл) та реакційну суміш перемішували протягом однієї години при кімнатній температурі. Осад відфільтровували, промивали DIPEA, потім гексаном, потім сушили 92608 42 (вакуум, 65°C) з одержанням 4,77г (76%; т.пл.: 157,4-159,6°C) проміжної сполуки 1. b) Одержання проміжної сполуки 2 До суміші проміжної сполуки 1 (0,001моль), 1,1-диметилетилового ефіру 2пропінілкарбамінової кислоти (0,0011моль), Nетилетанаміну (1,5мл), дихлорбіс(трифенілфосфін)паладію (0,00005моль), йодиду міді(I) (0,00005моль) та трифенілфосфіну (0,0002моль) у пробірці додавали ДМФА (10мл). Через суміш барботували газоподібний N2 протягом 5 хвилин. Пробірку герметично закривали та суміш перемішували при 60°C протягом 24 годин в атмосфері азоту. Після охолодження додавали воду та CH2Cl2. Органічний шар відокремлювали, сушили та концентрували. Залишок очищали за допомогою колоночної хроматографії з невеликою прокладкою силікагелю (елюент: CH2Cl2/MeOH 100/0 95/5). Фракції, що містять продукт, збирали та розчинник випарювали. Залишок кристалізували з CH3CN/MeOH. Осад відфільтровували та сушили з одержанням 0,3554г (82%; т.пл.: 154,4-156,2°C) проміжної сполуки 2. c) Одержання проміжної сполуки 3 До суспензії проміжної сполуки 2, що перемішується, (0,00075моль) у безводному CH3CN (10мл) додавали метансульфонілхлорид (0,0009моль) та DIPEA (0,0045моль). Додавали додаткову кількість метансульфонілхлориду (0,0002моль) для здійснення повного мезилування. Через 5 хвилин додавали 1,1диметилетиловий ефір Nметилгліцину.гідрохлорид (0,0015моль) та суміш перемішували при 65°C протягом 3,5 годин. Додавали 1-етеніл-4-(ізоціанатoметил)бензол, полімер з етенілбензолом (0,0015моль), та CH2Cl2 (10мл) та реакційну суміш струшували протягом 5 годин при кімнатній температурі. Суміш фільтрували та отриманий при фільтруванні залишок промивали CH2Cl2, потім MeOH та потім знову CH2Cl2. Розчинник фільтрату випарювали з одержанням проміжної сполуки 3 (використовували на наступній стадії реакцій без додаткового очищення). d) Одержання проміжних сполук 4a та 4b 43 Суміш проміжної сполуки 3 (0,00075моль) у TFA/CH2Cl2/TIS (49/49/2) (15мл) перемішували протягом ночі при кімнатній температурі. Розчинник випарювали з одержанням проміжної сполуки 4 у вигляді солі TFA (.C2HF3O2) (кількісний вихід; РХМС 4a: 70%, 4b: 30%; використовували на наступній стадії реакцій без додаткового очищення). Приклад A2 a) Одержання проміжної сполуки 5 Суміш проміжної сполуки 2 (0,0092моль) та Et3N (2мл) у MeOH (150мл) гідрували протягом ночі з використанням Pd/C (10%) (1г) як каталізатору у присутності розчину тіофену (0,5мл). Після поглинання H2 (2екв.) каталізатор відфільтровували та фільтрат випарювали. Залишок знову розчиняли в CH2Cl2 та фільтрували через шар силікагелю (елюент: CH2Cl2/Мео 100/0, потім 94/6). Фракції, що містять бажаний продукт, збирали та розчинник випарювали з одержанням 3,7406г (93%, тверда речовина жовтого кольору; т.пл.: 161,5-162,3°C) проміжної сполуки 5. b) Одержання проміжної сполуки 6 До розчину проміжної сполуки 5, що перемішується, (0,00025моль) у безводному CH3CN (5мл) додавали DIPEA (6екв.). Потім додавали метансульфонілхлорид (1,2екв.). Через 5-15 хвилин додавали 1,1-диметилетиловий ефір N-метил-β-аланіну, сіль соляної кислоти (1:1) (3екв.), та отриманий розчин перемішували 92608 44 протягом ночі при 65°C. Потім суміш охолоджували до кімнатної температури та додавали CH2Cl2 (5мл) з наступним додаванням MP-NCO (4екв.). Після струшування протягом ночі смолу відфільтровували та промивали CH2Cl2 (5мл), MeOH (5мл) та знову CH2Cl2 (5мл). Потім суміш концентрували з одержанням неочищеної проміжної сполуки 6 (використовували на наступній стадії реакцій без додаткового очищення). Проміжну сполуку 6a одержували аналогічним чином із проміжної сполуки 80 з використанням 1,1-диметилетилового ефіру 1піперазинкарбонової кислоти, дигідрохлориду. Проміжну сполуку 6b одержували аналогічним чином із проміжної сполуки 112 з використанням 1,1-диметилетилового ефіру N-метилгліцину, гідрохлориду. Проміжну сполуку 6c одержували аналогічним чином із проміжної сполуки 114 з використанням 1,1-диметилетилового ефіру N-метил-β-аланіну, солі соляної кислоти. c) Одержання проміжної сполуки 7 Проміжну сполуку 6 розчиняли в TFA/CH2Cl2/TIS (49/49/2) (5мл) та струшували протягом 5 годин при кімнатній температурі. Потім розчинник випарювали з одержанням проміжної сполуки 7 (сіль TFA, використовували на наступній стадії реакцій без додаткового очищення). Проміжну сполуку 7a одержували аналогічним чином із проміжної сполуки 6a. Проміжну сполуку 7b одержували аналогічним чином із проміжної сполуки 6b. Проміжну сполуку 7c одержували аналогічним чином із проміжної сполуки 6c. Приклад A3 a) Одержання проміжної сполуки 8 Проміжну сполуку 1 (0,0075моль) розчиняли в 1,2-етандіаміні (100мл). Розчин перемішували при температурі кипіння зі зворотним холодильником (117-118°C) протягом ночі. Розчинник випарювали. До залишку додавали ксилол, потім знову двічі разом випарювали з одержанням проміжної сполуки 8, що використовували як таку на наступній стадії реакцій. b) Одержання проміжних сполук 9 та 10 45 92608 46 неочищеної проміжної сполуки 11 (використовували на наступній стадії реакцій без додаткового очищення). d) Одержання проміжної сполуки 12 Проміжна сполука 9 Проміжна сполука 10 Неочищену проміжну сполуку 8 (0,0075моль) розчиняли в CH2Cl2 (100мл). Додавали біс(1,1диметилетиловий)ефір дивугільної кислоти (0,01125моль) та реакційну суміш перемішували при кімнатній температурі. Додавали MeOH (100мл) для досягнення повного розчинення. Реакційну суміш перемішували протягом однієї години при кімнатній температурі. Додавали додаткову кількість біс(1,1диметилетилового)ефіру дивугільної кислоти (0,01125моль) та реакційну суміш перемішували протягом вихідних при кімнатній температурі. Додавали 7н розчин NH3/МеОН (100мл). Розчинник випарювали. Залишок очищали над шаром силікагелю на скляному фільтрі (елюент: CH2Cl2/EtOAc 100/0 0/100). Бажані фракції збирали та розчинник випарювали. Залишок очищали далі за допомогою обернено-фазової високоефективної рідинної хроматографії (буферацетат амонію) з одержанням 0,62г проміжної сполуки 9 (19%, т.пл. >315°C (розк.)) та 0,49г проміжної сполуки 10 (14%, т.пл.: 184,6-184,8°C). c) Одержання проміжної сполуки 11 До розчину проміжної сполуки 9, що перемішується, (0,000125моль) у ДМФА (5мл) додавали DIPEA (6екв.). Потім додавали метансульфонілхлорид (1,2екв.). Через 5-15 хвилин додавали 1,1-диметилетиловий ефір Nметилгліцину.гідрохлорид (3екв.) та отриманий розчин перемішували протягом ночі при 65°C. Потім суміш охолоджували до кімнатної температури та додавали MP-NCO (6екв.). Після струшування протягом ночі смолу відфільтровували та промивали ДМФА (4?5мл). Потім суміш концентрували з одержанням Проміжну сполуку 11 (неочищена сполука) розчиняли в TFA/CH2Cl2/TIS (49/49/2) (5мл) та струшували протягом 1 години при 40°C. Потім розчинник випарювали з одержанням неочищеної проміжної сполуки 12 (сіль TFA, використовували на наступній стадії реакцій без додаткового очищення). Приклад A4 a) Одержання проміжної сполуки 13 Проміжну сполуку 1 (0,00768моль) розчиняли в 1,2-пропандіаміні (100мл). Розчин перемішували протягом 2 годин при 160°С, потім охолоджували до кімнатної температури. Розчинник випарювали. До залишку додавали ксилол, потім знову разом випарювали з одержанням проміжної сполуки 13, що використовували як таку на наступній стадії реакцій. b) Одержання проміжної сполуки 14 Біс(1,1-диметилетиловий) ефір дивугільної кислоти (0,023моль) додавали до проміжної сполуки 13 (0,00768моль), розчиненої в CH2Cl2/MeOH (100мл/100мл). Реакційну суміш перемішували протягом 3 годин при кімнатній температурі. Додавали додаткову кількість біс(1,1диметилетилового) ефіру дивугільної кислоти (0,023моль) та реакційну суміш перемішували протягом однієї години при кімнатній температурі. Осад видаляли фільтруванням. Фільтрат очищали над шаром силікагелю на скляному фільтрі (елюент: CH2Cl2/EtOAc 100/0 0/100). Бажані фракції збирали та розчинник випарювали. Залишок піддавали подальшому очищенню за допомогою обернено-фазової високоефективної рідинної хроматографії (буфер - ацетат амонію). Продукт осаджувався з водного компонента елюента. Осад відфільтровували, промивали дистильованою водою та сушили з одержанням 0,58г проміжної сполуки 14 (17%; т.пл. 183,5184,5°C). c) Одержання проміжної сполуки 15 47 До розчину проміжної сполуки 14, що перемішується, (0,000125моль) у ДМФА (5мл) додавали DIPEA (6екв.). Потім додавали метансульфонілхлорид (1,2екв.). Через 5-15 хвилин, додавали 1,1-диметилетилововий ефір Nметилгліцину.гідрохлорид (3екв.) та отриманий розчин перемішували протягом ночі при 65°С. Потім суміш охолоджували до кімнатної температури та додавали MP-NCO (6екв.). Після струшування протягом ночі смолу відфільтровували та промивали за допомогою ДМФА (4х5мл). Потім суміш концентрували з одержанням неочищеної проміжної сполуки 15 (використовували на наступній стадії реакцій без додаткового очищення). d) Одержання проміжної сполуки 16 Проміжну сполуку 15 (неочищена сполука) розчиняли в TFA/CH2Cl2/TIS (49/49/2) (5мл) та струшували протягом 1 години при 40°C. Потім розчинник випарювали з одержанням неочищеної проміжної сполуки 16 (сіль TFA, використовували на наступній стадії реакцій без додаткового очищення). Приклад A5 a) Одержання проміжної сполуки 17 Розчин 2-хлор-4-(2-хлор-4-піридиніл)-1,3,5триазину (0,01моль) та 1,1-диметилетилового ефіру [2-(3-амінофеніл)етил]карбамінової кислоти (0,01моль) у трихлорметані (30мл) перемішували при кімнатній температурі. Додавали DIPEA (0,02моль) та отриману реакційну суміш перемішували протягом ночі при 60°С. Додавали DIPEA (90мл) та реакційну суміш перемішували протягом 2,5 годин при кімнатній температурі. Осад відфільтровували, промивали гексаном, потім сушили (вакуум, 65°С) з одержанням 4,46г (100%; т.пл.: 144,1-147,0°С) проміжної сполуки 17. b) Одержання проміжної сполуки 18 92608 48 Суміш проміжної сполуки 17 (0,0095моль), Nетилетанаміну (15мл), дихлорбіс(трифенілфосфін)паладію (0,00048моль), йодиду міді(I) (0,00048моль) та трифенілфосфіну (0,00190моль) у ДМФА (100мл) перемішували при кімнатній температурі. Через суміш протягом 10 хвилин барботували газоподібний N2. Додавали 2-пропін-1-ол (0,01425моль) та реакційну суміш перемішували при 60°C (в атмосфері азоту) протягом 20 годин в атмосфері азоту. Після охолодження додавали воду (10мл). Розчинник випарювали та залишок знову розчиняли в CH2Cl2. Розчин очищали на силікагелі (елюент: спочатку CH2Cl2, потім EtOAc). Фракції, що містять бажаний продукт, збирали та розчинник випарювали. Залишок розчиняли в CH3CN та витримували при 0°C протягом ночі, у результаті відбувалося утворення осаду у вигляді кристалів коричневого кольору. Осад відфільтровували та сушили з одержанням 2,64г (62%; т.пл.: 155,5-158,0°C) проміжної сполуки 18. c) Одержання проміжної сполуки 19 Проміжну сполуку 18 (0,00025моль) розчиняли в ДМФА (10мл). Додавали DIPEA (0,0015моль). Додавали метансульфонілхлорид (0,000375моль) при перемішуванні. Додавали 1,1диметилетиловий ефір Nметилгліцину.гідрохлорид (0,00075моль) та реакційну суміш перемішували протягом 4,5 годин при 65°C. Потім суміш охолоджували до кімнатної температури та додавали MP-NCO (6екв.). Після струшування протягом ночі смолу відфільтровували та промивали за допомогою ДМФА (4х5мл). Після випарювання розчинника одержували неочищену проміжну сполуку 19 (РХМС: 93% P) (використовували на наступній стадії реакцій без додаткового очищення). d) Одержання проміжної сполуки 20 Суміш проміжної сполуки 19 (0,00025моль) у ДМФА (q.s.) гідрували протягом 4 годин при 49 кімнатній температурі (атмосферний тиск) з використанням нікелю Ренея (q.s.) як каталізатору. Після поглинання H2 (2екв.) каталізатор відфільтровували та фільтрат випарювали з одержанням неочищеної проміжної сполуки 20 (використовували на наступній стадії реакцій без додаткового очищення). e) Одержання проміжної сполуки 21 Розчин проміжної сполуки 20 (0,00025моль) у TFA/CH2Cl2/TIS (49/49/2) (10мл) перемішували протягом 45 хвилин при 45°C. Розчинник випарювали та залишок знову розчиняли в ДМФА з одержанням неочищеної проміжної сполуки 21 (сіль TFA, використовували на наступній стадії реакцій без додаткового очищення). Приклад A6 a) Одержання проміжної сполуки 22 Розчин 2-хлор-4-(2-хлор-4-піридиніл)-1,3,5триазину (0,01моль), 1,1-диметилетилового ефіру [(3-амінофеніл)метил] карбамінової кислоти (0,01моль) та DIPEA (0,02моль) у трихлорметані (40мл) перемішували при 60°C. Додавали додаткову кількість DIPEA (120мл) та отриману реакційну суміш перемішували протягом 75 хвилин при кімнатній температурі. Осад відфільтровували, промивали DIPEA, потім гексаном, потім сушили (вакуум, 65°C) з одержанням 4,05г (98%; жовті кристали; т.пл.: 144,0-145,6°C) проміжної сполуки 22. b) Одержання проміжної сполуки 23 Суміш проміжної сполуки 22 (0,0095моль), 2пропін-1-олу (0,01425моль), N-етилетанаміну (1,468мл), дихлорбіс(трифенілфосфін)паладію (0,00048моль), йодиду міді(I) (0,00048моль) та трифенілфосфіну (0,00190моль) у ДМФА (100мл) перемішували при кімнатній температурі. Через суміш протягом 15 хвилин барботували газоподібний N2. Реакційну суміш перемішували при 60°C (в атмосфері азоту) протягом 24 годин. Додавали додаткову кількість 2-пропін-1-олу (0,01425моль) та дихлорбіс(трифенілфосфін)паладію (0,000048моль). Додавали додаткову кількість N 92608 50 етилетанаміну (15мл) та реакційну суміш перемішували протягом ночі при 60°C. Після охолодження додавали воду (15мл) та розчинник випарювали. Залишок очищали на силікагелі (елюент: CH2Cl2/MeОН градієнт від 100/0 до 95/5), потім піддавали подальшому очищенню над шаром силікагелю (елюент: CH2Cl2/(7н NH3/MeOH) 98/2). Фракції, що містять бажаний продукт, збирали та розчинник випарювали. Залишок кристалізували з MeOH, відфільтровували та сушили з одержанням 2,22г (54%; т.пл.: 129,1130,5°C) проміжної сполуки 23. c) Одержання проміжної сполуки 24 Проміжну сполуку 23 (0,00025моль) розчиняли в ДМФА (10мл). Додавали метансульфонілхлорид (0,000375моль). Суміш перемішували протягом 15 хвилин при кімнатній температурі. Додавали 1,1диметилетиловий ефір Nметилгліцину.гідрохлорид (0,000750моль) при перемішуванні. Додавали DIPEA (0,0015моль) та реакційну суміш перемішували протягом 22 годин при 65°C. Одержували бажаний продукт. Додавали 1-етеніл-4-(ізоціанатoметил)бензол, полімер з етенілбензолом (0,001моль), та суміш струшували протягом 24 годин при кімнатній температурі. Смолу відфільтровували, промивали за допомогою ДМФА (20мл) та фільтрат, що містить неочищену проміжну сполуку 24, використовували як такий на наступній стадії реакцій. Проміжну сполуку 24a одержували аналогічним чином із проміжної сполуки 82 з використанням 1,1-диметилетиловового ефіру Nметилгліцину.гідрохлориду. d) Одержання проміжної сполуки 25 Суміш проміжної сполуки 24 (0,00025моль) у ДМФА (40мл) гідрували протягом ночі з використанням Pd/C (10%) (0,1г) як каталізатору. Після поглинання H2 (2екв.) каталізатор відфільтровували та фільтрат випарювали з одержанням неочищеної проміжної сполуки 25 (використовували на наступній стадії реакцій без додаткового очищення). Проміжну сполуку 25a одержували аналогічним чином із проміжної сполуки 24a e) Одержання проміжної сполуки 26 51 Розчин проміжної сполуки 25 (0,00025моль) у TFA/CH2Cl2/TIS (49/49/2) (10мл) перемішували протягом 60 хвилин при кімнатній температурі, потім протягом 1 години при 50°C. Розчинник випарювали з одержанням проміжної сполуки 26 (сіль TFA, використовували на наступній стадії реакцій без додаткового очищення). Проміжну сполуку 26a одержували аналогічним чином із проміжної сполуки 25a Приклад A7 a) Одержання проміжної сполуки 27 Проміжну сполуку 5 (0,00229моль) розчиняли в ДМФА (20мл). Додавали DIPEA (0,01374моль), потім метансульфонілхлорид (0,00275моль). Суміш перемішували протягом 5 хвилин при кімнатній температурі. Додавали 1,1диметилетиловий ефір Nметилгліцину.гідрохлорид (0,00458моль) та реакційну суміш перемішували протягом ночі при 65°С. Суміш охолоджували до кімнатної температури. Додавали MP-NCO (0,00458моль) та суміш струшували протягом вихідних при кімнатній температурі. Смолу відфільтровували, промивали за допомогою ДМФА (4х5мл) та розчинник фільтрату випарювали з одержанням проміжної сполуки 27. b) Одержання проміжної сполуки 28 Розчин проміжної сполуки 27 (0,00229моль) у TFA/CH2Cl2/TIS (49/49/2) (20мл) струшували протягом 60 хвилин при 40°C. Додавали додаткову кількість TFA/CH2Cl2/TIS (49/49/2) (10мл) та реакційну суміш струшували ще протягом години при 40°C. Розчинник випарювали з одержанням неочищеної проміжної сполуки 28 у вигляді солі TFA (використовували як таку на наступній стадії реакцій). Приклад A9 a) Одержання проміжної сполуки 31 92608 52 Метоксид натрію (0,30г, 0,0055моль) додавали до розчину 1-бром-3-ціанобензолу (10,00г, 0,055моль) у метанолі (55мл) та отриману суміш перемішували при кімнатній температурі протягом 4 годин. Потім додавали ціанамід (3,46г, 0,082моль) та суміш перемішували протягом ночі при кімнатній температурі. Потім додавали дихлорметан (200мл) та отриманий розчин промивали насиченим сольовим розчином (3х200мл). Сушіння над MgSO4, фільтрування та випарювання розчинника надавали 10,62г проміжної сполуки 31 (тверда речовина білого кольору, вихід: 86%). b) Одержання проміжної сполуки 32 До розчину проміжної сполуки 31 (2,63г, 0,012моль) у CH3CN (25мл) повільно додавали 2,25г (0,018моль) N-(хлорметилен)-Nметилметанамінійхлориду. Після 5 хвилин перемішування при кімнатній температурі суміш ставала гомогенної, а через 30 хвилин з‟являвся осад. Реакційну суміш перемішували ще протягом однієї години та потім гасили додаванням насиченого водного розчину бікарбонату натрію. Водну фазу екстрагували дихлорметаном (3х50мл) та об‟єднані органічні шари сушили над MgSO4. Фільтрування та випарювання розчинника надавали 2,98г проміжної сполуки 32 (тверда речовина жовтого кольору, вихід: 94%), що використовували як таку для наступної стадії реакцій. Приклад A10 a) Одержання проміжної сполуки 33 3-Амінобензиловий спирт (0,27г, 0,0022моль) додавали до розчину проміжної сполуки 32 (0,49г, 0,0018моль) у 1,4-діоксані (9мл). Потім додавали DIPEA (0,24г, 0,0018моль) та суміш перемішували при кімнатній температурі протягом 3 годин. Потім додавали 20мл CH2Cl2 та 20мл води та водну фазу екстрагували за допомогою CH2Cl2 (2х20мл). Об‟єднані органічні шари сушили над MgSO4. Фільтрування та випарювання розчинника надавали 0,53г проміжної сполуки 33 (тверда речовина білого кольору, вихід: 82%), що використовували як таку на наступній стадії реакцій. b) Одержання проміжної сполуки 34 Проміжну сполуку 33 (2,32г, 0,0065моль), 1,1диметилетиловий ефір 2-пропінілкарбамінової кислоти [92136-39-5] (2,52г, 0,016моль), 53 дихлорбіс(трифенілфосфін)паладію 0,456г, 0,0006моль), йодид міді(I) (0,124г, 0,0006моль) та трифенілфосфін (0,681г, 0,0026моль) розчиняли в ДМФА (80мл). Через суміш протягом 10 хвилин барботували газоподібний N2, після чого додавали N-етилетанамін (10,2мл, 0,097моль). Реакційну суміш потім перемішували при 60°C протягом 18 годин в атмосфері азоту. Після охолодження до кімнатної температури додавали CH2Cl2 (50мл) та органічний шар промивали 3х20мл насиченого сольового розчину та потім сушили над MgSO4. Розчинник випарювали та залишок очищали за допомогою колоночної флеш-хроматографії з використанням CH2Cl2/MeOH (9:1) як елюента. Випарювання об‟єднаних фракцій, що містять продукт, надавало 2,24г проміжної сполуки 34 (жовта тверда речовина, 80%). Приклад A11 a) Одержання проміжної сполуки 35 Суміш проміжної сполуки 34 (5,44г, 0,013моль) та Et3N (2,5мл, 0,018моль) у MeOH (190мл) гідрували (1атм. H2) протягом 15 годин з використанням 10% Pd/C (0,544г) як каталізатору. Після поглинання H2 (2екв.) реакційну суміш фільтрували через целіт та фільтрат концентрували. Проміжну сполуку 35 одержували фільтруванням після розтирання в порошок з діізопропіловим ефіром (блідо-жовта тверда речовина, 5,00г, вихід: 91%). b) Одержання проміжної сполуки 36 До розчину проміжної сполуки 35 (1,85г, 0,00425моль) та DIPEA (4,33мл, 0,0255моль) у ДМФА (80мл) додавали 0,493мл (0,00638моль) мезилхлориду. Отриману суміш перемішували протягом 30 хвилин. Потім 5мл (0,00025моль) цього розчину додавали до ефіру амінокислоти, у даному випадку до 1,1-диметилетилового ефіру гліцину.гідрохлориду (0,00125моль), та отриману суміш перемішували протягом ночі при 65°C. Потім суміш охолоджували до кімнатної температури та додавали 4формілфеноксиполістирольну смолу (1,00г, 0,0021моль). Після струшування протягом вихідних смолу відфільтровували та промивали за допомогою MeOH та MeOH/CH2Cl2 по черзі (порції по 5мл). Випарювання розчинника надавало проміжну сполуку 36, що використовували як таку на наступній стадії реакцій. Проміжну сполуку 36a одержували аналогічним чином із проміжної сполуки 85 з 92608 54 використанням трет-бутилового ефіру 2-аміно-3трет-бутокси-пропіонової кислоти гідрохлориду. c) Одержання проміжної сполуки 37 Проміжну сполуку 36 (неочищена сполука) розчиняли в TFA/CH2Cl2/TIS (49/49/2) (5мл) та струшували протягом ночі при кімнатній температурі. Потім розчинник випарювали з одержанням проміжної сполуки 37 (сіль TFA), що використовували як таку на наступній стадії реакцій. Проміжну сполуку 37a одержували аналогічним чином із проміжної сполуки 36a. Приклад A12 b) Одержання проміжної сполуки 38 Метоксид натрію (0,35г, 0,0064моль) додавали до розчину 1-ціано-3-нітробензолу (9,48г, 0,064моль) у метанолі (64мл) та отриману суміш перемішували при кімнатній температурі протягом 4 годин. Потім додавали ціанамід (4,00г, 0,096моль) та суміш перемішували протягом ночі при кімнатній температурі. Потім додавали діетиловий ефір (200мл). Осад, що утворився, відфільтровували, промивали простим ефіром та сушили з одержанням 11,53г проміжної сполуки 38 (біла тверда речовина, вихід: 95%). b) Одержання проміжної сполуки 39 До розчину проміжної сполуки 38 (11,53г, 0,061моль) у CH3CN (120мл) повільно додавали 11,60г (0,091моль) N-(хлорметилен)-Nметилметанамінійхлориду. Після 5 хвилин перемішування при кімнатній температурі суміш ставала гомогенною та через 30 хвилин з‟являвся осад. Реакційну суміш перемішували протягом ще однієї години та потім гасили додаванням насиченого водного розчину бікарбонату натрію. Водну фазу екстрагували дихлорметаном (3х50мл) та об‟єднані органічні шари сушили над MgSO4. Фільтрування та випарювання розчинника надавали 12,60г проміжної сполуки 39 (тверда речовина блідо-жовтого кольору, вихід: 88%). Приклад A13 a) Одержання проміжної сполуки 40 55 92608 56 отриманої твердої речовини надавали 3,00г проміжної сполуки 42 (тверда речовина блідожовтого кольору, вихід: 40%). b) Одержання проміжної сполуки 43 3-амінобензиловий спирт (1,19г, 0,0096моль) додавали до розчину проміжної сполуки 39 (1,90г, 0,0080моль) у 1,4-діоксані (40мл). Потім додавали DIPEA (1,05г, 0,0081моль) та суміш перемішували при кімнатній температурі протягом 5 годин. Потім суміш виливали в крижану воду та осад, що утворився в результаті, промивали водою (50мл) та потім охолодженим діетиловим ефіром (50мл). Сушіння у вакуумі давали 2,36г проміжної сполуки 40 (тверда речовина блідо-жовтого кольору, вихід: 89%). b) Одержання проміжної сполуки 41 До суспензії проміжної сполуки 40 (4,52г, 0,014моль) у MeOH (85мл) додавали Et3N (1,9мл, 0,014моль). Отриману суміш гідрували (1атм. H2) протягом 48 годин з використанням 10% Pd/C (0,45г) як каталізатору. Після поглинання H2 (3екв.) додавали 100мл 1,4-діоксану/MeOH (4:1) та отриманий розчин фільтрували через шар целіт. Випарювання розчинника надавало проміжну сполуку 41 у вигляді твердої речовини блідожовтого кольору (3,07г, вихід: 75%). Приклад A14 a) Одержання проміжної сполуки 42 Суміш проміжної сполуки 41 (5,00г, 0,017моль), трет-бутилового ефіру (2оксоетил)карбамінової кислоти (3,26г, 0,020моль) та ізопропоксиду титану(iv) (7,26г, 0,026моль) у 1,2-дихлоретані (250мл) перемішували при кімнатній температурі протягом 3,5 годин. Потім додавали оцтову кислоту (3,07г, 0,051моль) з наступним додаванням 7,95г (0,0375моль) триацетоксиборогідриду натрію та отриману суміш перемішували протягом 15 годин при кімнатній температурі. Потім реакційну суміш гасили насиченим водним розчином карбонату калію. Органічний шар відокремлювали та водну фазу екстрагували за допомогою CHCl3 (3х50мл). Об‟єднані органічні шари промивали насиченим сольовим розчином (250мл) та сушили над MgSO4. Після видалення розчинника здійснювали очищення за допомогою колоночної флешхроматографії (елюент: CH2Cl2/MeОН/Et3N, градієнт 99:0:1 98:1:1). Випарювання об‟єднаних фракцій, що містять продукт, надавало неочищену проміжну сполуку 42, що розтирали в порошок з діізопропіловим ефіром. Фільтрування та сушіння До розчину проміжної сполуки 42 (0,982г, 0,00225моль) та DIPEA (2,30мл, 0,0135моль) у ДМФА (42мл) додавали 0,209мл (0,00270моль) мезилхлориду. Отриману суміш перемішували протягом 30 хвилин. Потім 5мл (0,00025моль) цього розчину додавали до ефіру амінокислоти, у даному випадку 1,1-диметилетилового ефіру Nметилгліцину.гідрохлориду (0,00075моль), та отриману суміш перемішували протягом ночі при 65°C. Потім суміш охолоджували до кімнатної температури та додавали MP-NCO (6екв.). Після струшування протягом ночі смолу відфільтровували та промивали за допомогою ДМФА (2х5мл). Випарювання розчинника надавало проміжну сполуку 43, що використовували як таку на наступній стадії реакцій. Проміжну сполуку 43a одержували аналогічним чином із проміжної сполуки 45 з використанням трет-бутилового ефіру 2-аміно-3фенілпропіонової кислоти.гідрохлориду. c) Одержання проміжної сполуки 44 Проміжну сполуку 43 (неочищена сполука) розчиняли в TFA/CH2Cl2/TIS (49/49/2) (5мл) та струшували протягом ночі при кімнатній температурі. Потім розчинник випарювали з одержанням проміжної сполуки 44 у вигляді солі TFA, що використовували як таку на наступній стадії реакцій. Проміжну сполуку 44a одержували аналогічним чином із проміжної сполуки 43a Приклад A15 a) Одержання проміжної сполуки 45 Суміш проміжної сполуки 41 (1,60г, 0,0055моль), трет-бутилового ефіру (3оксопропіл)карбамінової кислоти (2,38г, 0,014моль) та ізопропоксиду титану(iv) (3,21г, 0,011моль) у 1,2-дихлоретані (82мл) перемішували при кімнатній температурі протягом 3,5 годин. 57 Потім додавали оцтову кислоту (1,15г, 0,019моль) з наступним додаванням 3,14г (0,015моль) триацетоксиборогідриду натрію та отриману суміш перемішували протягом 15 годин при кімнатній температурі. Потім реакційну суміш гасили за допомогою насиченого водного розчину карбонату калію. Отриману в результаті емульсію з осадженими частками фільтрували. Органічний шар фільтрату відокремлювали та осад на фильтрі екстрагували за допомогою CH2Cl2/CHCl3 (3х50мл). Об‟єднані органічні шари промивали насиченим сольовим розчином (250мл) та сушили над MgSO4. Після видалення розчинника здійснювали очищення з використанням колоночної флеш-хроматографіїї (елюент: CH2Cl2/MeОН/NEt3, градієнт 99:0:1 98,8:0,2:1). Випарювання об‟єднаних фракцій, що містять продукт, надавало неочищену проміжну сполуку 45, що розтирали в порошок з діізопропіловим ефіром. Фільтрування та сушіння отриманої твердої речовини надавали 0,67г проміжної сполуки 45 (тверда речовина жовтого кольору, вихід: 27%). Приклад A16 a) Одержання проміжної сполуки 46 Cs2CO3 (0,250моль) додавали до розчину 4гідроксибензонітрилу (0,125моль) у ДМФА (380мл) при перемішуванні при кімнатній температурі. Суміш перемішували протягом 30 хвилин при кімнатній температурі. Додавали (2-брометил)-1,1диметилетиловий ефір карбамінової кислоти (0,187моль) та реакційну суміш перемішували протягом ночі при кімнатній температурі. Осад відфільтровували, промивали за допомогою EtOAc, а потім додавали суміш EtOAc та насиченого сольового розчину. Шари розділяли. Органічну фазу промивали насиченим сольовим розчином, потім сушили (MgSO4), фільтрували та розчинник випарювали. Залишок очищали колоночною флеш-хроматографією на силікагелі (елюент: гексан/EtOAc 10/1 до 6/1). Фракції, що містять продукт, збирали та розчинник випарювали з одержанням 23,44г (вихід 73%; тверда речовина білого кольору) проміжної сполуки 46. b) Одержання проміжної сполуки 47 NaOCH3 (0,0553моль) додавали до розчину проміжної сполуки 46 (0,0276моль) у MeOH (83мл). Суміш перемішували протягом 2 годин при кімнатній температурі. Додавали одною порцією ціанамід (0,0553моль). Реакційну суміш перемішували протягом 48 годин при кімнатній температурі. Протягом 7 днів щодня додавали додаткову кількість NaOCH3 (1екв.), а також додавали додаткову кількість ціанаміду (6екв.). Осад, що утворився в результаті, відфільтровували, потім промивали метанолом та 92608 58 діетиловим ефіром. Розчинник випарювали. Залишок очищали колоночною флешхроматографією на силікагелі (елюент: гексан/EtOAc 30/10 через 20/10 до 10/10). Фракції, що містять продукт, збирали та розчинник випарювали. Залишок сушили у вакуумі при кімнатній температурі з одержанням 2,8г (вихід 33%; тверда речовина білого кольору) проміжної сполуки 47. c) Одержання проміжної сполуки 48 Проміжну сполуку 47 (0,0092моль) розчиняли в CH3CN (20мл). Додавали N-(хлорметилен)-Nметилметанамінійхлорид (0,0138моль) та реакційну суміш перемішували протягом 1,5 годин при кімнатній температурі. Реакційну суміш гасили додаванням води. Додавали CH2Cl2. Шари розділяли та водну фазу екстрагували CH2Cl2. Органічні шари поєднували, промивали насиченим сольовим розчином, сушили (MgSO4), фільтрували та розчинник випарювали. Залишок сушили у вакуумі при кімнатній температурі з одержанням 1,5г (жовта тверда речовина, використовували на наступній стадії реакцій, без додаткового очищення) проміжної сполуки 48. d) Одержання проміжної сполуки 49 Проміжну сполуку 48 (0,0043моль) розчиняли в 1,4-діоксані (20мл). Додавали 3амінобензолметанол (0,0051моль). Додавали DIPEA (0,0086моль) та реакційну суміш перемішували протягом 15 годин при кімнатній температурі. Додавали CH2Cl2 (20мл) та насичений сольовий розчин (20мл). Органічну фазу відокремлювали, потім промивали насиченим сольовим розчином, сушили (MgSO4), фільтрували та розчинник випарювали. Залишок очищали колоночною хроматографією на силікагелі (елюент: гексан/EtOAc від 3/1 до 1/1). Фракції, що містять продукт, збирали та розчинник випарювали. Залишок сушили у вакуумі при кімнатній температурі з одержанням 1,5г (38%) проміжної сполуки 49. e) Одержання проміжної сполуки 50 DIPEA (2,7мл) додавали до розчину проміжної сполуки 49, що перемішується, (0,00265моль) у ДМФА (50мл). Додавали метансульфонілхлорид (0,349мл) та реакційну суміш перемішували протягом однієї години при кімнатній температурі. 59 Додавали додаткову кількість метансульфонілхлориду (0,103мл) та реакційну суміш перемішували протягом однієї години при кімнатній температурі з одержанням неочищеного реакційного розчину, що містить проміжну сполуку 50, що використовували на наступній стадії реакцій без додаткового очищення. f) Одержання проміжної сполуки 51 1,1-диметилетиловий ефір 4піперидинкарбонової кислоти (0,0005моль) додавали до частини (5мл) неочищеного реакційного розчину проміжної сполуки 50 у ДМФА (50мл) та DIPEA (2,7мл). Реакційну суміш перемішували протягом ночі при 70°C. Додавали макропористий бензилізоціанатний акцептор (0,00075моль) та суміш перемішували протягом ночі при кімнатній температурі. Смолу відфільтровували, промивали метанолом, потім MeOH/CH2Cl2 1/10 та розчинник фільтрату випарювали з одержанням проміжної сполуки 51, що використовували як таку на наступній стадії. g) Одержання проміжної сполуки 52 Неочищену проміжну сполуку 51 (макс. 0,000250моль) поглинали в TFA/CH2Cl2/TIS 49/49/2 (5мл). Суміш струшували протягом 5 годин при кімнатній температурі. Розчинник випарювали з одержанням неочищеної проміжної сполуки 52 (сіль TFA, використовували на наступній стадії реакцій без додаткового очищення). Приклад A17 a) Одержання проміжної сполуки 53 Суміш 2-хлор-4-(2-хлор-4-піридиніл)-1,3,5триазину (0,05моль), (3-амінофенокси)-1,1диметилетилового ефіру оцтової кислоти (0,05моль), DIPEA (0,2моль) у CHCl3 (500мл) перемішували протягом 4 годин при 60°C. Реакційну суміш промивали 2 рази H2O (250мл; дистильована вода). Відділений органічний шар сушили (Na2SO4) та розчинник фільтрату випарювали. Залишок перекристалізовували з 92608 60 CH3CN/H2O з одержанням 15,30г (74%; т.пл.: 121,5°C-122,7°С; структура підтверджена ЯМР) проміжної сполуки 53. b) Одержання проміжної сполуки 54 Проміжну сполуку 53 (0,005моль), 2-пропініл1,1-диметилетиловий ефір карбамінової кислоти (0,006моль), діетиламін (0,075моль), дихлорбіс(трифенілфосфін)паладію (0,00025моль), йодид міді(I) (0,00025моль) та трифенілфосфін (0,001моль) розчиняли в ДМФА (50мл) та у реакційну суміш протягом 5 хвилин барботували N2. Реакційну суміш перемішували протягом 16 годин при 60°C (в атмосфері азоту). До реакційної суміші додавали H2O (10мл) та розчинник випарювали. Залишок очищали колоночною флеш-хроматографією на силікагелі (елюент: CH2Cl2/MeОН від 100/0 до 90/10). Фракції, що містять продукт, збирали та розчинник випарювали. Залишок перекристалізовували з DIPE з одержанням 1,8034г (68%; т.пл.: 161,2°С162,5°С) проміжної сполуки 54. c) Одержання проміжної сполуки 55 Суміш проміжної сполуки 54 (0,0028моль) у ТГФ (50мл) гідрували з використанням нікелю Ренея (каталітична кількість) як каталізатору. Через 20 годин та після поглинання H2 (2екв.; 140мл), каталізатор відфільтровували. Розчинник фільтрату випарювали. Залишок перекристалізовували з DIPE з одержанням 1,3161г (88%; т.пл.: 146,5°С-148,4°С) проміжної сполуки 55. d) Одержання проміжної сполуки 56 Проміжну сполуку 55 (0,002моль) розчиняли в суміші TFA/CH2Cl2/TIS (49/49/2, 20мл) та перемішували протягом 2,5 годин при кімнатній температурі. Розчинник випарювали та разом випарювали 3 рази з CH3CN з одержанням (РХМС: 94%; неочищену сполуку використовували як таку на наступній стадії реакцій) проміжної сполуки 56 у вигляді солі TFA (.C2HF3O2). Приклад A18
ДивитисяДодаткова інформація
Назва патенту англійськоюCyclic anilino - pyridinotriazines as gsk-3 inhibitors
Автори англійськоюRombouts Frederik Jan Rita, Love Christopher John, Van Emelen Kristof, Van Brandt Sven Franciscus Anna, Wu Tongfei
Назва патенту російськоюЦиклические анилинопиридинотриазины
Автори російськоюРомбутс Фредерик Ян Рита, Лав Кристофер Джон, ван Эмелен Кристоф, ван Брандт Свен Францискус Анна, Ву Тонгфей
МПК / Мітки
МПК: C07D 487/08, C07D 471/22, C07D 487/18, C07D 251/16, A61K 31/53, C07D 401/04
Мітки: циклічні, анілінопіридинотриазини
Код посилання
<a href="https://ua.patents.su/58-92608-ciklichni-anilinopiridinotriazini.html" target="_blank" rel="follow" title="База патентів України">Циклічні анілінопіридинотриазини</a>
Попередній патент: Спосіб видалення металевого відкладення, що містить сполуки металів, з поверхні
Наступний патент: Спосіб центрування двох профільних заготовок, зокрема рейок, у машині для контактного стикового зварювання
Випадковий патент: Спосіб масового вирощування паразита лускокрилих шкідників dibrachus cavus walk. (hymenoptera, pteromalidae)