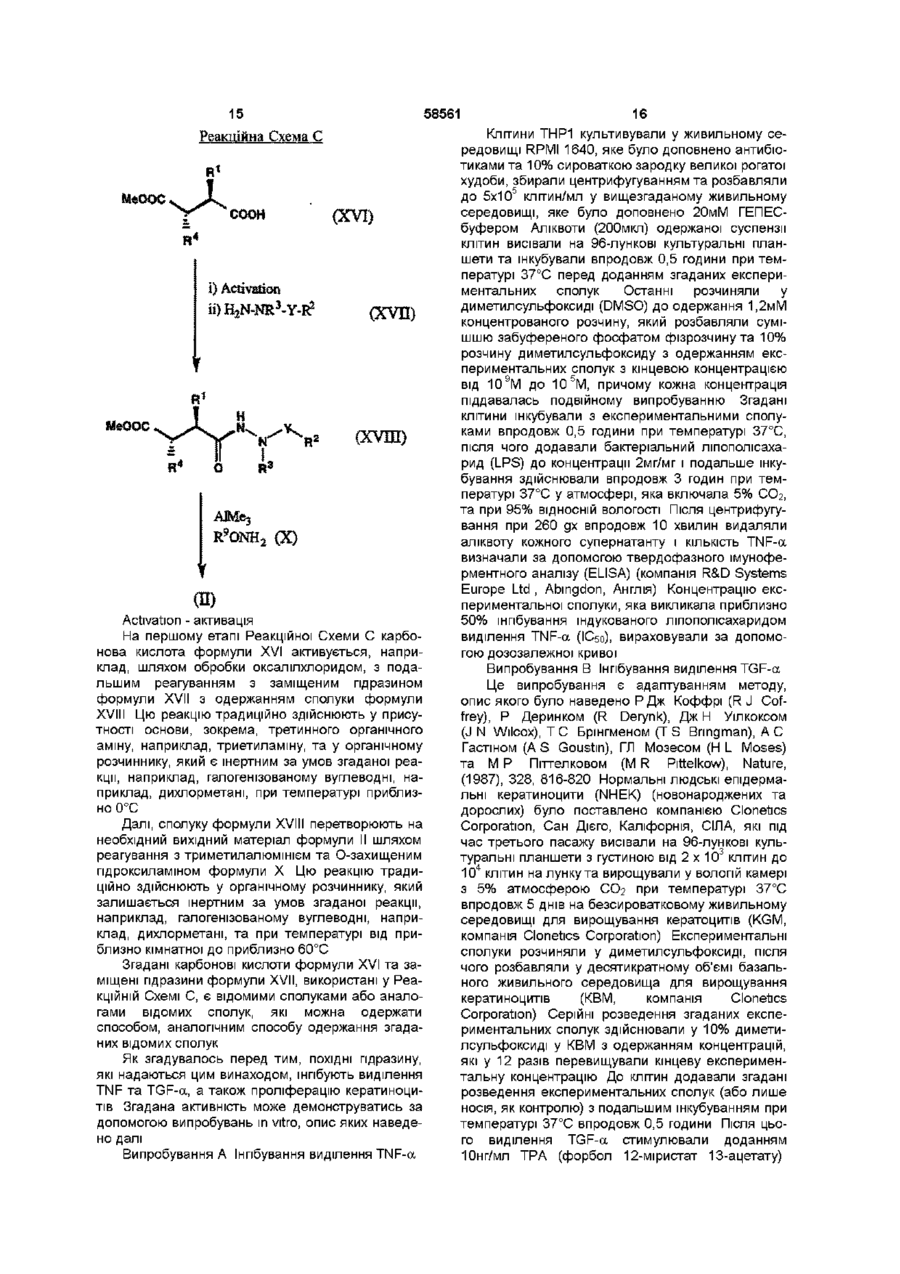
Похідні гідразину, спосіб їх отримання та лікарський засіб на їх основі
Номер патенту: 58561
Опубліковано: 15.08.2003
Автори: Уолтер Даріл Саймон, Джонсон Уільям Хенрі, Бродхерст Майкл Джон
Формула / Реферат
1. Похідні гідразину загальної формули
, (I)
де
Y означає CO або SO2;
R1 означає (С1-С7) алкіл, (С2-С7) алкеніл, (С3-С7) циклоалкіл, (С3-С7) циклоалкіл-(С1-С7) алкіл, арил або арил-(С1-С7) алкіл;
R2 означає (С1-С7) алкіл, галоген-(С1-С7) алкіл, арил-(С1-С7) алкіл, арил-(С2-С7) алкеніл або арил, у разі, коли Y означає SO2, та (С1-С7) алкіл, галоген-(С1-С7) алкіл, (С1-С7) алкоксигрупу, (С1-С7) алкоксикарбоніл, ацил, (С3-С7) циклоалкіл, арил, арил-(С1-С7) алкіл, арил-(С1-С7) алкоксигрупу або NR5R7, у разі, коли Y означає СО; та
R3 означає водень, (С1-С7) алкіл, факультативно заміщений ціаном, аміногрупою, гідроксилом, (С1-С7) алкоксигрупою, (С1-С7) алкоксикарбонілом, гетероциклілом або гетероциклілкарбонілом, (С2-С7) алкеніл, (С2-С7) алкініл, (С3-С7) циклоалкіл, (С3-С7) циклоалкіл-(С1-С7) алкіл, арил-(С1-С7) алкіл, арил-(С2-С7) алкеніл, арил або гетероцикліл; або
R2 та R3 разом утворюють залишок 5-, 6- або 7-членної циклічної амідної, циклічної імідної, циклічної сульфонамідної або циклічної уретанової групи;
R4 означає (С1-С7) алкіл, (С2-С7) алкеніл, (С3-С7) циклоалкіл, (С3-С7) циклоалкіл-(С1-С7) алкіл або групу формули Х-арил, Х-гетероарил або -(CH2)1-2-CH=CR7R8;
Х означає місточкову групу;
R5 та R6, кожен незалежно один від одного, означає водень, (С1-С7) алкіл або арил-(С1-С7) алкіл; та
R7 та R8 разом представляють (С2-С7) алкіленову групу, у якій одну метиленову групу факультативно заміщено гетероатомом;
рацемати цих сполук та суміші діастереоізомерів цих сполук;
та фармацевтично прийнятні солі цих сполук.
2. Сполуки формули (І), наведені у п. 1, де:
Y означає СО або SO2;
R1 означає (С1-С7) алкіл, (С3-С7) циклоалкіл, (С3-С7) циклоалкіл-(С1-С7) алкіл, арил або арил-(С1-С7) алкіл;
R2 означає (С1-С7) алкіл, арил-(С1-С7) алкіл або арил, у разі, коли Y означає SO2, та (С1-С7) алкіл, (С1-С7) алкоксигрупу, (С3-С7) циклоалкіл, арил-(С1-С7) алкоксигрупу або NR5R6, у разі, коли Y означає CO; та
R3 означає водень, (С1-С7) алкіл, факультативно заміщений ціаном, аміногрупою або фталімідогрупою, (С2-С7) алкеніл, (С2-С7) алкініл, (С3-С7) циклоалкіл, (С3-С7) циклоалкіл-(С1-С7) алкіл, арил-(С1-С7) алкіл, арил або гетероцикліл;
або R2 та R3 разом утворюють залишок 5-, 6- або 7-членної циклічної амідної, циклічної імідної, циклічної сульфонамідної групи;
R4 означає фталімідо-(С1-С7) алкіл або групу формули Х-арил або Х-гетероарил;
Х означає місточкову групу;
гетероарил зв'язаний з С; та
R5 та R6, кожний незалежно один від іншого, означають водень, (С1-С7) алкіл або арил-(С1-С7) алкіл;
та фармацевтично прийнятні солі цих сполук.
3. Сполуки за п. 1 або п. 2, де Y означає СО та R2 означає (С1-С7) алкоксигрупу або Y означає SO2 та R2 означає (С1-С7) алкіл.
4. Сполуки за п. 3, де Y означає CO та R2 означає метоксигрупу.
5. Сполуки за п. 3, де Y означає SO2 та R2 означає метил.
6. Сполуки за будь-яким з пп. 1-5, де R1 означає (С1-С7) алкіл.
7. Сполуки за будь-яким з пп. 1-6, де R1 означає ізобутил.
8. Сполуки за будь-яким з пп. 1-7, де R3 означає (С1-С7) алкіл, (С2-С7) алкеніл, арил-(С1-С7) алкіл або арил.
9. Сполуки за п. 8, де R3 означає ізобутил, 2-метилбутил, 2-метилаліл, незаміщений бензил або незаміщений феніл.
10. Сполуки за будь-яким з пп. 1-9, де X – група формули -(CH2)1-5-,
-CH2-CH=CH-, -CH2-CºC-, -CH2NHCO-, -(CH2)1 або 2NHCONH-, -(CH2)1-5-S-, -CH2NHSO2-, -CH2NHCH2-, -(CH2)1-5-O-, -O-(CH2)1-5 або -S-.
11. Сполуки за п. 10, де X – група формули -(CH2)1-5-, -CH2-CH=CH-,
-CH2-CºC-, -CH2NHCO-, -(CH2)1 або 2NHCONH-, -CH2S-, -CH2NHSO2- або
-CH2NHCH2-.
12. Сполуки за будь-яким з пп. 1-11, де R4 означає групу формули Х-арил.
13. Сполуки за п. 12, де Х означає групу формули -СН2-СН=СН- та арил означає незаміщений феніл.
14. Сполука за п. 1, вибрана з групи, до якої входять:
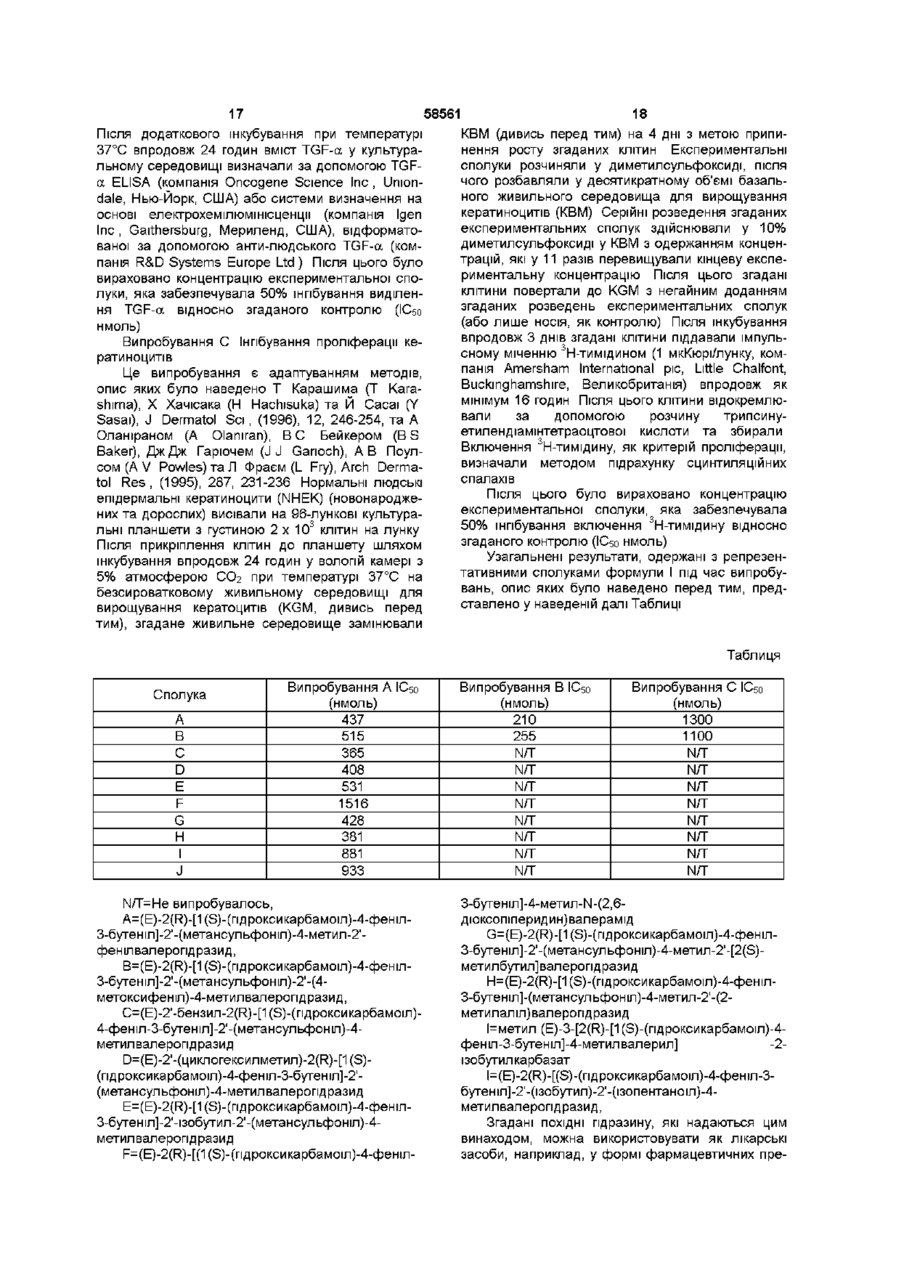
(Е)-2(R)-[1(S)-(гідроксикарбамоїл)-4-феніл-3-бутеніл]-2'-ізобутил-2'-(метансульфоніл)-4-метилвалерогідразид,
(Е)-2(R)-[1(S)-(гідроксикарбамоїл)-4-феніл-3-бутеніл]-2'-(метансульфоніл)-4-метил-2'-фенілвалерогідразид,
(Е)-2(R)-[1(S)-(гідроксикарбамоїл)-4-феніл-3-бутеніл]-2'-(метансульфоніл)-4-метил-2'-[2(S)-метилбутил]валерогідразид,
(Е)-2(R)-[1(S)-(гідроксикарбамоїл)-4-феніл-3-бутеніл]-2'-(метансульфоніл)-4-метил-2'-(2-метилаліл)валерогідразид та
метил (Е)-3-[2(R)-[1(S)-(гідроксикарбамоїл)-4-феніл-3-бутеніл]-4-метилвалерил] -2-ізобутилкарбазат.
15. Сполуки загальної формули
, (II)
де Y, R1, R2, R3 та R4 мають значення, які наведено у пункті 1, та R9 означає захисну групу.
16. Сполуки за п. 15, де R9 означає тетрагідропіраніл, 4-метоксибензил, бензил або три(С1-С7 алкіл)силіл.
17. Карбонові кислоти загальної формули
, (IX)
де Y, R1, R2, R3 та R4 мають значення, які наведено у пункті 1.
18. Сполуки за будь-яким з пп. 1-14 для застосування як терапевтично активні речовини, зокрема для застосування як терапевтично активні речовини при лікуванні запалення, гарячки, крововиливу, сепсису, ревматоїдного артриту, остеоартриту, розсіяного склерозу або псоріазу.
19. Спосіб одержання сполук за будь-яким з пп. 1-14, який включає відщеплення захисної групи від сполуки загальної формули
, (ІІ)
де Y, R1, R2, R3 та R4 мають значення, які наведено у пункті 1, та R9 означає захисну групу, та, у разі необхідності, перетворення одержаної сполуки формули І на фармацевтично прийнятну сіль.
20. Лікарський засіб, який містить сполуку за будь-яким з пп. 1-14 та терапевтично інертний носій.
21. Лікарський засіб для лікування запалення, гарячки, крововиливу, сепсису, ревматоїдного артриту, остеоартриту, розсіяного склерозу або псоріазу, який містить сполуку за будь-яким з пп. 1-14 та терапевтично інертний носій.
22. Спосіб виготовлення лікарського засобу, зокрема для лікування запалення, гарячки, крововиливу, сепсису, ревматоїдного артриту, остеоартриту, розсіяного склерозу або псоріазу, який включає виготовлення галенового препарату, що містить сполуку за будь-яким з пп. 1-14 і терапевтично інертний носій, а також, у разі потреби, одну або кілька додаткових терапевтично активних речовин.
23. Активний інгредієнт для виготовлення лікарського засобу для лікування захворювань, зокрема для лікування запалення, гарячки, крововиливу, сепсису, ревматоїдного артриту, остеоартриту, розсіяного склерозу або псоріазу, який являє собою сполуку за будь-яким з пп. 1-14.
24. Сполуки за будь-яким з пп. 1-14, виготовлені із застосуванням способу за п. 19.
Текст
1 ПОХІДНІ гідразину загальної формули О R 1 но. О ,(|) Де Y означає CO або SO2, R1 означає (С1-С7) алкіл, (С2-С7) алкеніл, (С3-С7) циклоалкіл, (С3-С7) циклоалкіл-(Сі-С7) алкіл, арил або арил-(Сі-С?) алкіл, R2 означає (С1-С7) алкіл, галоген-(Сі-С?) алкіл, арил-(Сі-С?) алкіл, арил-(С2-С?) алкеніл або арил, у разі, коли Y означає SO2, та (С1-С7) алкіл, галоген-(Сі-С7) алкіл, (С1-С7) алкоксигрупу, (С1-С7) алкокси карбоніл, ацил, (С3-С7) циклоалкіл, арил, арил-(Сі-С?) алкіл, арил-(Сі-С?) алкоксигрупу або NR 5 R , у разі, коли Y означає СО, та R3 означає водень, (С1-С7) алкіл, факультативно заміщений ціаном, аміногрупою, гідроксилом, ( d С7) алкоксигрупою, (С1-С7) алкоксикарбонілом, гетероциклілом або гетероциклілкарбонілом, (СгС7) алкеніл, (С2-С7) алкініл, (С3-С7) циклоалкіл, (СзС7) циклоалкіл-(Сі-С7) алкіл, арил-(Сі-С?) алкіл, арил-(С2-С?) алкеніл, арил або гетероцикліл, або R2 та R3 разом утворюють залишок 5-, 6- або 7членної циклічної амідної, циклічної ІМІДНОІ, циклічної сульфонамідної або циклічної уретанової групи, R4 означає (С1-С7) алкіл, (С2-С7) алкеніл, (С3-С7) циклоалкіл, (С3-С7) циклоалкіл-(Сі-С7) алкіл або групу формули Х-арил, Х-гетероарил або -(СНгії 2CH=CR 7 R 8 , X означає місточкову групу, R5 та R6, кожен незалежно один від одного, означає водень, (С1-С7) алкіл або арил-(Сі-С?) алкіл, та R7 та R8 разом представляють (С2-С7) алкіленову групу, у якій одну метиленову групу факультативно заміщено гетероатомом, рацемати цих сполук та суміші діастереоізомерів цих сполук, та фармацевтично прийнятні солі цих сполук 2 Сполуки формули (І), наведені у п 1, де Y означає CO або SO2, R1 означає (С1-С7) алкіл, (С3-С7) циклоалкіл, (СзС7) циклоалкіл-(Сі-С7) алкіл, арил або арил-(Сі-С?) алкіл, 2 R означає (С1-С7) алкіл, арил-(Сі-С?) алкіл або арил, у разі, коли Y означає SO2, та (С1-С7) алкіл, (С1-С7) алкоксигрупу, (Сз-Cj) циклоалкіл, арил-(Сг С7) алкоксигрупу або NR 5 R , у разі, коли Y означає CO, та R3 означає водень, (С1-С7) алкіл, факультативно заміщений ціаном, аміногрупою або фталімідогрупою, (С2-С7) алкеніл, (С2-С7) алкініл, (С3-С7) циклоалкіл, (С3-С7) циклоалкіл-(Сі-С7) алкіл, арил-(Сг С7) алкіл, арил або гетероцикліл, або R2 та R3 разом утворюють залишок 5-, 6- або 7-членноі циклічної амідної, циклічної ІМІДНОІ, циклічної сульфонамідної групи, R4 означає фталімідо-(Сі-С7) алкіл або групу формули Х-арил або Х-гетероарил, X означає місточкову групу, гетероарил зв'язаний з С, та R5 та R , кожний незалежно один від іншого, означають водень, (С1-С7) алкіл або арил-(Сі-С?) алкіл, та фармацевтично прийнятні солі цих сполук О (О ю 00 ю 58561 3 Сполуки за п 1 або п 2, де Y означає СО та R означає (С1-С7) алкоксигрупу або Y означає SO2 та 2 R означає (С1-С7) алкіл 2 4 Сполуки за п 3, де Y означає СО та R означає метоксигрупу 2 5 Сполуки за п 3, де Y означає SO2 та R означає метил 1 6 Сполуки за будь-яким з пп 1-5, де R означає (С1-С7) алкіл 1 7 Сполуки за будь-яким з пп 1-6, де R означає ізобутил 3 8 Сполуки за будь-яким з пп 1-7, де R означає (С1-С7) алкіл, (С2-С7) алкеніл, арил-(Сі-С?) алкіл або арил 3 9 Сполуки за п 8, де R означає ізобутил, 2метилбутил, 2-метилаліл, незаміщений бензил або незаміщений феніл 10 Сполуки за будь-яким з пп 1-9, де X - група формули -(СН2)і 5-, -СН2-СН=СН-, -СН2-С=С-, -CH2NHCO-, (CH2)ia6o2NHCONH-, -(CH2)i 5-S-, -CH2NHSO2-, CH2NHCH2-, -(CH2)i 5-O-, -O-(CH2)i 5 або -S11 Сполуки за п 10, де X - група формули -(СН2)і 5-, -СН2-СН=СН-, -CHrC^C-, -CH2NHCO-, -(CH2)ia6o2NHCONH-, CH2S-, -CH2NHSO2- або -CH2NHCH212 Сполуки за будь-яким з пп 1-11, де R4 означає групу формули Х-арил 13 Сполуки за п 12, де X означає групу формулиСН2-СН=СН- та арил означає незаміщений феніл 14 Сполука за п 1, вибрана з групи, до якої входять (Е)-2^)-[1(3)-(пдроксикарбамоіл)-4-феніл-3бутеніл]-2'-ізобутил-2'-(метансульфоніл)-4метилвалеропдразид, (Е)-2^)-[1(3)-(пдроксикарбамоіл)-4-феніл-3бутеніл]-2'-(метансульфоніл)-4-метил-2'фенілвалеропдразид, (Е)-2^)-[1(3)-(пдроксикарбамоіл)-4-феніл-3бутеніл]-2'-(метансульфоніл)-4-метил-2'-[2(3)метилбутил]валеропдразид, (Е)-2^)-[1(3)-(пдроксикарбамоіл)-4-феніл-3бутеніл]-2'-(метансульфоніл)-4-метил-2'-(2метилаліл)валеропдразид та метил (E)-3-[2(R)-[1(S)-(riflpoKCHKap6aMoin)-4феніл-3-бутеніл]-4-метилвалерил] -2ізобутилкарбазат 15 Сполуки загальної формули О R 1 де Y, R1, R2, R3 та R4 мають значення, які наведено у пункті 1, та R9 означає захисну групу Цей винахід має відношення до нових похідних гідразину, способу їх одержання та лікарських засобів, до складу яких вони входять Цей винахід має також відношення до використання цих похід 16 Сполуки за п 15, де R означає тетрапдропіраніл, 4-метоксибензил, бензил або три(Сі-С? алКІЛ)СИЛІЛ 17 Карбонові кислоти загальної формули R ноос О R' (IX) 1 2 3 R' 4 де Y, R , R , R та R мають значення, які наведено у пункті 1 18 Сполуки за будь-яким з пп 1-14 для застосування як терапевтично активні речовини, зокрема для застосування як терапевтично активні речовини при лікуванні запалення, гарячки, крововиливу, сепсису, ревматоїдного артриту, остеоартриту, розсіяного склерозу або псоріазу 19 Спосіб одержання сполук за будь-яким з пп 114, який включає відщеплення захисної групи від сполуки загальної формули R1 О Н 8 1 2 3 4 R3 , (ID де Y, R , R , R та R мають значення, які наведено у пункті 1, та R9 означає захисну групу, та, у разі необхідності, перетворення одержаної сполуки формули І на фармацевтично прийнятну сіль 20 Лікарський засіб, який містить сполуку за будьяким з пп 1-14 та терапевтично інертний носій 21 Лікарський засіб для лікування запалення, гарячки, крововиливу, сепсису, ревматоїдного артриту, остеоартриту, розсіяного склерозу або псоріазу, який містить сполуку за будь-яким з пп 1-14 та терапевтично інертний носій 22 Спосіб виготовлення лікарського засобу, зокрема для лікування запалення, гарячки, крововиливу, сепсису, ревматоїдного артриту, остеоартриту, розсіяного склерозу або псоріазу, який включає виготовлення галенового препарату, що містить сполуку за будь-яким з пп 1-14 і терапевтично інертний носій, а також, у разі потреби, одну або кілька додаткових терапевтично активних речовин 23 Активний інгредієнт для виготовлення лікарського засобу для лікування захворювань, зокрема для лікування запалення, гарячки, крововиливу, сепсису, ревматоїдного артриту, остеоартриту, розсіяного склерозу або псоріазу, який являє собою сполуку за будь-яким з пп 1-14 24 Сполуки за будь-яким з пп 1-14, виготовлені із застосуванням способу за п 19 них як лікарських засобів та для одержання лікарських засобів Нові ПОХІДНІ гідразину, які надаються цим винаходом, є сполуками загальної формули 58561 0) Де Y означає CO або SCb, 1 R означає нижчу алкільну, нижчу алкенільну, нижчу циклоалкільну, нижчу циклоалкільну-нижчу алкільну, арильну або арил-нижчу алкільну групу, 2 R означає нижчу алкільну, галоген-нижчу алкільну, арил-нижчу алкільну, арил-нижчу алкенільну або арильну групу, у разі, коли Y означає SO2, та нижчу алкільну, галоген-нижчу алкільну, нижчу алкоксильну, нижчу алкоксикарбонільну, ацильну, нижчу циклоалкільну, арильну, арил-нижчу алкільну, арил-нижчу алкоксильну групу або NR5R6, у разі, коли Y означає CO, та R3 означає водень, нижчу алкільну групу, факультативно заміщену ціано, аміно, гідроксильною, нижчою алкоксильною, нижчою алкоксикарбонільною, гетероциклільною або гетероциклілкарбонільною, нижчою алкенільною, нижчою алкінільною, нижчою циклоалкільною, нижчою циклоалкілнижчою алкільною, арил-нижчою алкільною, арилнижчою алкенільною, арильною або гетероциклільною групою, або R2 та R3 разом утворюють залишок 5-, 6- або 7-членноі циклічної амідної, циклічної ІМІДНОІ, циклічної сульфонамідної або циклічної уретанової групи, R4 означає нижчу алкільну, нижчу алкенільну, нижчу циклоалкільну, нижчу циклоалкіл-нижчу алкільну групу або групу формули Х-арил, Xгетероарил або -(СН2)і 2-CH=CR7R8, X означає просторову групу, R5Ta R6, кожен індивідуально, означає водень, нижчу алкільну або арил-нижчу алкільну групу, та R7 та R8 разом представляють нижчу алкіленову групу, у якій одну метиленову групу факультативно заміщено гетероатомом, та їхніми фармацевтично прийнятними солями Згадані ПОХІДНІ гідразину, які надаються цим винаходом, є інгібіторами виділення фактору некротизацм пухлинних клітин альфа (TNF-a) та трансформуючого фактору росту (TGF-a) з клітин Вони також інгібують проліферацію кератиноцитів ВІДПОВІДНО, згадані ПОХІДНІ гідразину можна використовувати як лікарські засоби, зокрема, при лікуванні запалення, гарячки, крововиливу, сепсису, ревматоїдного артриту, остеоартриту, розсіяного склерозу та псоріазу У протилежність до структурно споріднених похідних пдроксамової кислоти (див патент США № 5,304,549), згадані ПОХІДНІ гідразину, які надаються цим винаходом, демонструють лише слабку пригнічувальну активність відносно ферментів сімейства матричних металопротеїназ (ММР), наприклад, колагеназ, стромелізинівта желатиназ Згаданий термін "нижча алкільна група", який використано у цьому описі, самостійно або у поєднанні, наприклад, у виразі "галоген-нижча алкільна група" або "нижча циклоалкіл-нижча алкільна гру па", означає алкільну групу з нерозгалуженим або розгалуженим ланцюгом, до складу якої входить до 7 атомів вуглецю, за переважним варіантом до 4 атомів вуглецю, наприклад, метил, етил, ппропіл, ізопропіл, п-бутил, ізобутил, втор-бутил, трет-бутил, n-пентил та n-гексил Прикладом галоген-нижчої алкільної групи є трифторметил Згаданий термін "нижча алкоксильна група", який використано у цьому описі, самостійно або у поєднанні, наприклад, у виразі "нижча алкоксикарбонільна група", означає нижчу алкільну групу, як визначено перед тим, яка є зв'язаною через атом кисню, наприклад, метокси, етокси, п-пропокси, ізопропокси, п-бутокси, ізобутокси та трет-бутокси Прикладами нижчих алкоксикарбонільних груп є метоксикарбоніл, етоксикарбоніл і т ін Згаданий термін "нижча циклоалкільна група", який використано у цьому описі, самостійно або у поєднанні, наприклад, у виразі "нижча циклоалкілнижча алкільна група", означає циклоалкільну групу, до складу якої входить від 3 атомів до 7 атомів вуглецю, наприклад, циклопропіл, циклобутил, циклопентил, циклогексил та циклогептил Прикладами нижчих циклоалкіл-нижчих алкільних груп є циклопропіл метил, 2-циклобутил-етил та 3циклогексил-пропіл Згаданий термін "нижча алкенільна група", який використано у цьому описі, самостійно або у поєднанні, наприклад, у виразі "арил-нижча алкенільна група", означає алкенільну групу, до складу якої входить від 2 атомів вуглецю до 7 атомів вуглецю, наприклад, аліл, ВІНІЛ та бутеніл, та згаданий термін "нижча алкінільна група" означає алкінільну групу, до складу якої входить від 2 атомів вуглецю до 7 атомів вуглецю, наприклад, пропарпл або бути ніл Згаданий термін "нижча алкіленова група" означає алкіленову групу, до складу якої входить від 2 атомів вуглецю до 6 атомів вуглецю, наприклад, диметилен, триметилен, тетраметилен і тін Так, R та R8 разом з атомом вуглецю, до якого вони приєднані, можуть представляти, наприклад, циклопентан, циклогексан або тетрапдропіранільне кільце Згаданий термін "ацильна група" означає ацильну групу, яку було одержано з нижчої алканкарбонової кислоти, наприклад, алканкарбонової кислоти, до складу якої входить до 6 атомів вуглецю, або з ароматичної карбонової кислоти Прикладами таких ацильних груп є ацетил, пропюніл, бутирил, ізобутирил, півалоїл, бензоїл, р-хлорбензоїл і тш Згаданий термін "арил" означає феніл або нафтил, факультативно заміщені галогеном, наприклад, фтором, хлором, бромом або йодом, нижчою алкільною групою, нижчою алкоксильною групою, трифторметильною групою, гідроксильною групою, нижчою алкоксикарбонільною групою, нітрогрупою, фенільною групою і тін , наприклад, феніл, 1-нафтил, 2-метилфеніл, 4-метоксифеніл, 2,4-дифторфеніл, 4-нітрофеніл та 4метоксикарбонілфеніл Бензил, 4-хлорбензил, 4бромбензил, 3-пдроксибензил, 4-метоксибензил, 4-нітробензил, 2-фенілетил, 3,4-диметоксифенетил і т ін є типовими прикладами арилнижчих алкільних груп, та бензилокси, 4 58561 хлорбензилокси та 4-нітро-бензилокси є типовими прикладами арил-нижчих алкоксильних груп 2фенілвініл та 3-фенілаліл можна згадати як приклади арил-нижчих алкенільних груп Згаданий термін "гетероциклільна група" означає 4-, 5- або 6-членну насичену або частково ненасичену або 5- або 6-членну ароматичну гетероциклічну групу, зв'язану через атом С або вторинний атом N (наприклад, -NH-), до складу якої входить один або декілька гетероатомів, які вибирають з групи, до складу якої входять азот, сірка та кисень, та які є факультативно заміщеними, наприклад, галогеном, нижчою алкільною групою, нижчою алкоксильною групою та/або оксогрупою, та/або факультативно бензозлиті Прикладами гетероциклільних груп є піролідиніл, пірол ІНІЛ, піразолініл, піперидиніл, морфолініл, тіаморфолініл, тетрапдропіраніл, тетрапдротюпіраніл, фурил, ТІЄНІЛ, тіазоліл, оксазоліл, ізоксазоліл, оксетаніл, імідазолідиніл, дюксоланіл, піроліл, В А (а) о. 8 піридил, піримідиніл, бензофураніл, бензотієніл, бензотіазоліл, ІНДОЛІЛ, ІЗОІНДОЛІЛ, ХІНОЛІЛ та ІЗОХІ ноліл Згаданий термін "гетероцикліл карбонільна група" означає гетероциклільну групу, як було визначено перед тим, зв'язану з С(О) через вторинний атом N Морфолінокарбоніл є типовим прикладом такої гетероциклілкарбонільної групи Згаданий термін "гетероарильна група" означає ароматичну гетероциклічну групу у межах означення "гетероциклільна група" Згадана циклічна амідна, імідна, сульфонамідна або уретанова група, утворена R2, R3 та атомами, до яких вони приєднані, наприклад, атомом С або атомом S Y, та, ВІДПОВІДНО, атом N, може бути, наприклад, групою наведених далі формул (а)-(д), де п означає 3, 4 або 5, та Ra разом з Rb утворюють залишок ароматичного або циклоалканового кільця а X N J ЮНА, (Ь) (с) \ (0 Переважними просторовими групами, позначеними X, є групи формул -(СН2)і 5-, -СН2-СН=СН-, -СН2-С=С-, -CH2NHCO-, -(CH2)i або 2NHCONH-, (СН2)і 5-S-, зокрема, -CH2S-, -CH2NHSO2-, CH2NHCH2-, -(CH2)i 5-O-, -О-(СН2)і 5 та -SЗгадані сполуки формули І утворюють фармацевтично прийнятні солі з основами, наприклад, гідроксидами лужних металів, наприклад, гідроксидом натрію та гідроксидом калію, гідроксидами лужноземельних металів, наприклад, гідроксидом кальцію, гідроксидом барію та гідроксидом магнію, і т ш Сполуки формули І, які належать до основних, можуть утворювати фармацевтично прийнятні солі з неорганічними кислотами, наприклад, з галогенводневими кислотами, наприклад, хлористоводневою кислотою та бромисто-водневою кислотою, сірчаною кислотою, азотною кислотою та фосфорною кислотою, та з органічними кислотами, наприклад, з оцтовою кислотою, винною кислотою, бурштиновою кислотою, фумаровою кислотою, малеїновою кислотою, яблучною кислотою, (8) саліциловою кислотою, лимонною кислотою, метансульфоновою кислотою та ртолуолсульфоновою кислотою Буде зрозуміло, що, незважаючи нате, що наведені у цьому описі формули показують ВІДПОВІДНІ сполуки у їхній абсолютній стереохімічній формі, цей винахід охоплює не тільки наведені стереоізомери, але також і ВІДПОВІДНІ рацемати та суміші діастереоізомерів На додаток до цього, коли до складу просторової групи, позначеної X, входить олефіновий подвійний зв'язок, як, наприклад, у СН2-СН=СН-, вона може мати (Е) або (Z) конфігурацію, за переважним варіантом (Е) конфігурацію До переважних сполук формули І належать сполуки, де Y означає CO, R2 означає нижчу алкоксильну групу, зокрема, метокси, або Y означає SO2, та R означає нижчу алкільну групу, зокрема, метил R1, за переважним варіантом, означає нижчу алкільну групу, зокрема, ізобутил R3, за переважним варіантом, означає нижчу алкільну групу, зокрема, ізобутил або 2-метилбутил, нижчу алке 58561 нільну групу, зокрема, 2-метил-аліл, арил-нижчу алкільну групу, зокрема, незаміщений бензил або 4 арил, зокрема, незаміщений феніл R , за переважним варіантом, означає групу формули Х-арил, зокрема, коли X означає просторову групу формули -СЬІ2-СН=СН- та арил означає незаміщений феніл Особливо переважними сполуками формули І є (Е)-2^)-[1(3)-(пдроксикарбамоіл)-4-феніл-3бутеніл]-2'-ізобутил-2'-(метансульфоніл)-4метилвалеропдразид, (Е)-2^)-[1(3)-(пдроксикарбамоіл)-4-феніл-3бутеніл]-2'-(метансульфоніл)-4-метил-2'фенілвалеропдразид, (Е)-2^)-[1(3)-(пдроксикарбамоіл)-4-феніл-3бутеніл]-2'-(метансульфоніл)-4-метил-2'-(2(3)метилбутил)валеропдразид, (Е)-2^)-[1(3)-(пдроксикарбамоіл)-4-феніл-3бутеніл]-2'-(метансульфоніл)-4-метил-2'-(2метилаліл)валеропдразид, та метил (E)-3-[2(R)-[1(S)-(riflpoKCHKap6aMoin)-4феніл-3-бутеніл]-4-метилвалерил] 2ізобутилкарбазат ВІДПОВІДНО ДО способу, який надається цим винаходом, згадані нові ПОХІДНІ гідразину, визначення яких було наведено перед тим, одержують шляхом відщеплення захисної групи, позначеної R9, від сполуки, яка має загальну формулу О 10 відщеплення відбувається in situ] Перетворення одержаних сполук формули І на фармацевтично прийнятні солі здійснюється шляхом обробки за допомогою відповідної кислоти або основи за відомим способом Згадані сполуки формули II, які було використано як ВИХІДНІ матеріали у попередньому способі, є новими і представляють собою додаткову ціль цього винаходу, їх можна одержати різними шляхами, як показано на наведених далі Реакційних 1 2 3 4 9 Схемах, де Y, R , R , R , R та R мають значення, 1 яке було наведено перед тим, Ви означає третбутил, та Me означає метил Реакційна Схема А 'BuOOC соон (ПІ) R3-HN-NH2 0V) ( ВиООС R1 N H Н N R: СП) о де Y, R1, R2, R3 та R4 мають значення, яке було наведено перед тим, та R9 означає захисну групу, та, у разі необхідності, шляхом перетворення одержаної сполуки формули І на фармацевтично прийнятну сіль Згаданою захисною групою, яка позначається як R9 у сполуці формули II, може бути будь-яка традиційна захисна група, однак за переважним варіантом це тетрапдропіраніл, 4-метоксибензил, бензил або три(нижчий алкіл)силіл, зокрема, третбутилдиметилсиліл Відщеплення згаданої захисної групи, яка по9 значається R , від сполуки формули II здійснюється за методами, відомими per se Наприклад, згадана тетрапдропіранільна група може бути відщеплена шляхом обробки сульфокислотою, наприклад, метансульфо кислотою або ртолуолсульфокислотою, у нижчому алканолі, наприклад, метанолі Відщеплення згаданої 4метоксибензильної групи може здійснюватись, наприклад, за допомогою трифтороцтової кислоти Гідрогеноліз у присутності каталізатору, наприклад, паладію, у нижчому алканолі, наприклад, метанолі, може застосовуватись для відщеплення згаданої бензильної захисної групи Три(нижча алкіл)силільна захисна група може відщеплюватись за допомогою води або низького рН, згадане відщеплення, як правило, відбувається під час виділення відповідної сполуки формули II з середовища, у якому и було одержано (наприклад, R 2 -YC1 (VI)or 2 (VH) *Ви€ЮС TFA HOOC R 9 ONH 2 (X) 1 (П) or - або, ТО 58561 12 11 3 TFA - трифтороцтова кислота антом, сполука формули V, де R представляє Відносно Реакційної Схеми А, на першому водень, може реагувати з циклічним ангідридом етапі сполуку формули III конденсують з гідразизагальної формули ном або заміщеним гідразином формули IV з одержанням гідразиду формули V Згадане конденсування здійснюють за відомих умов реакцій сполучення пептидів та за допомогою реактивів сполучення, відомих per se для подібних сполу(XI) чень, наприклад, 1-пдроксибензотриазолу, у присутності пдрохлориду 1 -етил-3-(3диметиламшопропіл)карбодиіміду Після ЦЬОГО гідразид формули V реагує з хлоО ридом формули VI або з ангідридом формули VII з де п має значення, яке було наведено перед одержанням сполуки формули VIII Цю реакцію тим, здійснюють за відомим способом, наприклад, у наприклад, глутаранпдридом, традиційно у органічному розчиннику, який залишається інертприсутності органічної основи, наприклад, ним за умов згаданої реакції, та у присутності ортри(нижчого алкіл)амшу, наприклад, триетиламшу, ганічної основи при температурі від приблизно 0°С та у органічному розчиннику, який залишається до приблизно кімнатної температури ВІДПОВІДНИінертним за умов згаданої реакції, наприклад, МИ розчинниками є галогенізовані вуглеводні, наароматичному вуглеводні, наприклад, бензолі, приклад, дихлорметан Прикладами органічних толуолі і т ш , при підвищеній температурі, у приоснов, які можуть застосовуватись, є три(нижчі йнятному варіанті, при температурі перегонки згаалкіл)аміни, наприклад, триетиламш, піридин, 4даної реакційної суміші Таким чином, одержують диметиламшопіридин і т і н У разі, коли згадана сполуку формули VIII, де R2, R3 та атоми, з якими основа є рідкою за згаданих умов реагування, її вони зв'язані, разом утворюють групу формули (с), можна застосовувати з надлишком, і у цьому вияку було наведено перед тим падку вона може використовуватись як єдиний л Y розчинник Далі, на наступному етапі, сполука формули VIII позбавляється захисної групи за допомогою трифтороцтової кислоти (TFA) з одержанням карбонової кислоти формули IX Згадане відщеплення захисної групи здійснюють способом, відомим per se, наприклад, у органічному розчиннику, який є інертним за умов згаданої реакції, наприклад, галогенізованому вуглеводні, наприклад, дихлорметані, при приблизно кімнатній температурі І, нарешті, карбонову кислоту формули IX перетворюють на вихідний матеріал формули II шляхом конденсування з О-захищеним пдроксиламіном формули X Згадане конденсування здійснюють шляхом, відомим per se, для реакцій сполучення пептидів та за допомогою традиційних реактивів сполучення, наприклад, 1пдроксибензотриазолу, у присутності пдрохлориду 1-етил-3-(3-диметиламшопропіл)карбодиіміду У разі потреби сполуки, які зустрічаються на Реакційній Схемі А або які одержують шляхом, який наведено на Реакційній Схемі А, можуть бути взаємоперетвореними або заміщеними Так, сполука формули V, де R3 представляє водень, може бути перетворена на відповідну сполуку формули V, де R3 представляє нижчу алкільну, нижчу алкенільну, нижчу алкінільну, нижчу циклоалкільну або арил-нижчу алкільну групу у спосіб, відомий per se Наприклад, сполука формули V, де R представляє водень, може конденсуватись з альдегідом загальної формули R3 -СНО, де R30 означає нижчу алкільну, нижчу алкенільну, нижчу алкінільну, нижчу циклоалкільну, арил-нижчу алкільну або арильну групу, наприклад, у присутності р-толуолсульфонової кислоти та молекулярних сит, і одержаний заміщений ІМІН може відновлюватись, за переважним варіантом, in situ, за допомогою ціаноборопдриду лужного металу, зокрема, ціаноборопдриду натрію За альтернативним варі Так, сполука формули II, де R3 представляє водень, може бути перетворена на відповідну сполуку формули II, де R30 має значення, яке було наведено перед тим, шляхом реагування з відоo n o n мою сполукою загальної формули R -X, де R має значення, яке було наведено перед тим, та X представляє галоген, традиційно у присутності основи, наприклад, карбонату лужного металу, наприклад, карбонату натрію або карбонату калію, та у органічному розчиннику, який залишається інертним за умов згаданої реакції, наприклад, диметилформаміді Додатково, сполука формули VIII, де R4 представляє фталімід-нижчу алкільну групу, може оброблятись гідратом гідразину, традиційно у органічному розчиннику, який залишається інертним за умов згаданої реакції, наприклад, нижчому алканолі, наприклад, метанолі або етанолі, при приблизно кімнатній температурі, та одержаний продукт, сполука, яка відповідає формулі VIII, та у якій R4 представляє амін-нижчу алкільну групу, може реагувати з ВІДПОВІДНОЮ (гетеро)ароматичною карбоновою кислотою або галогенідом сульфокислоти, (гетеро)ароматичним ізоціанатом або (гетеро)ароматичною карбоновою кислотою у присутності реактиву сполучення у присутності основи з метою введення необхідної групи R4 Згадані карбонові кислоти формули IX у Реакційній Схемі А є новими і утворюють додаткову ціль цього винаходу Згадані сполуки формули III, які застосовано у Реакційній Схемі А, оскільки вони є невідомими сполуками або аналогами відомих сполук, можуть бути одержані, як описано у наведених далі Прикладах або за аналогією до них Більше того, згадані сполуки формул IV, VI, VII та X, також застосовані у Реакційній Схемі А, а також згадані альдегіди формули R30-CHO та згадані ЦИКЛІЧНІ ангідриди формули XI, є відомими сполуками або 13 аналогами відомих сполук 58561 Реакційна Схема В R1 %иООС соон (Ш) МеОН *ВиООС схщ COOMe TFA R1 ноос CO e OM R9ONH2 (X) R1 О N.. сооме н АЗМе; R3-NH-KH2 1 О в (TV) R ! N H О 2 R -YCl(VI)of 2 (R -Y)jO ( V I ) OD Відносно Реакційної Схеми В, перший етап включає перетворення карбонової кислоти формули III на ВІДПОВІДНИЙ метиловий ефір формули XII Це здійснюється відомим способом, напри 14 клад, шляхом реагування з метанолом у присутності третинної органічної основи, наприклад, 4диметиламшопіридину, та конденсаційного агенту, наприклад, диіміду, наприклад, 1-етил-3-(3диметиламшопропіл)карбодиіміду Після ЦЬОГО, згаданий метиловий ефір формули XII позбавляють захисної групи на третбутоксикарбонільній групі шляхом обробки за допомогою трифтороцтової кислоти Згадане відщеплення захисної групи здійснюють способом, відомим per se, наприклад, у органічному розчиннику, який є інертним за умов згаданої реакції, наприклад, галогенізованому вуглеводні, наприклад, дихлорметані, при приблизно кімнатній температурі Одержану сполуку формули XIII у подальшому конденсують з О-захищеним пдроксиламіном формули X з одержанням сполуки формули XIV Згадане конденсування здійснюють шляхом, відомим per se, для реакцій сполучення пептидів та за допомогою традиційних реактивів сполучення, наприклад, 1-пдроксибензотриазолу, у присутності пдрохлориду 1 -етил-3-(3диметиламшопропіл)карбодиіміду На наступному етапі сполука формули XIV реагує з триметилалюмінієм та гідразином або заміщеним гідразином формули IV з одержанням сполуки формули XV Згадану реакцію традиційно здійснюють у органічному розчиннику, який є інертним за умов згаданої реакції, наприклад, галогенізованому вуглеводні, наприклад, дихлорметані, при температурі у приблизному діапазоні від кімнатної температури до температури 60°С І, нарешті, необхідний вихідний матеріал формули II одержують шляхом реагування сполуки формули XV з хлоридом формули VI або ангідридом формули VII Цю реакцію здійснюють за відомим способом, наприклад, у органічному розчиннику, який залишається інертним за умов згаданої реакції, та у присутності органічної основи при температурі від приблизно 0°С до приблизно кімнатної температури ВІДПОВІДНИМИ розчинниками є галогенізовані вуглеводні, наприклад, дихлорметан Прикладами органічних основ, які можуть застосовуватись, єтри(нижчі алкіл)амши, наприклад, триетиламш, піридин, 4-диметиламшопіридин і т ш У разі, коли згадана основа є рідкою за згаданих умов реагування, її можна застосовувати з надлишком, і у цьому випадку вона може одночасно використовуватись як згаданий розчинник 15 58561 Реакційна Схема С R1 МвООС CO OH (XVI) i) Activation 3 ii)H2N-NR -Y-F? (XVH) (КУШ) R3 R4 AMe3 (П) (X) Activation - аісгивація На першому етапі Реакційної Схеми С карбонова кислота формули XVI активується, наприклад, шляхом обробки оксалілхлоридом, з подальшим реагуванням з заміщеним гідразином формули XVII з одержанням сполуки формули XVIII Цю реакцію традиційно здійснюють у присутності основи, зокрема, третинного органічного аміну, наприклад, триетиламшу, та у органічному розчиннику, який є інертним за умов згаданої реакції, наприклад, галогенізованому вуглеводні, наприклад, дихлорметані, при температурі приблизно 0°С Далі, сполуку формули XVIII перетворюють на необхідний вихідний матеріал формули II шляхом реагування з триметилалюмінієм та О-захищеним пдроксиламіном формули X Цю реакцію традиційно здійснюють у органічному розчиннику, який залишається інертним за умов згаданої реакції, наприклад, галогенізованому вуглеводні, наприклад, дихлорметані, та при температурі від приблизно кімнатної до приблизно 60°С Згадані карбонові кислоти формули XVI та заміщені гідразини формули XVII, використані у Реакційній Схемі С, є відомими сполуками або аналогами відомих сполук, які можна одержати способом, аналогічним способу одержання згаданих відомих сполук Як згадувалось перед тим, ПОХІДНІ гідразину, які надаються цим винаходом, інгібують виділення TNF та TGF-a, а також проліферацію кератиноцитів Згадана активність може демонструватись за допомогою випробувань in vitro, опис яких наведено далі Випробування А Інгібування виділення TNF-a 16 Клітини ТНР1 культивували у живильному середовищі RPMI 1640, яке було доповнено антибіотиками та 10% сироваткою зародку великої рогатої худоби, збирали центрифугуванням та розбавляли 5 до 5x10 клітин/мл у вищезгаданому живильному середовищі, яке було доповнено 20мМ ГЕПЕСбуфером Аліквоти (200МКЛ) одержаної суспензії клітин висівали на 96-лункові культуральні планшети та шкубували впродовж 0,5 години при температурі 37°С перед доданням згаданих експериментальних сполук Останні розчиняли у диметилсульфоксиді (DMSO) до одержання 1,2мМ концентрованого розчину, який розбавляли сумішшю забуференого фосфатом фізрозчинута 10% розчину диметилсульфоксиду з одержанням експериментальних сполук з кінцевою концентрацією 9 5 від 10 М до 10 М, причому кожна концентрація піддавалась подвійному випробуванню Згадані клітини шкубували з експериментальними сполуками впродовж 0,5 години при температурі 37°С, після чого додавали бактеріальний ліпополісахарид (LPS) до концентрації 2мг/мг і подальше інкубування здійснювали впродовж 3 годин при температурі 37°С у атмосфері, яка включала 5% ССЬ, та при 95% ВІДНОСНІЙ вологості Після центрифугування при 260 дх впродовж 10 хвилин видаляли аліквоту кожного супернатанту і КІЛЬКІСТЬ TNF-a визначали за допомогою твердофазного імуноферментного аналізу (ELISA) (компанія R&D Systems Europe Ltd , Abmgdon, Англія) Концентрацію експериментальної сполуки, яка викликала приблизно 50% інгібування індукованого ліпополісахаридом виділення TNF-a (IC50), вираховували за допомогою дозозалежної кривої Випробування В Інгібування виділення TGF-a Це випробування є адаптуванням методу, опис якого було наведено Р Дж Коффрі (R J Coffrey), Р Деринком (R Derynk), Дж Н Уїлкоксом (J N Wilcox), Т С Брінгменом (Т S Bnngman), A C Гастіном (A S Goustin), ГЛ Мозесом (Н L Moses) та М Р Піттелковом (М R Pittelkow), Nature, (1987), 328, 816-820 Нормальні людські епідермальні кератиноцити (NHEK) (новонароджених та дорослих) було поставлено компанією Clonetics Corporation, Сан Дієго, Каліфорнія, СІЛА, які під час третього пасажу висівали на 96-лункові культуральні планшети з густиною від 2 х 103 клітин до 4 10 клітин на лунку та вирощували у вологій камері з 5% атмосферою ССЬ при температурі 37°С впродовж 5 днів на безсироватковому живильному середовищі для вирощування кератоцитів (KGM, компанія Clonetics Corporation) Експериментальні сполуки розчиняли у диметилсульфоксиді, після чого розбавляли у десятикратному об'ємі базального живильного середовища для вирощування кератиноцитів (КВМ, компанія Clonetics Corporation) Серійні розведення згаданих експериментальних сполук здійснювали у 10% диметилсульфоксиді у КВМ з одержанням концентрацій, які у 12 разів перевищували кінцеву експериментальну концентрацію До клітин додавали згадані розведення експериментальних сполук (або лише носія, як контролю) з подальшим інкубуванням при температурі 37°С впродовж 0,5 години Після цього виділення TGF-a стимулювали доданням 10нг/мл ТРА (форбол 12-міристат 13-ацетату) 58561 18 17 Після додаткового інкубування при температурі КВМ (дивись перед тим) на 4 дні з метою припинення росту згаданих клітин Експериментальні 37°С впродовж 24 годин вміст TGF-a у культурасполуки розчиняли у диметилсульфоксиді, після льному середовищі визначали за допомогою TGFчого розбавляли у десятикратному об'ємі базальa ELISA (компанія Oncogene Science Inc , Unionного живильного середовища для вирощування dale, Нью-Йорк, США) або системи визначення на кератиноцитів (КВМ) Серійні розведення згаданих основі електрохемілюмінісценцм (компанія Igen експериментальних сполук здійснювали у 10% Inc , Gaithersburg, Мериленд, США), відформатодиметилсульфоксиді у КВМ з одержанням конценваної за допомогою анти-людського TGF-a (комтрацій, які у 11 разів перевищували кінцеву експепанія R&D Systems Europe Ltd) Після цього було риментальну концентрацію Після цього згадані вираховано концентрацію експериментальної споклітини повертали до KGM з негайним доданням луки, яка забезпечувала 50% інгібування виділензгаданих розведень експериментальних сполук ня TGF-a відносно згаданого контролю (ICso (або лише носія, як контролю) Після інкубування нмоль) впродовж 3 днів згадані клітини піддавали імпуль3 Випробування С Інгібування проліферації кесному міченнюН-тимідином (1 мкКюрі/лунку, комратиноцитів панія Amersham International ріс, Little Chalfont, Це випробування є адаптуванням методів, Buckinghamshire, Великобританія) впродовж як опис яких було наведено Т Карашима (Т Кагамінімум 16 годин Після ЦЬОГО КЛІТИНИ відокремлюshima), X Хачісака (Н Hachisuka) та Й Cacai (Y вали за допомогою розчину трипсинуSasai), J Dermatol Sci , (1996), 12, 246-254, та А етилендіамштетраоцтової кислоти та збирали Оланіраном (A Olamran), В С Бейкером (В S Включення 3Н-тимідину, як критерій проліферації, Baker), ДжДж Гарючем (J J Ganoch), А В Поулвизначали методом підрахунку сцинтиляційних сом (А V Powles) та Л Фраєм (L Fry), Arch Dermaспалахів tol Res, (1995), 287, 231-236 Нормальні людські Після ЦЬОГО було вираховано концентрацію епідермальні кератиноцити (NHEK) (новонароджеекспериментальної сполуки, яка забезпечувала них та дорослих) висівали на 96-лункові культура50% інгібування включення 3Н-тимідину відносно льні планшети з густиною 2 х 103 клітин на лунку згаданого контролю (ICso нмоль) Після прикріплення клітин до планшету шляхом Узагальнені результати, одержані з репрезенінкубування впродовж 24 годин у вологій камері з тативними сполуками формули І під час випробу5% атмосферою СОг при температурі 37°С на вань, опис яких було наведено перед тим, предбезсироватковому живильному середовищі для ставлено у наведеній далі Таблиці вирощування кератоцитів (KGM, дивись перед тим), згадане живильне середовище замінювали Таблиця Сполука А В С D Е F G Н І J Випробування A ICso (нмоль) 437 515 365 408 531 1516 428 381 881 933 N/T=He випробувалось, А=(Е)-2(Р)-[1(3)-(пдроксикарбамоіл)-4-феніл3-бутеніл]-2'-(метансульфоніл)-4-метил-2'фенілвалеропдразид, В=(Е)-2(Р)-[1(3)-(пдроксикарбамоіл)-4-феніл3-бутеніл]-2'-(метансульфоніл)-2'-(4метоксифеніл)-4-метилвалеропдразид, С=(Е)-2'-бензил-2(Р)-[1(3)-(пдроксикарбамоіл)4-феніл-3-бутеніл]-2'-(метансульфоніл)-4метилвалеропдразид О=(Е)-2'-(циклогексилметил)-2(Р)-[1(3)(пдроксикарбамоіл)-4-феніл-3-бутеніл]-2'(метансульфоніл)-4-метилвалеропдразид Е=(Е)-2(Р)-[1(3)-(пдроксикарбамоіл)-4-феніл3-бутеніл]-2'-ізобутил-2'-(метансульфоніл)-4метилвалеропдразид Р=(Е)-2(Р)-[(1(3)-(пдроксикарбамоіл)-4-феніл Випробування В ICso (нмоль) 210 255 N/T N/T N/T N/T N/T N/T N/T N/T Випробування С ICso (нмоль) 1300 1100 N/T N/T N/T N/T N/T N/T N/T N/T 3-бутеніл]-4-метил^-(2,6дюксопіперидин)валерамід С=(Е)-2(Р)-[1(3)-(пдроксикарбамоіл)-4-феніл3-бутеніл]-2'-(метансульфоніл)-4-метил-2'-[2(3)метилбутил]валеропдразид Н=(Е)-2(Р)-[1(3)-(пдроксикарбамоіл)-4-феніл3-бутеніл]-(метансульфоніл)-4-метил-2'-(2метилаліл)валеропдразид І=метил (E)-3-[2(R)-[1 (3)-(пдроксикарбамоіл)-4феніл-3-бутеніл]-4-метилвалерил] -2ізобутилкарбазат І=(Е)-2(Р)-[(3)-(пдроксикарбамоіл)-4-феніл-3бутеніл]-2'-(ізобутил)-2'-(ізопентаноіл)-4метилвалеропдразид, Згадані ПОХІДНІ гідразину, які надаються цим винаходом, можна використовувати як лікарські засоби, наприклад, у формі фармацевтичних пре 58561 20 19 паратів Згадані фармацевтичні препарати можна проміжних продуктів було підтверджено засобами вводити перорально, наприклад, у формі таблеЯМР-спектроскопм ток, таблеток з ентеросолюбільним покриттям, які Приклад 1 розпадаються у кишечнику, драже, твердих та м'я2(Р)-[1(3)-(пдроксикарбамоіл)-4-фенілбутил]ких желатинових капсул, розчинів, емульсій або 2'-(метансульфоніл)-4-метил-2'суспензій Однак вони можуть також вводитись фенілвалеропдразид ректально, наприклад, у формі супозиторіїв, або Розчин 0,165г 2(R)-[1 (3)-(карбокси)-4парентерально, наприклад, у формі розчинів для фенілбутил]-2'-(метансульфоніл)-4-метил-2'впорскування фенілвалеропдразиду у 4мл сухого диметилформаміду охолоджували до температури 0°С з одноПри виготовленні фармацевтичних препаратів часним перемішуванням у атмосфері азоту, після згадані ПОХІДНІ гідразину можуть вводитись до їхчого додавали 0,09г 1-пдроксибензотриазолу та нього складу разом з терапевтично інертними, 0,09г пдрохлориду 1 -етил-3-(3неорганічними або органічними носіями Лактозу, кукурудзяний крохмаль або їхні ПОХІДНІ, тальк, стедиметиламшопропіл)карбодиіміду Після переміаринову кислоту або и солі можна використовувашування впродовж 40 хвилин при температурі 0°С ти, наприклад, як такі носи для таблеток, таблеток одержаний розчин обробляли 0,18г О-(третз ентеросолюбільним покриттям, які розпадаються бутилдиметилсиліл)пдроксиламіну, одержану суу кишечнику, драже та твердих желатинових капміш витримували з нагріванням до кімнатної темсул Придатними носіями для м'яких желатинових ператури з подальшим перемішуванням впродовж капсул є, наприклад, рослинні масла, воски, жири, ночі Згаданий розчинник випарювали і одержаний напівтверді та рідкі полюли і т ш У залежності від залишок розподіляли поміж етилацетатом та 5% природи активного інгредієнту, однак, ноем, у виводним розчином гідрокарбонату натрію Одержападку м'яких желатинових капсул, як правило, не ний етилацетатний шар послідовно промивали потрібні Придатними носіями для виготовлення водою, 2М сірчаною кислотою, водою та розсолом, розчинів та сиропів є, наприклад, вода, полюли, після чого сушили над безводним сульфатом магсахароза, інвертований цукор, глюкоза і т ш Принію Згаданий розчинник випарювали з одержандатними носіями для виготовлення розчинів для ням блідо-рожевої смоли, з якої, після кристалізувпорскування є, наприклад, вода, спирти, полюли, вання з ефіру, було одержано 0,05г 2(R)-[1(S)гліцерин, рослинні масла і т ш Природні та затве(пдроксикарбамоіл)-4-фенілбутил]-2'рдлі масла, воски, жири, напіврідкі полюли і т ш є метансульфоніл)-4-метил-2'-фенілвалеропдразиду придатними носіями для виготовлення супозиторіу вигляді твердої речовини майже білого кольору їв Мас-спектрометрія 476 (М+Н)+ До складу згаданих фармацевтичних препараЯдерний магнітний резонанс (d6 диметилсутів можуть також входити консерванти, стабілізальфоксид при 353К) 10,73 (1Н, синглет), 10,30 тори, зволожуючі речовини, емульгатори, підсоло(1Н, широкий синглет), 8,46 (1Н, широкий синглет), джуючі речовини, барвники, коригенти, солі для 7,50-7,44 (2Н, мультиплет), 7,42-7,34 (2Н, мультирегулювання осмотичного тиску, буфери, ентероплет), 7,30-7,21 (ЗН, мультиплет), 7,18-7,06 (ЗН, солюбільні покривні речовини або антиоксиданти мультиплет), 3,17 (ЗН, синглет), 2,64-2,54 (1Н, мультиплет), 2,50-2,30 (2Н, мультиплет), 2,25-2,11 Лікарські засоби, до складу яких входить ви(1Н, мультиплет), 1,59-1,23 (6Н, мультиплет), 1,10щезгадана похідна гідразину та терапевтично при1,02 (1Н, мультиплет), 0,84 (1Н, дублет, J= Гц), йнятний носій, а також спосіб одержання таких 0,76 (1Н, дублет, J= Гц) лікарських засобів, також є цілями цього винаходу Цей спосіб включає введення сполуки формули І Високоефективна рідинна хроматографія або и фармацевтично прийнятної солі до галеноГрадієнтне елюювання за допомогою розчиннику вої лікарської форми до введення разом з терапеА, який включає 10% розчиннику В, впродовж 5 втично інертним носієм та, у разі необхідності, хвилин, з подальшим підвищенням вмісту розчиноднією або декількома додатковими терапевтичне нику В до 90% від 5 хвилин до 15 хвилин, швидактивними речовинами кість потоку 1мл/хвилину Час утримання 16,77 хвилини Розчинник А Н2О/0,1% TFA (тетрафтоДодаткову ціль цього винаходу становить зароцтова кислота), розчинник В СНзСІ\І/0,085% стосування згаданих похідних гідразину, які надатетрафтороцтової кислоти Тип колонки HYPERються цим винаходом, для лікування захворювань, PEP 300А зокрема, для лікування запалення, гарячки, крововиливу, сепсису, ревматоїдного артриту, остеоар2^)-[1(3)-(карбокси)-4-фенілбутил]-2'триту, розсіяного склерозу та псоріазу Дозування (метансульфоніл)-4-метил-2'може коливатись у широких межах і буде, звичайфенілвалеропдразид, який було використано як но, регулюватись індивідуальними вимогами у вихідний матеріал, одержали у наведений далі кожному конкретному випадку Взагалі, у випадку спосіб введення дорослим, ВІДПОВІДНОЮ була б добова (і) РОЗЧИН 0,35Г 2(R)-[1(S)-(TpeTдоза від приблизно 5мг до приблизно ЗОмг, за пебутоксикарбоніл)-4-фенілбутил]-4реважним варіантом від приблизно Юмг до приметилвалеріанової кислоти, який було одержано у близно 15мг, хоча, у разі необхідності, згадана спосіб, аналогічний способу, опис якого наведено верхня межа може бути перевищеною Згадана у Прикладі 2, частини (і) та (м), у 5мл диметилфодобова доза може вводитись у вигляді однієї дози рмаміду охолоджували до температури 0°С та або подрібненими дозами послідовно обробляли 0,1мл N-метилморфолшу, 0,16г 1-пдроксибензотриазолу, 0,16г фенілпдразиНаведені далі Приклади ілюструють цей винану та 0,27г пдрохлориду 1 -етил-3-(3хід Структуру згаданих продуктів та головних 58561 22 21 диметиламшопропіл)карбодиіміду Одержаний шили над безводним сульфатом магнію і згаданий розчин витримували з нагріванням до кімнатної розчинник випарювали Одержаний залишок розтемператури з подальшим перемішуванням впрочиняли у ефірі з одержанням 0,051г (E)-2(R)-[1 (S)довж ночі Згаданий розчинник випарювали і оде(пдроксикарбамоіл)-4-феніл-3-бутеніл]-2'ржаний залишок розподіляли поміж етилацетатом (метансульфоніл)-4-метил-2'-феніл гідразиду у та 5% водним розчином гідрокарбонату натрію вигляді твердої речовини білого кольору + Одержаний етилацетатний шар послідовно проМас-спектрометрія 474 (М+Н) мивали водою, 5% розчином лимонної кислоти, Ядерний магнітний резонанс (сіє диметилсуводою та насиченим розчином хлориду натрію, льфоксид при 353К) 10,80 (1Н, синглет), 10,30 сушили над безводним сульфатом магнію та ви(1Н, широкий синглет), 8,48 (1Н, широкий синглет), парювали Одержаний залишок очищали засоба7,51-7,45 (2Н, мультиплет), 7,42-7,34 (2Н, мультими гель-хроматографування під вакуумом з елююплет), 7,32-7,23 (5Н, мультиплет), 7,21-7,14 (1Н, ванням сумішшю гексану/етилацетату (61) мультиплет), 6,22 (1Н, дублет, J=15,5riO, 6,08-5,96 Одержали 0,41г масла жовтого кольору, яке, після (1Н, мультиплет), 3,20 (ЗН, синглет), 2,70-2,60 (1Н, кристалізування з суміші гексану/ефіру, забезпемультиплет), 2,42-2,12 (ЗН, мультиплет), 1,58-1,48 чило одержання 0,255г 2(R)-[1 (S)-(TpeT(1Н, мультиплет), 1,46-1,35 (2Н, мультиплет), 1,14бутоксикарбоніл)-4-фенілбутил]-4-метил-2'1,05 (1Н, мультиплет), 0,85 (ЗН, дублет, и=6,5Гц), фенілвалеропдразиду у вигляді твердої речовини 0,76 (ЗН, дублет, J=7,5I~4) білого кольору Високоефективна рідинна хроматографія Мас-спектрометрія 439 (М+Н)+ Градієнтне елюювання за допомогою розчиннику А, який включає 10% розчиннику В, впродовж 5 (м) Розчин 0,19г продукту з частини (і) у Змл хвилин, з подальшим підвищенням вмісту розчинпіридину охолоджували до температури 0°С та нику В до 90% від 5 хвилин до 15 хвилин, швиддодавали 0,15г метансульфонілхлориду Одержакість потоку 1мл/хвилину Час утримання 16,76 ний розчин витримували при кімнатній температурі хвилини Розчинник А Н2О/0,1% TFA (тетрафтоі згаданий розчинник випарювали Одержаний зароцтова кислота), розчинник В СНзСІ\І/0,085% лишок розподіляли поміж етилацетатом та 2М тетрафтороцтової кислоти Тип колонки HYPERсірчаною кислотою, одержаний етил ацетатний PEP 300А шар послідовно промивали 2М сірчаною кислотою, водою, 5% водним розчином гідрокарбонату на(E)-2(R)-[1(S)-[(TeTpanflpo-2(RS)трію та насиченим розчином хлориду натрію Після піранілокси)карбамоіл]-4-феніл-3-бутеніл]-2'висушування над безводним сульфатом магнію (метансульфоніл)-4-метил-2'згаданий розчинник випарювали, одержаний зафенілвалеропдразид, який було використано як лишок очищали відгонкою під вакуумом з елюювихідний матеріал, одержали у наведений далі ванням сумішшю гексану/етилацетату (6 1) Одерспосіб жали 0,19г 2(Р)-[1(3)-(трет-бутоксикарбоніл)-4(і) РОЗЧИН 5,19Г 4-трет-бутил водень 2(R)фенілбутил]-2'-(метансульфоніл)-4-метил-2ізобутилсукцинату у 50мл сухого тетрагідрофурану фенілвалеропдразиду у вигляді твердої речовини охолоджували до температури -78°С з одночасним білого кольору перемішуванням у атмосфері азоту Прикраплювали 25мл 2М розчину дмзопропіламіду ЛІТІЮ у Mac-спектрометрія 517(М+Н) + тетрапдрофурані і одержану суміш перемішували (їм) РОЗЧИН 0,19Г продукту з частини (м) розчипри температурі -78°С впродовж 15 хвилин Після няли у суміші 8мл дихлорметану та 4мл трифтоцього прикраплювали розчин 5,55г цинамілброміду роцтової кислоти та відстоювали при кімнатній у 25мл сухого тетрагідрофурану і одержану суміш температурі впродовж 5 годин Згаданий розчинвитримували з поступовим нагріванням до кімнатник випарювали і одержаний залишок поновно ної температури Після перемішування впродовж випарювали з толуолу Згадану процедуру додатночі тетрапдрофуран випарювали, одержаний ково повторили ДВІЧІ з одержанням залишку Згазалишок розподіляли поміж етилацетатом та 5% даний залишок розчиняли у ефірі і тверду речовирозчином лимонної кислоти Одержаний етилацену відфільтровували Одержали 0,165г 2(R)-[1(S)татний шар промивали двома додатковими порці(карбокси)-4-фенілбутил]-2'-(метансульфоніл)-4ями 5% розчину лимонної кислоти, водою та насиметил-2'-фенілвалеропдразиду у вигляді твердої ченим розчином хлориду натрію, після чого речовини білого кольору сушили над безводним сульфатом магнію ЗгадаМас-спектрометрія 461 (М+Н)+ ний розчинник випарювали з одержанням масла Приклад 2 оранжевого кольору Одержане масло розчиняли у (Е)-2(Р)-[1(3)-(пдроксикарбамоіл)-4-феніл-3ЮОмл гексану, до якого додавали 2,35г циклогекбутеніл]-2'-(метансульфоніл)-4-метил-2'силаміну Одержану суміш відстоювали впродовж фенілвалеропдразид 2 годин і одержану тверду речовину відфільтровуРозчин 0,095г (E)-2(R)-[1(S)-[(Terpariflpo-2(RS)вали Згадану тверду речовину суспендували у піранілокси)карбамоіл]-4-феніл-3-бутеніл]-2'етилацетаті і змішували з двома порціями 2М сір(метансульфоніл)-4-метил-2'чаної кислоти з одержанням прозорого розчину фенілвалеропдразиду у суміші Юмл метанолу та Одержаний етил ацетатний розчин ДВІЧІ промива5мл дихлорметану обробляли 0,043мг 4ли водою, потім насиченим розчином хлориду натолуолсульфонової кислоти Одержану суміш петрію з подальшим висушуванням над безводним ремішували впродовж 3 годин при кімнатній темсульфатом магнію Після випарювання згаданого пературі, після чого згаданий розчинник випарюрозчиннику одержали 6,41 г (E)-2(R)-[1 (R)-(TpeTвали Одержаний залишок розподіляли поміж бутоксикарбоніл)-4-феніл-3-бутеніл]-4етилацетатом та водою Етил ацетатний шар су 23 58561 метилвалеріанової кислоти у вигляді твердої речовини блідо-кремового кольору (м) Продукт, який було одержано у частині (і), розчиняли у 50мл сухого тетрапдрофурану, охолоджували до температури -78°С з одночасним перемішуванням і прикраплювали 20,5мл 2М розчину дмзопропіламіду ЛІТІЮ у тетрапдрофурані Після перемішування впродовж 1,75 години при температурі -78°С прикраплювали 8мл метанолу Одержану суміш витримували з поступовим нагріванням до кімнатної температури, після чого перемішували впродовж ночі Тетрапдрофуран випарювали, одержаний залишок розподіляли поміж етилацетатом та 5% розчином лимонної кислоти Одержаний етил ацетатний шар послідовно промивали двома додатковими порціями розчину лимонної кислоти, двома порціями води та насиченим розчином хлориду натрію, після чого сушили над сульфатом магнію Після випарювання одержали масло оранжевого кольору, до складу якого входила суміш 1 (S),2(R) та 1 (R),2(R) ізомерів (Е)-2[1-(трет-бутоксикарбоніл)-4-феніл-3-бутеніл-4метилвалеріанової кислоти Вищезгадану процедуру епімеризацм було повторено тричі з одержанням суміші, значно збагаченої 1(S),2(R) ізомером Одержаний неочищений продукт розчиняли у ЮОмл гексану і одержаний розчин обробляли 1,9г циклогексиламшу Після відстоювання впродовж З годин відфільтровували та сушили сіль, що випала до осаду Одержали 5,53г твердої речовини блідокремового кольору, яку перетворювали на вільну кислоту за допомогою процедури, аналогічній процедурі, опис якої наведено у (і) Одержали 4,36г (Е)-2^)-[1(3)-(трет-бутоксикарбоніл)-4-феніл-3бутеніл]-4-метилвалеріанової кислоти у вигляді твердої речовини жовтого кольору (їм) У спосіб, аналогічний способу, опис якого наведено у Прикладі 1, частина (і), з започаткуванням з 0,7г карбонової кислоти, яку було одержано у частині (м) цього прикладу, одержали 0,466г (Е)-2^)-[1(3)-(трет-бутоксикарбоніл)-4-феніл-3бутеніл]-4-метил-2'-фенілпдразиду у вигляді твердої речовини білого кольору Мас-спектрометрія 437 (М+Н)+ (iv) У спосіб, аналогічний способу, опис якого наведено у Прикладі 1, частини (м) та (мі), з започаткуванням з 0,15г (E)-2(R)-[1 (Б)-(третбутоксикарбоніл)-4-феніл-3-бутеніл]-4-метил-2'фенілвалеропдразиду, одержали 0,14г (E)-2(R)[1(3)карбокси)-4-феніл-3-бутеніл]-2'(метансульфоніл)-4-метил-2'фенілвалеропдразиду у вигляді твердої речовини білого кольору (v) Карбонову кислоту, яку було одержано у попередньому параграфі, розчиняли у Змл диметилформаміду, охолоджували до температури 0°С та послідовно обробляли 0,064г О-(тетрапдро-2НmpaH-2(RS)-in)riflpoKCHnaMiHy та 0,061г пдрохлориду 1-етил-3-(3диметиламшопропіл)карбодиіміду Одержану суміш витримували з нагріванням до кімнатної температури та перемішували впродовж ночі Згаданий розчинник випарювали і одержаний залишок розподіляли поміж 5% розчином лимонної кислоти та етилацетатом Одержаний етилацетатний шар промивали водою, 5% розчином гідрокарбонату 24 натрію та насиченим розчином хлориду натрію, після чого сушили над безводним сульфатом магнію та випарювали Одержану тверду речовину білого кольору змішували з ефіром та відфільтровували з одержанням 0,095г (E)-2(R)-[1 (S)[(тетрапдро-2^3)-піранілокси)карбоніл]-4-феніл-3бутеніл]-2'-(метансульфоніл)-4-метил-2'фенілвалеропдразиду у вигляді порошку білого кольору + Мас-спектрометрія 558 (М+Н) Приклад З Бензил 3-[2(R)-[1(S)-(riflpoKCHKap6aMoin)-4фенілбутил]-4-метилвалерил]-2-фенілкарбазат У спосіб, аналогічний способу, опис якого наведено у першому параграфі Прикладу 2, з започаткуванням з 0,05г бензил 3-[2(R)-[1 (S)[(тетрапдро-2^3)-піранілокси)карбамоіл]-4фенілбутил]-4-метилвалерил]-2-фенілкарбазату, одержали 0,032г бензил 3-[2(R)-[1 (S)(пдроксикарбамоіл)-4-фенілбутил]-4метилвалерил]-2-фенілкарбазату у вигляді твердої речовини блідо-кремового кольору Мас-спектрометрія 532 (М+Н)+ Ядерний магнітний резонанс (d6 диметилсульфоксид при 353К) 10,83 (1Н, синглет), 10,47 (1Н, широкий синглет), 8,62 (1Н, широкий синглет), 7,64 (2Н, мультиплет), 7,54 (7Н, мультиплет), 7,41 (ЗН, мультиплет), 7,33 (1Н, мультиплет), 7,24 (2Н, мультиплет), 5,40 (2Н, синглет), 2,76-2,30 (4Н, мультиплет), 1,75-1,45 (6Н, мультиплет), 1,22 (1Н, мультиплет), 0,97 (ЗН, дублет, 1=7Гц), 0,90 (ЗН, дублет, и=6,5Гц) Високоефективна рідинна хроматографія Градієнтне елюювання за допомогою розчиннику А, який включає 10% розчиннику В, впродовж 5 хвилин, з подальшим підвищенням вмісту розчиннику В до 80% від 10 хвилин до 20 хвилин, швидкість потоку 1мл/хвилину Час утримання 19,71 хвилини Розчинник А Н2О/0,1% TFA (тетрафтороцтова кислота), розчинник В СНзСІ\І/0,085% тетрафтороцтової кислоти Тип колонки HYPERPEP 300А Бензил 3-[2(R)-[1 (S)-[(TeTpariflpo-2(RS)піранілокси)карбамоіл]-4-фенілбутил]-4метилвалерил]-2-фенілкарбазат, який було використано як вихідний матеріал, одержали у наведений далі спосіб (і) 0,5Г 2(R)-[1(S)-(TpeT-6yroKCHKap6oHin 4фенілбутил]-4-метил-2'-фенілвалеропдразиду, який було одержано за описом, який наведено у Прикладі 1, частина (і), розчиняли у Юмл діетилового ефіру та перемішували з Юмл насиченого водного розчину гідрокарбонату натрію та 1,0мл бензилхлороформіату Через 24 години одержаний ефірний шар відокремлювали, промивали насиченим розчином хлориду натрію та сушили над безводним сульфатом магнію Після видалення згаданого розчиннику одержаний залишок очищали гель-хроматографуванням під вакуумом з елююванням сумішшю гексану/етилацетату (9 1) Одержали 0,767г бензил 3-[2(R)-[1 (Б)-(третбутоксикарбоніл)-4-фенілбутил] -4-метилвалерил]2-фенілкарбазату у вигляді твердої речовини білого кольору Мас-спектрометрія 573 (М+Н)+ (м) У спосіб, аналогічний способу, опис якого 25 58561 наведено у Прикладі 2, частина (iv) та (v), з започаткуванням з 0,115г фенілкарбазату, який було одержано у попередньому параграфі, одержали 0,115г бензил 3-[2(R)-[1 (S)-[(TeTpariflpo-2(RS)піранілокси)]-4-фенілбутил]-4-метилвалерил]-2фенілкарбазату у вигляді безбарвної смоли Mac-спектрометрія 616(М+Н) + Приклад 4 2'-ацетил-2(Р)-[1 (3)-(пдроксикарбамоіл)-4фенілбутил]-4-метил-2'-фенілвалеропдразид У спосіб, аналогічний способу, опис якого наведено у першому параграфі Прикладу 2, з започаткуванням з 0,09г 2'-ацетил-2(Р)-[1(3)[(тетрапдро-2(РЗ)-транілокси)карбамоіл]-4фенілбутил]-4-метил-2'-фенілвалеропдразиду, одержали 0,062г 2'-ацетил-2(Р)-[1(3)-[(тетрапдро2-(РЗ)-піранілокси)карбамоіл]-4-фенілбутил]-4метил-2'-фенілвалеропдразиду у вигляді твердої речовини білого кольору Мас-спектрометрія 440 (М+Н)+ Високоефективна рідинна хроматографія Градієнтне елюювання за допомогою розчиннику А, який включає 25% розчиннику В, впродовж 5 хвилин, з подальшим підвищенням вмісту розчиннику В до 60% від 5 хвилин до 20 хвилин, швидкість потоку 1мл/хвилину Час утримання 14,97 хвилини Розчинник А ЬІ2О/0,1% TFA (тетрафтороцтова кислота), розчинник В СНзСІ\І/0,085% тетрафтороцтової кислоти Тип колонки HYPERPEP 300А 2'-aMeTHn-2(R)-[1(S)-[(TeTpariflpo-2(RS)піранілокси)карбамоіл]-4-фенілбутил]-4-метил-2'фенілвалеропдразид, який було використано як вихідний матеріал, одержали у наведений далі спосіб (і) Суміш 0,2г 2(R)-[1(S)-(TpeTбутоксикарбоніл)-4-фенілбутил]-4-метил-2'фенілвалеропдразиду, який було одержано за описом, який наведено у Прикладі 1, частина (і), 0,3мл оцтового ангідриду та 0,35мл Nметилморфоліну у 2мл дихлорметану відстоювали при кімнатній температурі впродовж 3 днів Дихлорметан випарювали і одержаний залишок розподіляли поміж етилацетатом та 5% розчином гідрокарбонату натрію Одержаний етилацетатний розчин промивали 5% розчином гідрокарбонату натрію, водою, 5% розчином лимонної кислоти, водою та насиченим розчином хлориду натрію, після чого сушили над безводним сульфатом магнію Згаданий розчинник випарювали, одержаний залишок очищали гель-хроматографуванням під вакуумом з елююванням сумішшю гексану/етилацетату (1 1) Одержали 0,21 г 2'-ацетил-2^)-[1 (Б)-(третбутоксикарбоніл)-4-фенілбутил]-4-метил-2'фенілвалеропдразиду у вигляді твердої речовини білого кольору Мас-спектрометрія 481 (М+Н)+ (м) У спосіб, аналогічний способу, опис якого наведено у Прикладі 2, частина (iv) та (v), з започаткуванням з 0,21г гідразиду, який було одержано у попередньому параграфі, одержали 0,09г 2'a4eTHn-2(R)-[1(S)-[(TeTpariflpo-2(RS)піранілокси)карбамоіл]-4-фенілбутил]-4-метил-2'фенілвалеропдразиду у вигляді твердої речовини білого кольору Мас-спектрометрія 524 (М+Н)+ 26 Приклад 5 (Е)-2^)-[1(3)-(пдроксикарбамоіл)-4-феніл-3бутеніл]-2'-метансульфоніл)-4-метил-2-(2піридил)валеропдразид У спосіб, аналогічний способу, опис якого наведено у першому параграфі Прикладу 2, з започаткуванням з 0,11г (E)-2(R)-[1 (3)-[(тетрапдро2^3)-піранілокси)карбамоіл]-4-феніл-3-бутеніл]2'-(метансульфоніл)-4-метил-2'-(2піридил)валеропдразиду, одержали, після промивання розчину згаданого продукту у етилацетаті за допомогою 2% водного розчину гідрокарбонату натрію з метою одержання вільної основи, 0,052г (Е)-2^)-[1(3)-(пдрокарбамоіл)-4-феніл-3-бутеніл]2'-(метансульфоніл)-4-метил-2'-(2піридил)валеропдразиду у вигляді твердої речовини білого кольору Мас-спектрометрія 475 (М+Н)+ Ядерний магнітний резонанс (d6 диметилсульфоксид при 353К) 10,86 (1Н, синглет), 10,27 (1Н, широкий синглет), 8,45 (1Н, широкий синглет), 8,35 (1Н, мультиплет), 7,30 (1Н, мультиплет), 7,347,12 (7Н, мультиплет), 6,32 (1Н, дублет, и=15,5Гц), 6,13-6,04 (1Н, мультиплет), 3,51 (ЗН, синглет), 2,79-2,69 (1Н, мультиплет), 2,50-2,30 (ЗН, мультиплет), 1,53-1,50 (2Н, мультиплет), 1,19-1,10 (1Н, мультиплет), 0,91 (ЗН, дублет, и=7,0Гц), 0,83 (ЗН, дублет, 1=6,5Гц) Високоефективна рідинна хроматографія Градієнтне елюювання за допомогою розчиннику А, який включає 10% розчиннику В, впродовж 5 хвилин, з подальшим підвищенням вмісту розчиннику В до 90% від 5 хвилин до 20 хвилин, швидкість потоку 1мл/хвилину Час утримання 16,20 хвилини Розчинник А Н2О/0,1% TFA (тетрафтороцтова кислота), розчинник В СНзСН/0,085% тетрафтороцтової кислоти Тип колонки HYPERPEP 300А (E)-2(R)-[1(S)-[(TeTPariflpo-2(RS)піранілокси)карбамоіл]-4-феніл-3-бутеніл]-2'(метансульфоніл)-4-метил-2'-(2піридил)валеропдразид, який було використано як вихідний матеріал, одержали у наведений далі спосіб У спосіб, аналогічний способу, опис якого наведено у Прикладі 2, частини (III)-(V), з започаткуванням з (E)-2(R)-[1(S)-(TpeT-6yroKCHKap6oHin)-4феніл-3-бутеніл]-4-метилвалеріанової кислоти та 2-пдразинопіридину, одержали (E)-2(R)-[1 (S)(тетрапдро-2^3)-піранілокси)карбамоіл]-4-феніл3-бутеніл]-2'-(метансульфоніл)-4-метил-2'-(2піридил)валеропдразид у вигляді твердої речовини білого кольору Мас-спектрометрія 559 (М+Н)+ Приклад 6 (E)-2'-(2-6eH3OTia3onin)-2(R)-[1(S)(пдроксикарбамоіл)-4-феніл-3-бутеніл]-2'(метансульфоніл)-4-метилвалеропдразид У спосіб, аналогічний способу, опис якого наведено у першому параграфі Прикладу 2, з започаткуванням з 0,086г (E)-2'-(2-6eH3OTia3onin)-2(R)[1(S)-[(TeTpariflpo-2(RS)-mpaHinoKCH)Kap6aMoin]-4феніл-3-бутеніл]-2'-(метансульфоніл)-4метилвалеропдразиду, одержали, після промивання розчину згаданого продукту у етилацетаті за допомогою 2% водного розчину гідрокарбонату 58561 28 27 2-пдразинохіноліну, одержали (E)-2(R)-[1 (S)натрію, 0,045г (Е)-2'-(2-бензотіазоліл)-2(^-[1 (S)[(тетрапдро-2^3)-піранілокси)карбамоіл]-4-феніл(пдроксикарбамоіл)-4-феніл-3-бутеніл]-2'(мета3-бутеніл]-2'-(метансульфоніл)-4-метил-2'-(2нсульфоніл)-4-метилвалеропдразиду у вигляді хшоліл)валеропдразид у вигляді твердої речовини твердої речовини білого кольору білого кольору Мас-спектрометрія 531 (М+Н)+ Високоефективна рідинна хроматографія Приклад 8 Градієнтне елюювання за допомогою розчиннику 1 (E)-2(R)-[1 (3)-(пдроксикарбамоіл)-4-феніл-3А, який включає 5% розчиннику В, впродовж 5 бутеніл]-2'-(метансульфоніл)-2'-(4-метоксифеніл)хвилин, з подальшим підвищенням вмісту розчин4-метилвалеропдразид нику В до 95% від 5 хвилин до 20 хвилин, швидУ спосіб, аналогічний способу, опис якого накість потоку 1мл/хвилину Час утримання 18,16 ведено у першому параграфі Прикладу 2, з запохвилини Розчинник А Н2О/0,1% TFA (тетрафточаткуванням з 0,338г (E)-2(R)-1 (3)-[(тетрапдророцтова кислота), розчинник В СНзСІ\І/0,085% 2^3)-піранілокси)карбамоіл]-4-феніл-3-бутеніл]тетрафтороцтової кислоти Тип колонки HYPER2'-(метансульфоніл)-2'-(4-метоксифеніл)-4PEP 300А метилвалеропдразиду, одержали 0,195г 1(E)-2(R)[1(3)-(пдроксикарбамоіл)-4-феніл-3-бутеніл]-2'(Е)-2'-(2-бензотіазоліл)-2(Р)-[1(3)-(тетрагідро(метансульфоніл)-2'-(4-метоксифеніл)-42^3)-піранілокси)карбамоіл]-4-феніл-3-бутеніл]метилвалеропдразиду у вигляді твердої речовини 2'-(метансульфоніл)-4-метилвалеропдразид, який кремового кольору було використано як вихідний матеріал, одержали у наведений далі спосіб Мас-спектрометрія 504 (М+Н)+ У спосіб, аналогічний способу, опис якого наВисокоефективна рідинна хроматографія ведено у Прикладі 2, частини (III)-(V), з започаткуГрадієнтне елюювання за допомогою розчиннику ванням з (Е)-2(Р)-[1(3)-(трет-бутоксикарбоніл)-4А, який включає 5% розчиннику В, впродовж 5 феніл-3-бутеніл]-4-метилвалеріанової кислоти та хвилин, з подальшим підвищенням вмісту розчин2-пдразинобензотіазолу, одержали (Е)-2'-(2нику В до 95% від 5 хвилин до 20 хвилин, швид6eH3OTia3onin)-2(R)-[1(S)-[(TeTpariflpo-2(RS)кість потоку 1мл/хвилину Час утримання 16,53 піранілокси)карбамоіл]-4-феніл-3-бутеніл]-2'хвилини Розчинник А Н2О/0,01% TFA (тетрафто(метансульфоніл)-4-метилвалеропдразид у вигляроцтова кислота), розчинник В СНзСІ\І/0,085% ді твердої речовини білого кольору тетрафтороцтової кислоти Тип колонки HYPERPEP 300А Приклад 7 (Е)-2^)-[1(3)-(пдроксикарбамоіл)-4-феніл-3(E)-2(R)-1(S)-[(Terpariflpo-2(RS)бутеніл]-2'-(метансульфоніл)-4-метил-2'-(2піранілокси)карбамоіл]-4-феніл-3-бутеніл]-2'хшоліл)валеропдразид (метансульфоніл)-2'-(4-метоксифеніл)-4метилвалеропдразид, який було використано як У спосіб, аналогічний способу, опис якого навихідний матеріал, одержали у наведений далі ведено у першому параграфі Прикладу 2, з запоспосіб чаткуванням з 0,05г (E)-2(R)-[1 (3)-[(тетрапдро2^3)-піранілокси)карбамоіл]-4-феніл-3-бутеніл]У спосіб, аналогічний способу, опис якого на2'-(метансульфоніл)-4-метил-2'-(2ведено у Прикладі 2, частини (III)-(V), з започаткухшоліл)валеропдразиду, одержали, після промиванням з (Е)-2^)-[1(3)-(трет-бутоксикарбоніл)-4вання розчину згаданого продукту у етилацетаті за феніл-3-бутеніл]-4-метилвалеріанової кислоти та допомогою 2% водного розчину гідрокарбонату 4-метоксифенілпдразиду, одержали (E)-2(R)-[1 (S)натрію, 0,026г (E)-2(R)-[1(S)-(riflpoKCHKap6aMoin)-4[(тетрапдро-2^3)-піранілокси)карбамоіл]-4-фенілфеніл-3-бутеніл]-2'-(метансульфоніл)-4-метил-2'3-бутеніл]-2'-(метансул ьфоніл)-2'-(4(2-хшоліл)валеропдразиду у вигляді твердої речометоксифеніл)-4-метилвалеропдразид у вигляді вини білого кольору твердої речовини білого кольору Мас-спектрометрія 524 (М+Н)+ Приклад 9 Високоефективна рідинна хроматографія (Е)-2^)-[1(3)-(пдроксикарбамоіл)-4-феніл-3Градієнтне елюювання за допомогою розчиннику бутеніл]-2'-(метансульфоніл)-4-метил-2'-(2А, який включає 10% розчиннику В, впродовж 5 метилфеніл)валеропдразид хвилин, з подальшим підвищенням вмісту розчинУ спосіб, аналогічний способу, опис якого нанику В до 90% від 5 хвилин до 20 хвилин, швидведено у першому параграфі Прикладу 2, з запокість потоку 1мл/хвилину Час утримання 17,90 чаткуванням з 0,37г (E)-2(R)-[1(S)-[(jeTpanflpo-2хвилини Розчинник А ЬІ2О/0,1% TFA (тетрафто^3)-піранілокси)карбамоіл]-4-феніл-3-бутеніл]-2'роцтова кислота), розчинник В СНзСІ\І/0,085% (метансульфоніл)-4-метил-2'-(2тетрафтороцтової кислоти Тип колонки HYPERметилфеніл)валеропдразиду, одержали 0,192г (Е)PEP 300А 2^)-[1(3)-(пдроксикарбамоіл)-4-феніл-3-бутеніл]2'-(метансульфоніл)-4-метил-2'-(2(E)-2(R)-[1(S)-[(TeTpanflpo-2(RS)метилфеніл)валеропдразиду у вигляді твердої піранілокси)карбамоіл]-4-феніл-3-бутеніл]-2'речовини кремового кольору (метансульфоніл)-4-метил-2'-(2хшоліл)валеропдразид, який було використано як Мас-спектрометрія 488 (М+Н)+ вихідний матеріал, одержали у наведений далі Високоефективна рідинна хроматографія спосіб Градієнтне елюювання за допомогою розчиннику А, який включає 5% розчиннику В з подальшим У спосіб, аналогічний способу, опис якого напідвищенням вмісту розчиннику В до 90% впроведено у Прикладі 2, частини (III)-(V), з започаткудовж 15 хвилин, швидкість потоку 1мл/хвилину ванням з (Е)-2^)-[1(3)-(трет-бутоксикарбоніл)-4Час утримання 12,37 хвилини Розчинник А феніл-3-бутеніл]-4-метилвалеріанової кислоти та 58561 ЗО 29 + ЬІ2О/0,1% TFA (тетрафтороцтова кислота), розМас-спектрометрія 524 (М+Н) чинник В СНзСІ\І/0,085% тетрафтороцтової кислоВисокоефективна рідинна хроматографія ти Тип колонки HYPERPEP 300A Градієнтне елюювання за допомогою розчиннику А, який включає 5% розчиннику В, з подальшим (E)-2(R)-[1(S)-[(TeTpanflpo-2(RS)підвищенням вмісту розчиннику В до 95% впропіранілокси)карбамоіл]-4-феніл-3-бутеніл]-2'довж 15 хвилин, швидкість потоку 1мл/хвилину (метансульфоніл)-4-метил-2'-(2Час утримання 12,83 хвилини Розчинник А метилфеніл)валеропдразид, який було використаЬІ2О/0,1% TFA (тетрафтороцтова кислота), розно як вихідний матеріал, одержали у наведений чинник В СНзСІ\І/0,085% тетрафтороцтової кислодалі спосіб ти Тип колонки HYPERPEP 300A (і) У спосіб, аналогічний способу, опис якого наведено у Прикладі 1, частина (і), з започатку(E)-2(R)-[1(S)-[(TeTPariflpo-2(RS)ванням з 0,7г (Е)-2(Р)-[1(3)-(трет-бутоксикарбоніл)піранілокси)карбамоіл]-4-феніл-3-бутеніл]-2'4-феніл-3-бутеніл]-4-метилвалеріановоі кислоти та (метансульфоніл)-4-метил-2'-(1о-толіл гідразину, одержали 0,5г (E)-2(R)-[1 (S)нафтил)валеропдразид, який було використано як (трет-бутоксикарбоніл)-4-феніл-3-бутеніл]-4вихідний матеріал, одержали у наведений далі метил-2'-(2-метилфеніл)валеропдразиду у вигляді спосіб твердої речовини кремового кольору У спосіб, аналогічний способу, опис якого наведено у Прикладі 9, частини (і)-(ім), з започаткуМас-спектрометрія 451 (М+Н)+ ванням з (E)-2(R)-[1(S)-(TpeT-6yroKCHKap6oHin)-4(м) Розчин 0,15г (E)-2(R)-[1(S)-(TpeTфеніл-3-бутеніл]-4-метилвалеріанової кислоти та бутоксикарбоніл)-4-феніл-3-бутеніл]-4-метил-2'-(21-нафтилпдразину, одержали (E)-2(R)-[1 (S)метилфеніл)валеропдразиду у 5мл дихлорметану [(тетрапдро-2^3)-піранілокси)карбамоіл]-4-фенілобробляли 0,09г піридину та 0,1г метансульфанп3-бутеніл]-2'-(метансульфоніл)-4-метил-2'-(1дриду Після перемішування впродовж 1,5 години нафтил)валеропдразид у вигляді твердої речовидодатково додавали 0,05г піридину та 0,06г метани кремового кольору нсульфанпдриду і одержану суміш додатково перемішували впродовж 2 годин Згаданий розчинМас-спектрометрія 608 (М+Н)+ ник випарювали і одержаний залишок розподіляли Приклад 11 поміж етилацетатом та 5% розчином лимонної (E)-2'-(3-riflpoKCH6eH3Hn)-2(R)-[1(S)кислоти Одержаний етил ацетатний розчин про(пдроксикарбамоіл)-4-феніл-3-бутеніл]-2'мивали водою, 5% розчином гідрокарбонату на(метансульфоніл)-4-метилвалеропдразид трію та насиченим розчином хлориду натрію, після У спосіб, аналогічний способу, опис якого начого сушили над безводним сульфатом магнію ведено у першому параграфі Прикладу 2, з запоПісля випарювання згаданого розчиннику одержачаткуванням з 0,375г (Е)-2'-(3-пдроксибензил)ний залишок очищали гель-хроматографуванням 2(R)-[1(S)-[(TeTpariflpo-2(RS)-mpaHinoKCH)Kap6oHin]під вакуумом з елююванням сумішшю гекса4-феніл-3-бутеніл]-2'-(метансульфоніл)-4ну/етилацетату (6 1) Одержали 0,16г (E)-2(R)метилвалеропдразиду, одержали 0,29г (Е)-2'-(3[1(3)-(трет-бутоксикарбоніл)-4-феніл-3-бутеніл]-2'пдроксибензил)-2^)-[1(3)-(пдроксикарбамоіл)-4(метансульфоніл)-4-метил-2'-(2феніл-3-бутеніл]-2'-(метансульфоніл)-4метилфеніл)валеропдразид у вигляді смоли жовметилвалеропдразиду у вигляді твердої речовини того кольору білого кольору (їм) Гідразид, який було одержано у попереМас-спектрометрія 503 (М+Н)+ дньому параграфі, піддавали обробці за способом, Ядерний магнітний резонанс (d6 диметилсуаналогічним способу, опис якого наведено у Прильфоксид при 353К) 10,23 (1Н, широкий синглет), кладі 1, частина (їм), з подальшою обробкою за 10,09 (1Н, синглет), 8,98 (1Н, синглет), 8,41 (1Н, способом, аналогічним способу, опис якого навеширокий синглет), 7,30 (4Н, мультиплет), 7,18 (1Н, дено у Прикладі 2, частина (v), з одержанням (Е)мультиплет), 7,09 (1Н, мультиплет), 6,83-6,73 (2Н, 2(R)-1 (S)-[(TeTpariflpo-2(RS)мультиплет), 6,67 (1Н, мультиплет), 6,24 (1Н, дубпіранілокси)карбамоіл]-4-феніл-3-бутеніл]-2'лет, J=15,5FL|), 6,05-5,94 (1Н, мультиплет), 4,56(метансульфоніл)-4-метил-2'-(24,48 (2Н, мультиплет), 3,14 (ЗН, синглет), 2,55-2,45 метилфеніл)валеропдразиду у вигляді твердої (1Н, мультиплет), 2,33-2,18 (2Н, мультиплет), 2,16речовини кремового кольору 2,02 (1Н, мультиплет), 1,50-1,40 (1Н, мультиплет), 1,38-1,21 (1Н, мультиплет), 1,05-0,95 (1Н, мультиМас-спектрометрія 572 (М+Н)+ плет), 0,75 (ЗН, дублет, и=7Гц), 0,71 (ЗН, дублет, Приклад 10 (Е)-2^)-[1(3)-(пдроксикарбоніл)-4-феніл-3бутеніл]-2'-(метансульфоніл)-4-метил-2'-(1Високоефективна рідинна хроматографія нафтил)валеропдразид Градієнтне елюювання за допомогою розчиннику У спосіб, аналогічний способу, опис якого наА, який включає 5% розчиннику В, з подальшим ведено у першому параграфі Прикладу 2, з запопідвищенням вмісту розчиннику В до 95% впрочаткуванням з 0,09г (E)-2(R)-[1 (3)-[(тетрапдродовж 15 хвилин, швидкість потоку 1мл/хвилину 2^3)-піранілокси)карбамоіл]-4-феніл-3-бутеніл]Час утримання 10,95 хвилини Розчинник А 2'-(метансульфоніл)-4-метил-2'-(1Н2О/0,1% TFA (тетрафтороцтова кислота), рознафтил)валеропдразиду, одержали 0,053г (Е)чинник В СНзСІ\І/0,085% тетрафтороцтової кисло2^)-[1(3)-(пдроксикарбамоіл)-4-феніл-3-бутеніл]ти Тип колонки HYPERPEP 300A 2'-(метансульфоніл)-4-метил-2'-(1(E)-2'-(3-riflpoKCH6eH3Hn)-2(R)-[1(S)нафтил)валеропдразиду у вигляді твердої речо[(тетрапдро-2^3)-піранілокси)карбоніл]-4-феніл-3вини кремового кольору бутеніл]-2'-(метансульфоніл)-4 58561 32 31 метилвалеропдразид, який було використано як Mac-спектрометрія 519(М+Н) + вихідний матеріал, одержали у наведений далі Високоефективна рідинна хроматографія спосіб Градієнтне елюювання за допомогою розчиннику А, який включає 5% розчиннику В, з подальшим У спосіб, аналогічний способу, опис якого напідвищенням вмісту розчиннику В до 95% впроведено у Прикладі 9, частини (і)-(ш), з започаткудовж 15 хвилин, швидкість потоку 1мл/хвилину ванням з (Е)-2(Р)-[1(3)-(трет-бутоксикарбоніл)-4Час утримання 12,54 хвилини Розчинник А ЬЬО, феніл-3-бутеніл]-4-метилвалеріанової кислоти та розчинник В CH3CN Тип колонки HYPERPEP 3-пдроксибензил гід разину, одержали (Е)-2'-(3300А гідроксибензил)-2(Р)-[1(3)-[(тетрагідро-2(РЗ)піранілокси)карбамоіл]-4-феніл-3-бутеніл]-2'(E)-2(R)-[(TeTpariflpo-2(RS)(метансульфоніл)-4-метилвалеропдразид у вигляпіранілокси)карбамоіл]-4-феніл-3-бутеніл]-2'ді твердої речовини білого кольору (метансульфоніл)-4-метил-2'-(4нітрофеніл)валеропдразид, який було використано Мас-спектрометрія 588 (М+Н)+ як вихідний матеріал, одержали у наведений далі Приклад 12 спосіб (Е)-2'-(2,4-дифторфеніл)-2(Р)-[1(3)(пдроксикарбамоіл)-4-феніл-3-бутеніл]-2'У спосіб, аналогічний способу, опис якого на(метансульфоніл)-4-метилвалеропдразид ведено у Прикладі 2, частини (III)-(V), з започаткуванням з (Е)-2^)-[1(3)-(трет-бутоксикарбоніл)-4У спосіб, аналогічний способу, опис якого нафеніл-3-бутеніл]-4-метилвалеріанової кислоти та ведено у першому параграфі Прикладу 2, з запо4-нітрофеніл гід разину, одержали (E)-2(R)-[1(S)чаткуванням з 0,13г (Е)-2'-(2,4-дифторфеніл)-2(Р)[(тетрапдро-2^3)-піранілокси)карбамоіл]-4-феніл[1(S)-[(TeTpariflpo-2(RS)-mpaHinoKCH)Kap6aMoin]-43-бутеніл]-2'-(метансульфоніл)-4-метил-2'-(4феніл-3-бутеніл]-2-(метансульфоніл)-4нітрофеніл)валеропдразид у вигляді твердої речометилвалеропдразиду, одержали 0,083г (Е)-2'вини жовтого кольору (2,4-дифторфеніл)-2(^)-[1(3)-(пдроксикарбоніл)-4феніл-3-бутеніл]-2'-(метансульфоніл)-4Приклад 14 метилвалеропдразиду у вигляді твердої речовини (Е)-2'-ацетил-2^)-[1(3)-(пдроксикарбамоіл)-4білого кольору феніл-3-бутеніл]-4-метил-2'-(2піридил)валеропдразид Mac-спектрометрія 510(М+Н) + Високоефективна рідинна хроматографія У спосіб, аналогічний способу, опис якого наГрадієнтне елюювання за допомогою розчиннику ведено у першому параграфі Прикладу 2, з запоА, який включає 5% розчиннику В, з подальшим чаткуванням з 0,1г (E)-2'-aL(e™i-2(R)-[1(S)підвищенням вмісту розчиннику В до 95% впро[(тетрапдро-2^3)-піранілокси)карбамоіл]-4-фенілдовж 15 хвилин, швидкість потоку 1мл/хвилину 3-бутеніл]-4-метил-2'-(2-піридил)валеропдразиду, Час утримання 12,37 хвилини Розчинник А одержали, після промивання розчину згаданого ЬІ2О/0,1% TFA (тетрафтороцтова кислота), розпродукту у етилацетаті за допомогою 2' водного чинник В СНзСІ\І/0,085% тетрафтороцтової кислорозчину гідрокарбонату натрію з метою одержання та Тип колонки HYPERPEP 300A вільної основи, 0,035г (E)-2'-aqeTHn-2(R)-[1(S)(пдроксикарбамоіл)-4-феніл-3-бутеніл]-4-метил-2'(Е)-2'-(2,4-дифторфеніл)-2(Р)-[1(3)(2-піридил)валеропдразиду у вигляді твердої ре[(тетрапдро-2(РЗ)-піранілокси)карбамоіл]-4-фенілчовини кремового кольору 3-бутеніл] -2'(метансульфоніл)-4метилвалеропдразид, який було використано як Мас-спектрометрія 439 (М+Н)+ вихідний матеріал, одержали у наведений далі Високоефективна рідинна хроматографія спосіб Градієнтне елюювання за допомогою розчиннику А, який включає 5% розчиннику В, впродовж 5 У спосіб, аналогічний способу, опис якого нахвилин, з подальшим підвищенням вмісту розчинведено у Прикладі 2, частини (III)-(V), з започаткунику В до 95% від 5 хвилин до 20 хвилин, швидванням з (Е)-2(Р)-[1(3)-(трет-бутоксикарбоніл)-4кість потоку 1мл/хвилину Час утримання 15,67 феніл-3-бутеніл]-4-метилвалеріанової кислоти та хвилини Розчинник А Н2О/0,1% TFA (тетрафто2,4-дифторфеніл гід разину, одержали (Е)-2'-(2,4роцтова кислота), розчинник В СНзСІ\І/0,085% дифторфеніл)-2^)-[1(3)[(тетрапдро-2^3)тетрафтороцтової кислоти Тип колонки HYPERпіранілокси)карбамоіл]-4-феніл-3-бутеніл]-2'PEP 300А (метансульфоніл)-4-метилвалеропдразид у вигляді твердої речовини білого кольору (E)-2'-a4e™i-2(R)-[1(S)-[(TeTpariflpo-2(RS)піранілокси)карбамоіл]-4-феніл-3-бутеніл]-4Приклад 13 метил-2'-(2-піридил)валеропдразид, який було (Е)-2(Р)-[1(3)-(пдроксикарбамоіл)-4-феніл-3використано як вихідний матеріал, одержали у бутеніл]-2'-(метансульфоніл)-4-метил-2'-(4наведений далі спосіб нітрофеніл)валеропдразид У спосіб, аналогічний способу, опис якого наУ спосіб, аналогічний способу, опис якого наведено у першому параграфі Прикладу 2, з заповедено у Прикладі 4, частини (і) та (м), з започатчаткуванням з 0,1г (E)-2(R)-[(jeTpanflpo-2(RS)куванням з (E)-2(R)-[1(S)-(TpeT-6yroKCHKap6oHin)-4піранілокси)карбамоіл]-4-феніл-3-бутеніл]-2'феніл-3-бутеніл]-4-метил-2'-(2(метансульфоніл)-4-метил-2'-(4піридил)валеропдразиду, одержали (Е)-2'-ацетилнітрофеніл)валеропдразиду, одержали 0,06г (Е)2(R)-[1 (S)-[(TeTpariflpo-2(RS)2(Р)-[1(3)-(пдроксикарбамоіл)-4-феніл-3-бутеніл]піранілокси)карбамоіл]-4-феніл-3-бутеніл]-42'-(метансульфоніл)-4-метил-2'-(4-нітрофеніл)метил-2'-(2-піридил)валеропдразид у вигляді твевалеропдразиду у вигляді твердої речовини жоврдої речовини білого кольору того кольору Приклад 15 58561 34 33 (Е)-2(Р)-[1(3)-(пдроксикарбамоіл)-4-феніл-3бутоксикарбоніл)-4-феніл-3-бутеніл]-4бутенід]-2'-(метансульфоніл)-2',4метилвалеропдразиду, одержали 2,83г (E)-2(R)диметилвалеропдразид [1(S)-[(TeTpariflpo-2(RS)-mpaHinoKCH)Kap6aMoin]-4феніл-3-бутеніл]-2'-(метансульфоніл)-4У спосіб, аналогічний способу, опис якого наметилвалеропдразиду у вигляді твердої речовини ведено у першому параграфі Прикладу 2, з запобілого кольору чаткуванням з 0,122г (E)-2(R)-[1 (3)-[(тетрапдро+ 2(РЗ)-піранілокси)карбамоіл]-4-феніл-3-бутеніл]-2Мас-спектрометрія 482 (М+Н) (метансульфоніл)-2',4-диметилвалеропдразиду, (їм) РОЗЧИН 0,34Г гідразиду, який було одержаодержали 0,033г (E)-2(R)-[1 (S)но у частині (м), у 7мл диметилформаміду обробляли 0,126г метилйодиду та 0,293г безводного (пдроксикарбамоіл)-4-феніл-3-бутеніл]-2'карбонату калію Одержану суміш перемішували (метансульфоніл)-2',4-диметилвалеропдразиду у при кімнатній температурі впродовж 3 годин і леткі вигляді твердої речовини майже білого кольору + речовини видаляли випарюванням Одержаний Mac-спектрометрія 412(М+Н) залишок розподіляли поміж етилацетатом та 5% Ядерний магнітний резонанс (сіє диметилсурозчином лимонної кислоти Одержану етил ацельфоксид) 10,56 (1Н, синглет), 10,46 (1Н, сингтатну фазу промивали водою та насиченим розчилет), 8,75 (1Н, синглет), 7,35-7,25 (4Н, мультином хлориду натрію, після чого сушили над безвоплет), 7,23-7,15 (1Н, мультиплет), 6,31 (1Н, дним сульфатом магнію Після випарювання дублет, J=15,5riO, 6,10-6,00 (1Н, мультиплет), 3,06 згаданого розчиннику одержаний залишок очища(ЗН, синглет), 3,04 (ЗН, синглет), 2,55-2,45 (1Н, ли гель-хроматографуванням під вакуумом з елюмультиплет), 2,37 (ЗН, мультиплет), 1,54-1,36 (2Н, юванням спочатку сумішшю гексану/етилацетату мультиплет), 1,02-0,93 (1Н, мультиплет), 0,84 (ЗН, (41), потім сумішшю гексану/етилацетату (21) дублет, и=7Гц), 0,81 (ЗН, дублет, и=7,5Гц) Одержали 0,122г (E)-2(R)-[1(S)-[(TeTpariflpo-2(RS)Високоефективна рідинна хроматографія піранілокси)карбамоіл]-4-феніл-3-бутеніл]-2'Градієнтне елюювання за допомогою розчиннику (метансульфоніл)-2',4-диметилвалеропдразиду у А, який включає 10% розчиннику В, впродовж 5 вигляді твердої речовини білого кольору хвилин, з подальшим підвищенням вмісту розчиннику В до 90% від 5 хвилин до 20 хвилин, швидкість потоку 1мл/хвилину Час утримання 14,72 хвилини Розчинник А Н2О/0,1% TFA (тетрафтороцтова кислота), розчинник В СНзСІ\І/0,085% тетрафтороцтової кислоти Тип колонки HYPERPEP 300А (E)-2(R)-[1(S)-[(TeTPariflpo-2(RS)піранілокси)карбамоіл]-4-феніл-3-бутеніл]-2(метансульфоніл)-2',4-диметилвалеропдразид, який було використано як вихідний матеріал, одержали у наведений далі спосіб (і) Суміш 11г пентафторфенолу та 4,12г 1,3дициклогексилкарбодиіміду у 50мл гексану перемішували при кімнатній температурі впродовж 5 хвилин Одержану тверду речовину відфільтровували, промивали гексаном, сушили, після чого додавали до розчину 5,0г (E)-2(R)-[1 (S)-(TpeTбутоксикарбоніл-4-феніл-3-бутеніл]-4метилвалеріанової кислоти у 50мл диметоксиетану Одержану суміш відстоювали при температурі 4°С впродовж ночі, після чого фільтрували з метою видалення дициклогексилсечовини Одержаний фільтрат випарювали, залишок розчиняли у 50мл дихлорметану і до одержаного розчину додавали Змл гідрату гідразину Одержану суміш перемішували впродовж 6 годин, після чого послідовно промивали 5% розчином лимонної кислоти, насиченим розчином гідрокарбонату натрію, водою та насиченим розчином хлориду натрію, сушили над безводним сульфатом магнію та випарювали Одержаний залишок змішували з сумішшю гексану/етилацетату (4 1) і одержану тверду речовину відфільтровували Одержали 4,68г (E)-2(R)-[1 (3)-(трет-бутоксикарбоніл)-4феніл-3-бутеніл]-4-метилвалеропдразиду у вигляді твердої речовини майже білого кольору Мас-спектрометрія 361 (М+Н)+ (м) У спосіб, аналогічний способу, опис якого наведено у Прикладі 9, частини (м) та (мі), з започаткуванням з 8,96г (E)-2(R)-[1 (Б)-(трет Приклад 16 (Е)-2^)-[1(3)-(пдроксикарбамоіл)-4-феніл-3бутеніл]-2'-(метансульфоніл)-4метилвалеропдразид У спосіб, аналогічний способу, опис якого наведено у першому параграфі Прикладу 2, з започаткуванням з 0,151г (E)-2(R)-[1 (3)-[(тетрапдро2^3)-піранілокси)карбамоіл]-4-феніл-3-бутеніл]2'-(метансульфоніл)-4-метилвалеропдразиду, одержали 0,06г (E)-2(R)-[1(S)-(riflpoKCHKap6aMoin)4-феніл-3-бутеніл]-2'-(метансульфоніл)-4метилвалеропдразиду у вигляді твердої речовини майже білого кольору Мас-спектрометрія 398 (М+Н)+ Ядерний магнітний резонанс (d6 диметилсульфоксид) 10,55 (1Н, синглет), 10,34 (1Н, синглет), 9,52 (1Н, синглет), 8,85 (1Н, синглет), 7,367,25 (4Н, мультиплет), 7,23-7,16 (1Н, мультиплет), 6,30 (1Н, дублет, J=15,5I~4), 6,08-5,98 (1Н, мультиплет), 2,96 (ЗН, синглет), 2,56-2,46 (1Н, мультиплет), 2,39-2,13 (ЗН, мультиплет), 1,53-1,33 (2Н, мультиплет), 1,01-0,93 (1Н, мультиплет), 0,83 (ЗН, дублет, и=6,5Гц), 0,80 (ЗН, дублет, и=7Гц) Високоефективна рідинна хроматографія Градієнтне елюювання за допомогою розчиннику А, який включає 10% розчиннику В, впродовж 5 хвилин, з подальшим підвищенням вмісту розчиннику В до 90% від 5 хвилин до 20 хвилин, швидкість потоку 1мл/хвилину Час утримання 14,13 хвилини Розчинник А Ь-І2О/0,1% TFA (тетрафтороцтова кислота), розчинник В СНзСІ\І/0,085% тетрафтороцтової кислоти Тип колонки HYPERPEP 300А Приклад 17 (E)-2'-6eH3Hn-2(R)-[1(S)-(riflpoKCHKap6aMoin)-4феніл-3-бутеніл]-2'-(метансульфоніл)-4метилвалеропдразид У спосіб, аналогічний способу, опис якого наведено у першому параграфі Прикладу 2, з започаткуванням з 0,183г (E)-2'-6eH3nn-2(R)-[1(S) 58561 36 35 [(тетрапдро-2^3)-піранілокси)карбамоіл]-4-фенілметилвалеропдразид, який було використано як 3-бутеніл]-2'-(метансульфоніл)-4вихідний матеріал, одержали у спосіб, аналогічний метилвалеропдразиду, одержали 0,142г (Е)-2'способу, опис якого наведено у Прикладі 15, часбензил-2(Р)-[1(3)-(пдроксикарбамоіл)-4-феніл-3тина (їм), З започаткуванням з (E)-2(R)-[1(S)бутеніл]-2'-(метансульфоніл)-4[(тетрапдро-2^3)-піранілокси)карбамоіл]-4-фенілметилвалеропдразиду у вигляді твердої речовини 3-бутеніл]-2'-(метансульфоніл)-4майже білого кольору метилвалеропдразиду, шляхом реагування з 4+ метоксибензилбромідом Мас-спектрометрія 488 (М+Н) Ядерний магнітний резонанс (сіє диметилсуПриклад 19 льфоксид при 353К) 10,22 (1Н, широкий синглет), (E)-2'-anin-2(R)-[1(S)-(riflpoKCHKap6aMoin)-410,1 (1Н, синглет), 8,40 (1Н, широкий синглет), феніл-3-бутеніл]-2'-(метансульфоніл)-47,40-7,24 (9Н, мультиплет), 7,22-7,15 (1Н, мультиметилвалеропдразид плет), 6,23 (1Н, дублет, J=15f4), 6,05-5,94 (1Н, У спосіб, аналогічний способу, опис якого намультиплет), 4,63 (2Н, мультиплет), 3,15 (ЗН, синведено у першому параграфі Прикладу 2, з запоглет), 2,54-2,44 (1Н, мультиплет), 2,31-2,17 (2Н, чаткуванням з 0,168г (E)-2'-anin-2(R)-[1(S)мультиплет), 2,14-2,01 (1Н, мультиплет), 1,51-1,49 [(тетрапдро-2^3)-піранілокси)карбамоіл]-4-феніл(1Н, мультиплет), 1,34-1,18 (1Н, мультиплет), 1,043-бутеніл]-2'-(метансульфоніл)-40,95 (1Н, мультиплет), 0,74 (ЗН, дублет, J=6,5I~M), метилвалеропдразиду, одержали 0,013г (Е)-2'0,70 (ЗН, дублет, и=7,0Гц) аліл-2^)-[1(3)-(пдроксикарбамоіл)-4-феніл-3бутеніл]-2'-(метансульфоніл)-4Високоефективна рідинна хроматографія метилвалеропдразиду у вигляді твердої речовини Градієнтне елюювання за допомогою розчиннику білого кольору А, який включає 5% розчиннику В, з подальшим підвищенням вмісту розчиннику В до 95% впроМас-спектрометрія 438 (М+Н)+ довж 15 хвилин, швидкість потоку 1мл/хвилину Ядерний магнітний резонанс (d6 диметилсуЧас утримання 12,18 хвилини Розчинник А льфоксид при 353К) 10,26 (1Н, широкий синглет), Н2О/0,1% TFA (тетрафтороцтова кислота), роз10,08 (1Н, синглет), 8,44 (1Н, широкий синглет), чинник В СНзСІ\І/0,085% тетрафтороцтової кисло7,35-7,25 (4Н, мультиплет), 7,22-7,15 (1Н, мультити Тип колонки HYPERPEP 300A плет), 6,33 (1Н, дублет, и=15,5Гц), 6,13-6,03 (1Н, мультиплет), 5,90-5,78 (1Н, мультиплет), 5,28 (1Н, (E)-2'-6eH3Hn-2(R)-[1(S)-[(TeTpariflpo-2(RS)мультиплет), 5,18 (1Н, мультиплет), 4,05 (1Н, мупіранілокси)карбамоіл]-4-феніл-3-бутеніл]-2'льтиплет), 3,06 (ЗН, синглет), 2,63-2,53 (1Н, муль(метансульфоніл)-4-метилвалеропдразид, який типлет), 2,44-2,25 (ЗН, мультиплет), 1,59-1,45 (2Н, було використано як вихідний матеріал, одержали мультиплет), 1,14-1,03 (1Н, мультиплет), 0,85 (ЗН, у спосіб, аналогічний способу, опис якого наведедублет, и=7Гц), 0,82 (ЗН, дублет, и=6,5Гц) но у Прикладі 15, частина (їм), з започаткуванням з (E)-2(R)-[1(S)-[(TeTpanflpo-2(RS)Високоефективна рідинна хроматографія піранілокси)карбамоіл]-4-феніл-3-бутеніл]-2'Градієнтне елюювання за допомогою розчиннику (метансульфоніл)-4-метилвалеропдразиду, шляА, який включає 5% розчиннику В, з подальшим хом реагування з бензилбромідом підвищенням вмісту розчиннику В до 95% впродовж 15 хвилин, швидкість потоку 1 мл/хвилину Приклад 18 Час утримання 11,36 хвилини Розчинник А (Е)-2^)-[1(3)-(пдроксикарбамоіл)-4-феніл-3Н2О/0,1% TFA (тетрафтороцтова кислота), розбутеніл]-2'-(метансульфоніл)-2'-метоксибензил)-4чинник В СНзСІ\І/0,085% тетрафтороцтової кислометилвалеропдразид ти Тип колонки HYPERPEP 300A У спосіб, аналогічний способу, опис якого наведено у першому параграфі Прикладу 2, з запо(E)-2'-anin-2(R)-[1(S)-[(TeTpariflpo-2(RS)чаткуванням з 0,105г (E)-2(R)-[1 (3)-[(тетрапдропіранілокси)карбамоіл]-4-феніл-3-бутеніл]-2'2^3)-піранілокси)карбамоіл]-4-феніл-3-бутеніл](метансульфоніл)-4-метилвалеропдразид, який 2'-(метансульфоніл)-2'-(4-метоксибензил)-4було використано як вихідний матеріал, одержали метилвалеропдразиду, одержали 0,061г (E)-2(R)у спосіб, аналогічний способу, опис якого наведе[1(3)-(пдроксикарбамоіл)-4-феніл-3-бутеніл]-2'но у Прикладі 15, частина (їм), з започаткуванням з (метансульфоніл)-2'-(4-метоксибензил)-4(E)-2(R)-[1(S)-[(TeTpanflpo-2(RS)метилвалеропдразиду у вигляді твердої речовини транілокси)карбамоіл]-4-феніл-3-бутеніл]-2'білого кольору (метансульфоніл)-4-метилвалеропдразиду, шляхом реагування з алілбромідом Mac-спектрометрія 518(М+Н) + Високоефективна рідинна хроматографія Приклад 20 Градієнтне елюювання за допомогою розчиннику (E)-2'-(4-6poM6eH3Hn)-2(R)-[1(S)А, який включає 35% розчиннику В, впродовж 5 (пдроксикарбамоіл)-4-феніл-3-бутеніл]-2'хвилин, з подальшим підвищенням вмісту розчин(метансульфоніл)-4-метилвалеропдразид нику В до 85% від 5 хвилин до 20 хвилин, швидУ спосіб, аналогічний способу, опис якого накість потоку 1 мл/хвилину Час утримання 7,20 ведено у першому параграфі Прикладу 2, з запохвилини Розчинник А Н2О/0,1% TFA (тетрафточаткуванням з 0,215г (E)-2-(4-6poM6eH3Hn)-2(R)роцтова кислота), розчинник В СНзСІ\І/0,085% [1(S)-[(TeTpariflpo-2(RS)-mpaHinoKCH)Kap6aMoin]-4тетрафтороцтової кислоти Тип колонки HYPERфеніл-3-бутеніл]-2'-(метансульфоніл)-4PEP 300А метилвалеропдразиду, одержали 0,147г (Е)-2'-(4бромбензил) -2(R)- [ 1 (3)-(пдроксикарбамоіл)-4(E)-2(R)-[1(S)-[(TeTpanflpo-2(RS)феніл-3-бутеніл] -2'-(метансульфоніл)-4піранілокси)карбамоіл]-4-феніл-3-бутеніл]-2'(метансульфоніл)-2'-(4-метоксибензил)-4метилвалеропдразиду у вигляді твердої речовини 58561 38 37 білого кольору 2^)-[1(3)-(пдроксикарбамоіл)-4-феніл-3-бутеніл]2'-(метансульфоніл)-4-метил-2'Mac-спектрометрія 566/568 (М+Н)+ пропарплвалеропдразиду у вигляді твердої речоВисокоефективна рідинна хроматографія вини білого кольору Градієнтне елюювання за допомогою розчиннику А, який включає 5% розчиннику В, з подальшим Мас-спектрометрія 436 (М+Н)+ підвищенням вмісту розчиннику В до 95% впроЯдерний магнітний резонанс (d6 диметилсудовж 15 хвилин, швидкість потоку 1мл/хвилину льфоксид) 10,57 (1Н, синглет), 10,54 (1Н, сингЧас утримання 12,90 хвилини Розчинник А лет), 8,84 (1Н, широкий синглет), 7,35-7,25 (4Н, ЬІ2О/0,1% TFA (тетрафтороцтова кислота), розмультиплет), 7,22-7,16 (1Н, мультиплет), 6,30 (1Н, чинник В СНзСг\І/0,085% тетрафтороцтової кислодублет, J=15,5riO, 6,09-5,99 (1Н, мультиплет), ти Тип колонки HYPERPEP 300A 4,32-4,17 (2Н, мультиплет), 3,44 (1Н, синглет), 3,11 (ЗН, синглет), 2,63-2,54 (1Н, мультиплет), 2,41-2,17 (E)-2'-(4-6poM6eH3m-|)-2(R)-[1(S)-[(TeTpariflpo(ЗН, мультиплет), 1,56-1,41 (2Н, мультиплет), 1,032(РЗ)-піранілокси)карбамоіл]-4-феніл-3-бутеніл]0,93 (1Н, мультиплет), 0,85 (ЗН, дублет, и=7,0Гц), 2'-(метансульфоніл)-4-метилвалеропдразид, який 0,81 (ЗН, дублет, и=6,5Гц) було використано як вихідний матеріал, одержали у спосіб, аналогічний способу, опис якого наведеВисокоефективна рідинна хроматографія но у Прикладі 15, частина (їм), з започаткуванням з Градієнтне елюювання за допомогою розчиннику (E)-2(R)-[1(S)-[(TeTpanflpo-2(RS)А, який включає 40% розчиннику В, з подальшим піранілокси)карбамоіл]-4-феніл-3-бутеніл]-2'підвищенням вмісту розчиннику В до 60% впро(метансульфоніл)-4-метилвалеропдразиду, шлядовж 15 хвилин, швидкість потоку 1мл/хвилину хом реагування з 4-бромбензилбромідом Час утримання 11,04 хвилини Розчинник А Н2О/0,1% TFA (тетрафтороцтова кислота), розПриклад 21 чинник В СНзСІ\І/0,085% тетрафтороцтової кисло(Е)-2(Р)-[1(3)-(пдроксикарбамоіл)-4-феніл-3та Тип колонки HYPERPEP 300A бутеніл]-2'-(метансульфоніл)-4-метил-2'-(4нітробензил)валеропдразид (E)-2(R)-[1(S)-[(TeTpanflpo-2(RS)піранілокси)карбамоіл]-4-феніл-3-бутеніл]-2'У спосіб, аналогічний способу, опис якого на(метансульфоніл)-4-метил-2'ведено у першому параграфі Прикладу 2, з запопропарплвалеропдразид, який було використано чаткуванням з 0,159г (E)-2(R)-[1 (3)-[(тетрапдрояк вихідний матеріал, одержали у спосіб, аналогіч2(РЗ)-піранілокси)карбамоіл]-4-феніл-3-бутеніл]ний способу, опис якого наведено у Прикладі 15, 2'-(метансульфоніл)-4-метил-2'-(4частина (їм), з започаткуванням з (E)-2(R)-[1(S)нітробензил)валеропдразиду, одержали 0,085г [(тетрапдро-2^3)-піранілокси)карбамоіл]-4-феніл(Е)-2(Р)-[1(3)-(пдроксикарбамоіл)-4-феніл-33-бутеніл]-2'-(метансульфоніл)-4бутеніл]-2'-(метансульфоніл)-4-метил-2'-(4метилвалеропдразиду, шляхом реагування з 4нітробензил)валеропдразиду у вигляді твердої пропарплбромідом речовини білого кольору Мас-спектрометрія 533 (М+Н)+ Приклад 23 Високоефективна рідинна хроматографія (Е)-2'-(ціанометил)-2^)-[1 (S)Градієнтне елюювання за допомогою розчиннику (пдроксикарбамоіл)-4-феніл-3-бутеніл]-2'А, який включає 5% розчиннику В, з подальшим (метансульфоніл)-4-метилвалеропдразид підвищенням вмісту розчиннику В до 95% впроУ спосіб, аналогічний способу, опис якого надовж 15 хвилин, швидкість потоку 1мл/хвилину ведено у першому параграфі Прикладу 2, з запоЧас утримання 12,14 хвилини Розчинник А чаткуванням з 0,18г (Е)-2'-(ціанометил)-2^)-[1(3)ЬІ2О/0,1% TFA (тетрафтороцтова кислота), роз[(тетрапдро-2^3)-піранілокси)карбамоіл]-4-фенілчинник В СНзСІ\І/0,085% тетрафтороцтової кисло3-бутеніл]-2'-(метансульфоніл)-4ти Тип колонки HYPERPEP 300A метилвалеропдразиду, одержали 0,124г (Е)-2'(ціанометил)-2^)-[(3)-(пдроксикарбамоіл)-4(E)-2(R)-[1(S)-[(TeTpanflpo-2(RS)феніл-3-бутеніл]-2'-(метансульфоніл)-4піранілокси)карбамоіл]-4-феніл-3-бутеніл]-2'метилвалеропдразиду у вигляді твердої речовини (метансульфоніл)-4-метил-2'-(4білого кольору нітробензил)валеропдразид, який було використано як вихідний матеріал, одержали у спосіб, анаМас-спектрометрія 437 (М+Н)+ логічний способу, опис якого наведено у Прикладі Ядерний магнітний резонанс (d6 диметилсу15, частина (їм), з започаткуванням з (E)-2(R)-[1 (S)льфоксид) 10,94 (1Н, синглет), 10,56 (1Н, синг[(тетрапдро-2^3)-піранілокси)карбамоіл]-4-феніллет), 8,56 (1Н, широкий синглет), 7,37-7,25 (4Н, 3-бутеніл]-2'-(метансульфоніл)-4мультиплет), 7,23-7,15 (1Н, мультиплет), 6,33 (1Н, метилвалеропдразиду, шляхом реагування з 4дублет, J=15,5FL|), 6,10-5,99 (1Н, мультиплет), 4,65 нітробензилбромідом (2Н, мультиплет), 3,17 (ЗН, синглет), 2,61-2,52 (1Н, мультиплет), 2,40-2,19 (ЗН, мультиплет), 1,55-1,41 Приклад 22 (2Н, мультиплет), 1,06-0,95 (1Н, мультиплет), 0,85 (Е)-2^)-[1(3)-(пдроксикарбамоіл)~4-феніл-3(ЗН, дублет, и=7Гц), 0,82 (ЗН, дублет, и=6,5Гц) бутеніл]-2'-(метансульфоніл)-4-метил-2'пропарплвалеропдразид Високоефективна рідинна хроматографія Градієнтне елюювання за допомогою розчиннику У спосіб, аналогічний способу, опис якого наА, який включає 5% розчиннику В, з подальшим ведено у першому параграфі Прикладу 2, з запопідвищенням вмісту розчиннику В до 95% впрочаткуванням з 0,13г (E)-2(R)-[1 (3)-[(тетрапдродовж 15 хвилин, швидкість потоку 1мл/хвилину 2^3)-піранілокси)карбамоіл]-4-феніл-3-бутеніл]Час утримання 10,90 хвилини Розчинник А 2'-(метансульфоніл)-4-метил-2'Н2О/0,1% TFA (тетрафтороцтова кислота), розпропарплвалеропдразиду, одержали 0,04г (Е) 58561 40 39 чинник В СНзСІ\І/0,085% тетрафтороцтової кислоплет), 7,22-7,15 (1Н, мультиплет), 6,30 (1Н, дубти Тип колонки HYPERPEP 300A лет, J=15,5FL|), 6,06-5,96 (1Н, мультиплет), 5,30 (2Н, синглет), 3,16 (ЗН, синглет), 2,56-2,43 (1Н, (Е)-2'-(ціанометил)-2(Р)-[1(3)-[(тетрапдромультиплет), 2,40-2,21 (ЗН, мультиплет), 1,60-1,40 2^3)-піранілокси)карбамоіл]-4-феніл-3-бутеніл](2Н, мультиплет), 1,10-0,99 (1Н, мультиплет), 0,80 2'-(метансульфоніл)-4-метилвалеропдразид, який (ЗН, дублет, и=6,5Гц), 0,77 (ЗН, дублет, и=7,0Гц) було використано як вихідний матеріал, одержали у спосіб, аналогічний способу, опис якого наведеВисокоефективна рідинна хроматографія но у Прикладі 15, частина (їм), з започаткуванням з Градієнтне елюювання за допомогою розчиннику (E)-2(R)-[1(S)-[(TeTpanflpo-2(RS)А, який включає 5% розчиннику В, з подальшим піранілокси)карбамоіл]-4-феніл-3-бутеніл]-2'підвищенням вмісту розчиннику В до 95% впро(метансульфоніл)-4-метилвалеропдразиду, шлядовж 15 хвилин, швидкість потоку 1мл/хвилину хом реагування з бромацетонітрилом Час утримання 12,03 хвилини Розчинник А Н2О/0,1% TFA (тетрафтороцтова кислота), розПриклад 24 чинник В СНзСІ\І/0,085% тетрафтороцтової кисло(Е)-2(Р)-[1(3)-(пдроксикарбамоіл)-4-феніл-3ти Тип колонки HYPERPEP 300A бутеніл]-2'-(метансульфоніл)-4-метил-2'-(2фенілетил)валеропдразид (E)-2(R)-[1(S)-[(TeTpanflpo-2(RS)піранілокси)карбамоіл]-4-феніл-3-бутеніл]-2'У спосіб, аналогічний способу, опис якого на(метансульфони1)-4-метил-2'ведено у першому параграфі Прикладу 2, з запо(фталімідометил)валеропдразид, який було викочаткуванням з 0,158г (E)-2(R)-[1 (3)-[(тетрапдрористано як вихідний матеріал, одержали у спосіб, 2(РЗ)-піранілокси)карбамоіл]-4-феніл-3-бутеніл]аналогічний способу, опис якого наведено у При2'-(метансульфоніл)-4-метил-2'-(2кладі 15, частина (мі), з започаткуванням з (E)-2(R)фенілетил)валеропдразиду, одержали 0,093г (Е)[1(S)-[(TeTpariflpo-2(RS)-mpaHinoKCH)Kap6aMoin]-42(Р)-[1(3)-(пдроксикарбамоіл)-4-феніл-3-бутеніл]феніл-3-бутеніл]-2'-(метансульфоніл)-42'-метансульфоніл)-4-метил-2'-(2метилвалеропдразиду, шляхом реагування з N-2фенілетил)валеропдразиду у вигляді твердої ребромметилфталімідом човини білого кольору Мас-спектрометрія 502 (М+Н)+ Високоефективна рідинна хроматографія Градієнтне елюювання за допомогою розчиннику А, який включає 5% розчиннику В, з подальшим підвищенням вмісту розчиннику В до 95% впродовж 15 хвилин, швидкість потоку 1мл/хвилину Час утримання 12,90 хвилини Розчинник А ЬІ2О/0,1% TFA (тетрафтороцтова кислота), розчинник В СНзСІ\І/0,085% тетрафтороцтової кислоти Тип колонки HYPERPEP 300A (E)-2(R)-[1(S)-[(TeTpanflpo-2(RS)піранілокси)карбамоіл]-4-феніл-3-бутеніл]-2'(метансульфоніл)-4-метил-2'-(2фенілетил)валеропдразид, який було використано як вихідний матеріал, одержали у спосіб, аналогічний способу, опис якого наведено у Прикладі 15, частина (їм), з започаткуванням з (E)-2(R)-[1(S)[(тетрапдро-2^3)-піранілокси)карбамоіл]-4-феніл3-бутеніл]-2'-(метансульфоніл)-4метилвалеропдразиду, шляхом реагування з 2брометил-бензолом Приклад 25 (Е)-2^)-[1(3)-(пдроксикарбамоіл)-4-феніл-3бутеніл]-2'-(метансульфоніл)-4-метил-2'(фталімідометил)валеропдразид У спосіб, аналогічний способу, опис якого наведено у першому параграфі Прикладу 2, з започаткуванням з 0,187г (E)-2(R)-[1(S)-[(TeTpariflpo2^3)-піранілокси)карбамоіл]-4-феніл-3-бутеніл]2'-(метансульфоніл)-4-метил-2'(фталімідометил)валеропдразиду, одержали 0,127г (E)-2(R)-[1(S)-(riflpoKCHKap6aMoin)-4-qbeHin3-бутеніл]-2'-(метансульфоніл)-4-метил-2'(фталімідометил)валеропдразиду у вигляді твердої речовини білого кольору Мас-спектрометрія 557 (М+Н)+ Ядерний магнітний резонанс (d6 диметилсульфоксид при 353К) 10,18 (1Н, широкий синглет), 10,13 (1Н, синглет), 8,40 (1Н, широкий синглет), 7,92-7,82 (4Н, мультиплет), 7,32-7,25 (4Н, мульти Приклад 26 (Е)-2^)-[1(3)-(пдроксикарбамоіл)-4-феніл-3бутеніл]-2'-(метансульфоніл)-4-метил-2'-(2фталімідоетил)валеропдразид У спосіб, аналогічний способу, опис якого наведено у першому параграфі Прикладу 2, з започаткуванням з 0,134г (E)-2(R)-[1(S)-[(TeTpariflpo2^3)-піранілокси)карбамоіл]-4-феніл-3-бутеніл]2'-(метансульфоніл)-4-метил-2'-(2фталімідоетил)валеропдразиду, одержали 0,108г (Е)-2^)-[1(3)-(пдроксикарбамоіл)-4-феніл-3бутеніл]-2'-(метансульфоніл)-4-метил-2'-(2фталімідоетил)валеропдразиду у вигляді твердої речовини білого кольору Мас-спектрометрія 571 (М+Н)+ Високоефективна рідинна хроматографія Градієнтне елюювання за допомогою розчиннику А, який включає 5% розчиннику В, з подальшим підвищенням вмісту розчиннику В до 95% впродовж 15 хвилин, швидкість потоку 1мл/хвилину Час утримання 12,56 хвилини Розчинник А Н2О/0,1% TFA (тетрафтороцтова кислота), розчинник В СНзСН/0,085% тетрафтороцтової кислоти Тип колонки HYPERPEP 300A (E)-2(R)-[1(S)-[(TeTpanflpo-2(RS)піранілокси)карбамоіл]-4-феніл-3-бутеніл]-2'(метансульфоніл)-4-метил-2'-(2фталімідоетил)валеропдразид, який було використано як вихідний матеріал, одержали у спосіб, аналогічний способу, опис якого наведено у Прикладі 15, частина (мі), з започаткуванням з (E)-2(R)[1(S)-[(TeTpariflpo-2(RS)-mpaHinoKCH)Kap6aMoin]-4феніл-3-бутеніл]-2'-(метансульфоніл)-4метилвалеропдразиду, шляхом реагування з 2брометилфталімідом Приклад 27 (Е)-3-циклобутил-2^)-[1 (S)(пдроксикарбамоіл)-4-феніл-3-бутеніл]-2'(метансульфоніл)-2'-фенілпропюнпдразид 58561 42 41 У спосіб, аналогічний способу, опис якого на(циклопентилметил)сукцинату одержали (Е)-3ведено у першому параграфі Прикладу 2, з запо4HmoneHTHn-2(R)-[1(S)-[(TeTpariflpo-2(RS)чаткуванням з 0,159г (Е)-3-циклобутил-2^)-[1(3)піранілокси)карбамоіл]-4-феніл-3-бутеніл]-2'[(тетрапдро-2^3)-піранілокси)карбамоіл]-4-феніл(метансульфоніл)-2'-фенілпропюнпдразид у ви3-бутеніл]-2'-(метансульфоніл)-2'гляді твердої речовини білого кольору фенілпропюнпдразиду, одержали 0,103г (Е)-3Мас-спектрометрія 584 (М+Н)+ циклобутил-2^)-[1(3)-(пдроксикарбамоіл)-4Приклад 29 феніл-3-бутеніл]-2'-(метансульфоніл)-2'(E)-2'-(4-6poM4>eHin)-2(R)-[1(S)фенілпропюнпдразиду у вигляді твердої речовини (пдроксикарбамоіл)-4-феніл-3-бутеніл]-2'майже білого кольору (метансульфоніл)-4-метилвалеропдразид Мас-спектрометрія 486 (М+Н)+ У спосіб, аналогічний способу, опис якого наВисокоефективна рідинна хроматографія ведено у першому параграфі Прикладу 2, з запоГрадієнтне елюювання за допомогою розчиннику чаткуванням з 0,35г (Е)-2'-(4-бромфеніл)-2^)А, який включає 5% розчиннику В, з подальшим [1(S)-[(TeTpariflpo-2(RS)-mpaHinoKCH)Kap6aMoin]-4підвищенням вмісту розчиннику В до 95% впрофеніл-3-бутеніл]-2'-(метансульфоніл)-4довж 15 хвилин, швидкість потоку 1мл/хвилину метилвалеропдразиду, одержали 0,272г (Е)-2'-(4Час утримання 12,12 хвилини Розчинник А бромфеніл)-2^)-[1(3)-(пдроксикарбамоіл)-4ЬІ2О/0,1% TFA (тетрафтороцтова кислота), розфеніл-3-бутеніл]-2'-(метансульфоніл)-4чинник В СНзСІ\І/0,085% тетрафтороцтової кислометилвалеропдразиду у вигляді твердої речовини ти Тип колонки HYPERPEP 300A майже білого кольору (E)-3-MHmo6yTHn-2(R)-[1(S)-[(TeTpariflpo-2(RS)Мас-спектрометрія 552 (М+Н)+ піранілокси)карбамоіл]-4-феніл-3-бутеніл]-2'Ядерний магнітний резонанс (сіє диметилсу(метансульфоніл)-2'-фенілпропюнпдразид, який льфоксид) 10,85 (1Н, синглет), 10,31 (1Н, широкий було використано як вихідний матеріал, одержали синглет), 8,48 (1Н, широкий синглет), 7,58 (2Н, наведеним далі способом мультиплет), 7,32 (2Н, мультиплет), 7,29 (4Н, мультиплет), 7,23-7,16 (1Н, мультиплет), 6,23 (1Н, У спосіб, аналогічний способу, опис якого надублет, J=15,5riO, 6,07-5,97 (1Н, мультиплет), 3,23 ведено у Прикладі 2, частини (i)-(v), з започатку(ЗН, синглет), 2,60-2,50 (1Н, мультиплет), 2,41-2,12 ванням з 4-трет-бутил водень 2(R)(ЗН, мультиплет), 1,57-1,48 (1Н, мультиплет), 1,47(циклобутилметил)сукцинату одержали (Е)-31,35 (1Н, мультиплет), 1,16-1,06 (1Н, мультиплет), MHmo6yTHn-2(R)-[1(S)-[(TeTpariflpo-2(RS)0,85 (ЗН, дублет, и=6,5Гц), 0,78 (ЗН, дублет, піранілокси)карбамоіл]-4-феніл-3-бутеніл]-2'(метансульфоніл)-2'-фенілпропюнпдразид у вигляді твердої речовини білого кольору Високоефективна рідинна хроматографія Мас-спектрометрія 570 (М+Н)+ Градієнтне елюювання за допомогою розчиннику А, який включає 5% розчиннику В, з подальшим Приклад 28 підвищенням вмісту розчиннику В до 95% впро(Е)-3-циклопентил-2^)-[1 (S)довж 15 хвилин, швидкість потоку 1мл/хвилину (пдроксикарбамоіл)-4-феніл-3-бутеніл]-2'Час утримання 13,41 хвилини Розчинник А (метансульфоніл)-2'-феніл пропюнпдразид Н2О/0,1% TFA (тетрафтороцтова кислота), розУ спосіб, аналогічний способу, опис якого начинник В СНзСІ\І/0,085% тетрафтороцтової кисловедено у першому параграфі Прикладу 2, з запоти чаткуванням з 0,2г (Е)-3-циклопентил-2^)-[1(3)[(тетрапдро-2^3)-піранілокси)карбамоіл]-4-феніл(Е)-2'-(4-бромфеніл)-2^)-[1(3)-[(тетрапдро3-бутеніл]-2'-(метансульфоніл)-2'2^3)-транілокси)карбамоіл]-4-феніл-3-бутеніл]-2'фенілпропюнпдразиду, одержали 0,132г (Е)-3(метансульфоніл)-4-метилвалеропдразид, який циклопентил-2^)-[1(3)-(пдроксикарбамоіл)-4було використано як вихідний матеріал, одержали феніл-3-бутеніл]-2'-(метансульфоніл)-2у наведений далі спосіб фенілпропюнпдразиду у вигляді твердої речовини У спосіб, аналогічний способу, опис якого набілого кольору ведено у Прикладі 2, частини (III)-(V), з започаткуванням з (E)-2(R)-[1(S)-(TpeT-6yroKCHKap6oHin)-4Мас-спектрометрія 500 (М+Н)+ феніл-3-бутеніл]-4-метилвалеріанової кислоти та Високоефективна рідинна хроматографія 4-бромфеніл гід разину одержали (Е)-2'-(4Градієнтне елюювання за допомогою розчиннику бромфеніл)-2^)-[1(3)-[(тетрапдро-2^3)А, який включає 5% розчиннику В, з подальшим піранілокси)карбамоіл]-4-феніл-3-бутеніл]-2'підвищенням вмісту розчиннику В до 95% впро(метансульфоніл)-4-метилвалеропдразид у виглядовж 15 хвилин, швидкість потоку 1мл/хвилину ді твердої речовини білого кольору Час утримання 12,39 хвилини Розчинник А ЬІ2О/0,1% TFA (тетрафтороцтова кислота), розМас-спектрометрія 636/638 (М+Н)+ чинник В СНзСІ\І/0,085% тетрафтороцтової кислоПриклад ЗО ти Тип колонки HYPERPEP 300A (E)-2'-(TpeT-6y™n)-2(R)-[1 (S)(пдроксикарбамоіл)-4-феніл-3-бутеніл]-2'(Е)-3-циклопентил-2^)-[1(3)-[(тетрапдро(метансульфоніл)-4-метилвалеропдразид 2^3)-піранілокси)карбамоіл]-4-феніл-3-бутеніл]2'-(метансульфоніл)-2'-фенілпропюнпдразид, який У спосіб, аналогічний способу, опис якого набуло використано як вихідний матеріал, одержали ведено у першому параграфі Прикладу 2, з запонаведеним далі способом чаткуванням з 0,35г (Е)-2'-(трет-бутил)-2^)-[1(3)[(тетрапдро-2^3)-піранілокси)карбамоіл]-4-фенілУ спосіб, аналогічний способу, опис якого на3-бутеніл]-2'-(метансульфоніл)-4ведено у Прикладі 2, частини (i)-(v), з започаткуметилвалеропдразиду, одержали 0,272г (Е)-2'ванням з 4-трет-бутил водень 2(R) 58561 44 43 (трет-бутил)-2^)-[1(3)-(пдроксикарбамоіл)-42(R)-[1(R)-(riflpoKCHKap6aMoin)-2феніл-3-бутеніл]-2'-(метансульфоніл)-4фталімідоетил]-2'-(метансульфоніл)-4-метил)-4метилвалеропдразиду у вигляді твердої речовини метил-2'-фенілвалеропдразид майже білого кольору У спосіб, аналогічний способу, опис якого на+ ведено у першому параграфі Прикладу 2, з запоМас-спектрометрія 454 (М+Н) чаткуванням з 0,14г 2(R)-[1(R)-[(TeTpariflpo-2(RS)Високоефективна рідинна хроматографія піранілокси)карбамоіл]-2-фталімідоетил]-2'Градієнтне елюювання за допомогою розчиннику (метансульфоніл)-4-метил-2'А, який включає 10% розчиннику В, впродовж 5 фенілвалеропдразиду, одержали 0,092г 2(R)-[1(R)хвилин, з подальшим підвищенням вмісту розчин(пдроксикарбамоіл)-2-фталімідоетил] -2'нику В до 90% від 5 хвилин до 20 хвилин, швидкість потоку 1мл/хвилину Час утримання 16,56 (метансульфоніл)-4-метил-2'хвилини Розчинник А Н2О/0,1% TFA (тетрафтофенілвалеропдразиду у вигляді твердої речовини роцтова кислота), розчинник В СНзСІ\І/0,085% білого кольору + тетрафтороцтової кислоти Тип колонки HYPERМас-спектрометрія 517(М+Н) PEP 300А Високоефективна рідинна хроматографія (Е)-2'-(трет-бутил)-2(Р)-[1(3)-[(тетрапдроГрадієнтне елюювання за допомогою розчиннику 2(РЗ)-піранілокси)карбамоіл]-4-феніл-3-бутеніл]А, який включає 10% розчиннику В, впродовж 5 2'-(метансульфоніл)-4-метилвалеропдразид, який хвилин, з подальшим підвищенням вмісту розчинбуло використано як вихідний матеріал, одержали нику В до 90% від 5 хвилин до 20 хвилин, швиду наведений далі спосіб кість потоку 1мл/хвилину Час утримання 15,52 хвилини Розчинник А НгО, розчинник В CH3CN У спосіб, аналогічний способу, опис якого наТип колонки HYPERPEP 300A ведено у Прикладі 2, частини (III)-(V), з започаткуванням з (Е)-2(Р)-[1(3)-(трет-бутоксикарбоніл)-42(R)-[1 (R)-[(TeTpariflpo-2(RS)феніл-3-бутеніл]-4-метилвалеріанової кислоти та піранілокси)карбамоіл]-2-фталімідоетил]-2'трет-бутилпдразину одержали (Е)-2'-(трет-бутил)(метансульфоніл)-4-метил-2'2(R)-[1 (S)-[(TeTpariflpo-2(RS)фенілвалеропдразид, який було використано як піранілокси)карбамоіл]-4-феніл-3-бутеніл]-2'вихідний матеріал, одержали наведеним далі спо(метансульфоніл)-4-метилвалеропдразид у виглясобом ді твердої речовини білого кольору У спосіб, аналогічний способу, опис якого наведено у Прикладі 2, частини (III)-(V), з започаткуМас-спектрометрія 537 (М+Н)+ ванням з 2(R)-[1(R)-(jpeT-6yTOKCHKap6oHin)-2Приклад 31 фталімідоетил]-4-метил валеріанової кислоти та (Е)-2'-(циклогексилметил)-2(Р)-[1(3)феніл гід разину одержали 2(R)-[1(R)-[(TeTpariflpo(пдроксикарбамоіл)-4-феніл-3-бутеніл]-2'2^3)-піранілокси)карбамоіл]-2-фталімідоетил]-2'(метансульфоніл)-4-метилвалеропдразид (метансульфоніл)-4-метил-2'-фенілвалеропдразид У спосіб, аналогічний способу, опис якого у вигляді твердої речовини білого кольору наведено у першому параграфі Прикладу 2, з започаткуванням з 0,149г (Е)-2'-(циклогексилметил)Мас-спектрометрія 601 (М+Н)+ 2(R)-[1 (S)-[(TeTpariflpo-2(RS)Приклад 33 піранілокси)карбамоіл]-4-феніл-3-бутеніл]-2'2(R)-[2-6eH3aMifl-1(R)(метансульфоніл)-4-метилвалеропдразиду, одер(пдроксикарбамоіл)етил]-2'-(метансульфоніл)-4жали 0,116г (Е)-2'-(циклогексилметил)-2^)-[1 (S)метил-2'-фенілвалеропдразид (пдроксикарбамоіл)-4-феніл-3-бутеніл]-2'У спосіб, аналогічний способу, опис якого на(метансульфоніл)-4-метилвалеропдразиду у виведено у першому параграфі Прикладу 2, з запогляді твердої речовини білого кольору чаткуванням з 0,084г 2(R)-[2-6eH3aMiflo-1(R)[(тетрапдро-2^3)-піранілокси)карбамоіл]-2'Мас-спектрометрія 494 (М+Н)+ (метансульфоніл)-4-метил-2'Високоефективна рідинна хроматографія фенілвалеропдразиду, одержали 0,055г 2(R)-[2Градієнтне елюювання за допомогою розчиннику бензамідо-1^)-(пдроксикарбамоіл)етил]-2'А, який включає 5% розчиннику В, з подальшим (метансульфоніл)-4-метил-2'підвищенням вмісту розчиннику В до 95% впрофенілвалеропдразиду у вигляді твердої речовини довж 15 хвилин, швидкість потоку 1мл/хвилину білого кольору Час утримання 13,67 хвилини Розчинник А ЬІ2О/0,1% TFA (тетрафтороцтова кислота), розМас-спектрометрія 491 (М+Н)+ чинник В СНзСІ\І/0,085% тетрафтороцтової кислоВисокоефективна рідинна хроматографія ти Тип колонки HYPERPEP 300A Градієнтне елюювання за допомогою розчиннику А, який включає 5% розчиннику В, впродовж 5 (Е)-2'-(циклогексилметил)-2^)-[1(3)хвилин, з подальшим підвищенням вмісту розчин[(тетрапдро-2^3)-піранілокси)карбамоіл]-4-фенілнику В до 95% від 5 хвилин до 20 хвилин, швид3-бутеніл]-2'-(метансульфоніл)-4кість потоку 1мл/хвилину Час утримання 15,54 метилвалеропдразид, який було використано як хвилини Розчинник А Н2О/0,1% TFA (тетрафтовихідний матеріал, одержали у спосіб, аналогічний роцтова кислота), розчинник В СНзСІ\І/0,085% способу, опис якого наведено у Прикладі 15, частетрафтороцтової кислоти Тип колонки HYPERтина (їм), З започаткуванням з (E)-2(R)-[1(S)PEP 300А [(тетрапдро-2^3)-піранілокси)карбамоіл]-4-феніл3-бутеніл]-2'-(метансульфоніл)-42(R)-[2-6eH3aMiflo-1(R)-[(TeTpariflpo-2(RS)метилвалеропдразиду, шляхом реагування з цикпіранілокси)карбамоіл]етил]-2'-(метансульфоніл)логексилметилбромідом 4-метил-2'-фенілвалеропдразид, який було використано як вихідний матеріал, одержали у наведеПриклад 32 45 58561 ний далі спосіб (і) РОЗЧИН 0,705Г 2(R)-[1(R)-(TpeT бутоксикарбоніл)-2-фталімідоетил]-2'(метансульфоніл)-4-метил-2'фенілвалеропдразиду у 15мл метанолу обробляли 0,51мл гідрату гідразину Одержану суміш перемішували у атмосфері азоту впродовж ночі, після чого випарювали Одержаний залишок перемішували з 25мл суміші дихлорметану/метанолу/оцтової кислоти/води (120 15 3 2) Через 2 години тверду речовину, яка випала до осаду, відфільтровували и одержаний фільтрат випарювали Одержаний залишок очищали шляхом хроматографування на колонці з кізельгелем 60 (Kieselgel 60) з елююванням сумішшю дихлорметану/метанолу/оцтової кислоти/води (240 24 3 2) Фракції, до складу яких входив аміновий продукт, об'єднували та випарювали, одержаний залишок розчиняли у ЗОмл дихлорметану та промивали трьома Юмл порціями насиченого розчину гідрокарбонату натрію Після висушування над безводним сульфатом магнію одержаний розчин випарювали з одержанням 0,42г 2(R)-[2-aMmo1(Р)-(трет-бутоксикарбоніл)етил]-2'(метансульфоніл)-4-метил-2'фенілвалеропдразиду у вигляді піни блідо-жовтого кольору Мас-спектрометрія 428 (М+Н)+ (м) Суміш 0,42г аміну, який було одержано у частині (і), та 0,138г бензойної кислоти у 7мл диметилформаміду охолоджували до температури 0°С з перемішуванням та додавали 0,335г 1-етил3-(3-диметиламшопропіл)карбодиіміду Одержану суміш витримували з нагріванням до кімнатної температури та перемішували впродовж ночі Згаданий розчинник випарювали і одержаний залишок розподіляли поміж етилацетатом та насиченим розчином гідрокарбонату натрію Одержаний етилацетатний шар послідовно промивали насиченим розчином гідрокарбонату натрію, 5% розчином лимонної кислоти, водою та насиченим розчином хлориду натрію, після чого сушили над безводним сульфатом магнію Етилацетат випарювали і одержаний залишок змішували з сумішшю ефіру та гексану з одержанням 0,331г 2(R)-[2бензамід-1 (R) - (трет- бутоксикарбоніл )етил]-2'(метансульфоніл)-4-метил-2'фенілвалеропдразиду у вигляді твердої речовини майже білого кольору Мас-спектрометрія 532 (М+Н)+ (їм) У спосіб, аналогічний способу, опис якого наведено у Прикладі 2, частини (III)-(V), з започаткуванням з 2(R)-[2-6eH3aMifl-1(R)-(TpeTбутоксикарбоніл)етил]-2'-(метансульфоніл)-4метил-2'-фенілвалеропдразиду, одержали 2(R)-[26eH3aMiflo-2(R)-[(TeTpariflpo-2(RS)піранілокси)карбамоіл]етил]-2'-(метансульфоніл)4-метил-2'-фенілвалеропдразид у вигляді твердої речовини білого кольору Мас-спектрометрія 575 (М+Н)+ Приклад 34 2^)-[2-[(5-бром-2-фурил)карбоксамідо]-1^)(пдроксикарбамоіл)етил]-2'-(метансульфоніл)-4метил-2'-фенілвалеропдразид У спосіб, аналогічний способу, опис якого наведено у першому параграфі Прикладу 2, з запо 46 чаткуванням з 0,195г 2(R)-[2-[(5-6poM-2фурил)карбоксамідо]-1^)-[(тетрапдро-2^3)піранілокси)карбамоіл]етил]-2'-(метансульфоніл)4-метил-2'-фенілвалеропдразиду, одержали 0,127г 2^)-[2-[(5-бром-2-фурил)карбоксамідо] -1(R)(пдроксикарбамоіл)етил]-2'-(метансульфоніл)-4метил-2'-фенілвалеропдразиду у вигляді твердої речовини кремового кольору Мас-спектрометрія 560 (М+Н)+ Високоефективна рідинна хроматографія Градієнтне елюювання за допомогою розчиннику А, який включає 5% розчиннику В, з подальшим підвищенням вмісту розчиннику В до 95% впродовж 15 хвилин, швидкість потоку 1мл/хвилину Час утримання 10,69 хвилини Розчинник А ЬІ2О/0,1% TFA (тетрафтороцтова кислота), розчинник В СНзСН/0,085% тетрафтороцтової кислоти Тип колонки HYPERPEP 300A 2^)-[2-[(5-бром-2-фурил)карбоксамідо]-1^)[(тетрапдро-2^3)-піранілокси)карбамоіл]етил]-2'(метансульфоніл)-4-метил-2'фенілвалеропдразид, який було використано як вихідний матеріал, одержали у наведений далі спосіб У спосіб, аналогічний способу, опис якого наведено у Прикладі 33, частини (м) та (їм), з започаткуванням з 2(R)-[2-aMiHO-1(R)-(TpeTбутоксикарбоніл)етил]-2'-(метансульфоніл)-4метил-2'-фенілвалеропдразиду та 2-бром-2фуранкарбонової кислоти, одержали 2(R)-[2-[(5бром-2-фурил)карбоксамідо]-1^)-[(тетрапдро2^3)-піранілокси)карбамоіл]етил]-2'(метансульфоніл)-4-метил-2'-фенілвалеропдразид у вигляді твердої речовини майже білого кольору Мас-спектрометрія 644 (М+Н)+ Приклад 35 2(R)-[1(R)-(riflpoKCHKap6aMOMT)-2-[(2тіазоліл)карбоксамідо]етил-2'-(метансульфоніл)-4метил-2'-фенілвалеропдразид У спосіб, аналогічний способу, опис якого наведено у першому параграфі Прикладу 2, з започаткуванням з 0,1г 2(R)-[1(R)-[(TeTpariflpo-2(RS)піранілокси)карбамоіл]-2-[(2тіазоліл)карбоксамідо]етил]-2'-(метансульфоніл)-4метил-2'-фенілвалеропдразиду, одержали 0,041г 2(R)-[1(R)-(riflpoKCHKap6aMOMT)-2-[(2тіазоліл)карбоксамідо]етил]-2'-(метансульфоніл)-4метил-2'-фенілвалеропдразиду у вигляді твердої речовини майже білого кольору Мас-спектрометрія 498 (М+Н)+ Високоефективна рідинна хроматографія Градієнтне елюювання за допомогою розчиннику А, який включає 5% розчиннику В, з подальшим підвищенням вмісту розчиннику В до 95% впродовж 15 хвилин, швидкість потоку 1мл/хвилину Час утримання 10,14 хвилини Розчинник А ЬІ2О/0,1% TFA (тетрафтороцтова кислота), розчинник В СНзСІ\І/0,085% тетрафтороцтової кислоти Тип колонки HYPERPEP 300A 2(R)-[1 (R)-[(TeTpariflpo-2(RS)піранілокси)карбамоіл]-2-[(2тіазоліл)карбоксамідо]етил]-2'-(метансульфоніл)-4метил-2'-фенілвалеропдразид, який було використано як вихідний матеріал, одержали у наведений далі спосіб 58561 48 47 У спосіб, аналогічний способу, опис якого наМас-спектрометрія 507 (М+Н)+ ведено у Прикладі 33, частини (м) та (їм), з започатВисокоефективна рідинна хроматографія куванням з 2(R)-[2-aMiHO-1(R)-(TpeTГрадієнтне елюювання за допомогою розчиннику А, який включає 5% розчиннику В, з подальшим бутоксикарбоніл)етил]-2'-(метансульфоніл)-4підвищенням вмісту розчиннику В до 95% впрометил-2'-фенілвалеропдразиду та 2довж 15 хвилин, швидкість потоку 1мл/хвилину тіазолкарбонової кислоти, одержали 2(R)-[1 (R)Час утримання 10,91 хвилини Розчинник А [(тетрапдро-2^3)-піранілокси)карбамоіл]-2-[(2ЬІ2О/0,1% TFA (тетрафтороцтова кислота), розтіазоліл)карбоксамідо]етил]-2'-(метансульфоніл)-4чинник В CH2CN/0,085% тетрафтороцтової кислометил-2'-фенілвалеропдразид у вигляді твердої ти Тип колонки HYPERPEP 300A речовини білого кольору Мас-спектрометрія 582 (М+Н)+ 2(R)-[1 (R)-[(TeTpariflpo-2(RS)Приклад 36 піранілокси)карбамоіл]-2-(3-фенілуреідо)етил]-2'(метансульфоніл)-4-метил-2'2(R)-[1(R)-(riflpoKCHKap6aMOUT)-2-[(2фенілвалеропдразид, який було використано як тієніл)карбоксамідо]етил]-2'-(метансульфоніл)-4вихідний матеріал, одержали у наведений далі метил-2'-фенілвалеропдразид спосіб У спосіб, аналогічний способу, опис якого наведено у першому параграфі Прикладу 2, з запо(і) Суміш 0,8г 2(R)-[2-aMiHO-1(R)-(TpeTчаткуванням з 0,2г 2(R)-[1(R)-[Crerpariflpo-2(RS)бутоксикарбоніл)етил]-2'-(метансульфоніл)-4піранілокси)карбамоіл]-2[(2метил-2'-фенілвалеропдразиду, який було одержано за описом, який наведено у Прикладі 33, частієніл)карбоксамідо]етил]-2'-(метансульфоніл)-4тина (і), 0,325МЛ г\І,г\І-діізопропілетиламіну та метил-2'-фенілвалеропдразиду, одержали 0,115г 0,21 мл фенілізоціанату у 10мл диметилформаміду 2(R)-[1(R)-(riflpoKCHKap6aMoin)-2-[(2перемішували при температурі 60°С у атмосфері тієніл)карбоксамідо]етил]-2'-(метансульфоніл)-4азоту впродовж 2,5 години Згаданий розчинник метил-2'-фенілвалеропдразиду у вигляді твердої випарювали і одержаний залишок розподіляли речовини білого кольору поміж етилацетатом та 1М хлористоводневою киМас-спектрометрія 497 (М+Н)+ слотою Одержаний етил ацетатний розчин відоВисокоефективна рідинна хроматографія кремлювали та промивали розчином гідрокарбоГрадієнтне елюювання за допомогою розчиннику нату натрію та насиченим розчином хлориду А, який включає 5% розчиннику В, з подальшим натрію, сушили над безводним сульфатом магнію підвищенням вмісту розчиннику В до 95% впрота випарювали Одержаний залишок змішували з довж 15 хвилин, швидкість потоку 1мл/хвилину діетиловим ефіром та одержували 0,705г 2(R)Час утримання 10,39 хвилини Розчинник А [1^)-(трет-бутоксикарбоніл)-2-(3ЬІ2О/0,1% TFA (тетрафтороцтова кислота), розфенілуреідо)етил]-2'-(метансульфоніл)-4-метил-2'чинник В СНзСІ\І/0,085% тетрафтороцтової кислофенілвалеропдразиду у вигляді твердої речовини та Тип колонки HYPERPEP 300A білого кольору 2(R)-[1 (R)-[(TeTpariflpo-2(RS)піранілокси)карбамоіл]-2[(2Мас-спектрометрія 547 (М+Н)+ тієніл)карбоксамідо]етил]-2'-(метансульфоніл)-4(м) У спосіб, аналогічний способу, опис якого метил-2'-фенілвалеропдразид, який було викориснаведено у Прикладі 2, частини (III)-(V), з започаттано як вихідний матеріал, одержали у наведений куванням з гідразиду, який було одержано у попедалі спосіб редньому параграфі, одержали 2(R)-[1(R)[(тетрапдро-2^3)-піранілокси)карбамоіл]-2-(3У спосіб, аналогічний способу, опис якого нафенілуреідо)етил]-2'-(метансульфоніл)-4-метил-2'ведено у Прикладі 33, частини (м) та (їм), з започатфенілвалеропдразид у вигляді твердої речовини куванням з 2(R)-[2-aMiHO-1(R)-(TpeTбілого кольору бутоксикарбоніл)етил]-2'-(метансульфоніл)-4метил-2'-фенілвалеропдразиду та тюфен-2Мас-спектрометрія 590 (М+Н)+ карбонової кислоти, одержали 2(R)-[1(R)Приклад 38 [(тетрапдро-2^3)-піранілокси)карбамоіл]-2-[(22(R)-[1(R)-(riflpoKCHKap6aMOMT)-2-[(2тієніл)карбоксамідо]етил]-2'-(метансульфоніл)-4тієніл)сульфонамід]етил]-2'-(метансульфоніл)-4метил-2'-фенілвалеропдразид у вигляді твердої метил-2'-феніл валеропдразид речовини білого кольору У спосіб, аналогічний способу, опис якого наМас-спектрометрія 581 (М+Н)+ ведено у першому параграфі Прикладу 2, з започаткуванням з 0,28г 2(R)-[1(R)-[Crerpariflpo-2(RS)Приклад 37 піранілокси)карбамоіл]-2-[(22(R)-[1(R)-(riflpoKCHKap6aMoin)-2-(3тієніл)сульфонамід]етил]-2'-(метансульфоніл)-4фенілуреідо)етил]-2'-(метансульфоніл)-4-метил-2'метил-2'-фенілвалеропдразиду, одержали 0,066г фенілвалеропдразид 2(R)-[1(R)-(riflpoKCHKap6aMOMT)-2-[(2У спосіб, аналогічний способу, опис якого натієніл)сульфонамід]етил]-2'-(метансульфоніл)-4ведено у першому параграфі Прикладу 2, з запометил-2'-фенілвалеропдразиду у вигляді твердої чаткуванням з 0,157г 2(R)-[1(R)-[Crerpariflpo-2(RS)речовини білого кольору піранілокси)карбамоіл]-2-(3-фенілуреідо)етил]-2'(метансульфоніл)-4-метил-2'Мас-спектрометрія 533 (М+Н)+ фенілвалеропдразиду, одержали 0,072г 2(R)-[1 (R)Високоефективна рідинна хроматографія (пдроксикарбамоіл)-2-(3-фенілуреідо)етил]-2'Градієнтне елюювання за допомогою розчиннику (метансульфоніл)-4-метил-2'А, який включає 5% розчиннику В, з подальшим фенілвалеропдразиду у вигляді твердої речовини підвищенням вмісту розчиннику В до 95% впробілого кольору довж 15 хвилин, швидкість потоку 1мл/хвилину 58561 50 49 Час утримання 10,65 хвилини Розчинник А було використано як вихідний матеріал, одержали ЬІ2О/0,1% TFA (тетрафтороцтова кислота), розу наведений далі спосіб чинник В CH3CN/0,085% тетрафтороцтової кисло(і) У спосіб, аналогічний способу, опис якого ти Тип колонки HYPERPEP 300A наведено у Прикладі 1, частина (м), з започаткуванням з 0,3г (E)-2(R)-[1(S)-(TpeT-6yroKCHKap6oHin)2(R)-[1 (R)-[(TeTpariflpo-2(RS)4-феніл-3-бутеніл]-4-метил-2'-феніл гідразиду та піранілокси)карбамоіл]-2-[(20,543г бензилсульфонілхлориду, одержали 0,316г тієніл)сульфонамід]етил]-2'-(метансульфоніл)-4(Е)-2'-(бензилсульфоніл)-2^)-[1(3)-(третметил-2'-фенілвалеропдразид, який було викорисбутоксикарбоніл)-4-феніл-3-бутеніл]-4-метил-2'тано як вихідний матеріал, одержали у наведений фенілпдразиду у вигляді твердої речовини білого далі спосіб кольору (і) РОЗЧИН 0,504Г 2(R)-[2-aMmo-1(R)-(TpeTбутоксикарбоніл)етил]-2'-(метансульфоніл)-4Мас-спектрометрія 591 (М+Н)+ метил-2'-фенілвалеропдразиду у 20мл дихлорме(і) У спосіб, аналогічний способу, опис якого тану охолоджували до температури 0°С з перемінаведено у Прикладі 1, частина (мі), та Прикладі 2, шуванням та додавали 0,242г 2частина (v), з гідразиду, який було одержано у потюфенсульфонілхлориду Одержану суміш витрипередньому параграфі, одержали (Е)-2мували з нагріванням до кімнатної температурі та (бензилсульфоніл)-2^)-[1(3)-[(тетрапдро-2^3)перемішували впродовж ночі Згаданий розчинник піранілокси)карбоніл]-4-феніл-3-бутеніл]-4-метилвипарювали і одержаний залишок розподіляли 2'-фенілвалеропдразид у вигляді твердої речовипоміж етилацетатом та 5% водним розчином лини білого кольору монної кислоти Одержаний етилацетатний шар Мас-спектрометрія 634 (М+Н)+ промивали насиченим розчином гідрокарбонату Приклад 40 натрію, потім насиченим розчином хлориду натрію, (Е)-2^)-[1(3)-(пдроксикарбамоіл)-4-феніл-3сушили над безводним сульфатом магнію та вибутеніл]-2'-(метансульфоніл)-3-метил-2'парювали Одержаний залишок змішували з ефіфенілбутил гідразид ром та одержували 0,487г 2(R)-[1 (R)-(TpeTУ спосіб, аналогічний способу, опис якого набутоксикарбоніл)-2-[(2-тієніл)сульфонамід]етил]-2'ведено у першому параграфі Прикладу 2, з запо(метансульфоніл)-4-метил-2'чаткуванням з 0,098г (E)-2(R)-[1 (3)-[(тетрапдрофенілвалеропдразиду у вигляді твердої речовини 2^3)-піранілокси)карбамоіл]-4-феніл-3-бутеніл]білого кольору 2'-(метансульфоніл)-3-метил-2'фенілбутилгідразиду, одержали 0,054г (E)-2(R)Мас-спектрометрія 574 (М+Н)+ [1(3)-(пдроксикарбамоіл)-4-феніл-3-бутеніл]-2'(м) У спосіб, аналогічний способу, опис якого (метансульфоніл)-3-метил-2'-фенілбутил гідразиду наведено у Прикладі 2, частини (III)-(V), з започату вигляді твердої речовини майже білого кольору кувавшим з гідразиду, який було одержано у попередньому параграфі, одержали 2(R)-[1(R)Мас-спектрометрія 460 (М+Н)+ [(тетрапдро-2^3)-піранілокси)карбамоіл]-2-[(2Високоефективна рідинна хроматографія тієніл)сульфонамід]етил]-2'-(метансульфоніл)-4Градієнтне елюювання за допомогою розчиннику метил-2'-фенілвалеропдразид у вигляді твердої А, який включає 5% розчиннику В, з подальшим речовини білого кольору підвищенням вмісту розчиннику В до 95% впродовж 15 хвилин, швидкість потоку 1мл/хвилину Мас-спектрометрія 581 (М+Н)+ Час утримання 11,72 хвилини Розчинник А Приклад 39 ЬІ2О/0,1% TFA (тетрафтороцтова кислота), роз(Е)-2'-(бензилсульфоніл)-2^)-[1(3)чинник В СНзСІ\І/0,085% тетрафтороцтової кисло(пдроксикарбамоіл)-4-феніл-3-бутеніл]-4-метил-2'ти Тип колонки HYPERPEP 300A фенілвалеропдразид У спосіб, аналогічний способу, опис якого на(E)-2(R)-[1(S)-[(TeTPariflpo-2(RS)ведено у першому параграфі Прикладу 2, з запопіранілокси)карбамоіл]-4-феніл-3-бутеніл]-2'чаткуванням з 0,1г (Е)-2'-(бензилсульфоніл)-2^)(метансульфоніл)-3-метил-2'-фенілбутил гідразид, [1(S)-[(TeTpariflpo-2(RS)-mpaHinoKCH)Kap6aMoin]-4який було використано як вихідний матеріал, одефеніл-3-бутеніл]-4-метил-2'-фенілвалеропдразиду, ржали у наведений далі спосіб одержали 0,051г (Е)-2'-(бензилсульфоніл)-2^)У спосіб, аналогічний способу, опис якого на[1(3)-(пдроксикарбамоіл)-4-феніл-3-бутеніл]-4ведено у Прикладі 2, частини (i)-(v), з започаткуметил-2'-фенілвалеропдразиду у вигляді твердої ванням з 4-трет-бутил водень 2(R)речовини білого кольору ізопропілсукцинату, одержали (E)-2(R)-[1(S)[(тетрапдро-2^3)-піранілокси)карбамоіл]-4-фенілМас-спектрометрія 550 (М+Н)+ 3-бутеніл]-2'-(метансульфоніл)-3-метил-2'Високоефективна рідинна хроматографія фенілбутилгідразид у вигляді твердої речовини Градієнтне елюювання за допомогою розчиннику білого кольору А, який включає 5% розчиннику В, з подальшим підвищенням вмісту розчиннику В до 95% впроМас-спектрометрія 544 (М+Н)+ довж 15 хвилин, швидкість потоку 1мл/хвилину Приклад 41 Час утримання 13,62 хвилини Розчинник А (Е)-2'-ацетил-2^)-[1(3)-(пдроксикарбамоіл)-4ЬІ2О/0,1% TFA (тетрафтороцтова кислота), розфеніл-3-бутеніл]-4-метил-2'-феніл валеропдразид чинник В СНзСІ\І/0,085% тетрафтороцтової кислоУ спосіб, аналогічний способу, опис якого нати Тип колонки HYPERPEP 300A ведено у першому параграфі Прикладу 2, з започаткуванням з 0,23г (Е)-2'-ацетил-2^)-[1(3)(Е)-2'-(бензилсульфоніл)-2^)-[1(3)[(тетрапдро-2^3)-піранілокси)карбамоіл]-4-феніл[(тетрапдро-2^3)-піранілокси)карбамоіл]-4-феніл3-бутеніл]-4-метил-2'-фенілвалеропдразиду, оде3-бутеніл]-4-метил-2'-фенілвалеропдразид, який 58561 52 51 ржали 0,09г (Е)-2'-ацетил-2^)-[1 (S)температурі, після чого випарювали з одержанням смоли Шляхом гель-хроматографування з елюю(пдроксикарбамоіл)-4-феніл-3-бутеніл]-4-метил-2'ванням сумішшю гексану/етилацетату (2 1) одерфенілвалеропдразиду у вигляді твердої речовини жали 0,65г (Е)-2'-(етилкарбомоіл)-2(Р)-[1(3)-(третбілого кольору + бутоксикарбамоіл)-4-феніл-3-бутеніл]-4-метил-2'Мас-спектрометрія 438 (М+Н) фенілвалеропдразиду у вигляді піни білого кольоВисокоефективна рідинна хроматографія Градієнтне елюювання за допомогою розчиннику РУ А, який включає 5% розчиннику В, з подальшим (м) 0,64г трет-бутилового ефіру, який було підвищенням вмісту розчиннику В до 95% впроодержано ВІДПОВІДНО до частини (і), обробляли довж 15 хвилин, швидкість потоку 1мл/хвилину розчином 50% трифтороцтової кислоти у дихлорЧас утримання 11,29 хвилини Розчинник А метані впродовж 3 годин при кімнатній температуЬІ2О/0,1% TFA (тетрафтороцтова кислота), розрі та випарювали ДВІЧІ додавали толуол з випачинник В СНзСІ\І/0,085% тетрафтороцтової кислорюванням кожного разу Одержаний залишок ти Тип колонки HYPERPEP 300A очищали шляхом гель-хроматографування з елююванням сумішшю дихлорметану/метанолу (19 1) (E)-2'-aMeTHn-2(R)-[1(S)-[(TeTpariflpo-2(RS)з одержанням 0,36г (Е)-2'-(етилкарбамоіл)-2(Р)піранілокси)карбамоіл]-4-феніл-3-бутеніл]-4[1(3)-карбокси-4-феніл-3-бутеніл]-4-метил-2'метил-2'-фенілвалеропдразид, який було викорисфенілвалеропдразиду у вигляді скла тано як вихідний матеріал, було одержано у спосіб, аналогічний способу, опис якого наведено у (їм) 0,35Г карбонової кислоти, яку було одерПрикладі 4, частини і)-м), з започаткуванням з (Е)жано ВІДПОВІДНО до частини (м), розчиняли у Змл 2(Р)-[1(Р)-(трет-бутоксикарбоніл)-4-феніл-3диметилформаміду, охолоджували до температубутеніл]-4-метилвалеріанової кислоти, яку було ри 0°С та обробляли 0,26г О-(тетрапдро-2Н-піранодержано, як описано у Прикладі 2, частина (і) 2(РЗ)-іл)гідроксиламіну та 0,215г пдрохлориду 1етил-3-(3-диметиламшопропіл)карбодиіміду ОдеПриклад 42 ржану суміш перемішували впродовж ночі при кім(E)-2'-(e™-iKap6aM0in)-2(R)-[1(S)натній температурі, після чого виливали до води (пдроксикарбамоіл)-4-феніл-3-бутеніл]-4-метил-2'Одержану тверду речовину відфільтровували та фенілвалеропдразид послідовно промивали 2М розчином хлористоводРозчин 0,190г (Е)-2'-(етилкарбамоіл)-2(Р)невої кислоти, водою, 5% розчином гідрокарбона[1(S)-[(TeTpariflpo-2(RS)-mpaHinoKCH)Kap6aMoin]-4ту натрію та водою, після чого сушили in vacuo феніл-3-бутеніл]-4-метил-2'-фенілвалеропдразиду Шляхом гель-хроматографування з елююванням у суміші 2мл дихлорметану та 0,5мл метанолу сумішшю гексану/етилацетату одержали 0,2г (Е)обробляли 9мл метансульфонової кислоти Одер2'-(eTHnKap6aMoin)-2(R)-[1(S)-[(TeTpariflpo-2(RS)жану суміш перемішували впродовж 2 годин при піранілокси)карбамоіл]-4-феніл-3-бутеніл]-4кімнатній температурі, розчинник випарювали метил-2'-фенілвалеропдразиду у вигляді піни білоОдержаний залишок змішували з 5% розчином го кольору гідрокарбонату натрію та розчиняли у діетиловому ефірі Одержаний розчин сушили над сульфатом Мас-спектрометрія 551 (М+Н)+ магнію та випарювали з одержанням смоли ШляПриклад 43 хом гель-хроматографування з елююванням сумі(Е)-2'-(бензилкарбамоіл)-2^)-[1(3)шшю дихлорметану/метанолу (19 1) одержали (пдроксикарбамоіл)-4-феніл-3-бутеніл]-4-метил-2'0,02г (Е)-2'-(етилкарбамоіл)-2(Р)-[1 (S)фенілвалеропдразид (пдроксикарбамоіл)-4-феніл-3-бутеніл]-4-метил-2'0,17г (E)-2'-(6eH3HnKap6aM0MT)-2(R)-[1(S)-{(0фенілвалеропдразиду у вигляді твердої речовини трет-бутилдиметилсиліл)-пдроксикарбамоіл}-4білого кольору феніл-3-бутеніл]-4-метил-2'-фенілвалеропдразиду перемішували у 5мл суміші оцтової кислоМас-спектрометрія 467 (М+Н)+ ти/водил'етрапдрофурану (31 1) впродовж 1,5 Високоефективна рідинна хроматографія години при кімнатній температурі Згаданий розГрадієнтне елюювання за допомогою розчиннику чинник випарювали, одержаний залишок змішуваА, який включає 40% розчиннику В, з подальшим ли з діетиловим ефіром з одержанням 0,03г (Е)-2'підвищенням вмісту розчиннику В до 60% впро(бензилкарбамоіл)-2^)-[1(3)-(пдроксикарбамоіл)довж 15 хвилин, швидкість потоку 1мл/хвилину 4-феніл-3-бутеніл]-4-метил-2'Час утримання 11,80 хвилини Розчинник А фенілвалеропдразиду у вигляді твердої речовини ЬІ2О/0,1% TFA (тетрафтороцтова кислота), розбілого кольору чинник В СНзСІ\І/0,085% тетрафтороцтової кислоти Тип колонки HYPERPEP 300A Тонкошарова хроматографія дихлорметан/метанол (3 1) Відношення затримання Rf = (Е)-2'-(етилкарбамоіл)-2(Р)-[1(3)-[(тетрапдро0,43 2(РЗ)-піранілокси)карбамоіл]-4-феніл-3-бутеніл]-4метил-2'-фенілвалеропдразид, який було викорисМас-спектрометрія 529 (М+Н)+ тано як вихідний матеріал, одержали у наведений Високоефективна рідинна хроматографія далі спосіб Градієнтне елюювання за допомогою розчиннику А, який включає 5% розчиннику В, з подальшим (і) 0,8Г (E)-2(R)-[1 (3)-трет-бутоксикарбоніл-4підвищенням вмісту розчиннику В до 95% впрофеніл-3-бутеніл]-4-метил-2'-фенілвалеропдразиду, довж 15 хвилин, швидкість потоку 1мл/хвилину який було одержано за описом, який наведено у Час утримання 13,14 хвилини Розчинник А Прикладі 2, частина (їм), у 8мл сухого дихлорметаЬІ2О/0,1% TFA (тетрафтороцтова кислота), розну нагрівали при температурі 0°С у атмосфері азочинник В СНзСН/0,085% тетрафтороцтової кислоту з 0,88мл етилізоціанату і одержану суміш перети Тип колонки HYPERPEP 300A мішували впродовж ночі при кімнатній 53 58561 (Е)-2'-(бензилкарбамоіл)-2^)-[1(3)-{(О-третбутилдиметилсиліл)-пдроксикарбамоіл}-4-феніл-3бутеніл]-4-метил-2'-фенілвалеропдразид, який було використано як вихідний матеріал, одержали у наведений далі спосіб (Е)-2'-(бензилкарбамоіл)-2(Р)-[1(3)-карбокси-4феніл-3-бутеніл]-4-метил-2'-фенілвалеропдразид було одержано у спосіб, аналогічний способу, опис якого наведено у Прикладі 42 (і)-(м) 0,72г карбонової кислоти, яку було одержано у попередньому параграфі, розчиняли у 2мл диметилформаміду, який було охолоджено до температури 0°С, та обробляли 1,0г О-(третбутилдиметилсиліл)пдроксиламіну, 0,2мл Nетилморфоліну та 0,3г пдрохлориду 1-етил-3-(3диметиламшопропіл)-карбодиіміду Одержану суміш перемішували при кімнатній температурі впродовж ночі та випарювали Одержаний залишок розчиняли у дихлорметані, послідовно промивали 5% розчином гідрокарбонату натрію, водою, 2М хлористоводневою кислотою, водою, 5% розчином гідрокарбонату натрію та насиченим розчином хлориду натрію, сушили над сульфатом магнію та випарювали з одержанням напівтвердої маси брунатного кольору Шляхом гельхроматографування з елююванням сумішшю дихлорметану/метанолу (331) з подальшим змішуванням з сумішшю етилу/гексану одержали 0,19г (Е)-2'-(бензилкарбамоіл)-2(Р)-[1(3)-{(О-третбутилдиметилсиліл)пдроксикарбамоіл}-4-феніл-3бутеніл]-4-метил-2'-фенілвалеропдразиду у вигляді твердої речовини Тонкошарова хроматографія дихлорметан/метанол (9 10) Відношення затримання Rf = 0,65 Приклад 44 (Е)-2'-(циклогексил)-2(Р)-[1 (S)(пдроксикарбамоіл)-4-феніл-3-бутеніл]-2'(метансульфоніл)-4-метилвалеропдразид 0,09г (Е)-2'-циклогексил-2^)-[1 (S)-{(0-4метоксибензил)}-пдроксикарбамоіл)-4-феніл-3бутеніл]-2'(метансульфоніл)-4метилвалеропдразиду розчиняли у суміші 2,5мл дихлорметану, 0,35мл трифтороцтової кислоти та 0,1мл анізолу при температурі 0°С Одержану суміш перемішували впродовж 6 годин при кімнатній температурі, витримували при температурі 4°С впродовж ночі, після чого випарювали ДВІЧІ додавали по Юмл толуолу і одержану суміш кожного разу випарювали Внаслідок змішування одержаного залишку з діетиловим ефіром одержали 0,06г (Е)-2'-циклогексил-2(Р)-[1(3)-(пдроксикарбамоіл)4-феніл-3-бутеніл]-2'-(метансульфоніл)-4метилвалеропдразиду у вигляді твердої речовини білого кольору Мас-спектрометрія 480 (М+Н)+ Високоефективна рідинна хроматографія Градієнтне елюювання за допомогою розчиннику А, який включає 5% розчиннику В, з подальшим підвищенням вмісту розчиннику В до 95% впродовж 15 хвилин, швидкість потоку 1мл/хвилину Час утримання 12,39 хвилини Розчинник А ЬІ2О/0,1% TFA (тетрафтороцтова кислота), розчинник В СНзСІ\І/0,085% тетрафтороцтової кислоти Тип колонки HYPERPEP 300A (E)-2'-4HmoreKCHn-2(R)-[1(S)-{(O-4 54 метоксибензил)}пдроксикарбамоіл)-4-феніл-3бутеніл]-2'(метансульфоніл) -4метилвалеропдразид, який було використано як вихідний матеріал, одержали у наведений далі спосіб (і) РОЗЧИН 10Г (E)-2(R)-[1(S)-(TpeT бутоксикарбоніл)-4-феніл-3-бутеніл]-4метилвалеріанової кислоти у ЮОмл дихлорметану обробляли при температурі 0°С 0,61 г 4диметиламшопіридину, 6,1г 1-етил-3-(3диметиламшопропіл)карбодиіміду та 2,4мл метанолу Одержану суміш перемішували при температурі 0°С впродовж 1 години, витримували з нагріванням до кімнатної температури, додатково перемішували впродовж 3 годин, після чого випарювали Одержаний залишок у діетиловому ефірі послідовно промивали 2М хлористоводневою кислотою, водою та 5% розчином гідрокарбонату натрію, сушили над сульфатом магнію та випарювали з одержанням масла брунатного кольору Шляхом гель-хроматографування з елююванням сумішшю гексану/діетилового ефіру (9 1) з наступним випарюванням одержали 6,9г діефіру Згаданий діефір розчиняли у суміші 45мл дихлорметану та 45мл трифтороцтової кислоти і одержаний розчин перемішували впродовж 2 годин з подальшим випарюванням Сліди трифтороцтової кислоти видаляли шляхом додавання та випарювання толуолу (2х30мл) і одержаний продукт сушили m vacua з одержанням сукцинатмонометилового ефіру у вигляді твердої речовини жовтуватобрунатного кольору (м) 2,0г сукцинатмонометилового ефіру, який було одержано перед тим, розчиняли у 20мл диметилформаміду і одержаний розчин охолоджували до температури 0°С Додавали 1,06г гідрату пдроксибензотриазолу, 1,5г пдрохлориду 1-етил3-(3-диметиламшопропіл)-карбодиіміду, 1,7мл Nетилморфоліну та 1,5г О-(4метоксибензил)пдроксиламшу Одержану суміш перемішували впродовж 0,5 години при температурі 5°С та впродовж 2,5 години при кімнатній температурі, після чого випарювали під високим вакуумом Одержаний залишок у етилацетаті послідовно промивали 5% розчином гідрокарбонату натрію, 2М хлористоводневою кислотою, водою, 5% розчином гідрокарбонату натрію та насиченим розчином хлориду натрію, сушили над сульфатом магнію та випарювали з одержанням твердої речовини Шляхом гель-хроматографування з елююванням сумішшю етилацетату/гексану (1 4) одержали 1,83г метил (E)-2(R)-[1(S)-{(0-(4метоксибензил)}пдроксикарбамоіл)-4-феніл-3бутеніл]-3-метилвалерату у вигляді масла, яке стверджувалось при відстоюванні з одержанням твердої речовини білого кольору Мас-спектрометрія 440 (М+Н)+ (їм) 3,45МЛ розчину триметилалюмінію (2М у гексані) прикраплювали до суспензії 1,03г циклогексилпдразину у 5мл дихлорметану у атмосфері азоту Спостерігалось надзвичайно енергійне газоутворення і згадана тверда речовина поступово розчинялась впродовж 1 години з одержанням розчину А (iv) 0,44г метилового ефіру, який було одержано ВІДПОВІДНО до (м), розчиняли у 4мл дихлор 55 58561 метану, додавали розчин А і одержану суміш нагрівали на водяній бані впродовж 6 годин (температура бані 45°С) Одержаний розчин охолоджували, вкрай обережно обробляли надлишком 2М хлористоводневої кислоти (надзвичайно активне газоутворення), після чого ДВІЧІ екстрагували 20мл етилацетату кожного разу Одержану органічну фазу послідовно промивали 5% розчином гідрокарбонату натрію, водою та насиченим розчином хлориду натрію, сушили над сульфатом магнію та випарювали з одержанням смоли жовтого кольору Шляхом гель-хроматографування з елююванням сумішшю дихлорметану/метанолу (24 1) одержали 0,19г гідразиду Мас-спектрометрія 522 (М+Н)+ (v) 0,11г згаданого гідразиду, який було одержано ВІДПОВІДНО до (iv), суспендували у суміші 5мл дихлорметану та 0,026мл піридину у атмосфері азоту Додавали 0,046г метансульфанпдриду і одержану суміш перемішували впродовж 3 годин при кімнатній температурі з подальшим розбавленням 15мл дихлорметану Одержаний розчин послідовно промивали 2М хлористоводневою кислотою, водою та 5% розчином гідрокарбонату натрію, сушили над сульфатом магнію та випарювали з одержанням піни білого кольору Внаслідок змішування з діетиловим ефіром одержали 0,095г (E)-2'-4HmoreKCHn-2(R)-[1(S)-{(O-(4метоксибензил)}пдроксикарбамоіл)-4-феніл-3бутеніл]-2'-(метансульфоніл)-4метилвалеропдразиду у вигляді твердої речовини білого кольору Мас-спектрометрія 600 (М+Н)+ Приклад 45 (Е)-2(Р)-[1(3)-(пдроксикарбамоіл)-4-феніл-3бутеніл]-2'-ізобутил-2'-(метансульфоніл-4метилвалеропдразид Розчин 0,246г (E)-2(R)-[1(S)-[(Terpariflpo-2(RS)піранілокси)карбамоіл]-4-феніл-3-бутеніл]-2'ізобутил-2'-(метансульфоніл)-4метилвалеропдразиду у суміші Юмл метанолу та 2мл дихлорметану обробляли 0,006мл метансульфонової кислоти Одержану суміш перемішували впродовж 3 годин при кімнатній температурі, після чого згаданий розчинник випарювали Одержаний залишок розподіляли поміж етилацетатом та водою Одержаний етилацетатний шар сушили над безводним сульфатом магнію і розчинник випарювали Одержаний залишок змішували з гексаном з одержанням 0,119г (E)-2(R)-[1(S)(пдроксикарбамоіл)-4-феніл-3-бутеніл]-2'-ізобутил2'-(метансульфоніл)-4-метилвалеропдразиду у вигляді твердої речовини білого кольору Мас-спектрометрія 454 (М+Н)+ Високоефективна рідинна хроматографія Градієнтне елюювання за допомогою розчиннику А, який включає 5% розчиннику В, з подальшим підвищенням вмісту розчиннику В до 95% впродовж 15 хвилин, швидкість потоку 1мл/хвилину Час утримання 12,17 хвилини Розчинник А ЬІ2О/0,1% TFA (тетрафтороцтова кислота), розчинник В СНзСІ\І/0,085% тетрафтороцтової кислоти Тип колонки HYPERPEP 300A (E)-2(R)-[1(S)-[(TeTpanflpo-2(RS)піранілокси)карбамоіл]-4-феніл-3-бутеніл]-2'ізобутил-2'-(метансульфоніл)-4 56 метилвалеропдразид, який було використано як вихідний матеріал, одержали у наведений далі спосіб (і) РОЗЧИН 0,60Г (E)-2(R)-[1(S)-(TpeT бутоксикарбоніл)-4-феніл-3-бутеніл]-4метилвалеропдразиду, 0,166мл ізобутиральдепду та кристалічної 4-толуолсульфоновоі кислоти у Юмл дихлорметану перемішували впродовж 1 години з 4 L молекулярними ситами Одержану суміш фільтрували, згаданий розчинник випарювали та заміняли Юмл метанолу Додавали декілька кристалів бромкрезолового зеленого з одержанням розчину жовтого кольору До одержаного розчину невеликими порціями додавали 0,116г ціаноборопдриду натрію Жовтий колір згаданого розчину підтримували шляхом періодичного додавання 4М розчину хлористого водню у діоксані Метанол випарювали і одержаний залишок розподіляли поміж дихлорметаном та 5% водним розчином гідрокарбонату натрію Одержаний водний шар ДВІЧІ промивали дихлорметаном, після чого змішані органічні шари ДВІЧІ промивали 5% водним розчином гідрокарбонату натрію Одержаний дихлорметановий шар сушили над безводним сульфатом магнію і розчинник випарювали Одержаний залишок очищали шляхом гельхроматографування під вакуумом з елююванням сумішшю гексану/етилацетату (7 3) Одержали 0,312г (E)-2(R)-[1(S)-(TpeT-6yTOKCHKap6oHin)-4феніл-3-бутеніл]-2'-ізобутил-4метилвалеропдразиду у вигляді твердої речовини білого кольору Мас-спектрометрія 417(М+Н) + (м) У спосіб, аналогічний способу, опис якого наведено у Прикладі 2, частини (iv) та (v), з започаткуванням з 0,435г (E)-2(R)-[1 (Б)-(третбутоксикарбоніл)-4-феніл-3-бутеніл]-2'-ізобутил-4метилвалеропдразиду, було одержано 0,249г (Е)2(R)-[1 (S)-[(TeTpariflpo-2(RS)піранілокси)карбамоіл]-4-феніл-3-бутеніл]-2'ізобутил-2'-(метансульфоніл)-4метилвалеропдразиду у вигляді твердої речовини білого кольору Мас-спектрометрія 538 (М+Н)+ Приклад 46 (Е)-2^)-[1(3)-(пдроксикарбамоіл)-4-феніл-3бутеніл]-2'-ізопропіл-2'-(метансульфоніл)-4метилвалеропдразид У спосіб, аналогічний способу, опис якого наведено у Прикладі 45, але з використанням ацетону замість ізобутиральдепду на етапі (і), було одержано (Е)-2^)-[1(3)-(пдроксикарбамоіл)-4-феніл3-бутеніл]-2'-ізопропіл-2'-(метансульфоніл)-4метилвалеропдразид у вигляді твердої речовини білого кольору Мас-спектрометрія 440 (М+Н)+ Високоефективна рідинна хроматографія Градієнтне елюювання за допомогою розчиннику А, який включає 5% розчиннику В, з подальшим підвищенням вмісту розчиннику В до 95% впродовж 15 хвилин, швидкість потоку 1мл/хвилину Час утримання 11,16 хвилини Розчинник А ЬІ2О/0,1% TFA (тетрафтороцтова кислота), розчинник В СНзСІ\І/0,085% тетрафтороцтової кислоти Тип колонки HYPERPEP 300A 58561 58 57 Високоефеїсгивна рідинна хроматографія вмісту розчиннику В до 80% впродовж 18 хвилин, Градієнтне елюювання за допомогою розчиннику швидкість потоку 1мл/хвилину Час утримання А, який включає 5% розчиннику В, з подальшим 17,35 хвилини Розчинник А Н2О/0,1% TFA (тетпідвищенням вмісту розчиннику В до 95%, впрорафтороцтова кислота), розчинник В довж 15 хвилин, СНзСІ\І/0,085% тетрафтороцтової кислоти Тип колонки HYPERPEP 300A Приклад 47 (Е)-2(Р)-[1(3)-(пдроксикарбамоіл)-4-феніл-3Приклад 50 бутеніл]-2'-циклопентил-2'-(метансульфоніл)-4(E)-2(R)-[1(S)-(riflpoKCHKap6aMoin)-4метилвалеропдразид (метансульфоніл)-4-метилвалеропдразид У спосіб, аналогічний способу, опис якого наУ спосіб, аналогічний способу, опис якого наведено у Прикладі 45, але з використанням цикловедено у Прикладі 45, але з використанням 1-третпентанону замість ізобутиральдепду на етапі (і), бутоксикарбоніл-4-піперидону замість ізобутирабуло одержано (E)-2(R)-[1(S)-(riflpoKCHKap6aMoin)льдепду на етапі (і), було одержано (E)-2(R)-[1 (S)4-феніл-3-бутеніл]-2'-циклопентил-2'(пдроксикарбамоіл)-4-феніл-3-бутеніл]-2'-(4(метансульфоніл)-4-метилвалеропдразид у вигляпіперидиніл)-2'-(метансульфоніл)-4ді твердої речовини білого кольору метилвалеропдразид у вигляді твердої речовини білого кольору Мас-спектрометрія 466 (М+Н)+ Високоефективна рідинна хроматографія Мас-спектрометрія 481 (М+Н)+ Градієнтне елюювання за допомогою розчиннику Високоефективна рідинна хроматографія А, який включає 20% розчиннику В, впродовж 2 Прискорене градієнтне елюювання за допомогою хвилин, з подальшим підвищенням вмісту розчинрозчиннику А, який включає 20% розчиннику В, нику В до 80% впродовж 18 хвилин, швидкість повпродовж 2 хвилин, з подальшим підвищенням току 1мл/хвилину Час утримання 17,57 хвилини вмісту розчиннику В до 80% впродовж 18 хвилин, Розчинник А Н2О/0,1% TFA (тетрафтороцтова швидкість потоку 1мл/хвилину Час утримання кислота), розчинник В СНзСІ\І/0,085% тетрафто11,39 хвилини Розчинник А Н2О/0,1% TFA (тетроцтової кислоти Тип колонки HYPERPEP 300A рафтороцтова кислота), розчинник В СНзСІ\І/0,085% тетрафтороцтової кислоти Тип Приклад 48 колонки HYPERPEP 300A (Е)-2(Р)-[1(3)-(пдроксикарбамоіл)-4-феніл-3бутеніл]-2'-(4-тетрапдропіраніл)-2'Приклад 51 (метансульфоніл)-4-метилвалеропдразид (Е)-2^)-[1(3)-(пдроксикарбамоіл)-4-феніл-3бутеніл]-2'-(ізобутил)-2'-(ізопентаноіл)-4У спосіб, аналогічний способу, опис якого наметилвалеропдразид ведено у Прикладі 45, але з використанням тетрапдро-4Н-піран-4-ону замість ізобутиральдепду на У спосіб, аналогічний способу, опис якого наетапі (і), було одержано (E)-2(R)-[1 (S)ведено у першому параграфі Прикладу 2, з запо(пдроксикарбамоіл)-4-феніл-3-бутеніл]-2'-(4чаткуванням з 0,097г (E)-2(R)-[1 (3)-[(тетрапдротетрапдропіраніл)-2'-(метансульфоніл)-42^3)-піранілокси)карбамоіл]-4-феніл-3-бутеніл]метилвалеропдразид у вигляді твердої речовини 2'-(ізобутил)-2'(ізопентаноіл)-4білого кольору метилвалеропдразиду, було одержано 0,047г (Е)2(R)-[1 (3)-(пдроксикарбамоіл)-4-феніл-3- бутеніл]Мас-спектрометрія 482 (М+Н)+ 2'-(ізобутил)-2'-(ізопентаноіл)-4Високоефективна рідинна хроматографія метилвалеропдразиду у вигляді твердої речовини Прискорене градієнтне елюювання за допомогою білого кольору розчиннику А, який включає 20% розчиннику В, впродовж 2 хвилин, з подальшим підвищенням Мас-спектрометрія 460 (М+Н)+, 482 (M+Na)+ вмісту розчиннику В до 80% впродовж 18 хвилин, Високоефективна рідинна хроматографія швидкість потоку 1мл/хвилину Час утримання Градієнтне елюювання за допомогою розчиннику 13,72 хвилини Розчинник А Н2О/0,1% TFA (тетА, який включає 5% розчиннику В, з подальшим рафтороцтова кислота), розчинник В підвищенням вмісту розчиннику В до 95% впроСНзСІ\І/0,085% тетрафтороцтової кислоти Тип довж 15 хвилин, швидкість потоку 1мл/хвилину колонки HYPERPEP 300A Час утримання 12,79 хвилини Розчинник А Н2О/0,1% TFA (тетрафтороцтова кислота), розПриклад 49 чинник В СНзСІ\І/0,085% тетрафтороцтової кисло(Е)-2(Р)-[1(3)-(пдроксикарбамоіл)-4-феніл-3ти Тип колонки HYPERPEP 300A бутеніл]-2'-(4-тетрапдротюпіраніл)-2'(метансульфоніл)-4-метилвалеропдразид (E)-2(R)-[1(S)-[(TeTPariflpo-2(RS)піранілокси)карбамоіл]-4-феніл-3-бутеніл]-2'У спосіб, аналогічний способу, опис якого на(ізобутил)-2'-(ізопентаноіл)-4ведено у Прикладі 45, але з використанням тетраметилвалеропдразид, який було використано як пдротюпіран-4-ону замість ізобутиральдепду на вихідний матеріал, одержали у наведений далі етапі (і), було одержано (E)-2(R)-[1 (S)спосіб (пдроксикарбамоіл)-4-феніл-3-бутеніл]-2'-(4тетрапдротюпіраніл)-2'-(метансульфоніл)-4(і) РОЗЧИН 0,25Г (E)-2(R)-[1(S)-(TpeTметилвалеропдразид у вигляді твердої речовини бутоксикарбоніл)-4-феніл-3-бутеніл]-2'-ізобутил-4білого кольору метилвалеропдразиду, 0,061 мл піридину та кристалічного 4-диметиламшопіридину у бмл дихлорМас-спектрометрія 498 (М+Н)+ метану охолоджували до температури 0°С у атмоВисокоефективна рідинна хроматографія сфері азоту Додавали 0,091 мл Прискорене градієнтне елюювання за допомогою ізопентаноілхлориду і одержану реакційну суміш розчиннику А, який включає 20% розчиннику В, нагрівали до кімнатної температури Після перевпродовж 2 хвилин, з подальшим підвищенням 59 58561 мішування впродовж 2 годин при кімнатній температурі одержану реакційну суміш розбавляли дихлорметаном та промивали спочатку 2М водним розчином хлористоводневої кислоти, потім розсолом Одержану дихлорметанову фазу сушили над безводним сульфатом магнію та розчинник випарювали Після ЦЬОГО одержаний залишок розчиняли у Юмл 20% розчину трифтороцтової кислоти у дихлорметані та перемішували при кімнатній температурі впродовж 2 годин Згадані розчинники випарювали і одержаний залишок очищали гельхроматографуванням під вакуумом з елююванням 1% розчином метанолу у дихлорметані Одержали 0,16г (Е)-2^)-[1(3)-(карбокси)-4-феніл-3-бутеніл]2'-(ізобутил)-2'-(ізопентаноіл)-4метилвалеропдразиду у вигляді піни білого кольоРУ Мас-спектрометрія 445 (М+Н)+ (м) У спосіб, аналогічний способу, опис якого наведено у Прикладі 2, частина (v), з започаткуванням з 0,16г (E)-2(R)-[1(S)-(Kap6oKCH)-4-4>eHin-3бутеніл]-2'-(ізобутил)-2'-(ізопентаноіл)-4метилвалеропдразиду, було одержано 0,097г (Е)2(R)-[1 (S)-[(TeTpariflpo-2(RS)піранілокси)карбамоіл]-4-феніл-3-бутеніл]-2'(ізобутил)-2-(ізопентаноіл)-4метилвалеропдразиду у вигляді твердої речовини білого кольору Мас-спектрометрія 544 (М+Н)+ Приклад 52 (Е)-2^)-[1(3)-(пдроксикарбамоіл)-4-феніл-3бутеніл]-2'-(ізобутил)-2'-(циклогексанкарбоніл)-4метилвалеропдразид У спосіб, аналогічний способу, опис якого наведено у Прикладі 51, але з використанням циклогексанкарбонілхлориду замість ізопентаноілхлориду на етапі (і), було одержано (E)-2(R)-[1(S)(пдроксикарбамоіл)-4-феніл-3-бутеніл]-2'(ізобутил)-2'-(циклогексанкарбоніл)-4метилвалеропдразид у вигляді твердої речовини білого кольору Мас-спектрометрія 486 (М+Н)+ Високоефективна рідинна хроматографія Прискорене градієнтне елюювання за допомогою розчиннику А, який включає 35% розчиннику В, впродовж 5 хвилин, з подальшим підвищенням вмісту розчиннику В до 70% впродовж 15 хвилин, швидкість потоку 1мл/хвилину Час утримання 15,44 хвилини Розчинник А Н2О/0,1% TFA (тетрафтороцтова кислота), розчинник В СНзСІ\І/0,085% тетрафтороцтової кислоти Тип колонки HYPERPEP300A Приклад 53 (Е)-2^)-[1(3)-(пдроксикарбамоіл)-4-феніл-3бутеніл]-4-метил-І\І-(2 6дюксопіперидино)валерамід У спосіб, аналогічний способу, опис якого наведено у першому параграфі Прикладу 45, з започаткуванням з 0,095г (E)-2(R)-[1 (3)-[(тетрапдро2^3)-піранілокси)карбамоіл]-4-феніл-3-бутеніл]-4метил-г\І-(2,6-дюксопіперидино)валераміду, одержали 0,027г (E)-2(R)-[1 (3)-(пдроксикарбамоіл)-4феніл-3-бутеніл]-4-метил-І\І-(2,6дюксопіперидино)валераміду у вигляді твердої речовини білого кольору Мас-спектрометрія 416(М+Н) + 60 Високоефективна рідинна хроматографія Прискорене градієнтне елюювання за допомогою розчиннику А, який включає 20% розчиннику В, впродовж 5 хвилин, з подальшим підвищенням вмісту розчиннику В до 70%, впродовж 15 хвилин, швидкість потоку 1 мл/хвилину Розчинник А ЬІ2О/0,1% TFA (тетрафтороцтова кислота), розчинник В СНзСН/0,085% тетрафтороцтової кислоти Тип колонки HYPERPEP 300A (E)-2(R)-[1(S)-[(TeTPariflpo-2(RS)піранілокси)карбамоіл]-4-феніл-3-бутеніл]-4метил-г\І-(2,6-дюксопіперидино)валерамід, який було використано як вихідний матеріал, одержали у наведений далі спосіб (і) РОЗЧИН 1,0Г (E)-2(R)-[1(S)-(TpeT бутоксикарбоніл)-4-феніл-3-бутеніл]-4метилвалеропдразиду, 0,35г глутаранпдриду та 0,85мл триетиламшу у ЗОмл сухого толуолу нагрівали у колбі зі зворотним холодильником при температурі перегонки у атмосфері азоту впродовж 7 годин Одержану суміш охолоджували до кімнатної температури та промивали 2М водним розчином хлористоводневої кислоти, 5% водним розчином гідрокарбонату натрію та розсолом Одержану органічну фазу сушили над безводним сульфатом магнію, після чого згаданий розчинник випарювали Одержаний залишок змішували з діетиловим ефіром з одержанням 0,623г (E)-2(R)-[1 (S)-(TpeTбутоксикарбоніл)-4-феніл-3-бутеніл]-4-метил-г\І(2,6-дюксопіперидино)валераміду у вигляді твердої речовини білого кольору Мас-спектрометрія 457 (М+Н)+ (м) У спосіб, аналогічний способу, опис якого наведено у Прикладі 2, частини (iv) та (v), з започаткуванням з 0,62г (E)-2(R)-[1 (Б)-(третбутоксикарбоніл)-4-феніл-3-бутеніл]-4-метил-г\І(2,6-дюксопіперидино)валераміду, одержали 0,095г (E)-2(R)-[1 (S)-TeTpariflpo-2(RS)піранілокси)карбамоіл]-4-феніл-3-бутеніл]-4метил-г\І-(2,6-дюксопіперидино)валераміду у вигляді твердої речовини білого кольору Мас-спектрометрія 500 (М+Н)+ Приклад 54 (Е)-І\І-(тетрапдро-1,2-Tia3HH-2-ur)-2(R)-[1 (S)(пдроксикарбамоіл)-4-феніл-3-бутеніл]-4метилвалераміду S,S-flioKCHfl У спосіб, аналогічний способу, опис якого наведено у першому параграфі Прикладу 45, з 0,048г (Е)-І\І-(тетрапдро-1,2-Tia3HH-2-ur)-2(R)-[1 (S)[(тетрапдро-2^3)-піранілокси)карбамоіл] -4феніл-3-бутеніл] -4-метилвалераміду S,S-flioKCHfly, одержали 0,01 г (Е)-І\І-(тетрапдро-1,2-тіазин-2-іл)2^)-[1(3)-(пдрокси-карбамоія)-4-феніл-3-бутеніл]4-метилвалераміду 8,8-дюксиду у вигляді твердої речовини білого кольору Мас-спектрометрія 438 (М+Н)+ (Е)-І\І-(тетрапдро-1,2-Tia3HH-2-ur)-2(R)-[1 (S)[(тетрапдро-2^3)-піранілокси)карбамоіл]-4-феніл3-бутеніл]-4-метилвалераміду S,S-flioKCHfl, який було використано як вихідний матеріал, одержали у наведений далі спосіб (і) РОЗЧИН 5,64Г трет-бутилового ефіру лейкокислоти та 3,6мл піридину у 40мл дихлорметану прикраплювали до розчину 6,0мл трифторметансульфанпдриду у 60мл дихлорметану у атмосфері азоту при температурі 0°С Через 10 хвилин одер
ДивитисяДодаткова інформація
Назва патенту англійськоюHydrazine derivatives
Назва патенту російськоюПроизводные гидразина
МПК / Мітки
МПК: C07D 333/38, A61P 21/00, A61P 19/02, C07D 239/26, A61K 31/18, A61K 31/382, C07D 277/82, C07D 239/42, A61K 31/421, A61K 31/404, C07D 277/56, C07D 233/72, C07D 309/30, C07D 277/30, C07D 295/14, C07D 211/38, A61K 31/5375, C07D 295/18, A61K 31/167, A61K 31/4409, C07D 213/77, C07D 213/42, C07D 307/68, A61K 31/4468, C07D 305/00, A61K 31/44, C07D 215/38, C07C 259/00, C07C 311/49, C07D 335/00, C07D 307/81, A61K 31/4166, C07C 263/00, C07C 281/00, C07C 243/00, A61K 31/505, C07D 309/04, C07D 279/00, C07D 275/00, A61K 31/351, C07D 213/56, C07D 309/12, C07D 333/34, C07D 213/54, A61P 29/00, C07D 233/76, C07D 209/14, C07D 317/28, C07D 209/48, C07D 309/06, C07D 521/00, C07D 307/52, C07D 207/325, C07D 211/58, C07D 309/14, C07D 263/22
Мітки: гідразину, отримання, лікарський, спосіб, основі, засіб, похідні
Код посилання
<a href="https://ua.patents.su/60-58561-pokhidni-gidrazinu-sposib-kh-otrimannya-ta-likarskijj-zasib-na-kh-osnovi.html" target="_blank" rel="follow" title="База патентів України">Похідні гідразину, спосіб їх отримання та лікарський засіб на їх основі</a>
Попередній патент: Фунгіцидна суміш, спосіб боротьби з фітопатогенними грибами та засіб
Наступний патент: Спосіб кінцевого охолодження коксового газу
Випадковий патент: Спосіб визначення персистуючого вірусу грипу у віл-інфікованих осіб в міжепідемічний по грипу період