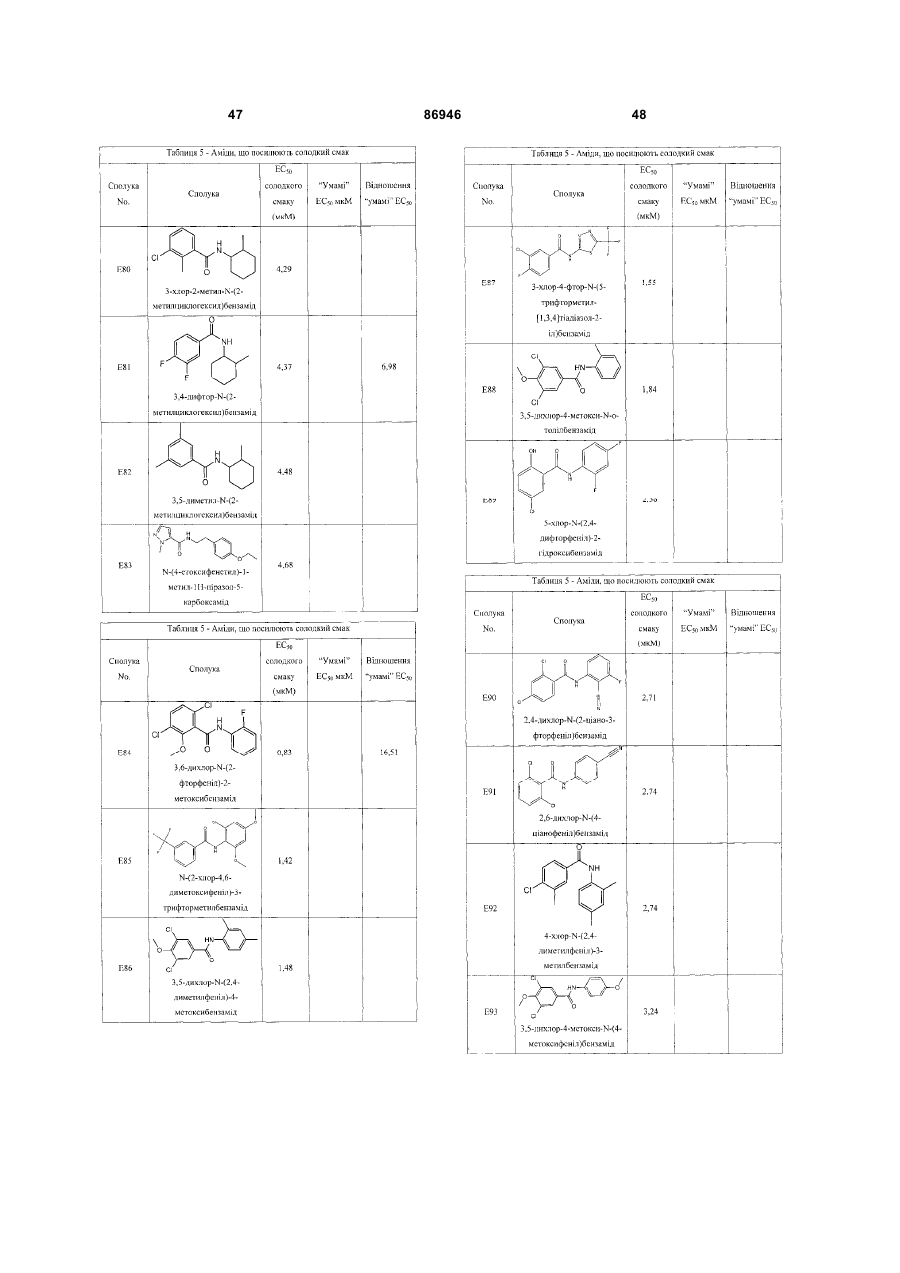
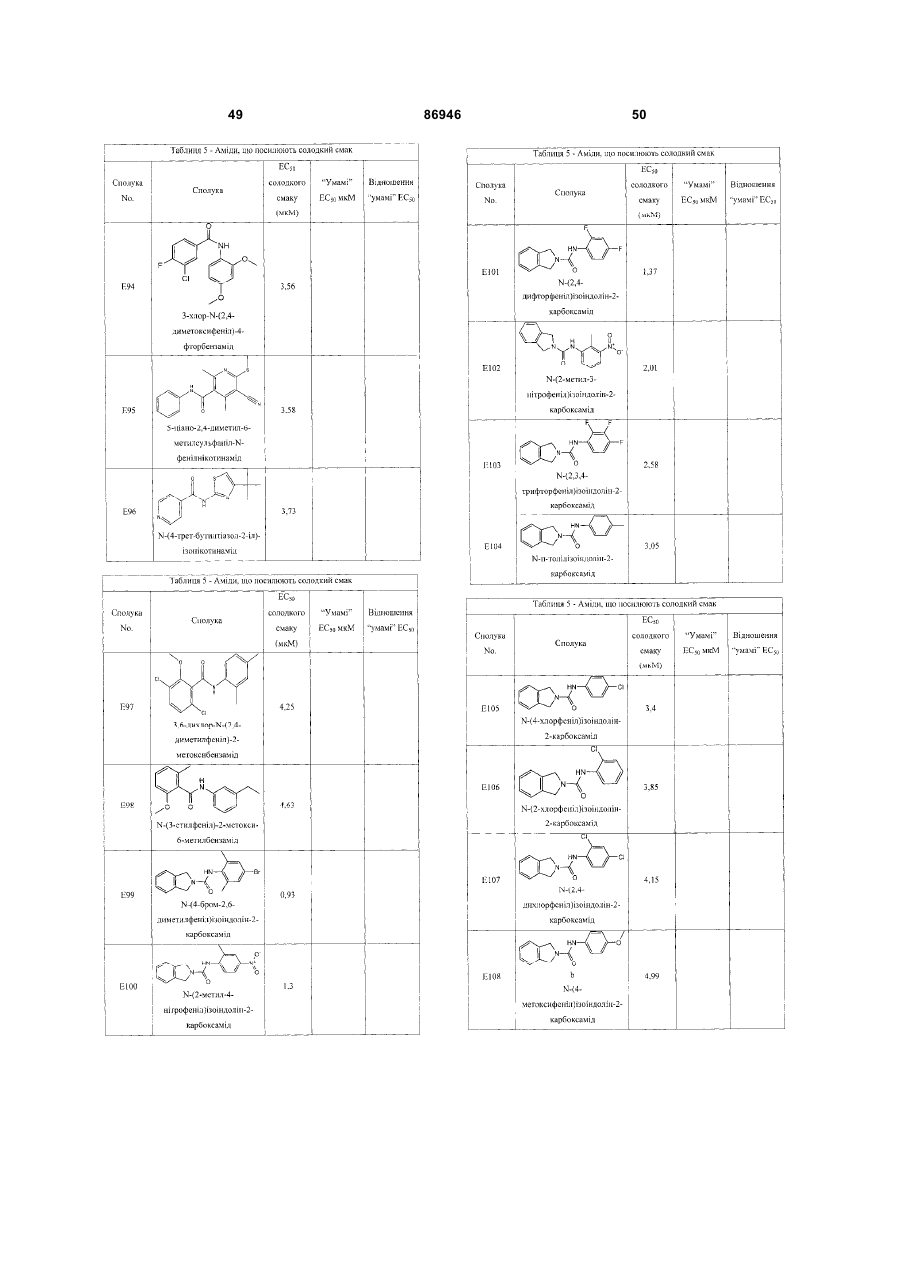
Гетероолігомерні смакові рецептори т1r, клітинні лінії, які експресують вказані рецептори, і смакові сполуки
Формула / Реферат
1. Неприродна сполука, яка специфічно зв'язується з рецептором T1R1/T1R3, що складається з hT1R1/hT1R3, і має ефективність як "умамі" смакового ароматизатора, підсилювача або модифікатора, що визначається за значенням ЕС50 менше 1мМ.
2. Сполука за п. 1, де відношення ЕС50 сполуки, яке визначене як відношення концентрації MSG до концентрації сполуки плюс MSG, необхідне для виникнення MSG доза-відповідь, менше 1.
3. Сполука за п. 1, де зниження ЕС50, як визначено за допомогою флуоресцентного аналізу, використовуючи апарат FLIPR, щонайменше двократне.
4. Сполука за п. 1, яка має активність, у порівнянні з максимальною активністю глютамату, як визначено за залежним від сполуки збільшенням флуоресценції, складає щонайменше 25 % у флуоресцентному аналізі з використанням апарата FLIPR.
5. Сполука за п. 1, що має таку ефективність, що щонайменше 10 з 100 клітин, трансфекованих рецептором, демонструють залежне від сполуки збільшення флуоресценції.
6. Сполука за п. 1, яка має таку ефективність, що кількість флуоресцентних клітин у відповіді на субмаксимальний рівень глютамату збільшується щонайменше вдвічі.
7. Сполука за п. 1, яка демонструє щонайменше 1,25-кратне збільшення відповіді клітин на субмаксимальний рівень глютамату, у порівнянні з єдиним підсолоджувачем, де відповідь вимірюють за флуоресценцією, рівнями кальцію, рівнями ІР3, рівнями цАМФ, зв'язуванням GTP![]() S або активністю репортерного гена.
S або активністю репортерного гена.
8. Харчовий або лікарський продукт, який містить сполуку за будь-яким з пп. 1-7.
9. Харчовий продукт за п. 8, де продукт вибраний з групи, що складається з: рідкого супу, дегідрованого або кулінарного продукту і напою.
10. Спосіб для модулювання гострого смаку харчового або медичного продукту, який включає
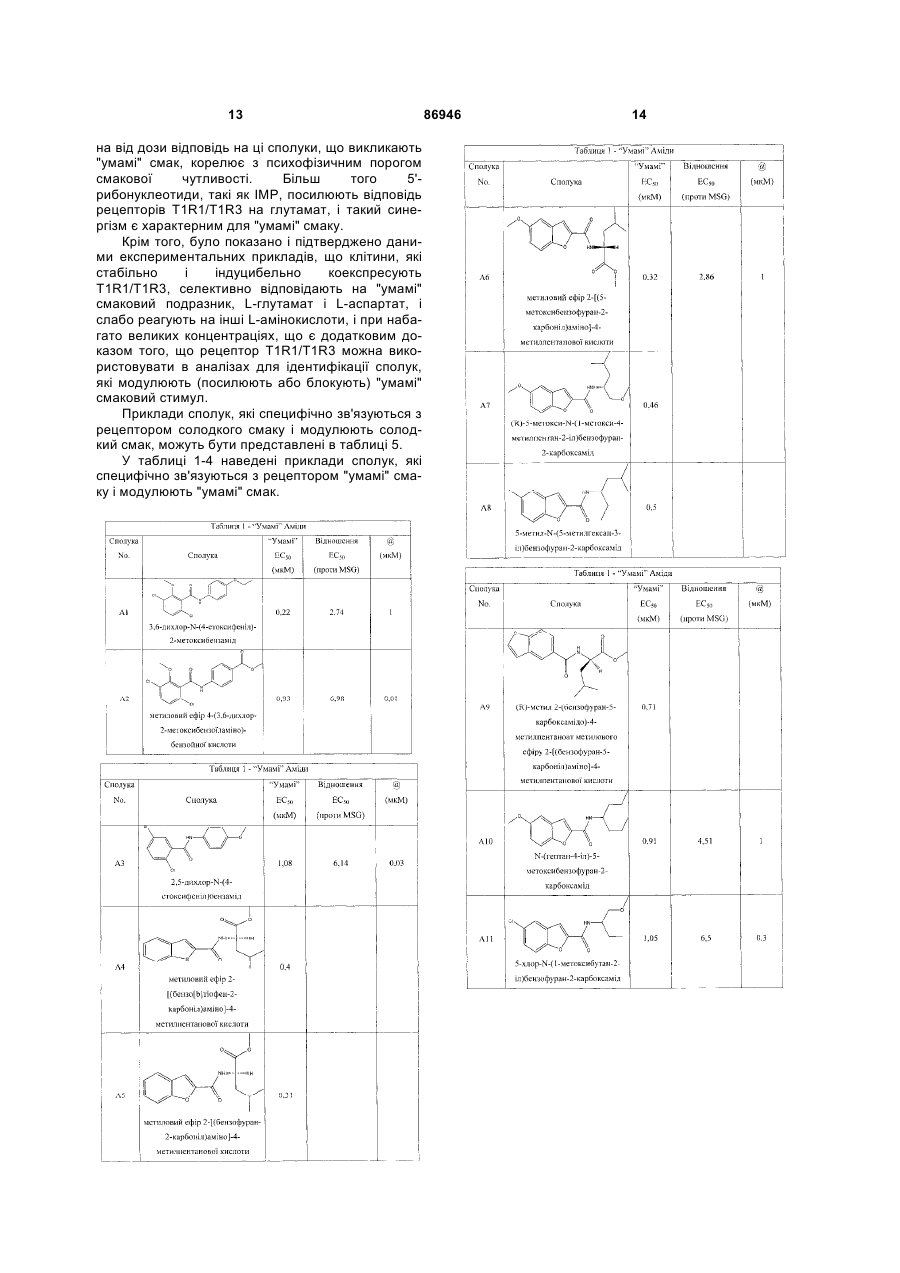
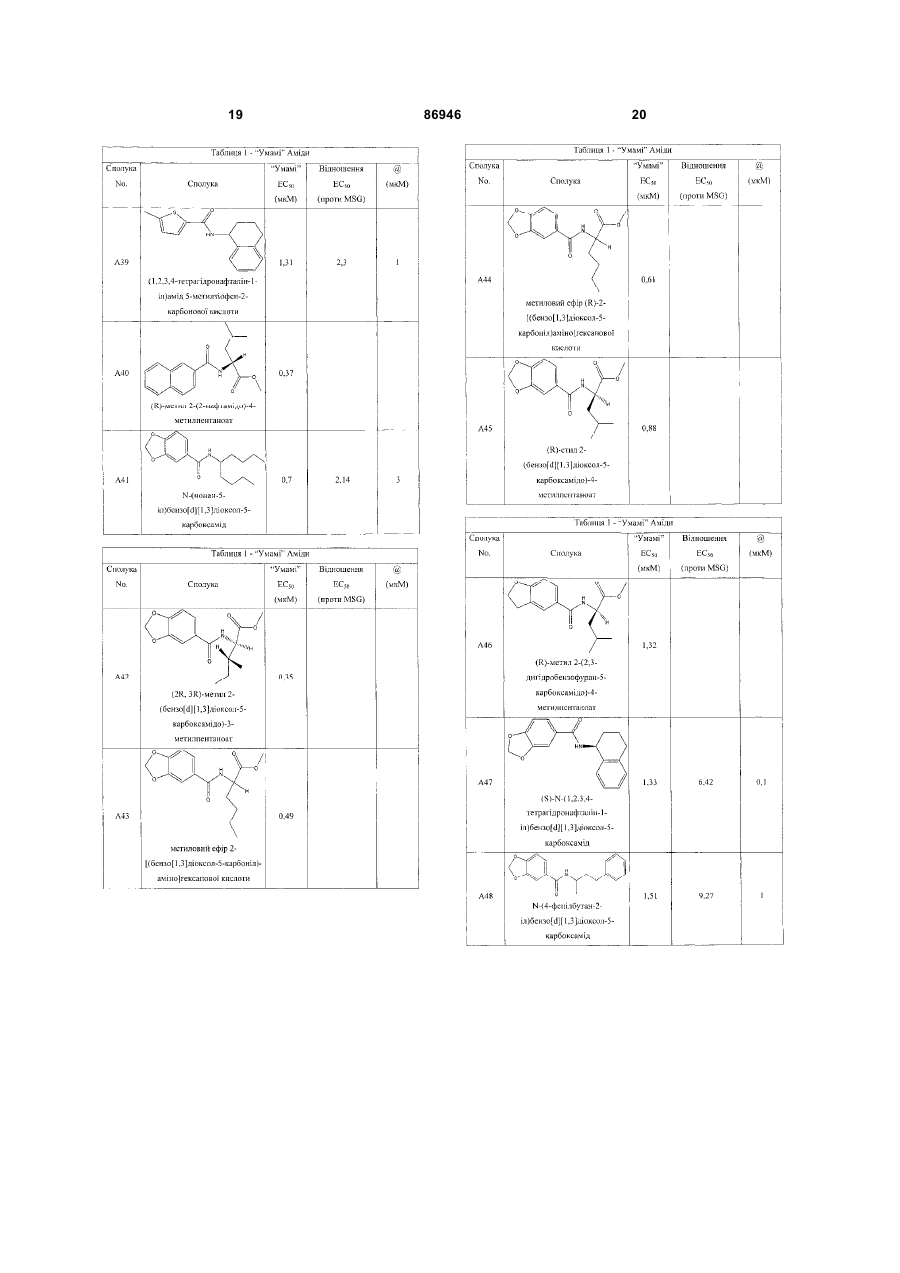
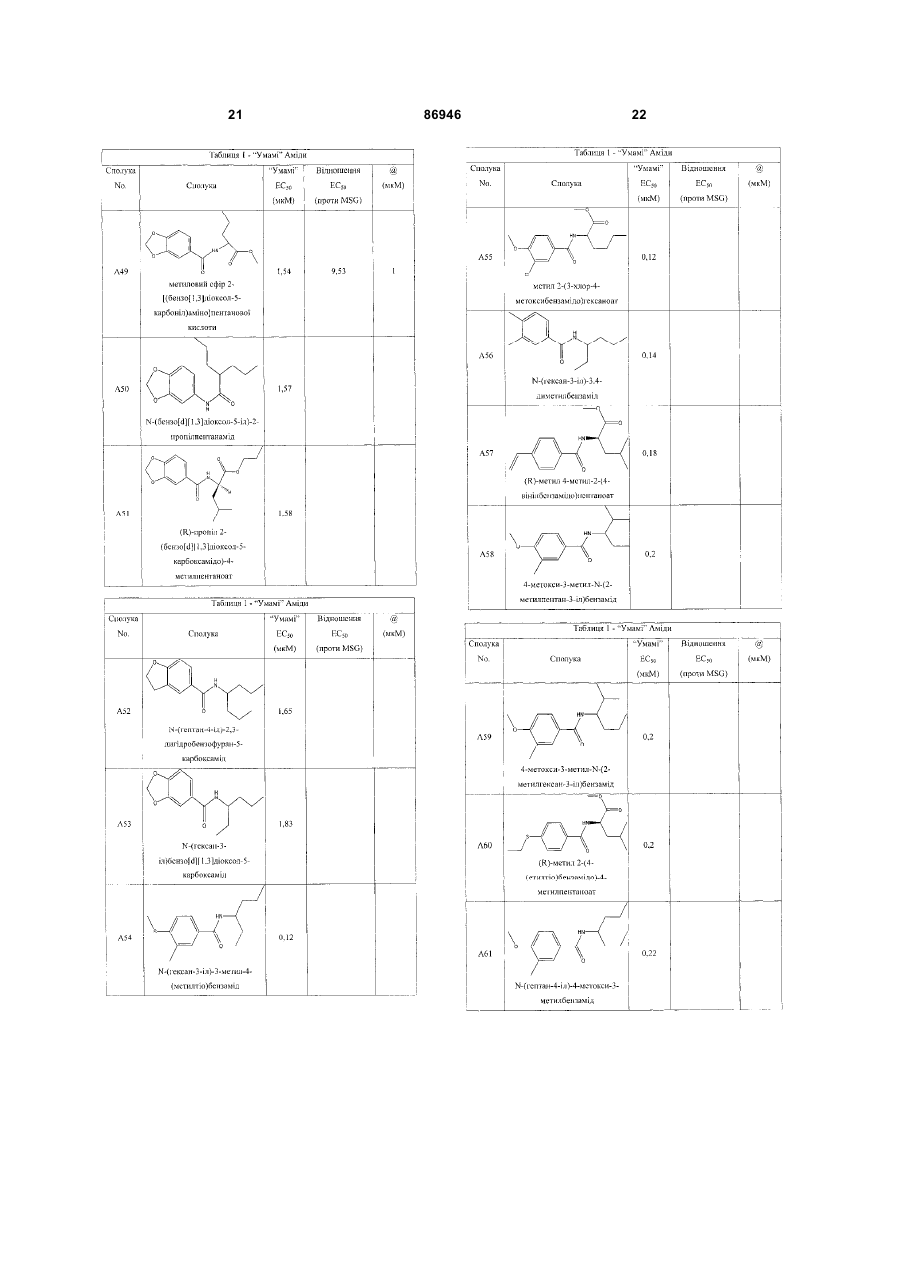
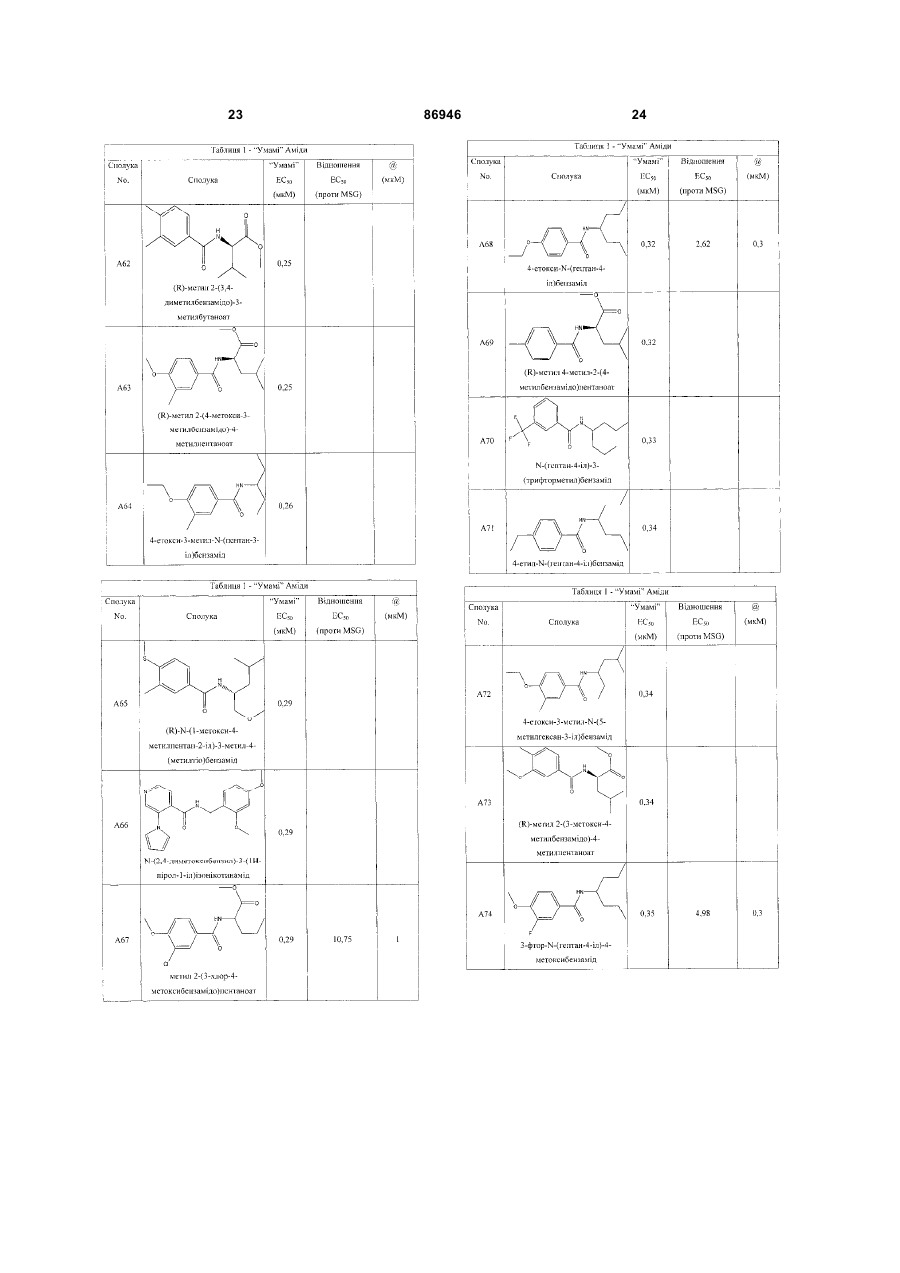
одержання щонайменше одного харчового або лікарського продукту або його попередника і об'єднання харчового або лікарського продукту або його попередника щонайменше з модулюючою гострий смак кількістю щонайменше однієї неприродної сполуки за будь-яким з пп. 1-7, або її придатної до їжі прийнятної солі, з одержанням, таким чином, модифікованого харчового або лікарського продукту, модулюючи, таким чином, гострий смак харчового або лікарського продукту.
11. Неприродна сполука, яка специфічно зв'язується з рецептором T1R2/T1R3, що складається з ht1R2/hT1R3, що має ефективність агоніста солодкого смаку, що визначається за значенням ЕС50менше 10 мкМ.
12. Сполука за п. 11, де сполука має розмір близько 12x5x5 ангстрем.
13. Сполука за п. 11 або 12, яка має одну або декілька наступних характеристик у клітині, яка одночасно експресує hT1R2 і hT1R3,
знижене ЕС50 у порівнянні з контролем щонайменше на 50 %,
підвищені рівні внутрішньоклітинного Са2+ щонайменше приблизно на 25 %,
підвищений внутрішньоклітинний цАМФ щонайменше приблизно на 25 %,
підвищений внутрішньоклітинний цГМФ щонайменше приблизно на 25 %,
підвищений внутрішньоклітинний ІР3 щонайменше приблизно на 25 % або
підвищений рівень зв'язування G-білка і GTP![]() S щонайменше приблизно на 25 %.
S щонайменше приблизно на 25 %.
14. Сполука за п. 13, де клітина, яка одночасно експресує hT1R2 і hT1R3, являє собою клітину НЕК, що стабільно експресує G![]() l5.
l5.
15. Сполука за п. 14, яка демонструє принаймні 1,25-кратну підвищену відповідь клітин на субмаксимальний рівень підсолоджувача, у порівнянні з відповіддю на єдиний підсолоджувач, де відповідь виміряна за флуоресценцією, рівнями кальцію, рівнями ІР3, рівнями цАМФ, зв'язуванням GTP![]() S або активністю репортерного гена.
S або активністю репортерного гена.
16. Сполука за п. 15, яка має активність, у порівнянні з максимальною активністю фруктози, як визначено за залежним від сполуки підвищенням флуоресценції щонайменше на 25 % у флуоресцентному аналізі, використовуючи апарат FLIPR.
17. Сполука за п. 16, яка має активність у порівнянні з максимальною активністю фруктози, як визначено за залежним від сполуки підвищенням флуоресценції, що демонструє залежне від сполуки щонайменше двократне збільшення ЕС50 у випадку фруктози у флуоресцентному аналізі, використовуючи апарат FLIPR.
18. Сполука за п. 16, яка має таку ефективність, що щонайменше 10 з 100 трансфекованих клітин демонструють залежне від сполуки збільшення флуоресценції, виміряної за допомогою флуоресцентного мікроскопа.
19. Сполука за п. 16, яка має таку ефективність, при якій кількість флуоресцентних клітин у відповідь на субмаксимальний рівень фруктози підвищується щонайменше вдвічі.
20. Харчовий або лікарський продукт, який містить сполуку за будь-яким з пп. 11-19.
21. Харчовий продукт за п. 20, де харчовий продукт вибраний з групи, що складається з: рідкого супу, дегідрованого або кулінарного продукту і напою.
22. Спосіб модулювання солодкого смаку харчового або лікарського продукту, який включає:
одержання щонайменше одного харчового або лікарського продукту або його попередника і
об'єднання харчового або лікарського продукту або його попередника щонайменше з модулюючою солодкий смак кількістю щонайменше однієї неприродної сполуки за будь-яким з пп. 1-7, або її придатної до їжі прийнятної солі, з одержанням, таким чином, модифікованого харчового або лікарського продукту, модулюючи, таким чином, солодкий смак харчового або лікарського продукту.
Текст
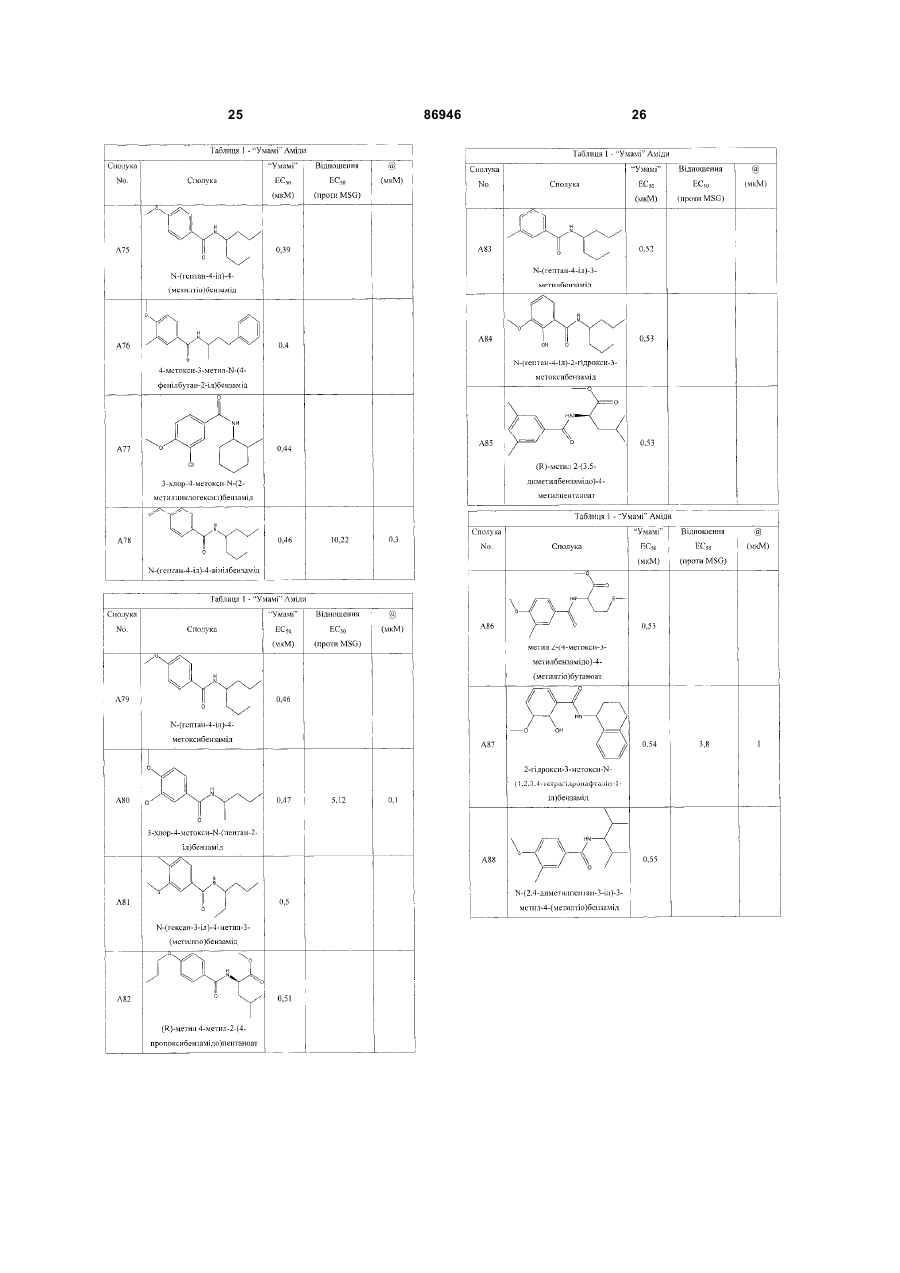
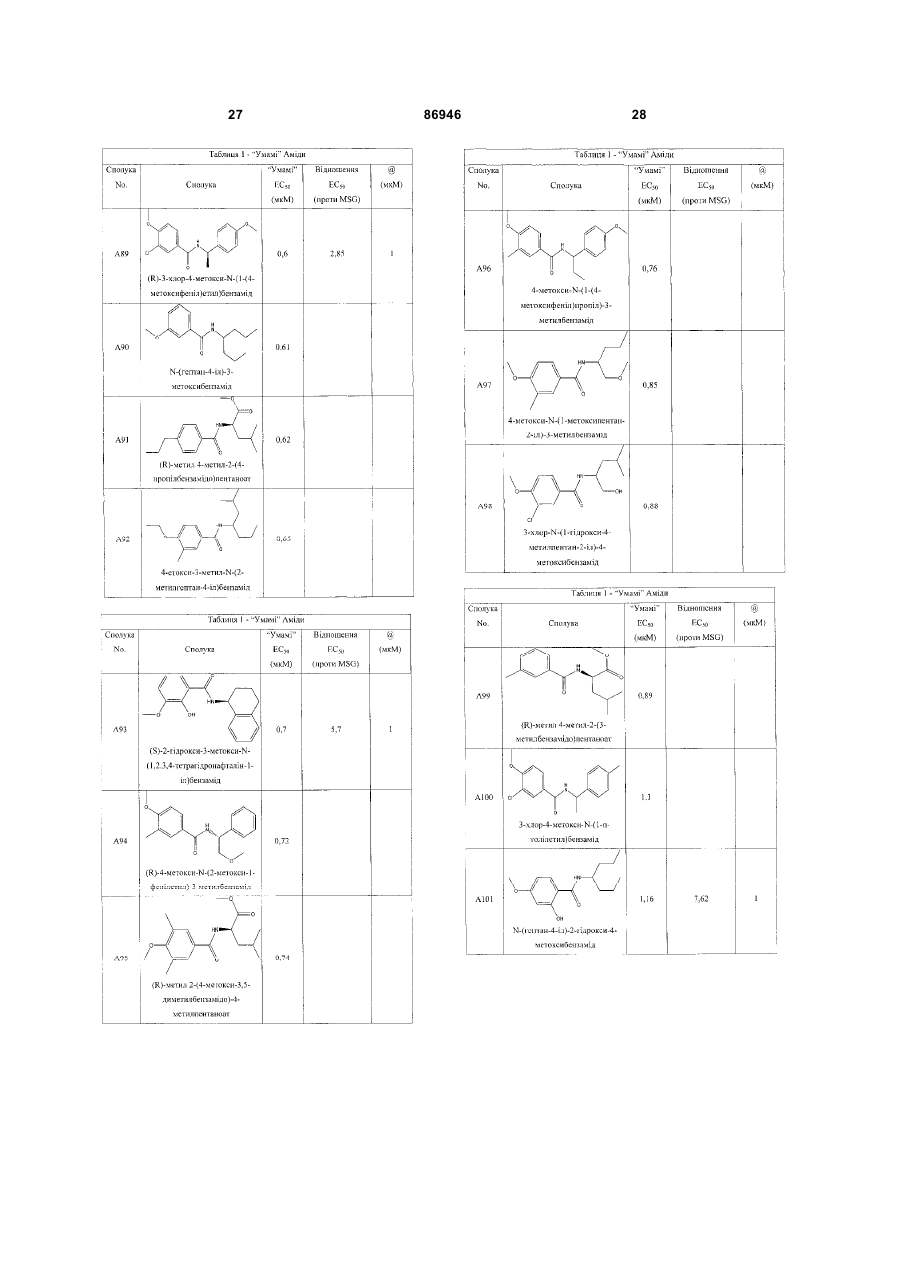
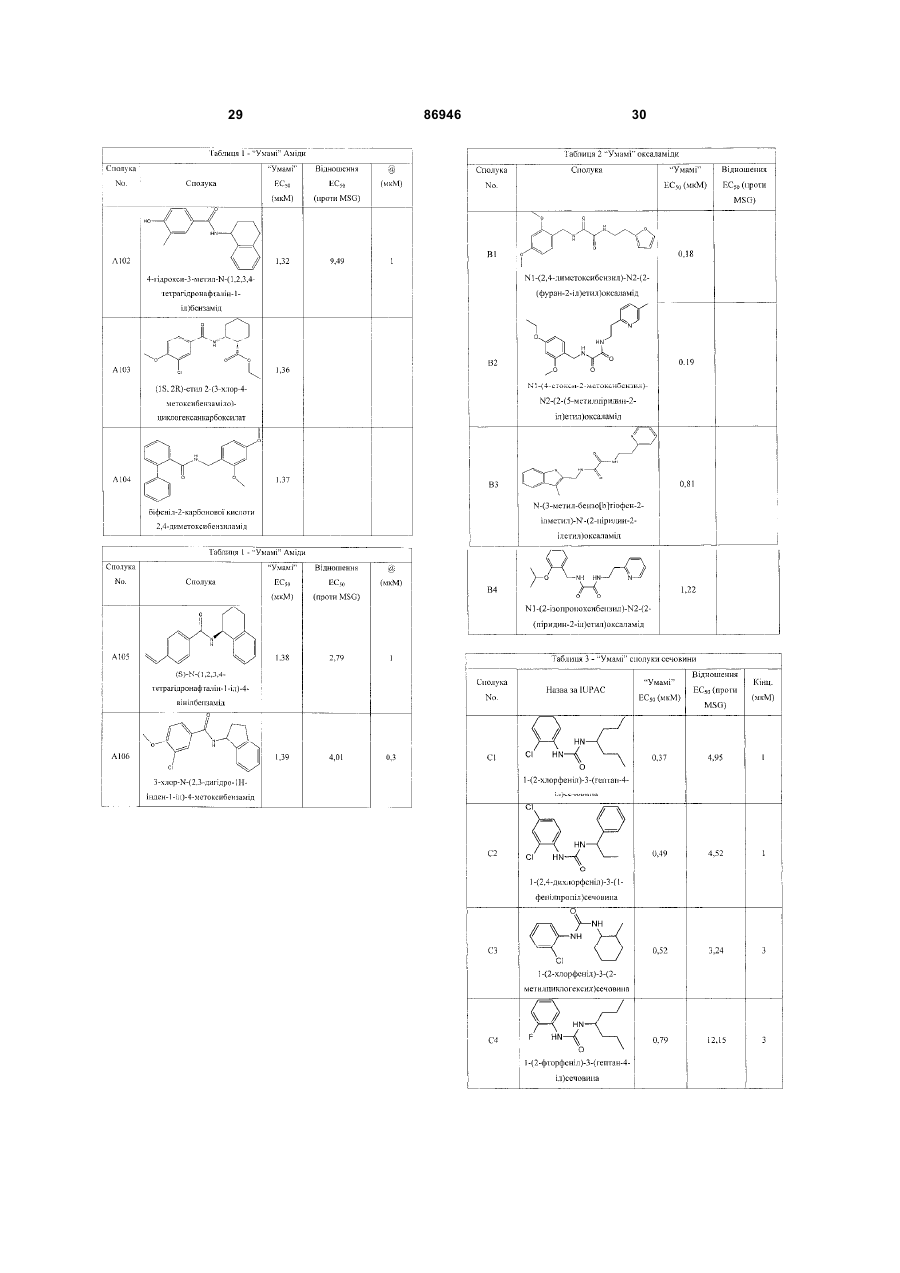
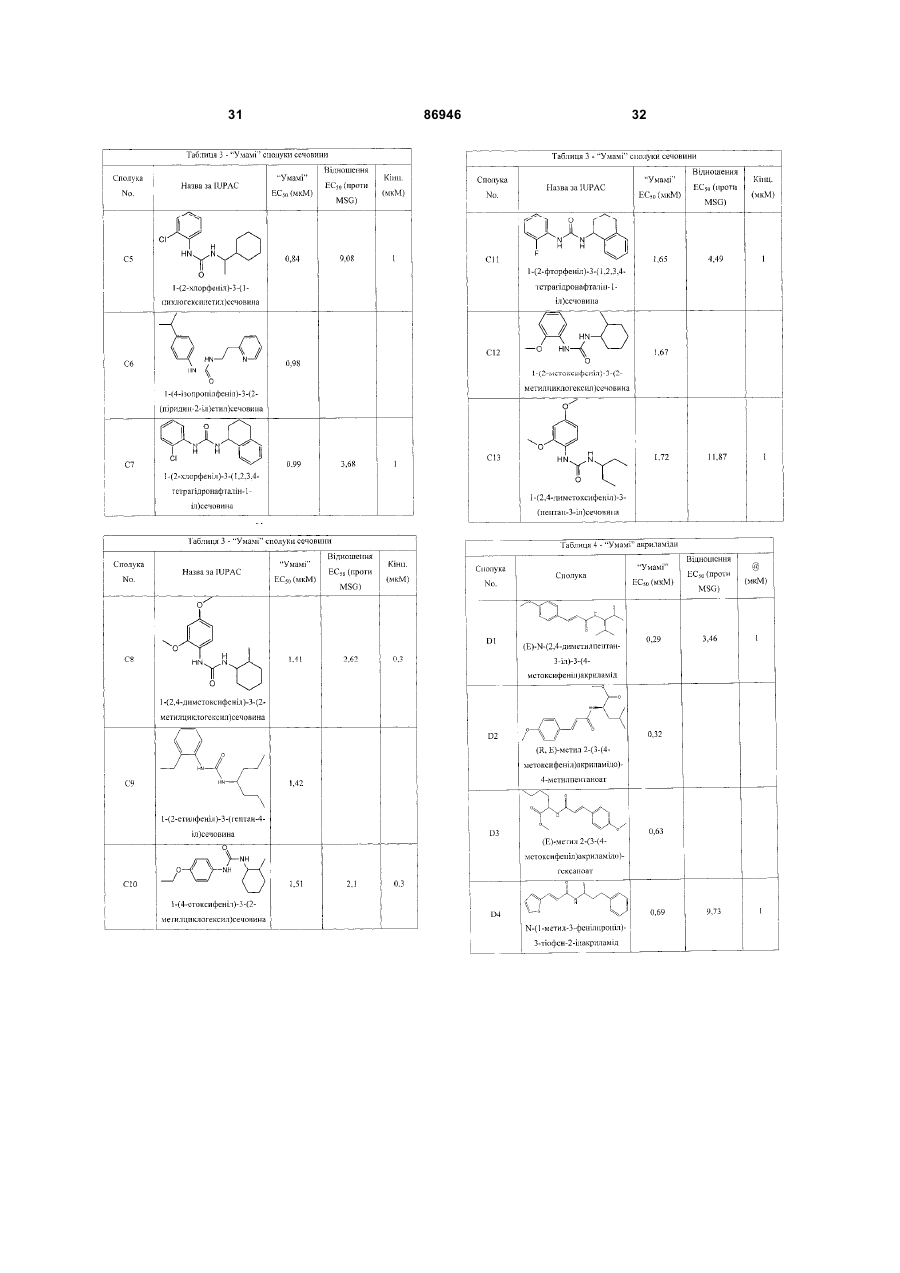
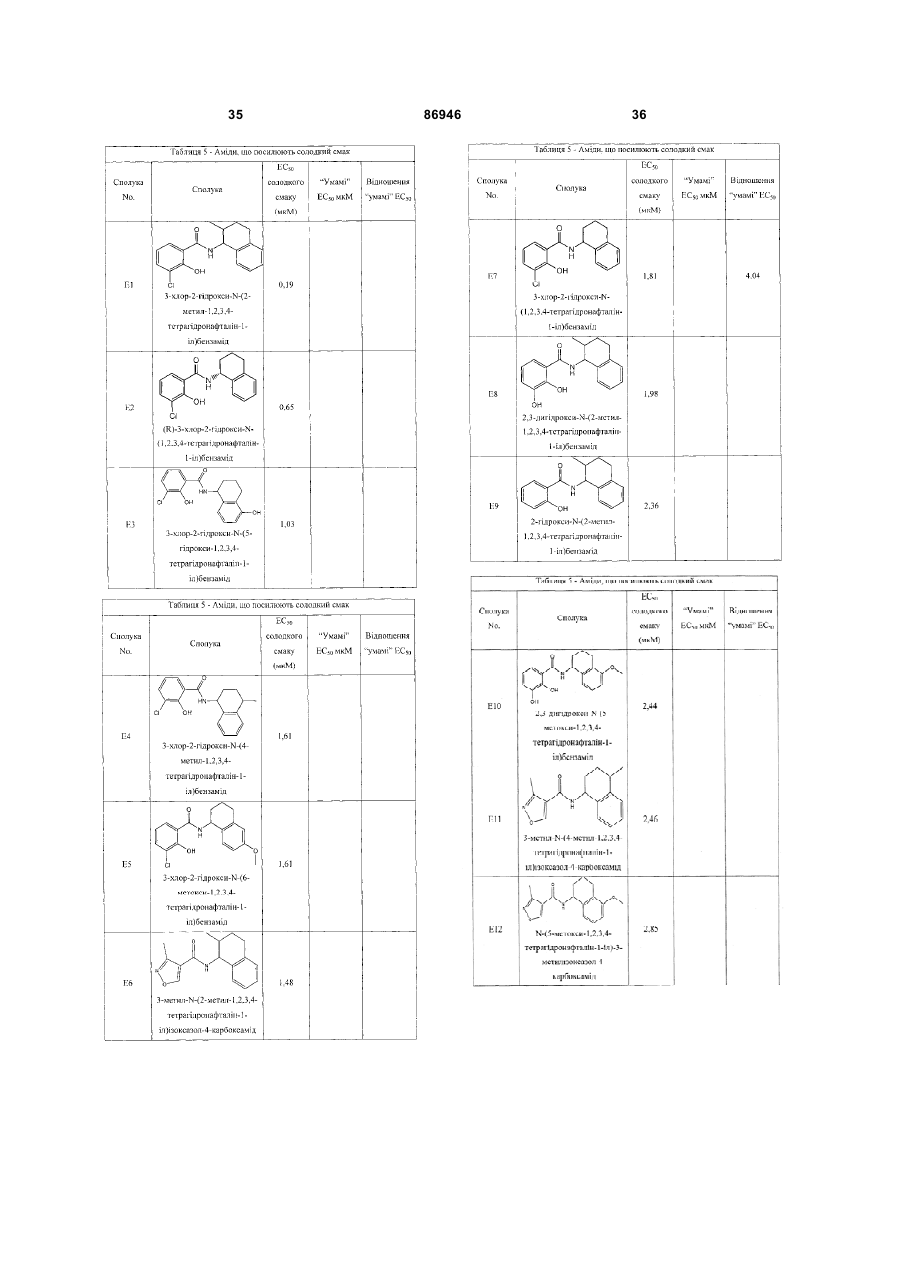
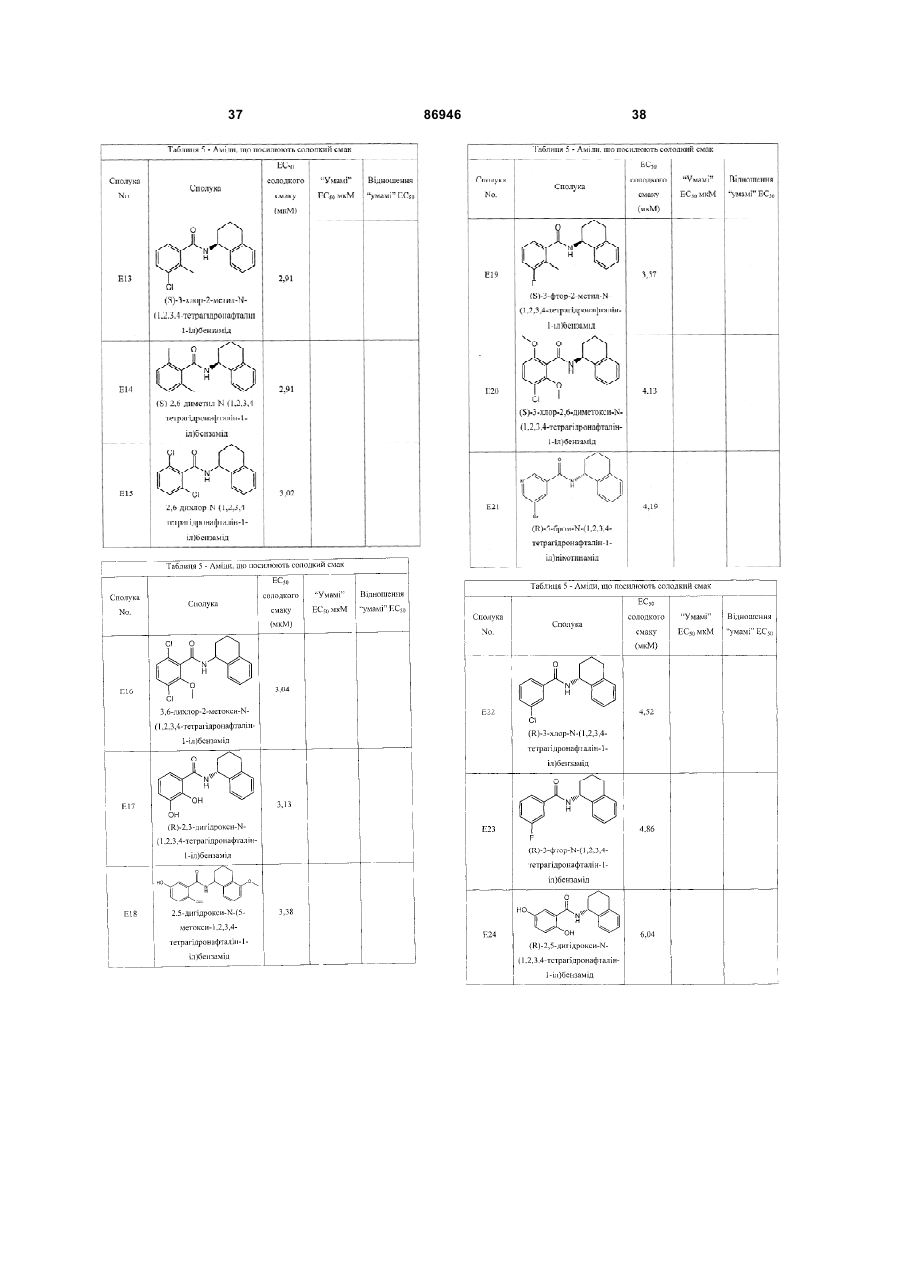
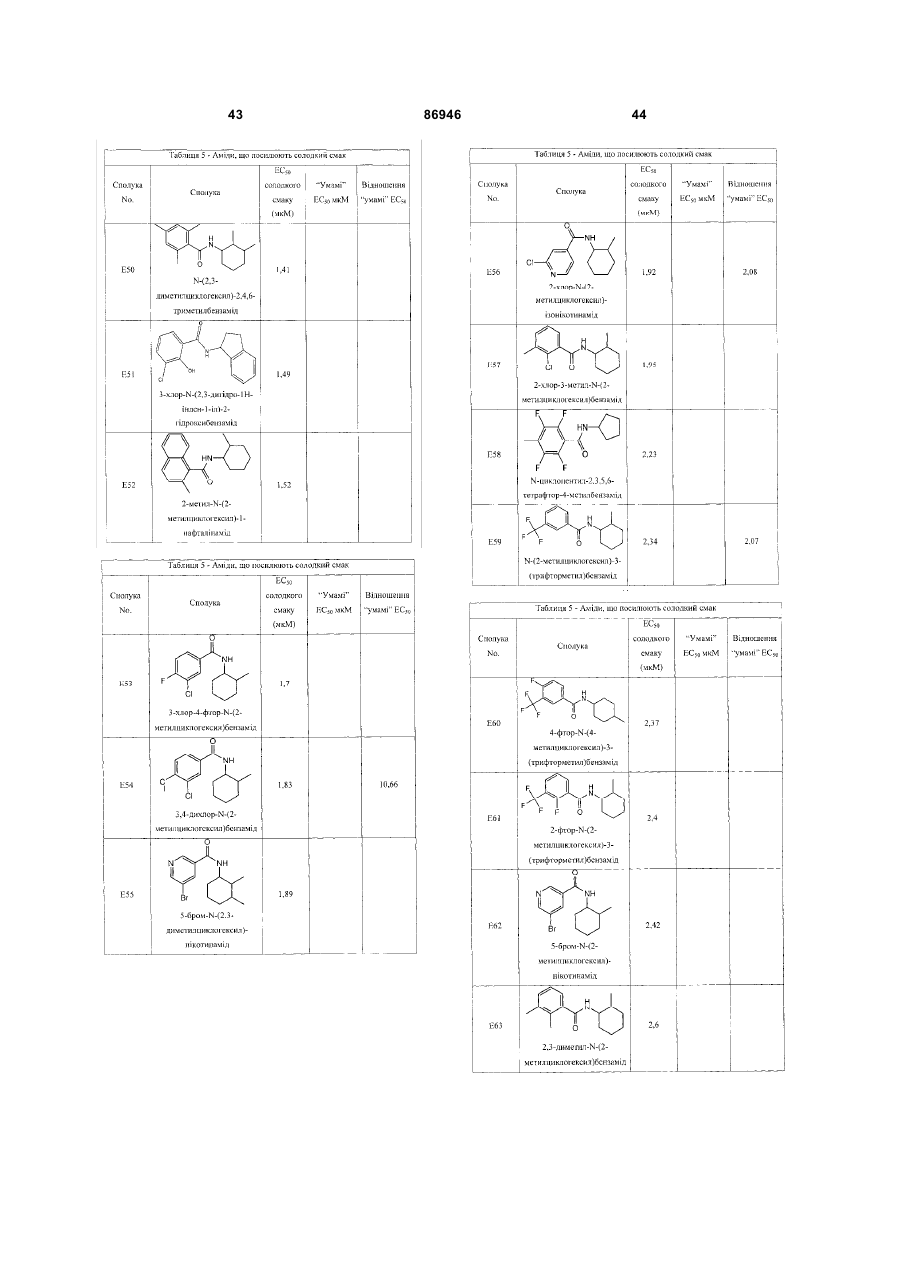
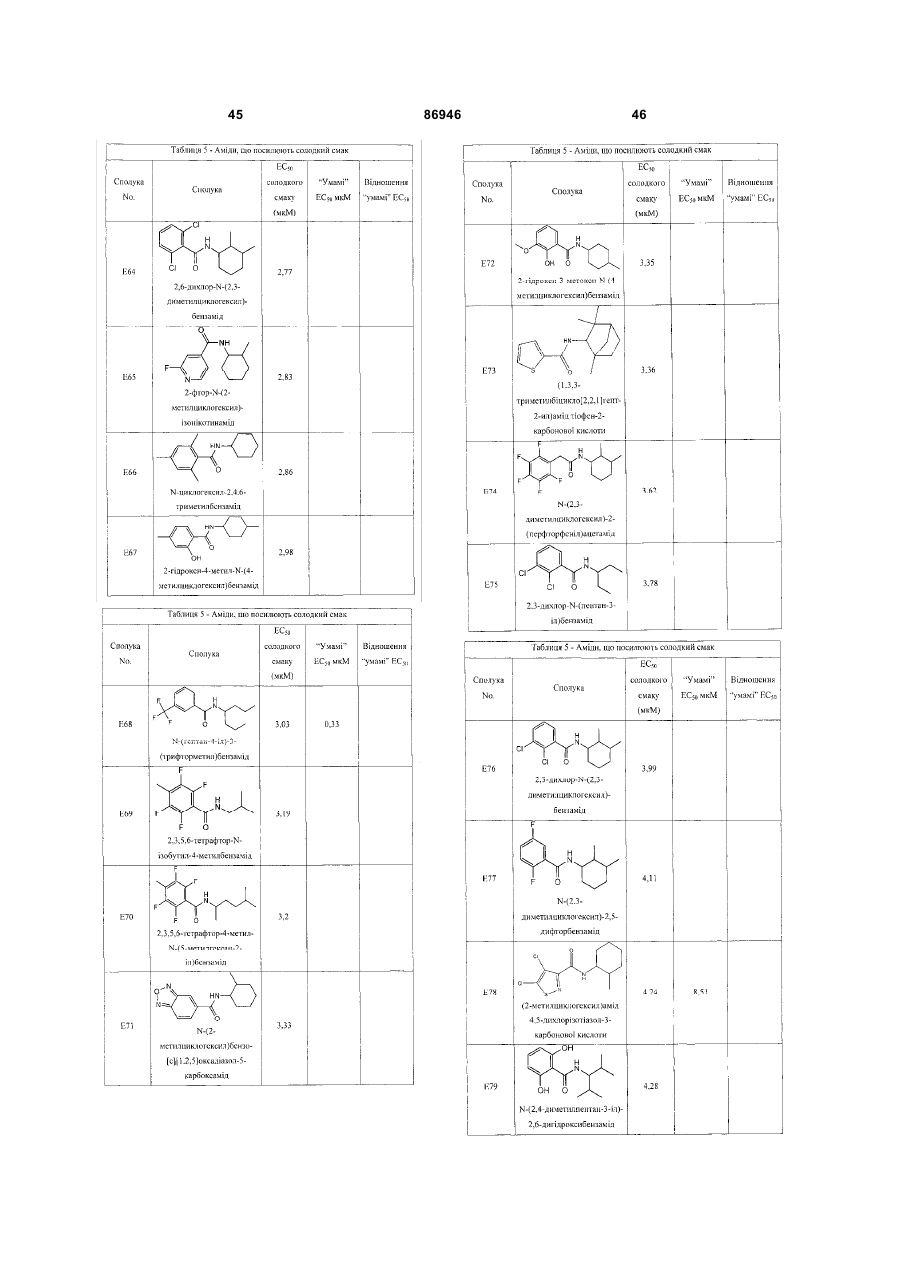
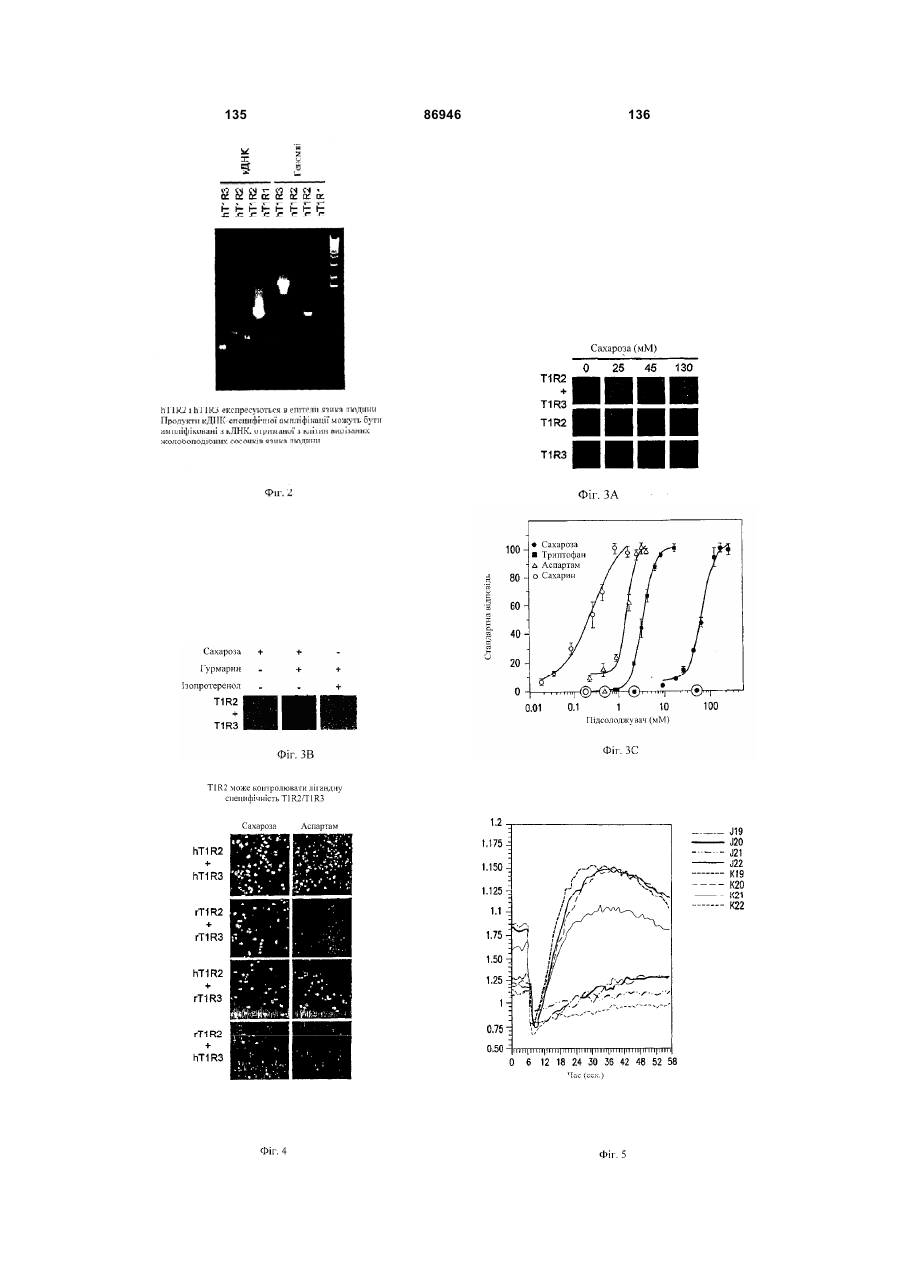
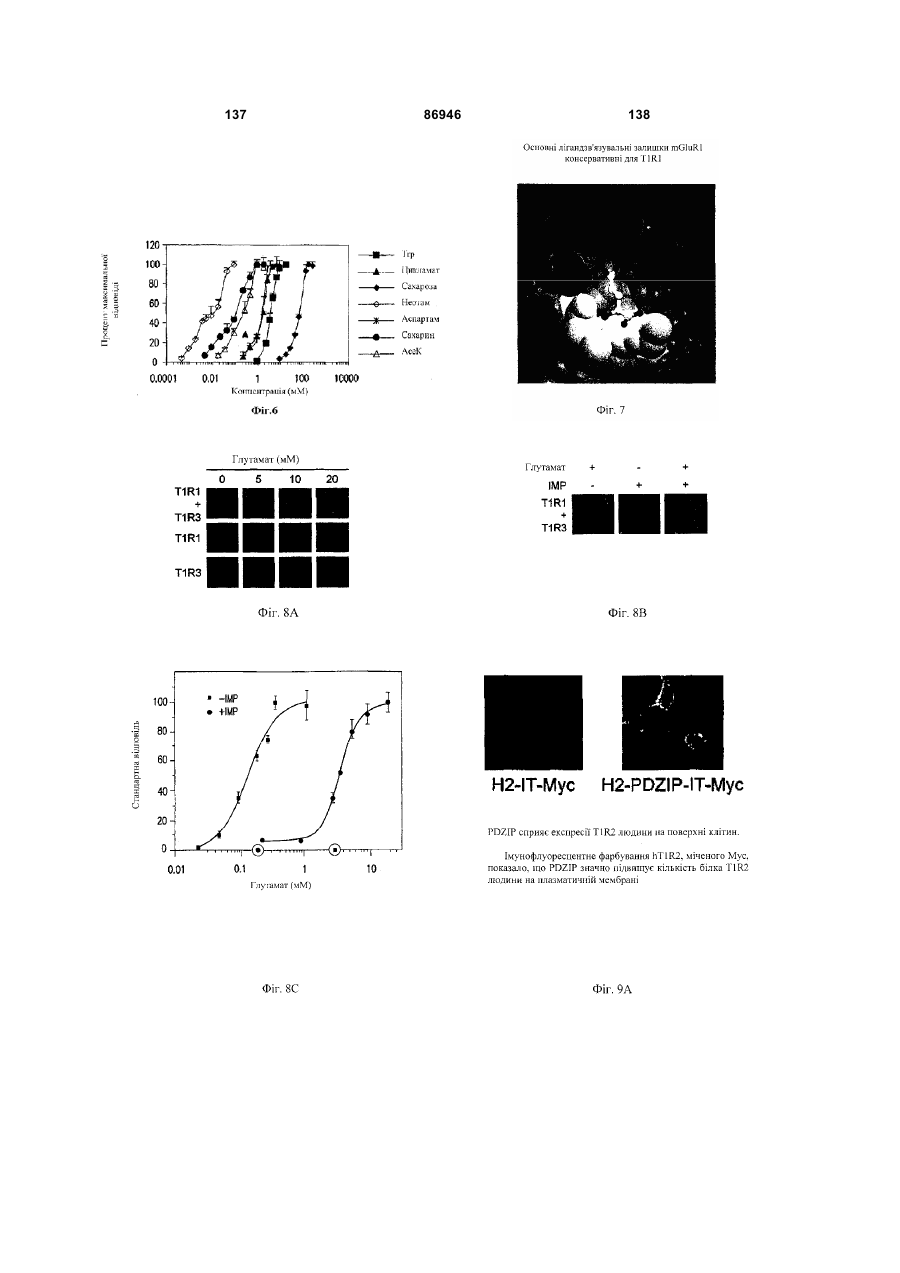
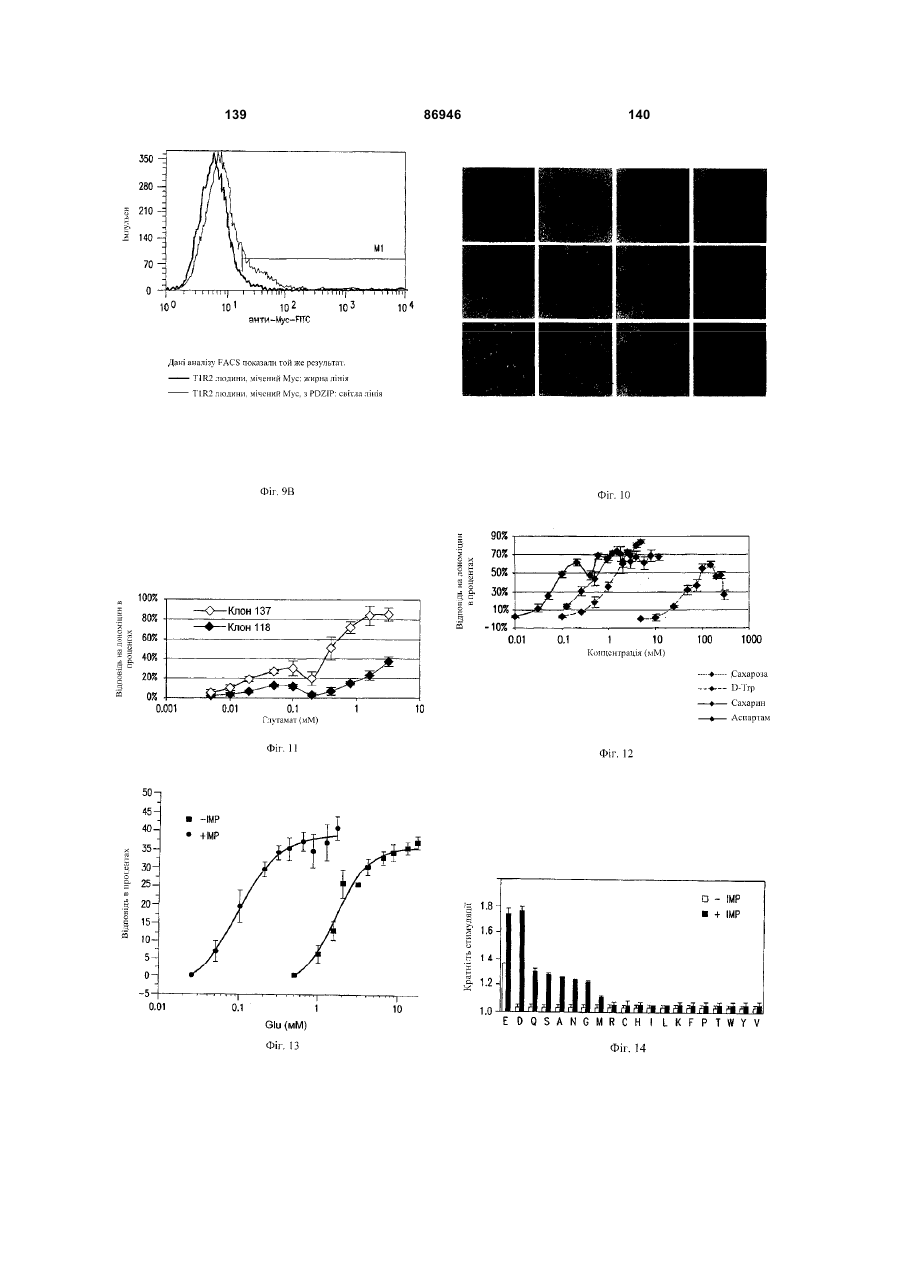
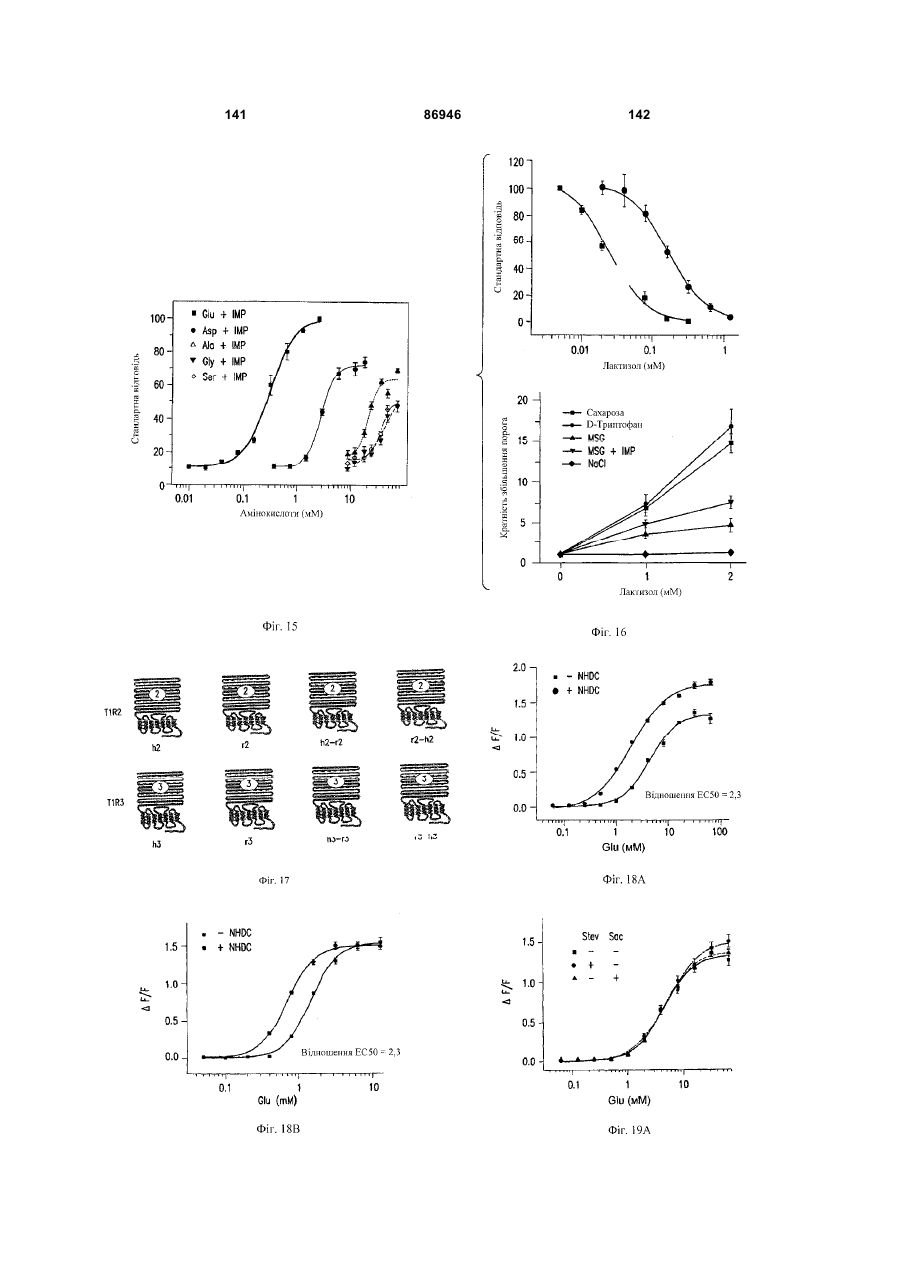
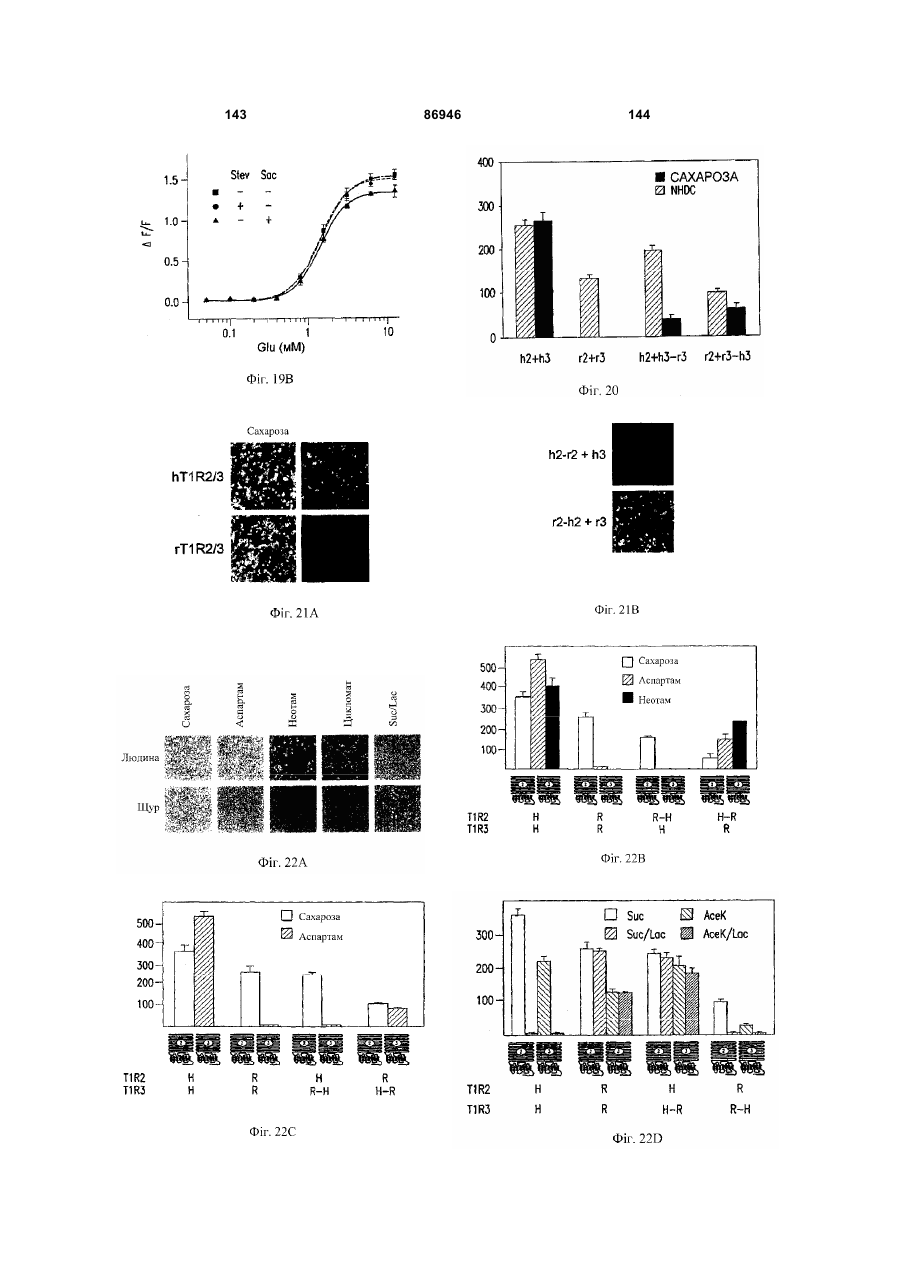
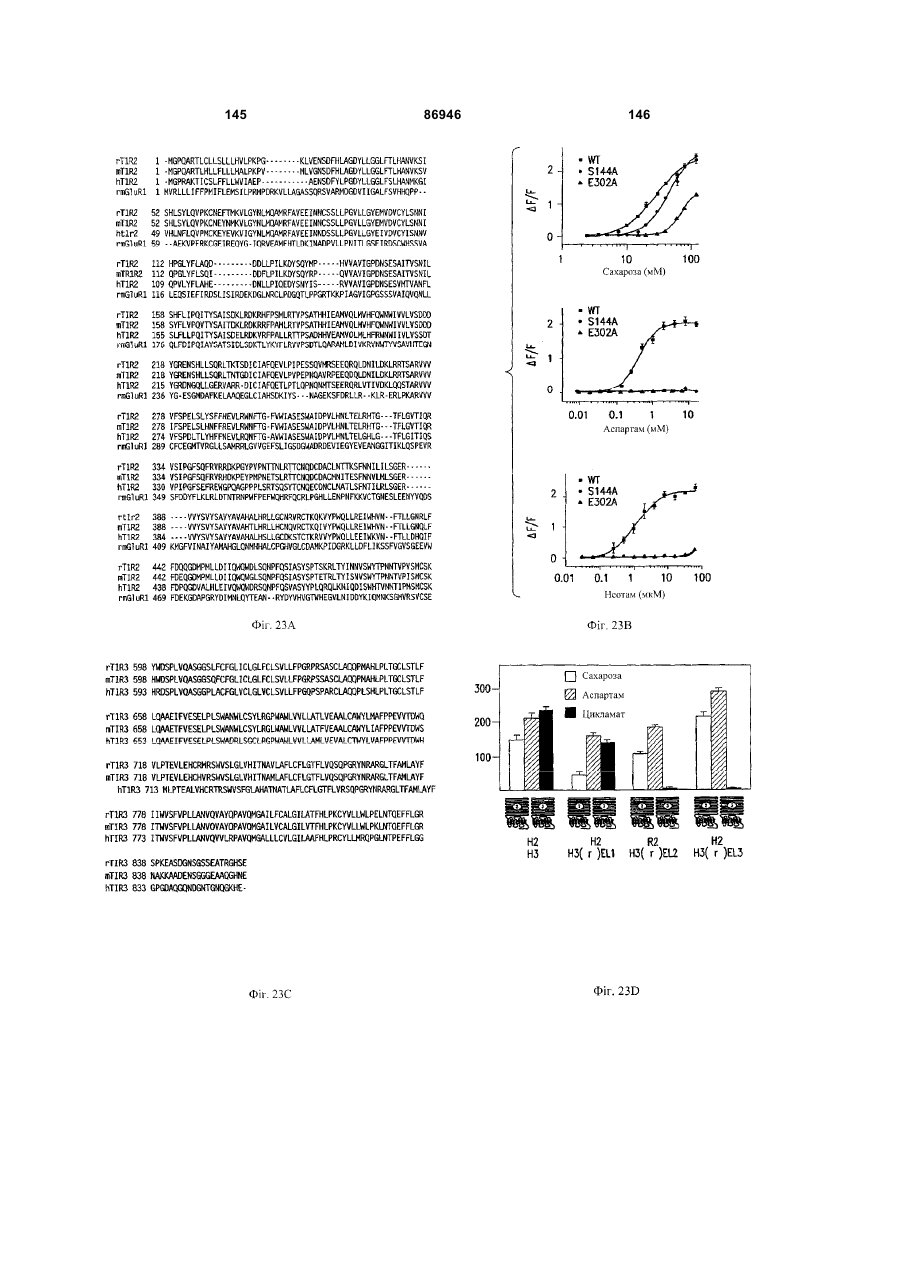
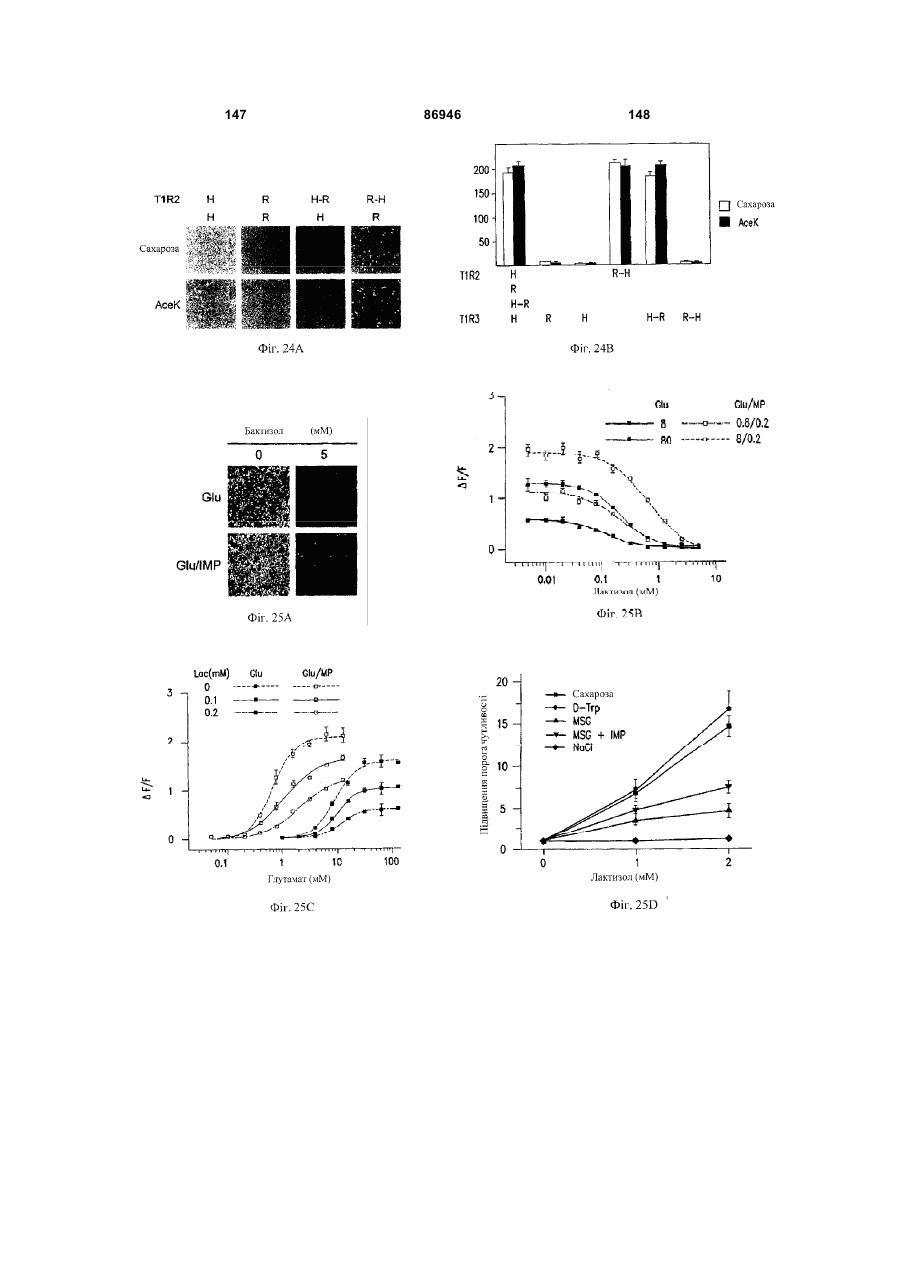
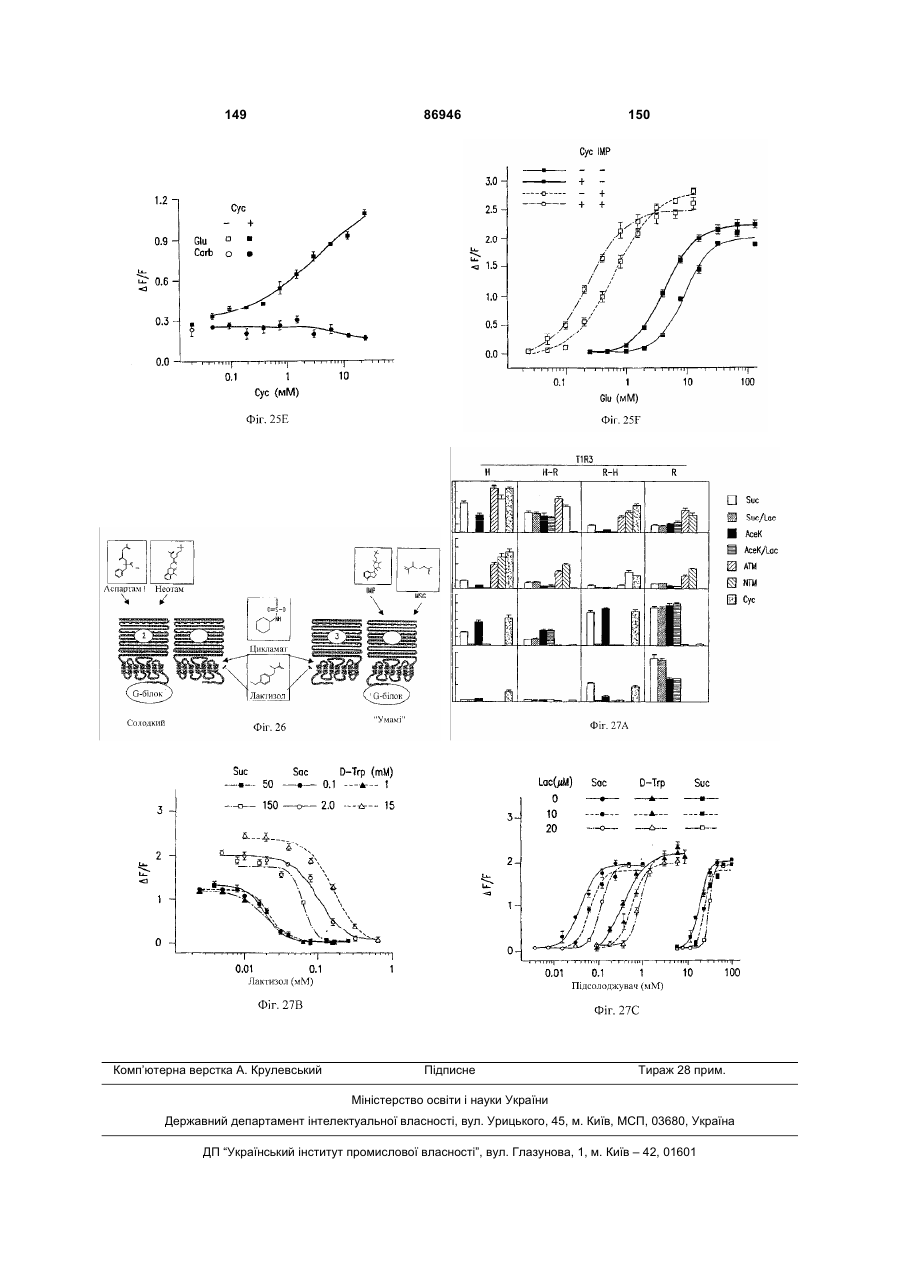
1. Неприродна сполука, яка специфічно зв'язується з рецептором T1R1/T1R3, що складається з hT1R1/hT1R3, і має ефективність як "умамі" смакового ароматизатора, підсилювача або модифікатора, що визначається за значенням ЕС50 менше 1мМ. 2. Сполука за п. 1, де відношення ЕС50 сполуки, яке визначене як відношення концентрації MSG до концентрації сполуки плюс MSG, необхідне для виникнення MSG доза-відповідь, менше 1. 3. Сполука за п. 1, де зниження ЕС50, як визначено за допомогою флуоресцентного аналізу, використовуючи апарат FLIPR, щонайменше двократне. 4. Сполука за п. 1, яка має активність, у порівнянні з максимальною активністю глютамату, як визначено за залежним від сполуки збільшенням флуоресценції, складає щонайменше 25% у флуоресцентному аналізі з використанням апарата FLIPR. 5. Сполука за п. 1, що має таку ефективність, що щонайменше 10 з 100 клітин, трансфекованих рецептором, демонструють залежне від сполуки збільшення флуоресценції. 6. Сполука за п. 1, яка має таку ефективність, що кількість флуоресцентних клітин у відповіді на субмаксимальний рівень глютамату збільшується щонайменше вдвічі. 2 (19) 1 3 86946 4 підвищений внутрішньоклітинний ІР3 щонайменше приблизно на 25% або підвищений рівень зв'язування G-білка і GTP γ S щонайменше приблизно на 25%. 14. Сполука за п. 13, де клітина, яка одночасно експресує hT1R2 і hT1R3, являє собою клітину НЕК, що стабільно експресує G α l5. 15. Сполука за п. 14, яка демонструє принаймні 1,25-кратну підвищену відповідь клітин на субмаксимальний рівень підсолоджувача, у порівнянні з відповіддю на єдиний підсолоджувач, де відповідь виміряна за флуоресценцією, рівнями кальцію, рівнями ІР3, рівнями цАМФ, зв'язуванням GTP γ S або активністю репортерного гена. 16. Сполука за п. 15, яка має активність, у порівнянні з максимальною активністю фруктози, як визначено за залежним від сполуки підвищенням флуоресценції щонайменше на 25% у флуоресцентному аналізі, використовуючи апарат FLIPR. 17. Сполука за п. 16, яка має активність у порівнянні з максимальною активністю фруктози, як визначено за залежним від сполуки підвищенням флуоресценції, що демонструє залежне від сполуки щонайменше двократне збільшення ЕС50 у випадку фруктози у флуоресцентному аналізі, використовуючи апарат FLIPR. 18. Сполука за п. 16, яка має таку ефективність, що щонайменше 10 з 100 трансфекованих клітин демонструють залежне від сполуки збільшення флуоресценції, виміряної за допомогою флуоресцентного мікроскопа. 19. Сполука за п. 16, яка має таку ефективність, при якій кількість флуоресцентних клітин у відповідь на субмаксимальний рівень фруктози підвищується щонайменше вдвічі. 20. Харчовий або лікарський продукт, який містить сполуку за будь-яким з пп. 11-19. 21. Харчовий продукт за п. 20, де харчовий продукт вибраний з групи, що складається з: рідкого супу, дегідрованого або кулінарного продукту і напою. 22. Спосіб модулювання солодкого смаку харчового або лікарського продукту, який включає: одержання щонайменше одного харчового або лікарського продукту або його попередника і об'єднання харчового або лікарського продукту або його попередника щонайменше з модулюючою солодкий смак кількістю щонайменше однієї неприродної сполуки за будь-яким з пп. 1-7, або її придатної до їжі прийнятної солі, з одержанням, таким чином, модифікованого харчового або лікарського продукту, модулюючи, таким чином, солодкий смак харчового або лікарського продукту. Перехресне посилання на родинні заявки За даним винаходом запитується пріоритет попередньої заявки США №60/494071, поданої 6 серпня, 2003, і попередній заявці США №60/552064, поданої 9 березня 2004, обидві наведені тут як посилання в повному об'ємі. Передумови винаходу Даний винахід частково базується на відкритті, що рецептори T1R об'єднуються і утворюють функціональні смакові рецептори. Зокрема, було виявлено, що одночасна експресія T1R1 і T1R3 приводить до формування смакового рецептора, який реагує на "умамі" смакові подразники, включаючи мононатрій глутамат. Також було виявлено, що одночасна експресія рецепторів T1R2 і T1R3 приводить до формування смакового рецептора, який реагує на солодкий смаковий подразник, включаючи природні і штучні підсолоджувачі. Також даний винахід належить до застосування гетероолігомерних смакових рецепторів, які містять T1R1/T1R3 і T1R2/T1R3, які реагують на "умамі" смаковий подразник і солодкої смаковий подразник, відповідно, в аналізах для ідентифікації сполук. Винахід також належить до химерних і усічених варіантів T1R1, T1R2 і T1R3, а також до химерних рецепторів T1R1/T1R3 і T1R2/T1R3, які містять субодиниці людини, щура або людини і щура. Більш того винахід належить до створення клітинних ліній, які стабільно або тимчасово експресують сполучання T1R1 і T1R3; або T1R2 і T1R3, в тому числі усічені або химерні варіанти цих субодиниць, а також химерні рецептори, які містять субодиниці дикого типу або химерні субодиниці; в конститутивних або індуцибельних умовах. Також винахід належить до застосування таких клітинних ліній в клітинних аналізах для ідентифікації сполук, які модулюють "умамі" і солодкий смак, зокрема, у високоефективних методах скринінгу для визначення активності рецептора, використовуючи метод флуорометричної візуалізації. Винахід також належить до сполук, які зв'язуються з рецепторами T1R1/T1R3, T1R2/T1R3, а також з химерними і усіченими субодиницями T1R1, T1R2 і T1R3 і химерними рецепторами. Опис аналогів винаходу Система смакового сприйняття забезпечує сенсорну інформацію про хімічний склад зовнішнього світу. Ссавці, ймовірно, можуть сприймати принаймні п'ять основних смаків: солодкий, гіркий, кислий, солоний і "умамі". Дивись, наприклад, Kawamura et al., Introduction to Umami: A Basic Taste (1987); Kinnamon et al., Ann. Rev. Physiol., 54:715-31 (1992); Lindemann, Physiol. Rev., 76:71866 (1996); Stewart et al., Am. J. Physiol., 272:1-26 (1997). Кожне смакове відчуття ймовірно опосередковано особливим білковим рецептором або рецепторами, які експресуються у смакових клітинах, виявлених на поверхні язика (Lindemann, Physol. Rev. 76:718-716 (1996)). Смакові рецептори, які розпізнають гіркі, солодкі і "умамі" смакові подразники, належать до суперсімейства рецепторів, спряжених з G-білками (GPCR) (Hoon et al., Cell 96:451 (1999); Adler et al., Cell 100:693 (2000)). (Інші смакові відчуття, ймовірно, опосередковані іонними каналами). 5 Рецептори, спряжені з G-білками, опосередковують велику кількість інших фізіологічних функцій, таких як ендокринна функція, екзокринна функція, частота серцевих скорочень, ліполіз і метаболізм вуглеводів. За допомогою біохімічного аналізу і молекулярного клонування множини таких рецепторів були виявлені основні принципи функціонування цих рецепторів. Наприклад, в патенті США №5691188 описано, що при зв'язуванні GPCR з лігандом рецептор зазнає конформаційних змін, які приводять до активації гетеротримерного G-білка, викликаючи перестановку зв'язаного GDP на GTP на поверхні субодиниці Gα і подальшу дисоціацію субодиниці Gα від субодиниць Gβ і Gγ. Вільні субодиниці Gα і комплекси GPγ активують подальший каскад різноманітних шляхів передачі сигналу. Раніше було зроблене припущення про те, що рецептори T1R функціонують як рецептори солодкого смаку (Hoon et al., Cell 96:541-51 (1999); Kitagawa et al., Biochem Biophys Res. Commun. 283:236-42 (2001); Max et al., Nat. Genet. 28:58-63 (2001); Montmayeur et al., Nat. Neurosci. 4: 412-8 (2001); Sainz et al., J. Neurochem. 77: 896-903 (2001)), a Nelson et al. (2001) і Li et al (2002) нещодавно показали, що для розпізнавання солодкого смакового подразника щурячі і людські рецептори, T1R2 і T1R3, відповідно, щура і людини, діють у вигляді сполучання. Проте, в даній галузі залишається необхідність створення нових і вдосконалених смакових речовин. Наприклад, одним з п'яти відомих основних смакових відчуттів є гострий або "умамі" смак, що викликається мононатрієм глутаматом ("MSG"). Як відомо, у деяких людей MSG викликає побічні дії, при цьому не було досягнуто значних успіхів в ідентифікації природних замінників MSG. Відомо, що деякі природні речовини можуть підвищувати або посилювати ефективність MSG як смакової речовини, яка викликає гострий смак, і, таким чином, можна зменшити кількість MSG, необхідну для придання смаку. Наприклад, відомо, що природні нуклеотидні сполуки, іонозинмонофосфат (IMP) або гуанозинмонофосфат (GMP), володіють множинним ефектом відносно гострого смаку MSG, але виділення і очищення IMP і GMP з природних джерел, або їх синтез, є дуже складними і дорого коштують і, тому, мають дуже обмежене практичне застосування для більшості комерційних потреб в харчових і медичних композиціях. Сполуки, що менш дорого коштують, які могли б викликати смак, аналогічний MSG, або посилювати ефективність будь-якого наявного MSG, мали б величезне значення. Аналогічно, корисним могло б стати виявлення сполук з новим "високоінтенсивним" солодким смаком (тобто, який у багато разів перевищує солодкий смак сахарози). У даній галузі необхідно ідентифікувати і охарактеризувати смакові рецептори, які діють як рецептори солодкого і "умамі" смаку, і можуть використовуватися в методах для ідентифікації сполук, які модулюють (посилюють або блокують) солодкий і "умамі" смак, і сполук, які специфічно зв'язуються з цими рецепторами. 86946 6 Короткий опис винаходу Даний винахід належить до химерних рецепторів, які містять різні сполучення T1R людини і щура, таких як химерний рецептор T1R2/T1R3, який містить субодиницю T1R2 людини і субодиницю T1R3 щура; химерний рецептор T1R2/T1R3, який містить субодиницю T1R2 щура і субодиницю T1R3 людини; химерна рецепторна субодиниця T1R2, яка містить екстрацелюлярний домен людини, трансмембранний домен щура і внутрішньоклітинний домен щура; і химерна рецепторна субодиниця T1R3, яка містить екстрацелюлярний домен тура, трансмембранний домен людини і внутрішньоклітинний домен людини. Даний винахід також належить до сполук, які специфічно зв'язуються з T1R1, T1R2, T1R3, T1R1/T1R3 і T1R2/T1R3, або з їх виділеними субодиницями, фрагментами, химерними або усіченими варіантами, описаними тут. Даний винахід базується на відкритті, що різні сполучення T1R при одночасній експресії утворюють функціональні смакові рецептори, які реагують на смакові подразники. Зокрема, даний винахід базується на відкритті, що одночасна експресія T1R2 і T1R3 приводить до формування гетероолігомерного смакового рецептора, який реагує на солодкий смаковий подразник. Також даний винахід належить до відкриття, що одночасна експресія T1R1 і T1R3 приводить до формування гетероолігомерного смакового рецептора, який реагує на смаковий подразник "умамі", такий як мононатрій глутамат. Даний винахід також належить до клітинних ліній, які одночасно експресують T1R1 і T1R3, в тому числі людини або щура, або T1R2 і T1R3, в тому числі людини або щура. У переважних варіантах здійснення ці клітинні лінії можуть експресувати підвищену кількість рецепторів, або конститутивно або індуцибельно. До цих клітинних ліній належать клітинні лінії, які тимчасово або стабільно експресують T1R1 і T1R3, або T1R2 і T1R3. Також даний винахід належить до аналізів, переважно, до високоефективних аналізів скринінгу, в яких використовується смаковий рецептор T1R2/T1R3 або рецептор T1R1/T1R3, переважно, до високоефективних клітинних аналізів для ідентифікації сполук, які модулюють солодкий або "умамі" смак. Винахід також належить до аналізів, включаючи смакові тести, для підтвердження того, що ці сполуки модулюють солодкий або "умамі" смак. Винахід також належить до сполук, які, наприклад, зв'язуються з N-кінцевим екстрацелюлярним доменом T1R2, до сполук, які зв'язуються з доменом T1R2, багатим цистеїном, до сполук, які зв'язуються з трансмембранним доменом T1R2, до сполук, які зв'язуються з трансмембранним доменом T1R3, до сполук, які зв'язуються з трансмембранним доменом T1R2 усіченого рецептора h2TM/h3TM, і до сполук, які зв'язуються з трансмембранним доменом T1R3 усіченого рецептора h2TM/h3TM. Короткий опис креслень На фігурі 1 представлене зіставлення послідовностей T1R людини і щура, кальційчутливого ре 7 цептора людини і метаботропного рецептора глутамату щура. На фігурі 2 представлені експериментальні результати RT-PCR ампліфікації, які показують, що hT1R2 і hT1R3 експресуються у "смаковій" тканині. На фігурі 3а-3b представлені дані функціонального аналізу (відповідь внутрішньоклітинного кальцію), одержані за допомогою клітин НЕК, стабільно експресуючих Gα15 і тимчасово трансфікованих T1R2, T1R3 і T1R2/T1R3 людини, у відповідь на різні солодкі подразники при різних концентраціях солодкого подразника (фігура 3а); показані відповіді T1R2/T1R3 людини в залежності від дози деяких солодких подразників (фігура 3b); і відповіді T1R2/T1R3 людини на сахарозу в присутності гурмарину, а також відповіді ендогенних β2адренергічних рецепторів на ізопротеренол в присутності гурмарину. На фігурі 3с представлені стандартні відповіді на різні підсолоджувачі. На фігурі 4 показані відповіді внутрішньоклітинного кальцію в клітинах НЕК, стабільно експреі тимчасово трансфікованих суючих Gα15 hT1R2/hT1R3, rT1R2/rT1R3, hT1R2/rT1R3 і rT1R2/hT1R3, у відповідь на 350мМ сахарозу, 25мМ триптофан, 15мМ аспартам і 0,05% монелін. На фігурі 5 представлені результати з використанням флуоресцентного лічильника планшетів, де клітини НЕК, стабільно експресуючі Gα15, були тимчасово трансфіковані hT1R2 і hT1R3, або тільки hT1R3, і приведені в контакт з барвником кальцію Fluo-4 і солодким смаковим подразником (12,5мМ цикламат). На фігурі 6 представлені стандартні криві "доза-відповідь", з яких, на основі їх залежної від дози взаємодії з різними солодкими подразниками (trp, цикламат, сахароза, неотам, аспартам, сахарин і Асек), видно, що в комплексі hT1R2 і hT1R3 діють як рецептор солодкого смаку людини. На фігурі 7 представлена інформація про структуру mGluR1 і T1R1, із зазначенням основних лігандзв'язуючих залишків, які спостерігаються в цих молекулах. На фігурі 8а-8с представлені дані функціонального аналізу, які показують, що клітини НЕК, які тимчасово трансфіковані T1R1/T1R3 і стабільно експресують Gα15, реагують на глутамат в аналізі внутрішньоклітинного кальцію. На фігурі 8а показано, що кількість внутрішньоклітинного кальцію підвищується у відповідь на підвищення концентрації глутамату; на фігурі 8b показані відповіді внутрішньоклітинного кальцію на IMP (2мМ), глутамат (0,5мМ) і 0,2мМ IMP; і на фігурі 8с показані відповіді T1R1/T1R3 людини на глутамат в присутності і за відсутності 0,2мМ IMP. На фігурах 9а-9b, відповідно, представлені результати імунофлуоресцентного забарвлювання з використанням Мус-міченого hT1R2 і результати експерименту FACS, які показують, що введення пептиду PDZIP (SEQ ID No: 1) посилює експресію T1R (hT1R2) на плазматичній мембрані. На фігурі 10 представлені дані візуалізації кальцію, які показують, що h1TR2/hT1R3 відповідають нарізні солодкі подразники. На фігурі 11 представлені відповіді клітинних 86946 8 ліній, які стабільно експресують hT1R1/hT1R3, на "умамі" смакові подразники, одержані за допомогою автоматичної флуоресцентної візуалізації. На фігурі 12 представлені відповіді клітинної лінії, стабільно експресуючої hT1R2/hT1R3, на солодкі смакові подразники, одержані за допомогою автоматичної флуоресцентної візуалізації. На фігурі 13 представлені криві "дозавідповідь" на L-глутамат, в присутності і за відсутності 0,2мМ IMP, одержані за допомогою автоматичної флуоресцентної візуалізації, для клітинної лінії, індуцибельно експресуючої смаковий рецептор T1R1/T1R3 людини. На фігурах 14 і 15 показана відповідь клітинної лінії, яка індуцибельно експресує смаковий рецептор T1R1/T1R3 людини (клон 1-17), на набір Lамінокислот. На фігурі 14 показано тестування різних С-амінокислот при 10мМ в присутності і за відсутності 1мМ IMP. На фігурі 15 представлені криві "доза-відповідь" на активні амінокислоти в присутності 0,2мМ IMP. На фігурі 16 показано, що лактизол інгібує активність рецепторів T1R2/T1R3 і T1R1/T1R3 людини. На фігурі 17 схематично показані химерні рецептори T1R людини-щура. Химерні рецептори конструювали шляхом злиття екстрацелюлярних доменів людини і щура з трансмембранними доменами щура або людини, відповідно, як показано в h2-r2, r2-h2, h3-r3 і r3-h3. На фігурі 18а-18b показано, що неогесперидин дигідрохалкон (NHDC) посилює активність смакових рецепторів "умамі" смаку T1R1/T1R3. [Неогесперидин дигідрохалкон] = 5мкМ. Крива "доза глутамату-відповідь" здвинута ліворуч на 2,3 одиниці (зліва), а крива "доза глутамату/ІМР-відповідь" здвинута ліворуч на 2,1 одиниці. На фігурі 19а-19b показано, що контрольні підсолоджувачі не впливають на активність рецептора "умамі" смаку T1R1/T1R3. [Стевіоцид] = 0,5мМ. [Сахарин] = 1мМ. Зліва показана крива "доза глутамату-відповідь", а праворуч показана крива "доза глутамату/ІМР-відповідь". На фігурі 20 NHDC нанесений на карту трансмембранного домену T1R3 людини. На фігурі 21а-21b показане співвідношення сполуки на трансмембранному домені T1R2. На фігурах 22a-d показані підсолоджувачі, співвіднесені з різними доменами/субодиницями рецептора солодкого смаку людини. На фігурі 22а показані відповіді рецепторів солодкого смаку людини і щура на сахарозу (200мМ), аспартам (10мМ), неотам (0,1мМ), цикламат (10мМ) і сахарозу (200мМ) в присутності лактизолу (1мМ) (Suc/Lac). Клітини НЕК-293Т тимчасово трансфікували T1R2, T1R3 людини або щура, і химерним Gα15, Gα15/i1, і аналізували на підвищення внутрішньоклітинного кальцію у відповідь на підсолоджувачі. На фігурі 22b з N-кінцевим екстрацелюлярним доменом T1R2 людини співвіднесені аспартам і неотам. Клітини НЕК-293Т, експресуючі Gα15/i1, тимчасово трансфікували сполученням химерних T1R, і аналізували їх відповіді на різні концентрації підсолоджувачів, перерахованих в 23а. Важливою була наявність або відсутність відповіді. На фігурі 9 22с з С-кінцевим трансмембранним доменом T1R3 людини співвіднесений цикламат. На фігурі 22d з трансмембранним доменом T1R3 людини співвіднесений лактизол. Клітини НЕК-293Т, експресуючі Gα15/i1, тимчасово трансфікували різними сполученнями химерних T1R, і аналізували їх відповіді на сахарозу (200мМ) і АсеК (10мМ) в присутності або за відсутності лактизолу (1мМ). Активність на Фіг.22В, C і D являє собою середнє значення ± SE числа клітин, що відповіли, в чотирьох візуалізованих областях з ~1000 конфлюентних клітин. На фігурі 23a-d показані мутації в T1R2 або T1R3, які вибірково впливають на активність різних підсолоджувачів. На фігурі 23а показане порівняння послідовностей N-кінцевого лігандзв'язуючого домену mGluR5 щура з T1R2 людини і щура. Вісім основних амінокислот mGluR5, які беруть участь у зв'язування ліганду, помічені *, три з 8 амінокислот, які є консервативними для T1R2, підкреслені. На фігурі 23b показані дві точкові мутації в Nкінцевому екстрацелюлярному домені T1R2 людини, які блокуютьвідповідь на аспартам і неотам, не впливаючи на відповідь на цикламат. Стабільні клітинні лінії hT1R2/hT1R3 (WT), hT1R2 S144A/hT1R3 (S 144A) і hT1R2 E302A/hTR3 (Е302А) одержували, як описано в прикладах. "Доза-відповідь" цих стабільних ліній на сахарозу, аспартам, неотам і цикламат визначали на обладнанні FLIPR. Активність являє собою середнє значення ± SE кратності збільшення інтенсивності флуоресценції для чотирьох зареєстрованих ямок. На фігурі 23 с показано вирівнювання послідовності трансмембранних доменів T1R3 людини і щура. Три екстрацелюлярні петлі підкреслені і позначені EL1, 2 або 3, у відповідності з порядком їх розташування в білкових послідовностях. На фігурі 23d показані мутації в екстрацелюлярній петлі hT1R3, які блокують відповідь на цикламат, не впливаючи на відповідь на аспартам. Кожну з трьох екстрацелюлярних петель hT1R3 замінювали білковою послідовністю щура, і одержані мутанти hT1R3 тимчасово трансфікували в клітини НЕК-293Т разом з Gα15/i1, і аналізували їх відповіді на сахарозу (200мМ), аспартам (10мМ) і цикламат (10мМ). Активність являє собою середнє значення ± SE числа клітин, що відповіли, для чотирьох областей, що візуалізуються, з ~1000 конфлюентних клітин. На фігурах 24а-b показаний T1R2 людини, необхідний для Сα15-приєднання. На фігурі 24а показані відповіді рецепторів людини, щура і химерних рецепторів на сахарозу (200мМ) і АсеК (10мМ). Клітини, стабільно експресуючі Gα15, тимчасово трансфікували T1R людини, щура і химерними T1R, і аналізували збільшення внутрішньоклітинного кальцію у відповідь на підсолоджувачі. На фігурі 24b показано, що Сα15-приєднання було опосередковано T1R2 людини. Активність являє собою середнє значення ± SE числа клітин, що відповіли, для чотирьох областей, що візуалізуються, з ~1000 конфлюентних клітин. На фігурах 25a-f показаний ефект лактизолу і цикламату на рецептор "умамі" смаку T1R1/T1R3 людини. На фігурі 25а показана відповідь клітинної лінії, стабільно експресуючої T1R1/T1R3 людини, на L-глутамат (5мМ) і L-глутамат/ІМР (1/0,2мМ) у 86946 10 відсутності і у присутності лактизолу (5мМ). На фігурі 25Ь показані криві "доза лактизолуінгібування", які були визначені для L-глутамату (GIu) і L-глутамату разом з 0,2мМ IMP (Glu/IMP), кожний в двох різних концентраціях. Значення IC50 становили 0,19 ± 0,02мМ і 0,21 ± 0,01мМ для Lглутамату при 8 і 80мМ; 0,35 ± 0,03мМ і 0,82 ± 0,06мМ для L-глутамату разом з IMP при 0,8 і 8мМ, відповідно. На фігурі 25с показані криві "дозавідповідь" для L-глутамату, в присутності або за відсутності 0,2мМ IMP, які визначали в присутності різних концентрацій лактизолу. У присутності 0,25 або 50мкМ лактизолу значення ЕС50 становили 9,9 ± 1,5мМ, 7,9 ± 0,5мМ і 7,0 ± 0,3мМ у випадку Lглутамату; в присутності 0,100 або 200мкМ лактизолу значення EC50 становили 0,53 ± 0,04мМ, 0,71 ± 0,10мМ і 0,84 ± 0,10мМ у випадку L-глутамату в присутності IMP. Значення являють собою середнє значення ± SE для чотирьох незалежних відповідей. На фігурі 25d показані пороги смакової чутливості для солодкого, "умамі" і солоного смакових подразників, які визначали в присутності або за відсутності лактизолу. Інгібуючий ефект лактизолу показаний як кратність збільшення порога смакової чутливості. "Поріг смакової чутливості" визначений як нижня межа виявлюваної сполуки, яка надає смак. Значення порога смакової чутливості усереднювали для чотирьох досліджень трьох індивідуумів. На фігурі 25е показані відповіді клітинної лінії, стабільно експресуючої T1R1/T1R3 людини, на пороговий рівень L-глутамату (4мМ) і карбахолу, агоніста ендогенного рецептора М2, які одержували на обладнанні FLIPR у відсутності і у присутності різних концентрацій цикламату. На фігурі 25f показані криві "доза-відповідь" клітинної лінії, стабільно експресуючої T1R1/T1R3 людини, на L-глутамат разом або без 0,2мМ IMP у відсутності і у присутності цикламату (8мМ), які одержували на обладнанні FLIPR. Активність на Фіг.25В, С, E і F являє собою середнє значення ± SE кратного збільшення інтенсивності флуоресценції для чотирьох зареєстрованих ямок. Криву "дозавідповідь" для В, С, E і F незалежно повторювали щонайменше 6 разів. На фігурі 26 показана робоча модель зв'язку структури і функції рецептора солодкого і "умамі" смаку. Зафарбовані стрілки вказують на безпосередню активацію, прозорі стрілки вказують на посилення, а стрілки з тупим кінцем вказують на інгібування. На фігурі 27а показані всі 16 сполучань T1R і химерних рецепторів, у яких тестували відповіді на підсолоджувачі і лактизол. Для rT1R2/T1R3H-R, rT1R2/hT1R3 і T1R2H-R/T1R3R-H показана значна відповідь на цикламат і показано, що вони можуть бути інгібовані лактизолом. Клітини НЕК-293Т, експресуючі Gα15/і1, тимчасово трансфікували химерними рецепторами T1R. Активність являє собою середнє значення ± SE числа клітин, що відповіли, відносно чотирьох областей, що візуалізуються, з ~1000 конфлюентних клітин, кожна одиниця на осі Y являє собою 50 клітин, що відповіли. Абревіатури: Sue (сахароза 100мМ); Suc/Lac (сахароза 100мМ, лактизол 1мМ); АсеК (ацесульфам K 10мМ); AceK/Lac (ацесульфам K 11 10мМ, лактизол 1мМ); ATM (аспартам 10мМ); NTM (неотам 10мМ); Сус (цикламат 10мМ). На фігурі 27b показані криві "доза лактизолу-інгібування" для рецептора солодкого смаку людини, які були визначені у відповідь на сахарозу (Sue), сахарин (Sac) і D-триптофан (D-Trp), кожну в двох різних концентраціях. Значення IC50 склали 19,6 ± 0,1мкМ і 64,6 ± 0,3мкМ для сахарози при 50мМ і 120мМ; 22,6 ± 0,1мкМ і 103 ± 7мкМ для сахарину при 0,1 і 2мМ; 19,9 ± 0,2мкМ і 168 ± 9мкМ для Dтриптофану, відповідно. На фігурі 27с показані криві "доза-відповідь" для рецептора солодкого смаку людини на сахарозу, D-Trp і сахарин при різних концентраціях лактизолу. У присутності 0, 10 або 20мкМ лактизолу значення ЕС50 становило 19,4 ± 0,9мМ, 24,7 ± 1,0мМ і 31,3 ± 0,3мМ для сахарози; 0,37 ± 0,02мМ, 0,60 ± 0,03мМ, 0,94 ± 0,08мМ для D-Trp; 42 ± 3мкМ, 67 ± 6мкМ, 118 ± 2мкМ для сахарину. Значення являють собою середнє значення ± SE для чотирьох незалежних відповідей. Криві "доза-відповідь" на Фіг.27В і C були визначені щонайменше 6 незалежних разів, і на Фіг.27В і C показані одержані схожі результати. Докладний опис винаходу Винахід належить до сполук, які специфічно зв'язуються з рецепторами солодкого і "умамі" смаку дикого типу і їх химерними варіантами, описаними тут. Також винахід належить до сполук, які специфічно зв'язуються з субодиницями T1R2 або T1R3 рецептора солодкого і "умамі" дикого химерного або усіченого рецептора солодкого або "умамі" смаку. Велика різноманітність молекул здатна зв'язуватися з рецептором солодкого смаку T1R2/T1R3. Рецептор відповідає на будь-який тестований підсолоджувач, включаючи вуглеводні цукри, амінокислоти і похідні, солодкі білки і синтетичні підсолоджувачі. Проте рецептор володіє стереоспецифічністю у відношенні певних підсолоджувачів, наприклад, він реагує на Dтриптофан, але не реагує на L-триптофан, що корелює з даними фізіології смаку. Таким чином, сполуки за винаходом специфічно зв'язуються з химерними рецепторами. Приклади включають, але ними не обмежуються, химерний рецептор T1R2/T1R3, що містить субодиницю T1R2 людини і субодиницю T1R3 щура; химерний рецептор T1R2/T1R3, що містить субодиницю T1R2 щура і субодиницю T1R3 людини; химерну субодиницю рецептора T1R2, що містить екстрацелюлярний домен людини, трансмембранний домен щура і внутрішньоклітинний домен щура; і химерну рецепторну субодиницю рецептора T1R3, що містить екстрацелюлярний домен щура, трансмембранний домен людини і внутрішньоклітинний домен людини. Винахід належить до функціональних смакових рецепторів, переважно, до смакових рецепторів людини, які утворюються при одночасній експресії поєднання різних T1R, переважно, T1R1/T1R3 або T1R2/T1R3, і до відповідних виділених послідовностей нуклеїнових кислот або їх фрагментів, химерних варіантів або інших варіантів, одночасна експресія яких приводить до утворення функціонального смакового рецептора, тобто рецептора солодкого смаку 86946 12 (T1R2/T1R3) або рецептора "умамі" смаку (T1R1/T1R3). T1R належать до сімейства рецепторів, спряжених з G білками (GPCR), класу C і селективно експресуються у смаковій тканині (Hoon, М.А., et al., Cell, 1999. 96(4): p. 541-51, Bachmanov, А.А, et al., Chem Senses, 2001. 26(7): p. 925-33, Montmayeur, J.P., et al., Nat Neurosci, 2001. 4(5): p. 492-8, Max, M., et al., Nat Genet, 2001. 28(1): p. 5863, Kitagawa, M., et al., Biochem Biophys Res Commun, 2001. 283(1): p. 236-42 і Nelson, G., et al., Cell, 2001. 106(3): p. 381-90.) При функціональній експресії T1R в клітинах НЕК293 було виявлено, що різні поєднання T1R відповідають на солодкий смаковий подразник і "умамі" смаковий подразник (Nelson, G., et al., Cell, 2001. 106(3): p. 381-90, Li, X., et al., Proc Natl Acad Sci USA, 2002. 99(7): p. 4692-6). При одночасній експресії в клітинах 293 T1R2 і T1R3 розпізнають різні природні і синтетичні підсолоджувачі, тоді як T1R1 і T1R3 розпізнають "умамі" смак L-глутамату, і ця відповідь посилюється в присутності 5'-рибонуклеотидів, що є відмінною рисою "умамі" смаку. Дані аналізу з "нокаут" генами підтвердили, що T1R дійсно опосередковує солодкий і "умамі" смак у мишей (Damak, S., et al., Science, 2003 301(5634): p. 8503, Zhao, G.Q, et al., Cell 2003 Oct 31; 115(3):25566). Рецептори GPCR класу C володіють великим N-кінцевим екстрацелюлярним доменом, часто званим доменом "венериної мухоловки" (VFD) (Pin, J.P., Pharmacol Ther, 2003 98(3): p. 325-54), і який, як відомо, функціонує або як гомодимер, у разі метаботропних глутаматних рецепторів (mGluR) і кальційчутливого рецептора (CaR), або як гетеродимер, у разі рецептора типу В γаміномасляної кислоти (GABABR). Дані функціонального аналізу експресії показали гетеродимерний механізм T1R:для функціонування необхідна одночасна експресія T1R3 з одним з T1R1 і T1R2, що підтверджується перекриттям областей експресії T1R на язиці гризуна. У даному винаході було виявлено, що для функціонування як рецепторів солодкого і "умамі" смаку члени сімейства T1R діють в поєднанні з іншими членами сімейства T1R. Як детально описано далі, наприклад, в експериментальних прикладах, було показано, що гетерологічні клітини, які одночасно експресують hT1R2 і hT1R3, селективно активуються під дією солодкого смакового подразника, що аналогічно сприйняттю солодкого смаку у людини. Наприклад, клітини HEK-293-Gα15, які одночасно експресують hT1R2 і hT1R3, специфічно реагують на цикламат, сахарозу, аспартам і сахарин, і залежна від дози відповідь на ці сполуки корелює з психофізичним порогом смакової чутливості. Також було показано і підтверджено даними експериментальних прикладів, що клітини, які одночасно експресують hT1R1 і hT1R3, селективно активуються глутаматом (мононатрій глутамат) і 5'-рибонуклеотидами, що аналогічно сприйняттю "умамі" смаку у людини. Наприклад, клітини HEK293-Gα15, які одночасно експресують hT1R1 і hT1R3, специфічно реагують на глутамат і залеж 13 на від дози відповідь на ці сполуки, що викликають "умамі" смак, корелює з психофізичним порогом смакової чутливості. Більш того 5'рибонуклеотиди, такі як IMP, посилюють відповідь рецепторів T1R1/T1R3 на глутамат, і такий синергізм є характерним для "умамі" смаку. Крім того, було показано і підтверджено даними експериментальних прикладів, що клітини, які стабільно і індуцибельно коекспресують T1R1/T1R3, селективно відповідають на "умамі" смаковий подразник, L-глутамат і L-аспартат, і слабо реагують на інші L-амінокислоти, і при набагато великих концентраціях, що є додатковим доказом того, що рецептор T1R1/T1R3 можна використовувати в аналізах для ідентифікації сполук, які модулюють (посилюють або блокують) "умамі" смаковий стимул. Приклади сполук, які специфічно зв'язуються з рецептором солодкого смаку і модулюють солодкий смак, можуть бути представлені в таблиці 5. У таблиці 1-4 наведені приклади сполук, які специфічно зв'язуються з рецептором "умамі" смаку і модулюють "умамі" смак. 86946 14 15 86946 16 17 86946 18 19 86946 20 21 86946 22 23 86946 24 25 86946 26 27 86946 28 29 86946 30 31 86946 32 33 86946 34 35 86946 36 37 86946 38 39 86946 40 41 86946 42 43 86946 44 45 86946 46 47 86946 48 49 86946 50 51 Також, було показано і підтверджено даними експериментальних прикладів, що клітинні лінії, які коекспресують T1R1/T1R3 або T1R2/T1R3, відповідно реагують на "умамі" солодкий смаковий подразник, і кількісний аналіз "доза-відповідь" також підтвердив твердження, що специфічне зв'язування з рецептором T1R1/T1R3 і T1R2/T1R3 може використовуватися для визначення агоністів і антагоністів рецептора, наприклад, замісників MSG, блокаторів "умамі" смаку, нових штучних і природних підсолоджувачів і блокаторів солодкого смаку. Також було показано і підтверджено даним експериментальних прикладів, що блокатор солодкого смаку лактизол інгібує як рецептор солодкого смаку T1R2/T1R3, так і рецептор "умамі" смаку T1R1/T1R3. У даному винаході представлені сполуки, які посилюють, імітують, модулюють або блокують солодкий або "умамі" смак. На основі того факту, що лактизол інгібує як рецептор T1R1/T1R3, так і рецептор T1R2/T1R3, можна передбачити, що в цих рецепторах може бути прису 86946 52 тнім загальна субодиниця, яка зв'язується з лактизолом і, ймовірно, іншими модуляторами смаку. Отже, це свідчить про те, що деякі сполуки, які посилюють, імітують, модулюють або блокують солодкий смак, можуть володіти схожим ефектом на "умамі" смак або навпаки. Крім того, було показано і підтверджено даними експериментальних прикладів, що клітинні лінії, які стабільно коекспресують T1R, тобто T1R1/T1R3 або T1R2/T1R3, при аналізі за допомогою автоматизованої флуоресцентної візуалізації, дуже ефективно реагують на різні солодкі і "умамі" подразники, тобто, величина відповіді значно вище за величину відповіді тимчасово трансфікованих клітин. Таким чином, ці клітинні лінії особливо добре підходять для застосування у високоефективних методах скринінгу для ідентифікації сполук, які модулюють, блокують, імітують або посилюють солодкий або "умамі" смак. Однак винахід також належить до способів, в яких застосовують клітини, тимчасово експресуючі T1R або їх поєднання. Крім того, незважаючи на те, що в заявці представлені дані, які демонструють, що деякі T1R діють у сполученні, зокрема T1R1/T1R3 і T1R2/T1R3, і що такі поєднання рецепторів можуть використовуватися в аналізах, переважно, у високоефективних методах скринінгу, потрібно зазначити, що об'єктом винаходутакож є методи, в яких застосовують тільки T1R1, T1R2 і T1R3 самі по собі або їх сполучення з іншими білками, наприклад, з іншими рецепторами GPCR. У людини і гризунів існують відмінності в лігандній специфічності, ефективності зв'язування з Gбілком, а також чутливості до інгібіторів. Видові відмінності лігандної специфічності T1R можна використати для доказу того факту, що рецептор солодкого смаку дійсно діє як гетеромерний комплекс, і що на рецепторі існує більше одного лігандзв'язуючого сайта. Більше того між рецепторами солодкого і "умамі" смаку показаний функціональний зв'язок, опосередкований T1R3 (приклад 16). Рецептори солодкого смаку як людини, так і щура можуть ефективно зв'язуються з химерним Gα15, який містить послідовність С-кінцевого хвоста Gα11 (Gα15/i1). Наприклад, рецептор T1R2/T1R3 людини, але не щура, селективно реагує на групу підсолоджувачів, включаючи аспартам, неотам і цикламат. Це узгоджується з фізіологічними даними смаку. Ці відмінності в агоністичній специфічності можуть використовуватися для картування сайтів зв'язування на рецепторі. Химерний T1R може бути одержаний за допомогою генів людини і щура, із сполучанням безпосередньо перед трансмембранним доменом. Кожний химерний T1R, таким чином, складається з двох половинок, одержаних з різних видів N-кінцевого екстрацелюлярного домену, і С-кінцевого трансмембранного і внутрішньоклітинного домену. Наприклад, химерний T1R2, позначений як T1R2-R, має послідовність N-кінцевого домену T1R2 людини, злиту з послідовністю C-кінцевого домену T1R2 щура. Потім можуть бути тестовані відповіді цих химерних рецепторів (фігура 22). Нові сполуки і нові смакові речовини, сполуки, що надають смаку, і підсилювачі солодкого смаку 53 були виявлені в хімічній групі амідних похідних. Амідні сполуки також містять певні підкласи амідних похідних або класи похідних, що належать до амідів, таких як, наприклад, сечовина, уретани, оксаламіди, акриламіди і тому подібне. Ці сполуки, при використанні разом з сахарозою або самостійно, посилюють відповідь in vitro, що супроводжується посиленням сприйняття солодкого смаку в тестах у людини. Ці сполуки посилюють інші природні і синтетичні смакові добавки, які викликають солодкий смак. Приклади таких сполук перераховані в таблиці 5. У одному з варіантів здійснення винахід належить до нових сполук, смакових речовин, сполук, які додають солодкого смаку, підсилювачам запаху, підсилювачам смаку, сполук, які модифікують смак, і/або до композицій, які їх містять. У більш конкретному варіанті здійснення винахід належить до нових солодких смакових речовин, сполук, які додають солодкого смаку, підсилювачам солодкого смаку і модифікаторам солодкого смаку і до композицій, які їх містять. Більш конкретно, в ще одному варіанті здійснення винахід належить до сполук, які модулюють, індукують, посилюють або інгібують дію природних або синтетичних сполук, які додають солодкого смаку, наприклад, природних або синтетичних підсолоджувачів. У ще одному варіанті здійснення винахід належить до композицій, переважно, до композицій, придатних для прийому людиною або твариною, які містять щонайменше одну сполуку за винаходом. Ці композиції включають харчові продукти, напої і лікарські препарати, а також харчові добавки, які при додаванні в харчові продукти, напої або лікарські препарати модулюють їх запах або смак, зокрема, посилюють солодкий смак. У ще одному варіанті здійснення винахід належить до застосування сполуки за винаходом для модулювання солодкого смаку необхідного харчового продукту, напою або лікарського препарату, де композиція може містити одну або декілька інших сполук, які викликають солодкий смак. При використанні таких сполук разом з природними або синтетичними підсолоджувачами, вони не тільки посилюють відповідь in vitro, але також роблять солодкий і інші сприйняття смаку і запаху людини більш інтенсивними. При використанні цих специфічних сполук разом із сполуками, які надають солодкий смак, такими як природні і синтетичні підсолоджувачі, не тільки посилюють відповідь T1R2/T1R3 in vitro, але також загострюють солодкий і інший смак або смакові відчуття у людини. Також тут описані нові сполуки і нові смакові речовини, сполуки, які надають "умамі" смак, і підсилювачі "умамі" смаку, такі як аміди, сечовина, аміноаміди, амідоаміди і Р-лактами. При використанні цих сполук разом з MSG або самостійно, вони підвищують відповідь in vitro і відчуття "умамі" смаку в тестах у людини. Ці сполуки також посилюють інші природні і синтетичні сполуки, які надають "умамі" смак. Приклади цих сполук перераховані в таблиці 1-4. У одному з варіантів здійснення винахід належить до нових сполук, смакових речовин, сполук, 86946 54 які надають смаку, підсилювачам запаху, підсилювачам смаку, сполукам, модифікуючим смак, і/або композиціям, які їх містять. У більш конкретному варіанті здійснення винахід належить до нових смакових речовин з "умамі" смаком, сполукам, які надають "умамі" смак, підсилювачам "умамі" смаку і модифікаторам "умамі" смаку і композиціям, які їх містять. Більш конкретно, в ще одному варіанті здійснення винахід належить до сполук, які модулюють (індукують, посилюють або інгібують) дію природних або синтетичних сполук, які надають "умамі" смак, наприклад, мононатрію глутамату (MSG). У ще одному варіанті здійснення винахід належить до композицій, переважно композицій, придатних для прийому людиною або твариною, які містять щонайменше одну сполуку за винаходом. Ці композиції включають харчові продукти, напої і лікарські препарати, а також харчові добавки, які при додаванні в харчові продукти, напої або лікарські препарати модулюють їх запах або смак, зокрема, посилюють "умамі" смак. Інший варіант здійснення винаходу належить до застосування сполуки за винаходом для модулювання "умамі" смаку необхідного харчового продукту, напою або лікарського препарату, де композиція може містити одну або декілька інших сполук, які викликають "умамі" смак, наприклад, MSG. При використанні таких сполук разом з MSG, вони не тільки посилюють відповідь in vitro, але також роблять "умамі" і інші сприйняття смаку або запаху людини більш інтенсивними. При використанні цих специфічних сполук разом із сполуками, які надають "умамі" смак, такими як MSG, вони не тільки посилюють відповідь T1R1/T1R3 in vitro, але також роблять "умамі" і інші сприйняття смаку або запаху людини більш інтенсивними. При самостійному тестуванні деякі сполуки викликають сприйняття "умамі" смаку. Сполуки, визначені за специфічним зв'язуванням зі специфічними рецепторами, в аналізах T1R за даним винаходом, можуть використовуватися для модулювання смаку харчових продуктів і напоїв. Відповідні аналізи, більш детально описані нижче, включають, як приклад, аналізи в цілих клітинах і біохімічні аналізи, включаючи аналіз прямого зв'язування, використовуючи одне з сполучень різних рецепторів T1R, їх химерних варіантів або фрагментів, особливо фрагментів, які містять Nкінцеві лігандзв'язуючі домени. Приклади аналізів, придатних для застосування у винаході, більш детально описані нижче і відомі в області GPCR. Можуть бути розроблені методики, за допомогою яких можна провести кількісний аналіз зв'язування різних сполук або суміші сполук зі смаковими рецепторами T1R або сполученням смакових рецепторів T1R, або рецепторами T1R, експресуючими в поєднанні з іншими гетерологічними (неT1R) білками, наприклад, іншими GPCR, або за допомогою яких можна провести кількісний аналіз активності клітин, які експресують смакові рецептори T1R. Такі аналізи можуть бути ефективно для стабільно або тимчасово експресуючихся смакових рецепторів в гетерологічних клітинах, таких як клітини НЕК-293, CHO і COS. Таким чином, ця фі 55 зико-хімічна характеристика сполук використовується для визначення роду сполуки, який володіє цією властивістю. У аналізах переважно можна використати клітини, які також експресують (переважно, стабільно) G-білок, такий як, Gα15 або Gα16, або інші проміскуітетні G білки або варіанти G-білків, або ендогенний G-білок. Крім того, клітини також можуть експресувати Gβ і Gγ білки. Ефект сполуки на солодкий або "умамі" смак, використовуючи клітини або композиції, які експресують або містять вищезгадані рецептори або сполучення рецепторів, може бути встановлений за допомогою різних способів, в тому числі використовуючи кальційчутливі барвники, потенціалчутливі барвники, аналізи сАМР, аналізи прямого зв'язування з використанням флуоресцентномічених лігандів або радіоактивних лігандів, такими як 3 Н-глутамат, або транскрипційні аналізи (із застосуванням відповідних репортерних молекул, таких як люцифераза або бета-лактамаза). Аналізи, в яких можна використовувати один або декілька T1R за даним винаходом, включають, наприклад, аналізи, в яких використовують генетичну селекцію живих клітин; аналізи, в яких використовують цілі клітини або фрагменти мембран або очищені білки T1R; аналізи, в яких використовують повторні месенджери, такі як сАМР і ІР3; аналізи, в яких визначають транслокацію арестину на клітинній поверхні; аналізи, в яких визначають втрату експресії рецептора на клітинній поверхні (інтерналізація) за допомогою лігандів, що тестуються; аналіз прямого зв'язування ліганду, аналіз конкурентного зв'язування з інгібіторами; аналізи, в яких використовують in vitro трансльований білок; аналізи, в яких визначають конформаційні зміни, які відбуваються при зв'язуванні ліганду (про що, наприклад, свідчить протеоліз, флуоресценція або ЯМР) аналіз поведінки, в яких використовують трансгенних тварин, експресуючих T1R або поєднання T1R, таких як мухи, черв'яки або миші; аналізи, в яких використовують клітини, інфіковані рекомбінантними вірусами, які містять гени T1R. Також в рамках винаходу знаходяться структурні аналізи, в яких визначають рентгенівську кристалічну структуру T1R або фрагмента T1R (або поєднання T1R, або поєднання T1R з ще одним білком) і які використовують для прогнозування за допомогою технологій молекулярного моделювання сполук, які будуть зв'язуватися з конкретним рецептором T1R або поєднанням рецепторів і/або посилювати, імітувати, блокувати або модулювати конкретний рецептор T1R або комбінацію рецепторів. Більш конкретно, винахід охоплює визначення кристалічної структури T1R1/T1R3 (переважно, hT1R1/hT1R3) і/або T1R2/T1R3 (переважно, hT1R2/hT1R3) і застосування такої кристалічної структури в методах структурного дизайну для ідентифікації молекул, які модулюють активність рецептора T1R. Винахід зокрема включає біохімічні аналізи, які проводять з використанням клітин, наприклад, клітин ссавців, дріжджів, комах або інших гетерологічних клітин, які експресують один або декілька 86946 56 повнорозмірних рецепторів T1R або фрагменти, переважно, N-кінцеві домени T1R1, T1R2 і/або T1R3. Ефект сполучення в таких аналізах може бути визначений за допомогою аналізів прямого зв'язування, наприклад, використовуючи радіоактивний глутамат або IMP, флуоресценцію (наприклад, флуоресцентну поляризацію, FRET) або 358 аналіз GТРγ -зв'язування. Як зазначалося, в переважному варіанті здійснення в таких аналізах можна використати клітинні лінії, які стабільно коекспресують T1R1/T1R3 або T1R2/T1R3 і придатний G-білок, такий як Gα15. Інші придатні G-білки включають химерні варіанти і варіанти G-білків, описані в заявках США №09/984292 і 60/243770, які наведені тут як посилання в повному об'ємі. Крім того, можуть бути сконструйовані і експресовані змінені рецептори з поліпшеними властивостями, наприклад, з підвищеною експресією на поверхні клітини або поліпшеним зв'язуванням з G-білком. Ці варіанти T1R можуть використовуватися в клітинних аналізах і біохімічних аналізах. Також передбачається, що даний винахід, який належить до рецепторів T1R людини, може належати і до рецепторів T1R інших видів, наприклад, гризунів, свиней, мавп, собак і кішок, а, можливо, навіть до нессавців, таких як риби. У зв'язку з цим, в прикладі 1 нижче ідентифіковані декілька фрагментів T1R риби. Отже, об'єктом винаходу є застосування в скринінгу сполук для використання в харчових композиціях для тварин. Винахід, крім того, належить до застосування різних алельних варіантів різних рецепторів T1R і їх сполучень, і, таким чином, може використовуватися для ідентифікації сполук, які викликають специфічне смакове сприйняття у індивідуумів, у яких експресуються такі алельні варіанти, або сполук, які викликають специфічне смакове сприйняття у всіх індивідуумів. Такі сполуки можуть використовуватися для поліпшення смаку харчових продуктів. Нуклеїнові кислоти, які кодують T1R, також є важливими зондами для ідентифікації смакових клітин, оскільки нуклеїнові кислоти специфічно експресуються у смакових клітинах. Наприклад, зонди до поліпептидів T1R1 білків можуть використовуватися для ідентифікації смакових клітин, присутніх в листоподібних, жолобоподібних і грибоподібних сосочках, а також смакових клітин, присутніх у смакових ділянках, ротовій порожнині, епітелії шлунково-кишкового тракту і надгортанника. Зокрема, способи визначення T1R можуть використовуватися для ідентифікації смакових клітин, чутливих до солодкого і/або "умамі" смакового подразнику або інших смакових подразників з іншими смаковими відчуттями. Наприклад, відповідно до даного винаходу можна зробити припущення, що клітини, стабільно або тимчасово експресуючі T1R2 і/або T1R3, будуть реагувати на солодкий смаковий подразник. Аналогічним чином, можна передбачити, що клітини, експресуючі T1R1 і/або T1R3, будуть реагувати на "умамі" смаковий подразник. Нуклеїнові кислоти, які кодують білки і поліпептиди T1R за винаходом, можуть бути виділені з різних джерел, одержані методами генної інженерії, ампліфіковані, синтезовані і/або реком 57 бінантно експресовані у відповідності зі способами, описаними в WO 00/035374, наведеній тут як посилання в повному об'ємі. Перелік рецепторів T1R, які можуть бути експресовані відповідно до винаходу, представлений в прикладах. Проте, необхідно підкреслити, що винахід охоплює експресію і застосування інших специфічних T1R або фрагментів, варіантів або химерних варіантів, сконструйованих на основі послідовностей таких T1R, і, зокрема, рецепторів T1R інших видів. Як описано тут, важливим аспектом винаходу є численні способи скринінгу модуляторів, наприклад, активаторів, інгібіторів, стимуляторів, підсилювачів, агоністів і антагоністів, цих специфічних для смакових клітин GPCR. Такі модулятори смакової трансдукції можуть використовуватися для модулювання шляхів передачі смакових сигналів. Ці способи скринування можуть використовуватися для ідентифікації високоафінних агоністів і антагоністів активності смакових клітин. Ці сполукимодулятори можуть потім використовуватися в харчовій промисловості для надання смаку, наприклад, для модулювання солодкого і/або "умамі" смаку харчових продуктів. Даний винахід заповнює пропуск, що існував раніше, в розумінні того, що солодкий і "умамі" смак визначається специфічними T1R1 комбінацією рецепторів T1R, які опосередковують солодке і "умамі" смакове сприйняття. Отже, загалом даний винахід належить до відкриття авторами класу смакових рецепторів T1R, зв'язаних з G-білками, і їх специфічної функції у смаковому сприйнятті і, в зв'язку з цим, кращого розуміння молекулярних основ смаку. Молекулярні основи, що лежать в основі солодкого і "умамі" смаку (смаку мононатрію глутамату), незрозумілі. Нещодавно були ідентифіковані три класи смакових рецепторів, зв'язаних з Gбілками, названі T1R. Факт перекриття областей експресії T1R і доказу того, що рецептор, який структурно належить до GABAB, Є гетеродимерним, зробили можливим припущення того, що T1R функціонують як гетеродимерні смакові рецептори. У прикладах, наведених нижче, авторами винаходу описана функціональна коекспресія рецепторів T1R1, T1R2 і T1R3 людини в гетерологічних клітинах; показано, що клітини, коекспресуючі T1R1 і T1R3, активуються під дією "умамі" смакового подразника; що клітини, коекспресуючі T1R2 і T1R3, активуються під дією солодкого смакового подразника. Активність T1R1/T1R3 і T1R2/T1R3 корелює з психофізичним порогом смакової чутливості. Крім того, було виявлено, що 5'рибонуклеотид IMP посилює відповідь T1R1/T1R3 на глутамат, що є синтетичною характеристикою "умамі" смаку. Ці дані показують, що специфічні рецептори T1R і абсолютно різні сполучення T1R функціонують як рецептори солодкого і "умамі" смаку. Вважається, що сприйняття людиною гіркого, солодкого і "умамі" смаку опосередковане рецепторами, зв'язаними з G-білками (Lindemann, В., Physiol. Res. 76:718-66 (1996)). Нещодавня оцінка геному людини виявила клас рецепторів гострого смаку T2R (Adler et al., Cell 100:613-702 (2000); 86946 58 Chandrasgekar et al., Cell 100:703-11 (2000); Matsunami et al., Nature 404: 601-604 (2000)), але рецептори солодкого і "умамі" смаку ідентифіковані не були. Також нещодавно був ідентифікований ще один клас можливих смакових рецепторів, T1R. Рецептори T1R уперше були ідентифіковані в великомасштабному секвенуванні виділеної бібліотеки кДНК, одержаної зі смакової тканини щура, в якій був ідентифікований T1R1, а в подальшому за допомогою PCR з олігонуклеотидним праймером на основі виродженої послідовності T1R1 був ідентифікований T1R2 (Hoon et al., Cell 96:541-551 (1999)). Нещодавно, авторами даного винаходу і іншими в базі даних людського геному був ідентифікований третій і, можливо, останній член сімейства T1R, T1R3 (Kitagawa et al., Biochem Biophys. Res Commun. 283(1): 236-42 (2001); Max et al., Nat. Genet. 28(1): 58-63 (2001); Sainz et al., J. Neurochem. 77(3): 896-903 (2001); Montmayeur et al., Nat. Neurosci. 4, 492-8. (2001)). Характерно, що T1R3 миші проецюється на геномний інтервал, який містить Sac, локус, який впливає на солодкий смак миші (Fuller et al., J. Hered. 65:33-6 (1974); Li et al., Mamm. Genome 12:13-16 (2001)). Отже, було зроблене припущення, що рецептор T1R3 функціонує як рецептор солодкого смаку. Нещодавні дослідження з високоефективного генетичного картування підтвердили зв'язок між T1R3 миші і Sac (Fuller Т.С, J. Hered. 65(1): 33-36 (1974); Li et al., Mammal. Genome 12(1): 13-16 (2001)). Цікаво, що всі рецептори сімейства С, які функціонально експресуються і відомі на сьогоднішній день, а саме, метаботропні глутаматні рецептори, рецептор GABAB, кальційчутливий рецептор (Conigrave, A.D., Quinn, S.J. & Brown, Е. М., Proc Natl Acad Sci USA 97, 4814-9. (2000)) і рецептор нюху риб (Speca, D. J. et al., Neuron 23, 487-98. (1999)), як було показано, активуються амінокислотами. Ця загальна властивість навела на думку про те, що рецептори T1R можливо розпізнають амінокислоти, і що рецептори T1R, крім розпізнаванняамінокислот з солодким смаком, можуть бути залучені до розпізнавання глутамату. Альтернативно, було зроблено припущення, що транскрипційний варіант метаботропного глутаматного рецептора mGluR4, є рецептором "умамі" смаку, оскільки він селективно експресується у смаковій тканині щура і має схожий поріг рецепторної активації з психофізичним смаковим порогом смакової чутливості до глутамату (Chaudhari et al., Nat. Neurosci. 3:113-119 (2000)). Ця гіпотеза насилу узгоджується з надзвичайно низьким рівнем експресії варіанта mGluR4 у смаковій тканині, і практично повною відсутністю зміни смаку до глутамату у мишей з нокаутом mGluR4 (Chaudhari and Roper, Ann. N.Y. Acad. Sci. 855:398-406 (1998)). Більш того смаковий варіант є структурно неможливим, оскільки в ньому відсутні не тільки осикові залишки, які утворять глутаматзв'язуючу карман в рецепторі дикого типу, але також відсутня приблизно половина глобулярного N-кінцевого глутаматзв'язуючого домену (Kunishima et al., Nature 407:971-7 (2000)). Порівняльний аналіз областей експресії T1R y гризунів показав, що кожний T1R2 і, можливо 59 T1R1, коекспресується разом з T1R3 (Hoon et al., Cell 96:541-51 (1999); Kitagawa et al., Biochem Biophy. Res. Commun. 283:236-242 (2001); Max et al., Nat. Genet. 28:58-63 (2001); Montmayeur et al., Nat. Neurosci 4:492-8 (2001); Sainz et al., J. Neurochem 77:896-903 (2001)). Більш того димеризація є загальною властивістю рецепторів Ссімейства: метаботропний глутаматний і кальційчутливий рецептори є гомодимерами (Romomano et al., J. Biol. Chem. 271:28612-6 (1996); Okamoto et al., J. Biol. Chem. 273: 13089-96 (1998); Han et al., J. Biol. Chem. 274:100008-13 (1999); Bai et al., J. Biol. Chem. 273:23605-10 (1998)), a структурно схожий рецептор GABAB Є гетеродимерним (Jones et al., Nature 396:674-9 (1998); Kaupmann et al., Nature 396:683-687 (1998); White et al., Nature 396: 679682 (1998); Kuner et al., Science 283:74-77 (1999)). Автори даного винаходу продемонстрували за допомогою функціональної коекспресії T1R В гетерологічних клітинах, що T1R2 людини в поєднанні з T1R3 людини функціонує як рецептор солодкого смаку, і що T1R1 людини в поєднанні з T1R3 людини функціонує як рецептор "умамі" смаку. Відкриття, описане тут, є особливо знаменним, оскільки раніше при розробці поліпшених штучних підсолоджувачів не вистачало аналізів солодкого смаку. Дійсно, п'ять поширених комерційних підсолоджувачів, кожний з яких активує hT1R2/hT1R3, були відкриті випадково. Аналогічно, крім смакового тестування, дуже трудомісткого процесу, не існує аналізу для ідентифікації сполук, які модулюють "умамі" смак. Ці труднощі зараз подолані оскільки на основі результатів експериментів, описаних нижче, були ідентифіковані рецептори солодкого і "умамі" смаку людини, і були розроблені аналізи для цих рецепторів, зокрема аналізи, в яких використовують клітини, стабільно експресуючі функціональні смакові рецептори T1R, тобто рецептори солодкого або "умамі" смаку. На основі цього винахід належить до аналізів для визначення і характеристики сполук, що модулює смак, в яких члени сімейства T1R діють, так само, як у смакових сосочках, як репортерних молекул ефекту солодкого і "умамі" смаку сполук, які модулюють смак. Зокрема, до складу винаходу входять аналізи для ідентифікації сполук, які модулюють, імітують, посилюють і/або блокують, кожний нарізно, солодкий і "умамі" смак. Способи дослідження активності рецепторів GPCR, і, зокрема, сполук, які впливають на активність GPCR, добре відомі і можуть використовуватися для дослідження активності представників сімейства T1R за даним винаходом і їх функціональних сполучень. Відповідні аналізи визначені раніше. Винахід також належить до сполук, які зв'язують T1R1, T1R2, T1R3, T1R2/T1R3 або T1R1/T1R3 або будь-який їх фрагмент, частину або субодиницю, як описано тут. Зокрема, досліджувані GPCR можуть використовуватися в in vitro і in vivo аналізах, наприклад, для вимірювання змін зв'язування ліганду, іонної концентрації, мембранного потенціалу, електричного струму, іонного потоку, транскрипції, взаємодій рецептора і ліганду, концентрації повторного 86946 60 месенджера. У ще одному варіанті здійснення члени сімейства T1R можуть бути рекомбінантно експресовані в клітинах, і модулювання передачі смаку через активність GPCR може бути проаналі2+ зоване шляхом вимірювання змін рівнів Ca і інших внутрішньоклітинних месенджерів, таких як сАМР. cGMP або ІР3. У деяких аналізах домен поліпептиду T1R, наприклад екстрацелюлярний, трансмембранний або внутрішньоклітинний домен, гібридизують з гетерологічним поліпептидом з одержанням, таким чином, химерного поліпептиду, наприклад, химерного білка з активністю GPCR. Зокрема було розглянуте застосування фрагментів T1R1, T1R2 або T1R3, що містять N-кінцевий лігандзв'язуючий домен. Такі білки можна використовувати, наприклад, в аналізах для ідентифікації лігандів, агоністів, антагоністів або інших модуляторів рецептора T1R. Наприклад, поліпептид T1R може бути експресований в еукаріотичних клітинах у вигляді химерного рецептора з гетерологічною послідовністю шаперону, яка забезпечує перенесення через плазматичну мембрану або дозрівання і направлену доставку в секреторному шляху. Необов'язковою гетерологічною послідовністю може бути доменвзаємодіючий пептид PDZ, такий як Скінцевий фрагмент PDZIP (SEQ ID NO 1). PDZIP являє собою сигнал експорту ендоплазматичного ретикулума (ЕР), який, відповідно до даного винаходу, забезпечує поверхневу експресію гетерологічних білків, таких як рецептори T1R, описані тут. Більш конкретно, в одному з аспектів винаходу PDZIP може бути використаний для активації певної направленої доставки невивчених мембранних білків, таких як нюхові рецептори, смакові рецептори T2R і смакові рецептори T1R, описані тут. Приклади таких химерних рецепторів включають міжвидові рецептори. Можна використати будь-яке поєднання рецепторних субодиниць різних видів з одержанням химерного рецептора, який потім може використовуватися, наприклад, для ідентифікації сполук, які надають смак. Отже, у винаході описується химерний рецептор T1R2/T1R3, який містить субодиницю T1R2 людини і субодиницю T1R3 щура. Також описується химерний рецептор T1R2/T1R3, який містить субодиницю T1R2 щура і субодиницю T1R3. Також представлена химерна рецепторна субодиниця T1R2, яка містить екстрацелюлярний домен людини, трансмембранний домен щура і внутрішньоклітинний домен щура (наприклад, SEQ ID NO: 16 і 17). Також описана химерна рецепторна субодиниця рецептора T1R3, яка містить екстрацелюлярний домен людини, трансмембранний домен людини і внутрішньоклітинний домен людини (наприклад, SEQ ID NO: 18 і 19). Такі химерні рецептори T1R можуть бути експресовані в будь-якій еукаріотичній клітині, такій як клітини НЕК-293. Переважно, клітини містять Gбілок, переважно, проміскуітентний G-білок, такий як Gα15 або Gα16, або інший тип проміскуітентного G-білка, здатний зв'язувати велике число GPCR з внутрішньоклітинним сигнальним шляхом або з сигнальним білком, таким як фосфоліпаза С. Активацію таких химерних рецепторів в цих клітинах
ДивитисяДодаткова інформація
Назва патенту англійськоюT1r hetero-oligomeric taste receptors, cell lines that express said receptors, and taste compounds
Автори англійськоюLI XIADONG, Staszewski Lena, Xu Hong
Назва патенту російськоюГетероолигомерные вкусовые рецепторы т1r, клеточные линии, которые экспресируют указанные рецепторы, и вкусовые соединения
Автори російськоюЛи Сядун, Стажевски Лена, Сюй Хун
МПК / Мітки
МПК: C07D 405/14, G01N 35/00, C07D 401/12, A23L 1/00
Мітки: т1r, вказані, рецептори, клітинні, лінії, смакові, гетероолігомерні, експресують, сполуки
Код посилання
<a href="https://ua.patents.su/75-86946-geterooligomerni-smakovi-receptori-t1r-klitinni-lini-yaki-ekspresuyut-vkazani-receptori-i-smakovi-spoluki.html" target="_blank" rel="follow" title="База патентів України">Гетероолігомерні смакові рецептори т1r, клітинні лінії, які експресують вказані рецептори, і смакові сполуки</a>
Попередній патент: Спосіб визначення механічних характеристик металічного матеріалу
Наступний патент: Спосіб одержання лозартрану
Випадковий патент: Спосіб міні-інвазивного хірургічного лікування псевдокіст підшлункової залози