Спосіб одержання фенільних гетероциклів, придатних як інгібітори циклооксигенази-2
Номер патенту: 57029
Опубліковано: 16.06.2003
Автори: Тілльєр Річард Д., Фрей Лайза Ф., Доллінг Ульф Х., Тшаєн Девід М., Десмонд Річард
Формула / Реферат
1. Способ получения соединений формулы 1
 1,
1,
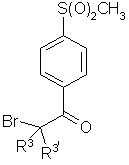
где R2 является моно- или дизамещенным фенилом, где заместитель выбран из группы, включающей:
(1) водород,
(2) галоген,
(3) C1-6-алкокси,
(4) C1-6-алкилтио,
(5) CN,
(6) СF3 и
(7) C1-6-алкил,
R3 и R3' независимо выбраны из водорода и C1-4-алкила,
который заключается в том, что осуществляют:
(b4) взаимодействие в N,N-диметилформамиде соединения формулы 2
 2,
2,
с фенилуксусной кислотой формулы
![]()
в присутствии неорганического основания с получением соединения формулы 5а
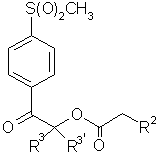 5a,
5a,
(b5) обработку в полярном апротонном растворителе соединения формулы 5а органическим основанием с получением соединения формулы 1.
2. Способ по п. 1, где неорганическим основанием является гидроксид натрия.
3. Способ по п. 1, где полярным апротонным растворителем является N,N-диметилформамид.
4. Способ по п. 1, где после стадии (b5) осуществляют кристаллизацию при температуре примерно от 40 до 60°С.
5. Способ по п. 1, где
R2 является моно- или дизамещенным фенилом, где заместитель выбран из группы, включающей:
(1) водород,
(2) галоген,
(3) метокси,
(4) метил,
оба R3 и R3' являются водородом или метилом.
6. Способ по п. 1, где R2 является моно- или дизамещенным фенилом, где заместитель выбран из группы, включающей:
(1) водород,
(2) галоген,
оба R3 и R3' являются водородом или метилом.
7. Способ по п. 1, где соединением формулы 1 является
(a) 5, 5-диметил-3-(3-фторфенил)-4-(4-(метилсульфонил)фенил)-2-(5Н)фуранон
или
(b) 3-фенил-4-(4-(метилсульфонил)фенил)-2-(5Н)-фуранон.
8. Способ по п. 1, включающий
(b3) взаимодействие в водном растворе уксусной кислоты соединения формулы 4
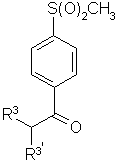 4,
4,
с бромом с получением соединения формулы 2
 2,
2,
(b4) взаимодействие в N,N-диметилформамиде соединения формулы 2 с фенилуксусной кислотой формулы
![]()
в присутствии неорганического основания с получением соединения формулы 5а
 5a,
5a,
(b5) обработку в полярном апротонном растворителе соединения формулы 5а органическим основанием с получением соединения формулы 1.
9. Способ по п. 8, включающий
(b2) взаимодействие в инертном растворителе в присутствии катализатора межфазного переноса и окислителя соединения формулы 3
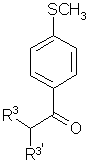 3,
3,
с получением соединения формулы 4
 4,
4,
(b3) взаимодействие в водном растворе уксусной кислоты соединения формулы 4 с бромом с получением соединения формулы 2
 2,
2,
(b4) взаимодействие в N, N-диметилформамиде соединения формулы 2 с фенилуксусной кислотой формулы
![]()
в присутствии неорганического основания с получением соединения формулы 5а
 5a,
5a,
(b5) обработку в полярном апротонном растворителе соединения формулы 5а органическим основанием с получением соединения формулы 1.
10. Способ по п. 9, где катализатором межфазного переноса на стадии (b2) является трикаприлилметиламмоний хлорид, для катализа окисления на стадии (b2) добавляют вольфрамат натрия и для инициирования реакции на стадии (b3) добавляют бромистый водород.
11. Способ по п. 9, где инертным растворителем является о-дихлорбензол, катализатором межфазного переноса является трикаприлилметиламмонийхлорид и окислителем является пероксид водорода.
12. Способ по п.9 получения соединения формулы 1
 1,
1,
где:
R2 является реакционно-устойчивой органической группой, такой как моно- или дизамещенный фенил, где заместитель выбран из группы, включающей:
(1) водород,
(2) галоген,
(3) C1-6-алкокси,
(4) C1-6-алкилтио,
(5) CN,
(6) СF3 и
(7) C1-6-алкил,
R3 и R3' независимо выбраны из водорода и C1-4-алкила,
который заключается в том, что осуществляют:
(b1) взаимодействие в инертном растворителе в присутствии ацилхлорида формулы R3R3'CHC(O)Cl и хлорида алюминия тиоанизола
с получением соединения формулы 3
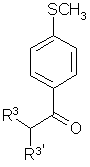 3,
3,
(b2) взаимодействие в инертном растворителе в присутствии катализатора межфазного переноса и окислителя соединения формулы 3 с получением соединения формулы 4
 4,
4,
(b3) взаимодействие в водном растворе уксусной кислоты соединения формулы 4 с бромом с получением соединения формулы 2
 2,
2,
(b4) взаимодействие в N,N-диметилформамиде соединения формулы 2 с производным уксусной кислоты формулы
![]()
в присутствии неорганического основания с получением соединения формулы 5а
 5a,
5a,
(b5) обработку в полярном апротонном растворителе соединения формулы 5а органическим основанием с получением соединения формулы 1.
Текст
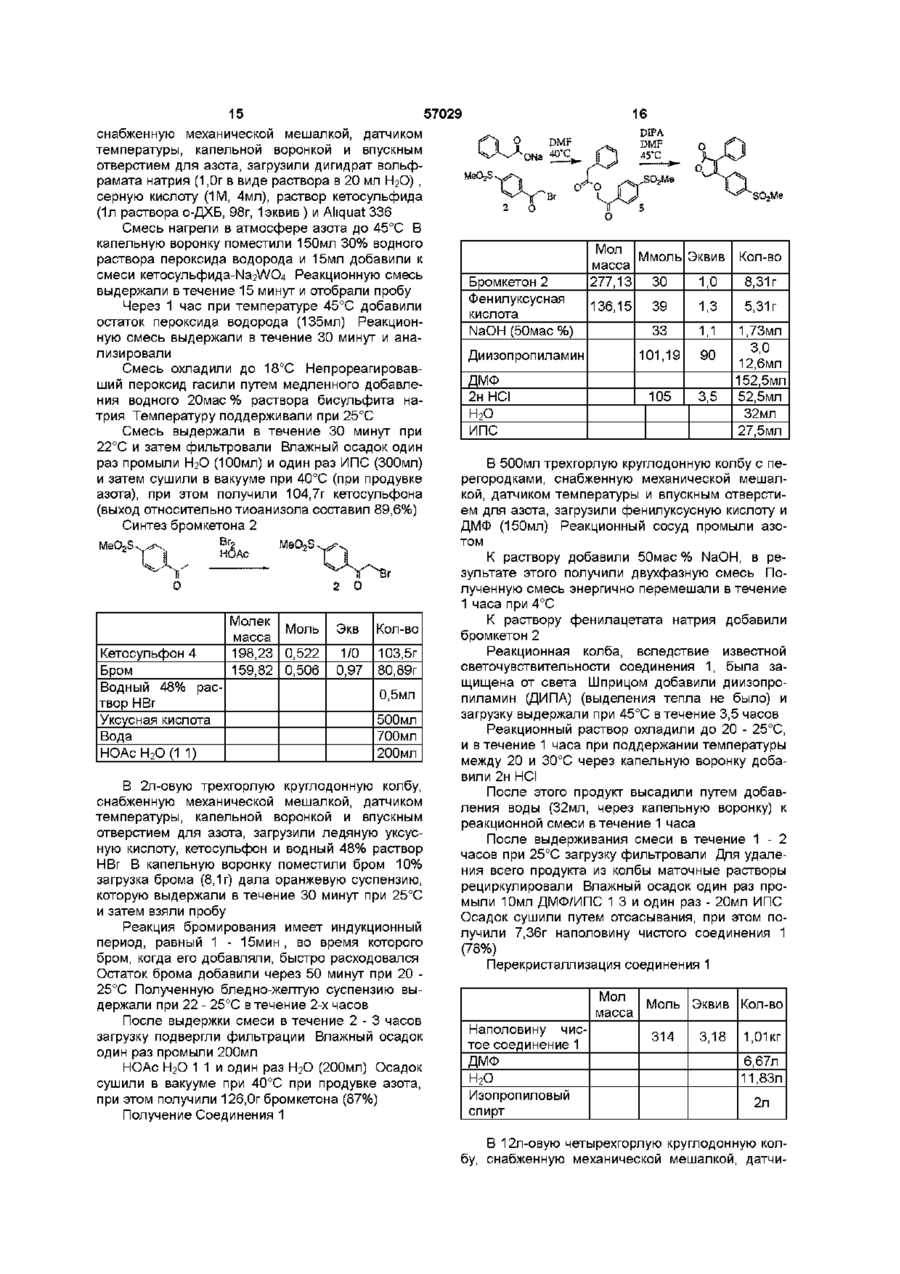
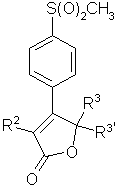
1 Способ получения соединений формулы 1 S(O) 2 CH 3 где R является моно- или дизамещенным фенилом, где заместитель выбран из группы, включающей (1) водород, (2) галоген, (3) Сі 6-алкокси, (4) Сі 6-алкилтио, (5) CN, (6) CF3 и (7) Сі 6-алкил, R и R3 независимо выбраны из водорода и Сі 4алкила, который заключается втом, что осуществляют (Ь4) взаимодействие в N.N-диметилформамиде соединения формулы 2 с фенилуксусной кислотой формулы в присутствии неорганического основания с получением соединения формулы 5а S(O)2CH3 О (Ь5) обработку в полярном апротонном растворителе соединения формулы 5а органическим основанием с получением соединения формулы 1 2 Способ по п 1, где неорганическим основанием является гидроксид натрия 3 Способ по п 1, где полярным апротонным растворителем является N.N-диметилформамид 4 Способ по п 1, где после стадии (Ь5) осуществляют кристаллизацию при температуре примерно от 40 до 60°С 5 Способ по п 1, где R2 является моно- или дизамещенным фенилом, где заместитель выбран из группы, включающей (1) водород, (2) галоген, (3) метокси, (4) метил, оба R3 и R3 являются водородом или метилом 6 Способ по п 1, где R2 является моно- или дизамещенным фенилом, где заместитель выбран из группы, включающей (1) водород, (2) галоген оба R3 и R являются водородом или метилом о ю 57029 7 Способ по п 1, где соединением формулы 1 является (a) 5, 5-диметил-3-(3-фторфенил)-4-(4(метилсульфонил)фенил)-2-(5Н)фуранон или (b) 3-фенил-4-(4-(метилсульфонил)фенил)-2-(5Н)фуранон 8 Способ по п 1, включающий (ЬЗ) взаимодействие в водном растворе уксусной кислоты соединения формулы 4 S(O),CH, R3 4, с бромом с получением соединения формулы 2 (Ь4) взаимодействие в N.N-диметилформамиде соединения формулы 2 с фенилуксуснои кислотой формулы в присутствии неорганического основания с получением соединения формулы 5а S(O),ChL (Ь5) обработку в полярном апротонном растворителе соединения формулы 5а органическим основанием с получением соединения формулы 1 9 Способ по п 8, включающий (Ь2) взаимодействие в инертном растворителе в присутствии катализатора межфазного переноса и окислителя соединения формулы 3 SCH, с получением соединения формулы 4 S(O)2CH3 (ЬЗ) взаимодействие в водном растворе уксусной кислоты соединения формулы 4 с бромом с получением соединения формулы 2 S(O)XHa R 2, (Ь4) взаимодействие в N, N-диметилформамиде соединения формулы 2 с фенилуксуснои кислотой формулы в присутствии неорганического основания с получением соединения формулы 5а S(O)-CH, R R3 ° 5a, (Ь5) обработку в полярном апротонном растворителе соединения формулы 5а органическим основанием с получением соединения формулы 1 10 Способ по п 9, где катализатором межфазного переноса на стадии (Ь2) является трикаприлилметиламмоний хлорид, для катализа окисления на стадии (Ь2) добавляют вольфрамат натрия и для инициирования реакции на стадии (ЬЗ) добавляют бромистый водород 11 Способ по п 9, где инертным растворителем является о-дихлорбензол, катализатором межфазного переноса является трикаприлилметиламмонийхлорид и окислителем является пероксид водорода 12 Способ по п 9 получения соединения формулы 1 S(O),CH, R является реакционно-устойчивой органической группой, такой как моно- или дизамещенный фенил, где заместитель выбран из группы, включающей (1) водород, (2) галоген, (3) Сі 6-алкокси, (4) Сі 6-алкилтио, (5) CN, (6) CF3 и (7) Сі 6-алкил, R и R3 независимо выбраны из водорода и Сі 4алкила, который заключается втом, что осуществляют 5 57029 6 (Ы) взаимодействие в инертном растворителе в чением соединения формулы 2 S(O)XHa присутствии ацилхлорида формулы 3 3 R R CHC(O)CI и хлорида алюминия тиоанизола SCI-L с получением соединения формулы 3 SCH. (Ь2) взаимодействие в инертном растворителе в присутствии катализатора межфазного переноса и окислителя соединения формулы 3 с получением соединения формулы 4 S(O)XHa (Ь4) взаимодействие в N.N-диметилформамиде соединения формулы 2 с производным уксусной кислоты формулы в присутствии неорганического основания с получением соединения формулы 5а S(O),CH, (Ь5) обработку в полярном апротонном растворителе соединения формулы 5а органическим основанием с получением соединения формулы 1 (ЬЗ) взаимодействие в водном растворе уксусной кислоты соединения формулы 4 с бромом с полу Это изобретение касается способа получения некоторых противовоспалительных соединений В частности, заявка касается способа получения описанных далее соединений формулы I, которые являются сильными ингибиторами циклооксигеназы-2 Нестероидные и противовоспалительные лекарственные средства более всего проявляют противовоспалительную, болеутоляющую и жаропонижающую активность и ингибируют маточные сокращения, вызванные гормонами, и рост некоторых типов опухолей вследствие ингибирования синтазы простагландина G/H, также известной как циклооксигеназа До недавнего времени была охарактеризована только одна форма циклооксигеназы, которая соответствует циклооксигеназе-1 или конститутивному ферменту, который первоначально был идентифицирован в бычьих семенных пузырьках Недавно был клонирован, секвентирован и охарактеризован ген второй индуцируемой формы циклооксигеназы (циклооксигеназы-2) цыпленка, мыши и человека Этот фермент отличается от циклооксигеназы-1 овцы, мыши и человека, которая была клонирована, секвентирована и охарактеризована Вторая форма циклооксигеназы циклооксигеназа-2 быстро и легко индуцируется рядом средств, включающих митогены, эндотоксин, гормоны, цитокины и факторы роста Так как простагландины имеют как физиологические, так и патологические функции, авторы пришли к заключению, что конститутивный фермент цикло оксигеназа-1 в значительной степени ответственен за эндогенную базальную секрецию простагландинов и, следовательно, за их физиологические функции, такие как желудочно-кишечная целостность и почечный кровоток Авторы также пришли к выводу о том, что в противоположность этому, индуцируемая форма циклооксигеназа-2 ответственна в основном за патологические эффекты простагландинов, когда в ответ на действие таких средств, как противовоспалительные средства, гормоны, факторы роста и цитокины, будет происходить быстрое индуцирование фермента Поэтому селективный ингибитор циклооксигеыазы-2 будет проявлять подобные противовоспалительные, жаропонижающие и болеутоляющие свойства, которые присущи общепринятому нестероидному противовоспалительному лекарственному средству и, кроме того, будет ингибировать вызванные гормонами маточные сокращения и обладать сильным противораковым действием, но при этом будет иметь ослабленную способность к индуцированию побочных действий В частности, такое соединение будет обладать пониженной желудочно-кишечной токсичностью, оказывать уменьшенное побочное действие на почки, ослабленное действие на время кровотечения и, возможно, обладать уменьшенной способностью к индуцированию приступов астмы у субъектов, страдающих этим заболеванием и являющихся чувствительным к аспирину В заявке WO 94/15932, опубликованной 21 57029 июля 1994, описан способ получения биарилфуранов с получением промежуточных продуїсгов биариллаїсгонов, в котором используют внутреннюю циклизацию кетоэфира с образованием лактона Авторы обнаружили, что при применении описанной технологической схемы, вследствие реакций внешней циклизации, которые конкурируют с желательной внутренней циклизацией, образуется значительное количество нежелательных побочных продуктов Хотя такие побочные продукты могут быть удалены посредством соответствующих методов разделения и очистки, для устранения трудностей авторы стремились разработать альтернативные способы Применение соединений формулы І в качестве ингибиторов циклооксигеназы-2 и способы их получения описаны в патенте США №5474995, который здесь приводится для ссылки Изобретение включает способ получения соединений формулы I, пригодных для лечения воспаления и других заболеваний, опосредованных циклооксигеназой-2 S{O)2CH3 В соответствии с первым аспектом изобретение включает способ получения соединений формулы I, пригодных для лечения воспаления и других заболеваний, опосредованных циклооксигеназой-2, S(O)2CH3 I где R2 является органической группой, такой как моно- или дизамещенный фенил, где заместитель выбран из группы, включающей (1) водород, (2) галоген, (3) Сі 6-алкокси, (4) Сі 6-алкилтио, (5) CN, (6) CF3 и (7) Сі 6-алкил, R и R3' независимо выбраны из водорода и Сі 4-алкила, который заключается в том, что осуществляют (Ы) взаимодействие в инертном растворителе в присутствии ацетилхлорида и хлорида алюминия тиоанизола SCH3 8 с получением соединения формулы 3 Для целей этого описания инертный растворитель определен как растворитель, включающий орто-дихлорбензол, метиленхлорид и хлороформ Предпочтительным является дихлорбензол Молярное отношение ацетилхлорида к тиоанизолу обычно составляет от 0,9 1 до 1,5 1 Предпочтительно, применяют избыток ацетилхлорида (например 1,21) Молярное отношение хлорида алюминия к тиоанизолу обычно составляет от 0,9 1 до 1,5 1 Предпочтительно используют избыток хлорида алюминия (например, 1,2 1) (Ь2) взаимодействие в инертном растворителе в присутствии межфазного катализатора соединения формулы 3 с окислителем с получением соединения формулы 4 8(0}гСН3 Для целей этого описания межфазный катализатор определен как катализатор, включающий трикаприлметиламмонийхлорид (ALIQUAT) и тетрабутиламмонийбромид Для целей этого описания окислителем является пероксид водорода Окислитель необязательно используют вместе с вольфраматом натрия или с другим соответствующим катализатором Молярное отношение соединения формулы 3 к окислителю обычно составляет от 0,5 1 до 0,5 2 Количество вольфрамата обычно составляет от 1 до Змас % относительно количества соединения формулы 3 Количество используемого межфазного катализатора обычно составляет от 1 до Юмас % относительно количества соединения формулы 3 (ЬЗ) взаимодействие в водном растворе уксусной кислоты соединения формулы 4 с бромом с получением соединения формулы 2 S{O)2CH3 Молярное отношение брома к соединению формулы 4 обычно составляет от 0,9 1 до 1,1 1 Для инициирования реакции необязательно может быть добавлен бромистый водород (Ь4) взаимодействие в N.N-диметилформамиде соединения формулы 2 с производным уксусной кислоты формулы R2 СОгН в присутствии неорганического основания с 10 57029 получением соединения формулы 5а S(O)2CH3 тосульфиду 3 Проведение ацилирования тиоанизола по Фриделю-Крафтсу (АІСІ3-СН3СОСІ, о-дихлорбензол) приводит к селективному получению кетосульфида 3 (пара орто > 100 1) После этого слои разделили и о-дихлорбензол раствор кетосульфида 3 (выход согласно анализу 97,5%) перенесли непосредственно на следующую стадию 5а Для целей этого описания неорганическое основание будет включать гидроксид натрия Молярное отношение фенилуксусной кислоты к соединению формулы 2 обычно составляет от 0,8 1 до 1 0,8 Предпочтительно используют избыток фенилуксусной кислоты (например 1,3 1) Молярное отношение неорганического основания к соединению формулы 2 обычно составляет около 1 1 Предпочтительно применяют избыток неорганического основания (около 1,1 1) (Ь5) обработку в полярном апротонном растворителе соединения формулы 5а органическим основанием с получением соединения формулы I Для целей этого описания полярный апротонный растворитель включает N.N-диметилформамид, диметилформамид, диметилацетамид и Nметилпирролидон Органическое основание включает диизопропиламин Затем полученное соединение формулы I может быть кристаллизовано из продукта стадии (Ь5), предпочтительно при температуре от 40 до 60°С Схема MaS o-DCB 1 к MeS S2e O M ta Ацилирование по Фриделю-Крафтсу Синтез бромкетона 2 начали с осуществления реакции Фриделя-Крафтса между тиоанизолом и ацетилхлоридом, при этом получили 4(метилтио)ацетофенон 3, отнесенный здесь к ке M o-DCB , О'С 3 п и Реакция Фриделя-Крафтса включает предварительное образование АІСІз-ацетилхлоридного комплекса в о-дихлорбензоле (около 1,2эквив каждого реагента) и последующее добавление тиоанизола (1эквив) Обе из этих стадий являются экзотермическими, поэтому желателен контроль температуры Применение о-дихлорбензола вносит потенциальную проблему, а именно ацилирование растворителя АІСІз-ацетилхлоридньїм комплексом с получением дихлорацетофенона Образование дихлорацетофенона эффективно сводят к минимуму путем проведения ацилирования при температуре от -5 до 30°С, предпочтительно при температуре от -5 до 25°С В течение 30 минут после добавления тиоанизола реакция обычно завершалась Реакционную смесь гасили путем медленного переноса в воду (экзотермическая реакция) Заявители обнаружили, что желательно поддерживать температуру 25°С или ниже Окисление сульфида М B Kc rO , A a снэсос1 А1С1Э S 2 5 mol% Na, Al.qn3i336 4 0 З о " Метод Фриделя-Крафтса касается раствора кетосульфида 3 в о-дихлорбензоле, который непосредственно подвергают окислению Окисление осуществили путем добавления водного раствора пероксида водорода к смеси, состоящей из кетосульфида, о-дихлорбензола, водного раствора вольфрамата натрия и ALIQUAT 336, применяемой в качестве межфазного катализатора Выделили кетосульфон, выход которого составил 88% Окисление осуществили с применением примерно 1 - 5мас % вольфрамата натрия относительно кетосульфида Считается, что сведение к минимуму загрузки катализатора является желательным, потому что предварительные результаты показали, что выделенный кетосульфон может захватывать вольфрам Реакция имеет индукционный период примерно 15мин , причем было установлено, что реакция протекает и до загрузки всего количества пероксида, поскольку инициирование экзотермической реакции на поздней стадии потенциально опасно Окисление сульфида в сульфоксид и сульфоксида в сульфон осуществили таким образом, чтобы обе реакции протекали быстро во избежание накопления после первого окисления Н2О2 Этого достигают путем добавления Н2О2 при повышенной температуре к смеси субстрат 11 57029 12 ALIQUAT 336 пероксида водорода Сразу же, как Последовательность реакций была следуютолько начинается окисление, температура подщей При взаимодействии фенилуксусной кислоты держивается выделением тепла, но иногда для с NaOH при 40°С in situ образуется фенилацетат поддержания температуры реакции 45 - 50°С ненатрия В результате добавления бромкетона-2 обходимо охлаждение Для поддержания желапроходит быстрое присоединение, при этом полутельного температурного диапазона во время вычается 4-(метилсульфонил)бензоилметилфенилдержки в течение 1 - 2 часов использовали нагреацетат 5 (обозначенный здесь как фенилуксусный вание эфир 5), который затем подвергают циклизации при 45°С с применением диизопропиламина (ДИСпособ выделения продукта основан на расПА) Продукт 1 выделяют циклизацией из реакцитворимости кетосульфона в о-дихлорбензоле Как онной смеси после добавления водного раствора только окисление приближается к завершению, из HCI и воды реакционной смеси выделяется в осадок кетоDIPA сульфон В конце реакции избыток Н2О2 разлагаDMF DMF о л ют путем взаимодействия с водным раствором 45"С NaHSO3, и продукт выделяют фильтрацией из -*„5О Ме трехфазной смеси Для удаления воды и одихлорбензола лепешку на фильтре промывают ИПС (изопропиловым спиртом) и сушат в вакууме О " 1 с получением продукта с выходом 86 - 90% Использование натрийфенилацетата в реакБромирование ции присоединения бромкетона 2 является важПрямое бронирование кетосульфона 4 броным ввиду высокой растворимости NaBr (образомом в НОАс инициировали с помощью НВг и прованного во время реакции присоединения) в ДМФ водили при комнатной температуре с получением Можно использовать ЫаНСОз-фенилуксусную ки93%-ного преобразования в 2-бром-4-(метилсульслоту, но реакция при этом протекает медленно фонил)ацетофенон 2 (обозначенный здесь как Калийфенилацетат (образующийся in situ из фебромкетон 2) нилуксусной кислоты и КОН) или КНСОзфенилуксусную кислоту не следует применять, так как при этом происходит выпадение в осадок КВг, который в процессе гашения реакционной смеси 2 4 О ° попадает в продукт В результате добавления 0,96 - 0,98 эквиваПоследовательность реакций присоединениялентов брома относительно кетосульфона осущециклизации предпочтительно осуществляют с ствили 93%-ное преобразование в бромкетон применением в качестве растворителя дегазироДальнейшее добавление брома приводит к увеливанного ДМФ, поскольку было обнаружено, что это чению количества дибромкетона Реакция бромиявляется выгодным с точки зрения окрашивания рования имеет индукционный период, равный в продукта Во избежание получения окрашенных среднем 1-15 минутам Реакция экзотермическая примесей растворитель дегазируют, например, и температуру реакции предпочтительно выдерпутем барботирования азота живают при от 25 до 24°С Реакцию циклизации осуществляют с примеВ результате добавления воды (1 объем) к нением примерно 3 эквивалентов ДИПА при 45°С взвеси в НОАс и последующей фильтрации выход Продукт сочетания (фенилуксусный эфир 5) быстбромкетона 2 составляет 87% ро преобразуют в промежуточные альдольные Бромирование проводят в уксусной кислоте, соединения 6, которые затем быстро преобразуют предпочтительно при температуре 22 - 24°С при в соединение 1 концентрациях уксусной кислоты в диапазоне 3 О 10мл/г кетосульфона Присоединение-циклизация Заявители неожиданно обнаружили, что реакция циклизации значительно быстрее протекает в амидных растворителях ДМФ, НМЛ, ДМАА (N,Nдиметилаформалиде, N-метилпирролидоне, N,NДля полного преобразования в реакции цикдиметилацетамиде), чем в ACN (ацетонитриле) лизации, происходящей при 40°С, обычно требоЧистые реакции сочетания осуществили с примевалось 4,5 часа Для полного осуществления ренением аминовых оснований, неорганических осакций циклизации, в которых применяли примерно нований и AMBERLITE IRA 900 Предпочтитель2 эквивалента ДИПА или 2,5 эквивалента ДИПА ными для сочетания являются неорганические при 45°С, требовалось примерно 4,25 часа, в реоснования, поскольку присутствие аминогидробзультате чего получают соединение 1 с выходом и ромидных солей (полученных присоединением, качеством, сравнимыми с выходом и качеством используя аминовые основания) замедляло реакпродукта, полученного с применением 3-х эквивацию циклизации Сточки зрения чистоты продукта лентов основания аминовыеоснования в реакции циклизации являются более предпочтительными по сравнению с Реакционную смесь гасили добавлением воднеорганическими основаниями, такими как карбоного 2н раствора HCI (3,5 эквивалента относинаты и бикарбонаты Наиболее быстро и наиботельно бромкетона) при 20 - 30°С Такое добавлелее чисто реакцию осуществляют с применением ние служит для нейтрализации ДИПА и для осудиизопропиламина ществления кристаллизации продукта Перекристаллизация конечного продукта Q г 13 57029 Было доказано, что сточки зрения выхода (90дом для подачи азота и датчиком температуры, 92%), удаления примесей и устранения окрашизагружают о-дихлорбензол Раствор охладили до вания продукта превосходным сочетанием рас5°С и добавили АІСІз творителей является ацетон и ИПС Однако при В течение 10 минут через капельную воронку порционном растворении и фильтрации умерендобавили чистый ацетилхлорид ная растворимость соединения формулы І в ацеПолученную суспензию охладили до -5°С и тоне (примерно 25мг/мл при 25°С) требует больчерез капельную воронку в течение 40 минут дошого объема растворителя Последующее конбавили тиоанизол центрирование (вакуумная перегонка) увеличиваВ конце добавления тиоанизола образовалась ет время обработки и необходимость разделения очень тяжелая желтая взвесь, в связи с чем было и рециркуляции ацетона и ИПС посредством перенеобходимо эффективное перемешивание (мехагонки приводит к увеличению затрат и снижению нической мешалкой с высоким моментом вращеэффективности ния) Суспензию выдержали в течение 60 минут при температуре от -2 °С до +2°С Для решения проблемы, связанной с производительностью процесса, необходим растворитель, В 50л-овую четырехгорлую круглодонную колв котором должно быть сильно растворимо соедибу, снабженную механической мешалкой и датчинение формулы I Неожиданно было обнаружено, ком температуры, загрузили Н2О (15л), и затем что превосходным растворителем с точки зрения охладили до 10°С Реакционную смесь при энервыхода (> 95%), удаления примесей и устранения гичном перемешивании с применением тефлоноокрашивания является сочетание ДМФ-Н2О Одвой канюли с широким отверстием медленно пенако, применение ДМФ вообще приводит к высоренесли в воду (в течение 1 часа) (температуру ким уровням остатка растворителя в кристаллизаустановили, равной 2°С с тем, чтобы суспензия ционном продукте Авторы неожиданно обнаружибыла достаточно подвижной при переносе) Остали, что, когда кристаллизацию осуществляют при ток реакционной смеси, находящийся в сосуде, температуре от 40° до 60°С, происходит незначигасили Н2О (2л), которую затем перенесли в среду тельное улавливание растворителя (менее 0,2%) для гашения Во время гашения путем регулироВ сравнении, когда кристаллизацию осуществляют вания скорости добавления и внешнего охлаждепри комнатной температуре, происходит значиния (охлаждающей баней, состоящей из смеси тельное улавливание растворителя (примерно от льда и солевого раствора) поддерживали темпе1 до 2%) Соединение 1 имеет высокую растворатуру, равную 10 - 22°С римость в ДМФ (135мг/мл при 25°С), что является Смесь энергично перемешали в течение 1,5 вполне допустимым для конечного продукта Начаса при 10 - 25°С половину чистое соединение 1 растворили в ДМФ Смесь перенесли в 100л экстракционный ап(6,5мл/г, 50°С) Для удаления посторонних вепарат и разделили слои Слой о-дихлорбензола ществ раствор фильтровали и при поддержании (о-ДХБ) (донный слой) загрузили в экстракционтемпературы раствора 50°С медленно (в течение ный аппарат, добавили Н2О (7л) и смесь переме1 часа) добавили воду (8мл/г) Смесь охладили до шали в течение 5 минут при 25°С Слои раздели25°С, выдержали в течение 30 минут и фильтроли, и слой о-ДХБ анализировали ВЭЖХ Количевали Лепешку на фильтре промыли ДМФ-Н2О ственный анализ относительно эталона показал (1 3), Н2О и ИПС и затем сушили под вакуумом образование 2,61кг кетосульфида 3, выход соста(25°С) с получением чистого соединения 1 (выход вил 97,5% 98%) Раствор продукта в о-ДХБ непосредственно подают на следующую стадию После добавления воды загрузку охладили до 25°С и перед фильтрацией выдержали в течение Получение кетосульфона 4 30 минут Загрузку фильтровали и осадок промыН-Д, ли ДМФ-Н2О (1 2), Н2О и затем ИПС Затем тверMeS..^ Na2WO4 дый продукт сушили в вакуумной печи при 25°С и Aliquat 336 получили конечный продукт, выход которого со£ o-DCB 4 О ставил 98% Методика эксперимента Синтез кетосульфида 3 1 СН3СОС1 АЮ13 UeS • » O D C ^ _ B Молек масса Тиоанизол 124,21 Ацетилхлорид 78,5 Хлорид алюминия 133,3 о-дихлорбензол Вода Моль Экв Кол-во 16,10 19,34 19,34 1,0 1,2 1,2 2кг 1,375л 2,58кг 25л 31л В 50л-овую четырехгорлую круглодонную колбу, снабженную механической мешалкой, подво Молек масса 166,23 329,86 404,17 Кетосульфид Na2WO4 2H2O Aliquat 336 30% Водный ра34,02 створ Н2О2 20% Водный раствор NaHSO3 ИПС Н2О Серная кислота (1М) 4 Моль ЭКБ Кол-во 0,59 0,003 0,012 1,0 0,015 0,02 98г 1,0г 5,0г 1,47 2,5 150мл 152мл 300мл 300мл 7мл В 1л-овую трехгорлую круглодонную колбу, 15 57029 16 снабженную механической мешалкой, датчиком температуры, капельной воронкой и впускным отверстием для азота, загрузили дигидрат вольфрамата натрия (1,0г в виде раствора в 20 мл Н2О) , серную кислоту (1М, 4мл), раствор кетосульфида SO,Me (1л раствора о-ДХБ, 98г, 1эквив ) и Ahquat 336 Смесь нагрели в атмосфере азота до 45°С В капельную воронку поместили 150мл 30% водного Мол Ммоль Эквив Кол-во раствора пероксида водорода и 15мл добавили к масса смеси кетосульфида-Ма2\Л/О4 Реакционную смесь Бром кетон 2 277,13 30 1,0 8,31г выдержали в течение 15 минут и отобрали пробу Фенилуксусная Через 1 час при температуре 45°С добавили 136,15 39 1,3 5,31г кислота остаток пероксида водорода (135мл) РеакционNaOH (50мас %) 33 1,1 1,73мл ную смесь выдержали в течение 30 минут и ана3,0 лизировали Диизопропиламин 101,19 90 12,6мл Смесь охладили до 18°С НепрореагировавДМФ 152,5мл ший пероксид гасили путем медленного добавле2н HCI 105 3,5 52,5мл ния водного 20мас % раствора бисульфита наН2О 32мл трия Температуру поддерживали при 25°С ИПС 27,5мл Смесь выдержали в течение 30 минут при 22°С и затем фильтровали Влажный осадок один раз промыли Н2О (100мл) и один раз ИПС (300мл) В 500мл трехгорлую круглодонную колбу с пеи затем сушили в вакууме при 40°С (при продувке регородками, снабженную механической мешалазота), при этом получили 104,7г кетосульфона кой, датчиком температуры и впускным отверсти(выход относительно тиоанизола составил 89,6%) ем для азота, загрузили фенилуксусную кислоту и ДМФ (150мл) Реакционный сосуд промыли азоСинтез бромкетона 2 том и НОАС К раствору добавили 50мас % NaOH, в результате этого получили двухфазную смесь По2 О лученную смесь энергично перемешали в течение 1 часа при 4°С К раствору фенилацетата натрия добавили Молек Моль Экв Кол-во бром кетон 2 масса Реакционная колба, вследствие известной Кетосульфон 4 198,23 0,522 1/0 103,5г светочувствительности соединения 1, была заБром 159,82 0,506 0,97 80,89г щищена от света Шприцом добавили диизопроВодный 48% рас0,5мл пиламин (ДИПА) (выделения тепла не было) и твор НВг загрузку выдержали при 45°С в течение 3,5 часов Уксусная кислота 500мл Реакционный раствор охладили до 20 - 25°С, Вода 700мл и в течение 1 часа при поддержании температуры НОАсН 2 О(1 1) 200мл между 20 и 30°С через капельную воронку добаВ 2л-овую трехгорлую круглодонную колбу, снабженную механической мешалкой, датчиком температуры, капельной воронкой и впускным отверстием для азота, загрузили ледяную уксусную кислоту, кетосульфон и водный 48% раствор НВг В капельную воронку поместили бром 10% загрузка брома (8,1 г) дала оранжевую суспензию, которую выдержали в течение 30 минут при 25°С и затем взяли пробу Реакция бромирования имеет индукционный период, равный 1 - 15мин , во время которого бром, когда его добавляли, быстро расходовался Остаток брома добавили через 50 минут при 20 25°С Полученную бледно-желтую суспензию выдержали при 22 - 25°С в течение 2-х часов После выдержки смеси в течение 2 - 3 часов загрузку подвергли фильтрации Влажный осадок один раз промыли 200мл НОАс Н2О 1 1 и один раз Н2О (200мл) Осадок сушили в вакууме при 40°С при продувке азота, при этом получили 126,0г бромкетона (87%) Получение Соединения 1 вили 2н НСІ После этого продукт высадили путем добавления воды (32мл, через капельную воронку) к реакционной смеси в течение 1 часа После выдерживания смеси в течение 1 - 2 часов при 25°С загрузку фильтровали Для удаления всего продукта из колбы маточные растворы рециркулировали Влажный осадок один раз промыли 10мл ДМФ/ИПС 1 3 и один раз - 20мл ИПС Осадок сушили путем отсасывания, при этом получили 7,36г наполовину чистого соединения 1 (78%) Перекристаллизация соединения 1 Мол масса Наполовину чистое соединение 1 ДМФ Н2О Изопропиловый спирт Моль Эквив Кол-во 314 3,18 1,01кг 6,67л 11,83л 2л В 12л-овую четырехгорлую круглодонную колбу, снабженную механической мешалкой, датчи 17 57029 ком температуры и впускным отверстием для азота, загрузили наполовину чистое, соединение 1 и ДМФ (5,5л) Смесь нагрели до 52°С в течение 20 минут Раствор отфильтровали через трубку с 1микронным фильтром в 20л четырехгорлую КК (круглодонную колбу) (снабженную механической мешалкой, впускным отверстием для азота, отверстием для создания вакуума и термопарой) Сосуд и трубку промыли 500мл ДМФ Температуру раствора установили равной 52°С и затем через перистальтический насос в течение 90 минут добавили воду (7,5л) Во время добавления воды температуру поддерживали между 49 и 52°С После добавления примерно 10% воды начали образовываться кристаллы Полученную взвесь в течение 90 минут охладили до 25°С Взвесь фильтровали, осадок промыли ДМФ Комп'ютерна верстка Е Гапоненко 18 Н2О (1 2,2л), Н2О (Зл) и затем 2л ИПС Твердый продукт сушили в течение 12 часов в вакууме при 25°С, при этом получили 980г (98%) соединения 1 в виде бледно-желтого твердого вещества Следующие аббревиатуры имеют указанные значения Ас = ацетил Ahquat = трикаприлилметиламмонийхлорид DIPA = DIA = ДИПА = диизопропиламин DMAC = ДМАА = N.N-диметилацетамид DMAP = ДМАП = 4-(диметиламино)пиридин DMF = ДМФ = N.N-диметилформамид НОАс = уксусная кислота IPA = ИПС = изопропиловый спирт NMP = ЫМП = 1-метил-2-пирролидон NSAID = НПЛС = нестероидное противовосп лекарствен средство o-DCB = о-ДХБ = орто-дихлорбензол THF = ТГФ = тетрагидрофуран Підписано до друку 05 07 2003 Тираж39 прим Міністерство освіти і науки України Державний департамент інтелектуальної власності, Львівська площа, 8, м Київ, МСП, 04655, Україна ТОВ "Міжнародний науковий комітет", вул Артема, 77, м Київ, 04050, Україна
ДивитисяДодаткова інформація
Назва патенту англійськоюA process for preparing phenyl heterocycles suitable as cyclooxygenase-2 inhibitors
Назва патенту російськоюСпособ получения фенильных гетероциклов, пригодных как ингибиторы циклооксигеназы-2
МПК / Мітки
МПК: C07D 307/38, C07D 307/58
Мітки: циклооксигенази-2, гетероциклів, придатних, фенільних, одержання, інгібітори, спосіб
Код посилання
<a href="https://ua.patents.su/9-57029-sposib-oderzhannya-fenilnikh-geterocikliv-pridatnikh-yak-ingibitori-ciklooksigenazi-2.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання фенільних гетероциклів, придатних як інгібітори циклооксигенази-2</a>
Попередній патент: Верстат для обробки криволінійних поверхонь плоских деталей
Наступний патент: Похідні (2r, 3s, 4s, 5r, 6r, 10r, 11r)-2,4,6,8,10-пентаметил-11-ацетил-12,13-діоксабіцикло[8.2.1]тридец-8-ен-1-ону, лікарські засіб та спосіб одержання похідних
Випадковий патент: Облицювальний матеріал для захисту від електромагнітного випромінювання