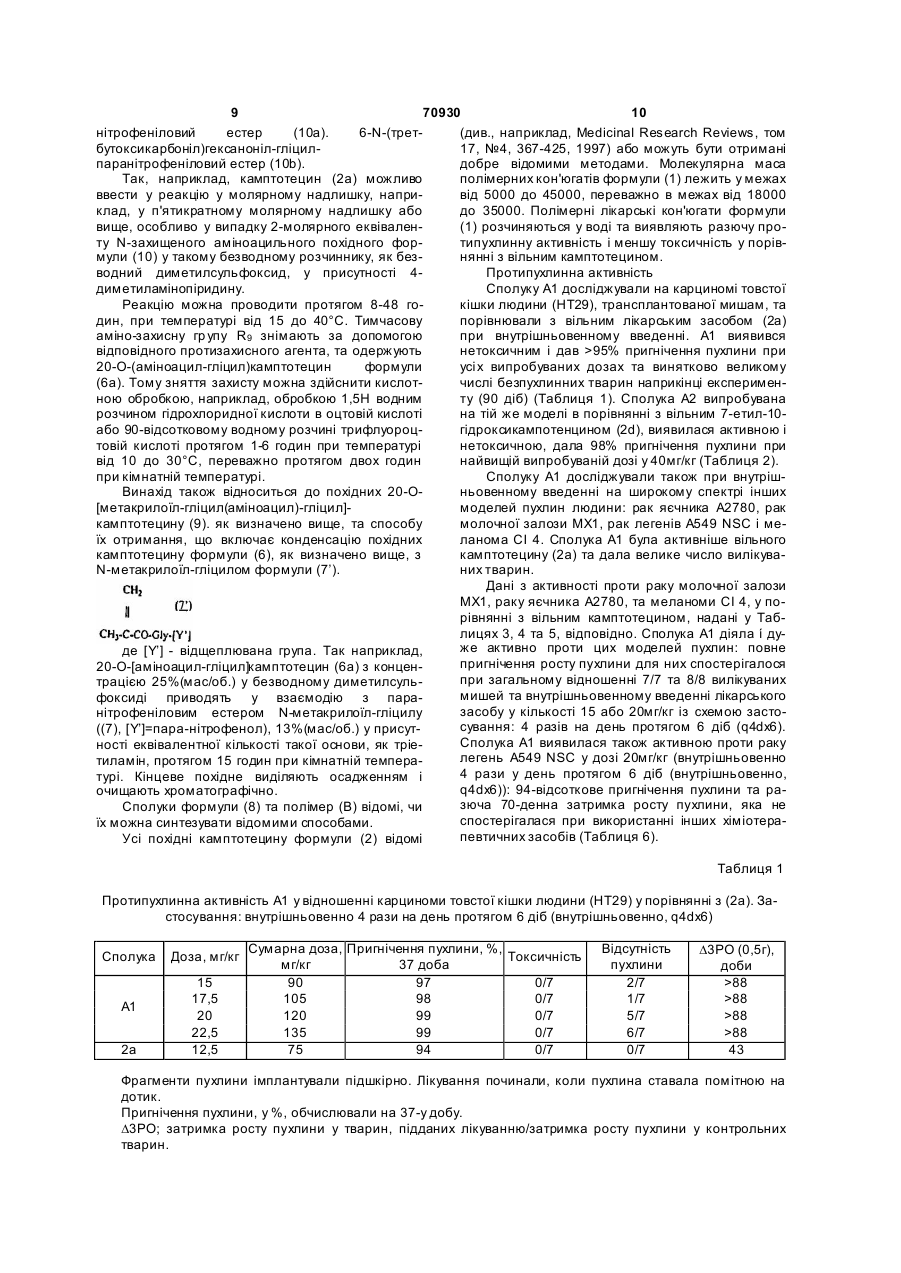
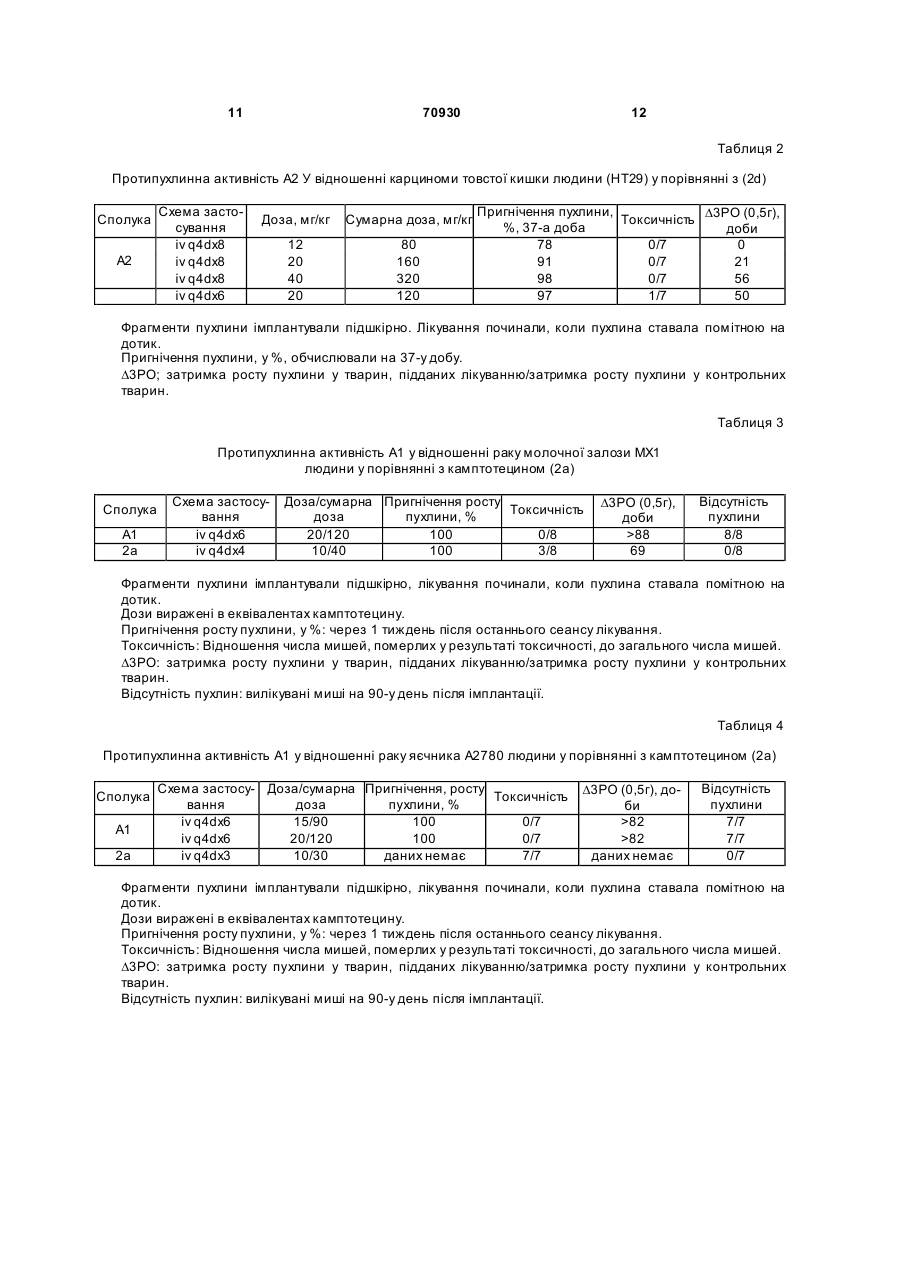
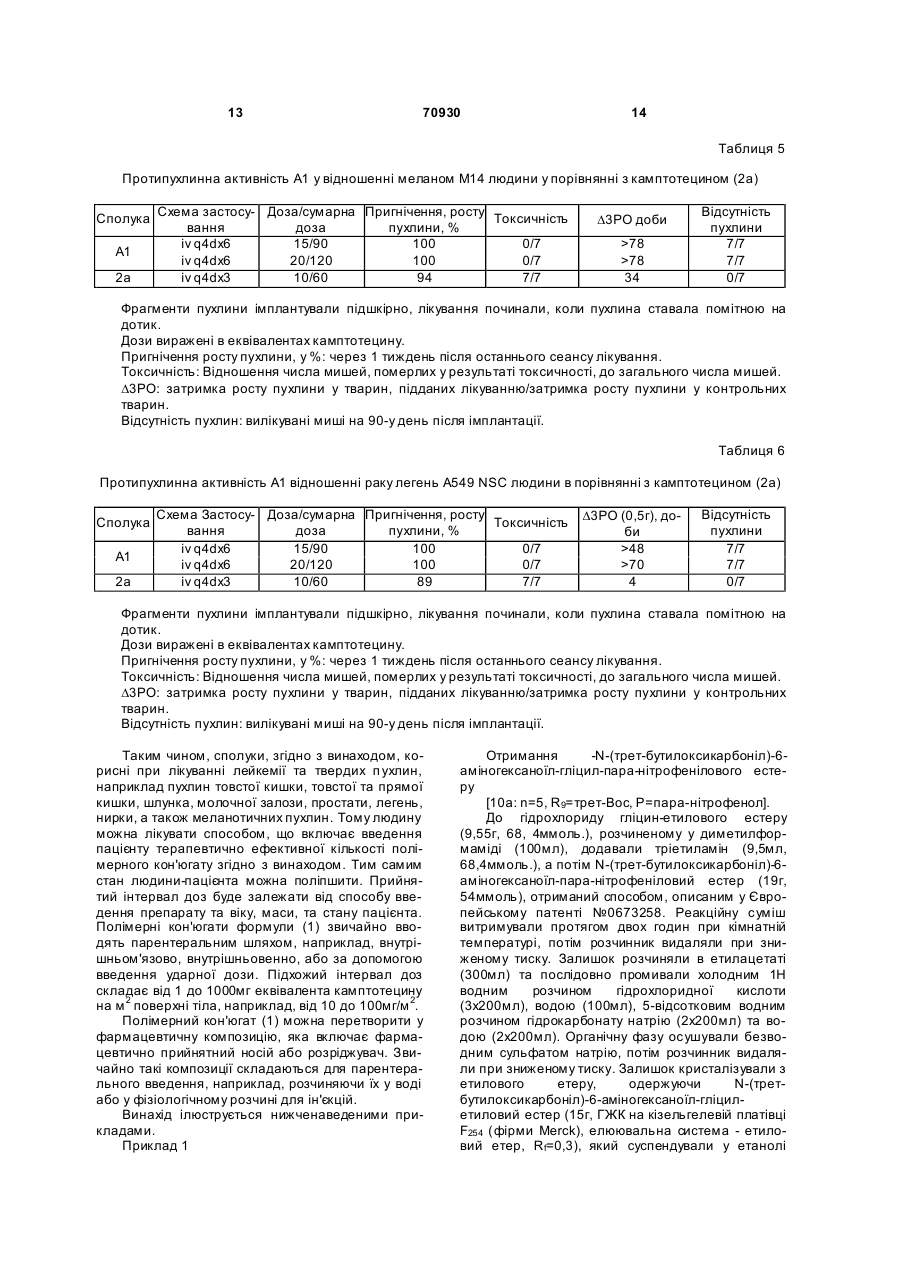
Полімерні похідні камптотецинів
Номер патенту: 70930
Опубліковано: 15.11.2004
Автори: Анджелуччі Франческо, Орці Фабріціо, Кайольфа Валерія, Дзамаї Морено, Факін Ґабріеле, Суарато Антоніно
Формула / Реферат
1. Полімерний кон'югат, який містить:
(і) від 85 до 97% мол. N-(2-гідроксипропіл)метакрилоїламідних ланок формули (3)
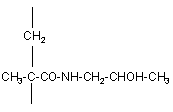 , (3)
, (3)
(іі) від 3 до 15% мол. 20-O-(N-метакрилоїлгліциламіноацилгліцил)камптотецинових ланок формули (4)
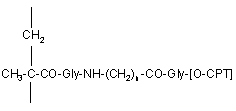 , (4)
, (4)
де n має значення від 2 до 8, -[O-СРТ] є залишком камптотецину формули (2)
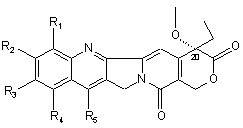 , (2)
, (2)
зв'язаним у положенні С-20, у якому кожний з R1, R2, R3, R4 та R5 , однакові або різні, являє собою водень, С1-С12 лінійний або розгалужений алкіл,
нітрогрупу, аміногрупу,
(CH2)aNR6R7, де а має значення від 0 до 4, R6 і R7 означають водень або один з R6 або R7 означає водень, а інший означає С1-С6 алкіл, або NR6R7 є піперазинo- або N-алкілпіперазиноциклом, який може бути заміщений С1-С6 лінійним або розгалуженим алкілом або піперидиноциклом,
(CH2)aNHCOR8, де а має вищевказані значення, a R8 є С1-С8 лінійним або розгалуженим алкілом або групою NR6R7, як визначено вище,
гідроксильну групу або O-СО-R8, де R8 має вищевказані значення або є 1-піперидиноциклом чи 1,4'-біпіперидином,
або R2 і R3 спільно є залишком O(CH2)b-O, у якому b дорівнює 1 або 2,
або R4 і R5 є залишком (CH2)m, у якому m має значення від 2 до 4 або залишком СН2-О-СН2 або CH2NHCH2, та
(ііі) до 12% мол. N-метакрилоїлгліцинових або N-(2-гідроксипропіл)метакрилоїлгліцинамідних ланок формули (5)
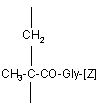 , (5)
, (5)
у якій [Z] означає гідроксильну групу або залишок, який має формулу -NH-CH2-СН(ОН)-СН3.
2. Полімерний кон'югат за п. 1, який містить 90% мол. N-(2-гідроксипропіл)метакрилоїламідних ланок формули (3).
3. Полімерний кон'югат за п. 1, який містить 10% мол. ланок формули (4).
4. Полімерний кон'югат за п. 1, у якому -[O-СРТ] у формулі (4) є залишком камптотецину формули (2), який вибраний з: камптотецину, 9-амінокамптотецину, 9-нітрокамптотецину, 7-етил-10-гідроксикамптотецину, 7-етил-10-[1,4'-біпіперидиніл]карбонілоксикамптотецину і 7-метилендиметиламіно-10-гідроксикамптотецину.
5. Полімерний кон'югат за п. 1, який містить 10% (мас./мас.) активного похідного камптотецину формули (2).
6. Полімерний кон'югат за п. 1, який є MAG-камптотецином, який містить 10% (мас./мас.) камптотецину.
7. Полімерний кон'югат, який містить:
(і) від 85 до 97% мол. N-(2-гідроксипропіл)метакрилоїламідних ланок формули (3)
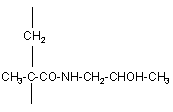 , (3)
, (3)
(іі) від 3 до 15% мол. 20-O-(N-метакрилоїлгліциламіноацилгліцил)камптотецинових ланок формули (4)
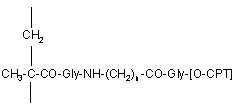 , (4)
, (4)
де n має значення від 2 до 8, -[O-СРТ] є залишком камптотецину формули (2)
 , (2)
, (2)
зв'язаним у положенні С-20, у якому кожний з R1, R2, R3, R4 та R5, однакові або різні, являє собою водень, С1-С12 лінійний або розгалужений алкіл,
нітрогрупу, аміногрупу,
(CH2)aNR6R7, де а має значення від 0 до 4, R6 і R7 означають водень або один з R6 або R7 означає водень, а інший означає С1-С6 алкіл, або NR6R7 є піперазинo- або N-алкілпіперазиноциклом, який може бути заміщений С1-С6 лінійним або розгалуженим алкілом або піперидиноциклом,
(CH2)aNHCOR8, де а має вищевказані значення, a R8 є С1-С8 лінійним або розгалуженим алкілом або групою NR6R7, як визначено вище,
гідроксильну групу або O-СО-R8, де R8 має вищевказані значення або є 1-піперидиноциклом чи 1,4'-біпіперидином,
або R2 і R3 спільно є залишком O(CH2)b-O, у якому b дорівнює 1 або 2,
або R4 і R5 є залишком (CH2)m, у якому m має значення від 2 до 4 або залишком СН2-О-СН2 або CH2NHCH2.
8. Полімерний кон'югат за п. 7, який містить 90% мол. N-(2-гідроксипропіл)метакрилоїламідних ланок формули (3).
9. Полімерний кон'югат за п. 7, який містить 10% мол. ланок формули (4).
10. Полімерний кон'югат за п. 7, у якому -[O-СРТ] у формулі (4) є залишком камптотецину формули (2), який вибраний з: камптотецину, 9-амінокамптотецину, 9-нітрокамптотецину, 7-етил-10-гідроксикамптотецину, 7-етил-10-[1,4'-біпіперидиніл]карбонілоксикамптотецину і 7-метилендиметиламіно-10-гідроксикамптотецину.
11. Полімерний кон'югат за п. 7, який містить 10% (мас./мас.) активного похідного камптотецину формули (2).
12. Полімерний кон'югат за п. 1, який є MAG-камптотецином, який містить 10% (мас./мас.) камптотецину.
13. Похідне 20-O-[аміноацилгліцил]камптотецину формули (6)
![]() , (6)
, (6)
де n і [O-СРТ] мають значення, зазначені в п. 1, або його сіль.
14. Похідне 20-O-[метакрилоїлгліциламіноацилгліцил]камптотецину формули (9)
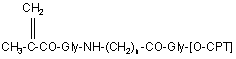 , (9)
, (9)
де n та [O-СРТ] такі, як визначено в п. 1, або його сіль.
15. Спосіб отримання полімерного кон'югату за п. 1 або п. 7, який одержують реакцією між похідним 20-O-6-(аміногексаноїлгліцил)камптотецину формули (6)
![]() , (6)
, (6)
де [O-СРТ] - залишок камптотецину,
з полімером (В), який вміщує, в основному, від 85 до 97% мол. N-(2-гідроксипропіл)метакрилоїламідних ланок формули (3), як визначено в п. 1, та від 3 до 15% мол. ланок похідного N-метакрилоїлгліцилу формули (7)
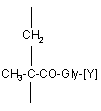 , (7)
, (7)
де [Y] - пара-нітрофеноксигрупа
і необов'язкового заміщення груп, які залишилися, активного складного ефіру 1-аміно-2-пропанолом.
16. Спосіб отримання полімерного кон'югату за п. 1 або п. 7, який одержують полімеризацією N-(2-гідроксипропіл)метакриламіду формули (8)
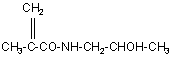 (8)
(8)
з похідними 20-O-[метакрилоїлгліцил(6-аміногексаноїл)гліцил]камптотецину формули (9)
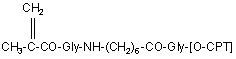 , (9)
, (9)
де [O-СРТ] - залишок камптотецину.
17. Фармацевтична композиція, яка містить фармацевтично прийнятний розріджувач або носій та як активний інгредієнт - полімерний кон'югат за будь-яким з пп. 1-12 або сполуку формули (6) або (9) за пп. 13 або 14.
Текст
1. Полімерний кон'югат, який містить: (і) від 85 до 97% мол. N-(2гідроксипропіл)метакрилоїламідних ланок формули (3) C2 1 3 70930 4 6. Полімерний кон'югат за п. 1, який є MAGбіпіперидиніл]карбонілоксикамптотецину і 7камптотецином, який містить 10% (мас./мас.) камметилендиметиламіно-10-гідроксикамптотецину. птотецину. 11. Полімерний кон'югат за п. 7, який містить 10% 7. Полімерний кон'югат, який містить: (мас./мас.) активного похідного камптотецину фо(і) від 85 до 97% мол. N-(2рмули (2). гідроксипропіл)метакрилоїламідних ланок форму12. Полімерний кон'югат за п. 1, який є MAGли (3) камптотецином, який містить 10% (мас./мас.) камптотецину. 13. Похідне 20-O-[аміноацилгліцил]камптотецину CH2 формули (6) NH2 -(CH2 )n-CO-Gly-[O-CPT] (3) , (6) CH3-C-CO-NH-CH2-CHOH-CH3 (іі) від 3 до 15% мол. 20-O-(Nметакрилоїлгліциламіноацилгліцил)камптотецинових ланок формули (4) (9) CH2 CH3 -C-CO-Gly-NH-(CH 2 )n -CO-Gly-[O-CPT] (4) CH3-C-CO-Gly-NH-(CH2)n -CO-Gly-[O-CPT] , де n має значення від 2 до 8, -[O-СРТ] є залишком камптотецину формули (2) R1 R2 R3 де n і [O-СРТ] мають значення, зазначені в п. 1, або його сіль. 14. Похідне 20-O[метакрилоїлгліциламіноацилгліцил]камптотецину формули (9) CH2 O N O 20 N O (2) R4 R5 O , зв'язаним у положенні С-20, у якому кожний з R 1, R2, R3, R4 та R5 , однакові або різні, являє собою водень, С1-С12 лінійний або розгалужений алкіл, нітрогрупу, аміногрупу, (CH2)aNR6R7, де а має значення від 0 до 4, R6 і R7 означають водень або один з R6 або R7 означає водень, а інший означає С 1-С6 алкіл, або NR6R7 є піперазинo- або N-алкілпіперазиноциклом, який може бути заміщений С 1-С6 лінійним або розгалуженим алкілом або піперидиноциклом, (CH2)aNHCOR8, де а має вищевказані значення, a R8 є С1-С8 лінійним або розгалуженим алкілом або групою NR6R7, як визначено вище, гідроксильну груп у або O-СО-R8, де R8 має вищевказані значення або є 1-піперидиноциклом чи 1,4'-біпіперидином, або R2 і R3 спільно є залишком O(CH2)b-O, у якому b дорівнює 1 або 2, або R4 і R5 є залишком (CH2)m, у якому m має значення від 2 до 4 або залишком СН2-О-СН2 або CH2NHCH2. 8. Полімерний кон'югат за п. 7, який містить 90% мол. N-(2-гідроксипропіл)метакрилоїламідних ланок формули (3). 9. Полімерний кон'югат за п. 7, який містить 10% мол. ланок формули (4). 10. Полімерний кон'югат за п. 7, у якому -[O-СРТ] у формулі (4) є залишком камптотецину формули (2), який вибраний з: камптотецину, 9амінокамптотецину, 9-нітрокамптотецину, 7-етил10-гідроксикамптотецину, 7-етил-10-[1,4' , де n та [O-СРТ] такі, як визначено в п. 1, або його сіль. 15. Спосіб отримання полімерного кон'югату за п. 1 або п. 7, який одержують реакцією між похідним 20-O-6-(аміногексаноїлгліцил)камптотецину формули (6) NH2 -(CH2 )6-CO-Gly-[O-CPT] (6) , де [O-СРТ] - залишок камптотецину, з полімером (В), який вміщує, в основному, від 85 до 97% мол. N-(2гідроксипропіл)метакрилоїламідних ланок формули (3), як визначено в п. 1, та від 3 до 15% мол. ланок похідного N-метакрилоїлгліцилу формули (7) CH2 (7) CH3-C-CO-Gly-[Y] , де [Y] - пара-нітрофеноксигрупа і необов'язкового заміщення груп, які залишилися, активного складного ефіру 1-аміно-2-пропанолом. 16. Спосіб отримання полімерного кон'югату за п. 1 або п. 7, який одержують полімеризацією N-(2гідроксипропіл)метакриламіду формули (8) CH2 (8) CH3 -C-CO-NH-CH 2 -CHOH-CH3 з похідними 20-O-[метакрилоїлгліцил(6аміногексаноїл)гліцил]камптотецину формули (9) CH2 (9) CH3-C-CO-Gly-NH-(CH2)6 -CO-Gly-[O-CPT] , де [O-СРТ] - залишок камптотецину. 17. Фармацевтична композиція, яка містить фармацевтично прийнятний розріджувач або носій та як активний інгредієнт - полімерний кон'югат за будь-яким з пп. 1-12 або сполуку формули (6) або (9) за пп. 13 або 14. 5 70930 Винахід відноситься до полімерних кон'югатів 20-О-[гліцил-аміноацил-гліцил]камптотецинів. У заявці WO-95/10304 описані та заявлені кон'югати камптотецинів, які зв'язані з полімером через пептидиловий спейсер. Зараз нами виявлено, що кон'югати, в яких спейсером є гліцил-аміноацилгліцил, мають виняткову цінність як протипухлинні агенти, що мають разючу протипухлинну активність і меншу токсичність у порівнянні з вільним лікарським засобом. Зокрема, винахід стосується полімерних кон'югатів формули (1), що містять: (і) від 85 до 97мол.% N-(гідроксипропіл)метакрілоїдамідних ланоу формули (3) (іі) від 3 до 15% 20-О-[метакрилоїл-гліциламіноацил-гліцил]камптотецинових ланок формули (4) де n приймає значення від 2 до 8 -[О-СРТ] є залишком камптотецину формули (2) який зв’язаний у положенні С-20, та в якому кожний з R1, R2, R3, R4 та R5, є однаковими або різними, є гідрогеном, С1-С2лінійним або розгалуженим алкілом, нітрогрупою, аміногрупою, (СН2)аNR6R7, де а приймає значення від 0 до 4, R6 і R7 є гідрогеном або один із R6 чи R7 є гідрогеном а інший із R6 чи R7 є С1-С6алкілом, або NR6R7 - є піперазиновим чи N-алкілпіперазиновим циклом, який може бути заміщений лінійним або розгалуженим С1-С6алкілом, або піперидиновим циклом, (СН2)аNHCOR8, де а приймає вищевказані значення, a R8 - лінійний або розгалужений С 1С8алкіл або група NR6R, як визначено вище, гідроксильною, групою або О-CO-R8, де R8 має вищевказані значення або є 1-піперидиновим циклом або 1,4'дипіперидином, або R2 та R3 спільно є залишком О-(СН2)b-О, в 6 якому b дорівнює 1 або 2, або R4 та R5 є залишком (СН2)m, в якому m приймає значення від 2 до 4, або залишком СН2-OCH2 aбo CH 2NHCH2 та (ііі) від 0 до 12мол.% N-метакрилоїлгліцинових або N-(2-гідроксипропіл)метакрилоїлгліцинамідних ланок формули (5) в якій [Ζ] є гідроксильною групою або залишком, що має формулу -NH-CH 2-CH(OH)-CH3. Полімерні кон'югати формули (1) можна визначити абревіатурою MAG-CPT, а також представити таким чином: [(3)]х; [(4)] у; [(5)]z; де (3), (4) і (5) - ланки формули як визначено вище, x дорівнює від 85 до 97мол.%, у дорівнює від 3 до 15мол.%, а z дорівнює від 0 до 12мол.% Кращими варіантами сполучень, згідно з винаходом є сполуки, в яких - [О-СРТ] у формулі (4) є залишком камптотецину формули (2), який вибраний з: камптотецину [2а: R1=R2=R3=R4=R 5=Η]; 9-амінокамптотецину [2b: R1=R2=R3=R4=R5= Η, R4=NH2]; 9-нітрокамптотецину [2c: R1=R2=R3=R 4=R5= Η, R4=NO2]; 7-етил-10-гідроксикамптотецину [2d: R1=R2=R4=Η, R3=OH, R 5=CH2CH3]; 7-етил-10-[1,4'дипіперидиніл]карбонілоксикамптотецину [2e: R 1=R2=R4=Η, R3=ОСО-[1,4'-дипіперидиніл]; R5=CH2CH3]; 7-метилендіметиламіно-10гідроксикамптотецину [2f: R1=R2=R4=Η, R3=OH, R 5=CH2N(CH3)2]; та 7-[метилен-(4'-метилпіперазин)]-9,10етилендіоксикамптотецину [2g: R 1=R4=H, R2 , R3=O-CH2CH2-O, R5=метилен-(4'-метилпіперазин)]. Переважно, щоб полімерні кон'югати формули (1) містили ланки N-(2гідроксипропіл)метакрилоїламіду, що мають формулу (3), у кількості 90% або більше, переважно 90%. Кон'югати можуть також містити від 3 до 10мол.% ланок формули (4), переважно 10мол.% таких ланок. Переважно, щоб кон'югат формули (1) не містив залишків формули (5), тобто, щоб z=0. Вміст активного похідного камптотецину формули (2) у кон'югаті формули (1) може бути від 2 до 15% (масове відношення, далі - мас/мас), переважно 10%(мас/мас.) Сполуки згідно з винаходом можуть бути отримані способом (який названий «Спосіб 1»), що включає взаємодію 20-O-(аміноацил-гліцил) похід 7 70930 8 ного камптотецину формули (6). ної спектроскопії. NH2-(CH2)n-CO-GIy-[OCPT] (6) Сполуки формули (1) можуть бути отримані де n та [ОСРТ] мають значення, які визначені також способом (який названий «Спосіб ІІ», що вище, з полімером (B), що містить, в основному: включає полімеризацію N-(2від 85 до 97мол.% N-(2гідроксипропіл)метакриламіду формули (8). гідроксипропіл)метакрилоїламідних ланок формули (2), як визначено вище, та від 3 до 15мол.% ланок похідного Nметакрилоїл-гліцилу формули (7). та 20-О-[метакрилоїл-гліцил-(аміноацил)гліцил] піхідних камптотецину формули (9). де [Υ] - залишок активного естеру, переважно пара-нітрофенілового естеру, або гідроксильна група, та необов'язкове заміщення груп активного естеру 1-аміно-2-пропанолом. Реакцію конденсації похідного формули (6) з полімером формули (В) проводять в умовах, що дозволяють зберегти характер зв'язку між камптотецином та аміноацил-гліциловим спейсером, а також характер кон'югату. Полімери формули (В), які складаються з ланок N-(2- гідроксипропіл)-метакрилоїлламіду формули (3) та з ланок N-метакрилоїл-гліцину формули (7), отримують співполімеризацією N-(2гідроксипропіл)-метакриламіду з N-метакрилоїлгліцином або з N-метакрилоїл-гліциновими похідними активного естеру, як описано в Makromol. Chem. 178, 2159 (1977). Залишок [Υ] може бути феноксигрупою, заміщеною на фенільному кільці однією або декількома електроноакцепторними групами, наприклад, нітрогрупами або гідрогеном. Залишок [Υ] переважно є паранітрофеноксилом. Реакція між (6) та (В) з утворенням полімерного лікарського кон'югату формули (1) згідно з винаходом звичайно може проводитися при температурі від 15 до 30°С, переважно при кімнатній температурі протягом 15 годин; потім можна провести аміноліз груп активного естеру, що залишилися, у присутності 1-аміно-2-пропанолу при кімнатній температурі протягом 0,5-1 години. Кон'югат осаджують етилацетатом, розчиняють у етанолі та переосаджують етилацетатом. Наприклад, полімер (В), в якому [Υ] є залишком активного естеру, з концентрацією, яка дорівнює 15% (відношення маси до об'єму, далі мас/об.) у безводному диметилсульфоксиді, обробляють 3% (мас/об.) похідного 20-О-(аміноацилгліцил)камптотецину (6) при кімнатній температурі протягом 15 годин. Потім додають 0,1%(мас./об.) 1-аміно-2-пропанолу та витримують реакційну суміш при кімнатній температурі протягом 1 години. Полімерний лікарський кон'югат, MAG-CPT, можна осадити етилацетатом, зібрати, промити етилацетатом, потім розчинити в абсолютному етанолі з концентрацією 10%(мас/об.), та знову осадити етилацетатом для отримання кон'югатівформули (1) згідно з винаходом. Вміст камптотецину у полімерному кон'югаті згідно з винаходом визначають методом рідинної хроматографії високого розділення або абсорбцій де n та [ОСРТ] такі, як вказано вище, в умовах, які дозволяють зберегти характер зв'язку між камптотецином та гліцил-аміноацил-гліциловим спейсером, а також характер кон'югату. Звичайно реакція між (5) та (9) може проводитися при температурі від 50 до 70°С, переважно при 60°С, протягом 6-24 годин, переважно протягом 15 годин, у такому апротонному розчиннику, як диметилсульфоксид, та у присутності такого каталізатору, як 2,2'-азобісізобутиронітрил. Кон'югат осаджують етилацетатом, розчиняють у етанолі, та переосаджують етилацетатом. Наприклад, N-(2-гідроксипропіл)метакриламід (8) з концентрацією 22%(мас/об.) та 20-J[метакрилоїл-гліцил-(6-аміногексаноїл)гліцил]камптотецинове похідне (9) з концентрацією 6%(мас/об.) у безводному диметилсульфоксиді нагрівають при 60°С у атмосфері азоту, потім додають 2,2'-азобісізобутиронітрил з концентрацією 1,3%(мас/об.). Суміш перемішують протягом 24 годин. Потім реакційну суміш охолоджують при кімнатній температурі, а кон'югат осаджують етилацетатом, розчиняють у етанолі, та переосаджують етилацетатом з отриманням кон'югату формули (1) згідно з винаходом. Винахід також відноситься до похідних 20-O(аміноацил-гліцил)камптотецину (6). як визначене вище, та їх солям. Крім того, у даному винаході передбачений спосіб отримання похідних 20-O-(аміноацилгліцил)камптотецину (6), що включає конденсацію залишку, який має формулу (2), як визначено вище, з N-захищеним аміноацил-гліцил похідним формули (10): R9-HN-(CH2)n-CO-GJy-[P] (10) де значення n визначено вище, R - така захисна група для аміногрупи, як бутоксикарбоніл (Вос), 9-флуореніл-метоксикарбоніл (FMOC), трифенілсиліл, дифенілметилен, або трифенілметил, а [Р] є залишком такого активованого естеру, як паранітрофеноксильного або Ν-оксисукцинімідного, з отриманням сполуки формули (11): R9-NH-(CH2)n-CO-GJy-[OCPT] (11) де n, [ОСРТ] та R9 визначені вище; та зняття захисної N-групи з отримуємої сполуки. Сполуку формули (10) одержують у відповідності зі стандартними процедурами синтезу, що відомі з літератури. Підхожі N-захищені аміноацилпохідні формули (10) включають: 6-N(трифенілметил)гексаноїл-гліцил-пара 9 70930 10 нітрофеніловий естер (10а). 6-Ν-(трет(див., наприклад, Medicinal Research Reviews, том бутоксикарбоніл)гексаноніл-гліцил17, №4, 367-425, 1997) або можуть бути отримані паранітрофеніловий естер (10b). добре відомими методами. Молекулярна маса Так, наприклад, камптотецин (2а) можливо полімерних кон'югатів формули (1) лежить у межах ввести у реакцію у молярному надлишку, напривід 5000 до 45000, переважно в межах від 18000 клад, у п'ятикратному молярному надлишку або до 35000. Полімерні лікарські кон'югати формули вище, особливо у випадку 2-молярного еквівален(1) розчиняються у воді та виявляють разючу проту N-захищеного аміноацильного похідного фортипухлинну активність і меншу токсичність у порівмули (10) у такому безводному розчиннику, як безнянні з вільним камптотецином. водний диметилсульфоксид, у присутності 4Протипухлинна активність диметиламінопіридину. Сполуку A1 досліджували на карциномі товстої Реакцію можна проводити протягом 8-48 гокішки людини (НТ29), трансплантованої мишам, та дин, при температурі від 15 до 40°С. Тимчасову порівнювали з вільним лікарським засобом (2а) аміно-захисну гр упу R9 знімають за допомогою при внутрішньовенному введенні. A1 виявився відповідного протизахисного агента, та одержують нетоксичним і дав >95% пригнічення пухлини при 20-O-(аміноацил-гліцил)камптотецин формули усі х випробуваних дозах та винятково великому (6а). Тому зняття захисту можна здійснити кислотчислі безпухлинних тварин наприкінці експерименною обробкою, наприклад, обробкою 1,5Н водним ту (90 діб) (Таблиця 1). Сполука А2 випробувана розчином гідрохлоридної кислоти в оцтовій кислоті на тій же моделі в порівнянні з вільним 7-етил-10або 90-відсотковому водному розчині трифлуороцгідроксикампотенцином (2d), виявилася активною і товій кислоті протягом 1-6 годин при температурі нетоксичною, дала 98% пригнічення пухлини при від 10 до 30°С, переважно протягом двох годин найвищій випробуваній дозі у 40мг/кг (Таблиця 2). при кімнатній температурі. Сполуку A1 досліджували також при внутрішВинахід також відноситься до похідних 20-Oньовенному введенні на широкому спектрі інших [метакрилоїл-гліцил(аміноацил)-гліцил]моделей пухлин людини: рак яєчника А2780, рак камптотецину (9). як визначено вище, та способу молочної залози МХ1, рак легенів А549 NSC і меїх отримання, що включає конденсацію похідних ланома СІ 4. Сполука А1 була активніше вільного камптотецину формули (6), як визначено вище, з камптотецину (2а) та дала велике число вилікуваN-метакрилоїл-гліцилом формули (7’). них тварин. Дані з активності проти раку молочної залози МХ1, раку яєчника А2780, та меланоми СІ 4, у порівнянні з вільним камптотецином, надані у Таблицях 3, 4 та 5, відповідно. Сполука A1 діяла ί дуже активно проти цих моделей пухлин: повне де [Υ’] - відщеплювана група. Так наприклад, пригнічення росту пухлини для них спостерігалося 20-O-[аміноацил-гліцил]камптотецин (6а) з конценпри загальному відношенні 7/7 та 8/8 вилікуваних трацією 25%(мас/об.) у безводному диметилсульмишей та внутрішньовенному введенні лікарського фоксиді приводять у взаємодію з паразасобу у кількості 15 або 20мг/кг із схемою застонітрофеніловим естером N-метакрилоїл-гліцилу сування: 4 разів на день протягом 6 діб (q4dx6). ((7), [Y’]=пара-нітрофенол), 13%(мас/об.) у присутСполука A1 виявилася також активною проти раку ності еквівалентної кількості такої основи, як тріелегень А549 NSC у дозі 20мг/кг (внутрішньовенно тиламін, протягом 15 годин при кімнатній темпера4 рази у день протягом 6 діб (внутрішньовенно, турі. Кінцеве похідне виділяють осадженням і q4dx6)): 94-відсоткове пригнічення пухлини та раочищають хроматографічно. зюча 70-денна затримка росту пухлини, яка не Сполуки формули (8) та полімер (B) відомі, чи спостерігалася при використанні інших хіміотераїх можна синтезувати відомими способами. певтичних засобів (Таблиця 6). Усі похідні камптотецину формули (2) відомі Таблиця 1 Протипухлинна активність A1 у відношенні карциноми товстої кішки людини (НТ29) у порівнянні з (2а). Застосування: внутрішньовенно 4 рази на день протягом 6 діб (внутрішньовенно, q4dx6) Сполука A1 2а Доза, мг/кг 15 17,5 20 22,5 12,5 Сумарна доза, Пригнічення пухлини, %, Токсичність мг/кг 37 доба 90 97 0/7 105 98 0/7 120 99 0/7 135 99 0/7 75 94 0/7 Відсутність пухлини 2/7 1/7 5/7 6/7 0/7 D3ΡΟ (0,5г), доби >88 >88 >88 >88 43 Фрагменти пухлини імплантували підшкірно. Лікування починали, коли пухлина ставала помітною на дотик. Пригнічення пухлини, у %, обчислювали на 37-у добу. D3ΡΟ; затримка росту пухлини у тварин, підданих лікуванню/затримка росту пухлини у контрольних тварин. 11 70930 12 Таблиця 2 Протипухлинна активність A2 У відношенні карциноми товстої кишки людини (НТ29) у порівнянні з (2d) Сполука А2 Схема застосування iv q4dx8 iv q4dx8 iv q4dx8 iv q4dx6 Доза, мг/кг Сумарна доза, мг/кг 12 20 40 20 80 160 320 120 Пригнічення пухлини, Токсичність D3ΡΟ (0,5г), %, 37-а доба доби 78 0/7 0 91 0/7 21 98 0/7 56 97 1/7 50 Фрагменти пухлини імплантували підшкірно. Лікування починали, коли пухлина ставала помітною на дотик. Пригнічення пухлини, у %, обчислювали на 37-у добу. D3ΡΟ; затримка росту пухлини у тварин, підданих лікуванню/затримка росту пухлини у контрольних тварин. Таблиця 3 Протипухлинна активність A1 у відношенні раку молочної залози МХ1 людини у порівнянні з камптотецином (2а) Сполука А1 2а Схема застосування iv q4dx6 iv q4dx4 Доза/сумарна Пригнічення росту Токсичність доза пухлини, % 20/120 100 0/8 10/40 100 3/8 D3ΡΟ (0,5г), доби >88 69 Відсутність пухлини 8/8 0/8 Фрагменти пухлини імплантували підшкірно, лікування починали, коли пухлина ставала помітною на дотик. Дози виражені в еквівалентах камптотецину. Пригнічення росту пухлини, у %: через 1 тиждень після останнього сеансу лікування. Токсичність: Відношення числа мишей, померлих у результаті токсичності, до загального числа мишей. D3ΡΟ: затримка росту пухлини у тварин, підданих лікуванню/затримка росту пухлини у контрольних тварин. Відсутність пухлин: вилікувані миші на 90-у день після імплантації. Таблиця 4 Протипухлинна активність А1 у відношенні раку яєчника А2780 людини у порівнянні з камптотецином (2а) Сполука А1 2а Схема застосу- Доза/сумарна Пригнічення, росту Токсичність вання доза пухлини, % iv q4dx6 15/90 100 0/7 iv q4dx6 20/120 100 0/7 iv q4dx3 10/30 даних немає 7/7 D3ΡΟ (0,5г), доби >82 >82 даних немає Відсутність пухлини 7/7 7/7 0/7 Фрагменти пухлини імплантували підшкірно, лікування починали, коли пухлина ставала помітною на дотик. Дози виражені в еквівалентах камптотецину. Пригнічення росту пухлини, у %: через 1 тиждень після останнього сеансу лікування. Токсичність: Відношення числа мишей, померлих у результаті токсичності, до загального числа мишей. D3ΡΟ: затримка росту пухлини у тварин, підданих лікуванню/затримка росту пухлини у контрольних тварин. Відсутність пухлин: вилікувані миші на 90-у день після імплантації. 13 70930 14 Таблиця 5 Протипухлинна активність А1 у відношенні меланом М14 людини у порівнянні з камптотецином (2а) Сполука Схема застосу- Доза/сумарна Пригнічення, росту Токсичність вання доза пухлини, % iv q4dx6 15/90 100 0/7 А1 iv q4dx6 20/120 100 0/7 2а iv q4dx3 10/60 94 7/7 D3ΡΟ доби >78 >78 34 Відсутність пухлини 7/7 7/7 0/7 Фрагменти пухлини імплантували підшкірно, лікування починали, коли пухлина ставала помітною на дотик. Дози виражені в еквівалентах камптотецину. Пригнічення росту пухлини, у %: через 1 тиждень після останнього сеансу лікування. Токсичність: Відношення числа мишей, померлих у результаті токсичності, до загального числа мишей. D3ΡΟ: затримка росту пухлини у тварин, підданих лікуванню/затримка росту пухлини у контрольних тварин. Відсутність пухлин: вилікувані миші на 90-у день після імплантації. Таблиця 6 Протипухлинна активність А1 відношенні раку легень А549 NSC людини в порівнянні з камптотецином (2а) Сполука А1 2а Схема Застосу- Доза/сумарна Пригнічення, росту Токсичність вання доза пухлини, % iv q4dx6 15/90 100 0/7 iv q4dx6 20/120 100 0/7 iv q4dx3 10/60 89 7/7 D3ΡΟ (0,5г), доби >48 >70 4 Відсутність пухлини 7/7 7/7 0/7 Фрагменти пухлини імплантували підшкірно, лікування починали, коли пухлина ставала помітною на дотик. Дози виражені в еквівалентах камптотецину. Пригнічення росту пухлини, у %: через 1 тиждень після останнього сеансу лікування. Токсичність: Відношення числа мишей, померлих у результаті токсичності, до загального числа мишей. D3ΡΟ: затримка росту пухлини у тварин, підданих лікуванню/затримка росту пухлини у контрольних тварин. Відсутність пухлин: вилікувані миші на 90-у день після імплантації. Таким чином, сполуки, згідно з винаходом, корисні при лікуванні лейкемії та твердих п ухлин, наприклад пухлин товстої кишки, товстої та прямої кишки, шлунка, молочної залози, простати, легень, нирки, а також меланотичних пухлин. Тому людину можна лікувати способом, що включає введення пацієнту терапевтично ефективної кількості полімерного кон'югату згідно з винаходом. Тим самим стан людини-пацієнта можна поліпшити. Прийнятий інтервал доз буде залежати від способу введення препарату та віку, маси, та стану пацієнта. Полімерні кон'югати формули (1) звичайно вводять парентеральним шляхом, наприклад, внутрішньом'язово, внутрішньовенно, або за допомогою введення ударної дози. Підхожий інтервал доз складає від 1 до 1000мг еквівалента камптотецину на м 2 поверхні тіла, наприклад, від 10 до 100мг/м 2. Полімерний кон'югат (1) можна перетворити у фармацевтичну композицію, яка включає фармацевтично прийнятний носій або розріджувач. Звичайно такі композиції складаються для парентерального введення, наприклад, розчиняючи їх у воді або у фізіологічному розчині для ін'єкцій. Винахід ілюструється нижченаведеними прикладами. Приклад 1 Отримання -N-(трет-бутилоксикарбоніл)-6аміногексаноїл-гліцил-пара-нітрофенілового естеру [10а: n=5, R 9=трет-Вос, Ρ=пара-нітрофенол]. До гідрохлориду гліцин-етилового естеру (9,55г, 68, 4ммоль.), розчиненому у диметилформаміді (100мл), додавали тріетиламін (9,5мл, 68,4ммоль.), а потім N-(трет-бутилоксикарбоніл)-6аміногексаноїл-пара-нітрофеніловий естер (19г, 54ммоль), отриманий способом, описаним у Європейському патенті №0673258. Реакційну суміш витримували протягом двох годин при кімнатній температурі, потім розчинник видаляли при зниженому тиску. Залишок розчиняли в етилацетаті (300мл) та послідовно промивали холодним 1Н водним розчином гідрохлоридної кислоти (3x200мл), водою (100мл), 5-відсотковим водним розчином гідрокарбонату натрію (2x200мл) та водою (2x200мл). Органічну фазу осушували безводним сульфатом натрію, потім розчинник видаляли при зниженому тиску. Залишок кристалізували з етилового етеру, одержуючи Ν-(третбутилоксикарбоніл)-6-аміногексаноїл-гліцилетиловий естер (15г, ГЖК на кізельгелевій платівці F254 (фірми Merck), елюювальна система - етиловий етер, Rf=0,3), який суспендували у етанолі 15 70930 16 (150мл) та обробляли при перемішуванні 1Н розТШХ на кізельгелевій платівці F254 (фірми чином гідрооксиду натрію (48мл, 48ммоль.). Через Merck), елюювальна система - метиленхлогодину у реакційну суміш додавали 1Н водний рид/метанол/оцтова кислота (80/20/7/3oб./oб.), розчин гідрохлоридної кислоти (48мл, 48ммоль.) Rf=0,83. та отриману суміш переганяли при зниженому тисПриклад 4 ку. Залишок суспендували у безводному тетрагідОтримання 20-О-[метакрилоїл-гліцил-(6рофурані (200мл), до суспензії додавали парааміногексаноїл)-гліцил]камптотецину нітрофенол (6,53г, 47ммоль.), суміш охолоджували [9а; n=5, ОСРТ=(2а)] при 0°С, а потім додавали розчин 1,3Трифлуорацетат 20-О-(6-аміногексаноїлдициклогексил-карбодіімиду (9,7г, 47ммоль.) у гліцил)камптотецину (6а: 2,53г, 4ммоль) розчиняли тетрагідрофурані (100мол.). Реакційну суміш лиу безводному диметилсульфоксиді (10мл) та дошали на ніч у ти х же умовах, а потім фільтрували давали метакрилоїл-гліцил-пара-нітрофеніловий через лійку з пористого скла. Розчинник видаляли естер (1,32г, 5ммоль), отриманий як описано в при зниженому тиску. Залишок кристалізували з Macromol. Chem. 178. 2159 (1977), та тріетиламін етилового етеру й одержували 17,5г цільової спо(0,56мл, 4ммоль). Розчин залишали на ніч при луки формули (10а). ТШХ на кізельгелевій платівці кімнатній температурі, а потім виливали у воду F254 (фірми Merck), елюювальна система - мети(100мл), осад збирали та відмивали водою ленхлорид/метанол (95/5oб./oб.), Rf=0,34. (2x100мл). Твердий матеріал піддавали ТШХ1 аналізу на силікагелі, використовуючи елюювальН-ЯМР (200мггцб ДМСО) d: ну систему - суміш метиленхлорид/метанол 1,34 (с, 9Н, трет-бут.); 1,0-1,7 [м, 6Н, NH-CH2(95,5об./об.). Одержували 2,2г цільової сполуки (CH2)3-CH2-CO]; 2,15 (т, J=7,2гц, 2Н, ΝΗ-(CH 2)4(9а). ТШХ на кізельгелевій платівці F254 (фірми СН2-СО); 2,85 [к, J=6,5гц, 2Н, NH-CH 2-(CH2)4-CO]; 4,11 (д, J=5,5гц, 2Н, CONHCH 2COO); 6,70 [шс, 1Н, Merck), елюювальна система - метиленхлорид/метанол (9/1об./об.), Rf=0,62 NH-(CH2)5-CО]; 7,40 (м, 2Н, аромат. 2,6-Н); 8,30 (м, 1 2Н, аромат. 3,5-Н); 8,43 (т, J=5,5гц, 1Н, Н-ЯМР (200мггц, ДМСО) d: CONHCH2COO) . 0,90 (т, J=7,3гц, 3Н, СН3-18); 1,1-1,6 [м, 6Н, Приклад 2 NHCH2-(СН2)3-(СН2)2СО]; 2,0-2,2 [м, 4Н, СН2-19 + Отримання 20-О-[(М-трет-бутилоксикарбоніл)NH-(СH2)4-СН2-СО], 2,95 (k, J=6,3гц, 2Н, NH-CH 2]камптотецину (CH2)4CO); 3,63 (д, J=5,8гц, 2H, CONH-CH 2-CONH); [11а: n=5, R 9=трет-Вос ОСРТ=(2a)] 3,97 (дд, J=17,8, 5,9гц, 1Н, СОNНСНаСНbСОО); Камптотецин (2a: 3,4г, 10ммоль), суспендова4,15 (дд, J=17,8, 5,9гц, 1H, CONHCHaCHbCOO); ний у диметилсульфоксиді (50мл), обробляли N5,29 (с, 2H, СН2-5); 5,33 (к, J=1,6гц, 1Н, (трет-бутилоксикарбонт)-6-аміногексаноїл-гліцилСН3СН= С(На)(Hb)]; 5,48 (с, 2Н, СН2-17); 5,69 (м, 1Н, пара-нітрофентовим естером (10а: 6,3г, 15ммоль.) CH3=CH(H а)(Hb)]; 7,15 (с, 1Н, Н-14); 7,6-7,9 (м, 3Н, та 4-диметиламінопіридином (2,4г, 20ммоль.). РеН-10 + Н-11 + NH-(CH2)5CO]; 8,0 (т, J=5,8гц, 1Н, акційну суміш ви тримували протягом 24 годин, CO-NH-CH2CONH); 8,15 (м, 2H, H-9 + Н-12); 8,32 потім до неї додавали аліквотну кількість N-(трет(т, J=5,9гц, 1Н, CО-NH-CHаCHbCОО); 8,69 (с, 1H, бутилоксикарбоніл)-6-аміногексаноїл-гліцил-параН-7). нітрофенілового естеру (6,3г, 15ммоль.). Через 48 Приклад 5 годин реакційну суміш розбавляли метиленхлориОтримання трифлуорацетату 7-етил-10дом (500мл) та промивали 0,2Н водним розчином гідрокси-20-О-(6-аміногексаноїлгідрохлоридної кислоти (2x250мл) та водою гліцил)камптотецину (2x250мл). Органічну фазу осушували безводним [6b: n=5, ОСРТ=(2d) сульфатом натрію, потім розчинник видаляли при 7-етил-10-гідроксикамптотецин (2d, 0,8г, зниженому тиску. Залишок розчиняли у метилен2ммоль.), пара-нітрофеніловий естер Ν-(третхлориді (100мл), додавали етиловий етер (500мл), бутоксикарбоніл)-6-аміно-гексаноніл-гліцилу (10; та залишали суміш на ніч при 0°С. Одержували 5г 2,5г, 6ммоль) та 4-диметиламінопіридин розчинятвердої цільової сполуки формули (11а). ТШХ на ли у безводному диметилсульфоксиді (30мл) та кізельгелевій платівці F254 (фірми Merck), елюювавитримували при кімнатній температурі протягом 3 льна система метиленхлорид/метанол діб при перемішуванні. Потім реакційну суміш ви(95/5oб./oб.), Rf=0,44. ливали у 0,1Н водний розчин гідрохлоридної кисПриклад 3 лоти (500мл), отриманий осад збирали, розчиняли Отримання 20-О-(6-аміногексаноїлу метиленхлориді (300мл), та промивали водою гліцил)камптотецину (2x100мл). Органічну фазу відокремлювали, осу[6а: n=5, ОСРТ=(2а)] шували безводним сульфатом натрію, та випаро20-O-[(Н-трет-бутоксикарбоніл)-6вували при зниженому тиску. Залишок обробляли аміногексаноіл-гліцил]камптотецин (11а: 5г) обро90-відсотковим водним розчином трифлуороцтової бляли 90-відсотковим водним розчином трифлуокислоти (40мл) протягом трьох годин, потім розроцтової кислоти (40мл) протягом 1 години, потім чинник видаляли при зниженому тиску, а залишок розчинник видаляли при зниженому тиску. Залипіддавали ТШХ на силікагелі, використовуючи сушок розтирали з етиловим етером (300мл) та відміш метиленхлорид/оцтова кислота/метанол фільтровували. Тверду речовину розчиняли у ме(100/5/20об./об.), як елюювальну систему. Фракції, танолі, об'єм зменшували (до 50мл) при які містять цільові сполуки, об'єднували та випазниженому тиску, та додавали етиловий етер ровували при зниженому тиску. Одержували 1,02г (300мл). Осад збирали та одержували 3,9 цільової сполуки формули (6b) у формі похідної солі трифсполуки (6a). луороцтової кислоти. ТШХ на кізельгелевій платі 17 70930 18 вці F254 (фірми Merck), елюювальна система - мером та сушили до постійної маси. Отримували тиленхлорид/метанол/оцтова кислота 2,68г цільової сполуки (А1). (80/20/7/3об./об.), Rf=0,4. Середньо-масова молекулярна маса (Mw): 1 19800. Полідисперсність (Mw/Mn): 1,5. Вміст кампН=ЯМР (200мггц ДМСО) d: тотецину, визначений після лужного гідролизу: 0,89 (т, J=7,2гц, 3Н, СН3-СН2-20); 1,1-1,5 (м, 10%мас/мас. 9Н, NH2-CH2-CH2-CH2-CH2-CH2+CH3-CH2-7); 1,80 Приклад 8 (с, 3Н, СН3-СООН); 2,10 (м, 4Н, СН3-CH2-20 + CH 2CONH); 2,53 (т, 6,8гц, 2Н, CH2-NH2); 3,06 (м, 2Η, Отримання МАG-(7-етил-10гідроксикамптотецину), використовуючи спосіб 1 СН3-CH2-7); 3,98, 4,13 (два дд, J=17,6, 5,7гц, 2Н, [A2]: n=5, OCPT=(2d)] CONH-CH2-CO); 5,27 (с, 2Н, CH2-5); 5,46 (с, 2Н, Полімерний попередник В (R2 пара= CH2-17); 7,01 (с, 1Н, Н-14); 7,40 (м, 2Н, Н-9 + Н-11); нітрофеноксил, 2,58г, який містить 1,16х10-3екв. 7,99 (д, J=9,8гц, 1Н, Н-12); 8,33 (т, J=5,7гц, 1Н, CONH-CHNH-CO) . залишку пара-нітрофенілового естеру), отриманий, як описано в Makromo Chem. 178, 2159 Приклад 6 (1977), розчиняли у безводному диметилсульфокОтримання гідрохлориду 7-етил-10-гідроксисиді (15мл) та додавали спочатку трифлуорацетат 20-O-(6-аміногексаноїл-гліцил)-камптотецину 7-етил-10-гідрокси-20-O-(6-аміногексаноїл[6b: n=5, ОСРТ=(2d)] Проводили реакцію 7-етил-10гліцил)камптотецину (6b: 0,68г, 1ммоль), а потім тріетиламін (0,14мл, 1ммоль.). Реакційну суміш гідроксикамптотецину (2d 0,8г, 2ммоль.) з параперемішували при кімнатній температурі протягом нітрофеніловим естером N-(трет-бутоксикарбоніл)22 годин, потім до суміші додавали 26-аміно-гексаноніл-гліцилу (10a: 2,5г, 6ммоль.) та пропаноламін (0,05мл) та продовжували перемі4-диметиламінопіридином, як описано у Прикладі 5. Проміжний продукт, екстрагований з реакційної шування ще 1 годину. Після цього реакційну суміш осаджували етилацетатом (200мл) та перемішусуміші метиленхлоридом, розчиняли в суміші 1,5Н вали протягом 30хв. Твердий продукт збирали у гідрохлоридної кислоти та оцтової кислоти (20мл). лійку з пористого скла, промивали етилацетатом Після перемішування протягом години при кімнат(200мл) та етиловим ефіром, потім розчиняли у ній температурі, об'єм розчину зменшували перегонкою та добавляли етиловий етер (100мл). Осад етанолі (30мл). Спиртовий розчин обробляли вологим аніонітом DOWEX 50 у сульфо-формі (1,2г) збирали та промивали етиловим етером (2x50мл). при перемішуванні протягом 30 хвилин, та після Одержували 1г цільової сполуки (6b) у формі вільцього додавали краплями до н-гексану (200мл). ного аміно-похідного. Осад збирали у лійку з пористого скла, промивали Приклад 7 Отримання MAG-камптотецину. застосовуючи етиловим ефіром та сушили до постійної маси. Одержували 2,68г цільової сполуки (А2). Спосіб І Середньо-масова молекулярна маса (Mw): [А1]: n=5, ОСРТ=(2а)] 20500. Полідисперсність (Mw/Mn): 1,87. Вміст 7Полімерний попередник В (R2 пара= етил-10-гідрокси-камптотецину, визначений після нітрофеноксил, 2,58г, який містить 1,16x10-3екв. залишку пара-нітрофенілового естеру), отриманий лужного гідролізу: 10%мас/мас. Приклад 9 як описано в Makromol. Chem. 178, 2159 (1977), Отримання MAG-камптотецину. застосовуючи розчиняли у безводному диметилсульфоксиді Спосіб II (15мл) та додавали спочатку трифлуорацетат 20[A1]: n=5, ОСРТ=(2а)] О-(6-аміногексаноїл-гліцил)камптотецину (6а: 0,63г, 1ммоль), а потім тріетиламін (0,14мл, 20-O-[метакрилоїл-гліцил-(6-аміногексаноїл)гліцил]камптотецину (2а: 1,26г, 2ммоль.), N-(21ммоль.). Реакційну суміш перемішували при кімгідроксипропіл)-метакриламіду (8, 4,4г, 31ммоль), натній температурі протягом 22 годин, потім до отриманого як описано в Makromol. Chem. 178, суміші додавали 2-пропаноламін (0,05мл) та про2159 (1977), і 2,2’-азобісізобутиронітрилу (0,26г, довжували перемішування ще 1 годину. Після цього реакційну суміш осаджували етилацетатом 1,6ммоль.) розчиняли у безводному диметилсульфоксиді (20мл), витримували при 60°С у атмос(200мл) та перемішували протягом 30хв. Твердий фері азоту при перемішуванні протягом 24 годин. матеріал збирали в лійку з пористого скла, промиПісля цього реакційну суміш охолоджували при вали етилацетатом (200мл) та етиловим ефіром кімнатній температурі та виливали у етилацетат (100мл), потім розчиняли у етанолі (30мл). Спиртовий розчин обробляли вологим аніонітом (500мл). Осад збирали і розчиняли у етанолі (50мл), звідси речовину переосаджували, додаючи DOWEX 50 у сульфо-формі (1,2г) при перемішуетилацетат (500мл). Тверду речовину збирали, ванні протягом 30 хвилин, та після цього додавали промивали етилацетатом (2x100мл). Одержували краплями до н-гексану (200мл). Осад збирали у 5г цільової сполуки (А1). лійку з пористого скла, промивали етиловим ефі Комп’ютерна в ерстка О. Гапоненко Підписне Тираж 37 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюPolymeric conjugates of camptothecin
Автори англійськоюANGELUCCI FRANCESCO
Назва патенту російськоюПолимерные производные камптотецинов
Автори російськоюАнджелуччи Франческо
МПК / Мітки
МПК: A61K 47/48, A61P 35/00, A61K 31/4745, A61K 31/787, C08F 220/00
Мітки: камптотецинів, полімерні, похідні
Код посилання
<a href="https://ua.patents.su/9-70930-polimerni-pokhidni-kamptoteciniv.html" target="_blank" rel="follow" title="База патентів України">Полімерні похідні камптотецинів</a>
Попередній патент: Підводний буровий верстат
Наступний патент: Газовий пальник
Випадковий патент: Валковий прес для пресування порошків