Енантіомерно чисті фосфоіндоли як інгібітори віл
Номер патенту: 98775
Опубліковано: 25.06.2012
Автори: Сторер Річард, Александер Франсуа-Рене, Мусса Адель М., Дуссон Сіріл, Бріджес Едвард
Формула / Реферат
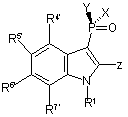
1. Чиста сполука формули (А) або її фармацевтично прийнятна сіль, сольват, гідрат або естер:
 ,
,
де X - гідроген; заміщений чи не заміщений арил або гетероцикл; С2-6алкеніл, С2-6алкініл або алкіл;
Y - гідроген, -R, -O-R, -NH-R або -NRR;
Z - -OR, -NHR, -NRR, карбоксамідо, амідо, карбоксил, карбоніл або амінокислотний залишок;
R1 - гідроген, ацил, -S(O)n-R, карбоксил, карбоніл або амінокислотний залишок;
кожна з R4’, R5’, R6’ і R7’ є незалежно гідрогеном, С2-6алкенілом, С2.6алкінілом, арилом, гетероциклом, галогеном, -CN, -CF3, -OR, -NHR, -NRR або -NO2;
n дорівнює 0, 1 або 2; і кожна R є незалежно гідрогеном, алкілом, С2-6алкенілом, С2-6алкінілом, арилом або гетероциклом.
2. Сполука за п. 1, яка відрізняється тим, що:
X - заміщений чи не заміщений арил або гетероцикл; С2-6алкеніл, С2-6алкініл або алкіл; і
Y - -R, -O-R, -NH-R або -NRR.
3. Сполука за п. 1, яка відрізняється тим, що: кожна R4’ і R5’ є незалежно гідрогеном або галогеном; R6’ і R7’ - гідроген;
R1 - гідроген або -S(O)n-R;
Y - гідроген, -R або -O-R;
Z - карбоксамідо, амідо, карбоксил або карбоніл;
n дорівнює 1 або 2; і
кожна R є незалежно гідрогеном або алкілом.
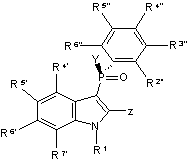
4. Сполука за будь-яким з пп. 1-3, яка відрізняється тим, що має формулу (С):
 ,
,
де кожна з R2", R3", R4", R5" і R6" є незалежно гідрогеном, галогеном, заміщеним або незаміщеним алкілом або заміщеним або незаміщеним С2-6алкенілом.
5. Сполука за п. 4, яка відрізняється тим, що кожна R3" і R5" є незалежно алкілом або С2-6алкенілом, який може, як варіант, бути заміщений CN або галогеном; a R2", R4" і R6" є гідрогеном.
6. Сполука за п. 5, яка відрізняється тим, що: R1 - гідроген;
Y - -O-R; і
Z - амідо, карбоксил або карбоніл.
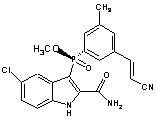
7. Чиста сполука наведеної нижче формули або її фармацевтично прийнятна сіль або естер:
 .
.
8. Чиста сполука наведеної нижче формули або її фармацевтично прийнятна сіль або естер:
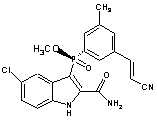 .
.
9. Сполука за будь-яким з пп. 1-8, яка відрізняється тим, що є енантіомерно чистою.
10. Сполука за будь-яким з пп. 1-8, яка відрізняється тим, що є суттєво вільною від її протилежного енантіомера.
11. Сполука за будь-яким з пп. 1-8, яка відрізняється тим, що включає щонайменше 80, 90, 95 або 99 % (за масою) зазначеного енантіомера.
12. Сполука за будь-яким з пп. 1-8, яка відрізняється тим, що є фармацевтично прийнятною сіллю, естером або нейтральною формою.
13. Фармацевтична композиція, яка містить сполуку за будь-яким з пп. 1-8 і 9-12, фармацевтичний носій, ексципієнт або розріджувач і суттєво вільною від протилежного енантіомера зазначеної сполуки.
14. Фармацевтична композиція за п. 13, яка відрізняється тим, що має форму, придатну для перорального дозованого введення.
15. Фармацевтична композиція за п. 14, яка відрізняється тим, що сполука є енантіомерно чистою.
16. Фармацевтична композиція, яка містить сполуку за будь-яким з пп. 1-8 і 9-12 і другий анти-ВІЛ агент і є суттєво вільною від протилежного енантіомера зазначеної сполуки.
17. Фармацевтична композиція за п. 16, яка відрізняється тим, що другим анти-ВІЛ агентом є інгібітор протеази або інгібітор інтегрази.
18. Застосування сполуки за будь-яким з пп. 1-8 і 9-12 у виготовленні медикаменту для лікування, відвертання, покращення або послаблення симптомів, пов'язаних з ВІЛ-інфекцією у суб'єкта.
19. Застосування за п. 18, яке відрізняється тим, що сполука має фармацевтично прийнятну пероральну дозовану форму.
20. Застосування за п. 18, яке відрізняється тим, що сполука є енантіомерно чистою.
21. Застосування за п. 18, яке відрізняється тим, що додатково включає введення сполуки суб'єкту у комбінації або переміжно з щонайменше другим анти-ВІЛ агентом.
22. Застосування за п. 21, яке відрізняється тим, що другий анти-ВІЛ агент вибрано з таких сполук:
- інгібітор протеази,
- нуклеозидний або нуклеотидний інгібітор зворотної транскриптази,
- ненуклеозидний інгібітор зворотної транскриптази,
- комбінація фіксованих доз,
- інгібітор входу,
- антагоніст співрецептора ЦKR5,
- інгібітор дозрівання або
- інгібітор інтегрази.
23. Застосування за п. 18, яке відрізняється тим, що додатково включає введення сполуки суб'єкту у комбінації або переміжно з анти-ВІЛ агентом.
24. Застосування за п. 18, яке відрізняється тим, що сполуку вводять перорально.
25. Застосування за п. 18, яке відрізняється тим, що сполуку вводять у комбінації з другою сполукою, ефективною у лікуванні або відвертанні інфекції HCV у суб'єкта.
26. Застосування за п. 18, яке відрізняється тим, що сполука пригнічує реплікацію ВІЛ.
27. Застосування сполуки за будь-яким з пп. 1-8 і 9-12 у терапії.
28. Застосування сполуки за будь-яким з пп. 1-8 і 9-12 у виготовленні медикаменту для лікування, відвертання, покращення або послаблення симптомів, пов'язаних з ВІЛ-інфекцією.
29. Фармацевтична композиція за п. 14, яка відрізняється тим, що пероральною дозованою формою є капсула або таблетка.
30. Фармацевтична композиція за п. 17, яка відрізняється тим, що другим анти-ВІЛ агентом є ампренавір, типранавір, індинавір, сакінавір, лопінавір, ритронавір, фосампренавір, дарунавір, атазанавір, нелфінавір, бреканивір, GS-8374, Elvitegravir, GSK-364735 або ральтегравір.
31. Застосування за п. 19, яке відрізняється тим, що пероральною дозованою формою є капсула або таблетка.
32. Застосування за п. 22, яке відрізняється тим, що другим анти-ВІЛ агентом є ампренавір, типранавір, індинавір, сакінавір, лопінавір, ритронавір, фосампренавір, дарунавір, атазанавір, нелфінавір, ламівудин, емтрицитабін, абакавір, зальцитабін, зидовудин, тенофовір, диданозин, ставудин, делавірдин, ефавіренц, невірапін, Atripla, Combivir, Trizivir, Truvada, маравірок, енфульвіртид, бреканивір, GS-8374, амдоксовір, априцитабін, ельвуцитабін, Etravirine, Rilpivirine, Calanolide A, Aplaviroc, PRO2000, Vicriviroc, Bevirimat, Elvitegravir, GSK-364735 або ральтегравір.
33. Застосування за п. 23, яке відрізняється тим, що анти-ВІЛ агентом є ентекавір, ламівудин, інтерферон альфа-2b, пегінтерферон альфа-2а, адефовір дипівоксил, тельбувідин, емтрицитибін, клевудин, тенофовір, вальторцитабін, амдоксовір, LB80380, ремофовір або рацивір.
34. Застосування за п. 24, яке відрізняється тим, що сполуку вводять перорально один раз на день.
35. Сполука за п. 7, яка відрізняється тим, що є енантіомерно чистою.
36. Сполука за п. 7, яка відрізняється тим, що є суттєво вільною від протилежного енантіомера.
37. Сполука за п. 7, яка відрізняється тим, що включає щонайменше 80, 90, 95 або 99 % (за масою) зазначеного енантіомера.
38. Сполука за п. 7, яка відрізняється тим, що є фармацевтично прийнятною сіллю, естером або нейтральною формою.
39. Фармацевтична композиція, яка містить сполуку за п. 7 і фармацевтичний носій, ексципієнт або розріджувач і є суттєво вільною від протилежного енантіомера зазначеної сполуки.
40. Фармацевтична композиція за п. 39, яка відрізняється тим, що має фармацевтично прийнятну пероральну дозовану форму.
41. Фармацевтична композиція за п. 40, яка відрізняється тим, що має форму капсули або таблетки.
42. Фармацевтична композиція за п. 40, яка відрізняється тим, що є енантіомерно чистою.
43. Фармацевтична композиція, яка містить сполуку за п. 7 і другий анти-ВІЛ агент і є суттєво вільною від протилежного енантіомера зазначеної сполуки.
44. Фармацевтична композиція за п. 43, яка відрізняється тим, що другим анти-ВІЛ агентом є інгібітор протеази або інгібітор інтегрази.
45. Фармацевтична композиція за п. 43, яка відрізняється тим, що другим анти-ВІЛ агентом є ампренавір, типранавір, індинавір, сакінавір, лопінавір, ритронавір, фосампренавір, дарунавір, атазанавір, нелфінавір, бреканивір, GS-8374, Elvitegravir, GSK-364735 або ральтегравір.
46. Застосування сполуки за п. 7 у виготовленні медикаменту для лікування, відвернення, послаблення або полегшення симптомів, пов'язаних з ВІЛ-інфекцією у суб'єкта.
47. Застосування за п. 46, яке відрізняється тим, що сполука має фармацевтично прийнятну пероральну дозовану форму.
48. Застосування за п. 47, яке відрізняється тим, що пероральною дозованою формою є капсула або таблетка.
49. Застосування за п. 46, яке відрізняється тим, що сполука є енантіомерно чистою.
50. Застосування за п. 46, яке відрізняється тим, що спосіб додатково включає введення сполуки суб'єкту у комбінації або переміжно з щонайменше одним другим анти-ВІЛ агентом.
51. Застосування за п. 50, яке відрізняється тим, що другим анти-ВІЛ агентом є інгібітор протеази, нуклеозидний або нуклеотидний інгібітор зворотної транскриптази, ненуклеозидний інгібітор зворотної транскриптази, комбінація фіксованих доз, інгібітор входу, антагоніст співрецептора ЦКR5, інгібітор дозрівання або інгібітор інтегрази.
52. Застосування за п. 50, яке відрізняється тим, що другим анти-ВІЛ агентом є ампренавір, типранавір, індинавір, сакінавір, лопінавір, ритронавір, фосампренавір, дарунавір, атазанавір, нелфінавір, ламівудин, емтрицитабін, абакавір, зальцитабін, зидовудин, тенофовір, диданозин, ставудин, делавірдин, ефавіренц, невірапін, Atripla, Combivir, Trizivir, Truvada, маравірок, енфульвіртид, бреканивір, GS-8374, амдоксовір, априцитабін, ельвуцитабін, Etravirine, Rilpivirine, Calanolide A, Aplaviroc, PRO2000, Vicriviroc, Bevirimat, Elvitegravir, GSK-364735 або ральтегравір.
53. Застосування за п. 46, яке відрізняється тим, що спосіб додатково включає введення сполуки суб'єкту у комбінації або переміжно з одним другим анти-ВІЛ агентом.
54. Застосування за п. 53, яке відрізняється тим, що анти-ВІЛ агентом є ентекавір, ламівудин, інтерферон альфа-2b, пегінтерферон альфа-2а, адефовір дипівоксил, тельбувідин, емтрицитибін, клевудин, тенофовір, вальторцитабін, амдоксовір, LB80380, ремофовір або рацивір.
55. Застосування за п. 46, яке відрізняється тим, що сполуку вводять перорально.
56. Застосування за п. 55, яке відрізняється тим, що сполуку вводять перорально один раз на день.
57. Застосування за п. 46, яке відрізняється тим, що сполуку вводять у комбінації з другою сполукою, ефективною у лікуванні або відверненні інфекції HCV у суб'єкта.
58. Застосування за п. 46, яке відрізняється тим, що сполука пригнічує реплікацію ВІЛ.
59. Фармацевтична композиція, яка містить сполуку за п. 7 і фармацевтичний носій, ексципієнт або розріджувач і включає щонайменше приблизно 10, 20, 30, 40, 50, 60, 70, 80, 90 або 99 % за масою зазначеного енантіомера відносно повної маси композиції, а решту композиції складають фармацевтичний носій, ексципієнт або розріджувач.
60. Фармацевтична композиція, яка містить сполуку за п. 7 і фармацевтичний носій, ексципієнт або розріджувач і включає щонайменше приблизно 80, 90, 95 або 99 % за масою зазначеного енантіомера відносно повної маси композиції.
61. Сполука за п. 8, яка відрізняється тим, що є енантіомерно чистою.
62. Сполука за п. 8, яка відрізняється тим, що є суттєво вільною від її протилежного енантіомера.
63. Сполука за п. 8, яка відрізняється тим, що містить щонайменше 80, 90, 95 або 99 % за масою зазначеного енантіомера.
64. Сполука за п. 8, яка відрізняється тим, що є фармацевтично прийнятною сіллю, естером або нейтральною формою.
65. Фармацевтична композиція, яка містить сполуку за п. 8 і фармацевтичний носій, ексципієнт або розріджувач і є суттєво вільною від протилежного енантіомера зазначеної сполуки.
Текст
Реферат: Запропоновано 3-фосфоіндольні сполуки, по суті у формі єдиного енантіомера, корисного у лікуванні інфекцій вірусу Flaviviridae і, зокрема, ВІЛ-інфекцій. Також запропоновано фармацевтичні композиції, які включають 3-фосфоіндольні сполуки окремо або у комбінації з одним або більше іншими антивірусними агентами, способи їх отримання і способи одержання медикаменту, що містить ці сполуки. 3-Фосфоіндольні сполуки мають формулу (А) і включають фармацевтично прийнятні солі, сольвати, гідрати або естери. У цій формулі X є гідрогеном; арилом або гетероциклілом; С 26алкенілом, С2-6алкінілом або алкілом; Y - гідроген, -R, -O-R, -NH-R або -NRR; Z - -OR, -NHR, 1 NRR, карбоксамідо, амідо, карбоксил, карбоніл або амінокислотний залишок; R - гідроген, 4' 5' 6' 7' ацил, -S(O)n-R, карбоксил, карбоніл або амінокислотний залишок; кожна з R , R , R і R є незалежно гідрогеном, С2-6алкенілом, С2-6алкінілом, арилом, гетероциклілом, галогеном, -CN, CF3, -OR, -NHR, -NRR або -NO2; n дорівнює 0, 1, або 2; і кожна R є незалежно гідрогеном, алкілом, С2-6алкенілом, С2-6алкінілом, арилом або гетероциклілом. UA 98775 C2 (12) UA 98775 C2 UA 98775 C2 5 10 15 20 25 30 35 40 45 50 55 Винахід стосується енантіомерно чистих фосфоіндольних сполук, які можуть бути використані для пригнічення реплікації вірусів. У деяких втіленнях запропоновано чисті Sфосфоіндольні сполуки, а також чисті R-фосфоіндольні сполуки, які можуть бути використані для пригнічення реплікації вірусів. Винахід стосується також фармацевтично прийнятних солей, похідних і аналогів цих сполук, фармацевтичних композицій, що містять ці сполуки, способів використання цих сполук, наприклад, у лікуванні або профілактиці ВІЛ інфекції, і способів приготування цих сполук. Індоли, нуклеозиди і їх аналоги є добре відомими і використовуються у лікуванні вірусних інфекцій у ссавців, включаючи людину. Віруси, що інфікують ссавців, можна лікувати введенням фармацевтичних композицій, що включають індоли, нуклеозиди або їх аналоги або похідні. Такі віруси включають (але не лише) гепацивірус, включаючи HCV, вірус імунодефіциту людини (ВІЛ), пестивіруси, наприклад, вірус бичачої діареї (BVDV), вірус класичної лихоманки свиней (CSFV, відомий також як вірус свинячої холери), овечу вірусну хворобу (BDV) і флавівіруси, наприклад, вірус лихоманки денге (DHF або DENV), вірус жовтої лихоманки (YFV), вірус західного Нілу (WNV), шоковий синдром і вірус японського енцефаліту (Moennig et al., Adv. Vir. Res. 1992, 41:53-98; Meyers, G., Thiel, H-J., Adv. In Viral Res., 1996, 47:53-118; Moennig et al., Adv. Vir. Res. 1992, 41:53-98; S.B. Halstead, Rev. Infect. Dis., 1984, 6:251-64; S.B. Halstead, Science, 1988, 239:476-81; T.P. Monath, New Engl. J. Med., 1988, 319:641-3). Індоли Деякі аналоги і похідні індолу використовувались для лікування інфекції ВІЛ. У патенті США 5 527 819 описано широкий клас сполук загальної формули (III): де визначення змінних X, Y, Z, R і R є широкими і охоплюють близько сотні сполук. У більшості прикладів Y є SO2, Z є -C(O)NH2 і R, як варіант, є заміщеним фенілом. У патенті США 5 124 327 клас, як варіант, заміщених сульфонілфеніл-індольних сполук. Як вважають, ці сполуки є активними як інгібітори зворотної транскриптази і тому можуть бути використані у лікуванні ВІЛ інфекції і СНІД. У патенті США 6 710 068 описано клас феніліндолів, заміщених щонайменше двома компонентами (не гідрогенами) на фенільному кільці або бензильному кільці індольної функції або на обох кільцях. Замісники взагалі знаходяться у позиціях 3" і 5" (на фенільному кільці) і у позиціях 4' і 5'; 5' і 6' або 5' і 7' (на бензильному кільці) індольного компоненту (див. також публікацію РСТ WO 02/083126). У публікації РСТ WO 2004/014364 описано інший клас феніліндолів з підвищеною анти-ВІЛ активністю. Як і їх попередники, ці сполуки заміщені щонайменше двома компонентами, відмінними від гідрогену на фенільному або бензокільці індольної функції, або на обох кільцях. Крім того, ці сполуки мають декілька замісників з карбоксамідною функціональністю у позиції-2 на індольній групі (див. Z у формулі (III)). У Idenix Pharmaceuticals описано ще один клас феніліндольних сполук, а саме, фосфофеніліндолів, які можуть бути використані у лікуванні ВІЛ і/або СНІД (US 2006/0074054 і WO 06/054182). Bristol Myers Squibb є цесіонарієм багатьох заявок на патенти і публікацій РСТ, в яких описано, як варіант, заміщені індоли, азаіндоли, піперазини і піролідин для лікування ВІЛ і/або СНІД. Див. публікації США 2004/0006090; 2004/0063746; 2003/0096825; 2003/0236277 і публікацію WO 03/068221. У WO 01/02388 описано феніліндоли, як варіант, заміщені карбаміловим замісником, корисні у лікуванні ВІЛ, СНІД, остеопороз, раків і хвороби Альцгеймера. У Warner-Lambert Company описано різні індол-тіазепінони, оксазепінони, діазепінони, бензотіофени, бензофурани і індол-2-карбоксаміди для лікування ВІЛ. (Див. U.S. 5 424 329; U.S. 5 565 446; U.S. 5 703 069 і WO 96/29077). У Shinogi & Co. описано, як варіант, заміщені похідні індолу, які є інгібіторуми вірусної інтегрази і є корисними як анти-ВІЛ ліки (публікація 2002/0019434 л; патент США 6 716 605 і патент США 6 506 787. У патенті США 5 945 440 описано клас індолкарбазоламідів для лікування різних хвороб, включаючи рак, вірусні хвороби (включаючи ВІЛ), серцеві і судинні хвороби, бронхолегеневі хвороби, запальні розлади, дегенеративні хвороби і інші хвороби. 1 UA 98775 C2 5 10 15 20 25 30 35 40 45 50 У патенті США 4 866 084 описано деякі біс-індольні алкалоїдні сполуки, які мають антивірусну і антипухлину активність, зокрема, проти HSV (симплексний вірус герпесу). У патенті США 5 935 982 описано інший клас біс-індолів, особливо корисних у лікуванні ретровірусних інфекцій, зокрема, ВІЛ. У патенті США 5 852 011 описано клас індольних похідних, заміщених гетероарильною функцією і амідною функцією. Відзначено, що ці сполуки взагалі мають антипухлинні, антивірусні і антимікробні якості. У патенті США 5 935 982 описано клас біс-індолів і їх використання у лікуванні ретровірусних інфекцій, зокрема, ВІЛ. У патенті США 5 929 114 описано клас арилтіо- і бітіобіс-ариламідних сполук, включаючи індольні похідні, які, як було відзначено, мають антибактеріальну і антивірусну активність. У патенті США 5 830 894 описано клас тріазиноіндольних похідних, які, як вважають, мають анти-пестивірусну активність, зокрема, проти BVDV. Індоли використовують у лікуванні не лише ВІЛ. У патенті США 5 981 525 описано комплекс + індолів, призначений для лікування остеопорозу, базуючись на їх здатності пригнічувати Н АТРазу остеокласту і цим знижувати ресорбцію кістки. У патенті США 6 025 390 описано іншу групу індольних похідних, а саме, похідних гетероароматичної пентадієнової кислоти також для лікування остеопорозу. У патенті США 5 489 685 описано ряд сполук, які є естерами фуро(2,3b)піридин-карбонової кислоти, придатними для лікування ВІЛ. У світлі того, що ВІЛ інфекція набула епідемічних рівнів і має трагічну дію на інфікованого реципієнта, існує гостра потреба у нових і ефективних фармацевтичних агентах для лікування цих вірусних інфекцій з низькою токсичністю. Задачею винаходу є створення сполуки, спосіб її використання і композицій для лікування реципієнта інфікованого ВІЛ або для лікування симптомів, пов'язаних з СНІД. Відповідно, у винаході запропоновано енантіомерно чисті сполуки, які можуть бути використані для лікування або відвертання вірусної інфекції, наприклад, ВІЛ у реципієнта, що потребує цього. Крім того, винахід включає фармацевтичні композиції, які включають сполуки, способи використання сполук для лікування або профілактики і способи приготування цих сполук. Як показано у прикладах нижче, активність хіральних фосфоіндольних сполук здебільшого зумовлюється одним енантіомером або стереоізомером. Крім того, деякі сполуки згідно з винаходом є потужними і селективними інгібіторами природної і ненуклеозидної зворотної транскриптази, стійкої до інгібітору (NNRTI) ВІЛ in vitro. Деякі сполуки, запропоновані тут, можуть створювати вищий генетичний бар'єр для розвитку резистентної ВІЛ порівняно з існуючими терапіями, наприклад, ефавіренцем. Одним з аспектів є чисті S-фосфоіндольні сполуки і способи їх використання для лікування або відвертання вірусної інфекції, наприклад, ВІЛ інфекції у реципієнта, що потребує цього. Ще одним з аспектів є чисті R-фосфоіндольні сполука і способи їх використання для лікування або відвертання вірусної інфекції, наприклад, ВІЛ інфекції у реципієнта, що потребує цього. Одним з аспектів винаходу є чисті фосфоіндольні сполуки формули (А) або їх фармацевтично прийнятні солі, сольвати, гідрати, естери або проліки: де, наприклад: X - гідроген; арил або гетероцикл, які можуть бути заміщені або незаміщені і можуть включати біциклічну, трициклічну або спіральну структуру; С 2-6алкеніл, С2-6алкініл або алкіл; Y - гідроген, R, O-R, NH-R або NRR; Z-OR, NHR, NRR, карбоксамід, амід, карбоксил, карбоніл, або амінокислотний залишок; 1 R - гідроген, ацил, S(O)n-R, карбоксил, карбоніл або амінокислотний залишок; 4 5 6 7 кожна з R , R , R і R є незалежно гідрогеном, С2-6алкенілом, С2-6алкінілом, арилом, гетероциклом, 0 галогеном, CN, CF3, OR, NHR, NRR або NO2; 2 UA 98775 C2 5 10 15 20 25 30 35 40 45 n дорівнює 0, 1 або 2; і кожна R є незалежно гідрогеном, алкілом, С2-6алкенілом, С2-6алкінілом, арилом або гетероциклом. У деяких втіленнях, згідно з формулою (А), X - арил або гетероцикл, С2-6алкеніл, С2-6алкініл або алкіл; і Y - гідроген, R, O-R, NH-R або NRR. Іншим аспектом винаходу є чисті фосфоіндольні сполуки формули (В) або їх фармацевтично прийнятні солі, сольвати, гідрати, естери або проліки: де, наприклад: X - гідроген; арил або гетероцикл, які можуть бути заміщені або не заміщені і можуть включати біциклічну, трициклічну або спіральну структуру; С2-6алкеніл, С2-6алкініл або алкіл; Y - гідроген, R, OR, NH-R або NRR; Z-OR, NHR, NRR, карбоксамід, амід, карбоксил, карбоніл або амінокислотний залишок; 1 R - гідроген, ацил, S(O),,-R, карбоксил, карбоніл або амінокислотний залишок; 4 5 6 7 кожна з R , R , R і R є незалежно гідрогеном, С2-6алкенілом, С2-6алкінілом, арилом, гетероциклом, галогеном, CN, CF3, OR, NHR, NRR або NO2; n дорівнює 0, 1 або 2; і кожна R є незалежно гідрогеном, алкілом, С2-6алкенілом, С2-6алкінілом, арилом або гетероциклом. У деяких втіленнях, згідно з формулою (В), X - арил або гетероцикл; С2-6алкеніл, С2-6алкініл або алкіл; і Y - гідроген, R, O-R, NH-R, або NRR. Іншим аспектом є фармацевтично прийнятні солі, сольвати, гідрати, естери і проліки цих сполуки. В іншому аспекті винахід включає фармацевтичні композиції, що містять зазначену сполуку і один або більше фармацевтично прийнятних носіїв, ексципієнтів або розріджувачів. Інший аспект включає способи лікування або відвертання ВІЛ інфекції реципієнта, що потребує цього, введенням описаних вище сполуки або фармацевтичної композиції. Іншим аспектом винаходу є спосіб перорального введення сполуки формули (А) або формули (В) для терапії або для лікування. Як показано у прикладах нижче, деякі сполуки формули (А) є перорально біосумісними з сприятливою фармакокінетикою. В іншому аспекті винахід включає способи пригнічення цитохрому Р450. Як показано у прикладах нижче, деякі сполуки, описані тут, ефективно пригнічують один або більше цитохромів Р450, включаючи цитохром Р450 3А4, цитохром Р450 2С8 і цитохром Р450 2С9. Відповідно, способи використання сполук згідно з винаходом для пригнічення цитохрому Р450, включають операцію введення цитохрому Р450 у контакт з певною кількістю описаної тут сполуки, наприклад, сполуки формули (А), що ефективно пригнічує цитохром Р450. Іншим аспектом є способи модуляції фармакокінетики ліків, метаболізованих цитохромом Р450. Ці способи включають операцію введення ліків у комбінації описаними тут сполуками, або цих сполук замість цих ліків. Ліками може бути будь-яка відома фармацевтично прийнятна молекула, яка метаболізується цитохромом Р450. У деяких втіленнях цитохромом Р450 є цитохром Р450 3А4, цитохром Р450 2С8 або цитохром Р450 2С9. Описані тут сполуки можна вводити окремо або у комбінації, або альтернативно з одним або більше іншими антивірусними агентами. Сполуки або їх композиції можуть бути використані профілактично для відвернення або уповільнення розвитку клінічної хвороби у пацієнтів, що мають анти-ВІЛ антитіло і які є позитивними до ВІЛ-антигену, або був вражений вірусом ВІЛ. Згідно з іншим аспектом, винахід включає композиції і способи лікування реципієнта, інфікованого як ВІЛ, так і гепатитом В, які включають введення чистої сполук, описаної тут, у комбінації з одним або більше агентами, ефективними для лікування гепатиту В. В іншому аспекті композиції і способи лікування реципієнта, інфікованого як ВІЛ, так і гепатитом С, 3 UA 98775 C2 5 10 15 20 25 30 35 40 45 50 55 включають введення чистої сполуки, описаної тут, у комбінації з одним або більше агентами, ефективними для лікування гепатиту С. Інший аспект стосується способів приготування сполук, описаних тут, які включають енантіомерно чисті фосфоіндольні сполуки, чисті S-фосфоіндольні сполуки, чисті Rфосфоіндольні сполуки, чисті сполуки формули (А) і чисті сполуки формули (В). У кресленнях: фіг. 1А - кристалічна структура зворотної транскриптази ВІЛ K103N/Y181C з 3фосфоіндольною сполукою формули І. фіг. 1В - схема кристалічної структури зворотної транскриптази ВІЛ K103N/Y181C з 3фосфоіндольною сполукою формули І. фіг. 2А - кристалічна структура молекули сполуки III. фіг. 2В - кристалічна структура молекули сполуки III. Наведений далі опис стосується комбінацій сполук, способів використання і фармацевтичних композицій, призначених для лікування вірусних інфекцій, зокрема, ВІЛ, у ссавців. Зокрема, описано чисті 3-фосфоіндольні сполуки, композиції, що містять ці сполуки, і способи використання цих сполук і композицій для лікування або профілактики інфекцій, включаючи інфекцію ВІЛ реципієнта. Крім того, розглядаються способи приготування чистих 3фосфоіндолів. Визначення Тут термін "чистий", застосований до хіральної сполуки, стосується енантіомеру хіральної сполуки, суттєво вільної від протилежного енантіомеру (в енантіомерному надлишку). Наприклад, чиста R-форма сполуки є суттєво вільною від S-форми сполуки і є, таким чином, в енантіомерному надлишку до S-форми. Термін "енантіомерно чистий" або "чистий енантіомер" означає, що сполука містить надлишок енантіомеру, наприклад, більше 75 %, більше 80 %, більше 85 %, більше 90 %, більше 91 %, більше 92 % (за масою), більше 93 %, більше 94 %, більше 95 %, більше 96 %, більше 97 %, більше 98 %, більше 98,5 %, більше 99 %, більше 99,2 %, більше 99,5 %, більше 99,6 %, більше 99,7 %, більше 99,8 % або більше 99,9 % (за масою) енантіомеру. У деяких втіленнях ця маса базується на повній масі сполуки, тобто всіх енантіомерів сполуки. У деяких втіленнях енантіомер може бути присутній з надлишком 30-80 % або 30-70 %, 30-60 %, 30 %, 35 %, 40 %, 45 %, 50 %, 55 % або 60 %, або з проміжними значеннями. Якщо не зазначено інше, термін "енантіомерно чистий (S)-фосфоіндол" або "(S)фосфоіндол" означає, вміст, наприклад, щонайменше приблизно 80 % (за масою) (S)фосфоіндол і щонайбільше приблизно 20 % (за масою) (R)-фосфоіндолу, щонайменше приблизно 90 % (за масою) (S)-фосфоіндолу і щонайбільше приблизно 10 % (за масою) (R)фосфоіндолу, щонайменше приблизно 95 % (за масою) (S)-фосфоіндолу і щонайбільше приблизно 5 % (за масою) (R)-фосфоіндолу, щонайменше приблизно 99 % (за масою) (S)фосфоіндолу і щонайбільше приблизно 1 % (за масою) (R)-фосфоіндолу або щонайменше приблизно 99,9 % (за масою) (S)-фосфоіндол і щонайбільше приблизно 0,1 % (за масою) (R)фосфоіндол. У деяких втіленнях ці маси базуються на повній масі сполуки, тобто всіх енантіомерів сполуки. Якщо не зазначено інше, термін "енантіомерно чистий (R)-фосфоіндол" означає вміст щонайменше приблизно 80 % (за масою) (R)-фосфоіндолу і щонайбільше приблизно 20 % (за масою) (S)-фосфоіндолу, щонайменше приблизно 90 % (за масою) (R)-фосфоіндолу і щонайбільше приблизно 10 % (за масою) (S)-фосфоіндолу, щонайменше приблизно 95 % (за масою) (R)-фосфоіндолу і щонайбільше приблизно 5 % (за масою) (S)-фосфоіндолу, щонайменше приблизно 99 % (за масою) (R)-фосфоіндолу і щонайбільше приблизно 1 % (за масою) (S)-фосфоіндолу, щонайменше приблизно 99,9 % (за масою) (R)-фосфоіндолу або щонайбільше приблизно 0,1 % (за масою) (S)-фосфоіндолу. У деяких втіленнях ці маси базуються на повній масі сполуки, тобто всіх енантіомерів сполуки. У композиціях згідно з винаходом енантіомерно чистий фосфоіндол або його фармацевтично прийнятна сіль, сольват, гідрат, естер або проліки можуть бути присутні разом з іншими активними або неактивними інгредієнтами. Наприклад, фармацевтична композиція, що містить енантіомерно чистий (S)-фосфоіндол, може містити, наприклад, приблизно 90 % ексципієнту і приблизно 10 % енантіомерно чистого (S)-фосфоіндолу. У деяких втіленнях енантіомерно чистий (S)-фосфоіндол у таких композиціях може, наприклад, включати, щонайменше приблизно 99,9 % (за масою) (S)-фосфоіндолу і щонайбільше приблизно 0,1 % (за масою) (R)-фосфоіндолу. У деяких втіленнях активний інгредієнт може бути застосований з невеликою кількістю або взагалі без носія, ексципієнта або розріджувача. 4 UA 98775 C2 5 10 15 20 25 30 35 40 45 50 55 Якщо вказано межі, то вони включають незалежно і окремо кожне значення між цими межами. Наприклад, термін " С2-10алкіл" включає незалежно кожного члена групи, наприклад, С2-10алкіл включає лінійні, розгалужені і (якщо це припустимо) циклічні С 1, С2, С3, С4, С5, С6, С7, С8, С9 і С10-алкільні функціональності. Подібним чином, як необмежуючий приклад, 1-10 % включає незалежно, 1 %, 2 %, 3 %, 4 %, 5 %, 6 %, 7 %, 8 %, 9 % і 10 %, а також внутрішні межі, наприклад, 1-2 %, 2-3 % тощо. Термін "хіральний" тут включає сполуки, які не мають спільних властивостей з їх дзеркальним відображенням. Термін "ізольований" включає композиції, що містять щонайменше 85 або 90 % (за масою), 95 %, 98 %, 99 % або 100 % (за масою), сполуки. Термін "алкіл" якщо не зазначено інше, означає насичений, лінійний, розгалужений або циклічний первинний, вторинний або третинний гідрокарбон, звичайно С2-10, і, зокрема, включає (не лише) метил, CF3, CCl3, CFCl2, CF2Cl, етил, CH2CF3, CF2CF3, пропіл, ізопропіл, циклопропіл, бутил, ізобутил, втор-бутил, t-бутил, пентил, циклопентил, ізопентил, неопентил, гексил, ізогексил, циклогексил, циклогексилметил, 3-метилпентил, 2,2-диметилбутил, і 2,3диметилбутил. Цей термін включає як заміщені, так і незаміщені алкільні групи, зокрема, галогеновані алкільні групи і навіть флуоровані алкільні групи. Необмежуючі приклади компонентів, якими алкільна група може бути заміщена, належать до групи, яку складають галоген (флуор, хлор, бром або йод), гідроксил, аміно, алкіламіно, ариламіно, алкокси, арилокси, нітро, ціано, сульфонова кислота, сульфат, фосфонова кислота, фосфат, або фосфонат, незахищені або захищені, за необхідністю (див, наприклад, Greene et al., Protected nd Groups in Organic Synthesis, John Wiley and Sons, 2 ed., 1991. Термін "нижчий алкіл", якщо не зазначено інше, стосується С 2-6 насиченої лінійної, розгалуженої або циклічної (наприклад, циклопропільної) алкільної групи, включаючи як заміщені, так і не заміщені компоненти. Терміни "алкіламіно" або "ариламіно" стосуються аміногрупи, яка має один або два алкільні або арильні замісники, відповідно. Якщо не зазначено інше, тут, якщо алкіл є придатним компонентом, то це нижчий алкіл, заміщений або незаміщений. Термін "нітро" означає -NO2; термін "сульфогідрил" означає -SH, термін "сульфоніл" означає -SO2. Терміни "алкеніл" і "алкініл" означають алкільний компонент, заміщені і не заміщені форми, де щонайменше один насичений зв'язок С-С заміщений подвійним або потрійним зв'язком. Так, С2-6алкенілом може бути вініл, аліл, 1-пропеніл, 2-пропеніл, 1-бутеніл, 2-бутеніл, 3-бутеніл, 1пентеніл, 2-пентеніл, 3-пентеніл, 4-пентеніл, 1-гексеніл, 2-гексеніл, 3-гексеніл, 4-гексеніл, або 5гексеніл. Подібним чином, С2-6алкінілом може бути етиніл, 1-пропініл, 2-пропініл, 1-бутиніл, 2бутиніл, 3-бутиніл, 1-пентиніл, 2-пентиніл, 3-пентиніл, 4-пентиніл, 1-гексиніл, 2-гексиніл, 3гексиніл, 4-гексиніл або 5-гексиніл. Термін "алкілен" включає насичений, лінійний ланцюг, дивалентний алкільний радикал формули -(СН2)n-, де n є цілим, від 1 до 10. "Алкіл", "алкокси", "алкеніл", "алкініл" тощо включають, як лінійний ланцюг, так і розгалужені групи. Однак, посилання на індивідуальний радикал, наприклад, "пропіл" включає лише цей лінійно-ланцюговий радикал, а розгалуженого ланцюгового ізомеру існує окремий термін "ізопропіл". Термін "захищений", якщо не зазначено інше, стосується груп, які додаються до атому оксигену, нітрогену, сульфуру або фосфору, щоб відвернути подальшу реакцію, або для інших цілей. Відомими є багато захисних груп для оксигену, нітрогену, сульфуру або фосфору. Термін "арил", якщо не зазначено інше, стосується будь-якого стабільного моноциклічного, біциклічного або трициклічного карбонового кільця, що має до 8 членів і щонайменше одне кільце є ароматичним згідно з правилом Гукеля 4n+2, зокрема, стосується фенілу, біфенілу або нафтилу. Цей термін включає заміщені і не заміщені компоненти. Арильна група може бути заміщена будь-яким описаним вище компонентом, включаючи (не лише) один або більше компонентів, вибраних з групи, яку складають галоген (флуор, хлор, бром або йод), гідроксил, аміно, азидо, алкіламіно, ариламіно, алкокси, арилокси, нітро, ціано, сульфонова кислота, сульфат, фосфонова кислота, фосфат або фосфонат, захищені або незахищені за потребою rd (див. Greene et al., Protective Groups in Organic Synthesis, John Wiley & Sons, 3 Ed., 1999). Термін "алкарил" або "алкіларил" стосується алкільної групи з арильним замісником або алкільної групи, приєднаної до молекули арильною групою, визначеною тут, Термін "аралкіл" або "арилалкіл" стосується арильної групи, заміщеної алкільним замісником або приєднаної до молекули алкільною групою, визначеною вище. Термін "циклоалкіл" означає кільце С3-8, 5 UA 98775 C2 5 10 15 20 25 30 35 40 45 50 55 60 включаючи (не лише) циклопропіл, циклобутил, циклопентил, циклогексил, циклогептил і циклооктил. Термін "алкокси" означає лінійну або розгалужену ланцюгову алкільну групу з приєднаним оксигеновим радикалом, яка має певну кількість карбонів або будь-яку їх кількість у певних межах, наприклад, "-О-алкіл", С1-4алкокси, метокси тощо. Термін "галоген" стосується будь-якого члена родини галогенів, зокрема, включаючи флуор, хлор, бром і йод. Термін "ацил" або "О-з'єднаний естер" включає групу формули C(O)R', де R' - лінійний, розгалужений або циклічний алкіл (включаючи нижчий алкіл), карбоксилатний залишок амінокислоти, арил, включаючи феніл, гетероарил, алкарил, араалкіл, включаючи бензил, алкоксиалкіл, включаючи метоксиметил, арилоксиалкіл, наприклад, феноксиметил; або заміщений алкіл (включаючи нижчий алкіл), арил, включаючи феніл, як варіант, заміщений хлором, бромом, флуором, йодом, С1-С4алкіл або C1-С4алкокси, сульфонатні естери, наприклад, алкіл- або аралкіл-сульфоніл, включаючи метансульфоніл, моно-, ди- або трифосфат-естер, тритил або монометокси-тритил, заміщений бензил, алкарил, аралкіл, включаючи бензил, алкоксиалкіл, включаючи метоксиметил, арилоксиалкіл, наприклад, феноксиметил. Арильні групи в естерах оптимально включають фенільну групу. У необмежуючих втіленнях ацильні групи включають ацетил, трифлуорацетил, метилацетил, циклопропілацетил, циклопропіл-карбокси, пропіоніл, бутирил, ізобутирил, гексаноїл, гептаноїлоктаноїл, нео-гептаноїл, фенілацетил, 2-ацетокси-2-фенілацетил, дифенілацетил, αметокси-α-трифлуорметил-фенілацетил, бромацетил, 2-нітро-бензолацетил, 4-хлорбензолацетил, 2-хлор-2,2-дифенілацетил, 2-хлор-2-фенілацетил, триметилацетил, хлордифлуорацетил, перфлуорацетил, флуорацетил, бромдифлуорацетил, метоксиацетил, 2тіофенацетил, хлорсульфонілацетил, 3-метоксифенілацетил, феноксиацетил, третбутилацетил, трихлорацетил, монохлор-ацетил, дихлорацетил, 7Н-додекафлуор-гептаноїл, перфлуор-гептаноїл, 7Н-додека-флуоргептаноїл, 7-хлордодекафлуор-гептаноїл, 7-хлордодекафлуор-гептаноїл, 7Н-додекафлуоргептаноїл, 7Н-додека-флуоргептаноїл, нона-флуор3,6-діокса-гептаноїл, нонафлуор-3,6-діоксагептаноїл, перфлуоргептаноїл, метоксибензоїл, метил 3-аміно-5-фенілтіофен-2-карбоксил, 3,6-дихлор-2-метокси-бензоїл, 4-(1,1,2,2тетрафлуор-етокси)-бензоїл, 2-бром-пропіоніл, омега-амінокаприл, деканоїл, n-пентадеканоїл, стеарил, 3-циклопентил-пропіоніл, 1-бензол-карбоксил, О-ацетилманделіл, півалоїлацетил, 1адамантан-карбоксил, циклогексан-карбоксил, 2,6-піридиндикарбоксил, циклопропан-карбоксил, циклобутан-карбоксил, перфлуор-циклогексил-карбоксил, 4-метилбензоїл, хлорметил ізоксазолілкарбоніл, перфлуор-циклогексил-карбоксил, кротоніл, 1-метил-1Н-індазол-3карбоніл, 2-пропеніл, ізовалерил, 1-піролідинкарбоніл, 4-фенілбензоїл. Термін "ациламіно" включає групу структури "-N(R')-C(=O)-R"', де кожна R' незалежно є такою, що була визначена вище. Термін "карбоніл" включає групу структури "-C(=O)-X-R"' або "X-C(=O)-R"', де X є О, S або зв'язком, і кожна R незалежно є такою, що була визначена вище. Термін "гетероатом" включає атом, який не є карбоном або гідрогеном, у структурі гетероциклічної сполуки. Необмежуючими прикладами є нітроген, оксиген, сульфур, фосфор або бор. Термін "гетероцикл" або "гетероциклічний, якщо не зазначено інше, включає стабільне 5-7членне моноциклічне або стабільне 8-11-членне біциклічне гетероциклічне кільце, насичене або ненасичене, включаючи гетероарил, яке складається з атомів карбону і 1-4 гетероатомів, включаючи (не лише) О, S, N і Р; і де гетероатоми нітроген і сульфуру, як варіант, можуть бути окислені і/або гетероатом нітроген кватернізовані, і включає будь-яку біциклічну групу, в якій будь-яке з визначених вище гетероциклічних кілець злите з бензольним кільцем. Гетероциклічне кільце може бути приєднане до будь-якого гетероатому або атому карбону, утворюючи стабільну структуру. Гетероароматичне кільце може бути частково або повністю гідрогеноване. Наприклад, замість піридину може бути використаний дигідропіридин. Функціональні оксигенові і нітрогенові групи на гетероарилі можуть бути захищені, якщо це необхідно або бажано. Придатні захисні групи для оксигену або нітрогену включають триметилсиліл, диметилгексилсиліл, t-бутилдиметилсиліл, t-бутилдифенілсиліл, тритил, заміщений тритил, алкіл, метан-сульфоніл, р-толуолесульфоніл, або ацильні групи, наприклад, ацетил і пропіоніл. Необмежуючими прикладами гетероарильних і гетероциклічних груп є фурил, піридил, піримідил, піридазиніл, піразиніл, піперадиніл, піперазиніл, тієніл, піроліл, піролініл, піролідиніл, імідазоліл, тетразоліл, тріазоліл, тріазиніл, тіазиніл, оксазоліл, пкриніл, карбазоліл, хінолініл, піразоліл, морфолініл, бензімідазоліл тощо. Будь-який з гетероароматичних і гетероциклічних 6 UA 98775 C2 5 10 15 20 25 30 35 40 45 50 компонентів може бути, як варіант, заміщений, як описано вище для арилу, включаючи заміщення одним або більше гідроксилами, аміно, алкіламіно, ариламіно, алкокси, арилокси, алкілом, гетероциклілом, галогеном, карбокси, ацилом, ацилокси, амідо, нітро, ціано, сульфоновою кислотою, сульфатом, фосфоновою кислотою, фосфатом або фосфонатом, захищеними або незахищеними (див., наприклад, Greene et al., Protective Groups in Organic Synthesis, John Wiley і Sons, Third Ed., 1999). Термін "аміно", якщо не зазначено інше, включає компонент структури "-NR2" і включає первинні, вторинні і третинні аміни, як варіант, заміщені алкільними, арильними, гетероциклільними і/або сульфонільними групами. Отже, R2 може репрезентувати два атоми гідрогену, два алкільні компоненти або один гідроген і один алкільний компонент. Термін "амінокислота" або "амінокислотний залишок" включає природні і синтетичні α, β, γ або δ амінокислоти, включаючи (не лише), амінокислоти, що знаходяться у протеїнах, тобто гліцин, аланін, валін, лейкін, ізолейкін, метіонін, фенілаланін, триптофан, пролін, серин, треонін, цистеїн, тирозин, аспарагін, глютамін, аспартат, глютамат, лізин, аргінін і гістидин. В одному з втілень амінокислота є у Е-конфігурації, але може бути використана у D-конфігурації. В іншому варіанті амінокислота може бути похідною аланіл, валініл, лейцинілу, ізолецинілу, пролінілу, фенілаланінілу, триптофанілу, метіонінілу, гліцинілу, серинілу, треонінілу, цистеїнілу, тирозинілу, аспарагінілу, глютамінілу, аспартоїлу, глютароїл, лізинілу, аргінінілу, гістидинілу, Раланілу, Р-валінілу, Р-лейцинілу, Р-ізолейцинілу, Р-пролінілу, Р-фенілаланінілу, Ртриптофанілу, Р- метіонінілу, Р-гліцинілу, Р-серинілу, Р-треонінілу, Р-цистеїнілу, Р-тирозинілу, Р- аспарагінілу, Р-глютамінілу, р-аспартоїлу, Р-глютароїлу, Р-лізинілу, Р-аргінінілу або Ргістидинілу. При використанні терміну амінокислота, це вважається конкретним і незалежним описом кожного з естерів α-, β-, γ- або δ-гліцину, аланіну, валіну, лейкіну, ізолейкіну, метіоніну, фенілаланіну, триптофану, проліну, серину, треоніну, цистеїну, тирозину, аспарагіну, глютаміну, аспартату, глютамату, лізину, аргініну і гістидину у D- і L-конфігураціях. Термін "амід" включає аміно-заміщений карбоніл, а термін "амідин" означає групу структури "-C(=NH)-NH2". Деякі сульфуро- і фосфоро-вмісні терміни мають такі структурні значення: "сульфонат" включає групу структури "-S(=O)(=O)-OR"'; "сульфат" включає групу структури "O-S(=O)(=O)OR"'; "сульфонамід" включає групу структури "N(R')-S(=O)(=O)-R"'; "сульфамоїл" включає групу структури "-S(=O)(=O)-N(R')(R')"; "фосфорил" включає групу структури "-P(=O)-OR"'; і "фосфорамідат" включає групу структури "O-P(NR1R2)(=O)-OR'", де кожна R' є незалежно такою, що була визначена вище. Термін "реципієнт" тут стосується одно- або багатокліткового організму, в якому можливою є реплікація вірусу, включаючи клітинні лінії і тварин, і, у деяких випадках, людину. В іншому варіанті реципієнт може бути носієм частини вірусного геному ВІЛ, реплікація якого або функції можуть бути змінені сполуками винаходу. Термін реципієнт, зокрема, стосується інфікованих клітин, трансфектованих повним або частиною геному ВІЛ, у тварин, зокрема, приматів (включаючи шимпанзе) і людини. У більшості тваринних застосувань винаходу реципієнтом є людина-пацієнт. У деяких випадках винахід може знайти застосування у ветеринарії (наприклад, для шимпанзе). Термін "заміщений" включає декілька рівнів заміщення одним або більше іменованими замісниками, наприклад, галогеном, гідроксилом, тіо, алкілом, алкенілом, алкінілом, нітро, ціано, азидо, аміно, карбоксамідо тощо. Якщо можливим є множинне заміщення, сполука може бути заміщено одним або більше зазначених заміщуючих груп, незалежних одна від одної. Сполуки У деяких втіленнях запропоновано чисті сполуки формули (А) або їх фармацевтично прийнятні солі, сольвати, гідрати, естери або проліки: де, наприклад: 7 UA 98775 C2 5 10 15 20 25 30 35 40 45 X - гідроген; арил або гетероцикл, які можуть бути заміщені або незаміщені і можуть включати біциклічну, трициклічну або спіральну структуру; С 2-6алкеніл, С2-6алкініл або алкіл; Y - гідроген, R, O-R, NH-R або NRR; Z-OR, NHR, NRR, карбоксамідо, амідо, карбоксил, карбоніл або амінокислотний залишок; 1 R - гідроген, ацил, S(O)n-R, карбоксил, карбоніл або амінокислотний залишок; 4 5 6 7 кожна з R , R , R і R є незалежно гідрогеном, С2-6алкеніл, С2-6алкініл, арилом, гетероциклом, галогеном, CN, CF3, OR, NHR, NRR або NO2; n дорівнює 0, 1 або 2; і кожна R є незалежно гідрогеном, алкілом, С2-6алкеніл, С2-6алкініл, арилом або гетероциклом. У деяких втіленнях, згідно з формулою (А), X - арил або гетероцикл; С2-6алкеніл, С2-6алкініл або алкіл; і Y - гідроген, R, O-R, NH-R, або NRR. 4 5 У деяких втіленнях, згідно з формулою (A), R і R є незалежно гідрогеном або галогеном, і 1 6 7 X, Y, Z, R , R , R і R є такими, що були визначені вище. У деяких втіленнях формули (А): 4 5 кожна з R , R є незалежно гідрогеном або галогеном; 6 7 R ' і R ' є гідрогеном; 1 R є гідрогеном або S(O)n-R; Y є гідрогеном, R або O-R; X є, як варіант, заміщеним арилом; Z - карбоксамідо, амідо, карбоксил або карбоніл; n дорівнює 0, 1 або 2; і кожна R є незалежно гідрогеном або алкілом. У деяких втіленнях використано чисті сполуки формули (С), або їх фармацевтично прийнятні солі, сольвати, гідрати, естери або проліки: 2 3 4 5 6 де R , R , R , R і R є незалежно гідрогеном, галогеном, алкілом або С 2-6алкенілом; 4 5 R і R є незалежно гідрогеном або галогеном; 6 7 R ' і R ' є гідрогеном; 1 R - гідроген або S(O)n-R; Y - гідроген, R або О-R; Z - карбоксамідо, амідо, карбоксил або карбоніл; n дорівнює 0, 1 або 2; і кожна R є незалежно гідрогеном або алкілом. У деяких втіленнях формули (С): 4 5 R ", R " є незалежно алкілом або С2-6алкенілом, кожний з яких незалежно може, як варіант, бути заміщений CN або галогеном; 2 4 6 R ', R " і R " є гідрогеном; 4 5 кожна з R , R є незалежно гідрогеном або галогеном; 6 7 R і R є гідрогеном; 1 R - гідроген або S(O)n-R; Y - гідроген, R або O-R; Z - карбоксамідо, амідо, карбоксил або карбоніл; n дорівнює 0, 1 або 2; і кожна R є незалежно гідрогеном або алкілом. У деяких втіленнях формули (С): 3 5 R і R є незалежно алкілом або С2-6алкенілом, кожний з яких незалежно може, як варіант, бути заміщений CN або галогеном; 2 4 6 R , R " і R " - гідроген; 4 5 кожна з R і R є незалежно гідрогеном або галогеном; 8 UA 98775 C2 6 5 10 15 20 25 7 R і R є гідрогеном; 1 R - гідроген; Y-O-R; Z - амідо, карбоксил або карбоніл; і кожна R є незалежно гідрогеном або алкілом. В одному з втілень використано чисту сполуку або її фармацевтично прийнятні солі, сольвати, гідрати, естери або проліки: де абсолютною конфігурацією на атомі фосфору є R. Хімічна назва сполуки І - (2-карбамоїл5-хлор-4-флор-1Н-індол-3-іл)-[3-((Е)-2-ціано-вініл)-5-метил-феніл]-(R)-фосфінової кислоти метил-естер, а емпірична формула - C20H16CIFN3O3P з молекулярною масою 431,78. В одному з втілень використано чисту сполуку або її фармацевтично прийнятну сіль, сольват, гідрат, естер або проліки: де абсолютною конфігурацією на атомі фосфору є S. Хімічна назва сполуки III - (2карбамоїл-5-хлор-1Н-індол-3-іл)-[3-((Е)-2-ціано-вініл)-5-метил-феніл]-(R)-фосфінової кислоти метил-естер, а емпірична формула - C20H17CIN3O3P з молекулярною масою 413,79. В одному з втілень використано чисту сполуку, вибрану з групи, яку складають: (2-карбамоїл-5-хлор-11Н-індол-3-іл)-[3-((Е)-2-ціано-вініл)-5-метил-феніл]-(R)-фосфінової кислоти метил-естер; і (2-карбамоїл-5-хлор-4-флуор-1Н-індол-3-іл)-[3-((Е)-2-ціано-вініл)-5-метил-феніл]-(R)фосфінової кислоти метил-естер, або їх фармацевтично прийнятна сіль, сольват, гідрат, естер або проліки. У деяких втіленнях використано чисті сполуки формули (В) або їх фармацевтично прийнятні сіль, сольват, гідрат, естер або проліки: де, наприклад: X - гідроген; арил або гетероцикл, які можуть бути заміщені або незаміщені і можуть включати біциклічні, трициклічні або спіральні структури; С 2-6алкеніл, С2-6алкініл або алкіл; Y - гідроген, R, O-R, NH-R, або NRR; 9 UA 98775 C2 5 10 15 20 Z-OR, NHR, NRR, карбоксамідо, амідо, карбоксил, карбоніл або амінокислотний залишок; 1 R - гідроген, ацил, S(O)n-R, карбоксил, карбоніл, або амінокислотний залишок; 4 5 6 7 кожна з R , R , R і R є незалежно гідрогеном, С2-6алкеніл, С2-6алкінілом, арилом, гетероциклом, галогеном, CN, CF3, OR, NHR, NRR або NO2; n дорівнює 0, 1 або 2; і кожна R є незалежно гідрогеном, алкілом, С2-6алкеніл, С2-6алкінілом, арилом або гетероциклом. У деяких втіленнях формули (В) X - гідроген; арил або гетероцикл; С2-6алкеніл, С2-6алкініл або алкіл; і Y - гідроген, R, O-R, NH-R або NRR. 4 5 1 У деяких втіленнях формули (В) R і R є незалежно гідрогеном або галогеном, а X, Y, Z, R , 6 7 R , R і R є такими, що були визначені вище. У деяких втіленнях формули (В): 4 5 кожна з R і R є незалежно гідрогеном або галогеном; 6 7 R ' і R ' є гідрогеном; 1 R - гідроген або S(O)n-R; Y - гідроген, R, або O-R; Z - карбоксамідо, амідо, карбоксил або карбоніл; n дорівнює 0, 1 або 2; і кожна R є незалежно гідрогеном або алкілом. У деяких втіленнях використано чисті сполуки формули (D) або їх фармацевтично прийнятні сіль, сольват, гідрат, естер або проліки: 2 25 30 35 40 45 3 4 5 6 де R , R , R , R і R є незалежно гідрогеном, галогеном, алкілом або С 2-6алкенілом; 4 5 R і R є незалежно гідрогеном або галогеном; 6 7 R і R є гідрогеном; 1 R - гідроген або S(O)n-R; Y - гідроген, R або O-R; Z - карбоксамідо, амідо, карбоксил або карбоніл; n дорівнює 0, 1 або 2; і кожна R є незалежно гідрогеном або алкілом. У деяких втіленнях формули (D): 3 5 R " і R " є незалежно алкілом або С2-6алкенілом, які можуть, як варіант, бути заміщені CN або галогеном; 2 4 6 R ", R " і R " є гідрогеном; 4 5 кожна з R і R є незалежно гідрогеном або галогеном; 6 7 R і R є гідрогеном; 1 R є гідрогеном або S(O)n-R; Y є гідрогеном, R або O-R; Z - карбоксамідо, амідо, карбоксил або карбоніл; n дорівнює 0, 1 або 2; кожна R є незалежно гідрогеном або алкілом. У деяких втіленнях формули (D): 3 5 R " і R " є незалежно алкілом або С2-6алкенілом, які можуть, як варіант, бути заміщені CN або галогеном; 2 4 6 R , R і R є гідрогеном; 4 5 кожна з R і R є незалежно гідрогеном або галогеном; 6 7 R і R є гідрогеном; 1 R - гідроген; Y-O-R; 10 UA 98775 C2 Z - амідо, карбоксил або карбоніл; і кожна R є незалежно гідрогеном або алкілом. В одному з втілень використано чисту сполуку, або її фармацевтично прийнятні сіль, сольват, гідрат, естер або проліки: 5 10 15 20 25 30 35 де абсолютною конфігурацією на атомі фосфору є S. В одному з втілень використано чисту сполуку або її фармацевтично прийнятні сіль, сольват, гідрат, естер або проліки: де абсолютною конфігурацією на атомі фосфору є S. В одному з втілень використано чисту сполуку, вибрану з групи, яку складають: (2-карбамоїл-5-хлор-1Н-індол-3-іл)-[3-((Е)-2-ціано-вініл)-5-метил-феніл]-(5)-фосфінової кислоти метил-естер; і (2-карбамоїл-5-хлор-4-флуор-1Н-індол-3-іл)-[3-((Е)-2-ціано-вініл)-5-метил-феніл]-(S)фосфінової кислоти метил-естер, або їх фармацевтично прийнятна сіль, сольват, гідрат, естер або проліки. У деяких втіленнях сполука формули (A)-(D) або (I)-(IV) є енантіомерно чистою сполукою або її фармацевтично прийнятною іллю, сольватом, гідратом, естером або проліками. У деяких втіленнях сполука згідно з (A)-(D) або (I)-(IV) є енантіомерно чистою сполукою або її фармацевтично прийнятною сіллю. У деяких втіленнях енантіомерно чиста сполука включає щонайменше приблизно 80 % (за масою) зазначеного енантіомеру і щонайбільше приблизно 20 % (за масою) іншого енантіомеру або інших стереоізомерів, щонайменше приблизно 90 % (за масою) зазначеного енантіомеру і щонайбільше приблизно 10 % (за масою) іншого енантіомеру або інших стереоізомерів, щонайменше приблизно 95 % (за масою) призначеного енантіомеру і щонайбільше приблизно 5 % (за масою) іншого енантіомеру або інших стереоізомерів, щонайменше приблизно 96,6 % (за масою) зазначеного енантіомеру і щонайбільше приблизно 3,4 % (за масою) іншого енантіомеру або інших стереоізомерів, щонайменше приблизно 97 % (за масою) зазначеного енантіомеру і щонайбільше приблизно 3 % (за масою) іншого енантіомеру або інших стереоізомерів, щонайменше приблизно 99 % (за масою) зазначеного енантіомеру і щонайбільше приблизно 1 % (за масою) іншого енантіомеру або інших стереоізомерів, або щонайменше приблизно 99,9 %> (за масою) зазначеного енантіомеру і щонайбільше приблизно 0,1 % (за масою) іншого енантіомеру або інших стереоізомерів. У деяких втіленнях маси базуються на повній масі сполуки. Винахід також включає сполуки, які можуть бути сіллю, естером або пролікам і які після введення реципієнту утворюють прямо або непрямо сполуку згідно з винаходом або таку, що виявляє бажану активність. Фармацевтично прийнятні солі, проліки, стереоізомери і таутомери 11 UA 98775 C2 5 10 15 20 25 30 35 40 45 50 55 60 Сполуку згідно з винаходом можна вводити як будь-яку сіль або проліки, які після введення реципієнту є здатними утворювати прямо або непрямо первісну сполуку або виявляти активність самі. Необмежуючими прикладами фармацевтично або фізіологічно прийнятні солі. Термін "фармацевтично або фізіологічно прийнятна сіль або проліки" описує будь-яку фармацевтично прийнятну форму (наприклад, естер, амід, сіль естеру, сіль амідної або спорідненої групи) сполуки, яка після введення пацієнту, утворює активну сполуку винаходу. Такі модифікації можуть впливати на біологічну активність сполук, яка у деяких випадках перевищує активність первісної сполуки. Термін "фармацевтично прийнятна сіль" стосується ситуації, коли сполука несе фармацевтично прийнятний контріон, і сіль виявляє біологічну активність зазначеної сполуки з мінімальною токсичністю. Такі солі є нетоксичними терапевтично корисними формами сполук винаходу. Сюди може бути включена будь-яка сіль, що має бажану біологічну активність або виявляє мінімальну токсичність або взагалі не має її. Фармацевтично прийнятні солі включають солі фармацевтично прийнятних органічних або неорганічних кислот і основ. Фармацевтично неприйнятні кислоти і основи також можуть знайти застосування, наприклад, у синтезі і/або очищенні бажаних сполук. Отже, всі такі "солі" можуть бути включені у винахід. Фармацевтично прийнятні солі включають солі фармацевтично прийнятних неорганічних або органічних основ і кислот, включаючи тозилат, метансульфонат, ацетат, цитрат, малонат, тартрат, сукцинат, бензоат, аскорбат, альфа-кетоглютарат, альфа-гліцерофосфат, формат, фумарат, пропіонат, гліколат, лактат, піруват, оксалат, малеат, саліцилат, сульфат, сульфонат, нітрат, бікарбонат, гідробромат, гідробромід, гідройодид, карбонат і солі фосфорної кислоти. Бажаним втіленням є моно- або дигідрохлоридна сіль. Придатними є солі, отримані з лужних металів, наприклад, калію і натрію, лужноземельних металів, наприклад, кальцію і магнію, і кислот, добре відомих у фармацевтиці. Фармацевтично прийнятними проліками є сполуки, що метаболізуються, наприклад, гідролізуються або окислюються, у реципієнті з утворенням сполуки винаходу. Типовими прикладам проліків є сполуки, що мають біологічно лабільні захисні групи на функціональному компоненті активної сполуки, включаючи (не лише) естерний або ацильний компонент. Проліки включають сполуки, які можуть бути окислені, відновлені, аміновані, деаміновані, гідроксиловані, дегідроксиловані, гідролізовані, дегідролізовані, алкіловані, деалкіловані, ациловані, деациловані, фосфориловані, дефосфриловані з отриманням активної сполуки. Фармацевтично прийнятні солі можуть бути отримані за стандартними процедурами, наприклад, реакцією достатньо основної сполуки, наприклад, аміну, з придатною кислотою для отримання фізіологічно прийнятного аніону. Лужний метал (наприклад, калій, натрій або літій) або лужно-земельний метал (наприклад, кальцій) може дати сіль також з карбоновими кислотами. Необмежуючі приклади придатних солей включають солі неорганічних кислот, наприклад, гідрохлорної, гідробромної, сульфурової, фосфорної, нітрокислоти, бікарбонової кислоти, карбонової кислоти; і солі органічних кислот, наприклад, наприклад, мурашиної, оцтової, оксалінової, виннокам'яної, бурштинової, малонової, аскорбінової, лимонної, бензойної, танінової, пальмонової, альгінінової, поліглютамінової, тозикової, метансульфонової, нафталінсульфонової, нафталіндисульфонової, α-кетоглютаринової, α-гліцерофосфорної і полігалактуронової кислоти. Придатні солі включають солі лужних металів, наприклад, літію, калію і натрію, лужно-земельних металів, наприклад, кальцію і магнію, а також інших основ, відомих у фармацевтиці. Інші придатні солі включають солі з катіонами металу, наприклад, цинку, вісмуту, барію або алюмінію, або катіоном аміну, наприклад, амонієм, N, Nдибензилетилен-діаміном, D-глюкозаміном, тетраетиламонієм або етилендіаміом. Крім того, придатні солі включають солі, отримані з комбінаціями кислот і основ, наприклад, танат цинку. Фармацевтично прийнятними проліками є сполуки, які метаболізуються (тобто гідролізуються або окислюються) у реципієнті з утворенням сполуки винаходу. Типовими прикладами проліків є сполуки, які мають біологічно лабільні захисні групи на функціональному компоненті активної сполуки. Проліки включають сполуки, які можуть бути окислені, відновлені, аміновані, деаміновані, гідроксиловані, дегідроксиловані, гідролізовані, дегідролізовані, алкіловані, деалкіловані, ациловані, деациловані, фосфориловані, дефосфориловані з отриманням активної сполуки. В одному з втілень сполуки згідно з винаходом мають антивірусну активність проти ВІЛ або метаболізуються до сполуки, що має таку активність. Способи лікування В одному з втілень запропоновано способи лікування або профілактики ВІЛ у реципієнта, які включають введення антивірусно ефективної кількості сполуки, описаної тут, включаючи 12 UA 98775 C2 5 10 15 20 25 30 35 40 45 50 55 60 сполуки формул A-D або сполуки I-IV, або їх фармацевтично прийнятну сіль, естер або проліки. Сполуки можуть бути об'єднані з фармацевтично прийнятним носієм або розріджувачем. В іншому важливому втіленні, описаному тут, запропоновано використання сполук формул A-D або I-IV, або їх фармацевтично прийнятної солі, естеру або проліків у лікуванні або профілактиці ВІЛ у реципієнта, як варіант, у комбінації фармацевтично прийнятним носієм або розріджувачем. Винахід включає також використання сполуки, описаної тут, або її фармацевтично прийнятної солі, естеру або проліків, у виготовленні медикаменту для лікування або профілактики ВІЛ у реципієнта, як варіант, у комбінації фармацевтично прийнятним носієм або розріджувачем. В одному з втілень запропоновано спосіб лікування або профілактики ВІЛ у реципієнта, який включає введення 3-фосфоіндольної сполуки, суттєво у формі одного енантіомеру, або її фармацевтично прийнятної солі, естеру або проліків, як варіант, у комбінації з фармацевтично прийнятним носієм реципієнту, що потребує цього. В одному з втілень, 3-фосфоіндол має формулу А. В іншому втілені ця сполука має формулу В. В одному з втілень 3-фосфоіндол має формулу С. В одному з втілень 3-фосфоіндол має формулу D. В одному з втілень 3фосфоіндол має формулу І, де абсолютною стереохімією на фосфорі є S. В іншому втіленні 3фосфоіндол має формулу II, з абсолютною R-стереохімією. 3-фосфоіндол може мати формулу III, з абсолютною S-стереохімією. В іншому втіленні 3-фосфоіндол має формулу IV з абсолютною стереохімією S. В іншому втіленні реципієнт може бути діагнозований вимірюванням титрів анти-ВІЛ антитіл у крові. В іншому втіленні сполуки вводять для послаблення або відвертання симптомів СНІД у реципієнта. У ще одному втіленні сполуки згідно з винаходом вводять реципієнту, що ризикує інфікуватись ВІЛ. В іншому втіленні активна сполука виявляє активність проти резистентної до ліків форми ВІЛ і викликає зниження перехресної резистентності до сучасної схваленої антивірусної терапії. Термін "активність проти резистентної до ліків форми ВІЛ" означає, що сполука (або її проліки або її фармацевтично прийнятна сіль) є активною проти мутантного штаму з показником концентрації ІК50, наприклад, менше приблизно 50, 25, 10 або 1 мМ. В одному з втілень ненуклеозидий інгібітор зворотної транскриптази (NNRTI) показує ІК (у молярній концентрації) проти мутантного штаму ВІЛ менше приблизно 5, 2,5, 1 або 0,1 мМ. В одному з необмежуючих втілень мутантний штам ВІЛ має мутацію зворотної транскриптази у лізині 103 → аспарагін і/або тирозин 181 → цистеїн. Сполуки згідно з винаходом можуть бути оцінені на їх здатність пригнічувати активність зворотної транскриптази in vitro згідно з стандартними способами скринінгу. Спектр активності, що виявляється будь-якою сполукою, визначають оцінюванням сполуки у кількісному аналізи, описаному тут, або в іншому підтверджуючому аналізі, відомому фахівцям з анти-ВІЛ сполук. Такі сполуки можуть мати ІК50 менше 10-15 мкМ. В одному з втілень ефективність 3-фосфоіндолів виміряють за допомогою специфічного до ВІЛ ензимного імуносорбентного аналізу р24 EL1SA. Ефективність ліків репрезентують як % пригнічення ВІЛ антигеном р24 у цьому швидкому і чутливому аналізі. У схожому втіленні, корисному для конкретних експериментів, ефективність анти-ВІЛ сполуки визначають "аналізом на зниження бляшок", який виміряє концентрацію сполуки, необхідну для зниження кількості бляшок вірусу in vitro більш, ніж на 50 % (тобто ІК50 сполуки). У деяких втіленнях сполука показує ІК50 менше 15 мкм або 10 нМ in vitro. Комбінована або переміжна терапія У деяких втіленнях індольну сполуку вводять у комбінації і/або переміжно з одним або більше іншими анти-ВІЛ агентами. В іншому втіленні введення двох або більше анти-ВІЛ агентів породжує синергічну дію при пригніченні ВІЛ. В іншому втіленні введення двох або більше таких агентів у комбінації і/або переміжно створює додаткове пригнічення реплікації ВІЛ. У деяких втіленнях індольну сполуку вводять у комбінації і/або переміжно з одним або більше анти-HBV (вірус гепатиту В) або одним або більше анти-HCV (вірус гепатиту С) агентами. Наприклад, у деяких втіленнях, індольну сполуку можна вводити реципієнту, інфікованому одночасно ВІЛ і HBV у комбінації з агентом, ефективним у лікуванні HBV, яким може бути будь-який відомий агент, описаний тут. У деяких втіленнях індольну сполуку можна вводити реципієнту, інфікованому ВІЛ і HCV у комбінації з агентом, ефективним у лікуванні HCV, яким може бути будь-який відомий агент, описаний тут. У деяких втіленнях індольну сполуку вводять у комбінації і/або переміжно з одним або більше агентами, що метаболізуються монооксигеназою цитохрому Р450. Таким агентом може бути будь-який відомий фахівцям агент, здатний метаболізуватись монооксигеназою цитохрому 13 UA 98775 C2 5 10 15 20 25 30 35 40 45 50 55 60 Р450. У деяких втіленнях цитохром Р450 є цитохромом Р450 3А4, цитохромом Р450 2С8 або цитохромом Р450 2С9. У комбінованій терапії, ефективні дози двох або більше агентів вводять разом, а при переміжній терапії такі дози вводять послідовно. Дози залежать від абсорбці, дезактивації і швидкості екскреції ліків, а також від інших факторів, відомих фахівцям. Дози також залежить від важкості стану. У будь-якому випадку режим і розклад введення доз мають коригуватись з часом згідно з потребами і індивідууму і професійними міркуваннями особи, що спостерігає за лікуванням і введенням композицій. Резистентність до ліків найчастіше викликається мутацією гену, який кодує ензим, що бере участь вірусному циклі реплікації. Було показано, що ефективність анти-ВІЛ ліків може бути продовжена, підсилена або відновлена введенням сполуки у комбінації або переміжно з другою і, можливо, третьою антивірусною сполукою, що викликає інші форми мутації, відмінні від вибраної для головних ліків. Такі комбінації одночасно знижують можливість резистентності до будь-яких одиночних ліків і будь-якої супутньої токсичності. В іншому варіанті фармакокінетика, біорозподілення або інші параметри ліків можуть бути змінені такою комбінованою або переміжною терапією. Наприклад, використання комбінації ліків може дозволити знизити дозу індивідуальних ліків у цій комбінації порівняно з дозами індивідуального введення цих ліків. Подібним чином, коли комбінують ліки, спрямовані на різні стадії вірусного життєвого циклу, існує можливість підсилення їх дії. Крім того, використання комбінацій ліків може знизити або усунути небажані побічні ефекти одиночних ліків з збереженням антивірусної активності. Взагалі комбінаційна терапія звичайно є більш бажаною, ніж переміжна. Оскільки створює множинний одночасний тиск на вірус. Агенти HCV Інтерферони (IFN) для лікування хронічного гепатиту були у продажу протягом майже декади і утворюють основу сучасної терапії HCV. IFN є глікопротеїнами, що виробляються імунними клітинами у відповідь на вірусні інфекції. Вони пригнічують реплікацію багатьох вірусів, включаючи HCV, і при використанні як єдиного лікування гепатиту С IFN можуть іноді пригнітити сироватку HCV-PHK до непомітного рівня. Крім того, IFN можуть нормалізувати рівні амінотрансферази сироватки. На жаль, дія IFN є тимчасовою, і постійна реакція спостерігається лише у 8-9 % пацієнтів, хронічно інфікованих HCV (Gary L. Davis, Gastroenterology, 2000, S104S114). Однак більшість пацієнтів важко переносять лікування інтерфероном, яке викликає у них важкі грипоподібні симптоми, втрату ваги і зниження життєвого тонусу. У багатьох патентах описано Flaviridae, включаючи HCV, лікування, базоване на використанні інтерферонній терапії. Наприклад, у патенті США 5 980 884 описано способи повторного лікування пацієнтів, вражених HCV, з використанням загальновизнаного інтерферону. У патенті США 5 942 223 описано анти-HCV терапія з використанням овечого або бичачого інтерферону-тау. У патенті США 5 928 636 описано комбіновану терапію інтерлейкіном-12 і інтерфероном-альфа для лікування інфекційних хвороб, включаючи HCV. У патенті США 5 849 696 описано використання тимозинів, окремо або у комбінації з інтерфероном для лікування HCV. У патенті США 5 830 455 описано комбіновану терапію HCV з використанням інтерферону і поглинача вільних радикал. У патенті США 5 738 845 описано використання протеїнів людського інтерферону-тау для лікування HCV. Інші базовані на інтерфероні терапії для HCV описано у патентах США 5 676 942 і 5 372 808. У ряді патентів описано також регульовані форми інтерферонів і їх використання, наприклад, у патентах США 5 747 646; 5 792 834 і 5 834 594; у РСТ WO 99/32139 і WO 99/32140; у WO 95/13090 і патентах США 5 738 846, 5 711 944 і 5 908 621. Інтерферон альфа-2а і інтерферон альфа-2b схвалені для одиночного застосування у лікуванні HCV. ROFERON®-A від Roche є рекомбінантною формою інтерферону альфа-2а. PEGASYS® від Roche є пегільованою або модифікованою поліетиленгліколевою формою інтерферону альфа-2а. 1NTRON® А від Schering Corporation є рекомбінантною формою інтерферону альфа-2b, a PEG-1NTRON® від Schering Corporation є пегільованою формою інтерферону альфа-2b. Наразі вивчається можливість використання інших форм інтерферону альфа, а також інтерферонів бета, гамма, тау і омега для лікування HCV. Прикладами є 1NFERGEN, інтерферон альфасон-1 від InterMune; OMNIFERON, природний інтерферон від Viragen; ALBUFERON від Human Genome Sciences; REBIF, інтерферон бета-ла від Ares-Serono; Omega Interferon від BioMedicine; Oral Interferon Alfa від Amarillo Biosciences; і інтерферони гамма, тау і гамма 1-b від InterMune. Рибавірин (І-Р-D-рибофуранозил-1-1,2,4-тріазоліл-3-карбоксамід) є синтетичним неінтерферонним препаратом, який є антивірусним нуклеозидним аналогом широкого спектру і 14 UA 98775 C2 th 5 10 15 20 25 30 35 40 45 50 55 є у продажу під назвою Віразол (Merck Index, 11 Ed., 1989, Editor: Budavari, S., Merck & Co., Inc., Rahway, NJ; p. 1304). Див. патент США 3 798 209 і RE29 835. Структурно рибавірин є подібним до, гуанозин і має in vitro активність проти декількох ДНК і РНК вірусів, включаючи Flaviviridae (Gary L. Davis, 2000, Gastroenterology, 77S:S104-S114). Рибавірин знижує рівні амінотрансферази сироватки до норми у 40 % пацієнтів, але не знижує рівнів HCV-PHK (Gary L. Davis, 2000, Gastroenterology, 77#:S104-S1 14). Отже, рибавірин як такий не є ефективним для зниження рівнів вірусної РНК. Крім того, рибавірин має значну токсичність і може викликати анемію. Його не рекомендують для монотерапії проти HCV, але вважають корисним у комбінації з інтерфероном альфа-2а або інтерфероном альфа-2b для лікування HCV. Поточним стандартом лікування хронічного гепатиту С є комбінована терапія з альфа інтерфероном і рибавірином. Дослідження показали, що більше пацієнтів з HCV краще реагують на пегільовану інтерферон-альфа/рибавіринову комбіновану терапію, ніж на терапію з непегільованим інтерфероном альфа. Однак, як і при монотерапії, під час комбінованої терапії виникають побічні явища, включаючи гемоліз, грипоподібні симптоми, анемію і виснаження (Gary L. Davis, 2000, Gastroenterology, 77S:S104-S114). Комбіновану терапію з PEG-1NTRON® (пегінтерферон альфа-2b) і капсулами REBETOL® (Ribavirin, USP) можна отримати від Schering Corporation. REBETOL® від Schering Corporation також рекомендують у комбінації з 1NTRON® А (рекомбінантний інтерферон альфа-2b від Schering Corporation). PEGASYS® від Roche (пегільований інтерферон альфа-2а) і COPEGUS® (рибавірин) рекомендують для лікування HCV. У РСТ WO 99/59621, WO 00/37110, WO 01/81359, WO 02/32414 і WO 03/024461 описано використання пегільованого інтерферону альфа і рибавірину у комбінованій терапії для лікування HCV. У РСТ WO 99/15194, WO 99/64016 і WO 00/24355 описано комбіноване використання пегільованого інтерферону альфа і рибавірину проти HCV. Продовжується розробка нових антивірусних агентів для лікування інфекцій Flaviviridae, зокрема інфекцій гепацивірусу HCV. Вивчаються інгібітори породжених HCV ензимів, наприклад, протеази, гелікази і полімерази. Розробляються ліки, що пригнічують певні стадії реплікації HCV, а також ліки, що блокують продукування антигенів HCV з РНК (інгібітори 1RES), ліки, що відвертають нормальний розвиток протеїнів HCV (інгібітори глікозування), ліки, що блокують проникнення вірусу HCV у клітину, наприклад, блокуванням його рецепторів і неспецифічні цитопротекторні агенти, які блокують пошкодження клітини, спричинене вірусною інфекцією. Крім того, був досліджений молекулярний підхід до лікування інфекції вірусом гепатитом С, наприклад, рибозимів, ензимів, що руйнують деякі молекули вірусної РНК, і антисенсибілізаційні олігонуклеотиди, які є малими комплементарними сегментами ДНК, які зв'язуються з вірусною РНК і пригнічують її. Огляд лікування HCV можна знайти у Bymock et al., Antiviral Chemistry&Chemotherapy, 2000,11:2, і De Francesco et al., Antiviral Res., 2003, 55:1-16. Інші класи ліків, які розробляються для лікування інфекцій Flaviviridae і гепатиту С, зокрема включають: 1) Інгібітори протеази: a. Субстратні інгібітори протеази NS3 описано у WO 98/22496 і DE 19914474, а також у Antiviral Chemistry&Chemotherapy, 1999, 70:259-273 і у WO 98/17679, включаючи альфакетоаміди і гідразиномочевини; b. Субстратні інгібітори, з електрофільними закінченнями, подібні до борної кислоти або фосфонату (WO 99/07734); с. Несубстратні інгібітори протеази NS3, наприклад, похідні 2,4,6-тригідрокси-3нітробензаміду, RD3-4082 і RD3-4078 (перший заміщений на аміді 14-карбоновим ланцюгом, другий містить парафеноксифенільну групу), як показано Sudo et al. у Biochemical and Biophysical Res. Comm., 1997, 255:643-7, і у Antiviral Chemistry&Chemotherapy, 1998, 9:186; d. Sch 68631, фенантренхінон описаний Chu et al. у Tetrahedron Letters, 1996, 57:7229-32 і Sch 351633, ізольований з грибка Penicillium griseofulvum, описаний Chu et al. у Bioorganic and Medicinal Chem. Lett., 9:1949-52; e. Eglin c, макромолекула, ізольована з п'явки, має наномолярну здатність пригнічувати декілька серинових протеаз, наприклад, протеази S. griseus А і В, α-хімотропсин, хімазу і субтілізин (Qasim et al., Biochemistry, 1997, 36:1598-1607); f. Інгібітори цистеїнової протеази для пригнічення ендопептидази HCV 2 (патент США 6 004 933); 15 UA 98775 C2 5 10 15 20 25 30 35 40 45 50 55 60 g. Синтетичні інгібітори протеази NS3 вірусу гепатиту С або співфактора NS4A, що є субпослідовністю субстратів, використаних протеазою і/або співфактором (патент США 5 990 276); h. Рестрикційні ензими для лікування HCV (патент США 5 538 865) і. Пептиди, наприклад, інгібітори протеази NS3 серину HCV (WO 02/008251, WO 02/08187 і WO 02/008256); j. Інгібітори трипептиду HCV (патенти США 6 534 523; 6 410 531 і 6 420 380 і WO 02/060926); k. Діарил-пептиди, наприклад, інгібітори протеази серину HCV (WO 02/48172); l. Імідазолідинони наприклад, інгібітори протеази NS3 серину HCV (WO 02/08198 і WO 02/48157); і m. Інгібітори протеази HCV (Vertex Pharmaceuticals, WO 98/17679 і WO 02/48116). 2) Похідні тіазолідину, які показують належне пригнічення згідно з зворотно-фазним аналізом РХВР з злитим протеїном NS3/4A і субстратом NS5A/5B (Sudo et al., Antiviral Res., 1996, 32:9-18), зокрема, сполуки RD4 6205, RD4 6193, і RD-1-6250 які мають злитий цинамоїловий компонент, заміщений довгим алкільним ланцюгом; 3) Тіазолідини і бензаніліди (Kakiuchi et al., J. EBS Letters, 421:217-220) і (Takeshita et al., Analytical Biochemistry, 1997, 247:242-46); 4) Інгібітори гелікази (патент США 5 633 358 і WO 97/36554); 5) Інгібітори нуклеотидної полімерази і гліотоксин (R. Ferrari et al., J. Virology, 1999, 73:164954); 6) Церуленін, природний продукт (V. Lohmann et al., Virology, 1998, 249:108-118); 7) Антисенсибілізаційні фосфортіоатні олігодеоксинуклеотиди (S-ODN), комплементарні до ділянок послідовності у 5'-некодуючій (NCR) вірусу Flaviviridae (M. Alt et al., Hepatology, 1995, 22:707-717); 8) Нуклеотиди 326-348, що включають кінець 3' NCR, і нуклеотиди 371-388, розташовані у регіоні кодування серцевини HCV РНК (М. Alt et al., Archives of Virology, 1997, 742:589-599; Galderisi et al., J. of Cellular Physiology, 1999, 757:251-257); 9) Інгібітори залежної від 1RES трансляції (JP-08268890 і JP-10101591) 10) Рибозими, наприклад, резистентні до нуклеази рибозими (D.D. Maccjak et al., Hepatology, 1999, 50:abstract 995; патенти США 6 043 077, 5 869 253 і 5 610054); 11) Нуклеозидні аналоги, включаючи використання розгалужених нуклеозидів у лікуванні флавівірусів, пестивірусів і гепацівірусів (WO 01/92282, WO 01/90121, U.S. 6 812 219 і U.S. 6 914 054), де описано способи лікування гепатиту С, пестивірусної і/або флавівірусної інфекції у людини і інших реципієнтів, які включають введення ефективної кількості біологічно активних 1', 2'-, 3'- або 4'-розгалужених P-D або P-L нуклеозидів або їх фармацевтично прийнятної солі або похідної, окремо або у комбінації з іншими антивірусними агентами, як варіант, у фармацевтично прийнятному носії. Нуклеозидні аналоги також описано у WO 01/32153 і WO 01/60315; WO 02/057425 і WO 02/057287; WO 02/18404; WO 01/79246, WO 02/32920 і WO 02/48165 і WO 99/43691. Див. також Сесія V - Вірус Гепатит С, Flaviviridae на 16-й міжнародній конференції з Антивірусних досліджень, April 27, 2003, Savannah, GA. 2'-модифіковані нуклеозиди для пригнічення HCV були описані у Eldrup et al.; нуклеозидні аналоги як інгібітори реплікації РНК HCV описано у Bhar et al. (p. A75), де автор повідомляє, що 2'-модифіковані нуклеозиди показують потужну інгібіторну активність клітинних репліконних аналізах; дія 2'модифікованих нуклеозидів на реплікацію РНК HCV була описана у Olsen et al. (p. A76). 12) Були створені різні сполуки, призначені для лікування інфекцій Flaviviridae і гепатиту С, які, зокрема включають: 1-аміно-алкілциклогексани (патент США 6 034 134); алкіл-ліпіди, вітамін Е і інші антиоксиданти (патент США 5 922 757; сквален, амантадин і жовчні кислоти (патент США 5 846 964); N-(фосфоноцетил)-1-аспартанова кислота і піперидини (патент США 5 830 905; бензолдикарбоксаміди (патент США 5 633 388); похідні поліаденілинової кислоти (патент США 5 496 546); 2',3'-дидеоксиінозин (патент США 5 026 687); бензімідазоли (патент США 5 891 874); і рослинні екстракти (патенти США 5 837 257 і 5 725 859). 13) Наразі проходять передклінічні або клінічні дослідження сполуки, призначені для лікування гепатиту С, включаючи: Інтерлейкін-10 від Schering Plough; IP-501 від Interneuron; Merimebodib (VX-497) від Vertex; AMANTADINE® (Symmetrel) від Endo Labs Solvay; HЕПТАZYME® від RPI; IDN-6556 від Idun Pharmaceuticals; XTL-002 від XTL; HCV/MF59 від Chiron; CIVAC1R® (Hepatite С Immune Globulin) від NABI; LEVOV1R1N® від ICN/Ribapharm; V1RАМІДИН® від ICN/Ribapharm (Valeant); ZADAXIN® (тимозин альфа-1) від Sci Clone; тимозин плюс пегільован інтерферон від Sci Clone; CEPLENE® (гістамін дигідрохлорид) від Maxim; VX 950/LY 570310 від Vertex/Eli Lilly; 1S1S 14803 від Isis Pharmaceuticals/Elan; JTK 003 від AKROS Pharma; BILN-2061 від Boehringer Ingelheim; CellCept (мікофенолат-мофетил) від Roche; T67 16 UA 98775 C2 5 10 15 20 25 30 35 40 45 50 55 60 (інгібітор Р-тубуліну) від Tularik; терапевтична вакцина проти Е2 від Innogenetics; FK788 від Fujisawa Healthcare, Inc.; IdB 1016 (Siliphos, оральна силубін-фосфатидилхолінова фітосома); інгібітор реплікації РНК VP50406 від ViroPharma/WyeT; терапевтичні вакцини від Intercell і Epimmune/Genencor; інгібітор 1RES від Anadys; ANA 245 і ANA 246 від Anadys; імунотерапія "Therapore" від Avant; інгібітори протеази від Bristol Myers Squibb/Axys і Corvas/Schering; інгібітор реплікази від Vertex; інгібітор злиття від Trimeris; T-cell терапія від CellExSys; інгібітор полімерази від Biocryst; хімія, спрямована на РНК від PTC Therapeutics; Dication від Immtech, International; інгібітори протеази від Agouron і Chiron/Medivir; антисенсибілізаційна терапія від AVI BioPharma і Hybridon; гемоочищувач від Аетіоn Medical; терапевтична вакцина від Merix; "Chron-VacC", терапевтична вакцина від Tripep; UT 23IB від United Therapeutics; інгібітори протеази, гелікази і полімерази від Genelabs Technologies, інгібітори 1RES від Immusol; R803 від Rigel Pharmaceuticals; INFERGEN® (інтерферон альфакон-1) від InterMune; OMNIFERON® (природний інтерферон) від Viragen; ALBUFERON® від Human Genome Sciences; REBIF® (інтерферон бета-la) від Ares-Serono; Omega Interferon від BioMedicine; Oral Interferon Альфа від Amarillo Biosciences; інтерферони гамма, тау і гамма-lb від InterMune; консенсус-інтерферон від Valeant; Nexavar від Onyx Pharmaceuticals; PI-88 від Progen Industries; доксорубіцинові трансліки від Bio Alliance Pharma; JBK-122 від Jenken Biosciences; Valopicitabine від Idenix; VGX-410C від VGX Pharmaceuticals; Celgosivir від Migenix; Suvus від Bioenvision; Multiferon від Viragen; омега інтерферон від Intarcia; 1NNO0101 (El) від Innogenetics; PF-03491390 від Pfizer; medusa інтерферон від Flamel Technologies; IC41 від Intercell; SCH 503034 від Schering; G126270 від GlaxoSmithKline; GV1001 від Pharmexa; R1626 від Roche; Maxygen/Roche; R7128 від Pharmasset/Roche; Belerofon від Nautilus Biotech; Alinia від Romark; Bavituximab від Peregrine; Oral Interferon alpha від Amarillo Biosciences; NOV-205 від Novelos; CGI 5005 від Globelmmune; HCV-796 від ViroPharma/Wyeth; HCV/MF59 від Chiron /Norvartis; EMZ702 від Transition Therapeutics; AVI-4065 від Biopharma; ANA975 від ANADYS; MitoQ від Антиpodean Pharmaceuticals, Inc; ACH-0137171 від Achillion Pharmaceuticals; R1626 від Roche; XTL-2125 від XTL; XTL-6865 від XTL; BLX-883 від Biolex Therapeutics/OctoPlus; DEBIO-025 від DEBIO; і UT231B від United Therapeutics; і 14) Нуклеозидні проліки, описані вище, для лікування інших форм гепатиту, включаючи 2'деокси-Р-1-нуклеозиди і їх 3'-проліки для лікування HBV (WO 00/09531 і WO 01/96353); і терапевтичні естери ацикловіру (патент США 4 957 924). Інші антивірусні агенти, які можна використовувати у комбінації і/або переміжно з описаними тут сполуками, включають (але не лише) такі агенти як VX-950 і інтерферон. Інтерферони, які можна використовувати, включають продукти альфа інтерферону-2b від Schering-Plough's, Intron® А і PEG-lntron™; і Hoffman La Roche's Co-Pegasus і PEGASYS (пегільований інтерферон альфа-2а). Агенти гепатиту В Агентами гепатиту В можуть бути будь-які агенти, відомі фахівцям і ефективні у лікуванні гепатиту В у реципієнта, що потребує цього. У деяких втіленнях агентом гепатиту В інтерферональфа (Intron A, Schering-Plough), пегільований інтерферон (Pegasys, Roche), ламівудин (EpivirHBV, Zeffix або Heptоdin, Glaxo-Smithkline), адефовір дипівоксил (Hepsera, Gilead), ентекавір (Baraclude, Bristol-Myers-Squibb), тельбівудин (Tyzeka або Sebivo, Idenix) або імуноглобулін HBV (HyperHEP S/D, Talecris; Nabi-HBV, Nabi; Hepa Gam B, Cangene). У деяких втіленнях агентом гепатиту В є FTC (Emtricitabine, Gilead), L-FMAU (Clevudine, Pharmasset; Levovir, Bukwang), тенофовір (Viread, Gilead), моновал LdC (Valtorcitabine, Idenix), DAPD (Amdoxovir, RFS Pharm LLC), Ana 380 (LB80380, Anadys), ремофовір (Pradefovir, ScheringPlough), рацивір (RCV, Pharmasset), BAM-205 (NOV-205, Novelos), XTL-001 (HepeX-B, XTL Biopharm, Cubist), нітоксанід (Alinia, Romark Labs), UT 231-B (United Therapeutics), Bay 41-4109 (Bayer), EHT899 (Enzo Biochem), тимозин альфа-1 (Zadaxin, SciClone), Hi-8 HBV (Oxxon), eiPHK (HepX, Nucleonics), HepaVaxx В (Virexx), HBV Core Antigen Vaccine (Emergent Europe) або SpecifEx-HepB (Chromos). Інші антивірусні агенти Будь-які антивірусні терапії, описані вище, можуть бути використані у комбінації або переміжно з сполуками, описаними тут. Необмежуючі приклади включають а) інгібітори протеази; b) похідні тіазолідину; с) інгібітори гелікази; d) бензаніліди; e) фенантренехінони; f) інгібітори полімерази і гліотоксин; g) антисенсибілізаційні фосфортіоатні олігодеоксинуклеотиди (S-ODN); h) інгібітори залежної від 1RES трансляції; і) рибозими; j) нуклеозидні аналоги; k) дизаміщені нуклеозидні аналоги (див. WO 01/90121, WO 01/92282, WO 04/00300, WO 04/002999 і WO 04/002422); І) 2'-флуорнуклеозидний аналог; m) 1-NH2-алкілциклогексани; n) алкіл-ліпіди; о) вітамін Е і інші антиоксиданти; р) сквален, амантидин і жовчні кислоти; q) N 17 UA 98775 C2 5 10 15 20 25 30 35 40 45 50 55 60 (фосфоноацетил)-1-аспартанова кислота; r) бензолдикарбоксаміди; s) похідні поліаленілінової кислоти; t) бензімідазоли; u) 2',3'-дидеоксиінозин; v) рослинні екстракти; w) піперидини; і х) інші сполуки, що проходять доклінічні або клінічні випробування і призначені для лікування пестивірусів, флавівірусів і/або гепацивірусів, включаючи рибавірин і родини інтерферонів. Другим антивірусним агентом для лікування ВІЛ може бути, наприклад, інгібітор протеази, інгібітор ВІЛ-інтегрази, інгібітор хемокіну, або інгібітор зворотної транскриптази ("RTI"), який може бути синтетичним нуклеозидним інгібітором зворотної транскриптази ("NRTI") або ненуклеозидним інгібітором зворотної транскриптази ("NNRTI"). В інших втіленнях другою або третьою сполукою може бути аналог пірофосфату або інгібітор злиття-зв'язування. Дані резистентності in vitro і in vivo для деяких антивірусних сполук можна знайти у Schinazi et al., Mutations in retroviral genes associated with drug resistent, International Antiviral News, 1997, 5(8). У деяких втіленнях індольну сполуку вводять у комбінації і/або переміжно з FTC (2',3'дидеокси-3'-тіа-5-флуорцитидин); 141W94 (ампренавір, Glaxo Wellcome, Inc.); Viramune і (невірапін); Rescriptor (делавірдин); DMP-266 (ефавіренц); DDI (2 , 3'-дидеоксиінозин); 3ТС (3'тіа-2',3'-дидеоксицитидин); DDC (2',3'-дидеоксицитидин), абакавір (1592U89), тобто (1S, 4R)-4[(2-аміно-6-циклопропіл-аміно)-9Н-пурин-9-іл]-2-циклопентен-1-метанол-сукцинат, Tenofovir DF (Viread), D4T або AZT. Інші антивірусні агенти можуть бути використані у комбінації і/або переміжно з описаними тут сполуками, включаючи (але не лише), фоскарнет; карбовір; ацикловір; інтерферон; інгібітор злиття, наприклад, енфувіртид; і P-D-діоксолан-нуклеозиди, наприклад, P-D-діоксоланілгуанін (DXG), Р-О-діоксоланіл-2,6-діамінопурин (DAPD) і P-D-діоксоланіл-6-хлорпурин (АСР). Інтерферони, що можуть бути використані, включають продукти альфа інтерферону-2b від Schering-Plough, Intron® А і PEG-lntron™ і Co-Pegasus і PEGASYS від Hoffman La Roche (пегільований інтерферон альфа-2а). Комбінації з 3-фосфоіндолами, які можна вводити, включають Epzicom (АВС+3ТС), Trizivir (ABC+3ТС+AZT), Truvada (FTC+Viread) і Combivir (AZT+3TC). Приклади інгібіторів протеази, які можуть бути використані у комбінації і/або переміжно з описаними тут сполуками, включають (але не лише) індинавір ({1 (S, 2R),5(S)}-2,3,5-тридеоксиN-(2,3-дигідро-2-гідрокси-1Н-інден-1-іл)-5-[2-[[(1,1-диметилетил)аміно]-карбоніл]-4-(3піридинілметил)-1-піперазиніл]-2-(фенілметил)-D-еритро-пентоамід-сульфат; Merck & Co., Inc.); нельфінавір (Agouron); ритонавір Abbott Labs), сагінавір (Roche); ампренавір; атазанавір; фосампренавір; Kaletra; і DMP-450 {[4R-4(r-a, 5-a, 6-b, 7-6)-гексагідро-5,6-біс(гідрокси)-1,3-біс(3аміно)-феніл]метил-4,7-біс(феніл-метил)-2Н-І, 3-діазепін-2-он}-бісмезилат (Tpiangle Pharmaceuticals, Inc.). Інші сполуки, які можна вводити у комбінації або переміжно з фосфоіндолом для підсилення його антивірусних властивостей, включають (1S, 4R)-4-[2-аміно-6-циклопропіл-аміно-9Н-пурин9-іл]-2-циклопентен-1-метанол-сукцинат (1592U89, аналог карбовіру від GlaxoSmithKline); BILA 1906 (N-{13-[[[3-[2S-{(1,1-диметилетил)-аміно]карбоніл}-4R-]3-піримідинілметил)тіо]-1піперидиніл]-2R-гідрокси-1S-фенілметил)пропіл]-аміно]карбоніл]-2-метилпропіл}-2хінолінкарбоксамід) (Bio Mega/Boehringer Ingelheim); BILA 2185 (N-(1,1-диметилетил)-1-[2S-[[[22,6-диметилфeнoкcи]-1-oкcoeтил]aмiнo]-2R-гiдpoкcи-4-фeнiлбyтил]4R-пipидинiлтio-2-пiпepидинкарбоксамід) (Bio Mega/Boehringer Ingelheim); BM+51,0836 (похідна тріазолізоіндолінону) і BMS 186,318 (амінодіольна похідна інгібітору протеази ВІЛ-1) (Bristol-Myers Squibb); d4API (9-[2,5дигідро-5-(фосфонометокси)-2-фураніл]-аденін) (Gilead); HBY097 (3-4-ізопропоксикарбоніл-6метокси-3-[метилтіо-метил]-3,4-дигідрохіноксалін-2(1Н)-тіон); ГЕПТ (1-[(2-гідроксиетокси)метил]6-[фенілтіо]-тимін); KNI-272 трипептид, що містить ((2S, 3S)-3-аміно-2-гідрокси-4фенілбутирову кислоту); L-697,593 (5-етил-6-метил-3-(2-фталімід-етил)піридин-2(1Н)-он); L732,524 (гідрокси-амінопентанамід ВІЛ-1, інгібітор протеази) (Merck & Co.); L-697,661 (3-{[(-4,7дихлор-1,3-бензоксазол-2-іл)метил]аміно}-5-етил-6-метил-піридин-2(1Н)-он); L-FDDC ((-)-р-1-5флуор-2',3'-дидеоксицитидин); L-FDOC ((-)-Р-1-5-флуор-діоксолан-цитозин); PFA (фосфоноформат; "фоскарнет"; Astra); PMEA (9-(2-фосфонілметоксиетил)аденін) (Gilead); PMPA ((R)-9-(2-фосфонілметокси-пропіл)-аденін) (Gilead); Ro 31-8959 (гідроксиетиламінова похідна інгібітору протеази ВІЛ-1) (Roche); RPI-3121 (пептидильний інгібітор протеази, 1-[(3S)-3(n-альфа-6ензилокси-карбоніл)-1-аспаргініл)-аміно-2-гідрокси-4-фенілбутирил]-n-трет-бутил-1пролінамід); 2720 (6-хлор-3,3-диметил-4-(ізопропенілоксикарбоніл)-3,4-дигідро-хіноксалін2(1Н)тіон); SC-52151 (гідроксиетилмочевинний ізостерний інгібітор протеази) (G.D. Searle); SC55389А (гідроксиетилмочевинний ізостерний інгібітор протеази (G.D. Searle); ТІВО R82150 ((+)(5S)-4,5,6,7-тетрагідро-5-метил-6-(3-метил-2-бутеніл)-імідазо-[4,5,1-jk]-[1,4]-бензодіазепін-2(1Н)тіон) (Janssen Pharmaceuticals); ТІВО 82913 ((+)-(5S)-4,5,6,7-тетрагідро-9-хлор-5-метил-6-(3метил-2-бутеніл)імідазо [4,5,1-jk]-[1,4]-бензо-діазепін-2(1Н)-тіон (Janssen Pharmaceuticals); 18 UA 98775 C2 5 10 TSAO-m3Т ([2',5'-біс-О-(трет-бутилдиметилсиліл)-3'-спіро-5'-(4'-аміно-1',2'-оксатіол-2',2'діоксид)]-β-D-пентофуранозил-N3-метил-тимін); U90152 (1-[3-[(1-метилетил-аміно]2-піридиніл]4-[[5-[(метилсульфоніл)-аміно]-1Н-індол-2-іл]-карбоніл]-піперазин); UC (похідні тіокарбоксаніліду) (Uniroyal); UC-781 (N-[4-хлор-3-(3-метил-2-бутенілокси)феніл]-2-метил-3фуранкарботіоамід); UC-82 (N-[4-хлор-3-(3-метил-2-бутенілокси)феніл]-2-метил-3тіофенкарботіоамід); інгібітор VB 11,328 (гідроксиетил-сульфонамідний інгібітор протеази) (Vertex/Glaxo Wellcome); ХМ 323 (циклічний мочевинний інгібітор протеази) (Dupont Merck); і пенцикловір. У ще одному втіленні індольну сполуку винаходу вводять у комбінації з інгібітором протеази LG 1350. Перелічені нижче ліки можуть бути використані у комбінації і/або переміжно з сполуками винаходу. Назва ліків 3ТС, Epivir® brand lamivudine abacavir generic Ziagen®, ABC, або 1592U89 ABC, Ziagen® brand abacavir, або 1592U89 ABT-378/r, або Kaletra® brand lopinavirp/ritonavir AG-1549, S-1153, або capravirine (CPV) AG 1661, Remune® brand ВІЛ-1 Immunogen, або Salk вакцина Agenerase® brand amprenavir (APV). 141W94. або VX-478 aldesleukin generic Proleukin®, або lnterleukin-2 (IL-2) amdoxovir, або DAPD amprenavir generic Agenerase®, APV, 141W94, або VX-478 Aptivus® APV, Agenerase® brand amprenavir 141W94, або VX-478 atazanavir generic Revataz™, або BMS-232632 Atripla® AZT, Ретpovir® brand zidovudine (ZDV) BisfPCO PMPA, Viread® brand tenofovir DF BMS-232632. або Revataz™ brand atazanavir BMS-56190, a6oDPC-083 FTC, або Emtriva® brand emtricitabine Fuzeon™ brand enfuvirtide, або Т-20 GW-433908, або fosamprenavir, або VX-175 HE2000, або alpha-ерібромід ВІЛ-1 Immunogen generic Remune®, Salk vaccine, або AG1661 BIЛid® brand zalcitabine, або ddC HU, або Droxia® brand hydroxy urea hydroxy urea generic Droxia®, або HU IDV, Crixivan® brand indinavir, або МК-639 IL-2 (lnterleukin-2), або Proleukin® brand aldesleukin indinavir generic Crixivan®, IDV, або МК-639 Interleukin-2 (IL-2), або Proleukin® brand aldesleukin Isentress brand raltegravir ^ Invirase® brand saquinavir (Hard Gel Cap), SQV (HGC), оr Ro-318959 Kaletra® brand lopinavir/ritonavir, або ABT-378/r lamivudine generic Epivir®, або 3ТС Lexiva® lopinavir/ritonavir generic Kaletra®, або АВТ-378/r MK-639. Crixivan® brand indinavir (IDV) nelfinavir generic Viracept®, NFV, або AG-1343 nevirapine generic Viramune®, NVP, або BI-RG-587 NFV, Viracept® brand nelfinavir, або AG-1343 Norvir® brand ritonavir (RTV). або АВТ-538 NVP, Viramune® brand nevirapine, або BI-RG-587 PNU-140690, або tipranavir Prezista® PRO-542 19 Виробник GlaxoSmithKline GlaxoSmithKline GlaxoSmithKline Abbott Laboratories Pfizer Immune Response Corp. GlaxoSmithKline Chiron Corporation Gilead Sciences GlaxoSmithKline Boehringer Ingelheim GlaxoSmithKline Bristol-Mvers Squibb Bristol-Mvers Squibb and! Gilead GlaxoSmithKline Gilead Sciences Bristol-Mvers Squibb Bristol-Mvers Squibb Gilead Sciences Trimeris і Hoffmann-La Roche GlaxoSmithKline HollisEden Pharmaceuticals Immune Response Corp. Hoffmann-La Roche Bristol-Myers Squibb Bristol-Myers Squibb Merck & Co. Chiron Corporation Merck & Co. Chiron Corporation Merck Hoffmann-La Roche Abbott Laboratories GlaxoSmithKline GlaxoSmithKline Abbott Laboratories Merck & Co. Pfizer Boehringer Ingelheim Pfizer Abbott Laboratories Boehringer Ingelheim Boehringer Ingelheim Tibotec Progenies Pharmaceuticals і UA 98775 C2 Procrit® brand epoetin alfa (erythropoietin) Proleukin® brand aldesleukin, або lnterleukin-2 (IL-2) Remune® brand ВІЛ-1 Immunogen, або Salk vaccine Rescriptor® brand delavirdine (DLV), або U-90152S/T Ретpovir® brand zidovudine (ZDV), або AZT Revataz™ brand atazanavir, або BMS-232632 ritonavir generic Norvir®, RTV, або АВТ-538 RTV, Norvir® brand ritonavir, або АВТ-538 Salk vaccine, Remune® brand ВІЛ-1 Immunogen, або AG 1661 saquinavir (Hard Gel Cap) generic Invirase®, SOV (HGC), or Ro-31-8959 saquinavir (Soft Gel Cap) generic Fortovase®, або SOV (SGC) SCH-C Selzentry brand maraviroc Serostim® brand somatropin somatropin generic Serostim® 1 SOV (HGC), Invirase® brand saquinavir (Hard Gel Cap), or Ro-31-8959 SOV (SGC). або Fortovase® brand saquinavir (Soft Gel Cap) stavudine generic Zerit®. d4T. або BMY-27857 T-20, або Fuzeon™ brand enfuvirtide Sustiva® brand efavirenz (EFV) T-1249 TDF, tenofovir DF generic Viread™, або Біс(РОС) РМРА tenofovir DF (TDF) generic Viread®, Біс(РОС) РМРА tipranavir, або PNU-140690 TMC-114 TMC-125 Trizivir® brand abacavir+zidovudine+lamivudine (ABC+AZT+3TC) Truvada® Videx® brand didanosine. ddl, або BMY-40900 Videx® EC brand didanosine (ddl): delaved-release капсуле Viracept® brand nelfinavir (NFV), або AG-1343 Viramune® brand nevirapine (NVP), або BI-RG-587 Viread® brand tenofovir DF, або Біс(РОС) РМРА VX-175, або fosamprenavir, або GW-433908 zalcitabine generic BІЛid®, або ddC ZDV, Ретpovir® brand zidovudine, або AZT Zerit® brand stavudine, d4T, або BMY-27857 Ziagen® brand abacavir (ABC), або 1592U89 zidovudine generic Ретpovir®, AZT, або ZDV Ortho Biotech Chiron Corporation Immune Response Corp. Pfizer GlaxoSmithKline Bristol-Myers Squibb Abbott Laboratories Abbott Laboratories Immune Response Corp. Hoffmann-La Roche Hoffmann-La Roche Schering-Plough Pfizer Serono Laboratories Serono Laboratories Hoffmann-La Roche Hoffmann-La Roche Bristol-Myers Squibb Trimeris and Hoffmann-La Roche Bristol-Myers Squibb Trimeris and Hoffmann-La Roche Gilead Sciences Gilead Sciences Boehringer Ingelheim Tibotec-Virco Group Tibotec-Virco Group GlaxoSmithKline Gilead Bristol-Mvers Squibb Bristol-Mvers Squibb Pfizer Boehringer Ingelheim Gilead Sciences GlaxoSmithKline Hoffmann-La Roche GlaxoSmithKline Bristol-Mvers Squibb GlaxoSmithKline GlaxoSmithKline Далі перелічено додаткові ліки, які можуть бути використані у комбінації і/або переміжно з 3фосфоіндолами: GW5634 (GSK) RO033-4649 (Roche) GW640385 (GSK/Vertex) Elvucitabine (Achillion Ph.) MIV-210 (GSK/Medivir) SPD754 (Shire Pharm.) FP21399 (Fuji Pharm.) GW873140 (GSK) Schering C/D (417690) MIV-150(Medivir/Chiron) TMC125 (Tibotec) TMC114(Tibotec) Alovudine (FLT) (B-l) Racivir (Pharmasset) Зворотні (Incyte Corp.) AMD070 (AnorMed) BMS-488043 (BMS) PRO 542 (Progenies Pharm) TAK-220 (Takeda) TNX-355 (Tanox) 20 Tipranavir (B-l) UA 98775 C2 UK-427,857 (Pfizer) Наведені далі ліки можуть бути використані у комбінації і/або переміжно з сполуками винаходу. Фірмова назва Abelcet, Ambisome Родова назва амфотерицин В, ABLC Bactrim, Septra сульфаметоксазол і триметоприм Biaxin, КІкислот кларитроміцин Cytovene гансікловір, DHPG DaunoXome даунорубіцинліпосомальний Diflucan флуконазол Famvir доусорубіцину дигідрохлоридліпосомальний фамцикловір Foscarnet фоскавір Doxil Intron A Marinol Megace імуноглобулін, гаммаглобулін, IGIV інтерферон альфа-2b дронабінол мегестеролу ацетат Mepron атовакон Mycobutin, Ansamycin рифабутин NebuПент пентамідин Gamimune N Neutrexin Panretin gel триметрексат-глюконат і лейковорин алітретиноїновий гель 0,1 % Використання антигрибкові для аспергільйозу антипротозоа антибіотик для Pneumocystis carinii антибіотик для Mycobacterium avium відантивірусні для ретиніту CMV хемотерапія для саркоми Капосі антигрибкові для candidiasis, cryptococcal хемотерапія для саркоми Капосі антивірусні для герпесу антивірусні для герпесу, ретиніту CMV імунні для відвертання бактеріальних інфекцій саркоми Капосі, гепатит С втрата апетиту втрата апетиту і ваги антипротозоа антибіотик для Pneumocystis carinii антиміко-бактеріальний антибіотик для Mycobacterium avium відантипротозоа-антибіотик для Pneumocystis carinii антипротозоа-антибіотик для Pneumocystis carinii саркома Капосі як наслідок СНІД анемія, пов'язана з АZТтерапією саркома Капосі і гепатит С втрати ваги антигрибкові для бластомікозу histoplasmosis, ассаркома Капосі антивірусні для ретиніту CMV антивірусні для ретиніту CMV антивірусні для ретиніту CMV Виготовник various various Abbott Laboratories Roche Gilead Pfizer Ortho Biotech Novartis Astra Pharmaceuticals Bayer Біологічне Schering Rоксан Laboratories Bristol Myers-Squibb GlaxoSmithKline Adria Pharmaceuticals Fujisawa Medlmmune Ліганд Pharmaceuticals Procrit, Epogen еритропоетин, ЕРО Roferon A Serostim інтерферон alfa-2a соматропін rДНК Sporanox ітраконазол Taxol пацитаксель Valcyte вальганцикловір Vistide цидофовір, НРМРС Vitrasert implant ганцикловір Vitravene intravitreal injectable ін'єкція фомівірсен натрій антивірусні для ретиніту CMV Isis Pharmaceuticals Zithromax азитроміцин антибіотик для Mycobacterium avium Pfizer 21 Амгеn Roche Serono Janssen Pharmaceuticals Bristol Myers-Squibb Roche Gilead Bausch & Lomb UA 98775 C2 5 10 15 20 25 30 35 40 45 50 55 60 Для лікування ускладнень ВІЛ-інфекції і СНІД можуть бути використані продукти, визначені як нові і такі, що можуть бути предметом досліджень (IND) від FDA. Наведені далі ліки можуть бути використані у комбінації і/або переміжно з сполуками винаходу. • Триметрексат глюкоронат для лікування пневмонії Pneumocystis carinii у хворих на СНІД. які не толерантними до стандартних форм лікування. • Ганцикловір для лікування цитомегаловірусного ретиніту у хворих на СНІД. • Аерозольний пентамідин для відвертання пневмонії Pneumocystis carinii у хворих на СНІД. • Еритропоєтин для лікування пов'язаної з зидовудином анемії. • Атовакон для лікування пневмонії Pneumocystis carinii у хворих на СНІД, які є не толерантними до триметоприм-сульфаметоксазолу або не реагують на нього. • Рифабутин для профілактики комплексної бактеремії у хворих на СНІД. • Внутрішньовенний цидофовір ВІЛ-інфікованих пацієнтів з рецидивом цитомегаловірусного (CMV) ретиніту, який прогресує незважаючи на лікування (Hoffmann-La Roche). • Серестим, отриманий від ссавця рекомбінантний гормон росту людини, для лікування пов'язаного з СНІД виснаження (Serono Laboratories). Згідно з деякими втіленнями, описані тут сполуки можна вводити у комбінації або переміжно з одним, двома або більше іншими анти-ВІЛ агентами. В одному з втілень додатковим агентом є: - інгібітор протеази, як варіант, вибраний з групи, яку складають ампренавір, типранавір, індинавір, сакінавір (включаючи сакінавір-мезилат), лопінавір, ритонавір, фосамправір, дарунавір, атазанавір (включаючи його сульфат) і нельфамавір (включаючи його мезилат); - нуклеозидний або нуклеотидний інгібітор зворотної транскриптази, як варіант, вибраний з ламівудину, емтрицитабіну, абакавіру, зальцитабіну, зидовудину, теннофовіру (включаючи тенофовір дизопроксил фумарат), диданозину і ставудину; - ненуклеозидний інгібітор зворотної транскриптази, як варіант, вибраний з деравірдину, ефавіренцу і невірапіну; - комбінації з фіксованою дозою, як варіант, вибрані з Atripla, Combivir, Trizivir і Truvada; - вхідний інгібітор (наприклад, інгібітор злиття або антагоніст співрецептора CCR5), як варіант, вибраний з маравіроку і енфувіртиду; і - інгібітор інтегрази, наприклад, ральтегравір (МК-0518) або ельвітегравір (GS-9137). Додатковий анти-ВІЛ агент при використанні, як варіант, може бути в іншій формі, наприклад, у формі солі, сольвату, гідрату, проліків, поліморфу, енантіомеру тощо. Додатковий анти-ВІЛ агент також може бути вибраний з групи, яку складають: - нуклеозидний інгібітор зворотної транскриптази, як варіант, вибраний з амдоксовіру, априцитабіну і ельвуцитабіну; - інгібітор протеази, а саме, як варіант, бреканавір або GS-8374; - антагоніст рецептора CCR5, як варіант, вибраний з Арlавірос, PRO2000 і Vicriviroc; - ненуклеозидний інгібітор зворотної транскриптази, як варіант, Etrabipine (TMC-125), Rilpivirine (TMC-278) або Calanolide A; - інгібітор інтегрази, як варіант, Elvitegrabip, GSK-364735 або ральтегравіір; і інгібітор нагноєння, як варіант, Bevirimat (PA457); - клітинний інгібітор, наприклад, гідроксимочевинний; - інгібітор входу, наприклад, вікривірок або TNX-355; і - імуногенний інгібітор, наприклад, імунітин (альфа-епібромід), пролейкін (IL-2), Remune (імуноген ВІЛ-1), BAY 50-4798 або 1R103. Агенти метаболізму цитохромом Р450 У деяких втіленнях сполуку згідно з винаходом можна вводити у комбінації або переміжно фармацевтично прийнятними агентами, які метаболізуються монооксигеназами цитохрому Р450. Типовими монооксигеназами цитохрому Р450 є монооксигенази цитохрому Р450 2С8, цитохрому Р450 2С9 і цитохрому Р450 3А4. У деяких втіленнях чисті сполуки згідно з винаходом можуть пригнічувати монооксигеназу цитохрому Р450, поліпшуючи цим фармакокінетику супутнього агента. У бажаному втіленні ізоцим Р450 пригнічується CYP3A4. У деяких втіленнях фосфоіндольну сполуку вводять у комбінації з другою анти-ВІЛ сполукою без застосуванням ритонавірного підсилювача. В окремих втіленнях фосфоіндольну сполуку вводять у комбінації з одними або більше такими ліками: Atazanavir, Fosamprenavir, Darunavir, Indinavir, Lopinavir, Nelfinavir, Saquinavir, Tipraniavir або Enfuvirtide. В окремих втіленнях фосфоіндольну сполуку вводять у комбінації з одним або більше нуклеозидними інгібіторуми зворотної транскриптази і/або одним або більше інгібіторуми інтегрази. 22 UA 98775 C2 5 10 15 20 25 30 35 40 45 50 55 60 Фармацевтично прийнятним агентом, що метаболізується монооксигеназою цитохрому Р450, може бути будь-який такий агент, відомий фахівцям. Наприклад (без обмеження), сполуки, що можуть бути метаболізовані монооксигеназою цитохрому Р450 включають (але не лише) пацитаксель, торземід, абодіахін, церивастатин і репаглінід (цитохром Р450 2С8); деякі NSAID (наприклад, диклофенак, ібупрофен, лорноксикам, мелоксикам, S-напроксен, проксикам, супрофен), деякі пероральні гіпглікемічні агенти (наприклад, тольбутамід, гліпіцид), деякі блокери ангіотензину II блокер (наприклад, лозартан, ірбесартан), деякі сульфонілмочевини (наприклад, глібурид, глібенкламід, гліпіцид, глімеприд, тольбутамід, t амітриптилін), целекоксиб, флуоксетин, флувастатин, глібурид, натеглінід, фенітоїн, розиглітазон, тамоксифен, еорземід, S-варфарин (цитохром Р450 2С9); деякі макролідні антибіотики (наприклад, кларитроміцин, еритроміцин, телітроміцин), деякі анти-аритмики (наприклад, гінідин), деякі бензодіазепіни (наприклад, альпразолам, діазепам, мідазолам, тріазолам), деякі імуномодулятори (циклоспорин, такролімус), деякі анти-ВІЛі (наприклад, індинавір, ельфінавір, ритонавір, сакінавір), деякі прокінетики (наприклад, цизаприд), деякі антигістаміни (наприклад, астемізол, хлорфенірамін, терфенідин), деякі блокери каналу кальцію (наприклад, а млодипін, дильтіазем, фелодипін, лерканідипін, ніфедипін, нізольдипін, нітрендипін, верапаміл), деякі інгібітори редуктази HMG СоА (наприклад, аторвастатин, цривастатин, ловастатин, симвастатин), деяк стероїди (естрадіол, гідрокортизон, прогестерон, тестостерон), альфентаніл, апрепітант, арипіпразол, буспірон, кафергот, кофеїн=>ТМU, цилостазол, кокаїн, кодеїн-Nдеметилація, дапсон, дексаметазон, декстрометорфан, доцетаксель, домперидон, еплегенон, фентаніл, інастерид, глеевек, галогенперидол, іринотекан, LAAM, лідокаїн, метадон, натеглінід, оданстрон, пімозид, пропанолол, кветіапін, хінін, рисперидон, розувастин NOT, сальметерол, сільденафіл, сіролімус, тамоксифен, таксол, терфенадин, тразодон, вінкристин, залеплон, зіпразедон, Zolpidem (цитохром Р450 3А4). В окремих втіленнях передбачено лікування у комбінації або переміжно анти-ВІЛ, які метаболізуються цитохромом Р450 (наприклад, індинавір, нельфінавір, ритонавір, сакінавір). Крім того, типові сполуки, які можуть бути метаболізовані монооксигеназою цитохрому Р450, включають (але не лише), інгібітори CCR5 (наприклад, PRO-140, віцівіпок або SCH-417 690, і маравіпок або UK-427,857), інгібітори інтегрази (наприклад, JTK-303/GS-913, 7,6-(3-хлор-2флуорбензил)-1-[(2S)-1-гідрокси-3-метилбутан-2-іл]-7-метокси-4-оксо-1,4-дигідрохінолін-3карбонову кислоту, МК-0518, 5-(1,1-діоксидо-1,2-тіазинан-2-іл)-N-(4-флуорбензил)-8-гідрокси1,6-нафтиридин-7-карбоксамід, описані у патентах США 6 924 282, 6 921 759, 6 919 351, 6 841 558, 6 541 515, 6 403 347, 6 395 743, 6 380 249, 6 306 891, 6 271 402, 6 262 055, 6 245 806, 6 124 327, 6 110 716, 5 939 414, 5 858 738, 5 759 842, 7 176 220 і 7 112 600, включені посиланням, інгібітори протеази (наприклад, сакінавір, індинавір, ритонавір, нельфінавір, ампренавір, лопінавір, атазанавір, фосампренавір, типранавір і дарунавір), інгібітори злиття (наприклад, енфурвітид), інгібітори нагноєння (наприклад, бевіримат або РА-457) і нуклеозидні інгібітори зворотної транскриптази (наприклад, зидовудин, диданозин, зальцитабін, ставудин, ламівудин, абакаавір, енофовір, емтрицитабін, комбівір, тризивір, трувада і епциком). Крім того, типові сполуки, які можуть бути метаболізовані монооксигеназою цитохрому Р450, включають (але не лише), ритонавір, імуносупресанти циклоспорин, FK-506 і рапаміцин, хемотерапевтичні агенти таксол і таксотер, антибіотик кларитроміцин і інгібітори протеази ВІЛ А-77003, А-80987, МК-639, saquinaвір, VX-478, AG1343, DMP-323, ХМ-450, BILA 2011 BS, BILA 1096 BS, BILA 2185 BS, BMS 186,318, LB71262, SC-52151, SC-629 (N, N-диметилгліцил-N-(2гідрокси-3-(((4-метоксифеніл)сульфоніл)(2-метил-пропіл)-аміно)-1-(фенілметил)пропіл)-3-метил1-валінамід), KNI-272, CGP 53437, CGP 57813 і U-103017. [00149]. У деяких втіленнях запропоновано способи поліпшення фармакокінетики інгібітору протеази ВІЛ (або фармацевтично прийнятної солі), який метаболізується монооксигеназою цитохрому Р450. Ці способи включають введення інгібітору протеази ВІЛ у комбінації або переміжно з описаними сполуками. Таке введення може сприяти пригніченню протеази ВІЛ у людини і пригніченню, лікуванню або профілактиці інфекції ВІЛ або СНІД у людини. Інгібітором протеази ВІЛ може бути будь-який такий інгібітор, відомий фахівцям. У деяких втіленнях інгібітором протеази ВІЛ є ампренавір (Agenerase, GlaxoSmithkline), типранавір (Aptivus, Boehringer Ingelheim), індинавір (Crixivan, Merck), сакінавір (Fortovase, Hoffmann-La Roche), сакінавір мезилат (Invirase, Hoffmann-La Roche), лопінавір і ритонавір (Kaletra, GlaxoSmithkline), ритон (Norvir, Abott), дарунавір (Prezista, Tibotec), атазанавір сульфат (Reyataz), або нельфінавір мезилат (Viracept, Agouron) або їх комбінації. У деяких втіленнях описані тут сполуки можна вводити у комбінації або переміжно з одним, двома або більше іншими інгібіторуми протеази або агентами анти-ВІЛ інгібіторуми інтегрази, які можуть поліпшувати метаболізм другого агента. В одному з втілень додатковий агент 23 UA 98775 C2 5 10 15 20 25 30 35 40 45 50 55 60 вибрано з групи, яку складають інгібітор протеази, як варіант, вибраний з аипренавіру, типранавіру, індинавіру, сакінавір (включаючи сакінавір мезилат), лопінавіру, ритонавір, фосампренавіру, дарунавіру, атазанавіру (включаючи сульфат), нельфінавіру (включаючи мезилат), бреканівіру або GS-8374; інгібітор інтегрази, наприклад, ральтегравір (МК-0518) або ельвітегравір (GS-9137), або GSK-364735. Взагалі у переміжній терапії ефективну дозу кожного агента вводять послідовно. У комбінаційній терапії ефективні дози двох або більше агентів вводять разом. Дози залежать від ряду факторів, наприклад, абсорбції, біорозподілення, метаболізму і швидкості екскреції кожних ліків, а також від інших факторів, відомих фахівцям. Слід відзначити, що доза може залежати від важкості стану, віку, ваги і загального фізичного стану пацієнта. Зрозуміло також, що для будь-якого конкретного пацієнта режим введення і розклади мають коригуватись з часом з урахуванням реакції пацієнта на лік, його потреб і професійних міркувань лікаря. Приклади придатних доз для сполук, включаючи похідні нуклеозидів, наприклад, D4T, DDI і 3ТС, 2'розгалужені нуклеозиди або інгібітори протеази, наприклад рельфінавір і індинавір, можна знайти у літературі і довідниках. Запропоновані значення доз є лише рекомендаціями і не обмежують об'єму або способів використання винаходу. Описані режими комбінаційного і переміжного введення можуть бути використані у лікуванні і відвертанні ретровірусних інфекцій і інших пов'язаних з ними станів, наприклад, пов'язаного з СНІД комплексу (ARC), постійної загальної лімфаденопатії (PGL), пов'язаних з СНІД неврологічних станів, положення анти-ВІЛ антитіл і ВІЛ-позитивних станів, саркоми Капосі, тромботичної пурпури і опортуністичних інфекцій. Крім того, ці сполуки або рецептури можуть бути використані профілактично для відвертання або уповільнення розвитку клінічної хвороби у осіб, що є анти-ВІЛ антитіл або ВІЛ-антиген-позитивними або інфіковані ВІЛ. Аналізи Сполуки згідно з винаходом можуть бути аналізовані на активність проти ВІЛ або ВІЛінфекції будь-яким аналізом, визнаним придатним для цього фахівцем. Типовими є аналізи, описані нижче і ілюстровані прикладами. Системи клітинних культур для визначення антивірусної активності Ампліфікаційні схеми виявлення продукту Гетерогенне виявлення: Саузерн-блотинг, наприклад, є процедурою гетерогенного виявлення. У саузерн-блотингу для сепарації ампліфікаційних продуктів за розмірами і зарядом використовується електрофорез. Фракціоновані за розміром продукти передаються до мембрани або фільтру дифузією, вакуумуванням або електроблотуванням. Мічені проби гібридизують для пов'язаних з мембраною об'єктів у розчині, фільтри промивають для видалення будь-яких негібридизованих проб і гібридизовані проби на мембран виявляють будьяким з багатьох відомих способів. Інші типи гетерогенного виявлення базуються на специфічному захопленні ампліфікаційних продуктів засобами імуносорбентного аналізу з іммобілізованими ферментами (EL1SA). Один з способів використання з PCR включає мічення одної затравки гаптеном або лігандом, наприклад, біотином і після ампліфікації розміщення її у мікроплаті з антитільним або стрептавідиновим покриттям. Іншу затравку мітять репортером, наприклад, флуоресцеїном, і виявлення досягається через додання антифлуоресцеїнових антитіл, наприклад, кон'югату пероксидату редьки (HRP). Такий спосіб є менш специфічним, ніж використання проб виявлення з гібридизаційним визначенням ампліфікаційних продуктів. Системи пробників LCx (Abbott Laboratories, Abbott Park, IL) і Amplicor ВІЛ-1 test (Roche Molecular Sistems, Inc., Pleasanton, CA) є системами, що використовують гетерогенні способи виявлення. У системі LCx мічені гаптеном олігонуклеотидні проби термоциклюють у лігазній ланцюговій реакції. Гаптен захоплення або гаптен виявлення ковалентно приєднаний до кожної з 4 затравок олігонуклеотидів. Після ампліфікації кожний ампліфікований продукт (амфікон) має один гаптен захоплення і один гаптен виявлення. Після завершення ампліфікації, інструмент системи LCx переносить реакцію у нову комірку, де покриті антитілом мікрочастки зв'язують гаптени захоплення. Кожна мікрочастка потім незворотно з'єднується з скловолоконною матрицею. Промивання видаляє мікрочастки з будь-якої проби, яка містить лише гаптен виявлення. Інструмент LCx додає лужну фосфотазу (АР)-кон'югат антитіл, що приєднується до гаптену виявлення. Флуоригенним субстратом для АР є 4-метилумбеліферил. Дефосфорилювання 4-метилумбеліферилу дією АР перетворює його у 4-метилунбеліферон, який є флуоресцентом. Тест Amplicor ВІЛ-1 використовує формат EL1SA. Після ампліфікації PCR амплікон денатурують хімічно. Специфічні до амплікону олігонуклеотидні проби захоплюють 24 UA 98775 C2 5 10 15 20 25 30 35 40 45 50 55 денатуровані волокна у покриту мікроплату. Оператор змиває будь-які неінкорпоровані затравки і негібридизований матеріал і потім додає кон'югат авідин-HRP у кожну комірку. Цей кон'югат приєднується до міченого біотином амплікону, захопленого на платі. Потім оператор додає 3,3',5,5'-тетраметилбензидин (ТМВ), хромогенний субстрат HPR. Якщо присутній гідрогенпероксид, HRP окислює ТМВ. Сигнал визначають колорометрично. Гомогенне Виявлення: оскільки гібридизовані і негібридизовані проби виявлення не є фізично розділеними у гомогенних системах виявлення, ці способи меншої кількості операцій, ніж гетерогенні способи і тому є менш схильними до контамінації. Серед комерційних комплектів для використання гомогенного виявлення флуоресцентних і хемілюмінесцентних міток є система TaqMan (Applied Biosystems, Foster City, CA), система ВDПробникТесЕТ (Becton Dickinson, Franklin Lakes, NJ), система QPCR 5000 (Perkin-Elmer Corp., Norwalk, CT) і Hybridization Protection Analisis (Gen-Пробник, Inc., San Diego, CA). Система TaqMan виявляє амплікон у реальному часі. Проба виявлення, яка гібридизує до регіону усередині амплікону, містить донорну флуорову пробу, наприклад, флуоресцеїн на його кінці 5' і компонент гасіння, наприклад, родамін на кінці 3'. Коли компонент гасіння і флуорфор знаходяться на одному олігонуклеотиді, донорна флуоресценція пригнічується. Під час ампліфікації проба приєднується до об'єкту. Полімераза Taq витісняє і розщепляє пробу виявлення у процесі синтезу волокна заміщення. Розщеплення проби виявлення призводить до відділення флуорфору від компоненту гасіння і підвищує донорний сигнал флуоресценції. Протягом кожного циклу ампліфікаційного процес повторюється. Сигнал флуоресценції зростає з зростанням кількості амплікону. Молекулярні маяки також використовують гасильники і флуорофори. Маяками є проби, комплементарні до об'єктного амплікону, але містять короткі ділянки (приблизно 5 нуклеотидів) комплементарних олігонуклеотидів на кожному кінці. Кінці 5' і 3' маяків мічені флуорофором і гасильником, відповідно. Коли маяк не гібридизований до об'єкту, утворюється шпилькоподібна структура, яка вводить у контакт флуорофор і гасильник, що призводить до гасіння флуоресценції. Петлевий регіон містить регіон, комплементарний до амплікону. Після гібридизації до об'єкту така структура відкриває і гасильник, і флуорофор, забезпечуючи появу флуоресцентного сигналу. А флуорометр виміряє сигнал у реальному часі. Система BDProbeTecET використовує спосіб виявлення у реальному часі, в якому комбіновано аспекти TaqMan і молекулярних маяків. Проба має шпилькоподібну петльову структуру і містить флуоресцеїнові і родамінові мітки. У цій системі, однак, регіон, комплементарний до молекули об'єкту не лежить не у петлі, а у регіоні 3' відносно родамінової мітки. Замість послідовності, комплементарної до об'єкту, одноволоконна петля містить рестрикційний сайт для рестрикційного ензиму BsoBI. Одноволоконна послідовність не є субстратом для ензиму. Флуоресцеїнові і родамінові мітки є поряд одна з одною перед ампліфікацією і це гасить флуоресцеїнову флуоресценцію. Ампліфікація з зміщенням волокна перетворює пробу подвійно-волоконну молекулу. Рестрикційний ензим BsoBI може розщеплювати молекулу, розділяючи мітки і підвищуючи флуоресцентний сигнал. Система QPCR 5000 використовує електрохемілюмінесценцію з рутенієвими мітками і біотинізовану затравку. Після ампліфікації біотинові продукти захоплюються на покритих стрептавідином парамагнітних кульках. Ці кульки переносяться електрохімічним потоком клітин аспірацією і магнітно утримуються на поверхні електроду. Після електричної стимуляції мічена рутенієм проба випромінює світло. Hybridization Protection Analysis використовують у Gen-Probe неампліфікованому аналізі РАСЕ так, як в ампліфікованих аналізах М. tuberculosis і С. trachomatis. Виявлену олігонуклеотидну пробу у НРА мітять хемілюмінесцентним естером акридинію (АЕ) через зв'язкове плече. Гібридизація відбувається протягом 15 хвил. при 60 °C у тій же пробірці, де проходить ампліфікація. Селекційний реагент слабоосновний буферований розчин, доданий після гібридизації, гідролізує АЕ на будь-якій негібридизованій пробі, роблячи її нехемілюмінесцентною. АЕ гібридизованих пробах складається у меншій канавці подвійної спіралі, захищаючись від гідролізу селекційним реагентом. АЕ випромінює хемілюмінесцентний сигнал після гідролізу гідроген-пероксидом і потім гідроксидом натрію. Люмінометр реєструє хемілюмінесцентний сигнал протягом 2 сек. (період "без світла") і реєструє фотони у термінах відносних світлових одиниць (RLU). Структура проби виявлення є важливою в усіх методологіях, що використовують проби, для виявлення продуктів ампліфікації. Якісні проби виявлення гібридизують лише до конкретних продуктів ампліфікації і не гібридизують неспецифічних продуктів. Іншими ключовими факторами в оптимізації виявлення включають мічення проб і максимізація виходу зразків. 25 UA 98775 C2 5 10 15 20 25 30 35 40 45 50 55 60 Способи мічення і репортерні молекули. Проби виявлення можуть бути мічені декількома шляхами. Ензимне вбудовування Р або S у проби є найбільш поширеним способом ізотопного мічення. Після гібридизації і промивання сигнал виявляється на ауто-радіографічній плівці. Для проведення нерадіоактивного виявлення проби можуть бути мічені ензимно різними молекулами. Біотин може бути вбудований ензимно і потім виявлений кон'югованою з стрептавідином лужною фосфатазою з використанням субстратів АР, наприклад, 5-бром-4хлор-3-індолілфосфату (ВСІР) і нітроблакитного тетразолію (NBT). Хемілюмінесцентні субстрати, наприклад, Lumi-Phos 530 або Lumi-Phos Plus (Lumigen, SouТГФield, MI) також можуть бути використані з АР. Крім того, дигоксигенін-11-dUTP може бути вбудований ензимно у ДНК або РНК, а анти- дигоксигенінові кон'югати з АР можуть бути використані разом з колориметричним або хемілюмінесцентним виявленням. Існують численні інші типи репортерних молекул, включаючи хемілюмінесцентний компонент, наприклад, акродиній-естери. Флуоресцентні компоненти можуть бути використані також. Можуть бути також використані електрохемілюмінесцентні сполуки, наприклад, трис-(2,2'біпіридин)рутеній (II). Крім того, дискусії з цього приводу і подібні способи можна знайти у Schiff et al., Se хвил. Liver Dis., 1999, 79:Suppl. 1:3-15). Аналіз на біозасвоюваність у мавп Cynomolgus За 1 тиждень перед початком дослідження мавпам cynomolgus були хірургічно імплантовані хронічні венні катетери і підшкірні порти доступу до вени (VAP) для забезпечення відбору крові, і були проведені фізичні перевірки, включаючи гематологію і оцінюванні хімії сироватки, а також вагу тіла. Кожна мавпи (усього 6) отримує дозу активної сполуки 10 мг/кг при концентрації 5 мг/мл, внутрішньовенним болюсом (3 мавпи, IV) через пероральний зонд (3 мавпи, РО). Кожний дозувальний шприц зважували перед дозуванням для кількісного визначення введеної рецептури. Були взяті зразки сечі з заздалегідь визначеним інтервалом (приблизно 18-0 год. перед дозою, 0-4, 4-8 і 8-12 год. після дози) і оброблені. Зразки крові були взяті також (перед дозою, 0,25, 0,5, 1, 2, 3, 6, 8, 12 і 24 год. після дози) хронічним венним катетером і VAP або з периферійного резервуару, якщо процедура з хронічним венним катетером не є можливою. Зразки крові і сечі були аналізовані РХ/МС на максимальну концентрацію (С mах), час досягнення максимальної концентрації (Тmах), площі під кривою (AUC), напівжиття концентрації дози (Т>1/2), очищення (СІ), об'єм і розподілення у статичному стані і біозасвоюваність (F). Аналіз токсичності кісткового мозку Клітини кісткового мозку людини отримували від нормальних здорових волонтерів і мононуклеарна популяція була відділена градієнтною центрифугою Ficoll-Hypaque, як це описано у Sommadossi J-P, Carlisle R. "Токсичність 3'-азидо-3'-деокситимідину і 9-(1,3дигідрокси-2-пропоксиметил)гуаніну для отримання нормальних людських гематопоєтичних прогеніторних клітин in vitro. Anti microbial Agent and Chemotherapy, 1987; 31:452-454; і Sommadossi J-P, Schinazi RF, Chu CK, Xie M-Y. "Порівняння цитотоксичності (-)- і (+)енантіомеру 2',3'-дидеокси-3'-тіацитидину у прогеніторних клітинах нормального людського кісткового мозку", Biochemical Pharmacology 1992; 44:1921-1925. Аналізи культур для CFU-GM і BFU-E проводили, використовуючи двошаровий м'який агар або метилцелюлозу. Ліки розріджували середовищем тканинної культури і фільтрували. Через 14-18 днів при 37 °C у вологій атмосфері 5 % СО2 у повітрі були підраховані колонії з більш, як 50 клітинами, з використанням інвертованого мікроскопу. Результат репрезентовано як % пригнічення формування колонії у присутності ліків порівняно з контрольними культурами у розчиннику. Аналіз цитотоксичності 3 4 Клітини були посіяні у кількості від 5 × 10 до 5 × 10 /комірка у 96-комірковому планшеті у середовищі росту протягом ночі при 37 °C у вологій атмосфері СО2 (5 %). Додавали свіже середовище росту з ліками у послідовних розрідженнях. Після 4-денної інкубації культури фіксували у 50 % ТСА і мітили сульфородаміном. Оптичну щільність зчитували на 550 нм. Цитотоксичну концентрацію репрезентували як концентрацію, потрібну для зниження кількості клітин на 50 % (КК50). Аналіз захисту клітин (СРА) Цей аналіз проводили, по суті, як це описано у Baginski, S. G.; Pevear, D. С; Seipel, М; Sun, S. С. С; Benetatos, С. A.; Chunduru, S. К.; Rice, С. М., М. S. Collett "Mechanism of action of pestivirus antiviral compound" PNAS USA 2000, 97(14), 7981-7986. Ритиніб MDBK (ATCC) сіяли у 96-комірковому культурному планшеті (4000 клітин на комірку) за 24 год. перед використанням. Після інфікування BVDV (штам NADL, АТСС) на рівні інфекції (МОI) 0,02 одиниць утворення бляшок (PFU) на клітину були додані випробувані сполуки з послідовним розрідженням як до інфікованих, так і до неінфікованих клітин з кінцевою концентрацією 0,5 % ДМСО середовищі росту. Кожне розрідження тестували 4 рази Щільності клітин і інокулюємість вірусу коригували 26 UA 98775 C2 5 10 15 20 25 30 35 40 45 50 55 60 для забезпечення безперервного росту клітин протягом експерименту і отримання більше 90 % зруйнованих вірусом глітин у необробленому контролі через 4 дні після інфекції. Через 4 дні планшети фіксували 50 % ТСА і мітили сульфородаміном В. Оптичну щільність комірок виміряли мікроплатним зчитувачем на 550 нм. 50 %-но ефективну концентрацію (ІК50) визначали як концентрацію сполуки, як забезпечувала 50 %-не зниження цитопатичної дії вірусу. Аналіз на зменшення бляшок Для кожної сполуки ефективну концентрацію визначали у 2 дублюючих 24-коміркових планшетах аналізом на зменшення бляшок. Клітинні моношари інфікували 100 PFU/комірка вірусу. Потім до моношарів додавали тест-сполуку у послідовних розрідженнях у MEM з 2 % дезактивованої сироватки і 0,75 % метилцелюлози. Культури інкубували при 37 °C 3 дні, потім фіксували 50 %-м етанолом і 0,8 % Crystal Violet, промивали і сушили повітрям. Потім підраховували бляшки для визначення концентрації, яка дає 90 %-не пригнічення вірусу. Біологічна активність проти штамів ВІЛ, резистентних до ліків В одному з втілень ефективність анти-ВІЛ сполуки виміряють in vitro швидким чутливим автоматизованим аналізом, який включає зниження броміду 3-(4,5-диметилтіазол-2-іл)-2,5дифенілтетразолію (МТТ). Трансформовану ВІЛ клітинну лінію з високою толерантністю і селективністю до для ВІЛ-інфекції, наприклад, лінію Т-4, МТ-4, вибирають як об'єктну клітинну лінію (Koyanagi et al., Int. J.Cancer, 1985, 3*5:445-451). In situ зниження броміду 3-(4,5диметилтіазол-2-іл)-2,5-дифеніл-тетразолію (МТТ) оцінюють стандартною спектрофотометрією, визначаючи цим життєздатність як контрольних, так і інфікованих ВІЛ клітин. Кінцевим результатом є пригнічення викликаної ВІЛ цитопатичної дії. 50 %-на цитотоксична концентрація (КК50 у мкМ) визначається як концентрація сполуки, яка знижує оптичну щільність удавано інфікованого зразка на 50 %. Ефективність (у %) анти-ВІЛ сполуки обчислюють за формулою: (ОЩВІЛ-тестсполуки)=(ОЩконтроль)/(ОЩудавано інфікованих клітин)-(ОЩконтроль) Тут (ОЩВІЛ-тестсполуки) - оптична щільність, виміряна для певної кількості випробуваної сполуки у ВІЛ-інфікованих клітинах; (ОЩконтроль) - оптична щільність, виміряна для необроблених ВІЛінфікованих контрольних клітин; (ОЩудавано інфікованих клітин) - оптична щільність, виміряна для контрольних удавано інфікованих необроблених клітин. Оптичну щільність звичайно виміряють на 540 нм. Дозу анти-ВІЛ випробуваної сполуки, яка забезпечує 50 %-й захист згідно з наведеною формулою, визначають як 50 %-ну концентрацію інгібітору (ІК50 у мкМ). Індекс селективності (SI) визначають як відношення КК50 до ІК50. В іншому втіленні аналіз р24 EL1SA використано для визначення ефективності анти-ВІЛ сполуки. Цей вірусно-реплікаційний імуноаналіз виміряє кількість зовнішнього протеїнового покриття зрілого вірусу р24 (серцевина) у присутності антигену і є комерційно доступним, наприклад, від Coulter Corporation/lmmunotech, Inc.® (Westbrook, MІ). Інші втілення включають аналіз зворотної транскриптази, в якому кількість вірусних реплікацій виміряють з використанням системи затравок гомополімеру полі rA:oligo dT, яка кількісно оцінює проникнення у клітини тритіатованого тимідин-монофосфату підраховуванням сцинтиляцій (Southern Research Institute, University of Alabama, Birmingham, AL); аналіз пригнічення синцитію з використанням CEM-SS, HeLa-CD4 або клітин HeLa-СD4-LТР-bгалактозидази, який використовує імунофлуоресценцію, хемілюмінесценцію або колориметрію; і аналіз пригнічення приєднання і злиття з використанням індикаторних клітинних ліній і кількісним оцінюванням через хемілюмінесценцію, колориметрію або мікроскопію (Southern Research Institute, University of Alabama, Birmingham, AL). В одному з втілень індольні сполуки винаходу не виявляють перехресної резистентності з іншими ненуклеозидними інгібіторуми зворотної транскриптази (NNRTI), і сполуки винаходу показують ІК50 (у молярній концентрації) у мутантному штамі ВІЛ менше приблизно 50, 25, 10 або 1 мкМ. У типовому втіленні, NNRTI показує ІК50 для мутантного штаму ВІЛ менше приблизно 5, 2,5, 1 або 0,1 мкМ. Рівень перехресної резистентності резистентного до ліків штаму ВІЛ виміряють оцінюванням ІК50 бажаної оксо-піримідинової сполуки в об'єкті мутації, тобто резистентному до ліків вірусі. Фармацевтичні композиції Реципієнти, включаючи людину, інфіковані вірусом або у будь-якому іншому стані, описаному тут, можуть бути ліковані введенням пацієнту ефективної кількості активної сполуки або її фармацевтично прийнятної солі або проліків, як варіант, у присутності фармацевтично прийнятного носія або розріджувача. Ці сполуки можна вводити суб'єкту, що потребує цього, як варіант, у комбінації або переміжно з іншим терапевтичним агентом і/або з фармацевтично прийнятним носієм, розріджувачем або ексципієнтом. В одному з втілень суб'єкта, інфікованого ВІЛ, можна лікувати введенням ефективної кількості сполуки згідно з винаходом або її солі, 27 UA 98775 C2 5 10 15 20 25 30 35 40 45 50 55 проліків, стереоізомеру або таутомеру, у присутності фармацевтично прийнятного носія або розріджувача. Для суб'єктів з множинною резистентністю до ліків, фосфоіндольну сполуку вводять окремо або у комбінації х одним або більше іншими терапевтичними агентами. Активні сполуки можна вводити будь-яким шляхом, наприклад, перорально, парентерально, ентерально, внутрішньовенно, інтрадермально, підшкірно, трансдермально, інтраназально, топічно або інгаляцією, у твердій, рідкій або паровій формі. Активні сполуки в одному з втілень входять у склад фармацевтично прийнятного носія, розріджувача або ексципієнта у кількості, достатній для введення пацієнту терапевтично ефективної кількості активної сполуки для, наприклад, пригнічення вірусної інфекції без серйозної токсичної дії для пацієнта. "Інгібіторна кількість" включає кількість активного інгредієнту, достатня, щоб зупинити вірусну реплікацію, виміряну, наприклад, аналізами, наприклад, описаними вище. Типова доза сполуки може становити від приблизно 1 до приблизно 50 мг/кг, від приблизно 1 до приблизно 20 мг/кг маси тіла на день, взагалі від приблизно 0,1 до приблизно 100 мг/кг маси тіла реципієнта на день. Дози можуть бути нижчими, наприклад, приблизно 0,5-100 мг, 0,510 мг або 0,5-5 мг на кг маси тіла на день. Можуть бути корисними навіть ще нижчі дози, наприклад, приблизно 0,1-0,5 мг/кг на день. Межі ефективної дози фармацевтично прийнятних похідних визначають, базуючись на первісній індольній похідній сполуці, що має бути введена. Якщо похідна сполука виявляє активність, то ефективна доза може бути визначена з урахуванням маси похідної або в інший відомий спосіб. Сполуки зручно вводити будь-якими придатними одиничними дозованими формами, включаючи (не лише) такі, що містять приблизно 7-3000 мг, приблизно 70-1400 мг або приблизно 25-1000 мг активного інгредієнту в одиничній дозованій формі. Наприклад, звичайна пероральна доза становить приблизно 50-1000 мг і включає одну або декілька дозованих форм по 50, 100, 200, 250, 300, 400, 500, 600, 700, 800, 900 або 1000 мг. Можуть бути бажані менші дози, наприклад, приблизно 10-100 або 1-50 мг. Припустимими є дози 0,1-50 мг, 0,1-20 мг або 0,1-10 мг. Крім того, нижчі дози можуть бути бажаними при непероральному введенні, наприклад, ін'єкцією або інгаляцією. Активний інгредієнт можна вводи цілком або розділити на декілька менших доз і вводити з часовим інтервалом. Точна доза і тривалість лікування залежать від конкретної хвороби і можуть бути визначені емпірично з використанням відомих протоколів тестування або екстраполяцією даних, отриманих in vivo або in vitro. Слід відзначити, що концентрації і дози можуть також залежати від важкості стану, який підлягає лікуванню. Зрозуміло, що для будьякого конкретного суб'єкту режим дозування має коригуватись з часом згідно з індивідуальними потребами і професійними міркуваннями лікаря і наведені межі концентрацій є лише прикладами і не обмежують об'єму або застосувань запропонованих композицій. У деяких втіленнях, сполуки або композиції згідно з винаходом можна вводити як одиночну денну дозу або, бажано, як розділену дозу протягом дня. В окремих втіленнях сполуку або композицію вводять 4 рази на день, або 3 рази на день, або 2 рази на день. В окремих втіленнях сполуку або композицію вводять один раз на день. В одному з втілень активний інгредієнт вводять, щоб досягти піку плазмової концентрації активної сполуки приблизно 0,02-70 мкМ або приблизно 0,5-10 мкМ. Цього можна досягти, наприклад, внутрішньовенною ін'єкцією. 0,1-5 %-го розчину активного інгредієнту, як варіант, у фізіологічному розчині або введенням болюсом активного інгредієнту. Зрозуміло, що для будьякого конкретного суб'єкту режим дозування має коригуватись з часом згідно з індивідуальними потребами і може змінюватись залежно від абсорбції, дезактивації і екскреції ліків. Наведенні тут концентрації є лише прикладами і не обмежують застосувань композиції згідно з винаходом. Активний інгредієнт можна вводи цілком або розділити на декілька менших доз і вводити з різними часовими інтервалами. Одним з способів введення активної сполуки є пероральний. Пероральні композиції звичайно включають інертний розріджувач або їстівний носій. Вони можуть бути розміщені у желатинових капсулах, спресовані у таблетки або вводитись у рідкій формі. Для орального терапевтичного введення активна сполука може бути змішана з ексципієнтами і виготовлена як тверда дисперсія або розчин і використана у формі таблеток, коржиків або капсул. "Твердою дисперсією" називають тверду речовину, яка включає щонайменше два компоненти, з яких один диспергований більш-менш однорідно у другому. "Твердим розчином" називають тверду речовину, що має щонайменше два компоненти, хімічно і фізично об'єднані з утворенням гомогенного продукту. Твердий розчин звичайно є бажанішим за тверду дисперсію, оскільки з більшою легкістю утворює рідкий розчин при контакті з належним рідким середовищем і цим 28
ДивитисяДодаткова інформація
Назва патенту англійськоюEnantiomerically pure phosphoindoles as hiv inhibitors
Автори англійськоюStorer Richard, Alexandre, Francois-Rene, Dousson Cyril, Moussa, Adel, M., Bridges, Edward
Назва патенту російськоюЭнантиомерно чистые фосфоиндолы как ингибиторы вич
Автори російськоюСторер Ричард, Александр Франсуа-Рене, Дуссон Сирил, Мусса Адель М., Бриджес Эдвард
МПК / Мітки
МПК: A61K 31/675, C07F 9/572, A61P 31/18
Мітки: віл, енантіомерно, чисті, фосфоіндоли, інгібітори
Код посилання
<a href="https://ua.patents.su/102-98775-enantiomerno-chisti-fosfoindoli-yak-ingibitori-vil.html" target="_blank" rel="follow" title="База патентів України">Енантіомерно чисті фосфоіндоли як інгібітори віл</a>
Попередній патент: Пристрій для магнітної терапії з комбінованим магнітним полем
Наступний патент: Спосіб доставки лікарського препарату для посилення синтезу білка в кістках
Випадковий патент: Перетворювач динамічних векторів взаємодії пневмоколіс транспортного засобу з покриттям автошляхів у електричні величини (перетворювач рахубовського)