Амінопіразол триазолотіадіазольні інгібітори протеїнкінази c-мет
Формула / Реферат
1. Сполука, що має формулу:
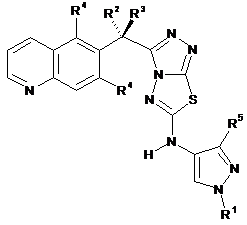 , (I)
, (I)
або її фармацевтично прийнятна сіль, в якій:
R1 являє собою С1-3аліфатичну групу;
R2 являє собою водень, фтор або метил;
R3 являє собою водень, фтор або метил;
кожний R4 являє собою незалежно водень або фтор; і
R5 являє собою водень, хлор, циклопропіл або С1-4аліфатичну групу, необов'язково заміщену 1-3 атомами фтору.
2. Сполука за п. 1, в якій R2 являє собою метил і R3 являє собою водень.
3. Сполука за п. 2, в якій R1 являє собою метил і R5 являє собою водень.
4. Сполука за п. 1, в якій R2 являє собою водень і R3 являє собою метил.
5. Сполука за п. 4, в якій R1 являє собою метил і R5 являє собою водень.
6. Сполука за п. 1, в якій кожен з R2 і R3 являє собою фтор.
7. Сполука за п. 6, в якій R1 являє собою метил і R5 являє собою водень.
8. Сполука за будь-яким одним з пп. 1-7, в якій R4 являє собою водень.
9. Сполука за будь-яким одним з пп. 1-7, в якій R4 являє собою фтор.
10. Сполука за п. 1, що вибрана з групи:
 ,
,  ,
,
 ,
,  ,
,
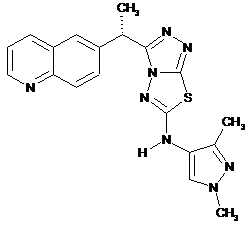 або
або 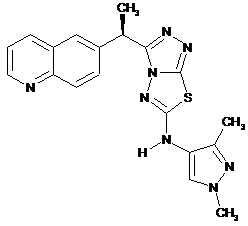 .
.
11. Сполука за п. 1, яка має наступну структуру:
 або
або 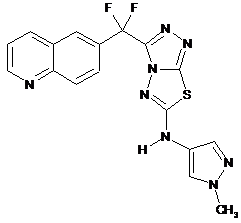 .
.
12. Фармацевтична композиція, що містить сполуку за п. 1 або її фармацевтично прийнятну сіль і фармацевтично прийнятний носій, ад'ювант або наповнювач.
13. Композиція за п. 12, що додатково містить хіміотерапевтичний або антипроліферативний агент, протизапальний агент, агент для лікування атеросклерозу або агент для лікування фіброзу легенів.
14. Застосування сполуки за будь-яким з пп. 1-11 при одержанні лікарського засобу для лікування або зменшення ступеня тяжкості проліферативного порушення у пацієнта.
15. Застосування за п. 14, в якому вказане порушення являє собою метастатичний рак.
16. Застосування за п. 14, в якому вказане порушення являє собою гліобластому, карциному шлунка або рак, вибраний з раку товстої кишки, грудей, простати, мозку, печінки, підшлункової залози або легені.
17. Застосування за п. 14, в якому вказане порушення являє собою гепатоцелюлярну карциному.
Текст
Реферат: Даний винахід стосується сполук формули (І), які є придатними для інгібування протеїнкінази cMet. Винахід також стосується фармацевтично прийнятної композиції, що містить сполуки формули (І), і способу застосування композицій при лікуванні проліферативних порушень. UA 106082 C2 (12) UA 106082 C2 UA 106082 C2 5 10 15 20 25 ГАЛУЗЬ ТЕХНІКИ, ЯКОЇ СТОСУЄТЬСЯ ВИНАХІД Даний винахід стосується селективних інгібіторів c-Met. Винахід також забезпечує фармацевтично прийнятні композиції, що містять інгібітор c-Met, і способи застосування композицій при лікуванні різних проліферативних порушень. РІВЕНЬ ТЕХНІКИ Фактор росту гепатоцитів (HGF), також відомий як розсіюючий фактор, являє собою багатофункціональний фактор росту, який збільшує перетворення і розвиток пухлини, викликаючи мітогенез і рухливість клітин. Додатково HGF забезпечує метастаз, стимулюючи рухливість клітини та інвазію за допомогою різних сигнальних шляхів. Для одержання клітинних ефектів HGF повинен зв'язатися з його рецептором, рецептором тирозинкінази c-Met. c-Met, широко експресований гетеродимерний протеїн, що містить 50 кілодальтон (кДа) α-субодиниці і 145 кДа альфа-субодиниці (Maggiora et al., J. Cell Physiol., 173:183-186, 1997), надекспресований у значному процентному співвідношенні ракових утворень людини і ампліфікується протягом переходу між первинними пухлинами і метастазами. Різні ракові утворення, з якими пов'язана надекспресія c-Met, включають, але не обмежуються ними, аденокарциному шлунка, рак нирок, дрібноклітинний рак легені, колоректальний рак, рак простати, рак мозку, рак печінки, рак підшлункової залози і рак грудей. c-Met також пов'язаний з атеросклерозом і фіброзом легенів. Відповідно, існує велика потреба у розвитку сполук, придатних як інгібітори рецептора протеїнкінази c-Met. Зокрема, переважні сполуки повинні мати високу афінність до рецептора cMet і проявляти функціональну активність як антагоністи, при цьому маючи невелику афінність до інших рецепторів кінази або цілей, які, як відомо, пов'язані з побічними ефектами. СУТЬ ВИНАХОДУ Було виявлено, що 3-(хінолін-6-іл)метил-N-(1H-пірол-3-іл)-[1,2,4]триазоло[3,4b][1,3,4]тіадіазол-6-аміни ефективні при інгібуванні c-Met. Відповідно, винахід забезпечує сполуку, що має формулу: 1 30 35 40 45 2 3 4 5 або її фармацевтично прийнятну сіль, в якій кожний R , R , R , R і R являє собою, як визначено в іншому місці у даному описі. Винахід також забезпечує фармацевтичні композиції, які включають сполуку формули I і фармацевтично прийнятний носій, ад'ювант або наповнювач. Крім того, винахід забезпечує способи лікування або зменшення ступеню тяжкості проліферативного захворювання, стану або порушення у пацієнта, які включають стадію введення пацієнту терапевтично ефективної дози сполуки формули I або її фармацевтичної композиції. ДОКЛАДНИЙ ОПИС ВИНАХОДУ Визначення і загальна термінологія Потрібно застосовувати використовувані у даному описі наведені нижче визначення, якщо не вказано інакше. У даному винаході хімічні елементи ідентифіковані відповідно до th Періодичної Системи Хімічних Елементів, версії CAS і Handbook of Chemistry and Physics, 75 Ed. 1994. Додатково, загальні принципи органічної хімії описані в "Organic Chemistry", Thomas th Sorrell, University Science Books, Sausalito: 1999 і "March's Advanced Organic Chemistry", 5 Ed., Smith, M.B. and March, J., eds. John Wiley & Sons, New York: 2001, весь зміст яких включений у даний опис у повному обсязі за допомогою посилання. Опис сполуки винаходу У першому аспекті винахід забезпечує наведені нижче сполуки формули I: 1 UA 106082 C2 5 10 15 або їх фармацевтично прийнятну сіль, де: 1 R являє собою C1-3аліфатичну групу; 2 R являє собою водень, фтор або метил; 3 R являє собою водень, фтор або метил; 4 кожний R являє собою незалежно водень або фтор; і 5 R являє собою водень, хлор, циклопропіл або C 1-4аліфатичну групу, необов'язково заміщену 1-3 атомами фтору. 2 3 В одному варіанті здійснення R являє собою метил і R являє собою водень. В іншому 2 3 варіанті здійснення R являє собою водень і R являє собою метил. 2 3 В іншому варіанті здійснення кожний з R і R являє собою фтор. 4 В іншому варіанті здійснення сполук винаходу R являє собою водень. 1 5 В іншому варіанті здійснення сполук винаходу R являє собою метил і R являє собою водень. 1 2 3 У додатковому варіанті здійснення R являє собою метил, кожний з R і R являє собою 4 5 фтор і кожний з R і R являє собою водень. В іншому варіанті здійснення сполука являє собою сіль гідрохлориду. Сполуки формули I включають наведені нижче: 2 UA 106082 C2 5 10 15 В іншому аспекті винахід забезпечує фармацевтичну композицію, що містить сполуку формули I або її фармацевтично прийнятну сіль і фармацевтично прийнятний носій, ад'ювант або наповнювач. В одному варіанті здійснення композиція містить додатковий хіміотерапевтичний або антипроліферативний агент, протизапальний агент, агент для лікування атеросклерозу або агент для лікування фіброзу легенів. В іншому аспекті винахід забезпечує спосіб лікування або зменшення ступеню тяжкості проліферативного порушення у пацієнта, що включає введення сполуки формули I у кількості, достатній для лікування або зменшення ступеню тяжкості проліферативного порушення у вказаного пацієнта. В одному варіанті здійснення проліферативне порушення являє собою метастатичний рак. В іншому варіанті здійснення проліферативне порушення являє собою гліобластому; гепатоцелюлярну карциному, карциному шлунка; або рак, вибраний з раку товстої кишки, грудей, простати, мозку, печінки, підшлункової залози або легені. В іншому варіанті здійснення проліферативне порушення являє собою метастатичний рак. 3 UA 106082 C2 5 10 15 20 25 30 35 40 45 50 55 60 Композиції, склади і введення сполук винаходу В іншому аспекті винахід забезпечує композицію, що містить сполуку формули I або її фармацевтично прийнятне похідне і фармацевтично прийнятний носій, ад'ювант або наповнювач. В одному варіанті здійснення кількість сполуки у композиції даного винаходу являє собою таку, яка є ефективною певною мірою для інгібування c-Met у біологічному зразку або у пацієнта. Переважно композицію даного винаходу одержують для введення пацієнту, який потребує такої композиції. Найбільш переважно композицію даного винаходу одержують для перорального введення пацієнту. Використовуваний у даному описі термін "пацієнт" означає тварину, переважно ссавця і найбільш переважно людину. Потрібно також зазначити, що сполуки формули I можуть існувати у вільній формі для лікування або, за необхідності, як їх фармацевтично прийнятне похідне. Відповідно до даного винаходу, фармацевтично прийнятне похідне включає, але не обмежується ними, фармацевтично прийнятні проліки, солі, складні ефіри, солі таких складних ефірів або будьякий інший адукт або похідне, яке при введенні пацієнту, який потребує такого лікування, є здатним до одержання, безпосередньо або опосередковано, сполуки формули I, як інакше описано у даному винаході, або її метаболіту, або залишку. Використовуваний у даному описі термін "фармацевтично прийнятна сіль" стосується таких солей, які у рамках результатів ретельної медичної оцінки є придатними для застосування при взаємодії з тканинами людей і нижчих тварин без неспецифічної токсичності, хворобливої чутливості, алергічної відповіді і подібного. Фармацевтично прийнятні солі добре відомі у даній галузі техніки. Наприклад, S. М. Berge та ін. описують фармацевтично прийнятні солі детально у J. Pharmaceutical Sciences, 66:1-19, 1977, який включений у даний опис за допомогою посилання. Фармацевтично прийнятні солі сполук формули I включають одержані з придатних неорганічних і органічних кислот і основ. Приклади фармацевтично прийнятних нетоксичних кислотно-адитивних солей являють собою солі аміногрупи, одержані з неорганічними кислотами, такими як хлористоводнева кислота, бромистоводнева кислота, фосфорна кислота, сірчана кислота і хлорна кислота, або з органічними кислотами, такими як оцтова кислота, щавлева кислота, малеїнова кислота, винна кислота, лимонна кислота, бурштинова кислота або малонова кислота, або при використанні інших способів, що застосовуються у даній галузі техніки, таких як іонний обмін. Інші фармацевтично прийнятні солі включають адипат, альгінат, аскорбат, аспартат, бензолсульфонат, бензоат, бісульфат, борат, бутират, камфорат, камфорсульфонат, цитрат, циклопентанпропіонат, диглюконат, додецилсульфат, етансульфонат, форміат, фумарат, глюкогептонат, гліцерофосфат, глюконат, гемісульфат, гептаноат, гексаноат, гідройодид, 2гідроксіетансульфонат, лактобіонат, лактат, лаурат, лаурилсульфат, малат, малеат, малонат, метансульфонат, 2-нафталінсульфонат, нікотинат, нітрат, олеат, оксалат, пальмітат, памоат, пектинат, персульфат, 3-фенілпропіонат, фосфат, пікрат, півалат, пропіонат, стеарат, сукцинат, сульфат, тартрат, тіоціанат, п-толуолсульфонат, ундеканоат, валерат солі і подібні. Солі, одержані з відповідних основ, включають солі лужного металу, лужноземельного металу, + амонію і N (C1-4алкілу)4. Вище описано, що фармацевтично прийнятні композиції даного винаходу додатково включають фармацевтично прийнятний носій, ад'ювант або наповнювач, який, як використовується у даному описі, включає різноманітні розчинники, розріджувачі або інші рідкі наповнювачі, дисперсійні або суспензійні допоміжні засоби, поверхнево-активні речовини, ізотонічні агенти, агенти, що загущують, або емульгувальні агенти, консерванти, тверді зв'язувальні речовини, змащувальні речовини і подібні, як придатні для визначеної бажаної st форми дозування. У Remington: The Science and Practice of Pharmacy, 21 edition, 2005, ed. D.B. Troy, Lippincott Williams & Wilkins, Philadelphia і Encyclopedia of Pharmaceutical Technology, eds. J. Swarbrick and J. C. Boylan, 1988-1999, Marcel Dekker, New York, зміст кожного з яких включений у даний опис за допомогою посилання, розкриті різні носії, що використовуються у складі фармацевтично прийнятних композицій, і відомі методики їх одержання. За винятком випадків, коли будь-яке стандартне середовище носія є несумісним зі сполукою формули I, як таке, що спричиняє будь-який небажаний біологічний ефект або взаємодіє у шкідливій манері з будьяким іншим компонентом(ами) фармацевтично прийнятної композиції, його використання розглядають як таке, що знаходиться в об'ємі даного винаходу. Деякі приклади матеріалів, які можуть служити як фармацевтично прийнятні носії, включають, але не обмежуються ними, іонообмінну смолу, оксид алюмінію, стеарат алюмінію, лецитин, сироваткові білки, такі як людський сироватковий альбумін, буферні речовини, такі як фосфати, гліцин, сорбінова кислота або сорбат калію, суміші неповних гліцеридів насичених 4 UA 106082 C2 5 10 15 20 25 30 35 40 45 50 55 60 рослинних жирних кислот, воду, солі або електроліти, такі як протамінсульфат, гідрофосфат натрію, гідрофосфат калію, хлорид натрію, солі цинку, діоксид кремнію, трисилікат магнію, полівінілпіролідон, поліакрилати, воски, блок полімери поліетилен-поліоксипропілен, ланолін, цукри, такі як лактоза, глюкоза і сахароза; крохмалі, такі як кукурудзяний крохмаль і картопляний крохмаль; целюлозу і її похідні, такі як натрій карбоксиметилцелюлоза, етилцелюлоза і ацетат целюлози; порошковий трагакант; солод; желатин; тальк; ексципієнти, такі як масло какао і воски для супозиторію; олії, такі як арахісова олія, бавовняна олія; сафлорова олія; сезамова олія; оливкова олія; кукурудзяна олія і соєва олія; гліколі; такі як пропіленгліколь або поліетиленгліколь; складні ефіри, такі як етилолеат і етиллаурат; агар; буферні агенти, такі як гідроксид магнію і гідроксид алюмінію; альгінову кислоту; апірогену воду; ізотонічний сольовий розчин; розчин Рінгера; етиловий спирт і фосфатні буферні розчини, так само як інші нетоксичні сумісні змащувальні речовини, такі як лаурилсульфат натрію і стеарат магнію, так само як барвники, вивільняючі агенти, покривні агенти, підсолоджуючі агенти, ароматизатори і ароматизуючі домішки, консерванти і антиоксиданти можуть також бути присутніми у композиції відповідно до рішення розробника рецептур. Композиції даного винаходу можуть вводитися перорально, парентерально, за допомогою інгаляції, місцево, ректально, назально, букально, вагінально або за допомогою імплантованого резервуара. Використовуваний у даному описі термін "парентеральний" включає підшкірну, внутрішньовенну, внутрішньом'язову, внутрішньосуглобову, інтрасиновіальну, надчеревну, інтратекальну, внутрішньоочну, внутрішньопечінкову, таку, що вводиться всередину уражених тканин, і внутрішньочерепну ін'єкцію або методи інфузії. Переважно композиції вводять перорально, внутрішньочеревинно або внутрішньовенно. Стерильні ін'єкційні форми композицій даного винаходу можуть бути водною або маслянистою суспензією. Ці суспензії одержують відповідно до способів, відомих у даній галузі техніки, використовуючи придатні диспергуючі або змочувальні агенти і суспендуючі агенти. Стерильний ін'єкційний лікарський засіб може також бути стерильним ін'єкційним розчином або суспензією у нетоксичному парентерально прийнятному розріджувачі або розчиннику, наприклад, як розчин в 1,3-бутандіолі. Серед прийнятних наповнювачів і розчинників, які можуть застосовуватися, знаходяться вода, розчин Рінгера та ізотонічний розчин хлориду натрію. Крім того, стерильні нелеткі масла традиційно використовують як розчинник або суспендуюче середовище. З цією метою можуть використовуватися будь-які м'які нелеткі масла, включаючи синтетичні моно- або дигліцериди. Жирні кислоти, такі як олеїнова кислота і її похідні гліцериди, придатні при одержанні ін'єкційних лікарських засобів, оскільки являють собою природні фармацевтично прийнятні олії, такі як оливкова олія або рицинова олія, особливо в їх поліоксіетилованих варіантах. Ці масляні розчини або суспензії можуть також містити довголанцюжковий спиртовий розріджувач або диспергуючу речовину, таку як карбоксиметилцелюлоза або подібні диспергуючі агенти, які звичайно використовують у складі фармацевтично прийнятних форм дозування, включаючи емульсії і суспензії. Інші звичайно використовувані поверхнево-активні речовини, такі як твіни, спани та інші емульгувальні агенти або агенти, що збільшують біодоступність, які звичайно використовують при одержанні фармацевтично прийнятної твердої речовини, рідини або інших форм дозування, можуть також застосовувати для цілей складу. Фармацевтично прийнятні композиції даного винаходу можуть вводитися перорально у будь-якій перорально прийнятній формі дозування, включаючи, але не обмежуючись ними, капсули, таблетки, водні суспензії або розчини. У випадку таблеток для перорального застосування, стандартно використовувані носії включають лактозу і кукурудзяний крохмаль. Також звичайно додають ковзні речовини, такі як стеарат магнію. Для перорального введення у формі капсул придатні розріджувачі включають лактозу і висушений кукурудзяний крохмаль. Коли потрібні водні суспензії для перорального застосування, активний інгредієнт об'єднують з емульгувальними і суспендуючими агентами. За бажанням можуть також додаватися визначені підсолоджуючі агенти, ароматизатори або барвники. Альтернативно, фармацевтично прийнятні композиції даного винаходу можуть вводитися у формі супозиторіїв для ректального введення. Вони можуть бути одержані за допомогою змішування агента з придатним не подразнюючим ексципієнтом, який являє собою тверду речовину при кімнатній температурі, але є рідиною при ректальній температурі і отже буде танути у прямій кишці для вивільнення лікарського засобу. Такі матеріали включають олію какао, віск і поліетиленгліколі. Фармацевтично прийнятні композиції даного винаходу можуть також вводитися місцево, особливо коли мета лікування включає області або органи, легко доступні для місцевого застосування, включаючи захворювання очей, шкіри або нижньої частини кишечнику. Придатні місцеві склади легко одержують для кожної(го) з цих областей або органів. 5 UA 106082 C2 5 10 15 20 25 30 35 40 45 50 55 60 Місцеве застосування для нижньої частини кишечнику може здійснюватися у складі ректального супозиторію (див. вище) або у складі придатної клізми. Можуть також застосовуватися місцево-трансдермальні пластирі. Для місцевого застосування фармацевтично прийнятні композиції можна одержати у формі придатної мазі, що містить активний компонент, суспендований або розчинений в одному або більше носіях. Носії для місцевого введення сполук формули I включають, але не обмежуються ними, мінеральне масло, рідкий петролатум, білий петролатум, пропіленгліколь, поліоксіетилен, сполуку поліоксипропілену, емульгувальний віск і воду. Альтернативно, фармацевтично прийнятні композиції можна одержати у формі придатного лосьйону або крему, що містить активні компоненти, суспендовані або розчинені в одному або більше фармацевтично прийнятних носіях. Придатні носії включають, але не обмежуються ними, мінеральне масло, сорбітан моностеарат, полісорбат 60, цетиловий складноефірний віск, цетеариловий спирт, 2октилдодеканол, бензиловий спирт і воду. Для офтальмологічного застосування фармацевтично прийнятні композиції можна одержати, наприклад, у вигляді тонкодисперсних суспензій в ізотонічному з встановленим pH стерильному сольовому розчині або іншому водному розчині, або, переважно, у вигляді розчинів в ізотонічному з встановленим pH стерильному сольовому розчині або іншому водному розчині; у присутності або за відсутності консерванту, такого як бензилалконію хлорид. Альтернативно, для офтальмологічних застосувань фармацевтично прийнятні композиції можна одержати у формі мазі, такої як петролатум. Фармацевтично прийнятні композиції даного винаходу можуть також вводитися за допомогою назального аерозолю або інгаляції. Такі композиції одержують відповідно до методів, добре відомих у галузі фармацевтичних складів, і можна одержати як розчини у сольовому розчині, використовуючи бензиловий спирт або інші придатні консерванти, що сприяють абсорбції речовини для збільшення біодоступності, фторвуглеці і/або інші стандартні солюбілізуючі або диспергуючі агенти. Найбільш переважно фармацевтично прийнятні композиції даного винаходу одержують для перорального введення. Рідкі форми дозування для перорального введення включають, але не обмежуються ними, фармацевтично прийнятні емульсії, мікроемульсії, розчини, суспензії, сиропи і еліксири. На додаток до активних сполук, рідкі форми дозування можуть містити інертні розріджувачі, що звичайно використовуються у даній галузі техніки, такі як, наприклад, вода або інші розчинники, солюбілізуючі агенти і емульгувальні агенти, такі як етиловий спирт, ізопропіловий спирт, етилкарбонат, етилацетат, бензиловий спирт, бензилбензоат, пропіленгліколь, 1,3бутиленгліколь, диметилформамід, олії (зокрема, бавовняна, арахісова, кукурудзяна, зародкова, оливкова, рицинова і сезамова олії), гліцерин, тетрагідрофурфуриловий спирт, поліетиленгліколь і складні ефіри сорбітану і жирних кислот, і їх суміші. Крім інертних розріджувачів, пероральні композиції можуть також включати ад'юванти, такі як змочувальні агенти, емульгувальні і суспендуючі агенти, підсолоджуючі агенти, ароматизатори і ароматизуючі агенти. Ін'єкційні лікарські засоби, наприклад, стерильні ін'єкційні водні або маслянисті суспензії, можна одержати відповідно до способу, відомого у даній галузі техніки, використовуючи придатні диспергуючі або змочувальні агенти і суспендуючі агенти. Стерильний ін'єкційний лікарський засіб може також бути стерильним ін'єкційним розчином, суспензією або емульсією у нетоксичному парентерально прийнятному розріджувачі або розчиннику, наприклад, як розчин в 1,3-бутандіолі. Серед прийнятних наповнювачів і розчинників, які можуть застосовуватися, знаходяться вода, розчин Рінгера, U.S.P. та ізотонічний розчин хлориду натрію. Крім того, стерильні нелеткі масла традиційно використовують як розчинник або суспендуюче середовище. З цією метою можуть використовуватися будь-які м'які нелеткі масла, включаючи синтетичні моно- або дигліцериди. Крім того, жирні кислоти, такі як олеїнова кислота, використовують при одержанні ін'єкційних лікарських засобів. Ін'єкційні склади можна стерилізувати, наприклад, за допомогою фільтрування через стримуючий бактерії фільтр або за допомогою введення стерилізуючих агентів у формі стерильних твердих композицій, які можуть бути розчинені або дисперговані у стерильній воді або іншому стерильному ін'єкційному середовищі до використання. Для продовження ефекту сполуки формули I часто бажано сповільнити абсорбцію цієї сполуки з підшкірної або внутрішньом'язової ін'єкції. Цього можна досягти за допомогою використання рідкої суспензії кристалічного або аморфного матеріалу з поганою розчинністю у воді. Швидкість абсорбції сполуки формули I тоді залежить від її швидкості розчинення, яка, у свою чергу, може залежати від розміру кристалів і кристалічної форми. Альтернативно, розчинення або суспендування сполуки формули I у маслянистому наповнювачі забезпечує 6 UA 106082 C2 5 10 15 20 25 30 35 40 45 50 55 60 уповільнену абсорбцію парентерально форми сполуки, що вводиться. Ін'єкційні форми депо одержують за допомогою утворення мікроінкапсульованих матриць сполуки формули I у біорозкладаних полімерах, таких як полілактид-полігліколід. Залежно від співвідношення сполуки до полімеру і природи застосовуваного визначеного полімеру, можна контролювати швидкість вивільнення сполуки. Приклади інших біорозкладаних полімерів включають полі(ортоефіри) і полі(ангідриди). Ін'єкційні склади депо також одержують за допомогою захоплення сполуки формули I у ліпосомах або мікроемульсіях, які є сумісними з тканинами тіла. Композиції для ректального або вагінального введення являють собою переважно супозиторії, які можна одержати за допомогою змішування сполуки формули I з придатними не подразнюючими ексципієнтами або носіями, такими як масло какао, поліетиленгліколь або віск для супозиторіїв, які являють собою тверді речовини при температурі навколишнього середовища, але є рідинами при температурі тіла і, отже, тануть у прямій кишці або вагінальній порожнині і вивільняють активну сполуку. Тверді форми дозування для перорального введення включають капсули, таблетки, пілюлі, порошки і гранули. У таких твердих формах дозування активну сполуку змішують щонайменше з одним інертним фармацевтично прийнятним ексципієнтом або носієм, таким як цитрат натрію або фосфат дикальцію і/або a) наповнювачами або обважнювачами, такими як крохмаль, лактоза, сахароза, глюкоза, маніт і кремнієва кислота, b) зв'язувальними речовинами, такими як, наприклад, карбоксиметилцелюлоза, альгінати, желатин, полівінілпіролідон, сахароза і акація, с) зволожуючими речовинами, такими як гліцерин, d) дезінтегруючими агентами, такими як агар-агар, карбонат кальцію, картопляний або маніоковий крохмаль, альгінова кислота, визначені силікати і карбонат натрію, е) агентами, що сповільнюють розчинення, такими як парафін, f) агентами, що прискорюють абсорбцію, такими як сполуки четвертинного амонію, g) змочувальними агентами, такими як, наприклад, цетиловий спирт і моностеарат гліцерину, h) абсорбентами, такими як каолін і бентонітова глина та i) ковзними агентами, такими як тальк, стеарат кальцію, стеарат магнію, тверді поліетиленгліколі, лаурилсульфат натрію і їх суміші. У випадку капсул, таблеток і пілюль, форма дозування може також включати буферні агенти. Тверді композиції подібного типу можуть також використовуватися як наповнювачі у м'яких і твердо-заповнених желатинових капсулах, використовуючи такі ексципієнти як лактоза або молочний цукор, так само як поліетиленгліколі з високою молекулярною масою і подібні. Тверді форми дозування таблеток, драже, капсул, пілюль і гранул можна одержати з покриттями і оболонками, такими як ентеросолюбільні покриття та інші покриття, добре відомі у галузі фармацевтичних складів. Вони можуть необов'язково містити рентгеноконтрастні агенти і можуть також бути з композиції, з якої вони вивільняють активний інгредієнт(и) тільки, або переважно, у визначеній частині кишкового тракту, необов'язково, уповільненим способом. Приклади капсулюючих композицій, які можна використовувати, включають полімерні речовини і воски. Тверді композиції подібного типу можна також використовувати як наповнювачі у м'яких і твердо-заповнених желатинових капсулах, використовуючи такі ексципієнти як лактоза або молочний цукор, так само як поліетиленгліколі з високою молекулярною масою і подібні. Активні сполуки можуть також бути у мікроінкапсульованій формі з одним або більше ексципієнтами, як зазначено вище. Тверді форми дозування таблеток, драже, капсул, пілюль і гранул можна одержати з покриттями і оболонками, такими як ентеросолюбільні покриття, покриття, що контролюють вивільнення, та інші покриття, добре відомі у галузі фармацевтичних складів. У таких твердих формах дозування активну сполуку можна змішати щонайменше з одним інертним розріджувачем, таким як сахароза, лактоза або крохмаль. Такі форми дозування можуть також містити, що є звичайною практикою, додаткові речовини, крім інертних розріджувачів, наприклад, таблетуючі ковзні речовини та інші таблетуючі допоміжні речовини, такі як стеарат магнію і мікрокристалічна целюлоза. У випадку капсул, таблеток і пілюль, форми дозування можуть також містити буферні агенти. Вони можуть необов'язково містити рентгеноконтрастні агенти і можуть також бути з композиції, з якої вони вивільняють активний інгредієнт(и) тільки, або переважно, у визначеній частині кишкового тракту, необов'язково, уповільненим способом. Приклади капсулюючих композицій, які можна використовувати, включають полімерні речовини і воски. Форми дозування для місцевого або трансдермального введення сполуки формули I включають мазі, пасти, креми, лосьйони, гелі, порошки, розчини, спреї, інгалятори або пластирі. Активний компонент змішують при стерильних умовах з фармацевтично прийнятним носієм і будь-якими необхідними консервантами або буферними агентами, як може бути потрібно. Офтальмологічний склад, вушні краплі і очні краплі також розглядають у рамках даного винаходу. Додатково, даний винахід розглядає використання трансдермальних пластирів, які 7 UA 106082 C2 5 10 15 20 25 30 35 40 45 50 55 60 мають додаткову перевагу забезпечення контрольованої доставки сполуки формули I до тіла. Такі форми дозування можна одержати за допомогою розчинення або розподілу сполуки формули I у відповідному середовищі. Агенти, що посилюють абсорбцію, можуть також використовуватися для збільшення потоку сполуки формули I через шкіру. Швидкість можна контролювати або за допомогою забезпечення мембрани, що контролює швидкість, або за допомогою диспергування сполуки формули I у полімерній матриці або гелі. Сполуки формули I переважно одержують у формі одиниці дозування для простоти введення і однорідності дозування. Використовуваний у даному описі вираз "форма одиниці дозування" стосується фізично дискретної одиниці агента, відповідного для пацієнта, якого лікують. Потрібно розуміти, однак, що повне щоденне застосування сполуки формули I і композицій, що містять сполуку формули I, буде вирішено лікуючим лікарем за результатами ретельної медичної оцінки. Визначений ефективний рівень дози для будь-якого визначеного пацієнта або організму буде залежати від різноманітності факторів, включаючи порушення, яке лікують, і ступінь тяжкості порушення; активність визначеної застосовуваної сполуки; визначену застосовувану сполуку; вік, масу тіла, загальний стан здоров'я, стать і режим харчування пацієнта; час введення, шлях введення і швидкість екскреції визначеної застосовуваної сполуки; тривалість лікування; лікарські засоби, що використовуються у комбінації або співпадають з визначеною застосовуваною сполукою, і подібні фактори, добре відомі у галузі медицини. Кількість сполуки формули I, яку можна об'єднати з матеріалами носія для одержання композиції в одиничній формі дозування, буде змінюватися залежно від хазяїна, якого лікують, визначеного режиму введення. Переважно композиції повинні бути складені так, що дозування від 0,01 до 100 мг/кг маси тіла/добу інгібітору можна вводити пацієнту, який одержує ці композиції. В одному прикладі композиції одержані так, що дозування сполуки формули I може бути від 3 до 30 мг/кг маси тіла/добу. В іншому прикладі композиції одержані так, що дозування сполуки формули I може бути від 5 до 60 мг/кг маси тіла/добу. Залежно від визначеного стану або захворювання, яке лікують або якому запобігають, додаткові терапевтичні агенти, які звичайно вводяться для лікування або запобігання такому стану, можуть також бути присутніми у композиціях даного винаходу. Використовувані у даному описі додаткові терапевтичні агенти, які звичайно вводяться для лікування або запобігання визначеному захворюванню або стану, відомі як "відповідні для захворювання або стану, що лікують". Приклади додаткових терапевтичних агентів подані нижче. Кількість додаткового терапевтичного агента, присутнього у композиціях даного винаходу, буде не більше, ніж кількість, яку звичайно вводили б у композицію, що містить такий терапевтичний агент як єдиний активний агент. Переважно кількість додаткового терапевтичного агента у наш час у розкритих композиціях становить приблизно від 50 % до 100 % кількості, звичайно присутньої у композиції, що містить такий агент як єдиний терапевтично активний агент. Застосування сполук Формули I і композицій, що містять сполуки Формули I Відповідно до одного варіанту здійснення, винахід стосується способу інгібування активності протеїнкінази c-Met у біологічному зразку, що включає стадію взаємодії вказаного біологічного зразка зі сполукою формули I або композицією, що містить вказану сполуку. Використовуваний у даному описі термін "біологічний зразок" означає типовий зовнішній живий організм і включає, не обмежуючись ними, клітинні культури або їх екстракти; біопсійний матеріал, одержаний від ссавця, або його екстракти; і кров, слину, сечу, екскременти, сперму, сльози або інші рідини тіла або їх екстракти. Інгібування активності кінази у біологічному зразку корисне для різноманітних цілей, відомих фахівцеві у даній галузі техніки. Приклади таких цілей включають, але не обмежуються ними, зберігання біологічного зразка і біологічні дослідження. В одному варіанті здійснення спосіб інгібування активності кінази у біологічному зразку обмежують не терапевтичними способами. Термін "c-Met" є синонімічним "c-MET", "cMet", "MET", "Met" або іншим позначенням, відомим фахівцеві у даній галузі техніки. Відповідно до іншого варіанту здійснення, винахід стосується способу інгібування активності кінази c-Met у пацієнта, що включає стадію введення вказаному пацієнту сполуки формули I або композиції, що містить вказану сполуку. Використовуваний у даному описі термін "c-Met-опосередковане захворювання" або "c-Metопосередкований стан" означає будь-який стан, захворювання або інший хвороботворний стан, при якому відомо, що c-Met відіграє певну роль. Терміни "c-Met-опосередковане захворювання" або "c-Met-опосередкований стан" також означають такі захворювання або стани, симптоми яких пом'якшуються при лікуванні за допомогою інгібітору c-Met. Такі стани включають, але не 8 UA 106082 C2 5 10 15 20 25 30 35 40 45 50 55 60 обмежуються ними, рак нирок, шлунка, товстої кишки, мозку, грудей, простати, печінки, підшлункової залози або легенів, гліобластому, атеросклероз або фіброз легенів. В одному аспекті даний винахід забезпечує спосіб лікування проліферативного порушення у пацієнта, що включає стадію введення пацієнту терапевтично ефективної дози сполуки формули I або композиції, що містить сполуку формули I. Відповідно до одного варіанту здійснення, проліферативне порушення являє собою рак, такий як, наприклад, рак нирок, шлунка, товстої кишки, мозку, грудей, печінки, простати і легенів або гліобластому. В іншому варіанті здійснення даний винахід стосується способу лікування або зменшення ступеню тяжкості гепатоцелюлярної карциноми у пацієнта, який потребує такого лікування, що включає введення вказаному пацієнту сполуки формули I або її композиції. В іншому варіанті здійснення проліферативне порушення являє собою справжню поліцитемію, есенціальну тромбоцитемію, хронічний ідіопатичний мієлофіброз, мієлоїдну метаплазію з мієлофіброзом, хронічний гранулоцитарний лейкоз (CML), хронічний мієломоноцитарний лейкоз, хронічний еозинофільний лейкоз, гіпереозинофільний синдром, системний мастоцитоз, нетиповий CML або ювенільний мієломоноцитарний лейкоз. В іншому варіанті здійснення проліферативне порушення являє собою атеросклероз або фіброз легенів. Інший аспект даного винаходу стосується способу інгібування метастазу пухлини у пацієнта, який потребує такого лікування, що включає введення вказаному пацієнту сполуки формули I або її композиції. Залежно від визначеного стану або захворювання, яке лікують, додаткові терапевтичні агенти, які звичайно вводять для лікування такого стану, можуть також бути присутніми у композиціях даного винаходу. Використовувані у даному описі додаткові терапевтичні агенти, які звичайно вводять для лікування визначеного захворювання або стану, відомі як "відповідні для захворювання або стану, що лікують". В одному варіанті здійснення хіміотерапевтичні агенти або інші антипроліферативні агенти можна об'єднати зі сполуками формули I для лікування проліферативних захворювань і раку. Приклади відомих хіміотерапевтичних агентів включають, але не обмежуються ними, алкілувальні агенти, такі як, наприклад, циклофосфамід, ломустин, бусульфан прокарбазин, іфосфамід, алтретамін, мелфалан, естрамустину фосфат, гексаметилмеламін, хлорметин, тіотепа, стрептозоцин, хлорамбуцил, темозоломід, дакарбазин, семустин або кармустин; платинові агенти, такі як, наприклад, цисплатин, карбоплатин, оксаліплатин, ZD-0473 (AnorMED), спіроплатин, лобаплатин (Aeterna), карбоксифталатоплатин, сатраплатин (Johnson Matthey), тетраплатин BBR-3464, (Hoffmann-La Roche), орміплатин, SM-11355 (Sumitomo), іпроплатин або AP-5280 (Access); антиметаболіти, такі як, наприклад, азацитидин, томудекс, гемцитабін, триметрексат, капецитабін, дезоксикоформіцин, 5-фторурацил, флударабін, флоксуридин, пентостатин, 2-хлордеоксіаденозин, ралтитрексед, 6-меркаптопурин, гідроксисечовина, 6-тіогуанін, децитабін (SuperGen), цитарабін, клофарабін (Bioenvision), 2фтордеоксицитидин, ірофулвен (MGI Pharma), метотрексат, DMDC (Hoffmann-La-Roche), ідатрексат або етинілцитидин (Taiho); інгібітори топоізомерази, такі як, наприклад, амсакрин, рубітекан (SuperGen), епірубіцин, ексатекану мезилат (Daiichi), етопозид, квінамед (ChemGenex), теніпозид, мітоксантрон, гіматекан (Sigma-Tau), іринотекан (CPT-11), дифломотекан (Beaufour-Ipsen), 7-етил-10-гідрокси-камптотецин, TAS-103 (Taiho), топотекан, ельсамітруцин (Spectrum), дексразоксанет (TopoTarget), J-107088 (Merck and Co), піксантрон (Novuspharma), BNP-1350 (BioNumerik), аналог ребекаміцину (Exelixis), CKD-602 (Chong Kun Dang), BBR-3576 (Novuspharma) або KW-2170 (Kyowa Hakko); протипухлинні антибіотики, такі як, наприклад, дактиноміцин (актиноміцин D), амонафід, доксорубіцин (адріаміцин), азонафід, деоксирубіцин, антрапіразол, валрубіцин, оксантразол, даунорубіцин (дауноміцин), лозоксантрон, епірубіцин, блеоміцин, сульфат (бленоксан), терарубіцин, блеоміцинова кислота, ідарубіцин, блеоміцин А, рубідазон, блеоміцин В, плікаміцин, мітоміцин С, порфіроміцин, MEN10755 (Menarini), ціаноморфолінодоксорубіцин, GPX-100 (Gem Pharmaceuticals) або мітоксантрон (новантрон), антимітотичні агенти, такі як, наприклад, паклітаксел, SB 408075 (GlaxoSmithKline), доцетаксел, E7010 (Abbott), колхіцини, PG-TXL (Cell Therapeutics), вінбластин, IDN 5109 (Bayer), вінкристин А, 105972 (Abbott), вінорелбін, А 204197 (Abbott), віндезин, LU 223651 (BASF), доластатин 10 (NCI), D 24851 (ASTAMedica), ризоксин (Fujisawa), ER-86526 (Eisai), мівобулін (Warner-Lambert), комбретастатин A4 (BMS), цемадотин (BASF), ізогомогаліхондрин-В (PharmaMar), RPR 109881A (Aventis), ZD 6126 (AstraZeneca), TXD 258 (Aventis), PEG-паклітаксел (Enzon), епотилон В (Novartis), AZ10992 (Asahi), Т 900607 (Tularik), IDN-5109 (Indena), Т 138067 (Tularik), AVLB (Prescient NeuroPharma), криптофіцин 52 (Eli Lilly), 9 UA 106082 C2 5 10 15 20 25 30 35 40 45 50 55 60 азаепотилон В (BMS), вінфлунін (Fabre), BNP-7787 (BioNumerik), ауристатин PE (Teikoku Hormone), CA-4 проліки (OXiGENE), BMS 247550 (BMS), доластатин-10 (NIH), BMS 184476 (BMS), CA-4 (OXiGENE), BMS 188797 (BMS) або таксопрексин (Protarga); інгібітори ароматази, такі як, наприклад, аміноглутетимід, ексеместан, летрозол, атаместан (BioMedicines), анастрозол YM-511 (Yamanouchi) або форместан; інгібітори тимідилатсинтази, такі як, наприклад, пеметрексед (Eli Lilly), нолатрексед (Eximias), ZD-9331 (BTG) або CoFactor™ (BioKeys); антагоністи ДНК, такі як, наприклад, трабектедин (PharmaMar), мафосфамід (Baxter International), глюфосфамід (Baxter International), апазиквон (Spectrum Pharmaceuticals), 32 альбумін + P (Isotope Solutions), О6 бензилгуанін (Paligent), тимектацин (NewBiotics) або едотреотид (Novartis); інгібітори фарнезилтрансферази, такі як, наприклад, арглабін (NuOncology Labs), типіфарніб (Johnson & Johnson), лонафарніб (Schering-Plough), периліловий спирт (DOR BioPharma) або BAY-43-9006 (Bayer); інгібітори насоса, такі як, наприклад, CBT-1 (CBA Pharma), зосуквідар тригідрохлорид (Eli Lilly), тариквідар (Xenova), бірикодар дицитрат (Vertex) або MS-209 (Schering AG); інгібітори гістон-ацетилтрансферази, такі як, наприклад, такединалін (Pfizer), півалоїлоксиметил бутират (Titan), SAHA (Aton Pharma), депсипептид (Fujisawa) або MS-275 (Schering AG); інгібітори металопротеїнази, такі як, наприклад, Неовастат (Aeterna Laboratories), CMT-3 (CollaGenex), маримастат (British Biotech) або BMS-275291 (Celltech); інгібітори рибонуклеозид-редуктази, такі як, наприклад, галію мальтолат (Titan), тезацитабін (Aventis), триапін (Vion) або дідокс (Molecules for Health); агоністи/антагоністи TNF альфа, такі як, наприклад, вірулізин (Lorus Therapeutics), ревімід (Celgene), CDC-394 (Celgene), ентанерцепт (Immunex Corp.), інфліксимаб (Centocor, Inc.) або адалімумаб (Abbott Laboratories); антагоністи рецептора ендотеліну А, такі як, наприклад, атрасентан (Abbott) YM-598 (Yamanouchi) або ZD-4054 (AstraZeneca); агоністи рецептора ретиноєвої кислоти, такі як, наприклад, фенретинід (Johnson & Johnson), алітретиноїн (Ligand) або LGD-1550 (Ligand); імуномодулятори, такі як, наприклад, терапія інтерферон декзосому (Anosys), онкофаг (Antigenics), пентрикс (Australian Cancer Technology), GMK (Progenics), ISF-154 (Tragen), вакцина проти аденокарциноми (Biomira), вакцина проти раку (Intercell), CTP-37 (AVI BioPharma), норелін (Biostar), IRX-2 (Immuno-Rx), BLP-25 (Biomira), PEP-005 (Peplin Biotech), MGV (Progeniсs), вакцини синхровакс (CTL Immuno), бета-алетин (Dovetail), вакцина проти меланоми (CTL Immuno), терапія CLL (Vasogen) або p21 RAS вакцина (GemVax); гормональні і антигормональні агенти, такі як, наприклад, естрогени, преднізон, кон'юговані естрогени, метилпреднізолон, етинілестрадіол, преднізолон, хлортрианізен, аміноглутетимід, іденестрол, лейпролід, гідроксипрогестерону капроат, гозерелін, медроксипрогестерон, лейпрорелін, тестостерон, бікалутамід, тестостерону пропіонат, флуоксиместерон, флутамід, метилтестостерон, октреотид, діетилстильбестрол, нілутамід, мегестрол, мітотан, тамоксифен, Р-04 (Novogen), торемофін, 2-метоксіестрадіол (EntreMed), дексаметазон або арзоксифен (Eli Lilly); фотодинамічні агенти, такі як, наприклад, талапорфін (Light Sciences), Pd-бактеріофеофорбід (Yeda), Тералюкс (Theratechnologies), лютеція тексафірин (Pharmacyclics), мотексафін гадолінію (Pharmacyclics) або гіперицин; та інгібітори тирозинкінази, такі як, наприклад, іматиніб (Novartis), кахалід F (PharmaMar), лефлуномід (Sugen/Pharmacia), CEP-701 (Cephalon), ZD1839 (AstraZeneca), CEP-751 (Cephalon), ерлотиніб (Oncogene Science), MLN518 (Millenium), канертиніб (Pfizer), PKC412 (Novartis), скваламін (Genaera), феноксодіол, SU5416 (Pharmacia), трастузумаб (Genentech), SU6668 (Pharmacia), C225 (ImClone), ZD4190 (AstraZeneca), ру-Маб (Genentech), ZD6474 (AstraZeneca), MDX-H210 (Medarex), ваталаніб (Novartis), 2C4 (Genentech), PKI166 (Novartis), MDX-447 (Medarex), GW2016 (GlaxoSmithKline), ABX-EGF (Abgenix), EKB-509 (Wyeth), IMC-1C11 (ImClone) або EKB-569 (Wyeth). У додатковому варіанті здійснення додатковий терапевтичний агент не метаболізується на більше ніж 90 % за допомогою Цитохрому P450 3A4 (CYP3A4). Такі додаткові агенти можна вводити окремо від композиції, що містить сполуку формули I, як частину режиму багаторазового дозування. Альтернативно, такі агенти можуть бути частиною одиничної форми дозування, змішаної разом зі сполукою формули I в одиничній композиції. При введенні як частини режиму багаторазового дозування два активних агенти можуть бути представлені одночасно, послідовно або у межах періоду часу відносно один одного, звичайно протягом п'яти годин відносно один одного. Кількість обох, сполуки формули I і додаткового терапевтичного агента (у таких композиціях, які містять додатковий терапевтичний агент, як описано вище), яку можна об'єднати з матеріалами носія для одержання одиничної форми дозування, змінюється залежно від об'єкта, якого лікують, і визначеного способу введення. Переважно, композиції даного винаходу повинні бути складені так, що можна вводити дозування сполуки формули I між 0,01-100 мг/кг маси тіла/добу. В одному прикладі композиції складені так, що дозування сполуки формули I може 10 UA 106082 C2 5 10 15 20 25 30 35 бути від 3 до 30 мг/кг маси тіла/добу. В іншому прикладі композиції складені так, що дозування сполуки формули I може бути від 5 до 60 мг/кг маси тіла/добу. У таких композиціях, які містять додатковий терапевтичний агент, такий додатковий терапевтичний агент і сполука формули I можуть діяти синергетично. Отже, кількість додаткового терапевтичного агента у таких композиціях буде меншою, ніж необхідна у монотерапії при використанні тільки такого терапевтичного агента. У таких композиціях можна вводити дозування додаткового терапевтичного агента 0,01-100 мг/кг маси тіла/добу. Кількість додаткового терапевтичного агента, присутнього у композиціях даного винаходу, буде не більша, ніж кількість, яку звичайно вводили б у композицію, що містить такий терапевтичний агент як єдиний активний агент. Переважно кількість додаткового терапевтичного агента у розкритих у наш час композиціях буде становити приблизно від 50 % до 100 % кількості, звичайно присутньої у композиції, що містить такий агент як єдиний терапевтично активний агент. Сполуки формули I або їх фармацевтичні композиції можуть також бути включені у композиції для покривання медичних пристроїв, що імплантуються, таких як протези, штучні клапани, судинні трансплантати, стенти і катетери. Судинні стенти, наприклад, використовували для запобігання рестенозу (повторне звуження стінки судини після рани). Однак, пацієнти, які використовують стенти або інші пристрої, що імплантуються, ризикують утворенням згустків крові або активацією тромбоцитів. Цим небажаним ефектам можна запобігти або їх можна пом'якшити за допомогою попереднього покривання пристрою фармацевтично прийнятною композицією, що включає інгібітор кінази. Придатні покриття і загальний спосіб одержання покритих пристроїв, що імплантуються, описані у Патентах США 6099562; 5886026 і 5304121. Покриття являють собою звичайно біологічно сумісні полімерні матеріали, такі як гідрогелевий полімер, поліметилдисилоксан, полікапролактон, поліетиленгліколь, полімолочна кислота, етиленвінілацетат і їх суміші. Покриття можуть необов'язково бути додатково покриті за допомогою придатного верхнього шару фторсилікону, полісахаридів, поліетиленгліколю, фосфоліпідів або їх комбінацій для надання властивостей контрольованого вивільнення композиції. Пристрої, що імплантуються, покриті за допомогою сполуки формули I, являють собою інший варіант здійснення даного винаходу. Одержання сполук Формули I Щоб винахід, описаний у даній заявці, був більш зрозумілим, нижче представлені приклади. Потрібно розуміти, що ці приклади є тільки ілюстративними і не повинні розглядатися як обмеження даного винаходу жодним чином. Використовувані у даному описі інші скорочення, символи та умовні позначення сумісні з тими, що використовуються у сучасній науковій літературі. Див., наприклад, Janet S. Dodd, ed., nd The ACS Style Guide: А Manual for Authors and Editors, 2 Ed., Washington, D. C: American Chemical Society, 1997, зміст яких включений у даний опис у повному обсязі за допомогою посилання. Наведені нижче визначення описують терміни і скорочення, що використовуються у даному описі: 40 Сольовий розчин БСА ДМСО ESMS EtOAc EtOH ВЕРХ РХМС Me MeOH МТБЕ Ph КТ ТХОК ТГФ ТФОК насичений розчин NaCl у воді бичачий сироватковий альбумін диметилсульфоксид мас-спектрометрія з електророзпиленням етилацетат етиловий спирт високоефективна рідинна хроматографія рідинна хроматографія-мас-спектрометрія метил метанол метил трет-бутиловий ефір феніл кімнатна температура трихлороцтова кислота тетрагідрофуран трифтороцтова кислота Приклад 1. Сполука формули II Сполуки 1001 і 1002 одержували від Okeanos Tech, Beijing, China (Каталожні номери OK-J05024 і OK-J-05025, відповідно). 11 UA 106082 C2 5 10 15 20 25 30 35 40 45 Сполуку 1004 одержували, як показано на Схемі 1. Відповідно, як показано у стадії 1-i, до суспензії NaH (60 % у мінеральному маслі, 8,47 г, 212 ммоль) у ДМСО при 0 °C (260 мл) повільно додавали діетил 2-метилмалонат (Сполука 1005, 29,5 г, 169,4 ммоль). Суміш перемішували при 0 °C протягом 2 годин і додавали 3,4,5-трифторнітробензол (25,0 г, 141,2 ммоль). Результуючу суміш нагрівали до КТ і перемішували протягом 12 годин. Реакційну суміш виливали у насичений водний розчин NH4Cl і осад збирали за допомогою фільтрації. Після промивання водою 3 рази результуючий діетил 2-(2,6-дифтор-4-нітрофеніл)-2-метилмалонат (Сполука 1006 [R=CH3], 44,5 г, 95 % вихід) висушували під зниженим тиском і використовували у такому вигляді у наступній реакції. Як показано у стадії 1-ii, до розчину діетил 2-(2,6-дифтор-4-нітро-феніл)-2-метилмалонату (44,5 г, 135 ммоль) у MeOH додавали Pd/С (10 %, 4,0 г) під атмосферою азоту. Атмосферу заміщали H2 і суміш гідрували при 50 psi протягом 3 днів. Атмосферу заміщали азотом, суміш відфільтровували через діатомову землю і леткі компоненти видаляли під зниженим тиском. Результуючий діетил 2-(4-аміно-2,6-дифторфеніл)-2-метилмалонат (Сполука 1007 [R=CH3], 40,5 г, 99 % вихід) висушували під зниженим тиском і використовували у такому вигляді у наступній реакції. Як показано у стадії 1-iii, до розчину діетил 2-(4-аміно-2,6-дифторфеніл)-2-метилмалонату (40,0 г, 132,8 ммоль) у метанолі (200 мл) додавали 6M NaOH (110,7 мл, 664,0 ммоль). Суміш нагрівали при 100 °C протягом 4 годин, охолоджували до 0 °C і окиснювали конц. HCl до одержання pH 3. Суміш нагрівали до КТ і перемішували протягом 3 годин. Результуючий осад збирали за допомогою фільтрації, промивали водою і висушували під високим вакуумом при 50 °C протягом 20 годин для одержання 2-(4-аміно-2,6-дифторфеніл)пропіонової кислоти 1 (Сполука 1008 [R=CH3], 22 г, 84 % вихід): H ЯМР (300,0 MГц, DMSO) δ 12,25 (уш.с, 1H), 6,16 (д, J=10,8 Гц, 2H), 5,58 (с, 2H), 3,74 (кв, J=7,2 Гц, 1H) і 1,28 (д, J=7,2 Гц, 3H) м. ч. Як показано у стадії 1-iv, суміш 2-(4-аміно-2,6-дифторфеніл)пропіонової кислоти (19,0 г, 94,45 ммоль), гліцерину (35,83 г, 28,41 мл, 389,1 ммоль), нітробензолу (7,209 г, 6,028 мл, 58,56 ммоль) і концентрованої сірчаної кислоти (30,57 г, 16,61 мл, 311,7 ммоль) м'яко нагрівали. Після припинення вихідної інтенсивної реакції суміш нагрівали до 170 °C протягом 16 годин. Після охолоджування леткі компоненти видаляли під зниженим тиском, осад розчиняли у MeOH (150 мл), додавали 150 мл 6N NaOH і суміш нагрівали при 110 °C протягом 3 годин. Після охолоджування до КТ суміш окиснювали концентрованою HCl до pH 3. Результуючий темний осад збирали за допомогою фільтрації і промивали водою. Осад поглинали в етанолі і обережно по краплях додавали тіонілхлорид (11,24 г, 6,891 мл, 94,45 ммоль). Після закінчення додання суміш нагрівали при 50 °C протягом 20 годин. Після охолоджування до КТ леткі компоненти видаляли під зниженим тиском і осад розчиняли у суміші насич. NaHCO 3 і ДХМ. Шари розділяли і водний шар екстрагували ДХМ. Об'єднані органічні шари висушували над MgSO4, зменшували в об'ємі під зниженим тиском і піддавали хроматографії на силікагелі середнього тиску (0 % EtOAc/гексан до 30 % через 36 хвилин) для одержання метил 2-(5,7дифторхінолін-6-іл)пропіонату (14,0 г, 56 % вихід за дві стадії). Метиловий ефір (5,0 г) омилювали за допомогою поглинання у метанолі (30 мл), обробляючи результуючий розчин за допомогою NaOH (16,58 мл 6 М, 99,50 ммоль) і перемішуючи при КТ протягом 20 годин. Після обережного окиснення за допомогою конц. HCl до pH 2 результуючий осад збирали за допомогою фільтрації і висушували під високим вакуумом для одержання 2-(5,7-дифторхінолін6-іл)пропіонової кислоти, яку використовували у такому вигляді у подальших реакціях. Сполуку 1003 можна одержати відповідно до такої ж методики, як використовується при одержанні сполуки 1004, замінюючи діетил 2-метилмалонат на діетил малонат. 12 UA 106082 C2 5 10 15 20 25 30 Схема 1 Приклад 2. Одержання сполук Формули III 2 3 Сполуки формули III, в якій R і R являють собою водень або метил, можна одержати, як показано на Схемі 2. Відповідно, як показано у стадії 2-i Схеми 2, відповідним чином заміщену хінолін оцтовою кислотою сполуку формули II (248,5 ммоль, 1,0 еквівалент) і 1,3діамінотіосечовину (273,4 ммоль, 1,1 еквіваленти) суспендують у суміші тетраметиленсульфону (сульфолан, 38 мл) і води (57 мл). Метансульфонову кислоту (546,7 ммоль, 2,2 еквіваленти) додають до суміші, внаслідок чого всі тверді речовини розчиняються. Реакційну суміш повільно нагрівають до 90 °C і реакцію нагрівають при 90 °C протягом 40 годин. Реакційну суміш охолоджують на льодяній бані і додають воду (75 мл) з подальшим обережним доданням насиченого розчину бікарбонату натрію (500 мл), доки не встановиться pH 8. Результуючий осад збирають за допомогою вакуумної фільтрації, промивають водою, насиченим бікарбонатом натрію, водою і метил трет-бутиловим ефіром відповідно. Продукт висушують у вакуумній печі при 55 °C для одержання сполуки формули III. Схема 2 Приклад 3. Одержання 5-(дифтор(хінолін-6-іл)метил)-4-(імінотрифеніл-фосфорано)-4H1,2,4-триазол-3-тіолу (Сполука 1011) 2 3 4 Сполуки Формули III, в якій кожний з R і R являє собою фтор і R являє собою водень, можна одержати, як показано на Схемі 3. Відповідно, як показано у стадії 3-i, до суміші 6йодхіноліну (10,0 г, 39,21 ммоль, одержаного від Нangzhou Trylead Chemical Technology Co., Ltd., Китай) і міді (нанопорошок) (9,964 г, 156,8 ммоль) у ДМСО (150 мл) додавали етил 2-бром2,2-дифтор-ацетат (10,35 г, 50,97 ммоль). Суміш нагрівали при 60 °C протягом 6 годин, протягом цього часу суміш перетворювалася з червоної мідної суспензії у темно-червоний майже гомогенний розчин. Після охолоджування до кімнатної температури, суміш розбавляли етилацетатом (300 мл) і водн. насиченим розчином NH 4Cl (450 мл). Після перемішування протягом 30 хвилин органічний шар відділяли, промивали водою, промивали сольовим розчином і висушували над сульфатом магнію. Видалення летких компонентів під зниженим тиском давало неочищений продукт у вигляді червоної рідини. Очищення за допомогою хроматографії на силікагелі середнього тиску (ДХМ/етилацетат: 100 % до 30 % через 25 хв.) 13 UA 106082 C2 1 5 10 15 20 25 давало етил 2,2-дифтор-2-(хінолін-6-іл)ацетат (Сполука 1009, 51 % вихід): H ЯМР (300,0 MГц, CDCl3) δ 9,04-9,03 (м, 1H), 8,29-8,21 (м, 2H), 8,15 (с, 1H), 7,93 (дд, J=2,1, 8,9 Гц, 1H), 7,52 (кв, J=4,2 Гц, 1H), 4,35 (кв, J=7,1 Гц, 2H) і 1,34 (т, J=7,1 Гц, 3H) м. ч. Як показано у стадії 3-ii на Схемі 3, Сполуку 1009 (10,0 г, 39,80 ммоль) розчиняли в етанолі (100 мл), додавали гідразин (7,65 г, 7,50 мл, 239 ммоль) і реакційну суміш перемішували при кімнатній температурі протягом 10 хвилин. Після виливання суміші у розчин 2N HCl, водну суміш промивали двічі ДХМ і встановлювали pH 8, весь час барботуючи азот через розчин. Результуючий водний розчин ретельно екстрагували ДХМ (10x) і об'єднані органічні шари висушували над MgSO4, відфільтровували і леткі речовини видаляли під зниженим тиском для одержання 2,2-дифтор-2-(хінолін-6-іл)ацетогідразиду у вигляді жовтої твердої речовини (Сполука 1010, 91 % вихід). Цю сполуку використовували безпосередньо без додаткового очищення. Як показано у стадії 3-iii Схеми 3, Сполуку 1010 (3,55 г, 14,97 ммоль) в EtOH (71 мл) обробляли за допомогою гідроксиду калію (924 мг, 16,5 ммоль) і реакційну суміш м'яко нагрівали для досягнення однорідності. Додавали дисульфід вуглецю (1,38 г, 1,09 мл, 18,2 ммоль) і суміш перемішували при 90 °C протягом 4 годин, у цей час утворювався інтермедіат сполуки 5-(дифтор(хінолін-6-іл)метил)-1,3,4-оксадіазол-2-тіол натрієва сіль. До розчину, що нагрівається зі зворотним холодильником, додавали гідразин (4,80 г, 4,70 мл, 150 ммоль) з подальшим доданням 3A молекулярних сит (3 г). Після нагрівання зі зворотним холодильником протягом 2 годин, сита видаляли за допомогою фільтрації і промивали EtOH. Об'єднані органічні шари охолоджували до 0 °C на льодяній бані і обробляли конц. HCl під атмосферою азоту до встановлення pH 6,5. Осад видаляли за допомогою фільтрації і фільтрат нагрівали зі зворотним холодильником протягом 4 годин, використовуючи пастку Дина-Старка, для збирання будь-якого надлишку води. Леткі компоненти видаляли під зниженим тиском, осад поглинали водою і встановлювали pH 6,5. Результуючу тверду речовину збирали за допомогою фільтрації, промивали водою і висушували для одержання 5-(дифтор(хінолін-6-іл)метил)-41 аміно-4H-1,2,4-триазол-3-тіолу (Сполука 1011, 61 % вихід): H ЯМР (300,0 MГц, DMСO) δ 14,28 (с, 1H), 9,03-9,02 (м, 1H), 8,56 (д, J=8,0 Гц, 1H), 8,31 (с, 1H), 8,16 (д, J=8,8 Гц, 1H), 7,90 (дд, J=1,9, 8,8 Гц, 1H), 7,65 (кв, J=4,2 Гц, 1H) і 5,69 (с, 2H) м. ч. 30 35 Схема 3 Приклад 4. Сполука формули IV 4-Ізотіоціанато-1-метил-1Н-піразол (Сполука 1012), 4-ізотіоціанато-1,3-диметил-1Н-піразол (Сполука 1013) і 1-етил-4-ізотіоціанато-1Н-піразол (Сполука 1014) одержували з 1-метил-1Нпіразол-4-аміну, 1,3-диметил-1Н-піразол-4-аміну (від Matrix Chemical Co.) і 1-етил-1Н-піразол-4аміну (від Oakwood Products), відповідно, за допомогою взаємодії піразоламіну з тіофосгеном при 0 °C у присутності піридину. 14 UA 106082 C2 5 10 15 20 25 30 35 Приклад 5. Одержання сполук Формули I Сполуки формули I можна одержати, як показано на Схемі 5. Як показано у стадії 5-i Схеми 5, сполуку формули III (453,3 ммоль, 1,00 еквівалент) і сполуку формули IV нагрівали разом у піридині при 110 °C протягом 15 годин. Після охолоджування до кімнатної температури реакційну суміш виливали у розчин 1 N HCl, осад збирали за допомогою фільтрації, промивали водою і очищали за допомогою хроматографії на силікагелі середнього тиску. За бажанням рацемічні суміші сполук можна розділити на їх відповідні енантіомери за допомогою надкритичної флюїдної хроматографії, використовуючи колонку ChiralPak® AD-H (20 мм×250 мм, 5 мікрон колонка) або колонку ChiralCel® OJ-H (20 мм×250 мм, 5 мікрон колонка), елююючи відповідним співвідношенням MeOH (0,1 % DEA)/CO2 при відповідній швидкості потоку. Схема 5 Приклад 6. Альтернативне одержання сполук Формули I - одержання 3-(дифтор(хінолін-6іл)метил)-N-(1-метил-1H-піразол-4-іл)-[1,2,4]триазоло[3,4-b][1,3,4]тіадіазол-6-аміну (Сполука 3) Сполуки формули I можна також одержати за допомогою взаємодії 4(імінотрифенілфосфорано)-4H-1,2,4-триазол-3-тіолів з ізоціанатами. Відповідно, як показано у стадії 6-i Схеми 6, 6-йодхінолін (750 г, 2,94 моль) завантажували у продуту стислим азотом 22 л круглодонну колбу, обладнану механічною мішалкою, температурним датчиком, зчитувачем температури, вхідним отвором для азоту і охолоджувальною банею. Додавали безводний ТГФ (5,25 л) і результуючий розчин охолоджували до -27 °C, використовуючи iPrOН/суха льодяна баня. Додавали i-PrMgCl•LiCl (2,45 л, 1,3 М у ТГФ, 1,1 екв.) більше 1 години 17 хвилин за допомогою краплинної лійки, підтримуючи температуру між -26 °C і -29 °C. Реакційну суміш потім перемішували протягом 2,5 годин при температурі, що підтримується між -20 °C і -29 °C. Коричневу суспензію охолоджували до -53 °C більше 25 хвилин, використовуючи i-PrOН/суха льодяна баня, і додавали діетилоксалат (469 г, 0,44 л, 1,1 екв.) більше 1 години 15 хвилин за допомогою краплинної лійки, підтримуючи температуру між -51 °C і -53 °C. Результуючий темний розчин нагрівали до КТ протягом ночі (~18 годин) до одержання суспензії гірчичного кольору. Одержували розчин хлориду амонію (500 г, 9,35 моль, 3,18 екв.) у воді (4,5 л) і охолоджували до 10 °C, використовуючи льодяну баню. Реакційну суміш переносили у розчин хлориду амонію більше 37 хвилин за допомогою лінії перетоку, підтримуючи невеликий вакуум у 22 л колбі, що містить розчин хлориду амонію, що перемішується. Після закінчення перенесення, льодяну баню видаляли, додавали EtOAc (3,75 л) і починали перемішування. Після приблизно 15 хвилин перемішування зупиняли і шари розділяли. Водну фазу (pH 8) екстрагували EtOAc (3,75 л). Два органічних шари об'єднували і промивали розчином NaCl (112 г у 2,5 л води). Органічну фазу концентрували під вакуумом при 25 °C для одержання маслянистої речовини (763 г), яку очищали за допомогою хроматографії на силікагелі (7:1 до 1:1 15 UA 106082 C2 5 10 15 20 25 30 35 40 45 50 55 60 гексан/EtOAc). Фракції, що містять чистий продукт, об'єднували і концентрували під вакуумом з одержанням етил 2-оксо-2-(хінолін-6-іл)ацетату у вигляді коричневої маслянистої речовини 1 (Сполука 1015, 503 г, вихід 74,5 %): H ЯМР (500 MГц, DMСO-d6) δ 1,40 (т, 3H), 4,51 (кв, 2H), 7,71 (дд, 1H), 8,21 (д, 1H), 8,24 (дд, 1H), 8,68 (дд, 1H), 8,77 (дд, 1H), 9,11 (дд, 1H). Як показано у стадії 6-ii Схеми 6, сполуку 1015 (282 г, 1,230 моль) і ДХМ (2,82 л) об'єднували у продутій стислим азотом 12 л круглодонній колбі, обладнаній механічною мішалкою, вхідним отвором для азоту, температурним датчиком і водяною банею кімнатної температури. До результуючого розчину додавали біс-(2-метоксіетил)аміносірки трифторид (DeoxoFluor™, 615 г, 0,50 л, 2,26 екв.) більше 45 хвилин за допомогою краплинної лійки. Додавали абсолютний EtOH (12,8 г, 15 мл, 0,21 екв.) за допомогою шприца частинами більше 3 хвилин і реакцію перемішували протягом ночі при температурі навколишнього середовища. Зразки, що 1 обробляються, забирали, обробляли і аналізували з допомогою H-ЯМР для контролювання проходження реакції. Типове молярне співвідношення вихідного матеріалу до продукту після першого додання етанолу становило 2:3. Відповідно, додаткові порції EtOH (12,3 г, 0,2 екв.) послідовно додавали за допомогою шприца з періодами 10-20 годин між додаваннями, доки вміст, що спостерігається, вихідного матеріалу не був нижчим ніж 10 %. Гашений розчин одержували за допомогою змішування бікарбонату натрію (827 г, 8 екв.) у воді (8,3 л) і охолоджування до 13 °C на льодяній бані. Реакційну суміш переносили у гашений розчин бікарбонату натрію більше 0,5 години за допомогою лінії перетоку, підтримуючи вакуум у 22 л колбі, що містить розчин бікарбонату натрію, що перемішується. Спостерігали інтенсивне виділення газу. Температуру підтримували між 10 °C-13 °C протягом гасіння, після цього льодяну баню видаляли і суміш перемішували протягом 2 годин при 12 °C-15 °C. Шар ДХМ відділяли і водний шар екстрагували ДХМ (2×1 л). Шари ДХМ об'єднували і концентрували при 26 °C під вакуумом для одержання 349 г неочищеної маслянистої речовини, яку очищали за допомогою хроматографії на силікагелі (7:1 до 4:1 гексан/EtOAc). Фракції, що містять чистий продукт, об'єднували і концентрували з одержанням маслянистої речовини, яку поглинали в 2×180 мл абс. EtOH і концентрували за допомогою роторного випаровування для одержання етил 2,2-дифтор-2-(хінолін-6-іл)ацетату у вигляді маслянистої речовини (Сполука 1009, 164 г, 1 53 % вихід): H ЯМР (500 MГц, DMСO-d6) δ 1,24 (т, 3H), 4,35 (кв, 2H), 7,67 (дд, 1H), 7,91 (дд, 1H), 19 8,20 (д, 1H), 8,37 (с, 1H), 8,60 (д, 1H), 9,05 (дд, 1H); F ЯМР (470 MГц, DMСO-d6) δ -101,2. Як показано у стадії 6-iii Схеми 6, в 1 л круглодонну колбу, обладнану магнітною мішалкою і термопарою, додавали сполуку 1009 (164 г, 633,9 ммоль) і EtOH (398 мл). Жовтий розчин охолоджували до 0 °C, використовуючи льодяну/водяну баню. Гідроксид натрію (570,5 мл 2 М водного розчину, 1,141 моль) повільно додавали більше 1 години до реакційної суміші, у той же час підтримуючи внутрішню температуру нижче 20 °C. Льодяну/водяну баню видаляли і суміш перемішували при кімнатній температурі протягом 2 годин. Реакційну суміш концентрували під вакуумом і жовту тверду речовину висушували у вакуумній печі (50 °C, 20-25 мм Hg, очищення N2) з одержанням натрій 2,2-дифтор-2-(хінолін-6-іл)ацетату (Сполука 1016, 156,0 г, 99 % вихід): 1 H ЯМР (500 MГц, DMСO-d6) δ 7,50-7,55 (дд, 1H), 7,90-7,85 (дд, 1H), 8,10-8,15 (д, 1H), 8,10 (с, 19 1H), 8,40-8,45 (д, 1H), 8,95-8,90 (дд, 1H); F ЯМР (470 MГц, DMСO-d6) δ-98,15. Як показано у стадії 6-iv Схеми 6, в 3 л круглодонну колбу, обладнану опорою, що нагрівається, конденсатором зворотного холодильника, термопарою, механічною мішалкою і продуту N2, додавали Сполуку 1016 (98,6 г, 326,4 ммоль), 1,3-диметил-2-імідазолідинон (1,607 л) і піридин (38,73 г, 39,60 мл, 489,6 ммоль). Додавали 50 % ангідрид пропанфосфонової кислоти (T3P®) у 2-метилтетрагідрофурані (415,4 г, 652,8 ммоль) в одиничній порції і спостерігали екзотермічний ефект при 15-20 °C. Реакційну суміш нагрівали до 70 °C протягом 1 години, у цей час додавали тіокарбогідразин (53,03 г, 489,6 ммоль) в одній порції. Реакційну суміш перемішували протягом додаткових 3 годин і потім додавали додаткову порцію 50 % T3P в 2-MeТГФ (207,7 г, 326,4 ммоль) з подальшим перемішуванням при 70 °C протягом ночі. Реакційну суміш охолоджували до кімнатної температури. В окремій колбі охолоджували розчин бікарбонату натрію (219,3 г, 2,611 моль) у воді (2,41 л), використовуючи льодяну/водяну баню. Реакційну суміш повільно додавали до гашеного розчину за допомогою порожнистої голки більше 45 хвилин, протягом яких спостерігали піноутворення і осадження продукту. Розчин перемішували при 5 °C протягом додаткової години при pH=7. Результуючі тверді речовини збирали за допомогою фільтрації з відсмоктуванням і відфільтрований осад промивали водою (3,2 л) і МТБЕ (3,2 л). Білу тверду речовину висушували у вакуумній печі (50 °C, 20-25 мм Hg) з одержанням 4-аміно-5-(дифтор(хінолін-6-іл)метил)-4H-1,2,4-триазол-3-тіолу (Сполука 1011, 57 г, 1 58 %): H ЯМР (500 MГц, DMСO-d6) δ 5,70-5,65 (с, 2H), 7,50-7,55 (дд, 1H), 7,90-7,85 (дд, 1H), 19 8,10-8,15 (д, 1H), 8,10 (с, 1H), 8,40-8,45 (д, 1H), 8,95-8,90 (дд, 1H), 14,3-14,25 (с, 1H); F ЯМР (470 MГц, DMСO-d6) δ-92,50. 16 UA 106082 C2 5 10 15 20 25 30 35 40 45 50 55 Як показано у стадії 6-v Схеми 6, трифенілфосфін (17,66 г, 67,35 ммоль), 1,1,1,2,2,2гексахлоретан (15,94 г, 67,35 ммоль), Сполуку 1011 (13,37 г, 44,90 ммоль) об'єднували під атмосферою азоту у 500 мл круглодонній колбі, обладнаній механічною мішалкою, термопарою, в атмосфері азоту. До суміші, що перемішується, додавали безводний ацетонітрил (461,0 мл) з подальшим доданням Et3N (14,09 г, 19,41 мл, 139,2 ммоль), у той же час підтримуючи температуру між 21,4-25,1 °C. Реакційна суміш ставала прозорим розчином і потім ставала суспензією, як тільки утворювався продукт (протягом приблизно 2 хвилин). Потім додавали воду (808,9 мг, 808,9 мкл, 44,90 ммоль) з подальшим доданням MeOH (14,39 г, 18,19 мл, 449,0 ммоль) і реакцію потім перемішували протягом додаткових 45 хв. Тверду речовину збирали за допомогою фільтрації і відфільтрований осад промивали CH 3CN (132 мл). Відфільтрований осад висушували у вакуумній печі при 45 °C з потоком азоту для одержання 5-(дифтор(хінолін6-іл)метил)-4-(імінотрифенілфосфорано)-4H-1,2,4-триазол-3-тіолу (Сполука 1017, 25,57 г, 1 98,8 % вихід) у вигляді бежевої твердої речовини: H ЯМР (400 MГц, DMСO-d6) δ 7,51-7,42 (м, 6H), 7,70-7,56 (м, 12H), 8,11 (д, 1H), 8,16 (м, 1H), 8,49 (дд, 1H), 9,03 (дд, 1H), 13,64 (уш. с, 1H); 19 31 F ЯМР(376 MГц, DMСO-d6) δ-91,77; P ЯМР (162 MГц, DMСO-d6) δ 19,71. Як показано у стадії 6-vi Схеми 6, у 2 л 4-горлу круглодонну колбу, обладнану верхньопривідною мішалкою, термопарою, конденсатором зворотного холодильника і пристроєм барботування для азоту, додавали 1-метилпіразол-4-карбонову кислоту (27,33 г, 216,7 ммоль). Толуол (600 мл) і триетиламін (30,70 г, 42,29 мл, 303,4 ммоль) додавали при 20,1 °C без спостережуваного збільшення температури. Результуюча біла суспензія ставала безбарвним розчином після нагрівання до 103 °C. Азид дифенілфосфорилу (DPPA, 61,48 г, 48,14 мл, 216,7 ммоль) додавали протягом періоду 30 хвилин, підтримуючи температуру між 103,1 і 107 °C. Нагрівання припиняли і охолоджували до кімнатної температури. Результуючий 4-ізоціанато-1-метил-1Н-піразол не виділяли і замість цього до нього додавали Сполуку 1017 (120 г, 216,7 ммоль) за одну порцію при кімнатній температурі. Аналітичний аналіз ВЕРХ відразу після додання показав 51,2 % перетворення вихідного матеріалу у Сполуку 3. Виходячи з 216,7 ммоль 1-метилпіразол-4-карбонової кислоти, додатково 4-ізоціанато-1-метил-1Н-піразол одержували в окремій колбі, як показано вище. Після охолоджування до кімнатної температури, цю реакційну суміш переносили у першу реакційну суміш за допомогою порожнистої голки. Аналіз ВЕРХ вказував 100 % перетворення після додання. До реакційної суміші додавали EtOAc (240 мл) і утворювався білий осад. Реакцію перемішували протягом 30 хвилин і тверду речовину збирали за допомогою фільтрації з відсмоктуванням. Відфільтрований осад [(що містить 1-(3-(дифтор(хінолін-6-іл)метил)-[1,2,4]триазоло[3,4-b][1,3,4]тіадіазол-6-іл)-1,3-біс(1метил-1H-піразол-4-іл)сечовину (Сполука 1018) як побічний продукт] промивали EtOAc (600,0 мл). Фільтрат концентрували під вакуумом за допомогою роторного випарника при 35 °C з одержанням 272,4 г коричневої маслянистої речовини. Маслянисту речовину висушували під високим вакуумом і очищали за допомогою колонкової хроматографії, використовуючи співвідношення 8:1 SiO2 до неочищеної маслянистої речовини і елююючи градієнтом від 1 % до 5 % EtOH у ДХМ для одержання 3-(дифтор(хінолін-6-іл)метил)-N-(1-метил-1H-піразол-4-іл)[1,2,4]триазоло[3,4-b][1,3,4]тіадіазол-6-аміну (Сполука 3, 111 г), що додатково очищували за допомогою кристалізації. Відповідно, порцію 33,5 г цього матеріалу переносили у 250 мл 3-горлу круглодонну колбу,обладнану механічною мішалкою і пристроєм барботування для азоту. Тверда речовина була оранжево-коричневого кольору. Загалом 135 мл СН3CN додавали для одержання згущеного залишку. Після 2,5 годин тверду речовину збирали за допомогою фільтрації з відсмоктуванням після 3 годин. Вологий відфільтрований осад промивали CH3CN (67 мл) з одержанням 13,9 г вологої твердої речовини. Сушіння під вакуумом проводили (43 °C, 20-25 мм Hg, очищення N2) більше, ніж 15,5 годин з одержанням 10,25 г чистої Сполуки 3 (>99,9 % чистота за допомогою аналізу ВЕРХ,
ДивитисяДодаткова інформація
Назва патенту англійськоюAminopyrazole triazolothiadiazole inhibitors of c-met protein kinase
Автори англійськоюLauffer, David, Li, Pan, McGinty, Kira
Автори російськоюЛауффер Девид, Ли Пань, МакГинти Кира
МПК / Мітки
МПК: A61P 35/00, A61K 31/47, C07D 513/04
Мітки: амінопіразол, c-met, інгібітори, триазолотіадіазольні, протеїнкінази
Код посилання
<a href="https://ua.patents.su/26-106082-aminopirazol-triazolotiadiazolni-ingibitori-protenkinazi-c-met.html" target="_blank" rel="follow" title="База патентів України">Амінопіразол триазолотіадіазольні інгібітори протеїнкінази c-мет</a>
Попередній патент: Гетероциклічні противірусні сполуки
Наступний патент: Спосіб одержання заміщених 2-(a,b,w-аміноалкіл)імідазолів
Випадковий патент: Спосіб отримання комбінованого покриття на мідних сплавах












