Похідні о-заміщеної дибензил-мочевини як антагоністи рецептора trpv1
Номер патенту: 95986
Опубліковано: 26.09.2011
Автори: Тревісані Марсело, Бореа П'єр Андреа, Баралді П'єр Джованні, Фруттароло Франческа, Павані Марія Джованна, Джеппетті П'єранжело
Формула / Реферат
1. Сполуки формули (І)
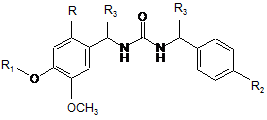 , (І)
, (І)
де:
R вибрано з галогену, алкілу, алкокси, арилу і гетероарилу;
R1 вибрано з 2-гідроксіетилу, 2,3-дигідроксипропілу, 3-гідроксипропілу, 2,2-дигідроксіетилу, 3,3-дигідроксипропілу, 1,3-діоксоланетилу, 1,3-діоксанметилу, 1,3-діоксоланметилу, 1,3-діоксанетилу, 3-флуор-2-гідроксипропілу, 3-карбокси-2-гідроксипропілу, 3-хлор-2-гідроксипропілу, 2-гідроксипропілу, 2-гідроксипропен-2-ілу, морфолінетилу, піперазинетилу, гідроксиметилу, бензилу, 4-(гідроксиметил)бензилу, 4-хлорбензилу, 4-флуорбензилу і 4-гідроксибензилу;
R2 є третбутилом або трифлуорметилом;
R3 незалежно вибрано з гідрогену, карбокси, ціано, алкілу або гідроксіалкілу,
включаючи всі їх можливі оптичні ізомери і діастереоізомери;
причому
"галоген" є атомом галогену, вибраного з флуору, хлору, брому або йоду;
"алкіл" є лінійною або розгалуженою (С1-С4)алкільною групою;
"алкокси" є лінійною або розгалуженою (С1-С4)алкоксигрупою;
"арил" є фенілом, як варіант, заміщеним одним або більше галогенами, алкілами, алкоксигрупами, визначеними вище, ціано- або аміногрупами, які можуть бути однаковими або різними;
"гетероарил" є 5- або 6-членним гетероциклом, який має один або більше атомів нітрогену, оксигену або сульфуру, які можуть бути однаковими або різними.
2. Сполука за п. 1, яка відрізняється тим, що:
R є хлором або бромом;
R1 є 2-гідроксіетилом;
R2 є третбутилом або трифлуорметилом;
R3 є гідрогеном.
3. Сполука за п. 1, яка відрізняється тим, що:
R є хлором або бромом;
R1 є 2,3-дигідроксипропілом;
R2 є трифлуорметилом;
R3 є гідрогеном.
4. Сполука за п. 1, яка відрізняється тим, що:
R є метилом, фенілом, піридином або 4-(заміщеним)-фенілом;
R1 є (R)-(-)-2,3-дигідроксипропілом;
R2 є трифлуорметилом; R3 є гідрогеном.
5. Сполука за п. 1, яка відрізняється тим, що:
R є хлором або бромом;
R1 є (R)-(-)-2,3-дигідроксипропілом;
R2 є трифлуорметилом;
R3 є гідрогеном.
6. Сполука, вибрана з групи, яку складають
1-[4-(2-гідроксіетокси)-2-бром-5-метоксибензил]-3-[4-(трифлуорметил)-бензил]сечовина;
1-[4-(2-гідроксіетокси)-2-хлор-5-метоксибензил]-3-[4-(трифлуорметил)-бензил]сечовина;
1-[4-(2-гідроксіетокси)-2-бром-5-метоксибензил]-3-[4-(трет-бутил)-бензил]сечовина;
1-[4-(2-гідроксіетокси)-2-хлор-5-метоксибензил]-3-[4-(трет-бутил)-бензил]сечовина;
1-[4-(2,3-дигідроксипропокси)-2-хлор-5-метоксибензил]-3-[4-(трифлуорметил)-бензил]сечовина;
1-[4-(2,3-дигідроксипропокси)-2-бром-5-метоксибензил]-3-[4-(трифлуорметил)-бензил]сечовина;
1-[4-((R)-(-)-2,3-дигідроксипропокси)2-хлор-5-метоксибензил]-3-[4-(трифлуорметил)-бензил]сечовина;
1-[4-((R-(-)-2,3-дигідроксипропокси)-2-феніл-5-метоксибензил]-3-[4-(трифлуорметил)-бензил]сечовина;
1-[4-((R)-(-)-2,3-дигідроксипропокси)-2-(піридин-3-іл)-5-метоксибензил]-3-[4-(трифлуорметил)-бензил]сечовина;
1-[4-((R)-(-)-2,3-дигідроксипропокси)-2-(4-хлорфеніл)-5-метоксибензил]-3-[4-(трифлуорметил)-бензил]сечовина;
1-[4-((R)-(-)-2,3-дигідроксипропокси)-2-бром-5-метоксибензил]-3-[4-(трифлуорметил)-бензил]сечовина.
7. Сполуки формули (І) за будь-яким з пп. 1-6, призначені для використання як медикаменти.
8. Використання сполук формули (І) за будь-яким з пп. 1-6 у приготуванні фармацевтичних композицій для терапії запальних станів.
9. Використання за п. 8, яке відрізняється тим, що запальний стан вибрано з групи, яку складають хронічний нейропатичний біль, синдром надмірної активності сечового міхура, пухлинний біль, геморой, запальна гіпералгезія, післяопераційний біль, видалення зубів, хвороби дихальних шляхів і шлунково-кишкові хвороби.
10. Фармацевтична композиція, яка містить сполуки формули (І) за будь-яким з пп. 1-6 у суміші з придатними ексципієнтами і/або носіями.
Текст
1. Сполуки формули (І) R3 R3 R O C2 2 (19) 1 3 95986 4 1-[4-(2-гідроксіетокси)-2-бром-5-метоксибензил]-31-[4-((R)-(-)-2,3-дигідроксипропокси)-2-(4[4-(трет-бутил)-бензил]сечовина; хлорфеніл)-5-метоксибензил]-3-[41-[4-(2-гідроксіетокси)-2-хлор-5-метоксибензил]-3(трифлуорметил)-бензил]сечовина; [4-(трет-бутил)-бензил]сечовина; 1-[4-((R)-(-)-2,3-дигідроксипропокси)-2-бром-51-[4-(2,3-дигідроксипропокси)-2-хлор-5метоксибензил]-3-[4-(трифлуорметил)метоксибензил]-3-[4-(трифлуорметил)бензил]сечовина. бензил]сечовина; 7. Сполуки формули (І) за будь-яким з пп. 1-6, при1-[4-(2,3-дигідроксипропокси)-2-бром-5значені для використання як медикаменти. метоксибензил]-3-[4-(трифлуорметил)8. Використання сполук формули (І) за будь-яким з бензил]сечовина; пп. 1-6 у приготуванні фармацевтичних композицій 1-[4-((R)-(-)-2,3-дигідроксипропокси)2-хлор-5для терапії запальних станів. 9. Використання за п. 8, яке відрізняється тим, метоксибензил]-3-[4-(трифлуорметил)бензил]сечовина; що запальний стан вибрано з групи, яку складають 1-[4-((R-(-)-2,3-дигідроксипропокси)-2-феніл-5хронічний нейропатичний біль, синдром надмірної метоксибензил]-3-[4-(трифлуорметил)активності сечового міхура, пухлинний біль, гемобензил]сечовина; рой, запальна гіпералгезія, післяопераційний біль, 1-[4-((R)-(-)-2,3-дигідроксипропокси)-2-(піридин-3видалення зубів, хвороби дихальних шляхів і шлуіл)-5-метоксибензил]-3-[4-(трифлуорметил)нково-кишкові хвороби. бензил]сечовина; 10. Фармацевтична композиція, яка містить сполуки формули (І) за будь-яким з пп. 1-6 у суміші з придатними ексципієнтами і/або носіями. Винахід стосується антагоністів ванілоїдного рецептора, зокрема О-гідроксиалкільної дибензилмочевинних похідних, які є антагоністами рецептора ванілоїду TRPV1. Нещодавні експериментальні дані показали, що експресія рецептор ванілоїду TRPV1 (перехідний рецептор потенційного каналу) зростає з розвитком запальних станів. Це дозволяє сподіватись, що антагоністи рецептора ванілоїду можуть бути використані для лікування станів запального болю, наприклад, хронічного нейропатичного болю, синдрому надмірної активності сечового міхура, геморою, запальної гіпералгезії, післяопераційного болю, видалення зубів, хвороб дихальних шляхів і шлунково-кишкових хвороб. Відомими є багато антагоністів рецептора ванілоїду; деякі з них походять з капсаїцину і їх називають капсаїциноїдними антагоністами. Винахід стосується сполуки формули (І): де: R вибрано з галогену, алкілу, алкокси, арилу і гетероарилу; R1 вибрано з 2-гідроксиетилу, 2,3дигідроксипропілу, 3-гідроксипропілу, 2,2дигідроксиетилу, 3,3-дигідроксипропілу, 1,3діоксоланетилу, 1,3-діоксан-метилу, 1,3-діоксоланметилу, 1,3-діоксан-етилу, 3-флуор-2гідроксипропілу, 3-карбокси-2-гідрокси-пропілу, 3хлор-2-гідроксипропілу, 2-гідрокси-пропен-2-ілу, морфолінетилу, піперазинетилу, гідроксиметилу, бензилу, 4-(гідроксиметил)бензилу, 4хлорбензилу, 4-флуорбензилу і 4-гідроксибензилу R2 є трет-бутилом або трифлуорметилом; R3 незалежно вибрано з гідрогену, карбокси, ціано, алкілу або гідроксиалкілу, включаючи всі її можливі оптичні ізомери і діастереоізомери. У даному описі: термін "галоген" означає атом галогену, вибраного з флуору, хлору, брому або йоду; термін "алкіл" означає лінійну або розгалужену (С1-С4)алкільну групу; термін "алкокси" означає лінійну або розгалужену (С1-С4)алкоксигрупу; термін "арил" означає феніл, як варіант, заміщений одним або більше галогенами, алкілами, алкоксигрупами, визначеними вище, ціано- або аміногрупами, які можуть бути однаковими або різними; термін "гетероарил" означає 5- або 6-членний гетероцикл, який має один або більше атомів нітрогену, оксигену або сульфуру, які можуть бути однаковими або різними, наприклад, пірол, тіофен, фуран, імідазол, тіазол, ізотіазол, оксазол, піридин або піримідин. Першою бажаною групою сполук формули (І) є та, в якій: R - хлор або бром; R1 - 2-гідроксиетил; R2 - трет-бутил або трифлуорметил; R3 - гідроген. Другою бажаною групою сполук формули (І) є та, в якій: R - хлор або бром; R1 - 2,3-дигідроксипропіл; R2 - трифлуорметил; R3 - гідроген. Третьою бажаною групою сполук формули (І) є та, в якій: R - метил, феніл, піридин або 4-(заміщений)феніл; R1 - (R)-(-)-2,3-дигідроксипропіл; R2 - трифлуорметил; R3 - гідроген. Четвертою бажаною групою сполук формули (І) є та, в якій: R - хлор або бром; 5 95986 6 R1 - (R)-(-)-2,3-дигідроксипропіл; приготовлені звичайними способами, наприклад, R2 - трифлуорметил; реакцією сполуки формули (II), в якій R, R1 і R3 є R3 - гідроген. такими, що були визначені вище: Прикладами найбільш бажаних сполук є: 1-[4-(2-гідроксиетокси)-2-бром-5метоксибензил]-3-[4-(трифлуорметил)бензил]мочевина; 1-[4-(2-гідроксиетокси)-2-хлор-5метоксибензил]-3-[4-(трифлуорметил)бензил]мочевина; 1-[4-(2-гідроксиетокси)-2-бром-5метоксибензил]-3-[4-(трет-бутил)з сполукою формули (III), в якій R2 і R3 є такибензил]мочевина; ми, що були визначені вище: 1-[4-(2-гідроксиетокси)-2-хлор-5метоксибензил]-3-[4-(трет-бутил)бензил]мочевина; 1-[4-(2,3-дигідроксипропокси)-2-хлор-5метоксибензил]-3-[4-(трифлуорметил)бензил]мочевина; 1-[4-(2,3-дигідроксипропокси)-2-бром-5метоксибензил]-3-[4-(трифлуорметил)бензил]мочевина; Сполуки формули (І), їх ізомери і солі є здат1-[4-((R)-(-)-2,3-дигідроксипропокси)-2-хлор-5ними пригнічувати рецептор ванілоїду TRPV1 і метоксибензил]-3-[4-(трифлуорметил)можуть бути використані для приготування фарбензил]мочевина; мацевтичних композицій для лікування запальних 1-[4-((R)-(-)-2,3-дигідроксипропокси)-2-феніл-5станів, хронічного нейропатичного болю, синдрому метоксибензил]-3-[4-(трифлуорметил)надмірної активності сечового міхура, геморою, бензил]мочевина; запальної гіпералгезії, післяопераційного болю, 1-[4-((R)-(-)-2,3-дигідроксипропокси)-2видалення зубів, хвороб дихальних шляхів і шлун(піридин-3-іл)-5-метоксибензил]-3-[4ково-кишкових хвороб і пухлинного болю. (трифлуорметил)-бензил]мочевина; Ці рецептури можуть бути приготовлені зви1-[4-((R)-(-)-2,3-дигідроксипропокси)-2-(4чайними способами і ексципієнтами, наприклад, хлорфеніл)-5-метоксибензил]-3-[4описаними у Remington's Pharmaceutical Sciences (трифлуорметил)-бензил]мочевина; Handbook, XVII ed. Mack Pub., N.Y., USA. 1-[4-((R)-(-)-2,3-дигідроксипропокси)-2-бром-5Винахід детально ілюструється Схемою 1 і метоксибензил]-3-[4-(трифлуорметил)Прикладами. бензил]мочевина. Сполуки загальної формули (І) можуть бути 7 Реагенти і умови: (і) оцтовий ангідрид, пір; (іі) NBS або NCS, ДМФ, 0°С; (ііі) водн. 10% НСІ, діоксан; (iv) коли R = Br, Pd(PPh3)4, Na2CO3, борна кислота, ДМЕ, 90°С; (v) гідроксиалкіл галогенід, K2CO3, ДМФ, 100°С; (vi) HCI 37%, EtOH, Rfx; (vii) трифосген, 4-(заміщений)бензил-амін, DlEA, CH2CI2, 10 хвил. Замісники: 6а: R = Cl, R1 = 2-гідроксиетил; R2 = трет-бутил, R3= H.; 6b: R = Br, R1 = 2-гідроксиетил; R2 = трет-бутил, R3 = Н; 6с: R = Cl, R1 = 2,3дигідроксипропіл; R2 = трифлуорметил, R3= Н; 6d. R = Br, R1 = 2,3-дигідроксипропіл; R2= трифлуорметил, R3= Н; 6е: R = Cl, R1 = 3-гідроксипропіл; R2 = трифлуорметил, R3 = Н; 6f: R = Cl, R1 = 3гідроксипропіл; R2 = трет-бутил, R3 = Н; 6g: R = Cl, R1 = 2-гідроксиетил; R2 = трифлуорметил, R3 = Н; 6h: R = Br, R1 = 2-гідроксиетил; R2 = трифлуорметил, R3 = Н; 6і: R = феніл, R1 = 2,3дигідроксипропіл; R2 = трифлуорметил; R3= Н; 61: R = піридин-3-іл, R1 = 2,3-дигідроксипропіл; R2 = трифлуорметил; R3= Н; 6m: R = 4-(хлор)-феніл, R1 = 2,3-дигідроксипропіл; R2= трифлуорметил; R3= H Приклади Реакції звичайно спостерігають за допомогою тонкошарової хроматографії (ТШХ) на силікагелі (планшети Merck F245 з покриттям) і продукти візуалізують йодом або розчином перманганату калію. 1 Спектри H ЯМР реєструють у CDCI3, CF3COOD або ДMCO-d6 спектрометром Varian VXR 200. Положення піків наведено у 1/млн () у полі нижче від тетраметилсилану як внутрішнього стандарту, і значення J дано у Гц. УФ спектри реєструють спектрометром Руе Unicam SP 300, використовуючи процедуру KBr Wafer. Мас-спектри отримують спектрометром Shimadzu QP5050 Dl 50. Термін "легкий петролейний етер" означає нафтову фракцію, що кипить при 40-60°С. Точки плавлення (т. плавл.) визначають на інструменті Buchi-Tottoli і не коригують. Хроматографію проводять, використовуючи силікагель Merck 60-200 mesh. Синтезовані 1 сполуки мають спектри H ЯМР, що відповідають призначеним структурам. Елементний аналіз має відхилення у межах ±0,4% від теоретичних значень для С, H і N. Приклад 1 1.1. Синтез 4-ацетокси-3-метокси-N-ацетилбензиламіну Оцтовий ангідрид (1 мл, 10,5 ммоль) додають до розчину 4-гідрокси-3-метокси-бензиламін гідрохлориду (0,5 г, 2,63 ммоль) у піридині (5 мл) і суміш перемішують при кімнатній температурі 6 год. Розчинник випарюють під зниженим тиском і залишок суспендують у воді (100 мл). Водний шар екстрагують етилацетатом (3 х 20 мл) і об'єднані органічні фази зневоднюють (Na2SO4) і випарюють під зниженим тиском, отримуючи названу сполуку як білу тверду речовину (0,45 г, вихід 75%). 1 H ЯМР(СDСІ3) 2,01 (s, 3Н, CH3), 2,31 (s, 3Н, CH3), 3,81 (s, 3Н, OCH3), 4,38 (d, 2Н, J=6, CH2), 5,90 (bs, 1Н, NH), 6,90 (m, 3Н, ароматичн.). + MS: m/z 238,1 (M C12H15NO4). 1.2. Синтез 2-бром-4-ацетокси-5-метокси-Nацетил бензиламіну N-бромсукцинімід (6,3 ммоль, 1,1г) додають до розчину 4-ацетокси-3-метокси-N-ацетил 95986 8 бензиламіну Прикладу 1.1 (1,5 г, 4,2 ммоль) у сухому ДМФ (8 мл) і суміш перемішують протягом 30 хвил. при 0C і потім ще 16 год. при кімнатній температурі. При доданні води (40 мл) утворюється білий осад. Тверду речовину відфільтровують і промивають двічі холодною водою (2 х 20 мл), потім сушать над P2O5, отримуючи названу сполуку як білу тверду речовину (1,4 г, 99%-й вихід). 1 H ЯМР (ДМСО-d6) 1,89 (s, 3Н), 2,24 (s, 3Н), 3,76 (s, 3Н, ОСН3), 4,27 (d, 2Н, CH2, J=8), 7,09 (s, 1Н, ароматичн.), 7,25 (s, 1Н, ароматичн.), 8,35 (t, 1Н, NH). Двомірне NOESY (ДMCO-d6): з'єднання між синглетом при 2,24 1/млн і синглетом при 7,25 1/млн підтверджує, що бром знаходиться у 2-й позиції ароматичного кільця. + MS: m/z 316 (M C12H14BrNO4). Приклад 2 2. Загальна процедура синтезу 2(феніл/піридин-3-іл/4-(хлор)феніл)-4-гідрокси-5метокси-N-ацетил бензиламіну Розчин 2-бром-4-ацетокси-5-метокси-N-ацетил бензиламіну (600 мг, 1,9 ммоль) у ДМЕ (15 мл) деоксигенують, пропускаючи N2 через суміш протягом 5 хвил., потім додають d(PPh3)4 (0,09 мольекв.) і розчин належної борної кислоти (1,4 мольекв.) в абсолютному етанолі (3 мл). Суміш перемішують протягом 10 хвил., потім додають 2М водний розчин Na2CO3 (9 мл) і реакцію нагрівають при 90C протягом 12 год. Розчинник випарюють під зниженим тиском, додають воду (60 мл) і водну фазу екстрагують EtOAc (3x30 мл). Об'єднані органічні фази зневоднюють над Na2SO4, випарюють і залишок очищають хроматографією (6:4 ЕtOАс:петролейний етер), отримуючи названу сполуку як тверду речовину. 2.1. 2-феніл-4-гідрокси-5-метокси-N-ацетил бензиламін Біла тверда речовина, вихід 95%. 1 H ЯМР (CDCI3) 1,89 (s, 3Н), 3,92 (s, 3Н), 4,33 (d, 2Н, J=4,4), 5,41 (bs, 1Н), 5,75 (s, 1Н), 6,84 (s, 1Н), 6,94 (s, 1Н), 7,41-7,29 (m, 5Н). + MS: m/z 271 (M C16H17NO3). 2.2. 2-(піридин-3-іл)-4-гідрокси-5-метокси-Nацетил бензиламін Блідожовта тверда речовина, вихід 68%. 1 H ЯМР (ДMCO-d6) 1,79 (s, 3Н), 3,79 (s, 3Н), 4,04 (d, 2Н, J=4), 6,65 (s, 1Н), 6,98 (s, 1Н), 7,42 (m, 1Н), 7,71 (m, 1Н), 8,41 (bt, 1Н), 8,54 (m, 1Н), 9,19 (s, 1Н). + MS: m/z 272 (M C15H16N2O3). 2.2. 2-(4-хлор)феніл-4-гідрокси-5-метокси-Nацетил бензиламін Блідожовта тверда речовина, вихід 78%. 1 H ЯМР (ДMCO-d6) 1,81 (s, 3Н), 3,79 (s, 3Н), 4,08 (d, 2Н, J=4), 6,01 (t, 1Н), 6,79 (s, 1Н), 6,98 (s, + 1Н), 7,44 (dd, 4Н), 8,15 (s, 1Н). MS: m/z 305 (M C16H16CINO3). Приклад 3 3.1. Синтез of 2-бром-4-гідрокси-5-метокси-Nацетил бензиламіну 10%-у водну гідрохлорну кислоту (2,5 мл) додають до розчину 2-бром-4-ацетокси-5-метокси-Nацетил-бензиламіну 2 (0,45 г, 1,66 ммоль) у діоксані (15 мл) і суміш витримують під зворотним хо 9 95986 10 лодильником протягом 2 год., потім охолоджують, дигідроксипропокси)-5-метокси-N-ацетил бензирозчинник концентрують під вакуумом і залишок ламін підлужують 10%-м водним NaOH. Отриману тверБлідожовта тверда речовина, вихід 60%. 1 ду речовину збирають фільтрацією, промивають H ЯМР (ДMCO-d6) 1,80 (s, 3Н), 3,44 (t, 2Н), холодною водою і сушать, отримуючи названу 3,80 (s, 3Н), 3,96 (m, 3Н), 4,08 (d, 2Н), 4,62 (t, 1Н), сполуку як білу тверду речовину з кількісним вихо4,93 (d, 1Н), 6,84 (s, 1Н), 7,02 (s, 1Н), 7,44 (m, 1Н), дом. 7,77 (m, 1Н), 8,20 (bt, 1Н), 8,56 (m, 2Н). 1 H ЯМР (ДMCO-d6) 2,18 (s, 3Н, CH3), 3,87 (s, 4.3. 2-(4-хлор)-феніл-4-(2,33Н, OCH3), 4,00 (d, 2Н, CH2), 6,91 (s, 1Н, аромадигідроксипропокси)-5-метокси-N-ацетил бензитичн), 7,32 (s, 1Н, ароматичн), 8,46 (t, 3Н, NH2), ламін 9,80 (bs, 1Н, ОН). Блідо жовто твердо речовино, вихід 65%. 1 Т. плавл.: >300°С. H ЯМР (ДMCO-d6) 1,81 (s, 3Н), 3,42 (d, 3Н), 3.2. Синтез 2-бром-4-(2-гідроксиетокси)-53,79 (s, 3Н), 3,90 (m, 4Н), 4,08 (d, 2Н), 6,79 (s, 1Н), метокси-N-ацетил бензиламіну 6,98 (s, 1Н), 7,45 (dd, 4Н), 8,20 (bt, 1Н). До розчину сполуки 3 (0,4 г, 1,46 ммоль) у суПриклад 5 хому ДМФ (15 мл) додають сухий K2CO3 (2 моль5.1. Синтез 2-бром-4-(2,3-дигідроксипропокси)екв.) і 2-йодетанол (2 моль-екв.). Суміш витриму5-метокси-N-ацетил бензиламіну ють під зворотним холодильником протягом 6 год., До розчину 2-бром-4-гідрокси-5-метокси-Nпотім розчинник випарюють під зниженим тиском. ацетил бензиламіну 3 (0,3 г, 1,1 ммоль) у сухому Після додання води водний шар екстрагують ДМФ (10 мл) додають сухий K2CO3 (2 моль-екв.) і EtOAc (3x25 мл) і органічні фази зневоднюють над 3-хлор-1,2-дигідроксипропан (2 моль-екв.). Суміш Na2SO4 і випарюють під зниженим тиском, отривитримують під зворотним холодильником протямуючи названу сполуку як блідо жовту тверду регом 6 год., потім розчинник випарюють під знижечовину (0,38 г, 81%-й вихід). ним тиском. Після додання води водний шар екст1 H ЯМР (CDCI3) 2,00 (s, 3Н), 3,84 (s, 3Н), 3,92 рагують EtOAc (3x25 мл) і органічні фази (t, 2Н, J=2), 4,09 (t, 2Н, J=2,1), 4,44 (d, 2Н, J=4), зневоднюють над Na2SO4 і випарюють під зниже5,21 (t, 1Н), 5,90 (bs, 1Н), 6,96 (s, 1Н), 7,07 (s, 1Н). ним тиском, отримуючи названу сполуку як блідо3.3. Синтез 2-бром-4-(2-гідроксиетокси)-5жовту тверду речовину (0,35 г, 84%-й вихід). 1 метокси-бензиламін гідрохлориду H ЯМР (ДМСО-d6) 1,88 (s, 3Н), 3,44 (t, 2Н), 37%-ну гідрохлорну кислоту (0,2 мл) додають 3,74 (s, 3Н), 3,88-3,96 (m, 3Н), 4,22 (d, 2Н, J=6), до розчину 2-бром-4-(2-гідроксиетокси)-5-метокси4,66 (t, 1Н), 4,96 (d, 1Н, J=6), 6,93 (s, 1Н), 7,14 (s, N-ацетил бензиламіну 4 (0,1 г, 0,31 ммоль) в абсо1Н), 8,25 (t, 1Н). лютному етанолі (5 мл) і суміш витримують під 5.2. Синтез 2-бром-4-(2,3-дигідроксипропокси)зворотним холодильником протягом 12 год. Після 5-метокси-бензиламін гідрохлориду охолодження розчинник випарюють під зниженим 37%-ну гідрохлорну кислоту (0,3 мл) додають тиском і залишок рекристалізують з суміші метадо розчину 2-бром-4-(2,3-дигідроксипропокси)-5нол/етилетер, отримуючи названу сполуку як бліметокси-N-ацетил бензиламіну 4 (0,3 г, 0,86 дожовту тверду речовину з кількісним виходом. ммоль) в абсолютному етанолі (12 мл) і суміш ви1 H ЯМР (ДMCO-d6) 3,95 (s, 3Н), 4,14 (t, 2Н, тримують під зворотним холодильником протягом J=2), 4,19 (m, 2Н), 5,01 (m, 2Н), 5,44 (t, 1Н), 7,02 (s, 12 год. Після охолодження розчинник випарюють 1 H), 7,27 (s, 1Н), 7,38 (m, 3Н). під зниженим тиском і залишок рекристалізують з Приклад 4 суміші метанол/етил, отримуючи названу сполуку Загальна процедура синтезу 2-(феніл/піридиняк блідооранжеву тверду речовину з кількісним 3-іл/4-(хлор)феніл)-4-(2,3-дигідрокси-пропокси)-5виходом. 1 метокси-N-ацетил бензиламіну H ЯМР (ДMCO-d6) 3,42 (t, 2Н), 3,74 (s, 3Н), До розчину 2-(фeнiл/пipидин-3-iл/43,74-3,95 (m, 4Н), 4,21 (d, 2Н, J=6), 4,98 (m, 4Н), (xлop)фeнiл)-4-гiдpoкcи-5-мeтoкcи-N-aцeтил бензи7,13 (s,1H), 7,38 (s, 1Н). ламіну (1,1 ммоль) у сухому ДМФ (10 мл) додають Приклад 6 сухий K2CO3 (2 моль-екв.) і 3-хлор-1,2Загальна процедура синтезу 2-(феніл/піридиндигідроксипропан (2 моль-екв.). Суміш витримують 3-іл/4-(хлор)феніл)-4-(2,3-дигідрокси-пропокси)-5під зворотним холодильником протягом 12 год., метокси-бензиламін гідрохлориду потім розчинник випарюють під зниженим тиск. 37%-ну гідрохлорну кислоту (5 мл) додають до Після додання води водний шар екстрагують розчину 2-(феніл/піридин-3-іл/4-(хлор)феніл)-4EtOAc (3x25 мл) і органічні фази промивають (2,3-дигідроксипропокси)-5-метокси-N-ацетил бенNaOH 3% (20 мл), зневоднюють над Na2SO4 і визиламіну (8 ммоль) в абсолютному етанолі (25 мл) парюють під зниженим тиском, отримуючи названу і суміш витримують під зворотним холодильником сполуку як тверду речовину після кристалізації з протягом 12 год. Після охолодження розчинник Et2O. випарюють під зниженим тиском і залишок рекрис4.1. 2-феніл-4-(2,3-дигідроксипропокси)-5талізують з суміші метанол/етилетер, отримуючи метокси-N-ацетил бензиламін названу сполук у як тверду речовину з кількісним Блідожовта тверда речовина, вихід 72%. виходом. 1 H ЯМР (ДMCO-d6) 1,83 (s, 1Н), 3,44 (t, 2Н), 6.1. Синтез 2-хлор-4-ацетокси-5-метокси-N3,79 (s, 1Н), 3,95 (m, 7Н), 4,10 (d, 2Н, J=4,2), 4,62 (t, ацетил бензиламіну 1Н), 4,92 (d, 1Н), 6,79 (s, 1Н), 6,98 (s, 1Н), 7,36 (m, N-хлорсукцинімід (3,15 ммоль, 0,42 г) додають 5Н), 8,16 (t, 1Н). до розчину 4-ацетокси-3-метокси-N-ацетил4.2. 2-(піридин-3-іл)-4-(2,3бензиламіну Прикладу 1.1 (0,5 г, 2,1 ммоль) у су 11 95986 12 хому ДМФ (6 мл) і суміш перемішують протягом 30 ванням протягом 30 хвил., використовуючи шприцевий насос. Через 5 хвил. додають розчин придахвил. при 0C і потім ще 16 год. при кімнатній темтного амінгідрохлориду 5 (0,33 ммоль) однією часпературі. Після додання води (40 мл) утворюється тиною. Реакційну суміш перемішують при кімнатній білий осад. Тверду речовину відфільтровують і температурі 2-4 год., випарюють під зниженим промивають двічі холодною водою (2х20 мл), потім тиском, розріджують EtOAc (20 мл), промивають сушать над P2O5, отримуючи названу сполуку як 10%-м водним KHSO4, 5% водним NaHCO3 і розбілу тверду речовину (0,45 г, 83% вихід). 1 солом, сушать над Na2SO4 і випарюють до сухості. H ЯМР (ДMCO-d6) 1,85 (s, 3Н), 2,21 (s, 3Н), Залишок очищають флеш-хроматографією (100% 3,74 (s, 3Н, ОСН3),4,21 (d, 2Н, CH2, J=8), 7,01 (s, EtOAc), отримуючи названу сполуку як тверду ре1Н, ароматичн), 7,22 (s, 1Н, ароматичн), 8,32 (t, човину. 1Н, NH). 7.1. 1-[4-(2-гідроксиетокси)-2-бром-5Двомірне NOESY (ДMCO-d6): з'єднання між метоксибензил]-3-[4-(трет-бутил)-бензил]мочевина синглетом при 2,21 1/млн і синглетом при 7,22 6b 1/млн підтверджує, що хлор знаходиться у 2-й по1 H ЯМР (ДMCO-d6) 1,26 (s, 9Н), 3,37 (s, 3Н), зиції ароматичного кільця. + 3,70 (m, 4Н), 3,98 (t, 2Н, J=2), 4,61 (bs, 4Н), 4,87 (t, MS: m/z 272,1 (M C12H14CINO4). 1Н, J=2,1), 6,98 (bs, 1Н), 7,21 (s, 1Н), 7,23 (d, 2Н, 6.2. Синтез 2-хлор-4-гідрокси-5-метокси-NJ=7,8), 7,34 (d, 2Н, J=8), 7,80 (bs, 1Н), 8,00 (bs, 1Н). ацетил бензиламіну Точка плавл. 138°C 10%-ну водну гідрохлорну кислоту (2,5 мл) до+ MS: m/z 481,4 (M C22H29BrN2O3S). дають до розчину 2-хлор-4-ацетокси-5-метокси-N7.2. 1-[4-(2,3-дигідроксипропокси)-2-хлор-5ацетил-бензиламіну 2 (0,45 г, 1,66 ммоль) у діокметоксибензил]-3-[4-(трифлуорметил)сані (15 мл) і суміш витримують під зворотним хобензил]мочевина 6с лодильником протягом 2 год. Після охолодження Біла тверда речовина, вихід 80%. розчинник випарюють під вакуумом і залишок під1 лужують 10%-м водним NaOH. Отриману тверду H ЯМР (ДМСО-d6) 3,44 (t, 2Н, J=6), 3,68 (s, речовину збирають фільтрацією, промивають хо1Н), 3,74-4,00 (m, 5Н), 4,22 (d, 2Н, J=6), 4,32 (d, 2Н, лодною водою і сушать, отримуючи названу споJ=6), 4,67 (t, 1Н), 4,94 (d, 1Н), 6,45 (bt, 1Н), 6,65 (bt, луку як білу тверду речовину з кількісним виходом. 1Н), 6,90 (s, 1Н), 7,00 (s, 1Н), 7,48 (d, 2Н, J=7,8), 1 7,69 (d, 2Н, J=8). H ЯМР (ДМСО-d6) 2,15 (s, 3Н, CH3), 3,82 (s, + MS: m/z 462 (M C20H22CIF3N2O5). 3Н, OCH3), 3,99 (d, 2Н, CH2), 6,86 (s, 1Н, аромаТочка плавл.: 154-5°С. тичн), 7,30 (s, 1Н, ароматичн), 8,41 (t, 3Н, NH2), 20 (R)-(-)6c: []D = -8,33 (95% EtOH). 9,77 (bs, 1Н, ОН). Т. плавл.: >300°С. 7.3. 1-[4-(2,3-дигідроксипропокси)-2-бром-56.3. Синтез 2-хлор-4-(2,3-дигідроксипропокси)метоксибензил]-3-[4-(трифлуорметил)5-метокси-N-ацетил бензиламіну бензил]мочевина 6d Сухий K2CO3 (2 моль-екв.) і 2-йодетанол (2 Біла тверда речовина, вихід 84%. 1 моль-екв.) додають до розчину 2-хлор-4-гідроксиH ЯМР (ДMCO-d6) 3,41 (t, 2Н, J=6), 3,74 (s, 5-метокси-N-ацетил бензиламіну 3 (0,4 г, 1,46 1Н), 4,00-3,85 (m, 5Н), 4,19 (d, 2Н, J=6), 4,32 (d, 2Н, ммоль) у сухому ДМФ (15 мл). Суміш витримують J=6), 4,62 (t, 1Н), 4,95 (d, 1Н), 6,49 (bt, 1Н), 6,68 (bt, під зворотним холодильником протягом 6 год., 1Н), 6,90 (s, 1Н), 7,13 (s, 1Н), 7,45 (d, 2Н, J=7,8), потім розчинник випарюють під зниженим тиском. 7,65 (d, 2Н, J=8). + Після додання води водний шар екстрагують MS: m/z 507 (M C20H22BrF3N2O5). EtOAc (3x25 мл) і органічні фази зневоднюють над Точка плавл.: 164°С. 20 Na2SO4 і випарюють під зниженим тиском, отри(R)-(-)6d: []D = -8,5 (95% EtOH). муючи названу сполуку як блідожовту тверду ре7.4. 1-[4-(2-гідроксиетокси)-2-бром-5човину (0,38 г, 81%-й вихід). метоксибензил]-3-[4-(трифлуорметил)-бензил]1 H ЯМР (CDCI3) 2,00 (s, 3Н), 3,84 (s, 3Н), 3,92 мочевина 6h (t, 2Н, J=2), 4,09 (t, 2Н, J=2,1), 4,44 (d, 2Н, J=4), Біла тверда речовина, вихід 73%. 1 5,21 (t, 1Н), 5,90 (bs, 1Н), 6,96 (s, 1Н), 7,07 (s, 1Н). H ЯМР (ДMCO-d6) 3,67 (s, 3Н), 3,47 (m, 2Н), 6.4. Синтез 2-хлор-4-(2,3-дигідроксипропокси)3,94 (t, 2Н, J=4), 4,16 (d, 2Н, J=6), 4,32 (d, 2Н, J=6), 5-метокси-бензиламін гідрохлориду 4,85 (t, 1Н, J=2), 6,52 (bt, 1Н), 6,68 (bt, 1Н), 6,90 (s, 37%-ну гідрохлорну кислоту (0,2 мл) додають 1Н), 7,14 (s, 1Н), 7,49 (d, 2Н, J=8), 7,65 (d, 2Н, J=8). + до розчину 2-бром-4-(2-гідроксиетокси)-5-метоксиMS: m/z 477 (M C19H20BrF3N2O4). N-ацетил бензиламіну 4 (0,1 г, 0,31 ммоль) в абсоТочка плавл.: 162°С. лютному етанолі (5 мл) і суміш витримують під 7,5. 1-[4-(2,3-дигідроксипропокси)-2-феніл-5зворотним холодильником протягом 12 год. Після метоксибензил]-3-[4-(трифлуорметил)охолодження розчинник випарюють під зниженим бензил]мочевина 6і тиском і залишок рекристалізують з суміші метаБіла тверда речовина, вихід 35%. 1 нол/етилетер, отримуючи названу сполуку як бліH ЯМР (ДМСО-d6) 3,41 (t, 2Н), 3,78 (s, 3Н), дожовту тверду речовину з кількісним виходом. 4,06 (m, 3Н), 4,23 (d, 2Н), 4,26 (d, 2Н), 4,61 (t, 1Н), Приклад 7 4,95 (d, 1Н), 6,40 (t, 1Н), 6,51 (t, 1Н), 6,80 (s, 1Н), Загальна процедура синтезу сполук 6а-6m 6,99 (s, 1Н), 7,36 (m, 7Н), 7,68 (d, 2Н). + Трифосген (0,37 моль-екв.) розчиняють у MS: m/z 504 (M C26H27F3N2O5). Точка плавл.: CH2CI2 (3 мл). Повільно додають суміш 4-трет168°С. бутил/грифлуорметил бензиламін (0,33 ммоль) і 7,6. 1-[4-(2,3-дигідроксипропокси)-2-(піридин-3DIEA (2,2 моль-екв.) у CH2CI2 (2 мл) з перемішуіл)-5-метоксибензил]-3-[4-(трифлуор-метил) 13 95986 14 бензил]мочевин 61 Munson and Rodbard, 1980). 2+ Блідожовта тверда речовина, вихід 30%. Вимірювання флуоресценції Ca проводили у 1 культурі тригемінальних гангліїв щура, і калібраH ЯМР (ДMCO-d6) 3,44 (t, 2Н), 3,75 (s, 3Н), ційну криву визначали, використовуючи буфер, що 3,91 (m, 4Н), 4,05 (d, 2Н, J=4,3), 4,29 (d, 2Н, J=4.2), містив Fura-2-АМ-естер і визначені концентрації 4,61 (t, 1Н), 4,92 (d, 1Н), 6,51 (m, 2Н), 6,84 (s, 1Н), 2+ вільної Ca . Цю криву потім використовували для 7,03 (s, 1Н), 4,45 (m, 3Н), 7,68 (d, 2Н), 7,77 (m, 1Н), перетворення даних, отриманих з відношення 8,56 (m, 1Н). 2+ + F340/F380 до [Са ]і (нМ) (Kudo, Y). Був вивчений MS: m/z 505 (M C25H26F3N3O5). вплив попередньої обробки сполуками 6а-6m на Точка плавл.: 201 °С. 2+ підвищення [Ca ]i, викликане 30 нМ капсаїцином. 7,7. 1-[4-(2,3-дигідроксипропокси)-2-(4Викликана капсаїцином вторинна алодинія у хлор)феніл-5-метоксибензил]-3-[4-(трифлуорщура метил)-бензил]мочевин 6m Капсаїцин (5 нмоль/50 мкл/лапа) вводили ін'єБіла тверда речовина, вихід 45%. 1 кцією у плоску поверхню безволосої шкіри правої H ЯМР (ДMCO-d6) 3,44 (t, 2Н), 3,74 (s, 3Н), лапи щурів, анестезованих діетилетером (Chaplan 3,93 (m, 4Н), 4,07 (d, 2Н), 4,30 (d, 2Н), 4,62 (t, 1Н), et аl., 1994). Сполуки 6с і 6d були введені перора4,92 (d, 1Н), 6,41 (m, 2Н), 6,78 (s, 1Н), 6,98 (s, 1Н), льно за 2 год. перед ін'єкцією капсаїцину. Тактиль7,43 (m, 6Н), 7,69 (d, 2Н). + ну алодинію оцінювали через 90 хвил. після ввеMS: m/z 538 (M C26H26CIF3N2O6). дення капсаїцину. Точка плавл.: 174°С. Реагенти Біологічні аналізи Материнські концентрації капсаїцину (10 мМ) Тварини приготовляли в абсолютному етанолі. Сполуки 6аIn vivo експерименти проводили з PharmEste 6m приготовляли у 50% ДМСО і 50% Tween 80. srl (Ferrara, Italy) і з University of Ferrara, згідно з Fura-2-АМ-естер і іономіцин розчиняли у 100% протоколами, схваленими Animal Care і Use ДМСО. Всі інші препарати розчиняли у дистильоCommittee of University of Ferrara. ваній воді. Подальші розрідження робили буферАналіз на зв'язування радіоліганду ним розчином Кребса. Були використані самці щура Sprague-Dawley Результати масою 250-350 г. Для аналізу на зв'язування щурів Аналізи на зв'язування радіоліганду вбивали відтяттям голови під анестезією і видаля3 Сполуки 6а-6m витіснили [ H]RTX з його сайту ли і подрібнювали спинний мозок, використовуючи зв'язування у мембранах спинного мозку щура при гомогенізатор тканини Polytron у льодяному холонизьких концентраціях, показаних як значення Ki у дному буфері, що містив 5 мМ КСІ, 5,8 мМ NaCI, Таблиці 1. 0,75 мМ CaCI2, 2 мМ MgCI2, 320 мМ сахарозу, 10 2+ Аналіз флуоресценції Ca мМ Hepes, рН 8,6 (Szallasi and Blunberg, 1992; 2+ Капсаїцин (30 нМ) підвищив [Са ]і переважній 1993). У конкурентних експериментах мембрани 3 більшості (95%) тригемінальних нейронних клітиінкубували при 37C протягом 60 хвил. з [ H]RTX нах щура, а саме, у нейронах, ідентифікованих як (0,4 нМ) і з підвищенням концентрацій дослідних такі, що експресують TRPV1. Значення IK50 пригнісполук від 0,1 нМ до 3 мкМ. Неспецифічне зв'язу2+ чення викликаної капсаїцином мобілізації [Ca ]i вання оцінювали у присутності 1 мкМ RTX. Дослінаведено у Таблиці 1. дження насичення і конкуренції проводили, використовуючи програму Ligand (Bradford, 1976; Таблиця 1 ЗначенняК і IKC50 деяких типових сполук винаходу Код Ki (нМ) IC50 (нМ) 6а 175 859 6b 76 61 6с 60 10,2 6d 86 80 6е >1000 >1000 (R)-(-) і (S)-(+)-ізомери сполук 6с і 6d також були синтезовані для оцінки різниці в активності відносно рацемічних сполук. Найбільш активним є ізомер (R)-(-), а (S)-(+)-форма була щонайменше у 6f 253 500 6g >1000 164 6і 273 >1000 6h 150 119 6l 172 >1000 6m 117 300 разів менш активною (Таблиця 2). Внаслідок результатів, отриманих при синтезі двох окремих ізомерів сполуки 6і-6m були безпосередньо синтезовані в активних формах (R)-(-). Таблиця 2 Порівняння сполук 6с і 6d з їх активними ізомерами Код IК50 (нМ) 6с 10,2 (R)-(-)6c 7 Результати надано як середнє і 95%-і фідуціальні межі. Викликана капсаїцином вторинна аподинія у (S)-(+)6c >1000 6d 80 (R)-(-)6d 53 (S)-(+)6d >1000 щура У більш розширеному дослідженні сполуки 6с і 6d були випробувані на викликану капсаїцином 15 95986 16 вторинну алодинію у щурів. Через 90 хвил. після середовища. Клітини підраховували і розріджувавведення капсаїцину сполуки 6с і 6d (обидві - 30 ли до кінцевої концентрації, придатної для засіюмкмоль/кг, перорально) значно знизили проалодивання 40000 клітин/комірка 96-коміркових планшенійний ефект капсаїцину (пригнічення 53,1% і тах клітинних культур (200 мкл/комірка). 47,9%, відповідно). Клітини засіювали у колонках 1-11 (колонка 12 Дослідження АDМЕ містила середовище без клітин), витримували 16Щоб вибрати придатних препаратів24 год. при 37°С з 5% CO2. кандидатів, були проведені дослідження ADME in Приготування сполук vitro для вибраних сполук 6с, 6d разом з їх активДослідні і контрольні сполуки приготовляли ними ізомерами для оцінювання властивостей цих для інкубації з подвійними концентраціями (10 і 1 сполук залежно від замісників. мкм) і розріджували 10 мкл основного розчину у Були обчислені значення log D при рН=7,0, 0,99 мл KHB до концентрації 10 мкМ і 5 мкл основпричому тести in vitro показали: ного розчину у 0,995 мкл KHB до концентрації 5 - метаболічну стабільність у кріозбережених мкМ. 300 мкл 10 мкМ і 1 мкМ розчинів розподіляли людських гепатоцитів; відповідно у 2 і 1 інкубаційні тестові пробірки - цитотоксичність на клітинах Hep G2; (Sterilin Т.С. tube 17 х 100 мм). - касетну фармакокінетику у щура. Попереднє дослідження касетної фармакокіДані сполук винаходу порівнювали з даними, нетики у катетеризованих свідомих щурів отриманими для двох структурно різних сполук, Сполуки вводили щурам разом. Перед викощойно описаних як антагоністи TRPV1, а саме, ристанням сполуки зберігали при -20C. РеJYL 1421 (Jakab et al., 2005) і SB-705498 (Rami et цептури, схему введення, ідентифікацію зразків al., 2006), і з даними, отриманими для двох широко плазми і фармакокінетичний аналіз готували і вивідомих препаратів, одного з коротким півжиттям конували згідно з стандартними протоколами (налоксон) і одного з довгим півжиттям (толбута(Raynaud, Fl et al., 2004; Manitpisitkul, P. et al., мід). Відповідні дані АДМЕ дозволяють зробити 2004; Singh S. et al., 2006). швидке порівняння впливу конкретних замісників, Результати зокрема, на метаболічну стабільність. У порівнянні з сполуками la, lb, Ic, описаними у Приготування гепатоцитів WO 2005/123666 А1 ця нова група похідних ОКлітини швидко і обережно розморожували і гідроксиалкілмочевини показали неочікуване порозріджували льодяному холодному буфері Кребліпшення метаболічної стабільності і цитотоксичса-Гензеляйта (Krebs-Henseleit) (КНВ). Після ності порівняно з еталонними сполуками JYL 1421 центрифуги (50 g, 5 хвил.) надосадову рідину віді SB-705498 і кращий час півжиття, з порівняно кидали і клітини суспендували в об'ємі холодного повільним виведенням. Прийнятним є також знаKHB до щільності вище 2х (відносно кінцевої кончення цитотоксичності, тобто мікромолярні IК50. центрації при інкубації) життєздатних клітин/мл, Таблиця 3 ілюструє профілі АДМЕ двох сполук базуючись на номінальній концентрації у кріозберівинаходу, порівняно з сполуками, описаними у WO гальних колбах. Життєздатні клітини підраховува2005/123666. ли Trypan виключенням Trypan Blue гемоцитометКрім того, (R)-(-)-ізомери сполук 6с і 6d покаром і концентрацію життєздатних гепатоцитів зали додаткове поліпшення тривалості півжиття з точно коригували до двократної концентрації доодночасним збереженням прийнятних значень данням КНВ. метаболічної стабільності низької цитотоксичності Приготування клітин Hep G2 (Таблиця 3). Клітини окультурювали протягом 3 днів, трипсинізували і суспендували у 20 мл культурного Таблиця 3 Профілі АДМЕ сполук 6с, 6d і їх активних ізомерів відносно вибраних контрольних сполук Код посилання 1 Ia посипання 1 IB посилання 1 Ic JYL 1421 SB-705498 налоксон толбутамід 6с 6d (R)-(-)6c (R)-(-)6d Цитотоксичність у клітинах Hep G2 IК50 (мкМ) 21,9 22,2 18,3 20,3 52 70 Метаболічна стабільність у людських гепатоцитах СІІНТ 1,81 2,19 2,21 0,9 0,33 1,99-2,30 0,04-0,38
ДивитисяДодаткова інформація
Назва патенту англійськоюO-substituted-dibenzyl urea-derivatives as trpv1 receptor antagonists
Автори англійськоюBaraldi, Pier Giovanni, Borea, Pier Andrea, Geppetti, Pierangelo, Fruttarolo, Francesca, Pavani, Maria Giovanna, Trevisani, Marcello
Назва патенту російськоюПроизводные о-замещенной дибензил-мочевины как антагонисты рецептора trpv1
Автори російськоюБаралди Пьер Джованни, Бореа Пьер Андреа, Джеппетти Пьеранжело, Фруттароло Франческа, Павани Мария Джованна, Тревисани Марсело
МПК / Мітки
МПК: A61K 31/17, C07C 275/24, A61P 29/00
Мітки: похідні, рецептора, дибензил-мочевини, антагоністи, trpv1, о-заміщеної
Код посилання
<a href="https://ua.patents.su/9-95986-pokhidni-o-zamishheno-dibenzil-mochevini-yak-antagonisti-receptora-trpv1.html" target="_blank" rel="follow" title="База патентів України">Похідні о-заміщеної дибензил-мочевини як антагоністи рецептора trpv1</a>
Попередній патент: База для зварювання труб в трубні секції
Наступний патент: Піщаний фільтрувальний пристрій
Випадковий патент: Спосіб одержання дисперсних металевих порошків