Сполуки з агоністичною активністю стосовно нікотинового ацетилхінолінового рецептора a7 (a7-nachr), композиція, спосіб її одержання та застосування
Номер патенту: 98317
Опубліковано: 10.05.2012
Автори: Варроне Мауріціо, Ненчіні Аріанна, Прателлі Кармела, ірон К'яра, Ботманн Гендрік, Гаррісон Бойд, Гайдар Саймон, Маккарі Лаура, Заналетті Ріккардо, МІККО Іоланда
Формула / Реферат
1. Сполука формули (І):
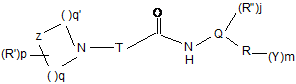 , (I)
, (I)
де
Τ - (С3-С5)-алкан-α,ω-діїл або -алкен-α,ω-діїл, що необов'язково несуть оксогрупу та необов'язково заміщені одним або більше з групи: галоген; гідроксигрупа; (С1-С5)-алкіл, алкоксил, флуоралкіл, гідроксіалкіл, алкіліден, флуоралкіліден; (С3-С6)-циклоалкан-1,1-діїл, оксациклоалкан-1,1-діїл; (С3-С6)-циклоалкан-1,2-діїл, оксациклоалкан-1,2-діїл, де зв'язки 1,2-діїльного радикала утворюють конденсоване кільце з Т-ланцюгом; та, за умови, що, коли несе оксогрупу, вона не є частиною амідного зв'язку;
Ζ - СН2, Ν, О, S, S(=O) або S(=O)2;
q та q', незалежно один від одного, є цілими числами від 1 до 4;
р = 0, 1 або 2;
R', незалежно один від одного для ρ=2, є вибраним з групи: моно- або ді-[лінійний, розгалужений або циклічний (С1-С6)-алкіл]амінокарбоніл; лінійний, розгалужений або циклічний (С1-С6)-алкіл, алкоксил, ацил;
Q - група формули ![]() ,
, 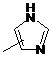 ;
;
R" - С1-С3-алкіл;
j = 0 або 1;
R - 5-10-членне ароматичне або гетероароматичне кільце;
m = 0, 1, 2, або 3;
Y, незалежно один від одного, коли m більше, ніж 1, - галоген; гідроксил; меркапто; ціано; нітро; аміно; лінійний, розгалужений або циклічний (С1-С6)-алкіл, тригалоалкіл, ді- або тригалоалкоксил, алкоксил або алкілкарбоніл; (С3-С6)-циклоалкл-(С1-С6)-алкоксил; (С3-С6)-циклоалкіл-(С1-С6)-алкіл; лінійна, розгалужена або циклічна (С1-С6)-алкілкарбоніламіногрупа; моно- або ді-, лінійний, розгалужений або циклічний (С1-С6)-алкіламінокарбоніл; карбамоїл; лінійна, розгалужена або циклічна (С1-С6)-алкілсульфоніламіногрупа; лінійний, розгалужений або циклічний (C1-С6)-алкілсульфоніл; моно- або ді-, лінійний, розгалужений або циклічний (С1-С6)-алкілсульфамоїл; лінійний, розгалужений або циклічний (С1-С6)-алкоксі-(C1-С6)-алкіл; або, коли m=2, два Y-замісники, разом із атомами R-групи, до яких вони є приєднаними, можуть утворювати кільце;
її солі, ізомери, діастереомери, рацемічні суміші та ізотопні склади.
2. Сполука формули (І) за п. 1, де:
Τ - бутан-1,4-діїл, необов'язково заміщений одним або більше з групи (C1-С3)-алкіл, галоген;
Ζ - Ν або О;
R', незалежно один від одного для p=2, є вибраним з групи: моно- бо ді-[лінійний, розгалужений або циклічний (С1-С6)-алкіл]амінокарбоніл; лінійний, розгалужений або циклічний (С1-С6)-алкіл, алкоксил, ацил;
Q - група 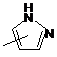 ;
;
p, q, q', R", j, R, Υ та m визначені формулою (І).
3. Сполука за п. 2, де
Τ - бутан-1,4-діїл;
Ζ - Ν або О;
R' є вибраним з групи: лінійний, розгалужений або циклічний (С1-С6)-алкіл, алкоксил, ацил;
p = 0 або 1;
Q - група 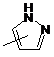 ;
;
j = 0;
R - 5-10-членне ароматичне або гетероароматичне кільце;
q, q', R, Υ та m є визначеними формулою (І);
4. Сполука за п. 3, де:
Τ - бутан-1,4-діїл;
Ζ - Ν;
р = 1;
R' - (C1-C6)-ацил;
Q - група 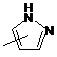 ;
;
j = 0;
R - феніл, піридил, тієніл; індоліл;
m = 0, 1 або 2;
Y, незалежно один від одного, коли m більше, ніж 1, - галоген; гідроксил; лінійний, розгалужений або циклічний (С1-С6)-алкіл, триалкіл, ді- або триалкоксил, алкоксил; (С3-С6)-циклоалкіл-(С1-С6)-алкіл;
q, q' є визначеними формулою (І).
5. Сполука за п. 4, де Q-R - 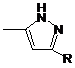 .
.
6. Сполука формули (І) за п. 1, де:
Τ - пропан-1,3-діїл, необов'язково заміщений вибраним з групи: (С1-С3)-алкіл, галоген;
Z - CH2, Ν, Ο;
Q - група формули 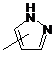 ,
, 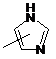 ;
;
R', p, q, q', R", j, R, Υ та m визначено формулою (І).
7. Сполука за п. 6, де:
Τ - пропан-1,3-діїл, необов'язково заміщений вибраним з групи: (С1-С3)-алкіл, галоген;
Z - CH2;
Q - група 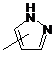 ;
;
q та q', незалежно один від одного, = 1 або 2;
p = 0 або 1;
R' є вибраним з групи: лінійний, розгалужений або циклічний (С1-С6)-алкіл, алкоксил, ацил;
j = 0;
R, Υ та m є визначеними формулою (І).
8. Сполука за п. 7, де:
Т - пропан-1,3-діїл;
Z - CH2;
q та q', незалежно один від одного, = 1 або 2;
p = 0 або1;
R' є вибраним з групи: лінійний, розгалужений або циклічний (С1-С6)-алкіл;
Q - група 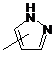 ;
;
j = 0;
R - феніл, піридил, нафтил;
m = 1 або 2;
Y, незалежно один від одного, коли m більше, ніж 1, - галоген; гідроксил; лінійний, розгалужений або циклічний (С1-С6)-алкіл, триалкіл, ді- або триалкоксил, алкоксил; (С3-С6)-циклоалкіл-(С1-С6)-алкоксил.
9. Сполука за п. 8, де:
Q-R - 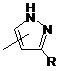 .
.
10. Сполука за п. 6, де:
Τ - пропан-1,3-діїл, необов'язково заміщений вибраним з групи: (С1-С3)-алкіл, галоген;
Z - CH2;
Q - група 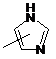 ;
;
q та q', незалежно один від одного, = 1 або 2;
p = 0 або 1;
R' є вибраним з групи: лінійний, розгалужений або циклічний (С1-С6)-алкіл, алкоксил, ацил;
j = 0;
R, Υ та m є визначеними формулою (І).
11. Сполука за п. 10, де:
Т - пропан-1,3-діїл;
Z - CH2;
q та q', незалежно один від одного, = 1 або 2;
p = 0 або 1;
R' є вибраним з групи: лінійний, розгалужений або циклічний (С1-С6)-алкіл;
Q - група 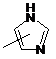 ;
;
j = 0;
R - феніл, піридил, нафталіл;
m = 1 або 2;
Y, незалежно один від одного, коли m більше, ніж 1, - галоген; гідроксил; лінійний, розгалужений або циклічний (С1-С6)-алкіл, триалкіл, ді- або триалкоксил, алкоксил; (С3-С6)-циклоалкіл-(С1-С6)-алкоксил.
12. Сполука за п. 11, де
Q-R - 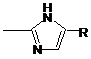 .
.
13. Фармацевтична композиція, що містить сполуку за пп. 1-12 та фармацевтично прийнятний носій або наповнювач.
14. Застосування сполуки за пп. 1-12 для отримання медикаменту для лікування неврологічних, нейродегенеративних, психіатричних розладів, розладів пізнавальної здатності, імунологічних, запальних, метаболічних, сексуальних, ноцицептивних розладів та згубних звичок.
15. Застосування за п. 14 для лікування сенільної деменції, розладів з дефіцитом уваги та гіперактивністю, хвороби Альцгеймера та шизофренії.
16. Спосіб попередження або лікування хвороб, станів або дисфункцій, де задіяно nAChR альфа-7, котрий полягає у застосуванні до суб'єкта при необхідності цього ефективної кількості сполуки за пп. 1-12.
17. Спосіб за п. 16 попередження або лікування сенільної деменції, розладів з дефіцитом уваги та гіперактивністю, хвороби Альцгеймера та шизофренії.
Текст
Реферат: Заявлений винахід стосується сполук та композицій, способів їх отримання та їх застосування для модулювання нікотинових ацетилхолінових рецепторів α7 та/або для лікування будь-яких різних розладів, хвороб та станів. UA 98317 C2 ДЕРЖАВНА СЛУЖБА ІНТЕЛЕКТУАЛЬНОЇ ВЛАСНОСТІ УКРАЇНИ UA 98317 C2 Запропоновані сполуки можуть впливати, серед іншого, на неврологічну, психіатричну та/або запальну систему. UA 98317 C2 5 10 15 20 25 30 35 40 45 50 55 60 Ця заявка претендує на пріоритет відносно попередньої заявки США на патент № 60/880,629, від 16,01,2007, що є уведеною як посилання. Заявлений винахід стосується сполук з агоністичною активністю стосовно нікотинового ацетилхолінового рецептору 7 (7-nAChR), способів їх отримання, фармацевтичних композицій, що їх містять, та їх застосування для лікування неврологічних, психіатричних та запальних хвороб. Агенти, що зв'язуються з нікотиновими ацетилхоліновими рецепторами показані як корисні у лікуванні та/або профілактиці різних хвороб та станів особливо психотичних хвороб, нейродегенеративних хвороб, у тому числі дисфункції холінергічної системи, та станів порушення пам'яті та пізнавальної здатності, у тому числі наприклад, шизофренії, тривоги, манії, маніакальної депресії, синдрому Туретта, хвороби Паркінсона, хвороби Хантингтона, розладів пізнавальної здатності (як-то хвороба Альцгеймера, деменція з тільцями Леві, бічний аміотрофічний склероз, порушення пам'яті, втрата пам'яті, дефіцит пізнавальної здатності, дефіцит уваги, розлад з дефіцитом уваги та гіперактивністю), та лікуванні фізичної залежності від нікотину, що індукуючи припинення паління, лікуванні болю (наприклад, анальгетичне застосування), забезпеченні нейрозахисту та лікуванні порушення добового ритму. Дивись наприклад, WO 97/30998; WO 99/03850; WO 00/42044; WO 01/36417; Holladay et al., J Med. Chem., 40:26, 4169-94 (1997); Schmitt et al., Annual Reports Med. Chem., Chapter 5, 41-51 (2000); Stevens et al., Psychopharmatology, (1998) 136: 320-27; та Shytle et al., Molecular Psychiatry, (2002), 7, pp. 525-535. Відмінні гетероциклічні сполуки, що несуть основний нітроген та виявляють афінність стосовно нікотинового та мускаринового ацетилхолінового рецептору або заявлені для застосування у хворобі Альцгеймера, описані, наприклад, 1Н-піразольні та пірол-азабіциклічні сполуки (WO2004013137); нікотинові агоністи ацетилхолін (WO2004039366); уреїдо-піразольні похідні (WO0112188); оксадіазольні похідні, що мають активність інгібітору ацетилхолінестерази та активність мускаринового агоністу (WO9313083); похідні амідів піразол-3-карбонових кислот, як фармацевтичні сполуки (WO2006077428); арилпіперидини (WO2004006924); уреїдоалкілпіперидини (US6605623); сполуки з активністю стосовно мускаринових рецепторів (WO9950247). На додаток, модулятори нікотинового ацетилхолінового рецептору альфа-7 є розкритими у WO06008133. Серед іншого, винахід стосується нових сполук, діючих як повні або часткові агоністи при нікотиновому ацетилхоліновому рецепторі 7 (nAChR 7), фармацевтичних композиції, що містять ці сполуки та їх застосування для лікування хвороб, що можуть бути корисними від активації нікотинового ацетилхолінового рецептору альфа-7, як-то неврологічних, нейродегенеративних, психіатричних, розлади пізнавальної здатності, імунологічних, запальних, метаболічних, фізичної залежності, ноцицептивних та сексуальних розладів, зокрема хвороби Альцгеймера, шизофренії, та/або інших. Опис фігур Фіг. 1: Ренгенодифрактограми різних кристалічних форм гідрохлориду. Фіг. 2: ДСК різних кристалічних форм хлориду. Фіг. 3: ТГА різних кристалічних форм хлориду. Фіг. 4: ДСП моно-солі НСl (без зміни форми після ДСП тест). Фіг. 5: ДСП хлориду (кристал II) (без зміни форми після ДСП). Фіг. 6: ДСП хлориду (кристал III) (дані від попередньо вибраної хвилини); Фіг. 7: ДСП хлориду (кристал V). Фіг. 8: Дія рН та НСl на еквівалентність утворення солі НСl. Фіг. 9: Дія рН та НСl на еквівалентність утворення солі НСl. Фіг. 10: Перетворення вищих солей у кристал І моно-НСl 259 мг ді-солі НСl суспендували у 4 об'ємах ацетону + 0,5 об'єму етанолу ASDQ при кімнатній температурі. Утворена кашка дала рН приблизно 2. Для збільшення рН додавали 0,02 мл NaOH 30 %, що збільшило рН до 5-5,5. Кашку перемішували протягом ночі та перетворювали у моно-НСl. Отримували 173 мг моно-НСl. Фіг. 11: Перетворення моно-НСl для утворення II зменшенням рН (суспендували протягом ночі). Фіг. 12: ДСК 5-(4-ацетил-1,4-діазепан-1-іл)-N-(5-(4-метоксифеніл)-1Н-піразол-3-іл)пентанамід хлориду, форма І. Фіг. 13: ТГА 5-(4-ацетил-1,4-діазепан-1-іл)-N-(5-(4-метоксифеніл)-1Н-піразол-3-іл)пентанамід хлориду, форма І. Фіг. 14: Ренгенодифрактограма 5-(4-ацетил-1,4-діазепан-1-іл)-N-(5-(4-метоксифеніл)-1Нпіразол-3-іл)пентанаміду хлориду, форма І. 1 UA 98317 C2 5 10 15 20 25 30 35 40 45 50 Фіг. 15: ДСП 5-(4-ацетил-1,4-діазепан-1-іл)-N-(5-(4-метоксифеніл)-1Н-піразол-3-іл)пентанамід хлориду, форма І. Фіг. 16: ДСК 5-(4-ацетил-1,4-діазепан-1-іл)-N-(5-(4-метоксифеніл)-1Н-піразол-3-іл)пентанамід хлориду, форма II. Фіг. 17: ТГА 5-(4-ацетил-1,4-діазепан-1-іл)-N-(5-(4-метоксифеніл)-1Н-піразол-3-іл)пентанамід хлориду, форма II. Фіг. 18: Ренгенодифрактограма 5-(4-ацетил-1,4-діазепан-1-іл)-N-(5-(4-метоксифеніл)-1Нпіразол-3-іл)пентанамід хлориду, форма II. Фіг. 19: ДСП 5-(4-ацетил-1,4-діазепан-1-іл)-N-(5-(4-метоксифеніл)-1Н-піразол-3-іл)пентанамід хлориду, форма II. Опис деяких конкретних втілень Сполуки У першому аспекті винахід стосується сполук формули (І): (І) де Т - (С3-С5) алкан-а,ои-дііл або алкен-,-дііл, що необов'язково несуть оксогрупу, та необов'язково заміщені одним або більше галогенами; гідроксигрупами; (С1-С5) алкіл, алкокси, флуоралкіл, гідроксіалкіл, алкіліден, флуоралкіліден; (С3-С6) циклоалкан-1,1-дііл, оксациклоалкан-1,1-дііли; (С3-С6) циклоалкан-1,2-дііл, оксациклоалкан-1,2-дііли, де зв'язки радикалу 1,2-дііл утворюють конденсоване кільце з Т-ланцюгом; та за умови, що коли Т несе оксогрупу, вона не є частиною амідного зв'язку; z - СН2, N, О, S, S(=O), або S(=O)2; q та q', незалежно один від одного, є цілими числами від 1 до 4, за умови, що сума q+q' є не більше, ніж 6; р=0, 1, або 2; R', незалежно один від одного для р=2, є вибраним з групи: моно- або ді-[лінійний, розгалужений або циклічний (С1-С6) алкіл]амінокарбоніл; лінійний, розгалужений або циклічний (С1-С6) алкіл, алкокси, ацил; Q - група формули ; ; R" - С1-С3 алкіл; j=0 або 1; R - 5-10-членне ароматичне або гетероароматичне кільце; m=0, 1, 2, або 3; Y, незалежно один від одного, коли m більше, ніж 1, - галоген; гідрокси; меркапто; ціано; нітро; аміно; лінійний, розгалужений або циклічний (С1-С6) алкіл, тригалогеналкіл, ді- або тригалогеналкокси, алкокси, або алкілкарбоніл; (C3-С6) циклоалкіл-(С1-С6) алкокси; (C3-C6) циклоалкіл-(С1-С6) алкіл; лінійний, розгалужений або циклічний(С1-С6) алкілкарбоніламіно; моно- або ді-, лінійний, розгалужений або циклічний(С1-С6) алкіламінокарбоніл; карбамоїл; лінійний, розгалужений або циклічний(С1-С6) алкілсульфоніламіно; лінійний, розгалужений або циклічний(С1-С6) алкілсульфоніл; моно- або ді-, лінійний, розгалужений або циклічний(С1-С6) алкілсульфамоїл; лінійний, розгалужений або циклічний (С1-С6) алкокси-(С1-С6) алкіл; або, коли m=2, два Y-замісники, разом із атомами R-групи, до якої вони є приєднаними, можуть утворювати кільце. У першому кращому втіленні винахід стосується сполуки формули (І), де: Т - бутан-1,4-дііл, необов'язково заміщений одним або більше з групи (С1-C3) алкіл, галоген; z - N або О; R', незалежно один від одного для р=2, є вибраним з групи: моно- або ді-[лінійний, розгалужений або циклічний (С1-С6) алкіл]амінокарбоніл; лінійний, розгалужений або циклічний (С1-С6) алкіл, алкокси, ацил; 2 UA 98317 C2 5 10 15 20 25 Q - група ; р, q, q', R", j, R, Y та m визначено формулою (І); У цьому втіленні особливо кращими сполуками формули (І) є ті, у котрих: Т - бутан-1,4-дііл; z - N або О; R' є вибраним з групи: лінійний, розгалужений або циклічний (С1-С6) алкіл, алкокси, ацил; р=0 або 1; Q - група ; j=0; R - 5-10-членне ароматичне або гетероароматичне кільце; q, q', R, Y та m є визначеними формулою (І); Ще одною групою особливо кращих сполуки є та, у котрій: Т - бутан-1,4-дііл; z - N; p=1; R'-(C1-C6) ацил; Q - група ; j=0; R - феніл, піридил, тієніл; індоліл; m=0, 1 або 2; Y, незалежно один від одного, коли m більше, ніж 1, - галоген; гідрокси; лінійний, розгалужений або циклічний (С1-С6) алкіл, тригалогеналкіл, ді- або тригалогеналкокси, алкокси;(C3-С6) циклоалкіл-(С1-С6) алкіл; q, q' є визначеними формулою (І); У наступному кращому втіленні винахід стосується сполук, далі позначених як G1 формули (І), де: Т - пропан-1,3-дііл, необов'язково заміщений вибраним з групи: (С1-C3) алкіл, галоген; z - CH2, N, О; Q - група формули 30 ; ; R', р, q, q', R", j, R, Y та m визначено формулою (І); Серед G1 особливо кращими сполуками формули (І) є ті, у котрих Т - пропан-1,3-дііл, необов'язково заміщений вибраним з групи: (С1-C3) алкіл, галоген; z - CH2; 35 Q - група ; q та q', незалежно один від одного, =1 або 2; р=0 або 1; R' є вибраним з групи: лінійний, розгалужений або циклічний (С1-С6) алкіл, алкокси, ацил; j=0; R, Y та m є визначеними формулою (І); Серед G1 ще одною групою особливо кращих сполук є ті, у котрих: Т - пропан-1,3-дііл; z - CH2; q та q', незалежно один від одного, =1 або 2; р=0 або 1; R' є вибраним з групи: лінійний, розгалужений або циклічний (С1-С6) алкіл; 40 45 3 UA 98317 C2 5 10 15 20 25 30 35 40 Q - група ; j=0; R - феніл, піридил, нафталіл; m=1 або 2; Y, незалежно один від одного, коли m більше, ніж 1, - галоген; гідрокси; лінійний, розгалужений або циклічний (С1-С6) алкіл, тригалогеналкіл, ді- або тригалогеналкокси, алкокси; (C3-С6) циклоалкіл-(С1-С6) алкоксил. У цій групі деякі патентнопридатні сполуки є тими, у котрих Q-R . До G1 підпадає ще одна група кращих сполук формули (І), у котрих Т - пропан-1,3-дііл, необов'язково заміщений вибраним з групи: (С1-C3) алкіл, галоген; z - CH2; Q - група q та q', незалежно один від одного, =1 або 2; р=0 або 1; R' є вибраним з групи: лінійний, розгалужений або циклічний (С1-С6) алкіл, алкокси, ацил; j=0; R, Y та m є визначеними формулою (І); Четвертою групою кращих сполук G1 є ті, у котрих Т - пропан-1,3-дііл; z - CH2; q та q', незалежно один від одного, =1 або 2; р=0 або 1; R' є вибраним з групи: лінійний, розгалужений або циклічний (С1-С6) алкіл; Q - група j=0; R - феніл, піридил, нафталіл; m=1 або 2; Y, незалежно один від одного, коли m більше, ніж 1, - галоген; гідрокси; лінійний, розгалужений або циклічний (С1-С6) алкіл, тригалогеналкіл, ді- або триалкокси, алкокси; (C3С6) циклоалкіл-(С1-С6) алкоксил. У цій групі найкращими сполуками є ті, у котрих Q-R Як повинно бути легко зрозуміло спеціалісту, незаміщені піразоли та імідазоли з кільцевим нітрогеном, як у сполуках заявленого винаходу, як відомо, швидко урівноважуються у розчині, як суміші обох таутомеріє: ; У нижченаведеному описі тому, де є показаним тільки один таутомер сполуки формули (І), інший таутомер є також у рамках заявленого винаходу. Сполуки винаходу можуть бути у формі вільної основи або кислотно-адитивної солі, переважно солі з фармацевтично прийнятною кислотою. Винахід також стосується 4 UA 98317 C2 5 10 15 20 25 30 35 40 45 50 55 60 відокремлених ізомерів та діастереоізомерів сполук формули (І), або їх суміші (наприклад, рацемічної та діастереомерної суміші), а також ізотопної композиції. Фармакологічну активність репрезентативної групи сполук формули (І) було продемонстровано в аналізі in vitro, застосовуючи клітини, стабільно трансфектовані нікотиновим ацетилхоліновим рецептором альфа-7, та клітини, що експресують нікотинові ацетилхолінові рецептори альфа 1 та альфа 3 та рецептор 5НТ3 як контролі селективності. Сполуки формули (І) можуть бути згідно з заявленим винаходом у будь-якій з корисних форм, наприклад, як фармацевтично прийнятні солі, як певні кристалічні форми. У деяких втіленнях є запропонованими проліки одної або більше сполук формули (І). Різні форми проліків є відомими у рівні техніки, наприклад, як обговорено у Bundgaard (ed.), Design of Prodrugs, Elsevier (1985); Widder et al. (ed.), Methods in Enzymology, vol. 4, Academic Press (1985); Kgrogsgaard-Larsen et al. (ed.); "Design and Application of Prodrugs", Textbook of Drug Design and Development, Chapter 5, 113-191 (1991); Bundgaard et al., Journal of Drug Delivery Reviews, 8:1-38 (1992); Bundgaard et al., J. Pharmaceutical Sciences, 77:285 et seq. (1988); та Higuchi and Stella (eds.), Prodrugs as Novel Drug Delivery Systems, American Chemical Society (1975). Застосування Агенти, що зв'язуються з нікотиновими ацетилхоліновими рецепторами, показаними як корисні у лікуванні та/або профілактиці різних хвороб та станів, особливо психотичних хвороб, нейродегенеративних хвороб, у тому числі дисфункції холінергічної системи, та станів порушення пам'яті та пізнавальної здатності, у тому числі, наприклад, шизофренії, тривоги, манії, маніакальної депресії, синдрому Туретта, хвороби Паркінсона, хвороби Хантингтона, розладів пізнавальної здатності (як-то хвороба Альцгеймера, деменція з тільцями Леві, бічний аміотрофічний склероз, порушення пам'яті, втрата пам'яті, дефіцит пізнавальної здатності, дефіцит уваги, розлад з дефіцитом уваги та гіперактивністю), та лікуванні фізичної залежності від нікотину, що індукує припинення паління, лікуванні болю (тобто, анальгетичному застосуванні), забезпеченні нейрозахисту та лікуванні порушення добового ритму. Дивись, наприклад, WO 97/30998; WO 99/03850; WO 00/42044; WO 01/36417; Holladay et al., J. Med. Chem., 40:26, 4169-94 (1997); Schmitt et al., Annual Reports Med. Chem., Chapter 5, 41-51 (2000); Stevens et al., Psychopharmatology, (1998) 136: 320-27; та Shytle et al., Molecular Psychiatry, (2002), 7, pp. 525-535. Таким чином, згідно з винаходом, запропоновано спосіб лікування пацієнта, особливо людини, що потерпає від будь-якої з психотичних хвороб, нейродегенеративних хвороб, у тому числі дисфункції холінергічної системи, та/або станів порушення пам'яті та пізнавальної здатності, у тому числі, наприклад, шизофренії, тривоги, манії, маніакальної депресії, синдрому Туретта, хвороби Паркінсона, хвороби Хантингтона, та/або розладів пізнавальної здатності (якто хвороба Альцгеймера, деменція з тільцями Леві, бічний аміотрофічний склероз, порушення пам'яті, втрата пам'яті, дефіцит пізнавальної здатності, дефіцит уваги, розлад з дефіцитом уваги та гіперактивністю), що полягає у застосуванні до пацієнта ефективної кількості сполуки формули (І). Нейродегенеративні розлади та їх лікування охоплено способами заявленого винаходу, у тому числі, але без обмеження, лікування та/або профілактику хвороби Альцгеймера, хвороби Піка (Friedland, Dementia, (1993) 192-203; Procter, Dement Geriatr Cogn Disord. (1999) 80-4; Sparks, Arch Neurol. (1991) 796-9; Mizukami, Acta Neuropathol. (1989) 52-6; Hansen, Am J Pathol. (1988) 507-18), дифузної хвороби з тільцями Леві, прогресуючого супрануклеарного паралічу (синдром Стилла-Ричардсона, дивись Whitehouse, J Neural Transm Suppl. (1987) 24:175-82; Whitehouse, Arch Neurol. (1988) 45(7):722-4; Whitehouse, Alzheimer Dis Assoc Disord. 1995; 9 Suppl 2:3-5; Warren, Мозку. 2005 Feb; 128(Pt 2):239-49), багатосистемної дегенерації (синдром Ші-Драгера), хвороби моторних нейронів, у тому числі бічний аміотрофічний склероз (Nakamizo, Biochem Biophys Res Commun. (2005) 330(4), 1285-9; Messi, FEBS Lett. (1997) 411(1):32-8; Mohammadi, Muscle Nerve. (2002) Oct; 26(4):539-45; Hanagasi, Brain Res Cogn Brain Res. (2002) 14(2):234-44; Crochemore, Neurochem Int. (2005) 46(5):357-68), дегенеративних атаксій, кортикальної базальної дегенерації, комплексу ALS-хвороба Паркінсона-деменція Гуама, підгострого склерозувального паненцефаліту, хвороби Хантингтона (Kanazawa, J Neurol Sci. (1985) 151-65; Manyam, J Neurol. (1990) 281-4; Lange, J Neurol. (1992) 103-4; Vetter, J Neurochem. (2003) 1054-63; De Tommaso, Mov Disord. (2004) 1516-8; Smith, Hum Моl Genet. (2006) 3119-31; Cubo, Neurology. (2006) 1268-71), хвороби Паркінсона, синуклеїнопатій, первинної прогресуючої афазії, стріатонігральної дегенерації, хвороби Мачадо-Джозефа/спінально-церебелярної атаксії типу 3, оливомостомозочкової дегенерацій, хвороби Жиля де ла Туретта, бульбарного, псевдобульбарного паралічу, атрофії м'язів спини, атрофії бульбарних м'язів (хвороби Кеннеді), первинного бічного склерозу, родинної спастичної параплегії, хвороби Вердніка-Гоффманна, 5 UA 98317 C2 5 10 15 20 25 30 35 40 45 50 55 60 хвороби Кугельберга-Веландера, хвороби Тай-Сачі, хвороби Сандхоффа, родинної спастичної хвороби, хвороби Вохлфарта-Кугельберга-Веландера, спастичного парапарезу, прогресуючої багатофокальної лейкоенцефалопатії, пріонних хвороб (як-то хвороби Крейцфельда-Якоба, Герстманна-Штраусслера-Шейнкера, куру та фатальної родинної інсомнії), та нейродегенеративних розладів, утворених від церебральної ішемії або інфаркту, у тому числі емболічної оклюзії та тромботичної оклюзії, а також інтракраніальної гематоми будь-якого типу (у тому числі, але без обмеження, епідуральної, субдуральної, субарахоїдальної та інтрацеребральної), та інтракраніальних та інтравертебральних уражень (у тому числі, але без обмеження, контузії, пенетрації, порізу, стиснення та розриву). На додаток, агоністи рецептору 7nACh, як-то сполуки заявленого винаходу можна застосовувати для лікування пов'язаної з віком деменції та інших деменцій та станів з втратою пам'яті, у тому числі пов'язаної з віком втрати пам'яті, старезності, судинної деменції, дифузної хвороби білої речовини (хвороба Бісвангера), деменції ендокринного або метаболічного походження, деменції від травми голови та дифузного пошкодження мозку, деменції боксерів, пов'язаної з алкоголізмом деменції (синдром Корсакова) та деменції лобної частини. Дивись, наприклад, WO 99/62505., Tomimoto Dement Geriatr Cogn Disord. (2005), 282-8; Tohgi - J Neural Transm. (1996), 1211-20; Casamenti, Neuroscience (1993) 465-71, Kopelman, Br J Psychiatry (1995) 154-73; Cochrane, Alcohol Alcohol. (2005) 151-4). Амілоїдний попередній білок (АРР) та похідні з нього пептиди Аβ, наприклад, Аβ1-42 та інші фрагменти, є відомими як залучені у патологію хвороби Альцгеймера. Аβ1-42-пептиди не тільки приймають участь у нейротоксичності, але також, як відомо, інгібують функцію холінергічного трансмітеру. Крім того, визначено, що Аβ-пептиди зв'язуються з рецепторами 7nACh. Запальний рефлекс є автономною реакцією нервової системи на запальний сигнал. При відчутті запального стимулу автономна нервова система спрацьовує крізь блукаючий нерв вивільненням ацетилхоліну та активуванням нікотинових рецепторів 7 на макрофагах. Ці макрофаги вивільняють цитокіни. Дисфункції у цьому провідному шляху зв'язані з запальними хворобами людини, у тому числі ревматоїдним артритом, діабетом та сепсисом. Макрофаги експресують нікотиновий рецептор 7 та є ймовірним, що цей рецептор опосередковує холінергічні анти-запальні реакції. Дивись наприклад, Czura, С J et al., J.Intern. Med., (2005) 257(2), 156-66; Wang, H. et al Nature (2003) 421: 384-388; de Jonge British Journal of Pharmacology (2007) 151, 915-929. Реакція акросом сперми ссавців є процесом екзоцитозу, важливим у заплідненні яйцеклітини спермою. Активація nAChR 7 на клітині сперми показана як суттєва для реакції акросом (Son, J.-H. та Meizel, S. Biol. Reproduct. 68: 1348-1353, 2003). На додаток, нікотинові рецептори приймають участь у реакції організму на вживання спирту. Агоністи рецептору 7nACh, як-то запропоновані тут сполуки, тому, є також корисними у лікуванні цих розладів, хвороб та станів. Наприклад, агоністи для підтипів рецептору 7nACh можна також застосовувати у лікуванні фізичної залежності від нікотину, що індукує припинення паління, лікування болю, та лікування порушення добового ритму, ожиріння, діабету, сексуальних розладів та розладів здатності до відтворення потомства (наприклад, передчасної еяколяції чи сухості вагіни, дивись US6448276), зловживання ліками (Solinas, Journal of Neuroscience (2007) 27(21), 5615-5620), та запалення (Wang H, et al. (2003) Naturne 421:384-388). Ряд нещодавніх спостережень стосовно можливої нейрозахисної дії нікотину у різних моделях нейродегенерації у тваринах та у культивованих клітинах, у тому числі ексцитотоксичних інсультів (Prendergast, M.A., et al. Med. Sci. Monit. (2001), 7 1153-1160; Garrido, R., et al. (2001), J. Neurochem. 76, 1395-1403; Semba, J., et al. (1996) Brain Res. 735, 335-338; Shimohama, S., et al. (1996), Ann. N.Y. Acad. Sci. 777, 356-361; Akaike, A., et al. (1994) Brain Res. 644, 181-187), трофічної втрати (Yamashita, H., Nakamura, S. (1996) Neurosci. Lett. 213, 145-147), ішемії (Shimohama, S. (1998) Brain Res. 779, 359-363), травми (Socci, D.J., Arendash, G.W. (1996) Mol. Chem. Neuropathol. 27, 285-305), Aβ-опосередкованої загибелі нейронів (Rusted, J.M., et al. (2000) Behav. Brain Res. 113, 121-129; Kihara, Т., et al. (1997) Ann.Neurol. 42, 159-163; Kihara, Т., et al. (2001) J. Biol. Chem. 276, 13541-13546) та опосередкованої агрегацією білку дегенерації нейронів (Kelton, М.С. et al.(2000) Brain Cogn 43, 274-282). У багатьох випадках, де нікотин виявляє нейрозахисну дію, відбувається безпосереднє втягання рецепторів, що містять підтип 7 (Shimohama, S. et al. (1998) Brain Res. 779, 359-363; Kihara, Т., et al. (2001) J.Biol.Chem. 276, 13541-13546; Kelton, M. C, et al. (2000) Brain Cogn 43, 274-282; Kern, W. R. (2000) Behav. Brain Res. 113, 169-181; Dajas-Bailador, F.A., et al. (2000) Neuropharmacology 39, 2799-2807; Strahlendorf, J.C, et al. (2001) Brain Res. 901, 71-78) вказуючи, що активація підтипу нікотинових ацетилхолінових рецепторів з вмістом 7 може бути діючою в опосередкуванні нейрозахисної дії нікотину. Доступні дані свідчать, що нікотиновий ацетилхоліновий рецептор альфа-7 6 UA 98317 C2 5 10 15 20 25 30 35 40 45 50 55 представляє важливу молекулярну ціль для розробки агоністів/позитивних модуляторів, активних як нейрозахисні молекули. Дійсно, нікотинові агоністи рецептору 7 вже ідентифіковані та оцінені як можливі для розробки нейрозахисних ліків (Jonnala, R.R., et al. (2002) Life Sci. 70, 1543-1554; Bencherif, M., et al. (2000) Eur. J. Pharmacol. 409, 45-55; Donnelly-Roberts, D.L, et al. (1996) Brain Res. 719, 36-44; Meyer, E.M., et al. (1998) J. Pharmacol. Exp. Ther. 284, 1026-1032; Stevens, T.R., et al. (2003) J. Neuroscience 23, 10093-10099). Сполуки, описані тут, можна застосовувати для лікування таких хвороб. Згідно з винаходом, запропоновано спосіб лікування пацієнта, особливо людини, що потерпає від пов'язаної з віком деменції та інших деменцій та станів з втратою пам'яті, що полягає у застосуванні до пацієнта ефективної кількості сполуки формули (І). Заявлений винахід стосується способів лікування пацієнтів, що потерпають від порушення пам'яті внаслідок, наприклад, помірного порушення пізнавальної здатності внаслідок старіння, хвороби Альцгеймера, шизофренії, хвороби Паркінсона, хвороби Хантингтона, хвороби Піка, хвороби Крейтцфельда-Якоба, депресії, старіння, травми голови, інсульту, гіпоксії центральної нервової системи, церебральної старезності та інших неврологічних станів, а також ВІЛ та серцево-судинних хвороб, що полягає у застосуванні ефективної кількості сполуки формули (I). Згідно з втіленням винаходу запропоновано спосіб лікування та/або попередження деменції у пацієнта з хворобою Альцгеймера, який полягає у застосуванні до пацієнта терапевтично ефективної кількості сполуки формули (І) для інгібування зв'язування амілоїдного бета-пептиду (переважно, А1-42) рецепторами nACh, переважно рецепторами 7nACh, найкраще, рецепторами людини 7nACh (а також спосіб лікування та/або попередження інших клінічних виявів хвороби Альцгеймера, що охоплюють, але без обмеження, дефіцит пізнавальної та мовної здатності, апраксії, депресію, манії, та інших нейропсихіатричних симптомів та ознак, та анормальностей руху та ходи). Заявлений винахід також стосується способів лікування інших амілоїдозних хвороб, наприклад, спадкової церебральної ангіопатії, неневропатичного спадкового амілоїдозу, синдрому Дауна, макроглобулінемії, вторинної родинної середньоземноморської лихоманки, синдрому Мукле-Велла, плазмоми, пов'язаного з підшлунковою залозою та серцем амілоїдозу, хронічної гемодіалізної артропатії, та фінського амілоїдозу та амілоїдозу Айови. На додаток, нікотинові рецептори приймають участь у реакції організму на вживання спирту. Таким чином, агоністи рецепторів 7nACh можна застосовувати у лікуванні спиртової абстиненції та при анти-інтоксикаційній терапії. Таким чином, згідно з втіленням винаходу запропоновано спосіб лікування пацієнта від спиртової абстиненції або лікування пацієнта антиінтоксикаційнлю терапією, що полягає у застосуванні до пацієнта ефективної кількості сполуки формули (І). Агоністи підтипів рецептору 7nACh можна також застосовувати для нейрозахисту проти пошкодження, асоційованого із інсультами та ішемією, та індукованою глютаматом ексцитотоксичністю. Таким чином, згідно з втіленням винаходу запропоновано спосіб лікування пацієнта за допомогою нейрозахисту проти пошкодження асоасоційованого із інсультами та ішемією, та індукованою глютаматом ексцитотоксичністю, що полягає у застосуванні до пацієнта ефективної кількості сполуки формули (І). Агоністи підтипів рецептору 7nACh можна також застосовувати у лікуванні фізичної залежності від нікотину, що індукує припинення паління, лікування болю, та лікування порушення добового ритму, ожиріння, діабет, сексуальні розлади та розлади здатності до відтворення потомства (наприклад, передчасної еяколяції чи сухості вагіни, дивись US 6448276), зловживання ліками (Solinas, Journal of Neuroscience (2007) 27(21), 5615-5620), та запалення. Таким чином, згідно з втіленням винаходу запропоновано спосіб лікування пацієнта, що потерпає від фізичної залежності від нікотину, болю, порушення добового ритму, ожиріння та/або діабету, або спосіб індукування припинення паління у пацієнта, що полягає у застосуванні до пацієнта ефективної кількості сполуки формули (І). Запальний рефлекс є автономною реакцією нервової системи на запальний сигнал. При відчутті запального стимулу автономна нервова система спрацьовує через блукаючий нерв вивільненням ацетилхоліну та активуванням нікотинових рецепторів 7 на макрофагах. Ці макрофаги вивільняють цитокіни. Дисфункції у цьому провідному шляху зв'язані з запальними хворобами людини, у тому числі ревматоїдним артритом, діабетом та сепсисом. Макрофаги експресують нікотиновий рецептор 7 та є ймовірним, що цей рецептор опосередковує холінергічні анти-запальні реакції. Тому, сполуки з афінністю до рецептору 7nACh на макрофагах можуть бути корисними при запальних хворобах людини, у тому числі ревматоїдному артриті, діабеті та сепсисі. Дивись, наприклад, Czura, С J et al., J. Intern. Med., 7 UA 98317 C2 5 10 15 20 25 30 35 40 45 50 55 60 (2005) 257(2), 156-66, Wang, H. et al Nature (2003) 421: 384-388; de Jonge British Journal of Pharmacology (2007) 151, 915-929. Таким чином, згідно з втіленням винаходу запропоновано спосіб лікування пацієнта (наприклад, ссавця, як-то людини), що потерпає від запальної хвороби, як-то, але без обмеження, ревматоїдний артрит, діабет або сепсис, що полягає у застосуванні до пацієнта ефективної кількості сполуки формули (І). Реакція акросом сперми ссавців є процесом екзоцитозу, важливим у заплідненні яйцеклітини спермою. Активація nAChR 7 на клітині сперми показана як суттєва для реакції акросом (Son, J.-H. та Meizel, S. Biol, Reproduct. 68: 1348-1353 2003). Тому, селективні агенти 7 демонструють перевагу стосовно лікування розладів здатності до відтворення потомства. На додаток, внаслідок їх афінності до рецепторів 7nACh, мічені похідні сполук формули (І) (наприклад, мічені С11 або F18 похідні), можна застосовувати у нейровідображенні рецепторів, наприклад, у мозку. Таким чином, застосовуючи такі мічені агенти відображення рецепторів in vivo, можна виконувати, наприклад, РЕТ-відображення. Стан порушення пам'яті виявляється порушенням здатності до сприйняття нової інформації та/або нездатності згадувати раніше отриману інформацію. Порушення пам'яті є первинним симптомом деменції та може також бути симптомом, асоційованим з такими хворобами як хвороба Альцгеймера, шизофренія, хвороба Паркінсона, хвороба Хантингтона, хвороба Піка, хвороба Крейтцфельда-Якоба, ВІЛ, серцево-судинна хвороба, та травма голови, а також пов'язаний з віком занепад пізнавальної здатності. Таким чином, згідно з втіленням винаходу запропоновано спосіб лікування пацієнта, що потерпає від, наприклад, помірного порушення пізнавальної здатності (МСІ), судинної деменції (VaD), пов'язаного з віком занепаду пізнавальної здатності (AACD), асоційованої з хірургією на відкритому серці амнезії, серцевого нападу та/або загальної анестезії, дефіциту пам'яті від дії анестезійних агентів, індукованого безсонням порушення пізнавальної здатності, синдрому хронічної втоми, нарколепсії, пов'язаної зі СНІД деменції, пов'язаної з порушення пізнавальної здатності епілепсії, синдрому Дауна, пов'язаної з алкоголізмом деменції (синдром Корсакова), індукованих ліками порушень пам'яті, деменції боксерів (синдром боксера), та деменції тварин (наприклад, собак, котів, коней, тощо), що полягає у застосуванні до пацієнта ефективної кількості сполуки формули (І). Доза сполуки для застосування у терапії може змінюватися залежно від, наприклад, шляху застосування, природи та суворості хвороби. Взагалі, прийнятну фармакологічну дію на людей можна отримувати з дозами на добу від 0,01 до 200 мг/кг. У деяких втіленнях заявленого винаходу, одну або більше сполук формули (І) застосовують у комбінації з одним або більше іншими фармацевтично активними агентами. Вираз "у комбінації", як застосовано тут, стосується агентів, що застосовують до суб'єкта одночасно. Слід усвідомлювати, що два або більше агентів вважають "у комбінації", коли суб'єкта одночасно піддають дії обох (або більш) агентів. Кожний з двох або більше агентів можна застосовувати згідно із відмінними режимами; не потрібно застосовувати дози відмінних агентів у той же час, або у т ій же композиції. Коли обидва (або більше) агентів залишаються в організмі, їх вважають застосовуваними "у комбінації". Наприклад, сполуки формули (І), у формах, які описано тут, можна застосовувати у комбінації з одним або більше іншими модуляторами нікотинових ацетилхолінових рецепторів альфа-7. Альтернативно або додатково, сполуки формули (І), у формах, які описано тут, можна застосовувати у комбінації з одним або більше іншими анти-психотичними агентами, аналгетиками, антизапальними, або іншими фармацевтично активними агентами. Ефективні кількості інших фармацевтично активних агентів є добре відомими спеціалістам. Однак, спеціалістам добре відомо як визначати оптимальні ефективні кількості інших фармацевтично активних агентів. Сполука формули (І) та інший фармацевтично активний агент можуть діяти адитивно або, у деяких втіленнях синергічно. У деяких втіленнях винаходу, де ще один фармацевтично активний агент застосовують до тварини, ефективна кількість сполуки формули (І) є менше, ніж її могла б бути ефективна кількість, де не застосовують інший фармацевтично активний агент. У цьому випадку, можна вважати, що сполука формули (І) та інший фармацевтично активний агент діють синергічно. У деяких випадках, пацієнта при необхідності лікування лікують одним або більше іншими фармацевтично активними агентами. У деяких випадках, пацієнта при необхідності лікування лікують принаймні двома іншими фармацевтично активними агентами. У деяких втіленнях інший фармацевтично активний агент є вибраним з групи: один або більше антидепресантів, антиседативних агентів, антипсихотичних агентів, або підсилювачі пізнавальної здатності. Приклади класів антидепресантів, що можна застосовувати у комбінації 8 UA 98317 C2 5 10 15 20 25 30 35 40 45 50 55 60 з активними сполуками цього винаходу охоплюють інгібітори перепоглинання норепінефрину, селективні інгібітори перепоглинання серотоніну (SSRI), антагоністи рецептору NK-1, інгібітори моноамін-оксидази (МАО), оборотні інгібітори моноамін-оксидази (RIMA), інгібітори перепоглинання серотоніну та норадреналіну (SNRI), антагоністи фактору вивільнення кортикотропіну (CRF), антагоністи -адренорецептору, та атипові антидепресанти. Придатні інгібітори перепоглинання норепінефрину охоплюють третинні трициклічні аміни та вторинні трициклічні аміни. Придатні третинні трициклічні аміни та вторинні трициклічні аміни охоплюють амітриптилін, кломіпрамін, доксепін, іміпрамін, триміпрамін, дотієпін, бутриптилін, іприндол, лофепрамін, нортриптилін, протриптилін, амоксапін, дезипрамін та мапротилін. Придатні селективні інгібітори перепоглинання серотоніну охоплюють флуоксетин, цитолопрам, есциталопрам, флувоксамін, пароксетин та сертралін. Приклади інгібіторів моноамін-оксидази охоплюють ізокарбоксазид, фенелзин та транілципромін. Придатні оборотні інгібітори моноаміноксидази охоплюють моклобемід. Придатні інгібітори перепоглинання серотоніну та норадреналіну у заявленому винаході охоплюють венлафаксин, нефазодон, мілнаципран, та дулоксетин. Придатні антагоністи CRF охоплюють сполуки, описані у міжнародних патентних публікаціях WO 94/13643, WO 94/13644, WO 94/13661, WO 94/13676 та WO 94/13677. Придатні атипові антидепресанти охоплюють бупропіон, літій, нефазодон, тразодон та вілоксазин. Придатні антагоністи рецептору NK-1 охоплюють визначені у міжнародній патентній публікації WO 01/77100. Антиседативні агенти, що можна застосовувати у комбінації зі сполуками формули (І) охоплюють, без обмеження, бензодіазепіни та агоністи або антагоністи серотоніну 1А (5-НТ-1A), особливо часткові агоністи 5-НТ1А, та антагоністи фактору вивільнення кортикотропіну (CRF). Зразкові придатні бензодіазепіни охоплюють алпразолам, хлордіазепоксид, клоназепам, хлоразепат, діазепам, галазепам, лоразепам, оксазепам та празепам. Зразкові придатні агоністи або антагоніст рецептору 5-НТ1А охоплюють буспірон, флезнеоксан, гепірон та іпсапірон. Антипсихотичні агенти, що є застосовуваними у комбінації зі сполуками формули (І) охоплюють без обмеження аліфатичний фетіазин, піперазин фенотіазин, бутирофенон, заміщений бензамід та тіоксантин. Додаткові приклади таких ліків охоплюють, без обмеження, галоперидол, оланзапін, клозапін, рисперидон, пімозид, арипіпразол, та зипразидон. У деяких випадках, ліками є антиконвульсант, наприклад, фенобарбітал, фенітоїн, примідон або карбамазепін. Підсилювачі пізнавальної здатності, що є застосовуваними у комбінації зі сполуками формули (І), охоплюють, без обмеження, ліки, що модулюють рівні нейротрансмітерів (наприклад, інгібітори ацетилхолінестерази або холінестерази, агоністи холінергічного рецептору або антагоністи рецептору серотоніну), ліки, що модулюють рівні розчинного А, утворення амілоїдозних фібрил, або амілоїдозного навантаження тромбоцитів (наприклад, інгібітори -секретази, інгібітори -секретази, терапії антитілами, та деградувальні ферменти), та ліки, що захищають цілісність нейронів (наприклад, антіоксиданти, інгібітори кінази, інгібітори каспази, та гормони). Інші репрезентативні можливі ліки, що співзастосовують зі сполуками винаходу, охоплюють інгібітори холінестерази, (наприклад, такрин (COGNEX®), донепезил 09 (ARICEPT®), ривастигмін (EXELON®) галантамін (REMIHIЛ ), метрифонат, фізостигмін, та ксиперзин А), антагоністи та агоністи N-метил-D-аспартату (NMDA) (наприклад, декстрометорфан, мемантин, дизолцилпін малеат (МК-801), ксенон, ремацемід, еліпроділ, амантадин, D-циклосерин, фелбамат, іфенпроділ, СР-101606 (Pfizer), делюцемін, та сполуки, описані у патентах США 6,821,985 та 6,635,270), ампакіни (наприклад, циклотіазид, анірацетам, СХ-516 (Ampalex®), СХ-717, СХ-516, СХ-614, та СХ-691 (Cortex Pharmaceuticals, Inc. Irvine, CA), 7-хлор-3-метил-3-4-дигідро-2Н-1,2,4-бензотіадіазин S,S-діоксид (дивись Zivkovic et al., 1995, J. Pharmacol. Exp. Therap., 272:300-309; Thompson et al., 1995, Proc. Natl. Acad. Sci. USA, 92:76677671), 3-біцикло[2,2,1]гепт-5-ен-2-іл-6-хлор-3,4-дигідро-2Н-1,2,4-бензотіадіазин-7-сульфонамід1,1-діоксид (Yamada, et al., 1993, J. Neurosc. 13:3904-3915); 7-флуор-3-метил-5-етил-1,2,4бензотіадіазин-8,3-діоксид; та сполуки, описані у патенті США 6,620,808 та Міжнародних заявках на патент WO 94/02475, WO 96/38414, WO 97/36907, WO 99/51240, та WO 99/42456), модулятори комплексу рецептор бензодіазепіну (BZD)/GABA (наприклад, прогабід, генгабін, залеплон, та сполуки, описані у патенті США 5,538,956, 5,260,331, та 5,422,355); антагоністи серотоніну (наприклад, модулятори рецептору 5НТ, антагоністи або агоністи 5НТ 1A (у тому числі, без обмеження, лекозотан та сполуки, описані у патентах США 6,465,482, 6,127,357, 6,469,007, та 6,586,436, та у міжнародній патентній публікації WO 97/03982) та антагоністи 5-НТ6 (у тому числі, без обмеження, сполуки, описані у патентах США 6,727,236, 6,825,212, 6,995,176, та 7,041,695)); нікотинові (наприклад, ніацин); мускаринові (наприклад, ксаномелін, CDD-0102, 9 UA 98317 C2 5 10 15 20 25 30 35 40 45 50 55 цевімелін, талсаклідин, оксибутин, толтеродин, пропіверин, тропсіум хлорид та дарифенацин); інгібітори моноамін-оксидази типу В (МАО В) (наприклад, разагілін, селегілін, депреніл, лазабемід, сафінамід, клоргілін, паргілін, N-(2-аміноетил)-4-хлорбензамід гідрохлорид, та N-(2аміноетил)-5(3-флуорфеніл)-4-тіазолкарбоксамід гідрохлорид); інгібітори фосфодіестерази (PDE) IV (наприклад, рофлуміласт, арофілин, циломіласт, роліпрам, RO-20-1724, теофілин, денбуфілин, ARIFLO, ROFLUMILAST, CDP-840 (триарилетан) СР80633 (піримідон), RP 7 3401 (Rhone-Poulenc Rorer), денбуфілин (SmithKline Beecham), арофілин (Almirall), CP-77,059 (Pfizer), пірид[2,3d]піридазин-5-они (Syntex), EP-685479 (Bayer), T-440 (Tanabe Seiyaku), та SDZ-ISQ-844 (Novartis)); G-білки; модулятори каналів; імунотерапевтичні (наприклад, сполуки, описані у патентній публікації США 2005/0197356 та 2005/0197379); анти-амілоїдозні агенти або агенти зниження амілоїдози (наприклад, бапінеюзумаб та сполуки, описані у патенті США 6,878,742 або у патентних публікаціях США 2005/0282825 або 2005/0282826); статини та модулятори активованого проліфераторами пероксизом рецептору (PPARS) (наприклад, гемфіброзил (LOPID®), фенофібрат (TRICOR®), розиглітазсн малеат (AVANДІA®), піоглітазон (Actos™), розиглітазон (Avanдia™), клофібрат та безафібрат); інгібітори цистеїніл-протеази; інгібітор рецептору для посиленого глікозилування кінцевого продукту (RAGE) (наприклад, аміногуанідин, піридоксамінем карнозин, феназиндіамін, ОРВ-9195, та тенілзетам); безпосередні або опосередковані нейротропні агенти (наприклад, Cerebrolysin®, пірацетам, оксирацетам, АІТ-082 (Emilieu, 2000, Arch. Neurol. 57:454)); інгібітори бета-секретази (ВАСЕ), секретази, імунофіліни, інгібітори каспази-3, інгібітори кінази Src, активатори активатору тканинного плазміногену (ТРА), модулятори АМРА (альфа-аміно-3-гідрокси-5-метил-4ізоксазолпропіонова кислота), агоністи М4, інгібітори JNK3, агоністи LXR, антагоністи Н3, та антагоністи ангіотензину IV. Інші підсилювачі пізнавальної здатності охоплюють, без обмеження, ацетил-1-карнітин, цитихолін, ксиперзин, DMAE (диметиламіноетанол), екстракт Васора monneiri, екстракт Sage, гліцерил-фосфорил-холін L-альфа, екстракт Ginko biloba та Ginko biloba, вінпроцетин, DHA, ноотропні, у тому числі фенілтропін, пікатропін (від Creative Compounds, LLC, Scott City, MO), безипірдин, лінопірдин, сибопірдин, естрогенні та естрогенічні сполуки, ідебенон, Т-588 (Toyama Chemical, Japan), та FK960 (Fujisawa Pharmaceutical Co. Ltd.). Сполуки, описані у патентах США 5,219,857, 4,904,658, 4,624,954 та 4,665,183 є також корисними як підсилювачі пізнавальної здатності, як описано тут. Підсилювачі пізнавальної здатності, що діють одним або більше з вищенаведених механізмів є також у рамках цього винаходу. У деяких втіленнях сполука формули (І) та підсилювач пізнавальної здатності діють адитивно або, у деяких втіленнях, синергічно. У деяких втіленнях, де підсилювач пізнавальної здатності та сполуку формули (І) винаходу співзастосовують до тварини, ефективна кількість сполуки або фармацевтично прийнятної солі сполуки винаходу є менше, ніж могла б бути її ефективна кількість, де не застосовують підсилювач пізнавальної здатності. У деяких втіленнях, де підсилювач пізнавальної здатності та сполуку формули (І) співзастосовують до тварин, ефективна кількість підсилювачу пізнавальної здатності є менше, ніж могла б бути його ефективна кількість, де не застосовують сполуку або фармацевтично прийнятну сіль винаходу. У деяких втіленнях підсилювач пізнавальної здатності га сполуку формули (І) винаходу співзастосовують до тварин у дозах, що є менше, ніж могли б бути їх ефективні кількості, де вони не були співзастосовуваними. У цих випадках, можна вважати, що сполука формули (І) та підсилювач пізнавальної здатності діють синергічно. У деяких втіленнях іншим фармацевтично активним агентом є агент, корисний для лікування хвороби Альцгеймера або станів в асоціації з хворобою Альцгеймера, як-то деменції. Зразкові агенти, корисні для лікування хвороб Альцгеймера охоплюють, без обмеження, донепезил, ривастигмін, галантамін, мемантин, та такрин. У деяких втіленнях сполуку формули (І) застосовують разом з ще одним фармацевтично активним агентом у поодинокому застосуванні або композицію. У деяких втіленнях можна застосовувати композицію, що містить ефективну кількість сполуки формули (І) та ефективну кількість ще одного фармацевтично активного агенту у тій же композиції. У ще одному втіленні композицію, що містить ефективну кількість сполуки формули (І), та окрему композицію, що містить ефективну кількість ще одного фармацевтично активного агенту, можна застосовувати одночасно. У ще одному втіленні ефективну кількість сполуки формули (І) застосовують до або після застосування ефективної кількості ще одного фармацевтично активного агенту. У цьому втіленні сполуку формули (І) застосовують, тоді як інший фармацевтично активний агент викликає свою терапевтичну дію, або інший 10 UA 98317 C2 5 10 15 20 25 30 35 40 45 50 55 60 фармацевтично активний агент застосовують, тоді як сполука формули (І) викликає свою попереджувальну або терапевтичну дію. Таким чином, у деяких втіленнях винахід стосується композиції, що містить ефективну кількість сполуки формули (І)заявленого винаходу та фармацевтично прийнятний носій. У деяких втіленнях композиція крім того містить другий фармацевтично активний агент. У ще одному втіленні композиція крім того містить фармацевтично активний агент, вибраний з групи: один або більше інших антидепресантів, антиседативних агентів, антипсихотичних агентів або підсилювачів пізнавальної здатності. Антидепресанти, антиседативні агенти, антипсихотичні агенти та підсилювачі пізнавальної здатності, придатні для застосування у композиції, охоплюють вищенаведені антидепресанти, антиседативні агенти, антипсихотичні агенти та підсилювачі пізнавальної здатності. У ще одному втіленні фармацевтично прийнятний носій є придатним для перорального застосування, а композиція містить пероральну дозовану форму. У деяких втіленнях одну або більше сполук формули (І) застосовують у комбінації з лікуванням антидепресантом, лікуванням антипсихотичними ліками, та/або лікуванням антиконвульсантними ліками. У деяких втіленнях сполуку формули (І) застосовують у комбінації з одним або більше селективними інгібіторами перепоглинання серотоніну (SSRI) (як-то, флуоксетин, циталопрам, есциталопрам оксалат, флувоксамін малеат, пароксетин, або сертралін), трициклічними антидепресантами (як-то, дезипрамін, амітриптиліп, амоксипін, кломіпрамін, доксепін, іміпрамін, нортриптилін, протритилін, триміпрамін, дотієпін, бутриптилін, іприндол, або лофепрамін), сполуками класу амінокетонів (як-то, бупропіон); у деяких втіленнях сполуку формули (І) застосовують у комбінації з інгібітором моноамін-оксидази (МАОІ) (як-то, фенелзин, ізокарбоксазид, або транілципромін), інгібітором перепоглинання серотоніну та норепіпеферину (SNRI) (як-то, венлафаксин, нефазодон, мілнаципран, дулоксетин), інгібітором перепоглинання норепінефрину (NRI) (як-то, ребоксєтин), частковий агоніст 5-НТ1A (як-то, буспірон), антагоніст рецептору 5-НТ2A (як-то, нефазодон), звичайними антипсихотичними ліками, або атиповими антипсихотичними ліками. Приклади так антипсихотичних ліків охоплюють аліфатичний фетіазин, піперазин фенотіазин, бутирофенон, заміщений бензамід, та тіоксантин. Додаткові приклади таких ліків охоплюють галоперидол, оланзапін, клозапін, рисперидон, пімозид, арипіпразол, та зипразидон. У деяких випадках, ліками є антиконвульсант, наприклад, фенобарбітал, фенітоїн, примідон, або карбамазепін. У деяких випадках, сполуку формули (І) застосовують у комбінації із принаймні двома ліками, що є антидепресантами, антипсихотичними ліками, антиконвульсантами або їх комбінацією. Фармацевтичні композиції У наступному аспекті винахід стосується фармацевтичної композиції, що містить одну або більше сполук формули (І) в асоціації з фармацевтично прийнятними носіями та наповнювачами. Фармацевтичні композиції можуть бути у формі твердих, напівтвердих або рідких препаратів, переважно у формі розчинів, суспензій, порошків, гранул, таблеток, капсул, сиропів, супозиторіїв, аерозолів або систем з регульованим постачанням. Композиції можна застосовувати різними шляхами, у тому числі пероральним, трансдермальним, підшкірним, внутрішньовенним, внутрішньом'язовим, ректальним та інтраназальним, та є переважно сформованими у формі окремої дози, кожна доза містить приблизно від 1 до 1000 мг, переважно від 1 до 600 мг активної складової. Сполуки винаходу можуть бути у формі вільної основи або як кислотно-адитивні солі, переважно солі з фармацевтично прийнятними кислотами. Винахід також стосується відокремлених ізомерів та діастереомерів сполук І, або їх суміші (наприклад, рацемічної суміші). Способи отримання фармацевтичних композицій є описаними наприклад, у Remington's Pharmaceutical Science, Mack Publishing Company, Easton (PA). При застосуванні до тварин, одну або більше сполук формули (І), у будь-якій бажаній формі (як-то, сіль, кристалічна форма, тощо), можна застосовувати чистою або як компонент фармацевтичної композиції, що містить фізіологічно прийнятний носій. Таку фармацевтичну композицію винаходу можна отримувати, застосовуючи стандартні способи, наприклад, змішування сполук та фізіологічно прийнятного носія, наповнювачу або розріджувачу. Змішування можна досягти, застосовуючи способи, добре відомі для змішування сполуки формули (І) та фізіологічно прийнятного носія, наповнювачу або розріджувачу. Запропоновані фармацевтичні композиції (тобто, що містять одну або більше сполук формули (І) у підхожій формі, можна застосовувати перорально. Альтернативно або додатково, запропоновані фармацевтичні композиції можна застосовувати будь-яким іншим зручним шляхом, наприклад, парентерально (як-то, підшкірно, внутрішньовенно, тощо, вливанням або 11 UA 98317 C2 5 10 15 20 25 30 35 40 45 50 55 60 болюсною ін'єкцією, тощо), поглинанням крізь епітеліальну або слизово-шкірну вистілки (як-то, перорально, ректально, вагінально та кишкову слизову), тощо. Застосування може бути системним або локальним. Різні відомі системи постачання можна застосовувати, у тому числі, наприклад, інкапсулювання у ліпосоми, мікрочастинки, мікрокапсули та капсули. Способи застосування охоплюють, але без обмеження, інтрадермальний, внутрішньом'язовий, інтраперитонеальний, внутрішньовенний, підшкірний, інтраназальний, епідуральний, пероральний, сублінгвальний, інтрацеребральний, інтравагінальний, трансдермальний, ректальний, інгаляцією, або місцевий, особливо до вух, носа, очей або шкіри. У деяких випадках, застосування призводитиме до вивільнення сполуки (та/або одного або більше її метаболітів) у кровообіг. Режим застосування можна залишати на рішення лікаря. У деяких втіленнях запропоновані фармацевтичні композиції застосовують перорально; у деяких втіленнях запропоновані фармацевтичні композиції застосовують внутрішньовенно. У деяких втіленнях може бути бажаним застосовувати запропоновані фармацевтичні композиції локально. Цього можна досягти, наприклад, локальним вливанням протягом хірургічного втручання, місцевого застосування, наприклад, разом з пов'язкою після хірургічного втручання, ін'єкцією, засобами катетеру, засобами супозиторію або клізми, або засобами імплантації, вказаний імплантат є пористим, непористим, або желатиновим матеріалом, у тому числі мембранами, як-то мембрани або волокна. У деяких втіленнях може бути бажаним уводити сполуку формули (І) у центральну нервову систему, кровоносну систему або шлунково-кишковий тракт будь-яким придатним шляхом, у тому числі інтравентрикулярним, інтратекальною ін'єкцією, параспінальною ін'єкцією, епідуральною ін'єкцією, клізмою та ін'єкцією поруч з периферійним нервом. Інтравентрикулярну ін'єкцію можна полегшувати інтравентрикулярним катетером, наприклад, приєднаним до резервуару. Застосування у легені можна також застосовувати, наприклад, застосуванням інгалятору або розпилювачу, та композиції з аерозольним агентом чи перфузією у флуоркарбоновий або синтетичний легеневий сурфактант. У деяких втіленнях сполуку формули (І) можна формувати як супозиторій з традиційними зв'язуючими та наповнювачами, як-то тригліцериди. У деяких втіленнях одну або більше сполук формули (І) можна постачати у везикулі, зокрема ліпосомі (дивись Langer, Science 249:1527-1533, 1990 та Treat et al., Liposomes in the Therapy of Infectious Disease and Cancer 317-327 та 353-365, 1989). У деяких втіленнях одну або більше сполуки формули (І) можна постачати у системі з регульованим вивільненням або системі з безперервним вивільненням (дивись, наприклад, Goodson, у Medical Applications of Controlled Release, vol. 2, pp. 115-138, 1984). Інші системи з регульованим чи безперервним вивільненням обговорено в огляді Langer, Science 249:15271533, 1990. У деяких втіленнях можна застосовувати насос (Langer, Science 249:1527-1533, 1990; Sefton, CRC Crit. Ref. Biomed. Eng. 14:201, 1987; Buchwald et al., Surgery 88:507, 1980; та Saudek el al., N. Engl. J Med. 321:574, 1989). У ще одному втіленні можна застосовувати полімерні матеріали (дивись Medical Applications of Controlled Release (Langer та Wise eds., 1974); Controlled Drug Bioavailability, Drug Product Design and Performance (Smolen та Ball eds., 1984); Ranger та Peppas, J. Macromol. Sci. Rev. Macromol. Chem. 2:61, 1983; Levy et al., Science 228:190, 1935; During et al., Ann. Neural. 25:351, 1989; та Howard et al., J. Neurosurg. 71:105, 1989). Як сказано вище, запропоновані фармацевтичні композиції можуть необов'язково містити придатну кількість фізіологічно прийнятного наповнювачу. Зразкові фізіологічно прийнятні наповнювачі можуть бути рідинами, як-то вода та оливи, у тому числі з нафти, тваринного, рослинного, або синтетичного походження, як-то арахісова олія, олія сої, мінеральна олива, кунжутна олія тощо. Наприклад, корисним фізіологічно прийнятним наповнювачем може бути фізіологічний розчин, гуміарабік, желатин, крохмальна паста, тальк, кератин, силікагель, сечовина тощо. Альтернативно або додатково можна застосовувати наповнювачі, стабілізатори, загусники, лубриканти та барвники. У деяких втіленнях є застосовуваним фізіологічно прийнятний наповнювач, що є стерильним при застосуванні до тварин. Такі фізіологічно прийнятні наповнювачі є бажано стабільними в умовах виробництва та зберігання та повинні звичайно бути захищеними проти забруднювальної дії мікроорганізмів. Вода є особливо корисним наповнювачем, коли сполуку формули (І) застосовують внутрішньовенно Фізіологічний розчин та водні розчини декстрози та гліцерину можна також застосовувати як рідкий наповнювачі, особливо придатний для застосування ін'єкціями. Придатні фізіологічно прийнятні наповнювачі також охоплюють крохмаль, глюкозу, лактозу, сахарозу, желатин, солод, рис, борошно, крейду, силікагель, натрій стеарат, гліцерин моностеарат, тальк, натрій хлорид, висушене знежирене молоко, гліцерин, 12 UA 98317 C2 5 10 15 20 25 30 35 40 45 50 55 60 пропіленгліколь, вода, етанол тощо. Запропоновані фармацевтичні композиції, якщо потрібно, можуть також містити другорядні кількості змочувальних або емульгувальних агентів, або рН буферувальних агентів. Рідкі носії можна застосовувати при отримуванні розчинів, суспензій, емульсій, сиропів та еліксирів. Сполуку формули (І) можна розчиняти або суспендувати у фармацевтично прийнятному рідкому носії, як-то вода, органічний розчинник, суміш обох, або фармацевтично прийнятні оливи або жир. Такий рідкий носій може містити інші придатні фармацевтичні добавки, у тому числі солюбілізатори, емульгатори, буфери, консерванти, підсолоджувачі, приправи, суспендувальні агенти, загусники, барвники, регулятори в'язкості, стабілізатори, або осморегулятори. Придатні приклади рідких носіїв для перорального та парентерального застосування охоплюють воду (особливо, що містить вищезгадані добавки, наприклад, похідні целюлози, у тому числі натрій-карбоксиметилцелюлозу), спирти (утому числі моноспирти та поліспирти, наприклад, гліколі) та їх похідні, та оливи (наприклад, фракціоновану кокосову олію та олію арахісу). Для парентерального застосування носієм може також бути оліїстий естер, якто етилолеат та ізопропілміристат. Стерильні рідкі носії є застосовуваними у стерильній рідкій формі композиції для парентерального застосування. Рідкі носії для композиції під тиском можуть бути галогенованим вуглеводнем або іншим фармацевтично прийнятним пропелентом. Запропоновані фармацевтичні композиції можуть мати форму розчинів, суспензій, емульсій, таблеток, пілюль, гранул, капсул, капсул, що містять рідини, порошків, композицій з безперервним вивільненням, супозиторіїв, емульсій, аерозолів, спреїв, суспензій, або будь-яку іншу форму, придатну для застосування. У деяких втіленнях є запропонованими фармацевтичні композиції у формі капсул. Інші приклади придатних фізіологічно прийнятних наповнювачів є описаними у Remington's Pharmaceutical Sciences 1447-1676 (Alfonso R. Gennaro, ed., 19th ed. 1995). У деяких втіленнях сполуку формули (І) (у підхожій формі) формують звичайними способами як композицію, адаптовану для перорального застосування до людей. Композиції для перорального постачання можуть бути у формі таблеток, пастилок, букальних форм, пігулок, водних або оліїстих суспензій або розчинів, гранул, порошків, емульсій, капсул, сиропів або еліксирів, наприклад. Перорально застосовувані композиції можуть містити один або більше агентів, наприклад, підсолоджувачів, як-то фруктоза, аспартам чи сахарин, приправи, як-то м'ятну, вишневу олію, олію гаультерії; барвники; та консерванти, для забезпечення фармацевтично приємного препарату. У порошках носієм може бути мілко подрібнений твердий матеріал, котрий є сумішшю з мілко подрібненою сполукою або фармацевтично прийнятною сіллю сполуки. У таблетках сполука або фармацевтично прийнятна сіль сполуки є змішаними з носієм, що має необхідні властивості для пресування, у придатній пропорції та спресованими до потрібної форми та розміру. Порошки та таблетки можуть містити до 99 % сполуки або фармацевтично прийнятної солі сполуки. Капсули можуть містити суміші одної або більше сполук формули (І) з інертними наповнювачами та/або розріджувачами, як-то фармацевтично прийнятні крохмалі, цукри, штучні підсолоджувачі, порошкові целюлози (як-то кристалічна та мікрокристалічна целюлози), борошно, желатини камеді, тощо. Композиції таблеток зробити можна звичайним пресуванням, вологим гранулюванням або сухим гранулюванням та застосовувати фармацевтично прийнятні розріджувачі, зв'язувальні агенти, лубриканти, дезинтегратори, модифікатори поверхні (у тому числі сурфактанти), суспендувальні засоби або стабілізатори (у тому числі, але без обмеження, магній стеарат, стеаринова кислота, натрій лаурилсульфат, тальк, цукри, лактоза, декстрин, крохмаль, желатин, целюлоза, метилцелюлоза, мікрокристалічна целюлоза, натрій-карбоксиметил целюлоза, кальцій-карбокси метил целюлоза, пол і вініл пірол ідин, альгінова кислота, гуміарабік, ксантанова камедь, натрій цитрат, силікати, кальцій карбонат, гліцин, сахароза, сорбітол, дикальцій фосфат, кальцій сульфат, лактоза, каолін, манітол, натрій хлорид, низькоплавкі воски, та іонообмінні смоли.) Поверхневі модифікатори охоплюють неіонні та аніонні поверхневі модифікатори. Репрезентативні приклади поверхневих модифікаторів охоплюють, але без обмеження, полоксамер 188, бензалконій хлорид, кальцій стеарат, цетостеариловий спирт, цетомакрогольний емульгувальний віск, естери сорбітану, силікагель, фосфати, натрій додецилсульфат, магній алюміній силікат, та триетаноламін. Більш того, коли у формі таблетки або пілюлі, запропоновані фармацевтичні композиції, їх можна покривати для затримки дезинтеграції та поглинання у шлунково-кишковому тракті для забезпечення безперервної ефект протягом періоду часу. Селективно проникні мембрани, оточені осмотично активною задавальною сполукою є також придатними для перорального застосовування. У цих останніх рідина з оточуючого капсулу середовища може всмоктуватися 13 UA 98317 C2 5 10 15 20 25 30 35 40 45 50 55 задавальною сполукою, що набрякає і виділяє агент або композицію агентів крізь щілину. Ці типи постачання можуть забезпечувати по суті нульовий порядок профілю постачання на відміну від композиції з негайним вивільненням. Матеріал для затримки у часі, як-то гліцерин моностеарат або гліцерин стеарат, можна також застосовувати. Пероральні композиції можуть містити стандартні наповнювачі, як-то манітол, лактоза, крохмаль, магній стеарат, натрійсахарин, целюлоза та магній карбонат. У деяких втіленнях наповнювачі мають фармацевтичний ґатунок. У деяких втіленнях одну або більше сполук формули (І) (у підхожій формі) можна формувати для внутрішньовенного застосування. Звичайно, композиції для внутрішньовенного застосування містять стерильний ізотонічний водний буфер Де необхідно, композиції можуть також містити солюбілізатор. Композиції для внутрішньовенного застосування можуть необов'язково містити локальний анестезійний агент, як-то лігнокаїн, для зменшення болю на ділянці ін'єкції. Загалом, складові постачають окремо або змішують разом у формі окремої дози, наприклад, як сухий ліофілізований порошок або безводний концентрат у закритому резервуарі, як-то ампул або пакетик, показуючи кількість активного агенту. Де сполуку формули (І) застосовують вливанням, її можна розподіляти, наприклад, з пляшки для вливання, що містить стерильну фармацевтичну воду або фізіологічний розчин. Де сполуку формули (І) застосовують ін'єкцією, ампулу стерильної води для ін'єкції або фізіологічний розчин можна забезпечувати так, щоб складові можна було змішувати до застосування. У деяких втіленнях одну або більше сполук формули (І) (у підхожій формі) можна застосовувати трансдермально як трансдермальну повязку. Трансдермальні застосування охоплюють застосування на поверхні тіла та внутрішніх вистілок організму, у тому числі епітеліальних та слизових тканин Такі застосування можна проводити, застосовуючи лосьйони, креми, пінки, пов'язки, суспензії, розчини та супозиторії (наприклад, ректальні або вагінальні). Трансдермального застосування можна досягти застосуванням трансдермальної пов'язки, що містить одну або більше сполук формули (І) (у підхожій формі) та носій, що є інертним стосовно сполуки або фармацевтично прийнятної солі сполуки, є нетоксичним для шкіри та дозволяє постачання агенту для системного поглинання у кров через шкіру. Носій може бути кремом або маззю, пастою, гелем або оклюзійним пристроєм. Креми або мазі можуть бути в'язкою рідиною або напівтвердим емульсіями олива-у-воді або вода-в-оливі. Пасти містять абсорбційні порошки, дисперговані у нафтопродуктах або гідрофільних нафтопродуктах, що містять активну складову. Різні оклюзійні пристрої можна застосовувати до вивільнення сполуки або фармацевтично прийнятної солі сполуки у кров, як-то покритий напівпроникною мембраною резервуар, що містить сполуку формули (І), або матриця, що містить активну складову. Одну або більше сполук формули (І) (у підхожій формі) можна застосовувати ректально або вагінально у формі звичайного супозиторію. Композицію супозиторію можна зробити з традиційних матеріалів, у тому числі масла какао, з додаванням або без нього восків для зміни точки плавлення супозиторію, та гліцерину. Водорозчинні основи супозиторію, як-то поліетиленгліколі різної молекулярної маси, можна застосовувати також. Одну або більше сполук формули (І) (у підхожій формі) можна застосовувати засобами для регульованого чи безперервного вивільнення або пристроями постачання, що є відомими спеціалістам. Такі дозовані форми можна застосовувати для забезпечення регульованого чи безперервного вивільнення одної або більше активних складових, застосовуючи, наприклад, гідропропілметилцелюлозу, інші полімерні матриці, гелі, проникні мембрани, осмотичні системи, багатошарові покриття, мікрочастинки, ліпосоми, мікросфери, або їх комбінації для забезпечення потрібного профілю вивільнення у змінюваній пропорції. Придатні композиції для регульованого чи безперервного вивільнення, відомі спеціалістам, у тому числі описані тут, можна легко вибрати для застосування з активними складовими винаходу. Винахід тому стосується поодинокої форми окремої дози, придатної для перорального застосування, як-то, але без обмеження, таблетки та капсули, що є адаптованими для регульованого чи безперервного вивільнення. У деяких втіленнях композиція для регульованого чи безперервного вивільнення, що містить мінімальну кількість сполуки формули (І) для лікування або попередження одного або більше розладів, хвороб або станів, асоційованих з активністю нікотинових ацетилхолінових рецепторів альфа-7. Переваги композицій для регульованого чи безперервного вивільнення охоплюють подовжену актиєність ліків, зменшену частоту доз, та збільшеним комплаєнсом для тварини, яку лікують. На додаток, композиції для регульованого чи безперервного вивільнення можуть впливати на час початку дії або інші характеристики, як-то рівні сполуки у крові, та можуть таким чином зменшувати шкідливу побічну дію. 14 UA 98317 C2 5 10 15 20 25 30 35 40 45 50 55 Композиції для регульованого чи безперервного вивільнення можуть спочатку вивільняти кількість одної або більше сполук формули (І), що продукує потрібну терапевтичну або профілактичну дію, та поступово та безперервно вивілььяють інші кількості сполуки для підтримування цього рівня терапевтичної або профілактичної дії протягом подовженого періоду часу. Для підтримування постійного рівня сполуки у тілі, сполука може бути вивільненою з дозованої форми при швидкості, що заміщуватиме кількість сполуки, що метаболізується та виводиться з організму. Регульоване чи безперервне вивільнення активної складової можна стимулювати різними умовами, у тому числі, але без обмеження, змінами рН, температури, концентрації наявністю ферментів, концентрації або наявністю води, або іншими фізіологічними умовами або сполуками. У деяких втіленнях запропоновані фармацевтичні композиції постачають кількість сполуки формули (І), що є ефективною у лікуванні одного або більше розладів, хвороб або станів, асоційованих з активністю (або інертністю) нікотинових ацетилхолінових рецепторів альфа-7. Згідно з заявленим винаходом, аналізи in vitro або in vivo можна необов'язково застосовувати для допомоги ідентифікації оптимальних меж доз. Точна доза для застосування може також залежати від шляху застосування, стану, серйозності стану, який лікують, а також різних фізичних факторів, пов'язаних з до особами, яких лікують, та може бути визначеною лікарем. Еквівалентні дози можна застосовувати протягом різних періодів часу, у тому числі, але без обмеження, приблизно кожні 2 години, приблизно кожні 6 годин, приблизно кожні 8 годин, приблизно кожні 12 годин, приблизно кожні 24 години, приблизно кожні 36 годин, приблизно кожні 48 годин, приблизно кожні 72 години, приблизно кожного тижня, приблизно кожні два тижні, приблизно кожні три тижні, приблизно кожного місяця, та приблизно кожні два місяці. Число та частота доз, відповідних завершеному курсу терапії слід визначати лікарю. Ефективні дози, описані тут, звичайно стосуються загальної застосовуваної кількості; якщо застосовують більше, ніж одну сполуку формули (І), ефективна доза кількості відповідає загальній застосовуваній кількості. Ефективна кількість сполуки формули (І) для застосування, як описано тут повинна звичайно бути приблизно від 0,001 мг/кг до 600 мг/кг маси тіла на добу, у деяких втіленнях приблизно від 1 мг/кг до 600 мг/кг маси тіла на добу, у ще одному втіленні приблизно від 10 мг/кг до 400 мг/кг маси тіла на добу, у ще одному втіленні приблизно від 10 мг/кг до 200 мг/кг маси тіла на добу, у ще одному втіленні приблизно від 10 мг/кг до 100 мг/кг маси тіла на добу, у ще одному втіленні приблизно від 1 мг/кг до 10 мг/кг маси тіла на добу, у ще одному втіленні приблизно від 0,001 мг/кг до 100 мг/кг маси тіла на добу, у ще одному втіленні приблизно від 0,001 мг/кг до 10 мг/кг маси тіла на добу, та у ще одному втіленні приблизно від 0,001 мг/кг до 1 мг/кг маси тіла на добу. У деяких втіленнях фармацевтичні композиції є запропонованими у формі окремої дози, наприклад, як таблетка, капсула, порошок, розчин, суспензія, емульсія, гранула або супозиторій. У такій формі композицію ділять на окремі дози, що містять підхожі кількості активної складової; формою окремої дози може бути упаковані композиції, наприклад, упаковані порошки, склянки, ампули, попередньо заповнені шприци або пакетики, що містять рідини. Формою окремої дози може бути, наприклад, капсула або таблетка, або підхоже число будьяких таких композицій в упакованій формі. Така форма окремої дози може містити, наприклад, приблизно від 0,01 мг/кг до 250 мг/кг, та може бути даною поодинокою дозою або двома або більше дозами. Варіації дози повинні неодмінно бути залежно від виду, маси та стану пацієнта, якого лікують та реакції на медикамент пацієнта. У деяких втіленнях формою окремої дози є приблизно 0,01-1000 мг. У ще одному втіленні формою окремої дози є приблизно 0,01-500 мг; у ще одному втіленні формою окремої дози є приблизно 0,01-250 мг; у ще одному втіленні формою окремої дози є приблизно 0,01-100 мг; у ще одному втіленні формою окремої дози є приблизно 0,01-50 мг; у ще одному втіленні формою окремої дози є приблизно 0,01-25 мг; у ще одному втіленні формою окремої дози є приблизно 0,01-10 мг; у ще одному втіленні формою окремої дози є приблизно 0,01-5 мг; та у ще одному втіленні формою окремої дози є приблизно 0,01-10 мг; Сполука формули (І) може бути аналізованою in vitro або in vivo стосовно потрібної терапевтичної або профілактичної активності стосовно застосування до людей. Тваринні моделі можна застосовувати для демонстрації безпечності та ефективності. Синтез та Отримання Сполуки формули (І) або їх попередники можна отримувати шляхами синтезу, котрі ілюстровані у схемах 1-5 нижче: 15 UA 98317 C2 Схема 1 Amine - амін 5 10 15 20 25 30 35 Згідно зі схемою 1, -алканоїл хлорид 1 (тут представлений як -бромалканоїлхлорид) реагує з придатним гетероциклічним аміном 2 у розчиннику, як-то наприклад, але без обмеження, дихлорметан, диметилформамід, диметилацетамід, тетрагідрофуран, етилацетат тощо, або їх суміші, у присутності основи, як-то наприклад, але без обмеження, триетиламін, основа Хьюніга (діізопропілетиламін) або неорганічної основи, як-то наприклад, калій карбонат, отримуючи продукт амідного сполучення 3, котрий може бути виділеним або не виділеним, та очищеним. Амід 3 тоді реагує у придатному розчиннику, як-то, але без обмеження, дихлорметан, диметилформамід, або диметилацетамід з аміном X, котрий можна застосовувати у надлишку чи ні, у присутності або відсутності додаткової основи, як-то триетиламін або основа Хьюніга, отримуючи сполуку формули (І). Схема 2 Amine - амін Згідно зі схемою 2, -алканову кислоту відповідним чином активують, застосовуючи агент, як-то, але без обмеження, 1,1'-карбонілдіімідазол у розчиннику, як-то наприклад, дихлорметан, диметилформамід, або їх суміші, та реагує з придатним гетероциклічним аміном, отримуючи інтермедіатний амід -алканової кислоти 3, котрий може бути виділеним або не виділеним, та очищеним. Амід 3 тоді реагує у придатному розчиннику, як-то, але без обмеження, дихлорметан, диметилформамід, або диметилацетамід з аміном X, котрий можна застосовувати чи ні у надлишку, у присутності або відсутності додаткової основи, як-то триетиламін або основа Хьюніга, отримуючи сполуку формули (І). Схема 3 Amine - амін Згідно зі схемою 3, -аміноалканову кислоту відповідним чином активують, застосовуючи агент, як-то, але без обмеження, 1,1'-карбонілдіімідазол у розчиннику, як-то наприклад, дихлорметан, диметилформамід, або їх суміші та реагує з придатним гетероциклічним аміном, отримуючи сполуку формули (І). d) Схема 4 Amine - амін Згідно зі схемою 4, -алканову кислоту 5 відповідним чином активують, застосовуючи агент, як-то, але без обмеження, 1,1'-карбонілдіімідазол у розчиннику, як-то наприклад, дихлорметан, диметилформамід, або їх суміші, та вона реагує з придатним бромгетероциклічним аміном, даючи бромгетероариламіди формули 7, котрі тоді далі реагують в умовах перехресного сполучення, наприклад, умовах Сузукі, отримуючи сполуку формули (І). 16 UA 98317 C2 Схема 5 показує один можливий шлях синтезу заміщеної ланцюгом кислоти 5, попереднику сполуки формули (І) Amine - амін, aq - водн, base - основа, dihaloalkane - дигалогеналкан, toluene - толуєн (толуол), reflux - нагрівання під зворотним холодильником 5 10 15 20 25 30 35 Згідно зі схемою 5, алкіл-заміщений діестер малонової кислоти обробляють основою, як-то наприклад, але без обмеження, натрій гідрид, у розчиннику, як-то тетрагідрофуран або диметилформамід, та він реагує із ,-діалканом. Дизаміщений діестер малонової кислоти, таким чином отриманий гідролізують та моно-декарбоксилують обробкою сильною кислотою, як-то наприклад, бромідна кислота. Естерифікацію тоді проводять, наприклад, обробкою метанолом та каталітичною кількістю кислоти. Заміщення -галогену можна досягти застосуванням придатного аміну нагріванням у розчиннику типу толуєну, але без обмеження, цим розчинником. Зрештою, гідроліз естеру водною основою дає інтермедіати формули 5, котрі можуть бути активованими, як описано, отримуючи сполуки формули (І). Сполуки формули (І), їх оптичні ізомери або діастереомери можна очищати або відокремлювати добре відомими способами, у тому числі, але без обмеження, хроматографією з хіральною матрицею та фракційною кристалізацією. Експериментальні процедури - Синтез сполук Загальне Якщо не визначене інше, усі спектри ядерного магнітного резонансу реєстрували, застосовуючи спектрометр Varian Mercury + 400 MHz з зондом PFG АТВ Broadband. ВЕРХ-МС-аналізи виконували на модулі відокремлення Waters 2795 з Waters Micromass ZQ (ЕР-іонізація) та Waters PDA 2996, застосовуючи колонку Waters XTerra МС С18 3,5 мкм 2,1×50 мм. Препаративну ВЕРХ проводили, застосовуючи систему Waters 2767 з бінарним насосом Gradient Module Waters 2525, сполучену з Waters Micromass ZQ (ES) або Waters 2487 DAD, застосовуючи колонку Supelco Discovery HS C18 5,0 мкм 10×21,2 мм. Градієнта проводили, застосовуючи 0,1 % мурашину кислоту/воду та 0,1 % мурашину кислоту/ацетонітрил з градієнтом 5/95 - 95/5 з часом перебігу, показаним у прикладах. Усі хроматографії на колонці виконували способом Still, С; J. Org Chem 43, 2923 (1978). Усі ТШХ-аналізи виконували на силікагелі (Merck 60 F254) та плями виявляли УФ-візуалізацією при 254 нм та проявляли KМnО4 або нінгідрином. Нагрівання виконували на системі Buchi Syncore®. Усі мікрохвильові реакції виконували у шафі СЕМ Discover. Скорочення AcOEt етилацетат ДХМ дихлорметан ДХЕ 1,2-дихлоретан DMEA N,N-диметилетиламін ДМФ N,N-диметилформамід ДМСО диметилсульфоксид DAM N,N-диметилацетамід SCX сильний катіонообмінн TEA триетиламін ТФОК трифлуороцтова кислота ТГФ тетрагідрофуран ТШХ тонко-шарова хроматографія РХ-МС рідинна хроматографія-мас-спектрометрі ВЕРХ високоефективна рідинна хроматографія Загальний синтез 3-аміно-5-арил/гетероарил-піразолу 3-аміно-5-арил/гетероарил-піразоли, застосовувані у прикладах були купленими або синтезованими, застосовуючи шляхи, показані у схемі нижче: 17 UA 98317 C2 Загальні способи синтезу арил/гетероарил -кетонітрилу (А1): 5 10 15 20 25 30 35 40 Арил або гетероарилметилкарбоксилат купували або синтезували стандартними способами: арил або гетероарил-карбонову кислоту (32 ммоль) розчиняли у МеОН (40 мл) та додавали сульфатну кислоту (1 мл). Суміш гріли при кипінні під зворотним холодильником протягом ночі, після чого розчинник випарювали під зменшеним тиском; сирий матеріал розчиняли у ДХМ та промивали насиченим водним розчином натрій гідрогенкарбонату. Органічну фазу сушили та випарювали під зменшеним тиском, та сирий матеріал було застосовано без подальшої очистки. До розчину арил або гетероарил-метил-карбоксилату (6,5 м моль) у сухому толуєні (6 мл) під атмосферою азоту, NaH (50-60 % дисперсія у мінеральній оливі, 624 мг, 13 ммоль) обережно додавали. Суміш гріли при 80 °C та тоді сухий CH3CN додавали краплями (1,6 мл, 30,8 ммоль). Реакційну суміш гріли протягом 18 годин та продукт осаджували з реакційної суміші як Na-сіль. Реакційній суміші тоді давали охолонути до кімнатної температури та утворений твердий продукт фільтрували та тоді розчиняли у воді. Розчин тоді підкислювали 2 Н розчином НСl та при рН 2-6 (залежно від кільцевого заміщення на системі арил/гетероарил) продукт осаджували та відфільтровували. Якщо не відбувалося осадження, продукт екстрагували ДХМ. Після обробки продукти загалом застосовували на наступному етапі без подальшої очистки. Загальний вихід був між 40 та 80 %. Загальні способи арил/гетероарил -кетонітрил синтез (шлях А1 біс): Арил- або гетероарил-карбонової кислоти метил-естери купують або синтезують стандартними способами, як описано у загальному способі А1. До розчину сухого алканнітрилу у толуєні (1 ммоль/мл, 5 екв.) охолодженого до -78 °C під азотом, додавали розчин н-бутиллітію у н-гексані (1,6 N, 3,5 екв) краплями. Суміш залишали перемішування при -78 °C протягом 20 хвилин та тоді розчин арил або гетероарил метилкарбоксилату у толуєні (0,75 ммоль/мл, 1 екв.) додавали та реакційній суміші давали досягти кімнатної температури. Після завершення реакції, через приблизно 20 хвилин, суміш охолоджували до 0 °C та додавали 2 Н НСl до рН 2. Органічну фазу збирали, сушили безводним натрій сульфатом та концентрували під зменшеним тиском, отримуючи заголовний продукт, котрий було загалом застосовано без подальшої очистки. Загальні способи синтез арил-амінопіразолу (шлях А2): До розчину -кетонітрилу (7,5 ммоль), в абсолютному EtOH (15 мл) додавали гідразин моногідрат (0,44 мл, 9,0 ммоль) та реакційну суміш гріли при кипінні під зворотним холодильником протягом 18 годин. Реакційній суміші давали охолонути до кімнатної температури та розчинник випарювали під зменшеним тиском. Залишок розчиняли у ДХМ та промивали водою. Органічну фазу концентрували під зменшеним тиском, отримуючи сирий продукт, що очищали колонкою SiO2 або осадженням з Et2O. 18 UA 98317 C2 5 10 15 20 Вихід був загалом між 65 та 90 %. Гідрокси-арил- або гідрокси-гетероарил-карбонової кислоти метил-естери Загальні способи 4-гідрокси-бензойну кислоту (звичайно 24,0 ммоль) розчиняли у МеОН (50 мл) та додавали сульфатну кислоту (1 мл/г субстрату). Суміш гріли при кипінні під зворотним холодильником протягом ночі, після чого розчинник випарювали під зменшеним тиском; сирий матеріал розчиняли у ДХМ та промивали насиченим розчином натрій гідрогенкарбонату до основного рН. Органічну фазу сушили та випарювали під зменшеним тиском, та продукт було застосовано без подальшої очистки, вихід був між 80 та 90 %. Гідрокси-арил- або гідрокси-гетероарил-карбонової кислоти метил-естер до F2СНО-арилабо гетероарилкарбонової кислоти метил-естеру Загальні способи Під атмосферою азоту, 4-гідрокси-бензойної кислоти метил або етил-естер (1,0 екв) та натрій хлордифлуорацетат (1,2 екв) розчиняли у ДМФ (20-25 мл) у двогорлій круглодонній колбі; калій карбонат (1,2 екв) додавали та суміш гріли при 125 °C до повного перетворення вихідного матеріалу, що спостерігали за допомогою РХ-МС. Суміш тоді розбавляли водою та екстрагували ДХМ; органічну фазу сушили та видаляли під зменшеним тиском, та сирий матеріал очищали крізь Si-колонку для отримання продукту (Вихід від 20 до 70 %). Наступна Таблиця 1 дає виходи та аналітичні дані отримані при отриманні серії F 2CHOарил- або F2СНО-гетероарил-карбонової кислоти метил-естерів, отримуваних загальними способами, описаними вище Таблиця 1 Вихідний матеріал Метил-естер -ОН 3-Флуор-4C8H7FO3 гідрокси-бензойна Вихід=85 % кислота 1Н ЯМР (ДМСО-d6) 3,78 (3Н, s), 7,00-7,05 (1Н, m), 7,60-7,65 (2Н, m) 2,6-Дифлуор-4гідрокси-бензойна кислота 3,5-Дихлор-4гідрокси-бензойна кислота 3-Хлор-4-гідроксибензойна кислота 4-Гідрокси-3метокси-бензойна кислота 4-Гідрокси-2метил-бензойна кислота 25 Метил-естер -OCHF2 C9H7F3O3 Вихід=66 % 1Н ЯМР (ДМСО-d6) 3,78 (3H, s), 6,24 (1Н, m), 7,61 (1Н, m), 7,64 (1Н, m), 10,89 (1Н, bs) C8H6F2O3 C9H6F4O3 Вихід=85 % Вихід=34 % 1Н ЯМР (ДМСО-d6) 3,79 (S, 3H, s), 1Н ЯМР (ДМСО-d6) 3,86 (3H, s), 7,186,53 (2Н, d, J=10,8 Гц), 11,13 (1Н, s) 7,24 (2Н, m), 7,42 (1Н, t, J=72,4 Гц). Куплено C9H6CI2F2O3 Вихід=74 % 1Н ЯМР (ДМСО-d6) 3,31 (3H, s), 7,22 (1Н, t, J=71,6 Гц), 8,05 (2Н, s). Куплено C9H7CIF2O3 Вихід=85 % 1Н ЯМР (ДМСО-d6) 3,85 (3H, s), 7,39 (1Н, t, J=72,4 Гц), 7,50 (1Н, t, J=8,4 Гц), 7,82-7,89 (2Н, m). Куплено C10H10F2O4 Вихід=85 % 1Н ЯМР (DMCO-d6) 3,84 (3H, s), 3,87 (3H, в); 7,22 (1Н, t, J=73,6 Гц), 7,29 (1Н, d, J=8,4 Гц), 7,57-7,60 (2Н, m). С9Н1003 C10H10F2O3 Вихід=95 % Вихід=85 % 1Н ЯМР (ДМСО-СІ6) 2,43 (3H, brs), 1Н ЯМР (DMCO-d6) 2,52 (3H, br s), 3,80 3,72 (3H, s); 6,61-6,64 (2Н, m); 7,71- (3H, s); 7,07-7,13 (2Н, m); 7,34 (1Н, t, 7,73 (1Н, m), 10,10 (1H, s). J=73,6 Гц), 7,89 (1Н, d, J=8,8 Гц). 3-Імідазо[1,2-а]піридин-6-іл-3-оксо-пропіонітрил Продукт отримували, починаючи з імідазо[1,2-а]піридин-6-карбонової кислоти метил-естеру загальними способами А1 Вихід 39 % C10H7N3O Маса (розраховано) [185]; (знайдено) [М+Н+]=186 [М-Н]=184 РХ Rt=0,23, 100 % (3 хвил спосіб) 19 UA 98317 C2 5 10 15 20 25 30 35 40 45 50 1Н-ЯМР: (DMCO-d6): 4,72 (2H,s), 7,61-7,65 (2Н, m), 7,70 (1Н, m), 8,07 (1Н, s), 9,40 (s, 1H). 5-Імідазо[1,2-а]піридин-6-іл-1Н-піразол-3-іламін Заголовну сполуку синтезували загальними способами А2, починаючи з 3-імідазо[1,2а]піридин-6-іл-3-оксо-пропіонітрилу Вихід: 84 % C10H9N5 Маса (розраховано) [199]; (знайдено) [М+1]=200 РХ-МС, (5 хвил спосіб, RT=0,21 хвил, ЯМР (1Н, 400 МГц, MeOH-d4) 3,34 (s, 2Н), 5,90 (br s, 1H), 7,57 (s, 1H), 7,63 (br s, 1H), 7,86 (s, 1H), 8,73 (s, 1H) Хлорцинамонітрил (шлях В1) РОСl3 (2 екв відносно арил/гетероарил-ацетофенону) додавали краплями до 4 мольеквівалентів безводного ДМФ, охолодженого до 0 °C, при такій швидкості, щоб температура не перевищувала 10 °C. Ацетофенон (1 екв) тоді додавали краплями та реакційній суміші давали досягти кімнатної температури. Реакційну суміш тоді перемішували ще 30' та тоді додавали 0,4 ммоль гідроксиламін гідрохлориду. Реакційну суміш тоді гріли до 50 °C, після чого нагрівання видаляли та додаткові 4 екв. гідроксиламін гідрохлориду додавали порціями (при такій швидкості, щоб температура не перевищувала 120 °C). Реакційну суміш тоді перемішували, доки температура суміші спонтанно не зменшувалася до 25 °C. Воду (100 мл) тоді додавали та суміш екстрагували діетил-етером. Органічну фазу сушили безводним натрій сульфатом та концентрували під зменшеним тиском. Сирий продукт було застосовано на наступному етапі без подальшої очистки. Арил амінопіразол (шлях В2) До розчину хлорцинамонітрилу (0,5 м моль/мл, 1 екв) в абсолютному EtOH додавали 2 екв гідразин моногідрату та реакційну суміш гріли при кипінні під зворотним холодильником протягом 4 годин. Реакційній суміші давали охолонути до кімнатної температури та розчинник випарювали під зменшеним тиском. Залишок розтирали у порошок з Et 2O, отримуючи заголовну сполуку, котру було загалом застосовано без подальшої очистки. 5-(2-Трифлуорметил-феніл)-2Н-піразол-3-іламін a) 3-Оксо-3-(2-трифлуорметил-феніл)-пропіонітрил Продукт отримували загальними способами синтезу амінопіразолу (шлях А1) з 2трифлуорметил-бензойної кислоти метил-естеру (3,1 г, 14,0 ммоль, 1,0 екв). Сирий матеріал осаджували з НСl, отримуючи заголовний продукт як жовтий твердий матеріал (2,8 г, вихід: 94 %). C10H6F3NO 1 Н-ЯМР (CD3OD): 4,90 (2Н, br s); 7,52-7,86 (4Н, m). b) 5-(2-Трифлуорметил-феніл)-2Н-піразол-3-іламін Продукт отримували загальними способами синтезу амінопіразолу (шлях А2). Сирий матеріал очищали крізь Si-колонку (елюент: ДХМ) та сушили, отримуючи заголовний продукт (0,6 г, 20 % виходу). C10H8F3N3 5-(2,6-Диметил-феніл)-2Н-піразол-3-іламін a) 3-(2,6-Диметил-феніл)-3-оксо-пропіонітрил Продукт отримували загальними способами синтезу амінопіразолу (шлях А1), гріючи при кипінні під зворотним холодильником суміш протягом ночі та тоді протягом 2 годин при 110 °C. Сирий продукт екстрагували ДХМ та застосовували на наступному етапі без подальшої очистки (2,2 г, вихід: 76 %). C11H11NO b) 5-(2,6-Диметил-феніл)-2Н-піразол-3-іламін Продукт отримували загальними способами синтезу амінопіразолу (шлях А2). Сирий матеріал очищали крізь Si-колонку (елюент: ДХМ) та промивали водою, екстрагували та сушили, отримуючи заголовний продукт (0,25 г, вихід 10 %). 20 UA 98317 C2 5 10 15 20 25 30 35 40 45 50 55 60 C11H13N3 1 Н-ЯМР (CD3OD): 2,09-2,23 (6Н, m); 7,04-7,12 (2Н, m); 7,18-7,26 (2Н, m). 5-(2-Хлор-4-флуор-феніл)-2Н-піразол-3-іламін a) 3-(2-Хлор-4-флуор-феніл)-3-оксо-пропіонітрил Продукт отримували загальними способами синтезу амінопіразолу (шлях А1) з 2-хлор-4флуор-бензойної кислоти метил-естеру (0,7 г, 3,7 ммоль, 1,0 екв). Сирий продукт екстрагували ДХМ та застосовували на наступному етапі без подальшої очистки (0,4 г, вихід: 60 %). C9H5CIFNO b) 5-(2-Хлор-4-флуор-феніл)-2Н-піразол-3-іламін Продукт отримували загальними способами синтезу амінопіразолу (шлях А2). Сирий матеріал розчиняли у ДХМ, промивали насиченим розчином натрій гідрогенкарбонату, екстрагували та сушили, отримуючи заголовний продукт (0,12 г, вихід 26 %). C9H7CIFN3 1 Н-ЯМР (ДМСО-d6): 7,03-7,53 (4Н, m). 5-(5-трет-Бутил-тіофен-2-іл)-2Н-піразол-3-іламін a) 3-(5-трет-Бутил-тіофен-2-іл)-3-оксо-пропіонітрил Продукт отримували загальними способами синтезу амінопіразолу (шлях А1) з 5-третБутил-тіофен-2-карбонової кислоти метил-естеру (3,0 г, 15,0 ммоль, 1,0 екв). Сирий продукт екстрагували ДХМ та застосовували на наступному етапі без подальшої очистки (2,7 г, вихід: 86 %). C11H13NOS b) 5-(5-трет-Бутил-тіофен-2-іл)-2Н-піразол-3-іламін Продукт отримували загальними способами синтезу амінопіразолу (шлях А2). Сирий матеріал промивали водою та осаджували, отримуючи заголовний продукт (2,7 г, вихід 91 %). C11H15N3S + Маса (розраховано) [221]; (знайдено) [М+Н ]=222. РХ Rt=2,53 хвил, 94 % (10 хвил спосіб) 1 Н-ЯМР (ДМСО-d6): 1,26-1,29 (9Н, m); 4,87 (2Н, br s); 5,47 (1Н, br s); 6,66-6,79 (1Н, m); 6,977,02 (1Н, m) 5-(3-Хлор-2-метил-феніл)-2Н-піразол-3-іламін a) 2-Етил-бензойної кислоти метил-естер 2-Етил-бензойну кислоту (3,0 г, 17,6 ммоль) розчиняли у МеОН (20 мл) та додавали сульфатну кислоту (1 мл). Суміш гріли при кипінні під зворотним холодильником протягом ночі, після чого розчинник випарювали під зменшеним тиском; сирий матеріал розчиняли у ДХМ та промивали насиченим розчином натрій карбонату до основного рН. Органічну фазу сушили та випарювали під зменшеним тиском, та продукт (3,1 г, вихід 96 %) було застосовано без подальшої очистки. С9Н9СlО2 1 Н-ЯМР (ДМСО-d6): 2,48 (3H, br s); 3,82 (3H, s); 7,31 (1Н, t, J=7,6 Гц); 7,63-7,67 (2Н, m). b) 3-(3-Хлор-2-метил-феніл)-3-оксо-пропіонітрил Продукт отримували загальними способами синтезу амінопіразолу (шлях А1) з 3-Хлор-2метил-бензойної кислоти метил-естеру (3,1 г, 16,8 ммоль, 1,0 екв). Сирий продукт осаджували водою та застосовували на наступному етапі без подальшої очистки (2,4 г, вихід: 74 %). C10H8ClNO 1 Н-ЯМР (ДМСО-d6): 2,31 (3H, br s); 4,64 (2Н, br s); 7,27-7,36 (2Н, m); 7,54-7,77 (1Н, m). с) 5-(3-Хлор-2-метил-феніл)-2Н-піразол-3-іламін Продукт отримували загальними способами синтезу амінопіразолу (шлях А2). Сирий продукт очищали крізь колонку з SiO2 (20 г) з градієнтом елювання від 100 % EtOAc до EtOAcMeOH 80:20. Заголовний продукт (1,3 г, вихід 50 %) отримували. C10H10ClN3 + Маса (розраховано) [207]; (знайдено) [М+Н ]=208. РХ Rt=1,96 хвил, 85 % (10 хвил спосіб) 1 Н-ЯМР (CDCl3): 2,41 (3H, s); 5,74 (1Н, s); 7,16 (1Н, t, J=8,0 Гц); 7,20-7,26 (1Н, m); 7,38-7,40 (1Н, m). 5-(2-Етил-феніл)-2Н-піразол-3-іл-амін a) 2-Етил-бензойної кислоти метил-естер 2-Етил-бензойну кислоту (3,0 г, 20,0 ммоль) розчиняли у МеОН (20 мл) та додавали каталітичну кількість сульфатної кислоти (1 мл). Суміш гріли при кипінні під зворотним холодильником протягом ночі, після чого розчинник випарювали під зменшеним тиском; сирий матеріал розчиняли у ДХМ та промивали насиченим розчином натрій карбонату до основного 21 UA 98317 C2 5 10 15 20 25 30 35 40 45 50 55 рН. Органічну фазу сушили та випарювали під зменшеним тиском, та продукт (2,9 г, вихід 88 %) було застосовано без подальшої очистки С10Н12О2 1 Н-ЯМР (ДМСО-d6): 1,12 (3H, t, J=7,2 Гц); 2,86 (2Н, q, J=7,2 Гц); 3,81 (3H, s); 7,27-7,34 (2Н, m); 7,46-7,51 (1Н, m); 7,73-7,75 (1Н, m). b) 3-(2-Етил-феніл)-3-оксо-пропіонітрил Продукт отримували загальними способами синтезу амінопіразолу (шлях А1) з 2-етилбензойної кислоти метил-естеру (2,9 г, 17,6 ммоль, 1,0 екв). Сирий продукт екстрагували ДХМ як жовту оливу та застосовували на наступному етапі без подальшої очистки (2,8 г, вихід: 92 %). C11H11NO 1Н-ЯМР (ДМСО-d6): 1,10-1,18 (3H, m); 2,78 (2Н, q, J=7,2 Гц); 4,67 (1Н, s); 7,23-7,53 (3H, m); 7,73-7,78 (1Н, m). c) 5-(2-Етил-феніл)-2Н-піразол-3-іл-амін Продукт отримували загальними способами синтезу амінопіразолу (шлях А2). Сирий продукт очищали крізь колонку з SiO2 (20 г) з градієнтом елювання від 100 % ЕtOАс до EtOAcMeOH 80:20. Заголовний продукт (1,2 г, вихід 40 %) отримували C11H13N3 + Маса (розраховано) [187]; (знайдено) [М+Н ]=188. РХ Rt=1,58 хвил, 90 % (10 хвил спосіб) 1 Н-ЯМР (CDCl3): 1,15 (3H, t, J=7,6 Гц); 2,71 (2Н, q, J=7,6 Гц); 5,72 (1H, s); 7,20-7,26 (1Н, m); 7,29-7,35 (3H, m). 5-(4-Метокси-феніл)-4-метил-2Н-піразол-3-іламін a) 3-(4-Метокси-феніл)-2-метил-3-оксо-пропіонітрил Продукт отримували загальними способами синтезу амінопіразолу (шлях А1) з 4-метоксибензойної кислоти метил-естеру (3,0 мл, 18,0 ммоль, 1,0 екв), NaH (1,4 г, 36,0 ммоль, 2,0 екв) та пропіонітрилу (6,1 мл, 84,9 ммоль, 4,7 екв). Сирий матеріал очищали крізь Si-колонку (елюент гексан/етилацетат), отримуючи 2,1 г заголовного продукту (вихід: 62 %). C11H11NO2 b) 5-(4-Метокси-феніл)-4-метил-2Н-піразол-3-іламін Продукт отримували загальними способами синтезу амінопіразолу (шлях А2). Сирий продукт промивали основною водою та сушили, та заголовний продукт (1,8 г, вихід 80 %) було застосовано без подальшої очистки C11H13N3O + Маса (розраховано) [203]; (знайдено) [М+Н ]=204. РХ Rt=1,34 хвил, 91 % (10 хвил спосіб) 1 Н-ЯМР (CDCl3): 2,03 (3H, s); 3,84 (3H, s); 6,96-6,98 (2Н, m); 7,37-7,39 (2Н, m). 4-Метил-5-(4-трифлуорметил-феніл)-2Н-піразол-3-іламін a) 2-Метил-3-оксо-3-(4-трифлуорметил-феніл)-пропіонітрил Продукт отримували загальними способами синтезу амінопіразолу (шлях А1) з 4трифлуорметил-бензойної кислоти метил-естеру (3,0 г, 14,7 ммоль, 1,0 екв), NaH (1,2 г, 29,4 ммоль, 2,0 екв) та пропіонітрилу (4,9 мл, 69,4 ммоль, 4,7 екв). Сирий продукт екстрагували ДХМ та застосовували на наступному етапі без подальшої очистки (3,2 г, вихід: 96 %). C11H8F3NO b) 4-Метил-5-(4-трифлуорметил-феніл)-2Н-піразол-3-іламін Продукт отримували загальними способами синтезу амінопіразолу (шлях А2). Сирий продукт промивали основною водою та сушили, та заголовний продукт (2,8 г, вихід 84 %) було застосовано без подальшої очистки C11H10F3N3 + Маса (розраховано) [241]; (знайдено) [М+Н ]=242. РХ Rt=2,34 хвил, 92 % (10 хвил спосіб) 1 Н-ЯМР (CDCl3): 2,05 (3H, s); 7,56 (2Н, d, J=8,4 Гц); 7,64 (2Н, d, J=8,4 Гц). 5-(4-Циклопропілметокси-2-метил-феніл)-2Н-піразол-3-іламін a) 4-Гідрокси-2-метил-бензойної кислоти метил-естер 4-Гідрокси-2-метил-бензойну кислоту (4,8 г, 32,0 ммоль) розчиняли у МеОН (40 мл) та додавали каталітичну кількість сульфатної кислоти (1 мл). Суміш гріли при кипінні під зворотним холодильником протягом ночі, після чого розчинник випарювали під зменшеним тиском; сирий матеріал розчиняли у ДХМ та промивали насиченим розчином натрій гідрогенкарбонату до основного рН. Органічну фазу сушили та випарювали під зменшеним тиском, та продукт (5,0 г, вихід 95 %) було застосовано без подальшої очистки. 60 22 UA 98317 C2 С9Н1003 1 Н-ЯМР (DMCO-d6): 2,43 (3H, s); 3,72 (3H, s); 6,62-6,64 (2Н, m); 7,71-7,73 (1Н, m); 10,10 (1Н, s). 5 10 15 20 25 30 35 40 45 50 55 b) 4-Циклопропілметокси-2-метил-бензойної кислоти метил-естер 4-Гідрокси-2-метил-бензойної кислоти метил-естер (1,0 г, 6,0 ммоль, 1,0 екв) розчиняли в ацетоні (14 мл), додавали Nal (0,45 г, 3,0 ммоль, 0,5 екв) та калій карбонат (1,66 г, 12,0 ммоль, 2,0 екв) та суміш перемішували при кімнатній температурі протягом 20 хвил. (Бромметил)циклопропан (0,53 мл, 5,4 ммоль, 0,9 екв) додавали, та суміш гріли при кипінні під зворотним холодильником протягом 2 діб. Розчинник концентрували під зменшеним тиском, NaOH 10 % додавали, та сирий матеріал екстрагували ДХМ та сушили. 0,42 г заголовного продукту (вихід 32 %) збирали та застосовували без подальшої очистки. С13Н16О3 1 Н-ЯМР (CDCl3): 0,23-0,34 (2Н, m); 0,52-0,64 (2Н, m); 1,15-1,24 (1Н, m); 2,52 (3H, s); 3,75 (2Н, d, J=7,2 Гц); 3,77 (3H, s); 6,64-6,66 (1Н, m); 7,83-7,85 (2Н, m). c) 3-(4-Циклопропілметокси-2-метил-феніл)-3-оксо-пропіонітрил Продукт отримували загальними способами синтезу амінопіразолу з 4-циклопропілметокси2-метил-бензойної кислоти метил-естеру (шлях А1біс). 0,54 г заголовного продукту екстрагували з води та сушили (вихід 69 %) та застосовували безпосередньо на наступному етапі. C14H15NO2 d) 5-(4-Циклопропілметокси-2-метил-феніл)-2Н-піразол-3-іламін Продукт отримували загальними способами синтезу амінопіразолу (шлях А2). Сирий продукт очищали крізь колонку з SiO2 з градієнтом елювання від 100 % EtOAc до EtOAc-МеОН 90:10. Заголовний продукт (206 мг, вихід 36 %) отримували. C14H17N3O 1 Н-ЯМР (CD3OD): 0,29-0,36 (2Н, m); 0,54-0,63 (2Н, m); 1,18-1,28 (1Н, m); 2,33 (3H, s); 3,81 (2Н, d, J=7,2 Гц); 5,67 (1H, s); 6,74-6,80 (2H, m); 7,25 (1H, d, J=8,8 Гц). 5-(3-Хлор-4-циклопропілметокси-феніл)-2Н-піразол-3-іламін a) 3-Хлор-4-циклопропілметокси-бензойної кислоти метил-естер 3-Хлор-4-гідрокси-бензойної кислоти метил-естер (1,1 г, 6,0 ммоль, 1,0 екв) розчиняли в ацетоні (14 мл), додавали Nal (0,45 г, 3,0 ммоль, 0,5 екв) та калій карбонат (1,66 г, 12,0 ммоль, 2,0 екв) та суміш перемішували при кімнатній температурі протягом 20 хвил. (Бромметил)циклопропан (0,53 мл, 5,4 ммоль, 0,9 екв) додавали, та суміш гріли при кипінні під зворотним холодильником протягом 2 діб. Розчинник концентрували під зменшеним тиском, NaOH 10 % додавали, та сирий матеріал екстрагували ДХМ та сушили. Заголовний продукт (0,88 г, вихід 32 %) збирали та застосовували без подальшої очистки. С12Н13СlО3 1 Н-ЯМР (DMCO-d6): 0,33-0,37 (2Н, m); 0,55-0,60 (2Н, m); 1,25-1,27 (1Н, m); 3,80 (3H, s); 3,99 (2Н, d, J=7,2 Гц); 7,21 (1Н, s, J=8,8 Гц); 7,85-7,91 (2H, m). b) 3-(3-Хлор-4-циклопропілметокси-феніл)-3-оксо-пропіонітрил Продукт отримували загальними способами з 3-Хлор-4-циклопропілметокси-бензойної кислоти метил-естеру (шлях А1біс). 0,74 г заголовного продукту екстрагували з води та сушили (вихід 81 %) та застосовували безпосередньо на наступному етапі. C13H12ClNO2 c) 5-(3-Хлор-4-циклопропілметокси-феніл)-2Н-піразол-3-іламін Продукт отримували загальними способами синтезу амінопіразолу (шлях А2). Сирий продукт очищали крізь колонку з SiO2 (градієнт елювання від 100 % EtOAc до EtOAc-MeOH 90:10). 521 мг заголовного продукту (вихід 67 %) отримували C13H14ClN3O + Маса (розраховано) [263]; (знайдено) [М+Н ]=264. РХ Rt=2,51 хвил, 90 % (10 хвил спосіб) 1 Н-ЯМР (CD3OD): 0,25-0,29 (2Н, m); 0,52-0,55 (2Н, m); 1,10-1,18 (1Н, m); 3,81 (2Н, d, J=6,8 Гц); 5,74 (1Н, s); 6,95-6,99 (1Н, m); 7,24-7,30 (2Н, m). 5-(4-Циклопропілметокси-2-трифлуорметил-феніл)-2Н-піразол-3-іламін а) 4-гідрокси-2-трифлуорметил-бензойної кислоти метил-естер 4-гідрокси-2-трифлуорметил-бензойну кислоту (5,0 г, 24,0 ммоль) розчиняли у МеОН (50 мл) та додавали каталітичну кількість сульфатної кислоти. Суміш гріли при кипінні під зворотним холодильником протягом ночі, після чого розчинник випарювали під зменшеним тиском; сирий матеріал розчиняли у ДХМ та промивали насиченим розчином натрій гідрогенкарбонату. 23 UA 98317 C2 5 10 15 20 25 30 35 40 45 50 55 60 Органічну фазу сушили та випарювали під зменшеним тиском, та продукт було застосовано без подальшої очистки. C9H7F3O3 b) 4-Циклопропілметокси-2-трифлуорметил-бензойної кислоти метил-естер 4-гідрокси-2-трифлуорметил-бензойної кислоти метил-естер (1,1 г, 4,8 ммоль, 1,0 екв) розчиняли в ацетоні (14 мл), Nal (0,5 екв) та додавали калій карбонат (1,04 г, 2,0 екв) та суміш перемішували при кімнатній температурі протягом 30 хвил. (Бромметил)циклопропан (0,42 мл, 4,3 ммоль, 0,9 екв) додавали, та суміш гріли при кипінні під зворотним холодильником протягом 2 діб. Розчинник концентрували під зменшеним тиском, додавали NaOH 10 %, та екстрагували ДХМ та сушили. Заголовний продукт (1,21 г, вихід 92 %) збирали та застосовували без подальшої очистки. C13H13F3O3 с) 3-(4-Циклопропілметокси-2-трифлуорметил-феніл)-3-оксо-пропіонітрил Продукт отримували загальними способами (шлях А1біс). Суміш підкислювали 1 Н розчином НСl та органічну фазу відокремлювали та сушили, отримуючи 1,2 г заголовного продукту (вихід 94 %), котрий було застосовано безпосередньо на наступному етапі. C14H12F3NO2 + Маса (розраховано) [283]; (знайдено) [М+Н ]=284 РХ Rt=3,86 хвил, 98 % (10 хвил спосіб) d) 5-(4-Циклопропілметокси-2-трифлуорметил-феніл)-2Н-піразол-3-іламін Продукт отримували загальними способами синтезу амінопіразолу (шлях А2). Сирий продукт очищали крізь колонку з SiO2 (градієнт елювання від Етилацетат-циклогексан 1:1 до Етилацетат-МеОН 90:10). 650 мг заголовного продукту (вихід 52 %) отримували. C14H14F3N3O + Маса (розраховано) [297]; (знайдено) [М+Н ]=298. РХ Rt=2,78 хвил, 59 % (10 хвил спосіб) 1 Н-ЯМР (CDCl3): 032-0,44 (2Н, m); 0,64-0,62 (2Н, m); 1,22-1,37 (1Н, m); 3,80-3,92 (2Н, m); 5,78 (1Н, s); 7,04-7,07 (1Н, m); 7,24-7,26 (1 Н, m); 7,38-7,40 (1Н, m). 5-(4-Циклопропілметокси-2,3-дифлуор-феніл)-2Н-піразол-3-іламін а) 4-гідрокси-2,3-дифлуор-бензойної кислоти метил-естер 4-гідрокси-2,3-дифлуор-бензойн кислот (2,0 г, 11,5 ммоль) розчиняли у МeОН (20 мл) та додавали каталітичну кількість сульфатної кислоти. Суміш гріли при кипінні під зворотним холодильником протягом ночі, після чого розчинник випарювали під зменшеним тиском; сирий матеріал розчиняли у ДХМ та промивали насиченим розчином натрій гідрогенкарбонату. Органічну фазу сушили та випарювали під зменшеним тиском, та продукт було застосовано без подальшої очистки. C8H6F2O3 b) 4-Циклопропілметокси-2,3-дифлуор-бензойної кислоти метил-естер 4-Гідрокси-2,3-дифлуор-бензойної кислоти метил-естер (0,9 г, 4,8 ммоль, 1,0 екв) розчиняли в ацетоні (14 мл), додавали Nal (0,5 екв) та калій карбонат (1,03 г, 2,0 екв) та суміш перемішували при кімнатній температурі протягом 30 хвил. (Бромметил)циклопропан (0,42 мл, 0,9 екв) додавали, та суміш гріли при кипінні під зворотним холодильником протягом 2 діб. Розчинник концентрували під зменшеним тиском, NaOH додавали 10 %, та екстрагували ДХМ та сушили. Заголовний продукт (0,97 г, вихід 84 %) збирали та застосовували без подальшої очистки. C12H12F2O3 c) 3-(4-Циклопропілметокси-2,3-дифлуор-феніл)-3-оксо-пропіонітрил Продукт отримували загальними способами (шлях А1біс). Суміш підкислювали 1 Н розчином НСl та органічну фазу відокремлювали та сушили, отримуючи 0,79 г заголовного продукту (вихід 79 %), котрий було застосовано безпосередньо на наступному етапі. C13H11F2NO2 + Маса (розраховано) [251]; (знайдено) [М+Н ]=252. РХ Rt=3,53 хвил, 82 % (10 хвил спосіб) d) 5-(4-Циклопропілметокси-2,3-дифлуор-феніл)-2Н-піразол-3-іламін Продукт отримували загальними способами синтезу амінопіразолу (шлях А2). Сирий продукт очищали крізь колонку з SiO2 (градієнт елювання від ЕЮАс-циклогексан 1:1 до EtOAc:MeOH 90:10). 810 мг заголовного продукту (вихід 97 %) отримували. C13H13F2N3O + Маса (розраховано) [265]; (знайдено) [М+Н ]=266. РХ Rt=2,59 хвил, 75 % (10 хвил спосіб) 24 UA 98317 C2 1 5 10 15 20 25 30 35 40 45 50 55 60 Н-ЯМР (CDCl3): 032-0,47 (2Н, m); 0,64-0,75 (2Н, m); 1,19-1,38 (1Н, m); 3,67-4,15 (4Н, m); 5,95 (1Н, s); 6,74-6,88 (1Н, m); 7,17-7,26 (1Н, m); 5-(3,5-Дихлор-4-циклопропілметокси-феніл)-2Н-піразол-3-іламін a) 3,5-Дихлор-4-Циклопропілметокси-бензойної кислоти метил-естер 3,5-Дихлор-4-гідрокси-бензойної кислоти етил-естер (1,0 г, 4,5 ммоль, 1,0 екв) розчиняли в ацетоні (14 мл), додавали Nal (0,5 екв) та калій карбонат (0,98 г, 9,0 ммоль, 2,0 eкв) та суміш перемішували при кімнатній температурі протягом 30 хвил. (Бромметил)циклопропан (0,39 мл, 4,1 ммоль, 0,9 екв) додавали, та суміш гріли при кипінні під зворотним холодильником протягом 2 діб. Розчинник концентрували під зменшеним тиском, додавали NaOH 10 %, та екстрагували ДХМ та сушили. Заголовний продукт (0,98 г, вихід 79 %) збирали та застосовували без подальшої очистки. С12Н12Сl2О3 b) 3(3,5-Дихлор-4-циклопропілметокси-феніл)-3-оксо-пропіонітрил Продукт отримували загальними способами (шлях А1біс). Суміш підкислювали 1 Н розчином НСl та органічну фазу відокремлювали та сушили, отримуючи 0,91 г заголовного продукту (вихід 90 %), котрий було застосовано безпосередньо на наступному етапі. C13H13Cl2N3O + Маса (розраховано) [283]; (знайдено) [М+Н ]=284. РХ Rt=4,06 хвил, 99 % (10 хвил спосіб) c) 5-(3,5-Дихлор-4-циклопропілметокси-феніл)-2Н-піразол-3-іламін Продукт отримували загальними способами синтезу амінопіразолу (шлях А2). Сирий продукт очищали крізь колонку з SiO2 (градієнт елювання від EtOAc-циклогексан 1:1 до Етилацетат:МеОН 90:10). 750 мг заголовного продукту (вихід 79 %) отримували. C13H13Cl2N3O + Маса (розраховано) [297]; (знайдено) [М+Н ]=298. РХ Rt=3,23 хвил, 93 % (10 хвил спосіб) 1 Н-ЯМР (CDCl3): 023-0,46 (2Н, m); 0,64-0,74 (2Н, m); 1,30-1,48 (1Н, m); 3,60-4,04 (4Н, m); 5,86 (1Н, s); 7,48 (2Н, s). 5-(4-Циклопропілметокси-3-метокси-феніл)-2Н-піразол-3-іламін а) 4-Циклопропілметокси-3-метокси-бензойної кислоти метил-естер 4-гідрокси-3-метокси-бензойної кислоти метил-естер (1,0 г, 5,5 ммоль, 1,0 екв) розчиняли в ацетоні (14 мл), Nal (0,5 екв) та додавали калій карбонат (1,0 г, 2,0 екв) та суміш перемішували при кімнатній температурі протягом 30 хвил. (Бромметил)циклопропан (0,53 мл, 0,9 екв) додавали, та суміш гріли при кипінні під зворотним холодильником протягом 2 діб. Розчинник концентрували під зменшеним тиском, додавали NaOH 10 %, та екстрагували ДХМ та сушили. Заголовний продукт (1,21 г, вихід 93 %) збирали та застосовували без подальшої очистки. С13Н16О4 b) 3(4-Циклопропілметокси--3-метокси-феніл)-3-оксо-пропіонітрил Продукт отримували загальними способами (шлях А1біс). Суміш підкислювали 1 Н розчином HCl та органічну фазу відокремлювали та сушили, отримуючи 1,24 г заголовного продукту (вихід 99 %), котрий було застосовано безпосередньо на наступному етапі. C14H15NO3 + Маса (розраховано) [245]; (знайдено) [М+Н ]=246. РХ Rt=3,03 хвил, 100 % (10 хвил спосіб) c) 5-(4-Циклопропілметокси-3-метокси-феніл)-2Н-піразол-3-іламін Продукт отримували загальними способами синтезу амінопіразолу (шлях А2). Сирий продукт очищали крізь колонку з SiO2 (градієнт елювання від EtOAc-циклогексан 1:1 до Етилацетат:МеОН 90:10). 220 мг заголовного продукту (вихід 50 %) отримували. C14H17N3O2 + Маса (розраховано) [259]; (знайдено) [М+Н ]=260. РХ Rt=1,86 хвил, 93 % (10 хвил спосіб) 1 Н-ЯМР (CDCl3): 027-0,43 (2Н, m); 0,56-0,72 (2Н, m); 1,23-1,40 (1Н, m); 348 (2Н, m); 3,87 (3H, s); 3,98 (2Н, br s); 5,82 (1Н, s); 6,85-6,89 (1Н, m); 7,05-7,10 (2Н, m); 3-Аміно-5-(3-флуор-феніл)-піразол-1 -карбонової кислоти трет-бутил-естер 3-Аміно-5-(3-флуор-феніл)-піразол (5,0 г, 28,0 ммоль, 1,0 екв) та KОН 4,5 М (50 мл, 226 ммоль, 8 екв) розчиняли у ДХМ (200 мл), та додавали ді-трет-бутил дикарбонат (6,5 г, 30,0 ммоль, 1,1 екв); суміш перемішували при кімнатній температурі до повного перетворення, що спостерігали за допомогою аналізу РХ-МС. Органічну фазу промивали насиченим розсолом та випарювали; сирий матеріал кристалізували з МеОН, отримуючи 7,4 г заголовного продукту (вихід 95 %). 25 UA 98317 C2 5 10 15 20 25 30 35 40 45 50 55 60 C14H16FN3O2 1 Н-ЯМР (ДМСО-d6): 1,57 (9Н, s), 5,80 (1Н, s), 6,43 (2Н, br s), 7,16-7,21 (1Н, m), 7,41-7,47 (1Н, m); 7,50-7,54 (1Н, m); 7,58-7,60 (1Н, m). 3-Аміно-5-о-толіл-піразол-1-карбонової кислоти трет-бутил-естер 3-Аміно-5-о-толіл-піразол (0,5 г, 2,89 ммоль, 1,0 екв) та KОН 4,5 М (5,1 мл, 23,1 ммоль, 8,0 екв) розчиняли у ДХМ (20 мл), та додавали ді-трет-бутил дикарбонат (0,66 г, 3,0 ммоль, 1,1 екв); суміш перемішували при кімнатній температурі до повного перетворення, що спостерігали за допомогою аналізу РХ-МС. Органічну фазу промивали насиченим розсолом та випарювали, отримуючи 0,6 г заголовного продукту (вихід 76 %). C15H19N3O2 + Маса (розраховано) [273]; (знайдено) [М+Н ]=274. РХ Rt=2,34 хвил, 96 % (5 хвил спосіб) 3-Аміно-5-(4-трифлуорметил-феніл)-піразол-1-карбонової кислоти трет-бутил-естер 3-Аміно-5-(4-трифлуорметил-феніл)-піразол (2,0 г, 8,8 ммоль, 1,0 екв) та KОН 4,5 М (15,7 мл, 70,5 ммоль, 8,0 екв) розчиняли у ДХМ (70 мл), та додавали ді-трет-бутил дикарбонат (2,02 г, 9,2 ммоль, 1,1 екв); суміш перемішували при кімнатній температурі до повного перетворення, що спостерігали за допомогою аналізу РХ-МС. Органічну фазу промивали насиченим розсолом та випарювали; сирий матеріал кристалізували із CH 3CN, отримуючи 1,9 г заголовного продукту (вихід 69 %). C15H16F3N3O2 + Маса (розраховано) [327]; (знайдено) [М+Н ]=328. РХ Rt=2,59 хвил, 100 % (5 хвил спосіб) 1 Н-ЯМР (ДМСО-d6): 1,57 (9Н, s), 5,83 (1Н, s), 6,46 (2Н, s), 7,74 (2Н, d, J=8,4 Гц), 7,95 (2Н, d, J=8,8 Гц) 5-Піридин-2-іл-2Н-піразол-3-іламін a) Оксо-піридин-2-іл-ацетонітрил Продукт отримували загальними способами синтезу амінопіразолу (шлях А1) з піридин-2карбонової кислоти метил-естеру (3,0 г, 21,9 ммоль, 1,0 екв). Сирий матеріал осаджували з HCl, отримуючи заголовний продукт як твердий матеріал (2,2 г, вихід: 69 %), котрий було застосовано безпосередньо на наступному етапі. C8H6N2O b) 5-Піридин-2-іл-2Н-піразол-3-іламін Продукт отримували загальними способами синтезу амінопіразолу (шлях А2). Сирий продукт розчиняли у EtOAc, промивали розчином натрій гідрогенкарбонату, сушили та випарювали. ЯМР-аналіз показав, що головна частина сирої суміші була ще у відкритій формі: суміш тоді розчиняли у СН3СООН та гріли при 80 °C протягом ночі, для закриття кільця відкритої форми. Продукт тоді збирали як ациловану форму, котра була деацилованою перемішуванням з 6 Н HCl при 60 °C протягом ночі, отримуючи заголовний продукт (0,816 г, вихід 60 %). C8H8N4 1 Н-ЯМР (ДМСО-d6): 4,81 (2Н, bs), 5,92 (1Н, s), 7,21-7,24 (1Н, m), 7,76 (2Н, d), 8,51 (1Н, d), 11,96 (1Н, bs) 5-(3-Дифлуорметокси-феніл)-2Н-піразол-3-іламін a) 3-Дифлуорметокси-бензойної кислоти метил-естер Дифлуорметокси-бензойну кислоту (2,0 г, 10,6 ммоль, 1,0 екв) розчиняли у МеОН (15 мл) та додавали каталітичну кількість сульфатної кислоти. Суміш гріли при кипінні під зворотним холодильником протягом ночі, після чого розчинник випарювали під зменшеним тиском; сирий матеріал розчиняли у ДХМ та промивали насиченим розчином натрій гідрогенкарбонату до основного рН. Органічну фазу сушили та випарювали під зменшеним тиском, та заголовний продукт Було застосовано без подальшої очистки (1,9 г, вихід 90 %). C9H8F2O3 1 Н-ЯМР (DMCO-d6): 3,86 (3H, s), 7,33 (1Н, t, J=73,6 Гц), 7,46-7,50 (1Н, m), 7,59 (1Н, t, J=8,0 Гц), 7,67 (1Н, s); 7,82 (1Н, d, J=7,6 Гц). b) 3-(3-Дифлуорметокси-феніл)-3-оксо-пропіонітрил Продукт отримували загальними способами синтезу амінопіразолу (шлях А1біс) з 3дифлуорметокси-бензойної кислоти метил-естеру (1,5 г, 7,4 ммоль, 1,0 екв). Сирий матеріал осаджували додаванням водної HCl, отримуючи продукт, котрий було застосовано безпосередньо на наступному етапі. C10H7F2NO2 c) 5-(3-Дифлуорметокси-феніл)-2Н-піразол-3-іламін 26 UA 98317 C2 5 10 15 20 25 30 Продукт отримували загальними способами синтезу амінопіразолу (шлях А2). Сирий продукт очищали крізь Si-колонку з градієнтом елювання від 100 % EtOAc до EtOAc-MeOH 90:10. 1,45 г заголовного продукту (вихід 87 %) отримували. C10H9F2N3O 1 Н-ЯМР (DMCO-d6): 4,89 (2Н, br s), 5,75 (1Н, s), 7,02 (1Н, d), 7,25 (1Н, t, J= 74,0 Гц), 7,36-7,42 (2Н, m), 7,48-7,50 (1Н, d), 11,76 (1Н, br s) 5-Піразоло[1,5-а]піридин-3-іл-2Н-піразол-3-іламін а) 3-Оксо-3-піразоло[1,5-а]піридин-3-іл-пропіонітрил До розчину сухого ацетонітрилу у толуєні (0,66 мл, 13 ммоль, 5 екв) охолодженого до -78 °C під азотом, додавали краплями розчин н-бутиллітію у н-гексані (5,2 мл, 13 ммоль, 5 екв). Суміш перемішували при -78 °C протягом 20 хвилин та тоді розчин піразоло[1,5-а]піридин-3-карбонової кислоти метил-естеру (0,46 г, 2,6 ммоль, 1 екв, отримуваного загальними способами (Anderson et al. Journal of Heterocyclic Chemistry 1981, 18, 1149-1152) у толуєні додавали та реакційній суміші давали досягти кімнатної температури. Після завершення реакції через приблизно 20 хвилин, суміш охолоджували до 0 °C та додавали 2 Н HCl до рН 2. Органічну фазу збирали, сушили безводним натрій сульфатом та концентрували під зменшеним тиском, отримуючи заголовний продукт, котрий було застосовано без подальшої очистки на наступному етапі. C10H7N3O b) 5-Піразоло[1,5-а]піридин-3-іл-2Н-піразол-3-іламін До розчину 3-оксо-3-піразоло[1,5-а]піридин-3-іл-пропіонітрилу (0,66 г, 3,6 ммоль), в абсолютному EtOH (25 мл) додавали гідразин моногідрат (0,44 мл, 9,0 ммоль) та реакційну суміш гріли при кипінні під зворотним холодильником протягом 18 годин. Реакційній суміші давали охолонути до кімнатної температури та розчинник випарювали під зменшеним тиском. Залишок розчиняли у ДХМ та промивали водою. Органічну фазу концентрували під зменшеним тиском, отримуючи сирий продукт, що очищали на колонці з SiO2 (ДХМ до ДХМ: Me ОН 95:5 до 85:15 градієнт), отримуючи заголовну сполуку з 41 % виходу (0,29 г, 1,48 ммоль). C10H9N5 1 Н-ЯМР (ДМСО-d6): 8,68 (s, 1Н); 8,21 (s, 1Н); 7,92 (s, 1Н); 7,28 (s, 1Н); 6,90 (s, 1Н); 5,75 (s, 1Н); 5,10 (s, 2Н). + Маса (розраховано) [199]; (знайдено) [М+Н ]=200. РХ Rt=0,86 хвил, 92 % (5 хвил спосіб). Нижченаведена Таблиця 2 показує аналітичні дані, отримані для серії амінопіразолів, синтезованих способами А1/А2, показаними у загальному розділі. 35 Таблиця 2 5-(2-Метоксифеніл)-2Нпіразол-3-іламін 79 C10H11N3О 189,22 190 96 1,08 5 5-Хінолін-6-іл-2Нпіразол-3-іламін 63 C12H10N4 210,24 211 100 0,45 5 5-(3-Бром-4метокси-феніл)2Н-піразол-3іламін 61 C10H10BrN3O 268,11 27 MeOD 3,92 (3H, s); 6,04 (1Н, s); 6,96-7,00 (1Н, m); 7,07-7,09 (1Н, m); 7,28-7,32 (1Н, m); 7,57-7,59 (1Н, m) MeOD 6,08 (1Н, s); 7,52-7,55 (1Н, m); 8,02-8,08 (2Н, m); 8,18 (1Н, s); 8,35-8,37 (1Н, m); 8,79-8,81 (1Н, m) 1Н ЯМР (ДМСОd6, 400 МГц) 3,84 (s, 1H), 6,29 (s, 1H), 7,11 (d, 1Н, J=8,6 Гц), 7,59 (dd, 1H, J=2,0 Гц, J=8,6 Гц), 7,83 (d, 1H, J=2,0 Гц), 12,50 (s, 1H). UA 98317 C2 5-Піридин-3-іл-2Н27 піразол-3-іламін C8H8N4 160,18 161 100 0,22 5 5-[6-(Тетрагідропіран-2-ілокси)піридин-3-іл]-2Нпіразол-3-іламін C13H16N4О2 260,3 260,2 94 1,93 10 5-(2-Флуор-4трифлуорметил44 феніл)-2Н-піразол3-іламін C10H7F4N3 245,18 5-(3-Флуор-4трифлуорметил67 феніл)-2Н-піразол3-іламін C10H7F4N3 245,18 99 5-(2-Метил-3трифлуормет ил42 феніл)-2Н-піразол3-іламін C11H10F3N3 241,22 5-(4-Хлор-3трифлуормет ил44 феніл)-2Н-піразол3-іламін C10H7ClF3N3 261,64 5-(3-Флуор-феніл)2Н-піразол-333 іламін C9H8FN3 177,18 178 69 % 1,13 5 5-(2-Дифлуормето кси-феніл)-2Н76 піразол-3-іламін C10H9F2N3О 225,20 5-(3Дифлуорметокси87 феніл)-2Н-піразол3-іламін C10H9F2N3О 225,20 28 ДМСО 5,9 (2Н, s, широкий); 7,457,47 (2Н, m); 8,08-8,1 (1Н, m), 8,45 (1Н, m, широкий), 8,84 (1Н, s) 1Н ЯМР (ДМСОd6, 400 МГц) 1,67 (m, 6Н), 3,53 (m, 1H), 5,45 (m, 1Н), 5,65 (bs, 1Н), 6,99 (d, 2H, J=8,8 Гц), 7,53 (d, 2Н, J=8,8 Гц). 1Н ЯМР (CDCl3, 400 МГц) 6,10 (s, 1H), 7,42 (d, 1Н, J=12,6 Гц), 7,45 (d, 1H, J=7,7 Гц), 7,73 (dd, 1H, J=7,7 Гц). 1Н ЯМР (CDCl3, 400 МГц) 5,96 (s, 1H), 7,40 (d, 1Н, J=11,4 Гц), 7,44 (d, 1Н, J=7,8 Гц), 7,62 (d, 1H, J=7,8 Гц). 1Н ЯМР (CDCl3, 400 МГц) 2,45 (s, 1H), 5,75 (s, 1Н), 7,30 (dd, 1H, J=7,7 Гц), 7,49 (d, 1Н, J=7,7 Гц), 7,66 (d, 1H, J=7,7 Гц). 1Н ЯМР (CDCl3, 400 МГц) 5,93 (s, 1H), 7,50 (d, 1Н, J=8,34 Гц), 7,66 (dd, 1H, J=8,34 Гц, J=2,0 Гц), 7,88 (d, 1H, J=2,0 Гц). ДМСО 4,82 (2Н, bs), 5,79 (1Н, s), 7,00-7,37 (4М, m), 7,79 (1Н, d), 11,74 (1Н, bs) ДМСО 4,89 (2Н, bs), 5,75 (1Н, s), 7,02 (1Н, d), 7,25 (1Н, t, J=74,0), 7,36-7,42 (2Н, m), 7,48-7,50
ДивитисяДодаткова інформація
Назва патенту англійськоюCompounds with alpha7 nicotinic acetylcholine receptor (alpha7 nachr) agonistic activity, composition, process for the preparation and use thereof
Автори англійськоюGhiron, Chiara, Nencini, Arianna, Zanaletti, Riccardo, Maccari, Laura, Bothmann, Hendrick, Haydar, Simon, Varrone, Maurizio, Pratelli, Carmela, Harrison, Boyd, MICCO, Iolanda
Назва патенту російськоюСоединения с агонистической активностью в отношении никотинового ацетилхинолинового рецептора a7 (a7-nachr), композиция, способ ее получения и применения
Автори російськоюГирон Кьяра, Ненчини Арианна, Заналетти Риккардо, Маккари Лаура, Ботманн Гендрик, Гайдар Саймон, Варроне Маурицио, Прателли Кармела, Гаррисон Бойд
МПК / Мітки
МПК: A61K 31/4155, C07D 409/04, C07D 403/12, C07D 473/04, C07D 487/04, C07D 231/40, C07D 413/12, C07D 403/14, C07D 407/04, A61P 25/00, C07D 401/04, C07D 403/04, C07D 407/14
Мітки: застосування, агоністичною, спосіб, сполуки, нікотинового, композиція, одержання, ацетилхінолінового, активністю, стосовно, рецептора, a7-nachr
Код посилання
<a href="https://ua.patents.su/160-98317-spoluki-z-agonistichnoyu-aktivnistyu-stosovno-nikotinovogo-acetilkhinolinovogo-receptora-a7-a7-nachr-kompoziciya-sposib-oderzhannya-ta-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Сполуки з агоністичною активністю стосовно нікотинового ацетилхінолінового рецептора a7 (a7-nachr), композиція, спосіб її одержання та застосування</a>
Наступний патент: Адаптер збиральної машини з лущильником стебел для збирання зернових культур
Випадковий патент: Спосіб термічного укріплення грунту












