Піридо[2,3-d]піримідин-2,4-діаміни як інгібітори фде 2
Номер патенту: 83091
Опубліковано: 10.06.2008
Автори: Томпсон Девід Дуейн, Лі Мей, Моррелл Ендрю Ян, Беєр Томас Артур, Лем Кельвін, Чамберс Роберт Джеймс
Формула / Реферат
1. Сполука формули (І)
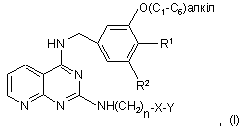
її проліки і фармацевтично прийнятні солі вказаної сполуки або проліків, в яких:
R1 і R2 є воднем або метокси, за умови, що R1 і R2 не є обидва воднем або обидва метокси;
n є 1, 2, 3 або 4;
X є зв'язком; О; S; C=O; -N(R)-, де R є воднем або -(С1-С3)алкілом; -С(ОН)-; або -SO2; і
Y є бензоксазолілом; бензотіазолілом; бензофуразанілом; бензофуранілом; бензотіадіазолілом; бензізоксазолілом; бензізотіазолілом; бензімідазолілом; піридилом; ізатинілом; оксіндолілом; індазолілом; індолілом; фенілом; тієнілом; або фуранілом; де Y, необов'язково, заміщений незалежно від одного до трьох атомами галогену; трифторметилом; метокси; -С(=О)СН3; ціано; -С(СН3)2ОН; -СН(СН3)ОН; -CH(CF3)OH;
-C(C=O)CF3; -SO2NH2; -C(=O)OCH3; -CH2COOH; 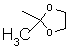 ; тіазолілом; або оксадіазолілом.
; тіазолілом; або оксадіазолілом.
2. Сполука за п. 1, в якій X є зв'язком і Y є бензофуразанілом; тієнілом; піридилом; або фенілом, де феніл, необов'язково, заміщений незалежно одним або двома атомами галогену; трифторметилом; метокси; -С(=О)СН3; ціано; -С(СН3)2ОН; -СН(СН3)ОН; -CH(CF3)OH; -C(C=O)CF3; -SO2NH2; -C(=O)OCH3; -CH2COOH; тіазолілом; або оксадіазолілом.
3. Сполука за п. 1 або 2, де X є зв'язком, n є 2 або 3, і Y є тієнілом; піридилом; або фенілом, де феніл, необов'язково, заміщений незалежно одним або двома метокси; галогеном; -С(СН3)2ОН; CH(CF3)OH або -C(C=O)CF3.
4. N2,N4-біс-(3,5-диметоксибензил)-піридо[2,3-d]піримідин-2,4-діамін;
N4-(3,5-диметоксибензил)-N2-(2-піридин-4-ілетил)-піридо[2,3-d]піримідин-2,4-діамін;
N4-(3,5-диметокси-бензил)-N2-(2-тіофен-2-ілетил)-піридо[2,3-d]піримідин-2,4-діамін;
N4-(3,5-диметоксибензил)-N2-2-фенетилпіридо[2,3-d]піримідин-2,4-діамін;
N4-(3,5-диметоксибензил)-N2-[2-(3,5-диметоксифеніл)-етил]-піридо[2,3-d]піримідин-2,4-діамін;
2-(3-{3-[4-(3,4-диметоксибензиламіно)-піридо[2,3-d]піримідин-2-іламіно]-пропіл}-феніл)-пропан-2-ол;
N4-(3,4-диметоксибензил)-N2-[2-(4-фторфеніл)-етил]-піридо[2,3-d]піримідин-2,4-діамін;
N4-(3,4-диметоксибензил)-N2-фенетилпіридо[2,3-d]піримідин-2,4-діамін або
N4-(3,4-диметоксибензил)-N2-(3-фенілпропіл)-піридо[2,3-d]піримідин-2,4-діамін;
їх проліки або фармацевтично прийнятні солі вказаних сполук або проліків.
5. Фармацевтична композиція, яка містить сполуку формули (І) за будь-яким з пп. 1-4, її пролікарську форму або фармацевтично прийнятну сіль вказаної сполуки або пролікарської форми, і фармацевтично прийнятний розчинник, носій, або розріджувач.
6. Спосіб лікування стану, захворювання або симптому, опосередкованого ФДЕ 2, у ссавця, якому необхідне таке лікування, який включає введення вказаному ссавцю терапевтично ефективної кількості сполуки формули (І) за будь-яким з пп. 1-4, її пролікарської форми або фармацевтично прийнятної солі вказаної сполуки або пролікарської форми.
7. Спосіб за п. 6, в якому вказаним станом, захворюванням або симптомом є остеопороз, легенева гіпертензія, порушення статевого збудження жінок, послаблення пам'яті або пізнавальної здатності, агрегація тромбоцитів, судинний ангіогенез, деменція, рак, аритмія, тромбоз, перелом і/або дефект кістки, уповільнене зрощення або незрощення, спондилодез, вростання кістки, реконструкція лицьового черепа або гіпоксія, який включає введення ссавцю, якому необхідне таке лікування, терапевтично ефективної кількості сполуки формули (І) за п. 1, її пролікарської форми або фармацевтично прийнятної солі вказаної сполуки або пролікарської форми.
8. Спосіб за п. 6, в якому вказаним станом є перелом і/або дефект кістки.
9. Спосіб за будь-яким з пп. 6-8, який додатково включає введення вказаному ссавцю терапевтично ефективної кількості селективного агоніста рецептора ЕР2.
10. Спосіб за будь-яким з п. 9, який включає введення фармацевтичної композиції, яка містить комбінацію вказаної сполуки формули (І) за п. 1 і вказаного селективного агоніста рецептора ЕР2.
11. Спосіб за п. 6, в якому вказаним інгібітором ФДЕ 2 є:
N4-(3,5-диметоксибензил)-N2-(2-піридин-4-ілетил)-піридо[2,3-d]піримідин-2,4-діамін;
2-(3-{3-[4-(3,4-диметоксибензиламіно)-піридо[2,3-d]піримідин-2-іламіно]-пропіл}-феніл)-пропан-2-ол;
N4-(3,4-диметоксибензил)-N2-(3-фенілпропіл)-піридо[2,3-d]піримідин-2,4-діамін;
їх пролікарська форма або фармацевтично прийнятна сіль вказаної сполуки або пролікарської форми.
12. Спосіб за будь-яким з пп. 9, 10, в якому вказаним селективним агоністом рецептора ЕР2 є (3-(((4-трет-бутилбензил)-(піридин-3-сульфоніл)-аміно)-метил)-фенокси)-оцтова кислота, її пролікарська форма або фармацевтично прийнятна сіль вказаної сполуки або пролікарської форми.
13. Спосіб лікування стану, захворювання або симптому, опосередкованого ФДЕ 2, у ссавця, якому необхідне таке лікування, який включає введення вказаному ссавцю фармацевтичної композиції, яка містить вказану сполуку формули (І), її пролікарську форму або фармацевтично прийнятну сіль вказаної сполуки або пролікарської форми і фармацевтично прийнятний розчинник, носій, або розріджувач.
14. Спосіб за п. 13, в якому вказаним станом, захворюванням або симптомом є остеопороз, легенева гіпертензія, порушення статевого збудження жінок, послаблення пам'яті або пізнавальної здатності, агрегація тромбоцитів, судинний ангіогенез, деменція, рак, аритмія, тромбоз, перелом і/або дефект кістки, уповільнене зрощення або незрощення, спондилодез, вростання кістки, реконструкція лицьового черепа або гіпоксія, який включає введення ссавцю, якому необхідне таке лікування, фармацевтичної композиції, яка містить вказану сполуку, її пролікарську форму або фармацевтично прийнятну сіль вказаної сполуки або пролікарської форми.
15. Спосіб за п. 13, в якому вказаним станом є перелом і/або дефект кістки.
16. Спосіб за будь-яким з пп. 13-15, який додатково включає введення вказаному ссавцю терапевтично ефективної кількості селективного агоніста рецептора ЕР2.
17. Спосіб за будь-яким з п. 16, який включає введення фармацевтичної композиції, яка містить комбінацію вказаної сполуки формули (І) за п. 1 і вказаного селективного агоніста рецептора ЕР2.
18. Спосіб за п. 16, в якому вказаним інгібітором ФДЕ 2 є:
N4-(3,5-диметоксибензил)-N2-(2-піридин-4-ілетил)-піридо[2,3-d]піримідин-2,4-діамін;
2-(3-{3-[4-(3,4-диметоксибензиламіно)-піридо[2,3-d]піримідин-2-іламіно]-пропіл}-феніл)-пропан-2-ол;
N4-(3,4-диметоксибензил)-N2-(3-фенілпропіл)-піридо[2,3-d]піримідин-2,4-діамін;
їх пролікарська форма або фармацевтично прийнятна сіль вказаної сполуки або пролікарської форми.
19. Спосіб за будь-яким з пп. 16, 17, в якому вказаним селективним агоністом рецептора ЕР2 є (3-(((4-трет-бутилбензил)-(піридин-3-сульфоніл)-аміно)-метил)-фенокси)-оцтова кислота, її пролікарська форма або фармацевтично прийнятна сіль вказаної сполуки або пролікарської форми.
20. Фармацевтична композиція, які містить інгібітор ФДЕ 2, селективний агоніст рецептора ЕР2 і фармацевтично прийнятний розчинник, носій або розріджувач.
21. Композиція за п. 20, в якій вказаним інгібітором ФДЕ 2 є:
N4-(3,5-диметоксибензил)-N2-(2-піридин-4-ілетил)-піридо[2,3-d]піримідин-2,4-діамін;
2-(3-{3-[4-(3,4-диметоксибензиламіно)-піридо[2,3-d]піримідин-2-іламіно]-пропіл}-феніл)-пропан-2-ол;
N4-(3,4-диметоксибензил)-N2-(3-фенілпропіл)-піридо[2,3-d]піримідин-2,4-діамін;
їх пролікарська форма або фармацевтично прийнятна сіль вказаної сполуки або пролікарської форми.
22. Композиція за п. 20 або 21, в якій вказаним селективним агоністом рецептора ЕР2 є (3-(((4-трет-бутилбензил)-(піридин-3-сульфоніл)-аміно)-метил)-фенокси)-оцтова кислота, її пролікарська форма або фармацевтично прийнятна сіль вказаної сполуки або пролікарської форми.
23. Спосіб лікування перелому і/або дефекту кістки у ссавця, якому необхідне таке лікування, який включає введення вказаному ссавцю терапевтично ефективної кількості інгібітора ФДЕ 2, його пролікарської форми або фармацевтично прийнятної солі вказаного інгібітора або пролікарської форми.
Текст
1. Сполука формули (І) C2 2 (19) 1 3 83091 необхідне таке лікування, який включає введення вказаному ссавцю терапевтично ефективної кількості сполуки формули (І) за будь-яким з пп. 1-4, її пролікарської форми або фармацевтично прийнятної солі вказаної сполуки або пролікарської форми. 7. Спосіб за п. 6, в якому вказаним станом, захворюванням або симптомом є остеопороз, легенева гіпертензія, порушення статевого збудження жінок, послаблення пам'яті або пізнавальної здатності, агрегація тромбоцитів, судинний ангіогенез, деменція, рак, аритмія, тромбоз, перелом і/або дефект кістки, уповільнене зрощення або незрощення, спондилодез, вростання кістки, реконструкція лицьового черепа або гіпоксія, який включає введення ссавцю, якому необхідне таке лікування, терапевтично ефективної кількості сполуки формули (І) за п. 1, її пролікарської форми або фармацевтично прийнятної солі вказаної сполуки або пролікарської форми. 8. Спосіб за п. 6, в якому вказаним станом є перелом і/або дефект кістки. 9. Спосіб за будь-яким з пп. 6-8, який додатково включає введення вказаному ссавцю терапевтично ефективної кількості селективного агоніста рецептора ЕР2. 10. Спосіб за будь-яким з п. 9, який включає введення фармацевтичної композиції, яка містить комбінацію вказаної сполуки формули (І) за п. 1 і вказаного селективного агоніста рецептора ЕР2. 11. Спосіб за п. 6, в якому вказаним інгібітором ФДЕ 2 є: N4 -(3 ,5 -диме токсибензил)-N2-(2-піридин-4-ілетил)піридо[2,3-d]піримідин-2,4-діамін; 2-(3-{3-[4-(3,4-диметоксибензиламіно)-піридо[2,3d]піримідин-2-іламіно]-пропіл}-феніл)-пропан-2-ол; N4-(3,4-диметоксибензил)-N2-(3-фенілпропіл)піридо[2,3-d]піримідин-2,4-діамін; їх пролікарська форма або фармацевтично прийнятна сіль вказаної сполуки або пролікарської форми. 12. Спосіб за будь-яким з пп. 9, 10, в якому вказаним селективним агоністом рецептора ЕР2 є (3-(((4трет-бутилбензил)-(піридин-3-сульфоніл)-аміно)метил)-фенокси)-оцтова кислота, її пролікарська форма або фармацевтично прийнятна сіль вказаної сполуки або пролікарської форми. 13. Спосіб лікування стану, захворювання або симптому, опосередкованого ФДЕ 2, у ссавця, якому необхідне таке лікування, який включає введення вказаному ссавцю фармацевтичної композиції, яка містить вказану сполуку формули (І), її пролікарську форму або фармацевтично прийнятну сіль вказаної сполуки або пролікарської форми і фармацевтично прийнятний розчинник, носій, або розріджувач. 14. Спосіб за п. 13, в якому вказаним станом, захворюванням або симптомом є остеопороз, легенева гіпертензія, порушення статевого збудження жінок, послаблення пам'яті або пізнавальної здатності, агрегація тромбоцитів, судинний ангіогенез, деменція, рак, аритмія, тромбоз, перелом і/або 4 дефект кістки, уповільнене зрощення або незрощення, спондилодез, вростання кістки, реконструкція лицьового черепа або гіпоксія, який включає введення ссавцю, якому необхідне таке лікування, фармацевтичної композиції, яка містить вказану сполуку, її пролікарську форму або фармацевтично прийнятну сіль вказаної сполуки або пролікарської форми. 15. Спосіб за п. 13, в якому вказаним станом є перелом і/або дефект кістки. 16. Спосіб за будь-яким з пп. 13-15, який додатково включає введення вказаному ссавцю терапевтично ефективної кількості селективного агоніста рецептора ЕР2. 17. Спосіб за будь-яким з п. 16, який включає введення фармацевтичної композиції, яка містить комбінацію вказаної сполуки формули (І) за п. 1 і вказаного селективного агоніста рецептора ЕР2. 18. Спосіб за п. 16, в якому вказаним інгібітором ФДЕ 2 є: N 4 -(3 ,5 -диме токсибензил)-N2-(2-піридин-4-ілетил)піридо[2,3-d]піримідин-2,4-діамін; 2-(3-{3-[4-(3,4-диметоксибензиламіно)-піридо[2,3d]піримідин-2-іламіно]-пропіл}-феніл)-пропан-2-ол; N4-(3,4-диметоксибензил)-N2-(3-фенілпропіл)піридо[2,3-d]піримідин-2,4-діамін; їх пролікарська форма або фармацевтично прийнятна сіль вказаної сполуки або пролікарської форми. 19. Спосіб за будь-яким з пп. 16, 17, в якому вказаним селективним агоністом рецептора ЕР2 є (3(((4-трет-бутилбензил)-(піридин-3-сульфоніл)аміно)-метил)-фенокси)-оцтова кислота, її пролікарська форма або фармацевтично прийнятна сіль вказаної сполуки або пролікарської форми. 20. Фармацевтична композиція, які містить інгібітор ФДЕ 2, селективний агоніст рецептора ЕР2 і фармацевтично прийнятний розчинник, носій або розріджувач. 21. Композиція за п. 20, в якій вказаним інгібітором ФДЕ 2 є: N 4 -(3 ,5 -диме ток си бензил)-N2-(2-піридин-4ілетил)-піридо[2,3-d]піримідин-2,4-діамін; 2-(3-{3-[4-(3,4-диметоксибензиламіно)-піридо[2,3d]піримідин-2-іламіно]-пропіл}-феніл)-пропан-2-ол; N4-(3,4-диметоксибензил)-N2-(3-фенілпропіл)піридо[2,3-d]піримідин-2,4-діамін; їх пролікарська форма або фармацевтично прийнятна сіль вказаної сполуки або пролікарської форми. 22. Композиція за п. 20 або 21, в якій вказаним селективним агоністом рецептора ЕР2 є (3-(((4трет-бутилбензил)-(піридин-3-сульфоніл)-аміно)метил)-фенокси)-оцтова кислота, її пролікарська форма або фармацевтично прийнятна сіль вказаної сполуки або пролікарської форми. 23. Спосіб лікування перелому і/або дефекту кістки у сса вця, якому необхідне таке лікування, який включає введення вказаному ссавцю терапевтично ефективної кількості інгібітора ФДЕ 2, його пролікарської форми або фармацевтично прийнятної солі вказаного інгібітора або пролікарської форми. 5 83091 Винахід стосується деяких піридо[2,3d]піримідин-2,4-діамінів, корисних у якості інгібіторів ФДЕ 2, їх фармацевтичних рецептур, їх комбінацій, а також способів їх застосування. Фосфодиестерази (ФДЕ) регулюють внутрішньоклітинні рівні вторинного месенджера сАМР (цАМФ) або cGMP (цГ МФ) шля хом його гідролітичної активності. Фосфодиестераза типу II (ФДЕ 2) має каталітичний домен із низькою спорідненістю і алостеричний домен, специфічний до цГМФ. Каталітичний сайт із низькою спорідненістю може гідролізувати як цАМФ, так і цГМФ із нижчою уявною Км для цГМФ у порівнянні з цАМФ. В той же час, якщо цГМФ зв'язується з алостеричним сайтом, каталітичний сайт зазнає конформаційної зміни, проявляючи високу спорідненістю до цАМФ. ФДЕ 2 проявляє найвищу експресію у мозку, але вона має місце також і у багатьох інших тканинах і, тому, цей фермент має широкий спектр функції і потенціал для терапевтичного застосування [J.Α. Beavo, et. al., Rev. Ph ysio. Biochem. Pharm., 135, 67 (1999)]. Приклади функцій і терапевтичного потенціалу ФДЕ 2 включають розвиток нейронів, пізнання і пам'я ть [W. С G. van Sta veren, et. al., Brain Res., 888, 275 (2001) і J. O'Donnell, et. al., J. Pharm. Exp. Then, 302, 249 (2002)]; секрецію пролактину і альдостерону [М.О. Velardez, et. al., Eur. J. Endo., J43, 279 (2000) і N. Gallo-Payet, et. al., Ende, 140, 3594 (1999)]; диференціацію та ріст кісних клітин, резорбцію кістки [С. Allardt-Lamberg, et. al., Biochem. Pharm., 59, 1133 (2000) і S. Wakabayashi, et. al., J. Bone. Miner. Res., 17, 249 (2002)]; імунологічну відповідь (М. D. Houslay, et. al., Cell. Signal., 8, 97 (1996); судинний ангіогенез (Т. Keravis, et. al., J. Vasc. Res., 37, 235 (2000); транзит запальних клітин (S.L. Wolda, et. al., J. Histochem. Cytochem., 47, 895 (1999); скорочення серця [R. Fischmeister, et. al., J. Clin. Invest, 99, 2710 (1997), P. DonzeauGouge, et. al., J. Physiol., 533, 329 (2001) і D.J. Paterson, et. al., Card. Res., 52, 446 (2001)]; агрегацію тромбоцитів (R.J. Haslam, et. al., Biochem. J., 323, 371 (1997); порушення статевого збудження жінок (FSAD) (СР. Wa yman, et al., публікації Європейських патентних заявок №№ ЕР 10977707 і 1097706); і гіпоксичну легеневу вазоконстрикцію [J. Haynes, et. al., J. Pharm. Exp. Ther, 276, 752 (1996)]. Продемонстрували, що EHNA (еритро-9(2-гідрокси-3-ноніл)аденін), потужний інгібітор аденозиндеамінази, селективно інгібує ФДЕ 2, але застосування EHNA у якості терапевтичного агента, дія якого спрямована на вплив на ФДЕ 2, обмежене через його низьку здатність до інгібування ФДЕ 2 та потужну дію при інгібуванні аденозиндеамінази [R. Fischmeister, et. al., Mol. Pharm., 48, 121 (1995)]. Було виявлено, що деякі похідні піридо[2,3d]піримідин-2,4-діаміну формули (І), яка наведена нижче, інгібують ФДЕ 2 і, тому, є корисними при лікування фізіологічних розладів, опосередкованих клітинним сигнальним шляхом цАМФ або цГМФ. В патентах США №№5547954 і 5710157 описані певні 2,4-діаміно-5,6-дизаміщені- і 5,6,7тризаміщені-5-деазаптеридини, їх композиції і спо 6 соби їх застосування для боротьби з комахами на сільськогосподарських посівах. Винахід включає сполуки формули (І) їх проліки і фармацевтично прийнятні солі сполук або проліків, де n, X, і Υ мають вказані нижче значення; їх фармацевтичні композиції; їх комбінації; та способи їх застосування. Даний винахід включає сполуки формули (І) їх проліки і фармацевтично прийнятні солі сполук або проліків, де: R1 і R2 є воднем або метокси, за умови, що R 1 і 2 R не є обидва воднем або обидва метокси; n є 1, 2, 3, або 4; X є зв'язком; О; S; C=O; -N(R)-, де R є воднем або -(С1-С3)алкілом; -С(ОН)-; або -SO2; і Υ є бензоксазолілом; бензотіазолілом; бензофуразанілом; бензофуранілом; бензотіадіазолілом; бензізоксазолілом; бензізотіазолілом; бензімідазолілом; піридилом; ізатинілом; оксіндолілом; індазолілом; індолілом; фенілом; тиєнілом; або фуранілом; де Υ, необов'язково, заміщений, незалежно, від одного до трьох атомів галогену; трифторметилу; метокси; -С(=О)СН3; ціано; С(СН3)2ОН; -СН(СН3)ОН; -CH(CF3)OH; C(C=O)CF3; -SO 2NH2; -С(=О)ОСН3; -СН2СООН; тіазолілу; або оксадіазолілу. В цілому, переважна підгрупа сполук формули (І) включає ті сполуки, в яких X є зв'язком і Υ є бензофуразанілом; тиєнілом; піридилом; або фенілом, де феніл, необов'язково, заміщений незалежно одним або двома атомами галогену; трифторметилу; метокси; -С(=О)СН3; ціано; С(СН3)2ОН; -СН(СН3)ОН; -CH(CF3)OH; C(C=O)CF3; -SO 2NH2; -C(=O)OCH 3; -СН2СООН; тіазолілу; або оксадіазолілу. Особливо переважна підгрупа сполук формули (І) включає ті сполуки, в яких X є зв'язком, n є 2 або 3, і Υ є тиєнілом; піридилом; або фенілом, де феніл, необов'язково, заміщений незалежно одним або двома метокси; галогеном; -С(СН3)2ОН; CH(CF3)OH; або -C(C=O)CF3. Циклічна група може бути зв'язана з іншою групою різними способами. Якщо певний вид зв'язку не вказаний, передбачаються всі можливі зв'я 7 83091 зки. Наприклад, термін "піридил" включає 2-, 3-, або 4-піридил, і термін "тиєніл" включає 2- або 3тиєніл. Сполуки і проміжні сполуки за цим винаходом можуть називатись відповідно номенклатурних систем IUPAC (ІЮПАК) [International Union for Pure i Applied Chemistry (Міжнародний союз теоретичної та прикладної хімії)], або CAS [Chemical Abstracts Service, Колумбус, штат Огайо]. Вміст атомів вуглецю в різних вуглеводвмісних замісниках може позначатись префіксом, що вказує на мінімальну і максимальну кількість атомів вуглецю в замісниках, тобто префікс "-(СаСb)алкіл" вказує на алкільний замісник із кількістю атомів вуглецю від "а" до "b" включно. Термін "алкіл" означає нерозгалужені або розгалужені моноваленті ланцюги атомів вуглецю. Приклади алкільних гр уп включають метил, етил, пропіл, ізопропіл, бутил, ізобутил і подібні. Термін "галоген" означає хлор, фтор, бром і йод. Термін "проліки" відповідає сполуці, яка є прекурсором лікарського засобу, який, після введення, вивільняє лікарський засіб in vivo внаслідок хімічних або фізіологічних процесів (наприклад, внаслідок дії фізіологічного рівня pH або дії ферментів). Опис одержання і застосування проліків наведений в публікації Т. Higuchi і W. Stella, "Prodrugs as Novel Delivery Systems", том 14 з серії ACS Symposium Series, і в "Bioreversible Carriers in Drug Design", ed. Edward B. Roche, American Pharmaceutical Association and Pergamon Press (1987). Термін "ссавець" означає тварин, включно з, наприклад, собаками, котами, коровами, вівцями, конями і людиною. Переважними ссавцями є люди незалежно від статі. Термін "солі" включає органічні і неорганічні солі сполуки формули (І), або її проліків. Такі солі одержують in situ під час кінцевого виділення і очищення сполуки, або шляхом окремої взаємодії сполуки формули (І), або її проліків, з придатною органічною або неорганічною кислотою або основою і виділення одержаної таким чином солі. Ілюстративними солями є гідробромідна, гідрохлоридна, сульфатна, бісульфа тна, нітратна, ацетатна, оксалатна, безплатна, пальмітатна, стеаратна, лауратна, боратна, бензоатна, лактатна, фосфатна, тозилатна, цитратна, малеатна, фумаратна, сукцинатна, тартратна, нафтилатна, мезилатна, глюкогептонатна, лактобіонатна і лаурилсульфонатна солі та подібні. Вони також можуть включати катіони на основі лужних і лужноземельних металів, таких як натрій, літій, калій, кальцій, магній і подібні, а також катіони нетоксичного амонію, четвертинного амонію і аміну, включаючи, без обмежень, амоній, тетраметиламоній, метиламін, диметиламін, триметиламін, триетиламін, етиламін і подібні. Додаткові приклади можна знайти у Berge, et al., J. Pharm. Sei., 66, 1-19 (1977). Термін "заміщений" означає, що атом водню на молекулі був заміщений іншим атомом, або молекулою. Атом або молекула, що заміщує атом водню, позначається як "замісник". 8 Як він вживається тут, термін "терапевтично ефективна кількість" означає кількість сполуки, яка здатна лікувати описаний патологічний стан. Терміни "лікувати", "терапія" і "лікування" включають запобіжну (наприклад, профілактику) і паліативну терапію (наприклад, загоєння або лікування), або процес запобіжної або паліативної терапії. Сполуки формули (І) можуть мати асиметричні або хіральні центри і, тому, існують у різних стереоізомерних формах. Передбачено, що всі стереоізомерні форми сполуки і проліків формули (І), а також їх сумішей, включаючи рацемічні суміші, входять до об'єму цього винаходу. Окрім того, даний винахід охоплює всі геометричні і позиційні ізомери. Наприклад, якщо сполука або проліки формули (І) має подвійний зв'язок (зв'язки), як цис, так і транс- форми, а також їх суміші, входять до об'єму цього винаходу. Діастереомерні суміші можна розділити на їх окремі діастереомери на основі їх фізичних/хімічних відмінностей способами, добре відомими фахівцям у галузі, такими як хроматографія і/або фракційна кристалізація. Енантіомери можна відділити шляхом перетворення суміш у діастереомерну суміш шляхом реакції з придатною оптично активно сполукою (наприклад, спиртом), відділенням діастереомерів і перетворенням (наприклад, шляхом гідролізу) окремих діастереомерів у відповідні чисті енантіомери. Сполуки і проліки сполук формули (І) можуть існувати в несольватованій формі та в формі, сольватованій фармацевтично придатними розчинниками, такими як вода, етанол і подібні, і передбачається, що винахід включає як сольватовані, так і несольватовані форми. Також сполуки і проліки формули (І) можуть існувати як та утомерні ізомери в рівновазі, і всі такі форми включені до об'єму цього винаходу. Даний винахід також включає мічені ізотопами сполуки, ідентичні описаним для формули І, за винятком того, що один або більше атомів заміщений атомом, атомна маса або масове число якого відрізняється від атомної маси або масового числа, яке звичайно існують у природі. Приклади ізотопів, які можуть бути включені у сполуки формули (І), включають ізотопи водню, вуглецю, азоту, кисню, фосфору, фтор у і хлору, такі як 2Н, 3Н, 13С, 14С, 15 N, 18 О, 17O, 31Р, 32Р, 35S, 18F і 36СІ, відповідно. Сполуки формули (І), їх проліки і фармацевтично прийнятні солі таких сполук або проліків, які містять вищенаведені ізотопи і/або інші ізотопи інших атомів, охоплюються об'ємом даного винаходу. Деякі мічені ізотопами сполуки згідно з винаходом, наприклад сполуки, в які введені радіоактивні ізотопи, такі як 3Н і 14С, використовують в аналізі розподілу лікарського засобу і/або аналізі субстрату тканини. Тритійовані, тобто 3Н, ізотопи і вуглець-14, тобто, 14С, ізотопи є особливо переважними завдяки простоті їх одержання та здатності до виявлення. Крім того, заміщення важчим ізотопом, таким як дейтерій, тобто 2Н, може зумовити певні позитивні терапевтичні ефекти, які є наслідком вищої метаболічної стійкості, наприклад збільшений період напіврозкладу in vivo або потреба 9 83091 в менших дозах, що може бути бажаним за деяких умов. Мічені ізотопами сполуки формули (І) згідно з винаходом і їх проліки, як правило, можна одержати шляхом методик, описаних на Схемах і/або у наведених далі Прикладах, шля хом заміни легкодоступного міченого ізотопами реагенту неміченим ізотопами реагентом. В іншому варіанті, винахід стосується способів лікування опосередкованих ФДЕ 2 станів, захворювань, або симптомів у ссавця, якому необхідне таке лікування, які включають введення ссавцю терапевтично ефективної кількості сполуки формули (І), її проліків, або фармацевтично прийнятної солі сполуки або проліків; або фармацевтичної композиції, яка містить сполуку формули (І), її проліки, або фармацевтично прийнятну сіль сполуки або проліків, і фармацевтично прийнятний розчинник, носій, або розріджувач. Переважні стани, захворювання, або симптоми, які піддають лікуванню способами за цим винаходом, включають остеопороз, легеневу гіпертензію, порушення статевого збудження жінок, послаблення пам'яті або пізнавальної здатності, агрегацію тромбоцитів, судинний ангіогенез, деменцію, рак, аритмію, тромбоз, перелом і/або дефект кістки, уповільнене зрощення або незрощення, спондилодез, вростання кістки, реконструкцію лицьового черепа, або гіпоксію. Особливо переважним станом є перелом і/або дефект кістки. В іншому варіанті винахід включає способи інгібування дії ФДЕ 2 у ссавця, якому необхідне таке інгібування, які включають введення ссавцю кількості сполуки формули (І), яка інгібує ФДЕ 2, її проліків, або фармацевтично прийнятної солі сполуки або проліків; або фармацевтичної композиції, яка містить сполуку формули (І), її проліки, або фармацевтично прийнятну сіль сполуки або проліків, і фармацевтично прийнятний розчинник, носій, або розріджувач. Сполуки формули (І), їх проліки і фармацевтично прийнятні солі сполук і проліків, можна вводити ссавцю у дозах, що знаходяться у межах від, приблизно, 0,001мг до, приблизно, 200мг на день. Для середньої дорослої людини із вагою приблизно 70кг доза у межах від, приблизно, 0,01мг до, приблизно, 100мг на кг ваги тіла є, звичайно, переважною, однак, може виникнути необхідність у деяких відхиленнях від загальних меж дозування в залежності від віку і ваги пацієнта, заданого шляху введення, певної сполуки, яка вводиться, і т.д. Визначення меж дозування і оптимальних доз для окремого пацієнта може провести фахівець у галузі, спираючись на цей опис. Ще в одному варіанті, винахід включає фармацевтичні композиції, які включають комбінацію інгібітора ФДЕ 2, селективного агоніста ЕР2; і фармацевтично прийнятний розчинник, носій, або розріджувач; і способи лікування остеопорозу, легеневої гіпертензії, порушення статевого збудження жінок, послаблення пам'яті або пізнавальної здатності, агрегації тромбоцитів, судинного ангіогенезу, деменції, раку, аритмії, тромбозу, перелому і/або дефекту кістки, уповільненого зрощення або незрощення, спондилодезу, вростання кістки, реконструкції лицьового черепа, або гіпоксії 10 із застосуванням таких композицій. Особливо переважним станом є перелом і/або дефект кістки. Ще в одному варіанті винахід включає способи лікування перелому і/або дефекту кістки у ссавця, якому необхідне таке лікування, які включають введення ссавцю терапевтично ефективної кількості інгібітора ФДЕ 2, його проліків, або фармацевтично прийнятної солі вказаного інгібітора або проліків. У комбінованих варіантах винаходу можна застосувати будь-який інгібітор ФДЕ 2, включно із сполуками формули (І). Прикладами відомих інгібіторів ФДЕ 2 є EHNA, 6-(3,4-диметокси-бензил)-1[(1-гідрокси-етил)-4-феніл-бутил]-3-метил-1,5дигідро-піразоло[3,4-d]піримідин-4-он (BAY-607550; патент США №6174884), і 9-(1-ацетил-4феніл-бутил)-2-(3,4-диметокси-бензил)-1,9дигідропурин-6-он [патент США №5861396]. Додаткові приклади інгібіторів ФДЕ 2 описані в патентах США №№5861396, 5 401 774, 6 458 796 і 6 555 547, та в міжнародній публікації заявки РСТ №98/32755. У комбінованих варіантах цього винаходу можна застосовувати будь-який селективний агоніст рецептора ЕР2, однак, в цілому переважний клас селективних агоністів рецептора ЕР2, описаний в звичайно цитованому патенті США № 6 498 172, включає сполуки Формули АА їх проліки і їх фармацевтично прийнятні солі, де G, А, В, К, М, Q і Ζ має визначені значення. В цілому, переважними сполуками Формули АА є (3-(((піридин-3-сульфоніл)-(4-піримідин-5-ілбензил)-аміно)-метил)-феніл)-оцтова кислота; (3(((5-феніл-фуран-2-ілметил)-(піридин-3сульфоніл)-аміно)-метил)-феніл)-оцтова кислота; (3-(((піридин-3-сульфоніл)-(4-піримідин-2-ілбензил)-аміно)-метил)-феніл)-оцтова кислота; (3(((піридин-3-сульфоніл)-(4-тіазол-2-іл-бензил)аміно)-метил)-феніл)-оцтова кислота; (3-(((4піразин-2-іл-бензил)-(піридин-3-сульфоніл)-аміно)метил)-феніл)-оцтова кислота; (3-(((4-циклогексилбензил)-(піридин-3-сульфоніл)-аміно)-метил)фенокси)-оцтова кислота; (3-(((піридин-3сульфоніл)-(4-піридин-2-іл-бензил)-аміно)-метил)фенокси)-оцтова кислота; (3-(((піридин-3сульфоніл)-(4-піридин-3-іл-бензил)-аміно)-метил)фенокси)-оцтова кислота; (3-(((піридин-3сульфоніл)-(4-піридин-4-іл-бензил)-аміно)-метил)фенокси)-оцтова кислота; (3-(((піридин-3сульфоніл)-(4-тіазол-2-іл-бензил)-аміно)-метил)фенокси)-оцтова кислота; 5-(3-((піридин-3сульфоніл)-(4-тіазол-2-іл-бензил)-аміно)-пропіл)тіофен-2-карбонова кислота; (3-(((2,3-дигідробензо[1,4]дюксин-6нлметил)-(піридин-3сульфоніл)-аміно)-метил)-феніл)-оцтова кислота; і (3-((бензофуран-2-ілметил-(піридин-3-сульфоніл)аміно)-метил)-феніл)-оцтова кислота; (3-(((4бутил-бензил)-(піридин-3-сульфоніл)-аміно)метил)-феніл)-оцтова кислота; (3 11 83091 ((бензолсульфоніл-(4-бутил-бензил)-аміно)метил)-феніл)-оцтова кислота; (3-(((4-бутилбензил)-(1-метил-1Н-імідазол-4-сульфоніл)-аміно)метил)-феніл)-оцтова кислота і (3-(((4диметиламіно-бензил)-(піридин-3-сульфоніл)аміно)-метил)-феніл)-оцтова кислота; (3-(((4диметиламіно-бензил)-(піридин-3-сульфоніл)аміно)-метил)-фенокси)-оцтова кислота і (3-(((4mреm-бутил-бензил)-(піридин-3-сульфоніл)аміно)-метил)-фенокси)-оцтова кислота; mранс-(3(((3-(3,5-дихлор-феніл)-аліл)-(піридин-3сульфоніл)-аміно)-метил)-феніл)-оцтова кислота; (3-(((2-(3,5-дихлор-фенокси)-етил)-(піридин-3сульфоніл)-аміно)-метил)-фенокси)-оцтова кислота; їх проліки, і фармацевтично прийнятні солі сполук і проліків. Особливо переважною сполукою Формули АА є (3-(((4-mреm-бутил-бензил)-(піридин-3сульфоніл)-аміно)-метил)-фенокси)-оцтова кислота, її проліки, або фармацевтично прийнятні солі сполуки або проліків. Особливо переважною сіллю є сіль натрію. Інший в цілому переважний клас селективних агоністів рецептора ЕР2, придатний в комбінованих варіантах винаходу, включає сполуки, проліки і фармацевтично прийнятні солі наведеної нижче Формули ВВ, яка описано в звичайно цитованому патенті США №6 288 120 де А, В, К, M,Q і Ζ мають визначені в ньому значення. В цілому, переважними сполуками Формули ВВ є 7-[(2'-гідроксиметил-біфеніл-4-ілметил)метансульфоніл-аміно]-гептанова кислота; 7-{[4(3-гідроксиметил-тіофен-2-іл)-бензил]метансульфоніл-аміно}-гептанова кислота; 7-[(2'хлор-біфеніл-4-ілметил)-метансульфоніл-аміно]гептанова кислота; 7-{[4-(1-гідрокси-гексил)бензил]-метансульфоніл-аміно]-гептанова кислота; 7-[(4-бутил-бензил)-метансульфоніл-аміно]гептанова кислота; 7-{[5-(1-гідрокси-гексил)тіофен-2-ілметил]-метансульфоніл-аміно}гептанова кислота; (3-{[(4-бутил-бензил)метансульфоніл-аміно]-метил}-феніл)-оцтова кислота; 7-{[3-(3-хлор-феніл)-пропіл]-метансульфоніламіно}-гептанова кислота; 7-{[3-(3,5-дихлор-феніл)пропіл]-метансульфоніл-аміно}-гептанова кислота; 5-(3-{[3-(3-хлор-феніл)-пропіл]-метансульфоніламіно}-пропіл)-тіофен-2-карбонова кислота; 7-{[2(3,5-дихлор-фенокси)-етил]-метансульфоніламіно}-гептанова кислота; 5-(3-{[2-(3,5-дихлорфенокси)-етил]-метансульфоніл-аміно}-пропіл)тіофен-2-карбонова кислота; N-[2-(3,5-дихлорфенокси)-етил]-Н-[6-(1Н-тетразол-5-іл)-гексил]метансульфонамід; mpaнc-(4-{[3-(3,5-дихлорфеніл)-аліл]-метансульфоніл-аміно}-бутокси)оцтова кислота; mранс-N-[3-(3,5-дихлор-феніл)аліл]-N-[6-(1Н-тетразоліл-5-іл)-гексил]метансульфонамід; mранс-5-(3-{[3-(3,5-дихлорфеніл)-аліл]-метансульфоніл-аміно}-пропіл)тіофен-2-карбонова кислота; mранс-[3-({[3-(3,5 12 дихлор-феніл)-аліл]-метансульфоніл-аміно}метил)-феніл]-оцтова кислота; їх проліки і фармацевтично прийнятні солі сполук і проліків. Особливо переважною сполукою Формули ВВ є 7-[(4-бутил-бензил)-метансульфоніл-аміно]гептанова кислота, її проліки, або фармацевтично прийнятні солі сполуки або проліків. Переважною сіллю є мононатрієва сіль. Інші селективні агоністи рецептора ЕР2, придатні в комбінованих варіантах винаходу, включають агоністи рецепторів простагландіну, описані в патентах США №№6 531 485, 6 376 533, 6 124 314, 5 877 211, 5 716 835, 5 698 598 і 5 462 968; опублікованій патентній заявці США №2002/187961; N. Duckworth, et al., Journal of Endocrinology, 172 (2), 263-269 (2002); К. Tani, et al., Synlett, 2, 239-242 (2002); K. Tani, et al., Bioorganic & Medicinal Chemistry, 10 (4), 1107-1114 (2002); K. Tani, et al., Bioorganic & Medicinal Chemistry, 10 (4), 1093-1106 (2002); J. Michelet, et al., EP 1 175 891 A1; K. Tani, et al., Bioorganic & Medicinal Chemistry Letters, 11 (15), 2025-2028 (2001); J. Y. Crider, et al., International Journal of Environmental Studies, 58 (1), 35-46 (2000); J. Y. Crider, et al., Journal of Ocular Pharmacology and Therapeutics, 17 (1), 35-46 (2001); D. F. Woodward, et al., Journal of Ocular Pharmacology and Therapeutics, 11 (3), 447-54 (1995); A. T. Nials, et al., Cardiovascular Drug Reviews, 11 (2), 165-79 (1993); і D. F. Woodward, et al., Prostaglandins, 46(4), 371-83(1993). У комбінованих варіантах винаходу селективні агоністи рецептора ЕР2 можна вводити ссавцям у дозах в межах від, приблизно, 0,001мг/кг до, приблизно, 100мг/кг ваги тіла на день. Для середньої дорослої людини із вагою тіла приблизно 70кг, дозування у межах від, приблизно, 0,01мг/кг до, приблизно, 50мг/кг ваги тіла є звичайно переважним, однак може виникнути необхідність у відхиленнях від загальних меж дозування в залежності від віку та ваги пацієнта, заданого шляху введення, певної сполуки, що водиться і т.д. Визначення меж дозування і оптимальних доз для окремого пацієнта може провести фахівець у галузі, спираючись на цей опис. Фармацевтичні композиції, придатні для парентеральних ін'єкцій, можуть містити фармацевтично прийнятні стерильні водні або неводні розчини, дисперсії, суспензії, або емульсії, а також стерильні порошки для розчинення у стерильні розчини або дисперсії для ін'єкцій безпосередньо перед застосуванням. Прикладами придатних водних і неводних носіїв, розчинників і розріджувачів є вода, етанол, поліоли (такі як пропіленгліколь, поліетиленгліколь, гліцерин і подібні), їх придатні суміші, рослинні масла (такі як оливкове масло) і органічні естери, придатні для ін'єкцій, такі як етилолеат. Відповідну текучість можна підтримувати, наприклад, шляхом використання покриття, такого як лецитин, шляхом підтримання необхідного розміру часток у випадку дисперсій, а також шляхом застосування поверхнево-активних речовин. Фармацевтичні композиції за винаходом можуть додатково містити ад'юванти, такі як консерванти, зволожуючі агенти, емульсифікатори і диспергуючі агенти. Запобігання забрудненню 13 83091 композицій за винаходом мікроорганізмами можна досягти за допомогою різних антибактеріальних і протигрибкових агентів, наприклад, парабенів, хлорбутанолу, фенолу, сорбінової кислоти і подібних. Також може бути бажаним додати ізотонічні агенти, наприклад, цукри, хлорид натрію і подібні. Пролонгованої абсорбції фармацевтичних композицій, придатних для ін'єкцій, можна досягти шляхом застосування агентів, які здатні затримувати абсорбцію, наприклад таких як моностеарат алюмінію і желатин. Тверді дозовані форми для перорального введення включають капсули, таблетки, порошки і гранули. В таких твердих дозованих формах активну сполуку змішують із принаймні одним інертним відомим фармацевтичним екципієнтом (або носієм), таким як цитрат натрію, або фосфат дикальцію, або (а) наповнювачами або розширювачами, такими як, наприклад, крохмалі, лактоза, цукроза, маніт і кремнієва кислота; (b) зв'язуючими агентами, таким як, наприклад, карбоксиметилцелюлоза, альгінати, желатин, полівінілпіролідон, цукроза і гуміарабік; (с) зволожувачами, такими як, наприклад, гліцерин; (d) дезінтегруючими агентами, такими як, наприклад, агар-агар, карбонат кальцію, картопляний крохмаль або тапіока, альгінова кислота, деякі складні силікати і карбонат натрію; (e) уповільнювачами розчинення, такими як, наприклад, парафін; (f) прискорювачами абсорбції, такими як, наприклад, сполуки четвертинного амонію; (g) зволожуючими агентами, такими як, наприклад, цетиловий спирт і моностеарат гліцерину; (h) адсорбентами, такими як, наприклад, коалін і бентоніт; і/або (і) змащуючими агентами, такими як, наприклад, тальк, стеарат кальцію, стеарат магнію, тверді поліетиленгліколі, лаурилсульфат натрію, або їх суміші. У випадку капсул або таблеток, форми дозування можуть додатково містити буфер уючі агенти. Подібні тверді композиції можуть також застосовува тись як наповнювачі у м'які або тверді желатинові капсули при застосуванні таких екципієнтів як лактоза або молочний цукор, а також високомолекулярні поліетиленгліколі і подібні. Тверді дозовані форми, такі як таблетки, драже, капсули і гранули, можна одержати із покриттям та у оболонках, таких як кишково-розчинні покриття і інші добре відомі фахівцю у галузі. Вони також можуть включати рентгенконтрастні агенти, і також мати таку композицію, в якій активна сполука(сполуки) вивільняється уповільнено, тривало, або контрольовано. Прикладами матричних композицій, які можна застосувати, є полімерні речовини і воски. Активна сполука(и) може бути також у мікроінкапсульованій формі, якщо придатно, з одним або більшою кількістю вищевказаних екципієнтів. Рідкі дозовані форми для перорального введення включають фармацевтично прийнятні емульсії, розчини, суспензії, сиропи і еліксири. Окрім активних сполук, рідкі дозовані форми можуть включати інертні розріджувачі, які звичайно застосовують в галузі, такі як вода, або інші розчинники, солюбілізатори і емульсифікатори, такі як, наприклад, етиловий спирт, ізопропіловий спирт, етил 14 карбонат, етилацетат, бензиловий спирт, бензилбензоат, пропіленгліколь, 1,3-бутиленгліколь, диметилформамід, масла, зокрема бавовняне масло, арахісове масло, масло зародків пшениці, оливкове масло, касторове масло і кунжутне масло, гліцерин, тетрагідрофур фуриловий спирт, поліетиленгліколі і естери жирних кислот і сорбіту, або суміші цих речовин і подібні. Окрім цих інертних розріджувачів, фармацевтична композиція також може містити ад'юванти, такі як зволожуючі агенти, емульсифікатори і суспендуючи агенти, підсолоджувачі, смакові добавки і ароматизатори. Суспензії, окрім активної сполуки(сполук), можуть додатково містити суспендуючи агенти, такі як, наприклад, етоксильовані ізостеарилові спирти, поліоксиетиленсорбіт і естери сорбіту, мікрокристалічна целюлоза, метагідроксид алюмінію, бентоніт, агар-агар і трагакант, або суміші вищевказаних речовин, і подібні. Композиціями для ректального або вагінального введення переважно є супозиторії, які можна одержати шляхом змішування активної сполуки (сполук) із придатними неподразнюючими екципієнтами або носіями, такими як масло какао, поліетиленгліколь, або віск для супозиторій, який є твердим при звичайній кімнатній температурі, але стає рідким при температурі тіла, і, тому, тане у прямій кишці або піхві, таким чином вивільняючи активний компонент. Дозовані форми для місцевого застосування можуть включати мазі, порошки, спреї і засоби для інгаляцій. Активний агент(и) змішують у стерильних умовах з фармацевтично прийнятним носієм, розчинником, або розріджувачем і будь-якими консервантами, буферами, або пропелантами, які можуть бути необхідними. Основна переважна композиція для введення інгібіторів ФДЕ 2, яка включає сполуки формули (І), а також комбінації, які містять інгібітори ФДЕ 2 і селективні агоністи рецептора ЕР2 при лікуванні переломів кісток, включає текучу композицію, придатну для ін'єкцій, яка забезпечує уповільнене вивільнення сполуки на місці ін'єкції шляхом утворення твердого або желеподібного депо, що зазнає біологічного розкладу, або імплантат. Прикладами такої системи для введення є система доставки на основі полімеру із повільним вивільненням, що зазнає біологічного розкладу. Див., наприклад, опубліковану патенту заявку США №2003-0104031 А1. Така система доставки на основі полімеру зазвичай містить терапевтично корисний агент(и), розчинений або диспергований у текучому розчині або дисперсії термопластичного полімеру, що зазнає біологічного розкладу, в органічному розчиннику. При введенні композиції шляхом ін'єкції, органічний розчинник дифундує з місця ін'єкції, внаслідок чого полімер осаджується або желатинізується, таким чином захоплюючи агент(и) в депо уповільненого вивільнення. Агент(и) згодом вивільняється шляхом дифузії з і ерозії полімерної матриці. Матриця повільно руйнується внаслідок гідролізу і в кінці кінців зникає з місця введення. Молекулярна маса і концентрація полімеру може 15 83091 контролювати вивільнення in vivo агента(ів), а також швидкість розкладу матриці. Система доставки на основі полімеру передбачає уповільнене вивільнення активного агента(ів) in vi vo протягом тривалого проміжку часу із мінімальним або зменшеним викидом в тілі пацієнта, якому необхідне лікування. Значний викид агента(ів) може викликати місцеві реакції (наприклад, подразнення), тобто майже не сприйматись, і може зменшити кількість агента(ів), що є ефективною. Перевагою цього способу введення є те, що в даному випадку мінімізується або зменшується початковий викид, але агент(и) все ж вивільняється в ефективній кількості упродовж тривалого проміжку часу після одноразової місцевої ін'єкції. Полімерну систему одержують шляхом введення текучої композиції у желатинуюче середовище для згущення або желатинізації композиції в твердій мікропористій полімерній матриці, або желеподібній полімерній матриці. Текуча композиція містить термопластичний полімер або співполімер у комбінації із придатним розчинником. Полімери або співполімери, які утворюють тіло матриці, є в основному нерозчинними, переважно майже повністю нерозчинними у воді і рідинах тіла. Нерозчинність тіла матриці забезпечує його функцію як єдиного джерела контрольованого вивільнення агента(ів). Полімери або співполімери є також біосумісними і піддаються біологічному розкладу і/або біологічній ерозії в тілі тварини, наприклад ссавця. Біологічний розклад дозволяє пацієнту засвоювати і виділяти полімерну матрицю таким чином, що немає необхідності в її хірургічному видаленні. Через те, що текуча композиція і полімерна система є біосумісними, процес введення і присутність полімерної системи у тілі не викликає значного подразнення тканини, або її некрозу на місці введення імплантату. Композиція за винаходом вводиться як текуча композиція безпосередньо у тканини тіла. Придатними термопластичними полімерами для введення в тверду матрицю системи із контрольованим вивільненням є тверді речовини, які є фармацевтично сумісними і зазнають біологічного розкладу внаслідок клітинної активності і/або впливу рідин тіла. Прикладами придатних термопластичних полімерів є діоли і дикарбонові кислоти, або гідроксикарбонові кислоти, такі як полілактили, полігліколіди, а також їх співполімери. Більш переважно, полімер містить співполімер, полімолочну-спів-гліколеву кислоту (скорочено PLGH), в результаті гідролізу якої утворюються молочна і гліколева кислота. Викид при вивільненні цього співполімеру може бути додатково мінімізований шляхом додавання поліетиленгліколю (ПЕГ) з утворенням ПЕГ кінець-блокованої PLGH. Переважними матеріалами є поліактиди, полігліколіди і їх співполімери. Ці полімери можуть застосовуватись в полімерній системі, надаючи їй переважних характеристик з огляду на їх відмінну біосумісність. Вони зумовлюють незначне подразнення, запалення, некроз, або токсичність, якщо зумовлюють взагалі. У присутності води полімери утворюють молочну і гліколеву кислоту, відповідно, які легко метаболізуються. Поліактиди також 16 можуть включати мономер гліколіду для посилення кінцевого розкладу полімерів. Ці полімери є переважними також через те, що вони ефективно контролюють швидкість вивільнення агента(ів) з полімерної системи і тому, що вони зумовлюють місцеве утримання агента(ів) на місці введення. Розчинність або здатність до змішування термопластичного полімеру в органічному розчиннику композиції змінюватиметься в залежності від таких факторів як кристалічність, гідрофільність, здатність до утворення водневих зв'язків і молекулярної маси полімеру. Відповідно, молекулярну масу і концентрацію полімеру в розчиннику доводять для одержання бажаної здатності до змішування, а також бажаної швидкості вивільнення для введеного агента(ів). Текуча композиція термопластичного полімеру, розчинника і агента(ів) містить стабільну текучу речовину. Переважно одержують гомогенний розчин агента(ів) в органічному розчиннику. Термопластичний полімер є, в основному, розчинним в органічному розчиннику. Після розміщення текучої композиції в тілі, розчинник розсіюється і полімер твердне або желатинізується з утворенням полімерної системи, в якій агент(и) знаходиться в твердій або желеподібній полімерній матриці. Для деяких переважних полімерів молекулярна маса полімеру або співполімеру доводиться до показника у межах від, приблизно, 0,2 до, приблизно, 0,4 характеристичної в'язкості (Х.В. в децилітрах/г) для ефективного уповільненого вивільнення сполуки, що сприяє росту кісток. Середня швидкість вивільнення введеного агента(ів) досягається при Х.В. приблизно 0,2 (приблизна молекулярна маса від 8 000 до приблизно 16 000), або приблизно 0,3 (приблизна молекулярна маса від 23 000 до приблизно 45 000), але може змінюватись в залежності від певних компонентів композиції. Для більшості систем переважно доводити молекулярну масу полімеру до приблизно 0,2Х.В. для е фективного уповільненого вивільнення агента(ів). Для полі (DL-лактид) або лактид-співгліколідної полімерної системи, бажана молекулярна маса знаходиться в межах від, приблизно, 0,2 до, приблизно, 0,4Х.В., причому Х.В. приблизно 0,2 є переважним. Молекулярну масу полімеру змінюють відомими способами. Особливо переважно, наявні у продажу термопластичні полімери включають наступні: PLGH співполімер із співвідношенням 1:1 молочної і гліколевої кислоти та з характеристичною в'язкістю приблизно 0,2дл/г (пропонується до продажу компанією Boehringer Ingelheim як Copolymer RESOMER® RG 502 Η) (приблизна молекулярна маса 12 000); PLGH співполімер із співвідношенням 1:1 молочної і гліколевої кислоти і з характеристичною в'язкістю приблизно 0,3дл/г (пропонується до продажу компанією Boehringer Ingelheim як Copolymer RESOMER® RG 503 Η) (приблизна молекулярна маса 37 000); PLGH співполімер із співвідношенням 1:1 молочної і гліколевої кислоти з характеристичною в'язкістю приблизно 0,4дл/г (пропонується до продажу компанією Boehringer Ingelheim як Copolymer RESOMER® RG 504 Η) (приблизна молекулярна маса 47 000); і поліети 17 83091 ленгліколь (ПЕГ) кінець-блокованої PLGH співполімер із співвідношенням 1:1 молочної і гліколевої кислоти з характеристичною в'язкістю приблизно 0,79дл/г (пропонується до продажу компанією Boehringer Ingelheim як PLG-ΠΕΓ) (приблизна молекулярна маса 52 000). Розчинники, які застосовують в термопластичних композиціях, є, переважно, фармацевтично прийнятними, біосумісними і розсіюються в рідинах тіла in situ таким чином, що їх можна визначити як такі, що мають розчинність у воді в межах від високорозчинних до нерозчинних. Переважно, вони викликають відносно невелике подразнення або некроз тканин на місці ін'єкції і імплантації, якщо викликають взагалі. Переважно, розчинник матиме принаймні мінімальну розчинність у воді. Якщо органічний розчинник є нерозчинним у воді, або мінімально розчинним у воді, розчинник повільно диспергується з текучої полімерної композиції. В результаті одержують імплантат, який протягом свого існування може містити різні кількості залишкового розчинника. Переважно, органічний розчинник є помірно або високорозчинним у воді, через що він легко диспергується з полімерної композиції в рідини тіла. Більш переважно, розчинник швидко диспергується з полімерної композиції, в результаті чого швидко утворюється твердий імплантат. Одночасно з диспергуванням розчинника, термопластичний полімер згущується або желатинізується в тверду полімерну систему. Переважно, при згущенні термопластичного полімеру, в полімерній системі утворюються пори внаслідок диспергування розчинника. В результаті, текуча композиція, що містить термопластичний полімер, розчинник і агент(и), утворює пористу тверду полімерну систему. Окрім того, якщо розчинник є не дуже розчинним у воді, або є нерозчинним у воді, диспергування розчинника може обумовити утворення твердого пористого імплантату, або, якщо деяка кількість розчинника залишається в імплантаті, може обумовити утворення желеподібного імплантату із невеликою кількістю або відсутністю пор. Придатними розчинниками є ті рідкі органічні сполуки, які відповідають вищенаведеним критеріям. В цілому, переважним розчинником є N-метил2-піролідон (NMP). Розчинники для текучої композиції термопластичного полімеру вибирають з огляду на сумісність і відповідну розчинність полімеру і розчинника. Низькомолекулярні термопластичні полімери загалом розчиняються швидше в розчинниках, ніж високомолекулярні полімери. В результаті, концентрація термопластичного полімеру, розчиненого в різних розчинниках, різниться в залежності від виду полімеру і його молекулярної маси. І навпаки, високомолекулярні термопластичні полімери більш схильні до згущення, желатинізації або затвердіння, ніж дуже низькомолекулярні термопластичні полімери. Окрім того, високомолекулярні полімери швидше зумовлюють більшу в'язкість розчину, ніж низькомолекулярні речовини. Таким чином, для бажаної ефективності ін'єкції і у доповнення до переважної швидкості вивільнення, та 18 кож контролюють молекулярну масу і концентрацію полімеру в розчиннику. При утворенні полімерної системи з текучої композиції, агент(и) захоплюються в полімерній матриці. Після введення текучої композиції з утворенням полімерної системи, агент(и) вивільняється з матриці в оточуючі тканини або рідини шляхом дифузії і процесів розкладу. Управління цими процесами також матиме вплив на вивільнення агента(ів) в оточуюче середовище при контрольованій швидкості. Наприклад, полімерну матрицю можна сформувати таким чином, щоб вона розкладалась після вивільнення ефективної і/або основної кількості агента(ів) з неї. Тож, вивільнення агента(ів) з матриці можна модулювати за допомогою, наприклад, поміж інших факторів, розчинності агента(ів) у воді, розподілення сполуки, що сприяє росту кісток, в матриці, або розміру, форми, пористості, розчинності і здатності до біологічного розкладу. Вивільнення агента(ів) з матриці контролюється ґрунтуючись на його характеристичній швидкості шляхом модифікації молекулярної маси полімеру з одержанням бажаної тривалості і швидкості вивільнення. Наприклад, переважна дозована форма агента(ів) включає ліофілізовану речовину для відновлення розчином PLGH в NMP перед введенням. Дозована форма, що складається з ліофілізованої сполуки в одному шприці (шприц А) і розчину PLGH в NMP в другому шприці (шприц В), відома як система відновлення А/В. Вміст обох шприців змішують безпосередньо перед доставкою дози на місце або біля місця введення. Введені дозовані форми знаходитимуться у формі розчину з наступним диспергуванням сполуки з PLGH в NMP при бажаній силі, наприклад, 5 і 50мгА/мл (мгА/мл відповідає еквіваленту вільної кислоти натрієвої солі агента(ів)). Дозована форма є парентеральною (наприклад, підшкірною, внутрішньом'язовою, або внутрішньомозковою) ін’єкцією тривалого вивільнення для місцевого введення. Сполука в полімерній матриці із низьким рівнем вивільнення (депоін'єкція) сформульована для введення у або близько місця дії і не призначена для внутрішньовенного застосування. Для забезпечення відповідної стабільності дозованої форми протягом строку зберігання, в описаній вище двошприцевій системі (А/В) переважно застосовувати натрієву сіль сполуки. Однофазова рецептура, переважно із сполукою у формі вільної кислоти, є переважною альтернативною рецептурою. Заважаючи на стабільність агента(ів) і полімеру, для виробництва стабільного стерильного продукту фільтрація в стерильних умовах агента(ів) і опромінення полімерного розчину можуть бути бажаними. В одному втіленні дозована форма може виготовлятись і доставлятись в окремих алюмінієвих пакетах, причому шприци, наповнені ліофілізованим агентом(ами), знаходяться в одному пакеті і полімерний розчин - в іншому пакеті. Контейнери, системи доставки і способи ліофілізації сполук, що сприяють росту кісток, описані в опублікованій міжнародній [патентній заявці РСТ № WO 01/73363]. Інші способи введення включають місцеве введення шляхом ін'єкцій у певне місце, або доставку кате 19 83091 20 тером. Інші приклади можна знайти в попередній заявці США №60/335,156, поданій 30 листопада 2001. Описи всіх зазначених тут патентів США включені до цього опису у якості посилань в усіх їх повноті. Сполуки формули (І), їх проліки і фармацевтично прийнятні солі сполук і проліків можна одержа ти відповідно до ілюстративних способів синтезу, описаних в Схемах і Прикладах, наведених нижче, а також іншими відомими способами одержання, або тими, які є очевидними фахівцю у відповідній галузі з огляду на опис. Способи, представлені на Схемах, наведені з метою ілюстрації цього винаходу і не передбачають його обмежень. На Схемі 1, стадія 1, 2,4-дихлор-піридо[2,3d]піримідин (IV) вступає у взаємодію з придатно заміщеним бензиламіном (V) в присутності тризаміщеної аміноснови, такої як триетиламін (TEA) або диізопропілетиламін (ДІПЕА), або ароматичної основи, такої як піридин. Реакцію звичайно проводять в полярному спиртовому розчиннику, такому як метанол (МеОН), етанол (ЕtOН), або ізопропанол (ІРА), при температурі у межах від, приблизно, 0°С до, приблизно, 100°С. Переважно, реакцію проводять в присутності ДІПЕА в етанолі при приблизно кімнатній температурі (КТ). На стадії 2 одержаний продукт конденсування (VI) вступає в реакцію з придатно заміщеним аміном (VII) в присутності тризаміщеної аміноснови, такої як TEA або ДІПЕА, або ароматичної основи, такої як піридин, з одержанням сполуки (І). Реакцію звичайно проводять в полярному апротонному розчиннику, такому як Ν,Ν-диметилформамід (ДМФА), диметилсульфоксид (ДМСО), N-метилпіролідинон, або сульфонат, при підвищеній температурі у межах від, приблизно, 60°С до, приблизно, 250°С. Переважно, реакцію проводять в присутності ДІПЕА в ДМСО при температурі від, приблизно, 90°С до, приблизно, 120°С. Хоча Схема 1 ілюструє обережний двостадійний спосіб, в якому проміжну сполуку (VI) виділяють і потім вона вступає в реакцію з аміном (VII), також було виявлено, що одержання і реакцію сполуки (IV) in situ з аміном (VII) можна проводити в одну стадію. В такому способі застосовують апротонний розчинник, переважно ДМСО. Реакцію також проводять в присутності ДІПЕА в ДМСО при температурі між приблизно 90°С до приблизно 120°С Експериментальне одержання Якщо не вказано інше, всі реагенти, що застосовувались, були одержані з комерційних джерел. Якщо не вказано інше, наступні скорочення, використані в експериментальних препаративних прикладах, мають наступні значення: АсОН - оцтова кислота роз. - розклад ДМАП - 4-диметиламінопіридин ЕtOАс - е тилацетат год. - година(и) LAH - літійалюмгідрид хв. - хвилина(и) MC - масс-спектрометія ЯМР - ядерно-магнітний резонанс ТГФ - тетрагідрофуран p-TsOH - n-толуолсульфонова кислота Препаративний приклад 1 (2-Хлор-піридо[2,3-d]піримідин-4-іл)-(3,5диметокси-бензил)-амін До перемішаного розчину 2,4 дихлорпіридо[2,3-d]піримідину (1,3г, 6,7 ммоль) і 3,5диметоксибензиламіну (1,1г, 6,7 ммоль) в 30мл ЕtOН при КТ додавали TEA (4мл, 28,7 ммоль). Утворювався осад, який відфільтровували і промивали холодним EtOH з наступним промиванням гексанами з одержанням 1,8г вказаної в заголовку сполуки (82%) у вигляді твердої речовини, темп.кип. 185°С (роз.). 1Н-ЯМР (ДМСО-d6) d: 9,5 (т, 1Η), 8,9 (дд, 1Н), 8,7 (дд, 1Н), 7,5 (м, 1Н), 6,5 (д, 2Н), 6,4 (т, 1Н), 4,6 (д, 2Н), 3,7 (с, 6Н). MC (m/z, %): 331 (100). Препаративний приклад 2 (2-Хлор-піридо[2,3-d]піримідин-4-іл)-(3,4диметокси-бензил)-амін Цю сполуку одержували способом, аналогічним описаному в Препаративному прикладі 1, застосовуючи відповідні вихідні матеріали. 1Н-ЯМР 21 83091 (ДМСО-d6) d: 9,5 (т, 1Η), 8,9 (дд, 1Н), 8,7 (дд, 1Н), 7,0 (с, 1Н), 6,9 (д, 2Н), 4,6 (д, 2Н), 3,7 (с, 3Н) 3,7 (с, 3Н). MC (m/z, %): 331 (100). Препаративний приклад 3 2-(4-Амінометил-феніл)-пропан-2-ол До перемішаного розчину 4-(1-гідрокси-1метил-етил)-бензонітрилу (2,0г, 12,4 ммоль) в 30мл ТГФ при 0°С додавали по краплях 1,0 N LAH в ТГФ (26мл, 26,1 ммоль). Суміш залишали нагрітись до КТ і потім кип'ятили із зворотним холодильником 20хв. С уміш потім охолоджували до 0°С і гасили 5мл МеОН, який додавали по краплях. Суміш розводили 300мл хлороформу і промивали водою (1x80мл), сушили над сульфатом магнію і концентрували з одержанням 1,9г (95%) вказаної в заголовку сполуки у вигляді твердої речовини. 1НЯМР (CDCI3) d: 7,45 (д, 2Н), 7,26 (д, 2Н), 3,83 (с, 2Н), 1,57 (с, 6Н). ТХ-МС (m/е, %): 164 (М+, 15), 150 (80), 132 (75), 106 (100). Препаративний приклад 4 3-(4-Ацетил-феніл)-пропіонітрил Суміш 4-(2-брометил)ацетофенону (2,0г, 8,8 ммоль) і KCN (0,6г, 8,8 ммоль) в 30мл ДМСО нагрівали при 75°С 4год. Суміш розводили водою і екстрагували ЕtOАс. Органічний екстракт промивали почергово водою і насиченим розчином солі, сушили і концентрували з одержанням масла. Хроматографією на силікагелі, елююючи 40% ЕtOАс/гексани, одержували 0,8г масла. 1Н-ЯМР (CD3OD) d: 7,9 (д, 2Н), 7,4 (д, 2Н), 3,3 (т, 2Н), 2,8 (т, 2Н), 2,6 (с, 3Н). ТХ-МС (m/е, %): 173 (М+, 20), 158 (100). Препаративний приклад 5 3-[4-(1-Гідрокси-1-метил-етил)-феніл]пропіонітрил До перемішаного розчину 3Μ метилмагнійхлориду в ТГФ (3,3мл, 9,8 ммоль), додатково розведеного 10мл ТГФ, додавали по краплях розчин 3(4-ацетил-феніл)-пропіонітрилу (0,7г, 3,9 ммоль) в 10мл ТГФ при -40°С. Реакційну суміш залишали повільно нагрітись до КТ на ніч, охолоджували до 0°С, потім гасили водним розчином АсОН, який додавали по краплях. Реакційну суміш розводили водою і екстрагували ЕtOАс. Органічний екстракт промивали почергово водою і насиченим розчином солі, сушили і концентрували з одержанням 0,8г масла. 1Н-ЯМР (CD3OD) d: 7,4 (д, 2Н), 7,2 (д, 2Н), 2,9 (т, 2Н), 2,7 (т, 2Н), 1,5 (с, 6Н). ТХ-МС (m/е, %): 189 (М+, 5), 174 (100). Препаративний приклад 6 2-[4-(3-Аміно-пропіл)-феніл]-пропан-2-ол До перемішаного розчину 1М LAH в ТГФ, додатково розведеного 20мл ТГФ, при 0°С додавали по краплях розчин 3-[4-(1-гідрокси-1-метил-етил)феніл]пропіонітрилу (0,8г, 4,0 ммоль) в 10мл ТГФ. Реакційну суміш залишали повільно нагрітись до КТ, потім кип'ятили із зворотним холодильником 4год. Реакційну суміш потім охолоджували до 0°С і гасили МеОН, який повільно додавали по краплях. Суміш розводили хлороформом і промивали водою. Органічний екстракт фільтрували через діатомову землю, фільтрат концентрували, потім розводили етилацетатом, сушили і концентрували з одержанням 0,5г масла. 1Н-ЯМР (CD3OD) d: 7,4 22 (д, 2Н), 7,1 (д, 2Н), 2,6 (м, 4Н), 1,7 (м, 2Н), 1,5 (с, 6Н). MC (m/е, %): 194 (М++1, 100), 176 (90). Препаративний приклад 7 3-[4-(2-Метил-[1,3]діоксолан-2-іл)-феніл1пропіонітрил Суміш 3-(4-ацетил-феніл)пропіонітрилу (2,2г, 13 ммоль), етиленгліколю (2,8мл, 51 ммоль) і каталітичної кількості p-TsOH (~200мг) в 100мл толуолу кип'ятили із зворотним холодильником із уловлювачем Діна-Старка 18год. Суміш розводили ЕtOАс і промивали почергово 5% розчином бікарбонату натрію, водою і насиченим розчином солі, сушили (MgSO4) і концентрували з одержанням масла. Хроматографією на силікагелі елююючи розчином EtOAc/гексани одержували 2,5г масла. 1 Н-ЯМР (CDCI3) d: 7,4 (д, 2Н), 7,2 (д, 2Н), 4,0 (м, 2Н), 3,8 (м, 2Н), 2,9 (т, 2Η), 2,6 (т, 2Η), 1,6 (с, 3Н). MC (m/е, %): 216 (М+-1, 1), 202 (100). Препаративний приклад 8 3-[4-(2-Метил]1,3]діоксолан-2-іл)-феніл]пропіламін До перемішаного розчину 3-[4-(2-метил[1,3]діоксолан-2-іл)-феніл]-пропіонітрилу (2,4г, 11 ммоль) в 30мл ТГФ додавали по краплях розчин 1М LAH в ТГФ. С уміш залишали нагрітись до КТ, потім кип'ятили із зворотним холодильником 1год. Суміш охолоджували до 0°С, потім гасили МеОН, який додавали по краплях. Суміш розводили хлороформом і промивали водою. Одержану суспензію фільтрували через діатомову землю і шари фільтрату відділяли. Органічний екстракт сушили над MgSO4 і концентрували з одержанням 2,4г масла. 1Н-ЯМР (CDCI3) d: 7,4 (м, 2Н), 7,1 (д, 2Н), 4,0 (м, 2Н), 3,8 (м, 2Н), 2,7 (м, 2Н), 2,6 (м, 2Н), 1,7 (м, 2Н), 1,6 (с, 3Н). MC (m/e, %): 221 (М+, 10), 206 (60), 189(100). Препаративний приклад 9 2,2,2-Трифтор-1-(4-йод-феніл)-етанол До перемішаного розчину 4-йодбензальдегіду (2,0г, 8,6 ммоль) в 20мл ТГФ при КТ додавали 0,5М розчин триметил(трифторметил)силану в ТГФ (19мл, 9,5 ммоль) з наступним додаванням фториду тетрабутиламіонію (112мг, 0,4 ммоль). Суміш перемішували при КТ протягом ночі, заливали в 0,1 N сірчану кислоту і екстрагували ЕtOАс. Органічний екстракт в свою чергу промивали водою і насиченим розчином солі, сушили (MgSO4) і концентрували з одержанням 2,6г масла. 1Н-ЯМР (CDCI3) d: 7,7 (д, 2Н), 7,2 (д, 2Н), 5,0 (м, 1Н), 2,7 (д, 1Н). MC (m/e, %): 302 (М+, 100), 233 (100). Препаративний приклад 10 2-{3-[4-(2,2.2-Трифтор-1-гідрокси-етил)феніл1-проп-2-ініл)-ізоіндол-1,3-діон До перемішаної суспензії 2,2,2-трифтор-1-(4йод-феніл)-етанолу (2,6г, 8,5 ммоль), Nпропалгілфталіміду (1,6г, 8,5 ммоль), дихлорбіс(трифенілфосфін)паладію (298мг, 0,43 ммоль) і йодиду міді (І) (82мг, 0,43 ммоль) в 20мл ТГФ при КТ додавали 5мл TEA. Суміш швидко вакуум ували в парах азоту і потім кип'ятили із зворотним холодильником 6год. Суміш розводили хлороформом, промивали водою, сушили над MgSO4 і концентрували з одержанням твердої речовини. Тверду речовину розтирали з ЕtOАс з одержанням 2,2г твердої речовини. 1Н-ЯМР (CDCI3) d: 7,9 (м, 2Н), 23 83091 7,7 (м, 2Н), 7,5 (д, 2Н), 7,4 (д, 2Н), 5,0 (м, 1Н), 4,7 (с, 2Н), MC (m/e, %): 359 (М+, 100). Препаративний приклад 11 2-{3-[4-(2,2,2-трифтор-1-гідрокси-етил)-феніл]пропіл)-ізоіндол-1,3,діон Суміш 2-{3-[4-(2,2,2-трифтор-1-гідрокси-етил)феніл]-проп-2-ініл}-ізоіндол-1,3-діону (2,2г, 6,1 ммоль) і 10% Pd/C (220мг) в 150мл EtOH і 150мл ТГФ струшували в атмосфері водню 50 псі при КТ в апараті Парра 2год. Додавали додатково 220мг 10% Pd/C і суміш перемішували в атмосфері водню 50 псі при КТ додаткові 2год. Потім додатково додавали 220мг 10% Pd/C і суміш перемішували в атмосфері водню 50 псі при КТ протягом ночі. Суміш фільтрували через діатомову землю і фільтрат концентрували з одержанням масла. Хроматографією на силікагелі, елююючи EtOAc/гексани, одержували 1,8г масла. 1Н-ЯМР (CDCI3) d: 7,8 (м, 2Н), 7,7 (м, 2Н), 7,3 (д, 2Н), 7,2 (д, 2Н), 4,9 (м, 1Н), 3,7 (т, 2Н), 2,7 (т, 2Н), 2,0 (м, 2Н). MC (m/e, %): 363 (М+, 15), 345 (35), 325 (50), 161 (100). Препаративний приклад 12 1-[4-(3-Аміно-пропіл)-феніл]-2,2,2-трифторетанол До перемішаної суспензії 2-{3-[4-(2,2,2трифтор-1-гідрокси-етил)-феніл]-пропіл}-ізоіндол1,3-діону (1,8г, 5,0 ммоль) в 50мл МеОН при КТ додавали гідрат гідразину (0,46мл, 15,0 ммоль). Суміш перемішували при КТ 18год. Реакційну суміш фільтрували і фільтрат концентрували з одержанням масла. Масло розтирали з хлороформом, фільтрували і фільтрат концентрували з одержанням 1,0г масла. 1Н-ЯМР (CDCI3) d: 7,3 (д, 2Н), 7,2 (д, 2Н), 5,0 (м, 1Н), 2,6 (м, 2Н), 2,5 (м, 2Н), 1,6 (м, 2Н). MC (m/e, %): 363 (М+, 10), 216(100). Препаративний приклад 13 Трифторметансульфонової кислоти бензо[1,2,5]оксадіазол-5-іловий естер До перемішаного розчину 5гідроксибензофуразану (1,8г, 13,0 ммоль), TEA (2,4мл, 33,0 ммоль) і ДМАП (79мг, 7,0 ммоль) в 40мл дихлорметану при -78°С додавали по краплях розчин ангідриду трифторметансульфонової кислоти (2,8мл, 17,0 ммоль) в 10мл дихлорметану. Суміш залишали повільно нагрітись до КТ на 3год., розводили дихлорметаном і промивали водою. Органічний екстракт сушили і концентрували з одержанням масла. Хроматографією на силікагелі, елююючи дихлорметаном, одержували 3,1г масла. 1Н-ЯМР (CDCI3) d: 8,0 (дд, 1Н), 7,8 (дд, 1Н), 7,3 (дд, 1Н). MC (m/e, %): 268 (М+, 60), 146(60), 69(100). Препаративний приклад 14 2-(Бензо[1,2,5]оксадіазол-5-іл-проп-2-ініл)ізоіндол-1,3-діон Цю сполуку одержували способом, аналогічним описаному в Препаративному прикладі 10, застосовуючи відповідні вихідні матеріали. 1Н-ЯМР (CDCI3) d: 8,2 (с, 1Н), 8,0 (дд, 1Н), 7,9 (м, 2Н), 7,8 (м, 2Н), 7,5 (дд, 2Н), 4,7 (с, 2Н). MC (m/e, %): 303 (М+, 100). Препаративний приклад 15 2-(3-Бензо[1,2,5]оксадіазол-5-іл-пропіл)ізоіндол-1,3,діон 24 Цю сполуку одержували способом, аналогічним описаному в Препаративному прикладі 11, застосовуючи відповідні вихідні матеріали. 1Н-ЯМР (CDCI3) d: 7,8 (м, 2Н), 7,7 (м, 3Н), 7,6 (с, 1Н), 7,2 (м, 1Н), 3,8 (т, 3Н), 2,8 (т, 2Н), 2,1 (м, 2Н). MC (m/e, %): 307 (М+, 40), 290(30), 272(20), 160(100). Препаративний приклад 16 3-Бензо[1,2,5]оксадіазол-5-іл-пропіламін Цю сполуку одержували способом, аналогічним описаному в Препаративному прикладі 12, застосовуючи відповідні вихідні матеріали. 1Н-ЯМР (ДМСО-d6): d 7,9 (м, 2Н), 7,7 (м, 1Н), 7,5 (м, 1Н), 2,7 (м, 2Н), 2,5 (м, 2Н), 1,7 (м, 2Н). MC (m/e, %): 177 (М+, 40), 160(100). Препаративний приклад 17 Трифторметансульфонової кислоти бензотіазол-6-іловий естер Цю сполуку одержували способом, аналогічним описаному в Препаративному прикладі 13, застосовуючи відповідні вихідні матеріали. 1Н-ЯМР (CDCI3) d: 9,1 (с, 1Н), 8,2 (д, 1Н), 7,9 (д, 1Н), 7,4 (дд, 1Н). MC (m/e, %): 283 (М+, 80), 150 (100). Препаративний приклад 18 2-(3-Бензотіазол-6-іл-проп-2-ініл)-ізоіндол-1,3діон Цю сполуку одержували способом, аналогічним описаному в Препаративному прикладі 10, заміщуючи три фторметансульфонової кислоти бензотіазол-6-іловий естер (Препаративний приклад 17) 2,2,2-трифтор-1-(4-йод-феніл)-етанолом. 1 Н-ЯМР (d6-ДМСО) d: 9,4 (с, 1Н), 8,3 (д, 1Н), 8,0 (д, 2Н), 7,9 (м, 1Н), 7,8 (м, 2Н), 7,5 (дд, 1Н), 4,6 (с, 2Н). MC (m/e, %):318(M+, 100). Препаративний приклад 19 2-(3-Бензотіазол-6-іл-пропіл)-ізоіндол-1,3-діон Цю сполуку одержували способом, аналогічним описаному в Препаративному прикладі 11, заміщуючи 2-(3-бензотіазол-6-іл-проп-2-ініл)ізоіндол-1,3-діон (Препаративний приклад 19) 2-{3[4-(2,2,2-трифтор-1-гідрокси-етил)-феніл]-проп-2ініл}-ізоіндол-1,3-діоном (Препаративний приклад 10). 1Н-ЯМР (CDCI3) d: 8,9 (с, 1Н), 8,0 (д, 1Н), 7,8 (м, 2Н), 7,7 (м, 2Н), 7,3 (дд, 1Н), 3,8 (т, 2Н), 2,8 (т, 2Н), 2,1 (м, 2Н). MC (m/e, %): 322 (М+, 80), 174(40), 162(100). Препаративний приклад 20 3-Бензотіазол-6-іл-пропіламін Цю сполуку одержували способом, аналогічним описаному в Препаративному прикладі 12, заміщуючи 2-(3-бензотіазол-6-іл-пропіл)-ізоіндол1,3-діон (Препаративний приклад 20) 2-{3-[4-(2,2,2трифтор-1-гідрокси-етил)-феніл]-пропіл}-ізоіндол1,3-діоном (Препаративний приклад 11). MC (m/e, %): 192 (М+, 20), 175 (100). Препаративний приклад 21 2-(3-Йод-феніл)-2-метил-[1,3]діоксолан Суміш 3-йодацетофенону (3,0г, 12 ммоль), етиленгліколю (2,7мл, 48 ммоль) і ртолуолсульфонової кислоти (30мг) в 50мл толуолу кип'ятили із зворотним холодильником під уловлювачем Діна-Старка 18год. Суміш розводили ЕtOАс і промивали почергово 5% розчином бікарбонату натрію, водою і насиченим розчином солі, сушили над MgSO4 і концентрували з одержанням масла. Хроматографією на силікагелі, елююючи 25 83091 ЕtOАс/гексани, одержували 3,1г масла. 1Н-ЯМР (CDCI3) d: 7,8 (м, 1Н), 7,6 (дд, 1Н), 7,4 (дд, 1Н), 7,0 (м, 1Н), 4,0 (м, 2Н), 3,7 (м, 2Н) 1,6 (с, 3Н). MC (m/e, %): 290 (М+, 20), 275(100). Препаративний приклад 22 2-{3-[3-(2-Метил-[1,3]діоксолан-2-іл)-феніл]проп-2-ініл)-ізоіндол-1,3-діон Цю сполуку одержували способом, аналогічним описаному в Препаративному прикладі 10, заміщуючи 2-(3-йод-феніл)-2-метил-[1,3]діоксолан (Препаративний приклад 21) 2,2,2-трифтор-1-(4йод-феніл)-етанолом. 1Н-ЯМР (CDCI3) d: 7,9 (м, 2Н), 7,7 (м, 2Н), 7,5 (с, 1Н), 7,4 (м, 1Н), 7,3 (м, 1Н), 7,2 (м, 1Н), 4,7 (с, 2Н), 4,0 (м, 2Н), 3,7 (м, 2Н), 1,6 (с, 6Н). MC (m/e, %): 347 (М+, 15), 332 (100). Препаративний приклад 23 2-{3-[3-(2-Метил-[1,3]діоксолан-2-іл)-феніл1пропіл)ізоіндол-1,3-діон Цю сполуку одержували способом, аналогічним описаному в Препаративному прикладі 11, заміщуючи 2-{3-[3-(2-метил-[1,3]діоксолан-2-іл)феніл]-проп-2-ініл}-ізоіндол-1,3-діон (Препаративний приклад 22) 2-{3-[4-(2,2,2-трифтор-1-гідроксиетил)-феніл]-проп-2-ініл}-ізоіндол-1,3-діоном (Препаративний приклад 10). 1Н-ЯМР (CDCI3) d: 7,8 (м, 2Н), 7,7 (м, 2Н), 7,2 (м, 4Н), 7,1 (д, 1Н), 4,0 (м, 2Н), 3,7 (м, 4Н), 2,6 (т, 2Н), 2,0 (м, 2Н), 1,6 (с, 3Н). MC (m/e, %): 351 (М+, 5), 336 (100). Препаративний приклад 24 3-[3-(2-Метил-[1,3]діоксолан-2-іл)-феніл]пропіламін Цю сполуку одержували способом, аналогічним описаному в Препаративному прикладі 12, заміщуючи 2-{3-[3-(2-метил-[1,3]діоксолан-2-іл)феніл]-пропілІ}-ізоіндол-1,3-діон (Препаративний приклад 23) 2-{3-[4-(2,2,2-трифтор-1-гідроксиетил)-феніл]-пропіл}-ізоіндол-1,3-діоном. 1Н-ЯМР (CDCI3) d: 7,3 (м, 3Н), 7,1 (дд, 1Н), 4,0 (м, 2Н), 3,8 (м, 2Н), 2,7 (т, 2Н), 2,6 (т, 2Н), 1,8 (м, 2Н), 1,6 (с, 3Н). MC (m/e, %): 221 (М+, 20), 206 (60), 189 (100). Препаративний приклад 25 2-(3-Йод-феніл)-пропан-2-ол До перемішаного розчину метилмагнійхлориду (65 ммоль) в 100мл ТГФ при 0°С додавали по краплях 3-йодацетофенон (4,0г, 16.3 ммоль). Реакційну суміш залишали нагрітись до КТ, потім охолоджували до 0°С і додавали додаткову еквівалентну кількість метилмагнійхлориду. Суміш залишали нагрітись до КТ і перемішували 5год. Реакційну суміш гасили МеОН, розводили водою, окислювали дуже холодною АсОН і екстрагували дихлорметаном. Органічний екстракт промивали 5% розчином бікарбонату натрію, потім концентрували. Хроматографією на силікагелі, елююючи дихлорметаном, одержували масло, яке згущувалось при відстоюванні. MC (m/e, %): 262 (М+, 80), 247 (100). Препаративний приклад 26 2-{3-[3-(1-Гідрокси-1-метил-етил)-фенілї-проп2-ініл}-ізоіндол-1,3-діон Цю сполуку одержували способом, аналогічним описаному в Препаративному прикладі 10, заміщуючи 2-(3-йод-феніл)-пропан-2-ол (Препаративний приклад 25) 2,2,2-трифтор-1-(4-йод-феніл) 26 етанолом. MC (m/e, %): 319 (М+, 90), 301 (80), 160 (100). Препаративний приклад 27 2-(3-[3-(1-Гідрокси-метил-етил)-феніл]-пропіл)ізоіндол-1,3-діон Цю сполуку одержували способом, аналогічним описаному в Препаративному прикладі 11, заміщуючи 2-{3-[3-(1-гідрокси-1-метил-етил)феніл]-проп-2-ініл}-ізоіндол-1,3-діон (Препаративний приклад 26) 2-{3-[4-(2,2,2-трифтор-1-гідроксиетил)-феніл]-проп-2-ініл}-ізоіндол-1,3-діоном (Препаративний приклад 10). MC (m/e, %): 305 (М+Н2О, 80), 145 (100). Препаративний приклад 28 2-[3-(3-Аміно-пропіл)-Феніл]-пропан-2-ол Цю сполуку одержували способом, аналогічним описаному в Препаративному прикладі 12, заміщуючи 2-{3-[3-(1-гідрокси-1-метил-етил)феніл]-пропіл}-ізоіндол-1,3-діон (Препаративний приклад 27) 2-{3-[4-(2,2,2-трифтор-1-гідроксиетил)-феніл]-пропіл}-ізоіндол-1.3-діоном. MC (m/e, %): 193 (М+, 30), 162 (60), 145 (100). Препаративний приклад 29 4-[3-(1.3-Діоксо-1,3-дигідро-ізоіндол-2-іл)-проп1-ініл]-бензонітрил Цю сполуку одержували способом, аналогічним описаному в Препаративному прикладі 10, застосовуючи відповідні вихідні матеріали. 1Н-ЯМР (CDCI3) d: 7,8 (м, 6Н), 7,6 (д, 2Н), 4,6 (с, 2Н). MC (m/e, %): 286 (М+, 100). Препаративний приклад 30 4-[3-(1,3-Діоксо-1,3-дигідро-ізоіндол-2-іл)пропіл]-бензонітрил Цю сполуку одержували способом, аналогічним описаному в Препаративному прикладі 11, заміщуючи 4-[3-(1,3-діоксо-1,3-дигідро-ізоіндол-2іл)-проп-1-ініл]-бензонітрил (Препаративний приклад 29) 2-{3-[4-(2,2,2-трифтор-1-гідрокси-етил)феніл]-проп-2-ініл}-ізоіндол-1,3-діоном (Препаративний приклад 10). 1Н-ЯМР (CDCI3) d: 7,8 (дд, 2Н), 7,7 (дд, 2Н), 7,5 (д, 2Н), 7,3 (д, 2Н), 3,7 (т, 2Н), 2,7 (т, 2Н), 2,0 (м, 2Н). MC (m/e, %): 290 (М+, 60), 161 (100). Препаративний приклад 31 4-(3-Аміно-пропіл)-бензонітрил Цю сполуку одержували способом, аналогічним описаному в Препаративному прикладі 12, заміщуючи 4-[3-(1,3-діоксо-1,3-дигідро-ізоіндол-2іл)-пропіл]-бензонітрил (Препаративний приклад 30) 2-{3-[4-(2,2,2-трифтор-1-гідрокси-етил)-феніл]пропіл}-ізоіндол-1,3-діоном. 1Н-ЯМР (CDCI3) d: 7,5 (д, 2Н), 7,3 (д, 2Н), 2,7 (м, 4Н), 1,8 (м, 2Н). MC (m/e, %): 160 (М+, 20), 143 (100). Препаративний приклад 32 2-Хлор-3,4-диметокси-бензальдегідоксим Суміш 2-хлор-3,4-диметоксибензальдегіду (1,5г, 7,5 ммоль), гідрохлориду гідроксиламіну (650мг, 9,4 ммоль) і ацетату натрію (1,5г, 18,8 ммоль) в 30мл МеОН і 15мл води нагрівали при 65°С 18год. Суміш розводили водою і екстрагували ЕtOАс. Органічний екстракт промивали почергово водою і насиченим розчином солі, сушили над MgSO4 і концентрували з одержанням 1,7г твердої речовини. 1Н-ЯМР (CDCI3) d: 8,5 (с, 1Н) 7,6 27 83091 (д, 1Н), 6,8 (д, 1Н), 3,9 (с, 3Н), 3,8 (с, 3Н). MC (m/e, %): 215 (М+, 40), 199 (100). Препаративний приклад 33 2-Хлор-3,4-диметокси-бензиламін До перемішаного розчину продукту Препаративного прикладу 32 (1,7г, 7,8 ммоль) в 40мл ТГФ при 0°С додавали повільно по краплях 1Μ розчин LAH в ТГФ (17мл, 17 ммоль). Суміш залишали повільно нагрітись до КТ, потім кип'ятили із зворотним холодильником 2год. Суміш охолоджували до 0°С і реакцію гасили МеОН, який повільно додавали по краплях. Суміш розводили водою і екстрагували хлороформом. Одержану емульсію фільтрували через діатомову землю і шари фільтрату відділяли. Органічний екстракт промивали водою, сушили (MgSO 4) і концентрували з одержанням 1,1г масла. MC (m/e, %): 202 (М+, 100). Препаративний приклад 34 3-Етокси-4-метокси-бензальдегідоксим Цю сполуку одержували способом, аналогічним описаному в Препаративному прикладі 32, застосовуючи відповідні вихідні матеріали. 1Н-ЯМР (CDCI3) d: 8,1 (с, 1Н) 7,2 (д, 1Н), 7,0 (м, 1Н), 6,8 (д, 1Н), 4,1 (кв, 2Н), 3,9 (с, 3Н), 1,5 (т, 3Н). MC (m/e, %): 195 (М+, 100). Препаративний приклад 35 3-Етокси-4-метокси-бензиламін Цю сполуку одержували способом, аналогічним описаному в Препаративному прикладі 33, застосовуючи відповідні вихідні матеріали. 1Н-ЯМР (CDCI3) d: 6,9 (с, 1Н) 6,8 (с, 2Н), 4,1 (кв, 2Н), 3,8 (с, 2Н), 1,5 (т, 3Н). MC (m/e, %): 181 (M+, 100). Препаративний приклад 36 2-(3-Піридин-4-іл-пропіл)-ізоіндол-1,3-діон До перемішаного розчину 4-піридинпропанолу (2,0г, 14,5 ммоль), фталіміду (2,1г, 14,5 ммоль) і трифенілфосфіну (4,9г, 15,2 ммоль) в 50мл ТГФ при 0°С додавали по краплях діетилазодикарбоксилат (2,5мл, 16,0 ммоль). Суміш залишали повільно нагрітись до КТ, потім перемішували протягом ночі. Суміш розводили 0,1 N сірчаною кислотою і промивали діетиловим етером. Водний екстракт робили основним 6N гідроксидом натрію і екстрагували ЕtOАс. Органічний екстракт промивали 1N гідроксидом натрію і водою, сушили над MgSO4 і концентрували з одержанням 1,8г твердої речовини. 1Н-ЯМР (CDCI3) d: 8,5 (с, 2Н), 7,8 (м, 2Н), 7,7 (м, 2Н), 7,2 (м, 2Н), 3,7 (т, 2Н), 2,7 (т, 2Н), 2,0 (м, 2Н). Препаративний приклад 37 3-Піридин-4-іл-пропіламін Цю сполуку одержували способом, аналогічним описаному в Препаративному прикладі 12, застосовуючи вказану в заголовку сполуку Препаративного прикладу 36. 1Н-ЯМР (CDCI3) d: 8,4 (м, 2Н), 7,1 (м, 2Н), 2,7 (т, 2Н), 2,6 (т, 2Н), 1,8 (м, 2Н). MC (m/e, %): 136 (М+, 30), 119(35), 107(100). Сполуки формули (І) одержувати так, як описано у наступних Прикладах. Приклад 1 N4-(3,5-Диметокси-бензил)-N2-(2-піридин-2-ілетил)-піридо[2,3-d]піримідин-2,4-діамін Суміш вказаної в заголовку сполуки Препаративного прикладу 1 (174мг, 0,5 ммоль), 2-(2 28 аміноетил)-піридину (386мг, 3,2 ммоль) і ДІПЕА (0,2мл, 1,1 ммоль) в 1мл ДМСО нагрівали при 90°С 18год. Суміш заливали в воду і екстрагували метиленхлоридом. Органічний екстракт промивали насиченим розчином солі, сушили над MgSO4 i концентрували. Одержаний залишок розтирали з ЕtOАс з одержанням 83мг (40%) вказаної в заголовку сполуки, темп.кип. 157-8°С. 1Н-ЯМР (ДMCOd6): d 8,6 (дд, 1Н), 8,5 (д, 1Н), 8,4 (дд, 1Н), 7,7 (м, 1Н), 7,2 (м, 1Н), 7,0 (м, 2Н), 6,5 (м, 2Н), 6,3 (м, 1Н), 4,6 (м, 2Н), 3,7 (с, 6Н), 3,6 (м, 2Н), 3,0 (м, 2Н). MC (m/z, %): 417 (100). Аналітичний аналіз розрахований для C23H24N6O2: С, 66,3; Н, 5,8; N, 20,2.. Знайдено: С, 65,3; Н, 6,3; N, 18,3. Сполуки Прикладів 2-5 одержували способом, аналогічним описаному в Прикладі 1, застосовуючи відповідні вихідні матеріали. Приклад 2 N4-(3,5-Диметокси-бензил)-N2-(2-піридин-3-ілетил)-піридо[2,3-d]піримідин-2,4-діамін темп.кип. 185-6°С Аналітичний аналіз розрахований для C23H24N6O2: С, 66,3; Η, 5,8; Ν, 20,2. Знайдено: С, 64,5; Η, 5,6; Ν, 19,6. Приклад 3 N4-(3,5-Диметокси-бензил)-N2-(2-піридин-4-ілетил)-піридо[2,3-d]піримідин-2,4-діамін темп.кип. 234-5°С. Аналітичний аналіз розрахований для C23H24N6O2: С, 66,3; Η, 5,8; Ν, 20,2. Знайдено: С, 66,0; Η, 5,6; Ν, 20,0. Приклад 4 N4-(3,5-Диметокси-бензил)-N2-2-піридин-3ілметил-піридо[2,3-d]піримідин-2,4-діамін темп.кип. 222-3°С. Аналітичний аналіз розрахований для C22H22N6 O2: С, 65,7; Η, 5,5; Ν, 20,9. Знайдено: С, 65,5; Η, 5,5; Ν, 20,8. Приклад 5 N2-N4-Бiс-(3,5-диметокси-бензил)-піридо[2,3d]піримідин-2,4-діамін темп.кип. 159-160°С. Аналітичний аналіз розрахований для C25H27N5O4: С, 65,1; Η, 5,9; Ν, 15.2. Знайдено: С, 65,3; Η, 5,9; Ν, 15,1. Приклад 6 N4-(3,5-Диметокси-бензил)-N2-[2-(4-метоксифеніл)-етил]-піридо[2,3-d]піримідин-2,4-діамін Суміш вказаної в заголовку сполуки Препаративного прикладу 1 (100мг, 0,5 ммоль), рметоксифенетиламіну (89мкл, 0,61 ммоль) і ДІПЕА (105мкл, 0,61 ммоль) в 0,8мл ДМСО нагрівали при 90°С 18год. Сполуку виділяли і очищували з неочищеної реакційної суміші шляхом безпосереднього вливання в препаративну ВЕРХ з оберненою фазою (Shimadzu Corp.; Кіото, Японія), застосовуючи поетапний градієнт ацетонітрил/вода із вмістом 0,1% гідроксиду амонію як елюенту. Фракції, які містили бажаний продукт, об'єднували, концентрували і залишок перекристалізовували з ІРА з одержанням 80мг (60%) вказаної в заголовку сполуки, темп.кип. 88-9°С. Аналітичний аналіз розрахований для C25H27N5O3 : С, 67,4; Н, 6,1; N, 15,7. Знайдено: С, 67,0; Н, 6,3; N, 15,2. Сполуки Прикладів 7-31 одержували способом, аналогічним описаному в Прикладі 6, застосовуючи відповідні вихідні матеріали. Окремі від 29 83091 мінності в умовах реакції і/або очищення зазначені. Приклад 7 N4-(3,5-Диметокси-бензил)-N2-(3-фенілпропіл)-піридо[2,3-d]піримідин-2.4-діамін 1Н-ЯМР (ДМСО-d6): 8,6 (дд, 1Н), 8,4 (д, 1Н), 7,2 (м, широкий, 3Н), 7,1 (м, широкий, 2Н), 7,0 (м, широкий, 1Н), 6,5 (с, широкий, 2Н), 6,3 (с, широкий, 1Н), 4,6 (м, широкий, 2Н), 3,7 (с, широкий, 6Н), 2,6 (м, широкий, 2Н), 1,8 (м, широкий, 2Н), 1,7 (м, широкий, 2Н). MC (m/z, %): 417 (100). MC (m/z, %): 430 (100). Приклад 8 N2-[2-(4-Хлор-феніл)-етил]-N4-(3,5-диметоксибензил)-піридо[2,3-d]піримідин-2,4-діамін темп.кип. 85-90°С. Аналітичний аналіз розрахований для C24H24N5O 2CI: С, 64,1; Н, 5,4; N, 15,6. Знайдено: С, 63,6; Н, 5,7; N, 15,3. Приклад 9 N2-Бензил-N4-(3,5-диметокси-бензил)піридо[2,3-d]піримідин-2,4-Діамін темп.кип. 84-85°С. Аналітичний аналіз розрахований для C23H23N5O2: С, 68,8; Н, 5,8; N, 17,4. Знайдено: С, 68,5; Н, 6,0; N, 17,4 Приклад 10 N4-(3,5-Диметокси-бензил)-N2-(2-тіофен-2-ілетил)-піридо[2,3-d]піримідин-2,4-діамін темп.кип. 120-1°С. Аналітичний аналіз розрахований для C22H23N5O2S: С, 62,7; Н, 5,5; N, 16,6. Знайдено: С, 62,2; Н, 6,0; N, 15,6. Приклад 11 2-(4-{[4-(3,5-Диметокси-бензиламіно)піридо[2,3-d]піримідин-2-іламіно]1-метил}-феніл)пропан-2-ол темп.кип. 105-9°С. Аналітичний аналіз розрахований для C26H29N5O3: С, 68,0; Н, 6,4; N, 15,2. Знайдено: С, 67,7; Н, 6,6; N, 14,4. Приклад 12 N4-(3.5-Диметокси-бензил)-N2-2-фенетилпіридо[2,3-d]піримідин-2,4-діамін темп.кип. 112-4°С. Аналітичний аналіз розрахований для C24H25N5O2: С, 69,4; Η, 6,1; Ν, 16,9. Знайдено: С, 68,5; Η, 6,9; Ν, 15,3. Приклад 13 N4-(3,5-Диметокси-бензил)-N2-[2-(3,5диметокси-феніл)-етил]-піридо[2,3-d]піримідин-2,4діамін темп.кип. 95-100°С. Аналітичний аналіз розрахований для C26H29N5O4: С, 65,7; Η, 6,2; Ν, 14,7. Знайдено: С, 65,5; Η, 6,6; Ν, 14,5. Приклад 14 N4-(3,4-Диметокси-бензил)-N2-[2-(3-фторфеніл)-етил]-піридо[2,3-d]піримідин-2,4-діамін темп.кип. 227-8°С. Аналітичний аналіз розрахований для C24H24N5O2F: С, 66,5; Н, 5,6; Ν, 16,2. Знайдено: С, 66,6; Н, 5,6; Ν, 16,2. Приклад 15 N4-(3,4-Диметокси-бензил)-N2-[2-(2-фторФеніл)-етил]-піридо[2,3-d]піримідин-2,4-діамін темп.кип. 220-2°С.Аналітичний аналіз розрахований для C24H24N5O2F: С, 66,5; Η, 5,6; Ν, 16,2. Знайдено: С, 66,4; Η, 5,5; Ν, 16,1. Приклад 16 N4-(3,4-Диметокси-бензил)-N2-[2-(4-фторФеніл)-етил]-піридо[2,3-d]піримідин-2,4-діамін 30 темп.кип. 225-6°С. Аналітичний аналіз розрахований для C24H24N5O2F: С, 66,5; Н, 5,6; Ν, 16,2. Знайдено: С, 66,4; Н, 5,6; Ν, 16,2. Приклад 17 N4-(3,4-Диметокси-бензил)-N2-фенетилпіридо[2,3-d]піримідин-2,4-діамін темп.кип. 217-8°С. Аналітичний аналіз розрахований для C24H25N5O2: С, 69,4; Н, 6,1; Ν, 16,9. Знайдено: С, 69,4; Н, 6,0; Ν, 16,8. Приклад 18 N4-(3,4-Диметокси-бензил)-N2-(4-феніл-бутил)піридо[2,3-d]піримідин-2,4-діамін темп.кип. 194-5°С. Аналітичний аналіз розрахований для C26H29N5O2: С, 70,4; Н, 6,6; Ν, 15,8. Знайдено: С, 70,5; Н, 6,6; Ν, 15,9. Приклад 19 N4-(3,4-Диметокси-бензил)-N2-(2-феноксиетил)-піридо[2,3-d]піримідин-2,4-діамін темп.кип. 227-8°С. Аналітичний аналіз розрахований для C24H25N5O3: С, 66,8; Н, 5,8; Ν, 16,2. Знайдено: С, 66,7; Н, 5,7; Ν, 16,2. Приклад 20 N4-(3,4-Диметокси-бензил)-N2-(2трифторметил-бензил)-піридо[2,3-d]піримідин-2,4діамін темп.кип. 227-8°С. Аналітичний аналіз розрахований для C24H22N5 O2F 3: С, 61,4; Η, 4,7; Ν, 14,9. Знайдено: С, 60,6; Η, 4,9; Ν, 14,8. Приклад 21 2-(4-(3-[4-(3.4-Диметокси-бензиламіно)піридо[2,3-d]піримідин-2-іламіно}-пропіл)-феніл)пропан-2-ол Фракції препаративної ВЕРХ з оберненою фазою, які містили бажаний неочищений продукт, концентрували і залишок перекристалізовували з ЕtOАс. темп.кип. 198-9°С. Аналітичний аналіз розрахований для C28H33N5O3: С, 69,0; Н, 6,8; N, 14,4. Знайдено: С, 68,7; Н, 6,9; N, 14,3. Приклад 22 2-(4-{3-[4-(3,5-Диметокси-бензиламіно)піридо[2,3-d]піримідин-2-іламіно]-пропіл}-феніл)пропан-2-ол (аморфна тверда речовина) темп.кип. 70-5°С. 1 Н-ЯМР (ДМСО-d6): 8,6 (дд, 1Н), 8,4 (д, 1Н), 7,3 (м, широкий, 2Н), 7,1 (м, широкий, 2Н), 7,0 (м, широкий, 2Н), 6,5 (с, широкий, 2Н), 6,3 (с, широкий, 1Н), 4,6 (м, широкий, 2Н), 3,7 (с, широкий, 6Н), 2,6 (м, широкий, 2Н), 1,8 (м, широкий, 2Н), 1,7 (м, широкий, 2Н), 1,4 (с, 6Н). MC (m/z, %): 430 (100). MC (m/z, %): 488 (M++1, 100), 470 (50). Аналітичний аналіз розрахований для C28H33N5O 3: С, 69,0; Н, 6,8; N, 14,4. Знайдено: С, 67,1; Н, 7,0; N, 12,1. Приклад 23 1-(4-({4-(3,4-Диметокси-бензиламіно)піридо[2,3-d]піримідин-2-іламіно]-метил}-феніл)2,2,2-трифтор-етанол Фракції препаративної ВЕРХ з оберненою фазою, які містили бажаний неочищений продукт, концентрували і залишок перекристалізовували з суміші ацетонітрил/вода. темп.кип. 121-2°С. Аналітичний аналіз розрахований для C25H24N5O3F 3: С, 60,1; Н, 4,8; N, 14.0. Знайдено: С, 58,0; Н, 5,0; N, 13,4. Приклад 24 31 83091 1-(4-(3-[4-(3,4-Диметокси-бензиламіно)піридо[2,3-d]піримідин-2-іламіно]-пропіл)-феніл)етанон Реакційну суміш, яка містила неочищений продукт, заливали в воду і одержаний осад відфільтровували. Залишок розчиняли в 30мл МеОН і додавали 10мл 1N сірчаної кислоти. Суміш перемішували при КТ4год., концентрували, нейтралізували 5% розчином бікарбонату натрію і екстрагували дихлорметаном. Органічні екстракти об'єднували і промивали насиченим розчином солі, сушили над MgSO4 і концентрували. Неочищений продукт очищували ВЕРХ з оберненою фазою як описано в Прикладі 6. Фракції, які містили бажаний продукт, об'єднували, концентрували і залишок перекристалізовували з суміші ацетонітрил/вода для одержання твердої речовини, темп.кип. 184-5°С. Аналітичний аналіз розрахований для C27H29N5O 3: С, 68,8; Н, 6,2; N, 14,9. Знайдено: С, 68,7; Н, 6,0; N,14,6. Приклад 25 1-(4-{3-[4-(3,4-Диметокси-бензиламіно)піридо[2,3-d]піримідин-2-іламіно1-пропіл}-феніл)2,2,2-трифтор-етанол темп.кип. 222-4°С. 1Н-ЯМР (ДМСО-d6):d 8,6 (дд, 1Н), 8,4 (дд, 1Н), 7,4 (м, широкий, 2Н), 7,3 (м, 1Н), 7,0 (м, широкий, 2Н), 6,8 (с, широкий, 2Н), 6,7 (д, 1Н), 5,0 (м, широкий, 1Н), 4,6 (с, широкий, 2Н), 3,7 (м, 6Н), 3,3 (м, 2Н), 2,6 (м, широкий, 2Н), 1,8 (м, широкий, 2Н). MC (m/z, %):528(M+, 100). Приклад 26 N2-3-(Бензо[1,2,5]оксадіазол-5-іл-пропіл)-N4(3,4-диметокси-бензил)-піридо[2,3-d]піримідин-2,4діамін Продукт виділяли хроматографією на силікагелі, елююючи 2,5% МеОН в 2N аміак/дихлорметан, з одержанням неочищеної твердої речовини. Розтиранням з ЕtOАс одержували тверду речовину, темп.кип. 191-3°С. 1Н-ЯМР (ДMCO-d6):d 8,6 (дд, 1Н), 8,4 (дд, 1Н), 7,9 (м, широкий, 1Н), 7,7 (м, 1Н), 7,5 (м, широкий, 1Н), 7,0 (м, широкий, 2Н), 6,8 (м, 2Н), 4,6 (м, широкий, 2Н), 3,7 (м, 6Н), 3,4 (м, 2Н), 2,7 (м, широкий, 2Н), 1,9 (м, широкий, 2Н). MC (m/z, %): 472 (М+, 100). Приклад 27 N2-3-(Бензотіазол-6-іл-пропіл)-N4-(3,4диметокси-бензил)-піридо[2,3-d]піримідин-2,4діамін Продукт виділяли хроматографією на силікагелі, елююючи 2,5% МеОН в 2N аміак/дихлорметан, з одержанням твердої речовини, темп.кип. 191-3°С. MC (m/z, %): 487 (М+, 100). Аналітичний аналіз розрахований для C26H26N6O2S: С, 64,2; Η, 5,4; Ν, 17,3. Знайдено: С, 64.5; Η, 5.5; Ν, 16.8. Приклад 28 N4-(3,4-Диметокси-бензил)-N2-{3-[3-(2-метил[1,3]-діоксолан-2-іл)-феніл]-пропіл)-піридо[2,3d]піримідин-2,4-діамін 1 Н-ЯМР (ДМСО-d 6):d 8,6 (д, 1Н), 8,3 (д, 1Н), 7,2 (м, широкий, 3Н), 7,0 (м, широкий, 3Н), 6,9 (м, широкий, 2Н), 4,6 (м, широкий, 2Н), 4,1 (м, 2Н), 3,9 (м, 2Н), 3,7 (м, широкий, 8Н), 2,6 (м, широкий, 2Н), 1,8 (м, широкий, 2Н), 1,5 (с, 3Н). MC (m/z, %): 516 (М++1, 100). 32 Приклад 29 2-(3-{3-[4-(3,4-Диметокси-бензиламіно)піридо[2,3-d]піримідин-2-іламіно]-пропіл)-феніл)пропан-2-ол темп.кип. 204-5°С. 1Н-ЯМР (ДМСО-d6): d 8,6 (д, 1Н), 8,3 (д, 1Н), 7,3 (м, широкий, 1Н), 7,2 (м, широкий, 1Н), 7,1 (м, широкий, 1Н), 7,0 (м, широкий, 3Н), 6,8 (с, широкий, 2Н), 4,6 (с, широкий, 2Н), 3,7 (м, широкий, 6Н), 3,3 (м, широкий, 2Н), 2,6 (м, широкий, 2Н), 1,8 (м, широкий, 2Н), 1,4 (с, 6Н). MC (m/z, %): 488 (М++1, 100). Приклад 30 4-{3-[4-(3,4-Диметокси-бензиламіно)піридо[2,3-d]піримідин-2-іламіно]-пропіл)бензонітрил темп.кип. 220-2°С. 1Н-ЯМР (ДМСО-d6):d 8,6 (д, 1Н), 8,3 (д, 1Н), 7,7 (м, широкий, 2Н), 7,4 (м, широкий, 2Н), 7,0 (м, широкий, 2Н), 6,8 (с, широкий, 2Н), 4,6 (с, широкий, 2Н), 3,7 (м, широкий, 6Н), 3,3 (м, широкий, 2Н), 2,7 (м, широкий, 2Н), 1,8 (м, широкий, 2Н). MC (m/z, %):455(М++1, 100). Приклад 31 N4-(3,5-Диметокси-бензил)-N2-(3-піридин-4-ілпропіл)-піридо[2,3-d]піримідин-2,4-діамін 1 Н-ЯМР (CD2CI2):d 9,1 (д, 1Н), 8,9 (м, широкий, 1Н), 8,4 (м, широкий, 3H), 7,2 (м, широкий, 2Н), 7,1 (м, широкий, 1Н), 7,0 (с, широкий, 1Н), 6,9 (д, 1Н), 6,6 (д, 1Н), 4,8 (д, 2Н), 3,7 (с, 3Н), 3,7 (с, 3Н), 3,6 (м, 2Н), 2,7 (м, 2Н), 2,0 (м, 2Н). MC (m/z, %): 432 (М++1, 20), 256 (15), 237 (30), 216(100). Сполуки Прикладів 32-35 одержували відповідно до наступної узагальненої методики. Окремі відмінності в умовах реакції і/або очищення зазначені. До перемішаного розчину 2,4-дихлорпіридо[2,3-d]піримідину (0,75 ммоль) і ДІПЕА (1,5 ммоль) в 3мл ДМСО додавали 0,75 ммоль аміну Формули (V), Схема 1, стадія 1, при КТ С уміш перемішували при КТ одну год., потім додавали 2,25 ммоль аміну Формули (VII), С хема 1, стадія 2 і додатково ДІПЕА (2,25 ммоль), і суміш нагрівали при 90°С дві год. Приклад 32 N4-(3,4-Диметокси-бензил)-N2-(3-фенілпропіл)-піридо[2,3-d]піримідин-2,4-діамін Сполуку виділяли і очищували з неочищеної реакційної суміші шля хом прямого заливання на препаративну ВЕРХ з оберненою фазою, застосовуючи поетапний градієнт ацетонітрил/вода із вмістом 0,1% гідроксиду амонію як елюенту. Фракції, які містили сполуку, об'єднували і концентрували з одержанням твердої речовини, темп.кип. 190-2°С. 1Н-ЯМР (d6-ДMCO):d 8,6 (дд, 1Н), 8,4 (дд, 1Н), 7,2 (м, широкий, 3Н), 7,1 (м, широкий, 2Н), 7,0 (м, широкий, 2Н), 6,8 (м, широкий, 2Н), 4,6 (м, широкий, 2Н), 3,7 (д, широкий, 6Н), 3,3 (м, широкий, 2Н), 2,6 (м, широкий, 2Н), 1,8 (м, 2Н). MC (m/e, %): 431 (М++1, 50), 430 (М+, 100). Приклад 33 N4-(3,5-Диметокси-бензил)-N2-(3-феноксиетил)-піридо[2,3-d]піримідин-2,4-Діамін Сполуку виділяли і очищували з неочищеної реакційної суміші шля хом прямого заливання на препаративну ВЕРХ з оберненою фазою, застосовуючи поетапний градієнт ацетонітрил/вода із вмістом 0,1% 33 83091 гідроксиду амонію як елюенту. Фракції, які містили сполуку, об'єднували, концентрували і залишок перекристалізовували з ІРА/вода. темп.кип. 1657°С. 1Н-ЯМР (d6-ДМСО): 8,6 (дд, 1Н), 8,4 (д, 1Н), 7,2 (м, широкий, 3Н), 7,1 (м, широкий, 2Н), 7,0 (м, 1Н), 6,9 (м, широкий, 2Н), 6,8 (м, широкий, 1Н), 6,5 (д, 2Н), 6,4 (с, 1Н), 4,6 (м, широкий, 2Н), 4,0 (м, широкий, 2Н), 3,7 (м, широкий, 8Н). MC (m/e, %): 433 (М++1, 50), 432 (М+, 100). Приклад 34 N4-(3-Етокси-4-метокси-бензил)-N2-(3-фенілпропіл)-піридо[2,3-d]піримідин-2,4-діамін Сполуку виділяли і очищували з неочищеної реакційної суміші шляхом прямого заливання на препаративну ВЕРХ з оберненою фазою, застосовуючи поетапний градієнт ацетонітрил/вода із вмістом 0,1% гідроксиду амонію як елюенту. Фракції, які містили сполуку, об'єднували, концентрували і перекристалізовували з суміші ацетонітрил/вода. темп.кип. 181-2°С. Аналітичний аналіз розрахований для C26H29N5O 2: С, 70,4; Н, 6,6; N, 15,8. Знайдено: С, 70,7; Н, 6,9; N, 15,9. Приклад 35 2-(4-{3-[4-(3-Етокси-4-метокси-бензиламіно)піридо[2,3-d]піримідин-2-іламіно]-пропіл)-феніл)пропан-2-ол Сполуку виділяли і очищували з неочищеної реакційної суміші шляхом прямого заливання на препаративну ВЕРХ з оберненою фазою, застосовуючи поетапний градієнт ацетонітрил/вода із вмістом 0,1% гідроксиду амонію як елюенту. Фракції із вмістом бажаної сполуки об'єднували, концентрували і перекристалізовували з суміші ацетонітрил/вода. темп.кип. 150-2°С. Аналітичний аналіз розрахований для С29Н35N5О3 : С, 69,4; Н, 7,0; N, 13,7. Знайдено: С, 69,1; Н, 6,9; N, 13,7. Приклад 36 1-(4-{3-[4-(3,4-Диметокси-бензиламіно)піридо[2,3-d]піримідин-2-іламіно]-пропіл)-феніл)2,2,2-трифтор-етанон До перемішаного розчину вказаної в заголовку сполуки Прикладу 25 (150мг, 0,28 ммоль) в 15мл дихлорметану при КТ додавали 1,1,1-триацетокси1,1-дигідро-1,2-бензйодоксол-3(1Н)-он (180мг, 0,43 ммоль). Суміш перемішували при КТ шість год, потім додавали додаткову порцію 1,1,1триацетокси-1,1-дигідро-1,2-бензйодоксол-3(1Н)ону (180мг, 0,43 ммоль) і суміш перемішували при КТ протягом ночі. Суміш розводили хлороформом, промивали водою, сушили над MgSO4 і концентрували з одержанням масла. Хроматографією на силікагелі, елююючи 5% МеОН 2N в суміші аміак/дихлорметан, одержували масло. Розтиранням з EtOAc одержували 45мг твердої речовини, темп.кип. 198-200°С. 1Н-ЯМР (d6-ДМСО): d 8,6 (дд, 1Н), 8,4 (дд, 1Н), 7,9 (м, широкий, 2Н), 7,5 (м, широкий, 2Н), 7,0 (м, широкий, 2Н), 6,8 (м, широкий, 2Н), 4,6 (м, 2Н), 3,7 (м, 6Н), 3,3 (м, 2Н), 2,7 (м, широкий, 2Н), 1,9 (м, широкий, 2Н). MC (m/e, %): 526 (М+, 100). Приклад37 1-(3-{3-[4-(3,4-Диметокси-бензиламіно)піридо[2,3-d]піримідин-2-іламіно]-пропіл)-феніл)етанон 34 Суміш вказаної в заголовку сполуки Препаративного прикладу 27 (419мг, 0,81 ммоль) в 8мл ТГФ із вмістом 10мл 6 N сірчаної кислоти перемішували при КТ шість годин. Реакційну суміш екстрагували ЕtOАс, органічний екстракт промивали 5% розчином бікарбонату натрію і потім концентрували з одержанням твердої речовини, темп.кип. 152-5°С. 1Н-ЯМР (d6-ДМСО): 8,8 (д, 1Н), 8,7 (д, 1Н), 7,7 (м, 2Н), 7,4 (м, 3Н), 7,0 (с, 1Н), 6,8 (м, 2Н), 4,6 (д, 2Н), 3,7 (с, 3Н), 3,6 (с, 3Н), 3,5 (м, 2Н), 2,7 (м, 2Н), 2,5 (с, 3Н), 1,9 (м, 2Н). MC (m/e, %): 471 (М+, 30), 470 (100). Методики біологічних досліджень Виділення ферменту ФДЕ 2 Фермент ФДЕ 2 виділяли з тромбоцитів людини з приблизно 1,4л крові від різних донорів, застосованої для одержання тромбоцитних бляшок. Тромбоцити повторно суспендували в приблизно 75мл буфера для лізису [20мМ Tris pH7,2, 5мМ MgCI2, 250мМ цукрози, 1мМ DTT, 1мкл/2мл інгібітор протеази Sigma №8340; Sigma-Aldrich; СентЛуїс, Міссурі] і піддавали лізису шляхом впливу ультразвуку при 4°С 3 рази із спалахом тривалістю 1хв., потім центрифугували при 4°С протягом ночі при 100 000г. Очищені лізати завантажували на АКТА Explorer FPLC (Amersham Biosciences; Піскатауей, Нью-Джерсі) в систему з трьох хроматографічних колонок для розділення із середнім об'ємом завантаження 25мл. Застосовували 5мл HiTrap Q колонку аніонного обміну (Amersham Biosciences). Буфер [20мМ Tris pH 7,2, 5мМ MgCI2, 1 мкл/2 мл інгібітор протеази Sigma №8340] змішували з градієнтом Буфер у В [20 мМ Tris pH 7,2, 500 мМ NaCI, 5 мМ MgCI2, 1 мкл/2 мл інгібітор протеази Sigma №8340] в об'ємі 20 колонок, починаючи з концентрації буферу В 0% до кінцевої концентрації 100%. Піки гідролізу цГМФ спостерігали при середньому розділенні при низькій концентрації солі - 125 мМ NaCI (ФДЕ 5) і високій концентрації солі - 325мМ NaCI (ФДЕ 2). Дві головні фракції з активністю цГМФ (ФДЕ 5 і ФДЕ 2) виділяли і зберігали окремо. Загальний об'єм зібраних фракцій ФДЕ 2 складав приблизно 40мл, який розміщували в кріопробірки по 200мкл/пробірку і зберігали при 80°С. Дослідження на зв'язування ферменту ФДЕ 2 Інгібуючу дію сполук формули (І) на рекомбінатну або виділену ФДЕ 2 і інші ФДЕ визначали за допомогою наборів дослідження сцинтиляційної близькості [3Н]цАМФ (SPA) від Amersham International (Літл Челфонт, Англія). SPA дослідження проводили, використовуючи 96-лункові планшети. ФДЕ SPA ітрієво-кремнієві шарики (Amersham Biosciences) переважно зв'язувались з лінійним нуклеотидом, ГМФ, при порівнянні із циклічним нуклеотидом, цГМФ. 3Н-цГМФ додавали до реакційної суміші, і коли продукт, 3Н-ГМФ, знаходився дуже близько до шариків, це викликало збудження сцинтилятора в шарику, яке фіксували за допомогою сцинтиляційного лічильника Packard (Perkin-Elmer Life Sciences; Бостон, Масачусетс). Концентрація ферменту попадала в лінійну ділянку, і визначали Km ферменту (15мкм). Кінцева концентрація субстрату складала
ДивитисяДодаткова інформація
Назва патенту англійськоюPyrido[2,3-d]pyrimidine-2,4-diamines as pde 2 inhibitors
Автори англійськоюBeyer Thomas Arthur, Chambers Robert James, Lam Kelvin, Li Mei, Morrell Andrew Ian, Thompson David Duane
Назва патенту російськоюПиридо[2,3-d]пиримидин-2,4-диамины как ингибиторы фде 2
Автори російськоюТомас Артур, Чамберс Роберт Джеймс, Лем Кельвин, Ли Мей, Моррелл Эндрю Ян, Томпсон Девид Дуэйн
МПК / Мітки
МПК: C07D 471/04, A61K 31/519, A61P 19/10, A61P 15/00, A61P 9/06, A61P 35/00
Мітки: піридо[2,3-d]піримідин-2,4-діаміни, інгібітори, фде
Код посилання
<a href="https://ua.patents.su/19-83091-pirido23-dpirimidin-24-diamini-yak-ingibitori-fde-2.html" target="_blank" rel="follow" title="База патентів України">Піридо[2,3-d]піримідин-2,4-діаміни як інгібітори фде 2</a>
Попередній патент: Вогнетривка набивна маса
Наступний патент: Пристрій для транспортування і очистки коренебульбоплодів
Випадковий патент: Спосіб виготовлення плавлених сирів з додаванням екстракту ехінацеї












