Похідні триазолу як інгібітори 11-бета-гідроксистероїддегідрогенази-1
Номер патенту: 80459
Опубліковано: 25.09.2007
Автори: Малєтік Мілана М., Балковец Джеймс М., Уодделл Шерман Т., Леєман Аарон Г., Астер Сьюзан Д., Гу Сінь, Сантореллі Джина М., Грехем Дональд У.
Формула / Реферат
1. Сполука структурної формули І:
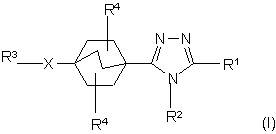
або її фармацевтично прийнятна сіль, де:
кожний р являє собою незалежно 0, 1 або 2,
кожний n являє собою незалежно 0, 1 або 2;
X вибирають з групи, що складається з одинарного зв'язку, О, S(O)p, NR6,

R1 вибирають з групи, що складається з арилкарбонілу, (СН2)n-арилу і (СН2)n-гетероарилу; в якому арил і гетероарил незаміщені або заміщені і мають від одного до трьох замісників, незалежно вибраних з R5;
R2 вибирають з групи, що складається з водню, С1-8алкілу, С2-6алкенілу і (СН2)n-С3-6циклоалкілу, в яких алкіл, алкеніл і циклоалкіл незаміщені або заміщені і мають від одного до трьох замісників, незалежно вибраних з R8 і оксо;
кожний R4 незалежно вибирають з групи, що складається з водню, галогену, гідрокси, оксо, С1-3алкілу і С1-3алкокси;
R3 вибирають з групи, що складається з
водню,
С1-10алкілу,
С2-10алкенілу,
(СН2)n-С3-6циклоалкілу,
(СН2)n-арилу,
(СН2)n-гетероарилу,
(СН2)n-гетероциклілу;
в яких арил, гетероарил і гетероцикліл незаміщені або заміщені і мають від одного до трьох замісників, незалежно вибраних з R5; і алкіл, алкеніл і циклоалкіл незаміщені або заміщені і мають від однієї до п'яти груп, незалежно вибраних з R8 і оксо;
R5 і R8 незалежно вибирають з групи, що складається з водню, формілу,
С1-6алкілу,
(СН2)n-арилу,
(СН2)n-гетероарилу,
(СН2)n-гетероциклілу,
(СН2)n-С3-7циклоалкілу, галогену,
OR7,
(CH2)nN(R7)2,
ціано,
(CH2)nCO2R7,
NO2,
(CH2)nNR7SO2R6,
(CH2)nSO2N(R7)2,
(CH2)nS(O)pR6,
(CH2)nSO2OR7,
(CH2)nNR7C(O)N(R7)2,
(CH2)nC(O)N(R7)2,
(CH2)nNR6C(O)R6,
(CH2)nNR6CO2R7,
O(CH2)nC(O)N(R7)2,
CF3,
CH2CF3,
OCF3,
OCHCF2 i
OCH2CF3;
де арил, гетероарил, циклоалкіл і гетероцикліл незаміщені або заміщені і мають від одного до трьох замісників, незалежно вибраних з галогену, гідрокси, C1-4алкілу, трифторметилу, трифторметокси і C1-4алкокси; і де будь-який метиленовий атом вуглецю (СН2) в R5 і R8 незаміщений або заміщений і має від однієї до двох груп, незалежно вибраних з галогену, гідрокси і C1-4алкілу; або два замісники, що знаходяться на одному і тому ж вуглецевому атомі метиленової групи (СН2), взяті разом з атомом вуглецю, до якого вони приєднані, утворюють циклопропільну групу;
кожний R6 незалежно вибирають з групи, що складається з
С1-8алкілу,
(СН2)n-арилу,
(СН2)n-гетероарилу і
(СН2)n-С3-7циклоалкілу;
де алкіл і циклоалкіл незаміщені або заміщені і мають від одного до п'яти замісників, незалежно вибраних з галогену, оксо, C1-4алкокси, C1-4алкілтіо, гідрокси, аміно; і арил і гетероарил незаміщені або заміщені і мають від одного до трьох замісників, незалежно вибраних з ціано, галогену, гідрокси, аміно, карбокси, трифторметилу, трифторметокси, C1-4алкілу і C1-4алкокси;
або дві R6-групи разом з атомом, з яким вони зв'язані, утворюють 5-8-членну моно- або біциклічну систему, що необов'язково містить додатковий гетероатом, вибраний з О, S і N C1-4алкілу; і кожний R7 є воднем або R6.
2. Сполука за п.1, де R2 являє собою циклопропіл, С1-3алкіл або С2-3алкеніл і R1 являє собою феніл або нафтил, в якому феніл і нафтил незаміщені або заміщені і мають від одного до трьох замісників, незалежно вибраних з R5.
3. Сполука за п. 2, де R5-вибирають з групи, що складається з галогену, гідрокси, трифторметилу, трифторметокси, С1-3алкілу, С1-3алкокси, С1-3алкілтіо і С1-3алкілсульфонілу.
4. Сполука за п. 3, де R2 являє собою метил і R4 являє собою водень.
5. Сполука за п. 1, де
X являє собою одинарний зв'язок;
R1 являє собою феніл або нафтил, де феніл і нафтил незаміщені або заміщені і мають від одного до трьох замісників, незалежно вибраних з R5;
R2 являє собою циклопропіл, С1-3алкіл або С2-3алкеніл; і
R3 являє собою незаміщений або заміщений С1-6алкіл і має від одного до трьох замісників, незалежно вибраних з R8 і оксо.
6. Сполука за п. 5, де R5 вибирають з групи, що складається з галогену, гідрокси, трифторметилу, трифторметокси, С1-3алкілу, С1-3алкокси, С1-3алкілтіо і С1-3алкілсульфонілу.
7. Сполука за п. 6, де R2 являє собою метил і R4 являє собою водень.
8. Сполука за п. 5, де R8 вибирають з групи, що складається з галогену, гідрокси, оксо, C1-4алкокси, C1-4алкілтіо, C1-4алкілсульфінілу, C1-4алкілсульфонілу, і феніл незаміщений або заміщений від однієї до трьох груп, незалежно вибраних з галогену і трифторметилу.
9. Сполука за п. 8, де R2 являє собою метил і R4 являє собою водень.
10. Сполука за п. 5, де R5 вибирають з групи, що складається з галогену, гідрокси, трифторметилу, трифторметокси, С1-3алкілу, С1-3алкокси, С1-3алкілтіо і С1-3алкілсульфонілу; і R8 вибирають з групи, що складається з галогену, гідрокси, оксо, C1-4алкокси, C1-4алкілтіо, C1-4алкілсульфонілу, і феніл незаміщений або заміщений від однієї до трьох груп, незалежно вибраних з галогену і трифторметилу.
11. Сполука за п. 10, де R2 являє собою метил і R4 являє собою водень.
12. Сполука за п. 1, де
X являє собою одинарний зв'язок;
R1 являє собою феніл або нафтил, в якому феніл і нафтил незаміщені або заміщені і мають від одного до трьох замісників, незалежно вибраних з R5;
R2 являє собою циклопропіл, С1-3алкіл або С2-3алкеніл; і
R3 являє собою феніл або гетероарил, де феніл і гетероарил незаміщені або заміщені і мають від одного до трьох замісників, незалежно вибраних з R5.
13. Сполука за п. 12, де R2 являє собою метил і R4 являє собою водень.
14. Сполука за п. 12, де R3 являє собою феніл, який незаміщений або заміщений і має від одного до трьох замісників, незалежно вибраних з R5.
15. Сполука за п. 14, де R5 вибирають з групи, що складається з галогену, гідрокси, трифторметилу, трифторметокси, С1-3алкілу, С1-3алкокси, С1-3алкілтіо і С1-3алкілсульфонілу.
16. Сполука за п. 15, де R2 являє собою метил і R4 являє собою водень.
17. Сполука за п. 12, де R3 являє собою оксадіазоліл, який незаміщений або заміщений і має від одного до двох замісників, незалежно вибраних з R5.
18. Сполука за п. 17, де R5 являє собою феніл, який незаміщений або заміщений і має від одного до трьох замісників, незалежно вибраних з галогену, гідрокси, C1-4алкілу, трифторметилу, трифторметокси і C1-4алкокси.
19. Сполука за п. 18, де R2 являє собою метил і R4 являє собою водень.
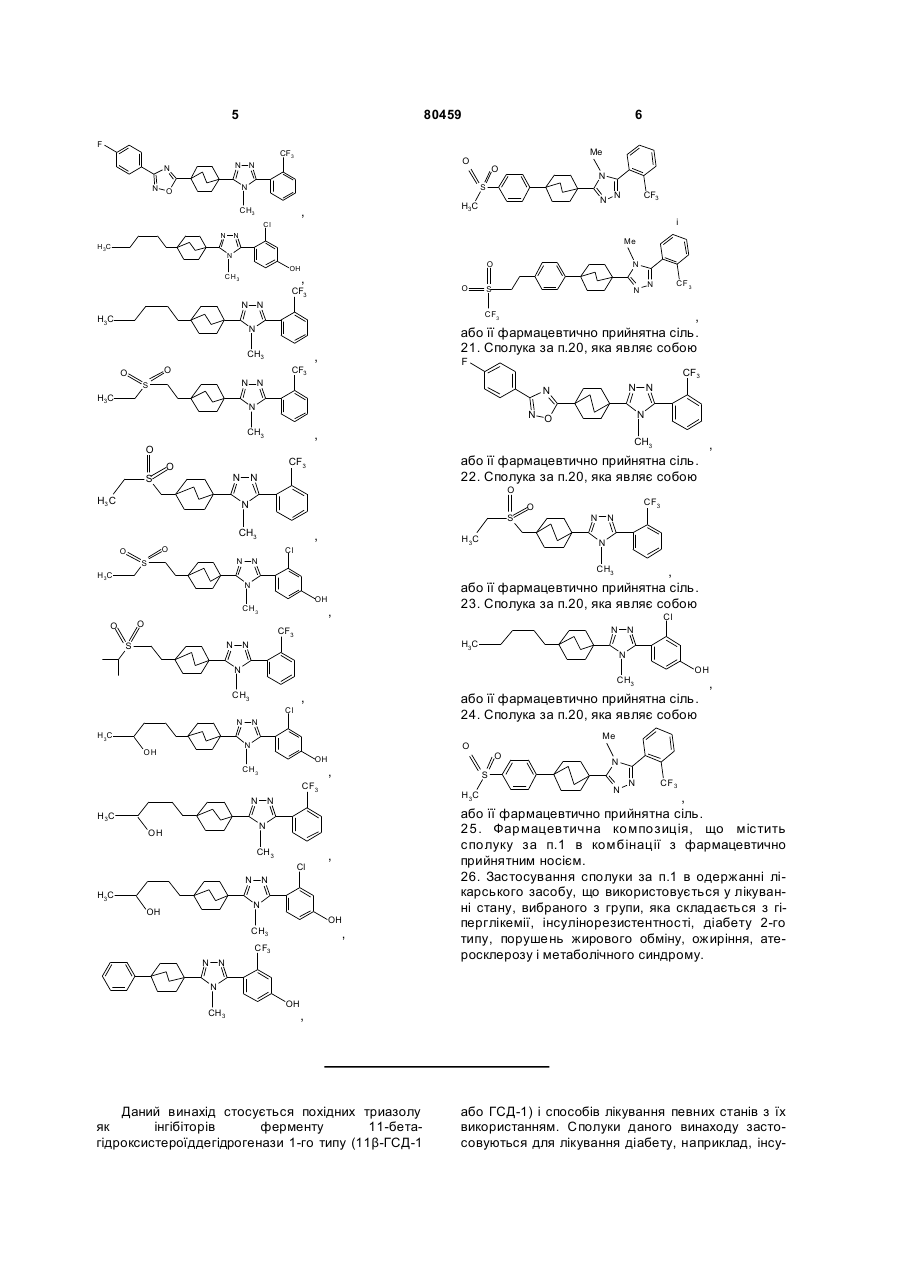
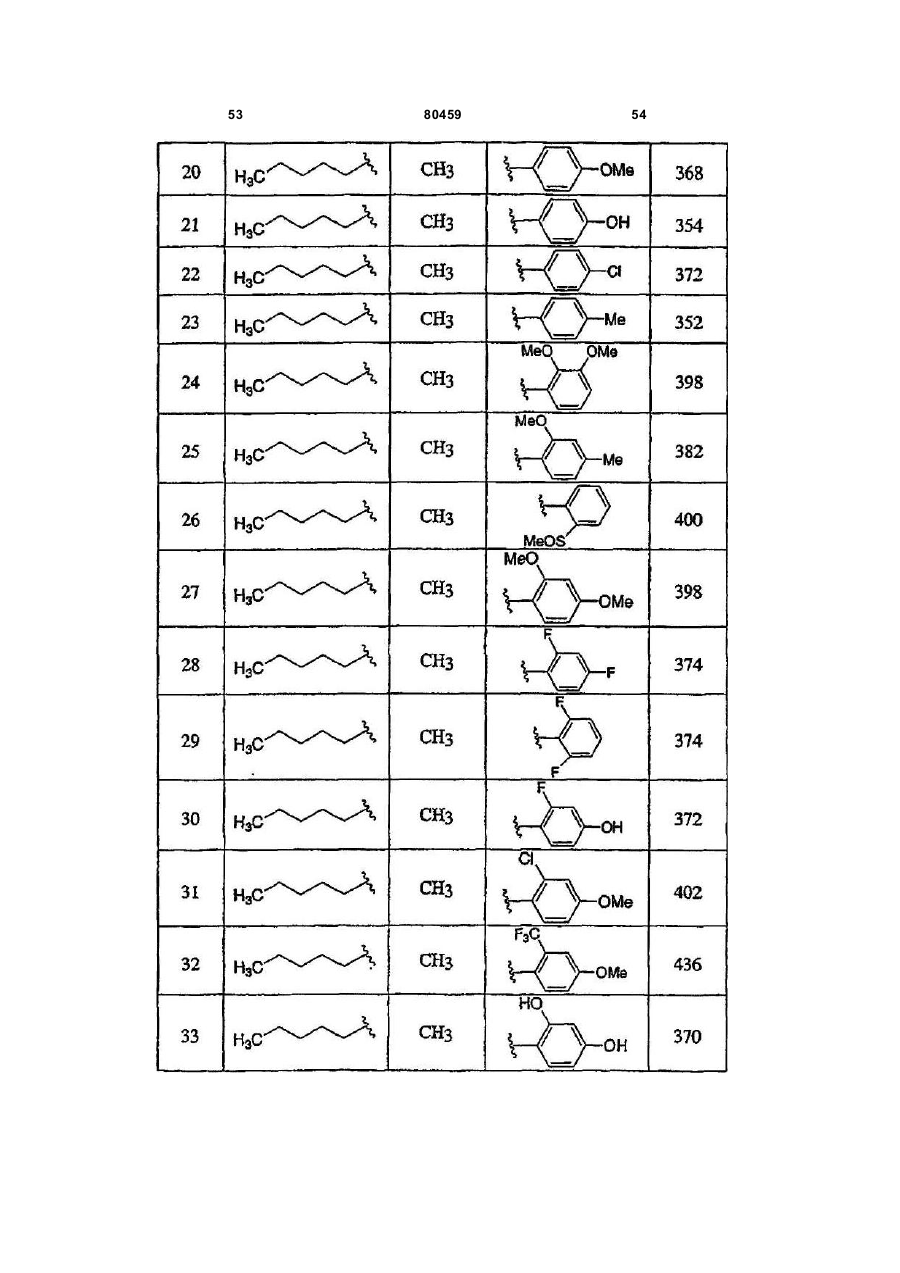
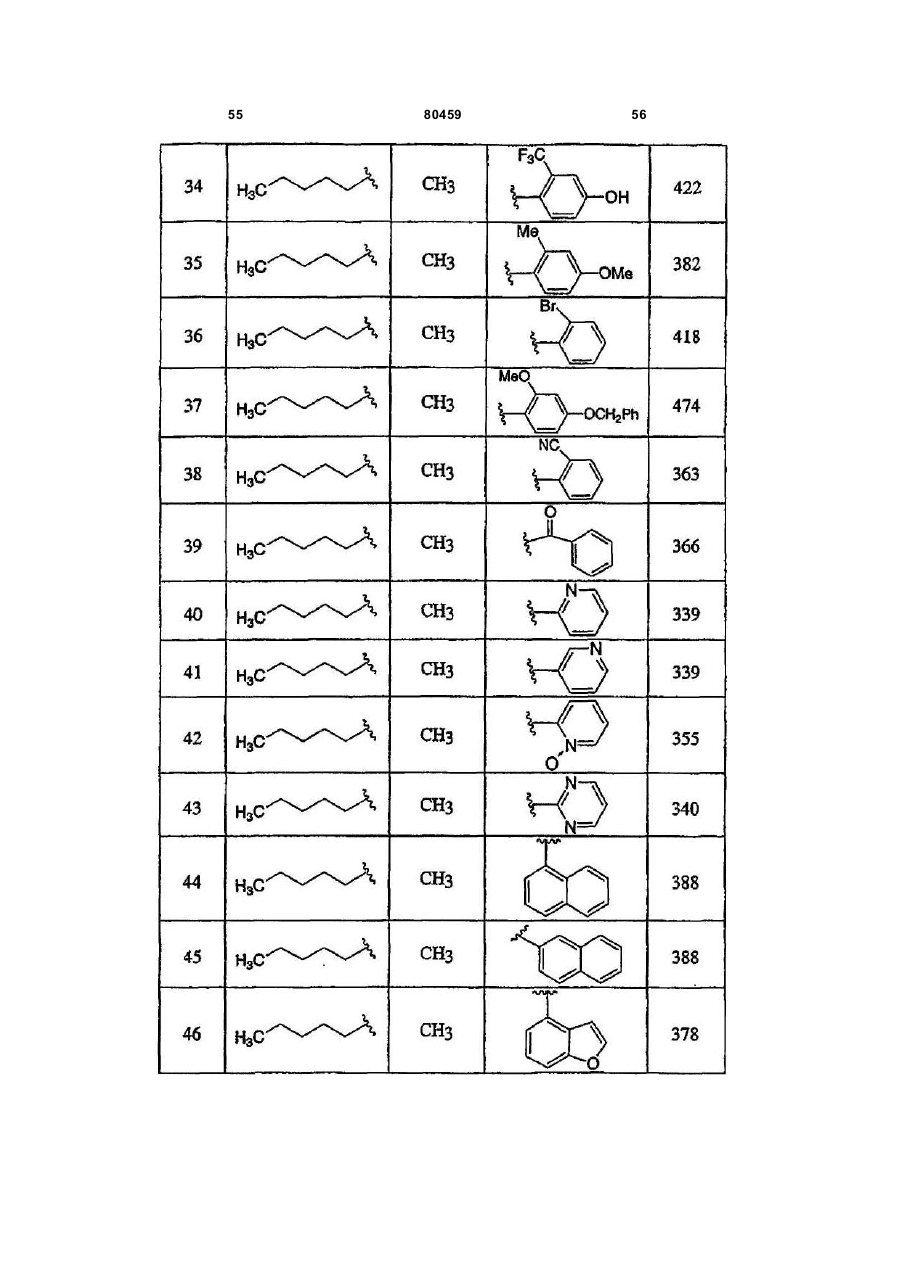
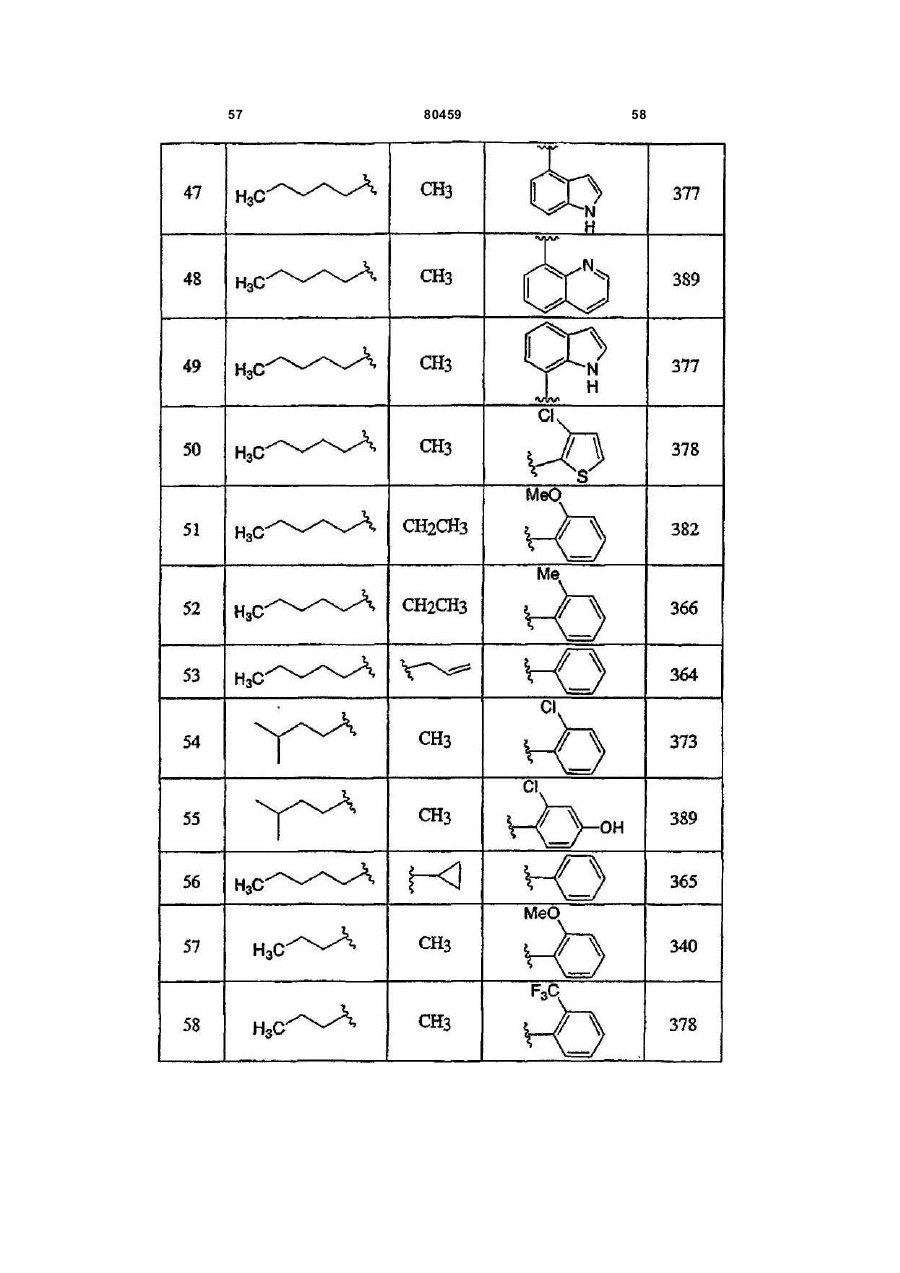
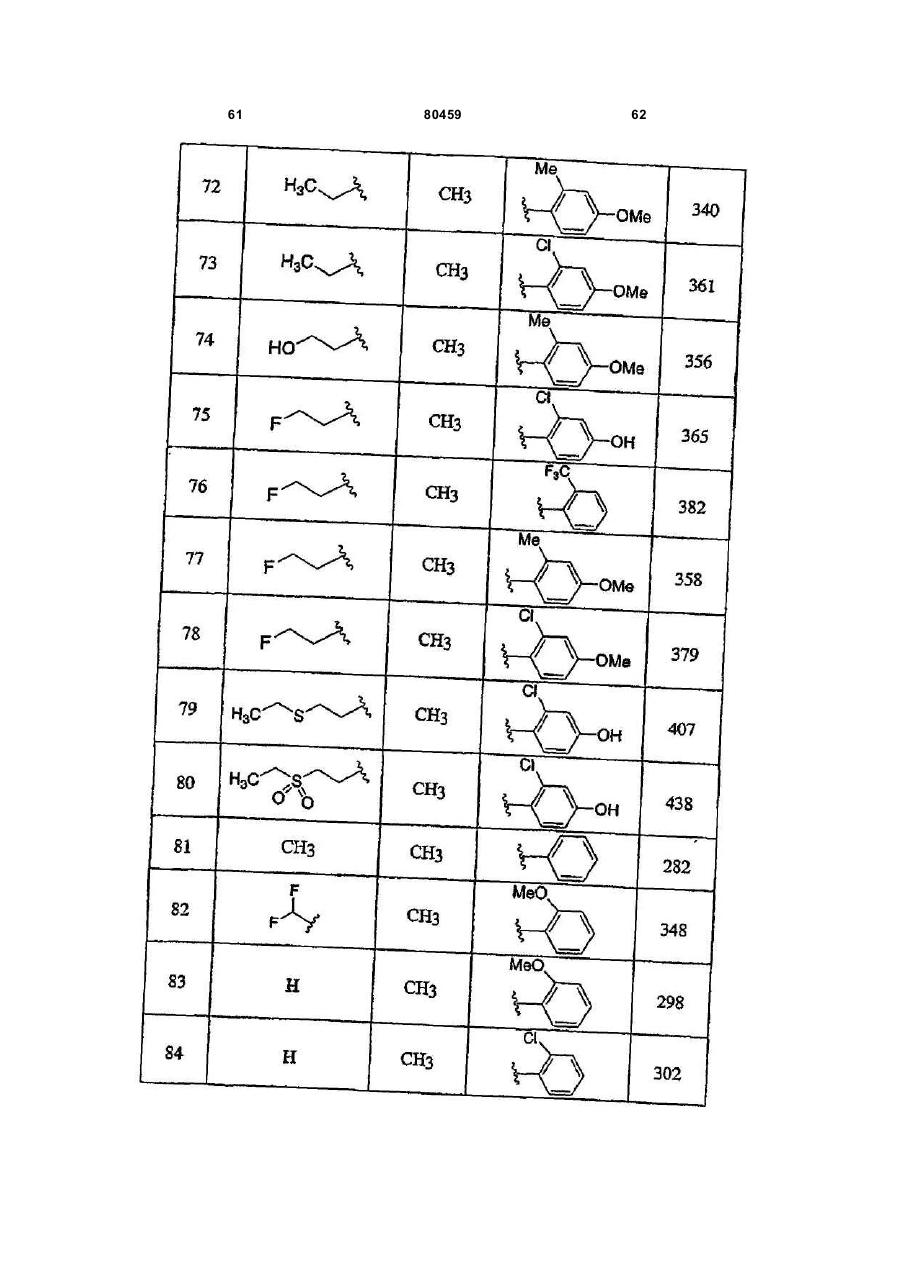
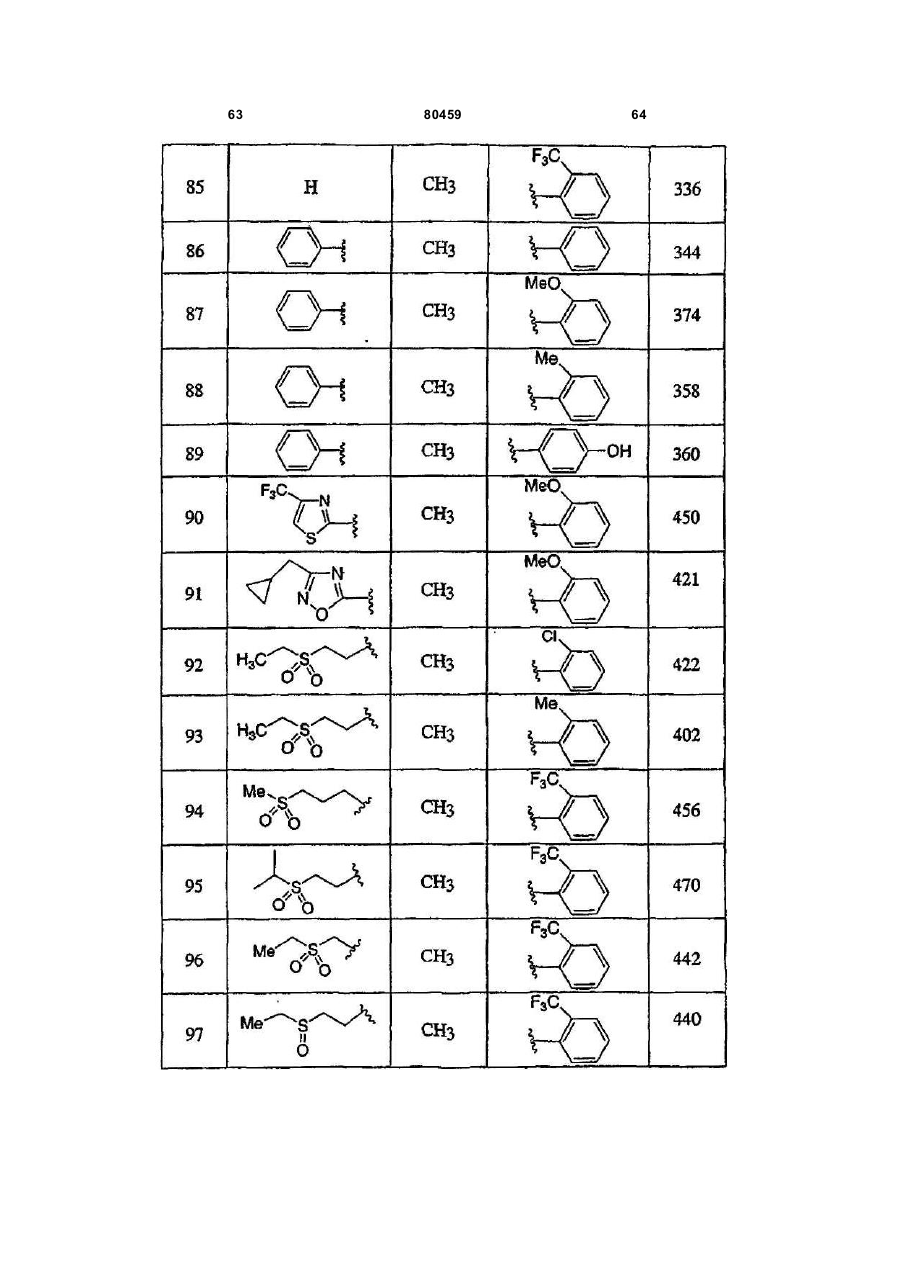
20. Сполука, вибрана з групи, що складається з:
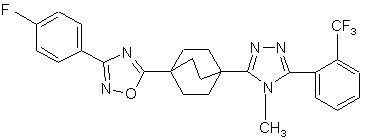 ,
,
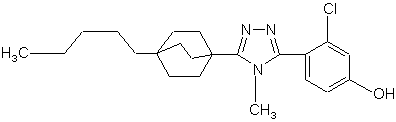 ,
,
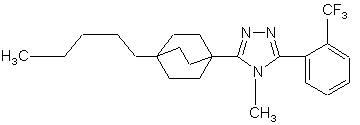 ,
,
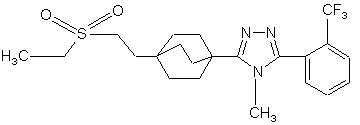 ,
,
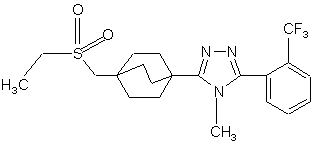 ,
,
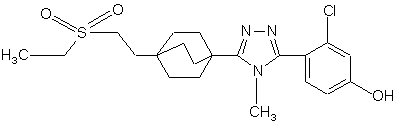 ,
,
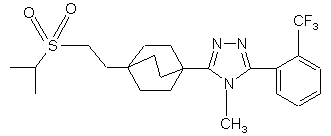 ,
,
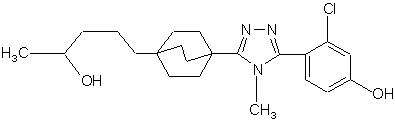 ,
,
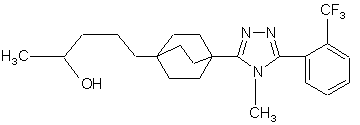 ,
,
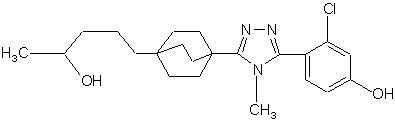 ,
,
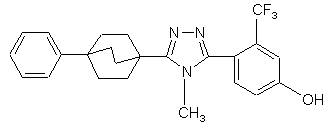 ,
,
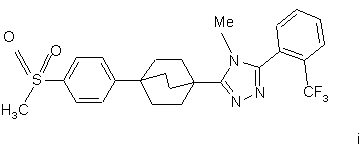
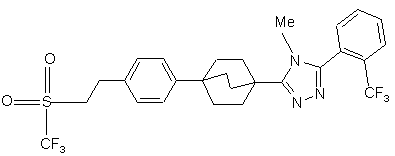 ,
,
або її фармацевтично прийнятна сіль.
21. Сполука за п. 20, яка являє собою
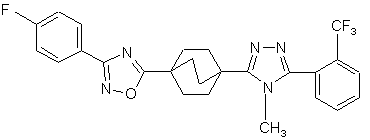 ,
,
або її фармацевтично прийнятна сіль.
22. Сполука за п. 20, яка являє собою
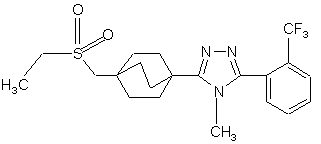 ,
,
або її фармацевтично прийнятна сіль.
23. Сполука за п. 20, яка являє собою
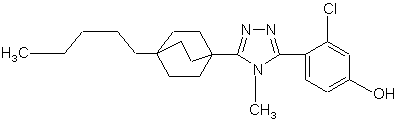 ,
,
або її фармацевтично прийнятна сіль.
24. Сполука за п. 20, яка являє собою
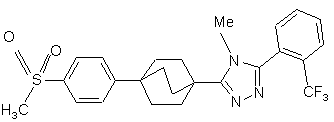 ,
,
або її фармацевтично прийнятна сіль.
25. Фармацевтична композиція, що містить сполуку за п. 1 в комбінації з фармацевтично прийнятним носієм.
26. Застосування сполуки за п. 1 в одержанні лікарського засобу, що використовується у лікуванні стану, вибраного з групи, яка складається з гіперглікемії, інсулінорезистентності, діабету 2-го типу, порушень жирового обміну, ожиріння, атеросклерозу і метаболічного синдрому.
Текст
1. Сполука структурної формули І: (19) 1 3 (CH2)nN(R7)2, ціано, (CH2)nCO2R7, NO2, (CH2)nNR7SO2R6, (CH2)nSO2N(R7)2, (CH2)nS(O)pR6, (CH2)nSO2OR7, (CH2)nNR7C(O)N(R7)2, (CH2)nC(O)N(R7)2, (CH2)nNR6C(O)R6, (CH2)nNR6CO2R7, O(CH2)nC(O)N(R7)2, CF3, CH2CF3, OCF3, OCHCF2 i OCH2CF3; де арил, гетероарил, циклоалкіл і гетероцикліл незаміщені або заміщені і мають від одного до трьох замісників, незалежно вибраних з галогену, гідрокси, C1-4алкілу, тр иф торметилу, тр иф торметокс и і C1-4алкокс и; і де б удь -який метиленовий атом вуглецю (СН2) в R5 і R8 незаміщений або заміщений і має від однієї до двох груп, незалежно вибраних з галогену, гідрокси і C1-4алкілу; або два замісники, що знаходяться на одному і тому ж вуглецевому атомі метиленової групи (СН2), взяті разом з атомом вуглецю, до якого вони приєднані, утворюють циклопропільну групу; кожний R6 незалежно вибирають з групи, що складається з С1-8алкілу, (СН2)n-арилу, (СН2)n-гетероарилу і (СН2)n-С3-7циклоалкілу; де алкіл і циклоалкіл незаміщені або заміщені і мають від одного до п'яти замісників, незалеж но вибраних з галогену, оксо, C1-4алкокси, C14алкі лтіо, гідрокси, аміно; і арил і гетероарил незаміщені або заміщені і мають від одного до трьох замісників, незалежно вибраних з ціано, галогену, гідрокси, аміно, карбокси, трифторметилу, трифторметокси, C1-4алкілу і C1-4алкокси; або дві R6-групи разом з атомом, з яким вони зв'язані, утворюють 5-8-членну моно- або біциклічну систему, що необов'язково містить додатковий гетероатом, вибраний з О, S і N C1-4алкілу; і кожний R7 є воднем або R6. 2. Сполука за п.1, де R2 являє собою циклопропіл, С1-3алкіл або С2-3 алкеніл і R1 являє собою феніл або нафтил, в якому феніл і нафтил незаміщені або заміщені і мають від одного до трьох замісників, незалежно вибраних з R5. 3. Сполука за п.2, де R 5 -вибирають з групи, що складає ть ся з галогену, гідрокси, трифторметилу, трифторметокси, С1-3алкілу, С1-3алкокси, С1-3алкілтіо і С1-3алкілсульфонілу. 4. Сполука за п.3, де R2 являє собою метил і R4 являє собою водень. 5. Сполука за п.1, де X являє собою одинарний зв'язок; R1 являє собою феніл або нафтил, де феніл і нафтил незаміщені або заміщені і мають від одного до трьох замісників, незалежно вибраних з R5; 80459 4 R2 являє собою циклопропіл, С1-3алкіл або С23алкеніл; і R3 являє собою незаміщений або заміщений С16алкіл і має від одного до трьох замісників, незалежно вибраних з R8 і оксо. 6. Сполука за п.5, де R 5 вибирають з групи, що складає ть ся з галогену, гідрокси, трифторметилу, трифторметокси, С1-3алкілу, С1-3алкокси, С1-3алкілтіо і С1-3алкілсульфонілу. 7. Сполука за п.6, де R2 являє собою метил і R4 являє собою водень. 8. Сполука за п.5, де R 8 виб ирають з групи, що складає ть ся з галогену, гідрокси, оксо, C1C1-4алкілтіо, C1-4алкілсульфінілу, C14алкокси, 4алкілсульфонілу, і феніл незаміщений або заміщений від однієї до трьох груп, незалежно вибраних з галогену і трифторметилу. 9. Сполука за п.8, де R2 являє собою метил і R4 являє собою водень. 10. Сполука за п.5, де R 5 вибирають з групи, що складаєть ся з галогену, гідрокси, трифторметилу, трифторметокси, С1-3алкілу, С1-3алкокси, С1-3алкілтіо і С1-3алкілсульфонілу; і R8 вибирають з групи, що складається з галогену, гідрокси, оксо, C1-4алкокси, C1-4алкілтіо, C1-4алкілсульфонілу, і феніл незаміщений або заміщений від однієї до трьох груп, незалежно вибраних з галогену і трифторметилу. 11. Сполука за п.10, де R2 являє собою метил і R4 являє собою водень. 12. Сполука за п.1, де X являє собою одинарний зв'язок; R1 являє собою феніл або нафтил, в якому феніл і нафтил незаміщені або заміщені і мають від одного до трьох замісників, незалежно вибраних з R5; R2 являє собою циклопропіл, С1-3алкіл або С23алкеніл; і R3 являє собою феніл або гетероарил, де феніл і гетероарил незаміщені або заміщені і мають від одного до трьох замісників, незалежно вибраних з R5. 13. Сполука за п.12, де R2 являє собою метил і R4 являє собою водень. 14. Спо лука з а п.12, де R 3 яв ляє собою феніл, який незаміщений або заміщений і має від одного до трьох замісників, незалежно вибраних з R5. 15. Сполука за п.14, де R 5 вибирають з групи, що складається з галогену, гідрокси, трифторметилу, трифторметокси, С1-3алкілу, С1-3алкокси, С1-3алкілтіо і С1-3алкілсульфонілу. 16. Сполука за п.15, де R2 являє собою метил і R4 являє собою водень. 17. Сполука за п.12, де R3 являє собою оксадіазоліл, який незаміщений або заміщений і має від одного до двох замісників, незалежно вибраних з R5. 18. Спо лука за п.17, де R 5 являє собою феніл, який незаміще ний або заміщений і має від одного до трьох замісників, незалежно вибраних з галогену, гідрокси, C1-4алкілу, трифторметилу, трифторметокси і C1-4алкокси. 19. Сполука за п.18, де R2 являє собою метил і R4 являє собою водень. 20. Сполука, вибрана з групи, що складається з: 5 80459 6 F CF3 O N S N N O Me O N N N N H3 C , CH3 CF3 N i Cl N N H 3C Me N OH CH3 O , O CF3 N N H3C CH3 , N CF 3 N N S H3C N CH3 або її фармацевтично прийнятна сіль. 22. Сполука за п.20, яка являє собою CF 3 O N N N O , O N N S N N CH3 CF 3 N F CF3 O S CF3 , або її фармацевтично прийнятна сіль. 21. Сполука за п.20, яка являє собою N O N , O H3 C N CH3 , O O H 3C Cl N S H3C N OH CH3 O N N N , Cl N N CF3 S N CH3 , або її фармацевтично прийнятна сіль. 23. Сполука за п.20, яка являє собою N O CF3 O S H3C N N N CH3 , Cl N H3C або її фармацевтично прийнятна сіль. 24. Сполука за п.20, яка являє собою N OH CH3 , CF3 H 3C H3C N OH CH 3 Cl , N N H3C N OH OH CH3 O N S N N , CF3 N N , Me O N OH OH CH3 N N CF 3 , або її фармацевтично прийнятна сіль. 25. Фармацевтична композиція, що містить сполуку за п.1 в комбінації з фармацевтично прийнятним носієм. 26. Застосування сполуки за п.1 в одержанні лікарського засобу, що використовується у лікуванні стану, вибраного з групи, яка складається з гіперглікемії, інсулінорезистентності, діабету 2-го типу, порушень жирового обміну, ожиріння, атеросклерозу і метаболічного синдрому. N CH 3 OH , Даний винахід стосується похідних триазолу як інгібіторів ферменту 11-бетагідроксистероїддегідрогенази 1-го типу (11β-ГСД-1 або ГСД-1) і способів лікування певних станів з їх використанням. Сполуки даного винаходу застосовуються для лікування діабету, наприклад, інсу 7 ліннезалежного діабету 2-го типу (ІНЗЦД), інсулінорезистентності, ожиріння, порушень жирового обміну, гіпертензії та інших захворювань і станів. Причиною діабету є множина факторів і найбільш спрощено діабет характеризується підвищеним вмістом глюкози в плазмі крові натщесерце (гіперглікемія). Існують дві найбільш вивчені форми діабету: діабет 1-го типу або інсулінзалежний цукровий діабет (ІЗЦД), при якому у пацієнтів продукується мало або не продукується інсулін, гормон, регулюючий засвоєння глюкози, і діабет 2-го типу, або інсуліннезалежний діабет 2-го типу (ІНЗЦД), при якому у пацієнтів продукується інсулін і навіть виявляється гіперінсулінемія (рівні інсуліну в плазмі крові такі ж, або навіть підвищені, у порівнянні з людьми, не страждаючими діабетом), при цьому у них виявляється гіперглікемія. Діабет 1-го типу звичайно лікують ін'єкційним введенням інсуліну. Однак, при діабеті 2-го типу часто розвивається "інсулінорезистентність", що стимулюючий вплив інсуліну на глюкозу і ліпідний метаболізм в основних інсулінчутливих тканинах, а саме, м'язах, печінці і жирових тканинах, знижений. Інсулінорезистентні пацієнти, які не є діабетиками, мають підвищені рівні інсуліну, що компенсують їх інсулінорезистентність, так, що рівні глюкози в сироватці крові не підвищені. У пацієнтів з ІНЗЦД, рівні інсуліну в плазмі крові, навіть якщо вони підвищені, недостатні для подолання вираженої інсулінорезистентності, приводячи до гіперглікемії. Інсулінорезистентність, головним чином, виникає через дефект зв'язування з рецептором, що поки ще не зовсім ясно. Резистентність до інсуліну приводить до недостатньої активації засвоєння глюкози, зниженого окислення глюкози і відкладення глікогену в м'язах, неадекватного придушення інсуліном ліполізу в жировій тканині і неадекватної продукції глюкози і секреції її печінкою. Хронічна або неконтрольована гіперглікемія, що спостерігається у діабетиків, пов'язана з підвищеною захворюваністю і передчасною смертністю. Ненормальний гомеостаз глюкози також як напряму, так і опосередковано, пов'язаний з ожирінням, гіпертензією і змінами в ліпідному, ліпопротеїновому і аполіпопротеїновому метаболізмі. Діабет 2-го типу супроводжується підвищеним ризиком розвитку серцево-судинних ускладнень, наприклад, атеросклерозу, захворювання коронарних артерій серця, інфаркту, захворювання периферичних судин, гіпертензії, нефропатії, нейропатії і ретинопатії. Отже, терапевтичний контроль над гомеостазом глюкози, ліпідним метаболізмом, ожирінням і гіпертензією є принципово важливим в клінічному управлінні і лікуванні цукрового діабету. Багато які пацієнти, що мають інсулінорезистентність, але що не мають виражений діабет 2-го типу, також схильні до ризику появи симптомів, названих "синдромом X" або "метаболічним синдромом". Синдром X і метаболічний синдром характеризуються інсулінорезистентністю, нарівні з абдомінальним ожирінням, гіперінсулінемією, високим кров'яним тиском, низьким рівнем ЛВЩ (ліпопротеїнів високої щільності) і високим рівнем ЛДНЩ (ліпопротеїнів дуже низької щільності). Такі пацієнти, в незалежності від того, чи мають вони 80459 8 виражений цукровий діабет чи ні, схильні до високого ризику розвитку серцево-судинних ускладнень, наведених вище. Лікування діабету 2-го типу звичайно включає фізичні вправи і дієту. Підвищення рівня інсуліну в плазмі введенням сульфонілсечовин (наприклад, толбутаміду і гліпізиду) або меглітиніду, який стимулює β-клітини підшлункової залози секретувати більше інсуліну, і/або ін'єкцією інсуліну, коли сульфонілсечовини або меглітинід стають неефективними, може привести до створення досить високої концентрації інсуліну для стимуляції інсулінрезистентних тканин. Однак, в результаті може виникнути небезпечно низький рівень глюкози, і, в кінцевому результаті, підвищений рівень інсулінорезистентності. Бігуаніди підвищують чутливість до інсуліну, приводячи до деякої корекції гіперглікемії. Однак, багато які бігуаніди, наприклад, фенформін і метформін, викликають лактоацидоз, нудоту і діарею. Глітазони (а саме, 5-бензилтіазолідин-2,4діони) утворюють новий клас ' 1 сполук зі здатністю поліпшення гіперглікемії та інших симптомів діабету 2-го типу. Дані агенти істотно підвищують чутливість до інсуліну м'язів, печінки і жирової тканини, приводячи до часткової або повної корекції підвищених рівнів глюкози в плазмі крові, в основному, не викликаючи гіпоглікемії. Глітазони, нещодавно випущені на ринок, є агоністами рецепторів, що активуються пероксисомним проліфератором підтипу гамма (РАПП). Вважають, що агонізм РАПП-гамма, в основному, відповідальний за підвищену чутливість до інсуліну, яка спостерігається у відношенні глітазонів. Нові РАПП-агоністи, створені для лікування діабету 2-го типу і/або дисліпідемії, є агоністами одного або більше РАППпідтипів альфа, гамма і дельта. Огляд за інсулінсенсибілізуючими агентами та іншими механізмами лікування діабету 2-го тину, [див. М. Tadayyon і S.A. Smith, "Insulin sensitisation in the treatment of Type 2 diabetes", Expert Opin. Investig. Drugs. 12: 307-324 (2003)]. Існує постійна потреба в нових способах лікування діабету і пов'язаних з ним станів, таких як метаболічний синдром. Даний винахід вирішує цю й інші задачі. Даний винахід стосується біцикло[2.2.2]-окт-1ил-1,2,4-триазолів структурної формули І: Дані похідні біцикло[2.2.2]-октилтриазолу ефективні як інгібітори 11βгідроксистероїддегідрогенази 1-го типу (11β-ГСД1). Таким чином, вони ефективні у лікуванні, контролі і профілактиці порушень, які реагують на інгібування 11β-ГСДI, таких як гіперглікемія, інсулінорезистентність, діабет 2-го типу, ліпідні порушення, ожиріння, атеросклероз і метаболічний синдром. Даний винахід також стосується фармацевтичних композицій, що містять сполуки даного винаходу і фармацевтично прийнятний носій. 9 Даний винахід також стосується способів лікування або контролювання гіперглікемії, інсулінорезистентності, діабету 2-го тину, ожиріння, ліпідних порушень, атеросклерозу і метаболічного синдрому введенням сполук і фармацевтичних композицій даного винаходу. Даний винахід стосується похідних біцикло[2.2.2]-окт-1-ил-1,2,4-триазолу, що застосовуються як інгібітори 11β-ГСД1. Сполуки даного винаходу описуються структурною формулою І: або їх фармацевтично прийнятною сіллю; де кожний p незалежно являє собою 0, 1 або 2; кожний n незалежно являє собою 0, 1 або 2; X вибирають з групи, що складається з одинарного зв'язку, О, S(O)p, NR6, R1 вибирають з групи, що складається з арилкарбонілу, (СН2)n-арилу, і (СН2)n-гетероарилу; де арил і гетероарил є незаміщеними або заміщеними від одного до трьох замісниками, незалежно вибраними з R5; R2 вибирають з групи, що складається з водню, С1-8алкілу, С2-6алкенілу, і (СН2)n-С3-6циклоалкілу, і в якому алкіл, алкеніл і циклоалкіл є незаміщеними або заміщеними від одного до трьох замісниками, незалежно вибраними з R8 і оксо; кожний R4 незалежно вибирають з групи, що складається з водню, галогену, гідрокси, оксо, С1-Залкілу, і С1-3алкокси; R3 вибирають з групи, що складається з водню, С1-10алкілу, С2-10алкенілу, (СН2)n-С3-6циклоалкілу, (СН2)n-арилу, (СН2)n-гетероарилу, і (СН2)n-гетероциклілу; в якому арил, гетероарил і гетероцикліл є незаміщеними або заміщеними від одного до трьох замісниками, незалежно вибраними з R5; і алкіл, алкеніл і циклоалкіл є незаміщеними або заміщеними від однієї до п'яти групами, незалежно вибраними з R8 і оксо; 80459 10 R5 і R8, кожний, незалежно вибирають з групи, що складається з водню, формілу, С1-6алкілу, (СН2)n-арилу, (СН2)n-гетероарил, (СН2)n-гетероциклілу, (СН2)n-С3-7циклоалкілу, галогену, OR7, (CH2)nN(R7)2, ціано, (CH2)nCO2R7, NO2, (CH2)nNR7SO2R6, (CH2)nSO2N(R7)2, (CH2)nS(O)pR6, (CH2)nSO2OR7, (CH2)nNR7C(O)N(R7)2, (CH2)nC(O)N(R7)2, (CH2)nNR6C(O)R6, (CH2)nNR6CO2R7, O(CH2)nC(O)N(R7)2, CF3, CH2CF3, OCF3, OCHCF2, і OCH2CF3; де арил, гетероарил, циклоалкіл і гетероцикліл є незаміщеними або заміщеними від одного до трьох замісниками, незалежно вибраними з галогену, гідрокси, С1-4алкілу, трифторметилу, трифторметокси і С1-4алкокси; і де будь-який вуглецевий атом метиленової групи (СН2) в R5 і R8 є незаміщеним або заміщеним однією-двома групами, незалежно вибраними з галогену, гідрокси і С14алкілу; або два замісники, що знаходяться на одному і тому ж вуглецевому атомі метиленової групи (СН2), взяті разом з атомом вуглецю, до якого вони приєднані, утворюють циклопропільну групу; кожний R6 незалежно вибирають з групи, що складається з С1-8алкілу, (СН2)n-арилу, (СН2)n-гетероарилу, і (СН2)n-С3-7циклоалкілу; де алкіл і циклоалкіл є незаміщеними або заміщеними від одного до п'яти замісниками, незалежно вибраними з галогену, оксо, С1-4алкокси, С14алкілтіо, гідрокси, аміно; і арил і гетероарил є незаміщеними або заміщеними від одного до трьох замісниками, незалежно вибраними з ціано, галогену, гідрокси, аміно, карбокси, трифторметилу, трифторметокси, С1-4алкілу і С1-4 алкокси; або двох R6 груп разом з атомом, до якого вони приєднані з утворенням 5-8-членної моно- або біциклічної кільцевої системи, що необов'язково містить додатковий гетероатом, вибраний з О, S і NC1-4алкілу; і кожний R7 є воднем або R6. В одному втіленні сполук даного винаходу R2 є циклопропілом, С1-3алкілом або С1-3алкенілом і R1 є фенілом або нафтилом, в якому феніл або нафтил є незаміщеними або заміщеними від одного до 11 трьох замісниками, незалежно вибраними з R5. У класі цього втілення, R5 вибирають з групи, що складається з галогену, гідрокси, трифторметилу, трифторметокси, С1-3алкілу, С1-3алкокси, С13алкілтіо і С1-3алкілсульфонілу. У підкласі цього класу R2 є метилом і R4 є воднем. У другому втіленні сполук даного винаходу X є одинарним зв'язком; R1 є фенілом або нафтилом, в якому феніл і нафтил є незаміщеними або заміщеними від одного до трьох замісниками, незалежно вибраними з R5; R2 є циклопропілом, С1-3алкілом або С2алкенілом; і 3 R3 є С1-6алкілом, незаміщеним або заміщеним одним або трьома замісниками, незалежно вибраними з R8 і оксо. У класі цього другого втілення R5 вибирають з групи, що складається з галогену, гідрокси, трифторметилу, трифторметокси, С1-3алкілу, С13алкокси, С1-3алкілтіо і С1-3алкілсульфонілу. У підкласі цього класу R2 є метилом і R4 є воднем. В іншому класі цього втілення R8 вибирають з групи, що складається з галогену, гідрокси, оксо, С1-4алкокси, С1-4алкілтіо, С1-4алкілсульфінілу, С14алкілсульфонілу, і феніл незаміщений або заміщений від однієї до трьох груп, незалежно вибраних з галогену і трифторметилу. У підкласі цього класу R2 є метилом і R4 є воднем. У третьому класі цього втілення R5 вибирають з групи, що складається з галогену, гідрокси, трифторметилу, трифторметокси, С1-3алкілу, С18 3алкокси, С1-3алкілтіо і С1-3алкілсульфонілу; і R вибирають з групи, що складається з галогену, гідрокси, оксо, С1-4алкокси, С1-4алкілтіо, С14алкілсульфошлу, і феніл незаміщений або заміщений від однієї до трьох груп, незалежно вибраних з галогену і трифторметилу. У підкласі цього класу R2 є метилом і R4 є воднем. У третьому втіленні сполук даного винаходу X є одинарним зв'язком; R1 є фенілом або нафтилом, в якому феніл і нафтил є незаміщеними або заміщеними від одного до трьох замісниками, незалежно вибраними з R5; R2 є циклопропілом, С1-3алкілом або С23алкенілом; і R3 є фенілом або гетероарилом, в якому феніл і гетероарил є незаміщеними або заміщеними від одного до трьох замісниками, незалежно вибраними з R5. У класі цього втілення R2 є метилом і R4 є воднем. В іншому класі даного втілення R3 є фенілом, незаміщеним або заміщеним від одного до трьох замісниками, незалежно вибраними з R5. У підкласі цього класу R5 вибирають з групи, що складається з галогену, гідрокси, трифторметилу, трифторметокси, С1-3алкілу, С1-3алкокси, С1-3алкілтіо і С1-3алкілсульфонілу. У підкласі цього класу R2 є метилом і R4 є воднем. У третьому класі цього втілення R3 є оксадіазолілом, незаміщеним або заміщеним від одного до двох замісників, незалежно вибраних з R5. 80459 12 У підкласі цього класу, R5 є фенілом, незаміщеним або заміщеним від одного до трьох замісників, незалежно вибраними з галогену, гідрокси, С1-4алкілу, трифторметилу, трифторметокси і С12 4 4алкокси. У підкласі цього класу R є метилом і R є воднем. У даному описі застосовуються наступні визначення. "Алкіл", також як і інші групи, що мають префікс "алк", такі як алкокси і алканоїл, мають на увазі вуглецеві ланцюги, які можуть бути лінійними або розгалуженими, і їх комбінації, якщо вуглецевий ланцюг не визначений інакше. Приклади алкільних груп включають метил, етил, пропіл, ізопропіл, бутил, втор- і трет-бутил, пентил, гексил, гептил, октил, ноніл і тому подібні. У випадку, коли певне число вуглецевих атомів дозволяє, наприклад, від С3-іо, термін "алкіл" також включає циклоалкільні групи, і комбінації лінійних або розгалужених алкільних ланцюгів, конденсованих з циклоалкільними структурами; коли число вуглецевих атомів не визначене, мається на увазі С1-6. "Алкеніл" має на увазі вуглецеві ланцюги, які містять, щонайменше, один вуглець-вуглецевий подвійний зв'язок, які можуть бути лінійними або розгалуженими або їх комбінації, якщо вуглецевий ланцюг не визначений інакше. Приклади алкенілу включають вініл, аліл, ізопропеніл, пентеніл, гексеніл, гептеніл, 1-пропеніл, 2-бутеніл, 2-метил-2бутеніл і тому подібні. У випадку, коли певне число вуглецевих атомів дозволяє, наприклад, від С5-10, термін "алкеніл" також включає циклоалкенільні групи, і комбінації лінійних, розгалужених і циклічних структур. Коли число вуглецевих атомів не визначене, мається на увазі С2-6. "Алкініл" має на увазі вуглецеві ланцюги, які містять, щонайменше, один вуглець-вуглецевий потрійний зв'язок, і які можуть бути лінійними або розгалуженими, або їх комбінації. Приклади алкінілу включають етиніл, пропаргіл, 3-метил-1пентиніл, 2-гептиніл і тому подібні. "Циклоалкіл" є підтипом алкілу і має на увазі насичене карбоциклічне кільце, що має певне число вуглецевих атомів. Приклади циклоалкілу включають циклопропіл, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, і тому подібні. Циклоалкільна група є, в основному, моноциклічною, якщо не визначено інакше. Циклоалкільні групи є насиченими, якщо не визначено інакше. Термін "алкокси" стосується прямого або розгалуженого ланцюга алкоксидів з певним числом атомів вуглецю (наприклад, С1-6алкокси) або з будь-яким числом атомів вуглецю в межах даного інтервалу [тобто, метокси (МеО-), етокси, ізопропокси, і т.д.]. Термін "алкілтіо" стосується прямого або розгалуженого ланцюга алкіл сульфідів з певним числом атомів вуглецю (наприклад, С1-6алкілтіо), або з будь-яким числом атомів вуглецю в межах даного інтервалу [тобто, метилтіо (MeS-), етилтіо, ізопропілтіо, і т.д.]. Термін "алкіламіно" стосується прямого або розгалуженого ланцюга алкіл амінів з певним числом атомів вуглецю (наприклад, С1-6алкіламіно) або з будь-яким числом атомів вуглецю в межах 13 даного інтервалу [тобто, метиламіно, етиламіно, ізопропіламіно, т-бутиламіно, і т.д.]. Термін "алкілсульфоніл" стосується прямого або розгалуженого ланцюга алкілсульфонів з певним числом атомів вуглецю (наприклад, С16алкілсульфоніл) або з будь-яким чиедом атомів вуглецю в межах даного інтервалу, [тобто, . метилсульфоніл (MeSO2-), етилсульфоніл, ізопропілсульфоніл, і т.д.]. Термін "алкілсульфініл" стосується прямого або розгалуженого ланцюга алкілсульфоксидів з певним числом атомів вуглецю (наприклад, С16алкілсульфініл); або з будь-яким числом атомів вуглецю в межах даного інтервалу [тобто, метилсульфініл (MeSO-), етилсульфініл, ізопропілсульфініл, і т.д.]. Термін "алкілоксикарбоніл" стосується прямого або розгалуженого ефіру похідних карбонових кислот даного винаходу з певним числом атомів вуглецю (наприклад, С1-6алкілоксикарбоніл) або з будь-яким числом атомів вуглецю в межах даного інтервалу [тобто, метилоксикарбоніл (МеОСО-), етилоксикарбоніл або бутилоксикарбоніл]. "Арил" має на увазі моно- або поліциклічну ароматичну кільцеву систему, що містить атоми вуглецевого кільця. Переважними арилами є моноциклічні або біциклічні 6-10-членні кільцеві ароматичні системи. Переважними арилами є феніл і нафтил. Найбільш переважним арилом є феніл. "Гетероцикл" і "гетероцикліл" стосуються насичених або ненасичених неароматичних кілець або кільцевих систем, що містять, щонайменше, один гетероатом, вибраний з О, S і N, що додатково містять окислені форми сірки, а саме SO і SO2. Приклади гетероциклів включають тетрагідрофуран (ТГФ), дигідрофуран, 1,4-діоксан, морфолін, 1,4-дитіан, піперазин, піперидин, 1,3-діоксолан, імідазолідин, імідазолін, піролін, піролідин, тетрагідропіран, дигідропіран, оксатіолан, дитіолан, 1,3діоксан, 1,3-дитіан, оксатіан, тіоморфолін і тому подібні. "Гетероарил" має на увазі ароматичний або частково ароматичний гетероцикл, який містить, щонайменше, один кільцевий гетероатом, вибраний з О, S і N. Гетероарили, отже, включають гетероарили, конденсовані з іншими типами кілець, такими як арили, циклоалкіли і гетероцикли, які не є ароматичними. Приклади гетероарильних груп включають: піроліл, ізоксазоліл, ізотіазоліл, піразоліл, піридил, оксазоліл, оксадіазоліл, тіадіазоліл, тіазоліл, імідазоліл, триазоліл, тетразоліл, фурил, триазиніл, тієніл, піримідил, бензізоксазоліл, бензоксазоліл, бензотіазоліл, бензотіадіазоліл, дигідробензофураніл, індолініл, піридазиніл, індазоліл, ізоіндоліл, дигідробензотієніл, індолізиніл, цинолініл, фталазиніл, хіназолініл, нафтиридиніл, карбазоліл, бензодіоксоліл, хіноксалініл, пуриніл, фуразаніл, ізобензилфураніл, бензімідазоліл, бензофураніл, бензотієніл, хіноліл, індоліл, ізохіноліл, дибензофураніл і тому подібні. У поняття гетероциклільної і гетероарильної груп включені кільця і кільцеві системи, що містять 3-15 атомів, утворюючи 1-3 кільця. 80459 14 "Галоген" стосується фтору, хлору, брому і йоду. В основному, переважними є хлор і фтор. Фтор найбільш переважний, коли галогени заміщені алкільною або алкоксигрупою (наприклад, CF3O і CF3CH2O). Термін "композиція", наприклад, фармацевтична композиція, охоплює продукт, що містить активний інгредієнт(и), та інертний інгредієнт(и), що утворює носій, також як будь-який продукт, який виходить напряму або опосередковано, комбінацією, комплексоутворенням або агрегацією будьяких двох або більше інгредієнтів, або дисоціацією одного або більше інгредієнтів, або іншими типами реакцій або взаємодій одного або більше інгредієнтів. Відповідно, фармацевтичні композиції даного винаходу включають будь-яку композицію, утворену змішуванням сполуки даного винаходу і фармацевтично прийнятного носія. Потрібно розуміти, що терміни "введення" і "призначення" сполуки, мають на увазі застосування сполуки даного винаходу або проліків сполуки даного винаходу для індивідуального споживання. Сполуки структурної формули І можуть містити один або більш асиметричних центрів і, отже, можуть існувати у вигляді рацематів і рацемічних сумішей, окремих енантіомерів, діастереомерних сумішей та індивідуальних діастереомерів. Мається на увазі, що даний винахід охоплює всі дані ізомерні форми сполук структурної формули І. Деякі з описаних тут сполук містять олефінові подвійні зв'язки і, якщо інакше не визначено, мається на увазі, що вони містять геометричні ізомери Ε і Ζ. Деякі з описаних тут сполук можуть існувати у вигляді таутомерів, таких як кетоенольні таутомери. Індивідуальні таутомери, також як і їх суміші, охоплені сполуками структурної формули І. Сполуки структурної формули І можуть бути розділені на індивідуальні діастереоізомери, наприклад, фракційною кристалізацією з відповідного розчинника, наприклад, метанолу або етилацетату, або їх суміші, або за допомогою хіральної хроматографії з використанням оптично активної стаціонарної (нерухомої) фази. Абсолютна стереохімія може бути визначена рентгенокристалографією кристалічних продуктів або кристалічних інтермедіатів, які дериватизують, якщо необхідно, реактивом, що містить асиметричний центр відомої абсолютної конфігурації. Альтернативно, будь-який стереоізомер загальної структурної формули І може бути одержаний стереоспецифічним синтезом, використовуючи оптично чисті вихідні матеріали або реагенти відомої абсолютної конфігурації. В іншому аспекті даного винаходу фармацевтична композиція цілеспрямовано містить сполуку згідно зі структурною формулою І або фармацевтично прийнятною сіллю, або їх сольватами, в комбінації з фармацевтично прийнятним носієм. Під терміном "сольват" мається на увазі гідрат, алкоголят або інший кристалізаційний сольват. Інший аспект даного винаходу направлений на спосіб лікування гіперглікемії, діабету або інсулінорезистентності у ссавців, потребуючих такого лікування, який включає введення вказаному паці 15 єнту ефективної кількості сполуки, відповідної структурній формулі І, або фармацевтично прийнятної солі або їх сольватів. В іншому аспекті даного винаходу описаний спосіб лікування інсуліннезалежного цукрового діабету (2-го типу) у ссавців, потребуючих такого лікування, що включає введення пацієнту ефективної кількості антидіабетичної сполуки, відповідної структурній формулі І. У наступному аспекті даного винаходу описаний спосіб лікування ожиріння у ссавців, потребуючих такого лікування, що включає введення вказаному пацієнту сполуки, відповідної структурній формулі І, в кількості, ефективній для лікування ожиріння. В іншому аспекті даного винаходу описаний спосіб лікування метаболічного синдрому у ссавців, потребуючих такого лікування, що включає введення вказаному пацієнту сполуки, відповідної структурній формулі І, в кількості, ефективній для лікування метаболічного синдрому. У наступному аспекті даного винаходу описаний спосіб лікування порушення жирового обміну, вибраного з групи, що складається з дисліпідемії, гіперліпідемії, гіпертригліцеридемії, гіперхолестеринемії, низького вмісту ЛВЩ, і високого вмісту ЛНЩ у ссавця-пацієнта, потребуючого такого лікування, що включає введення вказаному пацієнту сполуки, відповідної структурній формулі І; в кількості, ефективній для лікування вказаного порушення жирового обміну. В іншому аспекті даного винаходу описаний спосіб лікування атеросклерозу у ссавця-пацієнта, потребуючого такого лікування, що включає введення вказаному пацієнту сполуки, відповідно структурній формулі І, в кількості, ефективній для лікування атеросклерозу. Інший аспект даного винаходу стосується використання сполук структурної формули І для лікування гіперглікемії, інсулінорезистентності, діабету 2-го типу, ліпідних порушень, ожиріння, атеросклерозу і метаболічного синдрому. Крім того, додатковий аспект даного винаходу забезпечує використання сполук структурної формули І у виробництві лікарських засобів для застосування у лікуванні стану, вибраного з групи, що складається з гіперглікемії, інсулінорезистентності, діабету 2-го типу, порушень жирового обміну, ожиріння, атеросклерозу і метаболічного синдрому. Сполуки даного винаходу можуть бути введені у формі фармацевтично прийнятної солі. Термін "фармацевтично прийнятна сіль" відноситься до солей, приготованих з фармацевтично прийнятних нетоксичних основ або кислот, включаючи неорганічні або органічні основи і неорганічні або органічні кислоти. Солі основних сполук, охоплені терміном "фармацевтично прийнятна сіль", відносяться до нетоксичних солей сполук даного винаходу, які, в основному, одержують взаємодією вільної основи з відповідною органічною або неорганічною кислотою. Представники солей основних сполук даного винаходу включають, не обмежуючись ними: ацетат, бензолсульфонат, бензоат, бікарбонат, бісульфат, бітартрат, борат, бромід, камсилат, карбонат, хлорид, клавуланат, цитрат, 80459 16 дигідрохлорид, едетат, едисилат, естолат, есилат, фумарат, глуцептат, глюконат, глютамат, гліколліларсанілат, гексилрезорцинат, гідрабамін, гідробромід, гідрохлорид, гідроксинафтоат, йодид, ізотіонат, лактат, лактобіонат, лаурат, малат, малеат, манделат, мезилат, метилбромід, метилнітрат, метилсульфат, мукат, напсилат, нітрат, амонієву сіль N-метилглюкаміну, олеат, оксалат, памоат (ембонат), пальмітат, пантотенат, фосфат/дифосфат, полігалактуронат, саліцилат, стеарат, сульфат, субацетат, сукцинат, таннат, тартрат, теоклат, тозилат, триетилйодид і валерат. Крім того, коли сполуки даного винаходу несуть кислотну ділянку, їх фармацевтично прийнятні солі включають, не обмежуючись ними, солі, що одержуються з неорганічних основ, які містять алюміній, амоній, кальцій, мідь, залізо, двовалентне залізо, літій, магній, тривалентний марганець, двовалентний марганець, калій, натрій, цинк і тому подібні. Особливо переважними є амонієві, кальцієві, магнієві, калієві і натрієві солі. Солі, що одержуються з органічних нетоксичних основ, включають солі первинних, вторинних і третинних амінів, циклічних амінів, і основні іонообмінні смоли, такі як аргінін, бетаїн, кофеїн, холін, Ν,Νдибензилетилендіамін, діетиламін, 2діетиламіноетанол, 2-диметиламіноетанол, етаноламін, етилендіамін, N-етилморфолін, Nетилпіперидин, глюкамін, глюкозамін, гістидин, гідрабамін, ізопропіламін, лізин, метилглюкамін, морфолін, піперазин, піперидин, поліамінові смоли, прокаїн, пурини, теобромін, триетиламін, триметиламін, трипропіламін, трометамін і тому подібні. Також, у випадку карбонової кислоти (-СООН) або спиртової групи, представленої у сполуках даного винаходу, можуть бути застосовані фармацевтично прийнятні ефіри похідних карбонової кислоти, такі як метильні, етильні, або півалоїлоксиметильні, або ацильні похідні спиртів, таких як ацетат або малеат. Включені ті ефіри і ацильні групи, які відомі в рівні техніки модифікуючими розчинність або гідроліз характеристиками при застосуванні як композиції з уповільненим вивільненням або проліків. Потрібно розуміти, що посилання, які використовуються тут на сполуки структурної формули І, як мається на увазі, також включають фармацевтично прийнятні солі, а також солі, які не є фармацевтично прийнятними при використанні їх як попередників вільних сполук або їх фармацевтично прийнятних солей або в інших процесах синтезу. Сольвати, і, зокрема, гідрати сполук структурної формули І також включені в даний винахід. Сполуки, що описуються тут, є селективними інгібіторами ферменту 11β-ГСД1. Таким чином, даний винахід стосується застосування інгібіторів 11β-ГСД1 для інгібування редуктазної активності 11β-гідроксистероїддегідрогенази, відповідальної за перетворення кортизону в кортизол. Надлишок кортизолу пов'язаний з множиною порушень, включаючи ІНЗЦД, ожиріння, дисліпідемію, інсулінорезистентність і гіпертензію. Введення сполук даного винаходу знижує рівень кортизолу та інших 11β-гідроксистероїдів в тканинах-мішенях, таким 17 чином, знижуючи ефекти надмірних кількостей кортизолу та інших 11β-гідроксистероїдів. Інгібування 11β-ГСД1 може бути використане у лікуванні і контролюванні захворювань, зумовлених ненормально високими рівнями кортизолу та інших 11β-гідроксистероїдів, таких як ІНЗЦД, ожиріння, гіпертензії і дисліпідемії. Інгібування активності 11β-ГСД в мозку, наприклад, зниження рівня кортизолу, може бути також корисним у лікуванні або зниженні тривоги, депресії і когнітивного погіршення. Даний винахід також включає застосування інгібітору 11β-ГСД1 для лікування, контролю, поліпшення, запобігання, відстрочення початку або зниження ризику розвитку захворювань і станів, які описані тут, зумовлених надлишком або неконтрольованими кількостями кортизолу і/або інших кортикостероїдів у ссавця-пацієнта, особливо, у людини, введенням ефективної кількості сполуки структурної формули І або її фармацевтично прийнятної солі або сольвату. Інгібування ферменту 11β-ГСД1 обмежує перетворення кортизону, який в нормі інертний, в кортизол, який може зумовлювати або давати внесок в симптоми таких захворювань і станів, якщо присутній в надмірних кількостях. ІНЗЦД і гіпертензія: Сполуки даного винаходу є селективними інгібіторами у відношенні 11β-ГСД1 у порівнянні з 11β-ГСД2. У той час як інгібування 11β-ГСД1 застосовується для зниження рівня кортизолу і лікування станів, пов'язаних з ним, інгібування 11βГСД2 пов'язане з серйозними побічними ефектами, такими як гіпертензія. Кортизол є важливим і добре вивченим протизапальним гормоном, який також діє як антагоніст дії інсуліну в печінці, таким чином, що чутливість до інсуліну знижується, приводячи до зниженого глюконеогенезу і підвищеного рівня глюкози в печінці. Пацієнти, що вже мають розвинену толерантність до глюкози, мають велику імовірність розвитку діабету 2-го типу за наявності ненормально високих рівнів кортизолу. Високий рівень кортизолу в тканинах, де присутній рецептор до мінералокортикоїду, часто веде до гіпертензії. Інгібування 11β-ГСД1 зсуває співвідношення кортизолу і кортизону в певних тканинах на користь кортизону. Введення терапевтично ефективної кількості інгібітору 11β-ГСД1 ефективне у лікуванні, контролюванні і поліпшенні симптомів ІНЗЦД і регулярне введення терапевтично ефективної кількості інгібітору 11β-ГСД1 віддаляє або запобігає виникненню ІНЗЦД, зокрема, у людей. Ожиріння, метаболічний синдром, дисліпідемія: Надмірні рівні кортизолу пов'язані з ожирінням, ймовірно, завдяки підвищеному печінковому глюконеогенезу. Абдомінальне ожиріння тісно пов'язане з нетолерантністю до глюкози, гіперінсулінемією, гіпертригліцеридемією та іншими факторами метаболічного синдрому, такими як високий кров'яний тиск, підвищений рівень ЛДНЩ і знижений рівень ЛВЩ. [Montague та інш., Diabetes, 2000, 49: 883-888.]. Таким чином, введення ефективної кіль 80459 18 кості інгібітору 11β-ГСД1 застосовується у лікуванні або контролюванні ожиріння. Тривале лікування інгібітором 11β-ГСД1 також застосовується у відтягуванні або запобіганні початку ожиріння, особливо, якщо пацієнт застосовує інгібітор 11β-ГСД1 в комбінації з контрольованою дієтою і вправами. Сполуки даного винаходу можуть знайти застосування в лікуванні і профілактиці станів, супроводжуючих діабет 2-го тину та інсулінорезистентність, включаючи метаболічний синдром або синдром X, ожиріння, реактивну гіпоглікемію і діабетичну дисліпідемію, за рахунок зниження інсулінорезистентності і збереження рівня глюкози в плазмі у нормальних концентраціях. Атеросклероз: Як описано вище, інгібування активності 11βГСД1 і зниження кількості кортизолу корисні у лікуванні або контролюванні гіпертензії. У зв'язку з тим, що гіпертензія і дисліпідемія роблять внесок в розвиток атеросклерозу, введення терапевтично ефективної кількості інгібітору 11β-ГСД1 даного винаходу може також бути особливо корисним у лікуванні, контролюванні, відтягуванні початку або профілактиці атеросклерозу. Інші варіанти застосування: Наступні захворювання, порушення і стани можна лікувати, контролювати, запобігати або віддаляти їх виникнення лікуванням сполуками даного винаходу: (1) гіперглікемія, (2) низька толерантність до глюкози, (3) інсулінорезистентність, (4) ожиріння, (5) ліпідні порушення, (6) дисліпідемія, (7) гіперліпідемія, (8) гіпертригліцеридемія, (9) гіперхолестеринемія, (10) низький рівень ЛВЩ, (11) високий рівень ЛНЩ, (12) атеросклероз і його наслідки, (13) судинний рестеноз, (14) панкреатит, (15) абдомінальне ожиріння, (16) нейродегенеративне захворювання, (17) ретинопатія, (18) нефропатія, (19) нейропатія, (20) метаболічний синдром, (21) гіпертензія та інші порушення, в яких компонентом є інсулінорезистентність. Вищеперелічені захворювання і стани можна лікувати, використовуючи сполуки структурної формули І, або можна вводити сполуки для запобігання або зниження ризику розвитку захворювань і станів, описаних тут. У зв'язку з тим, що конкурентне інгібування 11β-ГСД2 може мати небезпечні побічні ефекти або може фактично підвищити кількість кортизолу в тканині-мішені, де зниження вмісту кортизолу є бажаним, бажані селективні інгібітори 11β-ГСД1 з незначним інгібуванням 11β-ГСД2 або його відсутністю. Інгібітори 11β-ГСД1 структурної формули І, в основному, мають константу інгібування ІС50 менше, ніж, приблизно, 500нМ, і, переважно, менше, 19 ніж приблизно, 100нМ. В основному, значення ІС50 для сполуки 11β-ГСД2 у порівнянні з 11β-ГСД1 дорівнює, щонайменше, двом або більш, і, переважно, приблизно, десяти або більше. Ще більш переважні сполуки зі значенням ІС 50 для 11βГСД2, у порівнянні, з 11β-ГСД1, приблизно, 100 або більше. Наприклад, сполуки даного винаходу ідеально демонструють константу інгібування ІС 50 при дії проти 11β-ГСД2 більше, ніж приблизно, 1000нМ, і, переважно, більш ніж 5000нМ. Будь-який придатний шлях введення може бути застосований для забезпечення ссавця, особливо, людини, ефективною дозою сполуки даного винаходу. Наприклад, пероральний, ректальний, місцевий, парентеральний, окулярний, інгаляційний, інтраназальний і тому подібні. Дозовані форми включають таблетки, пастилки, дисперсії, суспензії, розчини, капсули, креми, мазі, аерозолі і тому подібні. Переважно сполуку структурної формули І вводити перорально. Ефективне дозування активного інгредієнту варіює в залежності від окремої сполуки, що застосовується, режиму введення, стану, що виліковується, і вираженості стану. Таке дозування може бути легко встановлене кваліфікованим фахівцем в даній галузі. При лікуванні або профілактиці захворювань і станів, що описуються тут, для чого призначені сполуки структурної формули І, одержані задовільні результати при введенні сполук даного винаходу в денній дозі від, приблизно, 0,1 до, приблизно, 100 міліграм на кілограм (мнк) маси тіла, що переважно вводиться у вигляді разової денної дози або у вигляді окремих доз, приблизно, від двох до шести разів на день. Загальна денна доза, таким чином, знаходиться в межах від, приблизно, 0,1мг до, приблизно, 1000мг, переважно від, приблизно, 1мг до, приблизно, 50мг. У випадку стандартної дорослої людини масою 70кг, загальна денна доза буде варіювати від, приблизно, 7мг до, приблизно, 350мг. Дане дозування може бути змінене для забезпечення оптимального терапевтичного ефекту. Інший аспект даного винаходу стосується фармацевтичної композиції, яка містить сполуку структурної формули І, або фармацевтично прийнятну сіль або її сольват, в комбінації з фармацевтично прийнятним носієм. Дані композиції включають придатні для перорального, ректального, місцевого, парентерального (включаючи, підшкірне, внутрішньом'язове і внутрішньовенне),. окулярного (офтальмологічного), трансдермального, інгаляційного (назальної або букальної інгаляції), або інтраназального введення, хоча найбільш придатний шлях введення в будь-якому наявному випадку буде залежати від природи і вираженості стану, що виліковується, і активного інгредієнту. Вони можуть бути зручно представлені у вигляді стандартної дозованої форми і приготовані за допомогою будь-кого добре відомих у фармації методів. Сполука структурної формули І може бути об'єднана з фармацевтично прийнятним носієм, відповідно до традиційних методик приготування фармацевтичних препаратів. Носії можуть мати 80459 20 широку різноманітність форм. Наприклад, носії для пероральних рідких композицій включають, наприклад, воду, гліколі, олії, спирти, ароматизуючі агенти, консерванти, барвники та інші компоненти, що використовуються у виробництві пероральних рідких суспензій, еліксири і розчини. Носії, такі як крохмаль, цукор і мікрокристалічна целюлоза, розріджувачі, гранулюючі агенти, змащувальні речовини, зв'язувальні речовини, дезінтегруючі агенти і тому подібні використовують у приготуванні твердих дозованих форм, наприклад, порошків, твердих і м'яких капсул і таблеток. Тверді препарати для перорального застосування переважні у порівнянні з рідкими. Пероральні тверді дозовані форми можуть також містити зв'язувальну речовину, таку як камедь трагаканту, акації, кукурудзяний крохмаль або желатин; ексципієнти, такі як дикальцій фосфат; дезінтегруючий агент, такий як кукурудзяний крохмаль, картопляний крохмаль, альгінова кислота; змащувальна речовина, така як стеарат магнію; і підсолоджувач, такий як сахароза, лактоза або сахарин. Капсули можуть також містити рідкий носій, такий як жирна олія. Різні інші матеріали можуть бути присутніми і діяти як покриття або модифікувати фізичну форму стандартної дози. Наприклад, таблетки можуть бути покриті шелаком, цукром або ними обома. Таблетки можуть бути покриті за допомогою стандартних водних або безводних методик. Звичайний процентний вміст активної сполуки в даних композиціях може, звичайно, варіювати від, приблизно, 2 процентів, до, приблизно, 60мас/мас, процентів на основі. Таким чином, таблетки містять сполуку структурної формули І або її сіль або гідрати в кількості, що варіює вже від, приблизно, 0;1мг до, приблизно, 1,5г, переважно від, приблизно, 1,0мг до, приблизно, 500мг, і більш переважно від, приблизно, 10мг до, приблизно, 100мг. Рідкі форми для перорального застосування, такі як сиропи або еліксири можуть містити, в доповнення до активного інгредієнту, сахарозу, як підсолоджувач, метил або пропілпарабени як консерванти, барвник і ароматизатор, наприклад, вишневий або апельсиновий аромат. Парентеральні форми звичайно існують у вигляді розчину або суспензії, звичайно приготовані на воді і необов'язково містять поверхневоактивну речовину, таку як гідроксипропілцелюлоза. Дисперсії можуть бути приготовані на гліцерині, рідких поліетиленгліколях і їх сумішах в оліях. Звичайно препарати у розбавлених формах також містять консерванти. Фармацевтичні дозовані ін'єкційні форми, включаючи водні розчини і дисперсії і порошки для екстемпорального приготування ін'єкційних розчинів або дисперсій, також стерильні і повинні бути рідкими в такій мірі, щоб їх можна було легко набрати шприцом; вони повинні бути стабільні в умовах виробництва і зберігання, і традиційно, містити консерванти. Носій, таким чином, включає розчинник або дисперсійне середовище, що містить, наприклад, воду, етанол, поліол (наприклад, гліцерин, пропіленгліколь і рідкий поліетиленгліколь), їх відповідні суміші і олії. 21 Аналізи: вимірювання констант інгібування: За допомогою Scintillation Proximity Assay (SPA) оцінювали ферментну активність для тестсполук. Коротко, мічений тритієм субстрат кортизону, кофактор НАДФН і титровану сполуку структурної формули І інкубували з 11β-ГСД1 при 37°С для перетворення в кортизол. Після інкубації препаратом білка А покривали SPA гранули, заздалегідь змішані з антикортизол-моноклональними антитілами і неспецифічним інгібітором 11β-ГСД, наприклад, 18β-гліцеритиновою кислотою, додавали в кожну ямку. Суміш струшували при 15°С і, потім, аналізували за допомогою рідинного сцинтиляційного лічильника, придатного для 96 ямок. Процент інгібування підраховували відносно неінгібованої контрольної ямки і будували криві ІС 50. Даний аналіз застосовували подібним чином у відношенні 11β-ГСД2, при цьому мічений тритієм кортизол і НАД використали як субстрат і кофактор, відповідно. Для початку аналізу, додавали 40мкл субстрату (25нМ 3Н-кортизону +1,25мМ НАДФН в 50мМ буфері HEPES, рН7,4) в певні ямки в 96-ямковому планшеті. Сполуки розчиняли в 10мМ ДМСО з подальшим 50-кратним розбавленням ДМСО. Розбавлений матеріал потім 4-кратно титрували, сім разів. 1мкл кожної титрованої сполуки потім додавали у подвійній кількості до субстрату. Для ініціювання взаємодії в кожну ямку додавали 10мкл 11β-ГСД1 мікросоми з СНОтрансфектантів у відповідній концентрації з одержанням приблизно 10%-ного перетворення вихідного матеріалу. Для остаточного підрахунку процента інгібування додавали серії ямок, що представляли мінімум і максимум в аналізі: один набір, що містить субстрат без сполуки або фермент (фон), та інший набір, що містить субстрат і фермент без якої-небудь сполуки (максимальний сигнал). Планшети короткочасно центрифугували при низькій швидкості в центрифузі для об'єднання реагентів, закрили адгезивною смужкою, акуратно змішали, та інкубували при 37°С протягом 2год. Після інкубації в кожну ямку додавали 45мкл, SPA гранули, заздалегідь суспендовані з антикортизол-моноклональними антитілами і сполукою формули І. Планшети повторно закривали і акуратно струшували протягом більше ніж 1,5год. при 15°С. Дані збирали з рідинного сцинтиляційного лічильника для планшета, такого як Topcount. Для контролю над інгібуванням зв'язування антикортизол-антитіл з кортизолом, субстрат, зв'язаний з 1,25нМ [3]Н-кортизолом, додавали в певні стандартні ямки. 1мкл 200мкМ сполуки додавали в кожну з цих ямок разом з 10мкл буфера, замість ферменту. Будь-яке обчислене інгібування спостерігалось завдяки тому, що сполука заважала зв'язуванню кортизолу з антитілами на SPA гранули. Аналізи: вимірювання інгібування in vivo: У загальних термінах, тест-сполуку перорально вводили ссавцеві і чекали закінчення інтервалу часу, що описується, звичайно між 1 і 24год. Мічений тритієм кортизон вводили внутрішньовенно, з подальшим, після декількох хвилин, збиранням крові. Стероїди екстрагували з сепарованої сироватки і аналізували за допомогою ВЕРХ. Відносні рівні 3Н-кортизону і продукту його відновлення, 3 Н 80459 22 кортизолу, визначали для сполуки і контрольних груп, що приймали носій. Виходячи з даних значень, розраховували абсолютне перетворення і процент інгібування. Більш конкретно, сполуки готували для перорального введення розчиненням їх в носії (5% гідроксипропіл-бета-циклодекстрин об./об. Н2О, або еквівалент) в необхідній концентрації для одержання дозування, звичайно, 10мг на кг. Після нічного голодування розчини вводили ICR мишам (одержані від Charles River) пероральним зондом, 0,5мл на дозу на тварину, з трьома тваринами в тест-групі. Після закінчення необхідного часу, звичайно або через 4 або 16год., вводили в хвостову вену 0,2мл 3мкМ 3Н-кортизону в dPBS. Тварину відсаджували і через дві хвилини умертвляли в СО 2камері. Після смерті мишу видаляли і збирали кров пункцією серця. Кров залишали в пробірці для відділення сироватки не менше ніж на 30хв. при кімнатній температурі для досягнення адекватної коагуляції. Після інкубаційного періоду кров сепарували з одержанням сироватки центрифугуванням при 3000Xg, 4°C, протягом 10хв. Для аналізу стероїдів в сироватці їх спочатку екстрагували органічним розчинником. 0,2мл сироватки переносили в чисту мікроцентрифугальну пробірку. До цієї кількості додавали 1,0мл етилацетату, з подальшим енергійним струшуванням протягом 1хв. Швидке центрифугування в мікроцентрифузі приводить до утворення осаду водних сироваткових білків і просвітленого органічного супернатанту. 0,85мл верхньої органічної фази перенесли в чисту мікроцентрифугальну пробірку і висушили. Висушений зразок ресуспендували в 0,250мл ДМСО, що містить високу концентрацію кортизону і кортизолу для аналізу за допомогою ВЕРХ. Зразок об'ємом 0,200мл вводили в хроматографічну колонку С-18 Metachem Inertsil, урівноважену 30% метанолом. Повільний лінійний градієнт до 50% метанолу розділив цільові стероїди; одночасний моніторинг за допомогою УФ при 254нМ охолоджених стандартів в ресуспендованому розчині діяв як внутрішній стандарт. Тритієвий сигнал фіксували радіохроматографічним детектором і аналізували за допомогою відповідного програмного забезпечення. Процент перетворення 3Нкортизону в 3Н-кортизол обчислювали як відношення AUC для кортизолу до загальної AUC для кортизону і кортизолу. Приготування сполук даного винаходу: Сполуки даного винаходу структурної формули І можуть бути одержані відповідно до методик наступних схем і прикладів, використовуючи відповідні матеріали, і далі представлені наступними окремими прикладами. Сполуки, ілюстровані прикладами, не є, однак, єдиним класом сполук, який розглядається як сполуки даного винаходу. Приклади далі ілюструють в деталях одержання сполук даного винаходу. Кваліфіковані в цій галузі фахівці легко зрозуміють, що відомі варіації умов і процесів наступних препаративних методик можуть бути використані в одержанні даних сполук. Представлені сполуки виділяють, в основному, в нейтральній формі, але фрагмент триазолу може 23 бути далі перетворений у фармацевтично прийнятну сіль розчиненням в органічному розчиннику з подальшим додаванням відповідної кислоти і подальшим випарюванням, осадженням або кристалізацією. Всі температури виражені в градусах Цельсія, якщо іншого не відмічено. Мас-спектри (МС) були виміряні за допомогою масспектроскопії з іонним електророзпилюванням (МСІЕР). Фраза "умови стандартного пептидного синтезу" означає зв'язування карбонової кислоти з аміном з використанням агента, що активує кислоту, такого як EDC, DCC і ВОР в інертному розчиннику, такому як дихлорметан, у присутності каталізатора, такого як НОВТ. Використання захисних груп для аміну і карбонової кислоти призначене для полегшення необхідної взаємодії і мінімізації небажаних реакцій, що добре відомо. Умови, необхідні для видалення захисних груп, можна дізнатись зі стандартних книг, таких як [Greene, Т., і Wuts, P. G. Μ., Protective Groups in Organic Synthesis, John Wiley & Sons, Inc., New York, NY, 1991]. Cbz і ВОС є захисними групами, що звичайно використовуються в органічному синтезі, і умови їх видалення відомі фахівцеві в даній галузі. Абревіатури, що використовуються в описі одержання сполук даного винаходу: AIBN ВОС ВВr3 9-BBN Вn nBuLi Cbz CDI MeOTf CH2Cl2 CH2I 2 (COCl)2 Cs2CO3 DAST DMAP ДМФА Et Et3N EtOAc Et2Zn H2O2 Me iPr MeCN MeOH mCPBA MC NaBH4 NaHCO3 NaOAc NBS Ph PyBROP PPh3 2,2'-азобісізобутиронітрил т-бутилоксикарбоніл трибромід бору 9-борабіцикло[3.3.1]нонан бензил н-бутиллітій бензилоксикарбоніл 1,1'-карбонілдіімідазол метилтрифторметансульфонат дихлорметан дийодометан оксалілхлорид карбонат цезію трифторид (діетиламіно)сірки 4-(диметиламіно)піридин Ν,Ν-диметилформамід етил триетиламін етилацетат діетилцинк пероксид водню метил ізопропіл ацетонітрил метанол мета-хлорпербензойна кислота мас-спектр боргідрид натрію гідрокарбонат натрію ацетат натрію N-бромсукцинімід феніл бромтрипіролідинофосфонійгексафторфосфат трифенілфосфін 80459 24 Pyr SOCl2 TOO TFFH ΤΓΦ ТШХ TsOH піридин тіонілхлорид трифтороцтова кислота Ν,Ν,Ν',Ν'тетраметилформамідгексафторфосфат тетрагідрофуран тонкошарова хроматографія п-толуолсульфонова кислота Схеми реакцій 1-5 ілюструють способи, застосовані в синтезі сполук даного винаходу структурної формули І. Всі замісники є такими, як визначено вище, якщо не указано інакше. Схема реакції 1 ілюструє ключову стадію у синтезі нових сполук структурної формули І даного винаходу. Як показано на схемі реакції 1, вторинний амід (1-1) (N-Me або N-Et переважні) може бути метильований нагріванням з чистим метилтрифлатом для одержання іміноефіру (1-2). Альтернативно, можуть бути використані інші метилуючі реагенти, такі як метилйодид або метилсульфат без домішок або в ненуклеофільному органічному розчиннику. Як показано на схемі 1, біцикло[2.2.2]октан-1-карбонову кислоту (1-3) переводять в ацилгідразид (1-4). використовуючи зв'язувальний реактив TFFH і гідразин, у присутності основи третинного аміну, такої як триетиламін. Альтернативно, для даної трансформації, поряд з гідразином, можуть бути використані інші зв'язувальні реагенти, що звичайно використовуються для одержання амідів. Альтернативно, біцикло[2.2.2]октан-1-карбоновий ефір може бути нагрітий з гідразином для одержання ацилгідразидів (1-4). Ацилгідразид (1-4) та іміноефір (1-2), що одержуються таким чином, можуть бути нагріті разом в інертному висококиплячому органічному розчиннику, такому як толуол, у присутності основи третинного аміну, такої як триетиламін, з одержанням біцикло[2.2.2]октилтриазолів (1-5) структурної формули І. Альтернативно, реакцію можна провести у зворотному напрямі, як це відображено на реакційній схемі 2. В цій методиці вторинний амід (2-1) одержують з біцикло[2.2.2]октан-1-карбонової кислоти, використовуючи реакцію стандартного пептидного синтезу. Цю сполуку метилують з утворенням іміноефіру (2-2) і піддають взаємодії з 25 80459 26 ацилгідразидом, як відображено на схемі 1, з утворенням біцикло[2.2.2]октилтриазолів (2-3) структурної формули І. органічному розчиннику, такому як толуол з одержанням триазолу (5-3). Реакційна схема 3 демонструє альтернативний підхід до сполук даного винаходу структурної формули І, в якому ключовим етапом є реакція синтезу Сузукі, каталізована паладієм, між біцикло[2.2.2]октилбромтриазолом (3-1) і арилбороновою кислотою з одержанням триазолів (3-2) структурної формули І. У переважних умовах використовується тетракис(трифенілфосфін)паладій(0) як каталізатор в розчиннику ДМФА з карбонатом цезію, але можуть бути застосовані інші каталізатори і умови, що відомо фахівцям в цій галузі. Одержання [2.2.2]біциклооктил інтермедіатів: Методики, що застосовуються в одержанні [2.2.2]біциклооктил інтермедіатів для використання в одержанні сполук даного винаходу представлені нижче. Схеми одержання проміжних сполук 1-4 описують одержання оксадіазолів, які є важливими проміжними сполуками в синтезі сполук структурної формули І. Вони можуть бути перетворені у сполуки структурної формули І, використовуючи, наприклад, реакції, описані в реакційній схемі 4. Схема одержання проміжних сполук 1 демонструє переважний спосіб одержання оксадіазолів за допомогою дегідратації діацилгідразидів, використовуючи дегідратуючий реагент, такий як тіонілхлорид. Альтернативно, можуть бути застосовані інші дегідратуючі реагенти, такі як фосфороксихлорид, фосфорпентахлорид або оксалілхлорид. Діацилгідразиди можуть бути одержані переважно з гідразиду і активованої кислоти, такої як хлорангідрид кислоти, у присутності основи третинного аміну. Альтернативно, можуть бути застосовані реакції стандартного пептидного синтезу для одержання діацилгідразиду з гідразиду і карбонової кислоти. Схема одержання проміжних сполук 2 демонструє придатний реагент для дегідратації діацилгідразидів до оксадіазолів, а саме, 2-хлор-1,3диметил-4,5-дигідро-1H-імідазол-3-іній хлорид. Цей реагент в неполярному розчиннику (переважний метиленхорид) разом з основою третинного аміну (переважний триетиламін) дає цільові інтермедіати оксадіазолу найбільш ефективним чином. Схема одержання проміжних сполук 3 демонструє переважний реагент для однореакторного перетворення (з гідразиду і карбонової кислоти) і дегідратацію діацилгідразидів до оксадіазолів: 2хлор-1,3-диметил-4,5-дигідро-1Н-імідазол-3-іній хлорид. Цей реагент в неполярному розчиннику (переважний метиленхлорид) разом з основою третинного аміну (переважний триетиламін) дає необхідні інтермедіати оксадіазолу найбільш ефективним чином. Схема одержання проміжних сполук 4 демонструє ефективний спосіб одержання оксадіазолів з вторинних амідів і гідразидів. Вторинний амід (переважні N-Me або N-Et) може бути метильований нагріванням з чистим метилтрифлатом для одержання іміноефіру. Альтернативно, можуть бути Реакційна схема 4 демонструє ще інший синтетичний підхід до одержання сполук структурної формули І. Використовуючи цю методику, 4(біцикло[2.2.2]октил)оксадіазоли (4-1) при дегідратації конденсують з метиламіном, або в чистому вигляді в розплаві з метиламонійтрифторацетатом, або в буферованому розчині МеОН. Дані реакції краще проводити при підвищених температурах в реакторі під високим тиском для запобігання втрати метиламіну. Реакційна схема 5 демонструє ще інший синтетичний підхід до одержання сполук структурної формули І. Використовуючи цю методику, біцикло[2.2.2]октилкарбоксаміди (5-1) перетворюють в імінохлориди (5-2), із застосуванням реагенту, такого як оксалілхлорид, тіонілхлорид, фосфороксихлорид або фосфорпентахлорид, необов'язково у присутності ДМФА. Імінохлорид (5-2) конденсують з арилтетразолом у висококиплячому інертному 27 80459 28 використані інші метилюючі реагенти, такі як метилйодид або метилсульфат без домішок або в ненуклеофільному органічному розчиннику. Нагрівання іміноефіру, утворене таким чином у висококиплячому інертному органічному розчиннику у присутності гідразиду, дозволяє одержати оксадіазоли, як показано на схемі. Схеми одержання проміжних сполук 6 і 7 демонструють переважні способи одержання біцикло[2.2.2]октан-1-карбонових кислот з гетероарильною групою в положенні R3, як представлено структурною формулою І. Оксадіазоли у положенні R3 можуть бути одержані конденсацією біцикло[2.2.2]октан-1-карбонової кислоти з амідоксимом, як показано у проміжній схемі 6, придатним реагентом для синтезу CDI. Альтернативно, можуть бути використані інші відповідні для дегідратації або реакцій пептидного синтезу реагенти. Проміжна схема 7 ілюструє переважний спосіб синтезу інтермедіатів сполук структурної формули І, які несуть тіазольну групу в R3-позиції. Проміжна схема 5 демонструє переважний метод синтезу біцикло[2.2.2]октан-1-карбонової кислоти. Схеми одержання проміжних сполук 8-14 показують переважні способи одержання інтермедіатів біцикло[2.2.2]октан-1-карбонових кислот у синтезі сполук структурної формули І з різними алкільними або алкенільними або заміщеними алкільними групами у положенні R3. Ключовою реакцією є реакція Віттіга, здійснювана з біцикло[2.2.2]октан-1-карбоксальдегідом, як показано на проміжній схемі 8. Подвійний зв'язок в продукті цієї реакції може бути гідрований з одержанням алкільної групи різної довжини і характеру (яка стане R3-замісником у структурній формулі І), в залежності від реагенту Віттіга, як показано на проміжній схемі 9. Альтернативно, подвійний зв'язок може бути використаний для введення інших функціональних груп, таких як гідрокси або фторогруп, як показано на проміжній схемі 10. Сам по собі альдегід може бути використаний для одер 29 жання дифторметильної групи у положенні R3, як показано на проміжній схемі 11. Алкен, продукт реакції Віттіга, може зазнати множини інших трансформацій, наприклад, циклопропанування, як показано на проміжній схемі 12. Альтернативно, реагент Віттіга може містити віддалену функціональну групу, наприклад, кеталь, як показано на проміжній схемі 13. Ця функціональна група може зазнати характеристичних трансформацій функціональної групи після послідовного проведення реакції і Віттіга і відновлення, наприклад, гідроліз кеталю до кетону, як показано на проміжній схемі 13, або відновлення кеталю до спирту, як показано на проміжній схемі 14. Таким чином, можуть бути одержані сполуки структурної формули І з різноманіттям різних R3-замісників. Окремі приклади представлені для відображення основних принципів і не прагнуть обмежити об'єм R3-замісників. 80459 30 Основні хімічні трансформації функціональної групи, що використовуються в одержанні сполук даного винаходу, представлені нижче в одержанні окремих сполук даного винаходу. Ці трансформації функціональної групи в своєму різноманітті, в основному, добре розуміються фахівцями в даній галузі. 31 80459 32 Наступні приклади забезпечують ілюстрацію винаходу і не покликані яким-небудь чином обмежити об'єм даного винаходу. Приклад 1 3-Метокси-4-[4-метид-5-(4пентилбіцикло[2.2.2]окт-1-ил)-4Н-1,2,4-триазол-3іліфенол (1-F) Стадія А: До перемішуваного магнітною мішалкою розчину 4-бензилокси-2-гідроксибензонітрилу [1-А, WO 00/69841] (7,95г, 35,3ммоль) і йодометану (5,43мл, 87,2ммоль) в ДМФА (90мл), охолодженого до -5 °С, додавали відразу всю кількість гідриду натрію (60% дисперсія, 2,17г, 54,2ммоль). Суміш перемішували протягом 30хв., нагрівали до кімна 33 тної температури і додатково перемішували протягом 2год. Більшу частину ДМФА відганяли у вакуумі і залишок розподіляли між водою і етилацетатом. Водну фазу екстрагували три рази етилацетатом. Об'єднані органічні фази промивали водою і насиченим розчином солі і висушували (MgSO4). Залишок після видалення розчинника у вакуумі розтирали з гексаном і хроматографували на силікагелі з гексаном-СН2Сl2 (2:3) з одержанням 4бензилокси-2-метоксибензонітрилу (1-В). МС: m/z 240 (М+1); 1Н ЯМР (500МГц, CDCI 3): δ 7,47 (д, 1Н, J=8,4Гц), 7,36-7,45 (м, 5Н), 6,58 (дд, 1Н, J=2,3, 8,4Гц), 6,57 (д, 1Н, J=2,3Гц), 5,10 (с, 2Н), 3,88 (с, 3Н) м.ч. Стадія В: Суспензію, що енергійно перемішується, 4бензилокси-2-метоксибензонітрилу (1-В) (1,20г, 5,0ммоль), азиду натрію (732мг, 11,3ммоль), і триетиламінгідрохлориду (1,54г, 11,3ммоль) в толуолі (6мл) нагрівали при 110°С протягом 48год. Коричневу суспензію охолоджували, додавали воду (15мл), і суміш перемішували протягом 30хв. Органічний шар відділяли і екстрагували водою (5мл). рН об'єднаних водних екстрактів доводили до, приблизно, значення 1, за допомогою концентрованої НСI. Смола, яка спочатку осаджується, затвердівала при перемішуванні протягом 30хв. Тверду частину промивали водою і висушували з одержанням 5-[4-(бензилокси)-21 метоксифеніл]-2Н-тетразолу (1-С). Н ЯМР (500МГц, CDCI 3): δ 12,9 (ушир.с, 1Н), 7,37 (д, 1Н, J=8,7Гц), 7,34-7,48 (м, 5Н), 6,78 (дд, 1Н, J=2,3, 8,7Гц), 6,70 (д, 1Н, J=2,3Гц), 5,15 (с, 2Н), 4,05 (с, 3Н) м.ч. Стадія С: Оксалілхлорид (3,49мл, 40ммоль) додавали краплями до розчину N-метил-4пентилбіцикло[2.2.2]октан-1-карбоксаміду (1-D) (952мг, 4,0ммоль) в сухому СН2СІ 2 при кімнатній температурі. Після зниження інтенсивного виділення газу розчин перемішували при кімнатній температурі протягом 2год. СН2СІ 2 обережно ви 80459 34 даляли у вакуумі при кімнатній температурі і, потім, при 50°С. Чистий залишок у вигляді сиропу розчиняли в толуолі (8мл) і додавали 5-[4(бензилокси)-2-метоксифеніл]-2Н-тетразол (1-С) (1,13г, 4,0ммоль). Суміш нагрівали при 120°С протягом 9год. Суміш охолоджували і тверду речовину, що осаджувалась, фільтрували, промивали толуолом і висушували з одержанням солі триазолгідрохлориду. Сіль розподіляли між СН2СІ 2 і 10% водним K2СО3. Водну фазу екстрагували двічі СН2Сl2. Об'єднані екстракти СН2Сl2 висушували (MgSO4) і упарювали у вакуумі. Залишок хроматографували на силікагелі з 5% МеОН/СН2Сl2 з одержанням 3-[4-(бензилокси)-2-метоксифеніл]-4метил-5-(4-пентилбіцикло[2.2.2]окт-1-ил)-4Н-1,2,4триазолу (1-Е). МС: m/z 474 (М+1); 1Н ЯМР (500МГц, CDCI 3): δ 7,33-7,47 (м, 6Н), 6,65 (дд, 1Н, J=2,3, 8,5Гц), 6,60 (д, 1Н, J-2,3Гц), 5,10 (с, 2Н), 3,75 (с, 3Н), 3,48 (с, 3Н), 2,08 (м, 6Н), 1,51 (м, 6Н), 1,001,35 (м, 8Н), 0,89 (т, ЗН, J=7,2)м.ч. Стадія D: Розчин 3-[4-(бензилокси)-2-метоксифеніл]-4метил-5-(4-пентилбіцикло[2.2.2]-окт-1-ил)-4Н-1,2,4триазолу (1-Е) (272мг, 0,572ммоль) в МеОН (8мл) гідрогенізували протягом 19год. з 10% каталізатором Pd/C (27мг) при кімнатній температурі і атмосферному тиску. Каталізатор фільтрували і промивали МеОН. МеОН видаляли у вакуумі з одержанням 3-метокси-4-[4-метил-5-(4пентилбіцикло[2.2.2]окт-1-ил)-4Н-1,2,4-триазол-3іл]фенолу (1-F). МС: m/z 384 (М+1); 1Н ЯМР (500МГц, ДМСО-d6): δ 9,94 (с, 1H), 7,09 (д, 1Н, J=8,3), 6,53 (д, 1Н, J=1,6Гц), 6,46 (дд, 1H, J=2,2, 8,2Гц), 3,72 (с, 3Н), 3,40 (с, 3Н), 1,95 (м, 6Н), 1,44 (м, 6Н), 1,07-1,33 (м, 8Н), 0,86 (т, ЗН, J=7,2). Приклад 2 3-Хлор-4-[4-метил-5-(4пентилбіцикло[2.2.2]окт-1-ил)-4Н-1,2,4-триазол-3ілі фенол (2-G) 35 Стадія А: Оксалілхлорид (505мкл, 5,79ммоль) додавали краплями до суміші 4-пентилбіцикло[2.2.2]октан-1карбонової кислоти (2-А) в метиленхлориді (10мл). Розчин перемішували при кімнатній температурі протягом 3год. і, потім, концентрували у вакуумі з одержанням 4-пентилбіцикло[2.2.2]октан-1карбонілхлориду (2-B). 1 Н ЯМР (500МГц, CDCI 3): δ 0,90 (т, 3Η); 1,21 (м, 8Н); 1,45 (м,6Н); 1,88 (м,6Н)м.ч. Стадія В: Ν,Ν-діізопропілетиламін (1,44мл, 11,1ммоль) додавали до суміші 4-пентилбіцикло[2.2.2]октан-1карбонової кислоти (2-А) (1,09г, 4,45ммоль) і метиламінгідрохлориду (1,5г, 22,3ммоль) в метиленхлориді (10мл) і суміш перемішували при кімнатній температурі протягом 18год. Після розбавлення метиленхлоридом, суміш промивали водою, насиченим розчином солі, висушували (MgSO4) і концентрували у вакуумі з одержанням N-метил-4пентилбіцикло[2.2.2]октан-1-карбоксаміду (2-С). 1Н ЯМP (500МГц, CDCI 3): δ 0,91 (т, 3Н); 1,22 (м, 8Н); 1,43 (м, 6Η); 1,77 (м, 6Н); 2,82 (д, 3Н)м.ч. Стадія С: Оксалілхлорид (846мкл, 9,7ммоль) додавали краплями до розчину N-метил-4пентилбіцикло[2.2.2]октан-1-карбоксаміду (2-С) (230мг, 0,97ммоль) в метиленхлориді (2,0мл) і суміш перемішували при кімнатній температурі протягом 4год. Розчинник і надлишок реагенту видаляли у вакуумі з одержанням №метил-4пентилбіцикло[2.2.2]октан-1карбоксімідоилхлориду (2-D). Додавали толуол (1,5мл) з подальшим додаванням 5-(2-хлор-4метоксифеніл)-1Н-тетразолу (2-Е) (204мг, 0,97ммоль) і суміш нагрівали зі зворотним холоди 80459 36 льником протягом 18год. Реакційну суміш охолоджували до кімнатної температури і осад фільтрували, промивали холодним толуолом, гексаном, розчиняли в метиленхлориді, висушували (MgSO4) і концентрували у вакуумі з одержанням 3-(2-хлор4-метоксифеніл)-4-метил-5-(4пентилбіцикло[2.2.2]окт-1-ил)-4Н-1,2,4-триазолу (2F). Мас-спектр: 402 (М+1); 1H ЯМР (500МГц, CDCI 3): δ 0,94 (т, 3Н), 1,27 (м, 8Н), 1,56 (м, 6Η), 2,13 (м, 6Η), 3,56 (с, 3Н), 3,89 (с, 3Н), 6,95 (дд, 1Н), 7,07 (д, 1Н), 7,43 (д, 1Н). Стадія D: Трибромід бору (135мкл, 1,43ммоль) додавали краплями до розчину 3-(2-хлор-4-метоксифеніл)-4метил-5-(4-пентилбіцикло[2.2.2]окт-1-ил)-4Н-1,2,4триазолу (2-F) (287мг, 0,714ммоль) в метиленхлориді (5мл) при 0°С. Суміш перемішували при кімнатній температурі протягом 2,5год. Розчин промивали водою, 10% NaHCO3, висушували (MgSO4) і концентрували у вакуумі і залишок очищали колонковою хроматографією (силікагель, 5% МеОН/метиленхлорид) з одержанням 3-хлор-4-[4метил-5-(4-пентилбіцикло[2.2.2]окт-1-ил)-4Н-1,2,4триазол-3-іл]фенолу (2-G). Мас-спектр: 388 (М+1); 1 Н ЯМР (500МГц, CDCI 3): δ 0,93 (т, 3Н), 1,26 (м, 8Н), 1,56 (м, 6Η), 2,13 (м, 6Н), 3,58 (с, 3Н), 6,69 (дд, 1Н), 6,92 (д, 1Н), 7,09 (д, 1Н)м.ч. Приклад 3 5-(4-{1-Метил-5-[2-(трифторметил)феніл]-1-Η1,2,4-триазол-3-іл}біцикло-[2.2.2]окт-1-ил)пентан-2ол (3-J) 37 Стадія А: [2-(2-Метил-1,3-діоксолан-2іл)етил](трифеніл)фосфонійбромід (3-А, Synthesis: 532 (1986)) (5,99г, 12,7ммоль) перемішували в сухому ТГФ (200мл). Додавали біс(триметилсиліл)амід калію (20,4мл, 2М розчин в толуолі, 10,2ммоль). Реакційну суміш залишали для перемішування протягом 30хв. Потім реакційну суміш охолоджували до -78°С. За допомогою канюлі додавали метил-4формілбіцикло[2.2.2]октан-1-карбоксилат при 78°С. Реакційну суміш залишали для нагрівання до кімнатної температури на ніч. Об'єм зменшували випарюванням ТГФ у вакуумі. Додавали 100мл води. На суміш нашаровували 100мл діетилефіру. Ефір екстрагували і висушували (MgSO4). Продукт (метил-4-[(1Е)-3-(2-метил-1,3-діоксолан-2-іл)проп1-еніл]біцикло[2.2.2]октан-1-карбоксилат (3-В)) очищали флеш-хроматографією на силікагелі з сумішшю 10/90 етилацетат-гексан. Стадія В: (Метил-4-[(1Е)-3-(2-метил-1,3-діоксолан-2іл)проп-1-еніл]біцикло[2.2.2]октан-1-карбоксилат (3-В) (1,1 г) перемішували в етанолі (75мл). Додавали на кінчику шпателя 10% Pd на вугіллі (150 мг). Вводили водень з балона і суміш перемішували в атмосфері водню протягом 3год. Паладій на вугіллі фільтрували і етанол видаляли у вакуумі з одержанням 4-[3-(2метил-1,3-діоксолан-243 іл)пропіл]біцикло[2.2.2]октан-1 карбоксилату (3-С). Стадія С: Метил-4-[3-(2-метил-1,3-діоксолан-2іл)пропіл]біцикло[2.2.2]октан-1-карбоксилат (3-С) (1,0г, 3,38ммоль) перемішували в розчині 90% метанолу і 10% води (50мл). Додавали надлишок гідроксиду калію (2,0г). Суміш кип'ятили зі зворотним холодильником протягом ночі. В охолоджену суміш додавали 1н хлороводневу кислоту (100мл) і, потім, промивали двічі етилацетатом (100мл). Об'єднані органічні шари висушували (MgSO4). Етилацетат видаляли у вакуумі з одержанням чистої 4-[3-(2-метил-1,3-діоксолан-2 80459 38 іл)пропіл]біцикло[2.2.2]октан-1-карбонової кислоти (3-D). Стадія D: 4-[3-(2-Метил-1,3-діоксолан-2іл)пропіл]біцикло[2.2.2]октан-1-карбонової кислоти (3-D) (0,200г, 0,708ммоль) об'єднували з гідразидом 2-(трифторметил)бензойної кислоти (3-Е) (0,173г, 0,847ммоль) і двічі азеотропно переганяли з толуолу. Потім, суміш перемішували в сухому метиленхлориді (10мл). Додавали 2-хлор-1,3диметилімідазолінійхлорид (3-F) (0,718г, 4,25ммоль) з подальшим додаванням 1,184мл триетиламіну. Реакційну суміш залишали для перемішування протягом 2год. Реакційну суміш розбавляли метиленхлоридом і промивали водою. Одержаний оксадіазол, 2-{4-[3-(2-метил-1,3діоксолан-2-іл)пропіл]біцикло[2.2.2]окт-1-ил}-5-[2(трифторметил)феніл]-1,3,4-оксадіазол (3-G) очищали флеш-хроматографією на силікагелі з сумішшю 50/50 етилацетат-гексан. Стадія Е: 2-{4-[3-(2-Метил-1,3-діоксолан-2іл)пропіл]біцикло[2.2.2]окт-1-ил}-5-[2(трифторметил)феніл]-1,3,4-оксадіазол (3-G) (0,158г) перемішували в суміші 90% ацетон/10% вода (20мл). Додавали до розчину птолуолсульфонову кислоту (10мг). Реакційну суміш кип'ятили зі зворотним холодильником протягом 1год. Об'єм зменшували випарюванням у вакуумі ацетону. На суміш, потім, нашаровували етилацетат (25мл) і насичений розчин бікарбонату натрію (25мл). Шар етилацетату екстрагували і висушували (MgSO4). Розчинник видаляли у вакуумі з одержанням чистого 5-(4-{5-[2(трифторметил)феніл]-1,3,4-оксадіазол-2іл}біцикло[2.2.2]окт-1-ил)пентан-2-ону(3-Н). Стадія F: 5-(4-{5-[2-(Трифторметил)феніл]-1,3,4оксадіазол-2-іл}біцикло[2.2.2]окт-1-ил)пентан-2-он (3-Н) (0,072г) перемішували в метанолі (2мл) при 0°С. Додавали боргідрид натрію (20мг). Реакційну суміш залишали для перемішування при кімнатній температурі. На суміш, потім, нашаровували етилацетат (15мл) і воду (15мл). Шар етилацетату екстрагували і висушували (MgSO4). Розчинник видаляли у вакуумі з одержанням чистого 5-(4-{5[2-(трифторметил)феніл]-1,3,4-оксадіазол-2-іл} біцикло[2.2.2]окт-1-ил)пентан-2-олу (3-І). Стадія G: 5-(4-{5-[2-(Трифторметил)феніл]-1,3,4оксадіазол-2-іл}біцикло[2.2.2]окт-1-ил)пентан-2-ол (3-І) (50мг) вміщували в герметичну колбу в розчин 2М метиламіну (2,5мл). Додавали невеликою мірною ложечкою сіль ТФО і колбу герметично закривали. Герметичну колбу нагрівали до 150°С протягом 3 днів. Реакційну суміш розбавляли етилацетатом (15мл), промивали водою (15мл) і висушували (MgSO4). Етилацетат видаляли у вакуумі. Продукт, 5-(4-{1-метил-5-[2(трифторметил)феніл]-1-Н-1,2,4-триазол-3іл}біцикло[2.2.2]окт-1-ил)пентан-2-ол (3-J), очищували препаративною оберненофазовою ВЕРХ на колонці С-18 з силікагелем, використовуючи градієнт ацетонітрил-вода з буфером 0,1% трифтороц 39 80459 40 товою кислотою. Ефлюент, що містить чистий триазол, робили більш основним за допомогою 10% NaHCO3, випарювали у вакуумі для видалення більшої частини ацетонітрилу і екстрагували метиленхлоридом. Органічний екстракт висушували (MgSO4) і упарювали, і залишок висушували у вакуумі для одержання бажаної сполуки. МС (ЕСl+)=422,5 (М+1); 1Н ЯМР (500МГц, CDCI 3): δ 1,21 (2Н, м), 1,23 (3Н, д, J=6,5Гц), 1,29 (2Н, м), 1,57 (6Н, м), 2,13 (6Н, м), 3,47 (3Н, с), 3,85 (1Н, м), 7,51 (1Н, м), 7,70 (2Н, м), 7,85 (1Н, м)м.ч. Приклад 4 Стадія А: До суспензії 4(метоксикарбоніл)біцикло[2.2.2]октан-1-карбонової кислоти (4-А) (0,906г, 4,27ммоль) в дихлорметані (20мл) додавали 1,1'-карбонілдіімідазол (1,04г, 6,41ммоль). Реакційна суміш перейшла в стан прозорого розчину з постійним виділенням газу. Після перемішування суміші при кімнатній температурі протягом 1год. додавали 4фторбензамідоксим (1,98г, 12,8ммоль). Перемішування продовжували протягом ночі. Потім суміш концентрували і залишок кип'ятили зі зворотним холодильником в толуолі протягом 16год. Суміш концентрували і залишок очищали колонковою хроматографією, використовуючи як елюент гексан/етилацетат (7/1) з одержанням метил-4-[3-(4фторфеніл)-1,2,4-оксадіазол-5іл]біцикло[2.2.2]октан-1-карбоксилату (4-В) у вигляді білої твердої речовини. 1Н ЯМР (500МГц, CDCI 3): δ 1,96-1,99 (м, 6Н), 2,08-2,14 (м, 6Н), 3,71 (с, 3Н), 7,16-7,20 (м, 2Н), 8,08-8,10 (м, 2Н)м.ч., ЕСІМС: m/z (M+H) 349,2. Стадія В: Ефір (4-В) (1,01г, 3,06ммоль) обробляли КОН (0,52г, 9,18ммоль) в метанол/вода (95/5, 20мл). Після нагрівання його при 60°С протягом 12год. реакційну суміш концентрували, розбавляли водою, двічі екстрагували етилацетатом. У водний шар додавали водний розчин 1н НСl і випадав білий твердий осад. Осад 4-[3-(4-фторфеніл)-і,2,4оксадіазол-5-іл]біцикло[2.2.2]октан-1-карбонової кислоти (4-С) збирали і додатково висушували спільною перегонкою з толуолом. ЕСІ-МС: m/z (M+H) 317,2. Стадія С: Суміш кислоти (4-С) (138,9мг, 0,439ммоль) і гідразиду 2-(трифторметил)бензойної кислоти (4-D) (89,7мг, 0,439ммоль) спочатку три рази переганяли з толуолом. Дихлорметан (7мл) додавали до суміші як розчинник. До одержаної суспензії додавали 2-хлор-1,3-диметилімідазолінійхлорид (743мг, 4,39ммоль) з подальшим додаванням триетиламіну (1,2мл, 8,78ммоль). Суміш залишали для перемішування при кімнатній температурі в атмосфері азоту протягом 48год. для підтвердження завершення взаємодії. Потім реакційну суміш розбавляли дихлорметаном, промивали водою, 1н НСl, насиченим водним розчином бікарбонату натрію, і, в кінці, насиченим розчином солі. Органічну фазу висушували над безводним сульфатом натрію, фільтрували і концентрували. Залишок очищали колонковою хроматографією, використовуючи як елюент гексан/етилацетат (3/1) з одержанням 3-(4-фторфеніл)-5-(4-{5-[2(трифторметил)феніл]-1,3,4-оксадіазол-2іл}біцикло[2.2.2]окт-1-ил)-1,2,4-оксадіазолу (4-Е) у вигляді білої твердої речовини. 1 Н ЯМР (500МГц, CDCI 3): δ 2,25 (с, 12Н), 7,21 (т, J=8,7Гц, 2Н), 7,747,76 (м, 2Н), 7,91 (м, 1Н), 8,11-8,15 (м, 3Н)м.ч., ECI-MC: m/z (M+H) 485,2. Стадія D: Суміш вказаного вище 1,2,4-оксадіазолу (4-Е) (115,2мг, 0,238ммоль) і солі метиламіну і трифтороцтової кислоти (1,73г, 11,9ммоль) в 2М розчині метиламіну в метанолі (4мл) нагрівали при 150°С 41 в герметичній пробірці протягом 48год. Потім суміш концентрували і залишок переносили в дихлорметан, промивали насиченим розчином бікарбонату натрію. Органічну фазу концентрували і залишок очищали, використовуючи як елюент оберненофазову ВЕРХ з ТФО-буферованою сумішшю ацетонітрил/вода (40-80%). Фракції, що містять продукт, об'єднували, нейтралізували насиченим водним розчином бікарбонату натрію і ліофілізували з суміші ацетонітрил/вода з одержанням 3-(4-фторфеніл)-5-(4-{4-метил-5-[2(трифторметил)феніл]-4Н-1,2,4-триазол-3-іл}біцикло[2.2.2]окт-1-ил)-1,2,4-оксадіазолу (4-F). 1Η ЯМР (CDCI 3): δ 2,25-2,35 (м, 12Н), 3,53 (с, 3Н), 7,21 (т, J=8,7Гц, 2Н), 7,54 (м, 1Н), 7,73 (м, 2Н), 7,88 (м, 1Н), 8,13 (м, 2Н), ЕСІ-МС: m/z (M+H) 498,2. Приклад 5 4-[4-Метил-5-(4-фенілбіцикло[2.2.2]окт-1-ил)4Н-1,2,4-триазол-3-іл]-3-(трифторметил)фенол (5F) Одержання 4-фенілбіцикло[2.2.2]октан-1карбонової кислоти (5-А). Літературне джерело: [Chapman, N. В., Sotheeswaran, S., і Toyne, K. J., J. Org. Chem, 35: 917-923 (1970)]. 80459 42 Стадія А: До розчину, що перемішується на магнітній мішалці, 4-фенілбіцикло[2.2.2]октан-1-карбонової кислоти (5-А) (70мг, 0,30ммоль) в метиленхлориді (1мл) при кімнатній температурі додавали 2М оксалілхлорид в метиленхлориді (0,61мл, 1,22ммоль). Додавали дві краплі каталітичного ДМФА для каталізу взаємодії. Реакційну суміш перемішували протягом 30хв., і розчинник і реагент видаляли у вакуумі. Метиленхлорид (1мл) додавали до залишку, з подальшим додаванням гідразиду 4-(бензилокси)-2(трифторметил)бензойної кислоти (5-В) (141мг, 0,46ммоль) і триетиламіну (0,07мл, 0,46ммоль). Реакційну суміш перемішували при кімнатній температурі протягом ночі з одержанням інтермедіату 5-С, N'-[4-(бензилокси)-2-(трифторметил)бензоїл]4-фенілбіцикло-[2.2.2]октан-1-карбогідразиду, який не виділяли. До неочищеного продукту потім додавали (5С) 2-хлор-1,3-диметилімідазолінійхлорид (257мг, 1,52ммоль), ще триетиламін (0,42мл, 3,04ммоль) і метиленхлорид (2мл). Реакційну суміш перемішували при кімнатній температурі протягом 4год. Потім реакційну суміш розбавляли метиленхлоридом (30мл) і промивали водою (30мл) два рази і насиченим розчином солі (30мл) один раз. Об'єднані водні шари екстрагували метиленхлоридом (25мл) один раз. Об'єднані органічні шари висушували (MgSO4) і розчинник видаляли у вакуумі. Залишок хроматографували на силікагелі з 10% етилацетатом в гексані, як елюент з одержанням 2-[4(бензилокси)-2-(трифторметил)феніл]-5-(4фенілбіцикло[2.2.2]-окт-1-ил)-1,3,4-оксадіазолу (5D). МС: m/z 505 (М+1). Стадія В: Трифторацетатну сіль метиламіну (380мг, 2,61ммоль) і 2-[4-(бензилокси)-2(трифторметил)феніл]-5-(4-фенілбіцикло[2.2.2]окт1-ил)-1,3,4-оксадіазол (5-D) суспендували в 2М розчині метиламіну в метанолі (1,3мл, 2,61ммоль) і нагрівали при 150°С протягом ночі. Після охолоджування до кімнатної температури реакційну суміш розподіляли між етилацетатом (25мл) і насиченим водним розчином бікарбонату натрію (30мл). Шари розділяли і водний шар екстрагували двічі етилацетатом (25мл). Об'єднані органічні шари промивали насиченим розчином солі, висушували (MgSO4), і розчинник видаляли у вакуумі. Залишок розчиняли в метанолі (8мл) і очищали оберненофазовою хроматографією, використовуючи градієнтну елюцію з 10% ацетонітрил (0,1% ТФО)/вода (0,1% ТФО) до 100% ацетонітрилу (0,1% ТФО) протягом 10хв. (20мл/хв.). Фракції, що містять продукт, розподіляли між насиченим водним розчином бікарбонату натрію (25мл) і метиленхлоридом (15мл). Шари сепарували і водний шар екстрагували метиленхлоридом (15мл) три рази, висушували (MgSO4), і розчинник видаляли у вакуумі з одержанням 3-[4-(бензилокси)-2(трифторметил)феніл]-4-метил-5-(4фенілбіцикло[2.2.2]окт-1-ил)-4Н-1,2,4-триазолу (5Е). МС: m/z 518 (М+1). 43 Стадія С: 3-[4-(Бензилокси)-2-(трифторметил)феніл]-4метил-5-(4-фенілбіцикло[2.2.2]-окт-1-ил)-4Н-1,2,4триазол (5-Е) (27мг, 0,05ммоль) розчиняли в етилацетат/метанол (1:1, 4мл), до якого додавали 10% паладій на вугіллі (4мг). Потім реакційну суміш вміщували в атмосферу водню і перемішували протягом 3год. при кімнатній температурі і тиску. Після відповідного видалення атмосфери водню паладій відфільтровували через фільтр і промивали метанолом (40мл). Фільтрат збирали і розчинник видаляли у вакуумі з одержанням 4-[4метил-5-(4-фенілбіцикло[2.2.2]окт-1-ил)-4Н-1,2,4триазол-3-іл]-3-(трифторметил)фенолу (5-F). МС: m/z 428 (M+1); 1H ЯМР (500МГц, CDCI3): δ 1,92 (6H, м), 2,11 (6Н, м), 3,41 (3Н, с), 7,17 (2Н, м), 7,24 (1Н, м), 7,31 (2Н, м), 7,38 (3Н, м)м.ч. Приклад 6 3-{4-[2-(Етилсульфоніл)етил]біцикло[2.2.2]окт1-ил}-4-метил-5-[2-(трифторметил)феніл]-4Н-1,2,4триазол (6-6) Стадія А: Діетил(етилсульфонметан)фосфонат (1,12г, 4,6ммоль) [Popoff, I. С. та інш., J. Org. Chem., 34: 1128-30 (1969)] і 4карбометоксибіцикло[2.2.2]октан-1карбоксальдегід (6-1) (0,82г, 4,2ммоль) [Adcock, W., Kok, G.B., J. Org. Chem., 50: 1079-1087 (1985)] розчиняли в 8мл абсолютного метанолу. Суміш вміщували в атмосферу азоту, охолоджували на крижаній бані і обробляли 0,5Μ розчином метоксиду натрію в метанолі (8,8мл, 4,4ммоль). Реакційну суміш нагрівали зі зворотним холодильником протягом 4год., потім охолоджували до кімнатної температури, концентрували при зниженому тиску, потім обробляли 2мл води і дозволяли осісти в холодильнику протягом ночі. Суміш фільтрували і 80459 44 тверду речовину промивали невеликою кількістю холодного 1:1 МеОН/вода. Одержаний білий осад збирали і висушували у вакуумі з одержанням ненасиченого сульфону 6-2. МС (ЕСІ+): m/z 287 (М+1). Стадія В: Сульфон 6-2 (880мг, 3,08ммоль) розчиняли в суміші етилацетат/метанол 1:2 (30мл), вміщували в атмосферу азоту, потім обробляли 10% Pd/C (800мг). Реакційну суміш вміщували в атмосферу водню і енергійно перемішували протягом 90хв. Одержаний розчин фільтрували через целіт, промивали метанолом і етилацетатом, і упарювали з одержанням 4-[2-(етилсульфоніл)етил]біцикло[2.2.2]октан-1-карбоксилату (6-3) у вигляді білої твердої речовини. Стадія С: Ефір 6-3 (880мг, 3ммоль) розчиняли в розчині 10% вода/метанол (100мл) і обробляли 1г гідроксиду калію. Реакційну суміш нагрівали при 60°С протягом 1год., потім при 45°С протягом ночі. Суміш концентрували у вакуумі, потім доводили рН до значення 2 за допомогою 1М НСI і екстрагували трьома порціями метиленхлориду. Органічні шари об'єднували, висушували над безводним сульфатом натрію і упарювали з одержанням 4-[2(етилсульфоніл)етил]біцикло-[2.2.2]октан-1карбонової кислоти (6-4). Стадія D: Карбонову кислоту 6-4 (810мг, 2,96ммоль) розчиняли в 12мл безводного метиленхлориду в атмосфері азоту, обробляли оксалілхлоридом (2М в метиленхлориді, 4,4мл, 8,8ммоль) і послідовно 5 краплями ДМФА. Реакційну суміш перемішували при кімнатній температурі в атмосфері азоту протягом 90хв., потім упарювали і вміщували у вакуум на 20хв. Хлорангідрид кислоти розчиняли в безводному метиленхлориді (12мл), охолоджували на крижаній бані, і, потім, краплинно обробляли розчином метиламіну (2М в ТГФ, 8,9мл, 17,8ммоль). Після завершення додавання аміну охолоджуючу баню видаляли і реакційну суміш перемішували при температурі навколишнього середовища протягом 30хв. Суміш розбавляли 200мл метиленхлориду і промивали водної 1н НСI, насиченим водним розчином бікарбонату натрію і насиченим розчином солі. Органічний шар висушували над безводним сульфатом натрію і випарювали. Залишок піддавали хроматографії на силікагелі, елююючи градієнтом від 0 до 3,5% метанолу в метиленхлориді з одержанням 4-[2(етилсульфоніл)етил]-№метилбіцикло[2.2.2]-октан1-карбоксаміду 6-5 у вигляді білого порошку. МС (ЕСІ+): m/z 288 (М+1). Стадія Е: Метиламід 6-5 (220мг, 0,77ммоль) розчиняли в безводному метиленхлориді (2мл) і обробляли оксалілхлоридом (2М в метиленхлориді, 0,77мл, 1,54ммоль) і ДМФА (2 краплі). Реакційну суміш перемішували при кімнатній температурі протягом 1год., потім розчинник видаляли випарюванням при зниженому тиску. Залишок повторно розчиняли в безводному толуолі (2мл) і обробляли 5-[2(трифторметил)феніл]-1H-тетразолом (214мг, 1ммоль). Суміш нагрівали зі зворотним холодиль 45 ником 18год. Реакційну суміш охолоджували до кімнатної температури і осад кремового кольору відфільтровували і промивали для одержання 300мг неочищеного продукту, у вигляді солі НСI. Суміш поглинали метиленхлоридом/1н НСI і водний шар промивали двома додатковими порціями метиленхлориду. Органічні шари об'єднували і випарювали, і залишок хроматографу вали флешхроматографією на силікагелі. Елюцію проводили в градієнті в інтервалі від 0 до 5% метанол/метиленхлорид. Відповідні фракції об'єднували і випарювали з одержанням 3-{4-[2(етилсульфоніл)етил]біцикло-[2.2.2]окт-1-ил }-4метил-5-[2-(трифторметил)феніл]-4Н-1,2,4триазолу (6-6) у вигляді білого порошку. МС (ЕСl+): 456,2 (М+1); 1Н ЯМР (500МГц, CDCI 3): δ 1,46 (3Н, т, J=7,3Гц), 1,63 (6H, м), 1,78 (2Н, м), 2,19 (6Н, м), 2,96 (2Н, м), 3,05 (2Н, кв., J=7,2Гц), 3,50 (ЗН, с), 7,56 (Ш, м), 7,72 (2Н, м), 7,87 (1Н, м)м.ч. Приклад 7 3-{4-[3(Етилсульфоніл)пропіл]біцикло[2.2.2]окт-1-ил}-4метил-5-[2-(трифторметил)феніл]-4Н-1,2,4триазол (7-J) 80459 46 Стадія А: (Бензилоксикарбонілметил)трифенілфосфонійбромід (4,6г, 9,4ммоль) двічі азеотропно переганяли з толуолу, і, потім, суспендували в 30мл сухого ТГФ. Краплями додавали гексаметилдисилазид калію (0,5Μ в толуолі, 16,8мл, 8,4ммоль) при кімнатній температурі і жовтий розчин залишали для перемішування протягом 1год., після цього часу він ставав молочнобілим. Готували розчин 4-карбометоксибіцикло[2.2.2]октан-1-карбоксальдегіду (7-А) (0,50г, 2,55ммоль) [Adcock, W., Kok, G. В., J. Org. Chem., 50: 1079-1087 (1985)] і бензойної кислоти (0,015г, 0,13ммоль) в 2мл сухого ТГФ і додавали краплями шприцом при кімнатній температурі. Суміш нагрівали до 90°С і залишали для перемішування при температурі утворення флегми, після цього суміш розбавляли 200мл етилацетату і послідовно промивали порціями по 50мл 1н НСI (двічі), насиченим водним розчином бікарбонату натрію і насиченим розчином солі. Органічний шар висушували, використовуючи сульфат магнію, і розчинник видаляли при зниженому тиску. Залишок хроматографували на силікагелі, елююючи градієнтом від 5% до 10% етилацетатом в гексані з одержанням метил-4-[(1Е)-3-(бензилокси)-3-оксопроп-1-ен-1іл]біцикло[2.2.2]октан-1-карбоксилату (7-В) у вигляді безбарвної олії. 1Н ЯМР (500МГц, CDCI 3): δ 7,4 (5Н, м), 6,94 (1Н, д, J=17Гц), 5,77 (1H, д, J=17Гц), 5,21 (2H, с), 3,69 (3Н, с), 1,86 (6Н, м), 1,63 (6Н, м)м.ч. Стадія В: Діефір 7-B (0,625г, 1,90ммоль) розчиняли в суміші 1:1 етилацетат/метанол (30мл), вміщували в атмосферу азоту, потім обробляли 10% Pd/C (500мг) і 0,1мл оцтової кислоти. Реакційну суміш вміщували в атмосферу водню і енергійно перемішували протягом 2год. Одержаний розчин фільтрували через целіт і розчинник видаляли при зниженому тиску. Залишок розподіляли між 200мл етилацетату і 200мл розчину 1н NaOH. Водний шар сепарували і нейтралізували, потім три рази екстрагували 50мл метиленхлориду. Об'єднані органічні шари висушували над сульфатом магнію і розчинник видаляли при зниженому тиску з одержанням 3-[4-(метоксикарбоніл)біцикло[2.2.2]окт-1ил]пропанової кислоти (7-С). 1Н ЯМР (500МГц, CDCI 3): δ 3,62 (3Н, с), 2,20 (2Н, ушир.т, J=9Гц), 1,75 (6Н, м), 1,47 (2Н, ушир.т, J=9Гц), 1,38 (6Н, м)м.ч. Стадія С: Карбонову кислоту 7-С (400мг, 1,67ммоль) розчиняли в тетрагідрофурані (5мл) і боран (1М розчин в ТГФ, 2,17мл, 1,3екв.) краплями додавали при кімнатній температурі. Після 2год. реакційну суміш додавали до 50мл 1н НСI і, потім, три рази екстрагували 50мл метиленхлориду. Об'єднані органічні шари висушували над сульфатом магнію 47 і розчинник видаляли при зниженому тиску з одержанням неочищеного метил-4-(3гідроксипропіл)бщикло[2.2.2]октан-1-карбоксилату (7-D), який використали без очищення на наступній стадії. 1Н ЯМР (500МГц, CD3OD): δ 3,66 (ЗН, с), 3,62 (2Н, т, J=6,5Гц), 1,78 (6H, м), 1,50 (2Н, м), 1,41 (2Н, м), 1,17 (2Н, м)м.ч. Стадія D: Гідроксіефір 7-D (430мг, 1,9ммоль) розчиняли в 2,5мл безводного метиленхлориду в атмосфері азоту, обробляли піридином (0,5мл) і метансульфонілхлоридом (0,368:мл, 4,8ммоль), і перемішували протягом 4год. при кімнатній температурі. Суміш розбавляли 100мл етилацетату і промивали водної 1н НСI, насиченим водним розчином бікарбонату натрію і насиченим розчином солі. Органічний шар висушували над безводним сульфатом натрію і випарювали. Неочищений метил-4-{3[(метилсульфоніл)окси]пропіл}біцикло-[2.2.2]октан1-карбоксилат (7-Ε), одержаний таким чином використовували без очищення в наступній реакції. 1Н ЯМР (500МГц, CDCI 3): δ 4,22 (2Н, т, J=7,5Гц), 3,68 (3Н, с), 3,04 (3Н, с), 1,82 (6Н, м), 1,70 (2Н, м), 1,44 (6Н, м), 1,24 (2Н, м)м.ч. Стадія Е: Мезилат 7-E (3,30г, 10,9ммоль) розчиняли в ДМФА (20мл) і обробляли етантіолатом натрію (1,82г, 21,7ммоль). Розчин перемішували при 45°С протягом 3год., потім суміш розбавляли 100мл етилацетату і промивали двічі водною 1н НСI, потім насиченим водним розчином бікарбонату натрію і насиченим розчином солі. Органічний шар висушували над безводним сульфатом натрію і випарювали з одержанням метил-4-[3(етилтіо)пропіл]біцикло[2.2.2]октан-1-карбоксилату (7-F) у вигляді неочищеної олії, яку використовували в наступній стадії без очищення. 1Н ЯМР (500МГц, CDCI 3): δ 3,68м.ч. (3Η, с), 2,56 (2Н, кв., J=7Гц), 2,51 (2H, т, J=7,5Гц), 1,80 (6H, м), 1,52 (2Н, м), 1,42 (6Н, м), 1,28 (2Н, т, J=7Гц), 1,02 (2Н, м). Стадія F: Сульфід 7-F (3,0г, 11ммоль) розчиняли в метиленхлориді (50мл) і обробляли мхлорнадбензойною кислотою (75%, 6,2г). Розчин перемішували при кімнатній температурі протягом 2год., потім суміш розбавляли 100мл метиленхлориду і промивали насиченим водним розчином бікарбонату натрію, потім двічі насиченим водним розчином бісульфіту натрію, потім двічі насиченим водним розчином бікарбонату натрію і насиченим розчином солі. Органічний шар висушували над безводним сульфатом натрію і випарювали з одержанням метил-4-[3(етилсульфоніл)пропіл]біцикло[2.2.2]октан-1карбоксилату (7-G) у вигляді неочищеної олії, яку використовували в наступній стадії без очищення. 1 Н ЯМР (500МГц, CDCI 3): δ 3,68м.ч. (3Н, с), 2,56 (2Н, кв., J=7Гц), 2,51 (2Н, т, J=7,5Гц), 1,80 (6Н, м), 1,52 (2Н, м), 1,42 (6Н, м), 1,28 (2Н, т, J=7Гц), 1,02 (2Н, м)м.ч. Стадія G: Сульфон 7-G (3,1г, 10ммоль) розчиняли в 9:1 МеОН/вода (50мл) і обробляли гідроксидом калію (3г). Розчин перемішували при кімнатній температурі протягом ночі, потім в суміш додавали 1н НСI і 80459 48 екстрагували чотири рази 50мл метиленхлориду. Органічний шар висушували над безводним сульфатом натрію і випарювали з одержанням 4-[3(етилсульфоніл)пропіл]біцикло[2.2.2]октан-1карбонової кислоти (7-Н), яку використали в наступній стадії без очищення. 1Н ЯМР (500МГц, CDCI 3): δ 3,03 (2Н, кв., J=7Гц), 2,94 (2H, дд, J=7,5Гц), 1,84 (8Н, м), 1,45 (8Н, м), 1,30 (2Н, м)м.ч. Стадія Н: Карбонову кислоту 7-Н (3,0г, 11ммоль) розчиняли в 50мл безводного метиленхлориду в атмосфері азоту, обробляли оксалілхлоридом (2М в метиленхлориді, 16,2мл, 32,4ммоль) і далі 5 краплями ДМФА. Розчин перемішували при кімнатній температурі в атмосфері азоту протягом 90хв., потім упарювали і вміщували у вакуум на 20хв. Хлорангідрид кислоти розчиняли в безводному метиленхлориді (12мл), охолоджували на крижаній бані і, потім, краплинно обробляли розчином метиламіну (2М в ТГФ, 27мл, 54ммоль). Після додавання метиламіну охолоджуючу баню прибирали і реакційну суміш перемішували при температурі навколишнього середовища протягом 30хв. Суміш розбавляли 200мл метиленхлориду і промивали водною 1н НСI, насиченим водним розчином бікарбонату натрію і насиченим розчином солі. Органічний шар висушували над безводним сульфатом натрію і випарювали. Залишок піддавали хроматографії на силікагелі, елююючи градієнтом від 0 до 3% метанолу в етилацетаті з одержанням 4-[3(етилсульфоніл)пропіл]-Nметилбіцикло[2.2.2]октан-1-карбоксаміду 7-I у вигляді білого порошку. МС (ЕСІ+)=302 (М+1); 1Н ЯМР (500МГц, CDCI 3): δ 5,56 (1Н, ушир.с), 3,02 (2H, кв., J=7Гц), 2,94 (2Н, дд, J=7, 5Гц), 2,82 (3Н, д, J=4Гц), 1,80 (8Н, м), 1,45 (9Н, м), 1,28 (2Н, м)м.ч. Стадія І: Метиламід 7-І (0,470г, 1,56ммоль) розчиняли в безводному метиленхлориді (5мл) і обробляли оксалілхлоридом (2М в метиленхлориді, 1,56мл, 3,12ммоль) і ДМФА (2 краплі). Розчин перемішували при кімнатній температурі протягом 1год., потім розчинник видаляли випарюванням при зниженому тиску. Залишок повторно розчиняли в безводному толуолі (7мл) і обробляли 5-[2(трифторметил)феніл]-1H-тетразолом (368мг, 1,72ммоль). Суміш кип'ятили зі зворотним холодильником протягом 18год. Реакційну суміш охолоджували до кімнатної температури і осад відфільтровували і промивали з одержанням 300мг неочищеного продукту у вигляді солі НСI. Сіль поглинали метиленхлоридом/1н НСI і водний шар промивали двома додатковими порціями метиленхлориду. Органічні шари об'єднували і випарювали, і залишок піддавали флеш-хроматографії на силікагелі. Елюцію проводили з градієнтом в інтервалі від 0 до 5% метанол/метиленхлорид. Відповідні фракції об'єднували і випарювали з одержанням 3-{4-[3(етилсульфоніл)пропіл]біцикло[2.2.2]окт-1-ил}-4метил-5-[2-(трифторметил)феніл]-4Н-1,2,4триазолу (7-J) у вигляді білого порошку. МС (ЕСІ+)=470,4 (М+1), 1Н ЯМP (500МГц, CDCI3): δ 7,87 (1H, м), 7,72 (2H, м), 7,56 (1H, м), 3,49 (3Н, с), 3,05 (2Н, кв., J=7,2Гц), 2,96 (2Н, м), 2,18 (6Н, м), 49 1,86 (2Н, м), 1,62 (6Н, м), 1,46 (3Н, т, J=7,3Гц), 1,36 (2Н, м)м.ч. Приклад 8 4-Метил-3-[2-(трифторметил)феніл]-5-(4-{2[(трифторметил)сульфоніл]-етил}біцикло[2.2.2]окт1-ил)-4Н-1,2,4-триазол (8-G) Стадія А: До розчину, що перемішується, метилтрифенілфосфонійброміду (9,1г, 12,8ммоль) в ТГФ (50мл) при 0°С додавали краплями гексаметилдисилазид калію (0,5Μ в толуолі, 48,6мл), протягом 5хв. Одержану суміш залишали для нагрівання до кімнатної температури протягом 1год., потім знов охолоджували до 0°С і обробляли метил-4формілбіцикло[2.2.2]октан-1-карбоксилатом 8-A [Chapman, N. В. та інш., J. Org. Chem., 1970, 35, 917] (2,5г, 12,8ммоль). Реакційну суміш перемішували при кімнатній температурі протягом 18год., потім розбавляли ЕtOАс (350мл). Органічну фазу промивали водною НСI (1н), насиченим водним розчином бікарбонату натрію і насиченим розчином солі, потім висушували (Na2SO4) і концентрували у вакуумі. Одержану тверду речовину очищали флеш-хроматографією на силікагелі, елююючи градієнтом 0-4% ЕtOАс/гексан. Одержаний метил-4-вінілбіцикло[2.2.2]октан-1карбоксилат (8-В) був виділений у вигляді прозорої, безбарвної олії. Стадія В: До розчину, що перемішується, олефіну 8-В (1,6г, 8,3ммоль) в ТГФ (20мл) додавали краплями 9-BBN (0,5Μ в ТГФ, 49мл). Розчин залишали для перемішування при кімнатній температурі протягом 18год., потім послідовно обробляли етанолом (14,5мл), водним NaOH (5н, 5мл) і пероксидом 80459 50 водню (30% водний розчин, 9,7мл). рН реакційної суміші доводили до значення 2 водним розчином НСI (1н) і три рази екстрагували СН2Сl2. Органічні шари об'єднували, промивали насиченим розчином солі, висушували (Na2SO4) і зскрібали. Одержаний спирт 8-С очищали хроматографією на силікагелі, елююючи градієнтом 30-50% ЕЮАс/гексан і виділяли у вигляді прозорої, безбарвної олії. Стадія С: Розчин спирту 8-С (1,5г, 7,1ммоль) в СН2Сl2 (7,5мл), піридин (1,5мл) охолоджували до 0°С і обробляли метансульфонілхлоридом (1,65мл, 21,3ммоль), краплинно, протягом 5хв. Реакційну суміш залишали для нагрівання до кімнатної температури, потім перемішували протягом 3год. Додавали ЕtOАс (300мл) і органічну фазу промивали водним розчином НСI (1н) три рази, насиченим водним розчином бікарбонату натрію два рази і насиченим розчином солі. Органічний шар висушували (Na2SO4) і зскрібали для одержання метил-4-{2[(метилсульфоніл)окси]етил}біцикло[2.2.2]октан-1карбоксилату 8-D у вигляді білої твердої речовини. 1 Н ЯМР (500МГц, CDCI 3): δ 1,52 (6Н, м), 1,66 (2Н, т, J=7,1Гц), 1,84 (6Н, м), 3,04 (3Н, с), 3,69 (3Н, с), 4,29 (2Н, т, J=7,2Гц)м.ч. Стадія D: Розчин 8-D (0,25г, 0,86ммоль), трифторметансульфінат калію (0,3г, 1,72ммоль) і тетрабутиламоніййодид (0,15г, 0,4ммоль) в ДМФА (5мл) нагрівали при 140°С протягом 5год. в атмосфері азоту. Розчин потім охолоджували до кімнатної температури і розбавляли ЕtOАс (100мл) і промивали два рази водним розчином НСI (1н) і насиченим розчином солі. Органічний шар висушували (Na2SO4), зскрібали і піддавали флеш-хроматографії на силікагелі, елююючи градієнтом 5-20% ЕtOАс/гексан. Одержаний трифторметилсульфон 8-Е виділяли у вигляді білої твердої речовини. 1 Н ЯМР (500МГц, CDCI 3): δ 1,50 (6Н, м), 1,78 (2Н, м), 1,82 (6Н, м), 3,17 (2Н, м), 3,67 (3Н, с)м.ч. Стадія Е: Метиловий ефір 8-Е (0,035г, 0,11ммоль) переводили в метиламід 8-Е, використовуючи способи, описані у прикладі 6, на стадіях С і D. N-метил-4-{2[(трифторметил)сульфоніл]етил}біцикло[2.2.2]октан-1карбоксамід виділяли у вигляді білої твердої речовини; МС (ЕСІ +)=328,2 (М+1). Стадія F: Метиламід 8-F (0,030г, 0,092ммоль) перетворювали в триазол 8-G, за методикою прикладу 6, стадії Е. 4-Метил-3-[2-(трифторметил)феніл]-5-(4{2[(трифторметил)сульфоніл]етил}біцикло[2.2.2]окт1-ил)-4Н-1,2,4-триазол (8-G) виділяли у вигляді білого порошку; МС (ЕСІ+)=496,4 (М+1). Приклади 9-102 Слідуючи методикам, схожим з тими, що описані вище, також були одержані наступні сполуки формули II: 51 80459 52 53 80459 54 55 80459 56 57 80459 58 59 80459 60
ДивитисяДодаткова інформація
Назва патенту англійськоюTriazole derivatives as inhibitors of 11-beta-hydroxysteroid dehydrogenase-1
Автори англійськоюSantorelli Gina M., Maletic Milana M., Leieman Aaron G., Graham Donald U., Aster Susan D.
Назва патенту російськоюПроизводные триазола как ингибиторы 11-бета-гидроксистероиддегидрогеназы-1
Автори російськоюСанторелли Джина М., Малетик Милана М., Лееман Аарон Г., Грехем Дональд У., Астер Сьюзан Д.
МПК / Мітки
МПК: C07D 417/08, C07D 409/04, C07D 413/08, C07D 249/08, C07D 403/04, A61P 3/10, C07D 405/04, C07D 401/04, C07D 403/08
Мітки: 11-бета-гідроксистероїддегідрогенази-1, похідні, інгібітори, триазолу
Код посилання
<a href="https://ua.patents.su/33-80459-pokhidni-triazolu-yak-ingibitori-11-beta-gidroksisteroddegidrogenazi-1.html" target="_blank" rel="follow" title="База патентів України">Похідні триазолу як інгібітори 11-бета-гідроксистероїддегідрогенази-1</a>
Попередній патент: Пристрій для пролонгованої балонної дилатації стравоходу
Наступний патент: Вібротермостійкий сцинтиляційний детектор
Випадковий патент: Пристрій для ділення чисел у системі залишкових класів на дільник, кратний одному із модулів