Інгібітори ns3 протеази вгс
Номер патенту: 90909
Опубліковано: 10.06.2010
Автори: Людмерер Стівен У., Вакка Джозеф П, Макінтайр Чарльз Дж., Холловей М. Катарін, Олсен Девід Б., Макколі Джон А., Радд Майкл Т., Лівертон Найджел Дж.
Формула / Реферат
1. Сполука формули (І):
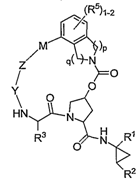 (І)
(І)
або її фармацевтично прийнятна сіль,
де:
р і q обидва дорівнюють 1;
R1 є CONR10SO2R6;
R2 є С1-С6алкілом або С2-С6алкенілом, де вказаний алкіл або алкеніл необов'язково заміщений від 1 до 3 атомами галогену;
R3 є С1-С8алкілом або С3-С8циклоалкілом;( )p q( )
R5 є H;
R6 є С3-С6циклоалкілом;
Y є С(=О);
Z є O;
М є С1-С12алкіленом або С2-С12алкеніленом; і кожен
R10 незалежно є Н або С1-С6алкілом.
2. Сполука за п. 1, де сполука має формулу ІІІ-а:
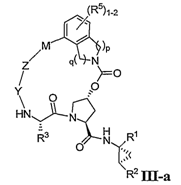
або її фармацевтично прийнятна сіль.
3. Сполука за п. 2, де R1 є CONHSO2R6.
4. Сполука за п. 3, де R6 є циклопропілом.
5. Сполука за п. 4, де R2 є С1-С4алкілом або С2-С4алкенілом.
6. Сполука за п. 5, де R3 є С5-С6циклоалкілом або С1-С4алкілом.
7. Сполука за п. 6, де М є С4-С10алкіленом або С4-С10алкеніленом.
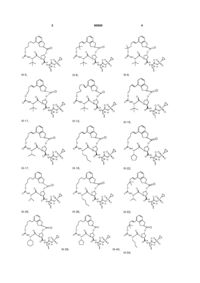
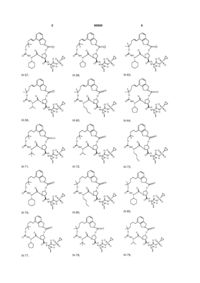
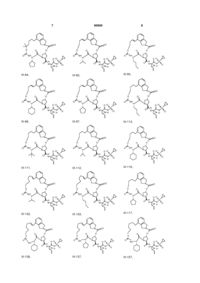
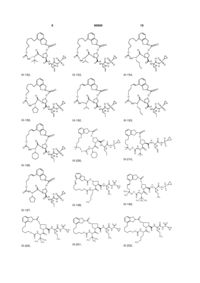
8. Сполука за п. 1, де сполуку вибирають із:
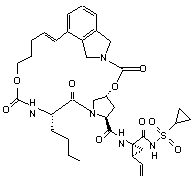
ІІІ-1,
 ІІІ-2,
ІІІ-2,

ІІІ-21,
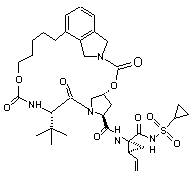
ІІІ-5,
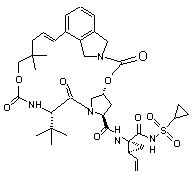
ІІІ-8,
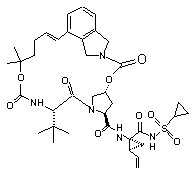
ІІІ-9,
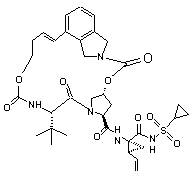
ІІІ-11,
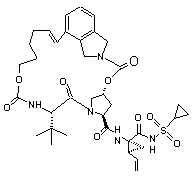
ІІІ-12,
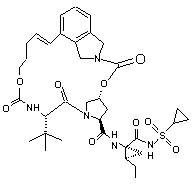
ІІІ-16,
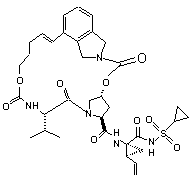
ІІІ-17,
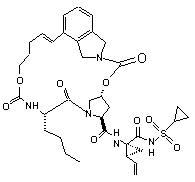
ІІІ-18,
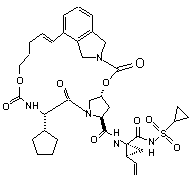
ІІІ-22,
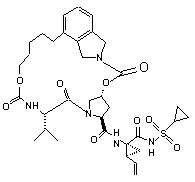
ІІІ-35,
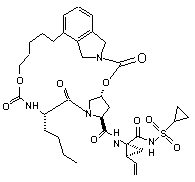
ІІІ-36,
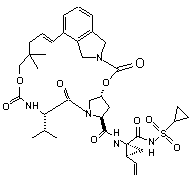
ІІІ-53,
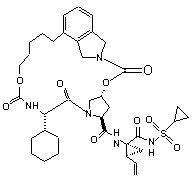
ІІІ-39,
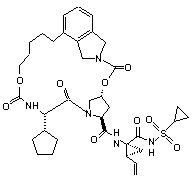
ІІІ-40,
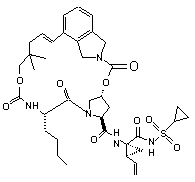
ІІІ-54,
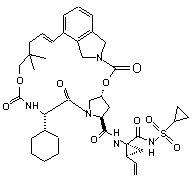
ІІІ-57,
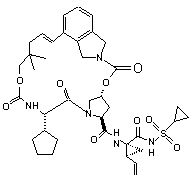
ІІІ-58,

ІІІ-63,

ІІІ-59,

ІІІ-60,

ІІІ-64,
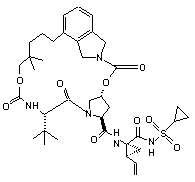
ІІІ-71,
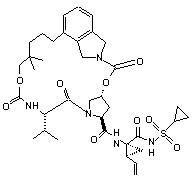
ІІІ-72,
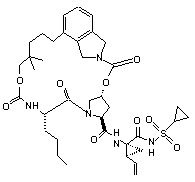
ІІІ-73,
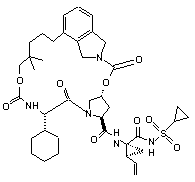
ІІІ-76,

ІІІ-80,

ІІІ-83,
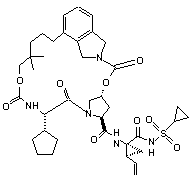
ІІІ-77,

ІІІ-78,

ІІІ-79,

ІІІ-84,
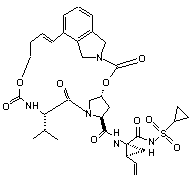
ІІІ-92,
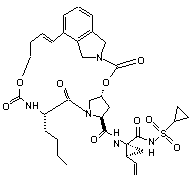
ІІІ-93,
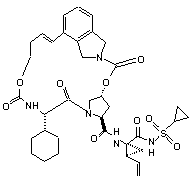
ІІІ-96,
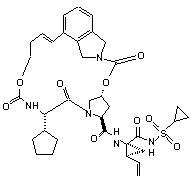
ІІІ-97,
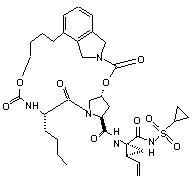
ІІІ-113,
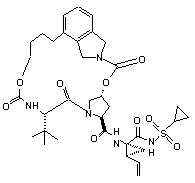
ІІІ-111,
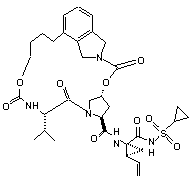
ІІІ-112,
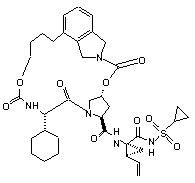
ІІІ-116,
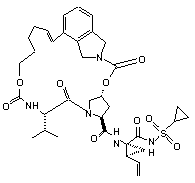
ІІІ-132,
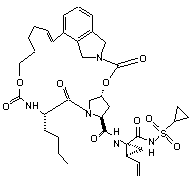
ІІІ-133,
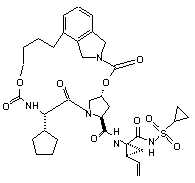
ІІІ-117,
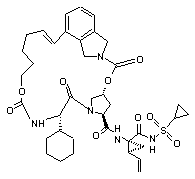
ІІІ-136,

ІІІ-137,

ІІІ-157,

ІІІ-152,

ІІІ-153,

ІІІ-154,
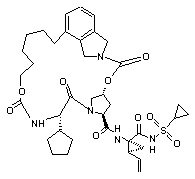
ІІІ-158,
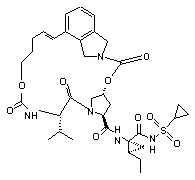
ІІІ-192,

ІІІ-193,

ІІІ-196,
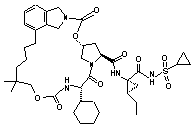 ІІІ-226,
ІІІ-226,
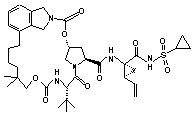
ІІІ-210,

ІІІ-197,
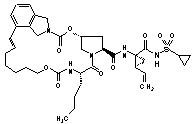
ІІІ-198,
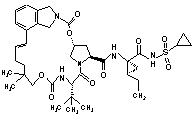
ІІІ-199,
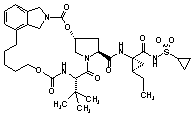
III-200,
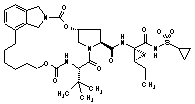
III-201,
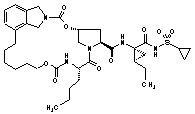
III-202,
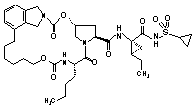
ІІІ-203,
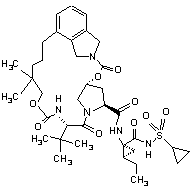
ІІІ-204,
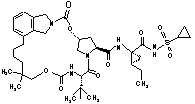
ІІІ-205,
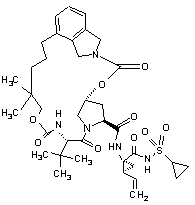
ІІІ-206,
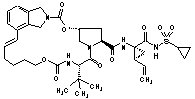
ІІІ-207,
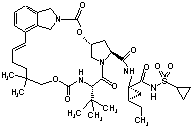
ІІІ-208,
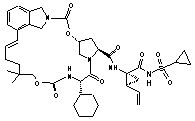
ІІІ-225
або її фармацевтично прийнятна сіль.
9. Фармацевтична композиція, що містить ефективну кількість сполуки за будь-яким із пп. 1-8 або її фармацевтично прийнятної солі і фармацевтично прийнятний носій.
10. Фармацевтична композиція за п. 9, яка додатково містить другий терапевтичний засіб, вибраний із групи, що включає проти-ВГС засіб, імуномодулятор і антибактеріальний засіб.
11. Фармацевтична композиція за п. 10, у якій проти-ВГС засіб являє собою противірусний засіб, вибраний із групи, що включає інгібітор протеази ВГС і інгібітор NS5B полімерази ВГС.
12. Застосування сполуки за будь-яким із пп. 1-8 або її фармацевтично прийнятної солі для приготування лікарського засобу для інгібування активності NS3 протеази ВГС у пацієнта, що потребує цього.
13. Застосування сполуки за будь-яким із пп. 1-8 або її фармацевтично прийнятної солі для приготування лікарського засобу для попередження або лікування інфекції ВГС у пацієнта, що потребує цього.
14. Застосування за п. 13, де зазначений лікарський засіб додатково включає щонайменше один другий терапевтичний засіб, вибраний із групи, що включає проти-ВГС засіб, імуномодулятор і антибактеріальний засіб.
15. Застосування за п. 14, де проти-ВГС засіб являє собою противірусний засіб, вибраний із групи, що включає інгібітор протеази ВГС та інгібітор NS5B полімерази ВГС.
16. Сполука за п.1, яка являє собою сполуку формули ІІІ-205
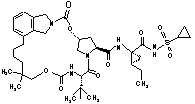
ІІІ-205
або її фармацевтично прийнятну сіль.
17. Фармацевтична композиція, яка містить ефективну кількість сполуки за п. 16 і фармацевтично прийнятний носій.
18. Спосіб інгібування активності NS3 протеази ВГС у пацієнта, який потребує цього, де вводять пацієнту ефективну кількість сполуки за п. 16.
19. Спосіб попередження або лікування інфекції ВГС у пацієнта, який потребує цього, де вводять пацієнту ефективну кількість сполуки за п. 16.
Текст
1. Сполука формули (І): O O OO N H O HN N O ІІІ-1, O O S O O O O O H N N H O HN O N O S O ІІІ-2, O O O H N N H S O ІІІ-21, 3 N O N O O O O NH O 90909 N H N O N H O O N H O H N N H O O NH O H N N H NH NH N N H H N N H O N O O N O O O O H N N H S ІІІ-39, NH O H N N N H S O O O H N O O N O O O N O O S O N H S O ІІІ-53, O NH N H O O O O N O O O H N O O O O N O O O N S ІІІ-36, O NH O N S ІІІ-35, S O O O O O O O O H N N H ІІІ-22, NH O N H N O O O N O O O O N O O O NH N H O N S O O O O O H N ІІІ-18, N NH O O S ІІІ-17, O O O O O N O S ІІІ-16, O O O O O O O O N N H N O N S O O O O H N O ІІІ-12, N N S O O NH O O O NH ІІІ-9, N ІІІ-11, O H N O O O O O O O N O O N O O O NH O O ІІІ-8, N O NH S ІІІ-5, N O O O O O O 4 O O O H N N H NH S N O O ІІІ-40, ІІІ-54, O O O O O H N N H S O 5 N O N O O O O NH O 90909 H N O N H S O NH N H S NH H N N H S O O NH N H N H O O N O O H N O H N N H S ІІІ-78, O N H O O H N O O N O O O N O O S O N S O O NH N H O O NH O N O O O O H N O N H S O ІІІ-83, O N O N O O O O NH O N S O O O O O S ІІІ-80, N ІІІ-77, H N O O O O H N S ІІІ-73, NH O N ІІІ-76, NH O N O N H N O O O O O ІІІ-72, N O O H N O O O O O ІІІ-71, O N H O N S O N O O O O H N O O NH O N O O O NH O N O S ІІІ-64, O O O O O ІІІ-60, N N H N O O O O ІІІ-59, O O O N O O H N O O H N O O O NH O N O O N H N O N ІІІ-63, O O O NH S ІІІ-58, N O H N O O O O O O O ІІІ-57, O O N O O N O O O NH O N 6 NH O O H N N H S N O O ІІІ-79, O O O O O H N N H S O 7 N O O O N H S N H S NH H N N H S NH H N N H N H S N O O O O H N N NH O O O O H N N H N H NH O ІІІ-137, N N H S O N O O O H N N H NH S N O O ІІІ-157, O O O O O O O O H N O O O S O O N S O N O S ІІІ-117, O O O N H O O NH O O ІІІ-133, N O O H N O O O S ІІІ-132, O O N O N O O H N S O O NH O O NH O N O ІІІ-136, N O N O N H ІІІ-116, O O O O O H N O O ІІІ-112, N O S O O O O ІІІ-111, O N H O N O N O O O O H N O O NH O N O O O NH O N O S ІІІ-113, O O O O O ІІІ-97, N N H N O O O O ІІІ-96, O O O N O O H N O O H N O O O NH O N O O N H N O N S ІІІ-93, O O O NH O H N ІІІ-92, N O O O O O NH O O O O ІІІ-84, N O N O O H N O O O NH O N 8 N O O O NH O 90909 O O H N N H S O 9 N O N O N H N NH S O O N H N O N O O O O H N O N H O O O O O H N N H O O O H N O O N N H S N H O O O S N H O O O O O N H N O O O S O O H N O O HN H N O O S N H O N O N O O O O NH O O H N ІІІ-193, N O O N NH S ІІІ-192, N O O O O N NH S ІІІ-158, S N H N O O O O N NH O O H N O ІІІ-154, O O O O N NH S ІІІ-153, ІІІ-152, O O O O H N O O O O O O H N O N O O O O NH 10 N O O O O 90909 ІІІ-210, ІІІ-226, ІІІ-196, O O N O O O O H N O NH N H N N H O O O H N N O N H O O S H3 C O O O O O N O N CH2 H N O H3 C S N O S N H O O CH2 O O O O H N H3C CH3 CH3 H3C ІІІ-199, ІІІ-198, ІІІ-197, O H N O H3 C III-200, N N O O O O N H N N O O O O O O N H S H N O O CH3 CH3 CH3 H3C III-201, H N N O CH3 CH3 O O O O O N H S H N O O CH3 H3C III-202, H N N O O O O O N H CH3 S 11 90909 O O N O O O O N S H N N H N O 12 O N H3 C O H3 C CH3 O H N O CH3 ІІІ-203, O O O HN O O N H CH3 N H N O H3C S S O O H N O H3C O O H N N O H3 C H3C O O H N O CH3 O CH3 H3C ІІІ-205, CH3 ІІІ-204, O N O H3C H3C O N H N O H3 C CH3 CH3 O HN O O N H O S H N N H N O O N O O O O N O O O H3C CH 3 O O O O S N H N H3 C H3 C CH3 CH3 NH H N O O O H3C CH 3 ІІІ-207, O O O N H S CH3 CH3 ІІІ-208, CH2 ІІІ-206, O N O O O N NH H N O N H O O S O O ІІІ-225 або її фармацевтично прийнятна сіль. 9. Фармацевтична композиція, що містить ефективну кількість сполуки за будь-яким із пп.1-8 або її фармацевтично прийнятної солі і фармацевтично прийнятний носій. 10. Фармацевтична композиція за п.9, яка додатково містить другий терапевтичний засіб, вибраний із групи, що включає проти-ВГС засіб, імуномодулятор і антибактеріальний засіб. 11. Фармацевтична композиція за п.10, у якій проти-ВГС засіб являє собою противірусний засіб, вибраний із групи, що включає інгібітор протеази ВГС і інгібітор NS5B полімерази ВГС. 12. Застосування сполуки за будь-яким із пп.1-8 або її фармацевтично прийнятної солі для приготування лікарського засобу для інгібування активності NS3 протеази ВГС у пацієнта, що потребує цього. 13. Застосування сполуки за будь-яким із пп.1-8 або її фармацевтично прийнятної солі для приготування лікарського засобу для попередження або лікування інфекції ВГС у пацієнта, що потребує цього. 14. Застосування за п.13, де зазначений лікарський засіб додатково включає щонайменше один другий терапевтичний засіб, вибраний із групи, що включає проти-ВГС засіб, імуномодулятор і антибактеріальний засіб. 15. Застосування за п.14, де проти-ВГС засіб являє собою противірусний засіб, вибраний із групи, що включає інгібітор протеази ВГС та інгібітор NS5B полімерази ВГС. 16. Сполука за п.1, яка являє собою сполуку формули ІІІ-205 O N O H N N H N H3C H3C H N O O O S O O O CH3 O H3C CH3 ІІІ-205 або її фармацевтично прийнятну сіль. 17. Фармацевтична композиція, яка містить ефективну кількість сполуки за п.16 і фармацевтично прийнятний носій. 18. Спосіб інгібування активності NS3 протеази ВГС у пацієнта, який потребує цього, де вводять пацієнту ефективну кількість сполуки за п.16. 13 90909 14 19. Спосіб попередження або лікування інфекції ВГС у пацієнта, який потребує цього, де вводять пацієнту ефективну кількість сполуки за п.16. Даний винахід стосується макроциклічних сполук, які застосовуються як інгібітори NS3 протеази вірусу гепатиту С (ВГС), їхнього синтезу та їхнього застосування для лікування або профілактики інфекції ВГС. Інфікування вірусом гепатиту С (ВГС) є основною проблемою здоров'я, що призводить до хронічного захворювання печінки, такого як цироз і злоякісна гепатома, у значної кількості інфікованих людей, оцінюваної як 2-15% від усього світового населення. За оцінками тільки в США налічується 3,9 мільйони інфікованих людей, що згідно з даними Центру з контролю за захворюваннями США, приблизно в п'ять разів більше, ніж людей, інфікованих вірусом імунодефіциту людини (ВІЛ). Відповідно до Всесвітньої організації охорони здоров'я, у світі налічується більше ніж 170 мільйонів інфікованих людей, і, принаймні, від 3 до 4 мільйонів чоловік інфікується щороку. При інфікуванні близько 20% людей усувають вірус, але в інших ВГС залишається на все життя. У від десяти до двадцяти відсотків хронічно інфікованих людей згодом розвивається руйнуючий печінку цироз або рак. Вірусне захворювання переноситься парентерально через заражену кров і продукти крові, заражені голки або статевим шляхом і по вертикалі від заражених матерів або матерів-носіїв вірусу до їхнього потомства. Сучасне лікування інфекції ВГС, що обмежене імунотерапією з рекомбінантним інтерфероном-α окремо або у поєднанні з нуклеозидним аналогом рибавірином, обмежує клінічну користь. Крім того, не створена вакцина від ВГС. Отже, існує гостра необхідність у поліпшених терапевтичних агентах, які ефективно борються зі хронічною інфекцією ВГС. Поточний стан відомого рівня техніки для лікування інфекції ВГС обговорюється в наступних посиланнях: В. Dymock, et al, "Novel approaches to the treatment of hepatitis С virus infection," Antiviral Chemistry & Chemotherapy. 11: 79-96 (2000); H. Rosen, et al., "Hepatitis С virus: current understanding and prospects for future therapies." Molecular Medicine Today. 5: 393-399 (1999); D. Moradpour, et al., "Current and evolving therapies for hepatitis C", European J. Gastroenterol. Hepatol., 11: 1189-1202 (1999); R. Bartenschlager, "Candidate Targets for Hepatitis С Virus-Specific Antiviral Therapy", Intervirology. 40: 378-393 (1997); G.M. Lauer and B.D. Walker, "Hepatitis С Virus Infection", N. Engl. J, Med., 345: 41-52 (2001); B.W. Dymock, "Emerging therapies for hepatitis С virus infection", Emerging Drugs. 6: 13-42 (2001); і С. Crabb, "HardWon Advances Spark Excitement about Hepatitis C", Science: 506-507 (2001). Декілька кодованих вірусами ферментів є передбачуваними цілями для терапевтичного втручання, включаючи металопротеазу (NS2-3), серинпротеазу (NS3), геліказу (NS3) і РНК-залежну РНК полімеразу (NS5B). NS3 протеаза розташована в N-кінцевому домені NS3 білка, і вважається первинною ціллю для лікарських засобів, тому що вона відповідає за внутрішньомолекулярний розпад у NS3/4A сайті, і за низхідний міжмолекулярний процесинг на NS4A/4B, NS4B/5A і NS5A/5B сайтах. Попередні дослідження визначили класи пептидів, такі як гексапептиди, а також трипептиди, описані в заявках на патент США US 2005/0020503, US 2004/0229818 і US 2004/00229776, що показують ступені активності при інгібуванні NS3 протеази. Завданням даного винаходу є надання інших сполук, які демонструють активність проти NS3 протеази ВГС. Даний винахід стосується нових макроциклічних сполук формули (І) і/або їхніх фармацевтично прийнятних солей або гідратів. Ці сполуки застосовують для інгібування NS3 (неструктурної 3) протеази ВГС (вірусу гепатиту С), для профілактики або лікування одного або більше із симптомів інфекції ВГС або у вигляді сполук, або у вигляді їхніх фармацевтично прийнятних солей або гідратів (якщо вони прийнятні), або у вигляді інгредієнтів фармацевтичних композицій, окремо або в сполученні з іншими проти-ВГС засобами, антибактеріальними засобами, імуномодуляторами, антибіотиками або вакцинами. Конкретніше, даний винахід стосується сполуки формули (І) і/або її фармацевтично прийнятної солі або гідрату: де: р і q обидва дорівнюють 1; R1 є CONR10SO2R6; R2 є С1-С6алкілом або С2-С6алкенілом, де зазначений алкіл або алкеніл необов'язково заміщений від 1 до 3 атомами галогену; R3 є С1-С8алкілом або С3-С8циклоалкілом; R5 є H; R6 є С3-С6циклоалкілом; Υ є С(=О); Ζ є О; Μ є С1-С12алкіленом або С2-С12алкеніленом; і кожен R10 незалежно є Η або С1-С6алкілом. Даний винахід також включає фармацевтичні композиції, що містять сполуку відповідно до даного винаходу і способи одержання таких фармацевтичних композицій. Даний винахід також включає способи лікування або профілактики одного або більше симптомів інфекції ВГС. 15 Інші варіанти, аспекти і характеристики даного винаходу або описані нижче, або будуть зрозумілими із наведеного нижче опису, прикладів і формули винаходу. Даний винахід включає сполуки вищенаведеної формули І та їхні фармацевтично прийнятні солі і/або гідрати. Ці сполуки та їхні фармацевтично прийнятні солі і/або гідрати є інгібіторами протеази ВГС (наприклад, інгібіторами NS3 протеази ВГС). Даний винахід також включає сполуки формул ІІ-а і ІІІ-а, де всі змінні такі, як визначені для формули І. Перший варіант даного винаходу включає сполуку формули І, ІІ-а або ІІІ-а або її фармацевтично прийнятну сіль або гідрат, де R є CONHSO2R6 і всі інші змінні такі, як визначені вище (наприклад, як визначені в розділі "Суть винаходу"). У першому аспекті першого варіанта R1 є CONHSO2R6, де R6 є С3-С5циклоалкілом; і всі інші змінні мають значення, визначені в першому варіанті. В одному з варіантів першого аспекту першого варіанта R1 є CONHSO2R6, де R6 є циклопропілом; і всі інші змінні мають значення, визначені в першому варіанті. Другий варіант даного винаходу включає сполуку формули І, ІІ-а або ІІІ-а або її фармацевтично прийнятну сіль або гідрат, де R2 є С1-С6алкілом або С2-С6алкенілом; і всі інші змінні такі, як визначені вище або такі, як визначені в будь-якому з попередніх варіантів. У першому аспекті другого варіанта R2 є С1-С4алкілом або С2-С4алкенілом; і всі інші змінні такі, як визначені вище або такі, як визначені в будь-якому з попередніх варіантів. У другому аспекті другого варіанта R2 є С2С4алкенілом; і всі інші змінні такі, як визначені вище або такі, як визначені в будь-якому з попередніх варіантів. В одному з варіантів другого аспекту другого варіанта R2 є вінілом; і всі інші змінні такі, як визначені в третьому варіанті або такі, як визначені в будь-якому з попередніх варіантів. У третьому аспекті другого варіанта R2 є С1-С4алкілом; і всі інші змінні такі, як визначені вище або такі, як визначені в будь-якому з попередніх варіантів. В одному з варіантів третього аспекту третього варіанта R2 є етилом; і всі інші змінні такі, як визначені в третьому варіанті або такі, як визначені в будьякому з попередніх варіантів. Третій варіант даного винаходу включає сполуку формули І, ll-а або lll-а або її фармацевтично прийнятну сіль або гідрат, де R3 є С3С8циклоалкілом або С1-С8алкілом; і всі інші змінні такі, як визначені вище або такі, як визначені в будь-якому з попередніх варіантів. У першому аспекті третього варіанта R3 є С5-С7циклоалкілом 90909 16 або С1-С8алкілом; і всі інші змінні такі, як визначені в третьому варіанті або такі, як визначені в будьякому з попередніх варіантів. У другому аспекті третього варіанта R3 є С5-С6циклоалкілом або С1С8алкілом; і всі інші змінні такі, як визначені в третьому варіанті або такі, як визначені в будь-якому з попередніх варіантів. У третьому аспекті третього варіанта R3 є пропілом або бутилом; і всі інші змінні такі, як визначені в третьому варіанті або такі, як визначені в будь-якому з попередніх варіантів. В одному з варіантів третього аспекту третього варіанта R3 є ізопропілом, н-пропілом або третбутилом; і всі інші змінні такі, як визначені в третьому варіанті або такі, як визначені в будь-якому з попередніх варіантів. У четвертому аспекті третього варіанта R3 є циклопентилом або циклогексилом; і всі інші змінні такі, як визначені в третьому варіанті або такі, як визначені в будь-якому з попередніх варіантів. Четвертий варіант даного винаходу включає сполуку формули І, ІІ-а або lll-а або її фармацевтично прийнятну сіль або гідрат, де Μ є С1С10алкіленом або С2-С10алкеніленом (включаючи алкіл єн або алкенілен із лінійним або розгалуженим ланцюгом); і всі інші змінні такі, як визначені вище або такі, як визначені в будь-якому з попередніх варіантів. У першому аспекті четвертого варіанта Μ є С1-С8алкіленом або С2-С8алкеніленом (включаючи алкілен або алкенілен із лінійним або розгалуженим ланцюгом); і всі інші змінні такі, як визначені вище або такі, як визначені в будь-якому з попередніх варіантів. У другому аспекті четвертого варіанта Μ є С4алкіленом або С4алкеніленом (включаючи алкілен або алкенілен із лінійним або розгалуженим ланцюгом); і всі інші змінні такі, як визначені в четвертому варіанті або такі, як визначені в будь-якому з попередніх варіантів. У третьому аспекті четвертого варіанта Μ є С5алкіленом або С5алкеніленом (включаючи алкілен або алкенілен із лінійним або розгалуженим ланцюгом); і всі інші змінні такі, як визначені в четвертому варіанті або такі, як визначені в будьякому з попередніх варіантів. У четвертому аспекті четвертого варіанта Μ є С6алкіленом або С6алкеніленом (включаючи алкілен або алкенілен із лінійним або розгалуженим ланцюгом); і всі інші змінні такі, як визначені в четвертому варіанті або такі, як визначені в будь-якому з попередніх варіантів. У п'ятому аспекті четвертого варіанта Μ є С7алкіленом або С7алкеніленом (включаючи алкілен або алкенілен із лінійним або розгалуженим ланцюгом); і всі інші змінні такі, як визначені в четвертому варіанті або такі, як визначені в будьякому з попередніх варіантів. У шостому аспекті четвертого варіанта Μ є С8алкіленом або С8алкеніленом (включаючи алкілен або алкенілен із лінійним або розгалуженим ланцюгом); і всі інші змінні такі, як визначені в четвертому варіанті або такі, як визначені в будь-якому з попередніх варіантів. У сьомому аспекті четвертого варіанта Μ є С9алкіленом або С9алкеніленом (включаючи алкілен або алкенілен із лінійним або розгалуженим ланцюгом); і всі інші змінні такі, як визначені в четвертому варіанті або такі, як визначені в будьякому з попередніх варіантів. У восьмому аспекті 17 90909 четвертого варіанта Μ є С10алкіленом або С10алкеніленом (включаючи алкілен або алкенілен із лінійним або розгалуженим ланцюгом); і всі інші змінні такі, як визначені в четвертому варіанті або такі, як визначені в будь-якому з попередніх варіа 18 нтів. У дев'ятому аспекті четвертого варіанта Μ вибирають із наведених нижче варіантів; і всі інші змінні такі, як визначені в четвертому варіанті або такі, як визначені в будь-якому з попередніх варіантів. П'ятий варіант даного винаходу включає сполуку або її фармацевтично прийнятну сіль або гідрат, вибрану із групи, що включає такі сполуки. N O H N O O O N N H O O HN O OO H N O N N O O O H N O N O O NH N O O O O O H N O N H O O NH O ІІІ-11, O O O H N O O N O N H O N S O H N N H S O NH O N O O O N O ІІІ-12, O O H N O O O O N H S O ІІІ-9, N O O O O O O NH ІІІ-8, N S ІІІ-21, O N S O O N H O O O NH ІІІ-5, N O O H N O ІІІ-2, O N N S N H O O O O ІІІ-1, O O HN O N S O O O O H N N H S O O O NH O N O O O H N ІІІ-16, N H S O 19 N O O H N O S N H O NH O O O NH O N H N S N H O NH O O NH O N H N N H S O O O O N NH H N N H S O NH O N H O O O H N N H S O NH O N O N H S O H N N H O O O NH O N S O O H N O O N H S O ІІІ-63, N O O O O N ІІІ-60, O O H N O O O O N S O O O O ІІІ-54, N O N ІІІ-59, H N O O O O NH ІІІ-58, N O O O S N H O O O O N ІІІ-57, O N O O O O O O O ІІІ-53, N O O O H N O ІІІ-40, N NH N H O N S O O ІІІ-39, O H N N O O O NH O O O O O O O N O O O O O ІІІ-36, N O N O O S N H ІІІ-22, N O O O O H N O O O O ІІІ-35, O N S N H N O O H N ІІІ-18, N O NH O O O O O O O ІІІ-17, O O N O O N O O O NH O N 20 N O O O NH O 90909 O O H N N H S O NH O O O N O ІІІ-64, O O H N N H S O 21 N O N O O O O NH O 90909 NH H N O S N H O NH O N O O H N S N H O NH O O O O O N NH O N H S O O NH O O NH O H N N H S ІІІ-84, N O O NH O O N O O O H N ІІІ-96, O N O N H S O NH NH O H N N H S O O N H S O ІІІ-93, N O O O O ІІІ-97, O O H N O O H N O O N O N S O O O O O N H ІІІ-79, O N O O O H N O ІІІ-92, O O N H O N S O O O O O O NH O N O O O N O O O S N H ІІІ-83, O N O N O ІІІ-78, O O N H O O H N O O H N O O N S O O ІІІ-77, N H N N S O O NH O O O O H N N O N N H ІІІ-73, ІІІ-80, O O O H N O O O O O O ІІІ-76, N N H O N O O O N S O O NH O N H N ІІІ-72, O O NH O O O O O O O O ІІІ-71, N O N O O N O O O O N 22 N H S O O O NH O N O O O H N ІІІ-113, N H S O 23 N O O N O O O NH 90909 O O N H N O S N H O NH O N O O NH O N H N O S N H O N O O O H N O N H O O O O O O N H S O N O O O O O H N ІІІ-158, N H S O NH O O O O N H O O N NH S O O H N O O N H S O ІІІ-154, N H O N O O O ІІІ-192, S O N S O O O O H N N H ІІІ-157, O N O O H N O O O O O N NH ІІІ-153, O N NH N H O O O O O O O O S O H N S O O O N NH ІІІ-152, N N O O N H ІІІ-117, O O N O H N O ІІІ-137, O N NH N H O O H N O O O O O O S O H N O O N O N NH S ІІІ-136, N H N O S O O NH O N O O NH O ІІІ-133, O O O N O O O O ІІІ-132, N O N O O N H ІІІ-116, O O O O H N O O ІІІ-112, O O N S N H O O O NH O O H N O O ІІІ-111, N O O N O O N O O O NH 24 NH N O O O H N ІІІ-193, N H S O 25 O N 26 O N O O O N NH H N O O O O H N O O O O O O H N N H N O H N O N H O O S H3 C O CH2 N H N O S N H O O O CH2 O O O O H N H3 C S N H O O ІІІ-210, O N O O S N H O O N O O H N N N O O O O O NH N H ІІІ-226, N O S O ІІІ-196, O HN H N S N H O O N O O O N O O O O 90909 H3C CH3 CH3 H3C ІІІ-199, ІІІ-198, ІІІ-197, O H N O H N N O O O O N H O S H N O O O H3 C CH3 CH3 CH3 H3C O O O S N H N N H N O O O O N H O S H N O O H N N O O O S CH3 CH3 CH3 CH3 O O N H H3C III-202, O O O N O O H N III-201, III-200, N N N O O O O N O N H3 C O H O H3 C CH3 O H N O ІІІ-203, CH3 O O HN CH3 O N H N O O O N H H3C H3C S S O O H N O O O H N N O H3 C H3C N O O CH3 O CH3 H3C ІІІ-205, CH3 ІІІ-204, N O O H3C H3C N O O H N O H3 C O N CH3 O HN CH3 O O N H CH2 ІІІ-206, O O N S O O O H N O H N N O O H3C CH 3 N H O CH3 ІІІ-207, CH3 O O O S N H3 C H3 C H N O O H3C CH 3 NH O O O O N H CH3 ІІІ-208, CH3 S 27 90909 28 O N O O N H N O NH O O N H O S O O ІІІ-225 Інші варіанти даного винаходу включають наступні: (a) Фармацевтичну композицію, що містить ефективну кількість сполуки формули І, ll-а або lll-а і фармацевтично прийнятний носій. (b) Фармацевтичну композицію за пунктом (а), що додатково містить другий терапевтичний засіб, вибраний із групи, що включає проти-ВГС засіб, імуномодулятор і антибактеріальний засіб. (c) Фармацевтичну композицію за пунктом (b), де проти-ВГС засобом є противірусний засіб, вибраний із групи, що включає інгібітор протеази ВГС і інгібітор NS5B полімерази ВГС. (d) Фармацевтичну комбінацію, що включає (і) сполуку формули І, ll-а або III-а і (іі) другий терапевтичний засіб, вибраний із групи, що включає проти-ВГС засіб, імуномодулятор і антибактеріальний засіб; де кожну зі сполук формули І, ll-а або lll-а і другого терапевтичного засобу застосовують у кількості, що робить поєднання ефективним для інгібування NS3 протеази ВГС або для лікування або профілактики інфекції ВГС. (e) Комбінацію за пунктом (d), де проти-ВГС засіб являє собою противірусний засіб, вибраний із групи, що включає інгібітор протеази ВГС та інгібітор NS5B полімерази ВГС. (f) Спосіб інгібування NS3 протеази ВГС у пацієнта, що потребує цього, який включає введення пацієнтові ефективної кількості сполуки формули І, II-а або III-а. (g) Спосіб попередження або лікування інфекції ВГС у пацієнта, що потребує цього, який включає введення пацієнтові ефективної кількості сполуки формули І, II-а або III-а. (h) Спосіб за пунктом (g), у якому сполуку формули І, II-а або III-а уводять у поєднанні з ефективною кількістю, принаймні, одного другого терапевтичного засобу, вибраного із групи, що включає проти-ВГС засіб, імуномодулятор і антибактеріальний засіб. (і) Спосіб за пунктом (h), де проти-ВГС засіб являє собою противірусний засіб, вибраний із групи, що включає інгібітор протеази ВГС та інгібітор NS5B полімерази ВГС. (І) Спосіб інгібування NS3 протеази ВГС у пацієнта, що потребує цього, який включає введення пацієнтові фармацевтичної композиції за пунктами (а), (b) або (с) або комбінації за пунктами (d) або (e). (k) Спосіб попередження або лікування інфекції ВГС у пацієнта, що потребує цього, який включає введення пацієнтові фармацевтичної компо зиції за пунктами (а), (b) або (с) або комбінації за пунктами (d) або (e). Даний винахід також включає сполуку відповідно до даного винаходу (і) для застосування, (іі) для застосування у ролі лікарського засобу для, або (ііі) для застосування для одержання лікарського засобу для: (а) інгібування NS3 протеази ВГС або (b) попередження або лікування інфекції ВГС. У зазначених галузях застосування сполуки відповідно до даного винаходу необов'язково можуть застосовуватися в сполученні з одним або більше терапевтичними засобами, вибраними із протиВГС засобів, антибактеріальних засобів та імуномодуляторів. Додаткові варіанти даного винаходу включають фармацевтичні композиції, комбінації та способи, перераховані в пунктах (а)-(k) вище, і галузі застосування, перераховані в попередньому параграфі, де застосовуваною сполукою відповідно до даного винаходу є сполука за одним або більше варіантом, аспектом, класом, підкласом або підваріантом сполук, описаних вище. У всіх цих варіантах сполука необов'язково може застосовуватися у вигляді фармацевтично прийнятної солі або гідрату, за необхідності. У даному описі термін "алкіл" стосується будьякої лінійної або розгалуженої алкільної групи, що має кількість атомів вуглецю в зазначеному інтервалі. Таким чином, наприклад, "С1-6алкіл" (або "С1C6алкіл") стосується всіх ізомерів гексилалкілу і пентилалкілу, а також н-, ізо-, втор- і трет-бутилу, н- та ізопропілу, етилу і метилу. Як інший приклад, "С1-4алкіл" стосується н-, ізо-, втор- і трет-бутилу, н- та ізопропілу, етилу і метилу. Термін "галоалкіл" стосується алкільної групи, у якій атом водню заміщений галогеном. Термін "алкокси" стосується " алкіл-О-" групи. Термін "алкілен" стосується будь-якої лінійної або розгалуженої алкіленової групи, що має кількість атомів вуглецю в зазначеному інтервалі. Таким чином, наприклад, "-С1-6алкілен" стосується будь-якого з від С1 до С6 лінійних або розгалужених алкіленів. Клас алкіленів, які становлять особливий інтерес у світлі даного винаходу, включає (СН2)1-6-, і особливо підкласи, що становлять особливий інтерес, -(СН2)1-4-, -(СН2)1-3-, -(СН2)1-2- і СН2-. Також становить інтерес алкілен -СН(СН3)-. Термін "алкенілен" стосується будь-якої лінійної або розгалуженої двовалентної алкеніленової групи, що має кількість атомів вуглецю в зазначеному інтервалі. Термін "циклоалкіл" стосується будь-якого циклічного кільця алкану або алкену, що має кіль 29 кість атомів вуглецю в зазначеному інтервалі. Таким чином, наприклад, "С3-8циклоалкіл" (або "С3С8циклоалкіл") стосується циклопропілу, циклобутилу, циклопентилу, циклогексилу, циклогептилу і циклооктилу. Термін "циклоалкокси" стосується "циклоалкіл-О-" групу. Термін "галоген" (або "гало") стосується фтору, хлору, брому та йоду (альтернативно позначений як фтор, хлор, бром і йод). Якщо не зазначене протилежне, всі інтервали, наведені тут, є включеними. Наприклад, гетероарильне кільце, описане як таке, що містить "від 1 до 3 гетероатомів" означає, що кільце може містити 1, 2 або 3 гетероатоми. Також повинно бути зрозумілим, що будь-який зазначений тут інтервал включає у свій обсяг всі підінтервали в межах даного інтервалу. Окислені форми гетероатомів N і S також включені в обсяг даного винаходу. Якщо будь-яка змінна (наприклад, R10) виникає більше одного разу в будь-якому елементі або у формулі І, II-а або III-а або в будь-якій іншій формулі, що зображена та описує сполуки відповідно до даного винаходу, її визначення в кожному випадку є незалежним від її визначення в будь-якому іншому випадку. Також сполучення замісників і/або змінних є припустимим, тільки якщо таке сполучення дає стабільні сполуки. Якщо не зазначене зворотне, заміщення зазначеного замісника дозволено на будь-якому атомі в кільці (наприклад, арилі, гетероароматичному кільці або насиченому гетероциклічному кільці) за умови, що заміщення кільця хімічно припустиме і дає стабільну сполуку. "Стабільною" сполукою є сполука, що може бути одержана і виділена, і структура та властивості якої залишаються або можуть бути практично незмінними протягом періоду часу, достатнього для застосування сполуки для описаних тут цілей (наприклад, терапевтичного або профілактичного введення пацієнтові). У результаті вибору замісників і схем заміщення, визначені сполуки відповідно до даного винаходу можуть мати асиметричні центри і можуть існувати у вигляді сумішей стереоізомерів, або у вигляді окремих діастереомерів або енантіомерів. Всі ізомерні форми цих сполук, виділені або в сумішах, включені в обсяг даного винаходу. Як повинно бути зрозумілим фахівцеві в даній галузі техніки, визначені сполуки відповідно до даного винаходу можуть існувати у вигляді таутомерів. Для цілей даного винаходу, всі посилання на сполуку формули І, II-а або III-а є посиланнями на саму сполуку або на кожний з її таутомерів, або на суміші двох або більше таутомерів. Сполуки відповідно до даного винаходу застосовуються для інгібування протеази ВГС (наприклад, NS3 протеази ВГС), і для попередження або лікування інфекції ВГС. Наприклад, сполуки відповідно до даного винаходу застосовуються для лікування інфекції ВГС після передбачуваного зараження ВГС через переливання крові, обміну рідинами організму, укусів, випадкового уколу голкою або контакту із кров'ю пацієнта під час хірургічної операції. 90909 30 Сполуки відповідно до даного винаходу застосовуються при одержанні і проведенні скринінгових досліджень для противірусних сполук. Наприклад, для сполук відповідно до даного винаходу застосовуються для виділення ферментних мутантів, які є чудовим засобом для скринінгу для сильніших противірусних сполук. Більше того, сполуки відповідно до даного винаходу застосовуються для встановлення або визначення місць зв'язування інших противірусних засобів із протеазою ВГС, наприклад, шляхом порівняльного інгібування. Таким чином, сполуки відповідно до даного винаходу є комерційними продуктами, які можуть продаватися для зазначених вище цілей. Сполуки відповідно до даного винаходу можуть уводитися у вигляді фармацевтично прийнятних солей. Термін "фармацевтично прийнятна сіль" стосується солі, що має ефективність вихідної сполуки, і яка не є біологічно або яким-небудь іншим чином небажаною (наприклад, не є ні токсичною, ні шкідливою для пацієнта). Придатні солі включають кислотно-адитивні солі, які можуть, наприклад, бути одержані змішуванням розчину сполуки відповідно до даного винаходу з розчином фармацевтично прийнятної кислоти, такої як хлористоводнева кислота, сірчана кислота, оцтова кислота, трифтороцтова кислота або бензойна кислота. Безліч сполук відповідно до даного винаходу мають кислотну групу, у цьому випадку їхні фармацевтично прийнятні солі можуть включати солі з лужними металами (наприклад, солі натрію або калію), солі із лужноземельними металами (наприклад, солі кальцію або магнію) і солі, одержані з придатними органічними лігандами, такими як солі четвертинного амонію. Також, у випадку присутності кислоти (-СООН) або спиртової групи, фармацевтично прийнятні складні ефіри можуть застосовуватися для зміни характеристик розчинності або гідролізу сполуки. Термін "введення" і його варіанти (наприклад, "уводити" сполуку), що застосовується стосовно сполуки відповідно до даного винаходу, означає надання сполуки або проліків сполуки пацієнтові за необхідності лікування. Якщо сполука або проліки сполуки дається в сполученні з одним або більше активними агентами (наприклад, противірусними агентами, застосовуваними для лікування інфекції ВГС), кожний термін "введення" і його варіанти розуміють як такі, що включають одночасне й послідовне надання сполуки або солі (або гідрату) та інших агентів. У даному описі термін "композиція" охоплює продукт, що містить визначені інгредієнти, а також будь-який продукт, що одержують, прямо або побічно, при об'єднанні певних інгредієнтів. Під "фармацевтично прийнятним" мають на увазі, що інгредієнти фармацевтичної композиції повинні бути сумісними один з одним і не повинні заподіювати шкоду пацієнтові. Термін "суб'єкт" (альтернативно позначений тут як "пацієнт") у даному описі стосується тварини, переважно, ссавця, найпереважніше, людини, що є об'єктом лікування, спостереження або експерименту. 31 Термін "ефективна кількість" у даному описі означає кількість активної сполуки або фармацевтичного агента, що дозволяє добитися біологічної або медичної реакції в тканині, системі у тварини або людини, що бажана для дослідника, ветеринара, лікаря або іншого клініциста. В одному варіанті, ефективною кількістю є "терапевтично ефективна кількість" для полегшення симптомів захворювання або стану, що лікують. В іншому варіанті, ефективною кількістю є "профілактично ефективна кількість" для профілактики симптомів захворювання або стану, що лікують. Термін також включає кількість активної сполуки, достатню для інгібування NS3 протеази ВГС, тим самим, викликаючи бажану реакцію (наприклад, "ефективна для інгібування кількість"). Якщо активну сполуку (наприклад, активний інгредієнт) уводять у вигляді солі, посилання на кількість активного інгредієнта дані для вільної кислоти або вільної основи сполуки. Для цілей інгібування NS3 протеази ВГС і попередження або лікування інфекції ВГС, сполуки відповідно до даного винаходу, необов'язково у формі солі або гідрату, можуть уводитися будьякими способами, які забезпечують контакт активного агента з місцем дії агента. Вони можуть уводитися будь-якими звичайними способами, доступними для застосування в сполученні з фармацевтичними засобами, або у вигляді окремих терапевтичних агентів, або в сполученні терапевтичних агентів. Вони можуть уводитися окремо, але звичайно уводяться з фармацевтичним носієм, вибраним на основі застосовуваного способу введення і стандартної фармацевтичної практики. Сполуки відповідно до даного винаходу, наприклад, можуть уводитися перорально, парентерально (включаючи підшкірні ін'єкції, внутрішньовенні, внутрішньом'язові, надчеревні ін'єкції або вливання), інгаляцією або ректально, у вигляді стандартної лікарської форми фармацевтичної композиції, що містить ефективну кількість сполуки і придатні нетоксичні фармацевтично прийнятні носії, ад'юванти і наповнювачі. Рідкі композиції, що є придатними для перорального введення (наприклад, суспензії, сиропи, еліксири та подібні) можуть бути одержані із застосуванням методик, відомих у даній галузі техніки, і в них може застосовуватися будь-яке зі звичайних середовищ, таке як вода, гліколі, масла, спирти і подібні. Тверді препарати для перорального введення (наприклад, порошки, пігулки, капсули і таблетки) можуть бути одержані із застосуванням методик, відомих у даній галузі техніки, і в них застосовуються такі тверді наповнювачі, як крохмалі, цукри, каолін, змащувальні агенти, зв'язувальні агенти, дезінтегрувальні агенти і подібні. Парентеральні композиції можуть бути одержані із застосуванням методик, відомих у даній галузі техніки, і звичайно в них застосовується стерильна вода як носій і, необов'язково, інші інгредієнти, такі як засоби, що поліпшують розчинність. Розчини для ін'єкцій можуть бути одержані із застосуванням методик, відомих у даній галузі техніки, де носій включає фізіологічний розчин, розчин глюкози або розчин, що містить суміш фізіологічного розчину і глюкози. Дета 90909 32 льніший опис методик, що є придатними для застосування при одержанні фармацевтичних композицій відповідно до даного винаходу, та інгредієнти, що є придатними для застосування в зазначених композиціях, представлений у Remington's Pharmaceutical Sciences, 18th edition, edited by A. R. Gennaro, Mack Publishing Co., 1990. Сполуки відповідно до даного винаходу можуть уводитися перорально в дозі від 0,001 до 1000мг/кг маси тіла ссавця (наприклад, людини) на добу, однією дозою або багаторазовими дозами. Переважний інтервал доз становить від 0,01 до 500мг/кг маси тіла на добу перорально, однократною дозою або багаторазовими дозами. Інший переважний інтервал становить від 0,1 до 100мг/кг маси тіла на добу перорально, однією дозою або багаторазовими дозами. Для перорального введення композиції можуть мати форму таблеток або капсул, що містять від 1,0 до 500 міліграмів активного інгредієнта, особливо 1, 5, 10, 15, 20, 25, 50, 75, 100, 150, 200, 250, 300, 400 і 500 міліграмів активного інгредієнта для симптоматичного коректування дози до пацієнта. Конкретне дозування і частота введення для кожного конкретного пацієнта може варіюватися і залежить від безлічі факторів, включаючи активність конкретної застосовуваної сполуки, метаболічну стабільність і тривалість дії сполуки, вік, масу тіла, загальний стан здоров'я, стать, режим харчування, спосіб і час введення, швидкість виведення, сполучення лікарських засобів, тяжкість конкретного стану і пацієнта, що проходить терапію. Як відзначено вище, даний винахід також стосується способу інгібування NS3 протеази ВГС, інгібування реплікації ВГС або попередження або лікування інфекції ВГС із застосуванням сполуки відповідно до даного винаходу в сполученні з одним або більше терапевтичними засобами, і фармацевтичною композицією, що містить сполуку відповідно до даного винаходу та один або більше терапевтичних засобів, вибраних із групи, що включає проти-ВГС засіб, імуномодулятор і антибактеріальний засіб. Такі терапевтичні засоби, активні проти ВГС, включають, але не обмежені ними, рибавірин, левовірин, вірамідин, тимозин, альфа-1, R7025 (поліпшений інтерферон (Roche)), інтерферон-β, інтерферон-α, пегільований інтерферон-α (пегінтерферон-α), сполучення інтерферону-α і рибавірину, сполучення пегінтерферону-α і рибавірину, сполучення інтерферону-α і левовірину, і сполучення пегінтерферону-α і левовірину. Інтерферон-а включає, але не обмежений ними, рекомбінантний інтерферон-α2а (такий як інтерферон Roferon від Hoffmann-LaRoche, Nutley, NJ), пегільований інтерферон-α2а (Pegasys™), інтерферон-α2b (такий як інтерферон Intron-A від Schering Corp., Kenilworth, NJ), пегільований інтерферон-α2b (Peglntron™), рекомбінантний консенсусний інтерферон (такий як інтерферон альфакон-1), альбуферон (інтерферон-α, зв'язаний з альбуміном бичачої сироватки (Human Genome Sciences)) і очищений продукт інтерферону-α. Рекомбінантний консенсусний інтерферон від Amgen має торгове найменування Infergen®. Левовірин являє собою L-енантіомер рибавірину, що демон 33 струє імуномодулюючу дію, схожу з рибавірином. Вірамідин являє собою аналог рибавірину, описаний у WO 01/60379 (перевідступлений ICN Pharmaceuticals). Відповідно до способу згідно з даним винаходом, окремі компоненти сполучення можуть уводитися окремо в різний час протягом курсу терапії, або одночасно в багаторазовій або однократній формі поєднання. Для лікування інфекції ВГС сполуки відповідно до даного винаходу також можуть уводитися в сполученні з агентом, що є інгібітором NS3 серинпротеази ВГС. NS3 серинпротеаза ВГС є життєво важливим вірусним ферментом і описана як чудова мета для інгібування реплікації ВГС. Інгібітори NS3 протеази ВГС на основі субстратів і такі, що не містять субстратів, описані в WO 98/22496, WO 98/46630, WO 99/07733, WO 99/07734, WO 99/38888, WO 99/50230, WO 99/64442, WO 00/09543, WO 00/59929, GB-2337262, WO 02/48116, WO 02/48172 і патенті США №6323180. Рибавірин, левовірин і вірамідин можуть проявляти їх проти-ВГС дія шляхом модулювання внутрішньоклітинних пулів нуклеотидів гуаніну шляхом інгібування внутрішньоклітинного ферменту інозинмонофосфатдегідрогенази (IMPDH). IMPDH є обмежуючим швидкість ферментом у способі біосинтезу в de novo біосинтезі нуклеотиду гуаніну. Рибавірин легко фосфорилується внутрішньоклітинно, і похідна монофосфату є інгібітором IMPDH. Таким чином, інгібування IMPDH є ще одною корисною метою для виявлення інгібіторів реплікації ВГС. Тому сполуки відповідно до даного винаходу також можуть уводитися в сполученні з інгібітором IMPDH, таким як VX-497, що описаний у WO 97/41211 і WO 01/00622 (перевідступлені Vertex); іншим інгібітором IMPDH, таким як описаний у WO 00/25780 (перевідступлений BristolMyers Squibb); або мікофенолатом мофетилом [див. А.С. Allison and E.M. Eugui, Agents Action, 44 (Suppl.): 165 (1993)]. Для лікування інфекції ВГС сполуки відповідно до даного винаходу також можуть уводитися в сполученні із противірусним засобом амантадином (1-аміноадамантан) [повний опис цього агента даний у J. Kirschbaum, Anal. Profiles Drug Subs. 12: 136(1983)]. Для лікування інфекції ВГС сполуки відповідно до даного винаходу також можуть уводитися в сполученні з противірусним засобом інгібітором полімерази R7128 (Roche). Сполуки відповідно до даного винаходу також можуть поєднуватися для лікування інфекції ВГС із противірусними 2'-С-розгалуженими рибонуклеозидами, описаними в R. E.Harry-О'kuru, et al., J. Org. Chem., 62: 1754-1759 (1997); M. S. Wolfe, et al., Tetrahedron Lett., 36: 7611-7614 (1995); патенті США №3480613 (25 листопада 1969); міжнародній публікації №WO 01/90121 (29 листопада 2001); міжнародній публікації №WO 01/92282 (6 грудня 2001); і міжнародній публікації №WO 02/32920 (25 квітня 2002); і міжнародній публікації №WO 04/002999 (8 січня 2004); і міжнародній публікації №WO 04/003000 (8 січня 2004); і міжнародній публікації №WO 04/002422 (8 січня 2004); зміст яких включений сюди як посилання повністю. Такі 2'-С 90909 34 розгалужені рибонуклеозиди включають, але не обмежені ними, 2'-С-метилцитидин, 2'-Сметилуридин, 2'-С-метиладенозин, 2'-Сметилгуанозин і 9-(2-С-метил-β-Dрибофуранозил)-2,6-діамінопурин, і відповідний складний ефір амінокислоти С-2', С-3' і С-5' гідроксилів рибози, і відповідні необов'язково заміщені циклічні складні ефіри 1,3-пропандіолу похідних 5'фосфату. Сполуки відповідно до даного винаходу також можуть бути об'єднані для лікування інфекції ВГС із іншими нуклеозидами, що мають проти-ВГС властивості, такими, як описані в WO 02/51425 (4 липня 2002), перевідступлений Mitsubishi Pharma Corp.; WO 01/79246, WO 02/32920, WO 02/48165 (20 червня 2002), і WO 2005003147 (13 січня 2005) (включаючи R1656 (2'Я)-2'-дезокси-2'-фтор-2'-Сметилцитидин, показаний як сполуки 3-6 на сторінці 77), перевідступлений Pharmasset, Ltd.; WO 01/68663 (20 вересня 2001), перевідступлений ICN Pharmaceuticals; WO 99/43691 (2 вересня 1999); WO 02/18404 (7 березня 2002), US 2005/0038240 (17 лютого 2005) і WO 2006021341 (2 березня 2006), включаючи 4'-азидонуклеозиди, такі як R1626, 4'-азидоцитидин, перевідступлений Hoffmann-LaRoche; U.S. 2002/0019363 (14 лютого 2002); WO 02/100415 (19 грудня 2002); WO 03/026589 (3 квітня 2003); WO 03/026675 (3 квітня 2003); WO 03/093290 (13 листопада 2003); US 2003/0236216 (25 грудня 2003); US 2004/0006007 (8 січня 2004); WO 04/011478 (5 лютого 2004); WO 04/013300 (12 лютого 2004); US 2004/0063658 (1 квітня 2004) і WO 04/028481 (8 квітня 2004); зміст яких включено сюди як посилання повністю. Для лікування інфекції ВГС сполуки відповідно до даного винаходу також можуть уводитися в сполученні з агентом, що є інгібітором NS5B полімерази ВГС. Такі інгібітори NS5B полімерази ВГС, які можуть застосовуватися в комбінованій терапії, включають, але не обмежені ними, описані в WO 02/057287, US 6777395, WO 02/057425, US 2004/0067901, WO 03/068244, WO 2004/000858, WO 04/003138 і WO 2004/007512; зміст яких включено сюди як посилання повністю. Інші подібні інгібітори полімерази ВГС включають, але не обмежені ними, валопіцитабін (NM-283; Idenix) і 2'-Р2'-бета-метилцитидин (див. також WO 2005/003147, перевідступлений Pharmasset, Ltd.). В одному варіанті, інгібітори нуклеозиду NS5B полімерази ВГС, які застосовуються в сполученні з даними інгібіторами NS3 протеази ВГС, вибирають із наступних сполук: 4-аміно-7-(2-С-метил-β-Dарабінофуранозил)-7Н-піроло[2,3-d]піримідину; 4аміно-7-(2-С-метил-β-D-рибофуранозил)-7Нпіроло[2,3-d]піримідину; 4-метиламіно-7-(2-Сметил-β-D-рибофуранозил)-7Н-піроло[2,3d]піримідину; 4-диметиламіно-7-(2-С-метил-β-Dрибофуранозил)-7Н-піроло[2,3-d]піримідину; 4циклопропіламіно-7-(2-С-метил-β-Dрибофуранозил)-7Н-пipoлo[2,3-d]пipимiдинy; 4аміно-7-(2-С-вініл-β-D-рибофуранозил)-7Нпіроло[2,3-d]піримідину; 4-аміно-7-(2-Сгідроксиметил-β-D-рибофуранозил)-7Н-піроло[2,3d]піримідину; 4-аміно-7-(2-С-фторметил-β-Dрибофуранозил)-7Н-піроло[2,3-d]піримідину; 4 35 аміно-5-метил-7-(2-С-метил-β-D-рибофуранозил)7Н-піроло[2,3-d]піримідину; 4-аміно-7-(2-С-метилβ-D-рибофуранозил)-7Н-піроло[2,3-d]піримідин-5карбонової кислоти; 4-аміно-5-бром-7-(2-С-β-Dрибофуранозил-7Н-піроло[2,3-а]піримідину; 4аміно-5-хлор-7-(2-С-метил-β-D-рибофуранозил)7Н-пipoлo[2,3-d]пipимiдину; 4-аміно-5-фтор-7-(2-Сметил-β-D-рибофуранозил)-7Н-пipoлo[2,3d]пipимiдинy; 2,4-діаміно-7-(2-С-метил-β-Dрибофуранозил)-7Н-пipoлo[2,3-d]пipимiдинy; 2аміно-7-(2-С-метил-β-D-рибофуранозил)-7Нпіроло[2,3-d]пipимiдину; 2-аміно-4циклопропіламіно-7-(2-С-метил-β-Dрибофуранозил)-7Н-пipoлo[2,3-d]пipимiдинy; 2аміно-7-(2-С-метил-β-D-рибофуранозил)-7Нпіроло[2,3-d]пipимiдин-4(3H)-онy; 4-аміно-7-(2-Сетил-β-D-рибофуранозил)-7Н-піроло[2,3d]пipимiдину; 4-аміно-7-(2-С,2-О-диметил-β-Dрибофуранозил)-7Н-піроло[2,3-d]пipимiдину; 7-(2C-мeтил-β-D-pибoфypaнoзил)-7H-пipoлo[2,3d]пipимiдин-4(3H)-ону; 2-аміно-5-метил-7-(2-С, 2-Одиметил-β-D-рибофуранозил)-7Н-піроло[2,3d]піримідин-4(3Н)-ону; 4-аміно-7-(3-дезокси-2-Сметил-β-D-рибофуранозил)-7Н-піроло[2,3d]піримідину; 4-аміно-7-(3-дезокси-2-С-метил-β-Dарабінофуранозил)-7H-пipoлo[2,3-d]пipимiдинy; 4аміно-2-фтор-7-(2-С-метил-β-D-рибофуранозил)7Н-пipoлo[2,3-d]пipимiдинy; 4-аміно-7-(3-С-метилβ-D-рибофуранозил)-7Н-піроло[2,3-d]піримідину; 4аміно-7-(3-С-метил-β-D-ксилофуранозил)-7Нпіроло[2,3-d]піримідину; 4-аміно-7-(2,4-ди-С-метилβ-D-рибофуранозил)-7Н-піроло[2,3-d]піримідину; 4аміно-7-(3-дезокси-3-фтор-2-С-метил-β-Dрибофуранозил)-7Н-піроло[2,3-d]піримідину; і відповідних 5'-трифосфатів; або їхніх фармацевтично прийнятних солей. Сполуки відповідно до даного винаходу також можуть бути об'єднані для лікування інфекції ВГС із не нуклеозидними інгібіторами полімерази ВГС, такими як описані у WO 01/77091 (18 жовтня 2001), перевідступлений Tularik, Inc.; WO 01/47883 (5 липня 2001), перевідступлений Japan Tobacco, Inc.; WO 02/04425 (17 січня 2002), перевідступлений Boehringer Ingelheim; WO 02/06246 (24 січня 2002), перевідступлений Istituto di Ricerche di Biologia Moleculare P. Angeletti S.P.A.; WO 02/20497 (3 березня 2002); WO 2005/016927 (зокрема, JTK003), перевідступленому Japan Tobacco, Inc.; зміст яких включено сюди як посилання повністю; і ВГС-796 (Viropharma Inc.). В одному варіанті, не нуклеозидні інгібітори NS5B полімерази ВГС, які застосовуються в сполученні з даними інгібіторами NS3 протеази ВГС, вибирають із наступних сполук: 14-циклогексил-6[2-(диметиламіно)етил]-7оксо-5,6,7,8тетрагідроіндоло[2,1-а][2,5]бензодіазоцин-11карбонової кислоти; 14-циклогексил-6-(2морфолін-4-ілетил)-5,6,7,8-тетрагідроіндоло[2,1а][2,5]бензодіазоцин-11-карбонової кислоти; циклогексил-6-[2-(диметиламіно)етил]-3-метокси5,6,7,8-тетрагідроіндоло[2,1-а][2,5]бензодіазоцин11-карбонової кислоти; 14-циклогексил-3-метокси6-метил-5,6,7,8-тетрагідроіндоло[2,1а][2,5]бензодіазоцин-11-карбонової кислоти; метил ({[(14-циклогексил-3-метокси-6-метил-5,6,7,8 90909 36 тетрагідроіндоло[2,1-а][2,5]бензодіазоцин-11іл)карбоніл]аміно}сульфоніл)ацетату; ({[(14циклогексил-3-метокси-6-метил-5,6,7,8тетрагідроіндоло[2,1-а][2,5]бензодіазоцин-11іл)карбоніл]аміно}сульфоніл)оцтової кислоти; 14циклогексил-N-[(диметиламіно)сульфоніл]-3метокси-6-метил-5,6,7,8-тетрагідроіндоло[2,1а][2,5]бензодіазоцин-11-карбоксаміду; 3-хлор-14циклогексил-6-[2-(диметиламіно)етил]-7-оксо5,6,7,8-тетрагідроіндоло[2,1-а][2,5]бензодіазоцин11-карбонової кислоти; біс(трифторацетату) N'(11-карбокси-14-циклогесил-7,8-дигідро-6Ніндоло[1,2-е][1,5]бензоксазоцин-7-іл)-N,Nдиметилетан-1,2-діамінію; 14-циклогексил-7,8дигідро-6Н-індоло[2,1-e][1,5]бензоксазоцин-11карбонової кислоти; 14-циюіогексил-6-метил-7оксо-5,6,7,8-тетрагідроіндоло[2,1а][2,5]бензодіазоцин-11-карбонової кислоти; 14циклогексил-3-метокси-6-метил-7-оксо-5,6,7,8тетрагідроіндоло[2,1-а][2,5]бензодіазоцин-11карбонової кислоти; 14-циклогексил-6-[2(диметиламіно)етил]-3-метокси-7-оксо-5,6,7,8тетрагідроіндоло[2,1-а][2,5]бензодіазоцин-11карбонової кислоти; 14-циклогексил-6-[3(диметиламіно)пропіл]-7-оксо-5,6,7,8тетрагідроіндоло[2,1-а][2,5]бензодіазоцин-11карбонової кислоти; 14-циклогексил-7-оксо-6-(2піперидин-1-ілетил)-5,6,7,8-тетрагідроіндоло[2,1а][2,5]бензодіазоцин-11-карбонової кислоти; 14циклогексил-6-(2-морфолін-4-ілетил)-7-оксо5,6,7,8-тетрагідроіндоло[2,1-а][2,5]бензодіазоцин11-карбонової кислоти; 14-циклогексил-6-[2(діетиламіно)етил]-7-оксо-5,6,7,8тетрагідроіндоло[2,1-а][2,5]бензодіазоцин-11карбонової кислоти; 14-циклогексил-6-(1метилпіперидин-4-іл)-7-оксо-5,6,7,8тетрагідроіндоло[2,1-а][2,5]бензодіазоцин-11карбонової кислоти; 14-циклогексил-N[(диметиламіно)сульфоніл]-7-оксо-6-(2-піперидин1-ілетил)-5,6,7,8-тетрагідроіндоло[2,1а][2,5]бензодіазоцин-11-карбоксаміду; 14циклогексил-6-[2-(диметиламіно)етил]-N[(диметиламіно)сульфоніл]-7-оксо-5,6,7,8тетрагідроіндоло[2,1-а][2,5]бензодіазоцин-11карбоксаміду; 14-циклопентил-6-[2(диметиламіно)етил]-7-оксо-5,6,7,8тетрагідроіндоло[2,1-а][2,5]бензодіазоцин-11карбонової кислоти; 14-циклогексил-5,6,7,8тетрагідроіндоло[2,1-а][2,5]бензодіазоцин-11карбонової кислоти; 6-аліл-14-циклогексил-3метокси-5,6,7,8-тетрагідроіндоло[2,1а][2,5]бензодіазоцин-11-карбонової кислоти; 14циклопентил-6-[2-(диметиламіно)етил]-5,6,7,8тетрагідроіндоло[2,1-а][2,5]бензодіазоцин-11карбонової кислоти; 14-циклогексил-6-[2(диметиламіно)етил]-5,6,7,8-тетрагідроіндоло[2,1а][2,5]бензодіазоцин-11-карбонової кислоти; 13циклогексил-5-метил)-4,5,6,7тетрагідрофуро[3',2',6,7][1,4]діазоцино[1,8-а]індол10-карбонової кислоти; 15-циклогексил-6-[2(диметиламіно)етил]-7-оксо-6,7,8,9-тетрагідро-5Ніндоло[2,1-а][2,6]бензодіазонін-12-карбонової кислоти; 15-циклогексил-8-оксо-6,7,8,9-тетрагідро-5Ніндоло[2,1-а][2,6]бензодіазонін-12-карбонової кислоти; 13-циклогексил-6-оксо-6,7-дигідро-5Н 37 індоло[1,2-d][1,4]бензодіазепин-10-карбонової кислоти; і їхніх фармацевтично прийнятних солей. Зазначені вище інгібітори NS5B на основі індолу можуть бути одержані наведеними нижче 90909 38 способами А-Е, де різні змінні можуть бути вибрані відповідно до конкретної одержуваної тетрациклічної сполуки індолу: Спосіб А Проміжну сполуку 2-броміндолу (одержану, як описано в опублікованій заявці на міжнародний патент WO 2004087714) функціоналізують на атомі азоту індолу із введенням попередньої функціональної групи W'/X' на кожному із двох або обох елементах W/X зв'язку. Методика Pd-медійованого перехресного сполучення (наприклад, Suzuki, Stille і т.д.) потім дає попередню функціональну групу Z'/Y', що має С2 ароматичну групу на кожному із двох або обох елементах Z/Y зв'язку. Обробка функціональної групи з наступним замиканням кільця дає тетрациклічну систему. Потім зняття захисту зі складного ефіру дає цільові індольні карбонові кислоти, у яких С2 ароматична група зв'язана з атомом азоту індолу. Спосіб В Після збирання зв'язків і одержання придатної 2-галогенароматичної групи, Pd-медійоване замикання кільця дає конденсовану тетрациклічну сис тему. Потім зняття захисту зі складного ефіру дає цільові індольні карбонові кислоти, у яких С2 ароматична група зв'язана з атомом азоту індолу. 39 90909 40 Спосіб С С2 ароматичну групу уводять на початковому етапі із застосуванням методики Pd-медійованого перехресного сполучення (Suzuki, Stille і т.д.). Потім утворюють зв'язок із циклізацією в атомі азоту індолу із замиканням кільця. Потім зняття захисту зі складного ефіру дає цільові індольні карбонові кислоти, у яких С2 ароматична група зв'язана з атомом азоту індолу. Спосіб D Конденсовані тетрациклічні проміжні сполуки зі способів А-С піддають обробці функціональної групи у зв'язку, потім знімають захист зі складного ефіру з одержанням цільових С2-зв'язаних індольних карбонових кислот. Спосіб E С2-зв'язані індольні карбонові кислоти, одержані в способах A-D, далі перетворені через обробку карбоксилатної функціональної групи з одержанням сполук, що мають карбоксилатний замісник або карбоксамід. Під час проведення зазначених вище методів синтезу може бути необхідно і/або бажано захистити чутливі або реакційно-здатні групи в будь-яких молекулах, що розглядають. Це може бути досягнуте із застосуванням звичайних захисних груп, таких як описані в Protective Groups in Organic Chemistry, ed. J.F.W. McOmie, Plenum Press, 1973; і T.W. Greene & P.G.M. Wuts, Protective Groups in Organic Synthesis, John Wiley & Sons, 3rd edition, 1999. Захисні групи можуть бути видалені на зручній для цього наступній стадії заміщення методами, відомими в даній галузі техніки. Інгібуюча дія на NS3 протеазу ВГС сполук відповідно до даного винаходу може бути протесто вана із застосуванням аналізів, відомих у даній галузі техніки. Одним із таких аналізів є аналіз флуоресценції з часовим розділенням (ФЧР), описаний у прикладі 56. Інші приклади таких аналізів описані, наприклад, у міжнародній публікації патенту WO 2005/046712. Сполуки, що застосовують як інгібітори NS3 протеази ВГС, мають Kі менше ніж 50мкМ, переважніше, менше ніж 10мкм, навіть переважніше, менше ніж 100нм. Даний винахід також включає способи одержання сполук формули І, II-а або III-а. Сполуки відповідно до даного винаходу можуть бути легко одержані відповідно до наведених нижче схем реакції і прикладів, або із застосуванням їхніх модифікацій, використовуючи легко доступні вихідні матеріали, реагенти і звичайні методики синтезу. У цих реакціях також можливо використовувати варіанти, які самі по собі відомі фахівцям у даній галузі техніки, але не зазначені більш детально. 41 90909 42 Більше того, інші способи одержання сполук відповідно до даного винаходу будуть очевидні фахівцеві в даній галузі техніки у світлі наведених нижче схем реакцій і прикладів. Якщо не зазначено інакше, всі змінні є такими, як визначені вище. Представлені нижче схеми реакцій і приклади наводяться тільки для ілюстрації даного винаходу і його практики. Приклади не повинні вважатися такими, що обмежують обсяг або суть даного винаходу. Загальний опис синтезу Сполуки відповідно до даного винаходу можуть бути синтезовані як показано на загальних схемах 1 і 2. Схема 1 На схемі 1 (n=0-9) зображений синтез характерної молекули. Відповідним чином захищена похідна 4-гідроксипроліну (наприклад, захищений карбаматом азот і захищена складним ефіром кислота може бути піддана взаємодії з карбонілдіімідазолом або еквівалентним реагентом і потім піддана взаємодії з відповідним чином захищеним ізоіндоліном або тетрагідроізохіноліном). Алкенільна функціональна група може бути введена на цій стадії або пізніше шляхом каталізованої паладієм реакції галогенідного замісника, такого як хлорид, бромід і йодид, або іншої функціональної групи, такої як трифлат, з металорганічним реагентом, таким як вініл або алілтриалкілолово. Альтернативно, алкенільна функціональна група може бути введена до реакції із захищеним пролінолом. На схемі 2 описаний синтез олефіну, що містить амінокислотну групу. Амінокислота (або комерційно доступна, або легко одержана методами, відомими в даній галузі техніки), в якій кислотна функціональна група захищена у вигляді складного ефіру (наприклад, R=метилу), може бути перетворена в аміди А сполученням олефінової карбо нової кислоти із застосуванням широкого спектра пептидних сполучних агентів, відомих фахівцям у даній галузі техніки, таких як ДЦК, ЕДК, БОФ, ТБТУ і т.д. Одержання сульфонамідів В може бути досягнуте взаємодією з придатним сульфонілхлоридом в органічному розчиннику (наприклад, ТГФ) з аміновою основою у ролі поглинача. Похідні сечовини С можуть бути одержані взаємодією аміноефіру з реагентом, таким як карбонілдіімідазол, з одержанням проміжного ізоціанату (Catalano et al., WO 03/062192) з наступним додаванням другого олефіновмісного аміну. Альтернативно, фосген, дифосген або трифосген може застосовуватися замість карбонілдіімідазолу. Похідні ціаногуанідину D можуть бути одержані взаємодією складного ефіру амінокислоти з дифеніл С-ціанокарбонімідатом в органічному розчиннику з наступним додаванням другого олефіновмісного аміну. Похідні карбамату Ε можуть бути одержані взаємодією олефіновмісного спирту з карбонілдіімідазолом (або фосгеном, трифосгеном або дифосгеном) в органічному розчиннику з наступним додаванням аміноефіру. 43 90909 44 Схема 2 Після функціоналізації аміну, складний ефір може бути гідролізований із застосуванням безлічі основних умов, відомих фахівцям у даній галузі техніки (Theodora W. Greene, Protective Groups in Organic Synthesis, Third Edition, John Wiley and Sons, 1999). Зняття карбаматної захисної групи на проліновій групі може бути проведене безліччю способів, відомих фахівцям у даній галузі техніки (Theodora W. Greene. Protective Groups in Organic Synthesis, Third Edition, John Wiley and Sons, 1999). Для завершення синтезу сполук відповідно до даного винаходу похідна амінокислоти може бути зв'язана з похідною проліну із застосуванням безлічі пептидних сполучних агентів, таких як ДЦК, ЕДК, БОФ, ТБТУ і т.д. (див. схему 1). Макроциклізація потім проводиться шляхом олефінової перестановки із застосуванням великої кількості каталізаторів, які описані в літературі для цієї мети. На цій стадії олефіновий зв'язок, утворений під час перестановки із замиканням кільця, може бути необов'язково гідрований з одержанням насиченого зв'язку, або функціоналізований альтернативними методами, такими як циклопропанування. Складний ефір проліну потім гідролізують в основних умовах і сполучать зі складним ефіром циклопропіламінокислоти (придатна алкенільна або алкілциклопропанова група молекули може бути одержана як описано вище (Llinas-Brunet et al., US 6323180) і піддають додатковому основному гідролізу з одержанням кінцевих сполук. Складний ефір проліну також може бути гідролізований і безпосередньо зв'язаний з сульфонамідом ацилу циклопропіламінокислоти, що має придатну функціональну групу (який може бути одержаний згідно Wang X.A. et al., WO 2003/099274) з одержанням кінцевих сполук. Каталізатори олефінового метатезису включають наступні види на основі рутенію: F: Miller et al J. Am. Chem. Soc 1996, 118, 9606; G: Kingsbury et al J. Am. Chem. Soc 1999, 121, 791; H: Scholl et al Org. Lett. 1999, 1, 953; Hoveyda et al US2002/0107138; K: Furstner et al. J. Org. Chem 1999, 64, 8275. Застосування цих каталізаторів при метатезисі із замиканням кільця є добре відомим у літературі (наприклад, Trnka and Grubbs, Ace. Chem. Res. 2001, 34, 18). 45 Список абревіатур БОФ - гексафторфосфат бензотриазол-1ілокситрис(диметиламіно)фосфонію ДЦК - дициклогексилкарбодіімід CH3CN - ацетонітрил ДБУ - 1,8-діазабіцикло[5.4.0]ундец-7-ен ДХЕ - дихлоретан ДХМ - дихлорметан ДМАП - 4-диметиламінопіридин ДІПЕА - діізопропілетиламін ДМФ - диметилформамід ДМСО - диметилсульфоксид ЕДК N-(3-диметиламінопропіл)-N'етилкарбодіімід Et3N – триетиламін Еt2О - діетиловий ефір EtOAc – етилацетат EtOH - етанол ГАТУ гексафторфосфат О-(7азабензотриазол-1-іл)-N,N,N',N'-тетраметилуронію НВr - бромистоводнева кислота НСI - хлористоводнева кислота НОАс - оцтова кислота ГОАт-1-гідрокси-7-азабензотриазол LiOH - гідроксид літію МеОН - метанол MgSO4 - сульфат магнію NаНСО3 - бікарбонат натрію Na2SO4 - сульфат натрію NaOH - гідроксид натрію NH4CI - хлорид амонію NH4OH - гідроксид амонію Pd/C - паладій на вугіллі Pd(PPh3)4 - тетракис(трифенілфосфін)паладій (0) PhMe - толуол PPh3 - трифенілфосфін КТ - кімнатна температура ТГФ - тетрагідрофуран ТБТУ - тетрафторборат О-бензотриазол-1-ілN,N,N',N'-тетраметилуронію Приклад 1 90909 46 (5R,7S,10S)-10-Бутил-N-((1R,2S)-1{[(циклопропілсульфоніл)аміно]карбоніл}-2вінілциклопропіл)-3,9,12-триоксо1,6,7,9,10,11,12,14,15,16-декагідро-5Н-2,22:5,8диметано-4,13,2,8,11бензодіоксатриазациклоікозин- 7-карбоксамід (ІІІ1) Стадія 1: 4-Хлоризоіндолін Суміш ангідриду 3-хлорфталевої кислоти (9г, 49,2ммоль) і формаміду (100мл) нагрівають до температури 125°С і перемішують протягом 3 годин. Потім додають воду (300мл), і суміш охолоджують до кімнатної температури. Суміш фільтрують, і одержану білу тверду речовину промивають водою і сушать із одержанням 4-хлор-1Н-ізоіндол1,3(2Н)діону (7,7г, вихід 86%). До твердого 4-хлор-1Н-ізоіндол-1,3(2Н)діону (4,0г, 22,0ммоль) додають комплекс боргідрид-ТГФ (1М/ТГФ, 88,1мл, 88,1ммоль) по краплях при перемішуванні. Після завершення додавання реакційну суміш нагрівають до температури кипіння зі зворотним холодильником (80°С) і перемішують протягом 6 годин. Потім реакційну суміш охолоджують до температури 0°С, обережно по краплях додають метанол (2,8мл, 88,1ммоль), і реакційну суміш нагрівають до кімнатної температури. До 47 дають НСІ (6н) доти, поки суміш не стане кислою, і потім суміш концентрують. Неочищений продукт розчиняють в 1М НСІ і двічі екстрагують етиловим ефіром і двічі дихлорметаном. рН водного шару доводять до рН=11 додаванням твердого NaOH і три рази екстрагують етилацетатом. Об'єднані етилацетатні екстракти сушать над Na2SO4, фільтрують і концентрують із одержанням 4хлорізоіндоліну (1,8г, вихід 53%). МСНР (ІЕР) m/z 154 [(М+Н)+; розраховано для C8H9CІN: 154]. Стадія 2: 1-трет-Бутил-2-метил (2S,4R)-4-{[(4xлop-1,3-дигідро-2H-ізоіндол-2іл)карбоніл]окси}піролідин-1,2-дикарбоксилат До розчину метилового ефіру N-Boc проліну (2,87г, 11,7ммоль) у ДМФ (15мл) при температурі 0°С додають карбонілдіімідазол (1,9г, 11,7ммоль). Реакційну суміш нагрівають до кімнатної температури і перемішують протягом 30хв. Потім додають розчин 4-хлорізоіндоліну (1,8г, 11,7ммоль) у ДМФ (10мл), і реакційну суміш нагрівають до температури 50°С і перемішують протягом 2 годин. Реакційну суміш виливають в етиловий ефір і 0,5М НСІ і шари розділяють. Органічний шар промивають водою, сушать над Na2SO4, фільтрують і концентрують. Неочищений продукт очищають на силікагелі (градієнтне елюювання від 10% до 90% етилацетату в гексані) з одержанням 1-трет-бутил-2метил (2S,4R)-4-{[(4-хлор-1,3-дигідро-2Н-ізоіндол2-іл)карбоніл]окси}піролідин-1,2-дикарбоксилату (3,3г, вихід 66%). МСНР (ІЕР) m/z 325 [(М+Н-Вос)+; розраховано для C15H18CIN2O4: 325]. Стадія 3: 1-трет-Бутил-2-метил (2S,4R)-4-{[(4метил-1,3-дигідро-2H-ізоіндол-2іл)карбоніл]окси}піролідин-1,2-дикарбоксилат Розчин 1-трет-бутил-2-метил (2S,4R)-4-{[(4вініл-1,3-дигідро-2Н-ізоіндол-2іл)карбоніл]окси}піролідин-1,2-дикарбоксилату (40мг, 0,09ммоль), вінілтрибутилстанану (36мг, 0,11ммоль) і фториду цезію (31мг, 0,21ммоль) у діоксані (0,5мл) дегазують із застосуванням N2 протягом 15хв. Потім додають біс(трибутилфосфін)паладій(0) (2мг, 0,005ммоль), і посудину з реакційною сумішшю герметично закривають і нагрівають до температури 100°С протягом 18 годин. Після охолодження реакційну суміш концентрують і очищають хроматографією на силікагелі (від 10% до 90% етилацетату в гексані) 90909 48 з одержанням 1-трет-бутил-2-метил (2S,4R)-4-{[(4вініл-1,3-дигідро-2Н-ізоіндол-2іл)карбоніл]окси}піролідин-1,2-дикарбоксилату (10мг, вихід 25%). МСНР (ІЕР) m/z 317 [(М+Н+ Вос) ; розраховано для C17H21N2O4: 317]. Стадія 4: Метил N-[(пент-4-енілокси)карбоніл]1-норлейцил-(4R)-4-{[(4-вініл-1,3-дигідро-2Нізоіндол-2-іл)карбоніл]окси}-L-пролінат У колбу, що містить 1-трет-бутил-2-метил (2S,4R)-4-{[(4-вініл-1,3-дигідро-2Н-ізоіндол-2іл)карбоніл]окси}піролідин-1,2-дикарбоксилат (60мг, 0,14ммоль) додають 4М розчин НСІ у діоксані (2мл). Через 1 годину РХ-МС аналіз показує повне поглинання вихідного матеріалу та утворення бажаного Вос продукту. Леткі сполуки потім видаляють у вакуумі, і неочищений продукт поміщають у ДМФ (2мл). До цієї суміші додають N-[(пент-4-ен-1ілокси)карбоніл]-L-норлейцин (41мг, 0,17ммоль) (одержаний за описаною нижче методикою), ДІПЕА (0,076мл, 0,43ммоль), ЕДК (54мг, 0,28ммоль) і ГОАт (44мг, 0,28ммоль). Після перемішування при к.т. протягом 30хв., повне поглинання аміну підтверджується РХ-МС. Потім реакційну суміш обробляють 0,5н НСІ і EtOAc. Органічний шар промивають насиченим розчином солі та сушать над MgSO4. Потім розчинник видаляють у вакуумі, і неочищений продукт очищають на двоокисі кремнію (10-90% EtOАс/гексан) з одержанням 60мг (вихід 79%) метил N-[(пент-4-енілокси)карбоніл]-1норлейцил-(4R)-4-{[(4-вініл-1,3-дигідро-2Нізоіндол-2-іл)карбоніл]окси}-L-пролінату. МСНР (ІЕР) m/z 542 [(М+Н)+; розрахований для C29H40N3O7,: 542]. Стадія 5: Метил (5R,7S,10S)-10-бутил-3,9,12триоксо-1,6,7,9,10,11,12,14,15,16-декагідро-5Н2,22:5,8-диметано-4,13,2,8,11бензодіоксатриазациклоікозин-7-карбоксилат Розчин метил N-[(пент-4-енілокси)карбоніл]-1норлейцил-(4R)-4-{[(4-вініл-1,3-дигідро-2Нізоіндол-2-іл)карбоніл]окси}-L-пролінату (60мг, 0,11ммоль) у ДХЕ (20мл) дегазують із застосуванням N2 протягом 15хв. Потім додають каталізатор перестановки на основі рутенію Zhan RC-301 (каталізатор Zhan І (зображений як J на стор.43), RC301, Zannan Pharma Ltd.) (7мг, 0,01ммоль). Потім 49 розчин нагрівають до температури 100°С протягом 1 години. У цей час аналізи РХ-МС і ТШХ показали повне поглинання вихідного матеріалу та утворення практично єдиного продукту, що має бажану масу. Потім розчинник видаляють у вакуумі, і неочищений продукт очищають на двоокисі кремнію (5-70% EtOAc/гексан) з одержанням 45мг (вихід 79%) метил (5R,7S,10S)-10-бутил-3,9,12-Триоксо1,6,7,9,10,11,12,14,15,16-декагідро-5Н-2,22:5,8диметано-4,13,2,8,11бензодіоксатриазациклоікозин-7-карбоксилату. МСНР (ІЕР) m/z 514 [(М+Н)+; розраховано для C27H36N3O7: 514]. Стадія 6: (5R,7S,10S)-10-бутил-N-((1R,2S)-1{[(циклопропілсульфоніл)аміно]карбоніл}-2вінілциклопропіл)-3,9,12-триоксо1,6,7,9,10,11,12,14,15,16-декагідро-5Н-2,22:5,8диметано-4,13,2,8,11бензодіоксатриазациклоікозин-7-карбоксамід До розчину метил (5R,7S,10S)-10-бутил-3,9,12триоксо-1,6,7,9,10,11,12,14,15,16-декагідро-5Н2,22:5,8-диметано-4,13,2,8,11бензодіоксатриазациклоікозин-7-карбоксилату (45мг, 0,09ммоль) у ТГФ (2мл), МеОН (0,5мл) і воді (1мл) додають LiOH (21мг, 0,87ммоль). Реакційну суміш нагрівають до температури 40°С і перемішують протягом 1 години, після чого повне поглинання вихідного метилового ефіру підтверджують РХ-МС. Потім сумішобробляють 0,5н НСІ і EtOAc. Потім органічний шар сушать над K2СО3 і розчинник видаляють у вакуумі. Неочищений продукт поміщають у ДМФ (1мл). До одержаного вище розчину додають хлорид (1R,2S)-1{[(циклопропілсульфоніл)аміно]карбоніл}-2вінілциклопропанамінію (Llinas-Brunet et al US03/15755 і Wang et al WO 03/099274) (32мг, 0,12ммоль), ТБТУ (51мг, 0,16ммоль) і ДІПЕА (0,071мл, 0,40ммоль), і реакційну суміш перемішують при кімнатній температурі протягом 2 годин. Реакційну суміш безпосередньо очищають ВЕРХ з оберненою фазою з одержанням (5R,7S,10S)-10-бутил-N-((1R,2S)-1{[(циклопропілсульфоніл)аміно]карбоніл}-2вінілциклопропіл)-3,9,12-триоксо1,6,7,9,10,11,12,14,15,16-декагідро-5Н-2,22:5,8диметано-4,13,2,8,11бензодіоксатриазациклоікозин-7-карбоксаміду (27мг, вихід 47%). 1Н ЯМР (500МГц, ч./млн., CDCІ3) δ 10,01 (с, 1Н), 7,27 (м, 2H), 7,12 (д, 1Н), 7,04 (с, 1Н), 6,40 (д, J=16,1Гц, 1Н), 6,08 (м, 1Н), 5,76 (м, 1Н), 5,44 (с, 1Н), 5,36 (д, 1Н), 5,25 (д, 1Н), 5,14 (д, 1Н), 4,80-4,68 (м, 3Н), 4,59 (д, 1Н), 4,44 (м, 2Н), 4,38 (м, 1Н), 4,28 (м, 1Н), 3,95 (м, 1Н), 3,77 (дд, 1Н), 2,94 (м, 1Н), 2,43 (м, 2Н), 2,29 (д, 2Н), 2,06 (м, 2Н), 1,94 (м, 1Н), 1,78 (м, 4Н), 1,45 (м, 1Н), 1,381,06 (м, 5Н), 1,04 (д, 2Н), 0,92 (т, 3Н) ч./млн. МСНР (IEP) m/z 712 [(М+Н)+; розраховано для C35H46N5O9S: 712]. Приклад 2 (5R,7S,10S)-10-трет-Бутил-N-((1R,2S)-1{[(циклопропілсульфоніл)аміно]карбоніл}-2вінілциклопропіл)-3,9,12-триоксо1,6,7,9,10,11,12,14,15,16-декагідро-5Н-2,22:5,8 90909 50 диметано-4,13,2,8,11бензодіоксатриазациклоікозин-7-карбоксамід (ІІІ-2) Приклад 2 одержують за методикою, яку застосовують для Прикладу 1 за винятком того, що 3-метил-N-[(пент-4-енілокси)карбоніл]-L-валін (одержаний за описаною нижче методикою) застосовують замість N-[(пент-4-ен-1-ілокси)карбоніл]-Lнорлейцину на стадії 4. 1Н ЯМР (500МГц, ч./млн., CDCІ3) δ 9,90 (с, 1Н), 7,28 (м, 2Н), 7,13 (м, 2Н), 6,31 (д, J=15,9Гц, 1Н), 6,04 (м, 1Н), 5,74 (м, 1Н), 5,45 (м, 2Н), 5,27 (д, 1Н), 5,16 (д, 1Н), 4,77-4,66 (м, 3Н), 4,55 (д, 1Н), 4,48 (т, 1Н), 4,41-4,35 (м, 2Н), 4,27 (м, 1Н), 3,93 (м, 1Н), 3,74 (дд, 1Н), 2,93 (м, 1Н), 2,45 (д, 2Н), 2,32 (м, 2Н), 2,10-1,95 (м, 2Н), 1,74 (м, 1Н), 1,47 (м, 1Н), 1,37 (м, 2Н), 1,07 (с, 9Н) ч./млн. МСНР (IEP) m/z 712 [(М+Н)+; розраховано для C35H46N5O9S: 712]. Приклад 3 (5R,7S,10S)-10-трет-Бутил-N-((1R,2S)-1{[(циклопропілсульфоніл)аміно]карбоніл}-2вінілциклопропіл)-15,15-диметил-3,9,12-триоксо1,6,7,9,10,11,12,14,15,16-декагідро-5Н-2,22:5,8диметано-4,13,2,8,11бензодїоксатриазациклоікозин-7-карбоксамід (lll-8) Стадія 1: Бром-2,3-біс(бромметил) бензол Суспензію 3-бром-о-ксилолу (196г, 1,06моль), N-бромсукциніміду (377г, 2,15моль) і перекису бензоїлу (0,26г, 1,0ммоль) у чотирихлористому вуглеці (1800мл) нагрівають до температури кипіння зі зворотним холодильником в атмосфері азоту протягом 15 годин. Вміст реакційної колби охолоджують, фільтрують, і фільтрат випарюють. Відганяють неочищений матеріал у високому вакуумі. Основні фракції відганяють при температурі від 88°С до 152°С. Відновлюють 108г чистого продукту. Відновлюють 182г злегка неочищеного матеріалу, що може застосовуватися в наступній реакції. 51 1 H ЯМР (CDCІ3) δ (ч./млн.) 7,56 (д, J=8,0Гц, 1Н), 7,31 (д, J=8,0Гц, 1Н), 7,26 (с, 1Н), 7,16 (т, J=8,0Гц, 1Н), 4,84 (с, 2Н), 4,64 (с, 2Н). Стадія 2: 2-Бензил-4-бромізоіндолін Бікарбонат калію (204г, 2,04моль) суспендують в ацетонітрилі (12л), і суміш нагрівають до температури 80°С. Розчини 1-бром-2,3біс(бромметил)бензолу (280г, 0,82моль у 500мл ацетонітрилу) і бензиламіну (87,5г, 0,82моль у 500мл ацетонітрилу) додають одночасно через краплинні лійки протягом 1 години. Реакційну суміш перемішують при температурі 77°С протягом 16 годин. Вміст реакційної колби охолоджують, фільтрують, і розчинник видаляють випарюванням. Реакційну суміш розділяють між 1М K2СО3 і EtOAc. Органічні фракції промивають насиченим розчином солі, сушать над безводним Na2SO4, фільтрують і випарюють. Флеш-хроматографія на колонці (градієнтне елюювання: гептан до 10% ЕtOАс у гептані) дає, після випарювання, зазначену в заголовку сполуку у вигляді блідого масла. 1H ЯМP (CDCІ3) δ (ч./млн.) 7,41-7,39 (м, 2Н), 7,37-7,34 (м, 2Н), 7,32-7,27 (м, 2Н), 7,10-7,03 (м, 2Н), 4,02 (с, 2Н), 3,97 (с, 2Н), 3,91 (с, 2Н), МСНР (ІЕР) m/z 289 [(М+Н)+; розраховано для C15H15BrN: 289]. Перетворюють у сіль НСІ у НСІ/МеОН. Додають МЕТБ і фільтрують тверду речовину з одержанням 188г продукту у вигляді солі НСІ. Стадія 3: 2-Бензил-4-вінілізоіндолін Розчин 2-бензил-4-бромізоіндоліну (16,7г, 58,0ммоль) і трибутил(вініл)олова (20,3мл, 69,6ммоль) у толуолі (400мл) дегазують шляхом барботування азоту через розчин протягом 0,25 години. Додають тетракис(трифенілфосфін)паладій (0) (1,30г, 1,16ммоль), і одержаний розчин нагрівають на масляній бані з температурою 100°С в атмосфері азоту протягом 24 годин. Вміст реакційної колби охолоджують, випарюють і піддають флешхроматографії на колонці, елююючи гексаном/етилацетатом 95/5 з одержанням, після випарювання, зазначеної в заголовку сполуки у вигляді блідого масла, що стає рожевим при вистоюванні. МСНР (ІЕР) m/z 236 [(М+Н)+; розраховано для C17H18N: 236]. Стадія 4: 4-Вінілізоіндолін Розчин 2-бензил-4-вінілізоіндоліну (58ммоль) в 1,2-дихлоретані (150мл) поміщають в 1-літрову круглодонну колбу в атмосфері азоту. До колби приєднують краплинну лійку, що містить розчин 90909 52 хлорформіату 1-хлоретилу (7,51мл, 69,6ммоль) в 1,2-дихлоретані. Реакційну колбу охолоджують на льодяній бані, і вміст крапельної лійки по краплях додають протягом 20хв., зберігаючи внутрішню температуру
ДивитисяДодаткова інформація
Назва патенту англійськоюHcv ns3 protease inhibitors
Автори англійськоюHolloway M Katharine, Liverton Nigel J., Ludmerer Steven W., Mccauley John A., Olsen David B., Rudd Michael T., Vacca Joseph P., Mcintyre Charles J.
Назва патенту російськоюИнгибиторы ns3 протеазы вгс
Автори російськоюХолловей М. Катарин, Ливертон Найджел Дж., Людмерер Стивен У., Макколи Джон А., Олсен Девид Б., Радд Майкл Т., Вакка Джозеф П., Макинтайр Чарльз Дж.
МПК / Мітки
МПК: A61P 31/14, C07K 5/08, A61K 38/06
Мітки: інгібітори, протеази, вгс
Код посилання
<a href="https://ua.patents.su/39-90909-ingibitori-ns3-proteazi-vgs.html" target="_blank" rel="follow" title="База патентів України">Інгібітори ns3 протеази вгс</a>
Попередній патент: Вібросито для очистки бурового розчину
Наступний патент: Зрівняльний гідравлічний пристрій для безпечних канатних підйомних систем
Випадковий патент: Спосіб тонкої абразивної обробки циліндричних отворів деталей обертання з високолегованих композитів