Фтор- та трифторалкіловмісні гетероциклічні сульфонамідні інгібітори утворення бета-амілоїду та їх похідні
Номер патенту: 82093
Опубліковано: 11.03.2008
Автори: Майєр Скотт Крістіан, Діамантідіс Джорж, Коул Дерек Сесіл, Реснік Лінн, Харрісон Бойд Лінн, Хоук Моллі, Галанте Рокко Джон, Чжан Міншен, Крефт Ентоні Франк, Ван Тінчжун
Формула / Реферат
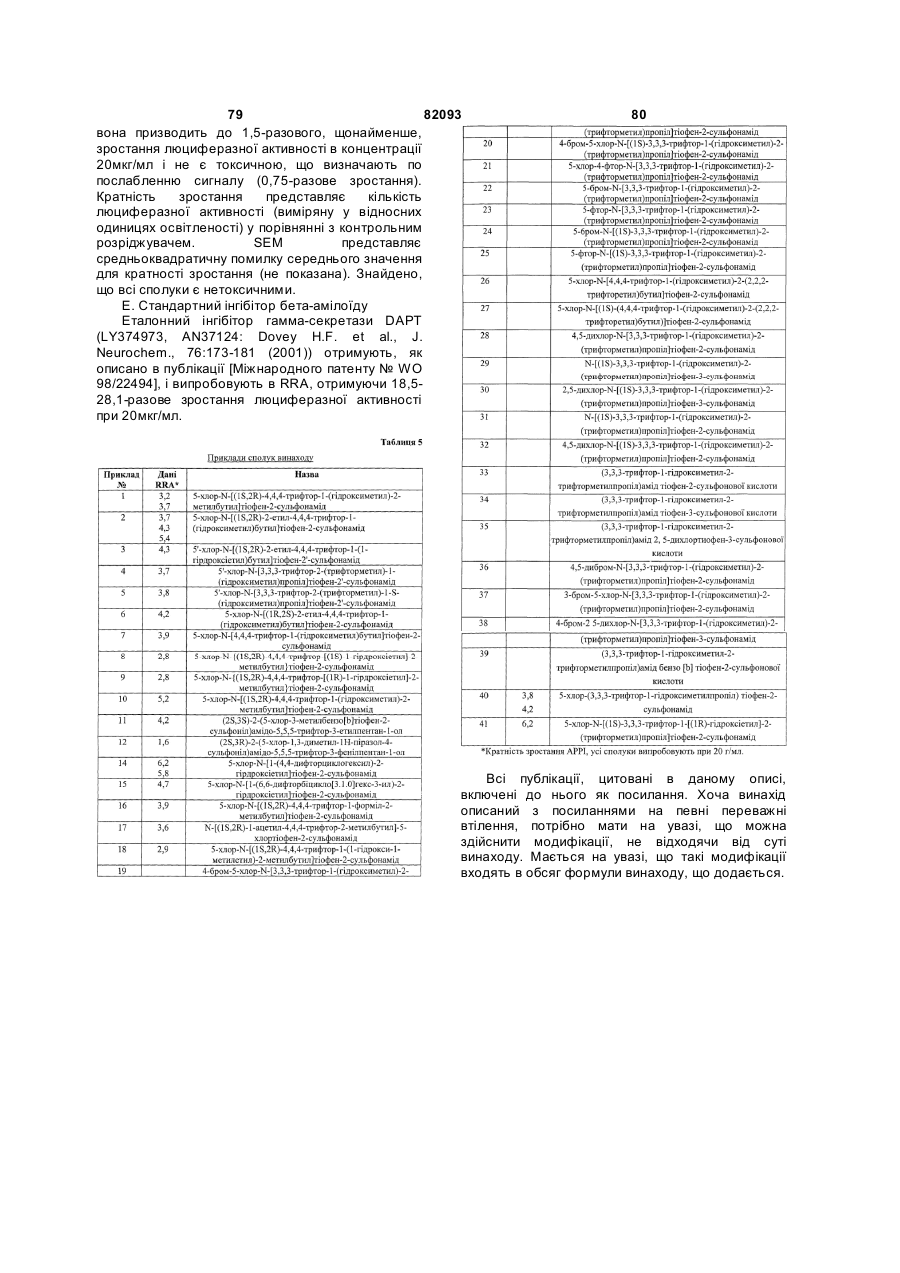
1. Сполука формули (І)
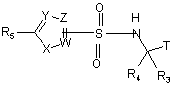 , (I)
, (I)
де
Т вибирають з групи, що складається з СНО, COR8 і С(ОН)R1R2;
R1 і R2 незалежно вибирають з групи, що складається з водню, нижчого алкілу, заміщеного нижчого алкілу, СFз, алкенілу, заміщеного алкенілу, алкінілу і заміщеного алкінілу;
R3 вибирають з групи, що складається з водню, нижчого алкілу і заміщеного нижчого алкілу;
R4 вибирають з групи, що складається з (СF3)nалкілу, (СF3)n(заміщеного алкілу), (СF3)nалкілфенілу, (СF3)nалкіл(заміщеного фенілу) і (F)nциклоалкілу;
N дорівнює 1-3;
R5 вибирають з групи, що складається з водню, галогену, СF3, дієну, конденсованого з Y, коли Y означає С, і заміщеного дієну, конденсованого з Y, коли Y означає С;
W, Y і Z незалежно вибирають з групи, що складається з С, СR6 і N, за умови, що щонайменше один з W або Y, або Z повинен бути С;
R6 вибирають з групи, що складається з водню, галогену, нижчого алкілу і заміщеного нижчого алкілу;
Х вибирають з групи, що складається з О, S, SO2 і NR7;
R7 вибирають з групи, що складається з водню, нижчого алкілу, заміщеного нижчого алкілу, бензилу, заміщеного бензилу, фенілу і заміщеного фенілу; і
R8 вибирають з групи, що складається з нижчого алкілу, СF3, фенілу і заміщеного фенілу;
або її фармацевтично прийнятна сіль, гідрат або проліки.
2. Сполука за п. 1, де R5 являє собою галоген.
3. Сполука за п. 2, де R5 являє собою хлор, бром або фтор.
4. Сполука за будь-яким з пп. 1-3, де R1 і R2 кожний являє собою водень.
5. Сполука за п. 1, де W являє собою С, і Z являє собою CR6.
6. Сполука за п. 1, де Х являє собою S, і W, Y і Z незалежно вибирають з С або СR6, за умови, що один з W, Y або Z являє собою С.
7. Сполука за п. 1, де R4 вибирають з групи, що складається з (СF3)n(нижчого алкілу), (СF3)n(заміщеного нижчого алкілу), (СF3)n(нижчого алкіл)фенілу і (СF3)n(нижчого алкіл)(заміщеного фенілу) S-стереохімії.
8. Сполука за п. 1, де Х являє собою S, W являє собою С, Y являє собою СН, Z являє собою СН, R5 являє собою хлор, R4 являє собою СF3СН2СНСН3, R3, R1 і R2, кожний являє собою водень, що має стереохімію 1S,2R.
9. Сполука за п. 1, де Х являє собою S, W являє собою С, Y являє собою СН, Z являє собою СН, R5 являє собою хлор, R4 являє собою СF3СНСF3, і R3, R1 і R2, кожний являє собою водень, що має стереохімію 1S.
10. Сполука за п. 1, де W являє собою N, і Х являє собою NR7.
11. Сполука за п. 1, де сполуку вибирають з групи, що включає
5-хлор-N-[(1S,2R)-4,4,4-трифтор-1-(гідроксиметил)-2-метилбутил]тіофен-2-сульфонамід;
5-хлор-N-[(1S,2R)-2-етил-4,4,4-трифтор-1-(гідроксиметил)бутил]тіофен-2-сульфонамід;
5'-xлop-N-[(1S,2R)-2-етил-4,4,4-трифтор-1-(1-гідроксіетил)бутил]тіофен-2'-сульфонамід;
5'-хлор-N-[3,3,3-трифтор-2-(трифторметил)-1-(гідроксиметил)пропіл]тіофен-2'-сульфонамід;
5'-хлор-N-[3,3,3-трифтор-2-(трифторметил)-1-S-(гідроксиметил)пропіл]тіофен-2'-сульфонамід;
5-хлор-N-[(1R,2S)-2-етил-4,4,4-трифтор-1-(гідроксиметил)бутил]тіофен-2-сульфонамід;
5-хлор-N-[4,4,4-трифтор-1-(гідроксиметил)бутил]тіофен-2-сульфонамід;
5-хлор-N-{(1S,2R)-4,4,4-трифтор-1-[(1S)-1-гідроксіетил]-2-метилбутил}тіофен-2-сульфонамід;
5-xлop-N-{(1S,2R)-4,4,4-трифтор-1-[(1R)-1-гідроксіетил]-2-метилбутил}тіофен-2-сульфонамід;
5-хлор-N-[(1S,2S)-4,4,4-трифтор-1-(гідроксиметил)-2-метилбутил]тіофен-2-сульфонамід;
(2S,3S)-2-(5-хлор-3-метилбензо[b]тіофен-2-сульфоніл)амідо-5,5,5-трифтор-3-етилпентан-1-ол;
(2S,3R)-2-(5-хлор-1,3-диметил-1Н-піразол-4-сульфоніл)амідо-5,5,5-трифтор-3-фенілпентан-1-ол;
5-хлор-N-[1-(4,4-дифторциклогексил)-2-гідроксіетил]тіофен-2-сульфонамід;
5-хлор-N-[1-(6,6-дифторбіцикло[3.1.0]гекс-3-ил)-2-гідроксіетил]тіофен-2-сульфонамід;
5-хлор-N-[(1S,2R)-4,4,4-трифтор-1-форміл-2-метилбутил]тіофен-2-сульфонамід;
N-[(1S,2R)-1-ацетил-4,4,4-трифтор-2-метилбутил]-5-хлортіофен-2-сульфонамід;
5-хлор-N-[(1S,2R)-4,4,4-трифтор-1-(1-гідрокси-1-метилетил)-2-метилбутил]тіофен-2-сульфонамід;
4-бром-5-хлор-N-[3,3,3-трифтор-1-(гідроксиметил)-2-(трифторметил)пропіл]тіофен-2-сульфонамід;
4-бром-5-хлор-N-[(1S)-3,3,3-трифтор-1-(гідроксиметил)-2-(трифторметил)пропіл]тіофен-2-сульфонамід;
5-хлор-4-фтор-N-[3,3,3-трифтор-1-(гідроксиметил)-2-(трифторметил)пропіл]тіофен-2-сульфонамід;
5-бром-N-[3,3,3-трифтор-1-(гідроксиметил)-2-(трифторметил)пропіл]тіофен-2-сульфонамід;
5-фтор-N-[3,3,3-трифтор-1-(гідроксиметил)-2-(трифторметил)пропіл]тіофен-2-сульфонамід;
5-бром-N-[(1S)-3,3,3-трифтор-1-(гідроксиметил)-2-(трифторметил)пропіл]тіофен-2-сульфонамід;
5-фтор-N-[(1S)-3,3,3-трифтор-1-(гідроксиметил)-2-(трифторметил)пропіл]тіофен-2-сульфонамід;
5-хлор-N-[4,4,4-трифтор-1-(гідроксиметил)-2-(2,2,2-трифторетил)бутил]тіофен-2-сульфонамід;
5-хлор-N-[(1S)-(4,4,4-трифтор-1-(гідроксиметил)-2-(2,2,2-трифторетил)бутил)]тіофен-2-сульфонамід;
4,5-дихлор-N-[3,3,3-трифтор-1-(гідроксиметил)-2-(трифторметил)пропіл]тіофен-2-сульфонамід;
N-[(1S)-3,3,3-трифтор-1-(гідроксиметил)-2-(трифторметил)пропіл]тіофен-3-сульфонамід;
2,5-дихлор-N-[(1S)-3,3,3-трифтор-1-(гідроксиметил)-2-(трифторметил)пропіл]тіофен-3-сульфонамід;
N-[(1S)-3,3,3-трифтор-1-(гідроксиметил)-2-(трифторметил)пропіл]тіофен-2-сульфонамід;
4,5-дихлор-N-[(1S)-3,3,3-трифтор-1-(гідроксиметил)-2-(трифторметил)пропіл]тіофен-2-сульфонамід;
(3,3,3-трифтор-1-гідроксиметил-2-трифторметилпропіл)амід тіофен-2-сульфонової кислоти;
(3,3,3-трифтор-1-гідроксиметил-2-трифторметилпропіл)амід тіофен-3-сульфонової кислоти;
(3,3,3-трифтор-1-гідроксиметил-2-трифторметилпропіл)амід 2,5-дихлортіофен-3-сульфонової кислоти;
4,5-дибром-N-[3,3,3-трифтор-1-(гідроксиметил)-2-(трифторметил)пропіл]тіофен-2-сульфонамід;
3-бром-5-хлор-N-[3,3,3-трифтор-1-(гідроксиметил)-2-(трифторметил)пропіл]тіофен-2-сульфонамід;
4-бром-2,5-дихлор-N-[3,3,3-трифтор-1-(гідроксиметил)-2-(трифторметил)пропіл]тіофен-2-сульфонамід;
(3,3,3-трифтор-1-(гідроксиметил)-2-(трифторметил)пропіл)амід бензо[b]тіофен-2-сульфонової кислоти;
5-хлор-(3,3,3-трифтор-1-гідроксиметилпропіл)тіофен-2-сульфонамід і
5-хлор-N-[(1S)-3,3,3-трифтор-1-[(1R)-1-гідроксіетил]-2-(трифторметил)пропіл]тіофен-2-сульфонамід;
або її фармацевтично прийнятна сіль, гідрат або проліки.
12. Сполука за п. 1, що являє собою 5-хлор-N-[(1S)-(4,4,4-трифтор-1-(гідроксиметил)-2-(2,2,2-трифторетил)бутил)]тіофен-2-сульфонамід або його фармацевтично прийнятну сіль, гідрат або проліки.
13. Сполука за п. 1, де Х являє собою О, і W, Y і Z незалежно вибирають з С і СR6, за умови, що один з W, Y або Z являє собою С.
14. Сполука за п. 13, де R5 являє собою галоген, R4 вибирають з групи, що складається з (СF3)n(нижчого алкілу), (СF3)n(заміщеного нижчого алкілу), (СF3)n(нижчого алкіл)фенілу, (СF3)n(нижчого алкіл)(заміщеного фенілу) S-стереохімії, і R3, R1 і R2 усі являють собою Н.
15. Сполука за п. 1, де Т являє собою С(ОН)R1R2, R1, R2 та R3 являють собою Н, і R4 являє собою (F)nциклоалкіл.
16. Сполука за п. 1, де Т являє собою С(ОН)R1R2, R1, R2 та R3 являють собою Н, і R4 являє собою (СF3)nалкіл.
17. Сполука за п. 1, де Т являє собою С(ОН)R1R2, R1 являє собою СН3, R2 являє собою Н, R3 являє собою Н, і R4 являє собою (СF3)nалкіл.
18. Сполука за п. 1, де Т являє собою СНО, R3 являє собою Н, і R4 являє собою (СF3)nалкіл.
19. Сполука за п. 1, де Т являє собою C(OH)R1R2, R1, R2 та R3 являють собою Н, і R4 являє собою (СF3)2СН S-стереохімії.
20. Сполука за п. 1, де Т являє собою СНО, R3 являє собою Н, і R4 являє собою СН(СН3)СН2СF3 S-стереохімії.
21. Сполука за п. 1, де Т являє собою C(O)R8, R3 являє собою Н, R4 являє собою СН(СН3)СН2СF3 S-стереохімії, і R8 являє собою СН3.
22. Сполука за п. 1, де Т являє собою C(OH)R1R2, R1, R2 та R3 являють собою Н, і R4 являє собою СН(СН2СF3)2 S-стереохімії.
23. Сполука за п. 1, де Т являє собою C(OH)R1R2, R1, R2 та R3 являють собою Н, і R4 являє собою СН(СН3)СН2СF3 S-стереохімії.
24. Сполука за п. 1, де Т являє собою C(OH)R1R2, R1 являє собою СН3, R2 і R3 являють собою Н, і R4 являє собою СН(СF3)2 S-стереохімії.
25. Сполука за п. 1, де Т являє собою C(OH)R1R2, R1, R2 і R3 являють собою Н, і R4 являє собою (F)n-циклоалкіл.
26. Сполука за п. 1, де фармацевтично прийнятну сіль вибирають з групи, що складається з солей органічних кислот, солей неорганічних кислот, солей основ і їх сумішей.
27. Сполука за п. 26, де солі органічних і неорганічних кислот вибирають з групи, що складається з солей оцтової кислоти, молочної кислоти, лимонної кислоти, винної кислоти, бурштинової кислоти, фумарової кислоти, малеїнової кислоти, малонової кислоти, мигдалевої кислоти, яблучної кислоти, хлористоводневої кислоти, бромводневої кислоти, фосфорної кислоти, азотної кислоти, сірчаної кислоти, метансульфонової кислоти, толуолсульфонової кислоти і їх сумішей.
28. Сполука за п. 26, де солі основ вибирають з групи, що складається з солей гідроксиду натрію, гідроксиду літію і гідроксиду калію і їх сумішей.
29. Фармацевтична композиція, що містить сполуку за п. 1 і фізіологічно сумісний носій.
30. Фармацевтичний набір, який містить контейнер, що містить фармацевтичну композицію за п. 29.
31. Спосіб одержання трифторметильованого або фторованого гетероциклічного сульфонаміду, що включає стадії:
(a) фільтрування суміші діастереомерів аміноефіру, де вказаний аміноефір містить щонайменше один хіральний центр і щонайменше одну трифторметильну або фторгрупу, приєднану до щонайменше одного хірального центру через алкільну групу;
(b) обробки аміноефіру DIBAL-H у толуолі з утворенням N-бензиламіноспирту;
(c) гідрування N-бензиламіноспирту в присутності каталізатора і утворення аміноспирту;
(d) сульфування аміноспирту зі стадії (с) гетероциклічним сульфонілхлоридом; і
(e) кристалізації сульфованого продукту зі стадії (d) з отриманням хірально чистого трифторметильованого або фторованого гетероциклічного сульфонаміду.
32. Спосіб за п. 31, де трифторметильований гетероциклічний сульфонамід являє собою сполуку за п. 1.
33. Спосіб за п. 32, де стадію кристалізації здійснюють з використанням етилацетату і гексану.
34. Спосіб одержання трифторметильованого або фторованого гетероциклічного сульфонаміду, що включає стадії:
(a) обробки трифторметильованого або фторованого альдегіду дегідратуючим агентом і хіральним сульфінамідом з утворенням трифторметильованого або фторованого хірального сульфінаміду;
(b) обробки вказаного трифторметильованого або фторованого хірального сульфініміду ціануючим агентом з утворенням трифторметильованого або фторованого діастереомерного α-амінонітрилу;
(c) гідролізу вказаного трифторметильованого або фторованого діастереомерного α-амінонітрилу до трифторметильованої або фторованої α-амінокислоти;
(d) відновлення вказаної трифторметильованої або фторованої α-амінокислоти до трифторметильованого або фторованого ![]() -аміноспирту; і
-аміноспирту; і
(e) взаємодії вказаного трифторметильованого або фторованого ![]() -аміноспирту з гетероциклічним сульфонілхлоридом з утворенням вказаного трифторметильованого або фторованого гетероциклічного сульфонаміду.
-аміноспирту з гетероциклічним сульфонілхлоридом з утворенням вказаного трифторметильованого або фторованого гетероциклічного сульфонаміду.
35. Спосіб за п. 34, що додатково включає:
(f) екстрагування вказаного трифторметильованого або фторованого гетероциклічного сульфонаміду.
36. Спосіб за п. 34 або 35, що додатково включає очищення вказаного трифторметильованого або фторованого гетероциклічного сульфонаміду.
37. Спосіб за п. 36, де вказаний трифторметильований або фторований гетероциклічний сульфонамід очищують з використанням хроматографії.
38. Спосіб за п. 34, де вказаний дегідратуючий агент являє собою етоксид титану, сульфат магнію або молекулярні сита 4![]() .
.
39. Спосіб за п. 34, де вказаний хіральний сульфінамід являє собою S-(+)-толуолсульфінамід або трет-бутансульфінамід.
40. Спосіб за п. 34, де вказаний ціануючий агент являє собою ціанід етилізопропоксіалюмінію.
41. Спосіб за п. 34, де вказаний дегідратуючий агент являє собою етоксид титану, вказаний хіральний сульфінамід являє собою S-(+)-толуолсульфінамід і вказаний ціануючий агент являє собою ціанід етилізопропоксіалюмінію.
42. Застосування сполуки за п. 1 або її композиції за п. 29 або 30 або її вказаної прийнятної солі при одержанні лікувального засобу.
43. Застосування сполуки за п. 1, або композиції за п. 29 або 30 при одержанні лікувального засобу, що застосовується для введення ссавцю для інгібування утворення бета-амілоїду.
44. Застосування за п. 43, де вказану сполуку вводять перорально, ін'єкцією або інгаляцією.
45. Застосування сполуки за п. 1 або композиції за п. 29 або 30 при одержанні лікувального засобу для лікування хвороби, вибраної з групи, що складається з хвороби Альцгеймера, амілоїдної ангіопатії, церебральної амілоїдної ангіопатії, системного амілоїдозу, спадкового внутрішньомозкового крововиливу з амілоїдозом по типу Дутча, міозиту тілець включення, помірного когнітивного погіршення (МСІ) і синдрому Дауна.
46. Сполука формули
або її фармацевтично прийнятна сіль, гідрат або проліки.
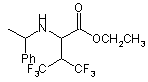
47. Сполука за п. 46 формули
 .
.
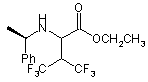
48. Сполука за п. 46 формули
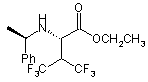 .
.
49. Сполука формули
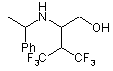
або її фармацевтично прийнятна сіль, гідрат або проліки.
50. Сполука за п. 49 формули
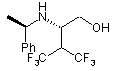 .
.
51. Сполука формули
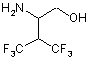
або її фармацевтично прийнятна сіль, гідрат або проліки.
52. Сполука за п. 51 формули
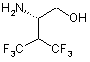 .
.
Текст
1. Сполука формули (І) O Y Z H R5 S N W T X O R4 R3 , (I) де Т вибирають з групи, що складається з СНО, COR8 і С(ОН)R1R2; R1 і R2 незалежно вибирають з групи, що складається з водню, нижчого алкілу, заміщеного нижчого алкілу, СFз, алкенілу, заміщеного алкенілу, алкінілу і заміщеного алкінілу; R3 вибирають з групи, що складається з водню, нижчого алкілу і заміщеного нижчого алкілу; R4 вибирають з групи, що складається з (СF3)nалкілу, (СF3)n(заміщеного алкілу), (СF3)nалкілфенілу, (СF3)nалкіл(заміщеного фенілу) і (F)nциклоалкілу; N дорівнює 1-3; R5 вибирають з групи, що складається з водню, галогену, СF3, дієну, конденсованого з Y, коли Y 2 (19) 1 3 82093 4 2,5-дихлор-N-[(1S)-3,3,3-трифтор-1R1 і R2, кожний являє собою водень, що має (гідроксиметил)-2-(трифторметил)пропіл]тіофен-3стереохімію 1S. сульфонамід; 10. Сполука за п. 1, де W являє собою N, і Х являє N-[(1S)-3,3,3-трифтор-1-(гідроксиметил)-2собою NR7. (трифторметил)пропіл]тіофен-2-сульфонамід; 11. Сполука за п. 1, де сполуку вибирають з групи, 4,5-дихлор-N-[(1S)-3,3,3-трифтор-1що включає (гідроксиметил)-2-(трифторметил)пропіл]тіофен-25-хлор-N-[(1S,2R)-4,4,4-трифтор-1-(гідроксиметил)сульфонамід; 2-метилбутил]тіофен-2-сульфонамід; (3,3,3-трифтор-1-гідроксиметил-25-хлор-N-[(1S,2R)-2-етил-4,4,4-трифтор-1трифторметилпропіл)амід тіофен-2-сульфонової (гідроксиметил)бутил]тіофен-2-сульфонамід; кислоти; 5'-xлop-N-[(1S,2R)-2-етил-4,4,4-трифтор-1-(1(3,3,3-трифтор-1-гідроксиметил-2гідроксіетил)бутил]тіофен-2'-сульфонамід; трифторметилпропіл)амід тіофен-3-сульфонової 5'-хлор-N-[3,3,3-трифтор-2-(трифторметил)-1кислоти; (гідроксиметил)пропіл]тіофен-2'-сульфонамід; (3,3,3-трифтор-1-гідроксиметил-25'-хлор-N-[3,3,3-трифтор-2-(трифторметил)-1-Sтрифторметилпропіл)амід 2,5-дихлортіофен-3(гідроксиметил)пропіл]тіофен-2'-сульфонамід; сульфонової кислоти; 5-хлор-N-[(1R,2S)-2-етил-4,4,4-трифтор-14,5-дибром-N-[3,3,3-трифтор-1-(гідроксиметил)-2(гідроксиметил)бутил]тіофен-2-сульфонамід; (трифторметил)пропіл]тіофен-2-сульфонамід; 5-хлор-N-[4,4,4-трифтор-13-бром-5-хлор-N-[3,3,3-трифтор-1-(гідроксиметил)(гідроксиметил)бутил]тіофен-2-сульфонамід; 2-(трифторметил)пропіл]тіофен-2-сульфонамід; 5-хлор-N-{(1S,2R)-4,4,4-трифтор-1-[(1S)-14-бром-2,5-дихлор-N-[3,3,3-трифтор-1гідроксіетил]-2-метилбутил}тіофен-2-сульфонамід; (гідроксиметил)-2-(трифторметил)пропіл]тіофен-25-xлop-N-{(1S,2R)-4,4,4-трифтор-1-[(1R)-1сульфонамід; гідроксіетил]-2-метилбутил}тіофен-2-сульфонамід; (3,3,3-трифтор-1-(гідроксиметил)-25-хлор-N-[(1S,2S)-4,4,4-трифтор-1-(гідроксиметил)(трифторметил)пропіл)амід бензо[b]тіофен-22-метилбутил]тіофен-2-сульфонамід; сульфонової кислоти; (2S,3S)-2-(5-хлор-3-метилбензо[b]тіофен-25-хлор-(3,3,3-трифтор-1сульфоніл)амідо-5,5,5-трифтор-3-етилпентан-1-ол; гідроксиметилпропіл)тіофен-2-сульфонамід і (2S,3R)-2-(5-хлор-1,3-диметил-1Н-піразол-45-хлор-N-[(1S)-3,3,3-трифтор-1-[(1R)-1сульфоніл)амідо-5,5,5-трифтор-3-фенілпентан-1гідроксіетил]-2-(трифторметил)пропіл]тіофен-2ол; сульфонамід; 5-хлор-N-[1-(4,4-дифторциклогексил)-2або її фармацевтично прийнятна сіль, гідрат або гідроксіетил]тіофен-2-сульфонамід; проліки. 5-хлор-N-[1-(6,6-дифторбіцикло[3.1.0]гекс-3-ил)-212. Сполука за п. 1, що являє собою 5-хлор-Nгідроксіетил]тіофен-2-сульфонамід; [(1S)-(4,4,4-трифтор-1-(гідроксиметил)-2-(2,2,25-хлор-N-[(1S,2R)-4,4,4-трифтор-1-форміл-2трифторетил)бутил)]тіофен-2-сульфонамід або метилбутил]тіофен-2-сульфонамід; його фармацевтично прийнятну сіль, гідрат або N-[(1S,2R)-1-ацетил-4,4,4-трифтор-2-метилбутил]проліки. 5-хлортіофен-2-сульфонамід; 13. Сполука за п. 1, де Х являє собою О, і W, Y і Z 5-хлор-N-[(1S,2R)-4,4,4-трифтор-1-(1-гідрокси-1незалежно вибирають з С і СR6, за умови, що один метилетил)-2-метилбутил]тіофен-2-сульфонамід; з W, Y або Z являє собою С. 4-бром-5-хлор-N-[3,3,3-трифтор-1-(гідроксиметил)14. Сполука за п. 13, де R5 являє собою галоген, 2-(трифторметил)пропіл]тіофен-2-сульфонамід; R4 вибирають з групи, що складається з 4-бром-5-хлор-N-[(1S)-3,3,3-трифтор-1(СF3)n(нижчого алкілу), (СF3)n(заміщеного нижчого (гідроксиметил)-2-(трифторметил)пропіл]тіофен-2алкілу), (СF3)n(нижчого алкіл)фенілу, сульфонамід; (СF3)n(нижчого алкіл)(заміщеного фенілу) S5-хлор-4-фтор-N-[3,3,3-трифтор-1-(гідроксиметил)стереохімії, і R3, R1 і R2 усі являють собою Н. 2-(трифторметил)пропіл]тіофен-2-сульфонамід; 15. Сполука за п. 1, де Т являє собою С(ОН)R1R2, 5-бром-N-[3,3,3-трифтор-1-(гідроксиметил)-2R1, R2 та R3 являють собою Н, і R4 являє собою (трифторметил)пропіл]тіофен-2-сульфонамід; (F)nциклоалкіл. 5-фтор-N-[3,3,3-трифтор-1-(гідроксиметил)-216. Сполука за п. 1, де Т являє собою С(ОН)R1R2, (трифторметил)пропіл]тіофен-2-сульфонамід; R1, R2 та R3 являють собою Н, і R4 являє собою 5-бром-N-[(1S)-3,3,3-трифтор-1-(гідроксиметил)-2(СF3)nалкіл. (трифторметил)пропіл]тіофен-2-сульфонамід; 17. Сполука за п. 1, де Т являє собою С(ОН)R1R2, 5-фтор-N-[(1S)-3,3,3-трифтор-1-(гідроксиметил)-2R1 являє собою СН3, R2 являє собою Н, R3 являє (трифторметил)пропіл]тіофен-2-сульфонамід; собою Н, і R4 являєсобою (СF3)nалкіл. 5-хлор-N-[4,4,4-трифтор-1-(гідроксиметил)-2-(2,2,218. Сполука за п. 1, де Т являє собою СНО, R3 трифторетил)бутил]тіофен-2-сульфонамід; являє собою Н, і R4 являє собою (СF3)nалкіл. 5-хлор-N-[(1S)-(4,4,4-трифтор-1-(гідроксиметил)-219. Сполука за п. 1, де Т являє собою C(OH)R1R2, (2,2,2-трифторетил)бутил)]тіофен-2-сульфонамід; R1, R2 та R3 являють собою Н, і R4 являє собою 4,5-дихлор-N-[3,3,3-трифтор-1-(гідроксиметил)-2(СF3)2СН S-стереохімії. (трифторметил)пропіл]тіофен-2-сульфонамід; 20. Сполука за п. 1, де Т являє собою СНО, R3 N-[(1S)-3,3,3-трифтор-1-(гідроксиметил)-2являє собою Н, і R4 являє собою СН(СН3)СН2СF3 (трифторметил)пропіл]тіофен-3-сульфонамід; S-стереохімії. 5 82093 6 (a) обробки трифторметильованого або 21. Сполука за п. 1, де Т являє собою C(O)R8, R3 фторованого альдегіду дегідратуючим агентом і являє собою Н, R4 являє собою СН(СН3)СН2СF3 Sхіральним сульфінамідом з утворенням стереохімії, і R8 являє собою СН3. трифторметильованого або фторованого 22. Сполука за п. 1, де Т являє собою C(OH)R1R2, хірального сульфінаміду; R1, R2 та R3 являють собою Н, і R4 являє собою (b) обробки вказаного трифторметильованого або СН(СН2СF3)2 S-стереохімії. фторованого хірального сульфініміду ціануючим 23. Сполука за п. 1, де Т являє собою C(OH)R1R2, агентом з утворенням трифторметильованого або R1, R2 та R3 являють собою Н, і R4 являє собою фторованого діастереомерного α-амінонітрилу; СН(СН3)СН2СF3 S-стереохімії. (c) гідролізу вказаного трифторметильованого або 24. Сполука за п. 1, де Т являє собою C(OH)R1R2, фторованого діастереомерного α-амінонітрилу до R1 являє собою СН3, R2 і R3 являють собою Н, і R4 трифторметильованої або фторованої αявляє собою СН(СF3)2 S-стереохімії. амінокислоти; 25. Сполука за п. 1, де Т являє собою C(OH)R1R2, (d) відновлення вказаної трифторметильованої R1, R2 і R3 являють собою Н, і R4 являє собою (F)nабо фторованої α-амінокислоти до циклоалкіл. 26. Сполука за п. 1, де фармацевтично прийнятну трифторметильованого або фторованого b сіль вибирають з групи, що складається з солей аміноспирту; і органічних кислот, солей неорганічних кислот, (e) взаємодії вказаного трифторметильованого солей основ і їх сумішей. b -аміноспирту або фторованого з 27. Сполука за п. 26, де солі органічних і гетероциклічним сульфонілхлоридом з неорганічних кислот вибирають з групи, що утворенням вказаного трифторметильованого або складається з солей оцтової кислоти, молочної фторованого гетероциклічного сульфонаміду. кислоти, лимонної кислоти, винної кислоти, 35. Спосіб за п. 34, що додатково включає: бурштинової кислоти, фумарової кислоти, (f) екстрагування вказаного малеїнової кислоти, малонової кислоти, трифторметильованого або фторованого мигдалевої кислоти, яблучної кислоти, гетероциклічного сульфонаміду. хлористоводневої кислоти, бромводневої кислоти, 36. Спосіб за п. 34 або 35, що додатково включає фосфорної кислоти, азотної кислоти, сірчаної очищення вказаного трифторметильованого або кислоти, метансульфонової кислоти, фторованого гетероциклічного сульфонаміду. толуолсульфонової кислоти і їх сумішей. 37. Спосіб за п. 36, де вказаний 28. Сполука за п. 26, де солі основ вибирають з трифторметильований або фторований групи, що складається з солей гідроксиду натрію, гетероциклічний сульфонамід очищують з гідроксиду літію і гідроксиду калію і їх сумішей. використанням хроматографії. 29. Фармацевтична композиція, що містить 38. Спосіб за п. 34, де вказаний дегідратуючий сполуку за п. 1 і фізіологічно сумісний носій. агент являє собою етоксид титану, сульфат магнію 30. Фармацевтичний набір, який містить ° контейнер, що містить фармацевтичну композицію або молекулярні сита 4 A . за п. 29. 39. Спосіб за п. 34, де вказаний хіральний 31. Спосіб одержання трифторметильованого або сульфінамід являє собою S-(+)-толуолсульфінамід фторованого гетероциклічного сульфонаміду, що або трет-бутансульфінамід. включає стадії: 40. Спосіб за п. 34, де вказаний ціануючий агент (a) фільтрування суміші діастереомерів являє собою ціанід етилізопропоксіалюмінію. аміноефіру, де вказаний аміноефір містить 41. Спосіб за п. 34, де вказаний дегідратуючий щонайменше один хіральний центр і щонайменше агент являє собою етоксид титану, вказаний одну трифторметильну або фторгрупу, приєднану хіральний сульфінамід являє собою S-(+)до щонайменше одного хірального центру через толуолсульфінамід і вказаний ціануючий агент алкільну групу; являє собою ціанід етилізопропоксіалюмінію. (b) обробки аміноефіру DIBAL-H у толуолі з 42. Застосування сполуки за п. 1 або її композиції утворенням N-бензиламіноспирту; за п. 29 або 30 або її вказаної прийнятної солі при (c) гідрування N-бензиламіноспирту в присутності одержанні лікувального засобу. каталізатора і утворення аміноспирту; 43. Застосування сполуки за п. 1, або композиції (d) сульфування аміноспирту зі стадії (с) за п. 29 або 30 при одержанні лікувального засобу, гетероциклічним сульфонілхлоридом; і що застосовується для введення ссавцю для (e) кристалізації сульфованого продукту зі стадії інгібування утворення бета-амілоїду. (d) з отриманням хірально чистого 44. Застосування за п. 43, де вказану сполуку трифторметильованого або фторованого вводять перорально, ін'єкцією або інгаляцією. гетероциклічного сульфонаміду. 45. Застосування сполуки за п. 1 або композиції за 32. Спосіб за п. 31, де трифторметильований п. 29 або 30 при одержанні лікувального засобу гетероциклічний сульфонамід являє собою для лікування хвороби, вибраної з групи, що сполуку за п. 1. складається з хвороби Альцгеймера, амілоїдної 33. Спосіб за п. 32, де стадію кристалізації ангіопатії, церебральної амілоїдної ангіопатії, здійснюють з використанням етилацетату і системного амілоїдозу, спадкового гексану. внутрішньомозкового крововиливу з амілоїдозом 34. Спосіб одержання трифторметильованого або по типу Дутча, міозиту тілець включення, фторованого гетероциклічного сульфонаміду, що включає стадії: 7 помірного когнітивного синдрому Дауна. 46. Сполука формули O H N OCH 2CH3 Ph F3C 82093 погіршення (МСІ) CF 3 CF 3 . 48. Сполука за п. 46 формули O H N OCH 2CH3 Ph F3C CF 3 H N OH Ph F3C або її фармацевтично прийнятна сіль, гідрат або проліки. 47. Сполука за п. 46 формули O H N OCH 2CH3 Ph F3C 8 і . CF3 або її фармацевтично прийнятна сіль, гідрат або проліки. 50. Сполука за п. 49 формули H N OH Ph F3C CF3 . 51. Сполука формули H2 N OH F 3C CF3 або її фармацевтично прийнятна сіль, гідрат або проліки. 52. Сполука за п. 51 формули H2 N OH CF3 49. Сполука формули F 3C Даний винахід відноситься до фтор- та трифторалкіловмісних гетероциклічних сульфонамідних інгібіторів утворення бетаамілоїду та їх похідних, до способів їх отримання, композицій, що містять їх, і способів лікування з їх використанням. Зокрема, такі інгібітори застосовні при лікуванні хвороби Альцгеймера. Хвороба Альцгеймера (AD) є найбільш поширеною формою деменції (втратою пам'яті) у людей похилого віку. Основними патологічними змінами при AD, виявленими в головному мозку, є позаклітинні відкладення білка бета-амілоїду у формі бляшок і ангіопатія і внутрішньоклітинні нейрофібрілярні сплетення агрегованого гіперфосфорильованого тау-білка. Останні дані показують, що підвищені рівні бета-амілоїду в головному мозку не тільки передують таупатології, але також корелюють з когнітивними погіршеннями. Крім припущення про причинну роль бета-амілоїду при AD останні дослідження показали, що агрегований бета-амілоїд токсичний для нейронів у клітинній культурі. Бета-амілоїдний білок складається, головним чином, з пептидів у 39-42 амінокислоти та утворюється з більш великого білка-попередника, що називається амілоїдним білком-попередником (АРР), при послідовному впливі протеаз бета- і гамма-секретази. Хоча й рідко, випадки раннього настання AD пов'язані з генетичними мутаціями в АРР, які призводять до надпродукування або загального бета-амілоїду, або його більш агрегованої (aggregation-prone) ізоформи в 42 амінокислоти. Крім того, люди з синдромом Дауна мають додаткову хромосому, яка містить ген, що кодує АРР, і, таким чином, мають підвищені рівні бета-амілоїду і пізніше в житті AD, що постійно розвивається. Зберігається потреба в композиціях, корисних при інгібуванні утворення бета-амілоїду і при лікуванні ефектів станів, пов'язаних з ним. Вказані сполуки корисні для лікування станів, при яких підвищені рівні бета-амілоїду (наприклад, AD, синдром Дауна). Системне введення вказаних сполук суб'єктам, з ризиком появи або страждаючих на такі хвороби, знижує рівні білка бета-амілоїду з подальшим зменшенням токсичних бета-амілоїдних агрегатів у головному мозку пацієнтів. Несподівано було виявлено, що трифторалкілі фторовмісні гетероциклічні сульфонаміди формули (І) мають несподівано хорошу інгібуючу активність відносно бета-амілоїду. Сполуки формули (І) характеризуються підвищеною стійкістю до окислення (метаболічна стійкість фази 1) у порівнянні з відповідними сполуками, що не містять трифторалкільних або фторгруп. Крім того, було виявлено, що сполуки формули (І), ідентифіковані в даному описі, мають підвищені метаболічну стійкість і період напіввиведення з кровообігу, і, таким чином, посилену біологічною активність у порівнянні з відповідним сполуками, що не містять трифторалкільні або фторгрупи. Крім того, було виявлено, що трифторалкіл- і фторовмісні сполуки формули (І) мають підвищену ефективність у порівнянні з відповідними нефторованими сполуками. Таким чином, очікується, що сполуки винаходу будуть корисні в більш низьких дозах, ніж сполуки відомого рівня техніки. . 9 82093 10 Вказані й інші аспекти винаходу будуть В одному втіленні Τ являє собою C(OH)R1R2, очевидні для фахівців в даній галузі після R1 і R2 являють собою водень, R3 являє собою прочитання подальшого докладного опису водень, R4 являє собою (CF3)2CH, переважно, R4 винаходу. має S-стереохімію, R5 являє собою галоген, і W У першому аспекті винахід розкриває сполуки означає С, X означає S, Υ означає СН, Ζ означає формули (І), що містять їх фармацевтичні СН, з сульфонамідною групою, приєднаною до 3-2 композиції, і їх застосування в модуляції тіофенового кільця. утворення бета-амілоїду у суб'єктів, з ризиком В іншому втіленні Т являє собою СНО, R1 і R2 являють собою водень, R3 являє собою водень, R4 появи або страждаючих на AD або інші хвороби, являє собою CH(CH3)CH2CF3, R5 являє собою що є результатом підвищених рівнів білка бетагалоген, і W означає С, X означає S, Υ означає СН, амілоїду в мозку. Отже, даний винахід відноситься Ζ означає СН, з сульфонамідною групою, до сполук формули (І) приєднаною до 3-2 тіофенового кільця. В іншому втіленні Τ являє собою C(O)R8, R1 і R2 являють собою водень, R3 являє собою водень, R4 являє собою CF3CH2(CH3)CH, R5 являє собою галоген, R8 являє собою СН3, і W означає С, X означає S, Υ означає СН, Ζ означає СН, з сульфонамідною групою, приєднаною до 3-2 , тіофенового кільця. У ще одному втіленні Τ являє собою де C(OH)R1R2, R1 і R2 являють собою водень, R3 Τ вибирають з групи, що складається з СНО, являє собою водень, R4 являє собою (CH2CF3)2CH, COR8 і C(OH)R1R2; R5 являє собою галоген, і W означає С, X означає R1 і R2 незалежно вибирають з групи, що S, Υ означає СН, Ζ означає СН, з сульфонамідною складається з водню, нижчого алкілу, заміщеного групою, приєднаною до 3-2 тіофенового кільця. нижчого алкілу, CF3, алкенілу, заміщеного У ще одному втіленні Τ являє собою алкенілу, алкінілу і заміщеного алкінілу; C(OH)R1R2, R1 і R2 являють собою СН3, R3 являє R3 вибирають з групи, що складається з собою водень, R4 являє собою CF3CH2(CH3)CH, R5 водню, нижчого алкілу і заміщеного нижчого являє собою галоген, і W означає С, X означає S, алкілу; Υ означає СН, Ζ означає СН, з сульфонамідною R4 вибирають з групи, що складається з групою, приєднаною до 3-2 тіофенового кільця. (CF3)nалкілу, (CF3)n(заміщеного алкілу), В іншому втіленні Τ являє собою C(OH)R1R2, (CF3)nалкілфенілу, (CF3)nалкіл(заміщеного фенілу) R1 являє собою СН3, R2 являє собою водень, R3 і (F)nциклоалкілу; являє собою водень, R4 являє собою (CF3)2CH, R5 N дорівнює 1-3; являє собою галоген, і W означає С, X означає S, R5 вибирають з групи, що складається з Υ означає СН, Ζ означає СН, з сульфонамідною водню, галогену, CF3, дієну, конденсованого з Y, групою, приєднаною до 3-2 тіофенового кільця. коли Υ означає С, і заміщеного дієну, У ще одному втіленні Τ являє собою конденсованого з Υ, коли Υ означає С; C(OH)R1R2, R1 і R2 являють собою водень, R3 W, Υ і Ζ незалежно вибирають з групи, що являє собою водень, R4 являє собою складається з С, CR6 і N, за умови, що, (Р)2циклоалкіл, R5 являє собою галоген, і W щонайменше, один з W або Υ або Ζ повинен означає С, X означає S, Υ означає СН, Ζ означає являти собою С; СН, з сульфонамідною групою, приєднаною до 3-2 R6 вибирають з групи, що складається з тіофенового кільця. водню, галогену, нижчого алкілу і заміщеного Місце приєднання гетероциклічного W-X-Y-Z-C нижчого алкілу; кільця до групи SO2 не обмежує даний винахід. X вибирають з групи, що складається з О, S, Однак в одному переважному втіленні кільце SO2 і NR7; приєднане до групи SO2 через атом вуглецю. R7 вибирають з групи, що складається з Однак кільце може бути приєднане через водню, нижчого алкілу, заміщеного нижчого алкілу, гетероатом N. бензилу, заміщеного бензилу, фенілу і заміщеного Сполуки винаходу можуть містити один або фенілу; і декілька асиметричних атомів вуглецю, і деякі R8 вибирають з групи, що складається з сполуки можуть містити один або декілька нижчого алкілу, CF3, фенілу і заміщеного фенілу; асиметричних (хіральних) центрів, і, таким чином, і їх фармацевтично прийнятних солей і/або можуть утворювати оптичні ізомери і гідратів або проліків. діастереомери. Хоча стереохімія у формулі (І) не З вказаних сполук переважними показана, коли сполуки формули (І) містять один представниками є сполуки, в яких R4 являє собою або декілька хіральних центрів, щонайменше, (CF3)nалкіл, такий як CF3, CF3CH2, CH(CH3)CH2CF3, хіральний центр b-аміноспирту є S-стереохімічним. CH(CH2CF3)2 або CH(CF3)2. Іншими переважними Найбільш переважно, атом вуглецю, до якого представниками є сполуки, в яких R4 являєсобою приєднані N, R3 і R4 є S-стереохімічним. Таким (F)nциклоалкіл, переважно (F)2циклоалкіл, більш чином, винахід включає такі оптичні ізомери та переважно (F)2циклогексан і біцикло[3.1.0]гексан, і діастереомери, а також рацемічні суміші та найбільш переважно 4,4-дифторциклогексан і 4,4розщеплену енантіомерно чисті стереоізомери, а дифторбіцикло[3.1.0]-3-гексан. 11 82093 12 сполучених кілець утворює кон'юговану також інші суміші R- і S-стереоізомерів, і їх ароматичну систему. Арильні групи включають, фармацевтично прийнятні солі, гідрати та проліки. але, не обмежуючись ними, феніл, нафтил, Термін "алкіл" використовується в даному біфеніл, антрил, тетрагідронафтил, фенантрил та описі для позначення як лінійних, так і індан. розгалужених насичених аліфатичних Термін "заміщений арил" відноситься до вуглеводневих груп з одними-десятьма атомами арилу, що має вказані вище значення, який вуглецю, переважно з одними-вісьма атомами містить один-чотири замісники, переважно, вуглецю, і найбільш переважно з одними-шістьма незалежно вибрані з групи, що складається з атомами вуглецю; термін "нижчий алкіл", що галогену, CN, OH, NO2, аміно, алкілу, циклоалкілу, використовується в даному описі, відноситься до алкенілу, алкінілу, алкокси, арилокси, заміщеного лінійних і розгалужених насичених аліфатичних алкілокси, алкілкарбонілу, алкілкарбокси, вуглеводневих груп з одним-шістьма атомами алкіламіно та арилтіо. вуглецю; мається на увазі, що термін "алкеніл" Термін "дієн" відноситься до ненасиченого включає як лінійні, так і розгалужені алкільні групи вуглеводню або діолефіну, що має два подвійні з, щонайменше, одним подвійним вуглецьзв'язки. Термін "заміщений дієн" відноситься до вуглецевим зв'язком і двома-вісьма атомами дієну, заміщеного одним-двома замісниками, вуглецю, переважно з двома-шістьма атомами переважно, незалежно вибраними з групи, що вуглецю; мається на увазі, що "алкінільна" група складається з галогену, CN, OH, NO2, аміно, перекриває як лінійні, так і розгалужені алкільні алкілу, заміщеного алкілу, циклоалкілу, групи з, щонайменше, одним потрійним вуглецьзаміщеного циклоалкілу, алкенілу, заміщеного вуглецевим зв'язком і двома-вісьма атомами алкенілу, алкінілу, заміщеного алкінілу, алкокси, вуглецю, переважно з двома-шістьма атомами заміщеного алкокси, арилокси, заміщеного вуглецю. арилокси, алкілкарбонілу, заміщеного Терміни "заміщений алкіл", "заміщений алкілкарбонілу, алкілкарбокси, заміщеного алкеніл" і "заміщений алкініл" відносяться до алкілкарбокси, алкіламіно, заміщеного алкіламіно, алкільної, алкенільної і алкінільної групам, арилтіо або заміщеного арилтіо. описаних вище, що містять від одного до трьох Як "дієн", так і "заміщений дієн" замісників, переважно, незалежно вибраних з використовують у контексті R5, втіленні, в якому групи, що складається з галогену, CN, OH, NO2, заміщений дієн являє собою 3-хлор-1,2-бутадієн, аміно, арила, гетероциклічної групи, заміщеного який конденсований з тіофеновим кільцем по R5 і арила, заміщеної гетероциклічної групи, алкокси, Υ з утворенням бензотіофену. Інші придатні дієни заміщеного алкокси, арилокси, заміщеного включають 1,3-бутадієніл і 2-трифторметил-1,3арилокси, алкілкарбоніла, алкілкарбокси, бутадієніл. Однак можна легко вибрати інші алкіламіно та арилтіо. Вказані замісники можуть відповідні придатні і незаміщені дієни з числа бути приєднані до будь-якого атома вуглецю сполук, згідно з даним описом. алкільної, алкенільної або алкінільної групи, за Термін "заміщений бензил" відноситься до умови, що приєднання складає стабільну хімічну бензильної групи, заміщеної в бензильному кільці групу. одним або декількома замісниками, переважно, Термін "циклоалкіл" використовується в незалежно вибраними з групи, що складається з даному описі для позначення вуглецевого галогену, CN, OH, NO2, аміно, алкілу, циклоалкілу, насиченого кільця, що містить більше 3 атомів алкенілу, алкінілу, алкокси, арилокси, заміщений вуглецю, що утворюють стабільне кільце. Термін алкілокси, алкілкарбонілу, алкілкарбокси, "циклоалкіл" може включати групи, де дві або алкіламіно та арилтіо. більше циклоалкільних груп конденсовані з Термін "гетероциклічна група" утворенням стабільного поліциклічного кільця. використовується в даному описі для опису Переважно, термін "циклоалкіл" відноситься до стабільного 4-7-членного моноциклічного або кільця, що містить приблизно 4-9 атомів вуглецю, і стабільного поліциклічного гетероциклічного більш переважно приблизно 6 атомів вуглецю. кільця, яке є насиченим, частково ненасиченим Термін "заміщений циклоалкіл" або ненасиченим, і яке включає атоми вуглецю і використовується в даному описі для позначення від одного до чотирьох гетероатомів, переважно, циклоалкільної групи, описаної вище, що містить незалежно вибраних з групи, що складається з від одного до п'яти замісників, переважно, атомів Ν, О і S. Атоми N і S можуть бути незалежно вибраних з групи, що складається з окисленими. До гетероциклічних також відноситься водню, галогену, CN, OH, NO2, аміно, алкілу, будь-яке поліциклічне кільце, в якому будь-яке з заміщеного алкілу, алкенілу, заміщеного алкенілу, гетероциклічних кілець, що мають вказані вище алкінілу, алкокси, арилокси, заміщеного алкілокси, значення, конденсоване з арильним кільцем. алкілкарбонілу, алкілкарбокси, алкіламіно, Гетероциклічне кільце може бути приєднане до заміщеного алкіламіно, арилтіо, гетероциклічної будь-якого гетероатома або атома вуглецю, за групи, заміщеної гетероциклічної групи, умови, що отримана структура є хімічно аміноалкілу та заміщеного аміноалкілу. стабільною. Такі гетероциклічні групи включають, Термін "арил" використовується в даному наприклад, тетрагідрофураніл, піперидиніл, описі для позначення карбоциклічної ароматичної піперазиніл, 2-оксопіперидиніл, азепініл, системи, яка може бути монокільцевою або піролідиніл, імідазоліл, піридил, піразиніл, системою з декількох ароматичних кілець, піримідиніл, піридазиніл, оксазоліл, ізоксазоліл, конденсованих або сполучених разом так, що, морфолініл, індоліл, хінолініл, тієніл, фурил, щонайменше, одна частина конденсованих або 13 82093 14 бензофураніл, бензотієніл, тіаморфолініл, Вказані солі, а також інші сполуки винаходу, тіаморфолінилсульфоксид, ізохінолініл і можуть знаходитися у формі складного ефіру, тетрагідротіопіраніл. карбаматів і в інших звичайних "пролікарських" Термін "заміщена гетероциклічна група" формах, які при введенні у такій формі використовується в даному описі для опису перетворюються in vivo на активний фрагмент. У гетероциклічної групи, описаної вище, що містить даному переважному втіленні проліки являють один-чотири замісники, переважно, незалежно собою складний ефір. [Див., наприклад, В. Testa вибрані з групи, що складається з галогену, CN, and J. Caldwell, "Prodrugs Revisited: The "Ad Hoc" OH, NO2, аміно, алкілу, заміщеного алкілу, Approach as a Complement to Ligand Design", циклоалкілу, заміщеного циклоалкілу, алкенілу, Medicinal Research Reviews, 16 (3): 233-241, ed., заміщеного алкенілу, алкінілу, заміщеного алкінілу, John Wiley & Sons (1996)]. алкокси, заміщеного алкокси, арилокси, В одному втіленні сполуки формули (І) заміщеного арилокси, алкілкарбонілу, заміщеного являють собою тіофенсульфонаміди, і більш алкілкарбонілу, алкілкарбокси, заміщеного переважно 5-галогентіофенсульфонаміди, і алкілкарбокси, алкіламіно, заміщеного алкіламіно, найбільш переважно 5арилтіо або заміщеного арилтіо. галогентіофенсульфонаміди з b-відгалуженнями в Коли використовуються терміни "заміщений боковому ланцюгу первинного спирту. Таким алкіл" або "заміщений алкілфеніл", заміщення чином, у зв'язку з формулою (І), сполука винаходу, може мати місце в алкільній групі або у відповідній бажано, має структуру, в якій R1 і R2 являють базовій сполуці. собою водень; R3 являє собою водень; R4 являє Термін "алкокси" використовується в даному собою (CF3)2СН S-стереохімії, R5 являє собою описі для позначення групи OR, де R являє собою галоген, W означає С, X означає S, Υ означає СН, алкіл або заміщений алкіл. Ζ означає СН, з сульфонамідною групою, Термін "арилокси" використовується в даному приєднаною до С-2 тіофенового кільця. описі для позначення групи OR, де R являє собою В іншому втіленні сполуки формули (І) арил або заміщений арил. являють собою фурансульфонаміди. Таким чином, Термін "арилтіо" використовується в даному у зв'язку з формулою (І), сполука винаходу має описі для позначення групи SR, де R являє собою структуру, в якій X являє собою О. В одному арил або заміщений арил. переважному втіленні фурансульфонаміди Термін "алкілкарбоніл" використовується в характеризуються b-відгалуженнями у боковому даному описі для позначення групи RCO, де R ланцюгу первинного спирту. являє собою алкіл або заміщений алкіл. Ще в іншому втіленні сполуки формули (І) Термін "алкілкарбокси" використовується в являють собою піразолсульфонаміди. Таким даному описі для позначення групи COOR, де R чином, у зв'язку з формулою (І), сполука має являє собою алкіл або заміщений алкіл. структуру, в якій X являє собою NR7, W являє Термін "аміноалкіл" відноситься як до собою N, і Ζ і Υ являють собою С або CR6, за вторинних, так і до третинних амінів, де алкільні умови, що, щонайменше, один з Υ або Ζ повинен або заміщені алкільні групи, які можуть бути являти собою С. однаковими або різними, містять один-вісім атомів Вказані й інші сполуки винаходу можна вуглецю, і місце приєднання знаходиться біля отримати, дотримуючись схем, які проілюстровані атома азоту. нижче. Термін "галоген" відноситься до СІ, Br, F або І. Синтез Термін "кільцева" структура включає Сполуки даного винаходу можна отримати моноциклічну структуру, місточкову циклічну рядом способів, добре відомих фахівцям в галузі структуру та конденсовану циклічну структуру, органічного синтезу. Сполуки даного винаходу якщо тип кільцевої структури не визначений можна отримати з використанням способів, інакше. описаних нижче, нарівні з методами синтезу, Сполуки даного винаходу можна відомими в галузі органічного синтезу, або використовувати у формі солей, утворених з варіантами таких способів, здійснених фахівцями фармацевтично або фізіологічно прийнятними в даній галузі. [Див. для загального уявлення, кислотами або основами. Такі солі включають, Comprehensive Organic Synthesis, "Selectivity, але, не обмежуючись ними, солі, отримані з Strategy & Efficiency in Modern Organic Chemistry", органічними та неорганічними кислотами, такими ed. I. Fleming, Pergamon Press, New York (1991); як оцтова, молочна, лимонна, винна, бурштинова, Comprehensive Organic Chemistry, "The Synthesis фумарова, малеїнова, малонова, мигдалева, and Reactions of Organic Compounds", ed. J.F. яблучна, хлористоводнева, бромистоводнева, Stoddart, Pergamon Press, New York (1979)]. фосфорна, азотна, сірчана, метансульфонова, Переважні способи включають, але, не толуолсульфонова і подібні відомі прийнятні обмежуючись ними, способи, описані нижче. кислоти, і їх суміші. Інші солі включають солі Перший спосіб отримання полягає у взаємодії діетаноламіну, етилендіаміну та солі лужних або 1,2-аміноспирту II з відповідним лужноземельних металів, такі як натрієві сульфонілгалогенідом у присутності основи, такої (наприклад, гідроксид натрію), калієві (наприклад, як триетиламін (TEA), і у придатному розчиннику, з гідроксид калію), кальцієві (наприклад, гідроксид отриманням сполук формули III. Потім, у випадку кальцію) або магнієві (наприклад, гідроксид сполук, де R1 і R2 являють собою водень, магнію). окислення первинного N-сульфонілспирту хлорхроматом піридинію (РСС), реагентом Деса 15 82093 Мартіна періодинаном [D.B. Dess, J.C. Martin, J. Org. Chem., 48:4155 (1983)] або в умовах за Сверном [Omura et al., J. Org. Chem., 41:957 (1976)] дає відповідний альдегід IV, який можна піддати взаємодії з реактивами Гріньяра (RMgX, де R являє собою органічний радикал, і X являє собою галоген) і отримати вторинні спирти V у вигляді суміші діастереомерів, які можна розділити високоефективною рідинною хроматографією (ВЕРХ) (схема 1). Другий спосіб отримання включає взаємодію a-амінокислоти або складного ефіру IX з відповідним сульфонілгалогенідом у присутності основи, такої як триетиламін, і у придатному розчиннику, з отриманням сполук формули X (схема 2). Проміжну N-сульфонілкислоту Χ (R X= Η) можна перетворити у відповідний первинний спирт VIII (R1=R2=H), використовуючи стандартну методику, із застосуванням алюмогідриду літію (LiAlH4), B2H6 або хлорангідриду ціанурової кислоти/NaBH4. Проміжний складний Nсульфонілефір Χ (Rxалкіл , Bn) також можна = відновити до відповідного первинного спирту VIII (R1=R2=H), використовуючи стандартну методику із застосуванням LiAlH4. Альтернативно, проміжний N-сульфонілефір Χ (Rxалкіл , Bn) = можна перетворити на альдегід IV за допомогою DIBAL. Нарешті, проміжний складний Nсульфонілефір Χ (Rx=алкіл, Вn) можна піддати взаємодії з 2 еквівалентами реактиву Гріньяра і отримати третинні спирти III з R1=R2. Альтернативно, у випадку третинних спиртів III, де R1 не дорівнює R2, можна отримати по Вейнребу відповідний амід N-сульфонілкислоти і потім піддати взаємодії з R1MgX і R2MgX. 16 У варіанті другого способу отримання первинних спиртів спочатку a-амінокислоту або складний ефір (або їх N-захищене похідне) VI перетворюють у відповідний первинний 1,2аміноспирт VII (з використанням методики, описаної у попередньому розділі), який потім після видалення захисної групи (за необхідності) піддають взаємодії з відповідним сульфонілгалогенідом (схема 3), отримуючи сполуки формули VIII. Для отримання сполук, що відбуваються від неприродних a-амінокислот, що містять бетавідгалуження у боковому ланцюгу амінокислоти, на схемі 4 представлений спосіб отримання, оснований на роботі Hruby [Tet. Lett., 38:5135-5138 (1997)]. Такий спосіб спричиняє утворення a,bненасиченого аміду XIV допоміжної хіральної речовини Еванса з ацилброміду XI через послідовність реакцій Хорнера-Емонса з подальшим приєднанням солі мідної кислоти з органічною речовиною з утворенням спряження, захопленням отриманого енолят-аніону XV Nбромсукцинамідом (NBS), заміною броміду XVI азид-аніоном (який надається азидом тетраметилгуанідинію (TMGA) або азидом натрію) з отриманням XVII, подальшим відновленням до 1, 2-аміноспирту і подальшим сульфуванням з отриманням цільової сполуки XVIII. 17 82093 18 Для сульфонамідів, утворених від 1,2аміноспиртів в ряді вторинних спиртів з R1=H, і R2=CF3 (сполуки XXVII), розроблений спосіб отримання, наведений на схемі 7, виходячи з альдегіду IV (отриманого, як показано на схемі 1). Коли гетероцикл, приєднаний у сульфонамідній групі у вищеописаних спиртах, являє собою тіофен, відповідне сульфонове похідне XX можна отримати окисленням тіофену XIX 3-хлорпероксибензойною кислотою (МСРВА) (схема 5). При альтернативному способі отримання сульфонамідів похідних неприродних 1,2аміноспиртів використовують модифікацію Бухерера синтезу a-амінокислот за Стрекером (схема 6). При такому шляху альдегід XXI піддають взаємодії з ціанід-аніоном і карбонатом амонію, отримуючи гідантоїн XXII, який гідролізують до a-амінокислоти XXIII. Потім отриману сполуку відновлюють до XXIV і сульфують, отримуючи потрібні сполуки формули XXV. Альтернативно, проміжну амінокислоту XXIII можна спочатку сульфувати з отриманням сполуки XXVI, яку потім відновлюють до XXV. Рацемічні продукти XXIII, XXV або XXVI фахівець в даній галузі може розщепити до потрібного Sенантіомеру з використанням стандартної методики. Коли гетероцикл, приєднаний до сульфонамідної групи у вищеописаних спиртах, являє собою тіофен, відповідні похідні 5-йод- і 5фтортіофенів можна отримати конверсією похідного 5-бромтіофену XXVIII (отриманого, як показано на схемі 1) до проміжної сполуки 5триалкілоловотіофену XXIX, яку можна перетворити або на 5-йодтіофен (XXXI) обробкою йодидом натрію і хлораміном Т, або на аналог 5фтортіофену (XXX) обробкою реагентом SELECTELUORÒ (Aldrich Chem. Co.) (схема 8). Інший спосіб отримання хірально чистих Nсульфоніл-1,2-аміноспиртів, що походять від aамінокислот, наведений на схемі 9. У даному способі спочатку отримують a,b-ненасичений амід XXXIV допоміжної хіральної речовини Еванса з бромацетилброміду XI через послідовність реакцій за Хорнер-Емонсом. Приєднання солі мідної кислоти з органічною речовиною з утворенням спряження і протонування отриманого енолятаніону дає XXXV, який потім перетворюють у відповідний енолят і електрофільно амінуть тризилазидом з утворенням ключової проміжної сполуки XXXVI [J. Am. Chem. Soc, 109:6881-6883 (1987)]. Потім проміжний азид XXXVI гідролізують до a-азидокислоти XXXVII і відновлюють до 19 82093 20 умови реакції на будь-якій з показаних стадій. хірально чистої a-амінокислоти XXXVIII, яку можна Однак, якщо R3' не дорівнює R4', тоді на стадії 3 перетворити на відповідні №сульфоніл-1,2схеми 12 отримують суміш олефінових ізомерів, аміноспирти способами, описаними вище яку потрібно розділити перед стадією 4. (наприклад, схеми 2 або 3). Нарешті, хірально чисті a-амінокислоти XLI одні з можливих синтетичних попередників хіральних N-сульфоніл-2-аміноспиртів XLIII, також можна отримати з використанням варіантів асиметричного синтезу a-амінокислот за Стрекером, як представлено на схемах 10 [J. Org. Chem., 61:440-441 (1996)] та 11 [J. Org. Chem., 54:1055-1062(1989)]. Спосіб отримання хірально чистих трифторалкіл- або фторовмісних гетероциклічних сульфонамідів формули (І) представлений на схемах 12 і 13. Схема 12 відображує методики, описані в літературі, для утворення відповідного аміноефіру XLVII [W.H. Vine et al, J. Med. Chem., 1981, 24:1043-1047; і R. Keese et al., Synthesis, 1996, 695-696]. На основі літературних відомостей і вказівок в даному описі фахівцеві в даній галузі буде очевидно, що, в залежності від потрібного аміноефіру, можна легко вибрати інший трифторметилальдегід на стадії 3, в залежності від замісників, вибраних для R4' і R3', іншу допоміжну хіральну речовину на стадії 4 або використати інші реагенти, замісники або інші Згідно зі схемою 13, аміноефір XLVIII відфільтровують; виявлено, що перекристалізація на даній стадії, яка описана в літературі як істотна, не потрібна. Проміжний складний аміноефір XLVIII перетворюють у N-бензиламіноспирт за допомогою DIBAL-H. N-Бензиламіноспирт XLIX гідролізують у присутності відповідного каталізатора, отримуючи аміноспирт L. Каталізатор видаляють фільтруванням і розчин концентрують до твердої речовини. Аміноспирт L сульфують, використовуючи ВБА/триетиламін/DМАР (або інший придатний агент, наприклад, TMSCl/амінна основа) і потрібний гетероциклічний сульфонілхлорид. Реакцію гасять для видалення силільної ефірної групи (наприклад, водної суміші HCI/ТГФ) і фільтрують (наприклад, використовуючи шар SiO2) із сумішшю етилацетат/гексан у співвідношенні, яке допускає кристалізацію хірально чистого трифторметилвмісного гетероциклічного сульфонаміду формули (І) за винаходом. У доповнення до корисності для отримання сполук винаходу, спосіб за схемою 13 можна легко використовувати для отримання трифторалкіл-, включаючи трифторметил- і фторовмісних сполук. Більш конкретно, даний спосіб може бути корисний для отримання інших трифторалкіл-, трифторметил- або фторовмісних сульфонамідів з діастереомерної суміші аміноефіру, що має, щонайменше, один хіральний центр і, щонайменше, одну трифторалкільну або 21 82093 22 фторованого гетероциклічного сульфонаміду, що фторгрупу, приєднану до, щонайменше, одного включає стадії хірального центру через алкільну групу, або, (a) фільтрування суміші діастереомерів щонайменше, одну фторгрупу, приєднану до аміноефіру, причому вказаний аміноефір має, циклоалкільної групи. Як визначено в даному щонайменше, один хіральний центр і, описі, алкільна група може приєднувати один або щонайменше, одну трифторметильну або декілька трифторалкілів безпосередньо до фторгрупу, приєднану до, щонайменше, одного хірального центра. Альтернативно, трифторалкіл хірального центра через алкільну групу; може розташовуватися в заміснику заміщеної (b) обробки аміноефіру DIBAL-H в толуолі з алкільної групи. утворенням N-бензиламіноспирту; Сполуки винаходу також можна отримати (c) гідрування N-бензиламіноспирту в взаємодією вторинного спирту V з хлорхроматом присутності каталізатора та утворення піридинію (РСС) або реагентом Деса-Мартіна аміноспирту; періодинаном [D.B. Dess, J.C. Martin, J. Org. (d) сульфування аміноспирту зі стадії (с) Chem., 48:4155 (1983)] з утворенням відповідного гетероциклічним сульфонілхлоридом і альдегіду LI (схема 14). (e) кристалізації сульфованого продукту зі стадії (d) з утворенням хірально чистого трифторметильованого або фторованого гетероциклічного сульфонаміду. У ще одному втіленні винахід відноситься до способу отримання трифторметильованого або фторованого гетероциклічного сульфонаміду, що включає стадії Інший спосіб отримання (a) обробки трифторметильованого або трифторметильованих або фторованих фторованого альдегіду дегідратуючим агентом і гетероциклічних сульфонамідів включає обробку хіральним сульфінамідом з утворенням трифторметильованого або фторованого трифторметильованого або фторованого альдегіду де гідратуючим агентом і хіральним хірального сульфінаміду; сульфінамідом з утворенням (b) обробки вказаного трифторметильованого трифторметильованого або фторованого або фторованого хірального сульфінаміду хірального сульфінаміду. Фахівець в даній галузі ціанучим агентом з утворенням зможе легко визначити відповідний дегідратуючий трифторметильованого або фторованого агент для використання в даному способі, що діастереомерного a-амінонітрилу; включає, без обмежень, етоксид титану, сульфат (c) гідролізу вказаного трифторметильованого магнію або молекулярні сита, такі як молекулярні сита 4Å. Потім трифторметильований або або фторованого діастереомерного a-амінонітрилу фторований хіральний сульфінамід можна до трифторметильованої або фторованої aобробити ціанучим агентом з утворенням амінокислоти; трифторметильованого або фторованого (d) відновлення вказаної діастереомерного a-амінонітрилу, відповідно. трифторметильованої або фторованої aВибір ціанучого реагенту для використання в амінокислоти до трифторметильованого або даному винаході знаходиться в компетенції фторованого b-аміноспирту і фахівця в даній галузі, і може включати, серед (e) взаємодії вказаного трифторметильованого інших, ціанід етилізопропоксіалюмінію. Потім або фторованого b-аміноспирту з гетероциклічним трифторметильований або фторований сульфонілхлоридом з утворенням вказаного діастереомерний α-амінонітрил можна виділити і, трифторметильованого або фторованого необов'язково, очистити з використанням методів, гетероциклічного сульфонаміду. добре відомих фахівцям в даній галузі. Способи застосування Альтернативно, трифторметильований або Сполуки формули (І) є інгібіторами утворення фторований діастереомерний a-амінонітрил може бета-амілоїду. У попередніх дослідженнях з бути гідролізований до трифторметильованої або використанням специфічних аналізів на протеази фторованої a-амінокислоти, відповідно, з показано, що представники сполук формули (І) використанням методів і агентів, добре відомих виявляють специфічне інгібування відносно фахівцям в даній галузі. Потім протеазної активності. Таким чином, сполуки трифторметильовану або фторовану aданого винаходу корисні для лікування і амінокислоту можна відновити до попередження різних станів, при яких модуляція трифторметильованого або фторованого bрівнів бета-амілоїду забезпечує лікувальну сприятливу дію. Такі стани включають, серед аміноспирту, відповідно, з використанням методів і інших, наприклад, амілоїдну ангіопатію, амілоїдну агентів, добре відомих фахівцям в даній галузі. церебральну ангіопатію, системний амілоїдоз, Трифторметильований або фторований bхворобу Альцгеймера (AD), спадковий аміноспирт можна піддати взаємодії з внутрішньомозковий крововилив з амілоїдозом за гетероциклічним сульфонілхлоридом з типом Дутча, міозит тілець включення, синдром утворенням відповідного трифторметильованого Дауна, помірне когнітивне погіршення (МСІ). або фторованого гетероциклічного сульфонаміду Крім того, сполуки формули (І) можна даного винаходу. використовувати при отриманні реагентів, В одному втіленні винахід відноситься до корисних у діагностиці станів, пов'язаних з способу отримання трифторметильованого або 23 82093 24 виникнення стану, але у якого він поки не аномальними рівнями бета-амілоїду. Наприклад, діагностований і/або у якого поки відсутні його сполуки формули (І) можна використовувати для симптоми. отримання антитіл, які будуть корисні в різних Вказані сполуки можна доставляти або діагностичних аналізах. Способи отримання вводити будь-яким придатним шляхом доставки, моноклональних, поліклональних, рекомбінантних наприклад, серед інших, пероральним способом, і синтетичних антитіл або їх фрагментів добре ін'єкцією, інгаляцією (включаючи пероральну, відомі фахівцям в даній галузі. [Див., наприклад, Е. інтраназальну і внутрішньотрахеальну), Mark and Padlin, "Humanization of Monoclonal внутрішньовенним, підшкірним, Antibodies", Chapter 4, The Handbook of внутрішньом'язовим, сублінгвальним, Experimental Pharmacology, Vol.113, The інтракраніальним, епідуральним, Pharmacology of Monoclonal Antibodies, Springerвнутрішньотрахеальним, ректальним, вагінальним Verlag (June, 1994); спосіб Kohler and Milstein і способом. Найбільш бажано доставляти сполуки багато відомих його модифікацій, заявка на патент перорально, шляхом інгаляції або відповідним РСТ №PCT/GB85/00392; публікація заявки на парентеральним шляхом. Сполуки можна ввести в патент Великобританії №GB2188638A; Amit et al., композицію у поєднанні зі звичайними Science, 233:747-753 (1986); Queen et al., Proc. фармацевтичними носіями, які фізіологічно Natl. Acad. Sci. USA, 86:10029-10033 (1989); сумісні. Необов'язково, одну або декілька сполук публікація міжнародного патенту №W090/07861; і винаходу можна змішувати з іншими активними Riechmann et al., Nature, 332:323-327 (1988); Huse речовинами. et al., Science, 246:1275-1281 (1988)]. Придатні фізіологічно сумісні носії може легко Альтернативно, сполуки формули (І) самі по собі вибрати фахівець в даній галузі. Наприклад, можуть бути використані в таких діагностичних придатні тверді носії, включають серед інших, аналізах. Незалежно від вибраного реагенту одну або декілька речовин, які також можуть діяти (наприклад, антитіл або сполуки формули (І)), як коригенти, що містять речовини, придатні діагностичні форми, що включають, солюбілізатори, суспендуючі агенти, наповнювачі, наприклад, радіоімуноаналізи і твердофазний гліданти, що сприяють пресуванню, зв'язуючі імуноферментний аналіз (ELISA), добре відомі речовини або речовини, що сприяють дезінтеграції фахівцям в даній галузі і не є обмеженням такого таблетки, або інкапсулюючий матеріал. У втілення винаходу. порошках носій являє собою тонко подрібнену Інгібуюча активність відносно бета-амілоїду тверду речовину, яка знаходиться в суміші з тонко багатьох сполук даного винаходу визначена з подрібненим активним інгредієнтом. У таблетках використанням аналізу на звільнення активатора активний інгредієнт змішують у відповідних (Represser Release Assay (RRA)). Див. таблицю 5, пропорціях з носієм, що має властивості, необхідні нижче. Сполука вважається активною в RRA, якщо для пресування, і пресують у потрібну форму вона призводить до, щонайменше, 1,5-кратного потрібного розміру. Порошки і таблетки, зростання люциферазної активності в концентрації переважно, містять до 99% активного інгредієнта. 20мкг/мл і є нетоксичною. Відповідні тверді носії включають, наприклад, Крім того, в даній галузі добре відомі клітинні, фосфат кальцію або дикальційфосфат, стеарат безклітинні та in vivo методи скринінгу для детекції магнію, тальк, крохмаль, цукор (включаючи, інгібіторів утворення бета-амілоїду. Такі аналізи, наприклад, лактозу і сахарозу), целюлозу серед інших, можуть включати радіоімуноаналізи і (включаючи, наприклад, мікрокристалічну твердофазний імуноферментний аналіз (ELISA). целюлозу, метилцелюлозу, [Див., наприклад, P.O. Mehta et al., Techniques in натрійкарбоксиметилцелюлозу), Diagnostic Pathology, vol.2, eds., Bullock et al., полівінілпіролідон, низькоплавкі воски, іонообмінні Academic Press, Boston, pages 99-112 (1991), смоли і каолін. публікація Міжнародного патенту №WO 98/22493, Рідкі носії можна використовувати при Європейський патент №0652009 і патенти США отриманні розчинів, суспензій, емульсій, сиропів і №№ 5703129 і 5592846]. Вибір відповідного еліксирів. Активний інгредієнт за даним винаходом скринінг-аналізу in vitro або in vivo не є можна розчинити або суспендувати в обмеженням даного винаходу. фармацевтично прийнятному рідкому носії, такому Фармацевтична композиція як вода, органічний розчинник, їх суміш або Фармацевтичну композицію даного винаходу фармацевтично прийнятні олії або жир. Рідкий можна вводити суб'єкту будь-яким бажаним носій може містити інші відповідні фармацевтичні способом з урахуванням конкретного стану, для домішки, такі як солюбілізатори, емульгатори, якого вона вибрана. Суб'єктом називають будьбуфери, суспендуючі речовини, загусники, якого відповідного ссавця, включаючи людину, регулятори в'язкості, стабілізатори або регулятори домашніх тварин (наприклад, собак і кішок) і осмосу. Відповідними прикладами рідких носіїв худобу, який визнаний як такий, що знаходиться для перорального і парентерального введення є або що має ризик виникнення одного або вода (зокрема, яка містить домішки, вказані вище, декількох станів, для яких бажана модуляція рівнів наприклад, похідні целюлози, переважно, розчин бета-амілоїду. Таким чином, сполуки винаходу натрійкарбоксиметилцелюлози), спирти корисні для лікування і/або попередження ряду (включаючи одноатомні спирти і багатоатомні станів у людей і тварин. Термін "попередження", спирти, наприклад, гліколі) і їх похідні й олії що використовується в даному описі, охоплює (наприклад, фракціоновану кокосову олію, попередження симптомів у суб'єкта, який арахісову олію, кукурудзяну олію та сезамову ідентифікований як такий, що має ризик 25 82093 26 для ін'єкції або інгаляції. Відповідно, окрема доза олію). Для парентерального введення носій також (тобто на одиницю) сполуки винаходу складає може являти собою ефір жирної кислоти, такий як інтервал від приблизно 1мкг/кг до приблизно етилолеат та ізопропілміристат. Стерильні рідкі 10г/кг. Однак, оскільки сполуки винаходу мають носії використовують у стерильних рідких поліпшену біологічну активність у порівнянні з композиціях для парентерального введення. подібними сполуками, позбавленими Необов'язково, до композицій винаходу трифторалкільних або фтор-замісників за можуть бути включені домішки, що зазвичай винаходом, можна вибрати такі відповідні дози в використовуються при отриманні фармацевтичних більш вузькому інтервалі, наприклад, від композицій. Такі компоненти включають, приблизно 1мкг/кг до приблизно 200мг/кг, більш наприклад, підсолоджувальні речовини або інші переважно від приблизно 10мкг/кг до приблизно коригенти, барвники, консерванти та 10мг/кг, і найбільш переважно від приблизно антиоксиданти, наприклад, вітамін Е, аскорбінову 100мкг/кг до приблизно 1мг/кг. Бажано, щоб кислоту, ВНТ і ВНА. вказані кількості надавалися як щодобові. Однак Рідкі фармацевтичні композиції, які являють дозування, що використовується при лікуванні або собою розчини або суспензії, можуть бути введені, попередженні специфічної когнітивної нестачі або наприклад, шляхом внутрішньом'язової, іншого стану, може бути встановлене вибірково інтраперитонеальної або підшкірної ін'єкції. лікарем-куратором. Враховуються такі фактори, як Стерильні розчини також можна вводити специфічний когнітивний недолік і маса, вік і внутрішньовенно. Композиція для перорального реакція пацієнта. Наприклад, на основі профілю введення може бути композицією або в рідкій або активності і дієвості сполук даного винаходу, в твердій формі. початкова доза від приблизно 375-500мг на добу з Відповідно, коли фармацевтичну композицію поступовим підвищенням до добової дози отримують для застосування у вигляді інгаляції, її приблизно 1000мг на добу може забезпечити отримують у вигляді рідких стандартних доз з потрібний рівень дозування для людини. використанням сполуки винаходу і Альтернативно, може бути бажане фармацевтичного носія, придатного для доставки застосування пристроїв з відстроченою доставкою за допомогою насосу для аерозольного спрею або для того, щоб пацієнту уникнути необхідності у вигляді сухого порошку для інсуфляції. Для приймати ліки щодня. "Відстрочена доставка" застосування у вигляді аерозолів сполуки визначається як затримка вивільнення активної винаходу вводять до композиції, яку беруть в речовини, тобто сполуки винаходу, після аерозольну упаковку разом з газоподібним або поміщення в ділянку доставки, з подальшим рідким пропелентом, наприклад, пролонгованим вивільненням речовини в більш дихлордифторметаном, діоксидом вуглецю, пізній час. Фахівцям в даній галузі відомі відповідні азотом, пропаном і т.п., зі звичайними пристрої для відстроченої доставки. Приклади компонентами, такими як співрозчинники і відповідних пристроїв для відстроченої доставки зволожувач, які можуть бути необхідні або бажані. включають, серед інших, наприклад, гідрогелі Наприклад, винахід забезпечує доставку дози, що [див., наприклад, патенти США №№ 5266325, відмірюється для пероральної або інтраназальної 4959217 і 5292515], осмотичний насос, такий як інгаляції за одне або два спрацювання. описаний Alza [патенти США №№ 4295987 і Відповідно, доза доставляється за одне або два 5173752] або Merk [Європейський патент спрацювання. Однак, можна легко визначити інші №314206]; гідрофобні плівкові матеріали, такі як відповідні способи доставки. етиленметакрилат (ЕМА) і етиленвінілацетат Переважно, фармацевтична композиція (EVA); здатні до біологічного розсмоктування знаходиться в стандартній дозованій формі, полімерні системи [див., наприклад, публікацію наприклад, у вигляді таблеток або капсул. У такій Міжнародного патенту № WO 98/44964, Bioxid and формі композиція поділена на стандартні дози, що Cellomeda; патенти США №№ 5756127 і 5854388]; містять відповідні кількості активного інгредієнта; описані інші здатні до біологічного розсмоктування стандартні дозовані форми можуть являти собою імплантовані пристрої як такі, що складаються, композиції в упаковці, наприклад, упаковані наприклад, зі складних поліефірів, поліангідридів порошки, флакони, ампули, заздалегідь заповнені або співполімерів молочної кислоти та гліколевої шприці або саше, які містять рідини. Стандартна кислоти [див., наприклад, патент США №5817343 дозована форма може представляти собою, (Alkermes Inc)]. Для використання в таких наприклад, капсулу або таблетку як таку, або вона пристроях для відстроченої доставки сполуки може являти собою відповідне число будь-яких винаходу можуть бути введені до композицій, таких композицій у формі упаковки. описаних у даному описі. Як описано в даному описі, терапевтично або В іншому аспекті винахід відноситься до профілактично корисна кількість сполуки винаходу фармацевтичного набору для доставки продукту. являє собою кількість сполуки, яка полегшує Відповідно, набір містить упаковку або ємність зі симптоми захворювання, наприклад, AD, або яка сполукою, введеною до композиції для бажаного запобігає появи симптомів або появи більш важких способу доставки. Наприклад, якщо набір симптомів. Корисні кількості сполуки можуть створюється для введення інгаляцією, він може змінюватися в залежності від композиції і способу містити суспензію, яка містить сполуку винаходу, доставки. Наприклад, для того, щоб доставити отриману для доставки у вигляді аерозолю або біологічно еквівалентну кількість лікарського спрею певної дози шляхом інгаляції. Відповідно, засобу, перорально можна доставляти більші набір містить інструкції по дозуванню і вкладиш кількості, ніж у випадку, коли композиція отримана 27 82093 28 Мас-спектр (-ESI): 309 (М-Н)відносно активного агента. Необов'язково, набір Аналіз. також може містити інструкції для контролю рівнів Обчислено для C7H9F3NO2: С, 40,01; Η, 4,32; продукту в системі кровообігу і матеріали для Ν, 13,33. здійснення таких аналізів, включаючи, наприклад, Знайдено: С, 39,91; Η, 4,10; Ν, 13,20. реагенти, ямкові планшети, ємності, маркери або 3. N-[(5-Хлортієн-2-іл)сульфоніл]-5,5,5мітки і т.п. Такі набори легко упаковуються трифторізолейцин способом, придатним для лікування за потрібними 5-(3,3,3-Трифтор-1-метилпропіл)імідазолідинпоказами. Наприклад, набір також може містити 2,4-діон (15,54г, 73,95ммоль) розчиняють у 150мл інструкції по застосуванню розпилювального водного розчину гідроксиду натрію (NaOH, 11,83г, насосу або іншого пристрою для доставки. 295,8ммоль). Розчин нагрівають мікрохвильовим Інші відповідні компоненти для таких наборів опроміненням у герметично закритій посудині будуть очевидні для фахівця в даній галузі, з протягом 1 години (умови мікрохвильового урахуванням потрібного показання і способу опромінення: 15хв. при приблизно 100% доставки. Дози можуть повторюватися щодобово, потужності, 150°С, 50ф/д2, потім 5хв. при 0% щотижнева або щомісячно, у заздалегідь потужності, потім 15хв. при приблизно 100% встановлені проміжки часу, або як прописано. потужності, 150°С, 50ф/д2, потім послідовність Приклади повторюють). Воду та гідроксид амонію видаляють Наступні приклади наводяться для ілюстрації з реакційної суміші у вакуумі і отриману суміш отримання та активності характерних неочищеної амінокислоти і NaOH використовують представників сполук винаходу і для ілюстрації їх у наступній реакції без додаткового очищення. ефективності в скринінг-аналізі. Фахівцеві в даній Суміш неочищеної амінокислоти і NaOH галузі буде зрозуміло, що хоча в наведених розчиняють у 300мл води. Суміш охолоджують до прикладах вказуються певні реагенти і умови, приблизно 0°С на льодяній бані. 5-Хлортіофен-2вказані реагенти і умови не є обмеженням даного сульфонілхлорид (17,6г, 81ммоль) розчиняють у винаходу. 100мл тетрагідрофурану (ТГФ) і додають по Приклад 1 краплях до реакційної суміші протягом 0,5 години. 5-Xлop-N-[(1S,2R)-4,4,4-тpифтop-lПісля поступового нагрівання реакційної суміші (гiдpoкcимeтил)-2-метилбутилітіофен-2протягом 1 години до 25°С і перемішування сульфонамід протягом 16 годин видаляють ТГФ у вакуумі і потім А. Спосіб 1 суміш підкислюють до рН приблизно 1 1н 1. 2-Метил-4,4,4-трифторбутаналь хлористоводневою кислотою. Приблизно через До 2-метил-4,4,4-трифтор-1-бутанолу (7,5г, 15хв. з молочно-білої суміші починає випадати 53ммоль) в метиленхлориді (СН2Сl2) (125мл) при осад. Через 1 годину суміш охолоджують до 0°С 0°С додають періодинан Деса-Мартіна (26,5г, протягом 1 години і потім фільтрують. Осад 63,3ммоль). Реакційну суміш нагрівають до 25°С і промивають 1н хлористоводневою кислотою, перемішують протягом 20хв. До отриманої суміші отримуючи 1Ч-[(5-хлортієн-2-іл)сульфоніл]-5,5,5додають діетиловий ефір (Et2O, 200мл) і потім трифторізолейцин у вигляді білої твердої розчин Na2S2O3 (20,0г, 185ммоль) у насиченому речовини (15,2г, 56%). водному розчині бікарбонату натрію (NaHCO3) Мас-спектр (-ESI): 364 (М-Н)-. (200мл) і 100мл води. Молочно-білу суміш Аналіз. перемішують доти, доки обидві фази не стануть Обчислено для C10H11F3NO4S2: С, 32,84; Η, гомогенними. Фази розділяють і органічний 3,03; Ν, 3,83. екстракт промивають насиченим водним розчином Знайдено: С, 32,45; Η, 2,94; Ν, 3,79. NaHCO3 (25мл) і водним 1н розчином Na2S2O3 4. 5-Хлор-N-[(1S,2R)-4,4,4-трифтор-1(25мл) і сушать з використанням сульфату магнію (гідроксиметил)-2-метилбутил]тіофен-2(MgSO4). Розчинники видаляють перегонкою при сульфонамід атмосферному тиску, отримуючи 2-метил-4,4,4До N-[(5-хлортієн-2-іл)сульфоніл]-5,5,5трифторбутанальдегід (6,5г, 88%). Спектр 1Н трифторізолейцину (15,2г, 41,6ммоль) у ТГФ ядерного магнітного резонансу (ЯМР) відповідає (500мл) при 0°С додають по краплях 1М розчин спектру, про який повідомляється в літературі [J. боран-тетрагідрофуранового комплексу у ТГФ Fluorine Chem., 36:163-170 (1987)]. (208мл, 208ммоль). Через 15хв. реакційну суміш 2. 5-(3,3,3-Трифтор-1нагрівають до 25°С і перемішують протягом 18 метилпропіл)імідазолідин-2,4-діон годин. Потім реакцію поступово гасять 10% До ціаніду натрію (18,4г, 375ммоль) і розчином АсОН у МеОН (100мл). Леткі речовини карбонату амонію (39,0г, 500ммоль) в Н2О (450мл) видаляють у вакуумі. Потім залишок розчиняють в додають 2-метил-4,4,4-трифторбутанальдегід етилацетаті (EtOAc) (500мл), розчин промивають (17,5г, 125ммоль) в етанолі (450мл). Реакційну суміш нагрівають при 90°С протягом 17 годин. насиченим водним розчином NaHCO3 (3´100мл), Після охолодження до 25°С приблизно 500мл сушать з використанням сульфату натрію (Na2SO4) розчинника видаляють у вакуумі. Додають і концентрують до білої твердої речовини (13,3г, концентровану HCI для підкислення суміші до рН вихід 91%). Діастереомери розділяють методом від приблизно 1 до приблизно 2, і випадає осад. ВЕРХ (колонка з силікагелем Luna, МТВЕ-гексан Суміш фільтрують і промивають 1н 3:7, діастереомер 1 елююється при 10,9хв., хлористоводневою кислотою, отримуючи 5-(3,3,3діастереомер 2 елююється при 15,3хв.). трифтор-1-метилпропіл)імідазолідин-2,4-діон у Діастереомер 2 розщеплюють на чисті вигляді білої твердої речовини (15,5г, 59%). енантіомери препаративної хіральної SFC 29 82093 30 Обчислено для C15H16F3NO3: С, 57,14; Η, 5,11; [chiralpack AD, ізопропанол-діоксид вуглецю 3:7, Ν, 4,44. енантіомер 1 елююється при 4,5хв., енантіомер 2 Знайдено: С, 57,18; Η, 5,24; Ν, 4,38. елююється при 5,6хв.]. Потім енантіомер 1 3. (2R)-4,4,4-Трифтор-2-метилбутан-1-ол перекристалізовують з суміші EtOAc/гептан, 1:4, Розчин боргідриду літію (23мл, 2,0Μ у ТГФ, отримуючи 5-хлор-N-[(1S,2R)-4,4,4-трифтор-145ммоль) при 0°С додають по краплях до розчину (гідроксиметил)-2-метилбутил]тіофен-2(4R)-4-бензил-3-[(2R)-4,4,4-трифтор-2сульфонамід, т.пл. 136-137°С. метилбутаноїл]-1,3-оксазолідин-2-ону (12,9г, [a]D25=+45,62° (c=1% розчин, МеОН). 40,9ммоль) і води (810мкл, 45,0ммоль) в Мас-спектр (-ESI): 350 (М-Н)-. діетиловому ефірі (200мл). Реакційній суміші Аналіз. дають нагрітися до 25°С, через 1 годину Обчислено для C10H13ClF3NO2S2: С, 34,14; Η, охолоджують до 0°С і гасять водним 1н розчином 3,72; Ν, 3,98. NaOH (124мл). Суміш нагрівають до 25°С і Знайдено: С, 34,12; Η, 3,45; Ν, 3,88. перемішують доти, доки обидва шари не стануть В. Спосіб 2 гомогенними. Шари розділяють, органічний 1. (4R)-4-Бензил-3-(4,4,4-трифторбутаноїл)екстракт промивають розсолом, сушать з 1,3-оксазолідин-2-он використанням MgSO4 і концентрують. ФлешДо розчину 4,4,4-тритформасляної кислоти хроматографія (елюент ефір-петролейний ефір, (10,00г, 70,38ммоль) у ТГФ (150мл) при -78°С 3:7) дає (2R)-4,4,4-трифтор-2-метилбутан-1-ол додають триетиламін (10,3мл, 73,9ммоль) і (5,05г, 87%) у вигляді безбарвного масла. Спектр півалоїлхлорид (9,1мл, 74ммоль). Реакційну суміш 1 H ЯМР ідентичний спектру, описаному в нагрівають до 0°С і перемішують протягом 1,5 літературі [J. Med. Chem., 37:1282-1297 (1994)]. години. В окремій колбі розчин н-BuLi (31мл, 2,5Μ 4. (S)-N-[(3R)-метил-4, 4,4-трифторбутиліден]у гексані, 77ммоль) додають протягом 10хв. до п-толуолсульфінамід охолодженого до -78°С розчину (R)-(+)-4-бензил-2До (2R)-4,4,4-трифтор-2-метилбутан-1-олу оксазолідинону (13,7г, 77,4ммоль) у ТГФ (150мл) і (2,90г, 20,4ммоль) у СН2Сl2 (50мл) при 0°С суміш перемішують протягом 1 години. додають періодинан Деса-Мартіна (10,24г, Густу завись змішаного ангідриду 24,49ммоль). Через 15хв. реакційну суміш охолоджують до -78°С і виливають через нагрівають до 25°С і перемішують протягом 1 крапельну лійку в розчин літованого години. Потім отриману суміш розбавляють оксазолідинону. Суміш залишають поступово діетиловим ефіром (50мл) і додають до розчину нагріватися до 25°С на ніч. Потім суміш Na2S2O3 (11,29г, 71,44ммоль) у насиченому розбавляють EtOAc (500мл) і промивають 1н водному розчині NaHCO3 (100мл). Молочно-білу хлористоводневою кислотою (500мл), насиченим суміш перемішують доти, доки обидва шари не водним розчином NaHCO3 (500мл) і насиченим стануть гомогенними. Фази розділяють, органічний водним розчином NaCl (500мл), потім сушать екстракт сушать (MgSO4) і фільтрують, отримуючи (Na2SO4) і концентрують. Флеш-хроматографія розчин (2R)-4,4,4-трифтор-2-метилбутаналя, який (елюент EtOAc-гексан, 1:4) дає (4R)-4-бензил-3використовують на наступній стадії без видалення (4,4,4-трифторбутаноїл)-1,3-оксазолідин-2-он розчинників. (18,29г, 86%) у вигляді безбарвного масла. До розчину неочищеного альдегіду додають [a]D25=-89,10° (с=1% розчин, ДМСО). етоксид титану(ІV) (15мл, 20% Ті, 82ммоль), потім Мас-спектр (-ESI): 300 (М-Н)-. (S)-(+)-толуолсульфінамід (3,48г, 22,4ммоль) і Аналіз. розчин кип'ятять зі зворотним холодильником Обчислено для C14H14F3NO3: С, 55,82; Η, 4,68; протягом 3 годин. Потім суміш охолоджують до Ν, 4,65. 0°С і додають воду (75мл) для осадження солей Знайдено: С, 56,03; Η, 4,67; Ν, 4,62. титану. Суспензію фільтрують через реагент 2. (4R)-4-Бeнзил-3-[(2R)-4,4,4-тpифтop-2мeтилбyтанoїл]-1,3-oкcазoлiдин-2-oн целітÒ і залишок на фільтрі промивають СН2Сl2. До розчину біс(триметилсиліл)аміду натрію Шари фільтрату розділяють і водний шар (57мл, 1,0Μ у ТГФ, 57ммоль) у ТГФ (250мл) при екстрагують СН2Сl2. Об'єднані органічні екстракти 40°С додають по краплях протягом 15хв. розчин сушать з використанням Na2SO4 і концентрують. (4R)-4-бензил-3-(4,4,4-трифторбутаноїл)-1,3Флеш-хроматографія (елюент EtOAc-гексан, 1:9) оксазолідин-2-ону (15,60г, 51,78ммоль) у ТГФ дає (S)-N-[(3R)-метил-4,4,4-трифторбутиліден]-п(250мл). Через 1 годину додають йодметан (4,2мл, толуолсульфінамід (3,03г, 54%) у вигляді жовтого 67ммоль). Через 3 години реакційну суміш масла. нагрівають до -20°С протягом приблизно 20хв. Мас-спектр (-ESI): 276 (М-Н)-. Суміш гасять насиченим водним розчином 5. N-[(1S,2R)-1-Ціано-4,4,4-трифтор-2хлориду амонію (NH4CI) (300мл) і потім метилбутил]-4-метилбензолсульфінамід екстрагують EtOAc (2´300мл), сушать з До ціаніду діетилалюмінію (16мл, 1,0Μ у толуолі, 16ммоль) у ТГФ (40мл) при 0°С додають використанням Na2SO4 і концентрують. Флешізопропанол (ізо-PrOH) (840мкл, 11,0ммоль). Через хроматографія (елюент EtOAc-гексан, 1:9) дає 15хв. отриманий розчин додають до розчину (S)-N(4R)-4-бензил-3-[(2R)-4,4,4-трифтор-2[(3R)-мeтил-4,4,4-тpифтopбyтилiдeн]-пметилбутаноїл]-1,3-оксазолідин-2-он (12,04г, 74%) толуолсульфінаміду (3,03г, 10,9ммоль) у ТГФ у вигляді безбарвного масла. (60мл), охолодженому до -78°С. Через 15хв. [a]D25=-98,68° (c=1% розчин, ДМСО). реакційну суміш нагрівають до 25°С. Через 1 Мас-спектр (+ЕІ): 315 (М+Н)+. годину тонкошарова хроматографія (ТШХ, EtOAcАналіз. 31 82093 32 розбавляють ЕtOАс (100мл) і промивають 0,1н гексан, 1:9) показує, вихідна речовина витрачена. водною хлористоводневою кислотою (50мл) і Суміш охолоджують до -78°С і додають насичений розсолом (50мл). Водний шар екстрагують ЕtOАс водний розчин хлориду амонію (100мл). Отриману (50мл). Об'єднані органічні екстракти сушать з суспензію фільтрують через реагент целітÒ і використанням Na2SO4 і концентрують. Флешзалишок на фільтрі промивають ЕtOАс (100мл). хроматографія (елюент EtOAc-гексан, 3:7) дає 5Шари фільтрату розділяють і водний шар xiiop-N-[(1S,2R)-4,4,4-трифтор-1-(гідроксиметил)-2екстрагують EtOAc. Об'єднані органічні екстракти метилбутил]тіофен-2-сульфонамід (1,66г, 75%) у сушать з використанням Na2SO4 і концентрують. вигляді білої твердої речовини. Перекристалізація Неочищена суміш, яка, згідно 1H ЯМР, являє (EtOAc-гептан, 1:4) дає білі голки (1,39 г, вихід собою суміш діастереомерів 1:3, осаджують 84%), т.пл. 136-137°С. сумішшю діетиловий ефір/гексан і збирають Аналіз. продукт. Дві додаткові порції продукту отримують, Обчислено для C10H13ClF3NO3S2: С, 34,14; Η, повторюючи процедуру осадження з 3,72; Ν, 3,98. концентрованим фільтратом. N-[(1S,2R)-1-ЦіаноЗнайдено: С, 34,24; Η, 3,97; Ν, 3,87. С. 4,4,4-трифтор-2-метилбутил]-4Спосіб 3 метилбензолсульфінамід (2,34г, 70%) отримують у 1. (4S)-4-Бензил-3-(бромацетил)-1,3вигляді окремого діастереомеру. оксазолідин-2-он [a]D25=+35,46° (c=l% розчин, СНСI 3). До розчину S-(-)-4-бензил-2-оксазолідинону Мас-спектр (+ESI): 305 (М+Н)+. (20,0г, 112,86ммоль) у ТГФ (200мл) при -78°С Аналіз. додають по краплях 2,5Μ розчин н-BuLi у гексані Обчислено для C13H15F3N2O5: С, 51,31; Η, 4,97; (47,4мл, 118,51ммоль). Розчин перемішують при Ν, 9,20. 78°С протягом 30хв. і потім додають Знайдено: С, 51,16; Η, 4,96; Ν, 9,08. бромацетилбромід (25,0г, 10,81мл, 124,15ммоль). 6. Гідрохлорид 5,5,5-трифтор-L-алоізолейцину Розчин залишають нагріватися до 25°С на ніч (19 Суспензію N-[(1S,2R)-1-ціано-4,4,4-трифтор-2годин). Відбирають аліквоту, і ТШХ (EtOAc-гексан, метилбутил]-4-метилбензолсульфінаміду (2,34г, 1:2) показує, що реакція завершилася. Суміш 7,69ммоль) у концентрованій хлористоводневій розбавляють етилацетатом (200мл) і органічний кислоті (75мл) кип'ятять зі зворотним шар промивають насиченим водним розчином холодильником протягом 18,5 годин. Після NаНСО3 (2´50мл). Органічний шар сушать над охолодження до 25°С реакційну суміш декілька MgSO4, фільтрують і концентрують, отримуючи разів промивають діетиловим ефіром. Водний шар неочищене коричневе масло (34г). концентрують, отримуючи суміш 5,5,5-трифтор-LНеочищений продукт очищають флешалоізолейцину, NH4CI і толуол сульфонової хроматографією, елюент EtOAc-гексан, 1:4, кислоти (2,35г). Неочищену амінокислоту отримуючи (4S)-4-бензил-3-(бромацетил)-1,3використовують на наступній стадії без оксазолідин-2-он у вигляді безбарвного масла додаткового очищення. (33,2г, 98,6%). Мас-спектр (-ESI): 309 (М-Н)-. Мас-спектр (-ESI): 297 (М-Н)-. 7. (2S,3R)-2-Аміно-5,5,5-трифтор-32. Диметил-2-[(4S)-4-бензил-2-оксо-1,3метилпентан-1-ол оксазолідин-3-іл]-2-оксоетилфосфонат До розчину боргідриду літію (7,7мл, 2,0н у (4S)-4-Бензил-3-(бромацетил)-1,3-оксазолідинТГФ, 15ммоль) у ТГФ (20мл) при 0°С додають 2-он (33,0г, 110,68ммоль) і триетилфосфін хлортриметилсилан (3,9мл, 31ммоль). Реакційну (39,2мл, 33,2ммоль) нагрівають при 120°С суміш нагрівають до 25°С і через 30хв. додають по протягом 18 годин. Відбирають аліквоту, і ТШХ краплях до суспензії неочищеного гідрохлориду (EtOAc-гексан, 1:2) показує, що реакція амінокислоти (7,7ммоль) у ТГФ (60мл), завершилася. Реакційну суміш охолоджують до охолодженої до 0°С. Суміш нагрівають до 25°С і 25°С, розбавляють етилацетатом (200мл) і через 21 годину гасять метанолом (МеОН). Леткі органічний шар промивають насиченим водним речовини видаляють у вакуумі, отримуючи залишок, який розчиняють у приблизно 50мл розчином NaHCO3 (2´50мл). Органічний шар водного 1н розчину NaOH, екстрагують сушать над MgSO4, фільтрують і концентрують, отримуючи диметил-2-[(4S)-4-бензил-2-оксо-1,3хлороформом (СНСI 3) (4´75мл), сушать (Na2SO4) і оксазолідин-3-іл]-2-оксоетилфосфонат у вигляді концентрують, отримуючи (2S,3R)-2-аміно-5,5,5неочищеного жовтого масла (36г, 99,3%). трифтор-3-метилпентан-1-ол, у вигляді жовтого Мас-спектр (-ESI): 326 (М-Н)-. масла (1,07г, 81%). 3. (4S)-4-Бензил-3-[(2Е)-5,5,5-трифторпент-2Мас-спектр (+ESI): 172 (М+Н)+. еноїл]-1,3-оксазолідин-2-он 8. 5-Хлор-N-[(1S,2R)-4,4,4-трифтор-1До розчину диметил-2-[(4S)-4-бензил-2-оксо(гідроксиметил)-2-метилбутил]тіофен-21,3-оксазолідин-3-іл]-2-оксоетилфосфонату (36г, сульфонамід 109,97ммоль) у ТГФ (200мл) при -78°С додають До (2S,3R)-2-аміно-5,5,5-трифтор-3KHMDS (0,5М, 242мл, 120,97ммоль). Розчин метилпентан-1-олу (1,07г, 6,25ммоль) і залишають нагріватися до 25°С на 30хв. і при триетиламіну (0,87мл, 6,2ммоль) у СН2Сl2 (15мл) 20°С додають 3,3,3-трифторпропіональдегід при 0°С додають по краплях розчин 5-хлортіофен(13,55г, 120,97ммоль). Розчин залишають 2-сульфонілхлориду (1,34г, 6,25ммоль) в СН2Сl2 нагріватися до 25°С на ніч (19 годин). Відбирають (15мл). аліквоту, і ТШХ (EtOAc-гексан, 1:2) показує, що Реакційну суміш нагрівають до 25°С і реакція завершилася. Реакцію гасять, додаючи перемішують протягом 24 годин. Потім її 33 82093 34 112,05ммоль). Після 5-хвилинного витримування насичений водний розчин NaHCO3 (50мл). Водний при -78°С додають безводний ацетат калію (9,77г, шар промивають етилацетатом (3´100мл). 99,6ммоль). Баню для -78°С прибирають і Органічний шар сушать над MgSO4, фільтрують і реакційну суміш залишають нагріватися до 25°С концентрують, отримуючи світло-коричневе масло на ніч (19 годин). Реакційну суміш розбавляють (32,1г). Неочищений продукт очищають флешEtOAc (200мл) і органічну фазу промивають хроматографією, елюент EtOAc-гексан, 1:6, насиченим водним розчином одноосновного отримуючи (4S)-4-бензил-3-[(2Е)-5,5,5фосфату калію (2´100мл) і насиченим водним трифторпент-2-еноїл]-1,3-оксазолідин-2-он у розчином NaCl (100мл). Органічний шар сушать вигляді безбарвного масла (17,7г, 55,1%). над MgSO4, фільтрують і концентрують, Мас-спектр (-ESI): 312 (М-Н)-. отримуючи жовте масло (9,5г). Неочищений Аналіз. продукт очищають флеш-хроматографією, елюент Обчислено для C15H14NF3O3: С, 57,51; Н, 4,50; EtOAc-гексан, 1:4, отримуючи (S)-3-[(2S,3R)-2N, 4,47. азидо-5,5,5-трифтор-3-метилпентаноїл]-4-бензилЗнайдено: С, 57,05; Н, 4,75; N, 4,52. 1,3-оксазолідин-2-он у вигляді безбарвного масла 4. (4S)-4-Бензил-3-[(3S)-5,5,5-трифтор-3(7,2г, 73,7%). метилпентаноїл]-1,3-оксазолідин-2-он Мас-спектр (-ESI): 342 (M-N2)-. Завись комплексу бромід міді(І)6. (2S,3R)-2-Азидо-5,5,5-трифтор-3диметилсульфід (9,45г, 45,96ммоль) у ТГФ (200мл) метилпентанова кислота і диметилсульфіді (100мл) як співрозчиннику До розчину (S)-3-[(2S,3R)-2-азидо-5,5,5охолоджують до -40°С і додають по краплях трифтор-3-метилпентаноїл]-4-бензил-1,3протягом 10хв. метилмагнійбромід (30,64мл, оксазолідин-2-ону (7,2г, 19,44ммоль) у ТГФ:Н2О 91,93ммоль). Суспензію перемішують протягом (3:1, 120мл) в атмосфері N2 при 0°С додають 40хв., нагріваючи до -15°С. Зеленувату суспензію моногідрат гідроксиду літію (LiOH) (1,63г, охолоджують до -40°С і при -40°С додають по 38,88ммоль). Реакцію контролюють методом ТШХ краплях розчин (4S)-4-бензил-3-[(2Е)-5,5,5(EtOAc/гексан, 1:2). Через 3 години додають трифторпент-2-еноїл]-1,3-оксазолідин-2-ону (12г, твердий КаНСО3 (6,0г). Суспензію розбавляють 38,30ммоль) у ТГФ (15мл). Реакційну суміш насиченим водним розчином NaHCO3 (20мл) і Н2О залишають нагріватися до 25°С на ніч (18 годин). Реакцію гасять насиченим водним розчином NH4CI (40мл) і екстрагують EtOAc (3´100мл). Органічний (20мл). Утворюється осад. Його відфільтровують, шар екстрагують насиченим водним розчином маточну рідину розбавляють EtOAc (250мл) і NaHCO3 (20мл). EtOAc містить допоміжну хіральну органічний шар промивають насиченим водним речовину, і його відкидають. Об'єднані шари розчином хлориду натрію (NaCl, 100мл). NaHCO3 підкислюють до рН менше 2. Підкислений Органічний шар сушать над MgSO4, фільтрують і водний шар екстрагують ЕЮ Ас (3´100мл). концентрують, отримуючи неочищену напівтверду Органічний шар сушать над MgSO4, фільтрують і речовина. Неочищена напівтверда речовина не концентрують, отримуючи (2S,3R)-2-азидо-5,5,5розчиняється в СН2Сl2, МеОН і EtOAc і частково трифтор-3-метилпентанову кислоту у вигляді розчиняється у диметилсульфоксиді (ДМСО). жовтого масла (3,2г, 98%). Неочищений продукт обробляють 1н HCI (100мл) і Мас-спектр (-ESI): 183 (M-N2)-. водний шар промивають EtOAc (2´150мл). 7. 5,5,5-Трифтор-L-алоізолейцин Органічний шар сушать над MgSO4, фільтрують і (2S,3R)-2-Азидо-5,5,5-трифтор-3концентрують, отримуючи жовте масло (12,1г). метилпентанову кислоту (3,2г, 17,27ммоль), 10% Неочищений продукт очищують флешпаладій-на-вуглеці (0,79г), льодяну оцтову кислоту хроматографією, елюент EtOAc-гексан, 1:4, (37мл) і воду (90мл) вміщують в гідрогенізатор отримуючи (4S)-4-бензил-3-[(3S)-5,5,5-трифтор-3Пара в атмосфері водню (40ф/д2) і струшують. метилпентаноїл]-1,3-оксазолідин-2-он у вигляді Через 20 годин реакційну суміш фільтрують через безбарвного масла (8,2г, 67,8%). шар целітуÒ, який ретельно був промитий водою Мас-спектр (+ESI): 330 (М+Н)+. (20мл). Фільтрат концентрують при зниженому Аналіз. тиску, отримуючи білу тверду речовину. Тверду Обчислено для C16H18NF3O3: С, 58,36; Η, 5,51; речовину розтирають з EtOAc (200мл), Ν, 4,25. відфільтровують і ще раз промивають EtOAc Знайдено: С, 58,36; Η, 5,70; Ν, 4,19. (200мл), потім сушать на повітрі, отримуючи 5,5,55. (S)-3-[(2S,3R)-2-Азидо-5,5,5-трифтор-3трифтор-L-алоізолейцин у вигляді білої твердої метилпентаноїл]-4-бензил-1,3-оксазолідин-2-он речовини (2,7г, 96%). Розчин (4S)-4-бензил-3-[(3S)-5,5,5-трифтор-3Мас-спектр (-ESI): 184 (М-Н)-. метилпентаноїл]-1,3-оксазолідин-2-ону (8,2г, Аналіз. 24,90ммоль) у ТГФ (100мл) охолоджують до -78°С Обчислено для C6H10NF3O2+0,12HCl: С, 38,13; і додають по краплях протягом 10хв. KHMDS Η, 5,50; Ν, 6,94. (калійгексаметилдисилазан, 59,7мл, 29,88ммоль). Знайдено: С, 38,03; Η, 5,38; Ν, 7,39. Після перемішування при -78°С протягом 1 години 8. (2S,3R)-2-Аміно-5,5,5-трифтор-3через канюлю додають протягом 10хв. заздалегідь метилпентан-1-ол охолоджений (-78°С, 50хв.) розчин 2,4,6До розчину боргідриду літію (14,5мл 2М триізопропілбензолсульфонілазиду (10,1г, розчину у ТГФ, 29ммоль) при перемішуванні при 32,37ммоль). Після додаткової 10-хвилинного 0°С додають по краплях протягом 30хв. витримування при -78°С через лійку додають в хлортриметилсилан (7,38мл, 58ммоль). Льодяну один прийом льодяну оцтову кислоту (6,7мл, баню прибирають і отриману суспензію 35 82093 36 Аналіз. перемішують при 25°С протягом 30хв. Реакційну Обчислено для C10H13ClF3NO3S2: С, 34,14; Η, суміш охолоджують до 0°С і додають по частинах 3,72; Ν, 3,98. протягом 15хв. 5,5,5-трифтор-L-алоізолейцин Знайдено: С, 34,44; Η, 3,70; Ν, 3,74. (2,7г, 16,98ммоль) у вигляді твердої речовини. При порівняльному дослідженні сполуки Реакційну суміш залишають нагріватися до 25°С даного прикладу і подібної сполуки, яка не містить на бані з льодом, що тане. Після 3-добового трифторметильні групи і відмінної стереохімією витримування при 25°С реакційну суміш відносно центру С-2, але ідентичної в інших охолоджують до 0°С і обережно протягом 30хв. відношеннях, сполука даного прикладу додають метанол (22мл). Розчин перемішують при демонструє істотно більш тривалу метаболічну 25°С ще протягом 40хв. і потім концентрують при стабільність (період напіввиведення -193 хвилин зниженому тиску на водяній бані при 60°С. проти 12,7 хвилин) в аналізі метаболізму фази І на Отриману завись підлуговують 20% розчином мікросомах печінки щура. гідроксиду натрію (10мл). Додають воду (10мл) і При порівняльному дослідженні сполуки весь водний шар екстрагують метиленхлоридом даного прикладу і відповідного аналога, (100мл) і екстракт сушать над MgSO4. Органічну позбавленого трифторметильних груп, сполука фазу фільтрують і упарюють, отримуючи (2S,3R)даного прикладу демонструє істотно більшу 2-аміно-5,5,5-трифтор-3-метилпентан-1-ол у метаболічну стабільність в аналізі фази 1 і 2 вигляді неочищеного масла (2,6г, 89,6%). метаболізму на мікросомах печінки щура (період Мас-спектр (-ESI): 170 (М-Н)-. напіввиведення 14хв. проти 2хв.), миші (період 9. 5-Хлор-N-[(1S,2R)-4,4,4-трифтор-1напіввиведення 10хв. проти 2хв.), людини (період (гідроксиметил)-2-метилбутил]тіофен-2напіввиведення 22хв. проти 13хв.) і собаки (31хв. сульфонамід проти 4хв.). До розчину (2S,3R)-2-аміно-5,5,5-трифтор-3Таким чином, сполука винаходу залишається в метилпентан-1-олу (2,6г, 15,18ммоль) і кровотоці більш тривалий час, ніж його відповідні триетиламіну (4,2мл, 30,38ммоль) в аналоги без CF3, причому зростає її біологічна метиленхлориді (50мл), охолодженому до 0°С, при доступність. перемішуванні додають по краплях розчин 5Приклад 2 хлортіофен-2-сульфонілхлориду (4,8г, 5-Хлор-N-[(1S,2R)-2-етил-4,4,4-трифтор-118,22ммоль) в метиленхлориді (5мл). Через 15хв. (гідроксиметил)бутил]тіофен-2-сульфонамід льодяну баню прибирають і реакційну суміш А. Спосіб 1 залишають досягати 25°С на ніч. Реакцію гасять, 1. (4S)-4-Бензил-3-[(3S)-3-етил-5,5,5виливаючи в насичений розчин бікарбонату натрію трифторпентаноїл]-1,3-оксазолідин-2-он (25мл) і додаючи метиленхлорид (150мл). Завись комплексу бромід міді(І)Органічну фазу відділяють, послідовно диметилсульфід (1,26г, 6,13ммоль) у ТГФ (20мл) і промивають 1н водною хлористоводневою диметилсульфіді (10мл) як співрозчиннику кислотою, Н2О і розсолом і сушать над MgSO4. охолоджують до -40°С і додають по краплях Органічну фазу фільтрують і упарюють, протягом 10хв. етилмагнійбромід (3М розчин в отримуючи неочищене масло (6,1г), яке очищують діетиловому ефірі, 4,08мл, 12,26ммоль). Завись флеш-хроматографією, використовуючи як елюент перемішують протягом 40хв., нагріваючи її до суміш етилацетат-гексан, 1:6. Отримують вказану 15°С. Зеленувату завись охолоджують до -40°С і у заголовку сполуку 5-xnop-N-[(1S,2R)-4,4,4при -40°С додають по краплях розчин (4S)-4трифтор-1-(гідроксиметил)-2-метилбутил]тіофен-2бензил-3-[(2Е)-5,5,5-трифторпент-2-еноїл]-1,3сульфонамід у вигляді білої аморфної твердої оксазолідин-2-ону (отриманого, як у прикладі 1, речовини (5,15г, 96,4%). Продукт містить домішки. спосіб 3, частина С) (1,6г, 5,10ммоль) у ТГФ (5мл). Білу аморфну тверду речовину додатково Реакційну суміш залишають нагріватися до 25°С очищають перекристалізацією з суміші EtOAcна ніч (18год.). Реакцію гасять насиченим водним гептан, 1:4. Суміш розчинників додають до 5-хлоррозчином NH4CI (20мл). Утворюється осад, який N-[(1S,2R)-4,4,4-трифтор-1-(гідроксиметил)-2відфільтровують. Маточну рідину розбавляють метилбутил]тіофен-2-сульфонаміду, нагрівають EtOAc (250мл) і органічний екстракт промивають для отримання розчину, залишають насиченим водним розчином NaCl (100мл). охолоджуватися до 25°С на 3 години і потім Органічний екстракт сушать над MgSO4, зберігають при 0°С протягом 19 годин. Білу фільтрують і концентрують, отримуючи неочищену кристалічну речовину, що випала в осад, напівтверду речовину. Неочищена напівтверда відфільтровують, промивають охолодженим на речовина не розчиняється в СН3СI 2, МеОН або льоді гептаном, отримуючи білу кристалічну EtOAc, але частково розчиняється в ДМСО. тверду речовину (2,7г, 40,9%). Перекристалізована Неочищений продукт обробляють 1н HCI (100мл) речовина все ще містить домішки. Білу тверду речовину (2,7г) додатково очищують та водний розчин промивають EtOAc (2´150мл). препаративною хіральною ВЕРХ [SFC, AD, Органічний шар сушать над MgSO4, фільтрують і концентрують, отримуючи жовте масло (1,41г). 25´0,46см; рухома фаза гексан-ізо-PrOH, 8:2 Неочищений продукт очищують флеш(1мл/хв.)], отримуючи 5-хлор-N-[(1S,2R)-4,4,4хроматографією, елюент EtOAc-гексан, 1:4, трифтор-1-(гідроксиметил)-2-метилбутил]тіофен-2отримуючи (4S)-4-бензил-3-[(3S)-3-етил-5,5,5сульфонамід у вигляді білої кристалічної твердої трифторпентаноїл]-1,3-оксазолідин-2-он у вигляді речовини, т.пл. 132-133°С (0,93г, 14,1%, хіральна безбарвного масла (0,96г, 55%). чистота 100%, аналітична чистота 100%). Мас-спектр (+ESI): 344 (М+Н)+. Мас-спектр (-ESI): 350 (М-Н)-. 37 82093 38 утворився через 5 годин, відфільтровують, Аналіз. органічний розчинник сушать над MgSO4, Обчислено для C17H20NF3O3: С, 59,47; Η, 5,87; фільтрують і концентрують, отримуючи (2S,3R)-2Ν, 4,08. аміно-3-етил-5,5,5-трифторпентан-1-ол у вигляді Знайдено: С, 59,58; Η, 5,91; Ν, 4,03. неочищеного масла (120мг, 96%). Мас-спектр 2. (S)-3-[(2S,3R)-2-Азидо-3-етил-5,5,5(+ESI): 186 (М+Н)+. трифторпентаноїл]-4-бензил-1,3-оксазолідин-2-он 5. 5-Хлор-N-[(1S,2R)-2-етил-4,4,4-трифтор-1До розчину (4S)-4-бензил-3-[(3S)-3-етил-5,5,5(гідроксиметил)бутил]тіофен-2-сульфонамід трифторпентаноїл]-1,3-оксазолідин-2-ону (0,9г, До розчину (2S,3R)-2-аміно-3-етил-5,5,52,62ммоль) у ТГФ (10мл), охолодженому до -78°С, трифторпентан-1-олу (120мг, 0,701ммоль) і додають по краплях протягом 10хв. KHMDS (0,5Μ триетиламіну (0,1мл, 1,4ммоль) в метиленхлориді розчин у толуолі, 6,3мл, 3,14ммоль). Після (50мл), охолодженому до 0°С, при перемішуванні перемішування при -78°С протягом 1 години через додають по краплям розчин 5-хлортіофен-2канюлю додають протягом 10хв. заздалегідь сульфонілхлориду (220мг, 0,841ммоль) у охолоджений (-78°С, 50хв.) розчин 2,4,6метиленхлориді (5мл). Через 15хв. льодяну баню триізопропілбензолсульфонілазиду (1,04г, прибирають і реакційну суміш залишають досягати 3,38ммоль) в 20мл ТГФ. Після додаткової 1025°С на ніч. Додатково додають метиленхлорид хвилинного витримування при -78°С через лійку (15мл) і реакційну суміш виливають у насичений додають в один прийом льодяну оцтову кислоту розчин бікарбонату натрію (25мл). Органічну фазу (0,7мл, 11,79ммоль). Після 5-хвилинного відділяють і послідовно промивають 1н витримування при -78°С додають безводний хлористоводневою кислотою, Н2О і розсолом і ацетат калію (1,07г, 10,48ммоль). Баню для -78°С сушать над MgSO4. Органічну фазу фільтрують і прибирають і реакційну суміш залишають упарюють, отримуючи неочищене масло (0,36г), нагріватися до 25°С на ніч (19 годин). Реакційну яке очищують флеш-хроматографією з суміш розбавляють EtOAc (200мл) і промивають використанням як елюенту суміші етилацетатнасиченим водним розчином одноосновного гексан, 1:4. Отримують вказану у заголовку фосфату калію (2´100мл) і насиченим водним сполуку 5-хлор-Н-[(1S,2R)-2-етил-4,4,4-трифтор-1розчином NaCl (100мл). Органічний шар сушать (гідроксиметил)бутил]тіофен-2-сульфонамід у над MgSO4, фільтрують і концентрують, вигляді масла (125мг, 53%). Масло (125мг) отримуючи жовте масло (1,09г). Неочищений додатково очищують препаративною хіральною продукт очищають флеш-хроматографією, елюент ВЕРХ [SFC, AD, 25´0,46см; рухома фаза гексанEtOAc-гексан, 1:4, отримуючи (S)-3-[(2S,3R)-2іра, 8:2 (1мл/хв.)], отримуючи 5-хлор-N-[(1S,2R)-2азидо-3-етил-5,5,5-трифторпентаноїл]-4-бензилетил-4,4,4-трифтор-11,3-оксазолідин-2-он у вигляді безбарвного масла (гідроксиметил)бутил]тіофен-2-сульфонамід у (0,587г, 59%). вигляді білої кристалічної твердої речовини (0,15г, Мас-спектр (-ESI): 357 (M-N2)-. 6,4%, хіральна чистота 100%, аналітична чистота 3. (2S,3R)-2-Азидо-3-етил-5,5,5100%). трифторпентанова кислота Мас-спектр (-ESI): 364 (М-Н)-. До розчину (S)-3-[(2S,3R)-2-азидо-3-етил-5,5,5Аналіз. трифторпентаноїл]-4-бензил-1,3-оксазолідин-2-ону Обчислено для C11H15NClF3O3S2+0,24C4H8O2: (287мг, 0,746ммоль) у ТГФ:Н2О (3:1, 4мл) в С, 37,50; Η, 4,08; Ν, 3,73. атмосфері N2 при 0°С додають моногідрат LiOH Знайдено: С, 37,12; Η, 4,41; Ν, 3,62. (62,66мг, 1,49ммоль). Реакцію контролюють В. Спосіб 2 методом ТШХ (EtOAc/гексан, 1:2). Через 3 години 1. 2-Етил-4,4,4-трифтормасляна кислота додають твердий NaHCO3 (1,0г). Завись Розчин діізопропіламіну (17,1г, 169ммоль) у розбавляють насиченим водним розчином ТГФ (180мл) перемішують в атмосфері азоту при NaHCO3 (2мл) і Н2О (4мл) і екстрагують ЕtOАс 0°С. Додають по краплях протягом 15хв. 2,5Μ (3´50мл). Органічний шар екстрагують насиченим розчин н-бутилітію (н-BuLi, 67,6мл) у гексані і водним розчином NaHCO3 (10мл). EtOAc містить отриманий розчин перемішують протягом 0,5 допоміжну хіральну речовину, і його відкидають. годин при 0°С. По закінченні вказаного періоду Об'єднані водні екстракти підкислюють до рН реакційну суміш охолоджують до -78°С і протягом менше 2, екстрагують EtOAc (3´50мл), екстракт 0,5 години додають по краплях розчин 4,4,4сушать над MgSO4, фільтрують і концентрують, трифтормасляної кислоти (10,0г, 70,4ммоль) у ТГФ отримуючи (2S,3R)-2-азидо-3-етил-5,5,5(20мл). Отриманий розчин додатково перемішують трифторпентанову кислоту у вигляді жовтого протягом 0,5 години при -78°С. По закінченні масла (130мг, 94%). вказаного періоду додають по краплях протягом Мас-спектр (-ESI): 197 (M-N2)-. 15хв. етилйодид (6,19мл, 77,4ммоль). Отриманий 4. (2S,3R)-2-Аміно-3-етил-5,5,5розчин перемішують протягом 15хв. при -78°С і трифторпентан-1-ол потім нагрівають до 25°С протягом 24 годин. По До сірої зависі алюмогідриду літію (LAH, закінченні вказаного періоду реакційну суміш 110,6мг, 2,91ммоль) у ТГФ (2мл) при 0°С додають гасять, додаючи поступово Н2О (-20мл). Після по краплях протягом 5хв. (2S,3R)-2 азидо-3-етилконцентрування залишок підкислюють до рН 1 2н 5,5,5-трифторпентанову кислоту (130мг, хлористоводневою кислотою і потім екстрагують 0,583ммоль). Отриману завись залишають Et2O (400мл). Потім органічний шар сушать з нагріватися до 25°С на 19 годин. Реакцію гасять, використанням MgSO4. Після концентрування додаючи послідовно при 0°С Н2О (0,5мл), 1н отриманий залишок використовують розчин NaOH (1,5мл) і Н2О (0,5мл). Білий осад, що 39 82093 40 Розчин 5-(1-етил-3,3,3безпосередньо в наступній реакції без додаткового трифторпропіл)імідазолідин-2,4-діону (1,76г, очищення. 7,85ммоль) в 20мл водного розчину NaOH (1,26г, 2. 2-Етил-4,4,4-трифторбутанол 31,4ммоль) нагрівають мікрохвильовим Розчин LAH (2,74г, 72,3ммоль) в Et2O (230мл) опроміненням у герметично закритому флаконі перемішують в атмосфері азоту при 0°С. Додають протягом 0,5год. (умови мікрохвильового по краплях розчин 2-етил-4,4,4-трифтормасляної опромінення: 15хв. при приблизно 100% кислоти (12,3г, 72,3ммоль) в Et2O (20мл), розчин потужності, 150°С, 50ф/д2; потім 5хв. при 0% перемішують протягом 15хв. при 0°С і потім 2 потужності; потім 15хв. при приблизно 100% години при 25°С. По закінченні вказаного періоду потужності, 150°С, 50ф/д2). Після охолодження до розчин гасять, додаючи по краплях Н2О (2,74мл), 25°С воду і аміак видаляють з реакційної суміші у 15% розчин NaOH (2,74мл) і Н2О (8,22мл) при вакуумі і отриману неочищену суміш натрієвої солі енергійному перемішуванні. Додають твердий амінокислоти розчиняють в Н2О (15мл). До Na2SO4 для того, щоб осушити розчинник, і отриманого розчину при 0°С додають ТГФ (25мл) і отриману суміш перемішують протягом 1 години. потім додають по краплях розчин 5-хлортіофен-2Отриману завись фільтрують і залишок на фільтрі сульфонілхлориду (1,87г, 8,64ммоль) у ТГФ (5мл). промивають надлишком Et2O. Після Після витримування протягом 18 годин при 25°С концентрування неочищений продукт очищають на реакційну суміш концентрують і залишок хроматографі Biotage FlashÔ 40, елюент Et2O:PE підкислюють до рН 1 2н хлористоводневою від 20:80 до 30:70, отримуючи 2-етил-4,4,4кислотою. Отриманий водний шар екстрагують трифторбутанол у вигляді масла (6,18г, вихід 55% Et2O (2´100мл) і отриманий органічний шар для двох стадій). промивають розсолом (20мл) і сушать з 3. 2-Етил-4,4,4-трифтормасляний альдегід використанням MgSO4. Після концентрування Розчин 2-етил-4,4,4-трифторбутанолу (6,18г, неочищений залишок перекристалізовують з 39,6ммоль) в СН2Сl2 (50мл) перемішують в суміші EtOAc:гексан для видалення побічних атмосфері азоту при 0°С. Додають в один прийом продуктів. Концентрування фільтрату дає продукт реагент Деса-Мартіна періодинан (20,16г, у вигляді твердої речовини (1,31г, 44%). 47,5ммоль) і розчин перемішують протягом 1 Мас-спектр (+ESI): 380 (М+Н)+ і (-ESI): 378 (Мгодини при 0°С. Після додаткового перемішування Н) . протягом 5 годин при 25°С реакція завершується, 6. 5'-Xлop-N-[(1S,2R)-2-eтил-4,4,4-тpифтop-1за даними ЯМР. Розчин розбавляють Et2O (100мл) (гiдpoкcимeтил)бyтил]тioфeн-2'-сульфонамід і до отриманого розчину додають Na2S2O3 (55г) у Розчин 2-[(5'-хлор-2'-тієніл)сульфоніламіно]-3насиченому водному розчині NaHCO3 (100мл). етил-5,5,5-трифторпентанової кислоти (2,19г, Отриману суміш перемішують протягом 0,5 годин. 5,77ммоль) у ТГФ (60мл) перемішують в Шари рідин розділяють, органічний шар додатково атмосфері азоту при 25°С. Додають по краплях промивають насиченим водним розчином NaHCO3 1,0М розчин комплексу боран-ТГФ у ТГФ (23,1мл) і (50мл) і розсолом (50мл) і потім сушать з отриманий розчин перемішують протягом 18 годин використанням Na2SO4. Велику частину при 25°С. По закінченні вказаного періоду реакція розчинника видаляють перегонкою з завершується, за даними ТШХ (МеОН:СНСl3, використанням колонки Вігре (колбу нагрівають 10:90). Реакційну суміш гасять, додаючи поступово при температурі від приблизно 50 до приблизно 10% оцтову кислоту (НОАс) в МеОН (80мл). Після 55°С і температура насадки становить приблизно концентрування залишок розчиняють в EtOAc 38°С). Отриманий залишок у реакційній колбі (200мл), промивають насиченим водним розчином використовують безпосередньо в наступній реакції без додаткового очищення (альдегід дуже леткий). NaHCO3 (3´20мл) і розсолом (20мл) і потім розчин 4. 5-(1-Етил-3,3,3-трифторпропіл)імідазолідинсушать з використанням Na2SO4. Після 2,4-діон концентрування неочищений продукт (2,20г) Розчин неочищеного 2-етил-4,4,4очищують за допомогою хроматографічної трифтормасляного альдегіду (6,10г, 39,6ммоль) в системи Biotage FlashÔ 40, елюент EtOAc:РЕ від Н2О (100мл) перемішують при 0°С. До отриманого 20:80 до 30:70, отримуючи одну з двох пар розчину додають ціанід натрію (5,82г, 119ммоль), рацемічних сумішей (0,623г). Потім отриману карбонат амонію (15,2г, 158ммоль) і EtOH (100мл). сполуку очищують додатково з використанням Реакційну суміш нагрівають при 90°С протягом 3 умов хіральної ВЕРХ (колонка з ChiracelÔ AD; діб. Після охолодження до 25°С і концентрування 25´2,2см, 254нм вприски 0,5мл; рухома фаза: отриманий залишок підкислюють до рН від 25мл/хв., 12% MeCN в гексані; продукт відповідає приблизно 1 до приблизно 2 концентрованою HCI. піку один, Rf=6,7, чистота >99,9%), отримуючи Тверду речовину, що утворилася, енантіомерно чистий 5'-хлop-N-[(1S,2R)-2-eтилвідфільтровують, промивають 2н HCI і надлишком 4,4,4-трифтор-1-(гідроксиметил)бутил]тіофен-2'Н2О і потім сушать протягом ночі з вакуумним сульфонамід у вигляді білої твердої речовини, насосом, отримуючи 5-(1-етил-3,3,3т.пл. 128-129°С (0,238г, вихід 45% для конкретного трифторпропіл)імідазолідин-2,4-діон (2,74г, вихід енантіомеру). 31% для двох стадій). Мас-спектр (-ESI): 364 (М-Н)-. + Мас-спектр (+ESI): 225 (М+Н) і (-ESI): 223 (МАналіз. Н)-. Обчислено для C11H15ClF3NO3S2: С, 36,12; Η, 5. 2-[(5'-Хлор-2'-тієніл)сульфоніламіно]-3-етил4,13; Ν, 3,83. 5,5,5-трифторпентанова кислота Знайдено: С, 36,22; Η, 4,20; Ν, 3,78. Приклад 3 41 82093 42 поступово 10% НОАс в МеОН (23мл). Після 5'-Хлор-N-[(1S,2R)-2-етил-4,4,4-трифтор-1-(1концентрування залишок розчиняють в Et2O гідроксіетил)бутил]тіофен-2'-сульфонамід (200мл), промивають насиченим водним розчином А. 5'-Хлор-N-[(1S,2R)-2-етил-4,4,4-трифтор-1(форміл)бутил]тюфен-2'-сульфонамід NаНСО3 (3´20мл) і розсолом (20мл) і потім сушать Розчин 5'-хлор-N-[(1S,2R)-2-етил-4,4,4з використанням Na2SO4. Після концентрування трифтор-1-(гідроксиметил)бутил]тіофен-2'отриманий залишок використовують сульфонаміду (отриманого, як у прикладі 2, 0,100г, безпосередньо в наступній реакції без додаткового 0,273ммоль) в СН2Сl2 (4мл) перемішують в очищення. атмосфері азоту при 0°С. Додають в один прийом В. 5'-Хлор-N-[3,3,3-трифтор-2-(трифторметил)реагент Деса-Мартіна періодинан (0,151г, 1-(гідроксиметил)пропіл]тіофен-2'-сульфонамід 0,355ммоль) і розчин перемішують протягом 1 Розчин 3,3,3-трифтор-2-(трифторметил)-1години при 0°С. Після додаткового перемішування (гідроксиметил)пропіламіну (0,400г, 1,89ммоль) в протягом 1 години при 25°С реакція завершується, СН2СI 2 (20мл) перемішують в атмосфері азоту при за даними ТШХ (EtOAc:РЕ, 30:70). Розчин 0°С. Додають по краплях триетиламін (Et3N, розбавляють Et2O (50мл) і до отриманого розчину 0,369мл, 2,65ммоль), потім в один прийом 5додають Na2S2O3 (0,363г) у насиченому водному хлортіофен-2-сульфонілхлорид (0,492г, розчині NaHCO3 (10мл). Отриману суміш 2,27ммоль) і отриманий розчин перемішують перемішують протягом 0,5 годин. Шари рідин протягом 18 годин при 25°С. По закінченні розділяють, органічний шар додатково вказаного періоду реакція завершується, за промивають насиченим водним розчином NaHCO3 даними ТШХ (EtOAc:PE, 30:70). Після гасіння (5мл) і розсолом (5мл) і потім сушать (Na2SO4). МеОН і концентрування залишок розчиняють в Після концентрування неочищений продукт Et2O (200мл), промивають 1н водною очищають препаративною хроматографією на хлористоводневою кислотою (20мл), насиченим пластинах, елюент EtOAc:РЕ, 30:70, отримуючи 5'водним розчином NaHCO3 (20мл) і розсолом хлор-N-[(1S,2R)-2-етил-4,4,4-трифтор-1(20мл) і потім сушать (MgSO4). Після (форміл)бутил]тіофен-2'-сульфонамід у вигляді концентрування неочищений продукт (2,20г) твердої речовини (0,036г, 36%). очищують за допомогою хроматографічної В. 5'-Хлор-N-[(1S,2R)-2-етил-4,4,4-трифтор-1системи Biotage FlashÔ 40, елюент EtOAc:РЕ від (1-гірдроксіетил)бутил]тіофен-2'-сульфонамід 10:90 до 30:70, отримуючи 5'-хлор-г4-[3,3,3Розчин 5'-хлор-N-[(1S,2R)-2-етил-4,4,4трифтор-2-(трифторметил)-1трифтор-1-(форміл)бутил]тіофен-2'-сульфонаміду (гідроксиметил)пропіл]тіофен-2'-сульфонамід у (0,035г, 0,0962ммоль) у ТГФ (3мл) перемішують в вигляді не зовсім білої твердої речовини (0,108г, атмосфері азоту при 0°С. Додають по краплях вихід 14% для двох стадій, рацемічна суміш). 1,4Μ розчин (0,206мл) метилмагнійброміду в Мас-спектр (-ESI): 390 (М-Н)-. суміші толуол:ТГФ і отриманий розчин Аналіз. перемішують протягом 1 години при 25°С. По Обчислено для C9H8CIF6NO3S2: С, 27,59; Η, закінченні вказаного періоду реакція 2,06; Ν, 3,58. завершується, за даними ТШХ (EtOAc:РЕ, 30:70). Знайдено: С, 28,24; Η, 1,90; Ν, 3,48. Розчин гасять насиченим водним розчином NH4CI Приклад 5 (2мл) і екстрагують Et2O (20мл). Органічний шар 5'-Хлор-N-[3,3,3-трифтор-2-(трифторметил)-1промивають розсолом (3мл) і потім сушать з S-(гідроксиметил)пропіл]тіофен-2'-сульфонамід використанням Na2SO4. Після концентрування А. Метил-2-аміно-3-(трифторметил)-4,4,4неочищений продукт очищають препаративною трифторбутаноат хроматографією на пластинах, елюент EtOAc:РЕ, Розчин 4,4,4,4',4',4'-гексафтор-DL-валіну 30:70, отримуючи 5'-хлор-N-[(1S,2R)-2-етил-4,4,4(2,00г, 8,89ммоль) у суміші СН2СI 2:МеOН (4:1, трифтор-1-(1-гідроксіетил)бутил]тіофен-2'50мл) перемішують в атмосфері азоту при 0°С. сульфонамід у вигляді не зовсім білої твердої Додають по краплях 2,0М розчин речовини (0,027г, 73%). тетраметилсилану (ТМS)-діазометану в гексані Мас-спектр (-ESI): 378 (М-Н) . (5,33мл) і отриманий розчин перемішують Аналіз. протягом 3 годин при 25°С. По закінченні Обчислено для C12H17CIF3NO3S2: С, 37,94; Η, вказаного періоду реакція завершується, за 4,51; Ν, 3,69. даними ТШХ (10% МеОН:хлороформ). Після Знайдено: С, 38,35; Η, 4,32; Ν, 3,29. концентрування отриманий залишок Приклад 4 використовують безпосередньо в наступній реакції 5'-Хлор-N-[3,3,3-трифтор-2-(трифторметил)-1без додаткового очищення. (гідроксиметил)пропіл]тіофен-2'-сульфонамід B. Метил-2-[(5'-хлор-2'-тієніл)сульфоніламіно]А. 3,3,3-Трифтор-2-(трифторметил)-13-трифторметил-4,4,4-трифторбутаноат (гідроксиметил)пропіламін Розчин метил-2-аміно-3-(трифторметил)-4,4,4Розчин 4,4,4,4',4',4'-гексафтор-DL-валіну трифторбутаноату (1,34г, 5,60ммоль) в СН2СI 2 (0,500г, 2,22ммоль) у ТГФ (20мл) перемішують в (10мл) перемішують в атмосфері азоту при 25°С. атмосфері азоту при 25°С. Додають по краплях Додають по краплях піридин (10мл, 126ммоль), 1,0М розчин комплексу боран-ТГФ у ТГФ (6,66мл) і потім в один прийом 5-хлортіофен-2отриманий розчин перемішують протягом 4 годин сульфонілхлорид (1,82г, 8,40ммоль) і отриманий при 25°С. По закінченні вказаного періоду реакція розчин перемішують протягом 72 годин при 25°С. завершується, за даними ТШХ (EtOAc:EtOH:Н2О, По закінченні вказаного періоду реакція 10:2:1). Реакційну суміш гасять, додаючи завершується, за даними ТШХ (EtOAc:РЕ, 20:80). 43 82093 44 A. (4R)-4-Бензил-3-(бромацетил)-1,3Після гасіння Н2О суміш розбавлюють Et2O оксазолідин-2-он (200мл). Органічний шар промивають 1н водною До розчину R-(-)-4-бензил-2-оксазолідинону хлористоводневою кислотою (20мл), насиченим (15,0г, 84,65ммоль) у ТГФ (200мл) при -78°С водним розчином NaHCO3 (20мл) і розсолом додають по краплях 2,5Μ розчин н-BuLi в гексані (20мл) і потім сушать (MgSO4). Після (34мл, 84,65ммоль). Розчин перемішують при концентрування неочищений продукт очищають за 78°С протягом 30хв. і потім додають допомогою хроматографічної системи Biotage бромацетилбромід (18,65г, 7,8мл, 124,15ммоль). FlashÔ 40, елюент EtOAc:PE від 5:95 до 25:75, Розчин залишають нагріватися до 25°С на ніч (19 отримуючи метил-2-[(5'-хлор-2'годин). Відбирають аліквоту, і ТШХ (EtOAc-гексан, тієніл)сульфоніламіно]-3-трифторметил-4,4,41:2) показує, що реакція завершилася. Суміш трифторбутаноат у вигляді твердої речовини розбавляють етилацетатом (200мл) і органічний (1,61г, 69%). шар промивають насиченим водним розчином Мас-спектр (-ESI): 418 (М-Н)-. NаНСО3 (2´50мл). Органічний шар сушать над C. 5'-Хлор-N-[3,3,3-трифтор-2-(трифторметил)MgSO4, фільтрують і концентрують, отримуючи 1-S-(гідроксиметил)пропіл]тіофен-2'-сульфонамід неочищене коричневе масло (24,6г). Неочищений Завись LAH (0,146г, 3,84ммоль) в Et2O (17мл) продукт очищають флеш-хроматографією, елюент перемішують в атмосфері азоту при 0°С. До EtOAc-гексан, 1:4, отримуючи (4R)-4-бензил-3отриманої суміші додають по краплях розчин (бромацетил)-1,3-оксазолідин-2-он у вигляді метил-2-[(5'-хлор-2'-тієніл)сульфоніламіно]-3безбарвного масла (19,9г, 79,6%). трифторметил-4,4,4-трифторбутаноату (1,61г, Мас-спектр (+ESI): 300, 299 (М+Н)+. 3,84мл) в Et2O (3мл). Після перемішування при B. Дieтил-2-[(4R)-4-бeнзил-2-oкco-1,3вказаній температурі протягом 0,25 години реакція oкcaзoлiдин-3-iл]-2-oкcoeтилфocфoнaт завершується, за даними ТШХ (EtOAc:РЕ, 30:70). (4R)-4-Бензил-3-(бромацетил)-1,3-оксазолідинОтриману суміш (при енергійному перемішуванні) 2-он (19,7г, 66,07ммоль) і триетилфосфіт (33,99мл, гасять, додаючи по краплях Н2О (0,146мл), 15% 198,2ммоль) нагрівають при 120°С протягом 18 водний розчин NaOH (0,146мл) і Н2О (0,438мл) і годин. Відбирають аліквоту, і ТШХ (EtOAc-гексан, потім додатково перемішують протягом 2 годин 1:2) показує, що реакція завершилася. Реакційну при 25°С. Отриману завись сушать (Na2SO4) і суміш охолоджують до 25°С і розбавляють потім фільтрують. Після концентрування етилацетатом (200мл). неочищений продукт очищають за допомогою Органічний шар промивають насиченим хроматографічної системи Biotage FlashÔ 40, водним розчином NaHCO3 (2´50мл), шар сушать елюент EtOAc:PE від 5:95 до 40:60, отримуючи 5'над MgSO4, фільтрують і концентрують, хлор-N-[3,3,3-трифтор-2-(трифторметил)-1отримуючи дieтил-2-[(4R)-4-бензил-2-оксо-1,3(гідроксиметил)пропіл]тіофен-2'-сульфонамід у оксазолідин-3-іл]-2-оксоетилфосфонат у вигляді вигляді твердої речовини (0,590г, 39%, рацемічна неочищеного жовтого масла (14,27г, 60,77%). суміш). Потім виділяють активний енантіомер 5'Мас-спектр (-ESI): 326 (М-Н)-. хлор-N-[3,3,3-трифтор-2-(трифторметил)-1-SС (4R)-4-Бeнзил-3-[(2E)-5,5,5-тpифтopпeнт-2(гідроксиметил)пропіл]тіофен-2'-сульфонамід eнoїл]-l,3-oкcaзoлiдин-2-oн (0,185г) у вигляді не зовсім білої твердої речовини До розчину діетил-2-[(4R)-4-бензил-2-оксо-1,3(т.пл. 148-150°С), використовуючи хіральну ВЕРХ оксазолідин-3-іл]-2-оксоетилфосфонату (14,27г, (колонка з Chiralpako AS; 2´25см, 254нм, вприски 40,17ммоль) у ТГФ (200мл) при -78°С додають по 0,5мл; рухома фаза: 15мл/хв., 8% ІРА у суміші KHMDS (0,5М, 88мл, 44,63ммоль). Розчин гексан/0,1% ТФК (домішка); продукт відповідає піку нагрівають до 25°С протягом 30хв. і при -20°С два, Rf=12,3, чистота 98,5%). додають 3,3,3-трифторпропіональдегід (5,0г, Мас-спектр (-ESI): 389,9 (М-Н)-. 44,63ммоль). Розчин залишають нагріватися до Аналіз. 25°С на ніч (19 годин). Відбирають аліквоту, і ТШХ Обчислено для C9H8CIF6NO3S2: С, 27,59; Η, (EtOAc-гексан, 1:2) показує, що реакція 2,06: Ν, 3,58. завершилася. Реакцію гасять, додаючи насичений Знайдено: С, 27,76; Η, 1,96; Ν, 3,47. водний розчин NaHCO3 (50мл). Водний шар При порівняльному дослідженні сполуки промивають етилацетатом (3´100мл). Органічний даного прикладу і подібної сполуки, позбавленої шар сушать над MgSO4, фільтрують і трифторметильних груп, але ідентичної у інших концентрують, отримуючи світло-коричневе масло відношеннях, сполука даного прикладу (32,1г). Неочищений продукт очищають флешдемонструє істотно більш високу ефективність хроматографією, елюент EtOAc-гексан, 1:6, (приблизно від 72 годин до приблизно 133 годин) в отримуючи (4R)-4-бензил-3-[(2Е)-5,5,5клітинному аналізі та істотно більш тривалу трифторпент-2-еноїл]-1,3-оксазолідин-2-он у метаболічну стабільність (період напіввиведення вигляді безбарвного масла (3,7г, 29,4%). 46хв. проти 10хв. в аналізі метаболізму на Мас-спектр (+ESI): 314 (М+Н)+. мікросомах печінки трансгенної миші (Tg2576)). Аналіз. Таким чином, сполуки винаходу можна Обчислено для C15H14NF3O3+0,25H2O: С, використовувати у більш низьких дозах, ніж 56,70; Η, 4,60; Ν, 4,41. відповідні сполуки, позбавлені трифторметильних Знайдено: С, 56,44; Η, 4,49; Ν, 4,41. груп. D. (4R)-4-Бeнзил-3-[(2R,3S)-2-бpoм-3-eтилПриклад 6 5,5,5-тpифтopпeнтaнoїл]-1,3-оксазолідин-2-он 5-Хлор-N-[(1R,2S)-2-етил-4,4,4-трифтор-1(гідроксиметил)бутил]тіофен-2-сульфонамід 45 82093 46 метиленхлориді (5мл), охолодженому до 0°С, при Завись комплексу бромід міді(І)перемішуванні додають по краплях розчин 5диметилсульфід (1,57г, 7,66ммоль) у ТГФ (20мл) і хлортіофен-2-сульфонілхлориду (225мг, дим етил сульфіді (10мл) як співрозчиннику 0,861ммоль) у метиленхлориді (5мл). Через 15хв. охолоджують до -40°С і додають по краплях льодяну баню прибирають і реакційну суміш протягом 10хв. метилмагнійбромід (5мл, залишають досягати 25°С на ніч. Додатково 15,3ммоль). Завись перемішують протягом 40хв., додають метиленхлорид (15мл) і реакцію гасять, нагріваючи до -15°С. Зеленувату завись виливаючи суміш в насичений розчин бікарбонату охолоджують до -40°С і при -40°С додають по натрію (25мл). Органічну фазу відділяють і краплях розчин (4R)-4-бензил-3-[(2Е)-5,5,5послідовно промивають 1н водною трифторпент-2-еноїл]-1,3-оксазолідин-2-ону (2г, хлористоводневою кислотою, Н2О і розсолом і 6,38ммоль) у ТГФ (5мл). Реакційну суміш сушать над MgSO4. Органічну фазу фільтрують і залишають нагріватися до 25°С на ніч (20 годин). упарюють, отримуючи неочищене масло (0,250г), Чорну завись охолоджують до -78°С і додають по яке очищають флеш-хроматографією, елюент частинах N-бромсукцинімід (2,3г, 12,76ммоль). етилацетат-гексан, 1:6. Отримують вказану у Суміш нагрівають до -40°С і додатково заголовку сполуку 5-хлор-N-[(1S,2S)-2-етил-4,4,4перемішують протягом 30хв. По закінченні трифтор-1-(гідроксиметил)бутил]тіофен-2вказаного періоду чорна завись набуває кольору сульфонамід у вигляді масла (140мг, 53,8%). від зеленуватого до синього. Утворюється осад, Неочищене масло додатково очищують який відфільтровують. Маточну рідину перекристалізацією з суміші EtOAc-гептан, 1:4. розбавляють ЕtOАс (150мл) і органічний шар Систему змішаного розчинника додають до 5промивають насиченим розчином NaCl (50мл). хлор-N-[(1S,2S)-2-етил-4,4,4-трифтор-1Органічний шар сушать над MgSO4, фільтрують і (гідроксиметил)бутил]тіофен-2-сульфонаміду, концентрують, отримуючи (4R)-4-бензил-3нагрівають для отримання розчину, залишають [(2R,3S)-2-бром-3-етил-5,5,5-трифторпентаноїл]охолоджуватися до 25°С на 3 години і потім 1,3-оксазолідин-2-он у вигляді зеленої зберігають при 0°С протягом 19 годин. Білу напівтвердої речовини (1,6г, 59,58%). кристалічну речовину, що випала в осад, Мас-спектр (-ESI): 421, 420 (М-Н)-. відфільтровують, промивають охолодженим на E. (4R)-3-[(2S,3S)-2-Aзидo-3-eтил-5,5,5льоду гептаном, отримуючи 5-(хлop-N-[(1S,2S)-2тpифтopпeнтaнoїл]-4-бeнзил-1,3-оксазолідин-2-он етил-4,4,4-трифтор-1До розчину (4R)-4-бeнзил-3-[(2R,3S)-2-бром-3(гідроксиметил)бутил]тіофен-2-сульфонамід у етил-5,5,5-трифторпентаноїл]-1,3-оксазолідин-2вигляді білої кристалічної твердої речовини (50мг, ону (1,6г, 3,79ммоль) в ДМФА (20мл) додають азид 19,2%, хіральна чистота 91%, аналітична чистота натрію (0,468 г, 7,119ммоль). Завись перемішують 100%). при 25°С протягом 20 годин і видаляють розчинник Мас-спектр (-ESI): 364 (М-Н)-. у вакуумі. Неочищений продукт розчиняють в Аналіз. EtOAc (100мл) і органічний шар промивають Η2Ο Обчислено для C11H15NClF3O3S2+0,10C4H8O2: (3´20мл) і насиченим водним розчином NaCl С, 36,55; Η, 4,25; Ν, 3,74. (20мл). Органічний шар сушать над MgSO4, Знайдено: С, 36,94; Η, 4,15; Ν, 3,57. фільтрують і концентрують, отримуючи жовте Приклад 7 масло (1,4г). Неочищений продукт очищають 5-Хлор-N-[4,4,4-трифтор-1флеш-хроматографією, елюент EtOAc-гексан, 1:4, (гідроксиметил)бутил]тіофен-2-сульфонамід отримуючи (4R)-3-[(2S,3S)-2-азидo-3-етил-5,5,5А. 4,4,4-Трифторбутаналь трифторпентаноїл]-4-бензил-1,3-оксазолідин-2-он До розчину етил-4,4,4-трифторбутаноату (5г, у вигляді безбарвного масла (1,21г, 83,2%). 29,38ммоль) в СН2Сl2 (50мл) в атмосфері N2 при Мас-спектр (-ESI): 357 (M-N2)-, 380, 381. 70°С додають діізобутилалюмогідрид (35мл, F. (2S,3S)-2-Аміно-3-етил-5,5,535,26ммоль). Через 6 годин додають 1н HCI (6мл), трифторпентан-1-ол після нагрівання до -60°С реакційну суміш До сірої зависі LAH (100мг, 2,65ммоль) у ТГФ виливають в Н2О (5мл) і екстрагують СН2СI 2 (3мл) при -10°С додають по краплях протягом 5хв. (2´50мл). Об'єднані органічні екстракти розчин (4R)-3-[(2S,3S)-2-азидо-3-етил-5,5,5трифторпентаноїл]-4-бензил-1,3-оксазолідин-2-ону промивають Н2О (2´10мл). Органічні екстракти (300мг, 0,78ммоль) у ТГФ (2мл). Отриману завись сушать над MgSO4, фільтрують і концентрують, залишають нагріватися до 25°С на 19 годин. отримуючи 4,4,4-трифторбутанальдегід у вигляді Реакцію гасять, додаючи послідовно при 0°С Н2О безбарвного нев'язкого масла (3,7г, 100%). (0,3мл), 1н розчин NaOH (0,9мл) і Н2О (0,3мл). В. 5-(3,3,3-Трифторпропіл)імідазолідин-2,4Осад, що утворився через 5 годин, діон відфільтровують. Маточну рідину сушать над Ціанід натрію (4,31г, 88,04ммоль) і 4,4,4MgSO4, фільтрують і концентрують, отримуючи трифторбутанальдегід (3,7г, 29,34ммоль) додають (2S,3S)-2-аміно-3-етил-5,5,5-трифторпентан-1-ол у до карбонату амонію (9,1г, 117,4ммоль) в Н2О вигляді ясно-жовтого масла (145мг, 98%). (60мл). Чорну реакційну суміш нагрівають до 90°С. Мас-спектр (-ESI): 184 (M-H)-. Через 1 годину суміш стає гомогенною і G. 5-Хлор-N-[(1S,2S)-2-етил-4,4,4-трифтор-1перемішують при 90°С протягом 18 годин. Після (гідроксиметил)бутил]тіофен-2-сульфонамід охолодження до 25°С приблизно 60мл розчинника До розчину (2S,3S)-2-аміно-3-етил-5,5,5видаляють у вакуумі. Додають концентровану HCI трифторпентан-1-олу (145мг, 0,78ммоль) і (4мл) для підкислення суміші до рН приблизно 2 і триетиламіну (0,22мл, 1,56ммоль) у утворюється осад. Його відфільтровують. Маточну 47 82093 48 [4,4,4-трифтор-1-(гідроксиметил)бутил]тіофен-2рідину промивають ЕtOАс (3´50мл). Органічний сульфонамід (0,46г, 48%) у вигляді безбарвного шар сушать над MgSO4, фільтрують і масла. концентрують, отримуючи 5-(3,3,3Мас-спектр (-ESI): 337 (М-Н)-. трифторпропіл)імідазолідин-2,4-діон у вигляді Аналіз. коричневого масла (3,95г, 69,7%). Обчислено для C11H15NClF3O3S2+0,30C4H8O2: Мас-спектр (-ESI): 195 (М-Н)-. С, 33,64; Η, 3,71; Ν, 3,85. С 5,5,5-Трифторнорвалін Знайдено: С, 34,01; Η, 3,65; Ν, 3,67. 5-(3,3,3-Трифторпропіл)імідазолідин-2,4-діон Приклади 8 і 9 (0,9г, 4,59ммоль) розчиняють в 10мл водного 5-Хлор-N-{(1S,2R)-4,4,4-трифтор-1-[(1S)-1розчину NaOH (0,734г в 10мл Н2О, 18,35ммоль). гірдроксіетил1-2-метилбутил)тіофен-2Розчин розподіляють на дві спеціальні посудини сульфонамід для мікрохвильової технології. Розчин нагрівають і мікрохвильовим опроміненням: у герметично 5-хлор-N-{(1S,2R)-4,4,4-трифтор-1-[(1R)-1закритих посудинах протягом 1 години. Умови прдрокс1етил]-2-метилбутил}тiофен-2мікрохвильового опромінення: 15хв. при сульфонамід приблизно 100% потужності, 150°С, 50ф/д2, потім До 5-хлор-N-[(1S,2R)-4,4,4-трифтор-15хв. перерва, потужність 0%. Послідовність (гідроксиметил)-2-метилбутил]тіофен-2операцій повторюють двічі або доти, доки не сульфонаміду (отриманого так, як описано в відбудеться реакція. Воду та аміак видаляють з прикладі 1, 290мг, 0,824ммоль) в СН2СI 2 (15мл) реакційної суміші у вакуумі і отриману суміш при 0°С додають реагент Деса-Мартіна періодинан неочищеного 5,5,5-трифторнорваліну (1/1г, 140%) і (410мг, 0,989ммоль). Реакційну суміш нагрівають NaOH використовують у наступній реакції без до 25°С. Через 10хв. ТШХ (EtOAc:гексан, 3:7) додаткового очищення. Мас-спектр (+ESI): 172 показує наявність вихідної речовини. Додатково (М+Н)+. додають періодинан Деса-Мартіна (410мг, D. N-(5-Хлортієн-2-іл)сульфоніл]-5,5,50,989ммоль) і через 15хв. ТШХ показує, що трифторнорвалін вихідна речовина витрачена. Додають діетиловий До суміші неочищеного 5,5,5ефір (30мл), потім водний 1н розчин Na2S2O3 трифторнорваліну (0,785г, 4,59ммоль) і NaOH, (25мл) і насичений водний розчин NaHCO3 (25мл). розчиненої у ТГФ (10мл) і 2н розчині NaOH (10мл), Молочно-білий розчин енергійно перемішують додають по краплях протягом 30хв. розчин 5доти, доки обидві фази не стануть гомогенними. хлортіофен-2-сульфонілхлориду (1,32г, Шари розділяють і водну фазу екстрагують 5,04ммоль) у ТГФ (10мл). Через 60хв. реакційну діетиловим ефіром. Об'єднані органічні екстракти суміш поступово нагрівають до 25°С і сушать (Na2SO4) і концентрують. Флешперемішують протягом 16 годин. ТГФ видаляють у хроматографія (елюент EtOAc:гексан, 3:7) дає 5вакуумі і суміш підкисляють до рН приблизно 2 1н хлор-N-[(1S,2R)-4,4,4-трифтор-1-(форміл-2HCI. Через 15хв. з молочно-білого розчину метилбутил)]тіофен-2-сульфонамід (100мг, 35%) у починає випадати осад. Через 60хв. суміш вигляді білої твердої речовини. охолоджують до 0°С протягом 45хв. і потім До 5-N-(1S,2R)-4,4,4-трифтор-1-(форміл-2фільтрують. Осад, що випав, промивають 1н HCI метилбутил)]тіофен-2-сульфонаміду (100мг, (10мл), отримуючи білу тверду речовину. Білу 0,286ммоль) у ТГФ (3мл) при 0°С додають по тверду речовину відділяють від фільтра. Його краплях розчин (1,4М, 0,61мл) метилмагнійброміду розчиняють в ЕtOАс (100мл). Водний шар в суміші ТГФ/толуол (0,86ммоль). Реакційну суміш промивають ЕtOАс (3´50мл) і органічні шари нагрівають до 25°С і перемішують протягом 3 промивають насиченим водним розчином NaCl годин. Потім реакцію гасять насиченим водним (50мл). Органічний шар сушать над MgSO4, розчином хлориду амонію, суміш екстрагують фільтрують і концентрують, отримуючи N-[(5EtOAc (2´40мл), сушать (Na2SO4) і концентрують. хлортієн-2-іл)сульфоніл]-5,5,5-трифторнорвалін у Флеш-хроматографія (елюент EtOAc:гексан, 3:7) вигляді темно-червоного масла (1,1г, 68,3%). дає 5-хлор-N-{(1S,2R)-4,4,4-трифтор-1-[1Мас-спектр (-ESI): 350 (М-Н)-. гірдроксіетил]-2-метилбутил}тіофен-2Е. 5-Хлор-N-[4,4,4-трифтор-1сульфонамід (75мг, 74%) у вигляді суміші (гідроксиметил)бутил]тіофен-2-сульфонамід діастереомерів 3:1. Діастереомери розділяють До розчину N-[(5-хлортієн-2-іл)сульфоніл]ВЕРХ (колонка з силікагелем ZorbaxÒ 25´5см, 5,5,5-трифторнорваліну (1,0г, 2,84ммоль) у ТГФ елюент метил-трет-бутиловий ефір (МТВЕ)-гексан, (10мл) при 0°С протягом 30хв. додають по краплях 3:2, діастереомер 1 елююється при 11/4хв., комплекс боран-ТГФ (1М розчин, 15мл, діастереомер 2 елююється при 14,1хв.). 14,21ммоль). Реакційну суміш залишають Діастереомер 1: мас-спектр (-ESI): 364 (М-Н)-. нагріватися до 25°С на 18 годин і потім гасять Діастереомер 2: мас-спектр (-ESI): 364 (М-Н)-. реакцію, додаючи 50мл 10% оцтової кислоти в Приклад 10 метанолі. Після випарювання розчинника 5-N-[(1S,2S)-4,4,4-трифтор-1-(гідроксиметил)неочищений продукт розчиняють в EtOAc і розчин 2-метилбутил]тіофен-2-сульфонамід промивають 1н HCI, Н2О і насиченим розчином А. Гідрохлорид 5,5,5-трифтор-L-золейцину NaHCO3 Органічний шар сушать над MgSO4, фільтрують і концентрують, отримуючи неочищене До гідрохлоридної солі (S)-(-)-aмасло (0,83г), яке очищають флешметилбензилуміну (0,340г, 2,16ммоль) в 20мл хроматографією, елюент етилацетат-гексан, 1:6. суміші МеОН/Н2О, 1:1, додають ціанід калію Отримують вказану у заголовку сполуку 5-хлор-Ν(0,139г, 2,13ммоль) і (2S)-4,4,4-трифтор-2 49 82093 50 EtOAc (50мл), двічі промивають 0,1н HCI, сушать і метилбутанол (0,300г, 2,14ммоль, отриманий за концентрують. Ретельне видалення домішок і методикою, описаною в прикладі 1, спосіб 2, але з неістотного діастереомеру флеш-хроматографією використанням як допоміжної хіральної речовини (елюент EtOAc-гексан, 3:7) дає 5-хлор-N-[(1S,2S)(S)-(-)-4-бензил-2-оксазолідинон) і реакційну суміш 4,4,4-трифтор-1-(гідроксиметил)-2перемішують протягом 17 годин. Метанол метилбутил]тіофен-2-сульфонамід (97мг, 28%) у видаляють у вакуумі і продукт екстрагують EtOAc. вигляді білої твердої речовини, т.пл. 99-100°С. Органічний екстракт промивають 0,1н водною хлористоводневою кислотою, сушать (Na2SO4) і ВЕРХ (колонка з силікагелем ZorbaxÒ, елюент концентрують. Флеш-хроматографія (елюент МТВЕ-гексан, 3:2) показує суміш діастереомерів EtOAc:гексан, 1:9) дає a-амінонітрил (0,224г, 39%) 97:3. Хіральна ВЕРХ (колонка AD, елюент ізопропанол-гексан, 1:9) показує енантіомерну у вигляді жовтого масла. 1 H ЯМР показує, що чистоту >99%. продукт являє собою суміш діастереомерів 3:1. [a]D25=+8,95° (c=1% розчин, МеОН). До суміші діастереомерів (0,224г, 0,829ммоль) Мас-спектр (-ESI): 350 (М-Н)-. додають сірчану кислоту (3мл) і розчин Аналіз. перемішують протягом 22 годин. Потім реакційну Обчислено для С10Н13СIF3NO3S2: С, 34,14; Η, суміш виливають на подрібнений лід (~10г). 3,72; Ν, 3,98. Додають для нейтралізації кислоти Знайдено: С, 34,43; Η, 3,70; Ν, 3,91. концентрований водний розчин гідроксиду амонію. Приклад 11 Отриману суміш екстрагують EtOAc, сушать (2S,3S)-2-(5-3-метилбензо[b]тіофен-2(Na2SO4), фільтрують і концентрують, отримуючи в сульфоніл)амідо-5,5,5-трифтор-3-етилпентан-1-ол результаті амід (0,224г, 94%), який А. (R)-4-Бензил-3-(2-R-бром-3-3-етил-5,5,5використовують на наступній стадії без трифторпентаноїл)оксазолідин-2-он додаткового очищення. До комплексу бромід міді(І)-диметилсульфід Суміш аміду (0,224г, 0,777ммоль) і 5% (328мг, 1,56ммоль) у ТГФ/ДМС (2:1, 60мл), паладію/С (Pd/C, 40мг) струшують протягом 2 діб в охолодженого до -40°С, додають апараті Пара за тиску водню (Н2 ) 3атм. Суміш етилмагнійбромід (1,06мл, 3М розчин у ТГФ, фільтрують через шар целітуÒ і видаляють 3,2ммоль). Розчин перемішують протягом 10хв., розчинник у вакуумі, отримуючи підсумковий амін нагріваючи до -15°С. Суміш знов охолоджують до у вигляді білої твердої речовини (128мг, 90%), 40°С і додають (R)-4-бензил-3-(5,5,5-трифторпентякий використовують на наступній стадії без 2-еноїл)оксазолідин-2-он (отриманий, як описано в додаткового очищення. прикладі 6, частина С, 416мг, 1,3ммоль)у ТГФ Амін (128мг, 0,695ммоль) в концентрованій (15мл). Розчин перемішують при 25°С протягом 16 хлористоводневій кислоті (3мл) кип'ятять зі годин. Розчин знов охолоджують до -78°С і зворотним холодильником протягом 24 годин. додають Ν-бромсукцинімід (473мг, 2,6ммоль) у Реакційну суміш охолоджують до кімнатної ТГФ (10мл). Розчин нагрівають до 0°С і струшують температури і концентрують, отримуючи суміш при 0°С протягом 3 годин. Реакцію гасять гідрохлоридної солі амінокислоти (співвідношення сумішшю 1:1 насиченого розчину карбонату діастереомерів 3:1) і 1 еквіваленту хлориду амонію амонію і 0,5н розчину бісульфату калію (15мл). у вигляді білої твердої речовини (183мг, 95%). Органічну фазу декантують і концентрують, Мас-спектр (+ESI): 186 (М+Н)+. отримуючи (R)-4-бензил-3-(2-N-бром-3-3-етилВ. (2S,3S)-2-Аміно-5,5,5-трифтор-35,5,5-трифторпентаноїл)оксазолідин-2-он, метилпентан-1-ол ідентифікований рідинною хроматографією-масДо розчину боргідриду літію (1,0мл, 2,0н у спекрометрією (РХ-МС). ТГФ, 2,0ммоль) у ТГФ (5мл) при 0°С додають B. 3-(2-S-Азидо-3-S-етил-5,5,5хлортриметилсилан (0,51мл, 4,01ммоль). трифторпентаноїл)-4R-бензилоксазолідин-2-он Реакційну суміш нагрівають до 25°С і через 30хв. До (R)-4-бензил-3-(2R-бром-3S-етил-5,5,5до суспензії, охолодженої до 0°С, додають по трифторпентаноїл)оксазолідин-2-ону, розчиненого краплях неочищену гідрохлоридну сіль в диметилформаміді (ДМФА, 10мл), додають азид амінокислоти (184мг, 0,669ммоль) у ТГФ (5мл). натрію (172мг, 2,6ммоль). Розчин перемішують Суміш нагрівають до 25°С і через 21 годину протягом 72 годин, розбавляють водою (20мл), реакцію гасять МеОН. Леткі речовини видаляють у екстрагують етилацетатом (2´20мл) і вакуумі і отриманий залишок розчиняють у концентрують, отримуючи 3-(2-S-азидо-3-S-етилводному 1н розчині NaOH, екстрагують СНСI 3 5,5,5-трифторпентаноїл)-4R-бензилоксазолідин-2(4´20мл), сушать (Na2SO4) і концентрують, он, ідентифікований РХ-МС. отримуючи аміноспирт у вигляді жовтого масла C. (2S,3S)-2-Азидо-3-етил-5,5,5(92мг, 81%), який, згідно з його спектрами: 1H трифторпентанова кислота ЯМР, являє собою суміш діастереомерів 3:1. 3-(2-S-Азидо-3-S-етил-5,5,5Мас-спектр (+ESI): 172 (М+Н)+. трифторпентаноїл)-4-бензилоксазолідин-2-он С. 5-N-[(1S,2S)-4,4,4-трифтор-1розчиняють при 0°С у суміші ТГФ і води, 2:1 (20мл) (гідроксиметил)-2-метилбутил]тіофен-2і додають моногідрат гідроксиду літію (1,4ммоль, сульфонамід 60мг). Розчин струшують протягом 1 години при До аміноспирту (168мг, 0,981ммоль) в СН2Сl2 0°С і потім додають насичений розчин карбонату (10мл) додають триетиламін (170мкл, 1,20ммоль) і натрію (20мл). Суміш екстрагують етилацетатом 5-хлортіофен-2-сульфонілхлорид (256мг, (20мл). Водну фазу підкислюють 2н 1,18ммоль). Реакційну суміш перемішують при хлористоводневою кислотою, екстрагують 25°С протягом 21 години. Розчин розбавляють 51 82093 52 Na2SO4 (250г). Розчин у толуолі охолоджують до етилацетатом (20мл), отримуючи (2S,3S)-2-азидотемператури від -68°С до -62°С і обробляють 25% 3-етил-5,5,5-трифторпентанову кислоту, розчином діізобутилалюмогідриду (DIBAL-H) у ідентифіковану РХ-МС. толуолі (1278мл, 1,9мол, 3екв.), підтримуючи D. (2S,3S)-2-Аміно-3-етил-5,5,5температуру нижче -60°С. Суміш нагрівають до трифторпентан-1-ол кімнатної температури і перемішують протягом 1 (2S,3S)-2-Азидо-3-етил-5,5,5години. Реакцію гасять 10% водним розчином трифторпентанову кислоту розчиняють у ТГФ NaOH (128мл), потім дигідратом цитрату натрію (5мл) при 0°С і додають алюмогідрид літію (1М (500г) і безводним сульфатом натрію (385г). Після розчин у ТГФ) (1мл, 1ммоль). Отриманий розчин перемішування протягом 1 години тверді речовини перемішують при 40°С протягом 2 годин. Реакцію видаляють фільтруванням і розчин концентрують гасять, послідовно додаючи воду (60мкл), 15% до масла. Отримане масло розчиняють в водний розчин гідроксиду натрію (60мкл) і воду діетиловому ефірі (2,6л), охолоджують до 5°С і (150 мкл) при енергійному перемішуванні між обробляють 1н розчином HCI в ефірі (750мл). кожним доданням. Потім суміш фільтрують і Після перемішування протягом 30 хвилин тверді концентрують, отримуючи (2S,3S)-2-аміно-3-етилречовини збирають фільтруванням, промивають 5,5,5-трифторпентан-1-ол. ефіром і сушать у вакуумі, отримуючи 189г (85%) E. (2S,3S)-2-(5-3-метилбензо[b]тіофен-2бензиламіну у вигляді білої твердої речовини. сульфоніл)амідо-5,5,5-трифтор-3-етилпентан-1-ол Бензиламін (150г, 0,43моль) у метанолі (150мл) До розчину (2S,3S)-2-аміно-3-етил-5,5,5гідрують при 40ф/д2 у присутності каталізатора 40г трифторпентан-1-олу (0,1ммоль) у ТГФ (2мл) 10% Pd/C. Через 1,5 години каталізатор додають триетиламін (83,7мкл, 0,6ммоль) і 5-хлорвидаляють фільтруванням і розчин концентрують 3-метилбензо[b]тіофен-2-сульфонілхлорид (28мг, до твердої речовини. Тверду речовину розтирають 0,1ммоль). Розчин перемішують протягом 16 годин у суміші ефір/гексан, збирають фільтруванням і і концентрують. Розчинник видаляють, залишок сушать, отримуючи 94,8г (90%) аміноспирту у розчиняють в МеОН (1,5мл) і очищюють вигляді твердої речовини. напівпрепаративною ВЕРХ з оберненою фазою Аміноспирт (100,2г, 0,41моль) в СН2Сl2 (ОФ)-ВЕРХ, використовуючи умови, описані нижче. (1150мл) обробляють Ν,ΟУмови напівпрепаративної ОФ-ВЕРХ: біс(триметилсиліл)ацетамідом (BSA, 110мл, Колонка: колонка з PhenomenexÒ C18, LunaÒ, 0,45моль), потім триетиламіном (152,4мл, 21,6мм´60мм, 5мкМ. 1,09моль) і диметиламінопіридином (DMAP, 13г). Розчинник А: вода (буфер 0,02% ТФК). Через 15 хвилин додають розчин Розчинник В: ацетонітрил (буфер 0,02% ТФК). сульфонілхлориду (105,5г, 0,49 моль) вСН2Сl2 Градієнт розчинника: час 0: 10% В; 2,5хв.: 10% (186мл) і суміш перемішують при кімнатній В; 14хв.: 90% В. температурі протягом 19 годин (протягом ночі). Об'ємна витрата: 22,5мл/хв. Додають ТГФ (450мл) і 5% водну HCI (800мл) і Продукт, що відповідає піку, збирають, суміш перемішують протягом 1 години. Шари основуючись на УФ-поглинанні і концентрують, розділяють і органічний шар промивають 5% отримуючи вказану у заголовку сполуку, 1,7мг, час розчином NaHCO3 і потім водою. Розчин утримування при ВЕРХ 2,97хв., іон, який концентрують, отримуючи масло, і пропускають спостерігається,- 428 (М-Н). через шар силікагелю, елююючи сумішшю 30% Приклад 12 EtOAc/гексан. Фракції, що містять продукт, (2S,3R)-2-(5-Хлор-1,3-диметил-1Н-піразол-4концентрують у вакуумі, який промотує сульфоніл)амідо-5,5,5-трифтор-3-фенілпентан-1кристалізацію. Додають гексан, тверді речовини ол збирають фільтруванням, отримуючи 87,1г (55%) Дотримуючись, по суті, аналогічної методики цільової сполуки у вигляді білої твердої речовини. прикладу 11, але з використанням Концентрування маточної рідини дає другу порцію фенілмагнійброміду і 5-хлор-1,3-диметилпіразолцільової сполуки, 12,6г, вихід 8%. 4-сульфонілхлориду, отримують (2S,3R)-2-(5-хлорПриклад 14 1,3-диметил-1Н-піразол-4-сульфоніл)амідо-5,5,55-N-[1-(4,4-дифторциклогексил)-2трифтор-3-фенілпентан-1-ол, 7,1мг, час гірдроксіетил]тіофен-2-сульфонамід утримування при ВЕРХ 2,25хв., іон 424 (М-Н), який спостерігається. Приклад 13 Синтез трифторметиловмісного гетероциклічного сульфонаміду В одному втіленні спосіб, показаний на схемі 13, здійснюють з використанням описаних нижче прикладів реагентів і умов. Однак фахівцеві в даній галузі буде зрозуміло, що деякі умови реакції, наприклад, час, температури, каталізатори і деякі реагенти, можна змінювати. Згідно зі схемою 13, аміноефір XVIII (250г, 0,64моль) суспендують у толуолі (4л) і суспензію нейтралізують до рН 7-8 0,4н розчином NaOH (1,6л). Шари розділяють, органічну фазу промивають водою (1,6л) і потім сушать над 53 A. {[(5-Хлортієн-2-іл)сульфоніл]аміно}(4,4дифторциклогексил)оцтова кислота Аміно(4,4-дифторциклогексил)оцтову кислоту (2,68г, 10,973ммоль) розчиняють в 2н розчині NaOH (20мл). Розчин охолоджують до 0°С і додають по краплях (5хв.) розчин 5-хлортіофен-2сульфонілхлориду (3,25г, 12,42ммоль) у ТГФ (10мл). Розчин залишають нагріватися до 25°С на ніч. Через 19 годин ТГФ видаляють у вакуумі і суміш підкислюють до рН від приблизно 1 до приблизно 2 2н HCI (20мл). Водний шар промивають ЕtOАс (4´50мл). Об'єднані органічні шари сушать над MgSO4, фільтрують і концентрують, отримуючи {(5-хлортієн-2іл)[сульфоніл]аміно}(4,4дифторциклогексил)оцтову кислоту у вигляді неочищеного масла (3,8г, 98,2%). Мас-спектр (-ESI): 372 (М-Н)-. B. 5-N-[1-(4,4-дифторциклогексил)-2гірдроксіетил]тіофен-2-сульфонамід До зависі LAH (0,406г, 10,70ммоль) у ТГФ (20мл) при 0°С додають по краплях протягом 20хв. {(5-хлортієн-2-іл)[сульфоніл]аміно}(4,4дифторциклогексил)оцтову кислоту (2,0г, 5,35ммоль). Реакційну суміш нагрівають при 70°С протягом 18 годин. Реакційну завись (світло-коричневого кольору) охолоджують до 0°С і реакцію гасять Н2О (1,5мл), 1н розчином NaOH (4,5мл) і Н-О (1,5мл). Реакційну суміш перемішують протягом 4 годин, отримуючи білу завись. Завись фільтрують, потім маточну рідину сушать над MgSO4, фільтрують і концентрують у вакуумі, отримуючи неочищене масло (1,68г). Неочищений продукт очищають хроматографією на Biotage FlashÔ 40, елюент EtOAc-гексан, 1:2, отримуючи 5-N-[1-(4,4дифторциклогексил)-2-гірдроксіетил]тіофен-2сульфонамід у вигляді білої аморфної твердої речовини (0,15г, 7,8%). Мас-спектр (-ESI): 358 (М-Н)-. Аналіз. Обчислено для C12H16ClNF2O3S2·0,17EtOAc: С, 41,02; Η, 4,49; Ν, 3,76. Знайдено: С, 40,63; Η, 4,67; Ν, 3,74. Приклад 15 5-N-[1-(6,6-дифторбіцикло[3.1.0]гекс-3-іл)-2гірдроксіетил]тіофен-2-сульфонамід 82093 54 Α. Метиламіно(6,6-дифторбіцикло[3.1.0]гекс-3іл)ацетат До розчину аміно(6,6дифторбіцикло[3.1.0]гекс-3-іл)оцтової кислоти (1,0г, 5,23ммоль) у суміші СН2СI 2:МеOН (4:1) при 0°С додають по краплях протягом 10хв. TMSCHN2 (10,5мл) доти, доки суміш не стане стійко неоновожовтою. Реакційну суміш залишають нагріватися до 25°С на 19 годин. Розчинник видаляють у вакуумі, отримуючи метиламіно(6,6дифторбіцикло[3.1.0]гекс-3-іл)ацетат у вигляді ясно-жовтого масла (0,9г, 84,11%). Мас-спектр (-ESI): 206 (М+Н)+. В. Метил{(5-хлортієн-2іл)[сульфоніл]аміно}(6,6-дифторбіцикло[3.1.0]гекс3-іл)ацетат Розчин 5-хлортіофен-2-сульфонілхлориду (1,26г, 4,82ммоль) в СН2Сl2 (10мл) додають по краплях (5хв.) до розчину метиламіно(6,6дифторбіцикло[3.1.0]гекс-3-іл)ацетату (0,9г, 4,38ммоль) в СН2Сl2 (10мл) і триетиламіні (1,22мл, 8,77ммоль), охолодженому до 0°С. Розчин залишають нагріватися до 25°С на ніч (19 годин). Відбирають аліквоту, і ТШХ (EtOAc-гексан, 1:4) показує, що реакція завершилася. Реакційну суміш розбавляють СН2Сl2 (100мл) і органічний шар промивають 1н HCI (20мл) і насиченим водним розчином NaCl (20мл). Органічний шар сушать над MgSO4, фільтрують і концентрують, отримуючи неочищену не зовсім жовту тверду речовину (1,69г). Неочищений продукт очищують на хроматографі Biotage FlashÔ 40, елюент EtOAcгексан, 1:4, отримуючи метил{(5-хлортієн-2іл)[сульфоніл]аміно}(6,6-дифторбіцикло[3.1.0]гекс3-іл)ацетат у вигляді безбарвного масла (0,230г, 12,23%). Мас-спектр (-ESI): 384 (М+Н)+. С. 5-Хлор-N-[1-(6,6-дифторбіцикло[3.1.0]гекс-3ил)-2-гірдроксіетил]тіофен-2-сульфонамід До зависі LAH (0,030г, 0,78ммоль) у ТГФ (50мл) при 0°С додають по краплях протягом 20хв. метил {(5-хлортієн-2-іл)[сульфоніл]аміно} (6,6дифторбіцикло[3.1.0]гекс-3-іл)ацетат (0,154г, 0,38ммоль). Завись (сірого кольору) залишають нагріватися до 25°С протягом 19 годин. Реакційну завись охолоджують до 0°С і реакцію гасять Н2О (0,5мл), 1н розчином NaOH (1,5мл) і Н2О (0,5мл). Реакційну суміш перемішують протягом 4 годин, отримуючи білу завись. Завись фільтрують, потім маточну рідину сушать над MgSO4, фільтрують і концентрують у вакуумі, отримуючи неочищене жовте масло (0,162г). Неочищений продукт 55 82093 56 очищають за допомогою хроматографічної Приклад 17 N-[(1S,2R)-1-Ацетил-4,4,4-трифтор-2системи Biotage FlashÔ 40, елюент EtOAc-гексан, метилбутил]-5-хлортіофен-2-сульфонамід 1:4, отримуючи 5-хлор-N-[1-(6,6дифторбіцикло[3.1.0]гекс-3-іл)-2гірдроксіетил]тіофен-2-сульфонамід у вигляді безбарвного масла (0,105г, 77,7%). Мас-спектр (-ESI): 356 (М-Н)-. Аналіз. Обчислено для C13H14ClNF2O4S2-0,20EtOAc: С, 41,41; Η, 3,84; Ν, 3,56. Знайдено: С, 41,08; Η, 3,90; Ν, 3,47. Приклад 16 5-N-[(1S,2R)-4,4,4-трифтор-1-форміл-2метилбутил]тіофен-2-сульфонамід Розчин 5-хлор-N-[(1S,2R)-4,4,4-трифтор-1(гідроксиметил)-2-метилбутил]тіофен-2сульфонаміду (отриманого, як описано в прикладі 1, 3,0г, 8,53ммоль) в СН2СI 2, насиченого водою (20мл), перемішують в атмосфері азоту при 0°С. Додають в один прийом реагент Деса-Мартіна періодинан (7,59г, 17,90ммоль). Отриману суспензію перемішують при 25°С, контролюючи розвиток реакції аналізом методом ТШХ (EtOAc/гексан, 1:2). Оскільки швидкість конверсії вихідної речовини знижується, додатково додають 2-мл порції СН2СI 2, насиченого водою (три порції протягом 15хв.). Після витримування при 25°С протягом 19 годин реакція, за даними ТШХ, завершується. Розчин розбавляють Et2O (50мл) і додають розчин тіосульфату натрію (Na2S2O3, 93,83ммоль, 14,8г, 11екв.) в 80% насиченому водному розчині бікарбонату натрію (50мл). Суміш швидко перемішують протягом 10хв. доти, доки обидві фази стануть прозорими. Шари розділяють і водний шар екстрагують ефіром (30мл). Об'єднані органічні шари послідовно промивають насиченим водним розчином бікарбонату натрію (10мл) і розсолом (15мл), потім сушать над MgSO4, фільтрують і концентрують, отримуючи неочищене масло (2,67г). Неочищений продукт очищають за допомогою хроматографічної системи Biotage FlashÔ 60, елюент EtOAc-гексан, 1:6, отримуючи 5-хлор-N-[(1S,2R)-4,4,4-трифтор-1форміл-2-метилбутил]тіофен-2-сульфонамід у вигляді безбарвного масла (2,65г, 88,93%). Мас-спектр (+ESI): 350 (М+Н)+. Аналіз. Обчислено для C10H11ClNF2O3S2·0,35H2O: С, 33,34; Η, 2,83; Ν, 3,87. Знайдено: С, 33,74; Η, 3,31; Ν, 3,93. А. 5-Хлор-N-[(1S,2R)-4,4,4-трифтор-1-(1гірдроксіетил)-2-метилбутил]тіофен-2сульфонамід Розчин 5-хлор-N-(1S,2R)-4,4,4-трифтор4форміл-2-метилбутил]тіофен-2-сульфонаміду (отриманого, як описано в прикладі 16, 1,0г, 2,86ммоль) у ТГФ (10мл) перемішують в атмосфері азоту при 0°С. Додають по краплях 3М розчин метилмагнійброміду в етиловому ефірі (1,9мл, 5,71ммоль) і отриманий розчин перемішують протягом 1 години при 25°С. По закінченні вказаного періоду реакція завершується, за даними ТШХ (EtOAc/гексан, 1:2). Розчин гасять насиченим водним розчином NH4CI (10мл) і екстрагують ефіром (40мл). Органічний шар промивають розсолом (20мл) і потім сушать над MgSO4 отримуючи неочищене масло (0,867г). Неочищений продукт очищають за допомогою хроматографічної системи Biotage FlashÔ 60, елюент EtOAc-гексан, 1:6, отримуючи 5-хлор-N[(1S,2R)-4,4,4-трифтор-1-(1-гірдроксіетил)-2метилбутил]тіофен-2-сульфонамід у вигляді безбарвного масла (0,495г, 49,5%). Мас-спектр (-ESI): 356 (М-Н)-. В. N-[(1S,2R)-1-Ацетил-4,4,4-трифтор-2метилбутил]-5-хлортіофен-2-сульфонамід Розчин 5-хлор-N-[(1S,2R)-4,4,4-трифтор-1-(1гірдроксіетил)-2-метилбутил]тіофен-2сульфонаміду (0,390г, 1,06ммоль) в СН2СI 2, насиченому водою (30мл), перемішують в атмосфері азоту при 0°С. Додають в один прийом реагент Деса-Мартіна періодинан (0,95г, 2,23ммоль). Отриману суспензію перемішують при 25°С, контролюючи розвиток реакції аналізом методом ТШХ (EtOAc/гексан, 1:2). Оскільки швидкість конверсії вихідної речовини знижується, додатково додають 1-мл порції СН2СI 2, насиченого водою (три порції протягом 15хв.). Після витримування при 25°С протягом 19 годин реакція, за даними ТШХ, завершується. Розчин розбавляють Et2O (50мл) і додають розчин тіосульфату натрію (Na2S2O3, 11,83ммоль, 4,8г, 11екв.) до 80% насиченого водного розчину бікарбонату натрію (40мл). Суміш швидко перемішують протягом 10хв. доти, доки обидві фази стануть прозорими. Шари розділяють і 57 82093 58 водний шар екстрагують ефіром (20мл). Об'єднані органічні шари послідовно промивають насиченим водним розчином бікарбонату натрію (10мл) і розсолом (15мл), потім сушать над MgSO4, фільтрують і концентрують, отримуючи неочищене масло (0,38г). Неочищений продукт очищають за допомогою хроматографічної системи Biotage FJashÔ 40, елюент EtOAc-гексан, 1:6, отримуючи N-[(l1,2R)-1-ацетил-4,4,4-трифтор-2-метилбутил]5-хлортіофен-2-сульфонамід у вигляді білої твердої речовини (0,265г, 73,10%). Мас-спектр (-ESI): 362 (М-Н)-. A. Метил-4,4,4,4',4',4'-гексафтор-d1-валінат Аналіз. Розчин 4,4,4,4',4',4'-гексафтор-d1-валіну (1,1г, Обчислено для C11H13CINF3O3S2: С, 36,32; Η, 4,88ммоль) у суміші СН2Сi2:МеOН (4:1, 25мл) 3,6; Ν, 3,85. перемішують в атмосфері азоту при 0°С. Додають Знайдено: С, 36,08; Η, 3,2; Ν, 3,74. по краплях розчин TMS-діазометан (2,0М розчин в Приклад 18 гексані, 20мл, 19,55ммоль) і отриманий неоново5-N-(1S,2R)-4,4,4-трифтор-1-(1-гідрокси-1зеленуватий розчин перемішують протягом 19 метилетил)-2-метилбутил]тіофен-2-сульфонамід годин при 25°С. По закінченні вказаного періоду реакція, за даними ТШХ (10% МеОН в хлороформі), завершується. Після концентрування отриманий залишок метил-4,4,4,4',4',4'-гексафторd1-валінату (1,1г) використовують безпосередньо на наступній стадії без додаткового очищення. Мас-спектр (-ESI): 238 (М-Н)-. B. Метил-N-[(4-бром-5-хлортієн-2іл)сульфоніл]-4,4,4,4',4',4'-гексафтор-d1-валінат Розчин метил-4,4,4,4',4',4'-гексафтор-d1валінату (1,0г, 4,18ммоль) в СН2Сl2 (10мл) перемішують в атмосфері Ν2 при 25°С. Додають по краплях піридин (0,81мл, 10,04ммоль), потім в один прийом додають 4-бром-5-хлортіофен-2сульфонілхлорид (1,486 г, 5,05ммоль) і отриманий Розчин Ν-[(1S,2R)-1-ацетил-4,4,4-трифтор-2розчин перемішують протягом 19 годин при 25°С. метилбутил]-5-хлортіофен-2-сульфонаміду По закінченні вказаного періоду, за даними ТШХ (отриманого, як описано в прикладі 17, 0,100г, (EtOAc-гексан, 1:4), реакція завершується. Після 0,275ммоль) у ТГФ (5мл) перемішують в гасіння водою (1,0мл) суміш розбавляють СН2Сl2 атмосфері азоту при 0°С. Додають по краплях 3М (30мл). Органічний шар послідовно промивають 1н розчин метилмагнійброміду в етиловому ефірі водною хлористоводневою кислотою (10мл), (0,266мл, 0,824ммоль) і отриманий розчин насиченим водним розчином NaHCO3 (10мл) і перемішують протягом 19 годин при 25°С. По розсолом (15мл), потім сушать над MgSO4, закінченні вказаного періоду реакція фільтрують і концентрують, отримуючи неочищене завершується, за даними ТШХ (EtOAc/гексан, 1:2). масло (2,1г). Неочищений продукт очищують за Розчин гасять насиченим водним розчином NH4CI допомогою хроматографічної системи Biotage (10мл) і екстрагують ефіром (40мл). Органічний FlashÔ 40, елюент EtOAc-гексан, 1:6, отримуючи шар промивають розсолом (20мл) і потім сушать метил-N-[(4-бром-5-хлортієн-2-іл)сульфоніл]над MgSO4, отримуючи неочищене масло (0,110г). 4,4,4,4',4',4'-гексафтор-d1-валінат у вигляді білої Неочищений продукт очищають за допомогою твердої речовини (1,62г, 83,07%). хроматографічної системи Biotage FlashÔ 40, Мас-спектр (-ESI): 497 (М-Н)-. елюент EtOAc-гексан, 1:4, отримуючи 5-хлор-NC. 4-Бром-5-хлор-N-[3,3,3-трифтор-1[(1S,2R)-4,4,4-трифтор-1-(1-гідрокси-1-метилетил)(гідроксиметил)-2-(трифторметил)пропіл]тіофен-22-метилбутил]тіофен-2-сульфонамід у вигляді сульфонамід білої твердої речовини (0,049г, 46,6%). До розчину метил-N-[(4-бром-5-хлортієн-2Мас-спектр (-ESI): 378 (М-Н) . іл)сульфоніл]-4,4,4,4',4',4'-гексафторвалінату (1,45г Аналіз. 2,907ммоль) у ТГФ (20мл) в атмосфері N2 при 0°С Обчислено для C12H17ClNF3O3S2: С, 37,94; Η, додають боргідрид літію (LiBH4) (5,82мл, 4,51; Ν, 3,69. 11,64ммоль). Реакційну суміш залишають Знайдено: С, 37,45; Η, 4,03; Ν, 3,68. нагріватися до 25°С на 19 годин. Реакційну суміш Приклад 19 охолоджують до 0°С, реакцію гасять 2н HCI 4-Бром-5-хлор-N-[3,3,3-трифтор-1(поступове додавання), розбавляють ефіром (гідроксиметил)-2-(трифторметил}нропіл1тіофен(40мл) і органічний шар послідовно промивають 1н 2-сульфонамід водною хлористоводневою кислотою (10мл), насиченим водним розчином NaHCO3 (10мл) і розсолом (15мл), потім сушать над MgSO4, фільтрують і концентрують, отримуючи неочищене масло (1,3г). Неочищений продукт очищають за 59 82093 60 допомогою хроматографічної системи Biotage A. 5-Хлор-N-[3,3,3-трифтор-1-(гідроксиметил)2-(трифторметил)пропіл]тіофен-4FlashÔ 40, елюент EtOAc-гексан, 1:6, отримуючи (трибутилстаніл)-2-сульфонамід 4-бром-5-хлор-N-[3,3,3-трифтор-1-(гідроксиметил)До розчину 4-бром-5-хлор-N-[3,3,3-трифтор-12-(трифторметил)пропіл]тіофен-2-сульфонамід у (гідроксиметил)-2-(трифторметил)пропіл]тіофен-2вигляді білої твердої речовини (1,13г, 84,32%). сульфонаміду (отриманого, як описано в прикладі Мас-спектр (-ESI): 469 (М-Н)-. 19, 0,9г, 1,91ммоль) в 1,4-діоксані (42мл) додають Аналіз. біс(трибутилолово) (0,939г, 2,87ммоль) і Обчислено для C9H7ClBrNF6O3S2: С, 22,97 Η, тетракіс(трифенілфосфін)паладій(0) (0,221г, 1,50; Ν, 2,98. 0,191ммоль). Коричневий розчин кип'ятять зі Знайдено: С, 23,11; Η, 1,16; Ν, 2,78. зворотним холодильником протягом ночі (19 Приклад 20 годин). Відбирають аліквоту, і ТШХ (EtOAc-гексан, 4-Бром-5-хлор-N-[(1S)-3,3,3-трифтор-11:1) показує, що реакція завершилася. Потім (гідроксиметил)-2-(трифторметил)пропіл]тіофен-2завись фільтрують, видаляють розчинник у сульфонамід вакуумі, отримуючи жовте масло (1,31г). Неочищений продукт очищають за допомогою хроматографічної системи Biotage FlashÔ 40, елюент EtOAc-гексан, 1:6, отримуючи 3-хлор-N[3,3,3-трифтор-1-(гідроксиметил)-2(трифторметил)пропіл]тіофен-4-(трибутилстаніл)2-сульфонамід у вигляді білої твердої речовини (0,220г, 18,86%). Мас-спектр (-ESI): 554 (М-Н)-. B. 5-Хлор-4-фтор-N-[3,3,3-трифтор-1(гідроксиметил)-2-(трифторметил)пропіл]тіофен-2сульфонамід Розчин 4-бром-5-хлортіофен-2Розчин 5-хлор-N-[3,3,3-трифтор-1сульфонілхлориду (0,193г, 0,654ммоль) в СН2СI 2 (гідроксиметил)-2-(трифторметил)пропіл]тіофен-4(1,0мл) додають по краплях (5хв.) до розчину (2S)(трибутилстаніл)-2-сульфонаміду (0,220г, 2-аміно-3,3,3-трифтор-3-(трифторметил)бутан-10,396ммоль) у сухому ацетонітрилі (10мл) олу (отриманого згідно зі способом прикладу 13, перемішують в атмосфері азоту при 25°С. 0,115г, 0,548ммоль) в СН2СI 2 (10мл) і піридині Додають в один прийом реагент SelectfluorÒ (0,9мл, 1,09ммоль), охолодженому до 0°С. Розчин (0,147г, 0,416ммоль) і розчин перемішують залишають нагріватися до 25°С на ніч (19 годин). протягом 19 годин при 25°С. Через 3 години Відбирають аліквоту, і ТШХ (EtOAc-гексан, 1:1) починає з'являтися білий осад. Через 19 годин показує, що реакція завершилася. Реакційну суміш відбирають аліквоту, і ТШХ (EtOAc-гексан, 1:2) розбавляють СН2СI 2 (100мл) і органічний шар показує, що реакція не завершилася. В основному, промивають 1н HCI (2´50мл) і насиченим водним присутня вихідна речовина. Реакційну суміш розчином NaCl (50мл), сушать над MgSO4, нагрівають при 80°С протягом 6 годин. Відбирають фільтрують і концентрують, отримуючи неочищену аліквоту, і ТШХ (ЕЮAc-гексан, 1:2) показує, що не зовсім білу тверду речовину (0,270г). реакція завершилася. Потім завись фільтрують, Неочищений продукт очищають за допомогою видаляють розчинник у вакуумі, отримуючи жовте хроматографічної системи Biotage FlashÔ 40, масло (0,11г). Неочищений продукт очищають елюент EtOAc-гексан, 1:6, отримуючи 4-бром-5препаративною ОФ-ВЕРХ (колонка з PrimeshereÔ, хлор-N-[(1S)-3,3,3-трифтор-1-(гідроксиметил)-22´25см, елюент 55% MeCN у 0,01% водному (трифторметил)пропіл]тіофен-2-сульфонамід у розчині трифтороцтової кислоти (ТФК), об'ємна вигляді білої твердої речовини (39мг, 15,11%). витрата=25 мл/хв., Rt 4,401хв.), отримуючи 5-хлорМас-спектр (-ESI): 469 (М-Н)-. 4-фтор-N-[3,3,3-трифтор-1-(гідроксиметил)-2Приклад 21 (трифторметил)пропіл]тіофен-2-сульфонамід у 5-Хлор-4-фтор-N-[3,3,3-трифтор-1вигляді аморфної білої твердої речовини (0,004г, (гідроксиметил)-2-(трифторметил)пропіл]тіофен-224,69%). сульфонамід Мас-спектр (-ESI): 408 (М-Н)-. Приклад 22 4-Бpoc-N-[3,3,3 -трифтор-1-(гідроксиметил)-2(трифторметил)пропіл]тіофен-2-сульфонамід
ДивитисяДодаткова інформація
Назва патенту англійськоюFluoro- and trifluoroalkyl-containing heterocyclic sulfonamide inhibitors of beta amyloid production and derivatives thereof
Автори англійськоюKREFT ANTHONY FRANK, Resnick Lynn, Mayer Scott Christian, Diamantidis George, COLE DEREK CECIL, Wang Tingzhong, Galante Rocco John, Hoke Molly, Harrison Boyd Lynn, Zhang Minsheng
Назва патенту російськоюФтор- и трифторалкилосодержащие гетероциклические сульфонамидные ингибиторы образования бета-амилоида и их производные
Автори російськоюКрефт Энтони Франк, Ресник Линн, Майер Скотт Кристиан, Диамантидис Джорж, Коул Дерек Сесил, Ван Тинчжун, Галанте Рокко Джон, Хоук Молли, Харрисон Бойд Линн, Чжан Миншен
МПК / Мітки
МПК: C07D 333/62, A61P 25/28, C07D 333/34, C07D 231/18
Мітки: утворення, сульфонамідні, гетероциклічні, інгібітори, трифторалкіловмісні, фтор, похідні, бета-амілоїду
Код посилання
<a href="https://ua.patents.su/40-82093-ftor-ta-triftoralkilovmisni-geterociklichni-sulfonamidni-ingibitori-utvorennya-beta-amilodu-ta-kh-pokhidni.html" target="_blank" rel="follow" title="База патентів України">Фтор- та трифторалкіловмісні гетероциклічні сульфонамідні інгібітори утворення бета-амілоїду та їх похідні</a>
Попередній патент: Заглушка ракетного двигуна малої тяги
Наступний патент: Пристрій для вимірювання гемодинамічних параметрів і спосіб здійснення вимірювань
Випадковий патент: Канал вимірювання радіальної швидкості літальних апаратів з використанням частот міжмодових биттів для полігонного вимірювального комплексу