Гексациклічні сполуки
Номер патенту: 80409
Опубліковано: 25.09.2007
Автори: Мурата Такеші, Суда Хітомі, Ніізума Сатоші, Шимма Нобуо, Цуказакі Масао
Формула / Реферат
1. Гексациклічні сполуки за формулою (1)
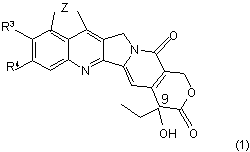 ,
,
де
Z являє собою -NH-C(=X)-N(R1)- або –N=C(R2)-N(R1)-;
R1 являє собою водень;
(С1-С10)алкіл, необов'язково заміщений однією - трьома складовими, що незалежно вибрані з групи, яка складається з (С1-С5)алкокси, гідрокси, галогену, аміно, моно-(С1-С5)алкіламіно, ді-(С1-С5)алкіламіно та (С3-С7)циклоалкілу, гетероциклічного кільця та арилу, де арильне кільце необов'язково заміщене однією - трьома складовими, що незалежно вибрані з групи, яка складається з гідрокси, алкокси, галогену, аміно, моно-(C1-С5)алкіламіно та ді-(С1-С5)алкіламіно;
R2 являє собою водень; аміно; (С1-С5)алкіл, (С1-С5)алкокси, (С1-С5)алкілтіо, моно-(С1-С5)алкіламіно, ді-(С1-С5)алкіламіно, що необов'язково заміщені однією - трьома складовими, які незалежно вибрані з групи, яка складається з (С1-С5)алкокси, гідрокси, галогену, аміно, (С3-С7)циклоалкілу, гетероциклічного кільця або арилу, де арильне кільце необов'язково заміщене однією - трьома складовими, що незалежно вибрані з групи, яка складається з гідрокси, (С1-С5)алкокси, аміно, моно-(С1-С5)алкіламіно або ді-(С1-С5)алкіламіно;
R3 та R4 являють собою незалежно водень, галоген або (С1-С5)алкіл; та
Х являє собою кисень або сірку;
та їх фармацевтичнo прийнятні солі.
2. Сполука за п. 1, де стереохімія положення 9 сполуки за формулою (1) являє собою S-конфігурацію.
3. Сполука за п. 1 або 2, яка представлена формулою (1А)
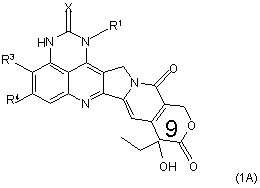 ,
,
де X являє собою кисень та R1, R3 та R4 є такими, як визначено у п. 1, та її фармацевтичнo прийнятні солі.
4. Сполука за п. 3, де
R1 являє собою водень; або
(С1-С8)алкіл, необов'язково заміщений однією або трьома складовими, що незалежно вибрані з групи, яка складається з (С1-С3)алкокси, гідрокси, галогену, аміно, моно-(С1-С3)алкіламіно, ді-(С1-С3)алкіламіно, (С3-С7)циклоалкілу, гетероциклічного кільця та арилу, де арильне кільце необов'язково заміщене однією - трьома складовими, що незалежно вибрані з групи, яка складається з гідрокси, алкокси та галогену; та
R3 тa R4 являють собою водень.
5. Сполука за п. 4, де R1 являє собою (С1-С8)алкіл, феніл-(С1-С8)алкіл, гетероцикл-(С1-С8)алкіл, алкоксифеніл(С1-С8)алкіл або галогенфеніл(С1-С8)алкіл.
6. Сполука за п. 5, де R1 являє собою метил, етил, n-пропіл, 1-метилетил, n-бутил, 1,1-диметилетил, 2-метилпропіл, 2,2-диметилпропіл, n-пентил, 3-метилбутил, 2-n-гексил, 3,3-диметилбутил, n-гептил, n-октил, бензил, фенетил, 2-(диметиламіно)етил, 2-(4-морфоліно)етил, 3-(диметиламіно)пропіл, 2-(піридин-2-іл)етил, 2-(піридин-3-іл)етил, 2-(4-метоксифеніл)етил, 2-(4-хлорфеніл)етил, 2-(4-фторфеніл)етил або 3-фенілпропіл.
7. Сполука за будь-яким з пп. 3-6, яка вибрана з групи, що складається з:
a) (9S)-1-бутил-9-етил-9-гідрокси-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-2,10,13(3Н,9Н,15Н)-триону,
b) (9S)-9-етил-9-гідрокси-1-[2-(4-морфоліно)етил]-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-2,10,13(3Н,9Н,15Н)-
триону гідрохлориду,
c) (9S)-1-[3-(диметиламіно)пропіл]-9-етил-9-гідрокси-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-2,10,13(3Н,9Н,15Н)-триону гідрохлориду,
d) (9S)-9-етил-9-гідрокси-1-фенетил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-2,10,13(3Н,9Н,15Н)-триону,
e) (9S)-9-етил-9-гідрокси-1-[2-(піридин-2-іл)етил]-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-2,10,13(3Н,9Н,15Н)-триону гідрохлориду,
f) (9S')-9-етил-1-гептил-9-гідрокси-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-2,10,13(3Н,9Н,15Н)-триону,
g) (9S)-9-етил-9-гідрокси-1-пропіл-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-2,10,13(3Н,9Н,15Н)-триону,
h) (9S)-9-етил-9-гідрокси-1-[2-(піридин-3-іл)етил]-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-2,10,13(3Н,9Н,15Н)-триону гідрохлориду,
і) (9S)-9-етил-9-гідрокси-1-(3-фенілпропіл)-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-2,10,13(3Н,9Н,15Н)-триону,
j) (9S)-9-етил-9-гідрокси-1-(2-метилпропіл)-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-2,10,13(3Н,9Н,15Н)-триону,
k) (9S)-9-етил-1-гексил-9-гідрокси-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-2,10,13(3Н,9Н,15Н)-триону,
l) (9S)-9-етил-9-гідрокси-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-2,10,13(3Н,9Н,15Н)-триону,
m) (9S)-9-етил-9-гідрокси-1-[2-(4-метоксифеніл)етил]-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-2,10,13(3Н,9Н,15Н)-триону,
n) (9S)-1-бензил-9-етил-9-гідрокси-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-2,10,13(3Н,9Н,15Н)-триону,
о) (9S)-9-етил-9-гідрокси-1-(3-метилбутил)-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-2,10,13(3Н,9Н,15Н)-триону,
р) (9S)-1,9-діетил-9-гідрокси-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-2,10,13(3Н,9Н,15Н)-триону,
q) (9S)-1-[2-(4-хлорфеніл)етил]-9-етил-9-гідрокси-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-2,10,13(3Н,9Н,15Н)-триону,
r) (9S)-9-етил-1-[2-(4-фторфеніл)етил]-9-гідрокси-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-2,10,13(3Н,9Н,15Н)-триону,
s) (9S)-9-етил-9-гідрокси-1-(1-метилетил)-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-2,10,13(3Н,9Н,15Н)-триону та
t) (9S)-1-(3,3-диметилбутил)-9-етил-9-гідрокси-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-2,10,13(3Н,9Н,15Н)-триону.
8. Сполука за п. 7, яка вибрана з групи, що складається з:
a) (9S)-1-бутил-9-етил-9-гідрокси-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-2,10,13(3Н,9Н,15Н)-триону,
b) (9S)-9-етил-9-гідрокси-1-фенетил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-2,10,13(3Н,9Н,15Н)-триону,
c) (9S)-9-етил-9-гідрокси-1-(2-метилпропіл)-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-2,10,13(3Н,9Н,15Н)-триону,
d) (9S)-9-етил-1-гексил-9-гідрокси-1Н,12Н-пipaнo[3",4":6',7']iндoлiзинo[1',2':6,5]пipидo[4,3,2-de]xiнaзoлiн-2,10,13(3H,9H,15H)-триону,
e) (9S)-9-етил-9-гідрокси-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-2,10,13(3Н,9Н,15Н)-триону,
f) (9S)-9-етил-9-гідрокси-1-(3-метилбутил)-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-2,10,13(3Н,9Н,15Н)-триону,
g) (9S)-1-[2-(4-хлорфеніл)етил]-9-етил-9-гідрокси-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-2,10,13(ЗН,9Н,15Н)-триону,
h) (9S)-9-етил-1-[2-(4-фторфеніл)етил]-9-гідрокси-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-2,10,13(3Н,9Н,15Н)-триону та
і) (9S)-1-(3,3-диметилбутил)-9-етил-9-гідрокси-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-2,10,13(3Н,9Н,15Н)-триону.
9. Сполука за п. 1 або 2 за формулою (1А)
 ,
,
де Х являє собою сірку, та R1 , R3 та R4 є такими, як визначено у п. 1, та її фармацевтичнo прийнятні солі.
10. Сполука за п. 9, де
R1 являє собою водень; (С1-С8)алкіл, необов'язково заміщений однією - трьома складовими, що незалежно вибрані з групи, яка складається з (С1-С3)алкокси, гідрокси, галогену, аміно, моно-(С1-С3)алкіламіно, ді-(С1-С3)алкіламіно, (С3-С7)циклоалкілу, гетероциклічного кільця або арилу, де арильне кільце необов'язково заміщене однією -трьома складовими, що незалежно вибрані з групи, яка складається з гідрокси, алкокси або галогену; та
R3 тa R4 являють собою водень.
11. Сполука за п. 10, де R1 являє собою (С1-С8)алкіл або феніл(С1-С8)алкіл.
12. Сполука за п. 11, де R1 являє собою фенетил, 3-метилбутил або n-пентил.
13. Сполука за будь-яким з пп. 9 -12, яка вибрана з групи, що складається з:
а) (9S)-9-етил-9-гідрокси-1-(3-метилбутил)-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-2(3Н)-тіон-10,13(9Н,15Н)-діону,
b) (9S)-9-етил-9-гідрокси-1-фенетил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-2(3Н)-тіон-10,13(9Н,15Н)-діону та
c) (9S)-9-етил-9-гідрокси-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-2(3Н)-тіон-10,13(9Н,15Н)-діону.
14. Сполука за п. 1 або 2 за формулою (1В)
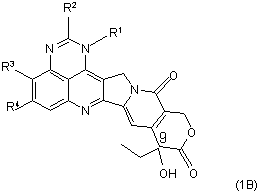 ,
,
де R1, R2, R3 та R4 є такими, як визначено у п. 1, та її фармацевтичнo прийнятні солі.
15. Сполука за п. 14, де
R1 являє собою водень;
(С1-С8)алкіл, який необов'язково заміщений однією - трьома складовими, що незалежно вибрані з групи, яка складається з (С1-С3)алкокси, гідрокси, галогену, аміно, моно-(С1-С3)алкіламіно, ді-(С1-С3)алкіламіно, (С3-С7)циклоалкілу, гетероциклічного кільця та арилу, де арильне кільце необов'язково заміщене однією - трьома складовими, що незалежно вибрані з групи, яка складається з гідрокси, алкокси та галогену;
R2 являє собою водень;
аміно; (С1-С5)алкіл, необов'язково заміщений однією - трьома складовими, що незалежно вибрані з групи, яка складається з (С1-С5)алкокси, гідрокси, галогену, аміно, моно-(С1-С5)алкіламіно, ді-(С1-С5)алкіламіно, (С3-С7)циклоалкілу, гетероциклічного кільця та арилу; (С1-С5)алкілтіо, (С1-С5)алкокси, моно-(С1-С5)алкіламіно та ді-(С1-С5)алкіламіно;
R3 являє собою водень або (С1-С3)алкіл; та
R4 являє собою водень.
16. Сполука за п. 15, де
R1 являє собою метил, етил, n-пропіл, 1-метилетил, n-бутил, 1,1-диметилетил, 2-метилпропіл, 2,2-диметилпропіл, n-пентил, 3-метилбутил, 2-n-гексил, 3,3-диметилбутил, n-гептил, n-октил, бензил, фенетил, 2-(диметиламіно)етил, 2-(4-морфоліно)етил, 3-(диметиламіно)пропіл, 2-(піридин-2-іл)етил, 2-(піридин-3-іл)етил, 2-(4-метоксифеніл)етил, 2-(4-хлорфеніл)етил або 2-(4-фторфеніл)етил, 3-фенілпропіл;
R2 являє собою водень, метил, етил, пропіл, гідроксиметил, амінометил, (метиламіно)метил, (диметиламіно)метил, хлорметил, трифторметил, феніл, 2-піридил, метокси, етокси, метилтіо, етилтіо, метиламіно, бутиламіно або диметиламіно;
R3 являє собою водень або метил; та
R4 являє собою водень.
17. Сполука за будь-яким з пп. 14-16, яка вибрана з групи, що складається з:
a) (9S)-1-бутил-9-етил-9-гідрокси-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-10,13(9Н,15Н)-діону,
b) (9S)-9-етил-9-гідрокси-1-[2-(4-морфоліно)етил]-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-10,13(9Н,15Н)діону гідрохлориду,
c) (9S)-9-етил-9-гідрокси-1-пропіл-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-10,13(9Н,15Н)-діону,
d) (9S)-1-бензил-9-етил-9-гідрокси-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-10,13(9Н,15Н)-діону,
e) (9S)-9-етил-9-гідрокси-1-фенетил-1Н,12Н-пірано[3",4":6',7']індолізино[1’,2’:6,5]піридо[4,3,2-de]хіназолін-10,13(9Н,15Н)-діону,
f) (9S)-2,9-діетил-9-гідрокси-1-фенетил-1Н,12Н-пірано[3",4":6',7']індолізино[1’,2’:6,5]піридо[4,3,2-de]хіназолін-10,13(9Н,15Н)-діону,
g) (9S)-9-етил-9-гідрокси-1-(3-фенілпропіл)-1Н,12Н-пірано[3",4":6',7']індолізино[1’,2’:6,5]піридо[4,3,2-de]хіназолін-10,13(9Н,15Н)-діону,
h) (9S)-9-етил-9-гідрокси-1-(3-метилбутил)-1Н,12Н-пірано[3",4":6',7']індолізино[1’,2’:6,5]піридо[4,3,2-de]хіназолін-10,13(9Н,15Н)-діону,
і) (9S)-2,9-діетил-9-гідрокси-1-(3-метилбутил)-1Н,12Н-пірано[3",4":6',7']індолізино[1’,2’:6,5]піридо[4,3,2-de]хіназолін-10,13(9Н,15Н)-діону,
j) (9S)-2,9-діетил-9-гідрокси-1-(2-метилпропіл)-1Н,12Н-пірано[3",4":6',7']індолізино[1’,2’:6,5]піридо[4,3,2-de]хіназолін-10,13(9Н,15Н)-діону,
k) (9S)-9-етил-1-гептил-9-гідрокси-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-10,13(9Н,15Н)-діону,
l) (9S)-9-етил-9-гідрокси-1-метил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-10,13(9Н,15Н)-діону,
m) (9S)-9-етил-9-гідрокси-1-(2-метилпропіл)-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-10,13(9Н,15Н)-діону,
n) (9S)-9-етил-1-гексил-9-гідрокси-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-10,13(9Н,15Н)-діону,
о) (9S)-9-етил-9-гідрокси-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-10,13(9Н,15Н)-діону,
р) (9S)-1,9-діетил-9-гідрокси-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-10,13(9Н,15Н)-діону,
q) (9S)-9-етил-9-гідрокси-1-[2-(4-метоксифеніл)етил]-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-10,13(9Н,15Н)-діону,
r) (9S)-1-[2-(4-хлорфеніл)етил]-9-етил-9-гідрокси-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-10,13(9Н,15Н)-діону,
s) (9S)-9-етил-1-[2-(4-фторфеніл)етил]-9-гідрокси-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-10,13(9Н,15Н)-діону,
t) (9S)-9-етил-1-[2-(4-фторфеніл)етил]-9-гідрокси-2-метил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-10,13(9Н,15Н)-діону,
u) (9S)-9-етил-9-гідрокси-1-(1-метилетил)-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-10,13(9Н,15Н)-діону,
v) (9S)-1-(3,3-диметилбутил)-9-етил-9-гідрокси-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-10,13(9Н,15Н)-діону,
w) (9S)-9-етил-9-гідрокси-2-метокси-1-(3-метилбутил)-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-10,13(9Н,15Н)-діону,
х) (9S)-2,9-діетил-9-гідрокси-1-(3-метилбутил)-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-10,13(9Н,15Н)-діону,
у) (9RS)-9-етил-9-гідрокси-4-метил-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-10,13(9Н,15Н)-діону,
z) (9S)-9-етил-9-гідрокси-1-(2-гідроксіетил)-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-10,13(9Н,15Н)-діону,
аа) (9S)-9-етил-9-гідрокси-1-(2-гідроксіетил)-2-метил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-10,13(9Н,15Н)-діону,
bb) (9S)-9-етил-9-гідрокси-2-метил-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-10,13(9Н,15Н)-діону,
сс) (9S)-2,9-діетил-9-гідрокси-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-10,13(9Н,15Н)-діону,
dd) (9S)-9-етил-9-гідрокси-1-пентил-2-пропіл-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-10,13(9Н,15Н)-діону,
ее) (9S)-9-етил-9-гідрокси-2-гідроксиметил-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1’,2’:6,5]піридо[4,3,2-de]хіназолін-10,13(9Н,15Н)-діону,
ff) (9S)-9-етил-9-гідрокси-2-гідроксиметил-1-(2-метилпропіл)-1Н,12Н-пірано[3",4":6',7']індолізино[1’,2’:6,5]піридо[4,3,2-de]хіназолін-10,13(9Н,15Н)-діону,
gg) (9S)-9-етил-9-гідрокси-2-гідроксиметил-1-(3-метилбутил)-1Н,12Н-пірано[3",4":6',7']індолізино[1’,2’:6,5]піридо[4,3,2-de]хіназолін-10,13(9Н,15Н)-діону,
hh) (9S)-2-хлорметил-9-етил-9-гідрокси-1-(3-метилбутил)-1Н,12Н-пірано[3",4":6',7']індолізино[1’,2’:6,5]піридо[4,3,2-de]хіназолін-10,13(9Н,15Н)-діону,
іі) (9S)-2-амінометил-9-етил-9-гідрокси-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1’,2’:6,5]піридо[4,3,2-de]хіназолін-10,13(9Н,15Н)-діону,
jj) (9S)-9-Етил-9-гідрокси-1-пентил-2-трифторметил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-10,13(9Н,15Н)-діону,
kk) (9S)-9-етил-9-гідрокси-1-(3-метилбутил)-2-метилтіо-1Н,12Н-пірано[3",4":6',7']індолізино[1’,2’:6,5]піридо[4,3,2-de]хіназолін-10,13(9Н,15Н)-діону,
ll) (9S)-9-етил-2-етилтіо-9-гідрокси-1-(3-метилбутил)-1Н,12Н-пірано[3",4":6',7']індолізино[1’,2’:6,5]піридо[4,3,2-de]хіназолін-10,13(9Н,15Н)-діону,
mm) (9S)-2-(диметиламіно)-9-етил-9-гідрокси-1-(2-метилпропіл)-1Н,12Н-пірано[3",4":6',7']індолізино[1’,2’:6,5]піридо[4,3,2-de]хіназолін-10,13(9Н,15Н)-діону гідрохлориду та
nn) (9S)-2-(бутиламіно)-9-етил-9-гідрокси-1-(3-метилбутил)-1Н,12Н-пірано[3",4":6',7']індолізино[1’,2’:6,5]піридо[4,3,2-de]хіназолін-10,13(9Н,15Н)-діону гідрохлориду.
18. Сполука за п. 17, яка вибрана з групи, що складається з:
a) (9S)-1-бутил-9-етил-9-гідрокси-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-10,13(9Н,15Н)-діону,
b) (9S)-9-етил-9-гідрокси-1-фенетил-1Н,12Н-пірано[3",4":6',7']індолізино[1’,2’:6,5]піридо[4,3,2-de]хіназолін-10,13(9Н,15Н)-діону,
c) (9S)-9-етил-9-гідрокси-1-(3-метилбутил)-1Н,12Н-пірано[3",4":6',7']індолізино[1’,2’:6,5]піридо[4,3,2-de]хіназолін-10,13(9Н,15Н)-діону,
d) (9S)-9-етил-9-гідрокси-1-(2-метилпропіл)-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-10,13(9Н,15Н)-діону,
e) (9S)-9-етил-9-гідрокси-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-10,13(9Н,15Н)-діону,
f) (9S)-9-етил-1-[2-(4-фторфеніл)етил]-9-гідрокси-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-10,13(9Н,15Н)-діону,
g) (9S)-1-(3,3-диметилбутил)-9-етил-9-гідрокси-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-10,13(9Н,15Н)-діону,
h) (9S)-9-етил-9-гідрокси-2-метил-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-de]хіназолін-10,13(9Н,15Н)-діону,
і) (9S)-9-етил-9-гідрокси-2-гідроксиметил-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1’,2’:6,5]піридо[4,3,2-de]хіназолін-10,13(9Н,15Н)-діону та
j) (9S)-2-амінометил-9-етил-9-гідрокси-1-пентил-1Н,12Н-пірано[3",4":6',7']індолізино[1’,2’:6,5]піридо[4,3,2-de]хіназолін-10,13(9Н,15Н)-діону.
19. Фармацевтична композиція, яка містить сполуку за будь-яким з пп. 1 -18 як активне начало та фармацевтичнo прийнятний носій.
20. Фармацевтична композиція за п. 19, яка є придатною для перорального або парентерального введення.
21. Застосування сполуки, яку визначено у будь-якому з пп. 1-18, для одержання лікарських засобів.
22. Застосування сполуки, яку визначено у будь-якому з пп. 1-18, для одержання лікарських засобів для лікування розладів, пов'язаних з проліферацією клітин.
23. Застосування сполуки, яку визначено у будь-якому з пп. 1-18, для одержання лікарських засобів для лікування раку.
24. Спосіб лікування розладів, пов'язаних з проліферацією клітин, який включає введення пацієнтові, якому це необхідно, терапевтично ефективної кількості сполуки за будь-яким з пп. 1-18.
25. Спосіб за п. 24, де розлад, пов'язаний з проліферацією клітин, є раком.
26. Спосіб за п. 25, де рак являє собою тверду пухлину.
27. Спосіб за будь-яким з пп. 24 - 25, де рак являє собою рак прямої кишки, рак легенів, рак грудей, рак шлунку, рак шийки матки та рак сечового міхура.
28. Спосіб одержання сполуки за формулою (2)
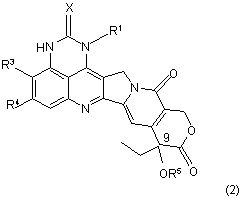 ,
,
де R1, R3, R4 та X є такими, як визначено у п. 1, та R5 являє собою (С1-С5)алканоїл, в якому піддають реакції сполуку за формулою (3) або її сіль
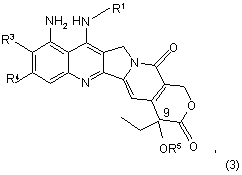
де R1, R3, R4 та R5 є такими, як визначено вище, зі сполукою за формулою (4)
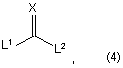
де Х являє собою кисень або сірку, та L1 та L2 являють собою групи, що вилучаються, у присутності лугу.
29. Спосіб одержання сполуки за формулою (5)
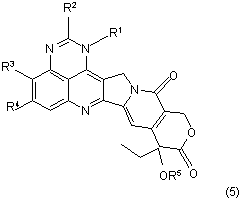 ,
,
де R1, R2, R3 та R4 є такими, як визначено у п. 1, та R5 являє собою (С1-С5)алканоїл, при якому піддають реакції сполуку за формулою (3) або її сіль.

де R1, R3, R4 та R5 є такими, як визначено вище, зі сполукою за формулою (6)
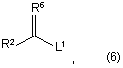
де R2 є таким, як визначено у п. 1, R6 являє собою кисень, сірку, =(OR7)2, де R7 являє собою (C1-C3)алкіл; =NR8, де R8 являє собою водень, (С1-С3)алкіл, (С1-С3)алканоїл, алкоксикарбоніл; =N+R9R10, де R9 та R10 являють собою незалежно (С1-С3)алкіл; або галоген; та L1 являє собою групу, що вилучається.
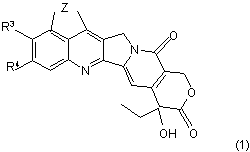
30. Спосіб одержання сполуки за формулою (1), як визначено у п. 1, або її фармацевтичнo прийнятної солі
 ,
,
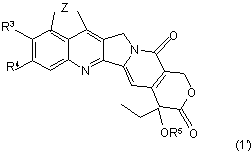
де Z, R1, R2, R3 та R4 є такими, як визначено у п. 1, який включає обробку сполуки за формулою (1')
 ,
,
де Z, R1, R2 та R4 є такими, як визначено вище; та R5 являє собою (С1-С5)алканоїл, шляхом деацилування гідразином або його похідним.
31. Сполука, одержана за способом, який визначено у пп. 28-30.
32. Сполука, яку визначено у пп. 1-18, для застосування як лікарського засобу.
33. Сполука, яку визначено у пп. 1-18, для застосування у лікуванні розладів, пов'язаних з проліферацією клітин.
Текст
1. Гексациклічні сполуки за формулою (1) Z C2 2 (19) 1 3 незалежно вибрані з групи, яка складається з гідрокси, алкокси та галогену; та R3 тa R4 являють собою водень. 5. Сполука за п. 4, де R1 являє собою (С1С8)алкіл, феніл-(С1-С8)алкіл, гетероцикл-(С1С8)алкіл, алкоксифеніл(С1-С8)алкіл або галогенфеніл(С1-С8)алкіл. 6. Сполука за п. 5, де R1 являє собою метил, етил, n-пропіл, 1-метилетил, n-бутил, 1,1-диметилетил, 2-метилпропіл, 2,2-диметилпропіл, n-пентил, 3метилбутил, 2-n-гексил, 3,3-диметилбутил, nгептил, n-октил, бензил, фенетил, 2(диметиламіно)етил, 2-(4-морфоліно)етил, 3(диметиламіно)пропіл, 2-(піридин-2-іл)етил, 2(піридин-3-іл)етил, 2-(4-метоксифеніл)етил, 2-(4хлорфеніл)етил, 2-(4-фторфеніл)етил або 3фенілпропіл. 7. Сполука за будь-яким з пп. 3-6, яка вибрана з групи, що складається з: a) (9S)-1-бутил-9-етил-9-гідрокси-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-2,10,13(3Н,9Н,15Н)-триону, b) (9S)-9-етил-9-гідрокси-1-[2-(4-морфоліно)етил]1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-2,10,13(3Н,9Н,15Н)триону гідрохлориду, c) (9S)-1-[3-(диметиламіно)пропіл]-9-етил-9гідрокси-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-2,10,13(3Н,9Н,15Н)-триону гідрохлориду, d) (9S)-9-етил-9-гідрокси-1-фенетил-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-2,10,13(3Н,9Н,15Н)-триону, e) (9S)-9-етил-9-гідрокси-1-[2-(піридин-2-іл)етил]1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-2,10,13(3Н,9Н,15Н)-триону гідрохлориду, f) (9S')-9-етил-1-гептил-9-гідрокси-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-2,10,13(3Н,9Н,15Н)-триону, g) (9S)-9-етил-9-гідрокси-1-пропіл-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-2,10,13(3Н,9Н,15Н)-триону, h) (9S)-9-етил-9-гідрокси-1-[2-(піридин-3-іл)етил]1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-2,10,13(3Н,9Н,15Н)-триону гідрохлориду, і) (9S)-9-етил-9-гідрокси-1-(3-фенілпропіл)-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-2,10,13(3Н,9Н,15Н)-триону, j) (9S)-9-етил-9-гідрокси-1-(2-метилпропіл)-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-2,10,13(3Н,9Н,15Н)-триону, k) (9S)-9-етил-1-гексил-9-гідрокси-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-2,10,13(3Н,9Н,15Н)-триону, l) (9S)-9-етил-9-гідрокси-1-пентил-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-2,10,13(3Н,9Н,15Н)-триону, m) (9S)-9-етил-9-гідрокси-1-[2-(4метоксифеніл)етил]-1Н,12Н 80409 4 пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-2,10,13(3Н,9Н,15Н)-триону, n) (9S)-1-бензил-9-етил-9-гідрокси-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-2,10,13(3Н,9Н,15Н)-триону, о) (9S)-9-етил-9-гідрокси-1-(3-метилбутил)-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-2,10,13(3Н,9Н,15Н)-триону, р) (9S)-1,9-діетил-9-гідрокси-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-2,10,13(3Н,9Н,15Н)-триону, q) (9S)-1-[2-(4-хлорфеніл)етил]-9-етил-9-гідрокси1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-2,10,13(3Н,9Н,15Н)-триону, r) (9S)-9-етил-1-[2-(4-фторфеніл)етил]-9-гідрокси1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-2,10,13(3Н,9Н,15Н)-триону, s) (9S)-9-етил-9-гідрокси-1-(1-метилетил)-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-2,10,13(3Н,9Н,15Н)-триону та t) (9S)-1-(3,3-диметилбутил)-9-етил-9-гідрокси1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-2,10,13(3Н,9Н,15Н)-триону. 8. Сполука за п. 7, яка вибрана з групи, що складається з: a) (9S)-1-бутил-9-етил-9-гідрокси-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-2,10,13(3Н,9Н,15Н)-триону, b) (9S)-9-етил-9-гідрокси-1-фенетил-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-2,10,13(3Н,9Н,15Н)-триону, c) (9S)-9-етил-9-гідрокси-1-(2-метилпропіл)1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-2,10,13(3Н,9Н,15Н)-триону, d) (9S)-9-етил-1-гексил-9-гідрокси-1Н,12Нпipaнo[3",4":6',7']iндoлiзинo[1',2':6,5]пipидo[4,3,2de]xiнaзoлiн-2,10,13(3H,9H,15H)-триону, e) (9S)-9-етил-9-гідрокси-1-пентил-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-2,10,13(3Н,9Н,15Н)-триону, f) (9S)-9-етил-9-гідрокси-1-(3-метилбутил)-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-2,10,13(3Н,9Н,15Н)-триону, g) (9S)-1-[2-(4-хлорфеніл)етил]-9-етил-9-гідрокси1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-2,10,13(ЗН,9Н,15Н)-триону, h) (9S)-9-етил-1-[2-(4-фторфеніл)етил]-9-гідрокси1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-2,10,13(3Н,9Н,15Н)-триону та і) (9S)-1-(3,3-диметилбутил)-9-етил-9-гідрокси1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-2,10,13(3Н,9Н,15Н)-триону. 9. Сполука за п. 1 або 2 за формулою (1А) 5 80409 X R1 HN N R3 O N R4 N 9 O OH O (1A) , де Х являє собою сірку, та R1 , R3 та R4 є такими, як визначено у п. 1, та її фармацевтичнo прийнятні солі. 10. Сполука за п. 9, де R1 являє собою водень; (С1-С8)алкіл, необов'язково заміщений однією - трьома складовими, що незалежно вибрані з групи, яка складається з (С1С3)алкокси, гідрокси, галогену, аміно, моно-(С1С3)алкіламіно, ді-(С1-С3)алкіламіно, (С3С7)циклоалкілу, гетероциклічного кільця або арилу, де арильне кільце необов'язково заміщене однією -трьома складовими, що незалежно вибрані з групи, яка складається з гідрокси, алкокси або галогену; та R3 тa R4 являють собою водень. 11. Сполука за п. 10, де R1 являє собою (С1С8)алкіл або феніл(С1-С8)алкіл. 12. Сполука за п. 11, де R1 являє собою фенетил, 3-метилбутил або n-пентил. 13. Сполука за будь-яким з пп. 9 -12, яка вибрана з групи, що складається з: а) (9S)-9-етил-9-гідрокси-1-(3-метилбутил)-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-2(3Н)-тіон-10,13(9Н,15Н)-діону, b) (9S)-9-етил-9-гідрокси-1-фенетил-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-2(3Н)-тіон-10,13(9Н,15Н)-діону та c) (9S)-9-етил-9-гідрокси-1-пентил-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-2(3Н)-тіон-10,13(9Н,15Н)-діону. 14. Сполука за п. 1 або 2 за формулою (1В) R2 R1 N N R3 O N R4 N 9 O OH O (1B) , де R1, R2, R3 та R4 є такими, як визначено у п. 1, та її фармацевтичнo прийнятні солі. 15. Сполука за п. 14, де R1 являє собою водень; (С1-С8)алкіл, який необов'язково заміщений однією - трьома складовими, що незалежно вибрані з 6 групи, яка складається з (С1-С3)алкокси, гідрокси, галогену, аміно, моно-(С1-С3)алкіламіно, ді-(С1С3)алкіламіно, (С3-С7)циклоалкілу, гетероциклічного кільця та арилу, де арильне кільце необов'язково заміщене однією - трьома складовими, що незалежно вибрані з групи, яка складається з гідрокси, алкокси та галогену; R2 являє собою водень; аміно; (С1-С5)алкіл, необов'язково заміщений однією - трьома складовими, що незалежно вибрані з групи, яка складається з (С1-С5)алкокси, гідрокси, галогену, аміно, моно-(С1-С5)алкіламіно, ді-(С1С5)алкіламіно, (С3-С7)циклоалкілу, гетероциклічного кільця та арилу; (С1-С5)алкілтіо, (С1С5)алкокси, моно-(С1-С5)алкіламіно та ді-(С1С5)алкіламіно; R3 являє собою водень або (С1-С3)алкіл; та R4 являє собою водень. 16. Сполука за п. 15, де R1 являє собою метил, етил, n-пропіл, 1метилетил, n-бутил, 1,1-диметилетил, 2метилпропіл, 2,2-диметилпропіл, n-пентил, 3метилбутил, 2-n-гексил, 3,3-диметилбутил, nгептил, n-октил, бензил, фенетил, 2(диметиламіно)етил, 2-(4-морфоліно)етил, 3(диметиламіно)пропіл, 2-(піридин-2-іл)етил, 2(піридин-3-іл)етил, 2-(4-метоксифеніл)етил, 2-(4хлорфеніл)етил або 2-(4-фторфеніл)етил, 3фенілпропіл; R2 являє собою водень, метил, етил, пропіл, гідроксиметил, амінометил, (метиламіно)метил, (диметиламіно)метил, хлорметил, трифторметил, феніл, 2-піридил, метокси, етокси, метилтіо, етилтіо, метиламіно, бутиламіно або диметиламіно; R3 являє собою водень або метил; та R4 являє собою водень. 17. Сполука за будь-яким з пп. 14-16, яка вибрана з групи, що складається з: a) (9S)-1-бутил-9-етил-9-гідрокси-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-10,13(9Н,15Н)-діону, b) (9S)-9-етил-9-гідрокси-1-[2-(4-морфоліно)етил]1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-10,13(9Н,15Н)діону гідрохлориду, c) (9S)-9-етил-9-гідрокси-1-пропіл-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-10,13(9Н,15Н)-діону, d) (9S)-1-бензил-9-етил-9-гідрокси-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-10,13(9Н,15Н)-діону, e) (9S)-9-етил-9-гідрокси-1-фенетил-1Н,12Нпірано[3",4":6',7']індолізино[1’,2’:6,5]піридо[4,3,2de]хіназолін-10,13(9Н,15Н)-діону, f) (9S)-2,9-діетил-9-гідрокси-1-фенетил-1Н,12Нпірано[3",4":6',7']індолізино[1’,2’:6,5]піридо[4,3,2de]хіназолін-10,13(9Н,15Н)-діону, g) (9S)-9-етил-9-гідрокси-1-(3-фенілпропіл)1Н,12Нпірано[3",4":6',7']індолізино[1’,2’:6,5]піридо[4,3,2de]хіназолін-10,13(9Н,15Н)-діону, h) (9S)-9-етил-9-гідрокси-1-(3-метилбутил)-1Н,12Нпірано[3",4":6',7']індолізино[1’,2’:6,5]піридо[4,3,2de]хіназолін-10,13(9Н,15Н)-діону, 7 і) (9S)-2,9-діетил-9-гідрокси-1-(3-метилбутил)1Н,12Нпірано[3",4":6',7']індолізино[1’,2’:6,5]піридо[4,3,2de]хіназолін-10,13(9Н,15Н)-діону, j) (9S)-2,9-діетил-9-гідрокси-1-(2-метилпропіл)1Н,12Н-пірано[3",4":6',7']індолізино[1’,2’:6,5]піридо[4,3,2-de]хіназолін-10,13(9Н,15Н)-діону, k) (9S)-9-етил-1-гептил-9-гідрокси-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-10,13(9Н,15Н)-діону, l) (9S)-9-етил-9-гідрокси-1-метил-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-10,13(9Н,15Н)-діону, m) (9S)-9-етил-9-гідрокси-1-(2-метилпропіл)1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-10,13(9Н,15Н)-діону, n) (9S)-9-етил-1-гексил-9-гідрокси-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-10,13(9Н,15Н)-діону, о) (9S)-9-етил-9-гідрокси-1-пентил-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-10,13(9Н,15Н)-діону, р) (9S)-1,9-діетил-9-гідрокси-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-10,13(9Н,15Н)-діону, q) (9S)-9-етил-9-гідрокси-1-[2-(4метоксифеніл)етил]-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-10,13(9Н,15Н)-діону, r) (9S)-1-[2-(4-хлорфеніл)етил]-9-етил-9-гідрокси1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-10,13(9Н,15Н)-діону, s) (9S)-9-етил-1-[2-(4-фторфеніл)етил]-9-гідрокси1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-10,13(9Н,15Н)-діону, t) (9S)-9-етил-1-[2-(4-фторфеніл)етил]-9-гідрокси-2метил-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-10,13(9Н,15Н)-діону, u) (9S)-9-етил-9-гідрокси-1-(1-метилетил)-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-10,13(9Н,15Н)-діону, v) (9S)-1-(3,3-диметилбутил)-9-етил-9-гідрокси1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-10,13(9Н,15Н)-діону, w) (9S)-9-етил-9-гідрокси-2-метокси-1-(3метилбутил)-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-10,13(9Н,15Н)-діону, х) (9S)-2,9-діетил-9-гідрокси-1-(3-метилбутил)1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-10,13(9Н,15Н)-діону, у) (9RS)-9-етил-9-гідрокси-4-метил-1-пентил1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-10,13(9Н,15Н)-діону, z) (9S)-9-етил-9-гідрокси-1-(2-гідроксіетил)-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-10,13(9Н,15Н)-діону, 80409 8 аа) (9S)-9-етил-9-гідрокси-1-(2-гідроксіетил)-2метил-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-10,13(9Н,15Н)-діону, bb) (9S)-9-етил-9-гідрокси-2-метил-1-пентил1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-10,13(9Н,15Н)-діону, сс) (9S)-2,9-діетил-9-гідрокси-1-пентил-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-10,13(9Н,15Н)-діону, dd) (9S)-9-етил-9-гідрокси-1-пентил-2-пропіл1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-10,13(9Н,15Н)-діону, ее) (9S)-9-етил-9-гідрокси-2-гідроксиметил-1пентил-1Н,12Нпірано[3",4":6',7']індолізино[1’,2’:6,5]піридо[4,3,2de]хіназолін-10,13(9Н,15Н)-діону, ff) (9S)-9-етил-9-гідрокси-2-гідроксиметил-1-(2метилпропіл)-1Н,12Нпірано[3",4":6',7']індолізино[1’,2’:6,5]піридо[4,3,2de]хіназолін-10,13(9Н,15Н)-діону, gg) (9S)-9-етил-9-гідрокси-2-гідроксиметил-1-(3метилбутил)-1Н,12Нпірано[3",4":6',7']індолізино[1’,2’:6,5]піридо[4,3,2de]хіназолін-10,13(9Н,15Н)-діону, hh) (9S)-2-хлорметил-9-етил-9-гідрокси-1-(3метилбутил)-1Н,12Нпірано[3",4":6',7']індолізино[1’,2’:6,5]піридо[4,3,2de]хіназолін-10,13(9Н,15Н)-діону, іі) (9S)-2-амінометил-9-етил-9-гідрокси-1-пентил1Н,12Нпірано[3",4":6',7']індолізино[1’,2’:6,5]піридо[4,3,2de]хіназолін-10,13(9Н,15Н)-діону, jj) (9S)-9-Етил-9-гідрокси-1-пентил-2трифторметил-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-10,13(9Н,15Н)-діону, kk) (9S)-9-етил-9-гідрокси-1-(3-метилбутил)-2метилтіо-1Н,12Нпірано[3",4":6',7']індолізино[1’,2’:6,5]піридо[4,3,2de]хіназолін-10,13(9Н,15Н)-діону, ll) (9S)-9-етил-2-етилтіо-9-гідрокси-1-(3метилбутил)-1Н,12Нпірано[3",4":6',7']індолізино[1’,2’:6,5]піридо[4,3,2de]хіназолін-10,13(9Н,15Н)-діону, mm) (9S)-2-(диметиламіно)-9-етил-9-гідрокси-1-(2метилпропіл)-1Н,12Нпірано[3",4":6',7']індолізино[1’,2’:6,5]піридо[4,3,2de]хіназолін-10,13(9Н,15Н)-діону гідрохлориду та nn) (9S)-2-(бутиламіно)-9-етил-9-гідрокси-1-(3метилбутил)-1Н,12Нпірано[3",4":6',7']індолізино[1’,2’:6,5]піридо[4,3,2de]хіназолін-10,13(9Н,15Н)-діону гідрохлориду. 18. Сполука за п. 17, яка вибрана з групи, що складається з: a) (9S)-1-бутил-9-етил-9-гідрокси-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-10,13(9Н,15Н)-діону, b) (9S)-9-етил-9-гідрокси-1-фенетил-1Н,12Нпірано[3",4":6',7']індолізино[1’,2’:6,5]піридо[4,3,2de]хіназолін-10,13(9Н,15Н)-діону, 9 c) (9S)-9-етил-9-гідрокси-1-(3-метилбутил)-1Н,12Нпірано[3",4":6',7']індолізино[1’,2’:6,5]піридо[4,3,2de]хіназолін-10,13(9Н,15Н)-діону, d) (9S)-9-етил-9-гідрокси-1-(2-метилпропіл)1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-10,13(9Н,15Н)-діону, e) (9S)-9-етил-9-гідрокси-1-пентил-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-10,13(9Н,15Н)-діону, f) (9S)-9-етил-1-[2-(4-фторфеніл)етил]-9-гідрокси1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-10,13(9Н,15Н)-діону, g) (9S)-1-(3,3-диметилбутил)-9-етил-9-гідрокси1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-10,13(9Н,15Н)-діону, h) (9S)-9-етил-9-гідрокси-2-метил-1-пентил1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2de]хіназолін-10,13(9Н,15Н)-діону, і) (9S)-9-етил-9-гідрокси-2-гідроксиметил-1-пентил1Н,12Нпірано[3",4":6',7']індолізино[1’,2’:6,5]піридо[4,3,2de]хіназолін-10,13(9Н,15Н)-діону та j) (9S)-2-амінометил-9-етил-9-гідрокси-1-пентил1Н,12Нпірано[3",4":6',7']індолізино[1’,2’:6,5]піридо[4,3,2de]хіназолін-10,13(9Н,15Н)-діону. 19. Фармацевтична композиція, яка містить сполуку за будь-яким з пп. 1 -18 як активне начало та фармацевтичнo прийнятний носій. 20. Фармацевтична композиція за п. 19, яка є придатною для перорального або парентерального введення. 21. Застосування сполуки, яку визначено у будьякому з пп. 1-18, для одержання лікарських засобів. 22. Застосування сполуки, яку визначено у будьякому з пп. 1-18, для одержання лікарських засобів для лікування розладів, пов'язаних з проліферацією клітин. 23. Застосування сполуки, яку визначено у будьякому з пп. 1-18, для одержання лікарських засобів для лікування раку. 24. Спосіб лікування розладів, пов'язаних з проліферацією клітин, який включає введення пацієнтові, якому це необхідно, терапевтично ефективної кількості сполуки за будь-яким з пп. 1-18. 25. Спосіб за п. 24, де розлад, пов'язаний з проліферацією клітин, є раком. 26. Спосіб за п. 25, де рак являє собою тверду пухлину. 27. Спосіб за будь-яким з пп. 24 - 25, де рак являє собою рак прямої кишки, рак легенів, рак грудей, рак шлунку, рак шийки матки та рак сечового міхура. 28. Спосіб одержання сполуки за формулою (2) 80409 10 X R1 HN N R3 O N R4 N 9 O OR5 O (2) , де R , R , R та X є такими, як визначено у п. 1, та R5 являє собою (С1-С5)алканоїл, в якому піддають реакції сполуку за формулою (3) або її сіль R1 NH2 H N R3 O N R4 N 1 3 4 9 O OR5 O , (3) де R1, R3, R4 та R5 є такими, як визначено вище, зі сполукою за формулою (4) X L1 L2 (4) , де Х являє собою кисень або сірку, та L1 та L2 являють собою групи, що вилучаються, у присутності лугу. 29. Спосіб одержання сполуки за формулою (5) R2 R1 N N R3 O N R4 N O OR5 O (5) , де R , R , R та R є такими, як визначено у п. 1, та R5 являє собою (С1-С5)алканоїл, при якому піддають реакції сполуку за формулою (3) або її сіль. 1 2 3 4 11 NH2 H N 80409 12 Z R1 R3 R3 O O N N R4 R4 N 9 N O O OR5 O , (3) де R1, R3, R4 та R5 є такими, як визначено вище, зі сполукою за формулою (6) R6 OH O (1) , де Z, R1, R2, R3 та R4 є такими, як визначено у п. 1, який включає обробку сполуки за формулою (1') Z R3 O N R2 L1 (6) , де R2 є таким, як визначено у п. 1, R6 являє собою кисень, сірку, =(OR7)2, де R7 являє собою (C1C3)алкіл; =NR8, де R8 являє собою водень, (С1С3)алкіл, (С1-С3)алканоїл, алкоксикарбоніл; =N+R9R10, де R9 та R10 являють собою незалежно (С1-С3)алкіл; або галоген; та L1 являє собою групу, що вилучається. 30. Спосіб одержання сполуки за формулою (1), як визначено у п. 1, або її фармацевтичнo прийнятної солі 4(8)-етил-4-гідрокси-1Н-пірано[3',4':6,7]індолізино[1,2-b]хінолін-3,14(4Н,12Н)-діон(камптотецин), пентациклічний алкалоїд, виділений з китайського дерева Camptotheca acuminata, впер1Hе відкрили у 1960-х роках Wall та інші як протипухлинний агент [Wall, М. Е. та інші, Plant tumor antigens. I. The isolation and structure of camptothecin, a novel alkaloidal leukemia and tumor inhibition from Camptotheca acuminata. J. Am. Chem. Sco., 88: 3888-3890,1966]. Цитотоксична активність камптотецину є атрибутом її здатності взаємодіяти з ДНКтопоізомеразою І [Hsiang, Y.-H. et al. Camptothecin induces protein-linked DNA breaks via mammalian DNA topoisomerase I. J. Biol. Chem., 260: 1487314878, 1985]. ДНК-топоізомераза І являє собою фосфорилований білок, який є необхідним для реплікації, транскрипції та рекомбінації ДНК. Вона утворює ковалентний зворотний комплекс ДНКтопоізомераза І-дволанцюгова ДНК (позначається як розщеплюваний комплекс) та послаблює надспіральну ДНК шляхом розщеплення та з1Hивання 3Hов одного з двох ланцюгів ДНК [Wang, J. C. DNA topoisomerases. Annu. Rev. Biochem. 54: 665697,1985, Champoux, J. J. Mechanistic aspects of type-I topoisomerase. У "DNA topology and its biological effects" pp. 217-242,1990; Wang, J. С et al. R4 N O OR5 O (1'), де Z, R1, R2 та R4 є такими, як визначено вище; та R5 являє собою (С1-С5)алканоїл, шляхом деацилування гідразином або його похідним. 31. Сполука, одержана за способом, який визначено у пп. 28-30. 32. Сполука, яку визначено у пп. 1-18, для застосування як лікарського засобу. 33. Сполука, яку визначено у пп. 1-18, для застосування у лікуванні розладів, пов'язаних з проліферацією клітин. The role of DNA topoisomerase in recombination and genome stability: A double-edged sword? Cell 62: 403-406,1990, Muller, M. T. Quantification of eukaryotic topoisomerase reactivity with DNA. Preferential cleavage of supercoiled DNA. Biochim. Biophys. Acta. 824: 263-267,1985]. Камптотецин оборотно взаємодіє з розщеплюваним комплексом та далі індукує ДНК-розрив одного ланцюга через втручання в етап повторного з1Hивання [Hsiang, Y.-H. et al. Camptothecin induces protein-linked DNA DNA breaks via mammalian DNA topoisomerase I. J. Biol. Chem., 260: 14873-14878,1985; Porter, S. E. et al. The basis for campthotecin enhancement of DNA breakage by eukaryotic DNA topoisomerase I. Nucleic Acid Res. 17: 8521-8532,1989]. Ha відміну від ДНК-топоізомерази II, ослаблення ДНК, опосередковане ДНК-топоізомеразою І, виникає незалежно від нуклеотидного кофактору або двовалентних катіонів. Незважаючи на те, що ДНК-топоізомераза І являє собою повсюдний ензим та присутня протягом усього клітинного циклу, протипроліфераційна активність камптотецину обмежується тільки клінічними випробуваннями, та, здається, період напіврозпаду камптотецину у плазмі є коротким (мен1H ніж 30 хвилин), при цьому він перетворю 13 ється на неактивну форму карбоксилату. Крім того, камптотецин є погано розчинним у воді, та, таким чином, він сам не може застосовуватися у складі для внутриішньовенної ін'єкції. Ряд похідних камптотецину синтезували з метою поліп1Hення протипухлинної активності, стійкості лактону у плазмі та/або водорозчинності та їх тестували у клінічних умовах [Gerrits, С. J. H., de Jonge, M. J. et al. Topoisomerase I inhibitors: the relevance of prolonged exposure for clinical development. Br. J. Cancer, 76: 952-962,1997; O'Leary, J. et al. Camptothecins: a review of their development and schedules of administration. Eur. J. Cancer, 34: 15001508,1988; Gerderblom, H. A. et al. Oral topoisomerase I inhibitors in adults patients: present and future. Investig. New Drugs, 17:401-415,1999]. Проте, у на1H час тільки два похідні камптотецину, 7-етил-10-[4-(1-піперидино)-1-піперидино]карбонілоксикамптотецин (іринотекан), який є проліками 7-етил-10-гідроксикамптотецину [SN-38, ЕР 0074256], та 9-(диметиламіно)метил-10гідроксикамптотецин (топотекан), застосовуються у клінічній практиці [Kunimoto, Т. et al. Antitumor activity of 7-ethyl-10-[4-(l-piperidino)-lpiperidino]carbonyloxy-camptothecin, a novel watersoluble derivative of camptothecin, against murine tumors. Cancer Res., 47: 5944-5947,1987, Kingsbury, W. D. et al. Synthesis of water-soluble (aminoalkyl)camptothecin analogs: inhibition of topoisomerase I and antitumor activity. J. Med. Chem., 34: 98-107,1991]. Внаслідок складності 1Hляхів його синтезу, очевидно, існує обмеження для утворення похідних камптотецину. Як у випадку з іринотеканом або топотеканом, велика Більшість аналогів камптотецину були похідними камптотецину, які мали замісників на А-кільці або В-кільці незалежно. Такі похідні камптотецину включають 9нітрокамптотецин [Pantazis, P. et al. The role of pH and serum albmin in the metabolic conversion of 9nitrocamptothecin to 9-aminocamptothecin by human hematopoietic and other cells. Eur. J. Hematol., 55: 211-213,1995; Loos, W. J. et al. Determination of the lactone та lactone plus carboxylate forms of 9amonocamptothecin in human plasma by sensitive high-performance liquid chromatography with fluorescent detection. J. Chromatogr. В., 694: 435441, 1997; Blaney, S. M. et al. Plasma and cerebrospinal fluid pharmacokinetics of 9aminocamptothecin (9-AC), irinotecan, and SN-38 in nonhuman primates. Cancer Chemother. Pharmacol., 41:464-468,1998), луртотекан (Emerson, D. L. et al. In vitro anti-tumor activity of two new sevensubstituted water-soluble camptothecin analogues. Cancer Res., 55: 603-609, 1955]. Також повідомлялось, що декілька похідних, таких як (IS,9S)-1-аміно-9-етил-5-фторо-9-гідрокси4-метил-2,3,9,10,13,15-гексагідро-1Н, 12Нбенз[де]пірано[3',4':6,7]індолізино[1,2-b]хінолін10,13(9Н,15Н)-діону метансульфонат (DX-8951f), що має F-кільце над А-та В-кільцем, мають сильну протипухлинну активність як in vitro, так і in vivo [Vey, N. et al. The topoisomerase I inhibitor DX-8951f is active in a severe combined immunodeficient 80409 14 mouse model of human acute myelogenous leukemia. Clin. Cancer Res., 6:731-736,2000]. Проте, через обмеження 1Hляхів їх синтезу, F-кільце, що вводиться у певну позицію, обмежується насиченим вуглеводневим ланцюгом без гетероатома, або з гетероатомом, включеним у ланцюг. Отже, все іще існує необхідність відкриття нових 1Hляхів синтезу та нових аналогів камптотецину з поліп1Hеною активністю проти 1Hирокого рі3Hоманіття пухлинних клітин. Згідно з цим винаходом ви3Hачили, що нові гексациклічні сполуки демонструють протипухлинну активність. Цей винахід стосується цих нових гексациклічних сполук, що мають сильну протипухлинну активність, способу одержання цих сполук, застосування згаданих сполук у медичній терапії, фармацевтичних композицій, що містять згадані сполуки, та способів одержання нових гексациклічних сполук. Предметом цього винаходу є гексациклічні сполуки за формулою [1] де Z являє собою -NH-C(=X)-N(R1)- або-N=C(R2)N(R1)-; R1 являє собою водень; (С1-С10) алкіл, необов'язково заміщений однією - трьома складовими, що незалежно вибрані з групи, яка складається з (С1-С5) алкокси, гідрокси, галогену, аміно, моно-(С1-С5) алкіламіно, ди-(С1С5) алкіламіно та (С3-С7) циклоалкілу, гетероциклічного кільця та арилу, де арильне кільце необов'язково заміщене однією - трьома складовими, що незалежно вибрані з групи, яка складається з гідрокси, алкокси, галогену, аміно, мономі-С5) алкіламіно та ди-(С1-С5) алкіламіно; R2 являє собою водень; аміно; (С1-С5) алкіл, (С1-С5) алкокси, (С1-С5) алкілтіо, моно-(С1-С5) алкіламіно, ди-(С1-С5) алкіламіно, що необов'язково заміщені однією -трьома складовими, що вибрані з групи, яка складається з (С1-С5) алкокси, гідрокси, галогену, аміно, (С3-С7) циклоалкілу, гетероциклічного кільця або арил, де арильне кільце необов'язково заміщене однією - трьома складовими, що незалежно вибрані з групи, яка складається з гідрокси, (С1-С5) алкокси, аміно, моно-(С1-С5) алкіламіно або ди-(С1-С5) алкіламіно; R3 та R4 являють собою незалежно водень, галоген або (С1-С5) алкіл; та X являє собою кисень або сірку; та їх фармацевтично прийнятні солі. Більш специфічно, предметом цього винаходу є гексациклічні сполуки за формулою [1А] 15 де X являє собою кисень та R1, R3 та R4 є такими, як визначено у пункті 1, та їх фармацевтично прийнятні солі. Ін1Hим предметом цього винаходу є гексациклічні сполуки за формулою [1В] де R1, R2, R3 та R4 є такими, як визначено у пункті 1, та їх фармацевтично прийнятні солі. Ін1Hим предметом цього винаходу є фармацевтична композиція, яка містить вищезгадані сполуки, та застосування цих сполук у медичній терапії, особливо у лікуванні пухлин. Іще наступним предметом цього винаходу є спосіб одержання вищезгаданих гексациклічних сполук. Якщо не вказано ін1Hе, наступні визначення при3Hачені для ілюстрування та визначення значення та обсягу рі3Hих термінів, які застосовуються тут для опису винаходу. Термін "алкіл" позначає пряму або розгалужену одновалентну насичену аліфатичну вуглеводневу групу. "(С1-С10) алкіл" позначає прямий ланцюг або розгалужений вуглеводневий ланцюг, що має від 1 до 10, переважно від 1 до 8 атомів вуглецю, наприклад, метил, етил, пропіл, ізопропіл, бутил, ізобутил, тер-бутил, сек-бутил, пентил, 1метилбутил, 2-метилбутил, 3-метилбутил, 1,1диметилпропіл, 2,2-диметилпропіл, 1-етилпропіл, гексил, 1-метилпентил, 2-метилпентил, 3метилпентил, 4-метилпентил, 2,2-диметилбутил, 2,3-диметилбутил, 3,3-диметилбутил тощо, Більш переважно бутил, ізобутил, 3-метилбутил, пентил тощо."(С1-С5)алкіл" переважно позначає метил, етил, пропіл, ізопропіл, бутил, ізобутил, тер-бутил, сек-бутил, пентил, 1-метилбутил, 2-метилбутил, 3метилбутил тощо, Більш переважно метил, етил, пропіл тощо. Термін "алкокси" позначає групу -O-R', де R' являє собою алкільну групу, як визначено вище. "(С1-С5) алкокси" переважно позначає метокси, етокси, пропокси, ізопропокси, бутокси, ізобутокси, 80409 16 /ирети-бутокси, пентокси, 3-метилбутокси, 2,2диметилпропокси тощо. Термін "гідрокси" позначає групу НО-. Термін "галоген" позначає фтор, хлор, бром та йод. Термін "аміно" позначає групу -NEb та включає аміногрупи, захищені групою, відомою у галузі як форміл, ацетил, тритил, wpem-бутоксикарбоніл, бензил, бензилоксикарбоніл тощо. Переважно, він позначає -NH2. Термін "моно-алкіламіно" позначає групу -NHR', де R' являє собою алкільну групу, як визначено вище, та включає аміногрупи, захищені групою, відомою у галузі як форміл, ацетил, тритил, третбутоксикарбоніл, бензил, бензилоксикарбоніл тощо. Термін "моно-(С1-С5)алкіламіно" переважно позначає N-метиламіно, N-етиламіно, Nпропіламіно, N-ізопропіламіно, N-бутиламіно, N-(1 -метилпроп1H)аміно, М-(2-метилпропіл)аміно, Nпентиламіно тощо, Більш переважно N-етиламіно, N-пропіламіно, N-бутиламіно тощо. Термін "ді-алкіламіно" позначає групу -NR'R", де R' та R" являють собою (незалежно один від одного) алкільну групу, як визначено вище. "Ди(С1-С5)алкіламіно" переважно позначає N, Nдиметиламіно, N, N-діетиламіно, N, Nдипропіламіно, N,N-діізопропіламіно, N,Nдибутиламіно, N-метил-N-етиламіно, N- метил-Nпропіламіно тощо, Більш переважно N,Nдиметиламіно, N,N-діетиламіно. Термін "(С3-С7) циклоалкіл" позначає 3- - 7членне кільце, яке не містить будь-яких гетероатомів у кільці. "Циклоалкіл" переважно позначає циклопропіл, циклобутан, циклопентил, циклогексил, циклогептил тощо, Більш переважно циклопентил та циклогексил. Термін "гетероциклічне кільце" позначає 3- 10-членне кільце, яке містить один або більше гетероатомів, які вибрані з N, S або О, переважно оксазоліл, тіазоліл, 4,5-дигідро-оксазоліл, 4,5дигідро-тіазоліл, фурил, піроліл, тієніл, імідазоліл, триазоліл, тетразоліл, піридил, піразиніл, піримідиніл, триазиніл, оксадіазоліл, тіадіазоліл, піролідиніл, тетрагідротієніл, тетрагідрофурил, морфолініл, піперидил, піперазиніл, 1-метилпіперазиніл тощо, Більш переважно імідазоліл, піридил, морфолініл та піролідиніл. Термін "арил" позначає ароматичну карбоциклічну групу, тобто ароматичне або частково ароматичне 3- - 10-членне кільце, наприклад, феніл, нафтил або тетрагідронафтил, переважно феніл або нафтил, та найбільш переважно феніл. Термін "(С1-С5) алкілтіо" позначає групу R'-S-, де R' являє собою (С1-С5) алкіл, як визначено вище, переважно метил, етил, пропіл, ізопропіл тощо, Більш переважно метил та етил. У цьому винаході вираз "необов'язково заміщений" позначає, що заміщення може виникнути на одному - трьох положеннях, переважно на одному положенні, та що, коли ін1Hе не вказано, замісники незалежно вибрані із перелічених варіантів вибору. Термін "фармацевтично прийнятний", такий як "фармацевтично прийнятний носій, наповнювач, проліки тощо", позначає фармакологічну прийнят 17 ність та суттєву нетоксичність для суб'єкта, якому вводиться певна сполука. Термін "фармацевтично прийнятна сіль" позначає звичайні кислотно-адитивні солі або лугоадитивні солі, які зберігають біологічну ефективність та властивості гексациклічних сполук за формулою (1), та утворюються з придатних нетоксичних органічних або неорганічних кислот або органічних або неорганічних лугів. Кислотноадитивні солі включають ті солі, що походять з неорганічних кислот, таких як соляна кислота, бромистоводнева кислота, йодистоводнева кислота, сірчана кислота, сульфамінова кислота, фосфорна кислота та азотна кислота, та ті солі, що походять з органічних кислот, таких як ртолуолсульфонова кислота, саліцилова кислота, метансульфонова кислота, щавлева кислота, бурштинова кислота, лимонна кислота, яблучна кислота, молочна кислота, фумарова кислота тощо. Луго-адитивні солі включають ті, що походять з калію, натрію, амонію та четвертинного гідроксиду амонію, такого як, наприклад, гідроксид тетраметиламонію. У вищезгаданих визначеннях переважні варіанти здійснення R1 являють собою метил, етил, пропіл, ізопропіл, бутил, ізобутил, пентил, 3метилбутил, 2,2-диметилпропіл, 1-етилпропіл, гексил, 4-метилпентил, 3,3-диметилбутил, гептил, 2-метоксиетил, 2-етоксиетил, 2-пропоксилетил, 3метоксипропіл, 4-метоксибутил, 2-гідроксиетил, 3гідроксипропіл, 4-гідроксибутил, 5-гідроксипентил, 2-фторетил, 3-фторпропіл, 4-фторбутил, 2хлоретил, 3-хлорпропіл, 4-хлорбутил, 2(диметиламіно)етил, 3-(диметиламіно)пропіл, 2(циклогексил)етил, 2-(4-морфоліно)етил, 2(піролідино)етил, 2-(піперидино)етил, 2-(4метилпіперазино)етил, 2-(піридин-2-іл)етил, 2(піридин-3-іл)етил, 2-(імідазол-1-іл)етил, бензил, фенетил, 2-(1-нафтил)етил, 3-фенілпропіл, 2-(4фторфеніл)етил, 2-(4-хлорфеніл)етил, 2-(4метоксифеніл)етил, 2-(4-гідроксифеніл)етил, 2-[4(диметиламіно)феніл]етил, 2-(3,4метилендіоксифеніл)етил тощо, Більш переважно метил, етил, пропіл, ізопропіл, бутил, ізобутил, пентил, 3-метилбутил, гексил, 3,3-диметилбутил, гептил, 2-гідроксиетил, 3-гідроксипропіл, 2(диметиламіно)етил, 3-(диметиламіно)пропіл, 2-(4морфоліно)етил, 2-(піридин-2-іл)етил, 2-(піридин3-іл)етил, бензил, фенетил, 3-фенілпропіл, 2-(4фторфеніл)етил, 2-(4-хлорфеніл)етил, 2-(4метоксифеніл)етил тощо. Переважні варіанти здійснення R2 являють собою водень, метил, етил, пропіл, ізопропіл, бутил, пентил, гідроксиметил, метоксиметил, ацетоксиметил, амінометил, (метиламіно)метил, (диметиламіно)метил, фторметил, хлорметил, трифторметил, феніл, піридин-2-іл, метокси, етокси, метилтіо, етилтіо, аміно, метиламіно, етиламіно, пропіламіно, бутиламіно, диметиламіно, діетиламіно тощо, та Більш переважно водень, метил, етил, пропіл, гідроксиметил, амінометил, хлорметил, трифторметил, метокси, метилтіо, етилтіо, метиламіно, бутиламіно та диметиламіно. Більш докладно, цей винахід стосується гексациклічних сполук за формулою [1] 80409 18 де Z являє собою -NH-C(=X)-N(R1)- або –N=С(R2)1 N(R )-; R1 являє собою водень; (С1-С10) алкіл, необов'язково заміщений однією - трьома складовими, що незалежно вибрані з групи, яка складається з (С1-С5) алкокси, гідрокси, галогену, аміно, моно-(С1-С5) алкіламіно, ди-(С1С5) алкіламіно та (С3-С7) циклоалкілу, гетероциклічного кільця та арилу, де арильне кільце необов'язково заміщене однією - трьома складовими, що незалежно вибрані з групи, яка складається з гідрокси, алкокси, галогену, аміно, моно-(С1-С5) алкіламіно та ди-(С1-С5) алкіламіно; R2 являє собою водень; аміно; (С1-С5) алкіл, (С1-С5) алкокси, (С1-С5) алкілтіо, моно-(С1-С5) алкіламіно, ди-(С1-С5) алкіламіно, що необов'язково заміщені однією -трьома складовими, що незалежно вибрані з групи, яка складається з (С1С5) алкокси, гідрокси, галогену, аміно, (С3-С7) циклоалкілу, гетероциклічного кільця або арил, де арильне кільце необов'язково заміщене однією трьома складовими, що незалежно вибрані з групи, яка складається з гідрокси, (С1-С5) алкокси, аміно, моно-(С1-С5) алкіламіно або ди-(С1-С5) алкіламіно; R3 та R4 являють собою незалежно водень, галоген або (С1-С5) алкіл; та X являє собою кисень або сірку; та їх фармацевтично прийнятні солі. У переважному варіанті здійснення цього винаходу стереохімія положення 9 сполуки за формулою [1] являє собою S-конфігурацію. Переважні сполуки цього винаходу - це сполуки за формулою [1 А] де X являє собою водень, a R1, R3 та R4 є такими, як визначено у пункті 1, та їх фармацевтично прийнятні солі. Винахід переважно стосується сполук за формулою [1А], де R1 являє собою водень; або (С1-С8) алкіл, необов'язково заміщений однією або трьома складовими, що незалежно вибрані з групи, яка складається з (С1-СЗ) алкокси, гідрокси, галогену, аміно, моно-(С1-С3) алкіламіно, ди-(С1-С3) алкіламіно, (С3-С7) циклоалкілу, гетероциклічного кільця та арилу, де арильне кільце необов'язково заміщене однією -трьома скла 19 довими, що незалежно вибрані з групи, яка складається з гідрокси, алкокси та галогену; та R3 та R4 являють собою водень. Ще Більш переважно, R1 у сполуках за формулою [1А] являє собою (С1С8)алкіл, феніл-(С1-С8) алкіл, гетероциклічне кільце-(С1-С8)алкіл, алкоксифеніл(С1-С8)алкіл або галогенфеніл(С1-С8)алкіл, та найбільш переважно R1 у сполуках за формулою [1А] являє собою метил, етил, n-пропіл, 1-метилетил, n-бутил, 1,1диметилетил, 2-метилпропіл, 2,2-диметилпропіл, n-пентил, 3-метилбутил, 2-n-гексил, 3,3диметилбутил, n-гептил, п-октил, бензил, фенетил, 2-(диметиламіно)етил, 2-(4-морфоліно)етил, 3-(диметиламіно)пропіл, 2-(піридин-2-іл)етил, 2(піридин-3-іл)етил, 2-(4-метоксифеніл)етил, 2-(4хлорфеніл)етил, 2-(4-фторфеніл)етил або 3фенілпропіл. Прикладами цих сполук є a) (9S)-1 -бутил-9-етил-9-гідрокси-1Н, 12Нпірано[3",4м:6',7']індолізино[1',2':6,5]піридо [4,3,2-dе]хіназолін-2,10,13(3Н,9Н,15Н)-трион, b) (9S)-9-етил-9-гідрокси-1 -[2-(4морфоліно)етил]-1H, 12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2(dе]хіназолін-2,10,13(3Н,9Н,15Н)-триону гідрохлорид, c) (9S)-1 - [3 -(диметиламіно)пропіл] -9-етил-9гідрокси-1Н, 12Н-пірано [3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3Н,9Н,15Н)-триону гідрохлорид, d) (9S)-9-етил-9-гідрокси-1 -фенетил-1Н, 12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3Н,9Н,15Н)-трион, e) (9S)-9-етил-9-гідрокси-1 -[2-(піридин-2іл)етил]-1Н, 12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2с1е]хіназолін-2,10,13(3Н,9Н,15Н)-триону гідрохлорид, f) (9S)-9-етил-1 -гептил-9-гідрокси-1Н, 12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3Н,9Н,15Н)-трион, g) (9S)-9-етил-9-гідрокси-1-пропіл-1Н, 12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3Н,9НД5Н)-трион, h) (9S)-9-етил-9-гідрокси-1-[2-(піридин-3іл)етил]-1Н, 12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-dе] хіназолін -2,10,13(3H,9Н,15Н)-10 триону гідрохлорид, і) (9S)-9-етил-9-гідрокси-1 -(3 -фенілпропіл)1Н, 12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3Н,9Н,15Н)-трион, j) (9S)-9-етил-9-гідрокси-1 -(2-метилпропіл)-1Н, 12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3Н,9Н,15Н)-трион, к) (9S)9-етил-1 -гексил-9-гідрокси-1Н, 12Нпірано(3",4":6',7')'індолізино[1',2',:6,5]піридо [4,3,2dе]хіназолін-2,10,13(3H,9H,15H)-трион, l) (9S)9-етил-9-гідрокси-1-пентил-1Н, 12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3Н,9Н,15Н)-трион, 80409 20 m) (9S)-9-етил-9-гідрокси-1-[2-(4метоксифеніл)етил]-1Н, 12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3Н,9Н,15Н)-трион, n) (9S)-1-бензил-9-етил-9-гідрокси-1Н, 12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3Н,9Н,15Н)-трион, о) (9S)-9-етил-9-гідрокси-1-(3 -метилбутил)-1Н, 12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3Н,9Н,15Н)-трион, р) (9S)-1,9-діетил-9-гідрокси-1Н, 12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3Н,9Н,15Н)-трион, q) (9S)-1-[2-(4-хлорфеніл)етил]-9-етил-9гідрокси-1Н, 12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3Н,9Н,15Н)-трион, r) (9S)-9-етил-1-[2-(4-фторфеніл)етил]-9гідрокси-1Н, 12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3Н,9Н,15Н)-трион, s) (9S)-9-етил-9-гідрокси-1-(1 -метилетил)-1Н, 12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-dе] хіназолін -2,10,13(3Н,9Н,15Н)-трион,та t) (9S)-1 -(3,3-диметилбутил)-9-етил-9-гідрокси1Н, 12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2Д0,13(3Н,9Н,15Н)-трион. Найбільш переважними сполуками є a) (9S)-1-бутил-9-етил-9-гідрокси-1Н, 12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3H,9Н,15Н)-трион, b) (9S)-9-етил-9-гідрокси-1 -фенетил-1Н, 12Нпірано[Зп,4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3H,9Н,15Н)-трион, c) (9S)-9-етил-9-гідрокси-1 -(2-метилпропіл)1Н, 12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3Н,9Н,15Н)-трион, d) (9S)-9-етил-1 -гексил-9-гідрокси-1Н, 12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3Н,9Н,15Н)-трион, є) (9S)-9-етил-9-гідрокси-1-пентил-1Н, 12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3Н,9Н,15Н)-трион, f) (9S)-9-етил-9-гідрокси-1-(3-метилбутил)-1Н, 12Н-пірано[3",4":6',7'] 3",4":6',7' [1',2':6,5]піридо[4,3,2-dе]хіназолін2Д0,13(3Н,9Н,15Н)-трион, g) (9S)-1 -[2-(4-хлорфеніл)етил]-9-етил-9гідрокси-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-dе] хіназолін-2,10,13(3H,9H,15H)трион, h) (9S)-9-етил-1-[2-(4-фторфеніл)етил]-9гідрокси-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3Н,9Н,15Н)-трион, та і) (9S)-1-(3,3-диметилбутил)-9-етил-9-гідрокси1Н, 12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3H,9Н,15Н)-трион. 21 В іншому переважному варіанті здійснення винахід стосується сполук, як визначено вище, які представлені формулою [1 А] де X являє собою сірку, a R1, R3 та R4 є такими, як визначено у пункті 1, та їх фармацевтично прийнятні солі. Переважно, винахід стосується сполук за формулою [1А], де R1 являє собою водень або (С1-С8) алкіл, необов'язково заміщений однією - трьома складовими, що незалежно вибрані з групи, яка складається з (С1-С3) алкокси, гідрокси, галогену, аміно, моно-(С1-С3) алкіламіно, ди-(С1-С3) алкіламіно, (С3-С7) циклоалкілу, гетероциклічного кільця або арил, де арильне кільце необов'язково заміщене однією -трьома складовими, що незалежно вибрані з групи, яка складається з гідрокси, алкокси або галогену; та R3 та R4 являють собою водень. Більш переважно R1 являє собою феніл або (С1-С8) алкіл та найбільш переважно R1 являє собою феніл, 3-метилбутил або nпентил. Прикладами цих сполук є a) (9S)-9-етил-9-гідрокси-1-(3-метилбутил)-1Н, 12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2(3H)-тіон-10,13(9Н,15Н)-діон, b) (9S)-9-етил-9-гідрокси-1 фенетил-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2(3Н)-тіон-10,13(9Н,15Н)-діон, та c) (9S)-9-етил-9-гідро"кси-1-пентил-1Н,12Нпірано[3",4":6',7']індолізино[Г,2':6,5]піридо[4,3,2ае]хіназолін-2(3Н)-тіон-10,13(9Н,15Н)-діон. Ін1Hий варіант здійснення цього винаходу стосується сполук за формулою [1В] де R1, R2, R3 та R4 є такими, як визначено у пункті 1, та їх фармацевтично прийнятні солі. Переважними є сполуки, як визначено вище, де R1 являє собою водень або (С1-С8) алкіл, який необов'язково заміщений однією - трьома складовими, які незалежно вибрані з групи, що складається з (С1-С3) алкокси, гідрокси, галогену, аміно, моно(С1-С3) алкіламіно, ди-(С1-С3) алкіламіно, (С3-С7) циклоалкілу, гетероциклічного кільця та арилу, де 80409 22 арильне кільце необов'язково заміщене однією трьома складовими, що незалежно вибрані з групи, яка складається з гідрокси, алкокси та галогену; R2 являє собою водень; аміно або (С1-С5) алкіл, необов'язково заміщений однією - трьома складовими, що незалежно вибрані з групи, яка складається з (С1-С5) алкокси, гідрокси, галогену, аміно, моно-(С1-С5) алкіламіно, ди-(С1-С5) алкіламіно, (С3-С7) циклоалкілу, гетероциклічного кільця та арилу; (С1-С5) алкілтіо; (С1-С5) алкокси; моно-(С1-С5) алкіламіно та ди-(С1-С5) алкіламіно; R3 являє собою водень або (С1-С3) алкіл, та R4 являє собою водень. Більш переважними є сполуки за формулою [1В], як описано вище, де R1 являє собою метил, етил, n-пропіл, 1-метилетил, пбутил, 1,1-диметилетил, 2-метилпропіл, 2,2диметилпропіл, n-пентил, 3-метилбутил, 2-пгексил, 3,3-диметилбутил, n-гептил, п-октил, бензил, фенетил, 2-(диметиламіно)етил, 2-(4морфоліно)етил, 3-(диметиламіно)пропіл, 2(піридин-2-іл)етил, 2-(піридин-3-іл)етил, 2-(4метоксифеніл)етил, 2-(4-хлорфеніл)етил або 2-(4фторфеніл)етил, 3-фенілпропіл; R2 являє собою водень, метил, етил, пропіл, гідроксиметил, амінометил, (метиламіно)метил, (диметиламіно)метил, хлорметил, трифторметил, феніл, 2піридил, метокси, етокси, метилтіо, етилтіо, метиламіно, бутиламіно або диметиламіно; R3 являє собою водень або метил, та R4 являє собою водень. Переважну сполуку можна обрати з групи, яка складається з: a) (9S)-1-бутил-9-етил-9-гідрокси-1Н, 12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-10,13(9Н, 15Н)-діону, b) (9S)-9-етил-9-гідрокси-1 -[2-(4морфоліно)етил]-1Н, 12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-10,13(9Н,15Н)-діону гідрохлориду, c) (9S)-9-етил-9-гідрокси-1-пропіл-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-10,13(9Н,15Н)-діону, d) (9S)-1-бензил-9-етил-9-гідрокси-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-10,13(9Н,15Н)-діону, є) (9S)-9-етил-9-гідрокси-1-фенетил-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-10,13(9Н,15Н)-діону, f) (9S)-2,9-діетил-9-гідрокси-1 -фенетил1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-10,13(9Н,15Н)-діону, g) (9S)-9-етил-9-гідрокси-1-(3-фенілпропіл)1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-10,13(9Н, 15Н)-діону, h) (9S)-9-етил-9-гідрокси-1-(3-метилбутил)1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-10,13(9Н,15Н)-діону, і) (9S)-2,9-діетил-9-гідрокси-1-(3-метилбутил)1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-10,13(9Н,15Н)-діону, j) (9S)-2,9-діетил-9-гідрокси-1-(2-метилпропіл)1Н,12Н 23 пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-10,13(9Н,15Н)-діону, к) (9S)-9-етил-1-гептил-9-гідрокси-1Н,12Нпірано[3",4":6',7']індолізино[Г,2':6,5]піридо[4,3,2dе]хіназолін-10,13(9Н,15Н)-діону, l)(9S)-9-етил-9-гідрокси-1-метил-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-10,13(9Н, 15Н)-діону, m) (9S)-9-етил-9-гідрокси-1-(2-метилпропіл)1Н,12Нпірано[3",4":67']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-10,13(9Н, 15Н)-діону, n) (9S)-9-етил-1-гексил-9-гідрокси-1Н,12Нпірано[3",4":67']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-10,13(9Н,15Н)-діону, о) (9S)-9-етил-9-гідрокси-1-пентил-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-10,13(9Н,15Н)-діону, р) (9S)-1,9-діетил-9-гідрокси-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-10,13(9Н,15Н)-діону, g)(9S)-9-етил-9-гідрокси-1-[2-(4метоксифеніл)етил]-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-10,13(9Н,15Н)-діону, r) (9S)-1-[2-(4-хлорфеніл)етил]-9-етил-9гідрокси-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-10,13(9Н,15Н)-діону, s) (9S)-9-етил-1-[2-(4-фторфеніл)етил]-9гідрокси-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-10,13(9Н,15Н)-діону, t) (9S)-9-етил-1-[2-(4-фторфеніл)етил]-9гідрокси-2-метил-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-10,13(9Н,15Н)-діону, u) (9S)-9-етил-9-гідрокси-1-(1-метилетил)1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-10,13(9Н,15Н)-діону, v) (9S)-1-(3,3-диметилбутил)-9-етил-9-гідрокси1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-10,13(9Н,15Н)-діону, w) (9S)-9-етил-9-гідрокси-2-метокси-1-(3метилбутил)-1Н,12НпіраноР'^'іб'^'ііндолізиноСІ'^'іб^іпіридо^^Дсіеіхіназолін-ІОЛЗСРНЛЗЩ-діону, х) (9S)-2,9-діетил-9-гідрокси-1 -(3-метилбутил)1Н, 12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-10,13(9Н,15Н)-діону, у) (9S)-9-етил-9-гідрокси-4-метил-1-пентил1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-10,13(9Н,15Н)-діону, z) (9S)-9-етил-9-гідрокси-1-(2-гідроксиетил)1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-10,13(9Н,15Н)-діону, аа) (9S)-9-етил-9-гідрокси-1-(2-гідроксиетил)-2метил-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-10,13(9Н, 15Н)-діону, 80409 24 bb) (9S)-9-етил-9-гідрокси-2-метил-1-пентил1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-10,13(9Н,15Н)-діону, сс) (9S)-2,9-діетил-9-гідрокси-1-пентил1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-10,13(9Н, 15Н)-діону, dd) (9S)-9-етил-9-гідрокси-1-пентил-2-пропіл1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-10,13(9Н, 15Н)-діону, ее) (9S)-9-етил-9-гідрокси-2-гідроксиметил-1пентил-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-10,13(9Н, 15Н)-діону, ff) (9S)-9-етил-9-гідрокси-2-гідроксиметил-1-(2метилпропіл)-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-10,13(9Н, 15Н)-діону, gg) (9S)-9-етил-9-гідрокси-2-гідроксиметил-1(3-метилбутил)-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-10,13(9Н, 15Н)-діону, hh) (9S)-2-хлорметил-9-етил-9-гідрокси-1-(3метилбутил)-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-10,13(9Н,15Н)-діону, іі) (9S)-2-амінометил-9-етил-9-гідрокси-1пентил-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-10,13(9Н,15Н)-діону, jj) (9S)-9-етил-9-гідрокси-1-пентил-2трифторметил-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-10,13(9Н,15Н)-діону, kk) (9S)-9-етил-9-гідрокси-1-(3-метилбутил)-2метилтіо-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-10,13(9Н,15Н)-діону, 11) (9S)-9-етил-2-етилтіо-9-гідрокси-1-(3метилбутил)-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-10,13(9Н, 15Н)-діону, mm) (9S)-2-(диметиламіно)-9-етил-9-гідрокси1-(2-метилпропіл)-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-10,13(9Н,15Н)-діону гідрохлориду, та nn) (9S)-2-(бутиламіно)-9-етил-9-гідрокси-1-(3метилбутил)-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-10,13(9Н,15Н)-діону гідрохлориду. Більш переважно, сполуки можна обирати з групи, яка складається з: a) (9S)-1-бутил-9-етил-9-гідрокси-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-10,13(9Н, 15Н)-діону, b)(9S)-9-етил-9-гідрокси-1-фенетил-1H,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2сіе]хіназолін-10,13(9Н,15Н)-діону, c) (9S)-9-етил-9-гідрокси-1-(3-метилбутил)1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-10,13(9Н,15Н)-дюну, 25 d) (9S)-9-етил-9-гідрокси-1-(2-метилпропіл)1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-10,13(9Н, 15Н)-діону, є) (9S)-9-етил-9-гідрокси-1-пентил-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-10,13(9Н,15Н)-дюну, r) (9S)-9-етил-1-[2-(4-фторфеніл)етил]-9гідрокси-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-10,13(9Н,15Н)-дюну, g) (9S)-1-(3,3-диметилбутил)-9-етил-9-гідрокси1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-10,13(9Н,15Н)-дюну, h) (9S)-9-етил-9-гідрокси-2-метил-1-пентил1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-10,13(9Н,15Н)-діону, і) (9S)-9-етил-9-гідрокси-2-гідроксиметил-1пентил-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-10,13(9Н, 15Н)-діону, та j) (9S)-2-амінометил-9-етил-9-гідрокси-1пентил-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-10,13(9Н,15Н)-діону. Крім того, серед сполук за формулою (1А) та (1В), ті сполуки, у яких асиметричний вуглець у положенні 9 має конфігурацію S, є переважними з точки зору медичної активності. Винахід також стосується фармацевтичних композицій, які включають сполуку, які описано вище, яка є активним початком, та фармацевтично прийнятний носій, особливо ті композиції, які є придатними для перорального або парентерального введення. Далі винахід стосується застосування сполуки, яку описано вище, для одержання лікарських засобів, особливо для лікування розладів, пов'язаних з проліферацією клітин, та/або раку, наприклад, раку прямої кишки, раку легенів, раку грудей, раку шлунку, раку шийки матки та раку сечового міхура. Цей винахід також стосується способу лікування розладів, пов'язаних з проліферацією клітин, наприклад, раку, при цьому спосіб включає введення пацієнтові, якому це необхідно, терапевтично ефективної кількості сполуки, яка описана вище. Спосіб є особливо корисним для лікування твердих пухлин та раку, такого як рак прямої кишки, рак легенів, рак грудей, рак шлунку, рак шийки матки та рак сечового міхура. Винахід також пропонує спосіб одержання сполуки за формулою [2] 80409 26 де R1, R3, R4 та X є такими, як визначено вище, та R5 являє собою (С1-С5) алканоїл, який включає реакцію сполуки за формулою [3] або її солі де R1, R3, R4 та R5 є такими, як визначено вище, зі сполукою за формулою [4] де X являє собою кисень або сірку, a L1 та L2 являють собою групи, що незалежно вилучаються, такі як галоген, (С1-С3)алкокси, необов'язково заміщені одним - трьома галогеном(-ами), фенілокси, необов'язково заміщений нітрогрупою, сукцинімідилокси або імідазолом, у присутності лугу. Ін1Hий спосіб винаходу стосується способу одержання сполуки за формулою [5] 27 80409 28 де R1, R2, R3 та R4 є такими, як визначено вище, та R5 являє собою (С1-С5) алканоїл, який включає реакцію сполуки за формулою [3] де Z, R1, R2, R3 та R4 є такими, як визначено у пункті 1, який включає обробку сполуки за формулою [1'] або її солі де R1, R3, R4 та R5 є такими, як визначено вище, зі сполукою за формулою [6] де R2 є таким, як визначено вище; R6 являє собою кисень; сірку; =(OR7)2, де R7 являє собою (С1-С3) алкіл; =NR8, де R8 являє собою водень, (С1-С3) алкіл, (С1-С3) алканоїл, алкоксикарбоніл; =N+ R9R10, де R9 та R10 являють собою незалежно (С1-С3) алкіл; або галоген; та L1 являє собою групу, що вилучається, таку як галоген, гідрокси, (С1С3)алкокси, необов'язково заміщений одним трьома галогеном(-ами), фенілокси, необов'язково заміщений нітрогрупою, сукцинімідилокси або імідазол. Винахід також стосується способу одержання сполуки за формулою [1], як визначено вище, або її фармацевтично прийнятної солі де Z, R1, R2 та R4 є такими, як визначено вище; та R5 являє собою (С1-С5) алканоїл, шляхом деацилування гідразином або його похідними. Винахід включає також ті сполуки, які одержано за способом, описаним вище, а також стосується сполук формули [1] для застосування як лікарського засобу, особливо при лікуванні розладів, пов'язаних з проліферацією клітин. Наступна Схема 1 показує одержання гексациклічних сполук за формулами [1], [1А] та [1В]. У наступній Схемі 1 R1, R2, R3, R4 та X по3Hачають те ж саме, що і для гексациклічних сполук, описаних вище. 29 80409 30 Початкові сполуки за формулою [7] є відомими сполуками, або їх можна одержати за способами, відомими у галузі. Для прикладу, (20S)-9нітрокамптотецину 20-ацетат одержують за спосо бами, про які повідомляється у М. С Wani et al. [J. Med. Chem. 1986, 29,2358] або у F. H. Hausheer et al. [WO 9835940]. Далі стисло описуються умови реакції вищезгаданих Етапів А, В, С, D, E, F та G. Етап А: Окиснення сполуки за формулою [7] для одержання сполуки за формулою [8] роформ, дихлорметан тощо. Звичайно, окиснення здійснюють при температурі від 0 до 100°С протягом 1-10 годин. Етап В: Хлорування сполуки за формулою [8] для одержання сполуки за формулою [9] Окиснення на вищезгаданому Етапі А переважно виконують придатним окиснювальним агентом у придатному розчиннику. Придатними окиснювальними агентами є пероксид водню, такий як водний пероксид водню та комплекс пероксиду водню-карбаміду, перкарбонова кислота, така як пероцтова кислота, пербензойна кислота або mхлорпербензойна кислота тощо, а придатним розчинником є оцтова кислота, тетрагідрофуран, хло Хлорування на вищезгаданому Етапі В переважно виконують придатним хлорувальним реагентом у придатному розчиннику. Придатними хлорувальними реагентами є фосфорилхлорид, тіонілхлорид, оксалілхлорид, реагент Вільсмейєра тощо, із застосуванням Н,Н-диметилформафіду як каталізатора або розчинника. Придатними розчинниками є хлороформ, дихлорметан тощо, а також 31 80409 32 N-N-диметилформамід, як згадувалося вище. Звичайно, реакцію здійснюють при температурі від 0 до 80°С протягом 1 -15 годин. Етап С: Приєднання аміну R!-NH2 до сполуки за формулою (9) для одержання сполуки за формулою [10] де L1 та L2 являють собою (необов'язково рі3Hі) групи, що вилучаються, наприклад, галоген, (С1-С3) алкокси, необов'язково заміщений одним трьома галогенами, фенілокси, необов'язково заміщений нітрогрупою, сукцинімідилокси або імідазол, для одержання сполуки за формулою [2'] Приєднання на вищезгаданому Етапі С переважно виконують у придатному органічному розчиннику, такому як метанол, етанол, тетрагідрофуран, 1,4-діоксан, хлороформ, N,Nдиметилформамід, тощо при температурі від кімнатної температури до 120°С протягом періоду від 15 хвилин до 1 дня. Етап D: Відновлення сполуки за формулою [10] для одержання сполуки за формулою [3'] Реакцію на вищезгаданому Етапі D здійснюють відновлювальним агентом у придатному розчиннику у присутності придатного каталізатора. Придатними відновлювальними агентами є молекулярний водень або джерело водню, таке як циклогексадієн, мура1Hина кислота, форміат амонію тощо. Придатними розчинниками є, наприклад, метанол, етанол, етилацетат, НЫдиметилформамщ, 1,4-діоксан та вода з або без органічної або неорганічної кислоти, такої як 1 -10 N водна соляна кислота, сульфонова кислота, фосфонова кислота, азотна кислота, оцтова кислота, трифторооцтова кислота. Придатними каталізаторами є перехідні метали, такі як паладій, платина, нікель, та звичайно є 5-10% паладію на вуглеці та оксид платини. Звичайно реакцію виконують при температурі від 0 до 100°С при тиску від 1 до 100 атмосфер протягом періоду від 15 хвилин до 1 дня. Реакцію Етапу D також здійснюють з сіллю елементного металу або низьковалентного металу, такого як цинк, залізо та SnCb, у придатному розчиннику, такому як водна соляна кислота та метанолова соляна кислота, при температурі від 0 до 100°С протягом періоду від 15 хвилин до 1 дня. Етап Е: Реакція сполуки за формулою [3'] зі сполукою за формулою [4] Реакцію на вищезгаданому Етапі Е переважно здійснюють придатним реагентом за формулою [7] та придатним лугом у придатному розчиннику. Придатні луги є звичайно триалкіламінами, такими як триетиламін та діізопропілетиламін, ароматичними амінами, такими як піридин та лутидини, та неорганічними основами, такими як карбонат натрію та бікарбонат натрію. Придатними розчинниками є хлороформ, дихлорметан, ацетонітрил, 1,4діоксан, N,N-диметилформамід тощо. Реакцію здійснюють звичайно при температурі від 20 до 100°С протягом періоду від 5 хвилин до декількох днів. Звичайними реагентами за формулою (10) є фосген, дифосген, трифосген, тіофосген, карбонілдіімідазол, тіокарбонілдіімідазол, фенілхлоформіат, етилхлорформіат, дифенілкарбонат тощо. Етап F: Реакція сполуки за формулою [3'] зі сполукою за формулою [6] де R2 є таким, як визначено вище; R6 являє собою кисень; сірку; (OR7)2, де R7 являє гобою (С1С5) алкіл; групу =NR8, де R8 являє собою водень, (С1-С5) алкіл, (С1-С5) алканоїл або (С1-С5) алкоксикарбоніл; =N+R9R10, де R9 та R10 являють собою незалежно [С1-С5) алкіл; або галоген, a L1 являє собою групу, що вилучається, таку як галоген, гідрокси, (С1-С3) алкокси, необов'язково заміщений одним - трьома галогеном(-ами), фенілокси, необов'язково заміщений нітрогрупою, сукцинімідилокси або імідазол, для эдержання сполуки за формулою [5'] 33 Реакцію на вищезгаданому Етапі F переважно здійснюють придатним реагентом за формулою [6] та придатним лугом або кислотними каталізаторами у придатному розчиннику. Придатними лугами є звичайно луги триалкіламіну, такі як триетиламін та діізопропілетиламін, луги ароматичних амінів, такі як піридин та лутидини, та неорганічні луги, такі як карбонат натрію та бікарбонат натрію. Придатними кислотними каталізаторами є звичайно неорганічні кислоти, такі як соляна кислота, сульфонова кислота та азотна кислота, органічні кислоти, такі як оцтова кислота, трифторооцтова кислота, метансульфонова кислота та ртолуолсульфонова кислота, та кислоти Л'юїса, такі як трифторид бору, тетрахлорид титану та тетрахлорид олова тощо. Придатними розчинниками є Умови реакції на вищезгаданих Етапах Н, І та J також стисло описуються далі. Етап Н: Алкілування сполуки за формулою [2'] алкілувальним 80409 34 хлороформ, дихлорметан, ацетонітрил, 1,4діоксан, N,N-диметилформамід тощо. Реакцію виконують звичайно при температурі від -20°С до 100°С протягом періоду від 15 хвилин до декількох днів. Етап G: Реакція (деацетилування) сполуки за формулою [2'] або [5'] гідразином для одержання гексациклічної сполуки за формулою [1А] або [1В] Реакцію на вищезгаданому Етапі G переважно здійснюють гідразином у придатному розчиннику та при придатній температурі. Придатним розчинником є звичайно метанол, етанол, 1,4-діксан, N,N-диметилформамід, диметилсульфоксид та вода тощо. Реакцію виконують звичайно при температурі від -20 до 100°С протягом періоду від 15 хвилин до декількох днів. Крім того, гексациклічні сполуки за формулою [1В] можна одержати альтернативно зі сполуки [2'] за способами, продемонстрованими на наступній Схемі 2. У наступній Схемі 2 R2 являє собою (С1С5) алкілтіоаміно, моно-(С1-С5) алкіламіно або ди(С1-С5) алкіламіно, X являє собою сірку; R1, R3 та R4 по3Hачають те ж саме, що і для гексациклічних сполук за формулою [1B]; R11 являє собою (С1-С5) алкіл; та R12 та R13 являють собою незалежно водень або (С1-С5) алкіл. реагентом для одержання сполуки за формулою [12] 35 Алкілування на вищезгаданому Етапі Н переважно здійснюють придатним алкілувальним реагентом у присутності розчинника. Придатними алкілувальними реагентами є алкілгаліди, алкілсульфонати та діадкілсульфати, такі як алкілйодид, алкілбромід, алкіл-р-толуолсульфонат, алкілметансульфонат та діалкілсульфат тощо. Придатними розчинниками є тетрагідрофуран, хлороформ, дихлорметан тощо. Звичайно реакцію здійснюють при температурі від 0 до 100°С протягом періоду від 0,1 до 10 годин. Етап І: Окиснення сполуки за формулою [12] для одержання сполуки за формулою [13] Окиснення на вищезгаданому Етапі І переважно здійснюють придатним окиснювальним агентом у придатному розчиннику. Придатними окиснювальними агентами є пероксид, такий як водний пероксид водню та комплекс пероксиду воднюкарбаміду, перкарбонові кислоті, такі як пероцтова кислота, пербензойна кислота або 1Hхлорпербензойна кислота, та персульфати, такі як OXONE® (DuPont, USA), а придатними розчинниками є оцтова кислота, тетрагідрофуран, хлороформ, дихлорметан тощо. Звичайно окиснення здійснюють при температурі від 0 до 100°С протягом 1-10 годин. Етап J: Приєднання аміну за формулою HNR12R13 до сполуки за формулою [13] для одержання сполуки за формулою [14] 80409 36 Реакцію на вищезгаданому Етапі J переважно здійснюють з придатним аміном HNR12R13 у придатному розчиннику. Придатними амінами HNR12R13 є аміак, первинні аміни та вторинні аміни, переважно моно- та ди-(С1-С5) алкіламіни, такі як монота диметиламін, моно- та діетиламін, моно- та дипропіламін, та моно- та дибутиламін тощо. Реакцію здійснюють у придатному розчиннику, такому як оцтова кислота, тетрагідрофуран, хлороформ, дихлорметан тощо. Звичайно реакції здійснюють при температурі від 0 до 100°С протягом періоду від 1 до 10 годин. Гексациклічні сполуки цього винаходу можна необов'язково перетворювати на форму фізіологічно прийнятної солі, наприклад, солі лужного металу або солі лужноземельного металу, шляхом застосування гідроксиду цих металів, або, коли така сполука є лужною сполукою, такою, що вона має аміногрупу або подібне, її можна перетворювати на неорганічну або органічну сіль, застосовуючи неорганічну кислоту, таку як соляна кислота, сірчана кислота, фосфорна кислота тощо, або органічну кислоту, таку як мура1Hина кислота, оцтова кислота, метансульфонова кислота тощо. Виробництво фармацевтично прийнятних кислотно-адитивних солей гексациклічних сполук за формулою [1] можна здійснювати шляхом обробки вільного лугу гексациклічної сполуки за формулою [1] кислотою за, по суті, звичайними способами солеутворення. Прикладами терапевтично прийнятних кислот, корисних у вищезгаданому процесі, є неорганічні кислоти (наприклад, соляна кислота, бромистоводнева кислота, фосфорна кислота, азотна кислота, сірчана кислота) та органічні кислоти (наприклад, щавлева кислота, оцтова кислота, мура1Hина кислота, трифторооцтова кислота, малеїнова кислота, бурштинова кислота, фумарова кислота, винна кислота, лимонна кислота, саліцилова кислота, сорбінова кислота, молочна кислота, метансульфонова кислота). Крім того, гексациклічні сполуки за формулою [1] можна перетворити на гідрати або сольвати та їх солі, використовуючи рі3Hі способи, відомі фахівцям у галузі. Гексациклічні сполуки цього винаходу є корисними для лікування раку. Отже, цей винахід включає застосування вищезгаданих сполук для одержання лікарських засобів для лікування раку та відповідних фармацевтичних композицій, які включають гексациклічну сполуку, яку визначено вище, та фармацевтично прийнятний носій. Гексациклічні сполуки цього винаходу є ефективними в інгібуванні або запобіганні росту пухлин у передракових та ракових клітинах та є корисними для лікування раку, що утворює тверді пухлини, особливо раку прямої кишки, раку легенів, раку грудей, раку шлунку, раку шийки матки та раку сечового міхура. Гексациклічні сполуки цього винаходу можна застосовувати для лікування таких пухлин, для уповільнення розвитку таких пухлин та для запобігання збільшенню кількості пухлин. Протиракову терапевтичну активність гексациклічних сполук цього винаходу можна продемонструвати, застосовуючи рі3Hі стандартні аналізи in vitro. Відомо, що такі аналізи, які описано нижче та 37 80409 у прикладах, вказують на протиракову активність, та їх застосовують як аналізи у терапії раку. Гексациклічні сполуки цього винаходу мають структуру, проілюстровану формулою [1], та протиракову активність, що ви3Hачається будь-яким стандартним аналізом, зокрема аналізами на апоптоз. Гексациклічні сполуки цього винаходу є особливо ефективними для індукування апоптозу у ракових клітинах, викликаючи смерть клітин. Отже, гексациклічні сполуки цього винаходу мають бажану активність, якщо сполуки примушують ракові клітини вмирати, коли клітини за3Hають впливу гексациклічних сполук цього винаходу. Ракові клітини для аналізів (наприклад, клітини раку грудей, легенів, прямої кишки тощо) легко отримати із сховищ клітин, таких як Американська колекція типових культур (АТСС), або фахівці .можуть їх виділити з ракових пацієнтів. Тип раку, проти якого гексациклічні сполуки цього винаходу є найбільш ефективними, ви3Hачають за типом клітин, що застосовуються в аналізах. Ракові клітини, вирощені у культурі, можна інкубувати зі специфічною сполукою, та зміни у життєздатності клітин можна визначити, наприклад, за допомогою барвників, які вибірково забарвлюють мертві клітини, або шляхом вимірювання оптичної густини (O.D.). Якщо загинуло Більш ніж 10% клітин, тоді сполука є активною в індукуванні апоптозу. Сполуки можуть не прямо вбивати клітини (клітинна токсичність), але можуть модулювати певні внутриішньоклітинні або зовнішньоклітинні події, які спричиняють апоптоз. Протиракову активність сполук цього винаходу можна також визначити за допомогою аналізів, які оцінюють вплив сполук на клітинний ріст та диференціацію. Інгібування клітинного росту можна визначити шляхом додавання сполуки, яку розглядають, до ракових клітин у культурі з барвниками або радіоактивними попередниками, та шляхом рахування клітин під мікроскопом, сцинтиляційного рахування або шляхом вимірювання оптичної густини з метою визначення, чи зросла кількість клітин протягом періоду інкубації. Якщо кількість клітин не зросла, ріст уповільнився, тоді вважають, що сполука має терапевтичну активність. Подібно до цього, застосовуючи відомі способи, можна визначити пропорцію клітин, які стали диференційованими після додавання сполуки тесту (тобто, шляхом вимірювання оки 38 слювального бурсту у клітинах HL-60, індикатора диференціації, за допомогою NBT (нітроблакитний тетразолій). Якщо диференціювалося 10% або більше клітин, тоді вважають, що сполука має терапевтичну активність. Аналіз антипроліфераційної активності здійснювали наступним способом. Єдину суспензію пухлинних клітин інокулювали у 96-лунковий мікро1Hіан1Hет з послідовним розведенням. Потім тестовий план1Hет інкубували в оточенні 5% СО2 при 37°С протягом 4 днів (2-3х103 клітин/лунка). Ступінь клітинного росту у моношарі вимірювали, застосовуючи WST-8 (Dojindo, Japan). значення IC50 ліків проти пухлинних клітин підраховували як концентрацію ліків, що виробляють 50%-ву оптичну густину контрольного росту. Результати представлено у наступній Таблиці 1. Пока3Hики протипухлинної активності гексациклічних сполук за формулами [1А] та [1В] проти росту in vitro пухлинних клітинних ліній людини, НСТ116 та DLD-1 раку прямої кишки (CRC), та QG56 та NCI-H460 недрібноклітинного раку легенів (NSCLC) наведено у Таблиці 1. Ці клітинні лінії є комерційно доступними у Американській колекції типових культур (АТСС). У Таблиці 1 Сполука А позначає (9S)-9-етил-9-гідрокси-1фенетил-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3H,9Н, 15Н)-трион. Сполука В позначає (9S)-9-етил-9-гідрокси-1пентил-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-10,13(9Н,15Н)-діон. Сполука D позначає (9S)-9-етил-9-гідрокси-1(3-метилбутил)-2(3H)-тіоксо-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-10,13(9Н,15Н)-діон. Сполука Е позначає (9S)-9-етил-9-гідрокси-2метил-1-пентил-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-10,13(9Н,15Н)-діон. Сполука F позначає (9S)-9-етил-9-гідрокси-2гідроксиметил-1-(3-метилбутил)-1H,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-10,13(9Н,15Н)-діон. SN-38 позначає 7-етил-10гідроксикамптотецин. Таблиця 1 Аналіз антипроліфераційної активності (IC50 у нМ) Сполука Сполука А Сполука В Сполука D Сполука Е Сполука F SN-38 (Контрольна) НСТ116 (рак прямої кишки) 1,9 6,1 5,1 4,5 3,1 DLD-1 (рак прямої кишки) 11 23 15 15 12 6,9 53 Для клінічного застосування гексациклічні сполуки за формулою [1], їхні проліки або сіль, утво QG56 (недрібноклітин- NCI-H460 (недрібнокліний рак легенів) тинний рак легенів) 7,1 6,5 7,7 7,0 17 10 15 7,9 7,4 4,8 27 21 рену з них, тощо, можна вводити самостійно, але звичайно вони будуть вводитися у фармацевтич 39 ній суміші, виготовленій відповідно до певного застосування та мети, якої бажано досягти, шляхом змі1Hування з наповнювачем, зв'язувальним агентом, мастильним агентом, розщеплювальним агентом, матеріалом покриття, емульгатором, суспендувальним агентом, розчинником, стабілізатором, активатором абсорбції та/або мазевою основою. Суміш можна застосовувати для перорального введення, введення шляхом ін'єкції, ректального або місцевого введення. Більш докладно, як згадувалося раніше, лікарські засоби, що містять сполуку за формулою [1] або її проліки, є також предметом цього винаходу поряд із способом одержання таких лікарських засобів, при цьому спосіб включає введення однієї або більше сполук за формулою [1] та, якщо бажано, однієї або більше терапевтично цінних речовин у галенову форму введення. Фармацевтичні композиції можна вводити перорально, наприклад, у формі таблеток, таблеток з покриттям, драже, твердих або м'яких желатинових капсул, розчинів, емульсій або суспензій. Введення можна також здійснювати ректально, наприклад, застосовуючи супозиторії, місцево або крізьшкірно, наприклад, застосовуючи мазі, креми, гелі або розчини, або парентерально, наприклад, застосовуючи розчини для ін'єкцій. Для одержання таблеток, таблеток з покриттям, драже або твердих желатинових капсул гексациклічні сполуки цього винаходу можна змішати з фармацевтично інертними, неорганічними або органічними наповнювачами (фармацевтично прийнятними носіями). Приклади придатних наповнювачів для таблеток, драже або твердих желатинових капсул включають лактозу, кукурудзяний крохмаль або їхні похідні, тальк або стеаринову кислоту або її солі. Придатні наповнювачі для застосування з м'якими желатиновими капсулами включають, наприклад, рослинні олії, віск, жири, напівтверді або рідкі поліоли тощо. Залежно від природи активних інгредієнтів, може, однак, статися так, що жодного наповнювача взагалі не потребується для м'яких желатинових капсул. Придатні наповнювачі для одержання розчинів та сиропів включають, наприклад, воду, поліоли, цукрозу, інвертний цукор та глюкозу. Придатні наповнювачі для розчинів для ін'єкцій включають, наприклад, воду, спирти, поліоли, гліцерин та рослинні олії. Придатні наповнювачі для супозиторіїв та для місцевого або крізьшкірного застосування включають, наприклад, природні або затвердлі олії, віск, жири та напівтверді або рідкі поліоли. Фармацевтичні композиції також можуть містити консерванти, солюбілізувальні агенти, стабілізатори, зволожувачі, емульгатори, підсолоджувачі, барвники, ароматизатори, солі для зміни осмотичного тиску, буфери, агенти для покриття або антиоксиданти. Вони можуть також містити іще інші терапевтично цінні речовини. Взагалі, фармацевтичний склад для перорального введення може бути у вигляді гранул, таблетки, таблетки з цукровим покриттям, капсули, пілюлі, суспензії або емульсії, а для парентеральної ін'єкції, наприклад, внутриішньовенної, внутриішньом'язової або підшкірної ін'єкції, його можна 80409 40 застосовувати у формі стерильного водного розчину, який може містити інші речовини, наприклад, солі або глюкозу, щоб зробити розчин ізотонічним. Протипухлинний агент можна також вводити у формі ректальних або піхвових супозиторіїв, або його можна застосовувати місцево у формі лосьйону, розчину, крему, мазі або присипки. Рівень щоденної дози гексациклічних сполук цього винаходу становить від 5 до 2000мг/м2, коли їх вводять або пероральним способом, або парентеральним способом. Отже, таблетки або капсули можуть містити від 5 до 1000мг активної сполуки для єдиного введення, або їх можна вводити по дві або більше за один раз, якщо це є доречним. У будь-якому випадку, дійсна доза може залежати від ваги та реакції певного пацієнта. Наступні приклади ілюструють переважні способи одержання гексациклічних сполук цього винаходу, при цьому вони не при3Hачені обмежувати обсяг цього винаходу. Приклади Базовий приклад 1 Одержання (20RS)-10-метил-9-нітрокамптотецину 20-ацетату (20RS)-10-Метилкамптотецин (18,1мг, 0,05ммоль) розчинили у сірчаній кислоті (0,2мл) та до розчину додали нітрат калію (6,1мг, 0,06ммоль). Після перемішування протягом 2 годин при кімнатній температурі суміш вилили у воду та екстрагували дихлорметаном. Органічний шар концентрували при зниженому тиску, внаслідок чого отримали (20RS)-10-метил-9-нітрокамптотецин (18,1мг, 89%) у вигляді не зовсім білої твердої речовини. 1 Н ЯМР (270мгц) d (DMSO-d6) 0,88 (т, J = 7,3Гц, 3Н), 1,75-2,00 (м, 2Н), 2,57 (с, 3Н), 5,28 (с, 2Н), 5,44 (с, 2Н), 6,56 (с, 1H), 7,37 (с, 1Н), 7,94 (д, J = 8,9Гц, 1H), 8,35 (д, J = 8,9Гц, 1H), 8,53 (с, 1Н): MS (ES) m/z 408 (М++1). (20RS)-10-метил-9-нітрокамптотецин (15,9мг, 0,039ммоль) суспендували в оцтовій кислоті (2мл) та до суспензії додали ацетилхлорид (0,4мл). Після перемішування при 70°С протягом 1,5 годин, до суміші на льодяній бані додали метанол. Залишок, отриманий шляхом концентрування суміші, очистили шляхом колоночної хроматографії на силікагелі (дихлорметан/ацетон = 30/1 -10/1), внаслідок чого одержали чистий продукт (11,4мг, 65%) у вигляді безбарвної твердої речовини. 1 Н ЯМР (270мгц) d (CDCl3) 0,99 (т, J = 7,6Гц, 3Н), 2,02-2,39 (м, 5Н), 2,62 (с, 3H), 5,31 (с, 2Н), 5,41 (д, J = 17,5Гц, 1Н), 5,68 (д, J = 17,5Гц, 1H), 7,21 (с, 1Н), 7,74 (д, J = 8,9Гц, 1Н), 8,28 (д, J = 8,9Гц, 1Н), 8,33 (с, 1Н), MS (ES) m/z 450 (M++1). Базовий приклад 2.1 Одержання (20RS)-9-нітрокамптотецин-Nоксиду 20-ацетату До розчину 9-нітрокамптотецину 20-ацетату (8,62г, 19,8ммоль) у трифторооцтовій кислоті (65мл) додали комплекс пероксиду воднюкарбаміду (3,11г, 33,1ммоль) при кімнатній температурі. Після перемішування протягом 4 годин при кімнатній температурі, суміш концентрували при зниженому тиску до приблизно половини об'єму та вилили у суміш льоду з водою. Одержаний осад 41 зібрали шляхом фільтрування, промили дистильованою водою та висушили в умовах вакууму, внаслідок чого отримали сполуку з заголовку (8,35г, 93% вихід). 1 Н ЯМР (270мгц) 5 (CDCl3) 0,98 (т, J = 7,6Гц, 3Н), 2,08-2,33 (м, 2Н), 2,23 (с, 3Н), 5,38 (с, 2Н), 5,40 (d, J = 17,7Гц, 1Н), 5,67 (д, J = 17,7Гц, 1H), 7,96 (с, 1Н), 7,96 (дд, J = 7,6 та 7,8Гц, 1H), 8,67 (с, 1Н), 9,16 (д, J = 7,6Гц, 1H), MS m/z (ES) 452 (M++1). Базовий приклад 2.2 Одержання (20RS)-10метил-9-нітрокамптотецин-N-оксиду 20-ацетату Ця сполука була одержана з (20RS)-10-метил9-нітрокамптотецину 20-ацетату з базового прикладу 1 за способом, аналогічним способу з базового прикладу 2.1. 1 Н ЯМР (270мгц) 5 (CDCl3) 0,97 (т, J = 7,4Гц, 32Н), 2,03-2,38 (м, 5Н), 2,61 (с, 3H), 5,31 (с, 2Н), 5,38 (д, J = 17,4Гц, 1Н), 5,64 (д, J = 17,4Гц, 1Н), 7,74 (с, 1Н), 7,77 (д, J = 9,1Гц, 1H), 7,93 (с, 1Н), 8,84 (д, J = 9,1Гц, 1H), MS (ES) m/z 466 (M++1). Базовий приклад 3.1 Одержання (20S)-7-хлор-9-нітрокамптотецину 20-ацетату До розчину (20S)-9-нітрокамптотецин-N-оксиду 20-ацетату (10,88г, 24,1ммоль) з базового прикладу 2.1 у N,N-диметилформаміді (196мл) додали оксалілхлорид (4,2мл, 48,2ммоль) при 0°С та суміш перемішували при 15°С протягом 3 годин. Суміш вилили у воду з льодом (500мл) та екстрагували етилацетатом (500млх1,250млх2). Органічний шар висушили над безводним сульфатом натрію та концентрували при зниженому тиску. Залишок очистили шляхом колоночної хроматографії на силікагелі (етилацетат/гексан = 1/1), внаслідок чого отримали сполуку з заголовку (5,54г, 49%) у вигляді жовтої твердої речовини. 1 Н ЯМР (270мгц) d (CDCl3) 0,99 (т, J = 7,6Гц, 3Н), 2,07-2,33 (м, 2Н), 2,23 (с, 3Н), 5,33 (с, 2Н), 5,41 (д, J = 17,8Гц, 1H), 5,69 (д, J = 17,8Гц, 1Н), 7,20 (с, 1Н), 7,87-7,95 (м, 2Н), 8,44 (дд, J = 2,3 та 7,6Гц, 1H), MS m/z (ES) 470 (М++1). Базовий приклад 3.2 Одержання (20RS)-7-хлор-10-метил-9нітрокамптотецину 20-ацетату Ця сполука була одержана з (20RS)-10-метил9-нітрокамптотецин-Н-оксиду 20-ацетату з базового прикладу 2.2 за способом, аналогічним способу з базового прикладу 3.1. 1 Н ЯМР (270мгц) 6 (CDCl3) 0,98 (т, J = 7,4Гц, 3Н), 2,02-2,36 (м, 5Н), 2,55 (с, 3Н), 5,30 (с, 2Н), 5,40 (д, J = 17,5Гц, 1h), 5,68 (д, J = 17,5Гц, 1h), 7,17 (с, 1Н), 7,78 (д, J = 8,6Гц, 1Н), 8,29 (д, J = 8,6Гц, 1h), MS (ES) m/z 484 (M++1). Базовий приклад 4.1 Одержання (20S)-9-нітро-7-(пентиламіно)камптотецину 20-ацетату До суспензії (20S)-7-хлор-9-нітрокамптотецину 20-ацетату (2,58г, 5,49ммоль) з базового прикладу 3.1 у 1,4-діоксані (29мл) додали п-аміламін (2,55мл, 21,96ммоль) та суміш перемішували при 80°С протягом 2 годин з наступним концентруванням при зниженому тиску. Одержаний залишок очистили за допомогою колоночної хроматографії на силікагелі (дихлорметан/ацетон = 30/1 - 20/1), 80409 42 внаслідок чого отримали сполуку з заголовку (1,80г, 63%) у вигляді коричневого масла. 1 Н ЯМР (270мгц) d (CDCl3) 0,86-1,01 (м, 6Н), 1,22-1,59 (м, 4Н), 1,60-1,78 (м, 2Н), 2,03-2,37 (м, 5Н), 3,57-3,68 (м, 2Н), 5,02 (1Hир, 1H), 5,40 (д, J = 17,2Гц, 1H), 5,47 (с, 2Н), 5,67 (д, J = 17,2Гц, 1Н), 7,13 (с, 1H), 7,66 (дд, J = 2,0,7,9Гц, 1H), 7,71 (т, J = 7,9Гц, 1H), 8,23 (дд, J = 2,0, 7,9Гц, 1Н), MS (ES) m/z 521 (M++1). Базовий приклад 4.2 Одержання (20S)-9-нітро-7-[2-(морфолініл)етиламіно]камптотецину20-ацетату Ця сполука була одержана з (20S)-7-хлор-9нітрокамптотецину 20-ацетату з базового прикладу 3.1 та 4-(2-аміноетил)морфоліну за способом, аналогічним способу з базового прикладу 4.1. 1 Н ЯМР (400мгц) d (CDCl3) 0,99 (т, J = 7,6Гц, 3Н), 2,12-2,18 (м, 2Н), 2,22 (с, 3H), 2,25-2,30 (м, 1H), 2,56 (м, 4Н), 2,71 (т, J = 5,6Гц, 2Н), 3,74-3,78 (м, 2Н), 3,84 (т, J = 4,6Гц, 4Н), 5,40 (д, J = 17,4Гц, 1Н), 5,49 (д, J = 18,4Гц, 1Н), 5,51 (д, J = 18,4Гц, 1Н), 5,66 (д, J = 17,4Гц, 1H), 7,13 (с, 1Н), 7,67-7,73 (м, 2Н), 8,20 (дд, J = 2,4 та 8,0Гц, 1H), MS (ES) m/z 564 (М++1). Базовий приклад 4.3 Одержання (20S)-7-[3-(диметиламіно)пропіламіно]-9-нітрокамптотецину 20-ацетату Ця сполука була одержана з (20S)-7-хлор-9нітрокамптотецину 20-ацетату з базового прикладу 3.1 та N,N-диметил 1,3-діамінопропану за способом, аналогічним способу з базового прикладу 4.1. 1 Н ЯМР (270мгц) 6 (CDCl3) 0,97 (т, J = 7,5Гц, 3Н), 1,82-1,88 (м, 2Н), 2,07-2,32 (м, 2Н), 2,18 (с, 3Н), 2,22 (с, 6Н), 2,47 (т, J = 5,7Гц, 2Н), 3,79-3,84 (м, 2Н), 5,40 (д, J = 17,2Гц, 1Н), 5,50 (с, 2Н), 5,60 (д, J = 17,2Гц, 1H), 7,09 (1Hир.т, 1Н), 7,13 (с, 1H), 7,67 (дд, J = 7,6 та 8,6Гц, 1Н), 7,83 (дд, J = dd, J = 1,3 та 7,6Гц, 1Н), 8,20 (дд, J = 1,3 та 8,6Гц, 1Н), MS (ES) m/z 536 (M++1). Базовий приклад 4.4 Одержання (20S)-9-нітро-7-(пропіламіно)камптотецину 20-ацетату Ця сполука була одержана з (20S)-7-хлор-9нітрокамптотецину 20-ацетату з базового прикладу 3.1 та пропіламіну за способом, аналогічним способу з базового прикладу 4.1. 1 Н ЯМР (270мгц) d (CDCl3) 0,97 (т, J = 7,6Гц, 3Н), 1,07 (т, J = 7,2Гц, 3Н), 1,67-1,80 (м, 2Н), 2,122,30 (м, 2Н), 2,22 (с, 3Н), 3,58-3,66 (м, 2Н), 5,04 (1Hир.с, 1Н), 5,40 (д, J = 17,2Гц, 1H), 5,46 (с, 2Н), 5,67 (д, J = 17,2Гц, 1H), 7,14 (с, 1H), 7,64-7,74 (м, 2Н), 8,23 (дд, J = 1,3 та 7,9Гц, 1Н), MS (ES) m/z 493 (М++1). Базовий приклад 4.5 Одержання (20S)-7-бензиламіно-9-нітрокамптотецину 20-ацетату Ця сполука була одержана з (20S)-7-хлор-9нітрокамптотецину 20-ацетату з базового прикладу 3.1 та бензиламіну за способом, аналогічним способу з базового прикладу 4.1. MS(ES)m/z541(M++1). Базовий приклад 4.6 Одержання (20S)-9-нітро-7-(фенетиламіно)камптотецину 20-ацетату 43 Ця сполука була одержана з (20S)-7-хлор-9нітрокамптотецину 20-ацетату з базового прикладу 3.1 та фенетиламіну за способом, аналогічним способу з базового прикладу 4.1. 1 Н ЯМР (400мгц) 8 (CDCl3) 0,97 (т, J = 7,4Гц, 3Н), 2,10-2,30 (м, 2Н), 2,22 (с, 3Н), 3,00 (т, J = 6,6Гц, 2Н), 3,94 (м, 2Н), 4,93 (м, 1Н), 5,40 (д, J = 17,0Гц, 1Н), 5,46 (с, 2Н), 5,67(д, J = 17,0Гц, 1H), 7,12 (с, 1Н), 7,25-7,33 (, 3Н), 7,36-7,39 (м, 2Н), 7,667,71 (м, 2Н), 8,21 (дд, J = 3,0 та 7,4Гц, 1H), MS (ES) m/z 555 (М++1). Базовий приклад 4.7 Одержання (20S)-9-нітро-7-(3-фенілпропіламіно)камптотецину 20-ацетату Ця сполука була одержана з (20S)-7-хлор-9нітрокамптотецину 20-ацетату з базового прикладу 3.1 та 3-фенілпропіламіну за способом, аналогічним способу з базового прикладу 4.1. 1 H ЯМР (270мгц) d (CDCl3) 0,97 (т, J = 7,4Гц, 3Н), 2,02 (м, 2Н), 2,10-2,29 (м, 2Н), 2,21 (с, 3Н), 2,78 (т, J = 7,4Гц, 2Н), 3,65 (м, 2Н), 5,05 (м, 1H), 5,39 (с, 2Н), 5,39 (д, J = 17,3Гц, 1Н), 5,67 (д, J = 17,3Гц, 1H), 7,13 (с, 1H), 7,20-7,34 (м, 5Н), 7,657,75 (м, 2Н), 8,24 (дд, J = 2,3 та 7,9Гц, 1Н), MS (ES) m/z 569 (М++1). Базовий приклад 4.8 Одержання (20S)-9-нітро-7-[2-(піридин-2іл)етиламіно]камптотецину 20-ацетату Ця сполука була одержана з (20S)-7-хлор-9нітрокамптотецину 20-ацетату з базового прикладу 3.1 та 2-(2-аміноетил)піридину за способом, аналогічним способу з базового прикладу 4.1. 1 H ЯМР (270мгц) d (CDCl3) 0,97 (т, J = 7,4Гц, 3Н), 2,10-2,32 (м, 2Н), 2,22 (с, 3Н), 3,16 (т, J = 5,9Гц, 2Н), 4,09 (м, 2Н), 5,40 (д, J = 17,2Гц, 1Н), 5,52 (с, 2Н), 5,68 (д, J = 17,2Гц, 1Н), 6,88 (м, 1Н), 7,13 (с, 1H), 7,19 (, 2Н), 7,63-7,78 (м, 3Н), 8,20 (дд, J = 1,3 та 8,3Гц, 1Н), 8,61 (дд, J = 1,8 та 5,8Гц, 1H), MS (ES) m/z 556 (М++1). Базовий приклад 4.9 Одержання (20S)-9-нітро-7-[2-(піридин-3іл)етиламіно]камптотецину20-ацетату Ця сполука була одержана з (205)-7-хлор-9нітрокамптотецину 20-ацетату з базового прикладу 3.1 та 3-(2-аміноетил)піридину за способом, аналогічним способу з базового прикладу 4.1. 1 Н ЯМР (270мгц) d (CDCl3) 0,97 (т, J = 7,4Гц, 3Н), 2,09-2,32 (м, 2Н), 2,22 (с, 3H), 3,02 (т, J = 6,8Гц, 2Н), 3,94 (м, 2Н), 4,96 (м, 1Н), 5,39 (д, J = 17,3Гц, 1Н), 5,46 (с, 2Н), 5,67 (д, J = 17,3Гц, 1Н), 7,13 (с, 1Н), 7,32 (дд, J = 4,8 та 7,4Гц, 1Н), 7,607,74 (м, 3Н), 8,24 (дц, J = 2,0 та 7,6Гц, 1Н), 8,508,58 (м, 2Н), MS (ES) m/z 556 (M++1). Базовий приклад 4.10 Одержання (20S)-7-(3-метилбутиламіно)-9нітрокамптотецину 20-ацетату Ця сполука була одержана з (20S)-7-хлор-9нітрокамптотецину 20-ацетату з базового прикладу 3.1 та ізоаміламіну за способом, аналогічним способу з базового прикладу 4.1. 1 Я ЯМР (270мгц) d (CDCl3) 0,97 (т, J = 7,6Гц, 3Н), 0,99 (д, J = 6,6Гц, 6Н), 1,55 (м, 2Н), 1,74 (м, 1H), 2,10-2,30 (м, 2Н), 2,22 (с, 3Н), 3,66 (дт, J = 5,0 та 7,1Гц, 2Н), 4,98 (м, 1H), 5,40 (д, J = 17,2Гц, 1Н), 5,49 (с, 2Н), 5,68 (д, J = 17,2Гц, 1H), 7,14 (с, 1Н), 80409 44 7,65-7,75 (м, 2Н), 8,24 (д, J = 6,9Гц, 1H), MS (ES) m/z 521 (М++1). Базовий приклад 4.11 Одержання (20S)-7-гептиламіно-9нітрокамптотецину 20-ацетату Ця сполука була одержана з (20S)-7-хлор-9нітрокамптотецину 20-ацетату з базового прикладу 3.1 та гептиламіну за способом, аналогічним способу з базового прикладу 4.1. 1 Н ЯМР (270мгц) 8 (CDCl3) 0,85-1,00 (м, 6Н), 1,22-1,52 (м, 8Н), 1,59-1,69 (м, 2Н), 2,14-2,28 (м, 5Н), 3,64 (к, J = 6,9Гц, 2Н), 5,00-5,03 (м, 1Н), 5,40 (д, J = 17,2Гц, 1Н), 5,47 (с, 2Н), 5,67 (д, J = 17,2Гц, 1H), 7,13 (с, 1H), 7,66 (дд, J = 2,0, 7,9Гц, 1H), 7,71 (т, J = 7,9Гц, 1Н), 8,23 (дд, J = 2,0, 7,9Гц, 1Н), MS (ES) m/z 549 (М++1). Базовий приклад 4.12 Одержання (20S)-7-метиламіно-9нітрокамптотецину 20-ацетату Ця сполука була одержана з (20S)-7-хлор-9нітрокамптотецину 20-ацетату з базового прикладу 3.1 та метиламіну за способом, аналогічним способу з базового прикладу 4.1. 1 Н ЯМР (270мгц) d (CDCl3) 0,97 (т, J = 5,1Гц, 3Н), 2,12-2,30 (м, 5Н), 3,37 (д, J = 3,2Гц, 3Н), 5,16 (1Hир, 1Н), 5,40 (д, J = 11,6Гц, 1H), 5,56 (с, 2Н), 5,67 (д, J = 11,6Гц, 1Н), 7,14 (с, 1Н), 7,72 (м, 2Н), 8,25 (м, 1Н), MS (ES) m/z 465 (М++1. Базовий приклад 4.13 Одержання (20S)-7-(2-метилпропіламіно)-9нітрокамптотецину 20-ацетату Ця сполука була одержана з (20S)-7-хлор-9нітрокамптотецину 20-ацетату з базового прикладу 3.1 та ізобутиламіну за способом, аналогічним способу з базового прикладу 4.1. 1 Н ЯМР (270мгц) 5 (CDCl3) 0,97 (т, J = 7,6Гц, 3Н), 1,06 (д, J = 6,6Гц, 6Н), 1,81-2,01 (м, 1Н), 2,052,36 (м, 5Н), 3,39-3,52 (м, 2Н), 5,08 (1Hир, 1Н), 5,40 (д, J = 17,2Гц, 1Н), 5,47 (с, 2Н), 5,67 (д, J = 17,2Гц, 1H), 7,13 (с, 1H), 7,65 (дд, J = 1,7, 7,8Гц, 1H), 7,71 (т, J = 7,8Гц, 1Н), 8,23 (дд, J = 1,7,7,8Гц, 1H), MS (ES) m/z 507 (М++1). Базовий приклад 4.14 Одержання (20S)-7-гексиламіно-9нітрокамптотецину 20-ацетату Ця сполука була одержана з (20S)-7-хлор-9нітрокамптотецину 20-ацетату з базового прикладу 3.1 та гексиламіну за способом, аналогічним способу з базового прикладу 4.1. 1 Н ЯМР (270мгц) d (CDCl3) 0,87-1,03 (м, 6Н), 1,24-1,59 (м, 6Н), 1,60-1,78 (м, 2Н), 2,05-2,37 (м, 5Н), 3,58-3,70 (м, 2Н), 5,02 (1Hир, 1Н), 5,40 (д, J = 17,5Гц, 1H), 5,47 (с, 2Н), 5,67 (д, J = 17,5Гц, 1Н), 7,13 (с, 1Н), 7,66 (дд, J = 2,0,7,8Гц, 1Н), 7,71 (т, J = 7,8Гц, 1Н), 8,23 (дд, J = 2,0, 7,8Гц, 1 Н), MS (ES) m/z 535 (M++1). Базовий приклад 4.15 Одержання (205)-7-бутиламіно-9нітрокамптотецину 20-ацетату Ця сполука була одержана з (205)-7-хлор-9нітрокамптотецину 20-ацетату з базового прикладу 3.1 та бутиламіну за способом, аналогічним способу з базового прикладу 4.1. 1 Н ЯМР (270мгц) d (CDCl3) 0,97 (т, J = 7,6Гц, 3Н), 1,00 (т, J = 7,3Гц, 3Н), 1,43-1,52 (м, 2Н), 1,63 45 1,71 (м, 2Н), 2,13-2,32 (м, 2Н), 2,22 (с, 3Н), 3,623,69 (м, 2Н), 5,02 (1Hир.т, 1H), 5,40 (д, J = 17,2Гц, 1H), 5,47 (с, 2Н), 5,66 (д, J = 17,2Гц, 1Н), 7,14 (с, 1H), 7,65-7,74 (м, 2Н), 8,23 (дд, J = 1,6 та 7,9Гц, 1Н), MS m/z (ES) 507 (М++1). Базовий приклад 4.16 Одержання (20S)-7-етиламіно-9-нітрокамптотецину 20-ацетату Ця сполука була одержана з (20S)-7-хлор-9нітрокамптотецину 20-ацетату з базового прикладу 3.1 та етиламіну за способом, аналогічним способу з базового прикладу 4.1. 1 Н ЯМР (270мгц) d (CDCl3) 0,97 (т, J = 7,6Гц, 3Н), 1,36 (т, J = 7,1Гц, 3Н), 2,12-2,30 (м, 5Н), 3,70 (к, J = 7,1Гц, 1Н), 3,72 (к, J = 7,1Гц, 1Н), 4,96 (1Hир, 1Н), 5,40 (д, J = 17,3Гц, 1H), 5,46 (с, 2Н), 5,67 (д, J = 17,3Гц, 1H), 7,13 (с, 1H), 7,67 (дд, J = 2,6, 7,3Гц, 1H), 7,71 (т, J = 7,3Гц, 1Н), 8,23 (дд, J = 2,6,7,3Гц, 1H), MS (ES) m/z 479 (M++1). Базовий приклад 4.17 Одержання (20S)-7-[2-(4-метоксифеніл)етиламіно]-9-нітрокамптотецину 20-ацетату Ця сполука була одержана з (20S)-7-хлор-9нітрокамптотецину 20-ацетату з базового прикладу 3.1 та 4-метоксифенетиламіну за способом, аналогічним способу з базового прикладу 4.1. 1 Н ЯМР (270мгц) d (CDCl3) 0,96 (т, J = 7,6Гц, 3Н), 2,02-2,37 (м, 5Н), 2,94 (т, J = 6,3Гц, 2Н), 3,81 (с, 3Н), 3,89 (к, J = 6,3Гц, 2Н), 4,91 (1Hир, 1Н), 5,39 (д, J = 17,2Гц, 1Н), 5,46 (с, 2Н), 5,67 (д, J = 17,2Гц, 1Н), 6,85-7,93 (м, 2Н), 7,12 (с, 1Н), 7,13-7,21 (м, 2Н), 7,64-7,73 (м, 2Н), 8,17-8,25 (м, 1Н), MS (ES) m/z 585 (M++1). Базовий приклад 4.18 Одержання (20S)-7-[2-(4-хлорфеніл)етиламіно]-9-нітрокамптотецину 20-ацетату Ця сполука була одержана з (20S)-7-хлор-9нітрокамптотецину 20-ацетату з базового прикладу 3.1 та 4-хлорфенетиламіну за способом, аналогічним способу з базового прикладу 4.1. 1 Н ЯМР (270мгц) d (CDCl3) 0,97 (т, J = 7,6Гц, 3Н), 2,02-2,37 (м, 5Н), 2,97(т, J = 6,3Гц, 2Н), 3,89 (к, J = 6,3Гц, 2Н), 4,90 (1Hир, 1Н), 5,39 (д, J = 17,2Гц, 1Н), 5,45 (с, 2Н), 5,66 (д, J = 17,2Гц, 1Н), 7,17-7,38 (м, 5Н), 7,65-7,70 (м, 2Н), 8,20-8,24 (м, 1Н), MS (ES) m/z 589 (М++1). Базовий приклад 4.19 Одержання (20S)-7-[2-(4фторфеніл)етиламіно]-9-нітрокамптотецину 20ацетату Ця сполука була одержана з (20S)-7-хлор-9нітрокамптотецину 20-ацетату з базового прикладу 3.1 та 4-фторфенетиламіну за способом, аналогічним способу з базового прикладу 4.1. 1 Н ЯМР (270мгц) d (CDCl3) 0,97 (т, J = 7,4Гц, 3Н), 2,03-2,38 (м, 5Н), 2,97(т, J = 6,6Гц, 2Н), 3,91 (к, J = 6,6Гц, 2Н), 4,91 (1Hир, 1H), 5,39 (д, J = 17,2Гц, 1Н), 5,46 (с, 2Н), 5,67 (д, J = 17,2Гц, 1Н), 6,91-7,27 (м, 5Н), 7,66-7,73 (м, 2Н), 8,21-8,24 (м, 1H, Н-10), MS (ES) m/z 573 (М++1). Базовий приклад 4.20 Одержання (20S)-7-(1-метилетиламіно)-9нітрокамптотецину 20-ацетату Ця сполука була одержана з (20S)-7-хлор-9нітрокамптотецину 20-ацетату з базового прикладу 80409 46 3.1 та ізопропіламіну за способом, аналогічним способу з базового прикладу 4.1. 1 Н ЯМР (270мгц) d (CDCl3) 0,97 (т, J = 7,6Гц, 3Н), 1,32 (дд, J = 2,0,6,3Гц, 6Н), 2,05-2,37 (м, 5Н), 3,97-4,15 (м, 1Н), 4,92 (д, J = 7,9Гц, 1H), 5,32 (с, 2Н), 5,40 (д, J = 17,2Гц, 1H), 5,68 (д, J = 17,2Гц, 1H), 7,14 (с, 1H), 7,66 (дд, J = 1,7, 8,3Гц, 1H), 7,72 (дц, J = 7,6, 8,3Гц, 1H), 8,23 (дд, J = 1,7, 8,3Гц, 1Н), MS (ES) m/z 493 (М++1). Базовий приклад 4.21 Одержання (20S)-7-(3,3-диметилбутиламіно)9-нітрокамптотецину 20-ацетату Ця сполука була одержана з (20S)-7-хлор-9нітрокамптотецину 20-ацетату з базового прикладу 3.1 та 3.3-диметилбутиламіну за способом, аналогічним способу з базового прикладу 4.1. 1 Н ЯМР (270мгц) d (CDCl3) 0,97 (т, J = 7,6Гц, 3Н), 1,01 (с, 9Н), 1,54-1,63 (м, 2Н), 2,04-2,37 (м, 5Н), 3,56-3,70 (м, 2Н), 4,91 (т, J = 5,0Гц, 1Н), 5,40 (д, J = 17,2Гц, 1H), 5,48 (с, 2Н), 5,67 (д, J = 17,2Гц, 1Н), 7,14 (с, 1Н), 7,67-7,74 (м, 2Н), 8,23 (дд, J = 2,8, 7,1Гц, 1H), MS (ES)m/z535(M++1). Базовий приклад 4.22 Одержання (20S)-1О-метил-9-нітро-7пентиламінокамптотецину 20-ацетату Ця сполука була одержана з (20S)-7-хлор-10метил-9-нітрокамптотецину 20-ацетату з базового прикладу 3.2 та пентиламіну за способом, аналогічним способу з базового прикладу 4.1. 1 Н ЯМР (270мгц) d (CDCl3) 0,85-1,00 (м, 6Н), 1,25-1,53 (м, 4Н), 1,54-1,75 (м, 2Н), 2,05-2,35 (м, 5Н), 2,42 (с, 3Н), 3,57-3,70 (м, 2Н), 4,89-5,00 (м, 1Н), 5,39 (д, J = 17,2Гц, 1H), 5,45 (с, 2Н), 5,67 (д, J = 17,2Гц, 1H), 7,11 (с, 1H), 7,57 (д, J = 8,9Гц, 1H), 8,05 (д, J = 8,9Гц, 1Н), MS (ES) m/z 535 (М++1). Базовий приклад 4.23 Одержання (20S)-7-(2-гвдроксиетиламіно)-9нітрокамптотецину 20-ацетату Ця сполука була одержана з (20S)-7-хлор-9нітрокамптотецину 20-ацетату з базового прикладу 3.1 та етаноламіну за способом, аналогічним способу з базового прикладу 4.1. 1 Н ЯМР (270мгц) d (CDCl3) 0,97 (т, J = 7,6Гц, 3Н), 2,02-2,37 (м, 6Н), 2,57 (1Hир, 1Н), 3,70-3,84 (м, 2Н), 3,85-4,01 (м, 2Н), 5,38 (д, J = 17,5Гц, 1H), 5,44 (с, 2Н), 5,65 (д, J = 17,5Гц, 1Н), 7,14 (с, 1Н), 7,597,75 (м, 2Н), 8,17-8,25 (м, 1Н), MS (ES) m/z 495 (М++1). Базовий приклад 5.1 Одержання (20S)-9-аміно-7(бутиламіно)камптотецину 20-ацетату (20S)-7-бутиламіно-9-нітрокамптотецину 20ацетат (156мг, 0,31ммоль) з базового прикладу 4.15 розчинили у водному розчині МеОН (10мл) та IN HCl (2мл). 5% Pd-C (15мг) додали та гідрування здійснювали в атмосфері Н2, застосовуючи балон, при кімнатній температурі протягом 1 години. Після вилучення Pd-C шляхом фільтрування, фільтрат концентрували при зниженому тиску, внаслідок чого одержали продукт (137мг, 87% вихід). 1 Н ЯМР (270мгц) d (CDCl3) 0,95 (т, J = 7,6Гц, 3Н), 1,01 (т, J = 7,3Гц, 3Н), 1,48-1,60 (м, 2Н), 1,681,78 (м, 2Н), 2,10-2,31 (м, 2Н), 2,20 (с, 3Н), 3,603,67 (м, 2Н), 3,90 (1Hир.с, 2Н), 5,39 (д, J = 17,0Гц, 1H), 5,41 (с, 2Н), 5,66 (д, J = 17,0Гц, 1Н), 6,85 (д, J 47 = 7,3Гц, 1H), 7,11 (с, 1Н), 7,45 (дд, J = 7,3 та 8,3Гц, 1Н), 7,64 (д, J = 8,3Гц, 1H), 8,77 (1Hир.с, 1Н), MS (ES) m/z 477 (М++1). Базовий приклад 5.2 Одержання (20S)-9-аміно-7-[2(морфолініл)етиламіно]камптотецину 20-ацетату Ця сполука була одержана з (20S)-7-[2(морфолініл)етиламіно]-9-нітрокамптотецину 20ацетату з базового прикладу 4.2 за способом, аналогічним способу з прикладу 5.1. 1 Н ЯМР (400мгц) d (CDCl3) 0,96 (т, J = 8,4Гц, 3Н), 2,09-2,27 (м, 2Н), 2,21 (с, 3Н), 2,53-2,55 (м, 4Н), 2,69-2,72 (м, 2Н), 3,71-3,76 (м, 6Н), 4,47 (1Hир.с, 2Н), 5,32 (д, J = 17,6Гц, 1Н), 5,35 (д, J = 17,6Гц, 1H), 5,39 (д, J = 17,2Гц, 1Н), 5,65 (д, J = 17,2Гц, 1H), 6,79 (д, J = 8,0Гц, 1Н), 7,12 (с, 1H), 7,45 (дд, J = 7,6 та 8,0Гц, 1H), 7,57 (д, J = 7,6Гц, 1Н), 8,37 (1Hир.т, 1H), MS (ES) m/z 534 (М++1). Базовий приклад 5.3 Одержання (20S)-9-аміно-7-[3(диметиламіно)пропіламіно]камптотецину 20ацетату гідрохлориду Ця сполука була одержана з (20S)-7-[3(диметиламіно)пропіламіно]-9-нітрокамптотецину 20-ацетату з базового прикладу 4.3 за способом, аналогічним способу з прикладу 5.1. 1 Н ЯМР (270мгц) d (D2O) 0,88 (т, 3Н), 2,01-2,27 (м, 4Н), 2,18 (с, 3Н), 2,85 (с, 6Н), 3,26-3,32 (м, 2Н), 3,87 (т, J = 7,3Гц, 2Н), 5,44 (д, J= 17,0Гц, 1Н), 5,49 (с, 2Н), 5,61 (д, J = 17,0Гц, 1H), 7,10 (д, J = 8,0Гц, 1Н), 7,40 (д, J = 7,6Гц, 1Н), 7,62 (дд, J = 7,6 та 8,0Гц, 1H), MS (ES) m/z 506 (M++1). Базовий приклад 5.4 Одержання (20S)-9-аміно-7(пропіламіно)камптотецину 20-ацетату Ця сполука була одержана з (20S)-9-нітро-7(пропіламіно)камптотецину 20-ацетату з базового прикладу 4.4 за способом, аналогічним способу з базового прикладу 5.1. 1 Н ЯМР (270мгц) d (CDCl3) 0,95 (т, J = 7,6Гц, З3Н), 1,09 (т, J = 7,3Гц, 3Н), 1,69-1,83 (м, 2Н), 2,062,31 (м, 2Н), 2,23 (с, 3Н), 3,53-3,60 (м, 2Н), 3,93 (1Hир.с, 2Н), 5,35 (с, 2Н), 5,38 (д, J = 17,5Гц, 1Н), 5,59 (д, J = 17,5Гц, 1H), 6,82 (д, J = 7,3Гц, 1Н), 7,10 (с, 1H), 7,43 (дд, J = 7,3 та 8,6Гц, 1H), 7,62 (д, J = 8,6Гц, 1H), 8,79 (1Hир.т, 1H), MS (ES) m/z 463 (М++1). Базовий приклад 5.5 Одержання (20S)-9аміно-7-(фенетиламіно)камптотецину 20-ацетату Ця сполука була одержана з (20S)-9-нітро-7(фенетиламіно)камптотецину 20-ацетату з базового прикладу 4.6 за способом, аналогічним способу з базового прикладу 5.1. 1 Н ЯМР (400мгц) d (CDCl3) 0,95 (т, J = 7,6Гц, 3Н), 2,10-2,30 (м, 2Н), 2,20 (с, 3Н), 3,05 (т, J = 6,4Гц, 2Н), 3,47 (1Hир.с, 2Н), 3,97 (м, 2Н), 5,40 (д, J = 17,2Гц, 1Н), 5,43 (с, 2Н), 5,67 (д, J = 17,2Гц, 1Н), 6,75 (д, J = 7,2Гц, 1H), 7,00 (с, 1Н), 7,26-7,34 (м, 5Н), 7,42 (дц, J = 7,2 та 8,8Гц, 1Н), 7,61 (д, J = 8,8Гц, 1H), 8,68 (1Hир.с, 1Н), MS (ES) m/z 525 (M++1). Базовий приклад 5.6 Одержання (20S)-9-аміно-7-(3фенілпропіламіно)камптотецину 20-ацетату 80409 48 Ця сполука була одержана з (20S)-9-нітро-7(3-фенілпропіламіно)камптотецину 20-ацетату з базового прикладу 4.7 за способом, аналогічним способу з базового прикладу 5.1. 1 Н ЯМР (270мгц) d (CDC13) 0,94 (т, J = 7,6Гц, 3H), 2,07 (м, 2Н), 2,02-2,31 (м, 2Н), 2,19 (с, 3Н), 2,82 (т, J = 7,6Гц, 2Н), 3,65 (дт, J = 5,3 та 6,6Гц, 2Н), 3,81 (1Hир.с, 2Н), 5,34 (с, 2Н), 5,39 (д, J = 17,2Гц, 1H), 5,66 (д, J = 17,2Гц, 1Н), 6,84 (д, J = 6,9Гц, 1Н), 7,11 (с, 1Н), 7,17-7,33 (м, 5Н), 7,44 (дд, J = 7,4 та 8,4Гц, 1H), 7,64 (д, J = 8,6Гц, 1Н), 8,84 (м, 1Н), MS (ES)m/z539(M++1). Базовий приклад 5.7 Одержання (20S)-9-аміно-7-[2-(піридин-2іл)ети л аміно]камптотецину 20-ацетату Ця сполука була одержана з (20S)-9-нітро-7-[2(піридин-2іл)етиламіно]камптотецину 20-ацетату з базового прикладу 4.8 за способом, аналогічним способу з базового прикладу 5.1. MS (ES) m/z 526 (М++1). Базовий приклад 5.8 Одержання (20S)-9-аміно-7-[2-(піридин-3іл)етиламіно]камптотецину 20-ацетату гідрохлориду Ця сполука була одержана з (20S)-9-нітро-7-[2(піридин-3-іл)етиламіно]камптотецину 20-ацетату з базового прикладу 4.9 за способом, аналогічним способу з базового прикладу 5.1. 1 Н ЯМР (270мгц) d (CDCl3) 0,94 (т, J = 7,3Гц, 3Н), 2,05 (м, 2Н), 3,37 (м, 2Н), 4,26 (т, J = 6,9Гц, 2Н), 5,52 (м, 2Н), 5,61 (с, 2Н), 7,13 (д, J = 7,4Гц, 1Н), 7,69 (дд, J = 7,4 та 8,4Гц, 1H), 7,85 (д, J = 8,4Гц, 1H), 8,06 (дд, J = 5,4 та 7,9Гц, 1H), 8,30 (с, 1H), 8,62 (д, J = 7,9Гц, 1Н), 8,86 (д, J = 5,4Гц, 1Н), 9,01 (с, 1Н), MS(ES) m/z 526 (M++1). Базовий приклад 5.9 Одержання (20S)-9-аміно-7(бензиламіно)камптотецину 20-ацетату гідрохлориду Ця сполука була одержана з (20S)-7(бензиламіно)-9-нітрокамптотецину 20-ацетату з базового прикладу 4.5 за способом, аналогічним способу з базового прикладу 5.1. MS(ES)m/z511(M++1). Базовий приклад 5.10 Одержання (20S)-9-аміно-7(гептиламіно)камптотецину 20-ацетату Ця сполука була одержана з (205)-7гептиламіно-9-нітрокамптотецину 20-ацетату з базового прикладу 4.11 за способом, аналогічним способу з базового прикладу 5.1. 1 Н ЯМР (270мгц) d (CDCl3) 0,87-0,97 (м, 6Н), 1,31-1,51 (м, 8Н), 1,68-1,79 (м, 2Н), 2,13-2,30 (м, 5Н), 3,62 (к, J = 6,9Гц, 2Н), 3,91 (1Hир, 2Н), 5,39 (д, J = 17,2Гц, 1H), 5,40 (с, 2Н), 5,66 (д, J = 17,2Гц, 1H), 6,84 (д, J = 7,6Гц, 1Н), 7,11 (с, 1Н), 7,44 (дц, J = 7,3, 8,6Гц, 1Н), 7,63 (д, J = 8,6Гц, 1Н), 8,76 (1Hир, 1H), MS (ES) m/z 519 (М++1). Базовий приклад 5.11 Одержання (20S)-9-аміно-7(метиламіно)камптотецину 20-ацетату , Ця сполука була одержана з (20S)-7-метиламіно-9нітрокамптотецину 20-ацетату з базового прикладу 49 4.12 за способом, аналогічним способу з базового прикладу 5.1. MS (ES) m/z 435 (М++1). Базовий приклад 5.12 Одержання (20S)-9-аміно-7-(2метилпропіламіно)камптотецину 20-ацетату гідрохлориду Ця сполука була одержана з (20S)-7-(2метилпропіламіно)-9-нітрокамптотецину 20ацетату з базового прикладу 4.13 за способом, аналогічним способу з базового прикладу 5.1. MS (ES) m/z 477 (М++1). Базовий приклад 5.13 Одержання (20S)-9-аміно-7гексиламінокамптотецину 20-ацетату гідрохлориду Ця сполука була одержана з (20S)-7гексиламіно-9-нітрокамптотецину 20-ацетату з базового прикладу 4.14 за способом, аналогічним способу з базового прикладу 5.1. MS (ES) m/z 505 (М++1). Базовий приклад 5.14 Одержання (205)-9-аміно-7(пентиламіно)камптотецину 20-ацетату гідрохлориду Ця сполука була одержана з (205)-9-нітро-7(пентиламіно)к1Hптотецину 20-ацетату з базового прикладу 4.1 за способом, аналогічним способу з базового прикладу 5.1. MS(ES)m/z491(M++1). Базовий приклад 5.15 Одержання (20S)-9-аміно-7(етиламіно)камптотецину 20-ацетату гідрохлориду Ця сполука була одержана з (205S)-7еталаміно-9-нітрокамптотецину 20-ацетату з базового прикладу 4.16 за способом, аналогічним способу з базового прикладу 5.1. MS(ES)m/z 449(M++1). Базовий приклад 5.16 Одержання (20S)-9-аміно-7-[2-(4метоксифеніл)етиламіно]камптотецину 20-ацетату гідрохлориду Ця сполука була одержана з (20S)-7-[2-(4метоксифеніл)етиламіно]-9-нітрокамптотецину 20ацетату з базового прикладу 4.17 за способом, аналогічним способу з базового прикладу 5.1. MS (ES) m/z 555 (M*+1). Базовий приклад 5.17 Одержання (20S)-9-аміно-7-[2-(4хлорфеніл)етиламіно]камптотецину 20-ацетату гідрохлориду Ця сполука була одержана з (20S)-7-[2-(4хлорфеніл)етиламіно]-9-нітрокамптотецину 20ацетату з базового прикладу 4.18 за способом, аналогічним способу з базового прикладу 5.1. MS (ES) m/z 559 (М++1). Базовий приклад 5.18 Одержання (20S)-9-аміно-7-[2-(4фторфеніл)етиламіно]камптотецину 20-ацетату гідрохлориду Ця сполука була одержана з (20S)-7-[2-(4фторфеніл)етиламіно]-9-нітрокамптотецину 20ацетату з базового прикладу 4.19 за способом, аналогічним способу з базового прикладу 5.1. MS (ES) m/z 543 (М++1). Базовий приклад 5.19 80409 50 Одержання (20S)-9-аміно-7-(1метилетиламіно)камптотецину 20-ацетату гідрохлориду Ця сполука була одержана з (20S)-7-(1метилетиламіно)-9-нітрокамптотецину 20-ацетату з базового прикладу 4.20 за способом, аналогічним способу з базового прикладу 5.1. MS(ES)m/z 463(M++1). Базовий приклад 5.20 Одержання (20S)-9-аміно-7-(3,3диметилбутиламіно)камптотецину 20-ацетату гідрохлориду Ця сполука була одержана з (20S)-7-(3,3диметилбутиламіно)-9-нітрокамптотецину 20ацетату з базового прикладу 4.21 за способом, аналогічним способу з базового прикладу 5.1. MS(ES)m/z 505(M++1). Базовий приклад 5.21 Одержання (20S)-9-аміно-7-(3метилбутиламіно)камптотецину 20-ацетату гідрохлориду Ця сполука була одержана з (20S)-7-(3метилбутиламіно)-9-нітрокамптотецину 20-ацетату з базового прикладу 4.10 за способом, аналогічним способу з базового прикладу 5.1. MS(ES)m/z 491(M++1). Базовий приклад 5.22 Одержання (20S)-9-аміно-10-метил-7(пентиламіно)камптотецину 20-ацетату гідрохлориду Ця сполука була одержана з (20S)-10-метил-9нітро-7-(пентиламіно)камптотецину 20-ацетату з базового прикладу 4.22 за способом, аналогічним способу з базового прикладу 5.1. MS(ES)m/z 505(M++1). Базовий приклад 5.23 Одержання (20S)-9-аміно-7-(2гідроксиетиламіно)камптотецину 20-ацетату гідрохлориду Ця сполука була одержана з (20S)-7-(2гідроксиетиламіно)-9-1Hтрокамптотецину 20ацетату з базового прикладу 4.23 за способом, аналогічним способу з базового прикладу 5.1. MS(ES)m/z 465(M++1). Приклад 1.1 Одержання (9S)-1-бутил-9-етил-9-гідрокси1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3Н,9Н,15Н)-триону Спосіб одержання включає наступні два етапи через сполуку (а). (а)(9S)-9-ацетокси-1-бутил-9-етил-1H,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін 2,10,13(3Н,9Н,15Н)-трион (20S)-9-аміно-7-(бутиламіно)камптотецину 20ацетату гідрохлорид (123мг, 0,24ммоль) з базового прикладу 5.1 розчинили у сухому CH2Cl2 (5мл) та охолодили на льодяній бані. DIEA (390мкл, 2,3ммоль) та трифосген (67мг, 0,23ммоль) додали послідовно та суміш перемішували протягом 1 години на льодяній бані. Реакційну суміш загасили водним IN розчином НС1 при 0°С та екстрагували CH2Cl2 (20мл). шар CH2Cl2промили сольовим розчином, висушили над MgSO4 та випарили при зниженому тиску. Одержаний залишок очистили 51 шляхом колоночної хроматографії (дихлорметан/ацетон = 15/1 - 7/1), одержуючи чистий продукт (70мг, 56%). 1 Н ЯМР (270мгц) d (CDCb) 0,98 (т, J = 7,7Гц, 3Н), 1,00 (т, J = 7,3Гц, 3Н), 1,43-1,59 (м, 2Н), 1,661,77 (м, 2Н), 2,07-2,35 (м, 2Н), 2,23 (с, 3Н), 4,124,18 (м, 2Н), 5,36 (с, 2Н), 5,40 (д, J = 17,4Гц, 1H), 5,68 (д, J = 17,4Гц, 1Н), 6,76 (дд, J = 1,5 та 6,7Гц, 1H), 7,16 (с, 1Н), 7,56-7,67 (м, 2Н), 9,24 (с, 1H), MS (ES) m/z 503 (M++1). (b)(9S)-1-бутил-9-етил-9-гідрокси-1H,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3Н,9Н,15Н)-трион До розчину (9S)-9-ацетокси-1-бутил-9-етил1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3Н,9Н,15Н)-триону (11,5мг, 0,023ммоль) у МеОН (3мл), охолодженому на льодяній бані, додали безводний гідразин (100мкл). Суміш нагріли до кімнатної температури та перемішували протягом 1 години. Водний IN розчин НС1 додали краплями, щоб підкислити реакційну суміш та суміш перемішували протягом 1 години при кімнатній температурі. Після концентрування при зниженому тиску, одержаний залишок екстрагували CH2Cl2 (20мл х 3). Комбінований розчин CH2Cl2 промили сольовим розчином, висушили над MgSCM та випарили. Залишок очистили за допомогою колоночної хроматографії (дихлорметан/метанол = 30/1), внаслідок чого одержали чистий продукт (6,1мг, 58%). 1Н ЯМР (400мгц) d (DMSO) 0,87 (т, J = 7,2Гц, 3Н), 0,96 (т, J = 7,6Гц, 3Н), 1,39-1,47 (м, 2Н), 1,641,70 (м, 2Н), 1,81-1,91 (м, 2Н), 4,03-4,07 (м, 2Н), 5,42 (с, 2Н), 5,43 (с, 2Н), 6,51 (с, 1Н), 6,77 (д, J = 7,2Гц, 1Н), 7,24 (с, 1Н), 7,41 (д, J = 7,6Гц, 1Н), 7,61 (дд, J = 7,2 та 7,6Гц, 1Н), 11,15 (1Hир.с, 1Н), MS (ES) m/z 461(M++1). Приклад 1.2 Одержання (9S)-9-етил-9-гідрокси-1-[2-(4морфоліно)етил]-1H,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3Н,9Н,15Н)-триону гідрохлориду Ця сполука була одержана з (20S)-9-аміно-7(2-морфоліноетил)амінокамптотецину 20-ацетату з базового прикладу 5.2 за способом, аналогічним способу з прикладу 1.1, двома етапами через сполуку (а). (а)(9S)-9-ацетокси-9-етил-1-[2-(4морфоліно)етил]-1Н12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3Н,9Н,15Н)-трион 1 Н ЯМP (270мгц) d (CDCl3) 0,98 (т, J = 7,4Гц, 3Н), 2,11-2,35 (м, 2Н), 2,24 (с, 3Н), 2,53-2,57 (м, 4Н), 2,66 (т, J = 6,6Гц, 2Н), 3,68 (т, J = 4,6Гц, 4Н), 4,24-4,40 (м, 2Н), 5,41 (д, J = 17,5Гц, 1H), 5,44 (с, 2Н), 5,68 (д, J = 17,5Гц, 1H), 6,74 (дд, J = 2,0 та 6,3Гц, 1H), 7,16 (с, 1H), 7,58-7,67 (м, 2H), 8,68 (1Hир.с, 1H), MS (ES) m/z 560 (M++1). (b)(9S)-9-етил-9-гідрокси-1-[2-(4морфоліно)етил]-1H,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3Н,9Н,15Н)-триону гідрохлорид 80409 52 1 Н ЯМР (270мгц) d (DMSO-d6) 0,87 (т, J = 7,2Гц, 3Н), 1,84-1,90 (м, 2Н), 2,44-2,52 (м, 4Н), 2,60-2,65 (м, 2Н), 3,55-3,58 (м, 4Н), 4,20 (м, 2Н), 5,42 (с, 2Н), 5,49 (с, 2Н), 6,49 (с, 1Н), 6,78 (д, J = 7,3Гц, 1H), 7,25 (с, 1H), 7,42 (д, J = 8,6Гц, 1H), 7,61 (дд, J = 7,3 та 8,6Гц, 1H), 11,12 (1Hир.с, 1Н), MS (ES) m/z 518 (M++1). Приклад 1,3 Одержання (9S)-9-етил-1-[3(диметиламіно)пропіл]-9-гідрокси-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3Н,9Н,15Н)-триону гідрохлориду Ця сполука була одержана з (20S)-9-аміно-7[3-(диметиламіно)пропіламіно]камптотецину 20ацетату з базового прикладу 5.3 за способом, аналогічним способу з прикладу 1.1, двома етапами через сполуку (а). (а)(9S)-9-ацетокси-9-етил-1-[3(диметиламіно)пропіл]-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3Н,9Н,15Н)-трион 1 Н ЯМР (270мгц) d (CDC13) 0,88 (т, J = 7,6Гц, 3Н), 1,84-1,95 (м, 2Н), 2,07-2,34 (м, 2Н), 2,23 (с, 9Н), 2,46 (т, J = 6,8Гц, 2Н), 4,21 (т, J = 7,5Гц, 2Н), 5,40 (д, J = 17,2Гц, 1H), 5,46 (с, 2Н), 5,68 (д, J = 17,2Гц, 1Н), 6,74 (дд, J = 1,8 та 6,8Гц, 1Н), 7,15 (с, 1Н), 7,55-7,65(м, 2Н), MS (ES) m/z 532 (M++1). (b)(9S)-9-етил-1-[3-(диметиламіно)пропіл]-9гідрокси-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3Н,9Н,15Н)-триону гідрохлорид 1 H ЯМР (270мгц) d (DMSO-d6) 0,88 (т, J = 7,6Гц, 3Н), 1,80-1,94 (м, 2Н), 2,08-2,19 (м, 2Н), 2,73 (с, 6Н), 3,14-3,20 (м, 2Н), 4,13-4,19 (м, 2Н), 5,43 (с, 2Н), 5,47 (с, 2Н), 6,53 (с, 1Н), 6,82 (дд, J = 1,0 та 7,6Гц, 1Н), 7,44 (дц, J = 1,0 та 8,2Гц, 1Н), 7,63 (дд, J = 7,6 та 8,2Гц, 1Н), 10,28 (с, 1H), 11,23 (с, 1Н), MS (ES) m/z 490 (M++1). Приклад 1.4 Одержання (9S)-9-етил-9-гідрокси-1-пропіл1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3Н,9Н,15Н)-триону Ця сполука була одержана з (20S)-9-аміно-7(пропіламіно)камптотецину 20-ацетату з базового прикладу 5.4 за способом, аналогічним способу з прикладу 1.1, двома етапами через сполуку (а). (а)(9S)-9-ацетокси-9-етил-1-пропіл-1H,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3Н,9Н,15Н)-трион 1 Н ЯМР (270мгц) d (CD3OD) 0,98 (т, J = 7,6Гц, 3Н), 1,05 (т, J = 7,3Гц, 3Н), 1,71-1,80 (м, 2Н), 2,102,24 (м, 2Н), 2,19 (с, 3Н), 5,36 (д, J = 17,2Гц, 1Н), 5,44 (с, 2Н), 5,56 (д, J = 17,2Гц, 1H), 6,76 (д, J = 7,6Гц, 1Н), 7,25 (с, 1H), 7,43 (д, J = 8,6Гц, 1H), 7,59 (дд, J = 7,6 та 8,6Гц, 1Н), MS (ES) m/z 489 (M++1). (b)(9S)-9-етил-9-гідрокси-1-пропіл-1H,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3Н,9Н,15Н)-трион 1 H ЯМР (270мгц) d (DMSO-d6) 0,88 (т, J = 7,3Гц, 3Н), 0,98 (т, J = 7,3Гц, 3Н), 1,66-1,75 (м, 2Н), 1,82-1,90 (м, 2Н), 3,97-4,03 (м, 2Н), 5,41 (с, 2Н), 5,42 (с, 2Н), 6,49 (с, 1Н), 6,76 (дд, J = 1,0 та 7,6Гц, 53 1Н), 7,24 (с, 1Н), 7,41 (дд, J = 1,0 та 8,2Гц, 1Н), 7,60 (дц, J = 7,6 та 8,2Гц, 1H), 11,13 (с, 1H), MS (ES) m/z 447 (M++1). Приклад 1.5 Одержання (95)-1-бензил-9-етил-9-гідрокси1H,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3Н,9Н,15Н)-трион Ця сполука була одержана з (20S)-9-аміно-7(бензиламіно)камптотецину 20-ацетату з базового прикладу 5.9 за способом, аналогічним способу з прикладу 1.1, двома етапами через сполуку (а). (а)(9S)-9-ацетокси-1-бензил-9-етил-1Н,12Нпірано[3",4":6',7']індозоліно[1',2':6,5]піридо[4,3,2de]хіназолін-2,10,13(3H,9H,15H)-трион 1 Н ЯМР (270мгц) d (CDCД3) 0,94 (т, J = 7,3Гц, 3Н), 2,00-2,33 (м, 2Н), 2,20 (с, 3H), 5,16 (с, 2Н), 5,32 (д, J = 17,2Гц, 1H), 5,47 (с, 2Н), 5,59 (д, J = 17,2Гц, 1H), 6,77 (м, 1H), 7,10 (с, 1H), 7,15-7,40 (м, 5Н), 7,50-7,78 (м, 2Н), 9,34 (1Hир.с, 1H), MS (ES) m/z 537 (M++1). (b)(9S)-1-бензил-9-етил-9-гідрокси-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3Н,9Н,15Н)-трион 1 Н ЯМР (270мгц) d (DMSO-d6) 0,84 (т, J = 7,3Гц, 3Н), 1,82 (к, J = 7,3Гц, 2Н), 5,12 (с, 2Н), 5,33 (с, 2Н), 5,42 (с, 2Н), 6,47 (с, 1H), 6,87 (д, J = 7,6Гц, 1H), 7,21 (с, 1H), 7,28-7,40 (м, 5Н), 7,48 (д, J = 8,6Гц, 1H), 7,68 (дд, J = 7,6 та 8,6Гц, 1H), 11,33 (1Hир.с, 1Н), MS (ES) m/z495(M++1). Приклад 1.6 Одержання (9S)-9-етил-9-гідрокси-1-фенетил1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[43,2dе]хіназолін-2,10,13(3Н,9Н,15Н)-трион Ця сполука була одержана з (20S)-9-аміно-7(фенетиламіно)камптотецину 20-ацетату з базового прикладу 5.5 за способом, аналогічним способу з прикладу 1.1, двома етапами через сполуку (а). (а)(9S)-9-ацетокси-9-етил-1-фенетил-1H,12Нпірано[3",4":6',7']індолізино[Г,2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3Н,9Н,15Н)-трион 1 Н ЯМР (400мгц) d (CDCl3) 0,98 (т, J = 7,6Гц, 3Н), 2,11-2,33 (м, 2Н), 2,23 (с, 32Н), 3,05 (т, J = 7,8Гц, 2Н), 4,35-4,41 (м, 2Н), 5,41 (д, J = 17,2Гц, 1H), 5,44 (с, 2Н), 5,69 (д, J = 17,2Гц, 1H), 6,72 (дд, J = 2,0 та 6,6Гц, 1Н), 7,16 (с, 1H), 7,22-7,36 (м, 5Н), 7,60-7,68 (м, 2Н), 8,08 (1Hир.с, 1Н), MS (ES) m/z 551 (M++1). (b)(9S)-9-етил-9-гідрокси-1-фенетил-1Н,12Нпірано[3",4":6',7']індолізино-[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3Н,9Н,15Н)-трион 1 H ЯМР (400мгц) d (DMSO-d6) 0,88 (т, J = 7,4Гц, 3Н), 1,74-1,92 (м, 2Н), 3,03 (т, J = 8,2Гц, 2Н), 4,24-4,32 (м, 2Н), 5,43 (с, 2Н), 5,53 (с, 2Н), 6,53 (с, 1Н), 6,77 (дд, J = 1,2 та 7,4Гц, 1H), 7,25 (с, 1H), 7,28 (м, 1H), 7,31-7,38 (, 4Н), 7,42 (дц, J = 1,2 та 8,8Гц, 1H), 7,61 (дц, J = 7,4 та 8,8Гц, 1Н), 11,17 (1Hир.с, 1Н), MS (ES) m/z 509 (M++1). Приклад 1.7 Одержання (9S)-9-етил-9-гідрокси-1-(3фенілпропіл)-1H,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3Н,9Н,15Н)-трион 80409 54 Ця сполука була одержана з (20S)-9-аміно-7(3-фенілпропіламіно)камптотецину 20-ацетату з базового прикладу 5.6 за способом, аналогічним способу з прикладу 1.1, двома етапами через сполуку (а). (а)(9S)-9-ацетокси-9-етил-1-(3-феніл-пропіл)1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3Н,9Н,15Н)-трион 1 Н ЯМР (270мгц) d (CDCl3) 0,98 (т, J = 7,4Гц, 3Н), 2,10 (м, 2Н), 2,10-2,32 (м, 2Н), 2,23 (с, 3Н), 2,83 (т, J = 7,8Гц, 2Н), 4,21 (м, 2Н), 5,31 (с, 2Н), 5,41 (д, J = 17,2Гц, 1H), 5,68 (д, J = 17,2Гц, 1H), 6,72 (дц, J = 1,8 та 6,8Гц, 1H), 7,12-7,28 (м, 5Н), 7,15 (с, 1Н), 7,59 (дд, J = 1,8 та 8,7Гц, 1H), 7,63 (дц, J = 6,8 та 8,7Гц, 1Н), 8,92 (1Hир.с, 1H), MS (ES) m/z 565 (M++1). (b)(9S)-9-етил-9-гідрокси-1-(3-феніл-пропіл)1H,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3Н,9Н,15Н)-трион 1 Н ЯМР (270мгц) d (DMSO-d6) 0,88 (т, J = 7,3Гц, 3Н), 1,79-1,91 (м, 2Н), 1,94-2,12 (м, 2Н), 2,74 (т, J = 7,9Гц, 2Н), 4,13 (т, J = 7,6Гц, 2Н), 5,43 (с, 2Н), 5,47 (с, 2Н), 6,49 (с, 1Н), 6,77 (дд, J = 1,0 та 7,6Гц, 1H), 7,16 (м, 1H), 7,20-7,31 (, 4H), 7,42 (дд, J = 1,0 та 8,6Гц, 1H), 7,61 (дд, J = 7,6 та 8,6Гц, 1Н), MS (ES) m/z 523 (М++1). Приклад 1.8 Одержання (9S)-9-етил-9-гідрокси-1-[2(піридин-2-іл)етил]-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3Н,9Н,15Н)-триону гідрохлориду Ця сполука була одержана з (20S)-9-аміно-7[2-(піридин-2-іл)етиламіно]камптотецину 20ацетату з базового прикладу 5.7 за способом, аналогічним способу з прикладу 1.1, двома етапами через сполуку (а). (а)(9S)-9-ацетокси-9-етил-1-[2-(піридин-2іл)етил]-1H,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3Н,9Н,15Н)-трион 1 H ЯМР (270мгц) d (CDCl3) 0,97 (т, J = 7,6Гц, 3Н), 2,10-2,32 (м, 2Н), 2,22 (с, 3Н), 3,21 (т, J = 7,9Гц, 2Н), 4,57 (м, 2Н), 5,41 (д, J = 17,2Гц, 1Н), 5,69 (д, J = 17,2Гц, 1H), 5,73 (дд, J = 18,8Гц, 1H), 5,83 (дд, J = 18,8Гц, 1H), 6,73 (дд, J = 2,3 та 6,3Гц, 1H), 7,13-7,27 (м, 3H), 7,58-7,66 (м, 3H), 8,43 (1шир.с, 1H), 8,60 (д, J = 4,6Гц, 1H), MS (ES) m/z 552 (M++1). (b)(9S)-9-етил-9-гідрокси-1-[2-(піридин-2іл)етил]-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[43,2dе]хіназолін-2,10,13(3Н,9Н,15Н)-триону гідрохлорид 1 Н ЯМР (270мгц) d (DMSO-d6) 0,87 (т, J = 7,3Гц, 3Н), 1,84-1,88 (м, 2Н), 3,18 (м, 2Н), 4,45 (м, 2Н), 5,42 (с, 2Н), 5,61 (с, 2Н), 6,50 (с, 1Н), 6,80 (д, J = 7,3Гц, 1H), 7,26 (с, 1Н), 7,27 (м, 1Н), 7,36 (д, J = 7,6Гц, 1H), 7,45 (д, J = 7,9Гц, 1H), 7,64 (дд, J = 7,3 та 7,6Гц, 1H), 7,74 (ддд, J = 2,0 та 7,6 та 7,9Гц, 1Н), 8,52 (м, 1Н), 11,18 (1Hир.с, 1Н), MS (ES) m/z 510 (М++1). 55 Приклад 1.9 Одержання (9S)-9-етил-9-гідрокси-1-[2(піридин-3-іл)етил]-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3H,9Н,15Н)-триону гідрохлориду Ця сполука була одержана з (205)-9-аміно-7[2-(піридин-3-іл)етиламіно]камптотецину 20ацетату з базового прикладу 5.8 за способом, аналогічним способу з прикладу 1.1, двома етапами через сполуку (а). (а)(9S)-9-ацетокси-9-етил-1-[2-(піридин-3іл)етил]-1Н,12Н-пірано[3",4":6',7']індолізиноІ1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3H,9Н,15Н)-трион 1 Н ЯМР (270мгц) d (CDCl3) 0,98 (т, J = 7,4Гц, 3H), 2,160-2,27 (м, 2Н), 2,23 (с, 3H), 3,07 (т, J = 7,3Гц, 2Н), 4,42 (м, 2Н), 5,40 (д, J = 17,2Гц, 1H), 5,44 (с, 2Н), 5,68 (д, J = 17,2Гц, 1H), 6,72 (дд, J = 2,6 та 5,9Гц, 1H), 7,17 (с, 1Н), 7,28 (м, 1Н), 7,597,70 (м, 3H), 8,13 (с, 1Н), 8,52 (м, 2Н), MS (ES) m/z 552 (M++1). b) (9S)-9-етил-9-гщрокси-1-[2-(піридин-3іл)етил]-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6, 5]піридо[4,3,2-dе]хіназолін-2,10,13(3H,9Н,15Н)триону гідрохлорид 1 Н ЯМР (270мгц) d (DMSO-d6) 0,88 (т, J = 7,3Гц, 3H), 1,86 (к, J = 7,3Гц, 1Н), 1,87 (к, J = 7,3Гц, 1Н), 3,07 (т, J = 7,6Гц, 2Н), 4,32 (м, 2Н), 5,43 (с, 2Н), 5,55 (с, 2Н), 6,50 (с, 1Н), 6,79 (д, J = 7,6Гц, 1Н), 7,28 (с, 1H), 7,36 (дд, J = 4,6 та 7,6Гц, 1Н), 7,46 (д, J = 8,4Гц, 1Н), 7,64 (дд, J = 7,8 та 8,4Гц, 1H), 7,74 (д, J = 7,8Гц, 1H), 8,46 (д, J = 4,6Гц, 1H), 8,52 (с, 1H), 11,14 (1Hир.с, 1Н), MS (ES) m/z 510 (M++1). Приклад 1.10 Одержання (9S)-9-етил-9-гідрокси-1-(3метилбутил)-1H,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3H,9Н,15Н)-триону Ця сполука була одержана з (205)-9-аміно-7(3-метилбутиламіно)камптотецину 20-ацетату з базового прикладу 5.21 за способом, аналогічним способу з прикладу 1.1, двома етапами через сполуку (а). (а)(9S)-9-ацетокси-9-етил-1-(3-метилбутил)1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3H,9Н,15Н)-трион 1 Н ЯМР (270мгц) d (CDCl3) 0,98 (т, J = 7,6Гц, 3H), 1,05 (д, J = 6,6Гц, 6Н), 1,65 (м, 2Н), 1,84 (м, 1Н), 2,07-2,35 (м, 2Н), 2,23 (с, 3H), 4,18 (м, 2Н), 5,36 (д, J = 18,5Гц, 1Н), 5,40 (д, J = 17,2Гц, 1Н), 5,43 (д, J = 18,5Гц, 1Н), 5,68 (д, J = 17,2Гц, 1H), 6,73 (дд, J = 2,0 та 6,8Гц, 1Н), 7,16 (с, 1Н), 7,59 (дд, J = 2,0 та 8,6Гц, 1Н), 7,64 (м, 1H), 8,66 (1Hир.с, 1H), MS (ES) m/z517(M++1). (b)(9S)-9-етил-9-гідрокси-1-(3-метилбутил)1НД2Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3H,9Н,15Н)-трион 1 Н ЯМР (270мгц) d (DMSO-d6) 0,88 (т, J = 7,3Гц, 3H), 1,00 (д, J = 6,6Гц, 6Н), 1,58-1,82 (м, 3H), 1,86 (к, J = 7,3Гц, 1H), 1,87 (к, J = 7,3Гц, 1H), 4,06 (т, J = 7,9Гц, 2Н), 5,41 (с, 2Н), 5,43 (с, 2Н), 6,49 (с, 80409 56 1H), 6,76 (дд, J = 1,0 та 7,6Гц, 1Н), 7,24 (с, 1H), 7,40 (дд, J = 1,0 та 8,6Гц, 1H), 7,60 (дд, J = 7,6 та 8,6Гц, 1H), 11,13 (1Hир.с, 1Н), MS (ES) m/z 475 (M++1). Приклад 1.11 Одержання (АУ)-9-етил-1-гептил-9-гідрокси1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10ДЗ(3H,9Н,15Н)-триону Ця сполука була одержана з (20S)-9-аміно-7(гептиламіно)камптотецину 20-ацетату з базового прикладу 5.10 за способом, аналогічним способу з прикладу 1.1, двома етапами через сполуку (а). (а)(9і$)-9-ацетокси-9-етил-1-гептил-1H,12Нпірано[3",4":6',7']індолізино[1'Д':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3H,9Н,15Н)-трион 1 Н ЯМР (270мгц) d (CDCl3) 0,86 (т, J = 6,6Гц, 3H), 0,98 (т, J = 7,4Гц, 3H), 1,26-1,33 (м, 6Н), 1,431,49 (м, 2Н), 1,70-1,76 (м, 2Н), 2,10-2,32 (м, 5Н), 4,14-4,16 (м, 2Н), 5,37 (с, 2Н), 5,40 (д, J = 17,1Гц, 1H), 5,68 (д, J = 17,1Гц, 1H), 6,74 (дд, J = 1,7,6,6Гц, 1H), 7,15 (с, 1Н), 7,57-7,66 (м, 2Н), 8,70 (1Hир, 1H), MS (ES) m/z 545 (M++1). (Ь)(95)-9-етил-1-гептил-9-гідрокси-1H,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3H,9НД5Н)-трион 1 Н ЯМР (270мгц) d (DMSO-d6) 0,85-0,90 (м, 6Н), 1,27-1,36 (м, 8Н), 1,69-1,88 (м, 4Н), 4,05 (м, 2Н), 5,42 (с, 4Н), 6,50 (1Hир, 1Н), 6,78 (д, J = 7,6Гц, 1Н), 7,25 (с, 1Н), 7,42 (д, J = 7,6Гц, 1H), 7,61 (т, J = 7,6Гц, 1Н), 11,14 (с, 1Н), MS (ES) m/z 503 (M++1). Приклад 1.12 Одержання (9S)-9-етил-9-гідрокси-1-(2метилпропіл)-1H,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2ае]хіназолін-2,10,13(3H,9Н,15Н)-триону Ця сполука була одержана з (20S)-9-аміно-7(2-метилпропіламіно)камптотецину 20-ацетату з базового прикладу 5.12 за способом, аналогічним способу з прикладу 1.1, двома етапами через сполуку (а). (а)(9S)-9-ацетокси-9-етил-1-(2-метилпропіл)1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[43,2dе]хіназолін-2,10,13(3H,9Н,15Н)-трион 1 Н ЯМР (270мгц) d (DMSO-d6) 0,88-0,94 (м, 10Н), 2,02-2,25 (м, 5Н), 3,96 (д, J = 7,9Гц, 2Н), 5,38 (с, 2Н), 5,47 (с, 2Н), 6,81 (д, J = 7,9Гц, 1Н), 6,94 (с, 1H), 7,45 (д, J = 7,9Гц, 1Н), 7,63 (т, J = 7,9Гц, 1Н), 11,15 (1Hир, 1Н), MS (ES) m/z 503 (M++1). (b) (9S)-9-етил-9-гідрокси-1-(2-метилпропіл)1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3H,9Н,15Н)-трион 1 Н ЯМР (270мгц) 8 (DMSO-d6) 0,87 (т, J = 7,3Гц, 3H), 0,94 (д, J = 6,6Гц, 6Н), 1,74-2,11 (м, 3H), 3,93-3,98 (м, 2Н), 5,37 (с, 2Н), 5,42 (с, 2Н), 6,48 (с, 1Н), 6,80 (д, J = 7,6Гц, 1H), 7,26 (с, 1H), 7,44 (д, J = 7,6Гц, 1H), 7,63 (т, J = 7,6Гц, 1H), 11,15 (1Hир, 1H), MS (ES) m/z 461 (M++1). Приклад 1.13 Одержання (95)-9-етил-1-гексил-9-гідрокси1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-dе]хіназолін-2,10,13(3H,9Н,15Н)-триону 57 Ця сполука була одержана з (205)-9-аміно-7(гексиламіно)камптотецину 20-ацетату з базового прикладу 5.13 за способом, аналогічним способу з прикладу 1.1, двома етапами через сполуку (а). (а)(9S)-9-ацетокси-9-етил-1-гексил-1H,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,1З(3H,9Н,15Н)-трион 1 Н ЯМР (270мгц) d (CDCl3) 0,89 (т, J = 7,1Гц, 3H), 0,98 (т, J = 7,6Гц, 3H), 1,32-1,37 (м, 4Н), 1,431,56 (м, 2Н), 1,68-1,76 (м, 2Н), 2,12-2,30 (м, 5Н), 4,08-4,18 (м, 2Н), 5,36 (с, 2Н), 5,40 (д, J = 17,5Гц, 1H), 5,68 (д, J = 17,5Гц, 1H), 6,74 (дд, J = 1,7, 6,6Гц, 1H), 7,15 (с, 1H), 7,57-7,66 (м, 2Н), 8,74 (1Hир, 1H), MS (ES) m/z 531 (M++1). (b) (9S)-9-етил-1-гексил-9-гідрокси-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3H,9Н,15Н)-трион 1 Н ЯМР (270мгц) 8 (DMSO-d6) 0,85-0,90 (м, 6Н), 1,23-1,50 (м, 6Н), 1,68-1,90 (м, 4Н), 4,05 (м, 2Н), 5,42 (с, 2Н), 5,43 (с, 2Н), 6,49 (с, 1H), 6,78 (д, J = 8,0Гц, 1Н), 7,25 (с, 1Н), 7,42 (д, J = 8,0Гц, 1H), 7,62 (т, J = 8,0Гц, 1H), 11,14 (1Hир, 1H), MS (ES) m/z 489 (M++1). Приклад 1.14 Одержання (95)-9-етил-9-гідрокси-1-пентил1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2-dе]хіназолін-2,10,13(3H,9Н,15Н)-триону Ця сполука була одержана з (20S)-9-аміно-7(пентиламіно)камптотецину 20-ацетату з базового прикладу 5.14 за способом, аналогічним способу з прикладу 1.1, двома етапами через сполуку (а). (а)(9S)-9-ацетокси-9-етил-1-пентил-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3H,9Н,15Н)-трион 1 Н ЯМР (270мгц) d (CDCl3) 0,92 (т, J = 6,9Гц, 3H), 0,98 (т, J = 7,6Гц, 3H), 1,29-1,53 (м, 4Н), 1,651,76 (м, 2Н), 2,12-2,30 (м, 5Н), 3,75-4,17 (м, 2Н), 5,36 (с, 2Н), 5,40 (д, J = 17,5Гц, 1Н), 5,68 (д, J = 17,5Гц, 1Н), 6,75 (дд, J = 1,7, 6,9Гц, 1Н), 7,15 (с, 1H), 7,58 (дд, J = 1,7, 6,9Гц, 1H), 7,64 (дд, J = 6,9, 8,6Гц, 1H), 8,88 (1Hир, 1H), MS (ES) m/z 517 (M++1). (b)(9S)-9-етил-9-гідрокси-1-пентил-1Н,12Нпірано[3",4":6',7']-індолізино[1',2':6,5]піридо[4,3,2ае]хіназолін-2,10,13(3H,9Н,15Н)-трион 1 H ЯМР (270мгц) d (DMSO-d6) 0,85-0,93 (м, 6H), 1,36-1,38 (м, 4Н), 1,69-1,88 (м, 4Н), 4,05 (м, 2Н), 5,43 (с, 4Н), 6,49 (с, 1H), 6,78 (д, J = 8,0Гц, 1H), 7,25 (с, 1Н), 7,42 (д, J = 8,0Гц, 1H), 7,61 (т, J = 8,0Гц, 1H), 11,13 (1Hир, 1Н), MS (ES) m/z 475 (M++1). Приклад 1.15 Одержання (9S)-l ,9-діетил-9гідрокси-1H,12Нпірано[3",4":6',7']індолЬино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3H,9Н,15Н)-триону Ця сполука була одержана з (20S)-9-аміно-7(етиламіно)камптотецину 20-ацетату з базового прикладу 5.15 за способом, аналогічним способу з прикладу 1.1, двома етапами через сполуку (а). (а)(9S)-9-ацетокси-1,9-діетил-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3H,9Н,15Н)-трион 1 Н ЯМР (270мгц) d (CDCl3) 0,98 (т, J = 7,6Гц, 3H), 1,41 (т, J = 7,3Гц, 3H), 2,03-2,38 (м, 5Н), 4,23 (к, J = 7,3Гц, 2Н), 5,40 (д, J = 17,2Гц, 1H), 5,41 (с, 80409 58 2Н), 5,67 (д, J = 17,2Гц, 1Н), 6,73 (дд, J = 2,0, 6,6Гц, 1H), 7,15 (с, 1Н), 7,59 (дц, J = 2,0, 8,6Гц, 1Н), 7,64 (дд, J = 6,6, 8,6Гц, 1H), 8,51 (1Hир, 1Н), MS (ES) m/z 475 (M++1). (Ь)(9S)-1,9-діетил-9-гідрокси-1H,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3H,9Н,15Н)-трион 1 Н ЯМР (270мгц) d (DMSO-d6) 0,87 (т, J = 7,4Гц, 3H), 1,30 (т, J = 6,9Гц, 3H), 1,84-1,88 (м, 2Н), 4,09-4,12 (м, 2Н), 5,42 (с, 2Н), 5,46 (с, 2Н), 6,49 (1Hир, 1Н), 6,78 (д, J = 7,6Гц, 1H), 7,25 (с, 1Н), 7,42 (д, J = 8,3Гц, 1Н), 7,61 (дд, J = 7,6, 8,3Гц, 1Н), 11,12 (1Hир, 1Н), MS (ES)m/z433(M++l). Приклад 1.16 Одержання (95)-9-етил-9-гідрокси-1-[2-(4метоксифеніл)етил]-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3H,9Н,15Н)-триону Ця сполука була одержана з (205)-9-аміно-7[2-(4-метоксифеніл)етиламіно]камптотецину 20ацетату з базового прикладу 5.16 за способом, аналогічним способу з прикладу 1.1, двома етапами через сполуку (а). (а)(9S)-9-ацетокси-9-етил-1-[2-(4-метоксифеніл)етил]-1Н,12Н-пірано[3",4":6',7']індолізино[1',2':6, 5]піридо[4,3,2-dе]хіназолін-2,10,13(3H,9Н,15Н)трион 1 Н ЯМР (270мгц) d (CDCl3) 0,99 (т, J = 7,4Гц, 3H), 2,03-2,38 (м, 5Н), 2,98 (т, J = 7,9Гц, 2Н), 3,72 (с, 3H), 4,23-4,50 (м, 2Н), 5,42 (д, J = 17,2Гц, 1H), 5,44 (с, 2Н), 5,69 (д, J = 17,2Гц, 1H), 6,74 (дд, J = 2,0, 6,6Гц, 1H), 6,83 (д, J = 8,6Гц, 2Н), 7,16 (с, 1Н), 7,22 (д, J = 8,6Гц, 2Н), 7,60 (дц, J = 2,0, 8,6Гц, 1H), 7,65 (дц, J = 6,6, 8,6Гц, 1Н), 8,52 (1Hир, 1Н), MS (ES) m/z 581 (M++l). (Ь)(9S)-9-етил-9-гідрокси-1-[2-(4метоксифеніл)етил]-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3H,9Н,15Н)-трион 1 Н ЯМР (270мгц) d (DMSO-d6) 0,88 (т, J = 7,3Гц, 3H), 1,77-1,95 (м, 2Н), 2,93-2,99 (м, 2Н), 3,74 (с, 3H), 4,15-4,31 (м, 2Н), 5,43 (с, 2Н), 5,54 (с, 2Н), 6,49 (с, 1H), 6,79 (д, J = 8,0Гц, 1Н), 6,90 (д, J = 8,9Гц, 2Н), 7,25 (д, J = 8,9Гц, 2Н), 7,26 (с, 1Н), 7,44 (д, J = 8,0Гц, 1H), 7,63 (т, J = 8,0Гц, 1H), 11,15 (1Hир, 1Н), MS (ES) m/z 539 (M++1). Приклад 1.17 Одержання (9S)-1-[2-(4-хлорфеніл)етил]-9етил-9-гідрокси-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3H,9Н,15Н)-триону Ця сполука була одержана з (205)-9-аміно-7[2-(4-хлорфеніл)етиламіно]камптотецину 20ацетату з базового прикладу 5.17 за способом, аналогічним способу з прикладу 1.1, двома етапами через сполуку (а). (а) (9S)-9-ацетокси-1-[2-(4-хлорфеніл)етил]-9етил-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3H,9Н,15Н)-трион 1 Н ЯМР (270мгц) d (CDCl3) 0,99 (т, J = 7,4Гц, 3H), 2,03-2,38 (м, 5Н), 2,99 (т, J = 7,9Гц, 2Н), 4,234,52 (м, 2Н), 5,42 (д, J = 17,2Гц, 1Н), 5,45 (с, 2Н), 5,70 (д, J = 17,2Гц, 1Н), 6,76 (дд, J = 2,0,6,6Гц, 1H), 7,14-7,32 (м, 5Н), 7,62 (дд, J = 2,0, 8,6Гц, 1Н), 7,66 59 (дд, J = 6,6, 8,6Гц, 1H), 8,97 (1Hир, 1H), MS (ES) m/z 585 (M++1). (b)(9S)-1-[2-(4-хлорфеніл)етил]-9-етил-9гідрокси-1H,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2Д0ДЗ(3H,9Н,15Н)-трион 1 Н ЯМР (270мгц) d (DMSO-de) 0,88 (т, J = 7,3Гц, 3H), 1,85-1,89 (м, 2Н), 3,00-3,06 (м, 2Н), 4,28-4,30 (м, 2Н), 5,43 (с, 2Н), 5,53 (с, 2Н), 6,52 (с, 1H), 6,79 (д, J = 7,6Гц, 1Н), 7,27 (с, 1H), 7,34 (д, J = 8,6Гц, 2Н), 7,40 (д, J = 8,6Гц, 2Н), 7,45 (д, J = 8,6Гц, 1Н), 7,63 (дд, J = 7,6, 8,6Гц, 1H), 11,16 (1Hир, 1Н), MS (ES) m/z 543 (M++1). Приклад 1.18 Одержання (95)-9-етил-1-[2-(4фторфеніл)етил]-9-гідрокси-1H,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3H,9Н,15Н)-триону Ця сполука була одержана з (205)-9-аміно-7[2-(4-фторфеніл)етиламіно]камптотецину 20ацетату з базового прикладу 5.18 за способом, аналогічним способу з прикладу 1.1, двома етапами через сполуку (а). (а) (9S)-9-ацетокси-9-етил-1-[2-(4фторфеніл)етил]-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3H,9Н,15Н)-трион 1 Н ЯМР (270мгц) d (CDCl3) 0,99 (т, J = 7,4Гц, 3H), 2,03-2,38 (м, 5Н), 3,00 (т, J = 7,8Гц, 2Н), 4,214,55 (м, 2Н), 5,42 (д, J = 17,2Гц, 1Н), 5,44 (с, 2Н), 5,70 (д, J = 17,2Гц, 1H), 6,77 (дд, J = 2,0, 6,6Гц, 1Н), 6,94-7,01 (м, 2Н), 7,18 (с, 1Н), 7,21-7,33 (м, 2Н), 7,61 (дд, J = 2,0, 8,6Гц, 1H), 7,66 (дд, J = 6,6, 8,6Гц, 1H), 8,89 (1Hир, 1Н), MS (ES) m/z 569 (M++1). (b) (9S)-9-етил-1-[2-(4-фторфеніл)етил]-9гідрокси-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3H,9Н,15Н)-трион 1 Н ЯМР (270мгц) d (DMSO-d6) 0,88 (т, J = 7,3Гц, 3H), 1,85-1,91 (м, 2Н), 3,00-3,06 (м, 2Н), 4,27-4,29 (м, 2Н), 5,43 (с, 2Н), 5,54 (с, 2Н), 6,52 (с, 1Н), 6,79 (д, J = 7,8Гц, 1Н), 7,16 (т, J = 8,9Гц, 2Н), 7,27 (с, 1Н), 7,36 (дд, J = 5,6, 8,9Гц, 2Н), 7,45 (д, J = 7,8Гц, 1Н), 7,63 (т, J = 7,8Гц, 1Н), 11,16 (1Hир, 1Н), MS (ES) m/z 527 (M++l). Приклад 1.19 Одержання (9S)-9-етил-9-гідрокси-1-(1метилетил)-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2ае]хіназолін-2,10,13(3H,9Н,15Н)-триону Ця сполука була одержана з (205)-9-аміно-7(1-метилетиламіно)камптотецину 20-ацетату з базового прикладу 5.19 за способом, аналогічним способу з прикладу 1.1, двома етапами через сполуку (а). (а) (9S)-9-ацетокси-9-етил-1-(1-метилетил)1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3H,9Н,15Н)-трион 1 H ЯМР (270мгц) d (CDCl3) 0,97 (т, J = 7,4Гц, 3H), 1,76 (д, J = 6,6Гц, 6Н), 2,09-2,35 (м, 5Н), 4,404,58 (м, 1Н), 5,40 (д, J = 17,2Гц, 1Н), 5,42 (с, 2Н), 5,68 (д, J = 17,2Гц, 1Н), 6,71 (дд, J = 1,5, 7,1Гц, 1Н), 7,15 (с, 1H), 7,57 (дд, J = 1,5, 8,6Гц, 1H), 7,63 80409 60 (дд, J = 7,1, 8,6Гц, 1H), 8,79 (1Hир, 1H), MS (ES) m/z 489 (M++1). (b)(9S)-9-етил-9-гідрокси-1-(1-метилетил)1H,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3H,9Н,15Н)-трион 1 Н ЯМР (270мгц) d (DMSO-d6) 0,87 (т, J = 7,3Гц, 3H), 1,64 (д, J = 6,6Гц, 6Н), 1,82-1,94 (м, 2Н), 4,43-4,53 (м, 1H), 5,42 (с, 2Н), 5,48 (с, 2Н), 6,50 (с, 1Н), 6,74 (д, J = 7,9Гц, 1H), 7,25 (с, 1H), 7,40 (д, J = 7,9Гц, 1Н), 7,60 (т, J = 7,9Гц, 1Н), 10,95 (1Hир, 1H), MS (ES) m/z 447 (M++1). Приклад 1.20 Одержання (95)-1-(3,3-диметилбутил)-9-етил9-гідрокси-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3H,9Н,15Н)-триону Ця сполука була одержана з (205)-9-аміно-7(3,3-диметилбутиламіно)камптотецину 20-ацетату з базового прикладу 5.20 за способом, аналогічним способу з прикладу 1.1, двома етапами через сполуку (а). (а) (9S)-9-ацетокси-1-(3,3-Диметилбутил)-9етил-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10,13(3H,9Н,15Н)-трион 1 Н ЯМР (270мгц) d (CDCl3) 0,98 (т, J = 7,4Гц, 3H), 1,12 (с, 9Н), 1,55-1,73 (м, 2Н), 2,02-2,37 (м, 5Н), 4,05-4,29 (м, 2Н), 5,40 (д, J = 17,2Гц, 1Н), 5,42 (с, 2Н), 5,67 (д, J = 17,2Гц, 1Н), 6,73 (дд, J = 2,0, 6,6Гц, 1H), 7,15 (с, 1Н), 7,58 (дц, J = 2,0, 8,6Гц, 1Н), 7,63 (дд, J = 6,6, 8,6Гц, 1H), 9,08 (1Hир, 1H), MS (ES) m/z 531 (M++1). (b) (9S)-1-(3,3-диметилбутил)-9-етил-9гідрокси-1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-2,10ДЗ(3H,9Н,15Н)-трион 1 Н ЯМР (270мгц) d (DMSO-d6) 0,88 (т, J = 7,3Гц, 3H), 1,04 (с, 9Н), 1,59-1,66 (м, 2Н), 1,79-1,90 (м, 2Н), 4,04 (м, 2Н), 5,41 (с, 2Н), 5,48 (с, 2Н), 6,49 (с, 1H), 6,76 (дд, J = 1,0, 7,6Гц, 1Н), 7,23 (с, 1H), 7,40 (дд, J = 1,0, 8,6Гц, 1Н), 7,60 (дд,J = 7,6, 8,6Гц, 1Н), 11,11 (1Hир, 1Н), S (ES) m/z 489 (M++1). Приклади 2.1 Одержання (9S)-1-бутил-9-етил-9-гідрокси1Н,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-10,13(9НД5Н)-діону Спосіб одержання включає наступні два етапи через сполуку (а). (а) (9S)-9-ацетокси-1-бутил-9-етил-1H,12Нпірано[3",4":6',7']індолізино[1',2':6,5]піридо[4,3,2dе]хіназолін-10,13(9Н,15Н)-діон До розчину (205)-9-аміно-7(бутиламіно)камптотецину 20-ацетату гідрохлориду (14,9мг, 0,029ммоль) з базового прикладу 5.1 у сухому СН2СІ 2 (5мл) додали триметилортоформіат (100мкл) та моногідрат р-толуолсульфонової кислоти (5мг). Суміш нагрівали у колбі зі зворотним холодильником протягом 1 години на масляній бані. Після охолодження до кімнатної температури суміш промили водним 1% розчином NaHCO3 та сольовим розчином послідовно, висушили над MgSO4 та концентрували при зниженому тиску. Одержаний залишок очистили за допомогою коло
ДивитисяДодаткова інформація
Назва патенту англійськоюHexacyclic compounds
Автори англійськоюMurata Takeshi, Niizuma Satoshi, Shimma Nobuo, Suda Hitomi, Tsukazaki Masao
Назва патенту російськоюГексациклические соединения
Автори російськоюМурата Такеши, Ниизума Сатоши, Шимма Нобуо, Суда Хитоми, Цуказаки Масао
МПК / Мітки
МПК: A61K 31/5377, A61P 35/00, C07D 491/22, A61K 31/519, A61P 43/00
Мітки: сполуки, гексациклічні
Код посилання
<a href="https://ua.patents.su/43-80409-geksaciklichni-spoluki.html" target="_blank" rel="follow" title="База патентів України">Гексациклічні сполуки</a>
Попередній патент: Аерозольний клапан для розпилення порошків
Наступний патент: Суміш домішок для виробництва цементного клінкеру та її застосування
Випадковий патент: Піротехнічне реле двосторонньої дії












