Трициклічні похідні як антагоністи ltd4, спосіб їх одержання, проміжна сполука, фармацевтична композиція на їх основі, їх застосування
Номер патенту: 80996
Опубліковано: 26.11.2007
Автори: Перес Креспо Даніель, Бач Тана Хорді, Райдер Хейміш, Пуйг Дуран Карлос
Формула / Реферат
1. Сполука формули (І):
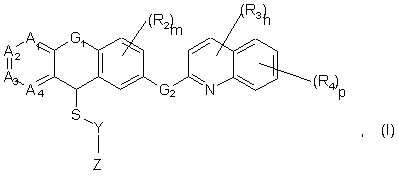
або її фармацевтично прийнятні солі, у якій:
від 1 до 3 з А1, А2, А3 та А4 означають атоми азоту, а інші означають групи –CR1-;
G1 означає групу, що вибрана із групи, яка включає -СН2-О-, -СН2-СН2-, -СН=СН-, -CH2-S-, -N(C1-C4алкіл)-CH2;
G2 означає групу, що вибрана із групи, яка включає -О-СН2-, -СН=СН-, -СН2-СН2-;
всі R1, R2, R3 та R4 є однаковими або різними та вибрані із групи, яка включає атоми водню або галогену й гідрокси-, алкільну, алкенільну, алкінільну, алкокси-, алкілтіо-, аміно-, моноалкіламіно-, діалкіламіно-, нітро-, ціано-, ацилокси-, алкоксикарбонільну, гідроксикарбонільну та ациламіногрупи, вуглеводневі ланцюги цих груп необов'язково містять один або більшу кількість додаткових замісників, вибраних із групи, яка включає галоген, гідрокси-, оксо-, алкокси-, алкілтіо-, ациламіно-, фенільну, алкоксикарбонільну, аміно-, моноалкіламіно-, діалкіламіно- та гідроксикарбонільну групи;
n, m та р незалежно дорівнюють 0, 1 або 2;
Y означає необов'язково заміщений залишок, що вибраний із групи, яка включає алкіл, циклоалкіл, арил, алкілциклоалкіл, циклоалкілалкіл, арилалкіл, алкіларил, алкілциклоалкілалкіл, циклоалкілалкілциклоалкіл, алкіларилалкіл та арилалкіларил;
Z означає тетразолільну групу, групу -COOR5, групу -CONR5R5, групу NHSO2R5 або групу -CONHSO2R5, де R5 означає водень або необов'язково заміщений алкіл, арил, циклоалкіл, гетероцикліл або гетероарил.
2. Сполука за п. 1, у якій один з А1 А2, А3 та А4 означає атом азоту, а інші означають групи –CR1-.
3. Сполука за п. 2, у якій А1 означає атом азоту, та А2, А3 та А4 означають групи –CR1-.
4. Сполука за п. 3, у якій R1 означає атом водню.
5. Сполука за п. 2, у якій А4 означає атом азоту, та А1, А2 та А3 означають групи –CR1-.
6. Сполука за п. 5, у якій R1 означає атом водню.
7. Сполука за будь-яким з попередніх пунктів, у якій G1 означає групу -СН2О-.
8. Сполука за будь-яким з попередніх пунктів, у якій G2 вибраний із групи, яка включає -ОСН2- та -СН=СН-.
9. Сполука за будь-яким з попередніх пунктів, у якій р дорівнює 2 і кожен R4 означає атом галогену.
10. Сполука за п. 9, у якій R4 вибрані із групи, яка включає F та Сl.
11. Сполука за будь-яким з попередніх пунктів, у якій Y означає групу, що вибрана із групи, яка включає алкіл, алкілциклоалкілалкіл й алкіларил, зазначені групи необов'язково можуть містити один або більшу кількість замісників, що вибрані із групи, яка включає галогени, гідрокси-, алкокси-, аміногрупи, алкільні групи та галогеналкільні групи.
12. Сполука за п. 11, у якій Y означає групу, що вибрана із групи, яка включає -СН2СН2- і 2-циклопропілпропіл.
13. Сполука за п. 1, що являє собою одну з наступних сполук:
3-{(7-[(6,7-дифторхінолін-2-іл)метокси]-5,11-дигідро[1]бензоксепіно[3,4-b]піридин-5-іл)тіо}пропанова кислота,
{(7-[(6,7-дифторхінолін-2-іл)метокси]-5,11-дигідро[1]бензоксепіно[3,4-b]піридин-5-іл)тіо}оцтова кислота,
{(7-[(7-хлор-6-фторхінолін-2-іл)метокси]-5,11-дигідро[1]бензоксепіно[3,4-b]піридин-5-іл)тіо}оцтова кислота,
3-{(7-[(7-хлор-6-фторхінолін-2-іл)метокси]-5,11-дигідро[1]бензоксепіно[3,4-b]піридин-5-іл)тіо}пропанова кислота,
[{(7-[(6,7-дифторхінолін-2-іл)метокси]-5,11-дигідро[1]бензоксепіно[3,4-b]піридин-5-іл)тіо}метил]бензойна кислота,
[{(7-[(7-хлор-6-фторхінолін-2-іл)метокси]-5,11-дигідро[1]бензоксепіно[3,4-b]піридин-5-іл)тіо}метил]бензойна кислота,
1-{[(7-[(6,7-дифторхінолін-2-іл)метокси]-5,11-дигідро[1]бензоксепіно[3,4-b]піридин-5-іл)тіо]метил}циклопропілоцтова кислота,
3-{(7-[(6,7-дифторхінолін-2-іл)метокси]-5,11-дигідро[1]бензоксепіно[3,4-b]піридин-5-іл)тіо}-2,2-диметилпропанова кислота,
3-{(7-[(6,7-дифторхінолін-2-іл)метокси]-5,11-дигідро[1]бензоксепіно[3,4-b]піридин-5-іл)тіо}-3-метилбутанова кислота,
3-{(7-[(Е)-2-(6,7-дифторхінолін-2-іл)вініл]-5,11-дигідро[1]бензоксепіно[3,4-b]піридин-5-іл)тіо}пропанова кислота,
1-{[(7-[(Е)-2-(6,7-дифторхінолін-2-іл)вініл]-5,11-дигідро[1]бензоксепіно[3,4-b]піридин-5-іл)тіо]метил}циклопропілоцтова кислота,
{(7-[(Е)-2-(6,7-дифторхінолін-2-іл)вініл]-5,11-дигідро[1]бензоксепіно[3,4-b]піридин-5-іл)тіо}оцтова кислота,
7-[(Е)-2-(6,7-дифторхінолін-2-іл)вініл]-5-{[2-(1Н-тетразол-5-іл)етил]тіо}-5,11-дигідро[1]бензоксепіно[3,4-b]піридин,
1,1,1-трифтор-N-[2-({7-[(Е)-2-(6,7-дифторхінолін-2-іл)вініл]-5,11-дигідро[1]бензоксепіно[3,4-b]піридин-5-іл)тіо)етил]метансульфонамід,
1,1,1-трифтор-N-[2-({7-[(6,7-дифторхінолін-2-іл)метокси]-5,11-дигідро[1]бензоксепіно[3,4-b]піридин-5-іл}тіо)етил]метансульфонамід,
3-{(9-[(Е)-2-(6,7-дифторхінолін-2-іл)вініл]-5,11-дигідро[1]бензоксепіно[4,3-b]піридин-11-іл)тіо}пропанова кислота,
3-{(9-[(6,7-дифторхінолін-2-іл)метокси]-5,11-дигідро[1]бензоксепіно[4,3-b]піридин-11-іл)тіо}пропанова кислота,
1-{[(9-[(6,7-дифторхінолін-2-іл)метокси]-5,11-дигідро[1]бензоксепіно[4,3-b]піридин-11-іл)тіо]метил}циклопропілоцтова кислота,
7-[(6,7-дифторхінолін-2-іл)метокси]-5-{[2-(1Н-тетразол-5-іл)метил]тіо}-5,11-дигідро[1]бензоксепіно[3,4-b]піридин,
7-[(6,7-дифторхінолін-2-іл)метокси]-5-{[2-(1Н-тетразол-5-іл)етил]тіо}-5,11-дигідро[1]бензоксепіно[3,4-b]піридин,
3-[7-(6,7-дифторхінолін-2-ілметокси)-11-метил-10,11-дигідро-5Н-бензо[е]піридо[2,3-b]азепін-5-ілсульфаніл]пропіонова кислота,
3-[7-(7-хлор-6-фторхінолін-2-ілметокси)-11-метил-10,11-дигідро-5Н-бензо[е]піридо[2,3-b]азепін-5-ілсульфаніл]пропіонова кислота,
3-[(9-хлор-7-(6,7-дифторхінолін-2-ілметокси)-5,11-дигідро[1]бензоксепіно[3,4-b]піридин-5-іл)тіо]пропанова кислота,
етил-3-[(7-(6,7-дифторхінолін-2-ілметокси)-5,11-дигідро[1]бензоксепіно[3,4-b]піридин-5-іл)тіо]пропаноат,
3-[(7-(6,7-дифторхінолін-2-ілметокси)-5,11-дигідро[1]бензоксепіно[3,4-b]піридин-5-іл)тіо]пропанамід,
3-[(7-(6,7-дифторхінолін-2-ілметокси)-2-метил-5,11-дигідро[1]бензоксепіно[3,4-b]піридин-5-іл)тіо]пропанова кислота,
3-[(7-(6,7-дифторхінолін-2-ілметокси)-9-фтор-5,11-дигідро[1]бензоксепіно[3,4-b]піридин-5-іл)тіо]пропанова кислота,
3-[(7-(6,7-дифторхінолін-2-ілметокси)-9-метил-5,11-дигідро[1]бензоксепіно[3,4-b]піридин-5-іл)тіо]пропанова кислота,
3-{(7-[(Е)-2-(6,7-дифторхінолін-2-іл)вініл]-5,11-дигідро[1]бензоксепіно[3,4-b]піридин-5-іл)тіо}пропанамід,
етил-3-{(7-[(Е)-2-(6,7-дифторхінолін-2-іл)вініл]-5,11-дигідро[1]бензоксепіно[3,4-b]піридин-5-іл)тіо}пропаноат.
14. Спосіб одержання сполуки формули (І):

у якій А1, А2, А3, А4, G1, G2, R2, R3, R4 Y та Z є такими, як визначено в будь-якому з попередніх пунктів, в якому вводять спирт формули (III):
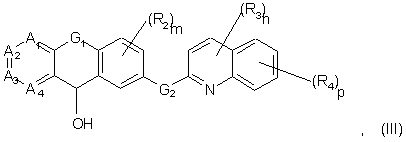
у якій А1, А2, A3, A4, G1, G2, R2, R3 та R4 є такими, як визначено вище, у реакцію з меркаптаном формули HS-Y-Z, у якій Y та Z є такими, як визначено в будь-якому з попередніх пунктів.
15. Сполука формули (III):

у якій А1, А2, A3, A4, G1, G2, R2, R3, R4, Y та Z є такими, як визначено в будь-якому з пп. 1-12.
16. Сполука за будь-яким з пп. 1-13, яка призначена для застосування при лікуванні патологічного стану або захворювання, перебіг якого полегшується внаслідок антагонізму до рецепторів LTD4.
17. Фармацевтична композиція, що містить сполуку за будь-яким з пп. 1-13 у суміші з фармацевтично прийнятним розріджувачем або носієм.
18. Застосування сполуки за будь-яким з пп. 1-13 при виготовленні лікарського препарату, який призначений для застосування при лікуванні патологічного стану або захворювання, перебіг якого полегшується внаслідок антагонізму до рецепторів LTD4.
19. Застосування за п. 18, у якому лікарський препарат призначений для застосування при лікуванні або попередженні запальних захворювань або алергійних захворювань.
20. Застосування за п. 18, у якому лікарський препарат призначений для застосування при лікуванні або попередженні захворювання, яким є бронхіальна астма, алергічний та цілорічний алергічний риніт, хронічне обструктивне захворювання дихальних шляхів, кропив'янка, атопічний дерматит, мігрень, вірусний бронхіоліт, що викликаний РСВ, муковісцидоз, еозинофільний гастроентерит, фіброміалгія А й інтерстиціальний цистит.
21. Спосіб лікування суб’єкта, що страждає від патологічного стану або захворювання, перебіг якого полегшується внаслідок антагонізму до рецепторів, в якому зазначеному суб'єкту вводять ефективну кількість сполуки за будь-яким з пп. 1-13.
22. Спосіб за п. 21, у якому патологічним станом або захворюванням є бронхіальна астма, алергічний та цілорічний алергічний риніт, хронічне обструктивне захворювання дихальних шляхів, кропив'янка, атопічний дерматит, мігрень, вірусний бронхіоліт, що викликаний РСВ, муковісцидоз, еозинофільний гастроентерит, фіброміалгія А й інтерстиціальний цистит.
23. Комбінація продуктів, що містить сполуку за будь-яким з пп. 1- 3 та іншу сполуку, що вибрана із групи, яка включає (а) сполуки, ефективні при лікуванні мігрені, (б) антагоністи НІ та (в) інгібітори PDE IV, яка призначена для одночасного, роздільного або послідовного застосування.
Текст
1. Сполука формули (І): C2 2 (19) 1 3 80996 4 гідрокси-, алкокси-, аміногрупи, алкільні групи та 7-[(6,7-дифторхінолін-2-іл)метокси]-5-{[2-(1Нгалогеналкільні групи. тетразол-5-іл)етил]тіо}-5,1112. Сполука за п. 11, у якій Y означає групу, що дигідро[1]бензоксепіно[3,4-b]піридин, вибрана із групи, яка включає -СН2СН2- і 23-[7-(6,7-дифторхінолін-2-ілметокси)-11-метил-10,11циклопропілпропіл. дигідро-5Н-бензо[е]піридо[2,3-b]азепін-513. Сполука за п. 1, що являє собою одну з ілсульфаніл]пропіонова кислота, наступних сполук: 3-[7-(7-хлор-6-фторхінолін-2-ілметокси)-11-метил3-{(7-[(6,7-дифторхінолін-2-іл)метокси]-5,1110,11-дигідро-5Н-бензо[е]піридо[2,3-b]азепін-5дигідро[1]бензоксепіно[3,4-b]піридин-5ілсульфаніл]пропіонова кислота, іл)тіо}пропанова кислота, 3-[(9-хлор-7-(6,7-дифторхінолін-2-ілметокси)-5,11{(7-[(6,7-дифторхінолін-2-іл)метокси]-5,11дигідро[1]бензоксепіно[3,4-b]піридин-5дигідро[1]бензоксепіно[3,4-b]піридин-5-іл)тіо}оцтова іл)тіо]пропанова кислота, кислота, етил-3-[(7-(6,7-дифторхінолін-2-ілметокси)-5,11{(7-[(7-хлор-6-фторхінолін-2-іл)метокси]-5,11дигідро[1]бензоксепіно[3,4-b]піридин-5дигідро[1]бензоксепіно[3,4-b]піридин-5-іл)тіо}оцтова іл)тіо]пропаноат, кислота, 3-[(7-(6,7-дифторхінолін-2-ілметокси)-5,113-{(7-[(7-хлор-6-фторхінолін-2-іл)метокси]-5,11дигідро[1]бензоксепіно[3,4-b]піридин-5дигідро[1]бензоксепіно[3,4-b]піридин-5іл)тіо]пропанамід, іл)тіо}пропанова кислота, 3-[(7-(6,7-дифторхінолін-2-ілметокси)-2-метил[{(7-[(6,7-дифторхінолін-2-іл)метокси]-5,115,11-дигідро[1]бензоксепіно[3,4-b]піридин-5дигідро[1]бензоксепіно[3,4-b]піридин-5іл)тіо]пропанова кислота, іл)тіо}метил]бензойна кислота, 3-[(7-(6,7-дифторхінолін-2-ілметокси)-9-фтор-5,11[{(7-[(7-хлор-6-фторхінолін-2-іл)метокси]-5,11дигідро[1]бензоксепіно[3,4-b]піридин-5дигідро[1]бензоксепіно[3,4-b]піридин-5іл)тіо]пропанова кислота, іл)тіо}метил]бензойна кислота, 3-[(7-(6,7-дифторхінолін-2-ілметокси)-9-метил1-{[(7-[(6,7-дифторхінолін-2-іл)метокси]-5,115,11-дигідро[1]бензоксепіно[3,4-b]піридин-5дигідро[1]бензоксепіно[3,4-b]піридин-5іл)тіо]пропанова кислота, іл)тіо]метил}циклопропілоцтова кислота, 3-{(7-[(Е)-2-(6,7-дифторхінолін-2-іл)вініл]-5,113-{(7-[(6,7-дифторхінолін-2-іл)метокси]-5,11дигідро[1]бензоксепіно[3,4-b]піридин-5дигідро[1]бензоксепіно[3,4-b]піридин-5-іл)тіо}-2,2іл)тіо}пропанамід, диметилпропанова кислота, етил-3-{(7-[(Е)-2-(6,7-дифторхінолін-2-іл)вініл]-5,113-{(7-[(6,7-дифторхінолін-2-іл)метокси]-5,11дигідро[1]бензоксепіно[3,4-b]піридин-5дигідро[1]бензоксепіно[3,4-b]піридин-5-іл)тіо}-3іл)тіо}пропаноат. метилбутанова кислота, 14. Спосіб одержання сполуки формули (І): (R3) 3-{(7-[(Е)-2-(6,7-дифторхінолін-2-іл)вініл]-5,11n (R2) дигідро[1]бензоксепіно[3,4-b]піридин-5m G1 A1 іл)тіо}пропанова кислота, A2 1-{[(7-[(Е)-2-(6,7-дифторхінолін-2-іл)вініл]-5,11A3 (R4) дигідро[1]бензоксепіно[3,4-b]піридин-5A4 G2 N p іл)тіо]метил}циклопропілоцтова кислота, S {(7-[(Е)-2-(6,7-дифторхінолін-2-іл)вініл]-5,11Y , (I) дигідро[1]бензоксепіно[3,4-b]піридин-5-іл)тіо}оцтова кислота, Z 7-[(Е)-2-(6,7-дифторхінолін-2-іл)вініл]-5-{[2-(1Нтетразол-5-іл)етил]тіо}-5,11у якій А1, А2, А3, А4, G1, G 2, R2, R3, R4 Y та Z є дигідро[1]бензоксепіно[3,4-b]піридин, такими, як визначено в будь-якому з попередніх 1,1,1-трифтор-N-[2-({7-[(Е)-2-(6,7-дифторхінолін-2пунктів, в якому вводять спирт формули (III): іл)вініл]-5,11-дигідро[1]бензоксепіно[3,4-b]піридин-5(R3) n (R2) іл)тіо)етил]метансульфонамід, m G1 A1 1,1,1-трифтор-N-[2-({7-[(6,7-дифторхінолін-2A2 іл)метокси]-5,11-дигідро[1]бензоксепіно[3,4A3 (R4) b]піридин-5-іл}тіо)етил]метансульфонамід, A4 G2 N p 3-{(9-[(Е)-2-(6,7-дифторхінолін-2-іл)вініл]-5,11дигідро[1]бензоксепіно[4,3-b]піридин-11OH , (III) іл)тіо}пропанова кислота, у якій А1, А2, A3, A4, G1, G2, R2, R3 та R4 є такими, як 3-{(9-[(6,7-дифторхінолін-2-іл)метокси]-5,11визначено вище, у реакцію з меркаптаном дигідро[1]бензоксепіно[4,3-b]піридин-11формули HS-Y-Z, у якій Y та Z є такими, як іл)тіо}пропанова кислота, визначено в будь-якому з попередніх пунктів. 1-{[(9-[(6,7-дифторхінолін-2-іл)метокси]-5,1115. Сполука формули (III): дигідро[1]бензоксепіно[4,3-b]піридин-11іл)тіо]метил}циклопропілоцтова кислота, 7-[(6,7-дифторхінолін-2-іл)метокси]-5-{[2-(1Нтетразол-5-іл)метил]тіо}-5,11дигідро[1]бензоксепіно[3,4-b]піридин, 5 80996 6 лікуванні або попередженні захворювання, (R2) m яким є бронхіальна астма, алергічний та G1 A1 цілорічний алергічний риніт, хронічне A2 обструктивне захворювання дихальних шляхів, A3 (R4) кропив'янка, атопічний дерматит, мігрень, A4 G2 N p вірусний бронхіоліт, що викликаний РСВ, OH муковісцидоз, еозинофільний гастроентерит, , (III) фіброміалгія А й інтерстиціальний цистит. у якій А1, А2, A3, A4, G 1, G2, R2, R3, R4, Y та Z є 21. Спосіб лікування суб’єкта, що страждає від такими, як визначено в будь-якому з пп. 1-12. патологічного стану або захворювання, перебіг 16. Сполука за будь-яким з пп. 1-13, яка якого полегшується внаслідок антагонізму до призначена для застосування при лікуванні рецепторів, в якому зазначеному суб'єкту вводять патологічного стану або захворювання, перебіг ефективну кількість сполуки за будь-яким з пп. 1якого полегшується внаслідок антагонізму до 13. рецепторів LTD4. 22. Спосіб за п. 21, у якому патологічним станом 17. Фармацевтична композиція, що містить або захворюванням є бронхіальна астма, сполуку за будь-яким з пп. 1-13 у суміші з алергічний та цілорічний алергічний риніт, фармацевтично прийнятним розріджувачем або хронічне обструктивне захворювання дихальних носієм. шляхів, кропив'янка, атопічний дерматит, 18. Застосування сполуки за будь-яким з пп. 1-13 мігрень, вірусний бронхіоліт, що викликаний при виготовленні лікарського препарату, який РСВ, муковісцидоз, еозинофільний призначений для застосування при лікуванні гастроентерит, фіброміалгія А й інтерстиціальний патологічного стану або захворювання, перебіг цистит. якого полегшується внаслідок антагонізму до 23. Комбінація продуктів, що містить сполуку за рецепторів LTD4. будь-яким з пп. 1- 3 та іншу сполуку, що вибрана із 19. Застосування за п. 18, у якому лікарський групи, яка включає (а) сполуки, ефективні при препарат призначений для застосування при лікуванні мігрені, (б) антагоністи НІ та (в) лікуванні або попередженні запальних інгібітори PDE IV, яка призначена для захворювань або алергійних захворювань. одночасного, роздільного або послідовного 20. Застосування за п. 18, у якому лікарський застосування. препарат призначений для застосування при 24. (R3) n Даний винахід стосується нових, придатних для терапії трициклічних похідних, способів їх одержання та фармацевтичних композицій, що їх містять. Ці сполуки є активними антагоністами лейкотрієну D4 і тому придатні для лікування, попередження або пригнічення патологічних станів, захворювань і порушень, для яких відомо, що вони піддаються лікуванню шляхом інгібування біологічних ефектів лейкотрієну D4. Лейкотрієни є сполуками, які продукуються в ссавців шляхом метаболізму арахідонової кислоти за ліпоксигеназним шляхом. Різні лейкотрієни позначають буквено-цифровими комбінаціями, як наприклад, непептидний лейкотрієн В4 (LTB4) і пептиди-лейкотрієни С4 (LTC4), D4 (LTD4) та Е4 (LTE4). Лейкотрієни приймають участь у запальних реакціях, проявляють хемотаксичну активність, стимулюють вивільнення лізосомного ферменту та відіграють важливу роль у проміжній реакції гіперчутливості. їх біологічні характеристики описані в декількох оглядах, наприклад, [Dahlen et al., Nature, 288, 484 (1980) відзначають, що LTD4 є активним бронхозвужувальним засобом для бронхів людини, a Burke et al., J. Pharmacol. And Exp. Therap., 221, 235 (1982)] відзначають, що він є активним засобом, що звужує коронарні судини, і впливає на скорочувальну здатність міокарда й коронарний кровотік ізольованого серця. Внаслідок своїх фізіологічних впливів недавно були розкриті антагоністи LTD4 різної хімічної структури, призначені для лікування або попередження патологічних станів, захворювань і порушень, для яких відомо, що їх протікання полегшується шляхом інгібування LTD4, таких як бронхіальна астма, алергічний та цілорічний алергічний риніт, хронічне обструктивне захворювання легенів, кропив'янка, атопічний дерматит, мігрень, вірусний бронхіоліт, що викликаний РСВ (респіраторно-синтиціальний вірус), муковісцидоз, еозинофільний гастроентерит, фіброміалгія А та інтерстиціальний цистит. [Див., наприклад, ЕР 0173516, ЕР 0463638, ЕР 0490648, US 5856322, HEADACHE, (2000 Feb) 40 (2) 158-63, Dermatology, (2001) 203 (4) 280-3. Ref: 51, International Journal of Clinical Pharmacology and Therapeutics, (2001 Dec) 39 (12) 529-33, Journal of the American Academy of Dermatology, (2001 Jan) 44 (1) 89-93, Annals of Pharmacotherapy, (1997 Sep) 31 (9) 1012-21. Ref: 43, Pulmonary Pharmacology and Therapeutics, (2000) 13 (6) 301-5, American Journal of physiology. Lung Cellular and Molecular Physiology (2002 May) 282 (5) LI 143-50, Respirology, (2000 Dec) 5 (4) 38992, Thorax, (2001 Mar) 56 (3) 244-5, Urology, (2001 Jun) 57 (6 Suppl 1) 118, Journal of Urology, (2001 Nov) 166 (5) 1734-7, BJU International, (2001 May) 87 (7) 690-6, Current Gastroenterology Reports, (2002 Oct) 4 (5) 366-72, Digestive Diseases and Sciences, (2001 Aug) 46 (8) 1787-90, Journal of Allergy and Clinical Immunology, (1999 Aug) 104 (2 Pt 1) 506, Acta Odontologica Scandinavica, (2002 Jan) 60 (1) 29-36, Journal of Orofacial Pain, (2001 7 80996 8 Winter) 15 (1) 9-28. Ref: 168, Acta Odontologica гідроксикарбонільну й ациламіногрупи, Scandinavica, (2001 Dec) 59 (6) 348-55]. вуглеводневі ланцюги цих груп необов'язково Кілька сполук, що здійснюють антагоністичний містять один або більшу кількість додаткових вплив на лейкотрієн D4, є в продажі. Наприклад, 1замісників, вибраних із групи, яка включає галоген, [[[(1R-1-[3-[(1Е)-2-(7-хлор-2-хінолініл)етеніл]феніл]гідрокси-, оксо-, алкокси-, алкілтіо-, ациламіно-, 3-[2-(1-гідрокси-1фенільну, алкоксикарбонільну, аміно-, метилетил)феніл]пропіл]тіо]метил]циклопропаноцт моноалкіламіно-, діалкіламінота ова кислота [Montelukast ex. Merck; Bioorg. Med. гідроксикарбонільну групи, Chem. Lett. 1995, 5, 283], циклопентиловий ефір [3n, m та p незалежно дорівнюють 0, 1 або 2; [[2-метокси-4-[[[(2Υ означає необов'язково заміщений радикал, метилфеніл)сульфоніл]аміно]карбоніл]феніл]мети що вибраний із групи, яка включає алкіл, л]-1-метил-1Н-індол-5-іл]карбамінової кислоти циклоалкіл, арил, алкіл-циклоалкіл, циклоалкіл[Zafirlukast ex. AstraZeneca; J. Med. Chem. 1990, алкіл, арилалкіл, алкіларил, алкіл-циклоалкіл33, 1781] і N-[4-оксо-2-(1Н-тетразол-5-іл)-4Н-1алкіл, циклоалкіл-алкіл-циклоалкіл, алкіл-арилбензопіран-8-іл]-4-(4-фенілбутокси)бензамід алкіл та арил-алкіл-арил; [Pranlukast ex. Ono; J. Med. Chem. 1988, 31, 84]. Ζ означає тетразолільну групу, групу -COOR5, Згідно з винаходом в даний час виявлено, що групу -CONR5R5, групу NHSO2R5 або групу трициклічні похідні нової серії є активними CONHSO2R5, де R5 означає водень або антагоністами лейкотрієну D4 і тому придатні для необов'язково заміщену групу, що вибрана із лікування або попередження патологічних станів, групи, яка включає алкіл, арил, циклоалкіл, захворювань і порушень, для яких відомо, що їх гетероцикліл і гетероарил. протікання полегшується шляхом інгібування Для виключення невизначеності зазначимо, LTD4, таких як бронхіальна астма, алергічний та що орієнтація групи G2 є такою, що права сторона цілорічний алергічний риніт, хронічне обструктивне зображених фрагментів приєднана до хінолінового захворювання легенів, кропив'янка, атопічний фрагмента. Так, наприклад, якщо G2 означає -Одерматит, мігрень, вірусний бронхіоліт, викликаний СН2-, то атом С приєднаний до хінолінового РСВ, муковісцидоз, еозинофільний гастроентерит, фрагмента. Аналогічним чином, орієнтація групи фіброміалгія А та інтерстиціальний цистит. G1 є такою, що права сторона зображених Сполуки, які пропонуються в даному винаході, фрагментів приєднана до бензольного кільця. Так, також можна застосовувати в комбінації з іншими наприклад, якщо G1 означає -СН2-О-, то атом О лікарськими препаратами, для яких відомо, що приєднаний до бензольного кільця. вони ефективні при лікуванні цих захворювань. Крім того, якщо групи Υ містять більше одного Наприклад, у комбінації із триптанами або фрагмента, то орієнтація груп Υ є такою, що інгібіторами СОХ при лікуванні мігрені; з перший фрагмент, що зазначений в назві, антагоністами НІ при лікуванні алергійних приєднаний до атома S, а останній фрагмент, що захворювань, таких як риніт або кропив'янка; або з зазначений в назві, приєднаний до групи Ζ. Так, інгібіторами PDE IV при лікуванні алергійних наприклад, якщо Υ означає алкіл-циклоалкіл, то захворювань, астми або хронічного SYZ означає -S-алкіл-циклоалкіл-Z. обструктивного захворювання легенів. Деякі антагоністи LTD4, що мають трициклічну Відповідно, даний винахід стосується нових структуру ядра, такі як деякі дибенз[b,е]оксепіни, сполук формули (І) розкриті в [заявці на Європейський патент №0685478А1 або в заявці РСТ № WO 01/47889A1]. Іншими об'єктами даного винаходу є: а) спосіб одержання сполук формули (І), б) фармацевтичні композиції, що містять ефективну кількість зазначених сполук, в) застосування зазначених сполук при виготовленні лікарського препарату, що призначений для лікування захворювань, які піддаються лікуванню внаслідок антагонізму до рецепторів LTD4; і г) способи лікування або їх фармацевтично прийнятних солей, у захворювань, протікання яких полегшується якій: внаслідок антагонізму для LTD4 рецепторів, ці від 1 до 3 залишків з А1, А2, А3 та А4 означають способи включають введення сполук, які атоми азоту, а інші означають групи -CR1-; пропонуються у даному винаході, суб'єкту, що G1 означає групу, що вибрана із групи, яка потребує лікування. включає -СН2-О-, -СН2-СН2-, -СН=СН -, -CH2-S-, У контексті даного винаходу деякі атоми, N(С1-С4алкіл)-СН2; групи, фрагменти, ланцюги або цикли, що G2 означає групу, що вибрана із групи, яка містяться в загальних структурах, які включає -О-СН2-, -СН=СН-, -СН2-СН2-; пропонуються у даному винаході, є "необов'язково всі R1, R2, R3 та R4 є однаковими або різними заміщеними". Це означає, що ці атоми, групи, та вибрані із групи, яка включає атоми водню і фрагменти, ланцюги або цикли можуть бути галогену та гідрокси-, алкільну, алкенільну, незаміщеними або в будь-якому положенні містити алкінільну, алкокси-, алкілтіо-, аміно-, один або більшу кількість, наприклад, 1, 2, 3 або 4 моноалкіламіно-, діалкіламіно-, нітро-, ціано-, замісника, якщо атоми водню, зв'язані з ацилокси-, алкоксикарбонільну, незаміщеними атомами, групами, фрагментами, 9 80996 10 ланцюгами або циклами, заміщені на хімічно радикали, які містять оксигрупу, кожний з яких прийнятні атоми, групи, фрагменти, ланцюги або включає алкільний фрагмент, що містить від 1 до цикли. Якщо містяться два або більша кількість 10 атомів вуглецю. Більш кращими алкоксильними замісників, то всі замісники можуть бути радикалами є "нижчі алкоксильні" радикали, які однаковими або різними. містять від 1 до 8, краще - від 1 до 6 та більш Типовими прикладами замісника(-ків) є, але не краще - від 1 до 4 атомів вуглецю. обмежуються тільки ними, атоми галогенів, краще Алкоксигрупа звичайно є незаміщеною або - атоми фтору, гідроксигрупи й алкоксигрупи. Самі містить 1, 2 або 3 замісника, які можуть бути ж замісники звичайно є незаміщеними. однаковими або різними. Замісники переважно У контексті даного винаходу алкільною групою вибрані із групи, яка включає атоми галогену, може бути необов'язково заміщений лінійний або краще атоми фтору, гідроксигрупи й розгалужений алкіл, і звичайно - нижча алкільна алкоксигрупи, що містять від 1 до 4 атомів група. Нижча алкільна група містить від 1 до 8, вуглецю. краще - від 1 до 6 та більш краще - від 1 до 4 Кращі необов'язково заміщені алкоксильні атомів вуглецю. радикали включають метокси-, етокси-, нПриклади включають метальну, етильну, нпропокси-, ізопропокси-, н-бутокси-, втор-бутокси-, пропільну, ізопропільну, н-бутильну, втортрет-бутокси-, трифторметокси-, дифторметокси-, бутильну, трет-бутильну, н-пентальну, 1гідроксиметокси-, 2-гідроксіетоксита 2метилбутильну, 2-метилбутильну, ізопентильну, 1гідроксипропоксигрупи. етилпропільну, 1,1-диметилпропільну, 1,2У контексті даного винаходу термін диметилпропільну, н-гексильну, 1-етилбутильну, 2алкілтіогрупа включає радикали, які містять етилбутильну, 1,1-диметилбутильну, 1,2необов'язково заміщений лінійний або диметилбутильну, 1,3-диметилбутильну, 2,2розгалужений алкільний радикал, що містить від 1 диметилбутильну, 2,3-диметилбутильну, 2до 10 атомів вуглецю, які приєднані до метилпентильну, 3-метилпентильну та двовалентного атома сірки. Більш кращими ізогексильну групи. алкілтіоїльними радикалами є "нижчі алкілтіоїльні" Особливо краще, щоб така алкільна група радикали, які містять від 1 до 8, краще - від 1 до 6 була вибрана із групи, яка включає метальну, та більш краще - від 1 до 4 атомів вуглецю. етильну, н-пропільну, ізопропільну, н-бутильну, Алкілтіогрупа звичайно є незаміщеною або втор-бутильну, трет-бутильну, н-пентильну, 1містить 1, 2 або 3 замісника, які можуть бути метилбутильну, 1-етилпропільну, 1,2однаковими або різними. Замісники переважно диметилпропільну, н-гексильну та 1-етилбутильну вибрані із групи, яка включає атоми галогену, групи. краще атоми фтору, гідроксигрупи й Алкільна група звичайно є незаміщеною або алкоксигрупи, що містять від 1 до 4 атомів містить 1, 2 або 3 замісника, які можуть бути вуглецю. однаковими або різними. Замісники переважно Кращі необов'язково заміщені алкілтіоїльні вибрані із групи, яка включає атоми галогену, радикали включають метилтіо-, етилтіо-, нкраще - атоми фтору, гідрокси- та алкоксигрупи, пропілтіо-, ізопропілтіо-, н-бутилтіо-, втор-бутилтіощо містять від 1 до 4 атомів вуглецю. Кращими , трет-бутилтіо-, трифторметилтіо-, алкільними групами є незаміщені або заміщені 1,2 дифторметилтіо-, гідроксиметилтіо-, 2або 3 атомами фтору. гідроксіетилтіо- та 2-гідроксипропілтіогрупи. У контексті даного винаходу алкенільна група У контексті даного винаходу термін може бути лінійної або розгалуженої, моно- або моноалкіламіногрупа включає радикали, які поліненасиченою та звичайно вона є нижчою містять необов'язково заміщений лінійний або алкенільною групою. Нижча алкенільна група розгалужений алкільний радикал, який містить від містить від 2 до 8, краще - від 2 до 6, більш краще 1 до 10 атомів вуглецю, що приєднані до - від 2 до 4 атомів вуглецю. двовалентного радикала -NH-. Більш кращими Особливо бажано, щоб така алкенільна група моноалкіламіновими радикалами є "нижчі була вибрана із групи, яка включає 2-вініл, проп-1моноалкіламінові" радикали, які містять від 1 до 8, еніл, аліл, бут-1-еніл, бут-2-еніл, бут-3-еніл, 2краще - від 1 до 6 та більш краще - від 1 до 4 метилпроп-2-еніл, 2-метилпроп-1-еніл, 1-етилвініл, атомів вуглецю. 1-метилпроп-1-еніл, 1-метилпроп-2-еніл і бута-1,3Моноалкіламіногрупа звичайно містить дієніл. алкільну групу, що є незаміщеною або містить 1, 2 У контексті даного винаходу алкінільна група або 3 замісника, які можуть бути однаковими або може бути моно- або поліненасиченою, лінійною різними. Замісники переважно вибрані із групи, яка або розгалуженою, та звичайно вона є нижчою включає атоми галогену, краще - атоми фтору, алкінільною групою. Нижча алкінільна група гідроксигрупи й алкоксигрупи, що містять від 1 до 4 містить від 2 до 8, краще - від 2 до 6 та більш атомів вуглецю. краще - від 2 до 4 атомів вуглецю. Кращі необов'язково заміщені Особливо бажано, щоб така алкінільна група моноалкіламінові радикали включають була вибрана із групи, яка включає 1-пропініл, 2метиламіновий, етиламіновий, н-пропіламіновий, пропініл, 1-бутиніл, 2-бутиніл, 3-бутиніл та 1ізопропіламіновий, н-бутиламіновий, вторметил-2-пропініл. бутиламіновий, трет-бутиламіновий, У контексті даного винаходу термін трифторметиламіновий, дифторметиламіновий, алкоксигрупа (або алкілоксигрупа) включає гідроксиметиламіновий, 2-гідроксіетиламіновий та необов'язково заміщені лінійні або розгалужені 2-гідроксипропіламіновий радикали. 11 80996 12 У контексті даного винаходу термін пропіл)аміновий, діалкіламіногрупа включає радикали, які містять гідроксипропіл(ізопропіл)аміновий, нтривалентний атом азоту із приєднаними до нього бутил(гідроксипропіл)аміновий, втордвома необов'язково заміщеними лінійними або бутил(гідроксипропіл)аміновий, третрозгалуженими алкільними радикалами, що бутил(гідроксипротл)аміновий, містять від 1 до 10 атомів вуглецю. Більш кращими дифторметил(гідроксипропіл)аміновий, діалкіламіновими радикалами є "нижчі гідроксипропіл(трифторметил)аміновий радикали. діалкіламінові" радикали, які містять у кожному У контексті даного винаходу термін алкільному радикалі від 1 до 8, краще - від 1 до 6 алкоксикарбоніл включає необов'язково заміщені та більш краще - від 1 до 4 атомів вуглецю. лінійні або розгалужені радикали, кожний з яких Діалкіламіногрупа звичайно містить дві включає алкільний фрагмент, що містить від 1 до алкільні групи, кожна з яких є незаміщеною або 10 атомів вуглецю, які приєднані до містить 1, 2 або 3 замісника, які можуть бути оксикарбонільного радикалу. Більш кращими однаковими або різними. Замісники переважно алкоксикарбонільними радикалами є "нижчі вибрані із групи, яка включає атоми галогену, алкоксикарбонільні" радикали, які містять від 1 до краще атоми фтору, гідроксигрупи й 8, краще - від 1 до 6 та більш краще - від 1 до 4 алкоксигрупи, що містять від 1 до 4 атомів атомів вуглецю. вуглецю. Алкоксикарбонільна група звичайно є Кращі необов'язково заміщені діалкіламінові незаміщеною або містить 1, 2 або 3 замісника, які радикали включають диметиламіновий, можуть бути однаковими або різними. Замісники діетиламіновий, метил(етил)аміновий, ди(нпереважно вибрані із групи, яка включає атоми пропіл)аміновий, н-пропіл(метил)аміновий, нгалогену, краще - атоми фтору, гідроксигрупи й пропіл(етил)аміновий, ді(ізопропіл)аміновий, алкоксигрупи, що містять від 1 до 4 атомів ізопропіл(метил)аміновий, вуглецю. ізопропіл(етил)аміновий, ди(н-бутил)аміновий, нКращі необов'язково заміщені бутил(метил)аміновий, н-бутил(етил)аміновий, налкоксикарбонільні радикали включають бутил(ізопропіл)аміновий, ди(втор-бутил)аміновий, метоксикарбонільний, етоксикарбонільний, нвтор-бутил(метил)аміновий, вторпропоксикарбонільний, ізопропоксикарбонільний, бутил(етил)аміновий, втор-бутил(нн-бутоксикарбонільний, втор-бутоксикарбонільний, пропіл)аміновий, втор-бутил(ізопропіл)аміновий, трет-бутоксикарбонільний, ди(трет-бутил)аміновий, треттрифторметоксикарбонільний, бутил(метил)аміновий, трет-бутил(етил)аміновий, дифторметоксикарбонільний, трет-бутил(н-пропіл)аміновий, третгідроксиметоксикарбонільний, 2бутил(ізопропіл)аміновий, гідроксіетоксикарбонільний та 2трифторметил(метил)аміновий, гідроксипропоксикарбонільний радикали. трифторметил(етил)аміновий, трифторметил(нУ контексті даного винаходу термін ацил пропіл)аміновий, включає необов'язково заміщені лінійні або трифторметил(ізопропіл)аміновий, розгалужені радикали, які містять від 2 до 20 трифторметил(н-бутил)аміновий, атомів вуглецю або, краще - від 2 до 12 атомів трифторметил(втор-бутил)аміновий, вуглецю, що приєднані до карбонільного радикала. дифторметил(метил)аміновий, Більш кращими ацильними радикалами є "нижчі дифторметил(етил)аміновий, дифторметил(нацильні" радикали, які містять від 2 до 8, краще пропіл)аміновий, дифторметил(ізопропіл)аміновий, від 2 до 6 та більш краще - від 2 до 4 атомів дифторметил(н-бутил)аміновий, вуглецю. Таким чином, звичайно це радикал дифторметил(втор-бутил)аміновий, формули -COR. дифторметил(трет-бутил)аміновий, Ацильна група звичайно є незаміщеною або дифторметил(трифторметил)аміновий, містить 1, 2 або 3 замісника, які можуть бути гідроксиметил(метил)аміновий, однаковими або різними. Замісники переважно етил(гідроксиметил)аміновий, гідроксиметил(нвибрані із групи, яка включає атоми галогену, пропіл)аміновий, краще атоми фтору, гідроксигрупи й гідроксиметил(ізопропіл)аміновий, налкоксигрупи, що містять від 1 до 4 атомів бутил(гідроксиметил)аміновий, вторвуглецю. бутил(гідроксиметил)аміновий, третКращі необов'язково заміщені ацильні бутил(гідроксиметил)аміновий, радикали включають ацетильний, пропіонільний, дифторметил(гідроксиметил)аміновий, бутирильний, ізобутирильний, ізовалерильний, гідроксиметил(трифторметил)аміновий, триметилацетильний, валерильний, лаурильний, гідроксіетил(метил)аміновий, міристильний, стеарильний та пальмітильний етил(гідроксіетил)аміновий, гідроксіетил(нрадикали. пропіл)аміновий, гідроксіетил(ізопропіл)аміновий, У контексті даного винаходу термін циклоалкіл н-бутил(гідроксіетил)аміновий, вторвключає насичені карбоциклічні радикали й, якщо бутил(гідроксіетил)аміновий, третне зазначене інше, циклоалкільний радикал бутил(гідроксіетил)аміновий, звичайно містить від 3 до 7 атомів вуглецю. дифторметил(гідроксіетил)аміновий, Приклади включають циклопропіл, циклобутил, гідроксіетил(трифторметил)аміновий, циклопентил, циклогексил і циклогептил. Кращими гідроксипропіл(метил)аміновий, є циклопропіл, циклопентан і циклогексил. етил(гідроксипропіл)аміновий, гідроксипропіл(н 13 80996 14 Циклоалкільна група звичайно є незаміщеною Приклади гетероциклічних радикалів або містить 1, 2 або 3 замісника, які можуть бути включають піперидил, піролідил, піролініл, однаковими або різними. Замісники переважно піперазиніл, морфолініл, тіоморфолініл, піроліл, вибрані із групи, яка включає атоми галогену, піразолініл, піразолідиніл, хінуклідиніл, триазоліл, краще атоми фтору, гідроксигрупи й піразоліл, тетразоліл, хроманіл, ізохроманіл, алкоксигрупи, що містять від 1 до 4 атомів імідазолідиніл, імідазоліл, оксираніл, азаридиніл, вуглецю. Кращими карбоциклільними групами є 4,5-дигідрооксазоліл та 3-азатетрагідрофураніл. незаміщені. Приклади гетероциклічних груп включають У контексті даного винаходу арильна група піперидил, піролідил, піролініл, піперазиніл, або фрагмент звичайно являє собою С5морфолініл, тіоморфолініл, піроліл, піразолініл, С14арильну групу або фрагмент, що може бути піразолідиніл, хінуклідиніл, триазоліл, піразоліл, моноциклічним або поліциклічним, такий як феніл, тетразоліл, хроманіл, ізохроманіл, імідазолідиніл, нафтил, антраніл або фенантрил. Арильна група імідазоліл, оксираніл, азаридиніл, 4,5звичайно є незаміщеною або містить 1, 2 або 3 дигідрооксазоліл та 3-азатетрагідрофураніл. замісника, які можуть бути однаковими або Більш кращі приклади включають різними. Замісники переважно вибрані із групи, яка піперидинільну, піперазинільну, морфолінільну, включає атоми галогену, краще - атоми фтору, 4,5-дигідрооксазолільну, 3гідроксигрупи й алкоксигрупи, що містять від 1 до 4 азатетрагідрофуранільну, імідазолідинільну та атомів вуглецю. Кращими арильними групами є піролідинільну групи. незаміщені. Гетероциклільна група звичайно є У контексті даного винаходу гетероарильна незаміщеною або містить 1, 2 або 3 замісника, які група або фрагмент звичайно являє собою 5- - 10можуть бути однаковими або різними. Замісники членну циклічну систему, що включає не менше переважно вибрані із групи, яка включає атоми одного гетероароматичного циклу та містить не галогену, краще - атоми фтору, гідроксигрупи й менше одного гетероатома, що вибраний із групи, алкоксигрупи, що містять від 1 до 4 атомів яка включає О, S та N. Гетероарильна група може вуглецю. Кращими гетероциклільними групами є являти собою один цикл або два або більшу незаміщені. кількість конденсованих циклів, у яких не менше, У контексті даного винаходу атом галогену ніж один цикл містить гетероатом. звичайно являє собою атом хлору, фтору або Приклади включають піридильну, брому. піразинільну, піримідинільну, піридазинільну, Сполуки формули (І), що містять один або фурильну, оксадіазолільну, оксазолільну, більшу кількість хіральних центрів, можуть імідазолільну, тіазолільну, тіадіазолільну, застосовуватися в енантіомерно або тієнільну, піролільну, піридинільну, діастереоізомерно чистій формі або у формі бензотіазолільну, індолільну, індазолільну, суміші ізомерів. нуринільну, хінолільну, ізохінолільну, У контексті даного винаходу фармацевтично фталазинільну, нафтиридинільну, хіноксалінільну, прийнятна сіль - це сіль із фармацевтично хіназолінільну, хінолізинільну, цинолінільну, прийнятною кислотою або основою. триазолільну, індолізинільну, індолінільну, Фармацевтично прийнятні кислоти включають і ізоіндолінільну, ізоіндолільну, індолільну, неорганічні кислоти, наприклад, хлористоводневу, індазольну, нуринільну, імідазолідинільну, сірчану, фосфорну, дифосфорну, птеридинільну, піразолільну. Кращими є бромистоводневу, йодистоводневу й азотну оксадіазолільна, оксазолільна, піридинільна, кислоти, та органічні кислоти, наприклад, лимонну, піролільна, імідазолільна, тіазолільна, фумарову, малеїнову, яблучну, мигдальну, тіадіазолільна, фурильна, тієнільна, піразинільна аскорбінову, щавлеву, бурштинову, винокам'яну, та пиримідинільна групи. бензойну, оцтову, метансульфонову, Гетероарильна група звичайно є незаміщеною етансульфонову, бензолсульфонову та пабо містить 1, 2 або 3 замісника, які можуть бути толуолсульфонову кислоти. Фармацевтично однаковими або різними. Замісники переважно прийнятні основи включають гідроксиди лужних вибрані із групи, яка включає атоми галогену, металів (наприклад, натрію та калію) і краще атоми фтору, гідроксигрупи й лужноземельних металів (наприклад, кальцію та алкоксигрупи, що містять від 1 до 4 атомів магнію) і органічні основи, наприклад, алкіламіни, вуглецю. Кращими гетероарильними групами є арилалкіламіни та гетероциклічні аміни. незаміщені. Всі R1, R2, R3 та R4 звичайно є незаміщеними У контексті даного винаходу гетероциклільна або містять 1, 2 або 3 замісника, які можуть бути група звичайно являє собою неароматичне однаковими або різними. Звичайно, якщо в групі насичене або ненасичене С3-С10циклоалкільне R1, R2, R3 або R4 є два або більша кількість кільце, таке як 5-, 6- або 7-членне кільце, у якому замісників, то не більше, ніж один із цих замісників один або більша кількість, наприклад, 1, 2, 3 або 4 є фенільною групою. Кращими замісниками для атомів вуглецю, краще - 1 або 2 атомів вуглецю R1, R2, R3 та R4 є атоми галогенів, переважно замінені на гетероатом, що вибраний із групи, яка фтор, гідроксигрупи й алкоксигрупи, що містять від включає Ν, Ο та S. Кращими є насичені 1 до 4 атомів вуглецю. Більш краще, якщо R1, R2, гетероциклільні групи. Гетероциклічна група може R3 та R4 є незаміщеними. являти собою один цикл або два або більшу R1 звичайно означає водень або атом кількість конденсованих циклів, у яких не менше, галогену, або алкільну групу, що містить від 1 до 4 ніж один цикл містить гетероатом. атомів вуглецю. Бажано, якщо R1 означає атом 15 80996 16 Звичайно n дорівнює 0 або 1, бажано - 0. R3 водню, атом галогену, краще - атом фтору або бажано означає атом галогену або алкільну групу, хлору, або метальну групу. що містить від 1 до 4 атомів вуглецю. Більш Відповідно до одного конкретного варіанта краще, якщо R3 означає метил, фтор або хлор. виконання даного винаходу в сполуках формули Якщо містяться дві або більша кількість груп R3, то (І): всі R3 є однаковими або різними. - від 1 до 3 залишків із А1, А2, А3 та А4 Відповідно до іншого варіанта виконання означають атоми азоту, а інші означають групи даного винаходу в сполуках формули (І) ρ CR1; дорівнює 0, 1 або 2, краще - 2. Звичайно всі R4 - G1 означає групу, що вибрана із групи, яка означають атом галогену або алкільну групу, що включає -СН2-О-, -СН2-СН2-, -CH2-S-, -N(C1містить від 1 до 4 атомів вуглецю. Більш краще, C4алкіл)-CH2; якщо всі R4 означають атом галогену, найкраще - G2 означає групу, що вибрана із групи, яка якщо вони вибрані із групи, яка включає F та СІ. включає -О-СН2-, -СН=СН-, -СН2-СН2-; Якщо містяться дві або більша кількість груп R4, то - всі R1, R2, R3 та R4 є однаковими або різними всі R4 є однаковими або різними. та вибрані із групи, яка включає атоми водню, Згідно ще з одним варіантом виконання даного галогену та гідрокси-, алкільну, алкенільну, винаходу в сполуках формули (І) Υ означає групу, алкінільну, алкокси-, алкілтіо-, аміно-, що вибрана із групи, яка включає алкіл, алкілмоноалкіламіно-, діалкіламіно-, нітро-, ціано-, циклоалкіл-алкіл й алкіларил, зазначені групи ацилокси-, алкоксикарбонільну, необов'язково можуть містити один або більшу гідроксикарбонільну й ациламіногрупи, кількість замісників, вибраних із групи, яка включає вуглеводневі ланцюги цих груп необов'язково галогени, гідрокси-, алкокси-, аміногрупу, алкіл і містять один або більшу кількість додаткових галогеналкіл. Звичайно зазначені фрагменти Υ є замісників, вибраних із групи, яка включає галоген, незаміщеними або містять 1, 2 або 3 замісника, які гідрокси-, оксо-, алкокси-, алкілтіо-, ациламіно-, можуть бути однаковими або різними. Замісники фенільну, алкоксикарбонільну, аміно-, бажано вибрані із групи, яка включає атоми моноалкіламіно-, діалкіламінота галогенів, гідрокси- і аміногрупи та С1гідроксикарбонільну групи; С4алкоксильні, С1-С4алкільні та С1- n, m та p незалежно дорівнюють 0, 1 або 2; С4галогеналкільні групи. Краще, якщо Υ є - Υ означає необов'язково заміщений радикал,незаміщеним або містить як замісники одну або що вибраний із групи, яка включає алкіл, більшу кількість алкільних груп, що містять від 1 до циклоалкіл, арил, алкіл-циклоалкіл, циклоалкіл4 атомів вуглецю, більш краще, якщо Υ означає алкіл, арилалкіл, алкіларил, алкіл-циклоалкілнезаміщений радикал. алкіл, циклоалкіл-алкіл-циклоалкіл, алкіл-арилЗвичайно Υ означає незаміщену алкільну алкіл та арил-алкіл-арил; групу, що містить від 1 до 4 атомів вуглецю, - Ζ означає тетразолільну групу, групу бензильну групу або метилциклопропілметильну COOR5, групу -CONR5R5, групу NHSO2R5 або групу групу. Найкраще, якщо Υ означає групу, що -CONHSO2R5, де R5 означає водень або вибрана із групи, яка включає -СН2СН2- та 2необов'язково заміщену групу, що вибрана із циклопропілпропіл. групи, яка включає алкіл, арил, циклоалкіл, R5 звичайно є незаміщеним або містить 1, 2 гетероцикліл і гетероарил. або 3 замісника, які можуть бути однаковими або Відповідно до одного варіанта виконання різними. Замісники переважно вибрані з групи, яка даного винаходу в сполуках формули (І) один з А1, включає атоми галогену, краще - атоми фтору, А2, А3 та А4 означає атом азоту, а інші означають гідроксигрупи й алкоксигрупи, що містять від 1 до 4 групи -CR1-. атомів вуглецю. Найкращими замісниками є атоми Більш краще, якщо А1 означає атом азоту та фтору. R5 бажано є незаміщеним або містить як А2, А3 і А4 означають групи -CR1-. Ще більш краще, замісники 1, 2 або 3 атома галогену, краще - 1, 2 якщо R1 означає атом водню. або 3 атома фтору. Також кращими є сполуки формули (І), у якій R5 переважно означає атом водню або А4 означає атом азоту та А1, А2 і А3 означають незаміщену або заміщену алкільну групу, що групи -CR1-. Ще більш краще, якщо R1 означає містить від 1 до 4 атомів вуглецю. Найбільш атом водню. кращими групами R5 є водень, метил, етил і Якщо містяться дві або більша кількість груп трифторметил. Якщо містяться дві або більша R1, то всі R1 є однаковими або різними. кількість груп R5, то всі R5 можуть бути однаковими Відповідно до іншого варіанта виконання або різними. даного винаходу в сполуках формули (І) G1 Ζ звичайно означає тетразолільну групу, групу означає групу -СН2О-. -COOR5, групу -CONR5R5 або групу -NHSO2R5, де Згідно ще з одним варіантом виконання даного R5 є таким, як визначено вище. Краще, якщо Ζ винаходу в сполуках формули (І) G2 вибраний із означає тетразолільну групу, групу -СООН, групу групи, яка включає -ОСН2- та -СН=СН-. СООМе, групу -COOEt, групу -CONH2 або групуЗвичайно m дорівнює 0 або 1, а краще, якщо NHSО2СF3· дорівнює 0. R2 бажано означає атом галогену або Конкретні індивідуальні сполуки, які алкільну групу, що містить від 1 до 4 атомів пропонуються в даному винаході, включають: вуглецю. Більш краще, якщо R2 означає метил, 3-{(7-[(6,7-дифторхінолін-2-іл)метокси]-5,11фтор або хлор. Якщо містяться дві або більша дигідро[1]бензоксепіно[3,4-b]піридин-5кількість груп R2, то всі R2 є однаковими або іл)тіо}пропанову кислоту, різними. 17 80996 18 {(7-[(6,7-дифторхінолін-2-іл)метокси]-5,113-[9-хлор-7-(6,7-дифторхінолін-2-ілметокси)дигідро[1]бензоксепіно[3,4-b]піридин-55,11-дигідро[1]бензоксепіно[3,4-b]піридин-5іл)тіо}оцтову кислоту, іл)тіо]пропанову кислоту, {(7-[(7-хлор-6-фторхінолін-2-іл)метокси]-5,11етил-3-[7-(6,7-дифторхінолін-2-ілметокси)дигідро[1]бензоксепіно[3,4-b]піридин-55,11-дигідро[1]бензоксепіно[3,4-b]піридин-5іл)тіо}оцтову кислоту, іл)тіо]пропаноат, 3-{(7-[(7-хлор-6-фторхінолін-2-іл)метокси]-5,113-[7-(6,7-дифторхінолін-2-ілметокси)-5,11дигідро[1]бензоксепіно[3,4-b]піридин-5дигідро[1]бензоксепіно[3,4-b]піридин-5іл)тіо}пропанову кислоту, іл)тіо]пропанамід, [{(7-[(6,7-дифторхінолін-2-іл)метокси]-5,113-[7-(6,7-дифторхінолін-2-ілметокси)-2-метилдигідро[1]бензоксепіно[3,4-b]піридин-55,11-дигідро[1]бензоксепіно[3,4-b]піридин-5іл)тіо}метил]бензойну кислоту, іл)тіо]пропанову кислоту, [{(7-[(7-хлор-6-фторхінолін-2-іл)метокси]-5,113-[7-(6,7-дифторхінолін-2-ілметокси)-9-фтордигідро[1]бензоксепіно[3,4-b]піридин-55,11-дигідро[1]бензоксешно[3,4-b]піридин-5іл)тіо}метил]бензойну кислоту, іл)тіо]пропанову кислоту, 1-{[(7-[(6,7-дифторхінолін-2-іл)метокси]-5,113-[7-(6,7-дифторхінолін-2-ілметокси)-9-метилдигідро[1]бензоксепіно[3,4-b]піридин-55,11-дигідро[1]бензоксепіно[3,4-b]піридин-5іл)тіо]метил} циклопропілоцтову кислоту, іл)тіо]пропанову кислоту, 3-{(7-[(6,7-дифторхінолін-2-іл)метокси]-5,113-{(7-[(Е)-2-(6,7-Дифторхінолін-2-іл)вініл]-5,11дигідро[1]бензоксепіно[3,4-b]піридин-5-іл)тіо}-2,2дигідро[1]бензоксепіно[3,4-b]піридин-5диметилпропанову кислоту, іл)тіо}пропанамід, 3-{(7-[(6,7-дифторхінолін-2-іл)метокси]-5,11етил-3-{(7-[(Е)-2-(6,7-дифторхінолін-2-іл)вініл]дигідро[1]бензоксепіно[3,4-b]піридин-5-іл)тіо}-35,11-дигідро[1]бензоксепіно[3,4-b]піридин-5метилбутанову кислоту, іл)тіо}пропаноат 3-{(7-[(Е)-2-(6,7-дифторхінолін-2-іл)вініл]-5,11та їх фармацевтично прийнятні солі. дигідро[1]бензоксепіно[3,4-b]піридин-5Іншим об'єктом даного винаходу є спосіб іл)тіо}пропанову кислоту, синтезу для одержання сполук формули (І), що 1-{[(7-[(Е)-2-(6,7-дифторхінолін-2-іл)вініл]-5,11представлений на схемі 1 і включає синтез дигідро[1]бензоксепіно[3,4-b]піридин-5продуктів, які пропонуються у даному винаході, іл)тіо]метил}циклопропілоцтову кислоту, через проміжний спирт формули (III), що вводять у {(7-[(Е)-2-(6,7-дифторхінолін-2-іл)вініл]-5,11реакцію з меркаптановою сполукою й одержують дигідро[1]бензоксепіно[3,4-b]піридин-5продукти формули (І)· іл)тіо}оцтову кислоту, Ще одним об'єктом даного винаходу є 7-[(Е)-2-(6,7-дифторхінолін-2-іл)вініл]-5-{[2-(1Нпроміжні сполуки (III), придатні для синтезу сполук тетразол-5-іл)етил]тіо}-5,11формули (І). дигідро[1]бензоксепіно[3,4-b]піридин, 1,1,1-трифтор-Н-[2-({7-[(Е)-2-(6,7дифторхінолін-2-іл)вініл]-5,11дигідро[1]бензоксепіно[3,4-b]піридин-5іл)тіо)етил]метансульфонамід, 1,1,1-трифтор-Ν-[2-({7-[(6,7-дифторхінолін-2іл)метокси]-5,11-дигідро[1]бензоксепіно[3,4b]піридин-5-іл)тіо)етил]метансульфонамід, 3-{(9-[(Е)-2-(6,7-дифторхінолін-2-іл)вініл]-5,11дигідро[1]бензоксепіно[4,3-b]піридин-11іл)тіо}пропанову кислоту, 3-{(9-[(6,7-дифторхінолін-2-іл)метокси]-5,11дигідро[1]бензоксепіно[4,3-b]піридин-11іл)тіо}пропанову кислоту, 1-{[(9-[(6,7-дифторхінолін-2-іл)метокси]-5,11дигідро[1]бензоксепіно[4,3-b]піридин-11іл)тіо]метил}циклопропілоцтову кислоту, 7-[(6,7-дифторхінолін-2-іл)метокси]-5-{[2-(1Нтетразол-5-іл)метил]тіо}-5,11дигідро[1]бензоксепіно[3,4-b]піридин, 7-[(6,7-дифторхінолін-2-іл)метокси]-5-{[2-(1Нтетразол-5-іл)етил]тіо}-5,11Конкретне виконання загального способу, що дигідро[1]бензоксепіно[3,4-b]піридин, представлений на схемі 1, наведено на схемах 23-[7-(6,7-дифторхінолін-2-ілметокси)-11-метил5, на яких описаний синтез сполук, що 10,11-дигідро-5Н-бензо[е]піридо[2,3-b]азепін-5пропонуються у даному винаході. Якщо Ζ=COOR5 ілсульфаніл]-пропіонову кислоту, або CONR5R5, то сполуки (II) можна одержати 3-[7-(7-хлор-6-фторхінолін-2-ілметокси)-11відповідно до схеми 2 або 12; якщо Ζ=5метил-10,11-дигідро-5Н-бензо[е]піридо[2,3тетразоліл, то шлях одержання сполук (V) b]азепін-5-ілсульфаніл]-пропіонову кислоту, представлений на схемі 3. У випадку, якщо Ζ=NHSO2R5 або CONHSO2R5 шлях синтезу сполук 19 80996 (VII) і (IX) представлено на схемах 4 та 5 відповідно. Схема реакції 2 За схемою 2 сполуки (II) можна синтезувати зі спиртів (III) через трифторацетати (одержані in situ за допомогою трифтороцтової кислоти або ангідриду) або хлориди (одержані за допомогою тіонілхлориду). Ця реакція проводиться при температурі від 0 до 70° С в органічному розчиннику, краще - галогенованому, а більш краще - в дихлорметані. Продукт (II) одержують у вигляді складного ефіру (R5лкіл ), якщо а = застосовується складний меркаптоефір, або у вигляді карбонової кислоти (R5 ), якщо Η = застосовується меркаптокарбонова кислота. Якщо необхідно гідролізовати складні ефіри (II) з R5=алкіл, у відповідні кислоти (II) з R=Н, то краще це можна виконати в лужному середовищі (тобто із застосуванням гідроксидів лужних металів) у системі органічний розчинник/вода при температурі від 10 до 70°С. З органічних розчинників кращими є ТГФ (тетрагідрофуран), діоксан й алканоли. Сполуки, у яких Ζ означає -CONR5R5, можна одержати, перетворюючи відповідну кислоту в ацилхлорид згідно з відомими методиками з наступною реакцією ацилхлориду з аміном. Наприклад, їх можна одержати реакцією аміну NHR5R5 з ацилхлоридом, що одержаний з відповідної кислоти (II). Схема реакції 3 20 На схемі 3 представлені два альтернативних способи одержання тетразолільних похідних. У першому способі (показаний на лівій стороні схеми) нітрили (IV) одержують зі спиртів (III) способом, який є дуже подібний до описаного для складних ефірів (II), але із застосуванням меркаптонітрилів замість відповідних складних меркаптоефіров. Тетразоли (V) одержують із нітрилів (IV) з використанням азидів, таких як азид лужного металу або оловоорганічний азид, з необов'язковим додаванням кислотної сполуки, такої як кислота Льюїса, або солі амонію. Цю реакцію можна провести з використанням або без використання розчинника при температурі від 25 до 150°С. В альтернативному способі (показаний праворуч на схемі) тетразолільні сполуки (V) одержують в одну стадію зі спиртів (III) реакцією з тетразолілмеркаптанами при умовах, які є дуже подібними до описаних для стадії, що приводить від сполук (III) до сполук (IV). Схема реакції 4 21 Згідно з методикою, що представлена на схемі 4, аміни (VI) одержують способом, який є дуже подібний до описаного для складних ефірів (II) або нітрилів (IV), але із застосуванням меркаптоамінгідрохлориду замість відповідних складних меркаптоефіров або меркаптонітрилів. Сульфонаміди (VII) можна синтезувати з аміну (VI), який одержаний на попередній стадії, прямим ацилюванням сульфонілгалогенідом або ангідридом у присутності речовини, яка зв'язує кислоту, такої як третинний амін. Ця реакція проводиться в інертному розчиннику, такому як ТГФ, ДМФ (диметилформамід) або Сl2СН2, при температурі від 0 до 100°С. Схема реакції 5 80996 22 Згідно з методикою, що представлена на схемі 5, карбонові кислоти (II) спочатку перетворюють в активовану форму (VIII), таку як ацилгалогенід або імідазолід. Потім цей проміжний продукт вводять у реакцію із сульфонамідом у лужному середовищі й одержують ацилсульфонамід (IX). У наведених вище шляхах синтезу сполук (І), які пропонуються у даному винаході, як вихідна речовина використовується спирт формули (III). Спирти формули (III) можна синтезувати за допомогою цілого ряду альтернативних методик. Альтернативні шляхи синтезу спиртів (III) включають стадію, на якій спирти одержують відновленням відповідних кетонів (X) шляхом відновлення згідно з відомими методиками, такими як обробка борогідридом натрію в нижчих спиртах або їх сумішах із ТГФ при температурах від 0 до 25°С. Залежно від природи групи G2 для одержання кетонів (X) можна використати цілий ряд шляхів. Можна використати схеми 6 та 7, якщо G2 означає -О-СН2, можна використати схему 8, якщо G2 означає -СН2-СН2або -СНН -, С = можна використати схему 9, якщо G2 означає -СН=СН- і, нарешті, можна використати схему 10, якщо G1 та G2 означають -СН2-СН2-. Схема реакції 6 23 Можна використати схему 6, якщо G2 означає -О-СН2. У цьому випадку кетони (X) можна одержати алкілуванням відповідних фенолів (XI) 2галогенметилхінолінами, які одержують галогенуванням відповідно до опису в роботі [J. Med. Chem. (1992), 35, 3822-3844]. Реакцію алкілування фенолів (XI) з одержанням сполук (X) проводять у присутності карбонату лужного металу, такого як карбонат калію або цезію, або, альтернативно, шляхом попереднього одержання солі фенолу за допомогою алкоксиду металу, гідриду натрію або іншого лужного реагенту. Цю реакцію можна провести в різних розчинниках, таких як ДМФ, аліфатичні кетони й т.п. у діапазоні температур від 0 до 100°С. Феноли (XI) одержують із відповідних метоксипохідних (XII) згідно з відомими методиками, такими як обробка кислотами Льюїса, такими як трифторид бору, або протонними кислотами, такими як бромистоводнева кислота, як це представлено на схемі 7а, або згідно з шляхом синтезу, що представлений на схемі 76. Схема реакції 7а Реакцію деметилювання з перетворенням (XII) в (XI), яка представлена на схемі 7, можна провести в галогенованому розчиннику в діапазоні температур від -60 до 30°С (з використанням 80996 24 кислот Льюїса) або, з використанням бромистоводневої кислоти при 100-150°С. Метоксипохідні (XII) одержують згідно з методиками, які описані в літературі; наприклад, у роботах [Synthesis, 1997(1), 113-116; J. Med. Chem., 1995, 38 (3), 496-507; DD 80449 (CA 76, 85803); Arzneim.-Forsch. (1972), 22(1), 133-7]. Схема реакції 76 За цією схемою синтезу сполуку (XXV) [яку можна одержати відповідно до DD 80449; СА 76:85803] нітрують із одержанням відповідної нітропохідної (XXVI) за допомогою нітруючого реагенту, наприклад, нітрату лужного металу в середовищі сірчаної кислоти при температурі від 20 до 25°С. Потім нітропохідну (XXVI) відновлюють до аміну (XXVII), наприклад, за допомогою хлориду олова (II) в оцтовій кислоті в діапазоні температур від 30 до 120°С. Амін (XXVII) перетворюють у фенол (XI) через відповідну діазонієву сіль, що одержують обробкою аміну в кислому середовищі, наприклад, в оцтовій кислоті, нітритом натрію при температурах від 5 до 40°С. Розкладання діазонієвої солі проводять in situ звичайно при кип'ятінні зі зворотним холодильником. Схема реакції 8 25 Синтез (X), у якому G2 не означає -О-СН2- та G1 означає -СН2-О-або -CH2-S-, здійснюють шляхом циклізації сполуки (XIII), як це показано на стадії 3 схеми синтезу 8. Сполуки (XIII) синтезують реакцією фенолу або тіофенолу (XIV) з бензилгалогенідом (XV), як це показано на стадії 2 схеми 8. Феноли або тіофеноли (XIV), у свою чергу, одержують із відповідних хінальдинів реакцією з 4-гідроксибензальдегідом (XIX) (де G2 означає С-СН = Н -) або з 4бензилоксибензилхлоридом (XX) з наступним дебензилюванням (де G2 означає -СН2-СН2-), що представлено на стадії 1 схеми 8. Хінальдини (XVI), у свою чергу, одержують відповідно до роботи [[J. Heterocycl. Chem (1993), 301(1), 17-21]. На схемі 8 стадію, що включає конденсацію хінальдинів (XVI) з п-метоксибензальдегідом (XIX), проводять у ксилолі з оптовим ангідридом як конденсуючий реагент у діапазоні температур від 100 до 200°С і потім проводять лужний гідроліз фенілацетату, що утворився. Реакцію між хінальдинами (XVI) і пбензилоксибензилхлоридом (XX) проводять у присутностісильної основи, такої, як діізопропіламід літію, та звичайно її проводять в ТГФ як розчинник у діапазоні температур від -60 до 50°С. 80996 26 Наступна реакція включає алкілування фенолів або тіофенолів (XIV) бензилбромідами (XV) та її проводять у присутності карбонату лужного металу, такого як карбонат калію або цезію, або шляхом попереднього одержання солі фенолу за допомогою алкоксиду металу, гідриду натрію або іншого лужного реагенту. Цю реакцію можна провести в різних розчинниках, таких як ДМФ, аліфатичні кетони й т.п., у діапазоні температур від 0 до 100°С. Циклізацію похідних кислот (XIII) у кетони (X) також можна провести різними способами, наприклад, спочатку одержуючи активний ангідрид за допомогою трифтороцтового ангідриду, а потім оброблюючи його кислотою Льюїса, такою як трифторид бору, або шляхом безпосередньої обробки конденсуючим реагентом, таким як поліфосфорна кислота. Реакцію проводять в галогенованих розчинниках або без розчинника в діапазоні температур від 50 до 150°С. Схема реакції 9 Синтез (III) або (X), якщо G2 означає -СН=СН-, також можна провести за допомогою реакції сполучення відповідної галогенідної або трифторметансульфонільної (трифлат) похідної (XVII) з 2-вінілхіноліном (XVIII), як це представлено на схемі 9. Реакцію сполучення, представлену на схемі 9, проводять із бромпохідними, які можна одержати згідно з наведеним у літературі методикам, таким як описані в [WO 89/10369, J. Heterocycl. Chem. (1986), 23, 257 або J. Med. Chem. (1995), 38, 496], або з використанням трифторметансульфонільних похідних, які можна одержати з фенольних похідних (XI). Реакція сполучення каталізуєтся солями паладію та триарилфосфінами та проводиться в інертному розчиннику, такому як диметилформамід, ТГФ або діоксан, при температурі від 25 до 200°С. Схема реакції 10 27 Синтез (X), у якому G1 та G2 означають -СН2СН2-, проводять за допомогою циклізації сполуки (XXIV), як це представлено на стадії 3 схеми синтезу 10. Сполуки (XXIV) синтезують реакцією альдегіду (XXII) з о-метил(аза)бензоатом (XXIII), як це представлено на стадії 2 схеми 10. Альдегіди (XXII), у свою чергу, одержують із відповідних хінальдинів (XVI) реакцією з охлорметилбензальдегідами (XXI), як це представлено на стадії 1 схеми 10. Хінальдини (XVI), у свою чергу, одержують відповідно до роботи [J. Heterocycl. Chem (1993), 301(1), 17-21]. На схемі 10 стадію, що включає конденсацію хінальдинів (XVI) з о-хлорметилбензальдегідами (XXI), проводять у присутності сильної основи, такої як діізопропіламід літію, та звичайно її проводять у ТГФ як розчинник у діапазоні температур від -60 до 50°С. Наступна реакція включає конденсацію альдегідів (XXII) із о-метил(аза)бензоатом (XXIII) і проводиться в присутності оцтового ангідриду в діапазоні температур від 100 до 200°С, звичайно при кип'ятінні зі зворотним холодильником. Циклізацію похідних кислот (XXIV) в кетони (X) також можна провести різними шляхами, наприклад, спочатку одержуючи активний ангідрид за допомогою трифтороцтового ангідриду, а потім 80996 28 обробляючи його кислотою Льюїса, такою як трифторид бору, або шляхом безпосередньої обробки конденсуючим реагентом, таким як поліфосфорна кислота. Реакцію проводять у галогенованих розчинниках або без розчинника в діапазоні температур від 50 до 150°С. Схема реакції 11 Синтез (X), де G2 означає -СН2-СН2- та G1 означає -NR-CH2-, проводять шляхом, що представлений на схемі 11. Альдегіди (XXVIII) одержують відповідно до роботи [J. Med. Chem., 1992, 35(21), 3832]. Ці альдегіди перетворюють в аміни (XXIX) за допомогою відновлювального алкілування в спиртовому середовищі (звичайно в метанолі або етанолі) з використанням борогідриду натрію як відновлювальний реагент у діапазоні температур від 5 до 30°С. Реакція амінів (XXIX) із хлорованими карбоновими кислотами (XXX) у висококиплячому розчиннику, такому як хлорбензол, у діапазоні температур від 100 до 140°С приводить до проміжних карбонових кислот (XXXI). Карбонові кислоти (XXXI) вводять у реакцію з хлоруючим реагентом, таким як тіонілхлорид або оксалілхлорид, при наявності або відсутності розчинника (звичайно хлорованого розчинника) у діапазоні температур від 10 до 50°С й одержують відповідні ацилхлориди (XXXII). 29 80996 30 Нарешті, ацилхлориди (XXXII) циклізують у Приклад шляху синтезу для випадку, якщо кетони (X) з використанням кислоти Льюїса як Ζ=COOR5, представлений на схемі 12. У цьому каталізатор, у звичайному розчиннику для реакції випадку дезамінування можна виконати шляхом Фриделя-Крафтса, такому як сірковуглець або безпосереднього дезамінування аміногрупи за хлорований розчинник, у діапазоні температур від допомогою гідроксиламін-О-сульфонової кислоти у 0 до 50°С. водному лужному середовищі, як це описано в [J. Схема реакції 12 Am. Chem. Soc. 1978, 341-2], або за допомогою Схема 12 йодиду самарію (II), як це описано в [Chem. Як вже було відзначено, сполуки, які Commun. 1999, 1065-6]. Дезамінування також пропонуються в даному винаході, можуть існувати можна виконати шляхом відновлення відповідної у двох енантіомерних формах. Способи, що діазопохідної за допомогою йодистоводневої описані на схемах 2-4, можна модифікувати так, кислоти [J. Am. Chem. Soc. 1943, 65, 1516; J. щоб виконати синтез енантіомерних форм. Chem. Soc. 1954, 3617] або трибутилоловогідриду Модифікація полягає у тому, що меркаптан, що [Tetrahedron 2000, 56(38), 7457-7461; Bull. Korean має хіральний центр, використовують для Chem. Soc. 1993, 14(6), 664-5]. Інша стратегія тіоетерифікації гідроксильної групи трициклічних полягає у відновленні діазопохідної у відповідний спиртів (III). Сполуки, що містять хіральний центр, гідразон за допомогою борогідриду натрію в мають загальну формулу (XXXV) органічному розчиннику, краще - ТГФ, і наступному відновленні метилену шляхом обробки основою, краще - вторинним аміном, таким як ДБУ (1,8діазабіцикло[5.4.0]ундец-7-ен) або Nметилморфолін. Діазапохідну одержують із відповідного аміну (XXXIII) шляхом обробки алкілнітритом, краще - ізоамілнітритом, в інертному розчиннику, краще - хлороформі або дихлорметані, та в присутності органічної кислоти, у якій Υ' означає радикал, що визначений під краще - оцтової кислоти, як це описано в позначенням Υ, у якому один атом водню, що [Tetrahedron Lett. 1971, 47, 4495-8]. приєднаний до одного з атомів вуглецю, Альтернативно, амінопохідні (XXXIII) можна заміщений на аміногрупу з одержанням сполуки, перетворити у відповідні ізонітрили через що має специфічну стереохімію за атомом формаміди за допомогою оксихлориду фосфору вуглецю, у якого заміщений атом водню. або дифосгену [J. Chem. Research 1982, 79-80; J. Застосування сполуки (XXXV), яка має хіральний Org. Chem. 1972 (37/2), 187-190] і потім відновити центр, дозволяє одержати сполуки (II), (V), (VII), трибутилоловогідридом, як це описано в [Synthesis (IX), яка містить два хіральні центри: один на атомі 1980, 68-70]. вуглецю трициклічної кільцевої системи, до якого приєднаний атом сірки, та інший на хіральному атомі вуглецю радикала Υ', як це представлено нижче: Одночасна наявність цих двох хіральних центрів приводить до утворення чотирьох різних діастереоізомерів, які можна розділити звичайними фізичними способами, такими як кристалізація або хроматографія. Після розділення аміногрупу видаляють шляхом дезамінування за допомогою методик, відомих у даній галузі техніки. Це дає хіральні сполуки: 31 80996 32 буфера, гомогенізували за допомогою Potter (1100обертів/хв) і проводили заключну стадію центрифугування впродовж 30хв при 40000´g при 4°С. Цю таблетку мембран остаточно повторно суспендували в 10 об'ємах 10мМ TRIS та 10мМ PIPES (1,4-піперазинбіс(етансульфокислота)) рН 7,4 і гомогенізували за допомогою Potter (1100обертів/хв). Концентрацію білка визначали згідно з методикою BRADFORD з використанням набору для аналізу білків Bio-Rad із БСА (бичачий сироватковий альбумін) як стандарт. Аліквоти білка зберігали замороженими при -80°С. Аналіз радіолігандного зв'язування [3H]LTD4 (136,9Ки/ммоль) одержували від фірми NEN. Аналізи проводили в кінцевому об'ємі, що дорівнює 250мкл 10мМ PIPES рН 7,5, який містить 10мМ СаСl2, 10мМ MgCl2, 50мМ NaCl, 2мМ Lцистеїну, 2мМ гліцину та 300пМ [3H]LTD4. Суміш для аналізу також містила 200мкг білка мембрани легенів/лунка планшета. Неспецифічне зв'язування визначали в присутності зафірлукаста 10мкм. Аналізи проводили безпосередньо в планшетах Millipore Multiscreen GF/B, попередньо змочених буфером для аналізу в кількості 200мкл/лунка при кімнатній температурі. Інкубацію проводили впродовж 30хв при кімнатній температурі при безперервному струшуванні. Розділення зв'язаного та вільного [3H]LTD4 проводили фільтруванням через планшети, які потім тричі промивали за допомогою 175мкл L-Цистеїнільну похідну (XXXIII) одержують із промивного розчину, що включає 10мМ TRIS, який спиртів (III) і гідрохлориду етилового ефіру Lмістить 100мМ NaCl, при 4°С. Планшети сушили й цистеїну в кислому середовищі. Ця реакція проводили підрахунки в рідинному проводиться в умовах, які є дуже подібними до сцинтиляційному лічильнику TRILUX Microbeta описаних для схеми синтезу 1 (за допомогою фірми Wallac. трифтороцтової кислоти або ангідриду або Специфічне зв'язування звичайно становило відповідної хлорпохідної). Відповідні 80-90% від повного зв'язування. діастереоізомери сполуки (XXXIII) розділяють за Результати наведені в таблиці І. допомогою кристалізації в різних розчинниках різного діапазону полярності або за допомогою Таблиця І хроматографії на колонці з силікагелем. Дезамінування обох ізомерів (XXXIII) в Приклад ІС50 нМ енантіомери (XXXIV) проводиться за будь-яким з 1 0,38 альтернативних шляхів, які описані вище. 3 0,27 Фармакологічна активність 4 0,28 Методика зв'язування CysLT1/LTD4 7 0,14 (приготування мембран легенів морських свинок) 8 0,50 Морських свинок умертвляли та витягували 9 0,59 тканини легенів. Сполучну тканину, трахею, великі 11 0,27 кровоносні судини й великі бронхи видаляли й 12 0,35 тканину, що залишилася, в основному паренхіму, 18 0,33 гомогенізували в 20 об'ємах 10мМ TRIS 23 0,34 (трис(гідроксиметиламіно)метан) рН 7,4, що містить 0,25Μ сахарози, 0,25мМ 24 0,60 фенілметилсульфоніл фториду, 155мкг/мл 25 0,67 бензолкарбоксіміду, 5мкг/мл соєвого інгібітору 28 2,00 тріпсину та 100мкг/мл бацитрацину (робочий 33 0,50 буфер) в ULTRA-TURRAX T25 при 34 1,20 13500обертів/хв. Гомогенізат центрифугували при 35 0,35 1000´g впродовж 10хв при 4°С. Одержану 40 0,50 надосадову рідину фільтрували через стерильну 43 3,40 тканину та додатково центрифугували впродовж 44 0,20 15хв при 40000´g при 4°С. Одержану таблетку Сполука А 0,51 повторно суспендували в 10 об'ємах робочого 33 80996 34 LTD4, таких як бронхіальна астма, алергічний та Сполука В 0,52 цілорічний алергічний риніт, хронічне обструктивне захворювання легенів, кропив'янка, атопічний Сполука А являє собою 3-[2-(7-хлор-6дерматит, мігрень, вірусний бронхіоліт, що фторхінолін-2-ілметокси)-6,11викликаний РСВ, муковісцидоз, еозинофільний дигідро[1]дибензоксепін-11-іл)тіо]пропанову гастроентерит, фіброміалгія А й інтерстиціальний кислоту, яка описана в [ЕР 0685478А1]. цистит. Сполука В являє собою (1-{1-{3-[2-(7Сполуки, які пропонуються в даному винаході, хлорхінолін-2-іл)-вініл]-феніл}-3-[2-(1-гідрокси-1також можна застосовувати в комбінації з іншими метилетил)-феніл]-пропілсульфанілметил}лікарськими препаратами, для яких відомо, що циклопропіл)-оцтову кислоту. вони ефективні при лікуванні цих захворювань. Викликана LTD4 проникність мікросудин у Наприклад, у комбінації із триптанами або морських свинок інгібіторами СОХ-2 при лікуванні мігрені; з Самцям морських свинок Dunkin-Hartey (450антагоністами Н1 при лікуванні алергійних 500г), що голодали впродовж 18год., вводили захворювань, таких як риніт або кропив'янка; або з перорально досліджувану сполуку за допомогою інгібіторами PDE IV при лікуванні алергійних шлункового зонда за 4год. до анестезування захворювань, астми або хронічного уретаном (15%, внутршньочеревно, 10мл/кг). Ліву обструктивного захворювання легенів. яремну вену катетеризували при анестезії. Через Відповідно, іншим варіантом виконання даного 5хв внутрішньовенно вводили барвник еванс винаходу є застосування сполук формули (І) при блакитний (40мг/кг). Ще через 5хв тварині вводили виготовленні лікарського препарату, який LTD4 (1мкг/кг, внутрішньовенно) для індукування призначений для лікування або попередження проникності мікросудин дихальних шляхів. Ще патологічних станів, захворювань і порушень, для через 5хв тварин знекровлювали шляхом яких відомо, що їх протікання полегшується розрізування лівого передсердя й судинне русло шляхом інгібування LTD4, а також спосіб лікування промивали шляхом перфузії 50мл фізіологічного суб'єкта, що страждає від патологічного стану або розчину через лівий шлуночок під тиском, що захворювання, протікання якого полегшується дорівнює 150см Н2О. Потім вирізали трахею та шляхом інгібування LTD4, що включає введення проводили інкубацію у формаміді впродовж 20год. зазначеному суб'єкту ефективної кількості сполуки при 55°С для екстрагування барвника евансу формули (І). блакитного із тканини. Проникність мікросудин Даний винахід також стосується визначали за допомогою оптичної фармацевтичних композицій, які як активний спектрофотометрії барвника, що проник з посудин інгредієнт включають не менше, ніж одну сполуку у тканину, при 620нм. формули (І) або її фармацевтично прийнятну сіль Результати наведені в таблиці II. разом з фармацевтично прийнятним інертним наповнювачем, таким як носій або розріджувач. Таблиця II Активний інгредієнт може складати від 0,001 до 99мас.%, краще - від 0,01 до 90мас.% від Приклад ED50 мг/кг композиції залежно від характеру композиції та від 1 0,009 того, чи варто проводити додаткове розведення 4 0,030 перед введенням. Бажано, щоб композиція 7 0,013 приготовлялася у формі, що придатна для 9 0,018 перорального, місцевого, назального, ректального, 11 0,0013 підшкірного введення або введення шляхом 23 0,002 ін'єкції. 24 0,010 Фармацевтично прийнятні інертні 34 0,018 наповнювачі, які змішують із активною сполукою 35 0,009 або солями такої сполуки для одержання Сполука А 0,010 композиції, яка пропонується в даному винаході, Сполука В 0,008 самі по собі добре відомі й те, які інертні наповнювачі реально застосовуються, зокрема, залежить від встановленого способу введення Сполука А являє собою 3-[2-(7-хлор-6композицій. фторхінолін-2-ілметокси)-6,11Композиції, призначені для перорального дигідро[1]дибензоксепін-11-іл)тіо]пропанову введення, можуть являти собою таблетки, кислоту, яка описана в [ЕР 0685478А1]. таблетки пролонгованої дії, сублінгвальні Сполука В являє собою наявний у продажі таблетки, капсули, аерозолі для інгаляції, розчини інгібітор LTD4 Montelukast: 1-[[[(1R-1-[3-[(1E)-2-(7для інгаляції, сухі порошки для інгаляції або рідкі хлор-2-хінолініл)етеніл]феніл]-3-[2-(1-гідрокси-1препарати, такі як мікстури, еліксири, сиропи або метилетил)феніл]пропіл]тіо]метил]циклопропаноцт суспензії, які містять сполуку, яка пропонується в ову кислоту. даному винаході; такі препарати можуть бути Результати, представлені в таблицях І та II, виготовлені способами, добре відомими в даній показують, що сполуки формули (І) є активними галузі техніки. антагоністами лейкотрієну D4 і тому придатні для Розріджувачі, які можуть використовуватися лікування або попередження патологічних станів, при виготовленні композицій, включають такі рідкі захворювань і порушень, для яких відомо, що їх та тверді розріджувачі, які сумісні з активним протікання полегшується шляхом інгібування 35 80996 36 інгредієнтом, і при необхідності застосовуються разом із забарвлювальними та ароматизуючими речовинами. Таблетки або капсули звичайно можуть містити від 2 до 500мг активного інгредієнта або еквівалентну кількість його солі. Рідкі композиції, призначені для перорального Цю сполуку синтезують так, як описано в введення, можуть являти собою розчини або роботі [Synthesis, 1997, 113-116]. суспензії. Розчини можуть бути водними Стадія 2: 7-Гідрокси[1]бензоксепіно[3,4розчинами розчинної солі або іншої похідної b]піридин-5(11Н)-он. активної сполуки, наприклад, разом із сахарозою для одержання сирону. Суспензії можуть включати нерозчинну активну сполуку, яка пропонується в даному винаході, або її фармацевтично прийнятну сіль разом з водою, разом із суспендуючою речовиною та ароматизуючою речовиною. Композиції, призначені для парентеральних ін'єкцій, можуть бути виготовлені з розчинних Розчин 9,7мл (25,7г; 0,10моль) триброміду солей, які можуть бути або не бути піддані бору в 125мл дихлорметану охолоджують до сушінню виморожуванням та які можуть бути 60°С. При перемішуванні додають по краплях розчинені в апірогенному водному середовищі або розчин 10,0г (41,45ммоль) продукту, який іншій рідині, що придатна для парентеральних одержаний на стадії 1, в 40мл дихлорметану. ін'єкцій. Після завершення додавання суміші дають досягти кімнатної температури. Перемішування Композиції, призначені для місцевого продовжують впродовж 16год. та обережно введення, можуть являти собою мазі, креми або лосьони, які містять сполуку, яка пропонується в додають 125мл води. Значення рН доводять до 5 даному винаході; такі препарати можуть бути за допомогою 8н. NaOH. Тверду речовину, що виготовлені способами, добре відомими в даній осіла, відфільтровують, промивають водою та галузі техніки. сушать. Одержують 8,2г (87%) коричневої твердої Ефективні дози звичайно знаходяться у речовини, досить чистої, щоб продовжувати діапазоні, що становить 10-600мг активного синтез. Стадія 3: 6,7-дифтор-2-метилхінолін інгредієнта на добу. Добову дозу можна вводити у вигляді одного або більшої кількості введень, краще - від 1 до 4 введень на добу. Даний винахід буде додатково проілюстровано за допомогою представлених нижче прикладів. Ці приклади наведені тільки для ілюстрації та їх не слід вважати обмежуючими. 25,0г 3,4-дифтораніліну розчиняють в 120 2Спектри ядерного магнітного резонансу 1H бутанолу. Повільно додають 50мл насиченого знімали на спектрометрі Varian Gemini 200. розчину хлориду водню в 2-бутанолі, а потім також Температури плавлення визначали за допомогою додають 47,6г (0,1936моль) п-хлоранілу. При приладу Perkin Elmer DSC-7. Хроматографічні ефективному перемішуванні та кип'ятінні зі розділення проводили з використанням системи зворотним холодильником (100-110°С) по краплях Waters 2690, що обладнана колонкою Symmetry повільно додають розчин 19,4мл (0,236моль) С18 (2,1´10мм, 3,5мм). Рухома фаза містила кротонового альдегіду в 45мл бутан-2-олу мурашину кислоту (0,4мл), аміак (0,1мл), метанол (приблизно 2год.). Суміш кип'ятять зі зворотним (500мл) та ацетонітрил (500мл) (В) і мурашину холодильником впродовж ще 2год. і потім кислоту (0,46мл), аміак (0,115мл) та воду (1000мл) випарюють досуху. Залишок змішують із (А): спочатку від 0 до 95% фази В впродовж 20хв, надлишком ТГФ, відфільтровують і ретельно а потім впродовж 4хв - 95% В. Час повторного промивають за допомогою ТГФ, поки фільтрат не встановлення рівноваги між двома інжектуваннями стане безбарвним. Одержану в такий спосіб становв 5хв. Швидкість потоку дорівнювала тверду речовину розчиняють у воді, 0,4мл/хв. Інжектований об'єм дорівнював 5мкл. відфільтровують невеликі кількості твердих Хроматограмми з використанням діодної решітки домішок і промивають етиловим ефіром. Водний одержували при 210нм. шар роблять слабколужним за допомогою 2н. Приклади: розчину NaOH і потім екстрагують діетиловим Приклад 1 ефіром. Ефірний шар сушать і для знебарвлення Одержання 3-{(7-[(6,7-дифторхінолін-2обробляють невеликою кількістю вугілля. Після іл)метокси]-5,11-дигідро[1]бензоксепіно[3,4випарювання одержують білу тверду речовину b]піридин-5-іл)тіо}пропанової кислоти (22,7г, 65%). Стадія 1: 7-Метокси[1]бензоксепіно[3,4Стадія 4: 2-(Бромметил)-6,7-дифторхінолін. b]піридин-5(11Н)-он. 37 80996 38 26,7г 6,7-дифтор-2-метилхіноліну розчиняють Додають 45,25мл (66,97г; 587ммоль) в 300мл етилацетату. До нього додають 26,6г Nтрифтороцтової кислоти (тверда речовина бромсукциніміду та невелику кількість розчиняється) і потім 2,27мл (2,76г; 26,05ммоль) 3бензоїлпероксиду. Суміш кип'ятять зі зворотним меркаптопропанової кислоти. Суміш перемішують холодильником на нагрівальній бані при 90°С впродовж 16год, додають надлишок води й впродовж 16год. і охолоджують до кімнатної органічний шар ретельно промивають водою, 0,5н. температури. Тверду речовину відфільтровують і розчином NaHCO3 та ще раз водою. Органічний відкидають. Маточні розчини промивають водою, шар сушать, частково випарюють і для сушать і концентрують. Залишок кристалізують із кристалізації продукту додають етиловий ефір. суміші етиловий ефір/петролейний ефір. Одержують 5,5г (85%) чистого продукту. 1 Н ЯМР (Cl3CD): 2,60-2,83 (m.4H); 5,05-5,78 Одержують 18,6г бромпохідної (49%). (система АВ, 2Н); 5,01 (s.1H); 5,38 (s.2H); 6,90-6,98 Стадія 5: 7-[(6,7-дифторхінолін-2(m.3Н); 7,26-7,37 (m.1Н); 7,55-7,80 (m.3Н); 7,85іл)метокси)[1]бензоксепіно[3,4-b]піридин-5(11Н)-он 7,98 (m.1Н); 8,18-8,22 (m.1Н); 8,51-8,56 (m.1Н). До суспензії 5,4г (23,76ммоль) продукту, який Приклад 2 одержаний на стадії 2, в 20мл МеОН додають Одержання ((7-[(6,7-дифторхінолін-24,6мл (23,76ммоль) 30мас/об.% розчину іл)метокси]-5,11-дигідро[1]бензоксепіно[3,4метоксиду натрію в метанолі. Одержаний у такий b]піридин-5-іл)тіо}оцтової кислоти спосіб розчин випарюють досуху та розчиняють в Стадія 1: Етил{(7-[(6,7-дифторхінолін-2100мл ДМФ. До нього однією порцією додають 6,1г іл)метокси]-5,11-дигідро[1]бензоксепіно[3,4(23,76ммоль) продукту, який одержаний на стадії b]піридин-5-іл)тіо}ацетат. 4, і суміш перемішують при кімнатній температурі впродовж 16год. Розчинник випарюють і залишок піддають розподілу між водою та метиленхлоридом. Органічний шар сушать, концентрують і кристалізують із діетилового ефіру. Одержують 7,0г білої твердої речовини (73%). Стадія 6 і 7-[(6,7-дифторхінолін-2-іл)метокси)5,11-дигідро[1]бензоксепіно[3,4-b]піридин-5-ол. Суспензію 5,4г (13,35ммоль) продукту, який одержаний на стадії 5, в 90мл ТГФ та 30мл метанолу перемішують при зовнішньому охолодженні на бані з льодом. До неї невеликими порціями додають 0,55г (14,4ммоль) борогідриду натрію. Після завершення додавання реакційну суміш перемішують впродовж 1год, випарюють і додають 100мл води. Суміш перемішують впродовж 30хв і тверду речовину відфільтровують та ретельно промивають водою. Після сушіння маса твердої речовини дорівнює 5,3г (97%). 1 Н ЯМР (Cl3CD): 5,25 (система АВ, 2Н); 5,31 (s.2H); 5,79 (d.1H); 6,85-6,95 (m.1H); 7,05-7,23 (m.3Н); 7,51-7,70 (m.2H); 7,78-7,90 (m.2H); 8,14 (d.1H);8,44(d.1H). Стадія 7: 3-{(7-[(6,7-дифторхінолін-2іл)метокси]-5,11-дигідро[1]бензоксепіно[3,4b]піридин-5-іл)тіо}пропанова кислота 5,3г (13,04ммоль) Продукту, який одержаний на стадії 6, суспендують в 100мл дихлорметану. 2,1г (5,2ммоль) Сполуки, яка одержана в прикладі 1, стадія 6, суспендують в 20мл дихлорметану, додають 18,2мл (26,94г; 236ммоль) трифтороцтової кислоти. Одержаний розчин охолоджують до 0°С і до нього додають 1,14мл (1,25г; 10,4ммоль) етилмеркаптоацетату. Суміш перемішують при 0°С впродовж 2год. і для нейтралізації кислоти додають достатню кількість насиченого розчину Nа2СО3. Органічний шар сушать і концентрують. Залишок обробляють за допомогою флеш-хроматографії на SiO2, шляхом елюювання в градієнтому режимі сумішшю СІ2СН2 - СІ2СН2/МеОН 90/10. Одержують 1,13г (43%) відповідного складного ефіру. Стадія 2: {(7-[(6,7-дифторхінолін-2-іл)метокси]5,11-дигідро[1]бензоксепіно[3,4-b]піридин-5іл)тіо}оцтова кислота 1,13г Продукту, який одержаний на стадії 1, розчиняють у суміші 10мл EtOH та 10мл ТГФ. Додають 2мл 2н. NaOH та реакційну суміш перемішують при кімнатній температурі впродовж 16год. Додають 2н. НСI до нейтральної реакції. Додають додаткову кількість води та продукт екстрагують дихлорметаном. Після флешхроматографування на SiO2 при елююванні 39 80996 40 сумішшю СI2СН2/МеОН 90/10 одержують 0,88г (83%) продукту. 1 Н ЯМР (CI3CD): 3,25 (s.2H); 4,98-5,85 (система АВ, 2Н); 5,16 (s.1H); 5,36 (s.2H); 6,96-8,42 (m.10Н). Приклад 3 Одержання ((7-[(7-хлор-6-фторхінолін-2іл)метокси]-5,11-дигідро[11бензоксепіно[3,4b]піридин-5-іл)тіо)оцтової кислоти. Цей продукт синтезують згідно з методикою, Стадія 1: 7-Хлор-6-фтор-2-метилхінолін. яка наведена в прикладі 1, стадія 6, але використовують 7-[(7-хлор-6-фторхінолін-2іл)метокси)[1]бегаоксепіно[3,4-b]піридин-5(11Н)-он замість 7-[(6,7-дифторхінолін-2іл)метокси)[1]бензоксепіно[3,4-b]піридин-5(11Н)ону. Вихід дорівнює 91%. Стадія 5: Етил{(7-[(7-хлор-6-фторхінолін-2Цю сполуку одержують відповідно до роботи [J. Het. Chem. 30, 17 (1993)]. іл)метокси]-5,11-дигідро[1]бензоксепіно[3,4Стадія 2: 2-(Бромметил)-7-хлор-6-фторхінолін. b]піридин-5-іл)тю}ацетат. 26,8г продукту, який одержаний на стадії 1, розчиняють в 300мл етилацетату. Додають 24,4г N-бромсукциніміду та невелику кількість бензоїлпероксиду і суміш кип'ятять зі зворотним холодильником при 90°С (температура бані) впродовж 16год. Після охолодження розчину до кімнатної температури його промивають водою, сушать і концентрують до невеликого об'єму. Тверду речовину, яка закристалізувалася, відфільтровують і промивають сумішшю етиловий ефір/петролейний ефір 1:1. Її маса дорівнює 16,2г. Маточні розчини концентрують й обробляють за допомогою флеш-хроматографії на SiO2, шляхом елюювання дихлорметаном. Одержують додаткову кількість продукту, що дорівнює 3,5г продукту (сумарний вихід: 52%). Стадія 3: 7-[(7-хлор-6-фторхінолін-2іл)метокси)[1]бензоксепіно[3,4-b]піридин-5(11Н)-он. Цей продукт синтезують згідно з методикою, яка наведена в прикладі 1, стадія 5, але використовують 2-(бромметил)-7-хлор-6фторхінолін замість 2-(бромметил)-6,7дифторхіноліну. У цьому випадку вихід дорівнює 68%. Стадія 4: 7-[(7-хлор-6-фторхінолін-2іл)метокси)-5,11-дигідро[1]бензоксепіно[3,4b]піридин-5-ол. 2,19г (5,2ммоль) Сполуки, яка одержана на стадії 4, суспендують в 20мл дихлорметану. Додають 18,2мл (26,94г; 236ммоль) трифтороцтової кислоти. Одержаний розчин охолоджують до 0°С і до нього додають 2,85мл (3,12г; 26ммоль) етилмеркаптоацетату. Суміш перемішують при кімнатній температурі впродовж 3год. і для нейтралізації кислоти додають достатню кількість насиченого розчину Nа2СО3. Органічний шар сушать і концентрують. Залишок обробляють за допомогою флеш-хроматографії на SiO2, шляхом елюювання в градієнтому режимі сумішшю СI2СН2 - СI2СН2/МеОН 90/10. Одержують 1,74г (64%) відповідного складного ефіру. Стадія 6: {(7-[(7-хлор-6-фторхінолін-2іл)метокси]-5,11-дигідро[1]бензоксепіно[3,4b]піридин-5-іл)тіо}оцтова кислота. Використовуючи як вихідну речовину продукт, одержаний на стадії 5, і застосовуючи ту ж методику, що й у прикладі 2, стадія 2, з виходом 66% одержують відповідну кислоту. 1 Н ЯМР (Cl3CD): 3,32 (s.2H); 4,99-5,73 (система АВ, 2Н); 5,16 (s.1H); 5,30 (s.2H); 6,92-6,97 (m.2H); 7,05-7,07 (m.1Н); 7,22-7,26 (m.1H); 7,56-7,59 (m.1H); 7,70-7,76 (m.2H); 8,15-8,20 (m.2H); 8,428,44 (m.1H). Приклад 4 41 80996 42 Одержання 3-{(7-[(7-хлор-6-фторхінолін-2кип'ятять зі зворотним холодильником впродовж іл)метокси]-5,11-дигідро[11бензоксепіно[3,45год. Тверду речовину відфільтровують і b]піридин-5-іл)тіо>пропанової кислоти. промивають за допомогою ССІ4. Маточні розчини Стадія 1: Етил-3-{(7-[(7-хлор-6-фторхінолін-2концентрують й одержують жовту тверду іл)метокси]-5,11-дигідро[1]бензоксепіно[3,4речовину, що переважно являє собою b]піридин-5-іл)тіо}пропаноат. монобромований продукт. Його використовують на наступній стадії без додаткового очищення. Стадія 2: 3-(Меркаптометил)бензойна кислота. 2,19г (5,2ммоль) Сполуки, яка одержана в прикладі 3, стадія 4, суспендують в 20мл дихлорметану. Додають 18,2мл (26,94г; 236ммоль) трифтороцтової кислоти. Одержаний розчин охолоджують до 0°С і до нього додають 3,30мл (3,48г; 26ммоль) етил-3-меркаптопропаноату. Суміш перемішують при кімнатній температурі впродовж 3год. і для нейтралізації кислоти додають достатню кількість насиченого розчину Na2CO3. Органічний шар сушать і концентрують. Залишок обробляють за допомогою флешхроматографії на SiO2, шляхом елюювання в градієнтому режимі сумішшю СI2СН2 СI2СН2/МеОН 90/10. Одержують 1,95г (70%) відповідного складного ефіру. Стадія 2: 3-{(7-[(7-хлор-6-фторхінолін-2іл)метокси]-5,11-дигідро[1]бензоксепіно[3,4b]піридин-5-іл)тіо}пропанова кислота. Використовуючи як вихідну речовину продукт, що одержаний на стадії 1, і застосовуючи ту ж методику, що й у прикладі 2, стадія 2, з виходом 82% одержують відповідну кислоту. 1 Н ЯМР (Cl3CD): 2,57-2,75 (m.4H); 5,00-5,72 (система АВ, 2Н); 4,90 (s.1H); 5,30 (s.2H); 6,86-7,01 (m.3Н); 7,15-7,19 (m.1Н); 7,48-7,51 (m.1Н); 7,617,67 (m.2Н); 8,08-8,18 (m.2Н); 8,44-8,47 (m.1Н). Приклад 5 Одержання [{(7-[(6,7-дифторхінолін-2іл)метокси]-5,11-дигідро[1]бензоксепіно[3,4b]піридин-5-іл)тіо>метил]бензойної кислоти. Стадія 1: Метил-3-(бромметил)бензоат. Суміш 5,5г (36ммоль) метил-3-метилбензоату, 7,1г (39,5ммоль) N-бромсукциніміду та 0,44г (1,8ммоль) бензоїлпероксиду в 75мл ССI4 Цю сполуку синтезують відповідно до роботи [Gazz. Chim. Ital., 1969, 99 (12), 1306]. Стадія 3: [{(7-[(6,7-дифторхінолін-2іл)метокси]-5,11-дигідро[1]бензоксепіно[3,4b]піридин-5-іл)тіо}метил]бензойна кислота. Цю сполуку одержують із виходом 96% згідно з методикою, яка наведена в прикладі 1, стадія 7, шляхом заміни 3-меркаптопропанової кислоти на 3-(меркаптометил)бензойну кислоту. У цьому випадку кінцеве очищення забезпечують за допомогою флеш-хроматографії на SiO2, шляхом елюювання в градієнтому режимі сумішшю СI2СН2 - Cl2CH2/AcOEt 90:10. 1 Н ЯМР (Cl3CD): 3,66 (система АВ, 2Н); 5,015,76 (система АВ, 2Н); 4,60 (s.1H); 5,31 (система АВ, 2Н); 6,77-6,78 (m.1Н); 6,91-6,95 (m.1H); 7,057,08 (т.1Н); 7,17-7,21 (m.1H); 7,35-7,59 (m.4H); 7,68-7,71 (m.1H); 7,83-7,89 (m.1H); 7,97-8,01 (m.1H); 8,06 (s.1H); 8,16-8,19 (m.1H); 8,43-8,45 (m.1H). Приклад 6 Одержання [{(7-[(7-хлор-6-фторхінолін-2іл)метокси]-5,11-дигідро[1]бензоксепіно[3,4b]піридин-5-іл)тіо)метил]бензойної кислоти. Цю сполуку одержують із виходом 85%, використовуючи як вихідну сполуку, що одержана в прикладі 3, стадія 4, та методику приклада 5, стадія 3 (схема 6). 43 80996 44 Н ЯМР (Cl3CD): 3,59 (s.2H); 5,00-5,75 перемішування при кімнатній температурі (сисmема АВ, 2Н); 4,63 (s.1Н); 5,30 (s.2H); 6,76впродовж 16год. для нейтралізації кислоти 6,77 (m.1Н); 6,91-6,95 (m.1Н); 7,05-7,08 (m.1Н); додають достатню кількість насиченого розчину 7,19-7,24 (m.1Н); 7,40-7,56 (m.4H); 7,70-7,72 Na2CO3. Органічний шар сушать і концентрують. (m.1Н); 7,96-8,02 (m.2H); 8,16-8,19 (m.2H); 8,41Залишок обробляють за допомогою флеш8,43 (m.1Н). хроматографії на SiO2, шляхом елюювання Приклад 7 сумішшю СI2СН2/МеОН 95/5. Одержують 0,147г Одержання 1-{[(7-[(6,7-дифторхінолін-2(43%) відповідного складного ефіру, що іл)метокси]-5,11-дигідро[1]бензоксепіно[3,4розчиняють в 5мл етанолу. Додають 1мл 1н. NaOH b]піридин-5-іл)тіо]метил}циклопропілоцтової та суміш перемішують впродовж 16год. Додають кислоти. додаткову кількість води й продукт екстрагують Стадія 1: Метил[(1 дихлорметаном. Після флеш-хроматографування меркаптометил)циклопропіл]ацетат. на SiO2 при елююванні сумішшю СI2СН2/МеОН 90/10 одержують 0,08г (59%) продукту. 1 Н ЯМР (Cl3CD): 1,28 (s.6H); 2,52-2,84 (система АВ, 2Н); 4,90 (s.1Н); 4,98-5,75 (система АВ, 2Н); 5,34 (s.2H); 6,83-6,90 (m.3Н); 7,10-7,19 (m.1Н); 7,50-7,67 (m.3Н); 7,85-7,98 (m.1Н); 7,10-7,19 (m.1Н); 8,41-8,44 (m.1Н). Цю сполуку одержують відповідно до роботи Приклад 9 [Bioorg. Med. Chem. Lett., 1995, 5 (3), 286]. Одержання 3-((7-[(6,7-дифторхінолін-2Стадія 2: 1-{[(7-[(6,7-дифторхінолін-2іл)метокси]-5,11-дигідро[1]бензоксепіно[3,4іл)метокси]-5,11-дигідро[1]бензоксепіно[3,4b]піридин-5-іл)тіо}-3-метилбутанової кислоти. b]піридин-5-іл)тіо]метил}циклопропілоцтова Стадія 1: 3-Меркапто-3-метилбутанова кислота. кислота 1 Цю сполуку одержують відповідно до роботи [J. Chem. Soc. Perkin trans. 1, 1992, 1215]. Стадія 2: 3-{(7-[(6,7-дифторхінолін-2іл)метокси]-5,11-дигідро[1]бензоксепіно[3,4b]піридин-5-іл)тіо}-3-метилбутанова кислота. Цю сполуку синтезують із виходом 25%, використовуючи як вихідний продукт, що описаний в прикладі 1, стадія 6, згідно з методикою, що описана в прикладі 2, стадії 1 та 2. 1 Н ЯМР (Cl3CD): 0,40-0,53 (m.2H); 0,58-0,68 (m.2H); 2,32-2,55 (система АВ, 2Н); 2,70-2,78 (система АВ, 2Н); 4,75 (s.1Н); 5,00-5,69 (система АВ, 2Н); 5,37-5,44 (система АВ, 2Н); 6,88-6,91 (m.2Н); 7,01-7,04 (m.1Н); 7,12-7,16 (m.1Н); 7,567,62 (m.2H); 7,67-7,70 (m.1Н); 7,96-8,02 (m.1Н); 8,18-8,21 (m.1Н); 8,42-8,44 (m.1Н). Приклад 8 Одержання 3-{(7-[(6,7-дифторхінолін-2іл)метокси]-5,11-дигідро[1]бензоксепіно[3,4b]піридин-5-іл)тіо}-2,2-диметилпропанової кислоти. Стадія 1: 0,25г (0,621ммоль) Продукту, який одержаний в прикладі 1, стадія 6, суспендують в 5мл дихлорметану. Додають 2,17мл (3,21г; 28,18ммоль) трифтороцтової кислоти. Розчин охолоджують до 0°С і додають 0,46г (3,1ммоль) метил-3-меркапто-2,2-диметилпропаноату. Після Цю сполуку одержують із виходом 69% відповідно до приклада 1, стадія 7. 1 Н ЯМР (Cl3CD): 1,29 (s.3H); 1,42 (s.3H); 2,58 (s.2H); 4,96-5,70 (система AB, 2H); 5,06 (s.1Н); 5,34 (s.2H); 6,85-6,89 (m.1Н); 6,97-7,03 (m.2H); 7,09-7,13 (m.1Н); 7,53-7,68 (m.3H); 7,87-7,94 (m.1Н); 8,138,16 (m.1Н); 8,41-8,43 (m.1Н). Приклад 10 Одержання 3-{(7-[(Е)-2-(6,7-дифторхінолін-2іл)вініл]-5,11-дигідро[1]бензоксепіно[3,4-b]піридин5-іл)тіо}пропанової кислоти. Стадія 1: 2-[(4-Бромфенокси)метил]нікотинова кислота. 45 80996 46 32г (185ммоль) 4-бромфенолу обробляють у метанолі за допомогою 33,32г (185ммоль) 30% розчину метоксиду натрію в метанолі. Розчинник видаляють і залишок перемішують із 5,0г (37,00ммоль) фуро[3,4-b]піридин-5(7Н)-ону (його одержують відповідно до роботи Synthesis, 1997, 113-116). Суміш перемішують при 165°С впродовж 30хв (суміш спочатку плавиться, а потім твердіє). 0,37г (1,26ммоль) Бромпохідної, яка одержана Після досягнення кімнатної температури тверду на стадії 3, перемішують із 0,27г (1,41ммоль) речовину розчиняють у надлишку води, значення вінілпохідної, яка одержана на стадії 4, 8,5мг рН доводять до 7-8 за допомогою 2н. НСl і двічі (0,0378ммоль) ацетату паладію та 36,2мг екстрагують дихлорметаном. Значення рН водного (0,118ммоль) три(о-толіл)фосфіну в 2,5мл ДМФ. шару доводять до 5-6 за допомогою додаткової Розчин дегазують і охолоджують на бані з льодом. кількості 2н. НСl і тверду речовину, що осіла, В атмосфері азоту до нього по краплях додають відфільтровують, промивають водою та сушать. розчин 0,27мл (0,196г; 1,937ммоль) Ν,Ν,ΝВихід дорівнює 6,6г (58%). триетиламіну в 1,2мл ДМФ. Суміш перемішують Стадія 2: 7-бром[1]бензоксепіно[3,4-b]піридинпри 100°С впродовж 1год. Після досягнення 5(11Н)-он кімнатної температури по краплях додають 4мл води та тверду речовину відфільтровують, промивають водою та сушать. Вихід дорівнює 0,5г (98%). Стадія 6: 3-{(7-[(Е)-2-(6,7-дифторхінолін-2іл)вініл]-5,11-дигідро[1]бензоксепіно[3,4-b]піридин5-іл)тіо}пропанова кислота. 6,6г (22,75ммоль) Продукту, який одержаний на попередній стадії, перемішують із 132г ПФК (поліфосфорна кислота) при 165°С впродовж 8год. Суміш виливають на суміш води з льодом і підлуговують за допомогою 8н. NaOH. Тверду речовину відфільтровують, промивають водою та сушать. Вихід дорівнює 3,0г (48%). Стадія 3: 7-бром-5,11дигідро[1]бензоксепіно[3,4-b]піридин-5-ол 0,4г (1,37ммоль) Продукту, який одержаний на попередній стадії, розчиняють в 8мл ТГФ та 4мл МеОН. Розчин перемішують при 5°С і порціями додають 0,064г (1,68ммоль) борогідриду натрію. Суміш перемішують 2год. при кімнатній температурі, концентрують у вакуумі та залишок перемішують із водою, фільтрують і сушать. Вихід дорівнює 0,37г (92%). Стадія 4: 6,7-дифтор-2-вінілхінолін Цю сполуку синтезують із сумарним виходом 34% відповідно до роботи [J. Org. Chem. 1996, 61, 3398-3405], але як вихідна речовина використовують продукт, що одержаний у прикладі 1, стадія 3. Стадія 5: 7-[(Е)-2-(6,7-дифторхінолін-2іл)вініл]-5,11-дигідро[1]бензоксепіно[3,4-b]піридин5-ол. Суміш 0,20г (0,49ммоль) продукту, який одержаний на попередній стадії, 0,087мл (0,105г; 1,0ммоль) 3-меркаптопропанової кислоти та 1,15мл (1,698г; 14,91ммоль) трифтороцтової кислоти в 4мл дихлорметану перемішують при кімнатній температурі впродовж 16год. Розчинники випарюють при кімнатній температурі, залишок піддають розрозділенню в системі етилацетат/вода й органічний шар промивають невеликою кількістю 1Μ розчину гідрокарбонату натрію. Розчин сушать, концентрують і залишок перемішують із етиловим ефіром, фільтрують та одержують 0,16г (65%) продукту. 1 Н ЯМР (d6-ДМСО (диметилсульфоксид): 2,56 (d.2H); 2,65 (d.2H); 5,00-6,03 (система АВ, 2Н); 5,38 (s.2H); 7,01 (d.1Н); 7,35-7,43 (m.2H); 7,63 (d.1Н); 7,62-7,97 (m.6H); 8,36 (d.1Н); 8,51-8,52 (m.1Н); 12,34 (s.1Н). Приклад 11 Одержання 1-{[(7-[(Е)-2-(6,7-дифторхінолін-2іл)вініл]-5,11-дигідро[1]бензоксепіно[3,4-b]піридин5-іл)тіо]метил}циклопропілоцтової кислоти. Стадія 1: [(1Меркаптометил)циклопропіл]оцтова кислота. Цю сполуку одержують відповідно до роботи [US 5523477 (1996)]. 47 80996 Стадія Стадія 2: 1-{[(7-[(Е)-2-(6,7-дифторхінолін-2етил]етантіоат. іл)вініл]-5,11-дигідро[1]бензоксепіно[3,4-b]піридин5-іл)тіо]метил}циклопропілоцтова кислота. З використанням як вихідну сполуку 0,2г продукту, який одержаний в прикладі 10, стадія 5, та відповідно до стадії 6 того ж приклада цю сполуку одержують із виходом 25%. 1 Н ЯМР (d6-ДМСО): 0,39-0,46 (m.4Н); 2,25 (s.2H); 2,56-2,80 (сисmема АВ, 2Н); 5,00-6,07 (сисmема АВ, 2Н); 5,25 (s.1Н); 6,99 (d.1Н)); 7,347,40 (m.2H); 7,62-7,99 (m.7H); 8,36 (d.1Н); 8,48-8,50 (m.1Н); 11,95-12,30 (b.s.1Н) Приклад 12 Одержання {(7-[(Е)-2-(6,7-дифторхінолін-2іл)вініл]-5,11-дигідро[1]бензоксепіно[3,4-b]піридин5-іл)тіо}оцтової кислоти. 3 використанням як вихідні сполуки 0,2г продукту, який одержаний в прикладі 10, стадія 5, і 0,09г меркаптооцтової кислоти та відповідно до стадії 6 того ж приклада цю сполуку одержують із виходом 43%. 1 Н ЯМР (d6-ДМСО): 3,30 (s.2H); 5,01-6,04 (система АВ, 2Н); 5,39 (S.1H); 7,03 (d.1Н); 7,347,43 (m.2H); 7,64-7,93 (m.7H); 8,35-8,38 (m.1Н); 8,51-8,52 (m.1Н); 12,67 (s.1Н). Приклад 13 Одержання 7-[(Е)-2-(6,7-дифторхінолін-2іл)вініл]-5-{[2-(1Н-тетразол-5-іл)етил]тіо}-5,11дигідро[1]бензоксепіно[3,4-b]піридину. Стадія 1: 8-(2-Ціанетил)етантіоат. Суміш 3,13мл (3,33г; 43,79ммоль) етантіоєвої S-кислоти та 2,9мл (3,59г; 67,81ммоль) акрилонітрилу охолоджують на бані з льодом. При перемішуванні по краплях додають 0,20мл (0,27г; 2,72ммоль) Ν,Ν,Ν-триетиламіну (екзотермічна реакція). Суміш перемішують при кімнатній температурі впродовж 16год. і піддають розподілу між сумішшю етиловий ефір/пентан 1:1 і водою. Органічний шар промивають водою, сушать, концентрують та одержують 4,73г (93%) неочищеного продукту, що використовують без очищення на наступній стадії. 2: 48 S-[2-(2Н-тетразол-5-іл) 1,55г (9,00ммоль) сполуки, яка одержана на попередній стадії, та 6г (18,0ммоль) азотрибутилолова перемішують при 110°С впродовж 3год. Залишок піддають розподілу між пентаном та 4% розчином NаНСО3. Водний шар промивають пентаном, підкисляють за допомогою 6н. НСI і насичують за допомогою NaCl. Продукт екстрагують етилацетатом, промивають водою, сушать і концентрують. Вихід неочищеного продукту дорівнює 0,64г (31%). Стадія 3: 2-(2Н-тетразол-5-іл)-етантіол. Суміш 0,56г (4,30ммоль) сполуки, яка одержана на попередній стадії, 28мл метанолу та 2,8мл метанолу, який насичений НСI, впродовж 5год. кип'ятять зі зворотним холодильником в атмосфері азоту. Розчин концентрують і залишок використовують на наступній стадії без додаткового очищення (він містить невелику кількість відповідної дитіанпохідної). Стадія 4: 7-[(Е)-2-(6,7-дифторхінолін-2іл)вініл]-5-{[2-(1Н-тетразол-5-іл)етил]тю}-5,11дигідро[1]бензоксепіно[3,4-b]піридин. Суміш 0,26г (0,64ммоль) сполуки, яка одержана в прикладі 10, стадія 5, та 0,17г (1,30ммоль) сполуки, яка одержана на попередній стадії, в 2,23мл трифтороцтової кислоти перемішують при кімнатній температурі впродовж ночі. Розчин концентрують і залишок піддають розподілу між етилацетатом та 4% розчином NaHCO3. Після промивання органічного шару водою його сушать і концентрують. Залишок обробляють за допомогою флеш-хроматографії на SiO2, шляхом елюювання сумішшю дихлорметан/метанол/водний розчин аміаку 40:8:1. Вихід дорівнює 0,065г (20%). 1 Н ЯМР (d6-ДМСО): 2,70-2,75 (m.2Н); 3,08-3,14 (m.2Н); 4,94-6,00 (система АВ, 2Н); 5,18 (s.1Н); 6,83-6,99 (m.2H); 7,22-8,15 (m.9H); 8,34-8,50 (m.1Н). Приклад 14 Одержання 1,1,1-трифтор-N-[2-({7-[(E)-2-(6,7дифторхінолін-2-іл)вініл]-5,11 49 80996 дигідро[1]бензоксепіно[3,4-b]піридин-5іл)тіо)етил]метансульфонаміду. Стадія 1: [2-({7-[(Е)-2-(6,7-дифторхінолін-2іл)вініл]-5,11-дигідро[1]бензоксепіно[3,4-b]піридин5-іл)тіо)етанамін. Суміш 0,20г (0,49ммоль) сполуки, яка одержана в прикладі 10, стадія 5, та 0,113г (1,0ммоль) 2-аміноетантіолгідрохлориду в 1,72мл трифтороцтової кислоти перемішують впродовж ночі при кімнатній температурі. Розчин концентрують, додають 2н. NaOH до досягнення лужної реакції та продукт екстрагують етиловим ефіром. Органічний шар промивають водою, сушать, концентрують та одержують 0,23г залишку, який без обробки використовують на наступній стадії. Стадія 2: 1,1,1-трифтор-N-[2-({7-[(Е)-2-(6,7дифторхінолін-2-іл)вініл]-5,11дигідро[1]бензоксепіно[3,4-b]піридин-5іл)тіо)етил]метансульфонамід. 0,13г (0,28ммоль) Продукту, який одержаний на попередній стадії, розчиняють в 25мл дихлорметану. Розчин охолоджують на бані з льодом і додають 0,080мл (0,057г; 0,57ммоль) Ν,Ν,Ν-триетиламіну та 0,046мл (0,077г; 0,28ммоль) трифторметансульфонового ангідриду. Після витримування впродовж 1год. на бані з льодом та 1год. при кімнатній температурі розчин промивають водою, сушать і концентрують. Залишок обробляють за допомогою флешхроматографії на SiO2, шляхом елюювання сумішшю хлороформ/метанол 97:3. Вихід дорівнює 0,048г (28%). 1 Н ЯМР (Cl3CD): 2,60 (t.2H); 3,18 (t.2H); 4,73 (s.1Н); 4,95-5,93 (система AB, 2H); 6,76-6,96 (m.2H); 7,13-7,32 (m.4H); 7,46, 7,90 (m.4H); 8,07 (s.1Н); 8,51-8,52 (m.1Н). Приклад 15 Одержання 1,1,1-трифтор-N-[2-({7-[6,7дифторхінолін-2-іл)метокси]-5,11дигідро[1]бензоксепіно[3,4-b]піридин-5іл)тіо)етил]метансульфонаміду. Стадія 1: 2-({7-[(6,7-дифторхінолін-2іл)метокси]-5,11-дигідро[1]бензоксепіно[3,4b]піридин-5-іл)тіо)етанамін. 50 Використовуючи як вихідну речовину продукт, що одержаний в прикладі 1, стадія 6, і з використанням методики приклада 14, стадія 1, потрібну сполуку одержують із виходом 76%. Стадія 2: 1,1,1-трифтор-N-[2-({7-[(6,7дифторхінолін-2-іл)метокси]-5,11дигідро[1]бензоксепіно[3,4-b]піридин-5іл)тіо)етил]метансульфонамід. Використовуючи як вихідну речовину продукт, одержаний на попередній стадії 6, і з використанням методики приклада 14, стадія 2, необхідну сполуку одержують із виходом 61%. 1 Н ЯМР (Cl3CD): 2,56-2,71 (m.2H); 3,13-3,32 (m.2H); 4,78 (s.1Н); 4,94-5,63 (система AB, 2H); 5,29 (s.2H); 6,87-6,93 (m.2H); 7,03-7,06 (m.1Н); 7,14-7,19 (m.1Н); 7,27 (b.s.1Н); 7,51-7,64 (m.3Н); 7,76-7,83 (m.1Н); 8,10-8,13 (m.1Н); 8,41-8,43 (m.1Н). Приклад 16 Одержання 3-{(9-[(Е)-2-(6,7-дифторхінолін-2іл)вініл]-5,11-дигідро[1]бензоксепіно[4,3-b]піридин11-іл)тіо}пропанової кислоти. Стадія 1: 3-[(4-Бромфенокси)метил]-піридин. Суміш 12,75г (77,73ммоль) 3(хлорметил)піридингідрохлориду, 13,45г (77,73ммоль) 4-бромфенолу та 27,6г (200ммоль) карбонату калію в 100мл метилетилкетону перемішують при кімнатній температурі впродовж 24год. і при 60°С впродовж 4год. Тверді речовини відфільтровують і фільтрат концентрують. Залишок піддають розподілу між водою та діетиловим ефіром. Ефірний шар промивають 2н. розчином NaOH та водою, сушать і концентрують. Одержане масло (12,9г, вихід 49%) твердіє при охолодженні. Стадія 2: 3-[(4-Бромфенокси)метил]піридин-1оксид. 51 12,02г (45,50ммоль) Сполуки, яка одержана на попередній стадії, розчиняють в 40мл дихлорметану. По краплях додають розчин 11,15г (49,7ммоль) 77% 3-хлорбензолкарбопероксоєвої кислоти в 100мл дихлорметану та суміш перемішують впродовж ночі. Розчинник видаляють у вакуумі та залишок розчиняють в 2н. NaOH і невеликій кількості діетилового ефіру. Водний шар потім екстрагують дихлорметаном, що сушать, концентрують та одержують 12,1г твердої речовини (вихід 95%). Стадія 3: 3-[(4-Бромфенокси)метил1піридин-2карбонітрил. 12,1г (43,2ммоль) Сполуки, яка одержана на попередній стадії, суспендують в 50мл толуолу. В інертній атмосфері до неї додають 6,9мл (5,13г; 51,8ммоль) триметилсилілціаніду та 3,98мл (4,64г; 43,2ммоль) диметилкарбамілхлориду та суміш перемішують при 60°С впродовж 20год. Додають діетиловий ефір і розчин промивають 1н. розчином K2СО3 і водою. Органічний шар сушать, концентрують та одержують масло, що кристалізують із етанолу. Вихід дорівнює 10,1г (81%). Стадія 4: 9-бром[1]бензоксепіно[4,3-b]піридин11(5Н)-он. 5,0г (17,3ммоль) Сполуки, яка одержана на попередній стадії, розчиняють в 25мл трифторметансульфонової кислоти та перемішують при кімнатній температурі впродовж ночі. Суміш обережно виливають на суміш льоду з водою та додають надлишок концентрованої хлористоводневої кислоти. Тверду речовину відфільтровують, промивають водою та суспендують він. NaOH. Після перемішування впродовж 1год. при кімнатній температурі тверду речовину відфільтровують і промивають водою. Вихід необхідної сполуки дорівнює 3,9г (77%). Стадія 5: 9-бром-5,11дигідро[1]бензоксепіно[4,3-b]піридин-11-ол. 80996 52 3,9г (13,4ммоль) продукту, який одержаний на попередній стадії, розчиняють в 78мл ТГФ та 39мл метанолу. Суміш охолоджують на бані з льодом і невеликими порціями додають 0,62г (16,3ммоль) борогідриду натрію. Після перемішування при кімнатній температурі впродовж 2год, розчинники видаляють у вакуумі та залишок піддають розподілу між діетиловим ефіром і водою. Ефірний шар промивають водою, сушать і концентрують. Таким способом одержують 2,9г (вихід 73%) необхідної сполуки. Стадія 6: 9-[(Е)-2-(6,7-дифторхінолін-2іл)вініл]-5,11-дигідро[1]бензоксепіно[4,3-b]піридин11-ол. Суміш 0,37г (1,26ммоль) продукту, який одержаний на попередній стадії, 0,27г (1,41ммоль), сполуки, яка одержана в прикладі 10, стадія 4, 0,0085г (0,037ммоль) ацетату паладію(II) і 0,0362г (0,12ммоль) три(о-толіл)фосфіну в 2,5мл диметилформаміду перемішують в інертній атмосфері. При зовнішньому охолодженні льодом по краплях додають розчин 0,27мл (0,19г; 1,9ммоль) Ν,Ν,Ν-триетиламіну в 1,2мл диметилформаміду. Суміш перемішують на бані при 100°С впродовж 1год. Після досягнення кімнатної температури додають 4мл води. Осад відфільтровують, промивають водою та сушать. Вихід потрібного продукту дорівнює 0,5г (98%). Стадія 7: 3-{(9-[(Е)-2-(6,7-дифторхінолін-2іл)вініл]-5,11-дигідро[1]бензоксепіно[4,3-b]піридин11-іл)тіо}пропанова кислота 0,3г (0,74ммоль) Сполуки, яка одержана на попередній стадії, розчиняють в 3мл трифтороцтової кислоти. Додають 0,066мл (0,080г; 0,75ммоль) 3-меркаптопропанової кислоти та суміш кип'ятять зі зворотним холодильником в інертній атмосфері впродовж 16год. Розчинник видаляють у вакуумі та залишок хроматографують на SiO2, шляхом елюювання сумішшю етилацетат/гексан/оцтова кислота 20:10:0,2. Вихід потрібного продукту дорівнює 0,085г (23%). 1 Н ЯМР (d6-ДМСО): 2,64-2,76 (m.4Н); 5,10-6,01 (сисmема АВ, 2Н); 5,40 (S.1H); 6,92 (d.1Н); 7,377,45 (m.2H); 7,59, 7,61 (d.1Н); 7,76, 7,99 (m.6H); 8,34-8,37 (m.1Н); 8,49-8,50 (m.1Н). Приклад 17 53 80996 Одержання 3-{(9-[(6,7-дифторхінолін-2іл)метокси]-5,11-дигідро[1]бензоксепіно[4,3b]піридин-11-іл)тіо}пропанової кислоти. Стадія 1: Фуро[3,4-b]піридин-7(5Н)-он. Цю сполуку одержують відповідно до роботи [J. Med. Chem.1995, 38, 496-507]. Стадія 2: 3-[(4Метоксифенокси)метил]піридин-2-карбонова кислота. 14,77г (119ммоль) 4-метоксифенолу суспендують в 50мл метанолу. Додають 22,6мл (119ммоль) 30% розчину метоксиду натрію в метанолі. Розчин концентрують досуху та додають 24,1г (178ммоль) лактону, який одержаний на попередній стадії, 12г хлориду натрію та 300мл ксилолу (суміш ізомерів, класифікація "розчинник"). Суміш кип'ятять зі зворотним холодильником впродовж 2год. Після досягнення кімнатної температури тверду речовину відфільтровують, промивають етиловим ефіром і розчиняють в 0,2н. NaOH. Тверду речовину відфільтровують і фільтрат роблять слабкокислим (рН 5) за допомогою 2н. НСI. Тверду речовину відфільтровують, промивають водою та сушать. Вихід дорівнює 24,1г (52%). Стадія 3: 3-[(4Метоксифенокси)метил]піридин-2-карбоксамід. 2,0г (7,7ммоль) Сполуки, яка одержана на попередній стадії, розчиняють в 50мл дихлорметану. Додають 1,26г (7,7ммоль) 1,1'карбонілбіс-1Н-імідазолу та суміш перемішують при кімнатній температурі впродовж 30хв. По краплях додають 35мл насиченого розчину ΝΗ3 в етанолі та перемішування продовжують впродовж ночі. Розчинник випарюють, до залишку додають воду й тверду речовину відфільтровують, промивають водою та сушать. Вихід потрібного продукту дорівнює 1,5г (75%). Стадия 4: 3-[(4Метоксифенокси)метил]піридин-2-карбонітрил. 54 0,6г (2,3ммоль) Продукту, який одержаний на попередній стадії, розчиняють в 25мл дихлорметану. Додають 0,4мл (0,29г; 2,8ммоль) Ν,Ν,Ν-триетиламіну та 0,4мл (0,59г; 5,2ммоль) трифтороцтової кислоти та суміш перемішують при кімнатній температурі впродовж 1год. Розчин промивають водою, розведеним розчином NаНСО3, потім знову водою, сушать і концентрують. Залишок кристалізують із суміші діетиловий ефір/діізопропіловий ефір. Вихід необхідної сполуки дорівнює 0,56г (100%). Стадія 5: 9-Метокси[1]бензоксепіно[4,3b]піридин-11(5Н)-он. 0,55г (2,2ммоль) Сполуки, яка одержана на попередній стадії, розчиняють в 4мл трифторметансульфонової кислоти та перемішують при кімнатній температурі впродовж ночі. Розчин виливають у надлишкову кількість льоду та суміш підлуговують за допомогою 8н. NaOH. Продукт екстрагують діетиловим ефіром, сушать і концентрують. Залишок розчиняють у діізопропіловому ефірі та фільтрують. Вихід дорівнює 0,4г (72%). Стадія 6: 9-Гідрокси[1]бензоксепіно[4,3b]піридин-11(5Н)-он. 0,9г (3,7ммоль) Сполуки, яка одержана на попередній стадії, суспендують в 18мл 48% водного розчину бромноватистої кислоти та суміш перемішують при 125°С впродовж 3,5год. Суміш підлуговують за допомогою 8н. NaOH, тверду речовину відфільтровують і фільтрат підкисляють оцтовою кислотою. Жовту тверду речовину відфільтровують, промивають водою та сушать. Вихід дорівнює 0,8г (94%). Стадія 7: 9-[(6,7-дифторхінолін-2іл)метокси][1]бензоксепіно[4,3-b]піридин-11(5Н)-он. Використовуючи як вихідні сполуки попередню сполуку та сполуку, що одержані в прикладі 1, 55 80996 56 стадія 4, і згідно з методикою приклада 1, стадія 5, (1,23ммоль) продукту, який одержаний в прикладі необхідну сполуку одержують із виходом 98%. 7, стадія 1, і суміш перемішують при 45°С Стадія 8: 9-[(6,7-дифторхінолін-2-іл)метокси]впродовж 36год. Розчин концентрують і залишок 5,11-дигідро[1]бензоксепіно[4,3-b]піридин-11-ол. піддають розподілу між дихлорметаном і водою. Органічний шар промивають водою, 4% розчином NaHCO3, 1% розчином лимонної кислоти, ще раз водою, сушать і концентрують. Необхідна сполука кристалізується із суміші дихлорметан/діетиловий ефір. Вихід дорівнює 0,17г (52%). 1 Н ЯМР (d6-ДМСО): 0,24-0,56 (m.4Н); 2,10-2,32 (сисmема АВ, 2Н); 2,62 (s.2H); 4,95-5,78 (сисmема АВ, 2Н); 5,17 (s.1Н); 5,31 (s.2H); 6,81-6,84 (m.1Н); 6,91-6,94 (m.1Н); 7,06-7,07 (m.1Н); 7,69-7,76 Використовуючи як вихідну попередню (m.2H); 8,00-8,13 (m.2H); 8,40-8,44 (m.2H); 12,02 сполуку та згідно з методикою приклада 1, стадія (s.1Н). 6, необхідну сполуку одержують із виходом 85%. Приклад 19 1 6 Н ЯМР (d -ДМСО): 5,12-5,63 (система АВ, Одержання 7-[(6,7-дифторхінолін-22Н); 5,28 (s.2H); 5,78 (s.1Н); 6,11 (b.s.1Н); 6,79-6,98 іл)метокси1-5-([2-(1Н-тетразол-5-іл)метил]тіо}(m.2H); 7,12-7,19 (m.1Н); 7,31-7,42 (m.1Н); 7,635,11-дигідро[1]бензоксепіно[3,4-b]піридину. 7,83 (m.2H); 8,00-8,18 (d.2H); 8,39-8,42 (d.2H). Стадія 1: ({7-[(6,7-дифторхінолін-2-іл)метокси]Стадія 9: 3-{(9-[(6,7-дифторхінолін-25,11-дигідро[1]бензоксепіно[3,4-b]піридин-5іл)метокси]-5,11-дигідро[1]бензоксепіно[4,3іл}тіо)ацетонітрил. b]піридин-11-іл)тіо}пропанова кислота. 0,3г (0,73ммоль) Сполуки, яка одержана на попередній стадії, розчиняють в 3мл трифтороцтової кислоти. Додають 0,15мл (0,18г; 1,72ммоль) 3-меркаптопропанової кислоти та суміш перемішують при 45°С впродовж 5год. Розчин концентрують і залишок піддають розподілу між дихлорметаном і водою. Органічний шар промивають водою, 4% розчином NaHCO3, 1% розчином лимонної кислоти, ще раз водою, сушать і концентрують. Необхідна сполука кристалізується з дихлорметану. Вихід дорівнює 0,18г (49%). 1 Н ЯМР (d6-ДМСО): 2,63-2,73 (m.4Н); 4,97-5,75 (сисmема АВ, 2Н); 5,32 (s.2H); 5,76 (s.1Н); 6,826,95 (m.2H); 7,20 (s.1Н); 7,36-7,40 (m.1Н); 7,72-7,77 (m.2H); 8,01-8,14 (m.2H); 8,43-8,46 (m.2H). Приклад 18 Одержання 1-{[(9-[(6,7-дифторхінолін-2іл)метокси[-5,11-дигідро[1]бензоксепіно[4,3b]піридин-11-іл)тіо]метил)циклопропілоцтової кислоти. 0,25г (0,61ммоль) Сполуки, яка одержана в прикладі 17, стадія 8, розчиняють в 2,5мл трифтороцтової кислоти. Додають 0,18г Суміш 0,3г (0,74ммоль) продукту, який одержаний в прикладі 1, стадія 6, і 0,3г (0,74ммоль) реагенту Лоуессона (2,4-біс(4метоксифеніл)-1,3,2,4-дитіадифосфетан-2,4дисульфід) в 30мл толуолу кип'ятять зі зворотним холодильником впродовж 15хв. Розчин промивають водою, сушать і концентрують. Залишок розчиняють в 25мл дихлорметану та додають 0,07г (0,93ммоль) хлорацетонітрилу та 0,14мл (0,10г; 1,0ммоль) Ν,Ν,Ν-триетиламіну. Суміш перемішують впродовж ночі при кімнатній температурі. Розчин промивають водою, сушать, концентрують і хроматографують на SiO2, шляхом елюювання сумішшю дихлорметан/метанол 98:2. Вихід потрібного продукту дорівнює 0,12г (35%). Стадия 2: 7-[(6,7-дифторхінолін-2-іл)метокси]5-{[2-(1Н-тетразол-5-іл)метил]тіо}-5,11дигідро[1]бензоксепіно[3,4-b]піридин. 0,12г (0,26г) Сполуки, яка одержана на попередній стадії, і 0,17г (0,5ммоль) азотрибутилолова нагрівають при 110°С впродовж 2год. Залишок хроматографують на SiO2, шляхом елюювання сумішшю дихлорметан/метанол/водний розчин аміаку 40:8:1. Вихід дорівнює 0,08г (60%). 57 80996 58 Н ЯМР (Cl3CD): 3,90 (s.2H); 4,85 (s.1Н);4,98сушать і концентрують. Залишок хроматографують 5,64 (система AB, 2H); 5,30 (s.2H); 6,90-6,87 на діоксиді кремнію, шляхом елюювання сумішшю (m.2H); 6,99-7,02 (m.1Н); 7,14-7,18 (m.1Н); 7,53гексан/етилацетат 7:3. Вихід: 0,36г (32%). 7,66 (m.3H); 7,79-7,85 (m.1Н); 8,14-8,17 (d.1Н); Стадія 2: 7-аміно-11-метил-10,118,44-8,47 (m.1Н). дигідробензо[е]піридо[2,3-b]азепін-5-он. Приклад 20 Одержання 7-[(6,7-дифторхінолін-2іл)метокси]-5-{[2-(1Н-тетразол-5-іл)етил]тіо}-5,11дигідро[1]бензоксепіно[3,4-b]піридину. 1 Цю сполуку одержують згідно з методикою приклада 19, заміняючи хлорацетонітрил на 3хлорпропаннітрил, з виходами 30% та 70%, відповідно. 1 Н ЯМР (Cl3CD): 2,65-3,12 (m.2H); 2,81-2,85 (m.2H); 4,71 (s.1Н); 5,03-5,69 (система AB, 2H); 5,33 (s.2H); 6,80-6,81 (m.1Н); 6,87-6,91 (m.1Н); 7,03-7,06 (m.1Н); 7,15-7,19 (m.1Н); 7,55-7,65 (m.3H); 7,80-7,86 (s.1Н); 8,14-8,17 (s.1Н); 8,45-8,46 (s.1Н). Приклад 21 Одержання 3-[7-(6,7-дифторхінолін-2ілметокси)-11-метил-10,11-дигідро-5Нбензо[е]піридо[2,3-b]азепін-5-ілсульфаніл]пропіонової кислоти. Стадія 1: 11-метил-10,11дигідробензо[е]піридо[2,3-b]азепін-5-он. Цю сполуку одержують відповідно до [DD 80449]. Стадія 2: 11-метил-7-нітро-10,11дигідробензо[е]піридо[2,3-b]азепін-5-он. 1,0г (4,46ммоль) продукту, який одержаний на стадії 1, розчиняють в 35мл концентрованої сірчаної кислоти. При підтримуванні температури суміші в проміжку від -5 до -10°С при перемішуванні порціями додають 0,45г (4,28ммоль) нітрату калію. Суміш перемішують при цій температурі впродовж ще 1год. і витримують у морозильнику впродовж 48год. Розчин виливають на лід, підлуговують водним розчином аміаку й екстрагують дихлорметаном. Органічний шар 0,26г (0,96ммоль) Сполуки, яка одержана на попередній стадії, розчиняють в 5,2мл оцтові кислоти та розчин нагрівають до 90°С. Порціями додають 0,78г (3,45ммоль) дигідрату хлориду олова(ll). Після завершення додавання розчин перемішують впродовж ще 10-15хв, виливають на лід, підлуговують за допомогою 2н. NaOH й екстрагують дихлорметаном. Екстракти сушать, концентрують та одержують 0,21г продукту (91%), достатньо чистого для подальшої роботи. Стадія 3: 7-гідрокси-11-метил-10,11дигідробензо[е]піридо[2,3-b]азепін-5-он. 0,082г (1,12ммоль) Нітриту натрію впродовж 10хв додають до 0,8мл сірчаної кислоти. Суміш потім нагрівають при 70°С до одержання прозорого розчину. Після цього температуру підтримують на рівні від 25 до 35°С і повільно додають розчин 0,26г (1,08ммоль) аміну, який одержаний на попередній стадії, в 2,3мл оцтові кислоти. Після завершення додавання суміш перемішують впродовж 10хв і цей розчин при кип'ятінні зі зворотним холодильником і при ефективному перемішуванні по краплях додають до 22мл 10% сірчаної кислоти. Через 15хв кип'ятіння зі зворотним холодильником розчин концентрують, залишок підлуговують 2н. розчином NaOH і підкисляють оцтовою кислотою до рН 5. Продукт екстрагують етилацетатом, промивають водою, сушать і концентрують. Вихід чистого фенолу дорівнює 0,24г (92%). Стадія 4: 7-(6,7-дифторхінолін-2-ілметокси)-11 -метил-10,11-дигідробензо-[е]піридо[2,3-b]азепін-5он. 0,24г (1,0ммоль) Фенолу, який одержаний на попередній стадії, розчиняють в 5мл сухого ДМФ і додають 0,0376г (1,0ммоль) 60% гідриду натрію в мінеральному маслі. Після перемішування при 59 80996 60 бензо[е]піридо[2,3-b]азепін-5-ілсульфаніл]кімнатній температурі впродовж 20хв додають пропіонової кислоти. 0,267г (1,0ммоль) продукту, який одержаний в прикладі 1, стадія 4, і суміш перемішують впродовж 16год. при кімнатній температурі. Розчинник видаляють і залишок піддають розподілу між дихлорметаном і водою. Органічний шар промивають водою, сушать і концентрують. Вихід: 0,40г (96%). Стадія 5: 7-(6,7-дифторхінолін-2-ілметокси)-11метил-10,11-дигідро-5Н-бензо[е]піридо[2,3b]азепін-5-ол. 0,4г (0,95ммоль) Кетону, який одержаний на попередній стадії, розчиняють в 7мл ТГФ і додають 2,3мл метанолу. Розчин охолоджують на бані з льодом і порціями при перемішуванні додають 0,043г (1,1ммоль) борогідриду натрію. Через 1год. перемішування при кімнатній температурі розчинники видаляють і залишок перемішують із водою впродовж 30хв. Залишок відфільтровують, промивають водою та сушать. Вихід: 0,28г (75%). Стадія 6: 3-[7-(6,7-дифторхінолін-2-ілметокси)11-метил-10,11-дигідро-5Н-бензо[е]піридо[2,3b]азепін-5-ілсульфаніл]-пропіонова кислота. Використовуючи як вихідну речовину продукт, одержаний в прикладі 21, стадія 3, шляхом заміни алкілуючого реагента на відповідний із приклада 3, стадія 2, і потім діючи так, як у попередньому прикладі, потрібний продукт одержують із виходами, близькими до описаних раніше. 1 Н ЯМР (Cl3CD): 2,68-2,73 (m.6H); 3,22 (s.3H); 3,82-5,75 (сисmема АВ, 2Н); 4,90 (s,1H); 5,35 (s.2H); 6,50-6,54 (m.1Н); 6,85-6,86 (m.1Н); 6,89-6,92 (m.1Н); 7,14-7,16 (d.1H); 7,37-7,40 (m.1Н); 7,51-7,54 (d.1Н); 7,65-7,68 (d.1Н); 8,04-8,06 (m.1Н); 8,06-8,11 (d.1Н); 8,19-8,21 (d.1Н). Приклад 23 Одержання 3-[7-(7-хлор-6-фторхінолін-2ілметокси)-10,11-дигідро-5Нбензо[4,51циклогепта[1,2-b]піридин-5ілсульфаніл]-пропіонової кислоти. Стадія 1: Етиловий ефір 2-метил-нікотинової кислоти. Цю сполуку одержують відповідно до роботи [Arzneim.Forsch. 1968, 18, 756]. Стадія 2: 2-[2-(4-Метоксифеніл)-вініл]нікотинова кислота. 0,17г (0,40ммоль) Спирту, який одержаний на попередній стадії, суспендують в 5мл дихлорметану. Додають 3,5мл трифтороцтової кислоти та 0,0882г (0,83ммоль) 3меркаптопропіонової кислоти та суміш перемішують при 45°С впродовж 16год. Розчинники видаляють і залишок піддають розподілу між дихлорметаном і водою. Органічний шар промивають водою, сушать і концентрують. Залишок хроматографують на SiO2, шляхом елюювання сумішшю етилацетат/гексан 6:4, і одержують 0,074г продукту (36%). 1 Н ЯМР (d6-ДМСО): 2,37-2,63 (m.6H); 3,14 (s.3H); 4,03-5,59 (система АВ, 4Н); 5,13 (s.1Н); 5,36 (s.2H); 6,54-6,58 (m.1Н); 6,96-6,99 (m.1Н); 7,08-7,09 (m.1Н); 7,29-7,31 (m.1Н); 7,42-7,45 (m.1Н); 7,677,69 (d.1Н); 7,98-8,12 (m.3H); 8,40-8,43 (d.1Н); 12,24 (b.s.1Н). Приклад 22 Одержання 3-[7-(7-хлор-6-фторхінолін-2ілметокси)-11-метил-10,11-дигідро-5Н Суміш 5,0г (30,26ммоль) сполуки, яка одержана на попередній стадії, та 7,74г (56,8ммоль) ганусового альдегіду нагрівають при 120°С. Додають 3,9г (28,6ммоль) безводного хлориду цинку та суміш нагрівають при 180°С для можливості відгону етанолу, що утворився. Через 2год. тверда речовина кристалізується, потім додають розчин 4,9г гідроксиду натрію в 41мл води. Після перемішування для руйнування агрегатів неорганічні солі відфільтровують і фільтрат промивають етиловим ефіром і нейтралізують оцтовою кислотою. Тверду речовину, що осіла, відфільтровують, промивають водою та перекристалізовують з етанолу. Вихід: 5,2г (67%).
ДивитисяДодаткова інформація
Назва патенту англійськоюTricyclic derivatives as ltd4 antagonists, process for the preparation thereof, intermediate, pharmaceutical composition based thereon, use thereof
Автори англійськоюPuig Duran Carlos, Perez Crespo Daniel, Bach Tana Jordi, Ryder Hamish
Назва патенту російськоюТрицикличиские производные как антагонисты ltd4, способ их получения, промежуточное соединение, фармацевтическая композиция на их основе, их применение
Автори російськоюПуйг Дуран Карлос, Перес Креспо Даниэль, Бач Тана Хорди, Райдер Хеймиш
МПК / Мітки
МПК: C07D 471/04, C07D 401/12, A61P 29/00, C07D 491/044, A61P 37/00, C07D 491/04
Мітки: антагоністи, похідні, одержання, ltd4, сполука, застосування, проміжна, композиція, фармацевтична, основі, трициклічні, спосіб
Код посилання
<a href="https://ua.patents.su/46-80996-triciklichni-pokhidni-yak-antagonisti-ltd4-sposib-kh-oderzhannya-promizhna-spoluka-farmacevtichna-kompoziciya-na-kh-osnovi-kh-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Трициклічні похідні як антагоністи ltd4, спосіб їх одержання, проміжна сполука, фармацевтична композиція на їх основі, їх застосування</a>
Попередній патент: Штам бактерій bacillus subtilis – продуцент позаклітинної днк, збагаченої неметильованим цитозином
Наступний патент: Конденсатор із плівковім діелектриком для свердловинних пристроїв
Випадковий патент: Ваги












