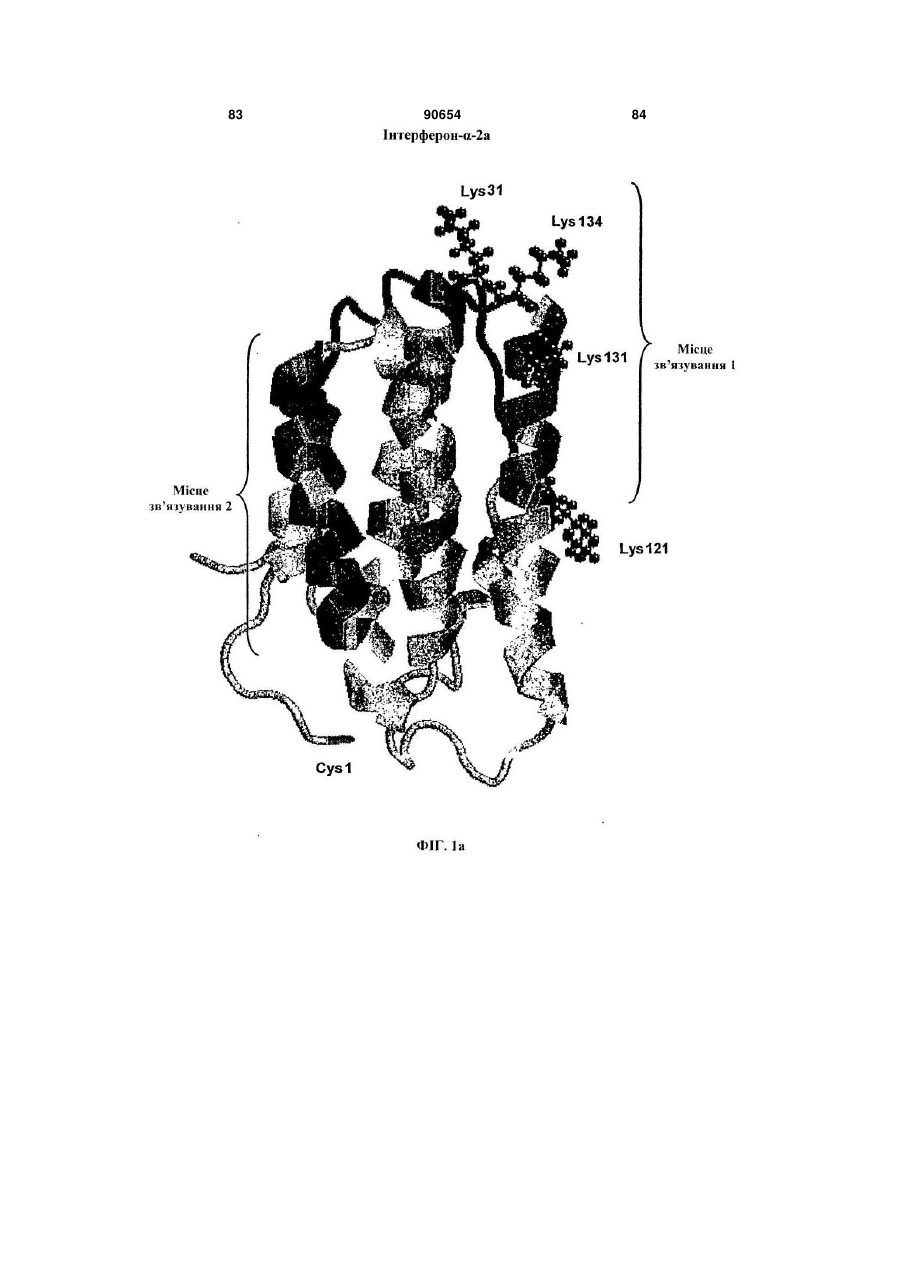
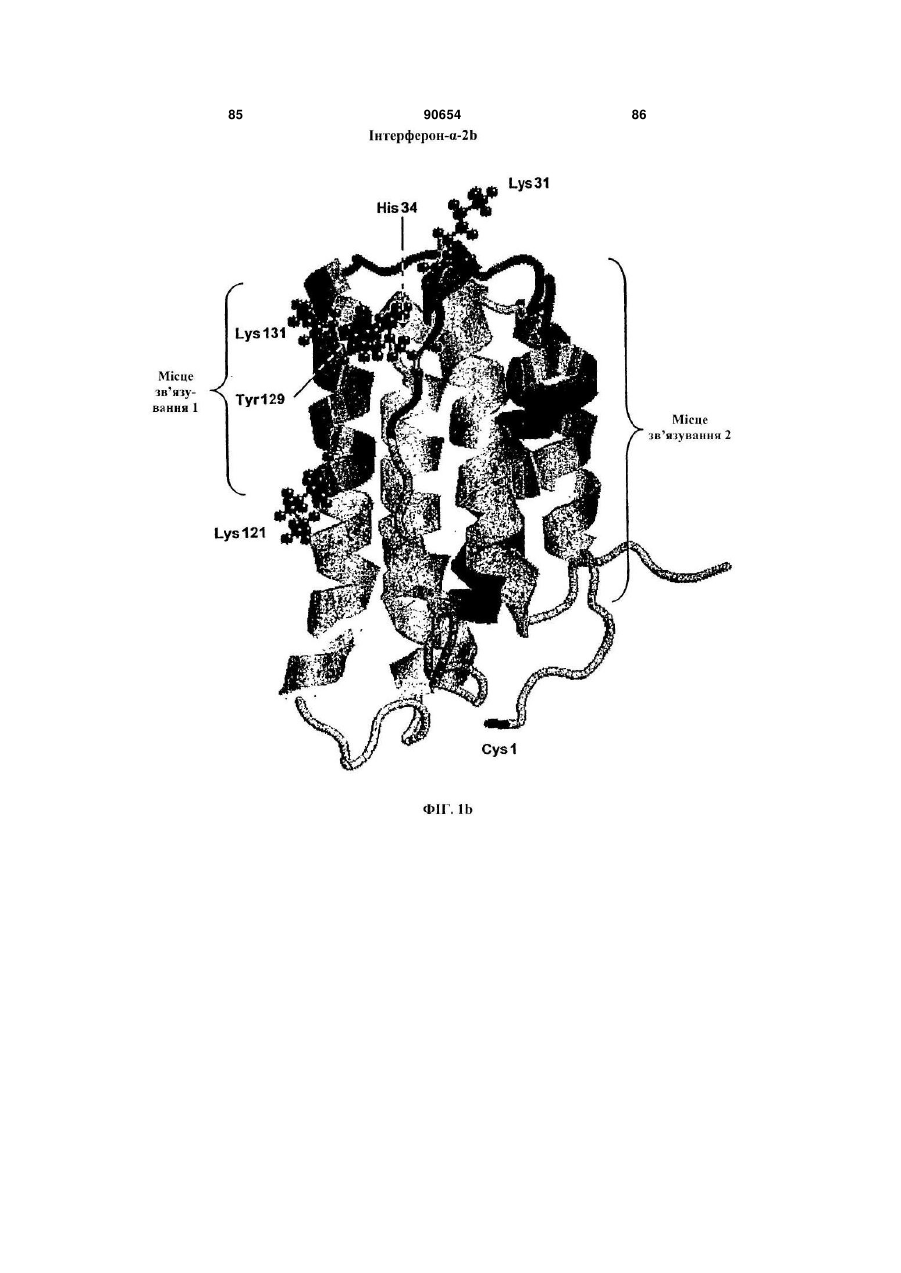
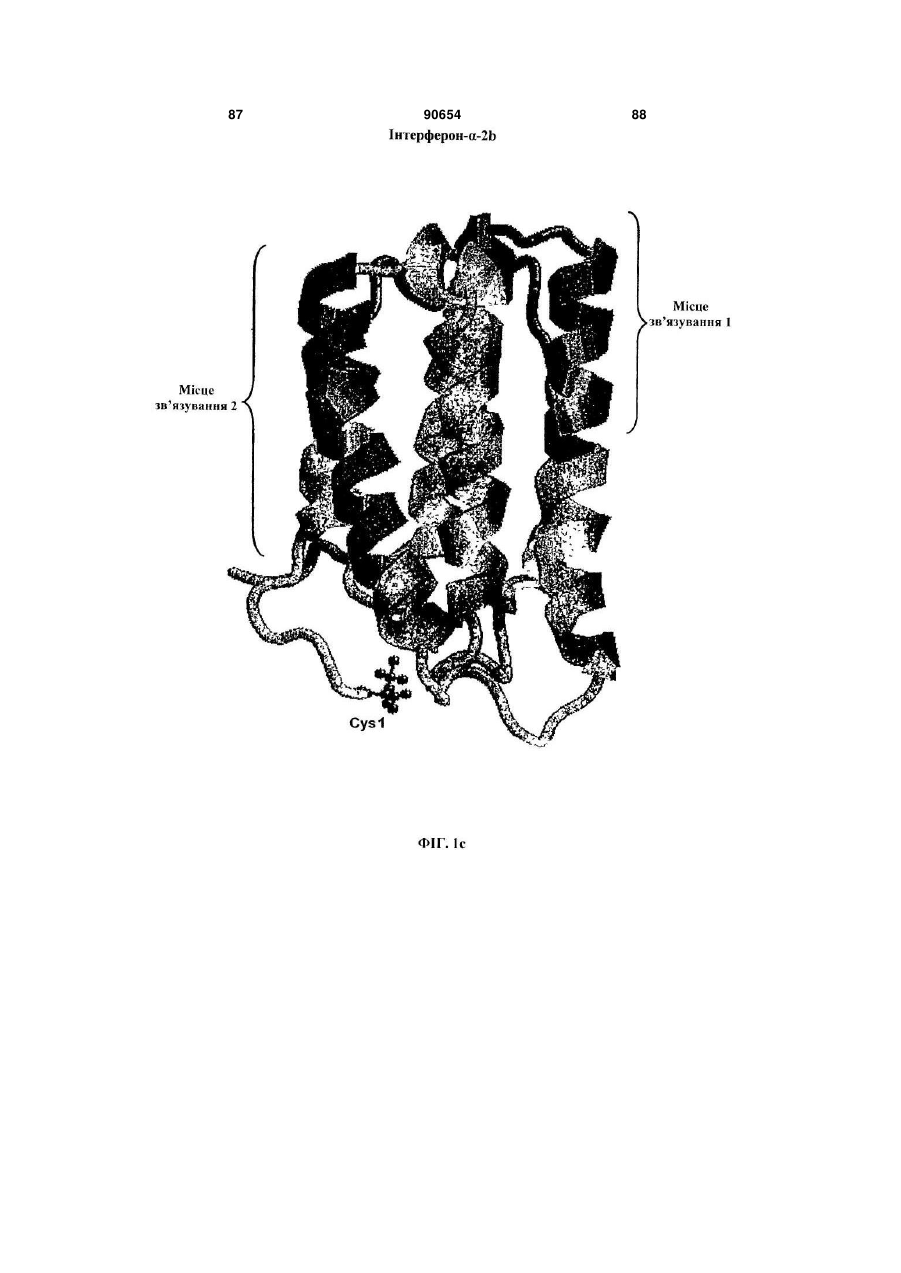
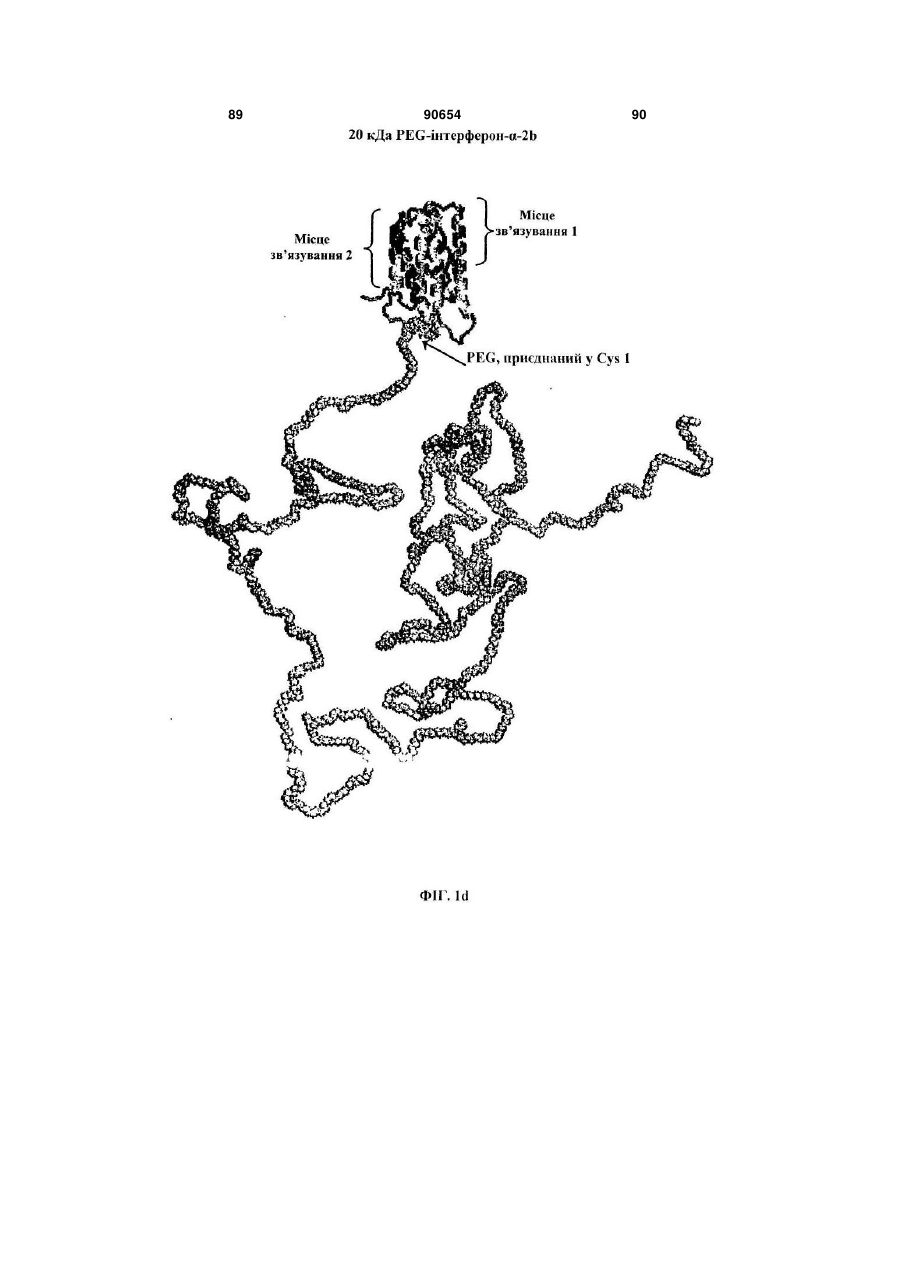
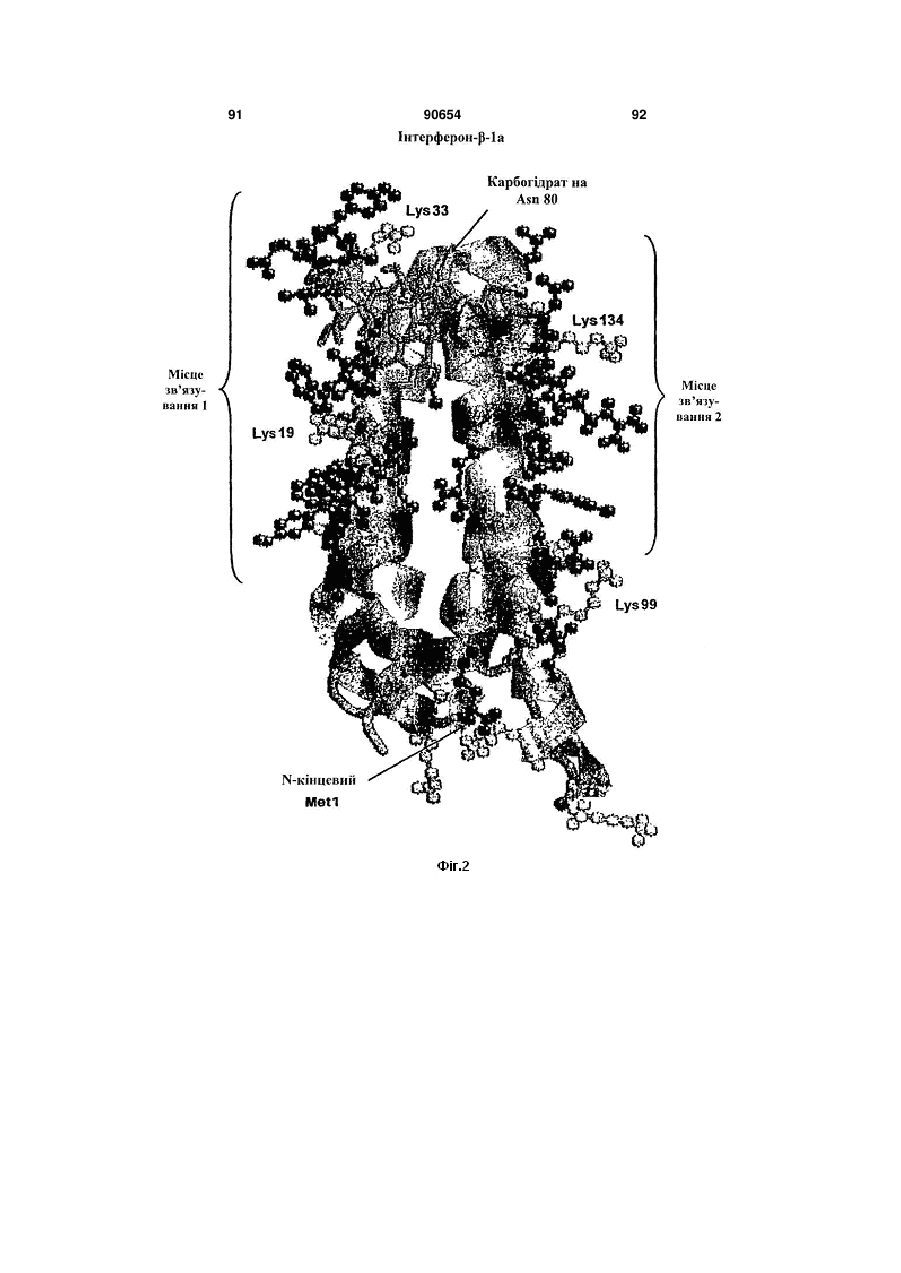
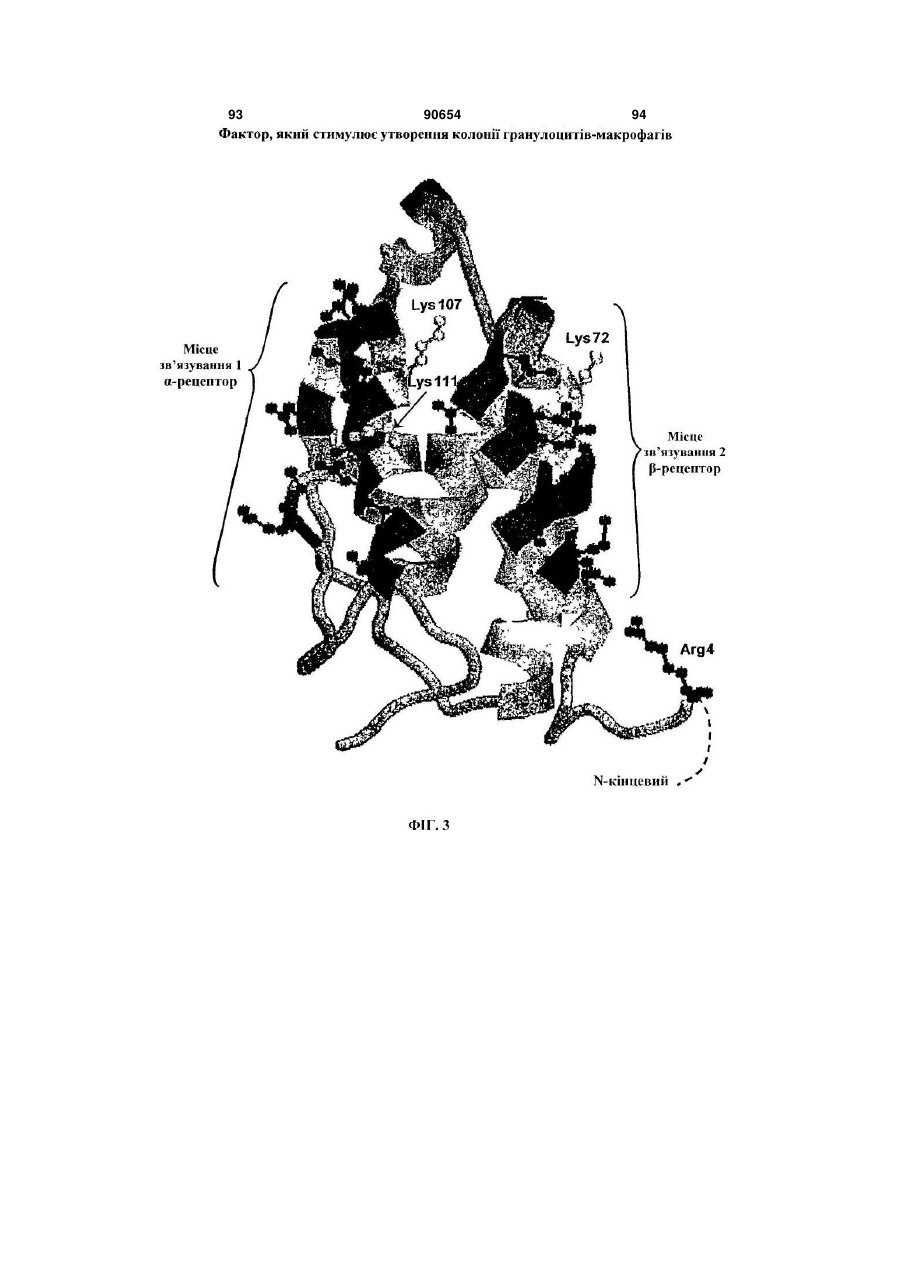
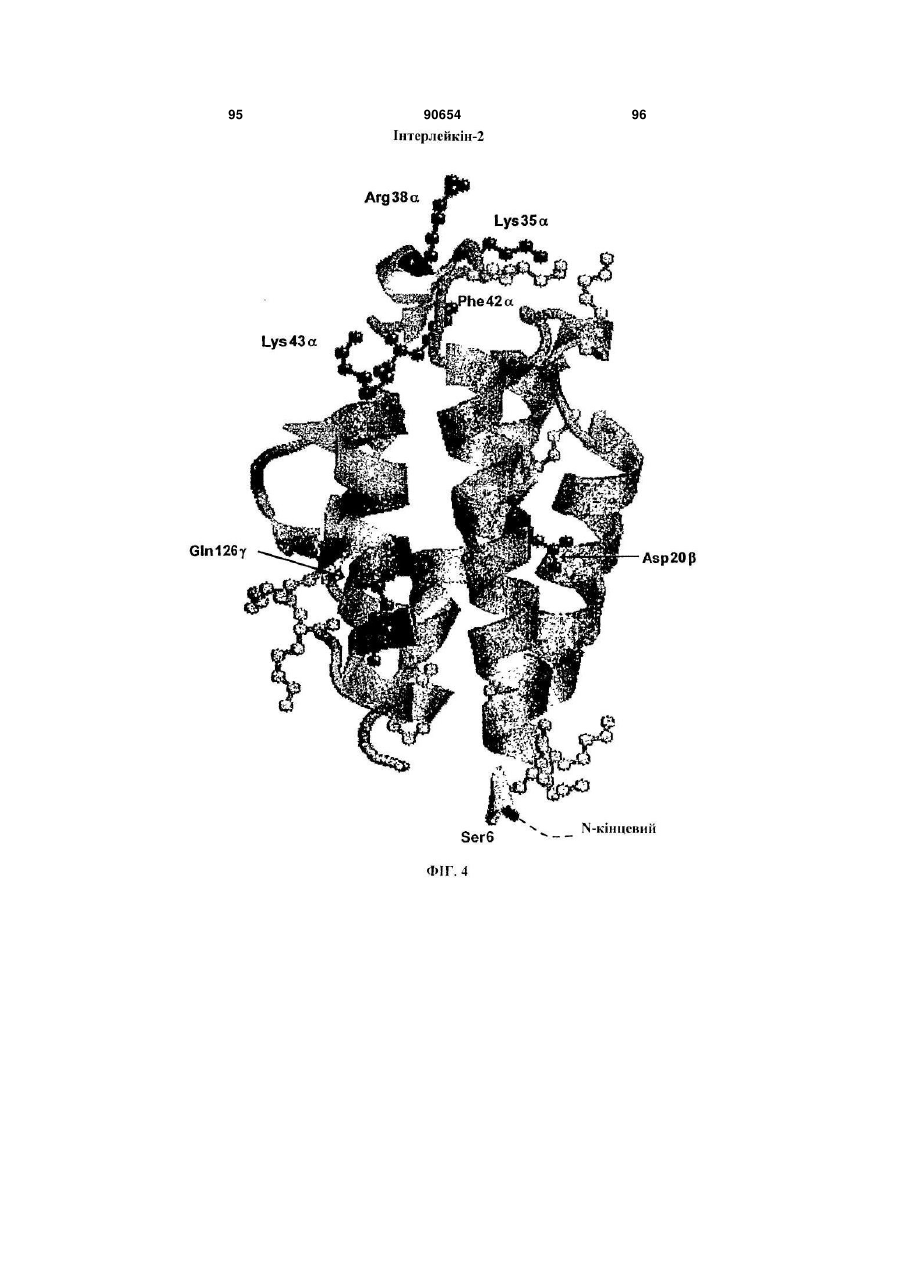
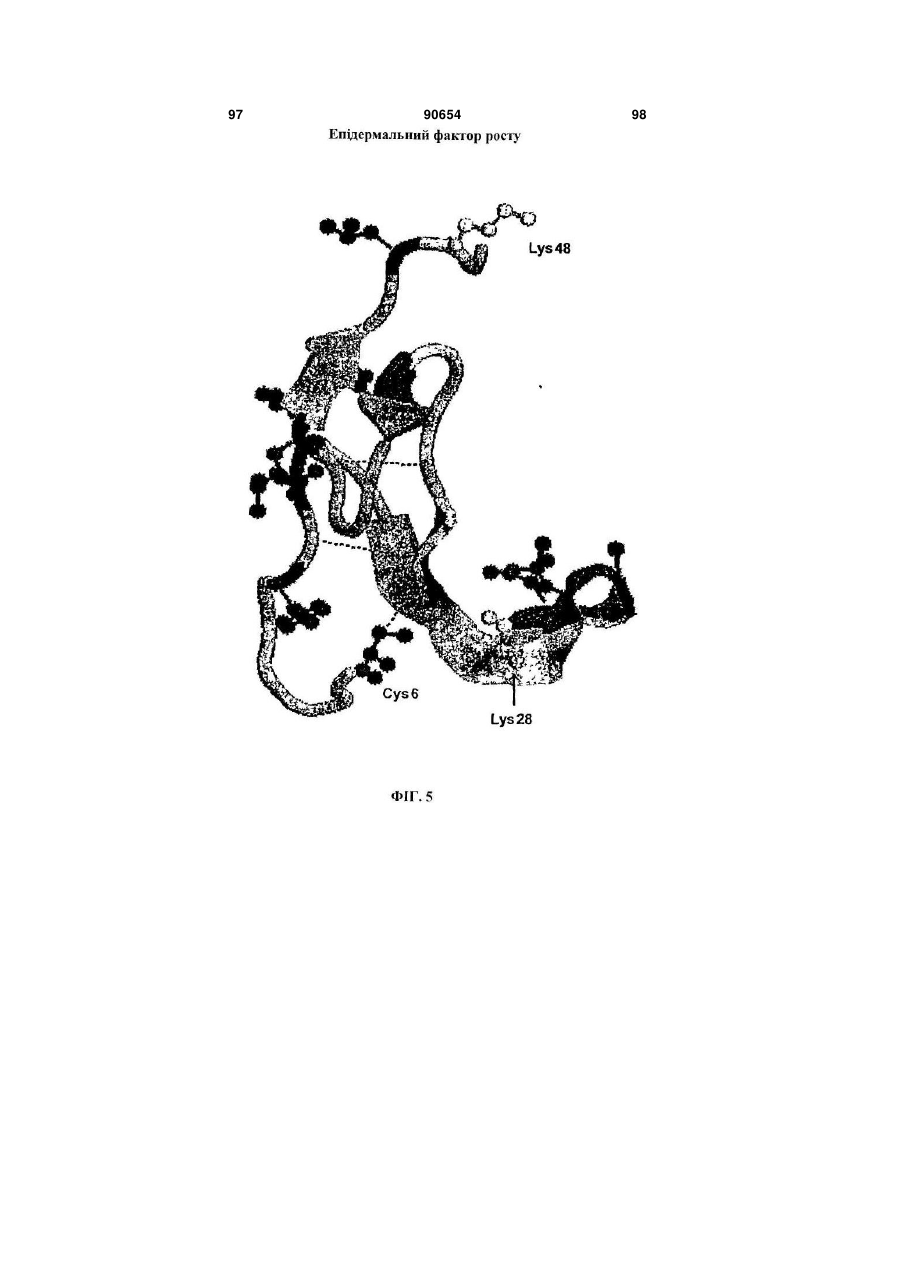
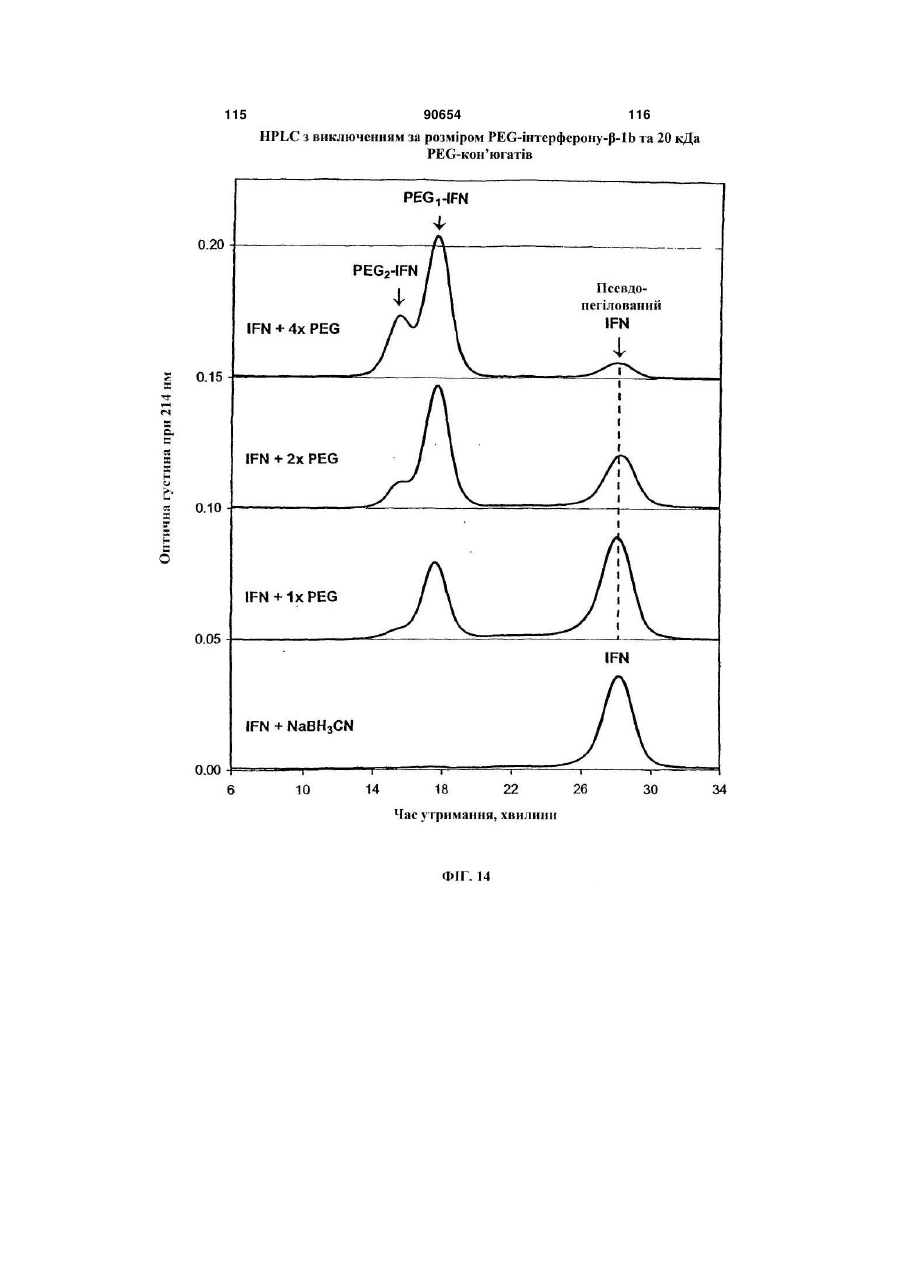
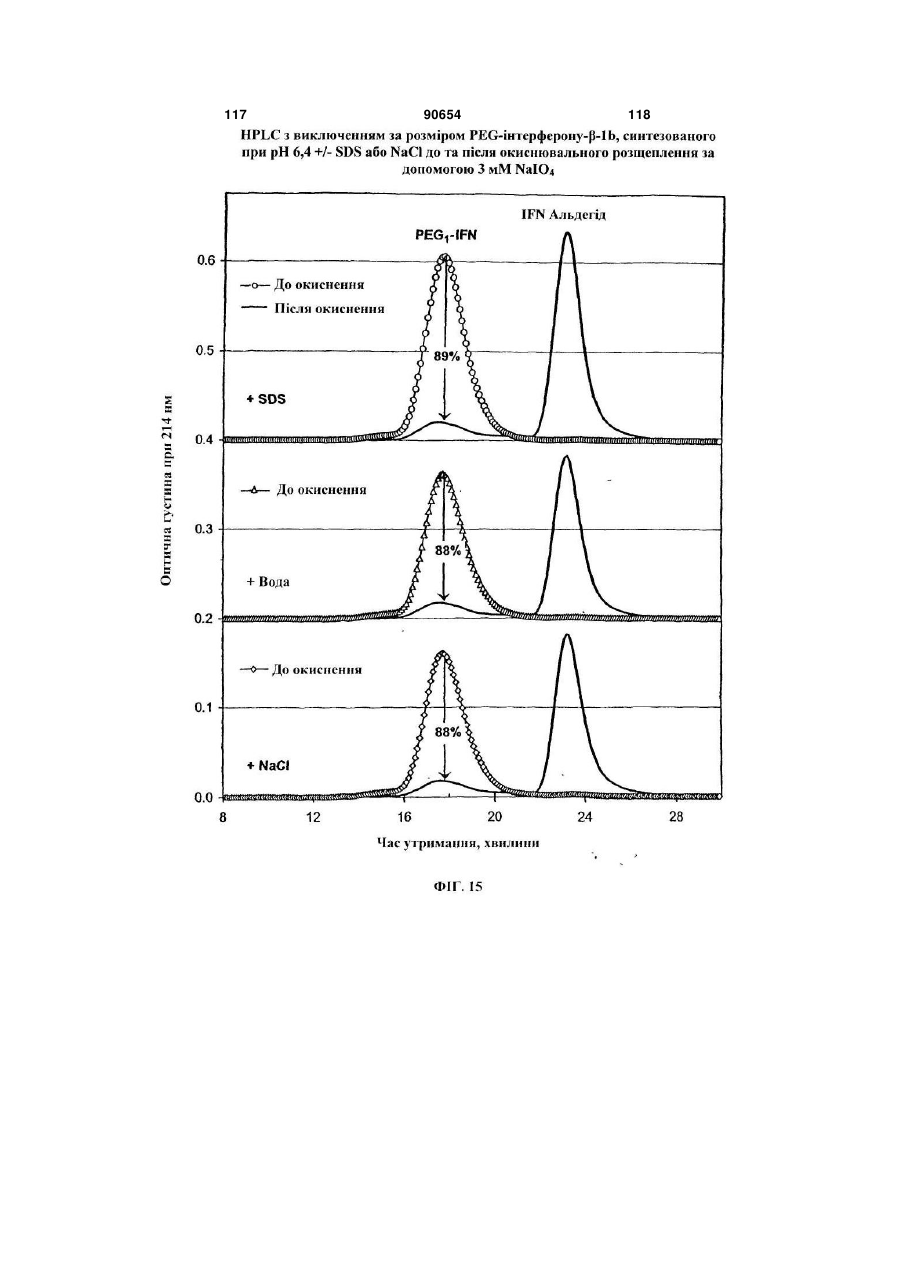
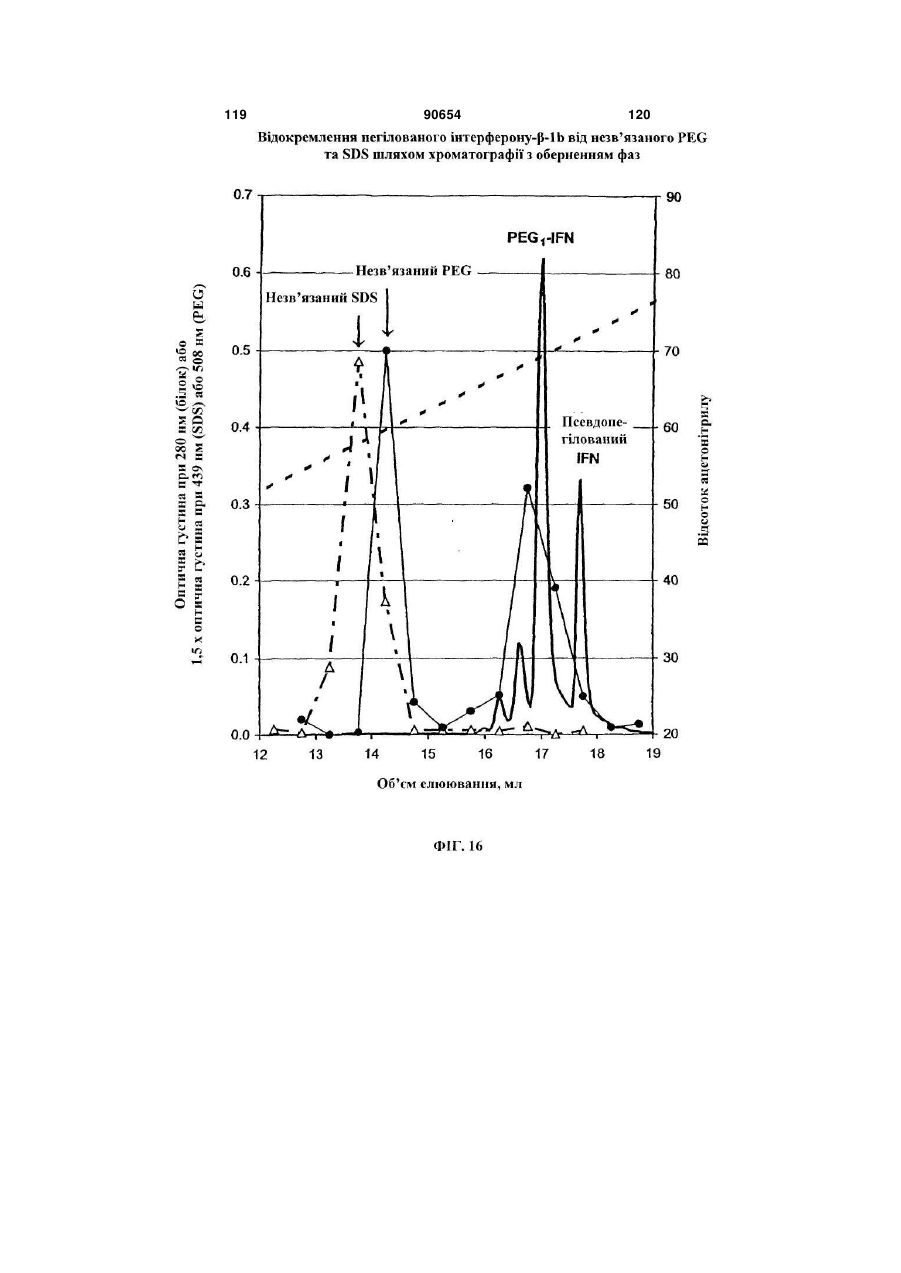
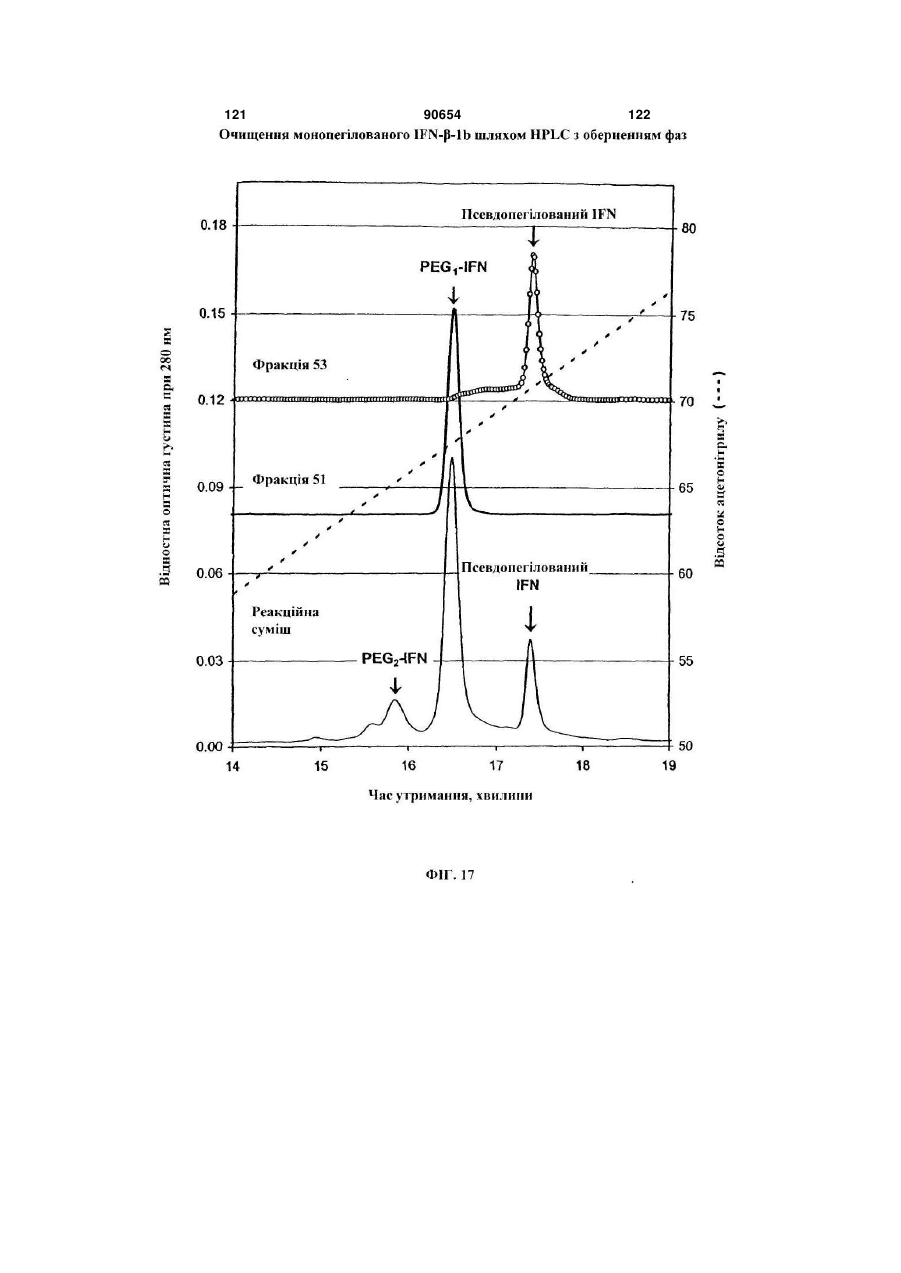
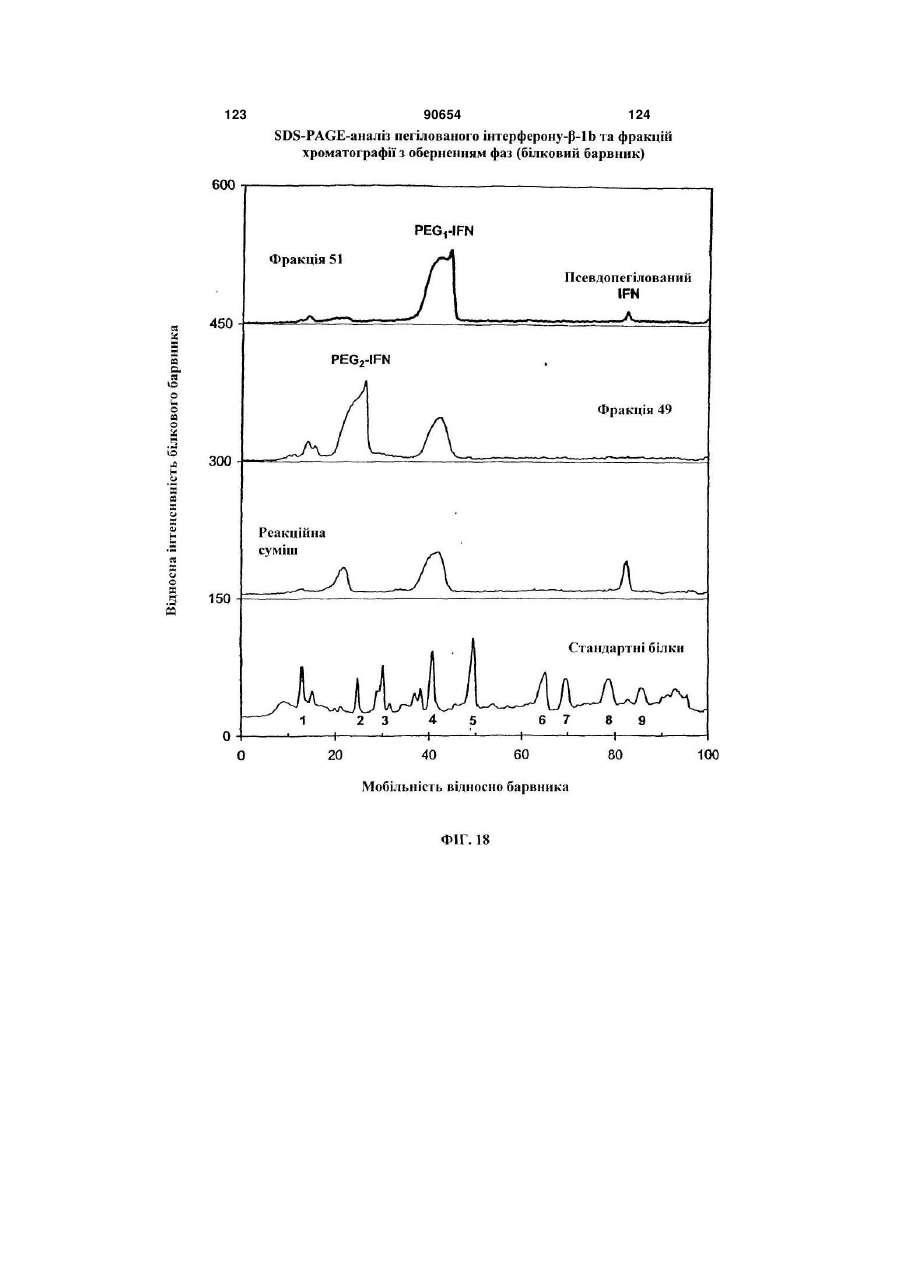
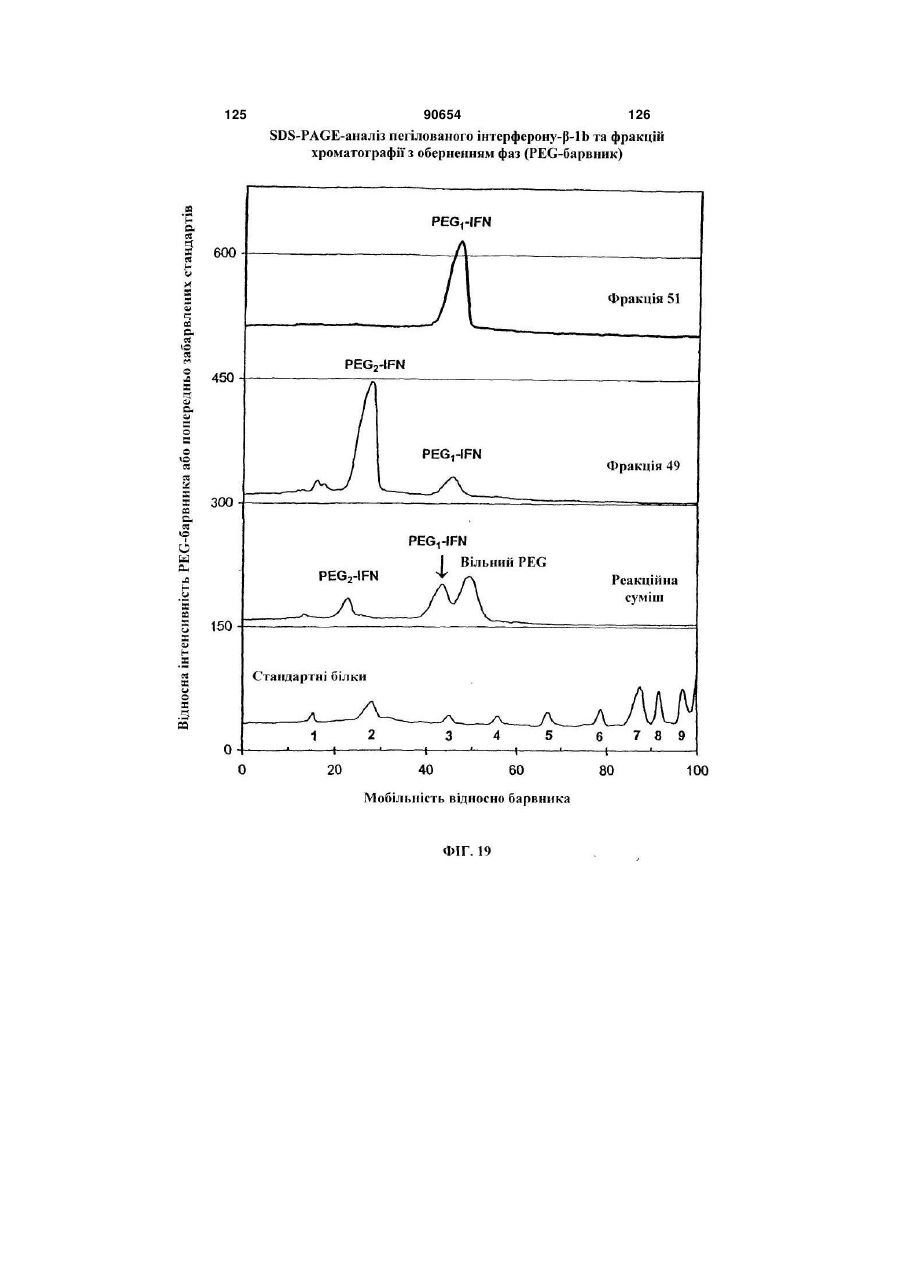
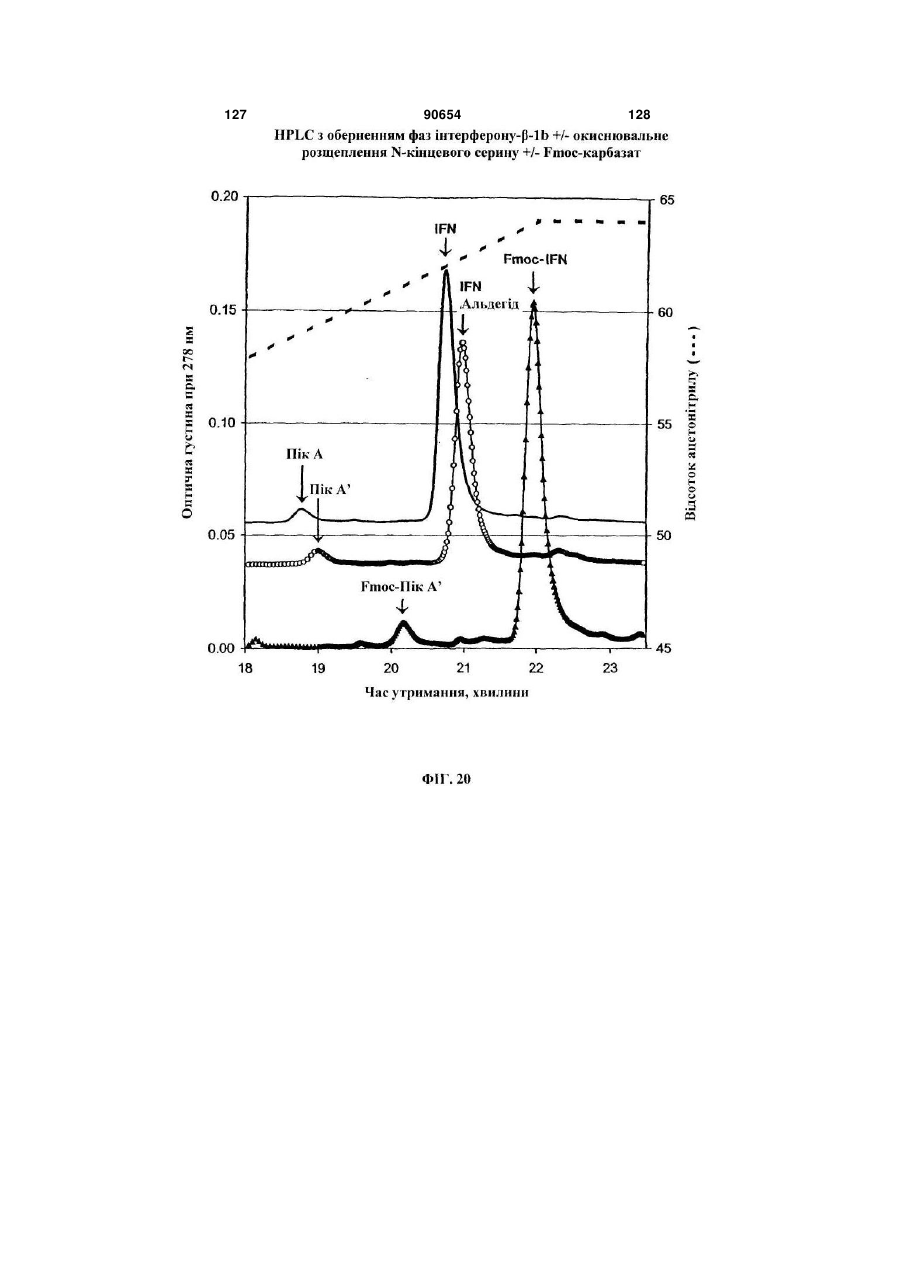
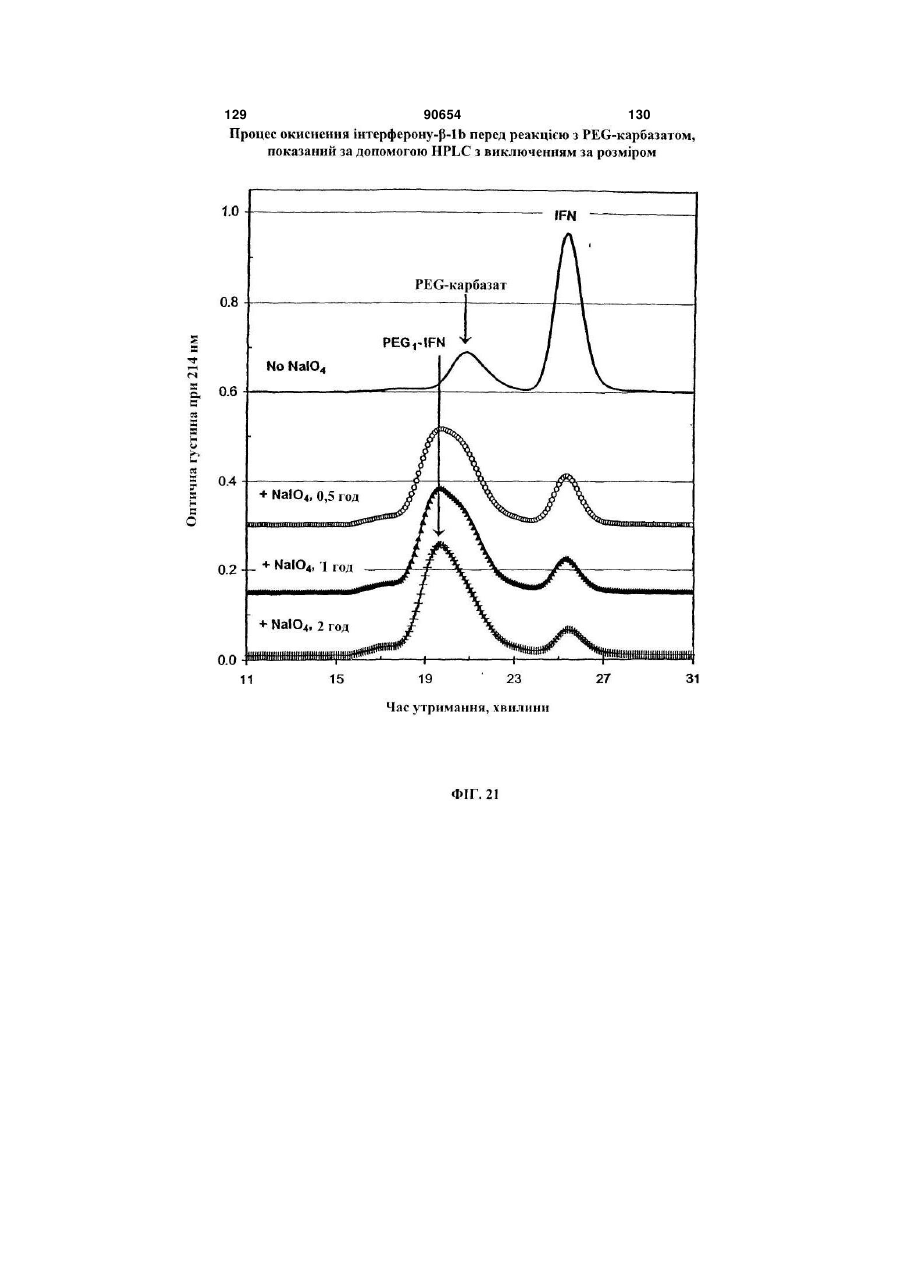
Полімерні кон’югати інтерферону-бета з підвищеною біологічною активністю
Номер патенту: 90654
Опубліковано: 25.05.2010
Автори: Мартінес Алекса Л., Саіфер Марк Г.П., Уілліамс Л. Девід, Шерман Меррі Р.
Формула / Реферат
1. Спосіб підвищення біологічної активності неглікозилованого інтерферону-бета, який включає вибіркове зв'язування одного або кількох синтетичних водорозчинних полімерів з амінокінцевою амінокислотою вищезгаданого інтерферону-бета, причому вищезгадана амінокінцева амінокислота є розташованою на відстані від домену(ів) рецепторного зв'язування вищезгаданого інтерферону-бета.
2. Спосіб за п. 1, який відрізняється тим, що вищезгадану біологічну активність вимірюють в аналізі культури клітин, що реагує на інтерферон-бета.
3. Спосіб за п. 1, який відрізняється тим, що вищезгадані один або кілька полімерів вибирають із групи, яка складається з одного або кількох поліалкіленгліколів, одного або кількох поліалкіленоксидів, одного або кількох полівінілових спиртів, одного або кількох полікарбоксилатів, одного або кількох полі(вінілпіролідонів), одного або кількох полі(оксіетилен-оксиметиленів), однієї або кількох полі(амінокислот), одного або кількох поліакрилоїлморфолінів, одного або кількох співполімерів одного або кількох амідів та одного або кількох алкіленоксидів, одного або кількох декстринів і однієї або кількох гіалуронових кислот.
4. Спосіб за п. 1, який відрізняється тим, що вищезгаданий інтерферон-бета має амінокислотну послідовність інтерферону-β-1b, вказану у SEQ ID NО:1.
5. Спосіб за п. 1, який відрізняється тим, що вищезгаданий інтерферон-бета має амінокислотну послідовність, яка по суті відповідає SEQ ID NО:1.
6. Спосіб за п. 1, який відрізняється тим, що вищезгаданий полімер є ковалентно зв'язаним з альфа-аміногрупою вищезгаданої амінокінцевої амінокислоти.
7. Спосіб за п. 6, який відрізняється тим, що вищезгадане ковалентне зв'язування вищезгаданого полімеру з вищезгаданою альфа-аміногрупою відбувається через вторинний амінний зв'язок.
8. Спосіб за п. 1, який відрізняється тим, що вищезгаданий полімер є з'єднаним з хімічно реакційноздатною групою бокового ланцюга вищезгаданої амінокінцевої амінокислоти.
9. Спосіб за п. 8, який відрізняється тим, що вищезгаданий реакційноздатний боковий ланцюг є альдегідною групою, включеною шляхом вибіркового окиснювального розщеплення амінокінцевого серинового або треонінового залишку інтерферону-бета.
10. Спосіб за п. З, який відрізняється тим, що вищезгаданим полімером є поліалкіленгліколь.
11. Спосіб за п. 10, який відрізняється тим, що вищезгаданий поліалкіленгліколь вибирають із групи, яка складається з полі(етиленгліколю), монометоксиполі(етиленгліколю) та моногідроксиполі(етиленгліколю).
12. Спосіб за п. 11, який відрізняється тим, що вищезгаданий поліалкіленгліколь є монометоксиполі(етиленгліколем).
13. Спосіб за п. 11, який відрізняється тим, що вищезгаданий поліалкіленгліколь є моногідроксиполі(етиленгліколем).
14. Спосіб за п. 10, який відрізняється тим, що вищезгаданий поліалкіленгліколь має молекулярну масу від приблизно 1 кДа до приблизно 100 кДа включно.
15. Спосіб за п. 14, який відрізняється тим, що вищезгаданий поліалкіленгліколь має молекулярну масу від приблизно 8 кДа до приблизно 14 кДа включно.
16. Спосіб за п. 14, який відрізняється тим, що вищезгаданий поліалкіленгліколь має молекулярну масу від приблизно 10 кДа до приблизно 30 кДа включно.
17. Спосіб за п. 16, який відрізняється тим, що вищезгаданий поліалкіленгліколь має молекулярну масу від приблизно 18 кДа до приблизно 22 кДа включно.
18. Спосіб за п. 17, який відрізняється тим, що вищезгаданий поліалкіленгліколь має молекулярну масу від приблизно 20 кДа.
19. Спосіб за п. 14, який відрізняється тим, що вищезгаданий поліалкіленгліколь має молекулярну масу від приблизно 30 кДа.
20. Спосіб за п. 1, який відрізняється тим, що з'єднання вищезгаданого полімеру з вищезгаданим інтерфероном-бета на вищезгаданій амінокінцевій амінокислоті відтворює сприятливий вплив глікозилування або гіперглікозилування вищезгаданого інтерферону-бета.
21. Кон'югат, утворений способом за п. 1.
22. Фармацевтична композиція, яка включає один або кілька з кон'югатів за п. 21 і один або кілька фармацевтично прийнятних наповнювачів або носіїв.
23. Кон'югат, який включає неглікозилований інтерферон-бета, ковалентно зв'язаний на його амінокінцевій амінокислоті з одним або кількома синтетичними водорозчинними полімерами, причому вищезгадана амінокінцева амінокислота є розташованою на відстані від домену(ів) рецепторного зв'язування вищезгаданого інтерферону-бета.
24. Кон'югат за п. 23, де біологічна активність зазначеного інтерферону-бета є збільшеною у порівнянні з таким самим інтерфероном-бета, що не був зв'язаний таким чином, або біологічна активність вищезгаданого кон'югату інтерферону-бета є збільшеною порівняно з таким самим інтерфероном-бета, з яким один або кілька таких самих синтетичних водорозчинних полімерів було з'єднано випадково через прийнятні для розчинника лізинові залишки.
25. Кон'югат за п. 24, який відрізняється тим, що біологічну активність вищезгаданого кон'югату вимірюють в аналізі культури клітин, що реагує на інтерферон-бета.
26. Кон'югат за п. 23, який відрізняється тим, що вищезгаданий інтерферон-бета має амінокислотну послідовність інтерферону-β-1b, вказану у SEQ ID NО:1
27. Кон'югат за п. 26, який відрізняється тим, що біологічна активність вищезгаданого інтерферону-β-1b збільшується приблизно до активності інтерферону-β-1а, який має амінокислотну послідовність, показану в SEQ ID NO:2, і який є глікозилованим на аспарагіновому залишку 80.
28. Кон'югат за п. 25, який відрізняється тим, що вищезгаданий аналіз культури клітин, що реагує на інтерферон-бета, вибирають із групи, яка складається з антипроліферативного аналізу, антивірусного аналізу, аналізу трансдукції сигналу та аналізу активації гена.
29. Кон'югат за п. 23 або п. 24, який відрізняється тим, що вищезгадані один або кілька полімерів вибирають із групи, яка складається з одного або кількох поліалкіленгліколів, одного або кількох поліалкіленоксидів, одного або кількох полівінілових спиртів, одного або кількох полікарбоксилатів, одного або кількох полі(вінілпіролідонів), одного або кількох полі(оксіетилен-оксиметиленів), однієї або кількох полі(амінокислот), одного або кількох поліакрилоїлморфолінів, одного або кількох співполімерів одного або кількох амідів та одного або кількох алкіленоксидів, одного або кількох декстранів і однієї або кількох гіалуронових кислот.
30. Кон'югат за п. 23 або п. 24, який відрізняється тим, що вищезгаданий полімер є ковалентно зв'язаним з альфа-аміногрупою амінокінцевої амінокислоти вищезгаданого інтерферону-бета.
31. Кон'югат за п. 30, який відрізняється тим, що вищезгадане ковалентне зв'язування вищезгаданого полімеру з вищезгаданою альфа-аміногрупою відбувається через вторинний амінний зв'язок.
32. Кон'югат за п. 23 або п. 24, який відрізняється тим, що вищезгаданий полімер є з'єднаним з хімічно реакційноздатною групою бокового ланцюга вищезгаданої амінокінцевої амінокислоти.
33. Кон'югат за п. 32, який відрізняється тим, що вищезгаданий реакційноздатний боковий ланцюг є альдегідною групою, яку включають шляхом вибіркового окиснювального розщеплення амінокінцевого серинового або треонінового залишку інтерферону-бета.
34. Кон'югат за п. 23 або п. 24, який відрізняється тим, що вищезгаданий водорозчинний полімер є поліалкіленгліколем.
35. Кон'югат за п. 34, який відрізняється тим, що вищезгаданий поліалкіленгліколь вибирають із групи, яка складається з полі(етиленгліколю), монометоксиполі(етиленгліколю) та моногідроксиполі(етиленгліколю).
36. Кон'югат за п. 35, який відрізняється тим, що вищезгаданий поліалкіленгліколь є монометоксиполі(етиленгліколем).
37. Кон'югат за п. 35, який відрізняється тим, що вищезгаданий поліалкіленгліколь є моногідроксиполі(етиленгліколем).
38. Кон'югат за п. 34, який відрізняється тим, що вищезгаданий поліалкіленгліколь має молекулярну масу від приблизно 1 кДа до приблизно 100 кДа включно.
39. Кон'югат за п. 38, який відрізняється тим, що вищезгаданий поліалкіленгліколь має молекулярну масу від приблизно 8 кДа до приблизно 14 кДа включно.
40. Кон'югат за п. 38, який відрізняється тим, що вищезгаданий поліалкіленгліколь має молекулярну масу від приблизно 10 кДа до приблизно 30 кДа включно.
41. Кон'югат за п. 40, який відрізняється тим, що вищезгаданий поліалкіленгліколь має молекулярну масу від приблизно 18 кДа до приблизно 22 кДа включно.
42. Кон'югат за п. 41, який відрізняється тим, що вищезгаданий поліалкіленгліколь має молекулярну масу приблизно 20 кДа.
43. Кон'югат за п. 38, який відрізняється тим, що вищезгаданий поліалкіленгліколь має молекулярну масу приблизно 30 кДа.
44. Кон'югат за п. 23 або п. 24, який відрізняється тим, що з'єднання вищезгаданого полімеру з вищезгаданим інтерфероном-бета на вищезгаданій амінокінцевій амінокислоті відтворює сприятливий вплив глікозилування або гіперглікозилування вищезгаданого інтерферону-бета.
45. Фармацевтична композиція, яка включає кон'югат за будь-яким з пп. 21, 23 та 24 і фармацевтично прийнятний носій або наповнювач.
46. Комплект, який включає кон'югат за п. 21.
47. Комплект, який включає кон'югат за п. 23 або п. 24.
48. Комплект, який включає фармацевтичну композицію за п. 22.
49. Комплект, який включає фармацевтичну композицію за п. 45.
50. Спосіб профілактики реагуючого на інтерферон-бета порушення у тварини, яка страждає або є схильною до вищезгаданого порушення, який включає введення вищезгаданій тварині ефективної кількості кон'югату за будь-яким з пп. 21, 23 та 25.
51. Спосіб профілактики реагуючого на інтерферон-бета порушення у тварини, яка страждає або є схильною до вищезгаданого порушення, який включає введення вищезгаданій тварині ефективної кількості фармацевтичної композиції за п. 22 або п. 45.
52. Спосіб за п. 50, який відрізняється тим, що вищезгаданою твариною є ссавець.
53. Спосіб за п. 51, який відрізняється тим, що вищезгаданою твариною є ссавець.
54. Спосіб за п. 52 або п. 53, який відрізняється тим, що вищезгаданим ссавцем є людина.
55. Спосіб за п. 50, який відрізняється тим, що вищезгадане реагуюче на інтерферон-бета порушення належить до групи, яка складається з раку, інфекційної хвороби, нейродегенеративного порушення, аутоімунного порушення та генетичного порушення.
56. Спосіб за п. 55, який відрізняється тим, що вищезгаданий рак належить до групи, яка складається з раку молочної залози, раку матки, раку яєчника, раку передміхурової залози, раку яєчка, раку легенів, лейкемії, лімфоми, раку товстої кишки, раку шлунково-кишкового тракту, раку підшлункової залози, раку сечового міхура, раку нирок, раку кісток, неврологічного раку, раку голови та шиї, раку шкіри, карциноми, саркоми, аденоми та мієломи.
57. Спосіб за п. 55, який відрізняється тим, що вищезгадана реагуюча на інтерферон-бета інфекційна хвороба належить до групи, яка складається з вірусного гепатиту, хвороби, викликаної кардіотропним вірусом, та ВІЛ/СНІД.
58. Спосіб за п. 55, який відрізняється тим, що вищезгаданим реагуючим на інтерферон-бета нейродегенеративним порушенням є розсіяний склероз.
59. Спосіб за п. 58, який відрізняється тим, що вищезгаданий розсіяний склероз належить до групи, яка складається з рецидивного-ремітуючого, первинного прогресуючого та вторинного прогресуючого розсіяного склерозу.
60. Спосіб за п. 51, який відрізняється тим, що вищезгадане реагуюче на інтерферон-бета фізичне порушення належить до групи, яка складається з раку, інфекційної хвороби, нейродегенеративного порушення, аутоімунного порушення та генетичного порушення.
61. Спосіб за п. 60, який відрізняється тим, що вищезгаданий рак належить до групи, яка складається з раку молочної залози, раку матки, раку яєчника, раку передміхурової залози, раку яєчка, раку легенів, лейкемії, лімфоми, раку товстої кишки, раку шлунково-кишкового тракту, раку підшлункової залози, раку сечового міхура, раку нирок, раку кісток, неврологічного раку, раку голови та шиї, раку шкіри, карциноми, саркоми, аденоми та мієломи.
62. Спосіб за п. 60, який відрізняється тим, що вищезгадана реагуюча на інтерферон-бета інфекційна хвороба належить до групи, яка складається з вірусного гепатиту, хвороби, викликаної кардіотропним вірусом, та ВІЛ/СНІД.
63. Спосіб за п. 60, який відрізняється тим, що вищезгаданим реагуючим на інтерферон-бета нейродегенеративним порушенням є розсіяний склероз.
64. Спосіб за п. 63, який відрізняється тим, що вищезгаданий розсіяний склероз належить до групи, яка складається з рецидивного-ремітуючого, первинного прогресуючого та вторинного прогресуючого розсіяного склерозу.
65. Спосіб діагностування реагуючого на інтерферон-бета порушення у тварини, яка страждає або є схильною до вищезгаданого порушення, який включає введення вищезгаданій тварині ефективної кількості кон'югату за будь-яким з пп. 21, 23 та 25.
66. Спосіб діагностування реагуючого на інтерферон-бета порушення у тварини, яка страждає або є схильною до вищезгаданого порушення, який включає введення вищезгаданій тварині ефективної кількості фармацевтичної композиції за п. 22 або п. 45.
67. Спосіб за п. 65, який відрізняється тим, що вищезгадана тварина є ссавцем.
68. Спосіб за п. 66, який відрізняється тим, що вищезгадана тварина є ссавцем.
69. Спосіб за п. 67 або п. 68, який відрізняється тим, що вищезгаданий ссавець є людиною.
70. Спосіб за п. 65, який відрізняється тим, що вищезгадане реагуюче на інтерферон-бета порушення є вибраним з групи, до якої належать рак, інфекційна хвороба, нейродегенеративне порушення, аутоімунне порушення та генетичне порушення.
71. Спосіб за п. 70, який відрізняється тим, що вищезгаданий рак є вибраним з групи, до якої належать рак молочної залози, рак матки, рак яєчника, рак передміхурової залози, рак яєчка, рак легенів, лейкемія, лімфома, рак товстої кишки, рак шлунково-кишкового тракту, рак підшлункової залози, рак сечового міхура, рак нирок, рак кісток, неврологічний рак, рак голови та шиї, рак шкіри, карцинома, саркома, аденома та мієлома.
72. Спосіб за п. 70, який відрізняється тим, що вищезгадане реагуюче на інтерферон-бета інфекційне порушення є вибраним з групи, до якої належать вірусний гепатит, хвороба, викликана кардіотропним вірусом, та ВІЛ/СНІД.
73. Спосіб за п. 70, який відрізняється тим, що вищезгаданим реагуючим на інтерферон-бета нейродегенеративним порушенням є розсіяний склероз.
74. Спосіб за п. 73, який відрізняється тим, що вищезгаданий розсіяний склероз є вибраним з групи, до якої належать рецидивний-ремітуючий, первинний прогресуючий та вторинний прогресуючий розсіяний склероз.
75. Спосіб за п. 66, який відрізняється тим, що вищезгадане реагуюче на інтерферон-бета порушення є вибраним з групи, до якої належать рак, інфекційна хвороба, нейродегенеративне порушення, аутоімунне порушення та генетичне порушення.
76. Спосіб за п. 75, який відрізняється тим, що вищезгаданий рак є вибраним з групи, до якої належать рак молочної залози, рак матки, рак яєчника, рак передміхурової залози, рак яєчка, рак легенів, лейкемія, лімфома, рак товстої кишки, рак шлунково-кишкового тракту, рак підшлункової залози, рак сечового міхура, рак нирок, рак кісток, неврологічний рак, рак голови та шиї, рак шкіри, карцинома, саркома, аденома та мієлома.
77. Спосіб за п. 75, який відрізняється тим, що вищезгадане реагуюче на інтерферон-бета інфекційне порушення є вибраним з групи, до якої належать вірусний гепатит, хвороба, викликана кардіотропним вірусом, та ВІЛ/СНІД.
78. Спосіб за п. 75, який відрізняється тим, що вищезгадане реагуюче на інтерферон-бета нейродегенеративне порушення є розсіяний склероз.
79. Спосіб за п. 78, який відрізняється тим, що вищезгаданий розсіяний склероз є вибраним з групи, до якої належать рецидивний-ремітуючий, первинний прогресуючий та вторинний прогресуючий розсіяний склероз.
80. Спосіб лікування реагуючого на інтерферон-бета порушення у тварини, яка страждає або є схильною до вищезгаданого порушення, який включає введення вищезгаданій тварині ефективної кількості кон'югату за будь-яким з пп. 21, 23 та 25.
81. Спосіб лікування реагуючого на інтерферон-бета порушення у тварини, яка страждає або є схильною до вищезгаданого порушення, який включає введення вищезгаданій тварині ефективної кількості фармацевтичної композиції за п. 22 або п. 45.
82. Спосіб за п. 80, який відрізняється тим, що вищезгадана тварина є ссавцем.
83. Спосіб за п. 81, який відрізняється тим, що вищезгадана тварина є ссавцем.
84. Спосіб за п. 80 або п. 81, який відрізняється тим, що вищезгаданий ссавець є людиною.
85. Спосіб за п. 80, який відрізняється тим, що вищезгадане реагуюче на інтерферон-бета порушення є вибраним з групи, до якої належать рак, інфекційна хвороба, нейродегенеративне порушення, аутоімунне порушення та генетичне порушення.
86. Спосіб за п. 85, який відрізняється тим, що вищезгаданий рак є вибраним з групи, до якої належать рак молочної залози, рак матки, рак яєчника, рак передміхурової залози, рак яєчка, рак легенів, лейкемія, лімфома, рак товстої кишки, рак шлунково-кишкового тракту, рак підшлункової залози, рак сечового міхура, рак нирок, рак кісток, неврологічний рак, рак голови та шиї, рак шкіри, карцинома, саркома, аденома та мієлома.
87. Спосіб за п. 85, який відрізняється тим, що вищезгадане реагуюче на інтерферон-бета інфекційне порушення є вибраним з групи, до якої належать вірусний гепатит, хвороба, викликана кардіотропним вірусом, та ВІЛ/СНІД.
88. Спосіб за п. 85, який відрізняється тим, що вищезгадане реагуюче на інтерферон-бета нейродегенеративне порушення є розсіяний склероз.
89. Спосіб за п. 88, який відрізняється тим, що вищезгаданий розсіяний склероз є вибраним з групи, до якої належать рецидивний-ремітуючий, первинний прогресуючий та вторинний прогресуючий розсіяний склероз.
90. Спосіб за п. 81, який відрізняється тим, що вищезгадане реагуюче на інтерферон-бета порушення є вибраним з групи, до якої належать рак, інфекційна хвороба, нейродегенеративне порушення, аутоімунне порушення та генетичне порушення.
91. Спосіб за п. 90, який відрізняється тим, що вищезгаданий рак є вибраним з групи, до якої належать рак молочної залози, рак матки, рак яєчника, рак передміхурової залози, рак яєчка, рак легенів, лейкемія, лімфома, рак товстої кишки, рак шлунково-кишкового тракту, рак підшлункової залози, рак сечового міхура, рак нирок, рак кісток, неврологічний рак, рак голови та шиї, рак шкіри, карцинома, саркома, аденома та мієлома.
92. Спосіб за п. 90, який відрізняється тим, що вищезгадане реагуюче на інтерферон-бета інфекційне порушення є вибраним з групи, до якої належать вірусний гепатит, хвороба, викликана кардіотропним вірусом, та ВІЛ/СНІД.
93. Спосіб за п. 90, який відрізняється тим, що вищезгадане реагуюче на інтерферон-бета нейродегенеративне порушення є розсіяний склероз.
94. Спосіб за п. 93, який відрізняється тим, що вищезгаданий розсіяний склероз є вибраним з групи, до якої належать рецидивний-ремітуючий, первинний прогресуючий та вторинний прогресуючий розсіяний склероз.
Текст
1. Спосіб підвищення біологічної активності неглікозилованого інтерферону-бета, який включає вибіркове зв'язування одного або кількох синтетичних водорозчинних полімерів з амінокінцевою амінокислотою вищезгаданого інтерферонубета, причому вищезгадана амінокінцева амінокислота є розташованою на відстані від домену(ів) рецепторного зв'язування вищезгаданого інтерферону-бета. 2. Спосіб за п. 1, який відрізняється тим, що вищезгадану біологічну активність вимірюють в аналізі культури клітин, що реагує на інтерферонбета. 3. Спосіб за п. 1, який відрізняється тим, що вищезгадані один або кілька полімерів вибирають із групи, яка складається з одного або кількох поліалкіленгліколів, одного або кількох поліалкіленоксидів, одного або кількох полівінілових спиртів, одного або кількох полікарбоксилатів, одного або кількох полі(вінілпіролідонів), одного або кількох полі(оксіетилен-оксиметиленів), однієї або кількох полі(амінокислот), одного або кількох поліакрилоїлморфолінів, одного або кількох співполімерів од 2 (19) 1 3 90654 4 15. Спосіб за п. 14, який відрізняється тим, що русного аналізу, аналізу трансдукції сигналу та вищезгаданий поліалкіленгліколь має молекуляраналізу активації гена. 29. Кон'югат за п. 23 або п. 24, який відрізняється ну масу від приблизно 8 кДа до приблизно 14 кДа включно. тим, що вищезгадані один або кілька полімерів 16. Спосіб за п. 14, який відрізняється тим, що вибирають із групи, яка складається з одного або вищезгаданий поліалкіленгліколь має молекуляркількох поліалкіленгліколів, одного або кількох пону масу від приблизно 10 кДа до приблизно 30 кДа ліалкіленоксидів, одного або кількох полівінілових включно. спиртів, одного або кількох полікарбоксилатів, од17. Спосіб за п. 16, який відрізняється тим, що ного або кількох полі(вінілпіролідонів), одного або вищезгаданий поліалкіленгліколь має молекуляркількох полі(оксіетилен-оксиметиленів), однієї або ну масу від приблизно 18 кДа до приблизно 22 кДа кількох полі(амінокислот), одного або кількох полівключно. акрилоїлморфолінів, одного або кількох співполі18. Спосіб за п. 17, який відрізняється тим, що мерів одного або кількох амідів та одного або кільвищезгаданий поліалкіленгліколь має молекуляркох алкіленоксидів, одного або кількох декстранів і ну масу від приблизно 20 кДа. однієї або кількох гіалуронових кислот. 19. Спосіб за п. 14, який відрізняється тим, що 30. Кон'югат за п. 23 або п. 24, який відрізняється вищезгаданий поліалкіленгліколь має молекуляртим, що вищезгаданий полімер є ковалентно зв'яну масу від приблизно 30 кДа. заним з альфа-аміногрупою амінокінцевої аміно20. Спосіб за п. 1, який відрізняється тим, що кислоти вищезгаданого інтерферону-бета. 31. Кон'югат за п. 30, який відрізняється тим, що з'єднання вищезгаданого полімеру з вищезгаданим інтерфероном-бета на вищезгаданій амінокінвищезгадане ковалентне зв'язування вищезгадацевій амінокислоті відтворює сприятливий вплив ного полімеру з вищезгаданою альфа-аміногрупою глікозилування або гіперглікозилування вищезгавідбувається через вторинний амінний зв'язок. 32. Кон'югат за п. 23 або п. 24, який відрізняється даного інтерферону-бета. 21. Кон'югат, утворений способом за п. 1. тим, що вищезгаданий полімер є з'єднаним з хімі22. Фармацевтична композиція, яка включає один чно реакційноздатною групою бокового ланцюга або кілька з кон'югатів за п. 21 і один або кілька вищезгаданої амінокінцевої амінокислоти. 33. Кон'югат за п. 32, який відрізняється тим, що фармацевтично прийнятних наповнювачів або носіїв. вищезгаданий реакційноздатний боковий ланцюг є 23. Кон'югат, який включає неглікозилований інтеальдегідною групою, яку включають шляхом вибіррферон-бета, ковалентно зв'язаний на його амінокового окиснювального розщеплення амінокінцекінцевій амінокислоті з одним або кількома синтевого серинового або треонінового залишку інтертичними водорозчинними полімерами, причому ферону-бета. 34. Кон'югат за п. 23 або п. 24, який відрізняється вищезгадана амінокінцева амінокислота є розташованою на відстані від домену(ів) рецепторного тим, що вищезгаданий водорозчинний полімер є зв'язування вищезгаданого інтерферону-бета. поліалкіленгліколем. 35. Кон'югат за п. 34, який відрізняється тим, що 24. Кон'югат за п. 23, де біологічна активність зазначеного інтерферону-бета є збільшеною у порівищезгаданий поліалкіленгліколь вибирають із внянні з таким самим інтерфероном-бета, що не групи, яка складається з полі(етиленгліколю), мобув зв'язаний таким чином, або біологічна активнометоксиполі(етиленгліколю) та моногідроксипоність вищезгаданого кон'югату інтерферону-бета є лі(етиленгліколю). 36. Кон'югат за п. 35, який відрізняється тим, що збільшеною порівняно з таким самим інтерфероном-бета, з яким один або кілька таких самих синвищезгаданий поліалкіленгліколь є монометокситетичних водорозчинних полімерів було з'єднано полі(етиленгліколем). 37. Кон'югат за п. 35, який відрізняється тим, що випадково через прийнятні для розчинника лізинові залишки. вищезгаданий поліалкіленгліколь є моногідроксиполі(етиленгліколем). 25. Кон'югат за п. 24, який відрізняється тим, що 38. Кон'югат за п. 34, який відрізняється тим, що біологічну активність вищезгаданого кон'югату вищезгаданий поліалкіленгліколь має молекулярвимірюють в аналізі культури клітин, що реагує на ну масу від приблизно 1 кДа до приблизно 100 кДа інтерферон-бета. включно. 26. Кон'югат за п. 23, який відрізняється тим, що 39. Кон'югат за п. 38, який відрізняється тим, що вищезгаданий інтерферон-бета має амінокислотну вищезгаданий поліалкіленгліколь має молекулярпослідовність інтерферону-β-1b, вказану у SEQ ID ну масу від приблизно 8 кДа до приблизно 14 кДа NО:1 включно. 27. Кон'югат за п. 26, який відрізняється тим, що 40. Кон'югат за п. 38, який відрізняється тим, що біологічна активність вищезгаданого інтерферонувищезгаданий поліалкіленгліколь має молекулярβ-1b збільшується приблизно до активності інтерну масу від приблизно 10 кДа до приблизно 30 кДа ферону-β-1а, який має амінокислотну послідоввключно. 41. Кон'югат за п. 40, який відрізняється тим, що ність, показану в SEQ ID NO:2, і який є глікозилованим на аспарагіновому залишку 80. вищезгаданий поліалкіленгліколь має молекуляр28. Кон'югат за п. 25, який відрізняється тим, що ну масу від приблизно 18 кДа до приблизно 22 кДа вищезгаданий аналіз культури клітин, що реагує включно. 42. Кон'югат за п. 41, який відрізняється тим, що на інтерферон-бета, вибирають із групи, яка складається з антипроліферативного аналізу, антивівищезгаданий поліалкіленгліколь має молекулярну масу приблизно 20 кДа. 5 90654 6 43. Кон'югат за п. 38, який відрізняється тим, що первинного прогресуючого та вторинного прогревищезгаданий поліалкіленгліколь має молекулярсуючого розсіяного склерозу. 60. Спосіб за п. 51, який відрізняється тим, що ну масу приблизно 30 кДа. 44. Кон'югат за п. 23 або п. 24, який відрізняється вищезгадане реагуюче на інтерферон-бета фізичтим, що з'єднання вищезгаданого полімеру з вине порушення належить до групи, яка складається щезгаданим інтерфероном-бета на вищезгаданій з раку, інфекційної хвороби, нейродегенеративноамінокінцевій амінокислоті відтворює сприятливий го порушення, аутоімунного порушення та генетивплив глікозилування або гіперглікозилування вичного порушення. 61. Спосіб за п. 60, який відрізняється тим, що щезгаданого інтерферону-бета. 45. Фармацевтична композиція, яка включає кон'ювищезгаданий рак належить до групи, яка складагат за будь-яким з пп. 21, 23 та 24 і фармацевтичється з раку молочної залози, раку матки, раку но прийнятний носій або наповнювач. яєчника, раку передміхурової залози, раку яєчка, 46. Комплект, який включає кон'югат за п. 21. раку легенів, лейкемії, лімфоми, раку товстої киш47. Комплект, який включає кон'югат за п. 23 або п. ки, раку шлунково-кишкового тракту, раку підшлун24. кової залози, раку сечового міхура, раку нирок, 48. Комплект, який включає фармацевтичну комраку кісток, неврологічного раку, раку голови та позицію за п. 22. шиї, раку шкіри, карциноми, саркоми, аденоми та 49. Комплект, який включає фармацевтичну коммієломи. 62. Спосіб за п. 60, який відрізняється тим, що позицію за п. 45. 50. Спосіб профілактики реагуючого на інтерфевищезгадана реагуюча на інтерферон-бета інфекрон-бета порушення у тварини, яка страждає або є ційна хвороба належить до групи, яка складається схильною до вищезгаданого порушення, який з вірусного гепатиту, хвороби, викликаної кардіотвключає введення вищезгаданій тварині ефективропним вірусом, та ВІЛ/СНІД. 63. Спосіб за п. 60, який відрізняється тим, що ної кількості кон'югату за будь-яким з пп. 21, 23 та 25. вищезгаданим реагуючим на інтерферон-бета 51. Спосіб профілактики реагуючого на інтерфенейродегенеративним порушенням є розсіяний рон-бета порушення у тварини, яка страждає або є склероз. 64. Спосіб за п. 63, який відрізняється тим, що схильною до вищезгаданого порушення, який включає введення вищезгаданій тварині ефективвищезгаданий розсіяний склероз належить до груної кількості фармацевтичної композиції за п. 22 пи, яка складається з рецидивного-ремітуючого, або п. 45. первинного прогресуючого та вторинного прогре52. Спосіб за п. 50, який відрізняється тим, що суючого розсіяного склерозу. вищезгаданою твариною є ссавець. 65. Спосіб діагностування реагуючого на інтерфе53. Спосіб за п. 51, який відрізняється тим, що рон-бета порушення у тварини, яка страждає або є вищезгаданою твариною є ссавець. схильною до вищезгаданого порушення, який 54. Спосіб за п. 52 або п. 53, який відрізняється включає введення вищезгаданій тварині ефективтим, що вищезгаданим ссавцем є людина. ної кількості кон'югату за будь-яким з пп. 21, 23 та 55. Спосіб за п. 50, який відрізняється тим, що 25. вищезгадане реагуюче на інтерферон-бета пору66. Спосіб діагностування реагуючого на інтерфешення належить до групи, яка складається з раку, рон-бета порушення у тварини, яка страждає або є інфекційної хвороби, нейродегенеративного порусхильною до вищезгаданого порушення, який шення, аутоімунного порушення та генетичного включає введення вищезгаданій тварині ефективпорушення. ної кількості фармацевтичної композиції за п. 22 56. Спосіб за п. 55, який відрізняється тим, що або п. 45. 67. Спосіб за п. 65, який відрізняється тим, що вищезгаданий рак належить до групи, яка складається з раку молочної залози, раку матки, раку вищезгадана тварина є ссавцем. 68. Спосіб за п. 66, який відрізняється тим, що яєчника, раку передміхурової залози, раку яєчка, раку легенів, лейкемії, лімфоми, раку товстої кишвищезгадана тварина є ссавцем. 69. Спосіб за п. 67 або п. 68, який відрізняється ки, раку шлунково-кишкового тракту, раку підшлункової залози, раку сечового міхура, раку нирок, тим, що вищезгаданий ссавець є людиною. 70. Спосіб за п. 65, який відрізняється тим, що раку кісток, неврологічного раку, раку голови та шиї, раку шкіри, карциноми, саркоми, аденоми та вищезгадане реагуюче на інтерферон-бета порумієломи. шення є вибраним з групи, до якої належать рак, 57. Спосіб за п. 55, який відрізняється тим, що інфекційна хвороба, нейродегенеративне порувищезгадана реагуюча на інтерферон-бета інфекшення, аутоімунне порушення та генетичне поруційна хвороба належить до групи, яка складається шення. 71. Спосіб за п. 70, який відрізняється тим, що з вірусного гепатиту, хвороби, викликаної кардіотропним вірусом, та ВІЛ/СНІД. вищезгаданий рак є вибраним з групи, до якої на58. Спосіб за п. 55, який відрізняється тим, що лежать рак молочної залози, рак матки, рак яєчнивищезгаданим реагуючим на інтерферон-бета ка, рак передміхурової залози, рак яєчка, рак ленейродегенеративним порушенням є розсіяний генів, лейкемія, лімфома, рак товстої кишки, рак склероз. шлунково-кишкового тракту, рак підшлункової за59. Спосіб за п. 58, який відрізняється тим, що лози, рак сечового міхура, рак нирок, рак кісток, вищезгаданий розсіяний склероз належить до груневрологічний рак, рак голови та шиї, рак шкіри, пи, яка складається з рецидивного-ремітуючого, карцинома, саркома, аденома та мієлома. 7 90654 8 72. Спосіб за п. 70, який відрізняється тим, що 84. Спосіб за п. 80 або п. 81, який відрізняється вищезгадане реагуюче на інтерферон-бета інфектим, що вищезгаданий ссавець є людиною. 85. Спосіб за п. 80, який відрізняється тим, що ційне порушення є вибраним з групи, до якої належать вірусний гепатит, хвороба, викликана карвищезгадане реагуюче на інтерферон-бета порудіотропним вірусом, та ВІЛ/СНІД. шення є вибраним з групи, до якої належать рак, 73. Спосіб за п. 70, який відрізняється тим, що інфекційна хвороба, нейродегенеративне порувищезгаданим реагуючим на інтерферон-бета шення, аутоімунне порушення та генетичне порунейродегенеративним порушенням є розсіяний шення. 86. Спосіб за п. 85, який відрізняється тим, що склероз. 74. Спосіб за п. 73, який відрізняється тим, що вищезгаданий рак є вибраним з групи, до якої навищезгаданий розсіяний склероз є вибраним з лежать рак молочної залози, рак матки, рак яєчнигрупи, до якої належать рецидивний-ремітуючий, ка, рак передміхурової залози, рак яєчка, рак лепервинний прогресуючий та вторинний прогресуюгенів, лейкемія, лімфома, рак товстої кишки, рак чий розсіяний склероз. шлунково-кишкового тракту, рак підшлункової за75. Спосіб за п. 66, який відрізняється тим, що лози, рак сечового міхура, рак нирок, рак кісток, вищезгадане реагуюче на інтерферон-бета поруневрологічний рак, рак голови та шиї, рак шкіри, шення є вибраним з групи, до якої належать рак, карцинома, саркома, аденома та мієлома. 87. Спосіб за п. 85, який відрізняється тим, що інфекційна хвороба, нейродегенеративне порушення, аутоімунне порушення та генетичне порувищезгадане реагуюче на інтерферон-бета інфекшення. ційне порушення є вибраним з групи, до якої на76. Спосіб за п. 75, який відрізняється тим, що лежать вірусний гепатит, хвороба, викликана карвищезгаданий рак є вибраним з групи, до якої надіотропним вірусом, та ВІЛ/СНІД. 88. Спосіб за п. 85, який відрізняється тим, що лежать рак молочної залози, рак матки, рак яєчника, рак передміхурової залози, рак яєчка, рак левищезгадане реагуюче на інтерферон-бета нейрогенів, лейкемія, лімфома, рак товстої кишки, рак дегенеративне порушення є розсіяний склероз. 89. Спосіб за п. 88, який відрізняється тим, що шлунково-кишкового тракту, рак підшлункової залози, рак сечового міхура, рак нирок, рак кісток, вищезгаданий розсіяний склероз є вибраним з неврологічний рак, рак голови та шиї, рак шкіри, групи, до якої належать рецидивний-ремітуючий, карцинома, саркома, аденома та мієлома. первинний прогресуючий та вторинний прогресую77. Спосіб за п. 75, який відрізняється тим, що чий розсіяний склероз. 90. Спосіб за п. 81, який відрізняється тим, що вищезгадане реагуюче на інтерферон-бета інфекційне порушення є вибраним з групи, до якої навищезгадане реагуюче на інтерферон-бета порулежать вірусний гепатит, хвороба, викликана каршення є вибраним з групи, до якої належать рак, діотропним вірусом, та ВІЛ/СНІД. інфекційна хвороба, нейродегенеративне пору78. Спосіб за п. 75, який відрізняється тим, що шення, аутоімунне порушення та генетичне порувищезгадане реагуюче на інтерферон-бета нейрошення. 91. Спосіб за п. 90, який відрізняється тим, що дегенеративне порушення є розсіяний склероз. 79. Спосіб за п. 78, який відрізняється тим, що вищезгаданий рак є вибраним з групи, до якої навищезгаданий розсіяний склероз є вибраним з лежать рак молочної залози, рак матки, рак яєчнигрупи, до якої належать рецидивний-ремітуючий, ка, рак передміхурової залози, рак яєчка, рак лепервинний прогресуючий та вторинний прогресуюгенів, лейкемія, лімфома, рак товстої кишки, рак чий розсіяний склероз. шлунково-кишкового тракту, рак підшлункової за80. Спосіб лікування реагуючого на інтерферонлози, рак сечового міхура, рак нирок, рак кісток, бета порушення у тварини, яка страждає або є неврологічний рак, рак голови та шиї, рак шкіри, схильною до вищезгаданого порушення, який карцинома, саркома, аденома та мієлома. 92. Спосіб за п. 90, який відрізняється тим, що включає введення вищезгаданій тварині ефективної кількості кон'югату за будь-яким з пп. 21, 23 та вищезгадане реагуюче на інтерферон-бета інфек25. ційне порушення є вибраним з групи, до якої на81. Спосіб лікування реагуючого на інтерферонлежать вірусний гепатит, хвороба, викликана карбета порушення у тварини, яка страждає або є діотропним вірусом, та ВІЛ/СНІД. 93. Спосіб за п. 90, який відрізняється тим, що схильною до вищезгаданого порушення, який включає введення вищезгаданій тварині ефективвищезгадане реагуюче на інтерферон-бета нейроної кількості фармацевтичної композиції за п. 22 дегенеративне порушення є розсіяний склероз. 94. Спосіб за п. 93, який відрізняється тим, що або п. 45. 82. Спосіб за п. 80, який відрізняється тим, що вищезгаданий розсіяний склероз є вибраним з вищезгадана тварина є ссавцем. групи, до якої належать рецидивний-ремітуючий, 83. Спосіб за п. 81, який відрізняється тим, що первинний прогресуючий та вторинний прогресуювищезгадана тварина є ссавцем. чий розсіяний склероз. 9 Рівень техніки Галузь винаходу Даний винахід стосується галузі біохімії білків і фармацевтичних та медичних наук. Зокрема, винахід забезпечує способи одержання кон'югатів між водорозчинними полімерами (наприклад, полі(етиленгліколем) та їх похідними) і цитокінами (наприклад, інтерфероном-бета), причому ці кон'югати мають підвищену активність порівняно з полімерними кон'югатами такого самого цитокіну, синтезованими стандартними способами. Винахід також забезпечує кон'югати, одержані такими способами, композиції, які включають такі кон'югати, комплекти, які включають такі кон'югати та композиції і способи застосування кон'югатів та композицій у профілактиці, діагностиці та лікуванні різних медичних та ветеринарних станів. Винахід також забезпечує способи визначення місць приєднання полімерів шляхом відновного алкілування за певних умов. Споріднена галузь Представлений нижче опис спорідненої галузі включає тлумачення авторів даного винаходу, які самі по собі не належать до існуючого рівня техніки. Цитокіни є секретованими регуляторними білками, які регулюють виживання, ріст, диференціацію, та/або ефекторну функцію клітин ендокринним, паракринним або аутокринним способом (огляд: Nicola, N.A. (1994) in: Guidebook to Cytokines and Their Рецептори, Nicola, N.A., ed., pp. 1-7, Oxford University Press, New York). Завдяки їх активності, специфічності, невеликому розмірові та відносній легкості одержання у рекомбінантних організмах, цитокіни мають потенціал для широкого застосування як терапевтичні засоби. Два ключові чинники перешкоджають розробці цитокінів зокрема і рекомбінантних білків взагалі як терапевтичних засобів: їх зазвичай короткий півперіод у системи кровообігу та їх можлива антигенність і імуногенність. Вжитий авторами і загальновживаний серед спеціалістів у даній галузі термін "антигенність" стосується здатності молекули зв'язуватися з уже існуючими антитілами, а термін "імуногенність" стосується здатності молекули викликати імунну реакцію in vivo, незалежно від того, чи включає ця реакція утворення антитіл ("гуморальна реакція"), чи стимуляцію клітинних імунних реакцій. При введенні рекомбінантних терапевтичних білків часто віддають перевагу внутрішньовенному (i.v.) введенню для досягнення найвищої активності у системі кровообігу та мінімізації проблем, пов'язаних з біодоступністю та розпадом. Однак, півперіод малих білків після i.v. введення зазвичай є надто коротким (див. Приклади у публікаціях Mordenti, J., et al., (1991) Pharm Res 5:1351-1359; Kuwabara, Т., et al., (1995) Pharm Res 72:14661469). Білки з гідродинамічними радіусами, які перевищують радіус альбуміну сироватки, який має радіус Стокса близько 36Å і молекулярну масу близько 66000 Дальтонів (66кДа), зазвичай утримуються у кровообігу здоровими нирками. Однак, менші білки, включаючи цитокіни, такі як фактор, що стимулює колонії гранулоцитів ("G-CSF"), інте 90654 10 рлейкін-2 ("IL-2"), інтерферон-альфа ("IFN-альфа") та інтерферон-гамма ("IFN-гамма"), швидко виводяться з кровообігу шляхом клубочкової фільтрації (Brenner, В.М., et al., (1978) Am J Physiol 234:F455F460; Venkatachalam, M.A. et al., (1978) Circ Res 43:337-347; Wilson, G., (1979) J Gen Physiol 74:495509; Knauf, M.J., et al., (1988) J Biol Chem 263:15064-15070; Kita, Y., et al., (1990) Drug Des Deliv 6:157-167; Rostaing, L., et al., (1998), J Am Soc Nephrol 9:2344-2348). В результаті підтримання терапевтично корисних концентрацій малих рекомбінантних білків у системі кровообігу після ін'єкції є проблематичним. Таким чином, як правило, буває необхідно вводити більш високі концентрації таких білків і збільшувати частоту ін'єкцій. В результаті такі режими дозування стають причиною збільшення вартості терапії, зниження ймовірності дотримання режиму з боку пацієнта і збільшення ризику негативних явищ, наприклад, імунних реакцій. І клітинні, і гуморальні імунні реакції можуть знижувати концентрацію в системі кровообігу введених шляхом ін'єкції рекомбінантних білків настільки, що можуть перешкоджати введенню ефективної дози або можуть призводити до подій, що обмежують лікування, включаючи прискорене виведення, нейтралізацію ефективності та анафілаксії (Ragnhammar, P., et al., (1994) Blood 84:40784087; Wadhwa, M., et al., (1999) Clin Рак Res 5:1353-1361; Hjelm Skog, A.-L., et al., (2001) Clin Рак Res 7:1163-1170; Li, J., et al., (2001) Blood 98:3241-3248; Basser, R.L., et al., (2002) Blood 99:2599-2602; Schellekens, H., (2002) Clin Ther 24:1720-1740). Модифікація рекомбінантних білків шляхом ковалентного зв'язування полі(етиленгліколю) ("PEG") широко досліджувалася як засіб подолання недоліків, які обговорювалися раніше (див. Sherman, M.R., et al., (1997): Poly(ethylene glycol): Chemistry and Biological Applications, Harris, J.M., et al., eds., pp. 155-169, American Chemical Society, Washington, D.C.; Roberts, M.J., et al., (2002) Adv Drug Deliv Rev 54:459-476). Було виявлено, що приєднання PEG до білків стабілізує білки, поліпшує їх біодоступність і/або знижує їх імуногенність in vivo. (Ковалентне зв'язування PEG з білком або іншим субстратом вказується авторами і є відомим серед спеціалістів у даній галузі як "пегілування"). Крім того, пегілування може значною мірою збільшувати гідродинамічний радіус білків. Коли малий білок, такий як цитокін, зв'язується з одним довгим ланцюгом PEG (наприклад, таким, що має молекулярну масу принаймні приблизно 18кДа), утворений в результаті кон'югат має гідродинамічний радіус, який перевищує радіус альбуміну сироватки, і його виведення з системи кровообігу через ниркові клубочки помітно уповільнюється. Комбіновані ефекти пегілування - знижений протеоліз, знижене імунне розпізнавання та знижена швидкість ниркового очищення - дають суттєві переваги пегілованим білкам як терапевтичним засобам. З 1970-х років робилися спроби застосування ковалентного зв'язування полімерів для поліпшення безпеки й ефективності різних білків для фармацевтичного застосування (див., наприклад, 11 90654 12 Davis, F.F., et al., Патент США №4,179,337). У деходом, зокрема, PEG, точніше - PEG, які містять яких прикладах було вказано на зв'язування PEG одну реакційноздатну групу ("монофункціонально або полі(етиленоксиду) ("РЕО") з аденозиндезаміактивовані PEG"). назою (EC 3.5.4.4) для застосування у лікуванні Ковалентне зв'язування PEG або інших поліахвороби важкого комбінованого імунодефіциту лкіленоксидів з білком вимагає перетворення при(Davis, S., et al., (1981) Clin Exp Immunol 46:649наймні однієї кінцевої групи полімеру на реакцій652; Hershfield, M.S., et al., (1987) N Engl J Med ноздатну функціональну групу. Цей процес часто 316:589-596), з супероксид-дисмутазою (EC називають "активацією", а продукт називають "ак1.15.1.1) для лікування запальних станів (Saifer, тивованим PEG" або активованим поліалкіленокΜ., et al., Патенти США №№ 5,006,333 та сидом. Монометокси-PEG, у яких кисень на одно5,080,891) і з урат оксидазою (ЕС 1.7.3.3) для виму кінці є прикритим нереакційноздатною, хімічно далення надлишкової сечової кислоти з крові та стійкою метильною групою (для утворення "метоксечі (Kelly, S.J., et al., (2001) J Am Soc Nephrol сильної групи"), а на іншому кінці - функціональ12:1001-1009; Williams, L.D., et al., Публікація РСТ ною групою, яка є реакційноздатною по відношен№ WO 00/07629 A3 та Патент США №6,576,235; ню до аміногруп на молекулі білка, найчастіше Sherman, M.R., et al., Публікація РСТ № WO застосовують у таких випадках. Так звані "розга01/59078 A2). лужені" mPEG, які містять дві або більше метоксиРЕО та PEG є полімерами, які складаються з льних груп, віддалених від єдиної активованої фуковалентно зв'язаних етиленоксидних одиниць. Ці нкціональної групи, застосовують рідше. полімери мають таку загальну структуру: Прикладом розгалуженого PEG є ди-mРЕО-лізин, у якому PEG є з'єднаним з обома аміногрупами, і R1-(OCH2CH2)n-R2 карбоксильна група лізину найчастіше активується шляхом естерифікації N-гідроксисукцинімідом де R2 може бути гідроксильною групою (або її (Martinez, Α., et al., Патент США №5,643,575; реакційноздатною похідною), і R1 може бути водGreenwald, R.B., et al., Патент США №5,919,455; нем, як у дигідроксиРЕG ("PEG-діол"), метильною Harris, J.M., et al., Патент США №5,932,462). групою, як у монометокси-PEG ("mPEG") або інЯк правило, активовані полімери реагують з шою нижчою алкільною групою, наприклад, як в біологічно активною сполукою, яка має нуклеофіізо-пропоксиРЕG або t-бутоксиРЕG. Параметр n у льні функціональні групи, які служать місцями призагальній структурі PEG вказує на кількість етилеєднання. Однією нуклеофільною функціональною ноксидних одиниць у полімері і вказується авторагрупою, яку широко застосовують як місце приєдми та взагалі спеціалістами у даній галузі як "стунання, є епсилон-аміногрупа лізинових залишків. пінь полімеризації". Полімерами такої самої Прийнятні для розчинника альфа-аміногрупи, карзагальної структури, у яких R1 є С1-7 алкільною боновокислотні групи, гуанідино-групи, імідазольні групою, також називають оксирановими похідними групи, відповідні активовані карбонільні групи, оки(Yasukohchi, Т., et al., Патент США №6,455,639). снені вуглеводні компоненти та тіольні групи також PEG та РЕО можуть бути лінійними, розгалуженивикористовують як місця приєднання. ми (Fuke, L, et al., (1994) J Control Release 30:27Гідроксильну групу PEG активують хлоридом 34) або зіркоподібними (Merrill, E.W., (1993) J ціаносечової кислоти перед його приєднанням до Biomater Sci Політ Ed 5:1-11). PEG та РЕО є алібілків (Abuchowski, Α., et al., (1977) J Biol Chem фатичними, тобто вони є розчинними у воді й у 252:3582-3586; Abuchowski, Α., et al., (1981) Рак деяких органічних розчинниках і можуть зчеплюваTreat Rep 65:1077-1081). Однак застосування цьотися з ліпідовмісними матеріалами, включаючи го способу має недоліки, які полягають у тому, що оболонкові віруси та мембрани тваринних та бактоксичність хлориду ціаносечової кислоти та його теріальних клітин, Деякі статичні або блок- або неспецифічна реактивність щодо білків, які мають переміжні співполімери етиленоксиду (ОСН2СH2) функціональні групи, які не є амінами, такі як прита пропіленоксиду, які мають таку структуру: йнятні для розчинника цистеїнові або тирозинові залишки, які можуть бути суттєвими для функції. Для подолання цих та інших недоліків було запроваджено альтернативні активовані PEG, такі як сукцинімідилсукцинатні похідні PEG ("SS-PEG") (Abuchowski, Α., et al., (1984) Cancer Biochem Biophys 7:175-186), сукцинімідилкарбонатні похідні мають властивості, які є достатньо подібними PAG ("SC-PAG") (Saifer, M., et al., Патент США до властивостей PEG, для того, щоб вважати ці №5,006,333) та альдегідні похідні PEG (Royer, співполімери придатними для заміни PEG у деяких G.P., Патент США №4,002,531). випадках (див., наприклад, Hiratani, Η., Патент Як правило, кілька (наприклад, від 5 до 10) лаСША №4,609,546 та Saifer, M., et al., Патент США нцюгів одного або кількох PAG, наприклад, одного №5,283,317). Термін "поліалкіленоксиди" та скороабо кількох PEG з молекулярною масою від прибчення "РАО" вжито авторами по відношенню до лизно 5кДа до приблизно 10кДа, зв'язують із задатаких співполімерів, а також до PEG або РЕО і ним білком через первинні аміногрупи (епсилонполі(оксіетилен-оксиметиленових) співполімерів аміногрупи лізинових залишків та, можливо, аль(Pitt, C.G., et al., Патент США №5,476,653). Вжитий фа-аміногрупу аміно-кінцевої ("N-кінцевої") аміноавторами термін "поліалкіленгліколі" та скороченкислоти). Останнім часом було синтезовано кон'юня "PAG" генетично стосуються полімерів, придатгати, які містять один ланцюг mPEG високої них для застосування у кон'югатах згідно з винамолекулярної маси, наприклад, 12кДа, 20кДа або 13 90654 14 30кДа. Було продемонстровано прямий зв'язок між модії з боку великих PEG- груп, нейтралізацію запівперіодом кон'югатів у плазмі та зростанням моряду або і те, й інше. лекулярної маси і/або зростанням кількості зв'язаТаким чином, існує потреба у способах одерних ланцюгів PEG (Knauf, M.J., et al., supra; Katre, жання PAG-вмісних (наприклад, PEG- та/або РЕОN.V. (1990) J Immunol 144:209-213; Clark, R., et al., вмісних) кон'югатів, зокрема, кон'югатів між такими (1996) J Biol Chem 271:21969-21977; Bowen, S., et водорозчинними полімерами та білками рецептоal., (1999) Exp Hematol 27:425-432; Leong, S.R., et рного зв'язування, зі збереженням значної біологіal., (2001) Cytokine 16:106-119). З іншого боку, зі чної активності (наприклад, принаймні приблизно зростанням кількості ланцюгів PEG, зв'язаних з 40%), майже повної біологічної активності (наприкожною молекулою білка виникає можливість моклад, принаймні приблизно 80%) або практично дифікації аміногрупи у суттєвій ділянці білка, а повної біологічної активності (наприклад, принайотже, погіршення біологічної функції білка, зокремні приблизно 90%). Такі кон'югати мають перевама, в разі, якщо він є білком рецепторного зв'язуги, які забезпечуються полімерним компонентом вання. Для великих білків, які містять багато амінопідвищеної розчинності, стійкості та біодоступності груп, і для ферментів із субстратами низької in vivo, і виявляють значно підвищену активність молекулярної маси компроміс між збільшенням або корисність порівняно з традиційними полімертривалості дії та зниженням специфічної активносними кон'югатами в організмі тварини, в який ці ті може бути прийнятним, оскільки це дає чисте кон'югати було введено з профілактичними, теразбільшення біологічної активності PEG-вмісних певтичними або діагностичними цілями. кон'югатів in vivo. Однак, для малих білків, які фунКороткий опис винаходу кціонують через взаємодію з рецепторами клітинДаний винахід стосується вищезазначених поної поверхні, таких як цитокіни, відносно високий треб і забезпечує способи одержання кон'югатів ступінь заміщення, за повідомленнями, знижує водорозчинних полімерів, наприклад, пофункціональну активність до точки зникнення пелі(етиленгліколю) та їх похідних з біологічно актиреваг подовження півперіоду в системі кровообігу вними компонентами, особливо, білками рецепто(Clark, R., et al., supra). рного зв'язування, зокрема терапевтичними або Таким чином, полімерна кон'югація є загальдіагностичними біологічно активними компонентаноприйнятим способом подовження біологічної ми, такими як цитокіни, включаючи інтерферонактивності та зниження імунореактивності терапебета, ще точніше - інтерферон-бета-1b. Винахід втичних білків, таких як ферменти (див., напритакож забезпечує кон'югати, одержані такими споклад, попередню заявку США №60/436,020, подасобами. Порівняно з відповідними некон'югованину 26 грудня 2002p., і попередні заявки США №№ ми біологічно активними компонентами, кон'югати 60/479,913 та 60/479,914, подані 20 червня 2003p., згідно з винаходом мають підвищену стійкість описи яких включено авторами шляхом посилання (тобто довший термін зберігання і довший півперів їх повному обсязі). До класу терапевтичних білод in vivo). Крім того, порівняно з кон'югатами того ків, для яких є особливо вигідною така знижена ж самого біологічно активного компонента, одерімунореактивність, належать інтерферони-бета, жаними з полімерними ланцюгами, які випадково є приєднаними до прийнятних для розчинника місць зокрема, інтерферон-бета-1b ("IFN- -1b;" SEQ ID уздовж поліпептидних ланцюгів, кон'югати згідно з NO:1) (The IFNB Multiple Sclerosis Study Group винаходом мають підвищену активність рецептор(1996) Neurology 47:889-894). Однак, кон'югація ного зв'язування, яка може бути виміряна або виполімерів з регуляторними білками, які функціонукористана in vitro, і підвищену активність, яка може ють шляхом специфічного зв'язування з рецептобути виміряна in vitro або in vivo. Крім того, винахід рами клітинної поверхні, зазвичай: (1) перешкозабезпечує композиції, які включають такі кон'югаджає такому зв'язуванню; (2) помітно послаблює ти, комплекти, які містять такі кон'югати, і композиефективність трансдукції сигналу цитокінових агоції та способи застосування кон'югатів та композиністів; і (3) помітно послаблює конкурентну ефекцій у різних терапевтичних та діагностичних тивність цитокінових антагоністів. Опублікованими режимах. прикладами таких кон'югатів з послабленою актиВ одному варіанті втілення винахід забезпечує вністю рецепторного зв'язування є полімерні кон'способи підвищення ефективності цитокіну. Деякі югати фактора, що стимулює колонії гранулоцитів способи згідно з цим аспектом винаходу включа("G-CSF") (Kinstler, О., et al., Публікація РСТ № WO ють, наприклад, вибіркове зв'язування одного або 96/11953; Bowen, S., et al., supra); гормон росту кількох синтетичних водорозчинних полімерів з людини ("hGH") (Clark, R., et al., supra); антагоністи аміно-кінцевою амінокислотою цитокіну, причому hGH (Ross, R.J.M., et al., (2001) J Clin Endocrinol аміно-кінцева амінокислота є розташованою на Metab 86:1716-1723; і IFN-альфа (Bailon, P., et al., відстані від одного або кількох доменів рецептор(2001) Bioconjug Chem 12:195-202; Wylie, D.C., et ного зв'язування цитокіну. Запропоновані винахоal., (2001) Pharm Res 18:1354-1360; та Wang, Y.-S., дом подібні способи підвищення ефективності циet al., (2002) Adv Drug Deliv Rev 54:547-570) та ін. У токіну включають, наприклад, вибіркове крайньому випадку зв'язування полімерів з інтерзв'язування одного або кількох синтетичних водолейкіном-15 ("IL-15") перетворює цей IL-2-подібний розчинних полімерів в одному або кількох місцях фактор росту на інгібітор клітинної проліферації глікозилування цитокіну або поблизу від них, при(Pettit, D.K., et al., (1997) J Biol Chem 272:2312чому ці одне або кілька місць глікозилування є 2318). Якщо не зв'язуватися межами теорії, мехарозташованими на відстані від одного або кількох нізм такого небажаного впливу пегілування може доменів рецепторного зв'язування цитокіну. включати стеричну перешкоду рецепторної взає 15 90654 16 До прийнятних полімерів для застосування у ною групою, сульфгідрильною групою, гуанідиноцих способах згідно з винаходом належать, крім групою, імідазольною групою, аміногрупою, карбоінших, один або кілька поліалкіленгліколів (вклюксильною групою або альдегідною похідною) амічаючи, крім інших, один або кілька поно-кінцевої амінокислоти на цитокіні. У додаткових лі(етиленгліколів), один або кілька монометоксиваріантах втілення зв'язування полімеру з цитокіполі(етиленгліколів) та один або кілька моногідроном в аміно-кінцевій амінокислоті або в одному ксиполі(етиленгліколів)), один або кілька поліалкіабо кількох місцях глікозилування або поблизу від леноксидів, один або кілька поліоксиранів, один них відтворює сприятливий вплив глікозилування або кілька поліолефінових спиртів, наприклад, цитокіну. У споріднених варіантах втілення зв'язуполівініловий спирт, один або кілька полікарбоксивання полімеру з цитокіном в одному або кількох латів, один або кілька полі(вінілпіролідонів), один місцях глікозилування або поблизу від них на циабо кілька полі(оксіетилен-оксиметиленів), один токіні відтворює сприятливий вплив гіперглікозиабо кілька полі(амінокислот), один або кілька полілування цитокіну, причому "гіперглікозилування" акрилоїл-морфолінів, один або кілька співполімевказує на ковалентне зв'язування простих або рів одного або кількох амідів та один або кілька складних вуглеводних компонентів додатково до алкіленоксидів, один або кілька декстранів та одна тих, які є присутніми у природній структурі. або кілька гіалуронових кислот. Полімери, прийняВинахід також забезпечує кон'югати, одержані тні для застосування згідно зі способами винаходу, способами згідно з винаходом. Кон'югати згідно з як правило, мають молекулярну масу від приблизвинаходом включають вибраний цитокін або його но 1кДа до приблизно 100кДа включно, або, точвибраний антагоніст (на зразок описаних вище), ніше, молекулярну масу від приблизно 8кДа до зв'язаний з одним або кількома синтетичними воприблизно 14кДа включно; від приблизно 10кДа до дорозчинними полімерами (на зразок описаних приблизно 30кДа включно; від приблизно 18кДа до вище), причому один або кілька полімерів є зв'язаприблизно 22кДа включно; або приблизно 20кДа ними з аміно-кінцевою амінокислотою цитокіну, і або приблизно 30кДа. аміно-кінцева амінокислота є розташованою на Різні цитокіни та аналоги, які відтворюють відстані від одного або кількох доменів рецептор(тобто агонізують) або антагонізують біологічний ного зв'язування вибраного цитокіну. Крім того, вплив відповідного цитокіну, опосередкований їх кон'югати згідно з винаходом включають вибраний специфічними рецепторами клітинної поверхні, є цитокін або його вибраний антагоніст (на зразок придатними для застосування при одержанні даописаних вище), зв'язаний з одним або кількома них кон'югатів. До них належать цитокіни, які масинтетичними водорозчинними полімерами (на ють чотириспіральну закручену структуру (вклюзразок описаних вище), причому один або кілька чаючи, крім інших, фактор, що стимулює колонії полімерів є з'єднаним з одним або кількома місцягранулоцитів (G-CSF), фактор, який стимулює ми глікозилування вибраного цитокіну, і одне або утворення колонії макрофагів (M-CSF), фактор, кілька місць глікозилування є розташованими на який стимулює утворення колонії гранулоцитіввідстані від одного або кількох доменів рецептормакрофагів (GM-CSF), фактор інгібування лейкемії ного зв'язування цитокіну. Для полімерних кон'ю(LIF), еритропоетин (Еро), тромбопоетин (Тро), гатів агоністів згідно з винаходом в оптимальному фактор стовбурових клітин (SCF), Flt3-ліганд, онваріанті місце (місця) приєднання полімеру є відкостатин Μ (OSM), інтерлейкін-2 (IL-2), IL-3, IL-4, даленими від усіх доменів рецепторного зв'язуIL-5, IL-6, IL-7, IL-9, IL-10, IL-11, IL-12 (субодиниця вання. Для полімерних кон'югатів деяких антагоністів згідно з винаходом, в оптимальному варіанті р35), IL-13, IL-15, IL-17, інтерферон-альфа (IFN- ), місце (місця) приєднання полімеру можуть бути інтерферон-бета (IFN- ) (зокрема, IFN- -1b), конвіддаленими від деяких доменів рецепторного сенсусний інтерферон та мутеїни, їх варіанти, зв'язування, які є суттєвими для зв'язування, але аналоги та похідні) і цитокіни, які мають -sheetне обов'язково віддаленими від усіх доменів рецеабо -berrel-структуру (включаючи, крім інших, пторного зв'язування, які є суттєвими для трансдуфактор некрозу пухлин альфа (TNF- ), IL-1 , ILкції сигналу агоністами. Винахід також забезпечує 1 , IL-12 (субодиниця р40), IL-16, епідермальний композиції, зокрема, фармацевтичні композиції, які фактор росту (EGF), інсуліноподібний фактор росвключають один або кілька кон'югатів згідно з виту-1 (IGF-1), основний фактор росту фібробластів находом і один або кілька додаткових компонентів, (bFGF), кислотний FGF, FGF-4 та фактор росту таких як один або кілька фармацевтично прийняткераноцитів (KGF; FGF-7), і мутеїни, їх варіанти, них розріджувачів, наповнювачів або носіїв. Винааналоги та похідні). хід також забезпечує комплекти, які включають Особливу перевагу віддають таким придатним один або кілька з кон'югатів, композицій та/або для застосування згідно з даним винаходом цитофармацевтичних композицій згідно з винаходом. кінам, як IL-2; IFN- ; IFN- ; IGF-1; EGF та bFGF. Винахід також забезпечує способи профілакТакож особливо придатними для застосування с тики, діагностування або лікування фізичного поконкурентні антагоністи вищезгаданих цитокінів, а рушення у тварини (наприклад, ссавця, такого як також мутеїни, варіанти та похідні цих цитокінів. людина), яка страждає від фізичного порушення У деяких варіантах втілення один або кілька або є схильною до нього. Такі способи можуть полімерів є ковалентно зв'язаними (зокрема, через включати, наприклад, введення тварині ефективвторинний амінний зв'язок) з альфа-аміногрупою ної кількості одного або кількох кон'югатів, компоаміно-кінцевої амінокислоти на цитокіні. В інших зицій або фармацевтичних композицій згідно з варіантах втілення один або кілька полімерів є даним винаходом. До фізичних порушень, які підковалентно зв'язаними з хімічно реакційноздатною даються лікуванню або профілактиці згідно з такигрупою бокового ланцюга (наприклад, гідроксиль 17 90654 18 ми способами винаходу, крім інших, належать рак від приблизно 0,5молів до приблизно 5молів пер(наприклад, рак молочної залози, рак матки, рак йодату на моль біологічно активного білка; і (с) яєчника, рак передміхурової залози, рак яєчка, рак інкубування вищезгаданої суміші протягом прилегенів, лейкемія, лімфома, рак товстої кишки, рак наймні однієї години, в оптимальному варіанті шлунково-кишкового тракту, рак підшлункової запри температурі від приблизно 2°С до приблизно лози, рак сечового міхура, рак нирок, рак кісток, 40°С. До білків, придатних для застосування згідно неврологічний рак, рак голови та шиї, рак шкіри, з такими способами, крім інших, належать цитокіни саркома, карцинома, аденома та мієлома); інфек(включаючи інтерферон-бета (зокрема, інтерфеційні хвороби (наприклад, бактеріальні хвороби, рон-бета-1b, який в оптимальному варіанті має грибкові хвороби, паразитарні хвороби та вірусні амінокислотну послідовність, показану у SEQ ID хвороби (такі як вірусний гепатит, хвороба, виклиNO:1). кана кардіотропним вірусом, ВІЛ/СHIД і т. ін.)); і У додаткових варіантах втілення винахід загенетичні порушення (наприклад, анемія, нейтробезпечує способи підвищення біологічної активнопенія, тромбоцитопенія, гемофілія, карликовість та сті композиції інтерферону-бета, зокрема, комповажкий комбінований імунодефіцит ("SCID"); аутозиції інтерферону-бета-1b, які включають імунні порушення (наприклад, псоріаз, системний видалення одного або кількох інгібіторних компочервоний вовчак та ревматоїдний артрит) і нейронентів композиції інтерферону-бета (або інтерфедегенеративні порушення (наприклад, різні форми рону-бета-1b). Згідно з цим аспектом винаходу, та стадії розсіяного склерозу ("PC"), такі як рециодин або кілька інгібіторних компонентів видалядивний-ремітуючий PC, первинний прогресуючий ють з композицій різними відомими спеціалістам PC та вторинний прогресуючий PC; хвороба Кройспособами обробки, очищення та/або аналізу білцфельдта-Якоба; хвороба Альцгеймера; і т. ін.). ків та пептидів, включаючи, крім інших, один або У споріднених варіантах втілення винахід такілька хроматографічних способів, таких як хромакож забезпечує способи визначення кількості потографія з виключенням за розміром, хроматоглімеру, який приєднується до аміно-кінця білка, рафія з оберненням фаз, хроматографія з гідроякий має N-кінцевий сериновий залишок, у полімефобною взаємодією та афінна хроматографія. рно-білковому кон'югаті, синтезованому шляхом Визначення біологічної активності даної композиції відновного алкілування. Способи згідно з цим асінтерферону-бета (тобто, чи збільшується, зменпектом винаходу включають, наприклад, (а) реакшується або залишається незмінною активність цію кон'югату з достатньою кількістю окисника провідносно вихідного розчину інтерферону-бета) тягом достатнього часу для відщеплення полімеру здійснюють будь-яким із багатьох in vitro або in від серинового залишку білка; і (b) вимірювання vivo аналізів, знайомих спеціалістам у даній галузі. збільшення частки некон'югованого білка у компоНаприклад, аналіз клітинної культури, що реагує зиції. До білків, придатних для застосування згідно на інтерферон-бета, застосовують для визначення з такими способами, належать, крім інших, цитокібіологічної активності композицій інтерферонуни (включаючи інтерферон-бета (зокрема, інтербета. Необмежувальними прикладами придатних ферон-бета-1b, який в оптимальному варіанті має аналізів таких клітинних культур є антипроліфераамінокислотну послідовність, показану у SEQ ID тивні аналізи, антивірусні аналізи, аналізи трансNO:1) і фактор росту та розвитку мегакаріоцитів). дукції сигналу та аналізи активації гена, приклади Окисник, який застосовують у деяких способах яких є добре відомими спеціалістам у даній галузі. згідно з винаходом, може бути перйодатом, вклюІнші оптимальні варіанти втілення даного вичаючи, крім інших, метаперйодат натрію, метапернаходу стануть зрозумілими спеціалістам після йодат калію, метаперйодат літію, метаперйодат ознайомлення з представленими нижче фігурами кальцію, метаперйодат барію та йодну кислоту. та описом винаходу, і з формулою винаходу. Прийнятними способами вимірювання збільшення Короткий опис фігур частки некон'югованого білка у композиції є будьНа Фігурах з 1 по 8 показано молекулярні моякі з різних відомих спеціалістам способів аналізу делі різних цитокінів та факторів росту, створені за білків та пептидів, включаючи, наприклад, хромадопомогою програми RasMol (Sayle, R.A., et al., тографію з виключенням за розміром, хроматог(1995) Trends Biochem Sci 20:374-316) на основі рафію з оберненням фаз, гель-електрофорез, какристалографічних даних. Кожну з моделей предпілярний електрофорез, ультрацентрифугування, ставлено у форматі "стрічки" або "кінокадрів", за ультрафільтрація, світлорозсіювання та масвинятком певних особливо цікавих залишків, які спектроскопія. показано у форматі "кульок та паличок". Ці формаУ додаткових споріднених варіантах втілення ти є опціями, передбаченими для користувачів винахід забезпечує способи вибіркового окиснюпрограми RasMol. Темні частини стрічок представвального розщеплення N-кінцевого серинового ляють домени цитокіну та факторів росту, про які залишку біологічно активного білка без окиснення відомо, що вони беруть участь у зв'язуванні з їх функціонально необхідних амінокислотних залишрецепторами. Для кожної структури вказано код ків вищезгаданого біологічно активного білка. Дедоступу в Банку даних білків ("PDB") (див. які подібні способи згідно з винаходом включають, Laskowski, R.A., (2001) Nucleic Acids Res 29:221наприклад, (а) доведення концентрації іонів водню 222; Peitsch, M.C., (2002) Bioinformatics 18:934-938; в розчині біологічно активного білка до рН від приSchein, C.H., (2002) Curr Pharm Des 8:2113-2129). близно 5 до приблизно 10, краще - до рН від прибФігура 1a показує модель інтерферону-альфализно 7 до приблизно 8; (b) змішування розчину 2а, у якій чотири лізинові залишки (Lys 31, Lys 121, біологічно активного білка з приблизно від Lys 131 та Lys 134), про які відомо, що вони є пер0,1молів до приблизно 10молів, або, ще краще винними місцями пегілування у продукті PEG 19 90654 20 ставленими у форматі "кульок та паличок", як і інтерферон від Roche, PEGASYS , показано у кілька лізинових залишків, які перебувають у доформаті "кульок та паличок" (на основі даних менах рецепторного зв'язування або поблизу від Bailon, P., et al., supra). Розпізнано ділянки, які бених. Найближчим амінокислотним залишком до руть участь у зв'язуванні з його рецепторами ("Міаміно-кінця, який є візуалізованим у кристалічній сця зв'язування 1 та 2"). Усі чотири лізинові залиструктурі, є серин 6 ("Ser 6"), який є віддаленим від шки, про які відомо, що вони є пегілованими у доменів рецепторного зв'язування (на основі даPegasys, перебувають у ділянці Місця зв'язування них публікації Bamborough, P., et al., (1994) 1 (код PDB 1ITF). Structure 2:839-851; Pettit, D.K., et al., supra) (код Фігура 1b показує модель інтерферону-aльфаPDB 3INK). 2b, у якій залишки, про які відомо, що вони є голоФігура 5 показує молекулярну модель людсьвними місцями пегілування у PEG-INTRON від кого епідермального фактора росту ("EGF") у фоSchering-Plough (His 34, Lys 31, Lys 121, Tyr 129 та рматі "кінокадрів", за винятком залишків, які беруть Lys 131), показано у форматі "кульок та паличок" участь у рецепторному зв'язуванні, та двох лізино(на основі даних Wylie, D.C., et al., supra). Ці амінових залишків (Lys 28 та Lys 48), які прилягають до кислотні залишки перебувають у ділянці Місця ділянок рецепторного зв'язування. Внутрішньолазв'язування 1. нцюгові дисульфідні зв'язки показано пунктирними Фігура 1с показує модель інтерферону-альфалініями. Найближчим амінокислотним залишком 2b, у якій аміно-кінцевий цистеїновий залишок до аміно-кінця, який є візуалізованим у кристаліч("Cys 1"), мішень пегілування згідно з даним винаній структурі, на якій базується ця модель, є цистеходом, показано у форматі "кульок та паличок". їн 6 ("Cys 6") (на основі даних публікації Carpenter, Cys 1 є віддаленим від Місць зв'язування 1 та 2. G., et al., (1990) J Biol Client 265:7709-7112; Lu, H.Фігура 1d показує таку саму модель інтерфеS., et al., (2001) J Biol Cliem 276:34913-34917). Гнурону-альфа-2b, як та, яку показано на Фігурі 1с, до чка частина аміно-кінця EGF (залишки 1-5), яка не якої було приєднано один ланцюг 20-кДа PEG на є візуалізованою у кристалічній структурі, перебуN-кінцевому цистеїновому залишку ("Cys 1"). Струває поза межами ділянки рецепторного зв'язуванктуру PEG відтворювали, застосовуючи адаптацію ня (код PDB 1JL9). програми, описаної у публікації Lee, L.S., et al., Фігура 6 показує молекулярну модель основ(1999) Bioconjug Chem 10:973-981), і її представного фактора росту фібробластів ("bFGF") у форлено у тому самому масштабі, що й білок. маті "кінокадрів", у якій залишки, які беруть участь Фігура 2 показує молекулярну модель людсьу зв'язуванні з рецепторами та гепарином, предкого інтерферону-бета-1a (див. SEQ ID NO:2), у ставлено у форматі "кульок та паличок" (на основі якій показано кілька лізинових залишків, які переданих публікації Schlessinger, J., et al., (2000) Mol бувають у доменах рецепторного зв'язування або Cell 6:743-750). Перші 12 амінокислотних залишків прилягають до них (Lys 19, Lys 33, Lys 99 та Lys від аміно-кінця не брали участі у рецепторному 134). Крім того, місце глікозилування (Asn 80) та Nзв'язуванні (код PDB 1FQ9). кінцевий метіоніновий залишок ("Met 1") показано Фігура 7 показує молекулярну модель інсуліу форматі "кульок та паличок" (на основі даних ноподібного фактора росту-1 ("IGF-1") у форматі Karpusas, Μ., et al., (1997) Proc Natl Acad Sci USA "кінокадрів", за винятком залишків, які брали 94:11813-11818; Karpusas, M., et al., (1998) Cell Mol участь у рецепторному зв'язуванні (23-25 та 28Life Sci 54:1203-1216; Runkel, L., et al., (2000) 37), та глутаміновокислотного залишку 3 ("Glu 3"), Biochemistry 39:2538-2551). Met 1 є віддаленим від який є найближчим амінокислотним залишком до Місць зв'язування 1 та 2, тоді як кілька лізинових аміно-кінця, який є візуалізованим у кристалічній залишків є розташованими у доменах рецепторноструктурі. Розпізнано два з лізинових залишків, го зв'язування (код PDB 1AUI). Структура інтерфеодин з яких (Lys 27) прилягає до домену рецепторону-бета-1b (див. SEQ ID NO:1) відрізняється від рного зв'язування, а інший є віддаленим від доместруктури інтерферону-бета-1a відсутністю Nну рецепторного зв'язування (на основі даних пубкінцевого метіонінового залишку та вуглеводного лікації Brzozowski, A.M., et al., (2002) Biochemistry компонента, а також сериновим залишком, який 41:9389-9397). Аміно-кінець IGF-1 є віддаленим від заміщує непарний цистеїновий залишок (Cys 17 у доменів рецепторного зв'язування. (код РОВ SEQ ID NO:2). 1GZR) Фігура 3 показує молекулярну модель людсьФігура 8 показує молекулярну модель інтеркого фактора, який стимулює утворення колонії ферону-гамма ("lFN-гамма"), який є гомодимером. гранулоцитів-макрофагів ("GM-CSF"), у якій три Для пояснення взаємодії між двома поліпептиднилізинові залишки (Lys 72, Lys 107 та Lys 111), які ми ланцюгами один з мономерів ("Ланцюг А") поперебувають у доменах рецепторного зв'язування, казано у форматі "стрічки", а інший ("Ланцюг В") а також перший амінокислотний залишок поблизу показано у форматі "хребта". Лізинові залишки від аміно-кінця, який є візуалізованим у кристаліч(показані у форматі "кульок та паличок") трапляній структурі ("Arg4"), показано у форматі "кульок ються уздовж поліпептидного ланцюга, включаючи та паличок" (на основі даних публікації Rozwarski, ділянки, які є задіяними у поверхні взаємодії між D.A., et al., (1996) Proteins 25:304-313). Аміномономерами або прилягають до амінокислотних кінцева ділянка GM-CSF є віддаленою від Місць залишків, які беруть участь у рецепторному зв'язузв'язування 1 та 2 (код PDB 2GMF). ванні. Аміно-кінцева ділянка lFN-гамма є віддалеФігура 4 показує молекулярну модель людсьною від поверхні димеризації, але глутамін 1 (Gln кого інтерлейкіну-2, у якій амінокислотні залишки, 1) є задіяним у рецепторному зв'язуванні. (Thiel, про які відомо, що вони є задіяними у кожному з трьох рецепторів (альфа, бета та гамма), є пред 21 90654 22 D.J., et al., (2000) Structure 8:927-936; код PDB оресцентним барвником і фотографували з ульт1FG9) рафіолетовим освітленням. Інтенсивність забарвФігура 9 показує фракціонування непегіловалення вимірювали за допомогою програми обробного інтерферону-альфа-2b ("IFN"), монопегіловаки зображень Kodak ID. ного інтерферону-альфа-2b ("PEG1-IFN") та дипеФігура 19 показує результати електрофоретигілованого інтерферону альфа-2b ("PEG2-IFN") чних аналізів таких самих зразків, що й на Фігурі шляхом катіонообмінної хроматографії реакційної 18, за винятком того, що гель забарвлювали для суміші, що містить IFN, 20-кДа mPEG-альдегіду та виявлення PEG реагентом, який містить ВаСl2, I2 відновника. та KІ. Інтенсивність забарвлення на фотографії Фігура 10 показує хроматографічний аналіз з гелю вимірювали як на Фігурі 18. У реакційній сувиключенням за розміром реакційної суміші, фраміші може бути виявлений пік залишкового вільнокціонованої, як показано на Фігурі 9, та вибраних го 20-кДа PEG. фракцій, зібраних з іонообмінної колонки, резульФігура 20 показує хроматограми з оберненням тати для якої показано на Фігурі 9. фаз зразків IFN- -1b, які були або необробленими Фігура 11 показує фракціонування шляхом ка(верхня крива) або інкубовані з 0,5мМ NaIO4, які тіонообмінної хроматографії реакційної суміші, яка приєднували N-кінцеві серинові залишки основних містить людський IL-2, 20-кДа mPEG-альдегід та та незначних компонентів до альдегідних похідних відновник. За вказаних умов елюювання залишко(середня крива), або окиснювалися NaIO4 і реагувий непегілований IL-2 не елюювався з колонки, вали з 9-флуоренілметилкарбазатом ("Fmocна відміну від результатів для інтерферону-альфакарбазатом"). Незначний компонент ("Пік А") міс2b, показаних на Фігурі 9. тить окиснений метіоніновий залишок. Подібне Фігура 12 показує хроматографічний аналіз з збільшення часу утримання як Піку А, так і основвиключенням за розміром реакційної суміші, франого компонента після окиснення відображає прикціонованої, як показано на Фігурі 11, та вибраних єднання N-кінцевих серинових залишків у кожному фракцій, елюйованих з цієї колонки. піку до альдегіду. Збільшення відсотка Піку А після Фігура 13 показує електрофоретичні аналізи інкубування з NaIO4 за цих умов не виявляли. На реакційної суміші пегілованого інтерлейкіну-2 утворення кон'югатів Fmoc з окиснених форм Піку ("PEG-IL-2") та фракції з катіонообмінної колонки, А та основного компонента вказує збільшення чадля яких показано хроматограму на Фігурі 11. су їх утримання та оптичної густини після реакції з Фігура 14 показує відщеплення шляхом HPLC Fmoc-карбазатом. з виключенням за розміром інтерферону- -1b Фігура 21 демонструє синтез PEG1-IFN- шля("IFN") від його кон'югатів, утворених шляхом відхом реакції 20-кДа PEG-карбазату з альдегідною новного алкілування за допомогою 20кДа mPEG похідною IFN- . Зростаюча пропорція кон'югату, альдегіду у різних початкових концентраціях ("1х", виявленого після інкубування білка з 0,125мМ "2х" або "4х"), ціаноборогідриду натрію (NaBH3CN) NaIO4 при кімнатній температурі протягом 0,5, 1 як відновника. Кон'югати, які містять один ланцюг або 2 годин вказує на те, що повне перетворення PEG ("PEG1-IFN") або два ланцюги ("PEG2-IFN"), N-кінцевого серину на альдегід вимагає більше 1 відщеплюють від IFN, з яким PEG не було зв'язано години за цих умов. PEG1-IFN- не повністю відза цих умов ("псевдопегілований IFN"). щеплювався від 20-кДа PEG-карбазату на цій коФігура 15 демонструє окиснювальне розщеплонці з виключенням за розміром. лення перйодатом натрію приблизно 90% PEG1Фігура 22 демонструє збільшену антипроліфеIFN- , синтезованого шляхом відновного алкілуративну ефективність стосовно клітин лімфоми вання за різних умов. HPLC з виключенням за роБаркітта людини (клітин Дауді) або розведень зміром у присутності додецилсульфату натрію PEG1-IFN- , очищеного шляхом хроматографії з ("SDS") відщеплювало залишковий PEG1-IFN- від оберненням фаз (Фракція 51, характеризується на продуктів розщеплення, включаючи формальдегід Фігурах 17-19) порівняно з розведеннями вихідного та IFN, де N-кінцевий серин був приєднаний до розчину IFN- . Концентрація очищеного PEG1-IFNальдегіду ("IFN-альдегід"). , яка вимагається для інгібування 50% росту цих Фігура 16 показує відщеплення шляхом хроклітин, який піддається інгібуванню, становила матографії з оберненням фаз PEG1-IFN- від псеприблизно 40пг/мл, що складало приблизно одну вдопегілованого IFN- , незв'язаного PEG, незв'яшосту від концентрації, необхідної для вихідного заного SDS та незначних компонентів реакційної розчину IFN- . Концентрація очищеного псевдопесуміші. гілованого IFN- (Фракція 53 з хроматограми з Фігура 17 показує результати аналітичної хрооберненням фаз, показаної на Фігурі 17), необхідматографії з оберненням фаз ("RP") пегілування на для інгібування 50% росту цих клітин, який підреакційної суміші та фракцій з препаративної RPдається інгібуванню, становила приблизно колонки, які були збагачені PEG1-IFN- (Фракція 80пг/мл, що складало приблизно одну третину від 51) або псевдопегілованим IFN- (Фракція 53), концентрації, необхідної для вихідного розчину відповідно. IFN- . Фігура 18 показує результати електрофоретиДетальний опис винаходу чних аналізів пегілування реакційної суміші та Якщо немає іншого визначення, усі вжиті авфракцій з препаративної RP-колонки, які є збагаторами технічні та наукові терміни мають загальчені або PEG1-IFN- (Фракція 51), або кон'югатами, ноприйняті значення для спеціалістів у галузі, якої які містять більш одного ланцюга PEG (Фракція стосується цей винахід. Хоча у практичному вті49). Гель забарвлювали для виявлення білка флуленні або випробуванні даного винаходу можуть 23 90654 24 бути застосовані будь-які способи та матеріали, інших, білки та поліпептиди, такі як описані автоподібні або рівноцінні тим, які описано авторами, рами. нижче описано оптимальні способи та матеріали. Зв'язаний: Вжитий авторами термін "зв'язаний" Визначення стосується зв'язування або приєднання, яке може Приблизно: Вжитий авторами по відношенню бути ковалентним, наприклад, шляхом хімічного до будь-якого числового значення, термін "прибзв'язку, або нековалентним, наприклад, іонною лизно" означає значення ±10% від вказаного знавзаємодією, гідрофобною взаємодією, водневими чення (наприклад, "приблизно 50°С" охоплює діазв'язками та ін. Ковалентними зв'язками можуть пазон температур від 45°С до 55°С включно; так бути, наприклад, естерні, етерні, фосфоестерні, само "приблизно 100мМ" охоплює діапазон концетіоестерні, тіоетерні, уретанові, амідні, амінні, пепнтрацій від 90мМ до 110мМ включно). тидні, імідні, гідразонові, гідразидні, вуглецевоАмінокислотний залишок: Вжитий авторами сірчані зв'язки, вуглецево-фосфорні зв'язки і т. ін. термін "амінокислотний залишок" стосується конкТермін "зв'язаний" є ширшим за такі терміни, як ретної амінокислоти, як правило, зневодненої в "з'єднаний", "кон'югований" та "приєднаний", і охорезультаті її участі у двох пептидних зв'язках, в плює їх. основному або боковому ланцюгу поліпептиду, Кон'югат/кон'югація: Вжитий авторами термін але також у разі, коли амінокислота бере участь в "кон'югат" стосується продукту ковалентного зв'яодному пептидному зв'язку, як це відбувається на зування полімеру, наприклад, PEG або РЕО, з кожному кінці лінійного поліпептидного ланцюга. біологічно активним компонентом, наприклад, білАмінокислотні залишки позначаються трилітерником або глікопротеїном. "Кон'югація" стосується ми кодами або однолітерними кодами, загальнопутворення кон'югату, як визначено у попередньому рийнятими серед спеціалістів у даній галузі. реченні. Будь-який спосіб, який зазвичай застосоАнтагоніст: Вжитий авторами термін "антаговують спеціалісти у галузі кон'югації полімерів з ніст" стосується сполуки, молекули, компонента біологічно активними матеріалами, може бути заабо комплексу, що знижує, значною мірою знижує стосований у даному винаході. або повністю інгібує біологічний та/або фізіологічЗ'єднаний: Вжитий авторами термін "з'єднаний вплив даного цитокіну на клітину, тканину або ний" стосується приєднання через ковалентні зв'яорганізм, опосередкований через рецептори для зки або через міцну нековалентну взаємодію, як даного цитокіну. Антагоністи можуть справляти правило, і в оптимальному варіанті - приєднання такий вплив різними шляхами, включаючи, крім через ковалентні зв'язки. Будь-який спосіб, який інших, конкуренцію з агоністом за місце (місця) зазвичай застосовують спеціалісти у даній галузі зв'язування або рецептор(и) на поверхні клітин; для з'єднання біологічно активних матеріалів, мовзаємодію з агоністом таким чином, щоб знизити, же бути застосований у даному винаході. значною мірою знизити або повністю інгібувати Цитокін: Вжитий авторами термін "цитокін" виздатність агоніста до зв'язування з рецепторами значають як секретований регуляторний білок, поверхні клітин; зв'язування та викликання конфоякий контролює виживання, ріст, диференціацію рмаційних змін у рецепторах поверхні клітин, тата/або ефекторну функцію клітин ендокринним, ким чином, щоб рецептори набували структури, з паракринним або аутокринним способом (див. якою агоніст уже не може зв'язуватися (або може Nicola, N.A., supra; Kossiakoff, Α.Α., et al., (1999) зв'язуватися лише зі зниженою або значно знижеAdv Білок Chem 52:67-108). Згідно з цим визначенною афінністю та/або ефективністю); викликання ням до цитокінів належать інтерлейкіни, колонієсфізіологічних змін (наприклад, збільшення у комтимулюючі фактори, фактори росту та інші пептиплексах внутрішньоклітинного сигналу; збільшення дні фактори, які виробляються різними клітинами, у транскрипційних інгібіторах; зниження експресії включаючи, крім інших, ті, які було спеціально рецептора ліганду поверхні клітин; і т. ін.) у клітиописано або наведено як приклади авторами. Так нах, тканинах або організмах, таким чином, щоб само, як і близько споріднені з ними поліпептидні зв'язування агоніста або фізіологічний сигнал, вигормони та фактори росту, цитокіни започатковукликаний агоністом після зв'язування з клітиною, ють їхні регуляторні функції шляхом зв'язування зі знижувалися, значною мірою знижувалися або специфічними рецепторними білками на поверхні повністю інгібувалися; та інші механізми, завдяки клітин-мішеней. яким антагоністи можуть діяти, відомі спеціалістам Хвороба, порушення, стан: Вжиті авторами у даній галузі. Як стане зрозуміло спеціалістові в терміни "хвороба" або "порушення" стосуються даній галузі, антагоніст може мати структуру, подібудь-якого негативного стану людини або тварини, бну до ліганду, який він антагонізує (наприклад, включаючи пухлини, рак, алергію, залежність, ауантагоніст може бути мутеїном, варіантом, фрагтоімунність, інфекцію, отруєння або погіршення ментом або похідною агоніста), або може мати оптимальної розумової або фізичної функції. Вжиповністю відмінну структуру. тий авторами термін "стани" включає хвороби та Біологічно активний компонент: Вжитий автопорушення, але також стосується фізіологічних рами термін "біологічно активний компонент" стостанів. Наприклад, фертильність є фізіологічним сується сполуки, молекули, компонента або комстаном, але не є хворобою або порушенням. Комплексу, що має конкретну біологічну дію in vivo, in позиції згідно з винаходом, придатні для запобіvitro або ex vivo на клітину, тканину орган або органня вагітності шляхом зниження фертильності, ганізм, і є здатною до зв'язування з одним або кітаким чином, слід описувати як засоби подолання лькома поліалкіленгліколями для утворення кон'юстану (фертильності), але не засоби лікування від гатів згідно з винаходом. До оптимальних порушення або хвороби. Інші стани є зрозумілими біологічно активних компонентів належать, крім спеціалістам у даній галузі. 25 90654 26 Ефективна кількість: Вжитий авторами термін чином, пептиди, дипептиди, трипептиди, олігопеп"ефективна кількість" стосується кількості даного тиди та білки охоплюються визначенням поліпепкон'югату або композиції, яка є необхідною або тиду. Цей термін також стосується продуктів пісдостатньою для досягнення потрібного біологічноляекспресійних модифікацій поліпептиду, го ефекту. Ефективною кількістю даного кон'югату наприклад, глікозилування, гіперглікозилування, або композиція згідно з даним винаходом має бути ацетилування, фосфорилування і т. ін. Поліпептид кількість, яка дозволяє досягти цього вибраного може походити з природного біологічного джерела результату, і таку кількість традиційним способом або може бути одержаний за допомогою технології визначають спеціалісти у даній галузі, застосовурекомбінантних ДНК, але не обов'язково є трансючи аналізи, відомі спеціалістам і/або описані авльованим із зазначеної нуклеїновокислотної посторами, без потреби у зайвих експериментах. Налідовності. Він може бути одержаний будь-яким приклад, ефективною кількістю для лікування від способом, включаючи хімічний синтез. дефіциту імунної системи може бути кількість, неБілок та глікопротеїн: Вжитий авторами термін обхідна для викликання активації імунної системи, "білок" стосується поліпептиду, який зазвичай має яка в результаті забезпечує розвиток антигенрозмір понад приблизно 10 або більше, 20 або специфічної імунної реакції після піддавання дії більше, 25 або більше, 50 або більше, 75 або біантигену. Цей термін також є синонімом "достатльше, 100 або більше, 200 або більше, 500 або ньої кількості". Ефективна кількість для будь-якого більше, 1 000 або більше або 2 000 або більше конкретного застосування може бути різною, заамінокислот. Білки зазвичай мають певну тривимілежно від таких чинників, як хвороба або стан, які рну структуру, хоча вони не обов'язково мають піддають лікуванню, конкретна композиція, яка має таку структуру і часто називаються згорнутими, на бути введена, шлях введення, розмір суб'єкта відміну від пептидів та поліпептидів, які часто не та/або тяжкість хвороби або стану. Звичайний мають певної тривимірної структури, а можуть наспеціаліст у даній галузі може емпірично визначибувати великої кількості різних конформацій і нати ефективну кількість конкретного кон'югату або зиваються незгорнутими. Однак, пептиди також композиції згідно з даним винаходом без необхідможуть мати певну тривимірну структуру. Вжитий ності у зайвих експериментах. авторами термін "глікопротеїн" стосується білка, Один: Термін "один", вжитий у цьому описі з'єднаного з принаймні одним вуглеводним компоозначає "принаймні один" або "один або кілька", нентом, який є приєднаним до білка через кисневякщо не вказано іншого. місний або азотовмісний боковий ланцюг амінокиPEG: Вжитий авторами термін "PEG" включає слотний залишок, наприклад, сериновий залишок всі полімери етиленоксиду, незалежно від того, чи або аспарагіновий залишок. є вони лінійними, чи розгалуженими, чи багатолаВіддалений: Вжитий авторами термін "відданцюговими, і незалежно від того, чи має він на лений" (наприклад, "віддалена N-кінцева амінокикінці захисну групу, чи гідроксил. Термін "PEG" слота" або "віддалене місце глікозилування") стовключає полімери, які є відомими спеціалістам як сується структури, у якій розташування одного або полі(етиленгліколь), метоксиполі(етиленгліколь) кількох місць приєднання для одного або кількох або mPEG або полі(етиленгліколь)полімерів на білку перебувають на відстані або є монометиловий етер, алкоксиполі(етиленгліколь), віддаленим у просторі від однієї або кількох ділянок або доменів рецепторного зв'язування білка, полі(етиленоксид) або РЕО, -метил- -гідроксияк визначають шляхом молекулярного моделюполі(окси-1,2-етандііл) та поліоксиран, крім інших вання. Кон'югація полімеру в такому віддаленому назв, які вживаються у даній галузі для полімерів місці приєднання (як правило, N-кінцевій амінокисетиленоксиду. лоті (для білків рецепторного зв'язування, які, таПегілування, пегілований та псевдопегіловаким чином, називають "віддаленими N-кінцевими" ний: Вжитий авторами термін "пегілування" стосуабо "RN-білками рецепторного зв'язування") або ється будь-якого процесу ковалентного зв'язуванодному чи кількох вуглеводних компонентах або ня PEG з біологічно активною молекулоюмісцях глікозилування на глікопротеїні (для білків мішенню, зокрема, білком рецепторного зв'язуванрецепторного зв'язування, які, таким чином, назиня. Кон'югат, одержаний таким способом, називавають "білками віддаленого глікозилування" або ють "пегілованим". Вжитий авторами термін "псев"RG-білками рецепторного зв'язування")) не видопегілований" стосується частини білка у кликає значної стеричної перешкоди для зв'язуреакційній суміші для пегілування, до якої PEG не вання білка з його рецептором(ами). Отже, аміноє ковалентно приєднаним. Незважаючи на це, кінцеву амінокислоту або місце глікозилування на псевдопегілований продукт може бути змінений під цитокіні називають "розташованими віддалено від час реакції або наступних етапів очищення, наприодного або кількох доменів рецепторного зв'язуклад, внаслідок піддавання дії відновника під час вання" цитокіну, коли кон'югація (наприклад, ковапегілування шляхом відновного алкілування та/або лентне зв'язування) водорозчинного полімеру з шляхом видалення одного або кількох інгібіторних аміно-кінцевою амінокислотою або місцем глікозиагентів, сполук і т. ін. під час етапів обробки та/або лування, відповідно, не має суттєвого впливу на очищення. здатність цитокіну до зв'язування з його рецептоПоліпептид: Вжитий авторами термін "поліпепром(ами), зокрема, з рецепторами клітинної поветид" стосується молекули, яка складається з морхні. Звичайно, визнається, що даний цитокін мономерів (амінокислот) лінійно зв"язаних амідними же містити більше одного домену рецепторного зв'язками (також відомими як пептидні зв'язки). Він зв'язування. У таких ситуаціях аміно-кінцева амівказує на молекулярний ланцюг амінокислот і не нокислота або місце глікозилування цитокіну мостосується конкретної довжини продукту. Таким 27 90654 28 жуть розташовуватися на віддалі від одного такого ність рецепторного зв'язування відносно полімердомену або від кількох таких доменів і все одно них кон'югатів того ж самого білка рецепторного вважатися "розташованими на віддалі від одного зв'язування, в якому один або кілька полімерів є або кількох доменів рецепторного зв'язування", приєднаними випадково. Завдяки застосуванню якщо кон'югація аміно-кінцевої амінокислоти або структурних аналізів на основі кристалографії за місце глікозилування не має суттєвого впливу на допомогою рентгенівських променів та ядерного зв'язування цитокіну з його рецептором(ами) через магнітного резонансу, мутаційного аналізу та проодин або кілька з доменів рецепторного зв'язуванграми молекулярного моделювання, автори даноня. Чи має кон'югація суттєвий вплив на здатність го винаходу розпізнали намічені місця пегілування білка зв'язуватися з його рецептором(ами), можна цитокінів, які беруть участь або не беруть участі у легко визначити, застосовуючи відомі спеціалістам зв'язуванні з їхніми рецепторами. Як клас білків, ці аналізи зв'язування лігандів з рецепторами, які є цитокіни вказуються авторами як білки рецепторзнайомими спеціалістам у даній галузі. ного зв'язування. Вибираючи способи синтезу, Як показано на Фігурі 1d цього опису, PEG є спрямовані на приєднання полімеру до ділянки дуже розтягнутим і гнучким полімером, який за(ділянок) білка рецепторного зв'язування, які не ймає великий об'єм у розчині відносно білка подіберуть участі у взаємодії з рецепторами, уникають бної молекулярної маси. Хоча амінокислотний деяких небажаних стеричних перешкод, і одержані залишок, до якого приєднується PEG, може бути в результаті полімерні кон'югати зберігають надвіддаленим від одного або кількох місць рецептозвичайно високу ефективність. Білки рецепторного рного зв'язування, частини полімеру все одно певзв'язування, що мають аміно-кінцевий залишок, ною мірою можуть впливати на рецепторне зв'язуякий є віддаленим від однієї або кількох їх ділянок вання. Ймовірність такого впливу зростає зі або доменів рецепторного зв'язування, визначазбільшенням молекулярної маси, а отже, об'єму, ються авторами як "віддалені N-кінцеві" або "RNякий займає полімер у розчині. У будь-якому разі, білки рецепторного зв'язування"; вони включають цільове приєднання PEG до одного або кількох усі їх цитокіни або антагоністи, які мають аміномісць, віддалених від ділянок рецепторного зв'язукінцеву амінокислоту, розташовану на віддалі від вання менше впливає на функцію цитокіну, ніж місця або місць рецепторного зв'язування білка. випадкове пегілування. У додаткових варіантах втілення винаходу До способів оцінки зв'язування лігандів з реодержують кон'югати, які включають один або кіцепторами, крім інших, належать аналізи конкурелька синтетичних полімерів (наприклад, один або нтного зв'язування, радіорецепторні аналізи зв'якілька полі(етиленгліколів)), ковалентно зв'язаних зування, аналізи на основі клітин, вимірювання з цитокінами, які мають природні місця глікозилурезонансів поверхневих плазмонів, динамічне свівання, які є віддаленими від однієї або кількох їх тлорозсіювання, ультрацентрифугування та ультділянок або доменів рецепторного зв'язування. рафільтрація. Згідно з цим аспектом винаходу біологічно активні Суттєвий, суттєво, значною мірою: Як сказано компоненти (наприклад, цитокіни) кон'югатів виявавторами, кон'югація білка не має "суттєвого" ляють добре збережену активність рецепторного впливу на здатність білка зв'язуватися з його резв'язування, коли синтетичні полімери є з'єднаницептором(ами), якщо швидкість та/або ступінь ми у ділянці місця (місць) глікозилування. Ця підгзв'язування кон'югованого білка з рецептором є не рупа білків рецепторного зв'язування вказується меншою, ніж приблизно 40%, приблизно 50%, авторами як "RG-білки рецепторного зв'язування". приблизно 60%, приблизно 65%, приблизно 70%, Коли гідрофільний або аліфатичний полімер є виприблизно 75%, приблизно 80%, приблизно 85%, бірково з'єднаним з таким місцем "віддаленого приблизно 90%, приблизно 91%, приблизно 92%, глікозилування" або поблизу від нього, зокрема, приблизно 93%, приблизно 94%, приблизно 95%, коли білок-мішень є неглікозилованою формою приблизно 96%, приблизно 97%, приблизно 98%, білка, який у природі є глікозилованим, полімер приблизно 99% або приблизно 100% або більше може імітувати сприятливий вплив природного від швидкості та/або ступеня зв'язування відповідвуглеводу, наприклад, на агрегацію, стійкість ного цитокіну, який не був кон'югований. та/або розчинність. Отже, приєднання полімеру в Лікування: Вжиті авторами терміни "лікування", місці або поблизу від місця глікозилування назва"лікувати" або "лікований" стосуються профілактино авторами "псевдоглікозилуванням". Таким чики та/або терапії. Вжитий, наприклад, по відноном, даний винахід забезпечує способи синтезу шенню до інфекційної хвороби, цей термін може кон'югатів, згідно з якими сайт-специфічне з'єдстосуватися профілактичного лікування, яке піднання синтетичного полімеру ефективно замінює вищує стійкість суб'єкта до інфікування патогеном природні вуглеводні компоненти. Псевдоглікозилуабо, іншими словами, знижує ймовірність того, що вання, яке забезпечується в результаті, сприяє цей суб'єкт може стати інфікованим патогеном або поліпшенню розчинності, зменшенню агрегації та буде виявляти ознаки хвороби, зумовлені інфекціуповільненню виведення з системи кровообігу поєю, а також лікування після інфікування суб'єкта з рівняно з іншими неглікозилованими формами метою боротьби з інфекцією, наприклад, для знибілка. Цей підхід, таким чином, є особливо вигідження або усунення інфекції або запобігання погіним для одержання кон'югатів та композицій білків, ршенню стану. які одержують із застосуванням технологій рекомЗагальний огляд бінантних ДНК у прокаріотних клітинах-хазяях (наДаний винахід забезпечує способи синтезу приклад, бактеріях, таких як Escherichia coli), оскіполімерних кон'югатів білків рецепторного зв'язульки прокаріотні організми, як правило, не вання, які зберігають несподівано високу активглікозилують білки, які вони експресують. 29 90654 30 Аналогічним чином вибіркове пегілування вугкілька детергентів, одна або кілька молекул нуклелеводного компонента глікопротеїну може призвеїнових кислот, один або кілька полімерів, таких як сти до "псевдогіперглікозилування" глікопротеїну. некон'югований PEG або поліалкіленгліколь, і т. ін. Цей процес було описано, наприклад, у публікації Винахід також забезпечує комплекти, які включаС. Bona et al., у публікації РСТ № WO 96/40731, ють кон'югати та/або композиції згідно з винахоопис яких включено авторами шляхом посилання у дом. повному обсязі. Таким чином, цей підхід є особлиВинахід також забезпечує фармацевтичні або во вигідним для одержання кон'югатів та композиветеринарні композиції, які включають кон'югати цій білків, які одержують із застосуванням технозгідно з винаходом та принаймні один наповнювач логій рекомбінантних ДНК в еукаріотних клітинахабо носій, який є прийнятним для фармацевтичнохазяях (наприклад, у дріжджах, рослинних клітинах го або ветеринарного застосування. Винахід також та тваринних клітинах (включаючи клітини ссавців забезпечує способи лікування або профілактики та комах), оскільки еукаріотні організми, як правирізних фізичних порушень із застосуванням таких ло, глікозилують білки, які вони експресують, якщо композицій, включаючи введення ефективної кільці білки включають природні сигнали глікозилуванкості одного або кількох кон'югатів або композицій ня або сигнали глікозилування, включені з застозгідно з даним винаходом тварині, яка страждає суванням технологій рекомбінантних ДНК. Такі або є схильною до фізичного порушення або стапсевдоглікозиловані і псевдогіперглікозиловані ну. RG-білки рецепторного зв'язування охоплюються Крім того, винахід забезпечує стабілізовані біобсягом даного винаходу. лки рецепторного зв'язування та способи їх одерВинахід, таким чином, також охоплює полімежання для застосування у промисловій клітинній рні кон'югати "RN-білків рецепторного зв'язуванкультурі, при яких досягають несподівано високої ня", які зберігають суттєву, майже повну або пракефективності в результаті комбінованого впливу тично повну активність рецепторного зв'язування, суттєвого збереження біологічної активності та та псевдоглікозиловані або псевдогіперглікозилозбільшенням тривалості дії при промисловому вані "RG-білки рецепторного зв'язування", які збезастосуванні. Несподівано висока ефективність рігають суттєву, майже повну або практично повну кон'югатів згідно з даним винаходом може відоактивність рецепторного зв'язування. Як вказано бражатися у несподівано високому виробленні авторами, цитокін "зберігає суттєву, майже повну біомаси, несподівано високому рівні експресії реабо практично повну активність рецепторного зв'якомбінантних білків та інших поліпшеннях ефектизування", якщо він є кон'югованим з одним або вності біологічної обробки. кількома водорозчинними полімерами згідно з даУ додаткових варіантах втілення винахід заним винаходом, якщо кон'югація цитокіну не має безпечує альтернативні способи підвищення біосуттєвого впливу на здатність білка зв'язуватися з логічної активності композиції інтерферону-бета, його рецептором(ами), тобто, якщо швидкість зокрема, одержання інтерферону-бета-1b. Спосота/або ступінь зв'язування кон'югованого білка з би згідно з цим аспектом винаходу можуть вклюйого відповідним(и) рецептором(ами) є не меншичати, наприклад, видалення одного або кількох ми, ніж приблизно 40%, приблизно 50%, приблизінгібіторних компонентів з композиції інтерферонуно 60%, приблизно 65%, приблизно 70%, приблизбета (або інтерферону-бета-1b). Згідно з цим асно 75%, приблизно 80%, приблизно 85%, пектом винаходу один або кілька інгібіторних комприблизно 90%, приблизно 91%, приблизно 92%, понентів видаляють з композицій різними відомиприблизно 93%, приблизно 94%, приблизно 95%, ми спеціалістам способами обробки білків та приблизно 96%, приблизно 97%, приблизно 98%, пептидів, очищення та/або аналізу, включаючи, приблизно 99% або приблизно 100% або більше, крім інших, один або кілька хроматографічних сповід швидкості та/або ступеня зв'язування некон'юсобів, таких як хроматографія з виключенням за гованої форми відповідного білка. Також обсяг розміром, хроматографія з оберненням фаз, хроданого винаходу охоплює полімерні кон'югати білматографія з гідрофобною взаємодією та афінна ків рецепторного зв'язування, які класифікуються і хроматографія. На практиці визначення біологічної як RN-, і як RG-білки рецепторного зв'язування. активності даної композиції інтерферону-бета Двома прикладами останніх білків є інтерферон(тобто визначення того, чи біологічна активність бета (зокрема інтерферон-бета-1b) та IL-2. зростає, знижується чи залишається незмінною У додаткових варіантах втілення винахід завідносно вихідного розчину цитокіну, такого як інбезпечує способи синтезу полімерних кон'югатів терферон-бета) здійснюють будь-яким із багатьох білків рецепторного зв'язування, які зберігають in vitro або in vivo аналізів, знайомих спеціалістам несподівано високу активність рецепторного зв'яу даній галузі. Наприклад, аналіз клітинної культузування відносно полімерних кон'югатів того ж ри, що реагує на інтерферон-бета, застосовують самого білка рецепторного зв'язування, в якому для визначення біологічної активності композицій випадково є приєднаними один або кілька полімеінтерферону-бета. Необмежувальними прикладарів. Винахід також забезпечує кон'югати, які одерми придатних аналізів таких клітинних культур є жують такими способами, та композиції, які вклюантипроліферативні аналізи, антивірусні аналізи, чають один або кілька цих кон'югатів згідно з аналізи трансдукції сигналу та аналізи активації винаходом, які також можуть включати один або гена, приклади яких є добре відомими спеціаліскілька додаткових компонентів або реагентів, татам у даній галузі. ких як одна або кілька буферних солей, один або У споріднених варіантах втілення винахід такілька вуглеводних наповнювачів, один або кілька кож забезпечує способи визначення кількості побілків-носіїв, один або кілька ферментів, один або лімеру, який є приєднаним до аміно-кінця білка, 31 90654 32 який має N-кінцевий сериновий залишок, у поліметорного зв'язування може бути збережений шлярно-білковому кон'югаті, синтезованому шляхом хом кон'югації білків згідно зі способами даного відновного алкілування. Способи згідно з цим асвинаходу, яка відбулася б, якби полімер був приєпектом винаходу включають, наприклад, (а) реакднаний у частині або поблизу частини молекули, цію кон'югату з достатньою кількістю окисника прояка бере участь у зв'язуванні з його рецептотягом достатнього часу для відщеплення полімеру ром(ами). Цей принцип, який у результаті може від серинового залишку білка; і (b) вимірювання забезпечити несподівано високе збереження актизбільшення частки некон'югованого білка у комповності рецепторного зв'язування, може бути прозиції. Білки, придатні для застосування згідно з демонстрований для білків рецепторного зв'язутакими способами, включають, крім інших, цитоківання, які вибирають з-поміж основного фактора ни (включаючи інтерферон-бета (зокрема, інтерросту фібробластів ("bFGF" або "FGF-2"), епідерферон-бета-1b, який в оптимальному варіанті має мального фактора росту ("EGF"), інсуліноподібного амінокислотну послідовність, показану у SEQ ID фактора росту-1 ("IGF-1"), інтерферону-альфа NO:1) і фактор росту та розвитку мегакаріоцитів ("IFN-альфа"), інтерферону-бета ("IFN-бета", (див. публікацію Guerra, P.I., et al., (1998) Pharm включаючи, крім інших, IFN-бета-1b), фактора, Res 15:1822-1827, опис якої є включеним автораякий стимулює утворення колонії гранулоцитівми шляхом посилання у повному обсязі). Окисник, макрофагів ("GM-CSF"), фактора, який стимулює який застосовують у деяких подібних способах утворення колонії моноцитів ("M-CSF"), Flt3винаходу, може бути перйодатом включаючи, крім ліганду, фактора стовбурових клітин ("SCF"), інтеінших, метаперйодат натрію, метаперйодат калію, рлейкінів 2, 3, 4, 6, 10, 12, 13 та 15, трансформуюметаперйодат літію, метаперйодат кальцію, метачого фактора росту-бета ("TGF-бета"), гормону перйодат барію та йодну кислоту. До прийнятних росту людини ("hGH"), пролактину, плацентарного способів вимірювання збільшення частки некон'юлактогенного гормону, циліарного нейротрофічногованого білка у композиції належать будь-які з го фактора ("CNTF"), лептину та структурних анарізних відомих спеціалістам способів аналізу білків логів цих білків рецепторного зв'язування, які іміта пептидів, включаючи, наприклад, хроматогратують дію цих білків або які є антагоністами їх фію з виключенням за розміром, хроматографію з рецепторного зв'язування. І навпаки, вибіркове оберненням фаз, гель-електрофорез, капілярний приєднання великого полімеру до аміно-кінця IFΝелектрофорез, ультрацентрифугування, ультрафігамма не зберігає більшої частини активності цьольтрацію, світлорозсіювання та масго цитокіну, оскільки таке з'єднання мало б перешспектроскопію. коджати зв'язуванню активного димеру з його реУ додаткових подібних варіантах втілення вицепторами (на основі даних публікації Walter, M.R., нахід забезпечує способи вибіркового окиснюваet al., (1995) Nature 376:230-235). льного розщеплення N-кінцевого серинового заУ подібному варіанті втілення винаходу полілишку біологічно активного білка без окиснення мери є з'єднаними з аміно-кінцевим залишком муфункціонально необхідних амінокислотних залиштеїнів білків рецепторного зв'язування, які функціків вищезгаданого біологічно активного білка. Деонують як конкурентні антагоністи природного які подібні способи згідно з винаходом включають, білка шляхом зв'язування з одним або кількома наприклад, (а) доведення концентрації іонів водню однаковими рецепторами, не викликаючи трансдув розчині біологічно активного білка до рН від прикції сигналу. Прикладами є полімерні кон'югати близно 5 до приблизно 10, краще - до рН від прибантагоніста hGH, який містить точкову мутацію лизно 7 до приблизно 8; (b) змішування розчину G120R (Sundstrom, Μ, et al., (1996) J Biol Chem біологічно активного білка з приблизно від 271:32197-32203), та антагоніста пролактину, який 0,1молів до приблизно 10молів, або, ще краще містить точкову мутацію G129R (Goffin, V., et al., від приблизно 0,5молів до приблизно 5молів, пер(1997) J Mammary Gland Biol Neoplasia 2:7-17; йодату на моль біологічно активного білка; і (с) Chen, W.Y., et al., (1999) Clin Рак Res 5:3583-3593; інкубування вищезгаданої суміші протягом приChen, W.Y., Публікація PCT № WO 99/58142 A1). наймні однієї години, в оптимальному варіанті Інші антагоністи білків рецепторного зв'язування при температурі від приблизно 2°С до приблизно одержують шляхом вибіркових точкових мутацій, 40°С. Білки, придатні для застосування згідно з зрізань або делецій (див., наприклад, Tchelet, Α., такими способами, включають, крім інших, цитокіet al., (1997) Mol Cell Endocrinol 130:141-152; ни (включаючи інтерферон-бета (зокрема інтерPeterson, F.C., (1998) Identification of Motifs ферон-бета-1b, який в оптимальному варіанті має Associated with the Lactogenic and Somatotropic амінокислотну послідовність, показану у SEQ ID Actions of Human Growth Hormone, Ph.D. NO:1). Dissertation, Ohio State University, UMI # 9822357). Способи У додаткових варіантах втілення винаходу для Автори даного винаходу виявили, що спрямуRG-білків рецепторного зв'язування способи дановання полімерів на аміно-кінцеву амінокислоту RNго винаходу в результаті забезпечують приєднанбілка рецепторного зв'язування або на місце побня одного або кількох синтетичних полімерів поблизу місця глікозилування RG-білка рецепторного лизу від природного місця приєднання зв'язування забезпечує приєднання полімеру в вуглеводних компонентів тих білків рецепторного місці, яке є віддаленим від однієї або кількох ділязв'язування, які є глікопротеїнами. Це призводить нок або доменів рецепторного зв'язування білка, до "псевдоглікозилування" цих білків рецепторного таким чином, мінімізуючи стеричну перешкоду резв'язування (наприклад, якщо їх було експресовацепторної взаємодії з боку приєднаних молекул но з застосуванням технологій рекомбінантних полімерів. Отже, вищий відсоток активності рецепДНК в Е. соlі або інших прокаріотних клітинах, які 33 90654 34 не виконують післятрансляційного глікозилування) Відповідним чином, у додаткових варіантах або призводить до "псевдогіперглікозилування" їх втілення даний винахід забезпечує способи розпіглікопротеїнових форм (наприклад, для утворених знання та відбору білкових лігандів рецепторного природним шляхом глікопротеїнів або для глікопзв'язування (наприклад, цитокінів та їх антагонісротеїнів, утворених еукаріотними клітинамитів), які мають N-кінець та/або місце (місця) глікохазяями (наприклад, дріжджами, рослинними клізилування, які є віддаленими від місць рецептортинами та тваринними клітинами (включаючи кліного зв'язування білкових лігандів (тобто способи тини ссавців та комах), які виконують післятрансрозпізнання та відбору RN- або RG-білків). У деляційне глікозилування). Прикладами є полімерні яких подібних варіантах втілення винаходу оптикон'югати інтерферонів альфа та бета, а також мальне місце для кон'югації одного або кількох еритропоетину ("Еро") та інтерлейкіну-2. Приєдполімерів (наприклад, одного або кількох PEG) нання синтетичних полімерів у місцях або поблизу визначають, застосовуючи молекулярне моделювід місць природного глікозилування здійснюють вання, наприклад, шляхом візуалізації тривимірної будь-яким способом, відомим спеціалістам, вклюструктури білка (цитокіну або його антагоніста) з чаючи мутаційний спосіб, описаний у публікації застосуванням програми молекулярного моделюR.J. Goodson, et al., ((1990) Biotechnology 8:343вання для передбачення місця (місць), у яких один 346), та спосіб, описаний у публікації R.S. Larson, або кілька полімерів можуть бути приєднаними до et al., ((2001) Bioconjug Chem 12:861-869), який білка без суттєвої втрати біологічної активності включає попереднє окиснення вуглеводу; описи, або активності рецепторного зв'язування білка які містяться у цих джерелах, є включеними авто(див. також Schein, С.Η., supra). Аналогічний підхід рами шляхом посилання в їх повному обсязі. було продемонстровано, наприклад, для кон'югації Аміно-кінцеву модифікацію деяких білків було PEG з G-CSF при спробі поліпшення його стійкості описано раніше (див., наприклад, Dixon, H.B.F., до протеолітичної деградації (див. опубліковану (1984) J Protein Chem 3:99-108). Наприклад, повіпатентну заявку США №2001/0016191 Α1, подану домлялося, що N-кінцева модифікація білків, крім T.D. Osslund, опис якої є включеним авторами іншого, стабілізує деякі білки перед дією амінопепшляхом посилання у повному обсязі). Відповідна тидаз (Guerra, P.І., et al., supra), поліпшує розчинпрограма молекулярного моделювання для застоність білка (Hinds, K., et al., (2000) Bioconjug Chem сування у даному винаході, наприклад, RASMOL 11:195-201), знижує заряд на N-кінцевій аміногрупі (Sayle et al., supra), та інші програми, які застосоабо поліпшує гомогенність утворених в результаті вували для створення бази даних макромолекулякон'югатів (Kinstler, О., et al., Європейська патентрних структур, депонованих у Банку даних білків на заявка № ЕР 0822199 А2; Kinstler, О., et al., (PDB; див. Laskowski, R.A., supra), є загальновідо(2002) Adv Drug Deliv Rev 54:477-485). Було опимою серед спеціалістів у даній галузі і є знайомою сано альтернативний спосіб з'єднання полімерів з спеціалістам. Завдяки застосуванню такої програaльфа-аміногрупою N-кінцевого цистеїнового або ми молекулярного моделювання, тривимірна стругістидинового залишку шляхом пристосування ктура поліпептиду, наприклад, цитокіну або його процедури, відомої серед спеціалістів як "природантагоніста, може бути передбачена або визначене хімічне зшивання" (Roberts, M.J., et al., Публікана з високим ступенем певності на основі кристація РСТ № WO 03/031581 А2 та Патентна заявка лографічних аналізів лігандів та їх рецепторів. США, Публікація №2003/0105224 А1, описи яких є Таким чином, звичайний спеціаліст у даній галузі включеними авторами шляхом посилання в їх поможе легко визначити, які ліганди є RN- або RGвному обсязі). Однак існування RN- та RGлігандами, придатними для застосування згідно з підкласів білків рецепторного зв'язування, загальданим винаходом. нозастосовуваних способів відбору представників Для практичного втілення даного винаходу цих класів і одержання та застосування полімерзручним шляхом ковалентного зв'язування водоних кон'югатів таких білків рецепторного зв'язурозчинного полімеру з альфа-аміногрупою Nвання як спосіб збереження несподівано високої кінцевого амінокислотного залишку білка є відновфункціональної активності RN-білків рецепторного не алкілування основ Шиффа, утворених з полізв'язування раніше не визнавалося і не було опимерами, які несуть одну альдегідну групу, наприсаним. клад, як заявлено автором G.P. Royer (Патент Таким чином, існує перевага для визначення США №4,002,531), але не так, як заявлено автотого, чи має даний цитокін N-кінець та/або місце рами J.M. Harris, et al., (Патент США №5,252,714), (місця) глікозилування. які є віддаленими від місця оскільки останні автори вказують лише на поліме(місць) рецепторного зв'язування ліганду. Можлири, утворені на обох кінцях з альдегідними групавість передбачення того, чи є даний цитокін RNми, які є зшиваючими агентами і, таким чином, є або RG-лігандом, до кон'югації ліганду з поліменепридатними для синтезу білків рецепторного ром суттєво зменшує необхідність в експеримензв'язування тривалої дії, які зберігають значну актах, необхідних для утворення кон'югатів полімертивність рецепторного зв'язування. ліганду (наприклад, цитокінів або їх антагоністів, Спрямування відновного алкілування основ кон'югованих з полімерами, наприклад, PEG), у Шиффа PEG-моноальдегідів на альфа-аміногрупу яких антигенність та імуногенність кон'югату є зниN-кінцевої амінокислоти білка рецепторного зв'яженою відносно антигенності та імуногенності незування і від епсилон-аміногруп її лізинових заликон'югованого ліганду, без суттєвого зниження шків здійснюють різними способами, на основі рецепторного зв'язування та фізіологічної активрозкриття, зробленого автором J.T. Edsall у Роздіності кон'югованого ліганду. лах 4 та 5 публікації Proteins Amino Acids and Peptides as Ions and Dipolar Ions ((1943), Reinhold 35 90654 36 Publishing Corporation, New York), опис якої є них похідних полі(етиленгліколю) з деякими білкавключеним авторами шляхом посилання у повноми при застосуванні трансглутамінази, яке здійсму обсязі. За розрахунками, стала кислотної дисонюють при рН 7,5 (Sato, Η., (2002) Adv Drug Deliv ціації ("рKа") альфа-аміногрупи N-кінцевої амінокиRev 54:487-504). слоти поліпептиду має бути нижчою, ніж 7,6, тоді Відновлення утворених у результаті основ як показники рKа епсилон-аміногруп лізинових заШиффа слабкими відновниками, такими як ціанолишків у поліпептидах мають становити приблизно борогідрид натрію або піридинборан (Cabacungan, 9,5. Edsall ((1943, supra) чітко вказував, що альдеJ.C., et al., (1982) Anal Biochem 124:272-278), утвогіди зв'язуються з аміногрупою амінокислоти "лирює вторинні амінні зв'язки, які зберігають позитише на лужному боці її ізоелектричної точки". вний заряд N-кінцевої альфа-аміногрупи білка при Таким чином, на основі даного розкригтя та фізіологічному рівні рН. Такі зв'язки, які зберігають інформації, яка є доступною для спеціалістів у такий самий заряд, як у природного білка, з більданій галузі, спеціаліст у даній галузі зможе визнашою вірогідністю зберігають свою біологічну актити, що (1) вибірковій реакції альдегідів з альфавність, ніж альтернативні способи хімічного зв'язуаміногрупою білка сприяє рівень рН, не вищий за вання, які нейтралізують заряд, наприклад, при 9,5 (приблизно рKа епсилон-аміногруп у білку); (2) утворенні амідних зв'язків (Burg, J., et al., публікашвидкість реакції альдегідів з епсилонція РСТ № WO 02/49673 А2; Kinstler, О., et al., єваміногрупами знижується, якщо рН реакції знизити ропейська патентна заявка № ЕР 0822199 А2; до 7,6 (приблизно рKа альфа-аміногрупи білка); (3) Kinstler, О., et al., (1996) Pharm Res, 13:996-1002; швидкість реакції альдегідів з альфа-аміногрупою Kita, Υ., et al., supra) або уретанових зв'язків знижується менше порівняно з еисилон(Gilbert, C.W., et al., патент США №6,042,822; аміногрупами при зниженні рН реакції до 7,6, і (4) Grace, Μ., et al., (2001) JInterferon Cytokine Res вибірковість для реакції альдегіду з альфа21:1103-1115; Youngster, S., et al., (2002) Gar аміногрупою дещо покращується зі зниженням рН Pharm Des 8:2139-2157). до 6,6. Оскільки останнє значення є приблизно на Альтернативні підходи до вибіркового з'єднанодну одиницю рН меншим за рKа aльфаня полімерів з N-кінцевими амінокислотними зааміногрупи і на три одиниці рН меншим за рKа еилишками є відомими спеціалістам у даній галузі. силон-аміногруп, приблизно 10% альфа-аміногруп Вони включають способи з'єднання гідразиду, гіді приблизно 0,1% епсилон-аміногруп перебувають разину, семікарбазиду або інших аміновмісних у їх реакційноздатному, непротонованому стані. полімерів з N-кінцевими сериновими або треоніноТаким чином, при рН 6,6 фракція непротонованих вими залишками, які було окиснювально приєднаальфа-аміногруп є у 100 разів вищою, ніж фракція но до альдегідів перйодатом (Dixon, H.B.F., supra; непротонованих епсилон-аміногруп. Таким чином, Geoghegan, K.F., патент США №5,362,852; дуже невеликого підвищення вибірковості досягаGaertner, H.F., et al. (1996) Bioconjug Chem 7:38-44; ють шляхом подальшого зниження рН реакції, наDrummond, R.J., et al., патент США №6,423,685). приклад, до 5,6, при якому, теоретично, 1% альфаПридатні полімери аміногруп і 0,01% епсилон-аміногруп мають бути в У деяких варіантах втілення винаходу бажаїх реакційноздатному, непротонованому стані. Таною є мінімізація утворення внутрішньомолекуляким чином, у деяких варіантах втілення винаходу рних та міжмолекулярних поперечних зв'язків побілкові ліганди (зокрема, RN- або RG-ліганди, лімерами, такими як PEG, під час реакції, в якій включаючи цитокіни та їх антагоністи) є кон'юговаполімер з'єднують з біологічно активним компоненими з одним або кількома полімерами через нтом для одержання кон'югатів згідно з винаходом. утворення суміші між лігандом(ами) і одним або Це здійснюють шляхом застосування полімерів, які кількома реакційноздатними полімерами при рН є активованими лише на одному кінці (які вказувід приблизно 5,6 до приблизно 7,6; при рН від ються авторами як "монофункціонально активоваприблизно 5,6 до приблизно 7,0; при рН від прибні PEG" або "монофункціонально активовані лизно 6,0 до приблизно 7,0; при рН від приблизно PAG"), або полімерних композицій, у яких відсоток 6,5 до приблизно 7,0; при рН від приблизно 6,6 до біфункціонально активованих (вказаних, у разі приблизно 7,6; при рН від приблизно 6,6 до приблінійних PEG, як "бiс-активовані PEG-діоли") або лизно 7,0; або при рН приблизно 6,6. Представлені багатофункціонально активованих полімерів є способи, таким чином, значною мірою відрізняютьменшим, ніж приблизно 30%, або, у кращому варіся від тих, що є відомими спеціалістам, згідно з анті - меншим, ніж приблизно 10%, або, у найкраякими з'єднання полімерів з aльфа-аміногрупами щому варіанті - меншим, ніж приблизно 2% ((мана N-кінцевих амінокислотних залишках лігандів са/маса)). Застосування активованих полімерів, які здійснюють при рН від приблизно 5 (Kinstler, О., et повністю або майже повністю є монофункціональal., (2002) supra; ЕР 0822199 А2; патенти США ними, може мінімізувати утворення: внутрішньо№№ 5,824,784 та 5,985,265; Roberts, M.J., et al., молекулярних поперечних зв'язків в окремих мо(2002), supra; Delgado, С, et al., публікація патентлекулах білків, "гантелеподібних" структур, у яких ної заявки США №2002/0127244 Α1), тоді як з'єдодин ланцюг полімеру з'єднує дві молекули білків, нання полімерів з епсилои-аміногрупами лізинових та великих агрегатів гелів. залишків в основному ланцюгу лігандного поліпепДо активованих форм полімерів, які є придаттиду здійснюють при рН 8,0 (Kinstler, О., et al., ЕР ними для застосування у способах та композиціях 0822199 А2; патенти США №№ 5,824,784 та згідно з цим винаходом, можу і ь належати будь5,985,265). Так само, представлені способи також які лінійні або розгаіужені, монофункціонально значною мірою відрізняються від ферментних споактивовані форми полімерів, які с відомими спецісобів, які застосовували для з'єднання алкіламіналістам у даній галузі. Наприклад, ті, які мають 37 90654 38 молекулярну масу (виключаючи масу активуючої номалеімідні, моно-ортопіридилдисульфідні, моногрупи) у межах від приблизно 1кДа до приблизно оксимові, моно-фенілгліоксальні, моно-тіазолідин100кДа. Прийнятні межі молекулярних мас вклю2-тіонові, монотіоестерні, монотіольні, монотриачають, але не обмежуються діапазоном від прибзинові та моновінілсульфонові похідні PEG. У долизно 5кДа до приблизно 30кДа; від приблизно даткових варіантах втілення цитокіни, хемокіни, 8кДа до приблизно 14кДа; від приблизно 10кДа до фактори росту, поліпептидні гормони та їх антагоприблизно 20кДа; від приблизно 18кДа до приблиністи можуть бути з'єднані з одним або кількома зно 60кДа; від приблизно 18кДа до приблизно полімерами, як описано у патентній заявці США 22кДа; від приблизно 12кДа до приблизно 30кДа, №10/669,597, яка перебуває у спільному володінні приблизно 5кДа, приблизно 10кДа, приблизно й розглядається одночасно з даною заявкою, і 20кДа або приблизно 30кДа. У разі лінійних PEG опис якої є включеним авторами шляхом посиланмолекулярні маси від приблизно 10кДа, приблизно ня у повному обсязі. 20кДа або приблизно 30кДа відповідають ступеБіологічно активні компоненти ням полімеризації (n) приблизно 230, приблизно Як було зазначено вище, кон'югати згідно з 450 або приблизно 680 мономерних одиниць етивинаходом включають один PAG або РАО, зокреленоксиду, відповідно. Слід зазначити, що задовго ма, один ланцюг PEG, ковалентно приєднаний до до того, як було визнано існування RN- та RGодного або кількох біологічно активних компоненкласів білків рецепторного зв'язування, було впетів. Біологічно активні компоненти, до яких є коварше розкрито переваги з'єднання терапевтичних лентно приєднаними один або кілька полімерів білків з полімерами, які мають відносно високу (або їх ланцюгів), вказуються авторами, у різних та молекулярну масу (тобто >20-30кДа) (Saifer, Μ., et однакових значеннях, як "кон'юговані біологічно al., публікація РСТ № WO 89/01033 Α1, опублікоактивні компоненти" або "модифіковані біологічно вана 9 лютого 1989p., включена авторами шляхом активні компоненти". Ці терміни слід відрізняти від посилання у повному обсязі). "некон'югованих біологічно активних компонентів", В інших варіантах втілення винаходу кон'югати "первісних біологічно активних компонентів" або білків рецепторного зв'язування з несподівано ви"немодифікованих біологічно активних компоненсоким відсотком збереженої біологічної активності тів", які всі стосуються біологічно активних компоодержують для застосування in vitro, наприклад, у нентів, які не мають ковалентно приєднаних до культурі клітин, шляхом з'єднання монофункціонаних полімерів. Однак слід розуміти, що "некон'югольно активованих полімерів приблизно 1кДа, приваний", "немодифікований" або "первісний" біолоблизно 2кДа або приблизно 5кДа, згідно зі спосогічно активний компонент може містити інші, непобами цього винаходу. Для такого in vitro лімерні кон'югації або модифікації порівняно з застосування перевагу віддають молекулярним дикою або природною молекулою, і має розглядамасам у цьому нижчому діапазоні. тись як "некон'югований", "немодифікований" або Необов'язково лінійний полімер може мати "первісний" згідно з даним винаходом, оскільки реакційноздатну групу на одному кінці або на обох біологічно активний компонент буває "некон'югокінцях, таким чином, утворюючи "реакційноздатний ваним", "немодифікованим" або "первісним" по полімер". У деяких варіантах втілення цього винавідношенню до приєднання полімерів, як у разі з ходу може бути бажаним застосування Nбіологічно активними компонентами, які вказуютьгідроксисукцинімідилового естеру монопропіонося авторами як "псевдопегіловані". вокислотної похідної PEG, як описано у публікації Термін "стабілізація" біологічно активного комJ.M. Harris, et al., патент США №5,672,662, який є понента (або "способи стабілізації" або "стабілізовключеним авторами у повному обсязі шляхом ваний біологічно активний компонент") означає, посилання, або інших N-гідроксисукцинімідщо біологічно активний компонент було стабілізоактивованих PEG-монокарбонових кислот. У девано згідно зі способами цього винаходу (тобто яких інших варіантах втілення може бути бажаним біологічно активний компонент, до якого було козастосування або моносукцинімідилкарбонатних валентно приєднано полімер згідно зі способами похідних PEG ("SC-PEG"), як описано у публікаціях винаходу). Такі стабілізовані біологічно активні М. Saifer, et al., патентах США №№ 5,006,333; компоненти виявляють деякі змінені біохімічні та 5,080,891; 5,283,317 та 5,468,478, або моно-pбіофізичні характеристики порівняно з біологічно нітрофенілкарбонатної похідної PEG, як описано у активним компонентом, який не був стабілізований публікації S.J. Kelly, et al., supra; у публікаціях L.D. (тобто біологічно активним компонентом, до якого Williams, et al., публікації РСТ № WO 00/07629 А2, полімер не було ковалентно приєднано). До таких L.D. Williams, et аl., патенті США №6,576,235, та змінених біохімічних та біофізичних параметрів, M.R. Sherman, et al., публікації РСТ № WO зокрема, для білків рецепторного зв'язування, мо01/59078 А2. Крім того, застосовують і інші типи жуть належати знижена сприйнятливість до прореакційноздатних груп для синтезування полімертеолітичного розпаду, зокрема, збереження активних кон'югатів білків: до цих похідних належать, ності білка рецепторного зв'язування під час крім інших, моноальдегідні похідні PEG (Royer, інкубації за певних жорстких умов навколишнього G.P., патент США №4,002,531; Harris, J.M., et al., середовища та експериментів. У деяких варіантах патент США №5,252,714), моноамінні, моновтілення винаходу до змінених біохімічних та біотрибромофенілкарбонатні, монокарбонілфізичних параметрів можуть належати, наприклад, індазольні, моно-трихлорофенілкарбонатні, монозбільшений півперіод у системі кровообігу in vivo, трифторофенілкарбонатні, моногідразидні, моногізбільшена біодоступність, збільшена тривалість дії дразинові, моносемікарбазидні, монокарбазатні, in vitro і т. ін. моно-тіосемікарбазидні, монойодоацетамідні, мо 39 90654 40 Будь-який білок рецепторного зв'язування (як згідно з даним винаходом. До них, крім інших, направило, цитокін), який має біологічну (тобто фізілежать: цитокіни з групи факторів некрозу пухлин, ологічну, біохімічну або фармацевтичну) активнаприклад, TNF- , TNF- та Fas ліганди, які мають ність, пов'язану з частинами молекули, які є віддазакручені структури -jelly; IL-1 (включаючи IL-1 леними від її аміно-кінця або від природного або та IL-1 ) і FGF (включаючи основний фактор росту мутаційно включеного місця глікозилування, мофібробластів (bFGF), кислотний FGF, FGF-4 та жуть бути використані як первісний компонент у фактор росту кераноцитів (KGF; FGF-7)) групи, які даному винаході. До таких біологічно активних мають складку бета-трилисника (Schein, C.H., компонентів належать, крім інших, пептиди, поліsupra; Schlessinger, J., et al., supra); IL-12; IL-16; пептиди, білки і т. ін. До біологічно активних комепідермальний фактор росту (EGF; Lu, H.-S., et al, понентів також належать фрагменти, мутеїни та supra); і тромбоцитарні фактори росту (PDGFs), похідні таких пептидів, поліпептидів, білків і т. ін., трансформуючі фактори росту (включаючи трансзокрема, фрагменти, мутеїни та похідні, які мають формуючий фактора росту- та трансформуючий біологічну (тобто фізіологічну, біохімічну або фарфактор росту- (TGF- )) та фактори росту нервів, мацевтичну) активність. які набувають структур цистинових вузлів. До прийнятних пептидів, поліпептидів та білків, Додатковим структурним класом білків, які виглікопро геїнів і т. ін., які є корисними як біологічно гідно застосовують у кон'югатах та композиціях активні компоненти у даному винаході, належать згідно з даним винаходом, є клас багатих на дисубудь-який пептид, поліпептид або білок і т. ін., який льфід змішаних / цитокінів та факторів росту має одну або кілька наявних аміногруп, тіольних (див. Schein, C.H., supra), включаючи, крім інших: груп або інших груп, які є віддаленим від ділянки групу EGF, яка має бета -меандрову структуру; ILабо ділянок рецепторного зв'язування біологічно 8; RANTES; нейтрофілоактивуючий пептид-2 активного компонента, і до яких можуть бути вибі(NAP-2); похідний від клітин строми фактор-1 рково приєднані полімери. До таких пептидів, по(SDF-1 ); білки-хемоатрактанти моноцитів (МСР-1, ліпептидів, білків, глікопротеїнів і т. ін. належать МСР-2 та МСР-3); еотаксини (наприклад, еотакцитокіни, які можуть мати будь-яку з різних струксин-1, еотаксин-2 та еотаксин-3); мієлоїдний вихітур (Nicola, N.A., supra; Schein, C.H., supra). дний інгібіторний фактор-1 (MPIF-1); нейротактин, Наприклад, до прийнятних пептидів, поліпепфактор інгібування міграції макрофагів (MIF); потидів та білків, крім інших, належить клас цитокінів, в'язаний з ростом онкоген/стимулюючу активність які мають структури, які включають чотири росту меланоми (GRO- /MGSA); соматомедини; та спіральні ділянки (як довголанцюгові, так і коротінсулін і інсуліноподібні фактори росту (наприклад, коланцюгові підкласи) (див. Schein, С.Η., supra). IGF-1 та IGF-2). Спорідненим за структурою клаРізні подібні чотириспіральні білки є придатними сом білків, які застосовують у кон'югатах та комподля застосування у даному винаході, включаючи, зиціях згідно з даним винаходом, є цитокіни з мокрім інших, інтерлейкіни, наприклад, IL-2, IL-3, IL-4, заїчними структурами, включаючи фактори росту, IL-5, IL-6, IL-7, IL-9, IL-10, IL-11, IL-12 (субодиниця такі як IL-12 та фактор росту гепатоцитів (Nicola, р35), IL-13, IL-15 та IL-17; колонієстимулюючі факN.A., supra). тори, наприклад, фактор, який стимулює утворенДо інших цікавих білків, крім інших, належать: ня колонії макрофагів (M-CSF), та фактор, який гормони росту (зокрема, гормон росту людини стимулює утворення колонії гранулоцитів(hGH; see Tchelet, A., et al., (1997) Моl Cell макрофагів (GM-CSF; Rozwarski, D.A., et al., (1996) Endocrinol 130:141-152) та його антагоністи (див., Proteins 26:304-313); інтерферони, наприклад, IFNнаприклад, Sundstrom, М., еt аl., (1996) J Biol Chem , IFN- (включаючи, крім інших, IFN- -1b) та кон277:32197-32203), пролактин та його антагоністи, сенсусний IFN; фактор інгібування лейкемії (LIF); хоріонічний гонадотропін, фолікулостимулюючий еритропоетин (Еро); тромбопоетин (Тро); фактор гормон, гормон, який стимулює діяльність щитовиросту та розвитку мегакаріоцитів (MFDF); фактор дної залози, пігментні гормони, рилізинг-фактор стовбурових клітин (SCF), також відомий серед гіпоталамусу, антидіуретичні гормони й антагонісспеціалістів як Steel Factor (Morrissey, P.J., et al, ти рецепторного зв'язування цитокінів та факторів (1994) Cell Immunol 157:118-131; McNiece, I.K., et росту всіх вищезгаданих структурних класів. Багаal, (1995) J Leukoc Biol 58:14-22); онкостатин M то таких білків існують як у глікозилованій, так і в (OSM); білок, який активує фосфоліпазу (PLAP); неглікозилованій формах. Неглікозиловані форми нейтрофільні фактори; i їх пептидоміметики. Хоча можуть бути результатом їх одержання з застосупролактин та гормон росту є класичними гормонаванням технологій рекомбінантних ДНК у прокаріми, які широко циркулюють в організмі, на відміну отах або з застосуванням хімічного синтезу. Такі від цитокінів, які зазвичай утворюються поблизу неглікозиловані продукти існують серед пептидів від їх клітин-мішеней, пролактин та гормон росту та білків, які є придатними біологічно активними належать до того ж самого структурного класу, що компонентами згідно з даним винаходом. І нарешй цитокіни з чотирма -спіральними ділянками ті, хоча деякі антитіла функціонують як агоністи (Nicola, N.A., supra; Goffin, V., et al., supra), і вони або антагоністи рецепторного зв'язування (див., так само є придатними мішенями для полімерного наприклад, Morris, J.C., et ai., (2000) Ann Rheum зв'язування і для утворення представлених кон'юDis 59 (Suppl І):і109-i114), такі імуноглобуліни не є гатів згідно з даним винаходом. придатними для N-кінцевого полімерного зв'язуБілки рецепторного зв'язування довго ланцювання у межах обсягу цього винаходу, тобто вони гових структурних класів -sheet або -barrel (див. не є RN-білками рецепторного зв'язування, оскільSchein, C.H., supra) також є придатними для застосування при одержанні кон'югатів та композицій 41 90654 42 ки аміно-кінцеві ділянки як легких, так і важких лачинних, синтетичних полімерів з молекулярною нцюгів беруть участь у розпізнаванні антигенів. масою, яка перевищує 10кДа, для терапевтичного Особливо корисними як біологічно активні застосування. Аналогічним чином, у публікації N.V. компоненти для застосування при одержанні поліKatre ((1990) supra) описано, що з'єднання великої мерних кон'югатів згідно з даним винаходом є інкількості ланцюгів 5-кДа mPEG з людським рекомтерферон-альфа, інтерферон-бета, IL-2, IL-4, ILбінантним інтерлейкіном-2 збільшує стійкість оде10, hGH, пролактин, інсулін, IGF-1, EGF, bFGF та ржаних в результаті кон'югатів у системі кровообігу еритропоетин (Еро). Також особливо корисними є мишей та кролів. Однак, у цьому джерелі не опимутеїни та фрагменти таких біологічно активних сано і не вказано на перевагу з'єднання меншої компонентів, зокрема, ті, що є здатними зв'язувакількості довгих ланцюгів PEG або з'єднання однотися з рецепторами для відповідного дикого або го ланцюга PEG високої молекулярної маси з аміінтактного поліпептиду, незалежно від того, чи но-кінцем IL-2, передбачене даним винаходом. викликає це зв'язування біологічний або фізіологіУ публікаціях G. Shaw (патент США чний ефект. У деяких подібних варіантах втілення №4,904,584 та публікація РСТ № WO 89/05824 А2) мутеїни та фрагменти біологічно активних компоописано способи викликання сайт-специфічного нентів можуть діяти як антагоністи для відповідних приєднання здатних реагувати з амінами полімерів лігандів, які знижують, суттєво знижують або повшляхом включення, заміни або делеції лізинових ністю інгібують зв'язування лігандів з їх рецептозалишків у білку-мішені, зокрема, Еро, G-CSF та рами та/або активність лігандів на їх клітинахIL-2. Однак, на відміну від опису даного винаходу, мішенях, тканинах та/або організмах. Інші антагоу цих джерелах не розкривається, що здатні реаністи, які можуть бути або не бути структурними гувати з амінами полімери можуть реагувати з аналогами, мутеїнами, варіантами або похідними будь-яким аміном у білку-мішені, крім епсилонвідповідних лігандів, також є придатними для одеаміногруп лізинових залишків, що чітко відрізняє ці ржання кон'югатів згідно з даним винаходом. Чи описи від даного винаходу. антагонізує даний мутеїн, фрагмент, варіант, похіУ публікації D.E. Nitecki et al. (патент США дна або антагоніст біологічний та/або фізіологіч№4,902,502) описано багаторазово пегіловані IL-2 ний вплив даного ліганду, на практиці без зайвих кон'югати, які одержували з різних хлороформатекспериментів визначають, застосовуючи аналізи них похідних PEG, які були призначені для реакції на біологічний/фізіологічний вплив самого ліганду, з епсилон-аміногрупами лізинових залишків. Одрізні варіанти яких є загальновідомими серед спенак, на відміну від даних способів, у цьому джерелі ціалістів і/або є описаними авторами. не розкривається жодний спосіб уникнення пегілуСтруктури (первинні, вторинні, третинні і, у вівання лізинових залишків у ділянках IL-2 білка, які дповідних випадках, четвертинні) цих та інших беруть участь у рецепторному зв'язуванні, і не поліпептидів, які вигідно застосовують згідно з вказується на відомості про переваги уникнення даним винаходом, є загальновідомими серед спетаких місць. ціалістів у даній галузі й є знайомими звичайним У публікації N. Katre, et al. (патент США спеціалістам у даній галузі, зокрема, з огляду на №5,206,344) описано PEG-IL-2 кон'югати, у яких структури, представлені авторами і зазначені у PEG є з'єднаним з епсилон-аміногрупами лізинопосиланнях, включених авторами шляхом посивих залишків, з непарною сульфгідрильною групою лання в їх повному обсязі. природного цистеїнового залишку у позиції 125 Кон'югати (від аміно-кінця) або з сульфгідрильною групою Даний винахід забезпечує стійкі кон'югати біоцистеїнового залишку, яку було мутаційно вставлогічно активних компонентів, зокрема, цитокінів, лено між першим та дванадцятим залишками від для застосування у різних випадках. Такі кон'югати аміно-кінця IL-2. До мутеїнів, описаних у зазначезгідно з винаходом мають численні переваги над ному патенті, належить "des-ala-1" IL-2, тобто мутими, які вже є відомими спеціалістам, як показано теїн, у якому аміно-кінцевий аланін є делетованим, на необмежувальних прикладах порівняння з уже і який не є пегілованим. Однак, на відміну від давідомими кон'югатами: ного опису, у патенті США №5,206,344 не розкрито У публікаціях Н. Hiratani (європейський патент жодного способу уникнення з'єднання PEG з амі№ ЕР 0098110 В1 і патент США №4,609,546) опинокислотними залишками, які беруть участь у зв'ясано кон'югати співполімерів етиленоксиду та прозуванні з рецепторами, і не визнається, що такий піленоксиду ("PEG-PPG", який належить до загапідхід має переваги. На підтвердження цього і на льного класу PAG) з білками, включаючи відміну від даного винаходу, широкий вибір місць інтерферони та інтерлейкіни, але не вказується на приєднання, запропонованих у патенті США перевагу уникнення ділянок білків, які беруть №5,206,344, не вказує на те, що з'єднання PEG з участь у рецепторному зв'язуванні. У цих джереаміно-кінцем IL-2 має особливі переваги. лах інтерферони альфа, бета та гамма розглядаУ публікаціях S.P. Monkarsh, et al, (1997) Anal лися як рівноцінні мішені для з'єднання PAG, на Biochem 247:434-440 і S.P. Monkarsh, et al, (1997), відміну від даного винаходу, згідно з яким інтерHarris, J.M., et al, eds., Polyethylene glycol): ферон-гашш не вважається придатною мішенню Chemistry and Biological Applications, pp. 207-216, для N-кінцевого з'єднання, оскільки аміно-кінець American Chemical Society, Washington, D.C., опиперебуває у межах ділянки рецепторного зв'язусано, що реакція інтерферону-альфа-2а з триравання цього цитокіну. Крім того, у публікаціях зовим молярним надлишком активованого PEG з Hiratani описано кон'югати, синтезовані лише з молекулярною масою 5300 Дальтонів утворює PAG від 1кДа до 10кДа, тоді як у способах даного одинадцять позиційних ізомерів моноPEGвинаходу перевагу віддають з'єднанню водорозінтерферону, які відповідають одинадцяти лізино 43 90654 44 вим залишкам в інтерферон-альфа-2а. Не повідопринаймні частину" первісної біологічної активносмлялося про жоден PEG-інтерферон, у якому PEG ті вихідного білка, таким чином, вказуючи на можє з'єднаним з альфа-аміногрупою на аміно-кінці ливу втрату значної частини біологічної активності. інтерферону. Одинадцять позиційних ізомерів, про Цей результат відповідає застосуванню описаних які повідомлялося у цих джерелах, виявляли антиу зазначених патентах способів неспрямованого вірусну активність у культурах клітин у межах від пегілування. На відміну від даного винаходу, у цих 6% до 40% активності немодифікованого інтерфепатентах не описано жодних спроб щодо поліпрону й антипроліферативну активність у культурах шення збереження біологічної активності їх кон'юклітин у межах від 9% до 29% активності немодигатів шляхом зміни вибірковості описаних у них фікованого інтерферону. Такі результати чітко способів пегілування. демонструють, що випадкове пегілування лізиноУ публікації О.В. Kinstler, et al., (європейська вих залишків, яке практикувалося цими досліднипатентна заявка № ЕР 0822199 А2) описано проками, впливало на функції інтерферону-альфа-2а, цес реакції полі(етиленгліколю) з альфаопосередковані його рецепторами, на відміну від аміногрупою амінокислоти на аміно-кінці поліпепкон'югатів, одержаних способами даного винаходу. тиду, зокрема, консенсусного інтерферону та GКрім того, на відміну від кон'югатів згідно з даним CSF, які є двома білками, які виробляє компанія винаходом, у кон'югатах, про які повідомлялося у Amgen, Inc., правонаступник цієї патентної заявки. цих джерелах, не було пегілованого на N-кінці інУ цій публікації вказано, що "рівень рН, достатньо терферону. кислотний для вибіркової активації альфаУ публікації О. Nishimura et al., (патент США, аміногрупи", є необхідною відмітною ознакою опиномер законної реєстрації винаходу Н1662) описасаного процесу. На відміну від нього, у даному но кон'югати інтерферону-альфа, інтерферонувинаході було виявлено, що зниження рівня рН гамма та IL-2, які одержують шляхом відновного знижує реактивність аміногруп з PEG альдегідами, алкілування активованих "поліетиленгліколь метил і що альфа-аміногрупа є більш реакційноздатною, етер альдегідів" з ціаноборогідридом натрію при якщо вона не є протонованою, тобто при рН, вирН 7,0 (для кон'югатів інтерферону) або рН 7,15 щому за її рKа. Таким чином, авторами даного ви(для кон'югатів IL-2). Однак, за повідомленнями, находу було виявлено, що жоден рН не є "достаткон'югати, одержані такими способами, втрачають ньо кислотним для вибіркової активації альфадо 95% біологічної активності немодифікованих аміногрупи" будь-якого з кон'югатів RN-цитокіну білків, очевидно, через присутність багатьох місць згідно з даним винаходом. Пояснення залежності приєднання полімеру, усі з яких перебувають на рН від реактивності N-кінцевих альфа-аміногруп з епсилон-аміногрупах лізинових залишків (пор. Фіальдегідами, представлені у публікаціях J.T. Edsall гури 1 та 4 даного винаходу). (supra) та R.S. Larsen et al, ((2001) Bioconjug Chem У публікації D.K. Pettit, et al., (1997) J Biol Chem 12:861-869), більш відповідають досвідові авторів 272:2312-2318, описано полімерні кон'югати інтерданого винаходу. Крім того, Kinstler et al. повідомлейкіну-15 ("IL-15"). Однак, кон'югований IL-15, про ляють про застосування N-кінцевого пегілування який повідомляється у цьому джерелі, не тільки поліпептидів для збільшення гомогенності утворевтрачає свою подібну до IL-2 здатність сприяти них в результаті кон'югатів та захисту аміно-кінця ростові в результаті з'єднання полімерів з лізиновід руйнування протеїназами, але не розкривають, вими залишками у ділянках білка, які беруть що N-кінцеве пегілування може зберігати більшу участь у рецепторному зв'язуванні, але й виявляє частину активності рецепторного зв'язування певшвидше антагонізм, ніж агонізм. Ці автори дійшли них білків рецепторного зв'язування (див., напривисновку, що вибіркове інгібування зв'язування ILклад, публікацію РСТ № WO 96/11953; європейсь15 з одним із кількох рецепторів поверхні клітин кий патент № ЕР 0733067 В1 і патенти США №№ може бути наслідком полімерної кон'югації, і що 5,770,577, 5,824,784 та 5,985,265, автором яких є таке інгібування може не лише знизити рецепторKinstler, O.B., et al.). не зв'язування, але й може змінити біологічний У європейській заявці на ім'я Kinstler et al. (ЕР вплив білка на протилежний. Завдяки уникненню 0822199 А2) також вказується на переваги Nз'єднання полімерів з частинами білка рецепторкінцевого пегілування стосовно всіх поліпептидів, з ного зв'язування, які беруть участь у взаємодії з їх якими не мали справи автори даного винаходу. рецепторами, даний винахід дозволяє уникати Тобто, оскільки аміно-кінці молекул антитіл знахотакого небажаного наслідку полімерного зв'язудяться поблизу від антиген-комбінуючої ділянки вання. білків антитіл (Chapman, A.P. (2002) Adv Drug Deliv У публікаціях J. Hakimi, et al., (патенти США Rev 54:531-545), N-кінцеве пегілування антитіл №№ 5,792,834 та 5,834,594) описано зв'язані уренесподівано виявилося шкідливим для біологічної таном PEG-кон'югати білків, включаючи інтерфеактивності, порівняно з випадковим пегілуванням рон-альфа, IL-2, інтерлейкін-1 ("IL-1") та антагоніст лізинових залишків, як описано авторами Larsen, IL-1-рецептора, які одержували для зниження імуR.S., et al, supra. Так само, N-кінцеве пегілування ногенності, підвищення розчинності і підвищення білків рецепторного зв'язування, які не є "RNбіологічного півперіоду відповідних білків. У цих білками рецепторного зв'язування", наприклад, джерелах вказується на те, що PEG був з'єднаний інтерферону-гамма (див. Фігуру 8), очевидно, є з "різними вільними аміногрупами", але немає жобільш інгібіторним для взаємодії з рецепторами, дного посилання на N-кінцеве пегілування, і не ніж випадкове пегілування лізинових залишків тарозкривається, що N-кінцеві альфа-аміногрупи ких білків рецепторного зв'язування. можуть або мають бути пегіловані. У цих патентах Таким чином, як було зазначено вище, спосотакож вказується, що описаний у них кон'югат "має би даного винаходу відрізняються від способів, 45 90654 46 описаних авторами Kinstler et al. у наведених пубмета, описана в цьому джерелі, полягала у розролікаціях, тим, що кон'югати згідно з даним винахобці способу, який міг би бути застосований до білдом одержують шляхом кон'югації одного або кільків у цілому, в ньому взагалі не розглядалося збекох цитокінів або їх антагоністів, які вибирають як реження активності рецепторного зв'язування, яке RN-білки рецепторного зв'язування з одним або може бути результатом вибору аміно-кінця як міскількома полімерами шляхом утворення суміші між ця пегілування певних білків рецепторного зв'язулігандом(ами) та одним або кількома полімерами вання. Таким чином, на відміну від опису, який при рН від приблизно 5,6 до приблизно 7,6; при рН міститься у публікації Wei, et al., даний винахід не від приблизно 5,6 до приблизно 7,0; при рН від вимагає видалення N-кінцевої альфа-аміногрупи, приблизно 6,0 до приблизно 7,0; при рН від приба навпаки, забезпечує збереження заряду Nлизно 6,5 до приблизно 7,0; при рН від приблизно кінцевої альфа-аміногрупи на нейтральному рівні 6,6 до приблизно 7,6; при рН від приблизно 6,6 до рН через утворення вторинного амінного зв'язку приблизно 7,0; або при рН приблизно 6,6. І навпаміж білком та полімером. ки, в основу способів, описаних Kinstler et al., покУ публікаціях C.W. Gilbert et al., (патент США ладено кон'югацію лігандів при рН, нижчому за 5,5, №6,042,822; європейський патент № ЕР 1039922 і цей рівень рН авторами даного винаходу було В1) вказано на бажаність суміші позиційних ізомевизнано частково оптимальним або неприйнятним рів PEG-інтерферону-альфа-2b, причому особливо для одержання композицій лігандів, вибірково бажаний ізомер має PEG, з'єднаний з гістидинокон'югованих з полімерами у віддалених Nвим залишком інтерферону-альфа-2b, зокрема, кінцевих амінокислотах і/або у віддалених місцях гістидином-34, і продемонстровано, що зв'язок глікозилування. PEG з гістидином-34 є нестійким. Оскільки гістиУ публікації Pepinsky, В., et al., (публікація РСТ дин-34 лежить на поверхні інтерферону-альфа-2b № WO 00/23114 і патентна заявка США у ділянці, яка повинна тісно контактувати з інтер№2003/0021765 Al) описано полімерні кон'югати фероновим рецептором для викликання трансдукглікозилованого інтерферону-бета-1а, які є більш ції сигналу (див. Фігуру 1b даного опису), нестійактивними, ніж неглікозилований інтерферон-бетакість зв'язку між PEG та гістидином-34, описана у 1b в антивірусному аналізі. Коли Pepinsky et al цих джерелах, є критичною для функції описаного приєднували 5-кДа або 20-кДа mPEG до аміноавторами кон'югату PEG-інтерферону. Практично чисті гістидин-зв'язані полімерні кон'югати було кінця IFN- -1a шляхом відновного алкілування, описано авторами S. Lee et al., патент США впливу пегілування на антивірусну активність не №5,985,263. Натомість даний винахід демонструє, спостерігалося, тоді як приєднання PEG більш що оптимальним кон'югатом є кон'югат PEGвисокої молекулярної маси знижувало або усувало інтерферону, в якому PEG є стійко зв'язаним у цю активність. У цьому джерелі також розкривамісці, яке є віддаленим від доменів рецепторного ється, що поліалкіленгліколь може бути з'єднаний зв'язування інтерферонового компонента. з інтерфероном-бета-1a через різні з'єднувальні У публікації P. Bailon, et al. ((2001) Bioconjug групи у різних місцях, включаючи аміно-кінець, Chem 12:195-202) описано, що інтерферон-альфакарбоксильний кінець та вуглеводний компонент 2а, який є пегілованим однією молекулою 40-кДа глікозилованого білка. Однак, способи, описані у ди-mРЕG-лізину на молекулу інтерферону, порівцій публікації, не можуть бути узагальнені: "ці доснювали з чотирма основними позиційними ізомелідження вказують на те, що, незважаючи на зберами. У цьому джерелі описано, що майже весь реження послідовності між інтерфероном-бета-1а PEG було приєднано амідними зв'язками до лізита інтерфероном-бета-1b, вони є різними біохімічнів 31, 121, 131 або 134, кожен з яких перебуває у ними утвореннями і, таким чином, велика частина доменах рецепторного зв'язування інтерферонувідомостей про інтерферон-бета-1b, не може бути альфа-2а (залишки 29-35 та 123-140, згідно з застосована до інтерферону-бета-1а, і навпаки". Bailon et al.; див. Фігуру 1a даного опису) або побНатомість у даному винаході розкрито спільні осолизу від них. У публікації P. Bailon, et al. не повідобливості, втілені у RN- та RG-білках рецепторного млялося про N-кінцеве пегілування. За повідомзв'язування, які було визначено авторами даного леннями, антивірусна активність виділеної суміші винаходу. Згідно з даним винаходом, як інтерфепозиційних ізомерів PEG-інтерферону по віднорон-бета-1а, так і інтерферон-бета-1b, є"RNшенню до інфекції вірусом везикулярного стомабілками рецепторного зв'язування". Крім того, інтиту клітин нирок великої рогатої худоби Madinтерферон-бета-1b є RG-білком рецепторного зв'яDarby in vitro становить 7% від активності некон'юзування. Відповідним чином, на відміну від спосогованого інтерферону-альфа-2а, який було піддабів, описаних у WO 00/23114, способи даного но випробуванню. Значна втрата біологічної активинаходу є корисними для одержання стійких, біовності, яку спостерігали для цих кон'югатів PEGлогічно активних кон'югатів як інтерферону-бетаінтерферону, які не включають N-кінцевого пегіло1b, так і інтерферону-бета-1а. ваного інтерферону, таким чином, чітко відрізняє У публікації Z. Wei, et al, (патент США кон'югати, вказані у публікації Bailon et al., від №6,077,939) описано способи приєднання водокон'югатів згідно з даним винаходом. розчинних полімерів (зокрема, PEG) до NУ публікації R.B. Pepinsky et al., ((2001) J кінцевого альфа-атома вуглецю поліпептиду (зокPharmacol Exp Ther 297:1059-1066) описано синтез рема, еритропоетину), при яких амін на альфакон'югату з (1) глікозилованого інтерферону-бетавуглеці N-кінцевої амінокислоти спочатку транса1а, що має N-кінцевий метіоніновий залишок, та мінують з альфа-карбонільною групою, яку після (2) 20-кДа PEG-альдегіду. Кон'югат, вказаний у цього піддають реакції з PEG-похідною для утводжерелі як монопеї ілований в N-кінцевому метіорення оксиму або гідразонового зв'язку. Оскільки 47 90654 48 ніні, зберігає повну біологічну активність в антивіропоетину, у яких від одного до трьох ланцюгів русному аналізі. Хоча цими авторами було зазнаалкокси-PEG є зв'язаними з однією-трьома аміногчено, що їх вибір N-кінцевого місця для пегілуванрупами білка. Однак, на відміну від даного винахоня глікозилованого інтерферону-бета-1 а було ду, у зазначеному джерелі не сказано про перевапродиктовано доступністю реагентів сайтгу альфа-аміногрупи N-кінцевої амінокислоти або специфічного пегілування та молекулярного моаміногруп, які перебувають не у ділянках, які беделювання, вони визнають, що "деякі ефекти є руть участь у взаємодії з рецепторами. характерними для конкретних продуктів". Крім тоУ публікації С Delgado et al. (патент США го, на відміну від даного винаходу, спостереження, №6,384,195) описано кон'югати фактора, який про які повідомляється у зазначеному джерелі, не стимулює утворення колонії гранулоцитівбуло узагальнено для включення класу білків ремакрофагів, які одержують, застосовуючи реакційцепторного зв'язування, які визначаються автораноздатний полімер, представлений як тресил моми цього винаходу як "RN-білки рецепторного зв'янометокси-PEG і вказаний як "TMPEG". У цьому зування". джерелі вказується, що коли TMPEG контактує з У публікації J. Burg, et al. (публікація РСТ № рекомбінантним людським GM-CSF, то "модифікоWO 01/02017 А2) описано одержання алкоксиваний матеріал містить зразки, які не мають актиРЕG-кон'югатів глікопротеїнів еритропоетину, у вності і мають більшу активність порівняно з неяких від одного до трьох ланцюгів метокси-PEG модифікованим матеріалом". Як стане легко було піддано реакції з сульфгідрильними групами, зрозуміло звичайному спеціалістові в даній галузі, які було хімічно включено шляхом модифікації зразки, які не мають активності, є небажаними у епсилон-аміногруп лізинових залишків на поверхні суміші кон'югатів полімеру - біологічно активного глікопротеїну. Однак, на відміну від даного винакомпонента, зокрема, у композиціях для терапевходу, у цьому джерелі зовсім не описано спроб тичного застосування, які включають такі кон'югазв'язування PEG з вільною альфа-аміногрупою Nти, оскільки вони збільшують ризик введення кон'кінцевої амінокислоти еритропоетину або уникюгату пацієнтові, який потребує такого введення, нення модифікації лізинових залишків у ділянках не збільшуючи сприятливого впливу. Як зазначено глікопротеїну еритропоетину, які є суттєвими для авторами, даний винахід дозволяє принаймні часвзаємодії з рецепторами еритропоетину. тково подолати це обмеження шляхом уникнення У публікації J. Burg, et al. (публікація РСТ № модифікації GM-CSF та інших білків рецепторного WO 02/49673 А2) описано синтез зв'язаних амідом зв'язування у місцях на білках, які беруть участь в на N-кінці PEG-кон'югатів природних та мутеїнових активності рецепторного зв'язування, таким чином, глікопротеїнів еритропоетину способом, який знижуючи або усуваючи синтез зразків, які не мавключає застосування вибірково відщеплюваних ють активності. Даний винахід також забезпечує N-кінцевих пептидних подовжень, які відщеплюють способи фракціонування та очищення кон'югатів, перед пегілуванням і після оборотного цитраконіякі мають інші розміри, інші заряди і/або інший лування всіх епсилон-аміногруп лізинових залишступінь захисту зарядів на поверхні з боку полімеків глікопротеїну. Основною причиною багатоетапра (див. Фігури 9-12). ного процесу в цьому джерелі є забезпечення Варто зазначити, що в патенті США вибірковості процесу пегілування щодо вільних №6,384,195 не згадано про N-кінцеве пегілування альфа-аміногруп N-кінцевої амінокислоти для GM-CSF і, таким чином, не визнаються переваги утворення гомогенних монопегілованих кон'югатів і способів даного винаходу. І нарешті, у патенті уникнення, таким чином, потреби у відокремленні США №6,384,195 вказано на перевагу кон'югатів, у монопегілованих кон'югатів від багаторазово пегіяких більше одного PEG є з'єднаними з кожною лованих похідних. Цей спосіб відрізняється від молекулою GM-CSF, без жодного вказування на способу даного винаходу в багатьох важливих те, в якому місця на молекулі GM-CSF приєднувідношеннях, включаючи, крім інших: (1) спосіб, ються ці молекули PEG (якщо вони не з'єднуються описаний Burg et al., обмежується глікопротеїнами з лізиновими залишками). Віддаючи перевагу еритропоетину, з якими зв'язується алкокси-PEG кон'югатам, які мають до шести молекул PEG на через амідні зв'язки, тоді як даний винахід може GM-CSF, автори зазначеного патенту, таким чибути застосований до різних біологічно активних ном, вказують на перевагу кон'югатів, у яких PEG компонентів, кон'югованих із застосуванням різних може бути приєднаний до всіх можливих лізинових синтетичних полімерів; (2) даний винахід застосозалишків, таким чином, забезпечуючи приєднання вують як для глікозилованих, так і для неглікозиPEG у позиціях, які стерично перешкоджають налованих RN- та RG-білків рецепторного зв'язуванближенню білка до його рецепторів клітинної поня, тоді як Burg et al. описують лише кон'югацію верхні (див. Фігуру 3 даного опису). Натомість даглікопротеїнів; (3) даний винахід охоплює як алконий винахід вказує на небажаність з'єднання PEG кси-PEG, такі як mPEG, так і монофункціональноз лізиновими залишками, за винятком випадків, активовані гідрокси-PEG, тоді як Burg et al. описуколи ці лізинові залишки є віддаленими від домеють лише застосування алкокси-PEG; і (4) у данонів білка рецепторного зв'язування, які є суттєвими му винаході вторинним амінним зв'язкам між полідля взаємодії з рецепторами, а отже, для трансдумером та білком віддають перевагу над амідними кції сигналу (у разі агоністів), або для того, щоб зв'язками, застосованими Burg et al, оскільки перші конкурентно інгібувати трансдукцію сигналу (у разі є більш стійкими і зберігають позитивний заряд на антагоністів). аміногрупі. В аналогічній роботі цієї групи, J. Burg, У публікації Т. Nakamura, et al. (публікація РСТ et al. (патент США №6,340,742) описано одержан№ WO 02/32957 Α1) описано, що збільшення моня амідно-зв'язаних кон'югатів глікопротеїнів еритлекулярної маси PEG, який є з'єднаним з епсилон 49 90654 50 аміногрупою лізинового залишку у позиції 52 глікоФармацевтичні композиції згідно з винаходом протеїну еритропоетину збільшує еритропоетичвводять реципієнтові будь-яким прийнятним споний ефект кон'югату in vivo з одночасним зниженсобом введення, наприклад, перорально, ректальням спорідненості кон'югату з рецепторами но, парентерально, внутрішньосистемно, вагінаеритропоетину. Однак, на відміну від даного винально, внутрішньочеревинно, місцево (за ходу, у зазначеному джерелі не розкривається допомогою порошків, мазей, крапель або крізьшкіз'єднання PEG на аміно-кінці або поблизу від місця рних пластирів), букально, як аерозоль для ротоглікозилування, і не визнається будь-яка перевага вої порожнини або носа або шляхом інгаляції. цього. Вжитий авторами термін "парентеральний" стосуОтже, даний винахід забезпечує кон'югати біоється способів введення, до яких належать внутлогічно активних компонентів, з'єднаних із синтерішньовенна, внутрішньоартеріальна, внутріштичними полімерами, які мають певні структурні і ньом'язова, внутрішньочеревинна, функціональні переваги перед тими, які було розкінтрацистернальна, підшкірна та внутрішньосуглорито раніше. бна ін'єкція або інфузія. Композиції Фармацевтичні композиції, які забезпечуються Винахід забезпечує кон'югати або комплекси, даним винаходом для парентеральної ін'єкції, моякі включають один або кілька біологічно активних жуть включати фармацевтично прийнятні стерикомпонентів, в оптимальному варіанті - один або льні водні або неводні розчини, дисперсії, суспенкілька цитокінів, з'єднаних з одним або кількома зії або емульсії, а також стерильні порошки для стабілізуючими полімерами, такими як один або відновлення вологовмісту до стерильних придаткілька PEG. Зазвичай такі кон'югати одержують них для ін'єкцій розчинів або дисперсій перед заописаними авторами способами згідно з даним стосуванням. Прикладами придатних водних та винаходом; однак кон'югати, які мають описані неводних носіїв, розріджувачів, розчинників або авторами структуру й активність, незалежно від індиферентних носіїв є вода, етанол, поліоли (такі способів, застосованих для одержання таких кон'як гліцерин та ін., пропіленгліколь, поліетиленгліюгатів, вважають рівноцінними тим, які одержують коль)), карбоксиметилцелюлоза та їх придатні супредставленими способами, і, таким чином, охопміші, рослинні олії (такі як оливкова олія) та прилюються обсягом даного винаходу. В інших аспекдатні для ін'єкцій органічні естери, такі як тах винахід також забезпечує композиції, які вклюетилолеат. Належну текучість підтримують, напричають один або кілька таких кон'югатів або клад, шляхом застосування матеріалів для поккомплексів. Композиції згідно з цим аспектом вириття, таких як лецитин, шляхом підтримання потнаходу включають один або кілька (наприклад, рібного розміру частинок у разі дисперсії та один, два, три, чотири, п'ять, десять і т. д.) вищеошляхом застосування поверхнево-активних речописаних кон'югатів або комплексів згідно з винаховин. дом. У деяких таких аспектах композиції можуть Такі фармацевтичні композиції згідно з даним включати один або кілька додаткових компонентів, винаходом також можуть містити ад'юванти, такі як наприклад, одну або кілька буферних солей, один консерванти, зволожувальні засоби, емульгатори або кілька агентів, які викликають дисоціацію комта диспергатори. Запобігання дії мікроорганізмів плексів, один або кілька детергентів, один або кізабезпечують шляхом включення різних антибаклька білків (наприклад, альбумін або один або теріальних і протигрибкових засобів, наприклад, кілька ферментів), один або кілька незв'язаних парабену, бензилового спирту, хлоробутанолу, полімерів, один або кілька осмотично активних фенолу, сорбінової кислоти і т. ін. Також може буагентів і т. ін. Композиції цього аспекту винаходу ти бажаним включення осмотичних агентів, таких можуть існувати в будь-якій формі, включаючи як цукри, хлорид натрію і т. ін. Тривалої абсорбції тверду (наприклад, сухий порошок) або розчин придатної для ін'єкцій фармацевтичної форми (зокрема, у формі фізіологічно сумісного буфернодосягають шляхом включення агентів, які затриго соляного розчину, який включає один або кілька мують абсорбцію, таких як моностеарат алюмінію, кон'югатів згідно з винаходом). гідрогелі та желатин. А. Фармацевтичні композиції У деяких випадках для подовження ефекту ліДеякі композиції згідно з винаходом спеціальків може бути бажаним уповільнення абсорбції з но рецептують для застосування як фармацевтичпідшкірної або внутрішньом'язової ін'єкції. Цього ні композиції для профілактики, діагностики або досягають шляхом застосування рідкої суспензії терапії. Такі композиції зазвичай включають один кристалічного або аморфного матеріалу зі слабабо кілька кон'югатів, комплексів або композицій кою розчинністю у водних рідинах організму. Швизгідно з винаходом і один або кілька фармацевтидкість абсорбції медикаменту в цьому разі залечно прийнятних носіїв або наповнювачів. Вжитий жить від швидкості його розчинення, яка, у свою авторами термін "фармацевтично прийнятний ночергу, може залежати від фізичної форми. В альсій або наповнювач" стосується нетоксичного тветернативному варіанті затриманої абсорбції парердого, напівтвердого або рідкого наповнювача, нтерально введеної лікарської форми досягають розріджувача, інкапсулюючого матеріалу або дошляхом розчинення або суспендування медикадаткової композиції будь-якого типу, що може пементу в індиферентній олійній речовині. реноситись твариною, включаючи людину або інПридатні для ін'єкцій форми уповільненого вишого ссавця, якій вводять фармацевтичну вільнення одержують шляхом утворення мікроінкомпозицію, без негативного впливу в результаті капсульованих матриць ліків у біодеградованих такого додавання. полімерах, таких як полілактид-полігліколід. Залежно від співвідношення медикаменту з носієм 51 90654 52 полімером та характеру конкретного застосованоемульсії, розчини, суспензії, сиропи та еліксири. го носія-полімеру, регулюють швидкість вивільКрім активних сполук, рідкі дозовані форми можуть нення медикаменту. Прикладами інших біодеграмістити інертні розріджувачі, які зазвичай застосодованих полімерів є біологічно сумісні вують у даній галузі, наприклад, воду або інші розполі(ортоестери) та полі(ангідриди). Придатні для чинники, солюбілізатори та емульгатори, такі як ін'єкцій композиції уповільненого вивільнення таетиловий спирт, ізопропіловий спирт, етилкарбокож одержують шляхом захоплення медикаменту нат, етилацетат, бензиловий спирт, бензилбензов ліпосоми або мікроемульсії, які є сумісними з ат, пропіленгліколь, 1,3-бутиленгліколь, диметилтканинами організму. формамід, олії (зокрема, бавовняна, арахісова, Придатні для ін'єкцій композиції стерилізують, кукурудзяна, зародкова, оливкова, рицинова та наприклад, шляхом фільтрації крізь фільтр, який кунжутна олії), гліцерин, тетрагідрофурфуриловий затримує бактерії, або шляхом включення стериліспирт, PEG та жирнокислотні естери сорбіту та їх зуючих агентів у формі стерильних твердих компосуміші. зицій, які можуть бути розчинені або дисперговані Крім інертних розріджувачів, композиції також у стерильній воді або іншому стерильному придаможуть включати ад'юванти, такі як зволожувальні тному для ін'єкцій середовищі перед застосуванзасоби, емульгатори та суспендуючі агенти, підсоням. лоджувачі, ароматизатори та віддушки. До твердих дозованих форм для перорального Суспензії, крім активних сполук, можуть містивведення належать капсули, таблетки, пілюлі, поти суспендуючі агенти, такі як, наприклад, етоксирошки та гранули. У таких твердих дозованих фоловані ізостеарилові спирти, поліоксіетиленсорбіт рмах активні сполуки змішують з принаймні одним та естери сорбітну, мікрокристалічна целюлоза, фармацевтично прийнятним наповнювачем або метагідроксид алюмінію, бентоніт, агар-агар, траносієм, таким як цитрат натрію або дикальцій фогакант та їх суміші. сфат, та/або а) наповнювачі або сухі розріджувачі, Місцеве введення включає введення у шкіру такі як крохмалі, лактоза, цукроза, глюкоза, маніт або слизову оболонку, включаючи поверхні легета кремнієва кислота, б) зв'язувальні речовини, нів та очей. Композиції для місцевого введення, такі як, наприклад, карбоксиметилцелюлоза, альвключаючи композиції для інгаляцій, одержують у гінати, желатин, полівінілпіролідон, цукроза та гуформі сухих порошків, які можуть бути або не бути міарабік, в) гігроскопічні речовини, такі як гліцерин, під підвищеним тиском. У порошкових композиціях г) дезінтегратори, такі як агар-агар, карбонат кальпід підвищеним тиском активні інгредієнти у тонко цію, крохмаль з картоплі та тапіоки, альгінова кисдиспергованій формі застосовують у суміші з фалота, деякі силікати та карбонат натрую, д) уповірмацевтично прийнятним інертним носієм більшольнювачі розчинення, такі як парафін, e) го розміру, який включає частинки, що мають розприскорювачі абсорбції, такі як четвертинні амонімір, наприклад, до 100 мікрометрів у діаметрі. До єві сполуки, є) зволожувальні засоби, такі як, наприйнятних інертних носіїв належать цукри, такі як приклад, цетиловий спирт та гліцерин моностеалактоза та цукроза. В оптимальному варіанті прират, ж) адсорбенти, такі як каолін та бетонітова наймні 95% за масою частинок активного інгредієглина, і з) мастила, такі як тальк, стеарат кальцію, нта мають ефективний розмір частинок у межах стеарат магнію, тверді PEG, лаурилсульфат навід 0,01 до 10 мікрометрів. трію та їх суміші. У разі капсул, таблеток та пілюль В альтернативному варіанті фармацевтична дозована форма також може містити буферні агекомпозиція може перебувати під підвищеним тиснти. ком і може містити стиснутий газ, такий як азот або Тверді композиції подібного типу також застозріджений газ-витискувач. Середовище зрідженого совують як наповнювачі у м'яких та твердих желавитискувана та загальний склад в оптимальному тинових капсулах з використанням таких наповнюваріанті можуть бути такими, щоб активні інгредієвачів, як лактоза (молочний цукор), а також PEG з нти не розчинялися в ньому значною мірою. Комвисокою молекулярною масою і т. ін. позиція під підвищеним тиском також може містити Тверді дозовані форми таблеток, драже, капповерхнево-активну речовину. Поверхневосул, пілюль та гранул можуть бути приготовлені з активна речовина може бути рідкою або твердою покриттям та оболонками, такими, як шлунковонеіонною поверхнево-активною речовиною або розчинні або хрономодулюючі покриття та інші твердою аніонною поверхнево-активною речовипокриття, добре відомі спеціалістам у галузі фарною. Перевагу віддають застосуванню твердої мацевтичних композицій. Вони необов'язково моаніонної поверхнево-активної речовини у формі жуть містити агенти забезпечення непрозорості і натрієвої солі. також можуть мати такий склад, що дозволяє вивіІншою формою місцевого введення є очне льнювати лише активний(і) інгредієнт(и), або, в введення. У цьому режимі введення кон'югати або оптимальному варіанті, лише у певній частині композиції згідно з винаходом вводять у фармацешлунково-кишкового тракту, необов'язково уповівтично прийнятній для очного введення індиферельненим чином. Прикладами композицій включеннтній речовині, таким чином, щоб активні сполуки ня, які можуть бути застосовані, є полімерні речопідтримувались у контакті з очною поверхнею провини та воски. Активні сполуки також можуть тягом достатнього періоду часу, що дозволяє споіснувати у мікроінкапсульованій формі, у відповідлукам проникати у кон'юнктиву або рогівку та внуному разі - з одним або кількома з вищезгаданих трішні ділянки ока, наприклад, передню камеру, наповнювачів. задню камеру, склисте тіло, водянисте тіло, райРідкі дозовані форми для перорального введужну оболонку/війкове тіло, кришталик, судинну дення можуть включати фармацевтично прийнятні оболонку/сітківку та склеру. Фармацевтично при 53 90654 54 йнятною офтальмологічною індиферентною речосприяють зв'язуванню одного або кількох кон'югавиною може бути, наприклад, мазь, рослинна олія тів або композицій згідно з винаходом з клітинами, або інкапсулюючий матеріал. тканинами, органами або організмами. Відразу Композиціями для ректального або вагінальпісля зв'язування біологічно активних компонентів ного введення в оптимальному варіанті є супозикон'югатів та/або композицій згідно з винаходом торії, які приготовляють шляхом змішування кон'ю(або, у деяких випадках, засвоєння) клітинами, гатів або композицій згідно з винаходом з тканинами, органами або організмами, компоненти прийнятними неподразнюючими наповнювачами починають здійснювати свої призначені біологічні або носіями, такими як масло какао, PEG або віск функції. Наприклад, пептидні компоненти можуть для супозиторіїв, які є твердими при кімнатній тезв'язуватися з рецепторами або іншими компоненмпературі, але рідкими при температурі тіла і, татами на поверхні або у клітинах, тканинах, органах ким чином, розплавляються у прямій кишці або або організмах; брати участь у метаболічних реаквагінальній порожнині і вивільнюють медикаменти. ціях у клітинах, тканинах, органах або організмах; Фармацевтичні композиції, які застосовують здійснювати, підвищувати або активувати, або згідно з представленими терапевтичними спосознижувати або інгібувати, один або кілька видів бами, також вводять у формі ліпосом. Як відомо ферментної активності у клітинах, тканинах, оргаспеціалістам у даній галузі, ліпосоми зазвичай нах або організмах; забезпечувати відсутній струкпоходять від фосфоліпідів або інших ліпідних ретурний компонент для клітин, тканин, органів або човин. Ліпосоми утворюються одно- або багатоорганізмів; задовольняти одну або кілька потреб у шаровими гідратованими рідкими кристалами, які живленні для клітин, тканин, органів або опганіздиспергуються у водному середовищі. Застосовумів; інгібувати, обробляти, обертати або іншим ють будь-який нетоксичний, фізіологічно прийнятчином поліпшувати один або кілька процесів або ний і метаболізований ліпід, здатний утворювати симптомів хвороби або фізичного порушення; і т. ліпосоми. Крім одного або кількох кон'югатів або ін. композицій згідно з винаходом, дані фармацевтиУ додаткових варіантах втілення кон'югати та чні композиції у формі ліпосом також можуть міскомпозиції згідно з винаходом застосовують у тити один або кілька стабілізаторів, консервантів, промисловій клітинній культурі, завдяки несподінаповнювачів і т. ін. Оптимальними ліпідами t фовано високій ефективності біологічно активних сфоліпіди та фосфатидилхоліни (лецитини), як компонентів кон'югатів, які одержують у результаті природні, так і синтетичні. Способи утворення лікомбінованого впливу значного збереження їх біопосом с відомими спеціалістам (див., наприклад, логічної активності та збільшення тривалості дії Zalipsky, S., et al., Патент США №5,395,619). Ліпонавіть в умовах промислового застосування. Ця соми, які включають фосфоліпіди, кон'юговані з несподівано висока ефективність даних кон'югатів PEG, найчастіше - фосфатидилетаноламін, з'єдможе забезпечувати несподівано високе виробнаний з монометокси-PEG, мають вигідні властилення біомаси, несподівано високий рівень ексвості, включаючи подовжений період існування у пресії рекомбінантних білків та інші поліпшення системі кровообігу ссавців (Fisher, D., Патент США ефективності біологічної обробки. №6,132,763). С. Режими дозування В. Застосування Кон'югати, комплекси або композиції згідно з Як вказується у будь-якому місці даного опису, винаходом вводять in vitro, ex vivo або in vivo у способи, кон'югати та композиції згідно з даним клітини, тканини, органи або організми для доставинаходом вигідно застосовують при здійсненні вления до них одного або кількох біологічно активспособів підтримання або підвищення біологічної них компонентів (тобто одного або кількох цитокіактивності біологічних компонентів без шкоди для нів або їх антагоністів). Звичайному спеціалістові у здатності біологічних компонентів до зв'язування з даній галузі стане зрозуміло, що ефективна кільїхніми рецепторами. кість даної активної сполуки, кон'югату, комплексу Деякі подібні способи згідно з винаходом моабо композиції може бути визначена емпірично і жуть забезпечувати доставления одного або кільможе застосовуватись у чистій формі або - якщо кох з кон'югатів та композицій у клітини, тканини, існують такі форми - у формі фармацевтично приоргани або організми. Зокрема, винахід забезпейнятної композиції або проліків. Сполуки, кон'югачує контрольоване доставления одного або кільти, комплекси або композиції згідно з винаходом кох компонентів кон'югатів, комплексів або комповводять тварині (включаючи ссавців, таких як люзицій у клітини, тканини, органи або організми, дина), яка цього потребує, у формі ветеринарних таким чином, надаючи користувачеві можливість або фармацевтичних композицій у комбінації з регулювати у часі та просторі кількість конкретного одним або кільком фармацевтично прийнятними компонента, яка вивільнюється для забезпечення наповнювачами. Рівень терапевтично ефективної активності у клітинах, тканинах, органах або оргадози для конкретного пацієнта залежить від різних нізмах. чинників, включаючи тип та ступінь клітинної реакВзагалі, такі способи згідно з винаходом вклюції, яка має бути досягнута; характеристики та/або чають один або кілька кроків. Наприклад, один активність конкретної(их) застосованої(их) сполуки такий спосіб згідно з винаходом включає: (а) оде(сполук), кон'югату(ів), комплексу(ів) або композиржання одного або кількох кон'югатів або композиції (композицій); вік, масу тіла або площу поверхні, цій згідно з винаходом, як детально описано автозагальний стан здоров'я, стать та раціон пацієнта; рами; і (b) контактування однієї або кількох клітин, час введення, шлях введення та швидкість виветканин, органів або організмів з одним або кількодення активної(их) сполуки (сполук); тривалість ма кон'югатами або композиціями в умовах, які лікування; інші ліки, застосовані у комбінації або 55 90654 56 паралельно з конкретною(ими) сполукою(ами), або фізичного порушення, тоді як "пригнічення" кон'югатом(ами), комплексом(ами) або композицівключає введення кон'югату або композиції перед ями); та інші подібні чинники, добре відомі спеціаклінічним виникненням хвороби; таким чином, "залістам у даній галузі фармацевтики та медицини. побігання" та "пригнічення" фізичного порушення Наприклад, спеціалістам у даній галузі добре візазвичай здійснюють у тварини, яка є схильною домо, що слід починати дозування даної сполуки, або сприйнятливою до порушення, але ще не кон'югату, комплексу або композиції згідно з винастраждає від нього. Однак "лікування" фізичного ходом з рівня, нижчого за той, що вимагається для порушення включає введення терапевтичного досягнення потрібного терапевтичного ефекту, і кон'югату або композиції згідно з винаходом після поступово збільшувати дозу, доки не буде досягвиникнення хвороби. Зрозуміло, що у людській та нуто потрібного ефекту. ветеринарній медицині не завжди існує можливість Режими дозування також визначають залежно розрізнення між "запобіганням" та "пригніченням" від конкретного пацієнта для забезпечення задафізичного порушення. У багатьох випадках останної концентрації даної активної сполуки у крові, яку ня індуктивна подія або події можуть бути невідовизначають способами, прийнятими і звичними мими або прихованими, і жоден пацієнт або лікар серед спеціалістів, наприклад, шляхом високоене можуть знати про цю індуктивну подію до її пофективної рідинної хроматографії ("HPLC") з вияви. Таким чином, на відміну від "лікування", заключенням за розміром, іонообмінної хроматогразвичай вживають термін "профілактика", який фії або з оберненням фаз, біологічних аналізів або включає і "запобігання", і "пригнічення", як визнаімунологічних аналізів. Таким чином, режими дочено авторами. Термін "захист", вжитий згідно зі зування для пацієнта регулюють для досягнення способами даного винаходу, таким чином, вклювідносно стійкого рівня у крові, згідно з вимірюванчає "профілактику". Способи згідно з цим аспектом нями шляхом HPLC або імунологічних аналізів, винаходу можуть включати один або кілька етапів, згідно зі способами, які є звичними і знайомими які дозволяють клінічному лікареві досягати вищедля спеціалістів у галузі медицини, фармацевтики описаних терапевтичних цілей. Один такий спосіб та/або фармакології. згідно з винаходом може включати, наприклад: (а) D. Застосування у діагностиці та фармацевтивиявлення тварини (в оптимальному варіанті ці ссавця, такого як людина), яка страждає або є Діагностичне застосування кон'югату згідно з схильною до фізичного порушення; і (б) введення винаходом може служити для визначення розтатварині ефективної кількості одного або кількох шування клітин або тканин, які мають несподівано кон'югатів, комплексів або композицій згідно з дависоку здатність до зв'язування з цитокіном, наним винаходом, як описано авторами, таким чиприклад, ракових, в організмі тварини, зокрема, ном, щоб введення кон'югату, комплексу або комлюдини, шляхом введення кон'югату або композипозиції запобігало, затримувало або дозволяло ції згідно з винаходом, причому кон'югат (або один діагностувати розвиток, або вилікувати або виклиабо кілька компонентів, тобто біологічно активний кати ремісію фізичного порушення у тварини. компонент та/або синтетичний полімер) є міченим Згідно з визначенням авторів, тварина, яка є або включає одну або кілька міток, які піддаються "схильною до" фізичного порушення, означає твавиявленню, що дозволяє здійснювати виявлення, рину, яка не виявляє багатьох явних фізичних наприклад, оптичним, радіометричним, флуорессимптомів порушення, але генетично, фізіологічно центним або резонансним шляхом згідно з відоабо іншим чином перебуває під ризиком розвитку мими спеціалістам способами. Наприклад, більпорушення. Згідно з представленими способами, шість видів недрібноклітинного раку легенів виявлення тварини (такої як ссавець, включаючи експресує несподівано високу концентрацію рецелюдину), яка є схильною, перебуває під ризиком пторів епідермального фактора росту (Bunn, P.Α., або страждає від даного фізичного порушення, et al., (2002) Semin Oncol 29 (Suppl 14):38-44). Отздійснюють стандартними відомими спеціалістам же, в іншому аспекті винаходу кон'югати та компоспособами, які є знайомими для клінічних лікарів зиції згідно з винаходом застосовують у діагностизвичайної кваліфікації, включаючи, наприклад, чних або терапевтичних способах, наприклад, для радіологічні аналізи, біохімічні аналізи (наприклад, діагностики, лікування або профілактики різних аналізи відносного рівня конкретних пептидів, білфізичних порушень у тварин, зокрема, ссавців, ків, електролітів і т. ін. у зразку, одержаному від таких як людина, які є схильними або страждають тварини), хірургічні способи, генетичний відбір, від такого порушення. Згідно з такими підходами сімейний анамнез, фізичну пальпацію, патологічні метою терапії є затримка або запобігання розвитабо гістологічні тести (наприклад, мікроскопічна кові порушення і/або виліковування, викликання оцінка тканини або зразків рідин організму або ремісії або підтримання ремісії порушення і/або мазків, імунологічні аналізи і т. ін.), випробування зниження або мінімізація побічних ефектів інших рідин організму (наприклад, крові, сироватки, платерапевтичних режимів. зми, спинномозкової рідини, сечі, слини, сперми т. Отже, кон'югати, комплекси та композиції згідін.), візуалізацію (наприклад, радіологічну, флуоно з даним винаходом застосовують для захисту, ресцентну, оптичну, резонансну (наприклад, із пригнічення або лікування фізичних порушень, застосуванням ядерного магнітного резонансу таких як інфекції або хвороби. Вжитий авторами ("ЯМР") або електронного парамагнітного резонатермін "захист" від фізичного порушення охоплює нсу ("ЕПР")) і т. ін. Відразу після виявлення твари"запобігання", "пригнічення" та "лікування". "Запони одним або кількома подібними способами твабігання" включає введення комплексу або компорину піддають інтенсивному і/або запобіжному зиції згідно з винаходом перед початком хвороби 57 90654 58 лікуванню для запобігання, пригнічення, затримки кретних порушень, таким чином, запобігаючи, заабо виліковування фізичного порушення. тримуючи, діагностуючи або лікуючи порушення у До фізичних порушень, які піддаються профіданої тварини. Вжитий авторами вираз "ефективлактиці, діагностиці або лікуванню з застосуванна кількість кон'югату (або комплексу або композиням кон'югатів, комплексів, композицій та способів ції)" стосується такої кількості, щоб кон'югат (або даного винаходу, належать будь-які фізичні порукомплекс або композиція) мав біологічну актившення, при яких застосовують біологічно активний ність біологічно активного компонента (тобто цитокомпонент (зазвичай цитокін або його антагоніст) кіну або його антагоніста) кон'югату, комплексу або кон'югатів або композицій для запобігання, діагнокомпозиції, таким чином, запобігаючи, затримуючи, стики або лікування. До таких порушень, крім індіагностуючи, лікуючи або виліковуючи фізичне ших, належать різні види раку (наприклад, рак мопорушення у тварини, якій було введено цей кон'лочної залози, рак матки, рак яєчника, рак югат, комплекс або композицію згідно з винахопередміхурової залози, рак яєчка, лейкемія, лімдом. Звичайному спеціалістові у даній галузі стане фоми, рак легенів, неврологічні види раку, рак зрозуміло, що ефективна кількість кон'югатів, комшкіри, рак голови та шиї, рак кісток, рак товстої плексів або композицій згідно з винаходом може кишки та шлунково-кишкового тракту, рак підшлунбути визначена емпірично, стандартними спосокової залози, рак міхура, рак нирок та інші карцибами, добре відомими звичайним спеціалістам у номи, саркоми, аденоми та мієломи); ятрогенні галузі фармацевтики та медицини; див., наприхвороби; інфекційні хвороби (наприклад, бактеріаклад, Beers, Μ.Η., et al., eds. (1999) Merck Manual льні хвороби, грибкові хвороби, вірусні хвороби of Diagnosis & Therapy, 17th edition, Merck and Co., (включаючи гепатит, хвороби, викликані кардіотRahway, NJ; Hardman, J.G., et al., eds. (2001) ропними вірусами, ВІЛ/СНІД і т. ін.), паразитарні Goodman and Gilman's The Pharmacological Basis хвороби і т. ін.); генетичні порушення (наприклад, of Therapeutics, 10th edition, McGraw-Hill Medical кістозний фіброз, боковий аміотрофічний склероз, Publishing Division, New York; Speight, T.M., et al., м'язова дистрофія, хвороба Гоше, генералізоваeds. (1997) Avery's Drug Treatment, 4th edition, Adis ний глікогеноз (Ротре), важкий комбінований імуInternational, Auckland, New Zealand; Katzung, B.G. нодефіцит, карликовість і т. ін.), анемія, нейтропе(2000) Basic & Clinical Pharmacology, 8th edition, нія, тромбоцитопенія, гемофілія та інші порушення Lange Medical Books/McGraw-Hill, New York; ці та крові; нейродегенеративні порушення (наприклад, інші наведені джерела є повністю включеними розсіяний склероз ("PC", включаючи, крім інших, авторами шляхом посилання. рецидивуючий-ремітуючий PC, первинний прогреЗрозуміло, що при введенні людині загальну суючий PC, вторинний прогресуючий PC і т. ін.), денну, тижневу або місячну дозу кон'югатів, комхворобу Кройцфельдта-Якоба, хворобу Альцгейплексів та композицій згідно з даним винаходом мера і т. ін.); ферментні порушення (наприклад, визначає лікар, керуючись розумним рішенням. подагра, уремія, гіперхолестеринемія і т. ін.); поНаприклад, задовільних результатів досягають рушення невизначеної або багатофокальної етіошляхом введення певних кон'югатів, комплексів логії (наприклад, серцево-судинна хвороба, гіперабо композицій згідно з винаходом у прийнятних тонія, запальна хвороба кишечника і т. ін.); дозах, залежно від конкретної застосованої біолоаутоімунні порушення (наприклад, системний чергічно активної сполуки, причому ці дози є добре воний вовчак, ревматоїдний артрит, псоріаз і т. ін.) знайомими спеціалістам у даній галузі або можуть та інші порушення медичного значення, які можуть бути легко визначені емпірично з застосуванням бути добре знайомими спеціалістам у даній галузі. звичних експериментів. Згідно з цим аспектом виКон'югати, комплекси, композиції та способи згідно находу кон'югати, комплекси або композиції ввоз даним винаходом також застосовують для заподять один раз, або розділяють на кілька доз, набігання прогресуванню хвороби, наприклад, хіміоприклад, раз або двічі на день, або раз або двічі профілактики прогресування передракового урана тиждень, або раз або двічі на місяць і т. ін. Приження до злоякісного. йнятні режими дозування для різних способів ввеТаким чином, згідно з терапевтичними спосодення (наприклад, парентерального, підшкірного, бами винаходу застосовують один або кілька кон'внутрішньом'язового, внутрішньоочного, інтранаюгатів, комплексів або композицій згідно з винахозального і т. ін.) також можуть бути легко визначені дом, або одну або кілька фармацевтичних емпірично, з застосуванням лише звичних експекомпозицій згідно з винаходом, які вводять тваририментів, або є легко зрозумілими спеціалістам у ні, яка цього потребує, різними шляхами введення, даній галузі, залежно від характеристик біологічно включаючи пероральний, ректальний, парентераактивного компонента (тобто цитокіну або його льний (включаючи внутрішньовенний, внутрішньоантагоніста) кон'югату, комплексу або композиції. артеріальний, внутрішньом'язовий, внутрішньочеВ інших випадках застосування кон'югати, ревинний, інтрацистернальний, підшкірний та комплекси та композиції згідно з винаходом застовнутрішньосуглобну ін'єкцію або інфузію), внутрісовують для специфічного спрямування діагностишньосистемний, вагінальний, внутрішньочеревинчного або терапевтичного агента на клітину, тканий, місцевий (за допомогою порошків, мазей, нину, орган або організм, що експресуе рецептор, крапель або крізьшкірних пластирів), букальний, як зв'язується, включає або іншим чином приймає аерозоль для ротової порожнини або носа, або біологічно активний компонент (тобто цитокін або шляхом інгаляції. Згідно з винаходом ефективну його антагоніст) або кон'югат, комплекс або компокількість кон'югатів, комплексів або композицій зицію. Способи згідно з цим аспектом винаходу вводять in vitro, ex vivo або in vivo у клітини або можуть включати, наприклад, контактування клітитваринам, які страждають або є схильними до конни, тканини, органу або організму з одним або кі 59 90654 60 лькома кон'югатами, комплексами або композицістосовують для виявлення клітин, тканин, органів ями згідно з винаходом, які додатково включають або організмів, які експресують рецептори або один або кілька діагностичних або терапевтичних іншим чином захоплюють біологічно активний комагентів, таким чином, щоб кон'югат, комплекс або понент (тобто цитокін або його антагоніст) кон'югакомпозиція зв'язувалися або захоплювалися клітитів, комплексів або композицій. В одному прикладі ною, тканиною, органом або організмом, таким такого способу клітину, тканину, орган або оргачином, доставляючи діагностичний або терапевтинізм піддають контактові з одним або кількома з чний агент у клітину, тканину, орган або організм. кон'югатів, комплексів або композицій згідно з виДіагностичним або терапевтичним агентом, який находом в умовах, які сприяють зв'язуванню або застосовують згідно з цим аспектом винаходу, захопленню кон'югату клітиною, тканиною або орможе бути, крім інших, принаймні один агент, вибганізмом (наприклад, шляхом зв'язування кон'югараний з-поміж нуклеїнової кислоти, органічної споту з рецептором поверхні клітин або шляхом пінолуки, білка або пептиду, антитіла або ферменту, цитозу або дифузії кон'югату у клітину) з глікопротеїну, ліпопротеїну, елемента, ліпіду, санаступним виявленням кон'югату, зв'язаного або хариду, ізотопу, вуглеводу, засобу візуалізації, включеного у клітину, з застосуванням засобів зонда, що піддається виявленню, або будь-якої їх виявлення, специфічних для застосованої мітки комбінації, які можуть бути мічені з можливістю (наприклад, флуоресцентного виявлення для виявлення, як описано авторами. Терапевтичний флуоресцентно мічених кон'югатів; магнітнозасіб, який застосовують у цьому аспекті даного резонансної візуалізації для магнітно мічених винаходу, може мати терапевтичний вплив на клікон'югатів; радіовізуалізації для радіоактивно мітину-мішень (або тканину, орган або організм), чених кон'югатів; і т. ін.). Іншими прикладами заяким, крім інших, може бути виправлення пошкостосування таких мічених з можливістю виявлення дженого гена або білка, гальмівний ефект, токсичкон'югатів можуть бути, наприклад, візуалізація ний ефект, стимулювання росту, інгібування росту, клітини, тканини, органа або організму або внутріметаболічний ефект, катаболічний ефект, анабошньої структури тварини (включаючи людину) лічний ефект, антивірусний ефект, протигрибковий шляхом введення ефективної кількості міченої ефект, антибактеріальний ефект, гормональний форми одного або кількох кон'югатів згідно з винаефект, нейрогуморальний ефект, стимулювання ходом та вимірювання опромінення, яке піддаєтьдиференціації клітин, інгібування диференціації ся виявленню, пов'язаного з клітиною, тканиною, клітин, нейромодулюючий ефект, антинеопластичорганом або організмом (або твариною). Способи ний ефект, протипухлинний ефект, інсуліностимувиявлення різних типів міток та їх застосування у люючий або -інгібуючий ефект, стимулюючий діагностичній та терапевтичній візуалізації є добре вплив на кістковий мозок, стимулюючий вплив на відомими спеціалістам у даній галузі і описуються поліпотенційні стовбурові клітини, стимулюючий у будь-якому іншому місці даного опису. вплив на імунну систему та будь-який інший відоВ іншому аспекті кон'югати та композиції згідно мий терапевтичний ефект, який може забезпечуз винаходом можуть бути застосовані у способах ватися терапевтичним засобом, який доставляють регулювання концентрації або активності рецептоу клітину (або тканину, орган або організм) через ра, специфічного до біологічно активного компосистему доставления згідно з цим аспектом даного нента кон'югату на поверхні клітини, яка експресує винаходу. такий рецептор. Під "регулюванням" активності Такі додаткові терапевтичні засоби вибирають, даного рецептора слід розуміти, що кон'югат, після крім інших, з-поміж відомих та нових сполук і комзв'язування з рецептором, або активує, або інгібує позицій, включаючи антибіотики, стероїди, цитотофізіологічну активність (наприклад, каскад внутріксичні засоби, вазоактивні медикаменти, антитіла шньоклітинних сигналів), опосередковану цим рета інші терапевтичні засоби. Необмежувальними цептором. Не вдаючись до конкретного механістиприкладами таких агентів є антибіотики та інші чного пояснення регулюючої активності кон'юіатів ліки, які застосовують у лікуванні від бактеріальнозгідно з даним винаходом, можна зазначити, що го шоку, такі як гентаміцин, небцин, нафцилін, патакі кон'югати можуть протидіяти фізіологічній акрентеральні цефалоспорини і т. ін.; надниркові тивності клітинного рецептора шляхом зв'язування кортикостероїди та їх аналоги, такі як дексаметаз рецептором через біологічно активний компонент зон, які зменшують пошкодження клітин, спричикон'югату, таким чином, блокуючи зв'язування нені ендотоксинами; вазоактивні медикаменти, природного агоніста (наприклад, некон'югованого такі як агент, що блокує альфа-адренергічний ребіологічно активного компонента) і запобігаючи цептор (наприклад, феноксибензамін), агоніст беактивації рецептора природним агоністом, при та-адренергічного рецептора (наприклад, ізопроцьому не викликаючи значної активації фізіологічтеренол) та допамін. ної активності самого рецептора. Способи згідно з Кон'югати, комплекси та композиції згідно з цим аспектом можуть включати один або кілька винаходом також застосовують для діагностуванетапів, наприклад, контактування клітини (яке ня хвороби та спостереження за реакцією на тераздійснюють in vitro або in vivo) з одним або кількопію. У деяких подібних способах кон'югати, комма з кон'югатів згідно з винаходом за таких умов, плекси або композиції згідно з винаходом можуть щоб кон'югат (тобто біологічно активний комповключати одну або кілька міток, які піддаються нент кон'югату) зв'язувався з рецептором для біовиявленню (такі, як описано у будь-якому іншому логічно активного компонента на поверхні клітин, місці даного опису). Згідно з конкретними спосоале суттєво не активував рецептор. Такі способи є бами ці мічені з можливістю виявлення кон'югати, корисними для різних випадків діагностичного та комплекси або композиції згідно з винаходом за
ДивитисяДодаткова інформація
Назва патенту англійськоюPolymer conjugates of interferon-beta with enhanced biological potency
Автори англійськоюSaifer Mark G P., Martinez Alexa L., Williams L David, Sherman Merry R.
Назва патенту російськоюПолимерные конъюгаты интерферона-бета с повышенной биологической активностью
Автори російськоюСаифер Марк Г.П., Мартинес Алекса Л., Уиллиамс Л. Девид, Шерман Мерри Р.
МПК / Мітки
МПК: A61K 38/21, C07K 1/06, C07K 14/565
Мітки: активністю, кон'югати, полімерні, біологічною, підвищеною, інтерферону-бета
Код посилання
<a href="https://ua.patents.su/66-90654-polimerni-konyugati-interferonu-beta-z-pidvishhenoyu-biologichnoyu-aktivnistyu.html" target="_blank" rel="follow" title="База патентів України">Полімерні кон’югати інтерферону-бета з підвищеною біологічною активністю</a>
Попередній патент: Спосіб адаптивного контекстно-граматичного стискання текстових повідомлень
Наступний патент: Оцінка шуму і взаємних перешкод у системі ofdm
Випадковий патент: Спосіб очистки стічних вод