Спосіб одержання n-арилпіперазинів (варіанти) та проміжна сполука
Номер патенту: 80272
Опубліковано: 10.09.2007
Автори: Джирковскі Іво, Зелдіс Джозеф, Чан Аніта Вай-Йін, Фейгельсон Грегг Брайан
Формула / Реферат
1. Спосіб одержання N-арилпіперазинів формули VI
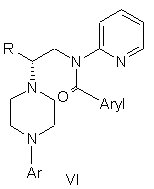 ,
,
де R являє собою С1-С3-алкіл;
Ar являє собою дигідробензодіоксиніл, бензодіоксиніл або феніл, необов'язково заміщений до трикратно замісниками, незалежно один від одного вибраними з галогену, метокси, галогенметилу, дигалогенметилу і тригалогенметилу;
Aryl являє собою С6-С12-ароматичну групу, необов'язково одно-тризаміщену замісниками, незалежно один від одного вибраними з групи, що включає атоми галогенів, алкіл, алкокси, алкоксикарбоніл, нітро, аміно, алкіламіно, діалкіламіно, галогеналкіл, дигалогеналкіл, тригалогеналкіл, нітрил і амідогрупу, кожний з яких містить не більше шести атомів вуглецю; в якому проводять наступні стадії:
a) взаємодію сполуки формули І з NH2R'
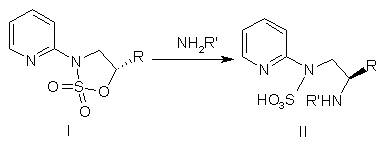 ,
,
де R вибраний із групи, що включає С1-С3-алкіл, і R' являє собою Н, С1-С6-алкіл, С3-С7-циклоалкіл, С2-С7-ацил, С5-С10-арил, С6-С11-ароїл, (С3-С7)циклоалкіл(С1-С6)алкіл, ди-(С3-С7)циклоалкіл-(С1-С6)алкіл, (С5-С10)арил(С1-С6)алкіл і ді(С5-С10)арил-(С1-С6)алкіл;
b) гідрування сполуки формули II, у якій R' не являє собою Н, для перетворення R' у Н;
c) кислотний гідроліз сполуки формули II, у якій R' являє собою Н, з одержанням сполуки формули III
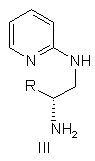 ,
,
d) взаємодію сполуки формули III із сполукою формули IV з одержанням сполуки формули V
 ,
,
де Ar являє собою дигідробензодіоксиніл, бензодіоксиніл або феніл, необов'язково одно-тризаміщений замісниками, незалежно один від одного вибраними з галогену, метокси, галогенметилу, дигалогенметилу і тригалогенметилу, і L являє собою придатну групу, що видаляється;
e) обробку сполуки формули V ароїльною сполукою, вибраною з ароїлхлориду, ароїлброміду й ароїлангідриду, у присутності основи з одержанням цільової сполуки формули VI.
2. Спосіб за п. 1, де R являє собою метил.
3. Спосіб за п. 1, де Aryl являє собою 4-ціанофеніл.
4. Спосіб одержання N-арилпіперазинів формули VI
 ,
,
деR являє собою С1-С3-алкіл;
Ar являє собою дигідробензодіоксиніл бензодіоксиніл або феніл, необов'язково заміщений до трикратно замісниками, незалежно один від одного вибраними з галогену, метокси, галогенметилу, дигалогенметилу і тригалогенметилу;
Aryl являє собою С6-С12-ароматичну групу, необов'язково одно-тризаміщену замісниками, незалежно один від одного вибраними з групи, що включає атоми галогенів, алкіл, алкокси, алкоксикарбоніл, нітро, аміно, алкіламіно, діалкіламіно, галогеналкіл, дигалогеналкіл, тригалогеналкіл, нітрил і амідогрупу, кожний з яких містить не більше шести атомів вуглецю; в якому проводять наступні стадії:
a) перетворення сполуки формули II
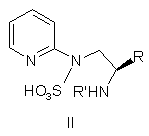 ,
,
де R являє собою С1-С3-алкіл, і R' являє собою Н, С1-С6-алкіл, С3-С7-циклоалкіл, С2-С7-ацил, С5-С10-арил, С6-С11-ароїл, (С3-С7)циклоалкіл(С1-С6)алкіл, ди-(С3-С7)циклоалкіл-(С1-С6)алкіл, (С5-С10)арил(С1-С6)алкіл і ді(С5-С10)арил-(С1-С6)алкіл; у сполуку формули III
 ,
,
де вказане перетворення здійснюють шляхом:
а1) гідрування сполуки формули II, у якій R' не являє собою Н, для перетворення R' у Н;
а2) кислотного гідролізу сполуки формули II, у якій R' являє собою Н, з одержанням сполуки формули III;
b) взаємодії сполуки формули III із сполукою формули IV з одержанням сполуки формули V
 ,
,
де Ar являє собою дигідробензодіоксиніл або бензодіоксиніл, або феніл, необов'язково заміщений до трикратно замісниками, незалежно один від одного вибраними з галогену, метокси, галогенметилу, дигалогенметилу і тригалогенметилу, і L являє собою придатну групу, що видаляється;
с) обробки сполуки формули V ароїльною сполукою, вибраною з ароїлхлориду, ароїлброміду й ароїлангідриду, у присутності основи з одержанням цільової сполуки формули VI.
5. Спосіб одержання N-арилпіперазинів формули VI
 ,
,
де R являє собою С1-С3-алкіл;
Ar являє собою дигідробензодіоксиніл, бензодіоксиніл або феніл, необов'язково заміщений до трикратно замісниками, незалежно один від одного вибраними з галогену, метокси, галогенметилу, дигалогенметилу і тригалогенметилу;
Aryl являє собою С6-С12-ароматичну групу, необов'язково одно-тризаміщену замісниками, незалежно один від одного вибраними з групи, що включає атоми галогенів, алкіл, алкокси, алкоксикарбоніл, нітро, аміно, алкіламіно, діалкіламіно, галогеналкіл, дигалогеналкіл, тригалогеналкіл, нітрил і амідогрупу, кожний з яких містить не більше шести атомів вуглецю; в якому проводять наступні стадії:
а) взаємодію сполуки формули II із сполукою формули IV з одержанням сполуки формули V
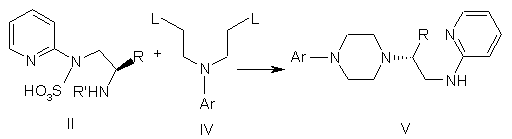 ,
,
де R являє собою С1-С3-алкіл, і R' являє собою Н, С1-С6-алкіл, С3-С7-циклоалкіл, С2-С7-ацил, С5-С10-арил, С6-С11-ароїл, (С3-С7)циклоалкіл(С1-С6)алкіл, ди-(С3-С7)циклоалкіл-(С1-С6)алкіл, (С5-С10)арил(С1-С6)алкіл і ді(С5-С10)арил-(С1-С6)алкіл;
Ar являє собою дигідробензодіоксиніл або бензодіоксиніл, або феніл, необов'язково заміщений до трикратно замісниками, незалежно один від одного вибраними з галогену, метокси, галогенметилу, дигалогенметилу і тригалогенметилу, і L являє собою придатну групу, що видаляється;
b) обробку сполуки формули V ароїльною сполукою, вибраною з ароїлхлориду, ароїлброміду й ароїлангидриду, у присутності основи з одержанням цільової сполуки формули VI.
6. Сполука формули II
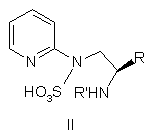 ,
,
де R вибраний з групи, що включає С1-С3-алкіл, і R' вибраний з групи, що включає Н, С1-С6-алкіл, С3-С7-циклоалкіл, С2-С7-ацил, С5-С10-арил, С6-С11-ароїл, (С3-С7)циклоалкіл(С1-С6)алкіл, ди-(С3-С7)циклоалкіл-(С1-С6)алкіл, (С5-С10)арил(С1-С6)алкіл і ді(С5-С10)арил-(С1-С6)алкіл,
і її оптичні ізомери.
7. Сполука за п. 6, де R' вибраний із групи, що включає Н, бензил і бензгідрил.
Текст
1. Спосіб одержання N-арилпіперазинів формули VI 2 3 e) обробку сполуки формули V ароїльною сполукою, вибраною з ароїлхлориду, ароїлброміду й ароїлангідриду, у присутності основи з одержанням цільової сполуки формули VI. 2. Спосіб за п. 1, де R являє собою метил. 3. Спосіб за п. 1, де Aryl являє собою 4ціанофеніл. 4. Спосіб одержання N-арилпіперазинів формули VI R N N O N Aryl N Ar VI , де R являє собою С1-С3-алкіл; Ar являє собою дигідробензодіоксиніл бензодіоксиніл або феніл, необов'язково заміщений до трикратно замісниками, незалежно один від одного вибраними з галогену, метокси, галогенметилу, дигалогенметилу і тригалогенметилу; Aryl являє собою С6-С12-ароматичну групу, необов'язково одно-тризаміщену замісниками, незалежно один від одного вибраними з групи, що включає атоми галогенів, алкіл, алкокси, алкоксикарбоніл, нітро, аміно, алкіламіно, діалкіламіно, галогеналкіл, дигалогеналкіл, тригалогеналкіл, нітрил і амідогрупу, кожний з яких містить не більше шести атомів вуглецю; в якому проводять наступні стадії: a) перетворення сполуки формули II N N R HO3S R'HN II , де R являє собою С 1-С3-алкіл, і R' являє собою Н, С1-С6-алкіл, С3-С7-циклоалкіл, С2-С7-ацил, С5-С10арил, С6-С11-ароїл, (С3-С7)циклоалкіл(С1-С6)алкіл, ди-(С3-С7)циклоалкіл-(С1-С6)алкіл, (С5-С10)арил(С1С6)алкіл і ді(С5-С10)арил-(С1-С6)алкіл; у сполуку формули III 80272 4 b) взаємодії сполуки формули III із сполукою формули IV з одержанням сполуки формули V L L NH R III NH2 , де вказане перетворення здійснюють шляхом: а1) гідрування сполуки формули II, у якій R' не являє собою Н, для перетворення R' у Н; а2) кислотного гідролізу сполуки формули II, у якій R' являє собою Н, з одержанням сполуки формули III; Ar N N N Ar NH , , де Ar являє собою дигідробензодіоксиніл або бензодіоксиніл, або феніл, необов'язково заміщений до трикратно замісниками, незалежно один від одного вибраними з галогену, метокси, галогенметилу, дигалогенметилу і тригалогенметилу, і L являє собою придатну групу, що видаляється; с) обробки сполуки формули V ароїльною сполукою, вибраною з ароїлхлориду, ароїлброміду й ароїлангідриду, у присутності основи з одержанням цільової сполуки формули VI. 5. Спосіб одержання N-арилпіперазинів формули VI IV R V N N N O Aryl N Ar VI , де R являє собою С1-С3-алкіл; Ar являє собою дигідробензодіоксиніл, бензодіоксиніл або феніл, необов'язково заміщений до трикратно замісниками, незалежно один від одного вибраними з галогену, метокси, галогенметилу, дигалогенметилу і тригалогенметилу; Aryl являє собою С6-С12-ароматичну групу, необов'язково одно-тризаміщену замісниками, незалежно один від одного вибраними з групи, що включає атоми галогенів, алкіл, алкокси, алкоксикарбоніл, нітро, аміно, алкіламіно, діалкіламіно, галогеналкіл, дигалогеналкіл, тригалогеналкіл, нітрил і амідогрупу, кожний з яких містить не більше шести атомів вуглецю; в якому проводять наступні стадії: а) взаємодію сполуки формули II із сполукою формули IV з одержанням сполуки формули V L N N R N N HO3S R'HN R + L N R Ar N N N NH Ar II V IV , де R являє собою С 1-С3-алкіл, і R' являє собою Н, С1-С6-алкіл, С3-С7-циклоалкіл, С2-С7-ацил, С5-С10арил, С6-С11-ароїл, (С3-С7)циклоалкіл(С1-С6)алкіл, ди-(С3-С7)циклоалкіл-(С1-С6)алкіл, (С5-С10)арил(С1С6)алкіл і ді(С5-С10)арил-(С1-С6)алкіл; Ar являє собою дигідробензодіоксиніл або бензодіоксиніл, або феніл, необов'язково заміщений до трикратно замісниками, незалежно один від одного вибраними з галогену, метокси, галогенметилу, дигалогенметилу і тригалогенметилу, і L являє собою придатну групу, що видаляється; 5 b) обробку сполуки формули V ароїльною сполукою, вибраною з ароїлхлориду, ароїлброміду й ароїлангидриду, у присутності основи з одержанням цільової сполуки формули VI. 6. Сполука формули II N N R 80272 6 де R вибраний з групи, що включає С1-С3-алкіл, і R' вибраний з групи, що включає Н, С1-С6-алкіл, С3-С7-циклоалкіл, С2-С7-ацил, С5-С10-арил, С6-С11ароїл, (С3-С7)циклоалкіл(С1-С6)алкіл, ди-(С3С7)циклоалкіл-(С1-С6)алкіл, (С5-С10)арил(С1С6)алкіл і ді(С5-С10)арил-(С1-С6)алкіл, і її оптичні ізомери. 7. Сполука за п. 6, де R' вибраний із групи, що включає Н, бензил і бензгідрил. HO 3S R'HN II , Даний винахід відноситься до способів отримання N-арилпіперазинів і їх проміжних сполук. Піперазини формули А: де R являє собою нижчий алкіл, Аr являє собою незаміщений або заміщений арил або гетероарил, і Q являє собою водень, СО-(нижчий)алкіл, СО-циклоалкіл або СО-арил, і * показує хіральний центр, є високоефективними засобами, зв'язуючими 5НТ1А-рецептор. У [патенті США № 6127357] описуються похідні піперазину, які придатні для лікування розладів центральної нервової системи (CNS). Енантіомери таких піперазинів можуть виявляти різну зв'язуючу активність відносно 5НТ1Арецепторів. Таким чином, їх ефективність, селективність і метаболічні ефекти можуть розрізнюватися. У [заявці WO 9703982] вказується, що деякі енантіомери таких піперазинів виявляють поліпшену спорідненість до зв'язування 5НТ1Арецепторів і біодоступність. Тому існує потреба в ефективному. простому, дешевому і безпечному способі отримання оптично переважних піперазинів. У [заявці WO 9533725] описується спосіб синтезу хіральних піперазинів формули А алкілуванням відповідного 1-арилпіперазину енантіомерно чистим 2-(5-метил-2,2-діоксидо-1,2,3оксатіазолідин-3-іл)піридин. У заявці WO 9533725 описуються також способи розкриття нуклеотидного кільця сульфамідатів 1-арилпіперазином, і розкриття різних первинних і вторинних амінів описано в [публікації L.T. Boulton, J.Chem. Soc, Perkin Trans. 1, 1999, 1421-1429]. У [публікаціях WO 97/37655 і Cignarella et al., Farmaco Ed. Sci.; 31; 1976; 194. 196] описується отримання і взаємодія N1-(2'-піридил)-1,2пропандіаміну. Даний винахід стосується способу отримання Н1-(2'-піридил)-1,2алкандіамінсульфамінової кислоти формули II, що включає взаємодію сполуки формули І з NH2R' де R вибраний з групи, що включає С1-С3алкіл, і R' являє собою Н, С1-С6-алкіл, С3-С7циклоалкіл, С2-С7-ацил, С5-С10-арил, С6-С11-ароїл, (С3-С7-)циклоалкіл (С1-С6)алкіл, ди-(С3-С7)циклоалкіл-( С1-С6)алкіл, (С5-С10)арил(С1-С6)алкіл і ді(С5-С10-)арил-( С1-С6)алкіл. Винахід також стосується сполуки формули II і її оптичних ізомерів. Винахід відноситься також до способів, які включають одну або декілька з наступних стадій реакції: Сполука формули II може гідруватися для перетворення R' в Н, якщо він не с Н, і потім гідролізуватися з використанням кислоти для отримання сполуки формули III Далі або сполука формули II, де R-H, або сполука формули III може зазнавати взаємодії із сполукою формули IV для отримання сполуки формули V 7 де Аr являє собою дигідробензодіоксиніл, або бензодіоксиніл, або феніл, необов'язково заміщений до трикратно замісниками, незалежно, вибраними з галогену, метокси, галогенметилу, дигалогенметилу і тригалогенметилу. і L являє собою відповідну групу, таку як галоген (зокрема хлор або бром), тозилат, мезилат або пбромфенілсульфонілокси. Сполука формули V може зазнавати обробки ароїльною сполукою, вибраною з ароїлхлориду, ароїлброміду і ароїлангідриду, в присутності основи для отримання сполуки формули VI де Aryl являє собою С6-С12 ароматичну групу, необов'язково заміщену до трикратно замісниками, незалежно вибраними з групи, що включає атоми галогенів, алкіл, алкокси, алкоксикарбоніл, нітро, аміно, алкіламіно, діалкіламіно, галогеналкіл, дигалогеналкіл, тригалогеналкіл, нітрил і амідогрупу, кожний з яких містить не більш шести атомів вуглецю. Об'єктом даного винаходу є нова проміжна сполука формули II. придатна для отримання Nарилпіперазинів. Наступним об'єктом даного винаходу є новий спосіб отримання N-арилпіперазинів і проміжні сполуки для нього. Ще одним об'єктом даного винаходу є новий спосіб отримання сполуки формули II. Інші об'єкти і переваги даного винаходу розкриваються фахівцеві наведеним далі докладним описом даного винаходу і прикладеною формулою винаходу. Переважна форма здійснення даного винаходу являє собою новий спосіб отримання Nарилпіперазинів з використанням N-(2'-піридил)1,2-пропандіамінсульфамінової кислоти, зокрема спосіб отримання N-арилпіперазину формули VI, де Aryl являє собою 4-ціанофеніл. Інша переважна форма здійснення даного винаходу являє собою спосіб отримання N-(2'-піридил)-1.2пропандіамінсульфамінової кислоти - нової, твердої проміжної сполуки, що легко виділяється, для отримання N-арилпіперазинів і її нових похідних, які також придатні для отримання Nарйлпіперазинів. Деякі сполуки, що використовуються в способах даного винаходу, містять один асиметричний атом вуглецю, що приводить до утворення енантіомерних форм сполук. Потрібно пояснити, що винахід включає все енантіомери таких сполук, в тому числі рацемічні суміші. Сполуки, що містять 80272 8 основний азот, можуї ь утворювати комплекси з багатьма кислотами (як протонними, так і апротонними). Винахід включає також прийнятні сольові форми, отримані внаслідок реакції приєднання як неорганічних, так і органічних кислот. Придатними є як неорганічні кислоти, наприклад, соляна кислота (НС1), бромистоводнева кислота (НВг), йодистоводнева кислота (НІ), сірчана кислота, фосфорна кислота, азотна кислота, так і органічні кислоти, наприклад, оцтова кислота, пропіонова кислота, лимонна кислота, малеїнова кислота, яблучна кислота, винна кислота, фталева кислота. янтарна кислота, метансульфонова кислота, толуолсульфонова кислота, нафталінсульфонова кислота, камфорсульфонова кислота, бензолсульфонова кислота. У переважній формі здійснення даного винаходу сполуку формули IV, де Аг являє собою дигідробензодіоксиніл, отримують діалкілуванням анілін) в присутності надлишку хлоретанолу з подальшим перетворенням отриманого гідроксильного фрагмента у відповідну групу, що видаляється, наприклад, СІ. Вг, мезилат або тозилат: Альтернативно, сполука формули IV, де Аr являє собою дигідробензодіоксиніл, отримують діалкілуванням аніліну за допомогою алкілгалогенацетату з подальшим відновленням. У переважній формі здійснення даного винаходу сполука формули І, де R=СН3, розкривається при використанні аміаку з інверсією стереоцентру і отриманням N1-(2'-піридил)-1,2пропандіамінсульфамінової кислоти у вигляді твердої речовини, що легко виділяється. В інших випадках сульфамідат формули І розкривається з використанням амінів, таких як бензиламін або бензгі дрил амін, з отриманням відповідних сульфамінових кислот. Отримана сполука може гідруватися в умовах гідрування з отриманням сульфамінової кислоти. Одна така форма здійснення показана нижче: де R' являє собою бензгідрил або бензил. В іншому переважному аспекті даного винаходу N1(2'-піридил)-1,2-пропандіамінсульфамінова кислота сполучається з димезилатом з отриманням піперазину: 9 де * показує асиметричний вуглецевий стереоцентр. Фрагмент сульфамінової кислоти може також функціонувати як захисна група на стадії поєднання з димезилатом з отриманням піперазину. Хіральність піперазинової сполуки залишається незмінною при проведенні послідовних реакцій синтезу. Даний винахід розкриває спосіб з використанням N1-(2'-піридил)-1,2пропандіамінсульфамінової кислоти, який придатний для одностадійного синтезу оптично активних М,1Ч'-дизаміщених піперазинів стереоселективним і конвергентним чином. Оптично активні N,N'дизаміщені піперазини володіють активністю як антагоністи 5-НТ1А (серотонінового) рецептора. В сполуці формули IV L може являти собою будь-яку відповідну групу, що видаляється. Фахівець в даній галузі без великих зусиль зможе визначити, які групи є відповідними для практичного застосування винаходу. Приклади таких відповідних груп, що видаляються, включають хлор, бром, мезилат, тозилат і пбромфенілсульфонілоксигрупи. Якщо в реакції даного винаходу необхідна присутність кислоти, основи або розчинника, можуть використовуватися будь-які відповідні кислота, основа або розчинник, відомі в даній галузі. Фахівець в даній галузі легко зможе визначити відповідні розчинники, кислоти і основи для практичного застосування даного винаходу. Приведені далі приклади представлені для ілюстрації деяких форм здійснення даного винаходу, але не повинні розглядатися як такі, шо обмежують об'єм домагань даного винаходу. Реагенти і розчинники для окремої стадії приведені тільки для ілюстрації і можуть бути замінені реагентами і розчинниками, відомими фахівцеві в даній галузі. Приклад 1: Бензгідриламінне розкриття сульфамідату До розчину сульфамідату формули І (R=метил) (8,0г, 37ммоль) в ацетонітрилі (64 мл) додають амінодифенілметан (8,1г, 44моль). Реакційну суміш перемішують при температурі навколишнього середовища в атмосфері Аг протягом 2 80272 10 днів, потім нагрівають до 55°С і витримують при цій температурі протягом 8 годин. Отриману суспензію фільтрують, промивають Et2O (40мл) і сушать на повітрі, отримуючи 12г (82%) вказаної вище сполуки формули VII у вигляді не зовсім білої твердої речовини. Rf=0,31 (10:1 СНСl3:СН3ОН); 1 Н ЯМР (ДМСО) d 9,77 (ушир.с, 1Н, ВІН), 7,158,0 (м, 13Н), 6,7-6,8 (м. 1Н). 5,81 (ушир.с, 1Н, NH), 4,1-4,3 (м, 2Н), 3,4 (м, 2Н), 3,4 (м, 2Н), 1,3 (д, J=4,8Гц, 2Н); 13 С ЯМР (ДМСО) d 155,2, 146,5, 137,4, 136,4, 129,4, 129,3, 129,2, 129,0, 128,8, 128,1, 127,8, 127,7, 127,5, 127,5, 126,3, 116,0, 114,8, 62,4, 5.7,3, 53,2, 50,1, 14,4; IЧ (КВr): vmax 3432, 3057, 3010, 2931, 2836, 2663, 2508, 2330, 1599, 1565, 1500, 1474, 1433см-1. Елементний аналіз. Обчислено: С 63,48; Н 5,79; N 10,57; Знайдено: С 63.38; Н 5,74; N 10,52. Т.пл. = 203,5-208°С. Приклад 2: Гідрування з отриманням сульфамінової кислоти Суміш бензгідрилзахищеної сульфамінової кислоти формули VII (5,0г, 12ммоль), 10% Pd/C (12,1г) в ЕtOН (100мл) перемішують при температурі навколишнього середовища в атмосфері Н2, що подається з балона. Через 2 дні, реакційну суміш фільтрують через шар целіту, промивають теплим ЕtOН (100мл) і концентрують у вакуумі, отримуючи 1,98г (72%) сполуки формули VIII у вигляді не зовсім білої твердої речовини. 1 Н ЯМР (ДМСО) d 8,17 (д, J=3Гц, 1Н), 7,5-7,9 (м, 5Н), 6,82 (т, J=4,5Гц, 1Н). 4,03 (дд, J=10,8Гц, 3,6Гц, Ш), 3,94 (дд, J=10,8 Гц, 5,7Гц, 1Н), 3,4-3,6 (м, 1Н), 1.18 (д,1=5,1Гц,3Н); 13 С ЯМР(ДМСО)d 156,1, 146,8, 136,9, 115,7, 114,6,50,1,47,9, 16,7; 1Ч (КВт): vmax 3436, 3137, 3073, 2980, 2518, 1629, 1588, 1520, 1465, 1432, 1366, 1286,1234, 1197, 1146, 1117, 1063, 1042см-1. Елементний аналіз. Обчислено: С 41,6; Н 5,62; N 18,2. Знайдено: С 41,1: И 5,49; N 17,7. Т. пл. 175,5-179°С. Приклад 3: Розкриття сульфамідату за допомогою аміаку Суміш сульфамідату формули І (R=метил) (22г, 0,11моль) в 2N розчині аміаку в ЕtOН (216мл, 11 0,432моль) перемішують при температурі навколишнього середовища в атмосфері N2 протягом 2 днів. Отриману суміш після цього концентрують до х /л початкового об'єму. Суміш фільтрують, промивають Et2O (50мл) і сушать на повітрі, отримуючи 17г (72%) сульфамінової кислоти формули VIII у вигляді твердої не зовсім білої речовини. Приклад 4: Гідроліз сульфамінової кислоти Розчин сульфамінової кислоти формули VIII (0,97г, 4,2ммоль) в 3N НСl (10мл) перемішують при температурі навколишнього середовища протягом 18 годин. Після цього реакційну суміш підлуговують до рН 13-14 за допомогою 6N NaOH (5мл) і екстрагують Et2O (3х40 мл). Об'єднані органічні шари сушать над Na2SO4. фільтрують і концентрують у вакуумі, отримуючи 0,49г (78%) N1-(2'піридил)-1.2-пропандіаміну у вигляді жовтої олії. 1 Н ЯМР (CD3OD) d 7,8-8,0 (м, 2Н), 7,3-7,5 (м, 2Н), 6,5-6,7 (м, 2Н), 3,0-3.4 (м, 3Н). Приклад 5: Зв'язування сульфамінової кислоти і димезилату До розчину димезилату формули X (30,5г, 84ммоль) в безводному ДМФА (240мл) додають сульфамінову кислоту VIII (16,2г, 70ммоль), карбонат калію (31,0г, 224ммоль) і броміду літію (12,8г, 147ммоль). Реакційну суміш нагрівають на масляній бані до 80-83°С і витримують при цій температурі в атмосфері N2 протягом 18 годин, потім охолоджують до температури навколишнього середовища і виливають в суміш 3N НСl (400мл) і СНСl3 (200мл). Отримай) суміш перемішують при температурі навколишнього середовища протягом 1 години, потім ділять на два шари. Водний шар промивають СНСl3 (2х75 мл) для видалення менш полярних домішок, потім підлуговують до.рН -14 за допомогою 5N NaOH (250мл). Основний водний шар потім екстрагують СНСl3 (3х150мл). Об'єднані органічні шари сушать над Na2SO4, фільтрують, концентрують у вакуумі, отримуючи 23г (92%) сполуки формули XI у вигляді коричневого сиропу. Приклад 6: Отримання піперазинової сполуки До розчину димезилату формули X (57мг, 0,14ммоль) в безводному ацетонітрилі (1 мл) додають амінопіридин (20мг, 0,13ммоль), карбонат калію (52мг, 0,38ммоль) і бромід літію (26мг, 0,30ммоль). Реакційну суміш кип'ятять із зворотним холодильником протягом 15 годин в атмосфе 80272 12 рі N2, потім охолоджують до кімнатної температури і фільтрують через рихлий шар целіту. Рихлий шар целіту промивають ацетонітрилом. Об'єднані органічні шари сушать над Na2SO4, фільтрують і концентрують у вакуумі, отримуючи 52г (105%) піперазин) XI у вигляді жовтої олії (92% (площ.) ГХ/МС). Приклад 7: Отримання піперазину дигідрохлориду До піперазину XI (23г, 65ммоль) додають 1М розчин НСl в ЕtOН (125мл, 125ммоль). Отриману суміш концентрують у вакуумі, потім знов розчиняють в СН3ОН (25мл). Після цього повільно додають Et2O (25мл). Отриману суміш залишають на 18 годин при температурі навколишнього середовиша. після чого спостерігають утворення не зовсім білого осаду. Твердий осад відфільтровують, промивають охолодженим ЕtOН (5мл) і сушать на повітрі, отримуючи 4,6г дигідрохлориду сполуки XI у вигляді твердої не зовсім білої речовини. Маточну рідину залишають. Через 5 днів спостерігають утворення додаткової кількості твердого осаду. Осад збирають фільтруванням, промивають охолодженим ЕtOН (5мл) і сушать на повітрі, отримуючи додаткові 3,7г дигідрохлориду сполуки XI у вигляді твердої не зовсім білої речовини. Приклад 8: Ацилювання піперазинової сполуки До розчину карбонату калію (3,4г, 24,6ммоль) в Н2О (5мл) додають дигідрохлорид, отриманий в прикладі 7 (3,0г, 7,0ммоль), і потім EtOAc (17мл). Суміш перемішують при 0-5°С на крижаній бані протягом 15 хвилин, потім повільно додають 4ціанобензоїлхлорид (1,3г, 7,9ммоль) в EtOAc (3,5мл). Через 1 годину ТШХ показує невелику кількість початкової речовини. Додають додаткову кількість 4-ціанобензоїлхлориду (100мг, 0,60ммоль). Через ще 1 годину додають Н2О (10мл). Суміш ділять на два шари. Органічний шар 13 80272 екстрагують насиченим розчином NaCl (10мл), Н2О (10мл). Водні шари знов екстрагують EtOAc (2х10мл). Об'єднані органічні шари сушать над Na2SO4, фільтрують, концентрують у вакуумі, отримуючи 3,0г (88%) сполуки формули XII у вигляді жовтої піни. Приклад 9: Алкілування бензодіоксананіліну до складного діефіру Суміш бензодіоксананіліну (3,0г, 20ммоль), етилбромацетату (7,5мл, 68ммоль), основи Ханіга (12,5мл, 72ммоль) і Nal (0,3г, 2,0ммоль) в толуолі (30мл) кип'ятять із зворотним холодильником протягом 23 годин. Після цього реакційну суміш охолоджують до кімнатної температури і додають воду (23мл). Суміш ділять на два шари. Водний шар екстрагують толуолом (25мл). Об'єднані органічні шари сушать над Na2SO4, фільтрують і концентрують у вакуумі, отримуючи 6,5г (100%) складного діефіру у вигляді коричневої олії. 1 Н ЯМР (CDCl3) d 6,70 (t,J=8,1 Гц, 1Н), 6,3-6,6 (м, 2Н), 4,1-4,3 (м, 12Н), 1,2-1,3(м,6Н). Приклад 10: Відновлення бензодіоксанового діефіру до двоатомного спирту Суміш діефіру (24г, 74,3ммоль) в ТГФ (240мл) охолоджують до 0-5°С. потім повільно додають гранули LAH (9,9г, 260ммоль), підтримуючи температуру реакції нижче за 10°С. Після додання LAH охолоджуючу баню прибирають і перемішування продовжують протягом ночі. Після перемішування протяіом 18 годин реакційну суміш охолоджують до 0±5° на охолоджувальній бані із сумішшю сухий лід/ІРА. До реакційної суміші пові Комп’ютерна верстка В. Клюкін 14 льно додають воду (10мл), потім 15% водний розчин гідроксиду натрію (10мл) і воду (30мл). Отриману суміш перемішують протягом 30 хвилин і потім фільтрують. Твердий осад промивають ТГФ (100мл). Фільтрат концентрують у вакуумі, отримуючи 14,5г (81%) двоатомного спирту формули IV у вигляді густої прозорої олії з чистотою 98% (площ.) (РХ-МС). 1 Н ЯМР (CDCl3) d 6,88-6,70 (м, 3Н), 4,34-4,22 (м, 4Н), 3,54 (т, J=7,5Гц, 4Н). 3,18(т,т=7,5Гц,4Н). Приклад 11: Діалкілування бензодіоксананіліну до двоатомного спирту Суміш бензодіоксананіліну з 2-хлоретанолом (210мл, 3,1ммоль) і основи Ханіга (105мл, 0,6моль) нагрівають до 120°С. Через 12,5 годин нагрівання припиняють і реакційної суміші дають охолодитися до кімнатної температури. До суміші додають етилацетат (300мл), розчин промивають розбавленим розчином солі (1х250мл) і потім насиченим розчином солі (2х75мл). Всі водні шари об'єднують, значення рН доводять до 7 доданням К2СО3 і розчин знов промивають етилацетатом (2х100мл). Всі органічні шари об'єднують і екстрагують 2N НСl (3x100мл). Отриманий водний розчин нейтралізують твердим К2СО3 до рН 7 і екстрагують етилацетатом (3х100мл). Органічну фазу сушать MgSO4. концентрують і додають толуол (2х50мл) для видалення залишковою хлоретанолу, отримуючи 39,6г (80%) неочищеного продукти у вигляді темної олії з чистотою 94% (площ.) (РХМС). 1 Н ЯМР (CDCl3) d 6,88-6,70 (м, 3Н), 4,34-4,22 (м, 4Н). 3,54 (т, J=7,5 Гц, 4Н). 3,18 (т, 1=7,514, 4Н). Множина варіантів даного винаходу, не проілюстрованих в даному описі. зрозуміла кваліфікованому фахівцеві. Даний винахід не обмежується представленими в описі ілюстративними прикладами, але включає всі об'єкти, що складають об'єм домагань прикладеної формули винаходу, і їх еквіваленти. Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of n-arylpiperazines (variants) and intermediate
Автори англійськоюChan Anita Wai-Yin, Feigelson Gregg Brian, Jirkovsky Ivo
Назва патенту російськоюСпособ получения n-арилпиперазинов (варианты) и промежуточное соединение
Автори російськоюЧан Анита Вай-Йин, Фейгельсон Грегг Брайан, Джирковски Иво
МПК / Мітки
МПК: A61P 25/00, C07D 213/76, C07D 405/12, C07D 213/74, C07D 213/75
Мітки: одержання, спосіб, n-арилпіперазинів, варіанти, проміжна, сполука
Код посилання
<a href="https://ua.patents.su/7-80272-sposib-oderzhannya-n-arilpiperaziniv-varianti-ta-promizhna-spoluka.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання n-арилпіперазинів (варіанти) та проміжна сполука</a>
Попередній патент: Застосування гетероциклічних сполук як інгібіторів бета-лактамази
Наступний патент: Спосіб та пристрій для прояснення рідин, зокрема води, насичених матеріалом у вигляді суспензії
Випадковий патент: Стоматологічний вимірювальний пристрій











