Спосіб одержання похідних хіноліна або їх солей
Формула / Реферат
Способ получения производных хинолина
где R- 4-метил-1-пиперазинильная группа, или их солей, отличающийся тем, что соединение формулы
вводят в реакцию с N -метилпиперазином в инертном растворителе, например пиридине, при кипячении реакционной массы с выделением целевого продукта в свободном виде или в виде соли.
Текст
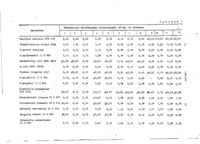
Способ получения производных хинолина общей формулы 0 А^СООН N где К. - 4-метил-1-пиперазинильная группа, или их солей, о т л и ч а ю щ и й что соединение формус я тем лы сода вводят в реакцию с N-метилпипераэином в инертном растворителе, например, пиридине, при кипячении реакционной массы с выделением целевого продукта в свободном виде или в виде соли. § СО С 00 £ I t Ї8Ї544 2 Изобретение относится к способу и 3 мл пиридина нагревают с о б р а т н о получения новых производных хинохолодильником в течение 4 ч . Реакционлинкарбоновой кислоты общей формулы ную смесь выпаривают досуха. Остаток подкисляют добавлением горячего вод5 його раствора уксусной кислоты и отфильтровывают нерастворенную фракцию. Фильтрат доводят до рН 1 добавлением (О концентрированной соляной кислоты и охлаждают. Отфильтрованный и перекрис10 таллизованный из воды осадок содержит 0,13 г гидрохлорида 6,8-дифторгде R - 4-метил-1-пиперазиннльная 1,4-дигидро-1-метил-4-ОКСО-7-(1-пипегруппа, разинил) -хинолин-3-карбоновой кислоили их солей, обладающих высокой анты, т . пл . 286-288°С (с разложением). тибактериальной активностью. Найдено, %: С 49,98; Н 4,38; Известна реакция образования N 11,58. C-N-свяэи взаимодействием галогенпроизводных с аминами. Условия проВычислено, %: С 50,08; Н 4,48; ведения процесса зависят от характеN 11,68. ра исходного соединения [ і ] . , 20 Исходный продукт - 6,7,8-трифторЦель изобретения - синтез новых 1,4-ДИГИДрО-1-МЄТИЛ-4-ОКСОХИНОЛИНсоединений, обладающих ценными фи3-карбоновая кислота - получен по зиологическими свойствами. следующей методике. Поставленная цель достигается Смесь 0,3 г этилового эфира уем, что согласно способу получения 25 6,7,8-трифтор-1,4-дигидро-4-оксохипроизводных хинолина общей формулы нолин—3-карбоновой кислоты, 0,8 г ( і ) ИЛИ ИХ солей, основанному на избезводного карбоната калия, 1,6 г вестной реакции образования C-N-свяйодистого метила и 10 мл диметнлзи, соединение формулы формамида (ДМФ) нагревают при пере30 мешивании в течение 10 ч при 90-100°С, Смесь выпаривают досуха. Остаток обрабатывают водой, экстрагируют дихлорметаном. Органический слой промывают водой, сушат над безводным сульфатом натрия и выпаривают. Остаток 35 добавляют к смеси из 5 мл 18%-ной соляной кислоты и 2,5 мл этаиопа, вводят в реакцию с N-метилпиперазиполученную смесь кипятят с обратным ном в инертном растворителе, наприхолодильником в течение 2,5 ч . После мер пиридине, при кипячении реакциондобавления 5 мл воды и 5 мл этанола ной массы с выделением целевого про- 40 и охлаждения выпавший осадок отфильтдукта в свободном виде или в виде соровывают и перекристаллизовывают из ли. смеси диметилформамида и этанола, Соли, такие, например, как соли получают 0,22 г 6,7,8-трифтор-1,4натрия, калия, кальция, магния, алюдигидро-1-метил-4-оксохинолин-3-карминия, четырехвалентного церия, трех-45 боновой кислоты, т.пп, 255-258°C, валентного кобальта, хрома, двухвалентной меди, трехвалентного железа, П р и м е р 2. Гидрохлорид 6,8серебра, цинка, и солн органических дифтор-1,4-ДИГИДРО-4-ОКСО-7-(1-пипеоснований или гидрохпориды, сульфаты, разинил) -1-н-пропилхинолин-3-карбофосфаты, ацетаты ,лактаты иметансуль- 50 новой кислоты. фонаты, получают обычным способом. Смесь 0,22 г 6,7,8-трифтор-1,4П р и м е р 1, Гидрохлорид 6,8дигидро-4-оксо-1н-пропилхинолин-3-кардифтор-1,4-дигидро-1-метил-4-оксо-7боновой кислоты, 0,34 г пнпераэина (1-пиперазинил)-хинолин-3-карбоновой и 3 мл пиридина кипятят с обратным кислоты. 55 холодильником в течение 6 ч . Смесь Смесь 0,22 г 6,7,8-трифтор-1,4выпаривают досуха, устанавливают вод* ным раствором соляной кислоты рН 1 .дигидро-1-метил-4-оксохинолин-3-кари охлаждают. Твердый остаток отфильтбо овой кислоты, 0,37 г пипераэина соон соон 1181544 4 тель испаряют и остаток подкисляют, ровывают и перекристаллиэовывают из в значительной мере, добавление водводы, получают 0,11 г гидрохлорида ного раствора соляной кислоты. После 6,8-дифтор-1,4-дигидро-4-оксо-7-(1охлаждения твердый остаток отфильтроциперазинил)-1-н.-пропилхинолин-35 Бывают и перекристаллиэовывают из карбоновой кислоты, т . п л . 279-282 С воды, получают 0,09 г гидрохлорида (с разложением). 6,8-дифтор-1-(2-фторэтил)-1,4-дигидНайдено, %: С 52,46; Н 5,16; ро-4-оксо-7-(1-пиперазинил)-хинолинN 10,68. 3-карбоновоЙ кислоты, т . п л . 291-294°С C 17 H 79 F 2 N,O 3 HC£ /О (с разложением). Вычислено, Z: С 52,65; Н 5,20; Найдено, Хг'С 4 9 , 0 4 ; Н 4 , 3 6 ; N 10,83. N 10,68. Получение исходного продукта 6,7,8-трифтор-1-4,-днгидро- 4-оксоВычислено, %: С 49,05; Н 4 , 3 7 ; 1-н-пропилхинолин-З-карбоновой кислоN 10,73. ты ( т . п л . 202-205°С) проводят по 15 методике примера 1 с использованием Исходный продукт - 6,7,8-трифторвместо йодистого метила н-пропилбро1-(2-фторэ тил)-1,4-дигидро-4-оксохимида.нолин-3-карбоновую кислоту получают по методике, описанной ниже. П р и м е р 3 . Гидрохлорид 2,2 г безводного карбоната калия, 1-аллйл-6,8-дифтор-1,4-дигидро-420 0,8 г этилового эфира 6,7,8-трифтороксо-7-(1-пиперазинил)-хинолин-31,4-дигидро-4-оксохинолин-3-карбонокарбоновой кислоты. вой кислоты, 3,8 г 1-бром-2-фторэтаСмесь 0,24 г (1-аллил-6,7,8-трина, 4,5 г йодистого натрия и 30 мл фтор-1,4-дигидро-4-оксо-хинолин-3Д Ф смешивают и нагревают при перемекарбоновой кислоты, 0,34 г пиперази- 25 М шивании в течение 10 ч при 90-100°С. на и 3 мл пиридина кипятят с обратПосле выпаривания растворителя и охным холодильником в течение 6 ч . лаждения к остатку добавляют воду и После высушивают смесь досуха, о с экстрагируют дихлорметаном в Органитаток подкисляют до рН 1 прибавленический слой промывают водой,сушат над ем разбавленной соляной кислоты и безводным сульфатом натрия и выпариохлаждают. Твердый остаток отфильтровают. К твердому остатку добавляют вывают и перекристаллизовывают из в о смесь 14 мл 18%-ной соляной кислоты ды, получают 0,1 г гидрохлорида и 7 мл этанола и кислую смесь кипятят 1-аллил-6,8-дифтор-1,4-дигидро-4с обратным холодильником в течение оксо-(1-пиперазинил)-хинолин-3-карбо35 2,5 ч . Добавляют 14 мл воды и 14 мл новой кислоты, т . п л . 278-281°С этанола к реакционной смеси и охлажда(с разложением), ют. Остаток отфильтровывают и переНайдено, %: С 52,65; Н 4 , 6 8 ; кристаллизовывают из смеси ЛИФ и э т а N 10,82 нола, получают 0,34 г 6,7,5-трифторл n 2 3 3 Вычислено, %: С 52,93; Н 4,70; N 10,89. Исходный продукт - 1-аллил-6,7,8ТрИфТОр-1,4-ДИГИДРО-4-ОКСО-ХИНОЛИН 45 3-карбоновую кислоту ( т . п л . 194197°С) получают по методике примера 1 с использованием вместо йодистого метила бромистого аллила. П р и м е р 4. Гидрохлорид 6 , 8 дифтор-2-(2-фторэтил)-1,4-дигидро-4оксо-7-(1-пипераэинил)-хннолин-3карбоновой кислоты. К смеси 6,7,8-трифтор-1-(2-фторэтил)-1,Д-дигидро-4-оксохинолин-Зкарбоновой кислоты (0,2 г) и пипера- 55 зина (0,3 г) добавляют 5 мл пиридина и смесь кипятят с обратным холодильником в течение 6 ч . Раствори 1«- ( 2 - ф т о р э т и л ) -1,4-ДИГИДРО-4-ОКСОХИНО лин-3-карбоновой кислоты, т о п л . 210°С. Найдено, %: С 4 9 , 8 6 ; Н 2,37; 208: *' С 1 2 Н 7 F4NO3 Вычислено, %: С 49,84; Н 2,44; N 4,84. J П р и м е р 5. Гидрохлорид 6 , 8 дифтор-1-(2-фторэтил)-1,4-дигидро-7(4-метил-1-пнперазинил)-4-оксохинолин3-карбоновой кислоты. Раствор, содержащий 0,34 г 1-метилпиперазина и 3 мл пиридина, добавляют к 0,12 г 6,7,8-трифтор-1-(2-фторэтил)1,Д-дигидро-4-оксохинолин—3-карбоновой кислоты и нагревают с обратным холодильником в течение 6 ч . После 1181544 испарения растворителя и охлаждения ром уксусной кислоты и экстрагируют остаток доводят до рН 1 прибавлением дихлорметаном. Слой дихлорметана проводной соляной кислоты. Охлажденную мывают водой, высушивают над безводсмесь отфильтровывают и остаток переным сульфатом натрия и испаряют. Оскристаллизовывают из воды, получают таток перекристаллизовьшают из смеси 0,08 г гидрохлорида б,8-дифтор-1-(2Д Ф и этанола и получают 0,06 г М фторэтил)-1,4-дигидро-7-(4-метил-11-этил-7-(4-этил-1-пиперазинил)-6,8пипераэинил)-4-оксохинолин-3-карбодифтор-1,4-дигидро-4-оксохинолин-3новой кислоты, т . п л . 269-27ГС JQ карбоновой кислоты, т . п л . 236-239°С, (с разложением). Найдено, %'. С 5 8 , 3 8 ; Н 5,74; Найдено, %: С 5 0 , 1 2 ; Н 4 , 9 7 ; N 11,31. N 10,24. C i B H 2 1 F 4 N 3 O 3 . 1 / 4 H20 Вычислено, %: С 5 8 , 4 5 ; Н 5,86; Вычислено, %: С 50,32; Н 4,72; N 11,36. t s N 10,36. П р и м е р 8 ( 3 ) . 1-этил-6,8дифтор-1,4~дигидро-7-£4-(2-оксиэтил)П р и м е р 6 (2-й способ). 7-(4 1-пилераэинилJ-4-оксохинолин-З-карбоАллил-1-пипёразинил)-1-этил-6,8-диновая кислота. фтор- 1,4-ДИГИДРО-4-ОКСОХИНОЛИН-3карбоновая кислота. 20 Смесь 0,3 г гидрохлорида 1-этил6,8-дифтор-1,4-дигидро-4-оксо-7-(1Смесь 0,18 г гидрохлорида 1-этилпиперазинил)-хинолин-3-карбоновой 6,8-дифтор-1,4-ДИГИДРО-4-ОКСО-7-(1кислоты, 0,2 г триэтиламина, 0,15 г пипёразинил)-хинолин-3-карбоновой 2-бромэтанола и 5 мл Д Ф нагревают М кислоты, 0,12 г триэтиламина, 0,09 г 25 при перемешивании при 90°С в течение бромистого аллила и 3 мл Д Ф нагреМ 3 ч . После выпаривания растворителя вают при перемешивании при 90°С в остаток растворяют в 2н о растворе течение 3 ч , растворитель испаряют. гидроксида натрия, нейтрализуют водОстаток растворяют в 2 н. растворе ной уксусной кислотой и экстрагируют гидроксида натрия. Щелочной раствор Зо днхлорметаном. Органический слой продоводят до рН 7 добавлением водной мывают водой, высушивают над безводуксусной кислоты и экстрагируют д и ным сульфатом натрия и отгоняют. Тверхлорметаном. Органический слой продый остаток перекристаллиэовывают из мывают водой, высушивают над безводсмеси Д Ф и этанола, получают 0,08 г М ным сульфатом натрия и испаряют. 1-этил-6,8-дифтор-1,4-дигидро-7- 4-(2Остаток перекристаллизовьшают из сме си Д Ф и этанола, получают 7-(4-ал- 35 оксиэтил)-1-пиперазинил -4-оксохиноМ лин-3-карбоновой кислоты, т . п л . 225лил-1-пиперазинил)-1-этил-6,8-дифтор 228°С. 1,4-дигидро-4-оксохинолин-3-карбоно~ вую кислоту в количестве 0,055 г , Найдено, %• С 5 6 , 4 3 ; Н 5,62; т . п л . 227-23О°С (с разложением). N 10,93. Найдено, %: С 59,69; Н 5,52; CieH21F2N,04 N 10,89. Вычислено, %: С 56,69; Н 5 , 5 5 , N 11,02. U 1 2 * 3 2 П р и м е р 9. Гидрохлорид 6 , 8 Вычислено, X: С 59,76; Н 5,76; , дифтор-1,4-дигидро-(2-оксиэтил)-4N 11,00. оксо-7-(1-пипёразинил)-хинолин-3-карП р и м е р 7 ( 2 ) . 1-Этил-7-(4боновая кислота. этил-1-пипёразинил)-6,8-дифтор-1,4Смесь 6,7,8-трифтор-1,4-дигидродигидро-4-оксохинолин-З-карбоновая 1-(2-оксиэтил)-4-оксохинолин-3-карбокислота. 0,2 г триэтиламина, 0,3 г гидро- 50 новой кислоты (0,14 г ) , пиперазина (0,22 г) и пиридина (3 мл) кипятят хлорида 1-э тил-6,8-дифтор-1,4-дигидс обратным холодильником в течение ро-4-оксо-7-(1-пипераэинил)-хинолин6 ч . После того, как смесь выпарива3-карбоновой кислоты, 0,19 г йодисют досуха, остаток сильно подкислятого этила и 5 мл Д Ф смешивают и М ют водной соляной кислотой и охлажданагревают при перемешивании в т е ч е 55 ют. Остаток отфильтровывают и п е р е ние 3 ч при 90°С, растворитель испакристаллизовывают из воды, получают ряют. Остаток растворяют в 2н. р а с т 0,05 г гидрохлорида 6,8-дифтор-1,4воре гидроксида натрия. Щелочной дигидро-1-(2-оксиэтил)-4-оксо-7-(1раствор нейтрализуют водным раство 7 1181544 8 кипятят с обратным холодильником в течение 4 ч . После выпаривания смеси досуха остаток обрабатывают водой, подщелаченной карбонатом калия, и экстрагируют дихлорметаном. Органический слой промывают водой, высушивают, испаряют, получают этиловый эфир 6,8~дифтор-1,4-дигидро-1-(2оксиэтил)-4-оксо-7-(1-пиперазинил)хинолин-3-карбоновоЙ кислоты, К раствору указанного эфира 7— (1-пипераэинил)-хинолина (1,1 г) и уксусной кислоты ( 6 , 5 мл)" добавляют 0,4 г уксусного ангидрида и смесь перемешивают при 80°С в течение 1 ч . После испарения растворителя остаток обрабатывают водой н экстрагируют дихлорметаном. Органический слой промывают водой, высушивают и испаряют, получают этиловый эфир 7 - ( 4 ацетил-1-пипераэинил)-5,8-дифтор-1,4дигидро-1-(2-оксиэ тнл)-4-оксохинолин-3-карбоновой кислоты. К охлажденному льдом раствору, содержащему указанный эфир 7 - ( 4 - а ц е тил-1-пилераэинил)~хинолина ( 1 , 0 г ) , пиридин (0,27 г) и хлороформ (30 мл), по каплям добавляют раствор, содержащий тионилхлорид (3,2 г) и хлороформ (13 м л ) . Смесь перемешивают при комнатной температуре в течение 15 ч , Растворитель испаряют. оксо-7-(1-пипераэинил)-1-винилхиноОстаток слегка подщелачивают водлин-3-карбоновой кислоты, т . п л . 267ным раствором карбоната калия, э к с т 27О°С (с разложением). рагируют хлороформом, промывают водой, Масс-спектр, т / е : 335 (М -НСЕ). высушивают и испаряют. Затем остаток Исходный продукт - этиловый эфир очищают хроматографированием на оки7-(4-ацетил-1-пиперазинил)-1-(2-хлорси алюминия, используя в качестве этил)-6,8-дифтор-1,4-дигидро-4-оксоэлюирующего агента хлороформ, получахинолин-3-карбоновой кислоты получало ют этиловый эфир 7-(4-ацетил-1-пипеют следующим способом. разинил)-1-(2-хлорэ тил)-6,8-дифторСмесь, этилового эфира 6 , 7 , 8 - т р и 1,4-дигидро-4-оксохинолин~3-карбонофтор-1,4-дигидро-4-оксохинолин-3вой кнслоты. карбоновон кислоты (4,1 г ) , безводП р и м е р 11. Соль серебра ного карбоната калия (5,2 г) 2-бромэтанола ( 9 , 5 г) и Д Ф (90 мл) пере- 4 5 и 1-этил-6,8-дифтор-1,4-дигидро-7М (4-окси-1-пиперидиннл)- 4-оксохиномешивают при 100°С в течение 10 ч . лин-3-карбоновой кислоты. После выпаривания смеси досуха остаК перемешиваемому раствору, содерток обрабатывают водой, экстрагируют жащему 235 мг 1-этил-6,8-дифтор-1,4дихлорметаном, промывают водой, су50 дигидро-7-С4-окси-1-пиперидинил)-4~ шат и испаряют. оксохинолин-3-карбоновой кислоты, Твердый остаток перекристаллизо26,7 мг гидроксида натрия и 3 мп в о вывают из э;ганола, получают этиловый ' ды, добавляют раствор, содержащий эфи,р 6, 7.,8гтрифтор-1,4 - дигидро-1(2-оксиэтил)-4-оксихинолин-3-карбо113 мг нитрата серебра и 2 мл воды. новой кислоты ( т . п л . 175—177°С). 55 Осадок отфильтровывают, промывают Смесь приведенного выше эфира 1водой и высушивают, получают 284 мг соли серебра и 1-этил-6,8-дифтор(2-оксиэтил)-хинолина (1,2 г ) , пипе-) 1,4-дигидро-7-(4-окси-1-пиперидинил)раэина (1,7 г) и пиридина (10 мл) пиперазинил)-хинолин-3-карбоновой кислоты, т.пл. 298-ЗО0°С (с разложением) . . Найдено, %: С 48,94; Н 4,50; 5 N 10,76. С 1в H 1 7 F 2 N 3 O 4 HCE Вычислено, %: С 49,30; Н 4 , 6 5 ; N 10,78. Исходный продукт - 6,7,8-трифгор10 1,4-дигидро-1-(2-оксиэтил)-4-оксихинолин-3-карбоновую кислоту получают по методике примера 1 с использованием вместо йодистого метила . 2-бромэтанола. 15 П р и м е р 10. Гидрохлорид 6,8-дифтор-1,4-дигидро-4-оксо-7(1пиперазинил)-Г-винилхинолин-3-карбоновой кислоты, К раствору, содержащему 0,2 г гид1 роксида натрия, 2,5 мл воды и 2,5 мл 20 этанола, добавляют 0,2 г этилового эфира 7-(4-ацетил-ї-пиперазинил)-1(2-хлорэтил)-6,8-дифтор-1,4-дигидро4-оксохинолин-З-карбоновой кислоты и смесь нагревают при перемешивании 25 в течение 3 ч при 80-90°С. После охлаждения смесь сильно подкисляют концентрированной соляной кислотой. Осадок отфильтровывают и перекристаллизовывают из воды, получают 30 гидрохлорид 6,8-дифтор-1,4-дигидро-4 9 1181544 0 4-оксохннолин-З-карбоновой кислоты, ным бактериям, определенная стандартт.пл, 181—184°С (с разложением). ным методом нанесения бактериальных культур штрихами на агаровую среду, Пример 12. 6,8~Дифтор-1-(2-приведена в табл. 1. фторэтил)-1,4-дигидро-7-(4-метил-1пипераэинил)-4-оксохинолин-3-карбоВ табл. 2 приведена антибактериальновая кислота. ная активность следующих соединений: АМ-833, предлагаемое соединение 6,8Хлоргидрат (1,0 г ) , полученный дифтор-1-(2-фгорэтил)-1,4-дигидро-7тем же способом, что в примере 5, (4-метил-1-пиперазинил)-4-оксохинорастворяют в вод*3» нейтрализуют водлин-3-карбоновая кислота; АМ-804 ным раствором гидроокиси натрия и известное соединение 6,8-дифтор-1получившиеся кристаллы собирают пуэтил-1,4-дигидро-7-(1-пиперазинил)тем фильтрации, после чего их пере4-оксохинолин-З-карбоновая кислота; кристаллиэовывают из Д Ф с получеМА АМ-805 - известное соединение 6,8нием 6,8-дифтор-1-1(2-фторэтил)-1,4дифтор-1-этил-1,4-дкгидро-7-(4-метилдигидро-7-(4-метил-1-пипераэинил)1-пипераэинил)-4-оксохинолин-3-карбо4-оксохинолин-З-карбоновой кислоты новая кислота; N - налидиксиновая A (0,86 г ) , т.пл. 286°€ кислота; РРА - пипемидиновая кислота. Найдено, X: С 55,51; Н 5,20; N 11,16. Защитные эффекты при системном 20 инфицировании мышей представлены в С17Н FSNSO3 табл. 3. Вычислено, %: С 55,28; Н 4,91е; N 11,37. Как видно из представленных данных, Антибактериальная активность предпредлагаемое соединение (АМ-833) пролагаемых соединений по отношению к являет большую эффективность, чем изграмположительным и грамотрицатель- 25 вестные соединения (АМ-804 и АМ-805) Т а б л и ц а м т ттг Минимальная ингибируищая концентрация, мг/мл, по примерам Организмы 1 " 2 I 10 I [11 м 1 м — -1 12 Bacillus subcilis РСТ 219 0,39 0,20 0,39 0,39 0,10 0,10 0,10 0,10 Staphylococcus aureus 209p 3,13 1,56 3,13 3,13 ' 0,78 0,78 0,78 0,78 0,20 0,20 0,10 *0,20 -3,13 3,13 3,13 3,13 0,78 0,78 0,78 0,78 0,20 0,39 0,10 "0,39 3,13 3,13 3,13 1,56 0,78 0,78 0,78 0,78 0,39 0,78 0,20 0,39 ^0,05 ^0,05 0,10 £0,05 0,10 £0,05 £0,05 0,20 0,39 0,20 0,20 0,20 0,39 S.aureus Tarajima S.epidermidis II D 866 Escherichia coli NIHJ JC-2 ^0,05 £0,05 ^0,05 E.coli ATCC 10536. 0,10 0,20 0,39 0,10 0,10 0,39 0,10 0,20 0,20 0,78 Proteus vulgaris 3167 0,10 .£0,05 0,10 £0,05 60,05 0,20 £0,05 0,10 ^0,05 0,10 ^0,05^0,05 £0,05^0,05 Z IT 00 P.mirabilis II D 994 0,10, 0,10 0,20 £0,05 ^0,05 0,39 0,20 0,20 P.morganii II D 602 0,20 0,39 0,39 0,20 0,10 0,78 0,39 0,78 ^0,05 0,10 0,10 £0,05 £0,05 ^0,05 ^0,05 Enterobacter cloacae II D 977 0,10 0,78 0,78 ^0,05 0,10 1,56 Citrobacter freundii II D 976 0,20 0,20 £0,05 £0,05 0,10 0,39 0,39 0,39 ^0,05 0,10 0,10 0,10 0,20 0,20 Klebsiella pneumoniae І70 3512 I Serratia marcescena II D 618 Shigella sonnei II 0 969 Salmonella enteritidis II D 604 0,39 0,10 0 f 20 0,78 1,56 0,39 0,78 £0,05 £0,05 0,10 0,39 0,39 1.56 6,25 1,56 1,56 0,78 0,20 0,39 0,78 1,56 0,39 0,78 0,10 1,56 0,39 0,78 1.57 3,13 1,56 1,56 ^0,05 |0,05 0,20 0,10 0,10 0,20 0,78 0,20 0,20 0,05 0,10 1,56 0,39 0,78 1,56 6,25 '1,56 .1,56 ^0,05 ^0,05 Продолжение таблі І Организмы Минимальная ингибирующая концентрация, мг/мл,по примерам '7 Versinia enterocolitica II D 981 Pseudomonas aeruginosa V-1 0,10 3,13 0,39 12,5 0,39 12,5 0,05 6,25 0,10 3,13 0,78 12,5 0,20 6,25 10 0,39 12,5 0,78 6,25 1,56 25 ]I 0,39 12 0,39 6. 25 12, 5 •С P. aeruginosa I FO 12689 1,56 6,25 6,25 1,56 3,13 25 6,25 12,5 12,5 Acinetobacter antitratus II D 876 1,56 1,56 3,13 3,13 0,39 0,78 0,39 1,56 1,56 1,56 O t 39 1,56 Alcaligeues faecaXis 0104002 6,25 1,56 3,13 3,13 0,78 3,13 1,56 1,56 1,56 3,13 0,39 1,56 25 6, 25 12, 5 15 16 1181544 Т а б л и ц а 2 Минимальная ингибирующая концентрация, мкг/мл Организмы АМ-833 АМ-8О4 АМ-805 NA РРА Bacillus subtilis PG 1219 0,10 0,10 0,20 6,25 6,25 Staphylococcus aureus 209P 0,78 0,39 0,39 100 25 ^0,05 0,05 0,05 3,13 1,56 0,10 0,05 0,05 • • 3,13 1,56 Escherichia coli NIHJJC-2 E.coli ATCC 10536 Proteus yulgaris 3167 ^0,05 0,025 0,05 3,13 3,13 Klebsiella pneumoniae IF0 3512 £0,05 0,025 0,025 1,56 1,56 12,5 Pseudomonas aeraginosa V-1 3,13 0,39 1,56 100 P.aeruginosa IFO 12689 3,13 0,78 3,13 ?200 Salmonella enteritides II D 604 0,10 0,20 0,39 Serratia marcescens II D 618 0,10 0,10 0,20 Jersinia enterocolitica II D 981 0,10 0,10 0,20 Acinetobacter auitratus II D 876 0,39 0,78 0,20 Штамм Е. coli ML 4707 I 12,5 Т а б л и ц а Соединение NA МИК мкг/мл 3,13 РРА " • 0,78 мг/кг ЭД_ 25 12,5 3 (соотношение) 33,0 0,07 33,00 0,07 АМ-804 0,05 2,3 1,00 АМ-805 0,05 1,3 1,76 АМ-833 0,05 0,7 • 3,28 Соотношение: ЗД У0 АМ-804/ІД Cft другого соединения. Редактор- В. Петраш Составитель Г. Жукова Техред Ж.Кастелевич Корректор М. Демчик Заказ 5954/63 Тираж 383 ' Подписное ВНИИПИ Государственного комитета СССР по делам изобретений и открытий , Москва, Ж-35, Раушская наб., д. 4/5 Филиал ППП "Патент", г. Ужгород, ул. Проектная, 4
ДивитисяДодаткова інформація
Назва патенту англійськоюProcess for the preparation of quinolone derivatives and salts thereof
Назва патенту російськоюСпособ получения производных хинолина или их солей
МПК / Мітки
МПК: C07D 215/14, C07D 215/18, C07D 215/233, C07D 401/04
Мітки: спосіб, одержання, хіноліна, солей, похідних
Код посилання
<a href="https://ua.patents.su/10-4875-sposib-oderzhannya-pokhidnikh-khinolina-abo-kh-solejj.html" target="_blank" rel="follow" title="База патентів України">Спосіб одержання похідних хіноліна або їх солей</a>
Попередній патент: Пересувна установка для безперервної заміни реєк та шпал рейкового шляху
Наступний патент: Пестицидна композиція
Випадковий патент: Спосіб деціанування оборотної води циклу кінцевого охолодження коксового газу