Антибактеріальні сполуки феніколу
Номер патенту: 110436
Опубліковано: 25.12.2015
Автори: Кертіс Майкл, Вайраґундар Раджендран, Гейбер-Стак Андреа К., Кайн Ґрем М., Івін Річард А., Джонсон Пол Д., удвін Річард М., Даклос Браян А., Шіган Сузан М. К., Джонсон Тімоті А., Біллен Деніс
Формула / Реферат
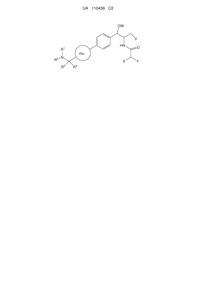
1. Сполука формули І
 I
I
або її фармацевтично прийнятна сіль або проліки, де:
Het фрагмент є 4-14-членною циклічною або біциклічною кільцевою системою, яка має від одного до п'яти гетероатомів, вибраних з N, О та S, необов'язково заміщеною одним-трьома R6;
R1 та R2 кожен незалежно є
a) Н,
b) -С1-8алкілом, необов'язково заміщеним одним або більше ОН, -SH, -CN, -NO2, галогеном, -NHR5, -NС1-4алкілR5, -ОС1-4алкілом, -SС1-4алкілом, -S(C=O)С1-4алкілом, -C(=O)NR5R5, -SO2R5, -SO2NR5R5 або -С3-6циклоалкілом,
c) -С3-8циклоалкілом, необов'язково заміщеним одним-трьома R6,
d) -SO2R5, -C(=O)NR5R5, -SO2NR5R5, -C(=O)OR5 або -C(=O)R5,
e) 4-6-членним гетероциклічним кільцевим фрагментом, який необов'язково має від одного до чотирьох гетероатомів, вибраних з групи, що складається з N, S та О, де кільце або атом необов'язково є заміщеним одним-трьома R6, або
f) R1 та R2 взяті разом з нітрогеном, до якого вони є приєднаними, утворюють 4-11-членний циклічний або біциклічний кільцевий фрагмент, який необов'язково має додаткові один-два гетероатоми, вибрані з групи, що складається з N, S та О, де кільце або атом необов'язково є заміщеним одним-трьома R6;
R3 та R4 кожен незалежно є
a) -Н,
b) -С1-8алкілом, необов'язково заміщеним ОН, -SH, галогеном, -CF3, -CN, -NO2, NH2, -NHR5, -NHR5, -ОС1-4алкілом, -СН2-О-СН3, -SС1-4алкілом, -S(C=O)С1-4алкілом, -C(=O)NR5R5, -C(=O)OH, -SO2NR5 або -SO2R5,
c) -С3-8циклоалкілом, необов'язково заміщеним одним-трьома R6,
d) -С(=O)С1-8алкілом, де алкіл необов'язково є заміщеним -S(=O2)R5, -SO2NR5 або -C(=O)R5,
e) 4-6-членним гетероциклічним кільцевим фрагментом, який необов'язково має від одного до трьох гетероатомів, вибраних з групи, що складається з N, S та О, де гетероциклічне кільце необов'язково є заміщеним одним-трьома R6,
f) R3 та R4 взяті разом утворюють С3-8циклоалкіл, необов'язково заміщений одним-трьома R6; або
g) R3 та R4 взяті разом з одним або двома гетероатомами, вибраними з групи, що складається з N, S та О, утворюють оксогрупу (=О) або утворюють 4-6-членний гетероциклічний кільцевий фрагмент, в якому гетероциклічне кільце необов'язково є заміщеним одним-трьома R6; або
R1 та R3, R2 та R4, R1 та R4 або R2 та R3 взяті разом з атомом нітрогену, до якого вони є приєднаними, утворюють 4-6-членний гетероциклічний кільцевий фрагмент, який необов'язково має від одного до двох гетероатомів, вибраних з групи, що складається з N, S та О, де гетероциклічне кільце необов'язково є заміщеним одним-трьома R6;
в кожному випадку, R5 незалежно є гідрогеном, С1-6алкілом, -С3-6циклоалкілом, NH2 або тетрагідро-2Н-піранілом, де зазначений алкіл необов'язково є заміщеним одним, двома або трьома R6;
в кожному випадку, R6 являє собою Н, С1-6алкіл, галоген, -CN, -NO2, -CF3, -С3-6циклоалкіл, оксо (=O), -NH2, -NНС1-4алкіл, -N(С1-4алкіл)2, -ОС1-4алкіл, оксо, -SH, -SС1-4алкіл, -S(С=О)С1-4алкіл, -SO2R5, -SОNС1-4алкіл, -С(=О)С1-4алкіл, -C(=O)NH2, -C(=O)NHС1-4алкіл, -С(=О)N(С1-4алкіл)2, -NC(=O)NH2, -NС(=О)NНС1-4алкіл, NC(=O)N(С1-4алкіл)2, CF3 або 4-6-членний гетероциклічний кільцевий фрагмент, який необов'язково має від одного до чотирьох гетероатомів, вибраних з групи, що складається з N, S та О;
W являє собою -Н, -РО(ОН)2, -РО(ОН)галоген, -СН2ОРО(ОН)2, -С(=О)С1-4алкіл або -СН2OC(=О)С1-4алкіл, де С1-4алкіл необов'язково є заміщеним -ОСО2Н, -ОСО2С1-4алкілом або -ОС(=О)NНС1-4алкілом;
та X, Y і Z кожен незалежно є Н, галогеном, С1-4алкілом, С3-6циклоалкілом, -ОН, CF3, -NH2, -CN, N3 або -S-CF3;
за умови, що, коли R3 та R4 є взяті разом, утворюючи оксогрупу (=О), то R1 та R2 обидва не є гідрогенами.
2. Сполука за п. 1, де W є Н, -РО(ОН)2 або -СН2ОРО(ОН)2.
3. Сполука за п. 2, де W є Н.
4. Сполука за п. 1, де X та Y є хлором; та Z є Н.
5. Сполука за п. 1, де X та Y є флуором; та Z є Н.
6. Сполука за п. 1, де Het фрагмент є 5- або 6-членною циклічною кільцевою системою, яка має від одного до трьох гетероатомів, вибраних з N, О та S, необов'язково заміщеною R6.
7. Сполука за п. 6, де Het-фрагмент є піридинілом, тіофенілом, тіазолілом, тіадіазолілом, імідазолілом, оксадіазолілом, піримідинілом, піразинілом, ізоксазолом, ізотіазолом або піридазином.
8. Сполука за п. 7, де Het-фрагмент є піридинілом або тіазолілом.
9. Сполука за п. 1, де зазначені R1 та R2 незалежно є Н, або R1 та R2 взяті разом з нітрогеном, до якого вони є приєднаними, утворюють 4-6-членний гетероциклічний кільцевий фрагмент, який необов'язково має додаткові один-два гетероатоми, вибрані з групи, що складається з N, S та О, де гетероциклічне кільце необов'язково є заміщеним R6.
10. Сполука за п. 9, де R1 та R2 кожен є Н.
11. Сполука за п. 1, де R3 та R4 незалежно є Н або С1-4алкілом, або R3 та R4 взяті разом утворюють С3-6циклоалкіл.
12. Сполука за п. 11, де R3 та R4 взяті разом утворюють циклопропіл.
13. Сполука за п. 1, де W є Н, -РО(ОН)2 або -СН2ОРО(ОН)2; Het-фрагмент є 5- або 6-членною циклічною кільцевою системою, що має від одного до трьох гетероатомів, вибраних з N, О та S, необов'язково заміщеною R6; R1 та R2 кожен є Н; -R3 та R4 незалежно є Н або С1-4алкілом, або R3 та R4 взяті разом утворюють циклопропіл; та X, Y та Z незалежно є Н, хлором або флуором.
14. Сполука за п. 1, де R3 та R4 взяті разом з одним або двома гетероатомами, вибраними з групи, що складається з N, S та О, утворюють 4-6-членний гетероциклічний кільцевий фрагмент, де гетероциклічне кільце необов'язково є заміщеним одним-трьома R6.
15. Сполука за п. 14, де R3 та R4 взяті разом з атомом оксигену утворюють оксетаніл.
16. Сполука за п. 15, де W є Н або -РО(ОН)2; Het-фрагмент є 5- або 6-членною циклічною кільцевою системою, що має від одного до трьох гетероатомів, вибраних з N, О та S, необов'язково заміщеною R6; R1 та R2 кожен є Н; R3 та R4 взяті разом з атомом оксигену утворюють оксетаніл; та X, Y та Z незалежно є Н, хлором або флуором.
17. Сполука за п. 1, де R2 та R3 взяті разом з атомом нітрогену, до якого вони є приєднаними, утворюють азетидиніл.
18. Сполука за п. 17, де W є Н або -РО(ОН)2; Het-фрагмент є 5- або 6-членною циклічною кільцевою системою, що має від одного до трьох гетероатомів, вибраних з N, О та S, необов'язково заміщеною R6; R1 та R4 кожен є Н; R2 та R3 взяті разом з атомом нітрогену, до якого вони є приєднаними, утворюють азетидиніл; та X, Y та Z незалежно є Н, хлором або флуором.
19. Сполука за п. 1, де R1 та R3 взяті разом з атомом нітрогену, до якого вони є приєднаними, утворюють піролідиніл.
20. Сполука за п. 19, де W є Н або -РО(ОН)2; Het-фрагмент є 5- або 6-членною циклічною кільцевою системою, що має від одного до трьох гетероатомів, вибраних з N, О та S, необов'язково заміщеною R6; R2 та R4 кожен є Н; R1 та R3 взяті разом з атомом нітрогену, до якого вони є приєднаними, утворюють піролідиніл; та X, Y та Z незалежно є Н, хлором або флуором.
21. Сполука за п. 1, вибрана з групи, що складається з:
N-((1R,2S)-1-(4-(2-(1-аміноетил)тіазол-5-іл)феніл)-3-флуор-1-гідроксипропан-2-іл)-2,2-дифлуорацетаміду;
N-((1R,2S)-1-(4-(2-(1-аміноетил)тіазол-5-іл)феніл)-3-флуор-1-гідроксипропан-2-іл)-2,2-дихлорацетаміду;
(1R,2S)-1-(4-(2-(1-аміноетил)тіазол-5-іл)феніл)-2-(2,2-дихлорацетамід)-3-флуорпропілу натрію гідрогенфосфату;
(1R,2S)-1-(4-(2-(1-аміноетил)тіазол-5-іл)феніл)-2-(2,2-дихлорацетамід)-3-флуорпропілу дигідрогенфосфату;
(1R,2S)-1-(4-(2-(1-аміноетил)тіазол-5-іл)феніл)-2-(2,2-дифлуорацетамід)-3-флуорпропілу натрію гідрогенфосфату;
(1R,2S)-1-(4-(2-(1-аміноетил)тіазол-5-іл)феніл)-2-(2,2-дифлуорацетамід)-3-флуорпропілу дигідрогенфосфату;
N-((1R,2S)-1-(4-(6-(1-аміноциклопропіл)піридин-3-іл)феніл)-3-флуор-1-гідроксипропан-2-іл)-2,2-дифлуорацетаміду;
N-((1R,2S)-1-(4-(6-(1-аміноциклопропіл)піридин-3-іл)феніл)-3-флуор-1-гідроксипропан-2-іл)-2,2-дихлорацетаміду;
(1R,2S)-1-(4-(6-(1-аміноциклопропіл)піридин-3-іл)феніл)-2-(2,2-дихлорацетамід)-3-флуорпропілу натрію гідрогенфосфату;
(1R,2S)-1-(4-(6-(1-аміноциклопропіл)піридин-3-іл)феніл)-2-(2,2-дихлорацетамід)-3-флуорпропілу дигідрогенфосфату;
(1R,2S)-1-(4-(6-(1-аміноциклопропіл)піридин-3-іл)феніл)-2-(2,2-дифлуорацетамід)-3-флуорпропілу натрію гідрогенфосфату;
(1R,2S)-1-(4-(6-(1-аміноциклопропіл)піридин-3-іл)феніл)-2-(2,2-дифлуорацетамід)-3-флуорпропілу дигідрогенфосфату;
N-((1R,2S)-1-(4-(6-((RS)-1-аміноетил)піридин-3-іл)феніл)-3-флуор-1-гідроксипропан-2-іл)-2,2-дифлуорацетаміду;
N-((1R,2S)-1-(4-(6-(1-аміноетил)піридин-3-іл)феніл)-3-флуор-1-гідроксипропан-2-іл)-2,2-дихлорацетаміду;
(1R,2S)-1-(4-(6-(1-аміноетил)піридин-3-іл)феніл)-2-(2,2-дихлорацетамід)-3-флуорпропілу натрію гідрогенфосфату;
(1R,2S)-1-(4-(6-(1-аміноетил)піридин-3-іл)феніл)-2-(2,2-дихлорацетамід)-3-флуорпропілу дигідрогенфосфату;
(1R,2S)-1-(4-(6-(1-аміноетил)піридин-3-іл)феніл)-2-(2,2-дифлуорацетамід)-3-флуорпропілу натрію гідрогенфосфату;
(1R,2S)-1-(4-(6-(1-аміноетил)піридин-3-іл)феніл)-2-(2,2-дифлуорацетамід)-3-флуорпропілу дигідрогенфосфату;
N-((1R,2S)-1-(4-(6-(азетидин-2-іл)піридин-3-іл)феніл)-3-флуор-1-гідроксипропан-2-іл)-2,2-дифлуорацетаміду;
N-((1R,2S)-1-(4-(6-(азетидин-2-іл)піридин-3-іл)феніл)-3-флуор-1-гідроксипропан-2-іл)-2,2-дихлорацетаміду;
(1R,2S)-1-(4-(6-(азетидин-2-іл)піридин-3-іл)феніл)-2-(2,2-дифлуорацетамід)-3-флуорпропілу дигідрогенфосфату;
(1R,2S)-1-(4-(6-(азетидин-2-іл)піридин-3-іл)феніл)-2-(2,2-дихлорацетамід)-3-флуорпропілу дигідрогенфосфату;
N-((1R,2S)-1-(4-(6-(3-амінооксетан-3-іл)піридин-3-іл)феніл)-3-флуор-1-гідроксипропан-2-іл)-2,2-дифлуорацетаміду;
(1R,2S)-1-(4-(6-(3-амінооксетан-3-іл)піридин-3-іл)феніл)-2-(2,2-дифлуорацетамід)-3-флуорпропілу дигідрогенфосфату;
(1R,2S)-1-(4-(6-(3-амінооксетан-3-іл)піридин-3-іл)феніл)-2-(2,2-дихлорацетамід)-3-флуорпропілу дигідрогенфосфату;
N-((1R,2S)-1-(4-(6-(3-амінооксетан-3-іл)піридин-3-іл)феніл)-3-флуор-1-гідроксипропан-2-іл)-2,2-дихлорацетаміду;
2,2-дихлор-N-{(1S,2R)-1-(флуорметил)-2-гідрокси-2-[4-(6-піролідин-2-ілпіридин-3-іл)феніл]етил}ацетаміду;
(1R,2S)-2-(2,2-дихлорацетамід)-3-флуор-1-(4-(6-(піролідин-2-іл)піридин-3-іл)феніл)пропілу дигідрогенфосфату;
2,2-дифлуор-N-{(1S,2R)-1-флуорметил-2-гідрокси-2-[4-(6-піролідин-2-ілпіридин-3-іл)феніл]етил}ацетаміду та
(1R,2S)-2-(2,2-дифлуорацетамід)-3-флуор-1-(4-(6-(піролідин-2-іл)піридин-3-іл)феніл)пропілу дигідрогенфосфату.
22. Сполука, яка є N-((1R,2S)-3-флуор-1-гідрокси-1-(4-(6-(метилсульфонамідо-метил)піридин-3-іл)феніл)пропан-2-іл)метансульфонамідом.
23. Фармацевтична композиція, яка містить сполуку за п. 1 або її фармацевтично прийнятну сіль та фармацевтично прийнятний носій.
24. Спосіб контролювання або лікування інфекцій у свійських тварин, за яким тварині, що цього потребує, вводять терапевтично ефективну кількість сполуки за пунктом 1 або її фармацевтично прийнятної солі.
Текст
Реферат: Представлений винахід передбачає нові похідні феніколу, їх застосування в лікуванні інфекцій у ссавців, фармацевтичну композицію, що міcтить дані нові сполуки, та способи одержання даних сполук. UA 110436 C2 ДЕРЖАВНА СЛУЖБА ІНТЕЛЕКТУАЛЬНОЇ ВЛАСНОСТІ УКРАЇНИ UA 110436 C2 OW F HN R1 O Het R2 N X 3 R R 4 Y UA 110436 C2 5 10 15 20 25 30 Галузь винаходу Представлений винахід передбачає нові похідні феніколу, їх застосування в лікуванні інфекцій у ссавців, фармацевтичну композицію, що містить дані нові сполуки, та способи одержання даних сполук. Передумови створення винаходу Існує зростаюча потреба в нових антибіотичних агентах для лікування бактеріальних інфекцій у тварин, та, зокрема, існує потреба в нових агентах, які долають зростання бактеріальної резистентності до існуючих антибіотиків. Флорфенікол є феніколовим антибіотиком широкого спектру дії, який застосовують виключно в ветеринарній медицині. Феніколові антибіотики, як клас, є потужними інгібіторами бактеріального протеїнового біосинтезу. Флорфенікол має широкий спектр дії проти багатьох грамнегативних та грампозитивних бактерій, та є корисним в попередженні та лікуванні бактеріальних інфекцій, викликаних чутливими збудниками у птахів, рептилій, риб, молюсків та ссавців. Важливе застосування флорфенікол знаходить в лікуванні респіраторних інфекцій у великої рогатої худоби, таких як ті, що викликані, наприклад, Mannheimia haemolytica, Pasteurella multocida та Haemophilus somnus. Ефективне лікування бичачого респіраторного захворювання (BRD) відіграє значну роль в зниженні останнього, що в протилежному випадку є однією з провідних причин економічних втрат, як в молочній, так і в м'ясній галузях по всьому світу. Звіти за останні роки показують, що розвивається резистентність бактерій до флорфеніколу, та спостерігається схрещування в декількох родинах та видах бактерій, таких як Salmonella (Bolton, L. F., et al., Clin. Microbiol., 1999, 37, 1348), E. coli (Keyes, K., et al., Antimicrob. Agents Chemother., 2000, 44, 421), Klebsiella pneumoniae (Cloeckaert, A., et al., Antimicrob. Agents Chemother., 2001, 45, 2381), та у сільськогосподарського збудника, Photobacterium damselae підвид piscicida (раніше Pasteurella piscicida) (Kim, E., et al., Microbiol. Immunol., 1996, 40, 665). У світлі зростаючої загрози резистентності до флорфенікол та очевидній рухливості генів резистентності по всім бактеріальним видам та тваринам-господарям (Cloeckaert, A., et al., Antimicrob. Agents Chemother., 2000, 44, 2858), існує важлива потреба в нових антибіотиках, які зберігають або перевищують активність флорфеніколу, в той же час, до того ж, долаючи труднощі щодо резистентності до флорфеніколу. Сполуки за представленим винаходом дають таке покращення. Суть винаходу Представлений винахід передбачає сполуку формули I OW F HN R1 O Het R 2 N X R3 35 40 45 50 Y R4 I або її фармцевтично прийнятні солі або проліки, в якій: Het фрагмент є 4- - 14-членною циклічною або біциклічною кільцевою системою, яка має від 6 одного до п'яти гетероатомів, вибраних з N, O та S, необов'язково заміщеною одним-трьома R ; 1 2 R та R кожен незалежно є a. H, b. -C1-8алкілом, необов'язково заміщеним одним або більше OH, -SH, -CN, -NO2, галогеном, 5 5 5 5 5 NHR , -NC1-4алкілR , -OC1-4алкілом, -SC1-4алкілом, -S(C=O)C1-4алкілом, -C(=O)NR R , -SO2R , 5 5 -SO2N R R , або -C3-6циклоалкілом, 6 c. -C3-8циклоалкілом, необов'язково заміщеним одним-трьома R , 5 5 5 5 5 5 5 d. -SO2R , -C(=O)NR R , -SO2N R R , –C(=O)OR , або -C(=O)R , e. 4- - 6-членним гетероциклічним кільцевим фрагментом, який необов'язково має від одного до чотирьох гетероатомів, вибраних з групи, що складається з N, S та O, де кільце або атом 6 необов'язково є заміщеним одним-трьома R , або 1 2 f. R та R взяті разом з нітрогеном, до якого вони є приєднаними, утворюють 4- - 11-членний циклічний або біциклічний кільцевий фрагмент, який необов'язково має додаткові один - два гетероатоми, вибраних з групи, що складається з N, S та O, де кільце або атом необов'язково є 6 заміщеним одним-трьома R ; 1 UA 110436 C2 3 5 10 15 20 25 30 35 40 45 50 55 60 4 R та R кожен незалежно є a. -H, 5 b. -C1-8алкілом, необов'язково заміщеним OH, -SH, галогеном, -CF3, -CN, -NO2, NH2, -NHR , 5 5 5 -NHR -OC1-4алкілом, -CH2-O-CH3, -SC1-4алкілом, -S(C=O)C1-4алкілом, -C(=O)NR R , -C(=O)OH, 5 5 SO2NR або -SO2R , 6 c. -C3-8циклоалкілом, необов'язково заміщеним одним-трьома R , 5 5 5 d. -C(=O)C1-8алкілом, де алкіл необов'язково є заміщеним -S(=O2)R , -SO2NR або -C(=O)R , e. 4- - 6-членним гетероциклічним кільцевим фрагментом, який необов'язково має від одного до трьох гетероатомів, вибраних з групи, що складається з N, S та O, де гетероциклічне кільце 6 необов'язково є заміщеним одним-трьома R , 3 4 6 f. R та R взяті разом утворюють C3-8циклоалкіл, необов'язково заміщений одним-трьома R ; або 3 4 g. R та R взяті разом з одним або двома гетероатомами, вибраними з групи, що складається з N, S та O, так, щоб утворити оксо групу (=O) або утворити 4- - 6-членний гетероциклічний кільцевий фрагмент, де гетероциклічне кільце необов'язково є заміщеним одним-трьома R6; або 1 3 2 4 4 2 3 R і R , R і R , і R або R і R взяті разом з атомом нітрогену до якого вони є приєднаними, утворюють 4- - 6-членний гетероциклічний кільцевий фрагмент, який необов'язково має від одного до двох гетероатомів, вибраних з групи, що складається з N, S та O, де гетероциклічне 6 кільце необов'язково є заміщеним одним-трьома R ; 5 в кожному випадку, R незалежно є гідрогеном, C1-6алкілом, -C3-6циклоалкілом, NH2 або тетрагідро-2Н-піранілом, де зазначений алкіл необов'язково є заміщеним одним, двома або 6 трьома R ; 6 в кожному випадку, R представляє собою H, C1-6алкіл, галоген, -CN, -NO2, -CF3, -C3-6циклоалкіл, оксо (=O), -NH2, -NHC1-4алкіл, -N(C1-4алкіл)2, -OC1-4алкіл, оксо, -SH, -SC1-4алкіл, 5 -S(C=O)C1-4алкіл, -SO2R , -SONC1-4алкілом, -C(=O)C1-4алкіл, -C(=O)NH2, -C(=O)NHC1-4алкіл, -C(=O)N(C1-4алкіл)2, -NC(=O)NH2, -NC(=O)NHC1-4алкіл, NC(=O)N(C1-4алкіл)2, CF3 або 4- - 6членний гетероциклічний кільцевий фрагмент, який необов'язково має від одного до чотирьох гетероатомів, вибраних з групи, що складається з N, S та O; W представляє собою -H, -PO(OH)2, -PO(OH)галоген, -CH2OPO(OH)2, -C(=O)C1-4алкіл або -CH2 °C(=O)C1-4алкіл, де C1-4алкіл необов'язково є заміщеним -OCO2H, -OCO2C1-4алкілом або -OC(=O)NHC1-4алкілом; та X, Y і Z кожен незалежно є H, галогеном, C1-4алкілом, C3-6циклоалкілом, -OH, CF3, -NH2, -CN, N3 або –S-CF3; 3 4 1 2 за умови, що, коли R і R є взяті разом, утворюючи оксо групу (=O), то R і R обидва не є гідрогенами. В іншому аспекті, представлений винахід також передбачає: фармацевтичні композиції, які містять фармацевтично прийнятний носій та сполуку формули I, способи контролювання або лікування інфекцій у ссавцій шляхом введення ссавцям, що цього потребують, терапевтично ефективної кількості сполуки формули I або її фармацевтично прийнятної солі, способи контролювання або лікування інфекцій у свійських та хатніх тварин шляхом введення тваринам, що цього потребують, терапевтично ефективної кількості сполуки формули I або її фармацевтично прийнятної солі, та способи одержання сполук за представленим винаходом. детальний опис винаходу Відповідно до зазначеної вище сполуки, та по всій заявці та формулі винаходу, наступні терміни мають значення, визначені нижче. Термін "галоген" стосується хлору, брому, флуору та йоду. Вміст атомів карбону різних вуглевод-вмісних фрагментів є показаний префіксом, який вказує мінімальну та максимальну кількість атомів карбону в фрагменті, тобто, префікс C i-j вказує фрагмент від цілого числа "i" до цілого числа "j" атомів карбону, включно. Таким чином, наприклад, C1-4алкіл стосується алкілу з одним - чотирма атомами карбону, включно; C1-6алкіл стосується алкілу з одним - шістьма атомами карбону, включно; та C1-8алкіл стосується алкілу з одним - вісьмома атомами карбону, включно. Термін алкіл стосується лінійних, розгалужених та циклічних насичених моновалентних вуглеводневих груп, але посилання на конкретний радикал, такий як "пропіл" охоплює тільки радикал з лінійним ланцюгом, ізомер з розгалуженим ланцюгом, такий як "ізопропіл" або циклічний ізомер, такий як циклопропілметил або циклопентил будуть зазначеними окремо. 2 UA 110436 C2 5 10 15 20 25 30 35 40 45 50 55 60 Термін "циклоалкіл" стосується монокільця, такого як циклопропіл, циклобутил, циклопентил, або циклогексил. Термін "Het" стосується насичених або ненасичених моноциклічних або біциклічних гетероциклілів, які містять, щонайменше, один гетероатом, вибраний з N, O та S. Біциклічні гетероциклічні кільця можуть бути анельованими, спіро або містковими кільцевими системами. Моноциклічні гетероциклічні кільця містять від 4- до 10-кільцевих атомів, переважно від 5 до 6 атомів-членів кільця. Біциклічні гетероцикліли містять від 7 до 14 атомів-членів, переважно від 9 до 12 атомів-членів кільця. Приклади гетероциклічних груп включають, але не обмежуються цим, заміщений або незаміщений тетрагідрофуран, діоксан, піролідин, піперидин, піперазин, тетрагідротриазин, тетрагідропіразол, тетрагідротіофен, дигідро-1,3-дитіол-2-іл, гексагідротієпін4-іл, тієніл, фураніл, піроліл, імідазоліл, піразоліл, тіазоліл, ізотіазоліл, оксазоліл, ізоксазоліл, триазоліл, тетразоліл, піридиніл, піразиніл, піридазиніл, піримідиніл, піперидиніл, піролідиніл, піперазиніл, азетидиніл, азиридиніл, морфолініл, тієтаніл, оксетарил, тіофеніл, тіадіазоліл, оксадіазоліл. Приклади прийнятних біциклічних гетероциклічних груп включають, але не обмежуються цим, 1-, 2-, 3-, 5-, 6-, 7- або 8-індолізиніл, 1-, 3-, 4-, 5-, 6- або 7-ізоіндоліл, 2-, 3-, 4-, 5-, 6- або 7-індоліл, 2-, 3-, 4-, 5-, 6- або 7-індазоліл, 2-, 4-, 5-, 6-, 7- або 8-пуриніл, 1-, 2-, 3-, 4-, 6-, 7-, 8- або 9-хінолізиніл, 2-, 3-, 4-, 5-, 6-, 7- або 8-хінолініл, 1-, 3-, 4-, 5-, 6-, 7- або 8-ізохінолініл, 1-, 4-, 5-, 6-, 7- або 8-, 2-, 3-, 4-, 5- або 6-нафтиридиніл, 2-, 3-, 5-, 6-, 7- або 8-хіназолініл, 3-, 4-, 5-, 6, 7- або 8-цинолініл, 2-, 4-, 6- або 7-птеридиніл, 1-, 2-, 3-, 4-, 5-, 6-, 7- або 8-4aH карбазоліл, 1-, 2, 3-, 4-, 5-, 6-, 7- або 8-карбазоліл, 1-, 3-, 4-, 5-, 6-, 7-, 8- або 9-карболініл, 1-, 2-, 3-, 4-, 6-, 7-, 8-, 9або 10-фенантридиніл, 1-, 2-, 3-, 4-, 5-, 6-, 7-, 8- або 9-акридиніл, 1-, 2-, 4-, 5-, 6-, 7-, 8- або 9перимідиніл, 2-, 3-, 4-, 5-, 6-, 8-, 9- або 10-фенатролініл, 1-, 2-, 3-, 4-, 6-, 7-, 8- або 9-феназиніл, 1, 2-, 3-, 4-, 6-, 7-, 8-, 9- або 10-фенотіазиніл, 1-, 2-, 3-, 4-, 6-, 7-, 8-, 9- або 10-феноксазиніл, 2-, 3-, 4-, 5-, 6- або 1-, 3-, 4-, 5-, 6-, 7-, 8-, 9-, або 10-бензізохінолініл, 2-, 3-, 4-, або тієно[2,3-b]фураніл, 2-, 3-, 5-, 6-, 7-, 8-, 9-, 10- або 11-7H-піразино[2,3-c]карбазоліл, 2-, 3-, 5-, 6- або 7-2H-фуро[3,2-b]піраніл, 2-, 3-, 4-, 5-, 7- або 8-5H-піридо[2,3-d]-o-оксазиніл, 1-, 3- або 5-1H-піразоло[4,3-d]оксазоліл, 2-, 4- або 5-4H-імідазо[4,5-d]тіазоліл, 3-, 5- або 8-піразино[2,3-d]піридазиніл, 2-, 3-, 5або 6-імідазо[2,1-b]тіазоліл, імідазо[1,2-a]піридиніл, тіазоло[5,4-b]піридиніл, 1-, 3-, 6-, 7-, 8- або 9фуро[3,4-c]цинолініл, 1-, 2-, 3-, 4-, 5-, 6-, 8-, 9-, 10, або 11-4H-піридо[2,3-c]карбазоліл, 2-, 3-, 6або 7-імідазо[1,2-b][1,2,4]триазиніл, 7-бензо[b]тієніл, 2-, 4-, 5-, 6-, або 7-бензоксазоліл, 2-, 4-, 5-, 6- або 7-бензімідазоліл, 2-, 4-, 5-, 6- або 7-бензотіазоліл, 1-, 2-, 4-, 5-, 6-, 7-, 8- або 9бензоксапиніл, 2-, 4-, 5-, 6-, 7- або 8-бензоксазиніл, 1-, 2-, 3-, 5-, 6-, 7-, 8-, 9-, 10- або 11-1Hпіроло[1,2-b][2]-бензазапиніл. Типові анельовані гетероарильні групи включають, але не обмежуються цим, 2-, 3-, 4-, 5-, 6-, 7- або 8-хінолініл, 1-, 3-, 4-, 5-, 6-, 7- або 8-ізохінолініл, 2-, 3-, 4-, 5-, 6- або 7-індоліл, 2-, 3-, 4-, 5-, 6- або 7-бензо[b]тієніл, 2-, 4-, 5-, 6- або 7-бензоксазоліл, 2-, 4-, 5-, 6- або 7-бензімідазоліл, 2-, 4-, 5-, 6- або 7-бензотіазоліл. Для гетероциклічних груп, що містять сульфур, також включеним є окиснений сульфур, такий як SO або SO2 групи. Для гетероциклічних груп, що містять нітроген, також включеним є нітрогенні групи, такі як N→O або NH. В кожному випадку, Het необов'язково є заміщеним одним-трьома OH, галогеном, -CN, -NO2, C1-6алкілом, -C3-6циклоалкілом, оксо (=O), -NH2, -NHC1-4алкілом, -N(C1-4алкіл)2, -OC1-4алкілом, SH, -SC1-4алкілом, -S(C=O)C1-4алкілом, -SONC1-4алкілом, -C(=O)C1-4 алкілом, -C(=O)NH2, -C(=O)NHC1-4алкілом, -C(=O)N(C1-4алкіл)2, -NC(=O)NH2, -NC(=O)NHC1-4алкілом або NC(=O)N(C14алкіл)2. Термін "ссавець" стосується людини або тварин, включаючи свійські та хатні тварини. Фраза "хатня тварина" або "хатні тварини" стосується тварин, яких тримають як улюбленців. Приклади хатніх тварин включають котів, собак та коней. Термін "свійська тварина" стосується тварин, які вирощують або розводять у сільському господарстві для виготовлення продукції, такої як продукти харчування або волокно, або для того, щоб вони працювали. В деяких варіантах втілення, свійські тварини є прийнятними для споживання тваринами, наприклад, людьми. Приклади свійських тварин включають ссавців, таких як велика рогата худоба, кози, коні, свині, вівці, у тому числі ягнята, та кролі, а також птахи, такі як кури, качки та індики. Зокрема, свійські тварини за представленим винаходом стосуються великої рогатої худоби та свиней. Сполуки за представленим винаходом, крім того, можуть бути прийнятними в рибному господарстві, наприклад, для риб. Термін "контролювання", "лікувати" або "лікування" захворювання включає: (1) попередження захворювання, тобто виникнення клінічних симптомів або ознак захворювання, які розвиваються у ссавця, що можуть піддаватися дії або бути схильними до захворювання, але ще не відчувають або демострують симптоми/ознаки захворювання; (2) інгібування 3 UA 110436 C2 5 10 15 20 25 30 35 40 45 50 55 60 захворювання, тобто, затримування або зменшення розвитку захворювання або його клінічних симптомів/ознак; або (3) послаблення захворювання, тобто, виникнення ремісії захворювання або послаблення його клінічних симптомів/ознак. Термін "терапевтично ефективна кількість" означає кількість сполуки, яка, коли її вводять ссавцю для лікування захворювання, є достатньою для ефекту такого лікування для захворювання. "Терапевтично ефективна кількість" буде варіювати в залежності від сполуки, захворювання та його тяжкості, та віку, ваги, тощо, ссавця, якого лікують. Термін "фармацевтично прийнятний" означає прийнятний для застосування у ссавців, хатнії тварин або свійських тварин. Термін "проліки" стосується біо-оборотної похідної молекули, тобто сполуки формули I за представленим винаходом. Проліки можуть змінювати розчинність, ліпофільність та in-vivo розподілення лікарського засобу. Шляхом навмисної зміни даних ключових властивостей, можливим може бути покращення абсорбції, збільшення часу до початку захворювання, зниження ефекту першого проходження, що дозволяє розвиток водних IV композицій та досягнення цільової доставки. До того ж, проліки є прийнятними для покращення трансдермальної доставки, маскування смаку, зведення до мінімуму болю при ін'єкції, покращення стабільності, тощо. В ситуаціях, коли сам фармакофор призводить до погіршення властивостей доставки, проліки є однією з декількох стратегій, які можуть застосовувати, щоб врятувати високо активну сполуку. Включеними в межі обсягу представленого винаходу є всі проліки сполук формули I, які можуть бути одержані за стандартними способами, відомими кваліфікованому фахівцю в даній галузі з рівня техніки. проліки сполук формули I можуть одержувати за наступними способами, описаними в "Prodrugs of phosphates, phosphonates, and phosphinates, ” Krise JP, Stella VJ, Advanced Drug Delivery Reviews, 19: (2) 287-310 MAY 22 1996; "Targeted Prodrug Design to Optimize Drug Delivery". Hyo-Kyung Han and Gordon Амідоn, AAPS PharmSci 2000; 2 (1) article 6; "Prodrugs", L. Prokai and K. Prokai-Tatrai, Chapter 12 in Injectable Drug Development: Techniques to Reduce Pain and Irritation, Interpharm Press, Buffalo Grove, IN, 1999; "Improved oral drug delivery: Solubility limitations overcome by the use of prodrugs", Fleisher D, Bong R, Stewart BH, Advanced Drug Delivery Reviews, 19: (2) 115-130 MAY 22 1996; або "Preparation and hydrolysis of water soluble, non-irritating prodrugs of pharmaceuticals with oxaalkanoic acids", Crooks, Peter Anthony; Cynkowski, Tadeusz; Cynkowska, Grazyna; Guo, Hong; Ashton, Paul, PCT Int. Appl. (2000), 65 pp. Приклади представлених проліків включають фосфати, фосфонати, фосфінати, естери карбонової кислоти і карбамати. Сполуки, які мають таку ж молекулярну формулу, але відрізняються за природою, або послідовностю зв'язування їх атомів, або розташування їх атомів в просторі, називаються "ізомерами". Включеними в межі обсягу описаних сполук є всі ізомери (наприклад, цис-, транс-, енантіомери або діастереомери) сполук, описані в даному документі самостійно, а також як бідь-які суміші. Всі дані форми, включаючи енантіомери, діастереомери, цис, транс, син, анти, сольвати (включаючи гідрати), таутомери та їх суміші, є включеними в описані сполуки. Конкретним значенням для W є H, -PO(OH)2 або -CH2OPO(OH)2. Конкретним значенням для W є H. Конкретним значенням для X та Y є хлором; та Z є H. Конкретним значенням для X та Y є флуором; та Z є H. Конкретним значенням для Het фрагмента є 5- або 6-членна циклічна кільцева система, що має від одного до трьох гетероатомів, вибраних з N, O та S, включаючи гетероатомні групи, такі 6 як S-O, -SO2, N→O і -NH. Het фрагмент необов'язково є заміщеним R . Конкретним значенням для Het фрагмента є піридиніл, тіофеніл, тіазоліл, тіадіазоліл, імідазоліл, оксадіазоліл, піримідиніл, піразиніл, ізоксазол, ізотіазол або піридазин. Конкретним значенням для Het фрагмента є піридиніл або тіазоліл. 1 2 1 2 Конкретними значеннями для R і R незалежно є H, або R і R є взяті разом з нітрогеном, до якого вони є приєднаними, утворюють 4- - 6-членний гетероциклічний кільцевий фрагмент, який необов'язково має додатковий один - два гетеро атоми, вибрані з групи, що складається з 6 N, S та O, де гетероциклічне кільце необов'язково є заміщеним R . 1 2 Конкретними значеннями для кожного R і R є H. 3 4 3 4 Конкретними значеннями для R і R незалежно є H або C1-4алкіл, або R і R є взяті разом, утворюючи C3-6циклоалкіл. 3 4 Конкретними значеннями для R і R є взяті разом, утворюючи циклопропіл. Конкретні значення для сполук за представленим винаходом включають ті, в яких W є H, PO(OH)2 або -CH2OPO(OH)2; Het фрагмент є 5- або 6-членною циклічною кільцевою системою, 6 що має від одного до трьох гетероатомів, вибраних з N, O та S, необов'язково заміщеною R ; 4 UA 110436 C2 1 5 10 15 20 25 30 35 40 45 50 55 60 2 3 4 3 4 кожен R і R є H; -R і R незалежно є H або C1-4алкілом, або R і R є взяті разом, утворюючи циклопропіл; та X, Y і Z незалежно є H, хлором або флуором. 3 4 Конкретними значеннями для R і R , що взяті разом з одним або двома гетероатомами, вибраними з групи, що складається з N, S і O, є утворення 4- - 6-членного гетероциклічного 6 кільцевого фрагменту, де гетероциклічне кільце необов'язково є заміщеним одним - трьома R . 3 4 Конкретними значеннями для R і R є такі, що взяті разом з атомом оксигену, утворюють оксетаніл. Конкретні значення для сполуки за представленим винаходом включають ті, в яких W є H або -PO(OH)2; Het фрагмент є 5- або 6-членною циклічною кільцевою системою, що має від 6 1 2 одного до трьох гетероатомів, вибраних з N, O та S, необов'язково заміщеною R ; кожен R і R 3 4 є H; R і R є взяті разом атомом оксигену, утворюючи оксетаніл; та X, Y і Z незалежно є H, хлором або флуором. 2 3 Конкретними значеннями для R та R , що взяті разом з атомом нітрогену, до якого вони є приєднаними, є такими, що утворюють азетидиніл. Конкретні значення для сполуки за представленим винаходом включають ті, в яких W є H або -PO(OH)2; Het фрагмент є 5- або 6-членною циклічною кільцевою системою, що має від 6 1 4 одного до трьох гетероатомів, вибраних з N, O і S, необов'язково заміщеною R ; кожен R і R є 2 3 H; R і R є взяті разом з атомом нітрогену, до якого вони є приєднаними, утворюючи азетидиніл; та X, Y і Z незалежно є H, хлором або флуором. 1 3 Конкретними значеннями для R і R , що взяті разом з атомом нітрогену, до якого вони є приєднаними, є ті, що утворюють піролідиніл. Конкретні значення для сполуки за представленим винаходом включають ті, в яких W є H або -PO(OH)2; Het фрагмент є 5- або 6-членною циклічною кільцевою системою, що має від 6 2 4 одного до трьох гетероатомів, вибраних з N, O і S, необов'язково заміщеною R ; кожен R і R є 1 3 H; R і R є взяті разом з атомом нітрогену, до якого вони є приєднаними, утворюючи піролідиніл; та X, Y і Z незалежно є H, хлором або флуором. Приклади сполук за представленим винаходом включають наступні: N-((1R, 2S)-1-(4-(2-(1-аміноетил)тіазол-5-іл)феніл)-3-флуор-1-гідроксипропан-2-іл)-2,2дифлуорацетамід; N-((1R, 2S)-1-(4-(2-(1-аміноетил)тіазол-5-іл)феніл)-3-флуор-1-гідроксипропан-2-іл)-2,2дихлорацетамід; (1R, 2S)-1-(4-(2-(1-аміноетил)тіазол-5-іл)феніл)-2-(2,2-дихлорацетамід)-3-флуорпропілу натрію гідрогенфосфат; (1R, 2S)-1-(4-(2-(1-аміноетил)тіазол-5-іл)феніл)-2-(2,2-дихлорацетамід)-3-флуорпропілу дигідрогенфосфат; (1R, 2S)-1-(4-(2-(1-аміноетил)тіазол-5-іл)феніл)-2-(2,2-дифлуорацетамід)-3-флуорпропілу натрію гідрогенфосфат; (1R, 2S)-1-(4-(2-(1-аміноетил)тіазол-5-іл)феніл)-2-(2,2-дифлуорацетамід)-3-флуорпропілу дигідрогенфосфат; N-((1R, 2S)-1-(4-(6-(1-аміноциклопропіл)піридин-3-іл)феніл)-3-флуор-1-гідроксипропан-2-іл)2,2-дифлуорацетамід; N-((1R, 2S)-1-(4-(6-(1-аміноциклопропіл)піридин-3-іл)феніл)-3-флуор-1-гідроксипропан-2-іл)2,2-дихлорацетамід; (1R, 2S)-1-(4-(6-(1-аміноциклопропіл)піридин-3-іл)феніл)-2-(2,2-дихлор-ацетамід)-3флуорпропілу натрію гідрогенфосфат; (1R, 2S)-1-(4-(6-(1-аміноциклопропіл)піридин-3-іл)феніл)-2-(2,2-дихлор-ацетамід)-3флуорпропілу дигідрогенфосфат; (1R, 2S)-1-(4-(6-(1-аміноциклопропіл)піридин-3-іл)феніл)-2-(2,2-дифлуор-ацетамід)-3флуорпропілу натрію гідрогенфосфат; (1R, 2S)-1-(4-(6-(1-аміноциклопропіл)піридин-3-іл)феніл)-2-(2,2-дифлуор-ацетамід)-3флуорпропілу дигідрогенфосфат; N-((1R, 2S)-1-(4-(6-((RS)-1-аміноетил)піридин-3-іл)феніл)-3-флуор-1-гідроксипропан-2-іл)-2,2дифлуорацетамід; N-((1R, 2S)-1-(4-(6-(1-аміноетил)піридин-3-іл)феніл)-3-флуор-1-гідроксипропан-2-іл)-2,2дихлорацетамід; (1R, 2S)-1-(4-(6-(1-аміноетил)піридин-3-іл)феніл)-2-(2,2-дихлорацетамід)-3-флуорпропілу натрію гідрогенфосфат; (1R, 2S)-1-(4-(6-(1-аміноетил)піридин-3-іл)феніл)-2-(2,2-дихлорацетамід)-3-флуорпропілу дигідрогенфосфат; (1R, 2S)-1-(4-(6-(1-аміноетил)піридин-3-іл)феніл)-2-(2,2-дифлуорацетамід)-3-флуорпропілу 5 UA 110436 C2 5 10 15 20 25 30 натрію гідрогенфосфат; (1R, 2S)-1-(4-(6-(1-аміноетил)піридин-3-іл)феніл)-2-(2,2-дифлуорацетамід)-3-флуорпропілу дигідрогенфосфат; N-((1R, 2S)-1-(4-(6-(азетидин-2-іл)піридин-3-іл)феніл)-3-флуор-1-гідроксипропан-2-іл)-2,2дифлуорацетамід; N-((1R, 2S)-1-(4-(6-(азетидин-2-іл)піридин-3-іл)феніл)-3-флуор-1-гідроксипропан-2-іл)-2,2дихлорацетамід; (1R, 2S)-1-(4-(6-(азетидин-2-іл)піридин-3-іл)феніл)-2-(2,2-дифлуорацетамід)-3-флуорпропілу дигідрогенфосфат; (1R, 2S)-1-(4-(6-(азетидин-2-іл)піридин-3-іл)феніл)-2-(2,2-дихлорацетамід)-3-флуорпропілу дигідрогенфосфат; N-((1R, 2S)-1-(4-(6-(3-амінооксетан-3-іл)піридин-3-іл)феніл)-3-флуор-1-гідроксипропан-2-іл)2,2-дифлуорацетамід; (1R, 2S)-1-(4-(6-(3-амінооксетан-3-іл)піридин-3-іл)феніл)-2-(2,2-дифлуор-ацетамід)-3флуорпропілу дигідрогенфосфат; (1R, 2S)-1-(4-(6-(3-амінооксетан-3-іл)піридин-3-іл)феніл)-2-(2,2-дихлор-ацетамід)-3флуорпропілу дигідрогенфосфат; N-((1R, 2S)-1-(4-(6-(3-амінооксетан-3-іл)піридин-3-іл)феніл)-3-флуор-1-гідроксипропан-2-іл)2,2-дихлорацетамід; 2,2-дихлор-N-{(1S, 2R)-1-(флуорметил)-2-гідрокси-2-[4-(6-піролідин-2-ілпіридин-3іл)феніл]етил}ацетамід; (1R, 2S)-2-(2,2-дихлорацетамід)-3-флуор-1-(4-(6-(піролідин-2-іл)піридин-3-іл)феніл)пропілу дигідрогенфосфат; 2,2-дифлуор-N-{(1S, 2R)-1-флуорметил-2-гідрокси-2-[4-(6-піролідин-2-ілпіридин-3іл)феніл]етил}ацетамід; та (1R, 2S)-2-(2,2-дифлуорацетамід)-3-флуор-1-(4-(6-(піролідин-2-іл)піридин-3-іл)феніл)пропілу дигідрогенфосфат. Крім того, прикладом сполуки за представленим винаходом є N-((1R, 2S)-3-флуор-1гідрокси-1-(4-(6-(метилсульфонамідометил)піридин-3-іл)феніл)пропан-2-іл)метансульфонамід. Наступні схеми реакції ілюструють загальні способи синтезу сполук за представленим винаходом. Всі вихідні речовини одержують за способами, описаними на даних схемах, або за способами, відомими кваліфікованому фахівцю в даній галузі з рівня техніки. Схема I O OH O N H N O I F I F 2 O O 1 Br Het O O N O N O N 4 O O B O O F F Het 5 3 R1 R2 N Br Het N 8 O O N O N O R1 R2 N F F Het Het H 2N 7 OH R1 R2 N 35 O O X H N 6 Z Y O F Het 9 Як показано на схемі I, сполуку структуру (2) можуть одержувати з трет-бутил 3-флуор-1гідрокси-1-(4-йодфеніл)пропан-2-іл)карбамату (1) в присутності прийнятного реагенту 6 UA 110436 C2 5 10 15 20 25 30 кеталізації, такого як 2-метоксипропен, та слабкої органічної кислоти, такої як паратолуолсульфонова кислота, при температурі, що знаходиться в діапазоні від 0 °C до температури кипіння в полярних органічних розчинниках, таких як дихлорметан. Сполуку структури (3) можуть одержувати шляхом сполучення прийнятного реагенту борування, такого як біс(пінаколато)диборон, застосовуючи каталітичні кількості паладієвого каталізатору, такого як біс(трифенілфосфін)паладію(ii) хлорид або паладію тетратрифеніл-фосфін в присутності прийнятної основи, такої як ацетат калія, в полярних апротонних розчинниках, таких як 1,4діоксан або ТГФ при температурах, що знаходяться в діапазоні від кімнатної температури до температури кипіння. Сполуку структури (5) можуть одержувати шляхом застосування процесу сполучення, який каталізується паладієм, такий як Сузукі сполучення між прийнятним гетероарилгалогенідом (4) та бороновим естером (3), застосовуючи паладієвий каталізатор, такий як паладію тетратрифенілфосфін в присутності прийнятної основи, такої як карбонат калію або натрію бікарбонат в прийнятній двофазній суміші розчинників, такій як толуол та вода при температурах, що знаходяться в діапазоні від кімнатної температури до температури кипіння. Сполуку структури (6) можуть одержувати зі сполуки структури (5) за реакцією з прийнятним відновлюючим реагентом, таким як паладій на вугіллі або суміш боргідрид натріюу з хлоридом нікелю в прийнятному протонному розчиннику, такому як метанол або ізопропіловий спирт, при температурі, що знаходиться в діапазоні від 0 °C до температури кіпіння. Сполуку структури (7) можуть одержувати конденсацією з відповідним агентом, таким як сульфуючий реагент, наприклад, мезилхлорид, або етансульфонілхлорид, або метансульфоновий ангідрид, в присутності прийнятної органічної основи, такої як ДІПЕА або триетиламін, в прийнятному розчиннику, такому як дихлорметан або ТГФ, при температурах що знаходиться в діапазоні від -78 °C до кімнатної температури. Альтернативно, сполуку структури (7) можуть одержувати безпосереднім сполученням відповідного агенту, такого як сульфонамід (8) з бороновим естером структури (3), застосовуючи паладієвий каталізатор, такий як паладію тетратрифенілфосфін, в присутності прийнятної основи, такої як карбонат калію або натрію бікарбонат, в прийнятній двофазній суміші розчинників, такій як толуол та вода, при температурах, що знаходяться в діапазоні від кімнатної температури до температури кипіння. 1 Застосування альтернативного способу, крім того, передбачає сполуку структури (6), в якій R і 2 R незалежно є гідрогенами. Сполуку структури (9) можуть одержувати обробкою сполуки структури (7) прийнятною органічною кислотою, такою як трифлуороцтова кислота, в прийнятному полярному розчиннику, такому як дихлорметан або 1,2-дихлоретан, при температурах, що знаходяться в діапазоні від 0 °C до кімнатної температури. Схема II O B F F + O Het N OH OH NH2 NH2 I Het 11 10 12 N OH OH F O HN Het X N 35 40 45 Z F O HN Y H2N 13 Het X Z Y 14 За схемою II, сполуку структури (12) можуть одержувати з арилгалогеніду (11) та прийнятного боронового естеру (10), застосовуючи паладієвий каталізатор, такий як паладію тетратрифенілфосфін, в присутності прийнятної основи, такої як карбонат калію або бікарбонат натрію, в прийнятній двофазній суміші розчинників, такій як толуол і вода, при температурах, що знаходяться в діапазоні від кімнатної температури до температури кипіння. Сполуку структури (13) можуть одержувати конденсацією аміну (12) з прийнятним ацилюючим агентом, таким як дихлорацетилхлорид або етилдифлуорацетат, в присутності прийнятної основи, такої як триетиламін або ДІПЕА, в прийнятному полярному протонному розчиннику, такому як метанол, або відповідному полярному розчиннику, такому як дихлорметан. Сполуку структури (14) можуть одержувати зі сполуки структури (13) за реакцією з прийнятним відновлюючим реагентом, таким як паладій на вугіллі або суміш боргідрид натріюу з хлоридом нікелю, в прийнятному протонному розчиннику, такому як метанол або ізопропіловий спирт, при температурі, що знаходиться в діапазоні від 0 °C до температури кіпіння. 7 UA 110436 C2 Схема III OH Br OH HN X Sn 1 R Z O 25 30 35 40 45 X Z Y 17 OH OH HN N F O X Y Z F O HN Het 9 20 Het H N O Br R2 15 16 Het N R1 10 HN O 20 5 F O Het Y 15 R2 H N O F O H2N Het X 18 Z Y За схемою III, сполуку структури (17) можуть одержувати, використовуючи сполучення Стілле станану стркутури (15) з арилгалогенідом стркутури (16), застосовуючи паладієвий каталізатор, такий як три(дибензиліденацетон)дипаладію або біс(трифенілфосфін)паладію(ii) хлорид, та необов'язково з прийнятним фосфіновим лігандом, таким як три(2-фурил)фосфін, разом з прийнятною металгалогенідною добавкою, такою як хлорид літію або флуорид цезію, у відповідному полярному апротонному розчиннику, такому як NMP або ДМФ, при температурах, що знаходиться в діапазоні від кімнатної температури до 120 °C. Сполуку структури (18) можуть одержувати обробкою сполуки структури (17) з прийнятною органічною кислотою, такою як трифлуороцтова кислота, в прийнятному розчиннику, такому як ДХМ або 1,2-дихлоретан, при температурах, що знаходяться в діапазоні від 0 °C до кімнатної температури. Сполуку структури (9) можуть одержувати зі сполуки структури (18) конденсацією з відповідним агентом, таким як сульфуючий реагент, наприклад, метилхлорид, або етансульфонілхлорид, або метансульфоновий ангідрид, в присутності прийнятної органічної основи, такої як ДІПЕА або триетиламін, в прийнятному розчиннику, такому як дихлорметан або ТГФ, при температурах, що знаходяться в діапазоні від -78 °C до кімнатної температури. Альтернативно, сполуку структури (9) можуть одержувати безпосереднім сполученням арилгалогенід сульфонамідом (20) з бороновим естером станану (15), паладієвим каталізатором, таким як три(дибензиліденацетон)дипаладій або біс(трифенілфосфін)паладію(ii) хлорид, та необов'язково прийнятним фосфіновим лігандом, таким як три(2-фурил)фосфін разом з прийнятною металгалогенідною добавкою, такою як хлорид літію або флуорид цезію, у відповідному полярному апротонному розчиннику, такому як NMP або ДМФ, при температурах, що знаходяться в діапазоні від кімнатної температури до 120 °C. Фармацевтичні солі Сполуку формули I можуть застосовувати в її природній формі або як сіль. У випадках, коли утворення стабільної нетоксичної кислотної або основної солі є бажаним, то відповідним може бути введення сполуки у вигляді фармацевтично прийнятної солі. Фармацевтично прийнятні солі сполук формули I включають ацетатні, аскорбатні, аспартатні, бензоатні, безилатні, бікарбонатні/карбонатні, бісульфатні/ сульфатні, боратні, камзилатні, цитратні, едизілатні, етоглутаратні, езилатні, форміатні, фумаратні, глюцептатні, глюконатні, глюкуронатні, гліцерофосфатні, гексафлуо-фосфатні, гібензaтні, гідрохлоридні/хлоридні, гідробромідні/бромідні, гідройодидні/ йодидні, ізетіонатні, лактатні, малатні, малеатні, малонатні, мезилатні, метилсульфатні, нафтилатні, 2-напсилатні, нікотинатні, нітратні, оротатні, оксалатні, пальмітатні, памоатні, фосфатні/гідрогенфосфатні/дигідрогенфосфатні, сахаратні, стеаратні, сукцинатні, тартратні, тозилатні та трифлуорацетатні солі. Композиція/Склад Фармацевтичні композиції за представленим винаходом можуть виготовляти за способами добре відомими в даній галузі з рівня техніки, наприклад, шляхом традиційних способів змішування, розчинення, гранулювання, виготовлення драже, розтирання в порошок, емульгування, капсулювання, включення, ліофілізування або висушування при розпиленні. Фармацевтичні композиції для застосування у відповідності з представленим винаходом можуть формулювати за загальноприйнятим способом, застосовуючи один або більше фармацевтично прийнятних носіїв, що включають ексципієнти та допоміжні речовини, які полегшують технологію введення активної сполуки в препарати, які можуть застосовувати фармацевтично. Прийнятний склад буде залежати від вибраного шляху введення. 8 UA 110436 C2 5 10 15 20 25 30 35 40 45 50 55 Фармацевтично прийнятні ексципієнти та носії є загально відомими кваліфікованому фахівцю в даній галузі та є, таким чином, включеними в даний винахід. Такі ексципієнти та носії є описаними, наприклад, в "Remington's Pharmaceutical Sciences", Mack Pub. Co., New Jersey (1991). Композиції за винаходом можуть бути призначеними для короткої дії, швидкого вивільнення, тривалої дії, подовженого вивільнення або контрольованого вивільнення. Зокрема, композиція за винаходом може представляти собою форму подовженого вивільнення. Таким чином, фармацевтичні композиції, крім того, можуть бути сформульованими для контрольованого вивільнення або для уповільненого вивільнення. Дозування Фармацевтичні композиції прийнятні для застосування в представленому винаході включають композиції, в яких активні інгредієнти знаходяться в кількості достатній, щоб досягти передбачену мету, тобто, контролю або лікування інфекцій. Більш конкретно, терапевтично ефективна кількість означає кількість сполуки, ефективну для попередження, зменшення або покращення симптомів/ознак інфекцій або подовження виживаності суб'єкта, якого піддають лікуванню. Кількість активного компонента, який є сполукою за даним винаходом, в фармацевтичній композиції та її одиничній дозованій формі, можуть варіювати або регулювати в широкому діапазоні в залежності від способу введення, активності конкретної сполуки та бажаної концентрації. Визначення терапевтично ефективної кількості знаходиться в межах можливостей кваліфікованих фахівців в даній галузі. Зазвичай, кількість активного компонента буде знаходитись в діапазоні від 0,01 % до 99 % за масоб композиції. Зазвичай, терапевтично ефективна кількість дозування активного компонента буде знаходитись в діапазоні від приблизно 0,1 мг до приблизно 100 мг/кг маси тіла/день; наприклад, від приблизно 0,1 до приблизно 50 мг/кг маси тіла/день; та, наприклад, від приблизно 5 до приблизно 50 мг/кг маси тіла/день; та, наприклад, від приблизно 20 до приблизно 50 мг/кг маси тіла/день. Слід розуміти, що дозування можуть варіювати в залежності від потреб кожного суб'єкта та тяжкості інжекцій. Потрібна доза зручно може бути представлена в одиничній дозі або як розділені дози, які вводять у відповідні інтервали часу, наприклад, як дві, три, чотири або більше суб-доз на день. Крім того, слід розуміти, що початкова доза, яку вводять, може бути збільшеною вище зазначеного верхнього рівня для того, щоб швидко досягти потрібної концентрації в плазмі. З іншого боку, початкова доза може бути меншою, ніж оптимальна та денну дозу можуть прогресивно збільшувати під час курсу лікування в залежності від конкретної ситуації. Якщо потрібно, денна доза, крім того, може бути розділеною на декілька доз для введення, наприклад, від двох до чотирьох разів на день. Медичне та ветеринарне застосування Сполуки за представленим винаходом представляють собою нові фенікольні антибактеріальні агенти для лікування бичачих респіраторних інфекційних захворювань у великої рогатої худоби, викликаних грамнегативними респіраторними патогенами, такими як M. haemolytica, P. multocida, H. somnus та M. bovis. Антибактеріальні аналізи Сполуки за представленим винаходом досліджують проти ряду грамнегативних та грампозитивних організмів, застосовуючи промислові стандартні способи, описані в M31-A3. Характеристичні стандарти для антимікробного диска та розбавлений тест антимікробної чутливості для бактерій, виділених з тварин; Інститут клінічних та лабораторних стандартів, затверджений стандарт – третє видання. Сполуки за представленим винаходом демонструть дуже гарну антибактеріальну активність проти BRD патогенів, наприклад, M. haemolytica, P. multo., H. somnus та M. bovis. Приклади Синтез сполук за представленим винаходом далі ілюструється наступними прикладами. Вихідні речовини та різні проміжні сполуки, які застосовують в прикладах, можуть одержувати з комерційних джерел, або легко одержують з комерційно доступних органічних сполук, застосовуючи добре відомі способи кваліфікованому фахівцю в даній галузі з рівня техніки. Приклад 1 Одержання N-((1R, 2S)-1-(4-(6-(амінометил)піридин-3-іл)феніл)-3-флуор-1гідроксипропан-2-іл)-2,2-дихлорацетаміду Стадія 1 Одержання 5-(4-((1R, 2S)-2-аміно-3-флуор-1-гідроксипропіл)феніл) піколінонітрилу 9 UA 110436 C2 5 10 15 20 25 30 35 40 До розчину комерційно доступного 5-(4,4,5,5-тетраметил-1,3,2-діоксаборолан-2іл)піколінонітрилу (0,5 г, 2,17 ммоль) в дегазованому діметоксіетані (10 мл) та воді (3мл) додають (1R, 2S)-2-аміно-3-флуор-1-(4-йодфеніл)пропан-1-ол (0,65 г, 2,20 ммоль) та Cs2CO3 (2,15 г, 6,6ммоль). Pd(PPh3)4 (0,25 г, 0,21ммоль) додають, та реакційну суміш нагрівають до 90 °C протягом 1,5 години. Розчинник випаровують в вакуумі, та сиру речовину очищають, застосовуючи колоночну хроматографію на силікагелі, елююючи сумішшю метанол/CHCl 3, одержуючи названу сполуку (206 мг): 1ЯМР (400 МГц, CDCl3) : 3,09-3,18 (м, 1H), 3,48 (с, 1H), 4,24 – 4,28 (м, 0,5H), 4,36 – 4,41 (м, 1H), 4,49 – 4,52 (м, 0,5H), 4,64 (д, J=6,16 Гц, 1H), 7,53 (д, J=8,16 Гц, 2H), 7,59 (д, J=8,24 Гц, 2H), 7,76 (д, J=8,2, 1H), 8,0 (дд, J1=8,16 Гц, J2=2,32 Гц, 1H), 8,93 (д, J=1,76 Гц, 1H). m/z (CI) 272 [M+H]. Стадія 2 Одержання 2,2-дихлор-N-((1R, 2S)-1-(4-(6-ціанопіридин-3-іл)феніл)-3-флуор-1гідроксипропан-2-іл)ацетаміду До розчину 5-(4-((1R, 2S)-2-аміно-3-флуор-1-гідроксипропіл)феніл)піколіно-нітрилу (0,5 г, 1,1ммоль) в метанолі (5 мл) додають триетиламін (0,22 г, 2,2 ммоль) та етилдихлорацетат (0,34 г, 2,2ммоль) та реакційну суміш перемішують при кімнатній температурі протягом 16 годин. Розчинник випаровують в вакуумі, та сиру речовину очищають, застосовуючи колоночну хроматографію на силікагелі, застосовуючи метанол/CH2Cl2, одержуючи названу сполуку (264 1 мг): H ЯМР (400 МГц, CDCl3) : 4,26 – 4,35 (м, 1H), 4,36 – 4,37 (м, 0,5H), 4,45 – 4,51 (м, 1H), 4,59 – 4,63 (м, 0,5H), 5,02 (д, J=3,28 Гц, 1H), 5,84 (с, 1H), 7,47 (д, J=8,2 Гц, 2H), 7,54 (д, J=8,24 Гц, 2H), 7,76 (д, J=8,04 Гц, 1H), 7,96 (дд, J1=8,08 Гц, J2=2,2 Гц, 1H), 8,85 (д, J=1,64 Гц, 1H). m/z (CI) 380 [M+H]. Стадія 3 Одержання N-((1R, 2S)-1-(4-(6-(амінометил)піридин-3-іл)феніл)-3-флуор-1гідроксипропан-2-іл)-2,2-дихлорацетаміду До крижано холодного розчину літію алюмогідриду (0,048 г, 1,33 ммоль, 4,0 екв.) в тетрагідрофурані (10мл) при -40 °C додають розчин 2,2-дихлор-N-((1R, 2S)-1-(4-(6-ціанопіридин3-іл)феніл)-3-флуор-1-гідроксипропан-2-іл)ацетаміду (0,13 г, 0,34 ммоль) в тетрагідрофурані (5мл) при -40 °C. Потім тричі додають літію алюмогідрид (0,012 г, 0,33 ммоль), та реакційну суміш перемішують при -40 °C протягом 4 годин. Реакційну суміш гасять насиченим водним розчином натрію сульфату та перемішують протягом 15 хвилин з наступною фільтрацією. Фільтрат випаровують в вакуумі, та сиру речовину очищають, застосовуючи колоночну хроматографію на силікагелі, використовуючи метанол/CH 2Cl2 та аміак. До розчину сирого продукту в CH2Cl2 (5мл) додають трифлуороцтову кислоту (0,5мл), та реакційну суміш перемішують при кімнатній температурі протягом 15 хв. Розчинник відганяють в вакуумі, та залишок промивають діетиловим етером, та залишок розчиняють в 10 % метанолі в CH2Cl2 та випаровують досуха. Промивають н-пентаном та сушать в вакуумі, одержуючи названу сполуку 1 (20 мг): H ЯМР (400 МГц, CDCl3) :4,24 – 4,25 (м, 2H), 4,28 – 4,32 (м, 0,5H), 4,40 – 4,44 (м, 0,5H), 4,56 – 4,60 (м, 0,5H), 4,68 – 4,72 (м, 0,5H), 4,92 (шс, 1H), 6,02 (шс, 1H), 6,52 (с, 1H), 7,48 (д, J=8,28 Гц, 2H), 7,57 (д, J=10,8 Гц, 1H, ), 7,73 (д, J=8,04 Гц, 2H), 8,17 (дд, J1=2,28 Гц, J2=8,08 Гц, 1H), 8,28 (шс, 2H), 8,65 (д, J=8,84 Гц, 1H), 8,93 (д, 1H, J=2,2 Гц). m/z (CI) 386 [M+H]. Приклад 2 Одержання N-((1R, 2S)-1-(4-(5-(амінометил)тіофен-2-іл)феніл)-3-флуор-1 10 UA 110436 C2 гідроксипропан-2-іл)-2,2-дихлорацетаміду Стадія 1 Одержання трет-бутил ((5-(4-((1R, гідроксипропіл)феніл)тіофен-2-іл)метил)карбамату 5 10 15 20 25 30 35 2S)-2-(2,2-дихлорацетамід)-3-флуор-1 До розчину трет-бутил ((5-бромтіофен-2-іл)метил)карбамату (0,508 г, 1,74 ммоль) та 2,2дихлор-N-((1R, 2S)-3-флуор-1-гідрокси-1-(4-(триметилста-ніл)феніл)пропан-2-іл) ацетаміду (0,7 г, 1,58 ммоль) в толуолі (10 мл) додають флуорид цезію (0,478 г, 3,16 ммоль) та йодид купруму (30 мг, 0,158 ммоль) та дегазують азотом протягом 30 хвилин. До даної суміші додають Pd(PPh3)2Cl2 (0,11 г, 0,16 ммоль) та суміш нагрівають до 90 °C протягом 26 годин. Розчинник випаровують в вакуумі, одержуючи сирий продукт, який чистять, застосовуючи колоночну хроматографію на силікагелі, застосовуючи метанол в CH2Cl2, одержуючи названу сполуку (490 1 мг): H ЯМР (400 МГц, ДМСО-d6) :1,39 (с, 9H), 4,17– 4,29 (м, 3,5H), 4,37 – 4,41 (м, 0,5H), 4,54 – 4,57 (м, 0,5H), 4,65 – 4,69 (м, 0,5H), 4,84 (т, J=3,56 Гц, 1H), 5,95 (д, J=4,12 Гц, 1H), 6,50 (с, 1H), 6,88 (д, J=3,48 Гц, 1H), 7,29 – 7,37 (дд, J=8,2 Гц, J=3,6 Гц, 3H), 7,51 – 7,56 (д, J=8,04 Гц, 3H). m/z (CI) 489[M-H]. Стадія 2 Одержання N-((1R, 2S)-1-(4-(5-(амінометил)тіофен-2-іл)феніл)-3-флуор-1гідроксипропан-2-іл)-2,2-дихлорацетаміду До розчину трет-бутил ((5-(4-((1R, 2S)-2-(2,2-дихлорацетамід)-3-флуор-1-гідрокси пропіл)феніл)тіофен-2-іл)метил)карбамату (140 мг, 0,238ммоль) в CH2Cl2 (10 мл) додають трифлуороцтову кислоту (1,0 мл), та реакційну суміш перемішують при кімнатній температурі протягом 2 годин. Розчинник видаляють при зниженому тиску, та залишок промивають діетиловим етером, потім розчиняють в 10 % метанолі в CH2Cl2 та випаровують досуха. 1 Промивають н-пентаном та сушать в вакуумі, одержуючи названу сполуку (56 мг): H ЯМР (400 МГц, ДМСО-d6) : 4,19 – 4,21 (м, 1H), 4,24 – 4,26 (м, 2H), 4,29– 4,31 (м, 0,5H), 4,39 – 4,43 (м, 0,5H), 4,55 – 4,59 (м, 0,5H), 4,67 – 4,70 (м, 0,5H), 4,87(шс, 1H), 5,90 (шс, 1H) 6,50 (с, 1H), 7,20 (д, J=3,64 Гц, 1H), 7,39 (д, J=8,24 Гц, 2H), 7,43 (д, J=3,68 Гц, 1H), 7,57 (д, J=8,16 Гц, 2H), 8,20 (шс, 3H), 8,59 – 8,63 (м, 1H). m/z (CI) 388 [M-H]. Приклад 3 Одержання 2,2-дихлор-N-((1R, 2S)-3-флуор-1-гідрокси-1-(4-(5-(метил сульфонамідометил)тіофен-2-іл)феніл)пропан-2-іл)ацетаміду До суспензії N-((1R, 2S)-1-(4-(5-(амінометил)тіофен-2-іл)феніл)-3-флуор-1-гідрокси пропан-2іл)-2,2-дихлорацетаміду (150 мг, 0,383 ммоль) в дихлорметані додають триетиламін (160 мкл, 1,15 ммоль), потім метансульфонілхлорид (30 мкл, 0,383 ммоль). Одержаний в результаті жовтий розчин перемішують при кімнатній температурі протягом 30 хвилин. Реакційну суміш 1 концентрують, потім чистять, використовуючи ВЕРХ, одержуючи названу сполуку (99 мг): H ЯМР (400 МГц, ДМСО-d6): 8,58 (д, 1H), 7,71 (т, 1H), 7,55 (д, 2H), 7,37 (д, 2H), 7,33 (д, 2H), 7,01 (д, 1H), 6,51 (с, 1H), 5,95 (шс, 1H), 4,85 (д, 1H), 4,71-4,52 (м, 1H), 4,44-4,13 (м, 4H), 2,89 (с, 3H). 11 UA 110436 C2 Приклад 4 Одержання N-((1R, 2S)-1-(4-(2-(амінометил)тіазол-5-іл)феніл)-3-флуор-1гідроксипропан-2-іл)-2,2-дихлорацетаміду Стадія 1 Одержання трет-бутил ((5-(4-((1R, 2S)-2-(2,2-дихлорацетамід)-3-флуор-1гідроксипропіл)феніл)тіазол-2-іл)метил)карбамату 5 10 15 20 25 30 35 Дотримуючись загальної процедури з прикладу 2 - Стадії 1 та роблячи некритичні зміни, але використовуючи 2,2-дихлор-N-((1R, 2S)-3-флуор-1-гідрокси-1-(4-(три метил станіл)феніл)пропан-2-іл)ацетамід та трет-бутил ((5-бромтіазол-2-іл)метил)карбамат як вихідні 1 речовини, одержують названу сполуку (346 мг): H ЯМР (400 МГц, ДМСО-d6) 1,41 (с, 9H), 4,194,22 (м, 1H), 4,26-4,30 (м, 0,5H), 4,36-4,42 (м, 2,5H), 4,54-4,58 (м, 0,5H), 4,66-4,70 (м, 0,5H), 4,86 (т, J=3,4 Гц, 1H), 5,98 (д, J=4,16 Гц, 1H), 6,50 (с, 1H), 7,39 (д, J=8,2 Гц, 2H), 7,60 (д, J=8,0 Гц, 2H), 7,77-7,82 (м, 1H), 8,05 (с, 1H), 8,60 (д, J=8,8 Гц, 1H) m/z (CI) 492 [M+H]. Стадія 2 Одержання N-((1R, 2S)-1-(4-(2-(амінометил)тіазол-5-іл)феніл)-3-флуор-1гідроксипропан-2-іл)-2,2-дихлорацетаміду До розчину, що перемішують, продукту зі стадії 1, Прикладу 4 (0,248 г, 0,50 ммоль) в CHCl3 (10мл) додають трифлуороцтову кислоту (1,1 мл), та реакційну суміш перемішують при кімнатній температурі протягом 2 годин. Реакційну суміш концентрують в вакуумі, та залишок промивають діетиловим етером. Залишок розчиняють в 10 % метанолі в CH2Cl2 та випаровують 1 досуха, потім сушать в вакуумі, одержуючи названу сполуку H-ЯМР (400 МГц, ДМСО-d6) :4,204,22 (м, 1H), 4,28-32 (м, 0,5H), 4,40-4,49 (м, 2,5H), 4,56-4,60 (м, 0,5H), 467–4,71 (м, 0,5H), 4,89 (т, J=3,8 Гц, 1H), 6,02 (д, J=4,28 Гц, 1H), 6,50 (с, 1H), 7,43 (д, J=8,2 Гц, 2H), 7,62 (д, J=8,2 Гц, 2H), 8,28 (с, 1H), 8,48 (шс, 2H), 8,63 (д, J=9 Гц, 1H). m/z (CI) 392 [M-H]. Приклад 5 Одержання 2,2-дихлор-N-((1R, 2S)-3-флуор-1-гідрокси-1-(4-(6-(метил сульфонамідометил)піридин-3-іл)феніл)пропан-2-іл)ацетаміду N-((5-бромпіридин-2-іл)метил)метансульфонамід (раніше описаний в WO9528400) (240 мг, 0,90 ммоль) та 2,2-дихлор-N-((1R, 2S)-3-флуор-1-гідрокси-1-(4-(триметил станіл)феніл)пропан-2іл)ацетамід (400 мг, 0,90 ммоль) в 2-метилпіролідиноні (5 мл) обробляють хлоридом літію (115 мг, 2,7 ммоль) та дегазують та продувають азотом. додають біс(трифенілфосфін)паладію (ii) хлорид та суміш нагрівають при 100 °C протягом 3 годин. Суміш охолоджують, розбавляють водою та екстрагують етилацетатом, сушать над безводним сульфатом натрію, фільтрують, концентрують та очищають, застосовуючи хроматографію з оберненою фазою, одержуючи 1 названу сполуку (324 мг): H ЯМР (400 МГц, CDCl3) : 2,96 (с, 3H), 4,2-4,3 (м, 3H), 4,4 (м, 0,5H), 4,57 (м, 0,5 H), 4,58 (м, 0,5H), 4,70 (м, 0,5H), 4,90 (шс, 1H), 6,00 (с, 1H), 6,52 (с, 1H), 7,47 (д, 2H), 7,52, (д, 1H), 7,69 (д, 3H), 8,1 (м, 1H), 8,85 (м, 1H), 8,82 (шс, 1H). m/z (CI) 464. Приклад 6 Одержання N-((1R, 2S)-1-(4-(5-(амінометил)-1,3,4-тіадіазол-2-іл)феніл)-3-флуор1-гідроксипропан-2-іл)-2,2-дихлорацетаміду 12 UA 110436 C2 Стадія 1 Одержання 2-бром-5-(бромметил)-1,3,4-тіадіазолу 5 10 15 20 25 30 35 До розчину 2-бром-5-метил-1,3,4-тіадіазолу (0,50 г, 2,79 ммоль) в CCl4 (8мл) додають Nбромсукцинамід (0,543 г, 3,067 ммоль) та азобіс-ізобутиронітрил (0,022 г, 0,139 ммоль), та реакційну суміш нагрівають до 70 °C протягом 3 годин. Реакційну суміш охолоджують до 0 °C, та розчинник випаровують в вакуумі одержуючи сирий продукт, який чистять, застосовуючи колоночну хроматографію, елююючи 5 % етилацетатом в гексані, одержуючи дану названу 1 сполуку (0,150 г): H-ЯМР (400 МГц, CDCl3) 4,75(с, 2H). РХ-МС (m/z): [M+H] = 260,8. Стадія 2 Одержання (5-бром-1,3,4-тіадіазол-2-іл)метанаміну Газоподібний аміак барботують крізь розчин 2-бром-5-(бромметил)-1,3,4-тіадіазолу (0,6 г, 2,352 ммоль) в метанолі (15мл) протягом 15 хвилин. Реакційну суміш перемішують при кімнатній температурі протягом 5 годин. Реакційну суміш концентрують в вакуумі, та сушать, 1 одержуючи названу сполуку (0,47 г): HЯМР (400 МГц, ДМСО-d6) 5,14(с, 2H). РХ-МС (m/z): [M+H] = 193,90. Стадія 3 Одержання трет-бутил ((5-бром-1,3,4-тіадіазол-2-іл)метил)карбамату До розчину, що перемішують, (5-бром-1,3,4-тіадіазол-2-іл)метанаміну (0,425 г, 2,19 ммоль) в 1,4-діоксані (10мл) додають 10 % водний розчин K2CO3 (0,392 г, 2,84ммоль). Суміш охолоджують до 0 °C, та додають ди-трет-бутилдикарбонат (0,525 г, 2,40ммоль). Реакційну суміш перемішують протягом 3 годин. Реакційну суміш концентрують в вакуумі. Сиру речовину розбавляють водою та екстрагують етилацетатом. Органічний шар сушать над сульфатом натрію, концентрують та очищають, застосовуючи колоночну хроматографію на силікагелі, 1 елююючи 20 % етилацетатом в гексані, одержуючи названу сполуку (0,30 г): H-ЯМР (400 МГц, CDCl3) 1,45(с, 9H), 4,34-4,40 (шс, 1H), 4,66 (д, J=6,28 Гц, 2H), РХ-МС (m/z): [M+H] = 294. Стадія 4 Одержання трет-бутил ((5-(4-((1R, 2S)-2-(2,2-дихлорацетамід)-3-флуор-1гідроксипропіл)феніл)-1,3,4-тіадіазол-2-іл)метил)карбамату До розчину, що перемішують, трет-бутил ((5-бром-1,3,4-тіадіазол-2-іл)метил) карбамату (0,878 г, 2,98 ммоль) та 2,2-дихлор-N-((1R, 2S)-3-флуор-1-гідрокси-1-(4(триметилстаніл)феніл)пропан-2-іл)ацетаміду (1,20 г, 2,71ммоль) в диметилформаміді (20 мл) додають CsF (0,818 г, 5,42ммоль), потім CuI (0,051 г, 0,271ммоль). Одержану в результаті реакційну суміш дегазують азотом протягом 30 хвилин та додають Pd(PPh 3)4 (0,313 г, 0,271 ммоль). Реакційну суміш нагрівають до 90 °C протягом 5 годин. Реакційну суміш концентрують в вакуумі, одержуючи сирий продукт, який чистять, застосовуючи колоночну хроматографію на 1 силікагелі, елююючи 1 % метанолом в CH2Cl2, одержуючи названу сполуку (100 мг): H-ЯМР (400 МГц, ДМСО-d6) 1,40 (с, 9H), 4,24-4,26 (м, 1H), 4,29-4,33 (м, 0,5H), 4,41-4,45 (м, 0,5H), 4,52 13 UA 110436 C2 5 10 15 20 25 30 35 40 (д, J=5,96 Гц, 2H), 4,57-4,61 (м, 0,5H), 4,69-4,72 (м, 0,5H), 4,93 (т, J=3,76 Гц 1H), 6,08 (д, J=4,28 Гц, 1H), 6,49 (с, 1H), 7,51 (д, J=8,24 Гц, 2H), 7,86-7,90 (м, 3H), 8,63 (д, J=8,96 Гц, 1H). РХ-МС (m/z): [M-H] = 490,80. Стадія 5 Одержання N-((1R, 2S)-1-(4-(5-(амінометил)-1,3,4-тіадіазол-2-іл)феніл)-3-флуор-1гідроксипропан-2-іл)-2,2-дихлорацетаміду До розчину, що перемішують, трет-бутил ((5-(4-((1R, 2S)-2-(2,2-дихлорацетамід)-3-флуор-1гідроксипропіл)феніл)-1,3,4-тіадіазол-2-іл)метил)карбамату (100 мг, 0,203 ммоль) в CH2Cl2 (10мл) додають трифлуороцтову кислоту (1,0мл). Через 2 години реакційну суміш концентрують в вакуумі, та залишок промивають діетиловим етером. Залишок розчиняють в 10 % метанолі в CH2Cl2 та випаровують досуха, промивають н-пентаном, сушать в вакуумі, одержуючи названу 1 сполуку (108 мг): H-ЯМР (400 МГц, ДМСО-d6) 4,27-4,28 (м, 1H), 4,31-4,35 (м, 0,5H), 4,43-4,47 (м, 0,5H), 4,59-4,61 (м, 0,5H), 4,64 (с, 2H), 4,70-4,74 (м, 0,5H), 4,96(т, J=2,76 Гц, 1H), 6,10 (д, J=4,28 Гц, 1H), 6,48 (с, 1H), 7,54 (д, J=8,32 Гц, 2H), 7,94 (д, J=8,32 Гц, 2H), 8,60 (шс, 2H), 8,64 (д, J=9,12 Гц, 1H). РХ-МС (m/z): [M+H] = 393,10. Приклад 7 Одержання N-((1R, 2S)-1-(4-(6-((1H-імідазол-1-іл)метил)піридин-3-іл)феніл) -3флуор-1-гідроксипропан-2-іл)-2,2-дихлорацетаміду Дотримуючись загальної процедури прикладу 6 - стадії 4 та роблячи некритичні зміни, але використовуючи 2,2-дихлор-N-((1R, 2S)-3-флуор-1-гідрокси-1-(4-(триметил станіл)феніл)пропан2-іл)ацетамід та комерційно доступний 2-((1H-імідазол-1-іл)метил)-5-бромпіридин одержують 1 названу сполуку (20 мг): H-ЯМР (400 МГц, ДМСО-d6) 4,21-4,24 (м, 1H), 4,27-40,31 (м, 0,5H), 4,38-4,42 (м, 0,5H), 4,55-4,59 (м, 0,5H), 4,67-4,70 (м, 0,5H), 4,89 (т, J=3,6 Гц, 1H), 5,33 (с, 2H), 5,99 (д, J=4,16 Гц, 1H), 6,51 (с, 1H), 6,92 (с, 1H), 7,22 (т, J=3,84 Гц, 2H), 7,46 (д, J=8,2 Гц, 2H), 7,67 (д, J=8,28 Гц, 2H), 7,77 (с, 1H), 8,06-8,08 (д, д J=2,36 Гц, J=8,08 Гц, 1H), 8,63 (д, J=8,84 Гц, 1H), 8,84 (д, J=2,2 Гц, 1H). РХ-МС (m/z): [M+H] = 437,1. Приклад 8 Одержання N-((1R, 2S)-1-(4-(3-(амінометил)-1,2,4-оксадіазол-5-іл)феніл)-3-флуор1-гідроксипропан-2-іл)-2,2-дихлорацетамід Стадія 1 Одержання метил 4-((4S, 5R)-3-(2,2-дихлорацетил)-4-(флуорметил)-2,2диметилоксазолідин-5-іл)бензоату До колби, що містить 2,2-дихлор-1-((4S, 5R)-4-(флуорметил)-5-(4-йодфеніл)-2,2диметилоксазолідин-3-іл)етанон (2,0 г, 4,48ммоль), додають триетиламін (5мл) та метанол (5мл). Газоподібний моноксид карбону барботують крізь розчин, в той же час перемішуючи протягом 30 хв. Наступними додають Pd(OAc)2 (51 мг, 0,22ммоль) та Xantphos (132 мг, 0,22ммоль), та балон що містить монооксид карбону під'єднують на виході до колби. Реакційну суміш нагрівають протягом 2 годин при 60 C та потім охолоджують до кімнатної температури. Далі, реакційну суміш розбавляють водою, екстрагують етилацетатом, сушать над Na 2SO4, та концентрують в вакуумі. Залишок хроматографують на силікагелі, елююючи від 100 % гексанів 1 до 50:50 етилацетат:гексани, одержуючи названу сполуку (1,11 г): H ЯМР (400 МГц, CDCl3) 8,10 (д, 2H, J=8,0 Гц), 7,55 (д, 2H, J=8,0 Гц), 6,34 (м, 1H), 5,30-4,42 (м, 4H), 3,95 (с, 3H), 1,97-1,53 (м, 6H). m/z (CI) 320 [M-(CH3)2CO]. Стадія 2 Одержання 4-((4S, 5R)-3-(2,2-дихлорацетил)-4-(флуорметил)-2,2 14 UA 110436 C2 диметилоксазолідин-5-іл)бензойна кислота 5 10 15 20 25 30 35 До 5:1 (60мл) діоксан:вода розчину продукту зі стадії 1, Прикладу 8 (1,1 г, 2,9ммоль) додають гідроксид літію (212 мг, 8,9ммоль) та одержану в результаті суміш перемішують при кімнатній температурі протягом 18 годин. Далі, реакційну суміш охолоджують до 0C та додають 1N HCl (7,5мл) щоб нейтралізувати (pH~7). Реакційну суміш розподіляють між водою (50 мл) та CH2Cl2 (150 мл). Органічну фазу збирають, сушать над сульфатом натрію та концентрують, 1 одержуючи названу сполуку (979 мг): H ЯМР (400 МГц, ДМСО-d6) 7,98 (д, 2H, J=8,0 Гц), 7,60 (д, 2H, J=8,0 Гц), 5,28 (м, 1H), 4,96-4,81 (м, 2,5 H), 4,75-4,70 (м, 0,5H), 4,67-4,62 (м, 0,5H) 4,55-4,50 (м, 0,5H), 1,61 (с, 3H), 1,46 (с, 3H). Стадія 3 Одержання трет-бутил (5-(4-((4S, 5R)-3-(2,2-дихлорацетил)-4-(флуорметил)-2,2диметилоксазолідин-5-іл)феніл)-1,2,4-оксадіазол-3-іл)метилкарбамату До розчину продукту зі стадії 2, Прикладу 8 (525 мг, 1,4ммоль) в диметилформаміді (15мл) додають 1,1'-карбонілдіімідазол (286 мг, 1,7ммоль). Одержаний в результаті розчин перемішують при кімнатній температурі протягом 30 хвилин, протягом якого додають ацетат натрію (140 мг, 1,7ммоль) та комерційно доступний трет-бутил 2-(гідро ксіаміно)-2іміноетилкарбамат (325 мг, 1,7ммоль). Реакційну суміш потім перемішують при кімнатній температурі протягом 72 годин. Далі, реакційну суміш розбавляють етилацетатом (75мл) та промивають водою (3 × 75мл). Органічну фазу сушать (Na2SO4) та концентрують в вакуумі. До залишку додають толуол (15мл) та ацетат натрію (140 мг, 1,7ммоль). Одержану в результаті суміш нагрівають до температури кіпіння протягом 18 годин, перемішуючи при цьому, потім охолоджують до кімнатної температури та концентрують в вакуумі. Залишок хроматографують на силікагелі, елююючи від 100 % гексанів до 50:50 EtOAc:гексани, одержуючи названу сполуку 1 (280 мг): H ЯМР (400 МГц, CDCl3) 8,19 (д, 2H, J=8,0 Гц), 7,64 (д, 2H, J=8,0 Гц), 6,33 (м, 1H), 5,16 (м, 2H) 4,88-4,52 (м, 4 H), 1,75 (с, 3H), 1,59 (с, 3H), 1,50 (с, 9H). m/z (CI) 461 [M-(CH3)2CO]. Стадія 4 Одержання N-((1R, 2S)-1-(4-(3-(амінометил)-1,2,4-оксадіазол-5-іл)феніл)-3-флуор-1гідроксипропан-2-іл)-2,2-дихлорацетаміду Дотримуючись загальної процедури з прикладу 2 - стадії 2 та роблячи некритичні зміни, але 1 використовуючи продукт зі стадії 3 - Прикладу 8, одержують названу сполуку (280 мг): H ЯМР (400 МГц, ДМСО-d6) 8,73-8,57 (м, 4H), 8,07 (д, 2H, J=8,0 Гц), 7,65 (д, 2H, J=8,0 Гц), 6,16 (м, 1H), 5,02 (м, 1H) 4,76-4,72 (м, 0,5 H), 4,64-4,60 (м, 0,5H), 4,50-4,24 (м, 4H). m/z (CI) 377 [M+H]. Приклад 9 Одержання 2,2-дихлор-N-((1R, 2S)-3-флуор-1-гідрокси-1-(4-(6-(1-(метил сульфоніл)піролідин-2-іл)піридин-3-іл)феніл)пропан-2-іл)ацетаміду Стадія 1 Одержання 5-бром-2-(1-(метилсульфоніл)піролідин-2-іл)піридину 15 UA 110436 C2 5 10 15 20 25 30 Дотримуючись загальної процедури з прикладу 3, та роблячи некритичні зміни, але використовуючи 5-бром-2-(піролідин-2-іл)піридин (раніше описаний в WO200853319), 1 одержують названу сполуку (400 мг): H ЯМР (400 МГц, CDCl3) 2,0-2,1 (м, 2H), 2,15-2,25 (м, 1H), 2,35-2,45 (м, 1H), 2,8 (с, 3H), 3,5-3,6 (м, 1H), 3,6-3,7 (м, 1H), 4,9-5,0 (м, 1H), 7,45 (д, 1H), 7,85 (дд, 1H), 8,6 (д, 1H). m/z (CI) M+H 305+307. Стадія 2 Одержання 2,2-дихлор-N-((1R, 2S)-3-флуор-1-гідрокси-1-(4-(6-(1-(метил сульфоніл)піролідин-2-іл)піридин-3-іл)феніл)пропан-2-іл)ацетаміду Суміш 5-бром-2-(1-(метилсульфоніл)піролідин-2-іл)піридину (100 мг, 0,328 ммоль), 2,2дихлор-N-((1R, 2S)-3-флуор-1-гідрокси-1-(4-(триметилстаніл)-феніл)пропан-2-іл)ацетаміду (145 мг, 0,328ммоль) та три(2-фурил)фосфіну (15,5 мг, 0,066 ммоль) розчиняють в Nметилпіролідиноні (1,6мл) та деоксигенують. Потім додають три(дибензоліденацетон) дипаладію(0) (30,5 мг, 0,033 ммоль), та суміш нагрівають до 80ºC протягом ночі. Суміш потім охолоджують та чистять, застосовуючи препаративну ВЕРХ (Преп. ВЕРХ = Waters, колонка = Gemini NX C18 21 × 150 мм 5 мкм, РФ А = 0,1 % трифлуороцтова кислота у воді РФ В = ацетонітрил, Градієнт 10 %B до 50 % в 10хв утриманні протягом 2 хв., 20 мл/хв.) Фракції сушать на роторному випарнику та сушать при заморозці з 1,4-діоксаном, одержуючи названу сполуку 1 (33 мг): H ЯМР (400 МГц, ДМСО-d6) 1,9-2,0 (м, 2H), 2,0-2,1 (м, 1H), 2,3-2,4 (м, 1H), 3,0 (с, 3H), 3,5-3,6 (м, 2H), 4,15-4,35 (м, 1,5H), 4,45 (т, 0,5H), 4,55-4,65 (м, 0,5H), 4,7-4,75 (м, 0,5H), 4,9-5,0 (м, 2H), 6,5 (с, 1H), 7,5 (д, 2H), 7,65 (д, 1H), 7,75 (д, 2H), 8,2 (дд, 1H), 8,6 (д, 1H), 8,85 (д, 1H). m/z (CI) M+H 504+506. Приклад 10 Одержання 2,2-дихлор-N-((1R, 2S)-3-флуор-1-гідрокси-1-(4-(5(метилсульфонамідометил)-1,3,4-тіадіазол-2-іл)феніл)пропан-2-іл)ацетаміду Дотримуючись загальної процедури з прикладу 9 - стадії 2, та роблячи некритичні зміни, але використовуючи N-((5-бром-1,3,4-тіадіазол-2-іл)метил)метансульфонамід та 2,2-дихлор-N-((1R, 2S)-3-флуор-1-гідрокси-1-(4-(триметилстаніл)феніл)пропан-2-іл)ацетамід, одержують названу 1 сполуку (11,8 мг): H ЯМР (400 МГц, ДМСО-d6) 3,0 (с, 3H), 4,2-4,4 (м, 1,5H), 4,45 (т, 1H), 4,55-4,6 (м, 0,5H), 4,65 (д, 2H), 4,7-4,75 (м, 0,5H), 4,95 (bt, 0,5H), 6,1 (д, 1H), 6,5 (с, 1H), 7,5 (д, 2H), 7,95 (д, 2H), 8,15 (т, 1H), 8,6 (д, 1H). m/z (CI) M+H 471. Приклад 11 Одержання 2,2-дихлор-N-((1R, 2S)-3-флуор-1-гідрокси-1-(4-(6-(1(метилсульфонамідо)етил)піридин-3-іл)феніл)пропан-2-іл)ацетаміду Стадія 1 Одержання (R, S)-N-(1-(5-бромпіридин-2-іл)етил)метан-сульфонаміду 16 UA 110436 C2 5 10 15 20 25 30 Дотримуючись загальної процедури з прикладу 3, та роблячи некритичні зміни, але використовуючи комерційно доступний (R, S)-1-(5-бромпіридин-2-іл), одержують названу 1 сполуку (570 мг): H ЯМР (400 МГц, ДМСО-d6) 1,55 (т, 3H), 2,8 (с, 3H), 4,7 (пент, 1H), 5,6 (д, 1H), 7,2 (д, 1H), 7,85 (дд, 1H), 8,65 (д, 1H). m/z (CI) M+H 279+281. Стадія 2 Одержання 2,2-дихлор-N-((1R, 2S)-3-флуор-1-гідрокси-1-(4-(6-(1(метилсульфонамідо)етил)піридин-3-іл)феніл)пропан-2-іл)ацетаміду Дотримуючись загальної процедури з прикладу 9 - стадії 2, та роблячи некритичні зміни, та використовуючи (R, S)-N-(1-(5-бромпіридин-2-іл)етил) та 2,2-дихлор-N-((1R, 2S)-3-флуор-1гідрокси-1-(4-(триметилстаніл)феніл)про-пан-2-іл)ацетамід, одержують названу сполуку (17 мг): 1 H ЯМР (400 МГц, ДМСО-d6) 1,5 (т, 3H), 2,8 (с, 3H), 4,15-4,35 (м, 1,5H), 4,4 (т, 0,5H), 4,55-4,65 (м, 1,5H), 4,65-4,75 (м, 0,5H), 4,9 (т, 1H), 6,0 (д, 1H), 6,5 (с, 1H), 7,45 (д, 2H), 7,55 (д, 1H), 7,7 (д, 2H), 8,1 (д, 1H), 8,6 (дд, 1H), 8,8 (дд, 1H). m/z (CI) M+H 478+480. Приклад 12 Одержання 2,2-дихлор-N-((1R, 2S)-3-флуор-1-гідрокси-1-(4-(2(метилсульфонамідометил)піримідин-5-іл)феніл)пропан-2-іл)ацетаміду Стадія 1 Одержання (4S, 5R)-трет-бутил 4-(флуорметил)-5-(4-йодфеніл)-2,2диметилоксазолідин-3-карбоксилату В 1л круглодонну колбу, що містить трет-бутил ((1R, 2S)-3-флуор-1-гідрокси-1-(4йодфеніл)пропан-2-іл)карбамат (24,4 г, 61,8ммоль) завантажують CH2Cl2 (250 мл), потім 2метоксипропен (9,0 мл, 92,8 ммоль). Розчин охолоджують за допомогою крижаної бані, та додають пара-толуолсульфонову кислоту (59 мг, 0,31ммоль). Реакційну суміш перемішують протягом 2 годин при кімнатній температурі, потім гасять насиченим розчином бікарбонату натрію (200мл). Органічні фази відокремлюють, сушать над MgSO 4 та концентрують, одержуючи 1 названу сполуку (26,5 г): H ЯМР (400 МГц, CDCl3) 7,73 (д, 2H), 7,20 (д, 2H), 5,08 (д, 1H), 5,034,69 (м, 1H), 4,54-4,31 (м, 1H), 3,91-3,68 (м, 1H), 1,70 (с, 3H), 1,58 (с, 3H), 1,50 (с, 9H). Стадія 2 Одержання (4S, 5R)-трет-бутил 4-(флуорметил)-2,2-диметил-5-(4-(4,4,5,5тетраметил-1,3,2-діоксаборолан-2-іл)феніл)оксазолідин-3-карбоксилату До розчину продукту зі стадії 1, Прикладу 12 (13,9 г, 32,0 ммоль) в діоксані (160мл) послідовно додають біс(пінаколато)диборан(9,1 г, 35,2ммоль), біс(трифенілфосфін) паладію(ii) хлорид (454 мг, 0,64ммоль) та ацетат калія (9,6 г, 95,9ммоль). Об'єднану суміш нагрівають до температури кіпіння та перемішують протягом ночі. Після охолодження до кімнатної 17 UA 110436 C2 5 10 15 20 25 30 35 40 температури реакційну суміш розподіляють між водою та етилацетатом. Органічні фази відокремлюють, сушать над MgSO4, фільтрують та випаровують, одержуючи смолу, яку чистять, використовуючи колоночну хроматографію, елююючи від чистого гептану до чистого 1 етилацетату, одержуючи названу сполуку (8,92 г): H ЯМР (400 МГц, CDCl3) 7,85 (д, 2H), 7,45 (д, 2H), 5,15 (д, 1H), 4,52-4,37 (м, 1H), 3,95-3,75 (м, 1H), 1,72 (шс, 3H), 1,60 (шс, 3H), 1,51 (шс, 9H), 1,37 (шс, 12H). Стадія 3 Одержання трет-бутилового естеру 5-[4-(2-ціанопіримідин-5-іл)-феніл]-4флуорметил-2,2-диметилоксазолідин-3-карбонової кислоти До розчину трет-бутилового естеру 4-флуорметил-2,2-диметил-5-[4-(4,4,5,5-тетра метил[1,3,2]діоксаборолан-2-іл)феніл]оксазолідин-3-карбонової кислоти (1 г, 2,298 ммоль, 1,0 екв.) в толуолі/воді (3:1-24мл) додають 5-бромпіримідин-2-карбонітрил (0,42 г, 2,282 ммоль, 1,20 екв.), Na2CO3 (0,48 г, 4,528ммоль) та дегазують азотом протягом 15 хвилин, з наступним додаванням тетра(трифенілфосфін)паладію(0) (0,132 г, 0,114ммоль), та нагрівають реакційну суміш до 80 °C протягом 16 годин. Розчинник випаровують в вакуумі, одержуючи сирий продукт, який чистять, застосовуючи колоночну хроматографію, елююючи сумішшю 10 % етилацетат/гексан, 1 одержуючи названу сполуку (0,45 г): H-ЯМР (400 МГц, ДМСО-d6) 1,43 (с, 9H), 1,51 (с, 3H), 1,63 (с, 3H), 3,85-3,92 (м, 1H), 4,47-4,59 (м, 1H), 4,76-4,96 (м, 1H), 5,17 (д, 1H, J=7,16), 7,67 (д, 2H, J=8,24 Гц), 7,96 (д, 2H, J=8,24 Гц), 9,40 (с, 2H).). m/z M-H 410,8. Стадія 4 Одержання трет-бутилового естеру 5-[4-(2-амінометилпі-римідин-5-іл)феніл]-4флуорметил-2,2-диметилоксазолідин-3-карбонової кислоти Розчин продукту з прикладу 12 - стадії 3 (0,4 г, 0,97 ммоль, 1,0 екв.) в метанолі (20 мл) дегазують азотом протягом 15 хвилин з наступним додаванням 10 % паладію на вугіллі (40 мг, 10 % мас./мас.) та витримують в атмосфері водню (1 атм.) при кімнатній температурі протягом 16 годин. Розчинник випаровують в вакуумі, одержуючи сирий продукт, який чистять, застосовуючи колоночну хроматографію, елююючи використовуючи 10-13 % метанол/CH2Cl2, 1 одержуючи названу сполуку (0,22 г): H-ЯМР (400 МГц, ДМСО-d6) 1,43 (с, 9H), 1,51 (с, 3H), 1,63 (с, 3H), 3,85-3,90 (м, 1H), 3,96 (с, 2H), 4,47-4,58 (м, 1H), 4,8-4,9 (м, 2H), 5,14 (д, 1H, J=7,16Гц), 7,62 (д, 2H, J=8,2Гц), 7,83 (д, 2H, J=8,08Гц), 9,11 (с, 2H). m/z M+H 417,1. Стадія 5 Одержання трет-бутилового естеру 4-флуорметил-5-{4-[2-(метан сульфоніламінометил)піримідин-5-іл]феніл}-2,2-диметилоксазолідин-3-карбонової кислоти Розчин продукту з прикладу 12 - стадії 4 (0,1 г, 0,240 ммоль, 1,0 екв.) в CH2Cl2 (10 мл) охолоджують до 0 °C та додають триетиламін (0,048 г, 0,48ммоль) з наступним додаванням мезилхлориду (0,041 г, 0,36ммоль) та перемішують при кімнатній температурі протягом 2 годин. Розчинник випаровують в вакуумі, одержуючи сирий продукт, який чистять, застосовуючи колоночну хроматографію, елююючи сумішшю 30 % етилацетат/гексан одержуючи названу сполуку (80 мг). m/z M+H 495,1. Стадія 6 Одержання N-{5-[4-(2-аміно-3-флуор-1-гідроксипропіл)феніл]піримідин-2 18 UA 110436 C2 ілметил}метансульфонамід 5 10 15 20 25 30 Розчин продукту з прикладу 12 - стадії 5 (0,08 г, 0,16 ммоль, 1,0 екв.) в CH 2Cl2 (2 мл) додають трифлуороцтову кислоту (0,3 мл, 3,91 ммоль) та перемішують при кімнатній температурі протягом 2 годин. Розчинник випаровують в вакуумі, одержуючи сирий продукт як названу сполуку (60 мг). m/z M+H 354,9. Стадія 7 Одержання 2,2-дихлор-N-(1-флуорметил-2-гідрокси-2-{4-[2-(метан сульфоніламінометил)піримідин-5-іл]феніл}етил)ацетаміду До розчину продукту з прикладу 12- стадії 6 (0,06 г, 0,169 ммоль, 1,0 екв.) в метанолі (1,1 мл) додають триетиламін (0,034 г, 0,33 ммоль, 2,0 екв.) та етилдихлорацетат (0,053 г, 0,33. ммоль, 2,0 екв.), та перемішують реакційну суміш при кімнатній температурі протягом 24 годин. Розчинник випаровують в вакуумі, одержуючи сирий продукт, який чистять, застосовуючи колоночну хроматографію, елююючи 5 % метанол/CH2Cl2, одержуючи названу сполуку (0,012 г). 1 H-ЯМР (400 МГц, ДМСО-d6) 2,97 (с, 3H), 4,28 – 4,30 (м, 1H), 4,32-4,36(м, 0,5H), 4,43 (с, 2H), 4,56 – 4,60 (м, 0,5H), 4,68 – 4,71 (м, 0,5H), 4,92 (м, 1H), 6,03 (д, 1H, J=4,16Гц), 6,52 (с, 1H), 7,50 (д, 2H, J=8,16Гц), 7,68 (т, 1H, J=5,76Гц), 7,78 (д, 2H, J=8,24Гц), 8,65 (д, 1H, J=8,72Гц), 9,13 (с, 2H). m/z M+H 464,8. Приклад 13 Одержання 2,2-дихлор-N-((1R, 2S)-3-флуор-1-гідрокси-1-(4-(6-(((R)-5-метил-2оксооксазолідин-3-іл)метил)піридин-3-іл)феніл)пропан-2-іл)ацетаміду Дотримуючись загальної процедури з прикладу 9 - стадії 2, та роблячи некритичні зміни, та використовуючи (R)-3-(5-бромпіридин-2-ілметил)-5-метилоксазолідин-2-он та 2,2-дихлор-N-[(1S, 2R)-1-флуорметил-2-гідрокси-2-(4-триметилстананілфеніл)етил]ацетамід, одержують названу 1 сполуку (21 мг): H-ЯМР (400 МГц, ДМСО-d6) 1,33 (д, 3H, J=6,24 Гц), 3,13-3,17 (м, 1H), 3,69 (т, 1H, J=8,4 Гц), 4,21-4,23 (м, 1,5H), 4,27-4,29 (м, 1H), 4,39-4,43 (м, 1H), 4,48 (д, 2H, J=4,96 Гц), 4,56-4,58 (м, 1H), 4,68-4,70 (м, 2H), 4,90 (м, 1H), 6,0(с, 1H), 6,5 (с, 1H), 7,39 (д, 1H, J=8,04 Гц), 7,47 (д, 2H, J=8,24 Гц), 7,68 (д, 2H, J=8,24 Гц), 8,09 (дд, 1H, J 1=2,32 Гц, J2=8,16 Гц), 8,65 (д, 1H, J=8,92 Гц), 8,84 (д, 1H, J=2,12 Гц). РХ-МС (m/z): [M-H] 468,0. Приклад 14 Одержання (1R, 2S)-2-(2,2-дифлуорацетамід)-3-флуор-1-(4-(6(метилсульфонамідометил)піридин-3-іл)феніл)пропілгідрогенфосфорфлуоридату Стадія 1 Одержання (1R, 2S)-2-(2,2-дифлуорацетамід)-3-флуор-1-(4-(6-(метил сульфонамідометил)піридин-3-іл)феніл)пропілдифенілфосфату 19 UA 110436 C2 5 10 15 20 25 30 До суспензії продукту зі стадії 4, Прикладу 16 (1,0 г, 2,3ммоль) в піридині (2 мл) та CHCl3 (2 мл) завантажують диметиламінопіридин (215 мг, 1,74ммоль). Суспензію охолоджують, використовуючи крижану баню, та по краплям додають дифенілхлорфосфонат (1,04 мл, 4,87ммоль). Реакційну суміш нагрівають до кімнатної температури та перемішують протягом 2,5 годин. Реакційну суміш розбавляють CH2Cl2 та виливають в насичений бікарбонат натрію (10мл). Органічні фази відокремлюють та водний шар знову екстрагують CH2Cl2. Органічні фази об'єднують, промивають лимонною кислотою, сушать над MgSO 4, фільтрують та випаровують, 1 одержуючи названу сполуку (1,57 г): H ЯМР (600 МГц, CDCl3) : 2,95 (3H, с), 4,10 – 4,30 (1H, дд), 4,38 – 4,70 (4H, м), 5,62 – 5,83 (1H, т), 5,76 – 5,85 (1H, м), 5,95 (1H, шс), 6,97 (2H, д), 7,70 – 7,26 (7H, м), 7,27 – 7,33 (1H, м), 7,37 (2H, т), 7,45 – 7,59 (4H, м), 7,88-8,07 (1H, дд), 8,68 – 8,83 (1H, м). m/z M+H 664,2. Стадія 2 Одержання (1R, 2S)-2-(2,2-дифлуорацетамід)-3-флуор-1-(4-(6-(метил сульфонамідометил)піридин-3-іл)феніл)пропілгідрогенфосфорфлуоридат До розчину продукту зі стадії 1, Прикладу 14 (200 мг, 0,3 ммоль) в тетрагідрофурані (1,2мл) додають тетрабутиламонію фосфат (102 мг, 0,39 ммоль). Реакційну суміш перемішують при кімнатній температурі протягом 1,5 години. Розчинник випаровують, та залишок очищають, застосовуючи хроматографію з оберненою фазою, одержуючи названу сполуку (19 мг): 1H ЯМР (600 МГц, ДМСО-d6) : 2,95 (3H, с), 4,25 – 4,46 (4H, м), 4,58 – 4,74 (1H, м), 5,34 – 5,52 (1H, м), 5,97 – 6,35 (1H, т), 7,43 – 7,52 (2H, м), 7,54 – 7,66 (1H, д), 7,69 – 7,80 (3H, м), 8,10 – 8,28 (1H, м), 8,83 – 8,90 (1H, м), 9,15 – 9,24 (1H, м). m/z M+1 514,1. Приклад 15 Одержання 2,2,2-трифлуор-N-((1R, 2S)-3-флуор-1-гідрокси-1-(4-(6(метилсульфонамідометил)піридин-3-іл)феніл)пропан-2-іл)ацетаміду Дотримуючись загальної процедури з прикладу 14, та роблячи некритичні зміни, та використовуючи трифлуороцтовий ангідрид на стадії 2, одержують названу сполуку: 1H ЯМР (400 МГц, ДМСО-d6) 2,95 (с, 3H), 4,30 – 4,45 (м, 1,5H), 4,32 (м, 2H), 4,50 – 4,60 (м, 1,5H), 4,65 – 4,70 (м, 1H), 4,89 (м, 1H), 5,85 (м, 1H), 7,46 (д, 2H, J=8,08 Гц), 7,55 (д, 1H, J=8,08 Гц), 7,65-7,75 (м, 3H), 8,11 (м, 1H), 8,84 (с, 1H), 9,48 (м, 1H). m/z (CI) M+H 450. Приклад 16 Одержання 2,2-дифлуор-N-((1R, 2S)-3-флуор-1-гідрокси-1-(4-(6(метилсульфонамідометил)піридин-3-іл)феніл)пропан-2-іл)ацетаміду Стадія 1 Одержання N-((5-бромпіридин-2-іл)метил)метансульфонаміду 20 UA 110436 C2 5 10 15 20 25 30 Дотримуючись загальної процедури з прикладу 3, та роблячи некритичні зміни, та використовуючи комерційно доступний (5-бромпіридин-2-іл)метанамін, одержують названу сполуку (1,95 г): m/z (CI) M+H 266. Стадія 2 Одержання 2,2-дифлуор-N-((1R, 2S)-3-флуор-1-гідрокси-1-(4-йодфеніл)пропан-2іл)ацетаміду Дотримуючись загальної процедури з прикладу 1 – стадії 2, та роблячи некритичні зміни, та використовуючи етилдифлуорацетат та (1R, 2S)-2-аміно-3-флуор-1-(4-йодфеніл)пропан-1-ол, одержують названу сполуку (18,3 г): 1H ЯМР (400 МГц, CDCl3) 7,72 (2H, д), 7,13 (2H, д), 6,78 (1H, д), 5,85 (1H, т), 5,06 (1H, с), 4,67-4,28 (3H, м), 2,58 (1H, с). Стадія 3 Одержання 2,2-дифлуор-N-((1R, 2S)-3-флуор-1-гідрокси-1-(4(триметилстаніл)феніл)пропан-2-іл)ацетаміду Гексаметилдитин (9,9 г, 29,9ммоль) додають до деоксигенованого розчину продукту з прикладу 17 – стадії 2 (10,6 г, 28,5ммоль), дихлорбіс(трифеніл-фосфін)паладію (490 мг, 0,68 ммоль) в діоксані (143 мл) та суміш нагрівають до 80 °C протягом 1 години. Після охолодження до кімнатної температури суміш очищають, використовуючи колоночну хроматографію елююючи від чистих гептанів до чистого етилацетату, одержуючи названу сполуку (9,3 г): 1H ЯМР (400 МГц, CDCl3) 7,27 (2H, д), 7,09 (2H, д), 6,59 (1H, д), 5,62 (1H, т), 4,81-4,79 (1H, т), 4,444,08 (3H, м), 2,20 (1H, д), 0,14-0,00 (9H, м). Стадія 4 Одержання 2,2-дифлуор-N-((1R, 2S)-3-флуор-1-гідрокси-1-(4-(6(метилсульфонамідометил)піридин-3-іл)феніл)пропан-2-іл)ацетаміду Дотримуючись загальної процедури з прикладу 9 - стадії 2, та роблячи некритичні зміни, та використовуючи продукт з прикладу 17 – стадії 1 та Прикладу 17 – стадії 3, одержують названу 1 сполуку (200 мг): H ЯМР (400 МГц, ДМСО-d6) 8,86-8,83 (2H, м), 8,13 (1H, д), 7,74-7,69 (3H, м), 7,55 (1H, д), 7,49 (2H, д), 6,23 (1H, т), 5,91 (1H, д), 4,91(1H, т), 4,70-4,56 (1H, м), 4,47-4,29 (4H, м), 2,97 (3H, с). m/z (CI) M+H 431. Приклад 17 Одержання 2,2-дихлор-N-((1R, 2S)-3-флуор-1-(4-(5-флуор-6-(метил сульфонамідометил)піридин-3-іл)феніл)-1-гідроксипропан-2-іл)ацетаміду Стадія 1 Одержання (4S, 5R)-трет-бутил 5-(4-(6-ціано-5-флуорпіридин-3-іл)феніл)-4(флуорметил)-2,2-диметилоксазолідин-3-карбоксилату 21 UA 110436 C2 5 10 До розчину комерційно доступного 5-бром-3-флуорпіколінонітрилу (800 мг, 3,98 ммоль) в суміші 1,4-діоксан:вода (32:8 мл) додають продукт з прикладу 12 – стадії 2 (1730 мг, 3,98 ммоль) та Cs2CO3 (2800 мг, 8,6 ммоль), та одержаний в результаті розчин барботують газоподібним азотом протягом 30 хвилин. До даної реакційної суміші додають Pd(PPh3)4 (460 мг, 0,4 ммоль), та одержану в результаті реакційну суміш нагрівають до 90 °C протягом 3 годин. Одержану в результаті реакційну суміш охолоджують, розбавляють водою та екстрагують етилацетатом. Органічний шар сушать над сульфатом натрію, та концентрують, та очищають використовуючи колоночну хроматографію на силікагелі, елююючи етилацетатом в гептані, одержуючи названу сполуку: 1H ЯМР (400 МГц, CDCl3) 1,52 (с, 9H), 1,63 (с, 3H), 1,75 (с, 3H), 3,80-4,00 (м, 1H), 4,404,60(м, 1H), 4,7-5,2 (м, 1H), 5,22 (д, 1H, J=7,33 Гц), 7,65 (с, 4H), 7,78 (д, 2H, J=9,35 Гц), 8,80 (с, 1H). m/z (CI) M+H 430. Стадія 2 Одержання (4S, 5R)-трет-бутил 5-(4-(5-флуор-6-(метил-сульфонамідо метил)піридин-3-іл)феніл)-4-(флуорметил)-2,2-диметилоксазолідин-3-карбоксилату 15 20 25 30 35 (4S, 5R)-трет-бутил-5-(4-(6-ціано-5-флуорпіридин-3-іл)феніл)-4-(флуорметил)-2,2диметилоксазолідин-3-карбоксилат (1440 мг, 3,4 ммоль) в метанолі (25 мл) при 5 °C обробляють NiCl2 (80 мг, 0,34 ммоль) та потім порціями додають боргідрид натрію (380 мг, 10 ммоль). Суміш перемішують протягом 1 години при кімнатній температурі, концентрують, щоб видалити метанол, гасять водним бікарбонатом натрію та екстрагують етилацетатом. Органічні фази сушать над безводним сульфатом натрію, фільтрують та концентрують до олії. Олію розчиняють в дихлорметані (5 мл), охолоджують до 5 °C та обробляють діізопропілетиламін (0,88 мл, 5,0 ммоль) та метансульфонілхлорид (0,30 мл, 3,7 ммоль) та перемішують протягом 2 годин при кімнатній температурі. Суміш концентрують та хроматографують на силікагелі, 1 елююючи етилацетатом в гептані, одержуючи названу сполуку. H ЯМР (400 МГц, CDCl3) 1,53 (с, 9H), 1,63 (с, 3H), 1,75 (с, 3H), 3,80-4,00 (м, 1H), 4,40-4,50(м, 0,5H), 4,55-4,65 (м, 2,5H), 5,22 (д, 1H, J=7,33 Гц), 5,72 (шс, 1H), 7,60-7,70 (м, 5H), 8,63 (с, 1H). m/z (CI) M+H 512. Стадія 3 Одержання 2,2-дихлор-N-((1R, 2S)-3-флуор-1-(4-(5-флуор-6-(метил сульфонамідометил)піридин-3-іл)феніл)-1-гідроксипропан-2-іл)ацетаміду (4S, 5R)-трет-бутил 5-(4-(5-флуор-6-(метилсульфонамідометил)піридин-3-іл)феніл)-4(флуорметил)-2,2-диметилоксазолідин-3-карбоксилат (890 мг, 1,74 ммоль) розчиняють в CH 2Cl2 (20 мл), охолоджують до 5 °C, та обробляють трифлуороцтовою кислотою (4 мл), перемішують протягом 1 год. при кімнатній температурі, розбавляють толуолом, концентрують до олії. Олію підлужнюють водним бікарбонатом натрію, екстрагують етилацетатом, сушать, фільтрують, концентрують до олії. Олію розчиняють в метанолі (8 мл) та обробляють діізопропілетиламіном (0,455 мл, 2,6 ммоль) та метилдихлорацетатом (305 мг, 2,1 ммоль), перемішують при 60 °C протягом 18 годин, потім охолоджують та хроматографують на силікагелі, елююючи 22 UA 110436 C2 1 5 10 15 20 25 30 35 етилацетатом в гептані, одержуючи названу сполуку. H ЯМР (400 МГц, ДМСО-d6) 2,94 (с, 3H), 4,15 – 4,45 (м, 4H), 4,55-4,75 (м, 1H), 4,92 (т, 1H, J=3,54 Гц),), 6,01 (д, 1H, J=4,29 Гц), 6,52 (с, 1H), 7,49 (д, 2H, J=8,08Гц), 7,59 (т, 1H, J=5,94 Гц), 7,77 (д, 2H, J=8,34 Гц), 8,07 (м, 1H), 8,63 (д, 2H, J=8,84 Гц), 8,77 (с, 1H). m/z (CI) M+H 465. Приклад 18 Одержання 2,2-дихлор-N-((1R, 2S)-3-хлор-1-(4-(5-флуор-6-(метил сульфонамідометил)піридин-3-іл)феніл)-1-гідроксипропан-2-іл)ацетаміду Стадія 1 Одержання (4S, 5R)-трет-бутил 5-(4-(6-ціано-5-хлорпіридин-3-іл)феніл)-4(флуорметил)-2,2-диметилоксазолідин-3-карбоксилату Дотримуючись загальної процедури з прикладу 17, стадії 1, та роблячи некритичні зміни, та використовуючи продукт з прикладу 12 – стадії 2 та комерційно доступний 5-бром-31 хлорпіколінонітрил, одержують названу сполуку. H ЯМР (400 МГц, CDCl3): 1,52 (с, 9H), 1,63 (с, 3H), 1,75 (с, 3H), 3,80-4,00 (м, 1H), 4,40-4,60(м, 1H), 4,7-5,2 (м, 1H), 5,22 (д, 1H, J=7,33 Гц), 7,64 (с, 4H), 8,04 (д, 2H, J=2,02 Гц), 8,84 (д, 2H, J=2,02 Гц). m/z (CI) M+H 446. Стадія 2 Одержання (4S, 5R)-трет-бутил-5-(4-(5-хлор-6-(метил-сульфонамідо метил)піридин3-іл)феніл)-4-(флуорметил)-2,2-диметилоксазолідин-3-карбоксилату Дотримуючись загальної процедури з прикладу 17, стадії 2, та роблячи некритичні зміни, та використовуючи продукт зі стадії 1 - Прикладу 19 одержують названу сполуку. 1H ЯМР (400 МГц, CDCl3): 1,53 (с, 9H), 1,63 (с, 3H), 1,75 (с, 3H), 3,02 (с, 3H), 3,80-4,00 (м, 1H), 4,40-4,50(м, 0,5H), 4,55-4,65 (м, 2,5H), 5,21 (д, 1H, J=7,33 Гц), 5,97 (шс, 1H), 7,61 (с, 5H), 7,61 (с, 1H), 8,70 (с, 1H). m/z (CI) M+H 528. Стадія 3 Одержання 2,2-дихлор-N-((1R, 2S)-1-(4-(5-хлор-6-(метилсульфонамідо метил)піридин-3-іл)феніл)-3-флуор-1-гідроксипропан-2-іл)ацетаміду Дотримуючись загальної процедури з прикладу 17, стадії 3, та роблячи некритичні зміни, та 1 використовуючи продукт зі стадії 2 - Прикладу 19, одержують названу сполуку: H ЯМР (400 МГц, ДМСО-d6) 2,96 (с, 3H), 4,15 – 4,35 (м, 1,5H), 4,35-4,55 (м, 2,5H), 4,55-4,75 (м, 1H), 4,92 (7, 1H, J=3,41 Гц), 6,01 (д, 1H, J=4,04 Гц), 6,52 (м, 1H), 6,53 (с, 1H), 7,45-7,60 (м, 3H), 7,77 (д, 1H, J=8,34 Гц), 8,26 (д, 2H, J=1,77 Гц), 8,63 (д, 2H, J=8,84 Гц), 8,77 (д, 1H, J=1,77 Гц). m/z (CI) M+H 498. Приклад 19 Одержання 2,2-дихлор-N-((1R, 2S)-3-флуор-1-гідрокси-1-(4-(5(метилсульфонамідометил)піразин-2-іл)феніл)пропан-2-іл)ацетаміду Стадія 1 Одержання (4S, 5R)-трет-бутил 5-(4-(5-ціанопіразин-2-іл)феніл)-4-(флуор метил)2,2-диметилоксазолідин-3-карбоксилату 23 UA 110436 C2 5 10 15 20 25 30 Дотримуючись загальної процедури з прикладу 17, стадії 1, та роблячи некритичні зміни, та використовуючи продукт з прикладу 12 – стадії 2 та комерційно доступний 5-бромпіразин-21 карбонітрил, одержують названу сполуку H ЯМР (400 МГц, CDCl3) 1,52 (с, 9H), 1,63 (с, 3H), 1,75 (с, 3H), 3,80-4,00 (м, 1H), 4,40-4,60(м, 1H), 5,23 (д, 1H, J=7,33 Гц), 7,66 (д, 2H, J=8,34 Гц), 8,14 (д, 2H, J=8,34 Гц), 8,97 (д, 1H), 9,16 (с, 1H). m/z (CI) M+H 413. Стадія 2 Одержання (4S, 5R)-трет-бутил 4-(флуорметил)-2,2-диметил-5-(4-(5(метилсульфонамідометил)піразин-2-іл)феніл)оксазолідин-3-карбоксилату Дотримуючись загальної процедури з прикладу 17, стадії 2, та роблячи некритичні зміни, та 1 використовуючи продукт зі стадії 1 - прикладу 20 одержують названу сполуку: H ЯМР (400 МГц, CDCl3) 1,52 (с, 9H), 1,63 (с, 3H), 1,75 (с, 3H), 3,01 (с, 3H), 3,80-4,00 (м, 1H), 4,40-4,50(м, 0,5H), 4,50-4,60 (м, 2,5H), 5,21 (д, 1H, J=7,33 Гц), 5,61 (м, 1H), 7,61 (д, 2H, J=8,34 Гц), 8,05 (д, 2H, J=8,34 Гц), 8,69 (с, 1H), 98,98 (с, 1H). m/z (CI) M+H 495. Стадія 3 Одержання 2,2-дихлор-N-((1R, 2S)-3-флуор-1-гідрокси-1-(4-(5-(метил сульфонамідометил)піразин-2-іл)феніл)пропан-2-іл)ацетаміду Дотримуючись загальної процедури з прикладу 17, стадії 3, та роблячи некритичні зміни, та 1 використовуючи продукт з прикладу 20 - стадії 2, одержують названу сполуку: H ЯМР (400 МГц, ДМСО-d6) 2,99 (с, 3H), 4,20 – 4,50 (м, 4H), 4,50 – 4,75 (м, 1H), 4,93 (т, 1H, J=3,28 Гц), 6,04 (д, 1H, J=4,29 Гц), 6,52 (с, 1H), 7,51 (д, 1H, J=8,34Гц), 7,76 (т, 2H, J=6,06 Гц), 8,10 (д, 2H, J=8,34 Гц), 8,62 (д, 2H, J=8,84 Гц), 8,73 (с, 1H), 9,19 (с, 1H). m/z (CI) M-H 483. Приклад 20 Одержання N-((1R, 2S)-1-(4-(6-(азетидин-1-ілметил)піридин-3-іл) феніл)-3флуор-1-гідроксипропан-2-іл)-2,2-дихлорацетаміду Стадія 1 Одержання 2,2-дихлор-1-((4S, 5R)-4-(флуорметил)-5-(4-(6-(гідроксиметил) піридин3-іл)феніл)-2,2-диметилоксазолідин-3-іл)етанону Дотримуючись загальної процедури з прикладу 1 - стадії 1, та роблячи некритичні зміни, та використовуючи 2,2-дихлор-1-((4S, 5R)-4-(флуорметил)-5-(4-йодфеніл)-2,2-диметилоксазолідин3-іл)етанон та (6-(гідроксиметил)піридин-3-іл)боронову кислоту, як вихідні речовини, одержують названу сполуку (800 мг): m/z (CI) M-H 426,1. Стадія 2 Одержання (5-(4-((4S, 5R)-3-(2,2-дихлорацетил)-4-(флуорметил)-2,2 24 UA 110436 C2 диметилоксазолідин-5-іл)феніл)піридин-2-іл)метилметансульфонату 5 10 15 20 25 30 Дотримуючись загальної процедури з прикладу 3, та роблячи некритичні зміни, та використовуючи продукт з прикладу 21 -стадії 1, одержують названу сполуку (940 мг): m/z (CI) M-H 504,1. Стадія 3 Одержання N-((1R, 2S)-1-(4-(6-(азетидин-1-ілметил)піридин-3-іл)феніл)-3-флуор-1гідроксипропан-2-іл)-2,2-дихлорацетаміду Діізопропілетиламін (296мкл, 1,68ммоль) додають до продукту з прикладу 20, стадії 2 (50 мг, . 0,11ммоль) та солі азетидин HCl (146 мг, 1,12 ммоль) в диметилформаміді (1мл), та суміш нагрівають до 60 °C протягом 4 годин. Розчинник видаляють при зниженому тиску, та залишок розчиняють в CH2Cl2 (2 мл). Суміш охолоджують до 0 °C, та додають трифлуороцтову кислоту (2 мл). Через 1 годину, розчинник видаляють при зниженому тиску, та сирий продукт продукт очищають, використовуючи ВЕРХ з оберненою фазою, одержуючи названу сполуку (10 мг): m/z (CI) M-H 425,1. Приклад 21 Одержання 2,2-дихлор-N-((1R, 2S)-1-(4-(6-(етилсульфонамідометил) піридин-3іл)феніл)-3-флуор-1-гідроксипропан-2-іл)ацетаміду Стадія 1 Одержання N-((5-бромпіридин-2-іл)метил)етансульфонаміду До розчину (5-бромпіридин-2-іл)метанаміну (250 мг, 1,34 ммоль) в CH2Cl2 (3 мл) додають етилсульфонілхлорид (95 мг, 0,74ммоль), потім триетиламін (0,3 мл, 2,0 ммоль). Реакційну суміш перемішують при кімнатній температурі протягом 1,5 години. Реакційну суміш безпосередньо ін'єкційно вводять в 12 г силікагелеву колонку та хроматографують, елююючи від 100 % гексанів до 50:50 етилацетат:гексани, одержуючи названу сполуку (158 мг): m/z (CI) M+H 279+281. Стадія 2 Одержання N-((5-(4-((4S, 5R)-3-(2,2-дихлорацетил)-4-(флуорметил)-2,2диметилоксазолідин-5-іл)феніл)піридин-2-іл)метил)етансульфонаміду 2,2-дихлор-1-((4S, 5R)-4-(флуорметил)-2,2-диметил-5-(4-(триметилстаніл)феніл)оксазолідин-3-іл)етанон (281 мг, 0,66ммоль) та N-((5-бромпіридин-2іл)метил)етансульфонамід (155 мг, 0,56ммоль) розчиняють в N-метил-2-піролідоні (40мл) та продувають газоподібним азотом. додають Pd2(dba)3 (51 мг, 0,055ммоль) та три-2-фурилфосфін (27 мг, 0,11ммоль); одержану в результаті суміш нагрівають до 80 C протягом 18 годин. Реакційну суміш охолоджують, розбавляють етилацетатом та промивають водою. Органічну 25 UA 110436 C2 5 10 15 20 фазу сушать (Na2SO4) та концентрують в вакуумі. Сиру речовину хроматографують (24 г RediSep колонка), елююючи від 100 % гексанів до 90:10 етилацетат:гексани, одержуючи названу сполуку (125 мг): m/z (CI) M+H 518. Стадія 3 Одержання 2,2-дихлор-N-((1R, 2S)-1-(4-(6-(етилсульфонамідо-метил) піридин-3іл)феніл)-3-флуор-1-гідроксипропан-2-іл)ацетаміду Дотримуючись загальної процедури з прикладу 2 - стадії 2, та роблячи некритичні зміни, та 1 використовуючи продукт зі стадії 2 - прикладу 21, одержують названу сполуку (23 мг): H ЯМР (400 МГц, ДМСО-d6) :1,19 (т, 3H), 3,04, (кв, 2H), 4,22– 4,32 (м, 3,5H), 4,40 – 4,44 (м, 0,5H), 4,56 – 4,60 (м, 0,5H), 4,68 – 4,72 (м, 0,5H), 4,91 (т, 1H), 5,98 (д, 1H), 6,53 (с, 1H), 7,46-7,54 (м, 3H), 7,68 – 7,73 (м, 3H), 8,10 (дд, 1H), 8,62 (д, 1H), 8,82 (д, 1H); m/z (CI) 478[M+H]. Приклад 22 2,2-дифлуор-N-((1R, 2S)-3-флуор-1-гідрокси-1-(4-(6-((2-метилпропіл сульфонамідо)метил)піридин-3-іл)феніл)пропан-2-іл)ацетамід Стадія 1 Одержання (4S, 5R)-4-(флуорметил)-5-(4-йодфеніл)-2,2-диметилоксазол ідину Ацетон (150мл) додають до комерційно доступного (1R, 2S)-2-аміно-3-флуор-1-(4йодфеніл)пропан-1-олу (15,0 г, 50,8ммоль). Після перемішування протягом ночі при кімнатній температурі, розчинник видаляють при зниженому тиску, одержуючи названу сполуку (17,6 г): m/z (CI) M+H 335. 26 UA 110436 C2 Стадія 2 Одержання 2,2-дифлуор-1-((4S, диметилоксазолідин-3-іл)етанону 5 10 15 20 25 30 5R)-4-(флуорметил)-5-(4-йодфеніл)-2,2 До розчину, що перемішують, продукту зі стадії 2 - приклад 8 (3,0 г, 8,9ммоль) в CH2Cl2 (50мл) при 0 °C додають триетиламін (6,2 мл, 44,8 ммоль) з наступним додаванням по краплям дифлуорацетилхлорида (2,2 мл, 27,0 ммоль). Реакційній суміші дають повільно нагрітися до кімнатної температури. Через 1 годину реакційну суміш розбавляють водою (75 мл) та екстрагують CH2Cl2 (2 × 75 мл). Об'єднану органічну фазу сушать над MgSO 4 та концентрують в вакуумі. Сиру речовину хроматографують (80 г Redi-Sep колонка), елююючи від 100 % гексанів до 25:75 EtOAc:гексани, одержуючи названу сполуку (3,54 г): m/z (CI) M+H 413,0. Стадія 3 Одержання 2,2-дифлуор-1-((4S, 5R)-4-(флуорметил)-2,2-диметил-5-(4-(4,4,5,5тетраметил-1,3,2-діоксаборолан-2-іл)феніл)оксазолідин-3-іл)етанону До розчину продукту зі стадії 3 - приклад 8 (3,5 г, 8,4ммоль) в діоксані (100мл) додають біс(пінаколато)диборон (2,4 г, 9,3ммоль), ацетат калія (2,5 г, 25,4ммоль) та Pd(PPh 3)2Cl2 (300 мг, 0,4ммоль). Реакційну суміш нагрівають до 90 °C під азотом протягом 22 годин. Реакційну суміш охолоджують до кімнатної температури та концентрують в вакуумі, щоб видалити діоксан до об'єму ~50 мл. Залишок розбавляють водою (150мл) та екстрагують CH 2Cl2 (2 × 125 мл). Об'єднані органічні фази сушать над Na2SO4 та концентрують в вакуумі. Сиру речовину очищають, використовуючи хроматографію (120 г Redi-Sep колонка), елююючи від 100 % гексанів до 25:75 EtOAc:гексани, одержуючи названу сполуку (2,06 г): m/z (CI) M+H 413,2. Стадія 4 Одержання трет-бутил (5-(4-((4S, 5R)-3-(2,2-дифлуорацетил)-4-(флуор метил)-2,2диметилоксазолідин-5-іл)феніл)піридин-2-іл)метилкарбамату До розчину продукту зі стадії 3, приклад 22 (1000 мг, 2,4ммоль) в толуолі/етанолі (30:20 мл) додають комерційно доступний трет-бутил (5-бромпіридин-2-іл)метил карбамат (695 мг, 2,42ммоль), бікарбонат натрію (5 мл насиченого розчину) та Pd(dppf) 2Cl2 (90 мг, 0,12ммоль). Реакційну суміш нагрівають до 80 °C, перемішуючи при цьому під азотом, протягом 4 годин. Реакційну суміш охолоджують та розбавляють водою. Вміст екстрагують етилацетатом (2 × 75мл), та об'єднану органічну фазу сушать (Na2SO4) та концентрують в вакуумі. Сиру речовину хроматографують (80 г Redi-Sep колонка), елююючи від 100 % гексанів до 90:10 етилацетат:гексани, одержуючи названу сполуку (912 мг): m/z (CI) M+H 494. Стадія 5 Одержання 1-((4S, 5R)-5-(4-(6-(амінометил)піридин-3-іл)феніл)-4-(флуор метил)2,2-диметилоксазолідин-3-іл)-2,2-дифлуоретанону 27 UA 110436 C2 5 10 15 20 25 30 35 До розчину трет-бутил (5-(4-((4S, 5R)-3-(2,2-дифлуорацетил)-4-(флуорметил)-2,2диметилоксазолідин-5-іл)феніл)піридин-2-іл)метилкарбамату (970 мг, 4,5ммоль) в CH2Cl2 (25мл) при 0 °C додають 2,6-лутидин (460мкл, 3,9ммоль), потім трет-бутилдиметилсилілтрифлуорметансульфонат (700мкл, 2,9ммоль). Реакційну суміш перемішують при кімнатній температурі протягом 18 годин. Додають додатковий лутидин (230мкл, 1,9ммоль) та третбутилдиметилсилілтрифлуорметансульфонат (350мкл, 1,4ммоль), та вміст нагрівають до 35C протягом 1 години. Додають насичений NH4Cl, та реакційну суміш перемішують протягом 15 хвилин. Вміст розбавляють CH2Cl2 та розділяють. Органічну фазу промивають насиченим NH4Cl, насиченим NaHCO3, насиченим сольовим розчином, сушать (Na2SO4) та концентрують в вакуумі. Сирий продукт силілкарбамат розчиняють в тетрагідрофурані (20 мл), та додають тетрабутиламонію флуорид (0,6 мл, 2,0 ммоль), та перемішують протягом 20 хвилин. додають насичений NH4Cl, та вміст екстрагують етилацетатом. Органічну фазу промивають послідовно насиченим гідрогенкарбонатом натрію, насиченим сольовим розчином, сушать над Na 2SO4 та концентрують в вакуумі, одержуючи названу сполуку (123 мг): m/z (CI) M+H 394. Стадія 6 Одержання 2,2-дифлуор-N-((1R, 2S)-3-флуор-1-гідрокси-1-(4-(6-((2-метил пропілсульфонамідо)метил)піридин-3-іл)феніл)пропан-2-іл)ацетаміду До розчину 1-((4S, 5R)-5-(4-(6-(амінометил)піридин-3-іл)феніл)-4-(флуорметил)-2,2диметилоксазолідин-3-іл)-2,2-дифлуоретанону (80 мг, 0,2ммоль) в CH2Cl2 (15мл) при 0 °C додають триетиламін (80мкл, 0,5ммоль), потім ізобутилсульфонілхлорид (29 мг, 0,2ммоль). Реакційну суміш перемішують при кімнатній температурі протягом 1 години. Далі, додають трифлуороцтову кислоту (1мл), та реакційну суміш перемішують при кімнатній температурі протягом додаткової 1 години. додають толуол (20мл), та реакційну суміш концентрують в вакуумі. Сирий продукт реакції очищають, використовуючи хроматографію з оберненою фазою, без основи насичений NaHCO3, екстрагують етилацетатом, та концентрують в вакуумі, 1 одержуючи названу сполуку (17 мг). H ЯМР (400 МГц, ДМСО-d6) :0,99 (д, 6H), 2,05-2,11 (м, 1H), 2,94 (д, 2H), 4,28– 4,36 (м, 3,5H), 4,41 – 4,45 (м, 0,5H), 4,52 – 4,58 (м, 0,5H), 4,65 – 4,68 (м, 0,5H), 4,89 (м, 1H), 5,90 (д, 1H), 6,21 (т, 1H), 7,47 (д, 2H), 7,54 (д, 1H), 7,69 – 7,74 (м, 3H), 8,12 (дд, 1H), 8,81-8,83 (м, 2H); m/z (CI) 474 [M+H]. Приклад 23 Одержання метил (5-(4-((1R, 2S)-2-(2,2-дифлуорацетамід)-3-флуор-1гідроксипропіл)феніл)піридин-2-іл)метилкарбамату Дотримуючись загальної процедури з прикладу 22 - стадії 3, та роблячи некритичні зміни, та використовуючи метил хлорформіат, одержують названу сполуку (21 мг): m/z (CI) M+H 412. 28
ДивитисяДодаткова інформація
Назва патенту англійськоюPhenicol antibacterials
Автори англійськоюCurtis, Michael, Duclos, Brian, A., Ewin, Richard, A., Johnson, Paul, D., Johnson, Timothy, A., Vairagoundar, Rajendran, Billen, Denis, Goodwin, Richard, M., Haber-Stuk, Andrea, K., Kyne, Graham, M., Sheehan, Susan, M. K.
Автори російськоюКертис Майкл, Даклос Браян А., Ивин Ричард А., Джонсон Пол Д., Джонсон Тимоти А., Вайрагундар Раджендран, Биллен Дэнис, Гудвин Ричард М., Гэйбэр-Стак Андрэа К., Кайн Ґрэм М., Шиган Сузан М. К.
МПК / Мітки
МПК: A61K 31/427, C07D 271/06, C07D 413/06, C07D 241/12, A61K 31/4245, C07D 417/06, C07D 277/28, C07D 285/12, A61K 31/4995, C07D 239/26, C07D 333/20, C07D 401/06, A61K 31/4439, A61K 31/4418, C07D 213/38
Мітки: антибактеріальні, феніколу, сполуки
Код посилання
<a href="https://ua.patents.su/114-110436-antibakterialni-spoluki-fenikolu.html" target="_blank" rel="follow" title="База патентів України">Антибактеріальні сполуки феніколу</a>
Попередній патент: Спосіб ведення доменної плавки
Наступний патент: Пристрій для нанесення покриття на протяжний виріб
Випадковий патент: Харчовий бальзам "софія лік"