Антидіабетичні агенти
Формула / Реферат
1. Сполука загальної формули 1, або її фармацевтично прийнятна сіль,
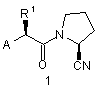 ,
,
де: А є![]() ,
, 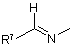 або
або 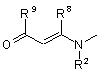 ;
;
R1 вибирають з Н, С1-С6 алкілу (включаючи розгалужений алкіл і циклоалкіл), (CH2)aNHW1, (CH2)bCOW2, (CH2)cOW3, CH(Me)OW4, (CH2)d-C6H4-W5 і (CH2)eSW6, де а є 2-5, b е 1-4, c є 1-2, d є 1-2, e є 1-3, W1 є COW6, CO2W6 або SO2W6, W2 є ОН, NH2, OW6 або NHW6, W3 є Н або W6, W4 є Н або W6, W5 є Н, ОН або ОМе, і W6 є С1-С6 алкілом, бензилом, необов'язково заміщеним фенілом, необов'язково заміщеним гетероарилом, що можуть необов'язково містити до двох замісників, які вибирають С1-С3 алкілу, С1-С3 алкокси, F і Сl;
R2 є Н або (CH2)nNH-C5H3N-Y, де n є 2-4 і Y вибирають з Н, F, Сl, NO2 і CN, або
R1 і R2 разом є -(СН2)р-, де p є 3 або 4;
Х вибирають з
(і) одної або більшої кількості L-α-аміноацильних груп вибраних з Аlа, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr і Val;
(ii) груп R3CO, де R3 є воднем, С1-С6 алкілом (включаючи розгалужений алкіл і циклоалкіл) або фенілом;
(ііі) груп R4COOC(R5)(R6)OCO, де R4 є воднем, С1-С6 алкілом (включаючи розгалужений алкіл і циклоалкіл), бензилом або необов'язково заміщеним фенілом, який може бути заміщений до двох замісників, які вибирають з С1-С3 алкілу, С1-С3 алкокси, F і Сl, і R5 і R6 є кожний, незалежно, воднем або С1-С6 алкілом або R5 і R6 разом є -(СН2)m-, де m є 4-6; і
(iv) метоксикарбонілу, етоксикарбонілу і бензилоксикарбонілу;
R7 вибирають з піридилу і необов'язково заміщеного фенілу, який може бути заміщений до двох замісників, які вибирають з С1-С3 алкілу, С1-С3 алкокси, F, Сl, NO2, CN і СО2Н;
R8 є Н або С1-С3 алкілом; і
R9 є Н, С1-С6 алкілом, С1-С6 алкокси або фенілом
за виключенням N-(Z-Val)-2-ціанопіролідину.
2. Сполука згідно з пунктом 1, де R1 є іншим ніж Н і R2 є Н.
3. Сполука згідно з пунктом 2, де R1 є С1-С6 алкілом.
4. Сполука згідно з пунктом 1, де R1 є Н, А є групою загальної формули 2 або 4, і R2 є (CH2)nNH-C5H3N-Y.
5. Сполука згідно з пунктом 4, де n є 2 і Y є CN.
6. Сполука згідно з пунктом 5, де NH замісник знаходиться в 2-положенні і ціаногрупа знаходиться в 5-положенні піридильного кільця.
7. Сполука згідно з пунктом 1, де А є групою загальної формули 2 і Х є аміноацильною групою.
8. Сполука згідно з пунктом 7, де аміноацильна група є лізилом або аргінілом.
9. Сполука згідно з пунктом 8, де аміноацильна група є аргінілом.
10. Сполука згідно з пунктом 7, де аміноацильна група є гліцинілом.
11. Сполука згідно з пунктом 1, де А є групою загальної формули 2 і Х є R4COOC(R5)(R6)OCO.
12. Сполука згідно з пунктом 11, де R4 є С1-С6 алкілом.
13. Сполука згідно з пунктом 11, де один з R5 і R6 є Н і іншій є метилом.
14. Сполука згідно з пунктом 11, де R4 є метилом, один з R5 і R6 є Н і іншій є метилом.
15. Сполука згідно з пунктом 1, де А є групою загальної формули 2 і Х є метоксикарбонілом.
16. Сполука згідно з пунктом 1, де А є групою загальної формули 3.
17. Сполука згідно з пунктом 1, де А є групою загальної формули 4.
18. Сполука згідно з пунктом 17, де R8 є С1-С3 алкілом.
19. Сполука згідно з пунктом 18, де R8 є метилом.
20. Сполука згідно з пунктом 17, де R9 є С1-С3 алкілом або С1-С3 алкокси.
21. Сполука згідно з пунктом 20, де R9 є метилом або метокси.
22. Сполука згідно з пунктом 1, яку вибирають з
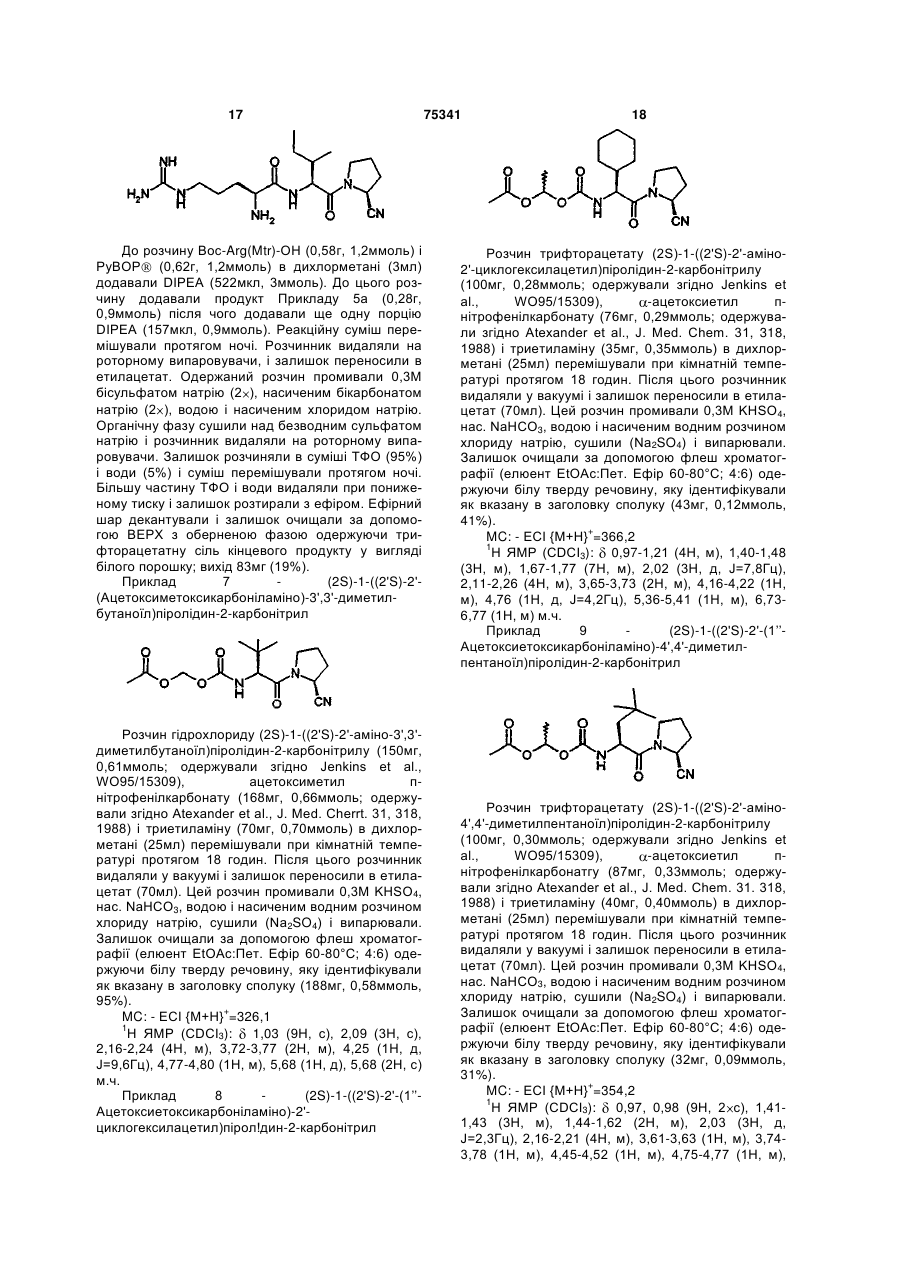
(2S)-1-((2'S)-2'-(1"-ацетоксіетоксикарбоніламіно)-3',3'-диметилбутаноїл)піролідин-2-карбонітрилу;
(2S)-1-(N'-(1"-ацетоксіетоксикарбоніл)ізолейцил)піролідин-2-карбонітрилу;
(2S)-1-(N'-(метоксикарбоніл)ізолейцил)піролідин-2-карбонітрилу;
(2S)-1-((N')-(4"-оксопент-2"-ен-2"-іл)ізолейцил)піролідин-2-карбонітрилу;
(2S)-1-(гліцилізолейцил)піролідин-2-карбонітрилу;
(2S)-1-(аргінілізолейцил)піролідин-2-карбонітрилу;
(2S)-1-((2'S)-2'-(aцeтoкcимeтoкcикapбoнiлaмiнo)-3',3'-димeтилбyтaнoїл)пipoлiдин-2-карбонітрилу;
(2S)-1-((2'S)-2'-(1"-ацетоксіетоксикарбоніламіно)-2'-циклогексилацетил)піролідин-2-карбонітрилу;
(2S)-1-((2'S)-2'-(1"-aцeтoкcіeтoкcикapбoнiлaмiнo)-4',4'-димeтилпeнтaнoїл)пipoлiдин-2-карбонітрилу;
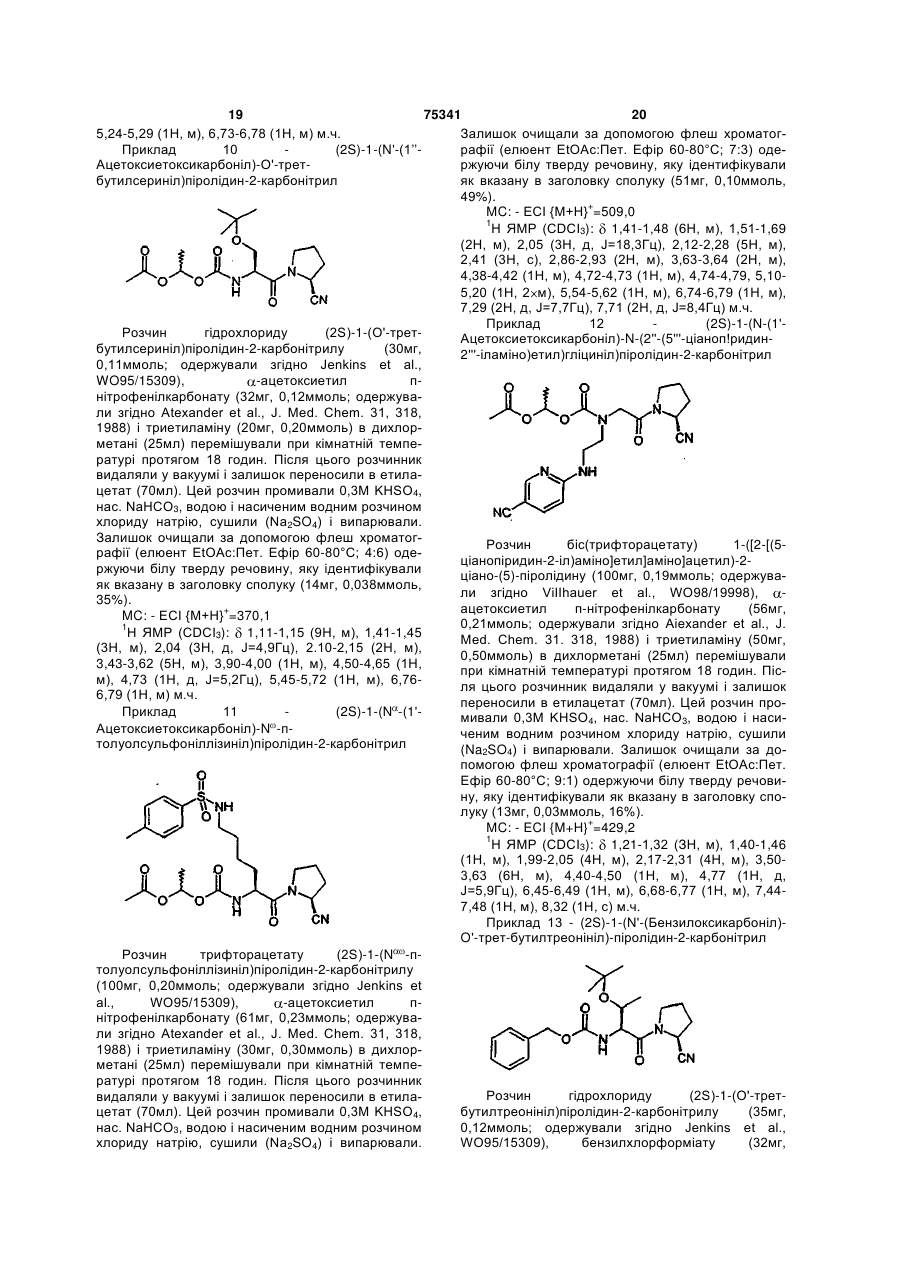
(2S)-1-(N'-(1"-ацетоксіетоксикарбоніл)-O'-трет-бутилсериніл)піролідин-2-карбонітрилу;
(2S)-1-(Nα-(1'-ацетоксіетоксикарбоніл)-Nω-п-толуолсульфоніллізиніл)піролідин-2-карбонітрилу;
(2S)-1-(N-(1'-aцeтoкcіeтoкcикapбoнiл)-N-(2"-(5"'-цiaнoпipидин-2'"-іламіно)етил)гліциніл)піролідин-2-карбонітрилу;
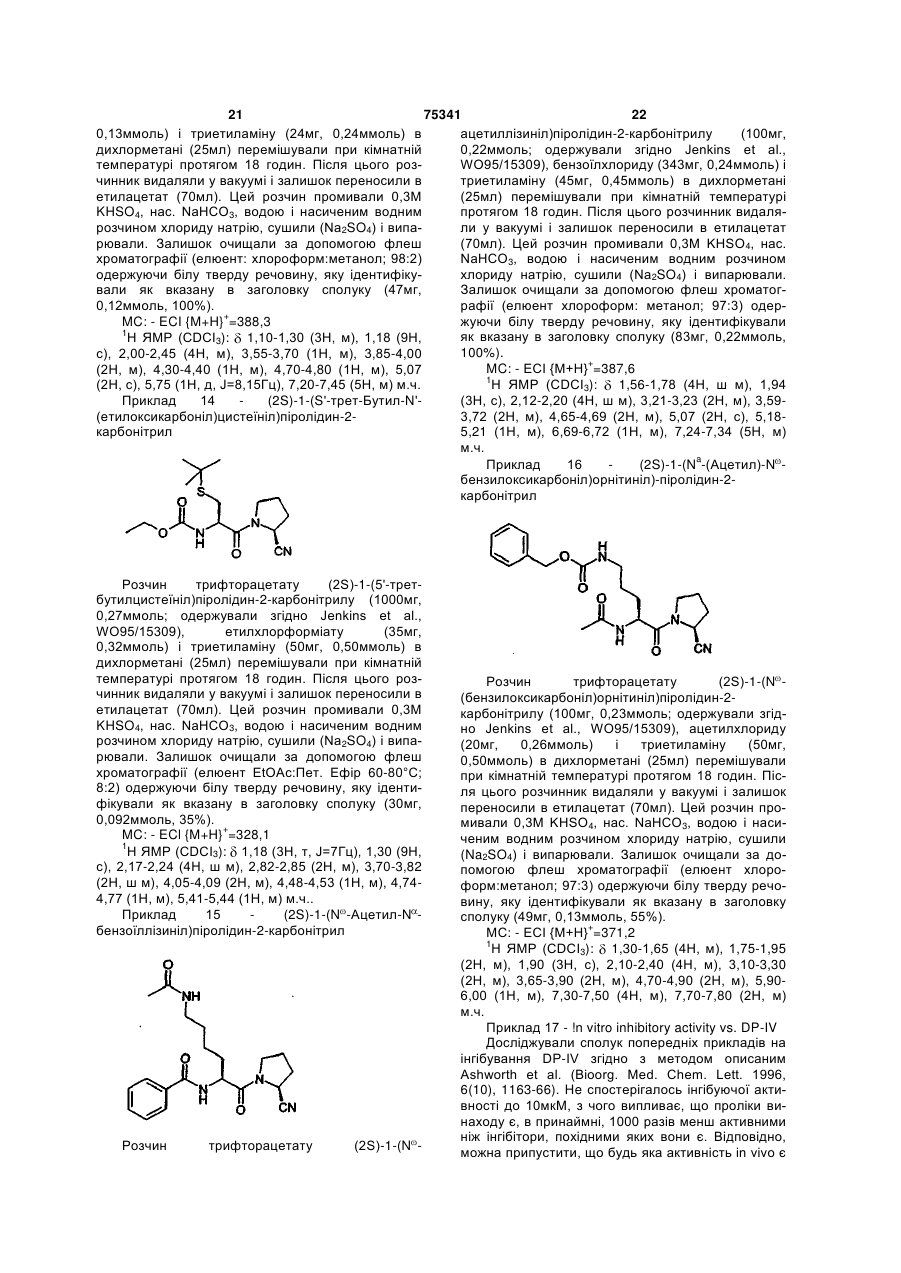
(2S)-1-(N'-(бензилоксикарбоніл)-O'-трет-бутилтреонініл)піролідин-2-карбонітрилу;
(2S)-1-(S'-трет-бутил-N'-(етилоксикарбоніл)цистеїніл)піролідин-2-карбонітрилу;
(2S)-1(Nω-ацетил-Nα-бензоїллізиніл)піролідин-2-карбонітрилу і
(2S)-1-(Nα-(ацетил)-Nω-(бензилоксикарбоніл)орнітиніл)піролідин-2-карбонітрилу.
23. Сполука згідно з будь-яким з попередніх пунктів, яку вибирають з оптичних ізомерів сполук, згаданих в будь-якому з попередніх пунктів.
24. Сполука згідно з будь-яким з попередніх пунктів, яку вибирають з фармацевтично прийнятних солей сполук, згаданих в будь-якому з попередніх пунктів.
25. Фармацевтична композиція, що містить як активний агент сполуку, яку вибирають з сполук будь-якого з попередніх пунктів або N-(Z-Val)-2-ціанопіролідин.
26. Композиція згідно з пунктом 25, яку використовують для лікування погіршення толерантності до глюкози та діабету типу 2.
27. Спосіб лікування погіршення толерантності до глюкози та діабету типу 2, що полягає у призначенні суб'єкту, що потребує такого лікування, терапевтично ефективної кількості сполук(и) згідно з будь-яким з пунктів 1-24.
28. Використання сполуки або сполук згідно з будь-яким з пунктів 1-24 у виробництві медикаментів для лікування погіршення толерантності до глюкози та діабету типу 2.
Текст
1. Сполука загальної формули 1, або її фармацевтично прийнятна сіль, R 1 N O 1 CN , X А , R7 N або N R2 ; R вибирають з Н, С1-С6 алкілу (включаючи розгалужений алкіл і циклоалкіл), (CH2)aNHW1, (CH2)bCOW2, (CH2)cOW3, CH(Me)OW4, (CH2)d-C6H4W5 і (CH2)eSW6, де а є 2-5, b е 1-4, c є 1-2, d є 1-2, e є 1-3, W1 є COW6, CO2W6 або SO2W6, W2 є ОН, NH2, OW6 або NHW6, W3 є Н або W6, W4 є Н або W6, W5 є Н, ОН або ОМе, і W6 є С1-С6 алкілом, бензилом, необов'язково заміщеним фенілом, необов'язково заміщеним гетероарилом, що можуть необов'язково містити до двох замісників, які вибирають С1-С3 алкілу, С1-С3 алкокси, F і Сl; R2 є Н або (CH2)nNH-C5H3N-Y, де n є 2-4 і Y вибирають з Н, F, Сl, NO2 і CN, або R1 і R2 разом є -(СН2)р-, де p є 3 або 4; Х вибирають з (і) одної або більшої кількості L-α-аміноацильних груп вибраних з Аlа, Arg, Asn, Asp, Cys, Gln, Glu, Gly, His, Ile, Leu, Lys, Met, Phe, Pro, Ser, Thr, Trp, Tyr і Val; 3 3 (ii) груп R CO, де R є воднем, С1-С6 алкілом (включаючи розгалужений алкіл і циклоалкіл) або фенілом; (ііі) груп R4COOC(R5)(R6)OCO, де R4 є воднем, С1С6 алкілом (включаючи розгалужений алкіл і циклоалкіл), бензилом або необов'язково заміщеним фенілом, який може бути заміщений до двох замі1 C2 8 (13) O R R2 75341 R 9 є (11) де: H N UA A (19) (21) 2002054387 (22) 30.11.2000 (24) 17.04.2006 (86) PCT/GB00/04572, 30.11.2000 (31) 9928330.1 (32) 30.11.1999 (33) GB (46) 17.04.2006, Бюл. № 4, 2006 р. (72) Еванс Девід Майкл, GB (73) ФЕРРІНГ БВ, NL (56) WO 97 40832 A (PAULY ROBERT P; PEDERSON RAY A (CA); MCINTOSH CHRISTOPHER H S (CA)) 6 November 1997 (199711-06) WO 95 15309 A (FERRING BV; JENKINS PAUL D (GB); JONES D MICHAEL (GB); SZELKE MICH) 8 June 1995 (1995-06-08) WO 98 19998 A (CIBA GEIGY AG; VILLHAUER EDWIN BERNARD (US)) 14 May 1998 (1998-05-14) HUGHES, THOMAS E. ET AL: "NVP-DPP728 (1-[[[2[(5-Cyanopyridin-2-yl)amino]ethyl]amino]acetyl]-2cyan(S)-pyrrolidine), a Slow-Binding Inhibitor of Dipeptidyl Peptidase IV" BIOCHEMISTRY (1999), 38(36), 11597-11603, ??000983860 YAMADA, TAKASHI ET AL: "Studies of unusual amino acids and their peptides. VIII. The syntheses of an iminohexapeptide as a model of bottromycin and its related iminopeptides" BULL. CHEM. SOC. JPN. (1977), 50(7), 1827-30, XP000983920 YAMADA, TAKASHI ET AL: "Studies of unusual amino acids and their peptides. IX. The synthetic study of bottromycins B1 and B2" BULL. CHEM. SOC. JPN. (1978), 51(3), 878-83, XP000983921 WO 00 56297 A (BROQUA PIERRE; FERRING BV (NL)) 28 September 2000 (2000-09-28) WO 00 56296 A (BROQUA PIERRE; FERRING BV (NL)) 28 September 2000 (2000-09-28) WO 00 55125 A (BRYANT CLIFFORD M; BUNIN BARRY A (US); AXYS PHARM INC (US); KRAYNA) 21 September 2000 (2000-09-21) US 6 172 081 B1 (R DAMON) 9 January 2001 (200101-09) WO 00 34241 A (NOVARTIS ERFIND VERWALT GMBH ;NOVARTIS AG (CH); VILLHAUER EDWIN BE) 15 June 2000 (2000-06-15) ASHWORTH D M ET AL: "2-Cyanopyrrolidides as potent, stable inhibitors of dipeptidyl peptidase IV" 2 3 75341 4 сників, які вибирають з С1-С3 алкілу, С1-С3 алкокси, (2S)-1-(N'-(1"F і Сl, і R5 і R6 є кожний, незалежно, воднем або ацетоксіетоксикарбоніл)ізолейцил)піролідин-2С1-С6 алкілом або R5 і R6 разом є -(СН2)m-, де m є карбонітрилу; 4-6; і (2S)-1-(N'-(метоксикарбоніл)ізолейцил)піролідин-2(iv) метоксикарбонілу, етоксикарбонілу і бензилоккарбонітрилу; сикарбонілу; (2S)-1-((N')-(4"-оксопент-2"-ен-2"R7 вибирають з піридилу і необов'язково заміщеіл)ізолейцил)піролідин-2-карбонітрилу; ного фенілу, який може бути заміщений до двох (2S)-1-(гліцилізолейцил)піролідин-2-карбонітрилу; замісників, які вибирають з С1-С3 алкілу, С1-С3 ал(2S)-1-(аргінілізолейцил)піролідин-2-карбонітрилу; кокси, F, Сl, NO2, CN і СО2Н; (2S)-1-((2'S)-2'-(aцeтoкcимeтoкcикapбoнiлaмiнo)R8 є Н або С1-С3 алкілом; і 3',3'-димeтилбyтaнoїл)пipoлiдин-2-карбонітрилу; R9 є Н, С1-С6 алкілом, С1-С6 алкокси або фенілом (2S)-1-((2'S)-2'-(1"-ацетоксіетоксикарбоніламіно)-2'за виключенням N-(Z-Val)-2-ціанопіролідину. циклогексилацетил)піролідин-2-карбонітрилу; 2. Сполука згідно з пунктом 1, де R1 є іншим ніж Н і (2S)-1-((2'S)-2'-(1"-aцeтoкcіeтoкcикapбoнiлaмiнo)R2 є Н. 4',4'-димeтилпeнтaнoїл)пipoлiдин-2-карбонітрилу; 3. Сполука згідно з пунктом 2, де R1 є С1-С6 алкі(2S)-1-(N'-(1"-ацетоксіетоксикарбоніл)-O'-третлом. бутилсериніл)піролідин-2-карбонітрилу; 4. Сполука згідно з пунктом 1, де R1 є Н, А є гру(2S)-1-(Nα-(1'-ацетоксіетоксикарбоніл)-Nω-п2 пою загальної формули 2 або 4, і R є (CH2)nNHтолуолсульфоніллізиніл)піролідин-2-карбонітрилу; C5H3N-Y. (2S)-1-(N-(1'-aцeтoкcіeтoкcикapбoнiл)-N-(2"-(5"'5. Сполука згідно з пунктом 4, де n є 2 і Y є CN. цiaнoпipидин-2'"-іламіно)етил)гліциніл)піролідин-26. Сполука згідно з пунктом 5, де NH замісник знакарбонітрилу; ходиться в 2-положенні і ціаногрупа знаходиться в (2S)-1-(N'-(бензилоксикарбоніл)-O'-трет5-положенні піридильного кільця. бутилтреонініл)піролідин-2-карбонітрилу; 7. Сполука згідно з пунктом 1, де А є групою зага(2S)-1-(S'-трет-бутил-N'льної формули 2 і Х є аміноацильною групою. (етилоксикарбоніл)цистеїніл)піролідин-28. Сполука згідно з пунктом 7, де аміноацильна карбонітрилу; група є лізилом або аргінілом. (2S)-1(Nω-ацетил-Nα-бензоїллізиніл)піролідин-29. Сполука згідно з пунктом 8, де аміноацильна карбонітрилу і група є аргінілом. (2S)-1-(Nα-(ацетил)-Nω10. Сполука згідно з пунктом 7, де аміноацильна (бензилоксикарбоніл)орнітиніл)піролідин-2група є гліцинілом. карбонітрилу. 11. Сполука згідно з пунктом 1, де А є групою зага23. Сполука згідно з будь-яким з попередніх пункльної формули 2 і Х є R4COOC(R5)(R6)OCO. тів, яку вибирають з оптичних ізомерів сполук, зга12. Сполука згідно з пунктом 11, де R4 є С1-С6 алданих в будь-якому з попередніх пунктів. кілом. 24. Сполука згідно з будь-яким з попередніх пунк13. Сполука згідно з пунктом 11, де один з R5 і R6 є тів, яку вибирають з фармацевтично прийнятних Н і іншій є метилом. солей сполук, згаданих в будь-якому з попередніх 14. Сполука згідно з пунктом 11, де R4 є метилом, пунктів. один з R5 і R6 є Н і іншій є метилом. 25. Фармацевтична композиція, що містить як ак15. Сполука згідно з пунктом 1, де А є групою загативний агент сполуку, яку вибирають з сполук льної формули 2 і Х є метоксикарбонілом. будь-якого з попередніх пунктів або N-(Z-Val)-216. Сполука згідно з пунктом 1, де А є групою загаціанопіролідин. льної формули 3. 26. Композиція згідно з пунктом 25, яку використо17. Сполука згідно з пунктом 1, де А є групою загавують для лікування погіршення толерантності до льної формули 4. глюкози та діабету типу 2. 18. Сполука згідно з пунктом 17, де R8 є С1-С3 ал27. Спосіб лікування погіршення толерантності до кілом. глюкози та діабету типу 2, що полягає у призна19. Сполука згідно з пунктом 18, де R8 є метилом. ченні суб'єкту, що потребує такого лікування, те20. Сполука згідно з пунктом 17, де R9 є С1-С3 алрапевтично ефективної кількості сполук(и) згідно з кілом або С1-С3 алкокси. будь-яким з пунктів 1-24. 21. Сполука згідно з пунктом 20, де R9 є метилом 28. Використання сполуки або сполук згідно з або метокси. будь-яким з пунктів 1-24 у виробництві медикамен22. Сполука згідно з пунктом 1, яку вибирають з тів для лікування погіршення толерантності до (2S)-1-((2'S)-2'-(1"-ацетоксіетоксикарбоніламіно)глюкози та діабету типу 2. 3',3'-диметилбутаноїл)піролідин-2-карбонітрилу; Представлений винахід стосується ряду нових сполук, що є корисними при лікуванні діабету типу 2, погіршення толерантності до глюкози і деяких інших станів. Фермент дипептидильна пептидаза lV (ЕС.3.4.14.5, тут використовується абревіатура DP-lV, і також відомі скорочення DPP-lV або DAPlV) втягнута в регулювання активності ряду гормонів. Одним з таких гормонів є глюкагонподібний пептид 1 (GLP-1), який включений в регулювання 5 75341 6 рівнів глюкози в крові після їжі і який перетворюR8 вибирають з Η і C1-C3 алкілу; і ється з його активної форми, GLP-1 (5-36), у неакR9 вибирають з Н, C1-C6 алкілу, C1-C6 алкокси і тивну GLP-1 (7-36) під дією DP-lV. У випадку діафенілу. бету типу 2 і погіршення толерантності до глюкози, Представлений винахід стосується нових споколи гіперглікемія може приводити до ушкодження лук, що зазначені вище, фармацевтичних компотканин, буде корисна дія ендогенного GLP-1. Відзицій, в яких, принаймні, один активний інгредієнт повідно, інгібітори DP-lV пропонуються в якості є такою сполукою, використання таких композиції лікарських засобів для лікування діабету типу 2 і для лікування деяких медичних станів і способу погіршення толерантності до глюкози. Наприклад, лікування в якому сполуки винаходу вводять суDemuth et аl. (WO97/40832) описують вплив Nб'єкту, що потребує лікування. ізолейцилпіролідину на рівень глюкози в крові в В першому аспекті, представлений винахід релевантній тваринній моделі. Однак, ці сполуки стосується ряду нових сполук, що є проліками тене є достатньо активними для використання в якорапевтично корисних інгібіторів DP-lV. Сполуками сті терапевтичних агентів. Більш ефективні інгібіпредставленого винаходу є похідні 1-(2'тори DP-lV описуються Jenkins et al. (WO95/15309) аміноацил)-2-ціанопіролідину загальної формули і Vitihauer (WO98/19998), але вони є досить неста1: більними і мають схильність до циклізації в розчині. Ця нестабільність приводить до складностей одержання і зберігання матеріалу адекватної якості для терапевтичного використання людьми. Тому, залишається потреба на агенти, що інгібують DP-lV in vivo, але які є достатньо стабільними при комерційному виготовленні. Ми розробили ряд похідних, що є хімічно стабільними, але які під дією матаболітичної активності після введення в людину вивільнюють високоаВ цій загальній формулі, А є групою, що вибиктивні інгібітори DP-lV. В літературі такі похідні, рають з 2, 3 і 4. зазвичай, називають проліками. Сполуки представленого винаходу є корисними при лікуванні діабету типу 2 і погіршення толерантності до глюкози, також як, і інших станів, в яких інактивування DP-lV активності гормону приводить до терапевтичного ефекту. Сполуками згідно з винаходом є похідні 1-(2'аміноацил)-2-ціанопіролідину загальної формули 1: Пунктирна лінія показує ковалентний зв'язок, що зв'язує атом азоту А з 1. Група X є ацильною або оксикарбонільною групою. Придатними групами є: (і) аміноацильні групи, що відповідає одній з природних амінокислот аланін (Ala), аргінін (Arg), аспаргін (Asn), аспарагінова кислота (Asp), цистеїн де А вибирають з груп 2, 3 і 4; X вибирають з (Cys), глютамін (Gln), глютамінова кислота (Glu), аміноацильної групи, що відповідає одній з прирогліцин (Gly), гістидин (His), ізолейцин (lle), лейцин дних амінокислот, ацильної групи R3CO, групи (Leu), лізин (Lys), метіонін (Met), фенілаланін 4 5 6 R COOC(R )(R )OCO, метоксикарбонілу, етоксика(Phe), пролін (Pro), серии (Ser), треонін (Thr), трипрбонілу і бензилоксикарбонілу; тофан (Тrр), тирозин (Туr) і валін (Val); R1 вибирають з Н, C1-C6 алкілу, (CH2)aNHW1, (іі) ацильні групи R3CO, де R3 є воднем, C1-C6 (CH2)bCOW2, (CH2)cOW3, CH(Me)OW4, (CH2)d-C6H4алкілом або фенілом; W5 і (CH2)eSW6, де а є 2-5, b є 1-4, с є 1-2, d є 1-2, c (ііі) ацилоксиметиленоксикарбонільні групи 1 6 6 6 2 є 1-3, W є COW , CO2W або SO2W , W є ОН, R4COOC(R5)(R6)OCO, де R4 є воднем, C1-C6 алкіNH2, OW6 або NHW6, W3 є Η або W6, W4 є Н або лом, бензилом або фенілом, який може бути заміW6, W5 є Н, ОН або ОМе, і W6 є C1-C6 алкілом, нещений C1-C3 групою, і R5 і R6 є кожний, незалежно, обов'язково, заміщеним фенілом, необов'язково, воднем або C1-C6 алкілом або R5 і R6 разом є позаміщеним гетероарилом або бензилом, і ліметиленовим фрагментом -(СН2)m-, де m є 4-6; і R2 вибирають з Η і (CH2)nNH-C5H3N-Y, де n є 2(iv) метоксикарбоніл, етоксикарбоніл і бензи4 і Υ є Н, F, О, NO2 або CN, або R1 і R2 разом є локсикарбоніл. (СН2)Р-, де ρ є 3 або 4; R1 є залишком природної амінокислоти або її R3 вибирають з Н, C1-C6 алкілу і фенілу; аналогом. Більш специфічно, R1 вибирають з водR4 вибирають з Н, C1-C6 алкілу, бензилу і неню, C1-C6 алкілу, (CH2)aNHW1, (CH2)bCOW2, обов'язково заміщеного фенілу; (СН2)сОW3, CH(M2)OW4, (CH2)d-C6H4-W5 і R5 і R6 кожний, незалежно, вибирають з Η і C1(CH2)eSW6, де а є 2-5, b є 1-4, с є 1 або 2, d є 1 або C6 алкілу або разом є -(СН2)m-, де m є 4-6; 2, e є 1-3, W1 є COW6, CO2W6 або SO2W6, W2 є ОН, R7 вибирають з піридилу і необов'язково заміNH2, OW6 або NHW6, W3 є Η або W6, W4 є Н або щеного фенілу; W6, W5 є Н, ОН або ОМе, і W6 є C1-C6 алкілом, не 7 75341 8 обов'язково, заміщеним фенілом, необов'язково, переважному втіленні, ΝΗ група знаходиться в 2заміщеним гетероарилом або бензилом. Придатположенні і CN група знаходиться в 5-положенні ними необов'язковими замісниками гетероарилу і піридинового кільця. фенілу є C1-C3 алкіл і C1-C3 алкокси, також як і В іншому переважному втіленні, представлеатоми фтору або хлору. Можуть бути присутні до ний винахід стосується сполуки загальної формудвох таких замісників. ли 1, в якій А є групою загальної формули 2 і X є R2 є воднем або групою -(CH2)nNH-C5H3N-Y, де аміноацильною групою. В одному з більш переваn є 2-4, C5H3N є дизаміщеним піридилом, і Υ є вожних втілень, X є аміноацильною групою, що відднем, атомом галогену, таким як фтор або хлор, повідає основній амінокислоті, такій як лізин або нітрогрупою або ціаногрупою. аргінін, і більш переважно аргінін. В іншому більш Альтернативно, R1 і R2 разом можуть бути переважному втіленні, X є аміноацильною групою, (СН2)р-, де p є 3 або 4. що відповідає гліцину. R7 вибирають з піридилу і необов'язково заміВ іншому переважному втіленні, представлещеного фенілу. Придатними необов'язковими заний винахід стосується сполуки загальної формумісниками є C1-C3 алкіл, C1-C3 алкокси, атоми гали 1, в якій А є групою загальної формули 2 i Χ є логену, нітрогрупи, ціаногрупи і карбоксигрупи. групою R4COOC(R5)(R6)OCO. В одному з більш Можуть бути присутні до двох таких замісників. переважних втілень, R4 є C1-C6 алкілом. В іншому R8 є воднем або C1-C3 алкілом. більш переважному втіленні, один з R5 і R6 є Η і 9 R є воднем, C1-C6 алкілом, C1-C6 алкокси або інший є метилом. Більш переважно, R4 і один з R5 і фенілом. R6 є метилом і інший з R5 і R6 є Н. В контексті представленого опису, термін "алВ іншому переважному втіленні, представлекіл" стосується розгалужених і нерозгалужених ний винахід стосується сполуки загальної формуалкільних груп, також як і циклоалкільних груп, ли 1, в якій А є групою загальної формули 2 і X є наприклад, C1-C6 алкілом є метил, етил, ізопропіл, метоксикарбонілом. трет-бутил, неопентил і циклогексил. Також, терВ іншому переважному втіленні, представлемін "гетероарил" стосується моно циклічних п'яти- і ний винахід стосується сполуки загальної формушести-членних ароматичних кілець, що містять від ли 1, в якій А є групою загальної формули 3. одного до трьох гетеро атомів, що вибирають з В іншому переважному втіленні, представлеазоту, кисню і сірки. Наприклад, гетероарилом є ний винахід стосується сполуки загальної формупіроліл, піридил, фурил, тієніл, імідазоліл, тіазоліл, ли 1, в якій А є групою загальної формули 4. В ізоксазоліл, тіадіазоліл, піримідил і піразиніл. більш переважному втіленні R8 є C1-C3 алкілом, і Деякі сполуки представленого винаходу мають більш переважно, є метилом. В іншому більш пе9 кислі і основні властивості і тому можуть існувати у реважному втіленні, R є C1-C3 алкілом або C1-C3 вигляді солей. Настільки, що солі є нетоксичними, алкокси, і більш переважно, є метилом або метока інакше є фармацевтично прийнятними, і вони си. Сполуки, що приведені тут далі в більш ніж включені в рамки винаходу. Прикладами таких одному з цих переважних втілень є особливо песолей є, але не обмежуються, ацетати, гідрохлореважними. Найбільш переважним втіленням риди, сульфати, фосфати і бензоати основних представленого винаходу є сполука, яку вибирасолей, і натрієві, калієві і тетаралкіламонієві солі ють з: кислих сполук. (2S)-1-((2'S)-2'-(1’’При умові, коли R1 є Н, сполуки загальної фоацетоксиетоксикарбоніламіно)-3',3'рмули 1 мають два стереогенічні центри (асиметдиметилбутаноїл)піролідин-2-карбонітрил; ричні атоми вуглецю), показані нижче як С*. Сте(2S)-1-(N'-(1’’реохімія цих двох позицій є показаною на ацетоксиетоксикарбоніл)ізолейцил)піролідин-2малюнках. Деякі втілення R1 і X дозволяють ввокарбонітрил; дити наступні стереогенічні центри, і ці сполуки (2S)-1-(N'винаходу можуть існувати у вигляді епімерів, (метоксикарбоніл)ізолейцил)піролідин-2включаючи діастереомери. Всі такі оптичні ізомекарбонітрил; ри, включаючи суміші таких оптичних ізомерів роз(2S)-1-((N')-(4’’-оксопент-2’’-ен-2’’глядаються в межах цього винаходу. іл)ізолейцил)піролідин-2-карбонітрил; (2S)-1-(гліцилізолейцил)піролідин-2карбонітрил; (2S)-1-(аргінілізолейцил)піролідин-2карбонітрил; (2S)-1-((2'S)-2'(ацетоксиметоксикарбоніламіно)-3',3'диметилбутаноїл)піролідин-2-карбонітрил; В переважному втіленні, представлений вина(2S)-1-((2'S)-2'-(1’’хід стосується сполуки загальної формули 1, в якій ацетоксиетоксикарбоніламіно)-2'1 2 R є іншим ніж Η і R , де присутній, є Н. В більш циклогексилацетил)піролідин-2-карбонітрил; переважному втіленні, R1 є C1-C6 алкілом. (2S)-1-((2'S)-2'-(1’’В іншому переважному втіленні, представлеацетоксиетоксикарбоніламіно)-4',4'ний винахід стосується сполуки загальної формудиметилпентаноїл)піролідин-2-карбонітрил; ли 1, в якій R1 є Η і А вибирають з груп загальних (2S)-1-(N'-(1’’-aцeτoкcиeтoкcикapбoнIл)-O'-тpeт2 формул 2 і 4 і R є -(CH2)nNH-C5H3N-Y. в більш бyтилcepиніл)піpoлiдин-2-карбонітрил; переважному втіленні n є 2 і Υ є CN. В найбільш (2S)-1-(N’’-(1'-aцeτoкcиeτoкcикapбoніл)-N -п 9 75341 10 τoлyoлcyльфoнiллізиніл)піpoлідин-2-карбонітрил; H2N(CH2)4 (лізин) i H2NC(:NH)(CH2)3 (аргінін). По(2S)-1-(N-(1'-aцeтoкcиeτoкcикapбoнiл)-N-(2’’винно бути зрозуміло для спеціаліста в хімії пеп(5'''-ціaнoпіpидин-2’’’тидів, що деякі з цих згаданих бокових ланцюгів іламіно)етил)гліциніл)піролідин-2-карбонітрил; містять функціональні групи, що є реакційно здат(2S)-1-(N'-(бeнзилoкcикapбoнίл)-О'-тpeтними за умов проведення конденсування двох бyтилтpeoнінiл)піpoлiдин-2-кapбoнітpил; фрагментів. Ці функціональні групи повинні бути (2S)-1-(S'-тpeт-бyтил-N'захищені використовуючи придатну захисну групу. (eτилoкcикapбoнiл)циcтeїніл)піpoлiдин-2Такі групи описані в, наприклад, ["Protective Groups кapбoнiтpил; in Organic Synthesis", T.W. Greene, Wileylnterscience, 1981]. Chn* означає ті ж самі бокові (2S)-1-(N -ацетил-Na-бензоїллізиніл)піролідинзамісники, але з будь якими захисними групами. 2-карбонітрил; і Відповідно, PG означає амінозахисну групу. (2S)-1-(Na-(aцeτил)-N 1-(2'-аміноацил)-2-ціанопіролідин 5 можна (бeнзилoкcикapбoнiл)opнiтинiл)пipoлiдин-2сконденсувати з прийнятно захищеною амінокискapбoнiтpил лотою 6 одержуючи проміжну сполуку 7 викорисСполуки згідно з представленим винаходом товуючи різноманітні умови, що добре відомі спеможна одержати використовуючи стандартні меціалістам в хімії пептидів. Зазвичай, два тодики, що добре відомі спеціалістам в цій галузі. компоненти розчиняють у в прийнятному розчинВ багатьох випадках, придатним вихідним матерінику, який є нормальним апротонним розчинниалом є амін загальної формули 5, в якому R1 і R2 ком, таким як дихлорметан або диметилформамід мають значення приведені тут вище. або їх суміш, і розчин охолоджують до 0°С або нижче. До розчину додають один або два еквіваленти амінооснови, такої як діізопропілетиламін або диметиламінопіридин. Потім додають конденсуючий агент і суміш перемішують до зникнення вихідних матеріалів, що визначають використовуючи, наприклад, аналітичну тонкошарову хроматографію. Якщо реакція іде повільно, може бути бажано залишити суміш для нагрівання до кімнатної Синтез таких сполук описаний в, наприклад, температури для прискорення процесу. Придат[Jenkins еt аl. (WO95/15309), Villhauer ним конденсуючими агентами є DCC (дициклогек(WO98/19998), Ashworth еt аl. (Bioorg. Med. Chem. силкарбодіімід), ВОР (гексафторфосфат (бензтриLett. 1996, 6(10), 1163-66) і Li еt аl. (Arch. Biochem. азол-1-ілокси)трис(диметиламіно)фосфонію), Biophys. 1995, 323(1), 148-54)]. Сполуки, що не РуВОР (гексафторфосфат (бензтриазол-1були окремо описані в цих публікаціях можна одержати використовуючи модифіковані методики ілокси)трипіролідинфосфонію), РуВrоР (гексафописані в цих публікаціях. Стадії включають одерторфосфат бромтрипіролідинфосфонію) і HBTU жання сполук винаходу з сполук загальної форму(гексафторфосфат О-(бензтриазол-1-іл)-N,N,N',N'ли 5, що залежать від природи групи А. тетраметилуронію). Зняття захисту з проміжної сполуки 7 дає цільову сполуку 1A (тобто сполуку загальної форму(і) А = ; X = аміноацильна група. ли 1 з А загальної формули 2 і X є аміноацильним залишком). Замість 6 можна використати придатно захищений пролін одержуючи аналог сполуки X - залишок пролілу. Всі захищені амінокислоти одержували з комерційних джерел. На Схемі 1 показано одержання цих сполук в дві стадії. Chn означає залишок амінокислоти. В залежності від амінокислоти, що використовується, Chn може бути Η (для гліцину), СН3 (аланін), (СН3)2СН (валін), (СН3)2СНСН2 (лейцин), СН3СН2CH(CH3) (ізолейцин), С6Н5СН2 (фенілаланін), НОС6Н4СН2 (тирозин), C8H6NCH2 (триптофан), НООССН2 (аспарагінова кислота), НООССН2СН2 (глютамінова кислота), H2NOCCH2 (аспарагін), H2NOCCH2CH2 (глютамін), НОСН2 (серин), СН3СН(ОН) (треонін), HSCH2 (цистеїн), CH3SCH2CH2 (метіонін), C3H3N2CH2 (гістидин), На Схемі 2 показано одержання цих сполук. Вихідну сполуку 5 обробляють ацилхлоридом або ангідридом в апротонному розчиннику і в присутності аміно основи, такої як описано вище, одержуючи продукт 1B. Коли R3=Η не можна використовувати ацилхлорид або ангідрид. В цьому випадку використовують змішаний ангідрид. Реагент можна одержати загальновідомими способами з мурашиної кислоти і оцтового ангідриду. 11 (III) А = ; X = R4COOC(R5)(R6)OCO. 75341 12 толуолсульфонова кислота. Реакцію проводять в розчиннику, такому як циклогексан або толуол при підвищеній температурі, такій як температура кипіння розчинника. Безперервно видаляють воду або за допомогою азеотропної відгонки, або використовуючи водопоглинаючий агент, такий як активовані молекулярні сита. Альдегіди 9 одержують з комерційних джерел. (vi) A = На Схемі 3 показано одержання цих сполук. Вихідну сполуку 5 обробляють пнітрофенілкарбонатом 8 в апротонному розчиннику і в присутності амінооснови, такої як описано вище, одержуючи продукт 1C. Карбонат одержували згідно методики описаної [AIexander еt аl., J. Med. Chem. 31,318,1988]. (iv) A = ; Χ = метоксикарбоніл, етоксикарбоніл, бензилоксикарбоніл. На Схемі 4 показано одержання цих сполук. Вихідну сполуку 5 обробляють хлорформіатом в апротонному розчиннику і в присутності амінооснови, такої як описано вище, одержуючи продукт 1D. Оскільки бензилхлорформіат (ВnОСОCI) не є дуже стабільним, його можна замінити бензил 1сукцинімідилкарбонатом (BnOCONSu). Ці і всі інші хлорформіати одержували з комерційних джерел. (v) A = . На Схемі 5 показано одержання цих сполук. Вихідна сполука 5A (тобто сполуки загальної формули 5 з R2=Н) реагує з альдегідом 9 в присутності кислотного каталізатору, такого як, наприклад, п . На Схемі 6 показано одержання цих сполук. Вихідна сполука 5 реагує з 1,3-дикарбонільною сполукою 10 в апротонному розчиннику і в присутності амінооснови, як описано вище, при кімнатній температурі. Дикарбонільні сполуки 10 одержують з комерційних джерел або можна одержати згідно з добре відомими методиками. Звичайно, можливі і інші синтетичні шляхи. Зазвичай вони відрізняються від описаних вище порядком проведення стадій. Два приклади показані на Схемі 7. Проміжну сполуку 11 одержують згідно з методиками описаними раніше. Її можна сконденсувати з пролінамідом (12) згідно з методикою описаною на Схемі 1 одержуючи проміжну сполуку 13. Її можна дегідратувати шляхом обробки трифтороцтовим ангідридом одержуючи цільову сполуку. Альтернативно, проміжну сполуку 11 можна сконденсувати з проліннітрилом (14) одержуючи цільові сполуки безпосередньо. Сполуки загальної формули 1 (сполуки представленого винаходу) метаболізують в тілі до сполук загальної формули 5. Ці метаболіти є інгібіторами DP-IV. 13 Як обговорювалось раніше, інгібітори DP-IV, як припускають, є корисними при лікуванні деяких медичних станів. Таким чином, сполуки представленого винаходу є корисними при лікуванні цих станів медичних станів. Зокрема, сполуки представленого винаходу є корисними при лікуванні погіршення толерантності до глюкози і діабету типу 2. Вони також можуть бути корисними при лікуванні захворювань, таких як безпліддя в наслідок полікістозного синдрому яєчників. Наступним використанням є лікування недостатності гормону росту, що обумовлює малий зріст, інші медичні стани також включені в рамки цього винаходу. Для використання при лікуванні цих захворювань, сполуки винаходу зазвичай включають у склад фармацевтичних композицій і формують в залежності від шляху введення. Такі композиції є другим аспектом представленого винаходу. Фармацевтична композиція може містити інші фармацевтично прийнятні екcціпієнти, що зазвичай використовуються в цій галузі, такі як наповнювачи, розріджувачи, дисперганти, консерванти, барвники і смакові агенти і їм подібні. Вибір ексціпієнтів буде залежати від способу формування композиції і шляху її введення. Композиції можна призначати шляхами, що зазвичай використовуються в цій галузі. Наприклад, композицію можна сформувати у таблетку, капсулу, сироп або порошок для орального введення, у млинець або облатку для сублінгвального або букального введення, у супозиторій для ректального або вагінального введення, у розчин, суспензію або порошок для назального введення, у крем або лосьйон для місцевого введення, у пластир для трансдермального використання або у розчин або суспензію для підшкірного, внутрішньом'язового або внутрішньовенного введення. Форми для ін'єкцій можуть містити інкапсульовані і інші рецептури з контрольованим вивільненням, що відомі в цій галузі для депо призначення. Переважною композицією є таблетка для орального призначення. В третьому аспекті, винахід стосується способу лікування інтолерантності глюкози або діабету типу 2, де особі, що потребує такого лікування, призначають терапевтично ефективну кількість сполуки, що описана вище. Режим дозування буде визначати лікар беручи до уваги характеристики пацієнта. Доза буде знаходиться в інтервалі від 1мг до 500мг від одного разу на день до чотирьох разів на день. Представлений раніше опис надалі описується за допомогою ряду прикладів. Вони приведені з ціллю демонстрації виконання винаходу, але вони не повинні розглядатися як такі, що обмежують рамки винаходу. Приклади Розчинники і реагенти використовують безпо 75341 14 середньо без попередньої очистки. Структури всіх проміжних сполук було підтверджено за допомогою 1Н ЯМР. Кінцеві продукти характеризували за допомогою масспектрометрії і/або елементного аналізу. Приклад 1 (2S)-1-((2'S)-2'-(1’’Ацетоксиетоксикарбон:ламіно)-3',3'диметилбутаноїл)піролідин-2-карбонітрил Розчин гідрохлориду (2S)-1-((2'S)-2'-аміно-3',3'диметилбутаноїл)піролідин-2-карбонітрилу (180мг, 0,73ммоль; одержували згідно Jenkins еt аl., WO95/15309), -ацетоксиетил пнітрофенілкарбонату (220мг, 0,82ммоль; одержували згідно Atexander еt аl., J. Med. Chem. 31, 318, 1988) і триетиламіну (90мг, 0,90ммоль) в дихлорметані (25мл) перемішували при кімнатній температурі протягом 18 годин. Після цього розчинник видаляли у вакуумі і залишок переносили в етилацетат (70мл). Цей розчин промивали 0,3М KHSO4, нас. NaНСО3, водою і насиченим водним розчином хлориду натрію, сушили (Na2SO4) і випарювали. Залишок очищали за допомогою флеш хроматографії (елюент ЕtOАс:Пет. Ефір 60-80°С; 3:7) одержуючи білу тверду речовину, яку ідентифікували як вказану в заголовку сполуку (170мг, 0,50ммоль, 68%). MC: - ECI {М+Н}+=340,2 1 Н ЯМР (CDCI3): 1,02, 1,03 (9Н, 2 с), 1,421,46 (3Н, м), 2,03, 2,05 (3Н, 2 ), 2,15-2,25 (4Н, м), 3,69-3,76 (2Н, м), 4,23-4,28 (1Н, м), 4,77-4,79 (1Н, м), 5,43 (1Н, д, J=9,5Гц), 6,73-6,77 (1Η, м) м.ч. Приклад 2 (2S)-1-(N'-(1’’Ацетоксиетоксикарбоніл)ізолейцил)піролідин-2карбонітрил Розчин гідрохлориду (2S)-1(ізолейцил)піролідин-2-карбонітрилу (500мг, 2,04ммоль; одержували згідно Jenkins еt аl., WO95/15309), -ацетоксиетил пнітрофенілкарбонату (610мг, 2,27ммоль; одержували згідно Aiexander еt аl., J. Med. Chem. 31. 318, 1988) і триетиламіну (250мг, 2,50ммоль) в дихлорметані (40мл) перемішували при кімнатній температурі протягом 18 годин. Після цього розчинник видаляли у вакуумі і залишок переносили в етилацетат (70мл). Цей розчин промивали 0,3М KHSO4, нас. NaНСО3, водою і насиченим водним розчином хлориду натрію, сушили (Na2SO4) і випарювали. Залишок очищали за допомогою флеш хроматографії (елюент ЕtOАс:Пет. Ефір 60-80°С; 3:7) одержуючи безбарвне масло, яке ідентифікували як 15 75341 16 вказану в заголовку сполуку (480мг, 1,42ммоль, MC: - ECI {М+Н}+=292,3 1 70%). Н ЯМР (CDCI3): 0,87-0,98 (6Н, м), 1,19-1,25 + MC: - ECI {M+H} =340,0 (1Н, м), 1,61-1,69 (2Н, м), 1,84 (3Н, с), 1,98 (3Н, с), 1 Н ЯМР (CDCI3): 0,86-0,89 (6Н, м), 0,92-0,97 2,15-2,25 (4Н, м), 3,49-3,54 (1Н, м), 3,62-3,69 (1Н, (1Н, м), 1,41-1,45 (3Н, м), 150-1,80 (2Н, м), 2,02 м), 3,95-3,98 (1Н, м), 4,75-4,79 (1Н, м), 4,98 (1Н, с), (3Н, д, J=5,2Гц), 2,14-2,27 (4Н, м), 3,60-3,75 (2Н, 11,09 (1Н, д, J=8,1 Гц) м.ч. м), 4,23-4,26 (1Н, т, J=7,6Гц), 4,77 (1Н, д, J=2,3Гц), Приклад 5 - (2S)-1-(Гліцилізолейцил)піролідин5,30-5,50 (1Н, м), 6,73-6,77 (1Н, м) м.ч. 2-карбонітрил Приклад 3 (2S)-1-(N'(Метоксикарбоніл)ізолейцил)піролiдин-2карбонітрил Розчин гідрохлориду (2S)-1(ізолейцил)піролідин-2-карбонітрилу (300мг, 1,22ммоль; одержували згідно Jenkins еt аl., WO95/15309), метилхлорформіату (125мг, 1,3ммоль) і триетиламіну (150мг, 1,50ммоль) в дихлорметані (40мл) перемішували при кімнатній температурі протягом 18 годин. Після цього розчинник видаляли у вакуумі і залишок переносили в етилацетат (70мл). Цей розчин промивали 0,3М KHSO4, нас. NaНСО3, водою і насиченим водним розчином хлориду натрію, сушили (Na2SO4) і випарювали. Залишок очищали за допомогою флеш хроматографії (ЕtOАс:Пет. Ефір 60-80°С; 4:6) одержуючи безбарвне масло, яке ідентифікували як вказану в заголовку сполуку (310мг, 1,16ммоль, 95%). MC:- ECІ {М+Н}+=268,2 1 Н ЯМР (CDCI3): 0,85-0,95 (6Н, м), 1,10-1,25 (1Н, м), 1,54-1,77 (2Н, м), 2,11-2,26 (4Н, м), 3,62 (3Н, с), 3,66-3,79 (2Н, м), 4,21 (1Н, т, J=9,2Гц), 4,74-4,78 (1Н, м), 5,30 (1Н, д, J=9,1Гц) м.ч. Приклад 4 - (2S)-1-((N')-(4’’-Оксопент-2’’-ен-2’’іл)ізолейцил)пірол!дин-2-карбонітрил Розчин гідрохлориду (2S)-1(ізолейцил)піролідин-2-карбонітрилу (150мг, 0,61ммоль; одержували згідно Jenkins еt аl., WO95/15309), 2,4-пентадіону (68мг, 0,68ммоль) і триетиламіну (75мг, 0,75ммоль) в дихлорметані (25мл) перемішували при кімнатній температурі протягом 18 годин. Після цього розчинник видаляли у вакуумі і залишок переносили в етилацетат (70мл). Цей розчин промивали 0,3М KHSO4, нас. NaНСО3, водою і насиченим водним розчином хлориду натрію, сушили (Na2SO4) і випарювали. Залишок очищали за допомогою флеш хроматографії (елюент ЕtOАс:Пет. Ефір 60-80°С; 7:3) одержуючи безбарвне масло, яке ідентифікували як вказану в заголовку сполуку (85мг, 0,29ммоль, 47%). (а) (2S)-1-()золейцил)піролідин-2-карбонітрил До розчину гемігідрату Вос-ізолейцину (0,96г, 4ммоль) і РуВОР (2,34г, 4,5ммоль) в дихлорметані (25мл) додавали DIPEA (1,74мл, 10ммоль). До цього розчину додавали твердий гідрохлорид (S)піролідин-2-карбонітрилу (0,60г, 4,5ммоль) після чого додавали ще одну порцію DIPEA (697мкл, 4ммоль). Реакційну суміш перемішували протягом 2г. Розчинник видаляли на роторному випаровувачи і залишок переносили в етилацетат. Одержаний розчин промивали 0,3М бісульфатом натрію (2 ), насиченим бікарбонатом натрію (2 ), водою і насиченим хлоридом натрію. Органічну фазу сушили над безводним сульфатом натрію і розчинник видаляли на роторному випаровувачи. Залишок розчиняли в суміші ТФО (95%) і води (5%). Через 1г більшу частину ТФО і води видаляли при пониженому тиску, і залишок розтирали з ефіром, одержуючи осад. Осад збирали і сушили в вакуумі одержуючи трифторацетатну сіль вказаного в заголовку продукту у вигляді білої твердої речовини; вихід 0,58г (1,8ммоль, 45%). (б) (2S)-1-(Гліцилізолейцил)піролідин-2карбонітрил До розчину Вос-гліцину (0,21г, 1,2ммоль) і РуВОР (0,62г, 1,2ммоль) в дихлорметані (3мл) додавали DIPEA (522мкл, 3ммоль). До цього розчину додавали продукт Прикладу 5а (0,28г, 0,9ммоль) після чого додавали ще одну порцію DIPEA (157мкл, 0,9ммоль). Реакційну суміш перемішували протягом ночі. Розчинник видаляли на роторному випаровувачи і залишок переносили в етилацетат. Одержаний розчин промивали 0,3М бісульфатом натрію (2 ), насиченим бікарбонатом натрію (2 ), водою і насиченим хлоридом натрію. Органічну фазу сушили над безводним сульфатом натрію і розчинник видаляли на роторному випаровувачи. Залишок розчиняли в суміші ТФО (95%) і води (5%) і суміш перемішували протягом ночі. Більшу частину ТФО і води видаляли при пониженому тиску. Залишок очищали за допомогою ВЕРХ з оберненою фазою одержуючи трифторацетатну сіль кінцевого продукту у вигляді білого порошку; вихід 171мг (50%). Приклад 6 - (2S)-1-(Аргінілізолейцил)піролідин2-карбонітрил 17 До розчину Boc-Arg(Mtr)-OH (0,58г, 1,2ммоль) і РуВОР (0,62г, 1,2ммоль) в дихлорметані (3мл) додавали DIPEA (522мкл, 3ммоль). До цього розчину додавали продукт Прикладу 5а (0,28г, 0,9ммоль) після чого додавали ще одну порцію DIPEA (157мкл, 0,9ммоль). Реакційну суміш перемішували протягом ночі. Розчинник видаляли на роторному випаровувачи, і залишок переносили в етилацетат. Одержаний розчин промивали 0,3М бісульфатом натрію (2 ), насиченим бікарбонатом натрію (2 ), водою і насиченим хлоридом натрію. Органічну фазу сушили над безводним сульфатом натрію і розчинник видаляли на роторному випаровувачи. Залишок розчиняли в суміші ТФО (95%) і води (5%) і суміш перемішували протягом ночі. Більшу частину ТФО і води видаляли при пониженому тиску і залишок розтирали з ефіром. Ефірний шар декантували і залишок очищали за допомогою ВЕРХ з оберненою фазою одержуючи трифторацетатну сіль кінцевого продукту у вигляді білого порошку; вихід 83мг (19%). Приклад 7 (2S)-1-((2'S)-2'(Ацетоксиметоксикарбоніламіно)-3',3'-диметилбутаноїл)піролідин-2-карбонітрил Розчин гідрохлориду (2S)-1-((2'S)-2'-аміно-3',3'диметилбутаноїл)піролідин-2-карбонітрилу (150мг, 0,61ммоль; одержували згідно Jenkins еt аl., WO95/15309), ацетоксиметил пнітрофенілкарбонату (168мг, 0,66ммоль; одержували згідно Atexander еt аl., J. Med. Cherrt. 31, 318, 1988) і триетиламіну (70мг, 0,70ммоль) в дихлорметані (25мл) перемішували при кімнатній температурі протягом 18 годин. Після цього розчинник видаляли у вакуумі і залишок переносили в етилацетат (70мл). Цей розчин промивали 0,3М KHSO4, нас. NaНСО3, водою і насиченим водним розчином хлориду натрію, сушили (Na2SO4) і випарювали. Залишок очищали за допомогою флеш хроматографії (елюент ЕtOАс:Пет. Ефір 60-80°С; 4:6) одержуючи білу тверду речовину, яку ідентифікували як вказану в заголовку сполуку (188мг, 0,58ммоль, 95%). MC: - ECI {М+Н}+=326,1 1 Н ЯМР (CDCI3): 1,03 (9Н, с), 2,09 (3Н, с), 2,16-2,24 (4Н, м), 3,72-3,77 (2Н, м), 4,25 (1Н, д, J=9,6Гц), 4,77-4,80 (1Н, м), 5,68 (1Н, д), 5,68 (2Н, с) м.ч. Приклад 8 (2S)-1-((2'S)-2'-(1’’Ацетоксиетоксикарбоніламіно)-2'циклогексилацетил)пірол!дин-2-карбонітрил 75341 18 Розчин трифторацетату (2S)-1-((2'S)-2'-аміно2'-циклогексилацетил)піролідин-2-карбонітрилу (100мг, 0,28ммоль; одержували згідно Jenkins еt аl., WO95/15309), -ацетоксиетил пнітрофенілкарбонату (76мг, 0,29ммоль; одержували згідно Atexander еt аl., J. Med. Chem. 31, 318, 1988) і триетиламіну (35мг, 0,35ммоль) в дихлорметані (25мл) перемішували при кімнатній температурі протягом 18 годин. Після цього розчинник видаляли у вакуумі і залишок переносили в етилацетат (70мл). Цей розчин промивали 0,3M KHSO4, нас. NaНСО3, водою і насиченим водним розчином хлориду натрію, сушили (Na2SO4) і випарювали. Залишок очищали за допомогою флеш хроматографії (елюент ЕtOАс:Пет. Ефір 60-80°С; 4:6) одержуючи білу тверду речовину, яку ідентифікували як вказану в заголовку сполуку (43мг, 0,12ммоль, 41%). MC: - ECI {М+Н}+=366,2 1 Н ЯМР (CDCI3): 0,97-1,21 (4Н, м), 1,40-1,48 (3Н, м), 1,67-1,77 (7Н, м), 2,02 (3Н, д, J=7,8Гц), 2,11-2,26 (4Н, м), 3,65-3,73 (2Н, м), 4,16-4,22 (1Н, м), 4,76 (1Н, д, J=4,2Гц), 5,36-5,41 (1H, м), 6,736,77 (1Н, м) м.ч. Приклад 9 (2S)-1-((2'S)-2'-(1’’Ацетоксиетоксикарбоніламіно)-4',4'-диметилпентаноїл)піролідин-2-карбонітрил Розчин трифторацетату (2S)-1-((2'S)-2'-аміно4',4'-диметилпентаноїл)піролідин-2-карбонітрилу (100мг, 0,30ммоль; одержували згідно Jenkins еt аl., WO95/15309), -ацетоксиетил пнітрофенілкарбонатгу (87мг, 0,33ммоль; одержували згідно Atexander еt аl., J. Med. Chem. 31. 318, 1988) і триетиламіну (40мг, 0,40ммоль) в дихлорметані (25мл) перемішували при кімнатній температурі протягом 18 годин. Після цього розчинник видаляли у вакуумі і залишок переносили в етилацетат (70мл). Цей розчин промивали 0,3М KHSO4, нас. NaНСО3, водою і насиченим водним розчином хлориду натрію, сушили (Na2SO4) і випарювали. Залишок очищали за допомогою флеш хроматографії (елюент ЕtOАс:Пет. Ефір 60-80°С; 4:6) одержуючи білу тверду речовину, яку ідентифікували як вказану в заголовку сполуку (32мг, 0,09ммоль, 31%). MC: - ЕСІ {М+Н}+=354,2 1 Н ЯМР (CDCI3): 0,97, 0,98 (9Н, 2 с), 1,411,43 (3Н, м), 1,44-1,62 (2Н, м), 2,03 (3Н, д, J=2,3Гц), 2,16-2,21 (4Н, м), 3,61-3,63 (1Н, м), 3,743,78 (1Н, м), 4,45-4,52 (1Н, м), 4,75-4,77 (1Н, м), 19 75341 20 5,24-5,29 (1Н, м), 6,73-6,78 (1Н, м) м.ч. Залишок очищали за допомогою флеш хроматогПриклад 10 (2S)-1-(N'-(1’’рафії (елюент ЕtOАс:Пет. Ефір 60-80°С; 7:3) одеАцетоксиетоксикарбоніл)-О'-третржуючи білу тверду речовину, яку ідентифікували бутилсеринiл)піролідин-2-карбонітрил як вказану в заголовку сполуку (51мг, 0,10ммоль, 49%). + MC: - ECI {М+Н} =509,0 1 Н ЯМР (CDCI3): 1,41-1,48 (6Н, м), 1,51-1,69 (2Н, м), 2,05 (3Н, д, J=18,3Гц), 2,12-2,28 (5Н, м), 2,41 (3Н, с), 2,86-2,93 (2Н, м), 3,63-3,64 (2Н, м), 4,38-4,42 (1Н, м), 4,72-4,73 (1Н, м), 4,74-4,79, 5,105,20 (1Н, 2 м), 5,54-5,62 (1Н, м), 6,74-6,79 (1Н, м), 7,29 (2Н, д, J=7,7Гц), 7,71 (2Н, д, J=8,4Гц) м.ч. Приклад 12 (2S)-1-(N-(1'Розчин гідрохлориду (2S)-1-(О'-третАцетоксиетоксикарбоніл)-N-(2''-(5'''-ціаноп!ридинбутилсериніл)піролідин-2-карбонітрилу (30мг, 2'''-іламіно)етил)гліциніл)піролідин-2-карбонітрил 0,11ммоль; одержували згідно Jenkins еt аl., WO95/15309), -ацетоксиетил пнітрофенілкарбонату (32мг, 0,12ммоль; одержували згідно Atexander еt аl., J. Med. Chem. 31, 318, 1988) і триетиламіну (20мг, 0,20ммоль) в дихлорметані (25мл) перемішували при кімнатній температурі протягом 18 годин. Після цього розчинник видаляли у вакуумі і залишок переносили в етилацетат (70мл). Цей розчин промивали 0,3M KHSO4, нас. NaНСО3, водою і насиченим водним розчином хлориду натрію, сушили (Na2SO4) і випарювали. Залишок очищали за допомогою флеш хроматогРозчин біс(трифторацетату) 1-([2-[(5рафії (елюент ЕtOАс:Пет. Ефір 60-80°С; 4:6) одеціанопіридин-2-іл)аміно]етил]аміно]ацетил)-2ржуючи білу тверду речовину, яку ідентифікували ціано-(5)-піролідину (100мг, 0,19ммоль; одержуваяк вказану в заголовку сполуку (14мг, 0,038ммоль, ли згідно ViIIhauer еt аl., WO98/19998), 35%). ацетоксиетил п-нітрофенілкарбонату (56мг, + MC: - ECI {М+Н} =370,1 0,21ммоль; одержували згідно Aiexander еt аl., J. 1 Н ЯМР (CDCI3): 1,11-1,15 (9Н, м), 1,41-1,45 Med. Chem. 31. 318, 1988) і триетиламіну (50мг, (3Н, м), 2,04 (3Н, д, J=4,9Гц), 2.10-2,15 (2Н, м), 0,50ммоль) в дихлорметані (25мл) перемішували 3,43-3,62 (5Н, м), 3,90-4,00 (1Н, м), 4,50-4,65 (1Н, при кімнатній температурі протягом 18 годин. Пісм), 4,73 (1Н, д, J=5,2Гц), 5,45-5,72 (1Η, м), 6,76ля цього розчинник видаляли у вакуумі і залишок 6,79 (1Η, м) м.ч. переносили в етилацетат (70мл). Цей розчин проПриклад 11 (2S)-1-(N -(1'мивали 0,3М KHSO4, нас. NaНСО3, водою і насиАцетоксиетоксикарбонiл)-N -пченим водним розчином хлориду натрію, сушили толуолсульфоніллізиніл)піролідин-2-карбонітрил (Na2SO4) і випарювали. Залишок очищали за допомогою флеш хроматографії (елюент ЕtOАс:Пет. Ефір 60-80°С; 9:1) одержуючи білу тверду речовину, яку ідентифікували як вказану в заголовку сполуку (13мг, 0,03ммоль, 16%). MC: - ECI {M+H}+=429,2 1 Н ЯМР (CDCI3): 1,21-1,32 (ЗН, м), 1,40-1,46 (1Н, м), 1,99-2,05 (4Н, м), 2,17-2,31 (4H, м), 3,503,63 (6Н, м), 4,40-4,50 (1Н, м), 4,77 (1Н, д, J=5,9Гц), 6,45-6,49 (1Н, м), 6,68-6,77 (1Н, м), 7,447,48 (1Н, м), 8,32 (1Н, с) м.ч. Приклад 13 - (2S)-1-(N'-(Бензилоксикарбоніл)O'-трет-бутилтреонініл)-піролідин-2-карбонітрил Розчин трифторацетату (2S)-1-(N -птолуолсульфоніллізиніл)піролідин-2-карбонітрилу (100мг, 0,20ммоль; одержували згідно Jenkins еt аl., WO95/15309), -ацетоксиетил пнітрофенілкарбонату (61мг, 0,23ммоль; одержували згідно Atexander еt аl., J. Med. Chem. 31, 318, 1988) і триетиламіну (30мг, 0,30ммоль) в дихлорметані (25мл) перемішували при кімнатній температурі протягом 18 годин. Після цього розчинник видаляли у вакуумі і залишок переносили в етилацетат (70мл). Цей розчин промивали 0,3M KHSO4, нас. NaНСО3, водою і насиченим водним розчином хлориду натрію, сушили (Na2SO4) і випарювали. Розчин гідрохлориду (2S)-1-(О'-третбутилтреонініл)піролідин-2-карбонітрилу (35мг, 0,12ммоль; одержували згідно Jenkins еt аl., WO95/15309), бензилхлорформіату (32мг, 21 75341 22 0,13ммоль) і триетиламіну (24мг, 0,24ммоль) в ацетиллізиніл)піролідин-2-карбонітрилу (100мг, дихлорметані (25мл) перемішували при кімнатній 0,22ммоль; одержували згідно Jenkins еt аl., температурі протягом 18 годин. Після цього розWO95/15309), бензоїлхлориду (343мг, 0,24ммоль) і чинник видаляли у вакуумі і залишок переносили в триетиламіну (45мг, 0,45ммоль) в дихлорметані етилацетат (70мл). Цей розчин промивали 0,3М (25мл) перемішували при кімнатній температурі KHSO4, нас. NaНСО3, водою і насиченим водним протягом 18 годин. Після цього розчинник видалярозчином хлориду натрію, сушили (Na2SO4) і випали у вакуумі і залишок переносили в етилацетат рювали. Залишок очищали за допомогою флеш (70мл). Цей розчин промивали 0,3M KHSO4, нас. хроматографії (елюент: хлороформ:метанол; 98:2) NaНСО3, водою і насиченим водним розчином одержуючи білу тверду речовину, яку ідентифікухлориду натрію, сушили (Na2SO4) і випарювали. вали як вказану в заголовку сполуку (47мг, Залишок очищали за допомогою флеш хроматог0,12ммоль, 100%). рафії (елюент хлороформ: метанол; 97:3) одерMC: - ECI {M+H}+=388,3 жуючи білу тверду речовину, яку ідентифікували 1 як вказану в заголовку сполуку (83мг, 0,22ммоль, Н ЯМР (CDCI3): 1,10-1,30 (3Н, м), 1,18 (9Н, 100%). с), 2,00-2,45 (4Н, м), 3,55-3,70 (1Н, м), 3,85-4,00 MC: - ЕСI {М+Н}+=387,6 (2Н, м), 4,30-4,40 (1Н, м), 4,70-4,80 (1Н, м), 5,07 1 Н ЯМР (CDCI3): 1,56-1,78 (4Н, ш м), 1,94 (2Н, с), 5,75 (1Н, д, J=8,15Гц), 7,20-7,45 (5Н, м) м.ч. Приклад 14 (2S)-1-(S'-трет-Бутил-N'(3Н, с), 2,12-2,20 (4Н, ш м), 3,21-3,23 (2Н, м), 3,59(етилоксикарбоніл)цистеїніл)пiролідин-23,72 (2Н, м), 4,65-4,69 (2Н, м), 5,07 (2Н, с), 5,18карбонітрил 5,21 (1Н, м), 6,69-6,72 (1Н, м), 7,24-7,34 (5Н, м) м.ч. Приклад 16 (2S)-1-(Na-(Ацетил)-N бензилоксикарбоніл)орнітиніл)-піролідин-2карбонітрил Розчин трифторацетату (2S)-1-(5'-третбутилцистеїніл)піролідин-2-карбонітрилу (1000мг, 0,27ммоль; одержували згідно Jenkins еt аl., WO95/15309), етилхлорформіату (35мг, 0,32ммоль) і триетиламіну (50мг, 0,50ммоль) в дихлорметані (25мл) перемішували при кімнатній температурі протягом 18 годин. Після цього розчинник видаляли у вакуумі і залишок переносили в етилацетат (70мл). Цей розчин промивали 0,3M KHSO4, нас. NaНСО3, водою і насиченим водним розчином хлориду натрію, сушили (Na2SO4) і випарювали. Залишок очищали за допомогою флеш хроматографії (елюент ЕtOАс:Пет. Ефір 60-80°С; 8:2) одержуючи білу тверду речовину, яку ідентифікували як вказану в заголовку сполуку (30мг, 0,092ммоль, 35%). MC: - ECl {M+H}+=328,1 1 Н ЯМР (CDCI3): 1,18 (3Н, т, J=7Гц), 1,30 (9H, с), 2,17-2,24 (4Н, ш м), 2,82-2,85 (2Н, м), 3,70-3,82 (2Н, ш м), 4,05-4,09 (2Н, м), 4,48-4,53 (1Н, м), 4,744,77 (1Н, м), 5,41-5,44 (1Н, м) м.ч.. Приклад 15 (2S)-1-(N -Ацетил-N бензоїллізиніл)піролідин-2-карбонітрил Розчин трифторацетату (2S)-1-(N Розчин трифторацетату (2S)-1-(N (бензилоксикарбоніл)орнітиніл)піролідин-2карбонітрилу (100мг, 0,23ммоль; одержували згідно Jenkins еt аl., WO95/15309), ацетилхлориду (20мг, 0,26ммоль) і триетиламіну (50мг, 0,50ммоль) в дихлорметані (25мл) перемішували при кімнатній температурі протягом 18 годин. Після цього розчинник видаляли у вакуумі і залишок переносили в етилацетат (70мл). Цей розчин промивали 0,3М KHSO4, нас. NaНСО3, водою і насиченим водним розчином хлориду натрію, сушили (Na2SO4) і випарювали. Залишок очищали за допомогою флеш хроматографії (елюент хлороформ:метанол; 97:3) одержуючи білу тверду речовину, яку ідентифікували як вказану в заголовку сполуку (49мг, 0,13ммоль, 55%). МС: - ЕСI {М+Н}+=371,2 1 Н ЯМР (CDCI3): 1,30-1,65 (4Н, м), 1,75-1,95 (2Н, м), 1,90 (3Н, с), 2,10-2,40 (4Н, м), 3,10-3,30 (2Н, м), 3,65-3,90 (2Н, м), 4,70-4,90 (2Н, м), 5,906,00 (1Н, м), 7,30-7,50 (4Н, м), 7,70-7,80 (2Н, м) м.ч. Приклад 17 - !n vitro inhibitory activity vs. DP-IV Досліджували сполук попередніх прикладів на інгібування DP-IV згідно з методом описаним Ashworth еt аl. (Bioorg. Med. Chem. Lett. 1996, 6(10), 1163-66). He спостерігалось інгібуючої активності до 10мкМ, з чого випливає, що проліки винаходу є, в принаймні, 1000 разів менш активними ніж інгібітори, похідними яких вони є. Відповідно, можна припустити, що будь яка активність in vivo є 23 75341 24 наслідком біоперетворення у вихідні інгібітори. відбирали зразки крові (200мкл) з хвостової вени Приклад 18 - In vivo активність на моделі тодля встановлення основного рівня глюкози (t=0), лерантності до глюкози потім тваринам давали орально глюкозу (1г/кг як Активність сполук досліджували на самицях 40% ваг/об розчин). Відбирали зразки крові t=10, щурів Zucker Fatty віком 10-20 неділь. Тварин не 20, 30, 60 і 120 хвилин. Рівень глюкози визначали годували протягом ночі і потім їм вводили тестуємі використовуючи ферментне дослідження. Резульсполуки (10мг/кг) у вигляді розчину для орального тати приведені в Таблиці нижче. введення за допомогою зонду. Через одну годину Сполука Розчинник Приклад 2 Приклад 3 Приклад 5 Порівняння t=0 95,1±7,36 80,2±4,2 86,4±3,4 80,5±1,4 91,4±5,2 Рівень глюкози в крові (мг/дл); значення±SЕ, n=4 t=10 t=20 t=30 t=60 151,6±8,12 164,3±10,7 153,2±7,8 153,4±7,8 122,2±7,8 117,8±4,8 104,4±5,6 117,6±6,7 175,1±3,8 148,5±23,2 136,7±16,9 120,6±8,3 141,3±14,5 134,2±10,3 129,2±8,2 114,6±8,1 125,8±8,9 110,0±21,5 110,9±4,4 112,2±7,5 Сполукою для порівняння у приведених вище експериментах була сполука Прикладу 11 WO 95/15309. Це вихідна сполука для проліків Прикладів 2-6 представленого винаходу. З представлених вище результатів зрозуміло, що проліки ефективні при зменшенні гіперглікемії, що викликана глюкозою, але вони не завжди є такими ж ефективними як порівняльна сполука на перших етапах дослідження. Це було очікуваним Сполука Розчинник Приклад 1 t=0 84,2±3,7 83,7±3,8 для проліків, що перетворюються з високим виходом у вихідний лікарський засіб. Результати перших етапів дослідження є наслідком метаболітичного перетворення циркулюючого пролікарського засобу. В окремих експериментах тестуємі сполуки вводили в тих же самих дозах (10мг/кг) але з 12 годин до орального введення глюкози. Результати приведені нижче. Рівень глюкози в крові (мг/дл);значення±SE, n=4 t=10 t=20 t=30 t=60 t=120 145,5±6,6 134,3±8,0 127,2±10,1 122,9±8,7 112,2±8,6 113,5±10,8 111,3±9,9 91,9±11,8 99,3±10,0 116,9±14,4 AUC (площина під кривою концентрація-час) є значно зменшеним, показує що проліки мають значну антигіперглікемічною активністю протягом 12 годин. Приведені вище результати демонструють, що сполуки представленого винаходу проявляють антигіперглікемічну активність після орального призначення в відповідних тваринних моделях неприйняття глюкози. Крім того, як і очікувалось, вони є ефективними при лікуванні погіршення толерантності до глюкози у людей і діабету типу 2. Крім того, in vivo результати підтвердили, що проліки перетворюються у активні інгібітори DP-lV, і що вони можуть бути корисні при лікуванні всіх інших патологій, для яких пропонуються такі інгібітори в якості терапевтичних агентів. Приклад 19 - Фармацевтичні рецептури 19А - 50мг Таблетки Комп’ютерна верстка О. Гапоненко t=120 122,4±7,0 111,3±12,1 101,9±4,5 121,2±5,8 108,7±8,9 AUC 4556±458 2430±591 Таблетки, що містять 50мг сполуки Прикладу 1, одержували наступним чином: Сполука Прикладу 154,5г Кукурудзяний крохмаль 53,5г Гідроксипропілцелюлоза 13,5г Кальцій карбоксиметилцелюлоза 11,0г Стеарат магнію 2,0г Лактоза 165,5г Загалом 400,0г Матеріали змішували і потім пресували одержуючи 2000 таблеток по 200мг, кожна містила 50мг сполуки Прикладу 1. Сполуки Прикладів 2, 3 і 5 формували окремо у відповідні таблетки тим же самим способом. Сполуки прикладів 4 і 6-16 формували окремо подібним чином в таблетки, що містять 100мг відповідної сполуки. Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюAntidiabetic agents
Назва патенту російськоюАнтидиабетические агенты
Автори російськоюEvans, David, Michael
МПК / Мітки
МПК: A61K 31/401, A61K 38/00, A61P 43/00, C12N 9/99, C07D 401/12, C07D 207/16, C07K 5/062, A61K 31/4439, A61P 3/10
Мітки: антидіабетичні, агенти
Код посилання
<a href="https://ua.patents.su/12-75341-antidiabetichni-agenti.html" target="_blank" rel="follow" title="База патентів України">Антидіабетичні агенти</a>
Попередній патент: Пристрій для обробки текучого середовища, система та спосіб обробки текучого середовища
Наступний патент: Амортизатор
Випадковий патент: Спосіб лікування термінальної вторинної некомпенсованої глаукоми