3-фторпіперидини як антагоністи nmda/nr2b
Номер патенту: 81319
Опубліковано: 25.12.2007
Автори: Лівертон Найджел Дж., Макколі Джон А., Клейрмон Девід А., Клейборн Крістофер Ф.
Формула / Реферат
1. Сполука формули (І)
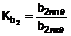 (I)
(I)
або її фармацевтично прийнятна сіль, в якій HetAr являє собою 5-6-членне гетероароматичне кільце, що містить 1 або 2 атоми азоту у кільці, тіазоліл або тіадіазоліл;
R1 та R2 незалежно являють собою Н, С1-С4-алкіл, фтор, хлор, бром або йод; А являє собою зв'язок або С1-С2-алкіл; В являє собою арил(СН2)0-3-O-С(O)-, інданіл(СН2)0-3-O-С(O)-, арил(СН2)1-3-С(О)-, арилциклопропіл-С(О)-, арил(СН2)1-3-NH-C(O)-, в яких арил може бути заміщений 1-5 замісниками, кожний замісник незалежно один від одного являє собою С1-С4-алкіл, фтор або хлор.
2. Сполука за п. 1 або її фармацевтично прийнятна сіль, в якій HetAr являє собою 6-членне гетероароматичне кільце, що містить 2 атоми азоту у кільці.
3. Сполука за п. 1 або її фармацевтично прийнятна сіль, в якій HetAr являє собою тіадіазоліл.
4. Сполука за п. 1 або її фармацевтично прийнятна сіль, в якій А являє собою метилен.
5. Сполука за п. 1 або її фармацевтично прийнятна сіль, в якій В являє собою арилциклопропіл-С(О)-, в якій арил необов'язково заміщений як вказано у п. 1.
6. Сполука за п. 1 або її фармацевтично прийнятна сіль, в якій В являє собою арил(СН2)0-3-O-С(O)-, в якій арил необов'язково заміщений як вказано у п. 1.
7. Сполука за п. 1, в якій вказана сполука являє собою її фармацевтично прийнятні солі
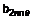
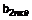
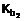
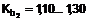
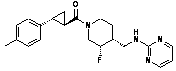
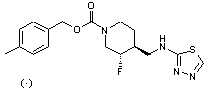
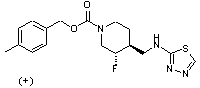
8. Сполука за п. 1, в якій вказана сполука являє собою сполуку формули
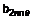
або її фармацевтично прийнятну сіль.
9. Сполука за п. 1, в якій вказана сполука являє собою сполуку формули
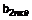
або її фармацевтично прийнятну сіль.
10. Сполука за п. 1, в якій вказана сполука являє собою сполуку формули
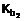
або її фармацевтично прийнятну сіль.
11. Сполука за п. 1, в якій вказана сполука являє собою сполуку формули
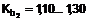
або її фармацевтично прийнятну сіль.
12. Фармацевтична композиція, що містить інертний носій і терапевтично ефективну кількість сполуки за п. 1.
13. Застосування сполуки за п. 1 або її фармацевтично прийнятної солі для одержання лікарського засобу для лікування болю у хворих.
14. Застосування сполуки за п. 1 або її фармацевтично прийнятної солі для одержання лікарського засобу для лікування або запобігання хворобі Паркінсона у хворих.
Текст
1. Сполука формули (І) 6. Сполука за п. 1 або її фармацевтично прийнятна сіль, в якій В являє собою арил(СН2)0-3O-С(O)-, в якій арил необов'язково заміщений як вказано у п. 1. 7. Сполука за п. 1, в якій вказана сполука являє собою її фармацевтично прийнятні солі O O N N (. ) O N N H N H N N F N N N (. ) O N H N R2 F (+ ) S N N O O N H N F N N або її фармацевтично прийнятну сіль. 9. Сполука за п. 1, в якій вказана сполука являє собою сполуку формули 81319 8. Сполука за п. 1, в якій вказана сполука являє собою сполуку формули (11) (I) або її фармацевтично прийнятна сіль, в якій HetAr являє собою 5-6-членне гетероароматичне кільце, що містить 1 або 2 атоми азоту у кільці, тіазоліл або тіадіазоліл; R1 та R2 незалежно являють собою Н, С1-С4-алкіл, фтор, хлор, бром або йод; А являє собою зв'язок або С1-С2-алкіл; В являє собою арил(СН 2)0-3-OС(O)-, інданіл(СН 2)0-3-O-С(O)-, арил(СН 2)1-3-С(О)-, арилциклопропіл-С(О)-, арил(СН 2)1-3-NH-C(O)-, в яких арил може бути заміщений 1-5 замісниками, кожний замісник незалежно один від одного являє собою С1-С4-алкіл, фтор або хлор. 2. Сполука за п. 1 або її фармацевтично прийнятна сіль, в якій HetAr являє собою 6-членне гетероароматичне кільце, що містить 2 атоми азоту у кільці. 3. Сполука за п. 1 або її фармацевтично прийнятна сіль, в якій HetAr являє собою тіадіазоліл. 4. Сполука за п. 1 або її фармацевтично прийнятна сіль, в якій А являє собою метилен. 5. Сполука за п. 1 або її фармацевтично прийнятна сіль, в якій В являє собою арилциклопропіл-С(О)-, в якій арил необов'язково заміщений як вказано у п. 1. (13) O O O N H N F N N або її фармацевтично прийнятну сіль. 10. Сполука за п. 1, в якій вказана сполука являє собою сполуку формули O O N H N F (. ) N N або її фармацевтично прийнятну сіль. UA HetAr C2 (+) (19) F N H H N F O O N N N F A O H N F R1 B N O N 3 81319 4 11. Сполука за п. 1, в якій вказана сполука являє 12. Фармацевтична композиція, що містить собою сполуку формули інертний носій і терапевтично ефективну кількість O сполуки за п. 1. 13. Застосування сполуки за п. 1 або її O N H N N фармацевтично прийнятної солі для одержання лікарського засобу для лікування болю у хвори х. F N 14. Застосування сполуки за п. 1 або її (+) фармацевтично прийнятної солі для одержання або її фармацевтично прийнятну сіль. лікарського засобу для лікування або запобігання хворобі Паркінсона у хворих. Винахід відноситься до N-заміщених неароматичних гетероциклічних сполук. Зокрема, винахід відноситься до N-заміщених неароматичних гетероциклічних сполук, які є антагоністами NMDA/NR2B, придатними для лікування хвороби Паркінсона і болю. Іони, такі як глутамат, грають ключову роль у процесах, пов'язаних з хронічним болем і нейротоксичністю, пов'язаною з болем, які діють, головним чином, через рецептори N-метил-Dаспартату (NMDA). Отже, інгібування такої дії шляхом використання іон-канальних антагоністів, особливо антагоністів NMDA, може мати позитивний ефект при лікуванні і регуляції хвороби Паркінсона і болю. Рецептори NMDA є гетеромерними ансамблями субодиниць, з яких два головних сімейства субодиниць, що позначаються NR1 і NR2, були клоновані. Без зв'язку з теорією, звичайно вважають, що різні функціональні рецептори NMDA у центральній нервовій системі (ЦНС) ссавців утворюються тільки комбінаціями субодиниць NR1 і NR2, які звичайно виражають сайти пізнавання гліцину і глутамату. У свою чергу, сімейство субодиниць NR2 розділяють на чотири індивідуальних типи субодиниць NR2A, NR2B, NR2C і NR2D. [Т. Ishii et al, J. Biol. Chem., 268, 2836-2843 (1993) D.J. Laurie et al., Моl. Brain Res., 51, 23-32 (1997)] описують як різні виникаючі комбінації дають різні рецептори NMDA, що відрізняються фізіологічними і фармакологічними властивостями, такими як ворітний механізм іонних каналів, чутливість до магнію, фармакологічний профіль і анатомічний розподіл. Наприклад, у той час як NR1 знаходять скрізь у мозку, субодиниці NR2 розподіляються порізному. Зокрема, вважається, що карта розподілу для NR2B знижує ймовірність побічних ефектів при хворобі Паркінсона або болю. Таким чином, було б бажано забезпечити нові антагоністи, націлені на рецептор NR2B. Даний винахід відноситься до N-заміщених неароматичних гетероциклічних сполук, представлених формулою (І): або їх фармацевтично прийнятних солей. Даний винахід також відноситься до фармацевтичних композицій, що містять такі сполуки. Винахід також відноситься до способів лікування і запобігання станам, включаючи хворобу Паркінсона, болі, хворобу Альцгеймера і епілепсію, з використанням даних сполук і композицій. Сполуки даного винаходу представлені формулою (І) або їх фармацевтично прийнятними солями, в якій HetAr представляє 5-6-членне гетероароматичне кільце, що містить 1 або 2 атоми азоту у кільці, або тіазоліл або тіадіазоліл; R1 і R2 представляє незалежно один від одного, водень, С1-С4-алкіл, фтор, хлор, бром або йод; А представляє зв'язок або С1-С2-алкіл; і В представляє арил(СН 2)0-3-О-С(О)-, інданіл(СН2)0-3-O-С(O)-, арил(СН 2)1-3-С(О)-, арилциклопропіл-С(О)-, арил(СН 2)1-3-NH-С(O)-, в яких арил може бути заміщений 1-5 замісниками, кожний замісник незалежно один від одного представляє С 1-С4-алкіл, фтор або хлор. В одному аспекті, сполуки даного винаходу представлені формулою (І) або їх фармацевтично прийнятними солями, в якій HetAr представляє 6членне гетероароматичне кільце, що містить 1 або 2 атоми азоту у кільці. У варіанті цього першого аспекту, сполуки даного винаходу представлені формулою (І) або їх фармацевтично прийнятними солями, в якій HetAr представляє 6-членне гетероароматичне кільце, що містить 1 атом азоту у кільці. В іншому варіанті цього першого аспекту, сполуки даного винаходу представлені формулою (І) або їх фармацевтично прийнятними солями, в якій HetAr представляє 6-членне гетероароматичне кільце, що містить 2 атоми азоту у кільці. У другому аспекті, сполуки даного винаходу представлені формулою (І) або їх фармацевтично прийнятними солями, в якій HetAr представляє тіазоліл або тіадіазоліл. У варіанті цього другого аспекту, сполуки даного винаходу представлені формулою (І) або їх 5 81319 6 фармацевтично прийнятними солями, в якій HetAr прийнятними солями, в якій HetAr представляє представляє 1,2,4-тіадіазоліл. 1,2,4-тіадіазоліл; А представляє метилен; і В В іншому варіанті цього другого аспекту, представляє арил-(СН2)-О-С(О)-, в якій арил сполуки даного винаходу представлені формулою представляє 4-толіл. (І) або їх фармацевтично прийнятними солями, в У сьомому аспекті, сполуки даного винаходу якій HetAr представляє тіазоліл. представлені формулою (І) або їх фармацевтично У третьому аспекті, сполуки даного винаходу прийнятними солями, в якій HetAr представляє 6представлені формулою (І) або їх фармацевтично членне гетероароматичне кільце, що містить 2 прийнятними солями, в якій А представляє зв'язок атоми азоту у кільці; А представляє метилен; і В або –С1-С2-алкіл-. представляє арилциклопропіл-С(О)-, в якій арил У варіанті цього третього аспекту, сполуки представляє феніл, можливо заміщений С 1-С4даного винаходу представлені формулою (І) або їх алкілом. фармацевтично прийнятними солями, в якій А «Алкіл», а також інші терміни, що мають корінь представляє зв'язок. «алк», такі як, наприклад, алкокси, алканоїл, В іншому варіанті цього третього аспекту, алкеніл, алкініл і їм подібні, означає вуглецевий сполуки даного винаходу представлені формулою ланцюг, який може бути лінійним або (І) або їх фармацевтично прийнятними солями, в розгалуженим або їх комбінацією. Приклади якій А представляє метилен. алкільних гр уп включають метил, етил, пропіл, В іншому варіанті цього третього аспекту, ізопропіл, бутил, втор- і трет-бутил, пентил, гексил, сполуки даного винаходу представлені формулою гептил і їм подібні алкіли. (І) або їх фармацевтично прийнятними солями, в Термін «арил», якщо не вказано інакше, якій А представляє -С2-алкіл-. включає можливо заміщені багато- або одноядерні У четвертому аспекті, сполуки даного системи, такі як, наприклад, феніл, нафтил і толіл. винаходу представлені формулою (І) або їх Термін «HetAr» включає, наприклад, фармацевтично прийнятними солями, в якій В гетероароматичні кільця, такі як піримідин і представляє арилциклопропіл-С(О)або піридин. арил(СН 2)0-3-O-С(O)-, в якій арил може бути Термін “(СН2)0” значить, що метил відсутній. заміщений С1-С4-алкілом. Таким чином, “(СН2)0-3” означає, що метил У варіанті цього четвертого аспекту, сполуки відсутній або присутні до трьох метилів, тобто, даного винаходу представлені формулою (І) або їх присутні три, два, один або жодного метилу. Коли фармацевтично прийнятними солями, в якій В метильні групи відсутні у зв'язувальній алкільній представляє арилциклопропіл-С(О)-, в якій арил групі, зв'язування здійснюється прямим зв'язком. представляє феніл, можливо заміщений С 1-С4Термін «можливо заміщений» означає як алкілом. наявність заміщення, так і відсутність заміщення. В іншому варіанті цього четвертого аспекту, Таким чином, наприклад, можливо заміщений сполуки даного винаходу представлені формулою арил може представляти кільце пентафторфенілу (І) або їх фармацевтично прийнятними солями, в або фенілу. Далі, заміщення може бути зроблене якій В представляє арил(СН 2)0-3-O-С(O)-, в якій на будь-якій групі. Наприклад, заміщений арил(С1арил представляє феніл, можливо заміщений С 1С6)алкіл включає заміщення як на арильній, так і С4-алкілом. на алкільній групах. В іншому варіанті цього четвертого аспекту, Сполуки, описані в описі, можуть містити один сполуки даного винаходу представлені формулою або більше асиметричних центрів і можуть, отже, (І) або їх фармацевтично прийнятними солями, в давати початок діастереомерам і оптичним якій В представляє арил-О-С(О)-, в якій арил ізомерам. Даний винахід включає всі такі можливі представляє феніл, можливо заміщений С 1-С4діастереомери, а також їх рацемічні суміші, їх алкілом. істотно чисті розщеплені енантіомери, всі можливі В іншому варіанті цього четвертого аспекту, геометричні ізомери, і їх фармацевтично прийнятні сполуки даного винаходу представлені формулою солі. Сполуки формули І вище показані без (І) або їх фармацевтично прийнятними солями, в визначеної стереохімії на визначених положеннях. якій В представляє арил-(СН2)-О-С(О)-, в якій арил Даний винахід включає всі стереоізомери представляє феніл, можливо заміщений С 1-С4формули І і їх фармацевтично прийнятні солі. алкілом. Далі, включені суміші стереоізомерів, а також У ще одному варіанті цього четвертого виділені особливі стереоізомери. У ході здійснення аспекту, сполуки даного винаходу представлені синтезу таких сполук або при використанні формулою (І) або їх фармацевтично прийнятними методик рацемізації або епімеризації, відомих солями, в якій В представляє арил-(СН2)-О-С(О)-, фа хівцям у даній галузі техніки, можуть бути в якій арил представляє 4-толіл. одержані суміші стереоізомерів. У п'ятому аспекті, сполуки даного винаходу Термін «фармацевтично прийнятні солі» представлені формулою (І) або їх фармацевтично відноситься до солей, одержаних з прийнятними солями, в якій HetAr представляє 6фармацевтично прийнятних нетоксичних кислот, членне гетероароматичне кільце, що містить 2 включаючи неорганічні і органічні кислоти. Такі атоми азоту у кільці; А представляє метилен; і В кислоти включають, наприклад, оцтову, представляє арил-(СН2)-О-С(О)-, в якій арил бензолсульфонову, бензойну, камфорсульфонову, представляє 4-толіл. лимонну, етансульфонову, фумарову, глюконову, У шостому аспекті, сполуки даного винаходу глутамінову, бромистоводневу, хлористоводневу, представлені формулою (І) або їх фармацевтично ізетіонову, молочну, малеїнову, яблучн у, 7 81319 8 мигдалеву, метансульфонову, слизову, азотну, Використовуваний фармацевтичний носій памову, пантотенову, фосфорну, бурштинову, може бути, наприклад, твердою речовиною, сірчану, винну, п-толуолсульфонову та інші рідиною або газом. Приклади твердих носіїв кислоти. Особливо переважними є лимонна, включають лактозу, розпилений гіпс, сахарозу, бромистоводнева, хлористоводнева, малеїнова, тальк, желатин, агар, пектин, гуміарабік, стеарат фосфорна, сірчана і винна кислоти. магнію і стеаринову кислоту. Приклади рідких Фармацевтичні композиції даного винаходу носіїв включають цукровий сироп, арахісову олію, містять сполуку, представлену формулою I (і/або її оливкову олію і воду. Приклади газоподібних носіїв фармацевтично прийнятну сіль (солі)) як активний включають діоксид вуглецю і азот. компонент, фармацевтично прийнятний носій і, При одержанні композицій для пероральних можливо, інші терапевтичні компоненти і лікарських форм можна використовувати будь-яке ад'юванти. Дані композиції включають композиції, придатне фармацевтичне середовище. придатні для перорального, ректального, Наприклад, вода, гліколі, олії, спирти, смакові місцевого і парентерального (включаючи домішки, консерванти, барвники та інші засоби підшкірне, внутрішньом'язове і внутрішньовенне) можуть бути використані, щоб утворити введення, хоча найбільш придатний шлях пероральні рідкі композиції, такі як суспензії, введення у будь-якому даному випадку буде еліксири і розчини; у той час як крохмаль, цукор, залежати від специфічного хазяїна і від природи і мікрокристалічна целюлоза, розріджувачі, засоби, тяжкості станів, для усунення яких вводиться що гранулюють, мастила, зв'язуючі, засоби для активний компонент. Фармацевтичні композиції розпаду та інші засоби можуть бути використані, звичайно можуть бути представлені в одиничній щоб утворити пероральні тверді композиції, такі як лікарській формі і виготовлені будь-яким порошки, капсули і таблетки. Внаслідок їх легкого способом, добре відомим у фармацевтичній введення, таблетки і капсули є переважними техніці. пероральними лікарськими одиницями, відповідно На практиці сполуки, представлені формулою до чого і використовуються тверді фармацевтичні І, або їх фармацевтично прийнятні солі, даного носії. Необов'язково, таблетки можуть бути покриті винаходу як активний компонент можуть бути стандартними водними і неводними способами. об'єднані в однорідну суміш з фармацевтичним Таблетка, що містить композиції даного носієм відповідно до звичайних способів винаходу, може бути одержана пресуванням або фармацевтичного компаундування. Носій може формуванням можливо з одним або більше мати різноманітні форми, що залежать від форми другорядними компонентами або ад'ювантами. композиції, бажаної для введення, наприклад, Пресовані таблетки можуть бути одержані перорального або парентерального (включаючи пресуванням, у відповідній машині, активного внутрішньовенне). Отже, фармацевтичні компонента у вільно-текучій формі, такого як композиції даного винаходу можуть бути порошок або гранули, можливо змішаного зі представлені як дискретні одиниці, придатні для зв'язуючим, замаслювачем, інертним перорального введення, такі як капсули, розріджувачем, поверхнево-активним або крохмальні капсули і таблетки, де кожна містить диспергуючим засобом. Формовані таблетки визначену кількість активного компонента. Далі, можуть бути виготовлені формуванням у композиції можуть бути представлені у вигляді відповідній машині суміші порошкової сполуки, порошку, гранул, розчину, суспензії у водній рідині, зволоженої інертним рідким розріджувачем. Кожна неводній рідині, емульсії масло-у-воді або рідкій таблетка переважно містить від приблизно 0,5мг емульсії вода-у-маслі. На додаток до звичайних до приблизно 5г активного компонента і кожна лікарських форм, перерахованих вище, сполуки, капсула або крохмальна капсула переважно представлені формулою І, і/або їх фармацевтично містить від приблизно 0,5мг до приблизно 5г прийнятні солі, також можуть бути введені за активного компонента. допомогою засобів регульованого виділення і/або Фармацевтичні композиції даного винаходу дозатора. Композиції можуть бути одержані будьмістять сполуку формули І (або її фармацевтично яким фармацевтичним способом. Загалом, такі прийнятну сіль) як активний компонент, способи включають стадію об'єднання активного фармацевтично прийнятний носій і, необов'язково, компонента з носієм, який складає один або один або більше додатковий терапевтичний засіб більше необхідних компонентів. Загалом, або ад'ювант. Дані композиції включають композиції одержують, ретельно змішуючи композиції, придатні для перорального, активний компонент з рідкими носіями або ректального, місцевого і парентерального ретельно подрібненими твердими носіями або з (включаючи підшкірне, внутрішньом'язове і обома такими носіями до одержання однорідної внутрішньовенне) призначення, хоча найбільш суміші. Потім продукту може бути надана будь-яка придатний шлях введення у будь-якому даному форма звичайним чином у бажані форми. випадку буде залежати від специфічного хазяїна і Таким чином, фармацевтичні композиції від природи і тяжкості станів, для усунення яких даного винаходу можуть включати фармацевтично вводиться активний компонент. Фармацевтичні прийнятний носій і сполуку або фармацевтично композиції звичайно можуть бути представлені в прийнятну сіль формули І. Сполуки формули І або одиничній лікарській формі і виготовлені будь-яким їх фармацевтично прийнятні солі також можуть способом, добре відомим у фармацевтичній бути включені у фармацевтичні композиції у техніці. комбінації з однією або більше іншими Фармацевтичні композиції даного винаходу, терапевтично активними сполуками. придатні для парентерального введення, можуть 9 81319 10 бути приготовані у формі розчинів або суспензій Аналізи активного компонента у воді. Придатна Функціональний аналіз, що базується на поверхнево-активна речовина, така як, наприклад, клітинах, визначення ІК50 антагоністів NR2B гідроксипропілцелюлоза, може бути включена до Здатність вибраних сполук інгібувати складу композиції. Також можуть бути приготовані NR1a/NR2B рецептор NMDA, як виміряно суспензії у гліцерині, рідких поліетиленгліколях і їх припливом Са2+, що опосередковується суміші в оліях. Також можуть бути включені NR1a/NR2B рецептором, оцінювали за наступною консерванти, щоб запобігти шкідливому зростанню методикою аналізу постійного руху кальцію. мікроорганізмів. L(tk-)-клітини, трансфіковані NR1a/NR2B Фармацевтичні композиції даного винаходу, рецептором, висівали у 96-ямковому планшеті з придатні для ін'єкцій, включають стерильні водні 3´104 клітин на ямку і вирощували протягом 1-2 розчини або дисперсії. Крім того, композиції днів у нормальному ростовому середовищі можуть бути у формі стерильних порошків для (Dulbeccos MEM з піруватом Na, 4500мг глюкози, незапланованого приготування таких стерильних pen/strep, глутаміном, 10% FCS (фетальна теляча ін'єкційних розчинів або дисперсій. У всіх випадках сироватка) і 0,5мг/мл генетицину). Експресію кінцева форма для ін'єкцій повинна бути NR1a/NR2B у цих клітинах викликали додаванням стерильною і повинна бути ефективно рідкою для 4-20нМ дексаметазону у присутності 500мкМ легкого введення шприцом. Фармацевтичні кетаміну протягом 16-24 годин. Розчини композиції повинні бути стабільні в умовах антагоністів NR2B одержували у ДМСО виробництва і зберігання; отже, повинні бути (диметилсульфоксиді) і серійно розбавляли ДМСО збережені від забруднюючої дії мікроорганізмів, для одержання 10 розчинів, 3-кратно відмінних за таких як бактерії і гриби. Носій може бути концентрацією. 96-ямковий планшет лікарського розчинником або дисперсійним середовищем, що засобу готували 250-кратним розбавленням ДМСО містить, наприклад, воду, етанол, поліол розчину в аналітичному буфері HBSS (наприклад, гліцерин, поліпропіленгліколь і рідкий (збалансований сольовий розчин Хенкса), що не поліетиленгліколь), рослинні олії і їх відповідні містить Mg2+ (Gibco #14175-079) і містить 20мМ суміші. HEPES (N-2-гідроксіетилпіперазин-N'-2Фармацевтичні композиції даного винаходу етансульфонова кислота), 2мМ СаСl2, 0,1% BSA можуть бути у формі, придатній для місцевого (альбумін бичачої сироватки) і 250мкМ застосування, такій як аерозоль, крем, мазь, Пробенесиду (Probenecid, Sigma #Р-8761). Після лосьйон, порошкувальний засіб або інші подібні індукції клітини двічі промивали (Labsystem cell засоби. Далі, композиції можуть бути у формі, washer, 3-кратне розбавлення, залишаючи придатній для використання у черезшкірних 100мкл) аналітичним буфером і завантажували методах. Ці композиції можуть бути виготовлені 4мкМ кальцієвого індикатора флуоресценції флуозвичайними способами переробки, 3 AM (fluo-3 AM) (молекулярні зонди #Р-1241) в використовуючи сполуки формули І даного аналітичному буфері, що містить Плуронік F-127 винаходу або їх фармацевтично прийнятні солі. (Pluronic F-127) (молекулярні зонди # Р-3000) і Наприклад, крем або мазь виготовляють 10мкМ кетаміну при 37°С за 1 годину. Потім змішуванням гідрофільного матеріалу і води з клітини промивали вісім разів аналітичним приблизно 5 - приблизно 10ваг.% сполуки, щоб буфером, залишаючи 100мкл буфер у у кожній одержати крем або мазь, що має бажану ямці. Інтенсивність флуоресценції негайно консистенцію. вимірювали у флуорометричному Фармацевтичні композиції даного винаходу сцинтиляційному планшет-рідері (FLIPR), можуть бути у формі, придатній для ректального використовуючи збудження 488нм і введення, в якій носієм є тверда речовина. випромінювання 530нм. Через 5 секунд після Відповідні носії включають олію какао та інші початку реєстрації інтенсивності флуоресценції матеріали, що звичайно використовується у додавали 50мкл розчину агоніста (40мкМ техніці. Супозиторії звичайно можуть бути глутамат/гліцин, кінцева концентрація 10мкМ) і одержані спочатку змішуванням композиції з через 1 хвилину, після стабілізації сигналу пом'якшуючим або розплавленим носієм з флуоресценції, додавали 50мкМ антагоніста NR2B подальшим охолоджуванням і формуванням у і контрольні розчини з планшета лікарського формах. засобу і інтенсивність флуоресценції реєстрували На додаток до згаданих вище компонентів ще 30 хвилин. Величини ІК50 визначали носія фармацевтичні рецептури, описані вище, нелінійною апроксимацією величин кінцевої можуть включати один або більше додаткових флуоресценції за методом найменших квадратів компонентів носія, таких як розріджувачі, буферні за рівнянням 1 нижче. речовини, смакові речовини, зв'язуючі, Рівняння 1 поверхнево-активні речовини, загусники, мастильні речовини, консерванти (включаючи антиоксиданти) та інші речовини. Крім того, інші ад'юванти можуть бути включені, щоб зробити де Yмін - середня кінцева флуоресценція рецептур у ізотонічною з кров'ю запланованого контрольних ямок, що містять 1мкМ АМД-2, і Yмакс реципієнта. Композиції, що містять сполуку середня кінцева флуоресценція ямок, що містять формули І і/або її фармацевтично прийнятні солі, 0,1% ДМСО в аналітичному буфері. також можуть бути одержані у формі порошку або Зв'язувальний аналіз для визначенні К1 рідкого концентрату. антагоністів NR2B 11 81319 12 Аналіз зв'язування радіоліганду виконували при кімнатній температурі у 96-ямкових титраційних планшетах з кінцевим аналітичним об'ємом 1,0мл у 20мМ буфері HEPES (рН7,4), що містить 150мМ NaCl. Розчини антагоністів NR2B готували у ДМСО і серійно розбавляли ДМСО з Відповідно до схеми 1а, хлористий водень одержанням 20мкл кожного з 10 розчинів, барботують через розчин цинамонітрилу 1 у відмінних 3-кратно за концентрацією. метанолі при кімнатній температурі. Леткі продукти Неспецифічне зв'язування (НСЗ) оцінювали, видаляють при зниженому тиску, залишок використовуючи АМД-1 (кінцева концентрація розтирають в ефірі і фільтрують, одержуючи 10мкМ), і повне зв'язування (ПЗ) вимірювали, проміжний імідат 2. Імідат 2 розчиняють у метанолі додаючи ДМСО (кінцева концентрація 2%). У всі при температурі навколишнього середовища, ямки титраційного планшета додавали мембрани, обробляють аміном 4 (Acros Chemicals) при що експресують NR1a/NR2B рецептори (кінцева температурі навколишнього середовища і концентрація 40пМ), і мічений тритієм АМД-2 перемішують під аргоном. Леткі продукти (кінцева концентрація 1нМ). Через 3 години видаляють при зниженому тиску, залишок інкубації при кімнатній температурі зразки очищають препаративною ВЕРХ або розтирають з фільтрували на фільтрах (Packard GF/B), ефіром, щоб одержати амідин 3. заздалегідь замочених у 0,05% ΠΕΙ Синтез АМД-2. міченого тритієм (поліетиленімін Sigma Р-3143), і промивали 10 разів, використовуючи 1мл холодного буфера HEPES на промивання. Після вакуумного сушіння фільтрувальних пластинок додавали 40мкл Пакард Мікросцинт-20 (Packard Microscint-20) і зв'язану радіоактивність визначали у лічильнику Packard TopCount. Уявну константу дисоціації (К1, максимальний процент інгібування (%Імакс), Тритований АМД-2 одержували за методикою, мінімальний процент інгібування (%Імін) і нахил показаною у Схемі 2. Попередник 3 (2мг, піка (nН) визначали нелінійною апроксимацією 0,008ммоль) розчиняли у диметилформаміді зв'язаної радіоактивності (імп/хв. зв'язана) за (0,6мл), що містить карбонат калію (1,2мг), методом найменших квадратів за рівнянням 2 протягом 1 години. При кімнатній температурі нижче. додавали тритований метилйодид (50мКі, Рівняння 2 0,0006ммоль, у толуолі (1мл), American Radiolabelled Chemicals) з високою питомою радіоактивністю і перемішували 2 години. де KD уявна константа дисоціації Реакційну суміш фільтрували за допомогою 0,45радіоліганду для рецептора, як знайдено в мкм безшприцевого фільтрувального пристрою експерименті з гарячим насиченням, і СЗ (Whatman PTFE 0.45-mm syringeless filter device), специфічно зв'язана радіоактивність, визначена як щоб видалити нерозчинний карбонат калію, різниця ПЗ і НСЗ контрольних ямок. промивали абсолютним етанолом (2мл, Pharmco) і АМД-1 об'єднані фільтрати концентрували досуха при кімнатній температурі, використовуючи роторний випарник; тим самим тритований метилйодид, що не прореагував, також видалявся. Залишок очищали ВЕРХ хроматографією на колонці Phenomenx Luna C8 semi-prep column (Luna 5 micro C8(2), 250´10,0мм), використовуючи градієнтну систему від ацетонітрил-вода 20/80 з 0,1% трифтороцтової кислоти до 100% ацетонітрилу з 0,1% трифтороцтової кислоти за 20 АМД-2 хвилин. Повна активність продукту 8мКі. Подальше очищення проводилося шляхом адсорбції на колонці Waters C-18 Sep-pak column (Waters Sep-Pak PLUS C-18) і елюювання водою і потім абсолютним етанолом. Продукт розбавляли абсолютним етанолом (10мл) перед кінцевим аналізом. Синтез неміченого АМД-2 АМД-1 може бути синтезований за загальним способом, описаним [C.F. Claiborne et all., Bioorganic and Medchem. Letters, 13, 697-700 (2003)]. Попередник 3 синтезу радіоміченого АМД-1 може бути синтезований відповідно до схеми 1а Відповідно до схеми 1б хлористий водень барботують через розчин цинамонітрилу 1 у метанолі при кімнатній температурі. Леткі продукти 13 81319 14 видаляють при зниженому тиску, залишок абстинентного синдрому скасування, наприклад, розтирають в ефірі і фільтрують, одержуючи алкоголю, опіоїдів і кокаїну. проміжний імідат 2. Імідат 2 розчиняють у метанолі Сполуки даного винаходу можуть бути при навколишній температурі, обробляють аміном призначені у профілактично ефективних рівнях 6 при температурі навколишнього середовища і доз, щоб запобігти станам, вказаним вище, а перемішують під аргоном. Леткі продукти також щоб запобігти іншим станам, видаляють при зниженому тиску, залишок опосередкованим NR2B рецептором NMDA. очищають препаративною ВЕРХ або розтирають з Сполуки формули І можуть бути використані у ефіром, щоб одержати амідин 5. комбінації з іншими лікарськими засобами, які Сполуки даного винаходу показують величини використовують для ІК50 і K1 менші, ніж 50мкМ у функціональному і лікування/запобігання/придушення або зв'язувальному аналізі, відповідно. Корисно, щоб поліпшення протікання захворювань або станів, величини ІК50 і К1 були меншими, ніж 5мкМ у для яких корисні сполуки формули І. Такі інші функціональному і зв'язувальному аналізі, лікарські засоби можуть вводитися, шляхом і у відповідно. Більш корисно, щоб величини ІК50 і К1 кількості, що звичайно використовуються, були меншими, ніж 1мкМ у функціональному і одночасно або послідовно, зі сполукою формули І. зв'язувальному аналізі, відповідно. Ще більш Коли сполуки формули І використовують корисно, щоб величини ІК50 і К1 були меншими, одночасно з одним або більше іншими ніж 0,1мкМ у функціональному і зв'язувальному лікарськими засобами, переважними є аналізі, відповідно. фармацевтичні композиції, що містять такі інші Дані сполуки є антагоністами NR2B рецепторів лікарські засоби на додаток до сполуки формули І. NMDA і як такі корисні для лікування і Відповідно, фармацевтичні композиції даного профілактики захворювань і порушень, що винаходу включають такі композиції, які також опосередковуються NR2B рецептором. Такі містять один або більше активних компонентів на захворювання і порушення включають, але ними додаток до сполуки формули І. Прикладами інших не обмежуються, хворобу Паркінсона, активних компонентів, які можуть бути з'єднані зі нейропатичні болі (такі як постгерпетична сполукою формули І, введені окремо або у тих же невралгія, невралгічні рани, «динії», наприклад, фармацевтичних композиціях, є, але ними не вульводинія, фантомний біль, авульсії коріння, обмежуються, 1) нестероїдні протизапальні хвороблива діабетична невропатія, хвороблива засоби; 2) інгібітори циклооксигенази 2-го типу, травматична мононевропатія, хвороблива ЦОГ-2 (СОХ-2); 3) антагоністи рецептора поліневропатія), центральні больові синдроми брадикініну В1; 4) блокатори і антагоністи (потенційно обумовлені фактично будь-якою натрієвих каналів; 5) антагоністи (оксид азоту)патологічною зміною на будь-якому рівні нервової синтази (NOS); 6) антагоністи сайта гліцину; 7) системи) і постхірургічні больові синдроми відкривачі калієвих каналів; 8) антагоністи (наприклад, постмастектомічний больовий рецептора АМРА/каїнат; 9) антагоністи кальцієвих синдром, постторакотомічний больовий синдром, каналів; 10) модулятори рецептора ГАМК-А фантомний біль), кістковий і суглобовий біль (GABА-А) (наприклад, агоніст рецептора ГАМК-А); (остеоартрит), біль, що повторюється, при русі, 11) інгібітори металопротеази матриксу (ММР); 12) зубний біль, раковий біль, міофасціальний біль тромболітичні засоби; 13) опіоїди, такі як морфін; (м'язові рани, фіброміалгія), періопераційний біль 14) нейтрофіл-інгібуючий фактор (NIF); 15) L(загальна хірургія, гінекологія), хронічний біль, ДОФА; 16) карбідопа; 17) леводопа/карбідопа; 18) дисменорею, а також біль, пов'язаний зі агоністи дофаміну, такі як бромкриптин, перголід, стенокардією, і запальний біль різної природи праміпексол, ропінірол; 19) антихолінергічні (наприклад, остеоартрит, ревматоїдний артрит, засоби; 20) амантидин; 21) карбідопа; 22) ревматизм, тендосиновіт і подагра), головний біль, інгібітори катехол-О-метилтрансферази (СОМТ), мігрень, депресію, тривогу, шизофренію, «удар», такі як ентакапон і толкапон; 23) інгібітори травматичне ушкодження мозку, хворобу моноаміноксидази В (МАО-В); 24) агоністи і Альцгеймера, церебральну ішемію, бічний антагоністи опіатів; 25) агоністи і антагоністи аміотрофічний склероз, хворобу Хантінгтона, рецепторів 5НТ; 26) агоністи і антагоністи перцептивну туговухість, шум у вуха х, гла укому, рецепторів NMDA; 27) антагоністи NK1; 28) неврологічне ушкодження, викликане інгібітори селективного зворотного захоплення епілептичними нападами або отруєнням серотоніну (SSRI) і/або інгібітори селективного нейротоксинами або недоліком глюкози і/або зворотного захоплення серотоніну і кисню у мозку, втрату зору, викликану норепінефрину (SSNRI); 29) трициклічні нейродегенерацією зорових шляхів, синдром антидепресантні лікарські засоби; 30) модулятори утомлених ніг, мультисистемну атрофію, первинну норепінефрину; 31) літій; 32) вальпроат; 33) гіпералгезію, вторинну гіпералгезію, первинну нейронтин (габапентин). алодинію, вторинну алодинію або інший біль, Креми, мазі, желе, розчини або суспензії, що викликаний центральною сенситизацією. Сполуки містять дані сполуки, можуть бути використані для формули І можуть бути використані, щоб запобігти місцевого застосування. Полоскання для ротової дискінезії, особливо побічним ефектам, що порожнини і горла включені у композиції місцевого супроводжують нормальні дози L-ДОФА. Крім того, застосування даного винаходу. сполуки формули І можуть бути використані, щоб Препарат, призначений для перорального знизити переносимість і/або залежність від призначення людям, звичайно може містити від опіоїдного лікування болю і для лікування приблизно 0,5мг до приблизно 5г активного 15 81319 16 компонента, змішаного з відповідною і звичайною кількістю носія, яка може змінюватися від 5 до 95% від ваги композиції. Одиничні лікарські форми можуть звичайно містити від приблизно 1мг до приблизно 1000мг активного компонента. Стани, вказані в описі, можна лікувати або запобігати їм введенням від приблизно 0,01мг до приблизно 140мг сполук винаходу на кілограм ваги тіла на день. Однак, конкретний рівень дози для будь-якого окремого пацієнта буде залежати від багатьох факторів. Такі фактори включають вік, вагу тіла, загальний стан здоров'я, стать і харчування Сполуки даного винаходу можуть бути пацієнта. Інші фактори включають час і спосіб одержані відповідно до схем, представлених введення, швидкість виведення, змішування нижче, а також методик, представлених у лікарського засобу і тип, і тяжкість окремого Прикладах. Наступні схеми і Приклади далі захворювання, що підлягає терапії. Наприклад, описують, але ними не обмежуються, галузь дії запальний біль можна ефективно лікувати винаходу. введенням від приблизно 0,01мг до приблизно Приклади 1 і 2 75мг сполуки винаходу на кілограм ваги тіла на день або, альтернативно, від приблизно 0,5мг до приблизно 3,5г на пацієнта на день. Нейропатичний біль можна ефективно лікувати введенням від приблизно 0,01мг до приблизно 125мг сполуки винаходу на кілограм ваги тіла на день або, альтернативно, від приблизно 0,5мг до приблизно 5,5г на пацієнта на день. Скорочення, що використовуються тут, якщо не вказано інакше (3S,4R)-4-Метилбензил-3-фтор-4-[(піримідин2-іламіно)метил]піперидин-1-карбоксилат 4-МеВnОН 4-метилбензиловий спирт CDI 1,1'-карбодіімдазол TEA триетиламін TBSCl трет-бутилдиметилсилілхлорид DMF диметилформамід (+)-BINAP (+)-2,2'-біс(дифенілфосфіно)-1,1'бінафтил NaOtBu трет-бутоксид натрію DIPEA діізопропілетиламін (3R,4S)-4-Метилбензил-3-фтор-4-[(піримідинEtOAc етилацетат 2-іламіно)метил]піперидин-1-карбоксилат TBSOTf трет-бутилдиметилсилілтрифлат Стадія 1 TBS трет-бутилдиметилсиліл Одержання 4-метилбензил-4-оксопіперидин-1THF тетрагідрофуран карбоксилату DMAP 4-диметиламінопіридин RT кімнатна температура Η години min хвилини DCM дихлорметан MeCN ацетонітрил іРrOH 2-пропанол 4-Метилбензиловий спирт (37,6г, 308ммоль) n-BuOH 1-бутанол додавали до розчину 1,1'-карбонілдіімідазолу EDC 1-(3-диметиламінопропіл)-3(50,0г, 308ммоль) у ДМФ при кімнатній етилкарбодіімідгідрохлорид температурі і перемішували 1год. Додавали HOAt 1-гідрокси-7-азабензтриазол гідратгідрохлорид 4-піперидону (Sigma-Aldrich) (47,0г, 308ммоль), розчин, що утворюється, нагрівали до 50°С і перемішували 15год. Реакційну суміш розбавляли етилацетатом, промивали 0,1Μ НС1, водою (4 рази) і насиченим розчином NaCl, сушили Na2SO4, фільтрували і концентрували. Очищення хроматографією на силікагелі (ступінчасте градієнтне елюювання: 10, 25 і 50% етилацетату у гексані) дало титульну сполуку (42,4г, 85% вихід) у вигляді прозорого масла. 17 81319 18 Н ЯМР (400МГц, CDCl3) δ 7,24 (д, 2Н), 7,15 (д, 2Н), 5,08 (с, 2Н), 3,79 (т, 4Η), 2,45 (ушир.с, 4Н), 2,31 (с, 3Н) м.ч.; Мас-спектроскопія високого розрізнення (електророзпилення) m/z 248,1281 [(М+Н)+; розраховано для C14H18NO3: 248,1287]; Обчислено C14H17NO3 : С, 68,03; Η, 7,05; Ν, 5,59. Знайдено: С, 68,00; Η, 6,93; Ν, 5,66. Стадія 2 (±)-4-метилбензил-3-фтор-(2)-4-(2-етокси-2Одержання (±)-4-метилбензил-3-фтор-4оксоетиліден)піперидин-1-карбоксилату. оксопіперидин-1-карбоксилату До розчину (±)-4-метилбензил-3-фтор-4оксопіперидин-1-карбоксилату (40г, 150ммоль) у толуолі (200мл) при кімнатній температурі додавали трифеніл(карбетоксиметилен)фосфоран (63,0г, 181ммоль) і реакційну суміш перемішували 1год. Реакційну суміш концентрували і очищали хроматографією на силікагелі (градієнтне елюювання: від 10 до 20% етилацетату у гексані), це дало (±)-4-метилбензил-3-фтор-(Е)-4-(2-етоксиРозчин 4-метилбензил-4-оксопіперидин-12-оксоетиліден)піперидин-1-карбоксилат і (±)-4карбоксилату (21,2г, 85,7ммоль) і діізопропілетиламіну (71,3мл, 428ммоль) у метилбензил-3-фтор-(2)-4-(2-етокси-2оксоетиліден)піперидин-1-карбоксилат (41,0г, 78% дихлорметані (425мл) охолоджували до 0°С і вихід, 3 стадії) у вигляді суміші Ε/Ζ (3:1). С уміш перемішували. Повільно додавали TDSOTf безпосередньо застосовують у наступній стадії. (29,5мл, 129ммоль), підтримуючи температуру Маленький зразок суміші розділяють всередині нижче 5°С. Додавали водний NaHCO3 (20мл) і розділяли шари. Органічний шар хроматографією на силікагелі з метою характеризації. промивали NaHCO3, водою, насиченим розчином (±)-4-Метилбензил-3-фтор-(Е)-4-(2-етокси-2NaCl, сушили Na2SO4, фільтрували і оксоетиліден)піперидин-1-карбоксилат: біла концентрували з одержанням неочищеного TBS тверда речовина ефіру енолу. 1 Неочищений TBS ефір енолу розчиняли у H ЯМР (400МГц, CDCl3) δ 7,26 (д, 2Н), 7,17 (д, 2Н), 5,98 (с, 1H), 5,11 (с, 2Н), 4,85 (м, 1H), 4,18 (кв., ДМФ (125мл) при кімнатній температурі. Додавали 2Н), 4,08 (ушир.д, 1H), 3,70 (м, 1Н), 3,55 (м, 1Н) реагент Селект-Фтор® (Air Products and Chemicals) 3,41 (м, 1Н), 3,33, (м, 1Н), 2,63 (ушир.д, 1H), 2,35 (30,4г, 85,7ммоль) і реакційну суміш перемішували (с, 3Н), 1,29 (т, 3Н) м.ч.; 10хв. Реакційну суміш розподіляли між етилацетатом і водою і органічний шар промивали Mac-спектроскопія високого розрізнення (електророзпилення) m/z 358,1420 [(M+Na)+; водою (три рази). Об'єднані водні шари розраховано для C18H22FNO4Na: 358,1425]; екстрагували етилацетатом (два рази) і об'єднані Обчислено C18H22FNO4 : С, 64,21; Η, 6,58; Ν, органічні шари сушили Na2SO4, фільтрували і 4,27. Знайдено: С, 64,46; Η, 6,61; N, 4,18. концентрували. Реакцію повторювали, і продукти реакції, що утворилися, з'єднували з одержанням (±)-4-Метилбензил-3-фтор-(Z)-4-(2-етокси-2оксоетиліден)піперидин-1-карбоксилат: біла сполуки (40г), яку використовували у наступній тверда речовина стадії без очищення. Дані ЯМР і мас-спектроскопії 1 Н ЯМР (400МГц, CDCl3) δ 7,24 (д, 2Н), 7,15 (д, дають підставу вважати продукт кетоном, що існує 2Н), 6,41 (м, 1Н), 5,82 (с, 1Н), 5,11 (д, 2Н), 4,61 (м, як гідрат. 1 Н ЯМР (400МГц, CDCl3) δ 7,24 (м, 2Н), 7,19 1Н), 4,38 (ушир.д, 1H), 4,16 (кв., 2Н), 3,05-2,95 (м, 1Н), 2,9-2,75 (м, 2Н), 2,33 (с, 3Н), 2,13 (м, 1H), 1,27 (м, 2Н), 5,18 (с, 2Н), 4,81 (ушир.д, 1H), 4,50 (т, 3Н) м.ч.; (ушир.д, 1H), 4,23 (д, 1Н), 3,90 (м, 1Н), 3,60 (м, 1H), Mac-спектроскопія високого розрізнення 3,35 (т, 1Η), 2,58 (м, 2Н), 2,35 (с, 3Н) м.ч.; (електророзпилення) m/z 358,1422 [(M+Na)+; Мас-спектроскопія високого розрізнення (електророзпилення) m/z, 284,1292 20 [(М+Н)+; розраховано для C18H22FNO4Na: 358,1425]. Стадія 4 розраховано для C14H18FNO4 : 284,1293]; Одержання Обчислено C14H18FNO4×1,2 Н2О: С, 58,61; Η, 6,46; Ν, 4,88. Знайдено: С, 58,28; Η, 6,06; Ν, 4,72. Стадія 3 Одержання 1 (±)-4-метилбензил-3-фтор-(Е)-4-(2-етокси-2оксоетиліден)піперидин-1-карбоксилату і 19 81319 20 (±)-цис-4-метилбензил-3-фтор-4-(2-етокси-2NaOH (1М, 50мл). Реакційну суміш перемішували оксоетил)піперидин-1-карбоксилату і 5год. при кімнатній температурі і потім розбавляли етилацетатом і 1М НСl. Шари розділяли, і водний шар двічі екстрагували етилацетатом. Об'єднані органічні шари промивали насиченим розчином NaCl, сушили Na2SO4, фільтрували і концентрували з одержанням титульної сполуки (9,1г) у вигляді білої твердої речовини, яку використовували у наступній стадії без (±)-транс-4-метилбензил-3-фтор-4-(2-етокси-2додаткового очищення. 1 оксоетил)піперидин-1-карбоксилату. H ЯМР (400МГц, CDCl3) δ 7,24 (д, 2Н), 7,15 (д, До розчину суміші олефінів стадії 3 (10,0г, 2Н), 5,08 (с, 2Н), 4,79-4,16 (м, 3Н), 3,05-2,75 (м, 29,8ммоль) у толуолі (160мл) і дихлорметані 2Н), 2,59 (дд, 1H), 2,36 (дд, 1H), 2,31 (с, 3Н), 2,20(120мл) додавали дифенілсилан (5,53мл, 2,02 (м, 1Н), 1,60 (м, 2Н) м.ч.; 29,8ммоль) і (R)-BINAP (1,86г, 2,98ммоль). Потім Mac-спектроскопія високого розрізнення додавали NaOtBu (0,29г, 2,98ммоль) і CuCl (0,30г, (електророзпилення) m/z 310,1457 [(М+Н)+; 2,98ммоль), реакційну суміш захищали від світла і розраховано для C16H20FNO4 : 310,1449]; перемішували 15год. Додавали додаткові порції Обчислено C16H20FNO 4×0,15 Н2О: С, 62,13; Н, дифенілсилану (2,76мл), NaOtBu (0,29г) і CuCl 6,52; N, 4,53. Знайдено: С, 61,55; Н, 6,37; N,4,41. (0,30г) і реакційну суміш перемішували при Стадія 6 кімнатній температурі 24год. Суміш потім Одержання (±)-цис-4-метилбензил-3-фтор-4фільтрували через целіт і концентрували. (амінометил)піперидин-1-карбоксилату Очищення на силікагелі (ступінчасте градієнтне елюювання: 5, 10, 15, 25 і 30% етилацетату у гексані) дало регенеровані вихідні матеріали (3,5г, 35% вихід), (±)-цис-4-метилбензил-3-фтор-4-(2етокси-2-оксоетил)піперидин-1-карбоксилат (5,0г, 50% вихід) і (±)-транс-4-метилбензил-3-фтор-4-(2етокси-2-оксоетил)піперидин-1-карбоксилат (1,2г, 12%). До суспензії неочищеної (±)-цис-3-фтор-1-[(4(±)-цис-4-метилбензил-3-фтор-4-(2-етокси-2метилбензилоксикарбоніл) піперидин-4-іл]оцтової оксоетил)піперидин-1-карбоксилат: прозоре кислоти (9,1г, 29,4ммоль) у толуолі додавали масло, триетиламін (10,2мл, 73,5ммоль) і 1 Н ЯМР (400МГц, CDCl3) δ 7,25 (д, 2Н), 7,15 (д, дифенілфосфорилазид (9,52мл, 44,1ммоль). 2Н), 5,10 (с, 2Н), 4,80-4,20 (м, 3Н), 4,15 (кв., 2Н), Реакційну суміш нагрівали до 70°С і перемішували 3,10-2,73 (м, 2Н), 2,52 (дд, 1H), 2,35 (с, 3Н), 2,30 20хв. Додавали суміш діоксану (80мл) і 1М NaOH (дд, 1Н), 2,10 (м, 1H), 1,72-1,48 (м, 2Н), 1,29 (т, 3Н) (80мл) і реакційну суміш охолоджували до м.ч.; кімнатної температури. Реакційну суміш Mac-спектроскопія високого розрізнення + упарювали, щоб видалити діоксан, і 3 рази (електророзпилення) m/z 338,1689 [(М+Н) ; екстрагували етилацетатом, сушили Na2SO4, розраховано для C18H25FNO4 : 338,1762]. фільтрували і концентрували. Залишок (±)-транс-4-метилбензил-3-фтор-4-(2-етокси-2суспендували у ди хлорметані, перемішували 30хв. оксоетил)піперидин-1-карбоксилат: прозоре і білий осад відфільтровували. Фільтрат масло, 1 концентрували з одержаннямнеочищеного Н ЯМР (400МГц, CDCL3) δ 7,24 (д, 2Н), 7,15 продукту (7,5г) у вигляді жовтого масла, яке (д, 2Н), 5,08 (с, 2Н), 4,50-3,95 (м, 3Н), 4,15 (кв., 2Н), безпосередньо використовували у наступній 2,81 (ушир.т, 2Н), 2,70 (ушир.д, 1Н), 2,35 (с, 3Н), стадії. Аналітичний зразок очищали 2,17 (м, 2Н), 1,89 (ушир.д, 1Н), 1,25 (м, 1H), 1,22 (т, хроматографією на силікагелі (градієнтне 3Н) м.ч.; елюювання: від СН 2Сl2 до CH2Cl2:MeOH:NH 4OH Mac-спектроскопія високого розрізнення 80:20:2) для характеризації. (електророзпилення) m/z 338,1699 [(М+Н)+; 1 H ЯМР (400МГц, CDCl3) δ 7,24 (д, 2Н), 7,15 (д, розраховано для C18H25FNO4 : 338,1762]. 2Н), 5,08 (с, 2Н), 4,90-4,18 (м, 3Н), 2,95-2,75 (м, Стадія 5 2Н), 2,79 (дд, 1H), 2,70 (дд, 1H), 2,35 (с, 3Н), 1,59 Одержання (±)-цис-3-фтор-1-[(4(м, 3Н) м.ч.; метилбензилоксикарбоніл)піперидин-4-іл]оцтової Mac-спектроскопія високого розрізнення кислоти (електророзпилення) m/z 281,1658 [(М+Н)+; розраховано для C15H22FN2O 2: 281,1660]. Стадія 7 Одержання До розчину (±)-цис-4-метилбензил-3-фтор-4(2-етокси-2-оксоетил)піперидин-1-карбоксилату (10,0г, 29,6ммоль) у ТГФ (50мл) додавали водний 21 81319 22 (3S,4R)-4-метилбензил-3-фтор-4-[(піримідин-24,79 (м, 1Н), 4,42 (т, 1H), 4,21 (д, 1Н), 3,60 (дд, 1Н), іламіно)метил]піперидин-1-карбоксилату і 3,50 (дд, 1H), 3,15-2,80 (м, 2Н), 2,30 (с, 3Н), 2,10 (м, 1H), 1,61 (м, 2Н) м.ч.; Mac-спектроскопія високого розрізнення (електророзпилення) m/z 359,1870 [(М+Н)+; розраховано для C19H24FN4O 2: 359,1878]. Обчислено C19H23FN4 O2×НСl×0,5Н2О: С, 56,50; Н, 6,24; N, 13,87. Знайдено: С, 56,68; Н, 6,27; N,13,80. (3R,4S)-4-метилбензил-3-фтор-4-[(піримідин-2Приклади 3 і 4 іламіно)метил]піперидин-1-карбоксилату Суміш неочищеного (±)-цис-4-метилбензил-3фтор-4-(амінометил)піперидин-1-карбоксилату (стадія 6, 3,7г, 13,2ммоль) і 2-хлорпіримідину (1,51г, 13,2ммоль) в н-бутанолдіізопропілетиламіні (1:1, 13мл) завантажували у дві ампули. Ампули запаювали, нагрівали до 140°С і перемішували (-)-транс-4-Метилбензил-3-фтор-42год. Після охолоджування реакційні суміші [(піримідин-2-іламіно)метил]піперидин-1об'єднували і розбавляли етилацетатом і карбоксилат (приклад 3) і (+)-транс-4насиченим NаНСО3. Шари розділяли, органічний метилбензил-3-фтор-4-[(піримідин-2шар промивали водою і насиченим розчином NaCl, іламіно)метил]піперидин-1-карбоксилат (приклад сушили Na2SO4, фільтрували і концентрували. 4) Очищення хроматографією на силікагелі Титульні сполуки одержували з (±)-транс-4(градієнтне елюювання: від етилацетат-гексан 1:1 метилбензил-3-фтор-4-(2-етокси-2до етилацетату) дало рацемічний цис-4оксоетил)піперидин-1-карбоксилату (Приклади 1 і метилбензил-3-фтор-4-[(піримідин-22, Стадія 4) за методикою, описаною у Стадіях 5, 6 іламіно)метил]піперидин-1-карбоксилат (6,9г, 65% і 7 Прикладів 1 і 2. вихід, 3 стадії) у вигляді білої твердої речовини. (-)-транс-4-Метилбензил-3-фтор-4-[(піримідинЕнантіомери розділяли препаративною ВЕРХ 2-іламіно)метил]піперидин-1-карбоксилат-НСІ на колонці ChiralPak AD (5см´50см, 20мкМ), [a]-11,5° (с 0,22, МеОН); використовуючи елюент МеОН-MeCN (15:85, Т.пл. 113-114°С; 150мл/хв.). Сіль гідрохлорид Прикладу 1 1 H ЯМР (400МГц, CD3OD) δ 8,80-8,39 (м, 2Н), одержували розчиненням (3S,4R)-цис-47,24 (д, 2Н), 7,15 (д, 2Н), 7,00 (т, 1Н), 5,08 (с, 2Н), метилбензил-3-фтор-4-[(піримідин-24,49-4,21 (м, 2Н), 4,00 (д, 1H), 3,81 (дд, 1Н), 3,58 іламіно)метил]піперидин-1-карбоксилату (6,9г, (дд, 1Н), 2,95 (м, 1Н), 2,31 (с, 3Н), 2,12 (м, 1Н), 1,90 19,3ммоль) в ізопропанолі (100мл) при 65°С. (м, 1Н), 1,34 (м, 1Н) м.ч.; Додавали розчин НСL в ізопропанолі (1,608М, Mac-спектроскопія високого розрізнення 12,6мл, 20,2ммоль), розчин повільно (електророзпилення) m/z 359,1867 [(М+Н)+; охолоджували до кімнатної температури за 15год., розраховано для C19H24FN4O 2: 359,1878]. додавали Et2O (25мл), суміш перемішували 3год., Обчислено C19H23FN4O 2×HCl×H2O: С, 55,27; Η, охолоджували до 0°С, перемішували 1год. і 6,35; Ν, 13,57. Знайдено: С, 55,08; Η, 6,11; Ν, фільтрували, одержуючи гідрохлорид (3S,4R)-413,36. метилбензил-3-фтор-4-[(піримідин-2(+)-транс-4-метилбензил-3-фтор-4-[(піримідиніламіно)метил]піперидин-1-карбоксилату у формі 2-іламіно)метил]піперидин-1-карбоксилат НСІ білої твердої речовини (7,0г, 92% діставання). [a]+16,3 о (с 0,17, МеОН); (3S,4R)-4-метилбензил-3-фтор-4-[(піримідин-2Т.пл. 113-114°С; іламіно)метил]піперидин-1-карбоксилат-НСІ 1 Н ЯМР (400МГц, CD3OD) δ 8,80-8,39 (м, 2Н), [a]D-36,4°(c 0,17,MeOH); 7,24 (д, 2Н), 7,15 (д, 2Н), 7,00 (т, 1Н), 5,08 (с, 2Н), Т. пл. 149-150°С; 4,49-4,21 (м, 2Н), 4,00 (д, 1H), 3,81 (дд, 1H), 3,58 1 Н ЯМР (400МГц, CD3OD) δ 8,58 (ушир.с, 2Н), (дд, 1Н), 2,95 (м, 1Н), 2,31 (с, 3Н), 2,12 (м, 1H), 1,90 7,21 (д, 2Н), 7,17 (д, 2Н), 6,99 (т, 1Н), 5,06 (с, 2Н), (м, 1Н), 1,34 (м, 1Н) м.ч.; 4,79 (м, 1Н), 4,42 (т, 1Н), 4,21 (д, 1H), 3,60 (дд, 1Н), Mac-спектроскопія високого розрізнення 3,50 (дд, 1H), 3,15-2,80 (м, 2Н), 2,30 (с, 3Н), 2,10 (електророзпилення) m/z 359,1873 [(М+Н)+; (м, 1Н), 1,61 (м, 2Н) м.ч.; розраховано для C19H24FN4O 2: 359,1878]; Mac-спектроскопія високого розрізнення + Обчислено C19H23FN4O 2×НСl×Н2О: С, 55,27; Н, (електророзпилення) m/z 359,1879 [(М+Н) ; 6,35; N, 13,57. Знайдено: С, 55,18; Н, 6,11; N,13,38. розраховано для C19H24FN4O 2: 359,1878]; Приклад 5 Обчислено C19H23FN4 O2×НСl×0,2Н2О: С, 57,27; Одержання Н, 6,17; N, 14,06. Знайдено: С, 57,22; Н, 6,37; N,14,16. (3R,4S)-4-метилбензил-3-фтор-4-[(піримідин-2іламіно)метил]піперидин-1-карбоксилат НСІ [a]D+34,9°(c 0,18, MeOH); Т. пл. 149-150°С; 1 Н ЯМР (400МГц, CD3OD) δ 8,58 (ушир.с, 2Н), 7,21 (д, 2Н), 7,17 (д, 2Н), 6,99 (т, 1Н), 5,06 (с, 2Н), 23 (3S,4R)-N-[(3-цис-фтор-1-{[(1R,2R)-2фенілциклопропіл]карбоніл}піперидин-4іл)метил]піримідин-2-аміну 81319 (3S,4R)-4-метилбензил-3-фтор-4-[(піримідин-2іламіно)метил]піперидин-1-карбоксилат (Приклад 1) (400мг, 1,16ммоль) розчиняли в 3Н НСl (4мл), нагрівали до 90°С і перемішували 1год. Реакційну суміш концентрували і неочищений гідрохлорид аміну розчиняли у ДМФ (3мл) при кімнатній температурі і додавали (1R,2R)-2фенілциклопропанкарбонову кислоту (188мг, 1,16ммоль) (одержання описано [T.N. Riley and C.G. Brier, J. Org. Chem., 15, 1187-1188, 1972]), EDC (222мг, 1,16ммоль), HOAt (158мг, 1,16ммоль) і триетиламін (323мкл, 2,32ммоль). Реакційну суміш нагрівали до 70°С і перемішували 10хв. Після охолоджування до кімнатної температури реакційну суміш розбавляли етилацетатом і водою. Шари розділяли, і органічний шар промивали водою і насиченим розчином NaCl, сушили Na2SO4, фільтрували і концентрували. Очищення хроматографією на силікагелі (градієнтне елюювання: від етилацетат-гексан 1:1 до етил ацетат/метанол/NН4ОН 90:10:1) дало титульну сполук у (320мг, 78% вихід) у вигляді білої твердої речовини. Сполуку характеризували як сіль гідрохлорид, яку одержували за методикою Прикладу 1, стадія 7. [a]D-164° (c 0,22, MeOH); Т.пл. 127-128°С; 1 H ЯМР (400МГц, CD3OD) δ 8,59 (ушир.с, 2Н), 7,25 (м, 2Н), 7,17 (м, 3Н), 7,01 (т, 1Н), 4,85 (м, 2Н), 4,65-4,30 (м, 2Н), 3,55 (м, 2Н), 3,30 (м, 1H), 2,80 (м, 1Н), 2,39 (м, 1Н), 2,30-2,10 (м, 2Н), 1,75 (м, 1H), 1,55 (м, 2Н), 1,33 (м, 1Н) м.ч.; Mac-спектроскопія високого розрізнення (електророзпилення) m/z 355,1925 [(М+Н)+; розраховано для C20H24FN4O: 355,1929]; Обчислено C20H23FN4O×HCl×H2O: С, 58,75; Η, 6,41; Ν, 13,70. Знайдено: С, 58,57; Η, 6,44; Ν, 13,54. Приклад 6 (-)-цис-4-Метилбензил-3-фтор-4-[(1,3,4тіадіазол-2-іламіно)метил]піперидин-1-карбоксилат Стадія 1 Одержання 24 (±)-цис-4-метилбензил-3-фтор-4{[(гідразинотіокарбоніл)аміно] метил}піперидин-1карбоксилату Розчин (±)-цис-4-метилбензил-3-фтор-4(амінометил)піперидин-1-карбоксилату (Приклад 1, стадія 6) (200мг, 0,71ммоль) у ДМФ (2мл) додавали по краплях до перемішуваного і охолоджуваного (0°С) розчину тіокарбонілдіімідазолу (127мг, 0,71ммоль) у ДМФ (4мл). Реакційну суміш перемішували 30хв., охолоджувальну баню видаляли і реакційну суміш перемішували 1год. при кімнатній температурі. Потім додавали гідразин (0,666мл, 2,14ммоль) і реакційну суміш перемішували ще 30хв., потім виливали у воду і екстрагували етилацетатом. Органічний шар промивали насиченим розчином NaHCO3, водою і насиченим розчином NaCl, сушили Na2SO4, розчинник видаляли у вакуумі і одержували неочищений твердий продукт. Твердий продукт розтирали з метанолом (10мл), фільтрували і одержували 180мг титульної сполуки. 1 H ЯМР (300МГц, CDCl3) δ 7,67 (ушир.с, 2Н), 7,25 (д, 2Н), 7,19 (д, 2Н), 5,10 (с, 2Н), 4,80-4,20 (ушир.м, 3Н), 3,75 (с, 2Н), 3,80-3,55 (м, 2Н), 3,052,70 (м, 2Н), 2,38 (с, 3Н), 2,10 (м, 1H), 1,60 (м, 2Н) м.ч. Стадія 2 (-)-цис-4-Метилбензил-3-фтор-4-[(1,3,4тіадіазол-2-іламіно)метил]піперидин-1-карбоксилат Суспензію (±)-цис-4-метилбензил-3-фтор-4{[(гідразинотіокарбоніл)аміно]метил}піперидин-1карбоксилату (180мг, 0,51ммоль) в етанолі (10мл) обробляли триетилортоформіатом (151мг, 1,02ммоль) і концентрованою НСl (0,01мл) і перемішували при кімнатній температурі під азотом 18год. Після розчинення усієї твердої речовини реакційну суміш кип'ятили зі зворотним холодильником 1,5год., охолоджували до кімнатної температури та упарювали леткі продукти. Залишок розподіляли між етилацетатом і розбавленим розчином NаНСО3. Органічний шар промивали насиченим розчином NaCl, сушили Na2SO4, розчинник упарювали. Неочищений продукт очищали хроматографією на силікагелі (градієнтне елюювання від 50% етилацетат/гексан до 20% метанол/етилацетат) і одержували титульну сполуку у вигляді білої твердої речовини. (-)-Енантіомер відділяють і сіль гідрохлорид одержують як описано у Прикладах 1 і 2, Стадії 7. [a]D-47,4° (c 0,17, MeOH); Т.пл. 115-117°С; 1 H ЯМР (400МГц, CDCl3) δ 8,37 (с, 1Н), 7,25 (д, 2Н), 7,16 (д, 2Н), 6,57 (ушир.с, 1Н), 5,10 (д, 2Н), 4,79 (дд, 1H), 4,56 (м, 1H), 4,29 (м, 1Н), 3,44 (д, 2Н), 3,10-2,77 (м, 2Н), 2,35 (с, 3Н), 2,2 (м, 1H), 1,63 (м, 2Н); Mac-спектроскопія високого розрізнення (електророзпилення) m/z 365,1437 [(М+Н)+; розраховано для C17H21FN4O 2S: 365,1442]; Обчислено C17H21FN4O 2S: С, 56,03; Н, 5,81; N, 15,37. Знайдено С, 55,82; Н, 5,74; N,15,11. Приклад 7 25 81319 (+)-транс-4-Метилбензил-3-фтор-4-[(1,3,4тіадіазол-2-іламіно)метил]піперидин-1-карбоксилат Титульну сполуку одержували з (±)-транс-4метилбензил-3-фтор-4-(2-етокси-2оксоетил)піперидин-1-карбоксилату (Приклади 1 і 2, Стадія 4), використовуючи методики, описані у Прикладах 1 і 2, Стадіях 5 і 6, з подальшим утворенням тіадіазолу, як описано у Прикладі 6. (+)-Енантіомер відділяли хіральною ВЕРХ хроматографією як описано у Прикладах 1 і 2, Стадія 7. [a]D+37,1° (с 0,56, МеОН); Т.пл. 93-95°С; 1 H ЯМР (400МГц, CDCl3) δ 8,36 (с, 1Н), 7,28 (д, 2Н), 7,19 (д, 2Н), 6,56 (ушир.с, 1H), 5,04 (с, 2Н), 4,45 (м, 2Н), 4,17 (м, 1Н), 3,56 (м, 2Н), 2,80 (м, 2Н), 2,35 (с, 3Н), 2,10 (м, 1H), 1,96 (м, 1H), 1,39 (м, 1Н) м.ч.; Mac-спектроскопія високого розрізнення (електророзпилення) m/z 365,1432 [(М+Н)+; розраховано для C17H22FN4O 2S: 365,1442]; Обчислено C17H22FN4O2S×0,25Н2О: С, 55,34; Н, 5,87; N, 15,19. Знайдено: С, 55,50; Н, 5,61; N,14,81. 26
ДивитисяДодаткова інформація
Назва патенту англійською3-fluoro-piperidines as nmda/nr2b antagonists
Автори англійськоюLiverton Nigel J., Claiborne Christopher F., Claremon David A., Mccauley John A.
Назва патенту російською3-фторпиперидины как антагонисты nmda/nr2b
Автори російськоюЛивертон Найджел Дж., Клейборн Кристофер Ф., Клейрмон Девид А., Макколи Джон А.
МПК / Мітки
МПК: C07D 417/12, C07D 401/12, A61P 25/16
Мітки: антагоністи, 3-фторпіперидини
Код посилання
<a href="https://ua.patents.su/13-81319-3-ftorpiperidini-yak-antagonisti-nmda-nr2b.html" target="_blank" rel="follow" title="База патентів України">3-фторпіперидини як антагоністи nmda/nr2b</a>
Попередній патент: Спосіб гідродинамічного дослідження свердловин
Наступний патент: Машина для очищення і нанесення захисного покриття магістральних трубопроводів
Випадковий патент: Керуюча насадка для вентиля












