Похідні 1-[(індол-3-іл)карбоніл]піперазину
Номер патенту: 78317
Опубліковано: 15.03.2007
Автори: Колфілд Вілсон, Кернс Джеймс, Адам-Воролл Джулія, Тірні Джейсон, Йорк Марк, Каулі Філіп Мартін
Формула / Реферат
1. Похідне 1-[(індол-3-іл)карбоніл]піперазину, що має загальну формулу І
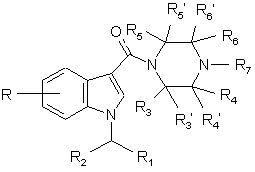 ,
,
Формула І
де
R представляє 1-4 замісники, незалежно вибрані з Н, (С1-4)алкілу (як варіант, заміщеного галогеном), (С1-4)алкілоксилу (як варіант, заміщеного галогеном), галогену, ОН, NH2, CN та NO2;
R1 представляє (С5-8)циклоалкіл або (С5-8)циклоалкеніл;
R2 представляє Н, метил або етил;
R3, R3', R4, R4', R5, R5' та R6' представляють, незалежно, гідроген або (С1-4)алкіл, як варіант, заміщений (С1-4)алкілоксилом, галогеном або ОН;
R6 представляє гідроген або (С1-4)алкіл, як варіант, заміщений (С1-4)алкілоксилом, галогеном або ОН; або
R6 утворює разом із R7 4-7-членний насичений гетероцикл, що, як варіант, містить інший гетероатом, вибраний з О та S;
R7 утворює разом із R6 4-7-членний насичений гетероцикл, що, як варіант, містить інший гетероатом, вибраний з О та S; або
R7 представляє Н, (С1-4)алкіл або (С3-5)циклоалкіл, алкілгрупи, як варіант, заміщені ОН, галогеном або (С1-4)алкілоксилом; або
його фармацевтичнo прийнятна сіль.
2. Похідне 1-[(індол-3-іл)карбоніл]піперазину за п.1, де R2 представляє Н, а R1 представляє (С5-6)циклоалкіл.
3. Похідне 1-[(індол-3-іл)карбоніл]піперазину за п. 2, де R представляє (С1-4)алкіл, окси або галоген.
4. Похідне 1-[(індол-3-іл)карбоніл]піперазину за п. 3, де R представляє метокси-групу на 7-позиції індольного кільця.
5. Похідне 1-[(індол-3-іл)карбоніл]піперазину за п. 4, де R3, R3', R4', R5, R5' та R6' представляють Н; R4, R6 та R7 представляють незалежно Н або (С1-4)алкіл; або R6 утворює разом із R7 5- або шестичленний насичений гетероцикл, а R4 представляє Н або (С1-4)алкіл.
6. Похідне 1-[(індол-3-іл)карбоніл-3-іл]піперазину формули І за п. 1, яке вибрано з групи:
1-{[1-(циклогексилметил)-7-метокси-1Н-індол-3-іл]карбоніл}-3,5-диметил-4-етилпіперазин;
1-{[1-(циклогексилметил)-7-метокси-1Н-індол-3-іл]карбоніл}-3,4,5-триметилпіперазин;
(S)-1-{[1-(циклогексилметил)-7-метокси-1Н-індол-3-іл]карбоніл}-3,4-диметилпіперазин;
(S)-2-{[1-(циклогексилметил)-7-метокси-1Н-індол-3-іл]карбоніл}-октагідро-2Н-піридо-[1,2-а]піразин;
(S)-2-{[1-(циклогексилметил)-7-метокси-1Н-індол-3-іл]карбоніл}-октагідро-2Н-піроло-[1,2-а]піразин та
(S)-2-{[1-(циклопентилметил)-7-метокси-1Н-індол-3-іл]карбоніл}-октагідро-2Н-піридо-[1,2-а]піразин;
або їх фармацевтично прийнятні солі.
7. Похідне 1-[(індол-3-іл)карбоніл]піперазину за одним із пп.1-6 для застосування у терапії.
8. Фармацевтична композиція, що містить похідне 1-[(індол-3-іл)карбоніл]піперазину за одним із пп. 1-6 разом із фармацевтично прийнятним носієм.
9. Застосування похідного 1-[(індол-3-іл)карбоніл]піперазину формули І за п.1 в отриманні медикаменту для лікування болю.
Текст
1. Похідне 1-[(індол-3-іл)карбоніл]піперазину, що має загальну формулу І R6 N R2 R3 R1 N R7 R4 R3 ' R4' , Формула І де R представляє 1-4 замісники, незалежно вибрані з Н, (С1-4)алкілу (як варіант, заміщеного галогеном), (С1-4)алкілоксилу (як варіант, заміщеного галогеном), галогену, ОН, NH2, CN та NO2; R1 представляє (С5-8)циклоалкіл або (С58)циклоалкеніл; R2 представляє Н, метил або етил; UA N R (11) R5' R6 ' O R5 (19) (21) 20041210112 (22) 13.06.2003 (24) 15.03.2007 (86) PCT/EP2003/050226, 13.06.2003 (31) 02077505.2 (32) 21.06.2002 (33) EP (46) 15.03.2007, Бюл. № 3, 2007 р. (72) Каулі Філіп Мартін, GB, Колфілд Вілсон , GB, Тірні Джейсон , GB, Кернс Джеймс , GB, АдамВоролл Джулія , GB, Йорк Марк , GB (73) Н.В. ОРГАНОН, NL (56) WO 01 58869 A Huffman J.W. et al: " Design, synthesis and pharmacology of cannabimimetic indoles " , Bioorganic & Medicinal chemistry letters, Oxford, GB, vol. 4, no.4, 1994, pages 563-566, XP000651749, ISSN: 0960-894X, table 1. Eissenstat M.A. et al. : " Avinoalkylindoles : strukture activity relationships of novel cannabinoid mimetics" Journal of medicsnal chemistry, American chemical society. Washington, US, vol. 38, no. 16, 1995, pages 2 78317 1 3 78317 4 R3, R3', R4, R4', R5, R5' та R6' представляють, неза4)алкіл; або R 6 утворює разом із R 7 5- або шестилежно, гідроген або (С1-4)алкіл, як варіант, заміщечленний насичений гетероцикл, а R4 представляє ний (С1-4)алкілоксилом, галогеном або ОН; Н або (С1-4)алкіл. R6 представляє гідроген або (С1-4)алкіл, як варіант, 6. Похідне 1-[(індол-3-іл)карбоніл-3-іл]піперазину заміщений (С1-4)алкілоксилом, галогеном або ОН; формули І за п. 1, яке вибрано з групи: або 1-{[1-(циклогексилметил)-7-метокси-1Н-індол-3R6 утворює разом із R7 4-7-членний насичений іл]карбоніл}-3,5-диметил-4-етилпіперазин; гетероцикл, що, як варіант, містить інший гетеро1-{[1-(циклогексилметил)-7-метокси-1Н-індол-3атом, вибраний з О та S; іл]карбоніл}-3,4,5-триметилпіперазин; R7 утворює разом із R6 4-7-членний насичений (S)-1-{[1-(циклогексилметил)-7-метокси-1Н-індол-3гетероцикл, що, як варіант, містить інший гетероіл]карбоніл}-3,4-диметилпіперазин; атом, вибраний з О та S; або (S)-2-{[1-(циклогексилметил)-7-метокси-1Н-індол-3R7 представляє Н, (С1-4)алкіл або (С3-5)циклоалкіл, іл]карбоніл}-октагідро-2Н-піридо-[1,2-а]піразин; алкілгрупи, як варіант, заміщені ОН, галогеном або (S)-2-{[1-(циклогексилметил)-7-метокси-1Н-індол-3(С1-4)алкілоксилом; або іл]карбоніл}-октагідро-2Н-піроло-[1,2-а]піразин та його фармацевтичнo прийнятна сіль. (S)-2-{[1-(циклопентилметил)-7-метокси-1Н-індол2. Похідне 1-[(індол-3-іл)карбоніл]піперазину за 3-іл]карбоніл}-октагідро-2Н-піридо-[1,2-а]піразин; п.1, де R2 представляє Н, а R1 представляє (С5або їх фармацевтично прийнятні солі. 7. Похідне 1-[(індол-3-іл)карбоніл]піперазину за 6)циклоалкіл. 3. Похідне 1-[(індол-3-іл)карбоніл]піперазину за п. одним із пп.1-6 для застосування у терапії. 2, де R представляє (С1-4)алкіл, окси або галоген. 8. Фармацевтична композиція, що містить похідне 4. Похідне 1-[(індол-3-іл)карбоніл]піперазину за п. 1-[(індол-3-іл)карбоніл]піперазину за одним із пп. 3, де R представляє метокси-групу на 7-позиції 1-6 разом із фармацевтично прийнятним носієм. індольного кільця. 9. Застосування похідного 1-[(індол-35. Похідне 1-[(індол-3-іл)карбоніл]піперазину за п. іл)карбоніл]піперазину формули І за п.1 в отри4, де R3, R3', R4', R5, R5' та R6' представляють Н; манні медикаменту для лікування болю. R4, R6 та R7 представляють незалежно Н або (С1 Представлений винахід стосується похідних 1[(індол-3-іл)карбоніл]піперазину, фармацевтичних композицій, що містять їх, та застосування похідних 1-[(індол-3-іл)карбоніл]піперазину, як агоністів канабіноїду у лікуванні болю та інших розладів. Похідні 1-[(Індол-3-іл)карбоніл]піперазину відомі, як сполуки, наділені цікавими фармакологічними якостями. Похідні 1-[(індол-3іл)карбоніл]піперазину з незаміщеним атомом нітрогену індолу розкрито у [WO 9806715 (SmithKlineBeecham Corp.)] як анти-запальні засоби. Споріднені похідні 1-[(індол-3іл)карбоніл]піперазину, які також заміщені при атомі нітрогену індолу, розкрито у [WO 0143746 (Nippon Shinyaku Co.)], як сполуки, що мають антизапальну та нефротропічну активності. Похідні 1-[(1-Бензил-індол-3іл)карбоніл]піперазину розкриті в дослідженні антагоністів H1-рецептору [Battaglia, S. et al. Eur. J. Med. Chem. 34, 93-105, 1999] і в дослідженні антизапальних засобів [Duflos, Μ. et al. Eur. J. Med. Chem. 36, 545-553, 2001], та знайдено відносно низьку активність у двох дослідженнях. Недавно похідні 1-[(індол-3-іл)карбоніл]піперазину, в цілому, описані у [WO 0158869 (Bristol-Myers Squibb)], як активні модулятори канабіноїдного рецептору та як такі, що корисні в лікуванні легеневих хвороб. Конкретних похідних 1-[(індол-3іл)карбоніл]піперазину в цій патентній заявці не розкрито. Лікування болю часто обмежене побічною дією існуючого зараз лікування. Від помірного до сильного болю широко застосовують опіоїди. Ці засоби дешеві та ефективні, але потенціально мають се рйозну побічну дію, що загрожує життю, - найбільш значну легеневу, депресію та м'язову ригідність. На додаток, дози опіоїдів, які можна застосувати, обмежуються нудотою, блюванням, запором, сверблячкою та затримкою сечі, що часто призводить до вибору пацієнтом субоптимального контролю болю ніж потерпати від дистресу внаслідок цієї побічної дії. Більш того, ця побічна дія часто закінчується необхідністю тривалої госпіталізації пацієнтів. До опіоїдів швидко звикають і вони є регламентованими ліками на багатьох територіях. Таким чином, є потреба у нових аналгетиках, що мають кращий профіль побічної дії у порівнянні із застосовуваними зараз продуктами, у еквіаналгетичних дозах. Отримано доказ, що агоністи канабіноїду мають потенціал, як анальгетичні та запальні засоби. Залучено два типи канабіноїдних рецепторів, канабіноїдний СВ1-рецептор, який локалізовано переважно в центральній нервовій системі, але, який також експресується у периферичних нейронах, та меншою мірою в інших периферичних тканинах, та канабіноїдний СВ2-рецептор, який переважно локалізовано в імунних клітинах [Howlett, А.С. et al.: International Union of Pharmacology. XXVII. Classification of Cannabinoid Receptors Pharmacol. Rev. 54, 161-202, 2002]. В той час, як СВ2рецептор залучено у моделювання імунного та протизапального відгуку канабіноїдів, агоністи канабіноїдного рецептора, особливо ті, що діють на СВ1 рецептор, як недавно припустили, корисні в лікуванні болю [Iversen, L. та Chapman, V.: Cannabinoids: real prospect for pain relief? Current Opinion in Pharmacology, 2, 50-55, 2002 та 5 78317 6 references therein]. Агоністи канабіноїдного рецепбутил, ізобутил, третинний бутил, пропіл, ізопротору, як-то СР 55,940 та WIN 55,212-2, створюють піл, етил та метил. потужну антиноцицепцію з ефективністю, еквіваВ терміні (С1-4)алкоксил (С1-4)алкіл визначено лентною морфіну, у тваринних моделях гострого вище. болю, стійкого запального болю та невропатичного Термін (С5-8)циклоалкіл означає насичену цикболю Відомі канабіноідні агоністи загалом є висолічну алкільну гр упу, що має 5-8 атомів карбону, та коліпофільними та нерозчинними у воді Таким може, таким чином означати циклопентил, циклочином, є необхідність у канабіноідних агоністах із гексил, циклогептил або циклооктил. кращими якостями для застосування як терапевПереважно (С5-8)циклоалкільні групи - циклотичних засобів. пентил та циклогексил. Для цього представлений винахід пропонує Термін (С5-8)циклоалкеніл означає циклічну похідні 1-[(індол-3-іл)карбоніл]піперазину, що маалкенільну групу, що має 5-8 атомів карбону та ють загальну формулу І принаймні один подвійний зв'язок, як-то циклопент-3-еніл або циклогекс-3-еніл. Термін галоген означає F, СІ, Вr або І. У визначенні формули І R6 може формувати разом з R7 4-7-членний насичений гете-роцикл, який означає, що R6 разом з атомом карбону, з яким він зв'язаний, та R7 разом з атомом нітрогену, із яким він зв'язаний, комплектує 4-7-членне насичене кільце, як-то азетидин, піролідин, піперидин, або 1Н-азепін. Такі кільця можуть містити додаткоде вий О або S-гетероатом з утворенням кілець, як-то R представляє 1-4 замісники незалежно вибморфоліну, піперазину, гомопіперазину, імідазолірані з Н, (С1-4)алкілу (як варіант, заміщеного галодину або тетрагідротіазолу. геном), (С1-4)алкілоксилу (як варіант, заміщеного Переважними є похідні 1-[(індол-3галогеном), галогену, ОН, NH 2 CN та NO 2, іл)карбоніл]піперазину формули І, де R2 - Η, a R1 R1 - (С5-8)циклоалкіл або (С5-8)циклоалкеніл, циклопентил або циклогексил. R2 - Н, метил або етил, Кращими є сполуки формули І, де R крім того R3, R3', R4, R4', R5, R5' та R6' - незалежно, гідропредставляє (С1-4)алкілоксил або галоген, а ще ген або (С1-4)алкіл, як варіант, заміщений (С1кращими є похідні 1-[(індол-3-іл)карбоніл]4)алкілоксилом, галогеном або ОН, піперазину винаходу, де R представляє метоксиR6 утворює разом з R7 4-7-членний насичений льну груп у на 7-позиції індольного кільця. гетероцикл, що, як варіант, містить інший гетероОсобливо переважними є похідні 1-[(індол-3атом, вибраний з О та S, іл)карбоніл]піперазину формули І, де R3, R3', R4', R7 утворює разом з R6 4-7-членний насичений R5, R5' та R6' представляють Η; R4, R6 і R7 незалегетероцикл, що, як варіант, містить інший гетерожно представляють Н або (С1-4)алкіл; або R6 утвоатом, вибраний з О та S, або рює разом із R7 5- або 6-членне насичене гетероR7 - Η, (С1-4)алкіл або (С1-4)циклоалкіл, алкілциклічне кільце, a R4 є Η або (С1-4)алкілом. групи, як варіант, заміщені ОН, галогеном або (С1Особливо переважними агоністами рецептора 4))алкілоксилом, або СВ-1 винаходу є: їх фармацевтично прийнятну сіль, як агоністи 1-{[1-(циклогексилметил)-7-метокси-1Н-індолрецептору канабіноіду 1, які тому можна застосу3-іл]карбоніл}-3,5-диметил-4-етилпіперазин; вати у лікуванні болю, як-то, наприклад, болю при 1-{[1-(циклогексилметил)-7-метокси-1Н-індолоперації, хронічного болю, невропатичного болю, 3-іл1карбоніл)3,4,5-триметилпіперазин; болю при раку та болю i спастичності, асоційова(S)-1-{[1-(циклогексилметил)-7-метокси-1Нних з розсіяним склерозом. індол-3-іл]карбоніл}-3,4-диметил-піперазин; Сполуки винаходу взагалі описано у WO (S)-2-{[1-(циклогексилметил)-7-метокси-1Н0158869 (вище) як модулятори канабіноїдних реіндол-3-іл]карбоніл}-октагідро-2Н-піридо-2Нцепторів для лікування легеневої хвороби. Ці мопіридо[1,2-а]піразин; дулятори переважно ідентифіковані тут як СВ2(S)-2-{[1-(циклогексилметил)-7-метокси-1Нмодулятори Більшість сполук, які розкрито у WO індол-3-іл]карбоніл}-октагідро-2Н-піроло-[1,20158869, охарактеризовано присутністю 2-(4а]піразин; та морфолініл)етильного бічного ланцюга на 1(S)-2-{[1-(циклопентилметил)-7-метокси-1Нпозиції серцевинної структури індолу або індазолу. індол-3-іл]карбоніл}-октагідро-2Н-піридо-[1,2Похідні 1-[(індол-3-іл)карбоніл]піперазину винахоа]піразин; або ду відрізняються від тих, що у WO 0158869, наявїх фармацевтично прийнятні солі. ністю циклопентилметилового або циклогексилПохідні 1-[(індол-3-іл)карбоніл]піперазину виметилового бічного ланцюга на відповідній позиції, находу можна одержати способами, загалом відотобто особливістю, яка, на відміну від 2-(4мими в органічній хімії. Більш конкретно, такі споморфолініл)етилового бічного ланцюга або бензилуки можна одержати, застосовуючи спосіб, лового бічного ланцюга, забезпечує сполуки, що описаний [С. J. Swain et al (J. Med. Chem. 34, 140мають агоністичну активність стосовно СВ1. 151, 1991) та P. Ε. Peterson, J. P. Wolf III та С. Термін (С1-4)алкіл, як застосовано у визначенні Niemann (J. Org. Chem. 23, 303-304, 1958)] або формули І, означає розгалужену або нерозгалужемодифікацією цих способів. ну алкільну групу, що має 1-4 атоми карбону, як-то 7 78317 8 Υ - гідроксил, a R 2 - гідроген, можна одержати відновленням карбонової кислота або естеру карбонової кислоти, застосовуючи відновник, як-то боран-тетрагідрофурановий комплекс або літій алюміній гідрид. Сполуки формули IV можна отримувати ацилуванням сполуки формули VI на 3-позиції, застосовуючи ацилувальний реагент. Наприклад, спо1-[(Індол-3-іл)карбоніл]піперазини Формули І луки формули IV можна отримувати із сполуки можна, наприклад, отримати із конденсату сполуки формули VI обробкою трифлуорцтовим ангідриформули II, де R1, R2 та R мають значення, які дом в розчиннику, як-то диметилформаміді, настувизначено раніше, а С(О)Х представляє карбонову пним гідролізом у водному натрій гідроксиді при кислоту або її активоване похідне, як-то галогенанпідвищеній температурі. гідрид карбонової кислоти, переважно хлорангідрид або бромангідрид, із сполукою Формули III, де R3 - R7 мають значення, які раніше визначено. Коли С(О)Х представляє карбонову кислоту (тобто, X - гідроксил) реакцію конденсації можна проводити за допомогою реагенту сполучення, як-то, наприклад, карбонілдіімідазолу, дициклогексилкарбодііСполуки формули VI можна отримати із комеміду тощо, в розчиннику, як-то диметилформаміді рційних джерел, отримати способом із літератури або дихлорметані. або модифікацією способу із літератури, що відоКоли С(О)Х представляє галогенангідрид кармий фахівцям. бонової кислоти (тобто, X - галоген), конденсацію з Сполуки формули II можна альтернативно похідним аміну III можна провести в присутності одержати ацилуванням сполуки формули VII, заоснови, наприклад, триетиламіну, в розчиннику, стосовуючи ацилувальний реагент. Наприклад, як-то дихлорметані. сполуки формули II, де X - хлорид, можна одержаСполуки формули III можна отримати із комети реакцією сполуки формули VII з оксалілхлорирційних джерел, отримати способами з літератури дом у розчиннику, як-то 1,1,2,2-тетрахлоретані, з або варіантами способів із літератури, що відомі наступною перебудовою при підвищеній темперафа хівцям. Наприклад, сполуки формули III можна турі. одержати відновленням дикетопіперазину, застоСполуки формули VII можна одержати реакцісовуючи відновник, як-то літій алюміній гідрид або єю сполуки формули VI з сполукою формули V у боран-тетрагідрофурановий комплекс, як описано присутності основи, як натрій гідриду. у [М. Е. Jung та J. С Rohlo (J. Org. Chem. 50, 4909Спеціаліст також розуміє, що різні 1-[(індол-34913, 1985)]. Дикетопіперазини можна одержати іл)карбоніл]-піперазинові похідні формули І можна різними способами, як описано у [С. J. DinsmoRe отримати відповідними реакціями перегрупування та D. С BershoRe (Тетpahedron 58, 3297-3312, функціональних груп, що відповідають, деяким із 2002)]. замісників R та R1-R7. Наприклад, сполуки формуСполуки формули II можна одержати реакцією ли І, де R7 - (С1- 4)алкіл або (С1-4)циклоалкіл, алкілсполуки формули IV, де R має значення, як раніше групи яких можуть бути заміщеними ОН, галогеном визначено, та сполуки формули V, де R1 та R2 маабо (С1-4)алкілоксилом, можна одержати реакцією ють значення, які визначено раніше, a Y є відщепсполуки формули І, де R7 - гідроген, з (С1люваною групою, наприклад, галогенідом або ал4)алкілгалогенідом або функціоналізованим (С 1кілсульфонатом, у присутності основи, як-то 4)алкілгалогенідом, у присутності основи, як-то гідриду натрію. Якщо необхідно, карбонову кислокарбонату калію. ту можна конвертувати до галогеніду карбонової Сполуки формули І, де R - (С1-4)алкілоксил або кислоти, наприклад, хлориду карбонової кислоти , функционалізований (С1-4)алкілоксил можна одерзастосовуючи реагент, як-то оксалілхлорид. жати реакцією сполуки формули І, де R - гідроген, з (С1-4)алкілгалогенідом або функционалізованим (С1-4)алкілгалогенідом, у присутності основи, як-то гідриду натрію. Сполуки формули І, де R - NH2, можна одержати реакцією сполуки формули І, де R - нітрогрупа, з відновником, як-то водень/паладій на активованому вугіллі. 1-[(індол-3-іл)карбоніл]піперазинові похідні Сполуки формули V можна отримати із комерформули І та їх солі містять, принаймні, один ційних джерел, отримати способами з літератури центр хіральності, та існують, отже, як стереоізоабо модифікаціями способів із літератури,що вімери, залучаючи енантіомери та діастереоізомедомі фахівцям. ри. Представлений винахід залучає у свої рамки Наприклад, сполуки формули V, де Υ - парараніше згадані стереоізомери, та кожний з окремих толуолсульфонат, можна одержати зі сполуки фоR- та S-енантіомерів сполук формули І та їх солей, рмули V, де Υ - гідроксил, застосовуючи спосіб, що є по суті вільним, тобто асоційованим з менше описаний у [В. Torok et al (J. Chem. Soc. Perkin ніж 5%, переважно менше ніж 2%, особливо менТранс. 1, 801-804, 1993)]. Сполуки формули V, де ше ніж 1% інших енантіомерів, та суміші таких 9 78317 10 енантіомерів у будь-яких пропорціях, залучаючи пілюлі, таблетки, або обробляти у капсули, супорацемічні суміші, що містять, по суті, рівні кількості зиторії або пластири. За допомогою фармацевтидвох енантіомерів. чно прийнятних рідин активні засоби застосовують Способи асиметричних синтезів, де чисті стеяк рідкі композиції, тобто як ін'єкційні препарати, у реоізомери отримують добре відомими в техніці вигляді розчину, суспензії, емульсії, або як спрею, способами, тобто синтези з індукуванням хіральтобто назального спрею. ності або, починаючи з хіраль-них інтермедіатів, Для виготовлення твердих дозованих одиниць енантіоселективних ферментативних перетворень, передбачають застосування звичайних адитивів, розділенням стереоізомерів або енантіомерів, заяк-то наповнювачів, барвників, полімерних зв'язустосовуючи хроматографію на хіральному середоючих тощо. Взагалі, можна застосовувати будьвищі. Такі способи, наприклад, описані в [Chirality у який фармацевтично придатний адитив, який не Industry (edited by A.N. Collins, G.N. Sheldrake та J. впливає на функцію активної складової. Придатні Crosby, 1992; John Wiley)]. носи, із якими активний засіб винаходу можна заФармацевтично прийнятні солі можна отримастосувати як тверді композиції, залучають лактозу, ти обробкою вільної основи сполуки формули І крохмаль, похідні целюлози тощо, або їх суміші мінеральною кислотою, як-то гідрохлоридною кисзастосовані в придатній кількості. Для парентералотою, гідробромідною кислотою, фосфатною кильного призначення, можна застосовувати водні слотою, сульфатною кислотою або органічною суспензії, ізотонічні розчини солі та стерильні ін'єкислотою, як-то, наприклад, аскорбіновою кислокційні розчини, що містять фармацевтично прийнтою, лимонною кислотою, виннокам'яною кислоятні диспергатори та/або змащувачі, як-то пропітою, молочною кислотою, малеїновою кислотою, ленгліколь або бутиленгліколь. Винахід крім того малоновою кислотою, фумаровою кислотою, глізалучає фармацевтичні композиції, які описані колевою кислотою, бурштиновою кислотою, пропівище, в комбінації з пакувальним матеріалом, оновою кислотою, оцтовою кислотою, метансульпридатним для названої композиції, названий пафоновою кислотою, тощо. кувальний матеріал має інструкції для описаного Сполуки винаходу можуть існувати як в несотут раніше застосування композиції. льватованій, так і в сольватованій фармацевтично Виявлено, що 1-[(індол-3прийнятними розчинниками формах, як-то водою, іл)карбоніл]піперазинові похідні винаходу є агонісетанолом тощо. Взагалі, для мети винаходу сольтами СВ-1-рецептору, як визначено в дослідженні ватовані форми вважають еквівалентними несоСВ-1-репортеру людини із застосуванням клітин льватованим формам. СНО. Способи визначення зв'язування рецептору, Представлений винахід крім того пропонує як і біологічної активності in vitro модуляторів кафармацевтичні композиції, що містять похідне 1набіноідних рецепторів добре відомі в рівні техні[(індол-3-іл)карбоніл]піперазину загальної формуки. Взагалі, експресований рецептор контактує із ли І, або його фармацевтично прийнятну сіль, із сполукою, яку тестують, і вимірюють зв'язування, фармацевтично прийнятними добавками, та, як стимулювання, або інгібування функціональної варіант, інші терапевтичні засоби. Термін "прийняреакції. тні" означає сумісність з іншими інгредієнтами Щоб визначити функціональний відгук виділекомпозиції та нешкідливість для реципієнта Комну ДНК, що кодує ген рецептору СВ1, переважно позиції залучають такі, що придатні для пероральрецептору людини, експресують у придатних кліного, сублінгвального підшкірного, внутрішньовентинах-хазяях. Така клітина може бути клітиною ного, епідурального, інтратекального, яєчника китайського хом'яка, але інші клітини привнутрішньом'язового, трансдермального, легенедатні також. Переважно клітини походять від ссавого, локального, або ректального призначення, вців. тощо, усі в формах одиниць дозування для приСпособи створення ліній клітин, що експресузначення. ють рекомбінантний СВ1 добре відомі в рівні техДля перорального призначення активний інгніки [Sambrook et aІ., Molecular Cloning Laboratory редієнт можна представити, як дискретну одиниManual, Cold Spring Harbor Laboratory PRess, Cold цю, як-то таблетки, капсули, порошки, гранули, Spring Harbor, latest edition]. Експреси рецептору розчини, суспензії, тощо. Для парентерального досягають експресією ДНК, кодуючої необхідний призначення, фармацевтичну композицію винахобілок. Способи лігування додаткових послідовносду можна представити в єдинодозових або багатей та придатних систем експресії добре відомі тодозових упаковках, тобто ін'єкційну рідину в заспеціалістам. Частини або всю кодування ДНК, здалегідь визначеній кількості, наприклад, в кодуючу необхідний білок, можна конструювати, герметичних флаконах та ампулах, та можуть тазастосовуючи стандартну те хніку твердофазового кож зберігатися у висушеному виморожуванням синтетезу, переважно для уведення рестрикційних (люфілізованому) стані, що тільки потребує додасайтів для полегшення літування. Для кодуючих вання до застосування стерильного рідкого носія, послідовностей ДНК можна забезпечити придатні тобто води. контрольні елементи для транскрипції та трансляЗмішаний з такими фармацевтично прийнятції, що містять кодуючу послідовність. Як добре ними добавками, які описано в стандартному повідомо, зараз доступні системи експреси, які сумісиланні, [Gennaro, A R et al, Remington Science та сні із широким розмаїттям хазяїв, залучаючи проPractice of Pharmacy (20th Edition , Lippincott каріоти, як-то бактерії, та еукарюти, як-то дріжджі, Williams & Wilkins, 2000, особливо дивись Part 5 клітини рослин, клітини комах, клітини ссавців, Pharmaceutical Manufacturing)], активний засіб моклітини птахів то що. жна пресувати у тверді дозовані одиниці, як-то Клітини, що експресують рецептори, потім ко 11 78317 12 нтактують із тест-сполукою, щоб спостерігати зв'я1-((1-(Циклогексилметил)-7-метокси-1Н-індолзування, стимулювання або інгібування функціо3-іл]карбоніл}4-етилпіперазин, сіль малеїнової нальної реакції. кислоти Альтернативно ізольовані клітинні мембрани, До розчину 7-метоксиіндолу (3,5г, 23,8ммол) у що містять експресований рецептор СВ1 (або диметилформаміді (35мл) при 0°С додають трифСВ2), можна застосувати для визначення зв'язулуорцтовий ангідрид (4,4мл, 31,5ммол) протягом 5 вання сполуки. хвилин. С уміш перемішують при кімнатній темпеДля вимірювання зв'язування радіоактивно ратурі 1год, потім доливають воду (200мл). Отриабо флуоресцентно мічених сполук можна застоманий осад 7-метокси-3сува ти найбільш широко застосованим радіопомі[(трифлуорметил)карбоніл]індолу відфільтровученим канабіноідним зондом є [3Н]СР55940, який ють, промивають водою та застосовують прямо в має приблизно рівну спорідненість до сайтів зв'янаступній стадії. зування СВ1 та СВ2. Інше дослідження залучає Сирий твердий продукт суспендують в 4Μ розскринінг сполук агоністів канабіноіду СВ1 визначині натрію гідроксиду (140мл) та нагрівають під ченням відгуку другого переносника, як-то, напризворотним холодильником із перемішуванням клад, вимір опосередкованих рецептором змін у 1год. Суміш охолоджують та промивають двічі шляха х обміну цАМФ або МАР-кінази. Таким чидіетиловим етером. Водну фазу потім підкислюють ном, спосіб залучає експресію рецептору СВ1 на до рН 1, застосовуючи 5Μ гідрохлоридну кислоту поверхні клітин хазяїна та піддавання клітини дії та отриманий чистий осад відфільтровують, протестованої сполуки. Далі визначають відгук другомивають водою та висушують, що дає 7го переносника. Рівень другого переносника збіметоксиіндол-3-карбонову кислоту (3,6г). льшуватиметься або зменшуватиметься залежно 7-Метоксиіндол-3-карбонову кислоту (3,0г, від дії тест-сполуки на зв'язування з рецептором. 16,6ммол) додають порціями до перемішуваної На додаток до прямого визначення, наприсуспензії натрій гідриду (60% дисперсія в мінераклад, рівнів цАМФ в обробленій клітині, можна льному маслі, 1,56г, 39ммол) у диметилформаміді застосувати клітини, які на додаток до трансфекци (75мл). Після 1год додають бромметилциклогекДНК, що кодує рецептор, також трансфектовані сан (5,7г, 32,3ммол). Суміш нагрівають до 60°С із другою ДНК, що кодує репортерний ген, експресія перемішуванням 1год. Суміш розбавляють водою якого корелює з активацією рецептору. Взагалі, (250мл) і промивають етилацетатом та потім діеекспресію репортерного гена можна було б конттиловим етером. Водну фазу підкислюють до рН 1, ролювати будь-яким чутливим елементом, що резастосовуючи 5Μ гідрохлоридну кислоту та осад агує на зміну рівнів другого переносника. Придатвідфільтровують. Сирий продукт перекристалізоними репортерними генами є, наприклад, LacZ, вують з етилацетату, що дає 1лужна фосфатаза, люцифераза світлячків та білок (циклогексилметил)-7-метоксиіндол-3-карбонову зеленої флуоресценції. Принципи оцінок такої кислоту (3,75г) у твердому кристалічному стані. До трансактивації добре відомі у рівні техніки та опирозчину 1-(циклогексилметил)-7-метоксиіндол-3сані, наприклад, в [Stratowa, Ch, Himmler, та карбонової кислоти (2,5г, 8,8ммол) в ТГФ (30мл) Czernilof-sky, АР, CurrOpin Biotechnol 6, 574 додають оксалілхлорид (4,5г, 35,3ммол), каплями (1995)]. Для вибору сполук активних агоністів вез перемішуванням. Суміш перемішують при кімналичина ЕК50 рецептора СВ1 повинна бути менше тній температурі 18год. Летючі складові випаро10-5М, переважно менше 10-7Μ. вують під зниженим тиском що дає 1Сполуки можна застосувати у лікуванні болю, (циклогексилметил)-7-метоксиіндол-3як-то, наприклад, болю при операціях, хронічного карбонілхлорид (2,7г) у твердому кристалічному болю, невропатичного болю, ракового болю та стані. До 1-(циклогексилметил)-7-метоксиіндол-3болю і спастичності, асоційованої з розсіяним карбонілхлориду (1,9г, 6,2ммол) додають розчин склерозом. N-етилпіперазину (1,35г, 11,8ммол) у дихлорметаКанабіноїдні агоністи винаходу також потенціні (60мл). Суміш перемішують до розчинення хлоально корисні у лікуванні інших розладів, залучаюрангідриду. Додають триетиламін (3мл, 21,5ммол чи розсіяний склероз, еластичність, запалення, та розчин перемішують при кімнатній температурі глаукому, н удоту та блювання, утрату апетиту, 18год. Реакційну суміш промивають водою розлади сну, легеневі розлади, алергії, епілепсію, (2´50мл), висушують із натрій сульфатом та випамігрень, серцево-судинні розлади, нейродегенераровують, що дає масло. Це очищають флештивні розлади, занепокоєння, травми головного хроматографією, елюючи 0-10% (об'єм %) метамозку та інсульт. нолом у дихлорметані, що дає названу сполуку, як Сполуки можна також застосувати в поєднанні вільну основу. Вільну основу розчиняють у діетиз іншими анальгетичними ліками, як-то опіоїдами ловому етері (50мл) та фільтрують у перемішувата нестероїдними анти-запальними ліками ний розчин малеїнової кислоти (0,8,3г, 7,15ммол) в (НСАЗЛ), залучаючи селективні інгібітори СОХ-2. етері (24мл) та метанолі (4мл). Отриману суміш Сполуки винаходу можна застосувати для люперемішують 30 хвилин та тверде відфільтровудей у відповідній кількості та протягом відповідноють. Тверде рекристалізують із метаного часу для пом'якшення симптомів. Для ілюстралу/діетилового етеру, що дає названу сполуку (1:1 ції, рівні добового дозування для людей можуть сіль малеїнової кислоти) у твердому кристалічнобути 0,001-50мг на кг ваги тіла, у перерахунку на му стані (2,7г, 5,4ммол). 1 добове дозування - 0,01-20мг на кг маси тіла. Н ЯМР (400МГц, CD3OD) dΗ 0,99-1,08 (2Н, m), Винахід ілюстровано наступними прикладами. 1,12-1,25 (3Н, m), 1,36 (3Н, t, J 7,5), 1,56 (2H, d, J Приклад 1 12,5) 1,63-1,74 (3Н, m), 1,77-1,89 (1H, m), 3 22 (2H, 13 78317 14 q, J 7,5), 3,30-3,35 (4H, m), 3 95 (3H s), 3,90-4,05 перемішують при кімнатній температурі 15 годин. (4H, m), 4,25 (2H, d, J 7,0), 6,25 (2H, s, малеат) 6,76 Подалі додають гідрид натрію (170мг, 4,23ммол) (1H, d, J 7,5), 7,10 (1H, t, J 7,5), 7,26 (1H, d, J 7,5), потім бромметилциклогексан (0,65мл, 4,65ммол) 7,53 (1H, s), EIMC: m/z=384,4 [M+H]+ та реакцію подалі перемішують 15 годин. Приклад 2 Реакційну суміш гасять 2-пропанолом (10мл) 1-{[1-(Циклопентилметил)-7-метокси-1Н-індолта потім концентрують. Отриману коричневу смолу 3-іл]карбоніл)-етилпіперазин, гідрохлорид розподіляють між етилацетатом (50мл) та 5% розЦиклопентанметанол-пара-толуолсульфонат чином натрій гідрокарбонату (50мл). Органічний одержують наступним способом: До розчину цикшар промивають водою (50мл), висушують над лопентанметанолу (2,0г, 20,0ммол) та піридину натрій сульфатом та концентрують. Сирий інтер(2,9мл, 36,3 і) у дихлорметані (20мл) додають пмедіат потім очищають флеш-хроматографією, толуолсульфонілхлорид (3,46г, 18,1ммол). Суміш застосовуючи 95% дихлорметан, 5% метанол, як перемішують при кімнатній температурі 24год під елюент, що дає 1-(циклогексилметил)-5азотом. Отриману суміш промивають 2М гідрохлофлуоріндол (1,26г, 5,45ммол). ридною кислотою, водний шар відокремлюють та До розчину 1-(циклогексилметил)-5екстрагують дихлорметаном. Об'єднані органічні флуоріндолу (208мг, 0,9 m ммол) в 1,1,2,2продукти висушують натрій сульфатом та концентетрахлоретані (15мл) при 0°С додають оксалілхтрують під зниженим тиском, що дає циклопенталорид (0,122мл, 0,945ммол) з перемішуванням у нметанол-пара-толуолсульфонат, як безбарвне потоці азоту. Суміш нагрівають до кімнатної теммасло (4,3г, 17,0ммол). ператури за 1 годину, потім нагрівають до 120°С Названу сполуку одержують за прикладом 1, за наступні 1,5 години. Суміш охолоджують до застосовуючи циклопентанметанол-паракімнатної температури та додають триетиламін толуолсульфонат замість бромметилциклогексану. (0,138мл, 0,99ммол). Перемішування продовжують 1 протягом 10 хвилин перед додавання NН ЯМР (400МГц, CD3OD) dΗ 1,29-1,35 (2Н m), 1 38 етилпіперазину (0,125мл, 0,99ммол). Суміш пере(ЗН, t, J 7,5), 1,52-1,71 (6H, m), 2,39-2,49 (1H, m), мішують при кімнатній температурі 15 годин та 3,24 (2H, q, J 7,5), 3,05-3,35 (2H, br m), 3,35-3,70 потім розподіляють між 0,4Μ розчином гідроксиду (4H, br m), 3,95 (3H, s), 4,38 (2H, d, J 7,5), 4,40-4,65 (2H, br m), 6,79 (1H, d, J 7,5), 7,10 (1H, t, J 7,5), 7,27 натрію (10мл) та дихлорметаном (10мл). Органічний шар промивають водою (10мл), висушують (1H, d, J 7,5), 7,60 (1H, s); EIMC m/z=370,2 [M+H]+ над Na2SO4 та концентрують. Отримане коричневе Приклад 3 масло очищають флеш-хроматографією, застосоПроцедура, описана в Прикладах 1 та 2, надавуючи 95% дихлорметан, 5% метанол, як елюент, лі застосована, щоб отримати наступні сполуки 3А: 1-([1-(циклогептилметил)-7-метокси-1Нщо дає названу сполуку, як вільну основу. Формування гідрохлоридної солі досягають індол-3-іл]карбоніл)-4-етилпіперазин, гідрохлорид додаванням 2М гідрогенхлоридного розчину в діеотримано, застосовуючи циклогептанметанол-птиловому етері (3мл) до розчину вільної основи в толуолсульфонат EIMC m/z=398,2 [М+Н]+. діетиловому етері (5мл). Осад фільтрують та ви3В: 1-{[1-(Цикпооктилметил)-7-метокси-1Ніндол-3-іл]карбоніл}-етилпіперазин гідрохлорид сушують. Тверда сполука кристалізується з діетилового етеру та метанолу, що дає названу сполуку отримано, застосовуючи циклооокганметанол-п(1:1 сіль гідрохлоридної кислоти) у твердому кристолуолсульфонат. El MS: m/z=412,4 [M+H]+. талічному стані (0,172г, 0,42ммол). 1Н ЯМР 3С: 1-{[1-(Циклогексилметил)-7-метокси-1Ніндол-3-іл1карбоніл)-4-(2-гідроксиетил)піперазин, (400МГц, CD3OD) dΗ 0,98-1,27 (2Н, m), 1 17-1 27 сіль трифлуорцтової кислоти отримано за Прикла(3Н, m), 1,39 (3Н, t, J 7,5), 1,59 (2H, d, J 13,0), 1,64дом 1, застосовуючи 1-(2-гідроксиетил)піперазин 1,77 (3H, m), 1,83-1,93 (1H, m) 3,08-3,20 (2H, m), замість N-етилпіперазину. EIMC: m/z=400,2 [M+H]+. 3,24-3,33 (2H m), 3,51 (2H, t, J 12,5), 3,63 (2H, d, J 3D: 1-{[1-(Циклогексилметил)-7-метокси-1Н11,0), 4,07 (2H, d J 7,5), 4 58 (2H, d, J 13,5), 7,04 індол-3-іл]карбоніл}-4-(2-метоксиетил)піперазин, (1H , td, J 9,0, 2,5), 7,45 (1H, dd, J 9,5, 2,5), 7,47сіль трифлуорцтової кислоти отримано, застосо7,51 (1H m) 7 77 (1H, s). EIMC m/z=372,0 [М+Н]+. вуючи 1-(2-метоксиетил)піперазин. EIMC: Приклад 5 m/z=414,2 [М+Н]+. Процедура, описана в Прикладі 4, подалі за3Е: 1-{[1-(Циклогексилметил)-7-метил-1Нстосована, щоб отримати наступні сполуки індол-3-іл]карбоніл)-4-етилпіперазин отримують за 5А: 1-{[1-(Циклогексилметил)-6-флуор-1НПрикладом 1, застосовуючи 7-метиліндол замість індол-3-іл]карбоніл}-4-етилпіперазин, гідрохлорид7-метоксиіндолу. EIMC: m/z=368,0 [М+Н]+. ну сіль отримують із 6-флуоріндолу. EIMC 3F: 1-{[1-(Циклогексилметил)-7-етил-1Н-індолm/z=372,0 [М+Н]+. 3-іл]карбоніл)-4-етилпіперазин отримують із 75В: 1-{[1-(Циклогексилметил)-7-флуор-1Нетиліндолу. EIMC: m/z=382,2 [М+Н]+. індол-3-іл]карбоніл}-4-етилпіперазин, гідрохлоридПриклад 4 ну сіль отримують із 7-флуоріндолу. EIMC 1-([1-(Циклогексилметил)-5-флуор-1Н-індол-3m/z=372,0 [М+Н]+. ілікарбоніл}-4-етилпіперазин, гідрохлорид 5С: 1-{[6-Бром-1-(циклогексилметил)-1Н-індолДо розчину 5-флуоріндолу (1,0г, 7,4ммол) у 3-іл]карбоніл}-4-етилпіперазин, гідрохлоридну сіль диметилформаміді (20мл) додають гідрид натрію отримують із 6-броміндолу. EIMC m/z=432,4 (60% дисперсія в мінеральному маслі, 327мг, [М+Н]+. 8,14ммол). Суміш перемішують при кімнатній тем5D: 1-{[7-Бром-1-(циклогексилметил)-1Н-індолпературі 10 хвилин перед додаванням броммети3-іл]карбоніл}-етилпіперазин, гідрохлоридну сіль лциклогексану (1,3мл, 9, ммол). Отриману суміш отримують із 7-броміндолу. EIMC m/z=432,5 15 78317 16 [М+Н]+. ють із 7-метоксиіндолу та циклогекс-3-енететанол5Е: 1-{[5-Хлор-1-(циклогексилметил)-1Н-індолп-толуолсуль фонату. EIMC: m/z=382,2 [М+Н]+. 3-іл)карбоніл)-4-етилпіперазин, гідрохлоридну сіль 5R: 1-{[1-Бром-1-(циклогексилметил)-1Н-індолотримують із 5-хлоріндолу. EIMC m/z=388,2 3-іл]карбоніл}-метилпіперазин, гідрохлоридну сіль [М+Н]+. отримують, застосовуючи 6-броміндол, як вихідну 5F: 1-{[6-Хлор-1-(циклогексилметил)-1Н-індолречовину, та N-метилпіперазин замість N3-іл]карбоніл}4-етил]піперазин, гідрохлоридну сіль етилпіперазину. EIMC: m/z=374,9 [М+Н]+. отримують із 6-хлоріндолу EIMC m/z = 388,5 5S: 1-{[1-(Циклогексилметил)-5-флуор-1Н[М+Н]+ індол-3-іл]карбоніл}-4-метилпіперазин гідрохлори5G: 1{[-7-Хлор-1-(циклогексилметил)-1Н-індолдну сіль отримують, застосовуючи 5-флуоріндол 3-іл]карбоніл}-4-етилпіперазин, гідрохлоридну сіль та N-метилпіперазин. EIMC: m/z=358,2 [М+Н]+. отримують із 7-хлоріндолу. EIMC m/z=388,0 5Т: 1-{[1-(Циклогексилметил)-6-флуор-1Н[М+Н]''''. індол-3-іл]карбоніл}-4-метилпіперазин, гідрохло5Н: 1-{[6-ціано-1-(циклогексилметил)-1Н-індолридну сіль отримують, із 6-флуоріндолу та N3-іл]карбоніл}-4-етилпіперазин, гідрохлоридну сіль метилпіперазину. EIMC: m/z=358,0 [М+Н]+. отримують із 6-цианіндолу. EIMC m/z=379,4 5U: 1-{[1-(1-Циклогексилметил)-7-флуор-1Н[М+Н]+. індол-3-іл]-4-метилпіперазин, гідрохлоридну сіль 5l: 1-{[1-Циклогексилетил)-1Н-індол-3отримують із 7-флуоріндолу та Nіл]карбоніл}-4-етилпіперазин, гідрохлоридну сіль метилпіперазину. EIMC: m/z=358,0 [М+Н]+. отримують з індолу та рацемічного 1-циклогексил5V: 1-{[6-Хлор-1-(циклогексилметил)-1Н-індол1-п-толуолсульфонілетану. EIMC m/z=368,0 3-іл]карбоніл}-4-метилпіперазин, гідрохлоридну [М+Н]+. сіль отримують, із 6-хлоріндолу та N--метил піпеПродукт отриманий у Прикладі 51, піддають разину. EIMC: m/z=374,0 [М+Н]+. хіральному РХ-ВР-розділенню на колонці 5W: 1-{[7-Хлор-1-(циклогексилметил)-1Н-індол3-іл]карбоніл}-4-метилпіперазин, гідрохлоридну ChiracelÒOD (2 С1-4 x 25 С1-4), елюючи ізогексіль отримують, із 7-хлоріндолу та N-метил піперасан/ізопропанолом 95/5 (об'єм %) при швидкості зину. EIMC: m/z=374,2 [M+H]+. потоку 20мл/хв. Продукти визначають, застосовуючи УФ-детектор при довжині хвилі 240нм. 5X: 1-{[6-циано-1-(циклогексилметил)-1Ніндол-3-іл]карбоніл}-4-метилпіперазин, гідрохло(-)-5І: Енантіомер 1, Час затримки 8,1 хвилин, ридну сіль отримують із 6-цианіндолу та Nнадлишок енантіомеру >98%, [a]D22 -12° метилпіперазину. EIMC: m/z=365,0 [М+Н]+. (с=1,25мг/мл в СНСІ3). 5Y: 1-{[1-(1-циклогексилетил)-6-метокси-1Н(+)-5І: Енантіомер 2, Час затримки 11,1 хвиіндол-3-іл]карбоніл}-4-метилпіперазин, гідрохлолин, надлишок енантіомеру >98%, [a]D22 +7° ридну сіль отримують, із 6-метоксиіндолу, N(с=1,50мг/мл в CHCI3). метилпіперазину та 1-циклогексил-1-п5J: 1-{[1-(1-Циклогексилетил)-6-метокси-1Нтолуолсульфонілетану. EIMC: m/z=384,2 [М+Н]+. індол-3-іл]карбоніл}-4-етилпіперазин, гідрохлорид5Z: 1-{[1-(1-циклогексилпропіл)-1Н-індол-3ну сіль отримують із 6-мeтоксиіндолу та 1іл]карбоніл}-1Н-метилпіперазин, гідрохлоридну циклогeксил-1-п-толуолсульфонілетану. EIMC: сіль отримують, із індолу N-метилпіперазине та 1m/z=398,2 [М+Н]+. циклогексил-1-п-толуолсульфонілпропану. EIMC: 5K: 1-{[1-(1-циклогексилетил)-7-метокси-1Нm/z=368,0 [М+Н]+. індол-3-іл]карбоніл}-4-етилпіперазин, гідрохлоридПриклад 6 ну сіль отримують із 7-метоксиіндолу та 11-{[7-Аміно-1-(циклогексилметил)-1Н-індол-3циклогексил-1-п-толуолсульфонілетану. EIMC: іл]карбоніл}-4-етилпіперазин m/z=398,2 [М+Н]+. 4-{[1-(Циклогексилметил)-7-нітро-1Н-індол-35мл: 1-{[1-(циклогексилметил)-6-нітро-1Ніл]карбоніл}-1-етилпіперазин (200мг, 0,5ммол) розіндол-3-іл]карбоніл)-4-етилпіперазин гідрохлоридчиняють в метанолі (10мл), до якого додають пану сіль отримують із 6-нітроіндолу. EIMC: ладій (5% на активованому вугіллі 50мг кат), як m/z=399,2 [М+Н]+. кашку в метанолі (3мл). Систему потім герметизу5М: 1-{[1-(циклогексилметил)-7-нітро-1Н-індолють та промивають азотом перед закріпленням 3-іл]карбоніл}-4-етилпіперазин, гідрохлоридну сіль джерела азоту (балон). Суміш перемішують при отримують із 7-нітроіндолу. EIMC: m/z=399,2 кімнатній температурі під воднем 15 годин, після [М+Н]+. чого и фільтрують через броунмілерит та концент5N: 1-{[1-Бензокси-1-(циклогексилметил)-1Нрують. Отримане коричневе масло очищають індол-3-іл]карбоніл}-4-етилпіперазин, гідрохлоридфлеш-хроматографією, застосовуючи 95% дихлону сіль отримують із 7-бензоксиіндолу. EIMC: рметан, 5% метанол, як елюент, що дає названий m/z=460,4 [М+Н]+. продукт, як вільну основу. 1Н ЯМР (400МГц, 5O: 1-{[1-(Циклогексилметил)-6-метокси-1НCD3OD) dΗ 0,97-1,08 (2Н, m),1,12 (3Н, t, J 7,5), 1,17індол-3-іл]карбоніл}-етилпіперазин, сіль малеїно1,26 (3Н m) 1 53 (2H, d J 12 5) 1,63-1,75 (3Н, m) вої кислоти отримують із 6-метоксиіндолу. EIMC: 1,87-1,98(1 Η, m), 2,44-2,55 (6H, m), 3,37 (4H, t, J m/z=384,5 [М+Н]+. 5,0) 4 20 (2H, d, J 7,5), 6,59 (1H dd, J 7,5, 1,0), 6,93 5Р: 1-{[1-(Циклогексилметил)-7-метокси-1Н(1H, t, J 7,5), 7,06 (1H, dd, J 8,0, 1,0) 7,39 (1H, s); індол-3-іл]карбоніл}-4-ізопропілпіперазин, гідроEIMC m/z=369,0 [M+H]+. хлоридну сіль отримують із 7-метоксиіндолу та 1+ Приклад 7 ізопропілпіперазину. EIMC: m/z=398,2 [М+Н] . 1-{[1-(Циклогексилметил)-7-гідрокси-1Н-індол5Q: 1-{[1-(Циклогекс-3-енілметил)-7-метокси3-іл]карбоніл)-4-етилпіперазин 1Н-індол-3-іл]карбоніл}-4-етилпіперазин отриму 17 78317 18 До розчину 4-{[7-бензилокси-1паровують під зниженим тиском та залишок очи(циклогексилметил)-1Н-3-іл]карбоніл}-1щають флеш-хроматографією, елюючи 5-10% етилпіперазину (1г, 2,2ммол) в етанолі (50мл), (об'єм %) метанолом в дихлорметані, що дає надодають паладій (5% на активованому вугіллі звану сполуку (вільна основа), як безбарвне масло 100мг). Суміш гідрогенізують під тиском 5,5бар при (0,43г). Вільну основу (0,1г, 0,24ммол) розчиняють 60°С 16 годин. Отриману суміш фільтрують через в ди хлорметані (1мл), оброблюють каплями 2Μ дикаліт та фільтрат концентрують під зниженим гідрохлоридної кислоти в діетиловому етері тиском що дає названу сполуку (вільна основа), як (0,3мл) та діетиловому етері (3мл). Отриманий смолу (865мг, 2,3ммол). осад збирають фільтрацією, промивають діетилоФормування гідрохлориду досягають додавим етером (15мл) та висушують під зниженим ванням гідрогенхлориду (2М розчин в діетиловому тиском, що дає названу сполуку (1:1 гідрохлоридетері 3 мл) до розчину вільної основи (180мг, ної кислоти сіль), як білу тверду речовину (0,09г, 0,5ммол) в діетиловому етері (5мл). Осад фільт0,20ммол). 1Н ЯМР (400МГц, CD3OD) dΗ 0,98-1,39 рують та висушують. Тверду речовину кристалізу(8Н, m), 1,42 (6Н, d, J 7,0), 1,64-1,89 (9H, m) 3,44ють із діетилового етеру та етанолу, що дає на3,70 (3Н, m), 3,95 (3Н, s), 4,21-4,34 (3Н, m), 6,77 звану сполуку (1:1 сіль гідрохлоридної кислоти) у (1H, d, J 7,7), 7,11 (1H, t, J 8,2), 7 38 (1H, d J 8,2), твердому кристалічному стані (132мг, 0,3ммол). 1Н 7,58 (1H, s); EIMC m/z 412,4 [M+H]+. Приклад 11 ЯМР (400МГц, CD3OD) dΗ 1,05 (2Н, m), 1,19 (3Н, m), 1,38 (3Н t J 7 5) 1 57 (2H, m), 1,69 (3H, m), 1,92 1-{[1-(Циклогексилметил)-7-метокси-1Н-індол(1H, m), 3,13 (2H, m), 3,27 (2H, q, J 7,5), 3,45 (2H, 3-іл]карбоніл}-2,6-диметилпіперазин, гідрохлорид m), 3,61 (2H, d, J 12,0), 4,29 (2H, d, J 7,0), 4,55 (2H, 4-{[1-(Циклогексилметил)-7-метокси-1Н-індолd, J 14,0), 6,59 (1H, d, J 7,0), 6,97 (1H t J 7 0), 7 14 3-іл]карбоніл}-3,5-диметилпіперазин-1-карбонової (1H d, J 7,0), 7,52 (1H, s); EIMC m/z=370,2 [M+H]+. кислоти трет-бутиловий естер отримують спосоПриклад 8 бом за Прикладом 10, застосовуючи 3,51-{[1-(Циклогексилметил)-7-(2-флуоретокси)диметилпіперазин-1-карбоновоі кислоти трет1Н-індол-3-іл]карбоніл}-4-етилпіперазин бутиловий естер [Е J Jacobsen et N-, J. Med. Chem. Натрій гідрид (60% дисперсія в мінеральному 42,1123-1144, 1999] замість 2 3,5,6маслі, 65мг, 1,62ммол) додають порціями до розтетраметилпіперазину. До о холодженого льодом чину 4-{[1-(циклогексилметил)-7-гідрокси-1Н-індолрозчину трет-бутилового естеру 4-{[13-іл]карбоніл}-1-етилпіперазину (200мг, 0,54ммол) (Циклогексилметил)-7-метокси-1Н-індол-3в диметилформаміді (5мл) із перемішуванням під іл]кабоніл}-3,5-диметилпіперазин-1-карбонової потоком азоту. Через 30 хвилин, додають 1-бромкислоти (0,52г, 1,08ммол) в дихлорметані (5мл) 2-флуоретан (49мкл, 0,65ммол). Суміш нагрівають додають каплями трифлуорцтову кислоту (2мл). до 60°С із перемішуванням 48 годин. Реакцію гаСуміш нагрівають до кімнатної температури 2год сять 2-пропанолом (10мл) та потім концентрують. перед видаленням деяких летючих складових під Отриману коричневу смолу розподіляють між дихзниженим тиском. Залишок потім суспендують в лорметаном (50мл) та 5% розчином натрій гідро5Μ розчині гідроксиду натрію (10мл) та екстрагукарбонату (50мл). Органічний шар промивають ють у дихлорметані (2´30мл). Об'єднані органічні водою (50мл), висушують над натрій сульфатом та шари висушують сульфатом магнію та випаровуконцентрують. Сирий інтермедіат очищають ють до масла. Цю речовину очищають флешфлеш-хроматографією, застосовуючи 95% дихлохроматографією, елюючи 5-10% (об'єм %) метарметан, 5% метанол, як елюент, що дає названу нолом в дихлорметані, що дає названу сполуку сполуку (54мг, 0,1ммол). 1Н ЯМР (400МГц, CD3OD) (вільна основа), як безбарвне масло. Вільну осноdΗ 1,05 (2Н, m), 1,19 (3Н, m), 1,39 (3Н, t, J 7,5), 1,56 ву розчиняють в діетиловому етері (3мл) та обро(2H, Μ), 1,69 (3Н, m), -1,92 (1H, m), 2,48 (2H, q, J бляють краплями 2Μ гідрохлоридної кислоти в 7,0), 2,53 (4H, m), 3,75 (4H, t, J 5,0), 4,26 (2H, d, J діетиловому етері (1мл). Отриманий осад збира,5), 4,32 (1H, m), 4,39 (1H, m), 4,75 (1H, m), 4,87 ють фільтрацією, промивають діетиловим етером (1H, m), 6,73 (1H, d, J 8,0), 7,06 (1H, t, J 8,0), 7,26 (15мл) та висушують під зниженим тиском, що дає (1H, d, J 8,0), 7,44 (1H, s); EIMC m/z=416 2 [M+H]+. названу сполуку (1:1 сіль гідрохлоридної кислоти), Приклад 9 як безбарвну тверду речовину (0,13г, 0,31ммол). 1 1-{[1-(циклогексилметил)-7-етокси-1Н-індол-3Н ЯМР (400МГц, CD3 OD) dΗ 1,04 (2Н, brq, J 9,0) іл]карбоніл}-4-етилпіперазин отримують наступ1,11-1,25 (3H, m), 1,44 (6H, d, J 7,0), 1,54 (2H, br d, ною процедурою, що описано в прикладі 8, застоJ 13 0), 1,62-1,90 (4H, m), 3,33-3,42 (4H, m), 3,95 совуючи брометан замість 1-бром-2-флуоретану. (3H, s), 4 26 (2H, d, J 7,0), 4 74-4,86 (2H, m), 6,76 EIMC m/z=398,2 [М+Н]+. (1H, d, J 7,5), 7,09 (1H, t, J 8,0), 7,21 (1H, d, J 7 5), Приклад 10 7,46 (1H, s); EIMC m/z 384,2 [M+H]+. 1-{[1-(Циклогексилметил)-7-метокси-1Н-індолПриклад 12 3-іл]карбоніл}-2,3,5,6-тетраметилпіперазин, гідро1-{[1-(Циклогексилметил)-7-метокси-1Н-індолхлорид 3-іл]карбоніл)-3,5-диметилпіперазин, гідрохлорид До розчину дизопропілетиламіну (0,83мл, До 1-(Циклогексилметил)-7-метокси-індол-34,90ммол) та 2,3,5,6-тетраметилпіперазину (0,35г, карбоновоі кислоти (0,25г, 0,87ммол, отриманої 2,45ммол) в дихлорметані (5мл) додають розчин способом за Прикладом 1) та 2,61-(циклогексилметил)-7-метоксиіндол-3диметилпіперазину (0,12г, 1,05ммол) в дихлормекарбонілхлориду (0,33г, 1,08ммол, далі - отримантані (10мл) додають діізопропілкарбодіімід ня за Прикладом 1) в дихлорметані (5мл). Суміш (0,16мл, 1,05ммол) та 1-гідроксибензотриазол перемішують при кімнатній температурі 6год, ви(0,01г, 0,0 ммол). Суміш перемішують при кімнат 19 78317 20 ній температурі 18год. Суміш промивають 5Μ наm/z=384,5 [М+Н]+. 13E: (S)-1-{[1-(Циклогексилметил)-7-метокситрію гідроксидом (2´10мл), висушують магнію сульфатом та випаровують. Залишок очищають 1Н-індол-3-іл]карбоніл}-3-метилпіперазин, гідрохлоридну сіль отримано, застосовуючи 1флеш-хроматографією, елюючи 5-10% (об'єм %) (циклогексилметил)-7-метоксиіндол-3-карбонову метанолом в дихлорметані, що дає названу сполукислоту та (S)-2-метилпіперазин. 1Н ЯМР (400МГц, ку (вільна основа), як безбарвне масло. Вільну основу (0,15г) розчиняють в діетиловому етері CD3OD) dΗ 1,01-1,23 (5Н, m), 1,33(3H, d, J 6,5), (3мл) та оброблюють каплями з 2Μ гідрохлоридної 1,52-1,87 (6Н, m), 3,16-3,51 (3Н, m), 3,95 (3Н, s), кислоти в діетиловому етері (1мл). Отриманий 4,27 (2Н, d, J 7,0), 4,43 (2H, br d, J 14,3), 6,76 (1H, осад збирають фільтрацією, промивають діетилоd, J 7,8), 7,10 (1H, t, J7,9), 7,25 (1H, d, J8,0), 7,54 вим етером (15мл) та висушують під зниженим (1H, s). EIMC; m/z=370,0 [M+H]+. тиском, що дає названу сполуку (1:1 сіль гідрохло13F: (R)-1-{[1-(Циклогексилметил)-7-метоксиридної кислоти), як безбарвну тверду речовину 1Н-індол-3-іл]карбоніл}-3-метилпіперазин, гідрохлоридну сіль отримано, застосовуючи 1(0,15г, 0 36ммол). 1Н ЯМР (400МГц, CD3OD) dΗ (циклогексилметил)-7-метоксиіндол-3-карбонову 0,98-1,26 (5Н, m) 1,32 (6Н, d, J 6,5), 1,56, (2H, brd, J кислоту та (R)-2-метилпіперазин. 1Н ЯМР (400МГц, 12,0), 1,62-1,90 (4H, m), 3,06 (2H, dd, J 14,5 11,5), 3,39-3,50 (2H, m), 3,95 (3H, s), 4,26 (2H, d, J 7,5), CD3OD) dΗ 1,01-1,23 (5Н, m), 1,33 (3Н, d, J 6,5), 4,52 (2H, br d, J 13,5), 6,77 (1H, d, J7,5), 7,1 (1H, t, J 1,52-1,87 (6Н, m), 3,16-3,27 (2Н, m), 3,38-3,51 (3Н, 8,0), 7,24 (1H, d, J 8,0), 7,54 (1H, s); EIMC: m/z m), 3,95 (3Н, s), 4,27 (2Н, d, J 7,0), 4,43 (2H, br d, J 384,2 [M+H]+. 14,3), 6,76 (1H, d, J 7,8), 7,10 (1H, t, J 7,9), 7,25 (1H, Приклад 13 d, J 8,0), 7,54 (1H, s). EIMC; m/z=370,0 [М+Н]+. Процедура, описана в прикладі 12, подалі заПриклад 14 стосована, щоб отримати наступну сполуку 1-{[1-(Циклогексилметил)-7-метокси-1Н-індол13А: 1-{[1-(циклогексилметил)-7-метокси-1Н3-іл]карбоніл}-3,5-диметил-4-етилпіперазин, гідроіндол-3-іл]карбоніл}-3-метилпіперазин, гідрохлохлорид рид, отримано, застосовуючи 1До розчину 1-{[1-(Циклогексилметил)-7(циклогексилметил)-7-метоксиіндол-3-карбонову метокси-1Н-індол-3-іл]карбоніл}-3,5кислоту та рац-2-метилпіперазин. 1Н ЯМР диметилпіперазину (0,7г, 1,83ммол) та калію карбонату (0,3г, 2,19ммол) в диметилформаміді (5мл) (400МГц, CD3OD) dΗ 0,98-1,24 (6Н, m), 1,33 (3Н, d J додають йодетан (0,17мл, 2,10ммол). Суміш нагрі6 5), 1,56 (2H, brd, J 12,5), 1,63-1,88 (4H, m), 3,17вають до 50°С 18год та розбавляють водою 3,22 (2H, m), 3,39-3,51 (3H, m), 3,94 (3H, s) 4,26 (2H, d, J 7,0), 4,43 (2H, br d, J 14,0), 6,76 (1H, d, J (20мл). Суспензію потім екстрагують метил-трет7,5), 7,1 (1H, t J 7,5), 7,25 (1Η d, J 8,0), 7 54 (1H, s). бутил-етером (2´30мл), Об'єднані органічні шари EIMC; m/z=370,2 [M+H]+. промивають водою (3´20мл), висушують магній 13B: 1-{[1-(Циклопентилметил)-7-метокси-1Нсульфатом та випаровують. Залишок очищають індол-3-іл]карбоніл}-3,5-диметилпіперазин, гідрофлеш-хроматографією, елюючи 5-10% (об'єм %) хлоридну сіль отримано, застосовуючи 1метанолом в дихлорметані, що дає названу сполу(циклопентилметил)-7-метоксиіндол-3-карбонову ку (вільна основа), як безбарвне масло. Вільну кислоту та 2,6-диметилпіперазин. 1Н ЯМР основу (0,42г) розчиняють в діетиловому етері (400МГц, CD3OD) dΗ 1,24-1,36 (8Н, m), 1,51-1,72 (10мл) та оброблюють каплями 2Μ гідрохлоридної (6Н, m), 2,43 (1Н, гептет, J 7,5), 3,07 (2Н, dd, J 14,5, кислоти в діетиловому етері (1мл). Отриманий 11,5), 3,39-3,50 (2Н, m), 3,95 (ЗН, s), 4,37 (2Н, d, J осад збирають фільтрацією, промивають діетило7,5), 4,52 (2H, d, J 14,0), 6,77 (1H, d, J 7,5), 7,10 вим етером (15мл) та висушують під зниженим (1H, t, J 7,5), 7,24 (1H, d, J 8,0), 7,59 (1H, s). EIMC; тиском, що дає названу сполуку (1:1 сіль гідрохлоm/z=370,2 [M+H]+. ридної кислоти), як білу тверду речовину (0,35г, 13C: (S)-1-{[1-(Циклопентилметил)-7-метокси0,78ммол). 1Н ЯМР (400МГц, CD3OD) dΗ 0,98-1,23 1Н-індол-3-іл]карбоніл}-3-метилпіперазин, гідро(5Н, m), 1,30 (3Н, t, J 7,0), 1,39 (6H, d, J 7,0), 1,53хлоридну сіль отримано, застосовуючи 11,88 (6H, m), 3,22-3,35 (2H, m), 3,42-3,61 (4H, m), (циклопентилметил)-7-метоксиіндол-3-карбонову 3,95 (3H, s), 4,26 (2H, d, J 7,0), 4,53 (2H, brd, J кислоту та (S)-2-метилпіперазин. 1Н ЯМР (400МГц, 13,0), 6,77 (1H, d, J 8,0), 7,10 (1H, t, J 8,0), 7,27 (1H, d, J 8,0), 7,57 (1H, s). EIMC: m/z 412,4 [M+H]+. CD3OD) dΗ 1,26-1,36 (5Н, m), 1,51-1,72 (6Н, m), 2,42 (1Н, гептет, J 7,7), 3,20 (2Н, dd, J 14,5, 10,9), 3,38Приклад 15 3,5 (3Н, m), 3,95 (3Н, s), 4,37(2Н, d, J 7,5), 4,43 (2Н, Процедура, описана в прикладі 14 подалі заbrd, J 14,5), 6,77 (1H, d, J 7,6), 7,10 (1H, t, J 7,7), стосована, щоб отримати наступну сполуку: 7,25 (1H, d, J 8,1), 7,59 (1H, s). EIMC; m/z=356,2 15А: 1-{[1-(Циклопентилметил)-7-метокси-1Н[M+H]+. індол-3-іл]карбоніл}-3,5-диметил-4-етилпіперазин, 13D: 1-{[1-(Циклогексилметил)-7-метокси-1Нгідрохлоридну сіль отримано, застосовуючи 1-{[1індол-3-іл]карбоніл}-3,3-диметилпіперазин, гідро(циклопентилметил)-7-метокси-1Н-індол-31 хлоридну сіль отримано, застосовуючи 1іл]карбоніл}-3,5-диметилпіперазин. Н ЯМР (циклогексилметил)-7-метоксиіндол-3-карбонову (400МГц, CD3OD) dΗ 1,27-1,40 (5Н, m). 1,39 (6Н, d, кислоту та 2,2-диметилпіперазин. 1Н ЯМР J 6,5),1,73-1,43 (6H, Μ), 2,44 (1Η, гептет, J 7,0) (400МГц, CD3OD) dΗ 1,10-1,22 (5Н, m), 1,38 (6Н, s), 3,22-3,33 (2Н, m), 3,42-3,61 (4Н, m), 3,95 (3Н, s), 1,54-1,86 (6Н, m), 3,31-3,34 (2Н, m), 3,2 (2Н, dd, J 4,38 (2Н, d, J 7,0), 4,53 (2H, br d, J 14,5), 6,77 (1H, 14,5, 10,9), 3,81 (2H, s), 3,95 (ЗН, s), 3,96-3,99 (2H, d, J 8,0), 7,10 (1H, t, J 8,0), 7,27 (1H, d, J 8,0), 7,61 m), 4,26 (2H, d, J 7,1), 6,76 (1H, d, J 7,5), 7,10 (1H, t, (1H,s). EIMC; m/z=398,0 [M+H]+. J 8,1), 7,24 (1H, d, J 8,0), 7,53 (1H, s). EIMC; 15B: 1-{[1-(Циклогексилметил)-7-метокси-1Н 21 78317 22 індол-3-іл]карбоніл}-4-етил-2,3,5,6хлоридну сіль отримано, застосовуючи 1-{[1тетраметилпіперазин, гідрохлоридну сіль отрима(циклогексилметил)-7-метокси-1Н-індол-3но, застосовуючи 1-{[1-(циклогексилметил)-7іл]карбоніл}-3-метилпіперазин та йодметан. 1Н метокси-1Н-індол-3-іл]карбоніл}-2,3,5,6ЯМР (400МГц, CD3OD) dΗ 0,97-1,89 (14Н, m), 2,92 тетраметилпіперазин. 1Н ЯМР (400МГц, CD3OD) dΗ (3Н, br s), 3,19-3,61 (5H, br m), 3,95 (3Н, s), 4,26 0,98-1,29 (8Н, m), 1,32 (3Н, t, J 6,5), 1,44-1,88 (15H, (2H, d, J 7,0), 4,49 (2H, m), 6,76 (1Η, d, J 7,5), 7,10 m), 3,32-3,83 (5H, m), 3,95 (3Н, s), 4,20-4,41 (3Н, (1H, t, J 8,0), 7,27 (1H, d, J 8,0), 7,54 (1H, s). EIMC; m), 6,77 (1H, d, J 8,0), 7,11 (1H, t, J 8,0), 7,37 (1H, d, m/z=384,2 [M+H]+. + J 8,5), 7,55 (1H, s). EIMC; m/z=440,2 [M+H] . 15I: (S)-1-{[1-(Циклопентилметил)-7-метокси15C: 1-{[1-(Циклогексилметил)-7-метокси-1Н1Н-індол-3-іл]карбоніл}-4-етил-3-метилпіперазин, індол-3-іл]карбоніл}-2,6-диметилетилпіперазин, гідрохлоридну сіль отримано, застосовуючи (S)-1гідрохлоридну сіль отримано, застосовуючи 1-{[1{[1-(циклопентилметил)-7-метокси-1Н-індол-3(циклогексилметил)-7-метокси-1Н-індол-3іл]карбоніл}-3-метилпіперазин i йодетан. 1Н ЯМР 1 іл]карбоніл}-2,6-диметилпіперазин. Н ЯМР (400МГц, CD3OD) dΗ 1,24-1,42 (8Н, m), 1,51-1,73 (400МГц, CD3OD) dΗ 0,97-1,22 (5Н, m), 1,43 (3Н, t, J (6Н, m), 2,43 (1Н, гептет, J 7,6), 3,12-3,23 (2Н, m), 7,0), 1,49 (6H, d, J 8,0), 1,51-1,88 (6H, m), 3,23-3,41 3,47-3,71 (5Н, br m), 3,95 (3Н, s), 4,38 (2Н, d, J 6,9), (4H, m), 3,56 (2H, brd, J 11,0), 3,95 (3H, s), 4,26 (2H, 4,51 (2Н, br s), 6,77 (1Н, d, J 8,2), 7,10 (1H, t, J 7,7), d, J 7,0), 4,86 (2H, brs), 6,76 (1H, d, J 7,5), 7 1 (1H, t 7,26 (1H, d, J 8,1), 7,60 (1H, s). EIMC; m/z=384,2 J 8,0), 7,23 (1H, d, J 8,0), 7,48 (1H, s). EIMC, [М+Н]+. + m/z=412,4 [M+H] . 15J: (R)-1-{[-(Циклопeнтилмeтил)-7-мeтокси15D: 1-{[1-(Циклогексилметил)-7-метокси-1Н1Н-індол-3-іл]карбоніл}-4-етил-3-метилпіперазин, індол-3-іл]карбоніл}-4-етил-3-метилпіперазин, гідгідрохлоридну сіль отримано, застосовуючи (R)-1рохлоридну сіль отримано, застосовуючи 1-{[1{[1-(циклопентилметил)-7-метокси-1Н-індол-3(циклогексилметил)-7-метокси-1Н-індол-3іл]карбоніл}-3-метилпіперазин (отримані, як детаіл]карбоніл}-3-метилпіперазин. 1Н ЯМР (400МГц, лізовано в прикладі 12) та йодетан. 1Н ЯМР CD3OD) dΗ 0,97-1,43 (11Н, m), 1,56 (2Н, brd, J 12,0), (400МГц, CD3OD) dΗ 1,24-1,42 (8Н, m), 1,51-1,73 1,64-1,89 (4H, m), 3,12-3,68 (7H, br m), 3,95 (3Н, s), (6Н, m), 2,43 (1Η, гептет, J 7,6), 3,12-3,23 (2H, m), 4,26 (2H, d, J 7,0), 4,50 (2H, brs), 6,77 (1H, d, J 8 0), 3,47-3,71 (5H, br m), 3,95 (3Н, s), 4,38 (2H, d, J 6,9), 7,10 (1H, t, J 8,0), 7,26 (1H, d, J 8,0), 7,54 (1H, s). 4,51 (2H, br s), 6,77 (1H, d, J 8,2), 7,10 (1H, t, J 7,7), EIMC, m/z=398,2 [M+H]+. 7,26 (1H, d, J 8,1), 7,60 (1H, s). EIMC; m/z=384,2 15E: 1-{[1-(Циклогексилметил)-7-метокси-1Н[M+H]+. індол-3-іл]карбоніл}транс-2,5-диметил-415K: (S)-1-{[1-(Циклопентилметил)-7-метоксиетилпіперазин, гідрохлорид 1Н-індол-3-іл]карбоніл)-3,4-диметилпіперазин, гід1-{[1-(Циклогексилметил)-7-метокси-1Н-індолрохлоридну сіль отримано, застосовуючи (S)-1-{[13-іл]карбоніл}транс-2,5-диметилпіперазин отриму(циклопентилметил)-7-метокси-1Н-індол-3ють способом за Прикладом 12, застосовуючи 1іл]карбоніл}3-метилпіперазин i йодметан. 1Н ЯМР (циклогексилметил)-7-метоксиіндол-3-карбонову (400МГц, CD3OD) dΗ 1,27-1,42 (5Н, m), 1,52-1,74 кислоту та транс-2,5-диметилпіперазин. Застосо(6Н, m), 2,43 (1Н, гептет, J 7,4), 2,86-2,99 (3Н, m), вано процедуру, описану в прикладі 14, що дає 3,17-3,60 (5Н, br m), 3,95 (3Н, s), 4,38 (2Н, d, J 7,6), названу сполуку. 1Н Я МР (400МГц, CD3 OD) dΗ 4,52 (2Н, brd, J 14,6), 6,77 (1H, d, J 7,9), 7 10 (1H, t, 0,97-1,32 (9Н, m), 1,37 (3Н, t, J 7,0), 1,44-1,89 (8H, J 7,7), 7,27 (1H, d, J 8,1), 7,60 (1H, s), EIMS; m), 3,12-3,78 (6H, br m), 3,95 (3Н s), 4 17-4,33 (3Н, m/z=370 [M+H]+. m), 5,00 (1H, brs), 6,76 (1H, d, J 7,5), 7,10 (1H, t, J 15L: (R)-1-{[1-(Циклопентилметил)-7-метокси8,0), 7,21 (1H, d, J8 0) 7,48 (1H, s). EIMC; m/z=412,4 1Н-індол-3-іл]карбоніл}-3,4-диметилпіперазин, гід[M+H]+. рохлоридну сіль отримано, застосовуючи (R)-1-{[115F: 1-{[1-(Циклогексилметил)-7-метокси-1Н(циклопентилметил)-7-метокси-1Н-індол-3індол-3-іл]карбоніл}-3,4,5-триметилпіперазин, гіділ]карбоніл}-3-метилпіперазин i йодметан. 1Н ЯМР рохлоридну сіль отримано, застосовуючи 1-{[1(400МГц, CD3OD) dΗ 1,27-1,42 (5Н, m), 1,52-1,74 (циклогексилметил)-7-метокси-1Н-індол-3(6Н, m), 2,43 (1Н, гептет, J 7,4), 2,86-2,99 (3Н, m), іл]карбоніл}-3,4,5-диметилпіперазин та йодметан. 3,17-3,60 (5Н, br m), 3,95 (3Н, s), 4,38 (2Н, d, J 7,6), 1 4,52 (2Н, br d, J 14,6), 6,77 (1H, d, J 7,9), 7,10 (1H, t, Н ЯМР (400МГц, CD3OD) dΗ (3Н, s), 4,26 (2Н, d, J 7,0), 4,49 (2H, br d, J 12,0), 6,77 (1H, d, J 7,5), 7,10 J 7,7), 7,27 (1H, d, J 8,1), 7,60 (1H, s). EIMC; (1H, t, J 8,0), 7,26 (1H, d, J 7,5), 7,54 (1H, s). EIMC; m/z=370,5 [M+H]+. + m/z=398,0 [М+Н] . 15M: 1-{[1-(Циклогексилметил)-7-метокси-1Н15G: 1-{[1-(Циклопентилметил)-7-метокси-1Ніндол-3-іл]карбоніл}-3,3-диметил-4-етилпіперазин індол-3-іл]карбоніл)-3,4,5-триметилпіперазин, гідгідрохлоридну сіль отримано, застосовуючи 1-{[1рохлоридну сіль отримано, застосовуючи 1-{[1(циклогексилметил)-7-метокси-1Н-індол-3(циклопентилметил)-7-метокси-1Н-індол-3іл]карбоніл}-3,3-диметилпіперазин та йодетан. 1Н 1 іл]карбоніл}-3,5-диметилпіперазин та йодметан. Н ЯМР (400МГц, CD3OD) dΗ 0,97-1,90 (20Н, m), 2,82ЯМР (400МГц, CD3OD) dΗ 1,23-1,70 (14Н, m), 2,40 3,69 (6Н, br m), 3,95 (3Н, s), 4,22-4,61 (4Н, m), 6,77 (1Н, гептет, J 7,5), 2,96 (3Н, br s), 3,21-3,48 (4Н, br (1Н, d, J 7,9), 7,10 (1Н, t, J 8,0), 7,25 (1Н, d, J 8,1), m), 3 95 (3Н, s), 4,38 (2Н, d, J 7,0), 4,50 (2H, br d, J 7,53 (1H, s). EIMC; m/z=412,4 [М+Н]+. 13,5), 6,77 (1H, d, J 7,5), 7,10 (1H, t, J 8,0), 7,26 (1H, 15N: 1-{[1-(Циклогексилметил)-7-метокси-1Нd, J 8,0), 7,60 (1H, s). EIMC; m/z=384,2 [M+H]+. індол-3-іл]карбоніл}-3,3,4-триметилпіперазин, гід15H: 1-{[1-(Циклогексилметил)-7-метокси-1Нрохлоридну сіль отримано, застосовуючи 1-{[1індол-3-іл]карбоніл}-3,4-диметилпіперазин гідро(циклогексилметил)-7-метокси-1Н-індол-3 23 78317 24 іл]карбоніл}-3,3-диметилпіперазин та йодметан. 1Н Додають тетрагідрофуран (10мл) і розчин перемішують 0,5год, перед фільтрацією. Твердий залиЯМР (400МГц, CD3OD) dΗ 0,98-1,90 (17Н, m), 2,85 (3Н, s), 3,29-3,70 (4Н, m), 3,95 (3Н, s), 4,22-4,60 шок на фільтрі промивають тетрагідрофураном (4H, m), 6,77 (1Н, d, J 7,7), 7,10 (1H, t, J 8,1), 7,25 (2´5мл) та об'єднані фільтрат і промивні розчини (1H, d, J 8,2), 7,54 (1H, s). EIMC; m/z=398,2 [M+H]+. концентрують, що дає (R)-октагідро-2Н-піридо[1,215O: (S)-1-{[1-(циклогексилметил)-7-метоксиа]піразин як жовте масло (0,29г, 2,07ммол). 1Н-індол-3-іл]карбоніл}-3,4-диметилпіперазин, гідДо розчину 1-(циклогексилметил)-7-метоксирохлоридну сіль отримано, застосовуючи (S)-1-{[11Н-індолу (0,49г, 2,03ммол) в 1,1,2,2(циклогексилметил)-7-метокси-1Н-індол-3тетрахлоретані (2,5мл), додають оксалілхлорид іл]карбоніл}-3-метилпіперазин та йодметан. 1Н (0,19мл, 2,13ммол), перемішуючи в потоці азоту. Суміш нагрівають при 120°С 2 години. Після охоЯМР (400МГц, CD3OD) dΗ 0,97-1,89 (14Н, m), 2,92 лодження до кімнатної температури додають три(3Н, br s), 3,19-3,61 (5H, br m), 3,95 (3H, s), 4,26 етиламін (0,30мл, 2,13ммол), далі - (R)-октагідро(2H, d, J 7,0), 4,49 (2H, m), 6,76 (1H, d, J 7,5), 7,10 2Н-піридо[1,2-а]піразиновий (0,28г, 2,03ммол) роз(1H, t, J 8,0), 7,27 (1H, d, J 8,0), 7,54 (1H,s). EIMC; чин в 1,1,2,2-тетрахлоретані (2мл). Розчин переm/z=384,2 [M+H]+. мішують при кімнатній температурі 2 години. Потім 15Р: (S)-1-{[1-(циклогексилметил)-7-метоксидодають розчин натрій гідроксиду (1М; 8мл) та 1Н-iндол-3-іл]карбоніл}-3-метил-4-(2отриману суміш розподіляють між діхлорметаном флуоретил)піперазин, гідрохлоридну сіль отрима(10мл) та водою (10мл). но, застосовуючи (S)-1-{[1-(циклогексилметил)-7Органічний шар екстрагують, промивають вометокси-1Н-індол-3-іл]карбоніл}-3-метилпіперазин дою (10мл), висушують над натрій сульфатом та та 1-бром-2-флуоретан. 1Н Я МР (400МГц, CD3OD) концентрують. Отримане фіолетове масло очиdΗ 0,96-1,90, (14Н, m), 3,31-3,90 (7Н, br m), 3,95 щають флеш-хроматографією, застосовуючи 98% (3Н, s), 4,26 (2Н, d, J 7,0), 4,40-4,59 (2Н, m), 4,68дихлорметан, 2% метанол, як елюент, що дає на5,04 (2Н, br m), 6,77 (1Н, d, J 7,5), 7,11 (1Н, t, J 8,0), званий продукт, як блідо коричневе масло (245мг, 7,27 (1Н, d, J 8,0), 7,56 (1H, s). EIMC; m/z=416,0 0,60ммол). [a]D22 +13° (с 1,87мг/мл в СНСІ3); 1Н [М+Н]+. Приклад 16 ЯМР (400Гц, CDCI3) dΗ 0,92-1,05 (2Н, m), 1,12-1,36 (R)-2-{[1-(Циклогексилметил)-7-метокси-1Н(6Н, m), 1,48-1,88 (9Н, m), 1,93-1,98 (1Н, m), 2,07 індол-3-іл]карбоніл}-октагідро-2Н-піридо[1,2(1Н, dt, J 11,5, 4,0), 2,24 (1Н, dt, J 12,0, 3,0), 2,70а]піразин 2,81 (3Н, m), 2,84-2,86 (1Н, m), 3,19-3,25 (2Н, m), До розчину (R)-(+)-1-(третбутоксикарбоніл)-23,93 (3Н, s), 4,18 (2Н, d, J 7,0), 4,18-4,32 (2H, m), піперидин карбонової кислоти (2,00г, 8,72ммол) в 6,65 (1H, d, J 7,5), 7,07 (1H, dd, J 8,0, 7,5), 7,25 (1H, дихлорметані (30мл) додають гліцинметиловий s), 7,29 (1H, d, J 8,0); EIMC: m/z=410,2 [M+H]+. естер гідрохлоридної кислоти (1,09г, 8,72ммол), 1Приклад 17 [3-(диметиламін)пропіл]-3-етилкарбодіімід гідроПроцедура, описана в прикладі 16, подалі захлорид (2,01г, 10,46ммол), 1-гідроксибензотриазол стосована, щоб отримати наступні сполуки: (1,22г, 9,04ммол) та триетиламін (2,43мл, 17А. (S)-2-{[1-(Циклогексилметил)-7-метокси17,4ммол). Суміш перемішують в потоці азоту 18 1Н-індол-3-іл]карбоніл}-октагідро-2Н-піридо[1,2годиню Отриману суміш промивають 0,5М гідроа]піразин, гідрохлоридну сіль отримано, застосовуючи (S)-(-)-1-(третбутоксикарбоніл)-2-піперидин хлоридною кислотою (20мл), водою (2´20мл) та розсолом (20мл), висушують над натрій сульфакарбонову кислоту, [a]D22 -18 (вільна основа; с том та концентрують, що дає (R)-14,05мг/мл в СНСІ3); 1Н Я МР (400МГц, CDCI3) dΗ (третбутоксикарбоніл)піперидин-20,99-1,08 (2Н, m), 1,13-1,28 (3Н, m), 1,50-2,03 (12Н, карбоксигліцинметиловий естер як безбарвне маm), 3,02-3,12 (1Н, m), 3,13-3,30 (3Н, m), 3,43-3,50 сло (2,47г, 8,2 ммол). (3Н, m), 3,95 (3Н, s), 4,27 (2Н, d, J 7,0), 4,49-4,59 (R)-1-(Третбутоксикарбоніл)піперидин-2(2H, m), 6,77 (1H, d, J 7,5), 7,11 (1H, dd, J 8,0, 7,5), карбоксигліцинметиловий естер (2,46г, 8,20ммол) 7,27 (1H, d, J 8,0), 7,54 (1H, s); EIMC: m/z=410,5 розчиняють в трифлуорцтовій кислоті (10мл) та [M+H]+. отриманий розчин перемішують 1 годину. Трифлу17B. (R)-2-{[1-(Циклогексилметил)-7-метоксиороцтову кислоту потім переносять до одержаного 1Н-індол-3-іл]карбоніл}-октагідро-2Н-пірол[1,2безбарвного масла, яке розчинено в метанолі а]піразин отримані, застосовуючи (R)-(+)-1(85мл), та додають триетиламін (9,0мл, 64,6ммол). (третбутоксикарбоніл)-2-піролідин карбонову кисОтриману суміш нагрівають під зворотним хололоту. 1Н ЯМР (400МГц, CDCI3) dΗ 0,92-1,04 (2Н, m), дильником 4 години. Розчин потім концентрують, 1,13-1,21 (3Н, m), 1,40-1,45 (1Н, m), 1,57-1,89 (9Н, що дає блідо оранжеве масло, яке перекристаліm), 2,00-2,10 (1Н, m), 2,15-2,29 (2Н, m), 2,76-2,85 зовують із гептану 48%, етеру 48%, 2-пропанолу (1Н, m), 3,02-3,23 (3Н, m), 3,93 (3Н, s), 4,18 (2Н, d, 4%, що дає (R)-октагідро-1,4-дюксо-2Н-піридо[1,2J 7,0), 4,32-4,56 (2H, m), 6,67 (1H, d, J 7,0), 7,08 а]піразин, як білі кристали (0,66г, 3,90ммол). (1H, t, J 8,0), 7,25-7,30 (2H, m); EIMC: m/z=396,2 (R)-Октагідро-1,4-дioксо-2Н-піридо[1,2[M+H]+. а]піразин (0,5г, 2,98ммол) додають порціями до 17С. (S)-2-{[1-(Циклогексилметил)-7-метоксиперемішуваного розчину літій алюміній гідриду (1M 1Н-індол-3-іл]карбоніл}октагідро-2Н-пірол[1,2в тетрагідрофурані, 11,9мл, 11,9ммол.) Отриману а]піразин, гідрохлоридну сіль отримано, застососуміш нагрівають під зворотним холодильником вуючи (S)-(-)-1-(третбутоксикарбоніл)-2-піролідин 0,5год. Розчин потім охолоджують до 0°С та оброкарбонову кислоту. 1Н ЯМР вільної основи блюють каплями води (1,35мл), розчином 1М на(400МГц, CDCI3) dΗ 0,93-1,03 (2Н, m), 1,11-1,21 трій гідроксиду (0,45мл), потім водою (1,35мл). (3Н, m), 1,35-1,46 (1Н, m), 1,56-1,89 (9Н, m), 1,96 25 78317 26 2,05 (1Н, m), 2,21 -2,27 (2Н, m), 2,77 (1Н, t, J 11,0), осад промивають толуолом (200мл). Об'єднані 3,07 (1Н, d, J 10,5), 3,08-3,20 (2Н, m), 3,93 (3Н, s), фільтрати промивають водою (2´200мл), висушу4,18 (2Н, d, J 7,0), 4,26-4,41 (1H, m), 4,43-4,56 (1H, ють над магній сульфатом та випаровують, що дає m), 6,65 (1H, d, J 8,0), 7,07 (1H, t, J 8,0), 7,25-7,30 етиловий естер 1,4-дібензил-піперазин-2(2H, m). EIMC: m/z=396,2 [M+H]+. карбонової кислоти (45,57г), як оранжеве масло. 17D: (S)-2-{[1-(Циклопентилметил)-7-метоксиЛітій алюміній гідрид (1Μ розчин в тетрагідро1Н-індол-3-іл]карбоніл}-октагідро-2Н-піридо[2фурані, 32мл, 32ммол) при 0°С оброблюють капа]піразин, гідрохлоридну сіль отримано, застосолями розчину етилового естеру 1,4вуючи (S)-(-)-1-(третбутоксикарбоніл)-2-піперидин дібензилпіперазин-2-карбонової кислоти (10г, карбонову кислоту та 1-(циклопентилметил)-732,1ммол) в тетрагідрофурані (30мл) та переміметокси-1Н-індол. 1Н ЯМР (400МГц, CD3OD) dΗ шують 16 годин. Суміш оброблюють повільним 1,27-2,03 (14Н, m), 2,41 (1Н, J 7,0), 3,01-3,52 (7Н, додаванням розчину натрій гідроксиду (4М, m), 3,95 (3Н, s), 4,38 (2Н, d, J 7,5), 4,52 (2H, dd, J 150мл), потім дихлорметану (200мл). Органічну 10,0, 7,0), 6,77 (1H, d, J 8,0), 7,1 (1H, t, J 8,0), 7,26 фазу відокремлюють, висушують натрій сульфа(1H, d, J 8,0), 7,6 (1H, s). EIMC; m/z=396,2 [M+H]+. том та випаровують, що дає 1,4-дібензил-217E: (S)-2-{[1-(Циклопентилметил)-7-метокси(гідроксиметил)піперазин (8,36г), як оранжеве ма1Н-індол-3-іл]карбоніл}-октагідро-2Н-пірол[2сло. а]піразин, гідрохлоридну сіль отримано, застосоДо розчину діетиламінсульфур-три флуориду вуючи (S)-(-)-1-(третбутоксикарбоніл)-2-піролідин (1,5мл, 12,16ммол) в дихлорметані (10мл) при карбонову кислоту та 1-(циклопентилметил)-772°С протягом 10 хвилин додають 1,4-дібензил-2(гідроксиметил)піперазин (3г, 10,1ммол) в дихлорметокси-1Н-індол. 1Н ЯМР (400МГц, CDCI3) dΗ метані (20мл). Суміш перемішують 16год, тим ча1,21-2,23 (15Н, m), 2,41 (1Н, гептет J 7,5), 2,75 (1Н, сом нагріваючи до кімнатної температури, та обt, J 11,0), 3,01-3,20 (3Н, m), 3,94 (3Н, s), 4,30 (2Н, d, роблюють водою (20мл). Водну фазу J 7,0), 4,32-4,53 (2H, m), 6,65 (1H, d, 7,5), 7,07 (1H, підлужувають до рН 9, застосовуючи 4Μ натрій t, 7,07 (1H, t, J 7,5), 7,23-7,31 (2H, m). EIMS; гідроксид та відокремлюють органічну фазу. Водну m/z=382,2 [M+H]+. 17F: (3R,9R)-2-{[1-(Циклогексилметил)-7фазу екстрагують дихлорметаном (2´30мл) та метокси-1Н-індол-3-іл]карбоніл}-3об'єднані органічні шари висушують натрій сульізобутилоктагідро-2Н-пірол[1,2-а]піразин отримано, фатом та випаровують. Залишок очищають флешзастосовуючи (3R,9R)-октагідро-1,4-діоксо-2Нхроматографією, елюючи 20% (об'єм %) етилацепірол[1,2-а]піразин (комерційно доступний) замість татом в гексані, що дає 1,4-дібензил-2(R)-октагідро-1,4-діоксо-2Н-піридо[1,2-а]піразину. (флуорметил)піперазин (0,94г), як безбарвне масEIMC; m/z=452,2 [М+Н]+. ло. До кашки паладію на вугіллі (10мас.%, 1г) в 17G: (3S,9S)-2-{[1-(Циклогексилметил)-7етанолі (20мл) додають 1,4-дібензил-2метокси-1Н-індол-3-іл]карбоніл}-3-метилоктагідро(флуорметил)піперазин (2,98г, 10ммол) в етанолі 2Н-пірол[1,2-а]піразин отримано, застосовуючи 1(20мл). Суміш нагрівають до 65°С в атмосфері (третбутоксикарбоніл)пролін та гідрохлоридну сіль водню (5атм.) 72 години, фільтрують через дикаліт L-аланінметилового естеру. EIMC; m/z=410,0 та дикаліт промивають етанолом (50мл). Фільтра[М+Н]+. ти випаровують, що дає 2-(флуорметил)піперазин (0,97г), як безбарвну тверду речовину. До розчину 17Н: (2R,aS)-1-{[1-(Циклогексилметил)-71-(циклогексил)метил-7-метокси-індол-3метокси-1Н-індол-3-іл1карбоніл)-2-(aкарбонової кислоти (0,59г, 2,04ммол, отриманої за гідрокси)етил-4-метилпіперазин отримано, застоПрикладом 1) та 2-(флуорметил)піперазину (0,37г, совуючи 1-метил-1-(третбутоксикарбоніл)гліцин та 3,15ммол) в дихлорметані (15мл) додають 1-(3гідрохлоридну сіль D-треонінметилового естеру. диметиламінпропіл)-3-етилкарбодіімідгідрохлорид EIMC; m/z=414,2 [M+H]+. (0,47г, 2,45ммол) та 1-гідроксибензотриазол (0,07г, 17Ι: (23,aR)-1-{[1-(Циклогексилметил-70,51ммол). Суміш перемішують при кімнатній темметокси-1Н-індол-3-іл]карбоніл}-2-(aпературі 18 годин і випаровують. Залишок очищагідрокси)етил-4-метилпіперазин отримано, застоють флеш-хроматографією, елюючи 0-10% (об'єм совуючи 1-метил-1-(третбутоксикарбоніл)гліцин та %) метанолом в дихлорметані, що дає названу гідрохлоридну сіль L-треонінметилового естеру. + сполуку (вільна основа), як безбарвне масло EIMC; m/z=414,2 [М+Н] . (0,47г). Вільну основу (0,05г) розчиняють в діети17J: (S)-2-{[1-(Циклогексилметил)-7-метоксиловому етері (3мл) та оброблюють каплями 2Μ 1Н-індол-3-іл]карбоніл}-3,3-диметил-октагідро-2Нгідрохлоридної кислоти в діетиловому етері (1мл). пірол[1,2-а]піразин отримано, застосовуючи 1Отриманий осад збирають фільтрацією, промива(третбутоксикарбоніл)-пролін та гідрохлоридну ють діетиловим етером (10мл) та висушують під сіль метилового естеру амінізомасляної кислоти. зниженим тиском, що дає названу сполуку (1:1 сіль EIMC; m/z=424,2 [М+Н]+. гідрохлоридної кислоти), як безбарвну тверду реПриклад 18 човину (0,05г, 0,12ммол). 1Н ЯМР (400МГц, 1-{[1-(Циклогексиметил)-7-метокси-1Н-індол-3CD3OD) dΗ 0,98-1,27 (5Н, m), 1,57 (2Н, brd, J 12,9), іл]карбоніл}-3-(флуорметил)піперазин гідрохлорид. 1,63-1,90 (4H, m), 3,21-3,53 (4H, m), 3,68-3,79 (1H, До розчину етилового естеру 2,3m), 3,95 (3H, s), 4,26 (2H, d, J 7,1), 4,43-4,82 (4H, дібромпропіонової кислоти (21,91мл, 150,7ммол) в m), 6,77 (1H, d, J 7,7), 7,11 (1H, t, J 7,5), 7,27 (1H, d, толуолі (175мл) при 40°С додають суміш N-N'J 8,0), 7,57 (1H, s); EIMS: m/z 270,2 [Фрагмент+Н]+. дибензилетилендіаміну (35,87г, 149,2ммол) та Приклад 19 триетиламіну (37мл, 269ммол) в толуолі (75мл). 1-{[1-(Циклогексилметил)-7-метокси-1Н-індолСуміш нагрівають до 80°С 16год, фільтрують та 27 78317 28 3-ілїкарбоніл}3-(флуорметил)-4(10мкл) додають прямо до відповідних комірок. циклопропілпіперазин, гідрохлорид Планшети інкубують при 37°С 5 годин для дозвоДо розчину 1-{[1-(Циклогексилметил)-7лення індукованої агоністом експресії люцифераметокси-1Н-індол-3-іл]карбоніл}-3-(флуорметил) зого ферменту. Під послабленому освітленні, піперазину (0,2г, 0,52ммол, отриманого за ПриLucLite-субстрат (Packard, відтворений відповідно кладом 18) в метанолі (10мл) додають оцтову кисінструкції виробника, 100мкл) додають до кожної лоту (0,18мл, 3,1ммол), 4А молекулярні сита (1г), комірки. Планшети герметизують та потім інкубу[(1-етоксициклопропіл)окси]триметилсилан ють при кімнатній температурі 5 хвилин перед під(0,62мл, 3,1ммол) та натрій цианборгідрид (0,15г, рахунком на Packard TopCount (підрахунок одини2,33ммол). Суміш нагрівають до 70°С 18год, фільчних фотонів, 0,01 хвилини час підрахунку, 5 трують та осад промивають дихлорметаном хвилин затримки підрахунку). Крива, що забезпе(20мл) та метанолом (20мл). Фільтрати випаровучує найкращу відповідність, обрахована способом ють, розчиняють в дихлорметані (30мл) та проминайменших квадратів стосовно графіку залежності вають розчином натрій гідроксиду (4 М, 15мл) та підрахунків на секунду (CPS) від концентрації спонасиченим розчином натрій хлориду (15мл). Оргалуки (Μ), що дає величину рЕК50 . Таблиця показує нічну фазу висушують натрій сульфатом, випаровеличини рЕК50, отримані для кількох представлевують та залишок очищають флешних сполук винаходу. хроматографією, елюючи 2 % (об'єм %) метанолом в дихлорметані, що дає названу сполуку (вільна основа), як жовте масло (0,2г). Вільну основу розчиняють в діетиловому етері (3мл) та обробляють каплями 2М гідрохлоридної кислоти в діетиловому етері (1мл). Отриманий осад збирають фільтрацією, промивають діетиловим етером (10мл) та висушують під зниженим тиском, що дає названу сполуку (1:1 сіль гідрохлоридної кислоти), як безбарвну тверду речовину (0,2г, 0,43ммол). 1Н ЯМР (400МГц, CD3OD) dΗ 0,91-1,25 (9Н, m), 1,57 (2Н, brd, J 12,6), 1,62-1,91 (4Н, m), 2,8-2,93 (1Η, m), 3,33-3,82 (5Η, m), 3,96 (3Н, s), 4,27 (2Н, d, J 7,0), 4,43-4,86 (3H, m), 5,10-5,31 (1H, m), 6,77(1H d, J 7,3), 7,11 (1H, t, J 8,1), 7,28 (1H, d, J 8,1), 7,56 (1H,s); EIMS: m/z 428,2 [M+H]+. Приклад 20 In-vitro визначення ефективності та сили на СВ1-рецепторі людини, експресованому в СНОкпітини Клітини яєчника китайського хом'яка (ЯКХ), що експресують рецептор СВ1 людини, та репортерний люциферазний ген суспендують у феноловий червоний/безсироваточний DMEM/F-12 Nut Міх, що містить пеніцилін/стрептоміцин (50U/5 мкг/мл) та фунгізон (1мкг/мл) та засівають у 96 коміркові планшети при щільності 3´104 клітин на комірку (100мкл кінцевого об'єму). Клітини інкубують протягом ночі (прибл 18год при 37°С, 5% СО2/95% повітря) до аналізу. Тестовану сполуку (10ммол розчин в DMCO) розбавлену F12 Nut Mix, що дає діапазон базового розчину від 0,11ммол дo 0,11нмол. Базові розчини 29 78317 30 Приклад 21 Затримка при ударі по хвосту у мишей Мишей навчають нерухомо сидіти в апараті для дослідження способом удару по хвосту (Ugo Basile, Italy), що визначає затримку при ударі по хвосту. Хвіст піддають дії сфокусованого інфрачервоного променя на відстані приблизно у 2,5см від кінця. Затримку при ударі по хвосту визначають як інтервал між термальним подразненням і відсмикуванням хвоста. Застосовують зупинки на 12 секунд для попередження ушкодження тканини. Чотири групи по сім мишей обробляють засобом з одними або трьома дозами тестованої сполуки, призначеної внутрішньовенно (засіб: фізіологічний розчин 9г/л; об'єм ін'єкції 10мл/кг). Затримку при ударі по хвосту визначено перед призначенням тестованої сполуки з регулярними інтервалами (типово - 20, 40 та 60 хвилин) після призначення сполуки. ED50 розраховано при Тмакс. Сполуки прикладів 14, 15F, 15О, 17А, 17С, та 17D значно підвищують латентність удару по хвосту з ED50 менше 5мкМ/кг. Комп’ютерна верстка О.Гапоненко Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійською1-[(indol-3-yl)carbonyl]piperazine derivatives
Назва патенту російськоюПроизводные 1-[(индол-3-ил)карбонил]пиперазина
МПК / Мітки
МПК: A61P 25/28, C07D 403/06, A61P 9/00, C07D 209/42, A61P 25/00, A61P 25/08, C07D 471/04, A61P 1/08, A61P 25/22, A61P 29/00, A61P 27/06, A61P 1/14, A61K 31/496, A61P 25/20, A61P 37/08, A61P 11/00, A61P 25/06, A61P 29/02, A61P 25/04, C07D 487/04, A61K 31/4985
Мітки: похідні, 1-[(індол-3-іл)карбоніл]піперазину
Код посилання
<a href="https://ua.patents.su/15-78317-pokhidni-1-indol-3-ilkarbonilpiperazinu.html" target="_blank" rel="follow" title="База патентів України">Похідні 1-[(індол-3-іл)карбоніл]піперазину</a>
Попередній патент: Електронагрівальна підлога
Наступний патент: Магнітний сенсор з активним індуктивним елементом
Випадковий патент: Спосіб одержання гідрату гідразину












