Мускаринові агоністи, фармацевтична композиція на їх основі
Номер патенту: 76492
Опубліковано: 15.08.2006
Автори: Джеймісон Джеймз Ендрю, Аллен Дженіфер Ребекка, Тернер Уільям Уілсон, мол., Лю Бін, Хічкок Стівен Ендрю
Формула / Реферат
1. Сполука формули
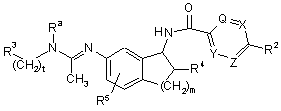 ,
,
де
Q, X, Y та Z незалежно один від одного вибрані з групи, до якої входять CR1 та N, за умови, що не більше двох груп з Q, X, Y та Z є N і щонайменше дві групи з Q, X, Y та Z є СН; або Y є СН, Z є СН та фрагмент "Q=X" являє собою "S" і утворює тіофеновий цикл;
R1 в кожному випадку незалежно вибраний з групи, до якої входять водень, галоїд, С1-С4-алкоксигрупа та С1-С4-алкіл;
R2 вибраний з групи, до якої входять галоїд; С1-С4-алкоксигрупа; С1-С4-алкіл; С3-С8-циклоалкіл; ціан; трифторметил; піридиніл, факультативно заміщений одним або двома замісниками, вибраними незалежно один від одного з групи, до якої входять галоїд, С1-С4-алкоксигрупа та С1-С4-алкіл; тієніл, факультативно заміщений одним замісником, вибраним із групи, до якої входять галоїд, С1-С4-алкоксигрупа та С1-С4-алкіл; феніл, факультативно заміщений замісниками в кількості від одного до трьох, вибраними незалежно один від одного з групи, до якої входять галоїд, С1-С4-алкоксигрупа, С1-С4-алкіл, трифторметил та ціан; та піроліл, факультативно заміщений одним або двома замісниками, вибраними незалежно один від одного з групи, до якої входять галоїд, С1-С4-алкоксигрупа та С1-С4-алкіл;
R3 вибраний з групи, до якої входять феніл, факультативно заміщений замісниками в кількості від одного до трьох, вибраними незалежно один від одного з групи, до якої входять галоїд, С1-С4-алкоксигрупа, С1-С4-алкіл, трифторметил, ціан та нітрогрупа; нафтил, факультативно заміщений замісниками в кількості від одного до трьох, вибраними незалежно один від одного з групи, до якої входять галоїд, С1-С4-алкоксигрупа, С1-С4-алкіл, трифторметил, ціан та нітрогрупа; гетероарил, факультативно заміщений одним або двома замісниками, вибраними незалежно один від одного з групи, до якої входять галоїд, С1-С4-алкоксигрупа та С1-С4-алкіл; та 1,3-бензодіоксоліл, факультативно заміщений одним замісником, вибраним із групи, до якої входять галоїд, С1-С4-алкоксигрупа та С1-С4-алкіл;
R4 вибраний з групи, до якої входять водень, гідроксил та фтор;
R5 вибраний з групи, до якої входять водень, галоїд, С1-С4-алкоксигрупа та С1-С4-алкіл;
Ra вибраний з групи, до якої входять водень та метил;
t є 1, 2 або 3; і
m є 1 або 2;
або фармацевтично прийнятні солі такої сполуки.
2. Сполука за п. 1, де Ra є метил, R5 є водень, R4 є гідроксил, t є 1, m є 1, і яка має стереохімічну транс-конфігурацію в положеннях 1 та 2, показаних нижче:
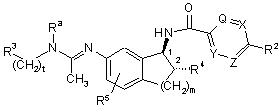 .
.
3. Сполука за п. 1, де кожна з груп Q, X, Y та Z є СН.
4. Сполука за будь-яким із пп. 1-3, де R2 є феніл.
5. Сполука за будь-яким із пп. 1-4, де R3 є феніл, однозаміщений галоїдом.
6. Сполука за будь-яким із пп. 1-4, де R3 є феніл, однозаміщений фтором.
7. Сполука за будь-яким із пп. 1-4, де R3 є феніл, однозаміщений фтором у пара-положенні.
8. Сполука за п. 1, яка є (R)-(6-(1-((4-фторбензил)метиламіно)-етиліденаміно)-2(R)-гідроксііндан-1-іл)амідом біфеніл-4-карбонової кислоти.
9. Фармацевтична композиція, яка містить сполуку за будь-яким із пп. 1-8 та один або кілька фармацевтично прийнятних носіїв, наповнювачів або розріджувачів для неї.
10. Активний інгредієнт для фармацевтичного засобу, який відрізняється тим, що він являє собою сполуку за будь-яким із пп. 1-8.
11. Активний інгредієнт для лікарського засобу для лікування розладів, пов'язаних із мускариновими рецепторами, який відрізняється тим, що він являє собою сполуку за будь-яким із пп. 1-8.
12. Активний інгредієнт для лікарського засобу для лікування розладів пізнавальної здатності, який відрізняється тим, що він являє собою сполуку за будь-яким із пп. 1-8.
13. Активний інгредієнт для лікарського засобу для лікування хвороби Альцгеймера, який відрізняється тим, що він являє собою сполуку за будь-яким із пп. 1-8.
14. Активний інгредієнт для лікарського засобу для лікування шизофренії, який відрізняється тим, що він являє собою сполуку за будь-яким із пп. 1-8.
15. Активний інгредієнт для лікарського засобу для лікування помірного погіршення пізнавальної здатності, який відрізняється тим, що він являє собою сполуку за будь-яким із пп. 1-8.
16. Активний інгредієнт для лікарського засобу для лікування погіршення пізнавальної здатності, пов'язаного із шизофренією, який відрізняється тим, що він являє собою сполуку за будь-яким із пп. 1-8.
Текст
1. Сполука формули C2 2 (11) 1 3 76492 4 гідроксііндан-1-іл)амідом біфеніл-4-карбонової 13. Активний інгредієнт для лікарського засобу для лікування хвороби Альцгеймера, який відрізнякислоти. ється тим, що він являє собою сполуку за будь9. Фармацевтична композиція, яка містить сполуку за будь-яким із пп.1-8 та один або кілька фармаяким із пп.1-8. цевтично прийнятних носіїв, наповнювачів або 14. Активний інгредієнт для лікарського засобу для лікування шизофренії, який відрізняється тим, що розріджувачів для неї. 10. Активний інгредієнт для фармацевтичного завін являє собою сполуку за будь-яким із пп.1-8. собу, який відрізняється тим, що він являє собою 15. Активний інгредієнт для лікарського засобу для сполуку за будь-яким із пп.1-8. лікування помірного погіршення пізнавальної здатності, який відрізняється тим, що він являє со11. Активний інгредієнт для лікарського засобу для лікування розладів, пов'язаних із мускариновими бою сполуку за будь-яким із пп.1-8. рецепторами, який відрізняється тим, що він яв16. Активний інгредієнт для лікарського засобу для ляє собою сполуку за будь-яким із пп.1-8. лікування погіршення пізнавальної здатності, пов'язаного із шизофренією, який відрізняється 12. Активний інгредієнт для лікарського засобу для лікування розладів пізнавальної здатності, який тим, що він являє собою сполуку за будь-яким із відрізняється тим, що він являє собою сполуку за пп.1-8. будь-яким із пп.1-8. Цей винахід стосується галузі фармацевтичної та органічної хімії і пропонує сполуки, активні відносно мускаринових рецепторів. Сполуки згідно з цим винаходом є мускариновими агоністами. Більш конкретно, сполуки згідно з цим винаходом є селективними агоністами мускаринового рецептора М-1. Внаслідок цієї властивості вони є корисними для лікування різноманітних розладів центральної нервової системи та інших систем організму, до яких належать розлади пізнавальної здатності, дефіцит уваги з гіперактивністю (ADHD), ожиріння,хв.ороба Альцгеймера, психози, в тому числі шизофренія, а також для зниження внутрішньоочного тиску, наприклад, при глаукомі. Деякі інданоподібні сполуки описані як агенти, корисні для лікуванняхв.оробливих станів, пов'язаних із порушеннями функцій мускаринової холінергічної системи, [в публікаціях РСТ заявок WO 97/25983, опублікованій 24 липня 1997p., та WO 99/04778, опублікованій 4 лютого 1999р.]. Цей винахід пропонує сполуки Формули І де Q, X, Υ та Ζ незалежно один від одного вибрані з групи, до якої входять CR1 та Ν, за умови, що не більше двох груп з Q, Χ, Υ та Ζ є N і щонайменше дві групи з Q, Χ, Υ та Ζ є СН; або Υ є СН, Ζ є СН та фрагмент "Q=X" являє собою "S" і утворює тіофеновий цикл; R1 в кожному випадку незалежно вибраний з групи, до якої входять водень, галоїд, С1-С4алкоксигрупа та С1-С4-алкіл; R2 вибраний з групи, до якої входять галоїд; С1-С4-алкоксигрупа; С1-C4-алкіл; С3-С8-циклоалкіл; ціан; трифторметил; піридиніл, факультативно заміщений одним або двома замісниками, вибраними незалежно один від одного з групи, до якої входять галоїд, С1-С4-алкоксигрупа та C1-C4-алкіл; тієніл, факультативно заміщений одним замісником, вибраним із групи, до якої входять галоїд, C1C4-алкоксигрупа та C1-C4-алкіл; феніл, факульта тивно заміщений замісниками в кількості від одного до трьох, вибраними незалежно один від одного з групи, до якої входять галоїд, С1-С4алкоксигрупа, C1-C4-алкіл, трифторметил та ціан; та піроліл, факультативно заміщений одним або двома замісниками, вибраними незалежно один від одного з групи, до якої входять галоїд, C1-C4алкоксигрупа та С1-С4-алкіл; R3 вибраний з групи, до якої входять феніл, факультативно заміщений замісниками в кількості від одного до трьох, вибраними незалежно один від одного з групи, до якої входять галоїд, C1-C4алкоксигрупа, C1-C4-алкіл, трифторметил, ціан та нітрогрупа; нафтил, факультативно заміщений замісниками в кількості від одного до трьох, вибраними незалежно один від одного з групи, до якої входять галоїд, С1-С4-алкоксигрупа, С1-С4-алкіл, трифторметил, ціан та нітрогрупа; гетероарил, факультативно заміщений одним або двома замісниками, вибраними незалежно один від одного з групи, до якої входять галоїд, C1-C4-алкоксигрупа та C1-C4-алкіл; та 1,3-бензодіоксоліл, факультативно заміщений одним замісником, вибраним із групи, до якої входять галоїд, C1-C4-алкоксигрупа та C1-C4-алкіл; R4 вибраний з групи, до якої входять водень, гідроксил та фтор; R5 вибраний з групи, до якої входять водень, галоїд, С1-С4-алкоксигрупа та C1-C4-алкіл; Ra вибраний з групи, до якої входять водень та метил; t є 1, 2 або 3; і m є 1 або 2; або фармацевтично прийнятні солі таких сполук. Цей винахід пропонує також фармацевтичні композиції, які містять сполуку Формули І та фармацевтично прийнятний розріджувач. Оскільки сполуки Формули І є агоністами мускаринового рецептора М-1, то сполуки Формули І є корисними для лікування різноманітних розладів, пов'язаних з мускариновими рецепторами, до яких належать: розлади пізнавальної здатності (в тому числі віковий розлад пізнавальної здатності, помірна недостатність пізнавальної здатності, погіршення пізнавальної здатності, пов'язане з шизоф 5 76492 6 ренією, та погіршення пізнавальної здатності, одержання таких солей, належать хлористоводнеспричинене хіміотерапією), ADHD, розлади нава, бромистоводнева, йодистоводнева, азотна, строю (в тому числі депресія, манія, біполярні розсірчана, фосфорна, гіпофосфорна, метафосфорлади), психози (зокрема, шизофренія), деменція (в на, пірофосфорна тощо. Можуть бути застосовані тому числі хвороба Альцгеймера, деменція, спритакож солі, що є похідними органічних кислот, начинена СНІД, судинна деменція та деменція за приклад, аліфатичних моно- та дикарбонових кисвідсутності характерної гістології), хвороба Паркінлот, фенілзаміщених алкілкарбонових кислот, гідсона та хорея Гентінгтона. Такі сполуки корисні роксіалкілкарбонових та також для лікування хронічних колітів, в тому числі гідроксіалкілендикарбонових кислот, ароматичних хвороби Крона. Крім того, сполуки згідно з винахокислот, аліфатичних та ароматичних сульфокисдом корисні для лікування болів (в тому числі гослот. Таким чином, до таких фармацевтично притрих болів та хронічних болів), ксеростомїї (сухості йнятних солей належать хлорид, бромід, йодид, в роті), захворювання тіла Леві (в тому числі динітрат, ацетат, фенілацетат, трифторацетат, акрифузного захворювання тіла Леві), афазії (в тому лат, аскорбат, бензоат, хлорбензоат, динітробенчислі первинної афазії та синдромів первинної зоат, гідроксибензоат, метоксибензоат, метилбенафазії) та гіпотензивних синдромів. зоат, о-ацетоксибензоат, ізобутират, Згідно з іншим варіантом здійснення, цей вифенілбутират, α-гідроксибутират, бутин-1,4нахід пропонує способи лікування розладів, пов'ядикарбоксилат, гексин-1,4-дикарбоксилат, капроат, заних із мускариновими рецепторами, який вклюкаприлат, цинамат, цитрат, форміат, фумарат, чає введення в організм пацієнта, котрий потребує гліколят, гептаноат, гіпурат, лактат, малат, малеат, такого лікування, ефективної кількості сполуки гідроксималеат, малонат, манделат, мезилат, ніФормули І. Тобто цей винахід пропонує застосукотинат, ізонікотинат, оксалат, фталат, терефтавання сполуки Формули І або її фармацевтичної лат, пропіолат, пропіонат, фенілпропіонат, саліцикомпозиції для виготовлення лікарського засобу лат, себацинат, сукцинат, суберат, для лікування розладів, пов'язаних із мускаринобензолсульфонат, п-бромбензолсульфонат, хлорвими рецепторами. Цей винахід пропонує також бензолсульфонат, етилсульфонат, 2сполуку Формули І для застосування в терапії. гідроксіетилсульфонат, В цьому описі перелічені нижче терміни мають метилсульфонат, нафталін- 1-сульфонат, нанижчевказані значення: фталін-2-сульфонат, нафталін-1,5-дисульфонат, Термін "галоїд" означає атом хлору, фтору, п-толуолсульфонат, ксилолсульфонат, тартрат брому або йоду. тощо. Термін "C1-C4-алкіл" означає алкіл нормальної Цей винахід охоплює стереоізомери та таутоабо розгалуженої будови, який містить від 1 до 4 мери сполук Формули І. Для позначення конкретатомів вуглецю, і охоплює метил, етил, н-пропіл, них ізомерів та відносної стереохімічної конфігуізопропіл, н-бутил, втор-бутил, ізобутил та третрації в описі застосовуються позначення (R)- та бутил. Термін "С3-C8-циклоалкіл" охоплює циклоп(S)- за Каном-Прелогом-Інгольдом і позначення ропіл, циклобутил, циклопентил, циклогексил, цикцис- та транс- для відносних стереохімічних конфілогептил та циклооктил. гурацій. Термін "С1-С4-алкоксигрупа" означає алкіл ноЯк у випадку будь-яких фармацевтично активрмальної або розгалуженої будови, який містить них сполук, деяким групам сполук віддається певід 1 атому до 4 атомів вуглецю, приєднаний до ревага при їх кінцевому застосуванні. Нижче подаатома кисню, і охоплює метоксигрупу, етоксигрупу, но визначення груп сполук, яким віддається н-пропоксигрупу, ізопропоксигрупу, н-бутоксигрупу, перевага. ізобутоксигрупу, втор-бутоксигрупу та третa) Коли R4 не є водень, перевага віддається бутоксигрупу. сполукам, котрі мають стереохімічну трансТермін "гетероарил" вживається для познаконфігурацію в положеннях 1 та 2. чення стабільного ненасиченого п'яти- або шестиb) Коли R4 не є водень, перевага віддається членного циклу, якій містить 1 гетероатом або 2 сполукам, котрі мають стереохімічну трансгетероатоми, вибрані з групи, до якої входять азот, конфігурацію в положеннях 1 та 2, показаних нижкисень та сірка. Прикладами гетероарилів є піриче. диніл, піримідиніл, піразиніл, піроліл, оксазоліл, ізоксазоліл, імідазоліл, тіазоліл, піридазиніл, фурил, тієніл тощо. Гетероарилами, яким віддається перевага, є тієніл, піридиніл та фурил. Сполуки згідно з цим винаходом утворюють c) Ra є метил. фармацевтично прийнятні солі кислот із різноманіd) R5 є водень. тними органічними та неорганічними кислотами, е) R4 є гідроксил. до яких належать фізіологічно прийнятні солі, які f) t є 1. часто застосовують у фармацевтичній хімії. Такі g) m є 1. солі також охоплюються цим винаходом. "Фармаh) Ra є метил, R5 є водень, R4 є гідроксил, t є 1 цевтично прийнятні солі" одержують із фармацевта m є 1. тично прийнятних кислот, добре відомих у галузі. і) Кожна з груп Q, Χ, Υ та Ζ є CR1 за умови, що До таких солей належать фармацевтично прийнящонайменше дві групи з Q, Χ, Υ та Ζ є СН. тні солі, перелічені в [Journal of Pharmaceutical j) R1 є водень, Science. 66. 2-19 (1977)], відомі фахівцям. До тиk) R1 є галоїд. пових неорганічних кислот, які використовують для 7 76492 8 l) R1 є фтор. Згідно зі Схемою А, стадія (а), сполуку Формуm) Кожна з груп Q, Χ, Υ та Ζ є СН. ли (1) піддають розділенню і одержують практично n) Одна з груп Q, Χ, Υ та Ζ є CF, а інші є СН. чисту сполуку Формули (2). Сполуку Формули (1) о) Q є CF і кожна з груп Χ, Υ та Ζ є СН. легко одержати способами, добре відомими та q) R2 є феніл, факультативно заміщений заміпоширеними в практиці, наприклад, способами, сниками в кількості від одного до трьох, вибраними [описаними в публікаціях РСТ заявок WO незалежно один від одного з групи, до якої входять 97/25983, опублікованій 24 липня 1997р., та WO галоїд, C1-C4-алкоксигрупа, C1-C4-алкіл, трифтор99/04778, опублікованій 4 лютого 1999р.]. Термін метил та ціан. "практично чистий" в цьому описі стосується енанr) R2 є феніл. тіомерної чистоти. Бажану стереохімічну конфігуs) R3 є феніл, факультативно заміщений замірацію кінцевих сполук Формули І можна легко засниками в кількості від одного до трьох, вибраними безпечити в Схемі А на стадії (а) шляхом незалежно один від одного з групи, до якої входять розділення сполук Формули (1). Подальше обробгалоїд, C1-C4-алкоксигрупа, C1-C4-алкіл, трифторлення розділених сполук Формули (1) на стадіях метил, ціан та нітрогрупа. (b), (c), (d) та факультативній стадії (є), описаних t) R3 є феніл, заміщений одним замісником, нижче, забезпечує одержання практично чистих вибраним із групи, до якої входять галоїд, трифтосполук Формули І. Можна одержати практично рметил, ціан та нітрогрупа. чисті сполуки Формули І, які мають енантіомерну u) R3 є феніл, однозаміщений галоїдом. чистоту понад 80%, у варіанті, якому віддається v) R3 є феніл, однозаміщений фтором. перевага, понад 90%, у варіанті, якому віддається w) R3 є феніл, однозаміщений фтором у парабільша перевага, понад 95%, у варіанті, якому відположенні. дається найбільша перевага, понад 97%. Сполуки х) R2 є феніл, R3 є феніл, однозаміщений фтоФормули (1) можна розділити шляхом хіральної ром у пара-положенні, і кожна з груп Q, Χ, Υ та Ζ є хроматографії або фракційної кристалізації діасСН. тереомерних солей кислот. Мається на увазі, що у) R2 є феніл, R3 є феніл, однозаміщений фтодля цієї мети придатні численні солі такого типу. ром у пара-положенні, Q є CF і кожна з груп Χ, Υ та На практиці з'ясовано, що особливо придатними є Ζ є СН. ізомери мигдалевої кислоти. z) Ra є метил, R5 є водень, R4 є гідроксил, t є 1, Наприклад, сполуку Формули (1) вводять в коm є 1, R2 є феніл і кожна з груп Q, Χ, Υ та Ζ є СН. нтакт з вибраною кислотою. Як правило, можна аа) Ra є метил, R5 є водень, R4 є гідроксил, t є застосовувати від приблизно 0,4 молярного екві1, m є 1, R2 є феніл, Q є CF і кожна з груп Χ, Υ та Ζ валента до значного надлишку згаданої вибраної є СН. кислоти, перевага віддається кількості від приблиbb) Ra є метил, R5 є водень, R4 є гідроксил, t є зно 0,4 молярного еквівалента до 1,5 молярного 1, m є 1 і R3 є феніл, однозаміщений фтором у еквівалента, а більша перевага - кількості від припара-положенні. близно 0,5 молярного еквівалента до 1,1 молярноВищезазначені пункти переліку можуть бути го еквівалента. Розділення, як правило, виконують скомбіновані і визначати додаткові групи сполук, шляхом кристалізації солі кислоти з розчину. Осояким віддається перевага. бливо придатними при цьому є розчинники типу Сполуки Формули І, де R4 є гідроксил, одернижчих спиртів, в тому числі метанол. Може видажують за методиками, описаними в Схемі А. У тися доцільним застосування незначних кількостей Схемі А всі замісники, якщо не обумовлено інше, води спільно з вибраним розчинником (розчиннивідповідають поданим вище визначенням, а всі ками) з метою виконання розділення в прийнятнореагенти добре відомі та поширені в практиці. му об'ємі. Застосування протирозчинника також може бути доцільним. В цьому описі термін "протирозчинник" означає розчинник, в якому сіль розчиняється значно гірше порівняно з іншим вибраним розчинником (розчинниками). В разі застосування протирозчинника він переважно є змішуваним з іншим вибраним розчинником (розчинниками). До придатних протирозчинників належать прості ефіри, наприклад, діетиловий ефір, метил-трет-бутиловий ефір тощо, та нижчі алкілацетати, наприклад, метилацетат, етилацетат, ізопропілацетат, пропілацетат, ізобутилацетат, вторбутилацетат, бутилацетат, амілацетат, ізоамілацетат тощо, а також алкани, наприклад, пентан, гексан, гептан, циклогексан тощо. В разі використання рацемічних сумішей слід додержуватися обережності при застосуванні протирозчинників для уникнення кристалізації небажаної діастереомерної солі. Як правило, кристалізацію виконують при початковій температурі від приблизно 40°С до температури кипіння вибраного розчинника (розчинників). Потім суміш охолоджують, і одержують сіль. 9 76492 10 Може бути доцільним внесення затравки. Переватонному полярному розріджувачі, наприклад, в га віддається повільному охолодженню кристалідиметилформаміді (ДМФ), хлористому метилені заційного розчину. Найбільш зручно охолоджувати (дихлорметані), хлороформі, ацетонітрилі, тетрагікристалізаційну суміш до температури від темпедрофурані (ТГФ) тощо. В типових випадках цю ратури навколишнього середовища до приблизно реакцію виконують при температурах від приблиз20°С. Сіль можна відділити, застосовуючи спосоно 0°С до приблизно 60°С; необхідна тривалість би, добре відомі в практиці, в тому числі фільтруреакції становить у типових випадках від приблизвання, декантацію, центрифугування, випаровуно 1год. до приблизно 24год. Після завершення вання, сушіння тощо. Сполуки Формули (2) можна реакції продукт Формули (3) виділяють звичайними використовувати безпосередньо в формі солей з способами, в тому числі екстракцією, осадженням, вибраними кислотами. За альтернативним варіанхроматографією, фільтруванням, розтиранням, том, сполуку Формули (2) перед використанням кристалізацією тощо. можна виділити в формі солі іншої кислоти після За альтернативним способом, сполуку Формукислотного обміну або у формі основи шляхом ли (2) вводять у контакт із галоїдангідридом приекстракції в основних умовах способами, добре датної кислоти, і одержують сполуку Формули (3). відомими та поширеними в практиці. Такі галоїдангідриди є комерційно доступними або Для фахівця зрозуміло, що зображена сполука можуть бути легко одержані з придатних кислот Формули (2) має транс-конфігурацію в положеннях способами, добре відомими в практиці, наприклад, 1 та 2 інданового циклу. З таких транс-сполук легдією трихлористого фосфору, трибромистого фоко одержати цис-сполук шляхом введення групи сфору, оксихлориду фосфору, п'ятихлористого захисту аміну, інвертування гідроксильного центра фосфору, тіонілхлориду, тіонілброміду або оксаліта подальшого відщеплення групи захисту в разі лхлориду, у присутності або за відсутності незначнеобхідності. Відомі численні способи, які забезної кількості диметилформаміду, в інертному розпечують інвертування гідроксильного центра, начиннику, наприклад, в толуолі, хлористому приклад, реакція Міцунобу з придатними карбонометилені або хлороформі, при температурі від вими кислотами, в тому числі з оцтовою кислотою приблизно 0°С до 80°С. Реакцію проводять у тита бензойною кислотою, з подальшим гідролізом. пових випадках протягом часу в межах від 1год. од На Схемі А, стадія (b), зображено утворення 24год. Одержаний галощангідрид кислоти можна сполуки Формули (3). Зрозуміло, що сполука Форвиділити та очистити або часто використати безмули (3) може бути сполукою, де R є групою, котру посередньо, тобто з відділенням та/або очищенбажано одержати в кінцевому продукті Формули І ням або без цих операцій. При проведенні реакцій згідно з поданим вище визначенням. Група R може сполучення, як правило, використовують придатну також бути сполучена з карбонілом і утворювати основу для зв'язування кислоти, що вивільнюється групу захисту, наприклад, t-BOC (третпри реакції. До придатних для цього основ налебутилоксикарбоніл), яку можна пізніше відщепити жать, наприклад, гідроксид натрію, гідроксид каперед введенням групи R, котру бажано одержати лію, піридин, триетиламін, Ν,Νв кінцевому продукті Формули І. Вибір та застосудіізопропілетиламін, N-метилморфолін тощо. Реавання придатних груп захисту є добре відомими та кцію звичайно проводять в розчиннику, наприклад, поширеними в практиці операціями [дивись Т.Гріні, в хлористому метилені, хлороформі, тетрагідро"Групи захисту в органічному синтезі" - Protecting фурані тощо, або в умовах реакції ШоттенаGroups in Organic Synthesis, by Theodora Greene Баумана, в суміші розчинників, наприклад, хлорис(Wiley Interscience)]. того метилену, етилацетату, толуолу та води. В Наприклад, коли R є групою, котру бажано матипових випадках реакцію сполучення виконують ти в складі кінцевого продукту, реакцію сполученпри температурах від приблизно -20°С до приблиня, ілюстровану стадією (b), виконують із застосузно 80°С; необхідна тривалість реакції становить у ванням придатної кислоти або одержаного з неї типових випадках від приблизно 1год. до приблизгалоїдангідриду. До придатних кислот належать но 24год. Після завершення реакції продукт Форрізноманітні заміщені бензойні кислоти та галоїдамули (3) виділяють звичайними способами, в тому нгідриди таких кислот, гетероарилкарбонові кислочислі екстракцією, осадженням, хроматографією, ти та галоїдангідриди таких кислот, а також різнофільтруванням, розтиранням, кристалізацією томанітні біарилкарбонові кислоти та що. галоїдангідриди таких кислот. Прикладами є біфеНа Схемі А, стадія (с), зображено відновлення нілкарбонова кислота та З-фторбіфеніл-4нітрогрупи з одержанням сполуки Формули (4). карбонова кислота. Таке відновлення можна виконувати різноманітниНаприклад, сполуку Формули (2) вводять в коми способами, добре відомими в практиці. нтакт з придатною кислотою і одержують сполуку Наприклад, сполуку Формули (3) можна піддаФормули (3). Такі реакції сполучення широко зати гідруванню з застосуванням каталізатора, настосовуються в синтезі пептидів, і їх можна викоприклад, паладію на вугіллі, і одержати сполуку нувати способами, застосовуваними в цій галузі. Формули (4). Таке гідрування в типових випадках Наприклад, для сприяння такому ацилюванню виконують у розчиннику, і для цієї мети придатні можна використовувати добре відомі агенти спорізноманітні розчинники, наприклад, метанол, еталучення, наприклад, прищеплені до смол реагенти нол, ізопропанол, тетрагідрофуран, етилацетат та карбодііміди із застосуванням або без застосуабо їх суміші. Гідрування можна виконувати при вання добре відомих домішок, наприклад, Nпочатковому тиску водню 20-180 фунтів на кв. гідроксисукциніміду, 1-гідроксибензотриазолу тодюйм (137-1241кПа). В типових випадках реакцію що. Реакцію зручно виконувати в інертному апропроводять при температурах від приблизно 0°С до 11 76492 12 приблизно 60°С. Необхідна тривалість реакції становить у типових випадках від приблизно 1год. до приблизно 3 діб. Продукт можна виділяти та очищати способами, добре відомими в практиці, наприклад, фільтруванням, екстракцією, випаровуванням, розтиранням, осадженням, хроматографією та перекристалізацією. Згідно зі Схемою А, стадія (d), сполуку Формули (4) вводять в контакт із придатним агентом утворення амідину, і одержують сполуку Формули І. До придатних агентів утворення амідину належать трифлат 1-метилтіо-1-метил-N-(4фторбензил)-N-метилімонію та йодид 1-метилтіо1-метил-N-(4-фторбензил)-N-метилімонію. Для фахівця зрозуміло, що відповідні агенти утворення амідину можуть бути одержані попередньо або, за бажанням, in situ. Наприклад, сполуку Формули (4) вводять в контакт із придатним агентом утворення амідину, взятим в кількості приблизно 1-3екв. Реакцію проводять у типових випадках в безводному розчиннику, наприклад, в хлористому метилені, толуолі На Схемі В, стадія (а), показано відновлюваабо тетрагідрофурані, при температурі від приблильне амінування сполуки Формули (5) з одержанзно -20°С до 50°С. Реакцію виконують із застосуням сполуки Формули (6). Такі реакції відновлюваванням придатної основи, наприклад, піридину, льного амінування виконують у різноманітних колідину або триетиламіну. Необхідна тривалість умовах. Реакцію, зображену на Схемі В, стадія (а), реакції становить у типових випадках від 1год. до можна виконувати з використанням аміаку або 18год. Продукт можна виділяти та очищати спосозахищеного аміну, наприклад, бензиламіну, дибебами, добре відомими в практиці, наприклад, ганзиламіну, тощо, з подальшим відщепленням грусінням, фільтруванням, екстракцією, випаровуванпи захисту дляодержанням сполуки Формули (6). ням, розтиранням, осадженням, хроматографією Наприклад, сполуку Формули (5) вводять у рета перекристалізацією. акцію з надлишком аміаку та ціанборгідриду наЯк легко зрозуміти, якщо R є групою захисту, трію, і одержують сполуку Формули (6). Як добре введеною на стадії (b), то можна відщепити цю відомо в практиці, може бути доцільним монітогрупу захисту після виконання стадії (d), і сполучиринг та регулювання рН в процесі таких реакцій. ти одержаний амін із придатною кислотою або Реакцію проводять у розчиннику, наприклад, в галоїдангідридом кислоти, як також описано для метанолі, етанолі, ізопропанолі та воді або в їхніх стадії (b), і одержати сполуку Формули І. сумішах. В типових випадках цю реакцію виконуДеякі сполуки Формули І є проміжними продукють при температурах від приблизно 0°С до прибтами для інших кінцевих сполук Формули І. Наприлизно 60°С; необхідна тривалість реакції стано2 клад, коли R є йод, для заміни йоду як рухомої вить у типових випадках від приблизно 1год. до 2 групи та введення іншої групи R , котру бажано приблизно 24год. Після завершення реакції промати в кінцевому продукті, можна застосувати індукт Формули (6) виділяють звичайними способаший реагент, наприклад, 2-(трибутилстаніл)тіофен ми, в тому числі екстракцією, осадженням, хромаабо 2-(трибутилстаніл)піридин. тографією, фільтруванням, розтиранням, Згідно зі Схемою А, на факультативній стадії кристалізацією тощо. (e), не показаній на схемі, одержують сіль сполуки Стадії (b), (c), (d) та факультативну стадію (e) Формули І із кислотою, використовуючи фармацеза Схемою В виконують способами, описаними втично прийнятну кислоту. Одержання солей кисдля стадій (b), (c), (d) та факультативної стадії (e) лот добре відоме та поширене в практиці. за Схемою А, і одержують сполуку Формули І. 4 Сполуки Формули І, де R є водень, одержуСполуки Формули І, де R4 є фтор, одержують ють зі сполук Формули (3) або зі сполук Формули зі сполук Формули (3) або зі сполук Формули (2) із (2) з захищеною аміногрупою шляхом відщеплензахищеною аміногрупою, застосовуючи способи ня гідроксилу. Такі реакції відщеплення гідроксилу галоїдування, добре відомі в практиці, наприклад, легко виконувати, застосовуючи способи, добре способи, описані Лароком [Larock, Comprehensive відомі в практиці, наприклад, способи, описані Organic Transformations, с. 689-701 (1999)]. Лароком [Larock, Comprehensive Organic Цей винахід додатково ілюстровано поданими Transformations, с. 44-52 (1999)]. За альтернативнижче прикладами та методиками підготовчих си4 ним варіантом сполуки Формули І, де R є водень, нтезів. Ці приклади та методики підготовчих синодержують за методиками, ілюстрованими Схетезів мають лише ілюстративний характер і не мою В. У Схемі В всі замісники, якщо не обумовпризначені для обмеження обсягу винаходу. лено інше, відповідають поданим вище визначенТерміни, застосовані в прикладах та методиням, а всі реагенти добре відомі та поширені в ках підготовчих синтезів, якщо не обумовлено інпрактиці. ше, мають загальновживані значення. Наприклад, "°С" означає градуси за Цельсієм; "М" означає молярність; "ммоль (mmol)" означає кількість мілі 13 76492 14 молів; "г (g)" означає грами; "мл (mL)" означає місуміш при доступі повітря вміщують в масляну лілітри; "т.пл. (тр)" означає температуру плавленбаню, де підтримують температуру 80°С. Після 5ня; "розеол" означає насичений водний розчин хвилинного нагрівання додають однією порцією хлориду натрію; тощо. В характеристиках 1H-ЯМР Pd(OAc)2 (81мг, 0,36ммоль) і перемішують до змівсі значення хімічних зсувів, якщо не обумовлено ни кольору реакційної маси на чорний. Охолоджу-1 інше, подано в δ (млн ). ють реакційну суміш до кімнатної температури, Методики сполучення розбавляють етилацетатом і фільтрують через Спосіб А нетовстий шар целіту з доданням додаткової кіль2'-хлорбіфеніл-4-карбонова кислота кості етилацетату. Органічний розчин промивають Змішують метил-4-бромбензоат (1,0г, водою, сушать над MgSO4, фільтрують і випаро4,65ммоль), 2-хлорфенілборну кислоту (799мг, вують. Після очищення флеш-хроматографією 5,1ммоль), Pd(OAc)2 (51мг, 0,46ммоль) та карбоодержують метиловий складний ефір 2нат натрію (1,5г, 13,9ммоль) в ДМФ (20мл) та воді фенілпіримідин-5-карбонової у вигляді твердої (2,0мл) при перемішуванні. Продувають реакційну речовини жовтого кольору. Розчиняють очищений суміш аргоном, додають трифенілфосфін (61мг, складний ефір в ТГФ (0,25М), і додають такий же 0,23ммоль) і знову продувають аргоном. Встановоб'єм 1Μ NaOH. Інтенсивно перемішують при кімлюють закриту реакційну посудину в масляну банатній температурі протягом 15год. Після заверню, де підтримують температуру 80°С, і перемішення цієї операції підкислюють реакційну суміш шують протягом 1год. Охолоджують реакційну концентрованою НСl і екстрагують етилацетатом. суміш до кімнатної температури, розбавляють Після випаровування розчинника одержують 63мг етилацетатом і фільтрують через нетовстий шар (8%) вказаної в заголовку сполуки. 1H ЯМР целіту з доданням додаткової кількості етилацета(DMSO): 9,37 (s, 1Н), 9,21 (s, 1H), 8,23-8,21 (m, 2Н), ту. Органічний розчин промивають водою, сушать 7,57-7,77 (m, 3Н). над MgSO4, фільтрують і випаровують. Після очиПерелічені нижче сполуки одержують практичщення флеш-хроматографією одержують метилоно, як описано вище. вий складний ефір 2'-хлорбіфеніл-4-карбонової 2'-фтор-6'-трифторметилбіфеніл-4-карбонова кислоти у вигляді твердої речовини жовтого кокислота MS 283,1 (М-) льору. Розчиняють очищений складний ефір в ТГФ 3,2',4'-трифторбіфеніл-4-карбонова кислота MS 251,1 (Μ-) (0,25М), і додають такий самий об'єм 1Μ NaOH. 4'-фтор-2'-метоксибіфеніл-4-карбонова кислота MS 245,1 (ΜΗ-) Інтенсивно перемішують при кімнатній температурі 3-хлор-2',4'-дифторбіфеніл-4-карбонова кислота MS 267,1 (M-) 4'-фтор-2'-метилбіфеніл-4-карбонова кислота MS 229,0 (M-) протягом 15год. Після завершення цієї операції 4'-трифторметилбіфеніл-4-карбонова кислота MS 265,1 (M-) підкислюють реакційну суміш концентрованою НСl 2-фтор-4-(тієн-2-іл)феніл-1-карбонова кислота MS 221,1 (M-) і екстрагують етилацетатом. Після випаровування розчинника одержують 762мг (67%) вказаної в Спосіб С заголовку сполуки. Мас-спектр (MS) (m/e) 231,1 (Μ3',4'-дифторбіфеніл-4-карбонова кислота ). Перелічені нижче сполуки одержують практично, Змішують 3,4-дифторфенілборну кислоту як описано вище. (1,0г, 5,2ммоль), метил-4-бромбензоат (0,241г, 1,73ммоль), Pd(OAc)2 (0,019г, 0,086ммоль), тетра6-(2-хлорфеніл)піридин-3-карбонова кислота MS 233,9 (МН+) бутиламонійбромід (0,111г, 0,345ммоль) та фос6-(2,4-дифторфеніл)піридин-3-карбонова кислота MS 235,9 (МН+) фат натрію (0,733г, 3,454ммоль). Продувають реа6-фенілпіридин-З-карбонової кислоти метилокційну посудину аргоном, і додають до реакційної + вий складний ефір MS 214,1 (МН ) + суміші безводний ДМФ (20мл). Нагрівають закриту 6-(2-метилфеніл)піридин-3-карбонова кислота MS 214,0 (МН ) реакційну посудину при 120°С із перемішуванням 2'-трифторметилбіфеніл-4-карбонова кислота MS 265,2 (Μ-) 2-метилбіфеніл-4-карбонова кислота MS 211,3 (М-) до завершення реакції. Охолоджують реакційну 3-фторбіфеніл-4-карбонова кислота MS 215,1 (M ) суміш до кімнатної температури, розбавляють 2',6'-дихлорбіфеніл-4-карбонова кислота MS 264,9 (M-) етилацетатом і фільтрують через нетовстий шар 2',6'-дифторбіфеніл-4-карбонова кислота MS 233,1 (M ) целіту з доданням додаткової кількості етилацета2'-метоксибіфеніл-4-карбонова кислота MS 227,0 (M ) ту. Органічний розчин промивають водою, сушать 3,4'-дифторбіфеніл-4-карбонова кислота MS 233,1 (M-) 3,2' -дифторбіфеніл-4-карбонова кислота MS 233,1 (M-) над MgSO4, фільтрують і випаровують. Після очиЗ-хлорбіфеніл-4-карбонова кислота MS 231,1 (M ) щення флеш-хроматографією одержують метило4-(тієн-2-іл)феніл-1-карбонова кислота MS 203,1 (M ) вий складний ефір 3',4'-дифторбіфеніл-44'-фторбіфеніл-4-карбонова кислота (гідроліз в карбонової кислоти у вигляді твердої речовини діоксані при 60°С) MS 214,9 (M-) 3'-фторбіфеніл-4-карбонова кислота (гідроліз в жовтого кольору. Розчиняють очищений складний діоксані) MS 215,0 (M-) ефір в діоксані (45мл), і додають такий же об'єм 1 3'-ціанбіфеніл-4-карбонова кислота (гідроліз Μ водного розчину NaOH. Нагрівають реакційну LiОН в діоксані) MS 222,0 (M ) посудину при 60°С із перемішуванням до завершення реакції. Видаляють розчинник випаровуСпосіб В ванням. Залишок розчиняють в дихлорметані і 5-фенілпіразин-2-карбонова кислота промивають 1-н. водною хлористоводневою кисЗмішують метиловий складний ефір 5лотою. Органічний розчин сушать над MgSO4, фіхлорпіразин-2-карбонової кислоти (626мг, льтрують і випаровують, одержуючи 0,048г (12%) 3,64ммоль), фенілборну кислоту (666мг, вказаної в заголовку сполуки. Мас-спектр (m/е) 235 5,45ммоль), фторид цезію (55мг, 0,36ммоль) та (М+). Перелічені нижче сполуки одержують практиNa2CO3 (964мг, 9,09ммоль) в ДМФ (5мл) та воді чно, як описано вище. (5мл) при перемішуванні. Гетерогенну реакційну 15 6-(2-фторфеніл)піридин-3-карбонова кислота 3', 5' -диметилбіфеніл-4-карбонова кислота 3',5'-дифторбіфеніл-4-карбонова кислота 3',5'-дихлорбіфеніл-4-карбонова кислота 3'-хлорбіфеніл-4-карбонова кислота 2',3'-дифторбіфеніл-4-карбонова кислота 4'-хлорбіфеніл-4-карбонова кислота 76492 MS 218,0 (МН+) MS 225,0 (М-) MS 233,0 (М-) MS 267,1 (М+) MS 230,9 (М-) MS 264,9 (M-) MS 230,9 (M-) Спосіб D 2',4',6'-триметилбіфеніл-4-карбонова кислота Змішують 1-йод-2,4,6-триметилбензол (2,966г, 12,05ммоль), 4-карбоксифенілборну кислоту (1,0г, 6,026ммоль), Pd(OAc)2 (0,0067г, 0,005ммоль), тетрабутиламонійбромід (0,388г, 1,2055ммоль) та фосфат натрію (2,557г, 12,05ммоль). Продувають реакційну посудину аргоном, і додають до реакційної суміші безводний ДМФ (20мл). Нагрівають закриту реакційну посудину при 120°С з перемішуванням до завершення реакції, яке визначають за даними хроматографії в тонкому шарі (ТШХ). Охолоджують реакційну суміш до кімнатної температури. Додають до реакційної суміші метилйодид (1,0мл, 36,63ммоль), і продовжують перемішування до завершення реакції. Розбавляють реакційну суміш етилацетатом і фільтрують через нетовстий шар целіту з доданням додаткової кількості етилацетату. Органічний розчин промивають водою, сушать над MgSO4, фільтрують і випаровують. Після очищення флеш-хроматографією на колонці одержують метиловий складний ефір 2',4',6'триметилбіфеніл-4-карбонової кислоти у вигляді твердої речовини жовтого кольору. Розчиняють очищений складний ефір в діоксані (45мл) та воді (5мл), яка містить 5екв. LiOH, при перемішуванні при 60°С. Після завершення реакції розчинник випаровують, підкислюють реакційну суміш хлористоводневою кислотою і екстрагують етилацетатом. Органічний розчин сушать над MgSO4, фільтрують і випаровують, одержуючи 0,023г (16%) вказаної в заголовку сполуки. Мас-спектр (m/е) 239,1 (М-). Перелічені нижче сполуки одержують практично, як описано вище. 2',4',6'-трифторбіфеніл-4-карбонова кислота 2'-фтор-4'-трифторметилбіфеніл-4-карбонова кислота MS 251,0 (Μ-) MS 283,0 (Μ-) Спосіб Е 2',4'-дифторбіфеніл-4-карбонова кислота Змішують 4-карбометоксифенілборну кислоту (1,021г, 5,67ммоль), 1-бром-2,4-дифторбензол (1,000г, 5,181ммоль), Pd(OAc)2 (0,113г, 0,50ммоль), трифенілфосфін (0,149г, 0,505ммоль) та карбонат натрію (1,664г, 0,568ммоль). Продувають реакційну посудину аргоном. Додають при перемішуванні ДМФ (20мл) і воду (2,0мл). Встановлюють закриту реакційну посудину в масляну баню, де підтримують температуру 80°С, і перемішують протягом 24год. Охолоджують реакційну суміш до кімнатної температури, розбавляють етилацетатом і фільтрують через нетовстий шар целіту з доданням додаткової кількості етилацетату. Органічний розчин промивають водою, сушать над MgSO4, фільтрують і випаровують. Після очищення флеш-хроматографією на колонці одержують метиловий складний ефір 2',4'-дифторбіфеніл 16 4-карбонової кислоти у вигляді твердої речовини жовтого кольору. Розчиняють очищений складний ефір в діоксані (5мл) і додають 5Μ NaOH (1мл). Інтенсивно перемішують при 50°С протягом 15год. Після завершення цієї операції підкислюють реакційну суміш концентрованою НСl і екстрагують етилацетатом. Після випаровування розчинника одержують 300мг (24,7%) вказаної в заголовку сполуки. Мас-спектр (m/е) 233,0 (М-). Спосіб F 6-(2,6-дифторфеніл)піридин-3-карбонова кислота Розчиняють метиловий складний ефір 6хлорпіридин-3-карбонової кислоти (6,86г, 40ммоль) в толуолі (100мл) і нагрівають до 90°С. Додають кількома порціями оксибромід фосфору (25г, 87ммоль), і продовжують нагрівання протягом 3год. Охолоджують реакційну суміш до кімнатної температури і виливають у воду з льодом. Екстрагують реакційну суміш етилацетатом, і знову промивають органічний екстракт водою, а потім розчином NaHCO3. Об'єднують органічні фази, сушать над MgSO4, фільтрують і випаровують, одержуючи тверду речовину оранжевого кольору (8,1г, 94%), яка, за даними 1H-ЯМР, являє собою суміш (8:1) метилового складного ефіру 6бромпіридин-3-карбонової кислоти з метиловим складним ефіром 6-хлорпіридин-3-карбонової кислоти. Суміш, одержану, як описано вище (0,225г, 1,04ммоль), змішують із гексаметилдіоловом (0,375г, 1,15ммоль), Pd(OAc)2 (21мг, 0,09ммоль) та трифенілфосфіном (25мг, 0,09ммоль) в толуолі (5мл). Продувають суміш азотом і перемішують при 80°С протягом 18год. Охолоджують реакційну суміш до кімнатної температури. Додають розчин 1-бром-2,6-дифторбензолу (250мг, 1,29ммоль) в толуолі (1мл), а потім Pd(OAc)2 (21мг, 0,09ммоль) та трифенілфосфін (25мг, 0,09ммоль). Продувають суміш азотом і перемішують при 80°С протягом додаткових 18год. Охолоджують реакційну суміш до кімнатної температури. Випаровують розчинник, і очищають залишок хроматографією на колонці (діоксид кремнію, 10% етилацетату в гексані), одержуючи 50мг (вихід 20%) етилового складного ефіру 6-(2,6-дифторфеніл)піридин-3карбонової кислоти. Гідролізують складний ефір 1н. розчином гідроксиду натрію (0,22мл, 0,22ммоль) в метанолі (3мл) при кімнатній температурі протягом 3 діб. Видаляють леткі компоненти у вакуумі, і змішують залишок з 1-н. розчином хлористоводневої кислоти. Відділяють білу тверду речовину фільтруванням, промивають водою і сушать у вакуумі, одержуючи 30мг (вихід 63%) вказаної в заголовку сполуки. Мас-спектр (m/е) 235,9 (МН+). Спосіб G 3-фторбіфеніл-4-карбонова кислота Змішують метил-2-фтор-4-бромбензоат (1,25г, 5,36ммоль), фенілборну кислоту (1,30г, 10,72ммоль) та CsF (2,02г, 13,40ммоль) в ДМФ (25мл) та воді (3,0мл) при перемішуванні. Гетерогенну реакційну суміш при доступі повітря вміщують в масляну баню, де підтримують температуру 80°С. Після 5-хвилинного нагрівання додають однією порцією Pd(OAc)2 (120мг, 0,536ммоль) і пе 17 76492 18 ремішують до зміни кольору реакційної маси на дин-літію (LiТМР), для чого додають бутиллітій чорний. Охолоджують реакційну суміш до кімнат(1,6Μ розчин в гексані, 5,33мл) до тетраметилпіної температури, розбавляють етилацетатом і фіперидину (1,4мл, 1,25екв.) при -78°С в ТГФ (14мл). льтрують через нетовстий шар целіту з доданням Через канюлю додають охолоджений LiTMP до додаткової кількості етилацетату. Органічний розохолодженого 3,5-дифторбіфенілу і перемішують чин промивають водою, сушать над MgSO4, фільреакційну суміш при -78°С протягом 1год. Барботрують і випаровують. Після очищення флештують через розчин вуглекислий газ протягом 5хв., хроматографією на колонці одержують метиловий нагрівають суміш до кімнатної температури, вилискладний ефір 3-фторбіфеніл-4-карбонової кисловають у 50мл 1М NaOH і екстрагують 50мл етилати у вигляді твердої речовини. Розчиняють очищецетату. Органічну фазу відкидають. Водний шар, ний складний ефір в ТГФ (0,25М) і додають такий що залишився, підкислюють концентрованою НСl і же об'єм 1Μ NaOH. Інтенсивно перемішують при двічі екстрагують етилацетатом. Органічні екстракімнатній температурі протягом 15год. Після завекти сушать над MgSO4, фільтрують і випаровують, ршення цієї операції підкислюють реакційну суміш одержуючи 1,22г вказаної в заголовку сполуки у концентрованою НС1 і екстрагують етилацетатом. вигляді білої твердої речовини (77%). Мас-спектр Після випаровування розчинника одержують 965мг (m/е) 233,1 (М-). (84%) вказаної в заголовку сполуки. Мас-спектр Спосіб K (m/е) 214,9 (М-). 3,2',6'-трифторбіфеніл-4-карбонова кислота Перелічені нижче сполуки одержують практичЗмішують метил-4-бром-2-фторбензоат (3,66г, но, як описано вище. 15,75ммоль), 4,4,5,5,4',4',5',5'-октаметил-2,2'-бі1,3,2-діоксабороланіл (5,0г, 19,68ммоль) та ацетат 3-фтор-2'-метилбіфеніл-4-карбонова кислота MS 229,0 (М-) калію (4,63г, 47,19ммоль) в ДМСО (40мл), і проду2'-хлор-3-фторбіфеніл-4-карбонова кислота MS 205,1 (М-) вають розчин аргоном. Додають РаСІ2(1,1'3-фтор-2'-трифторметилбіфеніл-4-карбонова біс(дифенілфосфіно)фероцен)2 (10% (моль), кислота MS 283,1 (М ) 1,35г), і знов продувають розчин аргоном. Нагрівають реакційну суміш при 80°С протягом 3год. і Спосіб Η охолоджують до кімнатної температури. Проми2-фтор-6-фенілпіридин-3-карбонова кислота вають суміш водою, екстрагують етилацетатом і Розчиняють 2,6-дифторпіридин (5,0мл, концентрують. Одержане масло чорного кольору 5,51ммоль) в безводному ТГФ (30мл) і охолоджузнов розчиняють в суміші етилацетату з гексаном ють до -40°С. Додають крапля за краплею розчин (1:2), фільтрують через нетовстий шар силікагелю феніллітію (1,8Μ в гексані, 30,6мл) протягом 5хв. і концентрують. Одержують метиловий складний Перемішують одержану реакційну суміш пурпуроефір 2-фтор-(4,4,5,5-тетраметил-1,3,2вого кольору при -40°С протягом 30хв. і нагрівають діоксаборолан-2-іл)бензойної кислоти у вигляді до кімнатної температури. Гасять реакційну суміш масла жовтого кольору. водою, і екстрагують розчин кілька разів етилацеОдержане жовте масло розчиняють в ацетоні татом. Об'єднують органічні екстракти, сушать над (100мл) і змішують з NaIO4 (10,1г, 47,25ммоль), MgSO4, фільтрують і випаровують із нанесенням NH4OAc (3,63г, 47,25ммоль) і водою (50мл) при на силікагель. Після очищення флешкімнатній температурі. Перемішують при кімнатній хроматографією на колонці одержують 2-фтор-6температурі протягом 18год., переносять у ділильфенілпіридин (1,0г, 12%) у вигляді масла жовтого ну лійку і кілька разів екстрагують етилацетатом. кольору. Об'єднані органічні екстракти сушать над MgSO4, Охолоджують розчин діізопропіламіду літію фільтрують і концентрують, одержуючи 3,0г 3(LDA) (3,46ммоль) в безводному ТГФ (6мл) до фтор-4-карбометоксифенілборної кислоти у ви78°С. До охолодженого розчину LDA додають чегляді не зовсім білої твердої речовини. рез канюлю розчин 2-фтор-6-фенілпіридину в безБорну кислоту, одержану, як описано вище водному ТГФ (6мл). Перемішують при -78°С протя(800мг, 4,04ммоль), і 2,6-дифторбромбензол гом 30хв., після чого барботують через розчин (1,17г, 6,06ммоль) вводять в реакцію сполучення вуглекислий газ протягом 10хв. Дають реакційній за методикою, описаною для Способу G, і одерсуміші нагрітися до кімнатної температури і продужують 380мг вказаної в заголовку сполуки. Масвають аргоном. Екстрагують суміш 1Μ NaOH, і спектр (m/е) 251,1 (М-). відкидають органічну фазу. Водний шар підкислюСпосіб L ють концентрованою НС1 і екстрагують етилаце6-фенілпіридазин-3-карбонова кислота татом. Органічний шар сушать над MgSO4, фільт6-фенілпіридазин-3-ол (5,0г, 29,06ммоль) розрують і випаровують, одержуючи вказану в чиняють в толуолі (100мл) і нагрівають до 90°С. заголовку сполуку у вигляді твердої речовини світДодають кількома порціями оксибромід фосфору ло-жовтого кольору (405мг, 65%). Мас-спектр (m/е) (25г, 87,19ммоль), і нагрівають реакційну суміш 216,1 (М-). протягом 30хв. Одержаний розчин жовтого кольоСпосіб J ру охолоджують до кімнатної температури, вили3,5-дифторбіфеніл-4-карбонова кислота вають у воду з льодом і екстрагують етилацетаЗмішують 1-бром-3,5-дифторбензол (0,863мл, том. Органічні фази додатково промивають водою 7,50ммоль) та фенілборну кислоту (1,22г, та 1Μ NaOH, сушать над MgSO4, фільтрують і ви10,00ммоль) і обробляють в умовах, вказаних у паровують, одержуючи тверду речовину жовтого Способі G, одержуючи 1,3г 3,5-дифторбіфенілу. кольору. Після перекристалізації з СНСІ3 одержуНеочищений 3,5-дифторбіфеніл (1,3г, ють 2,17г 3-бром-6-фенілпіридазину. 6,83ммоль) розчиняють в ТГФ (14мл) і охолоджу3-бром-6-фенілпіридазин (1,0г, 4,25ммоль) ють до -78°С. Готують розчин тетраметилпіпери 19 76492 20 змішують із ДМФ (5мл), МеОН (5мл), триетиламіпротягом 17год. Охолоджують реакційну суміш до ном (1,18мл, 8,50ммоль) та Pd(OAc)2 (76мг, кімнатної температури і пропускають через нетов0,33ммоль) і вакуумують суміш. Додають 1,1'стий шар силікагелю. Промивають колонку дихлобіс(дифенілфосфіно)фероцен (235мг, 0,42ммоль), рметаном (100мл), а потім метанольно-водною і знов вакуумують суміш. Барботують через розчин сумішшю (100мл; 3 частини метанолу на 1 частину вуглекислий газ протягом 5хв., і створюють над води). Випаровують об'єднані фракції у вакуумі, і реакційною сумішшю тиск вуглекислого газу 50 суспендують твердий залишок у воді (10мл). Фільфунтів на кв. дюйм (345кПа). Одержаний розчин трують для видалення чорної твердої домішки і нагрівають при 50°С протягом 18год. Охолоджупідкислюють фільтрат 1-н. хлористоводневою кисють суміш до кімнатної температури, розбавляють лотою до рН4. Утворюється білий осад, який віддіводою і екстрагують етилацетатом. Органічні фази ляють фільтруванням і сушать, одержуючи 306мг сушать над MgSO4, фільтрують, випаровують із (74%) вказаної в заголовку сполуки. Мас-спектр нанесенням на силікагель і піддають флеш(m/е) 231,9 (МН+). хроматографії на колонці. Перелічені нижче сполуки одержують практичПісля гідролізу в умовах, описаних для Спосоно, як описано вище. бу А, одержують 80мг вказаної в заголовку сполу6-(2,4-дифторфеніл)піридин-3-карбонова кислоки. 1Н ЯМР (CDCl3): 8,24 (d, 1H, J=8,8Гц), 8,18-8,15 та MS 236,0 (MH+) (m, 2H), 8,0 (d, 1H, J=9,2Гц), 7,56-7,55 (m, 3Н). 6-(2-фторфеніл)піридин-3-карбонова кислота MS 218,0 (MH+) Спосіб М 2'-фторбіфеніл-4-карбонова кислота MS 215,1 (М-) 6-(4-фторфеніл)піридин-3-карбонова кислота 2'-метилбіфеніл-4-карбонова кислота MS 211,2 (М-) Змішують метиловий складний ефір 6бромпіридин-3-карбонової кислоти (1,03г, Приклад 1-1 4,78ммоль), 4-фторфенілборну кислоту (1,88г, (R)-(6-(1-((413,41ммоль) та фторид цезію (2,55г, 16,78ммоль) фторбензил)метиламіно)етиліденаміно)-2(R)в ДМФ (25мл) та воді (4мл) при перемішуванні. гідроксііндан-1-іл)амід біфеніл-4-карбонової кисГетерогенну реакційну суміш при доступі повітря лоти вміщують у масляну баню, де підтримують температуру 80°С. Після 5-хвилинного нагрівання додають однією порцією Pd(OAc)2 (150мг, 0,67ммоль). Через 17год. реакційну суміш охолоджують до кімнатної температури, розбавляють етилацетаПовільно додають розчин 375г (5,13моль, том і фільтрують через нетовстий шар целіту з 1,12екв.) N-метилацетаміду в ТГФ (1,76л) до 224г доданням додаткової кількості етилацетату. Орга(5,55моль, 1,2екв.) гідриду натрію (60% дисперсія нічну фазу промивають водою, сушать над MgSO4, в мінеральному маслі) у формі суспензії в ТГФ фільтрують і випаровують. Після очищення флеш(8,75л). Через 30хв., після додання 25% згаданого хроматографією на колонці одержують метиловий розчину, додають 875г (4,63моль, 1екв.) 4складний ефір 6-(4-фторфеніл)піридин-3фторбензилброміду і залишок розчинів Nкарбонової кислоти у вигляді твердої речовини метилацетаміду та 4-фторбензилброміду паралежовтого кольору. Очищений складний ефір розчильно на протязі наступних 3год. Температуру підтняють у ТГФ (0,25М) і додають такий самий об'єм римують на рівні нижче 40°С за допомогою водя1Μ NaOH. Інтенсивно перемішують при кімнатній ної бані. Одержану суміш перемішують протягом температурі протягом 15год. Після завершення ночі і виливають у суміш 20% NH4Cl (2,5л), води реакції підкислюють реакційну суміш концентрова(6,5л) та етилацетату (9л). Розділяють шари, і підною НСl, і відділяють білий осад фільтруванням. дають водний шар зворотній екстракції етилацетаПісля висушування у вакуумі одержують 385мг том (4,5л, потім 2л). Органічні фази об'єднують і (37%) вказаної в заголовку сполуки. Мас-спектр промивають водою (4л), а потім розсолом (7л). + (m/е) 218,1 (МН ). Органічний шар сушать (Na2SO4) і видаляють розВказану нижче сполуку одержують практично, чинник, одержуючи залишок. Цей залишок розчияк описано вище. няють в ацетонітрилі (7л) та гептані (1,75л). Розді6-(тієн-2-іл)піридин-3-карбонова кислота MS 205,9 (МН+) Спосіб N 6-(4-фтор-2-метилфеніл)піридин-3-карбонова кислота Змішують метиловий складний ефір 6бромпіридин-3-карбонової кислоти (387мг, 1,79ммоль), 4-фтор-2-метилфенілборну кислоту (338мг, 2,19ммоль), Pd(OAc)2 (40мг, 0,18ммоль), фторид цезію (27мг, 0,18ммоль) та карбонат натрію (570мг, 5,38ммоль) в ДМФ (6мл) та воді (6мл) при перемішуванні. Продувають реакційну суміш азотом, додають трифенілфосфін (47мг, 0,18ммоль) і знов продувають азотом. Закриту реакційну посудину вміщують у масляну баню, де підтримують температуру 80°С, і перемішують ляють шари і знов промивають ацетонітрильний шар гептаном (1,75л). Гептанові шари об'єднують і піддають зворотній екстракції ацетонітрилом (0,5л). Ацетонітрильні екстракти об'єднують і випаровують, одержуючи 0,814кг N-метил-N-(4фторбензил)ацетаміду. Розчиняють N-метил-N-(4фторбензил)ацетамід (0,500кг, 2,76моль) в ТГФ (11,5л). Додають п'ятисірчистий фосфор (0,737кг, 1,65моль, 0,6екв.), і нагрівають суміш зі зворотним холодильником до кипіння протягом 1-2год. Після 5год кипіння дають суміші охолодитися до кімнатної температури, відділяють тверду фазу фільтруванням і промивають 12,5л ТГФ. Об'єднують фільтрат з таким самим фільтратом з окремої реакційної суміші і концентрують, одержуючи 0,978кг залишку. Розчиняють залишок і хроматог 21 76492 22 рафують на 2,7кг силікагелю, застосовуючи іл)аміду біфеніл-4-карбонової кислоти в 17,5л СН2СІ2, і одержують 1,01кг твердої речовини. Цю ДМФ, і вміщують суміш в атмосферу водню під речовину суспендують у хлористому метилені (1л) тиском 50 фунтів на кв. дюйм (345кПа). Через протягом 15-30хв., додають гептан (5л), охоло19год. реакційну суміш фільтрують, додають часджують суміш до 0-5°С і перемішують протягом тину розчину в ДМФ (5л) до води (10л), і перемі2год. Твердий продукт відділяють фільтруванням і шують одержану суспензію протягом 2год. Цю сушать, одержуючи 0,814кг N-метил-N-(4операцію повторюють двічі для перероблення фторбензил)тіоацетаміду. всього об'єму реакційної суміші. Фільтрують усі До 2,30кг (11,6моль) N-метил-N-(4суспензії спільно, і промивають одержаний осад на фторбензил)ацетаміду додають 11,5л ацетонітрифільтрі водою (3 7л). Осад сушать, і одержують лу та 2,52кг (17,7моль, 1,5екв.) метилйодиду. Су1,42кг (R)-(6-aіно-2(R)-гідроксііндан-1-іл)аміду біміш нагрівають при 35°С протягом 21год. Концентфеніл-4-карбонової кислоти. рують суміш до половини об'єму в роторному (R)-(6-аміно-2(R)-гідроксііндан-1-іл)амід біфевипарнику і додають 14л метил-трет-бутилового ніл-4-карбонової кислоти (0,969кг, 2,81моль) супростого ефіру (МТВЕ). Знов концентрують до спендують у ТГФ (9,7л) і додають 1-метилтіо-1половини об'єму і додають ще 14л МТВЕ. Охолометил-N-(4-фторбензил)-N-метилімоній-йодид джують одержану суспензію до 0°С, відділяють (0,954кг, 2,81моль) та 4-диметиламінопіридин твердий продукт фільтруванням і сушать, одержу(34,5г, 0,281моль). Перемішують суміш протягом ючи 3,92кг 1-метилтю-1-метил-N-(4-фторбензил)24год. і видаляють розчинник у вакуумі. Одержану N-метилімоній-йодиду у вигляді білої твердої репіну розчиняють в СН2Сl2 (12,5л), і промивають човини. органічну фазу 1,0-н. НСl (1 4л і 1 3л), 1,0Μ NaOH До 6,20кг (35,0моль) 1,2-епокси-6-нітроіндану (1 2,4л) і насиченим розчином NaCl (1 4л). Оргадодають 85л концентрованого NH4OH та 28л води. нічну фазу відділяють, сушать (Na2SO4), фільтруНагрівають суміш при 36°С протягом 21год. і дають, і видаляють розчинник, одержуючи тверду ють їй охолодитися до кімнатної температури. Фіречовину. Цю речовину розчиняють в ацетонітрилі льтрують реакційну суміш через шар вологого це(9л) при нагріванні до 35-40°С. Приблизно через літу (10кг), і промивають осад на фільтрі водою. 30хв. додають затравочні кристали, при цьому До вологого осаду додають 155л метанолу, 1,3л утворюється густа біла суспензія. Охолоджують води та 5,80кг (38,1моль, 1,09екв.) (S)-(+)суміш до -15°С і перемішують при цій температурі мигдалевої кислоти. Нагрівають суміш при 55°С протягом 1-2год. Відділяють тверду фазу і сушать, протягом 2год. і фільтрують через фільтрувальний одержуючи 1,10кг вказаної в заголовку сполуки у картридж, імпрегнований вугіллям. Зменшують формі часткового сольвату з ацетонітрилом. 1 об'єм фільтрату приблизно до 35л шляхом вакууH ЯМР (CDCl3): δ 7,90 (d, 2, J=8,6), 7,69 (d, 2, мноїдистиляції і додають 130л EtOAc. Зменшують J=8,6), 7,63 (d, 2, J=8,2), 7,48 (t, 2, J=8,2, 7,6), 7,41 об'єм приблизно до 65л шляхом вакуумної дисти(d, 1, J=7,3), 7,24 (dd, 2, J=8,5, 5,2), 7,14 (d, 1, ляції. Охолоджують суміш до -8°С і перемішують J=7,9), 7,04 (t, 2, J=8,7), 6,72-6,63 (m, 3), 5,31 (t, 1, протягом 8год. Фільтрують суспензію і сушать J=5,6), 4,84 (br s, 1), 4,64 (dd, 2, J=21,4, 15,6), 4,54 осад, одержуючи 7,6кг твердої речовини. Цю ре(dd, 1, J=14,0, 7,9), 3,32 (dd, 1, J=15,6, 7,9), 3,01 (s, човину суспендують у 30л метанолу і 0,3л води, і 3), 2,95 (dd, 1, J=15,7, 8,0), 1,97 (s, 3). Мас-спектр нагрівають суміш зі зворотним холодильником (m/z): 508,2 (M+1). протягом 0,5год. Охолоджують суміш до 45°С проПриклад 2-1 тягом 0,5год. і перемішують протягом 12год., потім (R)-(6-(1-((4охолоджують до 22°С і перемішують протягом фторбензил)метиламіно)етиліденамшо)-2(R)10год. Твердий продукт відділяють фільтруванням гідроксііндан-1-іл)амід біфеніл-4-карбонової кисі сушать, одержуючи 2,7кг (S)-манделату 1(R)лоти аміно-2(R)-гідрокси-6-нітроіндану. (S)-манделат 1(R)-аміно-2(R)-гідрокси-6нітроіндану (0,64кг, 1,85моль) додають до суміші толуолу (9,6л) та водного 1-н. NaOH (4,8л, 4,8моль, 2,6екв.). Через 1год. додають 4Змішують транс1-аміно-2-гідрокси-6біфенілкарбонілхлорид (0,44кг, 2,0моль, 1,1екв.) нітроіндан (20,2г, 0,10моль) та S-мигдалеву кислопорціями протягом 20-30хв. Через 22год. відділяту (16,7г, 0,11моль, 1,1екв.) в 173мл метанолу та ють тверду фазу фільтруванням і промивають 3,6мл води. Нагрівають зі зворотним холодильнипослідовно 0,5л толуолу, 2л води і 2л толуолу. ком до кипіння і потім додають 200мл етилацетату. Осад сушать, і одержують 0,74кг (R)-(6-нітро-2Вносять затравку і дають охолодитися до 23°С. гідроксііндан-1-іл)аміду біфеніл-4-карбонової кисПісля перемішування протягом 4год. при 23°С лоти. До 1,914кг (R)-(6-нітро-2(R)-гідроксііндан-1охолоджують і витримують при -3°С протягом іл)аміду біфеніл-4-карбонової кислоти, одержаного 3год., потім фільтрують і промивають охолоджеаналогічним чином, додають 38,2л етилацетату. ною сумішшю 40% метанолу з 60% етилацетату, і Суспензію перемішують протягом 18год., відділяодержують тверду речовину. Цю речовину сушать ють тверду фазу фільтруванням і сушать, одеру вакуумній шафі при 45°С протягом 16год., і одежуючи 1,76кг (R)-(6-нітро-2(R)-гідроксііндан-1ржують суміш діастереомерних солей у співвідноіл)аміду біфеніл-4-карбонової кислоти у вигляді шенні 59:41 з переважанням 1(R)-аміно-2(R)білої твердої речовини. гідрокси-6-нітроіндану. Змішують суспензію 0,176кг 10% Pd-C (50% Змішують суміш діастереомерних солей вологості) та 1,7кг (R)-(6-нітро-2(R)-гідроксііндан-1 23 76492 24 (59:41) з 35мл метанолу та 0,32мл води. Нагріваном; після відділення та висушування одержують ють приблизно до 64°С, дають охолодитися приб217,98г N-метил-N-(4-фторбензил)тіоацетаміду: лизно до 45°С і перемішують протягом 14год., а т.пл.:=99-104оС; Rf=0,42 (хлористий метилен); 1H потім при 23°С протягом 14год., одержуючи тверду ЯМР (CDCl3) 7,35-7,26 (m, 1), 7,14-6,96 (m, 3), 5,28 речовину. Цю речовину відділяють фільтруванням, (s, 1,2) та 4,79 (s, 0,8), 3,42 (s, 1,2) та 3,15 (s, 1,8), промивають метанолом і сушать у вакуумній шафі 2,72 (s, 1,2) та 2,69 (s, 1,8). Примітка: Вважається, при 45°С протягом 26год., одержуючи 2,64г (S)що часткові протони спричинені ротомерами. манделату 1(R)-аміно-2(R)-гідрокси-6-нітроіндану Змішують N-метил-N-(4високої енантіомерної чистоти. Мас-спектр високофторбензил)тіоацетамід (14,03г, 0,0711моль) із го розділення (m/z) 194,0691. ІЧ спектр (СНСl3) хлористим метиленом (140мл) в атмосфері азоту і 1347, 1074см-1. охолоджують у бані з льодяною водою. Крапля за Змішують (S)-манделат 1(R)-аміно-2(R)краплею додають метил-трифторметансульфонат гідрокси-6-нітроіндану (40,2г, 116,1ммоль), 320мл (9,66мл, 0,085моль, 1,2екв.). Через 15хв. відсуваводи, 650мл етилацетату, 26,6г ди-третють охолоджувальну баню, і перемішують суміш бутилдикарбонату (121,9ммоль, 1,05екв.) та додапротягом 2год. Видаляють розчинник у вакуумі, і тково 200мл етилацетату. Додають крапля за краодержують 25,89г (100%) 1-метилтіо-1-метил-N-(4плею 120мл 1-н. водного розчину гідроксиду нафторбензил)-N-метилімоній-трифлату. трію (120ммоль, 1,03екв.). Через 15год. Змішують 1-метилтіо-1-метил-N-(4утворюється тверда фаза. Тверду речовину віддіфторбензил)-N-метилімоній-трифлат (5г, ляють і промивають водою (тричі) і етилацетатом 13,8ммоль), хлористий метилен (50мл) та 1(R)(тричі). Сушать і одержують 1(R)-(трет(трет-бутоксикарбоніламіно)-2(R)-гідрокси-6бутоксикарбоніламіно)-2(R)-гідрокси-6-нітроіндан у аміноіндан (3,65г, 13,8ммоль) в атмосфері азоту. вигляді білої твердої речовини (19,4г, 57%). МасДодають піридин (0,15мл). Через 2,5год. утворюється тверда фаза. Відділяють тверду речовину спектр (m/z): 295 (М+1). [ ]D=-122 (c=1, МеОН). фільтруванням, промивають мінімальною кількісЗмішують 1(R)-(трет-бутоксикарбоніламіно)тю хлористого метилену і сушать у вакуумній ша2(R)-гідрокси-6-нітроіндан (30,5г, 0,11моль), 800мл фі, одержуючи 6,29г (79%) 1(R)-(третТГФ, 800мл етилацетату і 6,3г 5% паладію на вубутоксикарбоніламіно)-2(R)-гідрокси-6-(1-метил-N'гіллі. Гідрують при тиску водню 50 фунтів на кв. (4-фторбензил)-N'-метиламідино)індан-трифлату у дюйм (345кПа) протягом 2год. Видаляють каталівигляді білої твердої речовини. Т.пл. 123-132°С. затор фільтруванням, і випаровують розчинник, Охолоджують трифтороцтову кислоту (TFA, одержуючи 29,5г 1(R)-(трет66мл) у льодяній бані, і додають порціями 1(R)бутоксикарбоніламіно)-2(R)-гідрокси-6(трет-бутоксикарбоніламіно)-2(R)-гідрокси-6-(1аміноіндану. Мас-спектр (m/z): 265 (М+1). ІЧ (КВr) метил-N'-(4-фторбензил)-N'-метиламідино)індан1699, 1625, 1535см-1. [ ]D=-122 (c=1, МеОН). трифлат (29,65г, 0,051моль) разом із 3мл хлорисДо розчину NaH (6,86г, 0,172моль, 60% у мінетого метилену. Перемішують суміш у льодяній бані ральному маслі, 1,3екв.) в ТГФ (250мл) додають протягом 10хв., потім дають нагрітися до кімнатної крапля за краплею розчин N-метилацетаміду температури і перемішують протягом 1,5год. Роз(11,6г, 0,159моль, 1,2екв.) в ТГФ (90мл). Приблизподіляють реакційну суміш між хлористим метилено через 20хв. додають 4-фторбензилбромід (25г, ном (500мл) і льодяною водою (500мл). Додають 0,132моль). Перемішують протягом приблизно 2Μ водний розчин гідроксиду натрію (450мл), і 62год., потім виливають суміш у воду з льодом розділяють шари. Водний шар екстрагують хлори(300мл) і екстрагують етилацетатом (400мл і стим метиленом (250мл), і об'єднані органічні фа200мл). Органічні фази об'єднують і промивають зи промивають водою (300мл). Охолоджують орводою (300мл), сушать над Na2SO4, фільтрують і ганічний шар, додають 1-н. водний розчин концентрують, одержуючи масло. Це масло розчигідроксиду натрію (76мл) і воду (76мл) і перемішуняють в ацетонітрилі і екстрагують гексаном для ють. видалення мінерального масла; одержують 22,79г До N'-(3-аміно-2-гідроксііндан-5-іл)-N-(4N-метил-N-(4-фторбензил)-ацетаміду: т.пл. 48фторбензил)-N-метил-ацетамідину, одержаного, 54°С; Rf=0,45 (4% МеОН в хлористому метилені); 1 як описано вище, додають порціями 4H ЯМР (CDCl3) 7,27-6,93 (m, 4), 4,5 (d, 2), 2,91 (s, біфенілкарбонілхлорид (11,05г, 0,051моль, 1екв.). 3), 2,14 (s, 3). Додають додатково 50мл води. Через 2год. роздіЗмішують N-метил-N-(4-фторбензил)-ацетамід ляють шари, екстрагують органічний шар водою (364,8г, 2,01моль) з ТГФ (9л). Перемішують до (300мл), сушать над Na2SO4, фільтрують і випаророзчинення, після чого додають п'ятисірчистий вують, одержуючи 27,06г вказаної в заголовку фосфор (537,7г, 1,21моль). Через 45хв. нагрівають сполуки у вигляді білої піни. суміш зі зворотним холодильником до кипіння. Після перекристалізації 10г вказаної в заголоЧерез 3год. дають охолодитися і перемішують вку сполуки з ацетонітрилу (10мл/г) одержано 5,96 протягом ночі, одержуючи тверду речовину. Віддіг вказаної в заголовку сполуки з т.пл. 103-111°С. ляють тверду фазу фільтруванням, і промивають Мас-спектр (m/z) 508 (М+1). осад на фільтрі ТГФ (4л). Випаровують фільтрат, Після суспендування вказаної в заголовку одержуючи залишок, розчиняють останній в хлосполуки, одержаної перекристалізацією, в 45мл ристому метилені (500мл), і пропускають розчин етилацетату і 45мл гексану і перемішування прочерез коротку колонку із силікагелем 60 (1,2кг), тягом 16год. одержано вказану в заголовку сполупопередньо кондиціонованим гептаном. Елююванку з т.пл. 139-142°С. ня виконують 4л суміші гептану із хлористим меЗмішують вказану в заголовку сполуку з т.пл. тиленом (1:1), а потім 100% хлористим метиле 25 76492 26 139-142°С (1г) з абсолютним етанолом (12мл). лені (приблизно 500мл), і пропускають розчин чеНагрівають приблизно до 50°С до розчинення тверез шар силікагелю 60 (1,2кг), попередньо кондирдої речовини. Додають крапля за краплею деіоніціонованого гептаном. Елюювання виконують 4л зовану воду (4,5мл), а потім затравочні кристали суміші гептану з хлористим метиленом (1:1), а пополіморфної форми, яка має т.пл. 150-152°С. тім 100% хлористим метиленом; одержують Охолоджують протягом 1,5год. до приблизно 23°С, 217,98г N-метил-N-(4-фторбензил)тіоацетаміду і одержують густу суспензію. Цю суспензію охоло(55%): т.пл.=99-104°С; Rf=0,42 (хлористий метиджують у льодяній бані, фільтрують і сушать у лен); 1H ЯМР (CDCl3) 7,35-7,26 (m, 1), 7,14-6,96 (m, вакуумній шафі при 50-60°С, одержуючи 0,76г вка3), 5,28 (s, 1,2) та 4,79 (s, 0,8), 3,42 (s, 1,2) та 3,15 заної в заголовку сполуки з т.пл. 150-152°С. (s, 1,8), 2,72 (s, 1,2) та 2,69 (s, 1,8). Примітка: ВваДля фахівця зрозуміло, що альтернативною жається, що часткові протони спричинені ротоменазвою вказаної в заголовку сполуки є 6-(1-((4рами. фторбензил)метиламіно)етиліденаміно)-2До суспензії N-метил-N-(4гідрокси-1-біфеніламідоіндан. фторбензил)тіоацетаміду (10г, 50,6ммоль) в ацеПриклад 2-2 тонітрилі (50мл) додають однією порцією метил(R)-(6-(1-((4йодид (10,76г, 75,8ммоль). Суміш нагрівають при фторбензил)метиламіно)етилшенаміно)-2(R)35°С протягом 46год., після чого охолоджують до гідроксііндан-1-іл)амід біфеніл-4-карбонової кисприблизно 23°С. Зменшують об'єм реакційної сулоти міші приблизно до 25мл шляхом випаровування, і додають метил-трет-бутиловий простий ефір (50мл). Знов зменшують об'єм суміші до 25мл шляхом випаровування і розбавляють додатковими 50мл метил-трет-бутилового простого ефіру, Змішують (S)-манделат 1(R)-аміно-2(R)одержуючи тверду фазу. Охолоджують суміш до гідрокси-6-нітроіндану (50,0г, 0,144моль) з 750мл 0°С, відділяють твердий продукт фільтруванням, толуолу. Додають 375мл (0,375моль, 2,6екв.) 1-н. промивають 15мл охолодженого метил-третводного розчину гідроксиду натрію, а потім 470мл бутилового простого ефіру і сушать, одержуючи води. Перемішують протягом приблизно 22хв, піс16,89г 1-метилтіо-1-метил-N-(4-фторбензил)-Nля чого додають порціями 35,5г (0,159моль, метилімоній-йодиду у вигляді твердої речовини 1,1екв.) 4-біфенілкарбонілхлориду протягом прибжовтого кольору, т.пл. 142-150°С. Мас-спектр (іонілизно 6хв. Через 3,5год. одержану суспензію фільзація електронним ударом): теоретичне значення трують, осад промивають на фільтрі толуолом, для імінієвого фрагмента C11H15FNS 212; знайдено сушать у вакуумі при 50°С протягом 18год., і оде212. ржують 56,1г 1(R)-(4-біфенілкарбоніламіно)-2(R)Змішують 1(R)-(4-біфенілкарбоніламіно)-2(R)гідрокси-6-нітроіндану. ІЧ (КВr, см-1): 3293, 1640, гідрокси-6-аміноіндан (10,0г, 0,029моль), 41549, 1528, 1345, 1329, 1086, 739; мас-спектр видиметиламінопіридин (DMAP) (0,4 г, 0,0032моль, сокого розділення обчислено для C22H18N2O4: 0,011екв.), 200мл ацетону та 1-метилтіо-1-метил374,1267, знайдено: 374,1266. ]Ч-(4-фторбензил)-]Ч-метилімоній-йодид (10,8 г, Змішують 1(R)-(4-біфенілкарбоніламіно)-2(R)чистота 96%, 0,0305моль, 1,05екв.). Через 6год. гідрокси-6-нітроіндан (55,7г), 550мл ДМФ і 2,8г кареакційну суміш концентрують, одержуючи піну. талізатора - 10% Pd/C. Гідрують при тиску водню Змішують цю піну зі 120мл толуолу, перемішують 50 фунтів на кв. дюйм (345кПа) протягом 4,75год. при температурі навколишнього середовища пропри температурі навколишнього середовища. Фітягом 19,5год., фільтрують і сушать у вакуумі при льтрують реакційну суміш, і розбавляють фільтрат 50°С, одержуючи як залишок йодистоводневу сіль 1200мл води, одержуючи суспензію. Перемішують вказаної в заголовку сполуки, яка характеризуєтьсуспензію протягом 30хв., фільтрують, промивася такими даними ЯМР: 1H ЯМР (CDCl3, 300МГц): ють водою і сушать у вакуумі при 50°С. Змішують δ 8,02 (d, J=9,0Гц, 2Н); 7,82-7,93 (m, 1H); 6,90-7,69 висушений продукт із приблизно 1 л води, і пере(m, 14H); 4,85-5,25 (m, 2H); 4,60-4,80 (m, 2H); 3,45 мішують суспензію протягом 30хв., фільтрують, (s, 2H); 3,00-3,20 (m, 2H); 2,60-2,75 (m, 1H); 2,10промивають водою і сушать у вакуумі при 50°С, 2,35 (m, 4H). одержуючи 45,4г (90%) 1(R)-(4Розчиняють згаданий залишок у 200мл хлорибіфенілкарбоніламіно)-2(R)-гідрокси-6-аміноіндану. стого метилену і екстрагують 200мл 1,0Μ водного ІЧ (КВr, см-1): 3584, 3364, 3277, 1632, 1543, 1326, розчину гідроксиду натрію, а потім 200мл розсолу. 1073, 743; мас-спектр високого розділення обчисОрганічний шар сушать над MgSO4, фільтрують і лено для C22H20N2O2: 344,4120; знайдено: випаровують у вакуумі, одержуючи 15г вказаної в 344,1525. заголовку сполуки. Змішують N-метил-N-(4-фторбензил)-ацетамід Змішують 5,0 г сполуки, одержаної, як описано (364,8г, 2,01моль) з ТГФ (9л). Перемішують до вище, з 200мл хлористого метилену. Додають розчинення, після чого додають п'ятисірчистий 1,00г вугілля типу DARCO, перемішують протягом фосфор (537,7г, 1,21моль). Через 45хв. нагрівають 1год. і фільтрують через шар матеріалу Hyflo. Висуміш зі зворотним холодильником протягом 3год., паровують у вакуумі, і одержують 4,0г залишку. охолоджують і перемішують протягом ночі, одерЦей залишок розчиняють в абсолютному етанолі жуючи тверду речовину. Відділяють тверду фазу (приблизно 40мл), і додають деіонізовану воду фільтруванням, і промивають осад на фільтрі ТГФ (12мл), одержуючи тверду фазу. Нагрівають су(4л), випаровують фільтрат у вакуумі, одержуючи спендовану тверду речовину при 55°С протягом залишок, розчиняють останній в хлористому мети30хв., дають охолодитися до кімнатної температу 27 76492 28 ри і перемішують. Через 24год. фільтрують, прони. 1H ЯМР (dg-DMSO, 300МГц) 13,22 (br s, 1H), мивають 10мл етанольно-водної суміші (10:3) і 7,93 (t, J=8,1Гц, 1H), 7,74-7,78 (m, 2H), 7,60-7,66 сушать у вакуумі, одержуючи 1,5г вказаної в заго(m, 2H), 7,40-7,52 (m, 3H); ІЧ (см-1, KBr); 3035, ловку сполуки з т.пл. 108-112°С. 2666, 2575, 1699, 1621, 1563, 1408, 1298, 1265, Для фахівця зрозуміло, що альтернативною 1193, 904; елементний аналіз обчислено для назвою вказаної в заголовку сполуки є 6-(1-((4C13H9FC2: С 72,22, Η 4,20; знайдено: С 72,18, Η фторбензил)метиламіно)етиліденаміно)-24,35. гідрокси-1-біфеніламідоіндан. Змішують 3-фторбіфеніл-4-карбонову кислоту Приклад 3-1 (10,46г, 0,048моль), 432мл хлористого метилену, 7 (R)-(6-(1-((4крапель диметилформаміду та 5,44мл (0,062моль, фторбензил)метиламіно)етиліденаміно)-2(R)1,3екв.) оксалілхлориду. Через 2год. випаровують гідроксііндан-1-іл)амід 3-фторбіфеніл-4-карбонової розчинник і одержують 3-фторбіфеніл-4кислоти карбонілхлорид у вигляді твердої речовини. Змішують 1-метилтіо-1-метил-N-(4фторбензил)-N-метилімоній-трифлат (20,96г, 0,58моль), 53мл піридину та 1(R)-(третбутоксикарбоніламіно)-2(R)-гідрокси-6-аміноіндан (15,33г, 0,58моль, 1екв.). Через 4,2год. випаровуЗмішують 4-бром-2-фторбензойну кислоту ють в роторному випарнику, видаляючи більшу (10г, 45,7ммоль), метанол (100мл) та концентрочастину піридину, додають етилацетат, і видалявану сірчану кислоту (5,0мл). Нагрівають зі звороють розчинник в роторному випарнику, одержуючи тним холодильником. Через 16год. охолоджують залишок. Цей залишок витримують протягом ночі до кімнатної температури і випаровують у вакуумі, при 0°С, додають етилацетат (400мл) і екстрагуодержуючи білу тверду речовину. Розчиняють цю ють 200мл 1-н. водного розчину гідроксиду натрію, речовину в етилацетаті (приблизно 40мл), екстраа потім 200мл води. Органічний шар сушать над гують двічі порціями по 80мл насиченого водного Na2SO4, фільтрують і випаровують, одержуючи розчину бікарбонату натрію і один раз 80мл розсозалишок. Після хроматографування цього залишку лу, сушать над MgSO4, фільтрують і випаровують на силікагелі з градієнтним елююванням (від 3 до у вакуумі, одержуючи 9,32г (88%) метил-4-бром-21 10% метанолу в хлористому метилені) одержують фторбензоату у вигляді білої твердої речовини. H 18,85г (76%) 1(R)-(трет-бутоксикарбоніламіно)ЯМР (d6-DMSO, 300МГц) 8,80 (t, J=8,4Гц, 1H), 7,72 2(R)-гідрокси-6-(1-метил-N-(4-фторбензил)-N'(dd, J=10,8Гц, 1,8Гц, 1H), 7,54 (ddd, J=8,4Гц, 1,8Гц, метиламідино)індану. Мас-спектр m/z=428 (M+1), 0,6Гц, 1H), 3,83 (s, 3H); ІЧ (см-1, КВr): 3010, 2995, т.пл.=123-132°С. 1723, 1603, 1484, 1438, 1406, 1294, 1277, 1095, Змішують 1(R)-(трет-бутоксикарбоніламіно)885; елементний аналіз обчислено для C8H6BrFO2: 2(R)-гідрокси-6-(1-метил-N'-(4-фторбензил)-N'С, 41,23; Η, 2,60; знайдено: С, 40,97; Η, 2,61. метиламідино)індан (18,86г, 0,044моль) та 110мл Змішують метил-4-бром-2-фторбензоат (9,3г, трифтороцтової кислоти в льодяній бані. Після 40,0ммоль), фенілборну кислоту (9,75г, завершення додавання охолоджувальну баню 80,0ммоль) та фторид цезію (32,6г, 100,1ммоль), відсувають, і перемішують суміш при кімнатній ДМФ (190мл) та деіонізовану воду (50мл). Нагрітемпературі протягом 2,5год. Концентрують суміш вають до 80°С і додають Pd(OAc)2 (303г, у роторному випарнику, і одержують залишок. Цей 4,0ммоль). Через 20хв. охолоджують реакційну залишок розчиняють в 100мл хлористого метилену суміш до кімнатної температури, фільтрують через і охолоджують в льодяній бані до приблизно 13°С, НуFlo з використанням 100мл етилацетату, екстдодають 1-н. водний розчин гідроксиду натрію рагують фільтрат 5% водним розчином хлориду (272мл), а потім 3-фторбіфеніл-4-карбонілхлорид літію (2 100мл), 1,0Μ водним розчином гідроксиду (11,26г, 0,048моль, 1,1екв.), розчинений в 120мл натрію (2 50мл) і розсолом (2 100мл). Відділяють хлористого метилену. Додають додатково 30мл 1органічну фазу, сушать над MgSO4, фільтрують і н. водного розчину гідроксиду натрію, і перемішувипаровують у вакуумі, одержуючи 8,85г (96%) ють суміш приблизно при 10°С протягом 40хв. Рометил-3-фторбіфеніл-4-карбоксилату у вигляді зподіляють реакційну суміш між водою та хлорисбілої твердої речовини. 1H ЯМР (CDCl3, 300МГц) тим метиленом. Розділяють шари, і екстрагують 8,01 (t, J=7,8Гц, 1H), 7,58-7,62 (m, 2Н), 7,41-7,51 органічний шар водою, сушать і концентрують у (m, 4Н), 7,37 (m, 1Н), 3,96 (s, 3H); ІЧ (см-1, KBr): роторному випарнику, одержуючи 20,67 г залишку. 3033, 2954, 1721, 1622, 1437, 1409, 1298, 1289, Після хроматографування цього залишку на силі1266, 1097; елементний аналіз обчислено для кагелі з градієнтним елююванням (від 3% до 10% C14H11FO2: С 73,03, Η 4,82; знайдено: С 73,06, Η метанолу в хлористому метилені) та повторного 4,86. хроматографування на силікагелі (із застосуванЗмішують метил-3-фторбіфеніл-4-карбоксилат ням приладу Ргер 2000) з градієнтним елююван(8,18г, 35,5ммоль), ТГФ (225мл) та 1,0Μ водний ням (від 3% до 10% метанолу в хлористому метирозчин гідроксиду натрію (225мл). Нагрівають при лені) одержують 11,34г (49%) вказаної в заголовку 50°С протягом 8год. Охолоджують до кімнатної сполуки. Мас-спектр: m/z=526 (М+1). температури, додають 1,0Μ водний розчин хлориДля фахівця зрозуміло, що альтернативною стоводневої кислоти (300мл) і екстрагують етиланазвою вказаної в заголовку сполуки є 6-(1-((4цетатом (2 200мл). Відділяють органічну фазу, фторбензил)метиламіно)етиліденаміно)-2сушать над MgSO4, фільтрують і випаровують у гідрокси-1-(2-фторбіфеніламідо)індан. вакуумі, одержуючи 7,12г (93%) З-фторбіфеніл-4карбонової кислоти у вигляді білої твердої речови 29 76492 Приклад 4-1 (R)-(6-(1-((44-18 фторбензил)метиламіно)етиліденаміно)-2(R)гідроксііндан-1-іл)амід 2',6'-дихлорбіфеніл-44-19 карбонової кислоти 4-20 До суміші NциклогексилкарбодіімідNметилполістирольної смоли (Novobiochem, 2,0ммоль/г) (150мг, 0,30ммоль) та 2',6'дихлорбіфеніл-4-карбонової кислоти (14мг, 0,05ммоль) додають ДМФ (1,6мл), а потім розчин N'-гідроксисукциніміду (2,3мг, 0,02ммоль) в ДМФ (0,2мл), після чого додають розчин N-3-аміно-2гідроксііндан-5-іл)-N(4-фторбензил)-Nметилацетамідину (6,6мг, 0,02ммоль) в ДМФ (0,2мл). Перемішують суміш протягом 16год., після чого додають полістирол-трисамінову смолу (Argonaut Technologies, 3,7ммоль/г) (100мг, 0,37ммоль) і перемішують ще протягом 24год. Після фільтрування суміші одержують 0,01 Μ розчин вказаної в заголовку сполуки. Мас-спектр (m/е) 577 (М+). Сполуки за Прикладами 4-2 - 4-36 одержують практично за методикою, описаною в Прикладі 4-1. 4-21 4-22 4-23 4-24 4-25 4-26 4-27 4-28 Приклад № 4-2 4-3 4-4 4-5 4-6 4-7 4-8 4-9 4-10 4-11 4-12 4-13 4-14 4-15 4-16 4-17 Назва сполуки (R)-(6-(1-((4-фторбензил)метиламіно)етиліденаміно)2(R)-гідроксііндан-1-іл)амід 2',6'-дихлорбіфеніл-4карбонової кислоти (R)-(6-(1-((4-фторбензил)метиламіно)етиліденаміно)2(R)-гідроксііндан-1-іл)амід 2-метилбіфеніл-4карбонової кислоти (R)-(6-(1-((4-фторбензил)метиламіно)етиліденаміно)2(R)-гідроксііндан-1-іл)амід 2'-хлорбіфеніл-4карбонової кислоти (R)-(6-(1-((4-фторбензил)метиламіно)етиліденаміно)2(R)-гідроксііндан-1-іл)амід 4'-трифторметил-біфеніл4-карбонової кислоти (R)-(6-(1-((4-фторбензил)метиламіно)етиліденаміно)2(R)-гідроксііндан-1-іл)амід 3-хлор-2',4'дифторбіфеніл-4-карбонової кислоти (R)-(6-(1-((4-фторбензил)метиламіно)етиліденаміно)2(R)-гідроксііндан-1-іл)амід 2'-трифторметил-біфеніл4-карбонової кислоти (R)-(6-(1-((4-фторбензил)метиламіно)етиліденаміно)2(R)-гідроксіівдан-1-іл)амід 4'-метилбіфеніл-4карбонової кислоти (R)-(6-(1-((4-фторбензил)метиламіно)етиліденаміно)2(R)-гідроксііндан-1-іл)амід 6-(2,6-дифторфеніл)піридин-3-карбонової кислоти (R)-(6-(1-((4-фторбензил)метиламіно)етиліденаміно)2(R)-гідроксііндан-1-іл)амід 6-(2-метилфеніл)піридин3-карбонової кислоти (R)-(6-(1-((4-фторбензил)метиламіно)етиліденаміно)2(R)-гідроксііндан-1-іл)амід 3',4'-дифторбіфеніл-4карбонової кислоти (R)-(6-(1-((4-фторбензил)метиламіно)етиліденаміно)2(R)-гідроксііндан-1-іл)амід 3',5'-диметилбіфеніл-4карбонової кислоти (R)-(6-(1-((4-фторбензил)метиламіно)етиліденаміно)2(R)-гідроксііндан-1-іл)амід 4-циклогексилфеніл-1карбонової кислоти (R)-(6-(1-((4-фторбензил)метиламіно)етиліденаміно)2(R)-гідроксііндан-1-іл)амід 3'-ціанбіфеніл-4карбонової кислоти (R)-(6-(1-((4-фтopбeнзил)мeтилaмiнo)eтилiдeнaмінo)2(R)-гідроксііндан-1-іл)амід 3',5'-дифторбіфеніл-4карбонової кислоти (R)-(6-(1-((4-фторбензил)метиламіно)етиліденаміно)2(R)-гідроксііндан-1-іл)амід 3'-фторбіфеніл-4карбонової кислоти (R)-(6-(1-((4-фторбензил)метиламіно)етиліденаміно)2(R)-гідроксііндан-1-іл)амід 2',4'-дифторбіфеніл-4 Масспектр (m/е) 4-29 542 (М+) 4-30 522 (М+) 4-31 542 (М+) 4-32 576 (М+) 4-33 578 (М+) 4-34 576 (М+) 4-35 522 (М+) 4-36 545 (М+) 523 (М+) 544 (М+) 30 карбонової кислоти (R)-(6-(1-((4-фторбензил)метиламіно)етиліденаміно)576 2(R)-гідроксііндан-1-іл)амід 2',3'-дихлорбіфеніл-4(М+) карбонової кислоти (R)-(6-(1-((4-фторбензил)метиламіно)етиліденаміно)542 2(R)-гідроксііндан-1-іл)амід 4'-хлорбіфеніл-4(М+) карбонової кислоти (R)-(6-(1-((4-фторбензил)метиламіно)етиліденаміно)542 2(R)-гідроксііндан-1-іл)амід 3'-хлорбіфеніл-4(М+) карбонової кислоти (R)-(6-(1-((4-фторбензил)метиламіно)етиліденаміно)500 2(R)-гідроксііндан-1-іл)амід 4-трифторметил феніл-1(М+) карбонової кислоти (R)-(6-(1-((4-фторбензил)метиламіно)етиліденаміно)446 2(R)-гідроксііндан-1-іл)амід 4-метилфеніл-1(М+) карбонової кислоти (R)-(6-(1-((4-фторбензил)метиламіно)етиліденаміно)576 2(R)-гідроксііндан-1-іл)амід 3',5'-дихлорбіфеніл-4(М+) карбонової кислоти (R)-(6-(1-((4-фторбензил)метиламіно)етиліденаміно)550 2(R)-гідроксііндан-1-іл)амід 2',4',6'-триметилбіфеніл-4(М+) карбонової кислоти (R)-(6-(1-((4-фторбензил)метиламіно)етиліденаміно)541 2(R)-гідроксііндан-1-іл)амід 6-(4-фтор-2(М+) метилфеніл)піридин-3-карбонової кислоти (R)-(6-(1-((4-фторбензил)метиламіно)етиліденаміно)545 2(R)-гідроксііндан-1-іл)амід 5-(2,4-дифторфеніл)(М+) піридин-2-карбонової кислоти (R)-(6-(1-((4-фторбензил)метиламіно)етиліденаміно)594 2(R)-гідроксііндан-1-іл)амід 2'-фтор-4'-трифторметил(М+) біфеніл-4-карбонової кислоти (R)-(6-(1-((4-фторбензил)метиламіно)етиліденаміно)597 2(R)-гідроксіівдан-1-іл)амід 4-(пірол-1-іл)феніл-1(М+) карбонової кислоти (R)-(6-(1-((4-фторбензил)метиламіно)етиліденаміно)447 2(R)-гідроксііндан-1-іл)амід 6-метилпіридин-3(М+) карбонової кислоти (R)-(6-(1-((4-фторбензил)метиламіно)етиліденаміно)457 2(R)-гідроксііндан-1-іл)амід 4-ціанфеніл-1-карбонової (М+) кислоти (R)-(6-(1-((4-фторбензил)метиламіно)етиліденаміно)562 2(R)-гідроксііндан-1-іл)амід 3,2',6'-трифторбіфеніл-4(М+) карбонової кислоти (R)-(6-(1-((4-фторбензил)метиламіно)етиліденаміно)541 2(R)-гідроксііндан-1-іл)амід 3,2',6'-трифторбіфеніл-4(М+) карбонової кислоти (R)-(6-(1-((4-фторбензил)метиламіно)етиліденаміно)522 2(R)-гідроксііндан-1-іл)амід 2'-метилбіфеніл-4(М+) карбонової кислоти (R)-(6-(1-((4-фторбензил)метиламіно)етиліденаміно)538 2(R)-гідроксііндан-1-іл)амід 2'-метоксибіфеніл-4(МН+) карбонової кислоти (R)-(6-(1-((4-фторбензил)метиламіно)етиліденаміно)544 2(R)-гідроксііндан-1-іл)амід 3,2'-дифторбіфеніл-4(МН+) карбонової кислоти (R)-(6-(1-((4-фторбензил)метиламіно)етиліденаміно)594 2(R)-гідроксііндан-1-іл)амід 6'-фтор-2'(МН+) трифторметилбіфеніл-4-карбонової кислоти Приклад 5-1 (R)-(6-(1-((4фторбензил)метиламіно)етиліденаміно)-2(R)гідроксііндан-1-іл)амід 6-ціанпіридин-3-карбонової кислоти 536 (М+) 514 (М+) 533 (М+) 544 (М+) 526 (М+) 544 (М+) Розчиняють еквімолярні кількості N'-(3-аміно2-гідроксііндан-5-іл)-N-(4-фторбензил)-N-метилацетамідину (229мг, 0,70ммоль) та 6-ціан-3карбоксипіридину (0,70ммоль, 103мг) в безводному ДМФ (4,0мл). Додають триетиламін (0,487мл, 3,50ммоль), а потім гексафторфосфат бензотриазол-1-ілокситрис-диметиламінофосфонію (296мг, 0,70ммоль). Перемішують реакційну суміш протягом 0,5год. при кімнатній температурі. Розбавляють реакційну суміш водою (100мл) і екстрагують 31 76492 32 шами СНСl3/МеОН, і одержують 276мг (35,7%) етилацетатом (3 50мл). Об'єднані органічні фази вказаної в заголовку сполуки у вигляді твердої сушать над MgSO4, фільтрують і концентрують. речовини. Мас-спектр (m/е) 543,0 (М+). Неочищений продукт реакції розчиняють в ТГФ Сполуки за Прикладами 6-2 - 6-4 одержують в (5,0мл). Додають гідроксидну смолу (смола BIOосновному за методикою, описаною в Прикладі RAD AG 1-X8, 20-50меш (0,3-0,8мм), промита во6-1. дою, 1Μ NaOH, MeOH, діетиловим ефіром і висушена у вакуумі) до досягнення основної реакції ПриМасрозчину і перемішують при температурі оточуючоклад Назва сполуки спектр го середовища протягом 24год. Фільтрують суміш, № (m/е) промивають додатковою кількістю ТГФ, випарову(R)-(6-(1-((4фторбензил)метиламіно)етиліденаміно)-2(R)545,1 ють із нанесенням на силікагель і очищають 6-2 гідроксііндан-1-іл)амід 6-(2,4-дифторфеніл)-піридин- (М+) флеш-хроматографією на колонці з елююванням 3-карбонової кислоти сумішшю етилацетату з гексаном, одержуючи (R)-(6-(1-((4253мг (79%) вказаної в заголовку сполуки у вигляді фторбензил)метиламіно)етиліденаміно)-2(R)558,0 6-3 + гідроксііндан-1-іл)амід 4-йодфеніл-1 -карбонової (М+) білої твердої речовини. Мас-спектр (m/е) 458 (М ). кислоти Сполуки за Прикладами 5-2 - 5-8 одержують (R)-(6-(1-((4практично за методикою, описаною в Прикладі 5-1. фторбензил)метиламіно)етиліденаміно)-2(R)515,4 6-4 Приклад № 5-2 5-3 5-4 5-5 5-6 5-7 5-8 Назва сполуки (R)-(6-(1-((4фторбензил)метиламіно)етиліденаміно)-2(R)гідроксііндан-1-іл)амід 3,5-дифторбіфеніл-4карбонової кислоти (R)-(6-(1-((4фторбензил)метиламіно)етиліденаміно)-2(R)гідроксііндан-1-іл)амід 4-(тієн-3-іл)феніл-1карбонової кислоти (R)-(6-(1-((4фторбензил)метиламіно)етиліденаміно)-2(R)гідроксііндан-1-іл)амід 6-трифторметил-піридин-3карбонової кислоти (R)-(6-(1-((4фторбензил)метиламіно)етиліденаміно)-2(R)гідроксііндан-1-іл)амід 3-фтор-2'-трифторметилбіфеніл-4-карбонової кислоти (R)-(6-(1-((4фторбензил)метиламіно)етиліденаміно)-2(R)гідроксііндан-1-іл)амід 2-фтор-4-трифторметилфеніл-1-карбонової кислоти (R)-(6-(1-((4фторбензил)метиламіно)етиліденаміно)-2(R)гідроксііндан-1-іл)амід 2'-хлор-3-фторбіфеніл-4карбонової кислоти (R)-(6-(1-((4фторбензил)метиламіно)етиліденаміно)-2(R)гідроксііндан-1-іл)амід 5-фенілпіразин-2карбонової кислоти Масспектр (m/е) 544,2 (М+) 514,1 (М+) 501,1 (М+) 594,1 (М+) 518,4 (М+) 560,2 (М+) 510,3 (М+) Приклад 6-1 (R)-(6-(1-((4фторбензил)метиламіно)етиліденаміно)-2(R)гідроксііндан-1-іл)амід 6-(2-хлорфеніл)піридин-3карбонової кислоти Розчиняють N'-(3(R)-аміно-2(R)-гідроксііндан-5іл)-N-(4-фторбензил)-N-метил-ацетамідин (42мг, 0,13ммоль) та 6-(2-хлорфеніл)піридин-3-карбонову кислоту (103мг, 0,70ммоль) в безводному ДМФ (2,5мл). Додають триетиламін (0,178мл), а потім гексафторфосфат бензотриазол-1-ілокситрисдиметиламінофосфонію (54мг, 0,13ммоль). Перемішують реакційну суміш при кімнатній температурі до завершення реакції. Розбавляють реакційну суміш водою (100мл) і екстрагують етилацетатом. Об'єднані органічні фази сушать над MgSO4, фільтрують і концентрують. Очищають залишок флешхроматографією на колонці з елююванням сумі гідроксііндан-1-іл)амід карбонової кислоти 6-(тієн-3-іл)піридин-3- (МН+) Приклад 7-1 (R)-(6-(1-((4фторбензил)метиламіно)етилщенаміно)-2(R)гідроксііндан-1-іл)амід 4-(піридин-3-іл)феніл-1карбонової кислоти Змішують (R)-(6-(1-((4фторбензил)метиламіно)етиліденаміно)-2(R)гідроксііндан-1-іл)амід 4-йодфеніл-1-карбонової кислоти (0,131г, 0,235ммоль), 2(трибутилстаніл)піридин (0,129г, 0,352ммоль) та тетракіс-(трифенілфосфін)-паладій(О) (0,406г, 0,352ммоль) в діоксані при 80°С. Нагрівають при перемішуванні до завершення реакції. Видаляють розчинник випаровуванням. Розбавляють залишок етилацетатом і перемішують з рівним об'ємом насиченого розчину фториду калію протягом 3год. Фільтрують розчин через шар целіту. Відділяють органічний шар від водного шару і сушать над сульфатом магнію. Видаляють органічний розчинник випаровуванням і очищають залишок флешхроматографією з елююванням дихлорметаном та метанолом, одержуючи 0,035г (30%) вказаної в заголовку сполуки у вигляді твердої речовини. Мас-спектр (m/е) 509,2 (М+). Приклад 8-1 (R)-(6-(1-((4фторбензил)метиламіно)етиліденаміно')-2(R)гідроксііндан-1-іл)амід 2',4',6'-трифторбіфеніл-4карбонової кислоти Змішують 2',4',6'-трифторбіфеніл-4-карбонову кислоту (66мг, 0,26ммоль), (3диметиламінопропіл)-3-етилкарбодіімідгідрохлорид (EDC) (53мг, 0,28ммоль) та Nгідроксисукцинімід (33мг, 0,28ммоль) в дихлорметані і перемішують до завершення реакції. Промивають розчин 1-н. хлористоводневою кислотою. Органічний шар сушать над сульфатом магнію і концентрують. Залишок змішують з N'-(3(R)-аміно 33 76492 34 (R)-(6-(1-((42(R)-гідроксііндан-5-іл)-N-(4-фторбензил)-N-метилфторбензил)метиламіно)етиліденаміно)-2(R)562 ацетамідином (42мг, 0,13ммоль) в дихлорметані і 9-6 гідроксііндан-1-іл)амід 3,2',4'-трифторбіфеніл-4- (М+1) перемішують до завершення реакції. Видаляють карбонової кислоти розчинник випаровуванням, і очищають залишок флеш-хроматографією з елююванням дихлормеПриклад 10-1 таном та метанолом, одержуючи 37мг вказаної в (R)-(6-(1-((фуран-2заголовку сполуки. Мас-спектр (m/е) 562,0 (М+). ілметил)метиламіно)етиліденаміно)-2(R)Приклад 9-1 гідроксііндан-1-іл)амід 4-бромфеніл-1-карбонової (R)-(6-(1-((4кислоти фторбензил)метиламіно)етиліденаміно)-2(R)гідроксііндан-1-іл)амід 3,4'-дифторбіфеніл-4карбонової кислоти Перемішують суміш 3,4'-дифторбіфеніл-4карбонової кислоти (160мг, 0,684ммоль), Nгідроксисукциніміду (79мг, 0,684ммоль) та дициклогексил-карбодііміду (DCC) (141мг, 0,684ммоль) в 15мл хлористого метилену протягом 2год. при кімнатній температурі. Змішують трет-бутиловий складний ефір (6-(1-((4фторбензил)метиламіно)етиліденаміно)-2(R)гідроксііндан-1-іл)-карбамінової кислоти (256мг, 0,62ммоль) з TFA (2мл) при 0°С і перемішують протягом 2год. Випаровують TFA під зниженим тиском. Залишок розчиняють в хлористому метилені і випаровують досуха. Цю операцію повторюють тричі. Додають до залишку 5мл хлористого метилену та 1мл триетиламіну. Одержаний розчин додають до вищезгаданої суміші і перемішують при кімнатній температурі протягом 12год. Виливають суміш у хлористий метилен, промивають водою, сушать Na2SO4 і концентрують. Залишок очищають хроматографією на колонці (силікагель, 3% МеОН в СН2СІ2), і одержують 199мг вказаної в заголовку сполуки у вигляді білої твердої речовини (вихід 55%). 1 Н ЯМР (CDCl3) δ 8,21 (1Н, t, J=8,4Гц), 7,58 (2H, dd, J=8,8Гц та 4,8Гц), 7,32 (1Н, d, J=13,2Гц), 7,26-7,23 (2H, m), 7,19-7,12 (3H, m), 7,04 (2H, t, J=8,8Гц), 6,68 (1H, s), 6,66 (1H, s), 5,32 (1H, t, J=5,2Гц), 4,82-4,72 (1H, m), 4,64 (2H, s), 4,56 (1H, q, J=6,4Гц), 3,32 (1H, dd, J=15,6Гц та 8,0Гц), 3,00 (3Н, s), 2,96 (1Н, dd, J=15,2Гц та 8,4Гц), 1,96 (3Н, s). Мас-спектр 544 (МН+). Сполуки за Прикладами 9-2 - 9-6 одержують практично за методикою, описаною в Прикладі 9-1. Приклад № 9-2 9-3 9-4 9-5 Назва сполуки Масспектр (т/е) (R)-(6-(1-((4фторбензил)метиламіно)етиліденаміно)-2(R)526 гідроксііндан-1-іл)амід 4'-фторбіфеніл-4-карбонової (МН+) кислоти (R)-(6-(1-((4фторбензил)метиламіно)етиліденаміно)-2(R)556 гідроксііндан-1-іл)амід 4'-фтор-2'-метокси-біфеніл-4- (МН+) карбонової кислоти (R)-(6-(1-((4фторбензил)метиламіно)етиліденаміно)-2(R)544 гідроксііндан-1-іл)амід 2',6'-дифторбіфеніл-4- (МН+) карбонової кислоти (R)-(6-(1-((4-фторбензил)метиламіно)етиліденаміно) 526,1 -2(R)-гідроксііндан-1-іл)амід 2'-фторбіфеніл-4(МН+) карбонової кислоти До суміші тіоацетаміду (10,04г, 133,64ммоль) та K2СО3 (45,80г, 331,38ммоль) в 100мл ТГФ при 0°С додають крапля за краплею фталоїлхлорид (28,49г, 140,32ммоль). Через 2год. підвищують температуру реакційної суміші до 25°С і перемішують її ще протягом 2год., після чого знову охолоджують до 0°С. Гасять реакцію шляхом додавання крапля за краплею 125мл льодяної води. Екстрагують реакційну суміш двічі EtOAc. Органічний шар сушать MgSO4, і видаляють розчинник у вакуумі, одержуючи 3,7г N-тіоацетил-ізоіндол-1,3діону у вигляді неочищеної твердої речовини червонуватого кольору. Розчиняють N-метилфурфуриламін (117,2мг, 1,05ммоль) в 20мл Et2O при 25°С. Додають до розчину 1Ч-тіоацетил-ізоіндол-1,3-діон (294,4мг, 1,43ммоль) і перемішують протягом 24год. Додають до реакційної суміші MeOTf (181,7мг, 1,11ммоль) і перемішують ще протягом 23год. Відділяють Et2O від масла декантацією і розтирають масло з Et20; ці операції повторюють тричі. Видаляють надлишок Et2O з маслянистого залишку у вакуумі і одержують 320,4мг неочищеного тіоімідату у вигляді масла. Цей неочищений продукт (161,1мг, 0,483ммоль) розчиняють у 10мл піридину і додають N-(6-аміно-2-гідроксііндан-1-іл)-4бромбензамід (107,5мг, 0,310ммоль). Перемішують реакційну масу при 25°С протягом 22год. Видаляють розчинник у вакуумі і розподіляють залишок між СН2СІ2 і насиченим водним розчином NaHCO3. Органічний шар сушать MgSO4. Фільтрують і видаляють розчинник у вакуумі, одержуючи 146,2мг неочищеного продукту. Після очищення хроматографією в системі Biotage (елюент 1% МеОН в EtOAc) одержують 63,6мг вказаної в заголовку сполуки у вигляді не зовсім білої твердої речовини (43%). Мас-спектр (m/е) 483 (М+1). Приклад 11-1 (R)-(6-(1-((4-фторбензил)аміно)етиліденаміно)2(R)-гідроксііндан-1-іл)амід 4-бромфеніл-1карбонової кислоти Стадія а). Змішують трет-бутиловий складний ефір (6-аміно-2-гідроксііндан-1-іл)-карбамінової кислоти (3,7г, 14,0ммоль) з 10мл TFA при 0°С. Перемішують суміш протягом 1год. і випаровують досуха. До залишку додають 6,5мл триетиламіну та 30мл хлористого метилену. Цю суміш повільно додають до розчину бензотриазол-1-ілового скла 35 76492 36 дного ефіру 4-бромбензойної кислоти в 15мл хложеним тиском. Очищають залишок хроматографіристого метилену при 0°С. Одержану суміш переєю на колонці (силікагель, елюенти гексан/ацетон мішують протягом 12год. при кімнатній температу7:3, потім 1:1), і одержують 40мг вказаної в загорі і фільтрують, одержуючи 3,4г (вихід 70%) N-(6ловку сполуки (вихід 14%) у вигляді білої твердої аміно-4-гідроксііндан-1-іл)-4-бромбензаміду у виречовини. Мас-спектр 496 (МН+). гляді білої твердої речовини. Мас-спектр 348 Сполуки за Прикладами 11-2 - 11-17 одержу(МН+). ють практично за методикою, описаною в Прикладі Стадія b). До суміші триетиламіну (16,0г, 11-1. 158ммоль) та 4-фторбензиламіну (9,90г, Мас78,8ммоль) в 200мл етилацетату при 0°С додають ПриНазва сполуки спектр ацетилхлорид (9,28г, 118ммоль) і перемішують клад № (m/е) протягом 12год. Додають до суміші 100мл води. (R)-(6-(1-((3-фторбензил)аміно)етиліденаміно)496 Водний шар екстрагують етилацетатом (3 100мл). 11-2 2(R)-гідроксііндан-1-іл)амід 4-бромфеніл-1(МН+) карбонової кислоти Об'єднують органічні шари і промивають розсо(R)-(6-(1-((1,3-бензодіоксол-5-ілметил)аміно)лом, потім сушать над безводним Na2SO4. Вида522 11-3 етиліденаміно)-2(R)-гідроксііндан-1-іл)амід 4(МН+) ляють розчинник під зниженим тиском, і одержубромфеніл-1-карбонової кислоти ють N-(4-фторбензил)ацетамід (13,5г) з виходом (R)-(6-(1-((4метоксибензил)аміно)етиліденаміно)-2(R)508 100% у вигляді жовтого масла. До N-(411-4 гідроксііндан-1-іл)амід 4-бромфеніл-1- (МН+) фторбензил)ацетаміду (13,5г, 80,8ммоль) в 200мл карбонової кислоти тетрагідрофурану додають NaH (6,5г, 162ммоль) (R)-(6-(1-((3метоксибензил)аміно)етиліденаміно)-2(R)508 при 0°С і перемішують протягом 4год. Потім дода11-5 гідроксііндан-1-іл)амід 4-бромфеніл-1- (МН+) ють до вищеописаної суміші метил йодид (22,9г, карбонової кислоти 161,6ммоль), і перемішують суміш протягом 12год. (R)-(6-(1-((2Виливають суміш у 200мл води. Водний шар екстметоксибензил)аміно)етиліденаміно)-2(R)508 11-6 гідроксііндан-1-іл)амід 4-бромфеніл-1- (МН+) рагують хлористим метиленом (3 200мл). Органікарбонової кислоти чні шари об'єднують і промивають розсолом, потім (R)-(6-(1-((4сушать над безводним Na2SO4. Видаляють розфторбензил)метиламіно)етиліденаміно)-2(R)510 11-7 гідроксііндан-1-іл)амід 4-бромфеніл-1- (МН+) чинник під зниженим тиском. Очищають залишок карбонової кислоти хроматографією на колонці (силікагель, елюенти (R)-(6-(1-((2-(45% ацетону в гексані, потім 50% ацетону в гексафторфеніл)етил)аміно)етиліденаміно)-2(R)510 11-8 ні), і одержують N-(4-фторбензил)-Nгідроксііндан-1-іл)амід 4-бромфеніл-1- (МН+) карбонової кислоти метилацетамід (9,1г) з виходом 64% у вигляді жо(R)-(6-(1-((2-(2втого масла. Додають реактив Лавессона (20,3г, фторфеніл)етил)аміно)етиліденаміно)-2(R)510 11-9 50,3ммоль) до N-(4-фторбензил)-Nгідроксііндан-1-іл)амід 4-бромфеніл-1- (МН+) метилацетаміду (9,1г, 50,3ммоль) в 200мл толуолу карбонової кислоти (R)-(6-(1-((2-(4-метоксифеніл)етил)аміно)і нагрівають при 100°С протягом 3год. Видаляють 522 11-10 етиліденаміно)-2(R)-гідроксііндан-1-іл)амід 4розчинник під зниженим тиском. Очищають зали(МН+) бромфеніл-1-карбонової кислоти шок хроматографією на колонці (силікагель, елюе(R)-(6-(1-((2-(3нти 2% хлористого метилену в гексані, потім 100% фторфеніл)етил)аміно)етиліденаміно)-2(R)510 11-11 гідроксііндан-1-іл)амід 4-бромфеніл-1- (МН+) хлористий метилен), і одержують N-(4карбонової кислоти фторбензил)-N-метилтіоацетамід (5,6г, 56,5%) у (R)-(6-(1-((2-(2-метоксифеніл)етил)аміно)522 вигляді твердої речовини жовтого кольору. Мас11-12 етиліденаміно)-2(R)-гідроксііндан-1-іл)амід 4+ (МН+) бромфеніл-1-карбонової кислоти спектр 198 (МН ). (R)-(6-(1-((2-(3-метоксифеніл)етил)аміно)Стадія с). Додають реактив Лавессона (1,8г, 522 11-13 етиліденаміно)-2(R)-гідроксііндан-1-іл)амід 4(МН+) 3,6ммоль) до N-(4-фторбензил)ацетаміду (0,9г, бромфеніл-1-карбонової кислоти 5,4ммоль) в 50мл толуолу і нагрівають при 80°С (R)-(6-(1-((2-(2,3-диметоксифеніл)етил)аміно)552 11-14 етиліденаміно)-2(R)-гідроксііндан-1-іл)амід 4протягом 12год. Видаляють розчинник під зниже(МН+) бромфеніл-1-карбонової кислоти ним тиском. Очищають залишок хроматографією (R)-(6-(1-((2-(1,3-бензодіоксол-5-іл)етил)аміно)536 на колонці (силікагель, елюент ацетон:гексан, 11-15 етиліденаміно)-2(R)-гідроксііндан-1-іл)амід 4(МН+) 20:80), і одержують суміш продуктів. Промивають бромфеніл-1-карбонової кислоти (R)-(6-(1-((2-(4діетиловим ефіром і видаляють нерозчинні тверді фторфеніл)етил)аміно)етиліденаміно)-2(R) - 524 домішки фільтруванням. Видаляють розчинник під 11-16 гідроксііндан-1-іл)амід 4-бромфеніл-1- (МН+) зниженим тиском, і одержують N-(4карбонової кислоти фторбензил)тіоацетамід (0,7г, 71%) у вигляді тве(R)-(6-(1-((2-(2-метоксифеніл)етил)аміно)536 11-17 етиліденаміно)-2(R)-гідроксііндан-1-іл)амід 4рдої речовини жовтого кольору. Мас-спектр 184 (МН+) + бромфеніл-1-карбонової кислоти (МН ). Стадія d). До розчину N-(3Приклад 12-1 фторбензил)тіоацетаміду (0,106г, 0,580ммоль) в (R)-(6-(1-((410мл СН2СІ2 при кімнатній температурі додають фторбензил)метиламіно)етиліденаміно)-2(R)метил-трифторметансульфонат (0,190г, гідроксііндан-1-іл)амід біфеніл-4-карбонової кис1,16ммоль). Перемішують суміш протягом 30хв., і лоти видаляють розчинник під зниженим тиском. РозЗмішують трет-бутиловий складний ефір (6чиняють залишок у 5мл піридину. Потім додають аміно-2-гідроксііндан-1-іл)-карбамінової кислоти до розчину трифтороцтовокислу сіль N-(6-аміно-2(1,5г, 5,68ммоль) з 5мл TFA при 0°С. Перемішують гідроксііндан-1-іл)-4-бромбензаміду. Перемішують суміш протягом 1год. і випаровують досуха. До суміш протягом 3год. Видаляють піридин під зни 37 76492 38 залишку додають 3,0мл триетиламіну та 30мл Перемішують суміш 1-аміно-7-нітро-1,2,3,4хлористого метилену. До цієї суміші додають розтетрагідронафталін-2-олу (500мг, 2,40ммоль) та 1чин 2,5-діоксопіролідин-1-ілового складного ефіру н. NaOH (4,8мл, 4,8ммоль) у суміші 50мл толуолу біфеніл-4-карбонової кислоти (1,76г, 5,96ммоль) в та 50мл води протягом 30хв. Повільно додають 15мл хлористого метилену. Одержану суміш пебіфеніл-4-карбонілхлорид (570мг, 2,64ммоль) і ремішують протягом 12год. Випаровують розчинперемішують протягом 4год. при кімнатній темпеник, і очищають залишок хроматографією на колоратурі. Видаляють тверду фазу фільтруванням і нці (силікагель, елюент МеОН:СН2Сl2, 9:1), промивають толуолом. Випаровують розчинник під одержуючи 1,88г (вихід 96%) (6-аміно-2зниженим тиском. Одержують (2-гідрокси-7-нітрогідроксііндан-1-іл)аміду біфеніл-4-карбонової кис1,2,3,4-тетрагідронафталін-1-іл)амід біфеніл-4лоти. Мас-спектр 345 (МН+). карбонової кислоти з виходом 54% у вигляді білої До розчину N-(4-фторбензил)тіоацетаміду твердої речовини. 1Н NMR (DMSO-d6) δ 8,87 (1Н, d, (0,2г, 1,0ммоль) в 5мл СН2СІ2 при кімнатній темпеJ=8,4Гц), 8,03 (2H, d, J=8,4Гц), 7,99 (2H, d, ратурі додають метил-трифторметансульфонат J=7,6Гц), 7,79 (2H, d, J=8,4Гц), 7,74 (2H, t, J=8,4Гц), (0,290г, 1,76ммоль). Перемішують суміш протягом 7,50 (2H, t, J=7,2Гц), 7,43 (2H, t, J=6,8Гц), 5,22 (1H, 30хв., і видаляють розчинник під зниженим тиском. d, J=4,4Гц), 5,11 (1H, t, J=7,6Гц), 3,95-4,01 (1H, m), Розчиняють залишок у 5мл піридину. Потім дода2,87-3,07 (2H, m), 2,08-2,15 (1H, m), 1,81-1,94 (1H, ють до розчину (6-аміно-2-гідроксііндан-1-іл)амід m); мас-спектр 389 (MH+). Вищезгадану сполуку біфеніл-4-карбонової кислоти. Перемішують суміш (0,25г, 0,64ммоль) відновлюють в 10мл ДМФ у протягом 12год. Видаляють піридин під зниженим присутності 48мг 10% Pd/C при кімнатній температиском. Очищають залишок хроматографією на турі під тиском 60 фунтів на кв. дюйм (414кПа) колонці (силікагель, елюенти гексан/ацетон 7:3, протягом ночі, і одержують (7-аміно-2-гідроксипотім 1:1), і одержують 78мг вказаної в заголовку 1,2,3,4-тетрагідронафталін-1-іл)амід біфеніл-4сполуки (вихід 35%) у вигляді білої твердої речокарбонової кислоти з виходом 96% у вигляді масвини. 1H ЯМР (DMSO-d6) δ 8,78 (1H, d, J=8,8Гц), ла жовтого кольору. Мас-спектр 359 (МН+). 8,04 (2H, d, J=8,8Гц), 7,79 (2H, d, J=8,4Гц), 7,74 До розчину N-4-фторбензил-N(2H, dd, J=7,4, 1,6Гц), 7,50 (2H, t, J=8,0Гц), 7,41 метилтіоацетаміду (0,145г, 0,736ммоль) в 10мл (1H, t, J=7,2Гц), 7,28 (2H, dd, J=8,8, 6,6Гц), 7,14 СН2Сl2 при кімнатній температурі додають метил(2H, t, J=8,8Гц), 7,04 (1H, t, J=7,6Гц), 6,78 (1H, d, трифторметансульфонат (0,150г, 0,915ммоль). J=7,2Гц), 6,37 (1H, s), 5,33 (1H, d, J=5,6Гц), 5,27 Перемішують суміш протягом 30хв., і видаляють (1H, t, J=7,6Гц), 4,59 (2H, s), 4,45 (1H, q, J=6,0Гц), розчинник під зниженим тиском. Потім додають (73,10 (1H, dd, J=14,8Гц, 7,2Гц), 2,90 (3H, s), 2,68 аміно-2-гідрокси-1,2,3,4-тетрагідронафталін-1(1H, dd, J=14,8Гц, 7,2Гц), 1,88 (3H, s); мас-спектр іл)амід біфеніл-4-карбонової кислоти (0,22г, 508 (MH+). 0,61ммоль), а потім 5мл піридину. Перемішують Сполуки за Прикладами 12-2 - 12-7 одержують суміш протягом 12год. Після випаровування пірив основному за методикою, описаною в Прикладі дину очищають залишок хроматографією на коло12-1. нці (силікагель, елюент 5% МеОН в СН2Сl2), одержуючи 10мг вказаної в заголовку сполуки (вихід ПриМас2,6%) у вигляді твердої речовини світло-жовтого клад Назва сполуки спектр кольору. 1Н ЯМР (CDCl3) δ 7,89 (2Н, d, J=8,0Гц), № (m/е) 8,66 (2Н, d, J=8,4Гц), 7,61 (2H, d, J=7,2Гц), 7,47 (R)-(6-(1-((3-метоксибензил)метиламіно)520 (2H, t, J=7,6Гц), 7,39 (1H, t, J=7,6Гц), 7,21 (1H, dd, 12-2 етиліденаміно)-2(R)-гідроксііндан-1-іл)амід біфе+ (МН ) ніл-4-карбонової кислоти J=6,0, 8,8Гц), 6,98-7,05 (3H, m), 6,72 (1H, s), 6,62 (R)-(6-(1-((3,4-дифторбензил)метиламіно)(1H, dd, J=2,0Гц, 8,4Гц), 6,56 (Ш, d, J=7,2Гц), 5,22 526 12-3 етиліденаміно)-2(R)-гідроксііндан-1-іл)амід біфе(МН+) (1H, t, J=7,6Гц), 4,60 (2H, s), 3,98-4,04 (2H, m), 3,41 ніл-4-карбонової кислоти (1H, t, J=6,0Гц), 2,96 (3H, s), 2,85 (2H, t, J=4,8Гц), (R)-(6-(1-((2-(4фторфеніл)етил)аміно)етиліденаміно)-2(R)508 2,15-2,21 (2H, m), 1,87-1,95 (1H, m), 1,92 (3H, s), 12-4 + гідроксііндан-1-іл)амід біфеніл-4-карбонової кисло- (МН ) 1,60-1,64 (1H, m); мас-спектр 522 (MH+). ти Приклад 14-1 (R)-(6-(1-((2-(2-метоксифеніл)етил)аміно)520 12-5 етиліденаміно)-2(R)-гідроксііндан-1-іл)амід біфе(R)-(6-(1-((3,4(МН+) ніл-4-карбонової кислоти дифторбензил)метиламіно)етиліденаміно)-2(R)(R)-(6-(1-((2-(2гідроксііндан-1-іл)амід 3-фторбіфеніл-4-карбонової фторфеніл)етил)аміно)етиліденаміно)-2(R)508 12-6 кислоти гідроксііндан-1-іл)амід біфеніл-4-карбонової кисло- (МН+) ти (R)-(6-(1-((2-(4-фторфеніл)етил)метиламіно)522 12-7 етиліденаміно)-2(R)-гідроксііндан-1-іл)амід біфе(МН+) ніл-4-карбонової кислоти Приклад 13-1 (R)-(7-(1-((4фторбензил)метиламіно)етиліденаміно)-2(R)гідрокси-1,2,3,4-тетрагідронафталін-1-іл)амід феніл-4-карбонової кислоти бі Одержують N-(3,4-дифторбензил)-Nметилтіоацетамід за методикою, описаною для стадії b) Прикладу 11-1, використовуючи 3,4дифторбензиламін; цільову сполуку одержують з виходом 66% у вигляді твердої речовини жовтого кольору. Мас-спектр 216 (МН+). До розчину N-(3,4-дифторбензил)-Nметилтіоацетаміду (0,145г, 0,736ммоль) в 10мл 39 76492 40 СН2СІ2 при кімнатній температурі додають метилd, J=8,4Гц), 5,25 (1H, q, J=8,8Гц), 4,78 (1H, br d, трифторметансульфонат (0,750г, 3,49ммоль). ПеJ=6,4Гц), 3,08-2,00 (1H, m), 2,96-2,78 (1H, m), 2,72ремішують суміш протягом 30хв., і видаляють роз2,62 (1H, m), 1,93-1,83 (1H, m), 1,51 (9H, s). чинник під зниженим тиском. Потім додають третДо суміші трет-бутилового складного ефіру (6бутиловий складний ефір (6-аміно-2-гідроксіінданнітроіндан-1-іл)карбамінової кислоти (1,17г, 1-іл)карбамінової кислоти (0,78г, 2,97ммоль), а 4,2ммоль) та CuCl (1,25г, 12,6ммоль) в 50мл метапотім 5мл піридину. Перемішують суміш протягом нолу повільно додають при 0°С протягом 15хв. 12год. Після випаровування піридину очищають КВН4 (1,59г, 29,4ммоль). залишок хроматографією на колонці (силікагель, Перемішують суміш протягом 1год., після чого елюент 3% МеОН в СН2СІ2), одержуючи 0,98г пропускають через шар флорисилу (Florisil). Випатрет-бутилового складного ефіру (6-(1-((3,4ровують ТГФ, і розчиняють твердий залишок в дифторбензил)метиламіно)-етиліденаміно)-2EtOAc. Промивають суміш водою, сушать і концегідроксііндан-1-іл)карбамінової кислоти у вигляді нтрують, одержуючи 0,76г (73%) трет-бутилового білої твердої речовини. Мас-спектр 446 (МН+). складного ефіру (6-аміноіндан-1-іл)карбамінової Додають до трет-бутилового складного ефіру кислоти. 1Н ЯМР (CDCl3) δ 6,99 (1H, d, J=8,0Гц), (R)(6-(1-((3,4-дифторбензил)6,65 (1H, s), 6,56 (1H, dd, J=8,0Гц та 2,0Гц), 5,09 метиламіно)етиліденаміно)-2(R)-гідроксііндан-1(1H, q, J=8,0Гц), 4,70 (1H, br d, J=7,2Гц), 3,60 (2H, іл)карбамінової кислоти (180мг, 4,04ммоль) 5мл s), 2,86-2,79 (1H, m), 2,75-2,67 (1H, m), 2,58-2,47 трифтороцтової кислоти і перемішують протягом (1H, m), 1,78-1,69 (1H, m), 1,48 (3H, s), 2,86-2,79 30хв. Видаляють розчинник під зниженим тиском. (1H, m), 2,75-2,67 (1H, m), 2,58-2,47 (1H, m), 1,78Залишок розчиняють в 15мл СН2Сl2. Потім дода1,69 (1H, m), 1,48 (3H, s). ють до розчину 2,5-діоксопіролідин-1-іловий склаДо розчину N-4-фторбензил-Nдний ефір 3-фторбіфеніл-4-карбонової кислоти метилтіоацетаміду (0,662г, 3,4ммоль) в 10мл діе(150мг, 4,79ммоль) та триетиламін (0,6мл, тилового ефіру при кімнатній температурі додають 4,0ммоль) і перемішують протягом 12год. ВиливаMel (0,623г, 4,4ммоль). Перемішують суміш протяють суміш у хлористий метилен, промивають вогом 3год., і видаляють ефір у вакуумі. Додають дою, сушать Na2SO4, після чого концентрують. трет-бутиловий складний ефір (6-аміноіндан-1Очищають залишок хроматографією на колонці іл)карбамінової кислоти (0,7г, 2,28ммоль), а потім (силікагель, елюент 3% МеОН в СН2Сl2), одержую5мл піридину. Перемішують суміш протягом 12год. чи 35мг вказаної в заголовку сполуки (вихід 16%) у Випаровують піридин, і очищають залишок хромавигляді білої твердої речовини 1H ЯМР (CD3OD) δ тографією на колонці (силікагель, елюент 3% Ме7,88 (2Н, t, J=8,0Гц), 7,7 (2Н, d, J=8,4Гц), 7,60 (2Н, ОН в СН2СІ2), одержуючи 1,26г трет-бутилового dd, J=8,0, 1,2Гц), 7,47-7,55 (3Н, m), 7,43-7,47 (1H, складного ефіру (6-(1-((4m), 7,21-7,32 (2Н, m), 7,18 (1Н, d, J=8,0Гц), 7,11фторбензил)метиламіно)етиліденаміно)-індан-17,14 (1H, m), 6,71 (2H, dd, J=10,0Гц, 1,2Гц), 5,47 іл)карбамінової кислоти у вигляді твердої речови(1H, d, J=6,8Гц), 4,69 (2H, s), 4,54 (1H, q, J=7,2Гц), ни світло-жовтого кольору, мас-спектр 412 (МН+); 1 4,54 (1H, q, J=6,4Гц), 3,29 (1H, q, J=7,2Гц), 3,07 Н ЯМР (CD3OD) δ 7,35-7,29 (2Н, m), 7,18-7,10 (3Н, (3Н, s), 2,88 (1H, q, J=7,8Гц), 1,99 (3Н, s); масm), 6,70 (1Н, s), 6,65 (1Н, d, J=7,6Гц), 5,06 (1H, t, спектр 544 (MH+). J=6,8Гц), 4,69 (2H, s), 3,05 (3H, s), 2,97-2,91 (1H, Приклад 15-1 m), 2,84-2,77 (1H, m), 2,55-2,48 (1H, m), 1,97 (3H, (R)-(6-(1-((4s), 1,52 (9H, s). фторбензил)метиламіно)етиліденаміно)індан-1Перемішують суміш 2'-трифторметилбіфеніліл)амід 2'-трифторметилбіфеніл-4-карбонової кис4-карбонової кислоти (100мг, 0,376ммоль), Nлоти гідроксисукциніміду (43мг, 0,376ммоль) та DCC (77мг, 0,376ммоль) в 15мл хлористого метилену при кімнатній температурі протягом 2год. Змішують трет-бутиловий складний ефір (6-(1-((4фторбензил)-метиламіно)етиліденаміно)індан-1іл)карбамінової кислоти Змішують 1-аміноіндан (1,0г, 8,1ммоль) з (129мг, 0,313ммоль) з TFA (2мл) при 0°С і пе6,6мл димлячої HNO3 при -10°С. Перемішують ремішують протягом 2год. Випаровують TFA під одержану суміш протягом 30хв., виливають на лід і зниженим тиском. Розчиняють залишок в хлориспотім перемішують протягом 30хв. Відділяють тветому метилені і випаровують досуха; ці операції рду речовину, промивають її водою і сушать, одеповторюють тричі. Додають 5мл хлористого метиржуючи 0,614г (42%) продукту. Цей продукт змілену та 1мл триетиламіну. Одержаний розчин дошують з ди-трет-бутилдикарбонатом (0,929г, дають до вищезгаданої суміші і перемішують про4,26ммоль) в ТГФ. Змішують одержану суміш із тягом 12год. при кімнатній температурі. Виливають насиченим водним розчином K2СО3 для встановсуміш у хлористий метилен, промивають водою, лення рН11. Перемішують протягом 8год., вилисушать Na2SC>4 і концентрують. Очищають завають в СН2Сl2, промивають водою, сушать і конлишок хроматографією на колонці (силікагель, центрують. Залишок розчиняють в суміші елюент 3% МеОН в СН2Сl2), і одержують 82мг вкадіетилового ефіру з гексаном (1:1) і витримують заної в заголовку сполуки (вихід 47%) у вигляді протягом ночі при -10°С. Відділяють і сушать твебілої твердої речовини. рдий продукт, одержуючи 0,57г (59%) третMS 560 (МН+); 1Н ЯМР (CDCl3) δ 7,83 (2Н, d, бутилового складного ефіру (6-нітроіндан-1J=8,0Гц), 7,75 (1Н, d, J=7,6Гц), 7,56 (1H, t, J=7,2Гц), іл)карбамінової кислоти. 1Н ЯМР (CDCI3) δ 8,16 7,49 (1H, t, J=8,0Гц), 7,40 (2H, d, J=8,0Гц), 7,31 (1H, (1Н, br s), 8,11 (1H, dd, J=8,4Гц та 2,0Гц), 7,34 (1H, 41 76492 42 d, J=8,0Гц), 7,26-7,21 (3H, m), 7,15 (1H, d, J=7,6Гц), ють до 0-5°С. Суміш фільтрують, промивають осад 7,02 (2H, t, J=8,8Гц), 6,75 (1H, s), 6,64 (1H, d, метанолом (8мл) і водою (2мл) і сушать у вакуумі J=7,2Гц), 5,67 (1H, q, J=7,6Гц), 4,61 (2H, q, при 50-60°С протягом 16год., одержуючи 1,66г J=10,0Гц), 2,97 (3H, s), 2,94-2,83 (1H, m), 2,75-2,68 вказаної в заголовку сполуки. (1H, m), 2,00-1,70 (4H, brs), 1,69-1,58 (1H, m). Приклад Р-3 Сполуки за Прикладами 15-2 - 15-7 одержують Гемігідрат (R)-(6-(1-((4в основному за методикою, описаною в Прикладі фторбензил)метиламіно)етиліденаміно)-2(R)15-1. гідроксііндан-1-іл)аміду біфеніл-4-карбонової кислоти ПриМасЗмішують розчин ацетонітрильного сольвату клад Назва сполуки спектр (R)-(6-(1-((4-фторбензил) метиламі№ (т/е) но)етиліденаміно)-2-гідрокси-1-біфеніламіноіндану (R)-(6-(1-((4-фторбензил)метиламіно)528 (101г) та метанол (1,2л) з Darco G-60 (5г). Після 15-2 етиліденаміно)-індан-1-іл)амід 3,5-дифторбіфеніл(МН+) 4-карбонової кислоти перемішування протягом 15-30хв. при 15-25°С (R)-(6-(1-((4-фторбензил)метиламіно)суміш фільтрують і промивають відфільтровану 510 15-3 етиліденаміно)-індан-1-іл)амід 2'-фторбіфеніл-4(МН+) тверду речовину метанолом (0,4л). Додають до карбонової кислоти об'єднаних фільтратів воду (0,4л), обполіскують і (R)-(6-(1-((4-фторбензил)метиламіно) 528 15-4 етиліденаміно)-індан-1-іл)амід 2',6'додають затравочні кристали гемігідрату (1,5г). (МН+) дифторметилбіфеніл-4-карбонової кислоти Перемішують суміш протягом 2-3год. при 15-25°С, (К)-(6-(1-((4-фторбензил)метиламіно)492 15-5 після чого охолоджують до 0-5°С і перемішують етиліденаміно)(МН+) індан-1-іл)амід біфеніл-4-карбонової кислоти додатково протягом 90хв. Суміш фільтрують, про(R)-(6-(1-((4-фторбензил)метиламіно)мивають осад охолодженим до 0-5°С метанолом 510 15-6 етиліденаміно)-індан-1-іл)амід 3-фторбіфеніл-4(МН+) (0,8л) і водою (0,2л) і сушать у вакуумі при 47-53°С карбонової кислоти протягом 20год., одержуючи 88,7г вказаної в заго(R)-(6-(1-((4-фторбензил)метиламіно)528 15-7 етиліденаміно)-індан-1-іл)амід 3,2'-дифторбіфенілловку сполуки. (МН+) 4-карбонової кислоти Сполуки згідно з цим винаходом можна вводити в організм окремо або у формі фармацевтичних Приклад Р-1 композицій, тобто в комбінації з фармацевтично Гемігідрат (R)-(6-(1-((4прийнятними носіями або наповнювачами, пропофторбензил)метиламіно)етиліденаміно)-2(R)рція та природа яких визначаються розчинністю та гідроксііндан-1-іл)аміду біфеніл-4-карбонової кисхімічними властивостями вибраної сполуки, обралоти ним шляхом введення та стандартною фармацевДодають 21,8л метанолу до 2,86кг сольвату тичною практикою. Сполуки згідно з цим винахо(R)-(6-(1-((4дом є ефективними самі по собі, проте їх можна фторбензил)метиламіно)етиліденаміно)-2(R)вводити до складу композицій та застосовувати у гідроксііндан-1-іл)аміду біфеніл-4-карбонової кисформі їхніх фармацевтично прийнятних солей з лоти. Пропускають одержаний розчин через міркувань стабільності, зручності, розчинності тофільтр, імпрегнований вугіллям, і промивають що. На практиці сполуки Формули І звичайно зафільтр 24л метанолу. Додають до розчину 5,7кг стосовують у формі фармацевтичних композицій, води протягом 35хв., а потім затравочні кристали тобто в сумішах із фармацевтично прийнятними гемігідрату (R)-(6-(1-((4носіями або розріджувачами. фторбензил)метиламіно)етиліденаміно)-2(R)Таким чином, цей винахід пропонує фармацегідроксііндан-1-іл)аміду біфеніл-4-карбонової кисвтичні композиції, які містять сполуку Формули І та лоти. Через 20хв. додають 1,15кг води, а потім 15г фармацевтично прийнятний розріджувач. Цей визатравочних кристалів. Через 1год. додають ще нахід пропонує також відповідну упаковку (в тому 1,15кг води протягом 30хв., а потім 15г затравоччислі етикетку), яка включає фармацевтичні комних кристалів. Через 10хв. додають 3,4кг води позиції, що містять сполуку Формули І. протягом 1год., і перемішують суспензію при кімСполуки Формули І можна вводити в організм натній температурі протягом 1год., а потім при 0°С різноманітними шляхами. При лікуванні пацієнта, протягом 45хв. Відділяють твердий продукт фільткотрий страждає на розлади, описані в цьому доруванням, промивають охолодженою сумішшю кументі, сполуку Формули І можна застосовувати в 11,4л метанолу та 2,9л води і сушать, одержуючи будь-якій формі або різновиді, котрий забезпечує 2,19кг вказаної в заголовку сполуки у вигляді білої біодоступність сполуки в ефективній кількості, в твердої речовини. тому числі пероральними та парентеральними Приклад Р-2 шляхами. Наприклад, сполуки Формули І можна Гемігідрат (R)-(6-(1-((4вводити в організм пероральним, інгаляційним, фторбензил)метиламіно)етиліденаміно)-2(R)підшкірним, внутрішньом'язовим, внутрішньовенгідроксііндан-1-іл)аміду біфеніл-4-карбонової кисним, черезшкірним, інтраназальним, ректальним, лоти черезочним, місцевим, під'язичним, защічним Розчиняють сольват (R)-(6-(1-((4шляхами тощо. Як правило, при лікуванні розлафторбензил)метиламіно)-етиліденаміно)-2(R)дів, описаних в цьому документі, перевага віддагідроксііндан-1-іл)аміду біфеніл-4-карбонової кисється пероральному застосуванню. лоти (2,0г) в метанолі (24мл) при 20-23°С. ДодаФахівець у галузі приготування лікарських ють до розчину воду (5мл), а потім затравочні крипрепаратів може без утруднень вибрати відповідну стали гемігідрату (20мг). Перемішують суміш форму та спосіб введення сполук згідно з цим випротягом 2год. при 20-23°С, після чого охолоджунаходом в організм, залежно від конкретних харак 43 76492 44 теристик вибраної сполуки, розладу або хворобнаходом можуть бути введені до складу розчинів ливого стану, що підлягає лікуванню, стадії розвиабо суспензій. Ці препарати, як правило, містять тку розладу або хворобливого стану та інших рещонайменше 0,1% сполуки згідно з цим винахолевантних обставин. [Див. монографію дом, проте кількість згаданої сполуки може варіюRemington's Pharmaceutical Sciences, 18th Edition, вати і становити від 0,1% (мас.) до приблизно 90% Mack Publ. Co. (1990)]. (мас.) препарату. Кількість сполуки Формули І в Фармацевтичні композиції виготовляють спотаких композиціях забезпечує відповідне дозувансобами, добре відомими в фармацевтичній пракня сполуки. Розчини або суспензії можуть містити тиці. Носій або розріджувач може являти собою також одну або кілька таких допоміжних речовин: твердий, напівтвердий або рідкий матеріал, який стерильні розріджувачі, наприклад, воду для ін'єкможе бути носієм або середовищем для активного цій, сольовий розчин, нелеткі олії, поліетиленгліінгредієнта. Відповідні носії або наповнювачі добколі, гліцерин, пропіленгліколь або інші синтетичні ре відомі в галузі. Фармацевтична композиція морозчинники; протимікробні агенти, наприклад, бенже бути пристосована для перорального, інгалязиловий спирт або метилпарабен; антиоксиданти, ційного, парентерального або місцевого наприклад, аскорбінову кислоту або бісульфіт назастосування і може бути введена в організм пацітрію; хелатуючі агенти, наприклад, етилендіамінєнта у формі таблеток, капсул, аерозолів, інгалятетраоцтову кислоту; буферні сполуки, наприклад, ційних лікарських форм, супозиторіїв, розчинів, ацетати, цитрати або фосфати, та агенти для ресуспензій тощо. гулювання тонічності, наприклад, хлорид натрію Сполуки згідно з цим винаходом можна вводиабо декстрозу. Препарати для парентерального ти в організм перорально, наприклад, в комбінації застосування можуть бути вміщені в ампули, одз інертним розріджувачем або в капсулах, або у норазові шприци або багатодозові флакони, вигоформі пресованих таблеток. Для цілей пероральтовлені зі скла або пластмаси. Композиції та преного терапевтичного застосування згадані сполуки парати, яким віддається перевага, може визначити можна комбінувати з наповнювачами і застосовуфахівець. вати у формі таблеток, пастилок, капсул, еліксирів, Сполуки згідно з цим винаходом можна застосуспензій, сиропів, облаток, жувальних гумок тосовувати також місцево, і в таких випадках носій що. Ці препарати можуть містити як активний інгможе відповідно містити розчин, мазеву або гелередієнт щонайменше 4% сполуки згідно з цим виву основу. Така основа може містити, наприклад, находом, проте кількість згаданої сполуки може одну або кілька таких речовин: вазелін, ланолін, варіювати залежно від конкретної форми і станополіетиленгліколі, бджолиний віск, мінеральне вити від 4% (мас.) до приблизно 70% (мас.) дозомасло, розріджувачі, наприклад, воду та спирт, та ваної одиниці. Кількість сполуки в композиції заемульгатори, а також стабілізатори. Лікарські фобезпечує відповідне дозування сполуки. рми для місцевого застосування можуть містити Композиції та препарати згідно з винаходом, яким сполуку Формули І або її фармацевтично прийнятвіддається перевага, може визначити фахівець. ну сіль в концентрації (маса на одиницю об'єму) Таблетки, пілюлі, капсули, пастилки тощо мовід приблизно 0,1% до 10%. жуть містити також одну або кілька таких допоміжСполуки Формули І є агоністами мускаринових них речовин: в'яжучі, наприклад, мікрокристалічну рецепторів М-1. Крім того, сполуки Формули І є целюлозу, трагакантову камедь або желатин; населективними агоністами зазначеного конкретного повнювачі, наприклад, крохмаль або лактозу; дезмускаринового рецептора. Сполуки згідно з цим інтегратори, наприклад, альгінову кислоту, примовинаходом мають особливо корисні властивості з гель (Primogel), кукурудзяний крохмаль тощо; точки зору їхньої біодоступності, фармакокінетики, змащувальні агенти, наприклад, стеарат магнію безпечності та ефективності. Мускаринові агонісабо Стеротекс (Sterotex); ковзні агенти, наприклад, ти, в тому числі їхній профіль зв'язування за підтиколоїдний діоксид кремнію; можуть бути додані пами, можна ідентифікувати способами, добре також підсолоджувачі, наприклад, сахароза або відомими в практиці. сахарин, або смакоароматичні домішки, наприЗгідно з одним із варіантів здійснення, цей виклад, м'ята, метилсаліцилат або апельсиновий нахід пропонує способи лікування розладів, пов'яароматизатор. Якщо дозованою лікарською форзаних із мускариновими рецепторами, які включамою є капсула, то вона може містити, окрім матеють введення в організм пацієнта, котрий потребує ріалів вищезгаданих типів, рідкий носій, напритакого лікування, ефективної кількості сполуки клад, поліетиленгліколь або жирну олію. Інші Формули І. Тобто в цьому винаході маються на дозовані лікарські форми можуть містити різномаувазі різноманітні розлади, згадані в цьому докунітні інші матеріали, які змінюють фізичну форму менті як такі, що підлягають лікуванню, та інші відозованої одиниці, наприклад, у вигляді оболонок. домі фахівцям розлади, які можна лікувати згадаТак, таблетки або пілюлі можуть мати оболонку з ними агоністами. цукру, шелаку або інших матеріалів. Сироп, окрім Численні розлади, котрі можна лікувати муссполук згідно з винаходом, може містити сахарозу кариновими агоністами, є відомими і відповідають як підсолоджувач та певні консерванти, пігменти і встановленим та прийнятим класифікаціям, в той барвники та ароматизатори. Матеріали, що засточас як інші недосить відомі. Наприклад, пізнавальсовуються при виготовленні цих різноманітних на здатність є складним та іноді недосить чітко композицій, мають бути фармацевтично чистими визначеним явищем. Широко відомо, однак, що та нетоксичними у використовуваних кількостях. пізнавальна здатність охоплює різноманітні "сфеДля перорального та парентерального терари". До таких сфер належать короткочасна папевтичного застосування сполуки згідно з цим вим'ять, довгочасна пам'ять, робоча пам'ять, вико 45 76492 46 навчі функції та увага. документі, можна знайти також у Міжнародній клаМається на увазі, що сполуки згідно з цим висифікації захворювань,видання 10 (International находом є корисними при лікуванні розладів, котрі Classification of Diseases, 10th Revision (ICD-10)). характеризуються порушеннями в будь-якій з виФахівцям відомо, що існують також альтернативні щезгаданих сфер або в інших аспектах пізнавальноменклатури, системи нозології та класифікації ної здатності. Таким чином, термін "розлади пізнаописаних в цьому документі розладів, в тому числі вальної здатності" охоплює будь-який розлад, що розладів, описаних в DSM-IV та ICD-10, і що терхарактеризується порушенням в одній або кількох мінологія та системи класифікації розвиваються сферах пізнавальної здатності, в тому числі (але разом із прогресом в галузі наукової медицини. не тільки) порушень короткочасної пам'яті, довгоУ варіантах здійснення, яким віддається особчасної пам'яті, робочої пам'яті, виконавчих функцій лива перевага, цей винахід пропонує способи літа уваги. кування розладів, вибраних з групи, до якої вхоОдним із розладів пізнавальної здатності, який дять: розлади пізнавальної здатності (в тому числі підлягає лікуванню згідно з цим винаходом, є віковіковий розлад пізнавальної здатності, помірна ве зниження пізнавальної здатності. Цей розлад у недостатність пізнавальної здатності, погіршення практиці чітко не визначений, але включає послапізнавальної здатності, пов'язане із шизофренією, блення функцій в різних сферах пізнавальної здата погіршення пізнавальної здатності, спричинене тності, зокрема, пам'яті та уваги, яким супровохіміотерапією), ADHD, розлади настрою (в тому джується старіння. Іншим розладом пізнавальної числі депресія, манія, біполярні розлади), психози здатності є помірна недостатність пізнавальної (зокрема, шизофренія та розлади шизофренічного здатності. Цей розлад також чітко не визначений в типу), деменція (в тому числі хвороба Альцгеймепрактиці, але він включає послаблення функцій в ра, деменція, спричинена СНІД, судинна деменція різних сферах пізнавальної здатності і вважається та деменція за відсутності характерної гістології), типовим для групи пацієнтів, більшість з яких хвороба Паркінсона та хорея Гентінгтона, болі (в страждає на хворобу Альцгеймера в початкових тому числі гострі болі та хронічні болі), ксеростостадіях. Ще одним розладом пізнавальної здатномія (сухість у роті), захворювання тіла Леві (в тому сті є погіршення пізнавальної здатності, пов'язане числі дифузне захворювання тіла Леві), афазія (в із шизофренією. Залежність між порушеннями пітому числі первинна афазія та синдроми первинзнавальної здатності та іншими симптомами шиної афазії), гіпотензивні синдроми та хронічні колізофренії на цей час остаточно ще не з'ясована. У ти, в тому числі хвороба Крона, котрі (способи) деякиххв.орих спостерігалися явища погіршення включають введення в організм пацієнта, котрий пізнавальної здатності задовго до розвитку виразпотребує такого лікування, ефективної кількості них симптомів, в той час як в інших пізнавальна сполуки Формули І. Тобто цей винахід передбачає здатність погіршувалася після першого нападу з застосування сполуки Формули І або її фармацевподальшими рецидивами. Ще одним розладом тичної композиції для виготовлення лікарського пізнавальної здатності є порушення пізнавальної засобу для лікування розладів, пов'язаних із мусздатності, спричинене хіміотерапією. У хворих, кариновими рецепторами. яких піддають хіміотерапії з приводу раку, можуть Мається на увазі, що терміни "лікування", "лівиникати погіршення пізнавальної функції, і це кувати" охоплюють покращення симптоматики, погіршення може бути тривалим. Крім того, порупов'язаної з кожним з описаних в цьому документі шеннями пізнавальної здатності, котрі можна лікурозладів, пов'язаних із мускариновими рецептовати згідно з цим винаходом, є такі, що можуть рами. Мається на увазі також, що фахівець може виникати внаслідок різноманітних інсультів (пошвплинути на згадані розлади шляхом лікування коджень, нападів або травм), до яких належать пацієнта, котрий на даний час страждає на такий апоплексія, ішемія, гіпоксія, запалення, інфекційні розлад, або шляхом профілактичного лікування процеси, а також розлади пізнавальної здатності, пацієнта, котрий вважається схильним до таких котрі виникають після аорто-коронарного шунтурозладів, ефективною кількістю сполуки Формули вання та трансплантацій, апоплексії, церебральної І. Таким чином, терміни "лікування", "лікувати" стоішемії, травм спинного мозку, травм голови, перисуються всіх процесів, до яких належать сповільнатальної гіпоксії, синдрому алкогольного отруєннення, переривання, припинення, регулювання ня плода, зупинки серця та гіпоглікемічного пошабо зупинення розвитку розладів, описаних в цьокодження нейронів, судинної деменції, му документі, але не обов'язково означають повне багатоінфарктної деменції, бічного аміотрофічного усунення всіх симптомів розладу, а також охопсклерозу, хіміотерапії та розсіяного склерозу. люють профілактику таких розладів. Щодо відомих розладів, котрі відповідають Мається на увазі, що цей винахід охоплює встановленим та прийнятим класифікаціям як такі, комплексне лікування розладів, описаних в цьому що піддаються лікуванню мускариновими агонісдокументі. Більш конкретно, сполуки Формули І є тами, то ці класифікації можна знайти в різноманікорисними при лікуванні розладів, при яких одним тних джерелах. Наприклад, на цей час четверте із симптомів є погіршення пізнавальної здатності, в видання Довідника з діагностики та статистики комбінації з різноманітними іншими терапевтичнипсихічних розладів (Diagnostic and Statistical ми агентами, зокрема, в комбінації з підсилювачаManual of Mental Disorders (DSM-IV™), 1994, ми поглинання аденозинмонофосфату (АМРА); з American Psychiatric Association, Washington, D.C.) типічними та атипічними антипсихотичними агенпропонує діагностичні методики для ідентифікації тами, в тому числі з оланзапіном; із різноманітничисленних розладів, згаданих у цьому документі. ми агентами, наприклад, з агоністами mGluR, з Класифікацію багатьох розладів, згаданих у цьому антагоністами N-метил-D-аспартату (NMDA), з 47 76492 48 інгібіторами IL 1-6, з іншими холінергічними агенабо кілька розладів, пов'язаних із мускариновими тами, в тому числі з інгібіторами холінестерази, рецепторами. Мається на увазі, що прикладами наприклад, такрином та донепезилом, та зі сполуживих істот, які охоплюються цим терміном, є морками, які інгібують перероблення амілоїдних проські свинки, собаки, коти, пацюки, миші, коні, велитеїнів, в тому числі з інгібіторами перероблення ка рогата худоба, вівці, свині та люди. амілоїдних попередників протеїнів та антитілами, У значенні, вживаному в цьому описі, термін спрямованими проти амілоїдних протеїнів; з анти"ефективна кількість" сполуки Формули І означає депресантами, в тому числі із селективними кількість (тобто дозу), ефективну з точки зору ліку(SSRI) та неселективними інгібіторами засвоєння вання описаних в цьому документі розладів. серотоніну (SNRI), наприклад, із флуоксетином, Ефективну кількість може без утруднень випароксетином та венлафаксином; з анксіолітиказначити діагност, який веде хворого, застосовуючи ми; тощо. Вважається, що вищезгадані комбінації звичайні методики та спостерігаючи результати, є синергічно сприятливими і забезпечують ефекодержані в аналогічних випадках. При визначенні тивність при застосуванні в дозах, які складають ефективної кількості (дози) сполуки Формули І діанезначну частку доз, необхідних для досягнення гност враховує численні фактори, в тому числі такого самого ефекту в разі застосування окремих (але не тільки) конкретну сполуку Формули І, обкомпонентів. рану для застосування; комплексне застосування Згідно з вищезгаданими способами комплексінших терапевтичних засобів в разі такого застосуного лікування, цей винахід пропонує також провання; вид ссавця; його розміри, вік та загальний дукт, котрий містить сполуку Формули І та один стан здоров'я; конкретний розлад, що підлягає або кілька терапевтичних агентів, вибраних із грулікуванню; ступінь розвитку або тяжкість згаданого пи, до якої входять підсилювачі АМРА; типовий та розладу; індивідуальну реакцію пацієнта; спосіб атипові антипсихотичні агенти, в тому числі оланвведення; характеристики біодоступності застосозапін; агоністи mGluR; антагоністи NMDA; інгібітовуваного препарату; обраний режим дозування; ри IL 1-6; інгібітори холінестерази, наприклад, такпаралельне застосування інших засобів лікування; рин та донепезил; сполуки, які інгібують та інші релевантні обставини. перероблення амілоїдних протеїнів, в тому числі Очікується, що ефективна кількість сполуки інгібітори перероблення амілоїдних попередників Формули І варіює в межах від приблизно 0,01мг на протеїнів та антитіла, спрямовані проти амілоїдних кілограм маси тіла на добу (мг/кг/добу) до приблипротеїнів; антидепресанти, в тому числі SSRI та зно 50мг/кг/добу, а перевага віддається дозам від SNRI, наприклад, флуоксетин, пароксетин та вен0,1мг на кілограм маси тіла на добу (мг/кг/добу) до лафаксин; та анксіолітики, як комплексний препаприблизно 20мг/кг/добу. Кількості, яким віддається рат для одночасного, окремого або послідовного більша перевага, може визначити фахівець. застосування при лікуванні розладів, при яких одСеред розладів, що підлягають лікуванню згіним із симптомів є погіршення пізнавальної здатдно з цим винаходом, деяким віддається особлива ності. За іншим варіантом здійснення, цей винахід перевага. До розладів, лікуванню яких віддається пропонує також застосування сполуки Формули І особлива перевага, належать розлади пізнавальспільно з одним або кількома терапевтичними агеної здатності (особливо помірна недостатність нтами, вибраними з групи, до якої входять підсипізнавальної здатності та погіршення пізнавальної лювачі АМРА; типові та атипові антипсихотичні здатності, пов'язане із шизофренією), хвороба агенти, в тому числі оланзапін; агоністи mGluR; Альцгеймера та психози, в тому числі шизофренія. антагоністи NMDA; інгібітори IL 1-6; інгібітори холіОписані численні передклінічні лабораторні нестерази, наприклад, такрин та донепезил; спотваринні моделі розладів, згаданих в цьому докулуки, які інгібують перероблення амілощних протементі. їнів, в тому числі інгібітори перероблення Приклад А амілоїдних попередників протеїнів та антитіла, Лабіринт з радіальними ходами спрямовані проти амілоїдних протеїнів; антидепДля дослідження впливу лікарських засобів на ресанти, в тому числі SSRI та SNRI, наприклад, збереження пам'яті було застосовано вимірювання флуоксетин, пароксетин та венлафаксин; та анксікількості помилок при виконанні зразкового заолітики, для виготовлення лікарського засобу як вдання у восьмиходовому лабіринті після затримкомплексного препарату для одночасного, окремоки [Пуссінен та Сірвіо - R. Pussinen and J. Sirvio, J. го або послідовного застосування при лікуванні of Psychopharm. 13:171-179, 1999; Стоблі та інші розладів, при яких одним із симптомів є погіршенU. Staubli et al., Proc. Natl Acad. Sci. 91:777-781, ня пізнавальної здатності. 1994]. У значенні, вживаному в цьому описі, термін Добре натренованим пацюкам давали можли"одночасне, окреме або послідовне застосування" вість відшукувати нагороду (їжу) в чотирьох випадозначає, що два або більше терапевтичних агентів ково вибраних ходах лабіринту (фаза вибору). застосовуються в межах періоду часу, який забезЧерез деякий час (час затримки) пацюкам пропопечує виявлення певного лікувального ефекту всіх нували вісім відкритих ходів і випробовували їх згаданих терапевтичних агентів у певний момент здатність до згадування та уникнення ходів, до часу. Інакше кажучи, періоди терапевтичної активяких вони перед тим заходили для одержання їжі. ності мають щонайменше частково перекриватися Повторне відвідання ходу, в який була вміщена один з одним, хоча вони не обов'язково мають принада, на протязі сеансу вибору зараховувався бути одночасними. як контрольна помилка, тоді як відвідання одного й Термін "пацієнт" у значенні, вживаному в цьотого самого ходу більше одного разу на протязі му описі, означає ссавця, котрий страждає на один сеансу згадування зараховувалося як робоча по 49 76492 50 милка. Сумарна кількість помилок (контрольних та залежав від дози. Такрин значно покращував згаробочих) на протязі сеансу згадування зростає при дування після 6-годинної затримки при дозі зростанні періоду затримки. Наприклад, молоді 10мг/кг, але при 3мг/кг ефекту не виявлено. самці пацюків робили 0,66 (+0,4) помилки при затримці 1хв., 2 (+0,5) помилки при затримці 1год. і Приклад В 3,95 (+0,2) помилки при затримці 7год. (спостереСприйнятливість (випробування на сприйнятження в лабораторії авторів винаходу). ливість в 8-ходовому радіальному лабіринті) Самців пацюків лінії Спрег-Доулі (SpragueВідомою особливістю симптоматики ранньої Dawley) утримували в індивідуальних клітках в фази хвороби Альцгеймера є виразне погіршення умовах чергування 12-годинних періодів освітлендекларативної пам'яті ["Нейропсихологія хвороби ня та затемнення (початок періоду освітлення о 6Альцгеймера та інших видів деменції", під ред. йгод.ині ранку). Тварини мали вільний доступ до Паркса, Зека та Уїлсона - Neuropsychology of води, а масу тіла підтримували на рівні 85% маси Alzheimer's disease and other dementias, R.W. при вільному харчуванні шляхом додаткового підParks, R.F. Zee and R.S. Wilson (Eds.), NY, Oxford годовування лабораторним кормом "Пурина". Univ. Press, p.3-80 (1993)]. Спочатку пацюків тренували на пошук їжі в кіВ процесі розвитку захворювання наступають нці кожного з восьми ходів лабіринту. Коли тваритяжкі ураження також інших сфер пізнавальної ни досягали критерію, який відповідав кількості не здатності. Поряд з іншими зонами мозку, на ранніх більше 2 помилок (тобто відвідання одного й того стадіях хвороби Альцгеймера зазнає ураження самого ходу більше одного разу на протязі сеансу) гіпокамп, котрий є нервовим субстратом вирішана протязі трьох послідовних днів, між четвертим льного значення для декларативної пам'яті. Існута п'ятим сеансами вибору ходів виконували зають відмінності в картинах втрати нейронів гіпокатримку протягом 1хв. Таке тренування забезпечумпу при нормальному старінні та при хворобі вало повне звикання тварин до процедурних аспеАльцгеймера (Lancet, 344:769-772, 1994). Одним із ктів завдання перед застосуванням будь-яких тестів поведінки, який часто застосовують для лікарських засобів. Після досягнення стабільних оцінки функцій гіпокампу у піддослідних тварин, є показників при затримці виконання завдання (тобвипробування в 8-ходовому радіальному лабіринті то не більше однієї помилки за сеанс на протязі (Олтон - Olton D.S. The radial arm maze as a tool in трьох послідовних днів) починали випробування behavioral pharmacology. Physiology and Behavior, лікарських засобів та носія при 7-годинній затрим40:793-797, 1986). ці. Кожного дня принаду вміщували в нову сукупПошкодження або фармакологічне блокування ність ходів для кожного пацюка, а в період затримгіпокампу порушує характеристики при цьому тески лабіринт ретельно чистили. ті. Крім того, тварини старшого віку взагалі гірше При сеансі вибору кожну тварину вміщували виконують завдання цього тесту [Порсолт, Ру та на центральній платформі з доступом до всіх воВеттштайн - Porsolt R.D., Roux S. and Wettstein сьми блокованих ходів лабіринту. В чотири випадJ.G. Animal models of dementia. Drug Development ково вибраних ходи вміщували їжу. Піднімали Research, 35:214-229, 1995]. дверцята ходів із принадою і давали пацюку п’ять В цьому тесті на просторове навчання та пахвилин для відшукування їжі в кінці кожного з чом'ять голодного пацюка вміщують в центр лабіринтирьох ходів. Як тільки тварина одержувала їжу, її ту і дають йому пересуватися по лабіринту в повиймали з лабіринту, вводили їй носій або різні шуках їжі, вміщеної в кінці кожного ходу. В цьому дози випробовуваної сполуки і переносили в клітваріанті лабіринту пацюк навчається стратегії "вику. Через 7год. (сеанс згадування) пацюка знов грашу зі зсувом", за якою пройдений хід не замівміщували на центральній платформі з доступом нюється. Тому найбільш ефективною стратегією до всіх восьми блокованих ходів лабіринту. Внохарчування є одноразове відвідування кожного сили принаду в ті самі чотири ходи, в які була вміходу. Цей варіант лабіринту також застосовується щена принада в сеансі вибору, і піднімали дверцяпри загальних процесах навчання, оскільки лабіта всіх восьми ходів. Давали пацюку пять хвилин ринт не є знайомим для пацюка в перший день для одержання залишкових чотирьох порцій причотириденного експерименту. нади. Входження в хід без принади або повторне Після одержання від постачальника самців відвідання ходу, де тварина вже була перед тим, пацюків лінії Спрег-Доулі утримували в індивідуазараховувалося як помилка. Для зіставлення з льних клітках в умовах регулярного чергування контрольними дослідами визначали критерій знаперіодів освітлення та затемнення в загальному чущості (р
ДивитисяДодаткова інформація
Назва патенту англійськоюMuscarinic agonists, a pharmaceutical composition on their basis
Назва патенту російськоюМускариновые агонисты, фармацевтическая композиция на их основе
МПК / Мітки
МПК: C07C 251/00, A61P 25/28
Мітки: фармацевтична, основі, агоністи, композиція, мускаринові
Код посилання
<a href="https://ua.patents.su/27-76492-muskarinovi-agonisti-farmacevtichna-kompoziciya-na-kh-osnovi.html" target="_blank" rel="follow" title="База патентів України">Мускаринові агоністи, фармацевтична композиція на їх основі</a>
Попередній патент: Спосіб лікування хронічного пієлонефриту у дітей
Наступний патент: Спосіб спалювання низькосортного вугілля
Випадковий патент: Футерівка барабанного млина































