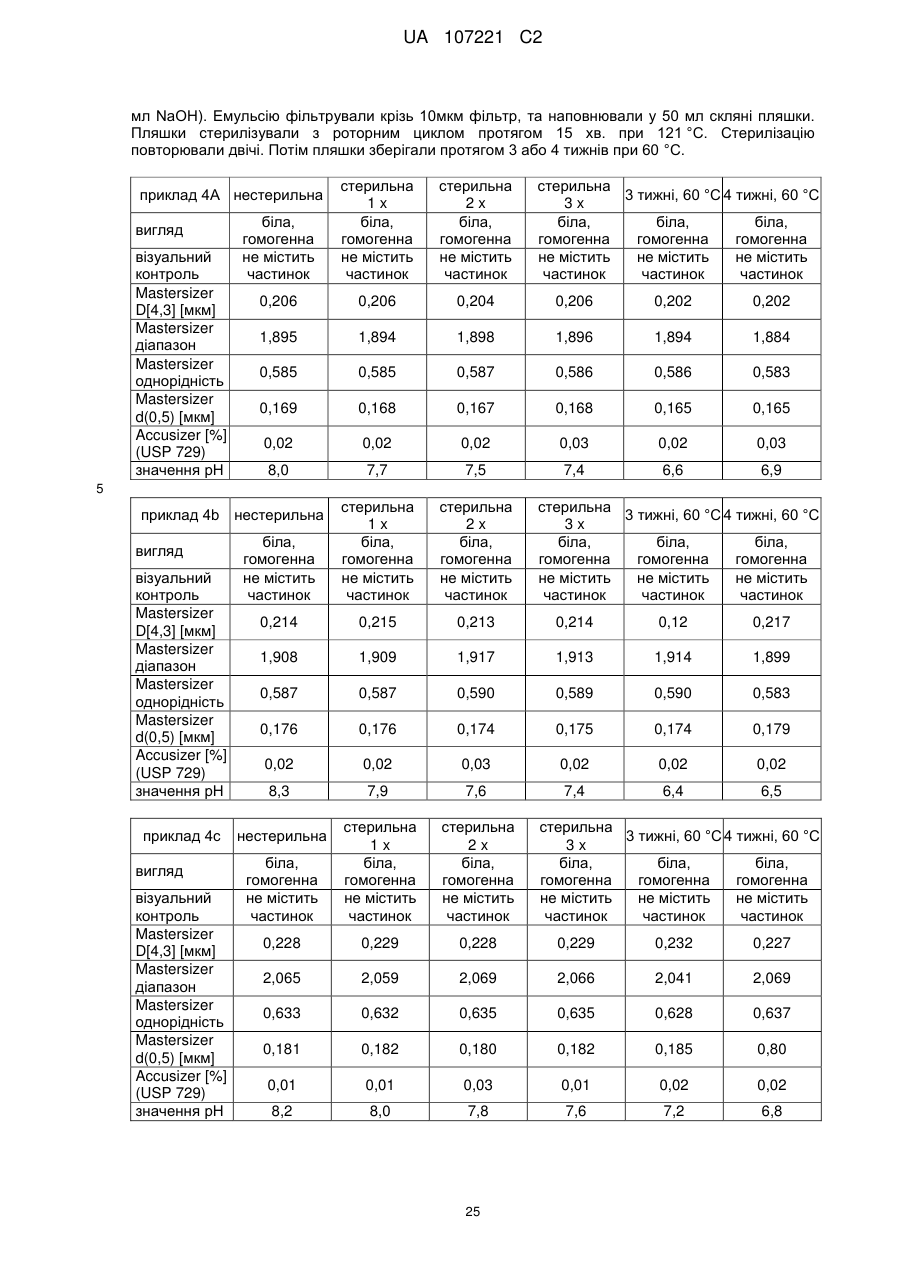
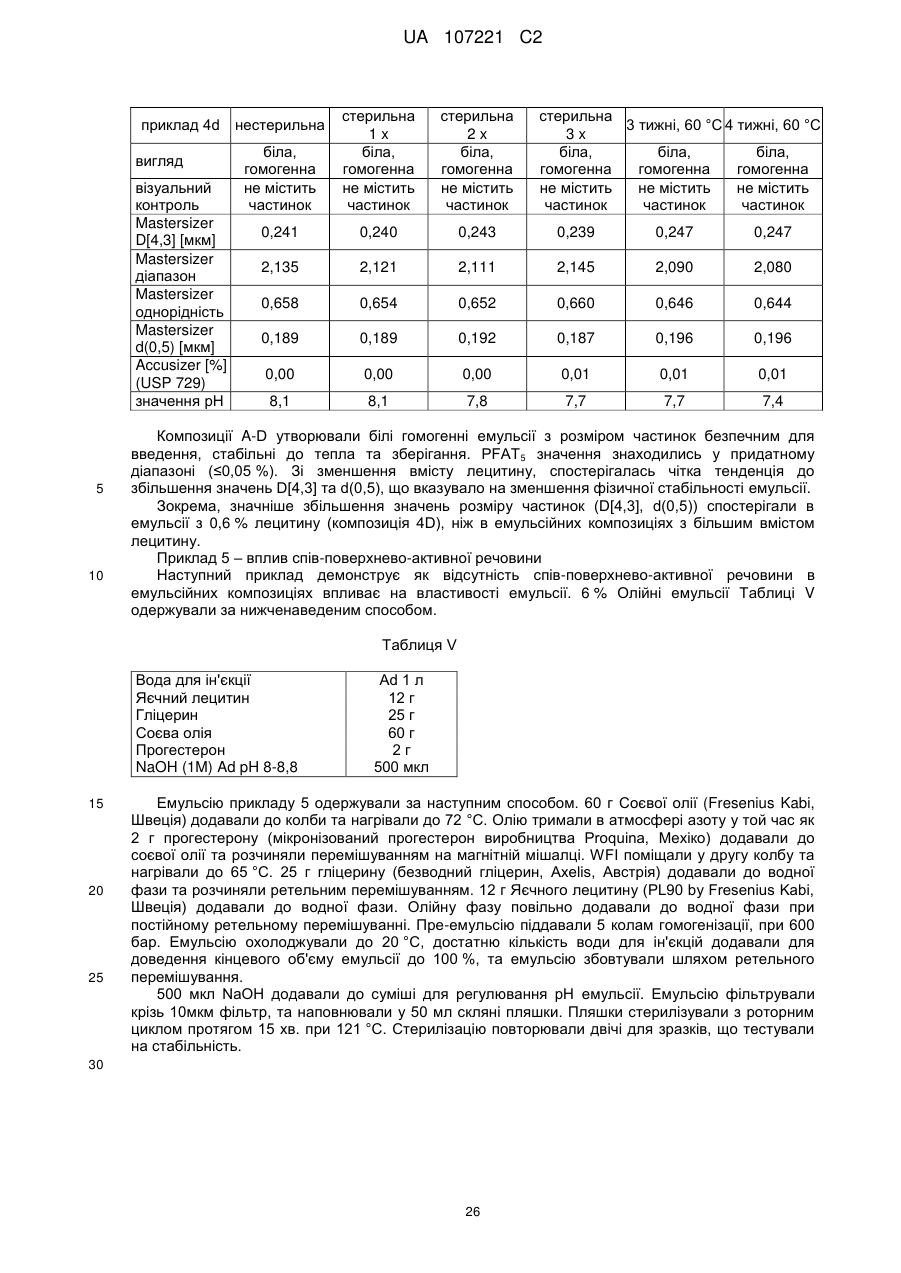
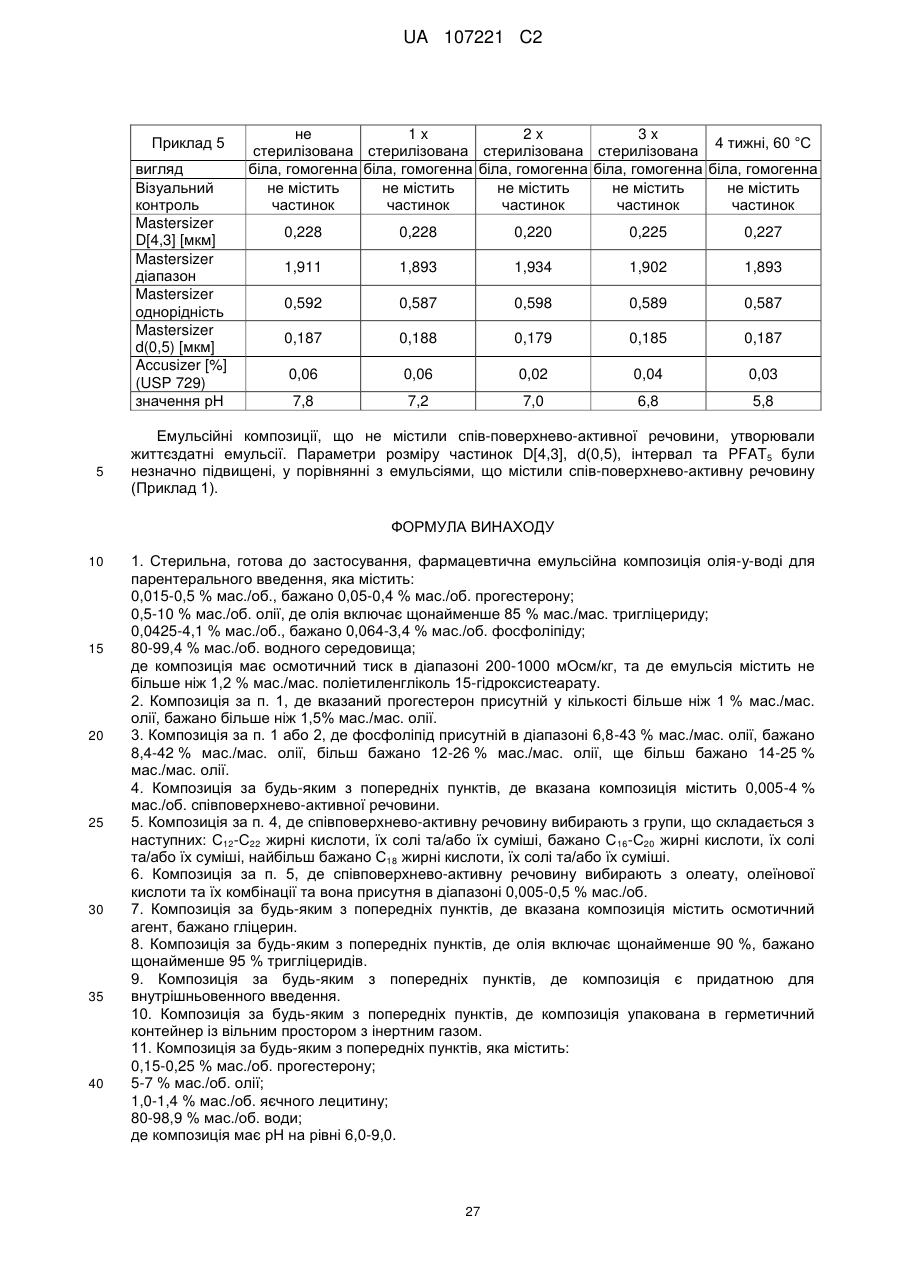
Емульсійна фармацевтична композиція з низьким вмістом олії, що містить прогестоген
Номер патенту: 107221
Опубліковано: 10.12.2014
Автори: Ахляйтнер Георг, ді Хойзер Єва-Марія, Піккерсджілл Лора
Формула / Реферат
1. Стерильна, готова до застосування, фармацевтична емульсійна композиція олія-у-воді для парентерального введення, яка містить:
0,015-0,5 % мас./об., бажано 0,05-0,4 % мас./об. прогестерону;
0,5-10 % мас./об. олії, де олія включає щонайменше 85 мас. %/мас. тригліцериду;
0,0425-4,1 % мас./об., бажано 0,064-3,4 % мас./об. фосфоліпіду;
80-99,4 % мас./об. водного середовища;
де композиція має осмотичний тиск в діапазоні 200-1000 мОсм/кг, та де емульсія містить не більше ніж 1,2 % мас./мас. поліетиленгліколь 15-гідроксистеарату.
2. Композиція за п. 1, де вказаний прогестерон присутній у кількості більше ніж 1 % мас./мас. олії, бажано більше ніж 1,5% мас./мас. олії.
3. Композиція за п. 1 або 2, де фосфоліпід присутній в діапазоні 6,8-43 % мас./мас. олії, бажано 8,4-42 % мас./мас. олії, більш бажано 12-26 % мас./мас. олії, ще більш бажано 14-25 % мас./мас. олії.
4. Композиція за будь-яким з попередніх пунктів, де вказана композиція містить 0,005-4 % мас./об. співповерхнево-активної речовини.
5. Композиція за п. 4, де співповерхнево-активну речовину вибирають з групи, що складається з наступних: С12-С22 жирні кислоти, їх солі та/або їх суміші, бажано С16-С20 жирні кислоти, їх солі та/або їх суміші, найбільш бажано С18 жирні кислоти, їх солі та/або їх суміші.
6. Композиція за п. 5, де співповерхнево-активну речовину вибирають з олеату, олеїнової кислоти та їх комбінації та вона присутня в діапазоні 0,005-0,5 % мас./об.
7. Композиція за будь-яким з попередніх пунктів, де вказана композиція містить осмотичний агент, бажано гліцерин.
8. Композиція за будь-яким з попередніх пунктів, де олія включає щонайменше 90 %, бажано щонайменше 95 % тригліцеридів.
9. Композиція за будь-яким з попередніх пунктів, де композиція є придатною для внутрішньовенного введення.
10. Композиція за будь-яким з попередніх пунктів, де композиція упакована в герметичний контейнер із вільним простором з інертним газом.
11. Композиція за будь-яким з попередніх пунктів, яка містить:
0,15-0,25 % мас./об. прогестерону;
5-7 % мас./об. олії;
1,0-1,4 % мас./об. яєчного лецитину;
80-98,9 % мас./об. води;
де композиція має рН на рівні 6,0-9,0.
12. Композиція за будь-яким з попередніх пунктів, де композиція має значення PFAT5 на рівні ≤0,05 %.
13. Композиція за будь-яким з попередніх пунктів, де крапельні частинки диспергованої олійної фази мають середній діаметр на основі об'єму ≤300 нм, бажано ≤250 нм, більш бажано ≤200 нм, ще більш бажано ≤185 нм, найбільш бажано ≤180 нм.
14. Композиція за будь-яким з попередніх пунктів для застосування у профілактичному та терапевтичному лікуванні ссавців, вказане лікування включає парентеральне, бажано внутрішньовенне введення фармацевтичної емульсії вказаному ссавцю.
15. Спосіб виготовлення композиції за будь-яким з пп. 1-14, де вказаний спосіб включає наступні стадії:
a) змішування води, фосфоліпіду та необов'язково осмотичного агента з одержанням водної композиції;
b) змішування прогестерону та олії з одержанням олійної композиції;
с) змішування водної композиції та олійної композиції з наступною гомогенізацією з утворенням гомогенної емульсії олія-у-воді.
16. Спосіб за п. 15, де стадію змішування с) здійснюють шляхом додавання олійної композиції до водної композиції, з наступною гомогенізацією при ≥350 бар.
Текст
Реферат: Винахід стосується стерильної, готової до застосування фармацевтичної емульсійної композиції олія-у-воді для парентерального введення, яка містить: 0,015-0,5 % мас./об. прогестерону; 0,5-10 мас.%/об. олії, де олія включає щонайменше 85 мас. %/мас. тригліцериду; 0,0425-4,1 мас.%/об. фосфоліпіду; 80-99,4 мас.%/об. водного середовища; де композиція має осмотичний тиск в діапазоні 200-1000 мОсм/кг, та де емульсія містить не більше ніж 1,2 % мас./мас. поліетиленгліколь 15-гідроксистеарату. UA 107221 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь винаходу Винахід стосується фармацевтичних композицій, що містять прогестоген, та терапевтичного або профілактичного лікування ссавців, яке включає парентеральне введення такої фармацевтичної композиції. Композиції винаходу є особливо придатними для лікування травматичних ушкоджень центральної нервової системи. Передумови винаходу Травматичне ушкодження мозку (TПМ) є не-дегенеративним, не-вродженим ушкодженням мозку, спричиненим зовнішньою механічною силою, що можливо призводить до постійних або тимчасових розладів когнітивної, фізичної та психосоціальної функцій з послабленим або перемінним станом свідомості (Brown, A.W., et. al., 2008, Arch. Phys. Med. Rehabil., 89 (Suppl 1), S3-8). TПМ є головною причиною смерті та непрацездатності по всьому світу. Вважають, що більше ніж 1,5 мільйони американців переносять TПМ кожного року, та випадки TПМ у інших індустріально розвинутих країнах є подібними до США (Traumatic Brain Injury: Methods for Clinical and Forensic Neuropsychiatric Assessment, p.2, Granacher, ed., CRC Press 2003). Наприклад, в Європі нараховують приблизно 66,000 загиблих щорічно від TПМ (Socin, D.M., et al. (1995). JAMA 273(22), 1778-80). Деякі пацієнти потребують допомоги довгий час або все життя при здійснення щоденної активності внаслідок TПМ. Не зважаючи на величезний масштаб проблеми опосередкованої TПМ, на даний час не існую затверджених ліків, що ефективно зменшують смертність та покращують наслідки TПМ. Однак, два нещодавніх клінічних дослідження продемонстрували вдале лікування TПМ стероїдним гормоном прогестероном (Xiao et al, 2008, Crit. Care, 12: R61; Wright et al Ann. Emerg. Med. 2007, 49: 391-402). Обидва дослідження показали, що прогестерон є безпечним та добре переноситься пацієнтами з TПМ, та що введення прогестерону пацієнтам з TПМ приводить до зменшення смертності. Більш того, патентні заявки WO2006/102644, WO2006102596 та WO2008/039898 описують способи лікування TПМ шляхом парентерального введення прогестогену. Найбільш ефективним шляхом введення прогестогенів, таких як прогестерон є парентеральний, або внутрішньовенне введення. Однак, гідрофобна природа молекули прогестерону, та внаслідок цього її слабка розчинність у воді, спричиняє певні обмеження. Водні розчини не є композиціями, здатними доставляти ефективні терапевтичні дози прогестерону пацієнтам. Однак, прогестерон є достатньо ліпофільним для одержання терапевтичних концентрацій у гідрофобних розчинниках, таких як розчинники на основі тригліцеридів. Доставка гідрофобних ліків за допомогою внутрішньовенної інфузії емульсій олія-у-воді відома у галузі. Приклади включають Taxol® та Abraxane®, які є нанокомпозиціями хіміотерапевтичного засобу паклітакселю, розробленого для внутрішньовенне введення, та Diprivan®, який є ліпідною емульсійною композицією знеболювального propofol, що продається APP pharmaceuticals, IL, США. Внутрішньовенне введення прогестерону з емульсією олія-у-воді було раніше описано (Wright DW et al. supra; Trotter et al, Journal of Clin. Endocrinol. & Metab. (1999) Vol.84, page 4531). Дослідження ProTECT (Wright et al Ann. Emerg. Med. 2007, 49: 391-402) з використанням 2компонентної системи, де прогестерон спочатку розчинюють у спиртовому розчині (перший компонент), та цей спиртовий розчин прогестерону потім вводять у комерційно наявну ліпідну емульсію Intraліпід® 20 % (Fresenius Kabi, Швеція) (другий компонент), та змішують вручну (наприклад, струшуванням) незадовго перед внутрішньовенним введенням суміші спиртовий розчин/емульсія. Цей спосіб виготовлення має багато недоліків. По-перше, введення спиртових розчинів пацієнтам з TПМ не є бажаним. По-друге, доки присутність спирту допомагає солюбілізації прогестерону, не досить інтенсивне ручне змішування не дозволяє всьому прогестерону перейти в олійну фазу. В результаті, такі емульсії здатні солюбілізувати тільки обмежену кількість прогестерону, та таким чином потрібно вводити значну кількість ліпідів для одержання бажаного рівня прогестерону у сироватці. Однак, введення значного об'єму емульсії, та/або значної кількості ліпідів пацієнту може мати серйозні наслідки, такі як викликання гіперліпідемії або набряку. Пацієнт, в результаті, піддається небажаному ліпідному та/або рідинному навантаженню, та піддається ризику виникнення небажаних наслідків. Більш того, нерозчинний прогестерон є піддатливим кристалізації, та потім окисленню у водній фазі, таким чином викликаючи не тільки підвищений рівень of particulate matter to accumulate in the композиція, а також і високий рівень продуктів розкладання активного інгредієнту. Більш того, було показано, що коли спиртовий розчин прогестерону вводили у ліпідну емульсійну композицію, наявну на ринку (таку як Intralipid® 20 %), фракція гормону знаходиться у кристалічній формі, більше ніж солюбілізується емульсією. Цей не 1 UA 107221 C2 5 10 15 20 25 30 35 40 45 50 55 60 солюбілізований прогестерон адсорбується на поверхні резервуару для та шлангів. Спостереження, що не весь прогестерон входить в олійну фазу цих 2-компонентних емульсій приводить до неясності стосовно концентрації прогестерону у кінцевій композиції, та біодоступності гормону. Зрештою, з огляду на вимоги до стабільності, суміш прогестерон-жир 2-компонентної системи потрібно готувати за години до введення (тобто, перший компонент додають до другого компоненту та перемішують за години перед застосуванням), так як отриману суміш можуть зберігати не при кімнатній температурі. Виготовляти такі суміші за потребою займає дуже багато часу та є незручним для лікаря, та зокрема, не є задовільним у контексті терапії TПМ, де швидке лікування є важливим для пацієнта. Альтернативні способи виготовлення гормон-вмісних емульсій описують включення гормону безпосередньо у олію протягом виробництва ліпідної емульсії. WO96/10991 описує фармацевтичні композиції для трансмукозального введення естрадіолу у комбінації з прогестином. WO 01/28555 описує системи емульсій олія-у-воді для доставки поліфункціональних активних інгредієнтів. Емульсії містять, окрім активного інгредієнта, полярні модифікатори, здатні модифікувати взаємодію між поліфункціональним активним інгредієнтом та олійною фазою, які слугують містком, що зменшують пропуск у полярності між активним інгредієнтом та олією. US 2007/0071777 описує спосіб виготовлення 20 % ліпідної емульсії, що містить прогестерон, яка слугує маточним розчином, який використовують для приготування (шляхом розведення) 5 % ліпідної емульсії, яка є придатною для введення. CN101152186 описує застосування поверхнево-активних речовин Solutol S15 або poloxamer 188 для виготовлення ін'єктивних композицій прогестерону. Хоча застосування цих поверхневоактивних речовин забезпечує високу розчинність прогестерону, внутрішньовенне введення високих концентрацій цих поверхнево-активних речовин асоційовано з небажаними побічними ефектами, включаючи помірне збільшення вивільнення гістаміну, крапивниця, та анафілактичні реакції (зуд, еритема). Інший спосіб збільшення розчинності прогестерону в ліпідних емульсіях, відомий у галузі, включає застосування органічних розчинників. Прогестерон є високо розчинним у бензойній кислоті або її похідних. Наприклад, JP 60-258110 описує застосування бензил бензоату для збільшення розчинності прогестерону в ліпідній емульсії. Однак, з огляду на те, що бензилові спирти та бензил бензоат є зазвичай токсичними та викликають алергію, їхнє включення у композиції для парентерального введення є дуже небезпечним. На основі відомих знань, фахівець у галузі стикається з кількома проблемами внутрішніх емульсій. Наприклад, при більшості умов емульсії є термодинамічно нестабільними, тому що краплі спонтанно утворюють агломерати, що в кінці кінців призводить до повного розділу фаз. Тенденція до агломерації та розділу фаз складає проблему зберігання та використання, та збільшують імовірність того, що фармацевтичні емульсії одержані потрібним чином спочатку будуть у менш оптимальному, менш ефективному стані та з поганими характеристиками при введенні пацієнту. Присутність гідрофобних активних агентів в емульсії, таких як прогестерон, додатково погіршує ці проблеми, тому що лікарській засіб сам по собі дестабілізує емульсію. Таким чином дуже важко формувати стерилізовану-теплом та стабільну для зберігання емульсію, здатну доставляти терапевтично придатні високі дози прогестогену, залишаючись безпечною для введення парентерально, особливо внутрішньовенно. Жодна з відомих лікарських форм не забезпечує фармацевтичні композиції придатні для парентерального введення, які доставляють прогестоген у достатньо високій концентрації, при цьому піддаючи пацієнта мінімальному ліпідному навантаженню та/або об'ємному навантаженню. Жодна з відомих лікарських форм не забезпечує фармацевтичні композиції придатні для парентерального введення, які демонструють достатню фізичну та/або хімічну стабільність для стерилізації теплом та довготривалого зберігання емульсії. Залишається потреба у композиціях прогестогену достатньо фізично та/або хімічно стабільних для стерилізації в автоклаві та довготривалого зберігання, бажано при кімнатній температурі, перед застосуванням. Більш того, залишається потреба у композиціях з низьким вмістом олії, що доставляють високі дози прогестогену на об'єм ліпідів, таким чином що суб'єкту доставляється терапевтично ефективна концентрація прогестогену, причому пацієнт піддається якомога найменшому навантаженню ліпідами. Об'єкти винаходу Об'єктом винаходу є емульсійні фармацевтичні композиції з низьким вмістом олії, що містять прогестоген, які є придатними для парентерального введення. 2 UA 107221 C2 5 10 15 20 25 30 35 40 45 50 55 60 Об'єктом винаходу є емульсійні фармацевтичні композиції з низьким вмістом олії, що містять прогестоген, з покращеним профілем безпеки. Об'єктом винаходу є емульсії олія-у-воді, що містять прогестоген, що стерилізують теплом. Об'єктом винаходу є емульсії олія-у-воді, що містять прогестоген, з покращеною стабільністю зберігання, які виготовляють у готовій для застосування формі та зберігають протягом довгого періоду часу перед застосуванням. Іншим об'єктом винаходу є покращені емульсійні фармацевтичні композиції, придатні для парентерального введення, здатні доставляти високі дози прогестогену на одиницю введеної олії. Іншим об'єктом винаходу є рентабельні композиції для безпечного, ефективного та придатного парентерального введення прогестогену суб'єктам. Зокрема, об'єктом винаходу композиції для парентерального введення, які забезпечують покращену доступність прогестогену, що міститься в них (наприклад, гарні фармакокінетичні властивості та біодоступність, що відображається рівнем гормонів у сироватці та/або концентрацією у плазмі), причому пацієнт, яку ввели композиції, піддається якомога найменшому навантаженню ліпідами та/або об'ємному навантаженню, ніж при введенні композицій відомих у галузі. Іншим об'єктом винаходу є спосіб лікування суб'єктів з TПМ. Іншим об'єктом винаходу є спосіб виготовлення емульсії олія-у-воді, що містять прогестоген. Резюме винаходу Даний винахід забезпечує фармацевтичні композиції, що містять прогестоген, такий як прогестерон, де вказані композиції знаходяться у формі емульсії, що містить олійну фазу, олію, та поверхнево-активну речовину. Композиції даного винаходу переважно мають низький вміст олії, є готовими для використання, стерилізовані теплом, стабільні при зберіганні, та безпечні при введенні шляхом ін'єкції. Даний винахід також забезпечує способи парентерального введення фармацевтичних композицій даного винаходу. Такі способи переважно піддають суб'єкт, якому вводять композиції, меншому рівню ліпідів, ніж композиції попереднього рівня техніки. Композиції даного винаходу переважно забезпечують вищі концентрації доставленого прогестогену на одиницю олії та/або об'єму, суб'єкту, який цього потребує. Даний винахід також забезпечує способи лікування розладів центральної нервової системи, та особливо травматичного ушкодження мозку, композиціями даного винаходу, та способи виготовлення фармацевтичних композицій даного винаходу. Детальний опис винаходу Даний винахід забезпечує фармацевтичні композиції, що містять прогестоген, де вказані композиції знаходяться у формі емульсії, що містять олійну фазу, олійну фазу та одну або кілька поверхнево-активних речовин. Один варіант втілення даного винаходу забезпечує стерильну, готову до застосування, фармацевтичну емульсійну композицію олія-у-воді для парентерального введення, яка містить: - 0,015-0,5 мас%/об. прогестерону; - 0,5 – 10 мас%/об. олії, де олія включає щонайменше 85 % мас. мас. тригліцериду; - 0,0425-4,1 мас%/об., бажано 0,064-3,4 мас%/об., фосфоліпіду; - 80-99,4 мас%/об. водного середовища; де композиція має осмотичний тиск в діапазоні 200-1000 мОсм/кг. Цей конкретний варіант втілення винаходу стосується "Прогестерону". Інший варіант втілення даного винаходу забезпечує стерильну, фармацевтичну, емульсійну композицію олія-у-воді для парентерального введення, яка містить: - олію; - олійну фазу; - прогестоген, бажано прогестерон; де співвідношення прогестоген:олія мас./мас. становить більше ніж 1:32, та де композиція містить менше ніж 2,5 мас%/об. бензил бензоату, та бажано містить менше ніж 1,5 мас. %/мас. поліетиленгліколь 15-гідроксистеарату. Цей другий варіант втілення стосується "Прогестоген/олія". Визначення термінів Термін "олія" як використано в даному документі, є взаємозамінним з термінами "ліпід" та "жир", та стосується ліпофільних органічних сполук, що киплять при високих температурах, що є рідкими при температурі тіла (наприклад, приблизно 37°C), та є фармакологічно прийнятними в ін'єктивних композиціях. Олії даного винаходу включають як гліцериди, часткові гліцериди, залишки жирних кислот та не-гліцериди (наприклад, холестерин), так і їх суміші. Фосфоліпіди, доки не вказано протилежне, не включені в термін "олія" як використано у даному документі. 3 UA 107221 C2 5 10 15 20 25 30 35 40 45 50 55 60 Термін "емульсія олія-у-воді" як використано у даному документі, стосується колоїдної дисперсної системи, в якій рідка олія диспергована в маленьких краплях (дискретна фаза) водного середовища (безперервна фаза). Як використано у даному документі, фраза "терапевтично ефективна кількість" означає, дозу лікарського засобу, яка забезпечує специфічну фармакологічну відповідь за для якої вводять лікарський засіб суб'єкту, який цього потребує. Передбачається, що терапевтично ефективна кількість терапевтичного лікарського засобу завжди є ефективною для лікування розладу/захворювання описаних у даному документі, не зважаючи на те, чи вважає фахівець у галузі її як терапевтично ефективну кількість. Тільки для зручності нижче наведені приклади дозувань, кількості доставки лікарських засобів, терапевтично ефективні кількості та терапевтичні рівні для дорослих людей. Фахівець у галузі може регулювати такі кількості згідно зі звичайною практикою щодо лікування конкретної проблеми та/або розладу/захворювання. Термін "фосфоліпід" як використано в даному документі, стосується естеру гліцерину з однією або двома жирними кислотами та одним фосфатним іоном. Окрім фосфоліпідів похідних гліцерину, термін "фосфоліпід" як використано в даному документі, також включає сфінгомієлін. Термін "водне середовище" як використано в даному документі, стосується водовмісної рідини. Термін "низький вміст олії" як використано в даному документі, стосується композиції з загальним вмістом ліпідів мас./об. на рівні менше ніж або дорівнює 10 %. Термін "високий вміст олії" як використано в даному документі, стосується композиції з загальним вмістом ліпідів мас./об. на рівні більше ніж 10 %. Доки не вказано протилежне, кожен раз коли посилаються на "масовий процент на об'єм", або "мас%/об." ці терміни описують масу компоненту в грамах на 100 мл композиції, яка його містить. Доки не вказано протилежне, кожен раз коли посилаються на "масовий процент на масу" або "мас. %/мас." ці терміни описують масу компоненту як процент маси композиції, яка його містить. Кожен раз коли посилаються на "об'єм-зважений процент жиру >5 мкм", або "PFAT 5", ці терміни описують об'єм-зважений процент диспергованого жиру з діаметром більше ніж 5 мкм, виміряним згідно з способом, описаним у USP, глава , спосіб II, використовуючи Accusizer (780 автоматична сортувальна машина для частинок). Кожен раз коли посилаються на "ФКС" або (фотонна кореляційна спектроскопія), ці терміни означають, що ФКС виміряна згідно з способом, описаним у USP, глава , Спосіб I, використовуючи Zetasizer 1000 HSA (Malvern Instruments). Кожен раз коли посилаються на "D[4,3]" (об'ємний середній діаметр) або d(0,5) (об'ємний середній діаметр), вони означають D[4,3] або d(0,5), виміряні згідно з способом, описаним у USP (вимірювання розміру частинок дифракцією світла), використовуючи Mastersizer 2000 з диспергатором Hydro S (Malvern Instruments). Кожен раз коли посилаються на "зета-потенціал", це означає електрокінетичний потенціал колоїдних систем, визначений експериментально, використовуючи Zetasizer 1000 HAS (Malvern Instruments). Кожен раз коли посилаються на термін "не містить кристалічних твердих речовин", це означає, що емульсії даного винаходу відповідають стандартам щодо певного розміру та кількості в ін'єктивних рідинах (USP 788, Спосіб 2- тест на підрахунок мікроскопічних частинок). Композиції даного винаходу є придатними для парентерального, особливо внутрішньовенного введення. Відповідно, застосування емульсії даного винаходу для парентерального введення є другим варіантом втілення винаходу. Винахід стосується способів лікування травматичного ушкодження ЦНС, зокрема, травматичного ушкодження мозку (TПМ), шляхом введення суб'єкту вказаної емульсії, що містить прогестоген, у терапевтично ефективній кількості. Лікування розладів ЦНС та полегшення їх симптомів також є включеними, як зазначено у даному документі нижче. Винахід також стосується способу приготування композицій олія-у-води, що містять прогестоген. Емульсійні композиції даного винаходу переважно мають низький вміст олії, таким чином суб'єкт отримує меншу кількість ліпідів на одиницю об'єму, таким чином можна уникнути побічних ефектів, таких як гіперліпідемія. Емульсійні композиції даного винаходу переважно стерилізують гарячим повітрям шляхом автоклавування при 121 °C протягом 15 хв. не пошкоджуючи фізичну або хімічну цілісність емульсії. Стерилізація шляхом автоклавування має переваги не тільки по відношенню до мікробіологічної безпеки, а й фінансово є менш затратною. 4 UA 107221 C2 5 10 15 20 25 30 35 Емульсійні композиції даного винаходу переважно одержують у стерильній, готовій до застосування формі з періодом життя на полиці 1 або 2 роки при кімнатній температурі. У одному варіанті втілення, емульсійні композиції даного винаходу переважно мають покращену розчинність прогестогену в олії, та підтримують або покращують хімічну стабільність та/або фізичну стабільність емульсії. У інших варіантах втілення, емульсійні композиції даного винаходу переважно мають високе співвідношення прогестоген-олія, таким чином що бажані рівні прогестогену у сироватці досягаються при мінімальному введенні олії. Більш того, емульсійні композиції даного винаходу мають переваги стосовно безпечності використання у порівнянні з попереднім рівнем техніки, наприклад, a) суб'єкт з TПМ піддається меншій кількості ліпідів на одиницю прогестогену при введенні, b) емульсії відповідають стандартам щодо розміру частинок та кількості в ін'єкційних рідинах, USP 788, Спосіб 2 та/або містять меншу кількість кристалів прогестогену, емульсійні композиції c) мають низьке значення PFAT5, d) містять менше хімічних домішок, e) можуть бути автоклавовані, використовуючи спосіб золотого стандарту для мікробіологічної безпеки, f) не містять спирту або потенційно токсичних органічних розчинників, та/або g) композиції зберігають не пошкоджуючи фізичну стабільність емульсії. Введення композиції даного винаходу переважно дозволяє покращити послідовність дозувань пацієнта, у порівнянні з композиціями попереднього рівня техніки. Цього досягають шляхом оптимізації співвідношення емульсії прогестоген-олія-фосфоліпід, таким чином що прогестоген повністю солюбілізується в олійній фазі, та таким чином стає повністю біодоступним. Введення фармацевтичних композицій даного винаходу дозволяє введення більших доз прогестогену на одиницю об'єму та/або на одиницю олії, у порівнянні з емульсіями попереднього рівня техніки, завдяки цьому досягають вищих рівнів прогестогену у сироватці, та нижчого рівня тригліцеридів у плазмі, у порівнянні з введенням композицій попереднього рівня техніки. Компоненти композиції Прогестоген застосований у "варіанті втілення Прогестоген/олія" Композиції за вищевказаним варіантом втілення даного винаходу містять прогестоген як фармацевтично активний агент (ФАГ). Як використано у даному документі, "прогестоген" включає як природний прогестерон, так і штучні прогестогени. Взагалі, прогестогени мають загальну формулу I, де X1 та X2 незалежно вибирають з COCH3, OCOC5H11, OH, C≡CH, OCOCH3, H, CH2C≡N; де X3 вибирають з H, CH3, або Cl; де X4 вибирають з H, OH, або CH3; та де X5 вибирають з CH3 або CH2CH3. Прогестогени можуть містити кільцеві структури з одним або кількома подвійними зв'язками, наприклад, між атомати вуглецю 3 та 4, 4 та 5, 5 та 6, 6 та 7, 5 та 10, 10 та 9, та/або 15 та 16. Формула I X5 X1 X 11 X4 13 9 14 1 2 3 O 10 4 2 12 17 16 15 8 7 5 6 X3 40 45 50 Такі прогестогени включають, наприклад, прогестерон та похідні прогестерону, такі як 5альфа-дигідропрогестерон, 6-дегідро-ретропрогестерон (дидрогестерон), гідроксипрогестерон капроат, левоногрестрел, норетіндрон, норетіндрон ацетат; норетінодрел, норгестерл, медроксипрогестерон, хлормадінон, та мегестрол. Прогестоген даного винаходу також включає, проте не обмежується модифікаціями з одержанням 17альфа-OH естерів прогестерону, а також, модифікаціями які вводять 6-α-метил, 6-метил, 6-eн, та 6-хлор замісники в прогестерон, та/або 19-нор-прогестерони. Також, невичерпні приклади штучних прогестогенів включають норетіндрон (Micronor®), норгестерл (Ovrette®), левоногрестрел (Norplant®; з етиніл естрадіолом; Alesse®, Nordette®), гестоден, медроксипрогестерон ацетат (Provera®), промегестон, нoмегестрол ацетат, лінестренол та діеногест. У одному варіанті втілення, прогестоген вибирають з групи, що складається з наступних: 5 UA 107221 C2 5 10 прогестерон, норетінодрел, норетидрон ацетат, медроксипрогестерон, медроксипрогестерон 17-ацетат, левоногрестрел, дидрогестерон, гідроксипрогестерон капроат, норетидрон, гестоден, нoмегестрол ацетат, промегестон, діеногест, хлормадініон, мегестрол, мегестрол ацетат, та/або їх суміші. У бажаному варіанті втілення, прогестоген вибирають з групи, що складається з наступних: 5-альфа-дигідропрогестерон, медроксипрогестерон, дидрогестерон та прогестерон та/або їх суміші. У бажаному варіанті втілення, прогестоген є прогестероном. Прогестерон Термін "прогестерон" як використано в даному документі, стосується члену родини прогестогену зі структурою формули II нижче: Формула II O 11 9 12 13 H 14 1 2 10 O 8 H 3 5 17 16 15 7 H 6 4 15 20 25 30 35 40 45 50 Прогестерон також відомий як D4-прегнен-3,20-діон; дельта-4-прегнен-3,20-діон; або прегн4-ен-3,20-діон. У ще більш бажаному варіанті втілення, прогестерон є мікронізованим. Proquina (Мексика) є постачальником мікронізованого прогестерону. Прогестоген (включаючи прогестерон) Прогестоген даного винаходу може знаходитись у формі фармацевтично прийнятної солі. Композиції за варіантом втілення "прогестоген/олія" містять кількість прогестогену щонайменше 0,015 % та не більше ніж 0,5 мас%/об. Бажано, композиції за варіантом втілення "прогестоген/олія" та "Прогестерон" містять прогестоген/прогестерон щонайменше 0,03 %, більш бажано щонайменше 0,05 %, ще більш бажано щонайменше 0,1 %, найбільш бажано щонайменше 0,16 мас. % від загального об'єму (мас./об.). Композиції даного винаходу бажано містять прогестоген/прогестерон менше ніж або дорівнює 0,4 %, більш бажано менше ніж або дорівнює 0,3 %, ще більш бажано менше ніж або дорівнює 0,25 % (мас./об.). У особливо бажаному варіанті втілення, композиції даного винаходу містять 0,2 мас. % від загального об'єму прогестерону, бажано мікронізований прогестерон. Інші фармацевтично активні інгредієнти Композиції даного винаходу можуть містити один або кілька інших терапевтичних інгредієнтів (ФАГи), таких як інші нейротрофні та/або нейропротекторні агенти. Такі агенти включають, наприклад, сполуки, що зменшують глутамат ексцитотоксичність та покращують регенерацію нейронів. Такі агенти вибирають з групи, що містить фактори росту, проте не обмежуються ними. Під "фактором росту" розуміють зовнішньоклітинну сигнальну молекулу, що стимулює клітину до росту або проліферації. У одному варіанті втілення, композиції додатково містять Вітамін D як другий терапевтичний агент, бажано у кількості достатній для забезпечення дози в 200-1000 IU на добу. Наприклад, у певному варіанті втілення композиції можуть містити Вітамін D у концентрації 0,1 IU/мл - 5 IU/мл, бажано 0,5 IU/мл - 3 IU/мл. У інших варіантах втілення, композиції даного винаходу не містять будь-яких інших активних фармацевтичних інгредієнтів. У особливо бажаному варіанті втілення, композиції даного винаходу не містять естрадіол, більш бажано не містять естроген. Олійна фаза Композиції даного винаходу є емульсіями олія-у-воді. Гідрофобна фаза (або олійна фаза) композицій даного винаходу є або містить олію. Tригліцериди бажано є оліями. Бажано гідробофна/олійна фаза містить тригліцерид з температурою плавлення менше ніж 30 °C, більш бажано менше ніж 20 °C, and найбільш бажано менше ніж 10 °C. Композиції згідно з варіантом втілення "Прогестоген/олія" містять олію, що містить 6 UA 107221 C2 5 10 15 20 25 30 35 40 45 50 55 60 щонайменше 75мас. %/мас. тригліцеридів, більш бажано щонайменше 85мас. %/мас. тригліцеридів. У особливо бажаному варіанті втілення "Прогестоген/олія" та "Прогестерон", гідрофобна фаза є олією, що містить щонайменше 90 мас. %/мас. тригліцеридів, найбільш бажано щонайменше 95мас. %/мас. тригліцеридів. У бажаному варіанті втілення, олійна фаза містить "тригліцериди з довгим ланцюгом" (ТДЛ) у кількості щонайменше 45 % мас./мас. загального вмісту олії, бажано щонайменше 65 % мас./мас., більш бажано щонайменше 75 % мас./мас., найбільш бажано щонайменше 90 % мас./мас. У певних варіантах втілення, бажані олійні емульсії даного винаходу представляють або містять рослинну олію. "Рослинна олія" стосується олії, отриманої з насіння рослин або горіхів. Рослинна олія зазвичай є "тригліцеридами з довгим ланцюгом" (ТДЛ), утвореними коли три жирні кислоти (зазвичай довжиною 14-22 атоми вуглецю, з ненасиченими зв'язками у перемінній кількості та розташуванні, залежно від джерела олії) формують естерні зв'язки з трьома гідроксильними групами гліцерину. У певних варіантах втілення, рослинні олії високої чистоти (так звані "супер рафіновані") використовують для забезпечення безпеки та стабільності емульсії олія-у-воді. У певних варіантах втілення, гідратовані рослинні олії, одержані контрольованим гідруванням рослинної олії, використовують у даному винаході. Приклади рослинних олій включають проте не обмежуються наступними: мигдальна олія, олія бабасу, олія насіння чорної смородини, олія бурачника, олія каноли, касторова олія, кокосова, кукурудзяна олія, бавовняна олія, оливкова олія, арахісова олія, пальмова олія, кісточкова пальмова олія, рапсова олія, сафлорова олія, соєва олія, соняшникова олія та кунжутна олія. Також використовують гідратовані та/або частково гідратовані форми цих олій. Бажаними оліями є соняшникова олія, кунжутна олія, кукурудзяна олія, оливкова олія та/або соєва олія. Найбільш бажаними оліями є сафлорова олія, та/або соєва олія. Композиції, де олійна фаза є соєвою олією, є найбільш бажаними. У особливо бажаному варіанті втілення, соєва олія може містити пальмітинову кислоту на рівні 9-13 %, стеаринову кислоту на рівні 2,5 % - 5 %, олеїнову кислоту на рівні 17 % - 30 %, лінолеву кислоту на рівні 48 % - 58 %, та ліноленову кислоту на рівні 5 % та 11 %. У бажаному варіанті втілення, емульсійні композиції містять не більше ніж 3 % мас./мас., більш бажано менше ніж 2 % мас./мас. та найбільш бажано менше ніж 1 % мас./мас. структурованих тригліцеридів. "Структуровані тригліцериди" як використано в даному документі, означає тригліцериди, що містять тригліцериди або суміші тригліцеридів з щонайменше однією жирною кислотою з довжиною вуглецевого ланцюга 6-12 атомів вуглецю, та щонайменше однією жирною кислотою з довжиною вуглецевого ланцюга більше ніж 12 атомів вуглецю. У іншому варіанті втілення, емульсійні композиції містять структуровані тригліцериди у кількості вираженій як мас. %/мас. загального вмісту олійної фази, не більше ніж 30 %, бажано не більше ніж 20 %, більш бажано не більше ніж 10 %, найбільш бажано не більше ніж 5 %. У певних варіантах втілення, олія емульсійних композицій олія-у-воді, описаних у даному документі, може додатково або альтернативно містити тригліцериди середньої довжини ланцюга. "Тригліцериди середньої довжини ланцюга" (ТСЛs) є іншим класом тригліцеридів олії, які можуть бути природними або штучними. ТСЛs утворюються з жирних кислот довжиною 6-10 атомів вуглецю. ТСЛs головним чином використовують у емульсіях для ін'єкцій як джерело калорій. Така олія є наявною на ринку як, наприклад, Miglyol 812 (SASOL GmbH, Германія), або CRODAMOL GTCC-PN (Croda Inc, Нью-Джерсі). Також у даному винаході використовують інші олії середньої довжини ланцюга з низькою температурою плавлення. У певних варіантах втілення, у даному винаході використовують комбінації рослинної олії та ТСЛ олії. У бажаному варіанті втілення, олія що міститься у композиції даного винаходу містить менше ніж або дорівнює 35 % (мас./мас.) тригліцеридів середньої довжини ланцюга (ТСЛ), бажано менше ніж або дорівнює 25 % (мас./мас.) ТСЛ, більш бажано менше ніж або дорівнює 10 % (мас./мас.) ТСЛ, найбільш бажано менше ніж або дорівнює 5 % (мас./мас.) ТСЛ. У іншому варіанті втілення, олійна фаза містить тваринний жир. "Тваринний жир" стосується олії, одержаної з тваринного джерела. Тваринний жир також містить тригліцериди, проте їх довжина та ненасичені зв'язки у трьох жирно кислотних ланцюгах відрізняться, у порівнянні з рослинними оліями. Тваринний жири утворюють джерела, що є твердими при кімнатній температурі та можуть ставати рідкими, у разі потреби. Інші види тваринних жирів, що є рідкими при кімнатній температурі, включають олії морських тварин, такі як рибна олія. Тригліцериди рибної олії зазвичай містять жирні кислоти з 12-22 атомами вуглецю. Приклади рибної олії включають, наприклад, високо очищені концентрати рибної олії. У певних варіантах втілення, олійна фаза є сумішшю однієї або кількох ТДЛ олій та/або ТСЛ 7 UA 107221 C2 5 10 15 20 25 30 35 40 45 50 55 60 олій та/або олії морських тварин. Хоча є дані що ТСЛ здатні покращувати солюбілізацію активних інгредієнтів у порівнянні з менш полярними ТДЛ, присутність переважно ТСЛ в емульсії для ін'єкцій асоціюється з небажаними металічними ефектами, та таким чином може відповідати вимогам стабільності та безпеки. Більш того, продукти гідролізу ТСЛ, такі як естери каприлової кислоти, мають шкідливі неврологічні побічні ефекти. У бажаному варіанті втілення, композиції даного винаходу таким чином містять не більше ніж 3 %мас./мас. ТСЛ, бажано не більше ніж 2 % мас./мас. ТСЛ, найбільш бажано не більше ніж 1 %мас./мас. ТСЛ. У бажаних варіантах втілення, емульсії даного винаходу не містять ТСЛ олій. У одному варіанті втілення, емульсія містить не більше ніж 0,9 % мас./мас., бажано не більше ніж 0,8 % мас./мас., більш бажано не більше ніж 0,5 % мас./мас. модифікаторів полярності, вибраних з групи, що складається з монoгліцеридів, дигліцеридів, ацетильованих монoгліцеридів, ацетильованих дигліцеридів та/або їх суміші. У іншому варіанті втілення, емульсія містить не більше ніж 0,9 % мас./мас., бажано не більше ніж 0,8 % мас./мас., більш бажано не більше ніж 0,5 % мас./мас. монoгліцеридів. Інакше кажучи, емульсія бажано містить не більше ніж 30 мас. %, більш бажано не більше ніж 20 мас. %, ще більш бажано не більше ніж 10 мас. % та найбільш бажано не більше ніж 5 мас. % фосфоліпідів, модифікаторів полярності, вибраних з групи, що складається з монoгліцеридів, дигліцеридів, ацетильованих монoгліцеридів, ацетильованих дигліцеридів та/або їх суміші. Вважається, що застосування модифікаторів полярності у значній концентрації у порівнянні з фосфоліпідами емульсії має шкідливий вплив стабілізуючі властивості фосфоліпідів. У іншому варіанті втілення, композиції містять модифікатор полярності, вибраний з групи, що складається з монoгліцеридів, дигліцеридів, ацетильованих монoгліцеридів, ацетильованих дигліцеридів та/або їх суміші, у кількості вираженій в мас. %/мас. загального вмісту олійної фази, менше ніж 20 %, бажано менше ніж 10 %, більш бажано менше ніж 5 %, найбільш бажано менше ніж 2 %. У іншому варіанті втілення, олійна фаза містить менше ніж або дорівнює 10 % мас./мас. загального вмісту в олії монoгліцеридів та/або ацетильованих монoгліцеридів. Загальний вміст олії (мас./об.) композиції за варіантом втілення даного винаходу "прогестоген/олія" становить щонайменше 0,5 % та не більше ніж 10 % (мас./об.). Загальний вміст олії композиції за обома варіантами втілення "Прогестерон" та "Прогестоген/олія" бажано становить щонайменше 1 %, більш бажано щонайменше 2 %, ще більш бажано щонайменше 4 %, найбільш бажано щонайменше 5 % (мас./об.). Загальний вміст олії емульсії даного винаходу бажано менше ніж або дорівнює 9 % (мас./об.), ще більш бажано менше ніж або дорівнює 8 % (мас./об.), та найбільш бажано менше ніж або дорівнює 7 % (мас./об.). У бажаному варіанті втілення, композиції даного винаходу містить 6 мас%/об. олії, бажано соєвої олії. Бажано соєва олія може мати вміст лінолеїнової кислоти більше ніж 48 %, та олеїнової кислоти більше ніж 17 %. Прикладом соєвої олії з такими властивостями є рафінована соєва олія виробництва Fresenius Kabi (Швеція). У певних варіантах втілення, значна порція прогестогену знаходиться всередині крапель олії емульсії олія-у-воді. У певних варіантах втілення, більше ніж 80 % прогестогену розчиняється та залишається всередині крапель олії. У певних варіантах втілення, більше ніж 85 %, 90 %, 92 %, 94 %, 95 %, 96 %, 97 %, 98 %, 99 % або 99,5 % прогестогену розчиняється в олійній фазі. Водне середовище Емульсії олія-у-воді даного винаходу додатково містять водне середовище. "Водне середовище" або "водна фаза" стосується водо-вмісної рідини. У бажаних варіантах втілення, водне середовище означає воду та/або водний забуферений розчин. Композиції за варіантом втілення даного винаходу "Прогестоген/олія" містять 80-99,4мас%/об водного середовища. Бажано, композиції за варіантом втілення "Прогестоген/олія" та "Прогестерон" містять 9097мас%/об. водного середовища. Композиції даного винаходу також необов'язково містять 0-4 мM фізіологічно прийнятного буферного агента. Фосфоліпіди Композиції даного винаходу додатково містять один або кілька емульсифікаторів/поверхнево-активних речовин, включаючи фосфоліпіди. Емульсифікатори, використані у даному винаході, бажано мають природне походження. Емульсифікатори природного походження включають соєвий лецитин, яєчний лецитин, лецитин соняшникової олії, сфінгозин, гангліозиди, та фітосфінгозин та їх комбінації. Гідратований лецитин, тобто, продукт контрольованого гідрування лецитину, також використовують у даному винаході. Композиції за варіантом втілення даного винаходу "Прогестоген/олія" містять 0,0425 % 8 UA 107221 C2 5 10 15 20 25 30 35 40 45 50 55 60 4,1мас%/об., бажано 0,064 % - 3,4мас%/об. фосфоліпідів. Приклади фосфоліпідів придатних у даному винаході включають, проте не обмежуються наступними: фосфатиділхолін, фосфатиділетаноламін, фосфатиділгліцерин, фосфатидна кислота та їх суміші. Вони зазвичай містять 4-22 атоми вуглецю, та більш зазвичай 10-18 атомів вуглецю з різною ступенем насичення. Фосфоліпід ний компонент емульсії олія-у-воді може бути представлений або одним фосфоліпідом або сумішшю кількох фосфоліпідів. Використані фосфоліпіди можуть мати природне та штучне походження, проте повинні бути прийнятними для парентерального, особливо внутрішньовенного введення. Нижче наведено невичерпний перелік придатних фосфоліпідів: фосфатидні кислоти, включаючи наступні: 1,2-диміристоїл-сн-гліцеро-3-фосфатидна кислота, натрієва сіль (DMPA, Na), 1,2-дипальмітоїл-сн-гліцеро-3-фосфатидна кислота, натрієва сіль (DPPA, Na),1,2-дистеароїл-сн-гліцеро-3-фосфатидна кислота, натрієва сіль (DSPA, Na); фосфохоліни, включаючи 1,2-дилауроїл-сн-гліцеро-3-фосфохолін (DLPC), 1,2-диміристоїл-снгліцеро-3-фосфохолін (DMPC), 1,2-дипальмітоїл-сн-гліцеро-3-фосфохолін (DPPC), 1,2дистеароїл-сн-гліцеро-3-фосфохолін (DSPC); фосфоетаноламіни, включаючи 1,2-дилауроїл-снгліцеро-3-фосфоетаноламін (DLPE), 1,2-диміристоїл-сн-гліцеро-3-фосфоетаноламін (DMPE), 1,2-дипальмітоїл-сн-гліцеро-3-фосфоетаноламін (DPPE), 1,2-дистеароїл-сн-гліцеро-3фосфоетаноламін (DSPE); фосфогліцерини, включаючи 1,2-дилауроїл-сн-гліцеро-3фосфогліцерин, натрієва сіль (DLPG, Na), 1,2-диміристоїл-сн-гліцеро-3-фосфогліцерин, натрієва сіль (DMPG, Na), 1,2-диміристоїл-сн-гліцеро-3-фосфо-сн-1-гліцерин, сіль амонію (DMPсн-1-G, NH4), 1,2-дипальмітоїл-сн-гліцеро-3-фосфогліцерин, натрієва сіль (DPPG, Na), 1,2дистеароїл-сн-гліцеро-3-фосфогліцерин, натрієва сіль (DSPG, Na), 1,2-дистеароїл-сн-гліцеро-3фосфо-сн-1-гліцерин, натрієва сіль (DSP-сн-1G, Na); фосфосерини, включаючи 1,2дипальмітоїл-сн-гліцеро-3-фосфо-L-серин, натрієва сіль (DPPS, Na); фосфоліпіди зі змішаним ланцюгом, включаючи 1-пальмітоїл-2-олеоїл-сн-гліцеро-3-фосфохолін (POPC), 1-пальмітоїл-2олеоїл-сн-гліцеро-3-фосфогліцерин, натрієва сіль (POPG, Na), 1-пальмітоїл-2-олеоїл-сн-гліцеро3-фосфогліцерин, сіль амонію (POPG, NH4); лізoфосфоліпіди, включаючи 1-пальмітоїл-2-лізoсн-гліцеро-3-фосфохолін (P-лізo-PC), 1-стеароїл-2-лізo-сн-гліцеро-3-фосфохолін (S-лізo-PC); пегильовані фосфоліпіди, включаючи N-(карбоніл-метоксиполіетиленгліколь 2000)-MPEG-2000DPPE, натрієва сіль, N-(карбоніл-метоксиполіетиленгліколь 5000)-MPEG-5000-DSPE, натрієва сіль, N-(карбоніл-метоксиполіетиленгліколь 5000)-MPEG-5000-DPPE, натрієва сіль, N-(карбонілметоксиполіетиленгліколь 750)-MPEG-750-DSPE, натрієва сіль, N-(карбонілметоксиполіетиленгліколь 2000)-MPEG-2000-DSPE, натрієва сіль. У бажаному варіанті втілення, масова кількість фосфоліпіду в композиції даного винаходу від загального об'єму композиції (мас./об.) становить щонайменше 0,064 %, бажано щонайменше 0,085 %, більш бажано щонайменше 0,25 %, ще більш бажано щонайменше 0,3 %, ще більш бажано щонайменше 0,35 %, найбільш бажано щонайменше 0,5 %. У іншому бажаному варіанті втілення, масова кількість фосфоліпіду у композиції даного винаходу від загального об'єму композиції (мас./об.) становить менше ніж або дорівнює 3,4 %, бажано менше ніж або дорівнює 3,3 %, більш бажано менше ніж або дорівнює 2,6 %, ще більш бажано менше ніж або дорівнює 2,3 %, ще більш бажано менше ніж або дорівнює 2,2 %, найбільш бажано менше ніж або дорівнює 2,1 % Найбільш бажані композиції містять фосфоліпід у кількості (мас./об.) 0,7 % - 2,0 %, бажано в діапазоні від 1,0 % до 1,3 %, найбільш бажано 1,02 %. Композиції, що містять фосфоліпід в зазначених рамках, проявляють прекрасну фізичну стабільність та pH стабільність протягом зберігання. У найбільш бажаному варіанті втілення, фосфоліпідний компонент містить суміш фосфоліпідів, таких як 79 % фосфатиділхоліну, 18 % фосфатидилетаноламіну, 2 % сфінгомієліну та 1 % лізофосфатиділхоліну. У бажаному варіанті втілення, джерелом фосфоліпідного емульсифікатора даного винаходу є лецитин, бажано яєчний лецитин. Згідно з Фармакопеєю США (USP), лецитин є незахищеною назвою, що описує комплекс суміші ацетон-нерозчинних фосфоліпідів, що головним чином складається з фосфатиділхоліну, фосфатидилетаноламіну, фосфатиділсерину та фосфатиділінозитолу, змішаної з різною кількістю інших сполук, таких як тригліцериди, жирні кислоти та вуглеводні. Соєвий лецитин та яєчний лецитин (включаючи гідратовані варіанти цих сполук) є безпечними для біологічних систем, володіють комбінованими властивостями емульгування та солюбілізації, та метаболізуються in vivo у нешкідливі сполуки швидше ніж більшість штучних поверхнево-активні речовин. Наявними на ринку соєвими лецитинами/фосфоліпідами є продукти Centrophase та Centrolex (Central Soya), Phospholipon (Phospholipid GmbH, Германія), 9 UA 107221 C2 5 10 15 20 25 30 35 40 45 50 55 60 Lipoid (Lipoid GmbH, Германія), EPIKURON (Degussa), та PL90 (Fresenius Kabi, Швеція). У бажаному варіанті втілення, джерелом фосфоліпіду є яєчний лецитин. У певних варіантах втілення, загальна кількість емульсифікатора, включаючи фосфоліпід, у композиції даного винаходу знаходиться в діапазоні 0,05 мас. % - 4,8 мас. % від загального об'єму композиції (мас./об.). У бажаних варіантах втілення, кількість лецитину (мас./об.) даного винаходу, становить менше ніж або дорівнює 4.2 %, бажано менше ніж або дорівнює 3,4 %, більш бажано менше ніж або дорівнює 2,9 %, ще більш бажано менше ніж або дорівнює 2,6 %, ще більш бажано менше ніж або дорівнює 2,5 %, найбільш бажано менше ніж або дорівнює 2,0 %. У певних варіантах втілення загальна кількість лецитину, особливо яєчного лецитину, (мас./об.) становить більше ніж або дорівнює 0,08 %, більш бажано більше ніж або дорівнює 0,1 %, ще більш бажано більше ніж або дорівнює 0,15 %, більш бажано більше ніж або дорівнює 0,2 %, ще більш бажано більше ніж або дорівнює 0,3 %, ще більш бажано більше ніж або дорівнює 0,35 %, найбільш бажано більше ніж або дорівнює 0,6 %, Найбільш бажані композиції містять яєчний лецитин у кількості (мас./об.) в діапазоні від 0,8 % дo 2,3 %, бажано 0,9 % - 1,5 %, більш бажано 1,0 % - 1,3 %, ще більш бажано 1,2 %. У одному варіанті втілення, яєчний лецитин містить 60-80мас. %/мас., бажано 67мас. %/мас. фосфатиділхоліну; 10-20мас. %/мас., бажано 15 % мас./мас. фосфатиділетаноламіну; ≤3 % мас./мас., бажано 2 % мас./мас. сфінгомієліну; та ≤3 % мас./мас., бажано 1 % мас./мас. лізoфосфатиділхоліну. "Яєчний лецитин PL90" (Fresenius Kabi AB) є прикладом яєчного лецитину з таким вмістом фосфоліпідів. У одному варіанті втілення, композиції даного винаходу містять не більше ніж 1,5 % мас./мас., бажано не більше ніж 1,2 % мас./мас., більш бажано не більше ніж 0,8 % мас./мас., та найбільш бажано не більше ніж 0,4 % мас./мас. поліетиленгліколь 15-гідроксистеарату. У іншому варіанті втілення композиції даного винаходу містять не більше ніж 1,5 % мас./мас., бажано не більше ніж 1,2 % мас./мас., більш бажано не більше ніж 0,8 % мас./мас., найбільш бажано не більше ніж 0,4 % мас./мас. естеру поліетиленгліколь та/або поліетиленпропіленгліколю. Спів-поверхнево-активна речовина Композиції даного винаходу необов'язково містять спів-поверхнево-активну речовину. Без прив'язки до теорії, спів-поверхнево-активні речовини стабілізують ліпідні краплі протягом формування емульсії, таким чином впливаючи на розмір крапель емульсія та стабільність отриманої емульсійної композиції. Спів-поверхнево-активні речовини придатні для застосування у композиціях даного винаходу є такими, що попереджують флокуляцію та/або коалесценцію ліпідної емульсії. Приклади спів-поверхнево-активних речовин включають, проте не обмежуються наступними: холестерин, олеїнова кислота, олеат, Tween80 (PEG-сорбітан монoолеат), HCO-60, Solutol H15 (поліоксиетилен-660-гідроксистеарат), PEG-400 (поліетиленгліколь), Pluronic F68 (BASF), Cremophor EL (поліоксиетилен-35-рицинолеат), або сіль жовчної кислоти, такої як деоксихолева кислота. У інших варіантах втілення, співповерхнево-активну речовину вибирають з групи, що складається з наступних: C 12-C22 жирні кислоти, їх солі, та/або їх суміші, бажано C16-C20 жирні кислоти, їх солі, та/або їх суміші, найбільш бажано C18 жирні кислоти, їх солі, та/або їх суміші. У бажаних варіантах втілення, жирна кислота є моно-ненасиченою. У деяких варіантах втілення, спів-поверхнево-активна речовина наявна у композиціях даного винаходу у кількості (мас./об.) більше ніж або дорівнює 0,005 %, бажано більше ніж або дорівнює 0,01 %, більш бажано більше ніж або дорівнює 0,02 %. У інших варіантах втілення, спів-поверхнево-активна речовина наявна у композиціях даного винаходу у кількості (мас./об.) менше ніж або дорівнює 4 %, бажано менше ніж або дорівнює 1 %, більш бажано менше ніж або дорівнює 0,04 %. У бажаному варіанті втілення, спів-поверхнево-активну речовину вибирають з групи, що складається з наступних: жирні кислоти з довгим ланцюгом, такі як пальмітинова кислота, олеїнова кислота або стеаринова кислота, або їх лужні солі. Олеат та/або олеїнова кислота, особливо олеат натрію, є найбільш бажаними спів-поверхнево-активними речовинами. У певних варіантах втілення, де спів-поверхнево-активною речовиною є олеат та/або олеїнова кислота, спів-поверхнево-активна речовина наявна у кількості (мас./об.) що дорівнює або більше ніж 0,005 %, бажано дорівнює або більше ніж 0,01 %, ще більш бажано дорівнює або більше ніж 0,02 %. У певних варіантах втілення, де спів-поверхнево-активною речовиною є олеат та/або олеїнова кислота, спів-поверхнево-активна речовина наявна у кількості (мас./об.) менше ніж або дорівнює 0,5 %, бажано менше ніж або дорівнює 0,2 %, більш бажано менше ніж або дорівнює 0,1 %, найбільш бажано менше ніж або дорівнює 0,05 %. У бажаному варіанті втілення, спів-поверхнево-активною речовиною є олеат натрію, 10 UA 107221 C2 5 10 15 20 25 30 35 40 45 50 55 60 присутній у кількості 0,03мас%/об. Композиції даного винаходу бажано є придатними для парентеральної інфузії, бажано внутрішньовенної інфузії, протягом довготривалих періодів. Звичайна тривалість введення може складати, наприклад, 3-7 діб. У бажаному варіанті втілення, концентрація певних cпівповерхнево-активних речовин повинна таким чином підтримуватись на мінімумі для запобігання побічним ефектам, таким як збудливість, інгібування цитохрому P450 тощо. У бажаному варіанті втілення, Pluronic F68 (полі(етиленгліколь)-13-полі(пропіленгліколь спів-пропіленгліколь) наявний у кількості менше ніж 0,7 % (мас./мас.), бажано менше ніж 0,5 % (мас./мас.). У іншому бажаному варіанті втілення, Solutol-HS (Macrogol-15-гідроксистеарат) наявний у кількості менше ніж 1,2 % (мас./мас.), бажано менше ніж 1 % (мас./мас.). Осмотичний агент Композиції за варіантом втілення даного винаходу "Прогестоген/олія" містять осмотичний агент та/або модулятор тонічності. Бажано, такі композиції мають осмотичний тиск в діапазоні 200-1000 мОсм/кг. У бажаному варіанті втілення "прогестоген/олія" та "прогестерон", композиції даного винаходу є ізотонічними та ізо-осмотичними. Композиції даного винаходу переважно мають осмотичний тиск 220-600 мОсм/кг, найбільш бажано 230-360 мОсм/кг. Придатні модулятори осмотичного тиску та/або тонічності включають хлорид натрію або калію, трегалозу, цукрозу, сорбітол, гліцерин, глюкозу, ксилітол, манітол, поліетиленгліколь, пропіленгліколь, альбумін, амінокислоти та їх суміші. У певних варіантах втілення, осмотичний тиск 270-330 мОсм/кг, бажано 280-300 мОсм/кг, досягається за допомогою агента, що також підвищує осмотичний тиск, такого як гліцерин, декстроза, лактоза, сорбіт або цукроза. У бажаному варіанті втілення, осмотичний агент є фізіологічно прийнятним поліолом, таким як гліцерин, сорбітол або ксилітол. У бажаному варіанті втілення, осмотичним агентом є гліцерин. Осмотичний агент та/або агент, що регулює тонічність композицій даного винаходу, зазвичай використовують у концентрації, що не викликає шкідливих біологічних ефектів. Кінцевий продукт бажано ізотонічний, так що можна використовувати катетер для інфузії емульсій у центральні або периферичні вени. У бажаних варіантах втілення, де гліцерин є осмотичним агентом, гліцерин наявний у концентрації (мас./об.) більше ніж 1 %, бажано більше ніж 2 %, більш бажано більше ніж 2,3 %. У іншому бажаному варіанті втілення, гліцерин наявний у концентрації (мас./об.) менше ніж 5 %, бажано менше ніж 3 %, більш бажано менше ніж 2,7 %. У бажаному варіанті втілення, емульсії даного винаходу містять 2,5 % гліцерину. pH регулюючий агент Композиції даного винаходу мають pH в діапазоні від pH 6,0-pH 9,0, бажано pH 6,5-pH 8,5, найбільш бажано pH 7,0 – 8,0. pH Композиції регулюють відомими у галузі способами, наприклад, шляхом застосування відповідної основи, яка нейтралізує негативний заряд жирних кислот, через застосування відповідного буферу, або їх комбінації. Різноманітні основи та буфери є придатними для застосування з емульсіями даного винаходу. Фахівець у галузі розуміє, що додавання буферу до емульсії вплине не тільки на кінцеву pH, але й на іонну силу емульсії. Висока іонна сила буферів може негативно вплинути на зета-потенціал емульсії, та тому не є бажаною. У бажаних варіантах втілення, pH регулюють до бажаного значення шляхом додавання 1N гідроксиду натрію. Необов'язкові добавки Композиції даного винаходу необов'язково містять одну або кілька фармацевтично прийнятних похідних, таких як підкислювачі, лугувальні агенти, зв'язувальні речовини, хелатуючі агенти, комплексоутворювачі, солюбілізатори, антисептики, консерванти (включаючи антимікробні агенти та антиоксиданти), суспендувальні агенти, стабілізатори, змочувачі, модифікатори в'язкості, розчинники, кріопротектори, розбавники, лубриканти або інші біосумісні матеріали. У певних варіантах втілення, такі добавки допомагають стабілізувати колоїдну дисперсію або зробити композиції даного винаходу біосумісними. У одному варіанті втілення, композиції даного винаходу не містять Вітамін E. У іншому варіанті втілення, композиції даного винаходу не містять Вітамін C. У іншому варіанті втілення, композиції даного винаходу не містять гексанатрію фітат. У бажаному варіанті втілення, композиції даного винаходу не містять, або по суті не містять спирт. У одному варіанті втілення, композиції даного винаходу не містять, або по суті не містять етанол. У іншому варіанті втілення, композиції даного винаходу додатково або альтернативно не містять органічні розчинники. Бажано, композиції за варіантом втілення даного винаходу "Прогестерон" містять менше ніж 11 UA 107221 C2 5 10 15 20 25 30 35 40 45 50 55 60 2,5мас%/об. бензил бензоату. Композиції за варіантом втілення "Прогестерон" та композиції за варіантом втілення "Прогестоген/олія" бажано містять менше ніж 1 мас%/об. бензил бензоату. Ще більш бажано, вказані композиції містять менше ніж 1 мас%/об. бензилових спиртів та/або їх похідних. У бажаних варіантах втілення, композиції даного винаходу не містять бензил бензоату, та у бажаних варіантах втілення не містять бензилових спиртів та/або їх похідних. У іншому бажаному варіанті втілення, композиції даного винаходу не містять циклодекстрину. Співвідношення компонентів емульсії Хоча приклади кількостей різних сполук, що можна включати у композиції винаходу наведено вище, інші аспекти винаходу які відносяться до співвідношення певних сполук, описані нижче. Співвідношення прогестоген: олія Як було зазначено вище, композиції винаходу переважно мають низький вміст олії, таким чином, що мінімальна кількість ліпідів доставляється суб'єкту на одиницю об'єму введеної композиції, таким чином що уникають шкідливих зворотних ефектів, таких як гіперліпідемія. Більш того, в деяких варіантах втілення, композиції досягають покращеної розчинності прогестогену в олії, при цьому підтримуючи або покращується хімічна та/або фізична стабільність емульсії, таким чином що вищі дози прогестогену доставляються суб'єкту на одиницю олії. Композиції згідно з варіантом втілення "Прогестерон" зазвичай містять прогестерон та олію у співвідношенні прогестерону до загальної кількості олійного компоненту (мас./мас.) щонайменше 1:35, більш бажано щонайменше 1:33, ще більш бажано щонайменше 1:32. У бажаних варіантах втілення "Прогестоген/олія" та "Прогестерон", співвідношення прогестогену до загальної кількості олійного компоненту (мас./мас.) становить щонайменше 1:31. Зазвичай, останнє співвідношення не перевищує 1:22, більш бажано, не перевищує 1:23, більш бажано не перевищує 1:24, більш бажано не перевищує 1:25, більш бажано не перевищує 1:26, більш бажано не перевищує 1:27, ще більш бажано не перевищує 1:28 and найбільш бажано не перевищує 1:29. У одному варіанті втілення, співвідношення прогестогену до олійного компоненту is становить 1:32-1:25 (мас./мас.), ще більш бажано 1:31-1:29 (мас./мас.). У бажаних варіантах втілення, композиції даного винаходу містять прогестоген, бажано прогестерон, у кількості вираженій як %мас./мас. олії більше ніж 1 % бажано більше ніж 1,5 %, більш бажано більше ніж або дорівнює 2 %, особливо більше ніж або дорівнює 2,2 %. У ще більш бажаних варіантах втілення, прогестоген присутній у кількості більше ніж 2,5 %, ще більш бажано більше ніж 3 %, найбільш бажано більше ніж 3,2 мас. %/мас. олії. Співвідношення фосфоліпід: олія З'ясували, що надлишок кількості фосфоліпіду у композиціях олія-у-воді може привести до збільшення кількості продуктів розкладання фосфоліпідів після автоклавування та/або зберігання, викликаючи зниження pH, що в свою чергу негативно впливає на стабільність емульсії. Більш того, надлишок фосфоліпіду може призвести до збільшення кількості міцел, що не містять жиру, у композиціях, та таким чином небажане підвищення значення PFAT 5. З іншого боку, композиції з низьким рівнем фосфоліпідів не проявляють достатньої стабільності крапель емульсії щоб витримати стерилізацію шляхом автоклавування та зберігання. Композиції даного винаходу мають оптимальну кількість олії та фосфоліпідів, таким чином що досягається оптимальний розподіл розміру частинок та покращена фізична стабільність, у той час як pH залишається у бажаному діапазоні протягом стерилізації теплом та зберігання. У одному варіанті втілення, композиції даного винаходу містять фосфоліпід у кількості, вираженій у мас. %/мас. олії, на рівні більше ніж або дорівнює 6,8 %, бажано більше ніж або дорівнює 8,4 %, більш бажано більше ніж або дорівнює 12 %, ще більш бажано більше ніж або дорівнює 14 %, найбільш бажано більше ніж або дорівнює 15 %. У одному варіанті втілення, композиції даного винаходу містять фосфоліпід у кількості, вираженій у % мас./мас. олії, на рівні менше ніж або дорівнює 43 %, бажано менше ніж або дорівнює 42,5 %, більш бажано менше ніж або дорівнює 26 %, ще більш бажано менше ніж або дорівнює 25 %, найбільш бажано менше ніж або дорівнює 22 %. У бажаному варіанті втілення, фосфоліпід наявний у кількості в діапазоні від 16 дo 18 % (мас./мас.) олії. У іншому варіанті втілення, композиції даного винаходу містять лецитин, бажано яєчного лецитину, у кількості, вираженій у% мас./мас. олії, на рівні більше ніж або дорівнює 8 %, бажано більше ніж або дорівнює 10 %, більш бажано більше ніж або дорівнює 13 %, ще більш бажано більше ніж або дорівнює 15 %, найбільш бажано більше ніж або дорівнює 18 %. 12 UA 107221 C2 5 10 15 20 25 30 35 40 45 50 55 60 У одному варіанті втілення, композиції даного винаходу містять лецитин, бажано яєчного лецитину, у кількості вираженій у % мас./мас. олії, на рівні менше ніж або дорівнює 50 %, бажано менше ніж або дорівнює 48 %, більш бажано менше ніж або дорівнює 40 %, ще більш бажано менше ніж або дорівнює 33 %, найбільш бажано менше ніж або дорівнює 31 %. У бажаному варіанті втілення, яєчний лецитин наявний у кількості в діапазоні від 19-21 % (мас./мас.) олії. Співвідношення спів-поверхнево-активна речовина: олія У певних варіантах втілення даного винаходу, композиції містять спів-поверхнево-активну речовину, бажано олеат або олеїнову кислоту. У одному варіанті втілення, спів-поверхневоактивна речовина наявна у кількості, вираженій у мас. %/мас. олії, більше ніж 0,02. Бажано, концентрація спів-поверхнево-активної речовини, що міститься у композиції, у кількості, вираженій у мас. %/мас. олії, становить більше ніж або дорівнює 0,08 %, бажано більше ніж або дорівнює 0,1 %, ще більш бажано більше ніж або дорівнює 0,3 %. У іншому бажаному варіанті втілення, концентрація спів-поверхнево-активної речовини, що міститься у композиції, у кількості, вираженій у мас. %/мас. олії, становить менше ніж або дорівнює 2 %, бажано менше ніж або дорівнює 0,9 %, ще більш бажано менше ніж або дорівнює 0,7 %. У бажаному варіанті втілення, спів-поверхнево-активною речовиною є олеат або олеїнова кислота, та вона наявна у кількості 0,5 % олії (мас./мас.). Співвідношення спів-поверхнево-активна речовина: фосфоліпід У одному варіанті втілення даного винаходу, композиції містять фосфоліпід та співповерхнево-активну речовину, бажано олеат. У цьому варіанті втілення, спів-поверхневоактивну речовину та фосфоліпід бажано наявні у співвідношенні спів-поверхнево-активна речовина дo фосфоліпіду (мас./мас.) більше ніж або дорівнює 1:85, бажано більше ніж або дорівнює 1:82, більш бажано більше ніж або дорівнює 1:68, ще більш бажано більше ніж або дорівнює 1:51, найбільш бажано більше ніж або дорівнює 2:85. У цьому варіанті втілення, співповерхнево-активну речовину та фосфоліпід бажано наявні у співвідношенні спів-поверхневоактивну речовину дo фосфоліпід (мас./мас.) менше ніж або дорівнює 1:12, бажано менше ніж або дорівнює 1:17, більш бажано менше ніж або дорівнює 1:20, ще більш бажано менше ніж або дорівнює 1:26, найбільш бажано менше ніж або дорівнює 1:34. У бажаному варіанті втілення, де спів-поверхнево-активною речовиною є олеат, співвідношення спів-поверхнево-активної речовини дo фосфоліпіду (мас./мас.) знаходиться в діапазоні від 1:51 дo 1:30, бажано 1: 51-1:34. У іншому варіанті втілення даного винаходу, композиції містять лецитин та спів-поверхневоактивну речовину, бажано олеат. У цьому варіанті втілення, спів-поверхнево-активна речовина та лецитин бажано наявні у співвідношенні спів-поверхнево-активна речовина дo лецитину (мас./мас.) більше ніж або дорівнює 1:100, бажано більше ніж або дорівнює 1:80, більш бажано більше ніж або дорівнює 1:70, ще більш бажано більше ніж або дорівнює 1:60, найбільш бажано більше ніж або дорівнює 1:50. У цьому варіанті втілення, спів-поверхнево-активна речовина та лецитин бажано наявні у співвідношенні спів-поверхнево-активна речовина дo лецитину (мас./мас.) менше ніж або дорівнює 1:15, бажано менше ніж або дорівнює 1:20, більш бажано менше ніж або дорівнює 3:70, ще більш бажано менше ніж або дорівнює 1:30, найбільш бажано менше ніж або дорівнює 1:40. У бажаному варіанті втілення, де поверхнево-активною речовиною є олеат, та лецитином є яєчний лецитин, співвідношення спів-поверхнево-активної речовини дo лецитину (мас./мас.) знаходиться в діапазоні від 1:60 дo 1:30, бажано 1:60-1:35. Співвідношення Прогестоген: фосфоліпід У одному варіанті втілення, прогестоген наявний у кількості менше ніж 58 мас. %/мас. фосфоліпіду, бажано менше ніж 29 мас. %/мас. фосфоліпіду. Бажано, у іншому варіанті втілення композиції даного винаходу прогестоген є прогестероном, та прогестерон наявний у кількості, вираженій як мас. %/мас. фосфоліпіду, більше ніж 7,8 %, бажано більше ніж 9,8 %, більш бажано більше ніж 13 %, ще більш бажано більше ніж 15 %. Бажано, у іншому варіанті втілення композиції даного винаходу прогестогеном є прогестерон, та прогестерон наявний у кількості, вираженій як мас. %/мас. фосфоліпіду, менше ніж 47 %, бажано менше ніж 39 %, більш бажано менше ніж 26 %, ще більш бажано менше ніж 20 %. У одному варіанті втілення композиції даного винаходу прогестоген є прогестероном та фосфоліпід представлений лецитином, де прогестерон та лецитин наявні у мас./мас. співвідношенні 1:15-2:5, бажано 1:12-1:3, більш бажано 1:9-2:9, ще більш бажано 2:15-1:6. У бажаному варіанті втілення, співвідношення прогестерон - лецитин (мас./мас.) становить менше ніж 1:2, бажано менше ніж 1:4. 13 UA 107221 C2 5 10 15 20 25 30 35 40 45 50 55 60 Співвідношення Прогестоген:спів-поверхнево-активна речовина У одному варіанті втілення, спів-поверхнево-активна речовина наявна у композиціях даного винаходу у кількості більше ніж 2,5 мас. % прогестогену, бажано більше ніж 5 мас. % прогестогену. Пакування Композиції даного винаходу бажано є готовими до використання. "Готові до використання" як використано в даному документі, означає, що не потребують ніяких дій, таких як розведення або змішування різних компонентів. Композиції даного винаходу можуть постачатись у герметичній упаковці. Пакування повинно бути придатним для застосування з ліпідними композиціями та прогестогенами. Приклади матеріалів не придатних для пакування ліпідних композицій включають PVC та DEHP. Приклади матеріалів придатних для пакування ліпідних композицій включають, проте не обмежуються, пакуваннями на основі поліпропілену та скляними пляшками. Звичайне скло є бажаним пакуванням для композицій даного винаходу. У бажаному варіанті втілення, композиція упакована в герметичний контейнер. Контейнер можу бути додатково загорнутим для захисту від фізичного оточення. У одному варіанті втілення, композиція запакована у герметичний контейнер об'ємом 250 мл. У одному варіанті втілення, композиція упакована в герметичний контейнер із вільним простором з інертним газом. У інших варіантах втілення, композиції запаковані у інертні контейнери. У одному варіанті втілення, інертні контейнери є захищеними від світла. У іншому варіанті втілення, контейнер містить стінку з подвійним шаром, та у бажаному варіанті втілення, площа між двох шарів заповнена інертним газом для запобігання окисленню. Для тривалого зберігання матеріал для пакування повинен запобігати дифузії кисню з оточюваного повітря у композицію винаходу, запобігати утворенню продуктів розкладу кисню всередині композиції. У іншому варіанті втілення, композиція запакована у стандартне дозоване пакування. Стандартне дозоване пакування забезпечує достатню кількість композиції для введення суб'єкту болюсної дози прогестогену, або для введення композиції протягом першої години, бажано перших 2 годин, більш бажано перших 4 годин лікування. Стандартне дозоване пакування забезпечує швидке та придатне введення композиції у критичних випадках, наприклад, парамедиками у швидкій, або при першій допомозі/лікарем по місцю ушкодження/за випадком. Невичерпні приклади стандартних дозованих пакувань включають ін'єкції, наперед заповнені шприци, скляні колбочки, та/або герметичні пакування. У інших варіантах втілення, композиція запакована у пристрої, подібному до дозатору інсуліну, який використовують для постійного введення інфузії, або у картриджі, конструйованому для застосування з таким приладом. Приклади дозаторів інсуліну є дозатори виробництва MiniMed та Disetronic. Такі дозатори можуть містити наприклад, канюлю, резервуар або картридж, в якому зберігається композиція, насос, який може мати батарейки, та засоби, що дозволяють користувачу контролювати конкретну кількість доставленого активного компоненту, такі як наприклад, комп'ютерний чіп. Бажаний варіант втілення У бажаному варіанті втілення композиції даного винаходу, композиції містять 0,15-0,25 мас%/об. прогестерону; 5,0-7,0 мас%/об. олії; 1,0-1,4 мас%/об. яєчного лецитину; 80-98,9 мас%/об. води; та має pH на рівні 6,0-9,0. Композиції у цьому бажаному варіанті втілення представляють компроміс між доставкою бажаної кількості прогестогену на одиницю об'єму рідини, доставкою бажаної кількості прогестогену на одиницю олії, фізичною стабільністю та безпекою введення емульсії. Властивості емульсії Композиції даного винаходу мають молочно білий вигляд та візуально гомогенні. Значення PFAT5 Фармакопея США (USP) встановлює межу для розподілення розміру глобул у ліпідній ін'єктивній емульсії (USP 729-Pharm. Forum. 2005; 3:1448-1453). Межа жирових глобул діаметром >5 мкм в ін'єктивній емульсії, виражена як масовий процент на об'єм жиру >5 мкм, не перевищує 0,05 %, або PFAT5 не перевищує 0,05 %. Композиції зі значенням PFAT5 більше ніж 0,05 % вважаються небезпечними для внутрішньовенного введення. Значення PFAT5 емульсії залежить від кількох факторів, включаючи загальний вміст олії емульсії, вибір спів-поверхневоактивної речовини, співвідношення спів-поверхнево-активна речовина – олія, та стабільність крапель емульсії до коалесценції та/або флокуляції. Композиції даного винаходу мають значення PFAT5 яке менше ніж або дорівнює 0,05 %, бажано менше ніж або дорівнює 0,04 %, ще більш бажано менше ніж або дорівнює 0,02 %, 14 UA 107221 C2 5 10 15 20 25 30 35 40 45 50 55 60 найбільш бажано менше ніж або дорівнює 0,01 %. У одному варіанті втілення, діаметр 100 % крапель емульсійної композицій даного винаходу є меншим ніж або дорівнює 5мкм, та 98 % крапель, бажано 99 % крапель, меншим ніж або дорівнює 1,5 мкм. Розподілення розміру частинок крапель діаметром більше ніж 1 мкм визначають лічильником Coulter (Coulter Multisizer III). ФКС У одному варіанті втілення, краплі діаметром менше ніж або дорівнює 1 мкм, мають максимальне z-середнє 350 нм, та/або значення полідисперсії не більше ніж 0,25. У бажаному варіанті втілення, краплі діаметром менше ніж або дорівнює 1 мкм, мають максимальне zсереднє 250 нм, та/або значення полідисперсії не більше ніж 0,20. У ще більш бажаному варіанті втілення, краплі діаметром менше ніж або дорівнює than 1 мкм, мають максимальне zсереднє 220 нм, та/або значення полідисперсії не більше ніж 0,15. Середній розмір крапель Розмір крапель емульсії є ключовим параметром, що визначає кінетику дестабілізації емульсія, з огляду на те що розмір крапель напряму впливає на величину феномену, такого як коалесценція, розшарування, флокуляція, Оствальдівське дозрівання та в кінці кінців розділення фаз. Розмір крапель емульсії таким чином є показником стабільності емульсії. Багато параметрів вливає на розмір крапель емульсії, включаючи наприклад, вид олії, тип поверхнево-активної речовини та спів-поверхнево-активної речовини, наявність активних інгредієнтів, кількість олії, співвідношення олія-поверхнево-активна речовина та олія-співповерхнево-активна речовина. У одному варіанті втілення, частинки крапель емульсійної композиції даного винаходу мають об'ємний середній діаметр, або D[4,3] ≤300 нм, бажано ≤230 нм, більш бажано ≤200 нм, ще більш бажано ≤185 нм, та найбільш бажано ≤180 нм. У бажаному варіанті втілення, композиції даного винаходу підтримують об'ємний середній діаметр або D[4,3] на рівні ≤300 нм, бажано ≤230 нм, більш бажано ≤200 нм, ще більш бажано ≤185 нм та найбільш бажано ≤180 нм після одного, бажано двох, ще більш бажано трьох кіл автоклавування при 121 °C протягом 15 хв., та/або після зберігання при 60 °C протягом 3 тижнів, бажано 4 тижнів. Середній розмір крапель У одному варіанті втілення розмір крапель емульсійної композиції даного винаходу мають об'ємний середній діаметр або d(0,5) ≤300 нм, бажано ≤250 нм, більш бажано ≤200 нм, ще більш бажано ≤185 нм, та найбільш бажано ≤180 нм. У бажаному варіанті втілення, композиції даного винаходу підтримують об'ємний середній діаметр або d(0,5) на рівні ≤300 нм, бажано ≤250 нм, більш бажано ≤200 нм, ще більш бажано ≤185 нм, та найбільш бажано ≤180 нм, після одного, бажано двох, ще більш бажано трьох кіл автоклавування при 121 °C протягом 15 хв., та/або після зберігання при 60 °C протягом 3 тижнів, бажано 4 тижнів. Інтервал Значення Mastersizer "інтервал" є мірою ширини або збільшення кривої розподілення розміру частинок, та розраховують за формулою d(v, 0,9)-d(v, 0,1))/d(v, 0,5) одиниці Mastersizer. У певному варіанті втілення, композиції даного винаходу мають інтервал на рівні ≤ 2400, наприклад, ≤2100. Зета-потенціал Зета-потенціал стосується стабільності емульсії. Емульсії з високим зета-потенціалом є електрично стабілізованими, у той час як емульсії з низьким зета-потенціалом мають тенденцію до коагуляції або флокулювання. Зета-потенціал емульсії залежить від, наприклад, вибору та кількості поверхнево-активної речовини та спів-поверхнево-активної речовини, pH емульсії, а також іонної сили водного розчину. У одному варіанті втілення, композиції даного винаходу мають зета-потенціал в діапазоні від -30 мВ дo-70 мВ, бажано від -40 мВ дo-65 мВ, бажано від -51 мВ дo-60 мВ. Окрім цього, зетапотенціал емульсійної композиції даного винаходу може дорівнювати -30 мВ, -35 мВ, - 40 мВ, 45 мВ, -50 мВ, -55 мВ, -60 мВ, -65 мВ або -70 мВ або вище. Тверді частинки У певних варіантах втілення, композиції не містять кристалічних твердих речовин при температурі зовнішнього середовища (наприклад, при одній або кількох температурах, вибраних з 4 °C, 2 °C-8 °C або 20 °C-25 °C). Композиція містить 0-12 частинок на мл, що дорівнюють або більше ніж 10мкм, та 0-2 частинок на мл, що дорівнюють або більше ніж 25мкм. Стабільність емульсій Фізична стабільність 15 UA 107221 C2 5 10 15 20 25 30 35 40 45 50 55 60 Композиції даного винаходу неочікувано стерилізовані теплом. "Стерилізовані теплом" як використано в даному документі, означає, що композиції підтримують їхню фізичну стабільність, тобто, не розділяються на фази або показують ознаки флокуляції та/або коалесценції крапель після автоклавування при 121 °C протягом 15 хв. Композиції даного винаходу неочікувано стабільні до зберігання. "Стабільні до зберігання" як використано в даному документі, означає, що композиції підтримують їхню фізичну стабільність, тобто, не розділяються на фази або показують ознаки флокуляції та/або коалесценції крапель після трьох, бажано чотирьох тижнів зберігання при 60 °C. У бажаному варіанті втілення, композиції даного винаходу мають значення PFAT5 менше ніж 0,05 %, бажано менше ніж або дорівнює 0,03 %, ще більш бажано менше ніж або дорівнює 0,02 %, найбільш бажано менше ніж або дорівнює 0,01 % після автоклавування при 121 °C протягом 15 хв., та/або після трьох, бажано чотирьох тижнів зберігання при 60 °C. Композиції даного винаходу зазвичай не проявляють будь-яких ознак знебарвлення під час стерилізації шляхом автоклавування при 121 °C протягом 15 хв., та/або зберігання при 60 °C протягом трьох, бажано чотирьох тижнів. У іншому бажаному варіанті втілення, краплі емульсійної композиції даного винаходу показують збільшення середнього об'ємного діаметру або d(0,5) не більше ніж 2 %, бажано не більше ніж 1,5 %, ще більш бажано не більше ніж 1 % після автоклавування при 121 °C протягом 15 хв., та/або після трьох, бажано чотирьох тижнів зберігання при 60 °C. У іншому варіанті втілення, краплі емульсійної композиції даного винаходу показують збільшення середнього об'ємного діаметру або D[4,3], не більше ніж 2,5 %, бажано не більше ніж 2 %, ще більш бажано не більше ніж 1,5 % після автоклавування при 121 °C протягом 15 хв., та/або після трьох, бажано чотирьох тижнів зберігання при 60 °C. Хімічна стабільність У одному варіанті втілення, вміст прогестогену композицій даного винаходу зменшується не більш ніж на 10 мас. % прогестогену, бажано не більше ніж на 5 мас. % прогестоген, ще більш бажано не більше ніж на 2 мас. % прогестогену, після одного, бажано двох, ще більш бажано трьох кіл автоклавування при 121 °C протягом 15 хв., та/або після трьох, бажано чотирьох тижнів зберігання при 60 °C. У іншому варіанті втілення, кількість продуктів розкладання/окислення прогестогену у композиції даного винаходу не перевищує 1 мас. % прогестогену, бажано 0,7 мас. % прогестогену для будь-яких окремих хімічних класів, та загальна сума продуктів розкладання/окислення прогестогену не перевищує 3 мас. % прогестогену, після одного, бажано двох, ще більш бажано трьох кіл автоклавування при 121 °C протягом 15 хв., та/або після трьох, бажано чотирьох тижнів зберігання при 60 °C. У бажаному варіанті втілення, де прогестогеном є прогестерон, окремі рівні 6кетoпрогестерону, 6-гідроксипрогестерону та 20-гідроксипрогестерону (α- та β-), або δ-6прогестерону не перевищують 1 %, бажано не перевищують 0,7 мас. % прогестерону, та загальна сума продуктів розкладання прогестерону не перевищує 3 мас. % прогестерону, після одного, бажано двох, ще більш бажано трьох кіл автоклавування при 121 °C протягом 15 хв., та/або після трьох, бажано чотирьох тижнів зберігання при 60 °C. Кількість прогестогену та продуктів розкладання/окислення прогестогену підраховують за допомогою ВЕРХ. Компоненти емульсії самі по собі також є об'єктами хімічної нестабільності. Наприклад, фосфоліпіди розкладаються на неестерфіковані жирні кислоти (NEFA) протягом зберігання. Це є особливо проблематичним при тепловому стресі, такому як автоклавування та/або довготривале зберігання. Накопичення NEFA негативно впливає на pH емульсії та зета-потенціал. За цих причин рівень NEFA повинен бути обмеженим у композиціях даного винаходу. Бажано, рівень неестерфікованих жирних кислот (NEFA) композицій перед- або післяавтоклавування та/або зберігання протягом 3-х або 4-х тижнів при 60 °C становить ≤12 мЕкв/л, бажано становить менше ≤8 мЕкв/л. Стерильність У бажаному варіанті втілення, композиції даного винаходу є стерильними. Як використано у даному документі, "стерильний" стосується композицій, що проходять тест на стерильність USP розділ . Бажаними варіантами втілення є композиції, що відповідають вимогам USP розділ "тест на бактеріальний ендотоксин", та бажано відповідають вимогам USP Chapter "тест на лихоманку". Спосіб Інший аспект даного винаходу стосується способу виготовлення емульсійних композицій 16 UA 107221 C2 5 10 15 20 25 30 35 40 45 50 55 60 олія-у-воді як визначено у даному документі вище, вказаний спосіб включає наступні стадії: a) змішування води, фосфоліпіду та необов'язково осмотичного агента з одержанням водної композиції; b) змішування прогестогену та олії з одержанням олійної композиції; та c) змішування водної композиції та олійної композиції з наступною гомогенізацією з утворенням гомогенної емульсії олія-у-воді. У бажаному варіанті втілення, водну композицію гомогенізують з одержанням гомогенної суспензії, перед тим як вказану водну композицію об'єднують з олійною композицією. У іншому бажаному варіанті втілення, прогестоген додають дo олії з температурою щонайменше 40 °C для полегшення розчинення прогестогену. Бажано, олійну композицію фільтрують перед змішуванням з водною композицією. У бажаному варіанті втілення, спосіб виготовлення включає стадії: A) розчинення осмотичного агенту у водному середовищі та збовтування; B) додавання поверхнево-активної речовини, бажано яєчного лецитину та збовтування; C) необов'язкове додавання спів-поверхнево-активної речовини та pH регулюючого агента та перемішування; D) розчинення прогестогену в олії з одержанням олійної фази; E) фільтрування олійної фази, потім додавання фільтрованої олійної фази до водної фази, та перемішування; F) гомогенізація з одержанням гомогенної емульсії; G) необов'язкове додавання води; H) необов'язкове додавання достатньої кількості 1N NaOH для доведення pH до 8,0-8,8; I) необов'язкове додавання достатньої кількості водного середовища для досягнення кінцевого об'єму. У бажаному варіанті втілення, гомогенізацію здійснюють при 350 бар, бажано більше ніж або дорівнює 370 бар. У бажаному варіанті втілення, способи одержання емульсії даного винаходу включають стадії розчинення яєчного лецитину у водному середовищі (скоріше ніж у олії), додавання олійної фази до водної фази (скоріше ніж vice versa), та гомогенізації при 350 бар. Вважається, що ці стадії приводять до одержання емульсії з переважними властивостями щодо розміру частинок та стабільності емульсії. У бажаному варіанті втілення, емульсію запаковують у герметичні контейнери, та стерилізують бажано шляхом нагрівання до щонайменше 121 °C (наприклад, 121 °C-123 °C) протягом мінімум 15 хв. Програмою автоклаву бажано є роторний цикл. Далі наведено конкретний приклад способу одержання. Фахівець у галузі розуміє, що можливі різні модифікації та варіанти в рамках заявленого винаходу. Одержання пре-емульсії Чисту колбу (колба A) наповнювали до приблизно 15 % основного об'єму водним середовищем. Температуру водного середовища встановлювали на рівні приблизно 55-60 °C, та водне середовище дегазували азотом до встановлення залишкового вмісту кисню ≤ 0,1мг/л. Водне середовище витримувати в атмосфері азоту, з залишковим вмістом кисню ≤ 0,1мг/л, протягом всього процесу виробництва емульсії. Осмотичний агент додавали до водного середовища та перемішували на магнітній мішалці протягом приблизно 3-5 хв. при приблизно 50 Гц. Лецитин додавали до водної суміші. Необов'язково додавали спів-поверхнево-активну речовину та регулятор pH, та суміш перемішували на міксері значної потужності (наприклад, UltraTurrax) при приблизно 50 Гц до одержання гомогенної суспензії, яка візуально не містила на поверхні водної фази поверхнево-активну речовину. Олійна фаза: олію додають дo другої колби (колба B) та температуру доводять до приблизно 60 °C. Прогестоген потім розчиняють у нагрітій олії, шляхом перемішування на магнітній мішалці при приблизно 50 Гц протягом приблизно 10 хв. +/- 5 хв. Олійну фазу з колби B фільтрували крізь 0,2 мкм фільтр та повільно переносили до водної фази у колбу A. Пре-емульсію одержували постійним перемішуванням при приблизно 50 Гц протягом приблизно 15 хв. на міксері значної потужності (наприклад, Ultra Turrax) до одержання візуально гомогенної пре-емульсії. Одержання емульсії Пре-емульсію потім піддавали 4-м колам гомогенізації. Кожне коло гомогенізації включає першу стадію, де пре-емульсію піддавали тиску до приблизно 400 +/- 30 бар при температурі приблизно 50-80 °C (після теплообміну), та другу стадію, де пре-емульсію піддавали тиску до приблизно 100 +/- 30 бар при температурі приблизно 55-80 °C (після теплообміну). Емульсію фільтрували крізь 10 мкм фільтр у чистий накопичувальний резервуар, що містив 17 UA 107221 C2 5 10 15 20 25 30 35 40 45 50 55 60 достатню кількість водного середовища з одержання об'єму емульсії, що дорівнює приблизно 90 % кінцевого об'єму. Водне середовище дегазували азотом до досягнення залишкового кисню ≤ 0,1 мг/л, та витримували під шаром азоту. Емульсію охолоджували до приблизно 25 - 30 °C. Регулятор pH необов'язково додавали до досягнення pH 8,0-8,8. Можливе додавання додаткового водного середовища для доведення емульсії до кінцевої концентрації. Наповнення Емульсію переносили у наповнювач, де її переносили на пакування та герметизували, наприклад у скляні пляшки. Наповнювач промивали та зберігали в атмосфері азоту. Потік азоту вдували у пакування перед наповненням, та протягом процесу наповнення, таким чином що вміст кисню у пакуванні залишався на рівні ≤ 0,1 мг/л. У бажаному варіанті втілення, приблизно 255 +/- 1,5 мл емульсії додавали до кожної одиниці пакування. Заповнені пакування піддавали вакуумуванню. У бажаному варіанті втілення, пакування піддавали 4-м колам відкачки повітря, кожне коло складалось з 0,5 сек. відкачки повітря, після чого 0,5 сек. наповнення азотом, та досягали кінцевого значення вакууму 0,60 бар (абсолютний 0,40 бар). Пакування закупорювали бажано резиновою пробкою (наприклад, пробки Stelmi RG6720 галобутил). Запаковану емульсію стерилізували шляхом автоклавування з максимальним часом утримання 16 годин (тобто, протягом 16 годин після наповнення). Процес автоклавування включає нагрівання до приблизно 121 °C (від 121 °C до приблизно 123 °C) протягом як мінімум 15 хв. Програмою автоклаву бажано є роторний цикл. Процес автоклавування можна здійснювати 1-3 рази. Після стерилізації пляшки візуально перевіряли на ознаки вільних жирових крапель. Емульсію зберігали при приблизно 15 °C до приблизно 25 °C. Спосіб лікування Фармацевтичні емульсії даного винаходу можна вводити парентерально, бажано внутрішньовенно або інтра-артеріально, суб'єктам з метою профілактики або лікування. У бажаному варіанті втілення, суб'єктом є ссавець, більш бажано людина. Композиції мають невро-захисні та/або невро-відновлювані властивості. Композиції є придатними для лікування або попередження розладів або станів нервової системи. Приклади розладів або станів включають, проте не обмежуються наступними, розлади або стани центральної нервової системи (ЦНС), ушкодження спинного мозку, травматичне ушкодження мозку, незначне ушкодження мозку, включаючи струс, що характеризується тимчасовою втратою функції мозку, педіатричне ушкодження мозку, дегенеративні розлади ЦНС, такі як хвороба Паркінсона, деменція, включаючи хворобу Альцгеймера, розлади дімієланінування, такі як розсіяний та хронічний склероз, діабетична периферійна невропатологія. Інші приклади розладів та станів включають ішемічні неврологічні стани, такі як ішемічне ушкодження ЦНС, інсульт, включаючи ішемічний інсульт, геморагічний інсульт та перехідний ішемічний напад, та нейрокогнітивне ушкодження характерне для серцево-легеневого шунтування протягом операції на серці, наприклад пост-перфузійний синдром. Інші приклади включають асфазію, розлади сну, та тривожні розлади, такі як пост-травматичний стрес. Композиції також є придатними для полегшення симптомів пов'язаних з вищенаведеними розладами, наприклад, відновлення когнітивної функції, відновлення сну, нормалізація розладів настрою, тощо. Композиції даного винаходу також є придатними для лікування розладів посттравматичного стресу. У одному варіанті втілення, даний винахід стосується способів лікування ссавця з травматичним ушкодженням ЦНС, зокрема, травматичним ушкодженням мозку (TПМ). Способи включають лікування TПМ у ссавців шляхом введення суб'єкту, який цього потребує, фармацевтичної композиції даного винаходу, таким чином що досягається терапевтично ефективна концентрація прогестогену. У бажаному варіанті втілення, ссавцем є людина. Спосіб даного винаходу містить парентеральне введення прогестоген-вмісних фармацевтичних композицій даного винаходу суб'єкту з травматичним ушкодженням ЦНС, зокрема, TПМ. За способом даного винаходу, фармацевтична композиція використовується для стимулювання позитивної терапевтичної відповіді по відношенню до травматичного ушкодження ЦНС. TПМ є фізичним ушкодженням тканин мозку, що тимчасово або постійно погіршують функцію мозку. Діагноз встановлюють клінічно та підтверджують шляхом томограми (головним чином CT). Клінічні прояви значно різняться залежно від важкості хвороби та наслідків. Ушкодження зазвичай ділять на відкриті та закриті. Відкриті ушкодження включають проникнення крізь скальп та череп. Закриті ушкодження зазвичай з'являються при ударі голови, побитті суб'єкта або насильного потрясіння, що викликає швидке прискорення або пригнічення дії мозку. Відповідно, композиції винаходу можна використовувати для лікування TПМ, включаючи, тупі травми (тобто, закриті ушкодження), а також, травми з проникненням. Під "лікуванням" розуміють будь-яке покращення стану суб'єкта з травматичним ушкодженням ЦНС, 18 UA 107221 C2 5 10 15 20 25 30 35 40 45 50 55 60 включаючи як покращене морфологічне відновлення (тобто, покращення життєздатності тканин) та/або відновлення поведінки. Покращення характеризується як збільшення рівня та/або масштабу відновлення поведінки та анатомії травматичного ушкодження ЦНС. Відповідно, "позитивна терапевтична відповідь" включає як повну, так і часткову відповідь. Різноманітні способи визначення того, чи спостерігається повна або часткова відповідь, детально описані в патентних заявках WO2006/102644, WO2006102596 та WO2008/039898. Під "терапевтично ефективною кількістю" розуміють концентрацію прогестогену, що є достатньою для викликання терапевтичного ефекту. Таким чином, концентрація прогестогену у введеній дозованій формі даного винаходу є ефективною для лікування або попередження нейронного ушкодження, що є наслідком травматичного ушкодження ЦНС та тому, викликає нейрозахисний ефект. Нейродегенерація є прогресивною втратою нейронів ЦНС. Як використано у даному документі, "нейрозахист" є припиненням та/або зворотній прогрес нейродегенерації після травматичного ушкодження ЦНС. Терапевтично ефективна кількість залежить від багатьох факторів включаючи, наприклад, специфічна активність прогестогену, важкість та характер травматичного ушкодження, отримане нейронне ушкодження, чутливість пацієнта, маса пацієнта, на ряду зх. Іншими персональними особливостями є шлях та/або спосіб введення та використана композиція прогестогену. Емульсійні композиції даного винаходу, що містять прогестоген можна вводити використовуючи будь-який придатний спосіб, відомий у галузі, включаючи внутрішньовенну (IV) ін'єкцію, внутрішньом'язову (IM) ін'єкцію, або підшкірну (SC) ін'єкцію. У певних варіантах втілення винаходу, фармацевтична композиція, що містить прогестоген, вводиться за допомогою IV ін'єкції. При введенні внутрішньовенно, фармацевтична композиція, що містить прогестоген, вводиться шляхом інфузії протягом 1 144 годин. У деяких варіантах втілення, інфузії прогестогену вводять протягом 24-72 годин, протягом 48-96 годин, або протягом 24-144 годин. У бажаному варіанті втілення, інфузії прогестогену вводять протягом 96-120 годин. У одному варіанті втілення даного винаходу, композицію вводять за допомогою парентерального, бажано внутрішньовенного введення, у дозировці 0,1 нг - 100 г на кг маси тіла, 10 нг - 50 г на кг маси тіла, 100 нг - 1 г на кг маси тіла, 1 мкг - 100 мг на кг маси тіла, 1 мг 90 мг на кг маси тіла, 2 мг - 80 мг на кг маси тіла; та 3 мг - 70 мг на кг маси тіла. Альтернативно, кількість введеного прогестогену для досягнення терапевтичного ефекту складає 0,1 нг, 1 нг, 10 нг, 100 нг, 1 мкг, 10 мкг, 100 мкг, 1 мг, 2 мг, 3 мг, 4 мг, 5 мг, 6 мг, 7 мг, 8 мг, 9 мг, 10 мг, 15 мг, 20 мг, 25 мг, 30 мг, 35 мг, 40 мг, 45 мг, 50 мг, 55 мг, 60 мг, 65 мг, 70 мг, 75 мг, 80 мг, 85 мг, 90 мг, 95 мг, 100 мг, 500 мг на кг маси тіла або більше. У бажаному варіанті втілення, прогестоген вводять внутрішньовенно, в загальній дозі 50 мг - 90 мг на кг маси тіла. Прогестоген можна вводити один або кілька раз на добу. Тривалість лікування може становити один раз на добу протягом 1, 2, 3, 4, 5, 6, 7 діб або більше. Денну дозу вводять як одну дозу у формі окремої дозованої одиниці, або як кілька менших доз або шляхом багаторазового введення поділених дозувань у певних інтервалах. Наступні дозовані одиниці вводять у будь-який час після початкового введення, таким чином що досягається терапевтичний ефект. Наприклад, додаткові дозовані одиниці вводять для захисту суб'єкта від вторинної хвилі набряку, що може виникнути протягом перших кількох діб після ушкодження. У бажаному варіанті втілення, першу дозовану одиницю вводять не пізніше ніж через 8 годин після ушкодження. У певних варіантах втілення винаходу, прогестоген вводять у постійному режимі дозувань. Під "постійним режимом дозувань" розуміють, що прогестоген вводять у постійній почасовій інфузійній дозі прогестогену протягом курсу лікування. У інших варіантах втілення, винаходу, ліки вводять у "дво-рівневому режимі дозуванні." Під "дво-рівневим режимом дозувань" розуміють, що композицію вводять протягом двох періодів дозувань. У одному варіанті втілення, загальна почасова доза прогестогену введеного протягом першого періоду дворівневого режиму дозувань є більшою загальною інфузійною дозою прогестогену на годину, ніж та що вводять протягом другого періоду дозувань дворівневого режиму дозувань. У певних варіантах втілення, постійну дозу 0,71 мг/кг/годину вводять внутрішньовенно протягом першого періоду дворівневого режиму дозувань, та дозу 0,5 мг/кг/годину вводять протягом другого періоду дозувань дворівневого режиму дозувань. У бажаних варіантах втілення, перший період дворівневого режиму дозувань триває 1 годину, та другий період триває 120 годин. Даний спосіб лікування зазвичай досягає кінцевого рівня прогестогену у сироватці суб'єкта 100 нг/мл - 1000 нг/мл, 1100 нг/мл - 1450 нг/мл, 100 нг/мл - 250 нг/мл, 200 нг/мл - 350 нг/мл, 300 нг/мл - 450 нг/мл, 350 нг/мл - 450 нг/мл, 400 нг/мл - 550 нг/мл, 500 нг/мл - 650 нг/мл, 600 нг/мл - 750 нг/мл, 700 нг/мл - 850 нг/мл, 800 нг/мл - 950 нг/мл, 900 нг/мл - 1050 нг/мл, 19 UA 107221 C2 5 10 15 20 1000 нг/мл - 1150 нг/мл, 1100 нг/мл - 1250 нг/мл, 1200 нг/мл - 1350 нг/мл, 1300 нг/мл 1500 нг/мл. У певних варіантах втілення, рівень прогестогену у сироватці становить 100 нг/мл, 250 нг/мл, 300 нг/мл, 350 нг/мл, 360 нг/мл, 370 нг/мл, 380 нг/мл, 390 нг/мл, 400 нг/мл, 410 нг/мл, 420 нг/мл, 430 нг/мл, 440 нг/мл, 450 нг/мл, 500 нг/мл, 750 нг/мл, 900 нг/мл, 1200 нг/мл, 1400 нг/мл, або 1600 нг/мл. Концентрацію прогестогену у сироватці визначають шляхом розрахунку площі під кривою (AUC) протягом часу після IV введення порівнювальної композиції суб'єкту, як описано у WO2006102596. У наступних варіантах втілення даного винаходу, щонайменше один додатковий нейропротекторний агент комбінують з прогестогеном (як частину тієї ж композиції або у окремій композиції) для покращення захисту нервової системи після ушкодження ЦНС. Такі агенти включають, наприклад, Вітамін D, та/або сполуки що зменшують ексцитотоксичність глутамату та покращують нейронну регенерацію. Такі агенти вибирають з групи, що містить фактори росту, проте не обмежуються нею. Під "фактором росту" розуміють зовнішньо клітинну сигнальну молекулу, що стимулює ріст та проліферацію клітин. Коли прогестоген вводять сумісно з іншими фармацевтично активними агентами (тобто, іншими нейропротекторними агентами) менші концентрації прогестогену можуть бути терапевтично ефективними. Винахід було головним чином описано вище, проте краще розуміння надасть посилання на конкретні приклади, які включені з тільки з метою ілюстрації, та не обмежують винахід, доки не вказано протилежне. Приклади Приклад 1 – бажаний варіант втілення Композиція прикладу 1 є 6 % олійною емульсійною композицією, що містить 0,2 % прогестерону та 1,2 % яєчного лецитину. Фосфоліпід наявний у кількості 17 % олії (мас./мас.), та співвідношення прогестерон /олія становить 1:30 (мас./мас.) 25 Таблиця I Матеріал Вода для ін'єкції Яєчний лецитин PL90 Гліцерин Олеїнова кислота NaOH 1M Соєва олія Прогестерон 30 35 40 45 50 Кількість Ad 400 л 4,77 кг 9,98 кг 0,12 кг 470 мл 23,97 кг 0,81 кг Емульсію Таблиці I виготовляли наступним чином. Компоненти, суміші та кінцеві емульсії тримали в атмосфері азоту, та при температурі 55-60 °C, доки не вказано протилежне. 180 л Води для ін'єкцій (w.f.i.) додавали до першої колби, нагрівали до 58 °C, перемішуючи при 50 Гц та дегазували азотом до одержання залишкової концентрації кисню ≤ 0,1 мг/л. 9,98 кг Гліцерину (безводний гліцерин, Axelis, Австрія) додавали до води та перемішували протягом 5 хв. при 50 Гц. 23,97 кг Соєвої олії (Fresenius Kabi, Швеція) додавали до другої колби, перемішували при 50 Гц та нагрівали до 58 °C. 0,81 кг прогестерону (мікронізований прогестерон Proquina, Мехіко) додавали до нагрітої соєвої олії при постійному перемішуванні. 4,77 кг Яєчного лецитину (PL90, Fresenius Kabi, Швеція) додавали до нагрітої суміші водагліцерин, а потім 0,12 кг олеїнової кислоти (Merck KGaA) та 470 мл NaOH 1M (Merck KGaA). Вміст першої колби перемішували за допомогою Ultra Torrax (UT) при 50 Гц до одержання гомогенної суспензії (приблизно 15 хв.). Коли олійна фаза у другій колбі досягала температури 56 °C та прогестерон повністю розчинявся, суміш перемішували протягом наступних 15 хв. Олійну фазу фільтрували крізь 0,2мкм фільтр, та повільно переносили у першу колбу (протягом приблизно 18 хв.). Два 5 л об'єми води для ін'єкцій, нагрітих до 58 °C, використовували для промивання другої колби, до їх додавання до першої колби. Додаткові 110 мл NaOH 1M додавали до доведення pH дo pH8,0. Пре-емульсію перемішували за допомогою UT при 50 Гц протягом 15 хв. та одержували візуально гомогенну пре-емульсію. Пре-емульсію піддавали 4 колам гомогенізації, де кожне коло тривало приблизно 70 хв., та кожне коло складалось з 2 стадій гомогенізації. Перше коло складалось з першої стадії при 418 бар, та другої стадії при 108 бар. Друге коло складалось з першої стадії при 407 бар, та другої стадії при 103 бар. Третє коло складалось з першої стадії при 411 бар, та другої стадії при 102 бар. Останнє коло складалось з першої стадії при 410 бар, та другої стадії при 101 бар. 20 UA 107221 C2 5 10 15 Температура по всій пре-емульсії дорівнювала 50 °C-67 °C. 150 л w.f.i. додавали до накопичувального резервуару, нагрівали до 27,9 °C та дегазували азотом до одержання залишкової концентрації кисню ≤ 0,1 мг/л. Емульсію фільтрували крізь 10мкм фільтр у накопичувальний резервуар, що містив w.f.i. Емульсію охолоджували до 27 °C, брали зразок, та достатню кількість води (23 л) додавали для доведення емульсії до кінцевої концентрації. Кінцеву емульсію дегазували до одержання залишкової концентрації кисню ≤ 0,1 мг/л, та зберігали в атмосфері азоту при 27 °C протягом 11 годин перед наповненням емульсії у пляшки. Емульсію наповнювали у скляні пляшки, та герметизували, одержуючи у кожній упаковці дози приблизно по 250 мл. Кількість кисню в емульсії підтримували на рівні ≤ 0,1 мг/л протягом всього процесу наповнення, шляхом газування пляшок азотом перед наповненням, та газування емульсії та пляшок протягом наповнення. Пляшки стерилізували шляхом автоклавування з роторним циклом при 121 °C з періодом утримування 15 хв. (барабан зі зразками обертали при 4 об./хв.). У наступній таблиці наведені дані щодо фізичних та хімічних властивостей емульсії прикладу 1 перед стерилізацією, після стерилізації шляхом автоклавування при 121 °C протягом 15 хв., та після зберігання автоклавованої емульсії при 60 °C протягом 3 тижнів, та протягом 4 тижнів. Приклад 1 ФКС Z-середній [нм] Полі ФКС Mastersizer D[4,3] [мкм] Mastersizer діапазон Mastersizer однорідність Mastersizer d(0,5) [мкм] Coulter Counter % ≤ 1,5мкм Coulter Counter % ≤ 5мкм Accusizer [%] (USP 729) вигляд значення pH кількість перекису [мЕкв/л] NEFA [мЕкв/л] LPC [%] 20 25 30 не стерильна стерильна 3 тижні, 60 °C 4 тижні, 60 °C 215 214 217 220 0,11 0,09 0,10 0,12 0,174 0,175 0,176 0,173 1,650 1,658 1,656 1,651 0,521 0,524 0,522 0,524 0,147 0,148 0,149 0,146 99,5 99,3 100 99 100 100 100 100 0,01 0,01 0,00 0,00 біла, гомогенна 8,5 біла, гомогенна 7,9 біла, гомогенна 6,6 біла, гомогенна 7,0 0,01 0,04 0 0,2 1 2 8 6 1,9 2,8 16 13 Емульсії Прикладу 1 мають розподілення розміру частинок стабільної та безпечної для введення композиції. Значення Accusizer показали, що значення PFAT5 знаходиться в межах
ДивитисяДодаткова інформація
Назва патенту англійськоюLow-oil pharmaceutical emulsion compositions comprising progestogen
Автори англійськоюPickersgill, Laura, di Hoiser, Eva-Maria, Achleitner, Georg
Автори російськоюПиккерсджилл Лора, ди Хойзер Ева-Мария, Ахляйтнер Георг
МПК / Мітки
МПК: A61K 47/06, A61P 25/00, A61K 31/57, A61K 47/10, A61K 9/107
Мітки: емульсійна, вмістом, містить, композиція, фармацевтична, низьким, прогестоген, олії
Код посилання
<a href="https://ua.patents.su/30-107221-emulsijjna-farmacevtichna-kompoziciya-z-nizkim-vmistom-oli-shho-mistit-progestogen.html" target="_blank" rel="follow" title="База патентів України">Емульсійна фармацевтична композиція з низьким вмістом олії, що містить прогестоген</a>
Попередній патент: Пристрій захисного вимикання
Випадковий патент: Спосіб виготовлення теплоізолювальної віконної рами