Полігетероциклічні сполуки і їх застосування як антагоністів метаботропного рецептора глютамату, фармацевтична композиція на їх основі
Номер патенту: 82434
Опубліковано: 10.04.2008
Автори: Арора Джалай, Гольм Бйорн, Сінь Тао, Венсбо Дейвід, Айзек Метвін, Стефанак Томіслав, Слессі Абделмалік, Керс Анніка, Едвардс Луіз, Стааф Карін
Формула / Реферат
1. Сполука формули І
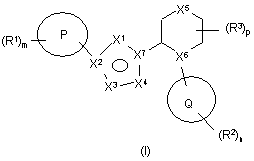 ,
,
де
Р вибрана з арилу і гетероарилу;
R1 приєднана до Р через атом карбону на кільці Р і вибрана з групи, яку складають гідрокси, галоген, нітро, С1-6алкілгалоген, ОС1-6алкілгалоген, С1-6алкіл, ОС1-6алкіл, С2-6алкеніл, ОС2-6алкеніл, С2-6алкініл, ОС2-6алкініл, С0-6алкілС3-6циклоалкіл, ОС0-6алкілС3-6циклоалкіл, С0-6алкіларил, ОС0-6алкіларил, СНО, (CO)R5, O(CO)R5, O(CO)OR5, O(CNR5)OR5, C1-6aлкiлOR5, OC2-6aлкiлOR5, C1-6алкіл(CO)R5, ОС1-6алкіл(СО)R5, C0-6алкілCO2R5, ОС1-6алкілСО2R5, С0-6алкілціано, ОС2-6алкілціано, C0-6алкілNR5R6, OC2-6aлкiлNR5R6, C1-6алкіл(CO)NR5R6, OC1-6aлкiл(CO)NR5R6, C0-6алкілNR5(CO)R6, OC2-6aлкiлNR5(CO)R6, C0-6алкілNR5(CO)NR5R6, C0-6aлкiлSR5, OC2-6алкілSR5, C0-6алкіл(SO)R5, OC2-6алкіл(SO)R5, C0-6алкілSO2R5, OC2-6алкілSO2R5, C0-6aлкiл(SО2)NR5R6, OC2-6aлкiл(SО2)NR5R6, C0-6aлкiлNR5(SО2)R6, ОC2-6алкілNR5(SО2)R6, C0-6aлкiлNR5(SО2)NR5R6, OC2-6алкілNR5(SO2)NR5R6, (CO)NR5R6, O(CO)NR5R6, NR5OR6, C0-6aлкiлNR5(CO)OR6, OC2-6aлкiлNR5(CO)OR6, SO3R5 і 5- або 6-членне кільце, яке містить атоми, незалежно вибрані з групи, яку складають С, N, О і S;
X1 вибрана з групи, яку складають: N, NR4 і CR4;
X2 вибрана з групи, яку складають: С і N;
X3 вибрана з групи, яку складають: CR4, N і О;
X4 вибрана з групи, яку складають: CR4, N, NR4 і О;
X5 вибрана з групи, яку складають: зв'язок, CR4R4’, NR4, О, S, SO і SO2;
X6 вибрана з групи, яку складають: CR4 і N;
X7 вибрана з групи, яку складають: С і N;
R4 незалежно вибрана з групи, яку складають гідроген, гідрокси, С1-6алкіл, С0-6алкілціано, оксо, =NR5, =NOR5, С1-4алкілгалоген, галоген, С3-7циклоалкіл, О(СО)С1-4алкіл, С1-4алкіл(SО)С0-4алкіл, С1-4алкіл(SО2)С0-4алкіл, (SО)С0-4алкіл, (SО2)С0-4алкіл, ОС1-4алкіл, C1-4алкілOR5 і C0-4алкілNR5R6;
Q вибрана з групи, яку складають гетероциклоалкіл і гетероарил;
R2 і R3 незалежно вибрані з групи, яку складають: гідрокси, С0-6алкілціано, оксо, =NR5, =NOR5, С1-4алкілгалоген, галоген, С1-6алкіл, С3-6циклоалкіл, С0-6алкіларил, С0-6алкілгетероарил, С1-6алкілциклоалкіл, С0-6алкілгетероциклоалкіл, ОС1-4алкіл, ОС0-6алкіларил, О(СО)С1-4алкіл, (CO)OC1-4алкіл, С0-4алкіл(S)С0-4алкіл, С1-4алкіл(SО)С0-4алкіл, С1-4алкіл(SО2)С0-4алкіл, (SО)С0-4алкіл, (SО2)С0-4алкіл, C1-4алкілOR5, C0-4алкілNR5R6 і 5- або 6-членне кільце, яке містить атоми, незалежно вибрані з С, N, О і S, причому це кільце може, як варіант, бути злите з 5- або 6-членним кільцем, що містить атоми, незалежно вибрані з групи, яку складають С, N і О, а зазначене кільце і зазначене злите кільце можуть бути заміщені однією або більше А;
де будь-які С1-6алкіл, арил або гетероарил для R1, R2 і R3 можуть бути заміщені однією або більше А;
А вибрана з групи, яку складають: гідроген, гідрокси, галоген, нітро, оксо, С0-6алкілціано, С0-4алкілС3-6циклоалкіл, С1-6алкіл, -ОС1-6алкіл, С1-6алкілгалоген, C1-6алкілгалоген, С2-6алкеніл, С0-3алкіларил, С0-6алкілOR5, ОС2-6алкілOR5, C0-6алкілSR5, ОС2-6алкілSR5, (CO)R5, O(CO)R5, ОС2-6алкілціано, OC1-6алкілCO2R5, O(CO)OR5, OC1-6aлкiл(CO)R5, С1-6алкіл(СО)R5, NR5OR6, C0-6NR5R6, OC2-6алкілNR5R6, C0-6aлкiл(CO)NR5R6, ОС1-6алкіл(СО)NR5R6, OC2-6aлкiлNR5(CO)R6, C0-6алкілNR5(CO)R6, C0-6aлкiлNR5(CO)NR5R6, O(CO)NR5R6, C0-6aлкiл(SО2)NR5R6, ОC2-6алкіл(SО2)NR5R6, C0-6алкілNR5(SO2)R6, OC2-6алкілNR5(SO2)R6, SO3R5, C1-6алкілNR5(SO2)NR5R6, OC2-6алкіл(SO2)R5, C0-6алкіл(SO2)R5, C0-6алкіл(SO)R5, OC2-6алкіл(SO)R5 і 5- або 6-членне кільце, що містить атоми, незалежно вибрані з групи, яку складають С, N, О і S;
R5 і R6 незалежно вибрані з Н, С1-6алкілу, С3-7циклоалкілу і арилу;
m дорівнює 0, 1, 2, 3 або 4;
n дорівнює 0, 1, 2, 3 або 4;
р дорівнює 0, 1, 2, 3 або 4; і
її сіль або гідрат,
за умови, що ця сполука не є:
4,4'-(1,2-піперазиндіїл)діантипірином,
дигідрохлоридом 4,4'-(1,2-піперазиндіїл)діантипірину або
дипікратом 4,4'-(1,2-піперазиндіїл)діантипірину.
2. Сполука за п. 1, яка відрізняється тим, що m дорівнює 1, 2, 3 або 4.
3. Сполука за п. 1, яка відрізняється тим, що X7 є С.
4. Сполука за п. 1, яка відрізняється тим, що X5 вибрана з групи, яку складають CR4R4', NR4, О, S, SO і SO2.
5. Сполуказа п. 1, яка відрізняється тим, що X3 вибрана з групи, яку складають N і О.
6. Сполука за п. 1, яка відрізняється тим, що Р є арилом.
7. Сполука за п. 6, яка відрізняється тим, що Р є фенілом.
8. Сполука за п. 7, яка відрізняється тим, що m дорівнює 1 або 2.
9. Сполука за п. 1, яка відрізняється тим, що R1 вибрана з групи, яку складають: галоген, С1-6алкілгалоген, ОС1-6алкілгалоген, C1-6алкіл, ОС1-6алкіл, С1-6алкілOR5, C0-6алкілціано, C0-6алкілNR5R6.
10. Сполука за п. 9, яка відрізняється тим, що R1 вибрана з групи, яку складають: Сl, F, Me, OMe, CF3, OCF3 і CN.
11. Сполука за п. 1, яка відрізняється тим, що X2 є С.
12. Сполука за п. 11, яка відрізняється тим, що X1 є N або CR4.
13. Сполука за п. 12, яка відрізняється тим, що X3 є О, X4 є N і коли X3 є N, то X4 є О.
14. Сполука за п. 1, яка відрізняється тим, що X2 є N.
15. Сполука за п. 14, яка відрізняється тим, що X1 є N.
16. Сполука за п. 15, яка відрізняється тим, що X3 є N і X4 є N або CR4.
17. Сполука за п. 1, яка відрізняється тим, що X6 є N.
18. Сполука за п. 12, яка відрізняється тим, що X5 вибрана з групи, яку складають зв'язок, CR4R4', NR4 і О.
19. Сполука за п. 13, яка відрізняється тим, що X5 вибрана з групи, яку складають зв'язок, О і NR4.
20. Сполука за п. 16, яка відрізняється тим, що X5 вибрана з групи, яку складають О і CR4.
21. Сполука за п. 1, яка відрізняється тим, що R4 вибрана з групи, яку складають: гідроген, С1-6алкіл, С1-6алкілгалоген і галоген.
22. Сполука за п. 1, яка відрізняється тим, що Q є гетероарилом.
23. Сполука за п. 1, яка відрізняється тим, що Q вибрана з групи, яку складають:
a)  ,
,
b) 
i c)  .
.
24. Сполука за п. 1, яка відрізняється тим, що Q є
a)  .
.
25. Сполука за п. 1, яка відрізняється тим, що R2 і R3 незалежно вибрані з групи, яку складають: С1-4алкілгалоген, С1-6алкіл, С3-6циклоалкіл, С0-6алкіларил і С0-6алкілгетероарил.
26. Сполука за п. 1, яка відрізняється тим, що А вибрана з групи, яку складають: гідроген, гідроксил, галоген, С0-6алкілціано, С1-6алкіл, -ОС1-6алкіл, С1-6алкілгалоген, ОС1-6алкілгалоген.
27. Сполука за п. 1, яка відрізняється тим, що вона вибрана з сполук:
4-(5-{2-[5-(3-хлорфеніл)-ізоксазол-3-іл]-піперидин-1-іл}-4-метил-4Н[1,2,4]триазол-3-іл)-піридин,
3-[5-(3-хлорфеніл)-ізоксазол-3-іл]-4-(4-метил-5-піридин-4-іл-4Н-[1,2,4]триазол-3-іл)-морфолін,
3-[5-(3-хлорфеніл)-ізоксазол-3-іл]-4-[5-(4-дифлуорметоксифеніл)-4-метил-4Н-[1,2,4]триазол-3-іл]-морфолін,
3-[3-(3-хлорфеніл)-[1,2,4]оксадіазол-5-іл]-4-(4-метил-5-піридин-4-іл-4Н-[1,2,4]триазол-3-іл)-морфолін,
3-[3-(3-хлорфеніл)-[1,2,4]оксадіазол-5-іл]-4-[5-(4-дифлуорметоксифеніл)-4-метил-4Н-[1,2,4]триазол-3-іл]-морфолін,
трет-бутиловий естер 3-[3-(3-хлорфеніл)-[1,2,4]оксадіазол-5-іл]-4-(4-метил-5-піридин-4-іл-4Н-[1,2,4]триазол-3-іл)-піперазин-1-карбонової кислоти,
2-[3-(3-хлорфеніл)-[1,2,4]оксадіазол-5-іл]-1-(4-метил-5-піридин-4-іл-4Н-[1,2,4]триазол-3-іл)-піперазин,
2-[3-(3-хлорфеніл)-[1,2,4]оксадіазол-5-іл]-4-метил-1-(4-метил-5-піридин-4-іл-4Н-[1,2,4]триазол-3-іл)-піперазин,
трет-бутиловий естер 3-[3-(3-хлорфеніл)-[1,2,4]оксадіазол-5-іл]-4-[5-(4-дифлуорметоксифеніл)-4-метил-4Н-[1,2,4]триазол-3-іл]-піперазин-1-карбонової кислоти,
2-[3-(3-хлорфеніл)-[1,2,4]оксадіазол-5-іл]-1-[5-(4-дифлуорметоксифеніл)-4-метил-4Н-[1,2,4]триазол-3-іл]-піперазин,
2-[3-(3-хлорфеніл)-[1,2,4]оксадіазол-5-іл]-1-[5-(4-дифлуорметоксифеніл)-4-метил-4Н-[1,2,4]триазол-3-іл]-4-метилпіперазин,
2-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]-1-{5-[4-(дифлуорметокси)феніл]-4-метил-4Н-1,2,4-триазол-3-іл}піперидин,
4-(5-{2-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]піперидин-1-іл}-4-метил-4Н-1,2,4-триазол-3-іл)піридин,
2-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]-1-[5-(4-метоксифеніл)-4-метил-4Н-1,2,4-триазол-3-іл]піперидин,
[4-(5-{2-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]піперидин-1-іл}-4-метил-4Н-1,2,4-триазол-3-іл)феніл]диметиламін,
[4-(5-{2-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]-піперидин-1-іл}-4-метил-4Н-[1,2,4]триазол-3-іл)-бензил]-диметиламін,
{2-[4-(5-{2-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]-піперидин-1-іл}-4-метил-4Н-[1,2,4]-триазол-3-іл)-феноксі]-етил}-диметиламін,
(R)-3-[3-(3-хлорфеніл)-[1,2,4]оксадіазол-5-іл]-4-(4-метил-5-піридин-4-іл-4Н-[1,2,4]-триазол-3-іл)-морфолін,
(S)-3-[3-(3-хлорфеніл)-[1,2,4]оксадіазол-5-іл]-4-(4-метил-5-піридин-4-іл-4Н-[1,2,4]-триазол-3-іл)-морфолін,
(R)-2-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]-1-{5-[4-(дифлуорметокси)феніл]-4-метил-4Н-1,2,4-триазол-3-іл}піперидин,
(S)-2-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]-1-{5-[4-(дифлуорметокси)феніл]-4-метил-4Н-1,2,4-триазол-3-іл}піперидин,
(R)-4-(5-{2-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]піперидин-1-іл}-4-метил-4Н-1,2,4-триазол-3-іл)піридин,
(S)-4-(5-{2-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]піперидин-1-іл}-4-метил-4Н-1,2,4-триазол-3-іл)піридин,
4-[5-(5-{2-[5-(3-хлорфеніл)-ізоксазол-3-іл]-піролідин-1-іл}-4-циклопропіл-4Н-[1,2,4]триазол-3-іл)-піридин-2-іл]-морфолін,
4-[5-(5-{2-[5-(3-хлорфеніл)-ізоксазол-3-іл]-піролідин-1-іл}-4-метил-4Н-[1,2,4]триазол-3-іл)-піридин-2-іл]-морфолін,
3-(5-{2-[5-(3-хлорфеніл)-ізоксазол-3-іл]-піролідин-1-іл}-4-метил-4Н-[1,2,4]триазол-3-іл)-піридин,
4-(5-{2-[5-(3-хлорфеніл)-ізоксазол-3-іл]-піролідин-1-іл}-4-циклопропіл-4Н-[1,2,4]-триазол-3-іл)-піридин,
3-[5-(3-хлорфеніл)-[1,2,4]оксадіазол-3-іл]-4-(5-піридин-4-іл-4Н-[1,2,4]триазол-3-іл)-морфолін,
3-[5-(3-хлорфеніл)ізоксазол-3-іл]-4-(4-циклопропіл-5-піридин-3-іл-4Н-1,2,4-триазол-3-іл)морфолін,
3-[5-(3-хлорфеніл)ізоксазол-3-іл]-4-(4-циклопропіл-5-піридин-4-іл-4Н-1,2,4-триазол-3-іл)морфолін,
3-[5-(3-хлорфеніл)ізоксазол-3-іл]-4-(4-метил-5-піридин-3-іл-4Н-1,2,4-триазол-3-іл)морфолін,
3-[5-(3-хлорфеніл)-ізоксазол-3-іл]-4-[5-(6-метоксипіридин-3-іл)-4-метил-4Н-[1,2,4]-триазол-3-іл]-морфолін,
3-[3-(3-хлорфеніл)-1,2,4-оксадіазол-5-іл]-4-[5-(2-метоксипіридин-4-іл)-4-метил-4Н-1,2,4-триазол-3-іл]морфолін,
3-[3-(3-хлорфеніл)-1,2,4-оксадіазол-5-іл]-4-[5-(2-метилпіридин-4-іл)-4-метил-4Н-1,2,4-триазол-3-іл]морфолін,
3-[3-(3-хлорфеніл)-1,2,4-оксадіазол-5-іл]-4-[5-(5-флуорпіридин-3-іл)-4-метил-4Н-1,2,4-триазол-3-іл]морфолін,
3-[5-(3-хлорфеніл)ізоксазол-3-іл]-4-[5-(5-флуорпіридин-3-іл)-4-метил-4Н-1,2,4-триазол-3-іл]морфолін,
3-[3-(3-хлорфеніл)-1,2,4-оксадіазол-5-іл]-4-(4-метил-5-піридин-2-іл-4Н-1,2,4-триазол-3-іл)морфолін,
4-[5-(5-флуорпіридин-3-іл)-4-метил-4Н-1,2,4-триазол-3-іл]-3-[3-(3-йодфеніл)-1,2,4-оксадіазол-5-іл]морфолін,
3-[3-(3-йодфеніл)-1,2,4-оксадіазол-5-іл]-4-(4-метил-5-піридин-4-іл-4Н-1,2,4-триазол-3-іл)морфолін,
3-[5-(3-хлорфеніл)ізоксазол-3-іл]-4-[5-(2-метилпіридин-4-іл)-4-метил-4Н-1,2,4-триазол-3-іл]морфолін,
3-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]-4-(4-метил-5-піридин-3-іл-4Н-1,2,4-триазол-3-іл)морфолін,
3-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]-4-[5-(3,5-дифлуорфеніл)-4-метил-4Н-1,2,4-триазол-3-іл]морфолін,
3-(5-{2-[5-(3-хлорфеніл)ізоксазол-3-іл]піролідин-1-іл}-4-циклопропіл-4Н-1,2,4-триазол-3-іл)піридин і
4-(5-{2-[5-(3-хлорфеніл)ізоксазол-3-іл]піролідин-1-іл}-4-метил-4Н-1,2,4-триазол-3-іл)піридин.
28. Фармацевтична композиція, яка містить як активний інгредієнт терапевтично ефективну кількість сполуки за будь-яким з пп. 1-26 з одним або більше фармацевтично прийнятними розріджувачами, ексципієнтами і/або інертними носіями.
29. Фармацевтична композиція за п. 28, яка відрізняється тим, що призначена для використання у лікуванні розладів, опосередкованих mgluR5.
30. Сполука за будь-яким з пп. 1-27, призначена для застосування у терапії.
31. Сполука за будь-яким з пп. 1-27, призначена для лікування розладів, опосередкованих mgluR5.
32. Застосування сполуки за будь-яким з пп. 1-27 у виготовленні медикаменту для лікування розладів, опосередкованих mgluR5.
33. Спосіб лікування розладів, опосередкованих mgluR5, в якому вводять ссавцю, включаючи людину, який потребує такого лікування, терапевтично ефективну кількість сполуки за будь-яким з пп. 1-27.
34. Спосіб за п. 33, який відрізняється тим, що призначений для застосування у лікуванні неврологічних розладів.
35. Спосіб за п. 33, який відрізняється тим, що призначений для застосування у лікуванні психіатричних розладів.
36. Спосіб за п. 33, який відрізняється тим, що призначений для застосування у лікуванні хронічних і гострих больових розладів.
37. Спосіб за п. 33, який відрізняється тим, що призначений для застосування у лікуванні шлунково-кишкових розладів.
38. Спосіб інгібування активування рецепторів mgluR5, в якому обробляють клітини, що містять зазначений рецептор, ефективною кількістю сполуки за п. 1.
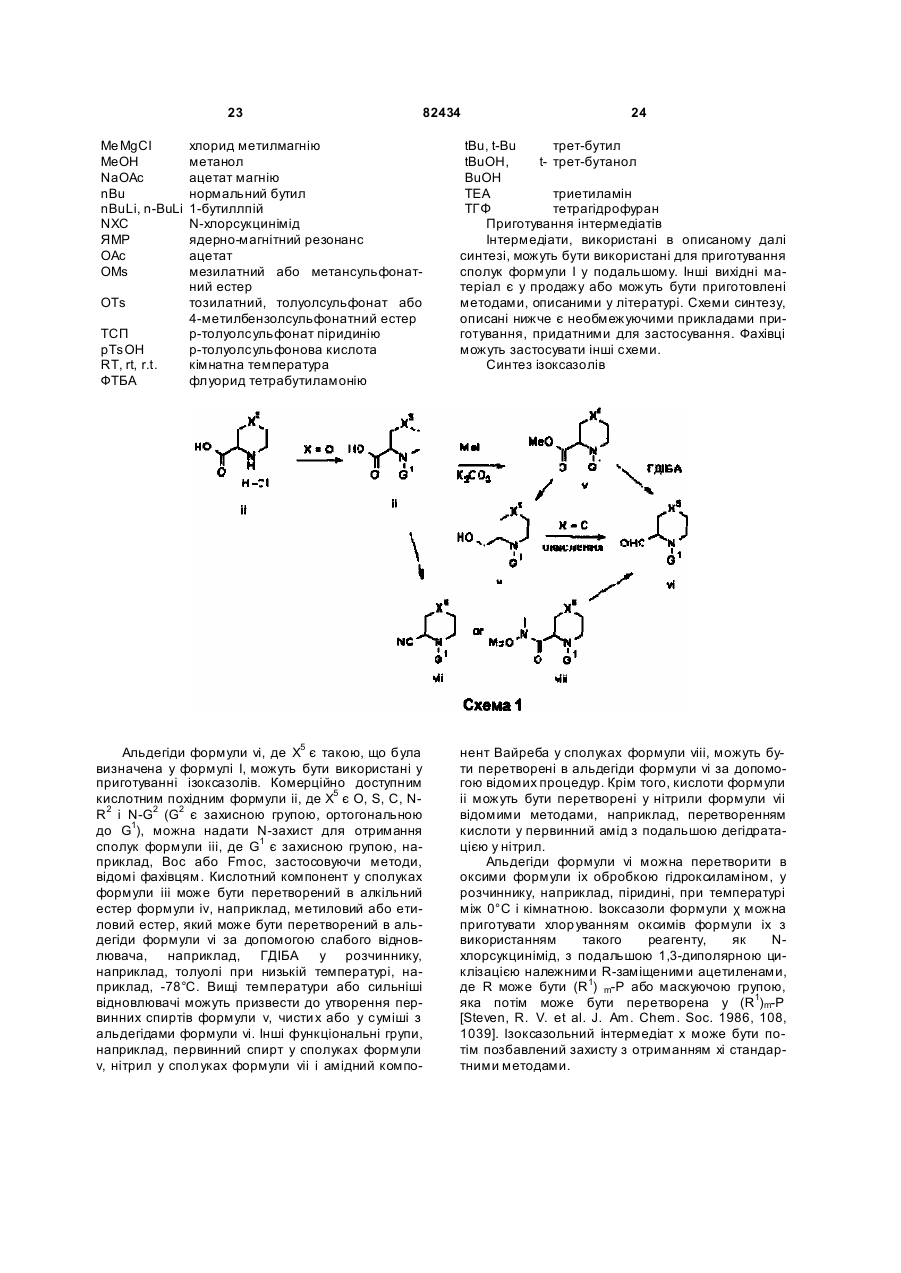
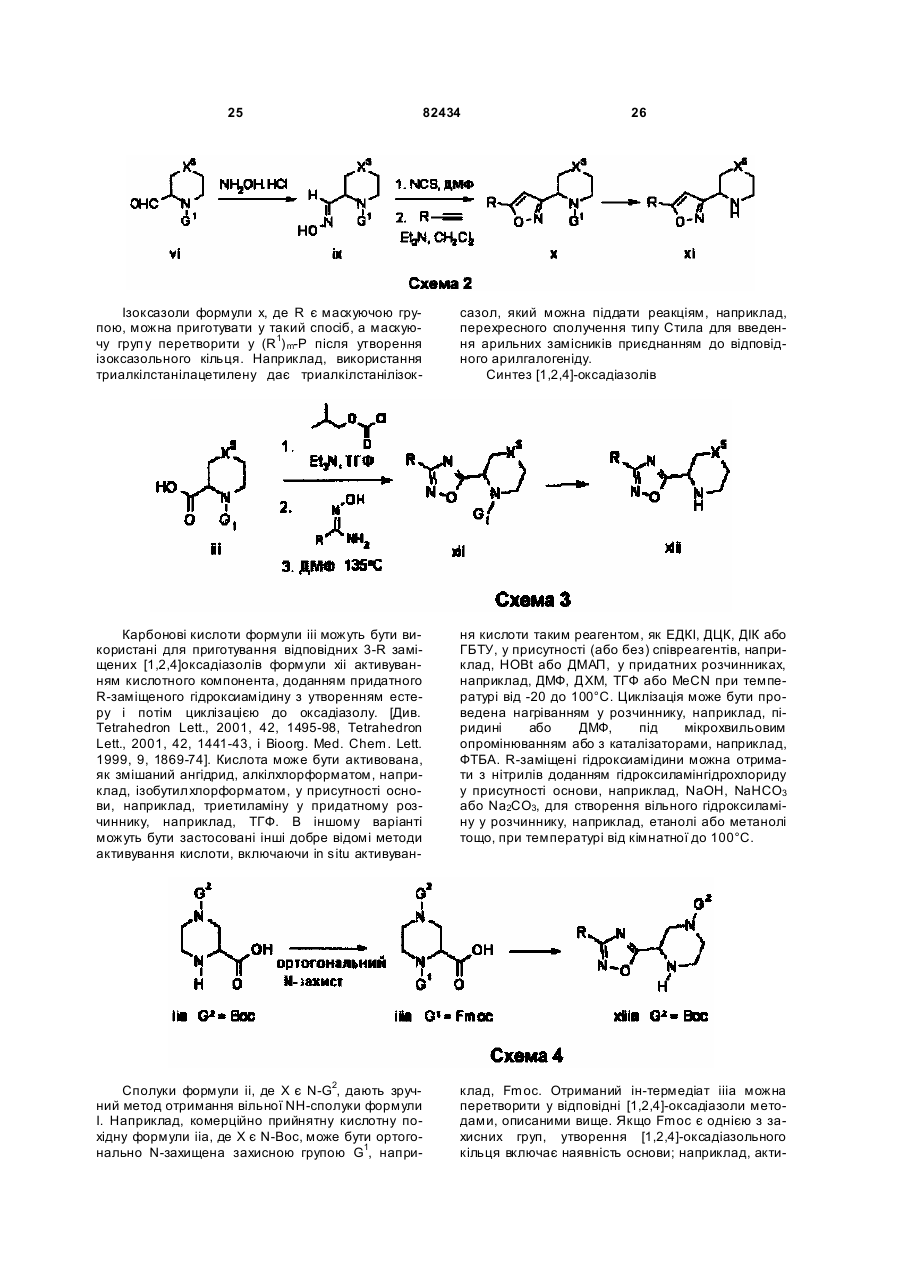
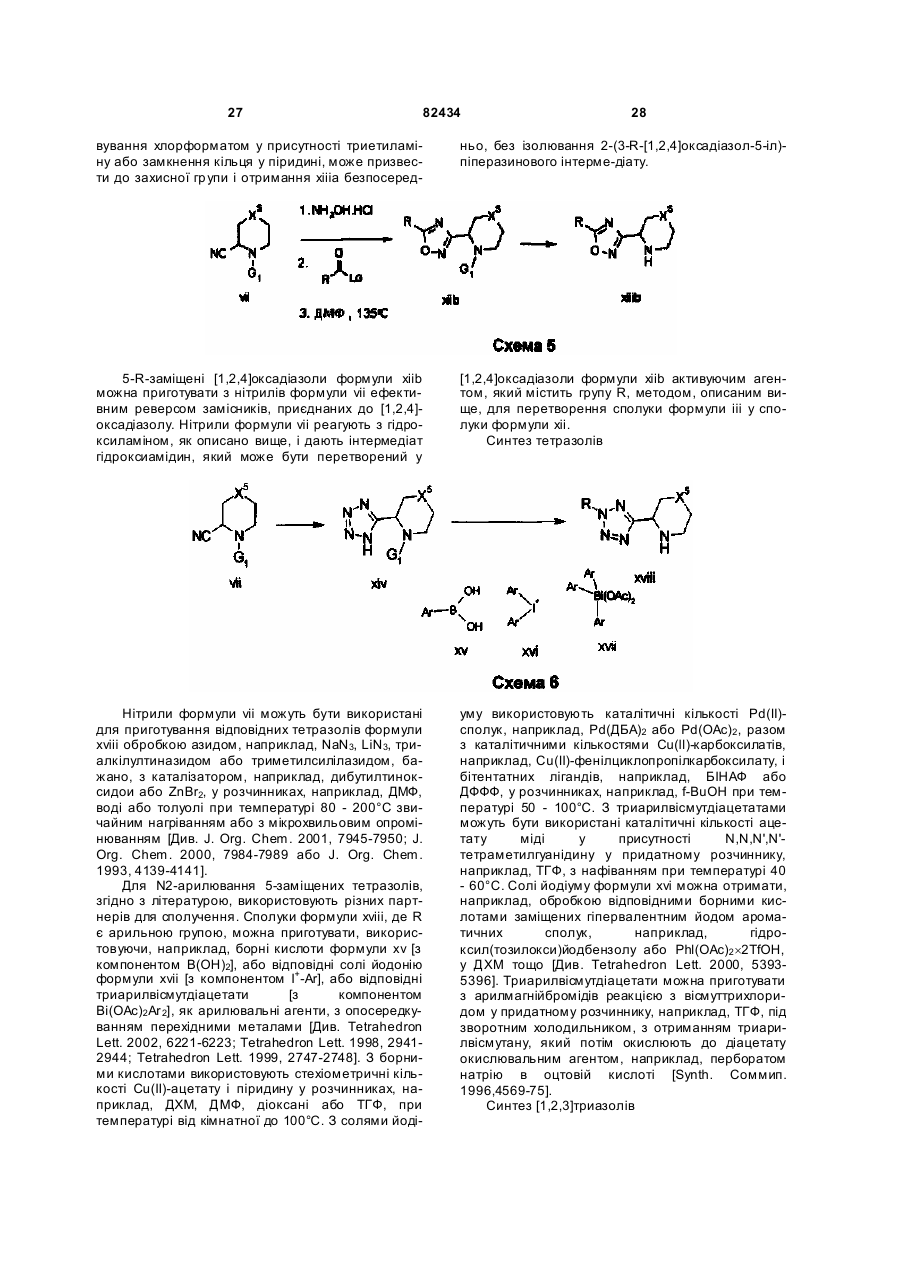
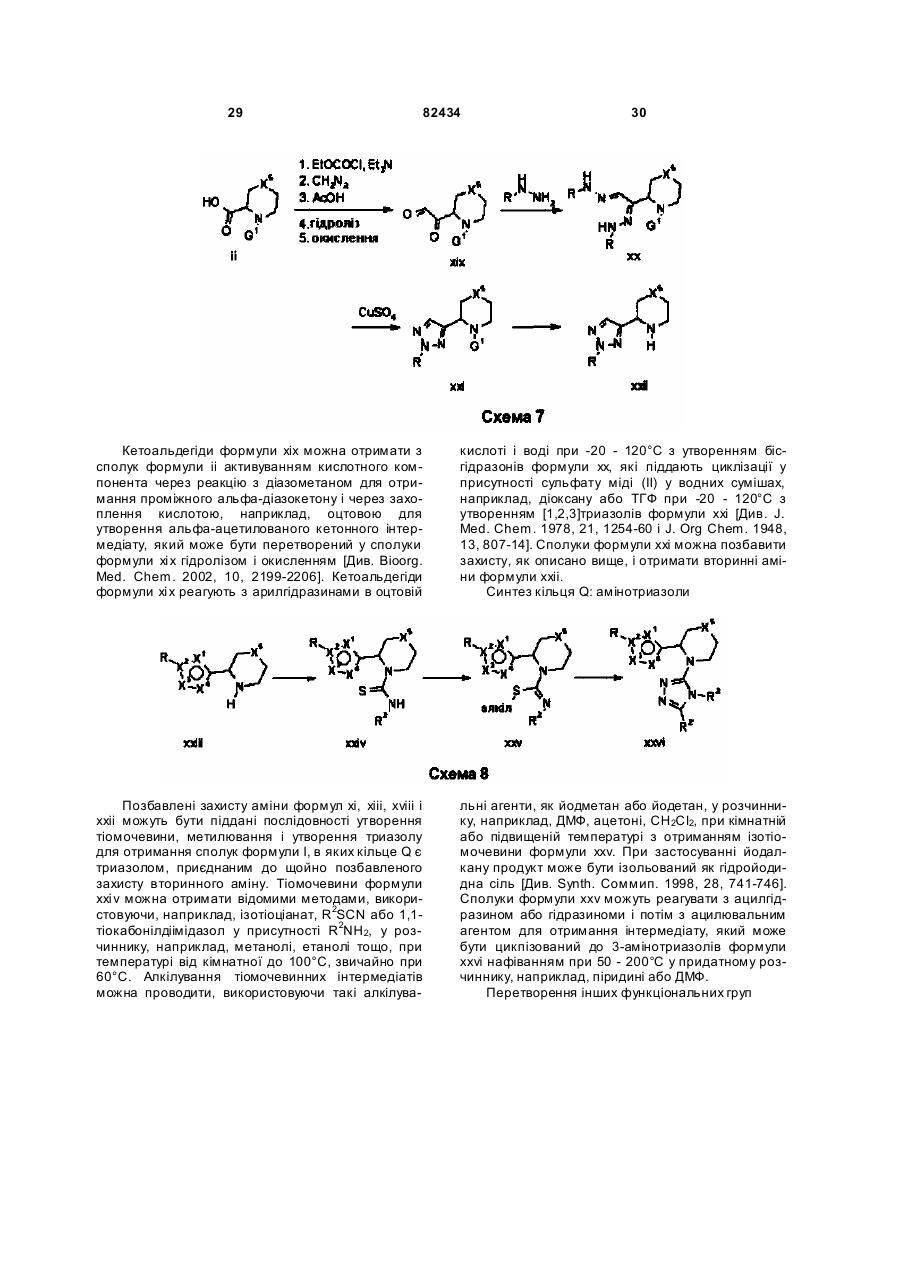
Текст
1. Сполука формули І C2 2 (19) 1 3 82434 жно вибрані з групи, яку складають С, N і О, а зазначене кільце і зазначене злите кільце можуть бути заміщені однією або більше А; де будь-які С 1-6алкіл, арил або гетероарил для R1, R2 і R3 можуть бути заміщені однією або більше А; А вибрана з групи, яку складають: гідроген, гідрокси, галоген, нітро, оксо, С0-6алкілціано, С0-4алкілС 3-6циклоалкіл, С1-6алкіл, -ОС1-6алкіл, С1-6алкілгалоген, C1-6алкілгалоген, С2-6алкеніл, С0-3алкіларил, С0-6алкілOR5, ОС2-6алкілOR5, C0-6алкілSR5, ОС2-6алкілSR5, (CO)R5, O(CO)R 5, ОС2-6алкілціано, OC1-6алкілCO2R5, O(CO)OR 5, 5 5 OC1-6aлкiл(CO)R , С1-6алкіл(СО)R , NR5OR6, 5 6 5 6 C0-6NR R , OC2-6алкілNR R , C0-6aлкiл(CO)NR5R6, ОС1-6алкіл(СО)NR5R6, OC2-6aлкiлNR5(CO)R6, C0-6алкілNR5(CO)R6, C0-6aлкiлNR5(CO)NR5R6, O(CO)NR5R6, C0-6aлкiл(SО2)NR5R6, 5 6 ОC2-6алкіл(SО2)NR R , C0-6алкілNR5(SO2)R6, 5 6 OC2-6алкілNR (SO2)R , SO3R5, 5 5 6 C1-6алкілNR (SO2)NR R , OC2-6алкіл(SO2)R5, 5 C0-6алкіл(SO2)R , C0-6алкіл(SO)R5, 5 OC2-6алкіл(SO)R і 5- або 6-членне кільце, що містить атоми, незалежно вибрані з групи, яку складають С, N, О і S; R5 і R6 незалежно вибрані з Н, С1-6алкілу, С3-7циклоалкілу і арилу; m дорівнює 0, 1, 2, 3 або 4; n дорівнює 0, 1, 2, 3 або 4; р дорівнює 0, 1, 2, 3 або 4; і її сіль або гідрат, за умови, що ця сполука не є: 4,4'-(1,2-піперазиндіїл)діантипірином, дигідрохлоридом 4,4'-(1,2піперазиндіїл)діантипірину або дипікратом 4,4'-(1,2-піперазиндіїл)діантипірину. 2. Сполука за п. 1, яка відрізняється тим, що m дорівнює 1, 2, 3 або 4. 3. Сполука за п. 1, яка відрізняється тим, що X7 є С. 4. Сполука за п. 1, яка відрізняється тим, що X5 вибрана з групи, яку складають CR4R4' , NR4, О, S, SO і SO2 . 5. Сполука за п. 1, яка відрізняється тим, що X3 вибрана з групи, яку складають N і О. 6. Сполука за п. 1, яка відрізняється тим, що Р є арилом. 7. Сполука за п. 6, яка відрізняється тим, що Р є фенілом. 8. Сполука за п. 7, яка відрізняється тим, що m дорівнює 1 або 2. 9. Сполука за п. 1, яка відрізняється тим, що R1 вибрана з групи, яку складають: галоген, С1-6алкілгалоген, ОС1-6алкілгалоген, C1-6алкіл, ОС1-6алкіл, С1-6алкілOR5, C0-6алкілціано, C0-6алкілNR5R6. 10. Сполука за п. 9, яка відрізняється тим, що R1 вибрана з групи, яку складають: Сl, F, Me, OMe, CF3, OCF 3 і CN. 11. Сполука за п. 1, яка відрізняється тим, що X2 є С. 12. Сполука за п. 11, яка відрізняється тим, що X1 є N або CR4. 13. Сполука за п. 12, яка відрізняється тим, що X3 є О, X4 є N і коли X3 є N, то X4 є О. 4 14. Сполука за п. 1, яка відрізняється тим, що X2 є N. 15. Сполука за п. 14, яка відрізняється тим, що X1 є N. 16. Сполука за п. 15, яка відрізняється тим, що X3 є N і X4 є N або CR4. 17. Сполука за п. 1, яка відрізняється тим, що X6 є N. 18. Сполука за п. 12, яка відрізняється тим, що X5 вибрана з групи, яку складають зв'язок, CR4R4' , NR4 і О. 19. Сполука за п. 13, яка відрізняється тим, що X5 вибрана з групи, яку складають зв'язок, О і NR4. 20. Сполука за п. 16, яка відрізняється тим, що X5 вибрана з групи, яку складають О і CR4. 21. Сполука за п. 1, яка відрізняється тим, що R4 вибрана з групи, яку складають: гідроген, С1-6алкіл, С1-6алкілгалоген і галоген. 22. Сполука за п. 1, яка відрізняє ться тим, що Q є гетероарилом. 23. Сполука за п. 1, яка відрізняється тим, що Q вибрана з групи, яку складають: a) b) i c) X6 X6 X6 N O N N N N N N , . 24. Сполука за п. 1, яка відрізняється тим, що Q є X6 N N N a) . 25. Сполука за п. 1, яка відрізняється тим, що R2 і R3 незалежно вибрані з групи, яку складають: С1-4алкілгалоген, С1-6алкіл, С3-6циклоалкіл, С0-6алкіларил і С 0-6алкілгетероарил. 26. Сполука за п. 1, яка відрізняється тим, що А вибрана з групи, яку складають: гідроген, гідроксил, галоген, С0-6алкілціано, С1-6алкіл, -ОС1-6алкіл, С1-6алкілгалоген, ОС1-6алкілгалоген. 27. Сполука за п. 1, яка відрізняється тим, що вона вибрана з сполук: 4-(5-{2-[5-(3-хлорфеніл)-ізоксазол-3-іл]-піперидин1-іл}-4-метил-4Н[1,2,4]триазол-3-іл)-піридин, 3-[5-(3-хлорфеніл)-ізоксазол-3-іл]-4-(4-метил-5піридин-4-іл-4Н-[1,2,4]триазол-3-іл)-морфолін, 3-[5-(3-хлорфеніл)-ізоксазол-3-іл]-4-[5-(4дифлуорметоксифеніл)-4-метил-4Н-[1,2,4]триазол3-іл]-морфолін, 3-[3-(3-хлорфеніл)-[1,2,4]оксадіазол-5-іл]-4-(4метил-5-піридин-4-іл-4Н-[1,2,4]триазол-3-іл)морфолін, 3-[3-(3-хлорфеніл)-[1,2,4]оксадіазол-5-іл]-4-[5-(4дифлуорметоксифеніл)-4-метил-4Н-[1,2,4]триазол3-іл]-морфолін, трет-бутиловий естер 3-[3-(3-хлорфеніл)[1,2,4]оксадіазол-5-іл]-4-(4-метил-5-піридин-4-іл4Н-[1,2,4]триазол-3-іл)-піперазин-1-карбонової кислоти, 2-[3-(3-хлорфеніл)-[1,2,4]оксадіазол-5-іл]-1-(4метил-5-піридин-4-іл-4Н-[1,2,4]триазол-3-іл)піперазин, 5 2-[3-(3-хлорфеніл)-[1,2,4]оксадіазол-5-іл]-4-метил1-(4-метил-5-піридин-4-іл-4Н-[1,2,4]триазол-3-іл)піперазин, трет-бутиловий естер 3-[3-(3-хлорфеніл)[1,2,4]оксадіазол-5-іл]-4-[5-(4дифлуорметоксифеніл)-4-метил-4Н-[1,2,4]триазол3-іл]-піперазин-1-карбонової кислоти, 2-[3-(3-хлорфеніл)-[1,2,4]оксадіазол-5-іл]-1-[5-(4дифлуорметоксифеніл)-4-метил-4Н-[1,2,4]триазол3-іл]-піперазин, 2-[3-(3-хлорфеніл)-[1,2,4]оксадіазол-5-іл]-1-[5-(4дифлуорметоксифеніл)-4-метил-4Н-[1,2,4]триазол3-іл]-4-метилпіперазин, 2-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]-1-{5-[4(дифлуорметокси)феніл]-4-метил-4Н-1,2,4триазол-3-іл}піперидин, 4-(5-{2-[2-(3-хлорфеніл)-2Н-тетразол-5іл]піперидин-1-іл}-4-метил-4Н-1,2,4-триазол-3іл)піридин, 2-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]-1-[5-(4метоксифеніл)-4-метил-4Н-1,2,4-триазол-3іл]піперидин, [4-(5-{2-[2-(3-хлорфеніл)-2Н-тетразол-5іл]піперидин-1-іл}-4-метил-4Н-1,2,4-триазол-3іл)феніл]диметиламін, [4-(5-{2-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]піперидин-1-іл}-4-метил-4Н-[1,2,4]триазол-3-іл)бензил]-диметиламін, {2-[4-(5-{2-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]піперидин-1-іл}-4-метил-4Н-[1,2,4]-триазол-3-іл)феноксі]-етил}-диметиламін, (R)-3-[3-(3-хлорфеніл)-[1,2,4]оксадіазол-5-іл]-4-(4метил-5-піридин-4-іл-4Н-[1,2,4]-триазол-3-іл)морфолін, (S)-3-[3-(3-хлорфеніл)-[1,2,4]оксадіазол-5-іл]-4-(4метил-5-піридин-4-іл-4Н-[1,2,4]-триазол-3-іл)морфолін, (R)-2-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]-1-{5-[4(дифлуорметокси)феніл]-4-метил-4Н-1,2,4триазол-3-іл}піперидин, (S)-2-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]-1-{5-[4(дифлуорметокси)феніл]-4-метил-4Н-1,2,4триазол-3-іл}піперидин, (R)-4-(5-{2-[2-(3-хлорфеніл)-2Н-тетразол-5іл]піперидин-1-іл}-4-метил-4Н-1,2,4-триазол-3іл)піридин, (S)-4-(5-{2-[2-(3-хлорфеніл)-2Н-тетразол-5іл]піперидин-1-іл}-4-метил-4Н-1,2,4-триазол-3іл)піридин, 4-[5-(5-{2-[5-(3-хлорфеніл)-ізоксазол-3-іл]піролідин-1-іл}-4-циклопропіл-4Н-[1,2,4]триазол-3іл)-піридин-2-іл]-морфолін, 4-[5-(5-{2-[5-(3-хлорфеніл)-ізоксазол-3-іл]піролідин-1-іл}-4-метил-4Н-[1,2,4]триазол-3-іл)піридин-2-іл]-морфолін, 3-(5-{2-[5-(3-хлорфеніл)-ізоксазол-3-іл]-піролідин-1іл}-4-метил-4Н-[1,2,4]триазол-3-іл)-піридин, 4-(5-{2-[5-(3-хлорфеніл)-ізоксазол-3-іл]-піролідин-1іл}-4-циклопропіл-4Н-[1,2,4]-триазол-3-іл)-піридин, 3-[5-(3-хлорфеніл)-[1,2,4]оксадіазол-3-іл]-4-(5піридин-4-іл-4Н-[1,2,4]триазол-3-іл)-морфолін, 3-[5-(3-хлорфеніл)ізоксазол-3-іл]-4-(4-циклопропіл5-піридин-3-іл-4Н-1,2,4-триазол-3-іл)морфолін, 3-[5-(3-хлорфеніл)ізоксазол-3-іл]-4-(4-циклопропіл5-піридин-4-іл-4Н-1,2,4-триазол-3-іл)морфолін, 82434 6 3-[5-(3-хлорфеніл)ізоксазол-3-іл]-4-(4-метил-5піридин-3-іл-4Н-1,2,4-триазол-3-іл)морфолін, 3-[5-(3-хлорфеніл)-ізоксазол-3-іл]-4-[5-(6метоксипіридин-3-іл)-4-метил-4Н-[1,2,4]-триазол-3іл]-морфолін, 3-[3-(3-хлорфеніл)-1,2,4-оксадіазол-5-іл]-4-[5-(2метоксипіридин-4-іл)-4-метил-4Н-1,2,4-триазол-3іл]морфолін, 3-[3-(3-хлорфеніл)-1,2,4-оксадіазол-5-іл]-4-[5-(2метилпіридин-4-іл)-4-метил-4Н-1,2,4-триазол-3іл]морфолін, 3-[3-(3-хлорфеніл)-1,2,4-оксадіазол-5-іл]-4-[5-(5флуорпіридин-3-іл)-4-метил-4Н-1,2,4-триазол-3іл]морфолін, 3-[5-(3-хлорфеніл)ізоксазол-3-іл]-4-[5-(5флуорпіридин-3-іл)-4-метил-4Н-1,2,4-триазол-3іл]морфолін, 3-[3-(3-хлорфеніл)-1,2,4-оксадіазол-5-іл]-4-(4метил-5-піридин-2-іл-4Н-1,2,4-триазол-3іл)морфолін, 4-[5-(5-флуорпіридин-3-іл)-4-метил-4Н-1,2,4триазол-3-іл]-3-[3-(3-йодфеніл)-1,2,4-оксадіазол-5іл]морфолін, 3-[3-(3-йодфеніл)-1,2,4-оксадіазол-5-іл]-4-(4-метил5-піридин-4-іл-4Н-1,2,4-триазол-3-іл)морфолін, 3-[5-(3-хлорфеніл)ізоксазол-3-іл]-4-[5-(2метилпіридин-4-іл)-4-метил-4Н-1,2,4-триазол-3іл]морфолін, 3-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]-4-(4-метил-5піридин-3-іл-4Н-1,2,4-триазол-3-іл)морфолін, 3-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]-4-[5-(3,5дифлуорфеніл)-4-метил-4Н-1,2,4-триазол-3іл]морфолін, 3-(5-{2-[5-(3-хлорфеніл)ізоксазол-3-іл]піролідин-1іл}-4-циклопропіл-4Н-1,2,4-триазол-3-іл)піридин і 4-(5-{2-[5-(3-хлорфеніл)ізоксазол-3-іл]піролідин-1іл}-4-метил-4Н-1,2,4-триазол-3-іл)піридин. 28. Фармацевтична композиція, яка містить як активний інгредієнт терапевтично ефективну кількість сполуки за будь-яким з пп. 1-26 з одним або більше фармацевтично прийнятними розріджувачами, ексципієнтами і/або інертними носіями. 29. Фармацевтична композиція за п. 28, яка відрізняється тим, що призначена для використання у лікуванні розладів, опосередкованих mgluR5. 30. Сполука за будь-яким з пп. 1-27, призначена для застосування у терапії. 31. Сполука за будь-яким з пп. 1-27, призначена для лікування розладів, опосередкованих mgluR5. 32. Застосування сполуки за будь-яким з пп. 1-27 у виготовленні медикаменту для лікування розладів, опосередкованих mgluR5. 33. Спосіб лікування розладів, опосередкованих mgluR5, в якому вводять ссавцю, включаючи людину, який потребує такого лікування, терапевтично ефективну кількість сполуки за будь-яким з пп. 1-27. 34. Спосіб за п. 33, який відрізняється тим, що призначений для застосування у лікуванні неврологічних розладів. 35. Спосіб за п. 33, який відрізняється тим, що призначений для застосування у лікуванні психіатричних розладів. 7 82434 8 36. Спосіб за п. 33, який відрізняється тим, що призначений для застосування у лікуванні хронічних і гостри х больових розладів. 37. Спосіб за п. 33, який відрізняється тим, що призначений для застосування у лікуванні шлунково-кишкових розладів. 38. Спосіб інгібування активування рецепторів mgluR5, в якому обробляють клітини, що містять зазначений рецептор, ефективною кількістю сполуки за п. 1. Винахід стосується нового класу сполук, фармацевтичних композицій, що містять зазначені сполуки, і застосування зазначених сполук у терапії. Винахід стосується також способів приготування зазначених сполук і нових інтермедіатів, що використовуються при їх приготуванні. Глютамат є головним збуджуючим нейротрансмітером у центральній нервовій системі (ЦНС) ссавців. Дія глютамату на центральні нейрони полягає у приєднанні до клітинної поверхні рецепторів і її активуванні. Ці рецептори розділяють на два головні класи - іонотропічні і метаботропічні рецептори глютамату, базуючись на структурних особливостях протеїнів рецептора, через які рецептори пересилають сигнали у клітину, і на фармакологічних профілях. Метаботропічними рецепторами глютамату (mgluR) є з'єднані G-протеїном рецептори, що активують різні внутрішньоклітинні другі інформаційні системи після зв'язування глютамату. Активування mgluR у цілісному нейроні ссавця викликає одну або декілька реакцій: активування фосфоліпази С; підвищення рівня гідролізу фосфоїноситиду (РІ); вивільнення внутрішньоклітинного кальцію; активування фосфоліпази D; активування або інгібування аденілциклази; підвищення або зниження формування циклічного аденозинмонофосфату (сАМР); активування гуанілілциклази; підвищення утворення циклічного гуанозинмонофосфату (cGMP); активування фосфоліпази А2; підвищення вивільнення арахідонічної кислоти; і підвищення або зниження активності іонних каналів, керованих напругою і керованих лігандом. [Див. Schoepp et al., Trends Pharmacol. Sci. 74: 13 (1993), Schoepp, Neurochem. Int. 24: 439 (1994), Pin et al., Neuropharmacology 34: 1 (1995), Bordi and Ugolini, Prog. Neurobiol. 59: 55 (1999)]. Молекулярним клонуванням були визначені вісім різних субтипів mgluR, позначених mgluR1 mgluR8. [Див. Nakanishi, Neuron 73: 1031 (1994), Pin et al., Neuropharmacology 34: 1 (1995), Knopfel et al., J. Med. Chem. 38: 1417 (1995)]. Подальша диверсифікація рецептора виявляється через експресію інших розщеплених форм певних субтипів mgluR. [Див. Pin et al., PNAS 89: 10331 (1992), Minakami et al., BBRC 799:1136 (1994), Joly etal., J. Neurosci. 75:3970 (1995)]. Субтипи метаботропічного рецептора глютамату можна розділити на три групи: Групу І, Групу II і Групу III mgluR, базуючись на гомології амінокислотної послідовності, другій інформаційній системі рецепторів і на їх фармакологічних характеристиках. Група І mgluR включає mgluR1, mgluR5 і їх розщеплені варіанти. Зв'язування агоністів з цими рецепторами активує фосфоліпазу С і мобілізує внутрішньоклітинний кальцій. Неврологічні психіатричні і больові розлади Згідно з спробами зрозуміти фізіологічні ролі Групи І mgluR, вважають, що активування цих рецепторів викликає нейронне збудження. Різні дослідження показали, що агоністи Групи І mgluR можуть викликати постсинаптичне збудження після дії на нейрони у гіпокампі, корі мозку, мозочку і в інших місцях ЦНС. Є свідчення того, що це збудження є наслідком прямого активування постсинаптичного mgluR, але вважають також, що активування пресинаптичного mgluR викликає підвищення вивільнення нейротрансмітеру. [Див. Baskys, Trends Pharmacol. Sci. 15: 92 (1992), Schoepp, Neurochem. Int. 24: 439 (1994), Pin et al., Neuropharmacology 34: 1 (1995), Watkins et al., Trends Pharmacol. Sci. 15: 33 (1994)]. Метаботропічні рецептори глютамату беруть участь у багатьох нормальних процесах у ЦНС ссавців. Активування mgluR, як було показано, є необхідним для індукування довготермінового потенціонування гіпокампу і довготермінової депресії мозочку. [Див. Bashir et al., Nature 363: 347 (1993), Bortolotto et al., Nature 368: 740 (1994), Aiba et al., Cell 79: 365 (1994), Aiba et al., клітин 79: 377 (1994)]. Роль активування mgluR у ноціцепції і аналгезії також була показана. [Див. Meller et al., Neuroreport 4: 879 (1993), Bordi and Ugolini, Brain Res. 871: 223 (1999)]. Крім того, було показано, що активування mgluR відіграє модуляторну роль у різних нормальних процесах, включаючи синаптичну передачу, нейронний розвиток, апоптичну смерть нейронів, синаптичну пластичність, просторове навчання, нюхову пам'ять, центральний контроль серцевої активності, пробудження, моторний контроль і контроль вестибулоокулярного рефлексу. [Див. Nakanishi, Neuron 13: 1031 (1994), Pin et al., Neuropharmacology 34: 1, Knopf el et al., J. Med. Chem. 38: 1417 (1995)]. Крім того, вважають, що Група І метаботропічних рецепторів глютамату грає певну роль у різних гострих і хронічних патофізіологічних процесах і розладах, що діють на ЦНС, включаючи інсульт, травму голови, аноксичні і ішемічні травми, гіпоглікемію, епілепсію, нейродегенеративні розлади, наприклад, хворобу Альцгеймера, психіатричні розлад і біль. [Див. Schoepp et al., Trends Phanvacol. Sci. 14: 13 (1993), Cunningham et al., Life Sci. 54: 135 (1994), Hollman et al., Ann. Rev. Neurosci. 17: 31 (1994), Pin et al., Neuropharmacology 34: 1 (1995), Knopfel et al., J. Med. Chem. 38: 1417 (1995), Spooren et al., Trends Phanvacol. Sci. 22: 331 (2001), Gasparini et al. Curr. 9 82434 Opin. Pharmacol. 2: 43 (2002), Neugebauer Pain 98: 1 (2002)]. Вважають, що більшість цих патологій викликаються надмірним індукованим глютаматом збудженням нейронів ЦНС. Оскільки, як вважають, Група І mgluR підвищує опосередковане глютаматом нейронне збудження через постсинаптичні механізми і підвищене пресинаптичне вивільнення глютамату, їх активування, можливо, сприяє патології. Тому деякі антагоністи Групи І рецепторів mgluR можуть мати терапевтичну цінність для усіх станів, викликаних надмірним індукованим глютаматом збудженням нейронів ЦНС, зокрема, як нейрозахисні агенти, аналге-тики або антиконвульсанти. Останні досягнення у виявленні нейрофізіологічних ролей метаботропічних рецепторів глютамату взагалі і Групи І зокрема показали, що ці рецептори є перспективними об'єктами у терапії гострих і хронічних неврологічних і психіатричних розладів і хронічних і гострих больових розладів. Шлунково-кишкові розлади Нижній стравохідний сфінктер (НСФ) має схильність до переміжних розслаблень, внаслідок чого рідина з шлунку може пройти у страво хід. Це явище називають "гастрорефлюк-сом". Гастро-стравохідна рефлюксна хвороба (ГСРХ) є найпоширенішою хворобою верхнього шлунково-кишкового тракту. Сучасна фармакотерапія спрямована на зниження секреції шлункової кислоти або її нейтралізації у стравоході. Головний механізм, що викликає гастрорефлюкс, як вважають, залежить від гіпотонії нижнього стравохідного сфінктеру. Однак, у [Holloway & Dent (1990) Gastroenterol. Clin. N. Аmer. 19, pp.517-535], показано, що рефлюксні явища виникають під час тимчасових релаксацій нижнього стравохідного сфінктеру (THCOR), тобто релаксацій, не викликаних ковтанням. Було також показано, що у пацієнтів з ГСРХ секреція шлункової кислоти є нормальною. Можна сподіватись, що нові сполуки згідно з винаходом можуть бути корисними для інгібування тимчасових релаксацій нижнього стравохідного сфінктеру (THCOR) і, отже, при лікуванні гастростравохідного рефлюксного розладу (ГСРХ). Термін "THCOR" - тимчасова релаксація нижнього стравохідного сфінктеру - відповідає визначенню у [Mittal, R.K., Holloway, R.H., Репадіпі, R., Blackshaw, L.A., Dent, J., 1995; Transient lower esophageal sphincter relaxation. Gastroenterology 109, pp.601-610]. Термін "гастрорефлюкс" означає здатність рідини з шлунку потрапляти у стравохід внаслідок тимчасового зникнення механічного бар'єру. Термін "ГСРХ" - гастро-стравохідна рефлюксна хвороба - визначено у [van Heerwarden,мл, Smout A.J.P.M, 2000; Diagnosis of reflux disease. Bailliere's Clin. Gastroenterol. 14, pp.759-774]. Внаслідок їх фізіологічного і патофізіологічного значення існує потреба у нових потужних агоністах і антагоністах mgluR з високою селективністю до субтипів mgluR, зокрема, до субтипу рецептора Групи І. Згідно з одним з аспектів, винахід стосується сполуки формули І 10 де P вибрана з арилу і гетероарилу; R1 приєднана до P через атом карбону на кільці P і вибрана з групи, яку складають гідрокси, галоген, нітро, С1-6алкілгалоген, ОС1-6алкілгалоген, С1-6алкіл, ОС1-6алкіл, С2-6алкеніл, ОС2-6алкеніл, С2-6алкініл, ОС2-6алкініл, С0-6алкілС-6циклоалкіл, ОС0-6алкілС 3-6циклоалкіл, С0-6алкіларил, ОС0-6алкіларил, СНО, (CO)R5, O(CO)R 5, O(CO)OR 5, O(CNR5)OR5 , С1-6алкілOR5, ОС2-6алкілOR5, С1-6алкіл(СО)R5, ОС1-6алкіл(СО)R5, C0-6aлкiлCO2R5, ОС1-6алкілСO2R5, С0-6алкілціано, ОС2--6алкілціано, C0-6алкілNR5R6, OC2-6алкілNR5R6, C1-6алкіл(CO)NR5R6, ОС1-6алкіл(СО)NR5R6, C0-6aлкілNR5(CO)R6, OC2-6алкілNR5(CO)R6, 5 5 6 C0-6алкілNR (CO)NR R , C0-6aлкiлSR5, OC2-6aлкiлSR5, C0-6алкіл(SO)R5, OC2-6aлкiл(SO)R5, C0-6алкілSO2R5, OC2-6алкілSO2R5, 5 6 C0-6алкіл(SO2)NR R , OC2-6aлкiл(SO2)NR5R6, 5 6 C0-6aлкiлNR (SO2)R , OC 2-6aлкiлNR5(SO2)R6, 5 5 6 C0-6алкілNR (SO2)NR R , OC2-6aлкiлNR5(SO2)NR5R6, (CO)NR5R6e, 5 6 5 6 O(CO)NR R , NR OR , C0-6aлкілNR5(CO)OR 6, 5 6 OC2-6алкілNR (СО)OR , SO3R5 і 5- або 6-членне кільце, яке містить атоми, незалежно вибрані з групи, яку складають С, Ν, Ο і S; X1 вибрана з групи, яку складають: N, NR4i 4 CR ; X2 вибрана з групи, яку складають: С і N; X3 вибрана з групи, яку складають: CR4, N і О; X4 вибрана з групи, яку складають: CR4, N, NR4 і О; X5 вибрана з групи, яку складають: зв'язок, CR4R4, NR4,O, S, SO і SO 2; Xе вибрана з групи, яку складають: CR4 і N; X7 вибрана з групи, яку складають: С і N; R4 незалежно вибрана з групи, яку складають гідроген, гідрокси, С1-6алкіл, С0-6алкілціано, оксо, =NR5, =NOR 5, С1-4алкілгалоген, галоген, С3-7циклоалкіл, О(СО)С1-4алкіл, С1-4алкіл(SО)С0-4алкіл, С1-4алкіл(SО2)С0-4алкіл, (SО)С0-4алкіл, (SО2)С0-4алкіл, ОС1-4алкіл, С1-4алкілOR5 і С0-4aлкілNR5R6; Q вибрана з групи, яку складають гетероциклоалкіл і гетероарил; R2 і R3 незалежно вибрані з групи, яку складають: гідрокси, С0-6алкілціано, оксо, =NR5, =NOR 5, С1-4алкілгалоген, галоген, С1-6алкіл, С3-7циклоалкіл, С0-6алкіларил, С0-6алкілгетероарил, С1-6алкілциклоалкіл, С0-6алкілгетероцикпоалкіл, ОС1-4алкіл, ОС0-6алкіларил, О(СО)С1-4алкіл, (СО)ОС 1-4алкіл, С0-4алкіл(S)С0-4алкіл, С1-4алкіл(SО)С0-4алкіл, С1-4алкіл(SО2)С0-4алкiл, (SO)С0-4алкіл, (SО2)С0-4алйл, С1-4алкілOR5, 5 6 С0-4алкілNR R і 5- або 6-членне кільце, яке міс 11 82434 тить атоми, незалежно вибрані з С, Ν, Ο і S, причому це кільце може, як варіант, бути злите з 5або 6-членним кільцем, яке містить атоми, незалежно вибрані з групи, яку складають С, N і О, а зазначене кільце і зазначене злите кільце можуть бути заміщені однією або більше А; де будь-які С 1-6алкіл, арил або гетероарил, визначені для R1, R2 і R3, можуть бути заміщені однією або більше А; А вибрана з групи, яку складають: гідроген, гідрокси, галоген, нітро, оксо, С0-6алкілціано, С0-4алкілС 3-7циклоалкіл, С1-6алкіл, -ОС1-6алкіл, С1-6алкілгалоген, ОС1-6алкілгалоген, С2-6алкеніл, С0-3алкіларил, C0-6алкілOR5, OC2-6алкілOR5, 5 5 C0-6алкілSR , OC2-6алкілSR , (CO)R5, O(CO)R 5, ОС2-6алкілціано, OC1-6aлкілCO2R5, O(CO)OR 5, 5 5 OC1-6aлкіл(CO)R , C1-6aлкіл(CO)R , NR5ORe, 5 6 5 6 С0-6NR R , OC2-6aлкілNR R , С0-6aлкіл(CO)NR5R6, ОС1-6aлкіл(CO)NR5R6, OC2-6aлкілNR5(CO)R6, 5 6 С0-6aлкілNR (CO)R , С0-6aлкілNR5(CO)NR5R6, 5 6 O(CO)NR R , С0-6aлкіл(SO2)NR5R6, 5 6 OC2-6алкіл(SO2)NR R , C0-6алкілNR5(SO2)R6, OC2-6алкілNR5(SO2)R6, SO3R5, 5 5 6 С1-6aлкілNR (SO2)NR R , OC2-6алкіл(SO2)R5, 5 С0-6aлкіл(SO2)R , С0-6алкіл(SO)R5, 5 OC2-6алкіл(SO)R і 5- або 6-членне кільце, яке містить атоми, незалежно вибрані з групи, яку складають С, Ν, Ο і S; R5 і R6 незалежно вибрані з Н, С1-6алкілу, С3-7циклоалкілу і арилу; m вибране з 0, 1, 2, 3 або 4; n вибране з 0,1, 2, 3 або 4; p вибране з 0,1, 2, 3 або 4; і і її солі або гідрату. Згідно з іншим аспектом, винахід включає фармацевтичні композиції, які містять терапевтично ефективну кількість сполуки формули І і фармацевтично прийнятні розріджувачі, ексципієнти і/або інертні носи. Згідно з ще одним аспектом, винахід включає фармацевтичну композицію, яка містить сполуку формули І і призначена для використання у лікуванні розладів, опосередкованих рецептором mgluR5, і для використання у лікуванні неврологічних розладів, психіатричних розладів, шлунковокишкових розладів і больових розладів. Згідно з іншим аспектом, винахід включає сполуку формули І, призначену для використання у терапії, зокрема, для лікування розладів, опосередкованих рецептором mgluR5, і для лікування неврологічних розладів, психіатричних розладів, шлунково-кишкових розладів і больових розладів. Згідно з подальшим аспектом, винахід включає застосування сполуки формули X у виготовленні медикаменту для лікування або профілактики ожиріння і станів, пов'язаних з ожирінням, а також розладів вживання їжі зниженням надмірного прийому їжі, що викликає ожиріння і і пов'язані з ним ускладнення. Згідно з іншим аспектом, винахід включає способи приготування сполуки формули І і інтермедіатів, що використовуються для цього. Ці і інші аспекти винаходу де тально розглядаються у подальшому описі. 12 Задачею винаходу є отримання сполук, які діють на метаботропічні рецептори глютамату (mgluR), зокрема, рецептори mgluR5. Нижче наведено визначення термінів в описі і Формулі винаходу. Якщо в описі певна група охарактеризована як "визначена раніше", "раніше визначена" або "визначена вище", це означає, що цієї групи стосується перше і ширше визначення у тексті, а також всі інші визначення цієї групи. "С1-6" означає карбонову груп у з 1, 2, 3, 4, 5 або б атомами карбону. "С1-3" означає карбонову груп у з 1, 2 або 3 атомами карбону. Якщо нижнім індексом є 0, то дана група відсутня. Якщо не зазначено інше, термін "алкіл" включає як лінійні, так і розгалужені ланцюгові алкільні групи і може включати (не лише) метил, етил, nпропіл, і-пропіл, n-бутил, і-бутил, s-бутил, t-бутил, n-пентил, і-пентил, t-пентил, nео-пентил, n-гексил або і-гексил, t-гексил. C1-3алкіл має 1-3 атоми карбону і може бути метилом, етилом, n-пропілом або і-пропілом. Термін "циклоалкіл" включає, як варіант, заміщену, насичену циклічну гідрокарбонову кільцеву систему. Термін "С3-7циклоалкіл" може означати циклопропіл, циклобутил, цикпопентил, циклогексил або циклогептил. Якщо не зазначено інше, термін "алкокси" включає лінійні або розгалужені алкоксигрупи. С13алкокси може бути (не лише) метокси-, етокси-, nпропокси- або і-пропоксигрупою. Якщо не зазначено інше, термін "зв'язок" може включати насичені або ненасичені зв'язки. Якщо не зазначено інше, термін "галоген" може означати флуор, хлор, бром або йод. Якщо не зазначено інше, термін "алкілгалоген" означає алкільну гр упу, визначену ви ще і заміщену галогеном, описаним вище. Термін "С1-6алкілгалоген" може включати (не лише) флуорметил, дифлуорметил, трифлуорметил, флуоретил, дифлуоретил або бромпропіл. Термін "ОС 1-6алкілгалоген" може включати (не лише) флуорметокси, дифлуорметокси, трифлуорметокси, флуоретокси або дифлуоретокси. Якщо не зазначено інше, термін "алкеніл" включає лінійні і розгалужені ланцюгові ал-кенільні групи. Термін "С2-6алкеніл" стосується алкенільної групи з 2 - 6 атомами карбону і одним або двома подвійними зв'язками і може включати (не лише) вініл, аліл, пропеніл, і-пропеніл, бутеніл, і-бутеніл, кротил, пентеніл, і-пентеніл і гексеніл. Якщо не зазначено інше, термін "алкініл" включає лінійні і розгалужені ланцюгові алкінільні групи. С2-6алкініл має 2 - 6 атомів карбону і один або два потрійні зв'язки і може бути (не лише) етинілом, пропаргілом, бутинілом, і-бутинілом, пентинілом, і-пентинілом і гексинілом. Якщо не зазначено інше, термін "арил" стосується як варіант, заміщеної моноциклічної або біциклічної гідрокарбонової кільцевої системи з щонайменше одним ненасиченим ароматичним кільцем. Прикладами "арилу" є феніл, нафтил, 1,2,3,4-тетрагідронафтил, індил і інденіл. 13 82434 Якщо не зазначено інше, термін "гетероарил" стосується як варіант, заміщеної моноциклічної або біциклічної ненасиченої кільцевої системи з щонайменше одним гетероатомом, вибраним незалежно з Ν, Ο або S. Прикладами "гетероарилу" можуть бути (не лише) тіо фен, тієніл, піридил, тіазоліл, фурил, піроліл, триазоліл, імідазоліл, оксадіазоліл, оксазоліл, ізоксазоліл, піразоліл, імідазолоніл, оксазолоніл, тіазолоніл, тетразо-ліл і тіадіазоліл, бензоімідазоліл, бензооксазоліл, тетрагідротриазолопіридил, тетрагід-ротриазолопіримідиніл, бензофурил, індоліл, ізоіндоліл, піридоніл, піридазиніл, піримі-диніл, імідазопіридил, оксазолопіридил, тіазолопіридил, піридил, імідазопіридазиніл, ок-сазолопіридазиніл, тіазолопіридазиніл і пуриніл. Якщо не зазначено інше, терміни "алкіларил", "алкілгетероарил" і "алкілцикпоалкіл" стосуються замісників, приєднаних через алкільну груп у до арильної, гетероарильної і циклоалкільної груп. Якщо не зазначено інше, термін "гетероциклоалкіл" стосується як варіант, заміщеної насиченої циклічної гідрокарбонової кільцевої системи, в якій один або більше атомів карбону заміщені гетероатомом. Термін "гетероциклоалкіл" включає (не лише) піролідин, ТГФ, тетрагідротіофен, піперидин, піперазин, морфолін, тіоморфолін, тетрагідропіран, тетрагідротіопіран. Якщо не зазначено інше, термін "5- або 6членне кільце, яке містить атоми, незалежно вибрані з С, N, О або S", включає ароматичні і гетероароматичні кільця, а також карбоциклічні і гетероциклічні кільця, які можуть бути насиченими, частково насиченими або ненасиче-ними. Прикладами таких кілець можуть бути (не лише) фурил, ізоксазоліл, ізотіазоліл, оксазоліл, піразиніл, піразоліл, піридазиніл, піридил, піримщил, піроліл, тіазоліл, тієніл, імідазоліл, імідазолідиніл, імідазолініл, триазоліл, морфолініл, піперазиніл, піперидил, піперодиніл, піразолідиніл, піразолініл, піролідиніл, піролініл, тетрагідропіраніл, тіоморфолініл, феніл, циклогексил, циклопентил і цикпогексеніл. Якщо не зазначено інше, терміни "-NR5" і "=NOR5" означають іміно- і оксимогрупи, що несуть замісник R5 і можуть бути (можливо, частиною) групами, що містять (не лише) іміноалкіл, іміногідрокси, іміноалкокси, амідин, гідроксиамідин і алкоксиамідин. Якщо нижній індекс для групи є 0, ця група відсутня, тобто між групами нема прямого зв'язку. Якщо не зазначено інше, термін "злиті кільця" стосується двох кілець, які мають 2 спільні атоми. Якщо не зазначено інше, термін "місток" означає молекулярний фрагмент з одного або більше атомів або зв'язок, що з'єднують два віддалені атоми у кільці, утворюючи бі- або трициклічні системи. Одне з втілень винаходу стосується сполук формули І 14 де P вибрана з арилу і гетероарилу; R1 приєднана до P через атом карбону на кільці P і вибрана з групи, яку складають: гідрокси, галоген, нітро, С1-6алкілгалоген, ОС1-6алкілгалоген, С1-6алкіл, ОС1-6алкіл, С2-6алкеніл, ОС2-6алкеніл, С2-6алкініл, ОС2-6алкініл, С0-6алкілС 3-6циклоалкіл, ОС0-6алкілС 3-6циклоалкіл, С0-6алкіларил, ОС0-6алкіларил, СНО, (CO)R5, O(CO)R 5, O(CO)OR 5, O(CNR5)OR5 , С1-6алкілOR5, ОС2-6алкілOR5, С1-6алкіл(CO)R6, OС1-6aлкiл(CO)R5, С0-6алкілCO2R5, OС1-6алкілCO2R5, С0-6алкілціано, ОС2-6алкілціано, C0-6алкілNR5R6, OC2-6aлкiлNR5R6, С1-6алкіл(CO)NR5R6, OС1-6алкіл(CO)NR5R6, С0-6aлкiлNR5(CO)R6, OC2-6aлкiлNR5(CO)R6, 5 5 6 С0-6алкілNR (CO)NR R , С0-6aлкiлSR5, 5 5 OС2-6aлкiлSR , С0-6алкіл(SO)R , OС2-6aлкiл(SO)R5, С0-6алкілSО2R5, OC2-6aлкiлSO2R5, 5 6 С0-6алкіл(SO2)NR R , OC2-6aлкiл(SO2)NR5R6, С0-6алкiлNR5(SO2)R6, OC 2-6алкілNR5(SO2)R6, C0-6алкілNR5(SO2)NR5R6, OC2-6алкілNR5(SO2)NR5R6, (CO)NR5R6, 5 6 5 6 O(CO)NR R , NR OR , C0-6алкілNR5(CO)OR 6, 5 6 ОC2-6алкілNR (CO)OR , SO3R5 і 5- або 6-членне кільце, яке містить атоми, незалежно вибрані з групи, яку складають С, Ν, Ο і S; X1 вибрана з групи, яку складають: N, NR4 і 4 CR ; X2 вибрана з групи, яку складають: С і N; X3 вибрана з групи, яку складають: CR4, N і О; X4 вибрана з групи, яку складають: CR4, N, NR4 і О; Xs вибрана з групи, яку складають: зв'язок, 4 4' CR R , NR4,0, S, SO і SO 2; Xе вибрана з групи, яку складають: CR4 і N; X7 вибрана з групи, яку складають: С і N; R4 незалежно вибрана з групи, яку складають гідроген, гідрокси, С1-6алкіл, С0-6алкілціано, оксо, =NR5, =NOR 5, С1-4алкілгалоген, галоген, С3-7циклоалкіл, О(СО)С1-4алкіл, С1-4алкіл(SO)С0-4алкіл, С1-4алкіл(SО2)С0-4алкіл, (SO)C0-4алкіл, (SО)2C0-4алкіл, ОС1-4алкіл, С1-4алкілOR5 і C0-4алкілNR5R6; Q вибрана з групи, яку складають гетероциклоалкіл і гетероарил; R2 і R3 незалежно вибрані з групи, яку складають: гідрокси, С0-6алкілціано, оксо, =NR5, =NOR 5, С1-4алкілгалоген, галоген, С1-6алкіл, С3-6циклоалкіл, С0-6алкіларил, С0-6алкілгетероарил, С1-6алкілцикпоалкіл, С0-6алкілгетероциклоалкіл, ОС1-4алкіл, ОС0-6алкіларил, О(СО)С1-4алкіл, (СО)ОС 1-4алкіл, С0-4алкіл(S)С0-4алкіл, С1-4алкіл(SO)С0-4алкіл, С1-4алкіл(SО2)С0-4алкіл, (SО)С0-4алкіл, (SО2)С0-4алкіл, C1-4алкілOR5, 5 6 C0-4алкілNR R і 5- або 6-членне кільце, яке міс 15 82434 тить атоми, незалежно вибрані з С, Ν, Ο і S, причому це кільце може, як варіант, бути злите з 5або 6-членним кільцем, яке містить атоми, незалежно вибрані з групи, яку складають С, N і О, а зазначене кільце і зазначене злите кільце можуть бути заміщені однією або більше А; де будь-які С 1-6алкіл, арил або гетероарил, визначені для R1, R2 і R3, можуть бути заміщені однією або більше А; А вибрана з групи, яку складають: гідроген, гідрокси, галоген, нітро, оксо, С0-6алкілціано, С0-4алкілС 3-7циклоалкіл, С1-6алкіл, -ОС1-6алкіл, С1-6алкілгалоген, OС1-6алкілгалоген, С2-6алкеніл, С0-3алкіларил, С0-6алкілОR5, OC2-6алкілOR5, 5 5 С0-6алкілSR , OC2-6алкілSR , (CO)R5, O(CO)R 5, ОС2-6алкілціано, ОС1-6алкілСО2R5, O(CO)OR 5, 5 5 OС1-6алкіл(CO)R , С1-6алкіл(CO)R , NR5OR6, 5 6 5 6 С0-6NR R , OC2-6алкілNR R , С0-6алкіл(CO)NR5R6, OС1-6aлкіл(CO)NR5R6, OC2-6алкілNR5(CO)R6, 5 6 С0-6алкілNR (CO)R , С0-6алкілNR5(CO)NR5R6, 5 6 O(CO)NR R , С0-6алкіл(SO2)NR5R6, 5 6 OС2-6алкіл(SO2)NR R , С0-6алкілNR5(SO2)R6, ОС2-6алкілNR5(SO2)R6, SO3R5, 5 5 6 C1-6алкілNR (SO2)NR R , OC2-6алкіл(SO2)R5, 5 С0-6алкіл(SO2)R , C0-6алкіл(SO)R5, 5 OC2-6алкіл(SO)R і 5- або 6-членне кільце, яке містить атоми, незалежно вибрані з групи, яку складають С, Ν, Ο і S; R5 і R6 незалежно вибрані з N, С1-6алкілу, С3-7циклоалкілу і арилу; m вибране з 0,1, 2, 3 або 4; n вибране з 0,1, 2, 3 або 4; p вибране з 0,1, 2, 3 або 4; і їх солей або гідратів. Інше втілення винаходу стосується сполук: 4-(5-{2-[5-(3-хлорфеніл)-ізоксазол-3-іл]піперидин-1-іл}-4-метил-4Н[1,2,4]триазол-3-іл)піридин, 3-[5-(3-хлорфеніл)-ізоксазол-3-іл]-4-(4-метил-5піридин-4-іл^-4Н-[1,2,4]триазол-3-іл)-морфолін, 3-[5-(3-хлорфеніл)-4-зоксазол-3-іл]-4-[5-(4дифлуорметоксифеніл)-4-метил-4Н-[1,2,4]триазол3-іл]-морфолін, 3-[3-(3-хлорфеніл)-[1,2,4]оксадіазол-5-іл]-4-(4метил-5-піридин-4-іл-4Н-[1,2,4]триазол-3-іл)морфолін, 3-[3-(3-хлорфеніл)-[1,2,4]оксадіазол-5-іл]-4-[5(4-дифлуорметоксифеніл)-4-метил-4Н[1,2,4]триазол-3-іл]-морфолін, трет-бутиловий естер 3-[3-(3-хлорфеніл){1,2,4]оксадіазол-5-іл]-4-(4-метил-5-піридин-4-іл4Н-[1,2,4]триазол-3-іл)-піперазин-1-карбонової кислоти, 2-[3-(3-хлорфеніл)-[1,2,4]оксадіазол-5-іл]-1-(4метил-5-піридин-4-іл-4Н-1,2,4]триазол-3-іл)піперазин, 2-[3-(3-хлорфеніл)-[1,2,4]оксадіазол-5-іл]-4метил-1-(4-метил-5-піридин-4-іл-4Н-[1,2,4]триазол3-іл)-піперазин, трет-бутиловий естер 3-[3-(3-хлорфеніл)[1,2,4]оксадіазол-5-іл]-4-[5-(4-дифлуорметоксифеніл)-4-метил-4Н-[1,2,4]триазол-3-іл]-піперазин1-карбонової кислоти, 16 2-[3-(3-хлорфеніл)-[1,2,4]оксадіазол-5-іл]-1-[5(4-дифлуорметоксифеніл)-4-метил-4Н[1,2,4]триазол-3-іл]-піперазин, 2-[3-(3-хлорфеніл)-[1,2,4]оксадіазол-5-іл]-1-[5(4-дифлуорметоксифеніл)-4-метил-4Н[1,2,4]триазол-3-іл]-4-метилпіперазин, 2-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]-1-{5-[4(дифлуорметокси)феніл]-4-метил-4Н-1,2,4триазол-3-іл}піперидин, 4-(5-{2-[2-(3-хлорфеніл)-2Н-тетразол-5іл]піперидин-1-іл}-4-метил-4Н-1,2,4-триазол-3іл)піридин, 2-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]-1-[5-(4метоксифеніл)-4-метил-4Н-1,2,4-триазол-3іл]піперидин, [4-(5-{2-[2-(3-хлорфеніл)-2Н-тетразол-5іл]піперидин-1-іл}-4-метил-4Н-1,2,4-триазол-3іл)феніл]диметиламін, [4-{5-{2-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]піперадин-1-іл}-4-метил-4Н-[1,2,4}триазол-3-іл)бензил]-диметиламін, {2-[4-(5-{2-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]піперидин-1-іл}-4-метил-4Н-[1,2,4]триазол-3-іл)фенокси]-етил}-диметиламін, (R)-3-[3-(3-хлорфеніл)-[1,2,4]оксадіазол-5-іл]-4(4-метил-5-піридин-4-іл-4Н-[1,2,4]триазол-3-іл)морфолін, (S)-3-[3-(3-хлорфеніл)-[1,2,4]оксадіазол-5-іл]-4(4-метил-5-піридин-4-іл-4Н-[1,2,4]триазол-3-іл)морфолін, (R)-2-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]-1-{5[4-(дифлуорметокси)феніл]-4-метил-4Н-1,2,4триазол-3-іл}піперидин, (S)-2-[2-(3-хлорфеніл)-2Н-тетразоп-5-іл]-1-{5[4-(дифлуорметокси)феніл]-4-метил-4Н-1,2,4триазол-3-іл}піперидин, (R)-4-(5-[2-[2-(3-хлорфеніл)-2Н-тетразол-5іл]піперидин-1-іл}-4-метил-4Н-1,2,4-триазол-3іл)піридин, (S)-4-(5-{2-[2-(3-хлорфеніл)-2Н-тетразол-5іл]піперидин-1-іл}-4-метил-4Н-1,2,4-триазол-3іл)піридин, 4-[5-(5-{2-[5-(3-хлорфеніл)-ізоксазол-3-іл]піролідин-1-іл}-4-циклопропіл-4Н-[1,2,4]триазол-3іл)-піридин-2-іл]-морфолін, 4-[5-(5-{2-[5-(3-хлорфеніл)-ізоксазол-3-іл]піролідин-1-іл}-4-метил-4Н-[1,2,4]триазол-3-іл)піридин-2-іл]-морфолін, 3-(5-{2-[5-(3-хлорфеніл)-4-iзоксазол-3-іл]піролідин-1-іл}-4-метил-4Н-[1,2,4]триазол-3-іл)піридин, 4-(5-{2-[5-(3-хпорфеніл)-ізоксазол-3-іл]піролідин-1-іл}-4-циклопропіл-4Н-[1,2,4]триазол-3іл)-піридин, 3-[5-(3-хлорфеніл)-[1,2,4]оксадіазол-3-іл]-4-(5піридин-4-іл-4Н-{1,2,4]триазол-3-іл)-морфолін, 3-[5-(3-хлорфеніл)ізоксазол-3-іл]-4-(4цикпопропіл-5-піридин-3-іл-4Н-1,2,4-триазол-3іл)морфолін, 3-[5-(3-хлорфеніл)ізоксазол-3-іл]-4-(4циклопропіл-5-піридин-4-іл-4Н-1,2,4-триазол-3іл)морфолін, 3-[5-(3-хлорфеніл)ізоксазол-3-іл]-4-(4-метил-5піридин-3-іл-4Н-1,2,4-триазол-3-іл)морфолін, 17 82434 3-[5-(3-хлорфеніл)-ізокcазол-3-іл]-4-[5-(6метокси-піридин-3-іл)-4-метил-4Н-[1,2,4]триазол-3іл]-морфолін, 3-[3-(3-хлорфеніл)-1,2,4-оксадіазол-5-іл]-4-[5(2-метоксипіридин-4-іл)-4-метил-4Н-1,2,4-триазол3-іл]морфолін, 3-[3-(3-хлорфеніл)-1,2,4-оксадіазолд-5-іл]-4-[5(2-метилпіридин-4-іл)-4-метил-4Н-1,2,4-триазол-3іл]морфолін, 3-[3-(3-хлорфеніл)-1,2,4-оксадіазол-5-іл]-4-[5(5-флуорпіридин-3-іл)-4-метил-4Н-1,2,4-триазол-3іл]морфолін, 3-[5-(3-хлорфеніл)ізоксазол-3-іл]-4-[5-(5флуорпіридин-3-іл)-4-метил-4Н-1,2,4-триазол-3іл]морфолін, 3-[3-(3-хлорфеніл)-1,2,4-оксадіазол-5-іл]-4-(4метил-5-піридин-2-іл-4Н-1,2,4-триазол-3іл)морфолін, 4-[5-(5-флуорпіридин-3-іл)-4-метил-4Н-1,2,4триазол-3-іл]-3-[3-(3-йрдфеніл)-1,2,4-оксадіазол-5іл]морфолін, 3-[3-(3-йoдфеніл)-1,2,4-оксадіазол-5-іл]-4-(4метил-5-піридин-4-іл-4Н-1,2,4-триазол-3іл)морфолін, 3-[5-(3-хлорфеніл)ізоксазол-3-іл]-4-[5-(2метилпіридин-4-іл)-4-метил-4Н-1,2,4-триазол-3іл]морфолін, 3-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]-4-(4метил-5-піридин-3-іл-4Н-1,2,4-триазол-3іл)морфолін і 3-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]-4-[5-(3,5дифлуорфеніл)-4-метил-4Н-1,2,4-триазол-3іл]морфолін. Винахід стосується поліцикпічних сполук формули 1, в якій P - арил, зокрема, феніл. У втіленнях винаходу m дорівнює 1 або 2. У бажаних втіленнях винаходу P - феніл з одним або двома замісниками R1. У більш бажаних втіленнях винаходу, коли P має одного замісника R1, цей замісник знаходиться у 3-й позиції фенілу відносно X2. В інших втіленнях винаходу, де є 2 замісники R1, вони знаходяться у 2-й і 5-й позиціях фенілу, відносно X2. В іншому втіленні винаходу R1 вибрана з групи, яку складають: гідроген, галоген, С1-6алкілгалоген, ОС1-6алкілгалоген, С1-6алкіл, ОС1-6алкіл, С1-6алкілOR5, С0-6алкілціано, 5 6 С0-6алкілNR R . У ще одному втіленні винаходу R1 вибрана з групи, яку складають СІ, F, Me, ОМе, CF3, OCF3 і CN. В одному з втілень винаходу R 1 СІ. У подальшому втіленні винаходу X7 - С В інших втіленнях винаходу X2 - С. У бажаних втіленнях винаходу щонайменше одна з X2 і X7 є С. В іншому втіленні винаходу X3 вибрана з N і О. Винахід також стосується сполук формули І, в яких X2 - С. Втілення винаходу включають такі, де X1 є N або CR4. В іншому втіленні винаходу, якщо X3 - О, то X4 - N і якщо X3 - N, то Х4-О. В іншому втіленні винаходу X2 - N. У ще одному втіленні винаходу Xі - N. У подальшому втіленні винаходу X3 - N і X4 є N або CR4. В іншому втіленні винаходу X5 вибрана з групи, яку складають CR4R4, NR4, О, S, SO і SO2. У ще одному втіленні винаходу X5 вибрана з групи, яку 18 складають CR4R4, NR4 і О. У подальшому втіленні винаходу X5 вибрана з групи, яку складають О і NR4. Бажані втілення винаходу включають ті, в яких кільце, що містять X1, X2 , X3 і X4, є таким, що це кільце є тетразольним, триазольним, оксадіазольним, оксазольним, ізоксазоль-ним або імідазольним. Бажаним є тетразольне, оксадіазольне або ізоксазольне кільце. У деяких втіленнях винаходу X6 - N. В інших втіленнях X5 вибрана з О і NR4. У подальших втіленнях винаходу X5 - CR 4R4 . У бажаних втіленнях винаходу, коли кільце, що містить X1, X2, X3 і X4 є тетразолом, X6 є N і Xs є CR4R4. В іншому бажаному втіленні винаходу, коли кільце, що містить X1, X2 , X3 і X4 вибрана з оксадіазолу і ізоксазолу, X6 є N, а X5 вибрана з О і NR4. В іншому втіленні винаходу R4 і R4 незалежно вибрані з групи, яку складають: гідроген, С1-6алкіл, С1-6алкілгалоген і галоген. Винахід також стосується сполук формули 1, які мають кільце Q. Втілення винаходу включають ті, в яких Q - гетероарил. У бажаних втіленнях Q вибрана з групи, яку складають: У більш бажаному втіленні винаходу кільце Q є Втілення винаходу включають такі, в яких R1 і R вибрані з групи, яку складають: гідроген, С1-4алкілгалоген, С1-6алкіл, С3-6циклоалкіл, С0-6алкіларил і С 0-6алкілгетероарил. В іншому втіленні винаходу С1-6алкіл, арил або гетероарил, визначені для R1, R2 і R3, можуть бути заміщені однією або більше замісниками А. Бажані втілення винаходу включають такі, що вибрані з групи, яку складають: гідроген, гідроксил, галоген, С0-6алкілціано, С1-6алкіл, -ОС1-6алкіл, С1-6алкілгалоген, ОС1-6алкілгалоген. Втілення винаходу включають сольові форми сполук формули І. Солі, придатні для використання у фармацевтичній композиції, є фармацевтично прийнятними солями, але і інші солі можуть бути використані для виготовлення сполук формули І. Придатними фармацевтично прийнятними солями сполук винаходу є, наприклад, кислотоадитивні солі, наприклад, неорганічні або органічні кислоти. Крім того, придатними фармацевтично прийнятними солями сполук винаходу є солі луж них металів, солі лужноземельних металів або солі з органічною основою. Інші фармацевтично прийнятні солі і методи їх приготування можна знайти, наприклад, [у Remington's Pharmaceutical Sciences (18 th Edition, Mack Publishing Co.) 1990]. Деякі сполуки формули І можуть мати хіральні центри і/або геометричні ізомерні центри (Е- і Zізомери). Винахід включає всі такі оптичні діастереомерні і геометричні ізомери. 2 19 82434 Винахід також стосується будь-яких і всіх таутомерних форм сполук формули І. Винахід, крім того, стосується гідратних і сольватних форм сполук формули І. Фармацевтичні композиції Винахід включає фармацевтичну композицію., яка містить як активний інгредієнт терапевтично ефективну кількість сполуки формули І або її солей, сольватів або сольватів цих солей разом з одним або більше фармацевтично прийнятними розріджувачами, ексципієнтами і/або інертними носіями. Композиція може мати форму, придатну для перорального введення пацієнту, наприклад, форму таблетки, пігулки, сиропу, порошку, гранули або капсули, для парентеральної ін'єкції (включаючи внутрішньовенні, підшкірні, внутрішньом'язові, внутрішньосудинні ін'єкції або інфузію) у вигляді стерильного розчину, суспензії або емульсії, для топічного введення у вигляді мазі, накладки або крему, або для ректального введення су позиторієм. Взагалі такі композиції можуть бути приготовлені звичайними методами з використанням одного або більше звичайних ексципієнтів, фармацевтично прийнятних розріджувачів і/або інертних носіїв. Придатна денна доза сполук формули І при лікуванні ссавця (включаючи людину) становить приблизно 0,01 - 250мг/кг маси тіла при пероральному введенні і приблизно 0,001 - 250мг/кг маси тіла при парентеральному введенні. Типова денна доза може змінюватись у широких межах залежно від різних факторів, наприклад, призначення, важкості хвороби, способу введення, віку, ваш і статі пацієнта і конкретної сполуки і може бути визначена лікарем. Медичне застосування Було виявлено, що сполуки згідно з винаходом мають високу ефективність і селективність до індивідуальних субтипів метаботропічного рецептора глютамату (mgluR). Тому можна сподіватись, що сполуки винаходу можуть бути корисними при лікуванні станів, пов'язаних з збуджувальним активуванням mgluR5, і для зниження пошкоджень нейронів, спричинених збуджувальним активуванням mgluR5. Ці сполуки можуть бути використані для створення інгібуючої дії на mgluR5 у ссавців, включаючи людину. Група І рецептора mgluR, включаючи mgluR5, значно експресовані у центральній і периферійній нервовій системі і в інших тканинах. Отже, можна сподіватись, що сполуки винаходу будуть придатними для лікування таких опосередкованих mgluR5 розпадів, як гострі і хронічні неврологічні і психіатричні розлади, шлунково-кишкові розлади і хронічні і гострі больові розлади. Винахід стосується сполук формули І, визначених вище, призначених для застосування у терапії'. Винахід стосується сполук формули І, визначених вище, призначених для застосування у лікуванні опосередкованих mgluR5 розладів. Винахід стосується сполук формули І, визначених вище, призначених для застосування у ліку 20 ванні хвороби Альцгеймера, старечого слабоумства, слабоумства, викликаного СНІД, хвороби Паркінсона, аміотропічного латерального склерозу, хореї Хантингтона, мігрені, епілепсії, шизофренії, депресії, тривожності, гострої тривожності, офтальмологічних розладів, наприклад, ретинопатій, діабетичних ретинопатій, глаукоми, слухо вих нейропатичних розладів, наприклад, тиніту, нейропатій, викликаних хемотерапією, постгерпетичної невралгії і тригемінальної невралгії, толерантності, залежності, Fragile X, а утизму, розумової відсталості і синдрому Дауна. Винахід стосується визначених вище сполук формули І, призначених для для застосування у лікуванні болю, пов'язаного з мігренню, запального болю, нейропатичних больових розладів, наприклад, діабетичних нейропатій, артриту і ревматоїдних хвороб, болю у попереку, післяопераційного болю і болю, зумовленого різними станами, включаючи стенокардію, ниркової або жовчної коліки, менструації, мігрені і подагри. Винахід стосується визначених вище сполук формули І, призначених для для застосування у лікуванні інсульту, травм голови, аноксичних і ішемічних травм, гіпоглікемії, серцево-судинних хвороб і епілепсії. Винахід стосується визначених вище сполук формули І, призначених для для застосування у виготовленні медикаменту для лікування розладів, опосередкованих рецептором Групи І mgluR і будь-яких розладів, перелічених вище. Одне з втілень винаходу стосується застосування сполуки формули І у лікуванні шлунковокишкових розладів. Інше втілення винаходу стосується застосування сполуки формули І у виго товленні медикаменту для інгібування тимчасової релаксації нижнього стравохідного сфінктеру, для лікування ГСРХ, для профілактик гастрорефлюкса, для лікування регурптації, для лікування астми, ларингіту, легеневих хвороб і контролю недостатності розвитку. Ще одним втіленням винаходу є застосування сполуки формули І у ви готовленні медикаменту для лікування або профілактики функціональних шлунково-кишкових розладів, наприклад, функціональної диспепсії (ФД). Іншим аспектом винаходу є застосування сполуки формули І у виго товленні медикаменту для лікування або профілактики синдрому подразненого кишечнику (СПК), наприклад, СПК з констипацією, СПК з діареєю або СПК з іншими порушеннями. Іншим аспектом винаходу є фармацевтична композиція, яка містить терапевтично ефективну кількість сполуки формули І і фармацевтично прийнятні розріджувачі, ексципієнти і/або інертні носії. Згідно з ще одним аспектом винахід включає фармацевтичну композицію, яка містить сполуку формули І і призначена для використання у лікуванні розладу, опосередкованого рецептором mgluR5, і у лікуванні неврологічних розладів, психіатричних розладів, шлунково-кишкових розладів і больових розладів. Згідно з іншим аспектом, винахід включає сполуку формули І, призначену для застосування у 21 82434 терапії, зокрема, для лікування розладів, опосередкованих рецептором mgluR5, і для лікування неврологічних розладів, психіатричних розладів, шлунково-кишкових розладів і больових розладів. Ще одним аспектом винаходу є застосування сполуки формули І у ви готовленні медикаменту для лікування або профілактик ожиріння і станів, пов'язаних з ожирінням, а також розладів вживання їжі зниженням надмірного прийому їжі, що викликає ожиріння і і пов'язані з ним ускладнення. Згідно з іншим аспектом, винахід включає способи приготування сполуки формули І і інтермедіатів, що використовуються для цього. Ці і інші аспекти винаходу розглядаються нижче. Винахід також включає спосіб лікування опосередкованих mgluR5 розладів і будь-яких розладів, перелічених ви ще, у пацієнта, що страждає від нього або має підвищений ризик зазначеного стану, який включає введення пацієнту ефективної кількості сполуки формули І, визначеної вище. Доза для терапевтичного або профілактичного лікування конкретного розладу може варіюватись залежно від пацієнта, способу введення і важкості захворювання. Терміни "терапія" і "лікування" включають відвернення або профілактику, якщо не зазначено інше. Терміни "терапевтичний" і "терапевтично" інтерпретуються відповідно. Терміни "антагоніст" і "інгібітор" означають сполуку, яка будь-яким чином частково або повністю блокує шлях передачі, який веде до виникнення реакції ліганду. Термін "розлад", якщо не зазначено інше, означає будь-який стан і хворобу, пов'язані з активністю метаботропічного рецептора глютамату. Немедичне застосування Крім використання у терапевтичній медицині сполуки формули І, її солі або гідрати можуть бути використані як фармакологічні інструменти у розвитку і стандартизації випробувальних систем in vitro і in vivo для оцінювання діє інгібіторів активності mgluR на лабораторних тваринах, наприклад, котах, собаках, кролях, мавпах, щурах і мишах у пошуку нови х терапевтичних агентів. Способи приготування Ще одним аспектом винаходу є способи приготування сполук формули І або її солей або гідратів. Далі розглядаються способи приготування сполук згідно з винаходом. У подальшому описі процесів розглядаються додання і видалення придатних захисних груп, а також різних реагентів і інтермедіатів у спосіб, зрозумілий для фахівців у галузі органічного синтезу. Процедури застосування захисних груп і приклади таких захисних груп описано, [наприклад, у "Protective Groups in Organic Synthesis", T.W. Green, P.G.M. Wuts, Wiley-Interscience, New York, (1999)]. Перетворення групи або замісника в іншу груп у або замісника хімічною маніпуляцією може бути проведене на будь-якому інтермедіаті або кінцевому продукті на шляху синтезу кінцевого продукту, причому можливі перетворення обмежуються лише природною несумісністю інших функціональностей молекули на цій стадії з умовами 22 і реагентами, що використовуються у даному перетворенні. Такі несумісності і способи їх подолання належними перетвореннями і операціями синтезу є добре відомими фахівцям. Приклади перетворень, наведені нижче, не обмежуються лише застосуванням до власних груп або замісників, які ілюструються цими прикладами. Описи інших придатних перетворень можна знайти у ["Comprehensive Organic Transformations - Guide to Functional Group Preparations" R. С Larock, VHC Publishers, Inc. (1989)]. Описи інших придатних реакцій можна знайти у посібниках з органічної хімії,наприклад, [у "Ad vanced Organic Chemistry", March, 4th ed. McGraw Hill (1992) або в "Organic Synthesis", Smith, McGraw Hill, (1994)]. Процедури очищення інтермедіатів і кінцевих продуктів є зрозумілими для фахівця і включають, наприклад, прямо- і зворотнофазову хроматографію на колонці або обертальній платі, рекристалізацію, дистиляцію і рідинно-рідинне або твердо-тверде екстрагування. Визначення замісників і групи наведені для формул, якщо не зазначено інше. Термін "кімнатна температура" і "зовнішня температура" означають, якщо не зазначено інше, температуру між 16 і 25°С. Термін "під зворотним холодильником" означає, якщо не зазначено інше, обробку розчинника при температурі кипіння або вище. Абревіатури водн. водний БІНАФ 2,2'біс(дифенілфосфін)-1,1'бінафтил Вос, ВОС трет-бутоксикабоніл КДІ Ν,Ν'-карбонілдіімідазол ДБА дибензиліденацетон ДЦК Ν,Ν-дициклогексилкарбодіімід ДХМ дихлорметан ДЕА N,N-діізопропілетиламін ГДІБА гідрид діізобутилалюмінію ДІК Ν,Ν'-діізопропілкарбодіімід ДМАП Ν,N-диметил-4-амінопіридин ДМФ диметилформамід ДМСО диметилсульфоксид ДФФФ 1,1'-біс(дифенілфосфін)фероцен ЕАабоЕЮАс етилацетат ЕДКІ N-[3-(диметиламiно)пропіл]-Ν'етилкарбодіімід-гідрохлорид Et етил Et2O діетилетер Etl йодетан ЕtOН етанол Et3N триетиламін Fmoc, FMOC 9-флуоренілметоксикабоніл ГБТУ Гексафлуорфосфат О(бeнзотриазол-1-іл)-Ν,N,Ν',Ν'тетраметилуронію HetAr гетероарил HOBt N-гідроксибензотриазол PXBP рідинна хроматографія високого розрізнення LCMS мас-спектрографія РХВР МХБК m-хлорбензойна кислота Me метил MeCN ацетонітрил Mel йодметан 23 Me MgCI MeOH NaOAc nBu nBuLi, n-BuLi NXC ЯМР OAc OMs 82434 24 хлорид метилмагнію метанол ацетат магнію нормальний бутил 1-бутиллпій N-хлорсукцинімід ядерно-магнітний резонанс ацетат мезилатний або метансульфонатний естер тозилатний, толуолсульфонат або 4-метилбензолсульфонатний естер р-толуолсульфонат піридинію р-толуолсульфонова кислота кімнатна температура флуорид тетрабутиламонію tBu, t-Bu трет-бутил tBuOH, t- трет-бутанол BuOH TEA триетиламін ΤΓΦ тетрагідрофуран Приготування інтермедіатів Інтермедіати, використані в описаному далі синтезі, можуть бути використані для приготування сполук формули І у подальшому. Інші вихідні матеріал є у продажу або можуть бути приготовлені методами, описаними у літературі. Схеми синтезу, описані нижче є необмежуючими прикладами приготування, придатними для застосування. Фахівці можуть застосувати інші схеми. Синтез ізоксазолів Альдегіди формули vi, де X5 є такою, що була визначена у формулі І, можуть бути використані у приготуванні ізоксазолів. Комерційно доступним кислотним похідним формули іі, де X5 є О, S, С, NR2 і N-G2 (G2 є захисною групою, ортогональною до G1), можна надати N-захист для отримання сполук формули ііі, де G1 є захисною групою, наприклад, Вос або Fmoc, застосовуючи методи, відомі фахівцям. Кислотний компонент у сполуках формули ііі може бути перетворений в алкільний естер формули iv, наприклад, метиловий або етиловий естер, який може бути перетворений в альдегіди формули vi за допомогою слабого відновлювача, наприклад, ГДІБА у розчиннику, наприклад, толуолі при низькій температурі, наприклад, -78°С. Вищі температури або сильніші відновлювачі можуть призвести до утворення первинних спиртів формули ν, чисти х або у суміші з альдегідами формули vi. Інші функціональні групи, наприклад, первинний спирт у сполуках формули ν, нітрил у сполуках формули vii і амідний компо нент Вайреба у сполуках формули viii, можуть бути перетворені в альдегіди формули vi за допомогою відомих процедур. Крім того, кислоти формули іі можуть бути перетворені у нітрили формули vii відомими методами, наприклад, перетворенням кислоти у первинний амід з подальшою дегідратацією у нітрил. Альдегіди формули vi можна перетворити в оксими формули іх обробкою гідроксиламіном, у розчиннику, наприклад, піридині, при температурі між 0°С і кімнатною. Ізоксазоли формули χ можна приготувати хлор уванням оксимів формули іх з використанням такого реагенту, як Nхлорсукцинімід, з подальшою 1,3-диполярною циклізацією належними R-заміщеними ацетиленами, де R може бути (R1) m-P або маскуючою групою, яка потім може бути перетворена у (R1)m-P [Steven, R. V. et al. J. Am. Chem. Soc. 1986, 108, 1039]. Ізоксазольний інтермедіат х може бути потім позбавлений захисту з отриманням хі стандартними методами. OTs ТСП pTsOH RT, rt, r.t. ФТБА 25 82434 26 Ізоксазоли формули х, де R є маскуючою групою, можна приготувати у такий спосіб, а маскуючу груп у перетворити у (R1) m-P після утворення ізоксазольного кільця. Наприклад, використання триалкілстанілацетилену дає триалкілстанілізок сазол, який можна піддати реакціям, наприклад, перехресного сполучення типу Стила для введення арильних замісників приєднанням до відповідного арилгалогеніду. Синтез [1,2,4]-оксадіазолів Карбонові кислоти формули ііі можуть бути використані для приготування відповідних 3-R заміщених [1,2,4]оксадіазолів формули хіі активуванням кислотного компонента, доданням придатного R-заміщеного гідроксиамідину з утворенням естеру і потім циклізацією до оксадіазолу. [Див. Tetrahedron Lett., 2001, 42, 1495-98, Tetrahedron Lett., 2001, 42, 1441-43, і Bioorg. Med. Chem. Lett. 1999, 9, 1869-74]. Кислота може бути активована, як змішаний ангідрид, алкілхлорформатом, наприклад, ізобутилхлорформатом, у присутності основи, наприклад, триетиламіну у придатному розчиннику, наприклад, ТГФ. В іншому варіанті можуть бути застосовані інші добре відомі методи активування кислоти, включаючи in situ активуван ня кислоти таким реагентом, як ЕДКІ, ДЦК, ДІК або ГБТУ, у присутності (або без) співреагентів, наприклад, HOBt або ДМАП, у придатних розчинниках, наприклад, ДМФ, ДХМ, ТГФ або MeCN при температурі від -20 до 100°С. Циклізація може бути проведена нагріванням у розчиннику, наприклад, піридині або ДМФ, під мікрохвильовим опромінюванням або з каталізаторами, наприклад, ФТБА. R-заміщені гідроксиамідини можна отримати з нітрилів доданням гідроксиламінгідрохлориду у присутності основи, наприклад, NaOH, NaHCO3 або Na2CO3, для створення вільного гідроксиламіну у розчиннику, наприклад, етанолі або метанолі тощо, при температурі від кімнатної до 100°С. Сполуки формули іі, де X є N-G2, дають зручний метод отримання вільної NH-сполуки формули І. Наприклад, комерційно прийнятну кислотну похідну формули ііа, де X є N-Boc, може бути ортогонально N-захищена захисною групою G1, напри клад, Fmoc. Отриманий ін-термедіат іііа можна перетворити у відповідні [1,2,4]-оксадіазоли методами, описаними вище. Якщо Fmoc є однією з захисних груп, утворення [1,2,4]-оксадіазольного кільця включає наявність основи; наприклад, акти 27 82434 28 вування хлорформатом у присутності триетиламіну або замкнення кільця у піридині, може призвести до захисної гр упи і отримання хіііа безпосеред ньо, без ізолювання 2-(3-R-[1,2,4]оксадіазол-5-іл)піперазинового інтерме-діату. 5-R-заміщені [1,2,4]оксадіазоли формули xiib можна приготувати з нітрилів формули vii ефективним реверсом замісників, приєднаних до [1,2,4]оксадіазолу. Нітрили формули vii реагують з гідроксиламіном, як описано вище, і дають інтермедіат гідроксиамідин, який може бути перетворений у [1,2,4]оксадіазоли формули xiib активуючим агентом, який містить групу R, методом, описаним вище, для перетворення сполуки формули ііі у сполуки формули хіі. Синтез тетразолів Нітрили формули vii можуть бути використані для приготування відповідних тетразолів формули xviii обробкою азидом, наприклад, NaN3, LiN3, триалкілултиназидом або триметилсилілазидом, бажано, з каталізатором, наприклад, дибутилтиноксидои або ZnBr2, у розчинниках, наприклад, ДМФ, воді або толуолі при температурі 80 - 200°С звичайним нагріванням або з мікрохвильовим опромінюванням [Див. J. Org. Chem. 2001, 7945-7950; J. Org. Chem. 2000, 7984-7989 або J. Org. Chem. 1993, 4139-4141]. Для N2-арилювання 5-заміщених тетразолів, згідно з літературою, використовують різних партнерів для сполучення. Сполуки формули xviii, де R є арильною групою, можна приготувати, використовуючи, наприклад, борні кислоти формули xv [з компонентом В(ОН)2], або відповідні солі йодонію формули xvii [з компонентом I+-Аr], або відповідні триарилвісмутдіацетати [з компонентом Bi(OAc)2 Ar 2], як арилювальні агенти, з опосередкуванням перехідними металами [Див. Tetrahedron Lett. 2002, 6221-6223; Tetrahedron Lett. 1998, 29412944; Tetrahedron Lett. 1999, 2747-2748]. З борними кислотами використовують стехіометричні кількості Сu(ІІ)-ацетату і піридину у розчинниках, наприклад, ДХМ, ДМФ, діоксані або ТГФ, при температурі від кімнатної до 100°С. З солями йоді уму використовують каталітичні кількості Рd(ІІ)сполук, наприклад, Pd(ДБA)2 або Pd(OAc)2 , разом з каталітичними кількостями Cu(ll)-карбоксилатів, наприклад, Сu(ІІ)-фенілциклопропілкарбоксилату, і бітентатних лігандів, наприклад, БІНАФ або ДФФФ, у розчинниках, наприклад, f-BuOH при температурі 50 - 100°С. З триарилвісмутдіацетатами можуть бути використані каталітичні кількості ацетату міді у присутності Ν,Ν,Ν',Ν'тетраметилгуанідину у придатному розчиннику, наприклад, ТГФ, з нафіванням при температурі 40 - 60°С. Солі йодіуму формули xvi можна отримати, наприклад, обробкою відповідними борними кислотами заміщених гіпервалентним йодом ароматичних сполук, наприклад, гідроксил(тозилокси)йодбензолу або Phl(OAc)2 ´2TfOH, у ДХМ тощо [Див. Tetrahedron Lett. 2000, 53935396]. Триарилвісмутдіацетати можна приготувати з арилмагнійбромідів реакцією з вісмуттрихлоридом у придатному розчиннику, наприклад, ТГФ, під зворотним холодильником, з отриманням триарилвісмутану, який потім окислюють до діацетату окислювальним агентом, наприклад, перборатом натрію в оцтовій кислоті [Synth. Соммип. 1996,4569-75]. Синтез [1,2,3]триазолів 29 82434 30 Кетоальдегіди формули хіх можна отримати з сполук формули іі активуванням кислотного компонента через реакцію з діазометаном для отримання проміжного альфа-діазокетону і через захоплення кислотою, наприклад, оцтовою для утворення альфа-ацетилованого кетонного інтермедіату, який може бути перетворений у сполуки формули хі х гідролізом і окисленням [Див. Bioorg. Med. Chem. 2002, 10, 2199-2206]. Кетоальдегіди формули хі х реагують з арилгідразинами в оцтовій кислоті і воді при -20 - 120°С з утворенням бісгідразонів формули хх, які піддають циклізації у присутності сульфату міді (II) у водних сумішах, наприклад, діоксану або ТГФ при -20 - 120°С з утворенням [1,2,3]триазолів формули ххі [Див. J. Med. Chem. 1978, 21, 1254-60 і J. Org Chem. 1948, 13, 807-14]. Сполуки формули ххі можна позбавити захисту, як описано вище, і отримати вторинні аміни формули ххіі. Синтез кільця Q: амінотриазоли Позбавлені захисту аміни формул хі, хііі, xviii і ххіі можуть бути піддані послідовності утворення тіомочевини, метилювання і утворення триазолу для отримання сполук формули І, в яких кільце Q є триазолом, приєднаним до щойно позбавленого захисту вторинного аміну. Тіомочевини формули xxi v можна отримати відомими методами, використовуючи, наприклад, ізотіоціанат, R2SCN або 1,1тіокабонілдіімідазол у присутності R2NH2, у розчиннику, наприклад, метанолі, етанолі тощо, при температурі від кімнатної до 100°С, звичайно при 60°С. Алкілування тіомочевинних інтермедіатів можна проводити, використовуючи такі алкілува льні агенти, як йодметан або йодетан, у розчиннику, наприклад, ДМФ, ацетоні, СН2СІ2, при кімнатній або підвищеній температурі з отриманням ізотіомочевини формули xxv. При застосуванні йодалкану продукт може бути ізольований як гідройодидна сіль [Див. Synth. Соммип. 1998, 28, 741-746]. Сполуки формули xxv можуть реагувати з ацилгідразином або гідразиноми і потім з ацилювальним агентом для отримання інтермедіату, який може бути цикпізований до 3-амінотриазолів формули xxvi нафіванням при 50 - 200°С у придатному розчиннику, наприклад, піридині або ДМФ. Перетворення інших функціональних груп 31 82434 Якщо сполуки формули І або будь-який попередник містять додаткові функціональні групи, ці групи можуть бути використані для введення інших замісників або функціональних груп відомими методами, якщо нема інших несумісних реактивних сайтів. Наприклад, у сполуках формули xxvii, які можна отримати з ортогонально заміщеного бісаміну хіііа, описаного вище, вторинний амін, отриманий зняттям захисту G2 , можна піддати алкілуванню або відновлювальному амінуванню для отримання третинного аміну формули хіх. Крім того, можуть бути присутні інші замісники, не зазначені явно у схемах, за умови, що вони не перешкоджають описаним вище реакціям. Винахід стосується також перелічених нижче сполук, які можуть слугувати інтермедіатами при приготуванні сполук формули І: метил 4-диметиламінометилбензоат, етил 4-(2-диметиламіноетокси)-бензоат, гідразид 4-диметиламінометил-бензойної кислоти, гідразид 4-(2-диметиламіноетокси)-бензойної кислоти, гідразид 4-дифлуорметокси-бензойної кислоти, трис-(3-хлорфеніл)-бісмутан, триc-(3-хлорфеніл)-бісмутандіацетат, трет-бутиловий естер 2гідроксиметилпіперидин-1-карбонової кислоти, 4-трет-бутиловий естер морфолін-3,4дикарбонової кислоти, 1-(9Н-флуорен-9-ілметил)овий естер 4-третбутилового естеру піперазин-1,2,4-трикарбонової кислоти, трет-бутиловий естер 2-формілпіперидин-1карбонової кислоти, 3-метиловий естер 4-трет-бутилового естер у морфолін-3,4-дикарбонової кислоти, трет-бутиловий естер 3-формілморфолін-4карбонової кислоти, трет-бутиловий естер 2-ціанопіперидин-1карбонової кислоти, трет-бутиловий естер 2-(1Н-тетразол-5-іл)піперидин-1-карбонової кислоти, трет-бутиловий естер 2-(гідроксиімінометил)піперидин-1-карбонової кислоти, трет-бутиловий естер 3-(гідроксиімінометил)морфолін-4-карбонової кислоти, трет-бутиловий естер 2-[5-(3-хлорфеніл)ізоксазол-3-іл]-піперидин-1-карбонової кислоти, трет-бутиловий естер 3-[5-(3-хлорфеніл)ізоксазол-3-іл]-морфолін-4-карбонової кислоти, 32 трет-бутиловий естер 3-[3-(3-хлорфеніл)[1,2,4]оксадіазол-5-іл]-морфолін-4-карбонової кислоти, трет-бутиловий естер 3-[3-(3-хлорфеніл)[1,2,4]оксадіазол-5-іл]-піперазин-1-карбонової кислоти, трет-бутиловий естер 2-{2-(3-хлорфеніл)-2Нтетразол-5-іл]-піперидин-1-карбонової кислоти, 2-[5-(3-хлорфеніл)-ізоксазол-3-іл]-піперидин, 3-[5-(3-хлорфеніл)-ізоксазол-3-іл]-морфолін, 3-[3-(3-хлорфеніл)-[1,2,4]оксадіазол-5-іл]морфолін, 2-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]піперидин, метиламід 2-[5-(3-хлорфеніл)-ізоксазол-3-іл]піперидин-1-карботіо-кислоти, метиламід 3-[5-(3-хлорфеніл)-ізоксазол-3-іл]морфолін-4-карботіо-кислоти, метиламід 3-[3-(3-хлорфеніл)[1,2,4]оксадіазол-5-іл]-морфолін-4-карботіокислоти, трет-бутиловий естер 3-[3-(3-хлорфеніл)[1,2,4]оксадіазол-5-іл]-4метилтіокарбамоїлпіперазин-1-карбонової кислоти, метиламід 2-[2-(3-хлорфеніл)-2Н-тетразол-5іл]-піперидин-1-карботіо-кислоти, метиловий естер 2-[5-(3-хлорфенiл)-ізоксазол3-іл]-N-метилпіперидин-1-карбоксимідотіо-кислоти, 3-[5-(3-хлорфеніл)-ізоксазол-3-іл]-N-метилморфолін-4-карбоксимідотіо-кислоти, метиловий естер 3-[3-(3-хлорфеніл)[1,2,4]оксадіазол-5-іл]-метилморфолін-4карбоксимідотіо-кислоти, трет-бутиловий естер 3-[3-(3-хлорфеніл)[1,2,4]оксадіазол-5-іл]-4-(метилімінометилсульфанілметил)-піперазин-1-карбонової кислоти метиловий естер 2-[2-(3-хлорфеніл)-2Нтетразол-5-іл]-N-метилпіперидин-1карбоксимідотіо-киспоти. Приклади Винахід ілюструють наведені нижче необмежуючі приклади. Загальні методи Всі вихідні матеріали є у продажу або описані у лі тературі. Спектри 1Н і 13С Я МР реєстр ують спектрометрами Bruker 300, Bruker DPX400 або Varian +400 на частотах 300,400 і 400МГц для 1Н ЯМР, відповідно, використовуючи сигнал TMS або залишкового розчинника як еталон, у дейтерованому хлороформі як розчиннику, якщо не зазначено інше. 33 82434 Всі виявлені хімічні зсуви наведено у 1/млн. на дельта-шкалі, а тонке розщеплення сигналів позначено такими записами: s - синглет, br s - широкий синглет, d -дублет, t - триплет, q - квартет, m мультиплет. Дані аналізу сепарацій у рідинній хроматографії і потім мас-спектру реєстр ують на Waters LCMS, який складається з Alliance 2795 (LC) і одиночного квадрупольного мас-спектрометра ZQ. Мас-спектрометр обладнано електророзпилювальним джерелом іонів, що працює у режимі позитивних або негативних іонів. Напруга розпилювання іонів ±3кВ, а мас-спектрометр сканується від m/z 100-700 з часом сканування 0,8с. У колонці ХТеrrа MS, Waters, С8, 2,1´50мм, 3,5мм, створюється лінійний градієнт від 5% до 100% ацетонітрилу у 10мМ ацетату амонію (водн.) або у 0,1% ТФК (водн.). Препаративну зворотно-фазову хроматографію проводять як автопрепаративну РХВР (Gilson) з детектором на діодах з використанням колонки ХТегга MS C8,19´300мм, 7мм. Очищення хроматотроном проводять на роторних скляних пластинах з покриттям (силікагель/гіпс, Merck, 60 PF-254, з сульфатом кальцію) товщиною 1, 2 або 4мм, використовуючи хроматотрон ТС Research 7924T. Очищення продуктів проводять також флеш-хроматографією на заповненій кремнеземом скляній колонці або у заповнених кремнеземом пластмасових трубках для екстракції твердої фази. Мікрохвильове нагрівання виконують у мікрохвильовій порожнині Smith Synthesizer Single-mode з безперервним опромінюванням при 2450МГц (Personal Chemistry AB, Uppsala, Sweden). Приклад 1 Метил 4-диметиламінометил-бензоат Метил 4-(бромметил)бензоат (4,58г, 20ммоль) змішують з 45% диметиламіну (5,57мл, 2,5ммоль) у ТГФ (50мл) при кімнатній температурі протягом 30 хвил. Суміш концентрують in vacuo і залишок розбавляють водою і екстрагують етером. Органічний шар сушать з MgSO4 і концентрують in vacuo, отримуючи зазначену сполуку (4,0г) у вигляді блідожовтого масла. 1Н ЯМР (CDCI3), δ (1/млн.): 8,01 (d, 2Н), 7,40 (d, 2Н), 3,92 (s, 3Н), 3,48 (s, 2Н) і 2,26 (s, 6Н). Приклад 2 Етил 4-(2-диметиламіноетокси)-бензоат Етил 4-гідрокси-бензоат (16,6г, 0,1моль) змішують з (2-хлоретил)-диметил-амінгідрохлоридом (40г, 0,28моль) і K2СО3 (100г, 0,724моль) у ДМФ. Суміш нагрівають до 150°С протягом 4год. і потім вливають у лід-вoду і продукт екстрагують етилацетатом. Ети-лацетатний шар промивають розсолом і продукт підкислюють 1N НСІ (130мл), етилацетат-ний шар відкидають. Підкислений водний шар промивають етилацетатом, потім підлужують 2М карбонатом натрію (100мл) і продукт екстрагують етилацетатом. Органічний шар промивають розсолом, сушать з MgSO4, фільтр ують і концентрують, отримуючи зазначену сполуку (12,6г, 53%) у вигляді клейкого жовто-коричневого масла. 1Н ЯМР (CDCI3), δ (1/млн.): 8,01 (d, 2H), 6,95 (d, 2H), 34 4,36 (q, 2H), 4,13 (t, 2H), 2,76 (t, 2H), 2,36 (s, 6H) і 1,39 (t, 3Н). Приклад 3 Гідразид 4-диметиламінометилбензойної кислоти Метил 4-диметиламінометилбензоат (4,0г, 20ммоль) змішують з гідразингідратом (9,7мл, 200ммоль) у метанолі при 80°С протягом ночі. Суміш концентрують in vacuo і залишок перетирають з етером, отримуючи зазначену сполуку (3,37г, 84,2%) як білу тверду речовину. 1Н Я МР (ДМСОd6), δ (1/млн.): 9,75 (w, 1Н), 7,76 (d, 2Н), 7,35 (d, 2Н), 4,50 (w, 2Н), 3,41 (s, 2H) i 2,13 (s, 6H). Приклад 4 Гідразид 4-(2-диметиламіноетокси)-бензойної кислоти Етил 4-(2-диметиламіноетокси)-бензоат (12,6г, 53ммоль) змішують з гідразингідридом (26,5г, 0,5моль) в етанолі при 100°С у герметичній колбі протягом ночі. Сумішконцентрують і перетирають з етером, отримуючи зазначену сполуку (9,83г, 82,9%) як блідожовту тверду речовину. 1Н ЯМР (ДМСО-d6), δ (1/млн.): 9,62 (s, 1Н), 7,77 (d, 2Н), 6,97 (d, 2Н), 4,45 (Ь, 2Н), 4,08 (t, 2H), 2,61 (t, 2H) і 2,20 (s, 6H). Приклад 5 Гідразид 4-дифлуорметоксибензойної кислоти HOBt (2,2г, 15,9ммоль) і ЕДКІ (3,1г, 15,9ммоль) додають до 4-дифлуорметоксибензойної кислоти (2,5г, 13,3ммоль) в ацетонітрилі (25мл) при кімнатній температурі. Через 2год. краплями додають розчин пдразинмоногідрату (0,493мл, 10,2ммоль) і циклогексану (0,33мл) в ацетонітрилі (5,0мл) додають при 0°С. Після перемішування при кімнатній температурі протягом 2год. розчинник видаляють in vacuo і залишок розбавляють етилацетатом, промивають насиченим бікарбонатом натрію (4 рази), сушать над сульфатом натрію, фільтрують і концентрують, отримуючи зазначену сполуку (2,12г, 79%, біла тверда речовина). 1Н ЯМР (ДМСО) (1/млн.): 9,80 (bs, 1Н), 7,88 (m, 2Н), 7,34 (t, 1Н), 7,23 (m, 2Н), 4,50 (bs, 2Н). Приклад 6 Тетрафлуорборат біс-(3-хлорфеніл)-йодонію Біс(ацетилокси)(3-хлорфеніл)-l-3-йодан приготовляють, як описано у [Ka zmierczak, P.; Skulski, L, Synthesis 1998, 12, 1721-1723]. З перемішуванням до суміші 3-хлорфенілборної кислоти (0,821г, 5,25ммоль) і BF3Et2O (0,78г, 5,5ммоль) у ДХМ (50мл) при 0°С додають розчин біс(ацетилокси)(3хлорфеніл)-l-3-йодану (1,78г, 5ммоль) у ДХМ (50мл) під аргоном, і реакційну суміш перемішують протягом 1,5год. при 0°С. Додають насичений водний NH4BF4 (10,5г, 100моль) і реакційну суміш перемішують протягом 1год., вливають у воду і екстрагують ДХМ. Органічний шар концентрують, отримуючи твердий залишок, який перетирають з діетилетером, отримуючи зазначену сполуку (білува та тверда речовина, 1,70г, 78%). 1Н ЯМР (CDCI3), δ (1/млн.): 8,02 (m, 4Н), 7,58 (dm, 2H), 7,4 (t, 2H). Приклад 7 2-фенілциклопропанкарбоксилат міді (II) Гідроксид натрію (0,81г, 20,25ммоль) у воді (10мл) додають до 2-феніл 35 82434 циклопропанкарбоксилату (32,4г, 20ммоль) і суміш перемішують до повного розчинення твердої речовини. Додають краплями розчин сульфату міді (ІІ)е (2,44г, 10ммоль) у воді, суміш перемішують протягом 2год. і блідо-блакитний осад збирають фільтруванням, сушать у вакуумі і використовують без очищення. Приклад 8 Трет-бутиловий естер 2гідроксиметилпіперидин-1-карбонової кислоти Ди-трет-бутилдикарбонат (8,3г, 38,2ммоль) додають з перемішуванням до розчину піперидинметанолу (4,0г, 37,4ммоль) у СН2СІ2 (50мл) і додають 1N NaOH (50мл, 50ммоль). Суміш перемішують при кімнатній температурі протягом ночі. Реакційну суміш розбавляють СН 2СІ2 і водну фаз відокремлюють, після чого екстрагують ДХМ (3´30мл). Об'єднані органічні фази промивають водою (30мл) і розсолом (30мл), сушать (сульфат натрію), фільтрують і концентрують in-vacuo, отримуючи сирий продукт, який перетирають з гексаном, отримуючи зазначену сполуку як білу тверду речовину (4,8г, 64%). Приклад 9 4-трет-бутиловий естер морфолін-3,4дикарбонової кислоти Ди-трет-бутилдикарбонат (3,33г, 15,3ммоль) додають до розчину морфолін-3-карбонової кислоти (1,7г, 10,2ммоль) і карбонату калію (7,04г, 51ммоль) в ацетоні (5мл) і воді (10мл) при 0°С. Суміш перемішують при кімнатній температурі протягом 24год., розбавляють водою (50мл) і екстрагують діетилетером (2´50мл). Водну фазу обробляють гідро-хлорною кислотою (2М водн., 100мл), екстрагують ДХМ (2´50мл), об'єднані органічні фази промивають водою (50мл), розсолом (50мл), сушать (сульфат натрію), фільтрують і концентрують in-vacuo, отримуючи бажаний продукт як білу тверду речовину (1,98г, 84%). 1Н ЯМР (CDCI3), δ (1/млн.): 4,46 (m, 2Н), 3,80 (m, 3Н), 3,53 (m, 1H), 3,31 (m, 1H), 1,48 (d, 9H). Приклад 10 1-(9Н-флуорен-9-іл метил) естер 4-третбутилового естеру піперазин-1,2,4-трикарбонової кислоти Розчин 9-флуоренілметилхлорформату (2,72г, 10,5ммоль) у 1,4-діоксани (19мл) додають краплями до розчину 1-трет-бутилового естеру піперазин-1,3-дикарбонової кислоти (2,20г, 9,6ммоль) і Ν,Ν-діізопропілетиламіну (4,2мл, 23,9ммоль) у воді (9,5мл) у льодяній ванні. Після перемішування протягом ночі при кімнатній температурі реакційну суміш розбавляють водою і екстрагують хлороформом (4 рази). Органічний шар промивають насиченим бікарбонатом натрію і водою і потім 1N НСІ і водою, сушать над безводним сульфатом натрію, фільтрують і концентрують, отримуючи 1-(9Нфлуорен-9-ілметил) естер 4-трет-бутилового естеру піперазин-1,2,4-трикарбонової кислоти (4,3г). Приклад 11 Трет-бутиловий естер 2-формілпіперидин-1карбонової кислоти ДМСО (7,14мл, 98ммоль) додають краплями з перемішуванням до розчину оксалілх-лориду (30мл, 2М у СН2СІ2, 60ммоль) у СН2СІ2 (60мл) при 36 -78°С. Через 5хвил. додають розчин третбутилового естеру 2-гідроксиметилпіперидин-1карбонової кислоти у СН 2СІ2 (25мл) і реакційну суміш перемішують при -78°С протягом 0,5год., після чого додають Et3N (25мл, 181ммоль) і суміш залишають нагрітись повільно до кімнатної температури з перемішуванням. Сумішпотім вливають у воду (100мл) і органічний шар відокремлюють. Органічний екстракт промивають NaHCO3 (насичен.) і водну фазу екстрагують ДХМ (3´30мл). Об'єднані органічні фази промивають водою (30мл) і розсолом (30мл), сушать (сульфат натрію), фільтрують і концентрують in vacuo. Хроматографія дає зазначений продукт у вигляді жовтого масла (3,27г, 73%). Приклад 12 3-метиловий естер 4-трет-бутилового естер у морфолін-3,4-дикарбонової кислоти Йодметан (0,32мл, 5,19ммоль) додають до розчину 4-трет-бутилового естеру мор-фолін-3,4дикарбонової кислоти (1г, 4,32ммоль) і карбонату калію у ДМФ (15мл). Суміш перемішують при кімнатній температурі протягом 4год., розбавляють діетилетером (100мл) і промивають водою (3´100мл) і розсолом (100мл). Органічну фазу сушать (сульфат натрію), фільтрують і концентрують in-vacuo, ізолюючи бажану сполуку як прозоре масло (0,99г, 94%). 1Н ЯМР (СDCІ3), δ (1/млн.): 4,40 (m, 2Н), 3,75 (m, 6Н), 3,39 (m, 2Н), 1,46 (d, 9H). Приклад 13 Трет-бутиловий естер 3-формілморфолін-4карбонової кислоти Гідрид діізобутилалюмінію (1М у толуолі) додають краплями до розчину 3-метилового естеру 4-трет-бутилового естер у морфолін-3,4дикарбонової кислоти (992мг, 4,05ммоль) у толуолі (10мл) при -78°С і залишають перемішуватись при -78°С на 1год. Реакцію гасять повільним доданням декагідрату сульфату натрію (0,6г) з перемішуванням при 80°С протягом 40хвил. Суміш фільтрують гарячою через целітну подушку, використовуючи е тилацетат. Фільтрат концентрують in vacuo, і хроматографія (силікагель, 8% ацетону у гексанах) дає зазначений продукт як білу тверду речовину (539мг, 62%). 1Н ЯМР (CDCI3), δ (1/млн.): 9,68 (s, 1Н), 4,45 (m, 2Н), 3,86 (m, 2Н), 3,70 (dd, 1Н), 3,51 (m, 1Н), 3,23 (m, 1Н), 1,48 (m, 9Н). Приклад 14 а) Трет-бутиловий естер 2-ціано-ліперидин-1карбонової кислоти 1-трет-бутиловий естер піперидин-1,2дикарбонової кислоти (12,8г, 55,6ммоль) і ТГФ (170мл) вносять у 500-міллітрову круглодонну колбу з стрижнем для перемішування. Розчин охолоджують до -20°С і додають триетиламін (10,1мл, 72,3ммоль) і потім етилхлорфо-рмат (5,32мл, 55,6ммоль). Утворений білий осад залишають перемішуватись при -10°С на 1год. Додають водний аміак (22,6мл, 1168ммоль) і прозору реакційну суміш перемішують при кімнатній температурі протягом ночі. Реакційну суміш концентрують in vacuo і залишок розчиняють в етилацетаті (300мл). Органічну фазу промивають водою (300мл) і потім розсолом (200мл), суша ть (сульфат натрію), фільтрують і концентрують in vacuo, ізолюючи прозору 37 82434 смолу, яку перетирають з гексанами, ізолюючи карбамат (9,4г, 74%) як білу тверду речовину. 1Н ЯМР (СDCІ3), δ (1/млн.): 6,03 (bs, 1H), 5,55 (bs, 1H), 4,77 (bs, 1H), 4,05 (bs, 1H), 2,81 (t, 1H), 2,27 (bs, 1H), 1,47 (m, 14H). Ацетонприл (220мл) і ДМФ (3,82мл, 49,4ммоль) вносять у 500-міллітрову круглодонну колбу з стрижнем для перемішування. До охолодженої до -5°С суміші додають оксалілхлорид (24,7мл, 49,4ммоль, 2М ДХМ) і отриману суміш перемішують протягом 15хвил. і потім додають розчин трет-бугилового естеру 2карбамоїлпіперидин-1-карбонової кислоти (9,4г, 41,2ммоль) в ацетонітрилі (50мл) і піридині (8,3мл, 103ммоль). Реакційну суміш залишають перемішуватись при кімнатній температурі протягом ночі, потім концентрують in vacuo і залишок розчиняють в етилацетаті (300мл). Органічну фазу промивають водою (300мл) і потім розсолом (200мл), сушать (сульфат натрію), фільтрують і концентрують in vacuo, ізолюючи зазначену сполуку (8,44г, 97%) як жовту тверду речовину. 1Н Я МР (CDCI3), δ (1/млн.): 5,23 (bs, 1H), 4,03 (bs, 1H), 2,93 (t, 1H), 1,75 (m, 5H), 1,46 (m, 10H). b) Трет-бутил 3-ціаноморфолін-4-карбоксилат Триетиламін (1,808мл, 12,97ммоль) і етилхлорформат (0,909мл, 9,514ммоль) додають до охолодженого (0°С) розчину 4-трет-бутилового естеру морфолін-3,4-дикарбонової кислоти (2,00г, 8,65ммоль) у ТГФ (25мл). Реакцію підігрівають до кімнатної температури і залишають перемішуватись на 2 год, потім охолоджують до 0°С і додають гідроксид амонію (4мл). Отриману суміш підігрівають до кімнатної' температури і перемішують ще 1год. Розчинник видаляють in vacuo, і продукт екстрагують з водної фази ДХМ. Об'єднану органіку сушать (Na2SO4), фільтрують і концентрують під зниженим тиском, отримуючи трет-бутиловий естер 3-карбамоїл-морфолін-4-карбонової кислоти (білувата тверда речовина, 1,37г, 69%). 1Н ЯМР (300МГц, CDCl3) δ= 1,51 (s, 9H); 3,19 (m, 1H); 3,52 (m, 2H); 3,88 (m, 2H); 4,50 (d, J=11,4,1H); 5,81 (s broad, 1H); 6,05 (s broad, 1H). Оксалілхлорид (3,87мл 2М у ДХМ, 7,73ммоль) додають до охолодженого (0°С) розчину ДМФ (0,598мл, 7,73ммоль) в ацетонітрилі (15мл). Розчин перемішують протягом 20хвил. при 0°С і додають розчин трет-бутилового естеру 3карбамоїлморфолін-4-карбонової кислоти (1,37г, 5,95ммоль) в ацетонітрилі (6мл) і піридині (0,481мл, 5,95ммоль). Суміш залишають нагрітись до кімнатної температури і перемішують протягом 30хвил. Розчинник видаляють in vacuo і залишок розчиняють у ДХМ і промивають водою. Водну фазу екстрагують ДХМ, об'єднану органіку сушать (Nа2SO4), фільтр ують і концентрують під зниженим тиском, отримуючи зазначену сполуку (білува ті кристали, 1,24г, 98%). 1Н ЯМР (300МГц, CDCI3) δ= 1,51 (s, 9Н); 3,26 (m, 1Н); 3,55 (td, J=11,8Гц, 2,7Гц, 1Н); 3,41 (dd, J=11,8Гц, 3,3Гц, 1Н); 3,83 (m, 1Н); 3,98 (d, J=11,4Гц, 1Н); 4,08 (d, J=12Гц, 1Н); 5,32 (m, 1Н). Приклад 15 a) Трет-бутил 2-(2Н-тетразол-5-іл)піперидин-1карбоксилат 38 Трет-бутил 2-ціанопіперидин-1-карбоксилат (2,10г, 10ммоль) змішують з азидом натрію (0,715г, 11ммоль) і хлоридом амонію (0,588г, 11ммоль) у ДМФ (7,5мл) і нагрівають при 100°С протягом ночі. Реакційну суміш гасять водою і екстрагують етилацетатом. Органічний шар промивають водою тричі і потім розсолом, сушать і концентрують, отримуючи зазначену сполуку (біла тверда речовина, 2,34г, 92,5%). 1Н ЯМР (CDCI3), δ (1/млн.): 5,7 (m, 1Н), 4,02 (m, 1Н), 2,93 (m, 1Н), 2,35 (m, 1Н), 2,07 (m, 1Н), 1,74 (m, 3Н), 1,49 (m+s, 11H). Наступну сполуку приготовляють у такий же спосіб: b) трет-бутил 3-(2Н-тетразол-5-іл)морфолін-4карбоксилат Трет-бутил 3-ціаноморфолін-4-карбоксилат (2,74г, 12,9ммоль) змішують з азидом натрію (0,923г, 14,2ммоль) і хлоридом амонію (0,759г, 14,2ммоль) у ДМФ (8мл) і нагрівають при 100°С протягом 6год. і залишають перемішуватись при кімнатній температурі на ніч. Реакційну суміш гасять водою, підкислюють до рН3 і екстрагують етилацетатом. Органічний шар промивають водою тричі і потім розсолом, сушать і концентрують, отримуючи зазначену сполуку (біла тверда речовина, 2,64г, 80,7%). 1Н ЯМР (CDCI3), δ (1/млн.): 5,5 (br s, 1H), 4,45 (d, 1Н), 3,8-3,98 (m, 3Н), 3,62 (t, 1Н), 3,3 (br s, 1H), 1,46 (s, 9H). Приклад 16 Трет-бутиловий естер 2-(гідроксиімінометил)піперидин-1-карбонової кислоти Трет-бутиловий естер 2-формілпіперидин-1карбонової кислоти (1,0г, 4,7ммоль) у піридині (1,3мл) додають до розчину гідроксиламінгідрохлориду (407мг, 5,9ммоль) у піридині (5,0мл) при 0°С і суміш перемішують при кімнатній температурі протягом 12год. Суміш розбавляють водою (50мл), екстрагують ДХМ (3´25мл), об'єднані органічні фази промивають розсолом (50мл), сушать (сульфат натрію), фільтрують і концентрують in vacuo, ізолюючи бажану сполуку як світложовте масло (1,0г). Приклад 17 Трет-бутиловий естер 3-(гідроксиімінометил)морфолін-4-карбонової кислоти Розчин трет-бутилового естер у 3формілморфолін-4-карбонової кислоти (539мг, 2,50ммоль) у піридині (1,3мл) додають до розчину гідроксиламінгідрохлориду (217мг, 3,13ммоль) у піридині (2,5мл) при 0°С. Суміш підігрівають до кімнатної температури і перемішують протягом 12год., розбавляють водою (50мл) і екстрагують ДХМ (3´25мл). Об'єднані органічні фази промивають розсолом (50мл), сушать (сульфат натрію), фільтрують і концентрують, in-vacuo, ізолюючи бажану сполуку як світложовте масло (578мг). Прикладів Трет-бутиловий естер 2-[5-(3-хлорфеніл)ізоксазол-3-іл]-піперидин-1-карбонової кислоти N-хлорсукцинімід (643мг, 4,82) у ДМФ (6мл) додають до трет-бутилового естеру 2(гідроксиімінометил)-ліперидин-1-карбонової кислоти (1,0г, 4,38ммоль) у ДМФ (10мл) при 40°С. Суміш перемішують при 40°С протягом 1,5год., охолоджують до кімнатної температури, розбав 39 82434 ляють діетилетером (75мл) і промивають водою (3x100мл) і розсолом (100мл). Органічну фазу сушать (сульфат натрію), фільтрують і концентрують in vacuo, отримуючи інтермедіат у вигляді жовтого масла. Цей інтермедіат у ДХМ (5мл) додають до 3хлор-1-етинілбензолу (1,24мл, 10ммоль) і триетиламіну (1,05мл, 7,54ммоль) і ДХМ (5мл) при 0°С і суміш перемішують при кімнатній температурі протягом 12год. і концентрують in vacuo. Залишок розчиняють в етилацетаті (75мл) і промивають водою (3´50мл) і потім розсолом (50мл). Органічну фазу сушать (сульфа т натрію), фільтрують і концентрують in vacuo. Хроматографія (силікагель, 2% етилацетату у ДХМ) дає зазначену сполуку як жовту тверду речовину (236мг). 1Н ЯМР (CDCI3), δ (1/млн.): 7,75 (dd, 1Η), 7,64 (m, 1Η), 7,40 (m, 2 Η), 6,37 (s, 1H), 5,48 (br, 1H), 4,08 (m, 1H), 2,83 (m, 1H), 2,35 (m, 1H), 2,00-1,53 (m, 5H), 1,52 (s, 9H). Приклад 19 Трет-бутиловий естер 3-[5-(3-хлорфеніл)ізоксазол-3-іл]-морфолін-4-карбонової кислоти Розчин N-хлорсукциніміду у ДМФ (6мл) додають до розчину трет-бутилового естеру 3(гідроксиімінометил)-морфолін-4-карбонової кислоти (578мг, 2,51ммоль) у ДМФ (10мл) при 40°С і суміш перемішують при 40°С протягом 1,5год. Реакційну суміш охолоджують до кімнатної температури, розбавляють діетилетером (75мл), промивають водою (3´100мл) і потім розсолом (100мл). Органічну фазу сушать (сульфат натрію), фільтрують і концентрують, in-vacuo, ізолюючи інтермедіат як прозоре масло. Цей інтермедіат у ДХМ (5мл) додають до розчину 3-хлор-1-етиніпбензолу (1,24мл, 10ммоль), триетиламіну (1,05мл, 7,54ммоль) у ДХМ (5мл) при 0°С і суміш перемішують при кімнатній температурі протягом 12год. Реакційну суміш концентрують in vacuo, розчиняють в етилацетаті (75мл) і промивають водою (3´50мл) і потім розсолом (50мл). Органічну фазу сушать (сульфат натрію), фільтрують і концентрують, in-vacuo. Хроматографія (силікагель, 2% етилацетату у ДХМ) дає зазначену сполуку як жовту тверду речовину (236мг). 1Н ЯМР (CDCI3), δ (1/млн.): 7,76 (bs, 1Н), 7,67 (m, 1Н), 7,43 (m, 2Н), 6,51 (s, 1Н), 5,24 (m, 1Н), 4,39 (d, 1Н), 3,88 (m, 3Н), 3,60 (dt, 1H), 3,24 (m, 1H), 1,52 (s, 9H). Приклад 20 Трет-бутиловий естер 3-[3-(3-хлорфеніл)[1,2,4]оксадіазол-5нл]-морфолін-4-карбонової кислоти Ізобутилхлорформат (0,42мл, 3,24ммоль) додають до розчину 4-трет-бутилового естеру морфолін-3,4-дикарбонової кислоти (500мг, 2,16ммоль) і триетиламіну (0,805мл, 5,79ммоль) у ТГФ (15мл) при 0°С. Суміш підігрівають до кімнатної температури протягом 2год., додають 3-хлорN-гідроксибензамідин (368мг, 2,16ммоль) і суміш перемішують протягом ночі при кімнатній температурі, потім охолоджують і розбавляють етилацетатом (350мл). Органічний шар промивають водою (2´30мл) і розсолом (30мл), сушать над безводним сульфатом натрію, фільтрують і концентрують in vacuo. Хроматографія (силікагель, 3040% етилацетату у гексанах) дає естер (755мг, 91%). 1Н ЯМР (CDCI3), δ (1/млн.): 7,73 (s, 1H), 7,60 (d, 1H), 7,47 40 (d, 1H), 7,38 (dd, 1H), 5,25 (d, 2H), 4,4-4,8 (m, 2H), 4,1-3,2 (m, 5H), 1,50 (s, 9H). Розчин цього естеру у ДМФ нагрівають при 127°С протягом 2год. Продукт екстрагують етилацетатом (100мл) і органічний шар промивають водою (3´20мл) і розсолом (20мл), сушать над безводним сульфатом натрію, фільтрують і концентрують in vacuo. Зазначену сполуку (783мг) отримують у кількості згідно з розрахунком. 1Н ЯМР (CDCI3): 8,09 (s, 1H), 7,98 (d, 1H), 7,46 (m, 2H), 4,50 (s, 1H), 4,2-3,2 (m, 6H), 1,49 (s, 9H). Приклад 21 Трет-бутиловий естер 3-[3-(3хлорфенілН1,2,4]оксадіазол-5-іп]-піперазин-1карбонової кислоти 1-(9Н-флуорен-9-іл метил) естер 4-третбутилового естеру піперазин-1,2,4-трикарбонової кислоти (4,3г, 9,6ммоль), 3-хпор-Nгідроксибензамщин (1,8г, 10,5ммоль), HOBt (1,4г, 10,5ммоль) і ЕДКІ (2,0г, 10,5ммоль) у ДМФ (25мл) перемішують при кімнатній температурі протягом ночі. Реакційну суміш розбавляють етилацетатом, промивають водою (3 рази), насиченим бікарбонатом натрію і розсолом, сушать над безводним сульфатом натрію, фільтрують і концентрують. Залишок розчиняють у ДМФ (20мл) і потім нагрівають при 135°С протягом 2год.. Після охолодження реакційну суміш розбавляють етилацетатом, промивають водою (3 рази) і розсолом, сушать над безводним сульфатом натрію, фільтрують і концентрують. Хроматографія (силікагель, гексани до 1:1 гексани:ДХМ до 1:3:4 етилацетат:гексани:ДХМ до 3:1:4 етилацетат:гексани:ДХМ) дає зазначену сполуку (1,35г, 39%). 1Н ЯМР (СDCI3) δ (1/млн.): 8,12 (m, 1Н), 8,00 (m, 1Н), 7,47 (m, 2Н), 4,21 (m, 2Н), 3,81 (m, 1Н), 3,25 (m, 2Н), 2,81 (m, 2Н), 2,38 (bs, 1H), 1,50 (bs, 9H). Приклад 22 a) Трет-бутил 2-[2-(3-хлорфеніл)-2Н-тетразол5-іл]піперидин-1-карбоксилат Суміш трет-бутил-2-(2Н-тетразол-5іл)піперидин-1-карбоксилату (253мг, 1ммоль), tбутоксиду натрію (96мг, 1ммоль), рац-БІНАФ (24,9мг, 0,04ммоль), Pd2(ДБA)3 (10,4мг, 0,01ммоль), 2-фенілциклопропанкарбоксилату міді (II) (7,72мг, 0,02ммоль) і біс-(3-хлорфеніл)тетрафлуорборату йодонію (436,8мг, 1ммоль) витримують під зворотним холодильником в tбутанолі (20мл) під аргоном протягом 2год. Розчинник видаляють in vacuo і хроматографія (5% етилацетату у гексанах) дає зазначену сполуку (блідо-жовте клейке масло, 237,8мг, 65,3%). 1Н ЯМР (СDCI3), δ (1/млн.): 8,14 (d, 1H), 8,03 (dm, 1H), 7,46 (m, 2H), 5,75 (br s, 1H), 4,1 (m, 1Н), 3,05 (m, 1Н), 2,43 (d, 1H), 1,99 (tm, 1H), 1,7 (t, 2H), 1,53 (т + s, 11H). Наступну сполуку приготовляють у такий же спосіб: b) Трет-бутил 3-[2-(3-хлорфеніл)-2Н-тетразол5-іл]морфолін-4-карбоксилат Суміш трет-бутил 3-(2Н-тетразол-5іл)морфолін-4-карбоксилату (701мг, 2,74ммоль), tбутоксид натрію (264мг, 2,74ммоль), рац-БІНАФ (68,5мг, 0,11ммоль), Pd2(ДБA)3 (28,4мг, 0,0274ммоль), (1R,2R)-2 41 82434 фенілциклопропанкарбоксилату міді (ІІ)(21,2мг, 0,059ммоль) і тетрафлуорборату біс-(3хлорфеніл)-йодонію (1200мг, 2,74ммоль) витримують під зворотним холодильником у t-бутанолі (40мл) під аргоном протягом 2год. Розчинник видаляють in vacuo і хроматографія (5 - 20% етилацетату у гексанах) дає зазначену сполуку (безбарвне клейке масло, 840мг, 83,7%). 1Н ЯМР (CDCI3), δ (1/млн.): 8,14 (s, 1H), 8,03 (dm, 1H), 7,48 (m, 2Н), 5,40 (br s, 1H), 4,56 (d, 1H), 3,94 (dd, 1H), 3,90 (m, 2H), 3,62 (td, 1H), 3,47 (brs, 1H). Приклад 23 2-[5-(3-хлорфеніл)-ізоксазол-3-іл]-піперидин Трифлуороцтову кислоту (5мл) додають до трет-бутилового естеру 2-[5-(3-хлорфеніл)ізоксазол-3-іл]-піперидин-1-карбонової кислоти (500мг, 1,38ммоль) у ДХМ (5мл) і суміш перемішують при кімнатній температурі протягом 1год., концентрують до сухості і залишок розчиняють у гідроксиді натрію (1N водн., 30мл). Водну фазу екстрагують ДХМ (3´30мл), об'єднані органічні фази промивають водою (30мл) і розсолом (30мл), сушать (сульфат натрію), фільтрують і концентрують in vacuo, отримуючи зазначену сполуку як світло-жовте масло (292мг, 81%). 1Н ЯМР (CDCI3), δ (1/млн.): 7,75 (dd, 1Η), 7,65 (m, 1Η), 7,41 (m, 2 Η), 6,60 (s, 1H), 3,94 (dd, 1H), 3,17 (m, 1H), 2,83 (m, 1H), 2,35 (m, 1H), 2,00-1,53 (m, 6H). Приклад 24 3-[5-(3-хлорфеніл)-ізоксазол-3-іл]-морфолін Трифлуороцтову кислоту (2мл) додають до трет-бутилового естеру 3-[5-(3-хлорфеніл)ізоксазол-3-іл]-морфолін-4-карбонової кислоти (236мг, 0,65ммоль) у ДХМ (2мл). Суміш перемішують при кімнатній температурі протягом 1год., концентрують до сухості і залишок розчиняють у гідроксиді натрію (1N водн., 30мл). Водну фазу екстрагують ДХМ (3´30мл), об'єднані органічні фази промивають водою (30мл) і розсолом (30мл), сушать (сульфат натрію), фільтрують і концентрують in vacuo, отримуючи зазначену сполуку як світло-жовте масло (171мг, 99%). 1Н ЯМР (CDCI3), δ (1/млн.): 7,72 (s, 1H), 7,62 (m, 1H), 7,37 (m, 2Н), 6,59 (s, 1Н), 4,18 (dd, 1Н), 4,00 (dd, 1Н), 3,87 (dt, 1Н), 3,62 (m, 2Н), 3,03 (m, 2Н), 2,10 (bs, 1Н). Приклад 25 3-[3-(3-хлорфеніл)-[1,2,4]оксадіазол-5-іл]морфолін Розчин трет-бутилового естеру 3-[3-(3хлорфеніл)-[1,2,4]оксадіазол-5-іл]-морфолін-4карбонової кислоти (783мг, 2,19ммоль) розчиняють у мінімальній кількості ДХМ і потім охолоджують до 0°С у льодяній ванні. Додають 1:1 розчин трифлуороцтової кислоти:ДХМ (10мл) і суміш перемішують при 0°С протягом 15хвил., потім суміш підігрівають до кімнатної температури протягом 45хвил. Додають льодяну воду (20мл) і суміш нейтралізують насиченим бікарбонатом натрію. Продукт екстрагують ДХМ (2´25мл) і промивають розсолом (2´25мл), сушать над безводним сульфатом натрію, фільтрують і концентрують in vacuo. Хроматографія (силікагель) дає зазначену сполуку (429мг, 74%). 1Н ЯМР (CDCI3), δ (1/млн.): 8,11 (s, 1Н), 8,00 (d, 1Н), 7,47 (m, 2Н), 3,6-4,4 (m, 6Н), 3,0-3,3 (m, 2Н). 42 Приклад 26 а) 2-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]піперидин Трет-бутил 2-[2-(3-хлорфеніл)-2Н-тетразол-5іл]піперидин-1-карбоксилат (237мг, 0,651ммоль) змішують з трифлуороцтовою кислотою (0,85мл) і ДХМ (0,85мл) при 0°С протягом 0,5год. Суміш вливають у насичений карбонат натрію і екстрагують ДХМ. Хроматографія (20 - 100% етилацетату у гексанах) дає 2-[2-(3-хлорфеніл)-2Н-тетразол-5іл]піперидин (біла тверда речовина, 113мг, 65,8%). 1 Н ЯМР (CDCI3), δ (1/млн.): 8,16 (s, 1H), 8,03 (dm, 1H), 7,46 (m, 2H), 4,17 (dm, 1H), 3,21 (dm, 1H), 2,84 (tm, 1H), 2,18 (dm, 1H), 2,15 (m, 1H), 1,94 (m, 1H), 1,8 (m, 1H), 1,68 (m, 1H), 1,59 (m, 2H). Наступну сполуку приготовляють у такий же спосіб: b) 3-[2-(3-хлорфеніл)-2Н-тетразол-5іл]морфолін Трет-бутил 3-[2-(3-хлорфеніл)-2Н-тетразол-5іл]морфолін-4-карбоксилат (840мг, 2,296ммоль) змішують з трифлуороцтовою кислотою (6мл) і ДХМ (6мл) при 0°С 1,5год. Суміш вливають у насичений карбонат натрію і екстрагують ДХМ, сушать і концентрують, отримуючи зазначену сполуку (блідо-жовте клейке масло, 550мг, 90%). 1Н ЯМР (CDCI3), δ (1/млн.): 8,18 (s, 1Н), 8,06 (dm, 1H), 7,52 (m, 2H), 4,45 (dd, 1H), 4,24 (dd, 1H), 3,92 (dt, 1H), 3,87 (dd, 1H), 3,72 (ddd, 1Н), 3,14 (m, 2Н), 2,11 (brs, 1H). Приклад 27 Метиламід 2-[5-(3-хлорфеніл)-ізоксазол-3-іл]піперидин-1-карботіо-кислоти Метилізотіоціанат (63мг, 0,86ммоль) додають до 2-[5-(3-хлорфеніл)-ізоксазол-3-іл]-піперидину (150мг, 0,57ммоль) у СН 2СІ2 (4мл) і отриману суміш перемішують при кімнатній температурі протягом 12год., потім концентрують in vacuo і залишок перетирають з 50%-м діетилетером у гексанах, ізолюючи бажану сполуку як білувату тверду речовину (кількість згідно з розрахунком). Приклад 28 Метиламід 3-[5-(3-хлорфеніл)-ізоксазол-3-іл]морфолін-4-карботіо-кислоти Метилізотіоціанат (46,2мг, 0,63ммоль) додають до 3-[5-(3-хлорфеніл)-ізоксазол-3-іл]морфоліну (145мг, 0,55ммоль) у СНСІ3 (4мл) і отриману суміш перемішують при кімнатній температурі протягом 12год., потім концентрують in vacuo і залишок перетирають з 50%-м діетилетером у гексанах, ізолюючи зазначену сполуку як білувату тверду речовину (181мг, 97%). 1Н ЯМР (СDCI3), δ (1/млн.): 7,78 (m, 1Н), 7,67 (m, 1Н), 7,45 (m, 2Н), 6,75 (s, 1H), 6,28 (m, 1Н), 5,80 (m, 1Н), 4,57 (d, 1Н), 4,29 (d, 1Н), 4,09 (dd, 1Н), 3,99 (dd, 1Н), 3,75 (dt, 1Н), 3,45 (dt, 1H),3,23(d,3H). Приклад 29 Метиламід 3-[3-{3-хлорфеніл)[1,2,4]оксадіазол-5-іл]-морфолін-4-карботіокислоти Метилізотіоціанат (161мг, 2,2ммоль) і Et3N (0,61мг, 4,4ммоль) додають до розчину 3-[3-(3хлорфеніл)-[1,2,4]оксадіазол-5-іл]-морфоліну (294мг, 1,1ммоль) у СН2СІ2 (4мл) і суміш перемішують при кімнатній температурі протягом 12год., 43 82434 потім концентрують in vacuo. Хроматографія дає зазначену сполуку як в'язке масло (313мг, 84%). 1Н ЯМР (CDCI3), δ (1/млн.): 8,06 (d, 1Η), 7,96 (dd, 1H), 7,48 (dd, 1Η), 7,45 (t, 1Η), 6,88 (dd, 1H), 6,01 (br, m, 1H), 4,57 (d, 1H), 3,99 (m, 2H), 3,80 (m, 2H), 3,67 (ddd, 1H), 3,26 (d,3H). Приклад 30 Трет-бутиловий естер 3-[3-(3-хлорфеніл)[1,2,4]оксадіазол-5-іл]-4-метилтіокарбамоїлпіперазин-1-карбонової кислоти Метилізотіоціанат (256мг, 3,50ммоль) додають до розчину трет-бутилового естер у 3-[3-(3хлорфеніл)-[1,2,4]-оксадіазол-5-іл]-піперазин-1карбонової кислоти (1,11г, 3,04ммоль) у хлороформі (17мл) при кімнатній температурі. Після перемішування протягом ночі суміш концентрують і хроматографія (силікагель, 1:3:4 етилацетат:гексани:ДХМ до 1,5:2,5:4 етилацетат:гексани:ДХМ) дає зазначену сполуку (796мг, 1 60%). Н ЯМР (CDCI3) δ (1/млн.): 8,05 (m, 1Н), 7,95 (m, 1Н), 7,45 (m, 2Н), 6,01 (m, 1Н), 4,68 (m, 1Н), 4,22 (m, 1Н), 3,80 (m, 2Н), 3,51 (m, 1Н), 3,25 (m, 3Н), 3,07 (m, 1Н), 1,30 (bs, 9H). Приклад 31 Метиламід 2-[2-(3-хлорфеніл)-2Н-тетразол-5іл]-піперидин-1-карботіо-кислоти 2-({2-[2-(3-хлорфеніл)-2Н-тетразол-5іл]піперидин-1-іл}метил)піридин (600мг, 2,38ммоль) змішують з метилізотіоціанатом (250мг, 3,41ммоль) у хлороформі (10мл) при кімнатній температурі протягом ночі. Реакційну суміш концентрують і перетирають з етером, отримуючи зазначену сполуку як білу тверду речовину (676мг, 88%). 1Н ЯМР (CDCI3), δ (1/млн.): 8,13 (s, 1Н), 8,03 (m, 1Н), 7,51 (m, 2Н), 6,93 (w, 1Н), 6,06 (w, 1Н), 4,24 (m, 1Н), 3,34 (m, 1Н), 3,23 (d, 3Н), 2,46 (m, 1Н), 2,11 (m, 1Н), 1,60-1,95 (m, 4Н). Приклад 32 Метиловий естер 2-[5-(3-хлорфеніл)нзоксазол3-іл]-N-метилпіперидин-1-карбоксимідотіо-кислоти Йодметан (50мкл, 0,80ммоль) додають до метиламіду 2-[5-(3-хлорфеніл)-ізоксазол-3-іл]піперидин-1-карботіо-кислоти (181мг, 0,54ммоль) у метанолі (4мл) і отриману суміш перемішують при 75°С протягом 3год. Суміш охолоджують до кімнатної температури, розбавляють насиченим бікарбонатом натрію (водн., 30мл) і екстрагують ДХМ (3´20мл). Об'єднані органічні фази промивають розсолом (30мл), сушать (сульфат натрію), фільтрують і концентрують in vacuo, отримуючи зазначену сполуку у вигляді жовтого масла (0,19г, 100%). 1Н ЯМР (CDCI3), δ (1/млн.): 7,73 (dd, 1H), 7,64 (m, 1H), 7,38 (m, 2H), 6,60 (s, 1H), 5,37 (m, 1H), 4,25 (m, 1Н), 3,95 (m, 2Н), 3,67 (m, 2Н), 3,32 (m, 1Н), 3,25 (s, 3Н), 2,36 (s, 3Н). Приклад 33 Метиловий естер 3-[5-(3-хлорфеніл)-ізоксазол3-іл]-N-метилморфолін-4-карбоксимідотіо-кислоти Подметан (50мкл, 0,80ммоль) додають до метиламіду 3-[5-(3-хлорфеніл)-ізоксазол-3-іл]морфолін-4-карботіо-кислоти (181мг, 0,54ммоль) у метанолі (4мл) і отриману суміш перемішують при 75°С протягом 3год. Суміш охолоджують до кімнатної температури, розбавляють насиченим бікарбонатом натрію (водн., 30мл) і екстрагують ДХМ 44 (3´20мл). Об'єднані органічні фази промивають розсолом (30мл), сушать (сульфат натрію), фільтрують і концентрують in vacuo, отримуючи зазначену сполуку у вигляді жовтого масла (0,19г, 100%). 1Н ЯМР (CDCI3), δ (1/млн.): 7,73 (dd, 1H), 7,64 (m, 1H), 7,38 (m, 2H), 6,60 (s, 1H), 5,37 (m, 1H), 4,25 (m, 1Н), 3,95 (m, 2Н), 3,67 (m, 2Н), 3,32 (m, 1Н), 3,25 (s, 3Н), 2,36 (s, 3Н). Приклад 34 Метиловий естер 3-[3-(3-хлорфеніл)[1,2,4]оксадіазол-5-іл]-метилморфолін-4карбоксимідотіо-кислоти Йодметан (212мг, 1,5ммоль) додають до розчину метиламіду 3-[3-(3-хлорфеніл)[1,2,4]оксадіазол-5-іл]-морфолін-4-карботіокислоти (313мг, 0,92ммоль) у метанолі (10мл) і суміш перемішують при 75°С протягом 3год. Суміш охолоджують до кімнатної температури, розбавляють насиченим бікарбонатом натрію (водн., 30мл) і екстрагують ДХМ (3´20мл). Об'єднані органічні фази промивають розсолом (30мл), сушать (сульфат натрію), фільтрують і концентрують in vacuo, отримуючи зазначену сполуку як білу тверду речовину (248мг, 76%). 1Н Я МР (СDCI3), δ (1/млн.) 8,08 (d, 1Η), 7,95 (dd, 1Н), 7,47 (dd, 1Η), 7,43 (t, 1Η), 5,47 (dd, 1Η), 4,36 (d, 1Н), 3,40-4,00 (m, 5Н), 3,21 (s, 3Н), 2,36 (s,3H). Приклад 35 Трет-бутиловий естер 3-[3-(3-хлорфеніл)[1,2,4]оксадіазол-5-іл]-4-(метилімінометилсульфанілметил)-піперазин-1карбонової кислоти Трет-бутиловий естер 3-[3-(3-хлорфеніл)[1,2,4]оксадіазол-5-іл]-4-метилтіокарбамоїлпіперазин-1-карбонової кислоти (796мг, 1,82ммоль) і йодметан (0,170мл, 2,73ммоль) у метанолі (11мл) нагрівають при 75°С у герметичній колбі протягом 2год. Після охолодження суміш концентрують і залишок розчиняють у ДХМ. Органічний шар промивають насиченим бікарбонатом натрію, сушать над безводним сульфатом натрію, фільтрують і концентрують. Хроматографія (силікагель, 25% етилацетату у гексанах) дає зазначену сполуку (632мг, 77%). 1Н ЯМР (CDCI3) δ. (1/млн.): 8,08 (m, 1H), 7,97 (m, 1H), 7,44 (m, 2Н), 5,51 (m, 1Н), 4,49 (m, 1Н), 4,01 (m, 2Н), 3,49 (m, 2Н), 3,20 (s, 3Н), 3,15 (m, 1Н), 2,37 (s, 3Н), 1,38(bs, 9H). Приклад 36 Метиловий естер 2-[2-(3-хлоофеніл)-2Нтетразол-5-іл]-N-метилпіперидин-1карбоксимідотіо-кислоти Метиламід 2-[2-(3-хлорфеніл)-2Н-тетразол-5іл]-піперидин-1-карботіо-кислоти (676мг, 2,0ммоль) змішують з йодметаном (0,4мл) у метанолі (15мл) у герметичній колбі при 80°С протягом 2год. Реакційну суміш концентрують у роторному випарювачі. Залишок підлужують насиченим бікарбонатом натрію і екстрагують ДХМ. Органічний шар сушать з MgSO4, отримуючи зазначену сполуку як клейке блідожовте масло (700мг, 100%). 1Н ЯМР (СDCI3), δ (1/млн.): 8,15 (s, 1Н), 8,04 (d, 1Н), 7,48 (m, 2Н), 5,75 (m, 1Н), 3,22 (m, 1Н), 3,22 (m,s, 4Н), 2,04 (s,m, 4Н), 2,10 (m, 1Н), 1,69 (m, 4Н). Приклад 37 45 82434 a) 4-{5-{2-[5-{3-хлорфеніл)-ізоксазол-3-iл]піперидин-1-іл}-4-метил-4Н[1,2,4]триазол-3-іл)піридин Гідразид ізонікотинової кислоти (42,3мг, 0,31ммоль) додають до метилового естеру 2-[5-(3хлорфеніл)-ізоксазол-3-іл]-N-метил-1-піперидин-1карбоксимідотіо-кислоти (90мг, 0,26ммоль) в етанолі (1,5мл). Суміш перемішують при 75°С протягом 12год. і потім розбавляють ДХМ (8мл). Органічну фазу промивають водою (4´10мл) і потім розсолом (10мл), сушать (сульфат натрію), фільтрують і концентрують in vacuo. Хроматографія (силікагель, 10% метанолу в етилацетаті) дає жовте масло, яке перетирають з 30% гексанів у діетилетері, отримуючи зазначену сполуку як білувату тверду речовину (50мг). 1Н Я МР (CDCI3), δ (1/млн.): 8,72 (d, 2Н), 7,69 (s, 1Н), 7,59 (m, 3Н), 7,36 (m, 2Н), 6,54 (s, 1Н), 4,79 (dd, 1Н), 3,64 (s, 3Н), 3,28 (m, 2H), 2,20 (m, 2H), 1,90-1,73 (m, 4H). Наступні сполуки приготовляють у такий же спосіб: b) 3-[5-(3-хлорфеніл)-[1,2,4]оксадіазол-3-іл]-4(5-піридин-4-іл-4Н-[1,2,4]триазол-3-іл)-морфолін; вихід 40,2мг, 24%, жовтий порошок; 1Н ЯМР CDCI3 (300МГц): 3,37 (m, 1H); 3,59 (m, 1Н); 3,75 (s, 3Н); 3,97 (m, 1Н); 4,08 (m, 2Н); 4,32 (dd, J=11,7Гц, 3,3Гц, 1Н); 5,00 (m, 1Η); 7,45 (t, J=8Гц, 7,56 (d, J=8Гц, 1Η); 7,62 (d, J=4,8Гц, 2H); 7,94 (d, J=7,8Гц, 1Η); 8,04 (m, 1H); 8,75 (br.s, 2H) Енантіомери відокремлюють, використовуючи колонку Chiralpak AD 4,6 Χ 250мм, з елюентом iPrOH/0,05% Et2NH при витраті 1мл/хвил., отримуючи 12,5мг енантіомеру 1, Rt 7,39хвил. і 12,7мг енантіомеру 2, Rt 12,57хвил. c) 3-[5-(3-хлорфеніл)ізоксазол-3-іл]-4-(4циклопропіл-5-піридин-3-іл-4Н-1,2,4-триазол-3іл)морфолін; вихід 63,5мг, 27%, білувата тверда речовина; 1Н ЯМР CDCI3 (300МГц): 9,07 (s, 1Н) 8,71 (dd, 1Н), 8,16 (dt, 1Н), 7,75 (d, 1Н), 7,64 (m, 1Н), 7,41 (m, 3Н), 6,83 (s, 1Н), 5,18 (t, 1H), 4,25 (d, 2H), 4,12 (m, 1H), 3,99 (m, 1H), 3,72 (m, 1H), 3,49 (m, 1H), 3,38 (m, 1Н), 1,30 (m, 1Н), 1,14 (m, 2H), 0,60 (m, 1H). Енантіомери відокремлюють, використовуючи колонку Chiralpak AD 4,6 Χ 250мм, з елюентом іРrОН при витраті 1мл/хвил. і отримують енантіомер 1 як білувату тверду речовину, 14,4мг, Rt 5,9хвил., і енантіомер 2 як білувату тверду речовину, 16,7мг, Rt 23,7 хвил. d) 3-[5-(3-хлорфеніл)ізоксазол-3-іл]-4-(4циклопропіл-5-піридин-4-іл-4Н-1,2,4-триазол-3іл)морфолін; вихід 103,4мг, 43%, біла тверда речовина; 1Н ЯМР CDCI3 (300МГц): 8,75 (d, 2Н), 7,76 (m, 3Н), 7,64 (m, 1H), 7,41 (m, 2H), 6,83 (s, 1H), 5,19(t, 1H), 4,25(d, 2H), 4,13 (m, 1H), 3,99 (td, 1H), 3,73(td, 1H), 3,50 (m, 1H), 3,41 (m, 1H), 1,28 (m, 1Η), 1,15 (m, 2H), 0,62 (m, 1Η). е) 3-[5-{3-хлорфеніл)ізоксазол-3-іл]-4-(4-метил5-піридин-3-іл-4Н-1,2,4-триазол-3-іл)морфолін; вихід 85,0мг, 35%, біла тверда речовина; 1Н ЯМР CDCI3 (300МГц): 8,90 (d, 1Н), 8,72 (m, 1Н), 8,05 (dt, 1Н), 7,73 (m, 1Н), 7,61 (m, 1Н), 7,41 (m, 3Н), 6,67 (s, 1H), 4,82 (m, 1Н), 4,25 (dd, 1Н), 4,08 (m, 3Н), 3,67 (s, 3Н), 3,48 (m, 1H), 3,40 (m, 1H). 46 f) 3-[5-(3-хлорфеніл)-ізоксазол-3-іл]-4-[5-(6метокси-піридин-3-іл)-4-метил-4Н-[1,2,4]триазол-3іл]-морфолін; вихід 73,2мг, 29%, білувата тверда речовина; 1Н ЯМР CDCI3 (300МГц): 8,40 (d, 1H), 7,88 (dd, 1H), 7,69 (s, 1H), 7,59 (m, 1H), 7,38 (m, 2H), 6,84(d, 1H), 6,65(s, 1Н), 4,79 (m, 1Н), 4,20 (dd, 1Н), 4,04 (m, 3Н), 3,98 (s, 3Н), 3,61 (s, 3Н), 3,44 (m, 1H), 3,36 (m, 1H). g) 3-[3-(3-хлорфеніл)-1,2,4-оксадіазол-5-іл]-4[5-(2-метоксипіридин-4-іл)-4-метил-4Н-1,2,4триазол-3-іл]морфолін; вихід 26,6мг, 5,8%, жовте масло; 1Н ЯМР CDCI3 (300МГц): 8,31 (d, 1H), 8,04 (t, 1H), 7,95 (dt, 1H), 7,44 (m, 2H), 7,24 (d, 1H), 7,02 (s, 1H), 5,14 (dd, 1Н), 4,38 (dd, 1Н), 4,19 (dd, 1Н), 4,05 (m, 2Н), 4,02(s, 3Н), 3,73 (s, 3Н), 3,7 (m, 1H), 3,34 (m, 1H). h) 3-[3-(3-хлорфеніл)-1,2,4-оксадіазол-5-іл]-4[5-(2-метилпіридин-4-іл)-4-метил-4Н-1,2,4-триазол3-іл]морфолін; вихід 42,3мг, 9,6%, жовте масло; 1Н ЯМР CDCI3 (300МГц): 8,64 (br, 1Н), 8,02 (t, 1Н), 7,94 (dt, 1Н), 7,44 (m, 4Н), 5,14 (dd, 1H), 4,38 (dd, 1H), 4,19 (dd, 1H), 4,03 (m, 2Н), 3,74 (s, 3Н), 3,7 (m, 1Н), 3,38 (m, 1Н), 2,66 (s, 3Н). і) 3-[3-(3-хлорфеніл)-1,2,4-оксадіазол-5-іл]-4-[5(5-флуорпіридин-3-іл)-4-метил-4Н-1,2,4-триазол-3іл]морфолін; вихід 285мг, 63,9%, жовте масло; 1Н ЯМР CDCI3 (300МГц): 8,72 (s, 1Н), 8,59 (d, 1Н), 8,03 (t, 1Н), 7,94 (dt, 1Н), 7,82 (dq, 1H), 7,45 (m, 2H), 5,14 (dd, 1H), 4,38 (dd, 1Н), 4,19 (dd, 1Н), 4,05 (m, 2Н)„ 3,75 (s, 3Н), 3,7 (m, 1H), 3,38 (m, 1H). j) 3-[5-(3-хлорфеніл)ізоксазол-3-іл]-4-[5-(5флуорпіридин-3-іл)-4-метил-4Н-1,2,4-триазол-3іл]морфолін; вихід 40мг, 38%, білувата тверда речовина; 1Н ЯМР CDCI3 (300МГц): 8,73 (s, 1Н), 8,59 (d, 1Н), 7,83 (m, 1Н), 7,73 (m, 1Н), 7,62 (m, 1Н), 7,41 (m, 2Н), 6,68 (s, 1Н), 4,83 (m, 1Н), 4,25 (m, 1Н), 4,08 (m, 3Н), 3,71 (s, 3Н), 3,45 (m, 2H) k) 3-[3-(3-хлорфеніл)-1,2,4-оксадіазол-5-іл]-4(4-метил-5-піридин-2-іл-4Н-1,2,4-триазол-3іл)морфолін; вихід 68мг, 14,3%, жовте масло; чистота 90% згідно з ЯМР; 1Н ЯМР CDCI3 (300МГц): 8,64 (d, 1H), 8,22 (d, 1H), 8,01 (s, 1H), 7,93 (d, 1H), 7,78 (td, 1H), 7,28 (m, 3Н), 5,14 (dd, 1Н), 4,38 (dd, 1Н), 4,19 (dd, 1Н), 4,03 (m, 2Н), 4,02(s, 3Н), 3,66 (m, 1H), 3,34 (m, 1Н). І) 4-{5-(5-флуорпіридин-3-іл)-4-метил-4Н-1,2,4триазол-3-іл]-3-[3-(3-йодфеніл)-1,2,4-оксадіазол-5іл]морфолін; вихід 103мг, 36,2%, прозоре масло; 1 Н ЯМР CDCI3 (300МГц): 8,74 (s, 1H), 8,61 (d, 1H), 8,38 (t, 1H), 8,02 (dt, 1H), 7,84 (dq, 2H), 7,21 (t, 1H), 5,14 (dd, 1Н), 4,38 (dd, 1H), 4,19 (dd, 1H), 4,03 (m, 2H), 3,75(s, 3Н), 3,70 (m, 1H), 3,38 (m, 1H). m) 3-[3-(3-йодфеніл)-1,2,4юксадіазол-5-іл]-4-(4метил-5-піридин-4-іл-4Н-1,2,4-триазол-3іл)морфолін; вихід 99,6мг, 37,3%, прозоре масло; 1 Н ЯМР CDCI3 (300МГц): 8,78 (dd, 2H), 8,38 (t, 1H), 8,02 (dt, 1H), 7,84 (dt, 1H), 7,63 (dd, 2H), 7,21 (t, 1H), 5,14 (dd, 1H), 4,38 (dd, 1Н), 4,18 (m, 1Н), 4,03 (m, 2Н), 3,76 (s, 3Н), 3,71 (m, 1H), 3,37 (m, 1H). n) 3-[5-(3-хлорфеніл)ізоксазол-3-іл]-4-[5-(2метилпіридин-4-іл)-4-метил-4Н-1,2,4-триазол-3іл]морфолін; вихід 5,6мг, 5%, жовте масло; 1Н ЯМР CDCI3 (300МГц): 8,64 (d, 1Н), 7,72 (m, 1Н), 7,5 (m, 1Н), 7,41 (m, 1Н), 7,38 (m, 3Н), 6,66 (s, 1H), 4,81 (m, 47 82434 1H), 4,24 (m, 1H), 4,09 (m, 3Н), 3,68 (s, 3Н), 3,52 (m, 2Н), 2,63 (s, 3Н) Приклад 38 3-[5-(3-хлорфеніл)-ізоксазол-3-іл]-4-(4-метил-5піридин-4-іл-4Н-[1,2,4]триазол-3-іл)-морфолін Гідразид ізонікотинової кислоти (56,1мг, 0,41ммоль) додають до метилового естеру 3-[5-(3хлорфеніл)-ізоксазол-3-іл]-N-метилморфолін-4карбоксимідотіо-кислоти (96мг, 0,27ммоль) в етанолі. Отриману суміш залишають перемішуватись при 75°С на 12год. і потім розбавляють ДХМ (8мл). Органічну фазу промивають водою (4´10мл) і потім розсолом (10мл), суша ть (сульфа т натрію), фільтрують і концентрують in vacuo. Хроматографія (силікагель, 10% метанолу в етилацетаті) дає жовте масло, яке перетирають з 30% гексанів у діетилетері, отримуючи зазначену сполуку як білувату тверду речовину (46мг). 1Н Я МР (CDCI3), δ (1/млн.): 8,76 (d, 2Н), 7,72 (dd, 1Н), 7,62 (m, 3Н), 7,42 (m, 2H), 6,67 (s, 1H), 4,82 (dd, 1H), 4,25 (dd, 1Н), 4,07 (m, 3Н), 3,71 (s, 3Н), 3,45 (m, 2H). Енантіомери відокремлюють, використовуючи колонку Chiralpak AD 4,6 Χ 250мм, з елюентом ІРrOН при витраті 1мл/хвил., і отримують енантіомер 1 як білу тверду речовину, 9мг, Rt 5,6хвил., і енантіомер 2 як білу тверду речовину, 9мг, Rt 9,9хвил. Приклад 39 3-[5-(3-хлорфеніл)-ізоксазол-3-іл]-4-[5-(4дифлуорметоксифеніл)-4-метил-4Н-[1,2,4]триазол3-іл]-морфолін Піридин (30мкл) і гідразид 4дифпуорметоксибензойної кислоти (57,9мг, 0,29ммоль) додають до розчину метилового естеру 3-[5-(3-хлорфеніл)-ізоксазол-3-іл]-Nметилморфолін-4-карбоксимідотіо-кислоти (960мг, 0,27ммоль) в етанолі. Суміш перемішують при 75°С протягом 48год. і потім розбавляють ДХМ (8мл). Органічну фазу промивають водою (4´10мл) і потім розсолом (10мл), сушать (сульфат натрію), фільтрують і концентрують in vacuo. Хроматографія (силікагель, 10% ДХМ в етилацетаті) дає зазначену сполуку як прозоре масло (18мг). 1Н ЯМР (CDCI3), δ (1/млн.): 7,67 (m, 4Н), 7,39 (m, 2Н), 7,23 (d, 2H), 6,66 (s, 1H), 6,58 (t, 1Н), 4,80 (dd, 1Н), 4,25 (dd, 1Н), 4,07 (m, 3Н), 3,61 (s, 3Н), 3,40 (m, 2Н). Приклад 40 3-[3-хлорфеніл)-[1,2,4]оксадіазол-5-іл]-4-(4метил-5-піридин-4-іл-4Н-[1,2,4]триазол-3-іл)морфолін Піридин (30мкл) і гідразид ізонікотинової кислоти (60мг, 0,29ммоль) додають до метилового естеру 3-[3-(3-хлорфеніл)-[1,2,4]оксадіазол-5-іл]метилморфолін-4-карбоксимідотіо-кислоти (101мг, 0,44ммоль) в етанолі і суміш перемішують при 75°С протягом 48год. Суміш розбавляють ДХМ (8мл), органічну фазу промивають водою (4´10мл) і потім розсолом (10мл), сушать (сульфа т натрію), фільтрують і концентрують in vacuo. Хроматографія (силікагель, 10% ДХМ в етилацетаті) дає зазначену сполуку як прозоре масло (40мг, 33%). 1Н ЯМР (CDCI3), δ (1/млн.): 8,78 (d, 2 Η), 8,03 (d, 1Η), 7,92 (dd, 1H), 7,63 (d, 2 Η), 7,46 (dd, 1Η), 7,40 (t, 48 1H), 5,14 (dd, 1H), 4,35 (d, 1H), 4,14 (m, 3Н), 3,75 (s, 3Η), 3,73 (m, 1H), 3,39(m, 1H). Приклад 41 3-[3-(3-хлорфеніл)-[1,2,4]оксадіазол-5-іл]-4-[5(4-дифлуорметоксифеніл)-4-метил-4H[1,2,4]триазол-3-іл]-морфолін Метиловий естер 3-[3-(3-хлорфеніл)[1,2,4]оксадіазол-5-іл]-N-метил-морфолін-4карбоксимідотіо-кислоти (100мг, 0,28ммоль), гідразид 4-дифлуорметокси-бензойної кислоти (60,2мг, 0,30ммоль) і піридин (4 краплі) в етанолі (10мл) нагрівають при 75°С протягом 24год. Після охолодження реакційну суміш розбавляють етилацетатом і потім промивають водою (5 разів) і розсолом, сушать над безводним сульфатом натрію, фільтрують і концентрують. Хроматографія (силікагель, 1-2% метанолу у ДХМ) дає зазначену сполуку (99,5мг, 73%). 1H ЯМР (CDCI3) δ (1/млн.): 8,03 (m, 1Н), 7,93 (m, 1Н), 7,67 (m, 2Н), 7,46 (m, 1Н), 7,42 (m, 1Н), 7,25 (m, 2Н), 6,59 (t, 1Н), 5,13 (m, 1Н), 4,37 (m,1Н), 4,16 (m, 1Н), 4,01 (m, 2Н), 3,66 (m, 1Н), 3,67 (s, 3Н), 3,36 (m, 1Н). Приклад 42 Трет-бутиловий естер 3-[3-(3-хлорфеніл)[1,2,4]оксадіазол-5-іл]-4-(4-метил-5-піридин-4-іл4Н-[1,2,4]триазол-3-іл)-ліперазин-1-карбонової кислоти Трет-бутиловий естер 3-[3-(3-хлорфеніл)[1,2,4]оксадіазол-5-іл]-4-(метилімінометилсульфанілметил)-піперазин-1-карбонової кислоти (211,6мг, 0,47ммоль) і гідразид ізонікотинової кислоти (96,5мг, 0,70ммоль) в етанолі (6мл) нагрівають при 80°С протягом 24год. Після охолодження суміш розбавляють етилацетатом і промивають водою (5 разів) і розсолом, суша ть над безводним сульфатом натрію, фільтрують і концентрують. Хроматографія (силікагель, 0 - 5% 2Μ метанолового амонію у 1:1 етилацетаті :ДХМ) дає зазначену сполуку (168,5мг, 69%, безбарвне масло). 1Н ЯМР (CDCI3) δ (1/млн.): 8,77 (m, 2Н), 8,04 (s, 1Н), 7,94 (m, 1Н), 7,62 (m, 2Н), 7,44 (m, 2Н), 5,08 (m, 1Н), 4,15 (m, 1Н) 4,06 (m, 1Н), 3,75 (m, 3Н), 3,73 (s, 3Н), 3,32 (m, 1Н), 1,43 (bs, 9H). Приклад 43 2-[3-(3-хлорфеніл)-[1,2,4]оксадіазол-5-іл]-1-(4метил-5-піридин-4-іл-4Н-1,2,4]триазол-3-іл)піперазин Трифлуороцтову кислоту (1,5мл) додають до розчину трет-бутилового естеру 3-[3-(3хлорфеніл)-[1,2,4]оксадіазол-5-іл]-4-(4-метил-5піридин-4-іл-4Н-[1,2,4]триазол-3-іл)-піперазин-1карбонової кислоти (164мг, 0,31ммоль) у ДХМ (3мл) при 0°С і перемішують протягом 2,5год. Суміш концентрують, залишок розбавляють ДХМ і потім промивають насиченим бікарбонатом натрію, сушать над безводним сульфатом натрію, фільтрують і концентрують, отримуючи зазначену сполуку (109мг, 83 %, тверда біла піна). 1Н ЯМР (CDCI3) δ (1/млн.): 8,75 (m, 2Н), 8,02 (m, 1Н), 7,93 (m, 1H), 7,62 (m, 2H), 7,43 (m, 2H), 5,01 (m, 1H), 3,73 (s, 3Н), 3,62 (m, 2Н), 3,40 (m, 1Н), 3,22 (m, 3Н). Приклад 44 2-[3-(3-хлорфеніл)-[1,2,4]оксадіазол-5-іл]-4метил-1-(4-метил-5-піридин-4-іл-4Н-[1,2,4]триазол3-іл)-піперазин 49 82434 Мурашину кислоту (0,1мл), формальдегід (37%-й (за масою) розчин у воді, 0,1мл) і ціаноборгідрид натрію (1,0М у ТГФ, 0,1мл) додають до розчину 2-[3-(3-хлорфеніл)-[1,2,4]оксадіазол-5-іл]-1-(4метил-5-піридин-4-іл-4Н-1,2,4)триазол-3-іл)піперазину (50,3мг, 0,12ммоль) у метанолі (0,8мл) при кімнатній температурі. Після перемішування протягом 30хвил. суміш розбавляють водою і екстрагують хлороформом (4 рази), сушать над безводним сульфатом натрію, фільтрують і концентрують. Хроматографія (силікагель, 1 - 5% 2М метанольного амонію у ДХМ) дає зазначену сполуку (90%). 1Н ЯМР (CDCI3) δ (1/млн.): 8,77 (m, 2Н), 8,03 (m, 1Н), 7,93 (m, 1Н), 7,63 (m, 2Н), 7,42 (m, 2Н), 5,21 (m, 1Н), 3,74 (s, 3Н), 3,70 (m, 1Н), 3,43 (m, 1Н), 3,09 (m, 2Н), 2,70 (m, 2Н), 2,41 (s, 3Н). Приклад 45 Трет-бутиловий естер 3-[3-(3-хлорфеніл)[1,2,4]оксадіазол-5-іл]-4-[5-(4-дифлуорметоксифеніл)-4-метил-4Н-[1,2,4]триазол-3-іл]піперазин-1-карбонової кислоти Трет-бутиловий естер 3-[3-(3-хлорфеніл)[1,2,4]оксадіазол-5-іл]-4-(метилімінометилсульфанілметил)-піперазин-1-карбонової кислоти (211,3мг, 0,47ммоль), гідразид 4-дифлуорметоксибензойної кислоти (99,2мг, 0,49ммоль) і піридин (8 крапель) в етанолі нагрівають при 75°С протягом 3 днів. Після охолодження реакційну суміш розбавляють етилацетатом і потім промивають водою (5 разів) і розсолом, сушать над безводним сульфатом натрію, фільтрують і концентрують. Хроматографія (силікагель, етилацетат: гексани:ДХМ 3:1:4 до 100% етилацетату) дає зазначену сполуку. Приклад 46 2-[3-(3-хлорфеніл)-[1,2,4]оксадІазол-5-іл]-1-[5(4-дифлуорметоксифеніл)-4-метил-4Н[1,2,4]триазол-3-іл]-піперазин Трифлуороцтову кислоту (1,5мл) додають до розчину трет-бутилового естеру 3-[3-(3хпорфеніл)-[1,2,4]-оксадіазол-5-іл]-4-[5-(4дифлуорметоксифеніл)-4-метил-4Н-[1,2,4]триазол3-іл]-піперазин-1-карбонової кислоти при 0°С і перемішують протягом 2,5год. Суміш концентрують, залишок розбавляють ДХМ і потім промивають насиченим бікарбонатом натрію, сушать над безводним сульфатом натрію, фільтрують і концентрують. Хроматографія (силікагель, 3 - 4% 2М метанольного амонію у ДХМ) дає зазначену сполуку (біла тверда речовина, 31% у двох операціях). 1Н ЯМР (CDCI3) δ (1/млн.): 8,05 (m, 1H), 7,95 (m, 1H), 7,69 (m, 2H), 7,47 (m, 1H), 7,42 (m, 1H), 7,26 (m, 2H), 6,59 (t, 1H), 5,01 (m, 1H), 3,63 (m, 5H), 3,39 (m, 1H), 3,20 (m, 3Н). Приклад 47 2-[3-(3-хлорфеніл)-[1,2,4]оксадіазол-5-іл]-1-[5(4-дифлуорметоксифеніл)-4-метил-4Н[1,2,4]триазол-3-іл]-4-метилпіперазин Мурашину кислоту (0,1мл), формальдегід (37% (за масою) у воді, 0,1мл) і ціаноборгі-дрид натрію (1,0М у ТГФ, 0,1мл) додають до розчину 2[3-(3-хлорфеніл)-{1,2,4]оксадіазол-5-іл]-1-[5-(4дифлуорметоксифеніл)-4-метил-4H-[1,2,4]триазол3-іл]-піперазину (27,3мг, 0,056ммоль) у метанолі (0,8мл) при кімнатній температурі. Після перемішування протягом 30хвил. суміш розбавляють 50 водою і екстрагують хлороформом (3 рази), сушать над безводним сульфатом натрію, фільтрують і концентрують. Хроматографія (силікагель, 1 3% метанолу у ДХМ) дає зазначену сполуку (57%). 1 Н ЯМР (CDCI3) δ (1/млн.): 8,03 (m, 1H), 7,93 (m, 1Н), 7,68 (m, 2Н), 7,46 (m, 1Н), 7,42 (m, 1Н), 7,25 (m, 2Н), 6,59 (t, 1Н), 5,20 (m, 1Н), 3,68 (m,1Н), 3,66 (s, 3Н), 3,40 (m, 1Н), 3,12 (m, 1Н), 3,02 (m, 1Н), 2,69 (m, 2Н), 2,40 (s, 3Н). Приклад 48 2-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]-1-{5-[4(дифлуорметокси)феніл]-4-метил-4Н-1,2,4триазол-3-іл}піперидин Метиловий естер 2-[2-(3-хлорфенiл)-2Нтетразол-5-іл]-N-метил-піперидин-1карбоксимідотіо-кислоти (70мг, 0,2ммоль) змішують з гідразидом (4-дифлуорметокси-бензойної кислоти 40,4мг, 0,2ммоль) в етанолі при 80°С протягом ночі. Реакційну суміш розбавляють водою і екстрагують ДХМ. Шар ДХМ сушать і очищають хроматографією (етилацетат), отримуючи зазначену сполуку (37мг, 38%). 1Н ЯМР (CDCI3), δ (1/млн.): 8,09 (s, 1Н), 7,99 (m, 1Н), 7,66 (d, 2Н), 7,46 (m, 2Н), 7,24 (d, 2Н), 6,58 (t, 1Н), 5,10 (m, 1Н), 3,66 (s, 3Н), 3,48 (m, 1H), 3,30 (m, 1H), 1,70-2,30 (m, 6H). Приклад 49 4-(5-{2-[2-(3-хлорфеніл)-2Н-тетразол-5іл]піперидин-1-іл}-4-метил-4Н-1,2,4-триазол-3іл)піридин Метиловий естер 2-[2-(3-хлорфеніл)-2Нтетразол-5-іл]-N-метил-піперидин-1карбоксимідотіо-кислоти (70мг, 0,2ммоль) змішують з гідразидом ізонікотинової кислоти (33,2мг, 0,2ммоль) в етанолі при 80°С протягом ночі. Реакційну суміш розбавляють водою і екстрагують ДХМ. Шар ДХМ сушать і очи щають хроматографією (етилацетат), отримуючи зазначену сполуку (34мг, 40,3%). 1Н ЯМР (CDCI3), δ (1/млн.): 8,74 (d, 2H), 8,07 (s, 1H ), 7,96 (m, 1Н), 7,61 (d, 2Н), 7,45 (m, 2Н), 5,11(m, 1Н), 3,73 (s, 3Н), 3,48 (m, 1H), 3,30 (m, 1H), 1,70-2,30 (m, 6H). Приклад 50 2-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]-1-[5-(4метоксифент)-4-метил-4Н-1,2,4-триазол-3іл]піперидин Метиловий естер 2-[2-(3-хлорфеніл)-2Нтетразол-5-іл]-N-метил-піперидин-1карбоксимідстіо-кислоти (70мг, 0,2ммоль) змішують з гідразидом 4-метоксибензойної кислоти (33,2мг, 0,2ммоль) в етанолі при 80°С протягом ночі. Реакційну суміш розбавляють водою і екстрагують ДХМ. Шар ДХМ сушать і очищають хроматографією (етилацетат), отримуючи зазначену сполуку (20,2мг, 22,4%). 1Н ЯМР (CDCI3), δ (1/млн.): 8,09 (s, 1H), 7,98 (m, 1Н), 7,57 (d, 2Н), 7,45 (m, 2Н), 7,99 (d, 2Н), 5,10 (m, 1Н), 3,86 (s, 3Н), 3,63 (s, 3Н), 3,48 (m, 1Н), 3,29 (m, 1H), 1,70-2,30 (m, 6H). Приклад 51 [4-(5-{2-[2-(3-хлорфеніл)-2Н-тетразол-5іл]піперидин-1-іл}-4-метил-4Н-1,2,4-триазол-3іл)феніл]диметиламін Метиловий естер 2-[2-(3-хлорфеніл)-2Нтетразол-5-іл]-N-метилпіперидин-1карбоксимідотіо-кислоти (70мг, 0,2ммоль) змішують з гідразидом 4-метокси-бензойної кислоти 51 82434 (27,4мг, 0,2ммоль) в етанолі при 80°С протягом ночі. Реакційну суміш розбавляють водою і екстрагують ДХМ. Шар ДХМ сушать і очищають хроматографією (етилацетат), отримуючи зазначену сполуку (20,2мг, 21,6%). 1Н ЯМР (CDCI3), δ (1/млн.): 8,10 (s, 1H), 7,97 (m, 1Н), 7,48 (m, 4Н), 6,75 (d, 2Н), 5,09 (m, 1Н), 3,63 (s, 3Н), 3,48 (m, 1Н), 3,29 (m, 1Н), 3,02 (s, 3Н), 1,70-2,30 (m, 6H). Енантіомери відокремлюють, використовуючи колонку Chiralpak AD 4,6 Χ 250мм, з елюентом ІРrOН при витраті 2мл/хвил., і отримують енантіомер 1 як білу піну, 2,6мг, Rt 6,3 хвил., і енантіомер 2 як білу піну, 2,6мг, Rt 7,1хвил. Приклад 52 [4-(5-{2-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]піперидин-1-іл}-4-метил-4Н-[1,2,4]-триазол-3-іл)бензил]-диметиламін Метиловий естер 2-[2-(3-хлорфеніл)-2Нтетразол-5-іл]-N-метилпіперидин-1карбоксимідотіо-кислоти (49,9мг, 0,1422ммоль) змішують з гідразидом 4-диметиламінометилбензойної кислоти (30мг, 0,156ммоль) в етанолі (1,2мл) при 100°С протягом ночі. Реакційну суміш розбавляють етилацетатом, промивають водою (´3), очи щають хроматографією (2 ~ 3% 2 М метанольного амонію у хлороформі), отримуючи зазначену сполуку (9,2мг, 13,5%) як білувату тверду речовину. 1Н Я МР (CDCI3), δ (1/млн.): 8,09 (s, 1Н), 7,98 (m, 1Н), 7,60 (d, 2Н), 7,45 (m, 4Н), 5,11 (m, 1Н), 3,66 (s, 3Н), 3,48 (s plus m, 3H), 3,30 (m, 1H), 2,28 (s, 6H), 1,60-2,20 (m, 6H). Приклад 53 {2-[4-(5-{2-[2-(3-хлорфeніл)-2Н-тетразол-5-іл]піперидин-1-іл}-4-метил-4Н-[1,2,4]триазол-3-іл)фенокси]-етил}-диметиламін Метиловий естер 2-[2-(3-хлорсреніл)-2Нтетразол-5-іл]-N-метилпіперидин-1карбоксимідотіо-киспоти (85мг, 0,242ммоль) змішують з гідразидом 4-(2-диметиламіноетокси)бензойної кислоти (75,7мг, 0,339ммоль) в етанолі (1,2мл) при 100°С протягом ночі. Реакційну суміш розбавляють ДХМ, промивають водою (´3) і очищають хроматографією (2 ~ 3% 2М метанольного амонію в хлороформі), отримуючи зазначену сполуку (32мг, 26%) як жовте клейке масло. 1Н ЯМР (CDCI3), δ (1/млн.): 8,09 (s, 1H), 7,97 (m, 1H), 7,56 (d, 2H), 7,44 (m, 2Н), 7,01 (d, 2Н), 5,09 (m, 1Н), 4,11 (t, 2Н), 3,62 (в, 3Н), 3,65 (m, 1Н), 3,44 (m, 1Н), 2,76 (t, 2Н), 2,36 (s, 6Н), 1,60-2,30 (m, 6Н). Приклади 54а і 54b (R-3-[3-(3-хлорфеніл)-[1,2,4]оксадіазол-5-іл]-4(4-метил-5-піридин-4-іл-4Н-[1,2,4]триазол-3-іл)морфолін і (S)-3-[3-(3-хлорфеніл)-[1,2,4]оксадіазол-5-іл]-4(4-метил-5-піридин-4-іл-4Н-[1,2,4]триазол-3-іл)морфолін Ці два енантіомери ізолюють з рацемічного 3[3-(3-хлорфеніл)-[1,2,4]оксадіазол-5-іл]-4-(4-метил5-піридин-4-іл-4Н-[1,2,4]триазол-3-іл)-морфоліну, використовуючи хіральну колонку РХВР (Chiralpak AD) з гексан/ізопропанол (20:80); енантіомер 1 має час ретенції 7,5хвил., а енантіомер 2 має час ретенції 8,7хвил.. Приклади 55а і 55b 52 (R)-2-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]-1-{5[4-(дифлуорметокси)феніл]-4-метил-4Н-1,2,4триазол-3-іл}піперидин (S)-2-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]-1-{5[4-(дифлуорметокси)феніл]-4-метил-4Н-1,2,4триазол-3-іл}піперидин 2-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]-1-{5-[4(дифлуорметокси)феніл]-4-метил-4Н-1,2,4триазол-3-іл}піперидин розділяють на Chiralpak AD (4,6 Χ 250) з етанолом:ізопропанолом (1:1) при витраті 1,0мл/хвил., отримуючи два енантіомери: 13,3 мг (Rt=14,2хвил.) і 11,9 мг (Rt=18,7хвил). Приклади 56а і 56b (R)-4-(5-{2-[2-(3-хлорфеніл)-2Н-тетразол-5іл]піперидин-1-іл}-4-метил-4Н-1,2,4-триазол-3іл)піридин (S)-4-(5-{2-[2-(3-хлорфеніл)-2Н-тетразол-5іл]піперидин-1-іл}-4-метил-4Н-1,2,4-триазол-3іл)піридин Ці продукти розділяють на Chiralpak AD (4,6 Χ 250) з етанолом:ізопропанолом (1:1) при витраті 1,0мл/хвил. і отримують два енантіомери: 9,5 мг (Rt=11,6хвил) і 10,8мг (Rt=16,8хвил). Приклад 57 5-флуорнікотингідразид Гідразинмоногідрат 98% (4,9мл, 101,1ммоль) додають до розчину етил-5-флуор-нікотинату (1,71г, 10,1ммоль) в ЕtOН (35мл) під аргоном. Реакцію залишають перемішуватись при кімнатній температурі на 5год. Реакцію концентрують і перетирають з гексаном, отримуючи зазначену сполуку (світло-жовта тверда речовина, 1,462г, 93%). 1Н ЯМР CD3OD δ (1/млн.): 8,82 (а, 1Н), 8,65 (m, 1H), 8,01 (dm, 1H). Приклад 58 2-метилізонікотингідразид НОBt (950мг, 6,99ммоль) і ЕДКІ (1,34г, 6,99ммоль) додають до суспензії 2-хлор-6метилізонікотинової кислоти (1г, 5,83ммоль) в ацетонітрилі (15мл) при кімнатній температурі. Через 1год. краплями додають розчин гідразинмоногідрату (0,56мл, 11,66ммоль) і циклогексену (0,15мл, 1,5ммоль) в ацетонітрилі (5мл) при 0°С. Суміш перемішують протягом ночі і залишають нагрітись до кімнатної температури. Розчинник видаляють in vacuo і залишок розбавляють етилацетатом, промивають насиченим бікарбонатом натрію і розсолом, сушать над суль фатом натрію, фільтрують і концентрують, отримуючи 2-хлор-6-метилізонікотингідразид (жовта тверда речовина, 1,1г, використовують без очищення). Балон з гідрогеном приєднують до колби, яка містить 2-хлор-6метилпіридин-4-карбонову кислоту (1,12г, 6,03ммоль), паладій, 10% (за масою) на активованому карбоні (0,56г), триетиламін (3,4мл) і етанол (20мл) і потім перемішують протягом ночі при кімнатній температурі. Реакційну суміш фільтр ують через броунмілерит, промивають метанолом і концентрують. Залишок перетирають з ДХМ і потім фільтрують, отримуючи 2-метилізонікотингідразид (світло-жовта тверда речовина, сирий продукт використовують без очищення). Приклад 59 2-Метоксиізонікотингідразид 53 82434 HOBt (1,73г, 12,79ммоль), і ЕДКІ (2,45г, 12,79ммоль) додають до суспензії 2-хлор-6метоксиізонікотинової кислоти (2г, 10,66ммоль) в ацетонітрилі (25мл) при кімнатній температурі. Через 1год. краплями додають розчин гідразинмоногідрату (1,03мл, 21,32ммоль) і циклогексену (0,2мл, 2,0ммоль) в ацетонітрилі (5мл) при 0°С. Суміш перемішують протягом ночі і залишають нагрітись до кімнатної температури. Розчинник видаляють in vacuo і залишок розбавляють етилацетатом, промивають насиченим бікарбонатом натрію і розсолом, сушать над сульфатом натрію, фільтрують і концентрують, отримуючи 2-хлор-6метоксиізонікотингідразид (блідо-жовта тверда речовина, 2,03г, 95%). Балон з гідрогеном приєднують до колби, яка містить 2-хлор-6метилпіридин-4-карбонову кислоту (1,83г, 9,07ммоль), паладій 10% (за масою) на активованому карбоні (0,91г), триетиламін (5,5мл) і етанол (30мл) і потім перемішують протягом ночі при кімнатній температурі. Реакційну суміш фільтр ують через броунмілерит, промивають метанолом і концентрують. Залишок перетирають з ДХМ і потім фільтрують, о тримуючи 2метоксиізонікотингідразид (світло-жовта тверда речовина, сирий продукт використовують без очищення, сирий продукт використовують без очищення). Приклад 60 3-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]-Nметилморфолін-4-карботіоамід З перемішуванням до розчину 3-[2-(3хлорфеніл)-2Н-тетразол-5-іл]морфоліну (550мг, 2,07моль) у хлороформі (8мл) додають метилізотіоціанат (227мг, 3,1ммоль). Розчин перемішують при кімнатній температурі протягом ночі, концентрують і перетирають з діетилетером, отримуючи зазначену сполуку (біла тверда речовина, 608мг, 86,7%). 1Н ЯМР (300МГц, CDCI3) δ (1/млн.): 8,13 (s, 1H), 8,03 (dm, 1H), 7,5 (m, 2H), 6,69 (m, 1H), 6,04 (m, 1H), 4,58 (d, 1Н), 4,02 (m, 3Н), 3,74 (m, 2Н), 3,24 (d, 3Н). Приклад 61 Метил 3-[2-(3-хлорфеніл)-2Н-тетразол-5-іл]-Nметилморфолін-4-карбімідотіоат До розчину 3-[2-(3-хлорфеніл)-2Н-тетразол-5іл]-N-метилморфолін-4-карботіоаміду (608мг, 1,79ммоль) у метанолі (12мл) додають СН3І (224мкл, 3,59ммоль). Розчин нагрівають до флегми протягом 1,5год., потім охолоджують до кімнатної температури, розбавляють ДХМ і промивають NaHCO3 (водн.). Водну фазу екстрагують ДХМ і об'єднану органіку суша ть (Na2SO4), фільтр ують і концентрують під зниженим тиском, отримуючи зазначену сполуку згідно з розрахунком. 1Н ЯМР (300МГц, CDCI3) δ (1/млн.): 8,15 (s, 1H), 8,04 (dm, 1H), 7,48 (m, 2Н), 5,65 (t, 1Н), 4,45 (dd, 1Н), 4,03 (dd, 1H), 3,93 (dt, 1H), 3,79 (dm, 1H), 3,72 (td, 1H), 3,59 (tm, 1Н), 3,25 (s, 3Н), 2,38 (s, 3Н). Приклад 62 Трет-бутиловий естер 3-(Nгідроксикагбамімідоїл)-морфолін-4-карбонової кислоти Трет-бутиловий естер 3-ціаноморфолін-4карбонової кислоти (600мг, 2,83ммоль) у метанолі 54 (20мл) додають до розчину пдроксиламінгідрохлориду (982мг, 14,13ммоль) і карбонату натрію (1,498г, 14,19ммоль) в деіонізованій воді (20мл). Отриманий розчин нагрівають до флегми протягом ночі, потім охолоджують до кімнатної температури і метанол видаляють in vacuo. Продукт екстрагують двічі етилацетатом, потім ще раз після додання хлориду натрію до насичення водної фази. Розчинник видаляють in vacuo, отримуючи зазначену сполуку (клейка білувата тверда речовина, 466,8мг, 67%). 1Н ЯМР (300МГц, CDCI3) δ (1/млн.): 1,50 (s, 9Н); 3,23 (td, J=11Гц, 3Гц, 1Н); 3,55 (m, 2Н); 3,81 (m, 2Н); 4,58 (s, broad, 1Н); 4,92 (s, broad, 1Η). Приклад 63 Трет-бутиловий естер 3-[5-(3-хлорфеніл)[1,2,4]оксадіазол-3-іл]-морфолін-4-карбонової кислоти З перемішуванням до розчину трет-бутилового естеру 3-(N-гідроксикагбамімідоїл)-морфолін-4карбонової кислоти (300мг, 1,22ммоль), 3хлорбензойної кислоти (193,4мг, 1,24ммоль) і HOBt (181,8мг, 1,35ммоль) у ДМФ (4мл) додають ЕДКІ (236,8мг, 1,24ммоль). Розчин перемішують протягом ночі при кімнатній температурі, потім розбавляють ДХМ і промивають водою. Водну фазу екстрагують ДХМ і об'єднану органіку сушать (Na2SO4), фільтр ують і концентрують під зниженим тиском. Сирий інтермедіат фільтрують через силікагель з 10% метанолу у ДХМ для видалення залишків HOBt. Елюент концентрують під зниженим тиском, потім розчиняють у ДМФ (3мл) і нагрівають до 130°С протягом 90хвил. Видалення розчинника in vacuo дає зазначену сполуку (300мг, 67%). 1Н ЯМР (300МГц, CDCI3) δ (1/млн.): 1,51 (s, 9Н); 3,54 (m, 3Н); 3,89 (m, 2H); 4,51 (m, 2H); 7,47 (m, 1H); 7,58 (m, 1H); 8,02 (m, 2H). Приклад 64 3-[5-(3-хлорфеніл)-[1,2,4]оксадіазол-3-іл]морфолін Розчин трифлуороцтової кислоти (4мл) у ДХМ (2мл) додають до розчину трет-бутилового естеру 3-[5-(3-хлорфенілН1,2,4]оксадіазол-3-іл1морфолін-4-карбонової кислоти (прибл. 200мг) у ДХМ (2мл). Отриманий розчин перемішують при кімнатній температурі протягом 30 хвил, потім розбавляють ДХМ і невеликою кількістю води. Водну фазу нейтралізують твердим бікарбонатом натрію, потім додають деіонізовану воду і органічну фазу відокремлюють. Водну фазу екстрагують ДХМ і об'єднану органіку сушать, фільтрують і концентрують під зниженим тиском, отримуючи зазначену сполуку (144,9мг, згідно з розрахунком). 1 Н ЯМР (300МГц, СDCI3) δ (1/млн.): 3,10 (m, 2Н); 3,72 (m, 1Н); 3,85 (m, 2Н); 4,18 (dd, J=11Гц, 3Гц, 1Н); 4,27 (dd, J=8Гц, 3Гц, 1Н); 7,49 (t, J=8Гц, 1Н); 7,60 (m, 1Н); 8,04 (m, 2Н). Приклад 65 Метиламід 3-[5-(3-хлорфеніл)[1,2,4]оксадіазол-3-іл]-морфолін-4-карботіоікациду З перемішуванням до розчину 3-[5-(3хлорсреніл)-[1,2,4]оксадіазол-3-іл]-морфолін (184,8мг, 0,696моль) у хлороформі (5мл) додають метилізотіоціанат (54,7мкл, 0,800ммоль). Розчин перемішують при кімнатній температурі протягом ночі, розбавляють ДХМ і промивають водою. Вод 55 82434 ну фаз у екстрагують ДХМ і об'єднану органіку сушать (Na2SO4) фільтрують і концентрують під зниженим тиском. Сирий продукт хроматографують у 60% етилацетату у гексанах, отримуючи зазначену сполуку як білуваті кристали. 1Н ЯМР (300МГц, CDCI3) δ (1/млн.): 3,06 (d, J=4,2Гц, 3Н); 3,61 (квінтет d, J=12Гц, 3Гц, 2Н); 3,92 (m, 3Н); 4,51 (d, J=12Гц, 1Н); 6,51 (s, broad, 2H); 7,42 (t, J=7,5Гц, 1Н); 7,51 (m, 1H); 7,92 (m, 1H); 8,01 (m, 1Н). Приклад 66 Метиловий естер 3-[5-(3-хлорфеніл)[1,2,4]оксадіазол-3-iл]-N-метил-морфолін-4карбоксимідотіо-кислоти До розчину метиламіду 3-[5-(3-хлорфеніл)[1,2,4]оксадіазол-3-іл]-морфолін-4-карботіокиспоти (137,6мг, 0,41ммоль) у метанолі (3мл) додають СН 3І (50,6мкл, 0,82ммоль). Розчин нафівають до флегми протягом 1,5год., потім охолоджують до кімнатної температури, розбавляють ДХМ і промивають NaHCO3 (водн.) Водну фазу екстрагують ДХМ і об'єднану органіку сушать (Na2SO4), фільтрують і концентрують під зниженим тиском, отримуючи зазначену сполуку у кількості згідно з розрахунком. 1Н ЯМР (300МГц, CDCI3) δ (1/млн.): 2,34 (s, 3Н); 3,24 (s, 3Н); 3,61 (квінтет d, J=12Гц, 3,3Гц, 2Н); 3,80 (d, J=12Гц, 1Н); 3,91 (m, 2H); 4,40 (dd, J=12Гц, 2Гц, 1Н); 5,46 (s, broad, 1Н); 7,43 (t, J=8,1Гц, 1Н); 7,52 (m, 1Н); 7,96 (d, J=7,5Гц, 1Н);8,07(m, 1Н). Приклад 67 Трет-бутил 3-[3-(3-йодфеніл)-1,2,4-оксадіазол5-іл]морфолін-4-карбоксилат Ізобутилхлорформат (1,56мл, 12,0ммоль) додають до розчину 4-трет-бутилового естеру морфолін-3,4-дикарбонової кислоти (2,528г, 10,9ммоль) і триетиламіну (3,8мл, 27,3ммоль) у ТГФ (35мл) при 0°С і суміш перемішують протягом 2год.. Додають 3-йод-N-гідрокси-бензамідин (2,86г, 10,9ммоль), суміш перемішують 1год. при кімнатній температурі і розчинник видаляють in vacuo. Ациклічний естер (інтермедіат) використовують без очищення. Додають ДМФ (25мл) і суміш нафівають при 120°С протягом ночі. Продукт екстрагують етилацетатом і органічний шар промивають водою і розсолом, суша ть над безводним сульфатом натрію, фільтрують і концентрують in vacuo. Хроматофафія (силікагель, 10 - 20% етилацетату у гексані) дає зазначену сполуку (світложовте масло, 3,0403г, 61%, суміш ро-тамерів). 1Н ЯМР (CDCI3) (1/млн.): 8,44 (s, 1Н), 8,06 (d, 1Н), 7,85 (d, 1Н), 7,23 (t, 1Н), 5,41 (Ьг s, 0,5Н), 5,24 (br s, 0,5Н), 4,52 (br s, 1Н), 3,9 (m, 3Н), 3,6 (t, 1Н), 3,49 (m, 1Н), 1,53 (s, 4,5Н), 1,46 (s, 4,5Н). Приклад 68 3-[3-(3-йодфеніл)-1,2,4-оксадіазол-5іл]морфолін Розчин трифлуороцтової кислоти (9,6мл) in ДХМ (25мл) додають до розчину трет-бутил 3-[3(3-йодфеніл)-1,2,4-оксадіазол-5-іл]морфолін-4карбоксилату (3,04г, 6,05ммоль) у ДХМ (30мл), суміш перемішують при кімнатній температурі протягом ночі і концентрують до сухості. Залишок розчиняють в етилацетаті і промивають гідроксидом натрію (1N водн, 15мл). Органічну фазу промивають розсолом, сушать (сульфа т натрію), фі 56 льтрують і концентрують in vacuo. Хроматографія (силікагель, 5% 2М метанольного амонію у ДХМ) дає зазначену сполуку (жовте масло, 2,1599г, 91%). 1Н ЯМР (CDCI3), δ (1/млн.): 8,48 (s, 1H), 8,08 (d, 1Н), 7,86 (d, 1H), 7,24 (t, 1H), 4,34 (m, 1H), 4,2 (d, 1H), 3,86-3,99 (m, 2H), 3,74 (t, 1H), 3,18 (d, 1H), 3,05 (t, 1H). 3-[3-(3-йодфеніл)-1,2,4-oксадіазол-5-іл]-Nметилморфолін-4-карботіоамід Метилізотіоціанат (575мг, 7,86ммоль) додають до 3-[3-(3-йодфеніл)-1,2,4-оксадіазол-5іл]морфоліну (2,16г, 6,05ммоль) у СНСІ3 (50мл), отриману суміш перемішують при 60°С протягом 7год. і залишають при кімнатній температурі на добу Суміш концентрують in vacuo і залишок перетирають з діетилетером у гексанах, ізолюючи зазначену сполуку (жовте масло, 2,6г, 100%). 1Н ЯМР (CDCI3), δ (1/млн.): 8,38 (s, 1H), 8,02 (d, 1H), 7,83 (d, 1H), 7,2 (t, 1Н), 6,86 (m, 1Н), 6,18 (m, 1Н), 4,56 (d, 1Н), 3,99 (m, 2Н), 3,78 (t, 2Н), 3,63 (m, 1Н), 3,03 (d, 3Н). Приклад 70 Метил 3-[3-{3-йодфеніл)-1,2,4-оксад1азол-5iл]-N-метилморфолін-4-карбімідотіоат Йодметан (0,11мл, 1,74ммоль) додають до 3[3-(3-йодфеніл)-1,2,4-оксадіазол-5-іп]-Nметилморфолін-4-карботіоаміду (465мг, 1,08ммоль) у метанолі (5мл) і отриману суміш перемішують при 75°С протягом 4год. Суміш охолоджують до кімнатної температури, концентрують in vacuo, розбавляють насиченим бікарбонатом натрію (водн.) і екстрагують ДХМ. Об'єднані органічні фази сушать (сульфат натрію), фільтрують і концентрують in vacuo, отримуючи зазначену сполуку у вигляді жовтого масла (460мг, 96%). 1Н ЯМР (CDCI3), δ (1/млн.): 7,44 (s, 1H), 8,05 (d, 1H), 7,84 (d, 1H), 7,22 (t, 1H), 5,46 (m, 1H), 4,36 (dm, 1H), 3,96 (m, 2Н), 3,65-3,86 (m, 3Н), 3,22 (s, 3Н), 2,37 (s, 3Н). Приклад 71 Трет-бутиловий естер 2-[5-(3-хлорфеніл)ізоксазол-3-iл]-піролідин-1-карбонової кислоти Розчин трет-бутилового естер у 2формілпіролідин-1-карбонової кислоти (4,2г, 21,1ммоль) [від PharmaCore, Inc., 4180 Mendenhall Oaks Parkway, Suite 160, High Point, NC 27265, USA або синтезованого за процедурою Beak et. al. J. Org. Chem. 1993, 58,1109] у сухому піридині (8мл) додають до льодяного розчину гідроксиламінгідрохлориду (1,90г, 27,4ммоль) у сухому піридині (25мл). Розчин перемішують при кімнатній температурі протягом ночі. Додають воду (500мл) і розчин екстрагують ДХМ (3´200мл). Об'єднані органічні шари промивають розсолом, сушать (сульфат натрію), фільтрують і концентрують in vacuo. Залишок розчиняють у сухому ДМФ (50мл) і нагрівають до 40°С. Додають розчин N-хлорсукциніміду (3,10г, 23,2ммоль) у сухому ДМФ (30мл) і реакцію перемішують при 40°С протягом 1,5год. і потім при кімнатній температурі протягом ночі. Додають ще 844 мг (6,3ммоль) N-хлорсукциніміду і реакцію перемішують при 40°С протягом 1,5год. Реакційну суміш залишають охолонути, розбавляють діетилетером (500мл) і промивають водою (3´300мл) і потім розсолом (100мл). Органічний шар сушать (сульфат натрію), фільтрують і концентрують in 57 82434 vacuo. Залишок розчиняють у сухому ДХМ (30мл) і додають до льодяного розчину 1-хлор-Зетинілбензолу і триетиламіну у сухому ДХМ (25мл). Реакцію перемішують протягом ночі при кімнатній температурі і розчинник видаляють in vacuo. Залишок розчиняють в етилацетаті (300мл) і промивають водою (3x100мл) і розсолом (100мл). Органічний шар сушать (сульфат натрію), фільтрують і концентрують in vacuo. Залишок очищають флеш-хроматографією (гептан:етилацетат 8:14:1), отримуючи зазначену сполуку (3,48г, 48%) у вигляді масла, яке з часом твердіє. 1Н ЯМР (400МГц, CDCI3, ротамери) δ (1/млн.): 1,10-1,69 (m, 9Н); 1,71-2,44 (m, 4Н); 3,34-3,68 (m, 2Н); 4,90-5,10 (m, 1H); 6,40-6,55 (m, 1H); 7,37 (bs, 2H); 7,67 (m, 1H); 7,72 (bs, 1H). Приклад 72 5-(3-хлорфеніл)-3-піролідин-2-іл-ізоксазол Трет-бутиловий естер 2-[5-(3-хлорфеніл)ізоксазол-3-іл]-піролідин-1-карбонової кислоти (3,45г, 9,9ммоль) розчиняють у ДХМ (15мл) і додають трифлуороцтову кислоту (15мл). Розчин перемішують при кімнатній температурі протягом 1год. і потім концентрують in vacuo. Залишок розчиняють у ДХМ (200мл) і промивають 1М водним NaOH (200мл). Водний шар екстрагують ДХМ (2´100мл) і об'єднані органічні шари промивають водою (100мл) і розсолом (100мл), сушать (сульфат натрію), фільтрують і концентрують in vacuo, отримуючи зазначену сполуку (2,12г, 86 %). 1Н ЯМР (400МГц, CDCI3) δ (1/млн.): 1,88 (m, 3Н); 2,1 (s, 1Н); 3,62 (m, 1Н); 3,12 (m, 1Н); 4,32 (dd, 1Н); 6,51 (s, 1Н); 7,35 (m, 1Н); 7,61 (m, 1Н); 7,72 (s, 1Н). Приклад 73 Метиламід 2-[5-(3-хлорфеніл)-ізоксазол-3-іл]піролідин-1-карботіо-кислоти Метилізотіоціанат (329мг, 4,5ммоль) додають до 5-(3-хлорфеніл)-3-піролідин-2-іл-ізоксазолу (746мг, 3,0ммоль) у сухому ДХМ (20мл) при кімнатній температурі. Реакцію перемішують протягом ночі і концентрують in vacuo. Залишок очищають флеш-хроматографією з градієнтом 20 - 80% етилацетату у гептані, отримуючи зазначену сполуку (580мг, 60%). 1Н ЯМР (400МГц, CDCI3) δ (1/млн.): 2,21 (m, 3Н); 2,37 (m, 1Н); 3,11 (d, 3Н); 3,79 (m, 2H); 5,53 (bs, 1H); 6,57 (s, 1H); 7,39 (m, 1H), 7,68 (m, 1H); 7,73 (m, 1H). Приклад 74 Циклопропіламід 2-[5-(3-хлорфеніл)-ізоксазол3-іл]-піролідин-1-карботіо-кислоти Циклопропілізотіоціанат (446мг, 4,5ммоль) додають до 5-(3-хлорфеніл)-3-піролідин-2-ілізоксазолу (746мг, 3,0ммоль) у сухому ДХМ (20мл) при кімнатній температурі. Реакцію перемішують протягом ночі і концентрують in vacuo. Залишок очищають фле ш-хроматографією з градієнтом 2080% етилацетату у гептані, отримуючи зазначену сполуку (585мг, 56%). 1Н ЯМР (400МГц, CDCI3) δ (1/млн.): 0,55 (m, 2Н); 0,83 (m, 2Н); 2,20 (m, 3Н); 2,39 (m, 1H); 3,03 (m, 1H); 3,80 (m, 2H); 5,45 (bs, 1H); 5,87 (bs, 1H); 6,65 (bs, 1H); 7,40 (m, 2H); 7,64 (m,1H);7,75 (bs, 1H). Приклад 75 Метиловий естер 2-[5-(3-хлорфеніл)-ізоксазол3-іл]-N-метилпіролідин-1-карбоксимідотіо-кислоти 58 Суспензію метиламіду 2-[5-(3-хлорфеніл)ізоксазол-3-іл]-піролідин-1-карботіо-кислоти (520мг, 1,61ммоль) і метилйодиду (344мг, 2,42ммоль) у сухому метанолі (10мл) нагрівають одновузловим мікрохвильовим опромінюванням у герметичному резервуарі при 110°С протягом 15хвил. Після охолодження отриманий розчин розбавляють насиченим водним бікарбонатом натрію (50мл) і екстрагують ДХМ (3´70мл). Об'єднані органічні шари промивають розсолом, сушать (сульфат натрію), фільтрують і концентрують in vacuo, отримуючи зазначену сполуку у вигляді масла (533мг, 98%). 1 Н ЯМР (400МГц, CDCI3) δ (1/млн.): 2,00 (m, 3Н); 2,12 (m, 1Н); 2,26 (s, 3Н); 3,23 (s, 3Н); 3,63 (m, 1H); 3,71 (m, 1H); 5,39 (m, 1H); 6,39 (s, 1H); 7,37 (m, 2H); 7,63 (m, 1H); 7,72 (bs, 1H). Приклад 76 a) Метиловий естер 2-[5-{3-хлорфеніл)iзоксазол-3-іл]-N-циклопропілпіролідин-1карбоксимідотіо-кислоти Суспензію циклопропіламіду 2-[5-(3хлорфеніл)-ізоксазол-3-іл]-піролідин-1-карботіокислоти (546мг, 1,57ммоль) і метилйодиду (335мг, 2,36ммоль) у сухому метанолі (10мл) нагрівають одновузловим мікрохвильовим опромінюванням у герметичному резервуарі при 75°С протягом 2год. Після охолодження отриманий розчин розбавляють насиченим водним бікарбонатом натрію (40мл) і екстрагують ДХМ (3´50мл). Об'єднані органічні шари промивають розсолом, сушать (сульфат натрію), фільтрують і концентрують in vacuo, отримуючи зазначену сполуку у вигляді масла (563мг, 99%). 1Н ЯМР (400МГц, CDCI3) δ (1/млн.): 0,51 (m, 1Н); 0,60 (m, 1Н); 0,69 (m, 2Н); 1,96 (m, 2Н); 2,12 (m, 1Н); 2,29 (m, 1Н); 2,33 (m, 3Н); 3,10 (m, 1H); 3,59 (m, 1H); 3,66 (m, 1H); 5,28 (m, 1H); 6,37 (s, 1H); 7,35 (m, 2H); 7,61 (m, 1H); 7,70 (bs, 1H). Наступні сполуки приготовляють у такий же спосіб: b) 4-[5-(5-{2-[5-{3-хлорфеніл)-ізоксазол-3-іл]піролідин-1-іл}-4-циіслопропіл-4Н-[1,2,4]триазол-3іл)-піридин-2-іл]-морфолін; вихід 24мг, 23%, білувата тверда речовина; 1Н ЯМР CDCI3 (500МГц): 8,54 (d, 1H), 7,92 (dd, 1H), 7,70 (s, 1H), 7,59 (m, 1H), 7,38 (m, 2H), 6,67 (d, 1H), 6,50 (s, 1H), 5,54 (dd, 1H), 4,06 (ddd, 1H), 3,83 (m, 4H), 3,61 (m, 1H), 3,58 (m, 4H), 3,21 (m, 1Н), 2,54 (m, 1Н), 2,29 (m, 1Н), 2,21 (m, 1Н), 2,14 (m, 1Η), 1,11 (m, 2H), 0,99 (m, 1H), 0,52 (m, 1Η) c) 4-[5-(5-{2-[5-(3-хлорфеніл)-ізоксазол-3-іл]піролідин-1-іл}-4-метил-4Н-[1,2,4]триазол-3-іл)піридин-2-іл]-морфолін; вихід 41мг, 34%, світложовта тверда речовина; 1Н ЯМР CDCI3 (500МГц): 8,38 (d, 1H), 7,81 (dd, 1H), 7,72 (s, 1H), 7,61 (m, 1H), 7,37 (m, 2Н), 6,70 (d, 1Н), 6,59 (s, 1Н), 5,41 (t, 1Н), 3,87 (m, 1Н), 3,83 (m, 4Н), 3,59 (m, 4Н), 3,52 (m, 4Н), 2,55 (m, 1Н), 2,30 (m, 1Н), 2,19 (m, 2Н). d) 3-(5-{2-[5-(3-хлорфеніл)-ізоксазол-3-іл]піролідин-1-іл}-4-метил-4Н-[1,2,4]триазол-3-іл)піридин; вихід 72мг, 64%, білувата тверда речовина; 1Н ЯМР CDCI3 (500МГц): 8,84 (d, 1Н), 8,68 (dd, 1Н), 8,01 (dt, 1H), 7,71 (m 1H), 7,61 (m, 1H), 7,42 (dd, 1H), 7,37 (m, 2Н), 6,54 (s, 1Н), 5,42 (dd, 1Н), 59 82434 3,90 (dt, 1Н), 3,57 (s, 3Н), 3,54 (ddd, 1H), 2,56 (dddd, 1H), 2,24 (m, 3H) e) 4-(5-{2-[5-(3-хлорфеніл)-ізоксазол-3-іл]піролідин-1-іл}-4-циклопропіл-4Н-[1,2,4]триазол-3іл)-піридин; вихід 75мг, 68%, білувата тверда речовина; 1Н ЯМР CDCI3 (500МГц): 8,69 (dd, 2Н), 7,70 (m, 3Н), 7,59 (m, 1H), 7,36 (m, 2H), 6,52 (s, 1H), 5,58 (dd, 1H), 4,11 (dt, 1Н), 3,66 (m, 1Н), 3,32 (m, 1Н), 2,57 (m, 1Н), 2,26 (m, 3Н), 2,16 (m, 1H), 1,15 (m, 2H), 1,00 (m, 1H), 0,47 (m, 1H). Приклад 77 4-(5-{2-[5-(3-хлорфеніл)ізоксазол-3іл]піролідин-1-іл}-4-метил-4Н-1,2,4-триазол-3іл)піридин Суспензію метилового естеру 2-[5-(3хлорфеніл)-ізоксазол-3-іл]-N-метил-піролідин-1карбоксимідотіо-кислоти (61мг, 0,18ммоль), гідразиду ізонікотинової кислоти (43,2мг, 0,32ммоль) і піридину (18мг, 0,23ммоль) в етанолі (3мл) нагрівають одновузловим мікрохвильовим опромінюванням у герметичній колбі при 130°С. Після охолодження розчинник випарюють і залишок очищають зворотно-фазовою РХВР, з лінійним градієнтом ацетонітрилу у 0,15%-й водній трифлуороцтовій кислоті. Друге очищення зворотнофазовою РХВР з лінійним градієнтом ацетонітрилу у 0,1 Μ водному ацетаті амонію після сушіння виморожуванням дає зазначену сполуку (18,5мг, 25%) як білу тверду речовину. 1Н ЯМР CDCI3 (500МГц) δ (1/млн.): 8,71 (d, 2Н), 7,69 (s, 1Н), 7,58 (m, 3Н), 7,36 (m, 2H), 6,53 (s, 1H), 5,42 (dd, 1H), 3,91 (dt, 1Н), 3,60 (s, 3Н), 3,54 (ddd, 1Н), 2,56 (m, 1Н), 2,23 (m, 3Н). Приклад 78 3-{5-{2-[5-(3-хлорфеніл)ізоксазол-3іл]піролідин-1-іл}-4-циклопропіл-4Н-1,2,4-триазол3-іл)піридин Суспензію метилового естеру 2-[5-(3хлорфеніл)-ізоксазол-3-іл]-Nциклопропілпіролiдин-1-карбоксимідотіо-кислоти (76мг, 0,21ммоль), гідразиду нікотинової кислоти (43,2мг, 0,32ммоль) і піридину (18мг, 0,23ммоль) у 2,5мл 2-пропанолу нагрівають одновузловим мікрохвильовим опромінюванням у герметичній колбі при 150°С. Після охолодження розчинник випарюють і залишок очищають зворотно-фазовою РХВР з лінійним градієнтом ацетонітрилу у 0,1Μ водному ацетаті амонію, отримуючи зазначену сполуку (50,3мг, 55%) як білувату тверду речовину після сушіння виморожуванням. 1Н ЯМР CDCI3 (500МГц) (1/млн.): 9,00 (d, 1H), 8,65 (dd, 1H), 8,13 (dt, 1H), 7,71 (m, 1H), 7,60 (m, 1H), 7,38 (m, 3Н), 6,53 (s, 1Н), 5,58 (dd, 1Н), 4,11 (dt, 1Н), 3,65 (ddd, 1H), 3,31 (m, 1H), 2,56 (m, 1H), 2,26 (m, 2Н), 2,16 (m, 1H), 1,14 (m, 2H), 0,98 (m, 1H), 0,44 (m, 1H). Приклад 79 a) 3-[2-(3-хлорфеніл)-2Н-тетразоп-5-іл]-4-(4метил-5-піридин-4-іл-4Н-1,2,4-триазол-3іл)морфолін Гідразид ізонікотинової кислоти (155,5мг, 1,13ммоль) додають до метил 3-[2-(3-хлорфеніл)2Н-тетразол-5-іл]-N-метилморфолін-4карбімідотіоату (200мг, 0,567ммоль) в ізопропанолі (4мл). Суміш перемішують при 85-95°С протягом ночі, і потім розбавляють ДХМ (8мл). Органічну 60 фазу промивають водою і потім розсолом, сушать, фільтрують і концентрують in vacuo. Перетирання з діетилетером дає зазначену сполуку (біла тверда речовина, 212мг, 88%). 1Н ЯМР (СDCI3), δ (1/млн.): 8,76 (d, 2H), 8,1 (s, 1H), 7,99 (m, 1H), 7,62 (m, 2Н), 7,48 (m, 2Н), 5,2 (dd, 1Н), 4,32 (dd, 1Н), 4,12 (m, 2Н), 4,03 (m, 1Н), 3,77 (s, 3Н), 3,6 (m, 1Н), 3,42 (m,1Н). Наступні сполуки приготовляють у такий же спосіб: b) 3-[2-(3-хлорфенiл)-2Н-тетразол-5-іл]-4-(4метил-5-піридин-3-іл-4Н-1,2,4-триазол-3іл)морфолін; вихід 89,3мг, 87,4% біла тверда речовина; 1Н ЯМР (CDCI3), δ (1/млн.): 8,89 (s, 1Н), 8,73 (d, 1Н), 8,11 (m, 1Н), 8,03 (m, 2Н), 7,47 (m, 3Н), 5,2 (dd, 1H), 4,33 (dd, 1H), 4,12 (m, 2Н), 4,04 (m, 1Н), 3,74 (s, 3Н), 3,59 (m, 1Н), 3,46 (m, 1Н). c) 3-[2-(3-хлорфенiл)-2Н-тетразол-5-іл]-4-[5(3,5-дифлуор феніл)-4-метил-4Н-1,2,4-триазол-3іл]морфолін; вихід 78,9мг, 71,4% біла тверда речовина; 1Н ЯМР (CDCI3), δ (1/млн.): 8,1 (s, 1Н), 7,99 (m, 1Н), 7,48 (m, 2Н), 7,23 (m, 2Н), 6,94 (tm, 1H), 5,18 (dd, 1H), 4,32 (dd, 1Н), 4,11 (m, 2Н), 4,02 (m, 1Н), 3,73 (s, 3Н), 3,57 (dm, 1Н), 3,41 (m, 1Н). Фармакологія Фармакологічні якості сполук винаходу можуть бути аналізовані стандартними аналізами на функціональну активність. Приклади аналізів рецептора глютамату є добре відомими і описані, [наприклад, у Aramori et al., Neuron 8:757 (1992), Tanabe et al., Neuron 8:169 (1992), Miller et al., J. Neuroscience 15: 6103 (1995), Balazs, et al., J. Neuro-chemy 69:151 (1997)]. Методологія цих публікацій включена в даний опис посиланням. Сполуки винаходу можуть бути вивчені засобами аналізу з вимірюванням мобілізації внутрішньоклітинного кальцію [Са2+]і у клітинах, що експресують mgluR5. Протягом аналізу ФМВПЗ клітини, що експресують mgluR5d людини, як це описано у [WO97/05252], були посіяні у покритих колагеном 96-коміркових планшетах з прозорим дном і чорними боками, і через 24год. після цього був проведений аналіз на мобілізацію [Са2+]i. Експерименти ФМВПЗ виконували, використовуючи лазер на 0,800Вт з швидкістю затвора камери 0,4сек. Кожний експеримент ФМВПЗ починали з 160мкл буфера у кожній комірці планшету. Після кожного додання сполуки, флуоресцентний сигнал виміряли 50 разів з інтервалом 1сек. і потім 3 рази з інтервалом 5сек. Реакцію виміряли як пік реакції у періоді вимірювання. ЕК50 і ІК 50 визначали з даних на кривих залежності від концентрації (КЗК), побудованих двічі. Дані для агоніста отримували масштабуванням КЗК для всіх реакцій відносно максимальної реакції у планшеті. Антагоністичне блокування дії агоніста нормалізували відносно середньої реакції на дію агоніста у 14 контрольних комірках того ж планшету. Вторинний функціональний аналіз для mgluR5d був проведений, як описано у [WO97/05252], базуючись на кругообігу інозітолфосфа ту (ІФ 3). Накопичення ІР3 виміряють і розглядають як показник кругообігу фосфоліпази С,
ДивитисяДодаткова інформація
Назва патенту англійськоюPolyheterocyclic compounds and their use as metabotropic glutamate receptor antagonists, pharmaceutical composition based thereon
Автори англійськоюArora Jalaj, Edwards Louise, ISAAC METHVIN, Kers, Annika, KERS ANNIKA, Staaf Karin, Slassi Abdelmalik, Stefanac Tomislav, Wensbo David, Xin Tao, Holm Bjoern
Назва патенту російськоюПолигетероциклические соединения и их применение как антагонистов метаботропного рецептора глютаматау, фармацевтическая композиция на их основе
Автори російськоюАрора Джалай, Эдвардс Луиз, Айзек Метвин, Керс Анника, Стааф Карин, Слесси Абдельмалик, Стефанак Томислав, Венсбо Дейвид, Синь Тао, Гольм Бьёрн
МПК / Мітки
МПК: A61K 31/5377, C07D 401/14, A61P 25/00, A61K 31/4545, A61K 31/496, C07D 413/14
Мітки: метаботропного, основі, фармацевтична, полігетероциклічні, застосування, сполуки, рецептора, антагоністів, композиція, глютамату
Код посилання
<a href="https://ua.patents.su/32-82434-poligeterociklichni-spoluki-i-kh-zastosuvannya-yak-antagonistiv-metabotropnogo-receptora-glyutamatu-farmacevtichna-kompoziciya-na-kh-osnovi.html" target="_blank" rel="follow" title="База патентів України">Полігетероциклічні сполуки і їх застосування як антагоністів метаботропного рецептора глютамату, фармацевтична композиція на їх основі</a>
Попередній патент: Спосіб формування відбитків індивідуальних ортопедичних устілок та пристрій для його здійснення
Наступний патент: Конденсовані гетероциклічні сполуки та їх застосування як метаботропних антагоністів рецепторів глутамату, фармацевтична композиція на їх основі
Випадковий патент: Установка для електрогідравлічного штампування з диференційованим нагрівом