Швидко дисоціюючі антагоністи рецептора 2 дофаміну
Номер патенту: 97826
Опубліковано: 26.03.2012
Автори: МакДональд Грегор Джеймс, ван Гоол Мішель Люк Марія, Ланглуа Ксав'є Жан Мішель, Бартоломе-Небреда Хосе Мануель
Формула / Реферат
1. Сполука формули (І)
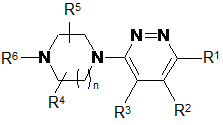 (І)
(І)
або її стереоізомерна форма, де
R1 являє собою хлор, трифторметил або ціано;
R2 являє собою феніл; феніл, заміщений 1, 2 або 3 замісниками, кожен з яких незалежно вибраний з групи, що включає галоген, ціано, С1-4алкіл, С1-4алкілокси, С1-4алкілсульфоніл; перфторС1-4алкіл, перфторС1-4алкілокси; діС1-4алкіламіно, гідроксил та феніл, необов'язково заміщений 1, 2 або 3 замісниками, кожен з яких незалежно вибраний з групи, що включає галоген, С1-4алкіл і перфторС1-4алкіл; тієніл; тієніл, заміщений 1 або 2 замісниками, кожен з яких незалежно вибраний з групи, що включає галоген і С1-4алкіл; нафтил; піридиніл; піроліл; бензотіазоліл; індоліл; хінолініл; С3-8циклоалкіл або С5-7диклоалкеніл;
R3 являє собою водень, С1-4алкіл, С1-4алкілокси або галоген;
кожен з R4 та R5 незалежно являє собою водень або С1-4алкіл, або ж R4 та R5 спільно утворюють С1-4алкандіїл;
n дорівнює 1 або 2; та
R6 являє собою водень, С1-4алкіл, гідроксіС2-4алкіл, С3-6циклоалкіл, С3-6циклоалкілС1-4алкіл, піридинілметил або фенілметил, необов'язково заміщений по фенільному ядру 1, 2 або 3 замісниками, кожен з яких незалежно вибраний з групи, що включає галоген, ціано, С1-4алкіл, С1-4алкілокси, С1-4алкілсульфоніл, перфторС1-4алкіл, перфторС1-4алкілокси і діС1-4алкіламіно; або ж R5 та R6 спільно утворюють С2-5алкандіїл;
або її фармацевтично прийнятна сіль чи сольват.
2. Сполука за п. 1, де
R1 являє собою хлор, трифторметил або ціано;
R2 являє собою феніл; феніл, заміщений 1, 2 або 3 замісниками, кожен з яких незалежно вибраний з групи, що включає галоген, ціано, С1-4алкіл, С1-4алкілокси, С1-4алкілсульфоніл, перфторС1-4алкіл, перфторС1-4алкілокси; діС1-4алкіламіно, гідроксил та феніл, заміщений 1, 2 або 3 замісниками, кожен з яких незалежно вибраний з групи, що включає галоген, С1-4алкіл і перфторС1-4алкіл; тієніл; тієніл, заміщений 1 або 2 замісниками, кожен з яких незалежно вибраний з групи, що включає галоген і С1-4алкіл;
нафтил; піридиніл; піроліл; бензотіазоліл; індоліл; хінолініл; С3-8циклоалкіл або С5-7циклоалкеніл;
R3 являє собою водень, С1-4алкіл або галоген;
кожен з R4 та R5 незалежно являє собою водень або С1-4алкіл, або ж R4 та R5 спільно утворюють С1-4алкандіїл;
n дорівнює 1 або 2; та
R6 являє собою водень, С1-4алкіл, гідроксіС1-4алкіл, С3-6циклоалкіл, С3-6циклоалкілС1-4алкіл або фенілметил, заміщений по фенільному ядру 1, 2 або 3 замісниками, кожен з яких незалежно вибраний з групи, що включає галоген, ціано, С1-4алкіл, С1-4алкілокси, С1-4алкілсульфоніл, перфторС1-4алкіл, перфторС1-4алкілокси і діС1-4алкіламіно; або ж R5 та R6 спільно утворюють С2-5алкандіїл;
або її фармацевтично прийнятна сіль чи сольват.
3. Сполука за п. 1, де
R1 являє собою трифторметил або ціано;
R2 являє собою феніл; феніл, заміщений 1, 2 або 3 замісниками, кожен з яких незалежно вибраний з групи, що включає галоген, ціано, С1-4алкіл, С1-4алкілокси, С1-4алкілсульфоніл, перфторС1-4алкіл, діС1-4алкіламіно, гідроксил і феніл, заміщений 1, 2 або 3 замісниками, кожен з яких незалежно вибраний з групи, що включає галоген, С1-4алкіл і перфторС1-4алкіл; тієніл; тієніл, заміщений 1 або 2 замісниками, кожен з яких незалежно вибраний з групи, що включає галоген і С1-4алкіл; нафтил; піридиніл; піроліл; бензотіазоліл; індоліл; хінолініл; С3-8циклоалкіл або С5-7циклоалкеніл;
R3 являє собою водень;
кожен з R4 та R5 незалежно являє собою водень або С1-6алкіл;
n дорівнює 1;
R6 являє собою водень, метил, етил, циклопропіл або фенілметил, заміщений по фенільному ядру 1, 2 або 3 замісниками, кожен з яких незалежно вибраний з групи, що включає галоген, ціано, С1-4алкіл, С1-4алкілокси, С1-4алкілсульфоніл, перфторС1-4алкіл і діС1-4алкіламіно; або ж R5 та R6 спільно утворюють С2-5алкандіїл;
або її фармацевтично прийнятна сіль чи сольват.
4. Сполука за п.1, де
R1 являє собою трифторметил;
R2 являє собою феніл; феніл, заміщений 1, 2 або 3 замісниками, кожен з яких незалежно вибраний з групи, що включає галоген, ціано, С1-4алкіл, С1-4алкілокси, С1-4алкілсульфоніл, перфторС1-4алкіл, діС1-4алкіламіно, гідроксил та феніл, заміщений 1, 2 або 3 замісниками, кожен з яких незалежно вибраний з групи, що включає галоген, С1-4алкіл і перфторС1-4алкіл; тієніл; тієніл, заміщений 1 або 2 замісниками, кожен з яких незалежно вибраний з групи, що включає галоген і С1-4алкіл; нафтил; піридиніл; піроліл; бензотіазоліл; індоліл; хінолініл; С3-8циклоалкіл або С5-7циклоалкеніл;
R3 являє собою водень;
кожен із замісників R4 та R5 незалежно являє собою водень або метил;
n дорівнює 1;
R6 являє собою водень, етил або (3,5-дифторфеніл)метил; або
R5 тa R6 спільно утворюють 1,3-пропандіїл;
або її фармацевтично прийнятна сіль чи сольват.
5. Сполука за п. 1, де сполука являє собою 4-феніл-6-піперазин-1-іл-3-трифторметилпіридазин.
6. Сполука за п. 1, де сполука являє собою моногідрохлорид 4-феніл-6-піперазин-1-іл-3-трифторметилпіридазин.
7. Фармацевтична композиція, що містить терапевтично ефективну кількість сполуки за п. 1 та один або більше фармацевтично прийнятних носіїв.
8. Сполука за п. 1 для застосування як лікарського засобу.
9. Сполука за п. 8 для застосування як антипсихотичного засобу.
10. Сполука за п. 8 для застосування як лікарського засобу при запобіганні або лікуванні шизофренії, шизофреніформного розладу, шизоафективного розладу, маревного розладу, короткочасного психотичного розладу, розділеного психотичного розладу, психотичного розладу, викликаного загальним станом здоров'я, психотичного розладу, викликаного тією або іншою речовиною, психотичного розладу, що не належить до перерахованих вище; психозу, пов'язаного з деменцією; великого депресивного розладу, дистимічного розладу, передменструального дисфорічного розладу, депресивного розладу, що не належить до перерахованих вище, біполярного розладу І, біполярного розладу II, циклотимічного розладу, біполярного розладу, що не належить до перерахованих вище, афективного розладу, викликаного загальним станом здоров'я, афективного розладу, викликаного тією або іншою речовиною, афективного розладу, що не належить до перерахованих вище; генералізованого тривожного розладу, обсесивно-компульсивного розладу, панічного розладу, гострого стресового розладу, посттравматичного стресового розладу; затримки розумового розвитку; загального розладу психічного розвитку; розладів дефіциту уваги, розладу дефіцит уваги/гіперактивність, розладу дезорганізації поведінки; розладу особистості параноїдального типу, розладу особистості шизоїдного типу, розладу особистості шизотипічного типу; тикового розладу, синдрому Туретта; залежності від речовин; неправильного вживання речовин;
утримання від вживання тих або інших речовин; трихотиломанії; а також станів, при яких порушена пізнавальна здатність; хвороби Альцгеймера, хвороби Паркінсона, хвороби Хантінгтона, деменції з тільцями Леві, деменції внаслідок ВІЛ-захворювання, деменції внаслідок хвороби Крейтцфельдта-Якоба; амнестичних розладів; помірного когнітивного розладу і вікового зниження пізнавальної здатності; а також розладів, пов'язаних з харчуванням, таких як анорексія і булімія; а також ожиріння.
Текст
Реферат: Винахід стосується 4-арил-6-піперазин-1-іл-3-заміщених піридазинів, які є швидко дисоціюючими антагоністами рецептора 2 дофаміну, способу одержання цих сполук, фармацевтичних композицій, що включають ці сполуки як активний інгредієнт. Описані сполуки можуть застосовуватися як лікарські засоби, призначені для лікування або запобігання розладам центральної нервової системи, наприклад шизофренії, завдяки тому, що вони проявляють антипсихотичну дію без побічних моторних ефектів. UA 97826 C2 (12) UA 97826 C2 UA 97826 C2 5 10 15 20 25 30 35 40 45 50 55 60 Область техніки, до якої належить винахід Даний винахід відноситься до 4-арил-6-піперазин-1-іл-3-замещених піридазинів, які є швидко дисоціюючими антагоністами рецептора 2 дофамину, способу одержання цих сполук, фармацевтичних композицій, що включають ці сполуки як активний інгредієнт. Ці сполуки можуть застосуватися у якості лікарських засобів, призначених для лікування або запобігання розладів центральної нервової системи, наприклад, шизофренії, завдяки тому, що вони проявляють антипсихотичну дію без побічних моторних ефектів. Опис винаходу Шизофренія є важким і хронічним розумовим розладом, яким уражено приблизно 1% населення. Клінічні симптоми проявляються у відносно ранньому віці, виникаючи в основному в підлітковому періоді або на початку зрілого віку. Симптоми шизофренії, як правило, ділять на так звані позитивні симптоми, включаючи галюцинації, маревні ідеї і дезорганізовані думки, і так звані негативні симптоми, до числа яких входять соціальні самоізоляція, знижена емоційна реакція, мізерність мови і нездатність відчувати задоволення. Крім того, пацієнти з шизофренією страждають від когнітивних розладів, наприклад, порушення уваги та пам'яті. Етіологія захворювання до цих пір невідома, але була висунута гіпотеза, згідно якої в основі симптомів шизофренії лежить порушення дії нейромедіаторів. Однією з найчастіше згадуваних є дофамінова гіпотеза; згідно з цією гіпотезою припускається, що за більшість позитивних симптомів, які спостерігаються у пацієнтів, несе відповідальність гіперактивність передачі сигналів через дофамін. Ця гіпотеза грунтується на спостереженні, що лікарські засоби, які підсилюють дію дофаміну, наприклад, амфетамін або кокаїн, можуть викликати психози, і на кореляції, яка існує між клінічними дозуваннями антипсихотичних засобів і їх ефективністю в блокуванні рецепторів дофаміну D2. Всі випущені в продаж антипсихотичні засоби опосередковують свою терапевтичну ефективність проти позитивних симптомів шляхом блокування рецепторів дофаміну D2. Разом з клінічною ефективністю, вважається, що більшість побічних ефектів антипсихотичних засобів, наприклад екстрапірамідальні симптоми (EPS) і пізня дискінезія, також пов'язані з дією антагоністів дофаміну. Ці виснажуючі побічні ефекти найчастіше виявляються при вживанні типових антипсихотичних засобів або антипсихотичних засобів першого покоління (наприклад, галоперідолу). Вони менш виражені при вживанні атипових антипсихотичних засобів або антипсихотичних засобів другого покоління (наприклад, рісперідону, оланзапіну) і навіть практично відсутні при вживанні клозапіну, який вважається прототипом атипових антипсихотичних засобів. Серед різних теорій, що пропонуються для пояснення рідшого виникнення EPS, що спостерігається при вживанні атипових антипсихотичних засобів, значну увагу впродовж останніх п'ятнадцяти років привертає мультирецепторная гіпотеза. Вона з'явилася в результаті досліджень по зв'язуванню рецепторів, які показали, що багато атипових антипсихотичних препаратів взаємодіють з рецепторами багатьох інших нейромедіаторів, крім рецепторів дофаміну D2, зокрема з рецепторами 5-НТ2 серотоніну, тоді як типові антипсихотичні засоби, такі як галоперідол, більш селективно зв'язуються з рецепторами D2. Ця теорія в останні роки була поставлена під сумнів, у зв'язку з тим, що всі основні атипові антипсихотичні засоби повністю зв'язують рецептори 5НТ2 серотоніну при клінічно ефективних дозуваннях, але все-таки розрізняються з точки зору побічних рухових ефектів, які викликаються ними. Як альтернатива мультирецепторній гіпотезі Kapur і Seeman ("Does fast dissociation from dopamine D2 receptor explain the action of atypical antipsychotics?: A new hypothesis" Am. J. Psychiatry 2001, 158: 3 p.360-369) передбачили, що атипові антипсихотичні засоби можуть відрізнятися від типових психотичних засобів швидкостями, з якими вони виділяються з комплексу з рецептором дофаміну D2. Швидка дисоціація комплексу з рецептором D2 могла б зробити антипсихотичний засіб більш легко пристосованим до фізіологічної передачі сигналу дофаміном, що допускає можливість антипсихотичної дії без побічних моторних ефектів. Ця гіпотеза є частково переконливою, якщо розглянути клозапін і кветіапін. Ці два препарати мають найбільшу швидкість дисоціації комплексу з рецептором D2 дофаміну, і вони характеризуються найменшою небезпекою появи EPS у людей. Навпаки, типові антипсихотичні засоби, з якими пов'язана значна частота появи EPS, є антагоністами рецептора D2, які мають найменші швидкості дисоціації. Отже, виявлення нових лікарських препаратів, виходячи з швидкості дисоціації їх комплексів з рецепторами D2, мабуть, є обгрунтованою стратегією для розробки нових атипових антипсихотичних засобів. Як було вказано раніше, сучасні атипові антипсихотичні засоби взаємодіють з багатьма рецепторами різних нейромедіаторів. Деякі з цих взаємодій (наприклад, блокування рецепторів серотоніну 5-НТ6 і дофаміну D3) можуть виявитися корисними, якщо йдеться про когнітивні порушення і негативні симптоми. Дійсно, численні дані доклінічних досліджень показали, що антагонізм по відношенню до рецептора 5-НТ6 виявляє позитивну дію на когнітивний процес у 1 UA 97826 C2 5 10 15 20 25 30 35 40 45 50 гризунів (Mithell and Neumaier (2005) 5-НТ6 receptors: a novel target for cognitive enhancement. Pharmacology & Therapeutics 108: 320-333). Антагонізм відносно рецептора 5-НТ6 також виявився пов'язаним з апетитом і пригніченням прийому їжі. Далі, антагонізм відносно рецептора D3 покращує соціальну взаємодію у щурів, що передбачає можливий сприятливий вплив на негативні симптоми пацієнтів із шизофренією (Joyce and Millan (2005) Dopamine D3 receptor antagonist as therapeutic agents. Drug Discovery Today 10: 917-925). З другого боку, інші взаємодії (наприклад, з адренергічним рецептором 1, рецепторами гістаміну H1 і серотоніну 5НТ2С) беруть участь в опосередкуванні побічних ефектів, включаючи гіпотензію, седативну дію, метаболічні розлади і набір ваги. Отже, додаткова мета полягає в тому, аби з'єднати властивості швидкої дисоціації комплексу з рецептором D2 з інгібуванням рецепторів серотоніну 5-НТ6 і дофаміну D3, за відсутності взаємодій з адренергічним рецептором 1, рецепторами гістаміну H1 і серотоніну 5-НТ2С. Такий профіль активності, як очікується, дасть можливість отримати нові сполуки, які ефективні проти позитивних симптомів, негативних симптомів і когнітивних розладів, за відсутності або при незначному прояві основних побічних ефектів, пов'язаних з відомими в даний час антипсихотичними засобами. Мета даного винаходу полягає в розробці нових сполук, які є антагоністами рецептора 2 дофаміну, утворюючи з ним швидко дисоціюючий комплекс, а також антагоністами рецептора серотоніну 5-НТ6 і дофаміну D3, які мають сприятливий фармакологічний профіль у вказаному вище сенсі, зокрема знижені моторні побічні дії, а також помірні або дуже незначні взаємодії з іншими рецепторами, що призводить до зниження ризику розвитку метаболічних розладів. Цієї мети вдалося досягти завдяки новим сполукам, структура яких відповідає формулі (І): та їх стереоізомерним формам, де 1 R являє собою хлор, трифторметил або ціано; 2 R являє собою феніл; феніл, заміщений 1, 2 або 3 заступниками, кожен з яких незалежно вибраний з групи, що включає галоген, ціано, С1-4алкіл, С1-4алкілокси, С1-4алкілсульфоніл; перфторС1-4алкіл, перфторС1-4алкілокси; диС1-4алкіламіно, гідроксил і феніл, необов'язково заміщений 1, 2 або 3 заступниками, кожен з яких незалежно вибраний з групи, що включає галоген, С1-4алкіл і перфторС1-4алкіл; тієніл; тієніл, заміщений 1 або 2 заступниками, кожен з яких незалежно вибраний з групи, що включає галоген і С1-4алкіл; нафтил; піридиніл; пірроліл; бензотіазоліл; індоліл; хінолініл; С3-8циклоалкіл; або С5-7циклоалкеніл; 3 R являє собою водень, С1-4алкіл, С1-4алкілокси або галоген; 4 5 4 5 кожен з R та R незалежно являє собою водень або С1-4алкіл, або ж R та R спільно утворюють С1-4алкандіїл; n дорівнює 1 або 2; та 6 R являє собою водень, С1-4алкіл, гідроксиС2-4алкіл, С3-6циклоалкіл, С3-6циклоалкіл-С1-4алкіл, піридинілметил або фенілметил, необов'язково заміщений по фенільному ядру 1, 2 або 3 заступниками, кожен з яких незалежно вибраний з групи, що включає галоген, ціано, С 1-4алкіл, С1-4алкілокси, С1-4алкілсульфоніл, перфторС1-4алкіл, перфторС1-4алкілокси і диС1-4алкіламіно; 5 6 або ж R та R спільно утворюють С2-5алкандіїл; а також їх фармацевтично прийнятним солям або сольватам. Сполуки за даним винаходом є швидко дисоціюючими антагоністами рецептора D2. Крім того, сполуки за даним винаходом мають приблизно таку ж спорідненість до рецепторів дофаміну D3 і серотоніну 5-НТ6, як і до рецепторів дофаміну D2. Наскільки показали проведені випробування, описані сполуки є антагоністами цих трьох підтипів рецепторів. Ця властивість робить сполуки за даним винаходом особливо корисними для застосування в якості лікарських засобів при лікуванні або запобіганні шизофренії, шизофреніформного розладу, шизоафективного розладу, маревного розладу, короткочасного психотичного розладу, розділеного психотичного розладу, психотичного розладу, викликаного загальним станом здоров'я, психотичного розладу, викликаного тією або іншою речовиною, психотичного розладу, що не відноситься до перерахованих вище; психозу, пов'язаного з деменцією; великого депресивного розладу, дистимічного розладу, передменструального дисфорічного розладу, 2 UA 97826 C2 5 10 15 20 25 30 35 40 45 50 55 60 депресивного розладу, що не відноситься до перерахованих вище, біполярного розладу І, біполярного розладу II, циклотимічного розладу, біполярного розладу, що не відноситься до перерахованих вище, афектного розладу, викликаного загальним станом здоров'я, афектного розладу, викликаного тією або іншою речовиною, афектного розладу, що не відноситься до перерахованих вище; генералізованого тривожного розладу, обсесивно-компульсивного розладу, панічного розладу, гострого стресового розладу, посттравматичного стресового розладу; затримки розумового розвитку; загального розладу психічного розвитку; розладів дефіциту уваги, розладу дефіцит уваги/гіперактивність, розлади дезорганізації поведінки; розлади особи параноїдального типу, розладу особи шизоїдного типу, розладу особи шизотипічного типу; тикового розладу, синдрому Туретта; залежності від речовин; неправильного вживання речовин; утримання від вживання тих або інших речовин; трихотиломанії; а також станів, при яких порушена пізнавальна здатність; хвороби Альцгеймера, хвороби Паркінсона, хвороби Хантінгтона, деменції з тельцями Леві, деменції внаслідок ВІЛ-захворювання, деменції внаслідок хвороби Крейтцфельдта-Якоба; амнестичних розладів; помірного когнітивного розладу; вікового зниження пізнавальної здатності; і розладів, пов'язаних з харчуванням, таких як анорексія і булімія; а також ожиріння. Фахівець в даній області може вибрати сполуки на основі експериментальних даних, приведених в експериментальній частині далі по тексту заявки. Будь-який вибір сполук входить в об'єм даного винаходу. Даний винахід відноситься до сполук формули (І) та їх стереоізомерних форм, в яких 1 R являє собою хлор, трифторметил або ціано; 2 R являє собою фенілом; феніл, заміщений 1, 2 або 3 заступниками, кожен з яких незалежно вибраний з групи, що включає галоген, ціано, С1-4алкіл, С1-4алкілокси, С1-4алкілсульфоніл, перфторС1-4алкіл, перфторС1-4алкілокси; диС1-4алкіламіно, гідроксил і фенілу, заміщеного 1, 2 або 3 заступниками, кожен з яких незалежно вибраний з групи, що включає галоген, С 1-4алкіл і перфторС1-4алкіл; тієніл; тієніл, заміщений 1 або 2 заступниками, кожен з яких незалежно вибраний з групи, що включає галоген і С1-4алкіл; нафтил; піридиніл; пірроліл; бензотіазоліл; індоліл; хінолініл; С3-8циклоалкіл або С5-7циклоалкеніл; 3 R являє собою водень, С1-4алкіл або галоген; 4 5 4 5 кожен із заступників R та R незалежно являє собою водень або С1-4алкіл, або ж R та R спільно утворюють С1-4алкандіїл; n дорівнює 1 або 2; та 6 R являє собою водень, С1-4алкіл, гідроксі С2-4алкіл, С3-6циклоалкіл, С3-6циклоалкіл-С1-4алкіл або фенілметил, заміщений по фенільному ядру 1, 2 або 3 заступниками, кожен з яких незалежно вибраний з групи, що включає галоген, ціано, С 1-4алкіл, С1-4алкілокси, С15 6 4алкілсульфоніл, перфторС1-4алкіл, перфторС1-4алкілокси і диС1-4алкіламіно; або ж R та R спільно утворюють С2-5алкандіїл; а також їх фармацевтично прийнятних солей або сольватів. Наприклад, винахід відноситься до сполук формули (І) та їх стереоізомерних форм, в яких 1 R являє собою трифторметил або ціано; 2 R являє собою феніл; феніл, заміщений 1, 2 або 3 заступниками, кожен з яких незалежно вибраний з групи, що включає галоген, ціано, С1-4алкіл, С1-4алкілокси, С1-4алкілсульфоніл, перфторС1-4алкіл, диС1-4алкіламіно, гідроксил і феніл, заміщений 1, 2 або 3 заступниками, кожен з яких незалежно вибраний з групи, що включає галоген, С 1-4алкіл і перфторС1-4алкіл; тієніл; тієніл, заміщений 1 або 2 заступниками, кожен з яких незалежно вибраний з групи, що включає галоген і С1-4алкіл; нафтил; піридиніл; пірроліл; бензотіазоліл; індоліл; хінолініл; С 3-8циклоалкіл або С5-7циклоалкеніл; 3 R являє собою водень; 4 5 кожен з R та R незалежно являє собою водень або С1-4алкіл; n дорівнює 1; 6 R являє собою водень, метил, етил, циклопропіл або фенілметил, заміщений по фенільному ядру 1, 2 або 3 заступниками, кожен з яких незалежно вибраний з групи, що включає галоген, ціано, С1-4алкіл, С1-4алкілокси, С1-4алкілсульфоніл, перфтор С1-4алкіл і диС15 6 4алкіламіно; або ж R та R спільно утворюють С2-5алкандіїл; а також їх фармацевтично прийнятних солей або сольватів. Особливий інтерес представляють сполуки формули (І) і їх стереоізомерні форми, в яких 1 R являє собою трифторметил; 2 R являє собою феніл; феніл, заміщений 1, 2 або 3 заступниками, кожен з яких незалежно вибраний з групи, що включає галоген, ціано, С1-4алкіл, С1-4алкілокси, С1-4алкілсульфоніл, перфторС1-4алкіл, диС1-4алкіламіно, гідроксил і феніл, заміщений 1, 2 або 3 заступниками, кожен 3 UA 97826 C2 5 10 15 20 25 30 35 40 45 50 55 60 з яких незалежно вибраний з групи, що включає галоген, С 1-4алкіл і перфторС1-4алкіл; тієніл; тієніл, заміщений 1 або 2 заступниками, кожен з яких незалежно вибраний з групи, що включає галоген і С1-4алкіл; нафтил; піридиніл; пірроліл; бензотіазоліл; індоліл; хінолініл; С 3-8циклоалкіл або С5-7циклоалкеніл; 3 R являє собою водень; 4 5 кожен із заступників R та R незалежно являє собою водень або метил; n дорівнює 1; 6 R являє собою водень, етил або (3,5-дифторфеніл)метил; 5 6 або ж R та R спільно утворюють 1,3-пропандіїл; а також їх фармацевтично прийнятні солі або сольвати. Серед сполук формули (І) і їх стереоізомерних форм найбільш цікавими є, наприклад 4-феніл-6-піперазин-1-іл-3-трифторметилпіридазин (Е1), 6-(4-етилпіперазин-1-іл)-4-феніл-3-трифторметилпіридазин (Е2), 6-[4-(3,5-дифторбензил)піперазин-1-іл]-4-феніл-3-трифторметилпіридазин (Е3), 6-(3,5-диметилпіперазин-1-іл)-4-феніл-3-трифторметилпіридазин (Е4), 2-(5-феніл-6-трифторметилпіридазин-3-іл)октагідропірроло[1,2-а]піразин (Е5) 4-(4-фторфеніл)-6-піперазин-1-іл-3-трифторметилпіридазин (Е6), 6-піперазин-1-іл-4-тіофен-3-іл-3-трифторметилпіридазин (Е7) 6-піперазин-1-іл-4-о-толіл-3-трифторметилпіридазин (Е8) 4-(4'-фторбіфеніл-4-іл)-6-піперазин-1-іл-3-трифторметилпіридазин (Е9) і 4-феніл-6-піперазин-1-ілпіридазин-3-карбонітрил (Е10), а також їх фармацевтично прийнятні солі та сольвати. В тексті даної заявки термін «С1-4алкіл», що використовується сам по собі або як складова частина комбінованих термінів, таких як «С1-4алкілокси», «перфторС1-4алкіл», «диС14алкіламіно», включає, наприклад, метил, етил, пропіл, бутил, 1-метилпропіл, 1,1-диметилетил; термін «перфторС1-4алкіл» включає, наприклад, трифторметил, пентафторетил, гептафторпропіл і нонафторбутил; С3-8циклоалкіл включає циклопропіл, циклобутил, циклопентил, циклогексил, циклогептил і циклооктил; С 5-7циклоалкеніл включає циклопентеніл, циклогексеніл і циклогептеніл. Термін «галоген» включає фтор, хлор, бром і йод. В число фармацевтично прийнятних солей, згідно з визначенням, входять терапевтично активні, нетоксичні кислотно-адитивні сольові форми, які можуть утворювати сполуки формули (І). Вказані солі можна отримати обробкою основних форм сполук формули (І) відповідними кислотами, наприклад, неорганічними кислотами, такими як галогеноводневі кислоти, зокрема хлористоводнева кислота, бромистоводнева кислота, сірчана кислота, азотна кислота і фосфорна кислота; органічними кислотами, наприклад, оцетовою кислотою, гидроксиоцетовою кислотою, пропановою кислотою, молочною кислотою, піровиноградною кислотою, щавлевою кислотою, малоновою кислотою, янтарною кислотою, малеїновою кислотою, мигдалевою кислотою, фумаровою кислотою, яблучною кислотою, винною кислотою, лимонною кислотою, метансульфоновою кислотою, етансульфоновою кислотою, бензолсульфоновою кислотою, птолуолсульфоновою кислотою, цикламовою кислотою, саліциловою кислотою, паміносаліциловою кислотою, памовою кислотою і мигдалевою кислотою. З іншого боку, вказані сольові форми можуть бути перетворені у вільні форми обробкою відповідною основою. Термін «сольвати» відноситься до гідратів і алкоголятів, які можуть утворювати сполуки формули (І). Термін «стереохімічно ізомерні форми» в даній заявці визначає всі можливі ізомерні форми, які можуть мати сполуки формули (І). Якщо не вказано або не згадано інше, хімічні назви сполук означають суміш всіх можливих стереохімічно ізомерних форм, причому вказані суміші містять всі діастереомери і енантіомери основної молекулярної структури. Конкретніше, стереогенні центри можуть мати R- або S-конфігурацію; замісники в двовалентних циклічних (частково) насичених радикалах можуть мати або цис- або транс-конфігурацію. Сполуки, що включають подвійні зв'язки можуть мати Е- або Z-конфігурацію при вказаному подвійному зв'язку. Стереохімічно ізомерні форми сполук формули (І) входять в об'єм даного винаходу. Сполуки формули (І), одержані за описаним нижче способом, можуть бути синтезовані у формі рацемічних сумішей або енантіомерів, які можуть бути розділені один з одним з використанням відомих в техніці методик розділення. Рацемічні сполуки формули (І) можуть бути перетворені у відповідні діастереомерні сольові форми взаємодією з відповідною хіральною кислотою. Після цього розділяють вказані діастереомерні сольові форми, наприклад, селективною або дробовою кристалізацією і вивільняють з отриманих солей діастереомери дією лугу. Альтернативний спосіб розділення енантіомерних форм сполук формули (І) включає рідинну хроматографію з використанням хіральної нерухомої фази. Вказані стереохімічно чисті 4 UA 97826 C2 5 10 15 20 25 30 35 40 45 50 55 ізомерні форми можуть бути також отримані з відповідних стереохімічно чистих ізомерних форм відповідних вихідних речовин, за умови, що реакція проходить стереоспецифічно. Якщо треба отримати конкретний стереоізомер, вказана сполука переважно могла б бути синтезована за допомогою стереоспецифічних методів синтезу. У цих методах переважно застосовують енантіомерно чисті вихідні сполуки. Фармакологія Для виявлення антипсихотичних сполук, які активні проти позитивних і негативних симптомів і когнітивних розладів і мають покращений профіль безпеки (низька частота появи EPS і відсутність метаболічних розладів), автори провели скринінг сполук, що селективно взаємодіють з рецептором дофаміну D2 і які створюють швидко дисоціюючий комплекс з цим рецептором і, окрім цього, які володіють спорідненістю до рецептора дофаміну D3, а також до рецептору серотоніну 5-НТ-6. В першу чергу сполуки досліджували на спорідненість до 3 рецептора D2 в аналізі зв'язування з використанням [ Н]спіперона і людського рецептора клітинних мембран D2L. Сполуки, які показали ІС 50 менше 10 мкМ, з метою оцінки швидкості дисоціації тестували в непрямому аналізі, що проводився по адаптованій методиці, що опублікована Josee E. Leysen and Walter Gommeren, Journal of Receptor Research, 1984, 4(7), 817-845. Потім сполуки відбирали за допомогою панелі, що складалася з більше чим 50 звичайних рецепторів, зв'язаних з G-білком (CEREP), і виявляли сполуки, які мають чистий профіль, тобто низьку спорідненість до досліджуваних рецепторів, за винятком рецептора дофаміну D3 і рецептора серотоніну 5-НТ6. Деякі із сполук додатково випробовували в моделях in vivo, наприклад «Протидія збудженню, викликаному апоморфіном, у щурів» і виявили, що вони активні і біодоступні при пероральному прийомі. Було додатково виявлено, що сполука Е1 проявляє активність в тесті «Інверсія субхронічного зрушення уваги у щурів, викликаного РСР» (J.C. Rodefer et al., Neuropsychopharraacology (2007), 1-10). Зважаючи на описану вище фармакологію сполук формули (І), можна зробити висновок, що вони корисні для застосування в якості лікарських засобів, зокрема, як антипсихотичні засоби. Конкретніше, ці сполуки корисні для застосування в якості лікарських засобів для лікування або запобігання шизофренії, шизофреніформного розладу, шизоафективного розладу, маревного розладу, короткочасного психотичного розладу, розділеного психотичного розладу, психотичного розладу, викликаного загальним станом здоров'я, психотичного розладу, викликаного тією або іншою речовиною, психотичного розладу, що не відноситься до перерахованих вище; психозу, пов'язаного з деменцією; великого депресивного розладу, дистимічного розладу, передменструального дисфорічного розладу, депресивного розладу, що не відноситься до перерахованих вище, біполярного розладу І, біполярного розладу II, циклотимічного розладу, біполярного розладу, що не відноситься до перерахованих вище, афектного розладу, викликаного загальним станом здоров'я, афектного розладу, викликаного тією або іншою речовиною, афектного розладу, що не відноситься до перерахованих вище; генералізованого тривожного розладу, обсесивно-компульсивного розладу, панічного розладу, гострого стресового розладу, посттравматичного стресового розладу; затримки розумового розвитку; загального розладу психічного розвитку; розладів дефіциту уваги, розладу дефіцит уваги/гіперактивність, розлади дезорганізації поведінки; розлади особи параноїдального типу, розладу особи шизоїдного типу, розладу особи шизотипічного типу; тикового розладу, синдрому Туретта; залежності від речовин; неправильного вживання речовин; утримання від вживання тих або інших речовин; трихотиломанії. Внаслідок антагоністичної активності відносно рецептора 5НТ6, сполуки за даним винаходом можуть додатково застосовуватися для лікування або профілактики станів, при яких порушена пізнавальна здатність; хвороби Альцгеймера, хвороби Паркінсона, хвороби Хантінгтона, деменції з тельцями Леві, деменції внаслідок ВІЛзахворювання, деменції внаслідок хвороби Крейтцфельдта-Якоба; амнестичних розладів; помірного когнітивного розладу; а також вікового зниження пізнавальної здатності. Для оптимізації лікування пацієнтів, що страждають на один з розладів, згаданих в попередньому параграфі, сполуки формули (І) можуть вводитися спільно з іншими психотропними сполуками. Так, в разі шизофренії, ціллю лікування можуть бути негативні та когнітивні симптоми. Крім того, в даному винаході розроблено спосіб лікування теплокровних тварин, що страждають вказаними розладами, причому згаданий спосіб включає системне введення терапевтичної кількості сполуки формули (І), ефективні для лікування описаних вище розладів. 5 UA 97826 C2 5 10 15 20 25 30 35 40 45 50 55 60 Крім цього даний винахід відноситься до застосування сполук формули (І), які відповідають даним вище визначенням, з метою виробництва лікарських засобів, зокрема, антипсихотичних лікарських засобів, конкретніше лікарських засобів, призначених для лікування або запобігання шизофренії, шизофреніформного розладу, шизоафективного розладу, маревного розладу, короткочасного психотичного розладу, розділеного психотичного розладу, психотичного розладу, викликаного загальним станом здоров'я, психотичного розладу, викликаного тією або іншою речовиною, психотичного розладу, що не відноситься до перерахованих вище; психозу, пов'язаного з деменцією; великого депресивного розладу, дистимічного розладу, передменструального дисфорічного розладу, депресивного розладу, що не відноситься до перерахованих вище, біполярного розладу І, біполярного розладу II, циклотимічного розладу, біполярного розладу, що не відноситься до перерахованих вище, афектного розладу, викликаного загальним станом здоров'я, афектного розладу, викликаного тією або іншою речовиною, афектного розладу, що не відноситься до перерахованих вище; генералізованого тривожного розладу, обсесивно-компульсивного розладу, панічного розладу, гострого стресового розладу, посттравматичного стресового розладу; затримки розумового розвитку; загального розладу психічного розвитку; розладів дефіциту уваги, розладу дефіцит уваги/гіперактивність, розладу дезорганізації поведінки; розладу особи параноїдального типу, розладу особи шизоїдного типу, розладу особи шизотипічного типу; тикового розладу, синдрому Туретта; залежності від речовин; неправильного вживання речовин; утримання від вживання тих або інших речовин; трихотиломанії; а також станів, при яких порушена пізнавальна здатність; хвороби Альцгеймера, хвороби Паркінсона, хвороби Хантінгтона, деменції з тельцями Леві, деменції внаслідок ВІЛ-захворювання, деменції внаслідок хвороби Крейтцфельдта-Якоба; амнестичних розладів; помірного когнітивного розладу; і вікового зниження пізнавальної здатності. Фахівець в лікуванні перерахованих розладів міг би визначити терапевтично ефективну денну кількість препаратів на основі результатів тестів, приведених нижче по тексту заявки. Терапевтично ефективна денна кількість могла б складати від приблизно 0,01 мг/кг до приблизно 10 мг/кг маси тіла, переважніше, від приблизно 0,05 мг/кг до приблизно 1 мг/кг маси тіла. Даний винахід відноситься також до фармацевтичної композиції, що включає фармацевтично прийнятний носій і терапевтично ефективну кількість сполуки формули (І) як активний інгредієнт. Для більш легкого введення описані сполуки можна включати до складу різних лікарських форм. Сполуки за даним винаходом, зокрема сполуки формули (І), їх фармацевтично прийнятні кислотно- і основно-адитивні солі, їх стереохімічно ізомерні форми, їх N-оксидні форми та їх проліки, або будь-які підгрупи і комбінації перерахованих речовин, з метою введення можуть бути включені в різні лікарські форми. В якості підходящих композиції можуть бути згадані всі композиції, які звичайно застосовуються для системного введення лікарських засобів. Для одержання фармацевтичних композицій за даним винаходом, ефективну кількість конкретної сполуки, необов'язково у формі адитивної солі, що є активною сполукою, ретельно змішують з фармацевтично прийнятним носієм, причому цей носій може мати найрізноманітніші форми, залежно від форми препарату, яку бажано ввести. Бажано, щоб ці фармацевтичні композиції були стандартними лікарськими формами, зокрема, підходили для перорального, ректального, черезшкірного введення, введення за допомогою парентеральної ін'єкції або інгаляції. Наприклад, при одержанні композицій у вигляді пероральних стандартних форм, може застосовуватися будь-яке із звичайних фармацевтичних середовищ, таких як, наприклад, вода, гліколі, масла, спирти тощо в разі рідких препаратів, таких як суспензії, сиропи, еліксири, емульсії і розчини; або тверді носії, такі як крохмалі, цукри, каолін, розчинники, змащуючі засоби, зв'язуючі засоби, дезінтегруючі засоби тощо в разі порошків, пілюль, капсул і пігулок. Завдяки легкості введення, пігулки і капсули є найбільш переважними пероральними стандартними лікарськими формами, і в цьому випадку, вочевидь, застосовуються тверді фармацевтичні носії. Для парентеральних композицій носій зазвичай включатиме стерильну воду, щонайменше як основний компонент, хоча в склад можуть входити й інші інгредієнти, наприклад, засоби, які сприяють розчинності. Наприклад, можуть бути отримані розчини для ін'єкцій, в яких носій включає сольовий розчин, розчин глюкози або суміш розчинів солі і глюкози. Розчини для ін'єкцій, що містять сполуки формули (І), можуть бути отримані із застосуванням масла, для досягнення пролонгованої дії. Підходящими для цієї мети маслами є, наприклад, арахісове масло, кунжутне масло, бавовняне масло, кукурудзяне масло, соєве масло, синтетичні ефіри гліцерину і жирних кислот з довгими ланцюгами, а також суміші цих та інших масел. Крім того, можуть бути отримані придатні для ін'єкцій суспензії, і в цьому випадку 6 UA 97826 C2 5 10 15 20 25 30 35 можуть застосовуватися відповідні рідкі носії і суспендуючі засоби. Крім того, в об'єм винаходу входять тверді препарати, які призначені для перетворення, незадовго перед застосуванням, в рідкі препарати. У композиціях, які підходять для черезшкірного введення, носій необов'язково включає засоби, що підсилюють здатність до проникнення і відповідні змочуючі засоби, необов'язково у поєднанні з відповідними добавками будь-якої природи в незначній кількості, які не чинять значного несприятливого впливу на шкіру. Вказані добавки можуть полегшувати введення через шкіру та/або можуть сприяти одержанню потрібних композицій. Ці композиції можуть вводитися різними шляхами, наприклад, у формі трансдермального пластиру, черезшкірного препарату або мазі. Кислотно- або основно-адитивні солі сполук формули (І) завдяки їх підвищеній розчинності у воді в порівнянні з відповідними основними або кислотними формами, більше підходять для одержання водних композицій. Особливо корисно отримувати описані вище фармацевтичні композиції у вигляді стандартних лікарських форм для легшого введення і постійності дозування. Термін «стандартна лікарська форма» в даній заявці відноситься до фізично дискретних одиниць, які підходять в якості однократних доз, причому кожна одиниця лікарської форми містить заздалегідь визначену кількість активного інгредієнта, розраховану на досягнення бажаного терапевтичного ефекту, в поєднанні з необхідним фармацевтичним носієм. Прикладами таких стандартних лікарських форм є пігулки (включаючи пігулки з насічкою або пігулки з покриттям), капсули, пілюлі, пакети з порошками, облатки, супозиторії, розчини або суспензії для ін'єкцій тощо та упаковки з великою кількістю окремих одиниць цих стандартних лікарських форм. Оскільки сполуки за даним винаходом є сполуками, потенційно придатними для перорального введення, особливо корисними є фармацевтичні композиції, призначені для перорального введення, які включають вказані сполуки. З метою покращення розчинності і стабільності сполук формули (І) у фармацевтичних композиціях, може бути доцільне застосування -, - або -циклодекстринів або їх похідних, зокрема гідроксиалкілзаміщених циклодекстринів, наприклад 2-гідроксипропіл-циклодекстрину. Крім цього розчинність і стабільність сполук за даним винаходом у фармацевтичних композиціях може бути покращена за рахунок застосування сорозчинників, наприклад, спиртів. Одержання 1 2 3 4 5 6 Сполуки формули (І), в яких R являє собою хлор або трифторметил і R , R , R , R , R та n відповідають даним вище визначенням, можуть бути отримані взаємодією сполуки формули (II) 1 у якій R являє собою хлор або трифторметил і R визначенням, зі сполукою формули (III) 40 45 4 5 6 2 та R 3 відповідають даним вище у якій R , R , R та n відповідають даним вище визначенням, у присутності відповідної основи, наприклад диізопропілетиламіну, у відповідному розчиннику, наприклад в ацетонитрилі, та у відповідних умовах, наприклад при відповідній температурі або при відповідному нагріванні або мікрохвильовому випромінюванні, протягом часу, що гарантує завершення реакції. 1 2 3 Сполуки формули (II), в яких R являє собою хлор і R та R відповідають даним вище визначенням, можуть бути отримані по аналогічній методиці, описаній в WO-2005/013907. 1 2 3 Сполуки формули (II), в яких R являє собою трифторметил і R та R відповідають даним вище визначенням, можуть бути отримані взаємодією сполуки формули (IV) 7 UA 97826 C2 1 3 1 5 2 2 3 у якій R являє собою трифторметил і R та R відповідають даним вище визначенням, з оксихлоридом фосфору, у відповідному розчиннику, наприклад, в ацетонітрилі, у відповідних умовах, наприклад, при відповідній температурі або при відповідному нагріванні або мікрохвильовому випромінюванні, протягом часу, що гарантує завершення реакції. 1 2 3 Сполуки формули (IV), в яких R являє собою трифторметил і R та R відповідають даним вище визначенням, можуть бути отримані взаємодією сполуки формули (V) 10 15 у якій R являє собою трифторметил і R та R відповідають даним вище визначенням, з гідразингідратом у присутності відповідного каталізатора, наприклад оцетової кислоти, у відповідному розчиннику, наприклад в ацетонітрилі, у відповідних умовах, наприклад при відповідних температурах, або при відповідному нагріванні або мікрохвильовому випромінюванні, протягом часу, який гарантує завершення реакції. 1 2 3 Сполуки формули (V), в яких R являє собою трифторметил і R та R відповідають даним вище визначенням, можуть бути отримані взаємодією сполуки формули (VI) 20 2 25 30 6' 35 3 у якій R та R відповідають даним вище визначенням, з СF 3SіМе3 (VII) у присутності відповідного каталізатора, наприклад фториду цезію, у відповідному розчиннику, такому як ацетонітрил, у відповідних умовах, наприклад, при низьких температурах, як правило в діапазоні від -78°С до 0°С. 2 3 Сполуки формули (VI), в яких R та R відповідають даним вище визначенням, можуть бути придбані на комерційній основі або отримані по методиці, аналогічній описаній в Dean, W.D.; Bum, D.M. J. Org. Chem. 1993, 58, 7916-7917. Сполуки формули (I-а) 6 1 в яких R являє собою R , згідно з даним вище визначенням, але за винятком водню, R 2 3 4 5 являє собою хлор або трифторметил і R , R , R , R та n відповідають даному вище визначенню, також можуть бути отримані взаємодією сполук формули (І-b) 8 UA 97826 C2 1 5 10 15 20 2 3 4 5 у яких R являють собою хлор або трифторметил і R , R , R , R та n відповідають даному 6' 6' 6 вище визначенню, з реагентом формули R -W, в яких R являє собою R , згідно з даним вище визначенням, але за винятком водню, і W являє собою рухому групу, таку як галоген, наприклад, хлор, бром або йод, або сульфонілоксигрупу, наприклад, метилсульфонілокси, трифторметилсульфонілокси або метилфенілсульфонілокси у присутності основи, наприклад, диізопропілетиламіну, у відповідному розчиннику, такому як ацетонітрил, і у відповідних умовах, наприклад, при відповідній температурі, або при відповідному нагріванні або при мікрохвильовому випромінюванні протягом часу, який гарантує завершення реакції. 6' 6 Як альтернатива, сполуки формули (I-а), в яких R являє собою R , згідно з даним вище 1 2 3 4 5 визначенням, але за винятком водню, R являє собою хлор або трифторметил і R , R , R , R та 1 n відповідають даному вище визначенню, також можуть бути зі сполук формули (І-b), в яких R 2 3 4 5 являє собою хлор або трифторметил і R , R , R , R та n відповідають даному вище визначенню, за допомогою реакції відновного N-алкілювання з відповідним кетоном або альдегідом у присутності відповідного поновлюючого реагенту, наприклад, триацетоксиборгідриду натрію у відповідному розчиннику, такому як тетрагідрофуран. 1 2 3 4 5 Сполуки формули (І-b), в яких R являє собою хлор або трифторметил і R , R , R , R та n відповідають даному вище визначенню, можуть бути отримані видаленням захисної групи з проміжної сполуки формули (VIII) 1 25 30 у якій L являє собою відповідну захисну групу, наприклад, трет-бутоксикарбоніл, R являє 2 3 4 5 собою хлор або трифторметил і R , R , R , R та n відповідають даному вище визначенню, у відповідних умовах, наприклад, в присутності трифтороцетової кислоти в дихлорметані або у присутності кислотної форми іонообмінної смоли Amberlyst 15 в метанолі, де L являє собою трет-бутоксикарбонільну групу. 1 2 3 4 5 Сполуки формули (VIII), в яких R являє собою хлор або трифторметил і R , R , R , R та n відповідають даному вище визначенню, можуть бути отримані взаємодією сполуки формули (II), 1 2 3 в якій R являє собою хлор або трифторметил і R та R відповідають даному вище визначенню, зі сполукою формули (IX) 35 40 4 5 у якій L являє собою відповідну захисну групу, наприклад, трет-бутоксикарбоніл і R , R та n відповідають даному вище визначенню, у присутності відповідної основи наприклад диізопропілетиламіну, у відповідному розчиннику, наприклад в ацетонітрилі, і у відповідних умовах, наприклад при відповідній температурі, або при відповідному нагріванні або мікрохвильовому опроміненні протягом часу, який гарантує завершення реакції. 9 UA 97826 C2 1 2 3 4 5 Сполуки формули (VIII), в яких R являє собою трифторметил, і R , R , R , R та n відповідають даному вище визначенню, і L являє собою відповідну захисну групу, наприклад, трет-бутоксикарбоніл, також можуть бути отримані взаємодією сполуки формули (X) 5 1 10 15 20 25 30 35 3 4 5 у якій R являє собою трифторметил, і R , R , R та n відповідають даному вище визначенню, і L являє собою відповідну захисну групу, наприклад, трет-бутоксикарбоніл, з 2 відповідною арилбороновою кислотою R -B(OH)2 у присутності відповідного каталізатора, наприклад, дихлориду 1,1'-біс(дифенілфосфіно) фероценпаладію(II), дихлорм етану у присутності відповідного ліганда, наприклад 1,1'-біс(дифенілфосфіно)фероцену і основи, такої як фосфат калію, у відповідному інертному розчиннику, наприклад в діоксані, при підвищеній температурі. 1 3 4 5 Сполуки формули (X), в яких R являє собою трифторметил, R , R , R та n відповідають даному вище визначенню і L являє собою відповідну захисну групу, наприклад третбутоксикарбоніл, можуть бути отримані взаємодією сполуки формули (XI) 1 3 4 5 у якій R являє собою трифторметил, R , R , R та n відповідають даному вище визначенню і L являє собою відповідну захисну групу, наприклад, трет-бутоксикарбоніл, з йодом у присутності відповідної основи, наприклад, суміші бутиллітію і 2,2,6,6-тетраметилпіперидину у відповідному інертному розчиннику, такому як тетрагідрофуран, при низьких температурах, як правило в діапазоні від -78°С до 0°С. 1 3 4 5 Сполуки формули (XI), в яких R являє собою трифторметил, R , R , R та n відповідають даному вище визначенню і L являє собою відповідну захисну групу, наприклад, третбутоксикарбоніл, можуть бути отримані взаємодією 6-хлор-3-трифторметилпіридазину (отриманого по методиці, описаній в Goodman, A.J.; Stanforth, S.P; Tarbit В. Tetrahedron 1999, 55, 15067-15070) з терт-бутил 1-піперазинкарбоксилатом у присутності відповідної основи, такої як диізопропілетиламін у відповідному розчиннику, такому як ацетонітрил, при відповідній температурі, або при відповідному нагріванні або при мікрохвильовому опроміненні протягом часу, який гарантує завершення реакції. 6' 6 Сполуки формули (I-c), в яких R являє собою R відповідно до даного вище визначення, 1 3 4 s 7 але за винятком водню, R являє собою трифторметил, R , R , R , R та n відповідають даним вище визначенням можуть бути отримані взаємодією сполуки формули (I-d) 10 UA 97826 C2 1 5 10 15 20 25 30 35 3 4 5 7 1 3 4 5 7 у якій R являє собою трифторметил, R , R , R , R та n відповідають даним вище 6' 6' 6 визначенням, з реагентом формули R -W, в якій R являє собою R , згідно з даним вище визначенням, але за винятком водню, і W являє собою рухому групу, таку як галоген, наприклад, хлор, бром або йод, або сульфонілоксигрупу, наприклад, метилсульфонілокси, трифторметилсульфонілокси або метилфенілсульфонілокси, у присутності основи, наприклад диізопропілетиламіну, у відповідному розчиннику, наприклад в ацетонітрилі, і у відповідних умовах, наприклад, при необхідній температурі або при відповідному нагріванні або при дії мікрохвильового випромінювання, протягом часу, який гарантує завершення взаємодії. 6' 6 Як альтернатива, сполуки формули (I-c), в яких R являє собою R , згідно з даним вище 1 3 4 5 7 визначенням, але за винятком водню, R являє собою трифторметил, R , R , R , R та n 1 відповідають даним вище визначенням, можуть бути отримані зі сполук формули (I-d), в яких R 3 4 5 7 являє собою трифторметил, R , R , R , R та n відповідають даним вище визначенням, шляхом відновного N-алкілювання з використанням відповідного кетону або альдегіду, у присутності відповідного відновлюючого засобу, наприклад, триацетоксиборгідриду натрію у відповідному розчиннику, наприклад, з тетрагідрофурані. 1 3 4 5 7 Сполуки формули (I-d), в яких R являє собою трифторметил, R , R , R , R та n відповідають даним вище визначенням, можуть бути отримані шляхом видалення захисної групи з проміжної сполуки формули (XII) у якій R являє собою трифторметил, R , R , R , R та n відповідають даним вище визначенням і L являє собою відповідну захисну групу, наприклад, трет-бутоксикарбоніл, у відповідних умовах, наприклад, у присутності трифтороцетової кислоти в дихлорметані або кислотної форми іонообмінної смоли Amberlyst 15 в метанолі, де L являє собою третбутоксикарбонільну групу. 1 3 4 5 7 Сполуки формули (XII), в яких R являє собою трифторметил, R , R , R , R та n відповідають даним вище визначенням і L являє собою відповідну захисну групу, наприклад, трет-бутоксикарбоніл, можуть бути отримані взаємодією сполуки формули (XIII) 1 3 4 5 у якій R являє собою трифторметил, R , R , R та n відповідають даним вище визначенням і L являє собою відповідну захисну групу, наприклад, трет-бутоксикарбоніл, з відповідною 11 UA 97826 C2 5 арилбороновою кислотою у присутності відповідного каталізатора, наприклад, трансРd(ОАс)2(Cy2NH)2 (отриманого по методиці, описаній в Тао, В.; Boykin, D.W. Tetrahedron Lett. 2003, 44, 7993-7996), у присутності відповідної основи, наприклад фосфату калію, у відповідному інертному розчиннику, наприклад в діоксані, при відповідних умовах реакції, наприклад, при необхідній температурі, або при відповідному нагріванні або при дії мікрохвильового випромінювання, протягом часу, який гарантує завершення взаємодії. 1 6 Сполуки формули (І), в яких R являє собою ціано, R відповідає даному вище визначенню, 2 3 4 5 але за винятком водню, R , R , R , R та n відповідають даним вище визначенням, можуть бути отримані взаємодією сполуки формули (I-е) 10 2 15 20 25 3 4 5 6' у якій R , R , R , R та n відповідають даним вище визначенням, з реагентом формули R -W, 6' 6 в якій R являє собою R , згідно з даним вище визначенням, але за винятком водню, і W являє собою рухому групу, таку як галоген, наприклад, хлор, бром або йод, або сульфонілоксигрупу, наприклад, метилсульфонілокси, трифторметилсульфонілокси або метилфенілсульфонілокси, у присутності основи, наприклад диізопропілетиламіну, у відповідному розчиннику, наприклад в ацетонітрилі, та при відповідних умовах, наприклад, при необхідній температурі або при відповідному нагріванні або при дії мікрохвильового випромінювання, протягом часу, який гарантує завершення взаємодії. 1 6' 6 Як альтернатива, сполуки формули (І), в яких R являє собою ціано, R являє собою R , але 2 3 4 5 за винятком водню, і R , R , R , R та n відповідають даним вище визначенням, можуть бути 1 6' 2 3 отримані зі сполуки формули (I-е), в якій R являє собою ціано, R являє собою водень і R , R , 4 5 R , R та n відповідають даним вище визначенням, шляхом відновного N-алкілювання з використанням відповідного кетону або альдегіду у присутності відповідного відновлюючого засобу у відповідному розчиннику. 1 6 Сполуки формули (І), в яких R являє собою ціано, R відповідає даному вище визначенню і 2 3 4 5 R , R , R , R та n відповідають даним вище визначенням, можуть бути отримані видаленням захисної групи з проміжної сполуки формули (XIV) 30 2 35 40 45 3 4 5 у якій R , R , R , R та n відповідають даним вище визначенням і L являє собою відповідну захисну групу, наприклад, трет-бутоксикарбоніл, у відповідних умовах, наприклад, у присутності трифтороцетової кислоти в дихлорметані або кислотної форми іонообмінної смоли Amberlyst 15 в метанолі, де L являє собою трет-бутоксикарбонільну групу. 2 3 4 5 Сполуки формули (XIV), в яких R , R , R , R та n відповідають даним вище визначенням і L являє собою відповідну захисну групу, наприклад, трет-бутоксикарбоніл отримували взаємодією 1 2 3 4 5 сполуки формули (VIII), в якій R являє собою хлор, і R , R , R , R та n відповідають даним вище визначенням, і L являє собою відповідну захисну групу, наприклад, трет-бутоксикарбоніл, з ціанидом цинку у присутності відповідного каталізатора, наприклад, тетракис(трифенілфосфин) паладію(0) у відповідному розчиннику, наприклад, в Ν,Νдиметилформаміді у відповідних умовах, наприклад, при необхідній температурі або при відповідному нагріванні, або при дії мікрохвильового випромінювання, протягом часу, який гарантує завершення взаємодії. Експериментальна частина 12 UA 97826 C2 5 10 15 20 25 30 35 40 45 50 55 60 Хімічні методики Реакції, які проходять за сприяння мікрохвильового випромінювання, проводили в однорежимному реакторі: EMRYS Optimizer microwave reactor (Personal Chemistry А.В., в даний час Biotage). Кінцеве очищення продуктів в прикладах (Е1-Е39) виконували або колонковою хроматографією на силікагелі із застосуванням вказаного елюента, або препаративною ВЕРХ на оберненій фазі на колонці Hyperprep RP 18 BDS (Shandon) (8 мкм, 200 мм, 250 г). Для реалізації градієнтної методики використовували три рухомі фази (рухома фаза А: 90% 0,5% ацетату амонію +10% ацетонітрилу; рухома фаза В: метанол; рухома фаза С: ацетонітрил), починаючи з 75% А і 25% В при швидкості потоку 40 мл/хв, зберігали ці параметри протягом 0,5 хвилин і потім збільшували швидкість потоку до 80 мл/хв протягом 0,01 хв, доводячи до співвідношення компонентів 50% В і 50% С протягом 41 хвилини і до 100% С протягом 20 хвилин і зберігали ці умови на протязі 4 хвилин. 1 Спектри H реєстрували на спектрометрах Bruker DPX 360, DPX 400 або Bruker AV-500. Хімічні здвиги виражені в мільйонних долях відносно тетраметилсілану. Визначення температур плавлення здійснювали на приладі FP62. РХМС Загальна методика РХМС, методика А: Виміри РХМС проводили з використанням приладу HP 1100 фірми Agilent Technologies, що включав насос для чотирьохкомпонентних сумішей з дегазатором, пристрій для автоматичного завантаження зразків, піч для колонки (встановлену на 40°С, за винятком методики 4, в якій температура була встановлена на 60°С), детектор на діодній матриці (DAD) і колонку, вказану нижче в описі відповідної методики. Частина потоку з колонки поступала на МС-детектор. МСдетектор був зконфігурований для роботи з джерелом іонізації електророзпиленням. В якості газу, що розпилювали, застосовували азот. Температуру джерела підтримували рівною 140°С. Реєстрацію даних проводили з використанням програми MassLynx-Openlynx. Загальна методика РХМС, методика В: Виміри РХМС проводили з використанням модуля Agilent 1100, що включав насос, детектор на діодній матриці (DAD) (використовувалася довжина хвилі 220 нм), підігрівач колонки і колонку, вказану нижче в описі відповідної методики. Частина потоку з колонки поступала на Agilent MSD Series G1946C і G1956A. МС-детектор був зконфігурований для роботи з API-ES (іонізація електророзпиленням при атмосферному тиску). Мас-спектри реєстрували шляхом сканування від 100 до 1000. Напруга на капілярній голці складала 2500 В для режиму іонізації позитивною напругою і 3000 В для режиму іонізації негативною напругою. Напруга фрагментації складала 50В. Температуру осушуючого газу підтримували на рівні 350°С при швидкості потоку 10 л/хв. Методика 1 РХМС На додаток до загальної методики А РХМС: здійснювали ВЕРХ на оберненій фазі на колонці АСЕ-С18 (3,0 мкм, 4,630 мм) фірми Advanced Chromatography Technologies, при швидкості потоку 1,5 мл/хв. Умови градієнтного елюювання: 80% А (розчин ацетату амонію 0,5 тіл), 10% В (ацетонітрил), 10% С (метанол) до 50% В і 50% С протягом 6,5 хвилин, до 100% В на 7 хвилині, і повернення до початкових умов на 7,5 хвилині до 9,0 хвилин. Об'єм вприскування 5 мкл. Масспектри високого розділення (час прольоту, TOF) реєстрували лише в режимі іонізації позитивним зарядом, шляхом сканування від 100 до 750 протягом 0,5 секунд з використанням часу затримки 0,1 сек. Напруга на капілярній голці складала 2,5 кВ для режиму іонізації позитивним зарядом і напруга на конусі складала 20 В. Стандартною речовиною, що використовували для калібрування мас-спектру, був лейцин-енкефалін. Методика 2 РХМС На додаток до загальної методики А РХМС: здійснювали ВЕРХ на оберненій фазі на колонці АСЕ-С18 (3,0 мкм, 4,630 мм) фірми Advanced Chromatography Technologies, при швидкості потоку 1,5 мл/хв. Умови градієнтного елюювання: 80% А (розчин ацетату амонію 0,5 тіл), 10% В (ацетонітрил), 10% С (метанол) до 50% В і 50% С протягом 6,5 хвилин, до 100% В на 7 хвилині, і повернення до початкових умов на 7,5 хвилині до 9,0 хвилин. Об'єм вприскування 5 мкл. Масспектри високого розділення (час прольоту, TOF) реєстрували шляхом сканування від 100 до 750 протягом 0,5 секунд з використанням часу затримки 0,3 сек. Напруга на капілярній голці складала 2,5 кВ для режиму іонізації позитивним зарядом і 2,9 кВ для режиму іонізації негативним зарядом. Напруга на конусі складала 20 В для обох режимів іонізації позитивним і негативним зарядом. Стандартною речовиною, яку використовували для калібрування масспектру, був лейцин-енкефалін. Методика 3 РХМС 13 UA 97826 C2 5 10 15 20 25 30 35 40 45 50 55 Те саме, що і в методиці 1, з використанням об'єму вприскування 10 мкл. Методика 4 РХМС На додаток до загальної методики А РХМС: здійснювали ВЕРХ на оберненій фазі з використанням картриджа XDB-C18 (1,8 мкм, 2,130 мм) фірм Agilent, при швидкості потоку 1 мл/хв. Умови градієнтного елюювання: 90% А (розчин ацетату амонію 0,5 г/л), 5% В (ацетонітрил), 5% С (метанол) до 50% В і 50% С протягом 6,5 хвилин, до 100% В на 7 хвилині, і повернення до початкових умов на 7,5 хвилині до 9,0 хвилин. Об'єм вприскування 2 мкл. Масспектри високого розділення (час прольоту, TOF) реєстрували лише в режимі іонізації позитивним зарядом, шляхом сканування від 100 до 750 протягом 0,5 секунд з використанням часу затримки 0,1 сек. Напруга на капілярній голці складала 2,5 кВ для режиму іонізації позитивним зарядом, і напруга на конусі складала 20 В. Стандартною речовиною, що використовували для калібрування мас-спектру, був лейцин-енкефалін. Методика 5 РХМС На додаток до загальної методики А РХМС: здійснювали ВЕРХ на оберненій фазі на колонці АСЕ-С18 (3,0 мкм, 4,630 мм) фірм Advanced Chromatography Technologies, при швидкості потоку 1,5 мл/хв. Умови градієнтного елюювання: 80% А (розчин бікарбонату амонію 1 г/л), 10% В (ацетонітрил), 10% С (метанол) до 50% В і 50% С протягом 6,5 хвилин, до 100% В на 7 хвилині, і повернення до початкових умов на 7,5 хвилині до 9,0 хвилин. Об'єм вприскування 5 мкл. Мас-спектри високого розділення (час прольоту, TOF) реєстрували лише в режимі іонізації позитивним зарядом, шляхом сканування від 100 до 750 протягом 0,5 секунд з використанням часу затримки 0,1 сек. Напруга на капілярній голці складала 2,5 кВ для режиму іонізації позитивним зарядом, і напруга на конусі складала 20 В. Стандартною речовиною, яку використовували для калібрування мас-спектру, був лейцин-енкефалін. Методика 6 РХМС На додаток до загальної методики В РХМС: здійснювали ВЕРХ на оберненій фазі на колонці YMC-Pack ODS-AQ, 502,0 мм, 5 мкм, при швидкості потоку 0,8 мл/хв. Використовували дві рухомі фази (рухома фаза А: вода з 0,1% ТФУ; рухома фаза В: ацетонітрил з 0,05% ТФУ). На першому етапі здійснювали елюювання 100% А протягом і хвилини. Потім поступово доводили склад елюента до 40% А і 60% В протягом 4 хвилин і витримували 2,5 хвилини. Використовували типовий об'єм вприскування 2 мкл. Температура печі складала 50°С. (Полярність МС: позитивна). Методика 7 РХМС На додаток до загальної методики В РХМС: здійснювали ВЕРХ на оберненій фазі на колонці YMC-Pack ODS-AQ, 502,0 мм, 5 мкм, при швидкості потоку 0,8 мл/хв. Використовували дві рухомі фази (рухома фаза А: вода з 0,1% ТФУ; рухома фаза В: ацетонітрил з 0,05% ТФУ). На першому етапі здійснювали елюювання 90% А і 10% В протягом 0,8 хвилин. Потім поступово доводили склад елюента до 20% А і 80% В протягом 3,7 хвилин і витримували 3 хвилини. Використовували типовий об'єм вприскування 2 мкл. Температура печі складала 50°С. (Полярність МС: позитивна). Опис синтезу 1 5,5,5-трифтор-4-оксо-3-фенілпент-2-енова кислота (D1) До перемішуваного розчину фенілмалеінового ангідриду (18,7 г, 0,107 моль) в ацетонітрилі (180 мл) при 0°С (баня лід/вода/хлорид натрію - температура бані -10°С) в атмосфері азоту додавали CSF (18,6 г, 0,127 моль) і потім по краплях додавали СF3SіМе3 (18,58 мл, 0,127 моль). Реакційну суміш перемішували протягом 1 г, потім розбавляли діетиловим ефіром і екстрагували 2М гідроксидом натрію (200 мл). Відокремлений водний шар підкисляли до рН=1 додаванням концентрованої хлористоводневої кислоти. Цю суміш екстрагували дихлорметаном. Відокремлений органічний шар висушували (Na 2SO4) і випаровували розчинник у вакуумі, отримуючи сполуки D1 (22,6 г, 86%) у вигляді суміші ізомерів (співвідношення 80/11 за даними РХМС). Обчислена маса для C11H7F3O3 складає 244; знайдено 243 (М-Н). Опис синтезу 2 5-феніл-6-трифторметил-2Н-піридазин-3-он (D2) 14 UA 97826 C2 5 10 До перемішуваного розчину 5,5,5-трифтор-4-оксо-3-фенілпент-2-енової кислоти (D1) (22,6 г, 0,084 моль) в суміші ацетонітрилу (150 мл) і оцетової кислоти (15 мл) додавали гідразингідрат (7,75 мл, 0,148 моль). Реакційну суміш нагрівали до кипіння зі зворотним холодильником протягом 16 г, охолоджували до кімнатної температури, розбавляли дихлорметаном і потім екстрагували 0,5М хлористоводневою кислотою (150 мл). Органічний шар відділяли, висушували (Na2SO4) і випаровували розчинник у вакуумі, отримуючи сполуки D2 (20,7 г, 100%) у вигляді суміші ізомерів (у співвідношенні 75/5 за даними РХМС). Обчислена маса для С11H7F3N2O складає 240; знайдено 239 (М-Н). Опис синтезу 3 6-хлор-4-феніл-3-трифторметилпіридазин (D3) 15 20 25 30 35 40 45 До перемішуваного розчину 5-феніл-6-трифторметил-2Н-піридазин-3-она (D2) (20,66 г, 0,086 моль) в ацетонітрилі (150 мл) додавали оксихлорид фосфору (20 мл, 0,215 ммоль) і реакційну суміш нагрівали до кипіння із зворотним холодильником протягом 1 г. Після цього реакційну суміш виливали в суміш насиченого розчину гідрокарбонату натрію, льоду і дихлорметану. Після цього додавали додаткову кількість твердого гідрокарбонату натрію до припинення виділення газу. Потім відділяли органічний шар, висушували (Na 2SO4) і випаровували розчинник у вакуумі. Потім неочищений залишок фільтрували через силікагель, промиваючи дихлорметаном для видалення мінорного ізомеру. Після випаровування розчинника неочищений продукт повторно очищали колонковою хроматографією (діоксид кремнію; 0-25% етилацетат/гептан), отримуючи D3 (7,1 г, 32%). Обчислена маса для С 11H6CIF3N2 складає 258; + знайдено 259 (МН ). Опис синтезу 4 трет-бутиловий ефір 4-(5-феніл-6-трифторметилпіридазин-3-іл)піперазин-1-карбонової кислоти (D4) До перемішуваного розчину 6-хлор-4-феніл-3-трифторметилпіридазину (D3) (7,1 г, 0,0274 моль) і N-Boc-піперазину (5,62 г, 0,0302 моль) в ацетонітрилі (150 мл) додавали диізопропілетиламін (5,1 мл, 0,0302 моль) і нагрівали суміш до 150°С протягом 20 хв при дії мікрохвильового випромінювання. Після закінчення цього часу реакційну суміш розбавляли дихлорметаном і екстрагували водою. Органічний шар відділяли, висушували (MgSO 4) і випаровували розчинники у вакуумі. Неочищений продукт очищали колонковою хроматографією (оксид кремнію; 20% етилацетат в гептані, потім 10% етилацетат в дихлорметані). Після випаровування розчинника отриманий продукт перекристалізовували з 2 гептана, отримуючи сполуки D4 (10,4 г, 93%). Обчислена маса для C20H23F3N4O складає 408; + знайдено 409 (МН ). Опис синтезу 5 5,5,5-трифтор-3-(4-фторфеніл)-4-оксопент-2-енова кислота (D5) 15 UA 97826 C2 5 10 15 20 25 До перемішуваного розчину 4-фторфенілмалеінового ангідриду (1,42 г, 7,39 ммоль) (отриманого по методиці, аналогічній описаній в Dean, W.D.; Bum, D.M. J. Org. Chem. 1993, 58, 7916-7917) в ацетонітрилі (15 мл) при 0°С (баня лід/вода/хлорид натрію, температура бані 10°С) в атмосфері азоту додавали CSF (1,1 г, 7,39 ммоль) і потім по краплях додавали СF 3SіМе3 (1 мл, 7,39 ммоль). Реакційну суміш перемішували протягом 1 г і потім розбавляли діетиловим ефіром і екстрагували 2М гідроксидом натрію (200 мл). Органічний шар видаляли і водний шар підкисляли до рН=1 додаванням концентрованої хлористоводневої кислоти. Отриману суміш екстрагували дихлорметаном, відділяли органічний шар, висушували (Na 2SO4) і видаляли розчинник у вакуумі, отримуючи сполуки D5 (1,4 г, 72%) у вигляді суміші ізомерів. Обчислена маса для C11H6F4O3 складає 262; знайдено 261 (М-Н). Опис синтезу 6 5-(4-фторфеніл)-6-трифторметил-2Н-піридазин-3-он (D6) До перемішуваного розчину 5,5,5-трифтор-3-(4-фторфеніл)-4-оксопент-2-енової кислоти (D5) (1,4 г, 5,3 ммоль) в суміші етанолу (10 мл) і оцетової кислоти (1 мл) додавали гідразингідрат (0,49 мл, 9,33 ммоль). Реакційну суміш нагрівали до кипіння зі зворотним холодильником протягом 16 г, охолоджували до кімнатної температури, розбавляли дихлорметаном і потім екстрагували 0,5М хлористоводневою кислотою (150 мл). Органічний шар відділяли, висушували (Na2SO4) і випаровували розчинник у вакуумі, отримуючи сполуки D6 (0,96 г, 70%) у вигляді суміші ізомерів. Обчислена маса для C 11H6F4N2O складає 258; + знайдено 259 (МН ). Опис синтезу 7 6-хлор-4-(4-фторфеніл)-3-трифторметилпіридазин (D7) 30 35 40 До перемішуваного розчину 5-(4-фторфеніл)-6-трифторметил-2Н-піридазин-3-она (D6) (0,96 г, 3,7 ммоль) у ацетонітрилі (10 мл) додавали оксихлорид фосфору (0,866 мл, 9,3 ммоль) і реакційну суміш перемішували при 180°С протягом 30 хв при мікрохвильовому опроміненні. Після закінчення цього часу реакційну суміш виливали в суміш насиченого розчину гідрокарбонату натрію, льоду і дихлорметану. Потім додавали додаткову кількість твердого гідрокарбонату натрію до припинення виділення газу. Потім органічний шар відділяли, висушували (Na2SO4) і випаровували розчинник у вакуумі, отримуючи сполуки D7 (0,81 г, 79%). Після обробки були виявлені лише кількості слідів небажаного ізомеру. Обчислена маса для + C11H5CIF4N2 складає 276; знайдено 277 (МН ). 16 UA 97826 C2 Опис синтезу 8 трет-бутиловий ефір карбонової кислоти (D8) 4-[5-(4-фторфеніл)-6-трифторметилпіридазин-3-іл]піперазин-1 5 10 15 20 25 До перемішуваного розчину 6-хлор-4-(4-фторфеніл)-3-трифторметилпіридазину (D7) (0,81 г, 2,93 ммоль) і N-Boc-піперазину (0,818 г, 4,39 ммоль) в ацетонітрилі (10 мл) додавали диізопропілетиламін (1 мл, 5,9 ммоль) і суміш перемішували при 80°С протягом 30 хвилин при мікрохвильовому опроміненні. Після закінчення цього часу реакційну суміш розбавляли дихлорметаном і екстрагували водою. Органічний шар відділяли, висушували (MgSO 4) і випаровували розчинники у вакуумі, отримуючи сполуки D8 (1,27 г, 62%). Обчислена маса для + C20H22F4N4O2 складає 426; знайдено 427 (МН ). Опис синтезу 9 трет-бутиловий ефір 4-(6-трифторметилпіридазин-3-іл)піперазин-1-карбонової кислоти (D9) Суміш 6-хлор-3-трифторметилпіридазину (0,666 г, 5,09 ммоль) (отриманого по методиці, описаній в Goodman, A.J.; Stanforth, S.P; Tarbit B. Tetrahedron 1999, 55, 15067-15070), N-Bocпіперазину (1,138 г, 6,11 ммоль) і диізопропілетиламіну (1,95 мл, 1,12 ммоль) в ацетонітрилі (10 мл) перемішували при 180°С протягом 30 хв при мікрохвильовому опроміненні. Розчинник випаровували у вакуумі і залишок очищали колонковою хроматографією (силікагель; гексан/етилацетат), отримуючи сполуки D9 (1,67 г, 99%) у вигляді світло-жовтої твердої + речовини. Обчислена маса для C14H19F3N4O2 складає 332; знайдено 333 (МН ). Опис синтезу 10 трет-бутиловий ефір 4-(5-йод-6-трифторметшшіридазин-3-іл)піперазин-1-карбонової кислоти (D10) 30 35 40 45 До суміші бутиллітію (2,5М в гексанах) (6,31 мл, 15,79 ммоль) і тетрагідрофурану (125 мл) при 0°С додавали 2,2,6,6-тетраметилпіперидин (3,808 мл, 22,56 ммоль). Отриману реакційну суміш потім перемішували при кімнатній температурі протягом 1 г. Суміш охолоджували до 78°С і потім додавали розчин трет-бутилового ефіру 4-(6-трифторметилпіридазин-3іл)піперазину-1-карбонової кислоти (D9) (2,5 г, 7,52 ммоль) в тетрагідрофурані (20 мл). Суміш перемішували протягом 1 г при -78°С і потім додавали розчин йоду (2,29 г, 9,024 ммоль) в тетрагідрофурані (10 мл). Цю суміш перемішували при -78°С протягом 1 г і потім розбавляли 10% розчином оцетової кислоти в тетрагідрофурані. Потім температурі суміші давали піднятися до кімнатної і після цього випаровували розчинник у вакуумі. Залишок розбавляли дихлорметаном і екстрагували водою. Органічний шар відділяли, висушували (MgSO 4), фільтрували і випаровували розчинник у вакуумі. Залишок осаджували з діетилового ефіру, отримуючи сполуки D10 (2,81 г, 82%) у вигляді світло-жовтої твердої речовини. Обчислена маса + для C14H18F3IN4O2 складає 458; знайдено 459 (МН ). Опис синтезу 11 трет-бутиловий ефір 4-[5-(2-толіл)-6-трифторметилпіридазин-3-іл]піперазин-1-карбонової кислоти (D11) 17 UA 97826 C2 5 10 15 20 25 30 35 Суміш трет-бутилового ефіру 4-(5-йод-6-трифторметилпіридазин-3-іл)піперазину-1карбонової кислоти (D10) (0,20 г, 0,436 ммоль), о-толілборонової кислоти (0,071 г, 0,523 ммоль), дихлориду 1,1'-біс(дифенілфосфіно)фероценпаладію(II), дихлорметану (0,022 г, 0,026 ммоль), 1,1'-біс(дифенілфосфіно)фероцену (0,015 г, 0,026 ммоль) і фосфату калію (0,138 г, 0,654 ммоль) в діоксані (8,5 мл) перемішували при 80°С протягом 16 г і потім при 110°С протягом 2 днів. Потім суміш фільтрували через шар діатомової землі і випаровували розчинник у вакуумі. Залишок очищали колонковою хроматографією (силікагель; дихлорметан/метанол 70/30), отримуючи D11 (0,089 г, 48%) у вигляді твердої речовини жовтого кольору. Обчислена маса для + C21H25F3N4O2 складає 422; знайдено 423 (МН ). Опис синтезу 12 трет-бутиловий ефір 4-[5-(4'-фторбіфеніл-4-іл)-6-трифторметилпіридазин-3-іл]піперазин-1карбонової кислоти (D12) Суміш трет-бутилового ефіру 4-[5-(4-бромфеніл)-6-трифторметилпіридазин-3-іл]піперазину1-карбонової кислоти (0,2 г, 0,41 ммоль) (отриманого по методиці, аналогічній описаній методиці одержання D8), 4-фторбензолборонової кислоти (0,069 г, 0,49 ммоль), трансРd(ОАс)2(Cy2NH)2 (0,015 г, 0,026 ммоль) (отриманої по методиці, описаній в Тао, В.; Boykin, D.W. Tetrahedron Lett. 2003, 44, 7993-7996) і фосфату калію (0,261 г, 1,23 ммоль) в діоксані (3 мл) перемішували при 80°С протягом ночі. Потім реакційну суміш розбавляли дихлорметаном і екстрагували насиченим розчином карбонату натрію. Органічні шари відділяли, висушували (Na2SO4), фільтрували і випаровували розчинник у вакуумі. Після цього залишок очищали колонковою хроматографією (силікагель; дихлорметан/гептан 3:7-10:0). Потрібні фракції збирали і упарювали у вакуумі, отримуючи сполуки D12 (0,115 г, 56%). Обчислена маса для + C26H26F4N4O2 складає 502; знайдено 503 (МН ). Опис синтезу 13 трет-бутиловий ефір 4-(6-хлор-5-фентлпіридазин-3-іл)піперазин-1-карбонової кислоти (D13) Суміш 3,6-дихлор-4-фенілпіридазину (0,41 г, 1,82 ммоль), отриманого по методиці, описаній в WO-2005/013907, N-Boc-піперазину (0,509 г, 2,37 ммоль) і диізопропілетиламіну (0,634 мл, 3,64) в ацетонітрилі (7,5 мл) перемішували при 180°С протягом 40 хв при мікрохвильовому опроміненні, і потім ще на протязі 30 хв. Після закінчення цього часу додавали додаткові 18 UA 97826 C2 5 кількості диізопропілетиламіну (0,1 мл, 0,57 ммоль) і N-Boc-піперазину (0,1 г, 0,54 ммоль) і отриману суміш перемішували при 180°С протягом 40 хв. Розчинник випаровували у вакуумі і потім додавали дихлорметан і насичений розчин хлориду амонію. Органічний шар відділяли, висушували (Na2SO4), фільтрували і випаровували розчинник у вакуумі. Після цього очищали залишок колонковою хроматографією (силікагель; дихлорметан і гептан/етилацетат 8:2-7:3). Потрібні фракції збирали і упарювали у вакуумі, отримуючи D13 (0,137 г, 20%) у вигляді білої + твердої речовини. Обчислена маса для C19H23CIN4O2 складає 374; знайдено 375 (МН ). Опис синтезу 14 трет-бутиловий ефір 4-(6-ціано-5-фенілпіридазин-3-іл)піперазин-1-карбонової кислоти (D14) 10 15 20 25 30 До суміші ціаниду цинку (0,077 г, 0,66 ммоль) і тетракис(трифенілфосфин) паладію(0) (0,1 г, 0,09 ммоль) додавали розчин трет-бутилового ефіру 4-(6-хлор-5-фенілпіридазин-3-іл)піперазин1-карбонової кислоти (D13) (0,137 г, 0,36 ммоль) в Ν,Ν-диметилформаміді (3,5 мл). Отриману суміш перемішували при 160°С протягом 30 хв при мікрохвильовому опроміненні. Розчинник випаровували у вакуумі, отримуючи сполуки D14 (0,133 г, кількісний вихід). Обчислена маса для + C20H23N5O2 складає 365; знайдено 366 (МН ). Опис синтезу 15 трет-бутиловий ефір 4-[5-(5-(хлортіофен-2-іл)-6-трифторметилпіридазин-3-іл]піперазин-1карбонової кислоти (D15) Суміш трет-бутилового ефіру 4-(5-йод-6-трифторметилпiридазин-3-iл)піперазин-1карбонової кислоти (D10) (0,20 г, 0,436 ммоль), 5-хлортіофен-2-боронової кислоти (0,082 г, 0,51 ммоль), тетракис(трифенілфосфин)паладію(0) (0,024 г, 0,021 ммоль) і карбонату натрію (0,103 г, 0,96 ммоль) в дихлорметані (3 мл) і воді (0,75 мл) перемішували в запаяній трубці при 110°С протягом 16 г. Потім суміш фільтрували через шар діатомової землі і випаровували розчинник у вакуумі. Залишок очищали колонковою хроматографією (силікагель; дихлорметан/10% аміак в метанолі (7М) в дихлорметані 97/3), отримуючи сполуки D15 (0,152 г, 67%) у вигляді жовтого + сиропу. Обчислена маса для C18H20CIF3N4O2S складає 448; знайдено 449 (МН ). Приклад 1 4-феніл-6-піперазин-1-іл-3-трифторметилпіридазин (Е1) 35 40 До розчину трет-бутилового ефіру 4-(5-феніл-6-трифторметилпіридазин-3-іл)піперазин-1карбонової кислоти (D4) (1,8 г, 0,0044 моль) в метанолі (125 мл) додавали кислотну форму іонообмінної смоли Amberlyst 15 (4,1 ммоль/г) (5,3 г, 0,022 моль) і реакційну суміш струшували при кімнатній температурі протягом 18 г. Після закінчення цього часу суміш фільтрували і потім додавали насичений розчин аміаку в метанолі. Суміш струшували протягом 1 г, фільтрували і 19 UA 97826 C2 5 10 15 20 25 30 фільтрат упарювали у вакуумі. Неочищений продукт кристалізували з суміші ефір/гептан, отримуючи сполуки Е1 (1,3 г, 96%). Обчислена маса для C15H15F3N4 складає 308; знайдено 309 + (МН ). Температура плавлення (ефір/гептан): 130,7°С 1 H ЯМР (500 Мгц, хлороформ-d) м.д.: 1,71 (ушир.с, 1Н), 3,01 (т, J=5,20 Гц, 4Н), 3,77 (т, J=5,20 Гц, 4Н), 6,71 (с, 1Н), 7,29-7,37 (м, 2Н), 7,42-7,49 (м, 3Н). 13 С ЯМР (126 Мгц, хлороформ-d) м.д.: 45,72 (с, 2СН2), 45,76 (с, 2СН2), 112,73 (с, СН), 122,48 (кв., J=581 Гц, С), 128,19 (с, СН), 128,36 (с, 2СН), 129,01 (с, СН), 135,66 (с, С), 140,55 (с, С), 141,03 (с, С), 160,22 (с, С). Приклад 2 6-(4-етилпіперазин-1-іл)-4-феніл-3-трифторметилпіридазин (Е2) До суміші 4-феніл-6-піперазин-1-іл-3-трифторметилпіридазин (Е1) (0,15 г, 0,49 ммоль) в тетрагідрофурані (5 мл) додавали ацетальдегід (55 мл, 0,97 ммоль). Реакційну суміш перемішували при кімнатній температурі протягом 30 хв і потім додавати триацетоксиборгідрид натрію (0,154 г, 0,73 ммоль). Реакційну суміш перемішували при кімнатній температурі протягом 16 г. Потім додавали додаткову кількість ацетальдегіду (55 мл, 0,97 ммоль) і триацетоксиборгідриду натрію (0,154 г, 0,73 ммоль) і суміш перемішували при кімнатній температурі протягом 4 г. Потім додавали дихлорметан і суміш екстрагували насиченим розчином хлориду амонію. Органічну фазу відділяли, висушували (Na 2SO4), фільтрували і випаровували розчинник у вакуумі. Залишок очищали колонковою хроматографією (силікагель; етилацетат/10% аміак в метанолі (7М) в дихлорметані 10:0-8:2). Збирали потрібні фракції, розчинник випаровували у вакуумі, залишок розчиняли в ацетонітрилі і перетворювали на сіль хлористоводневої кислоти додаванням насиченого розчину хлористоводневої кислоти в діетиловому ефірі. Отриману білу тверду речовину фільтрували і висушували, отримуючи Е2 + (0,039 г, 21%). C17H19F3N4·HCl, обчислена маса вільної основи складає 336; знайдено 337 (МН ). Температура плавлення: 281,9°С 1 H ЯМР (500 Мгц, ДМСО-d6) м.д.: 1,28 (т, J=7б22 Гц. 3Н), 2,98-3,22 (м, 4Н), 3,48-3,64 (м, 4Н), 4,73 (д, J=13,58 Гц, 2Н), 7,32-7,46 (м, 3Н), 7,46-7,60 (м, 3Н), 11,26 (ушир.с, 1H). Приклад 3 6-[4-(3,5-дифторбензил)піперазин-1-іл]-4-феніл-3-трифторметилпіридазин (Е3) 35 40 45 Суміш 4-феніл-6-піперазин-1-іл-3-трифторметилпіридазину (Е1) (0,050 г, 0,16 ммоль), 3,5дифторбензилброміду (0,031 мл, 0,24 ммоль) і диізопропілетиламіну (0,056 мл, 0,32 ммоль) в ацетонітрилі (2 мл) перемішували при 100°С протягом 10 хв при дії мікрохвильового випромінювання. Розчинник випаровували у вакуумі і потім додавали дихлорметан і хлорид амонію (10% водний розчин). Суміш фільтрували через картридж з діатомовою землею. Потім розчинник випаровували у вакуумі і залишок очищали за допомогою CC-TLC (відцентрової кругової тонкошарової хроматографії) на хроматотроні (препаративний радіальний тонкошаровий хроматограф з відцентровим прискоренням). Отриманий неочищений продукт кристалізували з суміші ефір/гептан, отримуючи сполуки Е3 (0,037 г, 52%) у вигляді твердої речовини. + Обчислена маса для C22H19F5N4 складає 434; знайдено 435 (МН ). 20 UA 97826 C2 5 10 15 20 Температура плавлення: 138,8°С 1 H ЯМР (400 Мгц, хлороформ-d) м.д.: 2,56-2,62 (м, 4Н), 3,54 (с, 2Н), 3,78-3,85 (м, 4Н), 6,72 (тт, J=8,91, 2,28 Гц, 1Н), 6,71 (с, 1H), 6,86-6,95 (м, 2Н), 7,28-7,35 (м, 2Н), 7,41-7,51 (м, 3Н). Приклад 4 цис-6-(3,5-диметилпіперазин-1-іл)-4-феніл-3-трифторметилпіридазин (Е4) Суміш 6-хлор-4-феніл-3-трифторметилпіридазину (D3) (0,15 г, 0,58 ммоль), 2,6-цисдиметилпіперазину (0,097 г, 0,87 ммоль) і диізопропілетиламіну (0,202 мл, 1,16 ммоль) в ацетонітрилі (3 мл) перемішували при 180°С протягом 30 хв при дії мікрохвильового випромінювання. Розчинник випаровували у вакуумі і потім додавали дихлорметан і насичений розчин хлориду амонію. Суміш фільтрували і розчинник випаровували у вакуумі. Залишок очищали колонковою хроматографією (силікагель; 1-3% аміак в метанолі (7М)/дихлорметан). Потрібні фракції збирали і упарювали у вакуумі. Отриманий таким чином продукт обробляли розчином хлористоводневої кислоти в діетиловому ефірі (2М), отримуючи відповідну сіль сполуки Е4 (0,058 г, 27%; ЦИС) у вигляді блідо-коричневої твердої речовини. C17H19F3N4·HCl, + обчислена маса вільної основи складає 336; знайдено 337 (МН ). Температура плавлення (ефір): 285,4°С 1 H ЯМР (400 Мгц, ДМСО-d6) м.д.: 1,32 (д, J=6,63 Гц, 6Н), 3,08 (дд, J=13,99, 11,51 Гц, 2Н), 3,30-3,41 (м, 2Н), 4,76 (д, J=13,27 Гц, 2Н), 7,36-7,43 (м, 3Н), 7,49-7,55 (м, 3Н), 9,16-9,27 (м, 1Н), 9,60 (д, J=9,74 Гц, 1Н). Приклад 5 2-(5-феніл-6-трифторметилпіридазин-3-іл)октагідропірроло[1,2-а]піразин (Е5) 25 30 35 40 45 Суміш 6-хлор-4-феніл-3-трифторметилпіридазину (D3) (0,10 г, 0,39 ммоль), октагідропірроло(1,2-а)піразину у вигляді рацемічної суміші (0,053 г, 0,42 ммоль) і диізопропілетиламіну (0,103 мл, 0,585 ммоль) в ацетонітрилі (3 мл) перемішували при 150°С протягом 30 хв при дії мікрохвильового випромінювання. Потім реакційну суміш розбавляли дихлорметаном (25 мл) і екстрагували насиченим розчином карбонату натрію (12 мл). Органічний шар відділяли, висушували (Na2SO4), фільтрували і випаровували розчинник у вакуумі. Після цього залишок очищали колонковою хроматографією (силікагель; 0-2,5% аміак в метанолі (7М)/дихлорметан). Потрібні фракції збирали і упарювали у вакуумі. Залишок осаджували з суміші ацетонітрил/гептан. Отриманий продукт обробляли розчином хлористоводневої кислоти в діетиловому ефірі (2М), отримуючи відповідну сіль сполуки Е5 (0,081 г, 54%) у вигляді білої твердої речовини. + C18H19F3N4·HCl, обчислена маса вільної основи складає 348; знайдено 349 (МН ). Температура плавлення: 104,2°С 1 H ЯМР (500 Мгц, ДМСО-d6) м.д.: 1,71-2,25 (м, 3,5Н), 2,88-3,01 (м, 0,5Н), 3,06-3,19 (м, 0,5Н), 3,19-3,60 (м, 4,5Н), 3,65 (д, J=11,85 Гц, 0,5Н), 3,83-3,98 (м, 2Н), 4,26-4,37 (м, 0,5Н), 4,86 (д, J=14,16 Гц, 0,5Н), 5,00 (д, J=13,29 Гц, 0,5Н), 7,28 (с, 0,5Н), 7,37-7,46 (м, 2,5Н), 7,47-7,57 (м, 3Н), 11,74 (с, 0,5Н), 11,87 (с, 0,5Н). Приклад 6 4-(4-фторфеніл)-6-піперазин-1-іл-3-трифторметилпіридазин (Е6) 21 UA 97826 C2 5 10 15 20 25 30 35 40 До розчину трет-бутилового ефіру 4-[5-(4-фторфеніл)-6-трифторметилпіридазин-3іл]піперазин-1-карбонової кислоти (D8) (1,25 г, 2,93 ммоль) в метанолі (50 мл) додавали кислотну форму іонообмінної смоли Amberlyst 15 (4,1 ммоль/г) (3,6 г, 14,64 ммоль) і реакційну суміш струшували при кімнатній температурі протягом 18 г. Після закінчення цього часу суміш фільтрували і потім додавали насичений розчин аміаку в метанолі. Цю суміш струшували протягом 1 г, фільтрували і фільтрат упарювали у вакуумі. Неочищений продукт очищали ВЕРХ. Потрібні фракції збирали і упарювали у вакуумі, отримуючи сполуки Е6 (0,507 г, 53%). + Обчислена маса C15H14F4N4 складає 326; знайдено 327 (МН ). Температура плавлення: 137,4°С 1 H ЯМР (400 Мгц, хлороформ-d) м.д.: 1,67 (ушир.с, 1Н), 2,99-3,05 (м, 4Н), 3,74-3,82 (м, 4Н), 6,68 (с, 1Н), 7,15 (т, J=8,71 Гц, 2Н), 7,31 (дд, J=8,50, 5,39 Гц, 2Н). Приклад 7 6-піперазин-1-іл-4-тіофен-3-іл-3-трифторметилпіридазин (Е7) До розчину трет-бутилового ефіру 4-[5-(3-тієніл)-6-трифторметилпіридазин-3-іл]піперазин-1карбонової кислоти (0,074 г, 0,18 ммоль), отриманого по методиці, аналогічній методиці одержання D8, в метанолі (5 мл) додавали кислотну форму іонообмінної смоли Amberlyst 15 (4,1 ммоль/г) (0,218 г, 0,89 ммоль) і реакційну суміш струшували при кімнатній температурі протягом 18 г. Після закінчення цього часу суміш фільтрували і потім додавали насичений розчин аміаку в метанолі. Цю суміш струшували протягом 1 г, фільтрували і фільтрат упарювали у вакуумі. Неочищений продукт кристалізували з суміші ефір/гептан, отримуючи + сполуки Е7 (0,049 г, 87%). Обчислена маса C13H13F3N4S складає 314; знайдено 315 (МН ). Температура плавлення (ефір/гептан): 244,3°С 1 H ЯМР (400 Мгц, хлороформ-d) м.д.: 1,68 (ушир.с, 1Н), 2,98-3,05 (м, 4Н), 3,73-3,81 (м, 4Н), 6,78 (с, 1Н), 7,14-7,21 (м, 1Н), 7,36-7,45 (м, 2Н). Приклад 8 6-піперазин-1-іл-4-о-толіл-3-трифторметилпіридазин (Е8) До розчину трет-бутилового ефіру 4-[5-(2-толіл)-6-трифторметилпіридазин-3-іл]піперазин-1карбонової кислоти (D11) (0,089 г, 0,21 ммоль) в метанолі (7 мл) додавали кислотну форму іонообмінної смоли Amberlyst 15 (4,1 ммоль/г) (0,257 г, 1,05 ммоль) і реакційну суміш струшували при кімнатній температурі протягом 18 г. Після закінчення цього часу, суміш фільтрували і потім додавали насичений розчин аміаку в метанолі. Цю суміш струшували протягом 1 г, фільтрували і фільтрат упарювали у вакуумі. Залишок очищали ВЕРХ і збирали потрібні фракції, отримуючи сполуки Е8 (0,026 г, 50%) у вигляді твердої речовини. Обчислена + маса C16H17F3N4 складає 322; знайдено 323 (МН ). 22 UA 97826 C2 H ЯМР (400 Мгц, ДМСО-d6) м.д.: 2,05 (с, 3Н), 2,74-2,83 (м, 4Н), 3,37 (ушир.с, 1Н), 3,62-3,72 (м, 4Н), 7,15 (т, J=3,63 Гц, 2Н), 7,26 (тд, J=7,26, 1,66 Гц, 1Н), 7,31-7,38 (м, 2Н). Приклад 9 4-(4'-фторбіфеніл-4-іл)-6-піперазин-1-іл-3-трифторметилпіридазин (Е9) 1 5 10 15 20 25 30 35 Суміш трет-бутилового ефіру 4-[5-(4'-фторбіфеніл-4-іл)-6-трифторметилпіридазин-3іл]піперазин-1-карбонової кислоти (D12) (0,115 г, 0,23 ммоль) і трифтороцетової кислоти (2 мл) в дихлорметані (8 мл) перемішували при кімнатній температурі протягом 2 г. Розчинник випаровували у вакуумі і потім додавали дихлорметан і насичений розчин карбонату натрію. Органічні шари відділяли, висушували (Na2SO4), фільтрували і випаровували розчинник у вакуумі. Після цього очищали залишок колонковою хроматографією (силікагель; 1-3% аміак в метанолі (7М)/дихлорметан). Потрібні фракції збирали і упарювали у вакуумі, отримуючи сполуки Е9 (0,084 г, 91%). + Обчислена маса C21H18F4N4 складає 402; знайдено 403 (МН ). Температура плавлення: 161,9°С 1 H ЯМР (400 Мгц, хлороформ-d) м.д.: 1,72 (ушир.с, 1Н), 2,99-3,05 (м, 4Н), 3,75-3,82 (м, 4Н), 6,74 (с, 1Н), 7,13-7,20 (м, 2Н), 7,40 (д, J=8,29 Гц, 2Н), 7,57-7,64 (м, 4Н). Приклад 10 4-феніл-6-піперазин-1-ілпіридазин-3-карбонітрил (Е10) До розчину трет-бутилового ефіру 4-(6-ціано-5-фенілпіридазин-3-іл)шперазин-1-карбонової кислоти (D14) (0,133 г, 0,37 ммоль) в метанолі (10 мл) додавали кислотну форму іонообмінної смоли Amberlyst 15 (4,1 ммоль/г) (1,3 г, 5,3 ммоль) і реакційну суміш струшували при кімнатній температурі протягом 18 г. Після закінчення цього часу суміш фільтрували і потім додавали насичений розчин аміаку в метанолі. Цю суміш струшували протягом 1 г, фільтрували і фільтрат упарювали у вакуумі. Залишок очищали ВЕРХ. Збирали потрібні фракції і упарювали у вакуумі, отримуючи сполуки Е10 (0,06989 г, 72%) у вигляді твердої речовини білого кольору. Обчислена + маса C15H15N5 складає 265; знайдено 266 (МН ). Температура плавлення: 271,6°С 1 H ЯМР (400 Мгц, ДМСО-d6) м.д.: 2,77-2,84 (м, 4Н), 3,34 (ушир.с, 1Н), 3,71-3,80 (м, 4Н), 7,29 (с, 1Н), 7,55-7,61 (м, 3Н), 7,66-7,72 (м, 2Н). Приклад 27 4-(5-хлортіофен-2-іл)-6-піперазин-1-іл-3-трифторметилпіридазин (Е27) 23 UA 97826 C2 5 10 15 До розчину трет-бутилового ефіру 4-[5-(5-хлортіофен-2-іл)-6-трифторметилпіридазин-3іл]піперазин-1-карбонової кислоти (D15) (0,114 г, 0,25 ммоль) в метанолі (10 мл) додавали кислотну форму іонообмінної смоли Amberlyst 15 (4,1 ммоль/г) (0,305 г. 1,25 ммоль) і реакційну суміш струшували при кімнатній температурі протягом 18 г. Після закінчення цього часу суміш фільтрували і потім додавали насичений розчин аміаку в метанолі. Цю суміш струшували протягом 1 г, фільтрували і фільтрат упарювали у вакуумі. Після цього очищали залишок колонковою хроматографією (силікагель; 3% розчину аміаку в метанолі (7М)/дихлорметан). Потрібні фракції збирали і упарювали у вакуумі. Отриманий продукт розчиняли в 2М розчині хлористоводневої кислоти в діетиловому ефірі і суміш перемішували при кімнатній температурі протягом 16 г. Розчинник випаровували у вакуумі. Отриману тверду речовину розтирали з діетиловим ефіром, отримуючи сполуки Е27 (0,062 г, 87%). Обчислена + маса C13H12CIF3N4S складає 348; знайдено 349 (МН ). Температура плавлення: розкладається. 1 Н ЯМР (500 Мгц, ДМСО-d6) м.д.: 3,24 (ушир.с, 4Н), 4,07 (д, J=5,2 Гц, 4Н), 7,23 (д, J=3,8 Гц, 1Н), 7,26 (д, J=3,8 Гц, 1Н), 7,41 (с, 1Н), 9,45 (ушир.с, 2Н). Приклад 40 4-феніл-6-піперазин-1-іл-3-трифторметилпіридазину моногідрохлорид (Е40) 20 25 30 35 До розчину Е1 (16 г, 51,90 ммоль) в 2-бутаноні (400 мл), нагрітому до 50°С, по краплях додавали розчин хлористоводневої кислоти в 2-пропанолі (6н, 51,90 ммоль). Суміш нагрівали до кипіння із зворотним холодильником протягом 90 хвилин і потім перемішували протягом 2 годин при 50°С і після цього протягом ночі при кімнатній температурі. Кристали, що випали в осад, відділяли фільтруванням і висушували у вакуумі при 45°С, отримуючи Е40 (10,4 г, 58%). Температура плавлення: >185°С (з розкладанням). Сполуки прикладів (Е11-Е19) отримували за методиками, аналогічними описаним в прикладі (Е6). Сполуку прикладу (Е20) отримували зняттям захисту зі сполуки, отриманої в описі синтезу (D13) по методиці, аналогічній описаній для прикладу (Е1). Сполуку прикладу (Е28) отримували по аналогії з (Е27), але із застосуванням карбонату калію як основи і 1,4-діоксану як розчинника. Сполуки прикладів (Е29) (толуол/етанол/H2О), (Е30) (толуол/етанол/Н2O), (E31) (1,4діоксан/Н2О), (Е32) (1,4-діоксан/Н2О), (Е33) (1,4-діоксан/Н2О), (Е34) (1,4-діоксан/Н2О) і (Е35) (1,4діоксан/Н2О) отримували за методиками, аналогічними методиці, описаній для сполуки прикладу (Е27), але з використанням розчинників, вказаних для кожного випадку відповідно. Сполуки прикладів (Е18, Е27, Е28, Е31, Е32, Е33 і Е34) виділяли у вигляді солей хлористоводневої кислоти. Значення в колонці Мол. маса вільна основа є точним значенням маси, обчисленим з використанням точних значень мас найбільш поширених ізотопів. 40 24 UA 97826 C2 25 UA 97826 C2 5 Сполуки прикладу (Е21) отримували за методикою, аналогічною методиці одержання, описаною для (Е3), сполуки прикладів (Е22, Е24 і Е25) отримували за методикою, аналогічною методиці, описаною для одержання (Е2), сполуки (Е23) отримували з (E1) шляхом відновлювального амінування з використаним (1-етоксіциклопропоксі) триметилсілану, слідуючи методиці, описаній в Gillaspy, M.L.; Lefker, B.A.; Hada, V.A.; Hoover, D.J. Tetrahedron Letters 1995, 26 UA 97826 C2 5 36, 7399-7407, сполуки E(26) отримували за методикою, аналогічною методиці, описаною для одержання (Е4), і сполуки прикладів (Е36, Е37, Е38 і Е39) отримували за методикою, аналогічною методиці одержання (Е2), але використовуючи як вихідну сполуку гідрохлорид сполуки Е1, дихлорметан як розчинник і триетиламін відповідно. Сполуки прикладів (Е2), (Е4), (Е5), (Е22) і (Е26) виділяли у вигляді гідрохлоридів. Сполуки прикладів (Е5) і (Е26) (транс) отримували у вигляді рацемічних сумішей. 27 UA 97826 C2 Фармакологія In vitro спорідненість до зв'язування з рецептором D2L людини 28
ДивитисяДодаткова інформація
Назва патенту англійськоюFast dissociating dopamine 2 receptor antagonists
Автори англійськоюMacdonald, Gregor, James, Langlois, Xavier, Jean, Michel, Bartolome-Nebreda, Jose, Manuel, van Gool, Michiel, Luc, Maria
Назва патенту російськоюБыстро диссоциирующие антагонисты рецептора 2 дофамина
Автори російськоюМакдональд Грегор Джеймс, Ланглуа Ксавье Жан Мишель, Бартоломе-Небреда Хосе Мануель, ван Гоол Мишель Люк Мария
МПК / Мітки
МПК: C07D 409/04, A61P 25/18, A61K 31/495, C07D 237/24, C07D 237/20, C07D 487/04
Мітки: антагоністи, дофаміну, рецептора, швидкої, дисоціюючі
Код посилання
<a href="https://ua.patents.su/36-97826-shvidko-disociyuyuchi-antagonisti-receptora-2-dofaminu.html" target="_blank" rel="follow" title="База патентів України">Швидко дисоціюючі антагоністи рецептора 2 дофаміну</a>
Попередній патент: Ланцюг, який містить з’єднані між собою ланки, і спосіб його зміцнення
Наступний патент: Запити ресурсів для системи безпровідного зв’язку
Випадковий патент: Робочий орган верстата для розколювання деревини












