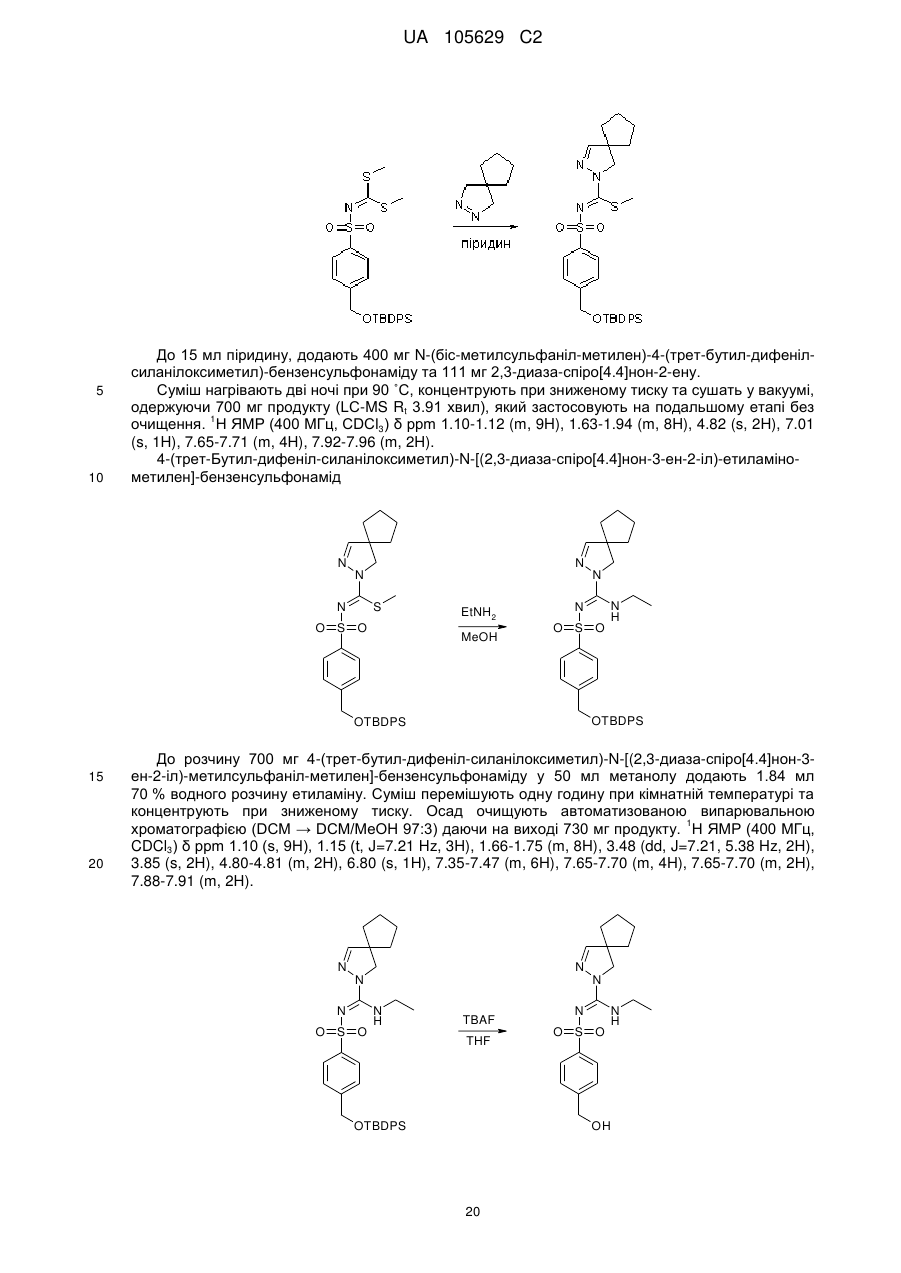
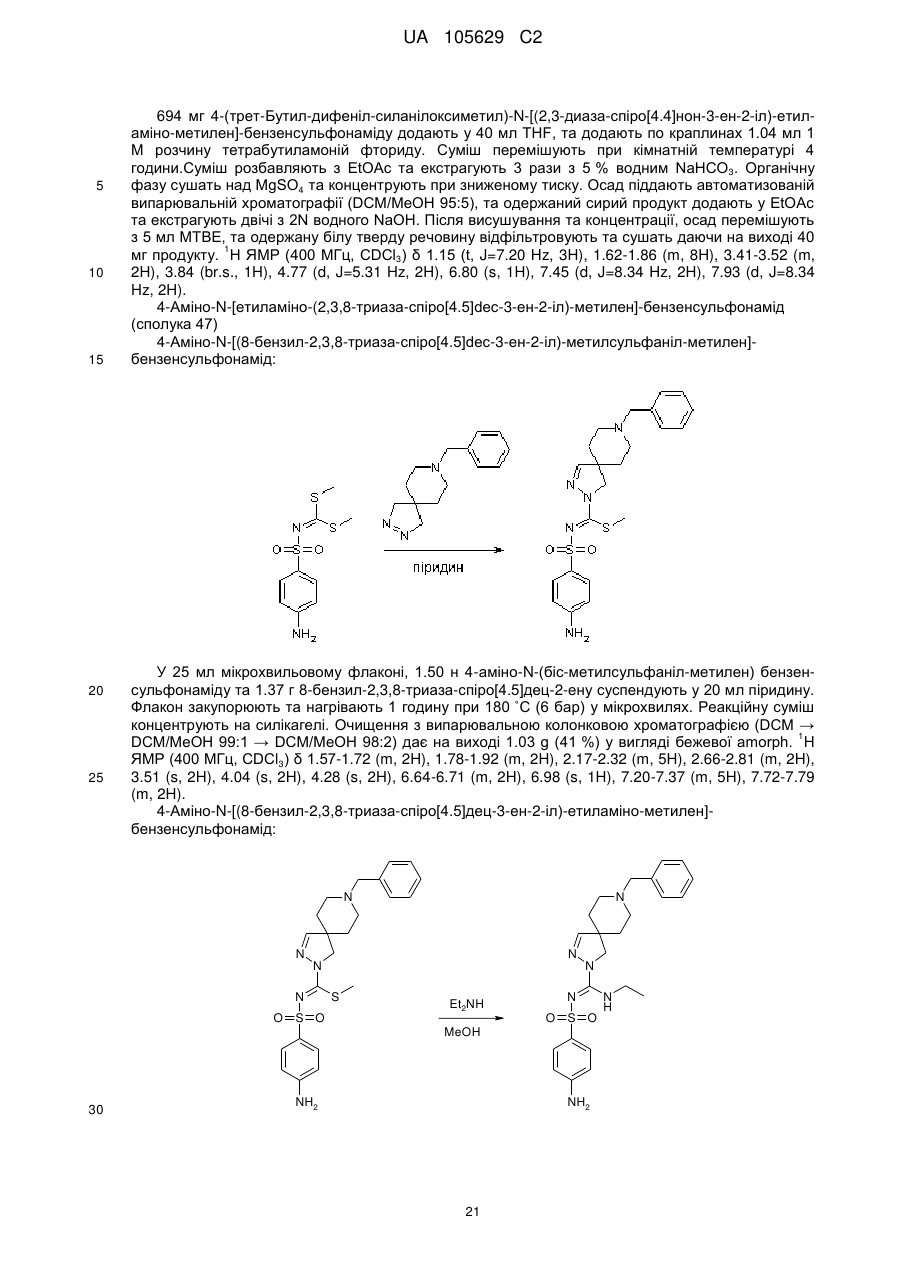
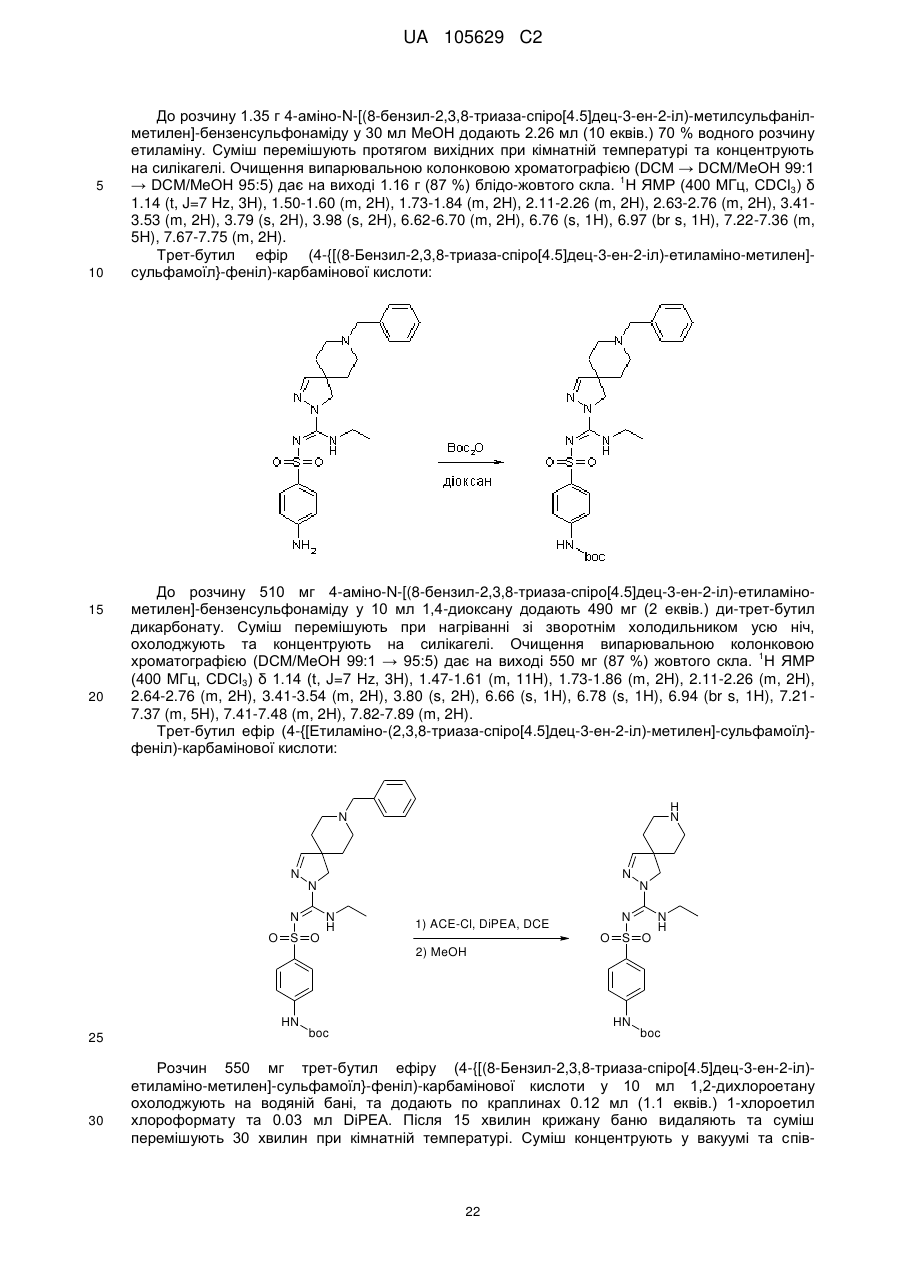
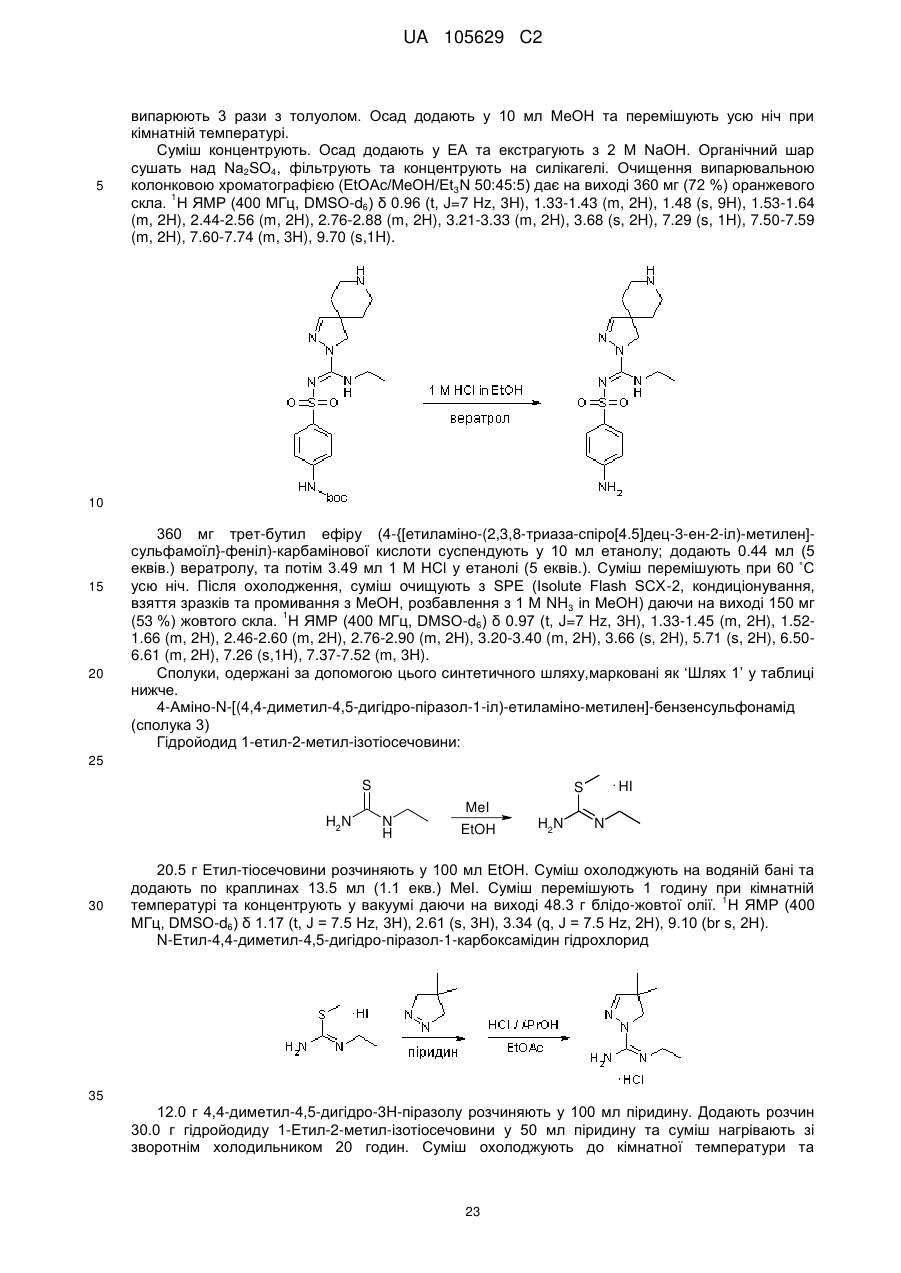
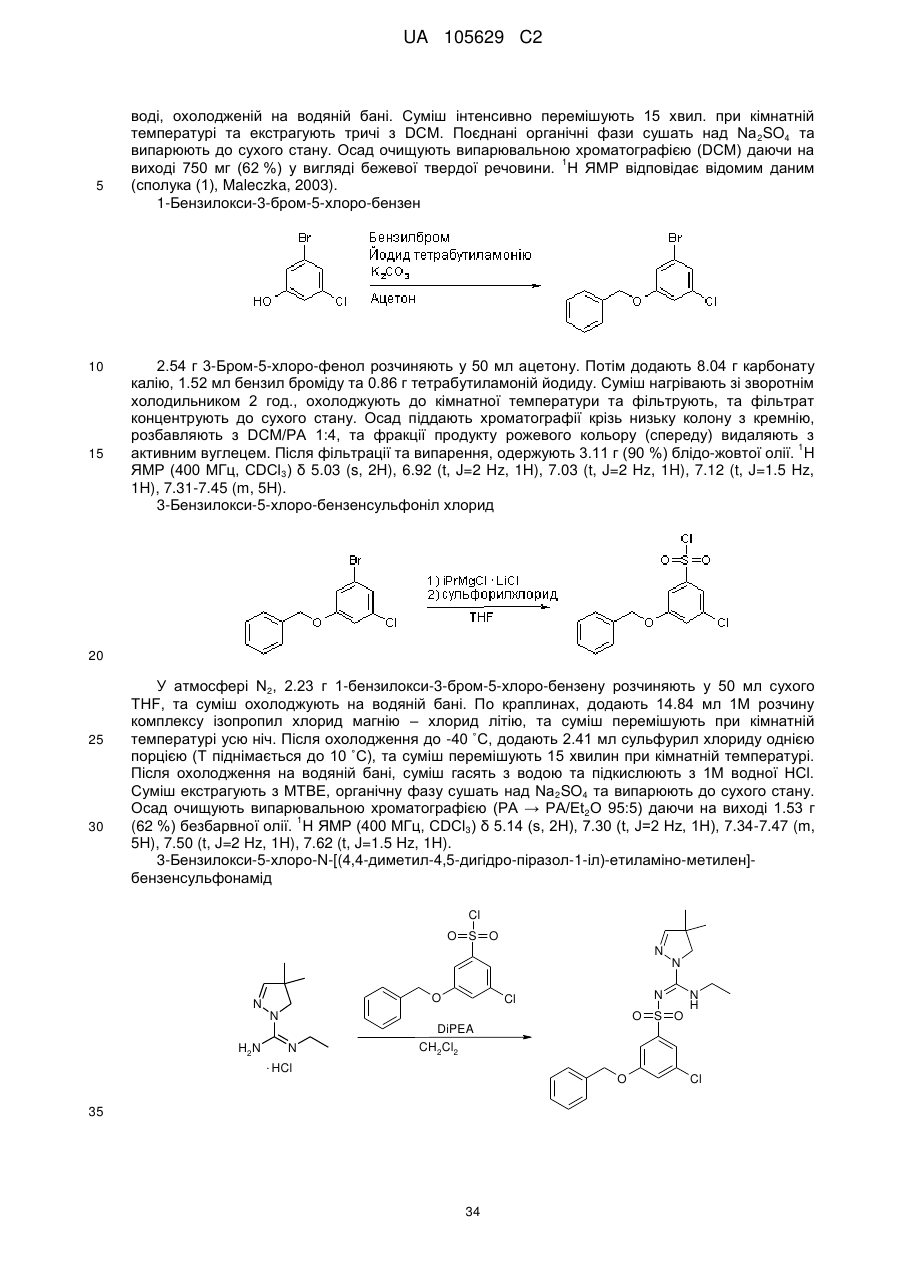
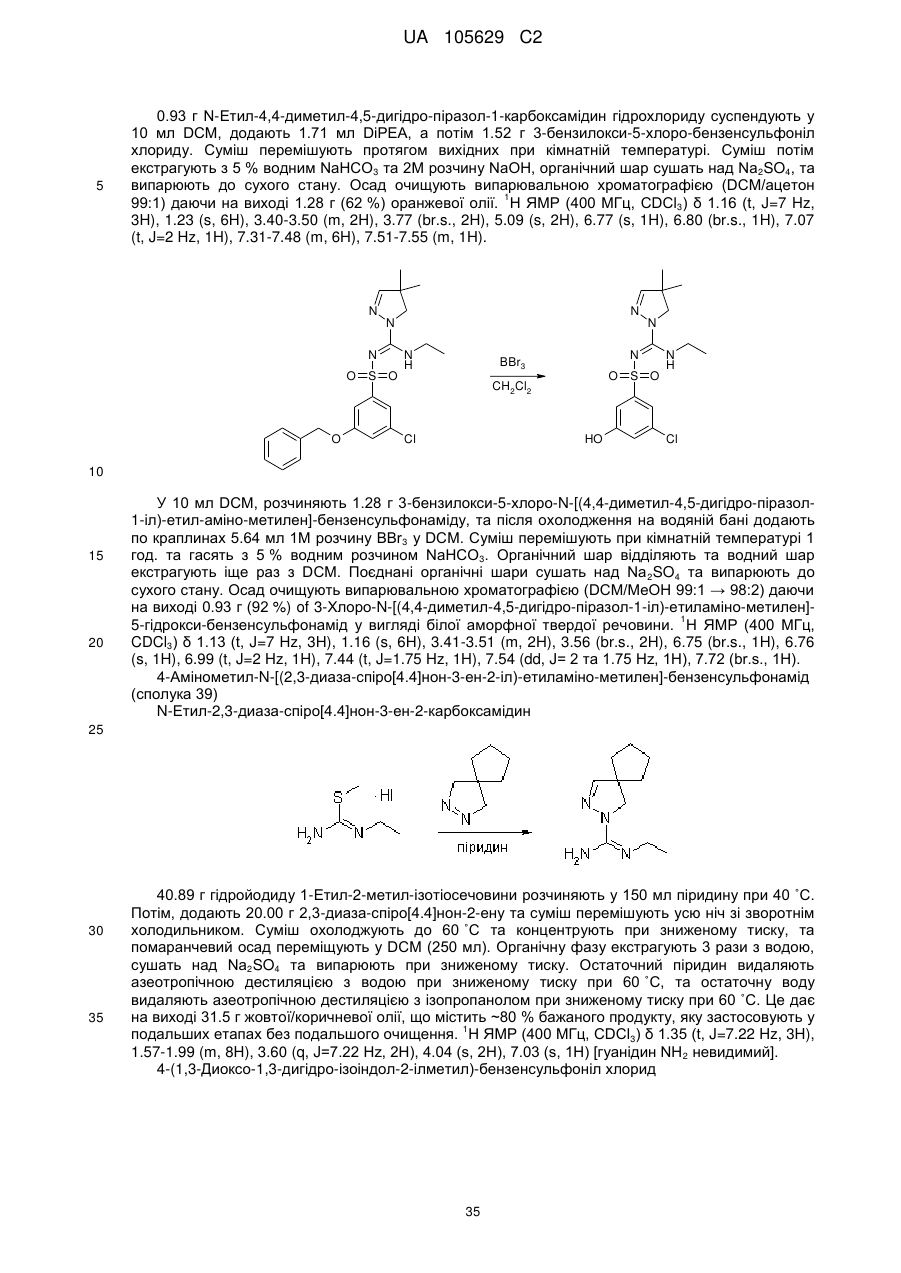
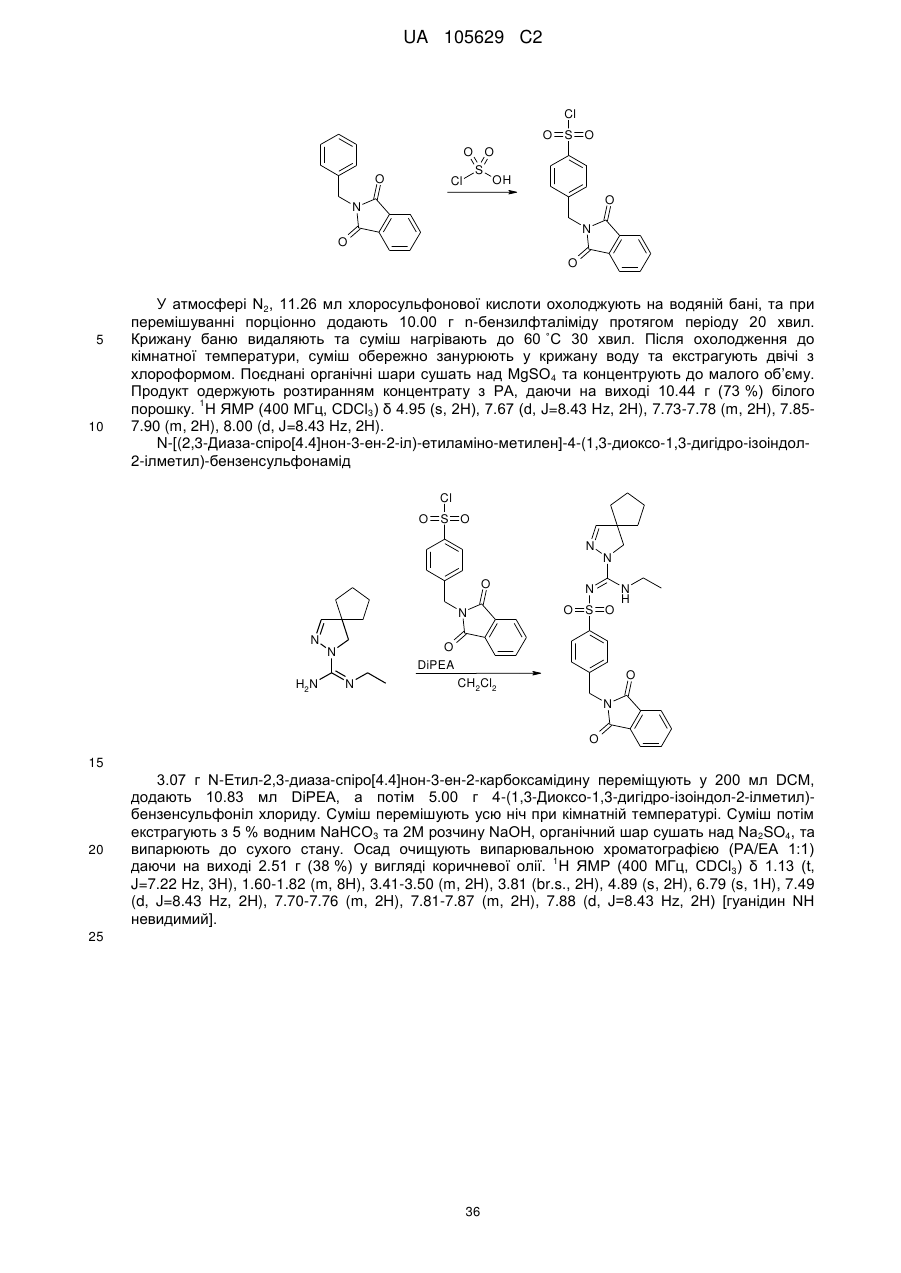
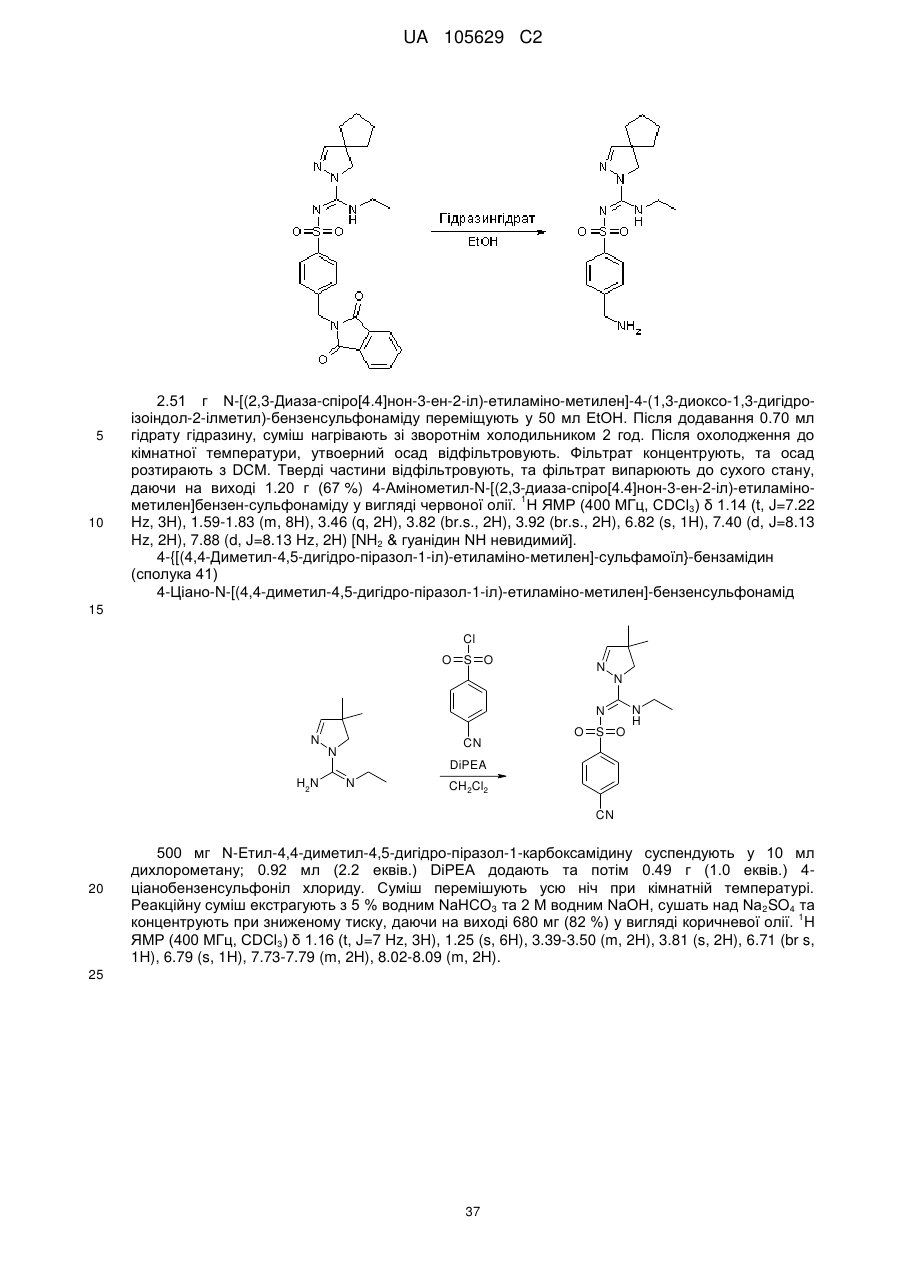
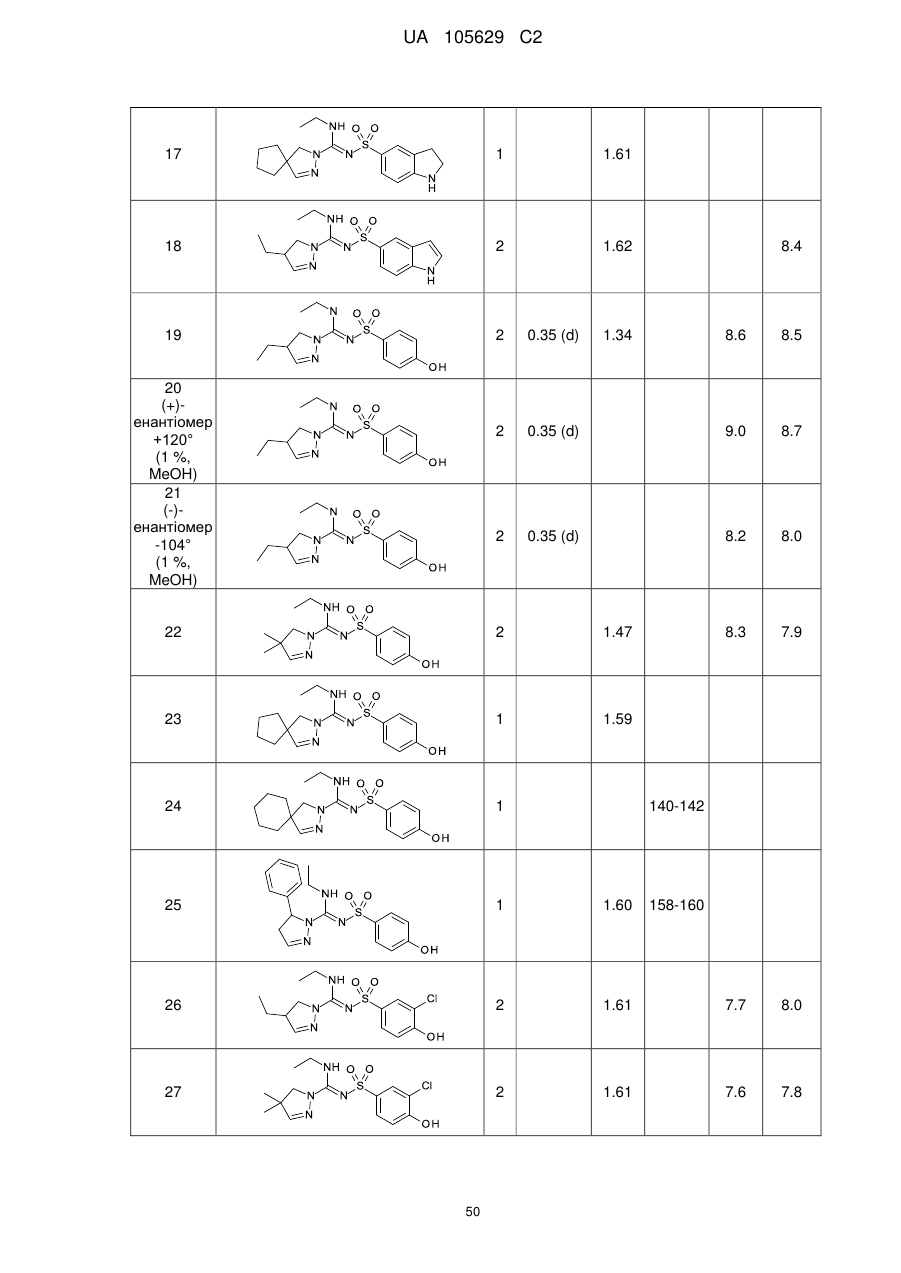
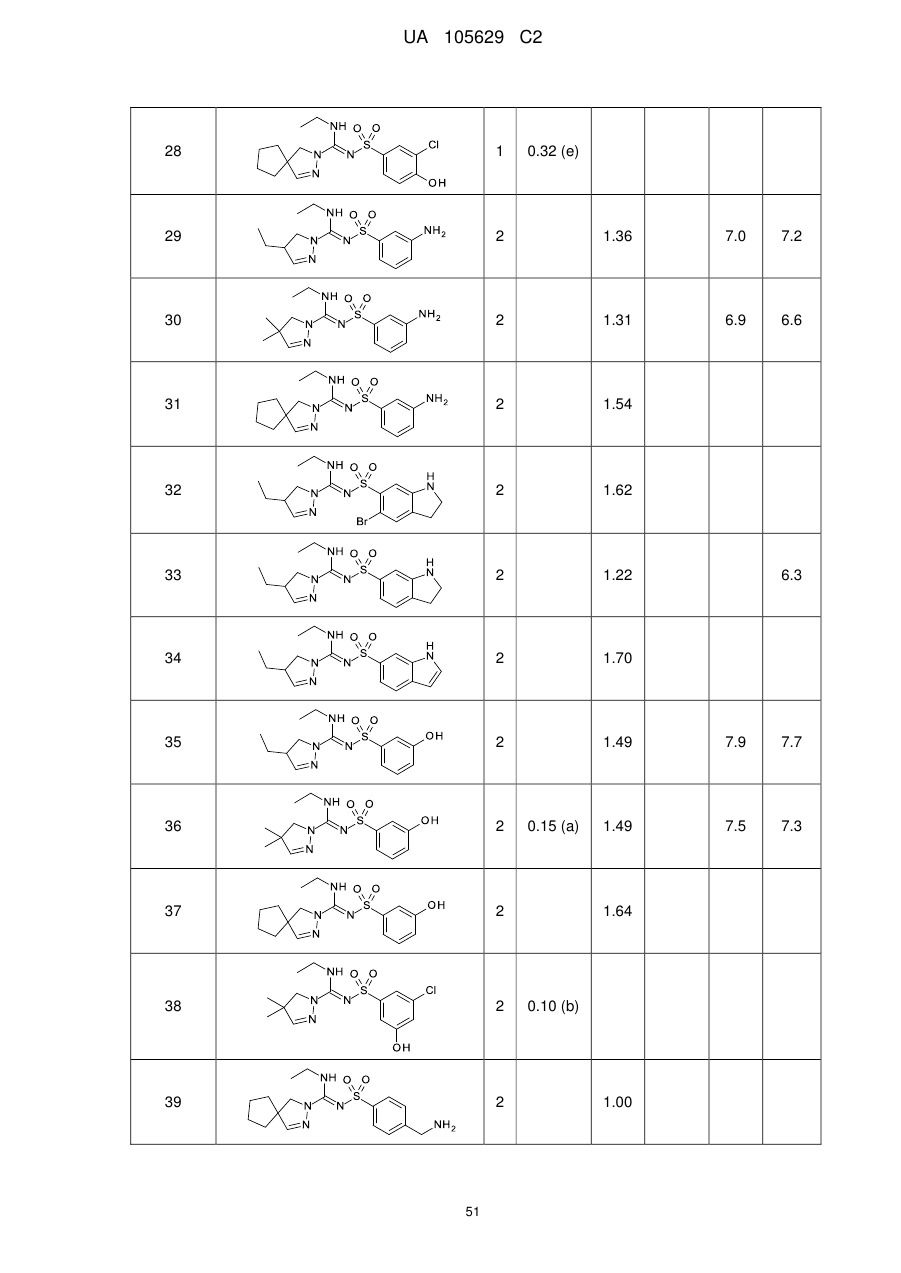
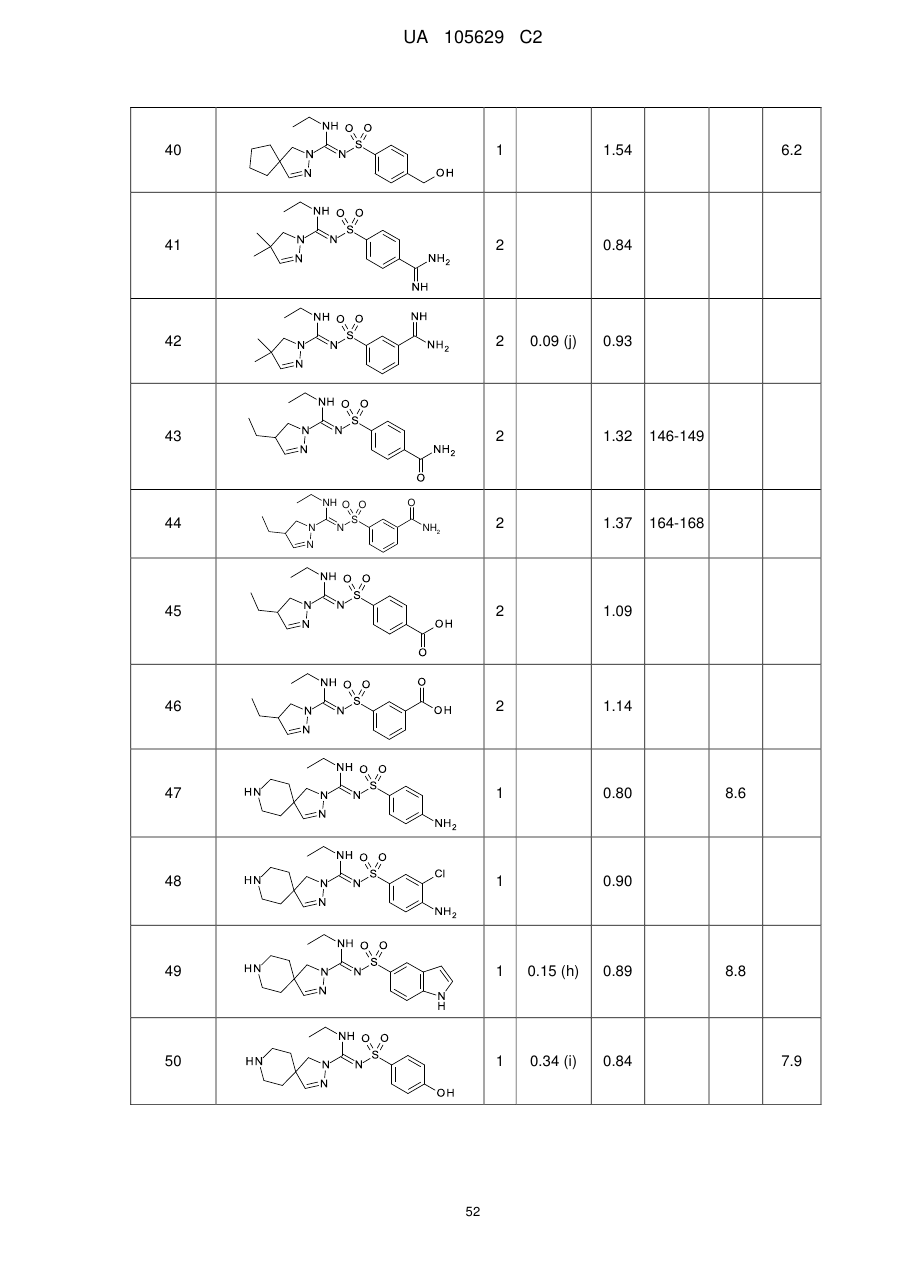
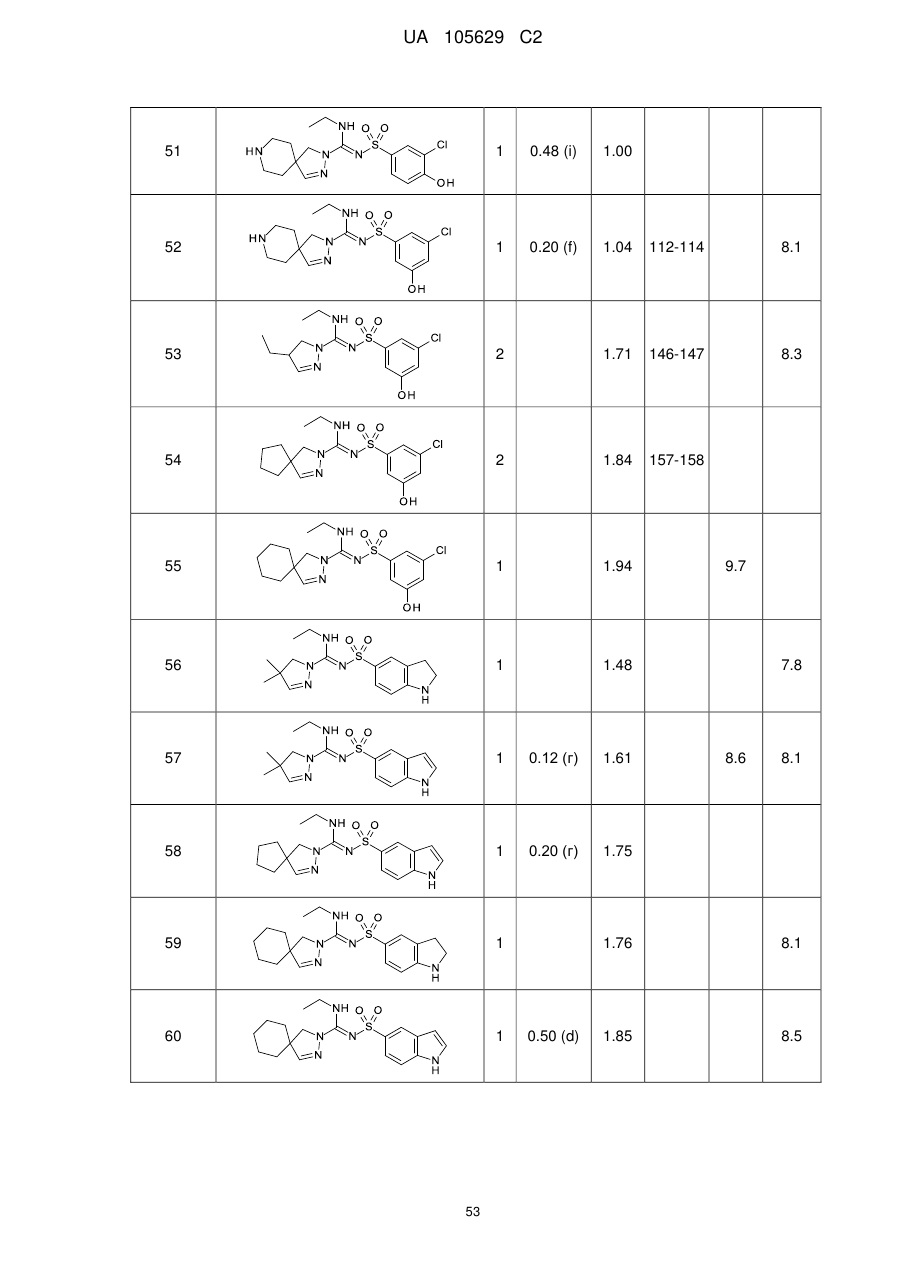
Похідні арилсульфоніл піразолін карбоксамідину як антагоністи 5-нт6
Номер патенту: 105629
Опубліковано: 10.06.2014
Автори: Крузе Корнеліс Г., Нойт Мартіна А.В. ван дер, Левезійн Арнольд ван, Стойт Аксель, Венхорст Дженніфер, Ренсінк Агата А.М., Хаан Мартін де, Івема Баккер Воутер І.
Формула / Реферат
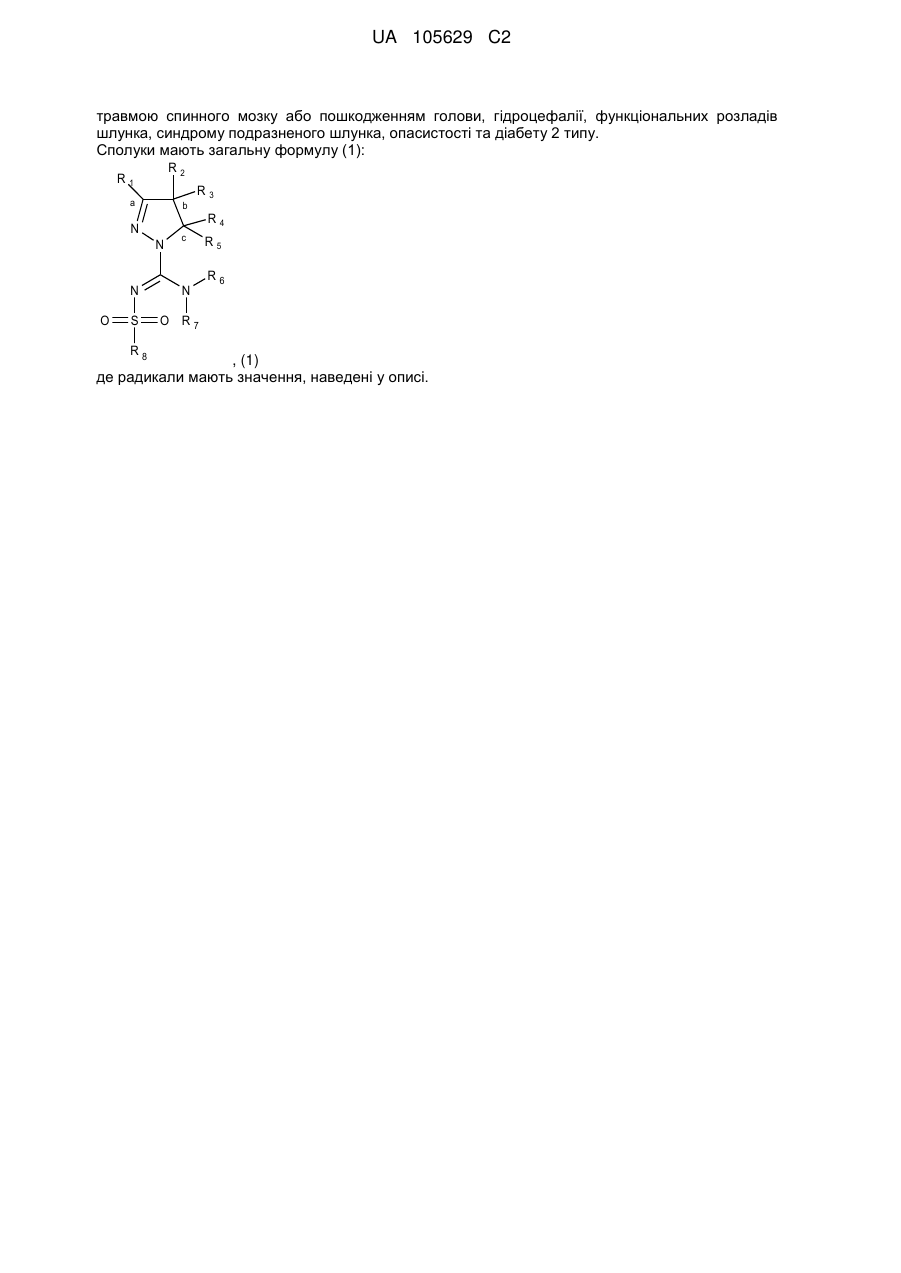
1. Сполука формули (1)
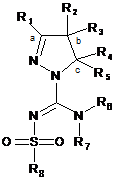 (1)
(1)
або її таутомер, стереоізомер, N-оксид або фармакологічно прийнятна сіль, де:
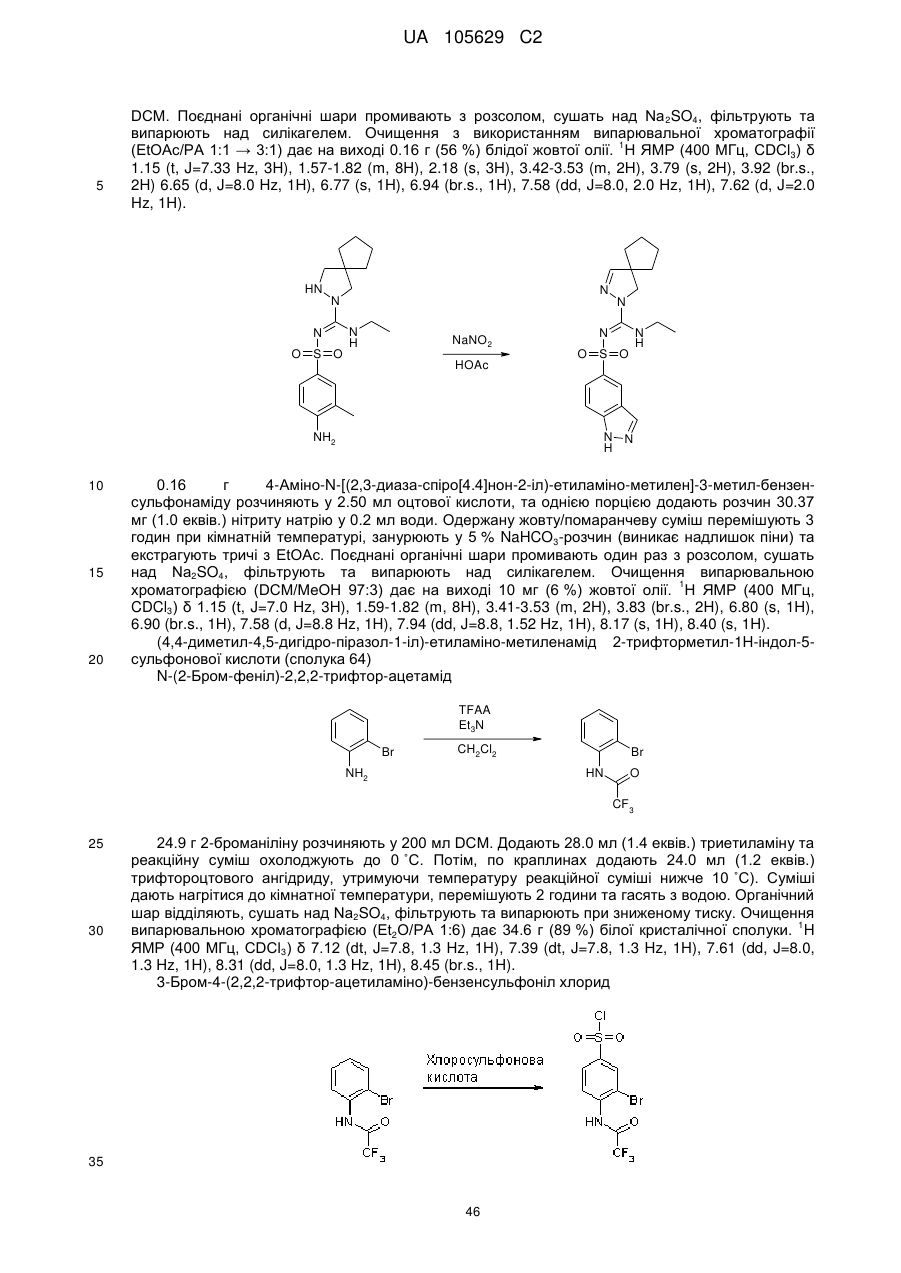
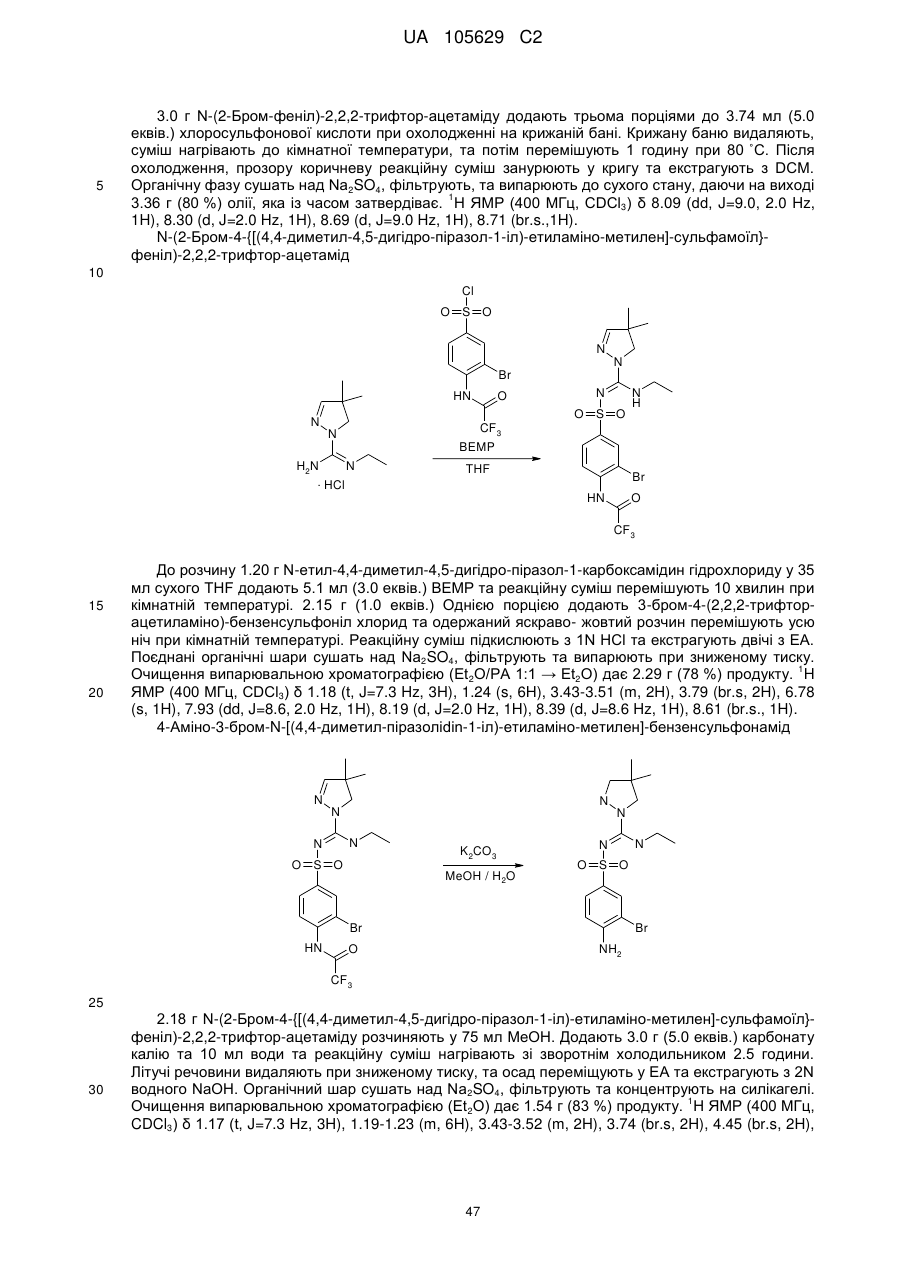
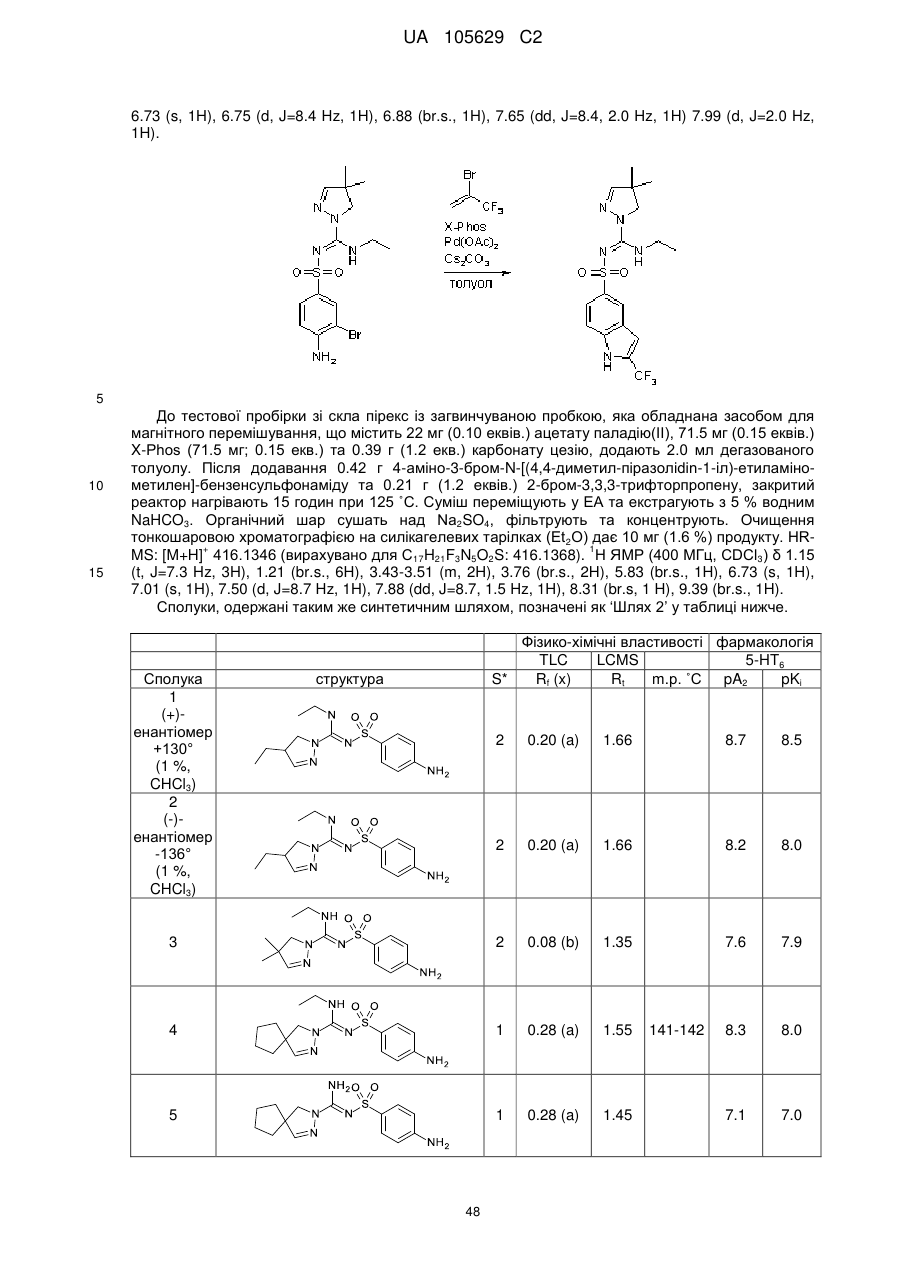
R1 вибраний з-поміж водню або алкіл(С1-4)групи, вибірково заміщеної одним або більше атомами галогену або гідроксильною групою,
R2 та R3 незалежно вибрані з-поміж водню, гідроксильної групи або алкіл(С1-4)групи, вибірково заміщеної одним або більше замісниками Q, незалежно вибраними з-поміж: галогену, алкілу(С1-4), алкенілу(С1-4), алкінілу(С1-4), CF3, NH2, NНалкілу(С1-4), N[алкілу(С1-4)]2, ОН, =O, O-алкілу(С1-4) або OCF3, або
R1 та R2, разом з атомами вуглецю, маркованими 'а' та 'b', утворюють С5-8-циклоалкільне кільце, вибірково заміщене одним або більше атомами галогену, гідроксильною групою або алкіл(С1-4)групою, або
R2 та R3, разом з атомом вуглецю, маркованим 'b', утворюють С3-8-циклоалкільне або С4-8-гетероциклоалкільне кільце, вибірково заміщене одним або більше замісниками Q, як визначено вище,
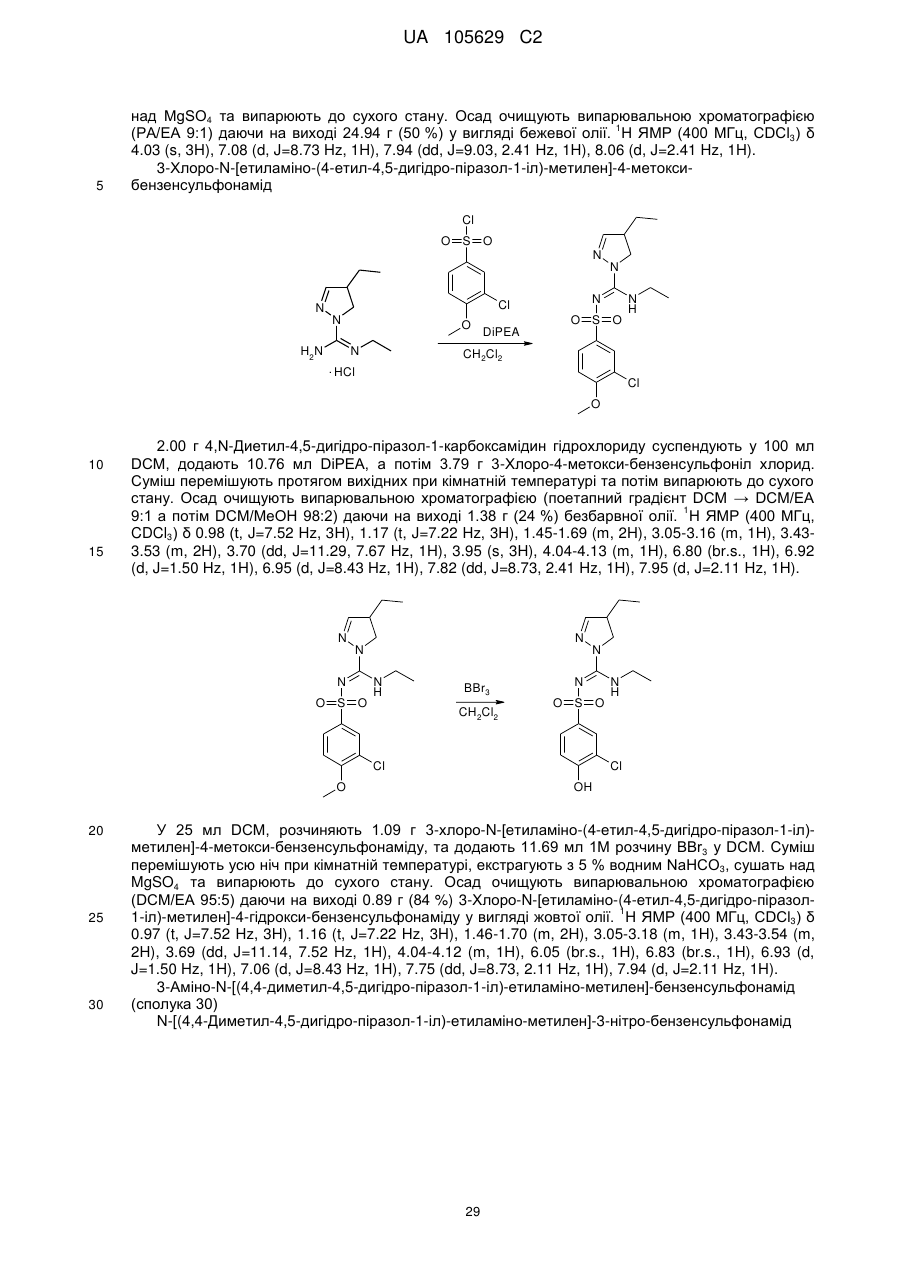
R4 та R5 незалежно вибрані з-поміж водню або алкіл(С1-4)групи, вибірково заміщеної одним або більше замісниками Q, як визначено вище, або
R4 тa R5 незалежно вибрані з-поміж моноциклічної або конденсованої біциклічної ароматичної або гетероароматичної групи, вибірково заміщеної одним або більше замісниками Q, як визначено вище, за умови, що Q не може бути =О (кето) у ароматичних кільцях, або
R3 та R4, разом з атомами вуглецю, маркованими 'b' та 'с', утворюють С3-8-циклоалкільне або С5-8-гетероциклоалкільне кільце, вибірково заміщене одним або більше замісниками Q, як визначено вище,
R6 та R7 незалежно вибрані з-поміж водню або алкіл(С1-4)групи, вибірково заміщеної одним або більше атомами галогену або гідроксильною групою, або діалкіл(С1-3)аміноалкіл(С1-3)групою, або
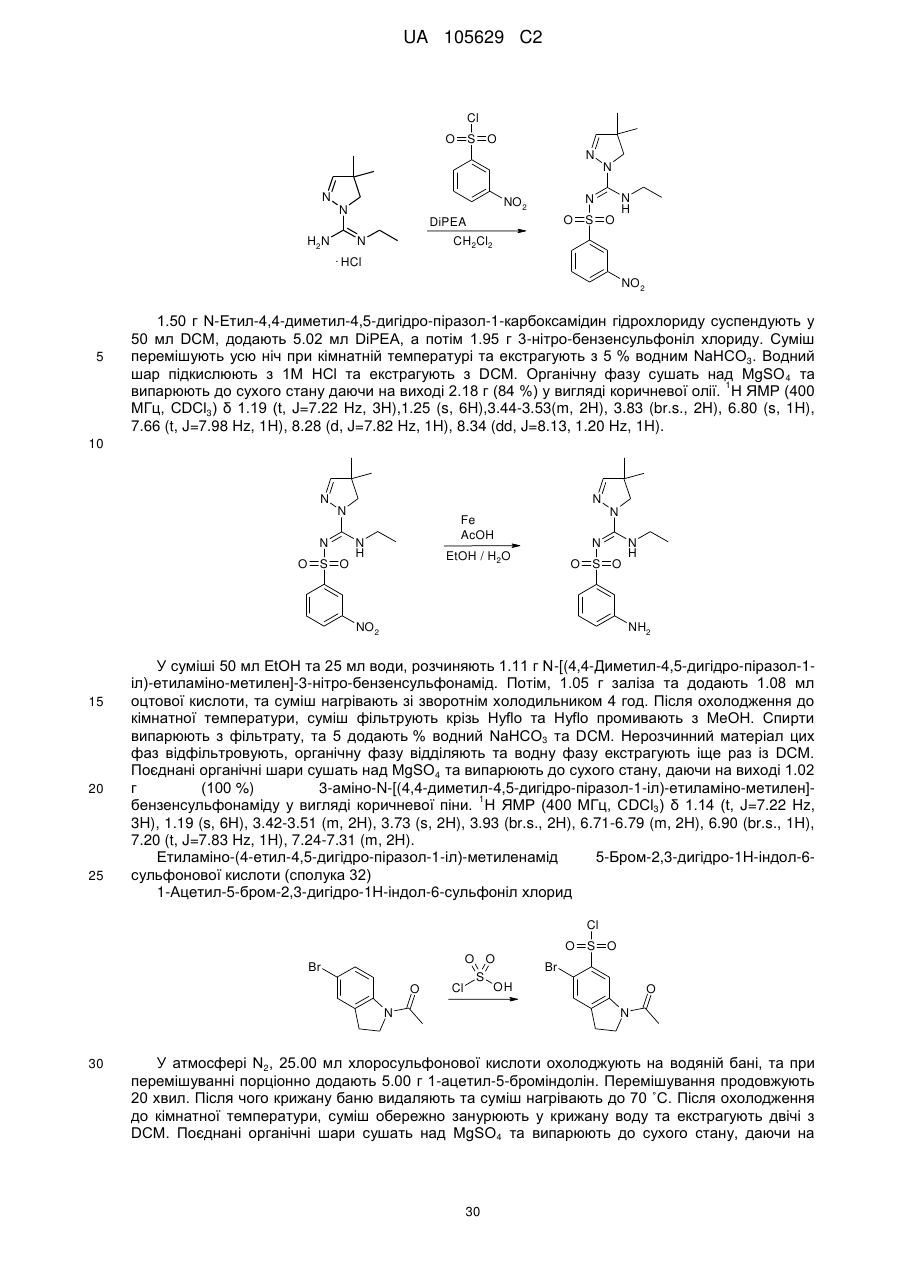
R6 та R7 незалежно вибрані з-поміж моноциклічної або конденсованої біциклічної ароматичної або гетероароматичної групи, вибірково заміщеної одним або більше замісниками Q, як визначено вище, або
R6 та R7 незалежно є С5-8-циклоалкільна група або С5-8-гетероциклоалкільна група, вибірково заміщена одним або більше замісниками Q, як визначено вище, або
R6 та R7, разом з атомом азоту, до якого вони приєднані, утворюють С5-8-гетероциклоалкільну групу, вибірково заміщену одним або більше замісниками Q, як визначено вище,
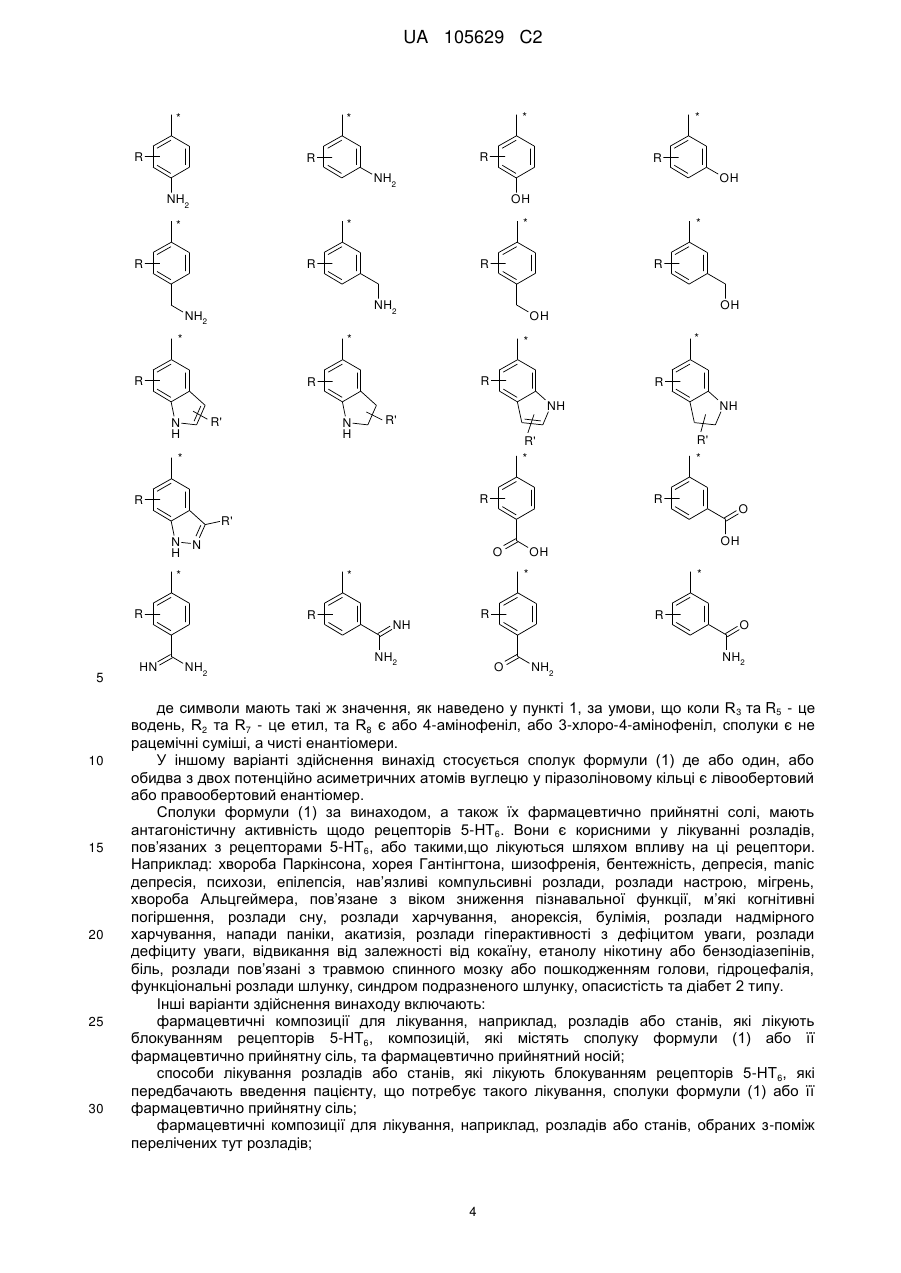
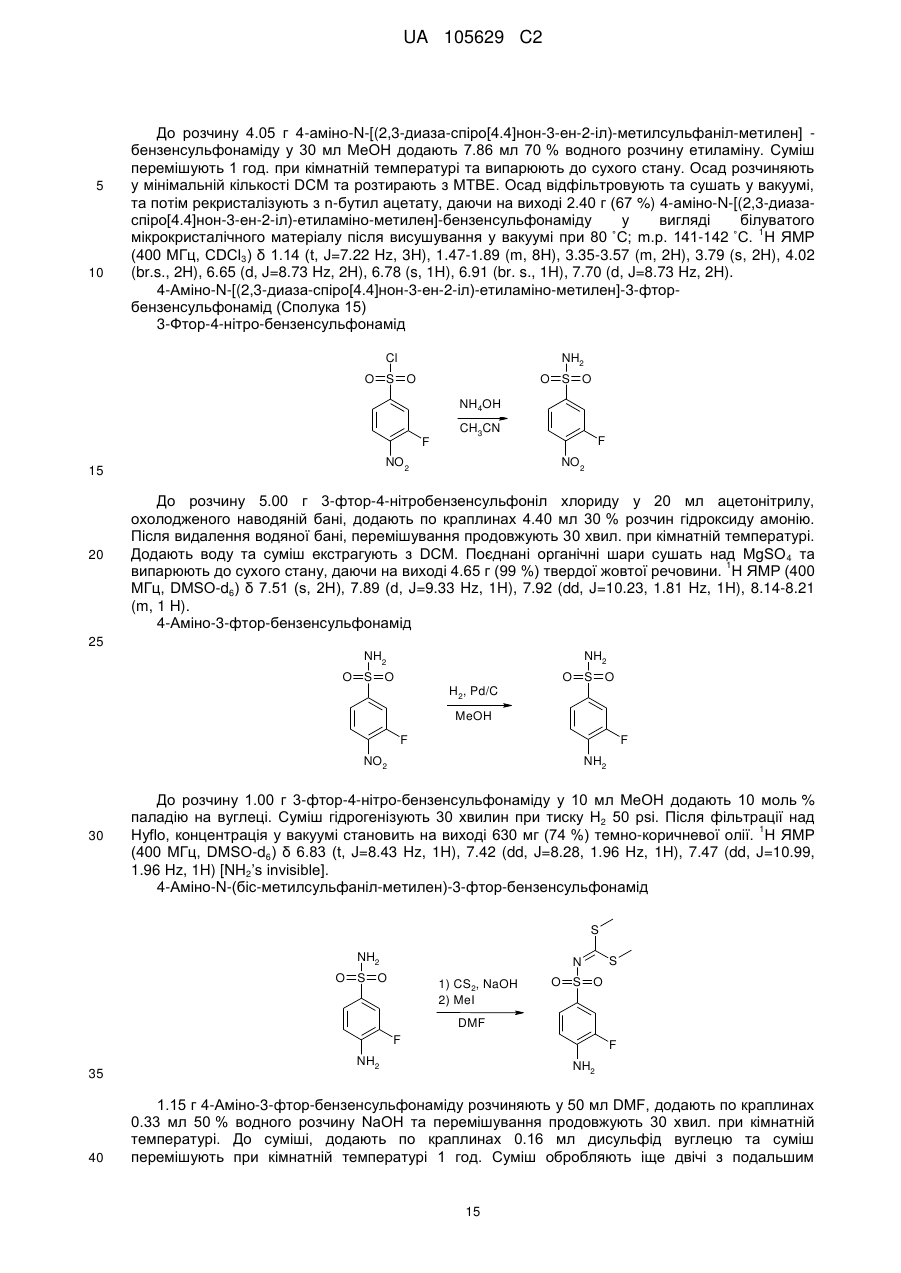
R8 - це феніл, заміщений групою R'' та (R''')р, або група, вибрана з-поміж:
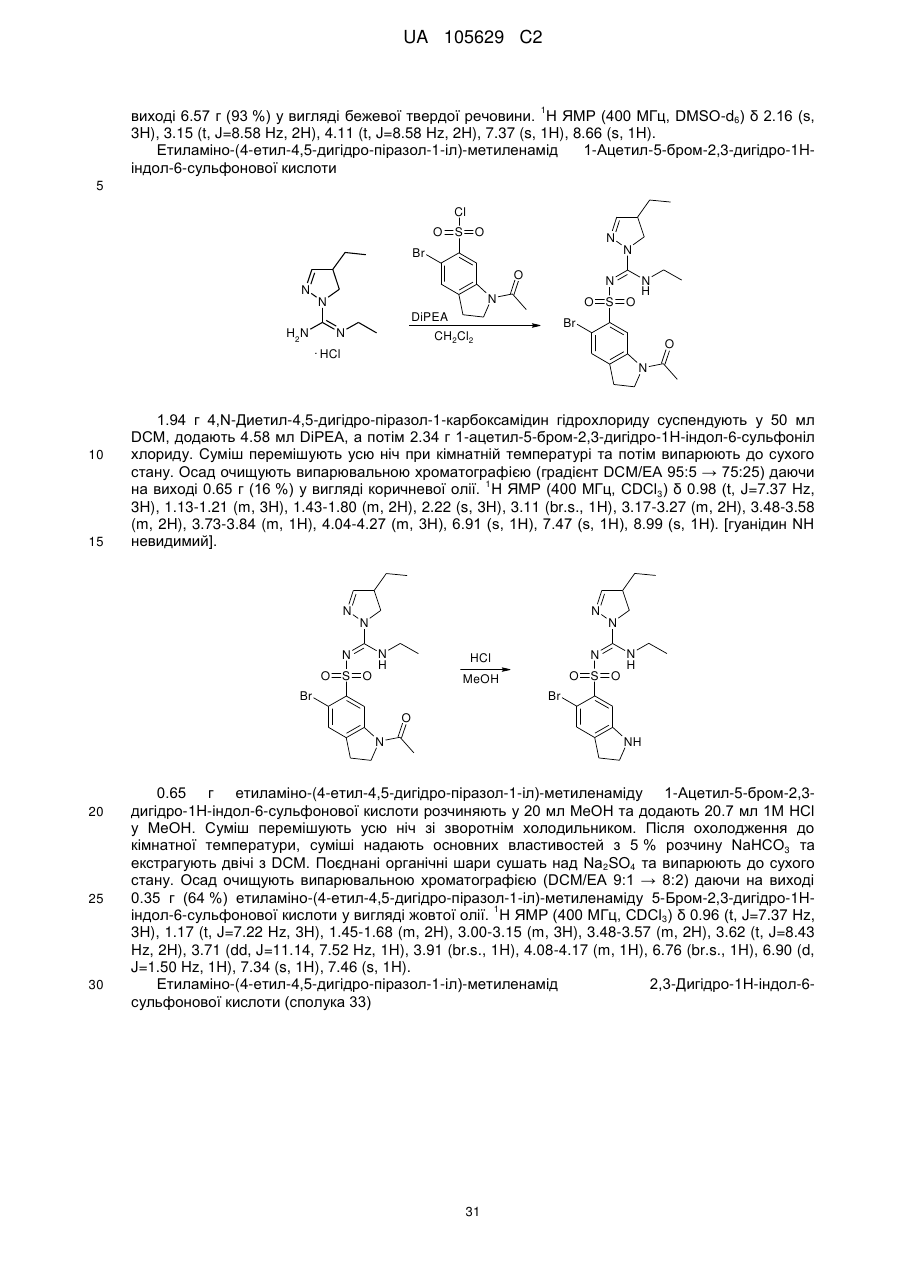
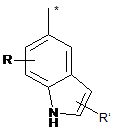 ,
, 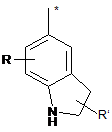 ,
, 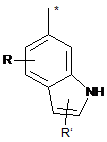 ,
, 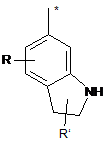 ,
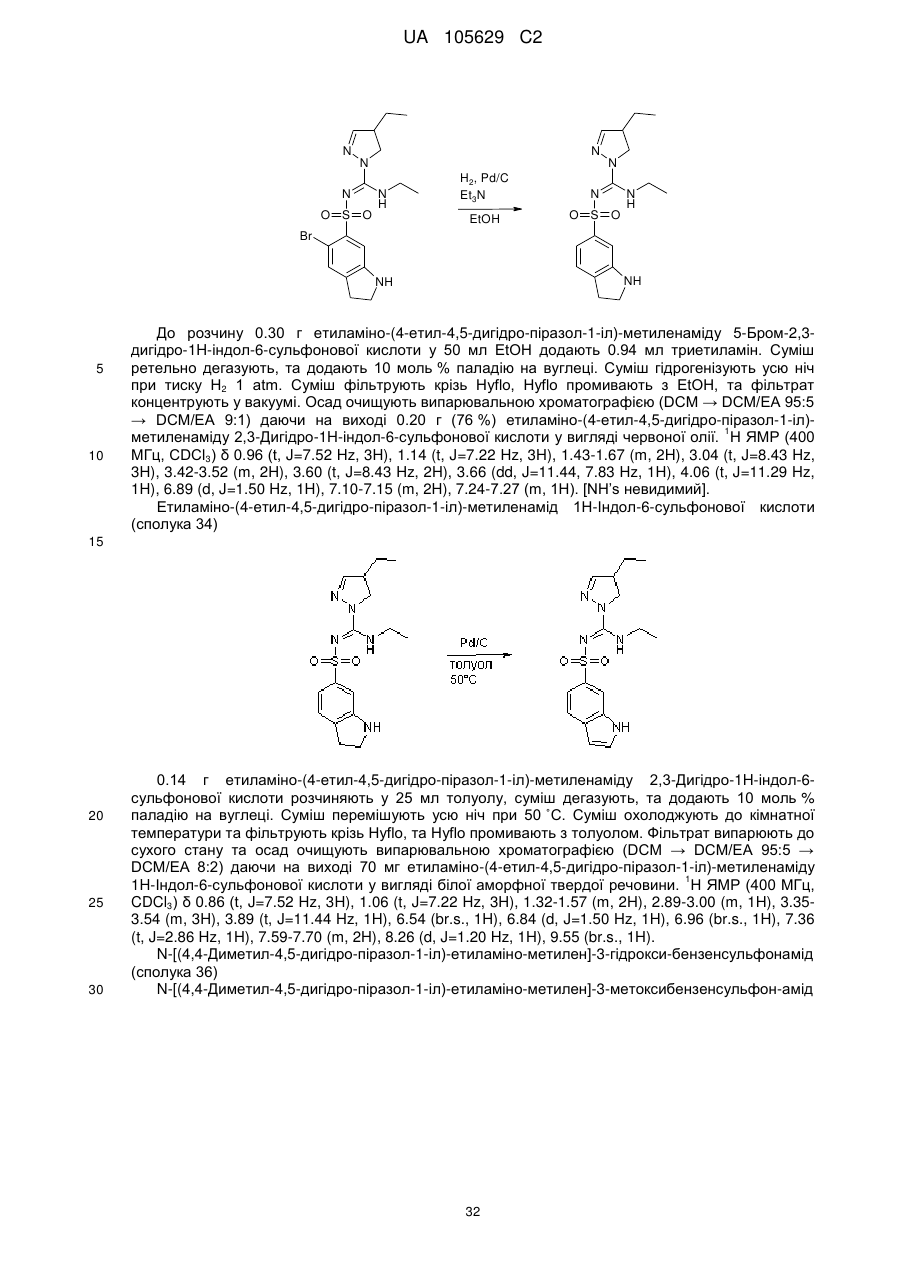
,
де:
R - це водень,
R' - це водень або трифторметил,
R'' - це галоген, СООН, ОН, С(NH)NH2, NH2, СH2NH2 або СH2ОH,
R''' - це галоген або гідроксил,
р - це 0 або 1, та
зірочка (*) означає зв'язок з S-атомом,
за умови, що, коли R1, R3, R4, R5 та R6 - це водень, R2 та R7 - це етил, та R8 - це або 4-амінофеніл, або 3-хлоро-4-амінофеніл, сполуки є не рацемічні суміші, а чисті енантіомери.
2. Сполука формули (1) за пунктом 1 або її таутомер, стереоізомер, N-оксид або фармакологічно прийнятна сіль, де:
R1, R4 та R6 - це водень,
R2 та R3 незалежно вибрані з-поміж водню, гідроксильної групи або алкіл(С1-4)групи, вибірково заміщеної одним або більше замісниками Q*, незалежно вибраними з-поміж: галогену, алкілу(С1-4), NH2, NНалкілу(С1-4), N[алкілу(С1-4)]2 або ОН, або
R2 та R3, разом з атомом вуглецю, до якого вони приєднані, утворюють С3-8-циклоалкільне або С5-8-гетероциклоалкільне кільце, вибірково заміщене одним або більше замісниками Q*, як визначено вище,
R5 вибраний з-поміж водню або алкіл(С1-4)групи, вибірково заміщеної одним або більше замісниками Q*, як визначено вище, або моноциклічної ароматичної або гетероароматичної групи, вибірково заміщеної одним або більше замісниками Q*, як визначено вище,
R7 вибраний з-поміж водню або незаміщеної алкіл(С1-4)групи, вибірково заміщеної одним або більше атомами галогену або гідроксильною групою,
R8 має такі ж значення, як наведено у пункті 1,
за умови, що, коли R3 та R5 - це водень, R2 та R7 - це етил та R8 - це або 4-амінофеніл, або 3-хлоро-4-амінофеніл, сполуки є не рацемічні суміші, а чисті енантіомери.
3. Сполука за пунктом 1 або пунктом 2 або її таутомер, стереоізомер, N-оксид або фармакологічно прийнятна сіль, причому зазначена сполука являє собою оптично активний енантіомер.
4. Лікарський засіб, який містить сполуку згідно з будь-яким з пунктів 1-3 або її фармакологічно прийнятну сіль.
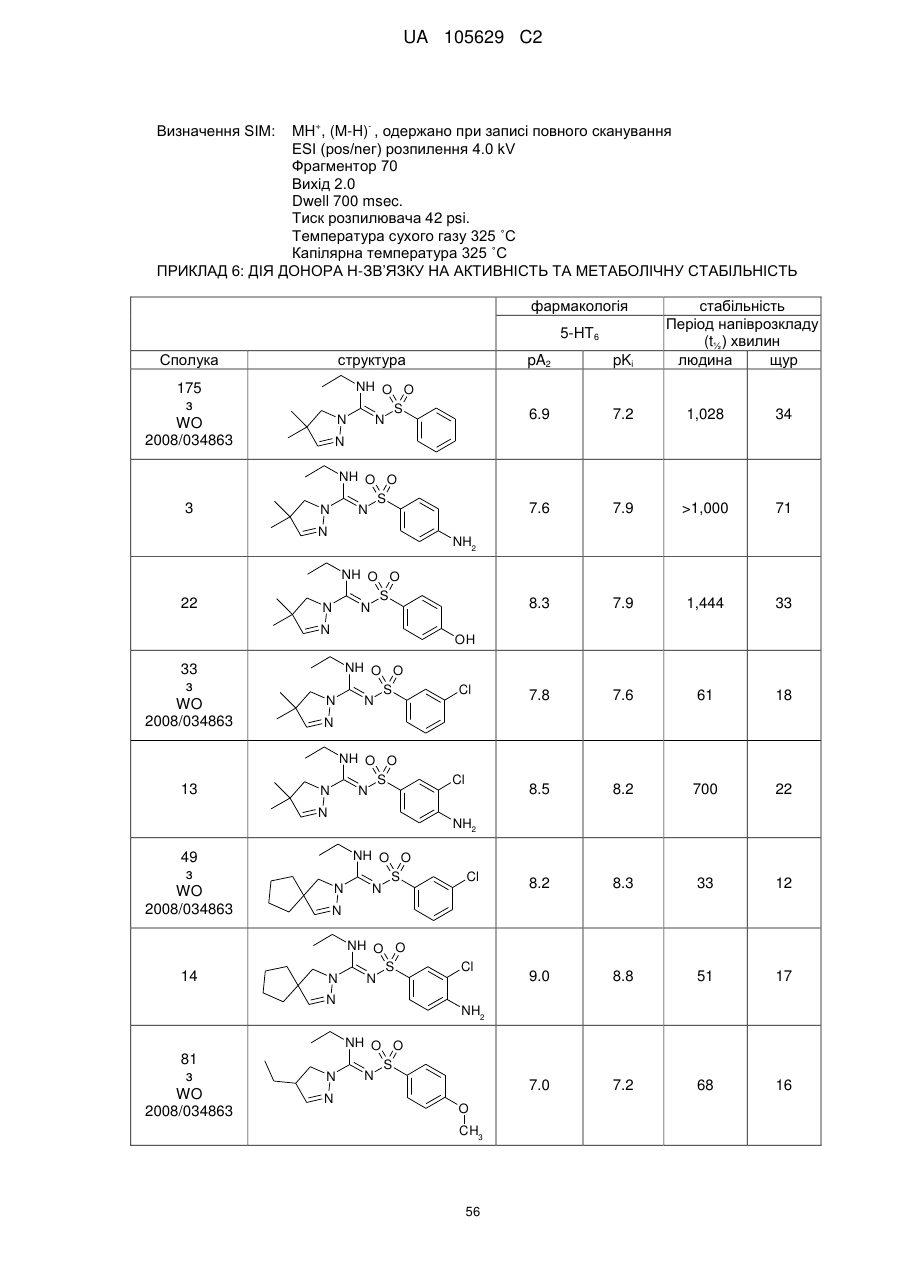
5. Застосування сполуки, як заявлено у будь-якому з пунктів 1-3, для приготування фармацевтичної композиції для лікування або профілактики хвороби Паркінсона, хореї Гантінгтона, шизофренії, бентежності, депресії, маніакальної депресії, психозів, епілепсії, нав'язливих компульсивних розладів, розладів настрою, мігрені, хвороби Альцгеймера, пов'язаного з віком зниження пізнавальної функції, м'яких когнітивних погіршень, розладів сну, розладів харчування, анорексії, булімії, розладів надмірного харчування, нападів паніки, акатизії, розладів гіперактивності з дефіцитом уваги, розладів дефіциту уваги, синдрому відміни при залежності від кокаїну, етанолу, нікотину або бензодіазепінів, болю, розладів, пов'язаних з травмою спинного мозку або пошкодженням голови, гідроцефалії, функціональних розладів шлунка, синдрому подразненого шлунка, опасистості та діабету 2 типу.
6. Сполука загальної формули (1X):
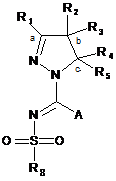 (1X)
(1X)
де А означає або галоген, або S-алкіл(C1-4), а інші радикали мають значення, які наведені у пункті 1, або її таутомери та стереоізомери, де сполуки застосовують у синтезі сполук загальної формули (1).
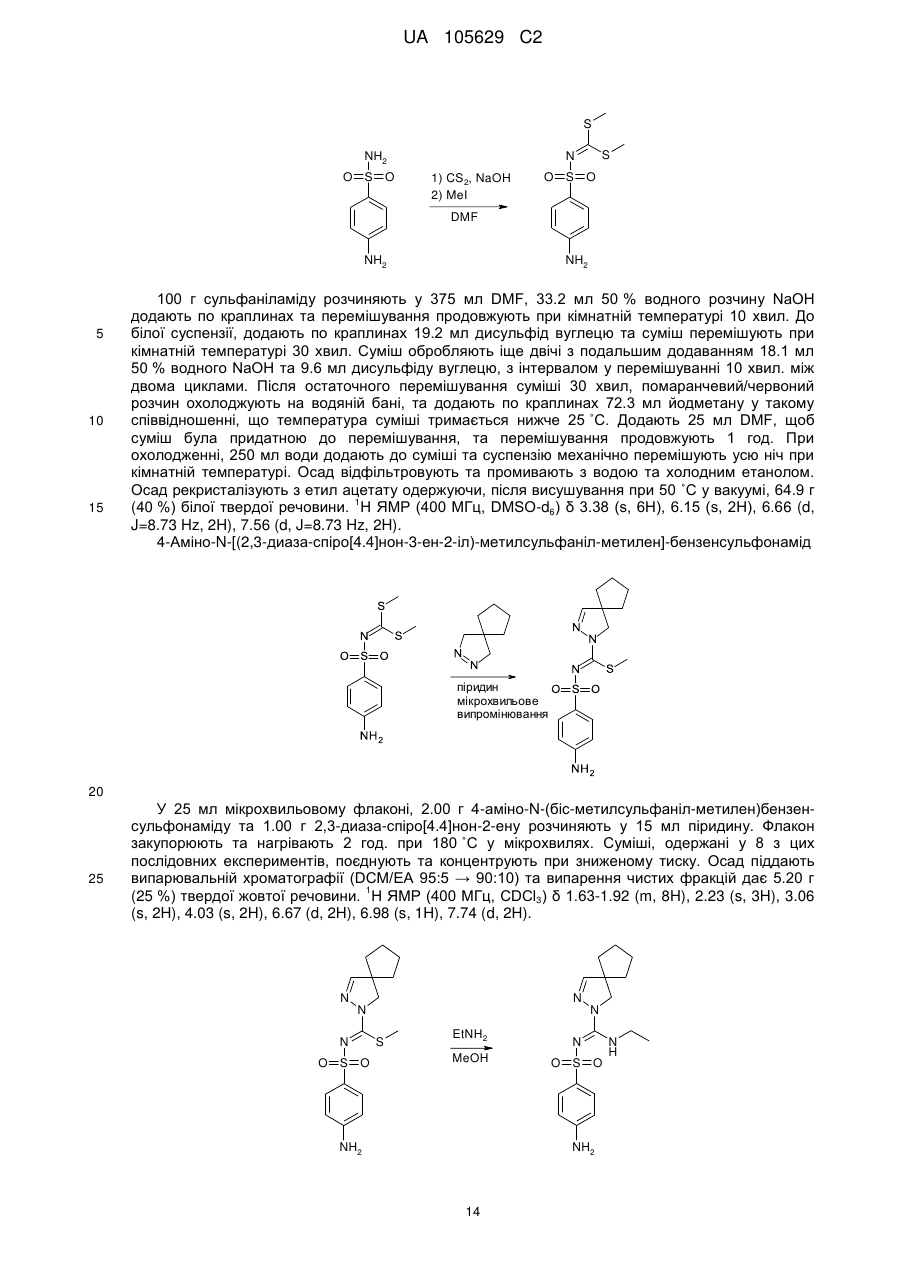
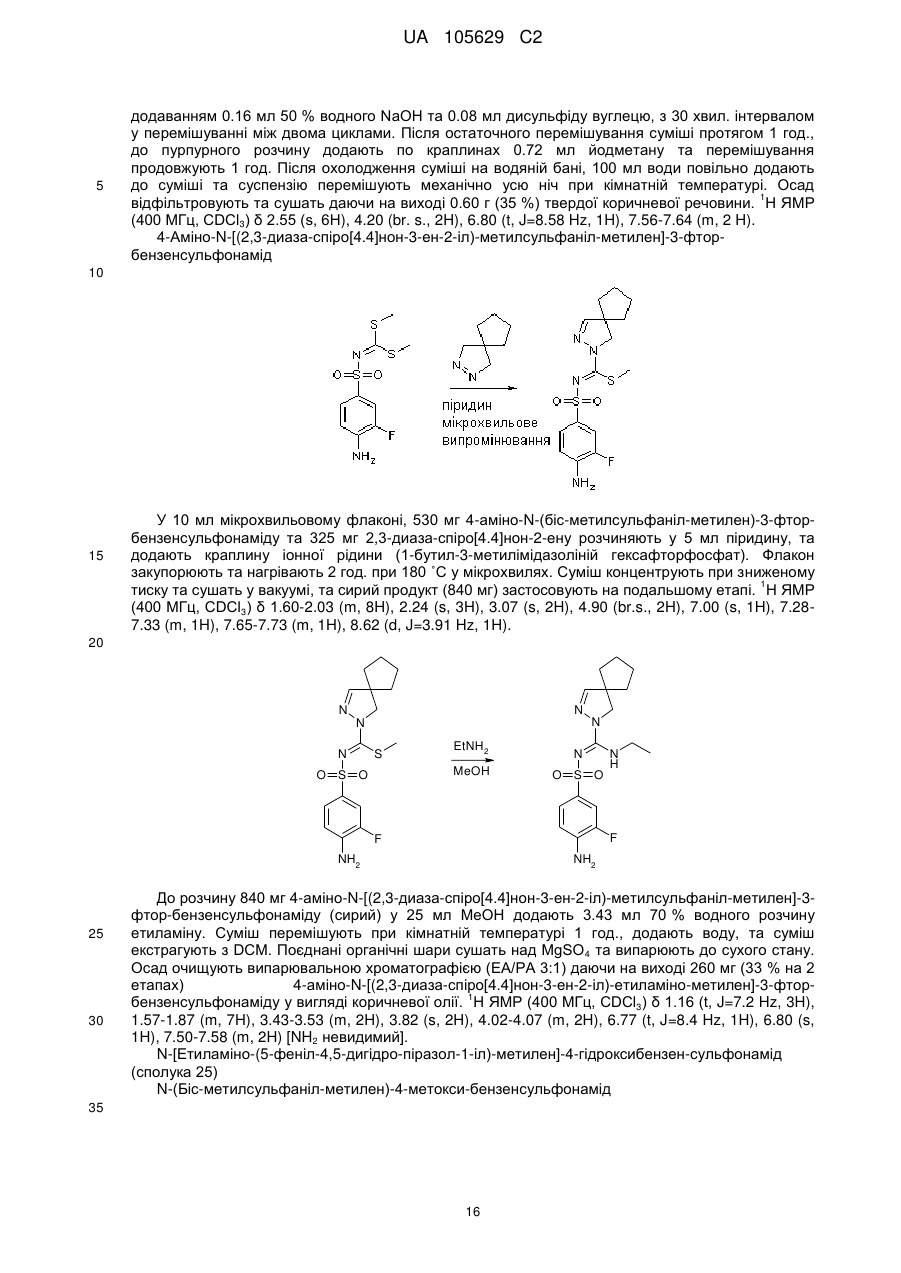
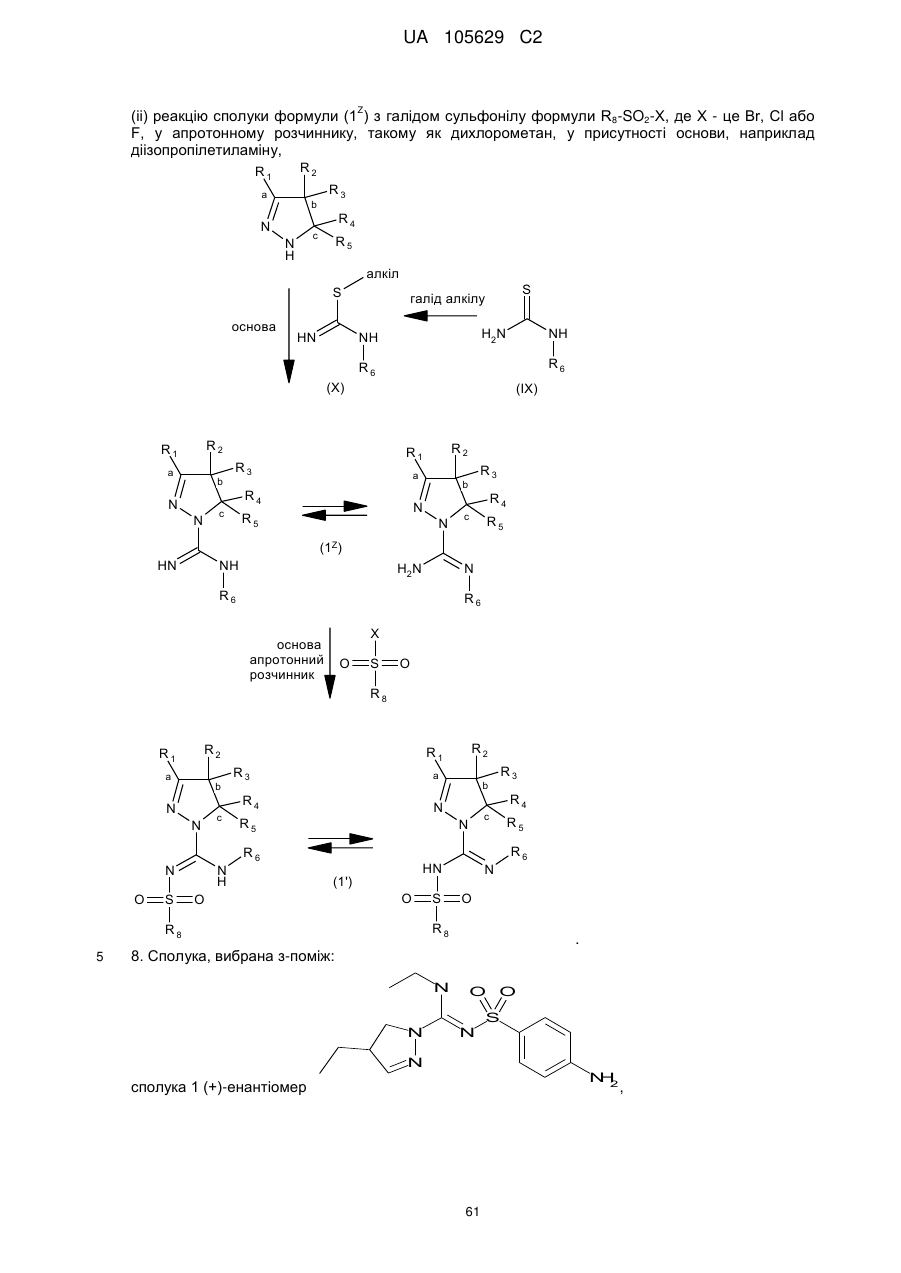
7. Спосіб одержання сполуки формули (1), як заявлено у пункті 1, де R7 - це водень, така сполука має формулу (1'), де усі радикали мають значення, як наведено у пункті 1, за яким здійснюють:
(і) реакцію сполуки формули (X), яку одержують шляхом реакції сполуки формули (IX) з галідом алкілу, наприклад метилйодидом,
з піразоліном у присутності основи, одержуючи сполуку формули (1Z),
(іі) реакцію сполуки формули (1Z) з галідом сульфонілу формули R8-SO2-X, де X - це Вr, Сl або F, у апротонному розчиннику, такому як дихлорометан, у присутності основи, наприклад діізопропілетиламіну,
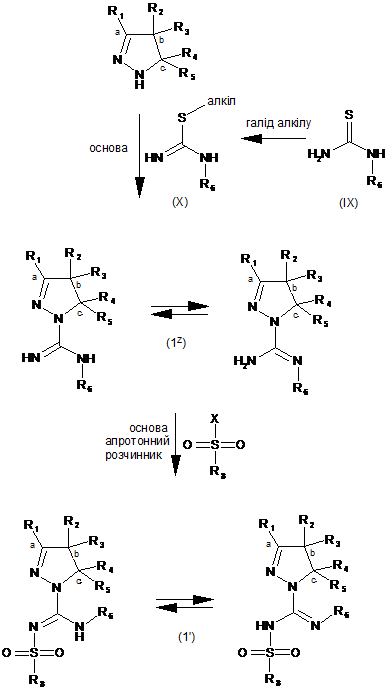 .
.
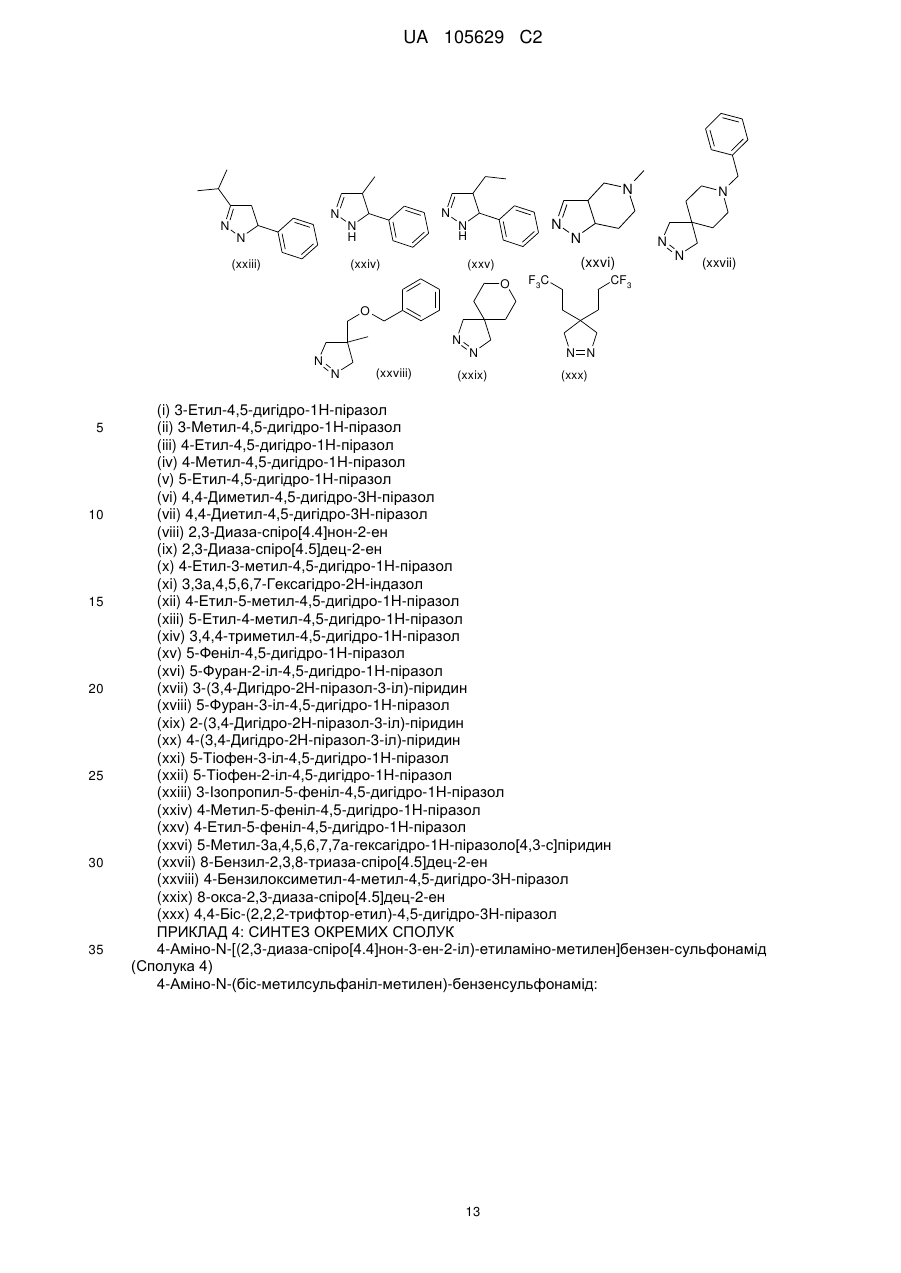
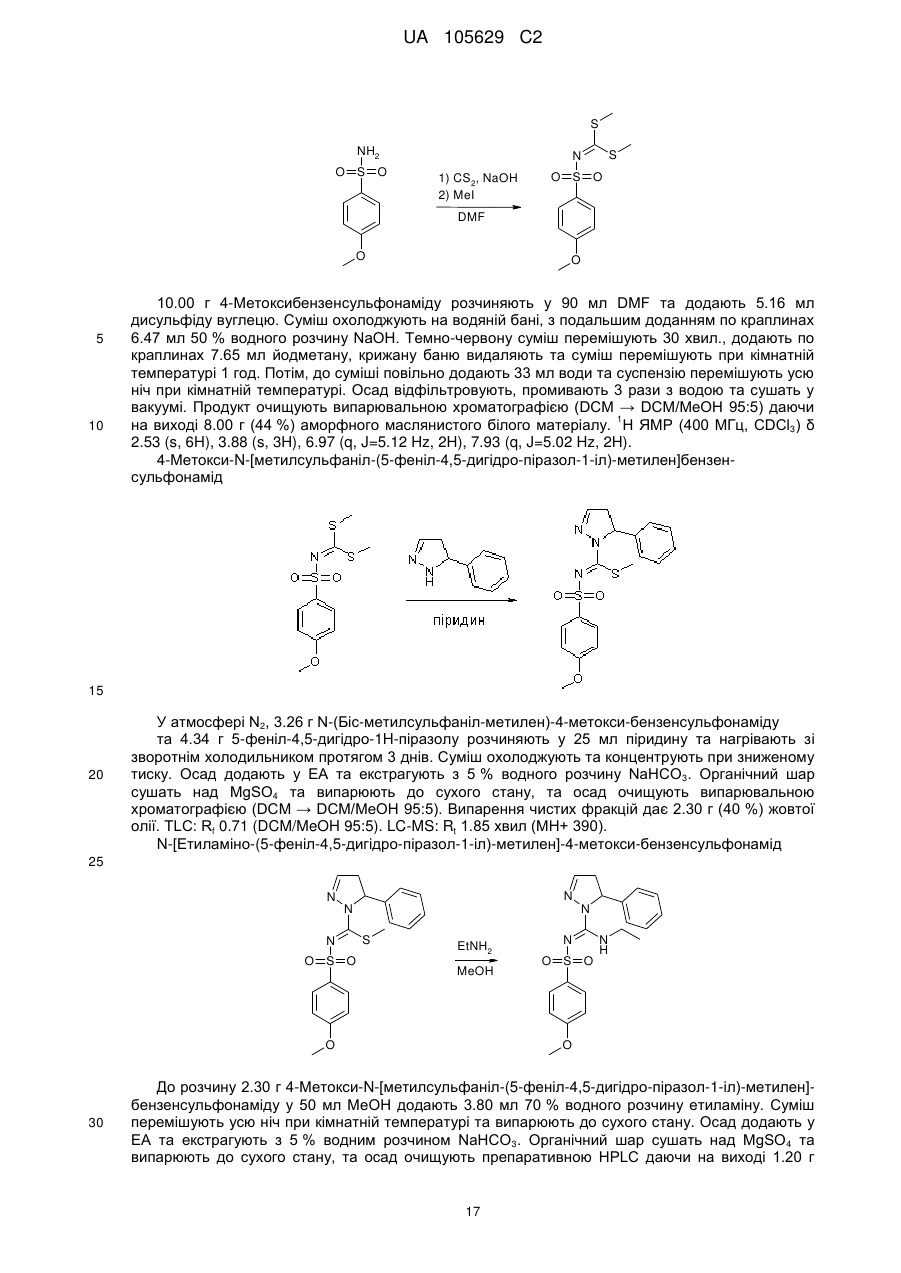
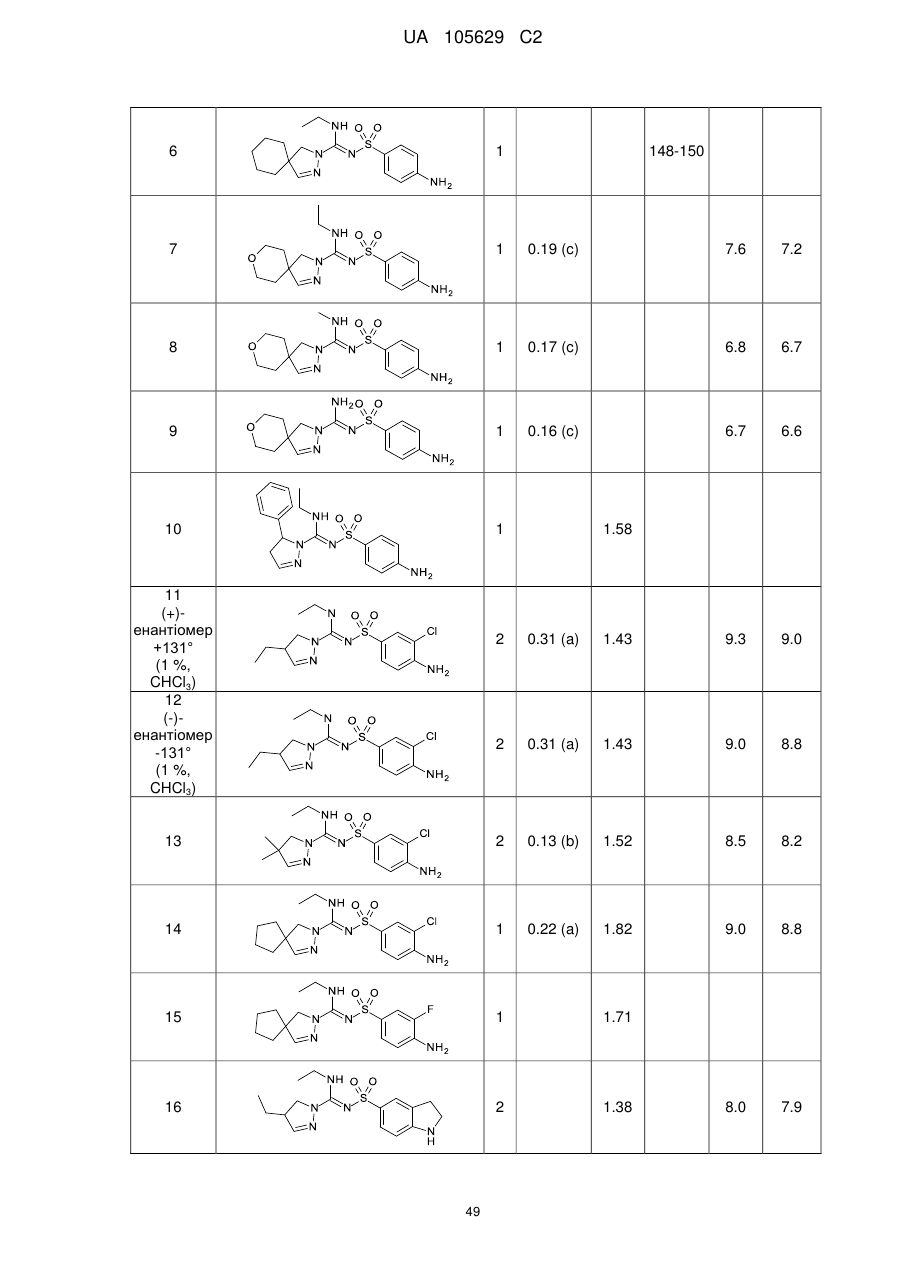
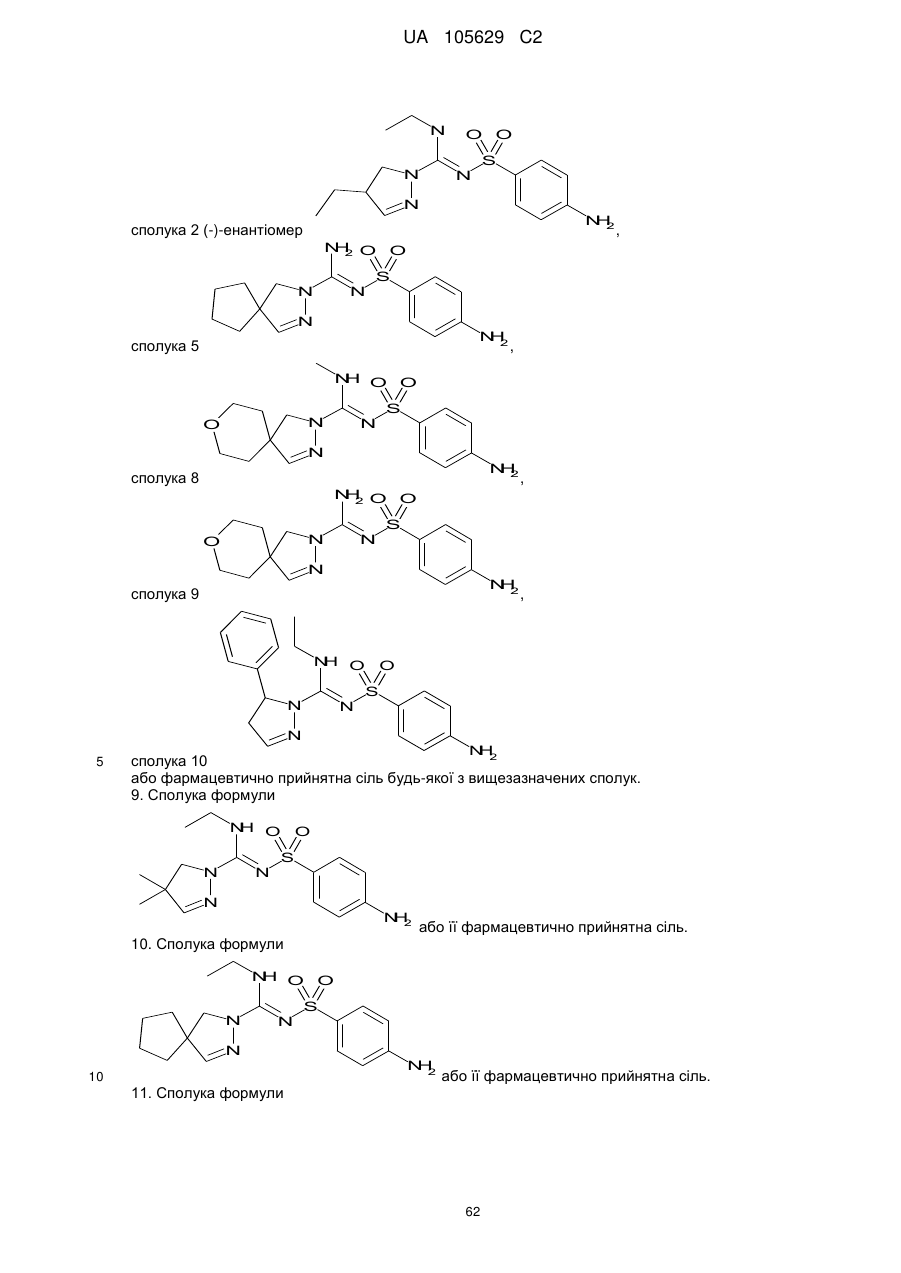
8. Сполука, вибрана з-поміж:
сполука 1 (+)-енантіомер 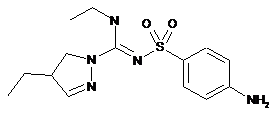 ,
,
сполука 2 (-)-енантіомер  ,
,
сполука 5 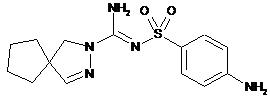 ,
,
сполука 8 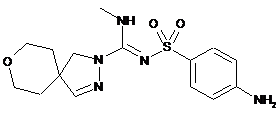 ,
,
сполука 9 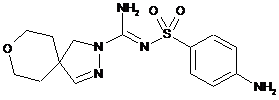 ,
,
сполука 10 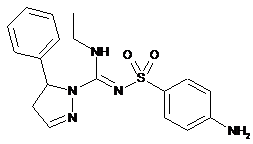
або фармацевтично прийнятна сіль будь-якої з вищезазначених сполук.
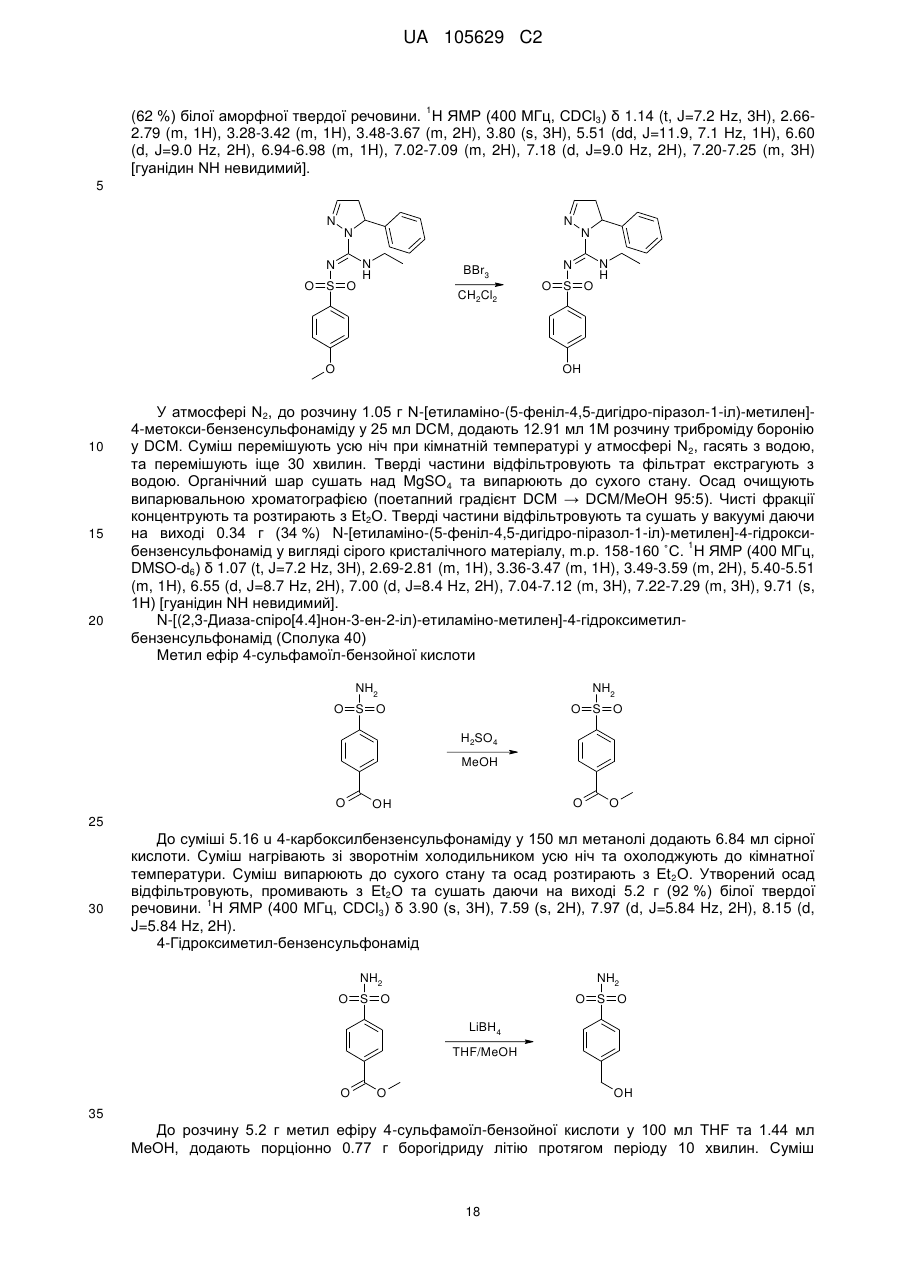
9. Сполука формули
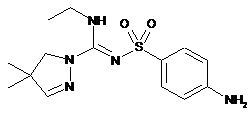 або її фармацевтично прийнятна сіль.
або її фармацевтично прийнятна сіль.
10. Сполука формули
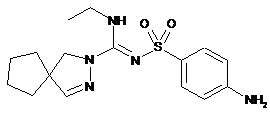 або її фармацевтично прийнятна сіль.
або її фармацевтично прийнятна сіль.
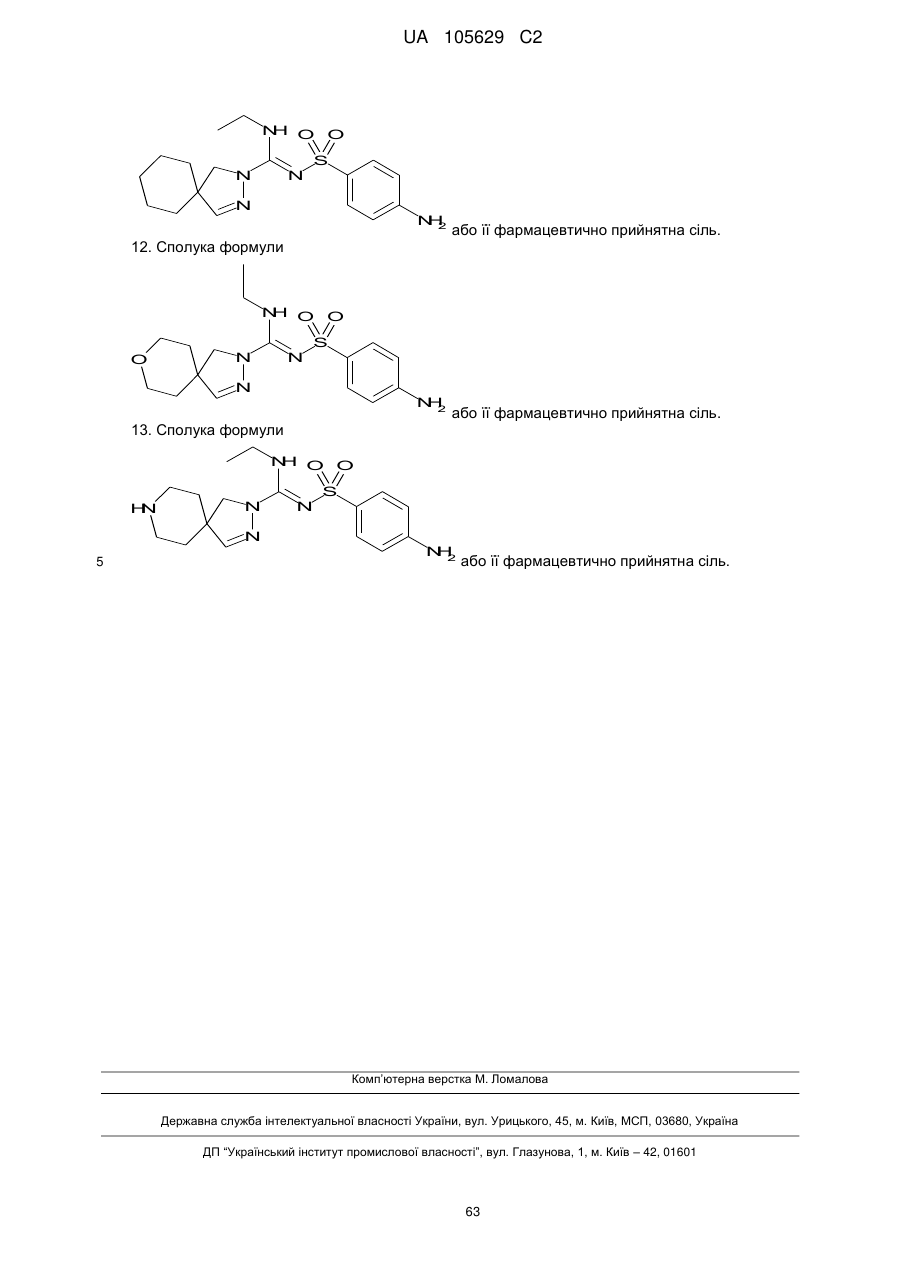
11. Сполука формули
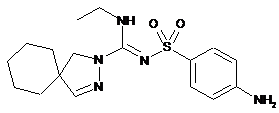 або її фармацевтично прийнятна сіль.
або її фармацевтично прийнятна сіль.
12. Сполука формули
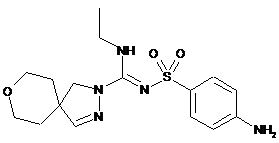 або її фармацевтично прийнятна сіль.
або її фармацевтично прийнятна сіль.
13. Сполука формули
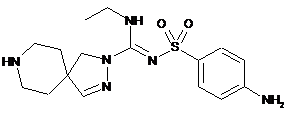 або її фармацевтично прийнятна сіль.
або її фармацевтично прийнятна сіль.
Текст
Реферат: Даний винахід стосується похідних арилсульфонілпіразолінкарбоксамідину як антагоністів рецепторів 5-НТ6, способів одержання цих сполук та нових проміжних сполук, корисних для їх синтезу. Винахід також стосується застосування таких сполук та композицій, зокрема їх застосування у введенні їх пацієнтам, для досягнення терапевтичної дії при лікуванні хвороби Паркінсона, хореї Гантінгтона, шизофренії, бентежності, депресії, маніакальної депресії, психозів, епілепсії, нав'язливих компульсивних розладів, розладів настрою, мігрені, хвороби Альцгеймера, пов'язаного з віком зниження пізнавальної функції, м'яких когнітивних погіршень, розладів сну, розладів харчування, анорексії, булімії, розладів надмірного харчування, нападів паніки, акатизії, розладів гіперактивності з дефіцитом уваги, розладів дефіциту уваги, синдрому відміни при залежності від кокаїну, етанолу, нікотину або бензодіазепінів, болю, розладів, пов'язаних з UA 105629 C2 (12) UA 105629 C2 травмою спинного мозку або пошкодженням голови, гідроцефалії, функціональних розладів шлунка, синдрому подразненого шлунка, опасистості та діабету 2 типу. Сполуки мають загальну формулу (1): R2 R1 a b N N N O S R8 R3 c N R4 R5 R6 O R7 , (1) де радикали мають значення, наведені у описі. UA 105629 C2 5 10 15 20 25 30 35 40 45 50 55 ГАЛУЗЬ ТЕХНІКИ Даний винахід стосується фармацевтичної та органічної хімії, та пропонує похідні арилсульфоніл піразолін карбоксамідину, проміжні сполуки, композиції та способи одержання. ПОПЕРЕДНІЙ РІВЕНЬ ТЕХНІКИ Серотонін (5-гідрокситриптамін або 5-HT), ключовий трансміттер периферичної та центральної нервової системи, регулює широкий ряд фізіологічних та патологічних функцій, є медіатором за допомогою ряду сімейств рецепторів 5-HT1, 5-HT2, 5-HT3, 5-HT4, 5-HT5, 5-HT6 та 5HT7. Хоча функції трьох останніх є менш зрозумілими, ніж функції інших, є загальноприйнятим, що ті сполуки, які вибірково впливають на медийовану 5-HT сигнальну трансдукцію, є важливим новим цільовим лікарським засобом. Рецептор 5-HT6 щурів клонують у двох різних групах (Ruat, 1993; Sebben, 1994), та невдовзі після цього людський, обмінюючи 89 % тотожності послідовності, (Kohen, 1996). Більшість інтересу щодо рецептора 5-HT6 викликана тим, що декілька психотропних засобів є високо спорідненими антагоністами щодо людського рецептора 5-HT6 (Kohen, 1996; Roth, 1994). Ці сполуки включають амітриптилін (Ki=65 nM) та атиповий антипсихотик клозапін (Ki=9.5 nM), оланзапін (Ki=10 nM), та кветіапін (Ki=33 nM). Але жодна з цих сполук не є селективною. Перші селективні антагоністи рецепторів 5-HT6 , про які доповідалось, це Ro 04-6790 та Ro 63-0563. Їх корисність обмежена їх помірною спорідненістю (Ki=50 nM та 12 nM, відповідно) та слабкою фармакокінетикою (Sleight, 1998). Нещодавні дослідження селективних антагоністів рецепторів 5-HT6 Ro-04-6790 та SB-271046 повідомляють про активність цих сполук на моделях когнітивної функції. SB-271046 покращує виконання у водному лабіринті Морріса (Rogers, 1999). Ці результати співпадають з даними, що хронічне внутрішньомізковошлуночкове введення античутливих олігонуклеотидів, спрямоване на послідовність рецепторів 5-HT6, призводить до b покращення деяких критеріїв оцінки роботи у водному лабіринті Морріса (Bentley, 1999 ). Нещодавно доповідалось про дію антагоністів античутливих олігонуклеотидів 5-HT6 та 5-HT6 на a зниження прийому їжі у щурів (Bentley, 1997; Bentley, 1999 ; Woolley, 2001). Опасистість – це стан, що характеризується підвищенням вмісту жира у тілі, яке призводить до надлишку ваги тіла понад прийняті норми. Опасистість – це найбільш важливий розлад харчування у західному світі і являє собою велику проблему для здоров’я у всіх індустріальних країнах. Цей розлад призводить до підвищеної смертності завдяки підвищенню випадків захворювань, таких як серцевосудинні захворювання, захворювання травлення, респіраторні захворювання, рак та діабет 2 типу. Селективні ліганди 5-HT6 визначаються, як потенційно корисні у лікуванні або профілактиці певних розладів центральної нервової системи, таких як хвороба Паркінсона, хорея Гантінгтона та/або шизофренія, бентежність, депресія, маніакальна депресія, психози, епілепсія, нав’язливі компульсивні розлади, розлади настрою, мігрень, хвороба Альцгеймера (покращення когнітивної пам’яті), пов’язане з віком зниження пізнавальної функції, м’які когнітивні погіршення, нейродегенеративні захворювання, що характеризуються погіршенням росту нейронів, розлади сну, розлади харчування, як от анорексія та булімія, розлади надмірного харчування, напади паніки, акатизія, розлади гіперактивності з дефіцитом уваги (ADHD), розлади дефіциту уваги (ADD), синдром відвикання від наркотичної залежності, як от кокаїн, етанол, нікотин та бензодіазепіни, та біль, а також розлади, асоційовані зі спинномозковою травмою та/або пошкодженням голови, як от гідроцефалія. Очікується, що селективні ліганди 5-HT6 також будуть корисними у лікуванні певних шлунково-кишкових розладів, як от функціональні розлади шлунку та синдром подразненого шлунку, та у лікуванні або профілактиці опасистості та діабету 2 типу, для досягнення зниження ваги тіла та приросту ваги тіла. Зниження ваги тіла та приросту ваги тіла (наприклад, лікування розладів ваги тіла) досягається між іншим шляхом зниження прийому їжі. Метою даного винаходу є забезпечення могутніх та селективних антагоністів 5-HT6, метаболічно білш стабільних, ніж відомі, хімічно споріднених, 5-HT6 антагоністів (як описано у WO 2008/034863), сполук, корисних для лікування певних розладів центральної нервової системи. СУТНІСТЬ ВИНАХОДУ Несподівано було встановлено, що певні похідні арилсульфоніл піразолін карбоксамідину, які мають функціональність донора H-зв’язку на або у арилсульфоніловій частині, є антагоністами рецепторів 5-HT6, більш могутніми, та метаболічно більш стабільними, ніж відомі, хімічно споріднені, антагоністи 5-HT6. Винахід стосується сполуки загальної формули (1): 1 UA 105629 C2 R2 R1 a b R4 N N N O R3 S O c N R5 R6 (1) R7 R8 5 10 15 20 25 30 35 або таутомерів, стереоізомерів, N-оксидів, або фармакологічно прийнятних солей будь-яких з вищевказаних, де: - R1 обраний з-поміж водню або алкіл(C1-4) групи, вибірково заміщений одним або більше атомами галогену або гідроксильною групою, - R2 та R3 незалежно обрані з-поміж водень, гідроксильної групи або алкіл(C1-4) групи, вибірково заміщеної одним або більше замісниками Q, незалежно обраними з-поміж: галогену, алкіл(C1-4), алкеніл(C1-4), алкініл(C1-4), CF3, NH2, NHалкіл(C1-4), N[алкіл(C1-4)]2, OH, =O, O-алкіл(C1-4), або OCF3, або, R1 та R2, разом з атомом вуглецю, маркованим як ‘a’ та ‘b’, утворюють C 5-8-циклоалкільне кільце, вибірково заміщене одним або більше атомами галогену, гідроксильною групою або алкіл(C1-4) групою, або, R2 та R3, разом з атомом вуглецю, маркованим ‘b’ утворюють C3-8-циклоалкільне або C4-8гетероциклоалкільне кільце, вибірково заміщене одним або більше замісниками Q, як визначено вище, - R4 та R5 незалежно обрані з-поміж водню або алкіл(C1-4) групи, вибірково заміщеної одним або більше замісниками Q, як визначено вище, або, R4 та R5 незалежно обрані з-поміж моноциклічної або конденсованої біциклічної ароматичної або гетеро-ароматичної групи, вибірково заміщеної одним або більше замісниками Q, як визначено вище, за умови, що Q не може бути =O (кето) у ароматичних кільцях, або R3 та R4, разом з атомами вуглецю, маркованими ‘b’ та ‘c’, утворюють C 3-8-циклоалкільне або C5-8-гетероциклоалкільне кільце, вибірково заміщене одним або більше замісниками Q, як визначено вище, - R6 та R7 незалежно обрані з-поміж водню, або алкіл(C1-4) групи, вибірково заміщеної одним або більше атомами галогену або гідроксильною групою, або диалкіл(C 1-3)-аміно-алкіл(C1-3) групою, або, R6 та R7 незалежно обрані з-поміж моноциклічної або конденсованої біциклічної ароматичної або гетеро-ароматичної групи, вибірково заміщеної одним або більше замісниками Q, як визначено вище, або, R6 та R7 незалежно - це C5-8-циклоалкільна група або C5-8-гетероциклоалкільна группа, вибірково заміщена одним або більше замісниками Q, як визначено вище, або, R6 та R7, разом з атомом азоту, до якого вони приєднані, утворюють C 5-8гетероциклоалкільну групу, вибірково заміщену одним або більше замісниками Q, як визначено вище, - R8 обраний з-поміж: * * R * * R R R NH N H R' N H NH R' R' 2 R' UA 105629 C2 * * R R R R * * R' N NH N N N H N H N N H N H R' * * * HN * H2N 5 (Het) Ar R z R NH NH X Y Y * * ( )n R X X N Y H (Het) Ar * R R R (Het) Ar O X * (Het) Ar R Y z * * (Het) Ar R (Het) Ar R R N HO ( )n H O OH O NH2 HN NH2 де: - знак (*) позначає зв’язок з S-атомом, - n - або 0 (нуль), або 1, (Het) Ar 10 15 20 25 30 35 - це арил або гетероарильна група, - X, Y та Z незалежно обрані з-поміж C, N, O або S, з розумінням, що зв’язки у кільці, що містить X, Y або Z, можуть бути одинарними або подвійними, та C та N заміщені тільки Hатомами, - R та R’ незалежно обрані з-поміж галогену, алкіл(C1-4), алкеніл(C1-4), алкініл(C1-4), CF3, NH2, NHалкіл(C1-4), N[алкіл(C1-4)]2, OH, SH, кето, O-алкіл(C1-4), S-алкіл(C1-4), SO-алкіл(C1-4), SO2алкіл(C1-4), OCF3, нітро та ціано, за умови, що коли R1, R3, R4, R5 та R6 - це водень, R2 та R7 - це етил, та R8 – це або 4амінофеніл, або 3-хлоро-4-амінофеніл, сполуки є не рацемічними сумішами, а чистими енантіомерами (рацемічні суміші описані у WO 2008/034863). Винахід стосується рацематів, сумішей діастереомерів, а також індивідуальних стереоізомерів сполук, що мають формулу (1). Винахід також стосується E ізомерів, Z ізомерів та E/Z сумішей сполук, що мають формулу (1). Винахід зокрема стосується сполук загальної формули (1) або таутомерів, стереоізомерів, N-оксидів, або фармакологічно прийнятних солей будь-яких з вищевказаних, де: - R1, R4 та R6 – це водень - R2 та R3 незалежно обрані з-поміж водню, гідроксильної групи або алкіл(C 1-4) групи, вибірково заміщеної одним або більше замісниками Q*, незалежно обраними з-поміж: галогену, алкіл(C1-4), NH2, NHалкіл(C1-4), N[алкіл(C1-4)]2 або OH, або R2 та R3, разом з атомом вуглецю, до якого вони приєднані, утворюють C 3-8-циклоалкільне або C5-8-гетероциклоалкільне кільце, вибірково заміщене одним або більше замісниками Q* як визначено вище, - R5 обраний з-поміж водню або алкіл(C1-4) групи, вибірково заміщеної одним або більше замісниками Q* як визначено вище, або моноциклічною ароматичною або гетероароматичною групою, вибірково заміщеною одним або більше замісниками Q* як визначено вище, - R7 обраний з-поміж водню, або незаміщеної алкіл(C1-4) групи, вибірково заміщеної одним або більше атомами галогену або гідроксильною групою, - R8 обраний з-поміж: 3 UA 105629 C2 * * * R * R R R NH2 OH NH2 OH * * * R R R R NH2 NH2 * OH OH * R * * * R R R NH R' N H N H NH R' R' * R' * * R R R O R' N N H O R 5 10 15 20 25 30 HN * * * R NH2 OH OH * R NH NH2 R O NH2 O NH2 де символи мають такі ж значення, як наведено у пункті 1, за умови, що коли R 3 та R5 - це водень, R2 та R7 - це етил, та R8 є або 4-амінофеніл, або 3-хлоро-4-амінофеніл, сполуки є не рацемічні суміші, а чисті енантіомери. У іншому варіанті здійснення винахід стосується сполук формули (1) де або один, або обидва з двох потенційно асиметричних атомів вуглецю у піразоліновому кільці є лівообертовий або правообертовий енантіомер. Сполуки формули (1) за винаходом, а також їх фармацевтично прийнятні солі, мають антагоністичну активність щодо рецепторів 5-HT6. Вони є корисними у лікуванні розладів, пов’язаних з рецепторами 5-HT6, або такими,що лікуються шляхом впливу на ці рецептори. Наприклад: хвороба Паркінсона, хорея Гантінгтона, шизофренія, бентежність, депресія, manic депресія, психози, епілепсія, нав’язливі компульсивні розлади, розлади настрою, мігрень, хвороба Альцгеймера, пов’язане з віком зниження пізнавальної функції, м’які когнітивні погіршення, розлади сну, розлади харчування, анорексія, булімія, розлади надмірного харчування, напади паніки, акатизія, розлади гіперактивності з дефіцитом уваги, розлади дефіциту уваги, відвикання від залежності від кокаїну, етанолу нікотину або бензодіазепінів, біль, розлади пов’язані з травмою спинного мозку або пошкодженням голови, гідроцефалія, функціональні розлади шлунку, синдром подразненого шлунку, опасистість та діабет 2 типу. Інші варіанти здійснення винаходу включають: фармацевтичні композиції для лікування, наприклад, розладів або станів, які лікують блокуванням рецепторів 5-HT6, композицій, які містять сполуку формули (1) або її фармацевтично прийнятну сіль, та фармацевтично прийнятний носій; способи лікування розладів або станів, які лікують блокуванням рецепторів 5-HT6, які передбачають введення пацієнту, що потребує такого лікування, сполуки формули (1) або її фармацевтично прийнятну сіль; фармацевтичні композиції для лікування, наприклад, розладів або станів, обраних з-поміж перелічених тут розладів; 4 UA 105629 C2 5 10 15 20 25 30 35 40 45 50 55 способи лікування розладів або станів, обраних з-поміж перелічених тут розладів, які передбачають введення пацієнту, що потребує такого лікування, сполуки формули (1) або її фармацевтично прийнятну сіль; фармацевтичні композиції для лікування розладів або станів, обраних з-поміж перелічених тут розладів, які містять сполуку формули (1) або її фармацевтично прийнятну сіль, та фармацевтично прийнятний носій; способи для лікування розладів або станів, обраних з-поміж перелічених тут розладів, які передбачають введення пацієнту, що потребує такого лікування, сполуки формули (1) або її фармацевтично прийнятну сіль. способи антагонізації рецептора 5-HT6 що передбачають введення пацієнту, що цього потребує, ефективну кількість сполуки формули (1); Винахід також пропонує застосування сполуки або солі згідно з формулою (1) для виготовлення медикаменту. Винахід далі стосується комбінованої терапії, де сполуку за винаходом, або її фармацевтично прийнятну сіль, або фармацевтичну композицію або суміш, що містить сполуку за винаходом, вводять одночасно або послідовно, або як комбінований препарат з іншим терапевтичним засобом або засобами, для лікування одного або кількох перелічених тут станів. Такий інший терапевтичний засіб (засоби) може бути введений до, одночасноз, або після введення сполук за винаходом. Винахід також охоплює сполуки, фармацевтичні композиції, набори та способи для лікування розладів або станів, обраних з-поміж перелічених тут розладів, де спосіб передбачає введення пацієнту, що потребує такого лікування, сполук формули (1) або її фармацевтично прийнятну сіль. Сполуки за винаходом посідають антагонізуючу активність щодо рецепторів 5-HT6. Ця активність сполук за винаходом легко демонструються, наприклад, при застосуванні одного або більше досліджень, описаних тут або відомих з рівня техніки. Винахід також охоплює способи одержання сполук за винаходом та проміжних сполук, застосованих у цих способах. За бажанням можуть бути проведені виділення та очищення описаних тут сполук та проміжних сполук, шляхом будь-якої підходящої процедури розділення або очищення, як от, наприклад, фільтрація, екстракція, кристалізація, колонкова хроматографія, тонкошарова хроматографія, товстошарова хроматографія, підготувальна низько- або високо-тискова рідинна хроматографія, або комбінація цих процедур. Характерні ілюстрації підходящих процедур розділення та виділення можна взяти із розділів «фармацевтичні препарати» та «приклади». Однак, звичайно, також можуть бути застосовані інші еквівалентні процедури розділення та виділення. Сполуки за даним винаходом можуть містити один або більше асиметричних центрів і тому можуть виступати у якості рацематів та рацемічних сумішей, одиничних енантіомерів, діастереомерних сумішей та індивідуальних діастереомерів. В залежності від природи різних замісників, молекули можуть мати додатковий асиметричний центр. Кожний такий асиметричний центр буде незалежно виробляти два оптичні ізомери. Всі можливі оптичні ізомери та діастереомери, у сумішах та як чисті або частково очищені сполуки, включені в обсяг цього винаходу. Мається на увазі, що даний винахід охоплює усі такі ізомерні форми таких сполук. Формула (1) показіє структуру класу сполук без переважної стереохімії. Незалежний синтез цих діастереомерів, або їх хроматографічне розділення, можуть проводитись способом, відомим з рівня техніки шляхом відповідної модифікації описаної тут методології. Їх абсолютна стереохімія може бути визначена шляхом рентгенівської кристалографії кристалічних продуктів або кристалічних проміжних сполук, які за бажанням дериватизують з реагентом, що містить асиметричний центр відомої абсолютної конфігурації. Рацемічні суміші сполук можуть бути розділені у індивідуальні енантіомери способами, відомими з рівня техніки, як от сполучення рацемічної суміші сполук у енантіомерно чисту сполуку, утворюючи діастереомерну суміш, з подальшим розділенням індивідуальних діастереомерів стандартними способами, як от фракціонована кристалізація або хроматографія. Сполучення часто складається з утвоерння солей, застосовуючи енантіомерно чисту кислоту або основу, наприклад (-)-ди-p-толуол-D-винна кислота та/або (+)-ди-p-толуол-Lвинна кислота. Діастереомерні похідні можуть потім бути перетворені у чисті енантіомери шляхом очищення доданого хорального осаду. Рацемічні суміші сполук можуть також бути розділені безпосередньо способами хроматографії, використовуючи хіральні стаціонарні фази: Ці способи відомі з рівня техніки. Альтернативно, будь-який енантіомер сполуки може бути 5 UA 105629 C2 5 10 15 20 25 30 35 40 45 50 55 60 одержаний за допомогою стерео селективного синтезу з використанням оптично чистих вихідних матеріалів або реагентів відомої конфігурації способами, відомими з рівня техніки. Цис та транс ізомери сполуки формули (1), або її фармацевтично прийнятної солі, також належать до обсягу даного винаходу, та це також стосується таутомерів сполуки формули (1) або її фармацевтично прийнятної солі. Деякі кристалінові форми сполук можуть існувати як поліморфи та по суті також належать до обсягу даного винаходу. Крім того, деякі сполуки можуть утворювати сольвати з водою (т.н., гідрати) або із звичайними органічними розчинниками, і такі сольвати також входять до обсягу даного винаходу. Мічені ізотопами сполуки формули (1) або їх фармацевтично прийнятні солі, включаючи мічені ізотопами сполуки формули (1), які розпізнаються методами PET або SPECT, також 13 14 також входять в обсяг винаходу, це також стосується сполук формули (I) мічених [ C]-, [ C]-, 3 18 125 [ H]-, [ F]-, [ I]- або інших збагачених ізотопами атомів, придатних для зв’язування рецепторів або дослідження метаболізму. Сполуки за винаходом можуть також застосовуватись, як реагенти або стандартні реагентиу біохімічних дослідженнях неврологічних функцій, дисфункцій та захворювань. ВИЗНАЧЕННЯ У контексті цього опису термін ‘антагоніст рецепторів 5-HT6’ стосується сполук, що виявляють цю активність - вимірену у точних та широко прийнятих фармакологічних дослідженнях, включаючи такі, що описані у WO 2008/034863 - без висвітлення істотної кроссреактивності по відношенню до іншого рецептора. Загальні терміни, використані у описуванні сполук, розкритих тут, мають їх звичайне значення. Термін алкіл у цьому описі означає одновалентний насичений, розгалужений або прямий, вуглеводневий ланцюг. Якщо не зазначено інше, такі ланцюги можуть містити від 1 до 18 атомів вуглецю. Представниками таких алкільних груп є метил, етил, пропил, ізопропил, бутил, ізобутил, втор-бутил, трет-бутил, пентил, ізопентил, неопентил, трет-пентил, гексил, ізогексил, гептил, октил, нонил, децил, ундецил, додецил, тридецил, тетрадецил, пентадецил, гексадецил, гептадецил, октадецил, та подібні. Коли зазначено ‘нижча’, алкільна група буде містити від 1 до 6 атомів вуглецю. Такий же вміст вуглецю стосується спорідненого терміну ‘алкан’, та до похідних термінів, як от ‘алкокси’. Вміст вуглецю різних частин, що містять вуглеводень, визначений префіксом, що визначає мінімальну та максимальну кількість атомів вуглецю у частині, тобто, префікс C x-y визначає кількість наявних атомів вуглецю від цілого "x" до цілого "y" включно. ‘Алкіл(C1-3)’ наприклад, означає метил, етил, n-пропил або ізопропил, та ‘алкіл(C1-4)’ означає ‘метил, етил, n-пропил, ізопропил, n-бутил, 2-бутил, ізобутил або 2-метил-nпропил’. Термін ‘алкеніл’ визначає прямі або розгалужені вуглеводневі радикали з одним або кількома подвійними вуглець-вуглецевими зв’язками, наприклад вініл, аліл, бутеніл, тощо, та наприклад представляє (C2-4)-алкеніл. В ‘алкінільних’ групах прямі або розгалужені вуглеводневі радикали мають один або кілька потрійних вуглець-вуглецевих зв’язків, наприклад етиніл, пропаргіл, 1-бутиніл, 2-бутиніл, тощо, та наприклад представляють (C2-4)алкініл. Якщо не зазначено інше, ‘алкенільні та ‘алкінільні ланцюги можуть містити від 1 до 18 атомів вуглецю. Термін ‘ацил’ означає алкіл(C1-3) карбоніл, арилкарбоніл або арил-алкіл(C1-3)-карбоніл. охоплює моно- або поліциклічні ароматичні групи, включаючи феніл, нафтил, 1,2,3,4-тетрагідронафтил, інденіл, фтореніл, антраценіл, фенантреніл, нафтаценіл та азуленіл. ‘Гетероарил’ охоплює моно- або поліциклічний гетеро-ароматичний, включаючи фурил, тієніл, пірроліл, оксазоліл, тіазоліл, імідазоліл, імідазо[2,1-b][1,3]тіазоліл, піразоліл, ізооксазоліл, ізотіазоліл, піридил, піридазиніл, піримідиніл, піразиніл, 1,3,5-триазиніл, індазоліл, індоліл, індолізиніл, ізоіндоліл, бензо[b]фураніл, 1,2,3,4-тетрагідроізо-хінолініл, інданіл, інденіл, бензо[b]тієніл, 2,3дигідро-1,4-бензодиоксин-5-іл, бензімідазоліл, циннолиніл, карбазоліл, акридиніл, феназиніл, фенотіазиніл, феноксазиніл, бензотіазоліл, бензо[1,2,5]тіа-диазоліл, пуриніл, хінолініл, ізохінолініл, хінолізиніл, фталазиніл, хіналолиніл, хіноксалиніл, 1,8-нафтиридиніл та птеридиніл. ‘Гало’ або ‘Галоген’ означає хлор, фтор, бром або йод; ‘гетеро’ як у ‘гетероалкіл, гетероароматичний’ тощо означає такий, що містить один або більше атомів N, O або S. ‘Гетероалкіл’ містить алкільні групи з гетероатомами у будь-якій позиції, тобто що містить Nзв’язані O-зв’язані або S-зв’язані алкільні групи. Термін "заміщений" означає, що визначена група або частина несе один або більше замісників. Там, де будь-яка група може нести декілька замісників, та забезпечується різноманітність можливих замісників, замісники є незалежно обраними, і не мають потреби бути однаковими. Термін "незаміщений" означає, що визначена група не несе замісників. По відношенню до замісників, термін "незалежно" означає, що коли можливими є більше, ніж один з таких замісників, вони можуть бути однаковими або різними один від одного. 6 UA 105629 C2 5 10 15 20 25 30 35 40 45 50 55 60 ‘Циклоалкіл(C3-8)’ означає циклопропил, циклобутил, циклопентил, циклогексил, циклоpгептил або циклооктил; ‘гетероциклоалкіл(C4-8)’ стосується кілець, що містять гетероатоми, у тому числі піперидинілу, морфолінілу, азепанілу, піролідинілу, тіоморфолінілу, піперазинілу, тетрагідрофурилу, тетрагідропіранілу. Терміни "окси", "тіо" та "карбо" як застосовано у цьому описі як частина іншої групи відповідно стосуються атома кисню, атома сірки та карбонільної (C=O) групи, що слугує лінкером між двома групами, наприклад гідроксил, оксиалкіл, тіоалкіл, карбоксиалкіл, тощо. Термін "аміно" тут окремо, або у складі іншої групи, стосується атома азоту, який може слугувати або закінченням, або лінкером між двома іншими групами, де група може бути первинним, вторинним або третинним аміном (два атоми водню зв’язані з атомом азоту, один атом водню зв’язаний з атомом азоту або жодний атом водню не зв’язаний з атомом азоту відповідно). Терміни "сульфініл" та "сульфоніл" тут у складі іншої групи відповідно стосуються групи –SO- або– SO2-. Щоб забезпечити більш компактний опис, терміни ‘сполука’ або ‘сполуки’ включають таутомери, стереоізомери, N-оксиди, мічені ізотопами аналоги, або фармакологічно прийнятні солі, а також коли це не визначено точно. N-оксиди вищевказаної сполуки належать до обсягу винаходу. породжують або не породжують метаболіти N-оксидів. Ступінь N-окислення сягає від слідів до практично повної конверсії. N-оксиди можуть бути більш активними, ніж іх відповідні третинні аміни, або менш активними. Хоча N-oксиди легко відновлюються до відповідних третинних амінів хімічними засобами, у людському організмі це відбувається у різному ступені. Деякі N-оксиди майже повністю відновлюються до третинних амінів, а в інших випадках така реакція майже або взагалі не відбувається (Bickel, 1969). Термін ‘форма’ охоплює усі тверді: поліморфи, сольвати та аморфні форми. ‘Кристалічна форма’ стосується різних твердих форм тієї ж сполуки, наприклад поліморфи, сольвати та аморфні форми.. ‘Аморфні форми’ - це некристалічні матеріали з недовгим порядком ряду, та такі, що звичайно не дають характерної порошкової рентгенодифракційної картини. Кристалічні форми в цілому описані у Byrn (1995) та Martin (1995). ‘Поліморфи’ – це кристалічні структури, у яких сполука може кристалізуватися у різних розташуваннях кристалічних носіїв, які усі мають однаковий елементарний склад. Поліморфізм – це часто виникаючий феномен, на який впливають деякі умови кристалізації, як от температура, рівень перенасичення, присутність домішок, полярність розчинника, ступінь охолодження. Різні поліморфи звичайно мають різні рентгенодифракційні картини, ЯМР спектр твердого стану, інфрачервоний спектр або спектр комбінаціонного розсіювання світла, точки топлення, густину, твердість, кристалічну форму, оптичні та електричні властивості, стабільність, та розчинність. Розчинник рекристалізації, рівень кристалізації, температура зберігання, та інші фактори можуть викликати домінування одніієї кристалічної форми. Для забезпечення більш лаконічного опису, деякі наведені тут кількісні вирази не супроводжуються терміном "біля" або "приблизно". Зрозуміло, що незалежно від наявності або відсутності цих термінів, усі наведені кількісні значення є фактичні, а ступінь наближення цієї величини цілком зрозумілий для фахівця з урахуванням експериментальних та/або вимірювальних умов для такої величини. Терміни "селективний" та "селективність" стосується сполук, що виявляють реактивність по відношенню до окремого рецептора (наприклад, рецептор 5-HT6) без виявляють істотну кроссреактивність по відношенню до іншого рецептора (наприклад, інші підтипи рецептора 5-HT). У описі та формулі цієї заявки слово "містять" та варіації цього слова, як от "що містить" and "містить" не виключає інших домішок, компонентів, цілих або етапів. Якщо буде можливим для сполук формули (1) бути застосованими як сира хімічна речовина, переважним є представити їх як ‘фармацевтична композиція’. Згідно із подальшим аспектом, даний винахід забезпечує фармацевтичну композицію, яка містить принаймні одну сполуку формули (1), або її фармацевтично прийнятну сіль або сольват, разом з їх одним або більше фармацевтично прийнятним носієм, та за бажанням один або більше інших терапевтичних інгредієнтів. Носій(ї) мають бути ‘прийнятним’ у розумінні того, що вони мають бути сумісними з іншими інгредієнтами композиції та не бути небезпечними особі, яка їх приймає. Термін "композиція" як використано тут, охоплює продукт, що містить визначені інгредієнти у обумовленій кількості або пропорціях, а також будь-який продукт, що є результатом, прямим або побічним, з’єднання визначених інгредієнтів у визначених кількостях. По відношенню до фармацевтичних композицій, цей термін охоплює продукт, що містить один або більше активних інгредієнтів, та вибірковий носій, що містить інертні інгредієнти, а також будь-який продукт, що є результатом, прямим або побічним, з’єднання, комплексоутворення або агрегації 7 UA 105629 C2 5 10 15 20 25 30 35 40 45 50 55 60 будь-яких двох або більше інгредієнтів, або розкладу одного або більше інгредієнтів, або з інших типів реакцій або взаємодій одного або більше інгредієнтів. Взагалі, фармацевтичні композиції готують готують шляхом однорідного та глибокого введення діучого інгредієнта у асоціацію з рідким носієм або добре розділеним твердим носієм або обома ними, і потім, за необхідності, формуючи продукт у бажану композицію. Фармацевтична композиція включає достатню кількість активної цільової сполуки для одержаного бажаного ефекту упродовж прогресування або стану захворювання. Відповідно, фармацевтичні композиції за даним винаходом охоплюють будь-яку композицію, одержану шляхом змішування сполуки за даним винаходом та фармацевтично прийнятного носія. "Фармацевтично прийнятний" - означає носій, розчинник або розбавник, який сумісний з іншими інгредієнтами композиції та не є небезпечним для особи, що його приймає. В контексті даної заявки, термін ‘комбіновані препарати’ охоплює як дійсні комбінації, що означають сполуку формули (1), та один або більше інших медикаментів, що фізично зкомбіновані в одному препараті, наприклад, у таблетці або рідині для ін’єкцій, а також термін ‘комплекти’ охоплює сполуки формули (1) та один або більше інших медикаментів у окремій формі дозування, разом з інструкцією для використання, та можливо з іншими засобами для полегшення належного введення компонентів сполуки, наприклад, етикетка або малюнок. З дійсними сполуками у фармакотерапії використовується визначення одночасно. У контексті з ‘комплектами’, введення може здійснюватись як одночасно, так і в інших часових інтервалах. Застосування одночасної або послідовної терапії залежить від характеристик інших використовуваних лікарських засобів, таких як початок та тривалість дії, рівень плазми, очищення, і т.д., а також і від захворювання, його стадії та індивідуальних характеристик пацієнта. Спорідненість сполуки за винаходом щодо рецепторів 5-HT6 визначені як описано вище. Зі зв’язуючої спорідненості, виміряної для даної сполуки формули (1), можна оцінити теоретично нижчу ефективну дозу. При концентрації сполуки, еквівалентній подвійному виміряному K iзначенню, приблизно 100 % рецепторів 5-HT6 будуть зайняті сполукою. При переведенні цих концентрацій у мг сполуки на кг ваги пацієнта - за умови ідеальної біозасвоюваності - можна отримати теоретично нижчу ефективну дозу. Фармакокінетика, фармакодинаміка, та інші припущення можуть варіювати звичайну застосовану дозу до вищої або нижчої величини. Типова денна доза активного інгредієнта знаходиться в межах широкого ряду та залежить від різних факторів, як от відповідні показання, шлях введення, вік, вага та стать пацієнта, і може бути визначена лікарем. Взагалі, загальна добова доза усієї кількості активних інгредієнтів, введена пацієнту у одиничній або індивідуальних дозах, може бути у кількості, наприклад, від 0.001 до 10 мг/кг ваги тіла щоденно, та більш звичайно від 0.01 до 1,000 мг у день. Такі дози можуть можуть бути введені пацієнту, який потребує лікування, від одного до трьох разів кожний день, або так часто як це необхідно для ефективності, та протягом періоду принаймні два місяці, більш звичайно протягом принаймні шести місяців, або постійно. Термін "терапевтично ефективна кількість" стосується кількості терапевтичного засобу для лікування стану, що лікується введенням композиції за винаходом. Ця кількість - це кількість, достатня для проявлення помітного терапевтичного або покращувального відгуку у тканинній системі тварини або людини. Ефект може включати, наприклад, лікування перелічених тут станів. Точна фармацевтично ефективна кількість для пацієнта залежить від розміру та здоров’я пацієнта, природи та ступеня стану, що потребує лікування, рекоменцацій спеціаліста, та терапії, або поєднання терапій, обраних для застосування. Тобто, наперед не потрібно визначати точну ефективну кількість. Термін "фармацевтично прийнятна сіль" стосується тих солей, які є, з точки зору здорового медичного глузду, підходящими для застосування у контакті з тканинами людини або нижчої тварини без впливу токсичності, подразнення, алергічної реакції, тощо, та є відповідними при обгрунтованому співвідношенні користь/ризик. Фармацевтично прийнятні солі є добре відомі з рівня техніки. Вони можуть бути одержані in situ при кінцевому виділенні та очищенні сполук за винаходом, або самі по собі шляхом їх реакції з фармацевтично прийнятними не токсичними основами або кислотами, включаючи неорганічні або органічні основи та неорганічні або органічні кислоти (Berge, 1977). Форма ‘вільна основа’ може бути відновлена шляхом контакту солі з основою або кислотою, та виділення спорідненої сполуки у звичайний спосіб. Споріднена фоорма сполуки залежить від різних форм солей з певними фізичними властивостями, як от розчинність у полярних розчинниках, але з іншого боку солі є еквівалентними спорідненій формі сполуки для цілей за даним винаходом. Термін "лікування", як використано тут, стосується будь-якого лікування ссавця, наприклад людського стану або захворювання, та містить: (1) пригнічення захворювання або стану, наприклад, зупинення його розвитку, (2) полегшення захворювання або стану,наприклад, 8 UA 105629 C2 5 10 15 призведення стану до регресу, або (3) припинення симптомів захворювання. Термін ‘пригнічує’ включає його загально прийняте значення, яке означає заборону, попередження, обмеження, полегшення, покращення, та уповільнення, зупинку або зворотню прогресування, тяжкості, або результуючих симптомів. Як використано тут, термін ”медична терапія” включає в себе діагностику та терапевтичний режим, які виконуються in vivo або ex vivo у людини. Як використано тут, термін "розлади ваги тіла" стосується розладів, викликаних дисбалансом між надходженням енергії та витратами енергії, що призводить до ненормальної (наприклад, надлишкової) ваги тіла. Такі розлади ваги тіла включають опасистість (Roth, 1994; Sibley, 1993; Sleigh, 1995, 1997). ‘Опасистість’ стосується стану, коли особа має індекс ваги тіла 2 (ІМТ), розрахований як вага, поділена на висоту в квадраті (кг/м ), принаймні 25.9. Звичайно, особи з нормальною вагою тіла мають ІМТ від 19.9 до менш ніж 25.9. Опасистість може бут ивикликана будь-якою причиною, генетичною, або викликаною навколишнім середовищем. Приклади розладів, які можуть призводити до опасистості або бути причиною опасистості, включають переїдання та булімія, полікистоз яєчників, краниофарингіома, синдром ПрадераВіллі, синдром Фроліха, діабет ІІ типу, особи з дефіцитом гормону роста, звичайний варіант низької будови тіла, синдром Тернерса, та інші патологічні стани, при яких виявляється зниження метаболічної активності або зниження середньої витрати енергії як процентне відношення загальної без жирової маси, наприклад, діти з гострою лімфобластною лейкемією. СКОРОЧЕННЯ ACE-Cl 1-хлороетил хлороформат ACN ацетонітрил ADD розлади дефіциту уваги ADHD розлади гіперактивності з дефіцитом уваги API іонізація атмосферного тиску BEMP 2-трет-бутиліміно-2-диетиламіно-1,3-диметил-пергідро-1,3,2-диазафосфорин BMI індекс маси тіла Boc трет-бутоксикарбоніл Boc2O ди-трет-бутил дикарбонат CHO яєчники китайського хом’яка (клітини) CNS центральна нервова система DCM дихлорометан DiPEA N,N-диізопропилетиламін DMAP 4-диметиламінопіридин DMC 2-хлоро-1,3-диметилімімідазоліній хлорид DMF N,N’-диметилформамід DMSO диметилсульфоксид EA етилацетат SI іонізація електронним розпиленням FCS сироватка зародків телят FP фокусуючий потенціал g грам(и) h година(и) HPLC High Pressure (Performance) Liquid Chromatography 5-HT 5-гідрокситриптамін, серотонін MeI метил йодид MeOH метанол mg міліграм(и) min хвилина(и) мл або мл міліметр(и) m.p. точка топлення c.q. інтервал топлення MS масс-спектрометрія MTBE метил трет-бутилетер PA ефіт нафти (40-60) Rf фактор утримання (тонкошарова хроматографія) Rt час утримання (LC/MS) RT кімнатна температура SIM визначення одиничного іона SCX сильний катіонообмін SPE фаза екстракції твердої речовини t½ період напіврозкладу 9 UA 105629 C2 5 10 15 20 TBAF тетрабутиламоній фторид TBDPS трет-бутилдифенілсиліл TFAA трифтороцтовий ангідрид TMS триметилсиліл TMSCl триметилсиліл хлорид THF тетрагідрофуран WME E середовище Вільямса X-Phos 2-дициклогексилфосфіно-2',4',6'-триізопропилбіфеніл ПРИКЛАД 1: АНАЛІТИЧНІ МЕТОДИ 1 Спектр ядерного магнітного резонансу ( H ЯМР) визначають у визначеному розчиннику 1 1 використовуючи апарат Bruker ARX 400 ( H: 400 МГц) або інстумент Varian VXR200 ( H: 200 МГц) при 300 K, unless indicated otherwise. якщо не зазначено інше. Спектр визначають у дейтерованому хлороформі або DMSO одержаному від Cambridge Isotope Laboratories Ltd. 1 Хімічні зсуви наводяться у ч. на млн. (шкала δ), починаючи від тетраметилсилану ( H). Константи взаємодії J наведені у Гц. Максимальні рівні ЯМР спектру показані символами ‘q’ (квартет), ‘dq’ (подвійний квартет), ‘t’ (триплет), ‘dt’ (подвійний триплет), ‘d’ (дуплет), ‘dd’ (подвійний дуплет), ‘ddd’ (подвійний подвійний дуплет), ‘s’ (синглет), ‘bs’ (широкий синглет) та ‘m’ (мультиплет). Сигнали NH та OH визначають після змішування зразка з краплиною D 2O. Випарювальна хроматографія здійснюється очищенням з використанням зазначеного елюента та силікагелю (силікагель Merck: 0.040-0.063 мм). Точки топлення записують на апараті для визначення точки топлення Büchi B-545. Усі реакції, де задіяні сполуки, чутливі до вологи та/або кисню, виконують у атмосфері безводного азоту. Реакції контролюють з використанням тонкошарової хроматографії (TLC) на скляних тарілках з кварцевим покриттям (покритий силікагелем Merck 60 F254) із зазначеним елюентом. Плями визначають УФ світлом (254 нм) або I2. Рідинна хроматографія-масс-спектрометрія (LC-MS): Система LC-MS складається з 2 мікронасосів Perkin Elmer серії 200. Насоси з’єднані трійниковим змішувачем на 50 мкл, з’єднаним з автоматичним пробовідбірником Gilson 215. Спосіб виконують, як вказано далі: етап 0 1 2 3 4 загальний час 0 1.8 2.5 2.7 3.0 витрата (мкл/хвил) 2000 2000 2000 2000 2000 A( %) 95 0 0 95 95 B( %) 5 100 100 5 5 A= 100 % води з 0.025 % HCOOH та 10ммоль NH4HCOO pH= ±3 B= 100 % ACN з 0.025 % HCOOH 25 30 35 40 Пробовідбірник має впорскувальний контур на 2 мкл. Він підключений до колонки Водаs Atlantis C18 30*4.6 мм з частками 3 мкм. Термостатична пічка Perkin-Elmer серії 200 підтримує у колонці температуру 40 °С. Колонка з’єднана с УФ-метром Perkin Elmer series 200 УФ проточною кюветою 2.7 мкл. Довжина хвилі встановлена 254 нм. УФ-метр підключений до масспектрометра Sciex API 150EX, який має наступні параметри: Діапазон розгортки: 150-900 од.маси; Полярність: позитивна; Режим розгортки: профільний; Перерозчинення Q1: одноразове; Крок: 0.10 од.маси; Час розгортки: 0.500 с; NEB: 10; CUR: 10 IS: 5200; TEM: 325; DF: 30; FP: 225 та EP: 10. До приладу Sciex API 150 підключений детектор розсіювання світла Sedere Sedex 55, який працює при 50 °С та тиску 3 бар N2. Усі системи управляються комп’ютером G3 powermac. ПРИКЛАД 2: ЗАГАЛЬНІ АСПЕКТИ СИНТЕЗУ Відповідний синтез заявлених сполук та проміжних сполук, що містять піразолінові частки, іде шляхом аналогічно описаному у WO 2008/034863, застосовуючи 4,5-дигідро-1H-піразолові або 4,5-дигідро-3H-піразолові будівельні блоки, які або доступні на ринку, або їх одержують, як вказано нижче. 10 UA 105629 C2 Шлях 1 SK Alkyl SK N X NH2 CS2 KOH O S O N R R N 10 R Alkyl N N (V) N N N 5 R O S O R R R Alkyl S O S O NH4OH R O S O S Cl HN Alkyl S N R N R N O S O N H R N R O S O R (VI) R (IV) Шлях 1 застосовує структури N-(біс-алкілсульфаніл-метилен)-сульфонаміду загальної формули (V), які можуть бути одержані з сульфонамідів реакцією з CS 2 у присутності KOH, з подальшою реакцією з галідом алкілу, як от метил йодид. Дві функціональності S-алкілу можуть потім бути заміщені амінами, переважно починаючи з піразолінових будівельних блоків, щоб отримати структури загальної формули (VI), закінчуючи похідними сульфонілпіразолін карбоксамідину загальної формули (IV). Шлях 2 S H2N N R Alkyl-X S R N R . HX N N HN N H R R Alkyl R N X R N N R (IX) HN R N R R (X) 15 20 N N O S O N N R O S O R R (IV) Шлях 2 застосовує фрагменти алкіл-ізотіосечовини або відповідні форми їх солей загальної формули (IX), одержані реакцією будівельних блоків тіосечовини з алкіл галідами, як от метил йодид, що можуть реагувати з піразолінами у присутності основи, одержуючи похідні піразолін карбоксамідину загальної формули (X). Останні можуть реагувати з сульфоніл галідами (X=Br, Cl, F, переважно Cl) у присутності основи, щоб одержати похідні сульфонілпіразолін карбоксамідину загальної формули (IV). 11 UA 105629 C2 Шлях 3 O NH2 O S O OMe Cl or Boc2O, DMAP O R N 5 10 15 20 N H R N HN N N R R N (I) R R N O S O R O S O R OR HN Cl NH4OH O N halogenating agent N N R X N O S O O S O (II) R N R HN R N R O S O R R (III) (IV) Шлях 3 застосовує сульфоніл карбамати загальної формули (I), які можуть, наприклад, бути одержані реакцією сульфонамідів з метил хлороформату або ди-трет-бутил дикарбонату у присутності основи. Продукти їх реакції з піразолінами загальної формули (II) можуть потім бути перетворені у проміжні сполуки хлороіміну загальної формули (III), з використанням галогенуючих засобів, як от PCl3, POCl3/DMAP або хлорид 2-хлоро-1,3-диметилімімідазолінію (DMC), з подальшою реакцією з амінами, одержуючи похідні сульфонілпіразолін карбоксамідину загальної формули (IV). Вибір специфічної процедури синтезу залежить від факторів, відомих фахівцям, як от сумісність функціональних груп із застосованим реагентами, можливість використання захисних груп, каталізаторів, активуючих та зв’язуючих реагентів та первинних структурних характеристик, що присутні у кінцевій сполуці. Фармацевтично прийнятнї солі можуть бути одержані з використанням стандартних процедур, добре відомих з рівня техніки, наприклад змішуванням сполуки за даним винаходом з відповідною кислотою, наприклад, неорганічною або органічною. ПРИКЛАД 3: СИНТЕЗ ПРОМІЖНИХ СПОЛУК ПІРАЗОЛІНУ Наступні проміжні сполуки піразоліну синтезують, як описано у WO 2008/034863. N N N H N H (i) N N N H N H (x) (xi) N N N N H (xvii) N O N H (xviii) (v) (vi) N H N N (xiv) (xix) 12 O N H (xvi) (xv) N (xx) (ix) N N N H N (viii) N H N N H N N N N N H (xiii) N N (vii) N N N H (xii) N N N H N H (iv) N H (iii) (ii) N N N S N H (xxi) S N N H (xxii) UA 105629 C2 N N N N N (xxiii) N N H N H N N (xxvi) (xxv) (xxiv) N O N (xxvii) CF3 F3C O N N N N 5 10 15 20 25 30 35 (xxviii) (xxix) N N (xxx) (i) 3-Етил-4,5-дигідро-1H-піразол (ii) 3-Метил-4,5-дигідро-1H-піразол (iii) 4-Етил-4,5-дигідро-1H-піразол (iv) 4-Метил-4,5-дигідро-1H-піразол (v) 5-Етил-4,5-дигідро-1H-піразол (vi) 4,4-Диметил-4,5-дигідро-3H-піразол (vii) 4,4-Диетил-4,5-дигідро-3H-піразол (viii) 2,3-Диаза-спіро[4.4]нон-2-ен (ix) 2,3-Диаза-спіро[4.5]дец-2-ен (x) 4-Етил-3-метил-4,5-дигідро-1H-піразол (xi) 3,3a,4,5,6,7-Гексагідро-2H-індазол (xii) 4-Етил-5-метил-4,5-дигідро-1H-піразол (xiii) 5-Етил-4-метил-4,5-дигідро-1H-піразол (xiv) 3,4,4-триметил-4,5-дигідро-1H-піразол (xv) 5-Феніл-4,5-дигідро-1H-піразол (xvi) 5-Фуран-2-іл-4,5-дигідро-1H-піразол (xvii) 3-(3,4-Дигідро-2H-піразол-3-іл)-піридин (xviii) 5-Фуран-3-іл-4,5-дигідро-1H-піразол (xix) 2-(3,4-Дигідро-2H-піразол-3-іл)-піридин (xx) 4-(3,4-Дигідро-2H-піразол-3-іл)-піридин (xxi) 5-Тіофен-3-іл-4,5-дигідро-1H-піразол (xxii) 5-Тіофен-2-іл-4,5-дигідро-1H-піразол (xxiii) 3-Ізопропил-5-феніл-4,5-дигідро-1H-піразол (xxiv) 4-Метил-5-феніл-4,5-дигідро-1H-піразол (xxv) 4-Етил-5-феніл-4,5-дигідро-1H-піразол (xxvi) 5-Метил-3a,4,5,6,7,7a-гексагідро-1H-піразолo[4,3-c]піридин (xxvii) 8-Бензил-2,3,8-триаза-спіро[4.5]дец-2-ен (xxviii) 4-Бензилоксиметил-4-метил-4,5-дигідро-3H-піразол (xxix) 8-окса-2,3-диаза-спіро[4.5]дец-2-ен (xxx) 4,4-Біс-(2,2,2-трифтор-етил)-4,5-дигідро-3H-піразол ПРИКЛАД 4: СИНТЕЗ ОКРЕМИХ СПОЛУК 4-Аміно-N-[(2,3-диаза-спіро[4.4]нон-3-ен-2-іл)-етиламіно-метилен]бензен-сульфонамід (Сполука 4) 4-Аміно-N-(біс-метилсульфаніл-метилен)-бензенсульфонамід: 13 UA 105629 C2 S S N NH2 O S O 1) CS2, NaOH 2) MeI O S O DMF NH2 NH2 5 10 15 100 г сульфаніламіду розчиняють у 375 мл DMF, 33.2 мл 50 % водного розчину NaOH додають по краплинах та перемішування продовжують при кімнатній температурі 10 хвил. До білої суспензії, додають по краплинах 19.2 мл дисульфід вуглецю та суміш перемішують при кімнатній температурі 30 хвил. Суміш обробляють іще двічі з подальшим додаванням 18.1 мл 50 % водного NaOH та 9.6 мл дисульфіду вуглецю, з інтервалом у перемішуванні 10 хвил. між двома циклами. Після остаточного перемішування суміші 30 хвил, помаранчевий/червоний розчин охолоджують на водяній бані, та додають по краплинах 72.3 мл йодметану у такому співвідношенні, що температура суміші тримається нижче 25 ˚C. Додають 25 мл DMF, щоб суміш була придатною до перемішування, та перемішування продовжують 1 год. При охолодженні, 250 мл води додають до суміші та суспензію механічно перемішують усю ніч при кімнатній температурі. Осад відфільтровують та промивають з водою та холодним етанолом. Осад рекристалізують з етил ацетату одержуючи, після висушування при 50 ˚C у вакуумі, 64.9 г 1 (40 %) білої твердої речовини. H ЯМР (400 МГц, DMSO-d6) δ 3.38 (s, 6H), 6.15 (s, 2H), 6.66 (d, J=8.73 Hz, 2H), 7.56 (d, J=8.73 Hz, 2H). 4-Аміно-N-[(2,3-диаза-спіро[4.4]нон-3-ен-2-іл)-метилсульфаніл-метилен]-бензенсульфонамід піридин мікрохвильове випромінювання 20 25 У 25 мл мікрохвильовому флаконі, 2.00 г 4-аміно-N-(біс-метилсульфаніл-метилен)бензенсульфонаміду та 1.00 г 2,3-диаза-спіро[4.4]нон-2-ену розчиняють у 15 мл піридину. Флакон закупорюють та нагрівають 2 год. при 180 ˚C у мікрохвилях. Суміші, одержані у 8 з цих послідовних експериментів, поєднують та концентрують при зниженому тиску. Осад піддають випарювальній хроматографії (DCM/EA 95:5 → 90:10) та випарення чистих фракцій дає 5.20 г 1 (25 %) твердої жовтої речовини. H ЯМР (400 МГц, CDCl3) δ 1.63-1.92 (m, 8H), 2.23 (s, 3H), 3.06 (s, 2H), 4.03 (s, 2H), 6.67 (d, 2H), 6.98 (s, 1H), 7.74 (d, 2H). N N N N N O S O S EtNH2 N MeOH O S O NH2 NH2 14 N H UA 105629 C2 5 10 До розчину 4.05 г 4-аміно-N-[(2,3-диаза-спіро[4.4]нон-3-ен-2-іл)-метилсульфаніл-метилен] бензенсульфонаміду у 30 мл MeOH додають 7.86 мл 70 % водного розчину етиламіну. Суміш перемішують 1 год. при кімнатній температурі та випарюють до сухого стану. Осад розчиняють у мінімальній кількості DCM та розтирають з MTBE. Осад відфільтровують та сушать у вакуумі, та потім рекристалізують з n-бутил ацетату, даючи на виході 2.40 г (67 %) 4-аміно-N-[(2,3-диазаспіро[4.4]нон-3-ен-2-іл)-етиламіно-метилен]-бензенсульфонаміду у вигляді білуватого 1 мікрокристалічного матеріалу після висушування у вакуумі при 80 ˚C; m.p. 141-142 ˚C. H ЯМР (400 МГц, CDCl3) δ 1.14 (t, J=7.22 Hz, 3H), 1.47-1.89 (m, 8H), 3.35-3.57 (m, 2H), 3.79 (s, 2H), 4.02 (br.s., 2H), 6.65 (d, J=8.73 Hz, 2H), 6.78 (s, 1H), 6.91 (br. s., 1H), 7.70 (d, J=8.73 Hz, 2H). 4-Аміно-N-[(2,3-диаза-спіро[4.4]нон-3-ен-2-іл)-етиламіно-метилен]-3-фторбензенсульфонамід (Сполука 15) 3-Фтор-4-нітро-бензенсульфонамід NH2 Cl O S O O S O NH4OH F F NO2 NO2 15 20 CH3CN До розчину 5.00 г 3-фтор-4-нітробензенсульфоніл хлориду у 20 мл ацетонітрилу, охолодженого наводяній бані, додають по краплинах 4.40 мл 30 % розчин гідроксиду амонію. Після видалення водяної бані, перемішування продовжують 30 хвил. при кімнатній температурі. Додають воду та суміш екстрагують з DCM. Поєднані органічні шари сушать над MgSO 4 та 1 випарюють до сухого стану, даючи на виході 4.65 г (99 %) твердої жовтої речовини. H ЯМР (400 МГц, DMSO-d6) δ 7.51 (s, 2H), 7.89 (d, J=9.33 Hz, 1H), 7.92 (dd, J=10.23, 1.81 Hz, 1H), 8.14-8.21 (m, 1 H). 4-Аміно-3-фтор-бензенсульфонамід 25 NH2 NH2 O S O O S O H2, Pd/C MeOH F F NH2 NO2 30 До розчину 1.00 г 3-фтор-4-нітро-бензенсульфонаміду у 10 мл MeOH додають 10 моль % паладію на вуглеці. Суміш гідрогенізують 30 хвилин при тиску H2 50 psi. Після фільтрації над 1 Hyflo, концентрація у вакуумі становить на виході 630 мг (74 %) темно-коричневої олії. H ЯМР (400 МГц, DMSO-d6) δ 6.83 (t, J=8.43 Hz, 1H), 7.42 (dd, J=8.28, 1.96 Hz, 1H), 7.47 (dd, J=10.99, 1.96 Hz, 1H) [NH2’s invisible]. 4-Аміно-N-(біс-метилсульфаніл-метилен)-3-фтор-бензенсульфонамід S NH2 N O S O 1) CS2, NaOH 2) MeI S O S O DMF F 35 40 F NH2 NH2 1.15 г 4-Аміно-3-фтор-бензенсульфонаміду розчиняють у 50 мл DMF, додають по краплинах 0.33 мл 50 % водного розчину NaOH та перемішування продовжують 30 хвил. при кімнатній температурі. До суміші, додають по краплинах 0.16 мл дисульфід вуглецю та суміш перемішують при кімнатній температурі 1 год. Суміш обробляють іще двічі з подальшим 15 UA 105629 C2 5 додаванням 0.16 мл 50 % водного NaOH та 0.08 мл дисульфіду вуглецю, з 30 хвил. інтервалом у перемішуванні між двома циклами. Після остаточного перемішування суміші протягом 1 год., до пурпурного розчину додають по краплинах 0.72 мл йодметану та перемішування продовжують 1 год. Після охолодження суміші на водяній бані, 100 мл води повільно додають до суміші та суспензію перемішують механічно усю ніч при кімнатній температурі. Осад 1 відфільтровують та сушать даючи на виході 0.60 г (35 %) твердої коричневої речовини. H ЯМР (400 МГц, CDCl3) δ 2.55 (s, 6H), 4.20 (br. s., 2H), 6.80 (t, J=8.58 Hz, 1H), 7.56-7.64 (m, 2 H). 4-Аміно-N-[(2,3-диаза-спіро[4.4]нон-3-ен-2-іл)-метилсульфаніл-метилен]-3-фторбензенсульфонамід 10 15 У 10 мл мікрохвильовому флаконі, 530 мг 4-аміно-N-(біс-метилсульфаніл-метилен)-3-фторбензенсульфонаміду та 325 мг 2,3-диаза-спіро[4.4]нон-2-ену розчиняють у 5 мл піридину, та додають краплину іонної рідини (1-бутил-3-метилімідазоліній гексафторфосфат). Флакон закупорюють та нагрівають 2 год. при 180 ˚C у мікрохвилях. Суміш концентрують при зниженому 1 тиску та сушать у вакуумі, та сирий продукт (840 мг) застосовують на подальшому етапі. H ЯМР (400 МГц, CDCl3) δ 1.60-2.03 (m, 8H), 2.24 (s, 3H), 3.07 (s, 2H), 4.90 (br.s., 2H), 7.00 (s, 1H), 7.287.33 (m, 1H), 7.65-7.73 (m, 1H), 8.62 (d, J=3.91 Hz, 1H). 20 N N N N N O S O EtNH2 N MeOH S O S O F F NH2 NH2 25 30 N H До розчину 840 мг 4-аміно-N-[(2,3-диаза-спіро[4.4]нон-3-ен-2-іл)-метилсульфаніл-метилен]-3фтор-бензенсульфонаміду (сирий) у 25 мл MeOH додають 3.43 мл 70 % водного розчину етиламіну. Суміш перемішують при кімнатній температурі 1 год., додають воду, та суміш екстрагують з DCM. Поєднані органічні шари сушать над MgSO 4 та випарюють до сухого стану. Осад очищують випарювальною хроматографією (EA/PA 3:1) даючи на виході 260 мг (33 % на 2 етапах) 4-аміно-N-[(2,3-диаза-спіро[4.4]нон-3-ен-2-іл)-етиламіно-метилен]-3-фтор1 бензенсульфонаміду у вигляді коричневої олії. H ЯМР (400 МГц, CDCl3) δ 1.16 (t, J=7.2 Hz, 3H), 1.57-1.87 (m, 7H), 3.43-3.53 (m, 2H), 3.82 (s, 2H), 4.02-4.07 (m, 2H), 6.77 (t, J=8.4 Hz, 1H), 6.80 (s, 1H), 7.50-7.58 (m, 2H) [NH2 невидимий]. N-[Етиламіно-(5-феніл-4,5-дигідро-піразол-1-іл)-метилен]-4-гідроксибензен-сульфонамід (сполука 25) N-(Біс-метилсульфаніл-метилен)-4-метокси-бензенсульфонамід 35 16 UA 105629 C2 S NH2 O S O S N 1) CS2, NaOH 2) MeI O S O DMF O 5 10 O 10.00 г 4-Метоксибензенсульфонаміду розчиняють у 90 мл DMF та додають 5.16 мл дисульфіду вуглецю. Суміш охолоджують на водяній бані, з подальшим доданням по краплинах 6.47 мл 50 % водного розчину NaOH. Темно-червону суміш перемішують 30 хвил., додають по краплинах 7.65 мл йодметану, крижану баню видаляють та суміш перемішують при кімнатній температурі 1 год. Потім, до суміші повільно додають 33 мл води та суспензію перемішують усю ніч при кімнатній температурі. Осад відфільтровують, промивають 3 рази з водою та сушать у вакуумі. Продукт очищують випарювальною хроматографією (DCM → DCM/MeOH 95:5) даючи 1 на виході 8.00 г (44 %) аморфного маслянистого білого матеріалу. H ЯМР (400 МГц, CDCl3) δ 2.53 (s, 6H), 3.88 (s, 3H), 6.97 (q, J=5.12 Hz, 2H), 7.93 (q, J=5.02 Hz, 2H). 4-Метокси-N-[метилсульфаніл-(5-феніл-4,5-дигідро-піразол-1-іл)-метилен]бензенсульфонамід 15 20 У атмосфері N2, 3.26 г N-(Біс-метилсульфаніл-метилен)-4-метокси-бензенсульфонаміду та 4.34 г 5-феніл-4,5-дигідро-1H-піразолу розчиняють у 25 мл піридину та нагрівають зі зворотнім холодильником протягом 3 днів. Суміш охолоджують та концентрують при зниженому тиску. Осад додають у EA та екстрагують з 5 % водного розчину NaHCO3. Органічний шар сушать над MgSO4 та випарюють до сухого стану, та осад очищують випарювальною хроматографією (DCM → DCM/MeOH 95:5). Випарення чистих фракцій дає 2.30 г (40 %) жовтої олії. TLC: Rf 0.71 (DCM/MeOH 95:5). LC-MS: Rt 1.85 хвил (MH+ 390). N-[Етиламіно-(5-феніл-4,5-дигідро-піразол-1-іл)-метилен]-4-метокси-бензенсульфонамід 25 N N N N N O S O S EtNH2 MeOH N H O O 30 N O S O До розчину 2.30 г 4-Метокси-N-[метилсульфаніл-(5-феніл-4,5-дигідро-піразол-1-іл)-метилен]бензенсульфонаміду у 50 мл MeOH додають 3.80 мл 70 % водного розчину етиламіну. Суміш перемішують усю ніч при кімнатній температурі та випарюють до сухого стану. Осад додають у EA та екстрагують з 5 % водним розчином NaHCO3. Органічний шар сушать над MgSO4 та випарюють до сухого стану, та осад очищують препаративною HPLC даючи на виході 1.20 г 17 UA 105629 C2 1 (62 %) білої аморфної твердої речовини. H ЯМР (400 МГц, CDCl3) δ 1.14 (t, J=7.2 Hz, 3H), 2.662.79 (m, 1H), 3.28-3.42 (m, 1H), 3.48-3.67 (m, 2H), 3.80 (s, 3H), 5.51 (dd, J=11.9, 7.1 Hz, 1H), 6.60 (d, J=9.0 Hz, 2H), 6.94-6.98 (m, 1H), 7.02-7.09 (m, 2H), 7.18 (d, J=9.0 Hz, 2H), 7.20-7.25 (m, 3H) [гуанідин NH невидимий]. 5 N N N N N O S O N H BBr3 CH2Cl2 15 20 N H OH O 10 N O S O У атмосфері N2, до розчину 1.05 г N-[етиламіно-(5-феніл-4,5-дигідро-піразол-1-іл)-метилен]4-метокси-бензенсульфонаміду у 25 мл DCM, додають 12.91 мл 1M розчину триброміду боронію у DCM. Суміш перемішують усю ніч при кімнатній температурі у атмосфері N 2, гасять з водою, та перемішують іще 30 хвилин. Тверді частини відфільтровують та фільтрат екстрагують з водою. Органічний шар сушать над MgSO4 та випарюють до сухого стану. Осад очищують випарювальною хроматографією (поетапний градієнт DCM → DCM/MeOH 95:5). Чисті фракції концентрують та розтирають з Et2O. Тверді частини відфільтровують та сушать у вакуумі даючи на виході 0.34 г (34 %) N-[етиламіно-(5-феніл-4,5-дигідро-піразол-1-іл)-метилен]-4-гідрокси1 бензенсульфонамід у вигляді сірого кристалічного матеріалу, m.p. 158-160 ˚C. H ЯМР (400 МГц, DMSO-d6) δ 1.07 (t, J=7.2 Hz, 3H), 2.69-2.81 (m, 1H), 3.36-3.47 (m, 1H), 3.49-3.59 (m, 2H), 5.40-5.51 (m, 1H), 6.55 (d, J=8.7 Hz, 2H), 7.00 (d, J=8.4 Hz, 2H), 7.04-7.12 (m, 3H), 7.22-7.29 (m, 3H), 9.71 (s, 1H) [гуанідин NH невидимий]. N-[(2,3-Диаза-спіро[4.4]нон-3-ен-2-іл)-етиламіно-метилен]-4-гідроксиметилбензенсульфонамід (Сполука 40) Метил ефір 4-сульфамоїл-бензойної кислоти NH2 NH2 O S O O S O H2SO4 MeOH O O OH O 25 30 До суміші 5.16 u 4-карбоксилбензенсульфонаміду у 150 мл метанолі додають 6.84 мл сірної кислоти. Суміш нагрівають зі зворотнім холодильником усю ніч та охолоджують до кімнатної температури. Суміш випарюють до сухого стану та осад розтирають з Et 2O. Утворений осад відфільтровують, промивають з Et2O та сушать даючи на виході 5.2 г (92 %) білої твердої 1 речовини. H ЯМР (400 МГц, CDCl3) δ 3.90 (s, 3H), 7.59 (s, 2H), 7.97 (d, J=5.84 Hz, 2H), 8.15 (d, J=5.84 Hz, 2H). 4-Гідроксиметил-бензенсульфонамід NH2 NH2 O S O O S O LiBH4 THF/MeOH O OH O 35 До розчину 5.2 г метил ефіру 4-сульфамоїл-бензойної кислоти у 100 мл THF та 1.44 мл MeOH, додають порціонно 0.77 г борогідриду літію протягом періоду 10 хвилин. Суміш 18 UA 105629 C2 5 нагрівають при нагріванні зі зворотнім холодильником усю ніч, охолоджують до кімнатної температури, та занурюють у кригу, що містить 100 мл 1N HCl. Суміш екстрагують з EtOAc, та органічний шар сушать над MgSO4 та концентрують при зниженому тиску. Осад очищують автоматичною випарювальною хроматографією (EtOAc/Гексан 1:1) даючи на виході 0.75 г 1 (17 %) продукту. H ЯМР (400 МГц, DMSO-d6) δ 4.57 (d, J=5.81 Hz, 1H), 5.38 (t, J=5.81 Hz, 1H), 7.48 (d, J=8.34 Hz, 2H), 7.78 (d, J=8.34 Hz, 2H). 4-(трет-Бутил-дифеніл-силанілоксиметил)-бензенсульфонамід 10 15 20 До суміші 750 мг 4-гідроксиметил-бензенсульфонаміду у 50 мл DMF додають 1.55 мл третбутилхлородифенілсилану та 539 мг імідазол. Суміш перемішують усю ніч при кімнатній температурі, розбавляють з EtOAc та екстрагують з водою. Органічну фазу сушать над MgSO 4 та концентрують при зниженому тиску. Сирий продукт очищують автоматизованою випарювальною хроматографією (DCM) даючи на виході 0.5 г чистого продукту та 0.6 г 1 матеріалу з неочищених фракцій продукту. H ЯМР (400 МГц, CDCl3) δ 1.07 (s, 3H), 1.11 (s, 6H), 4.75 (s, 2H), 4.82 (s, 2H), 7.35-7.47 (m, 6H), 7.49 (d, J=5.68 Hz, 2H), 7.64-7.74 (m, 4H), 7.90 (d, J=5.68 Hz, 2H). N-(Біс-метилсульфаніл-метилен)-4-(трет-бутил-дифеніл-силанілоксиметил)бензенсульфонамід S NH2 O S O 1) CS2, NaOH 2) MeI DMF 30 O S O OTBDPS OTBDPS 25 S N До суміші 500 мг 4-(трет-бутил-дифеніл-силанілоксиметил)-бензенсульфонаміду у 50 мл DMF додають 0.11 мл дисульфіду вуглецю, та суміш охолоджують до 10 ˚C. При перемішуванні, додають по краплинах 0.14 мл 50 % водного NaOH та суміш перемішують одну годину при кімнатній температурі. Потім, додають по краплинах 0.16 мл йодметану та перемішування при кімнатній температурі продовжують 30 хвилин. Після додавання 10 мл води, суміш перемішують усю ніч при кімнатній температурі. Осад відфільтровують, промивають з водою та сушать даючи 1 на виході 0.4 г продукту. H ЯМР (400 МГц, DMSO-d6) δ 1.04-1.08 (m, 9H), 2.57 (s, 6H), 4.88 (s, 2H), 7.40-7.50 (m, 6H), 7.59 (d, J=8.34 Hz, 2H), 7.63-7.68 (m, 4H), 7.90 (d, J=8.34 Hz, 2H). 4-(трет-Бутил-дифеніл-силанілоксиметил)-N-[(2,3-диаза-спіро[4.4]нон-3-ен-2-іл)метилсульфаніл-метилен]-бензенсульфонамід 19 UA 105629 C2 5 10 До 15 мл піридину, додають 400 мг N-(біс-метилсульфаніл-метилен)-4-(трет-бутил-дифенілсиланілоксиметил)-бензенсульфонаміду та 111 мг 2,3-диаза-спіро[4.4]нон-2-ену. Суміш нагрівають дві ночі при 90 ˚C, концентрують при зниженому тиску та сушать у вакуумі, одержуючи 700 мг продукту (LC-MS Rt 3.91 хвил), який застосовують на подальшому етапі без 1 очищення. H ЯМР (400 МГц, CDCl3) δ ppm 1.10-1.12 (m, 9H), 1.63-1.94 (m, 8H), 4.82 (s, 2H), 7.01 (s, 1H), 7.65-7.71 (m, 4H), 7.92-7.96 (m, 2H). 4-(трет-Бутил-дифеніл-силанілоксиметил)-N-[(2,3-диаза-спіро[4.4]нон-3-ен-2-іл)-етиламінометилен]-бензенсульфонамід N N N N S N O S O EtNH2 MeOH N O S O OTBDPS OTBDPS 15 20 N H До розчину 700 мг 4-(трет-бутил-дифеніл-силанілоксиметил)-N-[(2,3-диаза-спіро[4.4]нон-3ен-2-іл)-метилсульфаніл-метилен]-бензенсульфонаміду у 50 мл метанолу додають 1.84 мл 70 % водного розчину етиламіну. Суміш перемішують одну годину при кімнатній температурі та концентрують при зниженому тиску. Осад очищують автоматизованою випарювальною 1 хроматографією (DCM → DCM/MeOH 97:3) даючи на виході 730 мг продукту. H ЯМР (400 МГц, CDCl3) δ ppm 1.10 (s, 9H), 1.15 (t, J=7.21 Hz, 3H), 1.66-1.75 (m, 8H), 3.48 (dd, J=7.21, 5.38 Hz, 2H), 3.85 (s, 2H), 4.80-4.81 (m, 2H), 6.80 (s, 1H), 7.35-7.47 (m, 6H), 7.65-7.70 (m, 4H), 7.65-7.70 (m, 2H), 7.88-7.91 (m, 2H). N N N N N O S O N H TBAF THF N O S O N H OH OTBDPS 20 UA 105629 C2 5 10 15 20 25 694 мг 4-(трет-Бутил-дифеніл-силанілоксиметил)-N-[(2,3-диаза-спіро[4.4]нон-3-ен-2-іл)-етиламіно-метилен]-бензенсульфонаміду додають у 40 мл THF, та додають по краплинах 1.04 мл 1 M розчину тетрабутиламоній фториду. Суміш перемішують при кімнатній температурі 4 години.Суміш розбавляють з EtOAc та екстрагують 3 рази з 5 % водним NaHCO3. Органічну фазу сушать над MgSO4 та концентрують при зниженому тиску. Осад піддають автоматизованій випарювальній хроматографії (DCM/MeOH 95:5), та одержаний сирий продукт додають у EtOAc та екстрагують двічі з 2N водного NaOH. Після висушування та концентрації, осад перемішують з 5 мл MTBE, та одержану білу тверду речовину відфільтровують та сушать даючи на виході 40 1 мг продукту. H ЯМР (400 МГц, CDCl3) δ 1.15 (t, J=7.20 Hz, 3H), 1.62-1.86 (m, 8H), 3.41-3.52 (m, 2H), 3.84 (br.s., 1H), 4.77 (d, J=5.31 Hz, 2H), 6.80 (s, 1H), 7.45 (d, J=8.34 Hz, 2H), 7.93 (d, J=8.34 Hz, 2H). 4-Аміно-N-[етиламіно-(2,3,8-триаза-спіро[4.5]dec-3-ен-2-іл)-метилен]-бензенсульфонамід (сполука 47) 4-Аміно-N-[(8-бензил-2,3,8-триаза-спіро[4.5]dec-3-ен-2-іл)-метилсульфаніл-метилен]бензенсульфонамід: У 25 мл мікрохвильовому флаконі, 1.50 н 4-аміно-N-(біс-метилсульфаніл-метилен) бензенсульфонаміду та 1.37 г 8-бензил-2,3,8-триаза-спіро[4.5]дец-2-ену суспендують у 20 мл піридину. Флакон закупорюють та нагрівають 1 годину при 180 ˚C (6 бар) у мікрохвилях. Реакційну суміш концентрують на силікагелі. Очищення з випарювальною колонковою хроматографією (DCM → 1 DCM/MeOH 99:1 → DCM/MeOH 98:2) дає на виході 1.03 g (41 %) у вигляді бежевої amorph. H ЯМР (400 МГц, CDCl3) δ 1.57-1.72 (m, 2H), 1.78-1.92 (m, 2H), 2.17-2.32 (m, 5H), 2.66-2.81 (m, 2H), 3.51 (s, 2H), 4.04 (s, 2H), 4.28 (s, 2H), 6.64-6.71 (m, 2H), 6.98 (s, 1H), 7.20-7.37 (m, 5H), 7.72-7.79 (m, 2H). 4-Аміно-N-[(8-бензил-2,3,8-триаза-спіро[4.5]дец-3-ен-2-іл)-етиламіно-метилен]бензенсульфонамід: N N N N N N N S Et2NH N O S O O S O MeOH 30 NH2 NH2 21 N H UA 105629 C2 5 10 15 20 До розчину 1.35 г 4-аміно-N-[(8-бензил-2,3,8-триаза-спіро[4.5]дец-3-ен-2-іл)-метилсульфанілметилен]-бензенсульфонаміду у 30 мл MeOH додають 2.26 мл (10 еквів.) 70 % водного розчину етиламіну. Суміш перемішують протягом вихідних при кімнатній температурі та концентрують на силікагелі. Очищення випарювальною колонковою хроматографією (DCM → DCM/MeOH 99:1 1 → DCM/MeOH 95:5) дає на виході 1.16 г (87 %) блідо-жовтого скла. H ЯМР (400 МГц, CDCl3) δ 1.14 (t, J=7 Hz, 3H), 1.50-1.60 (m, 2H), 1.73-1.84 (m, 2H), 2.11-2.26 (m, 2H), 2.63-2.76 (m, 2H), 3.413.53 (m, 2H), 3.79 (s, 2H), 3.98 (s, 2H), 6.62-6.70 (m, 2H), 6.76 (s, 1H), 6.97 (br s, 1H), 7.22-7.36 (m, 5H), 7.67-7.75 (m, 2H). Трет-бутил ефір (4-{[(8-Бензил-2,3,8-триаза-спіро[4.5]дец-3-ен-2-іл)-етиламіно-метилен]сульфамоїл}-феніл)-карбамінової кислоти: До розчину 510 мг 4-аміно-N-[(8-бензил-2,3,8-триаза-спіро[4.5]дец-3-ен-2-іл)-етиламінометилен]-бензенсульфонаміду у 10 мл 1,4-диоксану додають 490 мг (2 еквів.) ди-трет-бутил дикарбонату. Суміш перемішують при нагріванні зі зворотнім холодильником усю ніч, охолоджують та концентрують на силікагелі. Очищення випарювальною колонковою 1 хроматографією (DCM/MeOH 99:1 → 95:5) дає на виході 550 мг (87 %) жовтого скла. H ЯМР (400 МГц, CDCl3) δ 1.14 (t, J=7 Hz, 3H), 1.47-1.61 (m, 11H), 1.73-1.86 (m, 2H), 2.11-2.26 (m, 2H), 2.64-2.76 (m, 2H), 3.41-3.54 (m, 2H), 3.80 (s, 2H), 6.66 (s, 1H), 6.78 (s, 1H), 6.94 (br s, 1H), 7.217.37 (m, 5H), 7.41-7.48 (m, 2H), 7.82-7.89 (m, 2H). Трет-бутил ефір (4-{[Етиламіно-(2,3,8-триаза-спіро[4.5]дец-3-ен-2-іл)-метилен]-сульфамоїл}феніл)-карбамінової кислоти: H N N N N N N N O S O N H 1) ACE-Cl, DiPEA, DCE N O S O N H 2) MeOH HN 25 30 HN boc boc Розчин 550 мг трет-бутил ефіру (4-{[(8-Бензил-2,3,8-триаза-спіро[4.5]дец-3-ен-2-іл)етиламіно-метилен]-сульфамоїл}-феніл)-карбамінової кислоти у 10 мл 1,2-дихлороетану охолоджують на водяній бані, та додають по краплинах 0.12 мл (1.1 еквів.) 1-хлороетил хлороформату та 0.03 мл DiPEA. Після 15 хвилин крижану баню видаляють та суміш перемішують 30 хвилин при кімнатній температурі. Суміш концентрують у вакуумі та спів 22 UA 105629 C2 5 випарюють 3 рази з толуолом. Осад додають у 10 мл MeOH та перемішують усю ніч при кімнатній температурі. Суміш концентрують. Осад додають у EA та екстрагують з 2 M NaOH. Органічний шар сушать над Na2SO4, фільтрують та концентрують на силікагелі. Очищення випарювальною колонковою хроматографією (EtOAc/MeOH/Et3N 50:45:5) дає на виході 360 мг (72 %) оранжевого 1 скла. H ЯМР (400 МГц, DMSO-d6) δ 0.96 (t, J=7 Hz, 3H), 1.33-1.43 (m, 2H), 1.48 (s, 9H), 1.53-1.64 (m, 2H), 2.44-2.56 (m, 2H), 2.76-2.88 (m, 2H), 3.21-3.33 (m, 2H), 3.68 (s, 2H), 7.29 (s, 1H), 7.50-7.59 (m, 2H), 7.60-7.74 (m, 3H), 9.70 (s,1H). 10 15 20 360 мг трет-бутил ефіру (4-{[етиламіно-(2,3,8-триаза-спіро[4.5]дец-3-ен-2-іл)-метилен]сульфамоїл}-феніл)-карбамінової кислоти суспендують у 10 мл етанолу; додають 0.44 мл (5 еквів.) вератролу, та потім 3.49 мл 1 M HCl у етанолі (5 еквів.). Суміш перемішують при 60 ˚C усю ніч. Після охолодження, суміш очищують з SPE (Isolute Flash SCX-2, кондиціонування, взяття зразків та промивання з MeOH, розбавлення з 1 M NH3 in MeOH) даючи на виході 150 мг 1 (53 %) жовтого скла. H ЯМР (400 МГц, DMSO-d6) δ 0.97 (t, J=7 Hz, 3H), 1.33-1.45 (m, 2H), 1.521.66 (m, 2H), 2.46-2.60 (m, 2H), 2.76-2.90 (m, 2H), 3.20-3.40 (m, 2H), 3.66 (s, 2H), 5.71 (s, 2H), 6.506.61 (m, 2H), 7.26 (s,1H), 7.37-7.52 (m, 3H). Сполуки, одержані за допомогою цього синтетичного шляху,марковані як ‘Шлях 1’ у таблиці нижче. 4-Аміно-N-[(4,4-диметил-4,5-дигідро-піразол-1-іл)-етиламіно-метилен]-бензенсульфонамід (сполука 3) Гідройодид 1-етил-2-метил-ізотіосечовини: 25 S . HI S MeI H2N 30 N H EtOH H2N N 20.5 г Етил-тіосечовини розчиняють у 100 мл EtOH. Суміш охолоджують на водяній бані та додають по краплинах 13.5 мл (1.1 екв.) MeI. Суміш перемішують 1 годину при кімнатній 1 температурі та концентрують у вакуумі даючи на виході 48.3 г блідо-жовтої олії. H ЯМР (400 МГц, DMSO-d6) δ 1.17 (t, J = 7.5 Hz, 3H), 2.61 (s, 3H), 3.34 (q, J = 7.5 Hz, 2H), 9.10 (br s, 2H). N-Етил-4,4-диметил-4,5-дигідро-піразол-1-карбоксамідин гідрохлорид 35 12.0 г 4,4-диметил-4,5-дигідро-3H-піразолу розчиняють у 100 мл піридину. Додають розчин 30.0 г гідройодиду 1-Етил-2-метил-ізотіосечовини у 50 мл піридину та суміш нагрівають зі зворотнім холодильником 20 годин. Суміш охолоджують до кімнатної температури та 23 UA 105629 C2 5 10 концентрують при зниженому тиску, та осад переміщують у DCM (120 мл). Органічну фазу екстрагують з 2N NaOH (2 x 120 мл), промивають з водою (120 мл), сушать над Na 2SO4 та випарюють при зниженому тиску даючи на виході 16.3 г (79 %) оранжевої олії. Олію (10.0 г) переміщують у EtOAc (50 мл) та нагрівають до 60 ˚C. Після видалення джерела тепла, дозовано додають 5-6N розчин HCl у ізопропанолі (20 мл) протягом 4 хвилин. Після охолодження до кімнатної температури, додають EtOAc (50 мл) протягом періоду 4 хвилин, та суміш перемішують при 20 ˚C 90 хвилин. Утворені кристали збирають фільтрацією та промивають з EtOAc (20 мл), з подальшим висушуванням при зниженому тиску при помірному нагріванні, 1 даючи на виході 6.52 г (54 %) бажаного продукту у вигляді твердої жовтої речовини. H ЯМР (400 МГц, DMSO-d6) δ 1.13 (t, J = 7 Hz, 3H), 1.24 (s, 6H), 3.27-3.34 (m, 2H), 3.64 (s, 2H), 7.26 (s, 1H), 8.03 (br s, 2H), 8.13 (br s, 1H). N-(4-{[(4,4-диметил-4,5-дигідро-піразол-1-іл)-етиламіно-метилен]-сульфамоїл}феніл)ацетамід: Cl O S O N N N N O N H2N NH O S O N H DiPEA N CH2Cl2 . HCl O NH 15 20 500 мг N-Етил-4,4-диметил-4,5-дигідро-піразол-1-карбоксамідин гідрохлориду суспендують у 10 мл DCM, додають 0.88 мл DiPEA, а потім 571 мг 4-ацетиламіно-бензенсульфоніл хлориду. Суміш перемішують усю ніч при кімнатній температурі. Перетворення продовжують шляхом реакції усю ніч після додавання іще 0.44 мл основи та 290 мг сульфоніл хлориду. Суміш потім екстрагують з 5 % водним NaHCO3 та 2M розчину NaOH, органічний шар сушать над Na 2SO4, випарюють до сухого стану та на подальшому етапі застосовують сирий продукт (900 мг пурпурної олії, містить >95 % бажаного продукту, базуючись на LC-MS). LC-MS: Rt 1.34 хвил (MH+ 366). 25 N N N N N O S O N H HCl N O S O N H MeOH O 30 NH2 NH 900 мг N-(4-{[(4,4-Диметил-4,5-дигідро-піразол-1-іл)-етиламіно-метилен]-сульфамоїл}-феніл) ацетаміду розчиняють у 5 мл MeOH, та додають 5 мл концентрованої HCl. Суміш перемішують усю ніч при кімнатній температурі. Суміші надають основних властивостей з 2M NaOH, та екстрагують двічі з DCM. Поєднані органічні шари сушать над Na 2SO4 та випарюють до сухого стану. Осад очищують випарювальною хроматографією (DCM/MeOH 99:1) даючи на виході 400 мг (50 %) 4-Аміно-N-[(4,4-диметил-4,5-дигідро-піразол-1-іл)-етиламіно-метилен]1 бензенсульфонаміду у вигляді твердої аморфної речовини. H ЯМР (400 МГц, CDCl3) δ 1.15 (t, 24 UA 105629 C2 5 J=7 Hz, 3H), 1.20 (s, 6H), 3.42-3.51 (m, 2H), 3.74 (br.s., 2H), 4.00 (br.s., 2H), 6.62-6.68 (m, 2H), 6.71 (s, 1H), 6.90 (br.s., 1H), 7.67-7.73 (m, 2H). 4-Аміно-3-хлоро-N-[(4,4-диметил-4,5-дигідро-піразол-1-іл)-етиламіно-метилен]бензенсульфонамід (сполука 13) N-(2-Хлоро-4-{[(4,4-диметил-4,5-дигідро-піразол-1-іл)-етиламіно-метилен]-сульфамоїл}феніл)-ацетамід Cl O S O N N Cl N O N H2N N NH O S O DiPEA N CH2Cl2 . HCl Cl O 10 15 N H NH 500 мг N-Етил-4,4-диметил-4,5-дигідро-піразол-1-карбоксамідин гідрохлориду суспендують у 10 мл DCM, додають 0.88 мл DiPEA, а потім 655 мг 4-ацетиламіно-3-хлоро-бензенсульфоніл хлориду. Суміш перемішують усю ніч при кімнатній температурі. Перетворення продовжують шляхом реакції усю ніч після додавання іще 0.44 мл основи та 290 мг сульфоніл хлориду. Суміш потім екстрагують з 5 % водним NaHCO3 та 2M розчину NaOH, органічний шар сушать над Na2SO4, та випарюють до сухого стану та на подальшому етапі застосовують сирий продукт (680 мг містить 85 % бажаного продукту базуючись на LC-MS). LC-MS: Rt 1.46 хвил (MH+ 400). N N N N N O S O N H HCl N O S O N H MeOH Cl Cl O 20 25 30 NH2 NH 680 мг N-(2-Хлоро-4-{[(4,4-диметил-4,5-дигідро-піразол-1-іл)-етиламіно-метилен]сульфамоїл}-феніл)-ацетамід розчиняють у 5 мл MeOH, та додають 5 мл концентрованої HCl. Суміш перемішують усю ніч при кімнатній температурі. Суміші надають основних властивостей з 2M NaOH, та екстрагують двічі з DCM. Поєднані органічні шари сушать над Na 2SO4 та випарюють до сухого стану. Осад очищують випарювальною хроматографією (DCM/MeOH 99:1) даючи на виході 240 мг (40 %) 4-Аміно-3-хлоро-N-[(4,4-диметил-4,5-дигідро-піразол-1-іл)1 етиламіно-метилен]-бензенсульфонаміду у вигляді помаранчевої олії. H ЯМР (400 МГц, CDCl3) δ 1.17 (t, J=7 Hz, 3H), 1.21 (s, 6H), 3.43-3.52 (m, 2H), 3.75 (br.s., 2H), 4.37 (br.s., 2H), 6.73 (s, 1H), 6.76 (d, J=8 Hz, 1H), 6.86 (br.s., 1H), 7.62 (dd, J=2 та 8 Hz, 1H), 7.83 (d, J=2 Hz, 1H). Етиламіно-(4-етил-4,5-дигідро-піразол-1-іл)-метиленамід 2,3-Дигідро-1H-індол-5сульфонової кислоти (сполука 16) 4,N-Диетил-4,5-дигідро-піразол-1-карбоксамідин гідрохлорид 25 UA 105629 C2 5 10 15 19.36 г 4-Етил-4,5-дигідро-1H-піразолу розчиняють у 100 мл толуолу. Додають 48.5 г гідройодиду 1-Етил-2-метил-ізотіосечовини та 33.8 мл DiPEA та суміш нагрівають зі зворотнім холодильником 48 годин. Суміш концентрують, додають 2 M NaOH, з подальшою екстракцією з DCM (тричі). Поєднані органічні шари сушать над Na2SO4 та розчинник випарюють у вакуумі даючи на виході 32.7 г (99 %) червоної олії, що містить 75 % бажаного продукту згідно з ЯМР. Олію розчиняють у EtOH та додають по краплинах 194 мл 1 M HCl у EtOH. Суміш перемішують при кімнатній температурі 30 хвилин та концентрують у вакуумі. Кристалізація з CH 3CN:MTBE = 1 1:1 дає 11.52 г (29 %) бажаного продукту у вигляді бежевої твердої речовини. H ЯМР (400 МГц, DMSO-d6) δ 0.96 (t, J = 7.5 Hz, 3H), 1.16 (t, J = 7 Hz, 3H), 1.46-1.72 (m, 2H), 3.32 (q, J = 7 Hz, 2H), 3.35-3.45 (m, 1H), 3.55 (dd, J = 10.5 та 7 Hz, 1H), 3.96 (t, J = 10.5 Hz, 1H), 7.34 (d, J = 2 Hz, 1H), 8.00 (br s, 2H). Етиламіно-(4-етил-4,5-дигідро-піразол-1-іл)-метиленамід 1-Ацетил-2,3-дигідро-1H-індол-5сульфонової кислоти Cl O S O N N N N N H2N O N N . HCl O S O DiPEA CH2Cl2 O 20 25 N H N 5.76 г 4,N-Диетил-4,5-дигідро-піразол-1-карбоксамідин гідрохлориду суспендують у 100 мл DCM, додають 13.10 мл DiPEA, а потім 5.00 г 1-ацетил-2,3-дигідро-1H-індол-5-сульфоніл хлориду. Суміш перемішують усю ніч при кімнатній температурі. Потім суміш екстрагують з 5 % водним NaHCO3 та 2M розчину NaOH, органічний шар сушать над Na 2SO4, та випарюють до сухого стану. Осад очищують випарювальною хроматографією (DCM/EA 3:1 → EA) даючи на 1 виході 1.85 г (25 %) жовтої олії. H ЯМР (400 МГц, CDCl3) δ 0.97 (t, J=7.52 Hz, 3H), 1.15 (t, J=7.37 Hz, 3H), 1.45-1.69 (m, 2H), 2.25 (s, 3H), 3.01-3.16 (m, 1H), 3.24 (t, J=8.58 Hz, 2H), 3.42-3.52 (m, 2H), 3.64-3.75 (m, 1H), 4.02-4.21 (m, 3H), 6.90 (d, J=1.20 Hz, 1H), 7.72-7.82 (m, 2H), 8.24 (d, J=8.43 Hz, 1H) [гуанідин NH невидимий]. 26 UA 105629 C2 N N N N N O S O O 5 10 N H HCl EtOH N O S O N H N H N 1.74 г етиламіно-(4-етил-4,5-дигідро-піразол-1-іл)-метиленаміду 1-ацетил-2,3-дигідро-1Hіндол-5-сульфонової кислоти розчиняють у 100 мл EtOH, та додають 22.2 мл 1M HCl. Суміш перемішують 5 г. Зі зворотнім холодильником. Після охолодження до кімнатної температури, суміші надають основних властивостей з 5 % розчином NaHCO3 та екстрагують двічі з DCM. Поєднані органічні шари сушать над Na2SO4 та випарюють до сухого стану. Осад очищують випарювальною хроматографією (DCM → DCM/EA 4:1) даючи на виході 0.66 г (43 %) етиламіно(4-етил-4,5-дигідро-піразол-1-іл)-метиленаміду 2,3-Дигідро-1H-індол-5-сульфонової кислоти у 1 вигляді жовтої олії. H ЯМР (400 МГц, CDCl3) δ 0.97 (t, J=7.52 Hz, 3H), 1.15 (t, J=7.22 Hz, 3H), 1.44-1.68 (m, 2H), 2.97-3.13 (m, 3H), 3.42-3.54 (m, 2H), 3.58-3.72 (m, 3H), 3.99-4.09 (m, 1H), 6.55 (d, J=8.13 Hz, 1H), 6.88 (d, J=1.50 Hz, 1H), 7.00 (br.s., 1H), 7.55-7.65 (m, 2H) [NH невидимий]. Етиламіно-(4-етил-4,5-дигідро-піразол-1-іл)-метиленамід 1H-Індол-5-сульфонової кислоти (Сполука 18) 15 20 25 30 0.42 г етиламіно-(4-етил-4,5-дигідро-піразол-1-іл)-метиленаміду 2,3-Дигідро-1H-індол-5сульфонової кислоти розчиняють у 25 мл толуолу, та додають 10 моль % паладію на вуглеці. Суміш перемішують при 50 ˚C 5 днів, з додаванням свіжого каталізатора (10 моль %) після 2 днів. Суміш охолоджують до кімнатної температури та фільтрують крізь Hyflo. Фільтрат випарюють до сухого стану та осад очищують випарювальною хроматографією (DCM → DCM/EA 9:1) даючи на виході 0.26 г (66 %) етиламіно-(4-етил-4,5-дигідро-піразол-1-іл)1 метиленаміду 1H-Індол-5-сульфонової кислоти у вигляді блакитної олії. H ЯМР (400 МГц, CDCl3) δ 0.87 (t, J=7.37 Hz, 3H), 1.08 (t, J=7.22 Hz, 3H), 1.32-1.59 (m, 2H), 2.89-3.02 (m, 1H), 3.353.50 (m, 2H), 3.58 (dd, J=11.44, 7.52 Hz, 1H), 3.96 (t, J=11.29 Hz, 1H), 6.54-6.58 (m, 1H), 6.85 (d, J=1.50 Hz, 1H), 6.97 (br.s., 1H) 7.23-7.29 (m, 1H), 7.42 (d, J=8.73 Hz, 1H), 7.69 (dd, J=8.73, 1.81 Hz, 1H), 8.24 (d, J=1.20 Hz, 1H), 9.43 (br.s., 1H). N-[Етиламіно-(4-етил-4,5-дигідро-піразол-1-іл)-метилен]-4-гідроксибензенсульфон-амід (Сполука 19) N-[Етиламіно-(4-етил-4,5-дигідро-піразол-1-іл)-метилен]-4-метокси-бензенсульфонамід 27 UA 105629 C2 Cl O S O N N N N N H2N O N O S O N H DiPEA CH2Cl2 . HCl O 5 У атмосфері N2, 0.50 г 4,N-Диетил-4,5-дигідро-піразол-1-карбоксамідин гідрохлорид суспендують у 50 мл DCM, додають 0.43 мл DiPEA, а потім 0.61 г 4-метокси-бензенсульфоніл хлориду. Суміш перемішують протягом вихідних при кімнатній температурі. Суміш потім екстрагують з 5 % водним NaHCO3 та 2M розчину NaOH, органічний шар сушать над MgSO 4, та випарюють до сухого стану. Осад очищують випарювальною хроматографією (поетапний градієнт DCM → DCM/MeOH 95:5) даючи на виході 0.28 г (28 %) продукту. TLC: Rf 0.33 (DCM/MeOH 99:1). LC-MS: Rt 1.58 хвил (MH+ 339). 10 N N N N N O S O N H BBr3 CH2Cl2 20 25 N H OH O 15 N O S O У 20 мл DCM, розчиняють 0.28 г N-[Етиламіно-(4-етил-4,5-дигідро-піразол-1-іл)-метилен]-4метокси-бензенсульфонамід, та 3 додають.32 мл 1M розчину BBr 3 у DCM. Суміш перемішують усю ніч при кімнатній температурі, екстрагують з 5 % водним NaHCO3, сушать над MgSO4 та випарюють до сухого стану. Осад очищують випарювальною хроматографією (поетапний градієнт DCM → DCM/MeOH 95:5) даючи на виході 0.186 г (59 %) N-[Етиламіно-(4-етил-4,51 дигідро-піразол-1-іл)-метилен]-4-гідрокси-бензенсульфонаміду. H ЯМР (400 МГц, CDCl3) δ 0.95 (t, J=7.52 Hz, 3H), 1.13 (t, J=7.22 Hz, 3H), 1.50 (dq, J=14.20, 7.00 Hz, 1H), 1.60 (dq, J=14.22, 7.00 Hz, 1H), 3.01-3.16 (m, 1H), 3.43-3.50 (m, 2H), 3.66 (dd, J=11.44, 7.52 Hz, 1H), 4.05 (t, J=11.29 Hz, 1H), 6.80 (br.s., 1H), 6.87 (d, J=8.73 Hz, 2H), 6.91 (d, J=1.50 Hz, 1H), 7.78 (d, J=8.73 Hz, 2H) [гуанідин NH невидимий]. 3-Хлоро-N-[етиламіно-(4-етил-4,5-дигідро-піразол-1-іл)-метилен]-4-гідроксибензенсульфонамід (сполука 26) 3-Хлоро-4-метокси-бензенсульфоніл хлорид Cl O O S OH Cl O S O Cl Cl O O 30 У атмосфері N2, 41.25 мл хлоросульфонової кислоти охолоджують на водяній бані, та при перемішуванні додають по краплинах 22.26 мл 2-хлороанізолу. Суміш нагрівають до 55 ˚C; після 10 хвил. видаляють джерело тепла та суміш перемішують усю ніч при кімнатній температурі. Суміш занурюють у крижану воду та екстрагують двічі з DCM. Поєднані органічні шари сушать 28
ДивитисяДодаткова інформація
Назва патенту англійськоюArylsulfonyl pyrazoline carboxamidine derivatives as 5-ht6 antagonists
Автори англійськоюvan Loevezijn, Arnold, Iwema Bakker, Wouter I., Stoit, Axel, Rensink, Agatha A.M., Venhorst, Jennifer, van der Neut, Martina A.W., de Haan, Martin, Kruse, Cornelis G.
Автори російськоюИвема Баккер Воутер И., Крузе Корнелис Г.
МПК / Мітки
МПК: A61K 31/4155, A61P 25/00, C07D 491/10, A61K 31/4162, A61K 31/416, C07D 231/54, C07D 231/06, C07D 403/12
Мітки: похідні, карбоксамідину, арилсульфоніл, піразолін, антагоністи, 5-нт6
Код посилання
<a href="https://ua.patents.su/65-105629-pokhidni-arilsulfonil-pirazolin-karboksamidinu-yak-antagonisti-5-nt6.html" target="_blank" rel="follow" title="База патентів України">Похідні арилсульфоніл піразолін карбоксамідину як антагоністи 5-нт6</a>
Попередній патент: Орально дезінтегровувана тверда лікарська форма
Наступний патент: Нові антитіла, які використовуються при лікуванні раку
Випадковий патент: Інжектор для введення розчинів у ґрунт, монолітні і фракційні будівельні матеріали, деревину і подібні їй матеріали