Склад на основі інгібіторів syk
Номер патенту: 115815
Опубліковано: 26.12.2017
Автори: Пакдаман Ровчанак, Кастіл Мелісса Жан, Сперджер Даяна, Стефанідіс Дімітріос, Лі Бей
Формула / Реферат
1. Композиція, яка містить:
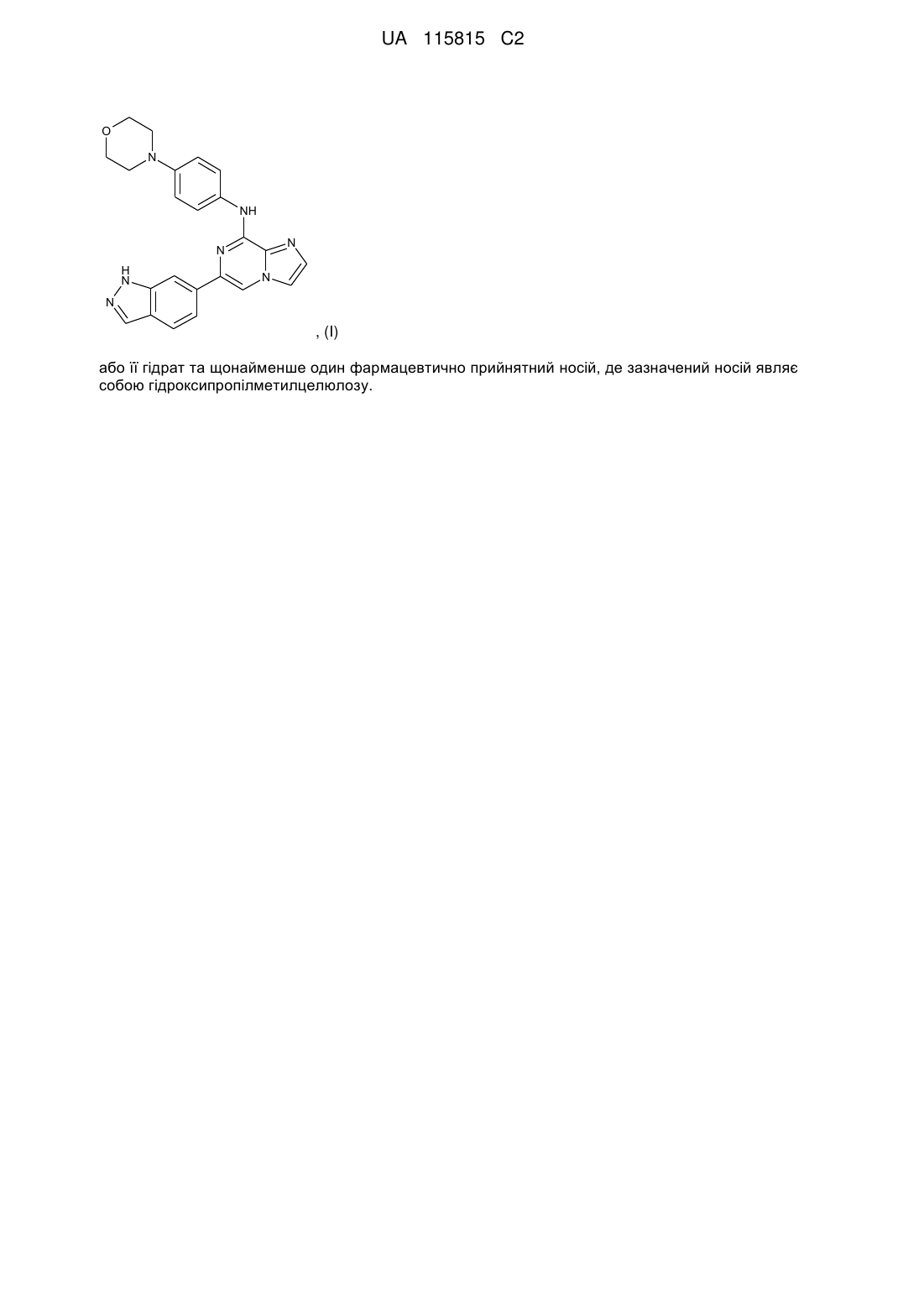
(і) біс-мезилатну сіль сполуки формули I:
 (І)
(І)
або її гідрат, та
(іі) щонайменше один фармацевтично прийнятний носій, де зазначений носій являє собою гідроксипропілметилцелюлозу.
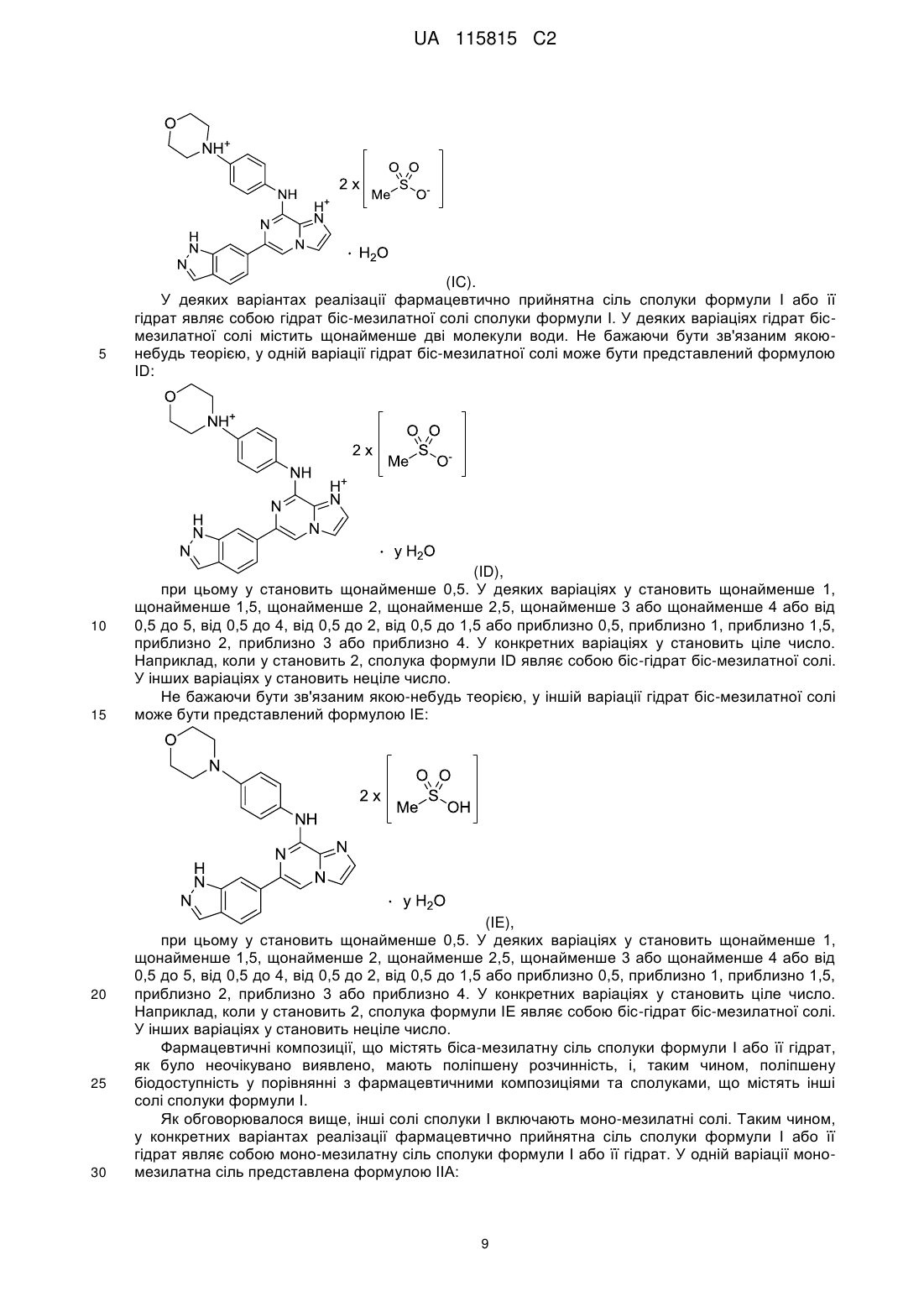
2. Композиція за п. 1, яка відрізняється тим, що зазначена біс-мезилатна сіль являє собою моногідрат біс-мезилатної солі сполуки формули І.
3. Композиція за п. 1 або п. 2, яка відрізняється тим, що зазначена біс-мезилатна сіль являє собою поліморф, рентгенівська дифрактограма якого містить 2q-відбиття, плюс або мінус 0,2 градуса 2q, при 7,7, 12,9, 17,7 та 18,1.
4. Композиція за п. 3, яка відрізняється тим, що зазначена біс-мезилатна сіль являє собою поліморф, що має рентгенівську дифрактограму, що додатково містить 2q-відбиття, плюс або мінус 0,2 градуса 2q, при 13,8, 16,9, 22,9 та 26,1.
5. Композиція за будь-яким з пп. 1-4, яка додатково містить метансульфонову кислоту.
6. Композиція за будь-яким з пп. 1-5, яка додатково містить воду.
7. Композиція за будь-яким з пп. 1, 2 та 5, яка відрізняється тим, що зазначена композиція являє собою вихідний розчин для розпилювального сушіння.
8. Композиція за будь-яким з пп. 1, 2 та 5, яка відрізняється тим, що зазначена композиція являє собою порошок, висушений розпиленням.
9. Композиція за п. 8, яка відрізняється тим, що зазначений порошок є некристалічним.
10. Композиція за п. 8 або п. 9, яка відрізняється тим, що зазначений порошок характеризується рентгенівською дифрактограмою, яка містить 2q-відбиття, плюс або мінус 0,2 градуса 2q, при 6,3 та у проміжку від 26,1 до 26,6.
11. Композиція за будь-яким з пп. 1-5 та 8-10, яка відрізняється тим, що зазначена композиція являє собою таблетку.
12. Композиція за п. 11, яка додатково містить щонайменше один розріджувач, зв'язувальний агент, розпушувач, поверхнево-активну речовину, ковзну речовину або змащувальний агент або будь-які їх комбінації.
13. Композиція за п. 12, яка відрізняється тим, що один із зазначених, щонайменше одного, розріджувачів являє собою манітол.
14. Композиція за будь-яким з пп. 11-13, яка додатково містить один або більше з кросповідону, полоксамеру, колоїдного діоксиду кремнію, стеарату магнію та мікрокристалічної целюлози.
15. Спосіб одержання таблетки, який включає:
а) одержання порошку, висушеного розпиленням, з вихідного розчину, де вихідний розчин містить:
(і) сполуку формули І:
 (І)
(І)
або її катіон;
(іі) метансульфонову кислоту або її аніон;
(iii) гідроксипропілметилцелюлозу; та
(iv) воду; та
b) сухе гранулювання зазначеного висушеного розпиленням порошку та щонайменше одного додаткового фармацевтично прийнятного носія з одержанням грануляту; та
c) пресування зазначеного грануляту з одержанням таблетки.
16. Спосіб за п. 15, який відрізняється тим, що метансульфонова кислота або її аніон та сполука формули І або її катіон присутні у зазначеному вихідному розчині у молярному співвідношенні метансульфонової кислоти або її аніону до сполуки формули І або її катіону, що знаходиться у проміжку від 2:1 до 3:1.
17. Спосіб за п. 15 або 16, який відрізняється тим, що мезилатна сіль сполуки формули І являє собою біс-мезилатну сіль сполуки формули І або її гідрат.
18. Спосіб за п. 17, який відрізняється тим, що мезилатна сіль являє собою моногідрат біс-мезилатної солі сполуки формули І.
19. Спосіб одержання таблетки, який включає:
а) сухе гранулювання:
(і) біс-мезилатної солі сполуки формули І:
 (І)
(І)
або її гідрату, та
(іі) гідроксипропілметилцелюлози
з одержанням грануляту; та
b) пресування зазначеного грануляту з одержанням таблетки.
20. Таблетка, отримана відповідно до способу за будь-яким з пп. 15-19.
21. Стандартна лікарська форма, яка містить композицію за будь-яким з пп. 1-4 та 8-14
або таблетку за п. 20.
22. Виріб, що містить композицію за будь-яким з пп. 1-4 та 8-14 або таблетку за п. 20, або стандартну лікарську форму за п. 21.
23. Спосіб лікування стану у людини, яка цього потребує, який включає введення зазначеній людині терапевтично ефективної кількості композиції за будь-яким з пп. 1-4 та 8-14 або терапевтично ефективної кількості таблетки за п. 20, або терапевтично ефективної кількості стандартної лікарської форми за п. 21, де зазначений стан вибраний з групи, яка складається з раку та аутоімунного захворювання.
24. Спосіб за п. 23, який відрізняється тим, що зазначений стан вибраний з групи, яка складається з гострої лімфоцитарної лейкемії (ALL), гострої мієлоїдної лейкемії (AML), хронічної лімфоцитарної лейкемії (CLL), дрібноклітинної лімфоцитарної лімфоми (SLL), мієлодиспластичного синдрому (MDS), мієлопроліферативного захворювання (MPD), хронічної мієлоїдної лейкемії (CML), множинної мієломи (MM), неходжкінської лімфоми (NHL), мантійноклітинної лімфоми (MCL), фолікулярної лімфоми (FL), макроглобулінемії Вальденстрема (WM), Т-клітинної лімфоми, В-клітинної лімфоми, дифузної великоклітинної В-клітинної лімфоми (DLBCL), лімфоплазматичної лімфоми (LPL) та лімфоми маргінальної зони (MZL).
25. Спосіб за п. 24, який відрізняється тим, що зазначений стан являє собою неходжкінську лімфому (NHL).
26. Спосіб за п. 24, який відрізняється тим, що NHL являє собою індолентну неходжкінську лімфому (iNHL).
27. Спосіб за п. 26, який відрізняється тим, що iNHL являє собою рефрактерну iNHL.
28. Спосіб за п. 26, який відрізняється тим, що iNHL являє собою нефолікулярну iNHL.
29. Спосіб за п. 23, який відрізняється тим, що зазначений стан вибраний з групи, яка складається з астми, ревматоїдного артриту, розсіяного склерозу та вовчаку.
30. Застосування композиції за будь-яким з пп. 1-4 та 8-14 або таблетки за п. 20, або стандартної лікарської форми за п. 21 для лікування стану вибраного з групи, що складається з раку та аутоімунного захворювання.
31. Застосування за п. 30, яке відрізняється тим, що зазначений стан вибраний з групи, яка складається з гострої лімфоцитарної лейкемії (ALL), гострої мієлоїдної лейкемії (AML), хронічної лімфоцитарної лейкемії (CLL), дрібноклітинної лімфоцитарної лімфоми (SLL), мієлодиспластичного синдрому (MDS), мієлопроліферативного захворювання (MPD), хронічної мієлоїдної лейкемії (CML), множинної мієломи (MM), неходжкінської лімфоми (NHL), мантійноклітинної лімфоми (MCL), фолікулярної лімфоми (FL), макроглобулінемії Вальденстрема (WM), Т-клітинної лімфоми, В-клітинної лімфоми, дифузної великоклітинної В-клітинної лімфоми (DLBCL), лімфоплазматичної лімфоми (LPL) та лімфоми маргінальної зони (MZL).
32. Застосування за п. 31, яке відрізняється тим, що зазначений стан являє собою неходжкінську лімфому (NHL).
33. Застосування за п. 32, яке відрізняється тим, що NHL являє собою індолентну неходжкінську лімфому (iNHL).
34. Застосування за п. 33, яке відрізняється тим, що iNHL являє собою рефрактерну iNHL.
35. Застосування за п. 33, яке відрізняється тим, що iNHL являє собою нефолікулярну iNHL.
36. Застосування за п. 30, яке відрізняється тим, що зазначений стан вибраний з групи, яка складається з астми, ревматоїдного артриту, розсіяного склерозу та вовчаку.
Текст
Реферат: Винахід стосується фармацевтичної композиції, яка містить біс-мезилатну сіль сполуки, що має формулу: UA 115815 C2 (12) ОПИС ДО ПАТЕНТУ НА ВИНАХІД UA 115815 C2 O N NH N N H N N N , (I) або її гідрат та щонайменше один фармацевтично прийнятний носій, де зазначений носій являє собою гідроксипропілметилцелюлозу. UA 115815 C2 5 10 15 20 25 30 35 40 45 50 Дана заявка заявляє пріоритет на підставі попередньої заявки на патент США № 61/860198, поданої 30 липня 2013 р., зміст якої повністю включений у дану заявку за допомогою посилання. ГАЛУЗЬ технІки Даний опис відноситься до фармацевтичних композицій сполук, які інгібують активність тирозинкінази селезінки (Syk). Даний опис також відноситься до способів одержання таких фармацевтичних композицій та застосування таких фармацевтичних композицій для лікування суб'єктів з різними захворюваннями, включаючи рак та запальні стани. РІвень технІки У цей час проводиться дослідження ряду імідазопіразинових сполук, спрямоване на виявлення у них інгібуючої активності у відношенні тирозинкінази селезінки (Syk). Syk являє собою нерецепторну тирозинкіназу, яка відіграє вирішальну роль у імунорецепторному та інтегрин-опосередкованому сигнальному шляху у різних типах клітин, включаючи В-клітини, макрофаги, моноцити, гладкі клітини, еозинофіли, базофіли, нейтрофіли, дендритні клітини, Тклітини, природні клітини-кілери, тромбоцити та остеокласти. Як повідомлялося, Syk відіграє важливу роль у передачі сигналів через B-клітинний рецептор, який, як відомо, є важливим сигналом виживаності у В-клітинах. Таким чином, інгібування активності Syk може використовуватися при лікуванні деяких видів раку, включаючи B-клітинну лімфому та лейкемію. Крім того, інгібування активності Syk, як вважають, можна застосовувати для лікування інших захворювань та станів, включаючи запальні захворювання (наприклад, ревматоїдний артрит), алергійні розлади та аутоімунні захворювання. Одна така сполука, яка, як було виявлено, інгібує активність Syk, представлена формулою I: (I), або її фармацевтично прийнятною сіллю. Дана сполука та її синтез описані у патентах США № 8450321 та 8455493, зміст яких повністю включено у дану заявку шляхом посилання, та включені у дану заявку шляхом посилання конкретно з посиланням на приклади 1 та 2. Більш ранні клінічні програми були спрямовані на пероральне введення сполуки формули I. Потрібен пероральний склад сполуки формули I, який має низьку міжсуб'єктну варіабельність, розширену лінійність дозування та низьку міжлікарську взаємодію. Крім того, необхідний комерційно перспективний виробничий спосіб одержання сполуки формули I. Наприклад, потрібен спосіб, який має малу або не має варіабельності при виробництві різних партій активного фармацевтичного інгредієнту, та який легко здійсненний у промисловому масштабі. Також потрібен склад, який є як хімічно, так і фізично стабільним у процесі виробництва та при зберіганні. КОРОТКИЙ ОПИС ВИНАХОДУ У даному винаході запропоновані фармацевтичні композиції (включаючи, наприклад, склади для перорального введення) сполуки формули I, які задовольняють одну або більше незадоволених потреб, описаних вище. Запропоновані фармацевтичні композиції (включаючи, наприклад, склади для перорального введення) можуть знижувати міжсуб'єктну варіабельність біофармацевтичних відповідей у суб'єктів. Крім того, запропоновані фармацевтичні композиції (включаючи, наприклад, сполуки для перорального введення) можуть проявляти розширену лінійність дозування, яка може приводити до більш високої ефективності. Запропоновані фармацевтичні композиції (включаючи, наприклад, сполуки для перорального введення) можуть знижувати міжлікарську взаємодію сполуки формули I з іншими лікарськими засобами, зокрема з антацидами, що може приводити до збільшення біодоступності сполуки формули I у суб'єктів (наприклад, людей), які можуть приймати такі інші лікарські засоби (наприклад, антациди). Зокрема, запропоновані фармацевтичні композиції мають гарні біофармацевтичні показники; можуть бути отримані із застосуванням надійного, масштабованого та комерційно перспективного твердого дозованого складу та способу; та проявляють фізичну та хімічну стабільність як у процесі виробництва, так і після процесу виробництва (наприклад, при зберіганні). У деяких аспектах запропонована композиція, що містить сполуку формули I, або її сіль або 1 UA 115815 C2 5 10 15 20 25 30 35 їх гідрат, та носій. Композиція може являти собою фармацевтичну композицію (таку як фармацевтична композиція, приготовлена для перорального застосування) або попередника композиції (такого як вихідний розчин для розпилювального сушіння або порошок, висушений розпиленням, отриманий розпилювальним сушінням), використовувані для одержання фармацевтичної композиції у формі таблеток. Композиція може бути у рідкій формі (наприклад, коли композиція являє собою вихідний розчин для розпилювального сушіння) або у твердій формі (наприклад, коли композиція являє собою таблетку або знаходиться у формі висушеного розпиленням порошку). У деяких аспектах запропонована композиція, що містить фармацевтично прийнятну сіль сполуки формули I або її гідрат і фармацевтично прийнятний носій. У конкретних варіантах реалізації фармацевтично прийнятний носій являє собою фармацевтично прийнятний полімер. У конкретних аспектах запропонована композиція, яка містить: (i) мезилатну сіль сполуки формули I: (I), або її гідрат, при цьому мезилатна сіль містить катіон сполуки формули I та мезилатний аніон, та при цьому молярне співвідношення мезилатного аніону до катіону сполуки формули I складає щонайменше 1: 1; та (ii) фармацевтично прийнятний носій. У одній варіації молярне співвідношення мезилатного аніону до катіону сполуки формули I складає від 1: 1 до 3,3: 1. У іншій варіації молярне співвідношення мезилатного аніону до катіону сполуки формули I складає від 1,9: 1 до 3,3: 1. У деяких варіантах реалізації мезилатна сіль сполуки формули I або її гідрат являє собою гідрат біс-мезилатної солі сполуки формули I. У конкретних варіантах реалізації мезилатна сіль сполуки формули I або її гідрат являє собою моногідрат біс-мезилатної солі сполуки формули I. У інших варіантах реалізації мезилатна сіль сполуки формули I або її гідрат являє собою мономезилатну сіль сполуки формули I або її гідрат. У конкретних аспектах запропонована композиція, яка містить: (i) біс-мезилатну сіль сполуки формули I: (I), або її гідрат, та (ii) фармацевтично прийнятний носій. У деяких варіантах реалізації біс-мезилатна сіль сполуки формули I або її гідрат являє собою моногідрат біс-мезилатної солі сполуки формули I. У іншому аспекті запропонована композиція, яка містить: (i) сполуку формули I: 2 UA 115815 C2 5 10 15 20 25 30 35 40 45 50 (I), або її катіон; (ii) метансульфонову кислоту або її аніон; та (iii) фармацевтично прийнятний носій. У деяких аспектах запропонована композиція, яка містить гідрат сполуки формули I або його катіон та метансульфонову кислоту або її аніон. У одній варіації гідрат являє собою моногідрат. У деяких варіантах реалізації композиція, описана у даному винаході (включаючи, наприклад, фармацевтичні композиції, описані у даному винаході), являє собою таблетку. У одному варіанті реалізації біс-мезилатна сіль сполуки формули I (така як біс-мезилатна сіль формули IA) приготовлена у формі таблетки. У одній варіації таблетка, запропонована у даному винаході, містить гідрат біс-мезилатної солі сполуки формули I. У іншій варіації таблетка, запропонована у даному винаході, містить моногідрат біс-мезилатної солі сполуки формули I. У ще одній варіації таблетка, запропонована у даному винаході, містить поліморфну форму 3, яка являє собою поліморф моногідрату біс-мезилатної солі сполуки формули I. У іншому варіанті реалізації моно-мезилатна сіль сполуки формули I (така як мономезилатна сіль формули IIA) приготовлена у формі таблетки. У одній варіації таблетка, запропонована у даному винаході, містить моно-мезилатну сіль сполуки формули I. У деяких варіантах реалізації композиції, описані у даному винаході (включаючи, наприклад, фармацевтичні композиції, описані у даному винаході), приготовлені у формі таблетки, що містить тверду дисперсію. Така таблетка може називатися у даному винаході як "таблетка з твердої дисперсії". У конкретних варіантах реалізації композиції, описані у даному винаході (включаючи, наприклад, фармацевтичні композиції, описані у даному винаході) приготовлені у формі таблетки, що містить тверду дисперсію, висушену розпиленням. Така таблетка може називатися у даному винаході як "таблетка з твердої дисперсії, висушеної розпиленням". У конкретних варіантах реалізації таблетки, що містять тверду дисперсію, описану у даному винаході (включаючи, наприклад, таблетки, що містять тверду дисперсію, висушену розпиленням), додатково містять полімерну матрицю. У одній варіації біс-мезилатна сіль сполуки формули I (така як біс-мезилатна сіль формули IA) диспергована у полімерній матриці. У одній варіації полімерну матрицю формують або одержують із фармацевтично прийнятного полімеру. У іншій варіації полімерну матрицю формують або одержують із гідроксипропілметилцелюлози. У одній варіації таблетка, запропонована у даному винаході, містить мезилатну сіль сполуки формули I. У іншій варіації таблетка, запропонована у даному винаході, містить мезилатну сіль сполуки формули I або її гідрат, при цьому мезилатна сіль містить катіон сполуки формули I та мезилатний аніон, та при цьому молярне співвідношення мезилатного аніону до катіону сполуки формули I становить від 1,9:1 до 3,3:1. Як більш докладно описано у даному винаході, сполука формули I або її фармацевтично прийнятна сіль (включаючи, наприклад, біс-мезилатну сіль сполуки формули I) або її гідрат може бути об'єднана з носієм (який може являти собою фармацевтично прийнятний носій) для одержання вихідного розчину, який сушать розпиленням для одержання порошку, висушеного розпиленням (також відомого як тверда дисперсія або твердодисперсні частки). У одній варіації вихідний розчин також містить воду та необов'язково додатковий розчинник. Таким чином, також у даному винаході запропонований порошок, висушений розпиленням, що містить сполуку формули I або її фармацевтично прийнятну сіль, наприклад, порошок, висушений розпиленням, що містить біс-мезилатну сіль сполуки формули I. Порошок, висушений розпиленням, потім може бути об'єднаний щонайменше з одним додатковим фармацевтично прийнятним носієм (наприклад, за допомогою сухого гранулювання), та отриманий гранулят може бути спресований у таблетку. У одній варіації щонайменше один фармацевтично прийнятний носій, використовуваний у розпилювального сушінню, являє собою фармацевтично прийнятний полімер. Фармацевтично прийнятний полімер може утворювати полімерну матрицю. Таким чином, у одному аспекті запропонована композиція, що містить фармацевтично прийнятну сіль сполуки формули I або її гідрат (включаючи, наприклад, біс-мезилатну сіль 3 UA 115815 C2 5 10 15 20 25 30 35 40 45 50 сполуки формули I), диспергованну у полімерній матриці. У іншому аспекті запропонована композиція, яка містить фармацевтично прийнятну сіль сполуки формули I або її гідрат (включаючи, наприклад, біс-мезилатну сіль сполуки формули I) та щонайменше один фармацевтично прийнятний носій, дисперговані у полімерній матриці. У конкретному аспекті полімерну матрицю формують або одержують із гідроксипропілметилцелюлози. У конкретних варіантах реалізації даного винаходу запропонована таблетка, яка містить порошок, висушений розпиленням, при цьому порошок, висушений розпиленням, містить сполуку формули I або її фармацевтично прийнятну сіль, наприклад, порошок, висушений розпиленням, що містить біс-мезилатну сіль сполуки формули I, та така таблетка характеризується рентгенівською дифрактограмою, яка містить 2θ-відбиття (+0,2°) при 6,3 та від 26,1 до 26,6. Слід розуміти, що +0,2° також може бути виражене як "плюс або мінус 0,2 градуса 2θ». У інших варіантах реалізації таблетка являє собою таблетку, отриману сухим гранулюванням. Таблетка, отримана шляхом сухого гранулювання, називається у даному винаході як "таблетка, отримана сухим гранулюванням". У одній варіації таблетка з твердої дисперсії, така як таблетка з твердої дисперсії, висушеної розпиленням, являє собою таблетку, отриману сухим гранулюванням. У іншій варіації, як більш детально описано у даному винаході, фармацевтично прийнятна сіль сполуки формули I (включаючи, наприклад, біс-мезилатну сіль сполуки формули I) або її гідрат може бути отримана у формі таблетки шляхом об'єднання фармацевтично прийнятної солі сполуки формули I (включаючи, наприклад, біс-мезилатну сіль сполуки формули I) або її гідрату з фармацевтично прийнятним носієм шляхом сухого гранулювання з одержанням грануляту, та пресуванням грануляту у таблетку. У конкретних варіантах реалізації таблетка містить поліморф моногідрату біс-мезилатної солі сполуки формули I (яка також може називатися у даному винаході як "форма 3", "форма III" або "поліморфна форма 3"), що характеризується або що має рентгенівську дифрактограму, яка містить 2θ-відбиття (+0,2°) при 13,8, 16,9, 22,9 та 26,1. У інших варіантах реалізації таблетки поліморф моногідрату біс-мезилатної солі сполуки формули I являє собою поліморфну форму 3, яка характеризується або має рентгенівську дифрактограму, яка містить 2θ-відбиття (+0,2°) при 7,7, 12,9, 17,7 та 18,1. У ще одному варіанті реалізації таблетки поліморф моногідрату бісмезилатної солі сполуки формули I являє собою поліморфну форму 3, яка характеризується або має рентгенівську дифрактограму, яка містить 2θ-відбиття (+0,2°) при 7,7, 12,9, 13,8, 16,9, 17,7,18,1, 22,9 та 26,1. При описі 2θ-відбиттів у рентгенівській дифрактограмі слід розуміти, що +0,2° також може бути виражене як "плюс або мінус 0,2 градуса 2θ». У деяких варіантах реалізації таблетки поліморф моногідрату біс-мезилатної солі сполуки формули I являє собою поліморфну форму 3, яка характеризується або має рентгенівську дифрактограму по суті як показано на ФІГ. 1A. У інших варіантах реалізації таблетки поліморф моногідрату бісмезилатної солі сполуки формули I являє собою поліморфну форму 3, яка характеризується або має рентгенівську дифрактограму по суті як показано на ФІГ. 1B. У одному аспекті запропонована фармацевтична композиція, яка містить біс-мезилатну сіль формули IA: (IA), та щонайменше один фармацевтично прийнятний полімер. Спеціалісту у даній галузі буде зрозуміло, що коли біс-мезилатна сіль зображена як формула IA, зазначена вище, мають на увазі іонну форму (наприклад, катіонну форму сполуки формули I та аніонну форму метансульфонової кислоти). У одній варіації біс-мезилатна сіль формули IA являє собою гідрат. У деяких варіантах реалізації біс-мезилатна сіль формули IA приготовлена у формі таблетки. Таким чином, у одному аспекті таблетки, як детально описано у даному винаході, містять біс-мезилатну сіль формули IA або її гідрат. У конкретних варіантах реалізації біс-мезилатна сіль формули IA або її гідрат приготовлена у формі таблетки з твердої дисперсії. У одній варіації таблетка з твердої дисперсії являє собою таблетку з твердої дисперсії, висушеної розпиленням. У конкретних варіантах реалізації 4 UA 115815 C2 5 10 15 20 25 30 35 40 45 50 55 60 таблетка з твердої дисперсії (така як таблетка з твердої дисперсії, висушеної розпиленням), яка містить біс-мезилатну сіль формули IA, додатково містить щонайменше один фармацевтично прийнятний полімер, який може бути присутнім у формі полімерної матриці. У іншій варіації щонайменше один фармацевтично прийнятний полімер утворює полімерну матрицю. У ще одній варіації біс-мезилатна сіль формули IA диспергована у полімерній матриці. У інших варіантах реалізації таблетка являє собою таблетку, отриману сухим гранулюванням. У одній варіації біс-мезилатна сіль формули IA або її гідрат являє собою поліморфну форму 3, яка характеризується або має рентгенівську дифрактограму, яка містить 2θ-відбиття (+0,2°) при 13,8, 16,9, 22,9 та 26,1. У деяких варіантах реалізації композицій, описаних у даному винаході (включаючи, наприклад, фармацевтичну композицію, таблетку, вихідний розчин та порошок, висушений розпиленням, описані у даному винаході), у яких композиції містять фармацевтично прийнятний полімер, фармацевтично прийнятний полімер являє собою інгібітор осадження. У одній варіації композиція містить фармацевтично прийнятний полімер, при цьому фармацевтично прийнятний полімер являє собою гідроксипропілметилцелюлозу (ГПМЦ). У іншій варіації композиція містить фармацевтично прийнятний полімер, при цьому фармацевтично прийнятний полімер являє собою коповідон. У інших варіантах реалізації фармацевтична композиція додатково містить щонайменше один розріджувач. По суті, запропоновані композиції містять фармацевтично прийнятний полімер (такий як ГПМЦ та/або коповідон) та розріджувач. У одній варіації композиція містить розріджувач, при цьому розріджувач являє собою манітол. У ще одному варіанті реалізації композиція містить один або більше з кросповідону, полоксамеру, колоїдного діоксиду кремнію, стеарату магнію та мікрокристалічної целюлози. Також запропонована стандартна лікарська форма, яка містить фармацевтичну композицію, як описано вище. У деяких варіантах реалізації стандартна лікарська форма являє собою таблетку. Також запропонований виріб, що містить фармацевтичну композицію, як описано вище, або стандартну лікарську форму, як описано вище. У ще одному аспекті запропонований спосіб лікування стану у суб'єкта, якому це необхідно, який включає введення суб'єкту терапевтично ефективної кількості фармацевтичної композиції, як описано вище, або терапевтично ефективної кількості стандартної лікарської форми, як описано вище, при цьому стан вибраний з групи, яка складається з раку та аутоімунного захворювання. У деяких варіантах реалізації стан вибраний з групи, яка складається з гострої лімфоцитарної лейкемії (ALL), гострої мієлоїдної лейкемії (AML), хронічної лімфоцитарної лейкемії (CLL), дрібноклітинної лімфоцитарної лімфоми (SLL), мієлодиспластичного синдрому (MDS), мієлопроліферативного захворювання (MPD), хронічної мієлоїдної лейкемії (CML), множинної мієломи (MM), неходжкінської лімфоми (NHL), мантійноклітинної лімфоми (MCL), фолікулярної лімфоми (FL), макроглобулінемії Вальденстрема (WM), T-клітинної лімфоми, Bклітинної лімфоми, дифузної великоклітинної В-клітинної лімфоми (DLBCL), лімфоплазматичної лімфоми (LPL) та лімфоми маргінальної зони (MZL). У конкретних варіантах реалізації стан являє собою неходжкінську лімфому. У одній варіації NHL являє собою індолентну неходжкінську лімфому (iNHL). У іншій варіації iNHL являє собою рефрактерну iNHL. У ще одній варіації iNHL являє собою нефолікулярну iNHL. У інших варіантах реалізації стан вибраний з групи, яка складається з астми, ревматоїдного артриту, розсіяного склерозу та вовчаку. У деяких із зазначених вище варіантів реалізації суб'єктом є людина. КОРОТКИЙ ОПИС КРЕСЛЕНЬ ФІГ. 1A та 1B являють собою показові дифрактограми рентгенівської порошкової дифракції (XRPD) поліморфної форми 3. ФІГ. 1C та 1D являють собою показові дифрактограми XRPD поліморфної форми 7. Дифрактограма XRPD на ФІГ. 1D була отримана при 25 °C та 53 % відносній вологості (RH). ФІГ. 2A являє собою графік порівняння розподілу частинок за розміром, отриманого шляхом ситового аналізу кінцевих сумішей складу 1 (таблетка, отримана сухим гранулюванням моногідрату біс-мезилатної солі формули IA), отриманого при різних параметрах одержання. ФІГ. 2B являє собою графік, який показує профілі пресування різних сумішей складу 1, отриманого при різних параметрах одержання. ФІГ. 3 являє собою графік, який показує профілі розчинення складів Fk, Fl, Fm та Fx у pH 4,5, 50 мМ ацетатному буфері, що містить 1 % CTAB. ФІГ. 4 являє собою дифрактограму XRPD моногідрату біс-мезилатної солі формули IA та інтрагранулярної суміші, розмелених гранул та кінцевої суміші складу 1, отриманих із застосуванням того ж моногідрату біс-мезилатної солі формули IA. На ФІГ. 5 представлена дифрактограма XRPD висушеної розпиленням дисперсії сполуки формули I та кінцевої суміші та таблетки складу 2, отриманої із застосуванням висушеної 5 UA 115815 C2 5 10 15 20 25 30 35 40 45 50 розпиленням дисперсії. На ФІГ. 6 представлені дифрактограми XRPD твердої дисперсії сполуки формули I: ГПМЦ після відкритого зберігання при 40 C/75 % відносній вологості (RH). 13 ФІГ. 7 являє собою спектр C SSNMR твердої дисперсії сполуки формули I: ГПМЦ після відкритого зберігання при 40 C/75 % RH. ФІГ. 8A являє собою графік порівняння розподілу частинок за розміром, отриманого шляхом ситового аналізу кінцевих сумішей складу 2 (таблетка з твердої дисперсії біс-мезилатної солі формули IA), отриманої із застосуванням різних параметрів ущільнення. ФІГ. 8B являє собою графік, який показує профілі пресування різних сумішей складу 2, отриманого із застосуванням різних параметрів одержання (включаючи, наприклад, параметри способу ущільнення). ФІГ. 9 являє собою графік порівняння профілів розчинення твердодисперсних складів F1 та F6 у pH 4,5, 50 мМ ацетатному буфері, що містить 1 % CTAB. ФІГ. 10 являє собою дифрактограму XRPD таблетки, яка містить сполуку формули I, включеної у формі твердої дисперсії після зберігання при 40C/75 % RH з осушувачем. ФІГ. 11 являє собою графік, що зображує вплив на собак, попередньо оброблених і пентагастрином та фамотидином, яким вводили склад Fx (таблетка, яка містить мономезилатну сіль формули IIA, включену шляхом вологого гранулювання), склад 1 (таблетка, яка містить моногідрат біс-мезилатної солі сполуки формули I, включену шляхом сухого гранулювання) або склад 2 (таблетка, яка містить біс-мезилатну сіль сполуки формули I, включену шляхом твердої дисперсії). ФІГ. 12 являє собою графік порівняння фармакокінетичної варіабельності між складами Fx, 1 та 2. ФІГ. 13 являє собою дифрактограми XRPD твердодисперсних зразків, отриманих з бісмезилатної солі сполуки формули I (як отримували у прикладі C6) після відкритого зберігання при кімнатній температурі /75 % відносній вологості (RH). На ФІГ. 14A показаний вид поліморфної форми 3 кристалічної структури, з відображенням використовуваної нумерації схеми. ФІГ. 14B ілюструє взаємодію водневих зв'язків поліморфної форми 3. ФІГ. 14C ілюструє необмежені ланцюги молекул поліморфної форми 3, мезилату та води, показаних на кристалографічній осі a. ФІГ. 14D ілюструє міжланцюгове упакування поліморфної форми 3 на кристалографічній осі b. детальнИЙ опис ВИНАХОДУ Наступні приклади включені для ілюстрації варіантів реалізації даного опису та не призначені для обмеження обсягу винаходу. Спеціалістам у даній галузі слід мати на увазі, що способи, описані у даному винаході, представляють способи, які застосовують у практиці даного опису. Спеціалістам у даній галузі слід розуміти, що у світлі даного опису можуть бути внесені зміни у прикладах даного винаходу без відхилення від суті та обсягу винаходу. У даному винаході запропоновані композиції, які містять фармацевтично прийнятну сіль сполуки формули I: (I), або її гідрат та щонайменше один фармацевтично прийнятний носій. У даному винаході запропоновані різні типи композицій. У деяких варіаціях композиція являє собою фармацевтичну композицію, таку як фармацевтична композиція, приготовлена для перорального застосування. У конкретних варіаціях композиція являє собою таблетку, отриману шляхом сухого гранулювання та пресування. У конкретних варіаціях композиція являє собою таблетку, отриману шляхом приготування сполуки формули I або її фармацевтично прийнятної солі або її гідрату у формі грануляту. У інших варіаціях композиція являє собою таблетку, отриману шляхом приготування сполуки формули I або її фармацевтично прийнятної солі або її гідрату у формі твердої дисперсії, та приготування твердої дисперсії у таблетці у формі сухого 6 UA 115815 C2 5 10 15 20 25 30 35 40 грануляту. У інших варіаціях композиція являє собою вихідний розчин для розпилювального сушіння. У інших варіаціях композиція являє собою порошок, висушений розпиленням, отриманий шляхом розпилювального сушіння, який можна застосовувати для одержання фармацевтичної композиції у формі таблетки. Термін "фармацевтично прийнятний" означає, що матеріал не має властивостей, які для завбачливого практикуючого лікаря є причиною уникати введення матеріалу суб'єктові (наприклад, людині), беручи до уваги захворювання або стани, що підлягають лікуванню, та відповідний спосіб введення. У одному аспекті запропоновані фармацевтичні композиції, які містять фармацевтично прийнятну сіль сполуки формули I: (I), або її гідрат та щонайменше один фармацевтично прийнятний носій. Такі фармацевтичні композиції містять більш розчинні сольові форми сполуки формули I, які були неочікувано ідентифіковані, та у одному аспекті містять конкретні допоміжні речовини, вибрані для мінімізації осадження сольової форми сполуки формули I або її гідрату, одноразово розчиненої. Отже, такі композиції (включаючи, наприклад, фармацевтичні композиції) можуть задовольняти потреби, описані вище, у відношенні міжсуб'єктної фармакокінетичної варіабельності, розширеної лінійності дозування та низької міжлікарської взаємодії. Крім того, фармацевтичні композиції, запропоновані у даному винаході, були виявлені хімічно та фізично стабільними протягом виробничого процесу та протягом довгого часу, та зберігають переваги ефективної терапії для лікування різних захворювань, які пов'язані з інгібуванням активності Syk, включаючи, наприклад, рак та запальні захворювання. Також запропоновані способи одержання та застосування таких композицій, як і набори, стандартні лікарські форми та готові вироби, що містять фармацевтично прийнятну сіль сполуки формули I або її гідрат. Сполука формули I та її солі, гідрати та поліморфи Композиції, запропоновані у даному винаході, включають фармацевтично прийнятну сіль сполуки формули I: (I), або її гідрат. Сполука формули I може існувати у формі вільної основи або у різних сольових формах або їх гідратах, та композиції, що містять будь-яку із цих форм, наведені у даному винаході. У деяких варіантах реалізації композиції, способи одержання та застосування таких композицій, набори, стандартні лікарські форми та готові вироби, запропоновані у даному винаході, містять мезилатну сіль сполуки формули I або її гідрат. У деяких варіаціях мезилатна сіль являє собою моно-мезилатну або біс-мезилатну сіль або її гідрат. У одній варіації композиції, способи одержання та застосування таких композицій, набори, стандартні лікарські форми та готові вироби, запропоновані у даному винаході, містять мономезилатну сіль сполуки формули I або її гідрат. У іншій варіації композиції способи одержання та застосування таких композицій, набори, стандартні лікарські форми та готові вироби, запропоновані у даному винаході, містять біса-мезилатну сіль сполуки формули I або її гідрат. У ще одній варіації композиції способи одержання та застосування таких композицій, набори, стандартні лікарські форми та готові вироби, запропоновані у даному винаході, містять вільну основу, моно-мезилатну сіль, біс-мезилатну сіль сполуки формули I або її гідрат або будь-які комбінації вищевказаного. Слід розуміти, що "моно-мезилатна сіль" також може називатися у 7 UA 115815 C2 5 10 15 20 25 30 35 40 даному винаході як "моно-MSA сіль", та що "біс-мезилатна сіль" також може називатися у даному винаході як "біс-MSA сіль". Форма, у якій сполука формули I або її сіль або її гідрат присутня у композиції, може варіюватися залежно від типу композиції та способу одержання такої композиції. Наприклад, композиція може являти собою таблетку, отриману за допомогою сухого гранулювання та пресування поліморфу моногідрату біс-мезилатної солі сполуки формули I (наприклад, поліморфної форми 3). Таким чином, у одній варіації запропонована композиція (наприклад, таблетка), що містить поліморф моногідрату біс-мезилатної солі сполуки формули I (наприклад, поліморфної форми 3). У іншому прикладі композиція може являти собою таблетку, отриману за допомогою розпилювального сушіння вихідного розчину, що містить мезилатну сіль сполуки формули I та метансульфонової кислоти з одержанням порошку, висушеного розпиленням (також званою твердою дисперсією), та сухого гранулювання та пресування висушеного розпиленням порошку з одержанням таблетки. Таким чином, у інших варіаціях запропонована композиція (наприклад, вихідний розчин, порошок, висушений розпиленням або тверда дисперсія або таблетка), що містить мезилатну сіль сполуки формули I. Мезилатні солі У деяких варіантах реалізації фармацевтично прийнятна сіль сполуки формули I або її гідрат являє собою мезилатну сіль сполуки формули I або її гідрат. Мезилатна сіль містить катіон сполуки формули I та мезилатний аніон. У одній варіації мезилатний аніон та катіон сполуки формули I присутній у молярному співвідношенні мезилатного аніону до катіону сполуки формули I, що складає щонайменше 1: 1 або від 1: 1 до 3,3: 1, від 1,9: 1 до 3,3: 1, від 1,9: 1 до 2,5: 1, від 1,9: 1 до 2,4: 1, від 2: 1 до 3,3: 1, від 2: 1 до 3: 1 або від 2: 1 до 2,7: 1 або від 2,1: 1 до 2,5: 1 або від 2,2: 1 до 2,4: 1 або приблизно 2,3: 1 або приблизно 2,4: 1. У іншій варіації молярне співвідношення мезилатного аніону до катіону сполуки формули I складає більше ніж 1: 1 та менше ніж 2: 1. У ще одній варіації молярне співвідношення мезилатного аніону до катіону сполуки формули I складає більше ніж 2: 1. У конкретних варіантах реалізації фармацевтично прийнятна сіль сполуки формули I або її гідрат являє собою біс-мезилатну сіль сполуки формули I або її гідрат. Біс-мезилатна сіль може бути зображена у даному винаході різними способами. У одній варіації біс-мезилатна сіль представлена формулою IA: (IA). Спеціалісту у даній галузі буде зрозуміло, що коли біс-мезилатна сіль зображена як формула IA, зазначена вище, мають на увазі іонну форму (наприклад, катіонну форму сполуки формули I та аніонну форму метансульфонової кислоти). Не бажаючи бути зв'язаним якою-небудь теорією, у іншій варіації біс-мезилатна сіль може бути представлена формулою IB: (IB). Не бажаючи бути зв'язаним якою-небудь теорією, у ще одній варіації біс-мезилатна сіль являє собою моногідрат біс-мезилатної солі сполуки формули I, яка може бути представлена формулою IC: 8 UA 115815 C2 5 10 15 20 25 30 (IC). У деяких варіантах реалізації фармацевтично прийнятна сіль сполуки формули I або її гідрат являє собою гідрат біс-мезилатної солі сполуки формули I. У деяких варіаціях гідрат бісмезилатної солі містить щонайменше дві молекули води. Не бажаючи бути зв'язаним якоюнебудь теорією, у одній варіації гідрат біс-мезилатної солі може бути представлений формулою ID: (ID), при цьому y становить щонайменше 0,5. У деяких варіаціях y становить щонайменше 1, щонайменше 1,5, щонайменше 2, щонайменше 2,5, щонайменше 3 або щонайменше 4 або від 0,5 до 5, від 0,5 до 4, від 0,5 до 2, від 0,5 до 1,5 або приблизно 0,5, приблизно 1, приблизно 1,5, приблизно 2, приблизно 3 або приблизно 4. У конкретних варіаціях y становить ціле число. Наприклад, коли y становить 2, сполука формули ID являє собою біс-гідрат біс-мезилатної солі. У інших варіаціях y становить неціле число. Не бажаючи бути зв'язаним якою-небудь теорією, у іншій варіації гідрат біс-мезилатної солі може бути представлений формулою IE: (IE), при цьому y становить щонайменше 0,5. У деяких варіаціях y становить щонайменше 1, щонайменше 1,5, щонайменше 2, щонайменше 2,5, щонайменше 3 або щонайменше 4 або від 0,5 до 5, від 0,5 до 4, від 0,5 до 2, від 0,5 до 1,5 або приблизно 0,5, приблизно 1, приблизно 1,5, приблизно 2, приблизно 3 або приблизно 4. У конкретних варіаціях y становить ціле число. Наприклад, коли y становить 2, сполука формули IE являє собою біс-гідрат біс-мезилатної солі. У інших варіаціях y становить неціле число. Фармацевтичні композиції, що містять біса-мезилатну сіль сполуки формули I або її гідрат, як було неочікувано виявлено, мають поліпшену розчинність, і, таким чином, поліпшену біодоступність у порівнянні з фармацевтичними композиціями та сполуками, що містять інші солі сполуки формули I. Як обговорювалося вище, інші солі сполуки I включають моно-мезилатні солі. Таким чином, у конкретних варіантах реалізації фармацевтично прийнятна сіль сполуки формули I або її гідрат являє собою моно-мезилатну сіль сполуки формули I або її гідрат. У одній варіації мономезилатна сіль представлена формулою IIA: 9 UA 115815 C2 5 10 15 20 25 30 35 40 45 50 (IIA). Спеціалісту у даній галузі буде зрозуміло, що коли моно-мезилатна сіль сполуки формули I зображена як формула IIA, зазначена вище, мається на увазі іонна форма (наприклад, катіонна форма сполуки формули I та аніонна форма метансульфонової кислоти). Гідрати У деяких варіантах реалізації фармацевтично прийнятна сіль сполуки формули I або її гідрат являє собою гідрат мезилатної солі сполуки формули I. У конкретних варіантах реалізації фармацевтично прийнятна сіль сполуки формули I або її гідрат являє собою моногідрат мезилатної солі сполуки формули I. У інших варіантах реалізації фармацевтично прийнятна сіль сполуки формули I або її гідрат являє собою гідрат біс-мезилатної солі сполуки формули I. У одному варіанті реалізації фармацевтично прийнятна сіль сполуки формули I або її гідрат являє собою моногідрат біс-мезилатної солі сполуки формули I. Поліморфи У деяких варіантах реалізації композиція (включаючи, наприклад, фармацевтичну композицію) містить поліморфну форму фармацевтично прийнятної солі сполуки формули I або її гідрату. У конкретних варіантах реалізації поліморфна форма являє собою поліморф бісмезилатної солі сполуки формули I або її гідрату, або будь-які суміші поліморфних форм бісмезилатної солі сполуки формули I або її гідратів. У будь-якому з попередніх варіантів реалізації біс-мезилатна сіль сполуки формули I може бути представлена формулою IA та IB; та гідрат бісмезилатної солі сполуки формули I може бути представлений формулою IC та ID. У конкретних варіантах реалізації поліморфні форми біс-мезилатної солі сполуки формули I або її гідрату, підходящі для застосування у композиціях (включаючи, не обмежуючись, фармацевтичні композиції), способах одержання та застосування таких композицій, наборів, стандартних лікарських форм та готових виробів, запропонованих у даному винаході, включають: (i) поліморфну форму 3, яка являє собою поліморф моногідрату біс-мезилатної солі сполуки формули I, (ii) поліморфну форму 7, яка являє собою гідрат біс-мезилатної солі сполуки формули I, та (iii) будь-які їх комбінації. Поліморфна форма 3 та поліморфна форма 7 більш детально описані нижче. Форма 3 У деяких аспектах композиції (включаючи, не обмежуючись, фармацевтичні композиції), способи одержання та застосування таких композицій, наборів, стандартних лікарських форм та готових виробів, запропонованих у даному винаході, містять поліморфну форму 3, яка являє собою поліморф моногідрату біс-мезилатної солі сполуки формули I. При прочитанні даного опису слід розуміти, що посилання на "поліморфну форму 3", "форму 3", "форму II", "біс-MSA сіль поліморфної форми 3" або "біс-MSA сіль форми 3" відноситься до поліморфної форми 3, яка являє собою поліморф моногідрату біс-мезилатної солі сполуки формули I. Як обговорювалося вище, біс-мезилатна сіль може бути зображена різними способами, включаючи сполуку формули IA або IB. Більше того, моногідрат біс-мезилатної солі може бути зображений формулою IC або ID (при цьому y становить 1) або IE (при цьому y становить 1). У деяких варіаціях поліморфна форма 3 характеризується або має дифрактограму рентгенівської порошкової дифракції по суті як показано на ФІГ. 1A або 1B. Слід розуміти, однак, що відносні інтенсивності та положення піків поліморфних форм, зображені на фігурах, можуть варіюватися залежно від безлічі факторів, включаючи підготовку зразку, обладнання та устаткування, та аналітичну методику, та налаштування, використовувані для одержання спектру. По суті, піки, показані у фігурах, та положення, перераховані у даному винаході (включаючи на ФІГ. 1A та 1B для поліморфної форми 3) охоплюють варіації, що становлять плюс або мінус 0,2 градуса 2θ. У інших варіаціях поліморфна форма 3 також характеризується або має дифрактограму рентгенівської порошкової дифракції, яка характеризується або має рентгенівську дифрактограму (XRPD), яка містить 2θ-відбиття (+0,2 градуса): 13,8, 16,9, 22,9 та 26,1. У деяких варіантах реалізації поліморфна форма 3 характеризується або має рентгенівську 10 UA 115815 C2 5 10 15 20 25 30 35 40 45 50 55 60 дифрактограму (XRPD), яка містить щонайменше одне або більше; щонайменше два або більше; або щонайменше три або більше 2θ-відбиттів (+0,2 градуса): 13,8, 16,9, 22,9 та 26,1. У деяких варіантах реалізації поліморфна форма 3 характеризується або має дифрактограму рентгенівської порошкової дифракції, яка містить 2θ-відбиття (+0,2 градуса): 7,7, 12,9, 17,7 та 18,1. У деяких варіантах реалізації поліморфна форма 3 характеризується або має рентгенівську дифрактограму, яка містить 2θ-відбиття (+0,2 градуса) при 7,7, 12,9, 13,8, 16,9, 17,7, 18,1, 22,9 та 26,1. У деяких варіантах реалізації поліморфна форма 3 характеризується або має рентгенівську дифрактограму (XRPD), яка містить щонайменше три або більше; щонайменше чотири або більше; або щонайменше п'ять або більше 2θ-відбиттів (+0,2 градуса): 7,7, 12,9, 13,8, 16,9, 17,7, 18,1, 22,9 та 26,1. При описі 2θ-відбиттів у рентгенівській дифрактограмі (наприклад, форми 3), слід розуміти, що +0,2 градуса можуть бути виражені як "плюс або мінус 0,2 градуса 2θ». У конкретних варіаціях поліморфна форма 3 може також мати одну або більше, дві або більше, три або більше, чотири або більше, п'ять або більше, або всі наступні властивості (i)(vi): (i) елементарна комірка, як визначено рентгенівською кристалографією, наступних розмірів: a=8,7831(6) Å; b=11,8484(8) Å; c=14,2485(10) Å; α = 98,108(6)°; β = 100,955(6)°; та γ = 98,861(6)°; (ii) триклинна кристалічна система; (iii) P-1 просторова група; 3 (iv) об'єм 1416,05(17) Å ; (v) Z величина становить 2; та 3 (vi) щільність 1,458 Mг/м . Форма 7 У деяких аспектах композиції (включаючи, не обмежуючись наведеними, фармацевтичні композиції), способи одержання та застосування таких композицій, набори, стандартні лікарські форми та готові вироби, запропоновані у даному винаході, містять поліморфну форму 7, яка являє собою поліморф гідрату біс-мезилатної солі сполуки формули I. У даній заявці слід розуміти, що посилання на "поліморфну форму 7", "форму 7", "форму VII", "біс-MSA сіль поліморфної форми 7" або "біс-MSA сіль форми 7" відноситься до поліморфної форми 7, яка являє собою поліморф гідрату біс-мезилатної солі сполуки формули I. Як обговорювалось вище, біс-мезилатна сіль може бути зображена різними способами, включаючи сполуку формули IA або IB. Більше того, біс-мезилатна сіль, що має змінюваний вміст води, може бути зображена формулою ID. У деяких варіаціях поліморфна форма 7 характеризується або має рентгенівську дифрактограму (XRPD), яка містить 2θ-відбиття (+0,2 градуса) при 4,9 та 9,8 та 2θ-відбиття (+0,4 градуса) при 26,7. У конкретних варіаціях поліморфна форма 7 характеризується або має рентгенівську дифрактограму (XRPD), яка містить 2θ-відбиття (+0,2 градуса) при 4,9 та 9,8 та 2θ-відбиття (+0,3 градуса) при 26,7. У конкретних варіаціях поліморфна форма 7 характеризується або має рентгенівську дифрактограму (XRPD), яка містить 2θ-відбиття (+0,2 градуса): 4,9, 9,8 та 26,7. У деяких варіаціях поліморфна форма 7 характеризується або має рентгенівську дифрактограму (XRPD), яка містить щонайменше одне або більше; або щонайменше два або більше 2θ-відбиттів при 4,9 (+0,2 градуса), 9,8 (+0,2 градуса) та 26,7 (+0,4 градуса). У деяких варіаціях поліморфна форма 7 характеризується або має рентгенівську дифрактограму (XRPD), яка містить щонайменше одне або більше; або щонайменше два або більше 2θ-відбиттів при 4,9 (+0,2 градуса), 9,8 (+0,2 градуса) та 26,7 (+0,3 градуса). У конкретних варіаціях поліморфна форма 7 характеризується або має рентгенівську дифрактограму (XRPD), яка містить щонайменше одне або більше; або щонайменше два або більше 2θ-відбиттів (+0,2 градуса): 4,9, 9,8 та 26,7. У інших варіантах реалізації поліморфна форма 7 характеризується або має рентгенівську дифрактограму, яка містить 2θ-відбиття (+0,2 градуса): 15,0 та 18,0. У деяких варіантах реалізації поліморфна форма 7 характеризується або має рентгенівську дифрактограму, яка містить 2θ-відбиття (+0,2 градуса) при 4,9, 9,8, 15,0 та 18,0 та 2θ-відбиття (+0,4 градуса) при 26,7. У деяких варіантах реалізації поліморфна форма 7 характеризується або має рентгенівську дифрактограму, яка містить 2θ-відбиття (+0,2 градуса) при 4,9, 9,8, 15,0 та 18,0, та 2θ-відбиття (+0,3 градуса) при 26,7. У деяких варіантах реалізації поліморфна форма 7 характеризується або має рентгенівську дифрактограму, яка містить 2θ-відбиття (+0,2 градуса) при 4,9, 9,8, 15,0, 18,0 та 26,7. У інших варіантах реалізації поліморфна форма 7 характеризується або має рентгенівську дифрактограму (XRPD), яка містить щонайменше три або більше; щонайменше чотири або 11 UA 115815 C2 5 10 15 20 25 30 35 40 45 50 55 60 більше; або кожне з 2θ-відбиттів при 4,9 (+0,2 градуса), 9,8 (+0,2 градуса), 15,0 (+0,2 градуса), 18,0 (+0,2 градуса) та 26,7 (+0,4 градуса). У деяких варіантах реалізації поліморфна форма 7 характеризується або має рентгенівську дифрактограму (XRPD), яка містить щонайменше три або більше; щонайменше чотири або більше; або кожне з 2θ-відбиттів при 4,9 (+0,2градуса), 9,8 (+0,2 градуса), 15,0 (+0,2 градуса), 18,0 (+0,2 градуса) та 26,7 (+0,3 градуса). У деяких варіантах реалізації поліморфна форма 7 характеризується або має рентгенівську дифрактограму (XRPD), яка містить щонайменше три або більше; щонайменше чотири або більше; або кожне з 2θ-відбиттів (+0,2 градуса) при 4,9, 9,8, 15,0, 18,0 та 26,7. При описі 2θ-відбиттів у рентгенівській дифрактограмі (наприклад, форми 7), слід розуміти, що +0,2 градуса, +0,3 градуса та +0,4 градуса також можуть бути виражені як "плюс або мінус 0,2 градуса 2θ», "плюс або мінус 0,3 градуса 2θ» та "плюс або мінус 0,4 градуса 2θ», відповідно. У інших варіантах реалізації поліморфна форма 7 являє собою перемінний гідрат бісмезилатної солі сполуки формули I. Перемінний гідрат може мати перемінний вміст води. Наприклад, у одному варіанті реалізації поліморфна форма 7 являє собою поліморф бісмезилатної солі, що має вміст води від 1,8 % до 10 %. На вміст води поліморфної форми 7 можуть впливати різні фактори, включаючи, наприклад, умови відносній вологості, якими характеризується поліморфна форма 7. У деяких варіаціях поліморфна форма 7 також характеризується або має рентгенівську дифрактограму (XRPD) по суті як показано на ФІГ. 1C або 1D. Слід розуміти, однак, що відносні інтенсивності та положення піків поліморфних форм, зображені на фігурах, можуть варіюватися залежно від безлічі факторів, включаючи підготовку зразку, обладнання та устаткування, та аналітичну методику, та налаштування, використовувані для одержання спектра. По суті, піки, показані у фігурах та положення, перераховані у даному винаході (включаючи на ФІГ. 1C та 1D для поліморфної форми 7) охоплюють варіації, що становлять плюс або мінус 0,2 градуса 2θ. Більше того, у деяких випадках дифрактограма XRPD поліморфної форми 7 може бути залежної від вологості або варіюватися на підставі відносної вологості, при якій характеризується форма 7. Наприклад, XRPD на ФІГ. 1D була отримана при 25 °C та 53 % відносної вологості (RH). У деяких варіантах реалізації термін "по суті як показано на" з посиланням на дифрактограми рентгенівської порошкової дифракції означає, що дифрактограма не обов'язково є ідентичною тим, які зображені у даному винаході, але охоплює ті, які знаходяться у межах експериментальної помилки або відхилень, при розгляді фахівцем у даній галузі. У деяких варіантах реалізації щонайменше приблизно 50 %, щонайменше приблизно 60 %, щонайменше приблизно 70 %, щонайменше приблизно 80 %, приблизно 85 %, приблизно 90 %, приблизно 95 %, приблизно 96 %, приблизно 97 %, приблизно 98 % або приблизно 99 % композиції (наприклад, фармацевтичної композиції) являє собою форму 3, як описано вище, форму 7, як описано вище, або їх суміш. У конкретних варіантах реалізації щонайменше приблизно 50 %, щонайменше приблизно 60 %, щонайменше приблизно 70 %, щонайменше приблизно 80 %, приблизно 85 %, приблизно 90 %, приблизно 95 %, приблизно 96 %, приблизно 97 %, приблизно 98 % або приблизно 99 % фармацевтичної композиції являє собою форму 3, як описано вище. У інших варіантах реалізації менше ніж приблизно 50 %, менше ніж приблизно 40 %, менше ніж приблизно 30 %, менше ніж приблизно 20 %, приблизно 15 %, приблизно 10 %, приблизно 5 %, приблизно 4 %, приблизно 3 %, приблизно 2 % або приблизно 1 % сполуки формули I, що присутня у фармацевтичній композиції сполуки формули I, відмінно від поліморфної форми 3, як описано вище, форми 7, як описано вище, або їх суміші. У конкретних варіантах реалізації менше ніж приблизно 50 %, менше ніж приблизно 40 %, менше ніж приблизно 30 %, менше ніж приблизно 20 %, приблизно 15 %, приблизно 10 %, приблизно 5 %, приблизно 4 %, приблизно 3 %, приблизно 2 % або приблизно 1 % сполуки формули I, що присутня у фармацевтичній композиції, відмінно від поліморфної форми 3, як описано вище. У конкретних аспектах запропонована стабільна фармацевтична композиція, яка містить щонайменше один поліморф фармацевтично прийнятної солі сполуки формули I або її гідрату та щонайменше один фармацевтично прийнятний носій. У деяких варіантах реалізації запропонована стабільна фармацевтична композиція, яка містить поліморф фармацевтично прийнятної солі сполуки формули I та щонайменше один фармацевтично прийнятний носій. У одній варіації запропонована стабільна фармацевтична композиція, яка містить форму 3 (яка являє собою поліморф моногідрату біс-мезилатної солі формули IA) та щонайменше один фармацевтично прийнятний носій. Термін "стабільна" відноситься до фармацевтичної композиції, яка залишається по суті незмінною або по суті не зміненою при умовах одержання та зберігання впродовж періоду часу 12 UA 115815 C2 5 10 15 20 25 30 35 40 45 50 55 60 при конкретних умовах. У одному аспекті фармацевтична композиція залишається по суті незмінною або незміненою при витримуванні при температурі приблизно 65 °C або менше, приблизно 60 °C або менше, приблизно 50 °C, приблизно 40 °C, приблизно 30 °C або менше, приблизно 25 °C або менше, приблизно 15 °C або менше, приблизно 5 °C або менше, впродовж щонайменше одного тижня, щонайменше двох тижнів, щонайменше трьох тижнів або щонайменше чотирьох тижнів. Наприклад, у одній варіації стабільна фармацевтична композиція залишається по суті незмінною або не зміненою (хімічно та/або фізично) при витримуванні при температурі 40 °C, 25 °C або 5 °C, при значеннях відносній вологості 75 % або 60 % впродовж щонайменше одного або двох або трьох або чотирьох тижнів. Фармацевтично прийнятна сіль сполуки формули I або її гідрат може бути кристалічною або некристалічною або може проявлять ближчий порядок як напівкристалічної твердої речовини. Кристалічність солі або її гідрату у композиціях (наприклад, фармацевтичних композиціях та складах) може залежати від способу або складу та обробки (наприклад, включення солі або її гідрату шляхом розпилювального сушіння та/або сухого гранулювання). Кристалічна сіль У деяких варіантах реалізації композицій (включаючи, не обмежуючись, фармацевтичні композиції), способів одержання та застосування таких композицій, наборів, стандартних лікарських форм та готових виробів, запропонованих у даному винаході, фармацевтично прийнятна сіль сполуки формули I або її гідрат є кристалічною. У одній варіації попереднього варіанту реалізації фармацевтично прийнятна сіль сполуки формули I або її гідрат може являти собою: (i) мезилатну сіль сполуки формули I або її гідрат; або (ii) біс-мезилатну сіль сполуки формули I або її гідрат; (iii) гідрат біс-мезилатної солі сполуки формули I; або (iv) моногідрат бісмезилатної солі сполуки формули I, при цьому фармацевтично прийнятна сіль або її гідрат у кожній варіації є кристалічною. Наприклад, кристалічна сіль як описано у попередніх варіантах реалізації, може знаходитися у таблетці, отриманій шляхом приготування поліморфної форми 3 у формі грануляту. Термін "кристалічний", у одній варіації відноситься до твердої фази, у якій матеріал має регулярну впорядковану внутрішню структуру на молекулярному рівні та дає відмітну рентгенівську дифрактограму з характерними піками. Термін "кристалічний" у іншій варіації може також відноситися до стану, у якому матеріал проявляє дальній порядок на молекулярному рівні та дає відмітну рентгенівську дифрактограму з характерними піками. Такі матеріали при достатньому нагріванні також проявляють властивості рідини, але зміна з твердого стану на рідкий характеризується фазовою зміною, звичайно першого порядку (точка плавлення). У конкретних варіантах реалізації фармацевтично прийнятна сіль сполуки формули I або її гідрат по суті є кристалічною. У одній варіації попереднього варіанту реалізації фармацевтично прийнятна сіль сполуки формули I або її гідрат може являти собою: (i) мезилатну сіль сполуки формули I або її гідрат; або (ii) біс-мезилатну сіль сполуки формули I або її гідрат; (iii) гідрат бісмезилатної солі сполуки формули I; або (iv) моногідрат біс-мезилатної солі сполуки формули I, при цьому фармацевтично прийнятна сіль або її гідрат у кожній варіації композиції є по суті кристалічною. У деяких варіантах реалізації сполука (наприклад, фармацевтично прийнятна сіль або її гідрат), яка є по суті кристалічною, більше ніж 50 %; або більше ніж 55 %; або більше ніж 60 %; або більше ніж 65 %; або більше ніж 70 %; або більше ніж 75 %; або більше ніж 80 %; або більше ніж 85 %; або більше ніж 90 %; або більше ніж 95 %, або більше ніж 99 % сполуки (наприклад, фармацевтично прийнятної солі або її гідрату) присутні у композиції у кристалічній формі. У інших варіантах реалізації сполука (наприклад, фармацевтично прийнятна сіль або її гідрат), яка по суті є кристалічною, має не більше ніж приблизно 20 %, або не більше ніж приблизно 10 %, або не більше ніж приблизно 5 %, або не більше ніж приблизно 2 % сполуки у некристалічній формі. У інших варіантах реалізації сполука (наприклад, фармацевтично прийнятна сіль або її гідрат), яка по суті є кристалічною, має не більше ніж приблизно 20 %, або не більше ніж приблизно 10 %, або не більше ніж приблизно 5 %, або не більше ніж приблизно 2 % сполуки у аморфній формі. Некристалічна У інших варіантах реалізації композицій (включаючи, не обмежуючись, фармацевтичні композиції), способів одержання та застосування таких композицій, наборів, стандартних лікарських форм та готових виробів, запропонованих у даному винаході, фармацевтично прийнятна сіль сполуки формули I є некристалічною. У одній варіації попереднього варіанту реалізації фармацевтично прийнятна сіль сполуки формули I може являти собою: (i) мезилатну сіль сполуки формули I; або (ii) біс-мезилатну сіль сполуки формули I, при цьому 13 UA 115815 C2 5 10 15 20 25 30 35 40 45 50 55 60 фармацевтично прийнятна сіль у кожній варіації є кристалічною. Наприклад, некристалічна сіль, як описано у попередніх варіантах реалізації, може знаходитися у порошку, висушеному розпиленням, отриманому зі сполуки формули I або її фармацевтично прийнятної солі або її гідрату. Термін "некристалічний" відноситься до стану, у якому у матеріалі відсутній дальній порядок на молекулярному рівні. Спеціаліст у даній галузі визначити, що такі матеріали звичайно не проявляють гострі піки у їх рентгенівських дифрактограмах. У деяких варіантах реалізації фармацевтично прийнятна сіль сполуки формули I або її гідрат (включаючи, наприклад, біс-мезилатну сіль формули IA), приготовлена у формі твердодисперсного складу (як більш детально описано нижче), по суті є некристалічною. У конкретному варіанті реалізації сполука або її фармацевтично прийнятна сіль або її гідрат, яка по суті є некристалічною, має більше ніж 50 %; або більше ніж 55 %; або більше ніж 60 %; або більше ніж 65 %; або більше ніж 70 %; або більше ніж 75 %; або більше ніж 80 %; або більше ніж 85 %; або більше ніж 90 %; або більше ніж 95 %, або більше ніж 99 % сполуки або її фармацевтично прийнятної солі, у композиції у некристалічній формі. У інших варіантах реалізації сполука або її фармацевтично прийнятна сіль або її гідрат, яка по суті є некристалічною, має не більше ніж приблизно 20 % кристалічності, або не більше ніж приблизно 10 % кристалічності, або не більше ніж приблизно 5 % кристалічності, або не більше ніж приблизно 2 % кристалічності. Аморфна У деяких варіантах реалізації фармацевтичної композиції фармацевтично прийнятна сіль сполуки формули I або її фармацевтично прийнятна сіль або її гідрат може бути аморфною. У конкретних варіантах реалізації біс-мезилатна сіль формули IA може бути аморфною. Термін "аморфний" відноситься до стану, у якому у матеріалі відсутній порядок (наприклад, дальній порядок) на молекулярному рівні, та, у залежності від температури, він може проявляти фізичні властивості твердої або рідкої речовини. Звичайно такі матеріали не дають характерних рентгенівських дифрактограм, та, коли проявляють властивості твердої речовини, більш формально описані як рідина. При нагріванні відбувається зміна твердих властивостей на рідкі, яка характеризується зміною стану, звичайно другого порядку (наприклад, склування). Наприклад, у одному варіанті реалізації фармацевтично прийнятна сіль сполуки формули I або її гідрат (включаючи, наприклад, біс-мезилатну сіль формули IA), приготовлена у формі твердодисперсного складу (як більш детально описано нижче), по суті є аморфною. У деяких варіантах реалізації сполука, яка по суті є аморфною, має більше ніж 50 %; або більше ніж 55 %; або більше ніж 60 %; або більше ніж 65 %; або більше ніж 70 %; або більше ніж 75 %; або більше ніж 80 %; або більше ніж 85 %; або більше ніж 90 %; або більше ніж 95 %, або більше ніж 99 % сполуки в композиції у аморфній формі. У інших варіантах реалізації сполука, яка по суті є аморфною, має не більше ніж приблизно 20 % кристалічності, або не більше ніж приблизно 10 % кристалічності, або не більше ніж приблизно 5 % кристалічності або не більше ніж приблизно 2 % кристалічності. Дейтеровані сполуки Будь-яка формула або структура, приведена у даному винаході, включаючи сполуку формули I та її фармацевтично прийнятні солі (включаючи, наприклад, моно-мезилатну та бісмезилатну солі) або їх гідрати також розглядають як ізотопно мічену форму сполук або солей або їх гідратів. Таким чином, хоча запропоновані немічені форми сполук, слід розуміти, що даний опис також пропонує ізотопно мічені сполуки, навіть якщо такі ізотопи безпосередньо не зображені. Ізотопно мічені сполуки або солі або їх гідрати мають структури, зображені формулами, приведеними у даному винаході, за виключенням того одного або більше атомів, які заміщені атомом, що має вибрану атомну масу або масове число. Приклади ізотопів, які можуть бути включені у сполуки згідно з даним описом, включають ізотопи водню, вуглецю, 2 3 азоту, кисню, фосфору, фтору та хлору, такі як, але не обмежуючись ними, H (дейтерій, D), H 11 13 14 15 18 31 32 35 36 125 (тритій), C, C, C, N, F, P, P, S, Cl та I. Наприклад, ізотопи водню, вуглецю, азоту, 2 3 кисню, фосфору, фтору та хлору, такі як, але не обмежуючись ними, H (дейтерій, D), H 11 13 14 15 35 (тритій), C, C, C, N та S, можуть бути включені у сполуку формули I, включаючи сіль (наприклад, мезилатну сіль) сполуки формули I або її гідрат. Різні ізотопно мічені сполуки або їх солі або гідрати згідно з даним описом, наприклад, такі, у які включені радіоактивні ізотопи, такі 3 13 14 як H, C та C. Такі ізотопно мічені сполуки або їх солі можуть підходити для досліджень метаболізму, досліджень кінетичних реакцій, способів виявлення або зображення, таких як позитронно-емісійна томографія (PET) або однофотонна емісійна комп'ютерна томографія (SPECT), включаючи аналіз розподілу лікарського засобу або субстрату у тканинах, або для радіоактивного лікування суб'єктів. 14 UA 115815 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний опис також включає сполуку формули I та її фармацевтично прийнятні солі (включаючи, наприклад, моно-мезилатну та біс-мезилатну солі) або їх гідрати, у яких від 1 до n атомів водню, приєднаних до атому вуглецю, заміщені дейтерієм, у якій n являє собою кількість атомів водню у молекулі. Такі сполуки можуть проявлять підвищену стійкість до метаболізму й, таким чином, підходять для збільшення періоду напіврозкладу сполуки формули I або її фармацевтично прийнятних солей або їх гідратів (включаючи біс-мезилатну сіль формули IA або IB або її гідрат; або гідрат біс-мезилату формули IC або ID) при введенні ссавцю. Див., наприклад, Foster, "Deuterium Isotope Effects in Studies of Drug Metabolism", Trends Pharmacol. Sci. 5(12):524-527 (1984). Такі сполуки синтезують за способами, добре відомими у даній галузі, наприклад, із застосуванням вихідних матеріалів, у яких один або більше атомів водню заміщені на дейтерій. Мічені дейтерієм або заміщені терапевтичні сполуки згідно із даним опису (включаючи їх солі або гідрати) можуть мати поліпшені властивості DMPK (метаболізм лікарських засобів та фармакокінетика), щодо всмоктування, розподілу, метаболізму та виведення (ADME). Заміщення більш важкими ізотопами, такими як дейтерій, може забезпечити конкретні терапевтичні переваги, забезпечуючи більш високу метаболічну стабільність, наприклад, збільшений період напіврозпаду in vivo, знижене необхідне дозування та/або поліпшення 18 терапевтичного індексу. Сполука, мічена F, може підходити для досліджень PET або SPECT. Ізотопно мічені сполуки згідно із даним описом та їх проліки у цілому можуть бути отримані за допомогою виконання методик, описаних у схемах або у прикладах та способах одержання, описаних нижче, за допомогою заміщення легко доступного ізотопно міченого реагенту на немічений ізотопом реагент. Слід розуміти, що дейтерій у даному контексті розглядають у якості заміснику у сполуці формули I та її фармацевтично прийнятних солях (включаючи, наприклад, моно-мезилатну та біс-мезилатну солі) або їх гідратах. Концентрація такого більш важкого ізотопу, конкретно дейтерію, може бути визначена фактором ізотопного збагачення. У сполуках згідно із даним описом будь-який атом, конкретно не позначений як конкретний ізотоп, являє собою будь-який стабільний ізотоп цього атому. Якщо не зазначене інше, коли положення позначене конкретно як "H" або "водень", слід розуміти, що положення має водень із його природною розповсюдженою ізотопною сполукою. Відповідно, у сполуках або їх солях згідно із даним описом будь-який атом, конкретно позначений як дейтерій (D), являє собою дейтерій. Фармацевтично прийнятні носії Термін "носій" відноситься до розріджувачів, розпушувачів, інгібіторів осадження, поверхнево-активних речовин, речовин, що сприяють ковзанню, зв'язуючих агентів, змащуючих агентів та інших допоміжних речовин та носіїв, з якими вводять сполуку. Носії в цілому описані у даному винаході та також у "Remington's Pharmaceutical Sciences" від E.W. Martin. Приклади носіїв включають, але не обмежуються ними, моностеарат алюмінію, стеарат алюмінію, карбоксиметилцелюлозу, карбоксиметилцелюлозу натрію, кросповідон, гліцерилізостеарат, гліцерилмоностеарат, гідроксиетилцелюлозу, гідроксиметилцелюлозу, гідроксиоктакозаніл гідроксистеарат, гідроксипропілцелюлозу, гідроксипропіл-метилцелюлозу, лактозу, лактози моногідрат, стеарат магнію, манітол, мікрокристалічну целюлозу, полоксамер 124, полоксамер 181, полоксамер 182, полоксамер 188, полоксамер 237, полоксамер 407, повідон, діоксид кремнію, колоїдний діоксид кремнію, силікон, силіконовий клей 4102 та силіконову емульсію. У деяких варіантах реалізації композиції (наприклад, фармацевтичні композиції), запропоновані у даному винаході, містять носії, вибрані з моностеарату алюмінію, стеарату алюмінію, карбоксиметилцелюлози, карбоксиметилцелюлози натрію, кросповідону, гліцерилізостеарату, гліцерилмоностеарату, гідроксиетилцелюлози, гідроксиметилцелюлози, гідроксиоктакозаніл гідроксистеарату, гідроксипропілцелюлози, гідроксипропілметилцелюлози, лактози, лактози моногідрату, стеарату магнію, манітолу, мікрокристалічної целюлози, полоксамеру 124, полоксамеру 181, полоксамеру 182, полоксамеру 188, полоксамеру 237, полоксамеру 407, повідону, діоксиду кремнію та колоїдного діоксиду кремнію. Слід розуміти, однак, що носії, вибрані для фармацевтичних композицій, запропонованих у даному описі, та кількості таких носіїв у композиції можуть залежати від способу приготування та обробки (наприклад, включення шляхом розпилювального сушіння та/або сухого гранулювання). Термін "розріджувач" в цілому відноситься до речовини, яку застосовують для розведення композиції, що представляє інтерес, перед доставкою. Розріджувачі також можуть слугувати для стабілізації сполук. Приклади розріджувачів можуть включати крохмаль, сахариди, дисахариди, сахарозу, лактозу, полісахариди, целюлозу, прості ефіри целюлози, гідроксипропілцелюлозу, цукрові спирти, ксиліт, сорбіт, мальтит, мікрокристалічну целюлозу, карбонат кальцію або натрію, лактозу, лактози моногідрат, дикальцій фосфат, целюлозу, 15 UA 115815 C2 5 10 15 20 25 30 35 40 45 50 55 60 стиснювані цукри, двозаміщений кальцію фосфат дигідрат, манітол, мікрокристалічну целюлозу та трикальційфосфат. Термін "розпушувач" в цілому відноситься до речовини, яка при додаванні до твердих лікарських засобів сприяє її розпаду або руйнуванню після введення та допускає вивільнення активного інгредієнту як можна більш ефективно, щоб забезпечити його швидке розчинення. Приклади розпушувачів можуть включати кукурудзяний крохмаль, натрію крохмальгліколят, кроскармелозу натрію, кросповідон, мікрокристалічну целюлозу, модифікований кукурудзяний крохмаль, карбоксиметилкрохмаль натрію, повідон, прежелатинізований крохмаль та альгінову кислоту. Термін "інгібітори осадження" в цілому відноситься до речовини, яка попереджає або інгібує осадження активного агенту з пересиченого розчину. Приклад інгібітору осадження являє собою гідроксипропілметилцелюлозу (ГПМЦ). Термін "поверхнево-активні речовини" у цілому відноситься до речовини, яка знижує поверхневий натяг між рідиною та твердою речовиною та може поліпшувати змочування активного агенту або поліпшувати розчинність активного агенту. Приклади поверхнево-активних речовин включають полоксамер та лаурилсульфат натрію. Термін "речовини, що сприяють ковзанню" у цілому відноситься до речовин, використовуваних у складах таблеток та капсул для поліпшення текучих властивостей у процесі пресування таблеток та для одержання ефекту проти злежування. Приклади речовин, що сприяють ковзанню, можуть включати колоїдний діоксид кремнію, тальк, високодисперсний діоксид кремнію, крохмаль, похідні крохмалю та бентоніт. Термін "зв'язуючий агент" у цілому відноситься до будь-якої фармацевтично прийнятної речовини (такої як будь-яка фармацевтично прийнятна плівка), яка можна застосовувати для зв'язування активного та інертного компонентів носія для підтримки зв'язаних та окремих частин. Приклади сполучних агентів можуть включати гідроксипропілцелюлозу, гідроксипропілметилцелюлозу, повідон, коповідон та етилцелюлозу. Термін "змащувальний агент" у цілому відноситься до речовини, яку додають до порошкової суміші для запобігання прилипання спресованої порошкової маси до обладнання протягом процесу таблетування або інкапсулювання. Змащувальний агент може допомагати вилученню таблетки із комірки та може поліпшувати плинність порошку. Приклади змащувальних агентів можуть включати стеарат магнію, стеаринову кислоту, діоксид кремнію, жири, стеарат кальцію, поліетиленгліколь, стеарилфумарат натрію або тальк; та солюбілізуючі агенти, такі як жирні кислоти, включаючи лауринову кислоту, олеїнову кислоту та C8/C10 жирну кислоту. У конкретних аспектах запропонована композиція, що містить щонайменше один активний агент (включаючи, наприклад, сполука формули I, або її фармацевтично прийнятну сіль або її гідрат) та один або більше із нижчеподаних (a)-(g): a) щонайменше одного розріджувача; b) щонайменше одного розпушувача; c) щонайменше одного інгібітору осадження; d) щонайменше однієї поверхнево-активної речовини; e) щонайменше однієї речовини, що сприяє ковзанню; f) щонайменше одного змащуючого агенту; та g) щонайменше одного зв'язуючого агенту. Слід розуміти, що фармацевтично прийнятний носій може бути охарактеризований двома або більше категоріями, приведеними у (a)-(g). Наприклад, гідроксипропілметилцелюлоза може бути охарактеризована як інгібітор осадження та зв'язуючий агент. У одній варіації запропонована фармацевтична композиція, яка містить щонайменше один активний агент (включаючи, наприклад, сполуку формули I або її фармацевтично прийнятну сіль або її гідрат) та один або більше з приведених нижче (a)-(f): a) щонайменше одного розріджувача; b) щонайменше одного розпушувача; c) щонайменше одного інгібітору осадження; d) щонайменше однієї поверхнево-активної речовини; e) щонайменше однієї речовини, що сприяє ковзанню; та f) щонайменше одного змащуючого агенту. У деяких варіантах реалізації фармацевтична композиція містить два із зазначених вище (a)-(f) або три із зазначених вище (a)-(f) або чотири із зазначених вище (a)-(f) або п'ять із зазначених вище (a)-(f) або усі із зазначених вище (a)-(f). У деяких варіантах реалізації фармацевтична композиція містить щонайменше один або щонайменше два розріджувача(ей). У одній варіації фармацевтична композиція містить 16 UA 115815 C2 5 10 15 20 25 30 35 40 45 50 55 60 щонайменше один розріджувач. У конкретних варіантах реалізації фармацевтична композиція містить один або два розріджувача(ей). У конкретних варіантах реалізації розріджувач вибраний з групи, яка складається з манітолу, мікрокристалічної целюлози, лактози, декстрози, сахарози, лудифлеш, F-melt, адвантози, GalenIQ та будь-яких їх сумішей. У одному варіанті реалізації розріджувач являє собою манітол, мікрокристалічну целюлозу або їх суміш. У одній варіації фармацевтична композиція містить один або більше розріджувачів та будь-який один або більше з перерахованих вище (b)-(f). У деяких варіантах реалізації фармацевтична композиція містить щонайменше один розпушувач. У конкретних варіантах реалізації фармацевтична композиція містить тільки один розпушувач. У одному варіанті реалізації розпушувач являє собою кроскармелозу натрію. У іншому варіанті реалізації розпушувач являє собою кросповідон. У одній варіації фармацевтична композиція містить один або більше розпушувачів та будь-який один або більше з перерахованих вище (a), (c)-(f). У деяких варіантах реалізації фармацевтична композиція містить щонайменше один інгібітор осадження. У конкретних варіантах реалізації фармацевтична композиція містить один інгібітор осадження. У одному варіанті реалізації інгібітор осадження являє собою гідроксипропілметилцелюлозу. У одній варіації фармацевтична композиція містить щонайменше один інгібітор осадження та щонайменше один розріджувач; наприклад, гідроксипропілметилцелюлозу та манітол. У деяких варіантах реалізації фармацевтична композиція містить щонайменше одну поверхнево-активну речовину. У конкретних варіантах реалізації фармацевтична композиція містить тільки одну поверхнево-активну речовину. У одному варіанті реалізації поверхневоактивна речовина являє собою полоксамер. У іншому варіанті реалізації поверхнево-активна речовина являє собою лаурилсульфат натрію. У деяких варіантах реалізації фармацевтична композиція містить щонайменше одну речовину, що сприяє ковзанню. У конкретних варіантах реалізації фармацевтична композиція містить тільки одну речовину, що сприяє ковзанню. У одному варіанті реалізації речовина, що сприяє ковзанню являє собою колоїдний діоксид кремнію. У деяких варіантах реалізації фармацевтична композиція містить щонайменше один змащуючий агент. У конкретних варіантах реалізації фармацевтична композиція містить тільки один змащуючий агент. У одному варіанті реалізації змащуючий агент являє собою стеарат магнію. Слід розуміти, що композиція (наприклад, фармацевтична композиція) містить фармацевтично прийнятні носії, детально описані у даному винаході, є тими ж, як у випадку, якщо б кожна комбінація фармацевтично прийнятних носіїв була конкретно та індивідуально зазначена. Наприклад, у деяких варіаціях фармацевтична композиція містить фармацевтично прийнятну сіль сполуки формули I або її гідрат та щонайменше один інгібітор осадження. У одній варіації фармацевтична композиція містить мезилатну сіль сполуки формули I або її гідрат та щонайменше один інгібітор осадження. У іншій варіації фармацевтична композиція містить мезилатну сіль сполуки формули I або її гідрат, щонайменше один інгібітор осадження та щонайменше один розріджувач. У іншій варіації фармацевтична композиція містить мезилатну сіль сполуки формули I або її гідрат, щонайменше один інгібітор осадження та щонайменше один розпушувач. У іншій варіації фармацевтична композиція містить мезилатну сіль сполуки формули I або її гідрат, щонайменше один інгібітор осадження та щонайменше одну поверхнево-активну речовину. У іншій варіації фармацевтична композиція містить мезилатну сіль сполуки формули I або її гідрат, щонайменше один інгібітор осадження та щонайменше одну речовину, що сприяє ковзанню. У іншій варіації фармацевтична композиція містить мезилатну сіль сполуки формули I або її гідрат, щонайменше один інгібітор осадження та щонайменше один змащуючий агент. У іншій варіації фармацевтична композиція містить мезилатну сіль сполуки формули I або її гідрат, щонайменше один інгібітор осадження, щонайменше один розріджувач та щонайменше поверхнево-активну речовину. У будь-якій з приведених вище варіацій мезилатна сіль сполуки формули I або її гідрат може являти собою моно-мезилатну сіль сполуки формули I або її гідрат; або біс-мезилатну сіль сполуки формули I або її гідрат; або гідрат біс-мезилатної солі сполуки формули I; або моногідрат біс-мезилатної солі сполуки формули I; або поліморфну форму 3, поліморфну форму 7 або їх комбінацію. У деяких варіантах реалізації композиція містить фармацевтично прийнятну сіль сполуки формули I або її гідрат, гідроксипропілметилцелюлозу та щонайменше один додатковий носій. У одній варіації композиція містить фармацевтично прийнятну сіль сполуки формули I або її 17 UA 115815 C2 5 10 15 20 25 30 35 40 45 50 55 60 гідрат, гідроксипропілметилцелюлозу та щонайменше один розріджувач. У іншій варіації композиція містить фармацевтично прийнятну сіль сполуки формули I або її гідрат, гідроксипропілметилцелюлозу та щонайменше один розпушувач. У іншій варіації композиція містить фармацевтично прийнятну сіль сполуки формули I або її гідрат, гідроксипропілметилцелюлозу та щонайменше одну поверхнево-активну речовину. У іншій варіації композиція містить фармацевтично прийнятну сіль сполуки формули I або її гідрат, гідроксипропілметилцелюлозу та щонайменше одну речовину, що сприяє ковзанню. У іншій варіації композиція містить фармацевтично прийнятну сіль сполуки формули I або її гідрат, гідроксипропілметилцелюлозу та щонайменше один змащуючий агент. У іншій варіації композиція містить фармацевтично прийнятну сіль сполуки формули I або її гідрат, гідроксипропілметилцелюлозу, щонайменше один розріджувач та щонайменше поверхневоактивну речовину. У будь-якому варіанті реалізації, у якій композиція містить гідроксипропілметилцелюлозу, у одній варіації композиція містить полімерну матрицю, сформовану з гідроксипропілметилцелюлози (наприклад, композиція, у якій фармацевтично прийнятна сіль сполуки формули I, така як біс-мезилатна сіль сполуки формули I або її гідрат або поліморфна форма 3, поліморфна форма 7 або їх комбінація диспергована у межах полімерної матриці, сформованої з гідроксипропілметилцелюлози). У будь-якій з приведених вище варіацій фармацевтично прийнятна сіль сполуки формули I або її гідрат може являти собою мезилатну сіль сполуки формули I; або моно-мезилатну сіль сполуки формули I або її гідрат; або біс-мезилатну сіль сполуки формули I або її гідрат; або гідрат біс-мезилатної солі сполуки формули I; або моногідрат біс-мезилатної солі сполуки формули I; або поліморфну форму 3, поліморфну форму 7 або їх комбінацію. У інших варіаціях фармацевтична композиція містить біс-мезилатну сіль формули IA або її гідрат, гідроксипропілметилцелюлозу та щонайменше один додатковий носій. У одній варіації фармацевтична композиція містить біс-мезилатну сіль формули IA або її гідрат, гідроксипропілметилцелюлозу та щонайменше один розріджувач. У іншій варіації фармацевтична композиція містить біс-мезилатну сіль формули IA або її гідрат, гідроксипропілметилцелюлозу та щонайменше один розпушувач. У іншій варіації фармацевтична композиція містить біс-мезилатну сіль формули IA або її гідрат, гідроксипропілметилцелюлозу та щонайменше одну поверхнево-активну речовину. У іншій варіації фармацевтична композиція містить біс-мезилатну сіль формули IA або її гідрат, гідроксипропілметилцелюлозу та щонайменше одно речовина, що сприяє ковзанню. У іншій варіації фармацевтична композиція містить біс-мезилатну сіль формули IA або її гідрат, гідроксипропілметилцелюлозу та щонайменше один змащуючий агент. У іншій варіації фармацевтична композиція містить біс-мезилатну сіль формули IA або її гідрат, гідроксипропілметилцелюлозу, щонайменше один розріджувач та щонайменше поверхневоактивну речовину. У будь-якій з приведених вище варіацій біс-мезилатна сіль формули IA або її гідрат являє собою поліморфну форму 3, поліморфну форму 7 або їх комбінацію. У інших варіантах реалізації композиція містить моногідрат біс-мезилатної солі сполуки формули I, гідроксипропілметилцелюлозу та манітол. У іншій варіації композиція містить моногідрат біс-мезилатної солі сполуки формули I, гідроксипропілметилцелюлозу та кросповідон. У іншій варіації композиція містить моногідрат біс-мезилатної солі сполуки формули I, гідроксипропілметилцелюлозу та полоксамер. У іншій варіації композиція містить моногідрат біс-мезилатної солі сполуки формули I, гідроксипропілметилцелюлозу та колоїдний діоксид кремнію. У іншій варіації композиція містить моногідрат біс-мезилатної солі сполуки формули I, гідроксипропілметилцелюлозу та мікрокристалічну целюлозу. У іншій варіації композиція містить моногідрат біс-мезилатної солі сполуки формули I, гідроксипропілметилцелюлозу та стеарат магнію. У ще одній варіації композиція містить моногідрат біс-мезилатної солі сполуки формули I, гідроксипропілметилцелюлозу, манітол та кросповідон. У ще одній варіації композиція містить моногідрат біс-мезилатної солі сполуки формули I, гідроксипропілметилцелюлозу, манітол, кросповідон та колоїдний діоксид кремнію. У ще одній варіації композиція містить моногідрат біс-мезилатної солі сполуки формули I, гідроксипропілметилцелюлозу, манітол, кросповідон, колоїдний діоксид кремнію та мікрокристалічну целюлозу. У ще одній варіації композиція містить моногідрат біс-мезилатної солі сполуки формули I, гідроксипропілметилцелюлозу, манітол, кросповідон, колоїдний діоксид кремнію, мікрокристалічну целюлозу та стеарат магнію. У будь-якому варіанті реалізації, у якій композиція містить гідроксипропілметилцелюлозу, у одній варіації композиція містить полімерну матрицю, сформовану з гідроксипропілметилцелюлози (наприклад, композиція, у якій фармацевтично прийнятна сіль сполуки формули I, така як біс-мезилатна сіль сполуки формули I, або її гідрат (та будь-який інший фармацевтично прийнятний носій) диспергована у межах 18 UA 115815 C2 5 10 15 20 25 30 35 40 45 50 55 60 полімерної матриці, сформованої з гідроксипропілметилцелюлози). У інших варіаціях фармацевтична композиція містить форму 3, гідроксипропілметилцелюлозу та манітол. У іншій варіації фармацевтична композиція містить форму 3, гідроксипропілметилцелюлозу та кросповідон. У іншій варіації фармацевтична композиція містить форму 3, гідроксипропілметилцелюлозу та полоксамер. У іншій варіації фармацевтична композиція містить форму 3, гідроксипропілметилцелюлозу та колоїдний діоксид кремнію. У іншій варіації фармацевтична композиція містить форму 3, гідроксипропілметилцелюлозу та мікрокристалічну целюлозу. У іншій варіації фармацевтична композиція містить форму 3, гідроксипропілметилцелюлозу та стеарат магнію. У ще одній варіації фармацевтична композиція містить форму 3, гідроксипропілметилцелюлозу, манітол та кросповідон. У ще одній варіації фармацевтична композиція містить форму 3, гідроксипропілметилцелюлозу, манітол, кросповідон та колоїдний діоксид кремнію. У ще одній варіації фармацевтична композиція містить форму 3, гідроксипропілметилцелюлозу, манітол, кросповідон, колоїдний діоксид кремнію та мікрокристалічну целюлозу. У ще одній варіації фармацевтична композиція містить форму 3, гідроксипропілметилцелюлозу, манітол, кросповідон, колоїдний діоксид кремнію, мікрокристалічну целюлозу та стеарат магнію. Слід розуміти, що форма 3 являє собою поліморф моногідрату біс-мезилатної солі сполуки формули I, який також може бути описаний як поліморф моногідрату біс-мезилатної солі формули IA, IB, IC, ID (де y становить 1) або IE (де y становить 1). У конкретних варіаціях композиція містить мезилатну сіль сполуки формули I або її гідрат та щонайменше один фармацевтично прийнятний носій, вибраний з групи, яка складається з гідроксипропілметилцелюлози, манітолу, кросповідону, полоксамеру, колоїдного діоксиду кремнію, мікрокристалічної целюлози, стеарату магнію та будь-яких їх сумішей. У іншій варіації композиція містить мезилатну сіль сполуки формули I або її гідрат, гідроксипропілметилцелюлозу та крім того щонайменше один фармацевтично прийнятний носій, вибраний з групи, яка складається з манітолу, кросповідону, полоксамеру, колоїдного діоксиду кремнію, мікрокристалічної целюлози, стеарату магнію та будь-яких їх сумішей. У будь-якій з приведених вище варіацій мезилатна сіль сполуки формули I або її гідратможе являти собою моно-мезилатну сіль сполуки формули I, або її гідрат; або біс-мезилатну сіль сполуки формули I або її гідрат; або гідрат біс-мезилатної солі сполуки формули I; або моногідрат біс-мезилатної солі сполуки формули I. У конкретних варіаціях фармацевтична композиція містить біс-мезилатну сіль формули IA (включаючи, наприклад, форму 3) та щонайменше один фармацевтично прийнятний носій, вибраний з групи, яка складається з гідроксипропілметилцелюлози, манітолу, кросповідону, полоксамеру, колоїдного діоксиду кремнію, мікрокристалічної целюлози, стеарату магнію та будь-яких їх сумішей. У іншій варіації фармацевтична композиція містить біс-мезилатну сіль формули IA (включаючи, наприклад, форму 3), гідроксипропілметилцелюлозу та крім того щонайменше один фармацевтично прийнятний носій, вибраний з групи, яка складається з манітолу, кросповідону, полоксамеру, колоїдного діоксиду кремнію, мікрокристалічної целюлози, стеарату магнію та будь-яких їх сумішей. Також слід розуміти, що фармацевтично прийнятні носії, описані вище, можуть проявляти одну або більше різних функцій у даному складі та можуть відноситися до одного або більше функціональних класів носіїв (наприклад, розпушувачів, змащуючих агентів, розріджувачів). Також слід розуміти, що у інших варіантах реалізації фармацевтична композиція може містити один або більше додаткових носіїв для покращення текучості, пресування, твердості, смаку та зовнішнього вигляду таблетки. Фармацевтично прийнятні полімери Хоча фармацевтично прийнятні носії, використовувані у запропонованих фармацевтичних композиціях, можуть бути описані функціонально, фармацевтично прийнятні носії також можуть бути описані структурно. Таким чином, фармацевтично прийнятні носії у одному аспекті являють собою фармацевтично прийнятні полімери. Запропонована композиція (наприклад, фармацевтична композиція), що містить мезилатну сіль сполуки формули I або її гідрат і щонайменше один, щонайменше два або щонайменше три фармацевтично прийнятні полімер(и). У вищевикладеному варіанті реалізації мезилатна сіль сполуки формули I або її гідрат може являти собою моно-мезилатну сіль сполуки формули I або її гідрат; або біс-мезилатну сіль сполуки формули I або її гідрат; або гідрат біс-мезилатної солі сполуки формули I; або моногідрат біс-мезилатної солі сполуки формули I. Термін "полімер" відноситься до хімічної сполуки або суміші сполук, що складаються з повторюваних структурних одиниць, які можуть бути отримані за допомогою способу полімеризації. Підходящі полімери, придатні для даного винаходу, описані у даному винаході. 19 UA 115815 C2 5 10 15 20 25 30 35 40 45 50 55 60 Термін "фармацевтично прийнятний полімер" відноситься до полімеру, який не має властивостей, які для завбачливого практикуючого лікаря є причиною уникати введення матеріалу суб'єктові (наприклад, людині), беручи до уваги захворювання або стану, що підлягають лікуванню та відповідний спосіб введення. У конкретних варіаціях композиція (наприклад, фармацевтична композиція) містить мезилатну сіль сполуки формули I (включаючи, наприклад, моно-мезилатну або біс-мезилатну сіль) та один, два, три або чотири фармацевтично прийнятні полімер(и). У одній варіації композиція (наприклад, фармацевтична композиція) містить мезилатну сіль сполуки формули I (включаючи, наприклад, моно-мезилатну або біс-мезилатну сіль), щонайменше один фармацевтично прийнятний полімер та щонайменше один, щонайменше два або щонайменше три додаткові фармацевтично прийнятні носій(ії). У інших варіаціях композиція (наприклад, фармацевтична композиція) містить мезилатну сіль сполуки формули I (включаючи, наприклад, моно-мезилатну або біс-мезилатну сіль), один, два, три або чотири фармацевтично прийнятні полімер(и) та щонайменше один, щонайменше два або щонайменше три додатковий(і) фармацевтично прийнятний(і) носій(ії). У деяких варіантах реалізації композиції (наприклад, фармацевтичної композиції) щонайменше один з фармацевтично прийнятних полімерів являє собою гідроксипропілметилцелюлозу (також відому у даній галузі як ГПМЦ або під іншою розповсюдженою назвою, такою як гіпромелоза). ГПМЦ часто застосовують у даній галузі як фармацевтично прийнятний носій у складах з уповільненим вивільненням, та також її можна застосовувати у складах з негайним вивільненням, як описано у даному винаході. Спеціалістам у даній галузі слід розуміти, що активний агент може бути приготовлений для уповільненого вивільнення або негайного вивільнення. "Склад з уповільненим вивільненням" являє собою склад, який призначений для повільного вивільнення активного агенту у суб'єкті впродовж тривалого періоду часу, тоді як "склад з негайним вивільненням" являє собою склад, який призначений для швидкого вивільнення активного агенту у суб'єкті впродовж короткого періоду часу. У деяких випадках склад з негайним вивільненням може бути покритий таким чином, що активний агент вивільнюється тільки один раз, коли він досягає необхідної цілі у суб'єкті, наприклад, у шлунку. У іншому варіанті реалізації фармацевтичної композиції фармацевтично прийнятна сіль сполуки формули I або її гідрат приготовані з негайним вивільненням. У викладеному вище варіанті реалізації фармацевтично прийнятна сіль сполуки формули I або її гідрат може являти собою мезилатну сіль сполуки формули I; або моно-мезилатну сіль сполуки формули I або її гідрат; або біс-мезилатну сіль сполуки формули I або її гідрат; або гідрат біс-мезилатної солі сполуки формули I; або моногідрат біс-мезилатної солі сполуки формули I. При застосуванні гідроксипропілметилцелюлози у такому складі з негайним вивільненням спостерігалось збільшення біодоступності фармацевтично прийнятної солі сполуки формули I або її гідрату, яку вводили суб'єкту (наприклад, людині), у порівнянні зі складом сполуки формули I без застосування гідроксипропілметилцелюлози. Таким чином, у деяких аспектах запропонований спосіб збільшення біодоступності фармацевтично прийнятної солі сполуки формули I або її гідрату, який включає введення людині, якому це необхідно, композиції, яка містить (i) фармацевтично прийнятну сіль сполуки формули I або її гідрат та (ii) гідроксипропілметилцелюлозу, для збільшення біодоступності фармацевтично прийнятної солі сполуки формули I або її гідрату. У одній варіації біодоступність для людини збільшували у порівнянні з введенням людині композиції, яка містить фармацевтично прийнятну сіль сполуки формули I або її гідрат, у якій відсутня гідроксипропілметилцелюлоза. У деяких варіантах реалізації композиція являє собою таблетку. У деяких варіаціях приведених вище способів збільшення біодоступності, фармацевтично прийнятна сіль сполуки формули I або її гідрат являє собою біс-мезилатну сіль сполуки формули I; та у одній варіації фармацевтично прийнятна сіль сполуки формули I або її гідрат являє собою моногідрат біс-мезилатної солі сполуки формули I. У деяких випадках було виявлено, що гідроксипропілметилцелюлоза пролонгує пересичення фармацевтично прийнятної солі сполуки формули I (включаючи, наприклад, мезилатну сіль сполуки формули I) або її гідрату. Таким чином, у деяких аспектах запропонований спосіб пролонгування пересичення фармацевтично прийнятної солі сполуки формули I або її гідрату у композиції, який включає додавання гідроксипропілметилцелюлози у композицію, яка містить фармацевтично прийнятну сіль сполуки формули I або її гідрат для пролонгування пересичення. У одній варіації пересичення сполуки формули I або її гідрату у композиції пролонговане у порівнянні з композицією, яка містить фармацевтично прийнятну сіль сполуки формули I або її гідрат, у якій гідроксипропілметилцелюлоза відсутня. 20 UA 115815 C2 5 10 15 20 25 30 35 40 45 50 55 60 У деяких варіаціях приведених вище способів пролонгування пересичення, фармацевтично прийнятна сіль сполуки формули I або її гідрат являє собою біс-мезилатну сіль сполуки формули I; та у одній варіації фармацевтично прийнятна сіль сполуки формули I або її гідрат являє собою моногідрат біс-мезилатної солі сполуки формули I. У деяких варіантах реалізації пересичення пролонгують впродовж години, що дає сполуці формули I більш широкий інтервал для поглинання in vivo. У деяких варіантах реалізації композиція являє собою вихідний розчин для розпилювального сушіння. У інших випадках спостерігали, що гідроксипропілметилцелюлоза мінімізує кристалізацію фармацевтично прийнятної солі сполуки формули I (включаючи, наприклад, мезилатну сіль сполуки формули I) або її гідрату, коли вона об'єднана з фармацевтично прийнятною сіллю сполуки формули I (включаючи, наприклад, мезилатну сіль сполуки формули I) або її гідратом у твердій дисперсії. Таким чином, у інших аспектах запропонований спосіб мінімізації кристалізації фармацевтично прийнятної солі сполуки формули I або її гідрату у композиції, що включає додавання гідроксипропілметилцелюлози до композиції, що містить фармацевтично прийнятну сіль сполуки формули I або її гідрат для мінімізації кристалізації у порівнянні з композицією, що містить фармацевтично прийнятну сіль сполуки формули I або її гідрат, у якій гідроксипропілметилцелюлоза відсутня. У одній варіації кристалізація сполуки формули I або її гідрату у композиції мінімізована у порівнянні з композицією, що містить фармацевтично прийнятну сіль сполуки формули I або її гідрат, у якій гідроксипропілметилцелюлоза відсутня. У деяких варіаціях вищевикладених способів мінімізації кристалізації фармацевтично прийнятна сіль сполуки формули I або її гідрат являє собою біса-мезилатну сіль сполуки формули I; та у одній варіації фармацевтично прийнятна сіль сполуки формули I або її гідрат являє собою моногідрат біс-мезилатної солі сполуки формули I. У деяких варіантах реалізації кристалізацію запобігають протягом більше ніж дев'яти місяців при 40 °C/75 % RT при відкритих умовах. У деяких варіантах реалізації композиція являє собою вихідний розчин для розпилювального сушіння. У одній варіації фармацевтичної композиції біс-мезилатна сіль формули IA приготовлена для негайного вивільнення. Коли гідроксипропілметилцелюлозу звичайно застосовують у даній області для сполук з уповільненим вивільненням, було виявлено, що застосування гідроксипропілметилцелюлози у сполуках з негайним вивільненням біс-мезилатної солі формули IA збільшує біодоступність біс-мезилатної солі формули IA, введеної суб'єктові, у порівнянні зі сполукою без застосування гідроксипропілметилцелюлози. У деяких випадках було виявлено, що гідроксипропілметилцелюлоза пролонгує пересичення сполуки формули I або її фармацевтично прийнятної солі (включаючи, наприклад, моно-мезилатну або біс-мезилатну сіль). У інших випадках було виявлено, що гідроксипропілметилцелюлоза мінімізує кристалізацію сполуки формули I або її фармацевтично прийнятної солі (включаючи, наприклад, моно-мезилатну або біс-мезилатну сіль) з розчину сполуки формули I або її фармацевтично прийнятної солі (включаючи, наприклад, її моно-мезилатну або біс-мезилатну сіль). У одній варіації щонайменше один з фармацевтично прийнятних полімерів являє собою будь-який фармацевтично прийнятний полімер (a), здатний пролонгувати пересичення сполуки формули I або її фармацевтично прийнятної солі (включаючи, наприклад, моно-мезилатну або біс-мезилатну сіль); (b) здатний мінімізувати кристалізацію сполуки формули I або її фармацевтично прийнятної солі (включаючи, наприклад, моно-мезилатну або біс-мезилатну сіль) з розчину сполуки формули I або її фармацевтично прийнятної солі (включаючи, наприклад, моно-мезилатну або біс-мезилатну сіль); або як (a), так і (b). У деяких варіантах реалізації на додаток до мезилатної солі (включаючи, наприклад, бісмезилатну сіль) сполуки формули I або її гідрату та гідроксипропілметилцелюлозі, фармацевтична композиція може додатково містити один або більше додаткових фармацевтично прийнятних полімерів. Такі додаткові полімери можуть включати, наприклад, блок-співполімери та полімери природного походження. Підходящі додаткові полімери можуть, наприклад, бути обрані із групи, що складається із кросповідону, повідону, полоксамеру, мікрокристалічної целюлози та будь-яких їх комбінацій. У інших варіантах реалізації на додаток до мезилатної солі (включаючи, наприклад, бісмезилатну сіль) сполуки формули I або її гідрату, гідроксипропілметилцелюлози та одного або більше додаткових полімерів, фармацевтична композиція може додатково містити один або більше інших фармацевтично прийнятних носіїв. Такі інші носії можуть бути вибрані із групи, що складається з лактози моногідрату, манітолу, лаурилсульфату натрію, колоїдного діоксиду кремнію, стеарату магнію та будь-яких їх комбінацій. Слід розуміти, що кількість індивідуальних компонентів (наприклад, активного агенту та фармацевтично прийнятних носіїв) фармацевтичної композиції може варіюватися залежно від 21 UA 115815 C2 5 10 декількох факторів, включаючи стандартну лікарську форму (наприклад, таблетку, що включає активний агент за допомогою розпилювального сушіння та/або сухого гранулювання). Термін «% мас./мас.» у даному винаході відноситься до маси компоненту у перерахуванні на загальну масу композиції, що містить компонент. Наприклад, якщо компонент A є присутнім у кількості 50 % мас./мас. у 100 мг композиції, компонент A є присутнім у кількості 50 мг. У даному винаході форма однини означає один або більше, якщо не зазначене інше. Застосування терміну "приблизно" включає та описує величину або параметр per se. Наприклад, "приблизно x" включає та описує "x" per se. У деяких варіантах реалізації термін "приблизно" при застосуванні у сполученні з вимірюванням або використаний для зміни величини, одиниці, сталої або діапазону величин відноситься до варіації +10 %. Наприклад, "приблизно 2:8" у деяких варіантах реалізації включає 1,8-2,2:7,2-8,8. У таблиці A нижче запропонований для прикладу масовий відсоток компонентів (наприклад, активного агенту та носіїв) для застосування у складах. Таблиця A. Прикладовий масовий відсоток компонентів у складі сполуки формули I або її фармацевтично прийнятної солі Компонент у композиції Масовий відсоток компоненту у композиції Від приблизно 1 % мас./мас. до приблизно 70 % мас./мас., або від приблизно 1 % мас./мас. до приблизно 60 % мас./мас., або від приблизно 1 % мас./мас. до приблизно 50 % мас./мас., або від приблизно 1 % мас./мас. до приблизно 45 % мас./мас., або від Сполука формули I або її приблизно 5 % мас./мас. до приблизно 40 % мас./мас., або від фармацевтично прийнятна приблизно 5 % мас./мас. до приблизно 35 % мас./мас., або від сіль (наприклад, вільна приблизно 5 % мас./мас. до приблизно 25 % мас./мас., або від основа сполуки формули I приблизно 10 % мас./мас. до приблизно 20 % мас./мас., або від або моно-мезилатна сіль приблизно 30 % мас./мас. до 40 % мас./мас., або від приблизно сполуки формули I або біс35 % мас./мас. до 40 % мас./мас.; або приблизно 5 % мас./мас., мезилатна сіль сполуки приблизно 10 % мас./мас., приблизно 15 % мас./мас., приблизно формули I), або її гідрат; 20 % мас./мас., приблизно 25 % мас./мас., приблизно 30 % або поліморфна форма 3, мас./мас., приблизно 31 % мас./мас., приблизно 32 % мас./мас., поліморфна форма 7 або приблизно 33 % мас./мас., приблизно 34 % мас./мас., приблизно будь-яка їх комбінація 35 % мас./мас., приблизно 36 % мас./мас., приблизно 37 % мас./мас., приблизно 38 % мас./мас., приблизно 39 % мас./мас., приблизно 40 % мас./мас., приблизно 45 % мас./мас., приблизно 50 % мас./мас., приблизно 60 % або приблизно 70 % Від приблизно 1 % мас./мас. до приблизно 50 % мас./мас., або від приблизно 1 % мас./мас. до приблизно 45 % мас./мас., або від приблизно 5 % мас./мас. до приблизно 40 % мас./мас., або від приблизно 5 % мас./мас. до приблизно 35 % мас./мас., або від приблизно 5 % мас./мас. до приблизно 25 % мас./мас., або від приблизно 10 % мас./мас. до приблизно 20 % мас./мас.; або Інгібітор осадження приблизно 1 % мас./мас., приблизно 2 % мас./мас., приблизно 3 % (наприклад, ГПМЦ) мас./мас., приблизно 4 % мас./мас., приблизно 5 % мас./мас., приблизно 10 % мас./мас., приблизно 15 % мас./мас., приблизно 20 % мас./мас., приблизно 25 % мас./мас., приблизно 26 % мас./мас., приблизно 27 % мас./мас., приблизно 28 % мас./мас., приблизно 29 % мас./мас., приблизно 30 % мас./мас., приблизно 35 % мас./мас., приблизно 40 % мас./мас., приблизно 45 % мас./мас., або приблизно 50 % мас./мас. Від приблизно 1 % мас./мас. до приблизно 50 % мас./мас., або від приблизно 1 % мас./мас. до приблизно 45 % мас./мас., або від Розріджувач (наприклад, приблизно 5 % мас./мас. до приблизно 40 % мас./мас., або від манітол або приблизно 5 % мас./мас. до приблизно 35 % мас./мас., або від мікрокристалічна приблизно 5 % мас./мас. до приблизно 25 % мас./мас., або від целюлоза) приблизно 10 % мас./мас. до приблизно 20 % мас./мас., або від приблизно 20 % мас./мас. до приблизно 30 % мас./мас., або від приблизно 25 % мас./мас. до приблизно 30 % мас./мас., або від 22 UA 115815 C2 Таблиця A. Прикладовий масовий відсоток компонентів у складі сполуки формули I або її фармацевтично прийнятної солі Компонент у композиції Масовий відсоток компоненту у композиції приблизно 25 % мас./мас. до 35 % мас./мас., або від приблизно 25 % мас./мас. до 40 % мас./мас.; або приблизно 5 % мас./мас., приблизно 10 % мас./мас., приблизно 15 % мас./мас., приблизно 20 % мас./мас., приблизно 21 % мас./мас., приблизно 22 % мас./мас., приблизно 23 % мас./мас., приблизно 24 % мас./мас., приблизно 25 % мас./мас., приблизно 28 % мас./мас., приблизно 30 % мас./мас., приблизно 35 % мас./мас., приблизно 40 % мас./мас., приблизно 45 % мас./мас., або приблизно 50 % мас./мас. Від приблизно 1 % мас./мас. до приблизно 25 % мас./мас., або від приблизно 1 до приблизно 10 % мас./мас., або від приблизно 1 % мас./мас. до приблизно 5 % мас./мас.; або приблизно 1 % Розпушувач (наприклад, мас./мас., приблизно 2 % мас./мас., приблизно 3 % мас./мас., кросповідон) приблизно 4 % мас./мас., приблизно 5 % мас./мас., приблизно 10 % мас./мас., приблизно 15 % мас./мас., приблизно 20 % мас./мас., або приблизно 25 % мас./мас. Від приблизно 1 % мас./мас. до приблизно 25 % мас./мас., або від приблизно 1 до приблизно 10 % мас./мас., або від приблизно 1 % Поверхнево-активна мас./мас. до приблизно 5 % мас./мас.; або приблизно 1 % речовина (наприклад, мас./мас., приблизно 2 % мас./мас., приблизно 3 % мас./мас., полоксамер) приблизно 4 % мас./мас., приблизно 5 % мас./мас., приблизно 10 % мас./мас., приблизно 15 % мас./мас., приблизно 20 % мас./мас., або приблизно 25 % мас./мас. Від приблизно 0,1 % мас./мас. до приблизно 10 % мас./мас., або від приблизно 0,1 % мас./мас. до приблизно 5 % мас./мас., або від приблизно 0,5 % мас./мас. до приблизно 1 % мас./мас., або від приблизно 0,5 % до приблизно 10 %, або від 1 % мас./мас. до Речовина, що сприяє приблизно 25 % мас./мас., або від приблизно 1 до приблизно 10 % ковзанню (наприклад, мас./мас., або від приблизно 1 % мас./мас. до приблизно 5 % колоїдний діоксид кремнію) мас./мас.; або приблизно 1 % мас./мас., приблизно 1,25 % мас./мас., приблизно 1,5 % мас./мас., приблизно 2 % мас./мас., приблизно 3 % мас./мас., приблизно 4 % мас./мас., приблизно 5 % мас./мас., приблизно 10 % мас./мас., приблизно 15 % мас./мас., приблизно 20 % мас./мас., або приблизно 25 % мас./мас. Від приблизно 0,1 % мас./мас. до приблизно 10 % мас./мас., або від приблизно 0,1 % мас./мас. до приблизно 5 % мас./мас., або від приблизно 0,5 % мас./мас. до приблизно 1 % мас./мас.; або Змащуючий агент приблизно 0,1 % мас./мас., приблизно 0,5 % мас./мас., приблизно (наприклад, стеарат 0,75 % мас./мас., приблизно 1 % мас./мас., приблизно 1,25 % магнію) мас./мас., приблизно 1,5 % мас./мас., приблизно 2 % мас./мас., приблизно 3 % мас./мас., приблизно 4 % мас./мас., або приблизно 5 % мас./мас. 5 10 Слід розуміти, що компоненти у запропонованих фармацевтичних композиціях можуть бути у кількостях, які обумовлюють одну або більше корисних властивостей, як описано у даному описі. У одній варіації кількості описані у таблиці A. Таким чином, описані фармацевтичні композиції можуть містити компоненти складу у масових співвідношеннях, детально описаних у даному винаході, також як якщо будь-яка та кожна комбінація компоненту та масовий відсоток були конкретно та індивідуально перераховані. Наприклад, у деяких варіаціях фармацевтична композиція містить від приблизно 30 % мас./мас. до приблизно 45 % мас./мас. фармацевтично прийнятної солі (включаючи, наприклад, мезилатну сіль) сполуки формули I або її гідрату, від приблизно 8 % мас./мас. до 13 % мас./мас. одного або більше розпушувачів, приблизно 3 % мас./мас. однієї або більше поверхневоактивних речовин; та від приблизно 19 % мас./мас. до 28 % мас./мас. одного або більше розріджувачів. У інших варіаціях фармацевтична композиція містить від приблизно 30 % 23 UA 115815 C2 5 10 15 20 25 30 35 40 45 50 55 60 мас./мас. до приблизно 45 % мас./мас. мезилатної солі (включаючи, наприклад, мономезилатну або біс-мезилатну сіль) сполуки формули I, від приблизно 8 % мас./мас. до 13 % мас./мас. одного або більше розпушувачів, приблизно 3 % мас./мас. однієї або більше поверхнево-активних речовин; та від приблизно 19 % мас./мас. до 28 % мас./мас. одного або більше розріджувачів. У деяких варіаціях фармацевтична композиція містить від приблизно 30 % мас./мас. до приблизно 45 % мас./мас. фармацевтично прийнятної солі (включаючи, наприклад, мезилатну сіль) сполуки формули I або її гідрату, від приблизно 10 % мас./мас. до 30 % мас./мас. гідроксипропілметилцелюлози та від приблизно 20 % мас./мас. до приблизно 30 % мас./мас. манітолу. У інших варіаціях фармацевтична композиція містить від приблизно 30 % мас./мас. до приблизно 45 % мас./мас. форми 3 (яка являє собою поліморф моногідрату біс-мезилатної солі формули IA), від приблизно 10 % мас./мас. до 30 % мас./мас. гідроксипропілметилцелюлози та від приблизно 20 % мас./мас. до приблизно 30 % мас./мас. манітолу. У інших варіаціях фармацевтична композиція містить від приблизно 30 % мас./мас. до приблизно 45 % мас./мас. фармацевтично прийнятної солі (включаючи, наприклад, мезилатну сіль) сполуки формули I або її гідрату, від приблизно 10 % мас./мас. до 30 % мас./мас. гідроксипропілметилцелюлози та від приблизно 5 % мас./мас. до приблизно 15 % мас./мас. кросповідону. У іншій варіації фармацевтична композиція містить від приблизно 30 % мас./мас. до приблизно 45 % мас./мас. форми 3 (яка являє собою поліморф моногідрату біс-мезилатної солі формули IA), від приблизно 10 % мас./мас. до 30 % мас./мас. гідроксипропілметилцелюлози та від приблизно 5 % мас./мас. до приблизно 15 % мас./мас. кросповідону. У інших варіаціях фармацевтична композиція містить від приблизно 30 % мас./мас. до приблизно 45 % мас./мас. фармацевтично прийнятної солі (включаючи, наприклад, мезилатну сіль) сполуки формули I або її гідрату, від приблизно 10 % мас./мас. до 30 % мас./мас. гідроксипропілметилцелюлози та від приблизно 1 % мас./мас. до приблизно 5 % мас./мас. полоксамеру. У іншій варіації фармацевтична композиція містить від приблизно 30 % мас./мас. до приблизно 45 % мас./мас. форми 3 (яка являє собою поліморф моногідрату біс-мезилатної солі формули IA), від приблизно 10 % мас./мас. до 30 % мас./мас. гідроксипропілметилцелюлози та від приблизно 1 % мас./мас. до приблизно 5 % мас./мас. полоксамеру. У інших варіаціях фармацевтична композиція містить від приблизно 30 % мас./мас. до приблизно 45 % мас./мас. фармацевтично прийнятної солі (включаючи, наприклад, мезилатну сіль) сполуки формули I або її гідрату, від приблизно 10 % мас./мас. до 30 % мас./мас. гідроксипропілметилцелюлози та від приблизно 0,1 % мас./мас. до приблизно 2 % мас./мас. колоїдного діоксиду кремнію. У іншій варіації фармацевтична композиція містить від приблизно 30 % мас./мас. до приблизно 45 % мас./мас. форми 3 (яка являє собою поліморф моногідрату біс-мезилатної солі формули IA), від приблизно 10 % мас./мас. до 30 % мас./мас. гідроксипропілметилцелюлози та від приблизно 0,1 % мас./мас. до приблизно 2 % мас./мас. колоїдного діоксиду кремнію. У інших варіаціях фармацевтична композиція містить від приблизно 30 % мас./мас. до приблизно 45 % мас./мас. фармацевтично прийнятної солі (включаючи, наприклад, мезилатну сіль) сполуки формули I або її гідрату, від приблизно 10 % мас./мас. до 30 % мас./мас. гідроксипропілметилцелюлози та від приблизно 1 % мас./мас. до приблизно 5 % мас./мас. мікрокристалічної целюлози. У іншій варіації фармацевтична композиція містить від приблизно 30 % мас./мас. до приблизно 45 % мас./мас. форми 3 (яка являє собою поліморф моногідрату біс-мезилатної солі формули IA), від приблизно 10 % мас./мас. до 30 % мас./мас. гідроксипропілметилцелюлози та від приблизно 1 % мас./мас. до приблизно 5 % мас./мас. мікрокристалічної целюлози. У інших варіаціях фармацевтична композиція містить від приблизно 30 % мас./мас. до приблизно 45 % мас./мас. фармацевтично прийнятної солі (включаючи, наприклад, мезилатну сіль) сполуки формули I або її гідрату, від приблизно 10 % мас./мас. до 30 % мас./мас. гідроксипропілметилцелюлози та від приблизно 0,5 % мас./мас. до приблизно 2 % мас./мас. стеарату магнію. У іншій варіації фармацевтична композиція містить від приблизно 30 % мас./мас. до приблизно 45 % мас./мас. форми 3 (яка являє собою поліморф моногідрату бісмезилатної солі формули IA), від приблизно 10 % мас./мас. до 30 % мас./мас. гідроксипропілметилцелюлози та від приблизно 0,5 % мас./мас. до приблизно 2 % мас./мас. стеарату магнію. У інших варіаціях фармацевтична композиція містить від приблизно 30 % мас./мас. до приблизно 45 % мас./мас. фармацевтично прийнятної солі (включаючи, наприклад, мезилатну 24 UA 115815 C2 5 10 15 20 25 30 35 40 45 50 55 60 сіль) сполуки формули I або її гідрату, від приблизно 10 % мас./мас. до 30 % мас./мас. гідроксипропілметилцелюлози, від приблизно 20 % мас./мас. до приблизно 30 % мас./мас. манітолу та від приблизно 5 % мас./мас. до приблизно 15 % мас./мас. кросповідону. У ще одній варіації фармацевтична композиція містить від приблизно 30 % мас./мас. до приблизно 45 % мас./мас. форми 3 (яка являє собою поліморф моногідрату біс-мезилатної солі формули IA), від приблизно 10 % мас./мас. до 30 % мас./мас. гідроксипропілметилцелюлози, від приблизно 20 % мас./мас. до приблизно 30 % мас./мас. манітолу та від приблизно 5 % мас./мас. до приблизно 15 % мас./мас. кросповідону. У інших варіаціях фармацевтична композиція містить від приблизно 30 % мас./мас. до приблизно 45 % мас./мас. фармацевтично прийнятної солі (включаючи, наприклад, мезилатну сіль) сполуки формули I або її гідрату, від приблизно 10 % мас./мас. до 30 % мас./мас. гідроксипропілметилцелюлози, від приблизно 20 % мас./мас. до приблизно 30 % мас./мас. манітолу, від приблизно 5 % мас./мас. до приблизно 15 % мас./мас. кросповідону та від приблизно 0,1 % мас./мас. до приблизно 2 % мас./мас. колоїдного діоксиду кремнію. У ще одній варіації фармацевтична композиція містить від приблизно 30 % мас./мас. до приблизно 45 % мас./мас. форми 3 (яка являє собою поліморф моногідрату біс-мезилатної солі формули IA), від приблизно 10 % мас./мас. до 30 % мас./мас. гідроксипропілметилцелюлози, від приблизно 20 % мас./мас. до приблизно 30 % мас./мас. манітолу, від приблизно 5 % мас./мас. до приблизно 15 % мас./мас. кросповідону та від приблизно 0,1 % мас./мас. до приблизно 2 % мас./мас. колоїдного діоксиду кремнію. У ще одній варіації фармацевтична композиція містить від приблизно 30 % мас./мас. до приблизно 45 % мас./мас. фармацевтично прийнятної солі (включаючи, наприклад, мезилатну сіль) сполуки формули I або її гідрату, від приблизно 10 % мас./мас. до 30 % мас./мас. гідроксипропілметилцелюлози, від приблизно 20 % мас./мас. до приблизно 30 % мас./мас. манітолу, від приблизно 5 % мас./мас. до приблизно 15 % мас./мас. кросповідону, від приблизно 0,1 % мас./мас. до приблизно 2 % мас./мас. колоїдного діоксиду кремнію та від приблизно 1 % мас./мас. до приблизно 5 % мас./мас. мікрокристалічної целюлози. У ще одній варіації фармацевтична композиція містить від приблизно 30 % мас./мас. до приблизно 45 % мас./мас. форми 3 (яка являє собою поліморф моногідрату біс-мезилатної солі формули IA), від приблизно 10 % мас./мас. до 30 % мас./мас. гідроксипропілметилцелюлози, від приблизно 20 % мас./мас. до приблизно 30 % мас./мас. манітолу, від приблизно 5 % мас./мас. до приблизно 15 % мас./мас. кросповідону, від приблизно 0,1 % мас./мас. до приблизно 2 % мас./мас. колоїдного діоксиду кремнію та від приблизно 1 % мас./мас. до приблизно 5 % мас./мас. мікрокристалічної целюлози. У інших варіаціях фармацевтична композиція містить від приблизно 30 % мас./мас. до приблизно 45 % мас./мас. фармацевтично прийнятної солі (включаючи, наприклад, мезилатну сіль) сполуки формули I або її гідрату, від приблизно 10 % мас./мас. до 30 % мас./мас. гідроксипропілметилцелюлози, манітолу, від приблизно 5 % мас./мас. до приблизно 15 % мас./мас. кросповідону, від приблизно 0,1 % мас./мас. до приблизно 2 % мас./мас. колоїдного діоксиду кремнію, від приблизно 1 % мас./мас. до приблизно 5 % мас./мас. мікрокристалічної целюлози та від приблизно 0,5 % мас./мас. до приблизно 2 % мас./мас. стеарату магнію. У ще одній варіації фармацевтична композиція містить від приблизно 30 % мас./мас. до приблизно 45 % мас./мас. форми 3 (яка являє собою поліморф моногідрату біс-мезилатної солі формули IA), від приблизно 10 % мас./мас. до 30 % мас./мас. гідроксипропілметилцелюлози, манітолу, від приблизно 5 % мас./мас. до приблизно 15 % мас./мас. кросповідону, від приблизно 0,1 % мас./мас. до приблизно 2 % мас./мас. колоїдного діоксиду кремнію, від приблизно 1 % мас./мас. до приблизно 5 % мас./мас. мікрокристалічної целюлози та від приблизно 0,5 % мас./мас. до приблизно 2 % мас./мас. стеарату магнію. У конкретних варіаціях будь-якої з приведених вище фармацевтичних композицій мезилатна сіль або її гідрат містить катіон сполуки формули I та мезилатний аніон, причому мезилатний аніон та катіон сполуки формули I присутні у молярному співвідношенні мезилатного аніону до катіону сполуки формули I: (i) щонайменше 1: 1, або від 1: 1 до 3,3: 1, від 1,9: 1 до 3,3: 1, від 1,9: 1 до 2,5: 1, від 1,9: 1 до 2,4: 1, від 2: 1 до 3,3: 1, від 2: 1 до 3: 1, або від 2: 1 до 2,7: 1, або від 2,1: 1 до 2,5: 1, або від 2,2: 1 до 2,4: 1, або приблизно 2,3: 1, або приблизно 2,4: 1; або (ii) більше ніж 1: 1 та менше ніж 2: 1; або (iii) більше ніж 2: 1. У інших варіаціях будь-якої з приведених вище фармацевтичних композицій мезилатна сіль являє собою біс-мезилатну сіль сполуки формули I або її гідрат. У одній варіації мезилатна сіль являє собою моногідрат біс-мезилатної солі сполуки формули I. Також слід розуміти, що у будь 25 UA 115815 C2 5 10 15 20 25 30 35 40 45 50 якій з приведених вище фармацевтичних композицій біс-мезилатна сіль може бути представлена формулою IA, IB, IC, ID або IE, як описано вище. Таблетки Фармацевтичні композиції, запропоновані у даному описі, звичайно вводять перорально. Введення можна здійснювати за допомогою капсули, таблетки або подібних. У конкретних варіантах реалізації композиція, представлена у даному винаході, являє собою таблетку. Сухе гранулювання У деяких варіантах реалізації композиція являє собою таблетку, отриману зі складу, отриманого сухим гранулюванням (наприклад, таблетку, отриману шляхом приготування сполуки формули I або фармацевтично прийнятної солі або її гідрату у формі грануляту). У даному винаході "склад, отриманий сухим гранулюванням" відноситься до складу, отриманого шляхом способу сухого гранулювання. Сухе гранулювання (що також називається сухою грануляцією) в цілому відноситься до способу формування гранул без застосування рідкого розчину. "Гранулят" відноситься до продукту, отриманого шляхом сухого гранулювання. У одній варіації запропонована таблетка, отримана сухим гранулюванням. Таблетка, отримана шляхом сухого гранулювання та пресування у даному винаході називається "таблетка, отримана сухим гранулюванням". У деяких варіаціях таблетку отримують шляхом сухого гранулювання біс-мезилатної солі сполуки формули I або її гідрату з одержанням грануляту; та пресування грануляту. У конкретних варіаціях таблетку отримують шляхом сухого гранулювання моногідрату бісмезилатної солі сполуки формули I з одержанням грануляту; та пресування грануляту. У одній варіації таблетку отримують шляхом сухого гранулювання поліморфної форми 3, яка являє собою поліморф моногідрату біс-мезилатної солі сполуки формули I з одержанням грануляту; та пресування грануляту. У деяких аспектах у даному винаході запропонована таблетка, яка містить: (i) біс-мезилатну сіль сполуки формули I: (I), або її гідрат та (ii) щонайменше один фармацевтично прийнятний носій. У конкретних аспектах у даному винаході запропонована таблетка, яка містить: (i) форму 3, яка являє собою поліморф моногідрату біс-мезилатної солі сполуки формули I; та (ii) щонайменше один фармацевтично прийнятний носій. У одній варіації поліморф моногідрату біс-мезилатної солі сполуки формули I (наприклад, форма 3) характеризується або має рентгенівську дифрактограму, яка містить 2θ-відбиття (+0,2°) при 13,8, 16,9, 22,9 та 26,1. У іншій варіації поліморф моногідрату біс-мезилатної солі сполуки формули I характеризується або має рентгенівську дифрактограму, яка містить 2θвідбиття (+0,2°) при 7,7, 12,9, 17,7 та 18,1. У інших варіаціях поліморф моногідрату бісмезилатної солі сполуки формули I характеризується або має рентгенівську дифрактограму, яка містить 2θ-відбиття (+0,2°) при 7,7, 12,9, 13,8, 16,9, 17,7, 18,1, 22,9 та 26,1. У інших варіаціях поліморф моногідрату біс-мезилатної солі сполуки формули I характеризується або має рентгенівську дифрактограму, яка містить щонайменше три або більше; щонайменше чотири або більше; або щонайменше п'ять або більше 2θ-відбиттів (+0,2 градуса): 7,7, 12,9, 13,8, 16,9, 17,7, 18,1, 22,9 та 26,1. При описі 2θ-відбиттів на рентгенівській дифрактограмі (наприклад, поліморфної форми 3, що також називається у даному винаході як "форма 3" або "форма III"), слід розуміти, що +0,2° також може бути виражене як "плюс або мінус 0,2 градуса 2θ». У одній варіації поліморф моногідрату біс-мезилатної солі сполуки формули I (наприклад, форма 3) характеризується або має рентгенівську дифрактограму по суті як показано на ФІГ. 1A. У іншій варіації поліморф моногідрату біс-мезилатної солі сполуки формули I (наприклад, форма 3) характеризується або має рентгенівську дифрактограму по суті як показано на ФІГ. 1B. У ще одній варіації поліморф моногідрату біс-мезилатної солі сполуки формули I (наприклад, форма 3) характеризується елементарною коміркою, як визначено за допомогою рентгеноструктурної кристалографії кристалу, що має наступні розміри: a=8,7831(6) Å; 26 UA 115815 C2 5 10 15 20 25 30 35 40 45 50 55 60 b=11,8484(8) Å; c=14,2485(10) Å; α = 98,108(6)°; β = 100,955(6)°; та γ = 98,861(6)°. У конкретних варіантах реалізації таблетки щонайменше один фармацевтично прийнятний носій являє собою інгібітор осадження. У одній варіації інгібітор осадження являє собою гідроксипропілметилцелюлозу (ГПМЦ). У іншій варіації інгібітор осадження являє собою коповідон. У інших варіантах реалізації таблетка додатково містить щонайменше один розріджувач, зв'язуючий агент, розпушувач, поверхнево-активну речовину, речовину, що сприяє ковзанню, або змащуючий агент або будь-які їх комбінації. Наприклад, будь-які підходящі розріджувачі, зв'язуючі агенти, розпушувачі, поверхнево-активні речовини, ковзкі агенти або змащуючі агенти, описані у даному винаході, можуть бути присутніми у таблетці. У конкретних варіаціях таблетка містить щонайменше один розріджувач. У одній варіації розріджувач являє собою манітол. У інших варіаціях таблетка додатково містить будь-який один або більше з кросповідону, полоксамеру, колоїдного діоксиду кремнію, стеарату магнію та мікрокристалічної целюлози. Таким чином, у деяких варіаціях таблетка містить (i) біс-мезилатну сіль сполуки формули I або її гідрат та (ii) гідроксипропілметилцелюлозу. У конкретних варіаціях таблетка містить (i) моногідрат біс-мезилатної солі сполуки формули I та (ii) гідроксипропілметилцелюлозу. У одній варіації таблетка містить (i) поліморфну форму 3, яка являє собою поліморф моногідрату бісмезилатної солі сполуки формули I та (ii) гідроксипропілметилцелюлозу. У інших варіаціях таблетка містить (i) біс-мезилатну сіль сполуки формули I або її гідрат, (ii) гідроксипропілметилцелюлозу; та (iii) манітол. У конкретних варіаціях таблетка містить (i) моногідрат біс-мезилатної солі сполуки формули I, (ii) гідроксипропілметилцелюлозу; та (iii) манітол. У одній варіації таблетка містить (i) поліморфну форму 3, яка являє собою поліморф моногідрату біс-мезилатної солі сполуки формули I, (ii) гідроксипропілметилцелюлозу; та (iii) манітол. У інших варіаціях таблетка містить (i) біс-мезилатну сіль сполуки формули I або її гідрат, (ii) гідроксипропілметилцелюлозу; (iii) манітол та (iv) один або більше, два або більше, три або більше, чотири або більше або п'ять з кросповідону, полоксамеру, колоїдного діоксиду кремнію, стеарату магнію та мікрокристалічної целюлози. У конкретних варіаціях таблетка містить (i) моногідрат біс-мезилатної солі сполуки формули I, (ii) гідроксипропілметилцелюлозу; (iii) манітол та (iv) один або більше, два або більше, три або більше, чотири або більше або п'ять з кросповідону, полоксамеру, колоїдного діоксиду кремнію, стеарату магнію та мікрокристалічної целюлози. У одній варіації таблетка містить (i) форму 3, яка являє собою поліморф моногідрату біс-мезилатної солі сполуки формули I, (ii) гідроксипропілметилцелюлозу; (iii) манітол та (iv) один або більше, два або більше, три або більше, чотири або більше або п'ять з кросповідону, полоксамеру, колоїдного діоксиду кремнію, стеарату магнію та мікрокристалічної целюлози. Спеціалісту у даній галузі буде також зрозуміло, що кількості компонентів, використовуваних у складі, можуть варіюватися в залежності від використовуваного способу та методики. У конкретних варіаціях фармацевтична композиція являє собою таблетку (наприклад, таблетку, отриману шляхом приготування сполуки формули I або її фармацевтично прийнятної солі або гідрату у формі грануляту), яка містить моно-мезилатну або біс-мезилатну сіль сполуки формули I або її гідрат та щонайменше один інгібітор осадження. У одній варіації інгібітор осадження являє собою гідроксипропілметилцелюлозу. У іншій варіації фармацевтична композиція являє собою таблетку (наприклад, таблетку, отриману шляхом приготування сполуки формули I або її фармацевтично прийнятної солі або гідрату у формі грануляту), яка містить моно-мезилатну або біс-мезилатну сіль сполуки формули I або її гідрат, яка містить щонайменше один інгібітор осадження та щонайменше один розріджувач. У іншій варіації фармацевтична композиція являє собою таблетку (наприклад, таблетку, отриману шляхом приготування сполуки формули I або її фармацевтично прийнятної солі або гідрату у формі грануляту), яка містить моно-мезилатну або біс-мезилатну сіль сполуки формули I або її гідрат, щонайменше один інгібітор осадження та щонайменше один розпушувач. У іншій варіації фармацевтична композиція являє собою таблетку (наприклад, таблетку, отриману шляхом приготування сполуки формули I або її фармацевтично прийнятної солі або гідрату у формі грануляту), яка містить моно-мезилатну або біс-мезилатну сіль сполуки формули I або її гідрат, щонайменше один інгібітор осадження та щонайменше одну поверхнево-активну речовину. У іншій варіації фармацевтична композиція являє собою таблетку (наприклад, таблетку, отриману шляхом приготування сполуки формули I або її фармацевтично прийнятної солі або гідрату у формі грануляту), яка містить моно-мезилатну або біс-мезилатну сіль сполуки 27 UA 115815 C2 5 10 15 20 25 30 35 40 45 50 55 60 формули I або її гідрат, щонайменше один інгібітор осадження та щонайменше одну речовину, що сприяє ковзанню. У іншій варіації фармацевтична композиція являє собою таблетку (наприклад, таблетку, отриману шляхом приготування сполуки формули I або її фармацевтично прийнятної солі або гідрату у формі грануляту), яка містить моно-мезилатну або біс-мезилатну сіль сполуки формули I або її гідрат, щонайменше один інгібітор осадження та щонайменше один змащуючий агент. У іншій варіації фармацевтична композиція являє собою таблетку (наприклад, таблетку, отриману шляхом приготування сполуки формули I або її фармацевтично прийнятної солі або гідрату у формі грануляту), яка містить моно-мезилатну або біс-мезилатну сіль сполуки формули I або її гідрат, щонайменше один інгібітор осадження, щонайменше один розріджувач та щонайменше поверхнево-активну речовину. У будь-якому з описаних вище варіантів реалізації таблетки, отриманої шляхом приготування сполуки формули I або її фармацевтично прийнятної солі або гідрату у формі грануляту, біс-мезилатна сіль сполуки формули I або її гідрат являє собою гідрат біс-мезилатної солі сполуки формули I. У одній варіації біс-мезилатна сіль сполуки формули I або її гідрат являє собою моногідрат біс-мезилатної солі сполуки формули I. У інших варіаціях фармацевтична композиція являє собою таблетку (наприклад, таблетку, отриману шляхом приготування сполуки формули I або її фармацевтично прийнятної солі або гідрату у формі грануляту), яка містить поліморфну форму 3, щонайменше один інгібітор осадження, щонайменше один розріджувач та щонайменше одну поверхнево-активну речовину. У інших варіаціях фармацевтична композиція являє собою таблетку (наприклад, таблетку, отриману шляхом приготування сполуки формули I або її фармацевтично прийнятної солі або гідрату у формі грануляту), яка містить форму 3, гідроксипропілметилцелюлозу та манітол. У іншій варіації фармацевтична композиція являє собою таблетку (наприклад, таблетку, отриману шляхом приготування сполуки формули I або її фармацевтично прийнятної солі або гідрату у формі грануляту), яка містить форму 3, гідроксипропілметилцелюлозу та кросповідон. У іншій варіації фармацевтична композиція являє собою таблетку (наприклад, таблетку, отриману шляхом приготування сполуки формули I або її фармацевтично прийнятної солі або гідрату у формі грануляту), яка містить форму 3, гідроксипропілметилцелюлозу та полоксамер. У іншій варіації фармацевтична композиція являє собою таблетку (наприклад, таблетку, отриману шляхом приготування сполуки формули I або її фармацевтично прийнятної солі або гідрату у формі грануляту), яка містить форму 3, гідроксипропілметилцелюлозу та колоїдний діоксид кремнію. У іншій варіації фармацевтична композиція являє собою таблетку (наприклад, таблетку, отриману шляхом приготування сполуки формули I або її фармацевтично прийнятної солі або гідрату у формі грануляту), яка містить форму 3, гідроксипропілметилцелюлозу та мікрокристалічну целюлозу. У іншій варіації фармацевтична композиція являє собою таблетку (наприклад, таблетку, отриману шляхом приготування сполуки формули I або її фармацевтично прийнятної солі або гідрату у формі грануляту), яка містить форму 3, гідроксипропілметилцелюлозу та стеарат магнію. У ще одній варіації фармацевтична композиція являє собою таблетку (наприклад, таблетку, отриману шляхом приготування сполуки формули I або її фармацевтично прийнятної солі або гідрату у формі грануляту), яка містить форму 3, гідроксипропілметилцелюлозу, манітол та кросповідон. У ще одній варіації фармацевтична композиція являє собою таблетку (наприклад, таблетку, отриману шляхом приготування сполуки формули I або її фармацевтично прийнятної солі або гідрату у формі грануляту), яка містить форму 3, гідроксипропілметилцелюлозу, манітол, кросповідон та колоїдний діоксид кремнію. У ще одній варіації фармацевтична композиція являє собою таблетку (наприклад, таблетку, отриману шляхом приготування сполуки формули I або її фармацевтично прийнятної солі або гідрату у формі грануляту), яка містить форму 3, гідроксипропілметилцелюлозу, манітол, кросповідон, колоїдний діоксид кремнію та мікрокристалічну целюлозу. У ще одній варіації фармацевтична композиція являє собою таблетку (наприклад, таблетку, отриману шляхом приготування сполуки формули I або її фармацевтично прийнятної солі або гідрату у формі грануляту), яка містить форму 3, гідроксипропілметилцелюлозу, манітол, кросповідон, колоїдний діоксид кремнію, мікрокристалічну целюлозу та стеарат магнію. У конкретних варіаціях фармацевтична композиція являє собою таблетку (наприклад, таблетку, отриману шляхом приготування сполуки формули I або її фармацевтично прийнятної 28
ДивитисяДодаткова інформація
Автори англійськоюLi, Bei, Sperger, Diana, Stefanidis, Dimitrios, Casteel, Melissa, Jean, Pakdaman, Rowchanak
Автори російськоюЛи Бэй, Спэрджэр Даяна, Стефанидис Димитриос, Кастил Мелисса Жан, Пакдаман Ровчанак
МПК / Мітки
МПК: A61K 31/5377
Мітки: інгібіторів, склад, основі
Код посилання
<a href="https://ua.patents.su/98-115815-sklad-na-osnovi-ingibitoriv-syk.html" target="_blank" rel="follow" title="База патентів України">Склад на основі інгібіторів syk</a>
Попередній патент: Спосіб синтезу тонкошарових електродів на основі сульфідів кобальту та заліза з підшаром нікель-графітового композита для літієвих джерел струму
Наступний патент: Система конденсації пари для грануляційної установки
Випадковий патент: Горілка особлива "золото полуботка"