Похідні хіноліну, ізохіноліну та фталазину як антагоністи гормону, що вивільнює гонадотропін
Номер патенту: 73409
Опубліковано: 15.07.2005
Автори: Шмеес Норберт, Полімеропоулос Еммануель, Дроешхер Петер, Буехманн Ульрік, Штрехлке Петер, Куехне Роланд, Тер Лаак Антоніус Марінус, Гесс-Штумпп Хольгер, Мухн Петер, Гюентер Екхард
Формула / Реферат
1. Сполука загальної формули (1)
 , (1)
, (1)
у якій
R1 (а) являє собою ацильну групу -CO-R11 або CN, де R11 являє собою насичений, ненасичений, циклічний та/або (гетеро)ароматичний органічний радикал, лінійний або розгалужений алкільний ланцюг, що має 1-10 С-атомів, або фенільну, фуранову або тіофенову групу, необов'язково заміщену алкільними групами або атомами галогену,
(б) являє собою групу естеру карбонової кислоти -CO-OR12 або групу аміду карбонової кислоти -CO-NR12R13 або групу -SOx-R12, у якій х = 0, 1 або 2 або -SО2-NR12R13, де R12 являє собою насичений, ненасичений, циклічний та/або (гетеро)ароматичний органічний радикал, лінійний або розгалужений алкільний ланцюг, що має 1-10 С-атомів, або аралкільну групу, що має 7-20 С-атомів, причому арильний радикал може бути необов'язково заміщений алкільними групами або атомами галогену, або фенільний радикал необов'язково заміщений алкільними групами або атомами галогену, і R13 може являти собою атом водню або лінійний або розгалужений алкільний ланцюг, що має 1-10 С-атомів,
або
(в) являє собою групу -A-NR14-CO-NR15R16, у якій А являє собою алкіленову групу, що має 1-4 С-атомів, необов'язково заміщену С1-С6-алкільною групою, карбонільну групу, атом кисню або групу -SОх-, де х = 0, 1 або 2, R14 та R15 у кожному випадку незалежно один від одного являють собою атом водню або лінійний або розгалужений алкільний ланцюг, що має 1-10 С-атомів, і R16 являє собою лінійний або розгалужений алкільний ланцюг, що має 1-10 С-атомів, циклоалкільну групу, що має 3-10 С-атомів, циклоалкілалкільну групу, що має 7-20 С-атомів, аралкільну групу, що має 7-20 С-атомів, причому арильний радикал необов'язково може бути заміщеним алкільними групами або атомами галогену, фенільну групу необов'язково заміщену алкільними групами або атомами галогену, або гетероциклічне кільце необов'язково заміщене алкільними групами або атомами галогену,
R2 являє собою групу -CH(R21)R22, причому R21 являє собою атом водню, С1-С10-алкільну групу або необов'язково заміщене фенільне кільце, і R22 являє собою необов'язково заміщене фенільне кільце або нафтильне кільце, або групу -CH2CH(R23)R24, де R23 та R24 являють собою необов'язково заміщене фенільне кільце,
R3 та R4 у кожному випадку незалежно один від одного являють собою атом водню або алкільну групу, що має 1-10 С-атомів, і R3 також може бути атомом галогену,
R5 являє собою групу, зв'язану через радикал Z,
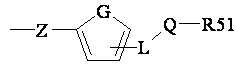 ,
,
у якій G являє собою -C=C-, -C=N-, -N=C-, атом кисню або сірки, Z являє собою прямий зв'язок, атом кисню або сірки, групу CH-R52 або –CHR52-CH-R53-, де R52 та R53 незалежно один від одного являють собою атом водню або алкільну групу, потрійний зв'язок -С≡С- або групу –CR52=CR53- або C=CR52R53, що має Е- або Z-конфігурацію, причому R52 та R53 незалежно один від одного являють собою атом водню або алкільну групу, L являє собою СН2 або NH групу, Q являє собою карбонільну групу або -SOx групу, де х = 0, 1 або 2, і R51 являє собою аміногрупу необов'язково заміщену алкільною групою, або лінійну або розгалужену алкільну групу необов'язково заміщену атомами галогену, гідроксильними або алкоксильними групами або циклоалкільну групу, що має 3-7 кільцевих члени, необов’язково заміщену атомами галогену, гідроксильними або алкоксильними групами,
R6 є групою СН2-N(R61)R62, причому R61 у кожному випадку незалежно являє собою атом водню або алкільну групу, і R62 являє собою алкільну групу або необов'язково заміщену аралкільну групу або гетероарилалкільну групу, що має 7-20 С-атомів, і
![]() являє собою групу
являє собою групу
 ,
,  або
або 
у будь-якій орієнтації, а також стереоізомер будь-якої з зазначених структур, та її солі з фізіологічно прийнятною кислотою або основою.
2. Сполука за п. 1, яка відрізняється тим, що
![]() являє собою групу
являє собою групу  або
або  .
.
3. Сполука за п. 1 або 2, яка відрізняється тим, що R1 являє собою групу -СО-R11.
4. Сполука за п. 3, яка відрізняється тим, що R11 являє собою метил, етил, і-пропіл, феніл, 2-тієніл або 2-фурил.
5. Сполука за п. 1 або 2, яка відрізняється тим, що R1 являє собою групу -СО-OR12.
6. Сполука за п. 5, яка відрізняється тим, що R12 являє собою метил, етил або і-пропіл.
7. Сполука за будь-яким з пп. 1 - 6, яка відрізняється тим, що R2 являє собою 2',5'-дифторбензильну групу.
8. Сполука за будь-яким з пп. 1 - 7, яка відрізняється тим, що R3 та R4 являють собою атоми водню.
9. Сполука за будь-яким з пп. 1 - 8, яка відрізняється тим, що Z являє собою прямий зв'язок або атом кисню.
10. Сполука за будь-яким з пп. 1 - 9, яка відрізняється тим, що G являє собою -С=С-.
11. Сполука за будь-яким з пп. 1 - 10, яка відрізняється тим, що L являє собою NH групу.
12. Сполука за будь-яким з пп. 1 - 11, яка відрізняється тим, що Q являє собою карбонільну групу, і R51 являє собою С1-С6-алкільну групу.
13. Сполука за будь-яким з пп. 1 - 12, яка відрізняється тим, що R61 являє собою атом водню або метильну групу або/та R62 являє собою бензильну групу.
14. Застосування сполук за будь-яким з пп. 1 - 13 як антагоністів гормону, що вивільнює гонадотропін (GnRH).
15. Застосування за п. 14 для контролю чоловічої фертильності, для гормональної терапії, для лікування жіночої субфертильності та безпліддя, для попередження вагітності у жінок та для боротьби з пухлинами.
16. Спосіб одержання сполуки загальної формули (1) при якому здійснюють
(а) реакцію сполуки загальної формули (2)
 , (2)
, (2)
у якій R7 являє собою відхідну групу, а всі інші радикали мають значення вказані для сполуки (1),
зі сполукою загальної формули (3)
R8-N(R61)R62 , (3)
у якій R8 являє собою атом водню або атом металу, і R61 та R62 мають значення вказані для сполуки (1); або
(б) реакцію сполуки загальної формули (4)
 , (4)
, (4)
у якій R9 являє собою групу -OSО2CnF2n+1, де n означає числа 1 або 2, атом галогену, або іншу відхідну групу, а всі інші радикали мають значення вказані для сполуки (1),
зі сполукою загальної формули (5)
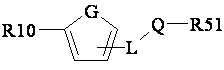 , (5)
, (5)
у якій R10 являє собою групу, що містить метал або неметал, гідрокси- або меркапто-групу необов'язково перетворену на сіль металу, групу -C≡C-R31 або групу -CR52=CR53R31 або -CR31=CR52R53, що має Е- або Z-конфігурацію, де R31 являє собою групу, що містить метал або неметал, а всі інші радикали мають значення вказані для сполуки (1), з застосуванням або без застосування каталізатора; або
(в) якщо Y у сполуці (1) являє собою атом азоту - здійснюють реакцію сполуки загальної формули (6)
 , (6)
, (6)
у якій R32 являє собою атом водню або атом металу, а всі інші радикали мають значення вказані для сполуки (1),
зі сполукою загальної формули (7)
R33-R2 , (7)
у якій R33 являє собою відхідну групу, а R2 має значення вказане для сполуки (1), або
(г) якщо W у сполуці (1) являє собою атом азоту - здійснюють реакцію сполуки загальної формули (8)
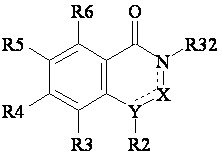 , (8)
, (8)
у якій R32 являє собою атом водню або атом металу, а всі інші радикали мають значення вказані для сполуки (1),
зі сполукою загальної формули (9)
R33-R1 , (9)
у якій R33 являє собою відхідну групу, а R1 має значення вказане для сполуки (1).
Текст
Гормон, що вивільнює гонадотропін (GnRH), є гормоном, який переважно, але не виключно, синтезується нервовими клітинами гіпоталамуса ссавців, через ворітну вену переноситься до гіпофізу і регульовано подається до гонадотропних клітин. Через взаємодію з рецептором, що має 7 трансмембранних доменів GnRH стимулює вироблення та вивільнення гонадотропних гормонів за допомогою вторинного посередника інозит-1,4,5-трифосфату та іонів Са2+. Вивільнюваний завдяки GnRH гонадотропін-лютеїнізуючий гормон (LH) та фолікулостимулюючий гормон (FSH) стимулюють вироблення статевих стероїдів та визрівання зародкових клітин у обох статей. Додатково до GnRH (описаного також як GnRH1) існують дві інші форми GnRH, а саме GnRH2 та 3. GnRH-рецептор застосовують як фармакологічний об'єкт при низці захворювань, які залежать від функціонального вироблення статевого гормону, таких як, наприклад, рак передміхурової залози, передклімактеричний рак молочної залози, ендометріоз та фіброїди матки. При цих захворюваннях успішно застосовують GnRH-суперагоністи або -антагоністи. Ще одним можливим показанням є, зокрема, контроль чоловічої фертильності у комбінації з заміщувальною дозою андрогенів. Перевагою GnRH-антагоністів порівняно з суперагоністами є їхня безпосередня ефективність при блокуванні секреції гонадотропіну. Суперагоністи спочатку сприяють надстимуляції гіпофізу, що веде до підвищеного вивільнення гонадотропіну та статевих стероїдів. Ця гормональна реакція через десенсибілізацію та знижувальну регуляцію концентрації GnRH-рецептора закінчується лише після певної затримки. Можливо, тому GnRH-суперагоністи, як окремо, так і у комбінації з тестостероном, не можуть ефективно пригнічувати вироблення сперми у чоловіків, а отже, є непридатними для контролю чоловічої фертильності. На відміну від них, пептидні GnRH-антагоністи, зокрема, у комбінації з заміщувальною дозою андрогену, здатні викликати значну олігозооспермію у людей. Однак пептидні GnRH-антагоністи мають низку недоліків. Так, вони виявляють значно меншу ефективність як суперагоністи і тому мають вводитись у значно вищих дозах. Незначною також є їх біодоступність при пероральному введенні, і тому вони мають вводитися шляхом ін'єкції. Повторні ін'єкції, в свою чергу, призводять до зниження відповідності умовам. Крім того, синтез пептидних GnRH-антагоністів порівняно з непептидними сполуками є дорогим і вимагає великих витрат. Похідні хіноліну як непептидні GnRH-антагоністи описано, наприклад, у WO 97/14682. Однак до цього часу непептидних GnRH-антагоністів на ринок не надходило. Завдання, яке лежить в основі даного винаходу, полягає в забезпеченні нових GnRH-антагоністів, які переважають відомі пептидні сполуки і являють собою ефективну альтернативу відомим непептидним сполукам. Нові GnRH-антагоністи повинні мати як високу ефективність, так і високу біодоступність при пероральному введенні. Крім того, їх синтез має бути простим і вимагати якомога менше витрат. Це завдання вирішується завдяки сполукам загальної формули (1): (1) де R1 є (а) ацильною групою -CO-R11 або CN, причому R11 є насиченим, ненасиченим, циклічним або/ί (гетеро)ароматичним органічним залишком, зокрема, прямим або розгалуженим алкільним ланцюгом з 1-10 Сатомами, або необов'язково заміщеною алкільними групами або атомами галогену фенільною, фурановою або тіофеновою групою, (б) групою естеру карбонової кислоти -CO-OR12 або групою аміду карбонової кислоти -CO-NR12R13 або групою –SOХ-R12 з X=0, 1 або 2 або -SО2-NR12R13, причому R12 є насиченим, ненасиченим, циклічним або/і (гетеро)ароматичним органічним залишком, зокрема прямим або розгалуженим алкільним ланцюгом з 1-Ю Сатомами, аралкільною групою з 7-20 С-атомами, причому арильний залишок необов'язково може бути заміщеним алкільними групами або атомами галогену, або є необов'язково заміщеним алкільними групами або атомами галогену фенільним залишком, і R13 може бути атомом водню або прямим або розгалуженим алкільним ланцюгом з 1-10 С-атомами, або (в) групою -A-NR14-CO-NR15R16, де А є необов'язково заміщеною С1-С6-алкільною групою алкіленовою групою з 1-4 С-атомами, зокрема з 1 С-атомом, карбонільною групою, атомом кисню або групою -SOX- з X = 0, 1 або 2, R14 та R15 незалежно один від одного є атомом водню або прямим або розгалуженим алкільним ланцюгом з 1-10 С-атомами, і R16 є прямим або розгалуженим алкільним ланцюгом з 1-10 С-атомами, циклоалкільною групою з 3-10 С-атомами, циклоалкілалкільною групою з 7-20 С-атомами, аралкільною групою з 7-20 С-атомами, причому арильний залишок необов'язково може бути заміщеним алкільними групами або атомами галогену, необов'язково заміщеною алкільними групами або атомами галогену фенільною групою або необов'язково заміщеним алкільними групами або атомами галогену гетероциклічним кільцем, R2 є групою -CH(R21)R22, причому R21 є атомом водню, С1-С10-алкільною групою або необов'язково заміщеним фенільним кільцем, і R22 є необов'язково заміщеним фенільним кільцем або нафтильним кільцем, або групою -CH2CH(R23)R24, де R23 та R24 означають необов'язково заміщене фенільне кільце, R3 та R4 незалежно один від одного є атомом водню або алкільною групою з 1-10 С-атомами, і R3 також може бути атомом галогену, R5 є зв'язаною через залишок Ζ групою, де є G-C=C-, -C=N-, -N=C-, атомом кисню або сірки, Ζ є прямим зв'язком, атомом кисню або сірки, групою CH-R52 або -CHR52-CH-R53-, причому R52 та R53 незалежно один від одного означають атом водню або алкільну групу, і n означає числа 1 та 2, потрійним зв'язком -С =С- або Е- або Z-конфігурованою групою CR52=CR53- або C=CR52R53, причому R52 та R53 незалежно один від одного означають атом водню або алкільну групу, L є СН2 - або NH-групою, Q є карбонільною або –SOX-групою з X=0, 1 або 2, і R51 є необов'язково заміщеною алкільною групою аміно- або лінійною або розгалуженою, необов'язково заміщену атомами галогену, гідроксильними або алкоксигрупами алкільною групою або необов'язково заміщеною атомами галогену, гідроксильними або алкоксигрупами циклоалкільною групою з 3-7 членами кільця, R6 є групою CH2-N(R61)R62, причому R61 незалежно є атомом водню або алкільною групою, і R62 є алкільною групою або необов'язково заміщеною аралкільною групою або гетероарилалкільною групою з 7-20 С-атомами, і у будь-якій орієнтації, а також усі стереоізомери зазначених структур та їх солі з фізіологічно прийнятними кислотами або основами. У сполуках Формули (1) означають: YR1 Прямий або розгалужений алкільний ланцюг: метильну, етильну, n-пропільну, ізопропільну, n-, ізо-, трет-бутильну, n-пентильну, 2,2-диметилпропільну або 3-метилбутильну групу, n-гексильну, n-гептильну, nоктильну, n-нонільну, n-децильну групу. Перевагу віддають метильній або етильній групі. Необов'язково заміщена алкільними групами або атомами галогену фенільна група: фенільну, о-, m- рметильну, етильну, пропільну, ізопропілфенільну групу, 2,3-, 2,4-, 2,5-, 2,6-, 3,4-, 3,5-диметильну або діетилфенільну групу, о-, m-, р-фтор-, хлор-, бром-, йодфенільну групу, 2,3-, 2,4-, 2,5-, 2,6-, 3,4-, 3,5-дифтор-, дихлор-, дибром-, або дийодфенільну групу або нафтильну групу. Перевагу віддають фенільній групі. Необов'язково заміщена фуранова або тіофенова група: незаміщену 2-або 3-тієнільну або 2- або 3фурильну групу або 3-метил-, 3-етил-, 3-фтор-, 3-хлор-, 3-бром-, 3-йод-2-фурильну або 2-тієнільну групу, 4метил-, 4-етил-, 4-фтор-, 4-хлор-, 4-бром-, 4-йод-2-фурильну або 2-тієнільну групу, 5-метил-, 5-етил-, 5-фтор-, 5-хлор-, 5-бром-, 5-йод-2-фурильну або -2-тієнільну групу, 2-метил-, 2-етил-, 2-фтор-, 2-хлор-, 2-бром-, 2-йод3-фурильну або -3-тієнільну групу, 4-метил-, 4-етил-, 4-фтор-, 4-хлор-, 4-бром-, 4-йод-3-фурильну або -3тієнільну групу, 5-метил-, 5-етил-, 5-фтор-, 5-хлор-, 5-бром-, 5-йод-3-фурильну або -3-тієнільну групу. Перевагу віддають 2-тієнільній або 2-фурильній групі. Аралкільна група з 7-20 С-атомами: бензильну групу, 1-феніл-етил-, -пропіл-, -бутил-, -гексил-, -2метилетил-, -2-етилетил-, -2,2-диметилетильну групу, о-, m- р-метил-, етил-, пропіл-, ізопропілбензильну групу, 2',3'-, 2',4'-, 2',5'-, 2',6'-, 3',4'-, 3',5'-диметил- або -діетилбензильну групу, 2'-, 3'-, 4'- фтор-, хлор-, бром-, йодбензильну групу, 2',3'-, 2',4'-, 2',5'-, 2',6'-, 3',4'-, 3',5'-, дифтор-, дихлор-, дибром- або дийодбензильну групу або 2- або 3-нафтилметильну групу, 2-фенілетильну, 3-фенілпропільну, 4-фенілбутильну, 5-фенілпентильну групу. С1-С6-алкільна група: лінійну або розгалужену алкільну групу з 1-6 С-атомами, таку як метильну, етильну, n-пропільну, ізопропільну, n-, ізо-, трет-бутильну, n-пентильну, 2,2-диметилпропільну або 3-метилбутильну групу. Циклоалкільний залишок: циклопропановий, циклобутановий, циклопентановий, циклогексановий, циклогептановий, декагідронафталіновий залишок. Циклоалкілалкільний залишок: циклопропіл-, циклобутил-, циклопентил-, циклогексил-, циклогептилметильний залишок, 1-циклопропіл-, 1-циклобутил-, 1-циклопентил-, 1-циклогексил-, 1-циклогептил-етильний залишок, 2-циклопропіл-, 2-циклобутил-, 2-циклопентил-, 2-циклогексил-, 2-циклогептил-етильний залишок. Гетероциклічне кільце: незаміщену 2- або 3-тієніл- або 2- або 3-фурильну групу або 3-метил-, 3-етил-, 3фтор-, 3-хлор-, 3-бром-, 3-йод-2-фурильну або -2-тієнільну групу, 4-метил-, 4-етил-, 4-фтор-, 4-хлор-, 4-бром-, 4-йод-2-фурильну або -2-тієнільну групу, 5-метил-, 5-етил-, 5-фтор-, 5-хлор-, 5-бром-, 5-йод-2-фурильну або 2-тієнільну групу, 2-метил-, 2-етил-, 2-фтор-, 2-хлор-, 2-бром-, 2-йод-3-фурильну або -3-тієнільну групу, 4метил-, 4-етил-, 4-фтор-, 4-хлор-, 4-бром-, 4-йод-3-фурильну або -3-тієнільну групу, 5-метил-, 5-етил-, 5-фтор-, 5-хлор-, 5-бром-, 5-йод-3-фурильну або -3-тієнільну групу, незаміщену 2-, 3- або 4-піридильну групу або 3метил-, 3-етил-, 3-фтор-, 3-хлор-, 3-бром-, 3-йод-2-піридильну групу, 4-метил-, 4-етил-, 4-фтор-, 4-хлор-, 5бром-, 4-йод-2-піридильну групу, 5-метил-, 5-етил-, 5-фтор-, 5-хлор-, 5-бром-, 5-йод-2-піридильну групу, 2метил-, 2-етил-, 2-фтор-, 2-хлор-, 2-бром-, 2-йод-3-піридильну групу, 4-метил-, 4-етил-, 4-фтор-, 4-хлор-, 4бром-, 4-йод-3-піридильну групу, 5-метил-, 5-етил-, 5-фтор-, 5-хлор-, 5-бром-, 5-йод-3-піридильну групу, 2-, 4-, 5-, 6-піримідинільну групу, 3-, 4-, 5-, 6-піридазинільну групу або 2- або 3-піразинільну групу. у R2 Алкільна група: лінійну або розгалужену алкільну групу з 1-6 С-атомами, таку як метил-, етил-, nпропіл-, ізопропіл-, n-, ізо-, трет-бутил-, n-пентил-, 2,2-диметилпропільну або 3-метилбутильну групу. Перевагу віддають атомові водню. Необов'язково заміщене фенільне кільце або нафтильне кільце: феніл-, о-, m-, р-метил-, -етил-, -пропіл-, ізопропілфенільну групу, 2,3-, 2,4-, 2,5-, 2,6-, 3,4-, 3,5-диметил- або діетилфенільну групу, о-, m-, р-фтор-, хлор, бром-, йодфенільну групу, 2,3-, 2,4-, 2,5-, 2,6-, 3,4-, 3,5-дифтор-, дихлор-, дибром- або дийодфенільну групу, о-, m-, р-тригалогенметилфенільну групу, 2,3-, 2,4-, 2,5-, 2,6-, 3,4- або 3,5 ди-тригалогенфенільну групу, о-, m-, р-метокси-, -етокси-, -пропокси-, -ізопропоксифенільну групу або нафтильну групу. Перевагу віддають 2,5дифторфенільній групі. У R3 та R4 Алкільна група: лінійну або розгалужену алкільну групу з 1-6 С-атомами, таку як метил-, етил-, n-пропіл-, ізопропіл-, n-, ізо-, трет-бутил-, n-пентил-, 2,2-диметилпропільну або 3-метилбутильну групу. Перевагу віддають атомові водню. У R5 Алкільна група: лінійну або розгалужену алкільну групу з 1-6 С-атомами, таку як метил-, етил-, nпропіл-, ізопропіл-, n-, ізо-, трет-бутил-, n-пентил-, 2,2-диметилпропільну або 3-метилбутильну групу. Перевагу віддають атомові водню. У R6 Алкільна група: лінійну або розгалужену алкільну групу з 1-6 С-атомами, таку як метил-, етил-, nпропіл-, ізопропіл-, n-, ізо-, трет-бутил-, n-пентил-, 2,2-диметилпропільну або 3-метилбутильну групу. Перевагу віддають метильній групі. Аралкільна група з 7-20 С-атомами: бензильну групу, 1-фенілетил-, -пропіл-, -бутил-, -гексил-, -2метилетил-, -2-етилетил-, -2,2-диметилетильну групу, о-, m- р-метил-, етил-, пропіл-, ізопропілбензильну групу, 2',3'-, 2',4'-, 2',5'-, 2',6'-, 3',4·-, 3',5'-диметил- або -діетилбензильну групу, 2'-, 3'-, 4'- фтор-, хлор-, бром-, йодбензильну групу, 2',3'-, 2',4'-, 2',5'-, 2',6'-, 3',4'-, 3',5'-, дифтор-, дихлор-, дибром- або дийодбензильну групу або 2- або 3-нафтилметильну групу, 2-фенілетильну, 3-фенілпропільну, 4-фенілбутильну, 5-фенілпентильну групу. Гетероаралкільна група з 7-20 С-атомами: 2-, 3- або 4-піридил-метильну, -етильну або -пропільну групу, 2або 3-фурил-метильну, -етильну, або -пропільну групу, 2- або 3-тієніл-метильну, -етильну або -пропільну групу, 2-, 3-, 4-, 5-, 6- або 7-індоліл-метильну, -етильну або -пропільну групу. Перевагу віддають бензильній групі. Перевагу віддають сполукам Формули (1), у яких Якщо R1 є групою -CO-R11, то R11 в оптимальному варіанті означає, наприклад, метил, етил, і-пропіл, феніл, 2-тієніл та 2-фурил. Якщо R1 означає -CO-OR12, то R12 в оптимальному варіанті є, наприклад, метилом, етилом або і-пропілом. Крім того, перевагу віддають сполукам, у яких R2 є заміщеною на ароматичному кільці одним або кількома атомами галогену, зокрема, атомами фтору, ароматичною групою, наприклад, бензильною групою, наприклад, 2',6'-дифторбензильною групою. Так само перевагу віддають сполукам, у яких принаймні один з R3 та R4, ще краще - обидва, є атомом водню. Оптимальним значенням Ζ є прямий зв'язок або атом кисню, тоді як G в оптимальному варіанті означає С=С-групу. L в оптимальному варіанті є ΝΗ-групою, тоді як Q в оптимальному варіанті є карбонільною групою, і R51 є С1-С6-алкільною групою. Найкращими значеннями для R61 є атоми водню або С1-С3-алкільні групи, зокрема, метильні групи, і для R62 - аралкільний залишок, наприклад, бензильна група. Одержання сполук (1) в оптимальному варіанті відбувається через (а) заміщення сполуки загальної формули (2) (2) де R7 означає відщеплювальну групу, наприклад, атом галогену або алкільну, перфторалкільну або арилсульфонільну групу, і всі інші залишки, які у сполуці (1) мають вказане значення, сполукою загальної формули (3) R8-N(R61)R62 (3) де R8 означає атом водню або атом металу, наприклад, атом літію, натрію, калію, цезію, кальцію або барію, і R61 та R62, які у сполуці (1) мають вказані значення, (б) заміщення сполуки загальної формули (4) (4) де R9 є групою -OSO2CnF2n+1, атомом галогену, зокрема, атомом брому або йоду, або іншою відщеплювальною групою, і всі інші залишки, які у сполуці (1) мають вказане значення, сполукою загальної формули (5) (5) де R10 є металовмісною групою, такою як триалкілолов'яна група, галогенмагнієвою групою або неметаловмісною групою, такою як група, що мітить бор, кремній та ін., діалкоксиборною або дигідроксиборною групою, необов'язково перетворюваною на сіль металу, наприклад, літію, натрію, калію, цезію, кальцію-, барію, срібла або міді, гідрокси- або меркаптогрупою, групою -C=C-R31 або Е- або Zконфігурованою групою -CR52=CR53R31 або -CR31=CR52R53, де R31 є групою, що містить метал або неметал, такою як група, що мітить бор, кремній та ін., такою як триалкілолов'яна група, галогенмагнієва група, діалкоксибор- або дигідроксиборгрупа, і всі інші залишки, які у сполуці (1) мають вказане значення, за допомогою або без допомоги каталізатора, наприклад, міді, нікелю, паладію, платини або органічних похідних зазначених металів; (в) якщо Υ у сполуці (1) є атомом азоту - шляхом заміщення сполуки загальної формули (6) (6) де R32 означає атом водню або атом металу, наприклад, літію, натрію, калію, цезію, кальцію, барію, срібла або міді, і всі інші залишки, які у сполуці (1) мають вказане значення, сполукою загальної формули (7) R33-R2 (7) де R33 означає відщеплювальну групу, наприклад, атом галогену або алкільну, перфторалкільну або арилсульфонільну групу, і R2 має вказане для сполуки (1) значення, або (г) якщо W у сполуці (1) є атомом азоту - шляхом заміщення сполуки загальної формули (8) (8) де R32 означає атом водню або атом металу, наприклад, літію, калію, цезію, кальцію, барію, срібла або міді, і всі інші залишки, які у сполуці (1) мають вказане значення, сполукою загальної формули (9) R33-R1 (9) де R33 означає відщеплювальну групу, наприклад, атом галогену або алкільну, перфторалкільну або арилсульфонільну групу, і R1 має вказане для сполуки (1) значення. Сполуки (1) згідно з винаходом застосовують як антагоністи гормону, що вивільнює гонадотропін, наприклад для контролю чоловічої фертильності, для гормональної терапії, для лікування жіночої субфертильності та безпліддя, для попередження вагітності у жінок та для боротьби з пухлинами. При контролі фертильності у чоловіків сполуки згідно з винаходом сприяють зменшенню сперматогенезу. В оптимальному варіанті відбувається комбіноване введення з андрогенами, наприклад, тестостерон або похідні тестостерону, такі як естери тестостерону. Введення похідних тестостерону здійснюють, наприклад, шляхом ін'єкції, наприклад, внутрішньом'язової ін'єкції уповільненого вивільнення. При гормональній терапії, наприклад, для лікування ендометріозу, лейоміоми матки та фіброїдів матки сполуки (1) застосовують необов'язково у комбінації з іншими гормонами, наприклад, естрогенами або/і прогестинами. Особливу перевагу віддають комбінаціям GnRH-антагоністів згідно з винаходом та тканиноселективними частковими агоністами естрогену, такими як Raloxifen®. Крім того, сполуки (1) згідно з винаходом застосовують для підвищення жіночої фертильності, наприклад, через викликання овуляції, та для лікування стерильності. З іншого боку, сполуки (1) також є придатними для попередження вагітності у жінок. Так, GnRH-антагоніст з 1-го по 15-й дні циклу може вводитись разом з естрогеном, в оптимальному варіанті - з дуже незначними дозами естрогену. З 16-го по 21-й дні циклу приймання додають прогестаген комбінації ecтрогену-GnRHантагоніста. GnRH-антагоніст може доставлятися безперервно протягом усього циклу. Таким чином можна досягти зменшення дозування гормонів, а отже, зменшення побічних ефектів від нефізіологічного рівня гормонів. Крім того, досягається сприятливий вплив для жінок, які страждають від поліцистичного оваріального синдрому та андроген-залежних захворювань, таких як акне, себорея та гірсутизм. Можна також очікувати поліпшення контролю циклу порівняно з уже відомими способами введення. Іншими показаннями є доброякісна гіперплазія передміхурової залози, Захист гонад у разі хіміотерапії, контрольована оваріальна стимуляція / штучні репродуктивні технології, дитячі порушення розвитку, наприклад, передчасне статеве визрівання та полікістозні яєчники. І нарешті, GnRH-агоністи згідно з винаходом також застосовують для лікування гормонозалежних пухлинних захворювань, таких як передклімактеричний рак молочної залози, рак передміхурової залози, рак яєчника та рак ендометрію, коли вони пригнічують ендогенні статеві стероїдні гормони. Сполуки (1) згідно з винаходом як GnRH-антагоністи є придатними не лише для людини, але й для ветеринарних цілей, наприклад, для домашніх та свійських тварин, а також для диких тварин. Введення здійснюють відомими способами, наприклад, перорально, місцево, ректально, інтравагінально, назально або шляхом ін'єкцій. Перевагу віддають пероральному введенню. Сполуки (1) перетворюють на придатну для введення форму і необов'язково змішують з фармацевтично прийнятними носіями або розріджувачами. Пероральне введення відбувається, наприклад, у твердій формі у вигляді таблеток, капсул, драже або порошку, однак може відбуватися також у формі придатного для пиття розчину. Непероральне введення може здійснюватися, наприклад, через внутрішньовенну, підшкірну або внутрішньом'язову Ін'єкцію або через мазі, креми або супозиторії. У відповідному разі введення також здійснюють у формі уповільненої дії. Дозування може бути різним, залежно від типу показання, тяжкості захворювання, віку, статі, маси тіла та чутливості підданого лікуванню суб'єкта. В оптимальному варіанті дози становлять від 0,01 до 30мг, краще від 0,1 до 3мг, найкраще - від 0,1 до 1мг на кг маси тіла на день. Введення може відбуватися однією дозою кількома окремими дозами. Нижче представлено перелік сполук (1), яким віддають особливу перевагу: Сполуки, яким віддають особливу перевагу Далі винахід пояснюється на представлених нижче Прикладах. Приклади втілення Приклад 1 Етиловий естер(6-ацетамідофенокси)-5-(N-бензил-N-метиламінометил)-1-(2',6'-дифторбензил)-1,4дигідро-4-oксо-хінолін-3-карбонової кислоти 78мг етилового естеру 6-(4-ацетамідофенокси)-5-(хлорметил)-1-(2',6'-дифторбензил)-1,4-дигідро-4-оксохінолін-3-карбонової кислоти, розчиненого у 3мл диметидформаміду, змішували з 84мкл N-метилбензиламіну та 84мкл Ν,Ν-діізопропілетиламіну при 0°С і при кімнатній температурі перемішували 20 годин. Після додавання 20мл водного розчину бікарбонату натрію осад відсмоктували, промивали водою, а потім nгексаном і при кімнатній температурі висушували у вакуумі. Одержують 70мг названої сполуки. ЯМР: δ=1.3 (t; 3Н; СН3); 1.9 (s; 3H; NCH3); 2.05 (s; 3Н; СН3); 3.55 (s; 2H; NCH2); 4.27 (q; 2Н; ОСН2); 4.91 (s; 2Н; NCH2); 5.68 (s; 2Н; NCH2); 6.85 (d; 2H; АrСН); 7.1-7.22 (m; 7Н; ArCH); 7.26 (d; 1H; ArCH); 7.42-7.6 (m; 4H; ArCH); 8.72 (s; 1H; NCH); 9.9(s; 1H; NH) MS: FAB: MÅ+1=526[M=525] Вихідний матеріал, етиловий естер 6-(4-ацетамідофенокси)-5-(хлорметил)-1-(2',6'-дифторбензил)-1,4дигідро-4-оксо-хінолін-3-карбонової кислоти, одержували таким чином: а. етиловий естер 1,4-дигідро-6-фтор-5-нітро-4-оксо-хінолін-3-карбонової кислоти 50г 4-фтор-3-нітроаніліну та 69г діетилового естеру етоксиметиленмалонової кислоти протягом 3 годин нагрівали до 120°С. Суміш додавали до n-гексану, 2 години перемішували і кристалічний матеріал відсмоктували, і висушували у вакуумі при кімнатній температурі. Одержують 93г діетилового естеру N-(4фтор-3-нітрофеніл)-амінометиленмалонової кислоти. Трьома порціями по 31г його додають відповідно до 150мл попередньо нагрітої до 260°С суміші з 26,5% дифенілу та 73,5% дифенілового етеру (DOWTHERM А®) і 30 хвилин перемішують при цій температурі. Після охолодження розводять 500мл n-гексану і осад відсмоктують. Одержують загалом 64г суміші етилового естеру 1,4-дигідро-6-фтор-5-нітро-4-оксо-хінолін-3карбонової кислоти та етилового естеру 1,4-дигідро-6-фтор-7-нітро-4-оксо-хінолін-3-карбонової кислоти. ЯМР: δ=1.31 (t; 3Н; СН3); 4.25 (q; 2H; ОСН2); 7.88 (s; 1H; АrСН; ізомер А); 7.92 (s; 1H; АrСН; ізомер А); 8.1 (d; 1H; АrСН; ізомер В); 8.45 (d; 1H; АrСН; ізомер В); 8.59+8.69 (2s; по 1Н; NCH; А+В) MS: Ε І: МÅ=280[М=280] б. етиловий естер 1-(2',6'-дифторбензил)-1,4-дигідро-6-фтор-5-нітро-4-оксо-хінолін-3-карбонової кислоти 22г вищеописаної суміші у 500мл диметилформаміду при кімнатній температурі 5 годин перемішували з 16г карбонату калію та 23,7г 2,6-дифторбензилброміду. Реакційну суміш додають до 1л водного розчину хлориду амонію і тричі екстрагують етилацетатом. Після висушування сульфатом натрію та випарювання у вакуумі додають 500мл n-гексану і перемішують 25 хвилин. Після декантування гексанової фази залишок перекристалізують з етилацетату. Одержують 10,4г названої сполуки. ЯМР: δ=1.3 (t; 3Н; СН3); 4.25 (q; 2H; ОСН2); 5.84 (s; 2H; NCH2); 7.15-7.25 (m; 2Н; АrСН); 7.45-7.55 (m; 1Н; АrСН); 7.92 (dd; 1Н; АrСН); 8.04-8.14 (m; 1Н; АrСН); 8.96 (s; 1H; NCH); MS: Ε Ι: ΜÅ=406[Μ=406] в. етиловий естер 6-(4-ацетамідофенокси)-1-(2',6'-дифторбензил)-1,4-дигідро-5-нітро-4-оксо-хінолін-3карбонової кислоти 3,74г 4-ацетамідофенолу у 40мл диметидформаміду змішують із 733мг гідриду натрію (80% у мінеральній олії) і 15 хвилин перемішують при кімнатній температурі. Потім цей розчин додають до 5г вищеописаної сполуки, розчиненої у 40мл диметидформаміду. Через 5 годин при кімнатній температурі суміш виливають на льодяну воду і осад відсмоктують. Після хроматографії на силікагелі (елюент дихлорметан / 2-пропанол 95:5) одержують 5,17г названої сполуки. ЯМР: δ= 1.3 (t; 3Н; СН3); 2.03 (s; 3Н; СН3); 4.27 (q; 2Н; ОСН2);5.79 (s; 2H; NCH2); 7.01 (d; 2Н; АrСН); 7.137.23 (m; 2Н; АrСН); 7.43-7.56 (m; 2Н; АrСН); 7.61 (d; 2H; АrСН); 7.8 (d; 1H; АrСН); 8.93 (s; 1H; NCH); 9.97(1Н; S; NH) MS: Ε Ι: ΜÅ=537[Μ=537] г. етиловий естер 6-(4-ацетамідофенокси)-5-аміно-1-(2',6'-дифтор-бензил)-1,4-дигідро-4-оксо-хінолін-3карбонової кислоти 5,1г вищеназваної сполуки гідрогенізують у 650мл метанолу з 510мг паладію/вуглецю (10%). Після відсмоктування каталізатор та випарювання одержують 4,55г названої сполуки. ЯМР: δ=1.29 (t; 3Н; СН3); 2.02 (s; 3Н; СН3); 3.25 (s; 2Н; NH2); 4.25 (q; 2H; ОСН2); 5.55 (s; 2Н; NCH2); 6.55 (d; 1Н; ArCH); 6.86 (d; 2H; АrСН); 7.07 (d; 1H; АrСН); 7.1-7.22 (m; 2Н; АrСН); 7.4-7.55 (m; 3Н; АrСН); 8.71 (s; 1Н; NCH); 9.8 (s; 1H; NH); MS: Ε Ι: ΜÅ=507[Μ=507] д. етиловий естер 6-(4-ацетамідофенокси)-1-(2',6'-дифторбензил)-1,4-дигідро-5-йод-4-оксо-хінолін-3карбонової кислоти 2г вищеназваної сполуки розчиняють у суміші 24мл концентрованої сірчаної кислоти та 12мл води і при 0°С змішують із 325мг нітриту натрію у 4мл води. Через 15 хвилин за допомогою розчину бікарбонату натрію рН установлюють на рівні 3 і додають 100мг сечовини. Потім додають 723мг йодиду калію у 0,5мл води і протягом години перемішують при кімнатній температурі. Після екстрагування дихлорметаном / метанолом (95:5, об'єм/об'єм) органічну фазу промивають водним розчином тіосульфату натрію, висушують і випарюють. Після хроматографії на силікагелі (елюент дихлорметан з 0-15% ізопропанолу) одержують 697мг названої сполуки. ЯМР: δ=1.3 (t; 3Н; СН3); 2.02 (s; 3H; СН3); 4.25 (q; 2H; ОСН2); 5,71 (s;2H; NCH2); 6.83 (d; 2Н; ArCH); 7.1-7.2 (2Н; m; ArCH); 7.3 (d; 1H; ArCH); 7.41-7.63 (m; 4H; ArCH); 8.83 (s; 1H; N-CH); 9.95 (s; 1H; NH) MS: es: MÅ+1=493[M=492] e. етиловий естер 6-(4-ацетамідофенокси)-1-{2',6'-дифторбензил)-1,4-дигідро-4-оксо-5-стирил-хінолін-3карбонової кислоти 550мг вищеназваної йодної сполуки, 198мг стирилборної кислоти, 55мг тетракіс-трифенілфосфінпаладію(0), 1,1мл 2 молярного розчину карбонату натрію, 2,2мл етанолу та 22мл толуолу 6 годин перемішують при 80°С. Потім додають воду, екстрагують дихлорметаном і органічну фазу промивають розчином кухонної солі, висушують і випарюють. Залишок очищають шляхом хроматографії на силікагелі (елюент дихлорметан з 0-10% ізопропанолу). Одержують 902мг названої сполуки. ЯМР: δ=1.28 (t; 3Н; СН3); 2.0 (s; 3Н; СН3); 4.24 (q; 2Н; ОСН2); 5.7 (s; 2Н; N-СН2 ); 6.75-6.85 (m; 3Н; ArCH; СН=СН); 7.08-7.28 (m; 3Н; ArCH); 7.3-7.68 (m; 9Н; ArCH); 7.86 (d; 1H; СН=СН); 8.75 (s; 1H; NCH); 9.72(1Н; S; NH) MS: es: MÅ+1=595[Μ=594] є. етиловий естер 6-(4-ацетамідофенокси)-1-(2',6'-дифторбензил)-1,4-дигідро-5-форміл-4-оксо-хінолін-3карбонової кислоти 450мг вищеназваної стирилової сполуки розчиняють у 25мл тетрагідрофурану та 7мл води і додають 0,11мл 2,5-відсоткового розчину тетроксиду осмію у трет-бутанолі. Через 15 хвилин перемішування при кімнатній температурі додають 482мг, через 20 та 22 години - 100мг, і через 24 години - ще 100мг перйодату натрію. Через 26 годин розводять водою і екстрагують етилацетатом. Після висушування органічної фази сульфатом натрію випарюють. Одержують 352мг названої сполуки у вигляді піни. ЯМР: δ=1.29 (t; 3Н; СН3); 2.01 (s; 3Н; СН3); 4.27 (q; 2Н; ОСН2); 5.71 (s; NCH2); 6.91 (d; 2Н; АrСН); 7.12-7.22 (m; 2Н; ArCH); 7.4 (d; 1H; АrСН); 7.43-7.64 (m; 3Н; АrСН); 7.72 (d; 1Н; АrСН); 9.0 (d; 1Н; NCH); 9.97 (s; 1Н; NH); 10.44 (s; 1H; СНО) MS: FAB: MÅ+1=521[Μ=520] ж. етиловий естер 6-(4-ацетамідофенокси)-1-(2',6'-дифторбензил)-1,4-дигідро-5-гідроксиметил-4-оксохінолін-3-карбонової кислоти 300мг вищеназваного альдегіду розчиняють у 13,8мл оцтової кислоти і з інтервалами 10 хвилин трьома порціями змішують з боргідридом натрію у кількості відповідно по 10мг. Після розведення водою екстрагують етилацетатом і органічну фазу промивають нейтральним розчином бікарбонату натрію. Після висушування сульфатом натрію випарюють. Шляхом хроматографії на силікагелі (елюент дихлорметан з 0-10% ізопропанолу) одержують 129мг названої сполуки у вигляді піни. MNR: δ=1.31 (t; 3Н; СН3); 2.02 (s; 3H; СН3); 4.27 (q; 2H; ОСН2); 4.86 (d; 2H; ОСН2); 5.12 (t; 1H; ОН); 5.8 (s; 2H; NCH2); 6.85 (d; 2H; АrСН); 7.12-7.22 (m; 2H; АrСН); 7.38 (d; 1Н; АrСН); 7.42-7.59 (m; 3Н; АrСН); 7.63 (d; 1Н; АrСН); 8.94 (s; 1H; NCH); 9.5(s; 1H; NH) MS: FAB: ΜÅ+1=523[Μ=522] з. етиловий естер 6-(4-ацетамідофенокси)-5-хлорметил-1-(2',6'-дифторбензил)-1,4-дигідро-4-оксо-хінолін3-карбонової кислоти 80мг вищеназваного спирту розчиняють у 2мл дихлорметану і змішують із 0,1мл тіоніл хлориду. Через 20 хвилин при кімнатній температурі додають воду, екстрагують дихлорметаном і органічну фазу промивають розчином кухонної солі. Після висушування сульфатом натрію випарюють. Одержують 80мг названої сполуки у вигляді піни. ЯМР: δ=1.33 (t; 3Н; СН3 ); 2.07 (s; 3Н; СН3); 4.3 (q; 2H; ОСН2); 5.66 (s; 2H; СН2СІ); 5.75 (s; 2H; NCH2); 6.98 (d; 2H; АrСН); 7.13-7.25 (m; 2H; АrСН); 7.3 (d; 1Н; АrСН); 7.53 (t; 1H; АrСН); 7.61 (d; 2H; АrСН); 7.68 (d; 1H; АrСН); 8.82 (s; 1H; NCH); 9.98 (s; 1H; NH) MS: es: MÅ+1=541/543[M=540/542] Приклад 2 2-пропіловий естер 6-(4-ацетамідофенокси)-5-(N-бензил-N-метил-амінометил)-1-(2',6'-дифтор-бензил)-1,4дигідро-4-оксо-хінолін-3-карбонової кислоти Цю сполуку одержують із етилового естеру 6-(4-ацетамідофенокси)-5-(N-бензил-N-метиламінометил)-1(2',6'-дифторбензил)-1,4-дигідро-4-оксо-хінолін-3-карбонової кислоти шляхом нагрівання з тетраізопропілатом титану в ізопропанолі. Приклад 3 Етиловий естер 5-(N-Бензил-N-метиламiнометил)-1-(2',6'-дифтор-бензил)-1,4-дигідро-6-(4ізобутирамідофенокси)-4-оксо-хінолін-3-карбонової кислоти Цю сполуку одержують аналогічно Прикладові 1 з етилового естеру 5-(хлорметил)-1-(2',6'-дифторбензил)1,4-дигідро-6-(4-ізобутирамідофенокси)-4-оксо-хінолін-3-карбонової кислоти та N-метилбензиламіну у вигляді піни. а. етиловий естер 5-(хлорметил)-1-(2',6'-дифторбензил)-1,4-дигідро-6-(4-ізобутирамідофенокси)-4-оксохінолін-3-карбонової кислоти Цю сполуку одержують, застосовуючи у Прикладі 1/с 4-ізобутирамідофенол замість 4-ацетамідофенолу і далі перетворюючи аналогічно Прикладам від 1/г до 1/з. Приклад 4 3-ацетил-6-(4-ацетамідофеніл)-1-бензил-5-(N-бензил-N-метил-амінометил)-фталазин-4-он Названу сполуку одержують, перетворюючи 6-(4-ацетамідофеніл)-1-бензил-5-(N-бензил-Nметиламінометил)-фталазин-4-он у присутності основи, такої як карбонат натрію або гідроксид натрію, ацетилхлоридом або ацетангідридом. 6-(4-ацетамщофент)-1-бензил-5-(N-бензил-N-метиламiнометил)-фталазин-4-он одержують таким чином: а. 6-(4-ацетамідофеніл)-1-бензил-5-йод-фталазин-4-он 1-бензил-5,6-дийод-фталазин-4-он (Indian J.Chem. 16B, 1978, 301-304) перетворюють аналогічно Прикладові 1/е 1 еквівалентом 4-ацетамідофенілборної кислоти. Названу сполуку одержують у чистому вигляді шляхом хроматографії на силікагелі. б. 6-(4-ацетамідофеніл)-1-бензил-5-хлорметил-фталазин-4-он 6-(4-ацетамідофеніл)-1-бензил-5-йод-фталазин-4-он піддають подальшому перетворенню аналогічно Прикладові 1/е-з до названої сполуки. Приклад 5 Етиловий естер 6-(4-ацетамщофенокси)-5-(N-бензил-N-метиламінометил)-1,4-дигідро-4-оксо-1-(2'трифторметилбензил)-хінолін-3-карбонової кислоти 130мг (0,226ммоль) етилового естеру 6-(4-ацетамідофенокси)-5-(хлорметил)-1,4-дигідро-4-оксо-1-(2'трифторметилбензил)-хінолдін-3-карбонової кислоти, розчиненої у 5мл DMF, при -5°С змішують із 125мкл Ν,Νдіізопропілетиламіну та 126мкл (0,97ммоль) N-бензил-метиламіну. Після нагрівання до кімнатної температури перемішують ще 20 годин і відразу після цього реакційну суміш додають до 50мл насиченого розчину бікарбонату натрію. Тверду речовину відсмоктують, промивають водою і висушують у вакуумі. Подальше очищення здійснюють шляхом хроматографії на силікагелі з елюентом, який складається з 90 частин дихлорметану, 10 частин етанолу та 1 частини конц. аміаку (Rf: 0,38).2 Одержують 45мг названої сполуки у вигляді піни. MS/Molpeak, M+=658 Вихідний матеріал етиловий естер 6-(4-ацетамідофенокси)-5-(хлорметил)-1,4-дигідро-4-оксо-1-(2'трифторметилбензил)-хінолін-3-карбонової кислоти одержують аналогічно описаному у Прикладах з 1а по 1з способові з застосуванням 2'-трифторметил-бензилбровду замість 2,6-дифторметилбензилброміду. Приклад 6 Етиловий естер 6-(4-метиламінокарбоніл-фенокси)-5-(N-бензил-N-метиламінометил)-1-(2',6'дифторбензил)-1,4-дигідро-4-оксо-хінолін-3-карбонової кислоти 35мг (0,061ммоль) етилового естеру 6-(4-метиламінокарбоніл-фенокси)-5-(хлорметил)-1-(2',6'дифторбензил)-1,4-дигідро-4-оксо-хінолін-3-карбонової кислоти, розчиненого у 1,3мкл DMF, при 0°С змішують із 35мкл Ν,Ν-діізопропілетиламіну та 35мкл (0,25ммоль) N-метилбензиламіну. Після нагрівання до кімнатної температури ще перемішують 20 годин, а потім реакційну суміш додають до 10мл насиченого розчину бікарбонату натрію. Одержану тверду речовину відсмоктують, промивають водою та гексаном і висушують у вакуумі над пентоксидом фосфору. Одержують 27мг названої сполуки у вигляді піни. MS (esi): M++1=626[Μ=625] Вихідний матеріал етиловий естер 6-(4-метиламінокарбоніл-фенокси)-5-(хлорметил)-1-(2',6'дифторбензил)-1,4-дигідро-4-оксо-хінолін-3-карбонової кислоти одержують аналогічно описаному у Прикладах з 1а по 1з способові з застосуванням аміду 4-гідрокси-N-метилбензойної кислоти замість 4-ацетамідофенолу. Приклад 7 Етиловий естер 6-(4-ацетамідофенокси)-5-(N-бензил-N-метиламінометил)-1-(1-нафтилметил)-1,4-дигідро4-оксо-хінол ін-3-карбонової кислоти 45мг (0,081ммоль) етилового естеру 6-(4-ацетамідофенокси)-5-(хлорметил)-1-(1-нафтилметил)-1,4дигідро-4-оксо-хінолін-3-карбонової кислоти, розчиненої у 1,7мл DMF, при 0°С змішують із 46мкл Ν,Νдіізопропілетиламіну та 46мкл (0,33ммоль) N-метилбензиламіну. Після нагрівання до кімнатної температури ще перемішують 20 годин, а потім реакційну суміш додають до 15мл насиченого розчину бікарбонату натрію. Одержану тверду речовину відсмоктують, промивають водою та гексаном і висушують у вакуумі над пентоксидом фосфору. Одержують 32мг названої сполуки у вигляді піни. MS (esi): M++1=639[Μ=638] Вихідний матеріал етиловий естер 6-(4-ацетамідофенокси)-5-(хлорметил)-1-(1-нафтилметил)-1,4-дигідро4-оксо-хінолін-3-карбонової кислоти одержують аналогічно описаному у Прикладах з 1а по 1з способові з застосуванням 1-хлорметилнафталіну замість 2,6-дифторметилбензилброміду. Приклад 8 Виявлення антагоністичного впливу а) Матеріали Бусерелін отримували від Welding (Франкфурт-на-Майні, Німеччина). Сполуку мітили 125І, застосовуючи метод хлораміну Τ та Na125l (4000Сі/ммоль; Amersham-Buchler, Брауншвейг, Німеччина). Мічену речовину очищають шляхом HPLC з оберненням фаз на колонці Spherisorb ODS II (250´4мм, розмір частинок 3мкм) через елюювання з 50% ацетонітрилу / 0,15% трифторооцтової кислоти зі швидкістю потоку 0,5мл/хв. Специфічна активність становила 2000Кі/ммоль. Всі інші хімікати найвищого рівня очищення отримували з комерційних джерел. б) Культура клітин Альфа Т3-1-клітини (Bilezikjian et. al., Моl. Endocinol 5 (1991), 347-355) культивували у DMEM-середовищі (Gibco-BRL, Eggenstein-Leopoldshafen, Німеччина) з пеніциліном (100 ОД/мл), стрептоміцином (0,1мг/мл) та глутаміном (0,01моль/л) і 10% ембріональної телячої сироватки (FCS; РАA Laboratories, Coelbe, Німеччина) на пластмасових планшетах для культивування (Nunc, 245´245´20mm). Клітини СНО-3 (Schmid et. al., J.Biol. Chem. 275 (2000), 9193-9200) культивували за ідентичних умов, крім того, що застосовували середовище Ham's F12 (Gibco-BRL). 10 планшетів з конфлюентними культурами двічі промивали 50мл фосфатно-буферного розсолу (PBS). Клітини шляхом зскрібання гумовим скребком збирали у 5мл PBS і осаджували шляхом центрифугування при 800об./хв протягом 10хв. у лабораторній центрифузі (Heraeus). Гранули клітин ресуспендували у 5мл 0,25моль/л сахарози / 0,01моль/л триетаноламіну, рН7,4. Клітини розкладали шляхом заморожування у три цикли у ванні з сухого льоду/етанолу та відморожування при кімнатній температурі. Лізат центрифугували при 900об./хв протягом 10хв. і осад видаляли. Надосадову рідину центрифугували при 18000об./хв у роторі Sorvall SS34 протягом 30хв. Гранули (клітинні мембрани) суспендували у 5мл аналітичного буфера (0,25моль/л сахарози, 0,01моль/л триетаноламіну, рН7,5, 1мг/мл яєчного альбуміну) і зберігали у 200мкл аліквот при 20°С. Визначення білка здійснюють способом Бредфорда (Bradford) (Anal. Biochem. 72 (1976), 248-254). в. рецепторний аналіз Дослідження зв'язування для кривих конкуренції здійснювали тричі. Випробуваний зразок містить 60мкл суспензії клітинної мембрани (10мкг білка для aТ3-1-клітин або 40мкг білка для СНО3-клітин), 20мкл міченого 125 І бусереліну (100000 Ірm на зразок для кривих конкуренції і від 1500 до 200000 Ірm для експериментів насичення) і 20мкл випробувального буфера або розчину випробуваної сполуки. Випробувані сполуки розчиняли у воді або 50% етанолі. Послідовні розведення (від 5´10-6моль/л до 5´10-12моль/л) одержували у випробувальному буфері. Неспецифічне зв'язування визначали у присутності надлишкової кількості неміченого бусереліну (10-6моль/л). Випробувані зразки інкубували протягом 30хв. при кімнатній температурі. Зв'язаний та вільний ліганд відокремлювали шляхом фільтрації (фільтр Whatman GF/C, діаметр 2,5см) з застосуванням пристрою Amicon 10´ і двічі промивали 5мл 0,02моль/л Tris/HCI, pH7,4. Фільтр змочували 0,3% поліетиленіміном (Serva; Heidelberg, Німеччина) протягом 30хв. для зменшення неспецифічного зв'язування. Радіоактивність, яка затримується фільтром, визначали у 5-канальному гамма-лічильнику (Wallac-LKB 1470 Wizard).
ДивитисяДодаткова інформація
Назва патенту англійськоюQuinoline, isoquinoline and phthalazine derivatives as antagonists of the gonadotropin-releasing hormone.
Автори англійськоюRehwinkel Hartnut, Hess-Stumpp Holger
Назва патенту російськоюПроизводные хинолина, изохинолина и фталазина как антагонисты гормона, который высвобождает гонадотропин
Автори російськоюШмеес Норберт, Гесс-Штумпп Хольгер
МПК / Мітки
МПК: A61P 15/00, A61K 31/47, A61P 5/02, A61P 35/00, A61K 31/473, C07D 237/32, C07D 215/56, A61P 15/08, A61P 5/24, A61P 15/18, A61K 31/502
Мітки: хіноліну, похідні, гонадотропін, фталазину, гормону, вивільнює, антагоністи, ізохіноліну
Код посилання
<a href="https://ua.patents.su/11-73409-pokhidni-khinolinu-izokhinolinu-ta-ftalazinu-yak-antagonisti-gormonu-shho-vivilnyueh-gonadotropin.html" target="_blank" rel="follow" title="База патентів України">Похідні хіноліну, ізохіноліну та фталазину як антагоністи гормону, що вивільнює гонадотропін</a>
Попередній патент: Трубчаста рушникосушарка
Наступний патент: Комбінований ґрунтообробний робочий орган
Випадковий патент: Спосіб моделювання із воску внутрішньокореневої куксової вкладки в ротовій порожнині















