Похідні амінопіридину як антагоністи mglur5
Номер патенту: 81464
Опубліковано: 10.01.2008
Автори: Лє Пуль Еммануель, Болєа Крістель, Мютель Венсан, Рошер Жан-Філіпп, Бессі Анн-Софі
Формула / Реферат
1. Сполука формули:
 , I-A
, I-A
де
R2 та R3 незалежно вибирають з таких груп: водень, С1-С6-алкіл;
R5 являє собою групу наступної формули
 або
або  ,
,
де
R9, R10, R11, R12 та R13 незалежно є такими групами, як водень, галоген, ціано, нітро, С1-С6-алкіл, галоген-С1-С6-алкіл, С1-С6-алкокси, карбоксі-С1-С6-алкіл або карбоксіарил;
R14 та R15 незалежно є такими групами, як визначено вище для R9-R13; або фармацевтично прийнятні солі, гідрати або сольвати такої сполуки.
2. Сполука за п. 1 наступної формули
 , I-B
, I-B
де
R2 та R3 незалежно вибирають з таких груп: водень, С1-С6-алкіл;
R9, R10, R11, R12 та R13 незалежно є такими групами, як водень, галоген, ціано, нітро, С1-С6-алкіл, галоген-С1-С6-алкіл, С1-С6-алкокси, карбоксі-С1-С6-алкіл або карбоксіарил;
або фармацевтично прийнятні солі, гідрати або сольвати такої сполуки.
3. Сполука за п. 1 наступної формули
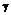 , I-C
, I-C
де R2 та R3 незалежно вибирають з таких груп: водень, С1-С6-алкіл;
R14 та R15 незалежно є такими групами, як водень, галоген, ціано, нітро, С1-С6-алкіл, галоген-С1-С6-алкіл, С1-С6-алкокси, карбоксі-С1-С6-алкіл або карбоксіарил;
або фармацевтично прийнятні солі, гідрати або сольвати такої сполуки.
4. Сполука за пп. 1-3, вибрана з наступних:
6-метил-2-фенілетинілпіридин-3-іламін,
2-(3-фторфенілетиніл)-6-метилпіридин-3-іламін,
2-(3-метоксифенілетиніл)-6-метилпіридин-3-іламін,
6-метил-2-піридин-3-ілетинілпіридин-3-іламін,
2-(4-фторфенілетиніл)-6-метилпіридин-3-іламін,
2-(3,5-дифторфенілетиніл)-6-метилпіридин-3-іламін,
2-(5-фторпіридин-3-ілетиніл)-6-метилпіридин-3-іламін,
3-(3-аміно-6-метилпіридин-2-ілетиніл)бензонітрил,
2-(5-хлорпіридин-3-ілетиніл)-6-метилпіридин-3-іламін,
2-(3-хлорфенілетиніл)-6-метилпіридин-3-іламін,
2-(3-фторфенілетиніл)-4,6-диметилпіридин-3-іламін,
2-(3-хлорфенілетиніл)-4,6-диметилпіридин-3-іламін,
та їх фармацевтично прийнятні солі.
5. Фармацевтична композиція, що містить терапевтично ефективну кількість сполуки відповідно до пунктів 1-4 та фармацевтично прийнятний носій та/або наповнювач.
6. Фармацевтична композиція за п. 5, в якій використовують 3-аміно-4-хлор-6-метил-2-(2-фенілетиніл)піридин.
7. Спосіб лікування або попередження станів у ссавців, включаючи людину, якщо таке лікування або попередження пов'язане з нейромодуляторним ефектом антагоністів mGluR5 або посилюється ним, що полягає у введенні ссавцю, який потребує такого лікування або попередження, ефективної кількості сполуки відповідно до пунктів 1-4.
8. Спосіб за п. 7, в якому використовують 3-аміно-4-хлор-6-метил-2-(2-фенілетиніл)піридин.
9. Спосіб лікування або попередження розладів центральної та периферичної нервової системи, вибраних з наступних: нечутливість або залежність, депресія, біполярний розлад, психіатричні хвороби, такі як: психотичні розлади, дефіцит уваги, гіперактивний розлад, хвороба Паркінсона, погіршення пам'яті, хвороба Альцгеймера, деменція, алкогольний делірій, нейродегенерація, нейротоксичність, ішемія, що полягає у введенні ссавцю, який потребує такого лікування або попередження, ефективної кількості сполуки відповідно до пунктів 1-4.
10. Спосіб за п. 9, в якому використовують 3-аміно-4-хлор-6-метил-2-(2-фенілетиніл)піридин.
11. Спосіб лікування або попередження болю при запаленні або невропатії, що полягає у введенні ссавцю, який потребує такого лікування або попередження, ефективної кількості сполуки відповідно до пунктів 1-4, яка суттєво не проникає у центральну нервову систему.
12. Спосіб за п. 11, в якому використовують 3-аміно-4-хлор-6-метил-2-(2-фенілетиніл)піридин.
13. Спосіб лікування або попередження нечутливості або залежності, булімії, анорексії, залежності від азартних ігор, тютюнопаління, сексуальних залежностей, синдрому відміни речовини або нав'язливих станів, що полягає у введенні ссавцю, який потребує такого лікування або попередження, ефективної кількості сполуки відповідно до пунктів 1-4.
14. Спосіб за п. 13, в якому використовують 3-аміно-4-хлор-6-метил-2-(2-фенілетиніл)піридин.
15. Спосіб лікування або попередження зловживання або залежності від нікотину, кокаїну, амфетаміну, бензодіазепінів, опіатів та алкоголю, що полягає у введенні ссавцю, який потребує такого лікування або попередження, ефективної кількості сполуки відповідно до пунктів 1-4.
16. Спосіб за п. 15, в якому використовують 3-аміно-4-хлор-6-метил-2-(2-фенілетиніл)піридин.
17. Спосіб лікування або попередження тривожних та панічних станів, фобій, посттравматичного стресу, генералізованої тривоги, гострого стресу, що полягає у введенні ссавцю, який потребує такого лікування або попередження, ефективної кількості сполуки відповідно до пунктів 1-4.
18. Спосіб за п. 17, в якому використовують 3-аміно-4-хлор-6-метил-2-(2-фенілетиніл)піридин.
19. Спосіб лікування або попередження мігрені, що полягає у введенні ссавцю, який потребує такого лікування або попередження, ефективної кількості сполуки відповідно до пунктів 1-4.
20. Спосіб за п. 19, в якому використовують 3-аміно-4-хлор-6-метил-2-(2-фенілетиніл)піридин.
21. Застосування сполуки формули І-А відповідно до пунктів 1-4 для приготування ліків для лікування або попередження станів у ссавців, якщо таке лікування або попередження пов'язане з або посилюється нейромодуляторним ефектом антагоністів mGluR5.
22. Застосування за п. 21, де сполукою формули І-А є 3-аміно-4-хлор-6-метил-2-(2-фенілетиніл)піридин.
Текст
1. Сполука формули: R3 3 81464 4 6-метил-2-піридин-3-ілетинілпіридин-3-іламін, 2-(4-фторфенілетиніл)-6-метилпіридин-3-іламін, 2-(3,5-дифторфенілетиніл)-6-метилпіридин-3іламін, 2-(5-фторпіридин-3-ілетиніл)-6-метилпіридин-3іламін, 3-(3-аміно-6-метилпіридин-2-ілетиніл)бензонітрил, 2-(5-хлорпіридин-3-ілетиніл)-6-метилпіридин-3іламін, 2-(3-хлорфенілетиніл)-6-метилпіридин-3-іламін, 2-(3-фторфенілетиніл)-4,6-диметилпіридин-3іламін, 2-(3-хлорфенілетиніл)-4,6-диметилпіридин-3іламін, та їх фармацевтично прийнятні солі. 5. Фармацевтична композиція, що містить терапевтично ефективну кількість сполуки відповідно до пунктів 1-4 та фармацевтично прийнятний носій та/або наповнювач. 6. Фармацевтична композиція за п. 5, в якій використовують 3-аміно-4-хлор-6-метил-2-(2фенілетиніл)піридин. 7. Спосіб лікування або попередження станів у ссавців, включаючи людину, якщо таке лікування або попередження пов'язане з нейромодуляторним ефектом антагоністів mGluR5 або посилюється ним, що полягає у введенні ссавцю, який потребує такого лікування або попередження, ефективної кількості сполуки відповідно до пунктів 1-4. 8. Спосіб за п. 7, в якому використовують 3-аміно4-хлор-6-метил-2-(2-фенілетиніл)піридин. 9. Спосіб лікування або попередження розладів центральної та периферичної нервової системи, вибраних з наступних: нечутливість або залежність, депресія, біполярний розлад, психіатричні хвороби, такі як: психотичні розлади, дефіцит уваги, гіперактивний розлад, хвороба Паркінсона, погіршення пам'яті, хвороба Альцгеймера, деменція, алкогольний делірій, нейродегенерація, нейротоксичність, ішемія, що полягає у введенні ссавцю, який потребує такого лікування або попередження, ефективної кількості сполуки відповідно до пунктів 1-4. 10. Спосіб за п. 9, в якому використовують 3-аміно4-хлор-6-метил-2-(2-фенілетиніл)піридин. 11. Спосіб лікування або попередження болю при запаленні або невропатії, що полягає у введенні ссавцю, який потребує такого лікування або попередження, ефективної кількості сполуки відповідно до пунктів 1-4, яка суттєво не проникає у центральну нервову систему. 12. Спосіб за п. 11, в якому використовують 3аміно-4-хлор-6-метил-2-(2-фенілетиніл)піридин. 13. Спосіб лікування або попередження нечутливості або залежності, булімії, анорексії, залежності від азартних ігор, тютюнопаління, сексуальних залежностей, синдрому відміни речовини або нав'язливих станів, що полягає у введенні ссавцю, який потребує такого лікування або попередження, ефективної кількості сполуки відповідно до пунктів 1-4. 14. Спосіб за п. 13, в якому використовують 3аміно-4-хлор-6-метил-2-(2-фенілетиніл)піридин. 15. Спосіб лікування або попередження зловживання або залежності від нікотину, кокаїну, амфетаміну, бензодіазепінів, опіатів та алкоголю, що полягає у введенні ссавцю, який потребує такого лікування або попередження, ефективної кількості сполуки відповідно до пунктів 1-4. 16. Спосіб за п. 15, в якому використовують 3аміно-4-хлор-6-метил-2-(2-фенілетиніл)піридин. 17. Спосіб лікування або попередження тривожних та панічних станів, фобій, посттравматичного стресу, генералізованої тривоги, гострого стресу, що полягає у введенні ссавцю, який потребує такого лікування або попередження, ефективної кількості сполуки відповідно до пунктів 1-4. 18. Спосіб за п. 17, в якому використовують 3аміно-4-хлор-6-метил-2-(2-фенілетиніл)піридин. 19. Спосіб лікування або попередження мігрені, що полягає у введенні ссавцю, який потребує такого лікування або попередження, ефективної кількості сполуки відповідно до пунктів 1-4. 20. Спосіб за п. 19, в якому використовують 3аміно-4-хлор-6-метил-2-(2-фенілетиніл)піридин. 21. Застосування сполуки формули І-А відповідно до пунктів 1-4 для приготування ліків для лікування або попередження станів у ссавців, якщо таке лікування або попередження пов'язане з або посилюється нейромодуляторним ефектом антагоністів mGluR5. 22. Застосування за п. 21, де сполукою формули ІА є 3-аміно-4-хлор-6-метил-2-(2фенілетиніл)піридин. Щодо сполук піридину існують численні літературні дані, однак дуже мала їх частка стосується похідних 3-аміно-2-арилалкініл- та 3аміно-2-гетероарилалкінілпіридинів, які є агентами винаходу. Представлений винахід стосується заміщених 3-аміноарилалкінілпіридинівта3аміногетероарилалкінілпіридинів. [Патент США №6,384235В2 та Rodriguez et al. (Angewandte Chemie, International Edition 2000, 39, 14, 2488-2490] описують 3-аміно-2фенілетинілпіридини як синтетичні проміжні сполуки. В публікації [міжнародної заявки WO 99/40091] згадані деякі 3-аміно-2 фенілетинілпіридини як проміжні сполуки для синтезу, що підлягають наступній циклізації. [Міжнародна заявка WO 99/02497] описує деякі 2гетероалкінілпіридини як модулятори mGluR рецепторів та дуже широкий спектр подібних сполук. Однак жодна з конкретно наведених сполук не належить до 3-аміно-2-арил- або гетероарилетинілпіридинів. [Заявка WO 02/46166] описує різноманітні сполуки загальної формули феніл-А-В як антагоністи mGluR, але серед них немає фенілетинілпіридинів. Вже відомою сполукою серед mGluR5 лігандів є 2-метил-6фенілетинілпіридин (МРЕР), але він має низьку 5 81464 біодоступність та селективність [R. Kuhn et al. Amino Acids, 2002, 23, 207-211; N.D.P. Costard et al. J. Med. Chem. 2003, 46, 204-206]. [Патент США 6,187,777] описує 3-аміно-4хлор-6-метил-2-(2-фенілетиніл)піридин як інтермедіат для синтезу сполук, що модулюють поведінку при годуванні. Виявилось, що сполуки амінопіридину, які є предметом цього винаходу, мають напрочуд сильну активність і селективність до mGluR5 рецептора та демонструють переважні властивості порівняно до сполук з відомого рівня техніки. Спостерігали поліпшення однієї, або більшої кількості таких наступних характеристик сполук винаходу як: селективність до мішені, розчинність, біодоступність, проникнення до мозку, активність для моделювання поведінки при психіатричних та неврологічних розладах. Ці сполуки можуть використовува тись для лікування або попередження mGluR5 опосередкованих розладів. L-глутамат є головним збуджуючим нейромедіатором мозку ссавців і діє через два гетерогенні типи рецепторів: а саме іонотропні та метаботропні рецептори глутамату (mGluR) [Nakanishi C. et al. 1998, Brain Res. Brain Res. Rev., 26: 230-235]. До сьогодні клонували вісім підтипів mGluR, які класифікували до трьох груп на основі подібності послідовностей та фармакологічних властивостей. mGluR1 and mGluR5 належать до групи І, і ініціюють клітинні відповіді через механізм опосередкований G-протеїном, сполучаються з фосфоліпазою С та стимулюють гідроліз фосфоінозитиду [Schoepp D.D. et al. 1999, Neuropharmacology, 38: 1431-1476]. Протеїн mGluR5 рецептора локалізований периферично в структурах, що беруть участь у ноцицептивній передачі, а останні відкриття припускають, що антагоністи mGluR5 можуть використовува тись для лікування болю при запаленнях, невропатичного, хронічного та гострого болю [В.A. Chizh in Amino Acids 2002, 23, 169-176]. ЦНС також має велику кількість mGluR5 рецепторів, якими скрізь насичені кора головного мозку, гіпокампу, шкарлупи хвостатого ядра (caudate-putamen) і nucleus accumbens. Вважають, що ці ділянки мозку залучені в емоційному та мотиваційному процесах, і тому mGluR5 рецептор розглядають як потенційну мішень при лікуванні психіатричних та неврологічних розладів. Захворюваннями, які успішно лікують є психоз, епілепсія, шизофренія, хвороба Альцгеймера, розлади інтелектуального мислення, склероз, хвороба Паркінсона, гіпоксія, ішемія, деменція, причиною якої є СНІД, мігрень, депресія, порушення настрою та тривожні стани. Також показанням до лікування є залежності від нікотину, кокаїну, амфетаміну, бензодіазепінів, опіатів та алкоголю, булімія та анорексія, залежність від азартних ігор, тютюнопаління, сексуальні залежності або нав'язливі стани [Brauner-Osbome Η. et al., 2000, J. Med. Chem. 43: 2609-45; Bordi F., Ugolini A. 1999, Prog. Neurobiol. 59: 55-79; Spooren W. et al. 2003, Behav. Pharmacol.: 14: 257-77]. 6 Представлений винахід стосується методу лікування або попередження станів у ссавців, включаючи людину, якщо таке лікування або попередження пов'язане з або посилюється нейромодуляторним ефектом антагоністів mGluR5. Даний винахід стосується нових похідних амінопіридину, та їх застосування. Ці сполуки можна представити такою загальною формулою: де R1 це метил R2 та R3 незалежно вибирають з таких груп: водень, галоген, нітро, С2-С6-алкіл; R4 це R6 та R7 можуть бути однаковими, або різними, такими як водень або група формули -X-R8, де X це =CH-N(R 8)2 a R8 це водень, C1-C6-алкіл, галоген-C1-C6-алкіл, арил, арил-C1-C6-алкіл, гетероарил або гетероарил-C1-C6-алкіл; R5 представляє собою групу наступної формули де R9, R10, R11 , R12 та R13 незалежно є такими групами як водень, галоген, ціано, нітро, C1-C6алкіл, галоген-C1-C6-алкіл, C1-C6-алкокси, карбокси-C1-C6-алкіл або карбоксиарил; R14 та R15 незалежно є такими групами як визначено вище для R9 - R13; або фармацевтично прийнятні солі, гідрати або сольвати таких сполук для попередження або лікування розладів центральної нервової системи (ЦНС) та інших порушень, які модулюють mGluR5 рецептори. Сполука 3-аміно-4-хлор-6-метил-2-(2фенілетиніл)піридин як така не входить до складу винаходу. У вищезгаданому визначенні термін "C1-C6алкіл" охоплює такі групи як метил, етил, пропіл, ізопропіл, бутил, ізобутил, emop-бутил, трет-бутил, пентил, ізопентил, неопентил, трет-пентил, гексил або подібні. Термін "Гідрокси-C1-C6-алкіл" охоплює такі групи як гідроксиметил, 2-гідроксиетил, 3гідроксипропіл, 4-гідроксибутил, 5-гідроксипентил, 6-гідроксигексил та подібні. Термін "C1-C6-алкокси" охоплює такі групи як метокси, етокси, пропокси, ізопропокси, бутокси, 7 81464 ізобутокси, трет-бутокси, пентилокси, гексилокси або подібні. Термін "Галоген" охоплює такі атоми як фтор, хлор та йод. Термін "Галоген-C1-C6-алкіл" охоплює такі групи як хлорметил, дихпорметил, трихлорметил, фторметил, дифторметил, трифторметил, бромметил, 1-хлоретил, 1,1-дихлоретил, 2хлоретил, 2,2,2-три хлоретил, 1-фторетил, 1,1дифторетил, 2-фторетил, 2,2,2-трифторетил, 2брометил, 3-хлорпропіл, 3-фторпропіл, 3бромпропіл та подібні. "Термін Галоген-C1-C6алкокси" охоплює такі групи як хлорметокси, фторметокси, дифторметокси, трифторметокси, 2фторетокси, 2,2,2-трифторетокси та подібні. Термін "Карбокси-C1-C6-алкіл" охоплює такі групи як карбоксиметил, 2-карбоксиетил, 3карбоксипропіл, 4-карбоксибутил, 5карбоксипентил, 6-карбоксигексил або подібні. Термін "Арил" о хоплює С 6-С10-арильні групи такі як феніл, 1-нафтил, 2-нафтил та подібні. Термін "Гетероарил" охоплює 5-10 членні гетероциклічні групи що містять від 1 до 4 гетероатомів, таких як кисень, азот або сірка з утворенням таких циклічних радикалів як фурил (фуранове кільце), бензофураніл (бензофуран), тієніл (тіофен), бензотіофеніл (бензотіофен), піроліл (пірольне кільце), імідазоліл (імідазольне кільце), піразоліл (піразольне кільце), тіазоліл (тіазольне кільце), ізотіазоліл (ізотіазольне кільце), тріазоліл (триазольне кільце), тетразоліл (тетразольне кільце), піридил (піридинове кільце), піразиніл (піразинове кільце), піримідиніл (піримідинове кільце), піридазиніл (піридазинове кільце), індоліл (індольне кільце), ізоіндоліл (ізоіндольне кільце), бензімідазоліл (бензімідазольне кільце), пурил (пуринове кільце), хіноліл (хінолінове кільце), фталазиніл (фталазинове кільце), нафтиридиніл (нафтиридинове кільце), хіноксалініл (хіноксалінове кільце), цинноліл (циннолінове кільце), птеридиніл (птеридинове кільце), оксазоліл (оксазольне кільце), ізоксазольне (ізоксазольне кільце), бензоксазоліл (бензоксазольне кільце), фуразаніл (фуразанове кільце) та подібні. Термін "Гетероарил-C1-C6-алкіл" охоплює групи де прикладом гетероарилу є радикали, перелічені у попередньому визначенні, такі як 2фурилметил, 3-фурилметил, 2-тієнілметил, 3тіенілметил, 2-імідазолілметил, 2-тіазолілметил, 2піридилметил, 3-піридилметил, 4-піридилметил, 2хінолілметил та подібні. Переважними сполуками даного винаходу є сполуки формули 1-А наведені нижче: де R2 та R3 незалежно вибирають з таких груп: водень, C1-C6-алкіл; R5 представляє формули 8 собою групу наступної де R9, R10, R11 , R12 та R13 незалежно є такими групами як водень, галоген, ціано, нітро, C1-C6алкіл, галоген-C1-C6-алкіл, C1-C6-алкокси, карбокси-C1-C6-алкіл або карбоксиарил; R14 та R15 незалежно є такими групами як визначено вище для R9 - R13; або фармацевтично прийнятні солі, гідрати або сольвати таких сполук. Більша перевага у даному винаході надається сполукам І-В наведеним нижче: де R2 та R3 незалежно вибирають з таких груп: водень, C1-C6-алкіл; R9, R10, R11 , R12 тa R13 незалежно є такими групами як водень, галоген, ціано, нітро, C1-C6алкіл, галоген-C1-C6-алкіл, C1-C6-алкокси, карбокси-C1-C6-алкіл або карбоксиарил; або фармацевтично прийнятні солі, гідрати або сольвати таких сполук. Особливу перевагу у даному винаході мають сполуки формули сполуки формули І-С: де R2 та R3 незалежно вибирають з таких груп: водень, C1-C6-алкіл; Ru та Ri5 незалежно є такими групами як водень, галоген, ціано, нітро, C1-C6-алкіл, галогенC1-C6-алкіл, C1-C6-алкокси, карбокси-C1-C6-алкіл або карбоксиарил; або фармацевтично прийнятні солі, гідрати або сольвати таких сполук. Специфічно переважними сполуками є наступні: 6-Метил-2-фенілетинілпіридин-3-іламін 9 81464 N,N-Диметил-N'-(6-метил-2фенілетинілпіридин-3-іл)формамідин 2-(3-Фторфенілетиніл)-6-метилпіридин-3іламін 2-(3-Метоксифенілетиніл)-6-метилпіридин-3іламін 6-Метил-2-піридин-3-ілетинілпіридин-3-іламін 2-(4-Фторфенілетиніл)-6-метилпіридин-3іламін 2-(3,5-Дифторфенілетиніл)-6-метилпіридин-3іламін 2-(5-Фторпіридин-3-ілетиніл)-6-метилпіридин3-іламін 3-(3-Аміно-6-метилпіридин-2ілетиніл)бензонітрил 2-(5-Хлорпіридин-3-ілетиніл)-6-метилпіридин3-іламін 2-(3-Хлорфенілетиніл)-6-метилпіридин-3іламін 2-(3-Фторфенілетиніл)-4,6-диметилпіридин-3іламін 2-(3-Хлорфенілетиніл)-4,6-диметилпіридин-3іламін Даний винахід стосується фармацевтично придатних кислотно-адитивних солей сполук формули (І) або композицій, що містять сполуки формули (І) разом з фармацевтично прийнятними носіями та наповнювачами. Представлений винахід стосується методу лікування або попередження станів у ссавців, включаючи людину, якщо таке лікування або попередження пов'язане з або посилюється нейромодуляторним ефектом антагоністів mGluR5. Даний винахід стосується способу, який використовують для лікування і попередження розладів центральної та периферичної нервової системи, обраних з наступних: нечутливість до або залежність від хімічних препаратів, тривожні стани, депресія, порушення настрою, психіатричні хвороби, такі як: психоз, біль при запаленні та невропатії, склероз, хвороба Альцгеймера, хвороба Паркінсона, мігрень, ішемія, медикаментозна та наркотична залежність. Даний винахід стосується фармацевтичних композицій, які містять від приблизно 0,01 до 1000мг активної речовини на одиницю дози. Композиції можуть бути призначені будь-яким з відомих способів. Наприклад, орально у формі капсул, тощо, парентерально у формі розчинів для ін'єкцій, місцево в формі мазей або лосьйонів, інокулярно в формі очних крапель, ректально у формі супозиторіїв, інтраназально або крізь шкіру в формі таких систем доставки, як пластир. Фармацевтичні композиції відповідно до винаходу можуть бути приготовлені традиційними методами, відомими в цій галузі; природа фармацевтичної композиції, що використовується буде залежати від бажаного застосування. Сумарна добова доза знаходиться в діапазоні від 0,05 до 2000мг. Винахід також передбачає використання відповідно зазначених вище сполук або композицій для виробництва медикаментів для лікування або попередження передбачених станів. 10 Сполуки Формули І можуть бути одержані за загальними методиками синтезу, як наведено нижче. Схема 1 ілюструє синтез сполук формули І взаємодією похідного алкіну, наприклад етинілбензолу, з заміщеним амінопіридином (або попередником), наприклад 2-бром-6метилпіридин-3-іламіном. Позначені на Схемі 1 радикали R1, R2, R3, R 5, R6 та R7 є такими як зазначено вище та Q включає галогени такі як СІ, Вr, І або трифторметансульфонільну та паратолуолсульфонільну групу. Цей загальний синтетичний підхід наведений у [М.Н. Norman et al. J. Med. Chem. 2000, 43, 4288-4312]. Схема 1 Каталізована паладієм реакція сполучення потребує таких каталізаторів як PdCI2(PPh3)2, Pd(PPh3)4, Pd(OAc) 2 або Pd на вугіллі у придатному розчиннику, такому як ДМФА, ацетонітрил або бензол. Зазвичай, у реакційній суміші присутній співкаталізатор такий як йодид міді(І) та основа (наприклад, триетиламін, діізопропіламін, КОАс, ...). Реакцію сполучення типово проводять при повільній зміні температури від 0° до кімнатної, або нагрівають до температури десь від 30°С та 150°С. Реакційну суміш підтримують при зручній температурі протягом від 1 до 24 годин, зазвичай буває достатньо 12 годин. Продукт реакції виділяють та очищують використовуючи стандартні методи, такі як екстракція, хроматографія, кристалізація, перегонка, сублімація та подібні. У іншому втіленні даного винаходу, зображеному на Схемі 2, алкінілзаміщений амінопіридин (або попередник) вступає в реакцію з сполукою, яка має реакційну функціональну групу Q як зазначено вище. Схема 2 Стосовно Схеми 2, замісники R1, R2, R3, R5, R6, R7, Q, каталізатори та умови реакції є такими, як наведено для Схеми 1. Інше втілення даного винаходу проілюстроване на Схемі 3. Заміщений амінопіридин (або попередник) вступає в реакцію з похідним алкену, як описано у [С Niu et al. Tetrahedron, 1998, 54, 6311-6318], за методикою, схожою на процедуру, наведену для С хеми 1. Схема 3 11 81464 Похідне алкену продукт реакції, представленої на Схемі 3, може бути перетворений на похідне алкіну за допомогою підходу, наведеного на Схемі 4. Схема 4 Це синтетичне перетворення проводять за методиками, наведеними у [G.R. Newkome et al. J. Org. Chem. 1980, 45, 4380-4385 або F. Gasparini et al. Bioorg. Med. Chem. Lett. 2002, 12, 407-410]. Для галогенування похідних алкенів можуть застосовуватись такі агенти як хлор або бром в СНСІ3 або ССl4. Одержані галогенвані похідні потім обробляють основою, наприклад, NaOH, KОН або KОtВu, яка сприяє подвійному елімінуванню з утворенням алкіну. Реакцію здійснюють у таких розчинниках як етанол, третбутанол, ТГФ, та подібних, при прийнятній температурі, як правило в діапазоні між 0°С та 150°С. У іншому втіленні даного винаходу, заміщений амінопіридин (або попередник) вступає в реакцію з альдегідом з утворенням заміщеного алкену за методикою, розробленою [D. Guay et al. Bioorg. Med. Chem. Lett. 1998, 8, 453-458]. (Схема 5) Схема 5 Літерою G на Схемі 5 позначені групи PR3 або P(O)(OR)2. Реакцію проводять зі зручним каталізатором у присутності таких основ як KН, NaH, н-бутиллітій, та подібні у ТГФ, ацетонітрилі, бензолі, та подібних при прийнятній температурі, як правило в діапазоні між приблизно 0°С та 150°С. У іншому втіленні даного винаходу, заміщений гетероциклічний альдегід вступає в реакцію зі сполукою, що містить активовану метиленову груп у з утворенням заміщеного алкену за процедурою наведеною у [М. Cushman et al. J. Med. Chem. 1991, 34, 2579-2588]. (Схема 6) Схема 6 12 У процесі на Схемі 6, замісник G, каталізатори та умови реакцій є такими як наведено для Схеми 5. Алкени - продукти реакцій, зображених на Схемі 5 та Схемі 6 перетворюють на алкіни з використанням реагентів та умов як для процесу на Схемі 4. Заміщені амінопіридини формули 1-А одержують з відповідних нітропіридинів шляхом селективного відновлення нітрогрупи за методом, описаним у [С. Glase et al. J. Med. Chem. 1996, 39, 3179-3187], використовуючи як відновник Fe та водний НСІ. За реакціями наведеними на Схемах з 1 по 6 можливо синтезувати сполуки з вільною аміногрупою, коли R6 та R7 є воднем. Наступне перетворення сполук винаходу в амідини здійснюють за стандартними методиками перетворення вільних амінів, відомих спеціалістам у даній галузі. Сполуки Формули І, основні за природою, можуть утворювати широкий ряд різноманітних фармацевтично прийнятних солей з різними неорганічними та органічними кислотами. Такі солі легко утворюються при додаванні до основних сполук по суті еквіваленту обраної мінеральної або органічної кислоти у придатному органічному розчиннику, такому як метанол, етанол або ізопропанол. Фармакологія Деякі сполуки Формули І були протестовані за наступними методами. Аналіз зв'язування mGluR5 Спорідненість сполук винаходу вивчали використовуючи техніку зв'язування з радіолігандом, використовуючи цілий мозок криси та мічений тритієм 2-метил-6-фенілетинілпіридин як ліганд, дотримуючись методів, подібних до описаних у [F. Gasparini et al. Bioorg. Med. Chem. Lett. 2002, 12, 407-409 та у J. F. Anderson et al. J. Pharmacol. Exp. Ther. 2002,303, 3,1044-1051]. Підготовка мембран: З мозку крис лінії Sprague-Dawiey (Charles River Laboratories, L'Arbresle, France) вагою 200300 грам препарували кору. Тканини гомогенізували у 10-кратній за об'ємом кількості крижаного 50мМ Hepes-NaOH (рН7,4) використовуючи гомогенізатор Polytron (Kinematica AG, Luzern, Switzerland) з наступним центрифугуванням протягом 30 хвилин при 40,000g (4°С). Супернатант відкидали, а осад промивали двічі ресуспендуванням у 10 об'ємах 50мМ Hepes-NaOH. Далі мембрани осаджували центрифугуванням і перед останнім ресуспендуванням промивали у 10 об'ємах 20мМ Hepes-NaOH, рН7,4. Концентрацію протеїну визначали за Бредфордом (Bio-Rad protein assay, Reinach, Switzerland), використовуючи як стандарт порівняння сироватку бичачого альбуміну. Експерименти зі зв'язування [3H]-MPEP Мембрани пом'якшували та ресуспендували у зв'язуючому буфері, який містив 20мМ HEPESNaOH, 3мМ МgСІ2, 100мМ NaCI, рН7,4. Конкурентні дослідження проводили шляхом інкубування протягом 1 години при 4°С: 3нМ [3H] 13 81464 MPEP (46,85Кі/ммоль, Tocris, Cookson Ltd, Bristol, U.K.), 50мкг мембран та випробовувані сполуки у концентраціях в діапазоні 0,03нМ - 30мкМ при повному реакційному об'ємі 300мкл. Неспецифічне зв'язування визначали використовуючи 30мкМ МРЕР. Реакцію переривали швидким відфільтровуванням крізь скловолоконні фільтрувальні пластинки (Unifilter 96-well GF/B filter plates, Perkin-Elmer, Schwerzenbach, Switzerland) використовуючи 4 пo 400мкл крижаного буферу та культиватор клітин (Filtermate, Perkin-Elmer, Downers Grove, USA). Радіоактивність визначали за допомогою рідинної сцинтиляційної спектрометрії, з використанням 96-лункового планшетного рідера (TopCount, Perkin-Elmer, Downers Grove, USA). Аналіз даних Криві інгібування генерували використовуючи програму Prism GraphPad (Graph Pad Software Inc, San Diego, USA). Визначення робили на основі даних, отриманих з 8-точкової концентраційної кривої, побудованої з використанням методу нелінійного регресійного аналізу. Профіль In-vitro селективності Сполуки винаходу демонструють підвищену селективність до mGluR5 рецептора. Це вказує на більшу специфічність та більш надійний профіль селективності. ln-vivo Сполуки винаходу є ефективними в моделях, які демонструють придатність сполук для лікування невропатичного болю при запаленнях [В.A. Chizh, Amino Acids 2002, 23, 169-176], тривожних станів [W.P.J.M. Spooren et al. J. Pharmacol. Exp. Ther. 2000, 295, 3,1267-1275; W.P.J.M. Spooren et al. Eur. J. Pharmacol. 2002, 435, 161-170], хвороби Паркінсона [Ν. Breysse et al. J. Neurosd. 2003, 10, 23, 23, 8302-8309], мігрені [P. De Vries et al. 1999, 375, 61-74], депресії [I.A. Paul, P. Skolnick, Ann. N. Y. Acad. Sci. 2003, 1003, 250-72] та наркозалежностей [Ν. Ε. Paterson et al. Psychopharmacology 2003, 167, 257-264; С Chiamulera et al. Nature Neurosci. 2001, 4, 9, 873874]. Сполуки цього винаходу демонструють високу селективність та спорідненість до mGluR5 рецептора. Як функціональні антагоністи, вони є корисними для виготовлення медикаментів, а особливо для лікування та попередження розладів центральної нервової системи та інших порушень, які модулює цей рецептор. Несуттєві відхилення не вважаються такими що виходять за рамки винаходу. Очевидно що спеціалісти в цій галузі зможуть вносити корективи у викладення даного винаходу. Наступні приклади ілюструють винахід, при цьому не обмежуючи його. Фізичні дані для наведених у прикладах сполук узгоджуються з наданими ним структурними формулами. Приклади Всі вихідні сполуки, якщо не зазначене інше, отримували з комерційних джерел та використовували без попереднього очищення. Наступні скорочення можуть використовува тись у прикладах, або тексті опису. 14 Всі реакцій проводили в інертній атмосфері при кімнатній температурі, якщо не зазначене інше. 1 Н ЯМР спектри були записані на приборі Bruker ARX400 або на Bruker 500МГц. Хімічні зсуви виражені у мільйонних долях (м.д., δ одиниці). Константи спін-спінової взаємодії виражені в Герцах (Гц). Розщеплення сигналів, визначені за видимою мультиплетністю, позначаються як с (синглет), д (дублет), т (триплет), q (квартет) та м (мультиплет). РХ-МС спектри записували на приборі Waters Micromass ZQ 2996 при таких наступних умовах: Колонка 3,0´50mm з нержавіючої сталі напакована 5мкм XTerra RP С-18; швидкість потоку 0,8мл/хв.; мобільна фаза: А фаза =0,07% розчин мурашиної кислоти у воді, В фаза =0,07% розчин мурашиної кислоти в ацетонітрилі. 0-0,5хв. (А: 95%, В: 5%), 0,5-6,0хв. (А: 0%, В: 100%), 6,0-6,5хв. (А: 95%, В: 5%), 6,5-7хв. (А: 95%, В: 5%); УФ детектування діодного випромінення: 200-400нм; Об'єм впорскування: 5мкл. Всі мас-спектри були зняті за допомогою методу електроспрей іонізації (ESI). Температури плавлення визначали на апараті Buchi B-540. За перебігом реакцій спостерігали використовуючи метод тонкошарової хроматографії на 0,20мм платівках, вкритих силікагелем (60F254, Merck або G/UV254 Macherey Nagel), які переглядали під УФ світлом. Колонкову флеш-хроматографію здійснювали на силікагелі (220-440меш, Fluka). Приклад 1 6-Метил-2-Фенілетинілпіридин-3іламінугідрохлорид До розчину Cul (10мг, 50мкмоль) у триетиламіні (5мл) додавали 2-бром-6метилпіридин-3-іламін (200мг, 1,07ммоль) та (РРh3)2РdСІ2 (36мг, 50мкмоль). Реакційну суміш охолоджували до 0°С та додавали фенілацетилен (176мкл, 1,60ммоль). Реакційну суміш залишали до набуття нею кімнатної температури, а потім кип'ятили протягом 14 годин. Розчинник випаровували та неочищений залишок очищували за допомогою флеш-хроматографії (гексан/етилацетат 4:1) з одержанням 105мг (0,50ммоль, 47%) 6-метил-2-фенілетинілпіридин-3іламіну у вигляді твердої речовини жовтого кольору. Rf: 0,09 (гексан/етилацетат 4:1). Т. пл.: 154-155°С. 15 1 81464 Н ЯМР (CDCI3, 400МГц) δ: 2,47 (с, 3Н), 4,134,17 (шс, 2Н), 6,93-7,01 (2Н), 7,34-7,39 (3Н), 7,577,63 (2Н). 6-метил-2-фенілетинілпіридин-3-іламін (105мг, 0,50ммоль) розчиняли у СНСІ3 (2мл) та обробляли 1,56мл (1,25ммоль) 0,8Μ розчину хлороводню у діетиловому етері. Після випаровування розчинника залишок розтирали з етилацетатом з одержанням 107мг (0,44ммоль, 87%) вказаного у заголовку гідрохлориду у вигляді твердої речовини жовтуватого кольору. Rf: 0,50 (гексан/етилацетат 1:1). Т. пл.: 183°С. 1 Н ЯМР (ДMCO[D6 ], 400МГц) δ: 2,57 (с, 3Н), 3,20-4,00 (шс, 3Н), 7,51-7,57 (4Н), 7,71 (д, J=8,8Гц, 1Н), 7,80-7,84 (2Н). РХ-МС (ЧУ): 2,14 хв.; МС (ЕС+) m/z: 209,1. Приклад 2 2-(3-Фторфенілетиніл)-6-метилпіридин-3іламінугідрохлорид За тою ж самою процедурою, як описано у Прикладі 1, 2-бром-6-метилпіридин-3-іламін (200мг, 1,07ммоль) вступав в реакцію з (РРh3)2РdСІ2 (36мг, 0,05ммоль), Cul (10мг, 0,05ммоль) та 1-етиніл-3-фторбензолом (148мкл, 1,28ммоль) у триетиламіні (5мл). Неочищений залишок очищували за допомогою флешхроматографії (гексан/етилацетат 4:1) з одержанням 145мг (0,64ммоль, 60%) 2-(3фтор фенілетиніл)-6-метилпіридин-3-іламіну у вигляді твердої речовини блідо-жовтого кольору. Гідрохлорид 2-(3-фторфенілетиніл)-6метилпіридин-3-іламіну синтезували як описано у Прикладі 1 з одержанням 148мг (0,56ммоль, 88%) вказаного у заголовку гідрохлориду у вигляді твердої речовини жовтого кольору. Rf: 0,52 (гексан/етилацетат 1:1). Т. пл.:199-200°С(роз.). 1 Н ЯМР (ДМСО[D6 ], 400МГц) δ: 2,52 (с, 3Н), 6,20-7,24 (шс, 2Н), 7,35-7,43 (м, 1Н), 7,48 (д, J=8,0Гц, 1Н), 7,52-7,61 (2Н), 7,62-7,67 (м, 1Н), 7,687,72 (м, 1Н). РХ-МС (ЧУ): 2,26 хв.; МС (ЕС+) m/z: 227,1. Аналіз Розраховано для C14H12CIFN2: С 64,01%; Η 4,60%; СІ 13,50%; F 7,23%; Ν 10,66%. Знайдено: С 63,30%; Η 4,62%; С113,56%; F 6,98%; Ν 10,57%. Приклад 3 2-(3-Метоксифенілетиніл)-6-метилпіридин-3іламін. За тою ж самою процедурою, як описано у Прикладі 1, 2-бром-6-метилпіридин-3-іламін (200мг, 1,07ммоль) вступав в реакцію з (РРh3)2РdСІ2 (37мг, 0,05ммоль), Cul (10мг, 0,05ммоль) та 1-етиніл-3-метоксибензолом (204мкл, 1,60ммоль) у триетиламіні (5мл) протягом 1,5 годин. Неочищений залишок очищували за допомогою флеш-хроматографії (гексан/етилацетат 4:1) з одержанням 118мг (0,50ммоль, 46%) 2-(3-метоксифенілетиніл)-6метилпіридин-3-іламіну у вигляді твердої речовини жовто-коричневого кольору. Rf: 0,30 (гексан/етилацетат 1:1). Т. пл.: 165-166°С. 16 1 Н ЯМР (ДМСО[D6 ], 400МГц) δ: 2,60 (с, 3Н), 3,85 (с, 3Н), 7,11-7,16 (м, 1Н), 7,37-7,49 (3Н), 7,56 (д, J=8,4Гц, 1Н), 7,77 (д, J=8,8Гц, 1Н). РХ-МС (ЧУ): 2,31 хв.; МС (ЕС+) m/z: 239,1. Приклад 4 6-Метил-2-піридин-3-ілетинілпіридин-3-іламіну гідрохлорид За тою ж самою процедурою, як описано у Прикладі 1, 2-бром-6-метилпіридин-3-іламін (200мг, 1,07ммоль) вступав в реакцію з (РРh3)2РdСІ2 (37мг, 0,05ммоль), Cul (10мг, 0,05ммоль) та 3-етинілпіридином (110мг, 1,07ммоль) у триетиламіні (1,6мл). Неочищений залишок очищували за допомогою флешхроматографії (ДХМ-ДХМ/МеОН 97:3) з одержанням 100мг (0,48ммоль, 49%) 6-метил-2піридин-3-ілетинілпіридин-3-іламіну у вигляді порошку жовтого кольору. Гідрохлорид 6-метил-2піридин-3-ілетинілпіридин-3-іламіну синтезували як описано у Прикладі 1 з одержанням після розтирання з пентаном 145мг (100%) вказаного у заголовку гідрохлориду у вигляді твердої речовини жовтого кольору. Т. пл.: 156,4-158°С. 1 Н ЯМР (ДМСО[D6 ], 500МГц) δ: 2,54 (с, 3Н), 7,52 (д, J=9Гц, 1Н), 7,61-7,68 (м, 1Н), 7,69 (д, J=9,0, 1Н), 8,25 (д, J=7,5, 1Н), 8,68-8,86 (шс, 1Н), 8,939,15 (шс, 1Н). РХ-МС (ЧУ): 0,65 хв.; МС (ЕС+) m/z: 210,1. Приклад 5 2-(4-Фторфенілетиніл)-6-метилпіридин-3іламіну гідрохлорид За тою ж самою процедурою, як описано у Прикладі 1, 2-бром-6-метилпіридин-3-іламін (200мг, 1,07ммоль) вступав в реакцію з (РРh3)2РdСІ2 (36мг, 0,05ммоль), Cul (10мг, 0,05ммоль) та 1-етиніл-4-фторбензолом (184мкл, 1,07ммоль) у триетиламіні (5мл). Неочищений залишок очищували за допомогою флешхроматографії (гексан/етилацетат 7:3) з одержанням 164мг (0,72ммоль, 68%) 2-(4фтор фенілетиніл)-6-метилпіридин-3-іламіну у вигляді твердої речовини жовтого кольору. Гідрохлорид 2-(4-фторфенілетиніл)-6метилпіридин-3-іламіну синтезували як описано у Прикладі 1 з одержанням після розтирання з етилацетатом 154мг (0,51ммоль, 71%) вказаного у заголовку гідрохлориду у вигляді твердої речовини жовтого кольору. Rf: 0,43 (гексан/етилацетат 1:1). Т. пл.: 122°С(роз.). 1 Н ЯМР (ДМСО[D6 ], 400МГц) δ: 2,53 (с, 3Н), 4,45-5,54 (шс, 2Н), 7,36-7,43 (2Н), 7,52 (д, J=8,8Гц, 1Н), 7,67 (д, J=8,8Гц, 1Н), 7,82-7,89 (2Н). РХ-МС (ЧУ): 2,24 хв.; МС (ЕС+) m/z: 227,1. Приклад 6 2-(3.5-ДиФторфенілетиніл)-6-метилпіридин-3іламінугідрохлорид За тою ж самою процедурою, як описано у Прикладі 1, 2-бром-6-метилпіридин-3-іламін (800мг, 4,28ммоль) вступав в реакцію з (РРh3)2РdСІ2 (150мг, 0,21ммоль), Cul (41мг, 0,21ммоль) та етинілтриметилсиланом (840мг, 8,55ммоль) у триетиламіні (30мл). Неочищений залишок очищували за допомогою флеш 17 81464 хроматографії (гексан/етилацетат 8:2) з одержанням 330мг (1,61ммоль, 38%) 6-метил-2триметилсилілетинілпіридин-3-іламін у вигляді твердої речовини бежевого кольору. 6-метил-2-триметилсилілетинілпіридин-3іламін (330мг, 1,61ммоль) розчиняли у МеОН (3мл) та охолоджували до 0°С, до одержаного розчину додавали 1Μ розчин NaOH (1,6мл). Крижану баню прибирали та перемішували реакційну суміш при кімнатній температурі протягом 4 годин. Додавали 90мкл оцтової кислоти. Реакційну суміш частково випаровували а залишок екстрагували етилацетатом. Органічні шари промивали водою, насиченим розчином солі, висушували над Na2SO4, відфільтровували та випаровували з одержанням 160мг (1,21ммоль, 75%) 2-етиніл-6метилпіридин-3-іламіну у вигляді твердої речовини коричневого кольору, яку використовували у наступній стадії без додаткового очищення. До розчину Cul (4,3мг, 23мкмоль) у триетиламіні (5мл) додавали 2-етиніл-6метилпіридин-3-іламін (60мг, 0,45ммоль), (РРh3)2РdСІ2 (16мг, 23мкмоль) та 1,3-дифтор-5йодбензол (109мг, 0,45ммоль). Реакційну суміш перемішували при кімнатній температурі протягом 20 годин. Розчинник випаровували з одержанням маслоподібної речовини коричневого кольору, яку переносили у ДХМ та промивали розчин водою. Водну фазу двічі екстрагували ДХМ. Органічні фази висушували над Na2SO 4, відфільтровували та випаровували. Неочищений залишок очищували за допомогою флеш-хроматографії (гексан/етилацетат 7:3) з одержанням 64мг (0,26ммоль, 58%) 2-(3,5-дифторфенілетиніл)-6метилпіридин-3-іламіну у вигляді твердої речовини жовтого кольору. Гідрохлорид 2-(3,5-дифторфенілетиніл)-6метилпіридин-3-іламіну синтезували як описано у Прикладі 1 з одержанням після розтирання з діетиловим етером 64мг (0,20ммоль, 78%) вказаного у заголовку гідрохлориду у вигляді порошку жовтого кольору. Rt: 0,61 (гексан/етилацетат 1:1). Т. пл.:212°С(роз.). 1 Н ЯМР (ДМСО[D6 ], 400МГц) δ: 2,49 (с, 3Н), 6,12-7,08 (шс, 2Н), 7,44-7,55 (2Н), 7,56-7,68 (3Н). РХ-МС (ЧУ): 2,39 хв.; МС (ЕС+) m/z: 245,0. Приклад 7 2-(5-Фторпіридин-3-ілетиніл)-6-метилпіридин3-іламіну гідрохлорид До розчину Cul (11мг, 0,06ммоль) у триетиламіні (5мл) додавали 2-етиніл-6метилпіридин-3-іламін (40мг, 0,30ммоль, описаний у Прикладі 7), (РРh3)2РdСІ2 (21мг, 0,06ммоль), та 3-фтор-5-йодпіридин (111мг, 0,45ммоль). Реакційну суміш перемішували при кімнатній температурі протягом 14 годин. Розчинник випаровували. Неочищений залишок очищували за допомогою флеш-хроматографії (циклогексан/етилацетат 7:3) з одержанням 15мг (66мкмоль, 22%) 2-(5-фторпіридин-3-ілетиніл)-6метилпіридин-3-іламіну у вигляді твердої речовини жовтого кольору. Гідрохлорид 2-(5-фторпіридин-3-ілетиніл)-6метилпіридин-3-іламіну синтезували як описано у 18 Прикладі 1 з одержанням після розтирання з етилацетатом 6мг (20мкмоль, 30%) вказаного у заголовку гідрохлориду у вигляді напівтвердої речовини коричневого кольору. Rf: 0,31 (циклогексан/етилацетат 7:3). РХ-МС (ЧУ): 1,71 хв.; МС (ЕС+) m/z: 228,0. Приклад 8 3-(3-Аміно-6-метилпіридин-2-ілетиніл)бензонітрилу гідрохлорид До розчину Cul (2,4мг, 12мкмоль) у триетиламіні (4мл) додавали 2-етиніл-6метилпіридин-3-іламін (33мг, 0,33ммоль описаний у Прикладі 7), (РРh3)2РdСІ2 (8,8мг, 12мкмоль), та 3йодбензонітрил (57мг, 0,25ммоль). Реакційну суміш перемішували при кімнатній температурі протягом 48 годин. Розчинник випаровували та неочищений залишок очищували за допомогою флеш-хроматографії (циклогексан/етилацетат 1:1) з одержанням 16мг (69мкмоль, 21%) 3-(3-аміно-6метилпіридин-2-ілетиніл)-бензонітрилу у вигляді твердої речовини блідо-жовтого кольору. Гідрохлорид 3-(3-аміно-6-метилпіридин-2ілетиніл)-бензонітрилу синтезували як описано у Прикладі 1 з одержанням після розтирання з діетиловим етером 10мг (33мкмоль, 47%) вказаного у заголовку гідрохлориду у вигляді порошку жовтого кольору. Rf: 0,36 (гексан/етилацетат 1:1). Т.пл.: 132,4-134°С. РХ-МС (ЧУ): 2,13 хв.; МС (ЕС+) m/z: 234,1. Приклад 9 2-(5-Хлорпіридин-3-ілетиніл)-6-метилпіридин3-іламіну гідрохлорид За тою ж самою процедурою, як описано у Прикладі 1, 2-бром-6-метилпіридин-3-іламін (150мг, 0,80ммоль) вступав в реакцію з (РРh3)2РdСІ2 (28мг, 40мкмоль), Cul (8мг, 40мкмоль) та 3-хлор-5-етинілпіридином (165мг, 1,20ммоль) у триетиламіні (5мл). Неочищений залишок очищували за допомогою флеш-хроматографії (гексан/етилацетат 7:3) з одержанням 141мг (0,58ммоль, 72%) 2-(5-хлорпіридин-3-ілетиніл)-6метилпіридин-3-іламіну у вигляді твердої речовини жовтого кольору. Гідрохлорид 2-(5-хлорпіридин-3-ілетиніл)-6метилпіридин-3-іламіну синтезували як описано у Прикладі 1 з одержанням 152мг (0,48ммоль, 83%) вказаного у заголовку гідрохлориду у вигляді твердої речовини жовтого кольору. Rf: 0,12 (гексан/етилацетат 1:1). Т. пл.: 193°С(роз.). 1 Н ЯМР (ДМСО[D6 ], 400МГц) δ: 2,59 (с, 3Н), 5,81-7,41 (шс, 2Н), 7,58 (д, J=8,8Гц, 1Н), 7,73 (д, J=8,8Гц, 1Н), 8,43-8,44 (м, 1Н), 8,79 (д, J=1,6Гц, 1Н), 8,89 (д, J=2,0Гц, 1Н). РХ-МС (ЧУ): 2,03 хв.; МС (ЕС+) m/z: 244,0. Приклад 10 2-(3-Хлорфенілетиніл)-6-метилпіридин-3іламіну гідрохлорид До розчину Cut (5,0мг, 28мкмоль) у триетиламіні (5мл) додавали 2-етиніл-6метилпіридин-3-іламін (75мг, 0,57ммоль описаний у Прикладі 7), (РРh3)2РdСІ2 (20мг, 28мкмоль), та 1хлор-3-йодбензол (135мг, 0,57ммоль). Реакційну суміш перемішували при кімнатній температурі 19 81464 протягом 4 годин. Розчинник випаровували з одержанням олієподібної речовини коричневого кольору, яку переносили у ДХМ та промивали розчин водою. Водну фазу двічі екстрагували ДХМ. Органічні фази висушували над Na2SO4, відфільтровували та випаровували. Неочищений залишок очищували за допомогою флешхроматографії (гексан/етилацетат 7:3) з одержанням 54мг (0,22ммоль, 39%) 2-(3хлорфенілетиніл)-6-метилпіридин-3-іламіну у вигляді твердої речовини жовтого кольору. Гідрохлорид 2-(3-хлорфенілетиніл)-6метилпіридин-3-іламіну синтезували як описано у Прикладі 1 з одержанням після розтирання з діетиловим етером 51мг (0,16ммоль, 73%) вказаного у заголовку гідрохлориду у вигляді порошку жовтого кольору. Rf: 0,57 (гексан/етилацетат 1:1). Т. пл.: 195°С(роз.). 1 Н ЯМР (ДМСО[D6 ], 400МГц) δ: 2,51 (с, 3Н), 6,43-7,11 (шс, 2Н), 7,50 (д, J=8,4Гц, 1Н), 7,52-7,58 (м, 1Н), 7,59-7,69 (2Н), 7,72 (д, J=8,0Гц, 1Н), 7,97 (с, 1Н). РХ-МС (ЧУ): 2,54 хв.; МС (ЕС+) m/z: 243,0. Аналіз Розраховано для C14H12CI2N2×½H 2O: С 58,35%; Η 4,55%; СІ 24,61 %; Ν 9,72%. Знайдено: С 58,15%; Η 4,49%; СІ 24,60%; Ν 9,48%. Приклад 11 2-(3-Фторфенілетиніл)-4,6-диметилпіридин-3іламіну гідрохлорид. До розчину 1,80г (11,0ммоль) 2-хлор-4,6диметилпіридин-3-іламіну (одержаний за методикою як описано у [J. М. Klunder et al. J. Med. Chem., 35, 1992, 1887-1897] в толуолі (10мл) додавали РВr3 (18мл). Реакційну суміш перемішували протягом 48 годин з оберненим холодильником, потім охолоджували, виливали на лід, підлуговували 2М розчином NaOH (400мл) та двічі екстрагували водну фазу етилацетатом. Об'єднані органічні фази промивали насиченим розчином солі, висушували над Na2SO4, відфільтровували та випаровували. Неочищений залишок очищували за допомогою флешхроматографії (циклогексан/етилацетат 7:3) з одержанням 2,31г (38%) 2-бром-4,6диметилпіридин-3-іламіну, який містив невелику кількість 2-хлор-4,6-диметилпіридин-3-іламіну у вигляді маслоподібної речовини жовтого кольору. До розчину Cul (41мг, 0,2ммоль) у триетиламіні (12мл) додавали 2-бром-4,6диметилпіридин-3-іламін (870мг, 4,33ммоль), (PPh3)2PdCI2 (152мг, 0,22ммоль), та 1-етиніл-3фторбензол (500мкл, 4,33ммоль). Реакційну суміш перемішували протягом 30 хвилин при кімнатній температурі та протягом 3 годин з оберненим холодильником. Розчинник випаровували та неочищений залишок очищували за допомогою флеш-хроматографії (циклогексан/етилацетат 4:1) з одержанням 745мг (3,10ммоль, 72%) 2-(3фтор фенілетиніл)-4,6-диметилпіридин-3-іламіну у вигляді твердої речовини коричневого кольору. Гідрохлорид 2-(3-фторфенілетиніл)-4,6диметилпіридин-3-іламіну синтезували як описано у Прикладі 1 з одержанням після розтирання з 20 пентаном 680мг (2,46ммоль, 79%) вказаного у заголовку гідрохлориду у вигляді порошку жовтого кольору. Rf: 0,37 (циклогексан/етилацетат 7:3). Т. пл.: 210°С. 1 Н ЯМР (ДМСО[D6 ], 500МГц) δ: 2,33 (с, 3Н), 2,51 (с, 3Н), 6,31-6,72 (шс, 3Н), 7,36-7,42 (м, 1Н), 7,47 (с, 1Н), 7,53-7,59 (м, 1Н), 7,60-7,63 (м, 1Н), 7,70-7,74 (м, 1Н). РХ-МС (ЧУ): 2,29 хв.; МС (ЕС+) m/z: 241,1. Аналіз Розраховано для C15H14CIFN2: С 65,10%; Η 5,10%; С112,81%; F 6,87%; Ν 10,12%. Знайдено: С 64,73%; Η 4,97%; С112,78%; F 6,71 %; Ν 9,87%. Приклад 12 2-(3-Хлорфенілетиніл)-4.6-диметилпіридин-3іламіну гідрохлорид. До розчину Cul (5,7мг, 30мкмоль) у триетиламіні (1,6мл) додавали 2-бром-4,6диметилпіридин-3-іламін (120мг, 0,60ммоль, описаний у Прикладі 12), (РРh3)2РdСІ2 (21мг, 30мкмоль), та 1-етиніл-3-хлорбензол (98мг, 0,72ммоль). Реакційну суміш перемішували протягом 30 хвилин при кімнатній температурі та протягом 3 годин з оберненим холодильником. Розчинник випаровували та неочищений залишок очищували за допомогою флеш-хроматографії (циклогексан/етилацетат 4:1) з одержанням 39мг (0,15ммоль, 25%) 2-(3-хлорфенілетиніл)-4,6диметилпіридин-3-іламіну у вигляді маслоподібної речовини коричневого кольору. Гідрохлорид 2-(3хлорфенілетиніл)-4,6-диметилпіридин-3-іламіну синтезували як описано у Прикладі 1 з одержанням після розтирання з пентаном 25мг (85мкмоль, 57%) вказаного у заголовку гідрохлориду у вигляді порошку жовтого кольору. Rf: 0,37 (циклогексан/етилацетат 7:3). Т. пл.: 204°С. РХ-МС (ЧУ): 2,56 хв.; МС (ЕС+) m/z: 257,0. Типові приклади рецептур для фармацевтичних композицій винаходу є наступними: 1) Таблетки Сполука з Прикладу 3 від 5 до 50мг Дикальцію фосфат 20мг Лактоза 30мг Тальк 10мг Стеарат магнію 5мг Картопляний крохмаль ad 200мг У цьому прикладі, сполука Прикладу 3 може бути замінена такою ж кількістю будь-якої сполуки, описаної у Прикладах 1-13. 2) Суспензія: Водну суспензію для орального застосування готують таким чином, що кожний мілілітр містить 1-5мг будь-якої сполуки, описаної у Прикладах 113, 50мг натрій карбоксиметилцелюлози, 1мг бензоату натрію, 500мг сорбітола та воду ad 1мл. 3) Для ін'єкцій Парентеральну композицію готують перемішуванням 1,5мас.% активного інгредієнту відповідно до даного винаходу у 10об.% пропіленгліколю та води. 4) Мазь Сполука з Прикладу 3 від 5 до 1000мг 21 81464 Стеариловий спирт 3г Ланолін 5г Медичний вазелін 15г Вода ad 100г У цьому прикладі, сполука Прикладу 3 може бути замінена такою ж кількістю будь-якої сполуки, описаної у Прикладах 1-13. Несуттєві відхилення не вважаються такими що виходять за рамки винаходу. Очевидно що спеціалісти в цій галузі зможуть вносити корективи у викладення даного винаходу. 22
ДивитисяДодаткова інформація
Назва патенту англійськоюNovel aminopyridine derivatives as mgiur5 antagonists
Автори англійськоюBolea Christelle, Mutel Vincent, Rocher Jean-Philippe, Bessis Anne-Sophie, Le Poul Emmanuel
Назва патенту російськоюПроизводные аминопиридина как антагонисты mglur5
Автори російськоюБолеа Кристель, Мютель Венсан, Рошер Жан- Филипп, Бесси Анн-Софи, Ле Пуль Эммануэль
МПК / Мітки
МПК: C07D 213/73, C07D 213/74, A61P 25/00
Мітки: похідні, амінопіридину, mglur5, антагоністи
Код посилання
<a href="https://ua.patents.su/11-81464-pokhidni-aminopiridinu-yak-antagonisti-mglur5.html" target="_blank" rel="follow" title="База патентів України">Похідні амінопіридину як антагоністи mglur5</a>
Попередній патент: Пристрій формування рулону зі скошеної рослинної маси
Наступний патент: Спосіб градуювання датчиків суцільності рідини та пристрій для здійснення способу
Випадковий патент: Ударотривка подвійна обшивка















