Похідні піролідину як антагоністи окситоцину
Номер патенту: 78058
Опубліковано: 15.02.2007
Автори: Валонь Дельфін, Жоран-Лебрен Катрін, Куаттропані Анна, Шварц Маттіас, Дорбе Жером
Формула / Реферат
1. Похідна піролідину формули І:
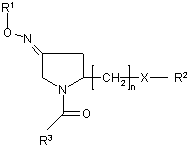 (I)
(I)
її геометричні ізомери, її оптично активні форми, наприклад, енантіомери, діастереомери, їхні суміші та їхні рацемічні форми, а також їхні солі, де:
R1 вибраний з групи, до якої входять або яку складають Н та C1-C6-алкіл;
R2 вибраний з групи, до якої входять або яку складають водень, C1-C6-алкіл, C1-C6-алкіларил, гетероарил, C1-C6-алкілгетероарил, C2-C6-алкеніл, C2-C6-алкеніларил, C2-C6-алкенілгетероарил, C2-C6-алкініл, C2-C6-алкініларил, C2-C6-алкінілгетероарил, С3-С8-циклоалкіл, гетероциклоалкіл, C1-C6-алкілциклоалкіл, C1-C6-алкілгетероциклоалкіл, C1-C6-алкілкарбоксигрупа, ацил, C1-C6-алкілацил, C1-C6-алкілацилоксигрупа, C1-C6-алкілалкоксигрупа, алкоксикарбоніл, C1-C6-алкілалкоксикарбоніл, амінокарбоніл, C1-C6-алкіламінокарбоніл, C1-C6-алкілациламіногрупа, C1-C6-алкілуреїдогрупа, аміногрупа, C1-C6-алкіламіногрупа, сульфонілоксигрупа, C1-C6-алкілсульфонілоксигрупа, сульфоніл, C1-C6-алкілсульфоніл, сульфініл, C1-C6-алкілсульфініл, C1-C6-алкілсульфаніл, C1-C6-алкілсульфоніламіногрупа;
R3 вибраний з групи, до якої входять або яку складають арил та гетероарил;
Х вибраний з групи, яку складають О або NR4;
R4 вибраний з групи, до якої входять або яку складають Н, C1-C6-алкіл, C1-C6-алкіларил, С1-С6-алкілгетероарил, арил, гетероарил; або
R2 та R4 можуть утворювати спільно з атомом азоту, до якого вони приєднані, 5-8-членний насичений або ненасичений гетероциклоалкіл; та
n - ціле число від 1 до 3.
2. Похідна піролідину за п. 1, де R1 - метил.
3. Похідна піролідину за п. 1 або п. 2, де R3 - феніл.
4. Похідна піролідину за будь-яким із попередніх пунктів, де n - ціле число 1 або 2.
5. Похідна піролідину за будь-яким із попередніх пунктів, де R2 та R4 утворюють спільно з атомом азоту, до якого вони приєднані, 5- або 6-членний циклоалкіл або гетероциклоалкіл.
6. Похідна піролідину за будь-яким з пп. 1-4, де Х-О або NH.
7. Похідна піролідину за будь-яким із попередніх пунктів, вибрана з такої групи:
O-метилоксим (3EZ,5S)-5-(гідроксиметил)-1-[(2'-метил-1,1'-біфеніл-4-іл)карбоніл]піролідин-3-ону;
O-метилоксим (3EZ,5S)-1-(1,1'-біфеніл-4-ілкарбоніл)-5-(гідроксиметил)-піролідин-3-ону;
O-метилоксим (3Е,5S)-1-(1,1'-біфеніл-4-ілкарбоніл)-5-(гідроксиметил)-піролідин-3-ону;
O-метилоксим (3Z,5S)-1-(1,1'-біфеніл-4-ілкарбоніл)-5-[(4-метилпіперазин-1-іл)метил]піролідин-3-ону;
трет-бутил-{[(2S,4ЕZ)-1-(1,1'-біфеніл-4-ілкарбоніл)-4-(метоксііміно)-піролідин-2-іл]метокси}ацетат;
{[(2S,4ЕZ)-1-(1,1'-біфеніл-4-ілкарбоніл)-4-(метоксііміно)піролідин-2-іл]-метокси}оцтова кислота;
2-{[(2S,4ЕZ)-1-(1,1'-біфеніл-4-ілкарбоніл)-4-(метоксііміно)піролідин-2-іл]-метокси}-N-(2-піролідин-1-ілетил)ацетамід;
O-метилоксим (3EZ,5S)-1-(1,1'-біфеніл-4-ілкарбоніл)-5-(метоксиметил)-піролідин-3-ону;
O-метилоксим (3EZ,5S)-1-(1,1'-біфеніл-4-ілкарбоніл)-5-[(4-метилпіперазин-1-іл)метил] -піролідин-3-ону;
O-метилоксим (3EZ,5S)-1-(1,1'-біфеніл-4-ілкарбоніл)-5-{[(4-метоксифеніл)аміно]метил}-піролідин-3-ону;
O-метилоксим (3EZ,5S)-1-(1,1'-біфеніл-4-ілкарбоніл)-5-({[2-(1Н-піразол-1-іл)етил] аміно}-метил)-піролідин-3-ону;
2-{[(2S,4ЕZ)-1-(1,1'-біфеніл-4-ілкарбоніл)-4-(метоксііміно)піролідин-2-іл}-метил}-1Н-ізоіндол-1,3(2Н)-діон;
O-метилоксим (3EZ,5S)-5-(амінометил)-1-(1,1'-біфеніл-4-ілкарбоніл)-піролідин-3-ону;
N-{[(2S,4ЕZ)-1-(1,1'-біфеніл-4-ілкарбоніл)-4-(метоксііміно)піролідин-2-іл]метил}ацетамід;
O-метилоксим (3EZ,5S)-1-(1,1'-біфеніл-4-ілкарбоніл)-5-(піперидин-1-ілметил)піролідин-3-ону;
O-метилоксим (3ЕZ,5S)-1-(1,1'-біфеніл-4-ілкарбоніл)-5-(2-гідроксіетил)-піролідин-3-ону.
8. Похідна піролідину за будь-яким із попередніх пунктів для застосування як лікарського засобу.
9. Застосування похідної піролідину за будь-яким із пп. 1-7, а також її ізомерів, оптично активних форм, наприклад, енантіомерів, діастереомерів та їхніх сумішей, а також солей таких сполук для виготовлення лікарського засобу для профілактики та/або лікування передчасних пологів, передчасного народження життєздатного, але недоношеного плода або дисменореї.
10. Застосування похідної піролідину за пп. 1-7 для виготовлення лікарського засобу для лікування розладів, які вимагають модулювання рецептора окситоцину.
11. Застосування за п. 10 для лікування або запобігання розладам, пов'язаних з активністю рецепторів окситоцину.
12. Застосування за п. 10 або п. 11, де згадане модулювання полягає у блокуванні рецептора окситоцину або у протидії зв'язуванню окситоцину з його рецептором.
13. Фармацевтична композиція, яка містить похідну піролідину за будь-яким із пп. 1-7 та фармацевтично прийнятний носій, розріджувач або наповнювач.
14. Спосіб одержання похідної піролідину за будь-яким із пп. 1-7, де Х є О, який включає стадію O-алкілування спиртових похідних формули (II) алкілувальним агентом R2-LG, де LG є відщеплювана група, причому R1, R2, R3 та n відповідають поданим вище визначенням.

15. Спосіб одержання похідної піролідину за будь-яким із пп. 1-7, де Х є NR4, який включає стадію відновлювального амінування альдегідних похідних формули (XI) аміном HNR2R4, де R1, R2, R3, R4 та n відповідають поданим вище визначенням.

Текст
1. Похідна піролідину формули І: R1 C2 2 (19) 1 3 78058 4 R2 та R4 можуть утворювати спільно з атомом азоO-метилоксим (3ЕZ,5S)-1-(1,1'-біфеніл-4ту, до якого вони приєднані, 5-8-членний насичеілкарбоніл)-5-(2-гідроксіетил)-піролідин-3-ону. ний або ненасичений гетероциклоалкіл; та 8. Похідна піролідину за будь-яким із попередніх n - ціле число від 1 до 3. пунктів для застосування як лікарського засобу. 2. Похідна піролідину за п. 1, де R1 - метил. 3. Похідна піролідину за п. 1 або п. 2, де R3 - фе9. Застосування похідної піролідину за будь-яким ніл. із пп. 1-7, а також її ізомерів, оптично активних 4. Похідна піролідину за будь-яким із попередніх форм, наприклад, енантіомерів, діастереомерів та пунктів, де n - ціле число 1 або 2. їхні х сумішей, а також солей таких сполук для ви5. Похідна піролідину за будь-яким із попередніх готовлення лікарського засобу для профілактики пунктів, де R2 та R4 утворюють спільно з атомом та/або лікування передчасних пологів, передчасазоту, до якого вони приєднані, 5- або 6-членний ного народження життєздатного, але недоношеноциклоалкіл або гетероциклоалкіл. го плода або дисменореї. 6. Похідна піролідину за будь-яким з пп. 1-4, де Х10. Застосування похідної піролідину за пп. 1-7 О або NH. для виготовлення лікарського засобу для лікуван7. Похідна піролідину за будь-яким із попередніх ня розладів, які вимагають модулювання рецептопунктів, вибрана з такої групи: ра окситоцину. O-метилоксим (3EZ,5S)-5-(гідроксиметил)-1-[(2'11. Застосування за п. 10 для лікування або запометил-1,1'-біфеніл-4-іл)карбоніл]піролідин-3-ону; бігання розладам, пов'язаних з активністю рецепO-метилоксим (3EZ,5S)-1-(1,1'-біфеніл-4торів окситоцину. ілкарбоніл)-5-(гідроксиметил)-піролідин-3-ону; 12. Застосування за п. 10 або п. 11, де згадане O-метилоксим (3Е,5S)-1-(1,1'-біфеніл-4модулювання полягає у блокуванні рецептора окілкарбоніл)-5-(гідроксиметил)-піролідин-3-ону; ситоцину або у протидії зв'язуванню окситоцину з O-метилоксим (3Z,5S)-1-(1,1'-біфеніл-4його рецептором. ілкарбоніл)-5-[(4-метилпіперазин-113. Фармацевтична композиція, яка містить похіділ)метил]піролідин-3-ону; ну піролідину за будь-яким із пп. 1-7 та фармацевтрет-бутил-{[(2S,4ЕZ)-1-(1,1'-біфеніл-4-ілкарбоніл)тично прийнятний носій, розріджувач або напов4-(метоксііміно)-піролідин-2-іл]метокси}ацетат; нювач. {[(2S,4ЕZ)-1-(1,1'-біфеніл-4-ілкарбоніл)-414. Спосіб одержання похідної піролідину за будь(метоксііміно)піролідин-2-іл]-метокси}оцтова кисяким із пп. 1-7, де Х є О, який включає стадію Oлота; алкілування спиртових похідних формули (II) алкі2-{[(2S,4ЕZ)-1-(1,1'-біфеніл-4-ілкарбоніл)-4лувальним агентом R2-LG, де LG є відщеплювана (метоксііміно)піролідин-2-іл]-метокси}-N-(2група, причому R1, R2, R3 та n відповідають подапіролідин-1-ілетил)ацетамід; ним вище визначенням. O-метилоксим (3EZ,5S)-1-(1,1'-біфеніл-4R1 R1 ілкарбоніл)-5-(метоксиметил)-піролідин-3-ону; O O-метилоксим (3EZ,5S)-1-(1,1'-біфеніл-4O N N ілкарбоніл)-5-[(4-метилпіперазин-1-іл)метил] 2 -LG, О-алкілуван ня сполукою R O R2 OH піролідин-3-ону; р еакція Міцунобу тощо n n N N O-метилоксим (3EZ,5S)-1-(1,1'-біфеніл-4O O ілкарбоніл)-5-{[(4-метоксифеніл)аміно]метил}R3 R3 піролідин-3-ону; Ia II O-метилоксим (3EZ,5S)-1-(1,1'-біфеніл-4ілкарбоніл)-5-({[2-(1Н-піразол-1-іл)етил] аміно}15. Спосіб одержання похідної піролідину за будьметил)-піролідин-3-ону; яким із пп. 1-7, де Х є NR4, який включає стадію 2-{[(2S,4ЕZ)-1-(1,1'-біфеніл-4-ілкарбоніл)-4відновлювального амінування альдегідних похід(метоксііміно)піролідин-2-іл}-метил}-1Н-ізоіндолних формули (XI) аміном HNR 2R4, де R1, R2, R3, R4 1,3(2Н)-діон; та n відповідають поданим вище визначенням. O-метилоксим (3EZ,5S)-5-(амінометил)-1-(1,1'біфеніл-4-ілкарбоніл)-піролідин-3-ону; R R відновлювальне аміну вання N-{[(2S,4ЕZ)-1-(1,1'-біфеніл-4-ілкарбоніл)-4HNR R , NaBH CN, NaHB(OA c) O N O N R O або аналогічними відновлювальними (метоксііміно)піролідин-2-іл]метил}ацетамід; агентами N R H n -1 n O-метилоксим (3EZ,5S)-1-(1,1'-біфеніл-4N N ілкарбоніл)-5-(піперидин-1-ілметил)піролідин-3O O ону; R R 1 1 2 4 3 3 4 2 3 XI Цей винахід стосується нових похідних піролідину, зокрема, їх застосування як лікарських засобів, а також фармацевтичних композицій, що містять такі похідні піролідину. Згадані похідні 3 Ib піролідину є придатними для лікування та/або запобігання передчасних пологів, передчасного народження життєздатного, але недоношеного, плода та дисменореї. За варіантами, яким віддається 5 78058 6 перевага, згадані похідні піролідину виявляють менореї. модуляторну, особливо антагоністичну активність На даний час у клінічних дослідженнях застовідносно рецептора окситоцину. За варіантами, совуються деякі засоби, які протидіють впливу яким віддається більша перевага, згадані сполуки окситоцину (4). До ци х токолітичних агентів (тобто є придатними для лікування та/або запобігання засобів розслаблення матки) належать b 2хворобливих станів, опосередкованих окситоциадренергічні агоністи, сульфат магнію та етанол. ном, у тому числі передчасних пологів, передчасПровідним b 2-адренергічним агоністом є ритодрин, ного народження життєздатного, але недоношеноякий викликає ряд серцево-судинних та метаболіго, плода та дисменореї. чних побічних ефектів у матері, у тому числі тахіОкситоцин (ОТ) є циклічний нонапептид, ефекардію, підвищену секрецію реніну, гіперглікемію, а кти якого опосередковуються активацією специфітакож реактивну гіпоглікемію у дитини. Інші b 2чних сполучених з G-протеїнам рецепторів, які на адренергічні агоністи, в тому числі тербуталін та даний час класифікуються як рецептори ОТ (OT-R) альбутерол, викликають побічні ефекти, схожі з (1). побічними ефектами ритодрину. Сульфат магнію у Окситоцин (ОТ) викликає скорочення матки разі концентрації у плазмі, що перевищує терапевссавців під час пологів. Відповідний рецептор октичний діапазон 4-8мг/дл, може спричиняти приситоцину належить до сімейства сполучених із Gгнічення провідності серцевого м'яза та нервовопротеїном рецепторів і є подібним до рецепторів м'язового переносу збудження, пригнічення дивазопресину V1а та V2. Кількість рецепторів оксихання та зупинку серця, що робить цей засіб нетоцину (ОТ) різко зростає під час вагітності. Було придатним, особливо в разі порушення функції показано, що концентрація ОТ рецепторів корелює нирок. Етанол, як і ритодрин, є ефективним засозі спонтанною активністю матки (2-3). Індуковані бом запобігання передчасним пологам, однак він ОТ скорочення матки під час пологів спричиняють не викликає відповідного зменшення частоти вирозкриття шийки матки і, в кінцевому підсумку, рух никнення дихальної недостатності плода, що має плода через вагінальний канал. В деяких випадках місце при введенні ритодрину. ці скорочення відбуваються раніше від досягнення Атозибану, пептидному антагоністу окситоциповної життєздатності плода, що призводить до ну, властиві проблеми більшості пептидів: низька передчасних пологів. Передчасні пологи та передоральна біодоступність внаслідок його розкладу в часне народження життєздатного, але недоношекишечнику. Такі сполуки слід вводити парентераного, плода є небажаними, оскільки вони являють льно. собою головну причину перинатальної захворюваОчікується, що створення непептидних ліганності. Отже, терапія передчасного народження дів для рецепторів пептидних гормонів може сприжиттєздатного, але недоношеного, плода є однією яти подоланню цих утр уднень Про низькомолекуз найважливіших проблем у галузі акушерства. лярні антагоністи окситоцину сповіщає фірма За останні роки нагромаджено значну кількість Merck. Окрім циклічних гексапептидів, фірма Merck інформації, котра ясно свідчить, що гормон оксипропонує інданілпіперидини та толілпіперазини як тоцин відіграє головну роль в ініціюванні пологів у антагоністи окситоцину, придатні до перорального ссавців, зокрема, у людей. При цьому припускавживання (5). У WO 96/22775 та US 5,756,497 фірється, що скситоцин спричиняє згаданий ефект як ма Merck розкриває бензоксазинілпіперидини або прямим, так і непрямим шляхом, скорочуючи матбензоксазинони як антагоністи рецептора окситоковий міометрій та інтенсифікуючи синтез та вивіцину. льнення скорочувальних простагландинів із міомеОписані конкретні сульфонаміди, які протидітрія та децидуальної оболонки мітки. Ці ють впливу окситоцину на рецептори окситоцину. простагландини, крім того, можуть відігравати пеУ патентах ЕР-А-0469984 та ЕР-А-0526348 видавну роль у процесі визрівання шийки матки. Імовіних Ельф-Санофі (Elf Sanofi), описано Nрно, що ця "надмірна активність" рецепторів оксисульфоніліндоліни, що діють як антагоністи вазотоцину та підви щена чутливість матки зумовлена пресину та рецепторів окситоцину. трофічними ефектами підвищення рівня естрогену Патент US 5,889,001 фірми American в плазмі при наближенні моменту пологів. Можна Cyanamid розкриває похідні піразол-бензодіазепіну очікувати, що шля хом негативного модулювання як антагоністи вазопресину та окситоцину. функції окситоцину можна блокувати прямий (скоНовітні похідні піролідину, наприклад, аміди рочувальний) та непрямий (посилений синтез пропіролідину та піролідини, заміщені конденсованим стагландинів) вплив окситоцину на матку. Імовіргетероарилом, описано як антагоністи рецепторів но, що модулятор окситоцину, наприклад, його окситоцину (WO 01/72705). блокатор або антагоніст, може виявитися ефектиЗа першим аспектом, цей винахід пропонує вним для лікування передчасних пологів. нові похідні піролідину формули І: Іншим патологічним станом, пов'язаним з окситоцином, є дигменорея, яка характеризується болем або неприємними відчуттями, пов'язаними з менструаціями. Вважається, що згаданий біль є наслідком скорочень та ішемії матки, які, можливо, опосередковуються впливом простагландинів, котрі продукуються в секреторному ендометрії. Антагоніст окситоцину, оскільки він блокує як прямий, так і непрямий вплив окситоцину на матку, ι може бути потенціальним засобом лікування дис 7 78058 8 R1 у формулі (І) вибраний з групи, до якої вхормули І, разом із фармацевтично прийнятними дять Η та замінений або незаміщений С 1-С6-алкіл. допоміжними речовинами та носіями. За варіантом, якому віддається перевага, R1 - Η За четвертим аспектом, цей винахід пропонує або метил. сполуку формули І, для виготовлення фармацевR2 у формулі (І) вибраний з групи, до якої вхотичної композиції, придатної для лікування та/або дять водень, замінений або незаміщений С 1-С6запобігання передчасних пологів, передчасного алкіл, заміщений або незаміщений С 1-С6народження життєздатного, але недоношеного, алкіларил, заміщений або незаміщений гетероплода та дисменореї. арил, заміщений або незаміщений С 1-С6За п'ятим аспектом, цей винахід пропонує алкілгетероарил, заміщений або незаміщений С 2сполуку формули І для модулювання функції реС6-алкеніл, заміщений або незаміщений С 2-С6цептора окситоцину. алкеніларил, заміщений або незаміщений С 2-С6За шостим аспектом, цей винахід пропонує заалкенілгетероарил, заміщений або незаміщений стосування сполуки формули І для лікування розС2-С6-алкініл, заміщений або незаміщений С 2-С6ладів, пов'язаних із рецепторами окситоцину, наалкініларил, заміщений або незаміщеник С 2-С6приклад, передчасних пологів, передчасного алкінілгетероарил, заміщений або незаміщений народження життєздатного, але недоношеного, С3-С8-циклоалкіл, заміщений або незаміщений плода та дисменореї. гетероциклоалкіл, заміщений або незаміщений С 1За сьомим аспектом, цей винахід пропонує С6-алкілциклоалкіл, заміщений або незаміщений спосіб лікування захворювання, пов'язаного з реС1-С6-алкілгетероциклоалкіл, заміщений або нецептором окситоцину, наприклад, передчасних заміщений С1-С6-алкілкарбоксил, ацил, заміщений пологів, передчасного народження життєздатного, або незаміщений С 1-С6-алкілацил, заміщена або але недоношеного, плода та дисменореї, який незаміщена С1-С6-алкілацилоксигрупа, заміщена включає введення в організм пацієнта, який поабо незаміщена С 1-С6-алкілалкоксигрупа, алкокситребує цього, ефективної кількості сполуки форкарбоніл, заміщений або незаміщений С 1-С6мули І. алкілалкоксикарбоніл, амінокарбоніл, заміщений За восьмим аспектом, цей винахід пропонує або незаміщений С 1-С6-алкіламінокарбоніл, заміспосіб синтезу сполуки за формулою І. щена або незаміщена С 1-С6-алкілациламіногрупа, Метою цього винаходу є створення речовин, замішена або незаміщена С 1-С6-алкілуреїдогрупа, придатних для і лікування та/або запобігання пезаміщена або незаміщена С 1-С6-алкіламіногрупа, редчасних пологів, передчасного народження житзаміщена або незаміщена С 1-С6тєздатного, але недоношеного, плода та дисменоалкілсульфонілоксигрупа, сульфоніл, заміщений реї. або незаміщений С 1-С6-алкілсульфоніл, сульфініл, Особливою метою цього винаходу є запропозаміщений або незаміщений С 1-С6-алкілсульфініл, нувати хімічні сполуки, здатні негативно модулюзаміщений або незаміщений С 1-С6-алкілсульфаніл вати, в тому числі антагонізувати, функції окситота заміщена або незаміщена С 1-С6цину при хворобливих станах у ссавців, особливо алкілсульфоніламіногрупа. у людей. R3 у формулі (І) вибраний з групи, до якої вхоЩе однією метою цього винаходу є запроподять замішений або незаміщений арил та заміщенувати низькомолекулярні хімічні сполуки для моний або незаміщений гетероарил. дулювання, за варіантом, якому віддається переX у формулі (І) вибраний з групи, до якої вховага, для негативного модулювання функції дять О і NR4. Таким чином, R4 вибраний з групи, до рецепторів окситоцину або протидії впливу цих якої входять Н, заміщений або незаміщеній С 1-С6рецепторів. алкіл, заміщений або незаміщений арил, заміщеОкрім того, метою цього винаходу є запропоний або незаміщений гетероарил, заміщений або нувати способи для одержання згаданих низьконезаміщений С1-С6-алкіларил, заміщений або немолекулярних хімічних сполук. Подальшою метою заміщений С 1-С6-алкілгетероарил. За варіантом, цього винаходу є створення нових видів фармацеякому віддається перевага, R4 - Η або С1-С6-алкіл, втичних композицій для лікування передчасних можливо метил або етил. пологів та дисменореї, та/або розладів, опосередЗа альтернативним варіантом, R2 та R4 у фокованих рецептором окситоцину. рмулі (І) можуть утворювати — спільно з атомом Останньою метою цього винаходу є запропоазоту, до якого вони приєднані - заміщену або ненувати спосіб лікування та/або запобігання розлазаміщену, 5-8-членну насичену або ненасичену дів, опосередкованих рецептором окситоцину, гетероциклоалкільну групу, наприклад, піперидитаких як передчасні пологи, за допомогою антагонільну або піперазинільну групу, яка може бути ністів окситоцину, які діють, наприклад, шляхом факультативно конденсована з арильною, гетеропротидії зв'язуванню окситоцину з його рецептоарильною, циклоалкільною або гетероциклоалкіром. льною групою. У подальших параграфах подано визначення n у формулі (І) - ціле число від 1 до 3, за варірізних хімічних фрагментів, з яких складаються антом, якому віддається більша перевага, - 1 або сполуки за цим винаходом, що призначені для 2. однозначного застосування у рамках опису та фоЗа другим аспектом, цей винахід пропонує нові рмули винаходу, якщо інше чітко сформульоване похідні фролідину формули І для застосування як визначення не надає відповідному терміну ширшолікарський засіб. го обсягу. За третім аспектом, цей винахід пропонує фаТермін "С1-С6-алкіл" означає одновалентні алрмацевтичну композицію, що містить сполуку фокільні групи, що містять 1-6 атомів вуглецю. При 9 78058 10 кладами таких груп є метил, етил, н-пропіл, ізоклад, норборніл). До циклоалкілів, яким віддається пропіл, н-бутил, ізобутил, трет-бутил, н-гексил топеревага, належать циклопентил, циклогексил, що. норборніл тощо. Термін "арил" означає ненасичену ароматичну Термін "гетероциклоалкіл" означає С3-С8карбоциклічну групу із кількістю атомів вуглецю від циклоалкільну груп у, що відповідає визначенню, 6 до 14 , що містить один цикл (наприклад, феніл) наведеному вище, в якій до 3 атомів вуглець з або кілька конденсованих циклів (наприклад, нафзамінені гетероатомами, вибраними з групи, до тил). До арнлів, яким віддається перевага, налеякої входять О, S, NR, де R визначений як водень жать феніл, нафтил, фенантрил тощо. або метил. До гетероциклоалкілів, яким віддається Термін "С1-С6-алкіларил" означає С1-С6перевага, належать піролідин, піперидин, піпераалкільні групи, що містять арильний замісник, в зин, 1-метилпіперазин, морфолін, тощо. тому числі бензил, фенетил тощо. Термін "С1-С6-алкілциклоалкіл" означає С1-С6Термін "гетероарил" означає моноциклічну геалкільні групи, що містять циклоалкільний замістероароматичну або конденсовану біциклічну чи ник, в тому числі циклогексилметил, циклопенгилтрициклічну гетероароматичну групу. (Окремими пропіл, тощо. прикладами гетероароматичних груп є факультаТермін "С1-С6-алкілгетероциклоалкіл" означає тивно заміщені) піридил, піроліл, фурил, тієніл, С1-С6-алкільні групи, що містять гетероциклоалкіімідазоліл, оксазоліл, ізоксазоліл, тіазоліл, ізотіальний замісник, в тому числі 2-(1-піролідиніл)етил, золіл, піразоліл, 1,2,3-триазоліл, 1,2,4-триазоліл, 4-морфолінілметил, (1-метил-4-піперидиніл)метил 1,2,3-окоадіазоліл, 1,2,4-оксадіазоліл, 1,2,5тощо. оксадіазоліл, 1,3,4-оксадіазоліл, 1,3,4-триазиніл, Термін "карбокси(л)" означає групу -С(О)ОН. 1,2,3-триазиніл, бензофурил, [2,3Термін "С1-С6-алкілкарбокси(л)" означає С1-С5дигідро]бензофурил, ізобензофурил, бензотієніл, алкільні групи, що містять карбоксильний замісник, бензотриазоліл, ізобензотієніл, індоліл, ізоіндоліл, в тому числі 2-карбоксіетил тощо. 3Н-індоліл, бензимідазоліл, імідазо[1,2-а]піридил, Термін "ацил" означає групу -C(O)R, де R є бензотіазоліл, бензоксазоліл, хітолізиніл, хіназолі"С1-С6-алкіл", "арил", "гетероарил", "С1-С6ніл, фталазиніл, хіноксалініл, цинолініл, нафтириалкіларил" або "С1-С6-алкілгетероарил". диніл, піридо[3,4-b]піридил, піридо[3,2-b]піридил, Термін "С1-С6-алкілацил" означає С1-С6піридо[4,3-b]піридил, хіноліл, ізохіноліл, тетразоалкільні групи, що містять ацильний замісник, в ліл, 5,6,7,8-тетрагідрохіноліл, 5,6,7,8тому числі 2-ацетилетил тощо. тетрагідроізохіноліл, пуриніл, птеридиніл, карбаТермін "ацилокси(група)" означає групу золіл, ксантеніл або бензохіноліл. OC(O)R, де R є "С1-С6-алкіл", "арил", "гетероарил", Термін "С1-С6-алкілгетероарил" означає С1-С6"С1-С6-алкіларил" або "С1-С6-алкілгетероарил". алкільні групи, що містять гетероарильний замісТермін "С1-С6-алкілацилокси(група)" означає ник, в тому числі 2-фурилметил, 2-тієнілметил, 2С1-С6-алкільні групи, що містять як замісник аци(1Н-індол-3-іл)етил тощо. локсигрупу, в тому числі 2-(ацетилокси)етил тощо. Термін "С2-С6-алкеніл" означає алкенільні груТермін "алкокси(група)" означає групу -O-R, де пи, які за варіантом, якому віддається перевага, R є "С1-С6-алкіл", "арил", "гетероарил", "С1-С6містять від 2 атомів до 6 атомів вуглецю та мають алкіларил" або "С1-С6-алкілгетероарил". До алкокпринаймні 1 ділянку чи 2 ділянки алкенільної несигруп, яким віддається перевага, належать, нанасиченості. До алкенільних груп, яким віддається приклад, метокси-, етокси-, феноксигрупа тощо. перевага, належать етеніл (-СН Н 2), н-2= С Термін "С1-С6-алкілалкокси(група)" означає С1пропеніл (аліл, -СН2СН=СН2) тощо. С6-алкільні групи, що містять алкоксильний замісТермін "С2-С6-алкеніларил" означає С2-С6ник, в тому числі 2-етоксіетил тощо. алкенільні групи, що містять арильний замісник, в Термін "алкоксикарбоніл" означає групу тому числі 2-фенілвініл тощо. C(O)OR, де R є Н, "С1-С6-алкіл", "арил", "гетероТермін "С2-С6-алкенілгетероарил" означає С2арил", "С1-С6-алкіларил" або "С1-С6С6-алкенільні групи, що містять гетероарильний алкілгетероарил". замісник, в тому числі 2-(3-піридиніл)вініл тощо. Термін "С1-С6-алкілалкоксикарбоніл" означає Термін "С2-С6-алкініл" означає алкінільні групи, С1-С6-алкільні групи, що містять алкоксикарбоніякі за варіантом, якому віддається перевага, місльний замісник, в тому числі 2тять від 2 атомів до 6 атомів вуглецю га мають (бензилоксикарбоніл)етил тощо. принаймні 1-2 ділянки алкінільної ненасиченості. Термін "амінокарбоніл" означає групу До алкінільних груп, яким віддається перевага, C(O)NRR', де кожним з R, R' незалежно один від одного є водень, С1-С6-алкіл, арил, гетероарил, належать етиніл (-СºСН), пропаргіл (-CН2СºCH) "С1-С6-алкіларил" або "С1-С6-алкілгетероарил". тощо. Термін "С1-С6-алкіламінокарбоніл" означає С1Термін "С2-С6-алкініларил" означає С2-С6алкінільні групи, що містять арильний замісник, в С6-алкільні групи, що містять амінокарбонільний замісник, в тому числі 2тому числі фенілетиніл тощо. (диметиламінокарбоніл)етил тощо. Термін "С2-С6-алкінілгетероарил" означає С2Термін "ациламіно(група)" означає групу С6-алкінільні групи, що містять гетероарильний NRC(O)R', де кожний з R, R' незалежно один від замісник, в тому числі 2-тієнілетиніл тощо. Термін "С3-С8-циклоалкіл" означає насичену одного є водень, "С1-С6-алкіл", "арил", "гетероарил", "С1-С6-алкіларил" або "С1-С6карбоциклічну групу із і кількістю атомів вуглецю алкілгетероарил". від 3 до 8, що містить один цикл (наприклад, цикТермін "С1-С6-алкілациламіно(група)" означає логексил) або кілька конденсованих циклів (напри 11 78058 12 С1-С6-алкільні групи, що містять як замісник ациалкіл", "С1-С6-алкіл", заміщений галогенами (наламіногрупу, в тому числі 2-(пропіоніламіно)етил приклад, група -SO-CF3), "арил", "гетероарил", "С1тощо. С6-алкіларил" або "С1-С6-алкілгетероарил". Термін "уреїдо(група)" означає групу Термін "С1-С6-алкілсульфініл" означає С 1-С6NRC(O)NR'R", де кожній з R, R', R" незалежно алкільні групи, що містять сульфінільний замісник, один від одного є водень, "С1-С6-алкіл", "С2-С6в тому числі 2-(метилсульфініл)етил тощо. алкеніл", "С2-С6-алкініл", "С3-С8-циклоалкіл", "гетеТермін "сульфаніл" означає групи -S-R, де R є роциклоалкіл", "арил", "гетероарил", "С1-С6"С1-С6-алкіл", "арил", "гетероарил", "С1-С6алкіларил" або "С1-С6-алкілгетероарил", "С2-С6алкіларил" або "С1-С6-алкілгетероарил". До сульалкеніларил", "С2-С6-алкенілгетероарил", "С2-С6фанільних гр уп, яким віддається перевага, налеалкініларил", "С2-С6-алкінілгетероарил", "С1-С6жать метилеульфаніл, етилсульфаніл, тощо. алкілциклоалкіл", "С1-С6-алкілгетероциклоалкіл", Термін "С1-С6-алкілсульфаніл" означає С 1-С6та де R' і R", спільно з атомом азоту, до якого вони алкільні групи, що містять сульфанільний замісник, приєднані, можуть утворювати 3-8-членну гетеров тому числі 2-(етилсульфаніл)етил тощо. циклоалкільну груп у. Термін "сульфоніламіно(група)" означає групу Термін "С1-С6-алкілуреїдо(група)" означає С1-NRSO2-R', де кожний з R, R' незалежно один від С6-алкільні групи, що містять як замісник уреїдогодного є водень, "С1-С6-алкіл", "арил", "гетерорупу, в тому числі 2-(N'-метилуреїдо)етил тощо. арил", "С1-С6-алкіларил" або "С1-С6Термін "карбамат" означає групу -NRC(O)OR', алкілгетероарил". де кожний з R, R' незалежно один від одного є воТермін "С1-С6-алкілсульфоніламіно(група)" день, "С1-С6-алкіл", "С2-С6-алкеніл", "С2-С6-алкініл", означає С1-С6-алкільні групи, що містять як заміс"С3-С8-циклоалкіл", "гетероциклоалкіл", "арил", ник сульфоніл аміногрупу, в тому числі 2"гетероарил", "С1-С6-алкіларил" або "С1-С6(етилсульфоніламіно)етил тощо. алкілгетероарил", "С2-С6-алкеніларил", "С2-С6Термін "заміщений або незаміщений": у разі алкенілгетероарил", "С2-С6-алкініларил", "С2-С6відсутності інших обмежень, що встановлюються алкінілгетероарил", "CpCgС1-С6-алкілциклоалкіл", визначенням окремого замісника, вищезгадані "С1-С6-алкілгетероциклоалкіл". групи, наприклад, "алкіл", "алкеніл", "алкініл", Термін "аміно(група)" означає групу -NRR', де "арил" та "гетероарил" тощо можуть факультативкожний з R, R' незалежно один від одного є воно бути заміщені 1-5 замісниками, вибраними з день, "С1-С6-алкіл", "арил", "гетероарил". "С1-С6групи, до якої входять "С1-С6-алкіл", "С2-С6алкіларил", "С1-С6-алкілгетероарил", "циклоалкіл" алкеніл", "С2-С6-алкініл", "циклоалкіл", "гетероцикабо "гетероциклоалкіл", та де R та R' спільно з лоалкіл", "С1-С6-алкіларил", "С1-С6атомом азоту, до якого вони приєднані, можуть алкілгетероарил", "С1-С6-алкілциклоалкіл", "С1-С6утворювати 3-8-членну гетероциклоалкільну гр упу. алкілгетероциклоалкіл", "аміногрупа", "амоній", Термін "С1-С6-алкіламіно(група)" означає С1"ацил", "ацилоксигрупа", "ациламіногрупа", "аміноС6-алкільні групи, що містять як замісник аміногрукарбоніл", "алкоксикарбоніл", "уреїдогрупа", "карпу, в тому числі 2-(1-піролідиніл)етил тощо. бамат", "арил", "гетероарил", "сульфініл", "сульТермін "амоній" означає позитивно заряджену фоніл", "алкоксигрупа", "сульфаніл", "галоген", груп у -N+RR'R", де кожний з R, R', R" незалежно "карбоксил", тригалоїдметил, ціаногрупа, гідроксиодин від одного є "С1-С6-алкіл", "С1-С6-алкіларил", група, меркапто-, нітрогрупа тощо. За альтернати"С1-С6-алкілгетероарил", "циклоалкіл" або "гетеровним варіантом, згадане заміщення може також циклоалкіл", та де R і R' спільно з атомом азоту, до включати ситуації, коли сусідні замісники піддані якого вони приєднані, можуть утворювати 3-8реакції замикання циклу, особливо у разі залученчленну гетероциклоалкільну гр упу. ня сусідніх функціональних гр уп, з одержанням, Термін "галоген" означає атоми фтору, хлору, таким чином, наприклад, лактамів, лактонів, цикліброму та йоду. чних ангідридів, але також ацеталів, тіоацеталів, Термін "сульфонілоксигрупа" означає групу аміналів, що утворюються при замиканні циклу, OSO2-R, де R вибраний з групи, до якої входять Н, наприклад, із метою одержання групи захисту. "С1-С6-алкіл", "С1-С6-алкіл", заміщений пілогенами Вираз "фармацевтично прийнятні солі або (наприклад, група -OSO2-CF3), "арил", "гетерокомплекси" означає солі або комплекси визначеарил", "С1-С6-алкіларил" або "С1-С6них нижче сполук формули (І). Необмежувальними алкілгетероарил". прикладами таких солей є солі, одержані реакціяТермін "С1-С6-алкілсульфонілокси(група)" ми сполук формули (І) з основами (солі з основаозначає С1-С6-алкільні групи, що містять як замісми), які одержують із застосуванням органічних ник сульфонілоксигрупу, в тому числі 2або неорганічних основ, наприклад, гідроксидів, (метилсульфонілокси)етил тощо. карбонатів або бікарбонатів катіонів металів, наТермін "сульфоніл" означає групу "-SO2-R", де приклад, вибраних з групи, до якої входять лужні R вибраний з групи, до якої входять Н, "арил", "геметали (натрій, калій або літій), лужноземельні тероарил", "С1-С6-алкіл", "С1-С6-алкіл", заміщений метали (наприклад, кальцій або магній), або з оргалогенами (наприклад, група -SO2-CF3), "С1-С6ганічними первинними, вторинними або третинниалкілгрил" або "С1-С6-алкілгетероарил". ми алкіламінами. Солі амінів, одержані з метилТермін "С1-С6-алкілсульфоніл" означає С 1-С6аміну, диметиламіну, триметиламіну, етиламіну, алкільні групи, що містять сульфонільний замісник, діетиламіну, триетиламіну, морфоліну, N-метил-Dв тому числі 2-(метилсульфоніл)етил тощо. глюкаміну, N,N'-біс(фенілметил)-1,2-етандіаміну, Термін "сульфініл" означає групу "-S(O)-R", де трометаміну, етаноламіну, діетаноламіну, етиленR вибраний з І групи, до якої входять Н, "С1-С6діаміну, N-метилморфоліну, прокаїну, піперидину, 13 78058 14 піперазину тощо розглядаються як такі, що входять Η та заміщений або незаміщений С1-С6-алкіл. дять до обсягу цього винаходу. За варіантом, якому віддається перевага, R1 - Η Цей вираз охоплює також солі, одержані реакабо метил. | ціями з кислотами (солі з кислотами), які одержуR2 у формулі (І) вибраний з групи, до якої вхоють із застосуванням неорганічних кислот (напридять водень, заміщений або незаміщений С 1-С6клад, хлористоводневої кислоти, алкіл, заміщений або незаміщений С 1-С6бромистоводневої кислоти, сірчаної кислоти, фоалкіларил, заміщений або незаміщений гетеросфорної кислоти, азотної кислоти тощо), та солі, арил, заміщений або незаміщений С 1-С6одержані реакціями з органічними кислотами, наалкілгетероарил, заміщений або незаміщений С 2приклад, із застосуванням оцтової кислоти, щавС6-алкеніл, замішений або незаміщений С 2-С6левої кислоти, винної кислоти, бурштинової кислоалкеніларил, заміщений або незаміщений С 2-С6ти, яблучної кислоти, фумарової кислоти, алкенілгетероарил, заміщений або незаміщений малеїнової кислоти, аскорбінової кислоти, бензоС2-С6-алкініл, заміщений або незаміщений С 2-С6йної кислоти, дубильної кислоти, памової кислоти, алкініларил, заміщений або незаміщений С 2-С6альгінової кислоти, поліглутамінової кислоти, нафалкінілгетероарил, заміщений або незаміщений талінсульфонової кислоти, нафталіндисульфоноС3-С8-циклоалкіл, заміщений або незаміщений вої кислоти та полігалактуронової кислоти. гетероциклоалкіл, заміщений або незаміщенил С 1Вираз "фармацевтично активна похідна" ознаС6-алкілциклоалкіл, заміщений або незаміщений чає будь-яку сполуку, яка, після введення в оргаС1-С6-алкілгетероциклоалкіл, заміщена або незанізм реципієнта, здатна виявляти, безпосередньо міщена С1-С6-алкілкарбоксигрупа, ацил, замішеабо опосередковано, активність, розкриту у цьому ний або незаміщений С 1-С6-алкілацил, заміщена описі. або незаміщена С 1-С6-алкілацилоксигрупа, заміТермін "енантіомерний надлишок" (ее) стосущена або незаміщена С 1-С6-алкілалкоксигрупа, ється продуктів, які одержують шляхом асиметриалкоксикарбоніл, заміщений або незаміщений С 1чного синтезу, тобто синтезу із застосуванням неС6-алкілалкоксикарбоніл, амінокарбоніл, заміщерацемічних ви хідних матеріалів та/або реагентів ний або незаміщений С 1-С6-алкіламінокарбоніл, або синтезу, який включає щонайменше одну еназаміщена або незаміщена С 1-С6нтіоселективну стадію, "ее" - виражений в проценалкілациламіногрупа, замішена або незаміщена тах надлишок основного енантіомеру у порівнянні С1-С6-алкілуреїдогрупа, заміщена або незаміщена з неосновним енантіомером [%ее=% основного С1-С6-алкіламіногрупа, заміщена або незаміщена енантіомеру мінус % неосновного]. За відсутності С1-С6-алкілсульфонілоксигрупа, сульфоніл, заміасиметричного синтезу одержують, як правило, щений або незаміщений С 1-С6-алкілсульфоніл, рацемічні продукти, які, однак, також мають активсульфініл, заміщений або незаміщений С 1-С6ність як антагоністи рецептора окситоцину. алкілсульфініл, заміщений або незаміщений С 1-С6Термін "передчасні пологи" або термін "передалкілсульфаніл, заміщена або незаміщений С 1-С6часне народження життєздатного, але недоношеалкілсульфоніламіногрупа. ного, плода" означає зганяння з матки дитини до R3 у формулі (І) вибраний з групи, до якої вхонормального завершення вагітності, або більш дять замішений або незаміщений арил та заміщеконкретно, початок пологів з вигладжуванням та ний або незаміщений гетероарил. розкриттям шийки матки до завершення 37-ого X у формулі (І) вибраний з групи, до якої вхотижня вагітності. Вони можуть супроводжуватися дять О та NR4, де R4 вибраний з групи, до якої вагінальною кровотечею або розривом мембрани входять Н, заміщений або незаміщений С 1-С6чи відбуватися без цих явищ. алкіл, заміщений або незаміщений арил, заміщеТермін "дисменорея" означає болісну менстний або незаміщений гетероарил, заміщений або руацію. незаміщений С1-С6-алкіларил та заміщений або Термін "розродження шляхом кесаревого рознезаміщений С1-С6-алкілгетероарил. За варіантом, тину" означає розтинання черевної стінки та стінки якому віддається перевага, R4 - Η або С1-С6-алкіл, матки для витягання плода. наприклад, метильна або етильна група. Цей винахід охоплює також геометричні ізоЗа альтернативним варіантом, R2 та R4 у фомери, оптично активні форми, енантіомери, діасрмулі (І) можуть утворювати - спільно з атомом тереомери сполук формули І, їхні суміші, рацемаазоту, до якого вони приєднані - заміщений або ти, а також фармацевтично прийнятні солі. незаміщений, 5-8-членний насичений або ненасиСполуки за цим винаходом мають формулу І. чений гетероциклоалкіл, наприклад, піперидинільну або піперазинільну групу, яка може бути факультативно конденсована з арильною, гетероарильною, циклоалкільною або гетероциклоалкільною групою. n у формулі (І) - ціле число від 1 до 3, за варіантом, якому віддається більша перевага, - 1 або 2. За варіантом, якому віддається перевага, R2 в сполуках за формулою І вибрані з групи, до якої входять Н, ацил, за варіантом, якому віддається перевага, ацетил, арил, факультативно заміщений заміщеною або незаміщеною С 1-С61 R у формулі (І) вибраний з групи, до якої вхоалкоксигрупою, наприклад, метилоксифенільною 15 78058 16 групою, С1-С3-алкіл, наприклад, метил або етил, як правило, у формі фармацевтичних композицій. факультативно заміщений заміщеною або незаміОтже, фармацевтичні композиції, які містять спощеною ацильною групою або складноефірною луку формули І та фармацевтично прийнятний групою, за варіантом, якому віддається перевага, носій, розріджувач або наповнював, також вклютрет-бутиловим складним ефіром мурашиної кисчено в обсяг цього винаходу. Фа хівцям відоме все лоти або оцтової кислоти, та N-(2-піролідин-1-ілрізноманіття таких носіїв, розріджувачів або напоетил)|-ацетамід, факультативно заміщений замівнювачів, придатних для виготовлення фармацевщеним або незаміщеним гетероарилом, за варіантичних композицій. том, якому віддається перевага, N-піразолом. Сполуки за цим винаходом разом зі звичайно За варіантом, якому віддається перевага, R3 в застосовуваними допоміжними речовинами, носісполуках за формулою І вибрані з групи, до якої ями, розріджувачами або наповнювачами можуть входять арильна група, факультативно заміщена бути виготовлені у формі фармацевтичних композаміщеною або незаміщеною арильною групою. зицій та дозованих одиниць таких композицій, і в R3, яким віддається особлива перевага, є біфенітакій формі можуть бути застосовані у вигляді льна або 2-метилбіфенільна група. твердих матеріалів, наприклад, таблеток або заВаріантом здійснення цього винаходу, якому повнених капсул, або рідин, наприклад, розчинів, віддається і особлива перевага, є похідна піролісуспензій, емульсій, еліксирів або капсул, заповдину формули І, де X - О або NH та n - 1 або 2. нених такими рідинами, для перорального застоІншим варіантом здійснення цього винаходу, сування, або у формі стерильних ін'єкційних розякому віддається перевага, є похідна піролідину чинів для парентерального (в тому числі формули І, де X - NR4 та де R4 і R2 утворюють напідшкірного) застосування. Такі фармацевтичні сичену або ненасичену, заміщену або незаміщену, композиції та дозовані одиниці таких композицій конденсовану або неконденсовану, гетероциклічну можуть містити інгредієнти у звичайних співвідногруп у з атомом азоту, до якого вони приєднані, за шеннях, разом з іншими активними сполуками чи варіантом, якому віддається перевага, 5- або 6діючими речовинами або без них, а такі дозовані членну груп у, за варіантом, якому віддається біодиниці можуть містити будь-яку відповідну ефекльша перевага, піперидин, метилпіперазин або тивну кількість активного інгредієнта, співмірну з ізоіндол-1,3-діон. діапазоном добових доз, необхідних для застосуСполуки формули І можуть бути застосовані вання. для лікування захворювань. При застосуванні як фармацевтичні засоби Зокрема, сполуки формули І придатні для запохідні піролідину за цим винаходом вживаються, стосування при лікуванні розладів, наприклад, як правило, у формі фармацевтичних композицій. передчасних пологів, передчасного народження Такі композиції можна виготовляти способами, життєздатного, але недоношеного, плода та дисдобре відомими у фармацевтичній галузі, і вони менореї та для припинення скорочувальної діяльмістять щонайменше одну активну сполук у. Як ності матки перед розродженням шляхом кесареправило, сполуки за цим винаходом застосовують вого розтину. Сполуки цього винаходу особливо у фармацевтично ефективній кількості. Конкретну придатні для лікування передчасних пологів, пезастосовувану кількість сполуки, як правило, виредчасного народження життєздатне то, але незначає лікар-куратор з урахуванням релевантних доношеного, плода та дисменореї. обставин, в тому числі розладу, що підлягає лікуЗа варіантом, якому віддається перевага, спованню, обраного способу застосування, конкретної луки формули І окремо або у формі фармацевтичзастосовуваної сполуки, віку, маси тіла та індивіної композиції придатні для модулювання функції дуальної реакції пацієнта, тяжкості симптомів роз(функцій) окситоцину, забезпечуючи, таким чином, ладу у цього пацієнта тощо. специфічну можливість лікування та/або профілакФармацевтичні композиції за цим винаходом тики розладів, опосередкованих рецептором оксиможна вводити й організм пацієнта різноманітними тоцину. Таке модулювання за варіантом, якому шляхами, в тому числі пероральним, ректальним, віддається перевага, включає пригнічення функції черезшкірним, підшкірним, внутрішньовенним, (функцій) рецептора окситоцину, особливо шлявнутрішньом'язовим та назальним. Залежно від хом протидії функціям рецептора окситоцину у обраного шляху введення, сполуки у варіантах, ссавців, зокрема, у людини. яким віддається перевага, виготовляють у формі Аномальна активність або гіперактивність реабо ін'єкційних, або пероральних композицій. Комцептора окситоцину часто є чинником різноманітпозиції для перорального застосування можуть них розладів, в тому числі перелічених вище розмаги форму нефасованих рідких розчинів або суладів та хворобливих станів. Отже, сполуки за цим спензій, або нефасованих порошків. Однак більш винаходом можуть бути застосовані для лікування поширеним є виготовлення композицій у формах розладів шляхом модулювання функцій або шлядозованих одиниць із метою спрощення точного хів впливу OT-R. Таке модулювання функцій або дозування. Термін "дозовані одиниці" означає фішляхів впливу OT-R може включати негативне зично дискретні одиниці, придатні як одиничні дози модулювання та/або інгібування рецепторів оксидля людей та інших ссавців, причому кожна одитоцину. Сполуки за цим винаходом можна застониця містить заздалегідь визначену кількість актисовува ти окремо або в комбінації з іншими фарвної речовини, розраховану на досягнення бажамацевтичними засобами, наприклад, з іншими ного терапевтичного ефекту, в комбінації з модуляторами OT-R. відповідним фармацевтичним наповнювачем. До При застосуванні як фармацевтичні засоби типових дозованих одиниць належать заповнені похідні піролідину за цим винаходом вживаються, відміряною кількістю фармацевтичної композиції 17 78058 18 ампули або шприци з рідкими композиціями, або Нижченаведені абревіатури мають відповідно пілюлі, таблетки, капсули тощо у випадку твердих такі визначення: композицій. В таких композиціях похідна піролідиACN - ацетонітрил ну є, як правило, неосновним компонентом (від Вос - трет-бутоксикарбоніл приблизно 0,1% (мас.) до приблизно 50% (мас.) CDCI3 - дейтерований хлороформ або за варіантом, якому віддається перевага, від сНех - циклогексан приблизно 1% (мас.) до приблизно 40% (мас.)), а DCM - ди хлорметан решту складають різномантні носії або середовиDECP - діетилціанофосфонат ща та технологічні домішки, які сприяють виготовDIC - діізопропіл карбодіімід ленню бажаної дозованої форми. DIEA - діізопропілетиламін Рідкі форми, придатні для перорального заDMAP (4-диметиламінопіролідин) стосування, можуть містити відповідні водні або DMF - диметилформамід неводні носії з буферними сполуками, суспензатоDMSO (диметилсульфоксид) рами та диспергаторами, барвниками, смакоароDMSO-d6 - дейтерований диметилсульфоксид матичними домішками тощо. Тверді форми можуть EDC 1-(3-диметил-аміно-пропіл)-3містити, наприклад, будь-які з перелічених нижче етилкарбодіімід інгредієнтів або сполуки аналогічної природи: в'яEtOAc - е тилацетат жуче, наприклад, мікрокристалічну целюлозу, траEt2O - діетиловий простий ефір гантову камедь або желатин; наповнювач, наприHATU гексафтор фосфонат О-(7клад, крохмаль або лактозу, дезінтегратор, азабензотриазол-1-іл-N,N,N',N'-тетраметилуронію) наприклад, альгінову кислоту, Primogel або кукуK2СО3 - карбонат калію рудзяний крохмаль; змащувальний агент, наприМЕК - метилетилкетон клад, стеарат магнію; ковзний агент, наприклад, MgSO4 - сульфат магнію колоїдний діоксид кремнію; підсолоджувач, наприNaH - гідрид натрію клад, сахарозу або сахарин; або смакоароматичну NaHCO3 - бікарбонат натрію домішку, наприклад, м'яту, метилсаліцилат або nBuLi - н-бутиллітій цитрусовий ароматизатор. NMO - моногідрат N-метилморфолін-N-оксиду Композиції для ін'єкцій, як правило, виготовPetEther - петролейний ефір ляють на основі стерильного сольового розчину OMs - О-мезилат=О-метилсульфонат або сольового розчину з фосфатним буфером для OTs - О-тозилат=О-толуолсуль фонат ін'єкцій, або інших ін'єкційних носіїв, відомих у гаTBAF - трет-бутиламонійфторид лузі. Як вказано вище, похідна піролідину формули TBDMS - трет-бутилдиметилсиліл І в таких композиціях є, як правило, неосновним TBTU - тетрафторборат О-бензотриазолілкомпонентом, вміст якого часто лежить у межах N,N,N',N' -тетраметилуронію від 0,05% (мас.) до 10% (мас), а решту складає TEA - триетиламін згаданий ін'єкційний носій тощо. TFA - трифтороцтова кислота Описані вище характеристики компонентів у THF - тетрагідрофуран композиціях для перорального застосування або ТРАР - тетрапропіламонійперрутенат) для ін'єкцій є лише типовими прикладами. Подак.т. (кімнатна температура). льші матеріали та способи перероблення тощо а) Алкоксипіролідини: описано в частині 8 посилання (6). Введення групи R2 Сполуки за цим винаходом можна застосовуАлкоксильні похідні піролідину загальної форвати також у с эормах із модифікованим вивільмули Іа (формула І, де X є О), в яких R1, R2, R3 та n ненням або у терапевтичних системах із тривалим відповідають визначенням, поданим для формули вивільненням лікарського засобу. Типові матеріаІ, можна одержати з відповідних похідних піролідили з модифікованим вивільненням також описані в ну формули II, де R1, R3 та n відповідають поданим (6). вище визначенням. Похідні формули II, які містять Ще одним предметом цього винаходу є спосіб спиртову гр упу, піддають прямому О-алкілуванню, одержання похідних піролідину формули І. застосовуючи відповідний алкілувальний агент R2Похідні піролідину, описані як приклади в цьоLG, де LG - відповідна відщеплювана група, в тому му документі, можна одержати з наявних на ринку числі СІ, Вr, І або OMs, OTs. За альтернативним або описаних раніше вихідних матеріалів, застоваріантом, сполуки Іа можна одержати шляхом совуючи вказані нижче загальні способи та метопроведення реакції типу реакції Міцунобу, як покадики. Мається на увазі, що у випадках, коли вказазано на Схемі 1. ні типові або доцільні умови експериментів (тобто температури, тривалість реакції, молярні кількості реагентів, розчинники тощо), можна використовувати також інші умови експериментів, якщо не зазначено інше. Оптимальні умови реакцій можуть варіювати залежно від застосовуваних конкретних реагентів або розчинників, проте такі умови може визначити фахівець у галузі за допомогою загальновідомих процедур оптимізації. Синтез сполук за цим винаходом: Приклади шляхів синтезу сполук формули І будуть подані нижче. 19 78058 Альтернативним способом синтезу алкоксильних похідних піролідину загальної формули Іа (формула І, де X є О), може бути одержання проміжної сполуки загальної формули llа, де R1, R3, n та LG відповідають поданим вище визначенням, шляхом проведення реакції спирту формули II з MsCl, TsCl або галогенувальним агентом, наприклад, РРh3Вr2. Потім відщеплювану гр уп у LG замінюють на групу R2OM, де R2 відповідає поданому вище визначенню та Μ є Η або метал, наприклад, Na, і одержують сполуку формули Іа. Введення групи оксиму Сполуки загальної формули II, де R1, R3 та n відповідають поданим вище визначенням, можна одержати зі сполук загальної формули IV, де R3 та n відповідають поданим вище визначенням та де PG1 є відповідна група захисту гідроксилу, за варіантом, якому віддається перевага, TBDMS. Кетон загальної формули IV вводять у реакцію з похідною гідроксиламіну загальної формули V, де R1 відповідає поданому вище визначенню. PG1 виділяють на стадії відщеплення групи захисту, застосовуючи стандартну методику синтезу, як показано на Схемі 2. Якщо гідроксиламін V не є наявним на ринку, то йогo можна синтезувати, наприклад, шляхом проведення реакції N-Boc-гідроксиламіну з відповідним алкілувальним агентом формули VI, де R 1 відповідає поданому вище визначенню та Ха= Сl, Вr, І, застосовуючи стандартні методики, як показано на Схемі 3. Одержання кетопіролідинів: 20 Кетопіролідини загальної формули IV, де R3, n та PG1 відповідають поданим вище визначенням, можна одержати з відповідних гідроксильних похідних піролідину формули VII, де R3, n та PG1 відповідають поданим вище визначенням, шляхом оброблення придатним окиснювачем, наприклад, DMSO/(COCІ) 2/TEA (умови реакції Сверна) або ТРАР у присутності N MO, як показано на Схемі 4. Стадія відновлення Гідроксильні похідні піролідину загальної формули VII, де R3 та n відповідають поданим вище визначенням та PG1 є гр упа захисту, можна одержати шляхом відновлення відповідних карбоксильних похідних піролідину формули VIII, де R3 та n відповідають поданим вище визначенням, R7 є Η або алкіл, a PG2 є придатна група захисту, після відповідних стадій введення та відщеплення груп захисту, як показано на Схемі 5. Перевага серед відновлювальних агентів віддається LiВН4, якщо R7 є алкіл, або LAH чи BH3·D MS, якщо R7 є Н. Стадія сполучення Захи щені карбоксильні похідні піролідину загальної формули VIII, де R3, n, R7 та PG2 відповідають поданим вище визначенням, одержують шляхом проведення реакції сполуки загальної формули IX, де n, R7 та PG2 відповідають поданим вище визначенням, a PG3 є Η або придатна група захисту N (у варіанті, якому віддається перевага, Вос) з ацилювальним агентом загальної формули R3-CO-Y, де R3 відповідає поданому вище визначенню, a Y є будь-яка придатна відщеплювана група, як показано на Схемі 6. Перевага серед ацилювальних агентів віддається хлорангідридам карбонових кислот (Y=Cl) або карбоновим кислотам (Y=OH), які використовуються в комбінації з придатним агентом пептидного спoлучення, наприклад, DIC, EDC, HATU, DECP або іншим. Як правило, вихідними матеріалами є сполуки 21 78058 22 формули IX, які можна одержати з комерційних значенням. джерел (наприклад, захищений 3-гідроксипролін, гомо-3-гідроксипролін, 3-гідроксипіролідин-5пропіонова кислота). Інші ви хідні матеріали (наприклад, сполуки формули XV, XVІ, XIX та XX) можна одержати з наявних на ринку сполук формули IX через проміжні сполуки формули XII. Чотири основних хімічних перетворення, опиУ цьому випадку карбоксильні похідні загальсані вище, тобто стадія сполучення, стадія відновної формули IX можна спочатку відновити до похілення, одержання оксиму та введення групи R2, дних загальної формули XII, де PG2, PG3 , R7 відможна виконувати в іншій послідовності. Оптимаповідають поданим вище визначенням та n=2 або льний добір послідовності стадій синтезу залежить 3, як показано на Схемі 7. від природи замісників R1-R4, n, Χ та інши х пара Потім сполуки формули XII піддають класичним реакціям введення та відщеплення груп захисту та перетворення функціональних груп, зокрема, процедурам гомологізації одним або двома атомами вуглецю, добре відомим фахівцям (7, 8). Один зі способів, яким віддається перевага, полягає в гомологізації одним атомом вуглецю сполук загальної формули XII, де PG2 та PG 3 відповідають поданим вище визначенням, а n є 2 або 3, шляхом заміни відщеплюваної групи ціаногрупою з подальшим гідролізом з одержанням карбонових кислот загальної формули XV, де PG2 , PG3 та n відповідають поданим вище визначенням, або відновленням з одержанням амінів загальної формули XVI, де PG2, PG3 та n відповідають поданим вище визначенням, як покaзано на Схемі 8. У випадку гомологізації двома атомами вуглецю, один зі способів, яким віддається перевага, полягає у проведенні реакції альдегіду загальної формули XVIII, одержаного окисненням сполуки загальної формули XII, де PG2 , PG3 та n відповідають поданим вище визначенням, реактивом Віттіга-Горнеіра (Wittig-Horner), як показано на Схемі 9. Одержану таким чином сполуку потім відновлюють до сполуки загальної формули XIX, де PG2, PG 3, n та R7 відповідають поданим вище ви метрів, зрозумілих для фа хівців. b) Амінопіролідини: Введення групи R2: Аміноалкільні похідні піролідину загальної формули Іb (формула І, де X є NR4), в яких R1-R4 та n відповідають визначенням, поданим для формули І, можна одержати з відповідних похідних піролідину llа, одержаних, як описано в розділі а), зі сполук формули II за схемою 1, де R1, R3, n та LG відповідають поданим вище визначенням, шляхом заміни групи LG із застосуванням відповідного аміну HNR2R4, як показано на Схемі 10. Альтернативний спосіб одержання аміноалкільних похідних гіролідину загальної формули Іb (формула І, де X є NR4), в яких R1-R4 та n відповідають поданим вище визначенням, показано на Схемі 11. Згідно з цим способом, гідроксильну групу у похідних піролідину загальної формули II (які можна одержати зі сполук формули IV; дивись схему 2), де R1, R3 та n відповідають поданим вище визначенням, окиснюють у відповідний альдегід, використовуючи добре відомі умови такого перетворення, наприклад, DMSO/(COCІ)2, TEA (умови реакції Сверна) або реактив ДессаМарітіна. Цей альдегід потім вводять в реакцію з аміном HNR2R4, де R2 та R4 відповідають поданим вище визначенням, у відновлювальних умовах. У випадку аміноалкільних похідних піролідину загальної формули Іb, де R4 є Н, a R1, R2, R3 та n відповідають поданим вище визначенням, можна застосувати альтернативний шлях синтезу. Аміноалкільні похідні піролідину загальної формули Іb (формула І, де X є ΝΗ), можна потім одержати з відповідних аміноалкільних похідних піролідину 23 78058 формули III, де R1 , R3 та n відповідають поданим вище визначенням, шляхом прямого алкілування сполукою R2-LG, де R2 та LG відповідають поданим вище визначенням, або відновлювального алкілування альдегідом формули R2CHO, де R2 відповідає поданому вище визначенню, з використанням придатного відновлювального агента, як показано на Схемі 12. Аміноалкільні похідні формули III, де R1 , R3 та n відповідають поданим вище визначенням, можна одержати з гідроксіалкілпіролідинів формули II (котрі можна одержати зі сполук формули IV; дивись схему 2), де R1, R3 та n відповідають поданим вище визначенням, або з похідних загальної формули llа (котрі можна одержати зі сполук формули II за схемою 1), де R1, R3, n та LG відповідають поданим вище визначенням, за добре відомими методиками виконання таких перетворень функціональних груп. Два приклади таких перетворень показано на Схемі 13. 24 Інші стадії, тобто введення групи оксиму, одержання кетопіролідинів, стадія відновлення та стадія сполучення, описані вище в розділі а). Проте, як і у випадку синтезу алкоксипіролідинів, чотири основні хімічні перетворення, описані вище, можна виконувати в іншій послідовності. Оптимальний вибір послідовності стадій синтезу залежить від природи замісників R1-R4, n, Χ та інших параметрів, зрозумілих для фа хівців. Наприклад, сполуки загальної формули І,де R1-R4, n та X відповідають поданим вище визначенням, можна одержати з кетопіролідинів загальної формули X, де R2, R3, n та X відповідають поданим вище визначенням, шляхом проведення реакції з гідроксиламіном V, де R1 відповідає поданому ви ще визначенню, як показано на Схемі 15; результатом цієї реакції є введення групи оксиму. Кетопіролідин формули X можна одержати шляхом окиснення спирту загальної формули XI, де R2, R3, n та X відповідають поданим вище визначенням, a PG2 є Η або придатна група захисту О, в умовах, аналогічних умовам перетворення сполук загальної формули VII у сполуки загальної формули IV, як показано на Схемі 16. Для одержання сполук формули Ib (формула І, де X є NR4), в яких R2 є COR5 , SO 2R5, COOR 5, CONR5R6, SO 2NR5R6, де R5 та R6 є заміщені або незаміщені алкіли або арили, a R4 є Η або заміщений чи незаміщений алкіл або арил, способи, представлені вище на Схемі 10, Схемі 11 та Схемі 12, непридатні. В такому випадку ці сполуки формули Іb можна одержатн| шляхом оброблення сполуки загальної формули Іс (сполука формули Іb, де R2 є Н, одержана способами, представленими на Схемі 10, Схемі 11 або Схемі 12) відповідним ацилювальним агентом, в тому числі ацилхлоридом або карбоновою кислотою, в комбінації з агентом пептидного сполучення, наприклад, DIC або EDC, сульфувальним агентом та іншими реагентами, як показано на Схемі 14. Сполуки загальної формули XI, де R2, R3 , n, PG2 та X відповідають поданим вище визначенням, можна одержати зі сполук загальної формули VII, де R3, n та PG 1 відповідають поданим вище визначенням, шляхом введення групи R2 із подальшим застосуванням одного зі способів, показаних на Схемі 1, Схемі 10, Схемі 11, Схемі 12, Схемі 13 або Схемі 14. Вибір способу залежить від природи замісників R3, R2, n та X і є зрозумілим для фахівця, як і вибір та послідовність відповідних стадій введення та відщеплення груп захисту, як показано на Схемі 17. 25 78058 26 шляхи синтезу індивідуальних сполук формули І залежать від конкретних замісників у кожній молекулі та від доступності необхідних проміжних сполук; такі фактори також зрозумілі для фахівців. Усі способи введення та відщеплення груп захисту описані в (7, 10). Приклади: Нижче цей винахід буде ілюстровано деякими І прикладами, які не слід розглядати як такі, що обмежують обсяг винаходу. Одержання сполук формули VII, а також стадія Сполуки за цим винаходом можуть бути синвідновлення описані вище. тезовані за різнимії схемами синтезу, наведеними Послідовності реакцій, представлені на подавище. Нижченаведені приклади ілюструють спосоних вище схемах, забезпечують одержання енанби, яким віддається перевага, синтезу сполук фотіомерно чистих сполук формули І за умови застормули І та визначення їхньої біологічної активноссування енантіомерно чистих вихідних матеріалів. ті. Можна одержати (R)-, а також (S)-енантіомери Приклад І: О-метилоксим 3ЕZ,5S)-5залежно від застосування як вихідні матеріали (R)(гідроксиметил)-1-[(2'-метил-1,1'-біфеніл-4або (S)-форм наявних на ринку сполук формули іл)карбоніл]піролідин-3-ону (1) (сполука формули II IX. або формули Іа, де R2 є Н) Послідовності реакцій, представлені на поданих вище схемах, забезпечують одержання сумішей (Е)- та (Ζ)-ізомерів відносно замісників при екзоциклічному подвійному зв'язку піролідинового циклу. (Е) та (Z)-ізомери можна розділити стандартними хроматографічними способами, добре відомими фахівцям, наприклад, рідинною хроматографією високого тиску (HPLC) з оберненою фазою або флеш-хроматографією на силікагелі (FC). За альтернативним варіантом, той чи інший (Е)- або (Z)-ізомер можна збагачувати шляхом послідовної селективної кристалізації з відповідних розчинників або сумішей розчинників. Абсолютні конфігурації екзоциклічного подвійного зв'язку були ідентиПроміжна сполука (1а): 1-(третфіковані із застосуванням способів ЯМР, широко бутоксикарбоніл)-4-оксо-L-пролін описаних в літературі, як відомо практичним працівникам галузі (ідентифікація конфігурації, наприклад, оксимних функціональних груп описана у (9)). З метою підвищення загального виходу одного з ізомерів (звичайно (Ζ)-ізомеру), др угий ізомер (звичайно (Е)-ізомер) можна повернути в цикл шляхом умисної повторної ізомеризації в органічних розчинниках, які містять слідові кількості кисі лоти, наприклад, НСI, із подальшим розділенням (Ε)/(Ζ) способами хроматографії та/або кристаліОдержання кетопіролідину: зації. Наявну на ринку (2S,4R)-1-(тpетЗа іншим загальним способом (Схема 18), бутоксикарбоніл)-4-г}дрокси-2-піролідинкарбонову сполуки формули І можна перетворити в альтеркислоту (30г, 0,13моль) розчиняли в ацетоні нативні сполуки формули І, застосовуючи придатні (1500мл). Встановлювали у колбу механічну мішаспособи взаємоперетворення, як описано, наприлку, та інтенсивно перемішували розчин. Готували клад, нижче у Прикладах. свіжий 8-н. розчин хромової кислоти шляхом розчинення триоксиду хрому (66,7г, 0,667моль) у воді (40мл), додання концентрованої сірчаної кислоти (53,3мл) та додання води в кількості, достатній для доведення об'єму розчину до 115мл. Потім цей 8н. розчин хромової кислоти (115мл) додавали краплями протягом 30хв при безперервному інтенсивному перемішуванні до вищезгаданого розчину похідної піролідинкарбонової кислоти, при відведенні тепла екзотермічної реакції з підтриманням оптимальної температури 25°С шляхом застосування льодяної бані. Після завершення додавання Якщо описані вище загальні способи синтезу хромової кислоти реакційну суміш перемішували непридатні для одержання сполук формули І ще протягом 15хв, підтримуючи оптимальну темта/або необхідних проміжних сполук для синтезу пературу 25°С. Потім реакційну суміш гасили досполук формули І, слід застосовувати придатні данням метанолу (20мл). Вивільнення тепла реакспособи одержання, відомі фахівцю. Як правило, 27 78058 28 ції регулювали шляхом застосування льодяної при кімнатній температурі в атмосфері азоту. Пісбані та, за потребою, додавання незначної кільколя завершення вивільнення газоподібного азоту сті подрібненого льоду безпосередньо до самої одержаний розчин жовтого кольору випарювали у реакційної суміші. Фільтрували реакційну суміш вакуумі, і залишок фільтрували через шар силікачерез шар целіту, а потім концентрували у вакуумі. гелю з елююванням етилацетатом. Після видаОдержаний кислий розчин екстрагували етилацелення розчинника з фільтрату одержували метилтатом (3х300мл), об'єднані органічні шари промиовий складний ефір (1с) у вигляді масла жовтого вали розсолом (2x100мл), супили над сульфатом кольору (0,646г, вихід 95%). магнію і концентрували у вакуумі. Неочищений Проміжна сполука 1d: метил-(25,4EZ)-4продукт перекристалізовували з етилацетату, і (метоксііміно)-1-[(2'-Цетил[1,1'-біфеніл]-4одержували білу кристалічну речовину, (2S)-1іл)карбоніл]-2-піролідинкарбоксилат (тpет-бутоксикарбоніл)-4-оксо-2піролідинкарбонову кислоту (22,55г, 76%) (1а). (1H ЯМР (360МГц, CDCI3): 1,4 (m, 9H), 2,4-3,0 (m, 2H), 3,7-3,9 (m, 2Н), 4,75 (dd, 1Н)). Проміжна сполука 1b: (4ЕZ)-1-(третбутоксикарбоніл)-4-(метоксііміно)-L-пролін ι Введення групи оксиму: Готували розчин, який містив (2S)-1-(тpетбутоксикарбоніл)-4-оксо-2-піролідинкарбонову кислоту (Проміжна сполука 1а, 5,0г, 21ммоль) та гідрохлорид О-метилгідроксиламіну (2,7г, 32,8ммоль) у хлороформі (100мл), який містив триетиламін (5,5г, 55ммоль). Реакційну суміш перемішували при температурі навколишнього середовища протягом ночі, після чого видаляли розчинник. Одержану неочищену реакційну суміш розчиняли в етилацетаті (150мл) і швидко промивали 1-н. НСl (40мл). Кислотний шар екстрагували етилацетатом (3x20мл), і об'єднані органічні шари промивали розсолом, після чого сушили над сульфатом магнію, фільтрували та видаляли розчинник у вакуумі. Цільовий продукт (1b) (5,3г, 94%) одержували у вигляді блідо-жовтого масла. 1H ЯМР (400МГц, CDCI3); 1,45 (m, 9H), 2,8-3,2 (m|, 2H), 3,9 (s, 3Н), 4,2 (m, 2Н), 4,4-4,7 (m, 1Н). Проміжна сполука 1с: 1-трет-бутил-2-метил(2S,4ЕZ)-4-(метоксііміно)-піролідин-1,2дикарбоксилат Готували розчин простого ефіру оксиму (2S,4EZ)-1-(трет-бутоксикарбоніл)-4-(метоксііміно)2-піролідинкарбонової кислоти (проміжна сполука 1b, 0,648г, 2,5ммоль) у суміші метанолу з толуолом (1:1) 05мл). До цього розчину додавали краплями при перемішуванні тримедилсилілдіазометан (3,8мл 2Μ розчину в гексані, 7,5ммоль) І Приєднання групи R3: Готували розчин, який містив 1-трет-бутил-2метил-(2S,4EZ)-4-(метоксііміно)-1,2-піролідиндикарбоксилат (проміжна сполука 1с, 0,892г, 3,28ммоль) у безводному DCM (28мл). Додавали краплями TFA (20%, 7мл). Суміш перемішували при кімнатній температурі протягом 20хв. Випарювали розчинники, і одержували цільовий продукт (0,564г, кількісний вихід) у вигляді жовтого масла. Цей продукт одразу ж розчиняли у суміші (7:3) DCM та DMF (30мл) і додавали 2'-метил[1,1єбіфеніл]-4-карбонову кислоту (0,765г, 3,60ммоль) та 4-диметиламінопіролідин (0,880г, 7,21ммоль). Повільно додавали при 0°С EDC (0,691мг, 3,60ммоль), і реакційну суміш перемішували протягом ночі при кімнатній температурі. Промивали суміш водою! (двічі по 20мл), сушили над MgSO4, фільтрували та випарювали у вакуумі. Проміжна сполука 1е: (2S,4EZ)-4(метоксііміно)-1-[(2'-метил[1,1'-біфеніл]-4іл)карбоніл]-2-піролідинкарбонова кислота Введення групи R2: Метил-(2S,4ЕZ)-4-(метоксііміно)-1-[(2' 29 78058 30 метил[1,1'-біфеніл]-4-іл)карбоніл]-2трували у високому вакуумі і розчиняли залишок в піролідинкарбоксилат (проміжна сполука 1d, етилацетаті, промивали водою, 1-н. розчином 391мг, 1,06ммоль) перемішували при кімнатній хлористоводневої кислоти, насиченим розчином температурі протягом 4год у розчині, який містив бікарбонату натрію та розсолом. Потім розчин судіоксан (9мл), воду (3мл) та NaOH (1,13мл 1,6-н. шили над сульфатом магнію, фільтрували та конрозчину). Видаляли діоксан у вакуумі та підкислюцентрували. Одержаний таким чином неочищений вали розчин 0,1-н. НСI. Екстрагували розчин продукт очищали флеш-хроматографією з елююEtOAc, промивали розсолом, сушили над сульфаванням сумішшю циклогексан/етилацетат 90:10 том магнію, фільтрували і концентрували, одер(сполука 2а). жуючи цільовий продукт (1е) (342мг, вихід 91%). 1H Вихід: 53% (12,6г). ЯМР (300МГц, CDCI3): 2,23 (s, 1,5Н), 2,25 (s, 1,5Н), Зовнішній вигляд: тверда речовина коричнево3,10 (m, 2H), 3,83 (s, 1,5Н), 3,85 (s, 1,5Н), 4,10 (m, го кольору. 1 2Н), 5,18 (m, 1Н), 7,18 (m, 4H), 7,37 (m, 2Н), 7,47 H ЯМР (CDCI3): 2,11 (m, 1Н), 2,36 (m, 1Н), (m, 2H). 3,48 (d, J=11,5Гц, 1Н), 3,77 (s, 3H), 3,86 (dd, J=3,4 MS (APCI+): 353 (M+1) (APCI-): 351 (M+1). та 11,1Гц, 1Н), 4,51 (s, 1H), 4,86 (t, J=8,3Гц, 1H), Приклад І: (2S,4EZ)-4-(метоксііміно)-1-[(2'7,33-7,62 (m, 9H). метил[1,1'-бiфеніл]-4-іл)карбоніл]-2MS (APCI+): 651 (2M+1). піролідинкарбонову кислоту (проміжна сполука 1е, Проміжна сполука 2b: (3R,5S)-1-(1,1'-біфеніл50мг, 0,14ммоль) розчиняли в THF (1мл) і оброб4-ілкарбоніл)-5-(гідроксиметил)-піролідин-3-ол ляли етилхлорформіатом (163мкл, 0,17ммоль) та TEA (29мкл, 0,76ммоль) при -15°С. Реакційну суміш перемішували при цій температурі в атмосфері азоту протягом 30хв, після чого додавали боргідрид натрію (13,4мг в 0,65мл води, 0,35ммоль). Суміші давали нагрітися до кімнатної температури. Через 3год реакційну суміш гасили 2,5мл 1-н. розчину НСl і екстрагували тричі EtOAc. Об'єднані органічні шари промивали 0,1-н. розчином НСl (тричі), водою (тричі), сушили над сульфатом магнію, фільтрували та концентрували, одержуючи сполуку (1). Вихід: 12% (6мг). Зовнішній вигляд: жовте масло. MS (АРСІ+): 339 (М+1). Боргідрид літію (600мг, 25,8ммоль) повільно Чистота за даними HPLC: 90,1%. додавали до розчину метилового складного ефіру Приклад II: О-метилоксим (3ЕZ,5S)-1-(1,1'(2а) (5,6г, 17,2ммоль) у THF (80мл) при 0°С в атбіфеніл-4-ілкарбоніл)-5-(гідроксиметил)піролідинмосфері азоту. С уміш перемішували при кімнатній 3-ону (2). О-метилоксим (3Z,5S)-1-(1,1'-біфеніл-4температурі протягом 2год, і нейтралізували борілкарбоніл)-5-(гідроксиметил)піролідин-3-ону (3). гідрид водою. Білий осад, який містив сполуку (2b), О-метилоксим (3E,5S)-1-(1,1'-біфеніл-4фільтрували і промивали діетиловим ефіром. ілкарбоніл)-5-(гідроксиметил)піролідин-3-ону (4) Вихід: 82% (4,2г). 2 (сполуки Формули II або Іа, де R є Н) Зовнішній вигляд: біла тверда речовина. 1 Проміжна сполука 2а: метил-(4R)-1-(1,1'H ЯМР (DMSO): 1,90-2,02 (m, 2Н), 3,24-3,30 біфеніл-4-ілкарбоніл)-4-гідрокси-L-пролінат (сполу(m, 2Н), 3,57 (m, 2Н), 3,67 (m, 1Н), 4,18 (m, 1Н), ка формули VIII). 4,28 (m, 1Н), 4,80 (brs, 1Н), 7,39-7,74 (m, 9Н). APCI (+): 299 (М+1). Проміжна сполука 2с: (3R,5S)-1-(1,1'-біфеніл-4ілкарбоніл)-5-({[третбутил(диметил)силіл]окси}метил)піролідин-3-ол (сполука формули VII). До розчину 4-біфенілкарбонової кислоти (17,5г, 88,3ммоль) у DMF (100мл) додавали EDC (16,9г, 88,3ммоль), HOBt (11,9г, 88,3ммоль) та DIEA (27,9мл, 183,9ммоль). Одержану суміш перемішували при кімнатній температурі протягом 10хв, після чого додавали гідрохлорид метилового складного ефіру транс-гідрокси-L-проліну (10,7г, 73,6ммоль) і залишали на 48год при кімнатній температурі в атмосфері азоту. Потім суміш концен Розчин діолу (2b) (4,2г, 14,1ммоль) та TBDMS 31 78058 32 Cl (1,9г, 12,6ммоль) у DMF (40мл) розбавляли DCM (150мл) та обробляли DBU (421мл, 2,81ммоль) та TEA (1,96мл, 14,1ммоль). Реакційну суміш перемішували протягом 16год при кімнатній температурі в атмосфері азоту. Після розбавлення етилацетатом органічну фазу промивали водою. Водну фаз у знов екстрагували етилацетатом, і об'єднані органічні фази промивали насиченим розчином хлориду амонію і тричі розсолом, після чого сушили над сульфатом магнію, фільтрували і концентрували. Одержаний таким чином не очищений продукт очищали флеш-хроматографією з елююванням сумішшю DCM/MeOH 95:5 (сполука Суміш кетону 2d (4,78г, 11,7ммоль), гідрохло2с). риду метилгідроксиламіну (2,44г, 29,2ммоль) та Вихід: 75% (4,39г). TEA (4,05мл, 29,2ммоль) у хлороформі (80мл) наЗовнішній вигляд: білий порошок. грівали при 65°С протягом 16год. Потім суміш 1 H ЯМР (DMSO): 0,03 (s, 6Н), 0,88 (s, 9Н), 1,92промивали розсолом, 1-н. розчином НСI, знову 2,04 (m, 2Н), 3,30 (m, 1Н), 3,54 (m, 1Н), 3,72 (brd, розсолом і сушили над сульфатом магнію, фільтJ=9,0Гц, 1Н), 3,92 (m, 1H), 4,20 (m, 1Н), 4,30 (m, рували та концентрували, одержуючи сполуку 2е. 1H), 4,83 (m, 1H), 7,37-7,56 (m, 5H), 7,77 (m, 4H). Вихід: 86% (4,41г). LC/MS (ESI, +): 412 (M+1). Зовнішній вигляд: коричневе масло. 1 Проміжна сполука 2d: (5S)-1-(1,1'-біфеніл-4H ЯМР (CDCI3): 0,06 (s, 6H), 0,88 (s, 9H), 2,68ілкарбоніл)-5-({[трет-бутил2,90 (m, 2H), 3,42 (m, 1Н), 3,78 (s, 1,5Н), 3,83 (s, (диметил)силіл]окси}метил)піролідин-3-он (сполука 1,5Н), 4,1 (m, 2H), 4,31 (m, 1Н), 4,83 (m, 1H), 7,34формули IV). 7,64 (m, 9H). LC/MS: ESI (+): 439 (M+1) Кінцеві сполуки: О-метилоксим (3EZ,5S)-1(1,1'-біфеніл-4-ілкарбоніл)-5(гідроксиметил)піролідин-3-ону (2), О-метилоксим (3Z,5S)-1-(1,1'-біфеніл-4-ілкарбоніл)-5-(гідроксиметил)піролідин-3-ону (3), О-метилоксим (3E,5S)1-(1,1'-біфеніл-4-ілкарбоніл)-5(гідроксиметил)піролідин-3-ону (4) (сполуки формули II або формули Іа, якщо R2 є Н): Розчин безводного DMSO (2,04мл, 28,8ммоль) у DCM (15мл) повільно додавали до розчину оксалілхлориду (1,34мл, 15,7ммоль) у DCM (5мл) при 78°С в атмосфері азоту. С уміш перемішували протягом 30хв, після чого повільно додавали спирт (2с) (5,38г, 13,1ммоль) у DCM (50мл). Реакційну суміш перемішували протягом 3год при -78°С, додавали краплями TEA (9,06мл, 65,3ммоль) і давали нагрітися до кімнатної температури. Потім суміш промивали розсолом, 1-н. розчином НСІ, знову розсолом, сушили над сульфатом магнію, фільтрували та концентрували (Сполука 2d). Вихід: 91% (4,88г). Зовнішній вигляд: коричневе масло. 1 H ЯМР (CDCI3): 0,06 (s, 6H), 0,86 (s, 9H), 2,492,70 (m, 2H), 3,69 (m, 1H), 3,84 (m, 1H), 3,98 (m, 1H), 4,20 (m, 1H), 5,07 (m, 1H), 7,37-7,65 (m, 9H). LC/MS (ESI,+): 410 (M+1). Проміжна сполука 2е: О-метилоксим (3ЕZ,5S)1-(1,1'-біфеніл-4-ілкарбоніл)-5-({[третбутил(диметил)силіл]окси}метил)піролідин-3-ону Розчин ТВАР (14,1мл 1Μ розчину в THF, 14,1ммоль) додавали до розчину оксиму (2е) (4,13г, 9,41ммоль) в THF (100мл). Реакційну суміш перемішували при кімнатній температурі протягом ночі. Потім суміш концентрували і розбавляли етилацетатом. Органічну фазу промивали водою, 1-н. розчином НСl і розсолом, сушили над сульфатом магнію, фільтрували та концентрували. Вихід суміші Е- та Z-ізомерів (2): кількісний. Зовнішній вигляд: біла піна. LC/MS: ESI (+): 325 (М+1). Два ізомери Ε та Ζ були розділені флешхроматографією із застосуванням суміші етилацетат/циклогексан (80:20) як елюента. Менш полярна Фракція: О-метилоксим (3Е,5S)-1-(1,1'-біфеніл-4-ілкарбоніл)-5(гідроксиметил)піролідин-3-ону (3) Rf: 0,36 (AcOEt/циклогексан 80:20). Вихід: 25% (765мг). Зовнішній вигляд: біла піна. 33 78058 34 H ЯМР (DMSO): 2,64 (brs, 2Н), 3,20-3,7 (m, ілкарбоніл)-4-(метоксііміно)-піролідин-23Н), 3,80 (s, 3Н), 3,8-4,6 (m, 2Н), 5,00 (t, J=8,0Гц, іл]метокси}оцтова кислота (6) (сполука формули 1Н), 7,37-7,60 (m, 9H). Іа) ІЧ (плівка): 3292, 1604, 1417, 1040. MS (APCI,+): 325 (M+1). Елементний аналіз: (С19H20N2О3 ;0,2Н2О): обчислено: С: 69,58; Η: 6,27; Ν: 8,54; знайдено: С: 69,53; Η: 6,32; Ν: 8,36. Чистота за даними HPLC: 98,6%. Більш полярна фракція: О-метилоксим (3Z,5S)-1-(1,1'-біфеніл-4-ілкарбоніл)-5(гідроксиметил)піролідин-3-ону (4) Rf: 0,22 (AcOEt/циклогексан 80:20). Вихід: 33% (1013мг). Зовнішній вигляд: білий порошок. До розчину трет-бутилового складного ефіру Температура плавлення: 189°С. (5) (45мг, 0,1ммоль) у дихлорметані (0,5мл) дода1 H ЯМР (DMSO): 2,64-2,82 (m, 2H), 3,20-3,57 вали при кімнатній температурі трифтороцтову (m, 3Н), 3,70-3,83 (m, 3Н), 3,98-4,60 (m, 2Н), 5,0 (t, кислоту (0,1мл). Після завершення реакції суміш J=8,0Гц, 1Н), 7,37-7,76 (m, 9H). концентрували у вакуумі. ІЧ (плівка): 3373, 1606, 1417, 1045. Неочищений продукт розчиняли в дихлормеMS (АРСІ ,+) : 649 (2M+1), 325 (M+1). тані та промивали HСI (1М). Елементний аналіз: (C19H20N2O3): обчислено: Органічний шар сушили (MgSO4) і концентруС: 70,35; Η: 6,2J; N: 8,64; знайдено: С: 70,22; Η: вали. 6,27; Ν: 8,46. Вихід: 40% (20мг). Чистота за даними HPLC: 99,9%. LC/MS (ESI-): 381 (М-Н); (ESI+): 383 (М+Н). Примітка: виділено також фракцію суміші E/Z Чистота за даними HPLC: 74%. (470мг). Приклад V: 2-{[(2S,4ЕZ)-1-(1,1'-біфеніл-4Приклад III: трет-бутил-{[(2S,4ЕZ)-1-(1,1'ілкарбоніл)-4-(метоксііміно)-піролщин-2біфеніл-4-ілкарбоніл)-4-(метоксііміно)-піролідин-2іл]метокси}-N-(2-піролідин-1-ілетил)ацетамід (7) іл]метокси}ацетат (5) (сполука формули Ia) (сполука формули Іа) 1 До розчину спирту (2) (суміш EZ, 58мг, 0,18ммоль) тa трет-бутилбромацетату (530мкл, 3,6ммоль) у дихлорметані (0,2мл) додавали при перемішуванні 50% водний розчин NaOH (0,8мл) та хлорид тетрабутиламонію (50мг, 0,18ммоль) при кімнатній температурі, і одержану реакційну суміш перемішували протягом 1год. Після розбавлення водою суміш екстрагували етилацетатом, органічну фазу промивали розсолом, сушили (MgSO4) і концентрували. Одержаний продукт (сполука 5) очищали хроматографією на колонці із силікагелем із застосуванням суміші DCM:MeOH (95:5) як елюента. Вихід: 99% (85мг). LC/MS (ESI, -): 381 (M-tBu-H). 1 H ЯМР (CDCI3): 1,45 (s, 9H), 2,94 (m, 2H), 3,60-4,20 (m, 8Н}, 4,36 (m, 1Н), 4,90 (m, 1H), 7,307,70 (m, 9H). Чистота за даними HPLC: 92%. Приклад IV: {[(2S,4ЕZ)-1-(1,1'-біфеніл-4 Розчин кислоти (6) (15мг, 0,04ммоль), 1-(2аміноетил)-піролідину (6мкл, 0,05ммоль), DIC (7,2мкл, 0,05ммоль) та DMAP (1мг, 0,01ммоль) у дихлорметані (1мл) перемішували в атмосфері аргону при кімнатній температурі протягом 18год. Одержану суміш концентрували у вакуумі і очищали продукт препаративною хроматографією на силікагелі із застосуванням суміші DCM:MeOH (50:50) як елюента. Вихід: 80% (17мг). 1 H ЯМР (CDCI3): 1,71 (s, 4H), 2,30-4,00 (m, 8H), 3,37 (m, 2H), 3,50-4,40 (m, 9H), 4,96 (m, 1H), 6,87 (m, 1H), 7,30-7,70 (m, 9H). LC/MS (ESI-): 477 (M-H); (ESI+): 479 (M+H). Чистота за даними HPLC: 88%. Приклад VI: О-метилоксим (3ЕZ,5S)-1-(1,1'біфеніл-4-ілкарбоніл)-5-(метоксиметил)піролідин3-ону (8) (сполука формули la). 35 78058 36 том магнію, фільтрували і концентрували. Вихід: кількісний (115мг). Чистота за даними HPLC: 87%. Приклад VII: Мезилат (9а) (60мг, 0,15ммоль) розчиняли у суміші MEK/ACN (1:1, 10мл) і обробляли бромідом літію (16мг, 0, (18ммоль). Реакційну суміш нагрівали при 85°С, а потім додавали Nметиіпіперазин (22мг, 0,22ммоль) та TEA (31мкл, 0,22ммоль), і перемішували суміш при цій температурі протягом ночі. Потім суміш концентрували, знов розчиняли в етилацетаті і промивали насичеДо розчину спирту (2) (суміш EZ, 20мг, ним розчином NaHCO3, розсолом, сушили над 0,06ммоль) та гідриду натрію (3мг, 0,12ммоль) у сульфатом магнію, фільтрували і концентрували. тетрагідрофурані (1мл) додавали в атмосфері арНеочищений продукт (48мг) очищали флешгону метилйодид (7,7мкл, 0,12ммоль). Реакційну хроматографією при елююванні сумішшю суміш перемішували протягом ночі і гасили водою. DCM/MeOH/NH4OH (92:8:1), і одержували сполуку Розбавляли суміш етилацетатом і промивали роз9а. солом, сушили (MgSO 4) та концентрували у вакууRf: 0,17 (DCM/MeOH/NH 4OH, 90:10:1). мі. Неочищений продукт очищали препаративною Вихід: 36% (22мг). хроматографією на силікагелі із застосуванням як: Зовнішній вигляд: коричневе масло. елюента суміші DCM:MeOH (100:0, потім 95:5). 1 H ЯМР (CDCI3): 2,31 (s, 3Н), 2,45-2,86 (m, Вихід: 94% (21мг). 14Н), 3,85 (brs, 3Н), 4,13 (m, 1Н), 7,34-7,64 (m, 9H). 1 H ЯМР (DMSO-d6): 2,80 (m, 2Н), 3,35 (m, ЗН), LC/MS (ESI, +): 407 (M+1). 3,46 (m, 1Н), 3,67, (m, 1H), 3,84 (s, 3H), 4,27 (m, Чистота за даними HPLC: 97,1%. 2H), 4,91 (m, 1H), 7,30-7,70 (m, 9H). Приклад VIII: О-метилоксим (3ЕZ,5S)-1-(1,1'LC/MS (ESI+): 339 (M+l). біфеніл-4-ілкабоніл)-5-{[(4Чистота за даними HPLC: 93%. метоксифеніл)аміно]метил}піролідин-3-ону (10) Приклад VII: О-метилоксим (3EZ,5S)-1-(1,1’(сполука формули Іb) біфеніл-4-ілкарбоніл)-5-[(4-метилпіперазин-1іл)метил]піролідин-3-ону (9) (сполука формули Іb) Проміжна сполука 9а: [(2S,4ЕZ)-1-(1,1'-біфеніл4-ілкарбоніл)-4-(метоксііміно)піролідин-2іл]метилметансульфонат (сполука формули IIа) Мезилхлорид (48мкл, 0,62ммоль) додавали до розчину спирту (2) (суміш EZ, 80мг, 0,25ммоль) у DCM (8мл), охолодженого до 0°С, в атмосфері азоту. Потім реакційній суміші давали нагрітися до кімнатної температури, і контролювали проходження реакції хроматографією в тонкому шарі. Завершення реакції досягалося через 1,5год. Органічну фазу промивали насиченим розчином амонійхлориду та розсолом, сушили над сульфа Розчин мезилату (9а) (32мг, 0,08ммоль), nметоксіаніліну (20мг, 0,16ммоль) та триетиламіну (22мкл, 0,16ммоль) у суміші метилетилкетону з ацетонітрилом (2мл, 1:1) перемішували протягом 2 діб. Реакційну суміш розбавляли етилацетатом і промивали насиченим розчином NH4CІ. Органічну фазу сушили (MgSO 4) і концентрували. Одержаний таким чином неочищений продукт очищали HPLC, використовуючи систему PAR ALLEX FLEXÒ . Вихід: 21% (10мг). Чистота за даними HPLC: 72%. LC/MS (ESI+): 430 (М+1). Приклад IX: О-метилоксим (3ЕZ,5S)-1-(1,1'біфеніл-4-ілкарбоніл)-5-({[2-(1Н-піразол-1іл)етил]аміно}метил)піролідин-3-ону (11) (сполука формули Іb) 37 78058 Розчин мезилату (9а) (60мг, 0,15ммоль), 1-(2'аміноетил)піразолу (58мг, 0,43ммоль), карбонату калію (41мг, 0,30ммоль) та йодиду натрію (225мг, 1,50ммоль) у тетрагідрофурані (5мл) перемішували протягом 2 діб. Реакційну суміш розбавляли етилацетатом і промивали 1-н. НСІ, а потім розсолом. Органічну фазу сушили (MgSO 4) і концентрували. Неочищений продукт очищали, застосовуючи картридж С8 SPE. Вихід: 5% (3мг). LC/MS (ESI+): 418 (М+Н). Чистота за даними HPLC: 79%. Приклад X: 2-{[(2S,4ЕZ)-1-(1,1'-біфеніл-4ілкарбоніл)-4-(метсксііміно)-піролідин-2-іл]метил}1Н-ізоіндол-1,3(2H)-діон (12) (сполука формули Іb) Розчин спирту (2) (суміш EZ, 51мг, 0,16ммоль), фталіміду (70мг, 0,48ммоль), прищепленого до полімеру три фенілфосфіну (158мг, 0,48ммоль) та діетилазодикарбоксилату (40% у толуолі, 205мкл, 0,48ммоль) у тетрагідрофурані (5мл) перемішували протягом 2 діб. Відфільтровували смолу, і реакційну суміш концентрували у вакуумі. Неочищений продукт очищали препаративною хроматографією на силікагелі із застосуванням як елюента DCM. Вихід: 59% (50мг). 1 H ЯМР (CDCI3): 2,76 (m, 2Н), 3,60-4,50 (m, 7Н), 5,32 (m, 1Н), 7,20-8,00 (m, 13H). LC/MS (ESI+): 454 (M+1). Чистота за даними HPLC: 85%. Приклад XI: О-метилоксим (3ЕZ,5S)-5(амінометил)-1-(1,1'-біфекіл-4ілкарбоніл)піролідин-3-ону (13) (сполука формули III) 38 Розчин фталіміду (12) (42мг, 0,09ммоль), моногідрату гідразину (45мкл, 0,93ммоль) у суміші етанол:тетрагідрофуран (1:1, 1мл) перемішували протягом ночі. Білий осад відділяли фільтруванням, а фільтрат концентрували у вакуумі, одержуючи очікуваний амін. Вихід: 76% (26мг). LC/MS (ESI-): 422 (М-1); (ESI+): 424 (М+1). 1 H ЯМР (CDCI3): 2,29 (m, 1Н), 2,70 (m, 1Н), 3,43 (m, 1H), 3,64 (m, 3H), 3,83 (s, 3H), 4,17 (m, 1H), 6,90 (m, NH2), 7,20-8,00 (m, 9H). Чистота за даними HPLC: 88%. Приклад XII: N-{[(4EZ,2S)-1-(1,1'-біфеніл-4ілкарбоніл)-4-(метоксііміно)піролідин-2іл]метил}ацетамід (14) (сполука формули Іb) Розчин аміну (13) (16мг, 0,05ммоль), оцтового ангідриду (5,6мкл, 0,06ммоль) та триетиламіну (7,9мкл, 0,06ммоль) у дихлорметані перемішували протягом 30хв. Реакційну суміш промивали водою. Органічну фазу сушили (MgSO 4) та концентрували у вакуумі. Неочищений продукт очищали препаративною хроматографією на силікагелі із застосуванням як елюента етилацетату. Вихід: 42% (8мг). LC/MS (ESI-): 364 (М-1); (ESI+): 366 (М+1). 1 H ЯМР (CDCI3): 2,10 (s, 3Н), 2,40-3,00 (m, 2Н), 3,54 (m, 2Н), 3,87 (s, 3Н), 4,24 (m, 2Н), 4,81 (m, 1Н), 7,20-8,00 (m, 9H). Чистота за даними HPLC: 95%. Приклад XIII: О-метилоксим (3ЕZ,5S)-1-(1,1'біфеніл-4-ілкарбоніл)-5-(піперидин-1-ілметил)піролідин-3-ону (15) (сполука формули 1b) Проміжна сполука 15а: метил-(4R)-1-(1,1' 39 біфеніл-4-ілкарбоніл)-4-{[третбутил(диметил)силіл]окси}-L-пролінат формули VIII) 78058 40 (сполука Метил-(4R)-1-(1,1'-біфеніл-4-ілкарбоніл)-4гідрокси-L-пролінат (проміжна сполука 2а, 2,07г, 6,35ммоль) розчиняли у DCM (30мл) і додавали 4DMAP (776мг, 6,35ммоль), TEA (2,21мл, 15,88ммоль) та TBDMS-Cl (1,91г, 12,7ммоль). Проходження реакції контролювали методом LC/MS. Через 24год, оскільки реакція не завершувалася, додавали TBDMS-CI (300мг, 2ммоль) та TEA (1мл). Через 48год реакція завершилася. Суміш промивали насиченим розчином NH 4CI та розсолом (двічі), сушили над сульфатом магнію, фільтрували та концентрували. Неочищений продукт (2,85г) очищали фле ш-хроматографією, застосовуючи суміш EtOAc/cHex 50:50 як елюент. Вихід: 93% (2,61г). 1 H ЯМР (CDCI3): -0,05 (s, 3Н), 0,02 (s, 3Н), 0,81 (s, 9H), 2,04 (m, 1H), 2,27 (m, 1H), 3,45 (d, J=9,4Гц, 1H), 3,78 (s, 3H), 3,81 (m, 1H), 4,43 (m, 1H), 4,80 (t, J=8,1Гц, 1H), 7,33-7,46 (m, 3H), 7,62 (m, 6H). Проміжна сполука 15b: ((2S,4R)-1-(1,1'біфеніл-4-ілкарбоніл)-4-{[тpетбутил(диметил)силіл]окси}піролідин-2-іл)метанол Розчин метил-(4КR)-1-(1,1'-біфеніл-4ілкарбоніл)-4-{[трет-бутил-(диметил)-силіл]окси}-Lпролінату (проміжна сполука 15а, 2,61г, 5,94ммоль) у THF (60мл) охолоджували до 0°С і додавали боргідрид літію (95%, 206мг, 8,9ммоль). Реакційну суміш перемішували протягом 3год і повільно гасили водою. THF видаляли під зниженим тиском, неочищений залишок знов розчиняли в AcOEt, промивали насиченим розчином NH4CI, розсолом, сушили над сульфатом магнію, фільтрували і концентрували. Вихід: 92% (2,268г). LC/MS (ESI+): 412 (М+1). Проміжна сполука 15с: 1-[((2S,4R)-1-(1,1'біфеніл-4-ілкарбоніл)-4-{[третбутил(диметил)силіл]окси}піролідин-2іл)метил]піперидин (сполука формули XI) До розчину спирту (15b) (200мг, 0,49ммоль) у дихлорметані (5мл) додавали в атмосфері аргону реагент Десса-Мартіна (227мг, 0,53ммоль). Реакційну суміш перемішували протягом 24год, потім розбавляли дихлорметаном і промивали насиченим розчином NaHCO3. Вод|ний шар екстрагували дихлорметаном. Органічні фази промивали водою, сушили (MgSO 4) і концентрували. Одержаний альдегід одразу ж використовували на наступній стадії. До розчину альдегіду (184мг, 0,45ммоль) в 1,2дихлоретані додавали піперидин (49мкл, 0,40ммоль), оцтову кислоту (28мкл, 0,40ммоль), а потім триацетоксиборгідрид натрію (143мг, 0,68ммоль). Реакційну масу перемішували протягом ночі, після чого розбавляли етилацетатом, (ррганічну фазу промивали насиченим розчином NaHCO3, а потім розсолом. Oрганічну фазу сушили (MgSO4) і концентрували, одержуючи очікуваний третинний амін. Вихід: 95% (230мг). LC/MS (ESI-): 513 (М+СI); (ESI+): 479 (М+1). 1 H ЯМР (CDCI3): -0,09 (s, 3Н), 0,00 (s, 3Н), 0,79 (s, 9H), 1,2θ|-1,6Ο (m, 6Н), 2,08 (m, 4Н), 2,40-2,90 (m, 4Н), 3,35 (m, 1Н), 3,56 (m, 1Н), 4,34 (m, 1Н), 4,59 (m, 1Н), 7,20-7,60 (m, 9Н). Чистота за даними HPLC: 90%. Проміжна сполука 15d: (3R,5S)-1-(1,1'-біфеніл4-ілкар|боніл)-5-(піперидин-1-ілметил)-піролідин-3ол (сполука формули XI) Розчин захищеного спирту (15с) (200мг, 0,42ммоль) та TBAF (0,63мл, 1Μ у THF) у тетрагідрофурані перемішували при кімнатній температурі протягом 1год. Реакційну суміш концентрували, а потім розбавляли сумішшю ацетону з етилацетатом (1:2) і промивали насиченим розчином NaНСО3. Органічну фазу сушили (MgSO 4) і концентрували, одержуючи очікуваний спирт. Вихід: 51% (90мг). LC/MS (ESI+): 365 (M+1). 1 H ЯМР (CDCI3): 1,20-1,60 (m, 6H), 2,19 (m, 4H), 2,25-2,90 (m, 4H), 3,50 (m, 2H), 4,43 (m, 1H), 4,62 (m, 1H), 7,30-7,70 (m, 9H). Чистота за даними HPLC: 86%. Проміжна сполука 15е: (5S)-1-(1,1'-біфеніл-4ілкарбоніл)-5-(піпіридин-1-ілметил)-піролідин-3-он (сполука формули X) 41 78058 Розчин DMSO (46,8мкл, 0,66ммоль) у дихлорметані (1мл) додавали краплями до розчину оксалілхлориду (28,2мкл, 0,33ммоль) у дихЬіорметані (2мл) при -78°С в атмосфері аргону. Після витримування 15хв при -78°С додавали краплями розчин спирту (15d) (80мг, 0,22ммоль) у дихілорметані (1мл). Реакційну суміш перемішували при -78°С протягом 1год, додавали триетиламін (0,152мл, 1,1ммоль), і давали суміші нагрітися до (кімнатної температури. Розбавляли реакційну суміш етилацетатом, промивали! водою, а потім розсолом. Органічну фазу сушили (MgSO4) і концентрували, одержуючи очікуваний кетон. Вихід: 84% (78 мг). LC/MS (ESI-): 361 (М-1); (ESI+): 363 (М+1). Чистота за даними HPLC: 86%. Приклад XIII: Розчин кетону (15е) (70мг, 0,19ммоль), гідрохлориду метилового простого ефіру гідроксиламіну (48мг, 0,48ммоль) та триетиламіну (80мкл, 0,58ммоль) у хлороформі (3мл) перемішували при 70°С протягом 2 діб. Реакційну суміш розбавляли дихлорметаном і промивали 1н. ΗСІ. Органічну фазу сушили (MgSO 4) і концентрували, одержуючи оксим простого ефіру. Вихід: 90% (73мг). LC/MS (ESI+): 392 (М+1). 1 H ЯМР (CDCI3): 1,39 (m, 2H), 1,50-1,90 (m, 4H), 2,07 (m, 2H), 2,43 (m, 2H), 2,50-3,10 (m, 4H), 3,38 (m, 1H), 3,68 (m, 1H), 3,79 (m, 3H), 4,21 (m, 2H), 4,86 (m, 1H), 7,20-8,00 (m, 9H). Чистота за даними HPLC: 94%. Приклад ХIV: О-метилоксим (3ЕZ,5S)-1-(1,1'біфеніл-4-ілкарбоніл)-5-(2-гідроксіетил)піролідин-3ону (16) (сполука формули IІ) Проміжна сполука 16а: [(2S,4R)-1-(1,1'-біфеніл4-ілкаpбоніл)-4-гідроксипіролідин-2-іл]оцтова кислота (сполука формули VIII) 42 До розчину наявного на ринку гідрохлориду Lb-гомогідрокрипроліну (245мг, 1,35ммоль), триетиламіну (1,13мл, 8,09ммоль) у воді (0,8мл) та тетрагідрофурані (2мл) при 0°С в атмосфері аргону додавали краплящи розчин 4-фенілбензоїлхлориду (438мг, 2,02ммоль) у те трагідрофурані (1мл). Реакційній суміші давали нагрітися до кімнатної температури і перемішували протягом 18год. Потім суміш розбавляли сумішшю ацетону з еталацетатом (1:2) і промивали 1-н. НСI. Органічну фазу сушили (MgSO 4) і концентрували, одержуючи суміш бажаного продукту та 4-фенілбензойної кислоти. Невелику кількість кислоти можна одержати шляхом осадження етилацетатом. 1 H ЯМР (DMSO): 1,82 (m, 1Н), 2,11 (m, 1H), 2,5 (m, 1H), 2,81 (dd, J=15,6Гц, J=3,2, 1H), 3,3 (m, 1H), 3,51 (dd, J=11,7Гц, J=2,6Гц, 1HJ), 4,16 (m, 1H), 4,40 (m, 1H), 7,30-8,00 (m, 9H). LC/MS: (ESI-): 280 (M-1-CO2), 324 (M-1); (ESI+): 326 (M+1). Чистота за даними HPLC: 84%. Проміжна сполука 16b: метил-[(2S,4R)-1-(1,1'біфеніл-4-ілкфбоніл)-4-гідрокси-піролідин-2іл]ацетат (сполука формули VIII) До розчину суміші кислот, одержаної на попередній стадії (проміжна сполука 16а), у суміші толуол-метанол (10мл, 1:1) | додавали діазометилтриметилсилан (2,76мл, 2Μ у гексані). Через 3год реакційну суміш концентрували і очищали хроматографією на колонці із силікагелем, застосовуючи етилацетат як елюент. Вихід: 40% (по двох стадіях, 256мг). 1 H ЯМР (DMSO): 1,82 (m, 1Н), 2,11 (m, 1Н), 2,6 (dd, J=15,4Гц, J=8,3Гц, 1Н), 2,97 (dd, J=15,3Гц, J=3,4Гц, 1H), 3,25 (d, J=11,4Гц, 1H), 3,62 (s, 3H), 3,67 (dd, J=11,4Гц, J=3,4Гц, 1H), 4,16 (m, 1H), 4,44 (m, 1H), 4,86 (d, J=3,4Гц, OH) 7,30-8,00 (m, 9H). LC/MS (ESI+): 340 (M+1). Чистота за даними HPLC: 98%. Проміжна сполука 16с: (3R,5R)-1-(1,1'-біфеніл4-ілкарбоніл)-5-(2-гідроксіетил)-піролідин-3-ол (сполука формули VII) 43 78058 До розчину метилового складного ефіру (16b) (310мг, 0,91ммоль) у тетрагідрофурані додавали при 0°С в атмосфері аргону боргідрид літію (30мг, 1,37ммоль). Реакційній суміші давали нагрітися до кімнатної температури і перемішували протягом 12год. LiBH4 гасили водою і випарювали тетрагідрофуран у вакуумі. Додавали до залишку ацетонітрил, білий осад фільтрували, промивали ацетонітрилом, потім діетиловим ефіром і сушили. Вихід: 97% (280мг). 1 H ЯМР (D MSO): 1,69 (m, 1Н), 1,87 (m, 1Н), 2,15 (m, 2Н), 3,35 (m, 1Н), 3,47 (m, 2Н), 3,72 (d, J=11,3Гц, 1Н), 4,25 (m, 1H), 4,40 (m, 1H), 4,56 (m, OH), 4,87 (m, OH) 7,30-8,00 (m, 9H). LC/MS (ESI+): 294 (M-H 2O+1), 312 (M+1)+, 334 (M+Na). Чистота за даними HPLC: 98,5%. Проміжна сполука 16d: (3R,5R)-1-(1,1'-біфеніл4-ілкарбоніл)-5-(2-{[третбутил(диметил)силіл]окси}етил)піролідин-3-ол (сполука формули VII). До розчину діолу (16с) (270мг, 0,87ммоль) у диметилформаміді (10мл) додавали краплями розчин трет-бутилдиметилсилілхлориду (131мг, 0,87ммоль) та триетиламін (120мкл, 0,87ммоль). Реакційну суміш перемішували при кімнатній температурі протягом 2 діб. Додавали етилацетат, і промивали реакційну суміш водою. Водну фазу екстрагували етилацетатом. Органічні фази сушили (MgSO4) і концентрували у вакуумі. Неочищений продукт очищали препаративною хроматографією на силікагелі, застосовуючи як елюент суміш етилацетат:циклогексан (50:50). Вихід: 17% (63мг). LC/MS (ESI+): 426 (М+1). Чистота за даними HPLC: 100%. Проміжна сполука 16е: (5R)-1-(1,1'-біфеніл-4ілкарбоніл)-5-(2-{[третбутил(диметил)силіл]окси}етил)піролідин-3-он (сполука формули IV) 44 Розчин DMSO (31,4мкл, 0,44ммоль) у дихлорметані (1мл) додавали краплями до розчину оксалілхлориду (19мкл, 0,22ммоль) у дюфіорметані (2мл) при -78°С в атмосфері аргону. Після витримування 15хв при -78°С додавали краплями розчин спирту (16d) (63мг, 0,15ммоль) у дихріорметані (1мл). Реакційну суміш перемішували при -78°С протягом 1год і додавали триетиламін (0,102мл, 0,74ммоль), і суміші давали нагрітися до кімнатної температури. Розбавляли реакційну суміш етилацетатом, промивали водою, а потім розсолом. Органічну фаз у сушили (MgSO 4) і концентрували, одержуючи очікуваний кетон. Вихід: 100% (64мг). LC/MS (ESI-): 422 (М-1); (ESI+): 424 (М+1). Чистота за даними HPLC: 99%. Проміжна сполука 16f: О-метилоксим (3Z,5S)1-(1,1'-)біфеніл-4-ілкарбоніл)-5-(2-{[третбутил(диметил)силіл]окси}етил)піролідин-3-oну Розчин кетону (16е) (64мг, 0,15ммоль), гідрохлориду е тилового простого ефіру гідроксиламіну (38мг, 0,45ммоль) та триетиламіну (62мкл, 0,45ммоль) у хлороформі (4мл) перемішували при 70°С протягом 5 діб. Реакційну суміш розбавляли дихлорметаном і промивали 1-н. НСl. Органічну фазу сушили (MgSO 4) і концентрували, одержуючи очікуваний оксим простого ефіру. Вихід: 96% (68мг). 1 H ЯМР (CDCI3): 0,01 (s, 6Н), 0,84 (s, 9Н), 1,52,0 (m, 2Н), 2,66 (m, 1Н), 2,81 (m, 1H), 3,67 (m, 2H), 3,82 (s, 3 H), 4,20 (m, 2H), 4,88 (m, 1H), 7,20-8,00 (m, 9H). Чистота за даними HPLC: 95%. LC/MS (ESI+): 453 (M+1) Приклад ХIV: Розчин захищеного спирту (16f) (68мг, 0,15ммоль) та TBAF (0,225мл, 1Μ у THF) в тетрагідрофурані перемішували при кімнатній температурі протягом 1год. Реакційну суміш концентрували, потім розбавляли етилацетатом і промивали водою. Органічну фазу сушили (MgSO 4) і концентрували. Вихід: 85%. 1 H ЯМР (CDCI3): 1,60 (m, 1Н), 1,89 (m, 1H), 2,55 (m, 1H), 2,92 (m, 1H), 3,67 (m, 2H), 3,82 (s, 3H), 4,20 (m, 2H), 5,07 (m, 1H), 7,20-8,00 (m, 9H). LC/MS (ESI+): 339 (M+1). 45 78058 46 Чистота за даними HPLC: 96%. Приклад XVI: Біологічні випробування Приклад ХV: Приготування фармацевтичних Сполуки формули І можна піддавати таким композицій випробуванням: Подані нижче приклади ілюструють типові фаа) Проба на конкурентне зв'язування з рецепрмацевтичні композиції за цим винаходом. тором hOT in vitro зі сцинтиляційним випробуванКомпозиція 1 - Таблетки ! ням зв'язування (11) Похідну піролідину формули І у формі сухого Це випробування дозволяє визначити спорідпорошку змішуюсь із сухим желатиновим в'яжучим неність випробовуваної сполуки до рецептора оку масовому співвідношенні приблизно 1:2. Додаситоцину людини (hOT). Мембран а клітин ють незначну кількість стеарату магнію як змащуHEK293EBNA (клітин, які експресують рецептор вальний засіб. Суміш формують на таблетувальhOТ) суспендують у буферному розчині, який місному пресі у таблетки масою 240-270мг (80-90мг тить 50мМ Tris-HCl, pH 7,4, 5 мМ MgCl2 та 0,1% активної похідної піролідину на одну таблетку). BSA (в одиницях маси на об'єм). Ці мембрани (2Композиція 2 - Капсули 4мкг) звішують з 0,1мг гранул SPA, покритих аглюПохідну піролідину формули І у формі сухого тиніном із зародків пшениці (гранули WGA-ΡVTпорошку змішують із крохмальним розріджувачем Polyethylene Imine, продукт фірми Amersham), та у масовому співвідношенні приблизно 1:1. Одер0,2нМ радіоміченого [125I]-OVTA (OVTA - вазоактижану суміш фасують у капсули місткістю 250мг вний орнітин і (Ornithin Vasoactive), що є аналогом (125мг активної похідної піролідину на одну капсуОТ для експериментів із конкурентного зв'язуванлу). ня). Неспецифічне зв'язування визначають у приКомпозиція 3 - Рідина сутності 1мкМ окситоцину. Загальний об'єм проби Похідну піролідину формули І (1250мг), сахастановить 100мкл. Планшети (CorningÒ NBS) інкурозу (1,75г) та ксантанову камедь (4мг) змішують, бують при кімнатній температурі протягом 30хв, і пропускають через сито 10меш за стандартом радіоактивність вимірюють із застосуванням сцинСША (розмір отворів 2,0мм), а потім змішують із тиляційного л|чильника MibrobetaÒ для планшетів. попередньо приготованим розчином мікрокристаВипробування конкурентного зв'язування виконулічної целюлози та натрієво} солі карбоксиметилють у присутності сполук формули (І) у таких концелюлози (11:89, 50мг) у воді. Бензоат натрію) центраціях} 30мкМ, 10мкМ, 1мкМ, 300нМ, 100нМ, (10мг), смакоароматичну домішку та барвник роз10нМ, 1нМ, 100нМ, 10нМ. Дані по конкурентному бавляють водою і додають до вищезгаданої суміші зв'язуванню аналізують із застосуванням програми при перемішуванні. Додають воду в кількості, Не"Prism" ітеративного нелінійного наближення до обхідній для одержання загального об'єму 5мл. кривих (розроблена фірмою GraphPad Software, Композиція 4 - Таблетки | Inc). Похідну піролідину формули І у формі сухого Шляхом виконання описаного вище біологічнопорошку змішують із сухим желатиновим в'яжучим го випробуваная in vitro оцінювали здатність похіу масовому співвідношенні приблизно 1:2. Додадних піролідину формули (І) інгібувати зві'язування 125 ють незначну кількість стеарату магнію як змащуІ-ОVTA з рецептором ОТ. Типові значення для вальний засіб. Суміш формують на таблетувальдеяких сполук, описаних у прикладах, подано в ному пресі у таблетки масою 450-900мг (150-300мг Таблиці І, де спорідненість до зв'язування випроактивної похідної піролідину на одну таблетку). бовуваних сполук за вищенаведеними прикладами Композиція 5 - Розчин для ін'єкцій виражена через константу інгібування (Кі; нМ). З Похідну піролідину формули І розчиняють у цих даних можна зробити висновок, що згадані стерильному водному середовищі для ін'єкцій з випробовувані сполуки формули І виявляють знабуферною сполукою у концентрації приблизно чний ступінь зв'язування з рецептором окситоцину. 5мг/мл. Таблиця І Сполука № 2 4 7 8 12 16 Назва за номенклатурою IUРАС О-метилоксим (3ΕΖ,5S)-1-(1,1'-біфеніл-4-іл-карбоніл)-5(гідроксиметил)піролідин-3-ону О-метил-оксим (3Z,5S)-1-(1,1’-біфеніл-4-іл-карбоніл)-5(гідроксиметил)піролідин-3-ону 2-{[(2S,4Z)-1-(1,1'-біфеніл-4-ілкарбоніл)-4-(метоксііміно)піролідин-2іл]метокси}-N-(2-піролідин-1-ілетил)-ацетамід О-метилоксим (3ЕZ,5S)-1-(1,1'-біфеніл-4-ілкарбоніл)-5(метоксиметил)піролідин-3-ону 2-{[(2S,4Z)-1-(1,1'-біфеніл-4-іл-карбоніл)-4-(метоксііміно)піролідин2-іл]-метил}-1Н-ізоіндол-1,3(2Н)-діон О-метилоксим (3ЕZ,5S)-1-(1,1'-біфеніл-4-іл-карбоніл)-5-(2гідроксіетил)піролідин-3-ону b) Функціональна проба №1: інгібування опосередкованої окситоцином мобмізації Са 2+ із за Спорідненість до зв'язування з hOT-R (Кі [нΜ]) 139 94,9 140 55,0 5,1 120 стосуванням FLIPRÒ (сканера для планшетів із флуорометричною візуалізацією) 47 78058 48 Вплив ОТ на рецептор ОТ ініціює в клітині 4, додають до клітин НЕК, які інкубують протягом складну послідовність явищ, наслідком якої є під1,5-2год у цьому флуоресцентному середовищі. вищення концентрації Са2+ в цитоплазмі. Це підFluo-4 поглинається цитоплазмо]ю клітин. Буфер: вищення концентрації Са 2+ виникає внаслідок як 145мМ NaCl, 5мМ KСl, 1мМ MgCl2, 10мМ Hepejs, вивільнення кальцію із саркоплазматичної сітки 10мΜ глюкози, EGTA (етилен-біс(депо кальцію) у цитоплазму, так і припливу кальоксіетиленнітрилтетраоцтова кислота). Встановцію з позаклітинного простору через кальцієві калюють рН буфера 7,4. нали. Ця мобілізації Са2+ у цитоплазму ініціює меВиконання випробування: Готують розчин ханізм скорочення клітин міометрію, яке сполук формули (І) (5´) у вищезгаданому буфері призводить до скорочення матки (1 та 3). (1´) у кількості не менше за 80мкл/лунку (96Це випробування дозволяє вимірювати ступінь лункові планшети). Сполуки формули (І) вносять у інгібування опосередкованої OT/OT-R мобілізації 96-лункові планшети у різних концентраціях Са2+ під впливом випробовуваних сполук формули (30мкМ, 10мкМ, 1мкМ, 300нМ, 100нМ, 10нМ, 1нМ, (І). 100нМ, 10нМ). Додають ОТ у концентрації 40нМ. FLIPRÒ являє собою пристрій для флуорометПотім вимірюють за допомогою FLIPR відносричної візуалізації, в якому лазер (аргоновий лану інтенсивність флуоресценції Fluo-4 (Іех=488нм, зер) використовується для одночасного освітлення lem=590нм) у присутності або у відсутності сполук та зчитування (охолоджувана камера CCD) кожної формули (І). Оскільки флуоресценція маркера є лунки 96-лункового планшета, забезпечуючи тачутливою до кількості Са 2+, таким чином можна ким чином швидке виконання вимірювань для ведетектувати переміщення Са 2+. Потім можна виликої кількості проб. значити здатність сполук формули (І) до протидії Підготовка планшетів: Планшети для FLIPR індукованої окситоцином мобілізації внутрішньопопередньо покривають PLL (полі-L-лізином) клітинного Са2+, опосередкованої рецептором ок10мкг/мл+0,1% желатину для фіксації клітинj ситоцину. HEK293EBNA (клітин ембріона людини, які ексШляхом виконання описаного вище біологічнопресують рецептор! hOT) та інкубували протягом го випробування in vitro оцінювали дію похідних періоду від 30хв до 2 діб при 37°С. Клітини висівапіролідину формули І. Типові значення для деяких ють на 96-лункові планшети (60000 клітин на лунсполук, описаних у прикладах, подано в Таблиці II. ку). Подані в таблиці значення характеризують концеМічення реагентом fluo-4: 50мкг fluo-4 (флуонтрації випробовуваних сполук формули І, необресцентний барвник, чутливий до Са 2+) розчиняхідні для 50%-ного інгібування мобілізації внутрішють в 20мкл розчину полігалактуроново|і кислоти ньоклітинного Са2+, спричиненої OT/OTR, на 50%. (20% у DMSO). Одержаний розчин fluo-4 потім З поданих даних можна зробити висновок, що згарозводять у 10мл живильного середовища DMEM дані випробовувані сполуки формули І виявляють (Dubecco's Minimal Essential Medium)-F12. Планзначну активність як антагоністи рецепторів оксишети промивають один раз середовищем DMEMтоцину. F12. 100мкл середовищa DMEM, яке містило fluoТаблиця II Сполука № 1 2 4 Назва за номенклатурою IUPAC О-метилоксим (3ЕZ,5S)-5-(гідроксиметил)-1-[(2'-метил-1,1'-біфеніл-4іл)карбоніл]-піролідин-3-ону О-метилоксим (3ЕZ,5S)-1-(1,1'-біфеніл-4-іл-карбоніл)-5(гідроксиметил)-піролідин-3-ону О-метилоксим (3Z,5S)-1-(1,1'-біфеніл-4-іл-карбоніл)-5(гідроксиметил)-піролідин-3-ону с) Функціональна проба №2: інгібування синтезу ІР3 (інозиттрифосфату) у клітинах HEK/EBNAOTR Дія ОТ на рецептор ОТ викликає синтез ІР3 вторинного месенджера вивільнення Са 2+ із саркоплазматичної сітки, яке є стадією процесу ініціювання скорочення матки (3). Це випробування можна застосувати для демонстрації інгібування опосередкованого OT/OT-R синтезу ІР3 за допомогою сполук формули (І). Стимуляція клітин: клітини HEK/EBNA (пацюка або людини), які експресують OTR, висівають на 12-лункові планшети Costar і витримують до рівноважного стану протягом 15-24год із радіоміченим [3Н]-інозитом (4мкКі/мл) із домішкою 1% FCS (0,5мл/лунку) та без додання інозиту. Середовище, яке містить мітку, видаляють відсмоктуванням. Інгібування мобілізації Са2+ hOT-R ІС50 [мкМ] 0,03 0,09 0,01 Додають у лунки середовище DMEM (без домішки FCS та інозиту), 20мМ Hepes (4-(2-гідроксіетил)-1піперазин-етан-сульфонова кислота), 1мг/мл BSA з домішкою 10мМ LiCl (свіжоприготований) і інкубують 10-15хв при 37°С. Агон|іст (тобто окситоцин у концентрації 10нМ) та антагоністи (тобто випробовувані сполуки формули І, які можна застосовувати в концентраціях 10мкМ, 1мкМ, 300нМ, 100нМ, 10нМ, 1нМ, 100нМ, 10нМ, 3нМ) можна додавати через необхідний проміжок часу (15-45хв), після чого відсмоктувати середовище. У присутності ОТ радіомічений інозит перетворюється у радіоміче|ний ІР3. Протидія впливу ОТ на рецептори ОТ інгібує утворення ІР3. Кількість радіоміченого ІР3 можна визначити за допомогою! описаної нижче процедури. Реакцію припиняють доданням 1мл стоп-розчину (тобто 49 78058 50 0,4Μ хлорної кислоти) і витримують суміш 5-10хв Виділяли одну яремну вену, канюлювали її при кімнатній температурі. Потім 0,8мл суміші петрубкою РЕ60, і приєднували до голки з клапаном реносять у пробірки, які містять 0,4мл нейтралізадля забезпечення внутрішньовенного (i.v.)| ввеційного розчину (0,72Μ ΚΟΗ/0,6 Μ ΚНСО3), пробірдення випробовуваної сполуки через розподільчий ки збовтують і витримують на холоді протягом шприц. щонайменше 2год. У випадку інтрадуоденального введення виВідділення інозитфосфатів: Проби центрифупробовуваної сполучи можна виділити дванадцягують на настільній центрифузі при 3000типалу кишку і аналогічно канюлювати її через 4000об/хв протягом 15хв. 1мл надосадової рідини невеликий розріз у її стінці. переносять у нові пробірки, які містять 2,5мл Н2О. Також виділяли одну сонну артерію, канюлюЗавантажену у хроматографічні колонки смолу вали її катетерам РЕ60 і приєднували до відповід(Dowex AG1 X8) врівноважують 20мл Н2О, і всю ного шприца для відбирання проб крові. кількість проб переносять у колонки, таким чином Після періоду стабілізації та на протязі експевиконуючи розділення суміші. Для видалення вірименту тварині повторно вводили внутрішньольного інозиту колонки двічі промивають 10мл венно одну й ту саму дозу окситоцину через 30Н2О. хвилинні інтервали. Після досягнення відтворюваЕлюювання всіх інозитфосфатів: Елюювання ної скорочувальної реакції матки на однакове повиконують 3мл суміші 1Μ форміату амонію з 0,1Μ дразнення ОТ (вибрану дозу окситоцину), вводили мурашиною кислотою. Елюат збирають у пробірки дозу випробовуваної сполуки або сполуки порівдля рахування сцинтиляцій, куди попередньо доняння (носія). Потім продовжували періодичні введають 7мл сцинтиляційної рідини. Кількість [3Н]дення однакових доз окситоцину (ін'єкції ОТ через ІР3 визначають за допомогою сцинтиляційного 30-хвилинні інтервали) протягом часу після оброблічильника. ки, достатнього для оцінювання інгібувального Шляхом виконання описаного вище біологічноефекту та оборотності цього ефекту. го випробуваная in vitro можна оцінити здатність Скорочувальну реакцію матки на окситоцин кісполук формули (І) до протидії індукованого оксилькісно характеризували шляхом вимірювання тоцином синтезу ІР3, опосередкованого рецептотиску в порожнині матки та кількості скорочень. ром окситоцину. Ефект сполуки порівняння та випробовуваної споd) Модель інгібування скорочень матки in vivo луки оцінювали шляхом з|ставлення значень тиску В цьому випробуванні оцінюють біологічний перед введенням та після нього. Крім того, виміефект випробовуваної сполуки на моделі передрювали скорочення матки через 5хв, 40 хв, 75 хв, часних пологів in vi vo 110хв, 145хв та 180хв після введення випробовуНевагітним самкам пацюків лінії Charles River ваної сполуки. CD (SD) ! BR (вік 9-10 тижнів, маса тіла 200-250г) Шляхом виконання описаного вище біологічновводили внутрішньоочеревинно (i.p.)j за 18год та го випробування in vivo можна оцінити дію похід24год перед експериментом 250мг/кг діетилстильних піролідину Формули І. Типові значення для бестролу (DES). Дія випробування тварин анестеоднієї сполуки, взятої за приклад, подано в Таблизували уретаном (1,75г/кг, і.р.) та клали на гомеоці III. Ці; значення характеризують здатність спотермічний операційний стіл. Виділяли трахею та луки формули І, взятої за приклад, до ефективної канюлювали її придатною поліетиленовою (РЕ) протидії індукованим окситоцином скороченням трубкою. Виконували розріз вздовж середньої лінії матки пацюка через 40хв після введення випробона рівні підчерев'я і виділяли один ріг матки, його вуваної сполуки внутрішньовенним або пероралькраніальний кінець канюлювали трубкою РЕ240, і ним шляхом. З поданих у Таблиці III даних можна після заповнення внутрішньої порожнини 0,2мл зробити висновок, що згадана взята за приклад стерильного фізіологічного розчину підключали до випробувана сполука формули І виявляє значну підсилювально-реєстраційної системи "Gemini" активність як токолітичний (розслаблюючий матку) через перетворювач тиску Р23ІD Gould Statham. засіб. Таблиця III Сполука № 2 2 Назва за номенклатурою IUРАС О-метилоксим (3Z,5S)-1-(1,1'-біфеніл-4-ілкарбоніл)-5(гідроксиметил)-піролідин-3-ону О-метилоксим (3Z,5S)-1-(1,1'-біфеніл-4-іл-карбоніл)-5(гідрокси-метил)піролідин-3-ону Комп’ютерна в ерстка О. Гапоненко % послаблення скорочення матки Дози [мг/кг] 39,8±10,0 10 внутрішньовенно) 50,9±8,6 30 (перорально) Підписне Тираж 26 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюPyrrolidine derivative as oxitocin antagonists
Автори англійськоюJorand-Lebrun Catherine, Dorbais Jerome, Quattropani Anna, Schwarz Matthias
Назва патенту російськоюПроизводные пирролидина в качестве антагонистов окситоцина
Автори російськоюЖоран-Лебрен Катрин, Дорбе Жером, Куаттропани Анна, Шварц Маттиас
МПК / Мітки
МПК: C07D 403/06, C07D 403/12, A61P 15/00, A61K 31/4025, A61P 5/10, A61P 43/00, A61P 15/06, A61K 31/4035, A61K 31/454, C07D 521/00, A61K 31/4155, A61K 31/496, C07D 207/22, A61K 31/40
Мітки: піролідину, антагоністи, окситоцину, похідні
Код посилання
<a href="https://ua.patents.su/25-78058-pokhidni-pirolidinu-yak-antagonisti-oksitocinu.html" target="_blank" rel="follow" title="База патентів України">Похідні піролідину як антагоністи окситоцину</a>












