Фунгіцидні 5-фенілзаміщені 2-(ціаноаміно)піримідини, спосіб їх одержання та проміжні сполуки
Номер патенту: 74584
Опубліковано: 16.01.2006
Автори: Пфренгле Вальдемар, Хеффернан Гавін, Пеес Клаус-Юрген
Формула / Реферат
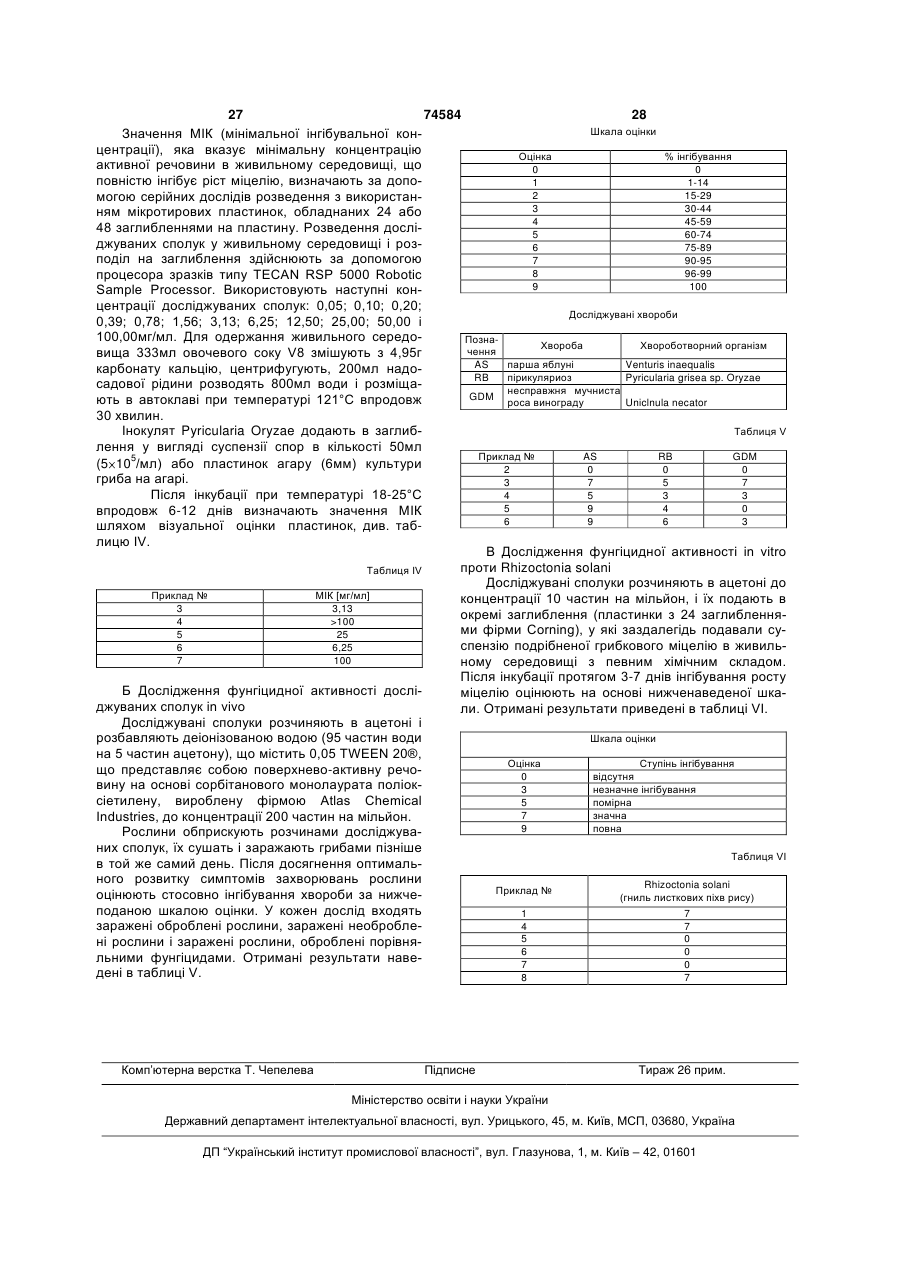
1. Піримідини формули (І)
 , І
, І
в якій R1 означає С1-С10-алкіл, С1-С10-галоалкіл, С2-С6-алкеніл, С2-С6-алкініл, С4-С8-алкадієніл, С1-С10-алкокси, С3-С8-циклоалкіл, феніл або
5- або 6-членний гетероарил, або 5- або 6-членний гетероцикліл, які містять 1-4 атоми азоту або 1-3 атоми азоту й один атом сірки або кисню, або
три-С1-С6-алкілсиліл, форміл або С1-С10-алкоксикарбоніл;
причому групи R1 є незаміщеними або заміщені 1-3 групами Ra, при цьому
Ra означає галоген, нітрогрупу, ціаногрупу, гідроксигрупу або
С1-С10-алкіл, С3-С6-циклоалкіл, С3-С6-циклоалкеніл, С1-С10-галоалкіл, С3-С6-галоциклоалкіл, С1-С10-алкокси, С1-С10-галоалкокси, С1-С6-алкоксикарбоніл, три-С1-С4-алкілсиліл, феніл, гало- або дигалофеніл, або 5- або 6-членний гетероарил, який містить 1-4 атоми азоту або 1-3 атоми азоту й один атом сірки або кисню;
R2 означає феніл, С3-С6-циклоалкіл або 5- або 6-членний гетероарил, який містить 1-4 атоми азоту або 1-3 атоми азоту й один атом сірки або кисню, що є незаміщеними або заміщені 1-3 групами Rа;
R3 означає водень, галоген або
С1-С10-алкіл, С1-С10-алкокси, С1-С10-алкілтіо, С1-С10-алкіламіно або ді-С1-С10-алкіламіно, що є незаміщеними або заміщені 1-3 групами Rа;
R4 означає С1-С10-алкіл, С2-С6-алкеніл або С2-С6-алкініл, що є незаміщеними або заміщені 1-3 групами Rа; і
Х означає О, S, NR5 або простий зв'язок, причому
R5 являє собою водень або С1-С10-алкіл; або
R1 і R5 разом з розміщеним між ними атомом азоту утворюють 5- або 6-членний гетероцикліл, який містить 1-4 атоми азоту або 1-3 атоми азоту й один атом сірки або кисню.
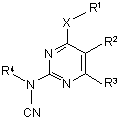
2. Піримідини формули (І) за п. 1, в яких R2 означає фенільну групу формули
 ,
,
в якій L1 - L4 незалежно означають водень, фтор, хлор або метокси.
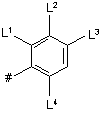
3. Піримідини за п. 1, які представлені формулою (ІА)
 , ІА
, ІА
у якій R1 - R5 мають вказані в п. 1 значення, a L1 - L4 мають вказані в п. 2 значення.
4. Піримідини за будь-яким з пп. 1-3, в яких R3 означає хлор.
5. Піримідини за будь-яким з пп. 1-4, в яких R4 означає С1-С6-алкіл або бензил.
6. Спосіб одержання піримідинів формули (І) за п. 1 шляхом взаємодії сульфонів формули (VI)
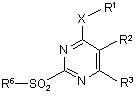 , VI
, VI
в якій R1 - R3 і Х мають вказані для формули (І) значення, a R6 означає С1-С6-алкіл або С1-С6-галоалкіл, з алкілованим ціанамідом формули (VII)
![]() , VII
, VII
в якій R4 означає С1-С10-алкіл, С2-С6-aлкеніл або С2-С6-алкініл, що є незаміщеними або заміщені 1-3 групами Ra, причому сульфони формули (VI) одержують шляхом взаємодії похідних 2-тіопіримідинів формули (VIII)
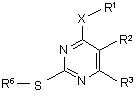 , VIII
, VIII
в якій замісники мають вказані для формули (VI) значення, з агентами окислення.
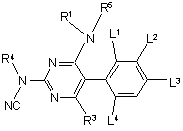
7. Сполуки формули
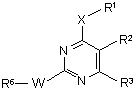 ,
,
в якій
W означає -S- або -SO2-;
R1, Ra, Х мають вказані в п. 1 значення;
R2 означає феніл, заміщений 2 або 3 замісниками Ra;
R3 означає галоген, С1-С10-алкіл, С1-С10-алкокси, С1-С10-алкілтіо, С1-С10-алкіламіно або ді-С1-С10-алкіламіно, що є незаміщеними або заміщені 1-3 групами Rа;
R5 означає водень, С1-С10-алкіл;
або
NR5R1 являє собою піролідинове, піперидинове, тетрагідропіридинове або азепанове кільце, незаміщене або заміщене однією або декількома групами С1-С10-алкіл;
R6 означає С1-С6-алкіл або С1-С6-галоалкіл.
Текст
1. Піримідини формули (І) 2 3 74584 4 в якій R4 означає С1-С10-алкіл, С2-С6-aлкеніл або С2-С6-алкініл, що є незаміщеними або заміщені 1-3 групами Ra, причому сульфони формули (VI) одержують шляхом взаємодії похідних 2тіопіримідинів формули (VIII) L2 L1 L3 # R1 L4 , в якій L1-L4 незалежно означають водень, фтор, хлор або метокси. 3. Піримідини за п.1, які представлені формулою (ІА) R5 R1 N R4 L1 L2 X R6 N S N R3 R1 X L3 N NC VIII в якій замісники мають вказані для формули (VI) значення, з агентами окислення. 7. Сполуки формули ІА N R2 N R2 N R3 L4 у якій R1 - R5 мають вказані в п.1 значення, a L1 - L4 мають вказані в п.2 значення. 4. Піримідини за будь-яким з пп.1-3, в яких R3 означає хлор. 5. Піримідини за будь-яким з пп.1-4, в яких R4 означає С1-С6-алкіл або бензил. 6. Спосіб одержання піримідинів формули (І) за п.1 шляхом взаємодії сульфонів формули (VI) R1 X R2 N R6 SO2 N VI R3 в якій R1 - R3 і Х мають вказані для формули (І) значення, a R6 означає С1-С6-алкіл або С1-С6галоалкіл, з алкілованим ціанамідом формули (VII) CN R4 N H VII Даний винахід стосується піримідинів формули (І) l у якій R1 означає водень або С1-С10-алкіл, С1-С10-галоалкіл, С2-С6-алкеніл, С2-С6-алкініл, С4-С8-алкадієніл, С1-С10-алкокси, С3С8-циклоалкіл, феніл, або 5- або 6-членний гетероарил або 5- або 6членний гетероцикліл, які містять 1-4 атоми азоту або 1-3 атоми азоту й один атом сірки або кисню, або три-С1-С6-алкілсиліл, форміл або С1-С10алкоксикарбоніл; причому групи R1 незаміщені або заміщені 1-3 групами Ra, при цьому Ra означає галоген, нітрогрупу, ціаногрупу, гідроксигрупу або С1-С10-алкіл, С3-С6-циклоалкіл, С3-С6циклоалкеніл, С1-С10-галоалкіл, С3-С6 R6 W N R3 , в якій W означає -S- або -SO2-; R1, Ra, Х мають вказані в п.1 значення; R2 означає феніл, заміщений 2 або 3 замісниками Ra; R3 означає галоген, С1-С10-алкіл, С1-С10-алкокси, С1-С10-алкілтіо, С1-С10-алкіламіно або ді-С1-С10алкіламіно, що є незаміщеними або заміщені 1-3 групами Rа; R5 означає водень, С1-С10-алкіл; або NR5R1 являє собою піролідинове, піперидинове, тетрагідропіридинове або азепанове кільце, незаміщене або заміщене однією або декількома групами С1-С10-алкіл; R6 означає С1-С6-алкіл або С1-С6-галоалкіл. галоциклоалкіл, С1-С10-алкокси, С1-С10галоалкокси, С1-С10-галоалкокси, С1-С6алкоксикарбоніл, три-С1-С4-алкілсиліл, феніл, гало- або дигалофеніл або 5-або 6-членний гетероарил, який містить 1-4 атоми азоту або 1-3 атоми азоту й один атом сірки або кисню; R2 означає феніл, С3-С6-циклоалкіл або 5- або 6-членний гетероарил, який містить 1-4 атоми азоту або 1-3 атоми азоту й один атом сірки або кисню, незаміщені або заміщені 1-3 групами Ra; R3 означає водень, галоген або С1-С10-алкіл, С1-С10-алкокси, С1-С10-алкілтіо, С1-С10-алкіламіно або ди-С1-С10-алкіламіно, незаміщені або заміщені 1-3 групами Ra; R4 означає водень або С1-С10-алкіл, С2-С6-алкеніл або С2-С6-алкініл, незаміщені або заміщені 1-3 групами Ra; і X означає О, S, NR5 або простий зв'язок, причому R5 представляє собою водень або С1-С10алкіл; або R1 і R5 разом з розміщеним між ними атомом азоту утворюють гетероцикл. Крім того, даний винахід стосується способів і проміжних сполук для одержання даних сполук, 5 74584 6 композицій, які включають дані сполуки, та їх занезаміщені або заміщені алкіл, алкеніл або алкініл, стосування для боротьби зі шкідливими грибами. можна одержувати шляхом взаємодії оксиму N[У Vestn. Slov. Kern. Drus. (1986), 33(3), 353-66, піримід-2-илформаміду формули (IV) ISSN міжнародний стандартний номер книги: 05603110, CAN 107:39701] описано, що в результаті lV взаємодії оксимів N-піримід-2-ілформаміду з діетиловим ацеталем Ν,Ν-диметилформаміду одержують 2-(N-ціано-N-етиламіно)піримідини. [У J. у якій R1-R3 і X мають вказані для формули (І) Org. Chem. 39 (9) 1256-1252 (1974)] описані Nзначення, з Ν,Ν-диметилформамідгліколізовані 2-(N-ціаноаміно)-піримідини, а [в падіалкілацетатом формули (V) тенті США №4,711,959] розкритий спосіб одержання 2-(N-ціаноаміно)-піримідинів. Задача винаходу полягає в розробці фунгіциV дних сполук, які мають підвищену активність. Дана задача вирішується за допомогою вищеу якій R4 представляє собою С1-С6-алкіл, описаних сполук. Крім того, були розроблені споС1-С6-алкеніл або С1-С6-aлкініл, незаміщені або соби їх одержання, композиції, які включають дані заміщені 1-3 групами Ra. сполуки, і способи боротьби з фітопатогенними Взаємодію сполук формули (IV) і сполук форгрибами, у яких застосовуються сполуки формули (V) можна здійснювати аналогічно до реакції, мули (І). [описаної в Vestn. Slov. Kern. Drus. (1986), 33(3), Сполуки формули (І), у яких R4 представляє стор.353-366]. собою незаміщену або заміщену алкільну, алкеніСполуки формули (І), у якій R4 означає водень, льну або алкінільну групу відповідно до вищенапереважно одержують шляхом обробки сульфонів веденого визначення, можна одержувати шляхом формули (VI) обробки сполуки формули (II) ll Vl у якій R1-R3 і X мають вказані для формули (І) значення, сильною основою й агентом алкілування формули (III) R4-Y lll у якій R4 означає С1-С6-aлкіл, С1-С6-aлкеніл або С1-С6-aлкініл, незаміщені або заміщені 1-3 групами Ra, a Y означає нуклеофільну групу, яка заміняється і вилучається, переважно атом галогену, зокрема, атом йоду. Сполуки формули (II) відомі, [наприклад, з патенту США №5,593,996, міжнародних заявок, опублікованих під №WO-A 98/46608, WO-A 99/41255 і WO-A 99/48893, або французької заявки FR-A 2,765,875]. Реакцію взаємодії триазолпіримідинів формули (II), сильної основи й агента алкілування формули (III) переважно здійснюють у середовищі інертного розчинника. Придатними розчинниками є, наприклад, прості ефіри як, наприклад, діоксан, простий діетиловий ефір і тетрагідрофуран, галогеновані вуглеводні як, наприклад, дихлорметан, аміди як, наприклад, диметилформамід або Nметилпіролідон, і ароматичні вуглеводні як, наприклад, толуол, або суміші вказаних розчинників. Взаємодію доцільно здійснюють при температурі від -78°С до 100°С, переважно від 10°С до 80°С, зокрема, при кімнатній температурі. Придатними сильними основами є, наприклад, гідриди металів як, наприклад, гідрид натрію, калію або кальцію, і аміди металів як, наприклад, амід натрію або калію, діізопропіламід літію або гексаметилдисилацид калію, або алкани металів як, наприклад, метиллітій, н-бутиллітій або трет.бутиллітій. Також, сполуки формули (І), у яких R4 означає у якій R1-R3 і X мають вказані для формули (І) значення, a R6 означає С1-С6-алкіл або С1-С6галоалкіл, ціанамідом або сіллю металу ціанаміду. При цьому може бути доцільним застосування основи і/або розчинника. Даний процес переважно здійснюють у середовищі інертного розчинника. Придатними розчинниками є, наприклад, ароматичні вуглеводні як, наприклад, толуол або ксилол, хлоровані вуглеводні як, наприклад, метиленхлорид, хлороформ, хлорбензол, кетони як, наприклад, ацетон, метилетилкетон, метил ізопропілкетон або метил ізобутилкетон, нітрили як, наприклад, прості ефіри ацетонітрилу або пропіонітрилу як, наприклад, простий діетиловий ефір, простий діізопропіловий ефір, простій метил-трет.бутиловий ефір, диметоксіетан, тетрагідрофуран або діоксан, аміди як, наприклад, диметилацетамід або діетилацетамід, сульфоксиди як, наприклад, диметилсульфоксид або сульфолан, або їх суміші. Може бути доцільним здійснювати дану реакцію в присутності основи. Придатними основами є, наприклад, гідриди лужних і лужноземельних металів як, наприклад, гідриди натрію, калію або кальцію, гідроксиди лужних і лужноземельних металів як, наприклад, гідроксиди натрію, калію або кальцію, карбонати лужних і лужноземельних металів як, наприклад, карбонат натрію, калію або кальцію, бікарбонати лужних і лужноземельних металів як, наприклад, бікарбонат натрію, калію або кальцію, аміди металів як, наприклад, амід натрію або калію, діізопропіламід літію або гексаметилдисилацид калію, алкани металів як, наприклад, метиллітій, н-бутиллітій або трет.-бутиллітій, або апротонні аміни як, наприклад, піридин, трибу 7 74584 8 тиламін, Ν,Ν-диметилбензиламін або діазабіцикму в кількості від 0,8 до 5 еквівалентів, переважно лоундецен. від 0,8 до 4,5 еквівалентів на еквівалент сполуки При здійсненні реакції можна користуватися формули (І). різними властивостями ціанаміду. З практичних Основу беруть у цілому в кількості від 0,8 до 3 міркувань може бути переважним використання еквівалентів, переважно від 0,8 до 2,5 еквівалентів водного розчину ціанаміду. Також можливе викона еквівалент сполуки формули (І). ристання солей металів з ціанамідом, наприклад, Сполуки формули (І), у яких R4 означає С1-С6ціанаміду калію, ціанаміду дикалію або ціанаміду алкіл, С1-С6-алкеніл або С1-С6-алкініл, незаміщені кальцію. або заміщені 1-3 групами Ra, можна також одерЗалежно від використовуваного ціанаміду або жувати шляхом взаємодії сульфону формули (VI) його солі, і залежно від основи вибирають придатний розчинник. Vl Взаємодію доцільно здійснюють при температурі між -78°С і температурою кипіння зі зворотним холодильником, переважно при температурі від 0°С до 150°С, зокрема, при кімнатній температурі. Основу беруть у цілому в кількості від 1 до 3 еквівалентів, переважно від 1,5 до 2,5 еквівалентів на еквівалент сульфону формули (VI). Ціанамід або його сіль беруть у цілому в кількості від 2 до 6 еквівалентів, переважно від 3 до 5 еквівалентів на еквівалент сульфону загальної формули (VI). Сполуки формули (І), у яких R4 означає С1-С6алкіл, С1-С6-алкеніл або С1-С6-алкініл, незаміщені або заміщені 1-3 групами Ra, можна одержувати шляхом алкілування сполук формули (І), у яких R4 означає водень, агентом алкілування формули (III). Може бути доцільним здійснення даної реакції в присутності основи. Придатними основами є, наприклад, гідриди лужних і лужноземельних металів як, наприклад, гідриди натрію, калію або кальцію, гідроксиди лужних і лужноземельних металів як, наприклад, гідроксиди натрію, калію або кальцію, карбонати лужних і лужноземельних металів як, наприклад, карбонат натрію, калію або кальцію, бікарбонати лужних і лужноземельних металів як, наприклад, бікарбонат натрію, калію або кальцію, аміди металів як, наприклад, амід натрію або калію, діізопропіламід літію або гексаметилдисилацид калію, алкани металів як, наприклад, метиллітій, н-бутиллітій або трет.-бутиллітій, або апротонні аміни як, наприклад, піридин, трибутиламін, Ν,Ν-диметилбензиламін або діазабіциклоундецен. Алкілування переважно здійснюють у середовищі інертного розчинника. Придатними розчинниками є, наприклад, ароматичні вуглеводні як, наприклад, толуол або ксилол, хлоровані вуглеводні як, наприклад, метиленхлорид, хлороформ, хлорбензол, кетони як, наприклад, ацетон, метилетилкетон, метилізопропілкетон або метилізобутилкетон, нітрили як, наприклад, ацетонітрил, прості ефіри пропіонітрилу як, наприклад, простий діетиловий ефір, простий діізопропіловий ефір, простий метил-трет.-бутиловий ефір, диметоксіетан, тетрагідрофуран або діоксан, аміди як, наприклад, диметилацетамід або діетилацетамід, сульфоксиди як, наприклад, диметилсульфоксид або сульфолан, або їх суміші. Взаємодію доцільно здійснюють при температурі від -78°С до температури кипіння зі зворотним холодильником, переважно при температурі від 0°С до 150°С, зокрема, при кімнатній температурі. Агент алкілування формули (III) беруть у ціло у якій R1-R3 і X мають вказані для формули (І) значення, і R6 означає СгС6-алкіл або С1-С6галоалкіл, з алкілованим ціанамідом формули (VII) Vll 4 у якій R означає С1-С6-алкіл, С1-С6-алкеніл або С1-С6-алкініл, незаміщені або заміщені 1-3 групами Ra. Може бути доцільним здійснити взаємодію в присутності основи і/або розчинника. Придатними є основи і розчинники, вказані і для взаємодії з ціанамідом. Взаємодію доцільно здійснюють при температурі від -78°С до температури кипіння зі зворотним холодильником, переважно при температурі від 0°С до 150°С, зокрема, при кімнатній температурі. У цілому взаємодію здійснюють при нормальному тиску. Основу беруть у цілому в кількості від 1 до 3 еквівалентів, переважно від 1,5 до 2,5 еквівалентів на еквівалент сульфону формули (VI). Алкілований ціанамід формули (VII) беруть у цілому в кількості від 2 до 6 еквівалентів, переважно від 3 до 5 еквівалентів на еквівалент сульфону формули (VI). Сульфони формули (VI) одержують шляхом взаємодії похідних 2-тіопіримідину формули (VIII) Vlll у якій замісники мають вказані для формули (VI) значення, з окисниками, наприклад, наприклад, м-хлорпербензойною кислотою, пероцтовою кислотою, трифтор-пероцтовою кислотою, хлорною водою, хлорнуватистою кислотою, або розчинами їх солей з металом у воді або перекисі водню, у разі потреби, у присутності каталізатора, наприклад, вольфрамату. У випадку використання придатних розчинників, наприклад, метиленхлориду, хлороформу, тетрахлориду вуглецю, 1,2-дихлоретану або хлорбензолу, взаємодію здійснюють при температурі від -20°С до температури флегми. Похідні 2-тіопіримідину формули (VIII) можна одержувати шляхом взаємодії 6-гало-2тіопіримідинів формули (IX) lX у якій замісники мають вищевказані значення і 9 74584 10 "Hal" означає галоген, з нуклеофільною сполукою диметилбутил, 2,3-диметилбутил, 3,3формули (X) диметилбутил, 1-етилбутил, 2-етилбутил, 1,1,2H-X-R1 X триметилпропіл, 1,2,2-триметилпропіл, 1-етил-1у якій R1 і X мають вказані для формули (І) метилпропіл і 1-етил-2-метилпропіл; переважно значення, у разі потреби, у присутності придатної етил або метил; основи і, у разі потреби, у середовищі органічного - С1-С6-галоалкіл і галоалкільні групи С1-С6розчинника. Використовувані розчинники і основи галоалкокси означають розгалужені або нерозгаподібні на ті, які наведені вище для одержання лужені алкільні групи з 1-6 атомами вуглецю (вкасполук формули (І). зані вище), причому атоми водню в даних групах 6-гало-2-тіопіримідини формули (IX) відомі, можуть частково або повністю бути замінені атоабо їх можна одержувати шляхом нижченаведеної мами галогену, вказаними вище, наприклад, С1-С2послідовності реакцій: галоалкіл як, наприклад, хлорметил, бромметил, дихлорметил, трихлорметил, фторметил, дифторметил, трифторметил, хлорфторметил, дихпорфторметил, хлордифторметил, 1-хлоретил, 1брометил, 1-фторетил, 2-фторетил, 2,2дифторетил, 2,2,2-трифторетил, 2-хлор-2фторетил, 2-хлор-2,2-дифторетил, 2,2-дихлор-2фторетил, 2,2,2-трихлоретил і пентафторетил; переважно 2,2,2-трифторетил або 1,1,1трифторпроп-2-іл; - С3-С8-циклоалкіл означає моноциклічні, насичені вуглеводневі залишки з 3-6 або 8 кільцевими атомами вуглецю, наприклад, циклопропіл, циклобутил, циклопентил, циклогексил, циклогептил і циклооктил, переважно з 5-7 атомами вуглецю, зокрема, циклопенитил, незаміщений або заміщений одним або декількома атомами галогену, нітрогрупою, ціаногрупою, С1-С6-алкілом або С1-С6-алкоксигрупою. - С2-С4-алкеніл означає ненасичені, розгалу(R2, R3 і R6 мають вищевказані значення, і R жені або нерозгалужені вуглеводневі залишки з 2представляє собою алкільну групу) Умови реакцій 4 атомами вуглецю і з подвійним зв'язком у будьє загальновідомими. якому положенні, наприклад, етеніл, 1-пропеніл, 2Шляхом взаємодії діалкілмалонату з тіосечопропеніл, 1-метилетеніл, 1-бутеніл, 2-бутеніл, 3виною у присутності основи як каталізатора одербутеніл, 1-метил-1-пропеніл, 2-метил-1-пропеніл, жують 2-тіобарбітурову кислоту формули (XII), яку 1-метил-2-пропеніл і 2-метил-2-пропеніл; переваможна вибірково алкілувати у присутності сірки з жно аліл або 2-метилаліл. одержанням сполуки формули (XIII). - С2-С4-галоалкеніл і галоалкенільні групи Потім шляхом галогенування, переважно хлоС2-С4-галоалкенілокси означають ненасичені, розрування або бромування, зокрема, хлорування, галужені або нерозгалужені вуглеводневі залишки наприклад, з використанням фосфорного оксихлоз 2-4 атомами вуглецю і з подвійним зв'язком у риду або фосфорного оксиброміду, у присутності будь-якому положенні (як вказано вище), причому основи третинного аміну одержують дігалопохідне атоми водню в даних групах можуть бути частково формули (XIV). або повністю бути замінені атомами галогену, як 3 Шляхом наступного введення радикала R , у вказано вище, зокрема, атомами фтору, хлору і разі потреби, шляхом нуклеофільного заміщення, брому; одержують 6-гало-2-тіопіримідин формули (IX). - С2-С4-алкініл означає розгалужені або нерозСульфони формули (VI) і похідні 2галужені вуглеводневі залишки з 3-4 атомами вугтіопіримідину формули (VIII) є новими. лецю і з потрійним зв'язком у будь-якому полоУ вищенаведених залишках вжиті загальні поженні, наприклад, етиніл, 1-пропініл, 2-пропініл, 1няття, які у цілому представляють собою наступні: бутиніл, 2-бутиніл, 3-бутиніл і 1-метил-2-пропініл; - галоген означає фтор, хлор, бром і йод; - С3-С4-галоалкініл і галоалкінільні групи С2-С4- С1-С6-алкіл і алкільні групи С1-С6-алкокси, галоалкінілокси означають ненасичені, лінійні або С1-С6-алкілтіо, С1-С6-алкіламіно, ди-С1-С6розгалужені вуглеводневі радикали з 2-4 атомами алкіламін або С1-С6-алкоксикарбоніл означають вуглецю і з потрійним зв'язком у будь-якому полонасичені, розгалужені або нерозгалужені вуглевоженні (як вказано вище), причому атоми водню в дневі залишки з 1-6 атомами вуглецю, переважно даних групах можуть частково або повністю бути С1-С4-алкіл як, наприклад, метил, етил, пропіл, 1замінені атомами галогену, як вказано вище, зокметилетил, бутил, 1-метилпропіл, 2-метилпропіл, рема, атомами фтору, хлору і брому; 1,1-диметилетил; або пентил, 1-метилбутил, 25-членний гетероарил, який містить 1-4 атоми метилбутил, 3-метилбутил, 2,2-диметилпропіл, 1азоту або 1-3 атоми азоту й один атом сірки або етилпропіл, гексил, 1,1-диметилпропіл, 1,2кисню: 5-членні гетероарильні групи, які на додадиметилпропіл, 1-метилпентил, 2-метилпентил, 3ток до атомів вуглецю як члени кільця можуть місметилпентил, 4-метилпентил, 1,1-диметилбутил, тити 1-4 атоми азоту або 1-3 атоми азоту й один 1,2-диметилбутил, 1,3-диметилбутил, 2,2атом сірки або кисню, наприклад, 2-фурил, 3 11 74584 12 фурил, 2-тієніл, 3-тієніл, 2-піроліл, 3-піроліл, 3або морфолін-4-іл. ізоксазоліл, 4-ізоксазоліл, 5-ізоксазоліл, 3Особливо переважні проміжні сполуки стосовізотіазоліл, 4-ізотіазоліл, 5-ізотіазоліл, 3-піразоліл, но замісників відповідають сполукам, які мають 4-піразоліл, 5-піразоліл, 2-оксазоліл, 4-оксазоліл, замісники R1, R2, R3 і R4 відповідно до формули (І). 5-оксазоліл, 2-тіазоліл, 4-тіазоліл, 5-тіазоліл, 2З урахуванням їх застосування переважають імідазоліл, 4-імідазоліл, 1,2,4-оксадіазол-3-іл, піримідини формули (І), які включають наступні 1,2,4-оксадіазол-5-іл, 1,2,4-тіадіазол-3-іл, 1,2,4замісники, причому перевага в кожному випадку тіадіазол-5-іл, 1,2,4-триазол-3-іл, 1,3,4-оксадіазолстосується або окремих випадків, або їх комбінації: 2-іл, 1,3,4-тіадіазол-2-іл і 1,3,4-триазол-2-іл; Переважними є сполуки формули (І), у яких R1 6-членний гетероарил, який містить 1-4 атоми означає С3-С10алкіл, С3-С8-циклоалкіл, С3-С8азоту: 6-членні гетероарильні групи, які на додаток циклоалкіл-С1-С6-алкіл, С1-С10-галоалкіл або федо атомів вуглецю як члени кільця можуть містити ніл, незаміщені або заміщені 1-3 атомами галоге1-3 або 1-4 атоми азоту, наприклад, 2-піридиніл, 3ну, С1-С10-алкілом або С1-С6-алкоксигрупою. піридиніл, 4-піридиніл, 3-піридазиніл, 4Далі, особливо переважними є сполуки форпіридазиніл, 2-піримідиніл, 4-піримідиніл, 5мули (І), у яких R1 означає С1-С10-галоалкіл, перепіримідиніл, 2-піразиніл, 1,3,5-триазин-2-іл і 1,2,4важно поліфторований алкіл, зокрема, 2,2,2триазин-3-іл; переважними гетарильними групами трифторетил, 2-(1,1,1-трифторпропіл) або 2-(1,1,1є піридил, піримідил, піразоліл або тієніл. трифторбутил). 5- або 6-членний гетероцикліл, який містить 1Крім того, особливо переважними є сполуки 4 атоми азоту або 1 -3 атоми азоту й один атом формули (І), у яких R1 означає незаміщений або сірки або кисню, наприклад, 2-тетрагідрофураніл, заміщений С3-С8-циклоалкіл, переважно циклопен3-тетрагідрофураніл, 2-тетрагідротієніл, 3тил або циклогексил. тетрагідротієніл, 2-піролідиніл, 3-піролідиніл, 3Далі, особливо переважними є сполуки форізоксазолідиніл, 4-ізоксазолідиніл, 5мули (І), у яких R2 означає феніл, заміщений 2 або ізоксазолідиніл, 3-ізотіазолідиніл, 4-ізотіазолідиніл, 3 замісниками. Найбільш переважно, принаймні, 5-ізотіазолідиніл, 3-піразолідиніл, 4-піразолідиніл, один з даних замісників зв'язаний з піримідиновою 5-піразолідиніл, 2-оксазолідиніл, 4-оксазолідиніл, групою в положенні 2 по відношенню до точки 5-оксазолідиніл, 2-тіазолідиніл, 4-тіазолідиніл, 5зв'язування. Такими замісниками переважно є гатіазолідиніл, 2-імідазолідиніл, 4-імідазолідиніл, логен або алкокси. 1,2,4-оксадіазолідин-3-іл, 1,2,4-оксадіазолідин-5-іл, Подальшими особливо переважними сполу1,2,4-тіадіазолідин-3-іл, 1,2,4-тіадіазолідин-5-іл, ками формули (І) є ті, у яких R2 представляє собою 1,2,4-триазолідин-3-іл, 1,3,4-оксадіазолідин-2-іл, фенільну групу формули 1,3,4-тіадіазолідин-2-іл, 1,3,4-триазолідин-2-іл, 2,3дигідрофур-2-ил, 2,3-дигідрофур-3-іл, 2,4дигідрофур-2-іл, 2,4-дигідрофур-3-іл, 2,3дигідротієн-2-іл, 2,3-дигідротієн-3-іл, 2,4дигідротієн-2-іл, 2,4-дигідротієн-3-іл, 2-піролін-2-іл, 2-піролін-3-іл, 3-піролін-2-іл, 3-піролін-3-іл, 2у якій L1-L4 незалежно означають водень, ізоксазолін-3-іл, 3-ізоксазолін-3-іл, 4-ізоксазолін-3фтор, хлор або метокси, зокрема, L1 означає фтор іл, 2-ізоксазолін-4-іл, 3-ізоксазолін-4-іл, 4або хлор, L2 і L4 незалежно означають водень, ізоксазолін-4-іл, 2-ізоксазолін-5-іл, 3-ізоксазолін-5фтор або хлор, і L3 означає водень, фтор, хлор іл, 4-ізоксазолін-5-іл, 2-ізотіазолін-3-іл, 3або метокси. ізотіазолін-3-іл, 4-ізотіазолін-3-іл, 2-ізотіазолін-4-іл, Зокрема надають перевагу сполуках формули 3-ізотіазолін-4-іл, 4-ізотіазолін-4-іл, 2-ізотіазолін-5(І), у яких R3 означає хлор. іл, 3-ізотіазолін-5-іл, 4-ізотіазолін-5-іл, 2,3Крім того, особливо переважними є сполуки дигідропіразол-1-іл, 2,3-дигідропіразол-2-іл, 2,3формули (І), у яких R4 означає водень, С1-С6-алкіл, дигідропіразол-3-іл, 2,3-дигідропіразол-4-іл, 2,3С2-С6-алкеніл або С2-С6-алкініл; або феніл-С1-С4дигідропіразол-5-іл, 3,4-дигідропіразол-1-іл, 3,4алкіл, у якому фенільне кільце може бути заміщедигідропіразол-3-іл, 3,4-дигідропіразол-4-іл, 3,4не одним або двома атомами галогену. дигідропіразол-5-іл, 4,5-дигідропіразол-1-іл, 4,5Далі, особливо надають перевагу сполукам дигідропіразол-3-іл, 4,5-дигідропіразол-4-іл, 4,5формули (І), у яких R4 означає водень, С1-С6-алкіл дигідропіразол-5-іл, 2,3-дигідрооксазол-2-іл, 2,3або бензил, зокрема, С1-С6-алкіл. дигідрооксазол-3-іл, 2,3-дигідрооксазол-4-іл, 2,3Зокрема переважними є сполуки формули (І), дигідрооксазол-5-іл, 3,4-дигідрооксазол-2-іл, 3,4у яких X означає NR5, причому R5 представляє дигідрооксазол-3-іл, 3,4- дигідрооксазол-4-іл, 3,4собою водень, С1-С10-алкіл або С1-С10-галоалкіл, дигідрооксазол-5-іл, 3,4-дигідрооксазол-2-іл, 3,4зокрема водень. дигідрооксазол-3-іл, 3,4-дигідрооксазол-4-іл, 2Далі, особливо надають перевагу сполукам піперидиніл, 3-піперидиніл, 4-піперидиніл, 1,3формули (І), у яких R5 означає С1-С6-алкіл, особдіоксан-5-іл, 2-тетрагідропіраніл, 4ливо водень або метил. тетрагідропіраніл, 2-тетрагідротієніл, 3Крім того, особливо переважними є також спогексагідропіридазиніл, 4-гексагідропіридазиніл, 2луки формули (І), у яких X означає NR5, і R1 разом гексагідропіримідиніл, 4-гексагідропіримідиніл, 5із проміжним атомом азоту утворює незаміщений гексагідропіримідиніл, 2-піперазиніл, 1,3,5або заміщений гетероцикл, переважно незаміщегексагідротриазин-2-іл і 1,2,4-гексагідротриазин-3ний або заміщений 3-7-членний гетероцикл, зокіл; переважними гетероциклільними групами є рема піролідин, піперидин, тетрагідропіридин, зокпіролідиніл, піразолідиніл, піперидиніл, піперазиніл 13 74584 14 рема циклічний 1,2,3,6-тетрагідропіридин або азелька носіїв. Винахід стосується також способу пан, незаміщений або заміщений однією або декіодержання такої композиції, який включає змішулькома С1-С10-алкільними групами. вання сполуки формули (І) відповідно до вищенаНайбільш переважними є сполуки форведеної дефініції, принаймні, з одним носієм. Така мули (ІА) композиція може містити одну активну речовину або ж суміш декількох активних речовин згідно із даним винаходом. Також можливо, що різні ізомери або суміші ізомерів можуть мати різні рівні або IA діапазони дії і, таким чином, композиції можуть містити індивідуальні ізомери або суміші ізомерів. Композиція відповідно до винаходу переважно містить від 0,5 до 95мас.% активної речовини. у якій R1-R5 мають вказане для формули (І) У композиції відповідно до винаходу як носій значення, L1 означає фтор або хлор, L2 і L4 незаможна використовувати будь-яку речовину, з якою лежно означають водень, фтор або хлор, і L3 змішують активну речовину для полегшення заозначає водень, фтор, хлор або ОСН3. стосування на місці, яке підлягає обробці, наприКрім того, найбільш переважними є сполуки, у клад, на рослині, насіннях, ґрунті або у воді, де яких R3 означає хлор, X означає NH, R4 представросте рослина, або для полегшення зберігання, ляє собою С1-С6-алкіл, С1-С6-алкеніл або С2-С6перевезення або маніпулювання. Як носій може aлкініл, зокрема С1-С6-алкіл, R2 означає феніл, бути тверда речовина або рідина, а також речовинезаміщений або заміщений одним або декількома на, яка звичайно є у вигляді газу і стиснута до рідатомами фтору і/або хлору і/або метоксигрупами. кого стану. Особливо переважними є подальші сполуки Композиції можна одержувати шляхом загальформули (ІА): новідомих методів, наприклад, у вигляді концентрованих емульсій, розчинів, емульсій типу маслоR1 R5 R3 R4 L1 L2 L3 L4 у-воді, змочуваних порошків, розчинних порошків, CH(CH3)CF3 Η СІ СН3 F Η F F концентрованих суспензій, пилів, гранул, дисперCH(CH3)CF3 Η СІ (СН2)3СН3 F Η F F гованих у воді гранул, мікрокапсул, гелів, таблеток СН(СН3)2 Η СІ СН3 F Η F F і препаратів інших видів. Дані відомі методи вклюС-С3Н5 Η СІ СН3 F F Η F чають інтенсивне перемішування і/або подрібнюазепан-1-іл Η СІ СН3 Η F Η F вання активних речовин з іншими речовинами як, (СН2)2СН(СН3)(СН2)2 СІ СН3 F Η Η СІ наприклад, наповнювачами, розчинниками, тверСН(СН3)СН2СН3 Η СІ СН3 F Η Η СІ дими носіями, поверхнево-активними речовинами, (СН2)2СН(СН3)(СН2)2 СІ СН3 F Η F F і, у разі потреби, твердими і/або рідкими допоміжCH(CH3)CF3 Η СІ СН3 F Η F F ними речовинами і/або ад'ювантами. Вид аплікації, тобто, наприклад, розприскування, розпилення, Даний винахід поширюється також на (R)- і (S)диспергування або розливання, можна вибрати, як ізомери сполук загальної формули (І), які мають і композиції, залежно від бажаного ефекту і конкхіральний центр, та на їх рацемати, солі, N-оксиди ретних умов. і кислотно-адитивні сполуки. Як розчинники можуть бути використані ароСполуки формули (І) відрізняються цінними матичні вуглеводні, наприклад, Solvess®200, зафунгіцидними властивостями, зокрема, поліпшеміщені нафталени, складні ефіри фталевої кислоною системною дією. Наприклад, їх можна застоти як, наприклад, дибутил- або діоктилфталат, совувати в сільському господарстві або пов'язаних аліфатичні вуглеводні як, наприклад, циклогексан, з ним галузях для боротьби з фітопатогенними або парафіни, спирти і гліколі і їх прості і складні грибами як, наприклад, Alternaria solani, Botrytis ефіри, наприклад, етанол, простий моно- і димеcinerea, Cercospora beticola, Cladosporium тиловий ефір етиленгліколю, кетони як, наприherbarum, Corticium rolfsi, Erysiphe graminis, клад, циклогексанон, сильно полярні розчинники Helminthosporium tritici repentis, Lepfosphaeria як, наприклад, ІМ-метил-2-піролідон, або γnodorum, Micronectriella nivalis, Monilinia fructigena, бутиролактон, вищі алкілпіролідони як, наприклад, Mycosphaerella ligulicola, Mycosphaerella pinodes, н-октилпіролідон або циклогексилпіролідон, епокRhizoctonia solani, Sclerotinia sclerotiorum, Uncinula сидовані складні ефіри рослинних олій, наприклад, necator і Venturia inaequalis, зокрема Pyriculana метиловані складні ефіри кокосової або соєвої олії oryzae, Rhizoctonia solani і Venturia inaequalis. Споі вода. Часто придатні суміші різних рідин. луки формули (І) відповідно до винаходу мають Як тверді носії, які можна використовувати для сильну фунгіцидну активність в широкому інтерваодержання пилів, змочуваних порошків, дисперголі концентрацій. ваних у воді гранул або гранул, можна взяти мінеЗавдяки їх відмінній дії сполуки формули (І) ральні наповнювачі як, наприклад, кальцит, тальк, можна застосовувати при вирощуванні рослин, де каолін, монтморилоніт або атапульгіт. Фізичні влазараження фітопатогенними грибами небажано, стивості можна поліпшити шляхом додавання винаприклад, зернових культур, пасльонових, овочів, соко диспергованого силікагелю або полімерів. Як бобових культур, яблуні, винограду. носій для одержання гранул можна використовуДаний винахід далі стосується фунгіцидної вати пористі речовини як, наприклад, пемзу, каокомпозиції, яка включає активну речовину, що лін, сепіоліт, бентоніт, і як не-сорбуючі носії можна представляє собою, принаймні, одну сполуку фовзяти кальцит або пісок. Крім того, можна викорисрмули (І) відповідно до винаходу, і один або декітовувати велику кількість заздалегідь гранульова 15 74584 16 них неорганічних або органічних речовин як, нарозчинників містять звичайно від 1 до 80мас.% приклад, доломіт або подрібнені рослинні заактивної речовини у перерахунку на об'єм, від 2 до лишки. 20мас.% емульгаторів у перерахунку на об'єм і до Пестицидні композиції часто одержують і пе20мас.% у перерахунку на об'єм інших добавок як ревозять у концентрованому вигляді, і потім користабілізаторів, речовин, які сприяють проникненстувач розбавляє їх перед застосуванням. Останню, і інгібіторів корозії. Концентровані суспензії нє полегшується завдяки наявності невеликої звичайно подрібнюють для одержання стабільної, кількості поверхнево-активної речовини як носія. не осідаючої рідкої речовини, і вони звичайно місТому переважно, принаймні, один з носіїв у запротять від 5 до 75мас.% активної речовини у перерапонованій композиції представляє собою поверххунку на об'єм, від 0,5 до 15мас.% диспергаторів у нево-активну речовину. Наприклад, композиція перерахунку на об'єм, від 0,1 до 10мас.% суспенможе містити два або більше носіїв, причому, придувальних агентів, наприклад, захисних колоїдів і наймні, один з них представляє собою поверхнетиксотропних агентів, у перерахунку на об'єм, до во-активну речовину. 10мас.% у перерахунку на об'єм інших добавок як, Поверхнево-активні речовини можуть преднаприклад, протиспінювальних агентів, інгібіторів ставляти собою неіонні, аніонні, катіонні або дипокорозії, стабілізаторів, агентів, які сприяють пронилярні речовини, які мають гарні диспергувальні, кненню, та адгезійних агентів, і воду або органічну емульгувальні і змочувальні властивості, залежно рідину, у якій активна речовина практично не розвід сполуки загальної формули (І), яку необхідно чинна. У препараті в розчиненому вигляді можуть перевести в препарат. Під поверхнево-активними бути також органічні або неорганічні тверді речоречовинами маються на увазі також суміші окревини, які перешкоджають осіданню і кристалізації мих поверхнево-активних речовин. або які діють як агенти, що понижують температуКомпозиції відповідно до винаходу можна перу замерзання води. ревести в препарат, наприклад, у вигляді змочуВодні дисперсії й емульсії, наприклад, компованих порошків, диспергованих у воді гранул, пизиції, отримані шляхом розчинення переведеного лів, гранул, таблеток, розчинів, емульгованих в препарат продукту відповідно до винаходу воконцентратів, емульсій, концентрованих суспензій і дою, також входять в обсяг даного винаходу. аерозолів. Змочувані порошки звичайно містять Особливий інтерес для продовження триваловід 5 до 90мас.% активної речовини, і вони звисті захисної активності сполук відповідно до виначайно додатково до інертного твердого носія місходу представляє застосування носія, який забезтять від 3 до 10мас.% агентів диспергування і змопечує уповільнене вивільнення пестицидних чування і, у разі потреби, до 10мас.% сполук у навколишнє середовище рослини, що стабілізатора або стабілізаторів і/або подальших підлягає захисту. добавок, наприклад, речовин, які сприяють прониБіологічну активність активної речовини можна кненню або адгезійних речовин. Пилі звичайно також підвищити шляхом включення ад'юванта в одержують у вигляді концентрованого пилу із призначений для розприскування розчин. У даноскладом, подібним до складу змочуваного порошму контексті під ад'ювантом слід розуміти речовику, але без диспергатора, і їх можна розбавляти за ну, здатну до підвищення біологічної активності допомогою подальшого твердого носія для одерактивної речовини, але яка сама не має помітної жання композиції, що звичайно містить від 0,5 до біологічної активності. Ад'ювант можна або вклю10мас.% активної речовини. Гранули, у тому числі чати в препарат як складову частину препарату і дисперговані у воді гранули, звичайно одержують або носій, або ж його можна подати в резервуар з розміром від 0,15мм і 2,0мм, і їх можна одержупід середовище для розприскування разом із превати за допомогою різних методів. У цілому такі паратом, що містить активну речовину. гранули містять від 0,5 до 90мас.% активної речоДля продажу композиції переважно є в концевини і до 20мас.% добавок як стабілізаторів, повентрованому вигляді, у той час як користувач зархнево-активних речовин, агентів, що сповільнюстосовує в основному розведені композиції. Комють вивільнення, і зв'язувальних речовин. Так позиції можна розбавляти до концентрації 0,001% звані "сухі плинні речовини" представляють собою активної речовини. Дози звичайно складають від порівняно невеликі гранули з порівняно високою 0,01 до 10кг активної речовини на га. У нижченаконцентрацією активної речовини. Емульгувальні веденому приведені деякі приклади препаратів концентрати додатково до розчинника або суміші відповідно до винаходу. 17 74584 18 Концентрована суспензія Активна речовина Емульгатор(и) Розчинник Активна речовина Диспергатор Сполука прикладу №5 30% (вага/об'єм) 1) Atlox® 4856 B/Atlox® 4858 В 5% (вага/об'єм) (суміш алкіларилсульфонату кальцію, етоксилатів спиртів жирного ряду і легких ароматів/суміш алкіларилсульфонату кальцію, етоксилатів спиртів жирного ряду і легких ароматів) 2) Shellsol®A до 1000мл (суміш ароматичних С9-С10-вуглеводнів) Сполука прикладу №5 50% (вага/об'єм) 3) Soprophor® FL 3% (вага/об'єм) (фосфат аміну простого поліоксіетиленполіарилфенілового ефіру) 3) Rhodorsil® 422 0,2 (вага/об'єм) (неіонна водна емульсія полідиметилсилоксанів) 4) Kelzan® S 0,2 (вага/об'єм) (ксантанова смола) Протиспінювальний агент Структурний агент Агент, який знижує темпераПропіленгліколь 5% (вага/об'єм) туру замерзання води 5) РгохеІ® 0,1 (вага/об'єм) (водний розчин дипропіленгліколю, який містить 20% 1,2Біоцидний агент бенізотіазолін-3-ону) Вода до 1000мл Змочуваний порошок Активна речовина Сполука прикладу №7 60% (вага/вага) 1) Змочувальний агент Atlox®4995 2% (вага/вага) (простий алкіловий ефір поліоксіетилену) Witcosperse® D-60 6) 3% (вага/вага) (суміш натрієвих солей конденсованої нафталенової Диспергатор сульфокислоти й алкіларилполіоксіацетатів Носій/фільтр каолін 35% (вага/вага) Дисперговані у воді гранули Активна речовина Сполука прикладу №7 50% (вага/вага) Диспергатор/зв'язувальний Witcosperse® D-450 6) 8% (вага/вага) (суміш натрієвих солей конденсованої нафталеноагент вої сульфокислоти й алкілсульфонатів) 6) Змочувальний агент Morwet® EFW 2% (вага/вага) (продукт конденсації формальдегіду) 3) Протиспінювач Rhodorsil® ЕР 6703 1% (вага/вага) (включений у капсули силікон) 7) Дисінтегратор Agrimer® ATF 2% (вага/вага) (зшитий гомополімер N-вініл-2-піролідону) Носій/фільтр каолін 35% (вага/вага) 1) є в торгівлі; продукт фірми ІСІ Surfactants є в торгівлі; продукт фірми Deutsche Shell AG 3) є в торгівлі; продукт фірми Rhone-Poulenc 4) є в торгівлі; продукт фірми Kelco Co. 5) є в торгівлі; продукт фірми Zeneca 6) є в торгівлі; продукт фірми Witco 7) є в торгівлі; продукт фірми International Speciality Products. 2) Композиції згідно із даним винаходом можна застосовувати на рослинах або їх довкіллі одночасно з іншими активними речовинами або послідовно з ними. Такі інші активні речовини можуть представляти собою добрива, агенти, що поставляють мікроелементи, або інші препарати, які впливають на ріст рослин. Однак, вони можуть також представляти собою вибірні гербіциди, інсектициди, фунгіциди, бактерициди, нематициди, альгіциди, молюскіциди, родентициди, вірусициди, сполуки, які викликають резистентність у рослин, біологічні агенти захисту рослин як, наприклад, віруси, бактерії, нематоди, гриби й інші мікроорганізми, репеленти птахів і тварин, регулятори росту рослин, або суміші декількох з таких засобів, у разі потреби, з іншими носіями, що звичайно використовують при одержанні препаратів, поверхневоактивними засобами або іншими добавками, які полегшують застосування препаратів. Далі, інший пестицид може мати синергетичний ефект на пестицидну дію сполуки формули (І). Інша фунгіцидна сполука може мати, наприклад, здатність інгібування захворювань зернових культур (наприклад, пшениці), приміром, захворювань, які викликаються Erysiphe, Puccinia, Septoria, Gibberella і Helminthosporium spp., захворювань, яка виникають на насіннях і в ґрунті, справжньої і несправжньої борошнистої роси винограду, бурої плямистості і бурою гнилі пасльонових, борошнистий роси і парші яблуні і т.д. Такі суміші фунгіцидів можуть мати більший діапазон дій, ніж одна сполука загальної формули (І). Крім того, інший фунгіцид може виявляти синергистичну дію на фунгіцидну активність сполуки формули (І). Як приклади інших фунгіцидних сполук можна називати анілазин, азоксистробін, беналаксил, беноміл, бінапакрил, бітертанол, бластицидин С, бордоську рідину, бромуконазол, бупіримат, каптафол, каптан, карбендазим, карбоксин, карпропамід, хлорбензтіазон, хлорталоніл, хлозолінат, мідьвмісні сполуки як, наприклад, оксихлорид міді і сульфат міді, циклогексімід, цимоксаніл, ципофурам, ципроконазол, ципродиніл, дихлофлуанід, дихлон, дихлоран, диклобутразол, диклоцимет, дикломезин, діетофенкарб, дифеноконазол, дифлуметорим, диметиримол, диметоморф, диніконазол, динокап, диталімфос, дитіанон, додеморф, додин, едифенфос, епоксиконазол, етаконазол, етиримол, етридіазол, фамоксадон, фенапаніл, фенамідон, фенаримол, фенбуконазол, фенфурам, фенгексамід, феноксаніл, фенпіклоніл, фенпропідин, фенпропіморф, фентин, фентинацетат, 19 74584 20 фентингідроксид, феримзон, флуазинам, флудіокного винаходу, є, наприклад, зернові культури, соніл, флуметовер, флухінконазол, флусилазол, такі, як пшениця, ячмінь, рис, цукровий буряк, зефлусульфамід, флутоланіл, флутріафол, фолпет, мляний горіх, картопля, овочі і томат. Тривалість фосетил-алюміній, фуберидазол, фуралаксил, захисту звичайно залежить від конкретно викорисфураметпир, гуазатин, гексаконазол, IKF-916, іматовуваної сполуки, а також від різноманітних інших заліл, іміноктадин, іпконазол, іпродіон, ізопротіофакторів, наприклад, клімату, вплив якого звичайлан, іпровалікарб, казугаміцин, KН-7281, китазин но знижують шляхом вибору придатного преП, крезоксимметил, манкозеб, манеб, мепанипіпарату. рим, мепроніл, металаксил, метконазол, метфуроПриклади одержання сполук ксам, MON 65500, міклобутаніл, неоасозин, димеОписані в нижченаведених прикладах методи тилдитіокарбамат нікелю, нітроталізопропіл, синтезу були використані також для одержання нуаримол, офурас, органічні сполуки ртуті, оксадіподальших сполук формули (І), причому викорисксил, оксикарбоксин, пенконазол, пенцикурон, фетовувалися відповідні інші вихідні сполуки. Одерназиноксид, фталід, поліоксин Д, полграм, пробежувані сполуки та їх фізичні дані перераховані в назол, прохлораз, процимідон, пропамокарб, таблицях. пропіконазол, пропінеб, піраклостробін, піразофос, Приклад 1 пірифенокс, піриметаніл, пірохілон, піроксифур, Одержання 2-(N-ціано-N-метиламіно)-4-хлорхінометіонат, хіноксифен, хінтозен, спіроксамін, 5-(2,4,6-трифторфеніл)-6-(1,1,1-трифторпроп-2SSF-126, SSF-129, стрептоміцин, сірка, тебуконаіламіно)-піримідину зол, теклофталам, текназен, тетраконазол, тіабеСуміш 2,5г (6,3ммоль) 5-хлор-6-(2,4,6ндазол, тифлузамід, тіофанат-метил, тірам, толктрифторфеніл)-7-(1,1,1-трифторпроп-2-іламіно)лофосметил, толілфлуанід, триадимефон, триазол[1.5а]піримідину, отриманого [відповідно триадименол, триазбутил, триазоксид, трицикладо міжнародної заявки WO-A 98/46608], 15мл дизол, тридеморф, трифлоксистробін, трифлумізол, метилформаміду, 0,25г 60%-ного гідриду натрію і трифорин, тритиконазол, валідаміцин А, вінклозометилйодиду розмішують при кімнатній темпералін, XRD-563, зариламід, цинеб, цирам. турі впродовж 45 хвилин. Отриману реакційну суКрім того, препарати згідно із винаходом моміш виливають у 400мл води і двічі екстрагують, жуть містити, принаймні, одну сполуку формули (І) кожного разу використовуючи 300мл простого діеі будь-який біологічний агент захисту рослин, натилового ефіру. Органічну фазу відділяють, суприклад із класу вірусів, бактерій, нематод, грибів і шать безводним сульфатом натрію і фільтрують. інших мікроорганізмів, здатних до стримування Фільтрат упарюють при зниженому тиску й очикомах, бур'янів і захворювань рослин, або здатний щають шляхом флеш-хроматографії з одержанням викликати резистентність у рослин. Як приклади 0,2г продукту у вигляді безбарвного масла. таких біологічних агентів можна називати: Bacillus Приклади 2-20: Таблиця І (отримані аналогічно thuringiensis, Verticillium lecanu, Autographica до прикладу №1) californica NPV, Beauvaria bassiana, Ampelomyces Таблиця І quisqualis, Bacilis subtilis. Pseudomonas chlororaphis, Pseudomonas fluorescens, Steptomyces griseoviridis і Trichoderma harzianum. Далі, препарати відповідно до винаходу можуть містити, принаймні, одну сполуку формули (І) і хімічний засіб, який викликає системну набуту резистентність рослин, наприклад, ізонікотинову кислоту або її похідні, 2,2-дихлор-3,3диметилциклопропанкарбонову кислоту або BION. Сполуки формули (І) можна змішувати з ґрунтом, торфом або іншим матеріалом для укорінення рослин з метою їх захисту від грибкових хвороб, які заражають насіння, ґрунт або листя рослин. Подальшими об'єктами даного винаходу є застосування сполуки формули (І) відповідно до вищенаведеної дефініції або композиції відповідно до вищенаведеної дефініції як фунгіциду, і спосіб боротьби з грибами на певному місці, який включає обробку такою сполукою або такою композицією даного місця, яке може представляти собою, наприклад, рослини, які піддаються зараженню грибами, насіння таких рослин або середовище, у яких ростуть рослини. Даний винахід можна застосовувати в широкій галузі захисту культурних і декоративних рослин від зараження грибами. Типовими культурними рослинами, які можна захищати за допомогою да 21 74584 Продовження таблиці І Приклад 26 Одержання 2-(N-ціано-N-метиламіно)-4-хлор5-(2,4,6-трифторфеніл)-6-циклогексилпіримідину Суміш 2,5г (6,3ммоль) 5-хлор-6-(2,4,6трифторфеніл)-7-циклогексилтриазол[1.5а]піримідину, отриманого [відповідно до заявки WO-A 99/41255], 15мл диметилформаміду, 0,25г 60%-ного гідриду натрію і метилйодиду розмішують при кімнатній температурі протягом 45 хвилин. Реакційну суміш виливають у 400мл води і двічі екстрагують, кожного разу використовуючи 300мл простого діетилового ефіру. Органічну фазу відділяють, сушать над безводним сульфатом натрію і фільтрують. Фільтрат упарюють при зниженому тиску й очищають шляхом флешхроматографії з одержанням 0,2г продукту у вигляді безбарвного масла. Приклади 27-39: Таблиця II (отримані аналогічно до прикладу №26) Таблиця ІІ Приклад 40 Одержання 4-хлор-2-(N-ціаноаміно)-6-[(4метил)-піперидин-1-іл]-5-феніл-піримідину До розчину 1,0г (2,7ммоль) 4-хлор-6-[(4метил)-піперидин-1-іл]-2-метил-сульфоніл-5феніл-піримідину в 8мл диметилформаміду при кімнатній температурі додають 0,76г (5,47ммоль) карбонату калію. Після розмішування реакційної суміші при кімнатній температурі протягом 17,5 годин розбавляють шляхом додавання 70мл води, 22 і отриманий мутний розчин підкисляють до значення рН1 шляхом додавання 4мл концентрованої хлористоводневої кислоти. Отриману білу суспензію розмішують при кімнатній температурі протягом 2 годин, потім фільтрують, промивають спочатку водою і потім гексаном і сушать у вакуумі протягом ночі. Отриманий сирий продукт перекристалізовують із суміші метиленхлориду і гексану, у результаті чого одержують 0,71г цільової сполуки у вигляді білої кристалічної твердої речовини. Вихід: 79%, точка плавлення: 219-220°С (розклад). Приклад 41 Одержання 4-хлор-2-(ї\І-ціано-М-метиламіно)6-[(4-метил)-піперидин-1 -іл]-5-фенілпіримідину До розчину 0,1г (0,305ммоль) 4-хлор-2-(Nціаноаміно)-6-[(4-метил)-піперидин-1-іл]-5фенілпіримідину в 4мл диметилформаміду при кімнатній температурі додають спочатку 2мл води, а потім 0,084г (0,61ммоль) карбонату калію. Отриману суспензію нагрівають повільно до одержання прозорого розчину. Даний розчин охолоджують, додають 0,076мл (1,22ммоль) метилйодиду, і реакційну суміш розмішують при кімнатній температурі протягом 2,5 годин. Розбавляють додаванням 40мл насиченого водного розчину хлориду амонію. Після додавання 40мл етилацетату двофазну суміш розмішують протягом 5 хвилин. Потім відділяють органічну фазу, промивають 50мл насиченого соляного розчину, сушать над сульфатом магнію і згущають у вакуумі з одержанням жовтого сиропу. Сирий продукт піддають хроматографії на силікагелі з використанням як елюенту суміші гексану і етилацетату в об'ємному співвідношенні 90:10, у результаті чого одержують 0,09г цільового продукту у вигляді безбарвного сиропу. Вихід: 87%. Приклад 42 Одержання 2-(N-бензил-N-ціано)-4-хлор-6-[(4метил)-піперидин-1-іл]-5-фенілпіримідину До розчину 0,37г (1,13ммоль) 4-хлор-2-(Nціаноаміно)-6-[(4-метил)-піперидин-1-іл]-5-фенілпіримідину в 10мл диметилформаміду при кімнатній температурі додають 3мл води і 0,19г (1,35ммоль) карбонату калію. До отриманої мутної суспензії додають 0,16мл (1,35ммоль) бензилброміду, і розмішують при кімнатній температурі протягом 18,75 годин, після чого розбавляють додаванням 40мл насиченого водного розчину хлориду амонію. Отриману суміш потім розподіляють між 75мл етилацетату і 75мл води, сушать над сульфатом магнію і згущають у вакуумі до одержання жовтого сиропу. Сирий продукт піддають хроматографії на силікагелі з використанням як елюенту суміші гексану і етилацетату в об'ємному співвідношенні 90:10, і одержують 0,47г цільового продукту у вигляді білої кристалічної твердої речовини. Вихід: 100%, точка плавлення 98-100°С. Приклад 43 Альтернатива одержання 4-хлор-2-(N-ціано-Nметиламіно)-6-[(4-метил)-піперидин-1-іл]-5фенілпіримідину До розчину 0,5г (1,37ммоль) 4-хлор-6-[(4метил)-піперидин-1-іл]-2-метил-сульфоніл-5феніл-піримідину в 6мл диметилформаміду додають спочатку 0,38г (2,73ммоль) карбонату калію і потім 0,31г (5,47ммоль) метилціанаміду. Реакційну 23 74584 24 суміш розмішують при кімнатній температурі пропіперидин-1-іл]-2-метил-сульфоніл-5 фенілпіримітягом 19 годин, потім розбавляють додаваннямдину 75мл води й екстрагують з використанням 75мл Розчин 17,19г (51,5ммоль) 4-хлор-6-[(4-метил)етилацетату. Органічну фазу промивають спочатку піперидин-1-іл]-2-метилтіо-5-фенілпіримідину в 75мл води, а потім 75мл насиченого соляного роз350мл метиленхлориду охолоджують до темперачину, сушать над сульфатом магнію і згущають у тури 0°С. До реакційної суміші додають 25,4г вакуумі до одержання жовтого сиропу. Сирий про(103ммоль) 70%-ної хлорпербензойної кислоти і дукт піддають хроматографії на силікагелі з викорозмішують при температурі 0°С впродовж години ристанням як елюенту суміші гексану і етилацетаі при кімнатній температурі протягом півтори готу в об'ємному співвідношенні 90:10, і одержують дин. Після цього реакційну суміш концентрують у 0,39г цільового продукту у вигляді безбарвного вакуумі до невеликого об'єму, розбавляють додасиропу. Вихід: 84%. ванням 400мл етилацетату, промивають тричі 5%Приклад 44 ним водним розчином карбонату натрію (3 300мл) Одержання вихідної сполуки 4-хлор-6-[(4і раз насиченим соляним розчином (300мл), суметил)-піперидин-1-іл]-2-метилсульфоніл-5шать над сульфатом магнію і згущають у вакуумі з фенілпіримідину одержанням білої твердої речовини, яку перекрисСтадія а: 5-феніл-2-метилтіо-4,6(1Н,5Н)талізовують із суміші етилацетату і гексану, у репіримідиндіон зультаті чого одержують 14,68г (вихід: 78%) цільо60,0г (208ммоль) етил 2-фенілмалонату і 19,0г вого продукту у вигляді білуватої кристалічної (249ммоль) тіосечовини нагрівають у 77г твердої речовини. Точка плавлення: 160-162°С. (416ммоль) три-н-бутиламіну при температурі Приклад 45 150°С впродовж 2,5 годин. Більшу частину утвореОдержання проміжної сполуки 4-хлор-6-(Nного етанолу видаляють шляхом перегонки. Після циклопентил)аміно-5-(2-фторфеніл)-2охолодження реакційної суміші додають 180мл метилтіопіримідин водного розчину 24,9г (623ммоль) NaOH. Після Стадія а: Одержання 5-(2-фторфеніл)-2додавання 50мл циклогексану і розмішування притіобарбітурової кислоти близно протягом півгодини водну фазу відділяють, До 200мл абсолютного етанолу при кімнатній обробляють додаванням 35,4г (142ммоль) метилтемпературі в атмосфері азоту додають 3,62г йодиду і розмішують приблизно при температурі (157ммоль) натрію. Реакційну суміш розмішують 20-25°С впродовж приблизно 16 годин. Підкислядо повної реакції натрію. Потім додають спочатку ють розведеним розчином НСІ, розмішують протярозчин 20г (78,7ммоль) діетил-(2гом приблизно півгодини й відфільтровують осад. фторфеніл)малонату в 50мл абсолютного етанолу Промивають водою, сушать, і одержують 16,7г і потім 8,38г (110ммоль) тіосечовини. Реакційну цільового продукту (28% теорії) у вигляді білих суміш нагрівають в атмосфері азоту при темперакристалів. турі кипіння зі зворотними холодильником протяСтадія б: 4,6-Дихлор-5-феніл-2гом 17 годин. Потім охолоджують, виливають у метилтіопіримідину 800мл води, отриману суміш розмішують протягом До розчину 48,8г (170ммоль) продукту стадії а) 15 хвилин і екстрагують додаванням 500мл просу 200мл фосфорилхлориду додають 3мл диметитого діетилового ефіру. Органічну фазу екстрагулформаміду (ДМФ) і нагрівають при температурі ють додаванням 150мл соляного розчину, насичефлегми протягом 40 годин. Більшу частину фосного на 1/3, і об'єднують водні шари. До водної форилхлориду видаляють шляхом перегонки, і фази додають 14мл концентрованої хлористоводзалишок розбавляють етилацетатом. Додають невої кислоти, і отриману білу суспензію розмішуводу, перемішуючи при температурі 15-20°С. Фази ють обережно протягом години. Суспензію фільтрозділяють, органічну фазу промивають водою і рують, отриману тверду речовину промивають розведеним розчином NaHCO3, потім сушать і виспочатку водою і потім простим діетиловим ефідаляють розчинник. Одержують 37,5г цільового ром, і сушать у вакуумі приблизно протягом 12 продукту (68% теорії) у вигляді масла, яке викоригодин. Одержують 8,59г цільової сполуки у вигляді стовують на стадії в) без подальшого очищення. білої твердої речовини з точкою плавлення вище Стадія в: 6-Хлор-5-феніл-4-[(4240°С. Вихід: 46 %. метил)піперидин-1-іл]-2-метилтіопіримідину Стадія б: Одержання 4,6-дигідрокси-5-(2Розчин 37,5г (324ммоль) продукту стадії б) у фторфеніл)-2-метилтіопіримідину 150мл безводного дихлорметану обробляють доДо суміші 8,20г (34,3ммоль) 5-(2-фторфеніл)-2даванням 24г (406ммоль) ізопропіламіну і розмітіобарбітурової кислоти і 68,8мл (13,8ммоль) 0,2Μ шують при температурі приблизно 20-25°С впроводного розчину гідроксиду натрію при перемішудовж 5 годин. Розчинник відганяють, залишок ванні при кімнатній температурі протягом 30 хвипоглинають етилацетатом, промивають розведелин прикапують 4,348г (34,4ммоль) диметилсульним НСІ, водою і розведеним розчином NaHCO3, фату. Після цього реакційну суміш перемішують потім сушать і видаляють розчинник. У результаті ще протягом 24 годин при кімнатній температурі. хроматографії залишку на силікагелі (циклогекДвічі промивають етилацетатом, кожного разу висан/метил-трет.бутиловий ефір у співвідношенні користовуючи 100мл, потім водну фазу підкислявід 100:1 до 19:1) одержують 13,4г цільової сполують до значення рН1 шляхом додавання 8мл конки (33% теорії) у вигляді безбарвних кристалів, які центрованої хлористоводневої кислоти. Отриману використовують на наступній стадії без подальшобілу суспензію розмішують протягом 30 хвилин, го очищення. фільтрують, і отриману білу тверду речовину проСтадія г: Одержання 6-Хлор-4-[(4-метил)мивають спочатку водою і потім гексаном, після 25 74584 26 чого сушать у вакуумі з одержанням 7,11г білої шують при температурі 150°С в атмосфері азоту твердої речовини. До сирого продукту додають протягом 3 годин. Охолоджену реакційну суміш 100мл етилацетату, і отриману суспензію при пепри інтенсивному розмішуванні протягом 15 хвиремішуванні нагрівають при температурі кипіння зі лин розподіляють між 84мл етилацетату і 83,2мл зворотним холодильником протягом 15 хвилин. (106ммоль) 2,0Μ розчину гідроксиду натрію. Потім Суспензію охолоджують, фільтрують і сушать, у відділяють водну фазу, додають 5,258г результаті чого одержують 5,41г (вихід: 615) ці(41,6ммоль) диметилсульфату, і отриману суміш льової сполуки у вигляді білої твердої речовини. розмішують при кімнатній температурі протягом Точка плавлення >240°С. приблизно 12 годин. Додатково додають 33,4мл Стадія в: Одержання 4,6-дихлор-5-(2(166ммоль) 5,0Μ розчину гідроокису натрію і 2,63г фторфеніл)-2-метилтіопіримідину (20,8ммоль) диметилсульфату, і отриману суміш До суспензії 0,75г (2,97ммоль) 4,6-дигідроксирозмішують протягом подальших 2 годин. Отри5-(2-фторфеніл)-2-метилтіо-піримідину в 7,5мл ману суспензію фільтрують, фільтрат підкисляють (80,5ммоль) фосфорного оксихлориду при кімнатдо значення рН1 шляхом додавання концентрованій температурі в атмосфері азоту додають 1,24мл ної хлористоводневої кислоти, і розмішують протя(6,54ммоль) три-н-пропіламіну. Реакційну суміш гом 30 хвилин. Суспензію фільтрують, отриману нагрівають при температурі флегми протягом 18 білу тверду речовину промивають спочатку водою годин, охолоджують до кімнатної температури і і потім гексаном, і сушать у вакуумі приблизно згущають у вакуумі. Отриманий темно-коричневий протягом 12 годин. Одержують 2,57г (вихід: 22%) залишок розчиняють у невеликій кількості ацетоніцільової сполуки у вигляді білої твердої речовини. трилу, і при розмішуванні додають до 75мл води. Стадія б: Одержання 4,6-дихлор-5-(2-хлор-6Потім додають 75мл етилацетату, і отриману двофторфеніл)-2-метилтіопіримідину фазну суміш розмішують інтенсивно протягом гоДо суспензії 2,57г (8,96ммоль) 4,6-дигідроксидини. Органічну фазу відділяють, промивають раз 5-(2-хлор-6-фторфеніл)-2-метилтіопіримідину в 75мл 2Μ водної хлористоводневої кислоти, двічі 25,7мл (276ммоль) фосфорного оксихлориду при насиченим водним розчином бікарбонату натрію, кімнатній температурі в атмосфері азоту додають кожного разу використовуючи 75мл, і раз 75мл 3,75мл (19,72ммоль) три-н-пропіламіну. Реакційну насиченого соляного розчину. Після сушіння над суміш нагрівають зі зворотним холодильником при сульфатом магнію органічну фазу згущають у ватемпературі 140°С впродовж 40 годин, охолоджукуумі, і одержують ясно-коричневе масло. Сирий ють до кімнатної температури, і потім згущають у продукт піддають хроматографії на силікагелі з вакуумі з одержанням чорного масла. Сирий провикористанням як елюенту суміші гексану і етиладукт розподіляють між 250мл етилацетату і 250мл цетату в об'ємному співвідношенні 98:2, і одержуводи, і отриману біфазну суміш розмішують інтенють 0,74г (вихід: 86%) цільової сполуки у вигляді сивно протягом 15 хвилин. Органічну фазу віддібезбарвних кристалів. ляють, промивають двічі 2М водною хлористоводСтадія г: Одержання 4-хлор-6-(Nневою кислотою, кожного разу використовуючи циклопентил)аміно-5-(2-фторфеніл)-2250мл, двічі насиченим розчином бікарбонату наметилтіопіримідину трію, кожного разу використовуючи також 250мл, і До розчину 0,74г (256ммоль) 4,6-дихлор-5-(2раз 250мл насиченого соляного розчину. Після фторфеніл)-2-метилтіопіримідину в 1мл метиленсушіння над сульфатом магнію органічну фазу хлориду при кімнатній температурі в атмосфері згущають у вакуумі з одержанням 2,3г (вихід: 79%) азоту додають 1,01мл (10,24ммоль) циклопентицільової сполуки у вигляді темно-коричневої тверламіну,і реакційну суміш розмішують при кімнатній дої речовини. температурі протягом 15 годин. Потім розбавляПриклади 47-49: Таблиця III (отримані аналогіють шляхом додавання 75мл суміші простого діечно до прикладів №40-46) тилового ефіру і етилацетату в об'ємному співвідТаблиця ІІІ ношенні 1:1, промивають двічі 1Μ водною хлористоводневою кислотою, кожного разу використовуючи 75мл, раз 75мл насиченого водного розчину бікарбонату натрію і раз 75мл насиченого соляного розчину, сушать над сульфатом магнію і згущають у вакуумі до одержання безбарвного сиропу. Сирий продукт піддають хроматографії на силікагелі з використанням як елюенту суміші гексану і етилацетату в об'ємному співвідношенні 95: 5. Одержують 0,87г (вихід: 100%) цільової сполуки у вигляді білої кристалічної твердої речовини. Точка плавлення: 81-83°С. Приклад 46 Одержання проміжної сполуки 4,6-дихлор-5(2~хлор-6-фторфеніл)-2-метилтіопіримідин Стадія а: Одержання 4,6-дигідрокси-5-(2-хлорБіологічні дослідження 5-фторфеніл)-2-метилтіопіримідину А Визначення мінімальної інгібувальної концеСуміш 12,01г (41,6ммоль) діетил(2-хлор-бнтрації досліджуваних сполук у серійному досліді фторфеніл)малонату, 3,8г (49,92ммоль) тіосечорозведення на Pyricularia Oryzae вини і 19,82мл (83,2ммоль) трибутиламіну розмі 27 74584 28 Шкала оцінки Значення МІК (мінімальної інгібувальної концентрації), яка вказує мінімальну концентрацію Оцінка % інгібування активної речовини в живильному середовищі, що 0 0 повністю інгібує ріст міцелію, визначають за допо1 1-14 2 15-29 могою серійних дослідів розведення з використан3 30-44 ням мікротирових пластинок, обладнаних 24 або 4 45-59 48 заглибленнями на пластину. Розведення дослі5 60-74 джуваних сполук у живильному середовищі і роз6 75-89 поділ на заглиблення здійснюють за допомогою 7 90-95 8 96-99 процесора зразків типу TECAN RSP 5000 Robotic 9 100 Sample Processor. Використовують наступні концентрації досліджуваних сполук: 0,05; 0,10; 0,20; Досліджувані хвороби 0,39; 0,78; 1,56; 3,13; 6,25; 12,50; 25,00; 50,00 і 100,00мг/мл. Для одержання живильного середоПознаХвороба Хвороботворний організм чення вища 333мл овочевого соку V8 змішують з 4,95г AS парша яблуні Venturis inaequalis карбонату кальцію, центрифугують, 200мл надоRB пірикуляриоз Pyricularia grisea sp. Oryzae садової рідини розводять 800мл води і розміщанесправжня мучниста GDM ють в автоклаві при температурі 121°С впродовж роса винограду Uniclnula necator 30 хвилин. Таблиця V Інокулят Pyricularia Oryzae додають в заглиблення у вигляді суспензії спор в кількості 50мл Приклад № AS RB GDM (5 105/мл) або пластинок агару (6мм) культури 2 0 0 0 гриба на агарі. 3 7 5 7 4 5 3 3 Після інкубації при температурі 18-25°С 5 9 4 0 впродовж 6-12 днів визначають значення МІК 6 9 6 3 шляхом візуальної оцінки пластинок, див. таблицю IV. В Дослідження фунгіцидної активності in vitro проти Rhizoctonia solani Таблиця IV Досліджувані сполуки розчиняють в ацетоні до Приклад № МІК [мг/мл] концентрації 10 частин на мільйон, і їх подають в 3 3,13 окремі заглиблення (пластинки з 24 заглиблення4 >100 ми фірми Corning), у які заздалегідь подавали су5 25 спензію подрібненої грибкового міцелію в живиль6 6,25 7 100 ному середовищі з певним хімічним складом. Після інкубації протягом 3-7 днів інгібування росту Б Дослідження фунгіцидної активності досліміцелію оцінюють на основі нижченаведеної шкаджуваних сполук in vivo ли. Отримані результати приведені в таблиці VI. Досліджувані сполуки розчиняють в ацетоні і Шкала оцінки розбавляють деіонізованою водою (95 частин води на 5 частин ацетону), що містить 0,05 TWEEN 20®, Оцінка Ступінь інгібування що представляє собою поверхнево-активну речо0 відсутня вину на основі сорбітанового монолаурата поліок3 незначне інгібування сіетилену, вироблену фірмою Atlas Chemical 5 помірна 7 значна Industries, до концентрації 200 частин на мільйон. 9 повна Рослини обприскують розчинами досліджуваних сполук, їх сушать і заражають грибами пізніше Таблиця VI в той же самий день. Після досягнення оптимального розвитку симптомів захворювань рослини Rhizoctonia solani Приклад № оцінюють стосовно інгібування хвороби за нижче(гниль листкових піхв рису) поданою шкалою оцінки. У кожен дослід входять 1 7 4 7 заражені оброблені рослини, заражені необробле5 0 ні рослини і заражені рослини, оброблені порівня6 0 льними фунгіцидами. Отримані результати наве7 0 дені в таблиці V. 8 7 Комп’ютерна верстка Т. Чепелева Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюFungicide 5-phenylsubstituted 2-(cyanoamino)pyrimidines, a method for producing thereof and intermediary compounds
Автори англійськоюPfrengle Waldemar
Назва патенту російськоюФунгицидные 5-фенилзамещенные 2-(цианоамино)пиримидины, способ их получения и промежуточные соединения
Автори російськоюПфренгле Вальдемар
МПК / Мітки
МПК: C07D 239/48, C07D 401/04, A01N 43/54, A01P 3/00
Мітки: спосіб, 2-(ціаноаміно)піримідини, сполуки, фунгіцидні, одержання, 5-фенілзаміщені, проміжні
Код посилання
<a href="https://ua.patents.su/14-74584-fungicidni-5-fenilzamishheni-2-cianoaminopirimidini-sposib-kh-oderzhannya-ta-promizhni-spoluki.html" target="_blank" rel="follow" title="База патентів України">Фунгіцидні 5-фенілзаміщені 2-(ціаноаміно)піримідини, спосіб їх одержання та проміжні сполуки</a>
Попередній патент: Похідні піридин-2,6-дикарбонової кислоти як індуктори g-інтерферону
Наступний патент: Модуль профілезгинального стана
Випадковий патент: Гіротеодоліт