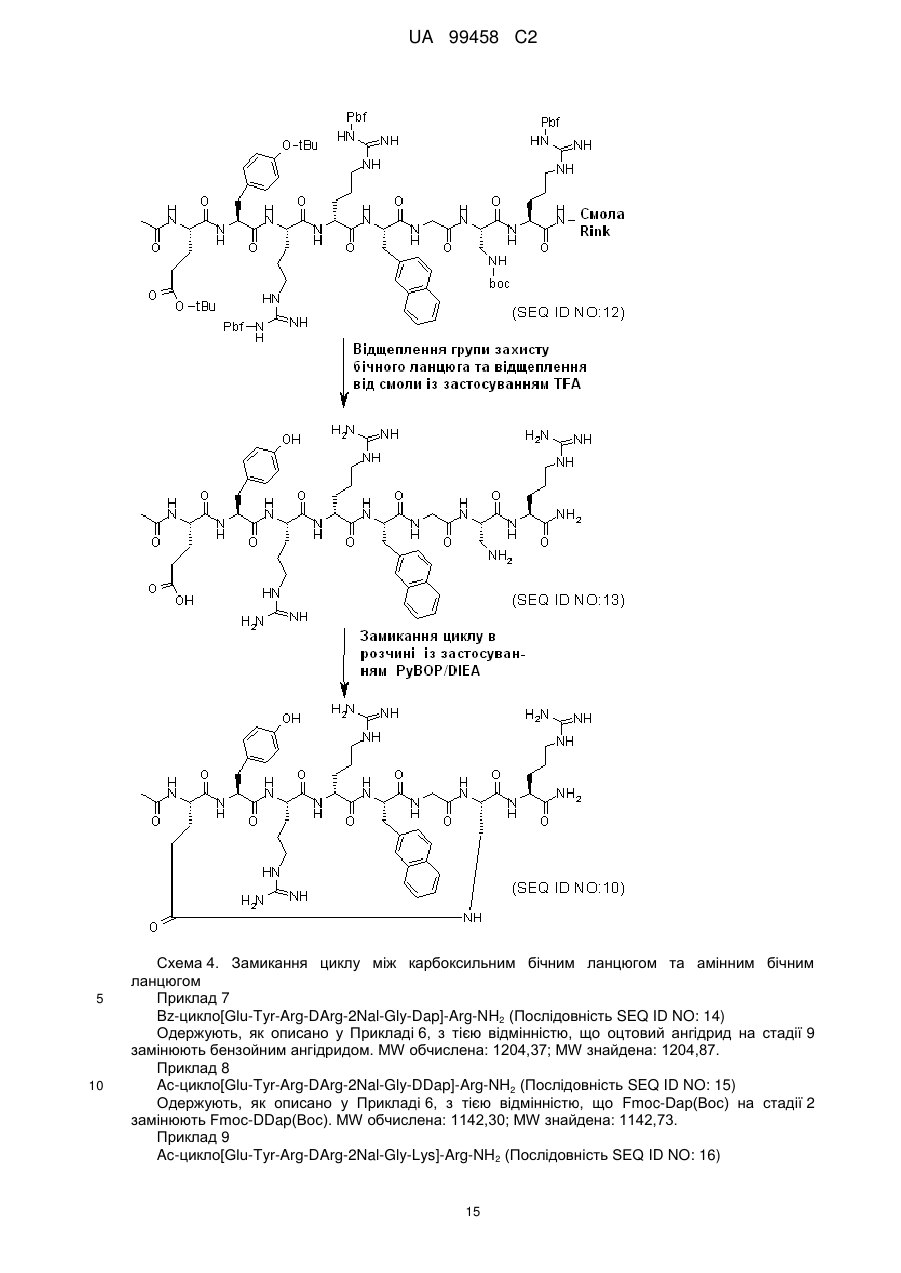
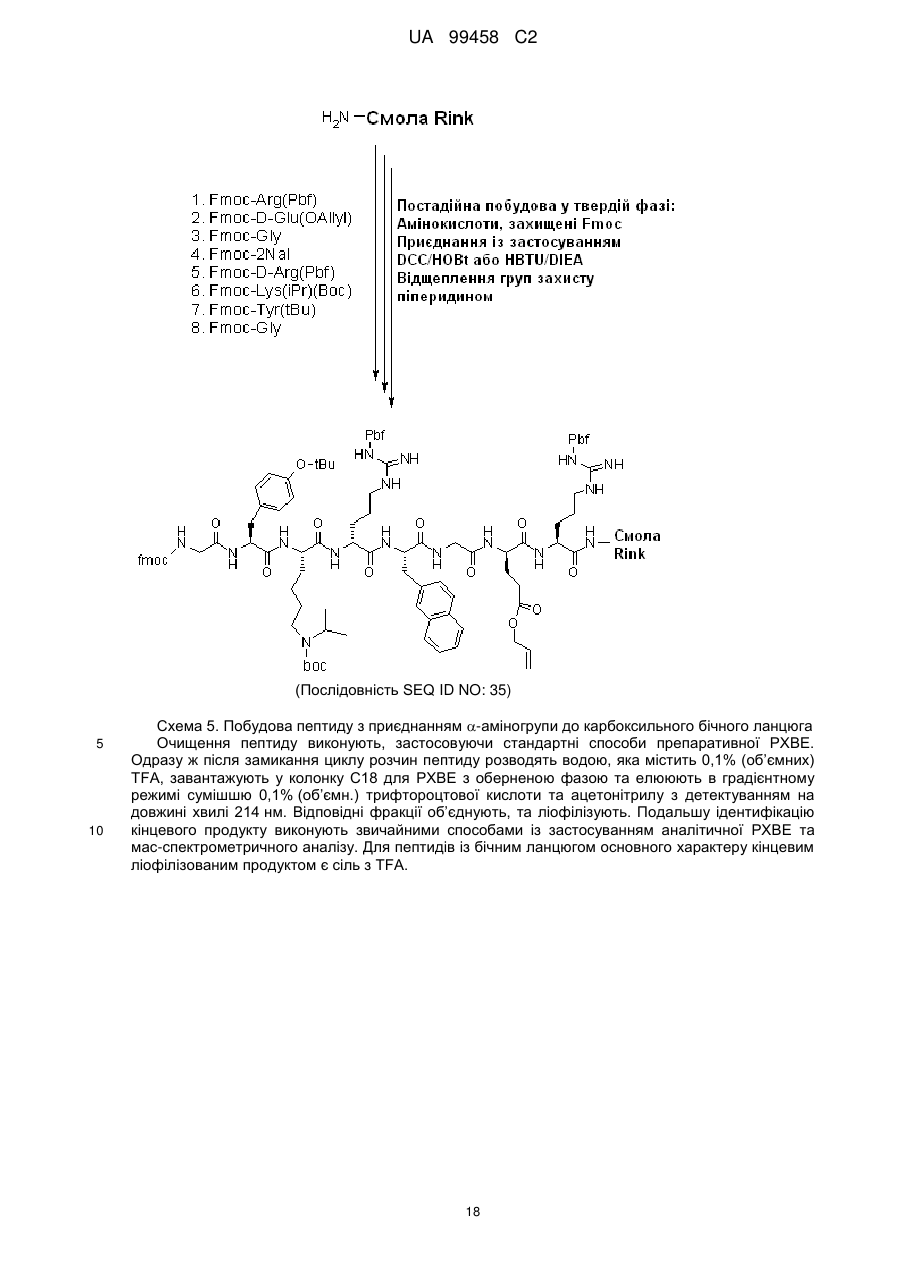
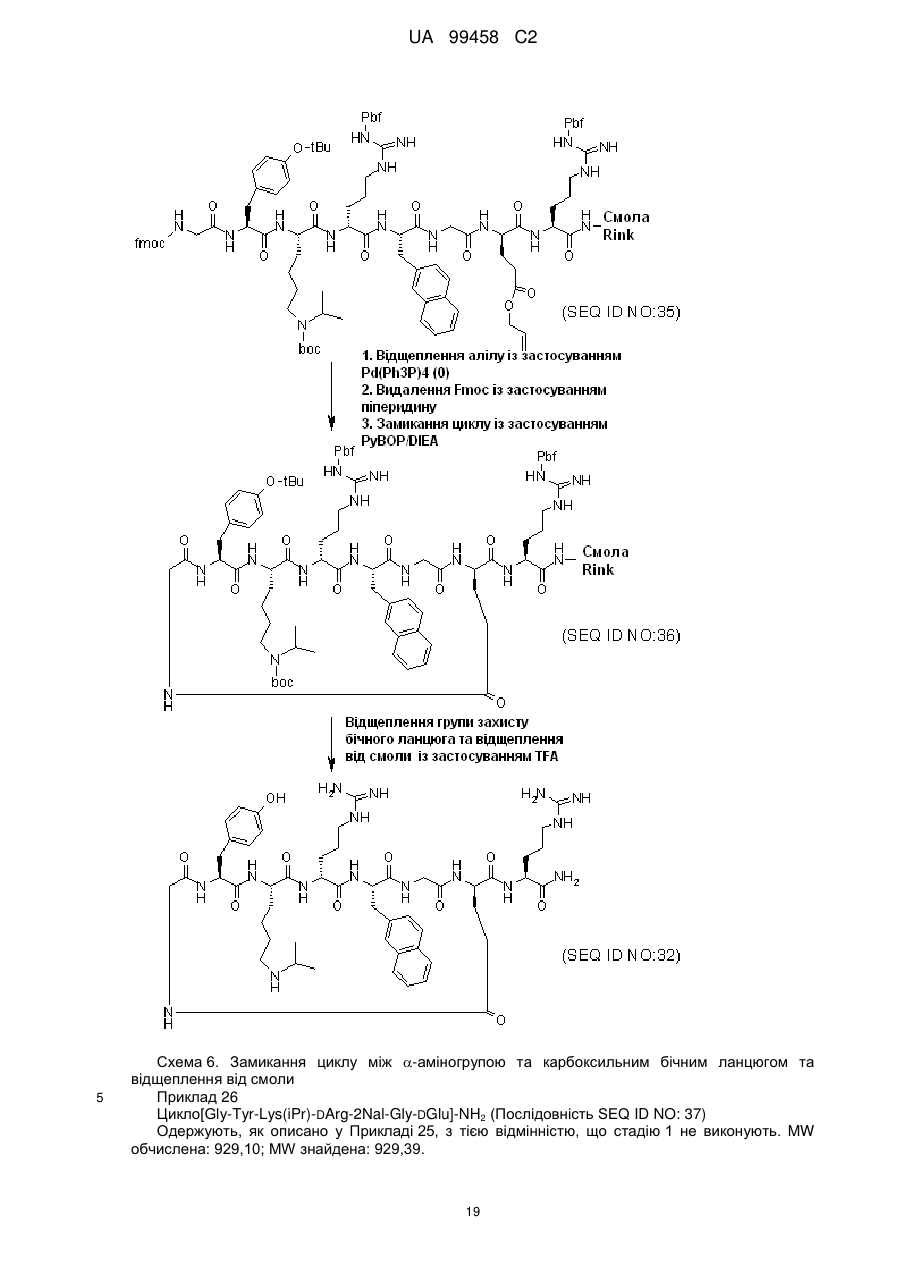
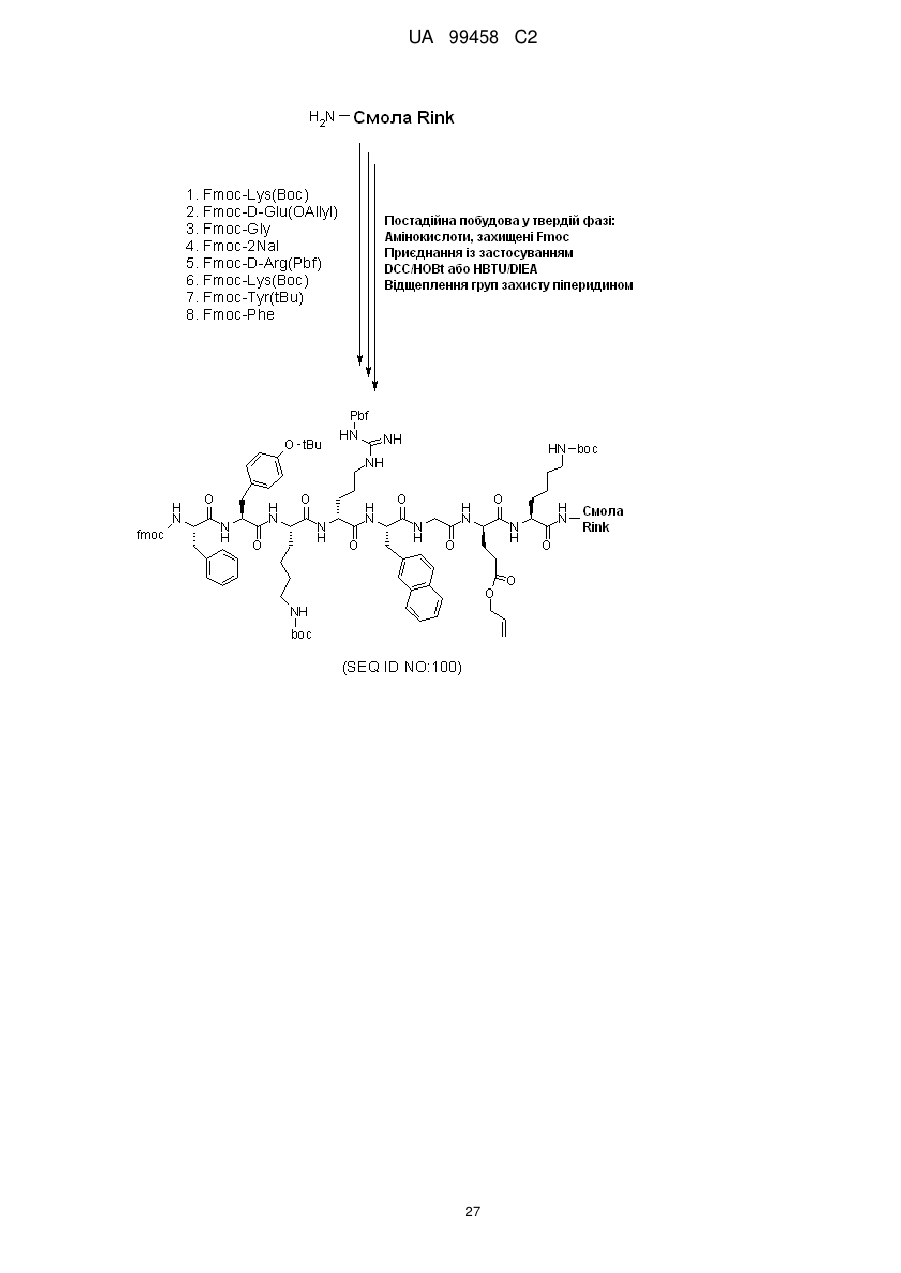
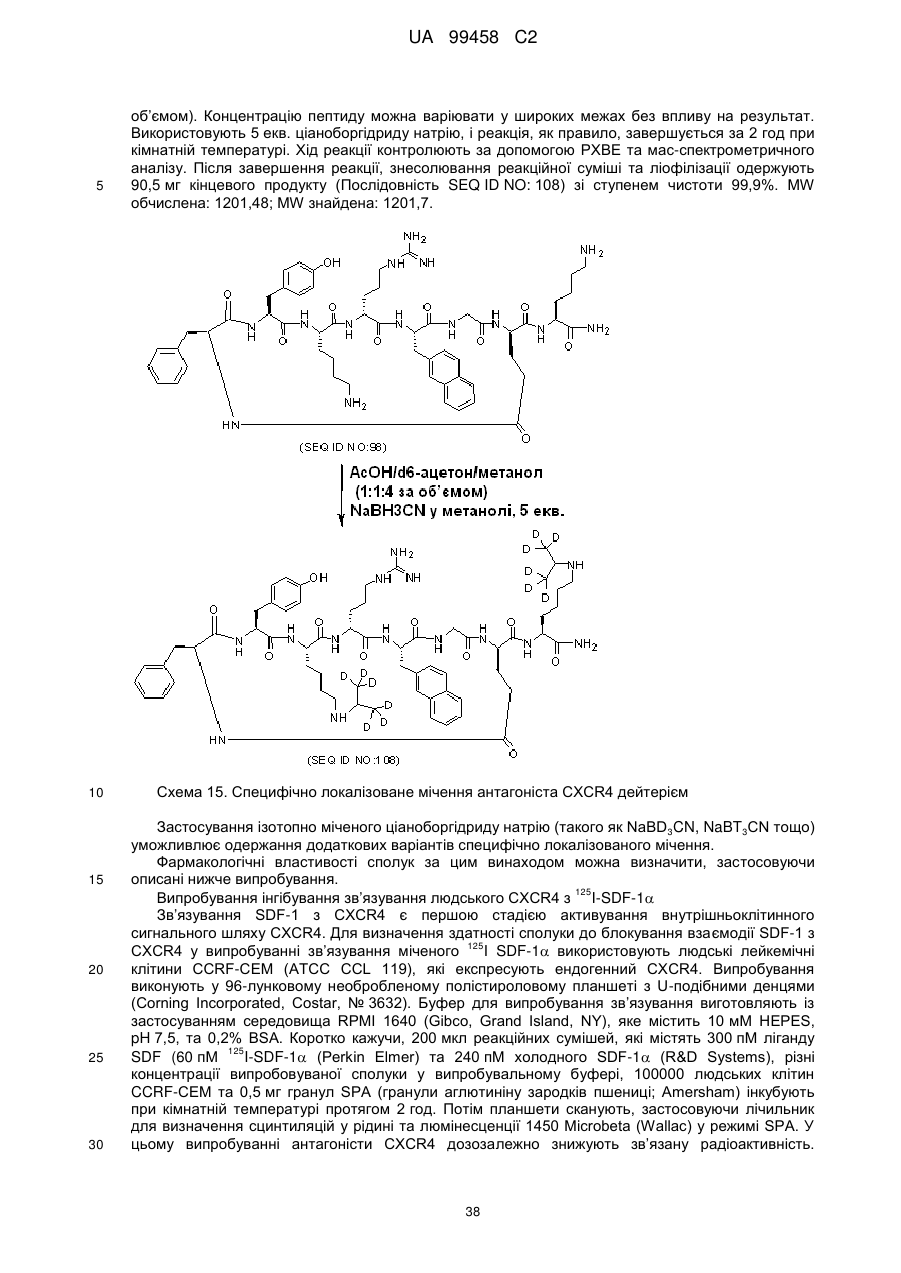
Циклопептидні антагоністи cxcr4
Формула / Реферат
1. Циклізований лактамом пептид формули І:
R1-циклo[X1-Tyr-X3-DArg-2Nal-Gly-X7]-X8-X9-X10-R2,
(І)
(Послідовність SEQ ID NO: 1)
де
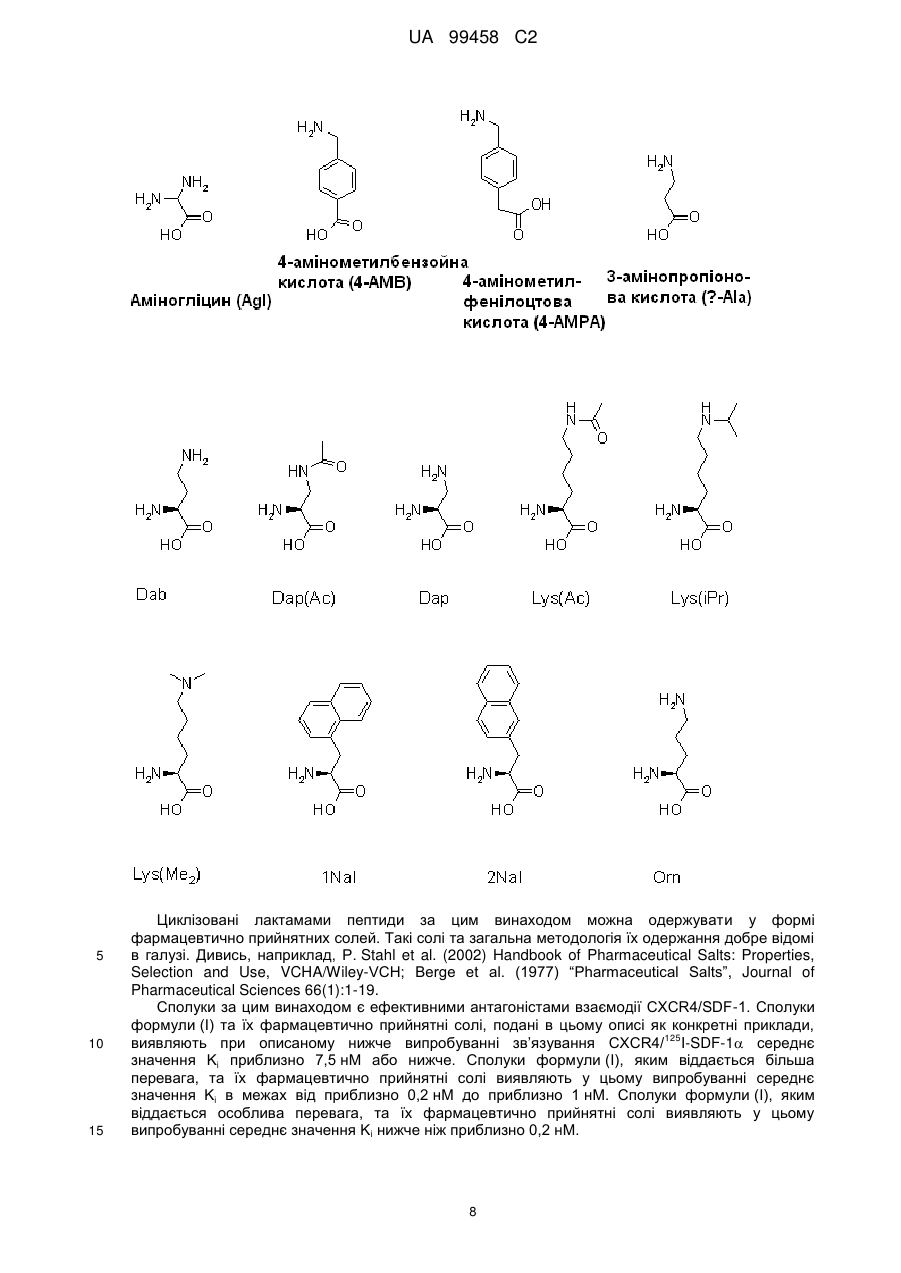
a) згаданий лактам утворений амідним зв'язком між аміногрупою бічного ланцюга Х1 та карбоксильною групою бічного ланцюга Х7, де X1 та Х7 є відповідно парою, вибраною з групи, до якої входять (D/L)Agl/Glu, Dab/Glu та Dap/Glu, та R1 є Ас або н-гексаноїл; або
b) згаданий лактам утворений амідним зв'язком між карбоксильною групою бічного ланцюга X1 та аміногрупою бічного ланцюга Х7, де Х1 та Х7 є відповідно парою, вибраною з групи, до якої входять Asp/(D/L)Agl, Asp/Dab, Asp/Dap, Glu/(D/L)Agl, Glu/Dab, Glu/Dap, Glu/DDap та Glu/Lys, та R1 є Ac або Bz, або де Х1 та X7 є відповідно парою, вибраною з групи, до якої входять cyкциніл/(D/L)Agl, сукциніл/Dab, сукциніл/Dap, сукциніл/Lys та сукциніл/Orn, та R1 є відсутнім; або
c) згаданий лактам утворений амідним зв'язком між a-аміногрупою Х1 та карбоксильною групою бічного ланцюга Х7, де Х1 та Х7 є відповідно парою, вибраною з групи, до якої входять Ala/Glu, Ala/DGlu, DAla/Glu, DAla/DGlu, Dap(Ac)/Glu, Gly/Asp, Gly/Glu, Gly/DGlu, Leu/Glu, Leu/DGlu, Lys/DGlu, Lys(Ac)/Glu, 2Nal/Glu, Phe/Glu, Phe/DGlu, DPhe/Glu та DPhe/DGlu, та R1 відсутній; або
d) згаданий лактам утворений амідним зв'язком між аміногрупою небічного ланцюга X1 в положенні, відмінному від a, та карбоксильною групою бічного ланцюга Х7, де Х1 та Х7 є відповідно парою, вибраною з групи, до якої входять b-Ala/Asp, b-Ala/Glu, 5-аміновалерил/Аsр, 5-аміновалерил/Glu, 4-AMB/Glu, 4-AMPA/Asp та 4-AMPA/Glu, та R1 відсутній; або
e) згаданий лактам утворений амідним зв'язком між a-аміногрупою Х2 та карбоксильною групою бічного ланцюга Х7, де Х2 та Х7 є відповідно парою, вибраною з групи, до якої входять Туr/Asp, Tyr/Glu та Tyr/DGlu, та кожний з R1 та X1 є відсутнім;
R1 - замісник при a-аміногрупі Х1, якщо Х1 містить a-аміногрупу, та згадана a-аміногрупа не є складовою частиною згаданого лактамового амідного зв'язку, вибраний з групи, до якої входять Ac, Bz та н-гексаноїл, або є відсутнім, причому X1 вибраний з групи, до якої входять (D/L)Agl, Asp, Dab, Dap та Glu;
X1 вибраний з групи, до якої входять (D/L)Agl, Ala, b-Ala, DAla, 5-аміновалерил, 4-AMB, 4-AMPA, Asp, Dab, Dap, Dap(Ac), Glu, Gly, Leu, Lys, Lys(Ac), 2Nal, Phe, DPhe та сукциніл, або є відсутнім;
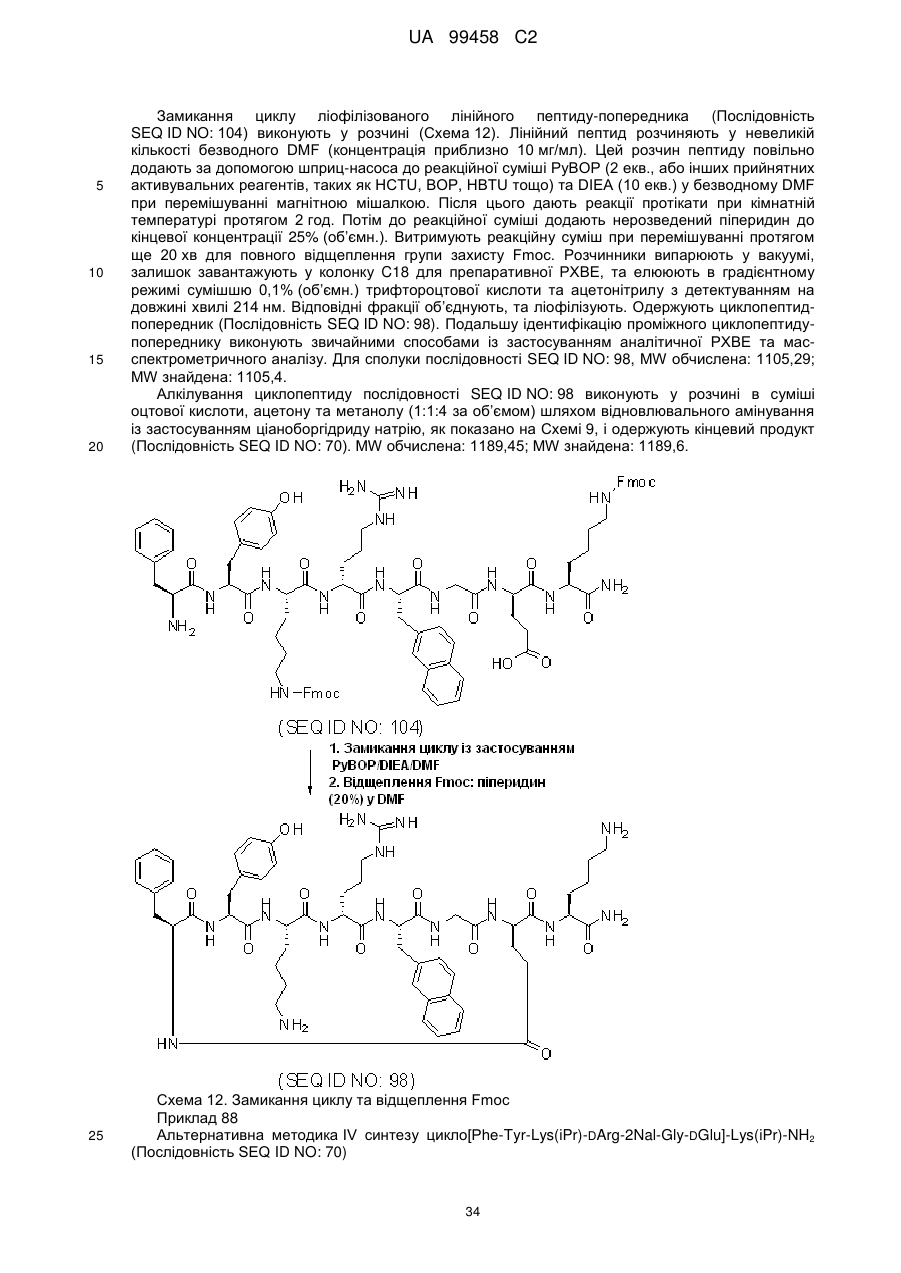
Х3 вибраний з групи, до якої входять Arg, Lys, Lys(iPr) та Lys(Me2);
Х7 вибраний з групи, до якої входять (D/L)Agl, Asp, Dab, Dap, DDap, Glu, DGlu, Lys та Orn;
X8 вибраний з групи, до якої входять b-Ala, Arg, DArg, Gly, Lys, Lys(iPr) та Orn, або є відсутнім;
Х9 вибраний з групи, до якої входять Gly, 2Nal, D2Nal та DPhe, або є відсутнім;
Х10 є 2Nal, або є відсутнім;
причому, якщо Х8 відсутній, то кожний з Х9 та Х10 є відсутнім, та, якщо Х9 відсутній, то Х10 є відсутнім, та
R2 вибраний з групи, до якої входять NH2 та NHEt, або фармацевтично прийнятна сіль такого пептиду.
2. Циклізований лактамом пептид або його фармацевтично прийнятна сіль за п. 1, де
R1 вибраний з групи, до якої входять Ас та Bz, або є відсутнім;
Х1 вибраний з групи, до якої входять b-Ala, 4-AMB, 4-AMPA, Asp, Dab, Dap, Dap(Ac), Glu, 2Nal, Phe та сукциніл, або є відсутнім;
Х3 вибраний з групи, до якої входять Arg, Lys, Lys(iPr) та Lys(Me2);
Х7 вибраний з групи, до якої входять Asp, Dab, Dap, Glu, DGlu, Lys та Orn;
X8 вибраний з групи, до якої входять Arg та Lys, або є відсутнім;
Х9 відсутній;
Х10 відсутній; та
R2 вибраний з групи, до якої входять NH2 та NHEt.
3. Циклізований лактамом пептид або його фармацевтично прийнятна сіль за п. 1, де
R1 вибраний з групи, до якої входять Ас та Bz, або є відсутнім;
X1 вибраний з групи, до якої входять DAla, 5-аміновалерил, 4-АМРА, Asp, Glu, Leu, Lys(Ac), Phe, DPhe та сукциніл;
X3 вибраний з групи, до якої входять Arg, Lys, Lys(iPr) та Lys(Me2);
Х7 вибраний з групи, до якої входять (D/L)Agl, Asp, Dab, Dap, DDap, Glu та DGlu;
X8 вибраний з групи, до якої входять Arg, DArg та Lys, або є відсутнім;
Х9 відсутній;
X10 відсутній; та
R2 вибраний з групи, до якої входять NH2 та NHEt.
4. Циклізований лактамом пептид або його фармацевтично прийнятна сіль за п. 1, де
R1 вибраний з групи, до якої входять Ac, Bz та н-гексаноїл, або є відсутнім;
X1 вибраний з групи, до якої входять (D/L)Agl, Ala, β-Ala, Asp, Dap, Glu, Gly, Lys та Phe;
Х3 вибраний з групи, до якої входять Arg, Lys, Lys(iPr) та Lys(Me2);
Х7 вибраний з групи, до якої входять (D/L)Agl, Asp, Dap, Glu та DGlu;
X8 вибраний з групи, до якої входять b-Ala, Arg, Gly, Lys, Lys(iPr) та Orn, або є відсутнім;
Х9 вибраний з групи, до якої входять Gly, 2Nal, D2Nal та DPhe, або є відсутнім;
X10 - 2Nal або є відсутнім; та
R2 вибраний з групи, до якої входять NH2 та NHEt.
5. Циклізований лактамом пептид або його фармацевтично прийнятна сіль за п. 1, де
R1 вибраний з групи, до якої входять Ас та Bz, або є відсутнім;
X1 вибраний з групи, до якої входять Ala, 5-аміновалерил, Asp, Glu, Gly, Phe, DPhe та сукциніл;
Х3 вибраний з групи, до якої входять Arg, Lys(iPr) та Lys(Me2);
Х7 вибраний з групи, до якої входять (D/L)Agl, Asp, Dap, Glu та DGlu;
X8 вибраний з групи, до якої входять b-Ala, Arg, Gly, Lys, Lys(iPr) та Orn, або є відсутнім;
Х9 вибраний з групи, до якої входять Gly, D2Nal та DPhe, або є відсутнім;
Х10 - 2Nal або є відсутнім; та
R2 вибраний з групи, до якої входять NH2 та NHEt.
6. Циклізований лактамом пептид або його фармацевтично прийнятна сіль за п. 1, п. 4 або п. 5, де
X1 вибраний з групи, до якої входять Gly та Phe;
Х3 - Lys(iPr); та
Х7 - DGlu.
7. Циклізований лактамом пептид або його фармацевтично прийнятна сіль за п. 5, де
R1 відсутній;
Х1 вибраний з групи, до якої входять Gly та Phe;
Х3 - Lys(iPr);
Х7 - DGlu;
Х8 вибраний з групи, до якої входять Arg та Lys(iPr), або є відсутнім;
Х9 відсутній;
Х10 відсутній; та
R2 вибраний з групи, до якої входять NH2 та NHEt.
8. Циклізований лактамом пептид формули:
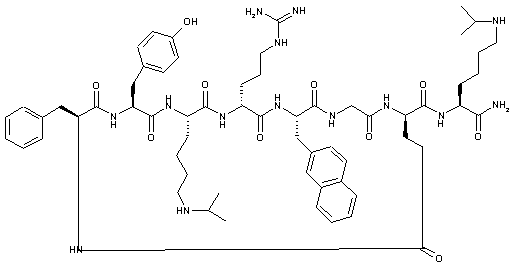
(Послідовність SEQ ID NO: 70)
або його фармацевтично прийнятна сіль.
9. Циклізований лактамом пептид за п. 8, де згадана фармацевтично прийнятна сіль є сіллю з оцтовою кислотою.
10. Фармацевтична композиція, яка містить циклізований лактамом пептид або його фармацевтично прийнятну сіль за будь-яким із пп. 1-9 та фармацевтично прийнятний носій, розріджувач або наповнювач.
11. Циклізований лактамом пептид або його фармацевтично прийнятна сіль за будь-яким із пп. 1-9 для застосування у терапії.
12. Циклізований лактамом пептид або його фармацевтично прийнятна сіль за будь-яким із пп. 1-9 для лікування ревматоїдного артриту, фіброзу легенів, ВІЛ-інфекції або раку, вибраного з групи, до якої входять рак молочної залози, рак підшлункової залози, меланома, рак передміхурової залози, рак нирки, нейробластома, неходжкінська лімфома, рак легенів, рак яєчників, рак ободової та прямої кишки, множинна мієлома, поліморфна гліобластома та хронічний лімфолейкоз.
13. Застосування циклізованого лактамом пептиду або його фармацевтично прийнятної солі за будь-яким із пп. 1-9 для виготовлення лікарського засобу для лікування ревматоїдного артриту, фіброзу легенів, ВІЛ-інфекції або раку, вибраного з групи, до якої входять рак молочної залози, рак підшлункової залози, меланома, рак передміхурової залози, рак нирки, нейробластома, неходжкінська лімфома, рак легенів, рак яєчників, рак ободової та прямої кишки, множинна мієлома, поліморфна гліобластома та хронічний лімфолейкоз.
Текст
Реферат: Винахід стосується циклізованих лактамом пептидних антагоністів CXCR4, які є корисними при лікуванні раку, ревматоїдного артриту, фіброзу легенів та ВІЛ-інфекції. UA 99458 C2 5 10 15 20 25 30 35 40 45 50 55 60 Цей винахід стосується нових циклопептидних сполук – антагоністів CXCR4 та їх застосування при лікуванні розладів, патогенез яких опосередкований CXCR4 та SDF-1. CXCR4 – рецептор, сполучений з G-протеїном, та його ліганд, що зустрічається в природі, – фактор-1, що походить від клітин строми (SDF-1; CXCL12), складають пару рецептор-ліганд хемокіну. CXCR4 конститутивно або надлишково експресується у різноманітних людських ракових пухлинах. SDF-1, єдиний відомий ліганд CXCR4, має високий ступінь експресії у мікромасштабному оточенні пухлин, так само як і у кістковому мозку, легенях, печінці та лімфатичних вузлах, тобто в органах, які найчастіше охоплюються метастазами пухлин. Взаємодія CXCR4/SDF-1 відіграє значну роль у багатьох стадіях онкогенезу, в тому числі при рості пухлини, інвазії, ангіогенезі та метастазуванні, а також при ревматоїдному артриті, фіброзі легенів та ВІЛ-інфекції (Tsutsumi et al. (2006) Peptide Science 88(2):279-289). З урахуванням участі CXCR4/SDF-1 у цих серйозних розладах CXCR4 є терапевтичною мішенню, яка становить інтерес. AMD3100, біцикламовий антагоніст CXCR4, на даний час знаходиться на III стадії клінічних випробувань як засіб мобілізації стовбурових клітин для трансплантації стовбурових клітин пацієнтам із множинною мієломою та неходжкінською лімфомою. AMD070, інший низькомолекулярний антагоніст CXCR4, на даний час знаходиться на стадії II клінічних випробувань для лікування ВІЛ-інфекції. CTCE9908, двовалентний (димерний) пептидний антагоніст CXCR4, на даний час знаходиться на стадії Ib/II клінічних випробувань для лікування 125 раку. FC131, циклічний пентапептидний антагоніст CXCR4, інгібує зв’язування I-SDF-1 з трансфектантами CXCR4 з IC50 4 нM (Fujii et al. (2003) Angew. Chem. Int. Ed. 42:3251-3253; Araki et al. (2003) Peptide Science. The Japanese Peptide Society (2004):207-210). Існує потреба у вдосконалених антагоністах CXCR4, які, будучи ефективними та селективними, виявляють низьку активність або взагалі не виявляють активності щодо інших рецепторів хемокінів. Сполуки за цим винаходом є такими ефективними та селективними антагоністами CXCR4. Їхня висока ефективність уможливлює застосування низьких доз у терапевтичних схемах, в той час як висока селективність зводить до мінімуму негативні побічні ефекти, пов’язані з нецільовою дією. Крім того, сполуки, розкриті у цьому описі, мають інші надзвичайно бажані фармацевтичні властивості, такі як висока біодоступність при підшкірному введенні, висока стійкість до метаболізму in vivo та фармакокінетичні/фармакодинамічні властивості, що забезпечують зручність дозування. Відповідно, за першим аспектом цей винахід пропонує циклізований лактамом пептид формули I: R1-цикло[X1-Tyr-X3-DArg-2Nal-Gly-X7]-X8-X9-X10-R2, (I) (Послідовність SEQ ID NO: 1) де a) згаданий лактам утворений амідним зв’язком між аміногрупою бічного ланцюга X1 та карбоксильною групою бічного ланцюга X 7, де X1 та X7 є відповідно парою, вибраною з групи, до якої входять (D/L)Agl/Glu, Dab/Glu та Dap/Glu, та R 1 є Ac або н-гексаноїл; або b) згаданий лактам утворений амідним зв’язком між карбоксильною групою бічного ланцюга X1 та аміногрупою бічного ланцюга X7, де X1 та X7 є відповідно парою, вибраною з групи, до якої входять Asp/(D/L)Agl, Asp/Dab, Asp/Dap, Glu/(D/L)Agl, Glu/Dab, Glu/Dap, Glu/DDap та Glu/Lys, та R1 є Ac або Bz, або де X1 та X7 є відповідно парою, вибраною з групи, до якої входять сукциніл/(D/L)Agl, сукциніл/Dab, сукциніл/Dap, сукциніл/Lys та сукциніл/Orn, та R 1 відсутній; або c) згаданий лактам утворений амідним зв’язком між -аміногрупою X1 та карбоксильною групою бічного ланцюга X7, де X1 та X7 є відповідно парою, вибраною з групи, до якої входять Ala/Glu, Ala/DGlu, DAla/Glu, DAla/DGlu, Dap(Ac)/Glu, Gly/Asp, Gly/Glu, Gly/DGlu, Leu/Glu, Leu/DGlu, Lys/DGlu, Lys(Ac)/Glu, 2Nal/Glu, Phe/Glu, Phe/DGlu, DPhe/Glu та DPhe/DGlu, та R1 відсутній; або d) згаданий лактам утворений амідним зв’язком між аміногрупою небічного ланцюга X1 в положенні, відмінному від , та карбоксильною групою бічного ланцюга X7, де X1 та X7 є відповідно парою, вибраною з групи, до якої входять -Ala/Asp, -Ala/Glu, 5-аміновалерил/Asp, 5-аміновалерил/Glu, 4-AMB/Glu, 4-AMPA/Asp та 4-AMPA/Glu, та R1 відсутній; або e) згаданий лактам утворений амідним зв’язком між -аміногрупою X2 та карбоксильною групою бічного ланцюга X7, де X2 та X7 є відповідно парою, вибраною з групи, до якої входять Tyr/Asp, Tyr/Glu та Tyr/DGlu, та кожний з R1 та X1 є відсутнім; R1 – замісник при -аміногрупі X1, якщо X1 містить -аміногрупу, та згадана -аміногрупа не є складовою частиною згаданого лактамового амідного зв’язку, вибраний з групи, до якої входять Ac, Bz та н-гексаноїл, або є відсутнім,причому X1 вибраний з групи, до якої входять (D/L)Agl, Asp, Dab, Dap та Glu; 1 UA 99458 C2 5 10 15 20 25 30 35 40 45 50 55 60 X1 вибраний з групи, до якої входять (D/L)Agl, Ala, -Ala, DAla, 5-аміновалерил, 4-AMB, 4AMPA, Asp, Dab, Dap, Dap(Ac), Glu, Gly, Leu, Lys, Lys(Ac), 2Nal, Phe, DPhe та сукциніл, або є відсутнім; X3 вибраний з групи, до якої входять Arg, Lys, Lys(iPr) та Lys(Me2); X7 вибраний з групи, до якої входять (D/L)Agl, Asp, Dab, Dap, DDap, Glu, DGlu, Lys та Orn; X8 вибраний з групи, до якої входять -Ala, Arg, DArg, Gly, Lys, Lys(iPr) та Orn, або є відсутнім; X9 вибраний з групи, до якої входять Gly, 2Nal, D2Nal та DPhe, або відсутній; X10 – 2Nal або є відсутнім; причому якщо X8 відсутній, то кожний з X9 та X10 є відсутнім, та якщо X9 відсутній, то X10 є відсутнім, та R2 вибраний з групи, до якої входять NH2 та NHEt, або фармацевтично прийнятну сіль такого пептиду. Інакше кажучи, це еквівалентно циклізованому лактамом пептиду формули I: R1-цикло[X1-Tyr-X3-DArg-2Nal-Gly-X7]-X8-X9-X10-R2, (I) (Послідовність SEQ ID NO: 1) де R1 – замісник при -аміногрупі X1, якщо X1 містить -аміногрупу, та згадана -аміногрупа не є складовою частиною згаданого лактамового амідного зв’язку, вибраний з групи, до якої входять Ac, Bz та н-гексаноїл, або є відсутнім, причому X1 вибраний з групи, до якої входять (D/L)Agl, Asp, Dab, Dap та Glu; X1 вибраний з групи, до якої входять (D/L)Agl, Ala, -Ala, DAla, 5-аміновалерил, 4-AMB, 4AMPA, Asp, Dab, Dap, Dap(Ac), Glu, Gly, Leu, Lys, Lys(Ac), 2Nal, Phe, DPhe та сукциніл, або є відсутнім; X3 вибраний з групи, до якої входять Arg, Lys, Lys(iPr) та Lys(Me2); X7 вибраний з групи, до якої входять (D/L)Agl, Asp, Dab, Dap, DDap, Glu, DGlu, Lys та Orn; X8 вибраний з групи, до якої входять -Ala, Arg, DArg, Gly, Lys, Lys(iPr) та Orn, або є відсутнім; X9 вибраний з групи, до якої входять Gly, 2Nal, D2Nal та DPhe, або є відсутнім; X10 – 2Nal або є відсутнім; причому якщо X8 відсутній, то кожний з X9 та X10 є відсутнім, та якщо X9 відсутній, то X10 є відсутнім, та R2 вибраний з групи, до якої входять NH2 та NHEt, де a) згаданий лактам утворений амідним зв’язком між аміногрупою бічного ланцюга X1 та карбоксильною групою бічного ланцюга X 7, де X1 та X7 є відповідно парою, вибраною з групи, до якої входять (D/L)Agl/Glu, Dab/Glu та Dap/Glu, та R 1 є Ac або н-гексаноїл; або b) згаданий лактам утворений амідним зв’язком між карбоксильною групою бічного ланцюга X1 та аміногрупою бічного ланцюга X7, де X1 та X7 є відповідно парою, вибраною з групи, до якої входять Asp/(D/L)Agl, Asp/Dab, Asp/Dap, Glu/(D/L)Agl, Glu/Dab, Glu/Dap, Glu/DDap та Glu/Lys, та R1 є Ac або Bz, або де X1 та X7 є відповідно парою, вибраною з групи, до якої входять сукциніл/(D/L)Agl, сукциніл/Dab, сукциніл/Dap, сукциніл/Lys та сукциніл/Orn, та R 1 відсутній; або c) згаданий лактам утворений амідним зв’язком між -аміногрупою X1 та карбоксильною групою бічного ланцюга X7, де X1 та X7 є відповідно парою, вибраною з групи, до якої входять Ala/Glu, Ala/DGlu, DAla/Glu, DAla/DGlu, Dap(Ac)/Glu, Gly/Asp, Gly/Glu, Gly/DGlu, Leu/Glu, Leu/DGlu, Lys/DGlu, Lys(Ac)/Glu, 2Nal/Glu, Phe/Glu, Phe/DGlu, DPhe/Glu та DPhe/DGlu, та R1 є відсутнім; або d) згаданий лактам утворений амідним зв’язком між аміногрупою небічного ланцюга X1 в положенні, відмінному від , та карбоксильною групою бічного ланцюга X 7, де X1 та X7 є відповідно парою, вибраною з групи, до якої входять -Ala/Asp, -Ala/Glu, 5-аміновалерил/Asp, 5-аміновалерил/Glu, 4-AMB/Glu, 4-AMPA/Asp та 4-AMPA/Glu, та R1 відсутній; або e) згаданий лактам утворений амідним зв’язком між -аміногрупою X2 та карбоксильною групою бічного ланцюга X7, де X2 та X7 є відповідно парою, вибраною з групи, до якої входять Tyr/Asp, Tyr/Glu та Tyr/DGlu, та кожний з R1 та X1 є відсутнім, або фармацевтично прийнятній солі такого пептиду. За іншим аспектом цей винахід пропонує циклізований лактамом пептид формули I: R1-цикло[X1-Tyr-X3-DArg-2Nal-Gly-X7]-X8-X9-X10-R2 (I) (Послідовність SEQ ID NO: 1) або фармацевтично прийнятну сіль такого пептиду, 2 UA 99458 C2 5 10 15 20 25 30 35 40 45 50 55 де X1 вибраний з групи, до якої входять (D/L)Agl, Ala, -Ala, DAla, 5-аміновалерил, 4-AMB, 4AMPA, Asp, Dab, Dap, Dap(Ac), Glu, Gly, Leu, Lys, Lys(Ac), 2Nal, Phe, DPhe та сукциніл, або є відсутнім, причому якщо X1 – (D/L)Agl, Dab або Dap, та -аміногрупа X1 не є складовою частиною лактамового амідного зв’язку, то згадана -аміногрупа заміщена R1, який вибраний з групи, до якої входять Ac та н-гексаноїл; якщо X1 – Asp або Glu, та -аміногрупа X1 не є складовою частиною лактамового амідного зв’язку, то згадана -аміногрупа заміщена R1, який вибраний з групи, до якої входять Ac та Bz; та якщо X1 – Ala, -Ala, DAla, 5-аміновалерил, 4-AMB, 4-AMPA, Dap(Ac), Gly, Leu, Lys, Lys(Ac), 2Nal, Phe, DPhe або сукциніл, то R1 є відсутнім; X3 вибраний з групи, до якої входять Arg, Lys, Lys(iPr) та Lys(Me2); X7 вибраний з групи, до якої входять (D/L)Agl, Asp, Dab, Dap, DDap, Glu, DGlu, Lys та Orn; X8 вибраний з групи, до якої входять -Ala, Arg, DArg, Gly, Lys, Lys(iPr) та Orn, або є відсутнім; X9 вибраний з групи, до якої входять Gly, 2Nal, D2Nal та DPhe, або є відсутнім; X10 – 2Nal або є відсутнім, причому якщо X8 відсутній, то кожний з X9 та X10 є відсутнім, та якщо X9 відсутній, то X10 є відсутнім, та R2 вибраний з групи, до якої входять NH2 та NHEt, та крім того, де згаданий лактам утворений амідним зв’язком між аміногрупою бічного ланцюга X1 та карбоксильною групою бічного ланцюга X 7, де X1 та X7 є відповідно парою, вибраною з групи, до якої входять (D/L)Agl/Glu, Dab/Glu та Dap/Glu, та R 1 є Ac або н-гексаноїл; або згаданий лактам утворений амідним зв’язком між карбоксильною групою бічного ланцюга X1 та аміногрупою бічного ланцюга X7, де X1 та X7 є відповідно парою, вибраною з групи, до якої входять Asp/(D/L)Agl, Asp/Dab, Asp/Dap, Glu/(D/L)Agl, Glu/Dab, Glu/Dap, Glu/DDap та Glu/Lys, та R1 є Ac або Bz, або де X1 та X7 є відповідно парою, вибраною з групи, до якої входять сукциніл/(D/L)Agl, сукциніл/Dab, сукциніл/Dap, сукциніл/Lys та сукциніл/Orn, та R 1 є відсутнім; або згаданий лактам утворений амідним зв’язком між -аміногрупою X1 та карбоксильною групою бічного ланцюга X7, де X1 та X7 є відповідно парою, вибраною з групи, до якої входять Ala/Glu, Ala/DGlu, DAla/Glu, DAla/DGlu, Dap(Ac)/Glu, Gly/Asp, Gly/Glu, Gly/DGlu, Leu/Glu, Leu/DGlu, Lys/DGlu, Lys(Ac)/Glu, 2Nal/Glu, Phe/Glu, Phe/DGlu, DPhe/Glu та DPhe/DGlu, та R1 є відсутнім; або згаданий лактам утворений амідним зв’язком між аміногрупою небічного ланцюга X1 в положенні, відмінному від , та карбоксильною групою бічного ланцюга X 7, де X1 та X7 є відповідно парою, вибраною з групи, до якої входять -Ala/Asp, -Ala/Glu, 5-аміновалерил/Asp, 5-аміновалерил/Glu, 4-AMB/Glu, 4-AMPA/Asp та 4-AMPA/Glu, та R1 є відсутнім; або згаданий лактам утворений амідним зв’язком між -аміногрупою Tyr при X2 та карбоксильною групою бічного ланцюга X7, та X7 вибраний з групи, до якої входять Asp, Glu та DGlu, та кожний з R1 та X1 є відсутнім. Повторюваним мотивом послідовності у всіх сполуках формули I є присутність Tyr у положенні X2, DArg у положенні X4, 2Nal у положенні X5 та Gly у положенні X6. За ще одним аспектом цей винахід пропонує циклізований лактамом пептид або його фармацевтично прийнятну сіль формули I (Послідовність SEQ ID NO: 1), де R1 вибраний з групи, до якої входять Ac та Bz, або є відсутнім; X1 вибраний з групи, до якої входять -Ala, 4-AMB, 4-AMPA, Asp, Dab, Dap, Dap(Ac), Glu, 2Nal, Phe та сукциніл, або є відсутнім; X3 вибраний з групи, до якої входять Arg, Lys, Lys(iPr) та Lys(Me2); X7 вибраний з групи, до якої входять Asp, Dab, Dap, Glu, DGlu, Lys та Orn; X8 вибраний з групи, до якої входять Arg та Lys, або є відсутнім; X9 відсутній; X10 відсутній; та R2 вибраний з групи, до якої входять NH2 та NHEt. За ще одним аспектом цей винахід пропонує циклізований лактамом пептид або його фармацевтично прийнятну сіль формули I (Послідовність SEQ ID NO: 1), де R1 вибраний з групи, до якої входять Ac та Bz, або є відсутнім; X1 вибраний з групи, до якої входять DAla, 5-аміновалерил, 4-AMPA, Asp, Glu, Leu, Lys(Ac), Phe, DPhe та сукциніл; 3 UA 99458 C2 5 10 15 20 25 30 35 40 45 50 55 60 X3 вибраний з групи, до якої входять Arg, Lys, Lys(iPr) та Lys(Me2); X7 вибраний з групи, до якої входять (D/L)Agl, Asp, Dab, Dap, DDap, Glu та DGlu; X8 вибраний з групи, до якої входять Arg, DArg та Lys, або є відсутнім; X9 відсутній; X10 відсутній; та R2 вибраний з групи, до якої входять NH2 та NHEt. За ще одним аспектом цей винахід пропонує циклізований лактамом пептид або його фармацевтично прийнятну сіль формули I (Послідовність SEQ ID NO: 1), де R1 вибраний з групи, до якої входять Ac, Bz та н-гексаноїл, або є відсутнім; X1 вибраний з групи, до якої входять (D/L)Agl, Ala, -Ala, Asp, Dap, Glu, Gly, Lys та Phe; X3 вибраний з групи, до якої входять Arg, Lys, Lys(iPr) та Lys(Me2); X7 вибраний з групи, до якої входять (D/L)Agl, Asp, Dap, Glu та DGlu; X8 вибраний з групи, до якої входять -Ala, Arg, Gly, Lys, Lys(iPr) та Orn, або є відсутнім; X9 вибраний з групи, до якої входять Gly, 2Nal, D2Nal та DPhe, або є відсутнім; X10 – 2Nal або є відсутнім; та R2 вибраний з групи, до якої входять NH2 та NHEt. За ще одним аспектом цей винахід пропонує циклізований лактамом пептид або його фармацевтично прийнятну сіль формули I (Послідовність SEQ ID NO: 1), де R1 вибраний з групи, до якої входять Ac та Bz, або відсутній; X1 вибраний з групи, до якої входять Ala, 5-аміновалерил, Asp, Glu, Gly, Phe, DPhe та сукциніл; X3 вибраний з групи, до якої входять Arg, Lys(iPr) та Lys(Me2); X7 вибраний з групи, до якої входять (D/L)Agl, Asp, Dap, Glu та DGlu; X8 вибраний з групи, до якої входять -Ala, Arg, Gly, Lys, Lys(iPr) та Orn, або є відсутнім; X9 вибраний з групи, до якої входять Gly, D2Nal та DPhe, або є відсутнім; X10 – 2Nal або є відсутнім; та R2 вибраний з групи, до якої входять NH2 та NHEt. За ще одним аспектом цей винахід пропонує циклізований лактамом пептид або його фармацевтично прийнятну сіль формули I (Послідовність SEQ ID NO: 1), де X1 вибраний з групи, до якої входять Gly та Phe; X3 – Lys(iPr); та X7 – DGlu. За ще одним аспектом цей винахід пропонує циклізований лактамом пептид або його фармацевтично прийнятну сіль формули I (Послідовність SEQ ID NO: 1), де R1 відсутній; X1 вибраний з групи, до якої входять Gly та Phe; X3 – Lys(iPr); X7 – DGlu; X8 вибраний з групи, до якої входять Arg та Lys(iPr), або є відсутнім; X9 відсутній; X10 відсутній; та R2 вибраний з групи, до якої входять NH2 та NHEt. За іншим аспектом цей винахід пропонує циклізований лактамом пептид або його фармацевтично прийнятну сіль формули I (Послідовність SEQ ID NO: 1), де згаданий лактам утворений амідним зв’язком між аміногрупою бічного ланцюга X1 та карбоксильною групою бічного ланцюга X7; R1 вибраний з групи, до якої входять Ac та н-гексаноїл; X1 вибраний з групи, до якої входять (D/L)Agl, Dab та Dap; X3 вибраний з групи, до якої входять Arg та Lys(iPr); X7 – Glu; X8 – Arg; X9 відсутній; X10 відсутній; та R2 – NH2. Відповідно до варіанта цього аспекту винаходу, якому віддається перевага, X 1 є (D/L)Agl або Dap. За іншим аспектом цей винахід пропонує циклізований лактамом пептид або його фармацевтично прийнятну сіль формули I (Послідовність SEQ ID NO: 1), де згаданий лактам утворений амідним зв’язком між карбоксильною групою бічного ланцюга X 1 та аміногрупою бічного ланцюга X7; 4 UA 99458 C2 5 10 15 20 25 30 35 40 45 50 55 60 R1 вибраний з групи, до якої входять Ac та Bz; X1 вибраний з групи, до якої входять Asp та Glu; X3 вибраний з групи, до якої входять Arg та Lys(Me2); X7 вибраний з групи, до якої входять (D/L)Agl, Dab, Dap, DDap та Lys; X8 – Arg; X9 відсутній; X10 відсутній; та R2 – NH2. Відповідно до варіанта цього аспекту винаходу, якому віддається перевага, X 7 є (D/L)Agl, Dab, Dap або DDap. Відповідно до варіанта, якому віддається більша перевага, X 7 є (D/L)Agl або Dap. За іншим аспектом цей винахід пропонує циклізований лактамом пептид або його фармацевтично прийнятну сіль формули I (Послідовність SEQ ID NO: 1), де згаданий лактам утворений амідним зв’язком між карбоксильною групою бічного ланцюга X 1 та аміногрупою бічного ланцюга X7; R1 відсутній; X1 – сукциніл; X3 – Arg; X7 вибраний з групи, до якої входять (D/L)Agl, Dab, Dap, Lys та Orn; X8 – Arg; X9 відсутній; X10 відсутній; та R2 – NH2. Відповідно до варіанта цього аспекту винаходу, якому віддається перевага, X 7 є (D/L)Agl або Dap. За іншим аспектом цей винахід пропонує циклізований лактамом пептид або його фармацевтично прийнятну сіль формули I (Послідовність SEQ ID NO: 1), де згаданий лактам утворений амідним зв’язком між -аміногрупою X1 та карбоксильною групою бічного ланцюга X7; R1 відсутній; X1 вибраний з групи, до якої входять Ala, DAla, Gly, Dap(Ac), Leu, Lys, Lys(Ac), 2Nal, Phe та DPhe; X3 вибраний з групи, до якої входять Arg, Lys, Lys(iPr) та Lys(Me 2); X7 вибраний з групи, до якої входять Asp, Glu та DGlu; X8 вибраний з групи, до якої входять -Ala, Arg, Gly, Lys, Lys(iPr) та Orn, або є відсутнім; X9 вибраний з групи, до якої входять Gly, 2Nal, D2Nal та DPhe, або є відсутнім; X10 є 2Nal або відсутній; причому якщо X8 відсутній, то кожний з X9 та X10 є відсутнім; та R2 вибраний з групи, до якої входять NH2 та NHEt. Відповідно до варіанта цього аспекту винаходу, якому віддається перевага, X 1 є Ala, DAla, Gly, Leu, Lys, Lys(Ac), Phe або DPhe. Відповідно до варіанта, якому віддається більша перевага, X1 є Ala, Gly, Lys або Phe. Відповідно до варіанта цього аспекту винаходу, якому віддається перевага, X 3 є Arg, Lys, Lys(iPr) або Lys(Me2). Відповідно до варіанта, якому віддається більша перевага, X 3 – Arg. Відповідно до варіанта цього аспекту винаходу, якому віддається перевага, X 7 є Asp, Glu або DGlu. Відповідно до варіанта, якому віддається більша перевага, X 7 – Asp. Відповідно до варіанта цього аспекту винаходу, якому віддається перевага, X 8 є -Ala, Arg, Gly, Lys, Lys(iPr), Orn або є відсутнім. Відповідно до варіанта, якому віддається більша перевага, X8 є -Ala, Gly, Lys, Lys(iPr), Orn або є відсутнім. Відповідно до варіанта цього аспекту винаходу, якому віддається перевага, X 9 – Gly, 2Nal, D2Nal, DPhe або є відсутнім. Відповідно до варіанта, якому віддається більша перевага, X 9 є Gly, 2Nal, D2Nal або DPhe. Відповідно до варіанта цього аспекту винаходу, якому віддається перевага, X 10 є 2Nal або є відсутнім. Відповідно до варіанта, якому віддається більша перевага, X 10 – 2Nal. Відповідно до варіанта цього аспекту винаходу, якому віддається перевага, R2 – NHEt. За іншим аспектом цей винахід пропонує циклізований лактамом пептид або його фармацевтично прийнятну сіль формули I (Послідовність SEQ ID NO: 1), де згаданий лактам утворений амідним зв’язком між аміногрупою небічного ланцюга X1 в положенні, відмінному від , та карбоксильною групою бічного ланцюга X7; R1 відсутній; 5 UA 99458 C2 5 10 15 20 25 X1 вибраний з групи, до якої входять -Ala, 4-AMB, 5-аміновалерил та 4-AMPA; X3 – Arg; X7 вибраний з групи, до якої входять Asp та Glu; X8 вибраний з групи, до якої входять Arg та DArg; X9 відсутній; X10 відсутній; та R2 – NH2. Відповідно до варіанта цього аспекту винаходу, якому віддається перевага, X 1 є -Ala, 5аміновалерил або 4-AMPA. Відповідно до варіанта, якому віддається більша перевага, X1 є Ala. Відповідно до варіанта цього аспекту винаходу, якому віддається перевага, X 7 – Asp. Відповідно до варіанта цього аспекту винаходу, якому віддається перевага, X 8 – Arg. За іншим аспектом цей винахід пропонує циклізований лактамом пептид або його фармацевтично прийнятну сіль формули I (Послідовність SEQ ID NO: 1), де згаданий лактам утворений амідним зв’язком між -аміногрупою X2 та карбоксильною групою бічного ланцюга X7; R1 відсутній; X1 відсутній; X3 – Arg; X7 вибраний з групи, до якої входять Asp, Glu та DGlu; X8 – Arg; X9 відсутній; X10 відсутній; та R2 – NH2. За іншим аспектом цей винахід пропонує циклізований лактамом пептид формули: H2 N OH NH NH NH O N H H N O O N H O H N N H O H N O O N H NH 2 O HN HN (Послідовність SEQ ID NO: 70) 30 35 40 O або його фармацевтично прийнятну сіль. Згаданий лактам утворений амідним зв’язком між -аміногрупою Phe та карбоксильною групою бічного ланцюга DGlu. Фармацевтично прийнятною сіллю може бути сіль оцтової кислоти. За іншим аспектом цей винахід пропонує фармацевтичну композицію, яка містить циклізований лактамом пептид або його фармацевтично прийнятну сіль за різними варіантами, описаними вище, та фармацевтично прийнятний носій, розріджувач або наповнювач. За іншим аспектом цей винахід пропонує циклізований лактамом пептид або його фармацевтично прийнятну сіль за різними варіантами, описаними вище, для застосування у терапії. За іншим аспектом цей винахід пропонує циклізований лактамом пептид або його фармацевтично прийнятну сіль за різними варіантами, описаними вище, для лікування ревматоїдного артриту, фіброзу легенів, ВІЛ-інфекції або раку, вибраного з групи, до якої входять рак молочної залози, рак підшлункової залози, меланома, рак передміхурової залози, рак нирки, нейробластома, неходжкінська лімфома, рак легенів, рак яєчників, рак ободової та прямої кишки, множинна мієлома, поліморфна гліобластома та хронічний лімфолейкоз. 6 UA 99458 C2 5 10 15 20 25 30 35 40 45 За іншим аспектом цей винахід пропонує застосування циклізованого лактамом пептиду або його фармацевтично прийнятної солі за різними варіантами, описаними вище, для виготовлення лікарського засобу для лікування ревматоїдного артриту, фіброзу легенів, ВІЛінфекції або раку, вибраного з групи, до якої входять рак молочної залози, рак підшлункової залози, меланома, рак передміхурової залози, рак нирки, нейробластома, неходжкінська лімфома, рак легенів, рак яєчників, рак ободової та прямої кишки, множинна мієлома, поліморфна гліобластома та хронічний лімфолейкоз. За ще одним аспектом цей винахід пропонує спосіб лікування ревматоїдного артриту, фіброзу легенів, ВІЛ-інфекції або раку, вибраного з групи, до якої входять рак молочної залози, рак підшлункової залози, меланома, рак передміхурової залози, рак нирки, нейробластома, неходжкінська лімфома, рак легенів, рак яєчників, рак ободової та прямої кишки, множинна мієлома, поліморфна гліобластома та хронічний лімфолейкоз, який включає введення в організм пацієнта, який потребує такого лікування, ефективної кількості циклізованого лактамом пептиду або його фармацевтично прийнятної солі за різними варіантами, описаними вище. У макроциклічних пептидних сполуках за цим винаходом (Послідовність SEQ ID NO: 1) амінокислоти X1 – X10 позначені їх загальновживаними трилітерними символами, причому порядок літер зліва направо відповідає напряму від амінного кінця до карбоксильного кінця. Позначення D- та L- (зменшені великі літери) стосуються абсолютної стереохімічної конфігурації. Якщо у конкретній формулі таке позначення відсутнє, то мається на увазі L-форма відповідної амінокислоти. Фрагмент X1 може бути також залишком дикарбонової кислоти, наприклад, сукцинілом. Амінокислоти або залишки карбонових кислот у квадратних дужках “[ ]” входять до складу циклічної структури; групи, що стоять поза дужками, не входять до складу циклу. У всіх випадках замикання циклу відбувається через лактамний (амідний) зв’язок між X 1 (або X2, тобто Tyr) та X 7, який може утворюватися кількома різними шляхами, залежно від структур X1, X2 та X7. Якщо лактамний зв’язок утворюється між аміногрупою бічного ланцюга X 1 та карбоксильною групою бічного ланцюга X7 (Схема 1 та Схема 2; Приклади 1-5), -аміногрупа X1 захищена групою Ac або н-гексаноїлом. Якщо лактамний зв’язок утворюється між карбоксильною групою бічного ланцюга X 1 та аміногрупою бічного ланцюга X7, -аміногрупа X1 захищена групою Ac або Bz (Схема 3 та Схема 4; Приклади 6-19). X1 може також бути біфункціональним залишком, відмінним від амінокислоти, наприклад, залишком, який містить дві карбоксильні групи, тобто сукцинілом. У цьому випадку одна карбоксильна група утворює амідний зв’язок з -аміногрупою Tyr, а друга утворює структуру циклічного лактаму за допомогою амідного зв’язку з аміногрупою бічного ланцюга X7 (Схема 3 та Схема 4; Приклади 20-24). Якщо X1 – сукциніл, то R1 відсутній. У складі більшості циклізованих лактамами пептидів, описаних у цьому документі (Схеми 515; Приклади 25-28, 32-66 та 75-89), -аміногрупа X1 утворює лактамну структуру за допомогою амідного зв’язку з карбоксильною групою бічного ланцюга X 7, та R1 відсутній. Крім того, схеми синтезу цієї категорії охоплюють циклічні пептиди, які містять залишки X 1, тобто -Ala, 4-AMB, 5аміновалерил та 4-AMPA, де аміногрупа є аміногрупою небічного ланцюга у положенні, відмінному від (Схема 5 та Схема 6; Приклади 67-74). У таких випадках R1 також відсутній. Якщо обидва R1 та X1 відсутні, то лактамна структура утворюється за допомогою амідного зв’язку між -аміногрупою Tyr (X2) та карбоксильною групою бічного ланцюга X 7 (Схема 5 тa Схема 6; Приклади 29-31). Структури звичайних амінокислот, наприклад, аланіну, гліцину тощо, добре відомі в галузі. Структури нестандартних та заміщених амінокислот, присутніх у сполуках за цим винаходом, показані нижче. 7 UA 99458 C2 5 10 15 Циклізовані лактамами пептиди за цим винаходом можна одержувати у формі фармацевтично прийнятних солей. Такі солі та загальна методологія їх одержання добре відомі в галузі. Дивись, наприклад, P. Stahl et al. (2002) Handbook of Pharmaceutical Salts: Properties, Selection and Use, VCHA/Wiley-VCH; Berge et al. (1977) “Pharmaceutical Salts”, Journal of Pharmaceutical Sciences 66(1):1-19. Сполуки за цим винаходом є ефективними антагоністами взаємодії CXCR4/SDF-1. Сполуки формули (I) та їх фармацевтично прийнятні солі, подані в цьому описі як конкретні приклади, 125 виявляють при описаному нижче випробуванні зв’язування CXCR4/ I-SDF-1 середнє значення Ki приблизно 7,5 нM або нижче. Сполуки формули (I), яким віддається більша перевага, та їх фармацевтично прийнятні солі виявляють у цьому випробуванні середнє значення Ki в межах від приблизно 0,2 нM до приблизно 1 нM. Сполуки формули (I), яким віддається особлива перевага, та їх фармацевтично прийнятні солі виявляють у цьому випробуванні середнє значення Ki нижче ніж приблизно 0,2 нM. 8 UA 99458 C2 5 10 15 20 25 30 35 40 45 50 55 60 Крім того, сполуки та фармацевтично прийнятні солі за цим винаходом відповідно до варіанта, якому віддається перевага, мають високу селективність до рецептора CXCR4, виявляючи у випробовуваних концентраціях незначну інгібувальну активність або взагалі не виявляючи інгібувальної активності відносно інших рецепторів хемокінів, в тому числі до CCR1, CCR2, CXCR2, CXCR3, та до інших рецепторів, сполучених з G-протеїном, та не виявляючи значної активності відносно рецепторів серотоніну, допаміну та опіоїдів. Відповідно до варіанта, якому віддається перевага, вони виявляють досить високу стабільність у крові та плазмі, високу біодоступність при підшкірному введенні, сприятливі фармакокінетичні та фармакодинамічні властивості та високу ефективність інгібування росту пухлин in vivo при широкому діапазоні безпечного застосування. Внаслідок таких фармакологічних властивостей сполуки за цим винаходом придатні для лікування розладів, які спричинюють взаємодію CXCR4/SDF-1 або рецепторну активність CXCR4, таку як при ВІЛ-інфекції. Зокрема, сполуки за цим винаходом є корисними при лікуванні злоякісних розладів, патогенез яких включає в себе шляхи ангіогенезу, росту, доживання та метастазування, опосередковані CXCR4 та SDF-1; до таких розладів належать рак молочної залози, рак підшлункової залози, меланома, рак передміхурової залози, рак нирки, нейробластома, неходжкінська лімфома, рак легенів, рак яєчників, рак ободової та прямої кишки, множинна мієлома, поліморфна гліобластома та хронічний лімфолейкоз, а також ревматоїдний артрит, фіброз легенів та ВІЛ-інфекція (Tsutsumi et al. (2006) Peptide Science 88(2):279-289). Agl (аміногліцин) є прохіральним структурним фрагментом. Коли цей залишок є наявним у формулі пептиду, згаданого у цьому описі, то -атом вуглецю перетворюється на хіральний центр, при якому кожна з двох відповідних -аміногруп окремо приєднана до різних фрагментів. В такому випадку кінцевий пептид містить два нерозділені діастереомери, які можуть бути присутні у відношенні, відмінному від 1:1. Позначення “(D/L)Agl” у формулі пептиду означає таку суміш діастереомерів. Позначення “(DL)Agl” означає рацемічне похідне Agl, наприклад, Fmoc(DL)Agl(Boc). Значення “Ki” обчислені із застосуванням значень IC50, визначених у описаному нижче 125 випробуванні зв’язування CXCR4/ I-SDF-1, за рівнянням 7.22, поданим у Enzymes, A Practical Introduction to Structure, Mechanism, and Data Analysis, Robert A. Copeland, Wiley-VCH, New York, 1996, page 207. Термін “SDF-1” охоплює дві ізоформи, SDF-1 та SDF-1, функціональні характеристики яких на даний час вважаються однаковими. Термін “лікування” у значенні, вживаному в цьому описі, стосується терапевтичного лікування розладів, пов’язаних із взаємодією CXCR4/SDF-1 або активністю рецептора CXCR4. Термін “терапевтичне лікування” стосується процесів, до яких належать уповільнення, переривання, припинення, регулювання або зупинення розвитку захворювання, але не обов’язково означає цілковите усунення усіх пов’язаних із захворюванням симптомів, станів або розладів. Сполуки за цим винаходом можна застосовувати як лікарські засоби у медицині або ветеринарії, і їх можна вводити в організм різноманітними шляхами. У варіанті, якому віддається найбільша перевага, такі композиції призначені для парентерального застосування. Такі фармацевтичні композиції можуть бути виготовлені способами, добре відомими у галузі th (дивись, наприклад, „Remington: The Science and Practice of Pharmacy, 19 ed. (1995), A. Gennaro et al., Mack Publishing Co.), і вони містять одну або декілька сполук формули (I) або їх фармацевтично прийнятних солей, та фармацевтично прийнятний носій, розріджувач або наповнювач. Ефективна кількість сполук за цим винаходом становить від приблизно 1 мг до приблизно 300 мг на добу, більша перевага віддається кількості від приблизно 1 мг до приблизно 200 мг на добу, ще більша перевага віддається кількості від приблизно 1 мг до приблизно 100 мг на добу, і ще більша перевага віддається кількості від приблизно 1 мг до приблизно 50 мг на добу. Усі циклізовані лактамами пептиди за цим винаходом можуть бути синтезовані способами або твердофазового синтезу, або синтезу у рідкій фазі, або комбінацією обох способів, причому побудова пептидного ланцюга виконується на твердій фазі, а циклізація або інші модифікації – на смолі або у розчині. Такі способи добре відомі в галузі. Подані нижче абревіатури, вживані в цьому описі, мають відповідні вказані значення: Ac: ацетил; Agl: аміногліцин; AMB: амінометилбензойна кислота; AMPA: амінометилфенілоцтова кислота; Bn: бензил; Boc: трет-бутоксикарбоніл; BOP: гексафторфосфат (бензотриазол-1-ілокси)-трис(диметиламіно)фосфонію; 2-Br-Z: 2бромбензилоксикарбоніл; Bz: бензоїл; Bzl: бензил; 2-Cl-Z: 2-хлорбензилоксикарбоніл; Dab: 2,4 9 UA 99458 C2 5 10 15 20 25 30 35 40 45 50 55 діаміномасляна кислота; Dap: 2,3-діамінопропіонова кислота; DCC: дициклогексилкарбодіімід; DCM: дихлорметан; DIC: діізопропілкарбодіімід; DIEA: діізопропілетиламін; DMF: N,Nдиметилформамід; DMSO: диметилсульфоксид; EDT: 1,2-етандитіол; Et: етил; Fm: 9флуоренілметил; Fmoc: 9-флуоренілметоксикарбоніл; HATU: N-оксид гексафторфосфату N[(диметиламіно)-1H-1,2,3-триазоло[4,5-b]піридин-1-ілметилен]-N-метилметанамінію; HBTU: гексафторфосфат O-бензотриазоліл-N,N,N’,N’-тетраметилуронію; HCTU: гексафторфосфату 1[біс(диметиламіно)метилен]-5-хлор-3-оксиду 1H-бензотриазолію; HF: фтороводень; HOBt: гідроксибензотриазол; IBCF: ізобутилхлорформіат; iPr: ізопропіл; IPA: ізопропіловий спирт; Me: метил; 2Nal: 2-нафтилаланін; NMM: N-метилморфолін; NMP: N-метилпіролідон; OtBu: третбутиловий складний ефір; Pbf: 2,2,4,6,7-пентаметил-дигідробензофуран-5-сульфоніл; PBS: фосфатно-сольовий буферний розчин; PyBOP: гексафторфосфат (бензотриазол-1-ілокси)трис(піролідино)фосфонію; PyBrOP: гексафторфосфат бром-трис(піролідино)фосфонію; tBu: трет-бутил; TFA: трифтороцтова кислота; THF: тетрагідрофуран; TIS: триізопропілсилан; Tos: птолуолсульфоніл; Z: бензилоксикарбоніл; ZOSu: N-(бензилоксикарбонілокси)сукцинімід. Способи одержання сполук за цим винаходом, описані у поданих нижче прикладах, слід розглядати як ілюстративні, а не обмежувальні. У кожному з цих прикладів знайдена молекулярна маса подана як деконволюційне значення. Це деконволюційне значення виводиться з формули MW(знайдена) = n(m/z)-n, де m/z означає заряджений іон (позитивний варіант), та n – кількість зарядів конкретного виду. Якщо у мас-спектрі присутні сполуки з множинним зарядом, то знайдена молекулярна маса вказується як середнє значення. Процеси синтезу, описані у Прикладах 85-87, та методики ізотопного мічення, описані у Прикладі 89, для лактамних циклопептидів, які містять бічні ланцюги ізопропіллізину, можуть також бути застосовані з відповідними модифікаціями до описаних у цьому документі інших пептидів, які містять бічні алкільні ланцюги лізину. Методи синтезу за Прикладами 86-88, які усувають необхідність у токсичних паладієвих каталізаторах, можуть також бути застосовані з відповідними модифікаціями до описаних у цьому документі інших пептидів. Приклад 1 Ac-цикло[Dap-Tyr-Arg-DArg-2Nal-Gly-Glu]-Arg-NH2 (Послідовність SEQ ID NO: 2) Послідовність Ac-Dap(Alloc)-Tyr(tBu)-Arg(Pbf)-DArg(Pbf)-2Nal-Gly-Glu(O-аліл)-А(Pbf) (Послідовність SEQ ID NO: 3) утворюють за стандартною методикою із застосуванням Fmoc, використовуючи реагент ABI 431 Peptide Synthesizer (продукт фірми Applied Biosystems), як показано нижче на Схемі 1. Автоматизовану побудову виконують, застосовуючи стандартну методику фірми Applied Biosystems із застосуванням DCC/HOBt або методику FastMoc із застосуванням HBTU/DIEA згідно з інструкціями постачальника (PE Applied Biosystems Inc., Foster City, CA). Твердим субстратом є амідна смола Rink (4-(2',4'-диметоксифеніл-Fmocамінометил)фенокси-смола) для C-кінцевих амідів або індольна смола AM ([3-({етил-Fmocаміно}метил)індол-1-іл]ацетильна смола) для C-кінцевих етиламідів (NovaBiochem, EMD Biosciences, Inc., San Diego, CA). Постадійна побудова ланцюга починається з С-кінцевої ланки лінійного пептиду і виконується за 9 основних стадій. На стадії 1 4 екв. захищеної амінокислоти Fmoc-Arg(Pbf) активують із застосуванням DCC/HOBt (або HBTU/DIEA для методики FastMoc) в NMP та приєднують до смоли Rink Amide з групами захисту, відщепленими із застосуванням 20% піперидину. На стадії 2 4 екв. Fmoc-Glu(O-аліл) активують та приєднують до одержаної на стадії 1 смоли з пептидом, від якого відщеплені групи захисту. Виконують відповідні стадії до завершення стадії 8 – приєднання групи Fmoc-Dap(Alloc). Потім відщеплюють групу Fmoc від Nкінцевої ланки, застосовуючи 20% піперидин у DMF, та автономно виконують ацетилювання аміногрупи, застосовуючи 5 екв. оцтового ангідриду, 10 екв. DIEA у безводному DMF або NMP протягом 1 год при кімнатній температурі. Групи захисту бічних ланцюгів – аліл та Alloc – відщеплюють, застосовуючи 0,1 екв. Pd(Ph3P)4 у присутності 24 екв. фенілсилану в дихлорметані (Схема 2). Цей процес повторюють ще один раз для повного відщеплення груп захисту від бічного ланцюга. Позбавлений груп захисту карбоксильний фрагмент Glu активують PyBOP/DIEA, та замикають цикл на аміногрупу бічного ланцюга Dap на смолі. Циклізований пептид одночасно позбавляють груп захисту та відщеплюють від смоли, застосовуючи поглинальну суміш TFA/H 2O/TIS/EDT (95/2/1/2, за об’ємом) або TFA/H2O/TIS/анізол (92/2/4/2, за об’ємом), протягом 2 год при кімнатній температурі. Потім розчинники випарюють у вакуумі, пептид осаджують, та тричі промивають охолодженим діетиловим ефіром для видалення поглиначів. Молекулярна маса обчислена (MW обчислена): 1142,30; Молекулярна маса знайдена (MW знайдена): 1142,50. 10 UA 99458 C2 5 10 (Послідовність SEQ ID NO: 4) Схема 1. Побудова пептиду з приєднанням амінного бічного ланцюга до карбоксильного бічного ланцюга Очищення пептиду виконують, застосовуючи стандартні способи препаративної РХВЕ (рідинна хроматографія високої ефективності). Одразу ж після замикання циклу розчин пептиду розводять водою, яка містить 0,1% (об’ємн.) TFA, завантажують у колонку С18 для РХВЕ з оберненою фазою та елююють в градієнтному режимі сумішшю 0,1% (об’ємн.) трифтороцтової кислоти та ацетонітрилу з детектуванням на довжині хвилі 214 нм. Відповідні фракції об’єднують, та ліофілізують. Подальшу ідентифікацію кінцевого продукту виконують звичайними способами із застосуванням аналітичної РХВЕ та мас-спектрометричного аналізу. Для пептидів із бічним ланцюгом основного характеру кінцевим ліофілізованим продуктом є сіль з TFA. 11 UA 99458 C2 5 Схема 2. Замикання циклу між амінним бічним ланцюгом і карбоксильним бічним ланцюгом та відщеплення від смоли Приклад 2 Ac-цикло[Dab-Tyr-Arg-DArg-2Nal-Gly-Glu]-Arg-NH2 (Послідовність SEQ ID NO: 6) Одержують, як описано у Прикладі 1, з тією відмінністю, що Fmoc-Dap(Alloc) на стадії 8 замінюють Fmoc-Dab(Alloc). MW обчислена: 1156,33; MW знайдена: 1156,10. Приклад 3 12 UA 99458 C2 5 10 15 20 25 30 35 40 45 Ac-цикло[Dap-Tyr-Lys(iPr)-DArg-2Nal-Gly-Glu]-Arg-NH2 (Послідовність SEQ ID NO: 7) Одержують, як описано у Прикладі 1, з тією відмінністю, що Fmoc-Arg(Pbf) на стадії 6 замінюють Fmoc-Lys(iPr)(Boc). MW обчислена: 1156,37; MW знайдена: 1156,78. Приклад 4 н-гексаноїл-цикло[Dap-Tyr-Lys(iPr)-DArg-2Nal-Gly-Glu]-Arg-NH2 (Послідовність SEQ ID NO: 8) Одержують, як описано у Прикладі 1, з тією відмінністю, що Fmoc-Arg(Pbf) на стадії 6 замінюють Fmoc-Lys(iPr)(Boc). Крім того, оцтовий ангідрид на стадії 9 замінюють гексановою кислотою, активованою PyBOP/DIEA. MW обчислена: 1212,47; MW знайдена: 1212,92. Приклад 5 Ac-цикло[(D/L)Agl-Tyr-Arg-DArg-2Nal-Gly-Glu]-Arg-NH2 (Послідовність SEQ ID NO: 9) Одержують, як описано у Прикладі 1, з тією відмінністю, що Fmoc-Glu(O-аліл) на стадії 2 замінюють Fmoc-Glu(OtBu), та Fmoc-Dap(Alloc) на стадії 8 замінюють Fmoc-(DL)Agl(Boc). Після побудови ланцюга оброблення Pd(Ph3P)4 не виконують, оскільки алільна група як група захисту відсутня. Натомість замикання циклу виконують у розчині після відщеплення лінійного пептиду від твердого субстрату та відщеплення від нього груп захисту. Неочищений лінійний пептид (0,25 ммоль) після відщеплення від смоли сушать у вакуумі та розчиняють у 10 мл безводного DMF. Цей розчин пептиду додають за допомогою шприц-насоса протягом 2 год до нижчезазначеного розчину: 15 мл безводного дихлорметану та 15 мл безводного DMF, який містить 1,0 ммоль PyBOP та 4,0 ммоль DIEA. Після цього дають реакції протікати при кімнатній температурі протягом 2 год. Потім розчинники випарюють у вакуумі, залишок завантажують у колонку С18 для РХВЕ з оберненою фазою, і цільовий циклопептид виділяють та ідентифікують, як описано у Прикладі 1. MW обчислена: 1128,27; MW знайдена: 1128,26. Приклад 6 Ac-цикло[Glu-Tyr-Arg-DArg-2Nal-Gly-Dap]-Arg-NH2 (Послідовність SEQ ID NO: 10) Послідовність Glu(OtBu)-Tyr(tBu)-Arg(Pbf)-DArg(Pbf)-2Nal-Gly-Dap(Boc)-Arg(Pbf) (Послідовність SEQ ID NO: 11) синтезують за стандартною методикою із застосуванням Fmoc, використовуючи прилад ABI 431, як показано нижче на Схемі 3. Автоматизовану побудову виконують, застосовуючи стандартну методику фірми Applied Biosystems із застосуванням DCC/HOBt або методику FastMoc із застосуванням HBTU/DIEA згідно з інструкціями постачальника (PE Applied Biosystems Inc., Foster City, CA). Твердим субстратом є амідна смола Rink для C-кінцевих амідів або індольна смола AM ([3-({етил-Fmoc-аміно}метил)індол-1іл]ацетильна смола) для C-кінцевих етиламідів. Постадійна побудова ланцюга починається з Скінцевої ланки лінійного пептиду і виконується за 9 основних стадій. На стадії 1 4 екв. захищеної амінокислоти Fmoc-Arg(Pbf) активують із застосуванням DCC/HOBt (або HBTU/DIEA для методики FastMoc) в NMP та приєднують до смоли Rink Amide з відщепленими групами захисту. На стадії 2 4 екв. Fmoc-Dap(Boc) активують та приєднують до одержаної на стадії 1 смоли з пептидом, від якого відщеплені групи захисту. Виконують відповідні стадії до завершення стадії 8 – приєднання групи Fmoc-Glu(OtBu). На стадії 9 відщеплюють групу Fmoc від N-кінцевої ланки, застосовуючи 20% піперидин у DMF, та автономно виконують ацетилювання аміногрупи, застосовуючи 5 екв. оцтового ангідриду, 10 екв. DIEA у безводному DMF або NMP протягом 1 год при кімнатній температурі. Відщеплюють групи захисту від одержаного пептиду, та одночасно відщеплюють пептид від смоли, застосовуючи поглинальну суміш TFA/H2O/TIS/EDT (95/2/1/2, за об’ємом) або TFA/H2O/TIS/анізол (92/2/4/2, за об’ємом), протягом 2 год при кімнатній температурі (Схема 4). Потім розчинники випарюють у вакуумі, пептид осаджують, та тричі промивають охолодженим діетиловим ефіром для видалення поглиначів. Неочищений продукт застосовують у реакції замикання циклу без додаткового оброблення. MW обчислена: 1142,30; MW знайдена: 1142,83. 13 UA 99458 C2 5 10 (Послідовність SEQ ID NO: 12) Схема 3. Побудова пептиду з приєднанням карбоксильного бічного ланцюга до амінного бічного ланцюга Замикання циклу виконують у розчині після відщеплення лінійного пептиду від твердого субстрату та відщеплення груп захисту від усіх бічних ланцюгів (Схема 4). Неочищений лінійний пептид (0,25 ммоль) після відщеплення від смоли сушать у вакуумі, та розчиняють у 10 мл безводного DMF. Цей розчин пептиду додають за допомогою шприц-насоса протягом 2 год до нижчезазначеної реакційної суміші: 15 мл безводного дихлорметану та 15 мл безводного DMF, який містить 1,0 ммоль PyBOP та 4,0 ммоль DIEA. Після цього дають реакції протікати при кімнатній температурі протягом 2 год. Потім розчинники випарюють у вакуумі, залишок завантажують у колонку С18 для препаративної РХВЕ з оберненою фазою, і цільовий циклопептид виділяють та ідентифікують, як описано у Прикладі 1. 14 UA 99458 C2 5 10 Схема 4. Замикання циклу між карбоксильним бічним ланцюгом та амінним бічним ланцюгом Приклад 7 Bz-цикло[Glu-Tyr-Arg-DArg-2Nal-Gly-Dap]-Arg-NH2 (Послідовність SEQ ID NO: 14) Одержують, як описано у Прикладі 6, з тією відмінністю, що оцтовий ангідрид на стадії 9 замінюють бензойним ангідридом. MW обчислена: 1204,37; MW знайдена: 1204,87. Приклад 8 Ac-цикло[Glu-Tyr-Arg-DArg-2Nal-Gly-DDap]-Arg-NH2 (Послідовність SEQ ID NO: 15) Одержують, як описано у Прикладі 6, з тією відмінністю, що Fmoc-Dap(Boc) на стадії 2 замінюють Fmoc-DDap(Boc). MW обчислена: 1142,30; MW знайдена: 1142,73. Приклад 9 Ac-цикло[Glu-Tyr-Arg-DArg-2Nal-Gly-Lys]-Arg-NH2 (Послідовність SEQ ID NO: 16) 15 UA 99458 C2 5 10 15 20 25 30 35 40 45 50 55 60 Одержують, як описано у Прикладі 6, з тією відмінністю, що Fmoc-Dap(Boc) на стадії 2 замінюють Fmoc-Lys(Boc). MW обчислена: 1184,38; MW знайдена: 1184,23. Приклад 10 Ac-цикло[Glu-Tyr-Arg-DArg-2Nal-Gly-Dab]-Arg-NH2 (Послідовність SEQ ID NO: 17) Одержують, як описано у Прикладі 6, з тією відмінністю, що Fmoc-Dap(Boc) на стадії 2 замінюють Fmoc-Dab(Boc). MW обчислена: 1156,33; MW знайдена: 1156,07. Приклад 11 Ac-цикло[Glu-Tyr-Arg-DArg-2Nal-Gly-(D/L)Agl]-Arg-NH2 (Послідовність SEQ ID NO: 18) Одержують, як описано у Прикладі 6, з тією відмінністю, що Fmoc-Dap(Boc) на стадії 2 замінюють Fmoc-(DL)Agl(Boc). MW обчислена: 1128,27; MW знайдена: 1128,86. Приклад 12 Bz-цикло[Glu-Tyr-Arg-DArg-2Nal-Gly-(D/L)Agl]-Arg-NH2 (Послідовність SEQ ID NO: 19) Одержують, як описано у Прикладі 6, з тією відмінністю, що Fmoc-Dap(Boc) на стадії 2 замінюють Fmoc-(DL)Agl(Boc). Крім того, оцтовий ангідрид на стадії 9 замінюють бензойним ангідридом. MW обчислена: 1190,34; MW знайдена: 1190,99. Приклад 13 Bz-цикло[Asp-Tyr-Arg-DArg-2Nal-Gly-Dab]-Arg-NH2 (Послідовність SEQ ID NO: 20) Одержують, як описано у Прикладі 6, з тією відмінністю, що Fmoc-Dap(Boc) на стадії 2 замінюють Fmoc-Dab(Boc), та Fmoc-Glu(OtBu) на стадії 8 замінюють Fmoc-Asp(OtBu). Крім того, оцтовий ангідрид на стадії 9 замінюють бензойним ангідридом. MW обчислена: 1204,37; MW знайдена: 1204,87. Приклад 14 Ac-цикло[Asp-Tyr-Arg-DArg-2Nal-Gly-Dab]-Arg-NH2 (Послідовність SEQ ID NO: 21) Одержують, як описано у Прикладі 6, з тією відмінністю, що Fmoc-Dap(Boc) на стадії 2 замінюють Fmoc-Dab(Boc), та Fmoc-Glu(OtBu) на стадії 8 замінюють Fmoc-Asp(OtBu). MW обчислена: 1142,30; MW знайдена: 1142,81. Приклад 15 Ac-цикло[Asp-Tyr-Arg-DArg-2Nal-Gly-Dap]-Arg-NH2 (Послідовність SEQ ID NO: 22) Одержують, як описано у Прикладі 6, з тією відмінністю, що Fmoc-Glu(OtBu) на стадії 8 замінюють Fmoc-Asp(OtBu). MW обчислена: 1128,27; MW знайдена: 1128,78. Приклад 16 Bz-цикло[Asp-Tyr-Arg-DArg-2Nal-Gly-Dap]-Arg-NH2 (Послідовність SEQ ID NO: 23) Одержують, як описано у Прикладі 6, з тією відмінністю, що Fmoc-Glu(OtBu) на стадії 8 замінюють Fmoc-Asp(OtBu). Крім того, оцтовий ангідрид на стадії 9 замінюють бензойним ангідридом. MW обчислена: 1190,34; MW знайдена: 1190,69. Приклад 17 Ac-цикло[Asp-Tyr-Arg-DArg-2Nal-Gly-(D/L)Agl]-Arg-NH2 (Послідовність SEQ ID NO: 24) Одержують, як описано у Прикладі 6, з тією відмінністю, що Fmoc-Dap(Boc) на стадії 2 замінюють Fmoc-(DL)Agl(Boc), та Fmoc-Glu(OtBu) на стадії 8 замінюють Fmoc-Asp(OtBu). MW обчислена: 1114,24; MW знайдена: 1114,85. Приклад 18 Ac-цикло[Asp-Tyr-Lys(Me2)-DArg-2Nal-Gly-Dap]-Arg-NH2 (Послідовність SEQ ID NO: 25) Одержують, як описано у Прикладі 6, з тією відмінністю, що Fmoc-Arg(Pbf) на стадії 6 замінюють Fmoc-Lys(Me2), та Fmoc-Glu(OtBu) на стадії 8 замінюють Fmoc-Asp(OtBu). MW обчислена: 1128,31; MW знайдена: 1128,92. Приклад 19 Bz-цикло[Asp-Tyr-Lys(Me2)-DArg-2Nal-Gly-Dap]-Arg-NH2 (Послідовність SEQ ID NO: 26) Одержують, як описано у Прикладі 6, з тією відмінністю, що Fmoc-Arg(Pbf) на стаідї 6 замінюють Fmoc-Lys(Me2), та Fmoc-Glu(OtBu) на стадії 8 замінюють Fmoc-Asp(OtBu). Крім того, оцтовий ангідрид на стадії 9 замінюють бензойним ангідридом. MW обчислена: 1190,38; MW знайдена: 1191,14. Приклад 20 Цикло[сукциніл-Tyr-Arg-DArg-2Nal-Gly-(D/L)Agl]-Arg-NH2 (Послідовність SEQ ID NO: 27) Одержують, як описано у Прикладі 6, з тією відмінністю, що Fmoc-Dap(Boc) на стадії 2 замінюють Fmoc-(DL)Agl(Boc), Fmoc-Glu(OtBu) на стадії 8 не застосовують, і цю стадію не виконують. Крім того, оцтовий ангідрид на стадії 9 замінюють бурштиновим ангідридом. MW обчислена: 1057,19; MW знайдена: 1057,87. Приклад 21 Цикло[сукциніл-Tyr-Arg-DArg-2Nal-Gly-Dap]-Arg-NH2 (Послідовність SEQ ID NO: 28) Одержують, як описано у Прикладі 6, з тією відмінністю, що Fmoc-Glu(OtBu) на стадії 8 не 16 UA 99458 C2 5 10 15 20 25 30 35 40 45 50 55 застосовують, і цю стадію не виконують. Крім того, оцтовий ангідрид на стадії 9 замінюють бурштиновим ангідридом. MW обчислена: 1071,22; MW знайдена: 1071,85. Приклад 22 Цикло[сукциніл-Tyr-Arg-DArg-2Nal-Gly-Dab]-Arg-NH2 (Послідовність SEQ ID NO: 29) Одержують, як описано у Прикладі 6, з тією відмінністю, що Fmoc-Dap(Boc) на стадії 2 замінюють Fmoc-Dab(Boc), Fmoc-Glu(OtBu) на стадії 8 не застосовують, і цю стадію не виконують. Крім того, оцтовий ангідрид на стадії 9 замінюють бурштиновим ангідридом. MW обчислена: 1085,25; MW знайдена: 1085,87. Приклад 23 Цикло[сукциніл-Tyr-Arg-DArg-2Nal-Gly-Orn]-Arg-NH2 (Послідовність SEQ ID NO: 30) Одержують, як описано у Прикладі 6, з тією відмінністю, що Fmoc-Dap(Boc) на стадії 2 замінюють Fmoc-Orn(Boc), Fmoc-Glu(OtBu) на стадії 8 не застосовують, і цю стадію не виконують. Крім того, оцтовий ангідрид на стадії 9 замінюють бурштиновим ангідридом. MW обчислена: 1099,27; MW знайдена: 1100,23. Приклад 24 Цикло[сукциніл-Tyr-Arg-DArg-2Nal-Gly-Lys]-Arg-NH2 (Послідовність SEQ ID NO: 31) Одержують, як описано у Прикладі 6, з тією відмінністю, що Fmoc-Dap(Boc) на стадії 2 замінюють Fmoc-Lys(Boc), Fmoc-Glu(OtBu) на стадії 8 не застосовують, і цю стадію не виконують. Крім того, оцтовий ангідрид на стадії 9 замінюють бурштиновим ангідридом. MW обчислена: 1113,30; MW знайдена: 1114,25. Приклад 25 Цикло[Gly-Tyr-Lys(iPr)-DArg-2Nal-Gly-DGlu]-Arg-NH2 (Послідовність SEQ ID NO: 32) Послідовність Gly-Tyr(tBu)-Lys(iPr)(Boc)-DArg(Pbf)-2Nal-Gly-DGlu(O-аліл)-Arg(Pbf) (Послідовність SEQ ID NO: 33) синтезують за стандартною методикою із застосуванням Fmoc, використовуючи прилад ABI 431, як показано нижче на Схемі 5. Автоматизовану побудову виконують, застосовуючи стандартну методику фірми Applied Biosystems із застосуванням DCC/HOBt або методику FastMoc із застосуванням HBTU/DIEA згідно з інструкціями постачальника (PE Applied Biosystems Inc., Foster City, CA). Твердим субстратом є амідна смола Rink для амідів або індольна смола AM ([3-({етил-Fmoc-аміно}метил)індол-1-іл]ацетильна смола) для C-кінцевих етиламідів. Постадійна побудова ланцюга починається з С-кінцевої ланки лінійного пептиду і виконується за 8 основних стадій (Схема 5). На стадії 1 4 екв. захищеної амінокислоти Fmoc-Arg(Pbf) активують DCC/HOBt (або HBTU/DIEA для методики FastMoc) в NMP та приєднують до амідної смоли Rink з відщепленими групами захисту. На стадії 2 4 екв. Fmoc-DGlu(O-аліл) активують та приєднують до одержаної на стадії 1 смоли з пептидом, від якого відщеплені групи захисту. Виконують відповідні стадії до завершення стадії 8 – приєднання Fmoc-Gly. Групу захисту бічного ланцюга – аліловий складний ефір – відщеплюють, застосовуючи0,1 екв. Pd(Ph3P)4 у присутності 24 екв. фенілсилану в дихлорметані (Схема 6). Цей процес повторюють один раз для повного відщеплення груп захисту бічного ланцюга. Потім відщеплюють групу Fmoc від N-кінцевої ланки із застосуванням 20% піперидину в DMF. Позбавлений груп захисту карбоксильний фрагмент DGlu активують PyBOP/DIEA, та замикають цикл на -аміногрупу гліцину на смолі. Відщеплюють групи захисту від циклізованого пептиду, та одночасно відщеплюють пептид від смоли, застосовуючи поглинальну суміш TFA/H2O/TIS/EDT (95/2/1/2, за об’ємом) або TFA/H2O/TIS/анізол (92/2/4/2, за об’ємом), протягом 2 год при кімнатній температурі. Потім розчинники випарюють у вакуумі, пептид осаджують, та тричі промивають охолодженим діетиловим ефіром для видалення поглиначів. MW обчислена: 1085,29; MW знайдена: 1085,32. Приклад 25a Цикло[Gly-Tyr-Lys(iPr)-DArg-2Nal-Gly-DGlu]-Arg-NH2, сіль з оцтовою кислотою (Послідовність SEQ ID NO: 34) Сіль пептиду, одержаного за Прикладом 25, з TFA перетворюють в сіль оцтової кислоти шляхом адсорбування матеріалу на препаративній колонці С18 відповідного розміру, врівноваженій 2% (об’ємн.) водним розчином оцтової кислоти. Потім колонку промивають 2% (об’ємн.) водним розчином оцтової кислоти в кількості від 3 об’ємів до 5 об’ємів колонки. Елююють пептид, застосовуючи суміш води з ацетонітрилом (1:1 за об’ємом), яка містить 2% оцтової кислоти за об’ємом, та ліофілізують. MW обчислена: 1085,29; MW знайдена: 1085,32. 17 UA 99458 C2 (Послідовність SEQ ID NO: 35) 5 10 Схема 5. Побудова пептиду з приєднанням -аміногрупи до карбоксильного бічного ланцюга Очищення пептиду виконують, застосовуючи стандартні способи препаративної РХВЕ. Одразу ж після замикання циклу розчин пептиду розводять водою, яка містить 0,1% (об’ємних) TFA, завантажують у колонку С18 для РХВЕ з оберненою фазою та елююють в градієнтному режимі сумішшю 0,1% (об’ємн.) трифтороцтової кислоти та ацетонітрилу з детектуванням на довжині хвилі 214 нм. Відповідні фракції об’єднують, та ліофілізують. Подальшу ідентифікацію кінцевого продукту виконують звичайними способами із застосуванням аналітичної РХВЕ та мас-спектрометричного аналізу. Для пептидів із бічним ланцюгом основного характеру кінцевим ліофілізованим продуктом є сіль з TFA. 18 UA 99458 C2 5 Схема 6. Замикання циклу між -аміногрупою та карбоксильним бічним ланцюгом та відщеплення від смоли Приклад 26 Цикло[Gly-Tyr-Lys(iPr)-DArg-2Nal-Gly-DGlu]-NH2 (Послідовність SEQ ID NO: 37) Одержують, як описано у Прикладі 25, з тією відмінністю, що стадію 1 не виконують. MW обчислена: 929,10; MW знайдена: 929,39. 19 UA 99458 C2 5 10 15 20 25 30 35 40 45 50 55 60 Приклад 26a Цикло[Gly-Tyr-Lys(iPr)-DArg-2Nal-Gly-DGlu]-NH2, сіль з оцтовою кислотою (Послідовність SEQ ID NO: 38) Сіль пептиду, одержаного за Прикладом 26, з TFA перетворюють в сіль оцтової кислоти шляхом адсорбування матеріалу на препаративній колонці С18 відповідного розміру, врівноваженій 2% (об’ємн.) водним розчином оцтової кислоти. Потім колонку промивають 2% (об’ємн.) водним розчином оцтової кислоти в кількості від 3 об’ємів до 5 об’ємів колонки. Елююють пептид, застосовуючи суміш води з ацетонітрилом (1:1 за об’ємом), яка містить 2% оцтової кислоти за об’ємом, та ліофілізують. MW обчислена: 929,10; MW знайдена: 929,39. Приклад 27 Цикло[Gly-Tyr-Arg-DArg-2Nal-Gly-DGlu]-Arg-NH2 (Послідовність SEQ ID NO: 39) Одержують, як описано у Прикладі 25, з тією відмінністю, що Fmoc-Lys(iPr)(Boc) на стадії 6 замінюють Fmoc-Arg(Pbf). MW обчислена: 1071,22; MW знайдена: 1071,02. Приклад 28 Цикло[Gly-Tyr-Lys(iPr)-DArg-2Nal-Gly-DGlu]-Lys(iPr)-NH2 (Послідовність SEQ ID NO: 40) Одержують, як описано у Прикладі 25, з тією відмінністю, що Fmoc-Arg(Pbf) на стадії 1 замінюють Fmoc-Lys(iPr)(Boc). MW обчислена: 1099,35; MW знайдена: 1099,91. Приклад 29 Цикло[Tyr-Arg-DArg-2Nal-Gly-Glu]-Arg-NH2 (Послідовність SEQ ID NO: 41) Одержують, як описано у Прикладі 25, з тією відмінністю, що Fmoc-DGlu(O-аліл) на стадії 2 замінюють Fmoc-Glu(O-аліл), Fmoc-Lys(iPr)(Boc) на стадії 6 замінюють Fmoc-Arg(Pbf), Fmoc-Gly на стадії 8 не застосовують, і цю стадію не виконують. MW обчислена: 1014,17; MW знайдена: 1014,78. Приклад 30 Цикло[Tyr-Arg-DArg-2Nal-Gly-DGlu]-Arg-NH2 (Послідовність SEQ ID NO: 42) Одержують, як описано у Прикладі 25, з тією відмінністю, що Fmoc-Lys(iPr)(Boc) на стадії 6 замінюють Fmoc-Arg(Pbf), Fmoc-Gly на стадії 8 не застосовують, і цю стадію не виконують. MW обчислена: 1014,17; MW знайдена: 1014,65. Приклад 31 Цикло[Tyr-Arg-DArg-2Nal-Gly-Asp]-Arg-NH2 (Послідовність SEQ ID NO: 43) Одержують, як описано у Прикладі 25, з тією відмінністю, що Fmoc-DGlu(O-аліл) на стадії 2 замінюють Fmoc-Asp(аліл), Fmoc-Lys(iPr)(Boc) на стадії 6 замінюють Fmoc-Arg(Pbf), Fmoc-Gly на стадії 8 не застосовують, і цю стадію не виконують. MW обчислена: 1000,14; MW знайдена: 1000,63. Приклад 32 Цикло[Gly-Tyr-Arg-DArg-2Nal-Gly-Asp]-Arg-NH2 (Послідовність SEQ ID NO: 44) Одержують, як описано у Прикладі 25, з тією відмінністю, що Fmoc-DGlu(O-аліл) на стадії 2 замінюють Fmoc-Asp(аліл), та Fmoc-Lys(iPr)(Boc) на стадії 6 замінюють Fmoc-Arg(Pbf). MW обчислена: 1057,19; MW знайдена: 1057,35. Приклад 33 Цикло[Gly-Tyr-Lys(Me2)-DArg-2Nal-Gly-Asp]-Arg-NH2 (Послідовність SEQ ID NO: 45) Одержують, як описано у Прикладі 25, з тією відмінністю, що Fmoc-DGlu(O-аліл) на стадії 2 замінюють Fmoc-Asp(аліл), та Fmoc-Lys(iPr)(Boc) на стадії 6 замінюють Fmoc-Lys(Me2). MW обчислена: 1057,23; MW знайдена: 1057,86. Приклад 34 Цикло[Gly-Tyr-Lys(iPr)-DArg-2Nal-Gly-Asp]-Arg-NH2 (Послідовність SEQ ID NO: 46) Одержують, як описано у Прикладі 25, з тією відмінністю, що Fmoc-DGlu(O-аліл) на стадії 2 замінюють Fmoc-Asp(аліл). MW обчислена: 1071,26; MW знайдена: 1071,76. Приклад 35 Цикло[Gly-Tyr-Lys(iPr)-DArg-2Nal-Gly-Asp]-NH2 (Послідовність SEQ ID NO: 47) Одержують, як описано у Прикладі 25, з тією відмінністю, що стадію 1 не виконують, та Fmoc-DGlu(O-аліл) на стадії 2 замінюють Fmoc-Asp(аліл). MW обчислена: 915,07; MW знайдена: 915,38. Приклад 36 Цикло[Gly-Tyr-Lys(iPr)-DArg-2Nal-Gly-Asp]-Lys(iPr)-NH2 (Послідовність SEQ ID NO: 48) Одержують, як описано у Прикладі 25, з тією відмінністю, що Fmoc-Arg(Pbf) на стадії 1 замінюють Fmoc-Lys(iPr)(Boc), та Fmoc-DGlu(O-аліл) на стадії 2 замінюють Fmoc-Asp(аліл). MW обчислена: 1085,33; MW знайдена: 1085,78. Приклад 37 Цикло[Gly-Tyr-Lys(Me2)-DArg-2Nal-Gly-Glu]-Arg-NH2 (Послідовність SEQ ID NO: 49) 20 UA 99458 C2 5 10 15 20 25 30 35 40 45 50 55 60 Одержують, як описано у Прикладі 25, з тією відмінністю, що Fmoc-DGlu(O-аліл) на стадії 2 замінюють Fmoc-Glu(O-аліл), та Fmoc-Lys(iPr)(Boc) на стадії 6 замінюють Fmoc-Lys(Me2). MW обчислена: 1071,26; MW знайдена: 1071,05. Приклад 38 Цикло[Gly-Tyr-Arg-DArg-2Nal-Gly-Glu]-Arg-NH2 (Послідовність SEQ ID NO: 50) Одержують, як описано у Прикладі 25, з тією відмінністю, що Fmoc-DGlu(O-аліл) на стадії 2 замінюють Fmoc-Glu(O-аліл), та Fmoc-Lys(iPr)(Boc) на стадії 6 замінюють Fmoc-Arg(Pbf). MW обчислена: 1071,22; MW знайдена: 1071,50. Приклад 39 Цикло[Gly-Tyr-Lys(iPr)-DArg-2Nal-Gly-Glu]-Arg-NH2 (Послідовність SEQ ID NO: 51) Одержують, як описано у Прикладі 25, з тією відмінністю, що Fmoc-DGlu(O-аліл) на стадії 2 замінюють Fmoc-Glu(O-аліл). MW обчислена: 1085,29; MW знайдена: 1085,91. Приклад 40 Цикло[Gly-Tyr-Lys(iPr)-DArg-2Nal-Gly-Glu]-NH2 (Послідовність SEQ ID NO: 52) Одержують, як описано у Прикладі 25, з тією відмінністю, що стадію 1 не виконують, та Fmoc-DGlu(O-аліл) на стадії 2 замінюють Fmoc-Glu(O-аліл). MW обчислена: 929,10; MW знайдена: 929,39. Приклад 41 Цикло[Gly-Tyr-Lys(iPr)-DArg-2Nal-Gly-Asp]-NHEt (Послідовність SEQ ID NO: 53) Одержують, як описано у Прикладі 25, з тією відмінністю, що амідну смолу Rink замінюють [3-({етил-Fmoc-аміно}метил)індол-1-іл]ацетильною смолою AM, стадію 1 не виконують, та FmocDGlu(O-аліл) на стадії 2 замінюють Fmoc-Asp(аліл). MW обчислена: 943,13; MW знайдена: 943,36. Приклад 42 Цикло[Gly-Tyr-Lys(iPr)-DArg-2Nal-Gly-Glu]-NHEt (Послідовність SEQ ID NO: 54) Одержують, як описано у Прикладі 25, з тією відмінністю, що амідну смолу Rink замінюють [3-({етил-Fmoc-аміно}метил)індол-1-іл]ацетильною смолою AM, стадію 1 не виконують, та FmocDGlu(O-аліл) на стадії 2 замінюють Fmoc-Glu(O-аліл). MW обчислена: 957,15; MW знайдена: 957,50. Приклад 43 Цикло[Gly-Tyr-Lys(iPr)-DArg-2Nal-Gly-DGlu]-NHEt (Послідовність SEQ ID NO: 55) Одержують, як описано у Прикладі 25, з тією відмінністю, що амідну смолу Rink замінюють [3-({етил-Fmoc-аміно}метил)індол-1-іл]ацетильною смолою AM, та стадію 1 не виконують. MW обчислена: 957,15; MW знайдена: 957,46. Приклад 44 Цикло[Gly-Tyr-Lys(iPr)-DArg-2Nal-Gly-DGlu]-Arg-NHEt (Послідовність SEQ ID NO: 56) Одержують, як описано у Прикладі 25, з тією відмінністю, що амідну смолу Rink замінюють [3-({етил-Fmoc-аміно}метил)індол-1-іл]ацетильною смолою AM. MW обчислена: 1113,34; MW знайдена: 1113,81. Приклад 44a Цикло[Gly-Tyr-Lys(iPr)-DArg-2Nal-Gly-DGlu]-Arg-NHEt,·сіль з оцтовою кислотою (Послідовність SEQ ID NO: 57) Сіль пептиду, одержаного за Прикладом 44, з TFA перетворюють в сіль оцтової кислоти шляхом адсорбування матеріалу на препаративній колонці С18 відповідного розміру, врівноваженій 2% (об’ємн.) водним розчином оцтової кислоти. Потім колонку промивають 2% (об’ємн.) водним розчином оцтової кислоти в кількості від 3 об’ємів до 5 об’ємів колонки. Елююють пептид, застосовуючи суміш води з ацетонітрилом (1:1 за об’ємом), яка містить 2% оцтової кислоти за об’ємом, та ліофілізують. MW обчислена: 1113,34; MW знайдена: 1113,81. Приклад 45 Цикло[Gly-Tyr-Lys(iPr)-DArg-2Nal-Gly-DGlu]-Lys(iPr)-NHEt (Послідовність SEQ ID NO: 58) Одержують, як описано у Прикладі 25, з тією відмінністю, що амідну смолу Rink замінюють [3-({етил-Fmoc-аміно}метил)індол-1-іл]ацетильною смолою AM, та Fmoc-Arg(Pbf) на стадії 1 замінюють Fmoc-Lys(iPr)(Boc). MW обчислена: 1127,41; MW знайдена: 1127,35. Приклад 46 Цикло[Lys(Ac)-Tyr-Lys(Me2)-DArg-2Nal-Gly-Glu]-Arg-NH2 (Послідовність SEQ ID NO: 59) Одержують, як описано у Прикладі 25, з тією відмінністю, що Fmoc-DGlu(O-аліл) на стадії 2 замінюють Fmoc-Glu(OtBu), Fmoc-Lys(iPr)(Boc) на стадії 6 замінюють Fmoc-Lys(Me2), та FmocGly на стадії 8 замінюють Boc-Lys(Fmoc). Після побудови ланцюга групу Fmoc при бічному ланцюгу N-кінцевої ланки Lys відщеплюють, застосовуючи 20% піперидину в DMF, після чого бічний ланцюг Lys ацетилюють, застосовуючи 10 екв. оцтового ангідриду/DIEA при кімнатній 21 UA 99458 C2 5 10 15 20 25 30 35 40 45 50 55 60 температурі протягом 1 год. Відщеплюють усі групи захисту бічних ланцюгів, і лінійний пептид відщеплюють від твердого субстрату, застосовуючи суміш TFA/вода/TIS/анізол (90/5/2,5/2,5 за об’ємом), протягом 2 год при кімнатній температурі. Замикання циклу неочищеного лінійного пептиду виконують у розчині. Відщеплений від смоли неочищений лінійний пептид (0,25 ммоль) сушать у вакуумі, та розчиняють у 10 мл безводного DMF. Цей розчин пептиду додають за допомогою шприц-насоса протягом 2 год до нижчезазначеної реакційної суміші: 15 мл безводного дихлорметану та 15 мл безводного DMF, який містить 1,0 ммоль PyBOP та 4,0 ммоль DIEA. Після цього дають реакції протікати при кімнатній температурі протягом 2 год. Потім розчинники випарюють у вакуумі, залишок завантажують у колонку С18 для препаративної РХВЕ з оберненою фазою, і цільовий циклопептид виділяють, та ідентифікують, як описано у Прикладі 1. MW обчислена: 1184,42; MW знайдена: 1184,06. Приклад 47 Цикло [Dap(Ac)-Tyr-Lys(Me2)-DArg-2Nal-Gly-Glu]-NH2 (Послідовність SEQ ID NO: 60) Одержують, як описано у Прикладі 25, з тією відмінністю, що стадію 1 не виконують, FmocDGlu(O-аліл) на стадії 2 замінюють Fmoc-Glu(OtBu), Fmoc-Lys(iPr)(Boc) на стадії 6 замінюють Fmoc-Lys(Me2), та Fmoc-Gly на стадії 8 замінюють Boc-Dap(Fmoc). Після побудови ланцюга групу Fmoc при бічному ланцюгу N-кінцевої ланки Dap відщеплюють, застосовуючи 20% піперидину в DMF, після чого бічний ланцюг Dap ацетилюють, застосовуючи 10 екв. оцтового ангідриду/DIEA при кімнатній температурі протягом 1 год. Після цього відщеплюють усі групи захисту бічних ланцюгів, і лінійний пептид відщеплюють від твердого субстрату, застосовуючи суміш TFA/вода/TIS/анізол (90/5/2,5/2,5 за об’ємом), протягом 2 год при кімнатній температурі. Замикання циклу неочищеного лінійного пептиду виконують у розчині. Відщеплений від смоли неочищений лінійний пептид (0,25 ммоль) сушать у вакуумі, та розчиняють у 10 мл безводного DMF. Цей розчин пептиду додають за допомогою шприц-насоса протягом 2 год до нижчезазначеної реакційної суміші: 15 мл безводного дихлорметану та 15 мл безводного DMF, який містить 1,0 ммоль PyBOP та 4,0 ммоль DIEA. Після цього дають реакції протікати при кімнатній температурі протягом 2 год. Потім розчинники випарюють у вакуумі, залишок завантажують у колонку для препаративної РХВЕ, і цільовий циклопептид виділяють, та ідентифікують, як описано у Прикладі 1. MW обчислена: 986,15; MW знайдена: 985,97. Приклад 48 Цикло[Ala-Tyr-Lys(iPr)-DArg-2Nal-Gly-Glu]-NH2 (Послідовність SEQ ID NO: 61) Одержують, як описано у Прикладі 25, з тією відмінністю, що стадію 1 не виконують, FmocDGlu(O-аліл) на стадії 2 замінюють Fmoc-Glu(O-аліл), та Fmoc-Gly на стадії 8 замінюють FmocAla. MW обчислена: 943,13; MW знайдена: 942,92. Приклад 49 Цикло[DAla-Tyr-Lys(iPr)-DArg-2Nal-Gly-Glu]-NH2 (Послідовність SEQ ID NO: 62) Одержують, як описано у Прикладі 25, з тією відмінністю, що стадію 1 не виконують, FmocDGlu(O-аліл) на стадії 2 замінюють Fmoc-Glu(O-аліл), та Fmoc-Gly на стадії 8 замінюють FmocDAla. MW обчислена: 943,13; MW знайдена: 943,44. Приклад 50 Цикло[DAla-Tyr-Lys(iPr)-DArg-2Nal-Gly-DGlu]-NH2 (Послідовність SEQ ID NO: 63) Одержують, як описано у Прикладі 25, з тією відмінністю, що стадію 1 не виконують, та Fmoc-Gly на стадії 8 замінюють Fmoc-DAla. MW обчислена: 943,13; MW знайдена: 943,42. Приклад 51 Цикло[Ala-Tyr-Lys(iPr)-DArg-2Nal-Gly-DGlu]-NH2 (Послідовність SEQ ID NO: 64) Одержують, як описано у Прикладі 25, з тією відмінністю, що стадію 1 не виконують, та Fmoc-Gly на стадії 8 замінюють Fmoc-Ala. MW обчислена: 943,13; MW знайдена: 943,48. Приклад 52 Цикло[Leu-Tyr-Lys(iPr)-DArg-2Nal-Gly-DGlu]-NH2 (Послідовність SEQ ID NO: 65) Одержують, як описано у Прикладі 25, з тією відмінністю, що стадію 1 не виконують, та Fmoc-Gly на стадії 8 замінюють Fmoc-Leu. MW обчислена: 985,21; MW знайдена: 985,56. Приклад 53 Цикло[Leu-Tyr-Lys(iPr)-DArg-2Nal-Gly-Glu]-NH2 (Послідовність SEQ ID NO: 66) Одержують, як описано у Прикладі 25, з тією відмінністю, що стадію 1 не виконують, FmocDGlu(O-аліл) на стадії 2 замінюють Fmoc-Glu(O-аліл), та Fmoc-Gly на стадії 8 замінюють FmocLeu. MW обчислена: 985,21; MW знайдена: 985,49. Приклад 54 Цикло[DPhe-Tyr-Lys(iPr)-DArg-2Nal-Gly-Glu]-NH2 (Послідовність SEQ ID NO: 67) Одержують, як описано у Прикладі 25, з тією відмінністю, що стадію 1 не виконують, FmocDGlu(O-аліл) на стадії 2 замінюють Fmoc-Glu(O-аліл), та Fmoc-Gly на стадії 8 замінюють Fmoc 22 UA 99458 C2 MW обчислена: 1019,22; MW знайдена: 1019,52. Приклад 55 Цикло[Phe-Tyr-Lys(iPr)-DArg-2Nal-Gly-Glu]-NH2 (Послідовність SEQ ID NO: 68) Одержують, як описано у Прикладі 25, з тією відмінністю, що стадію 1 не виконують, FmocDGlu(O-аліл) на стадії 2 замінюють Fmoc-Glu(O-аліл), та Fmoc-Gly на стадії 8 замінюють FmocPhe. MW обчислена: 1019,22; MW знайдена: 1019,53. Приклад 56 Цикло[DPhe-Tyr-Lys(iPr)-DArg-2Nal-Gly-DGlu]-NH2 (Послідовність SEQ ID NO: 69) Одержують, як описано у Прикладі 25, з тією відмінністю, що стадію 1 не виконують, та Fmoc-Gly на стадії 8 замінюють Fmoc-DPhe. MW обчислена: 1019,22; MW знайдена: 1019,50. Приклад 57 Цикло[Phe-Tyr-Lys(iPr)-DArg-2Nal-Gly-DGlu]-Lys(iPr)-NH2 (Послідовність SEQ ID NO: 70) Одержують, як описано у Прикладі 25, з тією відмінністю, що Fmoc-Arg(Pbf) на стадії 1 замінюють Fmoc-Lys(iPr)(Boc), та Fmoc-Gly на стадії 8 замінюють Fmoc-Phe. MW обчислена: 1189,48; MW знайдена: 1189,92. Приклад 57a Цикло[Phe-Tyr-Lys(iPr)-DArg-2Nal-Gly-DGlu]-Lys(iPr)-NH2, сіль з оцтовою кислотою (Послідовність SEQ ID NO: 71) Сіль пептиду, одержаного за Прикладом 57, з TFA перетворюють в сіль оцтової кислоти шляхом адсорбування матеріалу на препаративній колонці С18 відповідного розміру, врівноваженій 2% (об’ємн.) водним розчином оцтової кислоти. Потім колонку промивають 2% (об’ємн.) водним розчином оцтової кислоти в кількості від 3 об’ємів до 5 об’ємів колонки. Елююють пептид, застосовуючи суміш води з ацетонітрилом (1:1 за об’ємом), яка містить 2% оцтової кислоти за об’ємом, та ліофілізують. MW обчислена: 1189,48; MW знайдена: 1189,92. Приклад 58 Цикло[Phe-Tyr-Lys(iPr)-DArg-2Nal-Gly-DGlu]-Arg-NH2 (Послідовність SEQ ID NO: 72) Одержують, як описано у Прикладі 25, з тією відмінністю, що Fmoc-Gly на стадії 8 замінюють Fmoc-Phe. MW обчислена: 1175,41; MW знайдена: 1175,81. Приклад 59 Цикло[Phe-Tyr-Lys(iPr)-DArg-2Nal-Gly-DGlu]-NH2 (Послідовність SEQ ID NO: 73) Одержують, як описано у Прикладі 25, з тією відмінністю, що стадію 1 не виконують, та Fmoc-Gly на стадії 8 замінюють Fmoc-Phe. MW обчислена: 1019,22; MW знайдена: 1019,56. Приклад 60 Цикло[Phe-Tyr-Lys(iPr)-DArg-2Nal-Gly-DGlu]-Lys(iPr)-NHEt (Послідовність SEQ ID NO: 74) Одержують, як описано у Прикладі 25, з тією відмінністю, що амідну смолу Rink замінюють [3-({етил-Fmoc-аміно}метил)індол-1-іл]ацетильною смолою AM, Fmoc-Arg(Pbf) на стадії 1 замінюють Fmoc-Lys(iPr)(Boc), та Fmoc-Gly на стадії 8 замінюють Fmoc-Phe. MW обчислена: 1217,53; MW знайдена: 1217,97. Приклад 60a Цикло[Phe-Tyr-Lys(iPr)-DArg-2Nal-Gly-DGlu]-Lys(iPr)-NHEt, сіль з оцтовою кислотою (Послідовність SEQ ID NO: 75) Сіль пептиду, одержаного за Прикладом 60, з TFA перетворюють в сіль оцтової кислоти шляхом адсорбування матеріалу на препаративній колонці С18 відповідного розміру, врівноваженій 2% (об’ємн.) водним розчином оцтової кислоти. Потім колонку промивають 2% (об’ємн.) водним розчином оцтової кислоти в кількості від 3 об’ємів до 5 об’ємів колонки. Елююють пептид, застосовуючи суміш води з ацетонітрилом (1:1 за об’ємом), яка містить 2% оцтової кислоти за об’ємом, та ліофілізують. MW обчислена: 1217,53; MW знайдена: 1217,97. Приклад 61 Цикло[DAla-Tyr-Lys(iPr)-DArg-2Nal-Gly-Glu]-NHEt (Послідовність SEQ ID NO: 76) Одержують, як описано у Прикладі 25, з тією відмінністю, що амідну смолу Rink замінюють [3-({етил-Fmoc-аміно}метил)індол-1-іл]ацетильною смолою AM, стадію 1 не виконують, FmocDGlu(O-аліл) на стадії 2 замінюють Fmoc-Glu(O-аліл), та Fmoc-Gly на стадії 8 замінюють FmocDAla. MW обчислена: 971,18; MW знайдена: 971,49. Приклад 62 Цикло[2Nal-Tyr-Lys(iPr)-DArg-2Nal-Gly-Glu]-NHEt (Послідовність SEQ ID NO: 77) Одержують, як описано у Прикладі 25, з тією відмінністю, що амідну смолу Rink замінюють [3-({етил-Fmoc-аміно}метил)індол-1-іл]ацетильною смолою AM, стадію 1 не виконують, FmocDGlu(O-аліл) на стадії 2 замінюють Fmoc-Glu(O-аліл), та Fmoc-Gly на стадії 8 замінюють Fmoc2Nal. MW обчислена: 1097,34; MW знайдена: 1097,53. Приклад 63 DPhe. 5 10 15 20 25 30 35 40 45 50 55 60 23 UA 99458 C2 5 10 15 20 25 30 35 40 45 50 55 60 Цикло[DPhe-Tyr-Lys(iPr)-DArg-2Nal-Gly-Glu]-NHEt (Послідовність SEQ ID NO: 78) Одержують, як описано у Прикладі 25, з тією відмінністю, що амідну смолу Rink замінюють [3-({етил-Fmoc-аміно}метил)індол-1-іл]ацетильною смолою AM, стадію 1 не виконують, FmocDGlu(O-аліл) на стадії 2 замінюють Fmoc-Glu(O-аліл), та Fmoc-Gly на стадії 8 замінюють FmocDPhe. MW обчислена: 1047,28; MW знайдена: 1047,51. Приклад 64 Цикло[Phe-Tyr-Lys(iPr)-DArg-2Nal-Gly-Glu]-NHEt (Послідовність SEQ ID NO: 79) Одержують, як описано у Прикладі 25, з тією відмінністю, що амідну смолу Rink замінюють [3-({етил-Fmoc-аміно}метил)індол-1-іл]ацетильною смолою AM, стадію 1 не виконують, FmocDGlu(O-аліл) на стадії 2 замінюють Fmoc-Glu(O-аліл), та Fmoc-Gly на стадії 8 замінюють FmocPhe. MW обчислена: 1047,28; MW знайдена: 1047,57. Приклад 65 Цикло[Gly-Tyr-Lys(iPr)-DArg-2Nal-Gly-DGlu]-Gly-2Nal-NH2 (Послідовність SEQ ID NO: 80) Одержують, як описано у Прикладі 25, з тією відмінністю, що Fmoc-Arg(Pbf) на стадії 1 замінюють Fmoc-2Nal, та між стадією 1 та стадією 2 виконують додаткову стадію із застосуванням Fmoc-Gly. MW обчислена: 1183,39; MW знайдена: 1183,26. Приклад 66 Цикло[Gly-Tyr-Lys(iPr)-DArg-2Nal-Gly-Glu]--Ala-D2Nal-NH2 (Послідовність SEQ ID NO: 81) Одержують, як описано у Прикладі 25, з тією відмінністю, що Fmoc-Arg(Pbf) на стадії 1 замінюють Fmoc-D2Nal, між стадією 1 та стадією 2 виконують додаткову стадію із застосуванням Fmoc--Ala, та Fmoc-DGlu(O-аліл) на стадії 2 замінюють Fmoc-Glu(O-аліл). MW обчислена: 1197,40; MW знайдена: 1196,70. Приклад 67 Цикло[-Ala-Tyr-Arg-DArg-2Nal-Gly-Glu]-Arg-NH2 (Послідовність SEQ ID NO: 82) Одержують, як описано у Прикладі 25, з тією відмінністю, що Fmoc-DGlu(O-аліл) на стадії 2 замінюють Fmoc-Glu(O-аліл), Fmoc-Lys(iPr)(Boc) на стадії 6 замінюють Fmoc-Arg(Pbf), та FmocGly на стадії 8 замінюють Fmoc--Ala. MW обчислена: 1085,25; MW знайдена: 1085,05. Приклад 68 Цикло[-Ala-Tyr-Arg-DArg-2Nal-Gly-Asp]-Arg-NH2 (Послідовність SEQ ID NO: 83) Одержують, як описано у Прикладі 25, з тією відмінністю, що Fmoc-DGlu(O-аліл) на стадії 2 замінюють Fmoc-Asp(O-аліл), Fmoc-Lys(iPr)(Boc) на стадії 6 замінюють Fmoc-Arg(Pbf), та FmocGly на стадії 8 замінюють Fmoc--Ala. MW обчислена: 1071,22; MW знайдена: 1071,15. Приклад 69 Цикло[5-аміновалерил-Tyr-Arg-DArg-2Nal-Gly-Glu]-Arg-NH2 (Послідовність SEQ ID NO: 84) Одержують, як описано у Прикладі 25, з тією відмінністю, що Fmoc-DGlu(O-аліл) на стадії 2 замінюють Fmoc-Glu(O-аліл), Fmoc-Lys(iPr)(Boc) на стадії 6 замінюють Fmoc-Arg(Pbf), та FmocGly на стадії 8 замінюють Fmoc-5-аміновалеріановою кислотою. MW обчислена: 1113,30; MW знайдена: 1113,40. Приклад 70 Цикло[5-аміновалерил-Tyr-Arg-DArg-2Nal-Gly-Asp]-Arg-NH2 (Послідовність SEQ ID NO: 85) Одержують, як описано у Прикладі 25, з тією відмінністю, що Fmoc-DGlu(O-аліл) на стадії 2 замінюють Fmoc-Asp(O-аліл), Fmoc-Lys(iPr)(Boc) на стадії 6 замінюють Fmoc-Arg(Pbf), та FmocGly на стадії 8 замінюють Fmoc-5-аміновалеріановою кислотою. MW обчислена: 1099,27; MW знайдена: 1100,25. Приклад 71 Цикло[(4-AMPA)-Tyr-Arg-DArg-2Nal-Gly-Asp]-Arg-NH2 (Послідовність SEQ ID NO: 86) Одержують, як описано у Прикладі 25, з тією відмінністю, що Fmoc-DGlu(O-аліл) на стадії 2 замінюють Fmoc-Asp(O-аліл), Fmoc-Lys(iPr)(Boc) на стадії 6 замінюють Fmoc-Arg(Pbf), та FmocGly на стадії 8 замінюють Fmoc-4-амінометилфенілоцтовою кислотою (4-AMPA). MW обчислена: 1147,32; MW знайдена: 1148,20. Приклад 72 Цикло[(4-AMPA)-Tyr-Arg-DArg-2Nal-Gly-Glu]-Arg-NH2 (Послідовність SEQ ID NO: 87) Одержують, як описано у Прикладі 25, з тією відмінністю, що Fmoc-DGlu(O-аліл) на стадії 2 замінюють Fmoc-Glu(O-аліл), -Lys(iPr)(Boc) на стадії 6 замінюють Fmoc-Arg(Pbf), та Fmoc-Gly на стадії 8 замінюють Fmoc-4-амінометилфенілоцтовою кислотою (4-AMPA). MW обчислена: 1161,34; MW знайдена: 1161,99. Приклад 73 Цикло[(4-AMPA)-Tyr-Arg-DArg-2Nal-Gly-Glu]-DArg-NH2 (Послідовність SEQ ID NO: 88) Одержують, як описано у Прикладі 25, з тією відмінністю, що Fmoc-Arg(Pbf) на стадії 1 замінюють Fmoc-DArg(Pbf), Fmoc-DGlu(O-аліл) на стадії 2 замінюють Fmoc-Glu(O-аліл), Fmoc 24 UA 99458 C2 5 10 15 20 25 30 35 40 45 50 55 60 Lys(iPr)(Boc) на стадії 6 замінюють Fmoc-Arg(Pbf), та Fmoc-Gly на стадії 8 замінюють Fmoc-4амінометилфенілоцтовою кислотою (4-AMPA). MW обчислена: 1161,34; MW знайдена: 1161,83. Приклад 74 Цикло[(4-AMB)-Tyr-Arg-DArg-2Nal-Gly-Glu]-Arg-NH2 (Послідовність SEQ ID NO: 89) Одержують, як описано у Прикладі 25, з тією відмінністю, що Fmoc-DGlu(O-аліл) на стадії 2 замінюють Fmoc-Glu(O-аліл), Fmoc-Lys(iPr)(Boc) на стадії 6 замінюють Fmoc-Arg(Pbf), та FmocGly на стадії 8 замінюють Fmoc-4-амінометилбензойною кислотою (4-AMB). MW обчислена: 1147,32; MW знайдена: 1147,66. Приклад 75 Цикло[Gly-Tyr-Lys(iPr)-DArg-2Nal-Gly-DGlu]-Lys(iPr)-Gly-2Nal-NH2 (Послідовність SEQ ID NO: 90) Одержують, як описано у Прикладі 25, з тією відмінністю, що стадію 1 замінюють послідовним приєднанням таких трьох залишків: спочатку Fmoc-2Nal, потім Fmoc-Gly, і після цього Fmoc-Lys(iPr)(Boc). MW обчислена: 1353,69; MW знайдена: 1354,03. Приклад 76 Цикло[Phe-Tyr-Lys(iPr)-DArg-2Nal-Gly-DGlu]-Lys(iPr)-Gly-2Nal-NH2 (Послідовність SEQ ID NO: 91) Одержують, як описано у Прикладі 25, з тією відмінністю, що стадію 1 замінюють послідовним приєднанням таких трьох залишків: спочатку Fmoc-2Nal, потім Fmoc-Gly, і після цього Fmoc-Lys(iPr)(Boc). Крім того, Fmoc-Gly на стадії 8 замінюють Fmoc-Phe. MW обчислена: 1443,82; MW знайдена: 1444,13. Приклад 77 Цикло[Gly-Tyr-Lys(iPr)-DArg-2Nal-Gly-DGlu]-Gly-DPhe-NH2 (Послідовність SEQ ID NO: 92) Одержують, як описано у Прикладі 25, з тією відмінністю, що стадію 1 замінюють послідовним приєднанням таких двох залишків: спочатку Fmoc-DPhe, потім Fmoc-Gly. MW обчислена: 1133,36; MW знайдена: 1133,73. Приклад 78 Цикло[Gly-Tyr-Lys(iPr)-DArg-2Nal-Gly-DGlu]-Lys(iPr)-DPhe-NH2 (Послідовність SEQ ID NO: 93) Одержують, як описано у Прикладі 25, з тією відмінністю, що стадію 1 замінюють послідовним приєднанням таких двох залишків: спочатку Fmoc-DPhe, потім Fmoc-Lys(iPr)(Boc). MW обчислена: 1246,58; MW знайдена: 1246,88. Приклад 79 Цикло[Lys-Tyr-Lys(iPr)-DArg-2Nal-Gly-DGlu]-Lys(iPr)-NH2 (Послідовність SEQ ID NO: 94) Одержують, як описано у Прикладі 25, з тією відмінністю, що Fmoc-Arg(Pbf) на стадії 1 замінюють Fmoc-Lys(iPr)(Boc), та Fmoc-Gly на стадії 8 замінюють Fmoc-Lys(Boc). MW обчислена: 1170,50; MW знайдена: 1169,80. Приклад 80 Цикло[Phe-Tyr-Lys-DArg-2Nal-Gly-DGlu]-Lys(iPr)-NH2 (Послідовність SEQ ID NO: 95) Одержують, як описано у Прикладі 25, з тією відмінністю, що Fmoc-Arg(Pbf) на стадії 1 замінюють Fmoc-Lys(iPr)(Boc), Fmoc-Lys(iPr)(Boc) на стадії 6 замінюють Fmoc-Lys(Boc), та FmocGly на стадії 8 замінюють Fmoc-Phe. MW обчислена: 1147,40; MW знайдена: 1146,70. Приклад 81 Цикло[Phe-Tyr-Lys(iPr)-DArg-2Nal-Gly-DGlu]-Lys-NH2 (Послідовність SEQ ID NO: 96) Одержують, як описано у Прикладі 25, з тією відмінністю, що Fmoc-Arg(Pbf) на стадії 1 замінюють Fmoc-Lys(Boc), та Fmoc-Gly на стадії 8 замінюють Fmoc-Phe. MW обчислена: 1147,40; MW знайдена: 1146,70. Приклад 82 Цикло[Phe-Tyr-Lys(iPr)-DArg-2Nal-Gly-DGlu]-Orn-NH2 (Послідовність SEQ ID NO: 97) Одержують, як описано у Прикладі 25, з тією відмінністю, що Fmoc-Arg(Pbf) на стадії 1 замінюють Fmoc-Orn(Boc), та Fmoc-Gly на стадії 8 замінюють Fmoc-Phe. MW обчислена: 1133,40; MW знайдена: 1132,70. Приклад 83 Цикло[Phe-Tyr-Lys-DArg-2Nal-Gly-DGlu]-Lys-NH2 (Послідовність SEQ ID NO: 98) Одержують, як описано у Прикладі 25, з тією відмінністю, що обидва Fmoc-Arg(Pbf) на стадії 1 та Fmoc-Lys(iPr)(Boc) на стадії 6 замінюють Fmoc-Lys(Boc), та Fmoc-Gly на стадії 8 замінюють Fmoc-Phe. MW обчислена: 1105,37; MW знайдена: 1105,40. Приклад 84 Цикло[Phe-Tyr-Lys-DArg-2Nal-Gly-DGlu]-Lys-NHEt (Послідовність SEQ ID NO: 99) Одержують, як описано у Прикладі 25, з тією відмінністю, що смолу Rink замінюють [3({етил-Fmoc-аміно}метил)індол-1-іл]ацетильною смолою AM, обидва Fmoc-Arg(Pbf) на стадії 1 25 UA 99458 C2 5 10 15 20 25 30 35 40 та Fmoc-Lys(iPr)(Boc) на стадії 6 замінюють Fmoc-Lys(Boc), та Fmoc-Gly на стадії 8 замінюють Fmoc-Phe. MW обчислена: 1133,36; MW знайдена: 1133,82. Приклад 85 Альтернативна методика I синтезу цикло[Phe-Tyr-Lys(iPr)-DArg-2Nal-Gly-DGlu]-Lys(iPr)-NH2 (Послідовність SEQ ID NO: 70) У Прикладі 57 описаний синтез сполуки послідовності SEQ ID NO: 70 шляхом твердофазового синтезу пептиду із застосуванням Fmoc з використанням наявного на ринку реагента Fmoc-Lys(iPr)Boc, який є дорогим та складним для одержання у великих кількостях. Спосіб, описаний у цьому Прикладі, уможливлює синтез сполуки послідовності SEQ ID NO: 70 із застосуванням дешевшого реагента Fmoc-Lys(Boc), замикання циклу в розчині, та алкілування лізину шляхом відновлювального амінування із застосуванням ціаноборгідриду натрію, що забезпечує більш економічний спосіб одержання згаданого кінцевого продукту. Інші переваги полягають у тому, що середовища проведення реакції (оцтова кислота, ацетон та метанол) є відносно недорогими, умови реакції легко піддаються регулюванню, співвідношення розчинників можна варіювати в широких межах без впливу на реакцію алкілування, та вихід по стадії виділення становить 90% або вище. Послідовність Phe-Tyr(tBu)-Lys(Boc)-DArg(Pbf)-2Nal-Gly-DGlu(O-аліл)-Lys(Boc) (Послідовність SEQ ID NO: 100) одержують на амідній смолі Rink за стандартною методикою із застосуванням Fmoc, використовуючи прилад ABI 431 Peptide Synthesizer, як показано на Схемі 7. Автоматизовану побудову виконують, застосовуючи стандартну методику фірми Applied Biosystems з використанням DCC/HOBt або методику FastMoc з використанням HBTU/DIEA згідно з інструкціями постачальника (PE Applied Biosystems Inc., Foster City, CA). Застосовують таку схему груп захисту бічних ланцюгів: Lys(Boc), DGlu(O-аліл), DArg(Pbf), Tyr(tBu). Постадійна побудова ланцюга починається з С-кінцевої ланки лінійного пептиду і виконується за 8 стадій. На стадії 1 4 екв. захищеної амінокислоти Fmoc-Lys(Boc) активують DCC/HOBt (або HBTU/DIEA для методики FastMoc) в NMP та приєднують до амідної смоли Rink з відщепленими групами захисту. На стадії 2 4 екв. Fmoc-DGlu(O-аліл) активують та приєднують до одержаної на стадії 1 смоли з пептидом, від якого відщеплені групи захисту. Виконують відповідні стадії до завершення стадії 8 – приєднання Fmoc-Phe. Групу захисту бічного ланцюга (аліловий складний ефір) відщеплюють, застосовуючи 0,1 екв. Pd(Ph3P)4 у присутності 24 екв. фенілсилану в дихлорметані (Схема 8). Цей процес повторюють ще один раз для повного відщеплення груп захисту від бічного ланцюга. Потім групу Fmoc відщеплюють від N-кінцевої ланки, застосовуючи 20% піперидину в DMF. Позбавлений груп захисту карбоксильний фрагмент DGlu активують PyBOP/DIEA, та замикають цикл на -аміногрупу ланки Phe на смолі. Відщеплюють групи захисту від одержаного циклізованого пептиду, та одночасно відщеплюють пептид від смоли, застосовуючи поглинальну суміш TFA/H2O/TIS/EDT (95/2/1/2, за об’ємом) або TFA/H2O/TIS/анізол (92/2/4/2, за об’ємом), протягом 2 год при кімнатній температурі. Потім розчинники випарюють у вакуумі, пептид осаджують, та тричі промивають охолодженим діетиловим ефіром для видалення поглиначів. 26 UA 99458 C2 27 UA 99458 C2 Схема 7. Побудова ланцюга пептиду на твердій фазі 5 Схема 8. Одержання циклопептиду-попередника Очищення циклопептиду-попередника виконують, застосовуючи стандартні способи препаративної РХВЕ. Неочищений продукт після відщеплення від смоли розчиняють у мінімальній кількості DMSO, завантажують у колонку С18 для РХВЕ з оберненою фазою, та 28
ДивитисяДодаткова інформація
Назва патенту англійськоюCyclic peptide cxcr4 antagonists
Автори англійськоюKohn, Wayne, David, Peng, Sheng-bin, Yan, Leang, Zeng
Назва патенту російськоюЦиклопептидные антагонисты cxcr4
Автори російськоюКон Уэйн Дейвид, Пен Шен-бинь, Янь Лян Цзен
МПК / Мітки
МПК: C07K 7/54, A61P 31/18, A61K 38/12
Мітки: антагоністи, циклопептидні, cxcr4
Код посилання
<a href="https://ua.patents.su/149-99458-ciklopeptidni-antagonisti-cxcr4.html" target="_blank" rel="follow" title="База патентів України">Циклопептидні антагоністи cxcr4</a>
Попередній патент: Пристрої трансдермальної доставки, що забезпечують поліпшене вивільнення активної речовини через біологічну поверхню розділу
Наступний патент: Похідні 9-(піразол-3-іл)-9н-пурин-2-аміну і 3-(піразол-3-іл)-3н-імідазо[4,5-b]піридин-5-аміну та їх застосування для лікування раку
Випадковий патент: Косовалкова машина для правки труб і прутків