2-(заміщені аміно)бензотіазолсульфонамідні інгібітори віл-протеази
Номер патенту: 96445
Опубліковано: 10.11.2011
Автори: Баумістер Джудіт Єва, Ласт Стефаан Джулієн, де Кок Херман Августінус, Боонантс Пауль Джозеф Габріель Марія, Джонкєрс Тім Хуго Марія, ван 'Т Клоостер Гербен Алберт Елєузеріус, Діерінк Інге
Формула / Реферат
1. Сполука, що має формулу (І)
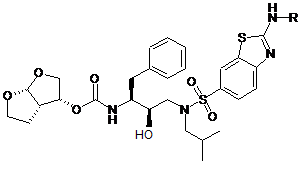 , (I)
, (I)
її сіль або стереоізомерна форма, де
R являє собою піперидинове або піролідинове кільце, що необов'язково заміщене на одному або декількох членах кільця С1-6алкілом, С3-7циклоалкілом, С1-6алкілоксі-С1-6алкілом, -С(=О)-С1-6алкіламіно-С1-6алкілом, -С(=О)-С1-6алкіл-Неt1, -С(=О)-С1-6алкіл-Неt2, бензилом, фенілом або С1-6алкілом, заміщеним Het2, де
Het1, як група або частина групи, означає насичений або частково ненасичений моноциклічний, біциклічний або трициклічний гетероцикл, що переважно містить від 3 до 14 членів кільця, більш переважно від 5 до 10 членів кільця та більш переважно від 5 до 6 членів кільця, що містить один або декілька гетероатомних членів кільця, вибраних з азоту, кисню або сірки, та який необов'язково заміщений на одному або декількох атомах азоту та/або вуглецю С1-6алкілом, С1-6алкілокси, аміноС1-6алкілом, галогеном, гідрокси, ацетилом, оксо, необов'язково моно- або дизаміщеним аміно, необов'язково моно- або дизаміщеним аміноалкілом, нітро, ціано, галогенС1-6алкілом, карбокси, С1-6алкоксикарбонілом, С3-7циклоалкілом, необов'язково моно- або дизаміщеним амінокарбонілом, метилтіо, метилсульфонілом, арилом та насиченим або частково ненасиченим моноциклічним, біциклічним або трициклічним циклом або гетероциклом, що містить від 3 до 14 членів, та де
Het2, як група або частина групи, означає ароматичний моноциклічний, біциклічний або трициклічний гетероцикл, що переважно містить від 3 до 14 членів кільця, більш переважно від 5 до 10 членів кільця та більш переважно від 5 до 6 членів кільця, що містить один або декілька гетероатомних членів кільця, вибраних з азоту, кисню або сірки, та який необов'язково заміщений на одному або декількох атомах азоту та/або вуглецю С1-6алкілом, що може бути необов'язково заміщений С3-7циклоалкілом, С1-6алкілокси, аміноС1-6алкілом, галогеном, гідрокси, необов'язково моно- або дизаміщеним аміно, нітро, ціано, галогенС1-6алкілом, карбокси, С1-6алкоксикарбонілом, С3-7циклоалкілом, необов'язково моно- або дизаміщеним амінокарбонілом, метилтіо, метилсульфонілом, арилом, Het1 та ароматичним моноциклічним, біциклічним або трициклічним циклом або гетероциклом, що містить від 3 до 12 членів кільця.
2. Сполука за п. 1, де R являє собою піперидинове кільце, заміщене на N-атомі кільця С3-7циклоалкілом.
3. Сполука за п. 2, де С3-7циклоалкіл являє собою C5циклоалкіл.
4. Сполука за п. 3, що має формулу (II)
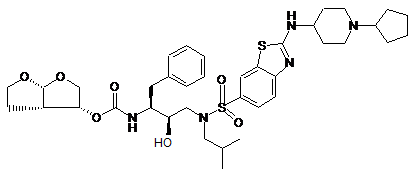 .
.
5. Сполука за п. 4, що має хімічну назву гексагідрофуро[2,3-b]фуран-3-іловий складний ефір (1-бензил-3-{[2-(1-циклопентилпіперидин-4-іламіно)-бензотіазол-6-сульфоніл]-ізобутиламіно}-2-гідроксипропіл)карбамінової кислоти.
6. Фармацевтична композиція, що містить ефективну кількість щонайменше однієї сполуки за будь-яким з пп. 1-5 та фармацевтично прийнятний ексципієнт.
7. Спосіб одержання фармацевтичної композиції за п. 6, який включає стадію, при якій одну із сполук за будь-яким з пп. 1-5, разом з твердими або рідкими фармацевтичними ексципієнтами та/або допоміжними засобами та, за потреби, у комбінації з іншими активними фармацевтичними сполуками, вводять у прийнятну для введення форму або дозовану форму.
8. Застосування сполуки за будь-яким з пп. 1-5 як лікарського засобу.
9. Спосіб інгібування протеази ретровірусу, резистентного до багатьох лікарських засобів, у ссавця, інфікованого зазначеним ретровірусом, який включає стадію введення сполуки, яка є інгібітором протеази, за пп. 1-5 ссавцю, що цього потребує.
10. Спосіб лікування або пригнічення інфекції або захворювання, пов'язаного з ретровірусною інфекцією, резистентною до багатьох лікарських засобів, у ссавця, при якому здійснюють введення ефективної кількості щонайменше однієї сполуки за пп. 1-5 зазначеному ссавцю.
11. Спосіб інгібування ретровірусної реплікації, стійкої до багатьох лікарських засобів, при якому здійснюють контактування ретровірусу з ефективною кількістю щонайменше однієї сполуки за будь-яким з пп. 1-5.
12. Застосування сполуки за будь-яким з пп. 1-5 при одержанні лікарського засобу для лікування або пригнічення інфекції або захворювання, пов'язаного з ретровірусною інфекцією, стійкою до багатьох лікарських засобів, у ссавця.
13. Композиція, що містить щонайменше (а) сполуку формули (І) або (II) за пп. 1-5 та (b) другий антиретровірусний агент для одночасного, роздільного або послідовного застосування.
14. Композиція за п. 13, де другим агентом є ритонавір.
15. Композиція за п. 14, де сполукою формули II є гексагідрофуро[2,3-b]фуран-3-іловий складний ефір (1-бензил-3-{[2-(1-циклопентилпіперидин-4-іламіно)-бензотіазол-6-сульфоніл]ізобутиламіно}-2-гідроксипропіл)-карбамінової кислоти.
Текст
1. Сполука, що має формулу (І) 3 96445 4 5. Сполука за п. 4, що має хімічну назву гексагідрофуро[2,3-b]фуран-3-іловий складний ефір (1бензил-3-{[2-(1-циклопентилпіперидин-4-іламіно)бензотіазол-6-сульфоніл]-ізобутиламіно}-2гідроксипропіл)карбамінової кислоти. 6. Фармацевтична композиція, що містить ефективну кількість щонайменше однієї сполуки за будьяким з пп. 1-5 та фармацевтично прийнятний ексципієнт. 7. Спосіб одержання фармацевтичної композиції за п. 6, який включає стадію, при якій одну із сполук за будь-яким з пп. 1-5, разом з твердими або рідкими фармацевтичними ексципієнтами та/або допоміжними засобами та, за потреби, у комбінації з іншими активними фармацевтичними сполуками, вводять у прийнятну для введення форму або дозовану форму. 8. Застосування сполуки за будь-яким з пп. 1-5 як лікарського засобу. 9. Спосіб інгібування протеази ретровірусу, резистентного до багатьох лікарських засобів, у ссавця, інфікованого зазначеним ретровірусом, який включає стадію введення сполуки, яка є інгібітором протеази, за пп. 1-5 ссавцю, що цього потребує. 10. Спосіб лікування або пригнічення інфекції або захворювання, пов'язаного з ретровірусною інфек цією, резистентною до багатьох лікарських засобів, у ссавця, при якому здійснюють введення ефективної кількості щонайменше однієї сполуки за пп. 1-5 зазначеному ссавцю. 11. Спосіб інгібування ретровірусної реплікації, стійкої до багатьох лікарських засобів, при якому здійснюють контактування ретровірусу з ефективною кількістю щонайменше однієї сполуки за будьяким з пп. 1-5. 12. Застосування сполуки за будь-яким з пп. 1-5 при одержанні лікарського засобу для лікування або пригнічення інфекції або захворювання, пов'язаного з ретровірусною інфекцією, стійкою до багатьох лікарських засобів, у ссавця. 13. Композиція, що містить щонайменше (а) сполуку формули (І) або (II) за пп. 1-5 та (b) другий антиретровірусний агент для одночасного, роздільного або послідовного застосування. 14. Композиція за п. 13, де другим агентом є ритонавір. 15. Композиція за п. 14, де сполукою формули II є гексагідрофуро[2,3-b]фуран-3-іловий складний ефір (1-бензил-3-{[2-(1-циклопентилпіперидин-4іламіно)-бензотіазол-6-сульфоніл]ізобутиламіно}2-гідроксипропіл)-карбамінової кислоти. Даний винахід відноситься до 2-(заміщених аміно)-бензотіазолсульфонамідних сполук та похідних, їх застосування як інгібіторів протеази, зокрема, як інгібіторів ВІЛ-протеази широкого спектру, способів їх одержання, а також фармацевтичних композицій та діагностичних наборів, що містять їх. Даний винахід також відноситься до комбінацій даних 2-(заміщених аміно)-бензотіазолсульфонамідних сполук та похідних з іншим антиретровірусним агентом. Винахід, крім того, відноситься до їх застосування в дослідженнях як еталонних сполук або як реагентів. Вірус, що є причиною синдрому набутого імунодефіциту (СНІД), відомий під різними назвами, що включають Т-лімфоцитарний вірус III (HTLV-III) або вірус, асоційований з лімфаденопатією (LAV), або СНІД-асоційований вірус (ARV), або вірус імунодефіциту людини (ВІЛ). На даний час ідентифіковані два різних сімейства, тобто, ВІЛ-1 та ВІЛ-2. Надалі, ВІЛ буде застосовуватися до загального позначення цих вірусів. Одним з відповідальних шляхів метаболізму в життєвому циклі ретровірусу є процесинг попередників полібілка аспарагіновою протеазою. Наприклад, ВІЛ вірусний білок gag-pol процесує протеаза ВІЛ. Коректний процесинг полібілків попередників аспарагіновою протеазою потрібен для зборки інфекційних віріонів, роблячи тим самим аспарагінову протеазу привабливою мішенню для антивірусної терапії. Зокрема, для лікування ВІЛ протеаза ВІЛ є перспективною мішенню. Інгібітори протеази ВІЛ (РІ) звичайно вводять пацієнтам зі СНІД у комбінації з іншими сполуками проти ВІЛ, такими як, наприклад, нуклеозидні інгібітори зворотної транскриптази (NRTI), ненуклеозидні інгібітори зворотної транскриптази (NNRTI), гібридні інгібітори, такі як Т-20 або інші інгібітори протеази. Незважаючи на той факт, що ці антиретровірусні засоби є досить корисними, вони мають загальне обмеження, а саме, націлювані у ВІЛ ферменти також здатні до мутації таким чином, що відомі лікарські засоби стають менш ефективними або навіть неефективними проти мутантних вірусів ВІЛ. Або, іншими словами, ВІЛ створює постійно зростаючу резистентність проти придатних лікарських засобів. Резистентність ретровірусів та, особливо ВІЛ, проти інгібіторів є основною причиною невдачі терапії. Наприклад, половина пацієнтів, що одержують комбіновану терапію проти ВІЛ, зовсім не реагують налікування, основним чином через резистенцію вірусу до одного або декількох лікарських засобів, що використовуються. Крім того, показано, що резистентний вірус передається знову інфікованим індивідуумам, що приводить до строго обмежених терапевтичних можливостей для таких лікарсько-беззахисних пацієнтів. Тому, в даній галузі техніки існує потреба в нових сполуках для ретровірусної терапії, більш конкретно, для терапії СНІД. Існує особливо гостра потреба в сполуках, що є активними не тільки проти дикого типу ВІЛ, але також проти значно більш розповсюдженого резистентного ВІЛ. Відомі антиретровірусні засоби, що часто застосовуються в схемі комбінованої терапії, які наведені вище, будуть в результаті викликати резистенцію. Часто це може змушувати лікаря збільшувати рівні активних лікарських засобів у плазмі для того, щоб зазначеним антиретровірусним засобам знову повернути ефективність проти мутованого ВІЛ. У результаті чого відбувається досить небажане збільшення навантаження таб 5 летками. Збільшення рівнів у плазмі також може призвести до підвищеного ризику не дотримання прописаної терапії. Тому, не тільки важливо мати сполуки, що демонструють активність проти широкого ряду мутантів ВІЛ, а також важливо те, щоб сполуки мали незначну зміну або не мали змін у відношенні між активністю проти мутантного вірусу ВІЛ та активністю проти вірусу ВІЛ дикого типу (також названого кратною резистенцією або FR) у межах широкої області мутантних штамів ВІЛ. Власне кажучи, пацієнт може мати таку ж схему комбінованої терапії протягом більш тривалого періоду часу, оскільки імовірність того, що мутантний вірус ВІЛ буде чутливим до активних інгредієнтів, буде підвищуватися. Виявлення сполук з високою ефективністю проти дикого типу вірусу та проти широкого ряду мутантів також є важливим, оскільки навантаження таблетками можна зменшити, якщо терапевтичні рівні підтримувати на мінімумі. Одним шляхом зменшення такого навантаження таблетками є виявлення сполук проти ВІЛ з високою біологічною доступністю, тобто, сприятливим фармакокінетичним та метаболічним профілем таким, щоб можна було мінімізувати добову дозу та, отже, також кількість одержуваних таблеток. Іншою важливою характеристикою корисної сполуки проти ВІЛ є те, що зв'язування інгібітору з плазмовим білком здійснює мінімальний вплив або навіть не впливає на його ефективність. На даний час декілька інгібіторів протеази наявні в продажу або знаходяться в розробці. Хоча інгібітори протеази, що наявні в продажі, мають відмінні властивості, існує висока постійна лікарська потреба в нових інгібіторах протеази, що також здатні придушувати широкий спектр мутантів ВІЛ з невеликою зміною в кратній резистенції, мають високу біологічну доступність, тобто сприятливий фармакокінетичний та метаболічний профіль, та відчувають невеликий вплив або не відчувають впливу на їх ефективність внаслідок зв'язування з плазмовим білком та крім цього, демонструють тільки припустимі побічні дії в живих людях. Зненацька виявлено, що 2-(заміщені аміно)бензотіазолсульфонамідні сполуки та похідні за даним винаходом мають сприятливий фармакологічний та фармакокінетичний профіль. Крім того, вони є активними проти ВІЛ дикого типу, але вони також демонструють широкий спектр активності проти різних мутантних ВІЛ, що виявляють резистентність проти відомих інгібіторів протеази. Сполуки, що відповідають винаходу, не викликають так названі реакції надчутливості, подібні до шкірних порушень, наприклад, еритему та/або набряк. Даний винахід відноситься до 2-(заміщених аміно)-бензотіазолсульфонамідних сполук та похідних як інгібіторів протеази, що мають формулу (І) 96445 6 їх солей, стереоізомерних форм та стереоізомерних сумішей, де R являє собою піперидинове або піролідинове кільце, що необов'язково заміщене на одному або декількох членах кільця С1-6алкілом, С37циклоалкілом, С1-6алкілоксі-С1-6алкілом, -С(=О)1 С1-6алкіламіно-С1-6алкілом, -С(=О)-С1-6алкіл-Неt , 2 С(=О)-С1-6алкіл-Неt , бензилом, фенілом або С12 1 6алкілом, заміщеним Het , де Het , як група або частина групи, являє собою насичений або частково ненасичений моноциклічний, біциклічний або трициклічний гетероцикл, що містить переважно від 3 до 14 членів кільця, більш переважно, від 5 до 10 членів кільця та більш переважно, від 5 до 6 членів кільця, що містить один або декілька гетероатомних членів кільця, вибраних з азоту, кисню або сірки, та який необов'язково заміщений на одному або декількох атомах азоту та/або вуглецю, С1-6алкілом, С1-6алкілокси, аміноС1-6алкілом, галогеном, гідрокси, ацетилом, оксо, необов'язково моно- або дизаміщеним аміно, необов'язково моно- або дизаміщеним аміноалкілом, нітро, ціано, галогенС1-6алкілом, карбокси, С16алкоксикарбонілом, С3-7циклоалкілом, необов'язково моно- або дизаміщеним амінокарбонілом, метилтіо, метилсульфонілом, арилом та насиченим або частково ненасиченим моноциклічним, біциклічним або трициклічним циклом або гетероциклом, що містить від 3 до 14 членів кільця, та де 2 Het , як група або частина групи, являє собою ароматичний моноциклічний, біциклічний або трициклічний гетероцикл, що містить, переважно, від 3 до 14 членів кільця, більш переважно, від 5 до 10 членів кільця та, більш переважно, від 5 до 6 членів кільця, що містить один або декілька гетероатомних членів кільця, вибраних з азоту, кисню або сірки, та який необов'язково заміщений на одному або декількох атомах азоту та/або вуглецю С16алкілом, що може бути необов'язково заміщений С3-7циклоалкілом, С1-6алкілокси, аміноС1-6алкілом, галогеном, гідрокси, необов'язково моно- або дизаміщеним аміно, нітро, ціано, галогенС1-6алкілом, карбокси, С1-6алкілоксикарбонілом, С37циклоалкілом, необов'язково моно- або дизаміщеним амінокарбонілом, метилтіо, метилсульфо1 нілом, арилом, Het та ароматичним моноциклічним, біциклічним або трициклічним циклом або гетероциклом, що містить від 3 до 12 членів кільця. Сполуки за винаходом, що представляють інтерес, являють собою такі сполуки, де R являє собою піперидинове кільце, заміщене на N-атомі в кільці С3-7циклоалкілом. 7 Переважні сполуки являють собою сполуки, де зазначений С3-7циклоалкіл являє собою С5циклоалкіл. Найбільш переважною є сполука, що має формулу (II), Крім того, даний винахід відноситься до фармацевтичної композиції та способу одержання зазначеної фармацевтичної композиції, що містить ефективну кількість, щонайменше, однієї сполуки формули (І) або (II) додатково до звичайних фармацевтично прийнятних ексципієнтів та допоміжних засобів. Фармацевтичні композиції звичайно містять від 0,1 до 90 % по масі сполуки формули (І або II). Фармацевтичні композиції можна одержувати за допомогою способу, відомого, власне кажучи, фахівцю в даній галузі техніки. З цією метою, щонайменше, одну зі сполук формули (І або II), разом з одним або декількома твердими або рідкими фармацевтичними ексципієнтами та/або допоміжними засобами та, якщо потрібно, у комбінації з іншими активними фармацевтичними сполуками, вводять у підходящу для введення форму або дозовану форму, яку потім можна застосовувати як фармацевтичний лікарський засіб для людини або лікарський засіб для ветеринарії. Фармацевтичні композиції, що містять сполуки за винаходом, можна вводити перорально, використовуючи, наприклад, суспензії, капсули, таблетки, саше, розчини, суспензії, емульсії; парентерально, використовуючи, наприклад, підшкірну, внутрішньовенну, внутрішньом'язову, інтрастернальну ін'єкції або інфузійні методи; ректально, використовуючи, наприклад, супозиторії; внутрішньовагінально; шляхом інгаляції або місцево. Переважно введення залежить від індивідуального випадку, наприклад, конкретного перебігу розладу, що піддається лікуванню. Пероральне введення є переважним. Фахівець в даній галузі техніки на основі свого кваліфікаційного знання знає допоміжні засоби, що придатні для необхідної технології одержання фармацевтичної композиції. Крім розчинників, також застосовують гелеутворюючі агенти, основи супозиторіїв, допоміжні засоби для таблеток та інші носії активних сполук, антиоксиданти, дисперсанти, емульгатори, антиспінювальні засоби, корисні коригенти, консерванти, солюбілізатори, агенти для досягнення дії депо, буферні речовини або барвники. Для форми, що вводиться перорально, сполуки за даним винаходом змішують з такими підходящими добавками, як ексципієнти, стабілізатори або інертні розріджувачі, та доставляють за допо 96445 8 могою звичайних способів у підходящих для введення формах, таких як таблетки, таблетки з покриттям, тверді капсули, водні, спиртові або масляні розчини. Приклади підходящих інертних носіїв являють собою аравійську камедь, магнезію, карбонат магнію, фосфат калію, лактозу, глюкозу або крохмаль, особливо, кукурудзяний крохмаль. У цьому випадку препарат можна виготовляти як у вигляді сухих, так і у вигляді вологих гранул. Підходящі масляні ексципієнти або розчинники являють собою рослинні або тваринні олії, такі, як соняшникова олія або жир печінки тріски. Підходящі розчинники для водних або спиртових розчинів являють собою воду, етанол, розчини цукру або їх суміші. Поліетиленгліколі та поліпропіленгліколі також застосовують як додаткові допоміжні засоби для інших форм введення. Для підшкірного або внутрішньовенного введення в розчин, суспензію або емульсію вводять активні сполуки, якщо потрібно, зі звичайними для цього речовинами, такими як солюбілізуючі агенти, емульгатори або додаткові допоміжні засоби. Сполуки формули (І) або (II) також можна ліофілізувати та отримані ліофілізати застосовувати, наприклад, для виготовлення композицій для ін'єкції або інфузії. Підходящі розчинники являють собою, наприклад, воду, фізіологічний сольовий розчин або спирти, наприклад, етанол, пропанол, гліцерин, крім того, також розчини цукру, такі як розчини глюкози або маніту, - або в альтернативному випадку, суміші різних зазначених розчинників. Підходящі фармацевтичні композиції для введення у формі аерозолей або спреїв являють собою, наприклад, розчини, суспензії або емульсії сполук формули (І або II), або їх фізіологічно прийнятні солі у фармацевтично придатному розчиннику, такому як етанол або вода, або суміші таких розчинників. Якщо потрібно, композиція також може додатково містити такі фармацевтичні допоміжні засоби, як поверхнево-активні речовини, емульгатори та стабілізатори, а також і пропелент. Така композиція звичайно містить активну сполуку при концентрації приблизно від 0,1 до 50 %, особливо, приблизно від 0,3 до 3 % по масі. Внаслідок своїх сприятливих фармакологічних властивостей, конкретно, своєї активності проти ферментів протеази ВІЛ, резистентного до багатьох лікарських засобів, сполуки за даним винаходом застосовують при лікуванні індивідуумів, інфікованих ВІЛ, та для профілактики таких індивідуумів. Профілактичне лікування може бути успішним у випадках, коли індивідуум піддається високому ризику впливу вірусом, що може відбуватися, коли індивідуум знаходиться в контакті з інфікованим індивідуумом, коли існує високий ризик переносу вірусу. Як приклад, профілактичне введення зазначеної сполуки буде успішним у ситуації, коли працівник охорони здоров'я піддається впливу крові від ВІЛ-інфікованого індивідуума, або в інших ситуаціях, коли індивідуум втягнутий у роботу з високим ризиком, при якій цей індивідуум, можливо, піддається впливу ВІЛ. Звичайно, сполуки за даним винаходом можна застосовувати при лікуванні теплокровних тварин, 9 інфікованих вірусами, існування яких опосередковано або залежить від ферменту протеази. Захворювання, які можна попереджати або лікувати за допомогою сполук за даним винаходом, включають, але не обмежуються перерахованими, лікування широкого ряду станів інфекції ВІЛ: СНІД, ARC (СНІД-асоційований комплекс), як симптоматичний, так і безсимптомний, та даний або можливий вплив ВІЛ. Сполуки за даним винаходом застосовують при лікуванні інфекції ВІЛ після передбачуваного минулого впливу ВІЛ, наприклад, при переливанні крові, заміні рідин з організму, укусах, випадковому проколюванні стеком або при впливі на кров пацієнта під час операції. Термін попередження включає профілактику інфекції ВІЛ та профілактику еволюції інфекції ВІЛ у СНІД. Таким чином, сполуки за даним винаходом або їх будь-які похідні можна застосовувати як лікарські засоби проти вищевказаних захворювань. Зазначене застосування як лікарського засобу або способу лікування включає системне введення ВІЛ-інфікованим суб'єктам кількості, ефективної для придушення захворювань, пов'язаних із ВІЛ та інших патогенних ретровірусів, особливо, ВІЛ-1. Отже, сполуки за даним винаходом можна застосовувати при виготовленні препарату, що використовують для лікування захворювань, пов'язаних із ВІЛ та іншими патогенними ретровірусами, особливо, препаратів, що використовують для лікування пацієнтів, інфікованих вірусом ВІЛ, резистентним до багатьох лікарських засобів. Комбінації антиретровірусної сполуки та сполуки за даним винаходом можна застосовувати як лікарський засіб. Таким чином, даний винахід також відноситься до продукту або композиції, що містить (а) сполуку за даним винаходом (яка відповідає формулі (І або II)) та (b) іншу антиретровірусну сполуку, у вигляді комбінованого препарату для одночасного, роздільного або послідовного застосування при лікуванні ретровірусних інфекцій, особливо, при лікуванні інфекцій ретровірусами, резистентними до багатьох лікарських засобів. Таким чином, для придушення або лікування інфекцій ВІЛ або інфекції та захворювання, пов'язаного з інфекціями ВІЛ, такими, як синдром набутого імунодефіциту (СНІД) або СНІД-асоційований комплекс (ARC), сполуки за даним винаходом можна вводити спільно в комбінації, наприклад, з інгібіторами зв'язування, інгібіторами злиття, інгібіторами зв'язування з до-рецепторами, RT-інгібіторами, RTI нуклеозидами, нуклеотидами RTI, NNRTI, інгібіторами Н RNAse, інгібіторами ТАТ, інгібіторами інтегрази, інгібіторами протеази або інгібіторами глікозилування. Сполуки за даним винаходом також можна вводити в комбінації з модуляторами метаболізму після застосування лікарського засобу у відношенні індивідуума. Ці модулятори включають сполуки, що перешкоджають метаболізму на цитохромах, таких як цитохром Р450. Деякі модулятори інгібують цитохром Р450. Відомо, що існує декілька ізоферментів цитохрома Р450, один із яких являє собою Р450 ЗА4. Ритонавір є прикладом модулятора метаболізму за допомогою цитохрому Р450. Сполуки, що представляють інтерес, які здійсню 96445 10 ють вилив на цитохром 450, включають такі сполуки, що містять тіазолільну, імідазолільну або піридинільну частину. Таку комбіновану терапію в різних препаратах можна вводити одночасно, роздільно або послідовно. В альтернативному випадку, таку комбінацію можна вводити у вигляді єдиної композиції, тим самим активні інгредієнти вивільняються з препарату одночасно або окремо. Такий модулятор можна вводити в такому ж або різному співвідношенні також як сполуки за даним винаходом. Переважно, масове відношення такого модулятора відносно сполуки за даним винаходом (модулятор:сполука за даним винаходом) складає 1:1 або нижче, більш переважно, співвідношення 1:3 або нижче, прийнятне співвідношення складає 1:10 або нижче, більш прийнятне співвідношення складає 1:30 або нижче. Комбінація може забезпечувати синергетичну дію, у результаті чого інфікованість вірусом та пов'язані з ним симптоми можуть бути попереджені, істотно зменшені або цілком усунуті. Комбінації сполук формули (І або II) з іншим інгібітором протеази ВІЛ або так названим підсилювачем, таким як ритонавір, таким як інгібітор цитохрому Р450, можуть діяти синергічно, адитивним чином або антагоністично. Це можна визначити в експериментальному режимі, коли вимірюють ефективність різних співвідношень двох інгібіторів протеази ВІЛ. Результати можна зобразити у вигляді графіка, ізоболограми, відповідно до методу, описаного Chou та Talalay (Adv. Enzyme Regul .22:2755,1984). Синергізм між двома інгібіторами буде позначати більш ефективну комбіновану терапію, але без збільшення небажаних побічних дій. Частиною винаходу є застосування ритонавіру або його фармацевтично прийнятної солі для одержання лікарського засобу для придушення або лікування ВІЛ-інфекції або СНІД в організмі людини в комбінації зі сполуками І або II, переважно, сполукою II, що піддається метаболізму цитохромом Р450, в якому кількість ритонавіру є достатньою для поліпшення фармакокінетик зазначених сполук І або II в організмі пацієнта, щодо фармакокінетик відповідних сполук І або II, що використовуються окремо. Інший аспект даного винаходу відноситься до набору або контейнера, що включає сполуку формули (І або II) у кількості, ефективній для застосування як стандарту або реагенту в тесті або аналізі для визначення здатності потенційного фармацевтичного засобу придушувати ВІЛпротеазу, ріст ВІЛ або і те, і інше. Такий аспект винаходу може знайти застосування у фармацевтичних дослідницьких програмах. Сполуки за даним винаходом можна використовувати в аналізах з моніторингом фенотипової резистенціїї, таких як відомі аналізи рекомбінатного вірусу, у клінічному керуванні захворюваннями з резистенцією, що розвивається, такими як ВІЛ. Конкретно, застосовувана система моніторингу резистенції являє собою аналіз рекомбінантного вірусу, відомий як Antivirogram™. Antivirogram™ є у високому ступені автоматизованим, високопродуктивним, другого покоління, аналізом рекомбі 11 нантного вірусу, що може вимірювати чутливість, особливо чутливість до вірусу, сполук за даним винаходом. (Hertogs K, de Bethune MP, Miller V et al. Antimicrob Agents Chemother, 1998; 42 (2):269276). Як використовується в даній заявці, термін "заміщений" у позначенні сполук формули (І або II), означає вказівку, що один або кілька атомів водню на атомі, зазначеному у виразі із застосуванням "заміщений", замінені на вибраний із зазначеної групи, за умови, що зазначена звичайна валентність атома не перевищена та що заміщення приводить до хімічно стабільної сполуки, тобто сполуки, що є досить стійкою, щоб витримати виділення з реакційної суміші до застосовуваного ступеня чистоти, та технологію одержання з перетворенням на терапевтичний агент. Як використовується в даній заявці, термін "галогено" або "галоген", як група або частина групи, є загальним для фтору, хлору, брому або йоду. Термін "С1-6алкіл", як група або частина групи, означає лінійні або розгалужені насичені вуглеводневі радикали, що містять від 1 до 6 атомів вуглецю, такі як метил, етил, пропил, бутил, 2метилпропіл, пентил, гексил, 2-метилбутил, 3метилпентил, тощо. Термін "С3-7 циклоалкіл", як група або частина групи, є загальним для циклопропілу, циклобутилу, циклопентилу, циклогексилу або циклогептилу. Як використовується в даній заявці, термін (=O) утворює карбонільну частину з атомом вуглецю, до якого він приєднаний. Коли будь-який символ (наприклад, галоген або С1-4алкіл) зустрічається більше, ніж один раз, у будь-якій складовій частині, то кожне позначення є незалежним. Het, як група або частина групи, являє собою насичений або частково ненасичений моноциклічний, біциклічний або трициклічний гетероцикл, що містить переважно від 3 до 14 членів кільця, більш переважно, від 5 до 10 членів кільця та більш переважно, від 5 до 6 членів кільця, що містить один або декілька гетероатомних членів кільця, вибраних з азоту, кисню або сірки, та який необов'язково заміщений на одному або декількох атомах азоту та/або вуглецю С1-6алкілом, С1-6алкокси, аміноС16алкілом, галогеном, гідрокси, ацетилом, оксо, необов'язково моно- або дизаміщеним аміно, необов'язково моно- або дизаміщеним аміноалкілом, нітро, ціано, галогенС1-6алкілом, карбокси, С16алкоксикарбонілом, С3-7циклоалкілом, необов'язково моно- або дизаміщеним амінокарбонілом, метилтіо, метилсульфонілом, арилом та насиченим або частково ненасиченим моноциклічним, біциклічним або трициклічним циклом або гетероциклом, що містить від 3 до 14 членів кільця. 2 Het , як група або частина групи, являє собою ароматичний моноциклічний, біциклічний або трициклічний гетероцикл, що переважно містить від 3 до 14 членів кільця, більш переважно, від 5 до 10 членів кільця та більш переважно, від 5 до 6 членів кільця, що містить один або декілька гетероатомних членів кільця, вибраних з азоту, кисню або сірки, та який необов'язково заміщений на одному або декількох атомах азоту та/або вуглецю С1 96445 6алкілом, 12 що може бути необов'язково заміщений С3-7циклоалкілом, С1-6алкілокси, аміноС1-6алкілом, галогеном, гідрокси, необов'язково моно- або дизаміщеним аміно, нітро, ціано, галогенС1-6алкілом, карбокси, С1-6алкоксикарбонілом, С37циклоалкілом, необов'язково моно- або дизаміщеним амінокарбонілом, метилтіо, метилсульфо1 нілом, арилом, Het та ароматичним моноциклічним, біциклічним або трициклічним циклом або гетероциклом, що містить від 3 до 12 членів кільця. Термін "арил" відноситься до будь-якої функціональної групи або замісника, отриманого з простого ароматичного кільця. Існують більш специфічні терміни, такі як феніл, для опису незаміщених арильних груп та підмножини (підгруп) арильних груп (а також і довільно заміщених груп), але "арил" застосовують для скорочення й узагальнення. Солі сполук формули (І) або (II) для терапевтичного застосування являють собою солі, в яких протиіон є фармацевтично або фізіологічно прийнятним. Однак, солі, що мають фармацевтично неприйнятний протиіон, також можуть знайти застосування, наприклад, при одержанні або очищенні фармацевтично прийнятної сполуки формули (І) або (II). Всі солі, незалежно від того, чи є вони фармацевтично прийнятними чи ні, включені в обсяг даного винаходу. Фармацевтично прийнятні або фізіологічно прийнятні адитивні сольові форми, які здатні утворювати сполуки, що використовуються в даному винаході, можна одержувати звичайним способом із застосуванням відповідних кислот, таких як, наприклад, неорганічні кислоти, такі як галогенводневі кислоти, наприклад, соляна або бромистоводнева кислоти; сірчана; гемісірчана, азотна; фосфорна та подібні кислоти; або органічні кислоти, такі як, наприклад, оцтова, аспарагінова, додецилсірчана, гептанова, гексанова, нікотинова, пропанова, гідроксіоцтова, молочна, піровиноградна, щавлева, малонова, бурштинова, малеїнова, фумарова, яблучна, винна, лимонна, метансульфонова, етансульфонова, бензолсульфонова, птолуолсульфонова, цикламова, саліцилова, паміносаліцилова, памова та подібні кислоти. І навпаки, зазначені адитивні сольові форми можна перетворити обробкою відповідною основою на вільну форму основи. Сполуки формули (І) або (II), що містять кислотний протон, також можна перетворити на їх нетоксичну металеву або амінну адитивну сольову форму обробкою відповідними органічними або неорганічними основами. Відповідні сольові форми основи включають, наприклад, солі амонію, солі лужних та лужноземельних металів, наприклад, солі літію, натрію, калію, магнію, кальцію, тощо, солі з органічними основами, наприклад, бензатинові, N-метил, -D-глюкамінові, гідрабамінові солі та солі з амінокислотами, такими, як наприклад, аргінін, лізин, тощо. І навпаки, зазначені адитивні сольові форми з основами можна перетворити обробкою відповідною кислотою на форму вільної кислоти. 13 Термін "солі" також включає гідрати та адитивні форми з розчинником, які здатні утворювати сполуки за даним винаходом. Прикладами таких форм є, наприклад, гідрати, алкоголяти, тощо. Дані сполуки, що використовуються в даному винаході, також можуть існувати у формах Nоксидів формули (І) або (II), в яких один або кілька атомів азоту окиснені в так названий N-оксид. Для одержання зазначених N-оксидів, сполуки формули (І або II) можна перетворити на відповідні Nоксидні форми наступними відомими в даній галузі техніки методами перетворення тривалентного азоту на його N-оксидну форму. Зазначену реакцію N-окиснення звичайно можна здійснювати шляхом взаємодії вихідної речовини формули (І або II) з підходящим органічним або неорганічним пероксидом. Підходящі неорганічні пероксиди включають, наприклад, пероксид водню, пероксиди лужних металів або лужноземельних металів, наприклад, пероксид натрію, пероксид калію; підходящі органічні пероксиди можуть включати пероксикислоти, такі як, наприклад, бензолкарбопероксокислота або галогензаміщена бензолкарбопероксокислота, наприклад, 3хлорбензолкарбопероксокислота, пероксоалканові кислоти, наприклад, пероксооцтова кислота, алкілгідропероксиди, наприклад, третбутилгідропероксид. Підходящими розчинниками є, наприклад, вода, нижчі спирти, наприклад, етанол, тощо, вуглеводні, наприклад, толуол, кетони, наприклад, 2-бутанон, галогеновані вуглеводні, наприклад, дихлорметан, та суміші таких розчинників. Термін "сполука або сполуки, що мають формулу (І) або (II) ", або будь-які подібні терміни, такі як "сполука або сполуки за винаходом", тощо, означає також включення будь-яких проліків, які можуть утворювати сполуки формули (І) або (II). Як використовується в даній заявці, термін "проліки" означає включення будь-яких фармакологічно прийнятних похідних, таких як складні ефіри, аміди та фосфати, так що продукт біотрансформації похідного, що утворюється in vivo, являє собою активний лікарський засіб, що визначений в сполуках формули (І) або (II). Таким чином, включені посилання, Goodman and Gilman (The Pharmacological th Basis of Therapeutics, 8 ed, McGraw-Hill, Int. Ed. 1992, "Biotransformation of Drugs", p. 13-15), що здебільшого описують проліки. Проліки, переважно, мають добру розчинність у воді, підвищену біологічну доступність та легко піддаються метаболізму в активні інгібітори in vivo. Проліки сполук за даним винаходом можна одержувати модифікуванням функціональних груп, що присутні у сполуці, таким способом, щоб модифікації розщеплювалися або звичайною маніпуляцією, або in vivo, з утворенням вихідної сполуки. Переважними є фармацевтично прийнятні складноефірні проліки, що гідролізуються in vivo та одержують з таких сполук формули (І) або (II), що мають гідрокси або карбоксигрупу. Гідролізуємий in vivo складний ефір являє собою складний ефір, що гідролізується в організмі людини або тварини з утворенням вихідної кислоти або спирту. Підходящі фармацевтично прийнятні складні ефіри для 96445 14 карбоксигрупи включають С1-6алкоксиметильні складні ефіри, наприклад, метоксиметильні, С16алканоїлоксиметильні складні ефіри, наприклад, півалоїлоксиметильні, фталідильні складні ефіри, С3-8циклоалкоксикарбонілоксС1-6алкільні складні ефіри, наприклад, 1циклогексилкарбонілоксіетильний; 1,3-діоксолен-2онилметильні складні ефіри, наприклад, 5-метил1,3-діоксолен-2-онілметильний; та С16алкоксикарбонілоксіетильні складні ефіри, наприклад, 1-метоксикарбонілоксіетильний, які можуть бути утворені при будь-якІй карбоксигрупі в сполуках за даним винаходом. Гідролізуємий in vivo складний ефір сполуки формули (І) або (II), що містить гідроксигрупу, включає неорганічні складні ефіри, такі як складні ефіри фосфатів та прості -ацилоксіалкільні ефіри й аналогічні сполуки, що в результаті гідролізу in vivo складного ефіру руйнуються з утворенням вихідної гідроксигрупи. Приклади простих ацилоксіалкільних ефірів включають ацетоксиметокси та 2,2-диметилпропіонілоксиметокси. Вибір гідролізуємого in vivo складного ефіру, що буде утворювати гідрокси групу, включає алканоїл, бензоїл, фенілацетил та заміщений бензоїл та фенілацетил, алкоксикарбоніл (з утворенням складних ефірів алкілкарбонатів), діалкілкарбамоїл та N(діалкіламіноетил)-N-алкілкарбамоїл (з утворенням карбаматів), діалкіламіноацетил та карбоксіацетил. Приклади замісників на бензоїлі включають морфоліно та піперазино, зв'язані з атомом азоту кільця через метиленову групу з бензоїльним кільцем у положенні 3 або 4. Складні алканоїльні ефіри, наприклад, являють собою будь-які С1складні ефіри, особливо, C830алканоїльні 30алканоїльні складні ефіри, та більш переважно, С10-24алканоїльні складні ефіри, більш особливо, С16-20алканоїльні складні ефіри, в яких алкільна частина може мати один або кілька подвійних зв'язків. Прикладами алканоїльних складних ефірів є деканоат, пальмітат та стеарат. Термін "сполука або сполуки, що мають формулу (І) або (II)", або будь-які подібні терміни, такі як "сполука або сполуки за винаходом", тощо, означає також включення будь-яких метаболітів, що утворюються in vivo після введення лікарського засобу. Деякі приклади метаболітів, відповідно до винаходу, включають, але не обмежуються перерахованими, (а) де сполука формули (І) або (II) містить метильну групу, її гідроксиметильне похідне; (b) де сполука формули (І) або (II) містить алкоксигрупу, її гідроксипохідне; (с) де сполука формули (І) або (II) містить третинну аміногрупу, її вторинне амінопохідне; (d) де сполука формули (І) або (II) містить вторинну аміногрупу, її первинне похідне; (e) де сполука формули (І) або (II) містить фенільну частину, її фенольне похідне; та (f) де сполука формули (І) або (II) містить амідну групу, її похідне карбонової кислоти. Мається на увазі, що даний винахід також включає будь-які ізотопи атомів, що присутні у сполуках за винаходом. Наприклад, ізотопи водню включають тритій та дейтерій, та ізотопи вуглецю включають С-13 та С-14. 15 Дані сполуки, що використовуються у винаході, також можуть існувати в таутомерних формах. Такі форми, хоча і не безпосередньо, зазначені у формулі вище по тексту, призначені для включення в обсяг даного винаходу. Дана сполука, що використовується в даному винаході, також може існувати в стереохімічно ізомерній формі, що позначає всі можливі сполуки, складені з таких же атомів, зв'язаних такою ж послідовністю зв'язків, але які мають різні тривимірні структури, що не є рівнозначними. Якщо не згадано або не зазначене інше, хімічне позначення сполук включає суміш усіх можливих стереохімічних ізомерних форм, які можуть мати зазначені сполуки. Зазначена суміш може містити всі діастереомери та/або енантіомери основної молекулярної структури зазначеної сполуки. Всі стереохімічні ізомерні форми сполук, що використовуються у даному винаході, або в чистій формі, або в суміші одна з одною, призначені для включення в обсяг даного винаходу, включаючи будь-які рацемічні суміші або рацемати. Чисті стереоізомерні форми сполук та проміжних сполук, які зазначені в даній заявці, позначають ізомери, які по суті вільні від інших енантіомерних або діастереоізомерних форм такої ж основної молекулярної структури зазначених сполук або проміжних сполук. Конкретно, термін 'стереоізомерно чистий' відноситься до сполук або проміжних сполук, що мають стереоізомерний надлишок щонайменше від 80 % (тобто, мінімально 90 % одного ізомеру та максимально 10 % інших можливих ізомерів) до стереоізомерного надлишку 100 % (тобто, 100 % одного ізомеру та жодного іншого), більш конкретно, сполук або проміжних сполук, що мають стереоізомерний надлишок від 90 % до 100 %, ще більш конкретно, що мають стереоізомерний надлишок від 94 % до 100 % та найбільш конкретно, що мають стереоізомерний надлишок від 97 % до 100 %. Терміни 'енантіомерно чистий' та 'діастереомерно чистий' варто розуміти аналогічним образом, але, крім того, враховуючи енантіомерний надлишок, відповідно діастереомерний надлишок розглянутої суміші. Чисті стереоізомерні форми сполук та проміжних сполук, що використовуються у даному винаході, можна одержати із застосуванням методів, відомих в даній галузі техніки. Наприклад, енантіомери можна відокремити один від одного селективною кристалізацією їх діастереомерних солей з оптично активними кислотами або основами. Приклади являють собою винну кислоту, дибензоїлвинну кислоту, дитолуоїлвинну кислоту та камфосульфонову кислоту. В альтернативному випадку, енантіомери можна розділяти хроматографічними методами із застосуванням хіральних стаціонарних фаз. Зазначені чисті стереохімічні ізомерні форми також можна одержати з відповідних чистих стереохімічних ізомерних форм підходящих вихідних речовин, за умови, що реакція відбуваєтьсястереоспецифічно. Переважно, якщо потрібен специфічний стереоізомер, зазначена сполука буде синтезована стереоспецифічними способами 96445 16 одержання. У таких способах будуть переважно застосовувати енантіомерно чисті вихідні речовини. Діастереомерні рацемати формули (І або II) можна одержати роздільно загальноприйнятими методами. Відповідні фізичні способи розділення, які можна переважно застосовувати, являють собою, наприклад, селективну кристалізацію та хроматографію, наприклад, колоночну хроматографію. Для фахівця в даній галузі техніки ясно, що сполуки формули (І) або (II) містять п'ять асиметричних центрів та, таким чином, можуть існувати як різні стереоізомерні форми. Два асиметричні центри позначені зірочкою (*) на фігурі нижче для формули (І). Абсолютну конфігурацію кожного асиметричного центра, що може бути присутній у сполуках формули (І), можна вказувати стереохімічними позначеннями R та S, причому таке позначення R та S відповідає правилам, описаним у Pure Appl. Chem.1976, 45, 11-30. Ті ж позначення застосовують до формули (II). Розділ прикладів Загальні експериментальні методи ЯМР спектри реєстрували на спектрометрі Bruker Avance 400, що функціонує при 400 МГц 1 для Н з CDCl3 як розчинником. У кожному випадку застосовували як внутрішній стандарт тетраметилсилан (TMS). Хімічні зсуви надані в м.ч. та величина J у Гц. Різноманіття позначень зазначене із застосуванням наступних скорочень: d для дублета, t для триплету, m для мультиплету та т.д. Через стислість був вибраний цілком охарактеризований (включаючи ЯМР) один ілюстративний приклад кожної підгрупи сполук. Мас-спектри з низькою роздільною здатністю (LRMS) реєстрували з іонною пасткою (ThermoFinnigan LCQ Deca) або часом прольоту (Waters LCT) масспектрометром із застосуванням електророзпилювальної іонізації (ESI) у позитивному режимі. Усі реагенти були комерційно доступними (Acros, Aldrich, Fluorochem,…), та їх застосовували такими, як одержували. Колоночну хроматографію здійснювали на силікагелі 60Å, 60-200 мкм (ROCC). Тонкошарову хроматографію здійснювали на пластинках силікагелю 60 F254 (Merck). Аналітичну ВЕРХ проводили на системі Waters Alliance2795 (насос + автосамплер), постаченій фотодіодним матричним детектором (система 1 та система 2). Для контролю чистоти кінцевих продуктів застосовували дві хроматографічні системи. Система 1: колонка: Waters Xterra MS C18 (3,5 17 мкм, 4,60 мм 100 мм), рухлива фаза А: 20 мМ CH3COONH4 та 5 % CH3CN у Н2О, рухлива фаза В: CH3CN. Аналіз виконували при 55 °C із застосуванням швидкості потоку 1,5 мл/хв., застосовуючи наступний градієнт: 0 хв.: 95 % А, 5,4 хв.: 5 % А, 7,2 хв.: 5 % А. У кожному випадку вводили 10 мкл 1 мМ розчину. Час рівноваги між двома аналізами складав 1,8 хвилин. Елюйовані піки детектували при одній довжині хвилі (макс). Система 2: колонка: Waters SunFire C18, (3,5 мкм, 4,60 мм 100 мм), рухлива фаза А: 10 мМ HCOONH4 та 0,1 % НСООН у Н2О, рухлива фаза В: СН3СN. Аналіз проводили при 55 °C із застосуванням швидкості потоку 1,5 мл/хв., застосовуючи наступний градієнт: 0 хв.: 96445 18 95 % А, 5,4 хв.: 5 % А, 7,2 хв.: 5 % А. Елюйовані піки детектували при одній довжині хвилі (макс). В результаті наданий час утримання для одного ілюстративного приклада кожної підгрупи сполук та він представлений в хвилинах. Синтез одного ілюстративного прикладу (сполука 7 у групі А) описаний повністю. Інші сполуки (у групі А та В, С та D відповідно) синтезували в такий же спосіб, як вже описано. Схема 1. Синтез гексагідрофуро[2,3-b]-фуран3-ілових складноефірних похідних {1-бензил-3-[(2амінобензотіазол-6-сульфоніл)-ізобутиламіно]-2гідроксипропіл}-карбамінової кислоти 5-25. + (і) RNH3 Cl Et3N, ТГФ/10 % Na2CO3. Схема 2. Синтез 1-циклопентилпіперидин-4-іламонійхлориду (4). (іі) Йодциклопентан, K2СО3,CH3CN; (ііі) НСІ/ізо-РrОН, СН3ОН. Приклад 1 Опис хімічних реакцій для схеми 2 Трет-бутиловий складний ефір (1циклопентилпіперидин-4-іл)-карбамінової кислоти (3) Дану сполуку синтезували з комерційно доступного трет-бутилового складного ефіру піперидин-4-ілкарбамінової кислоти (2) (5 г, 25 ммоль, 1 екв), який розчиняли в ацетонітрилі (150 мол), з наступним додаванням йодциклопентану (9,79 г, 50 ммоль, 2 екв) та K2СО3 (3,45 г, 25 ммоль, 1 екв). Розчин перемішували при кімнатній температурі протягом 48 годин. Внаслідок незакінченості реакції, до розчину додавали йодоциклопентан (1,70 г, 8,69 ммоль, 0,35 екв) та K2СО3 (1 г, 7,25 ммоль, 0,29 екв). Розчин перемішували при кімнатній температурі протягом декількох годин. Розчин фільтрували через шар дикаліту та фільтрат випарювали при зниженому тиску з одержанням 3 (6,70 г, 25 ммоль, кількісно). LRMS (ES+): m/z 269. 1-Циклопентилпіперидин-4-іламонійхлорид (4) трет-Бутиловий складний ефір (1циклопентилпіперидин-4-іл)карбамінової кислоти (3) (6,70 г, 25 ммоль, 1 екв) розчиняли в метанолі (30 мл), з наступним додаванням 6н НСд в ізопропанолі (10 мл). Розчин перемішували при кім натній температурі протягом 24 годин. Унаслідок незавершеності реакції до розчину додавали 6н НСl в ізопропанолі (10 мл) та метанолі (50 мл). Розчин перемішували при кімнатній температурі протягом наступних 24 годин. LC-MS показав незавершеність реакції. До розчину додавали тетрагідрофуран (20 мл), 6н НСl в ізопропанолі (10 мл) та метанол (200 мл). Розчин перемішували при кімнатній температурі протягом 5 годин, з наступним додаванням 6н НСl в ізопропанолі (10 мл). Розчин перемішували при кімнатній температурі протягом 72 годин. Розчин випарювали при зниженому тиску з одержанням 4 (4,20 г, 25 ммоль, вихід кількісний). LRMS (ES+): m/z 169. Приклад 2 Опис хімічних реакцій для схеми 1 Одержання сполуки гексагідрофуро[2,3b]фуран-3-ільного складного ефіру (1-бензил-3{[2-(1-циклопентилпіперидин-4-іламіно)бензотіазол-6-сульфоніл]-ізобутиламіно}-2гідроксипропіл)-карбамінової кислоти (7) (група А) 19 Гексагідрофуро[2,3-b]фуран-3-ільний складний ефір {1-бензил-2-гідрокси-3-[ізобутил-(2метансульфонілбензотіазол-6-сульфоніл)-аміно]1,2 пропіл}-карбамінової кислоти (1) (10 г, 15 ммоль, 1 екв), 1-циклопентилпіперидин-4іламонійхлорид (4) (6,02 г, 25 ммоль, 1,67 екв) та триетиламін (6,10 г, 60 ммоль, 4 екв) розчиняли в тетрагідрофурані (200 мол), з наступним додаванням 10 % Na2CO3 у воді (50 мл). Розчин перемішували при кімнатній температурі протягом 48 годин. Органічний шар відокремлювали та промивали насиченим розчином NaHCO3. Органічний шар сушили MgSO4, фільтрували та випарювали при зниженому тиску. Неочищену сполуку очищали колоночною хроматографією елююванням сумішшю дихлорметан:аміак у метанолі (7н) (від 100 до 95:5) з одержанням зазначеної у заголовку сполуки (4,45 г, 15 ммоль, 39 %). LRMS + (ES+): m/z 756 [М+Н] ; ВЕРХ (система 1) (290 нм) 1 tR 4,16 хв., 97,11 %; Н-ЯМР (CDCl3) 0,87 (д, 3Н, J=6,48, СН3), 0,92 (д, 3Н, J=6,50,CH3), 1,33-1,51 (м, 4Н, СН2 (2х) (циклопентил)), 1,51-1,77 (м, 6Н, СН2 (2х) (піперидин) та СН2, Н4), 1,77-1,96 (м, 5Н, СН2 (2х) (циклопентил) та СН (ізобутил)), 2,092,28 (м, 4Н, СН2 (2х) (піперидин)), 2,43-2,59 (м, 1H, СН (циклопентил)), 2,72-2,85 (м, 1Н, ОН), 2,85-2,92 (м, 1H, СН, Н3а), 2,92-3,12 (м, 5Н, СН (піперидин) та CH2-N та СН2 (ізобутил)), 3,20 (дд, 2Н, J=8,63 та J=15,16, СН2 у С6Н5СН2), 3,58-3,79 (м, 3Н, СН2, Н5 та СН2, Н2), 3,79-3,91 (м, 3Н, СН2, Н2 та CH-NH та СН-ОН), 4,90-5,10 (м, 2Н, СН, Н3 та NH), 5,42-5,59 (м, 1H, NH), 5,62 (д, 1Н, J=5,04, СН, Н6а), 7,12-7,32 (м, 5Н, С6Н5), 7,52 (д, 1Н, J=8,54, СН (бензотіазол)), 7,67 (дд, 1H, J=0,99 та J=8,47, СН (бензотіазол)), 7,95-8,02 (ушир.с, 1Н, СН (бензотіазол)). 1 Surleraux, D.L.N.G. et al. Broad spectrum 2(substituted-amino)-benzothiazolesulfonamide HIV protease inhibitors/PCT Int. Apl. 2002, WO 2002083657. 2 Surleraux, D.L.N.G.et al. Design of HIV-1 Protease Inhibitors Active on Multidrug-Resistant Virus., J. Med. Chem. 2005, 48, 1965-1973. Одержання сполуки гексагідрофуро[2,3b]фуран-3-ілового складного ефіру (1-бензил-3{[2-(1-бензилпіперидин-4-іламіно)-бензотіазол-6сульфоніл]-ізобутиламіно}-2-гідроксипропіл)карбамінової кислоти (11) (група В) 96445 20 LRMS (ES+): m/z 778 [М+Н]+; ВЕРХ (система 1) (296 нм) tR 4,92 хв., 95,51 %; ВЕРХ (система 2) 1 (296 нм) tR 3,65 хв., 95,41 %; Н-ЯМР (CDCl3) 6 0,90 (д, 3Н, J=6,52, СН3), 0,97 (д, 3Н, J=6,55, СН3), 1,55-1,71 (м, 6Н, СН2 (2х) (піперидин) та СН2, Н4), 1,71-1,99 (м, 3H, СН (ізобутил)), 2,09-2,19 (м, 2Н, СН2 (піперидин)), 2,19-2,35 (м, 2Н, СН2 (піперидин)), 2,70-2,93 (м, 3Н, СН (піперидин) та СН, Н3а та ОН), 2,93-3,12 (м, 4Н, CH2-N та СН2 (ізобутил)), 3,12-3,29 (м, 2Н, СН2 у С6Н5СН2), 3,58 (с, 2Н, С6Н5СН2), 3,61-3,81 (м, 3Н, СН2, Н5 та СН2, Н2), 3,81-3,92 (м, 3Н, СН2, Н2 та CH-NH та СН-ОН), 4,91-5,11 (м, 2Н, СН, Н3 та NH), 5,49-5,61 (м, 1Н, NH), 5,62 (д, 1Н, J=5,15, СН, Н6а), 7,08-7,41 (м, 10Н, С6Н5), 7,55 (д, 1Н, J=8,55, СН (бензотіазол)), 7,67 (дд, 1Н, J=1,63 та J=8,56, СН (бензотіазол)), 7,92-8,10 (м, 1Н, СН (бензотіазол)). Одержання сполуки гексагідрофуро[2,3b]фуран-3-ілового складного ефіру [1-бензил-2гідрокси-3-(ізобутил-{2-[1-(2метоксіетил)піролідин-3-іламіно]бензотіазол-6сульфоніл}-аміно)пропіл]-карбамінової кислоти (17) (група С) + LRMS (ES+): m/z 732 [М+Н] ; ВЕРХ (система 1) (286 нм) tR 4,06 хв., 89,02 %; ВЕРХ (система 2) 1 (286 нм) tR 3,42 хв., 87,19 %; Н-ЯМP (CDCl3) 8 0,89 (д, 3Н, J=6,49, СН3), 0,95 (д, 3Н, J=6,56, СН3), 1,55-1,72 (м, 2Н, СН2, Н4), 1,75-2,03 (м, 3Н, СН (ізобутил) та СН2 (піролідин)), 2,31-2,50 (м, 6Н, СН2 (2х) (піролідин) та СН2), 2,75-2,87 (м, 1H, ОН), 2,87-3,12 (м, 8Н, CH2-N та СН2 (ізобутил) та СН, Н3а та СН (піролідин) та СН2), 3,12-3,27 (м, 2Н, СН2 у С6Н5СН2), 3,38 (с, 3Н, СН3), 3,60-3,75 (м, 3Н, СН2, Н5 та СН2, Н2), 3,81-4,05 (м, 3Н, СН2, Н2 та CH-NH та СН-ОН), 4,92-5,08 (м, 2Н, СН, Н3 та NH), 5,62 (д, 1Н, J=5,15, СН, Н6а), 6,30-6,42 (м, 1Н, NH), 7,12-7,40 (м, 5Н, С6Н5), 7,57 (д, 1Н, J=8,54, СН (бензотіазол)), 7,68 (дд, 1H, J=1,96 та J=6,61, СН (бензотіазол)), 8,00 (д, 1Н, J=1,57, СН (бензотіазол)). Одержання сполуки гексагідрофуро[2,3b]фуран-3-ілового складного ефіру (1-бензил-2гідрокси-3-{ізобутил-[2-(1-піридин-3ілметилпіролідин-3-іламіно)-бензотіазол-6сульфоніл]-аміно}-пропіл)карбамінової кислоти (21) (група D) 21 96445 22 1H, NH), 7,12-7,40 (м, 6Н, С6Н5 та СН (піридин)), 7,50-7,60 (м, 1Н, СН (бензотіазол)), 7,60-7,75 (м, 2Н, СН (бензотіазол) та СН (піридин)), 7,91-8,08 (м, 1Н, СН (бензотіазол)), 8,40-8,65 (м, 2Н, СН (піридин)). Отримані сполуки (№ 5-25) наведені нижче в таблиці 1 та об'єднані в групи А, В, С та D відповідно. + LRMS (ES+): m/z 765 [М+Н] ; ВЕРХ (система 1) (286 нм) tR 4,28 хв., 95,18 %; ВЕРХ (система 2) 1 (286 нм) tR 3,40 хв., 94,56 %; Н-ЯМР (CDCl3) 5 0,88 (д, 3Н, J=6,34, СН3), 0,90 (д, 3Н, J=6,38, СН3), 1,50-1,65 (м, 2Н, СН2, Н4), 1,65-1,98 (м, 3Н, СН (ізобутил) та СН2 (піролідин)), 2,20-2,52 (м, 4Н, СН2 (2х) (піролідин)), 2,75-3,28 (м, 11Н, СН, Н3а та ОН та СН2-N та СН2 (ізобутил) та СН (піролідин) та СН2 у С6Н5СН2 та СН2), 3,55-3,75 (м, 3Н, СН2, Н5 та СН2, Н2), 3,75-4,05 (м, 3Н, СН2, Н2 та CH-NH та СН-ОН), 4,90-5,10 (м, 2Н, СН, Н3 та NH), 5,65 (д, 1H, J=4,50, СН, Н6а), 6,18-6,49 (м, 23 96445 24 25 Приклад 3 Вірусологічні властивості сполук за даним винаходом Сполуки тестували на антивірусну активність у клітинних аналізах із застосуванням клітин MT4LTR-EGFP. Аналіз продемонстрував, що дані сполуки виявляють сильну анти-ВІЛ активність проти лабораторного штаму ВІЛ дикого типу (WT lllВ-2-001). Внаслідок збільшення небезпеки лікарської резистенції ВІЛ-штамів, дані сполуки тестували 96445 26 на ефективність проти клінічно виділених ВІЛштамів, що містять кілька мутацій. Такі мутації пов'язані з резистенцією до інгібіторів протеази та приводять до вірусів, що демонструють різні ступені фенотипової перехресної резистенції до загальноприйнятих комерційно доступних лікарських засобів, таких як, наприклад, саквінавір, ритонавір, нелфінавір, індинавір та ампренавір. Вірусні штами, кодовані як А, В, С та D, містять мутації, як показано нижче в таблиці 2. Таблиця 2 А В D С V003I, L010I, V032T, LO33M, E035D, S037Y, М046І, R057R/K, Q058E, L063P, K070Т, A071V, I072V, I084V, L089V V003I, V032I, L035D, М036І, S037N, K043Т, М046І, I047V, I050V, K055R, І057K, I062V, L063P, A071L, V082I, I085V, L090M, I093L V003IL010I I013V G016A/G L019I L033F S037N М046І I050V F053L I054V K055R L063P A071V G073C V077I/V V082A L090M V003I L010F I013V V032T S037N М046І I047V I050V L063P A071V I084V L089V T091A Q092R Клітинний аналіз здійснювали у відповідності з наступною методикою. MT4-LTR-EGFP клітини, заражені ВІЛ або контрольні для зараженої проби (псевдозаражені), інкубували протягом трьох днів у присутності різних концентрацій сполук, що відповідають винаходу. Після зараження вірусний tat білок активує GFP репортер. Наприкінці періоду інкубування вимірювали сигнал GFP. У контрольних вірусних зразках (за відсутності будь-якого інгібітору) одержували максимальний сигнал флуоресценції. Інгібуючу активність сполуки піддавали моніторингу на заражених вірусом клітинах та виражали як EC50. Ці значення означають кількість сполуки, що необхідна для захисту 50 % клітин від вірусної інфекції (таблиця 3). 27 96445 Як можна побачити в цій таблиці, дані сполуки є ефективними в інгібуванні широкого ряду 28 мутантних штамів. Таблиця 3 Вірусні штами Сполука № WT-IIIB-2-001 рЕС50 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 7,72 8,31 7,88 7,44 6,56 6,53 8,60 8,34 8,18 7,85 8,24 6,82 7,73 7,76 8,42 8,27 7,95 7,71 7,97 8,22 5,77 А рЕС50 7,89 7,84 7,93 6,65 6,99 6,84 7,65 8,26 8,06 7,85 8,38 5,93 7,88 7,61 7,84 8,23 8,31 Не досліджували 8,56 7,91 5,59 Приклад 4 Біологічна доступність Аналіз проникності Сасо-2 для визначення кишкової абсорбції Проникність різних сполук оцінювали відповідно до протоколу тестування Сасо-2, як описано Augustijns et al. (Augustijns et al. (1998). Int.J. of Pharm, 166, 45-54), відповідно з чим, клітини Сасо-2 з числом переносу клітин між 32 та 45 вирощували в 24-лункових планшетах для культивування клітин протягом від 21 до 25 днів. Цілісність клітинного моношару контролювали шляхом вимірювання трансепітеліального електричного опору (TEE). Тестування проводили при pH 7,4 та при концентрації донорної сполуки 100 мкМ. Розчинність у воді при різних рівнях pH Рівноважна розчинність у модельних шлунково-кишкових розчинах у термодинамічних умовах являє собою надійне вимірювання профілю розчинності сполуки в шлунку та різних частинах кишечнику. У модельній шлунковій рідині (SGF) (без пепсину) встановлювали pH 1,5. У модельних кишкових рідинах (SIF) (без солей жовчних кислот) встановлювали pH 5, pH 6,5, pH 7 та pH 7,5. В експериментальному протоколі застосовували 96-лункові плоскодонні мікропланшети, в які додавали 1 мг сполуки на лунку (вихідний розчин у метанолі) та випарювали насухо. Сполуку повторно солюбілізували в SGF та SIF та інкубували протягом ночі на пристрої з горизонтальним струшуванням, при 37 °C. Після фільтрування В рЕС50 7,57 7,58 7,70 7,00 6,59 6,52 7,47 7,71 7,94 7,78 7,71 5,89 7,77 7,24 7,33 7,84 7,84 7,77 7,56 7,70 5,04 С рЕС50 5,38 5,46 5,54 5,25 5,00 5,11 5,24 5,19 6,04 5,90 5,46 5,90 5,47 5,32 5,35 5,59 5,74 6,19 5,36 5,08
ДивитисяДодаткова інформація
Назва патенту англійською2-(substituted-amino)-benzothiazole sulfonamide hiv protease inhibitors
Автори англійськоюde Kock Herman Augustinus, Jonckers, Tim Hugo Maria, Boonants Paul Jozef Gabriel Maria, Last Stefaan Julien, Dierynck Inge, Baumeister, Judith Eva, Van 't Klooster, Gerben Albert Eleutherius
Назва патенту російською2-(замещенные амино)бензотиазолсульфонамидные ингибиторы вич-протеазы
Автори російськоюде Кок Херман Августинус, Джонкерс Тим Хуго Мария, Боонантс Пауль Джозеф Габриэль Мария, Ласт Стефаан Джулиен, Диеринк Инге, Баумистер Джудит Ева, ван 'Т Клоостер Гербен Алберт Элеузериус
МПК / Мітки
МПК: C07D 493/04, A61K 31/34, A61P 31/18
Мітки: аміно)бензотіазолсульфонамідні, інгібітори, 2-заміщені, віл-протеази
Код посилання
<a href="https://ua.patents.su/17-96445-2-zamishheni-aminobenzotiazolsulfonamidni-ingibitori-vil-proteazi.html" target="_blank" rel="follow" title="База патентів України">2-(заміщені аміно)бензотіазолсульфонамідні інгібітори віл-протеази</a>
Попередній патент: Цементовмісна композиція, здатний до тужавлення склад, спосіб його виробництва та спосіб створення опори в шахті з використанням цього складу
Наступний патент: Спосіб та машина для трамбування вугілля, спосіб завантаження і коксування вугілля
Випадковий патент: Вузол трубобетонної колони каркаса будинку












