Сполуки на основі імідазолу, композиція, яка їх містить, і їх застосування
Номер патенту: 94737
Опубліковано: 10.06.2011
Автори: Карсон Кеннет Г., Оджері Девід Дж., Багданофф Джеффрі, Джессоп Теодор К., Кімболл Девід С., Ботеджу Лакмал У.
Формула / Реферат
1. Сполука формули:
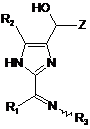
або її фармацевтично прийнятна сіль, де:
Z є необов'язково заміщеним алкілом;
R1 є воднем або необов'язково заміщеним алкілом або арилом;
R2 є воднем або необов'язково заміщеним нижчим алкілом;
R3 є OR3A, NHC(O)R3A, NHSO2R3A або воднем; і
кожний R3A є незалежно воднем або необов'язково заміщеним алкілом, арилом, алкіларилом, арилалкілом, гетероалкілом, гетероциклом, алкілгетероциклом або гетероциклоалкілом.
2. Сполука за п. 1, в якій Z є алкілом, необов'язково заміщеним однією або більше гідроксильними або ацетатними групами.
3. Сполука за п. 1, в якій R1 є необов'язково заміщеним нижчим алкілом.
4. Сполука за п. 1, в якій R2 є воднем.
5. Сполука за п. 1, в якій R3 є OR3A.
6. Сполука за п. 1, в якій R3 є NHC(O)R3A.
7. Сполука за п. 1, в якій R3 є NHSO2R3A.
8. Сполука за будь-яким з пп. 5, 6 або 7, в якій R3A є воднем або необов'язково заміщеним нижчим алкілом.
9. Сполука за п. 1, яка має формулу:
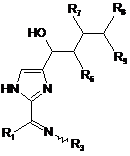 ,
,
де:
R6 є OR6A або OC(O)R6A;
R7 є OR7A або OC(O)R7A;
R8 є OR8A або OC(O)R8A;
R9 є воднем, CH2OR9A або CH2OC(O)R9A; і
кожний з R6B, R7B, R8B і R9B є незалежно воднем або нижчим алкілом.
10. Сполука за п. 9, яка має формулу:
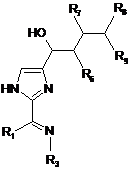 .
.
11. Сполука за п. 9, яка має формулу:
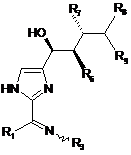 .
.
12. Сполука за п. 11, яка має формулу:
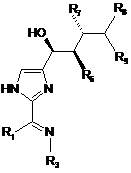 .
.
13. Сполука за п. 12, в якій R1 є необов'язково заміщеним нижчим алкілом.
14. Сполука за п. 12, в якій R3 є OR3A.
15. Сполука за п. 12, в якій R3 є NHC(O)R3A.
16. Сполука за п. 12, в якій R3 є NHSO2R3A.
17. Сполука за будь-яким з пп. 14, 15 або 16, в якій R3A є воднем або необов'язково заміщеним нижчим алкілом.
18. Сполука формули:
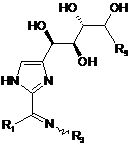
або її фармацевтично прийнятна сіль, де:
R1 є нижчим алкілом;
R3 є воднем, OR3A, NHC(O)R3A або NHSO2R3A;
R9 є воднем або СН2ОН; і
кожний R3A є незалежно воднем або нижчим алкілом.
19. Сполука за п. 18, яка має формулу:
 .
.
20. Сполука за п. 19, в якій R3 є OR3A.
21. Сполука за п. 19, в якій R3 є воднем.
22. Сполука або її фармацевтично прийнятна сіль, вибрана з групи:
1-(4-((1R,2S,3R)-1,2,3,4-тетрагідроксибутил)-1Н-імідазол-2-іл)етаноноксим;
(Е)-1-(4-((1R,2S,3R)-1,2,3,4-тетрагідроксибутил)-1Н-імідазол-2-іл)етаноноксим;
(Z)-1-(4-((1R,2S,3R)-1,2,3,4-тетрагідроксибутил)-1H-імідазол-2-іл)етаноноксим;
1-(4-((1R,2S,3R)-1,2,3,4-тетрагідроксибутил)-1Н-імідазол-2-іл)етанон-О-метилоксим;
(E)-1-(4-((1R,2S,3R)-1,2,3,4-тeтpaгiдpoкcибyтил)-1H-iмiдaзoл-2-iл)eтaнoн-О-метилоксим;
(Z)-1-(4-((1R,2S,3R)-1,2,3,4-тeтpaгiдpoкcибyтил)-1H-iмiдaзoл-2-iл)eтaнoн-О-метилоксим;
1-(5-метил-4-((1R,2S,3R)-1,2,3,4-тетрагідроксибутил)-1Н-імідазол-2-іл)етанон;
(1R,2S,3R)-1-(2-(1-гідразоноетил)-1Н-імідазол-4-іл)бутан-1,2,3,4-тетраол;
N'-(1-(4-((1R,2S,3R)-1,2,3,4-тетрагідроксибутил)-1Н-імідазол-2-іл)етиліден)ацетогідразид;
4-мeтил-N'-(1-(4-((1R,2S,3R)-1,2,3,4-тeтpaгiдpoкcибyтил)-1H-iмiдaзoл-2-іл)етиліден)бензолсульфоногідразид;
(E)-4-мeтил-N'-(1-(4-((1R,2S,3R)-1,2,3,4-тeтpaгідpoкcибyтил)-1H-iмiдaзoл-2-іл)етиліден)бензолсульфоногідразид;
(Z)-4-метил-N'-(1-(4-((1R,2S,3R)-1,2,3,4-тетрагідроксибутил)-1H-імідазол-2-іл)етиліден)бензолсульфоногідразид;
N'-(1-(4-((1R,2S,3R)-1,2,3,4-тетрагідроксибутил)-1H-імідазол-2-іл)етиліден)бензогідразид;
етил-2-(1-(4-((1R,2S,3R)-1,2,3,4-тетрагідроксибутил)-1Н-імідазол-2-іл)етиліден)гідразинкарбоксилат;
(Е)-етил-2-(1-(4-((1R,2S,3R)-1,2,3,4-тетрагідроксибутил)-1Н-імідазол-2-іл)етиліден)гідразинкарбоксилат;
(Z)-етил-2-(1-(4-((1R,2S,3R)-1,2,3,4-тетрагідроксибутил)-1Н-імідазол-2-іл)етиліден)гідразинкарбоксилат;
N'-(1-(4-((1R,2S,3R)-1,2,3,4-тетрагідроксибутил)-1Н-імідазол-2-іл)етиліден)нікотиногідразид;
(Е)-N'-(1-(4-((1R,2S,3R)-1,2,3,4-тетрагідроксибутил)-1Н-імідазол-2-іл)етиліден)нікотиногідразид;
(Z)-N'-(1-(4-((1R,2S,3R)-1,2,3,4-тетрагідроксибутил)-1H-імідазол-2-іл)етиліден)нікотиногідразид;
3-хлор-N'-(1-(4-((1R,2S,3R)-1,2,3,4-тетрагідроксибутил)-1Н-імідазол-2-іл)етиліден)бензогідразид;
4-фтор-N-(1-(4-((1R,2S,3R)-1,2,3,4-тетрагідроксибутил)-1Н-імідазол-2-іл)етиліден)бензогідразид;
(Е)-4-фтор-N'-(1-(4-((1R,2S,3R)-1,2,3,4-тетрагідроксибутил)-1H-імідазол-2-іл)етиліден)бензогідразид;
(Z)-4-фтор-N'-(1-(4-((1R,2S,3R)-1,2,3,4-тетрагідроксибутил)-1H-імідазол-2-іл)етиліден)бензогідразид;
6-аміно-N'-(1-(4-((1R,2S,3R)-1,2,3,4-тетрагідроксибутил)-1Н-імідазол-2-іл)етиліден)нікотиногідразид;
(E)-6-aміно-N'-(1-(4-((1R,2S,3R)-1,2,3,4-тетрагідроксибутил)-1Н-імідазол-2-іл)етиліден)нікотиногідразид;
(Z)-6-аміно-N'-(1-(4-((1R,2S,3R)-1,2,3,4-тетрагідроксибутил)-1Н-імідазол-2-іл)етиліден)нікотиногідразид;
N'-(1-(4-((1R,2S,3R)-1,2,3,4-тетрагідроксибутил)-1H-імідазол-2-іл)етиліден)ізонікотиногідразид;
(Е)-N'-(1-(4-((1R,2S,3R)-1,2,3,4-тетрагідроксибутил)-1Н-імідазол-2-іл)етиліден)ізонікотиногідразид;
(Z)-N'-(1-(4-((1R,2S,3R)-1,2,3,4-тетрагідроксибутил)-1Н-імідазол-2-іл)етиліден)ізонікотиногідразид;
N'-(1-(4-((1R,2S,3R)-1,2,3,4-тетрагідроксибутил)-1H-імідазол-2-іл)етиліден)біфеніл-3-карбогідроазид;
(Е)-N'-(1-(4-((1R,2S,3R)-1,2,3,4-тетрагідроксибутил)-1Н-імідазол-2-іл)етиліден)біфеніл-3-карбогідразид;
(Z)-N'-(1-(4-((1R,2S,3R)-1,2,3,4-тетрагідроксибутил)-1Н-імідазол-2-іл)етиліден)біфеніл-3-карбогідразид;
N-гідрокси-4-((1R,2S,3R)-1,2,3,4-тетрагідроксибутил)-1Н-імідазол-2-карбоксамід.
23. Фармацевтична композиція, яка містить сполуку за будь-яким з пп. 1, 18 або 22 і фармацевтично прийнятний ексципієнт або розріджувач.
24. Застосування сполуки за будь-яким з пп. 1, 18 або 22 для одержання лікарського засобу для пригнічення імунної реакції у пацієнта.
25. Застосування сполуки за пп. будь-яким з 1, 18 або 22 для одержання лікарського засобу для лікування ревматоїдного артриту, астми, атопічного дерматиту, хвороби Бехчета, реакції "трансплантат проти хазяїна", червоного вовчака, розсіяного склерозу, полінозу, псоріазу, відторгнення трансплантата або увеїту.
Текст
1. Сполука формули: HO Z N 94737 R3 або її фармацевтично прийнятна сіль, де: Z є необов'язково заміщеним алкілом; R1 є воднем або необов'язково заміщеним алкілом або арилом; R2 є воднем або необов'язково заміщеним нижчим алкілом; R3 є OR3A, NHC(O)R3A, NHSO2R3A або воднем; і кожний R3A є незалежно воднем або необов'язково заміщеним алкілом, арилом, алкіларилом, арилалкілом, гетероалкілом, гетероциклом, алкілгетероциклом або гетероциклоалкілом. 2. Сполука за п.1, в якій Z є алкілом, необов'язково заміщеним однією або більше гідроксильними або ацетатними групами. 3. Сполука за п.1, в якій R1 є необов'язково заміщеним нижчим алкілом. 4. Сполука за п.1, в якій R2 є воднем. 5. Сполука за п.1, в якій R3 є OR3A. 6. Сполука за п.1, в якій R3 є NHC(O)R3A. 7. Сполука за п.1, в якій R3 є NHSO2R3A. (11) R1 (13) N UA HN C2 R2 (19) (21) a200811468 (22) 21.02.2007 (24) 10.06.2011 (86) PCT/US2007/004648, 21.02.2007 (31) 60/776,473 (32) 24.02.2006 (33) US (31) 60/815,221 (32) 20.06.2006 (33) US (31) 11/698,253 (32) 25.01.2007 (33) US (46) 10.06.2011, Бюл.№ 11, 2011 р. (72) ОДЖЕРІ ДЕВІД ДЖ., US, БАГДАНОФФ ДЖЕФФРІ, US, БОТЕДЖУ ЛАКМАЛ У., US, КАРСОН КЕННЕТ Г., US, ДЖЕССОП ТЕОДОР К., US, КІМБОЛЛ ДЕВІД С., US (73) ЛЕКСІКОН ФАРМАСЬЮТІКАЛЗ, ІНК., US (56) DE 2145456 A1(BAYER AG), 15.03.1973 BELL ET AL: "2(1H)-Quinolinones with cardiac stimulant activity. 3. Synthesis and biological properties of 6-imidazol-1-yl derivatives" JOURNAL OF MEDICINAL CHEMISTRY, AMERICAN CHEMICAL SOCIETY. WASHINGTON, US, vol. 32, no. 7, 1989, pages 1552-1558 JOHN, W.: ''Uber einige Imidazol-carbonsaure-ester'' CHEM. BER., vol. 68, 1935, pages 2283-2291 OLIVER, J.E.; SONNET, P.E.:''Improved Routes to Methyl 4-Methylimidazole-2-carboxylate and Methyl 5-Methyl-1,2,4-triazole-3-carboxylate'' J. ORG. CHEM., vol. 38, no. 7, 1973, pages 1437-1438 MATTHEWS, D.P.; ET AL.: ''Synthesis and Cardiotonic Activity of Novel Biimidazoles'' J. MED. CHEM., vol. 33, no. 1, 1990, pages 317-327 JAMES, D.A.; ET AL.: ''Conjugated indole-imidazole derivatives displaying cytotoxicity against multidrug resistant cancer cell lines'' BIOORG. MED. CHEM. LETT., vol. 16, no. 19, 2006, pages 5164-5168 KUJUNDZIC: ''Ionization Constants of Some Aminohydroxamic Acids'' PHARMAZIE, vol. 32, 1977, page 296 GRIMMETT, M.R.; ET AL.: ''Imidazolic Compounds from the Reaction of Pyruvaldehyde with Ammonia'' J. CHEM. SOC., 1975, pages 3751-3754 2 3 94737 4 8. Сполука за будь-яким з пп.5, 6 або 7, в якій R3A є воднем або необов'язково заміщеним нижчим алкілом. 9. Сполука за п.1, яка має формулу: HO OH R8 HN R1 R9 N R9 R7 OH HO N HO R6 HN N R1 N R3 , де: R6 є OR6A або OC(O)R6A; R7 є OR7A або OC(O)R7A; R8 є OR8A або OC(O)R8A; R9 є воднем, CH2OR9A або CH2OC(O)R9A; і кожний з R6B, R7B, R8B і R9B є незалежно воднем або нижчим алкілом. 10. Сполука за п.9, яка має формулу: R3 або її фармацевтично прийнятна сіль, де: R1 є нижчим алкілом; R3 є воднем, OR3A, NHC(O)R3A або NHSO2R3A; R9 є воднем або СН2ОН; і кожний R3A є незалежно воднем або нижчим алкілом. 19. Сполука за п.18, яка має формулу: HO OH R9 R6 N N R3 . 11. Сполука за п.9, яка має формулу: R7 R8 HO R9 R6 HN N R1 N R3 . 12. Сполука за п.11, яка має формулу: R7 R8 HO R9 R6 HN N R1 N R N R1 HO R1 HN R9 N R8 R7 HN OH HO 3 . 13. Сполука за п.12, в якій R1 є необов'язково заміщеним нижчим алкілом. 14. Сполука за п.12, в якій R3 є OR3A. 15. Сполука за п.12, в якій R3 є NHC(O)R3A. 16. Сполука за п.12, в якій R3 є NHSO2R3A. 17. Сполука за будь-яким з пп.14, 15 або 16, в якій R3A є воднем або необов'язково заміщеним нижчим алкілом. 18. Сполука формули: R3 . 20. Сполука за п.19, в якій R3 є OR3A. 21. Сполука за п.19, в якій R3 є воднем. 22. Сполука або її фармацевтично прийнятна сіль, вибрана з групи: 1-(4-((1R,2S,3R)-1,2,3,4-тетрагідроксибутил)-1Німідазол-2-іл)етаноноксим; (Е)-1-(4-((1R,2S,3R)-1,2,3,4-тетрагідроксибутил)1Н-імідазол-2-іл)етаноноксим; (Z)-1-(4-((1R,2S,3R)-1,2,3,4-тетрагідроксибутил)1H-імідазол-2-іл)етаноноксим; 1-(4-((1R,2S,3R)-1,2,3,4-тетрагідроксибутил)-1Німідазол-2-іл)етанон-О-метилоксим; (E)-1-(4-((1R,2S,3R)-1,2,3,4-тeтpaгiдpoкcибyтил)1H-iмiдaзoл-2-iл)eтaнoн-О-метилоксим; (Z)-1-(4-((1R,2S,3R)-1,2,3,4-тeтpaгiдpoкcибyтил)1H-iмiдaзoл-2-iл)eтaнoн-О-метилоксим; 1-(5-метил-4-((1R,2S,3R)-1,2,3,4тетрагідроксибутил)-1Н-імідазол-2-іл)етанон; (1R,2S,3R)-1-(2-(1-гідразоноетил)-1Н-імідазол-4іл)бутан-1,2,3,4-тетраол; N'-(1-(4-((1R,2S,3R)-1,2,3,4-тетрагідроксибутил)1Н-імідазол-2-іл)етиліден)ацетогідразид; 4-мeтил-N'-(1-(4-((1R,2S,3R)-1,2,3,4тeтpaгiдpoкcибyтил)-1H-iмiдaзoл-2іл)етиліден)бензолсульфоногідразид; (E)-4-мeтил-N'-(1-(4-((1R,2S,3R)-1,2,3,4тeтpaгідpoкcибyтил)-1H-iмiдaзoл-2іл)етиліден)бензолсульфоногідразид; (Z)-4-метил-N'-(1-(4-((1R,2S,3R)-1,2,3,4тетрагідроксибутил)-1H-імідазол-2іл)етиліден)бензолсульфоногідразид; N'-(1-(4-((1R,2S,3R)-1,2,3,4-тетрагідроксибутил)1H-імідазол-2-іл)етиліден)бензогідразид; етил-2-(1-(4-((1R,2S,3R)-1,2,3,4тетрагідроксибутил)-1Н-імідазол-2іл)етиліден)гідразинкарбоксилат; (Е)-етил-2-(1-(4-((1R,2S,3R)-1,2,3,4тетрагідроксибутил)-1Н-імідазол-2іл)етиліден)гідразинкарбоксилат; 5 94737 6 (Z)-етил-2-(1-(4-((1R,2S,3R)-1,2,3,4тетрагідроксибутил)-1Н-імідазол-2іл)етиліден)гідразинкарбоксилат; N'-(1-(4-((1R,2S,3R)-1,2,3,4-тетрагідроксибутил)1Н-імідазол-2-іл)етиліден)нікотиногідразид; (Е)-N'-(1-(4-((1R,2S,3R)-1,2,3,4тетрагідроксибутил)-1Н-імідазол-2іл)етиліден)нікотиногідразид; (Z)-N'-(1-(4-((1R,2S,3R)-1,2,3,4тетрагідроксибутил)-1H-імідазол-2іл)етиліден)нікотиногідразид; 3-хлор-N'-(1-(4-((1R,2S,3R)-1,2,3,4тетрагідроксибутил)-1Н-імідазол-2іл)етиліден)бензогідразид; 4-фтор-N-(1-(4-((1R,2S,3R)-1,2,3,4тетрагідроксибутил)-1Н-імідазол-2іл)етиліден)бензогідразид; (Е)-4-фтор-N'-(1-(4-((1R,2S,3R)-1,2,3,4тетрагідроксибутил)-1H-імідазол-2іл)етиліден)бензогідразид; (Z)-4-фтор-N'-(1-(4-((1R,2S,3R)-1,2,3,4тетрагідроксибутил)-1H-імідазол-2іл)етиліден)бензогідразид; 6-аміно-N'-(1-(4-((1R,2S,3R)-1,2,3,4тетрагідроксибутил)-1Н-імідазол-2іл)етиліден)нікотиногідразид; (E)-6-aміно-N'-(1-(4-((1R,2S,3R)-1,2,3,4тетрагідроксибутил)-1Н-імідазол-2іл)етиліден)нікотиногідразид; (Z)-6-аміно-N'-(1-(4-((1R,2S,3R)-1,2,3,4тетрагідроксибутил)-1Н-імідазол-2іл)етиліден)нікотиногідразид; N'-(1-(4-((1R,2S,3R)-1,2,3,4-тетрагідроксибутил)1H-імідазол-2-іл)етиліден)ізонікотиногідразид; (Е)-N'-(1-(4-((1R,2S,3R)-1,2,3,4тетрагідроксибутил)-1Н-імідазол-2іл)етиліден)ізонікотиногідразид; (Z)-N'-(1-(4-((1R,2S,3R)-1,2,3,4тетрагідроксибутил)-1Н-імідазол-2іл)етиліден)ізонікотиногідразид; N'-(1-(4-((1R,2S,3R)-1,2,3,4-тетрагідроксибутил)1H-імідазол-2-іл)етиліден)біфеніл-3карбогідроазид; (Е)-N'-(1-(4-((1R,2S,3R)-1,2,3,4тетрагідроксибутил)-1Н-імідазол-2іл)етиліден)біфеніл-3-карбогідразид; (Z)-N'-(1-(4-((1R,2S,3R)-1,2,3,4тетрагідроксибутил)-1Н-імідазол-2іл)етиліден)біфеніл-3-карбогідразид; N-гідрокси-4-((1R,2S,3R)-1,2,3,4тетрагідроксибутил)-1Н-імідазол-2-карбоксамід. 23. Фармацевтична композиція, яка містить сполуку за будь-яким з пп.1, 18 або 22 і фармацевтично прийнятний ексципієнт або розріджувач. 24. Застосування сполуки за будь-яким з пп.1, 18 або 22 для одержання лікарського засобу для пригнічення імунної реакції у пацієнта. 25. Застосування сполуки за пп.будь-яким з 1, 18 або 22 для одержання лікарського засобу для лікування ревматоїдного артриту, астми, атопічного дерматиту, хвороби Бехчета, реакції "трансплантат проти хазяїна", червоного вовчака, розсіяного склерозу, полінозу, псоріазу, відторгнення трансплантата або увеїту. За даною заявкою вимагається пріоритет на основі заявки на патент США 11/698253 від 25 січня 2007 р. і попередніх заявок на патенти США №№ 60/776473 від 24 лютого 2006 р. і 60/815221 від 20 червня 2006 р., які включені сюди як посилання. 1. Галузь техніки, до якої належить винахід Цей винахід належить до сполук на основі імідазолу і способів їх застосування для лікування, попередження і контролювання різних захворювань і розладів. 2. Передумови створення винаходу Сфінгозин-1-фосфат (S1P) є біоактивною молекулою з сильними ефектами в різних системах органів (Saba, J. D., Hla, T. Circ. Res. 94:724-734 (2004)). Хоч деякі вважають, що ця сполука є внутрішньоклітинним вторинним месенджером, спосіб її дії всі ще залишається предметом дискусій (див. там же). Навіть її метаболізм вивчений недостатньо (Hla, Т., Science 309:1682-3 (2005)). В цей час дослідники вважають, що S1P утворюється при фосфорилуванні сфінгозину і розкладається за допомогою дефосфорилування або розщеплення. За опублікованим даними, його розщеплення на етаноламін і довголанцюговий альдегід каталізує S1P-ліаза (див. там же і у Pyne & Pyne, Biochem J. 349:385-402 (2000)). Сфінгозин-1-фосфатліаза є витамін-В6залежним ферментом, локалізованим в мембрані ендоплазматичної сітки (Van Veldhoven і Mannaerts, J. Biol. Chem. 266:12502-12507 (1991); Van Veldhoven і Mannaerts, Adv. Lipid. Res. 26:69 (1993)). Полінуклеотидна і амінокислотна послідовності людської S1P-ліази і продукти її гена описані в РСТ-заявці на патент № WO 99/16888. Нещодавно Schwab зі співробітниками прийшли до висновку, що компонент III паленого цукру, 2-ацетил-4-тетрагідроксибутилімідазол (THI), інгібує активність S1P-ліази при введенні мишам (Schwab, S. et al. Science 309:1735-1739 (2005)). Хоч інші дослідники затверджували, що THI здійснює свої ефекти за іншим механізмом (див., наприклад, Pyne, S. G., ACGC Chem. Res. Comm. 11:108-112 (2000)), ясно, що введення цієї сполуки щурам і мишам індукує лімфопенію і є причиною накопичення зрілих Т-клітин в тимусі. Див., наприклад, Schwab, вищезазначену публікацію; Pyne, S. G., ACGC Chem. Res. Comm. 11:108-112 (2000); Gugsyan, R., et al. Immunology 93(3):398-404 (1998); Halweg, K. M., Bulchi, G., J. Org. Chem. 50:1134-1136 (1985); Патент США № 4567194, виданий Kroeplien і Rosdorfer. Однак, все ще не було повідомлень про те, що THI викликає імунологічний ефект і у інших тварин (крім мишей і щурів). Хоч в патенті США № 4567194 повідомляється, що 7 THI і деякі родинні сполуки можуть бути корисними як медичні імунодепресанти, дослідження цієї сполуки на людях не виявили ніяких імунологічний ефектів. Див. Thuvander, А., Oskarsson, А., Fd. Chem. Toxic. 32(1):7-13 (1994); Houben, G. F. et al. Fd. Chem. Toxic. 30(9):749-757 (1992). 3. Суть винаходу Даний винахід належить, зокрема, до сполук формули I: і їх фармацевтично прийнятних солей і сольватів (наприклад, гідратів), в якій X є О або NR3; R1 є OR1A, NHOH, воднем або необов'язково заміщеним алкілом, арилом, алкіларилом, арилалкілом, гетероалкілом, гетероциклом, алкілгетероциклом або гетероциклоалкілом; R2 є OR2A, С(О)OR2A, воднем, галогеном, нітрилом або необов'язково заміщеним алкілом, арилом, алкіларилом, арилалкілом, гетероалкілом, гетероциклом, алкілгетероциклом або гетероциклоалкілом; R3 є OR3A, N(R3A)2, NHC(О)R3A, NHSO2R3A або воднем; R4 є OR4A, OC(О)R4A, воднем, галогеном або необов'язково заміщеним алкілом, арилом, алкіларилом, арилалкілом, гетероалкілом, гетероциклом, алкілгетероциклом або гетероциклоалкілом; R5 є N(R5A)2, воднем, гідроксилом або необов'язково заміщеним алкілом, арилом, алкіларилом, арилалкілом, гетероалкілом, гетероциклом, алкілгетероциклом або гетероциклоалкілом; і кожний з R1A, R2A, R3A, R4A і R5A є незалежно воднем або необов'язково заміщеним алкілом, арилом, алкіларилом, арилалкілом, гетероалкілом, гетероциклом, алкілгетероциклом або гетероциклоалкілом. Цей винахід також охоплює фармацевтичні композиції, які містять сполуку формули I, і способи лікування запальних захворювань і розладів з використанням сполук формули I. 4. Короткий опис креслень Визначені аспекти цього винаходу можуть бути зрозумілі при зверненні до наступних фігур: Фігура 1 представляє типову точкову діаграму, яка одержана методом FACS (флуоресцентноактивоване сортування клітин) і показує вплив на склад Т-клітин (CD4+ і CD8+) тимуса в контрольному прикладі з наповнювачем (VC), у випадку сполуки цього винаходу (Сполука 1) і у випадку THI, а також середні значення і стандартні відхилення для всіх мишей (n = 3). Фігура 2 представляє типову точкову діаграму, яка показує вплив на субпопуляцію клітин CD4+ (що нещодавно вийшли з тимуса) у мишей в контрольному прикладі з наповнювачем (VC), у випадку сполуки цього винаходу (Сполука 1) і у випадку THI. Фігура 3 представляє типову точкову діаграму, одержану методом FACS, яка показує вплив на субпопуляцію клітин CD8+ (що нещодавно вийшли 94737 8 з тимуса) у мишей в контрольному прикладі з наповнювачем (VC), у випадку сполуки цього винаходу (Сполука 1) і у випадку THI. Фігура 4 показує вплив на вміст формених елементів в цільній крові мишей в контрольному прикладі з наповнювачем, у випадку THI, у випадку Сполуки 1 і 1-(4-метил-5-((1S,2R,3R)-1,2,3,4тетрагідроксибутил)тіазол-2-іл)етанону (Сполука 2). Фігура 5 показує дію однократної пероральної дози сполуки цього винаходу на артрит у мишей, індукований колагеном. Фігура 6 показує дію однократної пероральної дози сполуки цього винаходу на вміст лейкоцитів і лімфоцитів в крові яванських макак. 5. Докладний опис Даний винахід є результатом досліджень мишей із зруйнованим геном S1P-ліази і в основному належить до сполук, передбачувано корисних для лікування, попередження і контролювання автоімунних і запальних захворювань і розладів. 5.1. Визначення Якщо не зазначено інакше, термін «алкеніл» означає вуглеводень з прямим або розгалуженим ланцюгом, або циклічний вуглеводень, що має від 2 до 20 (наприклад, від 2 до 10 або від 2 до 6) атомів вуглецю і щонайменше один подвійний вуглець-вуглецевий зв'язок. Репрезентативні алкенільні групи включають вініл, аліл, 1-бутеніл, 2бутеніл, ізобутиленіл, 1-пентеніл, 2-пентеніл, 3метил-1-бутеніл, 2-метил-2-бутеніл, 2,3-диметил2-бутеніл, 1-гексеніл, 2-гексеніл, 3-гексеніл, 1гептеніл, 2-гептеніл, 3-гептеніл, 1-октеніл, 2октеніл, 3-октеніл, 1-ноненіл, 2-ноненіл, 3-ноненіл, 1-деценіл, 2-деценіл і 3-деценіл. Якщо не зазначено інакше, термін «алкіл» означає вуглеводень з прямим або розгалуженим ланцюгом, або циклічний («циклоалкіл») вуглеводень, що має від 1 до 20 (наприклад, від 1 до 10 або від 1 до 4) атомів вуглецю. Алкільні групи, що мають від 1 до 4 атомів вуглецю, називають «нижчим алкілом». Приклади алкільних груп включають, але не обмежуються ними, метил, етил, пропіл, ізопропіл, н-бутил, трет-бутил, ізобутил, пентил, гексил, ізогексил, гептил, 4,4диметилпентил, октил, 2,2,4-триметилпентил, ноніл, децил, ундецил і додецил. Циклоалкільні групи можуть бути моноциклічними або мультициклічними, а їх приклади включають циклопропіл, циклобутил, циклопентил, циклогексил і адамантил. Додаткові приклади алкільних груп мають лінійні, розгалужені і/або циклічні частини (наприклад, 1етил-4-метилциклогексил). Термін «алкіл» включає насичені вуглеводні, а також алкенільні і алкінільні групи. Якщо не зазначено інакше, термін «алкіларил» або «алкіл-арил» означає алкільну групу, зв'язану з арильною групою. Якщо не зазначено інакше, термін «алкілгетероарил» або «алкіл-гетероарил» означає алкільну групу, зв'язану з гетероарильною групою. Якщо не зазначено інакше, термін «алкілгетероцикл» або «алкіл-гетероцикл» означає алкільну групу, зв'язану з гетероциклічною групою. 9 Якщо не зазначено інакше, термін «алкініл» означає вуглеводень з прямим або розгалуженим ланцюгом, або циклічний вуглеводень, який має від 2 до 20 (наприклад, від 2 до 20 або від 2 до 6) атомів вуглецю і включає один або більше потрійних вуглець-вуглецевих зв'язків. Репрезентативні алкінільні групи включають ацетиленіл, пропініл, 1бутиніл, 2-бутиніл, 1-пентиніл, 2-пентиніл, 3-метил1-бутиніл, 4-пентиніл, 1-гексиніл, 2-гексиніл, 5гексиніл, 1-гептиніл, 2-гептиніл, 6-гептиніл, 1октиніл, 2-октиніл, 7-октиніл, 1-нонініл, 2-нонініл, 8нонініл, 1-дециніл, 2-дециніл і 9-дециніл. Якщо не зазначено інакше, термін «алкоксигрупа» означає -O-алкільну групу. Приклади алкоксигруп включають, але не обмежуються ними, OCH3, -OCH2CH3, -O(CH2)2CH3, -O(CH2)3CH3, O(CH2)4CH3 і -O(CH2)5CH3. Якщо не зазначено інакше, термін «арил» означає ароматичне кільце або ароматичну або частково ароматичну кільцеву систему, складену з атомів вуглецю і водню. Арильна група може включати множинні кільця, зв'язані або конденсовані одне з одним. Приклади арильних груп включають, але не обмежуються ними, антраценіл, азуленіл, біфеніл, флуореніл, індан, інденіл, нафтил, фенантреніл, феніл, 1,2,3,4тетрагідронафталін і толіл. Якщо не зазначено інакше, термін «арилалкіл» або «арил-алкіл» означає арильну групу, зв'язану з алкільною групою. Якщо не зазначено інакше, термін «засіб, що знижує рівень циркулюючих лейкоцитів», означає сполуку, яка має CLRF більше ніж приблизно 20%. Якщо не зазначено інакше, термін «фактор зниження рівня циркулюючих лімфоцитів» або «CLRF» означає зменшення кількості циркулюючих лімфоцитів у мишей, викликане пероральним введенням сполуки в однократній дозі 100мг/кг, визначене способом, описаним нижче в Прикладах. Якщо не зазначено інакше, термін «галоген» і «гало» охоплює фтор, хлор, бром і йод. Якщо не зазначено інакше, термін «гетероалкіл» означає алкільну групу (наприклад, лінійну, розгалужену або циклічну), де принаймні один з атомів вуглецю замінений гетероатомом (наприклад, N, О або S). Якщо не зазначено інакше, термін «гетероалкіл» означає арильну групу, де принаймні один з атомів вуглецю замінений гетероатомом (наприклад, N, О або S). Приклади включають, але не обмежуються ними, акридиніл, бензімідазоліл, бензофураніл, бензоізотіазоліл, бензоізоксазоліл, бензохіназолініл, бензотіазоліл, бензоксазоліл, фурил, імідазоліл, індоліл, ізотіазоліл, ізоксазоліл, оксадіазоліл, оксазоліл, фталазиніл, піразиніл, піразоліл, піридазиніл, піридил, піримідиніл, піримідил, піроліл, хіназолініл, хінолініл, тетразоліл, тіазоліл і триазиніл. Якщо не зазначено інакше, термін «гетероарилалкіл» або «гетероарил-алкіл» означає гетероарильну групу, зв'язану з алкільною групою. Якщо не зазначено інакше, термін «гетероцикл» належить до ароматичного, частково ароматичного або неароматичного моноциклічного 94737 10 або поліциклічного кільця або кільцевої системи, що складається з вуглецю, водню і принаймні одного гетероатома (наприклад, N, О або S). Гетероцикл може включати множинні кільця (наприклад, два або більше), конденсовані або зв'язані одне з одним. Гетероцикли включають гетероарили. Приклади включають, але не обмежуються ними, бензо[1,3]діоксоліл, 2,3-дигідробензо[1,4]діоксиніл, цинолініл, фураніл, гідантоїніл, морфолініл, оксетаніл, оксираніл, піперазиніл, піперидиніл, піролідиноніл, піролідиніл, тетрагідрофураніл, тетрагідропіраніл, тетрагідропіридиніл, тетрагідропіримідиніл, тетрагідротіофеніл, тетрагідротіопіраніл і валеролактаміл. Якщо не зазначено інакше, термін «гетероциклоалкіл» або «гетероцикло-алкіл» означає гетероциклічну групу, зв'язану з алкільною групою. Якщо не зазначено інакше, термін «гетероциклоалкіл» означає неароматичний гетероцикл. Якщо не зазначено інакше, термін «гетероциклоалкілалкіл» або «гетероциклоалкіл-алкіл» означає гетероциклоалкільну групу, зв'язану з алкільною групою. Якщо не зазначено інакше, терміни «контролювати», «контроль» і «контролювання» охоплюють запобігання рецидиву конкретного захворювання або розладу у пацієнта, який вже страждав від цього захворювання або розладу, і/або продовження часу, протягом якого пацієнт, що страждав від цієї хвороби або розладу, залишається в стані ремісії. Ці терміни охоплюють зміну порога, розвитку і/або тривалості захворювання або розладу або зміну характеру реакції пацієнта на це захворювання або розлад. Якщо не зазначено інакше, термін «фармацевтично прийнятні солі» належить до солей, приготованих з фармацевтично прийнятних нетоксичних кислот або основ, включаючи неорганічні кислоти і основи і органічні кислоти і основи. Придатні фармацевтично прийнятні солі приєднання основ включають, але не обмежуються ними, солі металів, приготовані з алюмінію, кальцію, літію, магнію, калію, натрію і цинку, або органічні солі, приготовані з лізину, N,N'-дибензилетилендіаміну, хлорпрокаїну, холіну, діетаноламіну, етилендіаміну, меглюміну (N-метилглюкаміну) і прокаїну. Придатні нетоксичні кислоти включають, але не обмежуються ними, неорганічні і органічні кислоти, такі як оцтова, альгінова, антранілова, бензолсульфонова, бензойна, камфорсульфонова, лимонна, етенсульфонова, мурашина, фумарова, фуранкарбонова, галактуронова, глюконова, глюкуронова, глутамінова, гліколева, бромистоводнева, хлористоводнева (соляна), ізетіонова, молочна, малеїнова, яблучна, мигдалева, метансульфонова, муцинова (слизова), азотна, памова, пантотенова, фенілоцтова, фосфорна, пропіонова, саліцилова, стеаринова, янтарна, сульфанілова, сірчана, винна кислота і п-толуолсульфонова кислота. Конкретні нетоксичні кислоти включають хлористоводневу (соляну), бромистоводневу, фосфорну, сірчану і метансульфонову кислоти. Приклади конкретних солей включають гідрохлоридні і мезилатні солі. Інші солі добре відомі в даній галузі. Див., наприклад, Remington's Pharmaceutical Sciences (18th 11 ed., Mack Publishing, Easton PA.: 1990) і Remington: The Science and Practice of Pharmacy (19th ed., Mack Publishing, Easton PA.: 1995). Якщо не зазначено інакше, терміни «запобігати (попереджати)», «який запобігає (який попереджає)» і «запобігання (попередження)» передбачають дію, яку проводять до того, як пацієнт починає страждати від конкретного захворювання або розладу і яка інгібує або зменшує тяжкість цього захворювання або розладу. Іншими словами, ці терміни охоплюють профілактику. Якщо не зазначено інакше, «профілактично ефективна кількість» сполуки - це кількість, достатня для запобігання розвитку захворювання або хворобливого стану, або одного або більше симптомів, пов'язаних з цим захворюванням або станом, або для запобігання їх рецидиву. Профілактично ефективна кількість сполуки означає ту кількість терапевтичного засобу, одного або в комбінації з іншими засобами, яка забезпечує сприятливий профілактичний ефект в запобіганні захворюванню. Термін «профілактично ефективна кількість» може охоплювати кількість, яка поліпшує загальну профілактику або підвищує профілактичну ефективність іншого профілактичного засобу. Якщо не зазначено інакше, термін «засіб, що підвищує рівень S1P», означає сполуку, яка має SLEF не менше приблизно 10-кратного. Якщо не зазначено інакше, термін «фактор, той, що підвищує рівень S1P» або «SLEF» означає збільшення S1P в селезінці мишей, викликане пероральним введенням сполуки в однократній дозі 100мг/кг, визначене способом, описаним нижче в Прикладах. Якщо не зазначено інакше, термін «стереоізомерна суміш» охоплює рацемічні суміші, а також стереомерно збагачені суміші (наприклад, R/S = 30/70, 35/65, 40/60, 45/55, 55/45, 60/40, 65/35 і 70/30). Якщо не зазначено інакше, термін «стереомерно чистий» означає композицію, яка містить один стереоізомер сполуки і є суттєво вільною від інших стереоізомерів цієї сполуки. Наприклад, стереомерно чиста композиція сполуки, що має один стереоцентр, буде суттєво вільною від протилежного стереоізомера цієї сполуки. Стереомерно чиста композиція сполуки, що має два стереоцентри, буде суттєво вільною від інших діастереомерів цієї сполуки. Типове стереомерно чиста сполука містить більше приблизно 80% по масі одного стереоізомера цієї сполуки і менше приблизно 20% по масі інших стереоізомерів цієї сполуки, більше приблизно 90% по масі одного стереоізомера цієї сполуки і менше приблизно 10% по масі інших стереоізомерів цієї сполуки, більше приблизно 95% по масі одного стереоізомера цієї сполуки і менше приблизно 5% по масі інших стереоізомерів цієї сполуки, більше приблизно 97% по масі одного стереоізомера цієї сполуки і менше приблизно 3% по масі інших стереоізомерів цієї сполуки або більше приблизно 99% по масі одного стереоізомера цієї сполуки і менше приблизно 1% по масі інших стереоізомерів цієї сполуки. Якщо не зазначено інакше, термін «заміщений», коли його використовують для опису хімічної 94737 12 структури або групи, належить до похідного цієї структури або групи, в якій один або більше водневих атомів заміщені хімічною групою або функціональною групою, такими як наступні (але не обмежуючись ними): спирт, альдегід, алкоксигрупа, алканоїлоксигрупа, алкоксикарбоніл, алкеніл, алкіл (наприклад, метил, етил, пропіл, трет-бутил), алкініл, алкілкарбонілоксигрупа (-OC(О)алкіл), амід (-С(О)NH-алкіл- або -алкілNHC(О)алкіл), амідиніл (-С(NH)NH-алкіл або -C(NR)NH2), амін (первинний, вторинний і третинний, такі як алкіламіногрупа, ариламіногрупа, арилалкіламіногрупа), ароїл, арил, арилоксигрупа, азогрупа, карбамоїл (NHC(О)О-алкіл- або -OC(О)NH-алкіл), карбаміл (наприклад, CONH2, а також CONH-алкіл, CONHарил і CONH-арилалкіл), карбоніл, карбоксил, карбонова кислота, ангідрид карбонової кислоти, хлорид карбонової кислоти, ціаногрупа, складний ефір, епоксид, простий ефір (наприклад, метоксигрупа, етоксигрупа), гуанідинова група, галоген, галоалкіл (наприклад, -CCl3, -CF3, -C(CF3)3), гетероалкіл, напівацеталь, імін (первинний і вторинний), ізоціанат, ізотіоціанат, кетон, нітрил, нітрогрупа, оксогрупа, складний фосфодіефір, сульфід, сульфонамідна група (наприклад, SO2NH2), сульфон, сульфоніл (включаючи алкілсульфоніл, арилсульфоніл і арилалкілсульфоніл), сульфоксид, тіол (наприклад, сульфгідрил, тіоефір) і сечовина (-NHCONH-алкіл-). Якщо не зазначено інакше, «терапевтично ефективна кількість» сполуки - це кількість, достатня для забезпечення терапевтично сприятливого ефекту при лікуванні і контролюванні захворювання або хворобливого стану або для сповільнення або мінімізації одного або більше симптомів, пов'язаних з цим захворюванням або станом. Терапевтично ефективна кількість сполуки означає ту кількість терапевтичного засобу, одного або в комбінації з іншими засобами лікування, яка забезпечує терапевтично сприятливий ефект при лікуванні або контролюванні цього захворювання або стану. Термін «терапевтично ефективна кількість» може охоплювати ту кількість, яка поліпшує загальну терапію, ослаблює симптоми або причини захворювання або хворобливого стану або попереджає їх появу, або підвищує терапевтичну ефективність іншого терапевтичного засобу. Якщо не зазначено інакше, терміни «лікує», «лікуючий» і «лікування» передбачають дію, яку здійснюють, коли пацієнт страждає від конкретного захворювання або розладу, і яка зменшує тяжкість цього захворювання або розладу або затримує або сповільнює прогрес цього захворювання або розладу. Якщо не зазначено інакше, термін «включати» має те ж значення, що і вираз «включати, але не обмежуватися ним(и)», а термін «включає» має те ж значення, що і вираз «включає, але не обмежується ним(и)». Подібним же чином, термін «такий(і) як» має те ж значення, що і термін «такий(і) як, але не обмежуючись ним(и)». Якщо не зазначено інакше, одне або більше визначень, що безпосередньо передують ряду іменників, потрібно розуміти як застосовувані до кожного з цих іменників. Наприклад, фраза «не 13 обов'язково заміщений алкіл, арил або гетероарил» має те ж значення, що і «необов'язково заміщений алкіл, необов'язково заміщений арил або необов'язково заміщений гетероарил». Потрібно зазначити, що хімічна група, яка утворює частину більшої сполуки, тут може бути описана з використанням назви, прийнятої для неї, коли вона існує як окрема молекула, або назви, прийнятої для її радикала. Наприклад, терміни «піридин» і «піридил» мають одне і те ж значення, коли вони використані для опису групи, приєднаної до інших хімічних груп.Так, обидві фрази «ХОН, в якому Х є піридилом» і «ХОН, в якому Х є піридином» мають однакове значення і охоплюють сполуки піридин-2-ол, піридин-3-ол і піридин-4-ол. Потрібно також зазначити, що якщо стереохімія якої-небудь структури або частини структури не вказана, наприклад, жирними або пунктирними лініями, то цю структуру або частину цієї структури потрібно розуміти як таку, що охоплює всі її стереоізомери. Більше того, будь-який атом, показаний на кресленні з ненасиченими валентностями, потрібно вважати приєднаним до такої кількості атомів водню, якої достатньо для насичення цих валентностей. Крім того, хімічні зв'язки, зображені однією суцільною лінією, паралельною одній пунктирній лінії, означають як одинарні, так і подвійні (наприклад, ароматичні) зв'язки, якщо дозволяють валентності. 5.2. Сполуки Даний винахід належить до сполук формули I: і їх фармацевтично прийнятних солей і сольватів (наприклад, гідратів), в яких X є О або NR3; R1 є OR1A, NHOH, воднем або необов'язково заміщеним алкілом, арилом, алкіларилом, арилалкілом, гетероалкілом, гетероциклом, алкілгетероциклом або гетероциклоалкілом; R2 є OR2A, С(О)OR2A, воднем, галогеном, нітрилом або необов'язково заміщеним алкілом, арилом, алкіларилом, арилалкілом, гетероалкілом, гетероциклом, алкілгетероциклом або гетероциклоалкілом; R3 є OR3A, N(R3A)2, NHC(О)R3A, NHSO2R3A або воднем; R4 є OR4A, OC(О)R4A, воднем, галогеном або необов'язково заміщеним алкілом, арилом, алкіларилом, арилалкілом, гетероалкілом, гетероциклом, алкілгетероциклом або гетероциклоалкілом; R5 є N(R5A)2, воднем, гідроксилом або необов'язково заміщеним алкілом, арилом, алкіларилом, арилалкілом, гетероалкілом, гетероциклом, алкілгетероциклом або гетероциклоалкілом; і кожний з R1A, R2A, R3A, R4A і R5A є незалежно воднем або необов'язково заміщеним алкілом, арилом, алкіларилом, арилалкілом, гетероалкілом, гетероциклом, алкілгетероциклом або гетероциклоалкілом. Конкретними сполуками формули I є такі сполуки, в яких, якщо Х є О, то R1 є алкілом з 1-4 вуг 94737 14 леців, фенілом, бензилом або фенілетилом, R2 є воднем; і один з R4 і R5 є гідроксилом, а інший з R4 і R5 не є алкілом, який містить від 1 до 6 вуглеців, гідроксіалкілом, який містить від 1 до 6 вуглеців, полігідроксіалкілом, який містить від 1 до 6 вуглеців і має не більше одного гідроксилу на атом вуглецю, поліацетилалкілом, який містить від 1 до 6 вуглеців і має не більше одного ацетилу на атом вуглецю, фенілом, бензилом або фенілетилом. В конкретних варіантах здійснення ця сполука не є 2-ацетил-4-тетрагідроксибутилімідазолом, 1(4-(1,1,2,2,4-пентагідроксибутил)-1H-імідазол-2іл)етаноном, 1-(2-ацетил-1H-імідазол-4-іл)бутан1,1,2,2-тетраїлтетраацетатом або 1-(2-ацетил-1Hімідазол-4-іл)бутан-1,1,2,2,4пентаїлпентаацетатом. Конкретний варіант здійснення охоплює сполуки формули II: і їх фармацевтично прийнятні солі і сольвати, в якій: X є О або NR3; R1 є OR1A, NHOH, воднем або необов'язково заміщеним алкілом, арилом, алкіларилом, арилалкілом, гетероалкілом, гетероциклом, алкілгетероциклом або гетероциклоалкілом; R2 є OR2A, С(О)OR2A, воднем, галогеном, нітрилом або необов'язково заміщеним алкілом, арилом, алкіларилом, арилалкілом, гетероалкілом, гетероциклом, алкілгетероциклом або гетероциклоалкілом; R3 є OR3A, N(R3A)2, NHC(О)R3A, NHSO2R3A або воднем; R6 є OR6A, OC(О)R6A, N(R6B)2, NHC(О)R6B, воднем або галогеном; R7 є OR7A, OC(О)R7A, N(R7B)2, NHC(О)R7B, воднем або галогеном; R8 є OR8A, OC(О)R8A, N(R8B)2, NHC(О)R8B, воднем або галогеном; R9 є CH2OR9A, CH2OC(О)R9A, N(R9B)2, NHC(О)R9B, воднем або галогеном; кожний з R1A, R2A, R3A, R6A, R7A, R8A і R9A є незалежно воднем або необов'язково заміщеним алкілом, арилом, алкіларилом, арилалкілом, гетероалкілом, гетероциклом, алкілгетероциклом або гетероциклоалкілом; і кожний з R6B, R7B, R8B і R9B є незалежно воднем або алкілом, необов'язково заміщеним однією або більше гідроксильними групами або галогенами. Конкретні сполуки формули II являють собою такі сполуки, в яких: 1) якщо Х є О, R1 є алкілом, що містить від 1 до 4 вуглеців, фенілом, бензилом або фенілетилом, R2 є воднем, щонайменше два з R6, R7, R8 і R9 не є гідроксилом або ацетатом; 2) якщо X є О, R1 є метилом, R2 є воднем, R6 і R7 обидва є гідроксилами, і один з R8 і R9 є воднем, інший не є NHC(О)R9B; 3) якщо X є О, R1 є OR1A, R1A є воднем або нижчим алкілом, і R2 є воднем, а щонайменше один, але не всі, з R6, R7, R8 і R9 є гідроксилом або ацетатом. Конкретні сполуки цього винаходу мають формулу II(a): 15 . Інші конкретні сполуки мають формулу III: , в якій: Z є необов'язково заміщеним алкілом; R1 є OR1A, NHOH, воднем або необов'язково заміщеним алкілом, арилом, алкіларилом, арилалкілом, гетероалкілом, гетероциклом, алкілгетероциклом або гетероциклоалкілом; R2 є OR2A, С(О)OR2A, воднем, галогеном, нітрилом або необов'язково заміщеним алкілом, арилом, алкіларилом, арилалкілом, гетероалкілом, гетероциклом, алкілгетероциклом або гетероциклоалкілом; R3 є OR3A, N(R3A)2, NHC(О)R3A, NHSO2R3A або воднем; і кожний з R1A, R2A і R3A є незалежно воднем або необов'язково заміщеним алкілом, арилом, алкіларилом, арилалкілом, гетероалкілом, гетероциклом, алкілгетероциклом або гетероциклоалкілом. Інший варіант здійснення винаходу охоплює сполуки формули IV: і їх фармацевтично прийнятні солі і сольвати, в якій: R1 є OR1A, NHOH, воднем або необов'язково заміщеним алкілом, арилом, алкіларилом, арилалкілом, гетероалкілом, гетероциклом, алкілгетероциклом або гетероциклоалкілом; R3 є OR3A, N(R3A)2, NHC(О)R3A, NHSO2R3A або воднем; R6 є OR6A, OC(О)R6A, N(R6B)2, NHC(О)R6B, воднем або галогеном; R7 є OR7A, OC(О)R7A, N(R7B)2, NHC(О)R7B, воднем або галогеном; R8 є OR8A, OC(О)R8A, N(R8B)2, NHC(О)R8B, воднем або галогеном; R9 є CH2OR9A, CH2OC(О)R9A, N(R9B)2, NHC(О)R9B, воднем або галогеном; кожний з R1A, R3A, R6A, R7A, R8A і R9A є незалежно воднем або необов'язково заміщеним алкілом, арилом, алкіларилом, арилалкілом, гетероалкілом, гетероциклом, алкілгетероциклом або гетероциклоалкілом. Конкретні сполуки мають формулу IV(a): 94737 16 . Для кожної з формул, які показані вище і містять групи, описані нижче, визначені варіанти здійснення винаходу такі. У деяких Х є О. В інших Х є NR3. У деяких R1 є воднем. У інших R1 є необов'язково заміщеним нижчим алкілом. У інших R1 є NHOH. У інших R1 є OR1A, а R1A є, наприклад, воднем або необов'язково заміщеним нижчим алкілом. У деяких R2 є воднем. У інших R2 не є воднем. У інших R2 є нітрилом. У інших R2 є необов'язково заміщеним нижчим алкілом. У інших R2 є OR2A. У інших R2 є С(О)OR2A. У деяких R2 є воднем або необов'язково заміщеним нижчим алкілом. У деяких R3 є OR3A. У інших R3 є N(R3A)2 або NHC(О)R3A. У інших R3 є NHSO2R3A. У деяких R3 є воднем або необов'язково заміщеним нижчим алкілом. У інших R3 є необов'язково заміщеним арилом або гетероциклом. У деяких R4 є OR4A. У інших R4 є галогеном. У деяких R5 є N(R5A)2. У інших R5 є воднем. У інших R5 є гідроксилом. У інших R5 є гетероалкілом (наприклад, алкоксигрупою). У інших R5 є необов'язково заміщеним алкілом. У інших R5 є необов'язково заміщеним арилом. У деяких один або більше з R6, R7, R8 і R9 є гідроксилом або галогеном. У деяких всі R6, R7, R8 і R9 є гідроксилами або ацетатними групами. У деяких Z є алкілом, необов'язково заміщеним однією або більше гідроксильними, ацетатними або галогенними групами. Сполуки цього винаходу можуть містити один або більше стереоцентрів і можуть існувати у вигляді рацемічних сумішей енантіомерів або сумішей діастереомерів. Цей винахід охоплює стереомерно чисті форми таких сполук, а також суміші цих форм. Стереоізомери можна асиметрично синтезувати або розділити, використовуючи стандартну техніку, таку як хіральні колонки або хіральні розділювальні агенти. Див., наприклад, Jacques, J. et al. Enantiomers, Racemates and Resolutions (Wiley Interscience, New York, 1981); Wilen, S. H. et al. Tetrahedron 33:2725 (1977); Eliel, E. L., Stereochemistry of Carbon Compounds (McGraw Hill, N.Y., 1962); і Wilen, S. H., Tables of Resolving Agents and Optical Resolutions, р. 268 (Eliel, E. L., Ed., Univ. of Notre Dame Press, Notre Dame, IN., 1972). Крім того, цей винахід охоплює стереоізомерні суміші сполук, розкритих в даному описі. Він також охоплює конфігураційні ізомери сполук, розкритих в даному описі, як домішки або в чистій або суттєво чистій формі, такій як цис- (Z) і транс- (Е) ізомери алкену і syn- і anti-ізомери оксиму. Переважні сполуки цього винаходу являють собою засоби, які знижують кількість циркулюючих 17 лімфоцитів. Визначені сполуки зменшують кількість циркулюючих лімфоцитів більше ніж на 20, 50, 75, 100, 150 або 200%, що визначено з використанням способів, описаних в Прикладах. У цьому відношенні можна згадати, що було виявлено, що хоч THI може знижувати кількість циркулюючих лімфоцитів у мишей, багато які аналоги і похідні THI, такі як 1-(4-метил-5-((1S,2R,3R)-1,2,3,4тетрагідроксибутил)тіазол-2-іл)етанон, мають слабкий ефект або не виявляють ніякого ефекту на циркулюючі лімфоцити, незважаючи на повідомлення про зворотне. Див. WO 97/46543. Без обмежень якою-небудь теорією вважають, що сполуки цього винаходу впливають на шляхи метаболізму S1P і можуть прямо або непрямо інгібувати S1P-ліазу in vivo. Конкретні сполуки є засобами, які підвищують рівень S1P. Визначені сполуки збільшують кількість S1P більше ніж приблизно в 10, 15, 20, 25 або 30 разів, що визначено з використанням способу, описаного в Прикладах. Сполуки даного винаходу можна приготувати способами, відомими в даній галузі (наприклад, змінюючи і вносячи доповнення в підходи, описані в публікаціях Pyne, S. G., ACGC Chem. Res. Comm. 11:108-112 (2000); Halweg, K. M., Büchi, G., J. Org. Chem. 50:1134-1136 (1985)). Ці сполуки можна також приготувати способами, розкритими нижче, і їх варіантами, які відомі фахівцеві із звичайною кваліфікацією в даній галузі. 5.3. Способи застосування Цей винахід охоплює спосіб регулювання (наприклад, збільшення) кількості S1P у пацієнта (наприклад, у миші, щура, собаки, кота або людини), потребуючого цього, який включає введення цьому пацієнту ефективної кількості сполуки даного винаходу (тобто сполуки, розкритої тут). Інший варіант здійснення охоплює спосіб зниження числа Т-клітин в крові пацієнта, який включає введення цьому пацієнту ефективної кількості сполуки цього винаходу. Інший варіант здійснення охоплює спосіб лікування, контролювання або попередження захворювання, зумовленого (або симптомів, зумовлених) рівнями S1P, який включає введення пацієнту, потребуючому цього, терапевтично або профілактично ефективної кількості сполуки цього винаходу. Інший варіант здійснення охоплює спосіб пригнічення імунної реакції у пацієнта, який включає введення цьому пацієнту ефективної кількості сполуки цього винаходу. Інший варіант здійснення охоплює спосіб лікування, контролювання або попередження автоімунного або запального захворювання або розладу, який включає введення пацієнту, потребуючому цього, терапевтично або профілактично ефективної кількості сполуки цього винаходу. Приклади захворювань і розладів включають анкілозуючий спондилоартрит, астму (наприклад, бронхіальну астму), атопічний дерматит, хворобу Бехчета, реакцію «трансплантат проти хазяїна», хворобу Кавасакі, червоний вовчак, розсіяний склероз, важку псевдопаралітичну міастенію, поліноз (сінну лихоманку), псоріаз, псоріатичний артрит, ревматоїдний артрит, склеродермію, відторгнення транспла 94737 18 нтата (наприклад, органа, клітини або кісткового мозку), діабет першого типу і увеїт. Додаткові захворювання і розлади включають хворобу Аддісона, антифосфоліпідний синдром, автоімунний атрофічний гастрит, автоімунну ахлоргідрию, глютенову хворобу, хворобу Крона, синдром Іценко-Кушинга, дерматоміозит, синдром Гудпасчера, хворобу Грейвса (дифузний тиреотоксичний зоб), тиреоїдит Хашимото, ідіопатичну атрофію надниркових залоз, ідіопатичну тромбоцитопенію, синдром Ламберта-Ітона, пемфігоїд, звичайну пухирчатку, перніціозну анемію, вузликовий поліартеріїт, первинний біліарний цироз, первинний склерозуючий холангіт, хворобу Рейно, хворобу Рейтера, рецидивуючий поліхондрит, синдром Шмідта, синдром Шегрена, симпатичну офтальмію, синдром Такаясу, скроневий артеріїт, тиреотоксикоз, виразковий коліт і гранулематоз Вегенера. Кількість, шлях і схема (режим) введення сполуки буде залежати від таких факторів, як конкретні (специфічні) показання до лікування, попередження або контролю, вік, стать і стан пацієнта. Значення таких факторів добре відоме в даній галузі і може бути використане в звичайних експериментах. У конкретному варіанті здійснення сполуку цього винаходу вводять пацієнту-людині в кількості приблизно 0,5, 1, 2,5 або 5мг на 1кг маси тіла. 5.4. Фармацевтичні лікарські форми Винахід охоплює фармацевтичні композиції, які містять одну або більше сполук цього винаходу. Визначені фармацевтичні композиції є одиничними стандартними формами, застосовними для перорального, черезслизового (наприклад, інтраназального, сублінгвального, інтравагінального або ректального), парентерального (наприклад, підшкірного, внутрішньовенного, болюсної ін'єкції, внутрішньом'язового або внутрішньоартеріального) або трансдермального введення пацієнту. Приклади лікарських форм включають, але не обмежуються ними: таблетки; таблетки у вигляді капсул; капсули, такі як капсули з м'якого еластичного желатину; капсули (каше - cachet); пастилки; коржики; дисперсії; супозиторії; мазі; катаплазми (припарки); пасти; порошки; перев’язні матеріали; креми; пластири; розчини; серветки; аерозолі (наприклад, інтраназальні спреї і інгалятори); гелі; рідкі лікарські форми, застосовні для перорального або черезслизового введення пацієнту, включаючи суспензії (наприклад, водні або неводні рідкі суспензії, емульсії типу «масло у воді» або рідкі емульсії типу «вода в маслі»), розчини і еліксири; рідкі лікарські форми, застосовні для парентерального введення пацієнту; стерильні тверді речовини (наприклад, кристалічні або аморфні тверді речовини), з яких можна приготувати рідкі лікарські форми, придатні для парентерального введення пацієнту. Лікарська форма повинна відповідати способу введення. Наприклад, пероральне введення вимагає кишкових покриттів для захисту сполук цього винаходу від розкладання в шлунково-кишковому тракті. Схожим чином, лікарська форма може містити інгредієнти, які полегшують доставку активно 19 го інгредієнта(ів) до місця дії. Наприклад, сполуки можна вводити в ліпосомальних лікарських формах для захисту від руйнуючих ферментів, для полегшення транспорту в системі кровообігу і для доставки через клітинні мембрани до внутрішньоклітинних сайтів. Аналогічним чином, малорозчинні сполуки можна включити в рідкі лікарські форми (і в лікарські форми, придатні для реконструкції in situ) за допомогою солюбілізуючих засобів, емульгаторів, і поверхнево-активних речовин, таких як (але не обмежуючись ними) циклодекстрини (наприклад, αциклодекстрин, β-циклодекстрин, Captisol® і Encapsin™ (див., наприклад, Davis and Brewster, 2004, Nat. Rev. Drug Disc. 3:1023-1034), Labrasol®, Labrafil®, Labrafac®, кремафор, і неводних розчинників, таких як (але не обмежуючись ними) етиловий спирт, ізопропіловий спирт, етилкарбонат, етилацетат, бензиловий спирт, бензилбензоат, пропіленгліколь, 1,3-бутиленгліколь, диметилформамід, диметилсульфоксид (DMSO), біологічно сумісні олії (наприклад, бавовняна, арахісова, кукурудзяна, зародкова, оливкова, касторова і кунжутна олії), гліцерин, тетрагідрофурфуриловий спирт, поліетиленгліколі, складні ефіри жирних кислот і сорбітану і їх суміші (наприклад, DMSO з кукурудзяною олією). Малорозчинні сполуки можна також включити в суспензії, використовуючи інші способи, відомі в даній галузі. Наприклад, наночастинки сполуки можна суспендувати в рідині з утворенням наносуспензії (див., наприклад, Rabinow, 2004, Nature Rev. Drug Disc. 3:785-796). Нанопорошкові форми сполук, описані тут, можна приготувати способами, описаними в публікаціях патентів США №№ 20040164194, 2004-0195413, 2004-0251332, 20050042177 A1, 2005-0031691 A1, і патентах США №№ 5145684, 5510118, 5518187, 5534270, 5543133, 5662883, 5665331, 5718388, 5718919, 5834025, 5862999, 6431478, 6742734, 6745962, кожний з яких повністю включений сюди як посилання. У одному варіанті здійснення нанопрошкова форма містить частинки, що мають зразкові середні розміри менше 2000нм, менше 1000нм або менше 500нм. Склад, зовнішня форма і тип лікарської форми залежать від способу використання (сфери застосування). Наприклад, лікарська форма, використовувана для інтенсивного лікування захворювання, може містити більші кількості одного або більше активних інгредієнтів, що входять в неї, ніж лікарська форма, використовувана для тривалого лікування того ж захворювання. Схожим чином, парентеральна лікарська форма може містити менші кількості одного або більше активних інгредієнтів, що входять в неї, ніж пероральна лікарська форма, використовувана для лікування того ж захворювання. Ці і інші шляхи введення, при яких конкретні лікарські форми, охоплені цим винаходом, відрізняються одна від одної, добре відомі фахівцям в даній галузі. Див., наприклад, Remington's Pharmaceutical Sciences, 18th ed., Mack Publishing, Easton Pa. (1990). 5.4.1. Пероральні лікарські форми 94737 20 Фармацевтичні композиції цього винаходу, застосовні для перорального введення, можна представити в лікарських формах з дискретними дозами, такими як (але не тільки) таблетки (наприклад, жувальні таблетки), таблетки у вигляді капсул, капсули і рідини (наприклад, ароматизовані сиропи). Такі лікарські форми містять визначені кількості активних інгредієнтів і можуть бути приготовані способами фармації, добре відомими фахівцям в даній галузі. Див., наприклад, Remington's Pharmaceutical Sciences, 18th ed., Mack Publishing, Easton Pa. (1990). Типові пероральні лікарські форми готують, з'єднуючи активний інгредієнт(и) в тонкій суміші з щонайменше одним ексципієнтом згідно з традиційною фармацевтичною технікою змішування. Ексципієнти можуть приймати множину форм залежно від форми препарату, необхідного для введення. Внаслідок простоти введення таблетки і капсули представляються найбільш зручними пероральними лікарськими формами з одиничними дозами. Якщо бажано, таблетки можна покрити за допомогою стандартних водних і неводних процедур. Такі лікарські форми можна приготувати традиційними способами фармації. Звичайно фармацевтичні композиції і лікарські форми готують, однорідно і тонко змішуючи активні інгредієнти з рідкими носіями, тонко розподіленими твердими носіями або носіями обох типів, а потім за необхідності надаючи їм бажану зовнішню форму. Для полегшення швидкого розпаду твердої лікарської форми в неї можна включити дезінтегранти. Для полегшення виготовлення лікарських форм (наприклад, таблеток) можна також включити мастильні речовини. 5.4.2. Парентеральні лікарські форми Парентеральні лікарські форми можна вводити пацієнтам різними шляхами, включаючи, але не обмежуючись ними, підшкірний, внутрішньовенний (включаючи болюсну ін'єкцію), внутрішньом'язовий і внутрішньоартеріальний. Оскільки їх введення звичайно обходить природний захист пацієнта проти забруднюючих речовин, парентеральні лікарські форми є стерильними або придатними для стерилізації перед введенням пацієнту. Приклади парентеральних лікарських форм включають, але не обмежуються ними, розчини, готові для ін'єкції, сухі продукти, готові для розчинення або суспендування в фармацевтично прийнятному носії для ін'єкції, суспензії, готові для ін'єкції, і емульсії. Придатні наповнювачі, які можна використовувати для створення парентеральних лікарських форм цього винаходу, добре відомі фахівцям в даній галузі. Приклади включають, але не обмежуються ними: воду для ін'єкції за Фармакопеєю США; водні наповнювачі, такі як, але не обмежуючись ними, хлорид натрію для ін'єкції, розчин Рінгера для ін'єкції, декстроза для ін'єкцій, декстроза і хлорид натрію для ін'єкції, і розчин Рінгера з лактозою для ін'єкції; змішувані з водою наповнювачі, такі як, але не обмежуючись ними, етиловий спирт, поліетиленгліколь і поліпропіленгліколь; і неводні наповнювачі, такі як, але не обмежуючись ними, кукурудзяна олія, бавовняна олія, арахісова 21 олія, кунжутна олія, етилолеат, ізопропілміристат і бензилбензоат. 5.4.3. Трансдермальні, місцеві і черезслизові лікарські форми Трансдермальні, місцеві і черезслизові лікарські форми включають, але не обмежуються ними, очні розчини, спреї, аерозолі, креми, лосьйони, мазі, гелі, розчини, емульсії, суспензії або інші форми, відомі фахівцеві в даній галузі. Див., наприклад, Remington's Pharmaceutical Sciences, 16th and 18th eds., Mack Publishing, Easton РА. (1980 & 1990); і Introduction to Pharmaceutical Dosage Forms, 4th ed., Lea & Febiger, Philadelphia (1985). Трансдермальні лікарські форми включають серветки (накладки) «резервуарного типу» або «матричного типу», які можна накладати на шкіру і носити протягом визначеного періоду часу, щоб дозволити ввібратися бажаній кількості активних інгредієнтів. Придатні ексципієнти (наприклад, наповнювачі, носії і розріджувачі) і інші матеріали, які можна використовувати для створення трансдермальних, місцевих і черезслизових лікарських форм, добре відомі фахівцям в фармацевтиці; вони залежать від конкретної тканини, на яку будуть наносити дану фармацевтичну композицію або лікарську форму. Залежно від виду конкретної оброблюваної тканини можна використовувати додаткові компоненти, які застосовуються до обробки активними інгредієнтами цього винаходу, в поєднанні з ними або після них. Наприклад, можна використовувати підсилювачі проникності для сприяння доставці активних інгредієнтів до тканини. Для поліпшення доставки одного або більше активних інгредієнтів можна регулювати величину рН фармацевтичної композиції або лікарської форми, або тканини, на яку наносять цю фармацевтичну композицію або лікарську форму. Схожим чином, для поліпшення доставки можна регулювати полярність розчинника в наповнювачі, його іонну силу або концентрацію. Для сприятливої зміни гідрофільності або ліпофільності одного або більше активних інгредієнтів, щоб поліпшити доставку, до фармацевтичних композицій або лікарських форм можна додавати такі сполуки, як стеарати. При цьому стеарати можуть служити для лікарської форми ліпідним наповнювачем, емульгатором або поверхнево-активною речовиною і засобом, що підвищує доставку і посилює проникнення. Для подальшого регулювання властивостей одержуваної композиції можна також використовувати різні солі, гідрати або сольвати активних інгредієнтів. 6. ПРИКЛАДИ Аспекти цього винаходу можна зрозуміти з наступних прикладів, які не обмежують його об'єм. 6.1. Миші із зруйнованим геном S1P-ліази «Уловлювання генів» - це спосіб випадкового інсерційного мутагенезу, який як мутаген використовує фрагмент ДНК, який кодує репортерний ген або ген селектованого маркера. Вектори уловлювання гена сконструйовані для інтеграції в інтрони або екзони таким чином, щоб дозволити клітинному апарату сплайсингу провести сплайсинг екзонів, закодованих вектором, з матричними РНК. 94737 22 Вектори уловлювання гена звичайно містять послідовності селектованих маркерів, яким передують послідовності акцепторів сплайсингу і не передує промотор. Коли такий вектор інтегрується в ген, клітинний апарат сплайсингу проводить сплайсинг екзонів уловленого гена з 5'-кінцем послідовності селектованого маркера. Звичайно такі гени селектованих маркерів можуть експресуватися тільки в тому випадку, якщо вектор, який кодує цей ген, інтегрувався в інтрон. Уловлювання гена, що відбулося, потім ідентифікують шляхом селекції клітин, які вижили в селективній культурі. Ембріональні стовбурові клітини (похідний мишачий штам А129) мутували в процесі, який включав вставлення щонайменше частини генетично сконструйованої векторної послідовності в ген S1P-ліази. Ембріональні стовбурові клітини, що мутували, мікроін’єкціями ввели в бластоцисти, які потім ввели самицям з помилковою вагітністю і стандартними способами доводили до родів. У цьому випадку вірус, вставлений між екзонами 1 і 2, руйнував ген S1P-ліази. Процедури, застосовні для руйнування гена в клітині, особливо в ембріональній стовбуровій клітині, яка може вже мати зруйнований ген, розкриті в патентах США №№ 6136566, 6139833 і 6207371 і в заявці на патент США сер. № 08/728963, кожний з яких у всій повноті включений сюди як посилання. 6.2. Гематологічні ефекти руйнування гена S1P-ліази Цільну кров збирали при ретроорбітальній кровотечі і поміщали в пробірку для зразків капілярної крові, яка містить EDTA. Кров аналізували з використанням аналізатора Cell-Dyn 3500R (Abbott Diagnostics). Цей аналізатор застосовує подвійні технології для створення основи для п’ятичастинної диференціальної ідентифікації білих кров'яних клітин (WBC). Вимірювання методом багатокутового поляризаційного розділення пучка (multi-angle polarized scatter separation, MAPSS) дають первинний підрахунок лейкоцитів і диференціальну інформацію, а імпедансні вимірювання надають додаткову інформацію в присутності крихких лімфоцитів і еритроцитів, стійких до гіпотонічному лізису. Приблизно 135мкл цільної крові перистальтичним насосом всмоктувалися в аналізатор. Для одержання гематологічних параметрів система Cell-Dyn 3500R (Abbott, IL.) використовує чотири незалежних способи вимірювань. Оптичний підрахунок WBC (WOC) і диференціальні вимірювання WBC проводили в оптичному проточному каналі, ідентифікуючи субпопуляції WBC (нейтрофіли, лімфоцити, моноцити, еозинофіли і базофіли) для п’ятичастинного диференціала WBC. Імпедансний підрахунок WBC проводили в каналі електричного опору. Еритроцити і тромбоцити підраховували у другому каналі електричного опору. Гемоглобін визначали в спектрофотометричному каналі. Зразок всмоктувався, розбавлявся, перемішувався, і кожний параметр вимірювався протягом кожного циклу приладу. Остаточними параметрами, одержуваними при гематологічному аналізі, були загальні концентрації лейкоцитів, нейтрофілів, лімфо 23 цитів, моноцитів, еозинофілів, базофілів, еритроцитів, тромбоцитів, гемоглобіну, гематокриту, ширина розподілу еритроцитів за розмірами, середній об'єм еритроцитів і середній об'єм тромбоцитів. Зразки крові одержували від 16 мишей. Для порівняння використовували зразки крові семи мишей дикого типу, шести гетерозиготних мишей і трьох гомозиготних мишей. Між мишами різних груп не було значних генотипних відмінностей в середніх загальних концентраціях еритроцитів (RBC), рівнях гемоглобіну, середньому об'ємі еритроцитів, середній кількості гемоглобіну в еритроцитах, середній концентрації гемоглобіну в еритроцитах, концентрації тромбоцитів і середньому об'ємі тромбоцитів. Відмінності були в гематокриті і в ширині розподілу еритроцитів. Середній гематокрит у гомозиготних (-/-) мишей становив 37±2,56%, у гетерозиготних (+/-) мишей 40,9±4% і у мишей дикого типу (+/+) 44,7±2,7%. Ширина розподілу еритроцитів у гомозиготних (-/-) мишей становила 25,2±4,2%, у гетерозиготних (+/-) мишей 17,6±1,9% і у мишей дикого типу (+/+) 17,2±2%. Схожим чином, загальні концентрації лейкоцитів були однаковими у мишей, дефіцитних по S1Pліазі, гетерозиготних або дикого типу. Гомозиготні миші (-/-) мали загальну концентрацію лейкоцитів 7200±700 кл/мкл. Гетерозиготні миші (+/-) мали загальну концентрацію лейкоцитів 6200±1800 кл/мкл, а миші дикого типу мали загальну концентрацію лейкоцитів 7200±2600 кл/мкл. У мишей, які були гомозиготними по руйнуванню S1P-ліази, концентрація лейкоцитів була зниженою, хоч кількість нейтрофілів, моноцитів, еозинофілів і базофілів збільшувалася. Концентрації лімфоцитів в крові мишей, гомозиготних (-/-) по руйнуванню гена S1P-ліази, були сильно знижені. Середня концентрація лімфоцитів у гомозиготних (-/-) мишей становила 847±139кл/мкл, у гетерозиготних (+/-) мишей середня концентрація лімфоцитів була 4582±2364 кл/мкл, на відміну від середньої концентрації лімфоцитів у мишей дикого типу (+/+), яка становила 6126±2151кл/мкл. На відміну від цього, середня концентрація нейтрофілів у гомозиготних (-/-) мишей була 5020±612кл/мкл, тоді як у гетерозиготних (+/-) мишей середня концентрація нейтрофілів була 1380±1140кл/мкл, а у мишей дикого типу (+/+) середня концентрація нейтрофілів становила тільки 886±479кл/мкл. Схожим чином, середня концентрація моноцитів у гомозиготних (-/-) мишей була 950±218кл/мкл, тоді як у гетерозиготних (+/-) мишей середня концентрація моноцитів була 250±108кл/мкл, а у мишей дикого типу (+/+) середня концентрація моноцитів становила тільки 146±92кл/мкл. Так само було і з еозинофілами: середня концентрація еозинофілів у гомозиготних (-/-) мишей була 247±297кл/мкл, тоді як у гетерозиготних (+/-) мишей середня концентрація еозинофілів була 8±8кл/мкл, а у мишей дикого типу (+/+) середня концентрація еозинофілів становила тільки 14±21кл/мкл. Те ж справедливо і для базофілів. Середня концентрація базофілів у гомозиготних (-/-) мишей була 139±90кл/мкл, у гетерозиготних (+/-) мишей 94737 24 середня концентрація базофілів була 7±5кл/мкл, а у мишей дикого типу (+/+) середня концентрація базофілів становила тільки 16±11кл/мкл. Схожим чином, середня концентрація моноцитів у гомозиготних (-/-) мишей була 950±218кл/мкл, тоді як у гетерозиготних (+/-) мишей середня концентрація моноцитів була 250±108кл/мкл, а у мишей дикого типу (+/+) середня концентрація моноцитів становила тільки 146±92кл/мкл. Так само було і з еозинофілами: середня концентрація еозинофілів у гомозиготних (-/-) мишей була 247±297кл/мкл, тоді як у гетерозиготних (+/-) мишей середня концентрація еозинофілів була 8±8кл/мкл, а у мишей дикого типу (+/+) середня концентрація еозинофілів становила тільки 14±21кл/мкл. 6.3. Синтез (Z)-1-(4-((1R,2S,3R)-1,2,3,4тетрагідроксибутил)-1H-імідазол-2іл)етаноноксиму 1-[4-((1R,2S,3R)-1,2,3,4-тетрагідроксибутил)1H-імідазол-2-іл]етанон (THI, приготований згідно з Halweg, K. M., Büchi, G., J. Org. Chem. 50:11341136 (1985)) (350мг, 1,52ммоль) суспендували у воді (10мл). Додавали гідроксиламінгідрохлорид (126,8мг, 1,82ммоль, 1,2екв.) і ацетат натрію (247,3мг, 3,04ммоль, 2екв.), і суспензію перемішували при 50°С. Через приблизно 4 години реакційна суміш ставала прозорою. Перемішування продовжували при 50°С протягом 16 год. РХМСаналіз показав утворення продукту і відсутність вихідного матеріалу. Реакційну суміш залишали до встановлення кімнатної температури і пропускали через тонкопористий фільтр. Цей розчин використовували безпосередньо для очищення продукту за допомогою препаративної ВЕРХ: колонка діоксиду кремнію Atlantis HILIC 30×100мм; 2%-21% води в ацетонітрилі протягом 6хв.; 45мл/хв.; детектування при 254нм. Збирали фракції продукту і при зниженому тиску випарювали ацетонітрил. Водний розчин ліофілізували і одержували продукт - суміш ізомерів anti:syn (приблизно 3:1), у вигляді білої твердої речовини: 284мг (77%). РХМС: колонка Sunfire С-18, 4,6×50мм; 0-17% MeOH (0,1% TFA) у воді (0,1% TFA) протягом 5хв.; швидкість потоку 3 мл/хв.; детектування при 220нм; часи утримання: 0,56хв. (syn-ізомер, 246,0 1 (M+1)) і 0,69хв. (anti-ізомер, 246,0 (M+1)). Н ЯМР (D2O і DCl) δ 2,15 і 2,22 (синглети, 3H), 3,5-3,72 (м, 4H), 4,76 (ушир., протони OH і Н2O), 4,95 і 4,97 13 (синглети, 1H), 7,17 і 7,25 (синглети, 1H). C ЯМР (D2O і DCl) δ 10,80, 16,76, 63,06, 64,59, 64,75, 70,86, 72,75, 72,85, 117,22, 117,64, 135,32, 138,39, 141,35, 144,12. 6.4. Синтез (Е)-1-(4-((1R,2S,3R)-1,2,3,4тетрагідроксибутил)-1H-імідазол-2іл)етаноноксиму Ця сполука була приготована в дві стадії, як показано нижче 25 94737 Діоксан екв. екв. По-перше, в колбу з THI (21,20ммоль, 4,88г) додавали воду (25мл) і 1н водну HCl (21,2мл, 21,2ммоль). Після розчинення всієї твердої речовини додавали розчин тритилгідроксиламіну (25,44ммоль, 7,00г) в діоксані (55мл) і реакцію підДіоксан тримували при 50°С протягом 4год. Після її завершення суміш охолоджували до кімнатної температури і розчин доводили до рН 7 додаванням 1н водного NaOH. Нейтралізований розчин потім концентрували до стану пластичної маси, яку очищали флеш-хроматографією на силікагелі [10% MeOH/1% NH4OH (5% по масі розчин у воді) в DCM] і одержували тритиловий простий ефір у вигляді прозорого пластику. Обробка цієї пластичної маси гексаном і концентрування давали білий піноподібний матеріал, який можна було висушити у вакуумі до пластівчастого твердого стану (10,00г, вихід 97%). По-друге, до інтенсивно переміщуваного при кімнатній температурі розчину тритилового ефіру оксиму (4,8г, 10ммоль) в діоксані (90мл) додавали розчин HCl в діоксані (4M, 60мл). Через декілька хвилин спостерігали утворення білого осаду, і перемішування продовжували в загальній складності 30 хвилин, потім розчин фільтрували через притертий скляний фільтр і осад на фільтрі промивали діоксаном і ефіром. Осад знов розчиняли у воді 26 (200 мл), обробляли ультразвуком протягом 5 хвилин, потім охолоджували до 0°С, обробляли целітом (5г) і фільтрували через притертий скляний фільтр. Водний розчин концентрували до сухого стану, після чого Е-оксим перекристалізовували з суміші метанолу (30мл) з діетиловим ефіром (60мл) і одержували аналітично чистий білий порошок (3,8г, вихід 80%). 6.5. Синтез (Z)-1-(4-((1R,2S,3R)-1,2,3,4тетрагідроксибутил)-1H-імідазол-2-іл)етанон-Ометилоксиму Цю сполуку готували, як описано вище в Прикладі 6.3, використовуючи метоксиламінгідрохлорид замість гідроксиламінгідрохлориду, з виходом 74%. Продукт був білою пухкою твердою речовиною. РХМС: колонка Sunfire С-18, 4,6×50мм; 0-17% MeOH (0,1% TFA) у воді (0,1% TFA) протягом 5хв.; швидкість потоку 3мл/хв.; детектування при 220 нм; часи утримання: 1,59хв. (syn-ізомер, 260,1 1 (M+1)) і 1,73хв. (anti-ізомер, 260,1 (M+1)). Н ЯМР (D2O) δ 2,18 і 2,22 (синглети, 3H), 3,54-3,60 (м, 1H), 3,66-3,79 (м, 3H), 3,94 і 3,95 (синглети, 3H), 4,76 (ушир., протони OH і H2O), 4,93 і 4,97 (синглети, 13 1H), 7,17 і 7,25 (синглети, 1H). C ЯМР (D2O) δ 11,55, 17,56, 62,32, 62,38, 62,99, 63,07, 67,09, 71,54, 73,86, 119,09, 138,64, 139,79, 142,95, 144,98, 148,97. 6.6. Синтез 1-(5-метил-4-((1R,2S,3R)-1,2,3,4тетрагідроксибутил)-1H-імідазол-2-іл)етанону Цю сполуку готували в сім стадій, використовуючи спосіб, описаний нижче. 27 94737 28 тоді, 4-Метилімідазол-1-диметиламіносульфонамід (2): При кімнатній температурі до розчину 4метилімідазолу 1 (3,00г, 36,54ммоль) в толуолі (200 мл) послідовно додавали триетиламін (5,6мл, 40,20ммоль) і N,Nдиметиламіносульфамоїлхлорид (3,9мл, 36,54ммоль). Посудину витримували в холодильнику при 5°С протягом 48 годин, після чого тверді речовини фільтруванням відділяли від реакційної суміші, рідину концентрували і одержували суміш регіоізомерів 2 і 2а (2,5:1). Продукт очищали флеш-хроматографією на силікагелі (80-100% етилацетат:гексан як елюент) і одержували суміш регіоізомерів 2 і 2а у співвідношенні 5,5:1 (4,31г, вихід 62%): M+1=190,1. 4-Метил-2-ацетилімідазол-1диметиламіносульфонамід (3): При -78°С до розчину імідазолу 2 (1,99г, 10,54ммоль) в тетрагідрофурані (70 мл) повільно додавали розчин n-BuLi в гексані (2,5 M, 11,60мл). Через 40 хвилин до охолодженого розчину по краплях додавали Nметокси-N-метилацетамід (1,30г, 12,65ммоль). Реакційній суміші дозволяли нагрітися до кімнатної температури, при якій її тримали протягом 2 годин, після чого реакцію зупиняли додаванням насиченого водного NH4Cl (20мл), а суміш потім розбавляли водою (20мл). Розділяли шари, і органічний шар промивали етилацетатом (2×30мл). Об'єднані органічні фракції промивали сольовим розчином, потім сушили над MgSO4 і концентрували. Продукт очищали флеш-хроматографією на діоксиді кремнію (60-80% етилацетат:гексан як елюент) і одержували 3 у вигляді масла (1,85г, вихід 76%): M+1=232,1. 4-Метил-2-(1-(триізопропілсилілокси)вініл)-1диметиламіносульфонамід (4): До розчину імідазолу 3 (1,65г, 7,14ммоль) в дихлорметані (45мл) послідовно додавали триетиламін (1,00мл, 14,28ммоль) і триізопропілсилілтрифторметансульфонат (2,12мл, 7,86ммоль). Реакцію проводили при кімнатній температурі протягом 20 годин, потім зупиняли додаванням насиченого водного NaHCO3 (20мл). Суміш розбавляли водою (20мл) і розділяли шари. Водний шар промивали дихлорметаном (2×20мл), і об'єднані органічні фракції промивали сольовим розчином (20мл), сушили над MgSO4 і концентрували. Одержане масло очищали флеш-хроматографією на силікагелі (12% метанол:дихлорметан як елюент) і одержували силілований енольний простий ефір 4 у вигляді оранжевого масла (2,26г, вихід 83%): M+1=388,2. Лактол (5): При -78°С до розчину імідазолу 4 (2,26г, 5,84ммоль) в тетрагідрофурані (40мл) повільно додавали розчин n-BuLi в гексані (2,5M, 3,27мл). Через 30 хвилин до цього розчину при 78°С повільно додавали розчин (-)-2,3-Oізопропілідин-D-еритронолактону (1,66г, 10,51ммоль) в тетрагідрофурані (10мл). Реакцію проводили при -78°С протягом 2 годин, потім суміші давали нагрітися до 0°С і реакцію зупиняли додаванням насиченого водного NH4Cl (20мл). Суміш розбавляли водою (10мл) і розділяли шари. Органічні фракції промивали етилацетатом (2×20мл) і об'єднані органічні розчини промивали сольовим розчином (20мл), сушили над MgSO4 і концентрували. Продукт очищали на силікагелі (30-50% етилацетат:гексан як елюент) і одержували лактол 5 (2,69г, вихід 85%) у вигляді білої піноподібної маси: M+1=546,4. Діол (6): При 0°С до розчину лактолу 5 (2,09г, 3,83ммоль) в етанолі (70мл) декількома порціями додавали гранульований NaBH4 (1,4г, 38,32ммоль). Через 2 години реакційну суміш нагрівали до кімнатної температури протягом 30 хвилин і концентрували. Тверду речовину розчиняли у воді (40мл) і етилацетаті (40мл). Двофазну суміш інтенсивно перемішували протягом 10 хвилин, потім розділяли шари. Водний шар промивали етилацетатом (2×40мл), і об'єднані органічні розчини промивали сольовим розчином (30мл), сушили над MgSO4 і концентрували. Піноподібний продукт очищали флеш-хроматографією на діоксиді кремнію (5% метанол:дихлорметан як елюент) і одержували діол 6 (1,88г, вихід 90%) у вигляді суміші (3:1) нероздільних діастереомерів по бензильній позиції: M+1=547,4. Імідазол (7): Фторид цезію (315мг, 2,08ммоль) додавали до розчину імідазолу 6 (567мг, 1,04ммоль) в етанолі (10мл) і нагрівали до 65°С. Через 1 годину реакційну суміш охолоджували до кімнатної температури, обробляли насиченим водним NH4Cl (1мл) і концентрували. Продукт очи 29 щали флеш-хроматографією на силікагелі (5% метанол:дихлорметан як елюент) і одержували імідазол 7 (380мг, вихід 94%) у вигляді білої піноподібної маси: M+1=392,1. Кінцевий продукт (8): Захищений імідазол 7 (380мг, 0,97ммоль) розчиняли в ацетоні (6мл) і послідовно обробляли водою (6мл) і концентрованою водною HCl (3мл). Посудину протягом 45 хвилин нагрівали до 40°С, потім охолоджували до кімнатної температури і реакційну суміш концентрували. Одержаний матеріал очищали препаративною хроматографією з оберненою фазою на колонці Zorbax С-6, 150×30мм, використовуючи незабуферені розчинники за схемою 5-хвилинної ізократичної елюції 1%-ним ацетонітрилом у воді (TR=1,52хв.). Після ліофілізації одержували сполуку 8 у вигляді аморфної твердої солі диметиламі1 носульфамової кислоти: M+1=245,1; Н ЯМР (400МГц, CDCl3) головний δ 5,04 (д, 1H), 3,62 (комп.м, 2H), 3,42 (комп.м, 2H), 2,62 (с, 6H), 2,43 (с, 3H), 2,21 (с, 3H); мінорний δ 5,01 (д, 1H), 3,79 (комп.м, 2H), 3,55 (комп.м, 2H), 2,62 (с, 6H), 2,43 (с, 3H), 2,21 (с, 3H). 6.7. Синтез (1R,2S,3R)-1-(2-(1-гідразоноетил)1H-імідазол-4-іл)бутан-1,2,3,4-тетраолу 1-[4-((1R,2S,3R)-1,2,3,4-тетрагідроксибутил)1H-імідазол-2-іл]етанон (THI, приготований згідно з Halweg, K. M., Büchi, G., J. Org. Chem. 50:11341136 (1985)) (148мг, 0,64ммоль) суспендували в метанолі (3мл) і воді (1мл). Додавали гідразингідрат (35мг, 0,7ммоль, 1,2екв.) і оцтову кислоту (одну краплю), і суспензію 6 годин перемішували при 50°С. РХМС-аналіз показав утворення продукту і відсутність вихідного матеріалу. Реакційну суміш охолоджували до кімнатної температури і розбавляли тетрагідрофураном. Білий осад, що утворився, збирали, промивали тетрагідрофураном і одержували продукт - суміш зі співвідношенням ізомерів Е і Z, що дорівнює приблизно 3:1, у вигляді білої твердої речовини: 90мг (58%). РХМС: колонка Zorbax С-8, 4,6×150мм; 10-90% у воді (10мМ ацетат амонію) протягом 6 хв.; швидкість потоку 2мл/хв.; детектування при 220нм; часи утримання: 0,576хв. (syn-ізомер, 245,0 (M+1)) і1 1,08хв. (anti-ізомер, 245,0 (M+1)). Н ЯМР (ДМСОd6) δ 2,5 (синглет, 3H під DMSO), 3,4-3,7 (м, 4H), 4,3 (м, 2H), 4,6 (м, 2H), 4,8 (м, 1H), 4,9 і 5,0 (дуплет, 1H), 7,04 і 7,21 (синглети, 1H). 6.8. Синтез N'-(1-(4-((1R,2S,3R)-1,2,3,4тетрагідроксибутил)-1H-імідазол-2іл)етиліден)ацетогідразиду 94737 30 1-[4-((1R,2S,3R)-1,2,3,4-тетрагідроксибутил)1H-імідазол-2-іл]етанон (160мг, 0,70ммоль) суспендували в метанолі (3мл) і воді (1мл). Додавали гідразид оцтової кислоти (56мг, 0,75ммоль, 1,2екв.) і соляну кислоту (одну краплю, 12н), і суспензію 48 годин перемішували при 50°С. РХМСаналіз показав утворення продукту і відсутність вихідного матеріалу. Реакційну суміш охолоджували до кімнатної температури і розбавляли тетрагідрофураном. Білий осад, що утворився, збирали, промивали тетрагідрофураном і одержували продукт - суміш зі співвідношенням ізомерів Е і Z, що дорівнює приблизно 3:1, у вигляді білої твердої речовини: 129мг (65%). РХМС: колонка Sunfire С-18, 4,6×50мм; 2-20% у воді (10мМ ацетат амонію) протягом 2,5хв.; швидкість потоку 3,5 мл/хв.; детектування при 220нм; 1 час утримання: 0,53хв. (287,1 (M+1)). Н ЯМР (ДМСО-d6) δ 2,2 (синглети, 3H), 2,5 (синглети, 3H під DMSO), 3,4-3,7 (м, 4H), 4,3 (ушир., 2H), 4,6-5,0 (ушир., 4H), 7,0 (ушир., 1H), 10,30 і 10,37 (синглети, 1H). 6.9. Синтез (Е)-4-метил-N'-(1-(4-((1R,2S,3R)1,2,3,4-тетрагідроксибутил)-1H-імідазол-2іл)етиліден)бензолсульфоногідразиду 1-[4-((1R,2S,3R)-1,2,3,4-тетрагідроксибутил)1H-імідазол-2-іл]етанон (153мг, 0,67ммоль) суспендували в метанолі (3мл) і воді (1мл). Додавали п-толуолсульфонілгідразид (140мг, 0,75ммоль, 1,2екв.) і соляну кислоту (одну краплю, 12н), і суспензію 24 години перемішували при 50°С. РХМСаналіз показав утворення продукту і відсутність вихідного матеріалу. Реакційну суміш охолоджували до кімнатної температури і наносили на сухий силікагель. Флеш-хроматографія на силікагелі (10г SiO2, 4:1 етилацетат:метанол) давала продукт - суміш зі співвідношенням ізомерів Е і Z, що дорівнює приблизно 85:15, у вигляді білої твердої речовини: 142мг (53%). РХМС: колонка Sunfire С-18, 4,6×50мм; 10-90% у воді (10мМ ацетат амонію) протягом 2,5хв.; швидкість потоку 3,5мл/хв.; детектування при 220нм; часи утримання: 0,50хв. (399,2 (M+1)) і 0,66 хв. 1 (399,3 (M+1)). Н ЯМР (метанол-d4) δ 2,2 (синглети, 3H), 2,41 і 2,45 (синглети, 3H), 3,6-3,85 (м, 4H), 31 4,99 і 5,05 (синглети, 1H), 7,09 (ушир.с, 1H), 7,39 (д, 2H, j=8Гц), 7,77 і 7,87 (д, 2H, j=8Гц). 6.10. Синтез N'-(1-(4-((1R,2S,3R)-1,2,3,4тетрагідроксибутил)-1H-імідазол-2іл)етиліден)бензогідразиду 1-[4-((1R,2S,3R)-1,2,3,4-тетрагідроксибутил)1H-імідазол-2-іл]етанон (150мг, 0,65ммоль) суспендували в метанолі (3мл) і воді (1мл). Додавали гідразид бензойної кислоти (102мг, 0,75ммоль, 1,2екв.) і соляну кислоту (одну краплю, 12н), і суспензію 18 годин перемішували при 50°С. РХМСаналіз показав утворення продукту і відсутність вихідного матеріалу. Гомогенну реакційну суміш охолоджували до кімнатної температури і концентрували у вакуумі. Обробка С-18 Reverse-Phase SPE (10г Alltech Hi-load C18, градієнт від 0 до 20% метанолу у воді) дозволила одержати продукт суміш зі співвідношенням ізомерів Е і Z, що дорівнює приблизно 1:1, у вигляді безбарвної твердої речовини: 193мг (85%). РХМС: колонка Sunfire С-18, 4,6×50мм; 10-90% у воді (10мМ ацетат амонію) протягом 2,5хв.; швидкість потоку 3,5мл/хв.; детектування при 220нм; 1 час утримання: 0,49хв. (349,2 (M+1)). Н ЯМР (метанол-d4) δ 2,2 (синглети, 3H), 2,42 і 2,45 (синглети, 3H), 3,6-3,85 (м, 4H), 5,11 і 5,14 (синглети, 1H), 7,30 (ушир.с, 1H), 7,40-7,7 (м, 4H), 7,80 і 7,95 (м, 2H), 8,1 (ушир.с, 1H). 6.11. Синтез (Е)-етил-2-(1-(4-((1R,2S,3R)1,2,3,4-тетрагідроксибутил)-1H-імідазол-2іл)етиліден)гідразинкарбоксилату 1-[4-((1R,2S,3R)-1,2,3,4-тетрагідроксибутил)1H-імідазол-2-іл]етанон (150мг, 0,65ммоль) суспендували в метанолі (3мл) і воді (1мл). Додавали етилкарбазид (78мг, 0,75ммоль, 1,2екв.) і соляну кислоту (одну краплю, 12н), і суспензію 18 годин перемішували при 50°С. РХМС-аналіз показав утворення продукту і відсутність вихідного матеріалу. Реакційну суміш охолоджували до кімнатної температури, концентрували у вакуумі і розбавляли ацетоном. Білий осад, що утворився, збирали, промивали ацетоном і одержували один ізомер у вигляді білої твердої речовини: 96мг (47%). 94737 32 РХМС: колонка Sunfire С-18, 4,6×50мм; 2-20% у воді (10мМ ацетат амонію) протягом 2,5хв.; швидкість потоку 3,5 мл/хв.; детектування при 220нм; 1 час утримання: 0,25хв. (317,35 (M+1)). Н ЯМР (метанол-d4) δ 1,36 (т, 3H, j=8Гц), 2,28 (с, 3H), 2,42 і 2,45 (синглети, 3H), 3,60-3,85 (м, 4H), 4,34 (дд, 2H, j=8Гц), 5,08 (с, 1H), 7,27 (с, 1H). 6.12. Синтез (Е)-N'-(1-(4-((1R,2S,3R)-1,2,3,4тетрагідроксибутил)-1H-імідазол-2іл)етиліден)нікотиногідразиду 1-[4-((1R,2S,3R)-1,2,3,4-тетрагідроксибутил)1H-імідазол-2-іл]етанон (215мг, 0,93ммоль) суспендували в метанолі (3мл) і воді (1мл). Додавали гідразид нікотинової кислоти (137мг, 1,0ммоль, 1,1екв.) і соляну кислоту (одну краплю, 12 н), і суспензію 48 годин перемішували при 50°С. РХМСаналіз показав утворення продукту і відсутність вихідного матеріалу. Реакційну суміш охолоджували до кімнатної температури і частково концентрували у вакуумі. Білий осад, що утворився, збирали, промивали водою і одержували продукт один ізомер у вигляді білої твердої речовини: 311мг (95%). РХМС: колонка Sunfire С-18, 4,6×50мм; 10-90% у воді (10мМ ацетат амонію) протягом 2,5хв.; швидкість потоку 3,5мл/хв.; детектування при 220нм; 1 час утримання: 0,22хв. (350,27 (M+1)). Н ЯМР (ДМСО-d6) δ 2,37 (с, 3H), 3,60-3,85 (м, 4H), 4,40 (м, 2H), 4,71 (м, 1H), 5,01 (м, 2H), 5,16 (м, 1H), 7,25 (ушир., 1H), 7,64 (ушир., 1H), 8,35 (ушир., 1H), 8,80 (ушир., 1H), 9,14 (ушир., 1H). 6.13. Синтез 3-хлор-N'-(1-(4-((1R,2S,3R)1,2,3,4-тетрагідроксибутил)-1Н-імідазол-2іл)етиліден)бензогідразиду 1-[4-((1R,2S,3R)-1,2,3,4-тетрагідроксибутил)1H-імідазол-2-іл]етанон (194мг, 0,84ммоль) суспендували в етанолі (4мл) і воді (1мл). Додавали гідразид 3-хлорбензойної кислоти (170мг, 1,0ммоль, 1,2екв.) і соляну кислоту (одну краплю, 12н), і суспензію 48 годин перемішували при 50°С. РХМС-аналіз показав утворення продукту і відсутність вихідного матеріалу. Реакційну суміш охолоджували до кімнатної температури і частково концентрували у вакуумі. Білий осад, що утворився, 33 94737 34 збирали, промивали етанолом і одержували продукт - суміш Е- і Z-ізомерів у співвідношенні приблизно 3:1 у вигляді білої твердої речовини: 108мг (33%). РХМС: колонка Sunfire С-18, 4,6×50мм; 10-90% у воді (10мМ ацетат амонію) протягом 2,5хв.; швидкість потоку 3,5мл/хв.; детектування при 220нм; 1 час утримання: 0,63хв. (383,23 (M+1)). Н ЯМР (метанол-d4) δ 2,44 (с, 3H), 3,60-3,90 (м, 4H), 5,12 (с, 1H), 7,29 (с, 1H), 7,65 (м, 2H), 8,04 (м, 2H). 6.14. Синтез (Е)-4-фтор-N'-(1-(4-((1R,2S,3R)1,2,3,4-тетрагідроксибутил)-1H-імідазол-2іл)етиліден)бензогідразиду ної температури і частково концентрували у вакуумі. Білий осад, що утворився, збирали, промивали етанолом і одержували продукт - один ізомер у вигляді твердої білої речовини: 136мг (75%). РХМС: колонка Sunfire С-18, 4,6×50мм; 10-90% у воді (10мМ ацетат амонію) протягом 2,5хв.; швидкість потоку 3,5 мл/хв.; детектування при 220нм; 1 час утримання: 0,15хв. (365,32 (M+1)). Н ЯМР (метанол-d4, одна крапля DCl) δ 2,58 (с, 3H), 3,603,90 (м, 4H), 5,22 (с, 1H), 7,17 (м, 1H), 7,54 (м, 1H), 8,44 (м, 1H), 8,68 (м, 1H). 6.16. Синтез (Е)-N'-(1-(4-((1R,2S,3R)-1,2,3,4тетрагідроксибутил)-1H-імідазол-2іл)етиліден)ізонікотиногідразиду 1-[4-((1R,2S,3R)-1,2,3,4-тетрагідроксибутил)1H-імідазол-2-іл]етанон (172мг, 0,74ммоль) суспендували в етанолі (4мл) і воді (1мл). Додавали гідразид 4-фторбензойної кислоти (131мг, 0,85ммоль, 1,1екв.) і соляну кислоту (одну краплю, 12н), і суспензію 48 годин перемішували при 55°С. РХМС-аналіз показав утворення продукту і відсутність вихідного матеріалу. Реакційну суміш охолоджували до кімнатної температури і частково концентрували у вакуумі. Білий осад, що утворився, збирали, промивали етанолом і одержували продукт - один ізомер у вигляді твердої білої речовини: 97мг (35%). РХМС: колонка Sunfire С-18, 4,6×50мм; 10-90% у воді (10мМ ацетат амонію) протягом 2,5хв.; швидкість потоку 3,5мл/хв.; детектування при 220нм; 1 час утримання: 0,55хв. (367,24 (M+1)). Н ЯМР (метанол-d4, одна крапля DCl) δ 2,55 (с, 3H), 3,603,90 (м, 4H), 5,22 (с, 1H), 7,30 (м, 2H), 7,54 (с, 1H), 8,08 (м, 2H). 6.15. Синтез (Е)-6-аміно-N'-(1-(4-((1R,2S,3R)1,2,3,4-тетрагідроксибутил)-1H-імідазол-2іл)етиліден)нікотиногідразиду 1-[4-((1R,2S,3R)-1,2,3,4-тетрагідроксибутил)1H-імідазол-2-іл]етанон (168мг, 0,73ммоль) суспендували в етанолі (4мл) і воді (1мл). Додавали гідразид ізонікотинової кислоти (110мг, 0,80ммоль, 1,1екв.) і соляну кислоту (одну краплю, 12н), і суспензію 24 години перемішували при 55°С. РХМСаналіз показав утворення продукту і відсутність вихідного матеріалу. Реакційну суміш охолоджували до кімнатної температури і частково концентрували у вакуумі. Білий осад, що утворився, збирали, промивали етанолом і одержували продукт один ізомер у вигляді твердої білої речовини: 136мг (75%). РХМС: колонка Sunfire С-18, 4,6×50мм; 10-90% у воді (10мМ ацетат амонію) протягом 2,5хв.; швидкість потоку 3,5мл/хв.; детектування при 220нм; 1 час утримання: 0,15хв. (365,32 (M+1)). Н ЯМР (метанол-d4, одна крапля DCl) δ 2,63 (с, 3H), 3,60-3,90 (м, 4H), 5,12 (с, 1H), 7,58 (с, 1H), 8,63 (д, 2H, j=8Гц), 9,14 (д, 2H, j=8Гц). 6.17. Синтез (Е)-N'-(1-(4-((1R,2S,3R)-1,2,3,4тетрагідроксибутил)-1H-імідазол-2іл)етиліден)біфеніл-3-карбогідразиду 1-[4-((1R,2S,3R)-1,2,3,4-тетрагідроксибутил)1H-імідазол-2-іл]етанон (115мг, 0,50ммоль) суспендували в етанолі (4мл) і воді (1мл). Додавали заміщений гідразид (91мг, 0,6ммоль, 1,2екв.) і соляну кислоту (одну краплю, 12н), і суспензію 48 годин перемішували при 55°С. РХМС-аналіз показав утворення продукту і відсутність вихідного матеріалу. Реакційну суміш охолоджували до кімнат 1-[4-((1R,2S,3R)-1,2,3,4-тетрагідроксибутил)1H-імідазол-2-іл]етанон (315мг, 1,36ммоль) і біфеніл-3-карбогідразид (360мг, 1,81ммоль) суспендували в DMSO (2мл). Додавали концентровану соляну кислоту (дві краплі), і суспензію 5 годин перемішували при 40°С. РХМС-аналіз показав утворення продукту і відсутність вихідного матері 35 алу. Реакційну суміш охолоджували до кімнатної температури, розбавляли метанолом і очищали обернено-фазовою ВЕРХ (10мМ NH4OAc/ацетонітрил). Збирали і ліофілізували окремо дві фракції (Е- і Z-ізомери) з бажаною масою. Перша фракція була білою твердою речовиною, 95мг (16%). Друга фракція була білою твердою речовиною, 82мг (14%). Перша фракція: Аналітична ВЕРХ на колонці Zorbax С-8, 4,6×150мм; розчинник А - 10мМ ацетат амонію; розчинник В - MeCN; 0хв. - 5% В, 1хв. - 5% В, 3хв. - 90% В, 4 хв. - стоп; швидкість потоку 3мл/хв.; детектування при 220нм; час утримання: 2,9хв. (примітка: містить ~5% іншого ізомеру). 1 M+Н=425,28, Н ЯМР (ДМСО-d6 і 2 краплі D2O) δ 2,3 (синглет, 3H), 3,3-3,7 (м, 4H), 4,9 (м, 1H), 7,19 (с, 1H), 7,37 (м, 1H), 7,47 (м, 2H), 7,67 (м, 3H), 7,857,92 (м, 2H) і 8,15 (с, 1H). HSQC того ж зразка корелював сигнал протона при 2,3 (CH3) з сигналом вуглецю при 20ppm. Друга фракція: Аналітична ВЕРХ на колонці Zorbax С-8, 4,6×150мм; розчинник А - 10мМ ацетат амонію; розчинник В - MeCN; 0хв. - 5% В, 1хв. - 5% В, 3хв. - 90% В, 4хв. - стоп; швидкість потоку 3мл/хв.; детектування при 220нм; час утримання: 2,963хв. (примітка: містить ~6% іншого ізомеру). 1 M+Н=425,28, Н ЯМР (ДМСО-d6 і 2 краплі D2O) δ 2,4 (синглет, 3H), 3,4-3,6 (м, 4H), 4,77 і 4,86 (широкі синглети, об'єднані = 1H), 6,9 і 7,1 (широкі синглети, об'єднані = 1H), 7,40 (м, 1H) 7,50 (м, 2H), 7,61 (м, 1H), 7,73 (м, 2H), 7,87 (м, 2H) і 8,10 (с, 1H). HSQC того ж зразка корелював сигнал протона при 2,4 (CH3) з сигналом вуглецю при 13ppm. 6.18. Синтез N-гідрокси-4-((1R,2S,3R)-1,2,3,4тетрагідроксибутил)-1H-імідазол-2-карбоксаміду 1-[4-((1R,2S,3R)-1,2,3,4-тетрагідроксибутил)1H-імідазол-2-іл]етанон (18г, 78,3ммоль) суспендували в дихлорметані (160мл) і 2,2диметоксипропані (160мл). Додавали 4толуолсульфонову кислоту (3г) і суміш 18 годин перемішували при 70°С. Реакційну суміш розбавляли дихлорметаном і промивали водою, 5% бікарбонатом, сольовим розчином і потім наносили на сухий SiO2. Очищення флеш-хроматографією (гексан/етилацетат) давало 1-(4-((4S,4'R,5R)-2,2,2',2'тетраметил-4,4'-бі-(1,3-діоксолан)-5-іл)-1Hімідазол-2-іл)етанон у вигляді безбарвного масла (18,8г, 60,6ммоль, 77%; M+Н розраховано: 311,4, спостер.: 311,3). Продукт, одержаний вище (20г, 64,5ммоль), розчиняли в DMF. Додавали K2CO3 (12,5г, 90,3ммоль) і потім бензилбромід (10,7мл, 90,3ммоль). Реакційну суміш 18 годин нагрівали при 50°С. РХМС-аналіз показав вихідний матеріал, що залишився. Додавали додаткову порцію бензилброміду (5мл, 42ммоль) і підвищували темпе 94737 36 ратуру реакції до 60°С. Через 3 години реакцію зупиняли холодною водою і проводили екстракцію етилацетатом. Органічні екстракти промивали водою і сольовим розчином, сушили над сульфатом натрію і завантажували на силікагель. Флешхроматографія (від 20 до 40% етилацетату в гексані) давала 1-(1-бензил-4-((4S,4'R,5R)-2,2,2',2'тетраметил-4,4'-бі-(1,3-діоксолан)-5-іл)-1Hімідазол-2-іл)етанон (16,1 г, 62%). Одержаний проміжний продукт (13г, 32,5ммоль) розчиняли в діоксані (120мл) і обробляли NaOH (13,2г), розчиненим в комерційному вибілювачі (200мл, 6% NaOCl). Після двох годин інтенсивного перемішування реакційну суміш екстрагували етилацетатом. Органічні екстракти промивали сольовим розчином і сушили над целітом. Після фільтрації і випаровування одержували тверду речовину, яку додатково сушили у вакуумі, і одержували 1-бензил-4-((4S,4'R,5R)-2,2,2',2'тетраметил-4,4'-бі-(1,3-діоксолан)-5-іл)-1Hімідазол-2-карбоновую кислоту (13г, кількісний вихід, M+Н розраховано: 403,2, спостер.: 403,2). Продукт, одержаний вище (600мг, 1,49ммоль), О-тритилгідроксиламін (820мг, 2,98ммоль), EDAC (430мг, 2,24ммоль) і HOBt (3мг, 2,24ммоль) змішували з DMF (8мл) і триетиламіном (622мкл, 4,47ммоль). Реакційну суміш 22 години перемішували при кімнатній температурі, концентрували і потім завантажували на діоксид кремнію, використовуючи DCM/MeOH. Флеш-хроматографія (MeOH/DCM) давала 1-бензил-4-((4S,4'R,5R)2,2,2',2'-тетраметил-4,4'-бі-(1,3-діоксолан)-5-іл)-N(тритилоксі)-1H-імідазол-2-карбоксамід (480мг, 0,73ммоль, 49%, M+Н розраховано: 660,3, спостер.: 660,4). Продукт, одержаний вище (480мг, 0,73ммоль), розчиняли в етанолі (50мл). Додавали Pd(OH)2 (500мг, 20% на вугіллі, вологий) і реакційну суміш 18 годин перемішували в атмосфері Н2 (4,5 атм.), після чого фільтрували. Етанол видаляли у вакуумі. Залишок розчиняли в DCM, очищали флешхроматографією (MeOH/DCM) і одержували Nгідрокси-4-((4S,4'R,5R)-2,2,2',2'-тетраметил-4,4'-бі(1,3-діоксолан)-5-іл)-1H-імідазол-2-карбоксамід (150мг, 0,46ммоль, 63%, M+Н розраховано: 328,1, спостер.: 328,3). Продукт, одержаний вище (150мг, 0,46ммоль), розчиняли в ацетоні (8мл) і воді (8мл). Реакційну суміш охолоджували до внутрішньої температури 15°С на бані з сухим льодом в ацетоні. Додавали концентровану HCl (3мл) з такою швидкістю, щоб внутрішня температура залишалася нижче -10°С. Холодну баню видаляли і реакційну суміш 3 години перемішували при кімнатній температурі, 18 годин при 4°С і ще 7 годин при кімнатній температурі. Після видалення у вакуумі ацетону і деякої кількості води утворювався осад. Додавали діоксан (20мл), потім THF (10мл). Тверду речовину відділяли фільтрацією, промивали сумішшю THF з діоксаном, сушили у вакуумі і одержували Nгідрокси-4-((1R,2S,3R)-1,2,3,4-тетрагідроксибутил)1H-імідазол-2-карбоксамід у вигляді гідрохлоридної солі (98мг, 0,40ммоль, 87%). Мас-спектр: M+Н розраховано: 248,1, спостер.: 248,2, аналітична ВЕРХ: колонка Luna Pheny 37 Hexyl, 5 мкм, 4,6×50мм, ізократична елюція 10мМ ацетатом амонію з 1% ацетонітрилу, швидкість потоку 3мл/хв., детектування при 220нм, час утри1 мання 0,245хв. Н ЯМР (ДМСО-d6) δ 3,37-3,64 (м, 4H), 4,96 (широкий синглет, 1H), 7,47 (с, 1H), 11,9 (широкий синглет, 1H). 6.19. Вимірювання впливів на лімфоцити у мишей Сполуки вводили за допомогою шлункового зонда або в питну воду. Для експериментів з пероральними дозами сполуки ресуспендували з кристалів в носії (наприклад, у воді) в концентрації 10мг/мл. Мишам (F1-гібриди лінії 129/В6) через зонд вводили однократну дозу сполуки 100мг/кг (еквівалентну 100мг/кг вільної основи кожної сполуки) або контроль, що містив тільки наповнювач, і мишей повертали в їх клітки. Через 18 годин після введення дози мишей анестезували ізофлуораном і відбирали тканини для аналізу, як описано нижче. Для досліджень з питною водою сполуки розчиняли в концентрації 50мг/мл в підкисленій воді (рН 2,8), що містила 10г/л глюкози. Миші мали вільний доступ до води, яка містила сполуку (або до розчину глюкози як контролю), протягом 72 годин. Після закінчення 72 годин тканини відбирали для аналізу. Клінічний аналіз крові проводили таким чином. Мишей анестезували ізофлуораном і відбирали кров з ретроорбітального сплетення в пробірки для зразків крові, що містили EDTA (Capiject-MQK, Terumo Medical Corp, Elkton, Md.). Автоматичний клінічний аналіз крові виконували, використовуючи прилади Cell-Dyn 3500 (Abbott Diagnostics, Abbott Park, Ill.) або HemaVet 850 (Drew Scientific, Inc, Oxford, Conn.). Проточну цитометрію (FACS) виконували таким чином. Двадцять п'ять мкл цільної крові лізували гіпотонічним шоком, один раз промивали 2мл FACSпромивального буфера (FWB: PBS/0,1% BSA/0,1% NaN3/2мМ EDTA) і протягом 30 хвилин при 4°С в темряві забарвлювали сумішшю антитіл, кон’югованих з флуорохромом і розбавлених в 50мкл FWB. Після фарбування клітини один раз промивали 2мл FWB і ресуспендували в 300мкл FWB для аналізу. Стандартні процедури нестерильного витягання селезінки і тимуса виконували таким чином. Органи диспергували до одноклітинних суспензій, пропускаючи тканини через 70-мкм клітинний фільтр (Falcon, Becton Dickinson Labware, Bedford, Mass.). Для FACS-аналізу еритроцити лізували 6 гіпотонічно, промивали і 1×10 клітин інкубували з 10мкл анти-CD16/CD32 (Fc Block™, BDPharMingen, San Diego, Calif.) (десятикратно розбавленими в FWB) протягом 15хв. при 4°С. Клітини забарвлювали протягом 30 хвилин при 4°С в темряві сумішшю антитіл, кон’югованих з флуорохромом, розбавлених в 50-100мкл FWB і доданих прямо до клітин в Fc-блоці. Після фарбування клітини один раз промивали 1мл FWB і ресуспендували в 300 мкл FWB для аналізу. Всі антитіла були закуплені у BD-PharMingen, San Diego, Calif., якщо не зазначено інакше. Зразки аналізували, використовуючи проточний цитометр FACSCalibur і про 94737 38 грамне забезпечення CellQuest Pro (Becton Dickinson Immunocytometry Systems, San Jose, Calif.). Для тимуса використовували наступні суміші антитіл: TCRb APC Cy7; CD4 APC; CD8 PerCP; CD69 FITC і CD62L PEl. Для селезінки і крові використовували наступні суміші антитіл: B220 PerCP; TCRb APC; CD4 APC Cy7; CD8 PE Cy7; CD69 FITC і CD62L PE. 6.20. Вимірювання впливів на рівні S1P у мишей Рівні S1P в селезінці мишей (F1-гібриди лінії 129/В6) вимірювали, використовуючи адаптований радіорецепторний аналіз зв’язування, описаний в публікації Murata, N. et al. Anal. Biochem. 282:115120 (2000). Цей спосіб використовує клітини HEK293F з гіперекспресією Edg-1 одного з підтипів рецепторів S1P; він оснований на конкуренції міченого S1P з неміченим S1P в даному зразку. Клітини HEK293F трансфекували вектором pEFneo, що визначає експресію рецептора S1P (Edg-1), і відбирали клон G418-резистентних клітин. Клітини HEK293F, експресуючі Edg-1, культивували в 12 мультипланшетах в середовищі DMEM, що містило 5% (по об'єму) FBS, в атмосфері вологого повітря з CO2 (19:1). За 24 години до експерименту середовище замінювали свіжим середовищем DMEM (без сироватки), яке містило 0,1% (маса до об'єму) BSA. Через 18 годин після введення випробуваної сполуки мишей забивали і витягували і заморожували селезінки. S1P визначали в замороженій тканині, використовуючи відомі способи. Див., наприклад, Yatomi, Y. et al. FEBS Lett. 404:173-174 (1997). Зокрема, селезінки 10 мишей гомогенізували на льоду три рази з однохвилинними інтервалами в 1мл льодяного 50мМ фосфатного буфера (рН 7,5), що містив 1мМ EGTA, 1мМ DTT і повний комплект інгібіторів протеаз за Roche. Гомогенат центрифугували 10 хвилин при 2500об./хв. і 4°С для видалення клітинного дебрису. Супернатант потім ультрацентрифугували при 45000об./хв. і 4°С в 70Ti-роторі протягом 1 години для осадження білків, зв'язаних з мембранами. Супернатант відкидали, а осад ресуспендували в мінімальному об'ємі (~1мл) льодяного 50мМ фосфатного буфера (рН 7,5), що містив 1 мМ EGTA, 1мМ DTT, 33% гліцерину і повний комплект інгібіторів протеаз за Roche. Загальну концентрацію білка визначали способом Bradford. S1P екстрагували сумішшю хлороформу, KCl і NH4OH (pH ~12), зберігаючи верхню водну фазу. Її потім екстрагували сумішшю хлороформу, метанолу і HCl (pH
ДивитисяДодаткова інформація
Назва патенту англійськоюImidazole-based compounds, compositions comprising them and methods of their use
Автори англійськоюAugeri David J., Bagdanoff Jeffrey, Boteju Lakmal W., Carson Kenneth G., Jessop Theodore C., Kimball David S.
Назва патенту російськоюСоединения на основе имидазола, композиция, которая их содержит, и их применение
Автори російськоюОджери Девид Дж., Багданофф Джеффри, Ботеджу Лакмал У., Карсон Кеннет Г., Джессоп Теодор К., Кимболл Девид С.
МПК / Мітки
МПК: C07D 233/54, A61P 29/00, A61K 31/4164
Мітки: основі, яка, містить, композиція, імідазолу, сполуки, застосування
Код посилання
<a href="https://ua.patents.su/23-94737-spoluki-na-osnovi-imidazolu-kompoziciya-yaka-kh-mistit-i-kh-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Сполуки на основі імідазолу, композиція, яка їх містить, і їх застосування</a>
Попередній патент: Спосіб та установка для обдирання пшеничного зерна, застосування обідраного зерна і частинок їх зовнішніх оболонок
Наступний патент: Віконна система
Випадковий патент: Спосіб виготовлення сирцевого білкового крему












