Інгібітори простагландинсинтази, фармацевтична композиція на їх основі та спосіб лікування запальної хвороби та жару (лихоманки)
Номер патенту: 70275
Опубліковано: 15.10.2004
Автори: Петрайтіс Джозеф Джеймс, Пінто Дональд Джозеф Ф., Батт Дуглас Гай, Піттс Уільям Джон, Оруот Майкл Джеймс
Формула / Реферат
1. Ортозаміщені сполуки формули І:
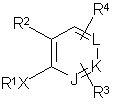 (I)
(I)
або їх фармацевтично придатні солі, або пролікарські засоби,
де J, К та L є незалежно СR3, СR4 або N;
X є простим зв'язком (тобто X відсутній), -(СНR5)2-, -СН=СR5-, -СR5=СН-, -C≡С-, -(СНR5)рZ-, -Z(СНR5)р-, -С(=O)СН2 або -СН2С(=O)-;
Z є O або S;
R1 - феніл, заміщений 0-2 R7,
2-нафтил, заміщений 0-2 R7,
С5-С7 циклоалкіл, заміщений 0-1 R9,
С5-С7 циклоалкеніл, за умовою, що, коли R1 приєднаний прямо до гетероатома, а останній не приєднаний до вуглецю, що несе подвійний зв'язок в циклоалкеновому кільці,
5-10-членне гетероциклічне кільце, яке вибирають з фурилу, тієнілу, піролілу, тіазолілу, оксазолілу, N-метилпіролілу, ізоксазолілу, ізотіазолілу, піразолілу, 3-піридинілу, піридазинілу, піразинілу, індолілу, бензофуранілу, бензотієнілу, бензотіазолілу, бензоксазолілу, бензотриазолілу, бензоізотіазолілу, бензізоксазолілу, хінолінілу, ізохінолінілу або піперидинілу, при цьому така кільцева система заміщена 0-2 R7,
R2 є:
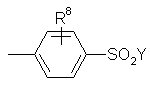 ,
,
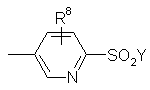
або
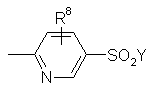 ,
,
Y є -СН3 або NH2;
R3 - Н, F, Вr, Сl, І, СN, С1-С4 алкіл, заміщений 0-1 R12, С1-С4 галогеналкіл, С1-С4 алкеніл, заміщений 0-1 R13, NO2, NR15R16, S(O)mR11, SO2NR15аR16, -С(=O)R6, -СООR17, -С(=O)NR15аR16 або -ОR18;
R4 - Н, F, Вr, Сl, І, С1-С2 алкіл, С1-С2 алкокси, С1-С2 галогеналкіл, -СF3, -SR10а,
або
з іншого боку, коли R3 і R4 є замісниками прилеглого атома вуглецю, R3 і R4 можуть бути взяті разом з вуглецевим атомом, до якого вони приєднані, утворюючи 5-7 -членну карбоциклічну чи гетероциклічну кільцеву систему, при цьому така гетероциклічна кільцева система складається з 1-3 гетероатомів, які вибирають з N, О або S;
R5 - С1-С2 алкіл, С1-С2 алкокси або С1-С2 галогеналкіл;
R6 - водень,
С1-С6 алкіл, заміщений 0-1 R14,
феніл, заміщений 0-2 R9,
С5-С7 циклоалкіл, заміщений 0-1 R9,
5-10- членна гетероциклічна кільцева система, яку вибирають з фурилу, тієнілу, тіазолілу, оксазолілу, N-метилпіролілу, ізоксазолілу, ізотіазолілу, піразолілу, піридинілу, піридазинілу, піразинілу або піримідинілу, при цьому така гетероциклічна кільцева система заміщена 0-2 R7;
R7 - замісник на вуглецевому атомі, який вибирають з Н, F, Вr, Сl, І, С1-С4 алкілу, фенілу, СН2ОН, СН2ОСН3, С1-С4 алкокси, С1-С4 галогеналкілу, -SR10, NR15R16, -С(=O)R10, -СН2СООR17 або -ОR19, за умови, що коли X - простий зв'язок, R7 не знаходиться в орто-положенні до Х;
R8 - Н, F, Вr, Сl, І, гідрокси, С1-С4 алкіл, С1-С4 алкокси, -(СН2)nСООR17 або -СН=СНСООR17;
R9 - Н, F, Вr, Сl, І, гідрокси, С1-С4 алкіл або С1-С4 алкокси;
R10 - Н або С1-С4 алкіл;
R11 - С1-С4 алкіл, С1-С2 фторалкіл, феніл або бензил;
R12 - F, ОR18, NR15R16, феніл, заміщений 0-2 R9, -СN, -С(=O)R6, -СООR17, -С(=O)NR15R16 або гетероциклічна кільцева система, яку вибирають з морфолінілу, піперидинілу, піролідинілу, фурилу, тієнілу, піридинілу, піперидазинілу, піримідинілу, піразинілу або тетрагідропіридинілу, при цьому така гетероциклічна кільцева система є заміщеною 0-2 R9;
R13 є -СN, -С(=O)R6, -СООR17, -NO2 або NR15R16;
R14 - F, ОН, С1-С4 алкокси, NH2, феніл, заміщений 0-2 R9, алкілкарбоніл, арилкарбоніл, -СООR17 або -С(=O)NH2;
R15 - Н, С1-С4 алкіл, заміщений 0-1 R23, С6-С10 арил, С3-С7 циклоалкіл, С4-С11 циклоалкілалкіл, С2-С4 алкеніл, С1-С4 алкокси, С1-С6 алкілкарбоніл, С1-С6 алкоксикарбоніл, С7-С14 арилалкоксикарбоніл, С6-С10 арилоксикарбоніл, С1-С6 алкіламінокарбоніл, С6-С10 арилкарбоніл, С1-С6 алкілсульфоніл, С6-С10 арилсульфоніл, С7-СІ4 алкіларилсульфоніл або С7-С14 арилалкілсульфоніл;
R15а - Н, С1-С4 алкіл, заміщений 0-1 R23, С6-С10 арил, С3-С7
циклоалкіл, С4-С11 циклоалкілалкіл, С2-С4 алкеніл або С1-С4 алкокси;
R16 - Н або С1-С4 алкіл; або
з іншого боку, R15 і R16 можуть бути з'єднані разом і бути -(СН2)4-, -(СН2)5-, -(СН2)2O(СН2)2- або - (СН2)2NR21 (СН2)2-;
R17 - С1-С4 алкіл або арилалкіл;
R18 - С1-С4 алкіл, заміщений 0-2 R24, С6-С10 арил, Сз-С7 циклоалкіл,
С1-С6 алкілкарбоніл, С1-С6 алкіламінокарбоніл, С7-С14
арилалкілкарбоніл або С6-С10 арилкарбоніл, заміщений 0-2 R9;
R19 - С1-С4 алкіл, С1-С4 галоалкіл, С1-С4 алкоксіалкіл, С1-С6 алкілкарбоніл, С1-Сб алкіламінокарбоніл, С7-С14 арилалкілкарбоніл або С6-С10 арилкарбоніл, заміщений 0-2 R9;
R20 - Н, С1-С4 алкіл, С1-С4 галоалкіл, С1-С4 алкоксіалкіл, С6-С10 арил, С3-С7 циклоалкіл, С1-С6 алкілкарбоніл, С1-С6 алкіламінокарбоніл, С7-С14 арилалкілкарбоніл або С6-С10 арилкарбоніл, заміщений 0-2 R9;
R21 - С1-С4 алкіл або бензил;
R22 - Н, R1, R2, С1-С4 алкіл, С3-С10 циклоалкілалкіл, С7-С14 арилалкіл або С6-С10 гетероарилалкіл;
R23 - це Н, F, феніл, заміщений 0-2 R9, -С(=О)R6, -СОOR17, -С(=О), NНR16 або гетероциклічна кільцева система, яку вибирають з морфолінілу, пиперидинілу, піролідинілу, фурилу, тієнілу, або тетрагідропіридинілу, при цьому така гетероциклічна кільцева система заміщена 0-2 R9;
R24 - Н, F, N R15R16, феніл, заміщений 0-2 R9, С1-С4 алкокси, С1-С4 алкілкарбонілокси, -С(=О)R6, -СООR17, -С(=О) NR16R17 або гетероциклічна кільцева система, яку вибирають з морфолінілу, пиперидинілу, піролідинілу, фурилу, тієнілу, піперидинілу або тетрагідропіридинілу, при цьому така гетероциклічна кільцева система заміщена 0-2 R9;
m - 0-2 та
р - 0-1,
при умові, що
коли J та L обидва є атомами азоту і К - СR4, тоді R4 не може бути SR10;
коли R3 та R4 взяті разом утворюють 6 -членну карбоциклічну кільцеву систему та R1Х - феніл, R2 не є 4-метилсульфонілфенілом;
коли J є N та R3 , R4 є Н, та R1X - феніл, R2 не є 4-метилсульфонілфенілом;
коли R3 та R4 є Н та R1X - феніл, R2 не є 4-аміносульфонілфенілом.
2. Сполуки за п. 1 або їх фармацевтично придатні солі, або пролікарські форми,
де
J є СН або N;
кожен К та L незалежно є СR3 або СR4;
X - простий зв'язок (тобто X відсутній), -С≡С- або -(СНR5)рZ-;
R3 - Н, F, Вr, СN, С1-С4 алкіл, заміщений 0-1 R12, С1-С4 галогеналкіл, NO2, SOmR11, -С(=O)R6, ОR18;
R4 - Н, F, СН3 або
з іншого боку, коли R3 і R4 є замісником прилеглого атома вуглецю, R3 і R4 можуть бути взяті разом з вуглецевим атомом, до якого вони приєднані, утворюючи 5-7 -членну карбоциклічну кільцеву систему;
R6-водень,
С1-С6 алкіл, заміщений 0-1 R14 або феніл, заміщений 0-2 К9, і
R7 - замісник на вуглецевому атомі, який вибирають з Н, F, Вr, С1-С4 алкілу, СН2ОН, СН2ОСН3, С1-С4 алкокси, С1-С4 галогеналкілу, NR15R16, -С(=O)R10,
де усі інші замісники для формули I мають значення визначене вище;
при умові, що
коли R3 та R4 взяті разом утворюють 6 -членну карбоциклічну кільцеву систему та R1Х - феніл, R2 не є 4-метилсульфонілфенілом;
коли J є N та R3 , R4 є Н, та R1X - феніл, R2 не є 4-метилсульфонілфенілом;
коли R3 та R4 є Н та R1X - феніл, R2 не є 4-аміносульфонілфенілом.
3. Сполуки за п. 2 або їх фармацевтично придатні солі, або пролікарськи форми,
де
R8 є Н;
R9 є Н;
R12 є F, ОR18, СN, -СООR17;
R14 є Н;
R15 є Н або С1-С4 алкіл;
R16 є Н або С1-С4 алкіл;
R18 є Н або С1-С4 алкіл;
R19 є С1-С4 алкіл,
при умові, що
коли R3 та R4 взяті разом утворюють 6 -членну карбоциклічну кільцеву систему та R1Х - феніл, R2 не є 4-метилсульфонілфенілом;
коли J є N та R3 , R4 є Н, та R1X - феніл, R2 не є 4-метилсульфонілфенілом;
коли R3 та R4 є Н та R1X - феніл, R2 не є 4-аміносульфонілфенілом.
4. Сполуки за п. 1 формули Іа:
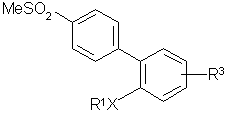 , (Ia)
, (Ia)
де:
R1Х - феніл, 4-фторфеніл, 3-метоксифеніл, 4-метоксифеніл, 3,4-диметоксифеніл, 4-гідроксиметилфеніл, 4-метоксиметилфеніл, 4-диметиламінофеніл, 4-формілфеніл, 2-нафтил, 5-метокси-2-нафтил, 2-хінолініл, 3-хінолініл, 2-бензотієніл, 5-бензотієніл, 3-піридил, фенілацетиленіл, фенокси, циклогексеніл, циклогексил, 4-фторфенокси, циклогексилокси, бензилокси, 1-піроліл, 1-піперидиніл, та
R3 - водень, 4-гідрокси, 4-нітро, 5-нітро або 4-ацето.
5. Сполуки за п. 4 або їх фармацевтично придатні солі, або пролікарськи форми, де:
R1Х - феніл; та
R3 - водень, 4-гідрокси, 4-нітро, 5-нітро або 4-ацето; або
R1Х - 4-фторфеніл, 3-метоксифеніл, 4-метоксифеніл, 3, 4-диметоксифеніл, 4-гідроксиметилфеніл, 4-метоксиметилфеніл, 4-диметиламінофеніл, 4-формілфеніл, 2-нафтил, 5-метокси-2-нафтил, 2-хінолініл, 3-хінолініл, 2-бензотієніл, 5-бензотієніл, 3-піридил, фенілацетиленіл, фенокси, циклогексеніл, циклогексил, 4-фторфенокси, циклогексилокси, бензилокси, 1-піроліл, 1-піперидиніл; та
R3 - водень.
6. Сполуки за п. 1, які являють собою:
2-(4-метилсульфонілфеніл)-3-фенілнафталін,
3-(4-метилсульфонілфеніл)-2-фенілпіридин і
2-(4-аміносульфонілфеніл)-1-біфеніл.
7. Фармацевтична композиція, що включає протизапальну кількість сполуки за будь-яким з пп. 1-5 і фармацевтично придатний носій.
8. Спосіб лікування запальної хвороби у ссавця, який відрізняється тим, що ссавцю, при необхідності такого лікування, вводять терапевтично ефективну кількість сполуки за п. 1.
9. Спосіб лікування жару (лихоманки) у ссавця, який відрізняється тим, що ссавцю, при необхідності такого лікування, вводять терапевтично ефективну кількість сполуки за п. 1.
Текст
Цей винахід стосується орто-заміщених фенільних сполук як інгібіторів простагландин синтази, фармацевтичних композицій, що включають такі сполуки і методів використання таких сполук як 10 протизапальних та жарознижуючих засобів. Нестероїдні протизапальні ліки (NSAID) були головним засобом протизапальної і жарознижуючої терапії протягом більш як 200 років (Weissman G., Scientific American: 84-90, 1991). Функціонують NSAID через інгібірування біосинтезу простагландинів (Vane J.R., Nature - New Biology: 231, 232-235, 1971). Для цих агентів характерна дія як інгібіторів циклооксигенази (простагландин G/H синтази). Циклооксигеназа є першим ферментом каскаду арахідонової кислоти, що веде до простагландинів рядів D2, Е2 та F2a- Крім того, простациклін (PGI 2) та тромбоксани А2 та В2 є похідними інтермедиа-ту PGHS2, що генерується циклооксигеназою (Prostaglandins and Related Substances - A Practical Approach (1987). Benedetto C, McDonaldGibson R.G. Nigam S. and Slater T.F., eds. IRL Press, Washington, DC). Ці метаболіти арахідонової кислоти залучені до процесів болю, лихоманки, коагуляції крові та запалення. Окрім того, простагландини відповідають за цілісність слизової оболонки шлунково-кишкового тракту (Сrуеr В. and Friedman M., Arch. Intern. Med. 152, 1145-11556 1992) та функцію нирок, особливо в умовах стресу (Whelton A. and Hamilton C.M. J.Clin. Pharmacol. 31, 588-598, 1994). Таким чином, агенти, що викликають інгібірування ферменту циклооксигенази, мають виключні протизапальні та знеболюючі властивості завдяки блокуванню продукції медиаторів запалення та болю, але, з урахуванням механізму їх дії, ці ж самі агенти мають побічний ефект, пов'язаний з їх шлунково-кишковою та нирковою функцією. Мінімізація або ж усунення цих перешкод в новій терапії призводить до того, що має рацію пошук "безпечного" NSAID з поліпшеним шлунково-кишковим (GI) та нирковим профілем (Vane J.R., Nature 367, 215-216, 1994). Дотепер припускалося, що тільки один ізофермент циклооксигенази має відповідальність за всю активність простагландин G/H2 синтази. Проте, нещодавно описано ідентифіковану, мітоген-индуцибельну форму цього фермента, що її названо циклооксигеназою 2 (Сох 2) (Хіе W., Chipman J.G., Robertson D.L., Erickson R.L. and Simmons D.L., Proc. Natl. Acad. Sci. 88, 2692-2696, 1991; Kujubu D.A., Fletcher B.S., Varnum B.C., Lim R.W. and Herschman H.R., J.Biol. Chem., 266(20) 12866-12872, 1991; Hla T. and Neilson K., Proc. Natl. Acad. Sci. 89, 7384-7388, 1991; Xie W., Robertson D.L. and Simmons D.L., Drug Development Research 25, 249265, 1992). Cox 2 виявляє фізичні та біологічні властивості, відмінні від класичних зразків циклооксигенази, Сох 1. Розподіл Сох 2 на рівні тканин і клітин, що супроводжується її регулярною експресією, свідчить про її залученість до реакцій на запалення та станів хвороби, таких як ревматоїдний артрит, в той час як експресія Сох 1 є відповідальною за конститутивні функції. Виходячи з розподілу між Сох 1 та Сох 2, висунуту раніше гіпотезу, що пояснює ефект NSAID, покладаючись, лише на один ізофермент, слід поставити під сумнів. Особливо, коли протизапальна та знеболююча дія NSAID, що є ознакою виключно інгібірування головного ізофермента Сох 1, не може бути поясненням. Фактично, більш імовірна гіпотеза полягає в тому, що протизапальну та знеболюючу дію більшості NSAID у відповідь на хронічний стимул можна взяти до уваги при інгібіруванні індуцибельних різновидів Сох 2, в той час як шлунково-кишкові та ниркові перешкоди використання існуючих NSAID виникають завдяки ферменту Сох 1, що істотно експресується (Vane J.R., Nature: 367, 215-216, 1994). Таким чином, слід чекати, що агенти, котрі мають здатність селективного або специфічного інгібірування Сох 2, забезпечуватимуть ліпший стан із побічним шлунково-кишковим та нирковим ефектом, зберігаючи при цьому високий рівень протизапальної, жарознижуючої та знеболюючої активності. Потенціал для більш безпечних NSAID із селективним інгібіруванням оцінювався як активність сполук на очищених препаратах ферменту. Переважне інгібірування або ізофермента, або така ж, інгібіторна потенція було отримано для колекції терапевтично корисних NSAID (DeWitt, D.L., Meade E.A., and Smith W.L., Amer. J. Mea. 95, (Suppi. 2A), 40S-44S, 1993). однак, тільки одна сполука з цієї колекції продемонструвала селективність до Сох 2, а саме 6-метокси-нафтилоцтова кислота (6MNA), активний метаболіт небуметону. Також було описано кілька інших агентів з подібною селективністю до Сох 2, включаючи BF389 (Mitchell J.A., Akarasereenot P., Thiemermann C, Flower R.J., and Vane J.R., Proc. Natl. Acad. Sci. 90, 11693-11697, 1994) та NS-398 (Futaki N., Takahashi S., Yokayama M., Arai I., Higuchi S., and Otomo S., Prostaglandins 47, 55-59, 1994; Masferrer J.L., Zuieifel B.S., Manning P.Т., Hauser S.D., Leaky K.M., Smith W.G., Isakson P.C, and Seibert K., Proc. Natl. Acad. Sci. 91, 3228-3232, 1994). Для останньої сполуки селективне інгібірування Сох 2 блокувало простагландиновий синтез, що супроводжує запалення у відповідь на ірландський мох (їстивна водорость), in vivo, але не блокувало шлунковий простагландиновий синтез, не призводячи до жодного шлункового враження (Masferrer et al., vide supra, див. вище). Ці знахідки свідчать на користь підстави того, що селективні інгібітори Сох 2 матимуть потужні протизапальні властивості та поліпшений профіль безпеки. Детальні рутинні дослідження виявили, що NS-398 поряд з іншим селективним інгібітором Сох 2, Dup 697, досягають своєї селективності через унікальний процес (Copeland R.A., Williams J.M., Giannaras J., Nurnberg S., Covington M., Pinto D., and Trzaskos J.M., Mechanism of Selective Inhibition of the Inducible Isoform of Prostaglandin G/H Synthase, прийнято до друку). Інгібірування є конкурентним по відношенню до обох ізоферментів, але виглядає селективним, залежним від часу по відношенню до Сох 2, призводячи до збільшення інгібірування за умов довшої експозиції. Залежність від часу призводить до винятково звуження інгібірування приєднання, яке можна обернути тільки з наступною денатурацією фермента та екстракією органічними розчинниками. Newkome G.R. et al., (J.Org.Chem. 1980, 45, 4380) повідомляють про біс-(5-карбокси-2-піридил)-бензоли, проте взиску з цих сполук не виявлено. Bushby et al., (J.Chem. Soc. Perkin Trans. I 721, 1986) описують синтез заміщених терфенілів, включаючи приклад, наведений нижче. Hori et al., (Chem. Pharm. Bull. 22(9), 2020, 1974) повідомляють про синтез терфенілів, включаючи 2-феніл2'-метилтіо-1-біфеніл. Kemp et al., (J.Org. Chem, 46, 5441, 1981) повідомляють про синтез 4-метоксифеніл-(4'-алкілфеніл)бензолів. Floyd et al., U.S. Patent No.4 613 611 виявили активність a-гідрокси-b-оксо-[1,1':2',1''-терфеніл]-4етансульфонової кислоти для використання при Diabetes Mellitus. Орто-біс-(диметоксифеніл)-бензол-карбоксаміди, як повідомлялося (Tilley, et al., J.Med. Chem. 32, 1814, 1989), є антагоністами фактору пластинчастої активації. Европейська патентна заявка ЕР130045, що опублікована 2.01.1985 повідомляє про заміщені біс(метоксифеніл)-бензоли як знеболюючі та протизапальні агенти. Патент США No.3 624 142 виявляє 4-метилсульфоніл-біфенілоцтові кислоти в якості протизапальних агентів. Жодне з вищенаведених посилань не викликає думку про метилсульфонільні сполуки даного винаходу. Так що, саме це є об'єктом даного винаходу, що виявляє ці сполуки як інгібітори простагландин-синтази, що відрізняються тим, що вони є селективними інгібіторами Сох 2 як новітні протизапальні агенти з:, поліпшеним терапевтичним профілем для використання при ревматичних та запальних хворобах і для використання при лихоманці. Цей винахід стосується орто-заміщених фенілів з формулою І, описаних нижче в якості інгібіторів простагаландин-синтази, фармацевтичних композицій, що вкючають такі сполуки, і засобів використання таких сполук як протизапальних та жарознижуючих агентів. Цей винахід надає сполуку формули І: або фармацевтично придатну сіль, або пролікарський засіб вищеозначеної сполуки, що відрізняється тим, що: J, К та L є незалежно CR3, CR4 або N; Х є простий зв'язок (тобто X відсутній), -(CHR5)2-, -CH=CR5-, -CR5=CH-, -С=С-, -(CHR5)pZ-, -Z(CHR5)р-, -C(=O)CH2 або -СН2С(=О)-; Z є О або S; R1 є: - феніл, заміщений 0-2 R7, - 2-нафтил, заміщений 0-2 R7, - С5-С7 циклоалкіл, заміщений 0-1 R9, - С5-С7 циклоалкеніл, за умовою, що, коли R1 приєднаний прямо до гетероатома, а останній не приєднаний до вуглецю, що несе подвійний зв'язок в циклоалкеновому кільці, - 5-10 членне гетероциклічне кільце, що обирається з фурилу, тіенілу, піролілу, тіазолілу, оксазолілу, Nметилпіролілу, ізоксазолілу, ізотіазолілу, піразолілу, 3-піридинілу, піразинілу, бензофуранілу, бензотіенілу, бензотіазолілу, бензоксазолілу, бензотриазолілу, бензоізотіазолілу, бензізоксазолілу, хінолінілу, ізохінолінілу, або піперидинілу, при цьому така кільцева система заміщена 0-2 R7, R2 є: Y є -СН3 або NH2; R3 є: Н, F, Вr, СІ, І, CN, С1-С4 алкіл, заміщений 0-1 R12, С1-С4 галогеналкіл, С1-С4 алкеніл, заміщений 0-1 13 R , NO2, NR15R16, SOmR11, SO2NR15aR16, -C(=O)R6, -COOR17, -C(=O)NR15aR16 або -OR18; R4 є: H, F, Br, СІ, І, С1-С2 алкіл, С1-С2 алкокси, С1-С2 галогеналкіл, -CF3, -SR10a; З іншого боку, коли R3 і R4 є заміщувачами прилеглого атому вуглецю, R3 і R4 можуть бути взяті разом з вуглецевим атомом, до якого вони приєднані, утворюючи 5-7 членну карбоциклічну чи гетероциклічну кільцеву систему, при цьому така гетероциклічна кільцева система складається з 1-3 гетероатомів, що обираються з N, O або S; R5 є С1-С2 алкіл, С1-С2 алкокси або С1-С2 галогеналкіл; R6 є - водень, - С1-С6 алкіл, заміщений 0-1 R14, - феніл, заміщений 0-2 R9, - С5-С7 циклоалкіл, заміщений 0-1 R9, - 5-10 членна гетероциклічна кільцева система, що обирається з фурилу, тіенілу, тіазолілу, оксазолілу, Nметилпіролілу, ізоксазолілу, ізотіазолілу, піразолілу, піридинілу, піридазинілу, піразинілу або піримідинілу, при цьому така гетероциклічна кільцева система заміщена 0-2 R7, R7 є заміщувач на вуглецевому атомі, що обирається з Н, F, Вr, СІ, І, С1-С4 алкілу, фенілу, СН2ОН, СН2ОСН3, С1-С4 алкокси, С1-С4 галогеналкілу, -SR10, NR15R16, -C(-O)R10a, -CH2COOR17 або -OR19, за умови, що коли X є, простий зв'язок, R7 не є в орто-положенні до X; R8 є H, F, Вr, СІ, І, С1-С4 алкіл, С1-С4 алкокси; R9 є Н, F, Вr, СІ, І, гідрокси, С1-С4 алкіл або С1-С4 алкокси; R10 є Н або С1-С4 алкіл; R10a є С1-С4 алкіл; R11 є С1-С4 алкіл, С1-С4 фторалкіл, феніл або бензил; R12 є F, OR18, NR15R16, феніл, заміщений 0-2 R9, -CN, -C(=O)R6, -COOR17, -C(=O)NR15R16 або гетероциклічна кільцева система, що обирається з морфолінілу, піперидинілу, піролідинілу, фурилу, тіенілу, піридинілу, піперидазинілу, піримідинілу, піразинілу або тетрагідропіридинілу, при цьому така гетероциклічна кільцева система заміщена 0-2 R9; R13 є -CN, -C(=O)R6, -COOR17, -NO2, - або NR15R16; R14 є F, ОН, С1-С4 алкокси, NH2, феніл, заміщений 0-2 R9, алкілкарбоніл, арилкарбоніл, -COOR17 або C(=O)NH2; R15 є Н, С1-С4 алкіл, заміщений 0-1 R23, С6-С10 арил, С3-С7 циклоалкіл, С4-С11 циклоалкілалкіл, С2-С4 алкеніл, С1-С4 алкокси, С1-С6 алкілкарбоніл, С1-С6 алкоксикарбоніл, С7-С14 арилалкоксикарбоніл, С6-С10 арилоксикарбоніл, С1-С6 алкіламінокарбоніл, С6-С10 арилкарбоніл, С1-С6 алкілсульфоніл, С6-С10 арилсульфоніл, С7-С14 алкіларилсульфоніл або С 7-С14 арилалкілсульфоніл; R15a є Н, С1-С4 алкіл, заміщений 0-1 R23, С6-С10 арил, С3-С7 циклоалкіл, С4-С11 циклоалкілалкіл, С2-С4 алкеніл або С1-С4 алкокси; R16 є Н або С1-С4 алкіл; або З іншого боку, R15 і R16 можуть бути з'єднані разом і бути -(СН2)4-, -(СН2)5 -, -(СН2)2O(СН2)2- або - (CH2)2 NR21 (СН2)2-; R17 є С1-С4 алкіл або арилалкіл; R18 є С1-С4 алкіл, заміщений 0-2 R24, С6-С10 арил, С3-С7 циклоалкіл, С1-С6 алкілкарбоніл, С1-С6 алкіламінокарбоніл, С7-С14 арил- алкілкарбоніл або С6-С10 арилкарбоніл, заміщений 0-2 R9; R19 є С1-С4 алкіл, С1-С4 галогеналкіл, С1-С4 алкоксиалкіл, С1-С6 алкілкарбоніл, С1-С6 алкіламінокарбоніл, С7-С14 арилалкілкарбоніл, C6-C10 арилкарбоніл, заміщений 0-2 R9; R20 є С1-С4 алкіл, С1-С4 галогеналкіл, С1-С4 алкоксиалкіл, С6-С10 арил, С3-С7 циклоалкіл, С1-С6 алкілкарбоніл, С1-С6 алкіламінокарбоніл, С7-С14 арилалкілкарбоніл, або С6-С10 арилкарбоніл, заміщений 0-2 R9; R21 є С1-С4 алкіл або бензил; R22 є Н, R2, R1, С1-С4 алкіл, С4-С10 циклоалкілалкіл, С7-С14 арилалкіл, С6-С10 гетероарилалкіл; R23 є Н, F, феніл, заміщений 0-2 R9, -C(=O)R6, -COOR17, -C(=O)NHR16 або гетероциклічна кільцева система, що обирається з морфолінілу, піперидинілу, піролідинілу, фурилу, тіенілу або тетрагідропіридинілу, при цьому така гетероциклічна кільцева система заміщена 0-2 R9; R24 є: - Н, F, NR15R16, феніл, заміщений 0-2 R9, С1-С4 алкокси, С1-С4 алкілкарбонілокси, -C(=O)R6, -COOR17, C(=O)N15R16 або - гетероциклічна кільцева система, що обирається з морфолінілу, піперидинілу, піролідинілу, фурилу, тіенілу або тетрагідропіридинілу, при цьому така гетероциклічна кільцева система заміщена 0-2 R9; m є 0-2; і р є 0-1. при умові, що коли J та L обидва є атомами азоту, і К є CR4, тоді R4 не може бути SR10. Передусім, сполуки Формули І або фармацевтично придатні солі! або пролікарські засоби вищеозначених відрізняються тим, що: J є СН або N; Кожен К та L незалежно є CR3 або CR4; X є простий зв'язок (тобто X відсутній), -С=С- або -(CHR5)pZ-; R3 є: Н, F, Br, CN, С1-С4 алкіл, заміщений 0-1 R12, С1-С4 галогеналкіл, NO2, SOmR11, -C(=O)R6, OR18; R4 є: H, F, СН3 або з іншого боку, коли R3 і R4 є заміщувачами прилеглого атому вуглецю, R3 і R4 можуть бути разом з вуглецевим атомом, до якого вони приєднані, утворюючи 5-7 членну карбоциклічну кільцеву систему; R6 є - водень, - С1-С6 алкіл, заміщений 0-1 R14 або феніл, заміщений 0-2 R9, і R7 є заміщувач на вуглецевому атомі, що обирається з Н, F, Вr, С1-С4 алкілу, СН2OН, СН2ОСН3, С1-С4 алкокси, С1-С4 галогеналкілу, NR15R16, -C(=O)R10; і де всі інші заміщувачі у Формулі І вище визначені. Далі, передусім, сполуки Формули І або фармацевтично придатні солі, або пролікарські засоби вищеозначених відрізняються тим, що: R8 є Н; R9 є Н; R12 є F, OR18, CN, -COOR17; R14 є Н; R15 є Н або С1-С4 алкіл; R16 є Н або С1-С4 алкіл; R18 є Н або С1-С4 алкіл; R19 є С1-С4 алкіл; Особливо бажаними є сполуки, або фармацевтично придатні солі, або пролікарські засоби вищезгаданих, що обираються з групи, що складається з: (а) сполуки Формули Іа: що відрізняються тим, що: R1X є феніл і R3 є водень, R1X є феніл і R3 є 4-ОН, R1X є феніл і R3 є 4-NO2, R1X є феніл і R3 є 5-NO2) R1X є феніл і R3 є 4-СН3С(=O), R1X є 4-фторфеніл і R3 є Н, R1X є 4-метоксифеніл і R3 є Н, R1X є 4-метилфеніл і R3 є Н, R1X є 3-метоксифеніл і R3 є Н, R1X є 3,4-диметоксифеніл і R3 є Н, R1X є 4-гідроксиметилфеніл і R3 є Н, R1X є 4-метоксиметилфеніл і R3 є Н, R1X є 4-диметиламінофеніл і R3 є Н, R1X є 4-формілфеніл і R3 є Н, R1X є 2-нафтил і R3 є Н, R1X є 5-метокси-2-нафтил і R3 є Н, R1X є 3-хінолініл і R3 є Н, R1X є 2-хінолініл і R3 є Н, R1X є 5-бензотіеніл і R3 є Н, R1X є 2-бензотіеніл і R3 є Н, R1X є 3-піридил і R3 є Н, R1X є PhC=C- і R3 є Н, R1X є фенокси і R3 є Н, R1X є 1-циклогексеніл і R3 є Н, R1X є циклогексил і R3 є Н, R1X є 4-фторфенокси і R3 є Н, R1X є циклогексилокси і R3 є Н, R1X є бензилокси і R3 є Н, R1X є 1-піперидиніл і R3 є Н, R1X є 1-піроліл і R3 є Н, (b) сполука Формули І, яка є 2-(4-метилсульфонілфеніл)-3-фенілнафталін, (с) сполука Формули І, яка є 3-(4-метилсульфонілфеніл)-2-фенілпіридин, і (d) сполука Формули І, яка є 2-(4-аміносульфонілфеніл)-1-біфеніл. Цей винахід також забезпечує фармацевтичні композиції, які включають сполуку Формули І і фармацевтично придатний носій. Сполуки, описані вище, корисні як протизапальні та жарознижуючі агенти в організмі ссавців, коли їх вводять фармацевтичною композицією в разі необхідності обробки такими протизапальними та жарознижуючими агентами. Даний винахід включає фармацевтичні композиції, що містять ефективну PGHS-2інгібіруючу, або протизапальну, або жарознижуючу кількість вищеописаних сполук Формули І. Даний винахід також включає засоби обробки артриту або іншої запальної хвороби ссавця, що складаються з введення ссавцю терапевтично ефективної кількості сполуки Формули І, описаної вище. Сполуки, що стосуються даного винаходу, можуть бути також введені в комбінації з одним чи більше додатковим терапевтичним агентом. Введення сполук Формули І даного винаходу в комбінації з таким додатковим терапевтичним агентом може надати дієвої переваги над сполуками та агентами поодинці, і може дозволити використання нижчих доз кожного. Нижче дозування мінімізує потенціальні побічні ефекти, і тому забезпечує більший діапазон безпеки. Під "терапевтично ефективною кількістю" розуміється кількість сполуки Формули І, така, що коли введена сама або в комбінації з додатковим терапевтичним агентом у клітину ссавця, вона ефективна для інгібірування PGHS-2, так що вона перешкоджає прогресії хвороби або поліпшує умови протікання запальної хвороби. Під "введенням у комбінації" або "комбінаційною терапією" розуміється те, що сполука Формули І і один чи більше додаткових терапевтичних агентів вводяться конкурентно до організму ссавця. При введенні в комбінації кожен компонент може бути введений одночасно чи послідовно в будь-якому порядку в різні проміжки часу. Так, що кожний компонент може бути введено окремо, але І достатньо близько в часі, щоб забезпечити бажаний терапевтичний ефект. Сполуки, описані тут, можуть мати асиметричні центри. Поки не зазначено інше, в даний винахід включено всі хіральні, диастереомірні та рацемічні форми. Багато геометричних ізомерів олефінів, подвійних зв'язків C=N, і подібних їм також можуть бути присутні серед сполук, описаних тут, і всі такі стабільні ізомери розглядаються в даному винаході. Буде особливо розглянуто, коли сполуки даного винаходу містять асиметрично заміщений атом вуглецю, і можуть бути ізольовані в оптично активних або рацемічних формах. В даній галузі добре відомо, як приготувати оптично активні форми, наприклад розділенням рацемічних форм чи синтезом з оптично активних вихідних матеріалів. Розуміються всі хіральні, диастереомірні, рацемічні форми і всі геометричні ізомерні форми певної структури, поки не зазначена особлива стереохімія або ізомерна форма. В випадку, коли якась змінна зустрічається більш як один раз в будь-якій складовій або в будь-якій Формулі, її визначення в кожному випадку незалежне від визначення в кожному іншому випадку. Так, наприклад, якщо показано, що група повинна бути заміщена 0-3 R6, тоді означена група може необов'язково заміщатись аж до трьох R6, і R6 в кожному випадку обирається незалежно з визначеного списку можливих R6. Також, наводячи подібний приклад для групи -N(R5a)2, кожен з двох R5a заміщувачів азоту незалежно обирається із визначеного списку можливих R5a. Подібно тому, для групи -C(R7)2-, кожен з двох R7 заміщувачів вуглецю незалежно обирається із визначеного списку можливих R7. Коли зв'язок до заміщувача показано перетинаючим зв'язок між двома атомами кільця, такий заміщувач може бути приєднаний до будь-якого атому кільця. Коли заміщувач наведений без показу атому, через котрий заміщувач приєднаний до залишку сполуки Формули І, такий заміщувач може бути приєднаний через будь-який атом в такому заміщувачі. Наприклад, коли заміщувач є піперазиніл, піперидиніл або тетразоліл, поки не зазначено інакше, така піперазинільна, піперидинільна або тетразолільна група може бути приєднана до залишку сполуки Формули І через будь-який атом в такій піперазинільній, піперидинільній або тетразолільній групі. Комбінації заміщувачів і/або змінних дозволено тільки, якщо такі комбінації призводять до стабільних сполук. Під стабільною сполукою або стабільною структурою тут розуміється сполука, яка достатньо стійка, щоб витримати виділення до необхідного ступеня чистоти з реакційної суміші і перетворення в дієвий терапевтичний агент. Поняття "заміщений", як тут вживається, означає, що один або більше воднів у визначеного атому замінено зазначеною групою при умові, що не перевищено нормальну валентність такого атому, і що заміщення призводить до стабільної сполуки. Коли заміщувач є кетогрупа (тобто =O), тоді заміщуються два атома водню визначеного атому. Як тут вживається, "алкіл" включає як розгалужені так і з прямим ланцюгом заміщені аліфатичні вуглеводневі групи, що мають визначене число атомів вуглецю (наприклад, "С1-С10" визначає алкіл, що має від 1 до 10 вуглецевих атомів); "галогеналкіл" використовується для визначення як розгалужених так і з прямим ланцюгом заміщених аліфатичних вуглеводневих груп, маючих певну кількість, атомів вуглецю, заміщених одним чи більше галогенами (наприклад, -C vFw, де v=1 до 3 і w=1 до (2v+1)); "алкокси" репрезентує алкільну групу з зазначеною кількістю атомів вуглецю, приєднану через кисневий місток; "алкілтіо" репрезентує алкільну групу з зазначеною кількістю атомів вуглецю, приєднану через сірковий місток; "диалкіламіно" репрезентує атом азоту, заміщений двома алкільними групами з зазначеною кількістю вуглецевих атомів; "циклоалкіл" включає насичені кільцеві групи, в тому числі моно-, бі- або поліциклічні кільцеві системи, такі як циклопропіл, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил і адамантил; а "біциклоалкіл" включає насичені біциклічні кільцеві групи, такі як [3.3.0] біциклооктан, [4.3.0] біциклононан, [4.4.0] біциклодекан (декалін), [2.2.2] біциклооктан і т.д. "Алкеніл" вживається для зазначення вуглеводневих ланцюгів прямої або розгалуженої конфігурації з одним чи кількома ненасиченими зв'язками вуглець-вуглець, які можуть траплятись в будь-якому придатному місці вздовж ланцюга, такі як етиленіл (етеніл), пропеніл і т.п., а "алкініл" визначає вуглеводневі ланцюги, або прямої, або розгалуженої конфігурації з одним чи кількома потрійними зв'язками вуглець-вуглець, які можуть траплятись в будь-якому придатному місці вздовж ланцюга, такі як етиніл, пропініл і т.п. Поняття "алкілен", "алкенілен", "фенілен" і подібні посилаються на алкільні, алкенільні чи фенільні групи відповідно, які приєднані двома зв'язками до залишку структури Формули І. Такі "алкілен", "алкенілен", "фенілен" і подібні можуть мати тут альтернативне і еквівалентне позначення як "-(алкіл)-", "-(алкеніл)-", "-(феніл)-" і подібні. "Гало" чи "галоген" тут вживається для посилання на фтор-, хлор-, бром- і йод-; а "протиіон" використовується для позначення малої, негативно зарядженої частинки, такої як хлорид, бромід, гідроксид, ацетат, сульфат і т.п. Як використано тут, "арил" або "ароматичний залишок" означає феніл або нафтил; поняття "арилалкіл" репрезентує арильну групу, приєднану через алкільний місток. Як тут вживається, "карбоцикл" або "карбоциклічний залишок" означає будь-яке стабільне 3-7 членне моноциклічне чи біциклічне, або 7-14 членне біциклічне чи трициклічне вуглецеве кільце, будь-яке з них може бути насиченим, частково ненасиченим чи ароматичним. Приклади таких карбоциклів включають, але не обмежуються ними, циклопропіл, циклопентил, циклогексил, феніл, біфеніл, нафтил, інданіл, адамантил чи тетрагідронафтил (тетралін). Далі, як тут використовується, поняття " гетероцикл", або "гетероарил", або "гетероциклічний" означає стабільне 5-7 членне моноциклічне чи біциклічне, або 7-10 членне біциклічне гетероциклічне кільце, що може бути насиченим, частково ненасиченим, або ароматичним, і яке складається з вуглецевих атомів і 1-4 гетероатомів, що незалежно обираються з групи N, O і S, і відрізняється зо тим, що азотні й сірчані гетероатоми можуть бути окисленими, гетероциклічне кільце може включати будь-яку біциклічну групу, де певне вищеозначене гетероциклічне кільце приєднане до бензольного кільця. Гетероциклічне кільце може приєднуватись як підвіска до будь-якого гетероатома чи вуглецевого атома, щоб утворилася стабільна структура. Описані тут гетероциклічні кільця можуть заміщуватись вуглецем або азотом, якщо результуюча сполука стабільна. Приклади таких гетероциклів включають, але не обмежуються ними, піридил (піридиніл), пиримідиніл, фураніл (фурил), тіазоліл, тіеніл, пироліл, піразоліл, імідазоліл, тетразоліл, бензофураніл, бензотіофеніл, індоліл, хінолініл, ізохінолініл, бензімідазоліл, піперидиніл, піролідиніл, 2-піролініл, тетрагідрофураніл, тетрагідрохінолініл, тетрагідроізохінолініл, декагідрохінолініл, октагідроізохінолініл, піраніл, ізобензофураніл, 2Н-піроліл, ізотіазоліл, ізоксазоліл, оксазоліл, піразиніл, пірідазиніл, індолізиніл, ізоіндоліл, 3Н-індоліл, 1Н-індазоліл, піролідиніл, піролініл, імідазолідиніл, імідазолініл, піразолідиніл, пиразолініл, піперидиніл, пеперазиніл, індолініл, ізоіндолініл, морфолініл або оксазолідиніл. Сюди також включено приєднане кільце і спіро- сполуки, що містять, наприклад, зазначені гетероцикли. Як тут використовується, "фармацевтично придатні солі" відповідають похідним зазначених сполук, які відрізняються тим, що батьківська сполука Формули І модифікована перетворенням в кислу чи основну сіль сполуки Формули І. Приклади фармацевтично придатних солей включають, але не обмежуються ними, солі мінеральних чи органічних кислот та основного залишку, такого як амін; лужні чи органічні солі кислих залишків, таких як карбонові кислоти і таке інше. "Пролікарські засоби" розглядаються як будь-які ковалентно з'єднані носії, які вивільняють активну сполуку лікарського засобу у відповідності до Формули І in vivo, коли такі пролікарські засоби вводяться до організму ссавця. Пролікарські засоби сполук Формули І модифікацією функціональних груп, що присутні в сполуках, в такий спосіб, що модифікації роз'єднуються або при звичайних маніпуляціях, або in vivo до батьківських сполук. Пролікарські засоби включають сполуки Формули І і відрізняються тим, що до якоїсь групи приєднується гідроксил-, аміно-, сульфгідрильна чи карбоксильна група, так що при введенні до організму ссавця розділяються, утворюючи вільні гідроксил-, аміно-, сульфгідрильну чи карбоксильну групу відповідно. Приклади пролікарських засобів включають, але не обмежуються ними, ацетат, форміат та бензоатні похідні спиртових та амінних функціональних груп у сполуках Формули І і т.п. Фармацевтично придатні солі сполук Формули І включають звичайні нетоксичні солі або четвертинні амонійні солі сполук Формули І, що утворюються, наприклад з нетоксичних неорганічних та органічних кислот. Наприклад, такі звичайні нетоксичні солі включають похідні неорганічних кислот таких, як соляна, бромоводнева, сірчана, сульфамінова, фосфорна, азотна і т.п., і солі, виготовлені з органічних кислот, таких як оцтова, пропіонова, бурштинова, гліколева, стеаринова, молочна, малонова, винна, лимонна, аскорбінова, памелинова, малеїнова, гідроксималеїнова, фенілоцтова, глютамінова, бензойна, саліцилова, сульфанілова, 2-ацетобензойна, фумарова, толуолсульфонова, метансульфонова, етандисульфонова, щавлева, ізетіонова і т.п. Фармацевтично придатні солі даного винаходу можуть бути синтезовані із сполук Формули І, які містять основний чи кислий фрагмент за допомогою звичайних хімічних методів. Взагалі, солі готуються при реакції вільної основи чи кислоти із стехіометричною кількістю або з надлишком бажаної солеутворюючої неорганічної чи органічної кислоти чи основи в придатному розчиннику або різних комбінаціях розчинників. Фармацевтично придатні солі кислот Формули І з відповідною кількістю основи, такої як гідроксиди лужних або лужноземельних металів, а саме натрію, калію, літію, кальцію чи магнію, або органічні основи, такі як аміни, а саме дибензилетилендиамін, триметиламін, піперидин, піролідин, бензиламін і т.і., або четвертинні амонійні гідроксиди, такі як гідроксид тетраметиламонію та ін. Як обговорювалося вище, фармацевтично придатні солі сполук даного винаходу, можуть бути виготовлені при реакції вільної кислотної чи основної форми цих сполук із стехіометричною кількістю відповідної основи чи кислоти відповідно у воді чи органічному розчиннику, або в суміші двох, звичайно, неводних середовищ., таких як переважно ефір, етилацетат, етанол, ізопропанол чи ацетонітрил. Перелік придатних солей міститься у Remington’s Pharmaceutical Sciences, 17th ed., Mack Publishing Company, Easton, PA, 1985, p.1418, і тут включене посилання на це джерело. Синтез Сполуки даного винаходу можуть бути виготовлені кількома способами, які добре відомі обізнаному з органічним синтезом. Поряд з методами, відомими в галузі органічного синтезу, вони можуть бути синтезовані за допомогою методів, що описуються нижче, або комбінуючи ці методи. Бажані методи включають описані нижче, але не обмежуються ними. Тут і далі всі посилання наведені повністю. Новітні сполуки Формули І можна виготовити за допомогою реакцій і методів, описаних в цьому розділі. Реакції виконуються в розчинниках, що підходять до застосовуваних реагентів і матеріалів і придатних для того, щоб перетворення відбувались ефективно. Також, нижче в описах синтетичних методів слід зрозуміти, що всі умови синтезу, що пропонуються, включаючи вибір розчинника, реакційну атмосферу, температуру, тривалість експерименту та завершальні процедури обрані для того, щоб бути стандартними для даної реакції, яка легко, таким чином, сприймається обізнаному в органічному синтезі. Також зрозуміло, що функціональна група, будь-як присутня в молекулі речовини, що виділяється, повинна бути сумісна з реагентами та реакціями, що пропонуються. Не всі сполуки Формули І, що потрапляють до даного класу, можуть бути сумісні з певними умовами реакцій і потребують деяких нижче описаних підходів. Такі обмеження у заміщувачах, що сумісні з умовами реакцій, легко зрозумілі обізнаному в органічному синтезі, і в такий спосіб слід використовувати альтернативний підхід. Сполуки Формули І де R1 є заміщений арил, X є одиничний зв'язок (тобто X є відсутнім), R2 є 4метилсульфонілфеніл і R3, R4, R7 та R8 визначені вище, можуть бути виготовлені у відповідності з загальним методом, що його ілюструє Схема 1. Зв'язування придатно заміщеної фенілборної кислоти з орто-дибромбензолом відповідно методології, запропонованої Suzuki (A.Suzuki et al., J.Amer. Chem. Soc. 1989, 11, 513; V.N.Kalinin, Russ. Chem. Rev. 1991, 60, 173) дає суміш 2-бромбіфенілу А та 1,2-диарилбензолу. Придатні розчинники для цього зв'язування включають, але не обмежуються ними, толуол, диметиформамід, диоксан та етанол. Реакція виконується в присутності паладієвого каталізатора, наприклад тетракис-трифенілфосфін паладію або біс(трифенілфосфін)паладій дихлориду. Видалення продукту біс-зв'язування може бути досягнуто використовуючи стандартні хроматографічні методики, даючи бажаний біфенільний інтермедиат. Друге зв'язування за Suzuki цього 2-бромбіфенілу з 4-метилтіофенілборною кислотою за умов, описаних вище, дав 2-(4'-метилтіо)феніл-1-біфеніл. Окислення метилтіольної групи у відповідну метилсульфонільну групу дає сполуку Формули І. Це окислення може бути виконано з використанням будь-яким відомим реагентом для окислення меркаптанів у сульфони. Приклади таких реагентів включають, проте не обмежені ними, оксон у водно-метанольній суміші (Trost et al., Tet. Lett. 22(14), 1287, 1981), перекис водню, м-хлорпербензойну кислоту, монопероксифталеву кислоту, магнезіеву сіль. З іншого боку, сполуки Формули І, де R1 є заміщений арил, X є одиничний зв'язок, R2 є 4метилсульфонілфеніл можуть бути також з комерційно наявних 2-бромфенолів, як показано на Схемі 2. Зв'язування за Suzuki 2-бромфенолу з фенілборною кислотою може бути виконано в умовах, описаних вище, використовуючи вільний або ж придатно захищений фенол, або відповідний трифлат. Друге зв'язування за Suzuki між інтермедиатним трифлатом і 4-метилтіофенілборною кислотою з наступним окисленням, як описано раніше, дає сполуку Формули І. Сполуки Формули І де R2 є 4-метилсульфонілфеніл, X є одиничний зв'язок і R1 є циклоалкенільною або циклоалкідьною долею готуються з 2-бром-(4'-метилтіо)-біфенілів у ряд стадій, що обрисовано на Схемі 3. Необхідні вихідні матеріали біфенілів отримують зв'язуванням за Suzuki 1,2-дибромбензолу з 4метилтіофенілборною кислотою в умовах, описаних вище. Обробка 2-бром-(4'-метилтіо)-біфенілу сильною основою при низькій температурі з наступним додаванням придатного циклоалканону дає (1-гідроксициклоалкіл)-біфенільний інтермедиат. Придатні сильні основи, що можуть використовуватись в цій реакції включають н-бутил-літій, трет-бутил-літій або метил-літій. Реакція відбувається в апротонному розчиннику, такому як тетрагідрофуран, ефір, гексан чи 1,4-диоксан. Дегідратація отриманого третинного спирту може бути легко виконана обробкою каталітичною кількістю сильної кислоти, наприклад, п-толуолсульфонової, в придатному розчиннику, наприклад, толуолі. Окислення метилтіольної групи до метилсульфонільної, як описано вище, дає сполуку Формули І, що відрізняється тим, що R1 є циклоалкенілом. Каталітична гідрогенізація цих циклоалкенільних сполук з придатним каталізатором, наприклад, оксидом платини, у відповідному полярному розчиннику, наприклад, метанолі, дає сполуку Формули І, що відрізняється тим, що R1 є циклоалкіл. З іншого боку, циклоалкільні сполуки можуть бути отримані з алкогольного інтермедиату з початку окисленням метилтіольної групи до метилсульфону, з наступною прямою гідрогенізацією третинних спиртів з використанням тих самих умов гідрогенізації для відновлення олефіну, що описані вище. Сполуки Формули І, де X є кисень, R1 є заміщений або незаміщений феніл і R2 є 4-метилсульфонілфеніл можна виготовити з 2-гідрокси-(4'-метилтіо)-біфенілу як зазначено на Схемі 4. Обробка 2-гідрокси-і-(4'-метилсульфоніл)-біфенілу (приготовленого за Схемою синтезу 2) придатною основою, наприклад, гідридом натрію, з наступним додаванням 4-фтор-1-нітробензолу дає 2-(4'нітрофенокси)-біфенільний інтермедиат. Відновлення нітрогрупи (див. "Compendium of Organic Synthetic Methods", vol.1, p.266, 1971) дає сполуку Формули І, де R7 є -NH2. Деамінування можна досягнути з використанням методу Cadogan J.I.G. et al., (J.Chem. Soc. Perkin. Trans. I 541, 1973). З іншого боку, амін можна трансформувати в іншу функціональні групи через проміжну діазонієву соль з використанням загальновідомих в органічному синтезі методів. Застосовуючи цю технологію, легко можна отримати інші певним чином заміщені арильні ефіри Формули І. Сполуки Формули І, де R2 є 4-метилсульфоніл гетероарил, при каталізованому паладієм зв'язуванні за Suzuki 2-біфенілборної кислоти з відповідно заміщеним 4-метилтіогетероарил-бромідом або трифлатом (див. Схему 5). Окислення оксоном селективно призводить до бажаних метилсульфонільних сполук. Реагенти 2-метилтіо-5-бромпіридини на схемі 5 можуть бути отримані в одну стадію з комерційно наявних 2,5-дибромпіридинів, як проілюстровано на Схемі 6, обробкою солі лужного металу метилмеркаптану, наприклад, метилтіолату натрію, в полярному апротонному розчиннику, такому, як безводний диметилформамид. Інші вихідні матеріали бром- або гідрокси-метилтіо-гетероарилів, які можуть бути використані в зв'язуванні за Suzuki з 2-біфенілборною кислотою, можна легко отримати подібним чином з комерційно наявних вихідних матеріалів. Наприклад, 2-бром-5-метилтіопіридин можна отримати обробкою 2-метокси-5-бром-піридину (Shiao M.J. et al., Syn. Comm. 20(19), 2971, 1990) н-бутил-літіем в безводному тетрагідрофурані при -78°С з наступним погашенням реакції диметилдисульфідом, отримуючи при цьому 2-метокси-5-метилтіо-піридин. Деметилювання дає 2-гідрокси-5-метилтіо-піридин, котрий при реакції з фосфооксибромідом дає бажаний вихідний матеріал 2-бром-5-метилтіопіридину (Схема 7). Сполуки Формули І, де X є одиничний зв'язок і R1 є ароматичний гетероцикл можуть бути отримані при використанні відповідного бромгетероарилу замість бромбензолу при зв'язуванні за Suzuki, описаному на вищенаведених Схемах. Такі бромгетероарили включають, але не обмежуються ними, 2- чи 3-бромфуран, 2чи 3-бромтіофен, 3-бром-піридин, 2-бром-бензофуран (Васіоссhі E. et al., J.Perk. Trans. II, 1976, 266) і 5-бромбензотіофен (Worden et al., J.Het. Chem. 25, 1271, 1988). Сполуки Формули І, що відрізняються тим, що R8 є відмінним від Н, можуть бути отримані використовуючи відповідно заміщені 4-метилтіофеноли як вихідні матеріали. Ці феноли можна отримати з комерційно наявних вихідних матеріалів за методами, відомими в органічному синтезі. Один такий процес проілюстровано на Схемі 8, де 3-метил-4-метилтіоанізол селективно деметильовано, даючи відповідний фенол, котрий при обробці трифлатним ангідридом в присутності 2,6-лутидину в метиленхлориді (Gerlach U. et al., Tet. Lett. 33(38), 5499, 1992) дає трифлат, придатний для використання в вищезгаданих процедурах зв'язування в присутності паладію. Результуючий метилтіо-інтермедиат може бути перетворений в сполуку Формули І окисленням до відповідного сульфону як вже описано. Сполуки Формули І, де R3 є відмінним від водню, можна отримати з використанням відповідно заміщених комерційно наявних бромбензолів як вихідних матеріалів для зв'язування за Suzuki, як описано вище. Стандартне маніпулювання з функціональними групами результуючих сполук, добре відоме обізнаним в органічному синтезі, приведе до додаткових R3 заміщувачів, для яких комерційні вихідні матеріали не є наявними. Наступні Схеми слугують для того, щоб проілюструвати методи отримання сполук Формули І з великим різноманіттям R3 заміщувачів. Каталізоване паладієм зв'язування за Suzuki 3-нітро-4-бром-ацетофенону з фенілборною кислотою дає 3нітро-1-ацетобіфеніл. Відновлення нітрогрупи дихлоридом олова в соляній кислоті дає амін, що може бути перетворений в диазоній-фторборат обробкою ізоамілнітритом та ефіратом трифториду бору в метиленхлориді (Doyle M.P. et al., J.Org. Chem. 44, 1572, 1979). Диазонієва сіль може бути далі безпосередньо перетворена у трифлат обробкою трифтороцтовою кислотою (Yoneda N. et al., Chem. Lett. 1991, 459). Зв'язування трифлату з метилтіофеніл-борною кислотою, як описано вище з наступним окисленням надлишком МСРВА (м-хлорпербензойна кислота) дає сполуку Формули І, де R3 є ОН (Схема 9). Ця сполука може слугувати вихідним матеріалом для наступних сполук Формули І, як проілюстровано на Схемі 10. Перетворення гідроксильної групи у ефірну можна досягнути алкілюванням гідридом натрію та відповідним галоген-алкілом в безводному тетрагідрофурані. Гідроксильна група може бути також конвертована у трифлатну обробкою трифлатним ангідридом в присутності 2,6-лутидину з використанням як розчинника метиленхлориду. Утворений трифлат можна ввести у каталізоване паладієм зв'язування за Suzuki (Cacchi et al., Tet. Lett. 27(33), 3931, 1986; Kalinin V. Synthesis 413, 1992) або зв'язування за Stille (Stille J.K., J.Amer. Chem. Soc. 1988, 110,1557), отримав заміщені алкеніл-, кетота карбоксил- похідні. У додаток до перетворень, показаних на Схемі 10, застосовуючи методики, відомі в органічному синтезі, ефіри можна омилювати у карбонові кислоти, які, в свою чергу, можуть бути трансформовані в заміщені аміди, кетони чи гідроксамові похідні. Алкенові ефіри можна також відновити каталітичним гідруванням у насичені ефіри з паладієм на активованому вугіллі як каталізатором. Сполуки Формули І, де R3 є амінна функціональна група, можна отримати з проміжного 2-[4метилтіофеніл]-4-ацето-і-біфенілу, отриманого за Схемою 9, як показано на Схемі 12а. Перегрупування Бекмана (Donaruma L.G. et al., Organic Reactions, Vol.11, 1-156, 1960) кетону з наступним гідролізом утвореного аміду дає амін, який може бути далі перетворений в аміди, незаміщені аміни або заміщені аміди за процедурами, відомими в органічному синтезі. Окислення метилтіольної групи, як описано вище, дає сполуки Формули І. З іншого боку, сполуки, де R3 є амінна функціональна група, можна також отримати з карбонових кислот через перегрупування Куртіуса /"Curtius rearrangement"/ (Banthorpe D.V. /"The Chemistry of the Azido Group", Ed. by Palai S., Interscience, New York, 1971, pp.397-405), як показано на Схемі 12b. Сполуки Формули І, де R3 та R4 обидва інші, ніж водень, можна отримати за допомогою відомих методів. Один такий шлях зображено на Схемі 13. Перетворення 3-(4'-метилтіо)-фенил-1-гідрокси-4-біфенілу (отриманого як описано на Схемі 12) у N,Nдиметил-карбаматекан можна досягнути за допомогою реакції з гідридом натрію та N,N-диметил-карбамоїлхлоридом у безводному тетрагідрофурані. Безпосереднє ортометалювання (Snieckus V. Chemical Reviews, 1990, 879) з використанням втор-бутил-літію в безводному тетрагідрофурані з наступною нейтралізацією утвореного аніону відповідним електрофілом (наприклад, метилйодидом) дає інтермедиат, який можна перетворити в різноманітні сполуки Формули І з використанням методів, як описано вище, або відомих в органічному синтезі. Сполуки Формули І, де один або кілька з J, К або L є азотом, можуть бути отримані заміщенням відповідного гетероциклу з функціональними групами бром- чи дибромбензолами за вищенаведенеми Схемами. Наприклад, для випадку, коли J є азот, синтез сполуки Формули І ілюструє Схема 14. Каталізоване паладієм зв'язування за Suzuki 2-бром-3-гідрокси-піридину з відповідно заміщеною фенілборною кислотою дає 2-феніл-3-гідрокеи-піридин. Перетворення гідроксильної групи у трифлатну в умовах, описаних вище, з наступним каталізованим паладієм зв'язуванням за Suzuki у безводному середовищі з 4-метилтіофеніл- борною кислотою дає 2,3-диарил-піридин. Розчинник, що придатний для цього процесу є безводний 1,4-диоксан. Селективне окислення метилтіольної групи може бути виконано обробкою оксоном з утворенням сполук Формули І, де J є N. Сполуки Формули І, де X є одиничний зв'язок і R1 є 1-піперидиніл або 1-піроліл можуть бути отримані з 2броманіліну, як зображено на Схемі 15. Зв'язування за Suzuki 2-броманіліну з 4-тіометилфенілборною кислотою за методом, описаним вище, з наступною конденсацією утвореного 2-(4-метилтіофеніл)-аніліну з дибромпентаном в присутності амінної основи, такої, як триетиламін, дає відповідний 1-[2-(4-метилтіофеніл)феніл]-піперидин. Окислення метилтіо- групи до метилсульфонільної з використанням методів, описаних вище, дає сполуки Формули І, де R1 є 1-піперидиніл. З іншого боку, вихідний 2-броманілін може бути, перетворений у 1-[(2-бромфеніл)-феніл]-пірол обробкою 2,5-диметокситетрагідрофураном у крижаній оцтовій кислоті. Зв'язування за Suzuki утвореного інтермедиату з 4-метилтіометилфенілборною кислотою, з наступним окисленням, як описано вище, дає 1-[2-(4-метилсульфонілфеніл)-феніл] -пірол. Схема 15. Сполуки даного винаходу та їх приготування можуть бути більш детально зрозумілі при розгляді наступних процедур та прикладів, котрі саме є прикладами, а не обмеженням даного винаходу. Приклади Всі точки плавлення нескоректовані. Всі реакції проводилися в атмосфері азоту, якщо не зазначено інше. Всі комерційні хімікати використовувалися в тому вигляді, в якому вони були отримані. Хроматографічні розділення проводилися із застосуванням сілікагелю 15 60 від Merck (230-400меш). Хроматографічні елюенти наводяться в відношеннях за об'ємом. Органічні фази при двофазній рідинній екстракції звичайно висушували сульфатом магнію, якщо не зазначено інакше. Звичайно розчинники видалялись упарюванням під зменшеним тиском на роторному випарювачі, якщо не зазначено інакше. Положення піків у 1H ЯМР спектрах повідомляються вираженими у частках на мільйон (зсув d вбік слабших полів відносно внутрішнього стандарту тетраметилсилану). Скорочення у 1Н ЯМР спектрах наступні: s-синглет, d-дублет, m-мультиплет, dd-дублет дублетів. Мас-спектри отримували з використанням хімічної іонізації аміаком як газом-реагентом. Мікроаналізи виконувались Quantitative Technologies Inc., Bound Book, N.J. Приклад 1 2-[(4-метилтіо)феніл]-1-біфеніл (метод 1) A. 4-метилтіофенілборна кислота: До магнієвих стружок (4.3г, 180ммоль), охолоджених до 0°С повільно додавали 1М розчин борано-тетрагідрофуранового комплексу (600мл, 600ммоль). До утвореної суміші по краплях додавали суспензію 4-бромтіоанізолу (30г, 148ммоль) у тетрагідрофурані (75мл). Додавали кілька кристалів йоду, і суміші дозволили нагрітися до кімнатної температури і розмішували 72год. Далі суміш обережно вилили на 500г подрібненого льоду. Розчин закислили (рН 3) 1н. соляною кислотою і залишили на ніч. Кислий розчин екстрагували диетиловим ефіром, а ефірні витяжки екстрагували 1н. гидроксидом натрію. Шар розчину гідроксиду натрію підкислили і тоді екстрагували диетиловим ефіром. Випарювання розчинника дало безбарвні кристали, що їх перекристалізували з етилацетату з малою кількістю води. Отримали 12.5г 4метилтіофенілборної кислоти; 1H ЯМР (ДМСО) d 7.73 (d, J=8.42 Гц, 2Н), 7.21 (d, J=8.42 Гц, 2Н), 2.47 (s, 3Н); мас-спектр (хемоіонізація, СН4) m/z 195 (М+Н+), ефір етиленгіколю). B. 2-бром-1-(4'-метилтіофеніл)-бензол: Суміш 4-метилтіофенілборної кислоти (31.1г, 185ммоль) і броміду тетрабутиламонію (1г, 3.10ммоль) в етанолі (125мл) і толуолі (250мл) була дегазована барботуванням азоту крізь суміш протягом 15хв. 2М розчин карбонату натрію (148мл, 296ммоль) був дегазований і доданий до суміші. Тетракіс-(трифенілфосфін)-паладій (0.35г, 0.303ммоль) додали до суміші і кип'ятили з оберненим холодильником 24год. Охолодили до кімнатної температури і відфільтрували для видалення твердих частинок. Фільтрат сконцентрували і розвели водою і етилацетатом. Водний шар екстрагували етилацетатом. Органічні фази об'єднали і промили ропою (концентрованим соляним розчином). Висушували сульфатом натрію. Етилацетатний розчин сконцентрували з утворенням осаду. Додатково осад утворився, коли додали диетиловий ефір (200мл). Осад видалили фільтрацією, і фільтрат сконцентрували з утворенням сирого масла. Очищення хроматографією на колонці з використанням як елюенту гексану дало бажаний продукт (25.75г, 62%), що з часом затвердів, t°пл. 33-35°С; 1Н ЯМР (CDCl3) d 7.66 (d, J=8.05 Гц, 1Н), 7.36-7.28 (m, 6H), 7.21 (m, 1H), 2.52 (s, 3H); мас-спектр m/z 279.1, 281.1 (M+H+); Аналіз на С13Н11ВrS: розраховано С:55.92%, Н:3.97%, Вr:28.62%; визначено С:56.24%, Н:4.04%, Br:28.96% С. 2-бром-1-(4-метилсульфонілфеніл)-бензол: Сполука Прикладу 1, частина В (5.2г, 18.7ммоль) була розчинена в дихлорметані (100мл) і охолоджена до 0°С. 3-хлорпербензойна кислота (8.9г, 41.2ммоль) була додана. Суміш перемішували при кімнатній температурі 18год. Розвели дихлорметаном і послідовно промивали бікарбонатом натрію, розведеним бісульфітом натрію та висушували сульфатом натрію. Фільтрували та концентрували. Очищення хроматографією на колонці силікагелю з використанням як елюенту гексан/етилацетат 7:1 дало безбарвні кристали, котрі перекристалізовували (дихлорметан/гексан) у чистий продукт (4.02г, 69%), t°пл. 155-157°С; 1Н ЯМР (CDCl3) d 8.02 (d, J=8.42 Гц, 2Н), 7.71 (d, J=6.96 Гц, 1Н), 7.63 (d, J=8.42 Гц, 2H) , 7.43 (m, 1H), 7.32 (m, 2H), 3.13 (s, 3H); lЧ-спектр (KBr) 1306, 1142 cм-1; Аналіз на C13H11BrO2S: розраховано С: 50.17%, Н:3.56%, S:10.30%; визначено С: 50.09%, Н:3.41%, S:10.52% D. 2-[(4-метилтіо)-феніл]-1-біфеніл: 2-бром-1-(4'-метилсульфоніл-феніл)-бензол (4г, 12.8ммоль), феніл борна кислота (1.72г, 14ммоль) та бромід тетрабутиламонію (0.21г, 0.65ммоль) розчинили в толуолі (70мл) і етанолі (35мл) і дегазовані барботуванням азоту крізь суміш протягом 15хв. Дегазований 2М карбонат натрію (14мл, 28ммоль) та тетракіс-(трифенілфосфін)-паладій (0.074г, 0.064ммоль) було додано, і суміш кип'ятили з оберненим холодильником 4год. Сконцентрували і розвели водою і етилацетатом. Шари розділили, і водний екстрагували етилацетатом. Об'єднані органічні шари промили ропою, висушили, відфільтрували і сконцентрували. Очищення хроматографією на колонці силікагелю з використанням як елюенту гексан/етилацетат 3:1 та перекристалізація (дихлометан/гексан) дали 2.55г (65%) сполуки в вигляді безбарвних кристалів, t°пл. 136138°С; 1H ЯМР (CDCl3) d 7.79 (d, J=8.42 Гц, 2Н), 7.47 (m, 3Н), 7.42 (m, 1Н), 7.34 (d, J=8.7 Гц, 2Н), 7.23 (m, 3Н), 7.11 (m, 2H), 3.04 (s, 3Н); мас-спектр (хемоіонізація, СН4) m/z 309 (М+Н+), 337 (М+С2Н5+); Аналіз на C19H16O2S: розраховано С: 74. 00%, Н:5.23%, S: 10.40%; визначено С: 74.01%, Н:5.13%, S:10.63% Приклад 1а 2-1(4'-метилтіо)феніл]-1-біфеніл (метод 2) А. 2феніл-1-фенокситрифторметан-сульфонат: Суміш 2-фенілфенолу (5г, 29.4ммоль), N,Nдиметиламінопіридину (0.61г, 4.99ммоль) і 2,6-лутидину (4.1мл, 35.0ммоль) у дихлорметані (180мл) було охолоджено до -30°С. Додали трифторметансульфоновий ангідрид (5.90мл, 35.0ммоль) і охолоджуючу баню прибрали. Після 1год. при кімнатній температурі суміш промивали 0.5н. НCl, водою, насиченим розчином бікарбонату натрію, ропою. Суміш висушували, фільтрували і концентрували, отримав бажаний трифлат (8.80г, 99%) в вигляді жовтого масла; 1Н ЯМР (CDCl3) d 7.35-7.50 (m, 9Н); мас-спектр (хемоіонізація, СН4) m/z 303 (М+Н+), 331 (М+С2Н4); B. 2-[(4'-метилтіо)феніл]-1-біфеніл: 2-феніл-1-фенокситрифторметан сульфонат (13.75г, 45.5ммоль), 4метилтіо-бензол-борна кислота (8.4г, 50.0ммоль) та триосновний фосфат калію (12.6г, 59.0ммоль) були суспендовані в 1,4-диоксані і дегазовані барботуванням азоту крізь суміш протягом 30хв. Тетракіс(трифенілфосфін)-паладій (1.30г, 1.14ммоль) було додано до суміші з наступним кип'ятінням з оберненим холодильником 24год. Суміш охолодили, відфільтрували та сконцентрували. Залишок розчинили в етилацетаті, промили водою, рjпою та висушили. Очищення хроматографією на колонці силікагелю з використанням як елюенту гексану та перекристалізація (етанол) дали бажаний продукт (4.27г) в вигляді білих кристалів, t°пл. 42-44°С. Концентрація маточного розчину дала додатково 4.98г продукту; 1Н ЯМР (CDCl3) d 7.41 (s, 4Н), 7.23 (m, 3Н), 7.16 (m, 2H), 7.13-7.04 (m, 4Н), 2.45 (s, 3Н); мас-спектр m/z 277.1 (М+Н+), 294.1 (M+NH4+); Аналіз на C19H16S: розраховано С:82.56%, Н:5.84%, S:11.60%; визначено С:82.39%, Н:5.77%, S:11.60% C. 2-[(4'-метилтiо)феніл]-1-біфеніл: 4'-метилтіофеніл-2-фенілбензол (2.0г, 7.30ммоль) було розчинено в дихлорметані (60мл) і охолоджено до 0°С. Додано 3-хлорпербензойну кислоту (3.40г, 15.9ммоль), і суміш перемішували 3год. Суміш промивали бікарбонатом натрію, бісульфатом натрію, ропою і висушували. Очищення хроматографією на колонці силікагелю з використанням як елюенту гексан/етилацетат 4:1 та перекристалізація (дихлометан/гексан) дали продукт в кількості 0.64г (28.6%) в кристалічному стані, t°пл. 135137°С; 1Н ЯМР (CDCl3) d 7.79 (d, J=8.42 Гц, 2Н), 7.47 (m, 3Н) , 7.42 (m, 1Н), 7.34 (d, J-8.7 Гц, 2Н), 7.23 (m, 3Н), 7.11 (m, 2Н), 3.04 (s, 3Н); мас-спектр m/z 309 (М+Н+), 326 (M+NH4+); ІЧ-спектр (КВr) 1312, 1154, 760 см-1; Аналіз на C19H16O2S: розраховано С: 74.00%, Н:5.23%, S:10.40%; визначено С:74.07%, Н:5.17%, S:10.37%. Приклад 109 1-циклогексен-2-(4' -метилсульфонілфеніл]-бензол A. 2-(4'-метилтіофеніл)-1-(1-гідрокси-1-циклогексил)-бензол: 2-бром-(4'-метилтіо-феніл)-бензол (3.02г, 10.8ммоль) був розчинений в тетрагідрофурані (35мл), охолоджений до -78°С, і до нього повільно було додано н-бутил-літій (4.5мл, 11.3ммоль). Блідо-жовта суміш перемішувалась при -78°С протягом 2год. з наступним додаванням циклогексанону (1.3мл, 12.9ммоль). Суміш перемішували 18год. і дозволили нагрітися до кімнатної температури. Суміш розвели водою та етилацетатом. Водний шар екстрагували етилацетатом, і об'єднані органічні шари висушували, фільтрували та концентрували. Очищення хроматографією на колонці силікагелю з використанням як елюенту гексан/етилацетат 6:1 дало бажаний продукт (2.51г, 77%) в вигляді прозорого масла; 1Н ЯМР (CDCІ 3) d 7.58 (d, 1Н), 7.36 (m, 2H), 7.27 (m, 4H), 7.04 (dd, 1H), 2.53 (s, 3H), 2.34 (t, 1H), 1.83-1.10 (m, 10H); мас-спектр (високе розрішення, EI/DEP) розраховано М+ 298.139137; визначено М+ 298.138665. В. 1-циклогексен-2-(4'-метилтіофеніл]-бензол: Сполука, приклад 109, частина А (2.17г, 7.27ммоль) була розчинена в толуолі (30мл) і туди ж була додана каталітична кількість п-толуолсульфокислоти (0.05г). Суміш нагрівали з оберненим холодильником. Після 4 год. суміш охолоджували, промивали бікарбонатом натрію, висушували, фільтрували і концентрували. Очищення хроматографією на колонці силікагелю з використанням як елюенту гексан/етилацетат 4:1 та перекристалізація (метанол) дали циклоалкен (1.29г, 65%) в вигляді білих кристалів, t°пл. 71-73°С. Концентрація маточного розчину дала додатково 0.15г продукту; 1Н ЯМР (CDCІ 3) d 7.37 (d, J=8.42 Гц, 2Н), 7.27 (m, 6H), 5.67 (m, 1H), 2.52 (s, 3H), 2.09 (m, 2H) , 1.83 (m, 2H), 1.53 (га, 4Н) ; Аналіз на C19H20S: розраховано С;81.38%, Н:7.19%, S: 11.43%; визначено С: 81.17%, Н: 7.16%, S: 11.53%. С. 1-циклогексен-2-(4'-метилсульфонілфеніл]-бензол: Сполука, приклад 109, частина В (1.35г, 4.80ммоль) була суспендована в метанолі (125мл), охолоджена до 0°С, і туди ж було додано (8.30г, 13.0ммоль) оксону /Охоnе™/ в воді (50мл). Концентрованій суспензії дозволили нагрітись до кімнатної . температури з наступним перемішуванням 18год. Суміш розвели водою (200мл) і зібрали білу кристалічну тверду речовину. Продукт трохи промили водою, слабким розчином бісульфіту натрію, знову водою. Продукт висушували в вакуумі. Очищення хроматографією на колонці силікагелю з використанням як елюенту гексан/етилацетат 4:1 та перекристалізація (метанолі дали бажану речовину (0.524г, 35%) в вигляді безбарвних кристалів, t°пл. 126128°C. Концентрація маточного розчину дала додатково 0.278г продукту; 1 Н ЯМР (CDCІ 3) d 7.95 (d, 5 J=8.42 Гц, 2Н), 7.63 (d, J=8.42 Гц, 2Н), 7.36-7.25 (m, 4H), 5.63 (m, 1H), 3.10 (s, 3H), 2.06 (m, 2Н), 1.84 (m, 2H), 1.51-1.45 (m, 4Н); Аналіз на C19H20O2S: розраховано С: 73.04%, Н:6.45%, S:10.26%; визначено С:73.22%, Н:6.47%, 3:10.46%. Приклад 130 3-(4'-метилсульфонілфеніл)-4-фенілфенол A. 3-нітро-4-фенілацетофенол: Суміш 4-бром-3-нітроацетофенон (2.0г, 8.19ммоль), фенілборна кислота (1.2г, 9.83ммоль), бромід тетрабутиламонію (0.13г, 0.41ммоль) у 2М розчині карбонату натрію (35мл), етанол (20мл), толуол (65мл) були дегазовані барботуванням азоту крізь суміш протягом 30хв. Розчин кип'ятили з оберненим холодильником протягом 4год. Суміш охолодили і шари розділили. Водний шар екстрагували етилацетатом та об'єднані органічні витяжки висушували, фільтрували і концентрували. Очищення хроматографією на колонці силікагелю з використанням як елюенту гексан/етилацетат 4:1 дало бажаний продукт (1.98г, 89%) в вигляді жовтого порошку; 1 Н ЯМР (CDCІ 3) d 8.39 (d, 1Н), 8.16 (dd, 1H), 7.57 (d, 1H), 7.43 (m, 3H), 7.32 (dd, 2H), 2.69 (s, 3H) ; мас-спектр m/z 242.1 (M+H+). В. 3-аміно-4-фенілацетофенон: Суміш продукту прикладу 130, частина А (2.0г, 8.29ммоль), хлориду олова (8.23г, 36.48ммоль), етанол (30мл) та концентрована соляна кислота (7мл) кип'ятили з оберненим холодильником протягом 2.5год. Далі суміш охолоджували до 0°С і залуговували до рН10 6М NaOH, екстрагували етилацетатом. Екстракт висушували, фільтрували крізь силікагель, концентрували. Далі знов фільтрували крізь силікагель з використанням хлороформу як елюента. Розчинник концентрували, отримав амін (1.20г, 69%') в вигляді жовтого порошку; 1 Н ЯМР (CDCІ 3) d 7.47 (d, 1Н), 7.46 (s, 3Н), 7.38 (dd, 2H), 7.36 (d, 1H), 7.20 (d, 1H), 3.90 (s, 2H), 2.60 (s, 3Н); мас-спектр m/z 212.1 (M+H+). C. 5-ацето-2-фенілбензол диазонія тетрафторборат: Сполука прикладу 130, частина В (0.50г, 2.36ммоль) була розчинена в дихлорметані (3мл), і розчин повільно додавали до ефірату трифтористого бору в дихлорметані (10мл) при -15°С. Потім додали розчин ізоамілнітриту (0.35 г, 2.60 ммоль) в дихлорметані (3мл). Крижану баню зняли, при цьому утворився коричневий осад. Додали 20мл пентану, і суміш знов охолодили до -15°С на 20хв. Фільтрація дала сіль диазонія (0.76г) в вигляді світло-коричневого порошку; 1 Н ЯМР (CDCІ 3) d 9.55 (d, 1Н), 8.71 (dd, 1H), 7.90 (d, 1H), 7.69 (s, 5H), 2.79 (s, 3H). D. 5-ацето-2-фенілбензол трифторметансульфонат: 5-ацето-2-фенілбензол-диазоній тетрафторборат (1.46г, 4.79ммоль) повільно додавали до трифторметансульфокислоти (10мл) при -15°С. Далі суміш нагріли до 50°С за 20хв., і вилили на кригу (25г). Водний шар екстрагували етилацетатом, висушували, фільтрували і концентрували. Очищення хроматографією на колонці силікагелю з використанням як елюенту гексан/етилацетат 4:1 дало трифлат (0.428г, 77%) в вигляді коричневого сиропу; 1 Н ЯМР (CDCІ 3) d 8.04 (dd, 1Н), 7.96 (d, 1H), 7.62 (d, 1H), 7.48 (s, 5H), 2.67 (s, 3Н); мас-спектр m/z 345 (M+H+). E. 3-(4'-метилтіофеніл)-4-ффенілацетофенон: Суміш сполуки прикладу 130, частина D (1.22г, 3.54ммоль), 4-метилтіофеніл борної кислоти (0.71г, 4.25ммоль), триосновного фосфату калію (1.13г, 5.32ммоль) у 1,4диоксані була дегазована барботуванням азоту крізь суміш протягом 15хв. Тетракіс-(трифенілфосфін)-паладій (0.10г, 0.089ммоль) було додано, і суміш нагрівали з оберненим холодильником упродовж 18год. Охолоджували, фільтрували і концентрували. Очищення хроматографією на колонці силікагелю з використанням як елюенту гексан/етилацетат 4:1 дало бажаний продукт (1.02г, 90%) в вигляді коричневого сиропу; 1Н ЯМР (CDCІ 3) 5 7.99 (d, 2Н), 7.53 (d, 1Н), 7.48 (s, 2H) , 7.27 (d,s, 2H), 7.17 (dd, 2H), 7.14 (q, 3H) ; масспектр ra/z 319 (M+H+). F. 3-(4'-метилсульфонілфеніл)-4-фенілфенол: До продукту-прикладу 130, частина Е (0.30г, 0.942ммоль) було додано пероцтову кислоту (10мл), а згодом концентровану сірчану кислоту (0.25мл). Перемішували при кімнатній температурі протягом 48год. Потім суміш вилили у лід з 20% розчином бісульфіту натрію (10мл). Водну фазу екстрагували етилацетатом, і органічні витяжки висушували, фільтрували та концентрували. Очищення хроматографією на колонці силікагелю з використанням як елюенту гексан/етилацетат 2:1 дало продукт (0.064г, 21%) в вигляді білого порошку; 1Н ЯМР (CDCІ 3) d 7.79 (d, 2Н), 7.35 (d, 1Н), 7.34 (d, 2H), 7.21 (d, 1H), 7.19 (d, 2H), 7.06 (m, 2H), 6.97 (dd, 1H), 6.90 (d, 1H), 4.96 (s, 1H), 3.05 (s, 3H); мас-спектр (високе розрішення) розраховано 342.1; визначено (M+NH4+) 342.116391. Приклад 151 1-[2-(4-метилсульфонілфеніл)феніл]піперидин А. 2-[(4-метилтіо)феніл]анілін: Суміш 2-броманіліну (2.0г, 11.62ммоль), 4-метилтіофеніл борної кислоти (2.3г, 13.69ммоль), тетрабутил-амонію броміду (0.19г, 0.58ммоль) і 2М карбонату натрію (12мл) у 85мл 2:1 толуол/етанол було дегазовано барботуванням азоту крізь суміш протягом 10хв. Було додано тетракіс(трифенілфосфін)-паладій (54мг, 0.047ммоль), і суміш нагрівали з оберненим холодильником упродовж 5год. Охолодили, сконцентрували і розвели етилацетатом та водою. Водний шар знову екстрагували етилацетатом, та об'єднані органічні шари висушували (MgSO4), фільтрували та концентрували. Сирий продукт хроматографували (гексан/етилацетат), при цьому отримали тверду речовину, (1.4г, 56%); t°пл. 70-72°С; ЯМР (CDCІ 3) d 7.41 (m, 4H), 7Л8-7.09 (m, 2Н), 6.85-6.75 (m, 2Н), 3.75 (brd.m, 2Н), 2.53 (s, 3Н); мас-спектр (хем.іон. NH3) m/z 215.9 (М+Н+, 100%). В. 1-[2-(4-метилтіофеніл)феніл]піперидин: До суміші продукту частини А (0.3г, 1.39ммоль), етанолу (10мл) та триетиламіну (0.39мл, 2.77ммоль) додали 1,5-дибромпентану (0.29мл, 2.08ммоль). Суміш нагрівали з оберненим холодильником протягом 48год., концентрували та хроматографували (гексан), отримав рожеве масло (0.47г, 37%). ЯМР (CDCl3) d 7.73 (d, 2Н), 7.39 (d, 2H), 7.36-7.30 (m, 2H), 7.15-7.10 (m, 2H), 2.87-2.85 (m, 4Н), 2.62 (s, 3Н), 1.55 (s, 6Н); мас-спектр (хем.іон. NH3 ) m/z 284.2 (М+Н+, 100%). C. 1-[2-(4-метилсульфоніл)феніл]піперидин: До сполуки прикладу 195, частина С (0.145г, 0.512ммоль) у метанолі (15мл), охолодженого до 0°С, додали Охоnе™ (0.79г, 1.28ммоль). Реакційну суміш перемішували при кімнатній температурі впродовж ночі, а згодом розвели метиленхлоридом та екстрагували. Об'єднані органічні шари промили бікарбонатом натрію, бісульфітом натрію, радою та висушили (MgSO4). Сирий продукт хроматографували (генсан/етилацетат) та перекристалізовували (метиленхлорид/гексан). Отримали тверду речовину (50мг, 31%); t°пл. 140-140.5°С; 1H ЯМР (CDCІ 3) d 7.97-7.85 (dd, 4Н), 7.36 (t, 1Н), 7.23-7.20 (dd, 1H), 7.10-7.05 (m, 2H), 3.10 (s, 3H), 2.75 (m, 4H), 1.43 (m, 6H); мас-спектр (високе розрішення) розраховано для C18H21NSO2 316.137126; визначено 316.136504. Приклад 153 1-[2-(4-метилсульфонілфеніл)феніл]пірол А. 1-(2-бромфеніл)пірол: Суміш 2-броманіліну (1.72г, 10ммоль), 2,5-диметокситетрагідрофурану (1.32г, 10ммоль) і крижаної оцтової кислоти (4.5мл) перемішували з оберненим холодильником протягом 2год. в атмосфері азоту. Дали охолонути до кімнатної температури. Розчинник видалили під зменшеним тиском, а залишок очищали колоночною флеш-хроматографією (9:1, гексан/етилацетат), отримав бажаний пірол (1.85г, 8.33ммоль, 83.3%) в вигляді прозорої рідини; 1Н ЯМР (CDCІ 3) d 7.70-6.35 (m, 8Н) ; ІЧ-спектр (КВr) 3102, 1588 см-1; мас-спектр m/z 221. 9 (М+Н+). В. 1-[(2-(4метилтіофеніл)феніл]пірол: Суміш 1-(2-бромфеніл)-піролу (0.666г, 3.0ммоль), 4метилтіофенілборної кислоти (0.554г, 1.1екв.), 2М розчину карбонату натрію (6мл) та толуолу (30мл) перемішували при кімнатній температурі в атмосфері азоту, барботуючи протягом 20хв. До суміші додавали тетракіс-(трифенілфосфін)-паладій (100мг, каталітичний), перемішували з оберненим холодильником протягом 4год. Охолоджували до кімнатної температури та вилили у 100мл води. Екстрагували три рази по 100мл етилацетату, об'єднані органічні шари висушували безводним сульфатом магнію, фільтрували. Розчинник видалили під зменшеним тиском. Залишок очищали колоночною флеш-хроматографією (29:1, гексан/етилацетат), отримав продукт зв'язування в вигляді масла (0.74г, 2.79ммоль, 92,3%). 1Н ЯМР (CDCІ 3) d 7.44-6.16 (m, 12Н), 2.46 (s, 3Н); ІЧ-спектр (чиста речовина) 2918, 1596 см-1; мас-спектр m/z 266.0 (М+Н+). C. 1-[2-(4-метилсульфонілфеніл)феніл]пірол: Суміш 1-(2-(4-метилтіофеніл)-феніл)-піролу (0.74г, 2.788ммоль) та метиленхлориду (35мл) перемішували і охолоджували у бані з льодом та сіллю в атмосфері азоту. Додали однією порцією 3-хлор-пероксибензойну кислоту (50-60%, 1.924г, >2екв.). Розчинові дали нагрітися до кімнатної температури та перемішували впродовж ночі. Суміш вилили у насичений розчин бісульфіту натрію і екстрагували трьома порціями (по 50мл) метиленхлориду. Об'єднані органічні шари промивали насиченим розчином бікарбонату натрію, висушували безводним сульфатом магнію, фільтрували і розчинник видаляли під зменшеним тиском. Залишок очищали колоночною флеш-хроматографією (2:1, гексан/етилацетат), отримали продукт в вигляді білуватого порошку (0.16г, 0.538ммоль, 19.2%); 1Н ЯМР (CDCІ 3) d 7.88-6.15 (m, 12Н), 3.06 (s, 3Н); ІЧ-спектр (КВr) 2922, 1602см-1,' мас-спектр m/z ,298.0 (М+Н+). Приклад 201 1-фенокси-2-(4-метилсульфонілфеніл) бензол A. 2-(4'-метилтіофеніл)фенoл: Суміш 2-бромфенолу (3.0г, 17.0ммоль), 4-метилтіо-бензол-борної кислоти (3.5г, 20.8ммоль) та броміду тетрабутиламонію (0.28г, 0.867ммоль) у толуолі (100мл), етанолі (25мл) та 2М розчин карбонату натрію (50мл) було дегазовано барботуванням азоту протягом 30хв. Додавали тетракіс(трифенілфосфін)паладій (0.06г, 0.052ммоль), нагрівали з оберненим холодильником протягом 2.5год. Охолоджували до кімнатної температури і розділяли фази. Водний шар екстрагували етилацетатом, об'єднані органічні шари висушували безводним, фільтрували і концентрували. Очищення хроматографією на силікагелі з застосуванням як елюенту суміші гексан/етилацетат (4:1) дало продукт зв'язування в вигляді жовтого порошку (3.03г, 81%); 1Н ЯМР (CDCl3) d 7.42 (m, 4H), 7.25 (m, 2Н), 7.01 (t, 4Н), 5.13 (s, 1H), 2.57 (s, 3Н); масспектр m/z 217 (М+Н+). В. 2-(4''-нітрофенокси)-1-(4'-метилтіофеніл)бензол: 2-(4'-метилтіофеніл)-фенол (0.4г, 1.9ммоль) та 1-фтор4-нітробензол (0.27г, 1.94ммоль) розчинили у диметилформаміді (2мл) та охолодили до 0°С. Було додано гідрид натрію (диспергований в олії, 80%, 0.063г, 2.1ммоль). Суміші дозволили нагрітись до кімнатної температури, та перемішували 18год. Розвели етилацетатом та водою. Водний шар екстрагували етилацетатом. Об'єднані органічні шари промивали ропою, висушували, фільтрували та концентрували. Очищення хроматографією на силікагелі з застосуванням як елюенту суміші гексан/етилацетат (6:1) та перекристалізація (дихлорметан/гексан) дали продукт в вигляді жовтих кристалів (0.59г, 96%); t°пл. 70-72°С; 1 Н ЯМР (CDCІ 3) d 8.11 (d, J=9.15 Гц, 2Н), 7.51 (dd, 1Н), 7.41-7.36 (m, 4H), 7.20 (d, J=8.42 Гц, 2H), 7.14 (dd, 1Н), 6.88 (d, J=9.15 Гц, 2H), 2.46 (s, 3H); ІЧ-спектр (KBr) 1514, 1342 cм-1; Аналіз на C19H15NO3S: розраховано С: 67. 64%, Н:4.48%, N:4.15%; визначено С: 67. 60%, Н: 4.-39%, S:4.09%. С. 2-фенокси-1-(4'-метилтіофеніл)бензол: Суміш сполуки прикладу 201, частини В (0.18г, 0.53ммоль), залізного порошку (0.1г, 1.8ммоль), крижаної оцтової кислоти (0.3мл, 5ммоль) та етанолу (10мл) нагрівали з оберненим холодильником протягом 4год. Охолодили, профільтрували та сконцентрували в вакуумі. До сирого аміну додали тетрагідрофуран (11мл), і суміш нагріли. Додали ізоамілнітрит (0.143мл, 1.06ммоль). Нагрівали з оберненим холодильником 4год. Концентрували та хроматографували на силікагелі з елюентом гексан/дихлорметан, отримав бажаний продукт (0.096г, 61%) в вигляді жовтого масла; 1Н ЯМР (CDCІ 3) d 7.49 (d, J=8.42 Гц, 2Н), 7.45 (dd, 1Н), 7.30-7.19 (m, 6H), 7.05 (m, 2H), 6.94 (d, J=8.42 Гц, 2H), 2.48 (s, 3Н); мас-спектр m/z 293 (М+Н+). D. 1-фенокси-2-(4'-метилсульфонілфеніл)бензол: Продукт прикладу 201, частина С (0.096г, 0.35ммоль) було розчинено в дихлорметані (5мл) та охолоджено 0°С. Додали 3-хлорпербензойну кислоту (0.15г, 0.73ммоль) та суміш перемішували при кімнатній температурі протягом 18год. Розвели дихлорметаном, промили послідовно бікарбонатом натрію, бісульфітом натрію, ропою, а згодом висушили, відфільтрували та сконцентрували. Продукт хроматографували на силікагелі з елюентом гексан/етилацетат (4:1) та перекристалізовували (дихлорметан/гексан). Одержали сполуку (0.063г, 56%). t°пл. 130-131°С. Концентрування маточного розчину дало 0.02г продукту; 1Н ЯМР (CDCІ 3) d 7.94 (d, J=8.79 Гц, 2Н), 7.77 (d, J=8.79 Гц, 2Н), 7.46 (dd, 1Н), 7.37 (m, 4H), 7.09 (m, 2H), 6.94 (dd, 2H), 3.06 (s, 3Н); мас-спектр m/z 325 (М+Н+), 342 (M+NH4+); Аналіз на C19H16O3S: розраховано С: 70. 35%, Н:4.97%, S:9.88%; визначено С:70.28%, Н:4.89%, S:9.99%. Використання описаних вище методик або їх варіацій зрозуміло обізнаним в органічному синтезі. Сполуки в Таблицях 1-3, наведених нижче, також можуть бути отримані. Прикл. № R1X R3 R4 1 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 2 Ph 4-F-Ph 4-Me-Ph 3-MeO-Ph 4-MeO-Ph 3,4-(MeO)2-Ph 4-Br-Ph 3-EtO-Ph 4-CF3CH2 O-Ph 4-MeOO-Ph 4-MeCOO-Ph 4-Me2 NCOO-Ph 4-PhCOO-Ph 4-PhCOO-Ph 4-PhCH2 OOC-Ph 4-NH2-Ph 3-Cl-Ph 4-NO2-Ph 4-EtS-Ph 4-Me2 N-Ph 4-MeC(=O)-Ph 4-MeC(=O)NH-Ph 4-PhCH2 NH-Ph 4-PhNH-Ph 4-MeONH-Ph 4-MeOOCNH-Ph 4-PhCH2 OOCNH-Ph 4-PhOOCNH-Ph 4-MeNHCONH-Ph 4-PhCONH-Ph 4-PhNH-Ph 4-(4-MePhSO2 NH)-Ph 4-PhCH2SO2 NH-Ph 4-N-піролідиніл-Рh 4-N-піперидиніл-Рh 4-N-морфолiнiл-Рh 4-(1-піперазиніл)-Ph 4-(4-Ме-1-піперазиніл)-Ph 4-(4-бензил-1-піперазиніл)-Ph 4-Br-Ph 4-СНО 4-MeOCH2-Ph 4-HOCH2-Ph 4-CF3-Ph 3-піридазиніл 2-бензофураніл 5-бензотіеніл 2-бензотіеніл 2-нафтил 5-МеО-2-нафтил 3-піридил 2-хіноліл 3-хіноліл 6-хіноліл 2-тіеніл 3 H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H Н Н Н Н Н Н Н Н Н H H H H н H H H H Н Н Н 4 H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H H Н Н Н Н Н Н Н Н Н Н Темп. пл., °С 5 135-137 165-167 131-133 121-122 141-144 161-163 Мас-спектр. (M+H)+ 6 326а 327 340а 356а 339 386а 100-103 324 180-182 352 176 88 134 354а 370а 356а 183-185 165-167 183-184 202-204 190 148-149 140-141 382а 382а 359 395 310 360 360 56 57 58 59 60 61 62 63 64 65 66 67 68 69 70 71 72 73 74 75 76 77 78 79 80 81 82 83 84 85 86 87 88 89 90 91 92 93 94 95 96 97 98 99 100 101 102 103 104 105 106 107 108 109 110 111 112 113 114 115 116 117 118 119 120 121 123 124 125 126 127 128 129 130 131 132 133 134 135 2-тіазоліл 3-тіеніл 2-фурил 2-оксазоліл N-метил-2-пиразоліл 3-ізооксазоліл 3-ізотіазоліл 2-бензотіазоліл 2-бензоксазоліл 3-бензиндазоліл 5-бензотриазоліл 3-бензоізотіазоліл 3-бензоізооксазоліл 3-ізохіноліл 1-циклогексеніл циклогексил циклопентил 3-Еt-циклогексил 4-МеО-циклогексил 2-СІ-циклопентил 3-F-циклопентил 2-НО-циклогексил 4-F-Ph 4-F-Ph 4-F-Ph 4-F-Ph 4-F-Ph 4-F-Ph 4-F-Ph 4-F-Ph 4-F-Ph Ph 4-F-Ph 4-F-Ph 4-F-Ph 4-F-Ph 4-F-Ph 4-F-Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph 4-F-Ph 4-F-Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph Ph (E)-4-F-C6H5CH=CH Н Н Н Н H Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н H H 4-NH2 5-NH2 4-NO2 5-NO2 4-Me 4-CF3 4-Br 4-Cl 4-CN 4-OH 4-OMe 4-CH2COOMe 5-CH2COOMe 4-COOMe 5-COOMe 4-C(=O)Me 4-SPh 5-SO2 Me 4-CH-CH2 4-NMe2 4-SO2 NH2 4-SO2CF3 4-SO2CH2Ph 4-F 4-CONH2 4-CH(Me)CO-OMe 4-C(=O)Ph 5-CH(Me)OMe 4-CH2CH2 OPh 4-CH2 OCOMe 4-CH2 OCH2 OMe H 4-CFH2 4-CH2 OH 4-CH2 O-циклогєксил 4-CH2 OCONHMe 4-CH2 OCONHCH2Ph 4-CH2 OCO-(4-ClPh) 4-CH2 OCH2F 4-СН2 OСН2 OСOМе 4-CH2 OCH2 NMe2 4-CH2 OCH2Ph 4-СН2 OСН2СOМе 4-СН2 OСН2СOOМе 4-СН2 OСН2-2-тіеніл 4-СН2 OСН2-2-піридил 4-CH2 NMe2 4-CH2Ph 4-CH2CONH2 4-СН2-2-тіеніл 4-СН2-2-піримідил 4-CH=CH-CN 4-СН=СН-СОМе 4-СН=СН-СOOН 4-CH=CH-NO2 4-СН=СН-СН2 NMе2 Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н H H H H H H H H H H H H 5-Cl H H H H H H H H H H H H 5-F H H H H H H H 5-CF3 H H H H H H H Н Н Н Н Н Н Н Н НН Н Н Н Н Н Н Н Н 126-128 151-153 313 332а 168-170 157-159 170-172 214-216 359а 359а 389а 389а 74 342а 135 386а 136 137 138 139 140 141 142 143 144 145 146 147 148 149 150 151 152 153 2- (4-фторфеніл)-2-метилетил 4-F-C6H5C(CH3)=CHфенілтіобензилтіоC6H5CH(CH3)S4-фторфенокси4-фторбензоїл циклогексилоксифеноксибензилокси3-піридилоксиС6Н5С(=О)СН2феноксиметилфенілметилтіоС6Н5С(-О)СН21-піперидиніл С6Н5 ОС1-піроліл Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н н Н H Н Н Н Н Н Н Н Н Н Н Н Н Н Н Н н 126-128 360 олія 130-131 95-97 331 325 339 \ 140-140.5 94-96 133-135 316 350а 298 Таблиця 2 Прикл. № 1 301 302 303 304 305 306 307 308 309 310 311 312 R1X 2 4-Me-Ph 4-F-Ph Ph Ph Ph Ph Ph 4-MeOPh 4-MeOPh 4-MePh 4-F-Ph Ph R2 3 5-МеSO2-2-піридил 5-MeSO2-2-піридил 2-MeSO2-5-піридил 3-F-4-MeSO2-Ph 2-Cl-4-MeSO2Ph 3-Me-4-MeSO2Ph 3-MeO-4-MeSO2Ph 5-MeSO2-2-п іридил 2-МеSО2-5-піридил 5-MeSO2-2-піридил 2-MeSO2-5-піридил 4-H2 NSO2-Ph R3 4 H H Н Н Н Н Н Н Н Н Н Н R4 5 Н Н Н Н Н Н Н Н Н Н Н Н Темп. пл., °С 6 Мас-спектр. (М+Н)+ 7 104.5-107 310 183-184 310 Таблиця 3 Прикл. № R1X R2 A Темп, пл., °С 401 402 403 404 405 406 407 408 409 410 411 412 413 Ph 4-F-Ph 4-F-Ph 4-F-Ph 4-F-Ph 4-F-Ph 4-F-Ph 4-F-Ph 4-F-Ph Ph 4-F-Ph 4-MeO-Ph 4-Me-Ph 4-MeSO2-Ph 4-MeSO2-Ph 4-MeSO2-Ph 4-MeSO2-Ph 4-MeSO2-Ph 4-MeSO2-Ph 4-MeSO2-Ph 4-MeSO2-Ph 4-MeSO2-Ph 4-MeSO2-Ph 4-MeSO2-Ph 4-MeSO2-Ph 4-MeSO2-Ph 2, 3-нафтил 1, 2-нафтил 1,2,3,4-тетрагідро-6,7-нафтил 1,2,3,4-тетрагідро-5,6-нафтил 5,6-бензотіеніл 1-метил-5,6-індоліл 4,5-бензоциклогептил 5,6-інданіл 5,6-бензімідазоліл 2,3-піридил 2,3-піридил 2,3-піридил 2,3-піридил 139-140 Мас-спектр. (М+Н)+ 359 126-128 147-148 138-139 310 328 340 Використання Сполуки Формули І є інгібіторами простагландин синтази, і тому їх доцільно використовувати в випадках запальних хвороб та як протилихоманкові агенти. Простагландин G/H синтазна інгібіторна активність сполук даного винаходу демонструється з використанням тестів на інгібірування простагландинів G/H, наприклад, застосовуючи тест, описаний нижче, для оцінки інгібіторів простагаландин G/H синтази. Сполуки даного винаходу, до яких привертається увага, селективно інгібірують активність PGHS2 та продукцію PGE2 в людських моноцитах, як це продемонстровано при використанні описаного нижче клітинного тесту. Сполуки Формули І мають властивість скорочувати процеси лихоманки in vivo, наприклад, як продемонстровано з використанням моделі тварини, описаної нижче. Сполуки даного винаходу мають протизапальну активність, як продемонстровано з використанням стандартної моделі тварини з гострими та хронічними запаленнями, описаної нижче. Сполуки даного винаходу також мають властивість подавляти та втамовувати біль in vivo, як продемонстровано з використанням тваринної моделі болевтамування, описаної нижче. Тут прийнято, що "mг" означає мікрограм, "мг" означає міліграм, "г" означає грам, "mл" означає мікролітр, "мл" означає мілілітр, "л" означає літр, "нМ" означає наномолярний, "mМ" означає мікромолярний, "мМ" означає мілімолярний, "М" означає молярний, а "нм" означає нанометр. Контекст "Sigma" є еквівалентом Sigma-Aldrich Corp., St.Louis, МО. Сполука розглядається як така, що має простагаландин G/H синтазну інгібіторну активність у описаному нижче тесті, якщо вона інгібірує простагаландин G/H синтазу з ІС50
ДивитисяДодаткова інформація
Назва патенту англійськоюInhibitors of prostaglandin synthase, pharmaceutical compositions, and method for treating inflammations
Назва патенту російськоюИнгибиторы простагландинсинтазы, фармацевтическая композиция на их основе и способ лечения воспалительных процессов
МПК / Мітки
МПК: C07D 213/71, C07D 307/79, A61K 31/12, C07C 317/22, A61K 31/10, C07C 317/24, A61K 31/425, A61K 31/495, A61K 31/135, A61K 31/165, C07D 213/52, A61K 31/42, C07D 213/70, C07D 333/22, A61K 31/535, A61K 31/47, A61K 31/496, C07D 277/26, C07D 333/18, A61P 29/00, C07D 261/08, A61K 31/421, C07D 307/38, C07D 277/66, A61K 31/426, A61K 31/445, A61K 31/5375, A61K 31/235, C07D 217/16, A61K 31/215, C07C 317/32, C07D 295/096, C07D 333/54, A61K 31/341, A61K 31/423, C07D 261/20, A61P 43/00, C07C 317/14, A61K 31/4406, C07D 263/32, A61K 31/38, C07D 275/00, A61K 31/34, A61K 31/381, C07D 215/12, A61K 31/5377, A61K 31/11, C07D 263/34, C07C 311/15, A61K 31/19, C07D 213/34, C07D 295/08, C07C 317/36, A61P 25/04, C07D 213/65, A61K 31/27, C07D 263/56, A61K 31/18, A61K 31/428, A61K 31/44, C07D 207/33, C07D 207/333, A61K 31/472, A61K 31/4402, A61K 31/17, A61K 31/343, A61K 31/275, A61K 31/40, A61K 31/4418
Мітки: жару, лікування, хвороби, фармацевтична, простагландинсинтази, композиція, основі, інгібітори, лихоманки, спосіб, запальної
Код посилання
<a href="https://ua.patents.su/25-70275-ingibitori-prostaglandinsintazi-farmacevtichna-kompoziciya-na-kh-osnovi-ta-sposib-likuvannya-zapalno-khvorobi-ta-zharu-likhomanki.html" target="_blank" rel="follow" title="База патентів України">Інгібітори простагландинсинтази, фармацевтична композиція на їх основі та спосіб лікування запальної хвороби та жару (лихоманки)</a>
Попередній патент: Лікарська композиція для локального лікування і профілактики геморою, тріщин анального отвору, запальних захворювань слизової оболонки прямої кишки
Наступний патент: Подрібнювач і спосіб подрібнювання
Випадковий патент: Каркас споруди з зубчастим барабаном












