Піримідинові сполуки, спосіб їх одержання, фармацевтична композиція та їх використання
Номер патенту: 73762
Опубліковано: 15.09.2005
Автори: Іф Роберт Джон, Сміт Стефен Аллан, Леч Колін Ендрю, Стенвей Стівен Джеймс, Хікей Дірдре Мері Бернадетта, Пінто Іван Лео
Формула / Реферат
1. 1-(N-(2-(діетиламіно)етил)-N-(4-(4-трифторметилфеніл)бензил)амінокарбонілметил)-2-(4-фторбензил)тіо-5,6-триметиленпіримідин-4-он

або його фармацевтично прийнятна сіль.
2. Сполука за п. 1, представлена в формі її вільної основи.
3. Сполука за п. 1, представлена в формі її хлоргідратної солі.
4. Сполука за будь-яким з пп. 1-3 для застосування в терапії.
5. Сполука за будь-яким з пп. 1-3 для застосування при лікуванні або попередженні патологічного стану, асоційованого з активністю ферменту Lp-PLA2.
6. Сполука за п. 5, яка відрізняється тим, що вказаний патологічний стан являє собою атеросклероз.
7. Сполука за п. 5, яка відрізняється тим, що вказаний патологічний стан являє собою діабет, гіпертензію, стенокардію, реперфузію, ішемію, ревматоїдний артрит, інсульт, хворобу Альцгеймера, інфаркт міокарда, сепсис, гостре та хронічне запалення та псоріаз.
8. Фармацевтична композиція, що містить сполуку, вказану в будь-якому з пунктів 1-3 та фармацевтично прийнятний носій.
9. Фармацевтична композиція за п. 8, пристосована для орального введення.
10. Фармацевтична композиція за п. 8 або 9, яка додатково містить терапевтично ефективну кількість агента, що знижує рівень холестерину.
11. Фармацевтична композиція за п. 10, яка відрізняється тим, що вказаний агент, що знижує рівень холестерину, являє собою статин.
12. Фармацевтична композиція за будь-яким з пп. 8-11 для застосування в терапії.
13. Фармацевтична композиція за будь-яким з пп. 8-11 для застосування при лікуванні або попередженні патологічного стану, асоційованого з активністю ферменту Lp-PLA2.
14. Композиція за п. 13, яка відрізняється тим, що вказаний патологічний стан являє собою атеросклероз.
15. Композиція за п. 13, яка відрізняється тим, що вказаний патологічний стан являє собою діабет, гіпертензію, стенокардію, реперфузію, ішемію, ревматоїдний артрит, інсульт, хворобу Альцгеймера, інфаркт міокарда, сепсис, гостре та хронічне запалення та псоріаз.
16. Застосування сполуки, вказаної в будь-якому з пп. 1-3, або фармацевтичної композиції, вказаної в будь-якому з пп. 8-11, при виготовленні лікарського засобу для первинного та вторинного попередження гострих приступів ішемії.
17. Застосування сполуки, вказаної в будь-якому з пп. 1-3, або фармацевтичної композиції, вказаної в будь-якому з пп. 8-11, при виготовленні лікарського засобу для лікування патологічного стану, асоційованого з активністю ферменту Lp-PLA2.
18. Застосування сполуки, вказаної в будь-якому з пп. 1-3, або фармацевтичної композиції, вказаної в будь-якому з пп. 8-11, при виготовленні лікарського засобу для лікування атеросклерозу.
19. Спосіб одержання сполуки, вказаної в п. 1, який відрізняється тим, що
сполуку формули (II):
 (II)
(II)
піддають взаємодії зі сполукою формули (III):
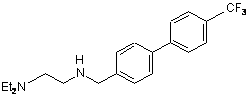 (III)
(III)
в умовах утворення аміду.
Текст
Даний винахід відноситься до деяких піримідинових сполук, до способів їх одержання, до проміжних сполук, що використовуються для їх одержання, до фармацевтичних композицій, що містять зазначені сполуки, і до їх використання в терапії, зокрема, для лікування атеросклерозу. У WO 95/00649 (SmithKline, Beeccham ріс) описано фермент фосфоліпазу А2, а саме, асоційовану з ліпопротеїном фосфоліпазу А2 (Lp-PLA2), її послідовність, виділення і очищення, виділені нуклеїнові кислоти, що кодують цей фермент, і рекомбінантні клітини-хазяїна, трансформовані ДНК, що кодують вказаний фермент. Передбаченим терапевтичним застосуванням інгібіторів вказаного ферменту є лікування атеросклерозу, діабету, ревматоїдного артриту, інсульту, інфаркту міокарду, репефузійних уражень, а також гострого і хронічного запалення. У наступній публікації тієї ж самої групи авторів також описано вказаний фермент [Tew D. et al, Arterioscler Thromb Vas Biol. 1996: 16; 591-9], де він позначається LDL-PLA2. У більш пізній патентній заявці (WO 95/09921, Icos Corporation) і в родинних публікаціях в Nature [Tjoelker et al., vol.374, 6 April 1995, 549] описано фермент PAF-AH, що має, в основному, таку ж послідовність, що і Lp-PLA2, і передбачається, що він може бути використаний у якості терапевтичного білка для регуляції патологічних запальних процесів. Було показано, що Lp-PLA2 відповідальний за перетворення фосфотидилхоліну в лізофосфатидилхолін у процесі перетворення ліпопротеїну низької щільності (ЛНЩ) у його окислену форму. Відомо, що цей фермент гідролізує складний sn-2-ефір окисленого фосфотидилхоліну з утворенням лізофосфатидинхоліну й окисно-модифікованої жирної кислоти. Обидва продукти, що утворюються під дією Lp-PLA2, є біологічно активними стосовно лізофосфатидилхоліну, компонента окисленого ЛНЩ, який, як відомо, є сильним хемоатрактантом для циркулюючих моноцитів. Очевидно, що самий лізофосфатидилхолін відіграє значну роль у розвитку атеросклерозу, оскільки він відповідальний за акумуляцію клітин артерій, навантажених складним ефіром холестерину. Тому, передбачається, що інгібування ферменту Lp-PLA2 повинно призводити до припинення розвитку уражень, пов'язаних із накопиченням макрофагів (шляхом інгібування утворення лізофосфатидилхоліну й окислених вільних жирних кислот), а тому воно може бути використане для лікування атеросклерозу. У нещодавно опублікованому дослідженні (WOSCOPS - Packard et al., N. Engl. J.Med. 343 (2000) 11481155) було показано, що рівень ферменту Lp-PLA2 є незалежним фактором ризику при ішемічній хворобі серця. Також передбачається, що підвищене утримання лізофосфатидилхоліну в окисно-модифікованому ЛНЩ є відповідальним за ендотеліальну дисфункцію, що спостерігається в пацієнтів з атеросклерозом. Тому інгібітори Lp-PLA2 можуть сприяти при лікуванні цього стану. Інгібітор Lp-PLA2 може бути також використаний при інших патологічних станах, при яких спостерігається ендотеліальна дисфункція, включаючи діабет, гіпертензію, стенокардію і реперфузійні постішемічні ураження. Крім того, інгібітори Lp-PLA2 можуть також мати загальне застосування при будь-яких розладах, у яких беруть участь активовані моноцити, макрофаги або лімфоцити, оскільки всі клітини цих типів експресують Lp-PLA2. Прикладами таких розладів є псоріаз. Крім того, інгібітори Lp-PLA2 можуть також мати загальне застосування при будь-яких розладах, обумовлених окислюванням ліпідів у сполученні з активністю Lp-PLA2, при яких продукуються два небажаних продукти, лізофосфатидилхолін і окисно-модифіковані жирні кислоти. Такими станами є вищевказані стани, такі як, атеросклероз, діабет, ревматоїдний артрит, інсульт, інфаркт міокарда, репефузійні ураження, а також гостре і хронічне запалення. В патентних заявках WO 96/13484, WO 96/19451, WO 97/02242, WO 97/21675, WO 97/217676, WO 97/41098 і WO 97/41009 (SmithKline Beecham ріс) описані, inter alia, різні серії 4тіоніл/сульфініл/сульфонілазетидинових сполук, що є інгібіторами ферменту Lp-PLA2. Ці сполуки являють собою необоротні ацилюючі інгібітори [Tew et al., Biochemistry, 37, 10087, 1998]. Був ідентифікований інший клас сполук, що є неацилюючими інгібіторами ферменту Lp-PLA2. Таким чином, у WO 99/24420 (SmithKline Beecham ріс) описано клас піримідинових сполук. У міжнародних патентних заявках WO 00/10980, WO 00/66566, WO 00/66567 і WO 00/68208 (SmithKline, Beecham pic, опублікованих пізніше дати пріоритету даної заявки) описані інші класи піримідинових сполук. Авторами даного винаходу було виявлено інший клас піримідинових сполук, які відрізняються по типу заміщення в 5- і 6-положенні піримідинового кільця, і які мають добру активність у якості інгібіторів ферменту Lp-PLA2. Відповідно до цього, даний винахід відноситься до сполук формули (І): де: Raявляє собою водень, галоген, С(1-3)алкіл, С(1-3)алкоксі, гідрокси С(1-3)алкіл, С(1-3)алкилтіо, С(13)алкілсульфініл, аміно-С(1-3)алкіл, моно- або ди-С(1-3)алкіламіноС(1-3)алкіл, С(1-3)алкілкарбониламіноС(13)алкіл, С(1-3)алкокси С(1-3)алкілкарбоніламіноС(1-3)-алкіл, С(1-3)алкілсульфоніламіноС(1-3)алкіл, С(1-3)алкілкарбокси або С(1-3)алкілкарбоксиС(1-3)алкіл; Rb являє собою водень, галоген, С(1-3)алкіл, або гідроксиС(1-3)алкіл, за умови, що Ra і Rb не є одночасно воднем; або Ra і Rb разом являють собою (СН2)n, де n дорівнює 3 або 4, і взяті разом з атомами вуглецю піримідинового кільця, з якими вони зв'язані, утворюють конденсоване 5- або 6-членне карбоциклічне кільце; або Ra і Rb, взяті разом з атомами вуглецю піримідинового кільця, з якими вони зв'язані, утворюють конденсоване бензо- або гетероарильне кільце, необов'язково заміщене 1, 2, 3 або 4 замісниками, що можуть бути однаковими або різними, і які вибрані з галогену, С(1-4)алкілу, ціано, С(1-4)-алкокси або С(1або моно - перфтор-С(1-4)алкілу; R являє собою водень або С(1-3)алкіл; R2 являє собою арильну або гетероарильну групу, необов'язково заміщену 1, 2, 3 або 4 замісниками, що можуть бути однаковими або різними, і які вибрані із С(1-8)алкілу (переважно, С(1-6)алкілу), С(1-18)алкокси (переважно, С(1-6)алкокси), С(1-18)алкилтіо (переважно, С(1-6)алкилтіо) арилС(1-18)алкокси (переважно, арилС(16 6 6 7 8 9 8 9 6 7 6)алкокси), гідрокси, галогену, CN, COR , карбокси, COOR , NR COR , CONR R , SO2NR R , NR SO2R , NR8R9, моно - перфтор-С(1-4)алкілу, моно - перфтор-С(1-4)алкоксиарилу і арилС(1-4)алкілу; R3 являє собою водень, С(1-6)алкіл, що може бути незаміщеним або заміщеним 1, 2 або 3 замісниками, вибраними з гідрокси, галогену, OR6, COR6, карбокси, COOR6, CONR8R9, NR8R9, NR8COR9, моно- або дигідрокси (С(1-6)алкіл) аміно і N-гідрокси (С(1-6)алкіл)-N-С(1-6)алкіламіно, наприклад, 1-піперидино-етилу; або R3 являє собою Неt-С(0-4)алкіл, де Het являє собою 5-7-членне гетероциклічне кільце, що містить атоми N і необов'язково О або S, зв'язані через кільцевий атом вуглецю, і де N може бути заміщений COR6, COOR6, CONR8R9 або С(1-6)алкілом, необов'язково заміщеним 1, 2 або 3 замісниками, вибраними з гідрокси, галогену, OR6, COR6, карбокси, COOR6, CONR8R9 або NR8R9, наприклад, піперидин-4-іла, піролідин-3-іла; R4 являє собою арильне або гетероарильне кільце, необов'язково заміщене 1, 2, 3 або 4 замісниками, що можуть бути однаковими або різними, і які вибрані з С(1-18)-алкілу (переважно, С(1-6)алкілу), С(1-18)алкокси (переважно, С(1-6)алкокси), С(1-18)алкилтіо (переважно, С(1-6)-алкилтіо), арилС(1-18)алкокси (переважно, арилС(1-6)алкокси), гідрокси, галогену, CN, COR6, карбокси, COOR6, NR6OR7, CONR8R9, SO2NR8R9, NR6SO2R7, NR8R9, moho - перфтор-С(1-4)алкілу і моно - перфтор-С(1-4)алкокси; R5 являє собою арильне або гетероарильне кільце, необов'язково заміщене 1, 2, 3 або 4 замісниками, що можуть бути однаковими або різними, і які вибрані із С(1-18)-алкілу (переважно, С(1-6)алкілу), С(1-18)алкокси (переважно, С(1-6)алкокси), С(1-18)алкилтіо (переважно, С(1-6)алкилтіо), арилС(1-18)алкокси (переважно, арилС(16 6 8 9 6 7 8 9 6 7 6)алкокси), гідрокси, галогену, CN, COR , карбокси, COOR , CONR R , NR COR , SO2NR R , NR SO2R , NR8R9, моно - перфтор-С(1-4)алкілу і моно -перфтор-С(1-4)алкокси; R6 і R7 незалежно являють собою водень або С(1-20)алкіл, наприклад, С(1-4)алкіл (наприклад, метил або етил); R8 і R9 можуть бути однаковими або різними і кожний з них вибрано із водню, С(1-12)алкілу (переважно, C(1-6)алкілу) або R8 і R9, взяті разом з атомом азоту, з якими вони зв'язані, утворять 5-7-членне кільце, що необов'язково містить один або декілька додаткових гетероатомів, вибраних із кисню, азоту і сірки і необов'язково заміщених одним або двома замісниками, вибраними з гідрокси; оксо; С(1-4)алкілу; С(1-4)алкілСО; арилу, наприклад, фенілу; або аралкілу, наприклад, бензилу, наприклад, морфоліну або піперазина; або R8 і R9 можуть бути однаковими або різними, і кожний з них вибрано з CH2R10, CHR11CO2H або його солі, де R10 являє собою СООН або його сіль, COOR12, CONR6R7, CN, СН2ОН або CH2OR6; R11 являє собою бічний ланцюг амінокислоти, такий як СН2ОН-ланцюг серину; R12 являє собою С(1-4)алкіл або фармацевтично прийнятну in vitro-гідролізуючу складноефірну групу; n дорівнює цілому числу від 1 до 4, переважно, 1 або 3, а більш переважно, 1; X являє собою О або S; Υ являє собою (CH2)p(O)q, де p дорівнює 1, 2 або 3, a q дорівнює 0, або p дорівнює 2 або 3, a q дорівнює 1; і Ζ являє собою О або зв'язок. Характерними прикладами Ra є хлор, бром, метил, етил, н-пропіл, метокси, гідроксиметил, гідроксиетил, метилтіо, метилсульфініл, аміноетил, диметиламінометил, ацетиламіноетил, 2(метоксиацетамідо) етил, мезиламіноетил, етилкарбокси, метан-сульфонамідоетил, (метоксиацетамідо)етил і ізопропілкарбоксиметил. Характерними прикладами Rb є водень і метил. Характерними прикладами Ra і Rb, що утворять разом з атомами вуглецю піримідинового кільця, з якими вони зв'язані, конденсоване бензо- або гетероарильне кільце, є бензо (з утворенням хіназолинілового кільця), піридо і тієно, відповідно. Переважно, Ra являє собою метил або етил, a Rb являє собою водень або метил, або Ra і Rb, взяті разом з атомами вуглецю піримідинового кільця, з якими вони зв'язані, утворюють конденсоване 5- або 6членне карбоциклічне кільце. Більш переважно, Ra і Rb, взяті разом з атомами вуглецю піримідинового кільця, з якими вони зв'язані, утворюють конденсоване 5-членне карбоциклічне кільце. Характерними прикладами Rc є водень і метил. Rc переважно, являє собою водень. X переважно являє собою S. Υ переважно являє собою СН2. Ζ переважно представляє прямий зв'язок. Характерними прикладами R2, у випадку, коли R2 являє собою арильну групу, є феніл і нафтил. Характерними прикладами R2, у випадку, коли R2 являє собою гетероарильну групу, є піридил, піримідиніл, піразоліл, фураніл, тієніл, тіазоліл, хіноліл, бензотіазоліл, піридазоліл і піразиніл. R2 переважно являє собою арильну групу, необов'язково заміщену 1, 2, 3 або 4 замісниками, що можуть бути однаковими або різними, і які вибрані із С(1-6)алкіла, С(1-6)алкокси, С(1-6)алкилтіо, гідрокси, галогену, CN, моно - перфтор-С(1-4)алкілу, моно - перфтор-С(1-4)алкоксиарилу і арилС(1-4)алкіла. Більш переважно, R2 являє собою феніл, необов'язково заміщений галогеном, переважно 1-3 атомами фтору, а найбільше переважно, 4-фтором. R2СН2Х переважно являє собою 4-фторбензилтіо. Характерними прикладами R3 є водень, метил, 2-(етиламіно)етил, 2-(диетиламіно)етил, 2-(етиламіно)2-метил'-пропіл, 2-(трет-бутиламіно)етил, 1-піперидиноетил, 1-етилпіперидин-4-іл. Переважно, R3 являє собою С(1-3)алкіл, заміщений замісником, вибраним із NR8R9; або R3 являє собою Неt-С(0-2)-алкіл, де Het являє собою 5-7-членне гетероциклічне кільце, що містить N, і де N може бути заміщений С(1-6)алкілом. Більш переважно, R3 являє собою 2-(діетиламіно)етил. 4)алкилтіо c Характерними прикладами R4 є феніл, піридин і піримідин. R4 переважно являє собою феніл. Характерними прикладами R5 є феніл або тієніл, необов'язково заміщені галогеном або трифторметилом, переважно, у 4-положенні. R5 переважно являє собою феніл, заміщений трифторметилом, переважно, у 4-положенні. Переважно, R4 і R5, взяті разом, утворять 4-(феніл)фенільний, 2-(феніл)піримідильний або 2-(феніл)піридинільний замісник, у яких віддалене фенільне кільце може бути, але необов'язково, заміщено галогеном або трифторметилом, переважно, у 4-положенні. Більш переважно, R4 і R5, взяті разом, утворять 4-(4-тритформетилфеніл)-фенільну частину. Слід зазначити, що сполуки формули (І) охоплюють підгрупу сполук, що має формулу (ІА): де: Ra, Rb, Rc, n, R2, R3, R4, R5 і X визначені вище; і іншу підгрупу сполук, що має формулу (IB): де: Ra, Rb, R2, R3, R4, R5 і X визначені вище, зокрема: Ra і Rb взяті разом з атомами вуглецю піримідинового кільця, із якими вони зв'язані, утворюють конденсоване 5-членне карбоциклічне кільце; R2CH2X являє собою 4-фторбензилтіо; R3 являє собою С(1-3)алкіл, заміщений NR8R9; або R3 являє собою Неt-С(0-2)алкіл, де Het подає 5-7-членне гетероциклічне кільце, що містить N, і де N може бути заміщений С(1-6)алкілом; R4 і R5 утворять 4-(4-трифторметилфеніл)фенільну частину; R8 і R9, які можуть бути однаковими або різними, вибрані з водню або C(1-6)алкілу; і X являє собою S. Фармацевтично прийнятними in vivo гідролізуючими складноефірними групами для R12 є групи, які легко розкладаються в організмі людини з утворенням вихідної кислоти або її солі. Фармацевтично прийнятні in vivo гідролізуючі складноефірні групи добре відомі спеціалістам, і прикладами таких груп, що використовуються у R12, є групи, описані в WO 00/68208 (SmithKline, Beeccham). Слід зазначити, що якщо Rc являє собою С(1-3)алкіл, то атом вуглецю, з яким він зв'язаний, може являти собою хіральний центр, так, що при цьому можуть утворюватися діастереомери. При відсутності інших хіральних центрів вони можуть бути енантіомерами. Даний винахід охоплює всі зазначені діастереомери і енантіомери, включаючи їхні суміші. Слід зазначити, що в деяких випадках, сполуки даного винаходу можуть мати основну функціональну групу, таку як аміногрупа, в якості замісника. Такі основні функціональні групи можуть бути використані для одержання кислотно-адитивних солей, а зокрема, фармацевтично прийнятних солей. Фармацевтично прийнятними солями є солі, описані в роботі Berge, Bighley & Monkhouse, J. Pharm. Sci., 1977, 66, 1-19. Такі солі можуть бути утворені з неорганічних і органічних кислот. Характерними прикладами таких кислот є малеїнова, фумарова, бензойна, аскорбінова, памова, бурштинова, бісметиленсаліцилова, метансульфонова, етандисульфонова, оцтова, пропіонова, винна, саліцилова, лимонна, глюконова, аспарагінова, стеаринова, пальмітинова, ітаконова, гліколева, п-амінобензойна, глутамінова, таурохолева, бензолсульфонова, п-толуолсульфонова, хлористоводнева, бромистоводнева, сірчана, циклогексилсульфамова, фосфорна й азотна кислоти. Слід зазначити, що в деяких випадках, даний винахід може включати карбоксигрупу в якості замісника. Такі як карбоксигрупи можуть бути використані для одержання солей, а зокрема, фармацевтично прийнятних солей. Фармацевтично прийнятними солями є солі, описані в роботі Berge, Bighley & Monkhouse, J. Pharm. Sci. , 1977, 66, 1-19. Переважними солями є солі лужних металів, такі як солі натрію і калію. Термін "алкіл", що тут використовується, і аналогічні терміни, такі як "алкокси", означають усі ізомери з прямим або розгалуженим ланцюгом, їхніми характерними прикладами є метил, етил, н-пропіл, ізопропіл, нбутил, втор-бутил, ізобутил, трет-бутил, н-пентил і н-гексил. Термін "арил", що тут використовується, якщо це не обговорено особливо, означає моно- або біциклічну ароматну кільцеву систему, що містить аж до 10 атомів вуглецю, наприклад, феніл або нафтил. Термін "гетероарил", що тут використовується, означає моно- або біциклічну гетероароматичну кільцеву систему, що містить аж до чотирьох, а переважно, 1 або 2 гетероатоми, кожний із який вибрано з кисню, азоту і сірки. Кожне кільце може мати від 4 до 7, а переважно, 5 або 6 кільцевих атомів. Біциклічна гетероароматична кільцева система може включати карбоциклічне кільце. Терміни "галоген" і "галогено", що тут використовуються, означають фтор, хлор, бром і іод, і фторо, хлоро, бром і іодно, відповідно. Оскільки сполуки даного винаходу, а зокрема, сполуки формули (І), призначені для використання у фармацевтичних композиціях, то, очевидно, що кожну з них одержують, в основному, у чистій формі, наприклад, принаймні, з 50%-ною чистотою, більш переважно, принаймні, із 75%-чистотою, а найбільше переважно, принаймні, із 95%-частотою (% по масі). Неочищені препарати сполук формули (І) можуть бути використані для одержання більш чистих форм, використовуваних у фармацевтичних композиціях. Хоча, чистота проміжних сполук даного винаходу має менш важливе значення, проте, цілком очевидно, що для сполук формули (І), кращою є, в основному, чиста форма. Якщо це можливо, то переважно, щоб сполуки даного винаходу були отримані в кристалічній формі. Якщо деякі сполуки даного винаходу можна кристалізувати або перекристалізовувати з органічних розчинників, то в отриманому кристалічному продукті може бути присутнім розчинник кристалізації. Такі сольвати також входять в об'єм даного винаходу. Аналогічним чином, деякі сполуки даного винаходу можуть бути кристалізовані або перекристалізовані з розчинників, що містять воду. У таких випадках може утворюватися гідратна вода. У обсяг даного винаходу входять стехіометричні гідрати, а також сполуки, що містять різну кількість води, що можуть бути продуковані в таких процесах, як ліофілізація. Крім того, різні стани кристалізації можуть призводити до утворення різних поліморфних форм кристалічних продуктів. В об'єм даного винаходу входять усі поліморфні форми сполук формули (І). Сполуки даного винаходу являють собою інгібітори асоційованої з ліпопротеїном фосфоліпази А2 (LpPLA2) і передбачається, що вони можуть бути використані в терапії, а зокрема, для первинного і вторинного попередження гострих приступів ішемії, що викликаються, наприклад, атеросклерозом, включаючи атеросклероз периферійних судин і цереброваскулярний атеросклероз. В іншому своєму аспекті, даний винахід відноситься до сполук формули (І) для використання в терапії. Сполуки формули (І) є інгібіторами продукування лізофосфатидилхоліну фосфоліпазою Lp-PLA2, а тому вони можуть також мати загальне застосування при будь-яких станах, що викликають ендотеліальну дисфункцію, наприклад, атеросклероз, діабет, гіпертензію, стенокардію і реперфузію. Крім того, сполуки формули (І) можуть мати загальне застосування при будь-яких станах, асоційованих з окислюванням ліпідів у сполученні з ферментативною активністю, якими, наприклад, крім атеросклерозу і діабету, можуть бути інші стани, такі як, ішемія, ревматоїдний артрит, інсульт, запальні захворювання головного мозку, такі як хвороба Альцгеймера, інфаркт міокарда, репефузійнні ураження, сепсис і гостре хронічне запалення. Інші застосування зазначених сполук спрямовані на будь-які розлади, що пов'язані з накопиченням активованих моноцитів, макрофагів або лімфоцитів, оскільки всі клітини цих типів експресують Lp-PLA2. Прикладами таких розладів є псоріаз. Відповідно до іншого свого аспекту, даний винахід відноситься до способу лікування патологічного стану, асоційованого з активністю ферменту Lp-PLA2, де вказаний спосіб передбачає лікування пацієнта, що потребує цього, терапевтично ефективною кількістю інгібітору даного ферменту. Вказаний патологічний стан може бути асоційований з підвищеним накопиченням моноцитів, макрофагів або лімфоцитів; з утворенням лізофосфатидилхоліну й окислених вільних жирних кислот; з окислюванням ліпіду в сполученні з активністю Lp-PLA2, або з ендотеліальною дисфункцією. Сполуки даного винаходу можуть бути також використані для лікування вищезгаданих патологічних станів у комбінації з гіполіподемічним засобом, протиатерокслеротичним засобом, антидіабетичним засобом, засобом проти стенокардії, протизапальним засобом або гіпотенсивньїм засобом, або засобом для зниження рівня Lp(a). Прикладами вищевказаних засобів є інгібітори синтезу холестерину, такі як статини, антиоксиданти, такі як пробукол, засоби, що підвищують чутливість до інсуліну, антагоністи кальцієвих каналів і протизапальні засоби, такі як НСПВС. Прикладами агентів, що сприяють зниженню рівня Lp(a), є амінофосфонати, описані в WO 97/02037, WO 98/28310, WO 98/28311 і WO 98/28312 (Symphar SA SmithKline, Beecham). Передбачається, що сполуки даного винаходу можуть бути використані в комбінації з агентами, що знижують рівні холестерину, наприклад, ті, що вводяться разом зі статином. Статини являють собою добре відомий клас агентів, що знижують рівень холестерину в крові (інгібітори HMG-CoA-редуктази), і такими агентами є атовастатин, цимвастатин, правастатин, серивастатин, флувастатин, ловастатин і ZD 4522 (також що позначається S-4522, Astra Zeneca). Два агенти можуть прийматися одночасно або в різноманітний час відповідно до призначення лікаря. Було виявлено, що, в основному, невелика кількість пацієнтів (прибл. 30%) із підвищеними рівнями холестерину не відповідають на лікування статином. Тому, інше застосування сполук даного винаходу передбачає введення цих сполук пацієнту, несприйнятливому до лікування статином. Іншою переважною комплексною терапією є використання сполук даного винаходу й антидіабетичного засобу або засобу, що підвищує сприйнятливість до інсуліну, оскільки ішемічна хвороба серця є смертельною для більшості діабетиків. Із сполук цього класу, переважними для використання разом з сполуками даного винаходу, є активатори PPAR-гама, наприклад, G1262570 (Glaxo Wellcome) і сполуки класу глітазонів, такі як розиглітазон (Avandia, SmithKline Beecham), троглітазон і піоглітазон. Переважними показаннями є первинне і вторинне попередження гострих приступів ішемії, викликаних, наприклад, атеросклерозом, включаючи атеросклероз периферичних судин і цереброваскулярний атеросклероз; додаткові лікувальні заходи щодо попередження рестенозу й уповільненню прогресування діабетичної/гіпертенсивної ниркової недостатності. При терапевтичному використанні, сполуки даного винаходу звичайно вводять у виді стандартної фармацевтичної композиції. Тому, в іншому своєму аспекті, даний винахід відноситься до фармацевтичної композиції, що містить сполуки формули (І) і фармацевтично прийнятний носій. Підхожими фармацевтичними композиціями є композиції, адаптовані для перорального або парентерального введення або для введення у вигляді супозиторіїв. Сполуки формули (І), що є активними при пероральному введенні, можуть бути приготовлені у вигляді рідин, наприклад, сиропів, суспензій або емульсій, таблеток, капсул і пастилок. Рідка композиція може, в основному, складатися із суспензії або розчину сполуки або фармацевтично прийнятної солі в підхожому рідкому носії(ях), наприклад, у етанолі, гліцерині, безводному розчиннику, наприклад, поліетиленгліколі, маслах або у воді з агентом, що суспендує, консервантом, віддушиною або барвником. Композиція у формі таблетки може бути отримана з використанням будь-якого підхожого фармацевтичного носія(їв), звичайно використовуваного для одержання твердих композицій. Прикладами таких носіїв є стеарат магнію, крохмаль, лактоза, сахароза і целюлоза. Композиція у формі капсули може бути отримана із застосуванням стандартних процедур інкапсулювання. Так, наприклад, гранули, що містять активний інгредієнт, можуть бути приготовлені з використанням стандартних носіїв, після чого вони можуть бути включені у тверді желатинові капсули; альтернативно, дисперсія або суспензія може бути отримана з використанням будь-якого підхожого фармацевтичного носія (їв), наприклад, водяних камедій, целюлози, силікатів або масел, після чого зазначені дисперсії або суспензії вводять у м'які желатинові капсули. Типові парентеральні композиції складаються з розчину або суспензії сполуки формули (І) у стерильному водяному носії або в парентерально прийнятному маслі, наприклад, у поліетиленгліколі, у полівинілпіролідоні, лецитині, арахісовій олії або в кунжутній олії. Альтернативно, вказаний розчин може бути ліофілізований, а потім розведений підхожим розчинником безпосередньо перед введенням. Типові композиція-супозиторій містить сполуку формули (І), що є активним при введенні подібним способом, у сполученні зі сполучним агентом і/або замаслюючим агентом, таким як поліетиленгліколь, желатинів або олія какао, або з іншими низькоплавкими рослинними або синтетичними восками або жирами. Переважна композиція являє собою разову лікарську форму, таку як таблетка або капсула. Кожна уніфікована доза для перорального введення містить, переважно, від 1 до 500мг (а для парентерального введення, переважно, від 0,1 до 25мг) сполуки формули (І). Схема добового прийому лікарського засобу для дорослого пацієнта може передбачати, наприклад, введення пероральної дози від 1мг до 1000мг, переважно, від 1мг до 500мг, або, для внутрішньовенного, підшкірного або внутрішньом'язового введення, ця доза складає від 0,1мг до 100мг, а переважно, від 0,1мг до 25мг сполуки формули (І), де, вказану сполуку вводять 1-4 разу в день. Вказані сполуки вводять у більшості безупинно протягом усього курсу лікування, наприклад, напротязі тижня або більше. Сполука формули (І) може бути отримана за допомогою взаємодії сполуки (II): де X, n, Ra, Rb i R2 визначені вище, із сполукою формули (III) R ZR4-YRCNHR3 (III) де Rc, R3, R4, R5, Υ і Ζ визначені вище; в умовах утворення аміду. Умови утворення аміду добре відомі спеціалістам, див. наприклад. Comprehensive Organic Synthesis 6, 382-399, і передбачають взаємодію кислотної сполуки формули (II) і амінової сполуки формули (III) в інертному розчиннику, такому як дихлорметан, при кімнатній температурі, в присутності агента сполучення. Переважними агентами сполучення є агенти, розроблені для використання в пептидній хімії, такі як гідрохлорид 1-(3-диметиламінопропіл)-3-етилкарбодиіміда ("EDC"), переважно в присутності добавки, такої як 1-гідроксибензотріазол, або гексафторфосфат О-(7-азабензотріазол-1-іл)-N,N,N',N'-триметилуронію ("HATU"), переважно в присутності діізопропілетиламіну. Сполуки формули (І) можуть бути також отримані іншими способами, що передбачають, наприклад: (а) взаємодію сполук формули (IV): 5 де X, Ra, Rb, і R2 визначені вище, із сполукою формули (V) : R Z-R4-YRCNR3CO-(CH2)n-L1 (V) де n, R3, R4, R5, Rc, Υ і Ζ визначені вище, a L1 означає уходящу групу, таку як галоген, наприклад, бром, іод або трифлат; в присутності основи, такої як вторинний або третинний амін, наприклад, діізопропілетиламін, в інертному розчиннику, такому як дихлорметан; (b) якщо X являє собою S, взаємодію сполуки формули (VI): 5 де n, Ra, Rb, Rc, R3, R4, R5, Υ и Ζ визначені вище, із сполукою формули (VII): R -CH2-L1 (VI) де R2 і L1 визначені вище, в присутності основи, такої як вторинний або третинний амін, наприклад, діізопропілетиламін, в інертному розчиннику, такому як дихлорметан; або 2 (с) якщо X являє собою О, взаємодію сполуки формули (VIII): де n, Ra, Rb, Rc, R3, R4, R5, Υ і Ζ визначені вище, a L2 означає уходящу групу, таку як галоген або алкилтіо, наприклад, метилтіо, із сполукою формули (IX): R2CH2-OH (IX) де R2 визначено вище, в присутності основи, такої як 4-диметиламінопіридин, в інертному розчиннику, такому як піридин. Слід зазначити, що спочатку отримана сполука формули (І) може бути перетворена в іншу сполуку формули (1) шляхом модифікації функціональної групи методами добре відомим спеціалістам, наприклад, шляхом перетворення сполук формули (І), де Ra являє собою аміноалкіл, у сполуку формули (І), де Ra являє собою алкілкарбоніламіноалкіл, за допомогою взаємодії з ацилюючим агентом, таким як, наприклад, оцтовий ангідрид. Сполуки формул (II), (IV), (VI) і (VIII) для використання у вищевказаних способах, можуть бути отримані методами, проілюстрованими на нижченаведеній схемі І: де L3 являє собою С(1-6)алкільну групу, наприклад, метил; R15 являє собою С(1-6)алкільну групу, наприклад, етил або трет-бутил і L1, L2, Ra, Rb, Rc, R2, R3, R4, R5, n, Χ, Υ і Ζ визначені вище. Пояснення до схеми І: Умови утворення аміду для стадії (а), добре відомі спеціалістам. Переважно, кислоту формули (II) піддають взаємодії з аміном формули (III) в інертному розчиннику, такому як дихлорметан, при кімнатній температурі і в присутності агента сполучення, такого як гексафторфосфат 0-(7-азабензотріазол-1-іл)N,N,N',N'-тетраметилуронію і діізопропілетиламін або гідрохлорид 1-(3-диметиламінопропіл)-3етилкарбодиіміду в присутності 1-гідроксибензотріазолу. Умови алкілування для стадії (b) включають реакцію в присутності основи, такої як вторинний або третинний амін, наприклад, ди-ізопропіл етил амін, в інертному розчиннику, такому як дихлорметан. Умови для стадії (с) включають гідроліз, наприклад, із використанням водяного гідроксиду натрію в розчиннику, такому як діоксан, або, якщо R15 являє собою трет-бутил, то ця стадія передбачає деалкілування кислотою, такою як трифтороцтова кислота в розчиннику, такому як дихлорметан. Умови для стадії (d) включають умови утворення тіоефіру. Реакцію переважно здійснюють в присутності основи, такої як етоксид натрію або карбонат калію, а переважно, у розчиннику, такому як етанол, диметилформамід або ацетон, або в присутності вторинної або третинної амінової основи, такої як діізопропілетиламін, у розчиннику, такому як дихлорметан. У стадії (e), сполуку формули (XVII) піддають взаємодії з тіосечовиною у присутності етоксиду натрію (переважно, утвореного in situ з натрію і етанолу). У стадії (f), сполуку формули (XVIII) піддають взаємодії з етилформіатом в присутності основи, такої як гідрид натрію або ізопропоксид калію. У стадії (g), сполуку формули (IV) піддають взаємодії зі сполукою формули (V) в присутності основи, такої як вторинний або третинний амін, наприклад, диізопропілетиламін, в інертному розчиннику, такому як дихлорметан. У стадії (h), сполуку формули (ХIII) піддають взаємодії із сполукою формули (XIV) у розчиннику, такому як диметилформамід з утворенням проміжної тіосечовини, яку потім опрацьовують основою, такою як метоксид натрію. У стадії (і), сполуку формули (XVI) піддають взаємодії з тіодианатом металу, наприклад, тіоцианатом калію, у розчиннику, такому як ацетонітрил. У стадії (j), сполуку формули (XVII) піддають взаємодії з метилюючим агентом, таким як диметилсульфат, в присутності основи, такої як карбонат калію, із наступним гідролізом проміжного складного ефіру стандартним способом, наприклад, шляхом основного гідролізу з використанням гідроксиду натрію і з одержанням відповідної карбонової кислоти, що потім може бути перетворена в ацилхлорид, наприклад, шляхом обробки оксалилхлоридом. У стадії (k) використовується каталізатор, такий як 4-диметиламінопіридин, і розчинник, такий як піридин. У стадії (1), сполуку формули (XIII) піддають взаємодії із сполукою формули (XV) у розчиннику, такому як диметилформамід з утворенням проміжної тіосечовини, яку потім обробляють основою, такою як метоксид натрію. У стадії (m), сполуку формули (XX) перетворюють у сполуку формули (XIX), де Ra являє собою галоген, шляхом обробки N-галогенсукцинимідом, наприклад, N-хлорсукцинимідом або N-бромсукцинимідом, у розчиннику, такому як тетрахлорметан. Сполуки формул (II) і (IV), а зокрема, сполуки, де Ra і Rb, взяті разом з атомами вуглецю піримідинового кільця, із якими вони зв'язані, утворюють конденсоване п'ятичленне карбоциклічне кільце, є новими і входять в інший аспект даного винаходу. Даний винахід проілюстрований нижченаведеними прикладами. Приклади Структура і чистота проміжних сполук і сполук, описаних у прикладах, були підтверджені 1H-ЯМРспектроскопією і (майже у усіх випадках) мас-спектроскопією, навіть у тих випадках, де ці дані точно незазначені. Проміжна сполука А1 - 4-(4-хлорфеніл)бензальдегід (a) Суміш 4-формілбензолборонової кислоти (2,50г, 2екв.), 4-хлоріодбензолу (1,98г, 1екв.), тетракис(трифенілфосфін)-паладію (0) (0,50г, 0,05екв), водяного карбонату натрію (18мл, 2М розчин, 2екв.) і диметоксіетану (50мл) перемішують при кип'ятінні із зворотнім холодильником в атмосфері аргону протягом ночі, а потім охолоджують і розбавляють етилацетатом. Суміш фільтрують, якщо це необхідно для видалення неорганічних залишків, а потім органічний шар послідовно промивають водяною лимонною кислотою і насиченим розчином солі, сушать і випарюють. Неочищений продукт очищають колоночною хроматографією (двоокис кремнію, 5% етилацетат в гексані); фракції продукту випарюють з одержанням білої твердої речовини (1,32г, 72%). (b) суміш 4-хлорбензолборонової кислоти (19,4г, 1екв.), 4-бромбензальдегіду (22,9г, 1екв.), ацетату паладію (II) (1,4г, 0,05екв), водяного карбонату натрію (30,3г у 144мл розчину, 2екв.) і диметоксіетану (500мл) перемішують при кип'ятінні із зворотнім холодильником в атмосфері аргону на протязі 2,5год, а потім випарюють до невеликого об'єму і розбавляють дихлорметаном. Обробку продовжують як описано в стадії (а) і одержують ідентичний продукт (25,2г, 94%). 1H-ЯМР (CDCl3) d: 10,05 (1Н, с), 7,96 (2Н, д), 7,73 (2Н, д), 7,57 (2Н, д), 7,46 (2Н, д); МС (АР+) для С13Н935СIO: знайдено (М+1)=217; обчислено 216. Проміжна сполука А2 - N-метил-4-(4-хлорфеніл)бензиламін Суміш проміжної сполуки А1 (3,5г, 1екв.), метиламіну (32,3мл 2М розчину в ТГФ, 4екв.) і безводного сульфату магнію (4,47г, 2екв.) перемішують при кімнатній температурі протягом 16год, а потім фільтрують, тверду речовину старанно промивають етилацетатом і об'єднані фільтрати випарюють з одержанням білої твердої речовини (3,7г). Отриману імінову проміжну сполуку суспендують в етанолі (100мл), охолоджують на льоду і порціями додають борогідрид натрію (0,61г, 1екв.). Потім льодяну баню видаляють і суміш перемішують протягом 45 хвилин при кімнатній температурі, а потім протягом 1год при 50°С. Розчинник видаляють у вакуумі, до залишку додають воду, і продукт екстрагують дихлорметаном. Після сушки і випарювання розчинника одержують білу тверду речовину (3,56г). 1H-ЯМР (CDCl3) d: 7,51 (4H, д), 7,40 (4Н, д), 3,79 (2Н, с), 2,48 (3Н, с); МС (APCI+) для C14H1435CIN: обчислено 231, знайдено: (М+1)=232. Проміжна сполука A3 – N-(2-діетиламіноетил)-4-(4-хлорфеніл)бензиламін Суміш проміжної сполуки А1 (55,0г), N,N-діетилетилендіаміну (35,6мл), 4А молекулярного сита (37г) і дихлорметану (1100мл) піддають взаємодії при кімнатній температурі в атмосфері аргону протягом 16год, періодично помішуючи. Тверду речовину відфільтровують і промивають дихлорметаном, а потім об'єднані фільтрати випарюють з одержанням жовтої піни (72,4г). Отриманий проміжний імін відновлюють борогідридом натрію (8,7г) в етанолі (850мл), як описано для проміжної сполуки А2, з одержанням вказаної в заголовку сполуки у вигляді жовтого масла (72,7г). 1H-ЯМР (CDCl3) d: 1,70 (2Н, т), 2,22 (6Н, с), 2,33 (2Н, т), 2,69 (2Н, шир.м), 3,83 (2Н, с), 7,37-7,43 (4Н, м), 7,52-7,56 (4Н, м). Проміжна сполука А4 - 5-гідроксиметил-(4-трифторметил-феніл)піридин Розчин проміжної сполуки А20 (4,63г) у сухому дихлорметані (100мл) охолоджують до -78°С в атмосфері аргону, а потім, протягом 20 хвилин по краплям додають DIBAL-H (26,6мл, 1,5Μ розчин у толуолі). Перемішування продовжують протягом 40 хвилин при -78°С, а потім протягом 15 хвилин по краплях додають 2М соляну кислоту (52мл). Розчин повільно нагрівають до кімнатної температури, а потім органічний шар відокремлюють, промивають водою, сушать і випарюють. Після хроматографії (двуокис кремнію, етилацетат/гексан, 1:1) одержують продукт у вигляді білої твердої речовини (3,03г, 75%). 1H-ЯМР (CDCl3) d: 1,85 (1Н, т), 4,81 (2Н, д), 7,75 (2Н, м), 7,83 (1Н, дд), 8,11 (1Н, д), 8,72 (1Н, м); МС (АРСІ+) для C13H10F3NO: знайдено (М+1)=254; обчислено 253. Проміжна сполука А5 - 5-форміл-2-(4-трифторметил-феніл)піридин Активований діоксид марганцю (3,19г) додають до розчину проміжної сполуки А4 (0,75г) у дихлорметані (50мл) і перемішують при кімнатній температурі протягом 16год. Тверді речовини відфільтровують і фільтрат випарюють із одержанням блідо-жовтої твердої речовини (0,57г). 1H-ЯМР (CDCl3) d: 7,7 (2Н, д), 7,96 (1Н, д), 8,21 (2Н, д), 8,27 (1Н, дд), 9,17 (1Н, д), 10,19 (1H, с); MC (APCI+) для C13H8F3NO: знайдено (М+1)=252; обчислено 251. Проміжна сполука А6 - Етил-2-(4-хлорфеніл)-4-оксопіримідин-5-карбоксилат Етоксид натрію (11,12мл, 2екв.) у вигляді 21% мас/об розчину в етанолі по краплях додають до суспензії діетилетоксималоната (3,03мл, 1екв.) і гідрохлориду 4-хлорбензамідину (4,23г, 1екв.) в етанолі (30мл), а потім суміш кип'ятять із зворотнім холодильником на протязі 4 годин. Після охолодження, розчинник видаляють у вакуумі, і залишок розтирають з ефіром. Тверду речовину відфільтровують, а потім ресуспендують у воді і підкислюють до рН 2. Продукт відфільтровують, промивають водою і сушать; вихід 2,94 р. 1H-ЯМР (ДМСО-d6) d: 1,29 (3Н, т), 4, 26 (2Н, кв.), 7,65 (2Н, м), 8,18 (2Н, м), 8,65 (1Н, с); MC (APCI-) для C13H11CIN2O3: знайдене: (М-1)=277/279; обчислено 278/280. Проміжна сполука А7 - Етил-2-(4-хлорфеніл)-4-хлорпіримідин-5-карбоксила Оксалилхлорид (0,31мл, 2екв.) додають до проміжної сполуки А6 (0,49г) у дихлорметані (20мл) при охолодженні льодом, а потім суміш перемішують протягом 3 годин при нагріванні до кімнатної температури. Після випарювання летучих компонентів одержують продукт у вигляді білої твердої речовини (2,94г). 1H-ЯМР (CDCl3) d: 1,44 (3Н, т), 4,48 (2Н, кв.), 7,50 (2Н, м), 8,45 (2Н, м), 9,17 (1Н, с); МС (АРСІ+) для С13Н10Сl2N2О2: знайдено (М+1)=297; обчислено 296. Проміжна сполука А8 - Етил-2-(4-хлорфеніл)піримідин-5-карбоксилат Суміш проміжної сполуки А7 (6,8г, 1екв), цинкового порошку (1,79г, 1,2екв), оцтової кислоти (1,57мл, 1,2екв) і ТГФ (100мл) перемішують при 60°С в атмосфері аргону протягом 18 годин, а потім додають додаткову порцію оцтової кислоти (1мл) і цинку (1,0г), і реакційну суміш перемішують ще 24 години. Розчинник видаляють у вакуумі, залишок розчиняють у суміші дихлорметану і метанолу, а цинковий порошок, що не розчинився, видаляють шляхом фільтрації. Після випарювання розчинника, продукт кристалізують із етанолу, вихід 2,02г. 1H-ЯМР (CDCl3)d: 1,44 (3Н, т), 4, 46 (2Н, кв), 7,48 (2Н, м), 8,48 (2H, м), 9,30 (2Н, с); МС (APCI+) для С13Н11СIN2О2: знайдено:(М+1)=263; обчислено 262. Проміжна сполука А9 - 5-гідроксиметил-2-(4-трифтор-метилфеніл)піримідин Проміжну сполуку А41 (0,96г) гідрують 10%-ним паладієм на вугіллі (96мг) у суміші триетиламіну (2мл) і етанолу (20мл) протягом 90 хвилин під тиском в 1 атмосферу. Каталізатор видаляють фільтрацією, розчинник випарюють і залишок розчиняють в етилацетаті і послідовно промивають водяним хлоридом амонію і водяним бікарбонатом натрію. Після сушки і випарювання одержують вказану в заголовку сполуку (0,77г). 1H-ЯМР (CDCl3) d: 4,82 (2Н, с), 7,75 (2Н, м), 8,57 (2Н, м), 8,85 (2Н, с); МС (АРС1+) для C12Η9F3Ν2Ο: знайдено: (М+1)=255; обчислено 254. Проміжна сполука А10 - 3-(4-трифторметилфеноксі)бензиловий спирт Суміш 4-хлорбензотрифториду (27,1г, 1,5екв.), 3-гідроксибензилового спирту (12, 4г, 1екв.), хлориду міді (І) (0,2г, 0, 02екв.), карбонату калію (8,3г, 0,6екв.), 8-хінолінола (0,29г, 0,02екв.) і 1,3-диметил-2імідазолідинона (50мл) перемішують при 150°С протягом 3 днів в атмосфері аргону. Після охолодження, залишок виливають у воду і екстрагують етилацетатом. Після сушки і випарювання з наступною хроматографією (двоокис кремнію, дихлорметан) одержують вказану в заголовку сполуку у вигляді світлої рідини (11,3г). 1H-ЯМР (CDCl3) d: 1,88 (1Н, τ), 4,69 (2Η, д), 6,97 (1H, м), 7,04 (3Н, м), 7,17 (1H, м), 7,36 (1Н, м), 7,57 (2Н, м); МС (АРСІ-) для C14H11F3O2: знайдено: (М-1)= 267; обчислено 268. Проміжна сполука А11 - 4-(4-трифторметилфеноксі)-бензилальдегід Суміш 4-(трифторметил)фенолу (4,86г, 1екв.), 4-фторбензальдегіду (3,22г, 1екв.), карбонату калію (4,15 р, 1екв.) і диметилформаміду (60мл) перемішують при 150°С протягом 3 годин, а потім виливають у льодову воду. Осад відфільтровують, промивають водою, а потім екстрагують гарячим етанолом. Нерозчинну тверду речовину видаляють фільтрацією, і фільтрат випарюють і очищають хроматографією на двоокисі кремнію. 1H-ЯМР (CDCl3) d: 7,14 (4Н, м), 7,66 (2Н, м), 7,90 (2Н, м), 9,97 (1H, с); МС (АРСІ+) для C14H9F3O2: знайдено: (М+1)=267; обчислено 266. Проміжна сполука А12 - трет-бутил-(2-гідроксиетил)етил-карбамат Ди-трет-бутилдикарбонат (15,5г, 1екв.) додають протягом 1 години до розчину 2-(етиламіно)етанолу (7,5г, 1екв.) у дихлорметані (30мл) при 0°С. Після перемішування при кімнатній температурі протягом 16 годин, розчинник випарюють, і залишок піддають дистиляції (1150, 0,6мМ. рт. ст.) з одержанням вказаної в заголовку сполуки у вигляді безбарвного масла (13, 42г). 1H-ЯМР (CDCl3) d: 1,11 (3Н, т), 1,47 (9Н, с), 3,27 (2Н, кв), 3,38 (2Н, т), 3,75 (2Н, т). Проміжна сполука А13 - трет-бутил-[(2-фталімідил)етил]-етилкарбамат Діетилазодикарбонат (12,35г, 1екв.) по краплях додають до суміші проміжної сполуки А12 (13,42г, 1екв.), фталиміду (10,43г, 1екв.) і трифенілфосфіну (18,6г, 1екв.) у ТГФ (200мл), і суміш перемішують при кімнатній температурі протягом 16 годин. Розчинник випарюють і додають діетиловий ефір. Розчин охолоджують до 0°С, і продукти, що не розчинилися, видаляють фільтрацією. Розчинник випарюють і залишок піддають колончатій хроматографії (двоокис кремнію, гексан/етилацетат, 9:1) з одержанням вказаної в заголовку сполуки у вигляді безбарвного масла (17г). 1H-ЯМР (CDCl3) d: 1,13 (3Н, м), 1,29 (9Н, с), 3,26 (2Н, м), 3,48 (2Н, м), 3,84 (2Н, т), 7,71 (2Н, м), 7,85 (2Н, м). Проміжна сполука А14 - трет-бутил-(2-аміноетил)етилкарбамат Моногідрат гідразину (5,2мл, 2екв.) додають до розчину проміжної сполуки А13 (17г, 1екв.) у етанолі (300мл) і реакційну суміш перемішують при кімнатній температурі протягом 16 годин. Отриману тверду речовину відфільтровують і розчинник випарюють. Залишок розподіляють між діетиловим ефіром і гідроксидом натрію (1М, 150мл), органічну фазу сушать (К2СО3), і розчинник видаляють, у результаті чого одержують вказану в заголовку сполуку у вигляді жовтого масла (9,05г). 1H-ЯМР (CDCl3) d: 1,10 (3Н, т), 1,45 (9Н, с), 2,65 (2Н, кв.), 2,73 (2Н, т), 3,23 (2Н, м). Проміжна сполука Α15 - 3-(4-трифторметил-біфеніл-4-іл)-пропан-1-ол Боран у тетрагідрофурані (1,ОМ, 44,5мл, 2,5екв.) по краплях додають до розчину проміжної сполуки А23 (5,23г, 1екв.) у тетрагідрофурані (65мл) при 0°С. Розчин залишають нагріватися до кімнатної температури і продовжують розмішувати протягом 16 годин. Реакцію гасять додаванням води, і суміш екстрагують етилацетатом. Органічну фазу промивають водяним розчином бікарбоната натрію, сушать (MgSO4) і розчинник випарюють з одержанням залишку, який вводять у колонку для хроматографії (двоокис кремнію, дихлоретан) і одержують вказану в заголовку сполуку у вигляді безбарвної твердої речовини (4,31г). 1H-ЯМР (CDCl3) d: 1,76 (2Н, м), 2,67 (2Н, т), 3,45 (2Н, м), 7,32 (2Н, д), 7,64 (2Н, д), 7,78 (2Н, д), 7,86 (2Н, д). Проміжна сполука А16 - 3-(4-трифторметил-біфеніл-4-іл)-пропіональдегід Диметилсульфоксид (2,36мл, 2,4екв.) по краплях додають до розчину оксалилхлориду (1,46мл, 1,1екв.) у дихлорметані (34мл) при -55°С, і розчин перемішують протягом 2 хвилин. Потім до цього розчину повільно при -55°С додають розчин проміжної сполуки А15 (4,28г, 1екв.) у дихлорметані (40мл), і отриманий розчин перемішують ще 10 хвилин, після чого додають триетиламін (9,7мл, 5екв.). Після перемішування ще 5 хвилин, реакційну суміш залишають нагріватися до кімнатної температури, а потім розбавляють водою. Органічну фазу відокремлюють, сушать (MgSО4) і розчинник видаляють, у результаті чого одержують вказану в заголовку сполуку (3,48г). 1H-ЯМР (CDCl3) d: 2,83 (2Н, м), 3,02 (2Н, т), 7,29 (2Н, д), 7,51 (2Н, д), 7,67 (4Н, с), 9, 85 (1Н, с), МС (АРСІ+) для C16H13F3O: знайдено:(М+1)=279; обчислено 278. Проміжна сполука А17 - С-(4'-трифторметил-біфеніл-4-іл)метиламін Розчин проміжної сполуки А13 (31г, 1екв.) у тетрагідрофурані (300мл) по краплях додають до розчину алюмогідриду літію (1,ОМ у тетрагідрофурані, 188мл, 1,5екв.) при кімнатній температурі і при перемішуванні. Реакційну суміш перемішують протягом 8 годин, після чого додають водяний хлорид амонію (200мл), а потім воду (200мл). Отриману суміш фільтрують через целіт, а потім екстрагують дихлорметаном. Органічну фазу сушать (MgSО4), і розчинник видаляють з одержанням вказаної в заголовку сполуки (26,7г). 1H-ЯМР (ДМСО) d: 3,89 (2Н, с), 7,52 (2Н, д), 7,73 (2Н, д), 7, 82 (2Н, д), 7, 98 (2Н, д). Проміжна сполука А18 - N-(1-етил-піперидин-4-іл)-(4'-трифторметилфеніл)бензиламін Розчин проміжної сполуки А17 (9,3г, 1екв.) і 1-етил-4-піперидон (5,0мл, 1,05екв.) у 1,2 дихлоретані (135мл) обробляють тріацетоксиборогідридом натрію (11мг, 1,4екв.) і оцтовою кислотою (2,23 р, 1,05екв.) при кімнатній температурі, і суміш перемішують протягом 24 годин. Реакцію гасять додаванням гідроксиду натрію (2М, 125мл) і екстрагують діетиловим ефіром. Органічну фазу сушать (MgSO4) і розчинник випарюють з одержанням залишку, що розтирають із гексаном, у результаті чого одержують вказану в заголовку сполуку у вигляді не зовсім білої твердої речовини (8,2г). 1H-ЯМР (CDCl3) d: 1,06 (3Н,. т), 1,48 (3Н, м), 2,01 (4Н, м), 2,38 (2Н, кв.), 2,55 (1Н, м), 2,92 (2H, м), 3,88 (2Н, с), 7,43 (2Н, д), 7,59 (2Н, д), 7,68 ( 4Н, с). Проміжна сполука А120 - Трет-бутил(2-аміно-2-метилпропіл)карбам ат Дитрет-бутилдикарбонат (6,58г, 1екв.) у тетрагідрофурані (100мл) по краплях додають до розчину 1,2діаміно-2-метилпропана (8,8г, 3,3екв.) у тетрагідрофурані (100мл) при 0°С. Потім розчин перемішують при кімнатній температурі протягом 16 годин. Розчинник випарюють і залишок розподіляють між водяним хлоридом натрію і етилацетатом. Органічну фазу сушать (К2СО3), і розчинник випарюють з одержанням вказаної в заголовку сполуки у вигляді безбарвної твердої речовини (5,45г). 1H-ЯМР (CDCl3) d: 1,09 (6Н, с), 1,45 (9Н, с), 3,00 (2Н, д), МС (АРСl+) для C9H20N2O2: знайдено: (М+1)=189; обчислено 188. Проміжна сполука А121 - трет-Бутил(2-етиламіно-2-метилпропіл)карбам ат Проміжна сполука А120 (5,45г, 1екв.) іодоетан (2,32мл, 1екв.) і карбонат калію (4г, 1екв.) у диметилформаміді (80мл) перемішують при кімнатній температурі протягом 16 годин. Розчинник випарюють, і залишок розподіляють між дихлорметаном і водою. Органічний шар сушать (К2СО3), розчинник випарюють і залишок піддають хроматографії на колонці (двоокис кремнію, дихлорметан/метанол, 10:1) з одержанням вказаної в заголовку сполуки у вигляді світло-коричневого масла (3,89г). 1H-ЯМР (CDCl3) d: 1,05 (6Н, с), 1,08 (3Н, т), 1,45 (9Н, с), 2,54 (2Н, кв.), 3,03 (2Н, м). МС (АРСІ+) для С11Н24N2О2: знайдено: (М+1)=217; обчислено 216. Проміжна сполука А122 - Дигідрохлорид N2-етил-2-метилпропан-1.2-діаміна Хлористий водень (4М у діоксані, 70мл) додають до розчину проміжної сполуки А121 (3,89г) у діоксані (100мл), і отриману суспензію перемішують при кімнатній температурі протягом 16 годин. Розчинник випарюють, і залишок суспендують у діетиловому ефірі, після чого отриману тверду речовину відфільтровують, збирають, і одержують вказану в заголовку сполуку у вигляді безбарвної твердої речовини (2,99г). 1H-ЯМР (ДМСО-d6) d: 1,26 (3Н, т), 1,39 (6Н, с), 2,97 (2Н, кв.), 3,19 (2Н, с), МС (АРСІ+) для C6H16N2: знайдено:(М+1)=117; обчислено 116. Проміжна сполука А123 - 2-(2-трет-бутиламіноетил)-фталимід Суміш 2-брометилфталиміду (20г, 2екв.), третбутиламіну (41мл, 1екв.) і карбонату калію (10,86г, 2екв.) у диметилформаміді (200мл) нагрівають до 50°С протягом 48 годин. Розчинник випарюють, і залишок розподіляють між дихлорметаном і водою. Органічну фазу сушать (К2СО3), і розчинник випарюють з одержанням вказаної в заголовку сполуки у вигляді жовтогарячої твердої речовини (18,93г). 1H-ЯМР (CDCl3) d: 1,05 (9Н, с), 2,85 (2Н, т), 3,77 (2Н, т), 7,72 (2Н, м), 7,85 (2Н, м). Проміжна сполука А124 - N-трет-бутилетан-1,2-діамін Суміш проміжної сполуки А123 (4г, 1екв.) і гідрат гідразину (1,58мл, 2екв.) в етиловому спирті, денатурованому метиловим спиртом, (100мл) кип'ятять із зворотнім холодильником протягом 16 годин. Тверду речовину відфільтровують і розчин використовують безпосередньо в послідуючій стадії. Нижченаведені проміжні сполуки були отримані способом, описаним для проміжної сполуки А1: № Попередники Метил-6-хлорнікотинат, 4-трифторметиленА20 бензолборонова кислота 4-бромбензальдегід, 4-трифторметилA21 бензолборонова кислота A22 4-бромацетофенон, 4-хлорбензолборо-нова кислота 4-(трифторметил)бромбензол 4-(2-карбоA23 ксиетил)фенілборонова кислота 2-(4-бромфеноксі)етанол 4-трифтормеA24 тилбромбензолборонова кислота 4-бромбензонітрил 4-трифторметилбромA130 бензолборова кислота Назва Метил-6-(4-трифторме-тилфеніл)нікотинату 4-(4-трифторметилфеніл)-бензальдегід 4-ацетил-4'-хлорбіфеніл 3-(4-трифторметил-біфеніл-4-іл)пропіонова кислота 2-(4-трифторметил-біфені-локсі)-етанол 4'-трифторметил-біфеніл-4 карбонітрил Нижченаведені проміжні сполуки були отримані методом, описаним для проміжної сполуки А2: Нижченаведені проміжні сполуки були отримані способом, описаним для одержання проміжної сполуки A3: Нижченаведені проміжні сполуки були отримані способом, описаним для проміжної сполуки А4: № А40 А41 Попередник Пром.спол. А8 Пром.спол. А53 Назва 5-Гідроксиметил-2-(4-хлорфеніл)піримідин 4-хлор-5-гідроксиметил-2-(4-трифтор-метилфеніл)піримідин Нижченаведені проміжні сполуки були отримані способом, описаним для проміжної сполуки А5: № A50 A51 A54 Попередник Пром.спол. А40 Пром.спол. А9 Пром.спол. А10 Назва 5-Форміл-2-(4-хлорфеніл)піримідин 5-Форміл-2-(4-трифторметилфеніл)піримідин 3-(4-трифторметилфеноксі)бензальдегід Нижченаведені проміжні сполуки були отримані способом, описаним для проміжної сполуки А6: № А52 Попередники Діетилетоксималонат, 4трифторметилбензамідин, HCl Назва Етил-2-(4-трифторметилфеніл)-4-оксопіримідин5-карбоксилат Нижченаведені проміжні сполуки були отримані способом, описаним для проміжної сполуки А7: № Попередники Назва А53 Пром. спол. А52 Етил-2-(4-трифторметилфеніл)-4-хлорпіримідин-5-карбоксилат Нижченаведені проміжні сполуки були отримані способом, описаним для проміжної сполуки А16: № A55 Попередники Пром. спол. А24 Назва (4-трифторметилбіфеніл)-4-ілокси)ацетальдегід Нижченаведені проміжні сполуки були отримані способом, описаним для одержання проміжної сполуки Α18 із використанням проміжної сполуки А17 і відповідним чином заміщеного 1-алкіл-4-піперидона: № А60 А61 А62 Назва Ν-(1-метилпіперидин-4-іл)-(4'-трифторметилфеніл)бензиламін N-(1-ізопропілпіперидин-4-іл)-(4'-трифторметилфеніл)-бензиламін N-(1-(2-метоксиетил)піперидин-4-іл)-(4'-трифторметилфеніл)-бензиламін Нижченаведені сполуки є комерційно доступними: Проміжна сполука В1, 2-тіоурацил; проміжна сполука В2, 5-метил-2-тіоурацил; проміжна сполука В3, 5етил-2-тіоурацил; проміжна сполука В4, 5-пропіл-2-тіоурацил; проміжна сполука В5, 5,б-диметил-2тіоурацил; Нижченаведені сполуки можуть бути отримані способами, описаними в літературі: Проміжна сполука В6, 5-карбетокси-2-тіоурацил (J.Amer.Chem.Soc. 794, 64 (1942)); Проміжна сполука В7, 5,6-триметилен-2-тіоурацил (J.Amer. Chem. Soc. 3108,81(1959)); Проміжна сполука В8, 5,6-тетраметилен-2-тіоурацил (J.Org. Chem. 133, 18 (1953)); Проміжна сполука В9, 5-метокси-2-тіоурацил (J. Chem. Soc. 4590 (1960)). Проміжна сполука В10 - 5-(2-гідроксиетил)-2-тіоурацил Розчин етилформіату (33,1мл, 2,1екв.) і gбутиролактону (15мл, 1екв.) в ефірі (400мл) по краплях, перемішуючи, додають до розчину трет-бутоксиду калію (52,5г, 2,4екв) у тетрагідрофурані (400мл). Суміш залишають для нагрівання до кімнатної температури і перемішують протягом ночі. Розчинник видаляють у вакуумі, додають 2-пропанол (600мл) і тіосечовину (29,7г, 2екв), і суміш кип'ятять із зворотнім холодильником протягом 5год. Після охолодження до кімнатної температури, осад відфільтровують, розчиняють у воді (500мл) і двічі промивають ефіром. Водяний розчин підкислють до рН 5,5 додаванням оцтової кислоти й отриманий осад відфільтровують, старанно промивають водою і сушать у вакуумі; вихід 23,85г. 1H-ЯМР (ДМСО-d6) d: 2,36 (2Н, т), 3,47 (2Н, м), 4,57 (1Н, м), 7,24 (1H, с), 12,2 і 12,4 (кожний 1Н, шир.с); МС (АРСІ-) для C6H8N2O2S: знайдено (М11)=171, обчислено 172. Проміжна сполука В111 - Етил(2,4-дioксо-4Н-бензо[d]-[1,3]оксазин-1-іл)ацетат Ангідрид ізатонової кислоти (10 р, 1екв.) у диметилформаміді (30мл) по краплях додають до суспензії гідриду натрію (2,45г, 60% у мінеральному маслі, 1екв.) у диметилформаміді (70мл) при кімнатній температурі. Реакційну суміш перемішують протягом 1 години, а потім додають етилбромацетат (6,8мл, 1екв.) і отриману суміш перемішують протягом 16 годин. Розчинник випарюють, залишок суспендують у воді, і тверду речовину збирають. Вказану в заголовку сполуку одержують шляхом кристалізації з етилацетату (10,5г). 1H-ЯМР (CDCl3) d: 1,29 (3Н, т), 4,27 (2Н, кв.), 4,82 (2Н, с), 6,96 (1Н, д), 7,33 (1Н, т), 7,74 (1Н, дт), 8,19 (1Н, дд). Проміжна сполука В112 - Етил(4-оксо-2-тіоксо-3,4-дигідро-2Н-хіназолін-1-іл)ацетат Проміжна сполука ВІН (2,64г, 1екв.) і тіосечовину (2,42г, 4екв.) у 1-метил-2-піролідиноні (40мл) нагрівають до 180°С протягом 2 годин. Після охолодження суміш оброблюють водою, і отриману тверду речовину збирають фільтрацією. Цю тверду речовину піддають колончатій хроматографії (двоокис кремнію, 2% метанол/дихлорметан) з одержанням вказаної в заголовку сполуки у вигляді безбарвної твердої речовини (0,169г). 1H-ЯМР (CDCl3) d: 1,22 (3Н, т), 4,21 (2Н, кв.), 5,53 (2Н, шир.с), 7,46 (1Н, т), 7,53 (1Н, д), 7,81 (1H, дт), 8,07 (1H, дд). Проміжна сполука В113 - Метил (3-[3-(1-фенілметаноіл)-тіоуреідо]тіофен-2-карбоксилат Метил-3-аміно-2-тіофенкарбоксилат (30г, 1екв.) і бензоілізотіоцианат (46мл, 1,8екв.) в ацетоні (250мл) нагрівають до 65°С протягом 30 годин. Після охолодження, розчин концентрують і отриману тверду речовину відфільтровують і сушать (40,54г). 1H-ЯМР (CDCl3) d: 3,98 (3Н, с), 7,54 (4Н, м), 7,94 (2Н, м), 8,81 (1H, д), 9,15 (1H, шир.с); МС (АРСІ+) для C14H12N2O3S2: знайдено: (М+1)=321, обчислено 320. Проміжна сполука В114 - 2-Тіоксо-2,3-дигідро-1Н-тієно[3,2-d]піримідин-4-он Гідроксид калію (13,83г, 2екв.) розчиняють в етанолі (1000мл), а потім, перемішуючи, виливають у проміжну сполуку ВИЗ (40,54г, 1екв.). Суміш кип'ятять із зворотнім холодильником протягом 1 години, і після охолодження одержують вказану в заголовку сполуку шляхом фільтрації (17,32г). 1H-ЯМР (CDCl3) d: 6,87 (1H, д), 7,77 (1H, д), 10,46 (2Н, шир.с); МС (АРСІ-) для C6H4N2OS2: знайдено: (М-1)=183, обчислено 184. Нижченаведені проміжні сполуки були отримані способом, описаним для проміжної сполуки В10: № Попередник Назва ВИ В12 В13 Моноетилсукцінат Етилетоксиацетат Етил(метилтіо)ацетат 5-карбоксиметил-2-тіоурацил 5-етокси-2-тіоурацил 5-метилтіо-2-тіоурацил Проміжна сполука В20 - 2-(4-фторбензилтіо)-5-метилпіримідин-4-он Суміш проміжної сполуки В2 (9,45г, 1екв.), 4-фторбензилхлориду (7,96мл, 1екв.), карбонату калію (18,4г, 2екв.) і диметилформаміду (100мл) перемішують при 90°С в атмосфері аргону протягом 16 годин. ДМФ видаляють у вакуумі, додають воду, і продукт екстрагують етилацетатом. Органічний шар сушать і випарюють, після чого залишок розтирають із петролійним ефіром і одержують вказану в заголовку сполуку у вигляді білої твердої речовини (8,76г). 1H-ЯМР (CDCl3) d: 2,02 (3Н, с), 4,38 (2Н, с), 6,97 (2Н, м), 7,35 (2Н, м), 7,74 (1Н, с); МС (АРС1+) для C12H11FN2OS: знайдено: (М+1)=251, обчислено 250. Нижченаведені проміжні сполуки були отримані способом, описаним для проміжної сполуки В20: № В21 В22 В23 В24 В25 В26 В27 В28 В29 В30 В31 В132 Попередник Пром.спол. В1 Пром.спол. В3 Пром.спол. В4 Пром.спол. В6 Пром.спол. В10 Пром.спол. В5 Пром.спол. В7 Пром.спол. В8 Пром.спол. В9 Пром.спол. В12 Пром.спол. В13 Пром.спол В114 Назва 2-(4-фторбензилтіо)піримідин-4-он 2-(4-фторбензилтіо)-5-етилпіримідин-4-он 2-(4-фторбензилтіо)-5-пропілпіримідин-4-он 2-(4-фторбензилтіо)-5-етоксикарбоніл-піримідин-4-он 2-(4-фторбензилтіо)-5-(2-гідроксиетил)-піримідин-4-он 2-(4-фторбензилтіо)-5,6-диметилпіримідин-4-он 2-(4-фторбензилтіо)-5,6-триметиленпіримідин-4-он 2-(4-фторбензилтіо)-5,6-тетраметиленпіримідин-4-он 2-(4-фторбензилтіо)-5-метоксипіримідин-4-он 2-(4-фторбензилтіо)-5-етоксипіримідин-4-он 2-(4-фторбензилтіо)-5-метилтіопіримідин-4-он 2-(4-фторбензилтіо)-1Н-тієно[3,2-d]-піримідин-4-он Нижченаведені проміжні сполуки були отримані способом, описаним для проміжної сполуки В20, і з використанням відповідного бензилхлориду № В133 В134 B135 B136 Попередник Пром.спол. В7 2,3-дифторбензилхлорид Пром.спол. В7 3,4-дифторбензилхлорид Назва 2-(2,3-дифторбензилтіо)-5,6-триметиленпіримідин-4-он 2-(3,4-дифторбензилтіо)-5,6-триметиленпіримідин-4-он 2-(2,3,4-трифторбензилтіо)-5,6-триметиленпіримідинПром.спол. В7 2,3,4-трифторбензилхлорид 4-он Пром.спол. В7 2-фторбензилхлорид 2-(2-фторбензилтіо)-5,6-триметиленпіримідин-4-он Проміжна сполука В37-2-(4-фторбензилтіо)-5-гідроксиметилпіримідин-4-он Комплекс борана-тетрагідрофурану (143мл, 2,2екв, 1,ОМ у ТГФ) по краплях, в атмосфері аргону, додають, перемішуючи, до охолодженого розчину проміжної сполуки В24 (20г, 1екв.) у сухому ТГФ (700мл). Після перемішування протягом ще 30 хвилин при 0°С, суміш залишають нагріватися до кімнатної температури і перемішування продовжують протягом ночі. Розчинник випарюють, додають, перемішуючи, 50% водяну оцтову кислоту (500мл), і суміш випарюють досуха. Залишок гідролізують гарячою водою (500мл) протягом 5 хвилин, а потім тверду речовину відфільтровують. Отриману тверду речовину і фільтрат екстрагують дихлорметаном, і органічні екстракти об'єднують і очищають хроматографією (двоокис кремнію, 2-8% метанол у дихлорметані). Фракції продукту випарюють і одержують білу тверду речовину (6,14г). 1H-ЯМР (ДМСО-d6) d: 4,25 (2Н, с), 4,39 (2Н, с), 7,14 (2Н, т), 7,45 (2Н, м), 7,82 (1H, шир.с); МС (АРСІ+) для C12H11FN2O2S: знайдено: (М+1)=267, обчислено 266. Проміжна сполука В38 - 2-(4-фторбензилтіо)-5-ізопропоксикарбонілметилпіримідин-4-он Суміш проміжної сполуки ВИ (2,60г, 1екв), 4-фторбензилброміду (1,74мл, 1екв.) і 2-пропанола (50мл) перемішують при кип'ятінні із зворотнім холодильником протягом 3 годин, а потім концентрують у вакуумі з одержанням суспензії, і розбавляють ефіром. Тверду речовину відфільтровують, промивають ефіром і сушать; вихід 2,87г; 1H-ЯМР (ДМСО-d6) d: 1,17 (6Н, д), 3,31 (2Н, с), 4,40 (2Н, с), 4,89 (1H, м), 7,14 (2Н, т), 7,45 (2Н, м), 7,84 (1Н, с); МС (АРСІ+) для C15H17FN2O3S: знайдено: (М+1)=325, обчислено 324. Проміжна сполука В40-1-(трет-бутоксикарбонілметил)-2-(4-фторбензил-тіо)-5-метилпіримідин-4-он Суміш проміжної сполуки В20 (6,30г, 1екв), трет-бутиліодацетату (6,1г, 1,2екв.), діізопропілетиламіну (5,27мл, 1,2екв.) і дихлорметану (100мл) перемішують при кімнатній температурі в атмосфері аргону протягом 16 годин, після чого розчин промивають водяним хлоридом амонію і водяним бікарбонатом натрію, сушать і випарюють. Після проведення хроматографії (двоокис кремнію, етилацетат + 0,5% об/об водяного аміаку) із наступною кристалізацією з етилацетату одержують вказану в заголовку сполуку у вигляді білої твердої речовини (3,36г); 1H-ЯМР (CDCl3) d: 1,44 (9Н, с), 2,01 (3Н, д), 4,36 (2Н, с), 4,51 (2Н, с), 6,98 (3Н, м), 7,36 (2Н, м); МС (АРСІ+) для C18H21FN2O3S: знайдено: (М+1)=365, обчислено 364. Нижченаведені проміжні сполуки були отримані способом, описаним для проміжної сполуки В40: № В41 В42 В43 В44 В45 Попередник Пром. спол. В21 Пром.спол. В22 Пром. спол. В23 Пром. спол. В24 Пром. спол. В38 Назва 1-(трет-бутоксикарбонілметил)-2-(4-фторбензилтіо)піримідин-4-он 1-(трет-бутоксикарбонілметил)-2-(4-фторбензилтіо)-5-етилпіримідин-4-он 1-(трет-бутоксикарбонілметил)-2-(4-фторбензилтіо)-5-пропілпіримідин-4-он 1-(трет-бутоксикарбонілметил)-2-(4-фторбензилтіо)-5-етоксикарбоніл-4-он 1-(трет-бутоксикарбонілметил)-2-(4-фторбензилтіо)-5 В46 Пром. спол. В37 В47 Пром. спол. В25 В48 Пром. спол. В26 B49 Пром. спол. В27 B50 Пром. спол. В28 B51 B52 B53 Пром. спол. В29 Пром. спол. В30 Пром. спол. В31 B154 Пром. спол. В133 B155 Пром. спол. В134 B156 Пром. спол. В135 B157 Пром. спол. В136 B158 Пром. спол. В132 ізопропоксикарбонілметилпіримідин- 4-он 1-(трет-бутоксикарбонілметил)-2-(4-фтор-бензилтіо)-5-гідроксиметилпіримідин-4он 1-(трет-бутоксикарбонілметил)-2-(4-фтор-бензилтіо)-5-(2-гідроксиетил)піримідин4-он 1-(трет-бутоксикарбонілметил)-2-(4-фтор-бензилтіо)-5,6-диметилпіримідин-4-он 1-(трет-бутоксикарбонілметил)-2-(4-фтор-бензилтіо)-5,6-триметиленпіримідин-4он 1-(трет-бутоксикарбонілметил)-2-(4-фтор-бензилтіо)-5,6-тетраметиленпіримідин4-он 1-(трет-бутоксикарбонілметил)-2-(4-фтор-бензилтіо)-5-метоксипіримідин-4-он 1-(трет-бутоксикарбонілметил)-2-(4-фтор-бензилтіо)-5-етоксипіримідин-4-он 1-(трет-бутоксикарбонілметил)-2-(4-фтор-бензилтіо)-5-метилтіопіримідин-4-он 1-(трет-бутоксикарбонілметил)-2-(2,3-дифтор-бензилтіо)-5,6тетраметиленпіримідин-4-он 1-(трет-бутоксикарбонилметил)-2-(3,4-дифтор-бензилтіо)-5,6тетраметиленпіримідин-4-он і-(трет-бутоксикарбонілметил)-2-( 2, 3, 4 -трифторбензилтіо)-5,6тетраметиленпіримідин-4-он 1-(трет-бутоксикарбонілметил)-2-(2-фтор-бензилтіо)-5,6-тетраметиленпіримідин4-он 1-(трет-бутоксикарбонілметил)-2-(4-фтор-бензилтіо)-4-оксо-4Н-тієно[3,2d]піримідин-1 -он 57 Нижченаведені проміжні сполуки були отримані способом, описаним для проміжної сполуки В20: № В159 Попередник Пром.спол. В112 Назва Етил[2-(4-фторбензилтіо)-4-оксо-4Н-хіназолін-1-іл]ацетат Проміжна сполука В56 - 1-(трет-бутоксикарбонілметил)-2-(4-фторбензилтіо)-5-хлорпіримідин-4-он Суміш проміжної сполуки В41 (7,45г, 1екв.), N-хлорсукциниміду (2,84г, 1екв.) і чотирьоххлористого вуглеводу (150мл) перемішують при кип'ятінні із зворотнім холодильником в атмосфері аргону протягом 2 годин, а потім розчин випарюють. Після проведення хроматографії (двоокис кремнію, етилацетат), із наступним розтиранням з ефіром одержують вказану в заголовку сполуку у вигляді білої твердої речовини (4,45г); 1H-ЯМР (CDCl3) d:1,45 (9Н, с), 4,40 (2Н, с), 4,50 (2Н, с), 6,99 (2Н, м), 7,35 (2Н, м), 7,40 (1Н, с); МС (АРСІ+) для C17H18ClFN2O3S: знайдено: (М+1) =385/387, обчислено 384/386. Проміжна сполука В57 - 1-(трет-бутоксикарбонілметил)-2-(4-фторбензилтіо)-5-бромпіримідин-4-он Зазначену в заголовку сполуку одержують так само, як і проміжну сполуку В56, за винятком того, що замість N-хлорсукциниміду використовують N-бромсукцинимід; 1H-ЯМР (CDCl3) d: 1,45 (9Η, с), 4,40 (2Н, с), 4,49 (2Н, с), 6,99 (2Н, м), 7,35 (2Н, м), 7,53 (1H, с); МС (APCI+) для C17H18BrFN2O3S: знайдено: (М+1)=429/431, обчислено 428/430. Проміжна сполука В58 1-(трет-бутоксикарбонілметил)-2-(4-фторбензилтіо)-5метилсульфінилпіримідин-4-он м-Хлорпербензойну кислоту (0,93г) додають до охолодженої льодом суспензії проміжної сполуки В53 (1,50г) у дихлорметані (20мл). Отриманий розчин залишають нагріватися до кімнатної температури і перемішують протягом ЗО хвилин, а потім промивають водяним бікарбонатом натрію. Після проведення хроматографії (двоокис кремнію, 3-8% метанол у етилацетаті) одержують зазначену в заголовку сполуку у вигляді білої твердої речовини (1,15г); 1H-ЯМР (CDCl3) d: 1,46 (9Н, с), 2,94 (3Н, с), 4,51 (4Н, м), 7,01 (2Н, м), 7,37 (2Н, м ), 7,60 (1H, с); МС (АРС1+) для C18H21FN2O4S2: знайдено: (М+1)=413, обчислено 412. Проміжна сполука В60 - 1-(карбоксиметил)-2-(4-фторбензилтіо)-5-метилпіримідин-4-он Проміжну сполуку В40 (3,88г) додають до розчину трифтороцтової кислоти (10мл) у дихлорметані (20мл) в атмосфері аргону і суміш перемішують протягом ночі при кімнатній температурі. Після випарювання розчинника і розтирання з ефіром одержують зазначену в заголовку сполуку у вигляді білої твердої речовини (3,04г). 1H-ЯМР (ДМСО-d6) d: 1,81 (3Н, д), 4,42 (2Н, с), 4,66 (2Н, с), 7,14 (2Н, м), 7,47 (2Н, м), 7,63 (1H, м); МС (АРСІ+) для C14H13FN2O3S: знайдено: (М+1)=309, обчислено 308. Нижченаведені проміжні сполуки були отримані способом, описаним для проміжної сполуки В60: Проміжна сполука В80-1-(N-метил-N-(4-(4-хлорфеніл)-бензил)амінокарбонілметил)-2-(4-фторбензил)тіо5-(2-азидоетил)-піримідин-4-он Суміш сполуки прикладу 39 (1,88г, 1екв.), метансульфонового ангідриду (0,713г, 1,2екв)/триетиламіну (0,665мл) і дихлорметану (20мл) перемішують при 0°С протягом 4 годин. Розчин промивають водою, сушать і випарюють з отриманням світлої піни (2,4г). Отримана речовина розчиняють у диметилформаміді (20мл), додають азид натрію (0,266г, 1,2екв.) і суміш перемішують в атмосфері аргону при кімнатній температурі протягом ночі. Розчинник випарюють, залишок розподіляють між водою і дихлорметаном, і органічний шар сушать і випарюють. Після проведення хроматографії (двоокис кремнію, етилацетат) одержують вказану в заголовку сполуку у вигляді білої твердої речовини; 1H-ЯМР (CDCl3) d: 2,66 (2Н, м), 2,88 (3Н, с), 3,60 (2Н, м), 4,46-4,64 (6Н, м), 6,84-7,50 (12Н, м), 8,02 (1Н, с); МС (АРСІ+) для C29H26ClFN6O2S: знайдено: (М+1)=577/579, обчислено 576/578. Нижченаведені проміжні сполуки були отримані способом, описаним для проміжної сполуки В80: Назва 1-(N-(2-(діетиламіно)етил)-N-(4-(4-трифторметилВ81 Приклад 42 феніл)бензил)амінокарбонілметил)-2-(4-фторбен-зил)тіо-5-(2азидоетил)піримідин-4-он № Попередник Приклад 1 -Бітартрат 1-(N-(-2-(діетиламіно)етил)-N-(4-(4-трифторметилфеніл)бензил)амінокарбонілметил-2-(4-фторбензил)тіо-5-етилпіримідин-4-она Суміш проміжної сполуки А30 (0,403г, 1екв.), проміжної сполуки В62 (0,371г, 1екв.), HATU (0,426г, 1,2екв.), діізопропілетиламіну (0,482мл, 2,4екв.) і дихлорметану (15мл) перемішують при кімнатній температурі протягом ночі, потім промивають водяним хлоридом амонію і водяним бікарбонатом натрію. Органічний шар сушать і випарюють і продукт очищають хроматографією (двоокис кремнію, 5% етанол у дихлорметані). Фракції продукту випарюють з одержанням білої піни (0,627г). Цю вільну основу (0,612г) розчиняють у метанолі (10мл), додають винну кислоту (0,14г) і суміш перемішують протягом 5 хвилин, а потім випарюють. Після розтирання з ефіром одержують бітартратну сіль у вигляді білої твердої речовини (0, 622г). 1H-ЯМР (d6ДМСО, са 1:1 суміш ротамерів) d 0.96 (3Н, м), 1. 07 (6Н, м), 2.27 (2Н, м), 2.59 (2Н, м), 2.84 (2Н, м), 3.37/3.50 (4Н, м), 4.26 (2Н, с), 4.39/4.43 (2Н, 2х, с), 4.64/4.72 (2Н, 2х, с), 4,94/5.09 (2Н, 2х, с), 7.11/7.14 (2Н, 2х, м), 7.36-7.49 (5Н, м), 7.63/7.72 ((2Н, 2х, д), 7.84 (4Н, м); МС (АРСІ+) для C35H38F4N4O2S: знайдено: (М+1)=655, обчислено 654. Приклад 2-Бітартрат 1-(N-(2-(діетиламіно)етил)-N-(2-(4-трифторметилфеніл)пірид-5ілметил)амінокарбонілметил)-2-(4-фторбензил)тіо-5-етилпіримідин-4-она Зазначену в заголовку сполуку одержують із проміжних сполук A31 і В62 способом, описаним у прикладі 1. 1Н-ЯМР-(d6 ДМСО, са 2:1 суміш ротамерів) d 0.93 (6H, м), 1. 08 (3Н, м), 2.27 (2Н, м), 2.66 (4Н, м), 3.39/3.45 (4Н, м), 4.21 (2Н, с), 4.39/4.42 (2Н, 2х, с), 4.66/4.77 (2Н, 2х, с), 4,97/5.10 (2Н, 2х, с), 7.09/7.12 (2Н, 2х, т), 7.42/7.49 (2Н, 2х, т), 7.79/7.86 (4Н, 2х, дц), 7.87 (2Н, д); 7.97/8.06 (1H, 2х дд), 8.28 (2Н, д), 8.62/8.71 (2Н, 2х с); МС (АРСІ+) для C34H37F4N5O2S: знайдено: (М+1)=656, обчислено 655. Приклад 3 (а) - 1-(Ν-(2-(діетиламіно)етил)-N-(4-(4-трифторметил-феніл)бензил)амінокарбонілметил)-2(4-фторбензил)тіо-5,6-триметиленпіримідин-4-он Проміжна сполука В 69 (87,1г, 0,26 моль) суспендують у дихлорметані (2,9 літра). Потім додають гідрат 1-гідроксибензотріазолу (35,2г, 0,26 моль) і гідрохлорид 1-(3-диметиламінопропіл)-3-етилкарбодиіміду (99,7г, 0,52 моль) і суспензію перемішують 45 хвилин, протягом яких отримують розчин повністю розчинених речовин. Проміжна сполука А30 (91,2г, 0,26 моль) протягом 5 хвилин додають у вигляді розчину в дихлорметані (100мл), і отриманий розчин перемішують протягом 4 годин. Потім додають суміш "насичений розчин хлориду амонію: вода" (1:1, 1 літр), і розчин перемішують 10 хвилин. Органічну фазу відокремлюють і екстрагують сумішшю насиченого хлориду амонію - води (1:1, 1 літр) і одержують екстракти з рН 6. Органічну фазу відокремлюють і екстрагують водою (1 літр), що містить оцтову кислоту (10мл) з одержанням екстракту з рН 5. Дихлорметановий шар відокремлюють і екстрагують сумішшю "насичений розчин карбонату натрію : вода : насичений розчин солі" (1:3:0,2, 1 літр), рН 10,5, а потім сумішшю "насичений розчин солі : вода" (1:1, 1 літр). Коричневий розчин сушать над безводним сульфатом натрію в присутності знебарвлюючого вугілля (35г), фільтрують і розчинник видаляють у вакуумі з одержанням темно-коричневої піни. Отриману піну розчиняють в ізопропілацетаті (100мл) і розчинник видаляють у вакуумі. Темно-коричневий смолистий залишок розчиняють у киплячому ізопропілацетаті (500мл), прохолоджують до кімнатної температури, осаджують і перемішують протягом ночі. Отримана тверда речовина світло-кремового кольору відфільтровують і промивають ізопропілацетатом (100мл). Отриману тверда речовину сушать шляхом вакуумної фільтрації у воронці зі спеченого скла протягом 1 години, а потім перекристалізовують із ізопропілацетату (400мл). Після перемішування протягом ночі, що утворилася тверда речовина відфільтровують, промивають ізопропілацетатом (80мл) і сушать у вакуумі з одержанням вказаної в заголовку сполуки, 110г, вихід 63,5% 1H-ЯМР-(СДСl3, са 1.9:1 суміш ротамерів) d 0.99 (6Н, т), 2. 10 (2Н, м), 2.50 (4Н, кв.), 2.58 /2.62 (2Н, 2х т) 2.70/2.82 (2Н, 2х т), 2.86 (2Н, т), 3.28/3.58 (2Н, 2х, т), 4.45/4.52 (2Н, 2х, с), 4.68/4.70 (2Н, 2х, с), 4.93 (2Н, с), 6.95 (2Н, м), 7.31 (2H, д), 7.31/7.37 (2Н, 2х, м), 7.48/7.52 (2Н, д), 7.65 (2Н, м), 7.72 (2Н, м); МС (APCI+) (М+Н)+ 667; т.пл. 125°С (ДСК - асиметрична ендотерма). Приклад 3(b) Бітартрат 1-(N-(2-(діетиламіно)етил)-N-(4-(4-трифторметилфеніл)бензил)амінокарбонілметил)-2-(4-фторбензил)тіо-5,6-триметиленпіримідин-4-она Вказану в заголовку сполуку отримують із проміжної сполуки А30 і В69 способом, описаним у прикладі 1. 1Н-ЯМР-(d6ДМСО, са 1:1 суміш ротамерів) d 0.92/0.99 (6Н, 2х, т), 1.99 (2Н, м), 2.54 (6Н, м), 2.68/2.74 (4Н, м), 3.36 (2Н, м), 4.21 (2Н, с), 4.37/4.44 (2Н, 2х, с), 4.63/4.74 (2Н, 2х, с), 4,89/5.13 (2Н, 2х, с), 7.08/7.14 (2Н, 2х, м), 7.36-7.50 (4Н, м), 7.64/7.70 (2Н, 2х, д), 7.83 (4Н, м); МС (АРСІ+) для C36H38F4N4O2S: знайдено: (М+1)=667, обчислено 666. Приклад 3(с) Гідрохлорид 1-(N-(2-(диетиламіно)етил)-N-(4-(4-трифторметиленіл)бензил)амінокарбонілметил)-2-(4-фторбензил)-тіо-5,6-триметиленпіримі-дин-4-она Вільна основа прикладу 3(а) (3,00г, 0,0045 моль) суспендують, перемішуючи, в ізопропанолі (30мл) і нагрівають до 45°С з одержанням світлого розчину. Потім розчин охолоджують до кімнатної температури і додають концентровану соляну кислоту (0,40мл, 0,045 моль). Отриману суспензію перемішують при кімнатній температурі протягом 35 хвилин, а потім прохолоджують до 0°С протягом 35 хвилин. Після цього суспензію фільтрують і промивають ізопропанолом (10мл), а потім гептаном (30мл), і сушать у вакуумі з одержанням вказаної в заголовку сполуки у вигляді білої твердої речовини (3,00 р, 95%). 1H-ЯМР (CДCl3) d 1.38 (6Н, т), 2. 08 (2Н, м), 2.82 (2Н, т), 2.99 (2Н, т), 3.19 (4Н, м), 3.35 (2Н, м), 3.97 (2Н, с), 4.42 (2Н, с), 4.81 (2Н, с), 4.99 (2Н, с), 6.87 (2Н, т), 7.26 (2Н, т), 7.33 (2Н, д), 7.41 (2Н, д), 7.53 (2Н, д),7.71(2Н,д), 11.91 (1Н, с); Приклад 4 Бітартрат 1-(N-(2-(діетиламіно)етил)-N-(2-(4-три-фторметилфеніл)пірид-5ілметил)амінокарбонілметил)-2-(4-фторбензил)тіо-5,б-триметиленпіримідин-4-она Вказану в заголовку сполуку одержують із проміжних сполук A31 і В69 способом, описаним у прикладі 1. Н-ЯМР-(d6ДМСО, са 3:1 суміш ротамерів) d 0.92/0.98 (6Н, т), 1.99 (2Н, м), 2.53 (6Н, м), 2.68/2.75 (4Н, м), 3.41 (2Н, м), 4.22 (2Н, с), 4.37/4.42 (2Н, 2х, с), 4.66/4.79 (2Н, 2х, с), 4,93/5.13 (2Н, 2х, с), 7.07/7.12 (2Н, 2х, т), 7.39-7.47 (2Н, 2х т), 7.77/7.86 (1H, 2х, дд), 7.87 (2Н, д), ), 7.98/8.05 (1Н, 2х, дд), 8.28 (2Н, д), 8.61/8.69 (1Н, 2х с); МС (АРСІ+) для C35H37F4O2S: знайдено: (М+1)=668, обчислено 667. Приклад 5 Бітартрат 1-(N-(2-(діетиламіно)етил)-N-(2-(4-три-фторметилфеніл)піримід-5ілметил)амінокарбонілметил)-2-(4-фторбензил)тіо-5,6-триметиленпіримідин-4-она 1 Вказану в заголовку сполуку одержують із проміжних сполук A3 3 і В69 способом, описаним у прикладі 1. 1Н-ЯМР-(d6ДМСО, са 3:1 суміш ротамерів) d 0.92/1.09 (6Н, т), 1.96 (2Н, м), 2.60 (6Н, м), 2.75 (4Н, м), 3.48 (2Н, м), 4.23 (2Н, с), 4.38/4.40 (2Н, 2х, с), 4.65/4.81 (2Н, 2х, с), 4,97/5.11 (2Н, 2х, с), 7.07/7.10 (2Н, 2х, т), 7.387.44 (2Н, 2х т), 7.91 (2Н, д), 8.57 (2Н, д), 8.84/8.93 (2Н, 2х, с); МС (АРСІ+) для C34H36F4N6O2S: знайдено: (М+1)=669, обчислено 668. Приклад 6 Гідрохлорид 1-(1-метил-N-(2-(4-хлорфеніл)бензил)-амінокар-бонілметил)-2-(4фторбензил)тіо-5-(2-аміноетил)-піримідин-4-она Розчин проміжної сполуки В80 (0,228г) в етанолі (20мл) гідрують при 10% паладія на вуглі (0,09г) при атмосферному тиску протягом 2 днів. Каталізатор відфільтровують, розчинник видаляють у вакуумі, і отриману олію очищають хроматографією (двоокис кремнію, 10% метаноловий розчин аміаку в дихлорметані). Вільну основу розчиняють у дихлорметані (5мл) і додають еквімолярну кількість хлористого водню в ефірі. Розчинник видаляють у вакуумі, і залишок розтирають з ефіром; вихід 0,132г. 1Н-ЯМР(d6ДМСО, са 2:1 суміш ротамерів) d 2.58 (2Н, м), 2.87/2.99 (3Н, 2х с), 2.99 (2Н, м), 4.40/4.45 (2Н, 2х с), 4.57/4.66 (2Н, 2х, с), 4.97/5.00 (2Н, 2х, с), 7.16 (2Н, м), 7.33-7.38 (2Н, 2х д), 7.4-7.7 (9Н, м), 8.07 (2Н, бр м); МС (АРСІ+) для C29H28ClF4N6O2S:знайдено: (М+1)=551/553, обчислено 550/552. Приклад 7 - 1-(N-метил-N-(2-(4-хлорфеніл)бензил)амінокарбоніл-метил)-2-(4-фторбензил)тіо-5-(2ацетамідоетил)піримідин-4-он Розчин сполуки приклада 6 (0,173г, 1екв.), оцтового ангідриду (0,033мл, 1,1екв.) і діізопропіламіну (0,066мл, 1,2екв.) в дихлорметані (10мл) перемішують при кімнатній температурі протягом ночі. Розчин промивають водяним хлоридом амонію і водяним бікарбонатом натрію, а потім органічний шар сушать і випарюють. Залишок розтирають з ефіром і одержують вказану в заголовку сполуку у вигляді білої твердої речовини (0,156г). 1Н-ЯМР-СДСІ3, са 2:1 суміш ротамерів) d 1.96 (3Н, с), 2. 64 (2Н, м), 2.96 /3.10 (3Н, 2х с), 3.49 (2Н, м), 4.46-4.64 (6Н, м), 6.77 (2Н, бр т), 6.97-7.16 (3Н, м), 7.26-7.49 (10Н, м); МС (АРСІ+) для С31Н30СlFN4O3S: знайдено: (М+1) =593/595, обчислено 592/594. Приклад 8 -1-(N-(2-(діетиламіно)етил)-N-(2-(4-хлорфеніл)-бензил)аміно-арбонілметил)-2-(4фторбензил)тіо-5-(диметиламіно-метил)піримідин-4-он Метансульфоновий ангідрид (0,134г, 1/2екв.) додають до розчину сполуки приклада 37 (0,40г, 1екв.) і триетиламіну (0,124мл, 1,4екв) у дихлорметані (5мл) при 0°С, а потім перемішують при цій температурі протягом 4 годин. Суміш промивають водою, сушать і випарюють з одержанням мезилату у вигляді світложовтої твердої речовини. Ця речовину розчиняють у 2М розчині диметиламіну в ТГФ (10мл) і перемішують при кімнатній температурі протягом 16 годин. Розчинник і надлишок диметиламіну видаляють у вакуумі і продукт очищають хроматографією (двоокис кремнію, 5-20% метанол у етилацетаті, а потім 1-10% метаноловий розчин аміаку в дихлорметані) з одержанням вказаної в заголовку сполуки. 1H-ЯМР (CDCl3) d: 0.98 (6Н, т), 2.28 /2.30 (кожний 3Н, с), 2.46-2.65 (2Н, м), 3.26/3.56 (2Н, 2х, т), 3.33/3.36 (2Н, 2х, с), 4.46/4.53/5.54/4.90 (4Н, 4х, с), 4.67 (2Н, с), 6.98 (2Н, м), 7.21/7.50 (11Н, м); МС (АРСІ+) для C35H41ClFN5O2S: знайдено:(M+1)=650/652, обчислено 649/651. Сполуки нижченаведених прикладів одержують способом, описаним у прикладі 1, в основному, відповідно до аналогічної процедури, за винятком того, що в деяких випадках замість HATU і діізопропіламину використовують EDC (2екв.) і 1-гідроксибензотріазол (1екв.). Потім, де це зазначено, одержують солі засобами, описаними в прикладах 1 або 6, якщо це можливо. Нижченаведені сполуки одержують способом, описаним у прикладі 6. Нижченаведені сполуки одержують способом, описаним у прикладі 7. Нижченаведену сполуку одержують способом, описаним для проміжної сполуки В60. Сіль одержують способом, описаним у прикладі 1. № Попередник Структура 93 Приклад 78 Назва Бітартрат 1-(N-(2-(етиламіно)-етил)-(N-(4-(4-трифторметилфеніл)бензил)аміно-карбонілметил)-2-(4-фторбензил)тіо-5,6триметиленпіримідин-4-она Біологічні дані 1. Скринінг на інгібування Lp-PLA2 Ферментативну активність визначали шляхом виміру інтенсивності кругообігу штучного субстрату (а) при 37°С у 50мМ буферу HEPES (N-2-гідроксиетилпіперазин-N'-2-етансульфонова кислота), що містить 150мМ NaCl, pH 7,4. Аналіз здійснювали в 96-ямкових титраційних планшетах. Рекомбінантний Lp-PLA2 очищали до гомогенності з інфікованих бакуловірусом клітин Sf9 із використанням колонки, що утворить хелатний комплекс з цинком, афінной хроматографічної колонки із сефарозою Blue і аніонообмінної колонки. Після очищення і ультрафільтрації, фермент при концентрації 6мг/мл зберігали при 4°С. Аналітичні планшети зі сполукою або носієм і з буфером установлювали на об'єм 170мкл із використанням автоматизованої робототехніки. Реакцію ініціювали додаванням 20мкл 10xсубстрату (А) з одержанням кінцевої концентрації 20мкМ, і 10мкл розведеного ферменту з одержанням кінцевої концентрації 0,2нМ Lp-PLA2. Реакцію здійснювали при 405нм і при 37°С протягом 20 хвилин із використанням планшет-ридера з автоматичним перемішуванням. Швидкість реакції вимірювали як швидкість зміни оптичної щільності. Результати Сполуки, описані в прикладах, тестували як описано вище, і їх розміри ІС50 складали в межах
ДивитисяДодаткова інформація
Назва патенту англійськоюPirimidine compounds, a method for the preparation thereof, a pharmaceutical composition and use thereof
Автори англійськоюPinto Ivan Leo, Stanway Steven James
Назва патенту російськоюПиримидиновые соединения, способ их получения, фармацевтическая композиция и их применение
Автори російськоюПинто Иван Лео, Стенвей Стивен Джеймс
МПК / Мітки
МПК: A61P 9/10, C07D 401/12, C07D 239/60, A61P 3/06, C07D 239/95, A61P 29/00, A61K 31/513, A61P 9/08, C07D 239/70, A61K 31/517, A61P 19/02, A61P 43/00, C07D 239/56, C07D 495/04
Мітки: піримідинові, сполуки, використання, одержання, композиція, спосіб, фармацевтична
Код посилання
<a href="https://ua.patents.su/26-73762-pirimidinovi-spoluki-sposib-kh-oderzhannya-farmacevtichna-kompoziciya-ta-kh-vikoristannya.html" target="_blank" rel="follow" title="База патентів України">Піримідинові сполуки, спосіб їх одержання, фармацевтична композиція та їх використання</a>
Попередній патент: Карбоксамідин для лікування вірусного гепатиту
Наступний патент: Фармацевтична композиція з хондропротекторною, протизапальною та анальгетичною дією
Випадковий патент: З'єднання двох деталей у стик