Гідроксильований піримідилциклопентан як інгібітор протеїнкінази akt
Номер патенту: 100544
Опубліковано: 10.01.2013
Автори: Ліанг Джун, Блейк Джеймс Ф., Сафіна Браян, Жанг Біронг, Бенсік Йозеф, Спенсер Кейт Л., Чабот Крістін, Мітчелл Ян С., До Стівен, Хіао Денгмінг, Ху Руі, Каллан Ніколас С.
Формула / Реферат
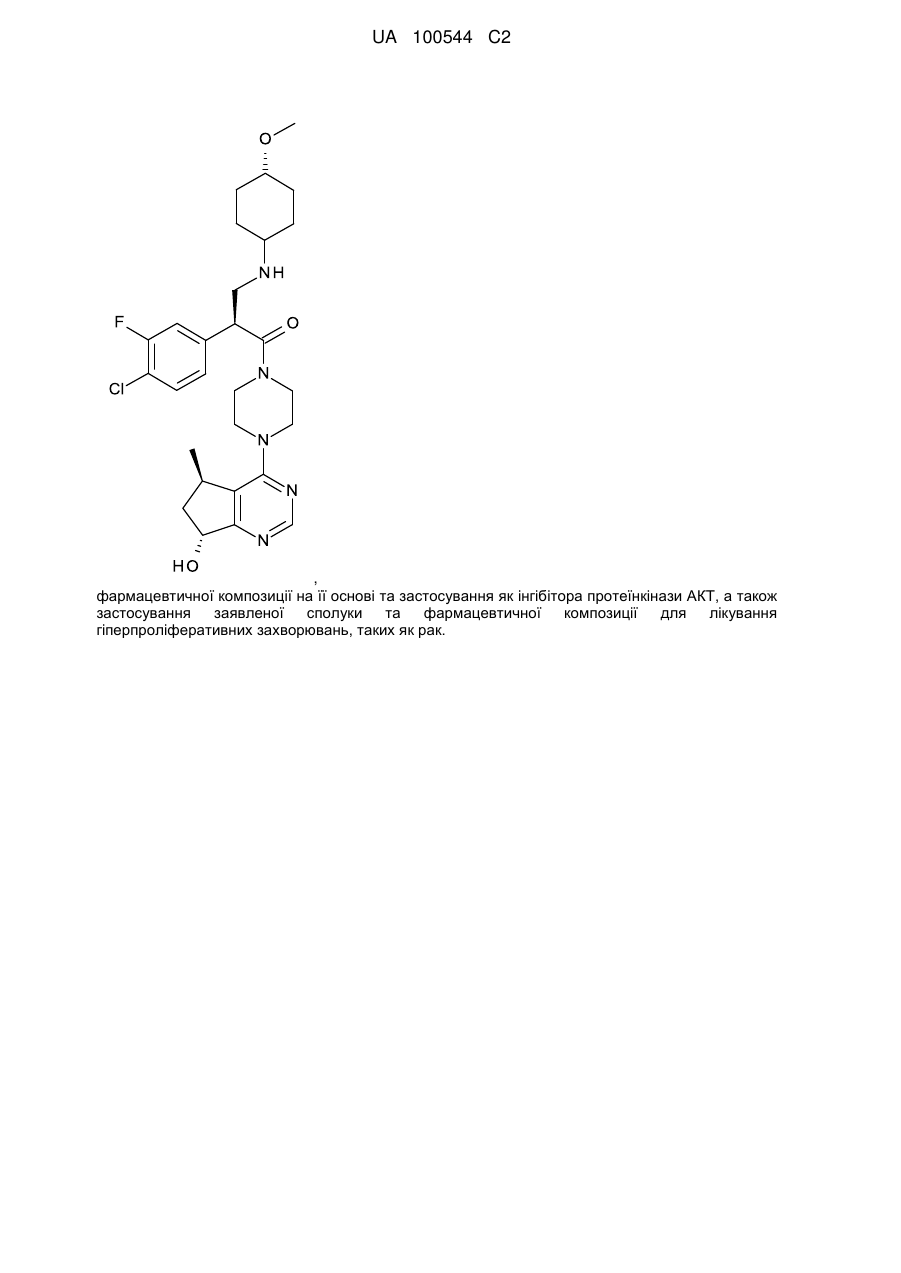
1. Сполука формули І:
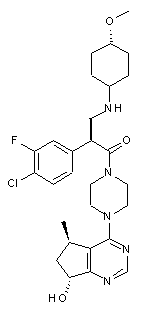 І.
І.
2. Фармацевтична композиція, що містить як активне начало сполуку за п. 1.
3. Спосіб лікування опосередковуваного АКТ захворювання або порушення у ссавця, за яким зазначеному ссавцеві вводять терапевтично ефективну кількість сполуки за п. 1.
4. Спосіб за п. 3, у якому зазначене захворювання або порушення є запальним, гіперпроліферативним, серцево-судинним, нейродегенеративним, гінекологічним або дерматологічним захворюванням або порушенням.
5. Спосіб інгібування вироблення протеїнкінази АКТ у ссавця, за яким зазначеному ссавцеві вводять ефективну кількість сполуки за п. 1.
6. Спосіб інгібування активності протеїнкінази АКТ у ссавця, за яким зазначену кіназу приводять в контакт зі сполукою за п. 1.
7. Сполука за п. 1 для застосування як лікарського засобу для лікування патологічних станів, опосередковуваних протеїнкіназами АКТ.
8. Застосування сполуки за п. 1 у виробництві лікарського засобу для терапії.
9. Застосування сполуки за п. 1 у лікуванні гіперпроліферативного захворювання.
10. Застосування сполуки за п. 1 у лікуванні раку.
11. Набір для лікування патологічного стану, опосередковуваного протеїнкіназою АКТ, де зазначений набір включає:
a) першу фармацевтичну композицію, що включає сполуку за п. 1; і
b) інструкції із застосування.
Текст
Реферат: Представлений винахід стосується сполуки UA 100544 C2 (12) UA 100544 C2 , фармацевтичної композиції на її основі та застосування як інгібітора протеїнкінази АКТ, а також застосування заявленої сполуки та фармацевтичної композиції для лікування гіперпроліферативних захворювань, таких як рак. UA 100544 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь техніки [0001] Даний винахід відноситься до нового інгібітора серин/треонін протеїнкіназ (тобто АКТ і родинних кіназ), фармацевтичних композицій, що містять зазначений інгібітор, і способів одержання зазначеного інгібітора. Даний інгібітор придатний, наприклад, для лікування гіперпроліферативних захворювань, таких як рак і запалення, у ссавців. Опис рівня техніки [0002] Протеїнкінази (PK) являють собою ферменти, що каталізують фосфорилювання гідроксильних груп білкових залишків тирозину, серину й треоніну шляхом перенесення кінцевого (гама) фосфату від АТФ. Через шляхи передачі сигналу зазначені ферменти регулюють ріст, диференціювання й поділ клітини, тобто, по суті, всі аспекти життя клітини так чи інакше залежать від активності протеїнкіназ (Hardie, G. й Hanks, S. (1995) The Protein Kinase Facts Book. I й II, Academic Press, San Diego, CA). Крім того, аномальну активність протеїнкіназ пов'язують із великою кількістю порушень, від відносно не небезпечних для життя захворювань, таких як псоріаз, до надзвичайно небезпечних захворювань, таких як гліобластома (рак мозку). Протеїнкінази є важливим класом мішеней для терапевтичної модуляції (Cohen, P. (2002) Nature Rev. Drug Discovery 1:309). [0003] Суттєво, що атипічне фосфорилювання та/або експресія білків часто виявляються однією з причин аномального поділу клітини, метастазування й виживаності клітини при раку. Порушену регуляцію та/або експресію різних кіназ, включаючи AKT, VEGF, ILK, ROCK, p70S6K, Bcl, PKA, PKC, Raf, Src, PDK1, ErbВ2, MEK, IKK, Cdk, EGFR, BAD, CHK1, CHK2 й GSK3, а також велику кількість інших, напряму пов'язують із раковими захворюваннями. [0004] Протеїнкінази включають два класи: протеїнтирозинкінази (PTK) і серинтреонінкінази (STK). Ферменти протеїнкінази B/Akt являють собою групу серин/треонінкіназ, експресія яких підвищена в різних видах злоякісних пухлин у людини. Однією з найбільш охарактеризованих мішеней ліпідних продуктів PI3K є серин/треонінкіназа Akt масою 57 КД, розташована після PI3K на шляху передачі сигналу (Hemmings, B.A. (1997) Science 275:628; Hay N. (2005) Cancer Cell 8:179-183). Akt є гомологом протоонкогену v-akt швидко трансформуючого ретровіруса AKT8. Через високу гомологію послідовностей із протеїнкіназами A й C Akt також називають протеїнкіназою B (PKB), а також родинною A й C (RAC). Відомі три ізоформи Akt, позначувані Akt1, Akt2 й Akt3, що мають загальну гомологію 80 % (Staal, S.P. (1987) Proc. Natl. Acad. Sci. 84:5034; Nakatani, K. (1999) Biochem. Biophys. Res. Commun. 257:906; Li et al (2002) Current Topics in Med. Chem. 2:939-971; WO 2005/113762). Ізоформи Akt мають загальну структуру доменів, яка складається з домену гомології Pleckstrin на N-кінці, каталітичного домену кінази, і короткої регуляторної ділянки на C-кінці. Крім того, для Akt2 й Akt3 існують варіанти сплайсування. Після проникнення в клітинну мембрану під дією PtdInd(3,4,5)P3, Akt фосфорилюється (активується) PDK1 на T308, T309 й T305 у випадку ізоформ Akt1 (PKB ), Akt2 (PKB і Akt3 (PKB відповідно, і на S473, S474 й S472 для ізоформ Akt1, Akt2 й Akt3 ) ) відповідно. Зазначене фосфорилювання здійснюється невідомою на даний момент кіназою (попередньо позначеною PDK2), хоча припускають, що в зазначеному процесі можуть відігравати роль PDK1 (Balendran, A., (1999) Curr. Biol. 9:393), автофосфорилювання (Toker, A. (2000) J. Biol. Chem. 275:8271) й інтегрин-асоційована кіназа (ILK) (Delcommenne, M. (1998) Proc. Natl. Acad. Sci. USA, 95:11211). Активація Akt вимагає її фосфорилювання за залишком Ser 473 гідрофобного мотиву C-кінця (Brodbeck et al (1999) J. Biol. Chem. 274:9133-9136; Coffer et al (1991) Eur. J. Biochem. 201:475-481; Alessi et al (1997) Curr. Biol. 7:261-269). Незважаючи на те, що монофосфорилювання Akt активує кіназу, для максимальної активізації кінази потрібне бісфосфорилювання. [0005] Вважають, що Akt діє на ракові клітини, придушуючи апоптоз і підсилюючи як ангіогенез, так і поділ (Toker et al. (2006) Cancer Res. 66(8):3963-3966). Експресія Akt підвищена при великій кількості ракових захворювань у людини, включаючи, без обмеження, рак кишечнику (Zinda et al (2001) Clin. Cancer Res. 7:2475), рак яєчника (Cheng et al (1992) Proc. Natl. Acad. Sci. USA 89:9267), рак мозку (Haas Kogan et al (1998) Curr. Biol. 8:1195), рак легень (Brognard et al (2001) Cancer Res. 61:3986), рак підшлункової залози (Bellacosa et al (1995) Int. J. Cancer 64:280-285; Cheng et al (1996) Proc. Natl. Acad. Sci. 93:3636-3641), рак передміхурової залози (Graff et al (2000) J. Biol. Chem. 275:24500), і рак шлунка (Staal et al (1987) Proc. Natl. Acad. Sci. USA 84:5034-5037). [0006] Мішень PI3K/Akt/ссавців рапаміцинового (mTOR) шляху досліджували як засіб терапії з використанням низькомолекулярних інгібіторів (Georgakis, G. й Younes, A. (2006) Expert Rev. Anticancer Ther. 6(1):131-140; Granville et al (2006) Clin. Cancer Res. 12(3):679-689). Інгібування сигналів PI3K/Akt викликає апоптоз і придушує ріст пухлинних клітин, що мають підвищений рівень Akt (Kim et al (2005) Current Opinion in Investig. Drugs 6(12):1250-1258; Luo et al (2005) 1 UA 100544 C2 5 10 15 Molecular Cancer Ther. 4(6):977-986). [0007] Розробка інгібіторів кіназ, націлених на шляхи з порушеною регуляцією, що у підсумку призводять до захворювання, представляє величезний етичний і комерційний інтерес для медичного й фармацевтичного співтовариства. Сполука, що інгібує (1) поповнення (залучення) Akt у клітинній мембрані, (2) активацію під дією PDK1 або PDK2, (3) фосфорилювання субстрату, або (4) одну з розташованих нижче мішеней Akt, може стати важливим протираковим агентом, який можна застосовувати або як окремий засіб лікування, або в комбінації з іншими допустимими процедурами. [0008] Заявка на патент США 2005/0130954 описує, серед іншого, ряд сполук, що діють як інгібітори AKT. Зазначені сполуки відмічені як придатні для лікування гіперпроліферативних захворювань, таких як рак. ОПИС ВИНАХОДУ [0009] Згідно із даним винаходом запропонована нова сполука, що інгібує протеїнкінази AKT. Сполуку згідно із даним винаходом, можна застосовувати як терапевтичний агент для лікування захворювань і патологічних станів, які можна лікувати інгібуванням протеїнкіназ AKT. [0010] Зокрема, даний винахід включає сполуку, що має формулу I: O NH F O N Cl N N N HO 20 25 30 35 40 I і її фармацевтично прийнятні солі. [0011] Даний винахід також передбачає фармацевтичні композиції, що включають сполуку формули I, або її фармацевтично прийнятні солі. [0012] Крім того, даний винахід передбачає спосіб лікування захворювань або патологічних станів, опосередковуваних протеїнкіназами АКТ, у ссавців, що включає введення зазначеному ссавцеві сполуки формули I або її фармацевтично прийнятної солі в кількості, ефективній для лікування або запобігання зазначеного порушення. Патологічні стани, опосередковувані протеїнкіназами АКТ, які можна лікувати способами згідно із даним винаходом, включають, але не обмежені перерахованими: запальні, гіперпроліферативні, серцево-судинні, нейродегенеративні, гінекологічні й дерматологічні захворювання та порушення. [0013] Крім того, даний винахід передбачає спосіб інгібування вироблення протеїнкіназ АКТ у ссавців, що включає введення зазначеному ссавцеві сполуки формули I або її фармацевтично прийнятної солі в кількості, ефективній для інгібування вироблення протеїнкінази АКТ. [0014] Крім того, даний винахід передбачає способи інгібування активності протеїнкіназ АКТ, що включають приведення зазначеної кінази в контакт із сполукою формули I. [0015] Сполука згідно із даним винаходом може бути корисною в комбінації з іншими відомими терапевтичними агентами. Відповідно, даний винахід також передбачає фармацевтичні композиції, що включають сполуку формули I, або її фармацевтично прийнятну сіль, у комбінації з другим терапевтичним агентом. [0016] Даний винахід також передбачає сполуку формули I, та її фармацевтично прийнятні солі для застосування як засобу для лікування патологічних станів, опосередковуваних протеїнкіназами АКТ. [0017] Додатково, згідно із даним винаходом запропоноване застосування сполуки формули I або її фармацевтично прийнятної солі при терапевтичному лікуванні. В одному варіанті здійснення терапевтичне лікування включає лікування патологічного стану, опосередковуваного 2 UA 100544 C2 5 10 15 20 25 30 35 40 45 50 55 60 протеїнкіназами АКТ. [0018] Даний винахід додатково передбачає набори для лікування захворювання або порушення, опосередковуваного протеїнкіназами АКТ, що включають сполуку формули I або її фармацевтично прийнятну сіль, контейнер, а також, можливо, вкладиш або ярлик з описом способу лікування. Набори можуть додатково включати другу сполуку або склад, що включає другий лікарський агент, придатний для лікування зазначеного захворювання або порушення. [0019] Додатково, згідно із даним винаходом запропоноване застосування сполуки формули I у лікуванні гіперпроліферативного захворювання. В іншому аспекті даного винаходу гіперпроліферативне захворювання являє собою рак. [0020] Даний винахід додатково включає способи приготування, способи розділення, і способи очищення сполуки згідно із даним винаходом. [0021] Додаткові переваги й нові ознаки даного винаходу будуть розкриті в нижченаведеному описі, і частково будуть очевидні для фахівця при ознайомленні з нижче наведеним описом, або стануть зрозумілі при здійсненні винаходу. Переваги даного винаходу можуть бути реалізовані й оцінені за допомогою засобів, комбінацій, композицій і способів, конкретно зазначених у формулі винаходу, яка додається. ДЕТАЛЬНИЙ ОПИС ВИНАХОДУ [0022] Нижче наведений детальний опис конкретних варіантів здійснення даного винаходу, приклади яких проілюстровані в супутніх формулах і структурах. Незважаючи на те, що нижче винахід описаний детально й наведені варіанти його здійснення, варто розуміти, що винахід не обмежується зазначеними варіантами здійснення. Навпаки, винахід включає всі альтернативні варіанти, модифікації й еквіваленти, які можуть бути включені в об'єм даного винаходу, визначений формулою. Для фахівця будуть очевидні численні методи й матеріали, аналогічні або еквівалентні описаним тут, які можуть бути застосовані при реалізації даного винаходу на практиці. Даний винахід ні в якому разі не обмежений описаними способами й матеріалами. У випадку, якщо одне або декілька включених в опис джерел і подібних матеріалів відрізняється або суперечить даному опису, включаючи, але не обмежуючись визначенням термінів, використанням термінів, описаними технічними прийомами тощо, пріоритетне значення має даний опис. ВИЗНАЧЕННЯ [0023] У даному описі терміни в однині означають "один або більше". [0024] У даному описі терміни "сполука відповідно до винаходу", "сполука згідно із даним винаходом" й "сполука формули I" включають сполуку формули I та її фармацевтично прийнятні солі. [0025] Фраза "ефективна кількість" означає кількість сполуки, яка, при введенні ссавцеві, що потребує відповідного лікування, достатня для (i) лікування або запобігання певного захворювання, патологічного стану або порушення, опосередковуваного активністю однієї або декількох протеїнкіназ АКТ, тирозинкіназ, додаткових серинтреонінкіназ, та/або кіназ подвійної специфічності, (ii) ослаблення, зниження виразності або усунення одного або декількох симптомів певного захворювання, патологічного стану або порушення, або (iii) запобігання чи уповільнення прояву одного або декількох симптомів певного захворювання, патологічного стану або порушення, описаного тут. У випадку ракового захворювання, ефективна кількість лікарського засобу може знижувати число ракових клітин; зменшувати розмір пухлини; інгібувати (тобто до деякої міри уповільнювати, і переважно зупиняти) проникнення ракових клітин у периферичні органи; інгібувати (тобто до деякої міри уповільнювати, і переважно зупиняти) метастазування пухлини; придушувати, до деякої міри, ріст пухлини; та/або до деякої міри знижувати виразність одного або декількох симптомів, пов'язаних з раковим захворюванням. Лікарський засіб може до деякої міри запобігати росту та/або знищувати існуючі ракові клітини, тобто він може мати цитостатичні та/або цитотоксичні властивості. При лікуванні раку ефективність може бути виміряна, наприклад, на основі оцінки прогресування захворювання в часі (TTP) та/або визначення ступеня відповіді (RR). [0026] Передбачається, що "Лікування" означає принаймні полегшення стану при захворюванні у ссавця, такого як людина, який залежить, принаймні частково, від активності однієї або декількох протеїнкіназ АКТ, тирозинкіназ, додаткових серинтреонінкіназ, та/або кіназ подвійної специфічності. Терміни "лікувати" й "лікування" відносяться як до терапевтичного лікування, так і до профілактичних або превентивних мір, метою яких є запобігання або уповільнення (зниження) небажаної фізіологічної зміни або порушення. У рамках даного винаходу, корисні або бажані клінічні результати включають, але не обмежені перерахованими: зняття симптомів, зниження ступеня захворювання, стабілізацію (тобто відсутність погіршень) стану хворого, затримку або уповільнення прогресування захворювання, покращення або 3 UA 100544 C2 5 10 15 20 25 30 35 40 45 50 55 60 тимчасове зниження виразності хворобливого стану, і ремісію (часткову або повну), що визначаються або не визначаються. "Лікування" також може означати продовження тривалості життя в порівнянні з очікуваною тривалістю життя при відсутності лікування. Ті, кому необхідне лікування включають тих, що вже мають патологічний стан або розлад, тих, хто схильний до захворювання, але у кого воно ще не діагностовано; тих, хто потребує модулювання та/або придушення патологічного стану. Терміни "лікувати" й "лікування" включають як превентивне, наприклад, профілактичне, так і паліативне лікування. [0027] Термін "ссавець" у даному описі відноситься до теплокровної тварини, що має, або знаходиться у групі ризику виникнення описаного тут захворювання, і включає, але не обмежений перерахованими: морських свинок, собак, кішок, пацюків, мишей, хом'яків і приматів, включаючи людину. [0028] "Хіміотерапевтичний агент" являє собою хімічну сполуку, придатну для лікування раку поза залежністю від механізму дії. Хіміотерапевтичні агенти включають сполуки, використовувані в "направленій терапії" та звичайній хіміотерапії. [0029] Приклади хіміотерапевтичних агентів включають Ерлотиніб (ТАРЦЕВА®, Genentech/OSI Pharm.), Ботрезоміб (ВЕЛКАД®, Millennium Pharm.), Фульвестрант (ФАСЛОДЕКС®, AstraZeneca), Сутент (SU11248, Pfizer), Летрозоль (ФЕМАРА®, Novartis), Іматинібу месилат (ГЛІВЕК®, Novartis), PTK787/ZK 222584 (Novartis), Оксаліплатин (Елоксатин®, Sanofi), 5-FU (5-флюороурацил), Лейковорин, Рапаміцин (Сиролімус, РАПАМУН®, Wyeth), Лапатиніб (ТІКЕРБ®, GSK572016, Glaxo Smith Kline), Лонафарніб (SCH 66336), Сорафеніб (BAY43-9006, Bayer Labs), Іринотекан (КАМПТОЗАР®, Pfizer) і Гефітиніб (ІРЕССА®, AstraZeneca), AG1478, AG1571 (SU 5271; Sugen), алкілуючі агенти, такі як тіотепа й ЦИТОКСАН® циклофосфамід; алкілсульфонати, такі як бусульфан, імпросульфан і піпосульфан; азиридини, такі як бензодопа, карбоквон, метуредопа й уредопа; етиленіміни й метиламеламіни, що включають альтретамін, триетиленмеламін, триетиленфосфорамід, триетилентіофосфорамід і триметилмеламін; ацетогеніни (особливо булатацин і булатацинон); камптотецин (включаючи синтетичний аналог – топотекан); бріостатин; калістатин; CC-1065 (включаючи його синтетичні аналоги – адозелесин, карзелесин і бізелесин); криптофіцини (особливо криптофіцин-1 і криптофіцин-8); доластатин; дуокарміцин (включаючи синтетичні аналоги - KW-2189 й CB1-TM1); елеутеробін; панкратистатин; саркодиктиін; спонгістатин; азотисті іприти, такі як хлорамбуцил, хлорнарфазин, естрамустин, іфосфамід, мехлоретамін, оксид гідрохлорид мехлоретаміну, мелфалан, новембіхін, фенестерин, преднімустин, трофосфамід, урацил іприт; нитрозосечовини, такі як кармустин, хлорозотоцин, фотемустин, ломустин, німустин і ранімустин; антибіотики, такі як енедиінові антибіотики (наприклад, калікеаміцин, особливо калікеаміцин гама1 і калікеаміцин омега1 Angew Chem. Intl. Ed. Engl. (1994) 33:183-186); динеміцин, включаючи демініцин А; біофосфонати, такі як клодронат; еспераміцин; а також хромофор неокарциностатину й родинні хромофори хромопротеїнів – енедиінових антибіотиків), аклациноміцини, актиноміцин, аутраміцин, азасерин, блеоміцини, кактиноміцин, карабіцин, карміноміцин, карцинофілін, хромоміцини, дактиноміцин, даунорубіцин, деторубіцин, 6-діазо-5-оксо-L-норлеуцин, АДРІАМІЦИН® (доксорубіцин), морфоліно-доксорубіцин, ціаноморфоліно-доксорубіцин, 2-піроліно-доксорубіцин, і деоксидоксорубіцин), епірубіцин, езорубіцин, ідарубіцин, марцеломіцин, мітоміцини, такі як мітоміцин C, мікофенольна кислота, ногаламіцин, олівоміцини, пепломіцин, порфіроміцин, пуроміцин, квеламіцин, родорубіцин, стрептонігрин, стрептозоцин, туберцидин, убенімекс, циностатин, зорубіцин; антиметаболіти, такі як метотрексат й 5-флюороурацил (5-FU); аналоги фолієвої кислоти, такі як деноптерин, метотрексат, птероптерин, триметрексат; аналоги пурину, такі як флударабін, 6-меркаптопурин, тіаміприн, тіогуанін; аналоги піримідину, такі як анцитабін, азацитидин, 6-азаурідин, кармофур, цитарабін, дідеоксиурідин, доксифлурідин, еноцитабін, флоксуридин; андрогени, такі як калустерон, пропіонат дромостанолону, епітіостанол, мепітіостан, тестолактон; антагоністи адреналіну, такі як аміноглутетимід, мітотан, трилостан; компенсатор фолієвої кислоти, такої як фолінова кислота; ацеглатон; глікозид альдофосфаламід; амінолевулінова кислота; енілурацил; амсакрин; бестрабуцил; бісантрен; едатраксат; дефофамін; демекольцин; діазиквон; елфорнітин; ацетат еліптинію; епотілон; етоглюцид; нітрат галію; гідроксиурея; лентинан; лонідаінін; маїтанзиноїди, такі як маїтанзин й ансамітоцини; мітогуазон; мітоксантрон; мопіданмол; нітраерин; пентостатин; фенамет; пірарубіцин; лозоксантрон; подофілінова кислота; 2-етилгідразид; прокарбазин; полісахаридний комплекс PSK® (JHS Natural Products, Eugene, OR); разоксан; ризоксин; сизофіран; спірогерманій; тенуазонова кислота; триазиквон; 2,2",2»-трихлоротриетиламін; трихотецени (особливо токсин Т-2, веракурин А, рорідин А й ангуідин); уретан; віндезин; дакарбазин; маномустин; мітобронітол; мітолактол; піпоброман; гацитозин; арабінозид ("Ara-C"); 4 UA 100544 C2 5 10 15 20 25 30 35 40 45 50 55 60 циклофосфамід; тіотепа; таксоїди, наприклад, ТАКСОЛ® (паклітаксель; Bristol-Myers Squibb Oncology, Princeton, N.J.), АБРАКСАН™ (без кремофору), сформовані на альбуміні утворення наночастин паклітакселю (American Pharmaceutical Partners, Schaumberg, Illinois), і ТАКСОТЕР® (доксетаксель; Rhone-Poulenc Rorer, Antony, France); хлорамбуцил; ГЕМЗАР® (гемцитабін); 6тіогуанін; меркаптопурин; метотрексат; аналоги платини, такі як цисплатин і карбоплатин; вінбластин; етопозид (VP-16); іфосфамід; мітоксантрон; вінкристин; НАВЕЛБІН® (вінорелбін); новантрон; теніпозид; едатрексат; дауноміцин; аміноптерин; капецитабін (КСЕЛОДА®); ібандронат; CPT-11; інгібітор топоізомерази RFS 2000; дифлюорометилорнітин (ДМФО); ретиноїди, такі як ретиноєва кислота; і фармацевтично прийнятні солі, кислоти й похідні будьякої з вищевказаних сполук. [0030] Також у визначення "хіміотерапевтичний агент" включені: (i) антигормональні агенти, що регулюють або інгібують дію гормонів на пухлині, такі як антиестрогени й вибіркові модулятори рецепторів естрогену (SERMs), включаючи, наприклад, тамоксифен (включаючи НОЛВАДЕКС®; цитрат тамоксифену), ралоксифен, дролоксифен, 4-гідрокситамоксифен, триоксифен, кеоксифен, LY117018, онапристон і ФАРЕСТОН® (цитрат тореміфіну); (ii) інгібітори ароматази, які інгібують фермент ароматазу, що регулює вироблення естрогену в надпочечниках, такі як, наприклад, 4(5)-імідазоли, аміноглютетимід, МЕГЕЙС® (ацетат мегестролу), АРОМАЗИН® (ексеместан; Pfizer), форместаїн, фадрозол, РИВІСОР® (ворозол), ФЕМАРА® (летрозол; Novartis), і АРИМІДЕКС® (анастрозол; AstraZeneca); (iii) антиандрогени, такі як флутамід, нілутамід, бікалутамід, лейпролід і госерелін; а також троксацитабін (аналог 13-діоксолан нуклеозид цитозину); (iv) інгібітори протеїнкінази; (v) інгібітори ліпідкінази; (vi) антизначеннєві олігонуклеотиди, що зокрема інгібують експресію генів у сигнальних шляхах, пов'язаних з аномальним поділом клітини, такі як, наприклад, PKC-альфа, Ralf й H-Ras; (vii) рибозими, такі як інгібітори експресії VEGF (наприклад, АНГІОЗИМ®) й інгібітори експресії HER2; (viii) вакцини, такі як вакцини генної терапії, наприклад, АЛОВЕКТИН®, ЛЕЙВЕКТИН® і ВАКСИД®; ПРОЛЕЙКІН® rIL-2; інгібітор топоізомерази 1, такий як ЛУРТОТЕКАН®; АБАРЕЛІКС® rmRH; (ix) антиангіогенні агенти, такі як бевацизумаб (АВАСТИН®, Genentech); та (x) фармацевтично прийнятні солі, кислоти й похідні будь-якої з вищевказаних сполук. [0031] Також у визначення "хіміотерапевтичні агенти" включені терапевтичні антитіла, такі як алемтузумаб (Campath), бевацизумаб (АВАСТИН®, Genentech); цетуксимаб (ЕРБІТУКС®, Imclone); панітумумаб (ВЕКТИБІКС®, Amgen), ритуксимаб (РИТУКСАН®, Genentech/Biogen Idec), пертузумаб (ОМНІТАРГ®, 2C4, Genentech), трастузумаб (ГЕРЦЕПТИН®, Genentech), тоситумомаб (Bexxar, Corixia), і кон'югат антитіла з лікарським засобом, гемтузумаб озогаміцин (МІЛОТАРГ®, Wyeth). [0032] Гуманізовані моноклональні антитіла, що мають терапевтичний потенціал як хіміотерапевтичні агенти у комбінації з інгібіторами PI3K згідно із даним винаходом, включають: алемтузумаб, аполізумаб, аселізумаб, атлізумаб, бапінеузумаб, бевацизумаб, біватузумаб мертанзин, кантузумаб мертанзин, цеделізумаб, цертолізумаб пегол, цидфузитузумаб, цидтузумаб, даклізумаб, екулізумаб, ефалізумаб, епратузумаб, ерлізумаб, фелвізумаб, фотнолізумаб, гемтузумаб озогаміцин, інотузумаб озогаміцин, іпілімумаб, лабетузумаб, лінтузумаб, матузумаб, меполізумаб, мотавізумаб, мотовізумаб, натализумаб, німотузумаб, ноловізумаб, нумавізумаб, окрелізумаб, омалізумаб, павілізумаб, пасколізумаб, пекфузитузумаб, пектузумаб, пертузумаб, пекселізумаб, ралівізумаб, ранібізумаб, реслівізумаб, реслізумаб, ресивізумаб, ровелізумаб, руплізумаб, сибротузумаб, сиплізумаб, сонтузумаб, такатузумаб, тетраксетан, тадокізумаб, талізумаб, тефібазумаб, токілізумаб, торалізумаб, трастузумаб, тукотузумаб целмолейкін, тукуситузумаб, умавізумаб і візилізумаб. ІНГІБІТОРИ АКТ [0033] Нова сполука формули I придатна для інгібування протеїнкіназ АКТ. Дану сполуку можна застосовувати як терапевтичного агента в лікуванні захворювань які, можна лікувати інгібуванням сигнального шляху протеїнкінази AKT, а також шляхів рецепторних тирозинкінази й серин/треонінкінази. [0034] Зокрема, сполуки формули I, що мають 7-гідрокси групу на циклопенту[d]піримідині, відповідно до досліджень, виявилися щонайменше в 50 разів більш вибірковими до АКТ, ніж протеїнкіназа А (PKA). Наприклад, щонайменше в 100 разів, а в насткпному прикладі – щонайменше в 150 разів більш вибіркові до АКТ, ніж PKA. Вибірковість відносно PKA є бажаною, тому що PKA залучена до великої кількості процесів у клітині, важливих для нормального функціонування й фізіології різних типів клітин. Крім того, вважається, що інгібування PKA не впливає на антипроліферативний і про-апоптотичний ефект інгібування AKT. Таким чином, інгібування PKA може призвести до небажаних наслідків, не пов'язаних з інгібуванням AKT, при цьому не сприяючи позитивним змінам у ході захворювання, пов'язаним з 5 UA 100544 C2 інгібуванням AKT. [0035] Сполуку формули I можна також застосовувати як інгібітор тирозинкіназ, а також серин- і треонінкіназ, на додаток до інгібування AKT. [0036] У цілому, аспект даного винаходу відноситься до сполуки формули I: 5 O NH F O N Cl N N N HO 10 15 20 25 30 35 40 I і фармацевтично прийнятних солей. [0037] Сполука формули I включає фармацевтично прийнятні солі даної сполуки. [0038] Фраза "фармацевтично прийнятні" вказує на те, що речовина або сполука хімічно та/або токсикологічно сумісна з іншими інгредієнтами, що входять до складу, та/або із ссавцем, якого лікують зазначеним засобом. [0039] Додатково, сполука згідно із даним винаходом може утворювати сіль. Приклади солей включають солі, одержувані шляхом здійснення взаємодії сполук згідно із даним винаходом з органічною або неорганічною кислотою, або неорганічною основою; подібні солі включають, але не обмежені перерахованими: сульфати, піросульфати, бісульфати, сульфіти, бісульфіти, фосфати, моногідрогенфосфати, дигідрогенфосфати, метафосфати, пірофосфати, хлориди, броміди, йодиди, ацетати, пропіонати, деканоати, каприлати, акрилати, форміати, ізобутирати, капроати, гептаноати, пропіолати, оксалати, малонати, сукцинати, суберати, себацати, фумарати, малеати, бутин-1,4-діоати, гексин-1,6-діоати, бензоати, хлоробензоати, метилбензоати, динітробензоати, гідроксибензоати, метоксибензоати, фталати, сульфонати, ксиленсульфонати, фенілацетати, фенілпропіонати, фенілбутирати, цитрати, лактати, γгідроксибутирати, гліколяти, тартрати, метансульфонати, пропансульфонати, нафтален-1сульфонати, нафтален-2-сульфонати й манделати. Так як одна сполука згідно із даним винаходом може включати більше ніж одну кислу або лужну групу, сполуки згідно із даним винаходом можуть включати одинарні, подвійні й потрійні солі в одній сполуці. [0040] У деяких варіантах виконання винаходу, сіль є "фармацевтично прийнятною сіллю", що включає, якщо не зазначено зворотне, солі, що зберігають біологічну ефективність відповідної вільної кислоти або основи конкретної сполуки, а зазначені солі не є біологічно (або інакше) небажаними. [0041] Сполука формули I також включає інші солі, які не обов'язково є фармацевтично прийнятними, і які можуть бути придатні як проміжні речовини для приготування та/або очищення сполуки формули I та/або для розділення сполуки формули I. [0042] Даний винахід також включає мічені ізотопами сполуки згідно із даним винаходом, які ідентичні зазначеним тут, за тим винятком, що один або декілька атомів замінені на атоми, що мають атомну масу або масове число, відмінне від атомної маси або масового числа відповідних атомів, які зазвичай зустрічаються в природі. Всі ізотопи будь-якого конкретного атома або елемента, а також їх застосування, відповідно вважаються віднесеними до сполук згідно із даним винаходом. Приклади ізотопів, які можуть бути включені в сполуки згідно із даним винаходом, включають ізотопи водню, вуглецю, азоту, кисню, фосфору, сірки, фтору, хлору і йоду, такі як 2H, 3H, 11C, 13C, 14C, 13N, 15N, 15O, 17O, 18O, 32P, 33P, 35S, 18F, 36Cl, 123I й 125I. Конкретні мічені ізотопами сполуки згідно із даним винаходом (наприклад, мічені 3H й 14C) можна використовувати при аналізі розподілу сполуки та/або субстрату в тканинах. Тритієві (тобто 3H) ізотопи й ізотопи вуглецю-14 (тобто 14C) корисні завдяки легкості їх 6 UA 100544 C2 5 10 15 20 25 30 35 40 45 50 55 60 приготування й детектування. Крім того, заміна атомів на більш важкі ізотопи, такі як дейтерій (тобто 2H), може забезпечити певні терапевтичні переваги, обумовлені більшою метаболічною стабільністю (тобто збільшеним періодом напіврозпаду, або більш низьким необхідним дозуванням), і із цієї причини заміна може бути переважною в деяких ситуаціях. Позитронноактивні ізотопи, такі як 15O, 13N, 11C й 18F можна застосовувати в дослідженнях, здійснюваних за допомогою позитронно-емісійоної томографії (PET) для вивчення заповнення рецепторів субстрату. Мічені ізотопами сполуки згідно із даним винаходом можуть бути приготовлені по суті за допомогою процедур, аналогічних описаним у Схемах та/або Прикладах, викладених нижче, шляхом заміни не міченого ізотопом реагенту на мічений ізотопом реагент. СИНТЕЗ СПОЛУК ФОРМУЛИ I [0043] Сполука згідно із даним винаходом може бути синтезована з використанням шляхів синтезу, які включають процеси, аналогічні широко відомим в хімічній галузі, зокрема, у світлі наведеного нижче опису. Вихідні матеріали зазвичай можна придбати в комерційних джерелах, таких як Aldrich Chemicals (Milwaukee, WI), або вони можуть бути легко приготовлені з використанням методів, добре відомих фахівцеві (тобто, приготовлені методами, суть яких описана в Louis F. Fieser, Mary Fieser, Reagents for Organic Synthesis, v. 1-19, Wiley, N.Y. (19671999 ed.), абоBeilsteins Handbuch der organischen Chemie, 4, Aufl. ed. Springer-Verlag, Berlin, включаючи додаткові матеріали). [0044] Більш детальний опис окремих етапів реакції наведено в розділі "Приклади" нижче. Фахівцеві буде зрозуміло, що для синтезу сполуки згідно із даним винаходом можуть бути використані й інші шляхи синтезу. Незважаючи на те, що в розділі "Приклади" нижче описуються й обговорюються конкретні вихідні матеріали й реагенти, вони можуть бути легко замінені на інші вихідні матеріали й реагенти для забезпечення різних рядів похідних та/або умов реакції. Додатково, багато сполук, приготовлені з використанням способів, описаних нижче, можуть бути додатково модифіковані з урахуванням даного опису, з використанням традиційних хімічних прийомів, добре відомих фахівцеві. [0045] При приготуванні сполуки формули I, може бути необхідний захист різних функціональних груп (наприклад, первинних або вторинних амінів тощо) проміжних речовин. Необхідність у подібному захисті може варіювати залежно від природи функціональної групи й умов методів приготування. Підходящі групи-амінопротектори (NH-Pg) включають ацетил, трифлюороацетил, t-бутоксикарбоніл (BOC), бензилоксикарбоніл (CBz) і 9флюоренілметиленоксикарбоніл (Fmoc). Необхідність у подібному захисті може бути легко визначена фахівцем. Загальний опис захисних груп та їх використання, можна знайти в T. W. Greene, Protective Groups in Organic Synthesis, John Wiley & Sons, New York, 1991. МЕТОДИ РОЗДІЛЕННЯ [0046] При використанні будь-якого з методів синтезу для приготування сполуки формули I може бути бажаним відокремити продукти реакції один від одного та/або від вихідних матеріалів. Бажані продукти кожного етапу або ряду етапів розділяють та/або очищають до бажаного ступеню гомогенності за допомогою широко відомих у даній галузі прийомів. Зазвичай, подібне розділення містить у собі багатофазне екстрагування, кристалізацію з розчину або суміші розчинів, дистиляцію, сублімацію або хроматографію. Хроматографія може включати будь-яку кількість методів, включаючи, наприклад: хроматографію зі зверненою фазою й нормальною фазою; ексклюзійну хроматографію; іонообмінну хроматографію; методи й пристрої для рідинної хроматографії високого, середнього й низького тиску; малооб'ємну аналітичну хроматографію; псевдоподвижний шар ("SMB") і препаративну тонкошарову або товстошарову хроматографію, а також методи малооб'ємної тонкошарової й флешхроматографії. [0047] Інша група способів розділення включає обробку реакційної суміші реагентом, обраним з метою зв'язування бажаного продукту, або забезпечення можливості розділення непрореагованого вихідного матеріалу, побічного продукту реакції тощо, іншим способом. Подібні реагенти включають адсорбенти або абсорбенти, такі як активоване вугілля, молекулярні сита, іонообмінні речовини, або тому подібні. Крім того, реагенти можуть являти собою кислоти у випадку, якщо матеріал є основою, основи у випадку, якщо матеріал є кислотою, зв'язуючі реагенти, такі як антитіла, зв'язуючі білки, окремі хелатори, такі як краунефіри, реагенти виділення іонів рідина-рідина ("LIX"), або тому подібні. [0048] Вибір підходящих способів розділення залежить від природи використовуваних матеріалів. Наприклад, температура кипіння й молекулярна маса мають значення при дистиляції й сублімації, наявність або відсутність протилежних функціональних груп мають значення при хроматографії, стабільність матеріалів у кислому й лужному середовищі мають значення при багатофазному екстрагуванні тощо. Фахівцеві буде неважко вибрати способи, за 7 UA 100544 C2 5 10 15 20 25 30 35 40 45 50 55 60 допомогою яких можна з найбільшою ймовірністю досягти бажаного розділення. [0049] Суміші діастереомерів можуть бути розділені на окремі діастереомери на основі їх базових фізико-хімічних відмінностей методами, добре відомими фахівцеві, такими як хроматографія та/або фракційна кристалізація. Енантіомери можуть бути розділені шляхом перетворення суміші енантіомерів у суміш діастереоізомерів шляхом реакції з підходящою оптично активною сполукою (наприклад, хіральним допоміжним агентом, таким як хіральний спирт або хлорид кислоти Мошера), розділення діастереомерів і перетворення (наприклад, гідролізу) окремих діастереоізомерів у відповідні чисті енантіомери. Також, деякі сполуки згідно із даним винаходом можуть бути атропоізомерами (наприклад, заміщені біарили), і вважаються частиною даного винаходу. Енантіомери також можуть бути розділені за допомогою колонки хіральної ВЕРХ. [0050] Окремий стереоізомер, наприклад, енантіомер, по суті вільний від свого стереоізомера, може бути одержаний розділенням рацемічної суміші з використанням такого методу, як утворення діастереомерів при використанні оптично активних розділюючих агентів (Eliel, E. й Wilen, S. "Stereochemistry of Organic Compounds, » John Wiley & Sons, Inc., New York, 1994; Lochmuller, C. H., J. Chromatogr., (1975) 113(3):283-302). Рацемічні суміші хіральних сполук згідно із даним винаходом можуть бути розділені й виділені будь-яким підходящим методом, включаючи: (1) утворення іонних діастереоізомерних солей з хіральними сполуками, і розділення шляхом фракційної кристалізації або інших методів, (2) утворення діастереоізомерних сполук із хіральними реагентами, використовуваними для одержання похідних, розділення діастереомерів, і перетворення в чисті стереоізомери, і (3) розділення по суті чистих або збагачених стереоізомерів напряму в хіральних умовах. Див.: "Drug Stereochemistry, Analytical Methods й Pharmacology, » Irving W. Wainer, Ed., Marcel Dekker, Inc., New York (1993). [0051] При використанні методу (1), діастереоізомерні солі можуть бути одержані шляхом реакції енантіомерно чистих хіральних основ, таких як бруцин, хінін, ефедрин, стрихнін, *-метил*-фенілетиламін (амфетамін) тощо, з асиметричними сполуками, що працюють як кислоти, такими як карбонова кислота й сульфонова кислота. Діастереоізомерні солі можуть бути розділені шляхом фракційної кристалізації або іонної хроматографії. При розділенні оптичних ізомерів аміносполук, додавання хіральних карбонових або сульфонових кислот, таких як камфорсульфонова кислота, винна кислота, мигдальна кислота, або молочна кислота, може призвести до утворення діастереоізомерних солей. [0052] В іншому варіанті, відповідно до методу (2), субстрат, що піддається розділенню, вводять у реакцію з одним енантіомером хіральної сполуки з метою утворення пари діастереоізомерів (E. й Wilen, S. "Stereochemistry of Organic Compounds", John Wiley & Sons, Inc., 1994, p. 322). Діастереоізомерні сполуки можуть бути одержані шляхом реакції асиметричних сполук із енантіомерно чистими хіральними реагентами, використовуваними для одержання похідних, таких як похідні ментилу, з наступним розділенням діастереомерів, і гідролізом з одержанням чистого або збагаченого енантіомера. Метод визначення оптичної чистоти включає в себе приготування складних хіральних ефірів, таких як складний ефір ментилу, наприклад, ()ментилхлороформіат, за наявністю основи, або складного ефіру Мошера, *-метокси-*(трифлюорометил)фенілацетат (Jacob III. J. Org. Chem., (1982) 47:4165) рацемічної суміші, і аналіз спектра 1H ЯМР на наявність двох атропізомерних енантіомерів або діастереомерів. Стабільні діастереомери атропізомерних сполук можуть бути розділені й виділені за допомогою хроматографії зі зверненою фазою й нормальною фазою, після застосування методів розділення атропізомерних нафтилізохінолінів (WO 96/15111). При використанні методу (3), рацемічна суміш двох енантіомерів може бути розділена за допомогою хіральної нерухомої фази ("Chiral Liquid Chromatography" (1989) W. J. Lough, Ed., Chapman й Hall, New York; Okamoto, J. of Chromatogr., (1990) 513:375-378). Збагачені або очищені енантіомери можуть бути розділені за допомогою методів, використовуваних для розпізнавання інших хіральних молекул з асиметричними атомами вуглецю, наприклад, оптичним обертанням або круговим дихроізмом. СПОСОБИ ЛІКУВАННЯ СПОЛУКОЮ ФОРМУЛИ I [0053] Сполука згідно із даним винаходом може бути використана як профілактичний або терапевтичний агент при лікуванні захворювань або порушень, опосередковуваних модулюванням або регулюванням протеїнкіназ АКТ, тирозинкіназ, додаткових серин/треонінкіназ, та/або кіназ подвійної специфічності. Патологічні стани, опосередковувані протеїнкіназами АКТ, які можна лікувати способами згідно із даним винаходом, включають, але не обмежені перерахованими, запальні, гіперпроліферативні, серцево-судинні, нейродегенеративні, гінекологічні та дерматологічні захворювання й порушення. 8 UA 100544 C2 5 10 15 20 25 30 35 40 45 50 55 60 [0054] В одному варіанті здійснення, зазначену фармацевтичну композицію застосовують для лікування гіперпроліферативних розладів, включаючи ракові захворювання наступних категорій: (1) Серця: саркома (ангіосаркома, фібросаркома, рабдоміосаркома, ліпосаркома), міксома, рабдоміома, фіброма, ліпома й тератома; (2) Легень: бронхогенна карцинома (плоскоклітинна, недиференційована дрібноклітинна, недиференційована крупноклітинна, аденокарцинома), альвеолярна (бронхіолярна) карцинома, бронхіальна аденома, саркома, лімфома, хондроматозна гамартома, мезотеліома, недрібноклітинний рак легень, дрібноклітинний рак легень; (3) Шлунково-кишкового тракту: рак стравоходу (плоскоклітинна карцинома, аденокарцинома, лейоміосаркома, лімфома), шлунку (карцинома, лімфома, лейоміосаркома), підшлункової залози (протокова аденокарцинома, інсулінома, глюкагонома, гастринома, карциноїдні пухлини, віпома), тонкого кишечнику (аденокарцинома, лімфома, карциноїдні пухлини, саркома Карпозі, лейоміома, гемангіома, ліпома, нейрофіброма, фіброма), товстого кишечнику (аденокарцинома, тубулярна аденома, ворсинчаста аденома, гамартома, лейоміома); (4) Сечостатевого тракту: рак нирок (аденокарцинома, пухлина Вільмса [нефробластома], лімфома, лейкемія), сечового міхура й уретри (плоскоклітинна карцинома, перехідно-клітинна карцинома, аденокарцинома), простати (аденокарцинома, саркома), яєчок (семінома, тератома, ембріональна карцинома, тератокарцинома, хоріокарцинома, саркома, карцинома гіюсних клітин, фіброма, фіброаденома, аденоматоїдні пухлини, ліпома); (5) Печінки: гепатома (карцинома клітин печінки), холангіокарцинома, гепатобластома, ангіосаркома, аденома клітин печінки, гемангіома; (6) Кістяка: остеогенна саркома (остеосаркома), фібросаркома, злоякісна фіброзна гістиоцитома, хондросаркома, саркома Юінга, злоякісна лімфома (ретикулоклітинна саркома), множинна мієлома, злоякісна гігантоклітинна хордома, остеохронфрома (кістково-хрящові екзостози), доброякісна хондрома, хондробластома, хондроміксофіброма, остеоїд-остеома й гігантоклітинні пухлини; (7) Нервової системи: рак черепа (остеома, гемангіома, гранулома, ксантома, деформуючий остоз), м'яких мозкових оболонок (менінгіома, менінгіосаркома, гліоматоз), мозку (астроцитома, медулобластома, гліома, епендімома, гермінома [пінеалома], мультиформна гліобластома, олігодендрогліома, шванома, ретинобластома, уроджені пухлини), спинного мозку (нейрофіброма, менінгіома, гліома, саркома); (8) Гінекологічні: рак матки (ендометріальна карцинома), шийки матки (карцинома шийки матки, передпухлинна дисплазія шийки матки), яєчників (карцинома яєчників [серозна цистаденокарцинома, муцинозна цистаденокарцинома, некласифікована карцинома], пухлини зернистих клітин, пухлини клітин Сертолі-Лейдіга, дисгермінома, злоякісна тератома), вульви (плоскоклітинна карцинома, інтраепітеліальна карцинома, аденокарцинома, фібросаркома, меланома), піхви (світлоклітинна карцинома, плоскоклітинна карцинома, ботриоїдная саркома (ембріональна рабдоміосаркома), фалопієвих труб (карцинома); (9) Гематологічні: рак крові (мієлоїдна лейкемія [гостра й хронічна], гостра лімфобластична лейкемія, хронічний лімфоцитарний лейкоз, мієлопроліферативний синдром, множинна мієлома, мієлодиспластичний синдром), хвороба Ходжкіна, не-ходжкінська лімфома [злоякісна лімфома]; (10) Шкірні: меланома в пізній стадії, злоякісна меланома, карцинома базальних клітин, плоскоклітинна карцинома, саркома Карпозі, диспластія родимок, ліпома, ангіома, дерматофіброма, келоїди, псоріаз; (11) Наднирковиків: нейробластома; (12) Молочної залози: метастази раку молочної залози; аденокарцинома молочної залози; (13) Кишечнику; (14) Ротової порожнини; (15) Лейкоз ворсистих клітин; (16) Голови й шиї; (17) та інші, включаючи резистентне метастазування; саркому Карпозі; синдром Банаян-Зонана; і хворобу Каудена або хворобу Лерміта-Дуклоса, а також інші гіперпроліферативні порушення. [0055] Сполука й способи згідно із даним винаходом також можуть бути використані при лікуванні захворювань і патологічних станів, таких як ревматоїдний артрит, остеоартрит, хвороба Хрона, ангіофіброма, захворювання очей (наприклад, васкуляризація сітківки, діабетична ретинопатія, вікова дегенерація жовтої плями, дегенерація жовтої плями й т.д.), множинний склероз, ожиріння, хвороба Альцгеймера, рестеноз, аутоімунні захворювання, алергія, астма, ендометріоз, атеросклероз, стеноз венозного трансплантата, періаностоматичний стеноз протетичного трансплантата, гіперплазія простати, хронічні обструктивні легеневі захворювання, псоріаз, інгібування нейрологічних пошкоджень через відновлення тканин, формування рубцевої тканини (може також допомагати при загоєнні ран), множинний склероз, запальні захворювання кишечнику, інфекції, зокрема, бактеріальні, вірусні, ретровірусні або паразитарні інфекції (завдяки посиленню апоптозу), захворювання легень, новоутворення, хвороба Паркінсона, відторгнення трансплантата (діє як імунодепресант), септичний шок тощо. [0056] Відповідно, ще один аспект даного винаходу відноситься до способу лікування захворювань або патологічних станів, опосередковуваних протеїнкіназами АКТ, у ссавців, що 9 UA 100544 C2 5 10 15 20 25 30 35 40 45 50 55 60 включає введення зазначеному ссавцеві сполуки формули I, або її фармацевтично прийнятної солі в кількості, ефективній для лікування або запобігання зазначеного порушення. [0057] Кількість сполуки формули I, яка буде відповідати подібній кількості, варіюють залежно від таких факторів, як конкретна сполука, тяжкість захворювання і його небезпека, і характеристики (наприклад, вага) ссавця, який потребує лікування, але тим не менше, може бути встановлено фахівцем у звичайному порядку. [0058] Даний винахід також передбачає сполуку формули I для застосування в лікуванні патологічних станів, опосередковуваних протеїнкіназами АКТ. [0059] Ще одним об'єктом даного винаходу є застосування сполуки формули I у приготуванні лікарського засобу для лікування, такого як лікування або запобігання патологічних станів, опосередковуваних активністю протеїнкінази АКТ. КОМБІНОВАНА ТЕРАПІЯ [0060] Сполука згідно із даним винаходом може бути використана в комбінації з одним або декількома додатковими лікарськими засобами, як описано нижче. Дозування другого лікарського засобу може бути відповідним чином обране на основі дозування, використовуваного в клініці. Співвідношення між сполукою згідно із даним винаходом й другим лікарським засобом може бути визначене відповідно до суб'єкта, якому вводять засоби, шляхом введення засобу, визначеним захворюванням, клінічним станом, характером комбінації, й іншими факторами. У випадку, якщо суб'єктом, якому вводять засіб, є людина, другий лікарський засіб може бути використано, наприклад, у кількості від 0.01 до 100 частин за масою на частину до маси сполуки згідно із даним винаходом. [0061] Друга сполука комбінованого фармацевтичного складу або режим дозування переважно здійснює дію, яка доповнює сполуку згідно із даним винаходом, таким чином, що сполуки не здійснюють одна на одну негативного впливу. Подібні лікарські засоби, відповідно, присутні в кількостях, що є ефективними для досягнення поставленої мети. Відповідно, згідно ще одному аспекту даного винаходу запропонована композиція, що включає сполуку згідно із даним винаходом в комбінації із другим лікарським засобом, описаним у даному тексті. [0062] Сполуку згідно із даним винаходом й додатковий фармацевтично активний агент або агенти можна вводити разом, у виді єдиної фармацевтичної композиції, або окремо, і у випадку, якщо агенти вводять роздільно, введення можна здійснювати одночасно або послідовно в будьякому порядку. Подібне послідовне введення можна здійснювати на короткому або тривалому проміжку часу. Кількість сполуки згідно із даним винаходом і другий агент або агенти, і відносний час введення вибирають таким чином, щоб досягти бажаного комбінованого терапевтичного ефекту. [0063] Комбінована терапія може забезпечити ефект "синергії" і виявитися "синергетичною", тобто ефект, досягнутий при спільному використанні активних інгредієнтів, вище, ніж сума ефектів, одержуваних при використанні даних сполук окремо. Синергетичний ефект може бути одержаний, якщо активні інгредієнти: (1) комбінують, і вводять або доставляють одночасно у виді комбінованої лікарської форми, (2) доставляють по черзі або паралельно у виді різних складів; або (3) при іншому режимі введення. При почерговій доставці, синергетичний ефект може бути одержаний, якщо сполуку вводять або доставляють у певній послідовності, тобто шляхом різних ін'єкцій в окремих шприцах. У цілому, при терапії, що чергується, ефективні дози кожного з активних інгредієнтів вводять у певній послідовності, тобто серіями, а при комбінованій терапії, ефективні дози двох або більше активних інгредієнтів вводять разом. ШЛЯХИ ВВЕДЕННЯ [0064] Сполуку згідно із даним винаходом можна вводити будь-яким шляхом, що підходить для лікування конкретного патологічного стану. Підходящі шляхи включають оральний, парентеральний (включаючи підшкірний, внутрім'язовий, внутрішньовенний, внутріартеріальний, внутрішкірний, інтратекальний і епідуральний), трансдермальний, ректальний, назальний, локальний (включаючи трансбукальний і під'язичний), вагінальний, внутрічеревний, внутрілегеневий й інтраназальний. Потрібно відмітити, що переважний спосіб може варіювати в залежності, наприклад, від стану реципієнта. Якщо сполуку вводять перорально, вона може бути виготовлена у виді пігулки, капсули, таблетки тощо, з фармацевтично прийнятним носієм або наповнювачем. Якщо сполуку вводять парентерально, вона може бути виконана у фармацевтично прийнятному парентеральном носії, й у виді складу для ін'єкцій у лікарській формі, як детально описано нижче. ФАРМАЦЕВТИЧНІ СКЛАДИ (ЛІКАРСЬКІ ФОРМИ) [0065] Для того, щоб застосовувати сполуку згідно із даним винаходом для терапевтичного лікування (включаючи профілактичне лікування) ссавців, включаючи людину, вона зазвичай виконана у відповідності зі стандартною фармацевтичною практикою у формі фармацевтичної 10 UA 100544 C2 5 10 15 20 25 30 35 40 45 50 55 60 композиції. Відповідно до даного аспекту цього винаходу, запропонована фармацевтична композиція, яка включає сполуку згідно із даним винаходом. У певних варіантах здійснення фармацевтична композиція включає сполуку формули I разом з фармацевтично прийнятним розріджувачем або носієм. [0066] Фармацевтичні композиції згідно із даним винаходом виготовляють, дозують і вводять згідно відповідній медичній практиці стосовно кількості, концентрації, режиму прийому, курсу лікування, носія й шляху введення. Фактори, які необхідно враховувати в даному контексті, включають: конкретне порушення, яке лікують, конкретного ссавця, якого лікують, клінічний стан конкретного пацієнта, причину порушення, місце введення агента, шлях введення, режим введення, та інші фактори, відомі медичним працівникам. Терапевтично ефективна кількість сполуки, яку вводить, залежить від зазначених факторів, і є мінімальною кількістю, необхідною для запобігання, зниження виразності або лікування порушення. Сполуку згідно із даним винаходом зазвичай виконано у виді дозованої лікарської форми, щоб забезпечити легко контрольоване дозоване введення лікарського засобу, і прийнятність запропонованого режиму прийому для пацієнта. [0067] Композиція згідно із даним винаходом переважно стерильна. Зокрема, засоби, що вводять in vivo, повинні бути стерильними. Подібна стерилізація легко досягається, наприклад, шляхом фільтрації через стерильні фільтраційні мембрани. Сполуку зазвичай можна зберігати у твердому виді, у виді ліофілізованого складу або у виді водного розчину. [0068] Фармацевтичні композиції, що містять сполуки згідно із даним винаходом можуть бути приготовлені з урахуванням різних шляхів і типів введення. Наприклад, сполука згідно із даним винаходом, що має достатній ступінь чистоти, може за бажанням бути змішана з фармацевтично прийнятними розріджувачами, носіями, наповнювачами або стабілізаторами (Remington's Pharmaceutical Sciences (1980) 16-е видання, Osol, A. Ed.), приготована у формі ліофілізованої композиції, меленого порошку або водного розчину. Склад може бути приготовлений шляхом змішування при кімнатній температурі й підходящому рівні pН, а також при бажаному ступені чистоти, з фізіологічно прийнятними носіями, тобто носіями, в обраних дозах і концентраціях, що не є токсичними для реципієнта. Рівень pН композиції залежить головним чином від конкретного способу застосування й концентрації сполуки, але може варіюватися від приблизно 3 до приблизно 8. Склад в ацетатному буфері при pН 5 є підходящим варіантом здійснення. Композиції можуть бути приготовлені з використанням відомих процедур розчинення й змішування. Наприклад, партію лікарської речовини (тобто сполуки згідно із даним винаходом або стабілізованої форми сполуки (наприклад, комплекс із похідним циклодекстрину або іншим відомим комплексутворюючим агентом)) розчиняють у підходящому розчиннику за наявністю одного або декількох наповнювачів. [0069] Конкретний використовуваний носій, розріджувач або наповнювач залежить від засобів і мети, для досягнення якої використовується сполука згідно із даним винаходом. Розчинники зазвичай вибирають на основі розчинників, які фахівці вважають безпечними (GRAS) для введення ссавцеві. У цілому, безпечними розчинниками називають нетоксичні водні розчинники, такі як вода та інші нетоксичні розчинники, розчинні в воді або такі, що змішуються з водою. Підходящі водні розчинники включають воду, етанол, пропіленгліколь, поліетиленгліколі (наприклад, PEG 400, PEG 300) тощо, а також їх суміші. Прийнятні розріджувачі, носії, наповнювачі й стабілізатори є нетоксичними для реципієнтів у використовуваних дозах і концентраціях, і включають буфери, такі як фосфат, цитрат та інші органічні кислоти; антиоксиданти, включаючи аскорбінову кислоту й метіонін; консерванти (такі як хлорид октадецилдиметилбензиламонію; хлорид гексонію; хлорид бензалконію, хлорид бензетонію; феноловий, бутиловий або бензиловий спирт; парабени алкілів, такі як парабен метилу або пропілу; катехол; резорцин; циклогексанол; 3-пентанол; і m-крезол); поліпептиди низької молекулярної маси (менше приблизно 10 залишків); білки, такі як серумальбумін, желатин, абоімуноглобуліни; гідрофільні полімери, такі як полівінілпіролідон; амінокислоти, такі як гліцин, глутамін, аспарагін, гістидин, аргінін, або лізин; моносахариди, дисахариди й інші вуглеводи, включаючи глюкозу, манозу, або декстрини; хелуючі агенти, такі як ЕДТА; цукри, такі як сахароза, манітол, трегалоза або сорбітол; солеформуючі протиіони, такі як натрій; комплекси металів (наприклад, цинкопротеїнові комплекси); та/або неіонні сурфактанти, такі як TWEENтм, PLURONICSтм, або поліетиленгліколь (PEG). Композиції можуть також включати один або декілька стабілізуючих агентів, сурфактантів, змочувальних агентів, змащувальних агентів, емульгаторів, суспендуючих агентів, консервантів, антиоксидантів, криючих агентів, глідантів, технологічних добавок, барвників, підсолоджувачів, ароматизуючих агентів, смакових добавок й інших відомих добавок для зручної форми композиції (тобто сполуки згідно із даним винаходом або фармацевтичній композиції на її основі), або допомоги при виробництві 11 UA 100544 C2 5 10 15 20 25 30 35 40 45 50 55 60 фармацевтичного продукту (тобто лікарського засобу). Активні фармацевтичні інгредієнти також можуть бути залучені в мікрокапсули, приготовлені, наприклад, методом концервації або шляхом міжфазної полімеризації, наприклад, гідроксиметилцелюлози або желатинових мікрокапсул, і мікрокапсул з полі-(метилметакрилату) відповідно, у колоїдних системах доставки (наприклад, ліпосомах, альбумінових мікросферах, мікроемульсіях, наночастинках і нанокапсулах) або в макроемульсіях. Подібні технології описані в Remington's Pharmaceutical Sciences 16th edition, Osol, A. Ed. (1980). "Ліпосома" являє собою маленький пухирець, що складається з різних типів ліпідів, фосфоліпідів та/або поверхнево-активної речовини, яку можна використовувати для доставки лікарського засобу (такого, як сполука формули I й, можливо, додатковий терапевтичний агент) в організм ссавця. Компоненти ліпосоми зазвичай мають двошарову структуру, подібну до організації ліпідів у біологічних мембранах. [0070] Із сполук згідно із даним винаходом можуть бути приготовлені форми уповільненого вивільнення. Підходящі приклади форм уповільненого вивільнення включають напівпроникні матриці із твердих гідрофобних полімерів, що містять сполуку формули I, де зазначені матриці виконані у виді виробу, що має певну форму, наприклад, плівки або мікрокапсули. Приклади матеріалів матриць уповільненого вивільнення включають поліефіри, гідрогелі (наприклад, полі(2-гідроксиетилметакрилат) або полівініловий спирт, поліактиди (Патент США № 3,773,919), сополімери L-глутамінової кислоти й гамаетил-L-глутамат, етилен вінілацетат, що не розкладається, сополімери молочної кислоти-гліколевої кислоти, що розкладаються, такі як LUPRON DEPOTтм (ін'єкуємі мікросфери, виконані із сополімера молочної кислоти-гліколевої кислоти й лейпролід ацетату), і полі-D-(-)-3-гідроксимасляна кислота. [0071] Фармацевтичні композиції, що містять сполуки згідно із даним винаходом, можуть бути виконані у формі стерильного ін'єкуємого складу, такого як стерильна суспензія для ін'єкцій у воді або олії. Зазначена суспензія може бути виготовлена відповідно до відомих способів з використанням підходящих диспергуючих або змочувальних агентів, а також суспендуючих агентів, які були зазначені вище. Стерильний склад для ін'єкцій може також являти собою стерильний розчин для ін'єкцій у нетоксичному розріджувачі або розчиннику, придатному для парентерального введення, такий як розчин в 1,3-бутандіолі, або може бути приготовлений у виді ліофілізованого порошку. Деякі із прийнятних носіїв і розчинників, які можуть бути використані для зазначеної мети: вода, розчин Рінгера й ізотонічний розчин хлориду натрію. Крім того, як розчинник або суспендуюче середовища можуть бути використані стерильні нелетучі олії. Із цією метою може бути використана будь-яка легка нелетуча олія, включаючи синтетичні моно- або дигліцериди. Крім того, жирні кислоти, такі як олеїнова кислота, також можуть бути використанні в приготуванні складів для ін'єкцій. [0072] Композиції, що підходять для парентерального введення, включають водні й неводні стерильні розчини для ін'єкцій, які можуть містити антиоксиданти, буфери, бактеріостатики, і розчинені речовини, що забезпечують ізотонічність складу із кров'ю бажаного реципієнта; а також водні й неводні стерильні суспензії, які можуть включати суспендуючи агенти й загусники. [0073] Композиції згідно із даним винаходом можуть також бути виконані у формі, що підходить для перорального введення (наприклад, у виді таблеток, пастилок, твердих або м'яких капсул, водних або олійних суспензій, емульсій, дисперсних порошків або гранул, сиропів або еліксирів), для зовнішнього застосування (наприклад, у виді кремів, мазей, гелів, або водних або олійних розчинів або суспензій), для введення шляхом інгаляції (наприклад, у виді пилоподібного порошку або рідкого аерозолю), або для введення шляхом інсуфляції (наприклад, у виді пилоподібного порошку). [0074] Підходящі фармацевтично прийнятні наповнювачі для композиції у формі таблетки включають, наприклад, інертні розріджувачі, такі як лактоза, карбонат натрію, фосфат кальцію або карбонат кальцію, гранулювальні речовини й дезінтегрувальні речовини, такі як кукурудзяний крохмаль або альгінова кислота; зв'язувальні агенти, такі як крохмаль; змащувальні агенти, такі як стеарат магнію, стеаринова кислота, або тальк; консерванти, такі як етил або пропіл p-гідроксибензоат, і антиоксиданти, такі як аскорбінова кислота. Склади у формі таблеток можуть бути глазурованими або неглазурованими, або, для зміни швидкості їх розпаду й наступного усмоктування активного інгредієнта в шлунково-кишковому тракті, або для підвищення їх стабільності та/або покращення зовнішнього виду; у будь-якому разі можуть бути використані глазурувальні агенти й процедури, відомі науці. [0075] Композиції для перорального введення можуть бути виконані у формі твердих желатинових капсул, в яких активний інгредієнт змішаний з інертним твердим розріджувачем, наприклад, карбонатом кальцію, фосфатом кальцію або каоліном, або у виді м'яких желатинових капсул, у яких активний інгредієнт змішаний з водою або олією, такою як арахісова олія, рідкий парафін або маслинова олія. 12 UA 100544 C2 5 10 15 20 25 30 35 40 45 50 55 60 [0076] Водні суспензії зазвичай містять активний інгредієнт у виді тонкодисперсного порошку разом з одним або декількома суспендувальними агентами, такими як натрійкарбоксиметилцелюлоза, метилцелюлоза, гідроксипропілметилцелюлоза, альгінат натрію, полівінілпіролідон, трагакантова камедь і гуміарабік; диспергувальними або змочувальними агентами, такими як лецитин або продукти конденсації оксиду алкілену з жирними кислотами (наприклад, поліоксетилен стеарат), або продукти конденсації оксиду етилену із довголанцюговими аліфатичними спиртами, наприклад, гептадекаетиленоксикетанол, або продукти конденсації оксиду етилену з неповними складними ефірами, похідними жирних кислот і гекситолу, такі як поліоксиетиленсорбітолмоноолеат, або продукти конденсації оксиду етилену з неповними складними ефірами, похідними жирних кислот й ангідридів гекситолу, наприклад, поліетиленсорбітанмоноолеат. Водні суспензії можуть також містити один або декілька консервантів (таких як етил або пропіл p-гідроксибензоат), антиоксидантів (таких як аскорбінова кислота), барвників, смакових добавок, та/або підсолоджувачів (таких як сахароза, сахарин або аспартам). [0077] Олійні суспензії можуть бути приготовлені шляхом суспендування активного інгредієнта в рослинній олії (такій як арахісова олія, маслинова олія, кунжутна олія або кокосова олія) або в мінеральній олії (такій, як рідкий парафін). Олійні суспензії також можуть містити загусник, такий як бджолиний віск, твердий парафін або цетиловий спирт. Підсолоджувачі, такі як зазначені вище, і смакові добавки можуть бути додані для забезпечення приємного смаку композиції для перорального введення. Зазначені композиції можна консервувати додаванням антиоксиданту, такого як аскорбінова кислота. [0078] Сипучі порошки й гранули, що підходять для приготування рідкої суспензії шляхом додавання води, зазвичай містять активний інгредієнт разом з диспергувальним або змочувальним агентом, суспендувальним агентом й одним або більше консервантами. Приклади підходящих диспергуючих або змочувальних агентів наведені вище. Також можуть бути присутніми додаткові наповнювачі, такі як підсолоджувачі, смакові добавки й барвники. [0079] Фармацевтичні композиції згідно із даним винаходом можуть також мати форму емульсії типу "олія у воді". Олійна фаза може бути рослинною олією, такою як арахісова олія або маслинова олія, або мінеральною олією, такою як рідкий парафін, або сумішшю будь-яких вищезгаданих олій. Підходящими емульгуючими агентами можуть бути, наприклад, природні камеді, такі як гуміарабік або трагакантова камедь, фосфатиди, що зустрічаються в природі, такі як соя, лецитин, складні ефіри або неповні складні ефіри, похідні жирних кислот й ангідридів гекситолу (наприклад, сорбітанмоноолеат), і продукти конденсації зазначених неповних складних ефірів з оксидом етилену, такі як поліоксиетиленсорбітанмоноолеат. Емульсії також можуть містити підсолоджувачі, смакові добавки й консерванти. [0080] Сиропи й еліксири можуть бути приготовлені з використанням підсолоджувачів, таких як гліцерол, пропіленгліколь, сорбітол, аспартам або сахароза, й також можуть містити засіб, що пом'якшує подразнення, консервант, смакову добавку та/або барвник. [0081] Композиції у формі супозиторію можуть бути приготовлені змішуванням активного інгредієнта з підходящими недратівними наповнювачами, що знаходяться у твердому стані при кімнатній температурі, і в рідкому стані при температурі прямої кишки, завдяки чому він буде плавитися в прямій кишці, виділяючи лікарський засіб. Підходящі ексцепієнти включають, наприклад, какао-олію й поліетиленгліколі. Композиції, що підходять для вагінального введення, можуть мати вид песарію, тампона, крему, гелю, пасти, піни або спрею, що містить на додаток до активного інгредієнта носії, які в даній галузі відомі як придатні. [0082] Композиції для зовнішнього застосування, такі як креми, мазі, гелі й рідкі або олійні розчини або суспензії, можуть у цілому бути одержані шляхом приготування активного інгредієнта в традиційному, придатному для зовнішнього застосування середовищі або розріджувачі, з використанням добре відомих процедур. [0083] Композиції для трансдермального введення можуть бути виконані у формі трансдермальних шкірних пластирів, які добре відомі фахівцеві. [0084] Композиції, що підходять для внутрілегеневого або назального введення, мають розмір часток, наприклад, у межах від 0.1 до 500 мікронів (включаючи розміри часток у межах від 0.1 до 500 мікронів із кроком в, наприклад, 0.5, 1, 30 мікрон, 35 мікрон тощо), які вводяться частим вдиханням через носовий хід, або вдиханням через рот для доставки в альвеолярні мішечки. Підходящі композиції включають рідкі або олійні розчини активного інгредієнта. Композиції, що підходять для аерозольного введення або введення у виді сухого порошку, можуть бути приготовлені за відомими способами, і можуть доставлятися разом з іншими терапевтичними агентами, такими як сполуки, до цього застосовувані в ході лікування або профілактики розладів, як описано нижче. 13 UA 100544 C2 5 10 15 20 25 30 35 40 45 50 55 60 [0085] Для використання фармацевтична композиція може бути упакована різними способами, залежно від шляху введення композиції. Наприклад, розповсюджуваний виріб може включати контейнер, у якому розташована фармацевтична композиція у відповідній формі. Підходящі контейнери загальновідомі, і включають матеріали, такі як пляшки (пластикові й скляні), саше-пакети, ампули, пластикові пакети, металеві циліндри тощо. Контейнер також може включати захищені від неумілого використання пристрої для запобігання необережного поводження з вмістом упаковки. Крім того, на контейнері розміщений ярлик, на якому описаний вміст контейнера. Ярлик може також містити відповідні попередження. Композиції можуть також бути упаковані в однодозові або многодозові контейнери, наприклад, герметичні ампули й флакони, і можуть зберігатися в ліофілізованому (сублімованому) стані, коли для здійснення ін'єкції потрібно лише додавання стерильного рідкого носія, наприклад, води, безпосередньо перед використанням. Виготовлювані для негайного прийому ін'єкційні розчини і суспензії, готують зі стерильних порошків, гранул і таблеток будь-якого описаного вище типу. Переважні лікарські форми являють собою лікарські форми, які містять щоденну дозу або щоденну частину дози, як описано вище, або підходящу частину дози активного інгредієнта. [0086] Винахід також передбачає ветеринарні композиції, які включають щонайменше один визначений вище активний інгредієнт у комбінації із застосовуваним у ветеринарії носієм. Ветеринарні носії являють собою матеріали, використовувані з метою введення лікарського засобу, і можуть бути твердими, рідкими або газоподібними матеріалами, які в інших випадках є інертними або прийнятними у ветеринарній науці, а також сумісні з активним інгредієнтом. Зазначені ветеринарні композиції можуть бути введені парентерально, орально, або будь-яким іншим бажаним способом. [0087] Кількість сполуки згідно із даним винаходом, комбінованої з одним або декількома ексципієнтами з метою приготування однієї дози лікарського засобу, буде варіюватися залежно від реципієнта, небезпеки порушення або патологічного стану, частоти введення, розташування сполуки й вибору лікаря, який приписує даний засіб. В одному варіанті здійснення, підходяща кількість сполуки згідно із даним винаходом вводиться ссавцеві, який має потребу в даній сполуці. В одному варіанті здійснення, введення сполуки здійснюють у кількості від приблизно 0.001 мг/кг ваги тіла до приблизно 60 мг/кг ваги тіла на добу. В іншому варіанті здійснення, введення сполуки відбувається в кількості від 0.5 мг/кг ваги тіла до приблизно 40 мг/кг ваги тіла на добу. У деяких випадках рівень дозування нижче нижнього порогу зазначених вище меж може бути більше ніж достатнім, а в інших випадках без яких-небудь несприятливих ефектів можуть бути введені більші дози, якщо зазначені більші дози попередньо розділені на декілька маленьких доз, що вводять протягом доби. Для одержання додаткової інформації про способи введення й дозування, див. главу 25.3 тому 5 видання Comprehensive Medicinal Chemistry (Corwin Hansch; Chairman of Editorial Board), Pergamon Press 1990, яке особливо відмічено тут за допомогою посилання. ГОТОВІ ВИРОБИ [0088] В іншому варіанті здійснення винаходу представлений готовий виріб, або "набір", що містить матеріали, використовувані для лікування порушень, описаних вище. В одному варіанті здійснення набір включає контейнер, що містить сполуку згідно із даним винаходом. Підходящі контейнери включають, наприклад, пляшки, флакони, шприци, блістерну упаковку тощо. Контейнер може бути виконаний з ряду матеріалів, таких як скло або пластик. Контейнер може містити сполуку згідно із даним винаходом, або композицію на її основі, що є ефективною при лікуванні патологічного стану, і може мати стерильний канал доступу (наприклад, контейнер може являти собою пакет із внутрішньовенним розчином або флакон, оснащений заглушкою, яку можна проколоти голкою шприца). [0089] Набір може додатково включати ярлик або вкладиш на контейнері або пов'язаний з ним. Термін "вкладиш" використовується для позначення інструкцій, традиційно включених у комерційні упаковки терапевтичних продуктів, які містять інформацію про показання до застосування, використання, дозування, правила прийому, протипоказання та/або попередження, що стосується використання подібних терапевтичних продуктів. В одному варіанті здійснення, ярлик або вкладиш вказує, що композиція, яка містить сполуку згідно із даним винаходом може бути використана для лікування порушення, опосередковуваного, наприклад, кіназою АКТ. Ярлик або вкладиш може також вказувати, що композиція може бути використана для лікування інших розладів. [0090] У певних варіантах виконання, набори підходять для доставки твердих оральних форм сполуки згідно із даним винаходом, таких як таблетки або капсули. Подібний набір переважно включає декілька доз лікарського засобу. Подібні набори можуть включати картку, на якій відображені дози, розташовані в порядку запропонованого використання. Прикладом 14 UA 100544 C2 5 10 15 20 25 30 35 40 45 50 55 60 подібного набору є "блістерна упаковка". Блістерні упаковки добре відомі в пакувальній промисловості, й широко використовуються для упаковування доз фармацевтичних композицій. За бажанням, у набір може бути включене нагадування у виді чисел, букв чи інших позначень, або вкладиша-календаря для позначення днів режиму лікування, коли можуть вводитися дози. [0091] Відповідно до іншого варіанта здійснення, набір може включати (a) перший контейнер із сполукою, яка міститься в ньому, згідно із даним винаходом; і (b) другий контейнер з другою фармацевтичною композицією, яка міститься в ньому, причому друга фармацевтична композиція містить другу сполуку, придатну для лікування порушення, опосередковуваного кіназою АКТ. В іншому варіанті або додатково, набір може додатково включати третій контейнер, що містить фармацевтично прийнятний буфер, такий як бактеріостатична вода для ін'єкцій (BWFI), фосфатний буферний розчин, розчин Рінгера й розчин декстрози. Набір може додатково включати інші матеріали, бажані з комерційної й користувальницької точки зору, включаючи інші буфери, розріджувачі, фільтри, голки й шприци. [0092] Набір може додатково включати вказівки стосовно введенню сполуки згідно із даним винаходом і другої фармацевтичної композиції, у випадку, якщо вона є наявною. Наприклад, якщо набір включає першу композицію, що містить сполуку згідно із даним винаходом й другу фармацевтичну композицію, набір може додатково включати вказівки щодо одночасного, послідовного або окремого введення першої й другої фармацевтичної композицій пацієнтові, який має потребу в зазначених композиціях. [0093] У визначених інших варіантах виконання, де набір включає композицію згідно із даним винаходом й другий терапевтичний агент, набір може включати контейнер для вмісту компонентів окремо, такий як розділена пляшка, або розділений пакет з фольги, однак, окремі компоненти можуть також знаходитися в одному нерозділеному контейнері. У визначених варіантах виконання набір включає вказівки щодо введення окремих компонентів. Форма набору має особливу перевагу, коли окремі компоненти здебільшо вводять у різних формах (наприклад, орально й парентерально), вводять за різними тимчасовими інтервалами, або якщо титрування окремих компонентів комбінації бажане з погляду лікаря, який приписує його. [0094] Відповідно, ще один об'єкт даного винаходу забезпечує набір для лікування захворювання або порушення, опосередковуваного кіназою АКТ, де зазначений набір включає а) першу фармацевтичну композицію, що містить сполуку згідно із даним винаходом або її фармацевтично прийнятну сіль; і b) інструкції із застосування. [0095] У деяких варіантах здійснення, набір додатково включає © другу фармацевтичну композицію, причому друга фармацевтична композиція містить другу сполуку, придатну для лікування порушення або захворювання, опосередковуваного кіназою АКТ. У конкретному варіанті здійснення, що включає другу фармацевтичну композицію, набір додатково включає інструкції з одночасного, послідовного або окремого введення зазначених перших і других фармацевтичних композицій пацієнтові, який має в цьому потребу. У деяких варіантах здійснення зазначені перша й друга фармацевтичні композиції знаходяться в окремих контейнерах. В інших варіантах здійснення зазначені перша й друга фармацевтичні композиції знаходяться у тому ж самому контейнері. [0096] Незважаючи на те, що сполука формули I у першу чергу цінна як терапевтичний агент для ссавців, її також можна застосовувати в будь-якому разі, коли необхідний контроль протеїнкіназ АКТ, тирозинкіназ, додаткових серинтреонінкіназ, та/або кіназ подвійної специфічності. Таким чином, сполуку можна застосовувати як фармакологічний стандарт для використання в сфері розробки нових біологічних тестів і пошуку нових фармакологічних агентів. [0097] Активність сполуки згідно із даним винаходом може бути оцінена шляхом тесту із протеїнкіназами АКТ, тирозинкіназами, додатковими серин/треонінкіназами, та/або кіназами подвійної специфічності in vitro, in vivo, або в клітинній лінії. Дослідження in vitro включають дослідження, в яких визначають інгібування активності кіназ. Інші дослідження in vitro забезпечують кількісний аналіз здатності інгібітора зв'язувати кінази, які можна вимірювати або радіоактивним міченням інгібітора перед зв'язуванням, виділенням комплексу інгібітор/кіназа й визначенням кількості зв'язаних міток, або проведенням конкурентного експерименту, де нові інгібітори інкубують з відомими радіолігандами. Ці й інші підходящі тести in vitro і тести в культурах клітин добре відомі фахівцеві. [0098] Незважаючи на те, що винахід був описаний і проілюстрований з певним ступенем уточнення, варто розуміти, що даний опис наведений лише як приклад, і що велика кількість змін у комбінаціях і розташуванні частин може бути зроблена фахівцем, не виходячи за рамки об'єму даного винаходу, визначеного в наведеній нижче формулі винаходу. БІОЛОГІЧНИЙ ПРИКЛАД 15 UA 100544 C2 5 10 15 20 25 30 35 40 45 50 55 60 Тест із кіназою АКТ-1 [0099] Активність сполуки згідно із даним винаходом може бути визначена за допомогою наступного тесту з кіназою, який дозволяє виміряти фосфорилювання флуоресцентно-міченого пептиду активної повнорозмірної рекомбінантної АКТ-1 людини шляхом флуоресцентної поляризації з використанням комерційно доступного набору IMAP. [00100] Матеріали для дослідження одержані з повного набору IMAP AKT Assay Bulk Kit, продукт #R8059 від Molecular Devices, Sunnyvale (Каліфорнія, США). Матеріали набору включають реакційний буфер IMAP (5x). Розведений реакційний буфер IMAP 1x включав 10 мМ Tris-HCl, pН 7.2, 10 мМ MgCl2, 0.1 % БСА, 0.05 % NaN3. Дитіотреітол зазвичай додають безпосередньо перед використанням до кінцевої концентрації 1 мМ. Також включений зв'язуючий буфер IMAP (5x), і зв'язуючий реагент IMAP. Зв'язуючий розчин готують у виді розчину 1:400 зв'язуючого реагенту IMAP у зв'язуючому буфері IMAP 1x. [00101] Флуоресцентно-мічений субстрат АКТ (Crosstide) має послідовність (Fl)GRPRTSSFAEG. Готували вихідний розчин з концентрацією 20 у реакційному буфері IMAP 1x. [00102] Використовували наступні чашки Петрі: Costar 3657 (382, з поліпропілену, з білим Vподібним дном), використовується для розведення сполуки, і для приготування суміші сполуки й АТФ. Чашка Петрі для аналізу– Packard ProxyPlateTM-384 F. [00103] Використовувана АКТ-1 являла собою повнорозмірну рекомбінантну АКТ-1 людини, активуєму при PDK-1 і кіназою MAP-2. [00104] Для виконання аналізу готували основні розчини сполук при 10 мМ у диметилсульфоксиді ("ДМСО"). Основні розчини й контрольну сполуку послідовно розбавляли в пропорції 1:2 дев'ять раз у ДМСО (10 мкл сполуки + 10 мкл ДМСО) з одержанням серії розведень 50x у бажаному діапазоні дозування. Потім, аліквоти сполук у ДМСО об'ємом 2.1 мкл переносяться в чашку Петрі Costar 3657, що містить 50 мкл 10.4 мкМ АТФ в 1x реакційному буфері IMAP, що містить 1 мМ дитіотреітолу. Після ретельного змішування, аліквоти об'ємом 2.5 мкл переносять у чашку Петрі ProxyPlate™-384 F. [00105] Аналіз ініціюють шляхом додавання аліквот розчину, що містить 200 нМ флуоресцентно-міченого пептидного субстрату й 4 нМ AKT-1, об'ємом 2.5 мкл. Чашку Петрі піддають центрифугуванню протягом 1 хвилини при 1000 g, і витримують протягом 60 хвилин при кімнатній температурі. Потім, реакцію гасять додаванням 15 мкл зв'язуючого розчину, знову піддають центрифугуванню, і витримують протягом ще 30 хвилин при кімнатній температурі, після чого аналізують на приладі Victor 1420 Multilabel HTS Counter, настроєному на вимірювання флуоресцентної поляризації. [00106] З використанням описаної вище процедури досліджували Сполуку Приклада 1, і виявили, що вона має значення IC50 менше 500 нМ. ПРИКЛАД ПРИГОТУВАННЯ [00107] Нижчезазначений приклад наведений з метою проілюструвати винахід. Проте, варто розуміти, що даний приклад не обмежує винахід, і є лише прикладом практичного здійснення винаходу. Фахівцеві буде зрозуміло, що хімічні реакції, описані в даному прикладі, можуть бути легко адаптовані для альтернативних способів приготування сполуки згідно із даним винаходом, і входять в об'єм даного винаходу. Наприклад, синтез сполуки згідно із даним винаходом може бути успішно проведений зі змінами, очевидними для фахівця, тобто при відповідному захисті груп, що заважають протіканню реакції, з використанням підходящих реагентів, відмінних від зазначених в описі, відомих у даній галузі, та/або внесенням звичайних змін в умови реакцій. В іншому варіанті, інші реакції, відомі в даній галузі, можуть застосовуватися для приготування сполуки згідно із даним винаходом. [00108] В описаному нижче прикладі всі значення температур наведені в градусах Цельсія, якщо не зазначено інше. Реагенти були придбані у комерційних постачальників, таких як Aldrich Chemical Company, Lancaster, TCI або Maybridge, і були використані без додаткового очищення, якщо не зазначено інше. Тетрагідрофуран ("ТГФ"), дихлорометан ("ДХМ"), толуол і діоксан були придбані у компанії Aldrich у герметичних пляшках, і використані в тому виді, у якому були одержані. [00109] Реакції, описані нижче, зазвичай проводили при позитивному тиску азоту або аргону, або з використанням осушувача (якщо не зазначено інше) у безводних розчинниках, а реакційні сосуди оснащували гумовою мембраною для введення субстратів і реагентів за допомогою шприца. Склотару сушили в печі та/або тепловим сушінням. [00110] 1H ЯМР спектр реєстрували на приладі Varian на частоті 400 МГц. 1H-ЯМР спектр одержували для розчинів CDCl3, CD3OD, D2O або d6-ДМСО (наведені в мкг/г) з використанням тетраметилсилану (0.00 ppm) або залишкового розчинника (CDCl3:7.25 мкг/г; CD3OD: 3.31 мкг/г; D2O: 4.79 ppm; d6-ДМСО: 2.50 мкг/г) як контрольний стандарт. Для опису мультиплетів піків 16 UA 100544 C2 використовують наступні абревіатури: s (синглет), d (дуплет), t (триплет), m (мультиплет), br (широкий), dd (дуплет дуплетів), dt (дуплет триплетів). Якщо дані константи взаємодії наведені в Герцах (Гц). 1. Приклад 1 5 O NH F O N Cl N N N HO [0001] (S)-2-(4-хлор-3-фторофеніл)-1-(4-((5R, 7R)-7-гідрокси-5-метил-6,7-дигідро-5Hциклопенту[d]піримідин-4-іл)піперазин-1-іл)-3-((1r, 4S)-4-метоксициклогексиламіно)пропан-1-он 10 15 20 [00111] Етап 1: Етилпулегенат (130 г, 662 ммоль) в етилацетаті ("EtOAc"; 900 мл) охолоджували до -78 °C з використанням бані із суміші сухого льоду з ізопропанолом. Суміш піддавали озонолізу доки реакційна суміш не придбала фіолетового кольору. У цей момент вироблення озону припиняли, а реакційну суміш вилучали з бані із сухим льодом. Через реакцію пропускали кисень доки реакція не стала жовтою. Реакційну суміш концентрували в умовах вакууму, а одержаний залишок був розчинений у чистій оцтовій кислоті (400 мл). Розчин охолоджували до 0 °C, і додавали цинковий пил (65 г, 993 ммоль) порціями протягом 30 хвилин. Потім реакційну суміш перемішували протягом 2 годин, після чого реакційну суміш фільтрували через шар целіту для видалення цинкового пилу. Оцтову кислоту нейтралізували до рівня pН 7 за допомогою водного розчину NaOH й NaHCO3, і екстрагували ефіром (3 × 800 мл). Об'єднані органічні речовини сушили сольовим розчином MgSO 4 і концентрували з одержанням (2R)-етил2-метил-5-оксоциклопентункарбоксилату у виді рідини (107 г, 95 %). 25 30 35 [00112] Етап 2: KOH (8.3 г, 147.9 ммоль) у воді (60 мл) додавали до розчину (2R)-етил-2метил-5-оксоциклопентункарбоксилату (20 г, 117.5 ммоль) і тіосечовини (9.2 г, 120.9 ммоль) в етанолі (100 мл). Суміш дефлегмували протягом 10 годин. Після охолодження, розчинник видаляли. Одержаний залишок нейтралізували концентрованою HCl (12 мл) при 0 °C й потім екстрагували за допомогою ДХМ (3 × 150 мл). Розчинник видаляли, а одержаний залишок очищали хроматографією на силікагелі з елююванням сумішшю гексан/етилацетат (2:1) з одержанням ®-2-меркапто-5-метил-6,7-дигідро-5H-циклопенту[d]піримідин-4-олу (12 г, 56 %). MS (APCI+) [M+H] +183. 17 UA 100544 C2 5 10 15 20 25 30 35 [00113] Етап 3: Нікель Ренею (15 г) і NH4OH (20 мл) додавали до суспензії ®-2-меркапто-5метил-6,7-дигідро-5H-циклопенту[d]піримідин-4-олу (12 г, 65.8 ммоль) у дистильованій воді (100 мл). Суміш дефлегмували протягом 3 годин і потім відфільтровували. Фільтрат концентрували з одержанням ®-5-метил-6,7-дигідро-5H-циклопенту[d]піримідин-4-олу (9.89 г, 99 %). MS (APCI+) [M+H] +151. [00114] Етапи 4 й 5 описують альтернативний варіант синтезу ®-меркапто-5-метил-6,7дигідро-5H-циклопенту[d]піримідин-4-олу, з використанням як вихідної сполуки ®-етил-2-метил5-оксоциклопентункарбоксилату. [00115] Етап 4: Ацетат амонію (240 г, 3114 ммоль) додавали в розчин ®-етил-2-метил-5оксоциклопентункарбоксилату (106.0 г, 622.8 ммоль) в MeOH (1.2 л). Реакційну суміш перемішували при кімнатній температурі в атмосфері азоту протягом 20 годин, впродовж яких реакція проходила повністю, що визначали методами тонкошарової хроматографії й високоефективної хроматографії. Реакційну суміш концентрували для видалення MeOH. Одержаний залишок розчиняли в ДХМ, промивали H2O (2 X), соляним розчином (1 X), сушили (Na2SO4), фільтрували й концентрували з одержанням ®-етил-2-аміно-5-метилциклопент-1енкарбоксилату (102 г, 97 %) у виді олії. РХ/МС (APCI+) m/z 170 [M+H]+. [00116] Етап 5: Розчин, що містить ®-етил-2-аміно-5-метилциклопент-1-енкарбоксилат (161.6 г, 955 ммоль) і форміат амонію (90.3 г, 1433 ммоль) у формаміді (303.5 мл, 7640 ммоль), нагрівали до внутрішньої температури 150 °C і перемішували протягом 17 годин. Реакційну суміш охолоджували й переносили в окрему колбу об'ємом 2 л… Потім зайвий фомамідин видаляли дистиляцією у високому вакуумі. Після припинення відходу формамідину, залишену олію в сосуді розчиняли в ДХМ і промивали соляним розчином (3 × 200 мл). Об'єднані змиви були екстраговані ДХМ. Об'єднані органічні екстракти сушили (Na2SO4), фільтрували й концентрували. Одержану олію розчиняли в мінімальній кількості ДХМ, і одержаний розчин за допомогою сортувальної лійки додавали до перемішуваного розчину ефіру (приблизно 5 об'ємів ефіру до одного об'єму розчину ДХМ), що викликало формування осаду. Зазначений осад видаляли фільтрацією через середню керамічну лійку, яку споліскували ефіром і видаляли. Фільтрат концентрували, і осадження з ефіру повторювали ще два рази. Потім продукт сушили на високовакуумній лінії з одержанням ®-5-метил-6,7-дигідро-5H-циклопенту[d]піримідин-4-олу (93.23 г, 65.0 %) у виді пастоподібної твердої речовини. РХ/МС (APCI-) m/z 149.2. 40 [00117] Етап 6: Бездомішковий POCl3 (463.9 мл, 5067 ммоль) повільно додавали за 18 UA 100544 C2 5 10 15 20 25 30 35 40 допомогою лійки для додавання до розчину ®-5-метил-6,7-дигідро-5H-циклопенту[d]піримідин-4олу (152.2 г, 1013 ммоль) у ДХЕ (1.2 л) при 0 °C. Після завершення додавання, реакційну суміш нагріли до кімнатної температури, а потім дефлегмували з перемішуванням протягом 70 хвилин. Реакція проходила повністю, як було визначено шляхом ВЕРХ. Реакційну суміш охолоджували до кімнатної температури, і надлишок POCl3 гасили 4 порціями наступним чином: реакційну суміш переносили в ділильну лійку й по краплях додавали в мірну склянку, що містить лід і насичений розчин NaHCO3, охолоджений на крижаній бані. Після завершення додавання кожної порції реакційної суміші, погашену суміш перемішували протягом 30 хвилин, щоб упевнитися в повному руйнуванні POCl3, а потім переносили в ділильну лійку. Суміш переносили в ділильну лійку й екстрагували ДХМ (2 X). Об'єднані екстракти сушили (Na 2SO4), фільтрували й концентрували. Сирий продукт очищали на силікагелі наступним чином: силікагель (1 кг) суспендували в суміші 9:1 гексан:етилацетат у лійці з пористим фільтром об'ємом 3 л., кремній осаджували під вакуумом і покривали піском. Сирий продукт завантажували із сумішшю ДХМ/гексан, і елюювали сполуку з використанням допоміжних колб об'ємом 1 л. під вакуумом. Спочатку елюювали побічні продукти з високим Rf, а потім ®-4-хлор5-метил-6,7-дигідро-5H-циклопенту[d]піримідин (104.4 г, 61.09 %) у виді олії. Триетиламін (93.0 мл, 534 ммоль) і терт-бутил піперазин-1-карбоксилат (34.8 г, 187 ммоль) додавали до розчину ®-4-хлор-5-метил-6,7-дигідро-5H-циклопенту[d]піримідину (30.0 г, 178 ммоль) в n-BuOH (250 мл). Реакційну суміш нагрівали зі зворотним холодильником в атмосфері азоту й перемішували протягом 17 годин, після чого концентрували на роторному вакуумному випарнику. Одержану олію розчиняли в ДХМ, промивали H2O, сушили (Na2SO4), фільтрували й концентрували. Одержану олію очищали на силікагелі, з елююванням спочатку в суміші 2:1 гексани:етилацетат до повного елюювання продукту, а потім із градієнтом від 1:1 до 1:5 ДХМ:етил ацетат з одержанням ®-тертбутил-4-(5-метил-6,7-дигідро-5H-циклопенту[d]піримідин-4-іл)піперазин-1карбоксилат (42.0 г, 74.1 %) у виді порошку. РХ/МС (APCI+) m/z 319.1 [M+H]+. [00118] Етап 7: Тверду, 77 % макс. m-хлоробензойну кислоту ("m-CPBA"; 23.9 г, 107 ммоль) додавали порціями до 0 °C розчину (®-терт-бутил-4-(5-метил-6,7-дигідро-5Hциклопенту[d]піримідин-4-іл)піперазин-1-карбоксилату (20.0 г, 62.8 ммоль) в CHCl3 (310 мл). Реакційну суміш перемішували протягом 5 хвилин, потім нагріли до кімнатної температури й перемішували ще 90 хвилин. Результати ВЕРХ були схожими через 7.5 годин. Реакційну суміш охолоджували до 0 °C, а потім додавали NaHCO3 (13.2 г, 157 ммоль) і ще 0.5 еквіваленту mCPBA. Реакційну суміш перемішували протягом 14 годин. Реакційну суміш охолоджували до 0 °C, і через лійку для додавання по краплях додавали розчин Na2S2O3 (29.8 г, 188 ммоль) в H2O (50 мл). Потім додавали розчин Na2CO3 (24.6 г, 232 ммоль) в H2O (70 мл) через лійку для додавання (суміш стає гомогенною). Реакційну суміш перемішували протягом 30 хвилин, а потім суміш екстрагували CHCl3 (3 × 150 мл). Комбіновані екстракти сушили (Na2SO4), фільтрували й концентрували з одержанням ®-4-(4-(терт-бутоксикарбоніл)піперазин-1-іл)-5-метил-6,7-дигідро5H-циклопенту[d]піримідин 1-оксиду (21.0 г, 100 %). РХ/МС (APCI+) m/z 335.1 [M+H]+. 19 UA 100544 C2 5 [00119] Етап 8: Ac2O (77.0 мл, 816 ммоль) додавали до ®-4-(4-(тертбутоксикарбоніл)піперазин-1-іл)-5-метил-6,7-дигідро-5H-циклопенту[d]піримідин 1-оксиду (21.0 г, 62.8 ммоль). Реакційну суміш нагрівали в атмосфері азоту на піщаній 90 °C бані й перемішували протягом 100 хвилин. Реакційну суміш охолоджували до кімнатної температури, і надлишок оцтового ангідриду видаляли за допомогою роторного випарника. Одержану олію розчиняли в ДХМ, а потім обережно переливали в насичений крижаний Na2CO3. Суміш екстрагували в ДХМ, а об'єднані екстракти сушили (Na2SO4), фільтрували й концентрували з одержанням (5R)-тертбутил 4-(7-ацетокси-5-метил-6,7-дигідро-5H-циклопенту[d]піримідин-4-іл)піперазин-1карбоксилату (23.6 г, 100 %) у виді піни. РХ/МС (APCI+) m/z 377.1 [M+H]+. 10 15 20 25 [00120] Етап 9: LiOH-H2O (6.58 г, 157 ммоль) додавали до 0 °C розчину (5R)-терт-бутил 4-(7ацетокси-5-метил-6,7-дигідро-5H-циклопенту[d]піримідин-4-іл)піперазин-1-карбоксилату (23.6 г, 62.69 ммоль) в 2:1 ТГФ:H2O (320 мл). Реакційну суміш перемішували протягом 10 хвилин, потім нагріли до кімнатної температури. Результати РХ/МС виглядали однаково після 3 годин й 4.5 годин. Реакційну суміш охолоджували до 0 °C, а потім у суміш додавали насичений NH4Cl. Реакційну суміш перемішували протягом 5 хвилин, і більшу частину ТГФ видаляли в роторному випарнику. Суміш екстрагували EtOAc (3 × 250 мл), і об'єднані екстракти сушили (Na 2SO4), фільтрували й концентрували. Сирий продукт піддавали флеш-хроматографії на картриджі Biotage 65M: 4:1 ДХМ:етил ацетат, потім градієнт від 1:1 до 1:4 ДХМ:етил ацетат. Після початку елюювання продукту, колонку промивали етилацетатом. Потім сумішшю 30:1 ДХМ:MeOH елюювали залишки продукту (8.83 г). Об'єднані фракції знову піддавали флеш-хроматографії з використанням Biotage 40M у тих самих умовах із одержанням ще однієї порції (2.99 г), що в підсумку склало загальний вихід (5R)-терт-бутил 4-(7-гідрокси-5-метил-6,7-дигідро-5Hциклопенту[d]піримідин-4-іл)піперазин-1-карбоксилату (11.82 г, 56.38 %) у виді піни. РХ/МС (APCI+) m/z 335.1 [M+H]+. 30 35 40 [00121] Етап 10: Розчин ДМСО (5.45 мл, 76.8 ммоль) у ДХМ (50 мл) додавали по краплях за допомогою лійки для додавання до розчину оксаліл хлориду (3.35 мл, 38.4 ммоль) у ДХМ (150 мл) при температурі -78 °C. Реакційну суміш перемішували протягом 35 хвилин, після чого повільно додавали розчин (5R)-терт-бутил 4-(7-гідрокси-5-метил-6,7-дигідро-5Hциклопенту[d]піримідин-4-іл)піперазин-1-карбоксилату (9.17 г, 27.4 ммоль) у ДХМ (80 мл) за допомогою лійки для додавання. Реакційну суміш перемішували ще 1 годину при -78 °C, після чого до суміші додавали чистий триетиламін (18.0 мл, 129 ммоль). Реакційній суміші потім дозволили нагрітися до кімнатної температури, після чого її перемішували протягом 30 хвилин. Додавали H2O. Суміш екстрагували ДХМ (3 × 200 мл), а об'єднані екстракти сушили (Na 2SO4), фільтрували й концентрували у вакуумі. Сирий продукт очищали на силікагелі (Biotage 65M): колонку промивали приблизно 800 мл суміші 4:1 ДХМ:EtOAc, потім градієнтом 1:1 ДХМ:етил ацетат до початку елюювання продукту, потім сумішшю 1:4 ДХМ:EtOAc елюювали продукт із одержанням ®-терт-бутил 4-(5-метил-7-оксо-6,7-дигідро-5H-циклопенту[d]піримідин-4іл)піперазин-1-карбоксилату (7.5 г, 82.3 %) у виді піни. Піну концентрували із суміші ДХМ/гексани 20 UA 100544 C2 (3 X), що також дало піну. ВЕРХ >95 % площі. РХ/МС (APCI+) m/z 333 [M+H]+. 5 10 15 20 25 30 35 [00122] Етап 11: Триетиламін (4.33 мл, 31.1 ммоль; дегазований азотом за 30 хвилин до використання) і мурашину кислоту (1.36 мл, 36.1 ммоль; дегазована з азотом за 30 хвилин до використання) додавали до розчину ®-терт-бутил 4-(5-метил-7-оксо-6,7-дигідро-5Hциклопенту[d]піримідин-4-іл)піперазин-1-карбоксилату (9.75 г, 29.3 ммоль) у ДХМ (210 мл; дегазований азотом за 30 хвилин до використання). Суміш перемішували протягом 5 хвилин, а потім додавали рубідієвий каталізатор (0.0933 г, 0.147 ммоль). Реакційну суміш перемішували протягом 18 годин під позитивним тиском азоту. Реакційну суміш сконцентрували до сухого стану й сушили під сильним вакуумом. Продукт із домішками обробили за допомогою флешхроматографії на Biotage 65M, у який була завантажена суміш 1:1 ДХМ:етил ацетат, промивали 500 мл, потім сумішшю 1:4 ДХМ:етил ацетат до появи продукту (2 пляма), потім градієнтом до одержання чистого етилацетату, потім сумішшю 25:1 ДХМ:MeOH елюювали залишки продукту. Фракції поєднували й концентрували на роторному випарнику. Залишок знову концентрували із суміші ДХМ/гексани з одержанням суміші терт-бутил 4-((5R, 7R)-7-гідрокси-5-метил-6,7-дигідро5H-циклопенту[d]піримідин-4-іл)піперазин-1-карбоксилату (основний компонент) і терт-бутил 4((5R, 7S)-7-гідрокси-5-метил-6,7-дигідро-5H-циклопенту[d]піримідин-4-іл)піперазин-1карбоксилату (додатковий компонент) (9.35 г, 95.3 %) у виді піни. РХ/МС (APCI+) m/z 335 [M+H]+. 1H ЯМР (CDCl3) показав 88 % діастереоселективність за інтеграцією карбінолметину. [00123] Етап 12: 4-нітробензоїлхлорид (4.27 г, 23.0 ммоль) додавали до розчину терт-бутил 4-((5R, 7R)-7-гідрокси-5-метил-6,7-дигідро-5H-циклопенту[d]піримідин-4-іл)піперазин-1карбоксилату (7.0 г, 20.9 ммоль) і триетиламіну (4.38 мл, 31.4 ммоль) у ДХМ (110 мл) при 0 °C. Реакційну суміш залишили при перемішуванні на ніч при кімнатній температурі, після чого додавали насичений NaHCO3. Реакційну суміш перемішували протягом 10 хвилин, і потім екстрагували ДХМ. Об'єднані екстракти сушили (Na2SO4), фільтрували й концентрували. Сирий продукт піддавали флеш-хроматографії з використанням Biotage 65M (3:1 гексани:етил ацетат для завантаженого сирого продукту, потім 2:1 гексани:етил ацетат, при цьому елюював тертбутил 4-((5R, 7R)-5-метил-7-(4-нітробензоокси)-6,7-дигідро-5H-циклопенту[d]піримідин-4іл)піперазин-1-карбоксилат і декілька змішаних фракцій). Потім елюював терт-бутил 4-((5R, 7S)5-метил-7-(4-нітробензоокси)-6,7-дигідро-5H-циклопенту[d]піримідин-4-іл)піперазин-1карбоксилат при використанні 1:2 гексани:етил ацетат. Фракції, що містять продукт, концентрували роторним випарюванням з одержанням терт-бутил 4-((5R, 7R)-5-метил-7-(4нітробензоокси)-6,7-дигідро-5H-циклопенту[d]піримідин-4-іл)піперазин-1-карбоксилату (8.55 г, 84.5 %) у виді піни. РХ/МС (APCI+) m/z 484 [M+H]+. 1H ЯМР (CDCl3) виявив один діастереомер). 21 UA 100544 C2 5 Фракції з іншим діастереомером концентрували роторним випарюванням з одержанням тертбутил 4-((5R, 7S)-5-метил-7-(4-нітробензоокси)-6,7-дигідро-5H-циклопенту[d]піримідин-4іл)піперазин-1-карбоксилату (0.356 г, 3.52 %) у виді піни. РХ/МС (APCI+) m/z 484 [M+H]+. [00124] Етап 13 описує альтернативний спосіб приготування терт-бутил 4-((5R, 7R)-5-метил7-(4-нітробензоокси)-6,7-дигідро-5H-циклопенту[d]піримідин-4-іл)піперазин-1-карбоксилату й терт-бутил 4-((5R, 7S)-5-метил-7-(4-нітробензоокси)-6,7-дигідро-5H-циклопенту[d]піримідин-4іл)піперазин-1-карбоксилату з (5R)-терт-бутил 4-(7-гідрокси-5-метил-6,7-дигідро-5Hциклопенту[d]піримідин-4-іл)піперазин-1-карбоксилату (Етап 9). 10 15 20 25 30 35 [00125] Етап 13: 4-нітробензоїлхлорид (15.78 г, 85.03 ммоль) додавали до розчину тертбутил 4-((5R, 7R)-7-гідрокси-5-метил-6,7-дигідро-5H-циклопенту[d]піримідин-4-іл)піперазин-1карбоксилату (25.85 г, 77.30 ммоль) і NEt3 (11.73 г., 16.16 мл, 115.9 ммоль) у ДХМ (400 мл) при 0 °C. Реакційну суміш перемішували протягом 5 хвилин. Потім реакційну суміш нагріли до кімнатної температури й перемішували протягом 17 годин, після чого додавали насичений NaHCO3. Реакційну суміш перемішували протягом 10 хвилин і переносили в ділильну лійку. Зібрали органічні фази, а водні екстракти промивали ДХМ (2 X). Об'єднані органічні екстракти сушили (Na2SO4), фільтрували й концентрували. Сирий продукт піддавали флеш-хроматографії на силікагелі з елююванням сумішшю 7:1 гексани:етил ацетат (градієнт 5:1 гексани:етил ацетат до 2:1 гексани:етил ацетат до 1:1 гексани:етил ацетат). Одержали деяку кількість чистого тертбутил 4-((5R, 7R)-5-метил-7-(4-нітробензоокси)-6,7-дигідро-5H-циклопенту[d]піримідин-4іл)піперазин-1-карбоксилату, деяку кількість чистого терт-бутил 4-((5R, 7S)-5-метил-7-(4нітробензоокси)-6,7-дигідро-5H-циклопенту[d]піримідин-4-іл)піперазин-1-карбоксилату, і деяку кількість змішаних фракцій. Змішані фракції знову пропускали через колонку і змішували з раніше виділеним матеріалом з одержанням терт-бутил 4-((5R, 7R)-5-метил-7-(4нітробензоокси)-6,7-дигідро-5H-циклопенту[d]піримідин-4-іл)піперазин-1-карбоксилату (14.27 г, 38 %), і терт-бутил 4-((5R, 7S)-5-метил-7-(4-нітробензоокси)-6,7-дигідро-5Hциклопенту[d]піримідин-4-іл)піперазин-1-карбоксилату (12.58 г, 34 %). Використання 4бромбензоїлхлориду дало дещо краще розділення ізомерів. [00126] Етап 14: LiOH-H2O (0.499 г, 11.9 ммоль) додавали до розчину терт-бутил 4-((5R, 7R)5-метил-7-(4-нітробензоокси)-6,7-дигідро-5H-циклопенту[d]піримідин-4-іл)піперазин-1карбоксилату (2.30 г, 4.76 ммоль) у суміші 2:1 ТГФ:H2O (40 мл) при 0 °C. Реакційну суміш нагріли до кімнатної температури й перемішували протягом 1 години. ТГФ видаляли за допомогою роторного випарювання. Потім додавали насичений NaHCO3, і суміш екстрагували етил ацетатом. Об'єднані екстракти промивали (1 X) насиченим NaHCO 3, сушили (Na2SO4), 22 UA 100544 C2 фільтрували й концентрували з одержанням терт-бутил 4-((5R, 7R)-7-гідрокси-5-метил-6,7дигідро-5H-циклопенту[d]піримідин-4-іл)піперазин-1-карбоксилату (1.59 г, 100.0 %) у виді піни. Дослідження продукту методом ВЕРХ показало, що 98 % площі становить чистий продукт РХ/МС (APCI+) m/z 335 [M+H]+. 5 10 15 [00127] Етап 15: 4M HCl/діоксан (11.2 мл, 44.9 ммоль) додавали до розчину терт-бутил 4((5R, 7R)-7-гідрокси-5-метил-6,7-дигідро-5H-циклопенту[d]піримідин-4-іл)піперазин-1карбоксилату (0.600 г, 1.79 ммоль) у діоксані (15 мл). Реакційну суміш перемішували при кімнатній температурі протягом 20 годин в атмосфері азоту. Реакційну суміш концентрували до сухого стану й сушили на високовакуумній лінії. Сирий продукт суспендували в ефірі, диспергували ультразвуком і перемішували протягом 5 хвилин. Тверді речовини виділяли фільтрацією через середню лійку з пористим фільтром під тиском азоту, промивали ефіром, сушили під тиском азоту, і піддавали додатковому сушінню на високовакуумній лінії з одержанням (5R, 7R)-5-метил-4-(піперазин-1-іл)-6,7-дигідро-5H-циклопенту[d]піримідин-7-ол дигідрохлориду (0.440 г, 79.8 %) у виді порошку. РХ/МС (APCI+) m/z 235. 20 25 30 [00128] Етап 16: Триметилацетилхлорид (1.68 г, 13.9 ммоль) додавали до розчину 2-(4-хлор3-фторофеніл)оцтової кислоти (2.50 г, 13.3 ммоль) і TEA (d. 0. 726; 2.00 мл, 14.3 ммоль) у сухому ТГФ (100 мл) при 0 °C, і перемішували при кімнатній температурі. В окремій колбі додавали n-BuLi (6.424 мл, 14.58 ммоль) до ®-4-бензилоксазолідин-2-ону (2.47 г, 13.9 ммоль) у сухому ТГФ (100 мл) при -78 °C. Реакційну суміш перемішували протягом 20 хвилин при -78 °C, а потім по краплях додавали розчин ®-4-бензилоксазолідин-2-ону до розчину змішаних ангідридів при 0 °C. Реакцію залишили при перемішуванні на ніч при кімнатній температурі. Реакцію гасили водою (100 мл) і розводили етилацетатом (100 мл). Шари розділяли, і органічні речовини промивали соляним розчином, сушили (MgSO 4) і концентрували з одержанням залишку. Одержаний залишок очищали флеш-хроматографією з одержанням ®-4-бензил-3-(2(4-хлор-3-фторофеніл)ацетил)оксазолідин-2-ону (2.79 г, 8.02 ммоль, 60.5 %). 1H ЯМР (400 МГц, CDCl3) 7.37 (t, J=8.2 Гц, 1H), 7.33-7.26 (m, 3H), 7.18-7.12 (m, 3H), 7.07 (d, J=8.2 Гц, 1H), 4.73-4.65 (m, 1H), 4.33-4.18 (m, 4H), 3.27 (dd, J1=3.5 Гц, J2=13.3 Гц, ,1H), 2.77 (dd, J1=9.4Гц, J2=13.7 Гц, 1H). 35 40 [00129] Етап 17: (1r, 4r)-4-аміноциклогексанол гідрохлорид (6.67 г, 44 ммоль) суспендували в ДХМ (100 мл). Потім додавали основу Гюнінга (15 мл), після чого додавали каталізатор 4диметиламінопіридин ("DMAP"). Реакційну суміш перемішували протягом 5 хвилин, а потім порціями протягом 10 хвилин додавали Boc2O (10.2 г, 47 ммоль). Потім реакційну суміш залишали при перемішуванні на ніч при кімнатній температурі. Реакцію потім гасили 23 UA 100544 C2 5 додаванням 1N HCl, і залишили перемішуватися на 10 хвилин. Відокремлювали органічну фазу, а водний шар обмивали ДХМ (2 X). Об'єднані органічні речовини були потім висушені соляним розчином й MgSO4, і сконцентровані. Одержаний залишок суспендували в гексанах (видалення зайвого Boc2O) і фільтрували. Бажаний матеріал одержали у виді твердого терт-бутил (1r, 4r)-4гідроксициклогексилкарбамату (5.1 г, 54 %). 1H ЯМР (400 МГц, CDCl3) 4.35 (br s, 1H), 3.65-3.52 (m, 1H), 3.43 (br s, 1H), 1.99 (очевидний триплет, J1=17.2 Гц, J2=12.1 Гц, 4H), 1.49-1.30 (m, 12H), 1.4-1.08 (m, 2H). 10 15 20 [00130] Етап 18: NEt3 (d. 0. 726; 4.95 мл, 35.5 ммоль) додавали при кімнатній температурі до розчину терт-бутил (1r, 4r)-4-гідроксициклогексилкарбамату (5.1 г, 23.7 ммоль) у ДХМ (100 мл) і перемішували у виді суспензії. Реакційну суміш перемішували протягом 10 хвилин, а потім додали терт-бутилдиметилсиліо трифторометансульфонат (6.52 мл, 26.1 ммоль), після чого реакційна суміш перетворилася в гомогенний розчин, який перемішували протягом 2 годин. Реакційну суміш розбавляли водою (50 мл), після чого фази розділялися. Органічні речовини промивали 1N HCl (2 × 50 мл), сушили (MgSO 4) і концентрували у твердий стан. Тверда речовина була очищена за допомогою флеш-хроматографії (5 % етил ацетат/гексани) з одержанням терт-бутилу (1r, 4r)-4-(терт-бутилдиметилсилілокси)циклогексилкарбамату (6.54 г, 19.8 ммоль, 83.8 %). 1H ЯМР (400 МГц, CDCl3) 4.34 (br s, 1H), 3.61-3.50 (m, 1H), 3.4 (br s, 1H), 1.97 (d, J=12.9 Гц, 2H), 1.82 (d, J=13.7 Гц, 2H), 1.44 (s, 9H), 1.43-1.30 (m, 2H), 1.21-1.05 (m, 2H), 0.87 (s, 9H), 0.04 (s, 6H). 25 30 35 [00131] Етап 19: Розчин терт-бутил (1r, 4r)-4-(тертбутилдиметилсилілокси)циклогексилкарбамату (1.00 г, 3.03 ммоль) у сухому ТГФ (50 мл) охолоджували до -78ºC. Потім додавали n-BuLi (1.27 мл, 3.19 ммоль). Реакційну суміш перемішували протягом 20 хвилин з нагріванням до -40ºC. Потім ішло швидке додавання по краплях хлорометилметилефіру (d=1.060; 0.254 мл, 3.34 ммоль). Холодну баню видаляли, і реакційну суміш перемішували з нагріванням в атмосфері азоту. Реакцію гасили водою, а виділення й очищення проводили флеш-хроматографією (5 % етил ацетат/гексани) з одержанням терт-бутил (1r, 4r)-4-(тертбутилдиметилсилілокси)циклогексил(метоксиметил)карбамат (0.957 г, 2.36 ммоль, 84 %). 1H ЯМР (400 МГц, CDCl3) 4.69 (br s, 1H), 3.85-3.47 (m, 1H), 3.27 (br s, 3H), 1.90 (d, J=10.5 Гц, 2H), 1.79 (d, J=12.9 Гц, 2H), 1.67-1.50 (s, 2H), 1.47 (m, 9H), 1.46-1.30 (m, 4H), 0.88 (s, 9H), 0.04 (s, 6H). 24 UA 100544 C2 5 [00132] Етап 20: Фторид тетрабутиламонію (8.94 мл, 8.94 ммоль) додавали до розчину тертбутил (1r, 4r)-4-(терт-бутилдиметилсилілокси)циклогексил(метоксиметил)карбамату (1.97 г, 5.96 ммоль) у ТГФ (50 мл) і протягом ночі нагрівали до 40ºC. Реакційну суміш розбавляли водою (100 мл) і етилацетатом (100 мл). Після цього фази розділяли, і органічні речовини сушили (MgSO4) і концентрували з одержанням олії. Олію очищали за допомогою флеш-хроматографії (25 % етил ацетат/гексани) з одержанням терт-бутил (1r, 4r)-4гідроксициклогексил(метоксиметил)карбамату (1.32 г, 5.09 ммоль, 85 %). 10 15 [00133] Етап 21: NaН (60 % у виді олії; 0.563 г, 14.07 ммоль) додавали до розчину терт-бутил (1r, 4r)-4-гідроксициклогексил(метоксиметил)карбамату (3.65 г, 14.07 ммоль) у ТГФ (50 мл), і нагрівали до 40ºC. Метилйодид (0.878 мл, 14.07 ммоль) додавали до теплого перемішуваного розчину і нагрівали до 60 °C протягом ночі. Реакцію гасили водою (100 мл) і розводили етил ацетатом (100 мл). Після цього шари розділялися. Органічні речовини сушили (MgSO4) і концентрували. Одержаний залишок очищали флеш-хроматографією (10 % етил ацетат/гексани) з одержанням терт-бутил (1r, 4r)-4метоксициклогексил(метоксиметил)карбамату (3.51 г, 12.8 ммоль, 91 %). 20 25 30 35 [00134] Етап 22: TiCl4 (0.207 г, 1.09 ммоль) додавали до охолодженого до -78 °C розчину ®4-бензил-3-(2-(4-хлор-3-фторофеніл)ацетил)оксазолідин-2-ону (0.362 г, 1.04 ммоль) і (1r, 4r)-4метоксициклогексил(метоксиметил)карбамату (0.55 г, 2.01 ммоль) у сухому ДХМ (20 мл). Диізопропілетиламін ("DIEA"; d 0.742; 0.199 мл, 1.15 ммоль) додавали до зазначеного холодного перемішуваного розчину. Реакційну суміш перемішували протягом 15 хвилин, при -78 °C, а потім нагріли до -10 °C і перемішували 3 години. Реакцію гасили за допомогою NH4Cl. Реакційну суміш розбавляли ДХМ (50 мл) і водою (50 мл). Після цього відбувалося розділення шарів. Водний шар екстрагували ДХМ (25 мл), сушили (MgSO 4) і концентрували з одержанням олії. Олію очищали колонковою хроматографією (10 % Et2O/гексани до 30 % Et2O/гексани) з одержанням терт-бутил (S)-3-(®-4-бензил-2-оксооксазолідин-3-іл)-2-(4-хлор-3-фторофеніл)-3оксопропіл((1r, 4S)-4-метоксициклогексил)карбамату (0.610 г, 1.04 ммоль, 99.5 %). 1H ЯМР (400 МГц, CDCl3) 7.38-7.28 (m, 4H), 7.25-7.15 (m, 3H), 7.10 (d, J=8.6 Гц, 1H), 4.65-4.56 (m, 1H), 4.154.03 (m, 2H), 3.60-3.36 (m, 2H), 3.31 (s, 3H), 3.15-2.95 (m, 1H), 2.12-1.97 (m, 3H), 1.69-1.57 (m, 2H), 1.47 (s, 9H), 1.46-1.37 (m, 3H), 1.37-1.07 (m, 4H). 25 UA 100544 C2 5 10 15 [00135] Етап 23: H2O2 (0.294 мл, 3.06 ммоль) додавали в розчин LiOH-H2O (0.0855 г, 2.04 ммоль) у ТГФ/воді (2:1, 83 мл). Реакційну суміш перемішували при кімнатній температурі протягом 10 хвилин. Реакційну суміш остудили до 0 °C й обробили розчином терт-бутил (S)-3(®-4-бензил-2-оксооксазолідин-3-іл)-2-(4-хлор-3-фторофеніл)-3-оксопропіл((1r, 4S)-4метоксициклогексил)карбамату (0.600 г, 1.019 ммоль) у ТГФ (10 мл). Реакційну суміш перемішували при 0 °C протягом двох годин, потім дозволили нагрітися до кімнатної температури, і перемішували протягом ночі. Реакційну суміш охолоджували до 0 °C й обробляли 1M Na2SO3 (10 мл), після чого перемішували протягом 10 хвилин. Потім реакційну суміш нагріли до кімнатної температури й перемішували протягом 10 хвилин. Реакційну суміш концентрували й екстрагували етилацетатом (2 × 20 мл). Водну фракцію підкислювали HSO 4 (s) до рівня pН приблизно від 1 до приблизно 2, і потім екстрагували ДХМ (2 × 20 мл). Органічні речовини поєднували, сушили (MgSO4) і концентрували. Одержаний залишок забезпечив (S)-3(терт-бутоксикарбоніл((1r, 4S)-4-метоксициклогексил)аміно)-2-(4-хлор-3-фторфеніл)пропіонову кислоту (0.312 г, 0.726 ммоль, 71 %). РХ/МС >95 % чистоти, r.t. = 3.25 хвилини, (APCI+) m/z=430 [M+H]+. 20 25 30 [00136] Етап 24: (5R, 7R)-5-метил-4-(піперазин-1-іл)-6,7-дигідро-5H-циклопенту[d]піримідин7-ол дигідрохлорид (0.236 г, 0.768 ммоль), O-(7-азабензотриазол-1-іл)-N, N,N",N’тетраметилуроній гексафторфосфат ("HATU"; 0.265 г, 0.698 ммоль) і колідин (0.369 мл, 2.79 ммоль) додавали до розчину (S)-3-(терт-бутоксикарбоніл((1r, 4S)-4-метоксициклогексил)аміно)2-(4-хлор-3-фторфеніл)пропіонової кислоти (0.300 г, 0.698 ммоль) у ДХМ/ДМФ (15 мл, 2:1), і Реакційну суміш перемішували протягом ночі при кімнатній температурі. Реакційну суміш розділяли між водою (20 мл) і ДХМ (50 мл) і розділяли фази. Органічну фазу промивали водою (2 × 10 мл). Водну фазу піддавали повторній екстракції ДХМ (25 мл), сушили (MgSO 4) і концентрували з одержанням олії. Олію очищали колонковою хроматографією (5 % MeOH/ДХМ) з одержанням терт-бутил (S)-2-(4-хлор-3-фторфеніл)-3-(4-((5R, 7R)-7-гідрокси-5-метил-6,7дигідро-5H-циклопенту[d]піримідин-4-іл)піперазин-1-іл)-3-оксопропіл((1r, 4S)-4метоксициклогексил)карбамату (0.394 г, 0.610 ммоль, 87.4 %). РХ/МС >95 % чистоти, r.t. = 3.83 хвилини, (APCI+) m/z=646. 26 UA 100544 C2 O NH F O N Cl N N N HO 5 10 15 20 [00137] Етап 25: 4N HCl у діоксані (4 мл, 16 ммоль) додавали до розчину терт-бутил (S)-2-(4хлор-3-фторфеніл)-3-(4-((5R, 7R)-7-гідрокси-5-метил-6,7-дигідро-5H-циклопенту[d]піримідин-4іл)піперазин-1-іл)-3-оксопропіл((1r, 4S)-4-метоксициклогексил)карбамату (0.370 г, 0.573 ммоль) у ДХМ (10 мл), реакційну суміш перемішували при кімнатній температурі протягом 3 годин. Вміст реакційного сосуду додавали по краплях у інтенсивно перемішувану суміш Et2O/гексанів (75 мл, 3:1), при цьому одержали тверду речовину у виді дрібних часток. Частки фільтрували й сушили з одержанням (S)-2-(4-хлор-3-фторфеніл)-1-(4-((5R, 7R)-7-гідрокси-5-метил-6,7-дигідро-5Hциклопенту[d]піримідин-4-іл)піперазин-1-іл)-3-((1r, 4S)-4-метоксициклогексиламіно)пропан-1-он гідрохлориду (0.325 г, 0.525 ммоль, 91.7 %). РХ/МС >95 % чистоти, r.t. = 2.52 хвилини, (APCI+) m/z=546. [00138] Даний опис варто розглядати лише як ілюстрацію принципів винаходу. Далі, оскільки для фахівця очевидні численні можливі модифікації й зміни, даний винахід не обмежується конкретною конструкцією або процесом, показаними або описаними вище. Відповідно, всі підходящі модифікації й еквіваленти можна розглядати як включені в об'єм даного винаходу, визначений наведеною нижче формулою винаходу. [00139] Слова "включати", "що включає", "містити" й "що містить" у даному описі й наведеній нижче формулі винаходу, призначені для визначення наявності заявлених властивостей, значень, компонентів або кроків, але вони не виключають наявності або додавання однієї або декількох властивостей, значень, компонентів, етапів або груп. ФОРМУЛА ВИНАХОДУ 25 1. Сполука формули І: І. 27 UA 100544 C2 5 10 15 2. Фармацевтична композиція, що містить як активне начало сполуку за п. 1. 3. Спосіб лікування опосередковуваного АКТ захворювання або порушення у ссавця, за яким зазначеному ссавцеві вводять терапевтично ефективну кількість сполуки за п. 1. 4. Спосіб за п. 3, у якому зазначене захворювання або порушення є запальним, гіперпроліферативним, серцево-судинним, нейродегенеративним, гінекологічним або дерматологічним захворюванням або порушенням. 5. Спосіб інгібування вироблення протеїнкінази АКТ у ссавця, за яким зазначеному ссавцеві вводять ефективну кількість сполуки за п. 1. 6. Спосіб інгібування активності протеїнкінази АКТ у ссавця, за яким зазначену кіназу приводять в контакт зі сполукою за п. 1. 7. Сполука за п. 1 для застосування як лікарського засобу для лікування патологічних станів, опосередковуваних протеїнкіназами АКТ. 8. Застосування сполуки за п. 1 у виробництві лікарського засобу для терапії. 9. Застосування сполуки за п. 1 у лікуванні гіперпроліферативного захворювання. 10. Застосування сполуки за п. 1 у лікуванні раку. 11. Набір для лікування патологічного стану, опосередковуваного протеїнкіназою АКТ, де зазначений набір включає: a) першу фармацевтичну композицію, що включає сполуку за п. 1; і b) інструкції із застосування. 20 Комп’ютерна верстка В. Мацело Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 28
ДивитисяДодаткова інформація
Назва патенту англійськоюHydroxylated pyrimidyl cyclopentane as akt protein kinase inhibitor
Автори англійськоюBencsik, Josef, Blake, James, F., Kallan, Nicholas, C., Mitchell, Ian, S., Spenser Kait L., Xiao, Dengming, Xu, Rui, Chabot, Christine, Do, Steven, Liang, Jun, Safina, Brian, Zhang, Birong
Назва патенту російськоюГидроксилированный пиримидилциклопентан как ингибитор протеинкиназы акт
Автори російськоюБенсик Йозеф, Блейк Джеймс Ф., Каллан Николас С., Митчелл Ян С., Спенсер Кейт Л., Хиао Денгминг, Ху Руи, Чабот Кристин, До Стивен, Лианг Джун, Сафина Браян, Жанг Биронг
МПК / Мітки
МПК: A61K 31/517, A61P 35/00, C07D 239/70
Мітки: піримідилциклопентан, гідроксильований, протеїнкінази, інгібітор
Код посилання
<a href="https://ua.patents.su/30-100544-gidroksilovanijj-pirimidilciklopentan-yak-ingibitor-protenkinazi-akt.html" target="_blank" rel="follow" title="База патентів України">Гідроксильований піримідилциклопентан як інгібітор протеїнкінази akt</a>
Попередній патент: Нанодисперсія, що включає наночастинки, які містять похідне таксану
Наступний патент: Гідроксильовані піримідил циклопентани як інгібітори протеїнкінази akt
Випадковий патент: Фрикційний клиновий гаситель коливань екіпажного візка транспортного засобу