Інгібітори фосфодіестераз
Номер патенту: 98639
Опубліковано: 11.06.2012
Автори: Нільсен Сімон Фельдбек, Ларсен Йєнс Хрістіан Хойланн, Бабу Боллу Равіндра, Фелдінг Якоб
Формула / Реферат
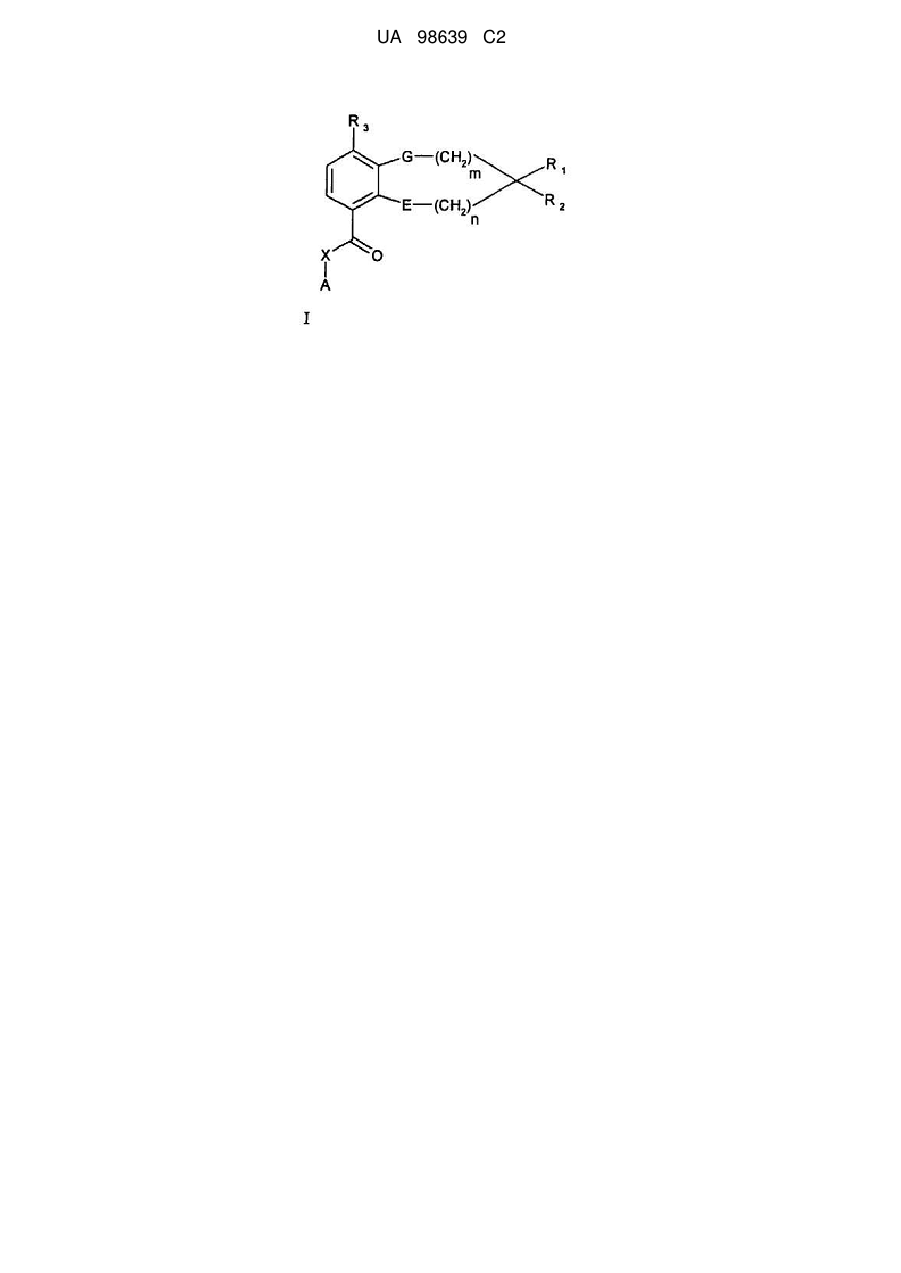
1. Сполука загальної формули (І):
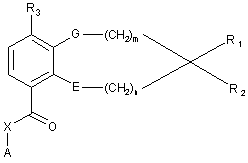 , (I)
, (I)
де m і n незалежно являють собою 0, 1, 2, 3, 4, 5, 6 або 7;
і де G і Е незалежно являють собою сірку, кисень, -N(R5)- або -N(R5)C(O)-,
і R1 і R2 разом з атомом вуглецю, до якого вони приєднані, утворюють ненасичений карбоцикл або гетероцикл, що включає один або два гетероатоми, вибрані з кисню, сірки, -S(O)-, -S(O)2-, -N=, -N(R5)-, причому один або більше атомів вуглецю у вказаному ненасиченому карбоциклі або гетероциклі необов'язково заміщені одним або більше однаковими або різними замісниками, вибраними з числа замісників R4; або
де G і Е незалежно являють собою сірку, кисень, -N(R5) або -N(R5)C(O)-,
і R1 і R2 разом з атомом вуглецю, до якого вони приєднані, утворюють насичений карбоцикл, причому один або більше атомів вуглецю у вказаному насиченому карбоциклі необов'язково заміщені одним або більше однаковими або різними замісниками, вибраними з числа замісників R4, за умови, що, якщо G являє собою кисень, обидва коефіцієнти m і n не дорівнюють нулю, і за додаткової умови, що, якщо обидва фрагменти G і Е являють собою атоми кисню, сума m і n дорівнює шести або більше;
R3 являє собою галоген, гідрокси, алкіл, алкеніл, алкініл, галогеналкіл, алкокси, галогеналкокси, алкілтіо, форміл, алкоксикарбоніл, алкілкарбоніл або амінокарбоніл;
R4 являє собою водень, аміно, тіоксо, алкіл, галогеналкіл, гідроксіалкіл, алкокси, галоген, оксо, тіа або гідрокси;
R5 являє собою водень, алкіл, галогеналкіл, алкілкарбоніл, гідроксіалкіл, алкоксикарбоніл, алкілсульфоніл, алкіламіносульфоніл або аміносульфоніл;
X являє собою зв'язок, -СН2- або -NH-;
А являє собою арил, циклоалкіл, циклоалкеніл, арилалкіл, гетероарил, гетероарилалкіл, гетероциклоалкіл або гетероциклоалкеніл, необов'язково заміщений одним або більше однаковими або різними замісниками, вибраними з числа замісників R4;
і її фармацевтично прийнятні солі, гідрати, N-оксиди або сольвати.
2. Сполука за п. 1, де обидва фрагменти Е і G являють собою кисень.
3. Сполука за п. 1, де обидва коефіцієнти m і n дорівнюють одиниці.
4. Сполука за п. 1, де обидва коефіцієнти m і n дорівнюють нулю.
5. Сполука за будь-яким з попередніх пунктів, в якій R1 і R2 разом з атомом вуглецю, до якого вони приєднані, утворюють гетероцикл, що включає один або два гетероатоми, вибрані з групи, яка складається з -О-, -S-, -S(O)-, -S(O)2-, -N= і -N(R5)-; причому один або більше атомів вуглецю у вказаному гетероциклі необов'язково заміщені одним або більше однаковими або різними замісниками, вибраними з числа замісників R4.
6. Сполука за будь-яким з попередніх пунктів, в якій R1 і R2 разом з атомом вуглецю, до якого вони приєднані, утворюють 4-, 5- або 6-членний гетероцикл.
7. Сполука за п. 5 або 6, в якій вказаний гетероцикл являє собою тетрагідропіран, оксетан, [1,3]діоксолан, [1,3]діоксан, тетрагідротіопіран, тетрагідротіопіран-1,1-діоксид, тетрагідротіопіран-1-оксид, піперидин, тетрагідротіофен, [1,3]-дитіан, тіетан, [1,3]-дитіан-1,3-діоксид, тіетан-1-оксид або тіетан-1,1-діоксид.
8. Сполука за п. 5 або 6, де гетероцикл включає один гетероатом.
9. Сполука за п. 5 або 6, де гетероцикл включає два гетероатоми.
10. Сполука за п. 8 або 9, де гетероатом (гетероатоми) являє (являють) собою кисень.
11. Сполука за п. 8 або 9, де гетероатом (гетероатоми) являє (являють) собою сірку, -S(O)- або -S(O)2-.
12. Сполука за будь-яким з попередніх пунктів, де А являє собою гетероарил або гетероарилалкіл.
13. Сполука за п. 12, де А являє собою піридил, піразиніл або хіноліл.
14. Сполука за будь-яким з пп. 1-11, де А являє собою феніл.
15. Сполука за будь-яким з попередніх пунктів, де фрагмент А заміщений галогеном.
16. Сполука за будь-яким з попередніх пунктів, де R3 являє собою С1-6алкокси, С1-6галогеналкіл або галоген.
17. Сполука за п. 16, де R3 являє собою метокси або етокси.
18. Сполука за будь-яким з попередніх пунктів, де X являє собою -СН2-.
19. Сполука за будь-яким з пп. 1-17, де X являє собою -NH-.
20. Сполука за п. 13, де А являє собою 4-(3,5-дихлорпіридил).
21. Сполука за будь-яким з попередніх пунктів, де R4 являє собою водень.
22. Сполука за будь-яким з попередніх пунктів, вибрана з групи, яка складається з:
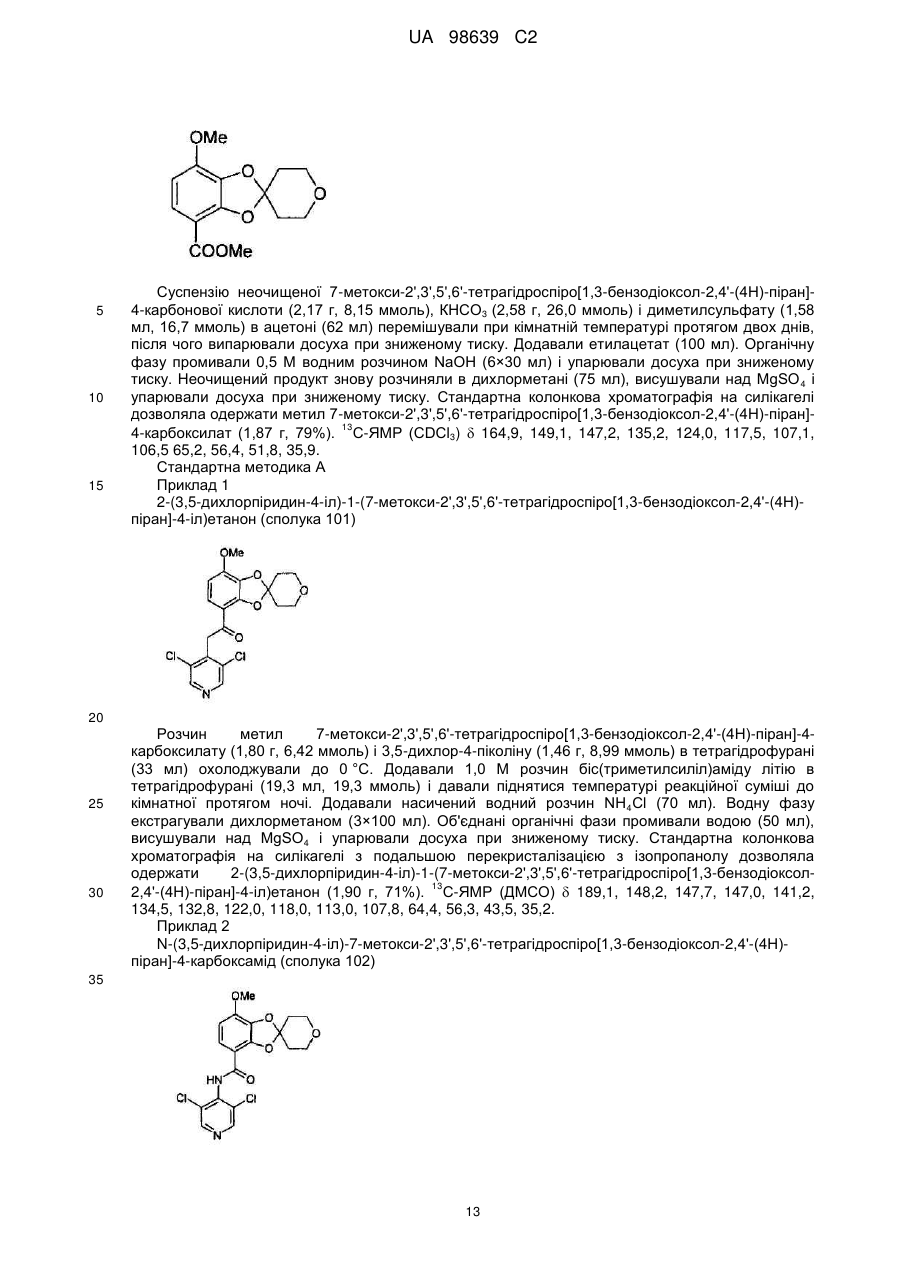
2-(3,5-дихлорпіридин-4-іл)-1-(7-метокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол-2,4'-(4Н)-піран]-4-іл)етанону (сполука 101),
N-(3,5-дихлорпіридин-4-іл)-7-метокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол-2,4'-(4Н)-піран]-4-карбоксаміду (сполука 102),
2-(3,5-дихлор-1-оксидопіридин-4-іл)-1-(7-метокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол-2,4'-(4Н)-піран]-4-іл)етанону (сполука 103),
2-(3,5-дихлорпіридин-4-іл)-1-(7-метокси-4',5'-дигідроспіро[1,3-бензодіоксол-2,3'-(2Н)-тіофен]-4-іл)етанону (сполука 104),
2-(3,5-дихлорпіридин-4-іл)-1-(7-метоксиспіро[1,3-бензодіоксол-2,4'-піперидин]-4-іл)етанону (сполука 105),
2-(3,5-дихлорпіридин-4-іл)-1-(7-метокси-1'-[метоксикарбоніл]спіро[1,3-бензодіоксол-2,4'-піперидин]-4-іл)етанону (сполука 106),
2-(3,5-дихлорпіридин-4-іл)-1-(7-метокси-1'-[метилсульфоніл]спіро[1,3-бензодіоксол-2,4'-піперидин]-4-іл)етанону (сполука 107),
2-(3,5-дихлорпіридин-4-іл)-1-(7-метоксі-1'-ацетилспіро[1,3-бензодіоксол-2,4'-піперидин]-4-іл)етанону (сполука 108),
2-(3,5-дихлорпіридин-4-іл)-1-(7-метокси-1'-метилспіро[1,5-бензодіоксол-2,4'-піперидин]-4-іл)етанону (сполука 109),
2-(3,5-дихлорпіридин-4-іл)-1-(7-метокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол-2,4'-(4Н)-тіопіран]-4-іл)етанону (сполука 110),
2-(3,5-дихлорпіридин-4-іл)-1-(7-метокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол-2,4'-(4Н)-тіопіран-1'-оксид]-4-ил)етанону (сполука 111),
2-(3,5-дихлорпіридин-4-іл)-1-(7-метокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол-2,4'-(4Н)-тіопіран-1',1'-діоксид]-4-ил)етанону (сполука 112),
2-(3,5-дихлор-1-оксидопіридин-4-іл)-1-(7-метокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол-2,4'-(4Н)-тіопіран-1',1'-діоксид]-4-ил)етанону (сполука 113),
2-(3-бромпіридин-4-іл)-1-(7-метокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол-2,4'-(4Н)-тіопіран]-4-іл)етанону (сполука 114),
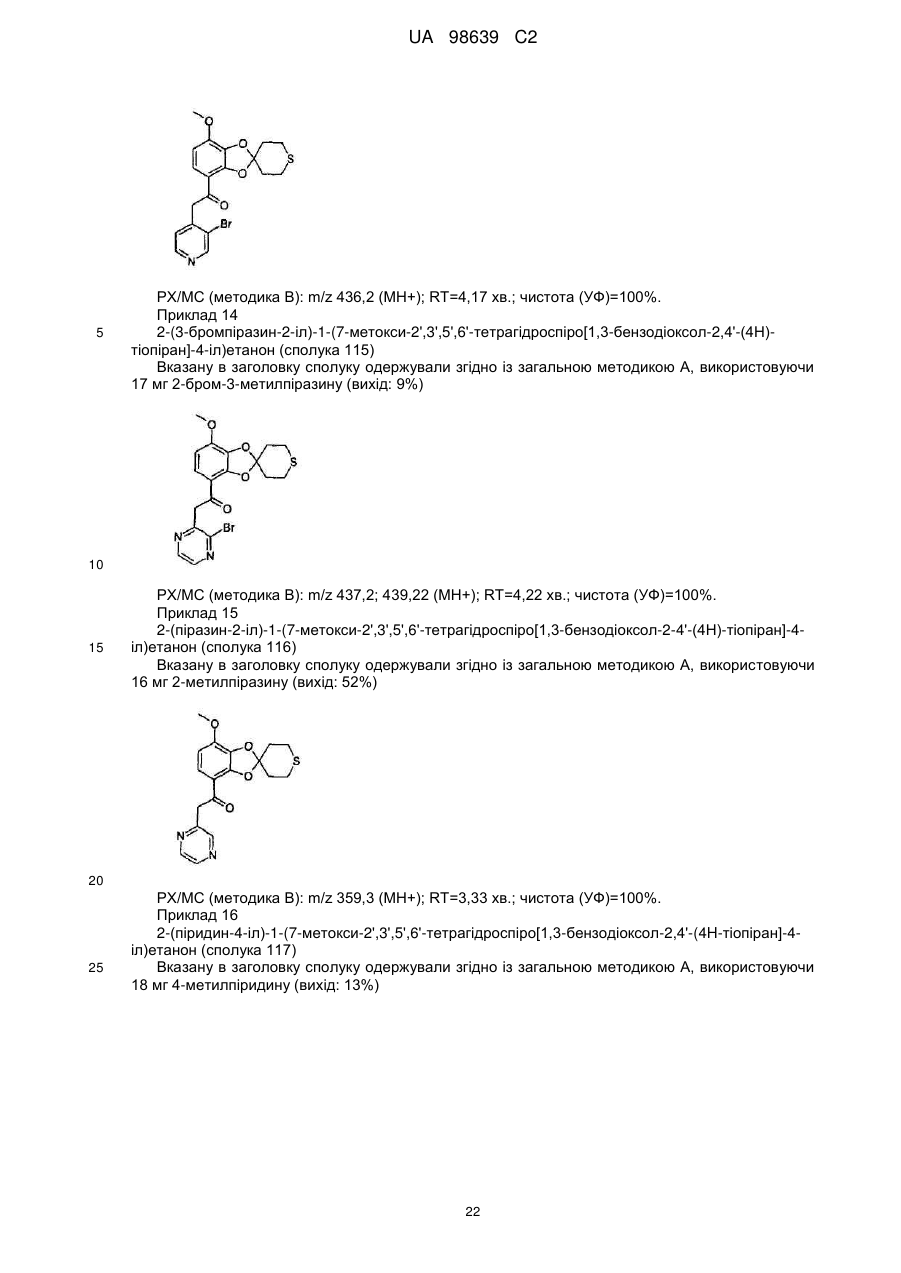
2-(3-бромпіразин-2-іл)-1-(7-метокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол-2,4'-(4Н)-тіопіран]-4-іл)етанону (сполука 115),
2-(піразин-2-іл)-1-(7-метокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол-2,4'-(4Н)-тіопіран]-4-іл)етанону (сполука 116),
2-(піридин-4-іл)-1-(7-метокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол-2,4'-(4Н)-тіопіран]-4-іл)етанону (сполука 117),
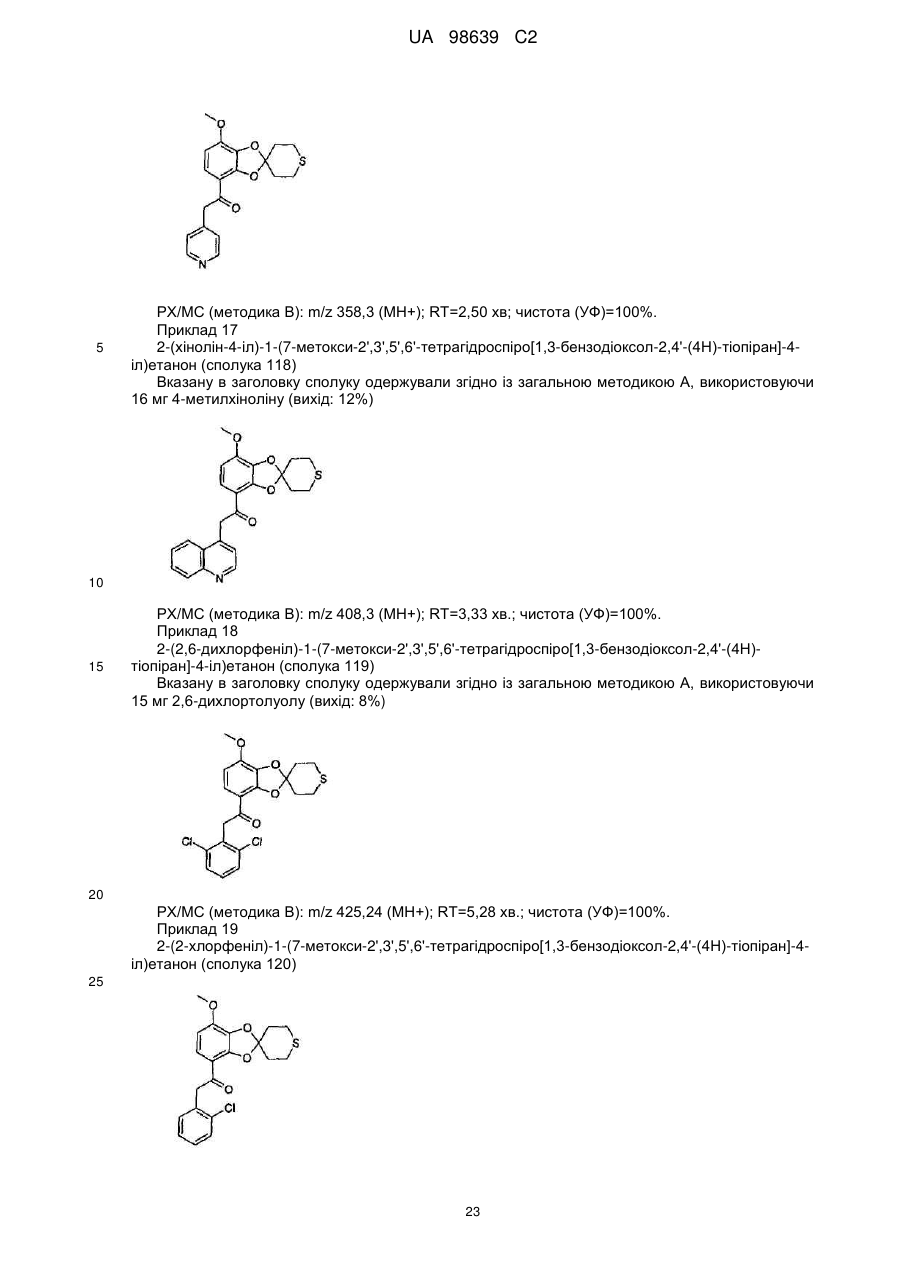
2-(хінолін-4-іл)-1-(7-метокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол-2,4'-(4Н)-тіопіран]-4-іл)етанону (сполука 118),
2-(2,6-дихлорфеніл)-1-(7-метокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол-2,4'-(4Н)-тіопіран]-4-іл)етанону (сполука 119),
2-(2-хлорфеніл)-1-(7-метокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол-2,4'-(4Н)-тіопіран]-4-іл)етанону (сполука 120),
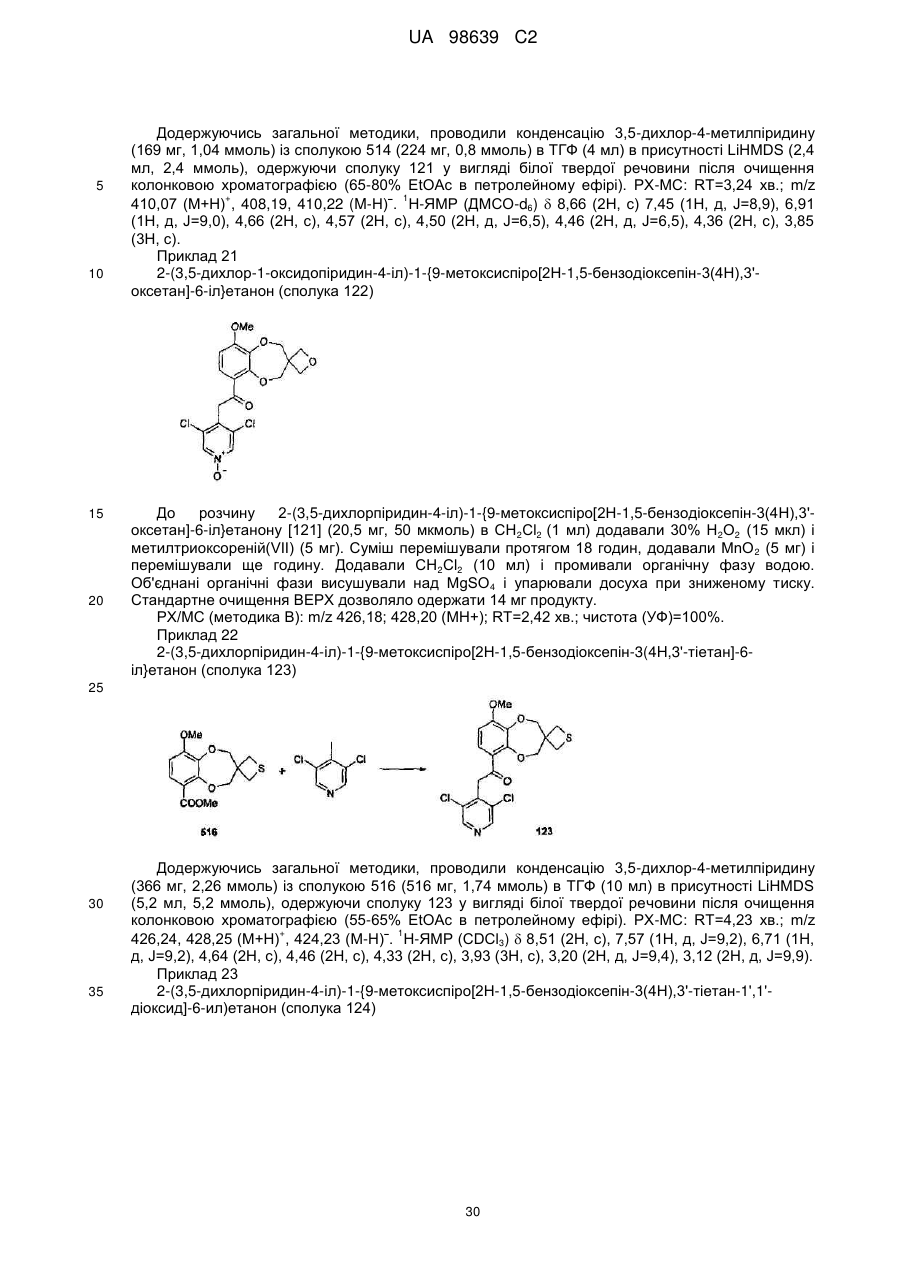
2-(3,5-дихлорпіридин-4-іл)-1-{9-метоксиспіро[2Н-1,5-бензодіоксепін-3(4Н),3'-оксетан]-6-іл}етанону (сполука 121),
2-(3,5-дихлор-1-оксидопіридин-4-іл)-1-{9-метоксиспіро[2Н-1,5-бензодіоксепін-3(4Н),3'-оксетан]-6-іл}етанону (сполука 122),
2-(3,5-дихлорпіридин-4-іл)-1-{9-метоксиспіро[2Н-1,5-бензодіоксепін-3(4Н),3'-тіетан]-6-іл}етанону (сполука 123),
2-(3,5-дихлорпіридин-4-іл)-1-{9-метоксиспіро[2Н-1,5-бензодіоксепін-3(4Н),3'-тіетан-1',1'-діоксид]-6-ил}етанону (сполука 124),
2-(3,5-дихлорпіридин-1-оксидо-4-іл)-1-{9-метоксиспіро[2Н-1,5-бензодіоксепін-3(4Н),3'-тіетан-1', 1'-діоксид]-6-ил}етанону (сполука 125),
2-(3,5-дихлорпіридин-4-іл)-1-{9-метоксиспіро[2Н-1,5-бензодіоксепін-3(4Н),2'-(1,3-діоксолан)]-6-іл}етанону (сполука 126),
2-(3,5-дихлорпіридин-4-іл)-1-{9-метоксиспіро[2Н-1,5-бензодіоксепін-3(4Н),4'-тетрагідропіран]-6-іл}етанону (сполука 127),
2-(3,5-дихлор-1-оксидопіридин-4-іл)-1-{9-метоксиспіро[2Н-1,5-бензодіоксепін-3(4Н),4'-тетрагідропіран]-6-іл}етанону (сполука 128),
2-(3,5-дихлорпіридин-4-іл)-1-{9-метокси-2',2'-диметилспіро[2Н-1,5-бензодіоксепін-3(4Н),5'-[1,3]діоксан]-6-іл}етанону (сполука 129),
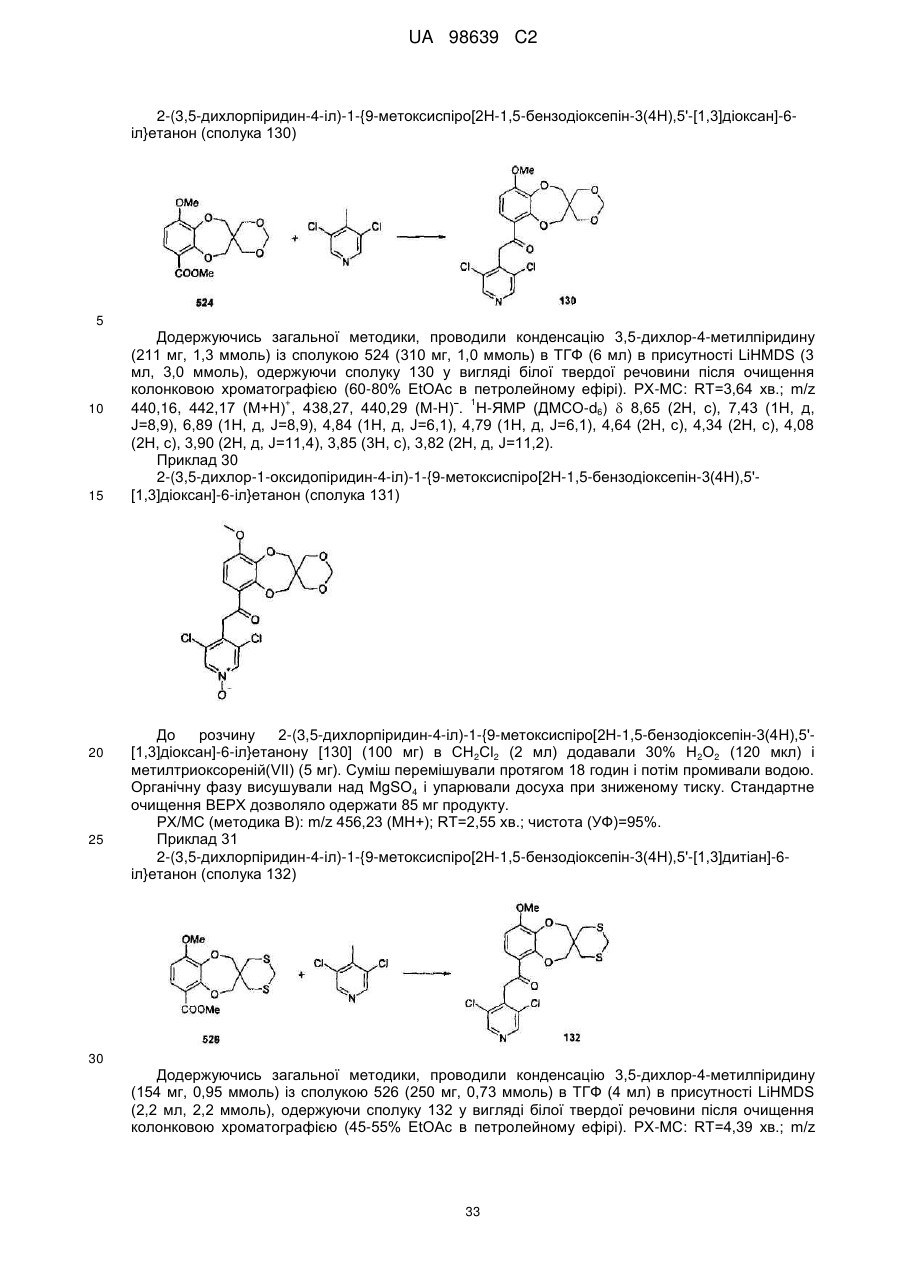
2-(3,5-дихлорпіридин-4-іл)-1-{9-метоксиспіро[2Н-1,5-бензодіоксепін-3(4Н),5'-[1,3]діоксан]-6-іл}етанону (сполука 130),
2-(3,5-дихлор-1-оксидопіридин-4-іл)-1-{9-метоксиспіро[2Н-1,5-бензодіоксепін-3(4Н),5'-[1,3]діоксан]-6-іл}етанону (сполука 131) і
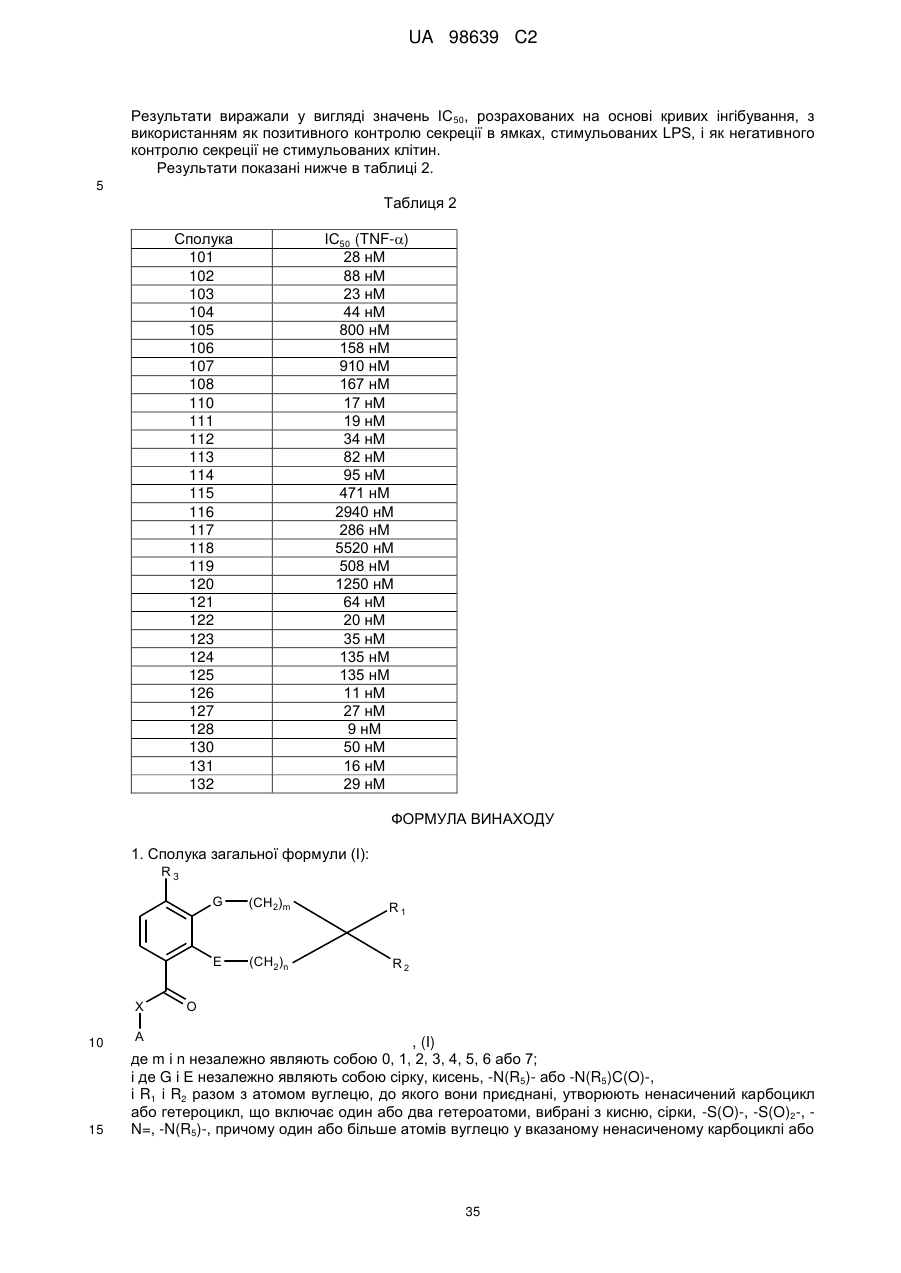
2-(3,5-дихлорпіридин-4-іл)-1-{9-метоксиспіро[2Н-1,5-бензодіоксепін-3(4Н),5'-[1,3]дитіан]-6-іл}етанону (сполука 132),
і їх фармацевтично прийнятних солей, гідратів, N-оксидів або сольватів.
23. Сполука за будь-яким з попередніх пунктів з молекулярною масою менше 800 Дальтон.
24. Сполука за будь-яким з пп. 1-22 для застосування в терапії.
25. Фармацевтична композиція, яка містить сполуку за будь-яким з пп. 1-22 в сполученні з фармацевтично прийнятним наповнювачем або розріджувачем, або фармацевтично прийнятним носієм (носіями).
26. Фармацевтична композиція за п. 25, яка додатково містить одну або більше інших терапевтично активних сполук.
27. Сполука за будь-яким з пп. 1-22 для застосування при профілактиці, лікуванні або полегшенні перебігу шкірних захворювань або станів, або ж гострих або хронічних шкірних виразкових розладів.
28. Сполука за п. 27 для застосування при профілактиці, лікуванні або полегшенні перебігу шкірних захворювань або станів, вибраних з групи, яка складається з проліферативних і запальних шкірних розладів, псоріазу, раку, запалення епідермісу, втрати волосся, атрофії шкіри, атрофії шкіри, викликаної стероїдами, старіння шкіри, старіння шкіри під дією світла, акне, дерматиту, атопічного дерматиту, себорейного дерматиту, контактного дерматиту, алергічного висипу, свербежу і екземи.
29. Спосіб профілактики, лікування або полегшення шкірних захворювань або станів або гострих або хронічних шкірних виразкових розладів, де вказаний спосіб включає введення пацієнту, що страждає щонайменше одним з вказаних захворювань, ефективної кількості однієї або більше сполук за будь-яким з пп. 1-22, необов'язково спільно з фармацевтично прийнятним носієм або одним або більше наповнювачами, необов'язково в комбінації з іншими терапевтично активними сполуками.
30. Спосіб за п. 29, де шкірне захворювання або стан вибрані з групи, яка складається з проліферативних і запальних шкірних розладів, псоріазу, раку, запалення епідермісу, втрати волосся, атрофії шкіри, атрофії шкіри, викликаної стероїдами, старіння шкіри, старіння шкіри під дією світла, акне, дерматиту, атопічного дерматиту, себорейного дерматиту, контактного дерматиту, алергічного висипу, свербежу і екземи.
Текст
Реферат: Даний винахід стосується сполук формули (І), де X, A, G, E, R1, R2, R3 відповідають визначенням, наданим в заявці; а також їх фармацевтично прийнятних солей, гідратів, Nоксидів або сольватів. Далі, винахід стосується вказаних сполук для застосування в терапії, фармацевтичних композицій, що включають вказані сполуки, способів лікування захворювань, наприклад шкірних захворювань, із застосуванням вказаних сполук, а також застосування описаних сполук у виробництві лікарських засобів. UA 98639 C2 (12) UA 98639 C2 UA 98639 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід стосується нових сполук, які виявляють інгібуючу дію відносно фосфодіестераз, а також їх застосування як терапевтичних засобів при лікуванні запальних захворювань і станів. Фосфодіестерази є ферментами, які каталізують гідроліз циклічного AMP і/або циклічного GMP в клітинах до 5'-АМР і 5-GMP, відповідно, і, внаслідок цього, вони мають вирішальне значення для клітинного регулювання рівнів сАМР і cGMP. З 11 фосфодіестераз, ідентифікованих до цього часу, фосфодіестераза (PDE) 4, PDE7 і PDE8 виявляють селективність відносно сАМР. PDE4 є найбільш важливим регулятором сАМР, експресованого в імунних і запальних клітинах, наприклад, нейтрофілах, макрофагах і Т-лімфоцитах (Z. Huang and J.A. Mancini, Current Med. Chem. 13, 2006, pp. 3253-3262). Оскільки сАМР є ключовим вторинним месенджером в модулюванні запальних реакцій, PDE4, як було виявлено, регулює запальні відповіді клітин запалення за рахунок модулювання прозапальних цитокінів, таких як TNF, IL-2, IFN-, GM-CSF і LTB4. Тому інгібування PDE4 стає привабливою ціллю при лікуванні запальних захворювань, таких як астма, хронічні обструктивні хвороби легень (COPD), ревматоїдний артрит, атопічний дерматит, хвороба Крона і т. д. (M.D. Houslay et al., Drug Discovery Today 10 (22), 2005, pp. 1503-1519). Оскільки у пацієнтів з атопічним дерматитом (AD) спостерігається підвищена активність PDE, інгібування PDE4 також, мабуть, могло б стати продуктивним способом лікування AD (Journal of Investigative Dermatology (1986), 87(3), 372-6). Сімейство генів PDE4 складається як мінімум з чотирьох генів, а саме А, В, С і D, які мають високу міру гомології (V. Boswell Smith and D. Spina, Curr. Opinion Investig. Drugs 6(11), 2006, pp. 1136-1141). Чотири ізоформи PDE4 диференційовано експресуються в різних тканинах і типах клітин. Так, наприклад, PDE4B переважно експресується в моноцитах і нейтрофілах, але не в корі головного мозку і епітеліальних клітинах, тоді як PDE4D експресується в легенях, корі головного мозку, мозочку і Т-клітинах (С. Kroegel and M. Foerster, Exp. Opinion Investig. Drugs 16(1), 2007, pp. 109-124). Було висунене припущення, що інгібування PDE4D в мозку пов'язане з несприятливими ефектами, виявленими при клінічному введенні інгібіторів PDE4, насамперед нудотою і блюванням, в той час як інгібування PDE4B пов'язане з протизапальними ефектами (В. Lipworth, Lancet 365, 2005, pp. 167-175). Однак, розроблені до цього часу інгібітори PDE, мабуть, не є специфічними для якої-небудь з чотирьох ізоформ PDE4. Численні інгібітори PDE4 були досліджені з точки зору їх терапевтичної дії при запальних захворюваннях, насамперед астмі, запальних захворюваннях кишечнику і COPD. Перший з них, а саме теофілін, є слабим, неселективним інгібітором фосфодіестерази, застосовуваним при лікуванні респіраторних захворювань, таких як астма і COPD. Проте, лікування теофіліном приводить до появи як легких, так і важких побічних ефектів, наприклад, аритмії і конвульсій, які обмежує клінічне застосування теофіліну (Kroegel and Foerster, дивіться вище). Оскільки фосфодіестераза залишається привабливою мішенню для протизапальної терапії, було розроблено і досліджено в клінічних умовах декілька інших, більш селективних інгібіторів PDE4. Клінічна розробка багатьох інгібіторів PDE4 першого покоління, наприклад, роліпраму, була припинена через обмежуючі дози побічні ефекти, насамперед нудоту і блювання. У цей час проходять клінічні випробування інгібіторів PDE4 другого покоління, які мають значно менш виражені небажані ефекти (Houslay, дивіться вище). Розроблені останнім часом інгібітори PDE4 розкриті, наприклад, в ЕР 0771794 і ЕР 0943613. У WO 96/31476 розкриті структурно різні 4-заміщені-3,5-дихлорпіридини, які є інгібіторами фосфодіестерази циклічного AMP. Існує постійна потреба в розробці нових інгібіторів PDE4, які мають більш сприятливе терапевтичне вікно, тобто менші несприятливі ефекти, при збереженні їх терапевтичної протизапальної дії. Огляд доклінічних і клінічних випробувань селективних інгібіторів PDE4, в тому числі інгібіторів, призначених для лікування атопічного дерматиту і псоріазу, був наведений нещодавно в Inflammation & Allergy: Drug Targets, 2007, 6(1), 17-26. Автори винаходу несподівано виявили, що нові сполуки за даним винаходом виявляють інгібуючу активність відносно PDE4 і можуть застосовуватися як терапевтичні засоби для лікування запальних алергічних захворювань, таких як бронхіальна астма, алергічний риніт і нефрит; аутоімунних захворювань, таких як ревматоїдний артрит, розсіяний склероз, хвороба Крона і системний червоний вовчак; захворювань центральної нервової системи, таких як депресія, амнезія і деменція; органопатії, пов'язаної з ішемічним рефлюксом, викликаним серцевою недостатністю, шоком і цереброваскулярними захворюваннями, і т. п.; інсулінорезистентного діабету; виразок; СНІДу і т. п. Сполуки за даним винаходом можуть також виявитися корисними при профілактиці, лікуванні і полегшенні перебігу ряду захворювань, наприклад, шкірних захворювань або станів, таких як проліферативні і запальні шкірні розлади і, зокрема, псоріаз, запалення епідермісу, 1 UA 98639 C2 випадіння волосся, атрофія шкіри, атрофія шкіри, викликана стероїдами, старіння шкіри, старіння шкіри під дією світла, акне, дерматит, атопічний дерматит, себорейний дерматит, контактний дерматит, алергічний висип, свербіж і екзема. Відповідно, даний винахід стосується сполук, представлених формулою (І) 5 , 10 15 20 25 30 35 40 45 де m і n незалежно являють собою 0, 1, 2, 3, 4, 5, 6 або 7; де G і Е незалежно являють собою сірку, кисень, -N=, -N(R5)- або -N(R5)C(O)-, і R1 і R2 разом з атомом вуглецю, до якого вони приєднані, утворюють ненасичений карбоцикл або гетероцикл, що включає один або два гетероатоми, вибрані з кисню, сірки, -S(O), -S(O)2-, -N(R5)-, причому один або більше атомів вуглецю у вказаному ненасиченому карбоциклі або гетероциклі необов'язково заміщені одним або більше однаковими або різними замісниками, вибраними з числа замісників R4; або де G і Е незалежно являють собою сірку, кисень, -N=, -N(R5) або -N(R5)C(O)-, і R1 і R2 разом з атомом вуглецю, до якого вони приєднані, утворюють насичений карбоцикл, причому один або більше атомів вуглецю у вказаному насиченому карбоциклі необов'язково заміщені одним або більше однаковими або різними замісниками, вибраними із замісників R4, за умови, що, якщо G являє собою кисень, обидва коефіцієнти m і n не дорівнюють нулю, і за додаткової умови, що, якщо обидва фрагменти G і Е являють собою атоми кисню, сума m і n дорівнює шести або більше; R3 являє собою галоген, гідрокси, алкіл, алкеніл, алкініл, галогеналкіл, алкокси, галогеналкокси, алкілтіо, форміл, алкоксикарбоніл, алкілкарбоніл або амінокарбоніл; R4 являє собою водень, аміно, тіоксо, алкіл, галогеналкіл, гідроксіалкіл, алкокси, галоген, оксо, тіа або гідрокси; R5 являє собою водень, алкіл, галогеналкіл, алкілкарбоніл, гідроксіалкіл, алкоксикарбоніл, алкілсульфоніл, алкіламіносульфоніл або аміносульфоніл; X являє собою зв'язок, -СН2- або -NH-; А являє собою арил, циклоалкіл, циклоалкеніл, арилалкіл, гетероарил, гетероарилалкіл, гетероциклоалкіл або гетероциклоалкеніл, необов'язково заміщений одним або більше однаковими або різними замісниками, вибраними з числа замісників R 4; а також їх фармацевтично прийнятних солей, гідратів, N-оксидів або сольватів. У іншому аспекті винахід стосується фармацевтичної композиції, яка включає сполуку загальної формули (І) згідно з наданим вище визначенням в сполученні з фармацевтично прийнятним наповнювачем або фармацевтично прийнятним носієм (носіями), необов'язково, спільно з одним або більше іншими терапевтично активними сполуками (сполукою). У ще одному аспекті винахід стосується сполуки формули (І) згідно з наданим вище визначенням, а також її фармацевтично прийнятних солей, гідратів, N-оксидів або сольватів, для застосування в профілактиці, лікуванні або полегшенні перебігу шкірних захворювань або станів, або ж гострих або хронічних шкірних виразкових розладів. У ще одному аспекті винахід стосується способу профілактики, лікування або полегшення перебігу шкірних захворювань або станів, або ж гострих або хронічних шкірних виразкових розладів, де спосіб включає введення пацієнту, що страждає як мінімум одним з вказаних розладів, ефективної кількості однієї або більше сполук формули (І), згідно з наданим вище визначенням, а також їх фармацевтично прийнятних солей, гідратів, N-оксидів або сольватів; необов'язково в сполученні з фармацевтично прийнятним носієм або одним або більше наповнювачами і, необов'язково, в комбінації з іншими терапевтично активними сполуками. 2 UA 98639 C2 5 10 15 20 25 30 35 40 45 50 55 Мається на увазі, що термін «вуглеводневий радикал» означає радикал, який містить тільки атоми водню і вуглецю, він може містити один або більше подвійних і/або потрійних вуглецьвуглецевих зв'язків, крім того, він може включати циклічні фрагменти в поєднанні з розгалуженими або лінійними фрагментами. Згадані вуглеводні включають 1-20 атомів вуглецю, і переважно містять 1-12, наприклад, 1-6, наприклад, 1-4, наприклад, 1-3, наприклад, 1-2 атоми вуглецю. Даний термін охоплює алкіл, алкеніл, циклоалкіл, циклоалкеніл, алкініл, а також арил, арилалкіл, які визначені нижче. Мається на увазі, що термін «арил» означає залишок ароматичних карбоциклів, що включають 6-20 атомів вуглецю, наприклад, 6-14 атомів вуглецю, переважно 6-10 атомів вуглецю, зокрема 5- або 6-членних циклів, необов'язково конденсованих карбоциклів, що включають як мінімум один ароматичний цикл, наприклад, феніл, нафтил, інденіл і інданіл. Мається на увазі, що термін «гетероарил» означає залишок ароматичного гетероциклу, що включає 1-6 гетероатомів (вибраних з О, S і N) і 1-20 атомів вуглецю, наприклад, 1-5 гетероатомів і 1-10 атомів вуглецю, наприклад, 1-5 гетероатомів і 1-6 атомів вуглецю, наприклад, 1-5 гетероатомів і 1-3 атоми вуглецю, зокрема 5- або 6-членні цикли з 1-4 гетероатомами, вибраними з О, S і N, або необов'язково конденсовані біциклічні системи з 1-4 гетероатомами, в яких як мінімум один цикл є ароматичним, наприклад, піридил, хіноліл, ізохіноліл, індоліл, тетразоліл, тіазоліл, імідазоліл, піразоліл, оксазоліл, ізоксазоліл, тієніл, піразиніл, ізотіазоліл, бензімідазоліл і бензофураніл. У контексті даного винаходу мається на увазі, що термін «алкіл» означає радикал, одержаний при видаленні одного атома водню з вуглеводню. Згаданий алкіл включає 1-20, переважно 1-12, наприклад, 1-6, наприклад, 1-4 атоми вуглецю. Цей термін включає підклас нормальних алкілів (н-алкілів), вторинних і третинних алкілів, таких як метил, етил, н-пропіл, ізопропіл, н-бутил, ізобутил, втор-бутил, трет-бутил, пентил, ізопентил, гексил і ізогексил. Мається на увазі, що термін «циклоалкіл» означає залишок насиченого циклоалкану, що включає 3-20 атомів вуглецю, переважно 3-10 атомів вуглецю, зокрема 3-8 атомів вуглецю, наприклад, 3-6 атомів вуглецю, включаючи конденсовані біциклічні системи, наприклад, циклопропіл, циклобутил, циклопентил, циклогексил або циклогептил. Мається на увазі, що термін «гетероциклоалкіл» означає описаний вище залишок циклоалкану, в якому один або більше атомів вуглецю замінені гетероатомами, що включає 119 атомів вуглецю, наприклад, 2-4 атоми вуглецю, що містить крім цього 1-6 гетероатомів, переважно 1, 2 або 3 гетероатоми, вибрані з О, N або S, які можуть бути необов'язково зв'язані з одним або двома атомами кисню, наприклад, [1,3]діоксол, оксетан, [1,3]діоксолан, [1,3]діоксан, тетрагідротіопіран, тетрагідротіопіран-1,1-діоксид, тетрагідротіопіран-1-оксид, піперидин, тетрагідротіофен, [1,3]дитіан, тіетан, [1,3]дитіан-1,3-діоксид або тіетан-1-оксид, або включає конденсовану біциклічну систему з 1-4 гетероатомами, в якій як мінімум один цикл містить гетероатом, і інший цикл може бути, наприклад, карбоциклом, наприклад, ізоіндолілом. Мається на увазі, що термін «алкеніл» означає моно-, ди-, три-, тетра- або пентаненасичений вуглеводневий радикал, що містить 2-10 атомів вуглецю, зокрема 2-6 атомів вуглецю, наприклад, 2-4 атоми вуглецю, наприклад, етеніл, пропеніл, бутеніл, пентеніл або гексеніл. Мається на увазі, що термін «циклоалкеніл» означає моно-, ди-, три- або тетраненасичені неароматичні циклічні вуглеводневі радикали, що містять 3-20 атомів вуглецю, включаючи конденсовані біциклічні системи, які, як правило, містять 3-10 атомів вуглецю, як, наприклад, 3, 4 або 6 атомів вуглецю, наприклад, циклопропеніл, циклобутеніл, циклопентеніл, циклогексеніл, циклогептеніл. Мається на увазі, що термін «гетероциклоалкеніл» означає описаний вище залишок циклоалкену, в якому один або більше атомів вуглецю замінені на гетроатоми, що містить 1-19 атомів вуглецю, наприклад, 2-4 атоми вуглецю, що включає крім цього 1-6 гетероатомів, переважно 1, 2 або 3 гетероатоми, вибрані з О, N або S, включаючи конденсовані біциклічні системи з 1-4 гетероатомами, в яких як мінімум один цикл містить гетероатом, і інший цикл може бути, наприклад, карбоциклом, наприклад, дигідрофуранілом або 2,5-дигідро-1Нпіролілом. Мається на увазі, що термін «арилалкіл» означає визначений вище арильний радикал, ковалентно приєднаний до алкільної групи, наприклад, бензил. Мається на увазі, що термін «гетероарилалкіл» означає визначений вище гетероарильний радикал, ковалентно зв'язаний з алкільною групою. Мається на увазі, що термін «алкініл» означає вуглеводневий радикал, що містить 1-5 потрійних зв'язків С-С і 2-20 атомів вуглецю, який, як правило, включає 2-10 атомів вуглецю, 3 UA 98639 C2 5 10 15 20 25 30 35 40 45 50 55 зокрема 2-6 атомів вуглецю, наприклад, 2-4 атоми вуглецю, наприклад, етиніл, пропініл, бутиніл, пентиніл або гексиніл. Мається на увазі, що термін «галоген» означає замісник, який належить до головної підгрупи 7-ої групи періодичної системи, наприклад, фтор, хлор, бром і йод. Мається на увазі, що термін «галогеналкіл» означає визначену вище алкільну групу, заміщену одним або більше визначеними вище атомами галогенів, наприклад, дифторметил. Мається на увазі, що термін «гідроксіалкіл» означає визначену вище алкільну групу, заміщену однією або більше гідроксигрупами, наприклад, гідроксиметил, гідроксіетил, гідроксипропіл. Мається на увазі, що термін «алкокси» означає радикал формули -OR', в якому R' являє собою алкіл згідно з наданим вище визначенням, наприклад, метокси, етокси, н-пропокси, ізопропокси, бутокси і т. д. Мається на увазі, що термін «алкоксикарбоніл» означає радикал формули -C(O)-O-R', де R' являє собою алкіл згідно з наданим вище визначенням, наприклад, метоксикарбоніл, етоксикарбоніл, н-пропоксикарбоніл, ізопропоксикарбоніл і т. д. Мається на увазі, що термін «алкілкарбоніл» означає радикал формули -C(O)-R', де R' являє собою алкіл згідно з наданим вище визначенням, наприклад, етаноїл, ацетил. Мається на увазі, що термін «аміносульфоніл» означає радикал формули -S(O)2-NR", де R" відповідає наданому вище визначенню, наприклад, -SO2Me. Мається на увазі, що термін «гетероцикл» включає в себе наведені вище визначення гетероарилу, гетероциклоалкілу і гетероциклоалкенілу, додатково включаючи анельовані циклічні системи, утворені з іншими гетероциклами або з циклічними вуглеводнями, наприклад, 2,5-дигідробензо(b)діоксоцин, 2,3,5,8-тетрагідро-[1,4]діоксоцин, 5,8-дигідро-[1,4]діоксоцин. Мається на увазі, що термін «фармацевтично прийнятна сіль» означає солі, одержані взаємодією сполуки формули (І) з придатною неорганічною або органічною кислотою, такою як хлористоводнева, бромистоводнева, йодистоводнева, сірчана, азотна, фосфорна, мурашина, оцтова, 2,2-дихлороцтова, адипінова, аскорбінова, L-аспарагінова, L-глутамінова, галактарова, молочна, малеїнова, L-яблучна, фталева, лимонна, пропіонова, бензойна, глутарова, глюконова, D-глюкуронова, метансульфонова, саліцилова, янтарна, малонова, винна, бензолсульфонова, етан-1,2-дисульфонова, 2-гідроксіетансульфонова, толуолсульфонова, сульфамова або фумарова кислота. Фармацевтично прийнятні солі сполук формули (І) також можуть бути одержані взаємодією з придатною основою, такою як гідроксид натрію, гідроксид калію, гідроксид магнію, гідроксид кальцію, гідроксид срібла, аміак і т. п., або придатними нетоксичними амінами, такими як нижчі алкіламіни, наприклад, триетиламін, гідроксипохідні нижчих алкіламінів, наприклад, 2-гідроксіетиламін, біс-(2-гідроксіетил)амін, циклоалкіламіни, наприклад, дициклогексиламін або бензиламіни, наприклад, N,N'-дибензилетилендіамін, а також дибензиламін або L-аргінін, або L-лізином. Солі, одержані реакцією з придатною основою, включають, не обмежуючись вказаними, солі натрію, солі холіну, солі 2-(диметиламіно)етанолу, солі 4-(2-гідроксіетил)морфоліну, солі L-лізину, солі N-(2-гідроксіетил)тролідину, солі етаноламіну, солі калію, солі тетрабутиламонію, солі бензилтриметиламонію, солі цетилтриметиламонію, солі тетраметиламонію, солі тетрапропіламонію, солі трис(гідроксиметил)амінометану, солі N-метил-D-глюкаміну, солі срібла, солі бензетонію і солі триетаноламіну. Мається на увазі, що термін «сольват» означає сполуки, утворені взаємодією між сполукою, наприклад, сполукою формули (І), і розчинником, наприклад, спиртом, гліцерином або водою, де вказані сполуки існують у твердій формі. Якщо розчинником є вода, вказані сполуки іменують гідратами. Варіанти здійснення даного винаходу У одному або декількох варіантах здійснення даного винаходу обидва фрагменти Е і G являють собою кисень. У одному або декількох варіантах здійснення даного винаходу обидва коефіцієнти m і n дорівнюють одиниці. У одному або декількох варіантах здійснення даного винаходу обидва коефіцієнти m і n дорівнюють нулю. У одному або декількох варіантах здійснення даного винаходу R 1 і R2 разом з атомом вуглецю, до якого вони приєднані, утворюють гетероциклічний фрагмент, який включає один або два гетероатоми, вибрані з групи, що складається з -О-, -S-, -S(O)-, -S(O)2-, -N= і -N(R5)-; причому один або більше атомів вуглецю гетероциклічного фрагмента необов'язково заміщені одним або більше однаковими або різними замісниками, вибраними з числа замісників R4. 4 UA 98639 C2 5 10 15 20 25 30 35 У одномуабо декількох варіантах здійснення даного винаходу R1 і R2 разом з атомом вуглецю, до якого вони приєднані, утворюють гетероциклічний фрагмент, який включає один або два гетероатоми, вибрані з групи, що складається з -О-, -S-, -S(O)-, -S(O)2- і -N(R5)-; причому один або більше атомів вуглецю гетероциклічного фрагмента необов'язково заміщені одним або більше однаковими або різними замісниками, вибраними з числа замісників R 4. У одному або декількох варіантах здійснення даного винаходу R1 і R2 разом з атомом вуглецю, до якого вони приєднані, утворюють 4-, 5- або 6-членний гетероциклічний фрагмент, зокрема 6-членний гетероциклічний фрагмент. У одному або декількох варіантах здійснення даного винаходу, вказаний гетероциклічний фрагмент являє собою тетрагідропіран, оксетан, [1,3]діоксолан, [1,3]діоксан, тетрагідротіопіран, тетрагідротіопіран-1,1-діоксид, тетрагідротіопіран-1-оксид, піперидин, тетрагідротіофен, [1,3]дитіан, тіетан, [1,3]-дитіан-1,3-діоксид, тіетан-1-оксид або тіетан-1,1-діоксид. У одному або декількох варіантах здійснення даного винаходу гетероциклічний фрагмент, утвореній замісниками R1 і R2, а також атомом вуглецю, до якого вони приєднані, включає один гетероатом або два гетероатоми. У одному або декількох варіантах здійснення даного винаходу, гетероатом знаходиться в положенні 4 гетероциклічного фрагмента. Цей гетероатом може бути, наприклад, киснем. У одному або декількох варіантах здійснення даного винаходу гетероатом (гетероатоми) являє (являють) собою кисень, сірку, -S(O)- або -S(O)2-. У одному або декількох варіантах здійснення даного винаходу фрагмент А являє собою гетероарил або гетероарилалкіл. У одному або декількох варіантах здійснення даного винаходу фрагмент А являє собою піридил, піразиніл або хіноліл. У інших варіантах здійснення А може являти собою феніл. У одному або декількох варіантах здійснення даного винаходу, фрагмент А заміщений галогеном, зокрема хлором, фтором, бромом або йодом. У одному або декількох варіантах здійснення даного винаходу R 3 являє собою С1-6алкокси, С1-6галогеналкіл або галоген. У одному або декількох варіантах здійснення даного винаходу R 3 являє собою метокси або етокси. У одному або декількох варіантах здійснення даного винаходу X являє собою -СН2- або -NH. У одному або декількох варіантах здійснення даного винаходу А являє собою 4-(3,5дихлорпіридил). У одному або декількох варіантах здійснення даного винаходу сполука формули (І) представлена формулою Іа або Іb , 40 45 , де X, A, G, Е, R1, R2, R3, R4, R5, m і n відповідають наданим вище визначенням. У окремих варіантах здійснення даного винаходу X являє собою -NH-, де R3 являє собою С16алкокси. Даний винахід охоплює всі варіанти здійснення, в яких X, A, G, E, R 1, R2, R3, R4, R5 скомбіновані будь-яким чином, описаним в даній заявці. Зокрема, сполуки формули (І) можуть бути вибрані з однієї з наступних сполук: 5 UA 98639 C2 5 10 15 20 25 30 35 40 45 50 55 60 2-(3,5-дихлорпіридин-4-іл)-1-(7-метокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол-2,4'-(4Н)піран]-4-іл)етанону (сполука 101), N-(3,5-дихлорпіридин-4-іл)-7-метокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол-2,4'-(4Н)піран]-4-карбоксаміду (сполука 102), 2-(3,5-дихлор-1-оксидопіридин-4-іл)-1-(7-метокси-2',3',5,6'-тетрагідроспіро[1,3-бензодіоксол2,4'-(4Н)-піран]-4-іл)етанону (сполука 103), 2-(3,5-дихлорпіридин-4-іл)-1-(7-метокси-4',5'-дигідроспіро[1,3-бензодіоксол-2,3'-(2Н)-тіофен]4-іл)етанону (сполука 104), 2-(3,5-дихлорпіридин-4-іл)-1-(7-метоксиспіро[1,3-бензодіоксол-2,4'-піперидин]-4-іл)етанону (сполука 105), 2-(3,5-дихлорпіридин-4-іл)-1-(7-метокси-1'-[метоксикарбоніл]спіро[1,3-бензодіоксол-2,4'піперидин]-4-іл)етанону (сполука 106), 2-(3,5-дихлорпіридин-4-іл)-1-(7-метокси-1'-[метилсульфоніл]спіро[1,3-бензодіоксол-2,4'піперидин]-4-іл)етанону (сполука 107), 2-(3,5-дихлорпіридин-4-іл)-1-(7-метоксі-1'-ацетилспіро[1,3-бензодіоксол-2,4'-піперидин]-4іл)етанону (сполука 108), 2-(3,5-дихлорпіридин-4-іл)-1-(7-метокси-1'-метилспіро[1,5-бензодіоксол-2,4'-піперидин]-4іл)етанону (сполука 109), 2-(3,5-дихлорпіридин-4-іл)-1-(7-метокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол-2,4'-(4Н)тіопіран]-4-іл)етанону (сполука 110), 2-(3,5-дихлорпіридин-4-іл)-1-(7-метокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол-2,4'-(4Н)тіопіран-1'-оксид]-4-ил)етанону (сполука 111), 2-(3,5-дихлорпіридин-4-іл)-1-(7-метокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол-2,4'-(4Н)тіопіран-1',1'-діоксид]-4-ил)етанону (сполука 112), 2-(3,5-дихлор-1-оксидопіридин-4-іл)-1-(7-метокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол2,4'-(4Н)-тіопіран-1',1'-діоксид]-4-ил)етанону (сполука 113), 2-(3-бромпіридин-4-іл)-1-(7-метокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол-2,4'-(4Н)тіопіран]-4-іл)етанону (сполука 114), 2-(3-бромпіразин-2-іл)-1-(7-метокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол-2,4'-(4Н)тіопіран]-4-іл)етанону (сполука 115), 2-(піразин-2-іл)-1-(7-метокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол-2,4'-(4Н)-тіопіран]-4іл)етанону (сполука 116), 2-(піридин-4-іл)-1-(7-метокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол-2,4'-(4Н)-тіопіран]-4іл)етанону (сполука 117), 2-(хінолін-4-іл)-1-(7-метокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол-2,4'-(4Н)-тіопіран]-4іл)етанону (сполука 118), 2-(2,6-дихлорфеніл)-1-(7-метокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол-2,4'-(4Н)тіопіран]-4-іл)етанону (сполука 119), 2-(2-хлорфеніл)-1-(7-метокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол-2,4'-(4Н)-тіопіран]-4іл)етанону (сполука 120), 2-(3,5-дихлорпіридин-4-іл)-1-{9-метоксиспіро[2Н-1,5-бензодіоксепін-3(4Н),3'-оксетан]-6іл}етанону (сполука 121), 2-(3,5-дихлор-1-оксидопіридин-4-іл)-1-{9-метоксиспіро[2Н-1,5-бензодіоксепін-3(4Н),3'оксетан]-6-іл}етанону (сполука 122), 2-(3,5-дихлорпіридин-4-іл)-1-{9-метоксиспіро[2Н-1,5-бензодіоксепін-3(4Н),3'-тіетан]-6іл}етанону (сполука 123), 2-(3,5-дихлорпіридин-4-іл)-1-{9-метоксиспіро[2Н-1,5-бензодіоксепін-3(4Н),3'-тіетан-1',1'діоксид]-6-ил}етанону (сполука 124), 2-(3,5-дихлорпіридин-1-оксидо-4-їл)-1-{9-метоксиспіро[2Н-1,5-бензодіоксепін-3(4Н),3'-тіетан1',1'-діоксид]-6-ил}етанону (сполука 125), 2-(3,5-дихлорпіридин-4-іл)-1-{9-метоксиспіро[2Н-1,5-бензодіоксепін-3(4Н),2'-(1,3-діоксолан)]6-іл}етанону (сполука 126), 2-(3,5-дихлорпіридин-4-іл)-1-{9-метоксиспіро[2Н-1,5-бензодіоксепін-3(4Н),4'-тетрагідропіран]6-іл}етанону (сполука 127), 2-(3,5-дихлор-1-оксидопіридин-4-іл)-1-{9-метоксиспіро[2Н-1,5-бензодіоксепін-3(4Н),4'тетрагідропіран]-6-іл}етанону (сполука 128), 2-(3,5-дихлорпіридин-4-іл)-1-{9-метокси-2',2'-диметилспіро[2Н-1,5-бензодіоксепін-3(4Н),5'[1,3]діоксан]-6-іл}етанону (сполука 129), 2-(3,5-дихлорпіридин-4-іл)-1-{9-метоксиспіро[2Н-1,5-бензодіоксепін-3(4Н),5'-[1,3]діоксан]-6іл}етанону (сполука 130), 6 UA 98639 C2 5 10 15 20 25 30 35 40 45 50 55 60 2-(3,5-дихлор-1-оксидопіридин-4-іл)-1-{9-метоксиспіро[2Н-1,5-бензодіоксепін-3(4Н),5'[1,3]діоксан]-6-іл}етанону (сполука 131) і 2-(3,5-дихлорпіридин-4-іл)-1-{9-метоксиспіро[2Н-1,5-бензодіоксепін-3(4Н),5'-[1,3]дитіан]-6іл}етанону (сполука 132), а також їх фармацевтично прийнятних солей, гідратів, N-оксидів або сольватів. У одному або декількох варіантах здійснення даного винаходу, сполуки загальної формули (І) мають молекулярну масу менше 800 Дальтон, наприклад, менше 750 Дальтон, наприклад, менше 700 Дальтон або менше 650, 600, 550 або 500 Дальтон. У одному або декількох варіантах здійснення даного винаходу, сполуки формули (І), відповідні наданому вище визначенню, застосовні в терапії. Сполуки формули (І) можуть бути одержані в кристалічній формі або безпосередньо шляхом концентрування розчину в органічному розчиннику, або шляхом кристалізації або перекристалізації з органічного розчинника або суміші вказаного розчинника і співрозчинника, який може бути органічним або неорганічним, наприклад, водою. Ці кристали можуть бути виділені у формі, переважно вільній від розчинника, або у вигляді сольвату, наприклад, гідрату. Даний винахід охоплює всі кристалічні модифікації і форми, а також їх суміші. Сполуки формули (І) можуть включати або не включати асиметрично заміщені (хіральні) атоми вуглецю, які забезпечують існування ізомерних форм, наприклад, енантіомерів і, можливо, діастереомерів. Даний винахід стосується всіх таких ізомерів, або у вигляді чистих форм, або у вигляді сумішей чистих форм (наприклад, рацематів). Чисті стереоізомерні форми сполук і проміжні сполуки за даним винаходом можуть бути одержані при використанні методик, відомих в техніці. Різні ізомерні форми можуть бути розділені за допомогою фізичних способів розділення, наприклад, селективної кристалізації і хроматографічних методик, наприклад, рідинної хроматографії із застосуванням хіральних нерухомих фаз. Енантіомери можуть бути розділені за допомогою селективної кристалізації їх діастереомерних солей з оптично активними амінами, наприклад, 1-ефедрином. Як альтернатива, енантіомери можуть бути розділені за допомогою хроматографічних методик із застосуванням хіральних нерухомих фаз. Вказані чисті стереоізомерні форми можуть також бути одержані з відповідних чистих стереоізомерних форм придатних вихідних сполук, за умови, що реакції проходять стереоселективно або стереоспецифічно. Переважно, якщо бажано одержати конкретний стереоізомер, вказану сполуку потрібно синтезувати за допомогою стереоселективних або стереоспецифічних методик одержання. У цих методиках переважно повинні застосовуватися хірально чисті вихідні сполуки. Сполуки за даним винаходом, необов'язково в комбінації з іншими діючими сполуками, можуть застосовуватися для лікування шкірних захворювань або станів, або гострих або хронічних шкірних виразкових розладів, зокрема для лікування проліферативних і запальних шкірних розладів, псоріазу, раку, запалення епідермісу, випадіння волосся, атрофії шкіри, атрофії шкіри, викликаної стероїдами, старіння шкіри, старіння шкіри під дією світла, акне, дерматиту, атопічного дерматиту, себорейного дерматиту, контактного дерматиту, алергічного висипу, свербежу і екземи. Крім того, що сполуки за даним винаходом застосовні в лікуванні людей, їх можна також застосовувати для лікування тварин, включаючи ссавців, наприклад, коней, велику рогату худобу, овець, свиней, собак і кішок. Для застосування в терапії, сполуки за даним винаходом, як правило, застосовуються у формі фармацевтичних композицій. Тому даний винахід стосується фармацевтичної композиції, яка включає сполуку формули (І), необов'язково разом з однією або більше іншими терапевтично активними сполуками, в сполученні з фармацевтично прийнятним наповнювачем або носієм. Цей носій повинен бути «прийнятним» в значенні сумісності з іншими інгредієнтами композиції і не повинен бути шкідливим для пацієнта, який одержує композицію. Як правило, діючий інгредієнт становить 0,05-99,9% по масі від маси складу. У вигляді дозованої лікарської форми сполуку можна вводити один або більше разів на день через відповідні інтервали, однак, в будь-якому випадку залежно від стану пацієнта і відповідно до призначення, зробленого практикуючим медиком. Як правило, одиниця дозованої лікарської форми містить від 0,1 мг до 1000 мг, переважно від 1 мг до 100 мг, наприклад, 5-50 мг сполуки формули (І). Відповідне дозування сполуки за даним винаходом буде залежати, в числі іншого, від віку і стану пацієнта, тяжкості захворювання, що піддається лікуванню, а також інших факторів, добре відомих практикуючому лікарю. Сполуку за даним винаходом можна вводити перорально, парентерально або місцево залежно від різного режиму дозування, наприклад, денного або з тижневими інтервалами. В основному разова доза повинна знаходитися в межах від 0,01 до 400 7 UA 98639 C2 5 10 15 20 25 30 35 40 45 50 55 60 мг/кг маси тіла. Сполуку можна вводити у формі болюсної дози (тобто всю денну дозу вводять за один раз) або у вигляді окремих доз два або більше разів на день. Що стосується місцевого введення, можливо, більш правильно використовувати термін «одиниця застосування», який означає разову дозу, яку можна ввести пацієнту і яка може бути легко оброблена і упакована, зберігаючись при цьому фізично і хімічно стабільною дозувальною одиницею, яка включає або діючу сполуку як таку, або суміш цієї сполуки з твердими або рідкими фармацевтичними розріджувачами або носіями. Термін «одиниця застосування» в зв'язку з місцевим застосуванням означає одиничну, тобто одну, дозу, яка допускає при місцевому введенні пацієнту нанесення на квадратний сантиметр інфікованої поверхні від 0,1 мг до 10 мг і переважно від 0,2 мг до 1 мг діючого інгредієнта, що розглядається. Крім того передбачається, що в певних режимах лікування може виявитися застосовним введення з більш тривалими інтервалами, наприклад, через день, раз на тиждень або навіть з ще більш тривалими інтервалами. Якщо лікування включає введення іншої терапевтично активної сполуки, рекомендується th звернутися за довідкою до Goodman & Gilman's The Pharmacological Basis of Therapeutics, 9 Ed., J.G. Hardman and L.E. Limbird (Eds.), McGraw-Hill 1995, для з'ясування застосовних дозувань вказаних сполук. Введення сполуки за даним винаходом спільно з однією або більше іншими діючими сполуками може здійснюватися або одночасно, або послідовно. Фармацевтичні склади включають, наприклад, склади у формі, придатній для перорального (включаючи склади з відстроченим або довготривалим вивільненням), ректального, парентерального (включаючи підшкірне, інтраперитонеальне, внутрішньом'язове, внутрішньосуглобове і внутрішньовенне), трансдермального, очного, місцевого, шкірного, назального або букального введення. Особливо переважним є місцеве введення заявлених складів. Склади, як правило, можуть бути представлені у вигляді дозованих лікарських форм і їх можна одержувати будь-яким зі способів, добре відомих в фармацевтичній техніці, наприклад, th розкритих в Remington, The Science and Practice of Pharmacy, 20 ed., 2000. Всі методики включають стадію змішування діючого інгредієнта з носієм, який містить один або більше необхідних інгредієнтів. В основному склади одержують шляхом однорідного і ретельного змішування діючих інгредієнтів з рідким носієм або тонкоподрібненим твердим носієм, або носіями обох цих типів і потім, якщо це необхідно, надання продукту бажаної форми. Склади за даним винаходом, придатні для перорального введення, можуть мати форму дискретних одиниць, таких як капсули, саше, таблетки або пастилки, кожна з яких містить передбачену кількість діючого інгредієнта; форму порошку або гранул; форму розчину або суспензії у водній або неводній рідині, наприклад, етанолі або гліцерині; або форму емульсії масло-у-воді або вода-в-маслі. Ці масла можуть бути харчовими оліями, як, наприклад, бавовняною олією, кунжутною олією, кокосовою олією або арахісовою олією. Придатні диспергуючі або суспендуючі засоби для водних суспензій включають синтетичні або натуральні камеді, такі як трагакант, альгінати, гуміарабік, декстран, натрійкарбоксиметилцелюлозу, желатин, метилцелюлозу, гідроксипропілметилцелюлозу, гідроксипропілцелюлозу, карбомери і полівінілпіролідон. Діючі інгредієнти можуть вводитися також у формі болюсів, лікарської кашки або пасти. Таблетка може бути виготовлена пресуванням або формуванням діючого інгредієнта необов'язково з одним або більше додатковими інгредієнтами. Пресовані таблетки можуть бути одержані шляхом пресування у придатній машині для таблетування діючого інгредієнта(ів) в сипкій формі, наприклад, порошку або гранулах, необов'язково змішаного зі зв'язуючими речовинами, як, наприклад, лактозою, глюкозою, крохмалем, желатином, гуміарабіком, смолою трагаканту, альгінатом натрію, карбоксиметилцелюлозою, метилцелюлозою, гідроксипропілметилцелюлозою, поліетиленгліколем, воском або подібними речовинами; мастильними засобами, як, наприклад, олеатом натрію, стеаратом натрію, стеаратом магнію, бензоатом натрію, ацетатом натрію, хлоридом натрію і т. п.; дезінтегруючими засобами, як, наприклад, крохмалем, метилцелюлозою, агаром, бентонітом, кроскармелозою натрію, крохмальгліколятом натрію, кросповідоном і т. п., або дезінтегруючим засобом, як, наприклад, полісорбатом 80. Формовані таблетки можуть бути виготовлені шляхом формування у придатному агрегаті суміші порошкоподібного діючого інгредієнта і придатного носія, змоченого інертним рідким розріджувачем. Склади для ректального введення можуть мати форму супозиторіїв, в яких сполука за даним винаходом змішана з легкоплавкими розчинними або не розчинними у воді твердими 8 UA 98639 C2 5 10 15 20 25 30 35 40 45 50 55 60 речовинами, наприклад, маслом какао, гідрованими рослинними оліями, поліетиленгліколем або ефірами жирних кислот і поліетиленгліколів, тоді як еліксири можуть бути приготовані із застосуванням міристилпальмітату. Склади, придатні для парентерального введення, звичайно включають стерильні масляні або водні препарати діючого інгредієнта, які переважно ізотонічні крові пацієнта, який одержує препарат, наприклад, ізотонічний сольовий розчин, ізотонічний розчин глюкози або буферний розчин. Склад, як правило, можна стерилізувати, наприклад, фільтруванням через фільтр, затримуючий бактерії, додаванням до складу стерилізуючого засобу, опроміненням або нагріванням складу. Ліпосомальні склади, описані, наприклад, в Encyclopedia of Pharmaceutical Technology, vol. 9, 1994, також придатні для парентерального введення. Як альтернатива, сполуки формули (І) можуть входити до складу стерильних твердих препаратів, наприклад, ліофілізованих порошків, які легко розчиняються в стерильному розчиннику безпосередньо перед застосуванням. Трансдермальні склади можуть мати форму пластиру або пов'язки. Склади, придатні для очного введення, можуть мати форму стерильного водного препарату діючого інгредієнта, який може бути присутнім у мікрокристалічній формі, наприклад, у формі водної суспензії мікрокристалів, Ліпосомальні склади або біоруйновні полімерні системи, наприклад, описані в Encyclopedia of Pharmaceutical Technology, vol. 2, 1989, також можуть застосовуватися для одержання препаратів діючих інгредієнтів, призначених для очного введення. Склади, придатні для місцевого або очного введення, включають рідкі або напіврідкі препарати, такі як лініменти, лосьйони, гелі, спреї, піни, емульсії масло-у-воді або вода-в-маслі, такі як креми, мазі або пасти; або ж розчини або суспензії, наприклад, краплі. Композиції для лікування очей переважно можуть додатково містити циклодекстрин. Для місцевого введення, сполуки формули (І), як правило, можуть бути присутніми в кількості від 0,01 до 20% від маси композиції, як, наприклад, від 0,1% до приблизно 10%, але, крім того, вони можуть бути присутнім в кількості до приблизно 50% від маси композиції. Склади, застосовні для назального або букального введення, включають порошки, саморозпилювані склади і спреї, наприклад, аерозолі і розпилювачі. Такі склади детально nd розкриті, наприклад, Modern Pharmaceutics, 2 ed., G.S. Banker and C.T. Rhodes (Eds.), page th 427-432, Marcel Dekker, New York; Modern Pharmaceutics, 3 ed., G.S. Banker and C.T. Rhodes (Eds.), page 618-619 and 718-721, Marcel Dekker, New York and Encyclopedia of Pharmaceutical Technology, vol. 10, J. Swarbrick and J.C. Boylan (Eds), page 191-221, Marcel Dekker, New York. Крім згаданих вище інгредієнтів, фармацевтичні склади сполук формули (І) можуть включати один або більше додаткових інгредієнтів, наприклад, розріджувачів, буферів, смакоароматичних засобів, барвників, ПАР, загусників, консервантів, наприклад, метилгідроксибензоат (включаючи антиоксиданти), емульгуючих засобів і т. п. Якщо діючий інгредієнт вводять у формі солей з фармацевтично прийнятними нетоксичними кислотами або основами, переважними солями є, наприклад, легкорозчинні у воді або незначно розчинні у воді, для досягнення визначеної і придатної швидкості абсорбції. Фармацевтична композиція може додатково включати один або більше інших діючих компонентів, звичайно застосовуваних при лікуванні шкірних захворювань або станів, наприклад, вибраних з групи, що складається з глюкокортикоїдів, вітаміну D і аналогів вітаміну D, антигістамінних засобів, антагоністів фактора активації тромбоцитів (PAF), антихолінергічних засобів, метилксантинів, β-адренергічних засобів, інгібіторів СОХ-2, саліцилатів, індометацину, флуфенамату, напроксену, тимегадину, солей золота, пеніциламіну, засобів для зниження рівнів холестерину в сироватці, ретиноїдів, солей цинку, саліцилазосульфапіридину і інгібіторів кальциневрину. Винахід більш детально описаний в наступних прикладах, які ніяким чином не обмежують заявлений обсяг винаходу. СПОСОБИ ОДЕРЖАННЯ Сполуки за даним винаходом можуть бути одержані рядом способів, добре відомих фахівцям в галузі органічного синтезу. Сполуки формули (І) можуть бути одержані, наприклад, із застосуванням реакцій і методик, описаних нижче, в поєднанні зі способами, відомими в техніці синтетичної органічної хімії, або їх варіантами згідно з оцінкою фахівців в даній галузі. Переважні способи включають, не обмежуючись цим, способи, описані нижче. Реакції проводять в розчинниках, які придатні для застосовуваних реагентів і речовин і придатні для здійснення виконуваних хімічних перетворень. Крім того, потрібно розуміти, що в описаних нижче синтетичних методиках всі запропоновані умови реакцій, включаючи вибір розчинника, атмосферу реакції, температуру реакції, тривалість експерименту і способи обробки реакційної 9 UA 98639 C2 5 10 15 20 суміші, вибрані таким чином, щоб бути стандартними умовами для даної реакції, які повинні бути повністю визнані фахівцем в даній галузі. Не всі сполуки, що належать до даного класу, можуть виявитися сумісними з деякими з умов реакції, які необхідні для деяких з описаних способів. Ці обмеження на замісники, які сумісні з умовами реакції, повинні бути легко зрозумілі фахівцеві в даній галузі техніки, і можуть застосовуватися альтернативні способи. Вихідні речовини є або відомими сполуками, які є в продажу, або їх можна одержати за допомогою звичайних синтетичних методик, добре відомих фахівцеві в даній галузі. Сполуки за даним винаходом або будь-які проміжні сполуки за необхідності можуть бути очищені із застосуванням стандартних методик, добре відомих фахівцеві з синтетичної th органічної хімії, наприклад, методик, описаних в "Purification of Laboratory Chemicals", 5 ed. 2003. Вихідні сполуки є або відомими речовинами, які є в продажу, або їх можна одержати стандартними способами, добре відомими фахівцям в даній галузі. ЗАГАЛЬНІ МЕТОДИКИ, ОДЕРЖАННЯ СПОЛУК І ПРИКЛАДИ 1 Спектри ядерного магнітного резонансу (ЯМР) Н реєстрували при частоті 300 МГц і спектри 13 С-ЯМР - при частоті 75,6 МГц. Значення хімічних зсувів (, в м.ч.) наведені для вказаного розчинника відносно внутрішніх стандартів тетраметилсилану (=0,00), хлороформу (=7,25) 13 або дейтерохлороформу (=76,81 для ЯМР С). Значення хімічного зсуву для мультиплету, або вказаного конкретно (дублет (д), триплет (т), квартет (кв)), або ні (м), надане приблизно для середньої точки, якщо не вказаний діапазон. Скорочення ушир.с вказує на уширений синглет. Застосовані органічні розчинники як правило були безводними. Хроматографію здійснювали на силікагелі Merck silica gel 60 (0,040-0,063 мм). Співвідношення розчинників наведені у вигляді співвідношення об'єм:об'єм, якщо не відмічене інше. У тексті заявки використані наступні скорочення: 25 DCM DMF (ДМФА) DMSO (ДМСО) Et EtOAc h (год) 1 (л) LDA LiHMDS m Me МеОН NMR (ЯМР) ppt RT (к.т.) TsCl THF (ТГФ) v 30 35 дихлорметан N,N'-диметилформамід диметилсульфоксид етил етилацетат година літр діізопропіламід літію гексаметилдисилазид літію мілі метил метанол ядерний магнітний резонанс осад кімнатна температура n-толуолсульфонілхлорид тетрагідрофуран об'єм Препаративна ВЕРХ/МС Препаративну ВЕРХ/МС проводили на системі Dionex APS з двома препаративними насосами Shimadzu PP150 і мас-спектрометром Thermo MSQ Plus. Колонка: Waters XTerra C-18, 150×19 мм, 5 мкм; система розчинників: А=вода (0,1% мурашина кислота) і В=ацетонітрил (0,1% мурашина кислота); швидкість потоку=18 мл/хв.; методика (10 хв.): методика лінійного градієнта, починаючи з 10% В до 100% В протягом 6 хвилин і збереження 100% В протягом ще 2 хвилин. Фракції збирали, основуючись на слідових кількостях відповідних іонів і сигналі PDA (240-400 нм). Аналітична ВЕРХ/МС Методика А: Аналітичну ВЕРХ/МС проводили на системі Dionex APS з аналітичним насосом Р680А і мас-спектрометром Thermo MSQ Plus. Колонка: Waters XTerra С-18, 150×4,6 мм, 5 мкм; система розчинників: А=вода (0,1% мурашина кислота) і В=ацетонітрил (0,1% мурашина кислота); швидкість потоку=1,0 мл/хв.; методика (10 хв.): методика лінійного градієнта, 10 UA 98639 C2 5 10 починаючи з 10% В до 100% В протягом 6,6 хвилин і збереження 100% В протягом ще 1,5 хвилини. Методика В: Аналітичну ВЕРХ/МС проводили на системі, яка складається з Waters 2795 HPLC, мас-спектрометра Micromass ZQ, Waters 996 PDA. Колонка: Waters XTerra C-18, 50×3,0 мм, 5 мкм; система розчинників: А=вода:ацетонітрил 95:5 (0,05% мурашина кислота) і В=ацетонітрил (0,05% мурашина кислота); швидкість потоку=1,0 мл/хв.; методика (8 хв.): методика лінійного градієнта, починаючи з 10% В до 100% В протягом 6,0 хвилин і збереження 100% В протягом 1 хвилини. Загальна методика одержання Сполуки за даним винаходом можуть бути одержані, наприклад, наступними основними способами. Сполуки загальної формули Іа, в яких R 1, R2 і R3 відповідають наданим вище визначенням, можуть бути одержані наступним способом: . 15 20 25 30 35 40 45 Вихідні сполуки формули 1а одержують за стандартними методиками, відомими фахівцям в галузі хімії. 2,3,4-Триметоксибензойну кислоту піддають селективному ди-деметилюванню по положеннях 2- і 3-, використовуючи ВСl3, згідно з роботою Kaisalo et al. Synth. Commun, (1986), 16, 645-48. Подальша реакція цієї сполуки, в якій знятий захист, з чистими (без домішок) кетонами, ефірами енолів, кеталями або сумішами перерахованих реагентів з додатковими каталізаторами, такими як пара-толуолсульфонова кислота або кислоти Льюїса, або без них при температурі від кімнатної до 180 °C з використанням мікрохвильового випромінювання або звичайного нагрівання приводить до одержання сполук 2а. Взаємодія сполук формули 2а з МеІ (або диметилсульфатом) в присутності придатної основи, наприклад, К2СО3, КНСО3 або Et3N, у придатному розчиннику, такому як ДМФА, ацетон, ТГФ або DCM, при температурі від кімнатної до 100 °C приводить до одержання сполук формули 3а. Складний ефір 3а може бути одержаний також за класичною методикою етерифікації з використанням спирту і придатної кислоти, наприклад, H2SO4. Сполуки формули Іа (Х=СН2) одержували конденсацією синтезованого метилового ефіру з літієвими похідними карбаніонів, одержаними із сполук формули А-метил, де А відповідає наданим вище визначенням, і придатної основи, наприклад, LDA або LiHMDS, у придатному розчиннику, такому як ТГФ, при температурах від -78 °C до кімнатної температури. Як альтернатива літієвим похідним карбаніонів можуть застосовуватися реактиви Гріньяра. Сполуки формули Ia (X=NH) одержували взаємодією сполук формули 2а з (СОСl) 2, SOCl2 або РСl5 у придатному розчиннику, наприклад, DCM або толуолі, в присутності або за відсутності каталітичної кількості ДМФА при температурах від 0 °C до 70 °C, що приводило до утворення хлорангідриду відповідної кислоти. Після випарювання розчинника у вакуумі здійснювалася подальша конденсація одержаного хлорангідриду кислоти з азотовмісними аніонами, генерованими додаванням придатної основи, наприклад, NaH, LDA або LiHMDS, у придатному розчиннику, наприклад, ТГФ, при температурах від -78 °C до кімнатної температури до A-NH2, де А відповідає наданому вище визначенню. Сполуки загальної формули Іb, де R1, R2 і R3 відповідають наданому вище визначенню, можуть бути одержані наступним способом: 11 UA 98639 C2 . 5 10 15 20 25 30 35 Етерифікація сполуки 1b з використанням стандартних методик, наприклад, МеОН і H 2SO4, приводить до одержання складного ефіру 2b. Алкілування 2b сполукою 3b (X=Br, I, OTs) в присутності придатної основи, наприклад, К2СО3, у придатному розчиннику, наприклад, ДМСО, при температурах від кімнатної до 120 °C приводить до одержання сполук формули 4b. Сполуку формули Іb (Х=СН2) одержували конденсацією синтезованого метилового ефіру з літієвими похідними карбаніонів, генерованими із сполук формули А-метил, де А відповідає наданому вище визначенню, і придатної основи, наприклад, LDA або LiHMDS, у придатному розчиннику, наприклад, ТГФ, при температурах від -78 °C до кімнатної. Як альтернатива літієвим похідним карбаніонів можуть застосовуватися реактиви Гріньяра. Очікується, що гідроліз складних ефірів в стандартних умовах (кислотних або основних), приведе до утворення карбонової кислоти 7b, яку можна перетворити в хлорангідрид карбонової кислоти і потім ввести в реакцію з азотовмісним аніоном (генерованим з A-NH2), як описано для синтезу Ia (X=NH). Методика синтезу 1 7-метокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол-2,4'-(4H-піран]-4-карбонова кислота (сполука 501) Суспензію 2,3-дигідрокси-4-метоксибензойної кислоти (6,04 г, 32,8 ммоль) в 5,6-дигідро-4метокси-2Н-пірані (20 мл, 152 ммоль) витримували при 140 °C протягом трьох днів. При кімнатній температурі додавали етилацетат (200 мл) і органічну фазу екстрагували насиченим водним розчином NaHCO3 (2×50 мл). Водну фазу промивали Et2O (2×40 мл), підкисляли до рН=1 концентрованою НСl і екстрагували дихлорметаном (2×50 мл). Органічну фазу висушували над MgSO4. Після упарювання при зниженому тиску одержували слідові кількості 2,3-дигідрокси-4-метоксибензойної кислоти поряд з 7-метокси-2',3',5',6'-тетрагідроспіро[1,313 бензодіоксол-2,4'-(4Н)-піран]-4-карбоновою кислотою (1,23 г, 14%). С-ЯМР (ДМСО) 164,9, 148,2, 146,6, 134,5, 123,7, 117,0, 107,1, 106,8, 64,4, 56,0, 35,3. Методика синтезу 2 метил 7-метокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол-2,4'-(4Н)-піран]-4-карбоксилат (сполука 502) 12 UA 98639 C2 5 10 15 Суспензію неочищеної 7-метокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол-2,4'-(4Н)-піран]4-карбонової кислоти (2,17 г, 8,15 ммоль), КНСО3 (2,58 г, 26,0 ммоль) і диметилсульфату (1,58 мл, 16,7 ммоль) в ацетоні (62 мл) перемішували при кімнатній температурі протягом двох днів, після чого випарювали досуха при зниженому тиску. Додавали етилацетат (100 мл). Органічну фазу промивали 0,5 М водним розчином NaOH (6×30 мл) і упарювали досуха при зниженому тиску. Неочищений продукт знову розчиняли в дихлорметані (75 мл), висушували над MgSO 4 і упарювали досуха при зниженому тиску. Стандартна колонкова хроматографія на силікагелі дозволяла одержати метил 7-метокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол-2,4'-(4Н)-піран]13 4-карбоксилат (1,87 г, 79%). С-ЯМР (CDCl3) 164,9, 149,1, 147,2, 135,2, 124,0, 117,5, 107,1, 106,5 65,2, 56,4, 51,8, 35,9. Стандартна методика А Приклад 1 2-(3,5-дихлорпіридин-4-іл)-1-(7-метокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол-2,4'-(4Н)піран]-4-іл)етанон (сполука 101) 20 25 30 Розчин метил 7-метокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол-2,4'-(4Н)-піран]-4карбоксилату (1,80 г, 6,42 ммоль) і 3,5-дихлор-4-піколіну (1,46 г, 8,99 ммоль) в тетрагідрофурані (33 мл) охолоджували до 0 °C. Додавали 1,0 М розчин біс(триметилсиліл)аміду літію в тетрагідрофурані (19,3 мл, 19,3 ммоль) і давали піднятися температурі реакційної суміші до кімнатної протягом ночі. Додавали насичений водний розчин NH 4Cl (70 мл). Водну фазу екстрагували дихлорметаном (3×100 мл). Об'єднані органічні фази промивали водою (50 мл), висушували над MgSO4 і упарювали досуха при зниженому тиску. Стандартна колонкова хроматографія на силікагелі з подальшою перекристалізацією з ізопропанолу дозволяла одержати 2-(3,5-дихлорпіридин-4-іл)-1-(7-метокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол13 2,4'-(4Н)-піран]-4-іл)етанон (1,90 г, 71%). С-ЯМР (ДМСО) 189,1, 148,2, 147,7, 147,0, 141,2, 134,5, 132,8, 122,0, 118,0, 113,0, 107,8, 64,4, 56,3, 43,5, 35,2. Приклад 2 N-(3,5-дихлорпіридин-4-іл)-7-метокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол-2,4'-(4Н)піран]-4-карбоксамід (сполука 102) 35 13 UA 98639 C2 5 10 15 Оксалілхлорид (92 мкл, 1,1 ммоль) і каталітичну кількість N,N-диметилформаміду додавали до суспензії 7-метокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол-2,4'-(4Н)-піран]-4-карбонової кислоти (48 мг, 0,18 ммоль) в дихлорметані (2 мл). Після перемішування протягом однієї години при кімнатній температурі, розчинник видаляли при зниженому тиску і неочищений хлорангідрид кислоти знову розчиняли в тетрагідрофурані (2 мл). Суспензію 3,5-дихлорпіридин4-аміну (67 мг, 0,40 ммоль) і NaH (60% дисперсія в мінеральному маслі, 16 мг, 0,40 ммоль) в тетрагідрофурані (1 мл) перемішували протягом трьох годин при кімнатній температурі і потім при кімнатній температурі по краплях додавали до тетрагідрофуранового розчину, що містить неочищений хлорангідрид кислоти. Після перемішування при кімнатній температурі протягом ночі, реакційну суміш розбавляли діетиловим ефіром (30 мл) і органічну фазу промивали 0,5 М водним розчином NaOH (3×10 мл). Органічну фазу висушували над MgSO 4 і упарювали досуха при зниженому тиску. Стандартне очищення ВЕРХ дозволяло одержати N-(3,5-дихлорпіридин4-іл)-7-метокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол-2,4'-(4Н)-піран]-4-карбоксамід (14 мг, 13 19%). С-ЯМР (ДМСО) 160,8, 148,0, 146,5, 146,2, 141,1, 134,1, 130,5, 122,5, 118,2, 108,3, 107,6, 64,2, 56,2, 35,2. Приклад 3 2-(3,5-дихлор-1-оксидопіридин-4-іл)-1-(7-метокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол2,4'-(4Н)-піран1-4-іл)етанон (сполука 103) 20 25 30 35 40 До розчину 2-(3,5-дихлорпіридин-4-іл)-1-(7-метокси-2',3',5',6'-тетрагідроспіро[1,3бензодіоксол-2,4'-(4Н)-піран]-4-іл)етанону (41 мг, 0,99 ммоль) в дихлорметані (0,5 мл) додавали 30% Н2О2 (25 мкл) і метилтриоксореній(VІІ) (3 мг). Одержану суміш перемішували при кімнатній температурі протягом ночі, додавали МnО2 (3 мг) і перемішували ще протягом години. Додавали воду (10 мл) і водну фазу екстрагували дихлорметаном (3×10 мл). Об'єднані органічні фази висушували над MgSO4 і упарювали досуха при зниженому тиску. Стандартне очищення ВЕРХ приводило до одержання сполуки 103 (8 мг, 19%). РХ/МС (методика В): m/z 426,1; 428,1 (МН+); RT=2,98 хв.; чистота (УФ)=100%. Методика синтезу 3 тетрагідро-3,3-диметокситіофен (сполука 503) Розчин тетрагідротіофен-3-ону (10,0 г, 97,9 ммоль), метилортоформіату (21,4 мл, 196 ммоль) і моногідрату пара-толуолсульфонової кислоти (50 мг, 0,29 ммоль) в сухому метанолі (25 мл) кип'ятили із зворотним холодильником протягом однієї години. Потім додавали 1,0 М розчин NaOMe в метанолі (0,30 мл, 0,30 ммоль) і надлишок метанолу і триметилортоформіату видаляли відгонкою (при атмосферному тиску). Подальша відгонка при зниженому тиску приводила до одержання суміші тетрагідротіофен-3-ону (~0,67 г, 7%) і тетрагідро-3,313 диметокситіофену (~9,8 г, 67%). С-ЯМР (МеОН) 113,01, 50,11, 36,90, 36,11, 27,72. Методика синтезу 4 7-метокси-4',5'-дигідроспіро[1,3-бензодіоксол-2,3'-(2Н)-тіофен]-4-карбонова кислота (сполука 504) 45 14 UA 98639 C2 5 10 п-Толуолсульфонову кислоту (54 мг, 0,28 ммоль) додавали до суміші тетрагідро-3,3диметокситіофену (~9,8 г, 66 ммоль) і тетрагідротіофен-3-ону (~0,67 г, 6,6 ммоль). Масляну баню нагрівали до 145 °C і відганяли приблизно один еквівалент метанолу (2,7 мл, 67 ммоль). Знижували температуру, і в результаті відгонки при зниженому тиску одержували 7,04 г масла, до якого додавали 2,3-дигідрокси-4-метоксибензойну кислоту (1,00 г, 5,43 ммоль). Одержану суспензію нагрівали при дії мікрохвильового випромінювання (180 °C, одна година) в запаяній реакційній посудині. Фільтрування з подальшим стандартним очищенням ВЕРХ приводило до одержання сполуки 504 (164 мг, 11%). РХ/МС (методика В): m/z 267,2 (М-1); RT=2,79 хв.; чистота (УФ)=100%. Методика синтезу 5 метил 7-метокси-4',5'-дигідроспіро[1,3-бензодіоксол-2,3'-(2Н)-тіофен]-4-карбоксилат (сполука 505) 15 20 25 Суспензію 7-метокси-4',5'-дигідроспіро[1,3-бензодіоксол-2,3'-(2Н)-тіофен]-4-карбонової кислоти (161 мг, 0,600 ммоль), К2СО3 (166 мг, 1,20 ммоль) і диметилсульфату (74 мкл, 0,78 ммоль) в ацетоні (1 мл) витримували при 50 °C протягом ночі. При кімнатній температурі додавали воду і екстрагували водну фазу етилацетатом (2×20 мл). Органічну фазу висушували над MgSO4 і упарювали досуха при зниженому тиску. Стандартне очищення ВЕРХ дозволяло 1 одержати сполуку 505 (24 мг, 14%). Н-ЯМР (CDCl3) 7,44 (д, 1Н), 6,56 (д, 1H), 3,94 (с, 3Н), 3,88 (с, 3Н), 3,32 (д, 1H), 3,24 (д, 1Н), 3,05 (т, 2Н), 2,49 (тд, 2Н). Приклад 4 2-(3,5-дихлорпіридин-4-іл)-1-(7-метокси-4',5'-дигідроспіро[1,3-бензодіоксол-2,3'-(2Н)-тіофен]4-іл)етанон (сполука 104) 30 35 Розчин метил 7-метокси-4',5'-дигідроспіро[1,3-бензодіоксол-2,3'-(2Н)-тіофен]-4-карбоксилату (24 мг, 85 мкмоль) і 3,5-дихлор-4-піколіну (21 мг, 0,13 ммоль) в тетрагідрофурані (1 мл) охолоджували до 0 °C. Додавали 1,0 М розчин біс(триметилсиліл)аміду літію в тетрагідрофурані (0,26 мл, 0,26 ммоль) і реакційну суміш залишали нагріватися до кімнатної температури протягом ночі. Додавали насичений водний розчин NH4Cl (10 мл). Водну фазу екстрагували дихлорметаном (3×10 мл). Об'єднані органічні фази промивали водою (20 мл), висушували над MgSO4 і упарювали досуха при зниженому тиску. Стандартне очищення ВЕРХ дозволяло 15 UA 98639 C2 одержати вказану в заголовку сполуку (12 мг, 34%). С-ЯМР (ДМСО) 189,02, 148,09, 147,51, 147,05, 140,98, 134,48, 132,69, 127,57, 122,31, 112,81, 107,81, 56,35, 43,26, 37,54, 36,54, 25,70. Методика синтезу 6 1-ацетил-4,4-диметоксипіперидин (сполука 506) 13 5 10 15 20 25 Розчин 1-ацетил-4-піперидону (17,0 г, 121 ммоль), триметилортоформіату (26,4 мл, 241 ммоль) і моногідрату пара-толуолсульфонової кислоти (80 мг, 0,42 ммоль) в сухому метанолі (34 мл) кип'ятили із зворотним холодильником протягом однієї години. Потім додавали 1,0 М розчин NaOMe в метанолі (0,42 мл, 0,42 ммоль) і надлишок метанолу і триметилортоформіату видаляли відгонкою (при атмосферному тиску). Додаткова відгонка при зниженому тиску 1 дозволила одержати 1-ацетил-4,4-диметоксипіперидин (20,2 г, 89%). Н-ЯМР (ДМСО) 3,453,32 (м, 4Н), 3,10 (с, 6Н), 1,99 (с, 3Н), 1,72-1,62 (м, 2Н), 1,61-1,52 (м, 2Н). Методика синтезу 7 1-ацетил-1,2,3,6-тетрагідро-4-метоксипіридин (сполука 507) До 1-ацетил-4,4-диметоксипіперидину (20,2 г, 108 ммоль) додавали моногідрат паратолуолсульфонової кислоти (80 мг, 0,42 ммоль). Одержану суміш нагрівали до 160 °C і відганяли приблизно один еквівалент метанолу (4,38 мл, 108 ммоль). Знижували температуру і в результаті відгонки при зниженому тиску одержували суміш 1-ацетил-4,4диметоксипіперидину (1,4 г, 7%) і 1-ацетил-1,2,3,6-тетрагідро-4-метоксипіридину (14,2 г, 85%). 1 Н-ЯМР (ДМСО) 4,68-4,62 (м, 1Н), 4,00-3,88 (м, 2Н), 3,59-3,49 (м, 2Н), 3,49-3,45 (м, 3Н), 2,192,12 (м, 1Н), 2,09-2,03 (м, 1Н), 2,03-1,96 (м, 3Н). Методика синтезу 8 7-метоксі-1'-ацетилспіро[1,3-бензодіоксол-2,4'-піперидин]-4-карбонова кислота (сполука 508) 30 35 Суміш 2,3-дигідрокси-4-метоксибензойної кислоти (1,23 г, 6,67 ммоль), 1-ацетил-4,4диметоксипіперидину (1,4 г, 7,6 ммоль) і 1-ацетил-1,2,3,6-тетрагідро-4-метоксипіридину (14,2 г, 91,5 ммоль) нагрівали під дією мікрохвильового випромінювання (180 °C, одна година) в запаяній реакційній посудині. Фільтрування і подальше стандартне очищення ВЕРХ дозволяли одержати сполуку 508 (0,54 г, 26%). РХ/МС (методика В): m/z 308,2 (МН+); RT=2,27 хв.; чистота (УФ)=95%. Методика синтезу 9 метил 7-метоксиспіро[1,3-бензодіоксол-2,4'-піперидин]-4-карбоксилат (сполука 509) 40 16 UA 98639 C2 5 10 15 20 25 30 35 Розчин 7-метоксі-1'-ацетилспіро[1,3-бензодіоксол-2,4'-піперидин]-4-карбонової кислоти (143 мг, 0,467 ммоль) і LiOH (224 мг, 9,34 ммоль) у воді (3 мл) і МеОН (3 мл) нагрівали до 75 °C протягом п'яти годин. При кімнатній температурі суміш нейтралізували 2 М НСl і упарювали досуха при зниженому тиску. Неочищену 7-метоксиспіро[1,3-бензодіоксол-2,4'-піперидин]-4карбонову кислоту [РХ/МС (методика В): m/z 266,2 (МН+); RT=1,57 хв.; чистота (УФ)=82%] кип'ятили із зворотним холодильником протягом ночі в 1,7 М розчині НСl в метанолі (5 мл). При кімнатній температурі додавали воду (20 мл). Водну фазу промивали Et 2O (10 мл), підлуговували додаванням Na2CO3 і екстрагували дихлорметаном (3×10 мл). Органічну фазу висушували над MgSO4 і після упарювання при зниженому тиску одержували метил 71 метоксиспіро[1,3-бензодіоксол-2,4'-піперидин]-4-карбоксилат (75 мг, 57%). H-ЯМР (ДМСО) 7,31 (д, 1Н), 8,72 (д, 1Н), 3,87 (с, 3Н), 3,78 (с, 3Н), 2,96-2,77 (м, 4Н), 1,94-1,83 (м, 4Н). Приклад 5 2-(3,5-дихлорпіридин-4-іл)-1-(7-метоксиспіро[1,3-бензодіоксол-2,4'-піперидин1-4-іл)етанон (сполука 105) Розчин метил 7-метоксиспіро[1,3-бензодіоксол-2,4'-піперидин]-4-карбоксилату (75 мг, 0,268 моль) і 3,5-дихлор-4-піколіну (65 мг, 0,40 ммоль) в тетрагідрофурані (2,5 мл) охолоджували до 0 °C. Додавали 1,0 М розчин біс(триметилсиліл)аміду літію в тетрагідрофурані (0,80 мл, 0,80 ммоль) і температурі реакційної суміші давали піднятися до кімнатної протягом ночі. Додавали насичений водний розчин NH4Cl (10 мл). Водну фазу екстрагували дихлорметаном (3×10 мл). Об'єднані органічні фази висушували над MgSO4 і упарювали досуха при зниженому тиску. 1 Стандартне очищення ВЕРХ дозволяло одержати сполуку 105 (58 мг, 53%). H-ЯМР (ДМСО) 8,66 (с, 2Н), 7,38-7,36 (м, 1H), 6,83-6,80 (м, 1Н), 4,62 (с, 2Н), 3,91 (с, 3Н), 3,02-2,91 (м, 4Н), 2,121,93 (м, 4Н). Приклад 6 2-(3,5-дихлорпіридин-4-іл)-1-(7-метокси-1'-[метоксикарбоніл]спіро[1,3-бензодіоксол-2,4'піперидин]-4-іл)етанон (сполука 106) Розчин 2-(3,5-дихлорпіридин-4-іл)-1-(7-метоксиспіро[1,3-бензодіоксол-2,4'-піперидин]-4іл)етанону (10 мг, 24 мкмоль), триетиламіну (24 мкл, 171 мкмоль) і метилхлорформіату (10 мкл, 122 мкмоль) в дихлорметані (200 мкл) витримували при кімнатній температурі протягом ночі. 17 UA 98639 C2 5 Додавали воду (500 мкл) і водну фазу екстрагували дихлорметаном (3×500 мкл). Органічну фазу висушували над MgSO4 і упарювали досуха при зниженому тиску. Стандартне очищення 1 ВЕРХ дозволяло одержати сполуку 106 (2,5 мг, 22%). Н-ЯМР (ДМСО) 8,65 (с, 2Н), 7,39 (д, 1Н), 6,84 (д, 1Н), 4,62 (с, 2Н), 3,91 (с, 3Н), 3,80-3,66 (м, 2Н), 3,62 (с, 3Н), 3,58-3,46 (м, 2Н) 2,181,97 (м, 4Н). Приклад 7 2-(3,5-дихлорпіридин-4-іл)-1-(7-метокси-1'-[метилсульфоніл]спіро[1,3-бензодіоксол-2,4'піперидин]-4-іл)етанон (сполука 107) 10 15 20 Розчин 2-(3,5-дихлорпіридин-4-іл)-1-(7-метоксиспіро[1,3-бензодіоксол-2,4'-піперидин]-4іл)етанону (10 мг, 24 мкмоль), триетиламіну (24 мкл, 171 мкмоль) і мезилхлориду (10 мкл, 122 мкмоль) в дихлорметані (200 мкл) витримували при кімнатній температурі протягом ночі. Додавали воду (500 мкл) і водну фазу екстрагували дихлорметаном (3×500 мкл). Органічну фазу висушували над MgSO4 і упарювали досуха при зниженому тиску. Стандартне очищення 1 ВЕРХ дозволяло одержати сполуку 107 (1,8 мг, 15%). Н-ЯМР (ДМСО) 8,66 (с, 2Н), 7,45-7,38 (м, 1H), 6,88-6,81 (м, 1H), 4,62 (с, 2Н), 3,92 (с, 3Н), 3,50-3,36 (м, 4Н), 2,98 (с, 3Н), 2,29-2,11 (м, 4Н). Приклад 8 2-(3,5-дихлорпіридин-4-іл)-1-(7-метоксі-1'-ацетилспіро[1,3-бензодіоксол-2,4'-піперидин]-4іл)етанон (сполука 108) 25 30 35 Розчин 2-(3,5-дихлорпіридин-4-іл)-1-(7-метоксиспіро[1,3-бензодіоксол-2,4'-піперидин]-4іл)етанону (10 мг, 24 мкмоль), триетиламіну (24 мкл, 171 мкмоль) і оцтового ангідриду (12 мкл, 122 мкмоль) в дихлорметані (200 мкл) витримували при кімнатній температурі протягом ночі. Додавали воду (500 мкл) і водну фазу екстрагували дихлорметаном (3×500 мкл). Органічну фазу висушували над MgSO4 і упарювали досуха при зниженому тиску. Стандартне очищення 1 ВЕРХ дозволяло одержати сполуку 108 (7,2 мг, 65%). Н-ЯМР (ДМСО) 8,66 (с, 2Н), 7,40 (д, 1Н), 6,84 (д, 1H), 4,63 (с, 2Н), 3,92 (с, 3Н), 3,90-3,84 (м, 1Н), 3,75-3,68 (м, 1Н), 3,64-3,58 (м, 1Н), 3,55-3,49 (м, 1H), 2,21-2,15 (м, 1H), 2,15-2,05 (м, 5Н), 2,01-1,94 (м, 1Н). Методика синтезу 10 4,4-диметокситетрагідро-(4H-тіопіран (сполука 510) 18 UA 98639 C2 5 10 15 20 25 30 35 40 45 Суміш тетрагідро-(4Н)-тіопіран-4-ону (15,0 г, 129 ммоль), триметилортоформіату (28,3 мл, 258 ммоль) і моногідрату пара-толуолсульфонової кислоти (67 мг, 0,35 ммоль) в метанолі (40 мл) кип'ятили із зворотним холодильником протягом 1 години. Реакційну суміш охолоджували до кімнатної температури, додавали 1 М NaOMe (0,35 мл, 0,35 ммоль), і надлишок метанолу і триметилортоформіату видаляли відгонкою (при атмосферному тиску). Додаткова відгонка при 1 зниженому тиску дозволяла одержати 4,4-диметокситетрагідро-(4Н)-тіопіран (20,7 г, 99%). НЯМР (ДМСО) 3,07 (с, 6Н), 2,56 (м, 4Н), 1,84 (м, 4Н). Методика синтезу 11 7-метокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол-2,4'-(4Н)-тіопіран]-4-карбонова кислота (сполука 511) п-Толуолсульфонову кислоту (97 мг, 0,51 ммоль) додавали до 4,4-диметокситетрагідро(4Н)-тіопірану (20,7 г, 128 ммоль), суміш нагрівали до 145 °C і витримували при цій температурі до відгонки приблизно одного еквівалента метанолу (5,17 мл, 128 ммоль). Потім суміш охолоджували до 130 °C і в результаті відгонки при зниженому тиску одержували 10,1 г суміші 1 5:3 5,6-дигідро-4-метокси-(2Н)-тіопірану [ Н-ЯМР (ДМСО) 4,87 (м, 1Н), 3,44 (с, 3Н), 3,15 (дт, 2Н), 2,72 (т, 2Н), 2,22 (м, 2Н)] і 4,4-диметокситетрагідро-(4Н)-тіопірану. Без додаткового очищення цю суміш додавали до 2,3-дигідрокси-4-метоксибензойної кислоти (2,00 г, 10,9 ммоль) і суспензію нагрівали дією мікрохвильового випромінювання (180 °C, одна година) в запаяній реакційній посудині. Додавали етилацетат (100 мл) і органічну фазу, по-перше, промивали 0,5 М НСl (40 мл), і потім екстрагували насиченим водним розчином NaHCO 3 (2×30 мл). Водну фазу промивали Et2O (2×40 мл), підкисляли до рН=1 концентрованою НСl і екстрагували дихлорметаном (2×30 мл). Органічну фазу висушували над MgSO4. Упарювання при зниженому тиску приводило до одержання 7-метокси-2',3',5',6'-тетрагідроспіро[1,313 бензодіоксол-2,4'-(4Н)-тіопіран]-4-карбонової кислоти (1,86 г, 61%). С-ЯМР (ДМСО) 164,9, 148,2, 146,6, 134,5, 123,8, 118,0, 107,2, 106,9, 56,1, 35,9, 25,4. Методика синтезу 12 метил 7-метокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол-2,4'-(4H-тіопіран]-4-карбоксилат (сполука 512) Суспензію 7-метокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол-2,4'-(4Н)-тіопіран]-4карбонової кислоти (570 мг, 2,02 ммоль), К2СО3 (558 мг, 4,04 ммоль) і диметилсульфату (0,25 мл, 2,62 ммоль) в ацетоні (14 мл) перемішували при 50 °C протягом ночі. При кімнатній температурі додавали воду (30 мл). Водну фазу екстрагували дихлорметаном (3×15 мл). Об'єднані органічні фази висушували над MgSO4 і упарювали досуха при зниженому тиску. Стандартна колонкова хроматографія на силікагелі дозволяла одержати метил 7-метокси13 2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол-2,4'-(4Н)-тіопіран]-4-карбоксилат (407 мг, 68%). СЯМР (ДМСО) 163,8, 148,1, 146,9, 134,6, 123,4, 118,3, 107,1, 105,9, 56,1, 51,6, 35,9,25,4. Приклад 9 2-(3,5-дихлорпіридин-4-іл)-1-(7-метокси-2',3',5',6'-тетрагідроспіро[1,3-6ензодіоксол-2,4'-(4Н)тіопіран]-4-іл)етанон (сполука 110) 19 UA 98639 C2 5 10 15 Розчин метил 7-метокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол-2,4'-(4Н)-тіопіран]-4карбоксилату (40 мг, 0,14 ммоль) і 3,5-дихлор-4-піколіну (33 мг, 0,20 ммоль) в тетрагідрофурані (1,1 мл) охолоджували до 0 °C. Додавали 1,0 М розчин біс(триметилсиліл)аміду літію в тетрагідрофурані (0,41 мл, 0,41 ммоль), і реакційній суміші давали нагрітися до кімнатної температури протягом ночі. Додавали насичений водний розчин NH 4Cl (20 мл). Водну фазу екстрагували дихлорметаном (3×15 мл). Об'єднані органічні фази висушували над MgSO 4 і упарювали досуха при зниженому тиску. Стандартне очищення ВЕРХ дозволяло одержати 2(3,5-дихлорпіридин-4-іл)-1-(7-метокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол-2,4'-(4Н)13 тіопіран]-4-іл)етанон (38 мг, 67%). С-ЯМР (ДМСО) 189,1, 148,2, 147,7, 147,0, 141,3, 134,5, 132,8, 122,0, 119,1, 113,0, 107,9, 56,3, 43,6, 35,9, 25,5. Приклад 10 2-(3,5-дихлорпіридин-4-іл)-1-(7-метокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол-2,4'-(4H)тіопіран-1'-оксид]-4-ил)етанон (сполука 111) 30 До розчину 2-(3,5-дихлорпіридин-4-іл)-1-(7-метокси-2',3',5',6'-тетрагідроспіро[1,3бензодіоксол-2,4'-(4Н)-тіопіран]-4-іл)етанону (17 мг, 40 мкмоль) в дихлорметані (0,5 мл) додавали, по-перше, 0,25 М розчин Н2О2 в етанолі (128 мкл, 32 мкмоль) і, по-друге, метилтриоксореній(VII) (1 мг, 4 мкмоль). Суміш перемішували при кімнатній температурі протягом двох днів і випарювали досуха при зниженому тиску. Стандартне очищення ВЕРХ дозволяло одержати 2-(3,5-дихлорпіридин-4-іл)-1-(7-метокси-2',3',5',6'-тетрагідроспіро[1,31 бензодіоксол-2,4'-(4Н)-тіопіран-1'-оксид]-4-ил)етанон (7 мг, 40%). Н-ЯМР (ДМСО) 8,66 (с, 2Н), 7,42 (д, 1Н), 6,85 (д, 1Н), 4,63 (с, 2Н), 3,93 (с, 3Н), 3,17-2,94 (м, 4Н), 2,69-2,55 (м, 2Н), 2,36-2,24 (м, 2Н). Приклад 11 2-(3,5-дихлорпіридин-4-іл)-1-(7-метокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол-2,4'-(4Н)тіопіран-1',1'-діоксид]-4-ил)етанон (сполука 112) 35 До розчину 2-(3,5-дихлорпіридин-4-іл)-1-(7-метокси-2',3',5',6'-тетрагідроспіро[1,3бензодіоксол-2,4'-(4Н)-тіопіран]-4-іл)етанону (11 мг, 26 мкмоль) в дихлорметані (0,25 мл) 20 25 20 UA 98639 C2 5 10 15 20 25 30 35 додавали мета-хлорпербензойну кислоту (10 мг, 58 мкмоль) і реакційну суміш перемішували при кімнатній температурі протягом ночі. Додавали насичений водний розчин NаНСО 3 (1 мл) і водну фазу екстрагували дихлорметаном (2×2 мл). Об'єднані органічні фази висушували над MgSO4 і упарювали досуха при зниженому тиску. Стандартне очищення ВЕРХ дозволяло одержати 2-(3,5-дихлорпіридин-4-іл)-1-(7-метокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол1 2,4'-(4Н)-тіопіран-1',1'-діоксид]-4-ил)етанон (5 мг, 42%). Н-ЯМР (CDCl3) 8,52 (с, 2Н), 7,55 (д, 1Н), 6,68 (д, 1Н), 4,55 (с, 2Н), 3,99 (с, 3Н), 3,45-3,37 (м, 2Н), 3,33-3,25 (м, 2Н), 2,79-2,66 (м, 4Н). Приклад 12 2-(3,5-дихлор-1-оксидопіридин-4-іл)-1-(7-метокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол2,4'-(4Н)-тіопіран-1',1'-діоксид]-4-ил)етанон (сполука 113) До розчину 2-(3,5-дихлорпіридин-4-іл)-1-(7-метокси-2',3',5',6'-тетрагідроспіро[1,3бензодіоксол-2,4'-(4Н)-тіопіран]-4-іл)етанону (10 мг, 23 мкмоль) в абсолютному етанолі (2 мл), по-перше, додавали Н2О2 (100 мкл, 0,97 ммоль) і потім, по-друге, метилтриоксореній(VII) (2 мг, 8 мкмоль). Одержану суміш перемішували при 40 °C протягом ночі і потім додавали 5% мас/об'єм водний розчин NaHSO3 (10 мл). Водну фазу екстрагували дихлорметаном (3×20 мл). Об'єднані органічні фази висушували над MgSO4 і упарювали досуха при зниженому тиску. Стандартне очищення ВЕРХ дозволяло одержати 2-(3,5-дихлор-1-оксидопіридин-4-іл)-1-(7-метокси-2',3',5',6'1 тетрагідроспіро[1,3-бензодіоксол-2,4'-(4Н)-тіопіран-1',1'-діоксид]-4-ил)етанон (2,5 мг, 23%). НЯМР (ДМСО) 8,64 (с, 2Н), 7,42 (д, 1H), 6,85 (д, 1Н), 4,59 (с, 2Н), 3,92 (с, 3Н), 3,51 (м, 2Н), 3,31 (м, 2Н), 2,59 (м, 4Н). Загальна методика А LiHMDS (1 M в ТГФ, 3,0 екв.) по краплях додавали до льодяного розчину складного ефіру 512 (1 екв.) і сполуки формули А-метил (1,3 екв.) в безводному ТГФ. Реакційну суміш перемішували при к.т. протягом 12 годин, додавали Н 2О (10 мл) і насичений водний розчин NH4Cl (20 мл), і потім екстрагували EtOAc (3×50 мл). Об'єднані органічні фази висушували (Na2SO4), фільтрували і концентрували при зниженому тиску. Одержаний залишок очищали колонковою флеш-хроматографією, одержуючи кетон. Приклад 13 2-(3-бромпіридин-4-іл)-1-(7-метокси-2',3',5',6'-тетрагідроспіро['1,3-бензодіоксол-2,4'-(4Hтіопіран]-4-іл)етанон (сполука 114) Вказану в заголовку сполуку одержували згідно із загальною методикою А, використовуючи 18 мг 4-бром-3-метилпіридину (вихід: 40%) 21 UA 98639 C2 5 РХ/МС (методика В): m/z 436,2 (МН+); RT=4,17 хв.; чистота (УФ)=100%. Приклад 14 2-(3-бромпіразин-2-іл)-1-(7-метокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол-2,4'-(4Н)тіопіран]-4-іл)етанон (сполука 115) Вказану в заголовку сполуку одержували згідно із загальною методикою А, використовуючи 17 мг 2-бром-3-метилпіразину (вихід: 9%) 10 15 РХ/МС (методика В): m/z 437,2; 439,22 (МН+); RT=4,22 хв.; чистота (УФ)=100%. Приклад 15 2-(піразин-2-іл)-1-(7-метокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол-2-4'-(4Н)-тіопіран]-4іл)етанон (сполука 116) Вказану в заголовку сполуку одержували згідно із загальною методикою А, використовуючи 16 мг 2-метилпіразину (вихід: 52%) 20 25 РХ/МС (методика В): m/z 359,3 (МН+); RT=3,33 хв.; чистота (УФ)=100%. Приклад 16 2-(піридин-4-іл)-1-(7-метокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол-2,4'-(4H-тіопіран]-4іл)етанон (сполука 117) Вказану в заголовку сполуку одержували згідно із загальною методикою А, використовуючи 18 мг 4-метилпіридину (вихід: 13%) 22 UA 98639 C2 5 РХ/МС (методика В): m/z 358,3 (МН+); RT=2,50 хв; чистота (УФ)=100%. Приклад 17 2-(хінолін-4-іл)-1-(7-метокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол-2,4'-(4Н)-тіопіран]-4іл)етанон (сполука 118) Вказану в заголовку сполуку одержували згідно із загальною методикою А, використовуючи 16 мг 4-метилхіноліну (вихід: 12%) 10 15 РХ/МС (методика В): m/z 408,3 (МН+); RT=3,33 хв.; чистота (УФ)=100%. Приклад 18 2-(2,6-дихлорфеніл)-1-(7-метокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол-2,4'-(4Н)тіопіран]-4-іл)етанон (сполука 119) Вказану в заголовку сполуку одержували згідно із загальною методикою А, використовуючи 15 мг 2,6-дихлортолуолу (вихід: 8%) 20 РХ/МС (методика В): m/z 425,24 (МН+); RT=5,28 хв.; чистота (УФ)=100%. Приклад 19 2-(2-хлорфеніл)-1-(7-метокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол-2,4'-(4Н)-тіопіран]-4іл)етанон (сполука 120) 25 23 UA 98639 C2 5 10 Розчин метил 7-метокси-2',3',5',6'-тетрагідроспіро[1,3-бензодіоксол-2,4'-(4Н)-тіопіран]-4карбоксилату (14 мг) в сухому ТГФ (500 мл) охолоджували до 0 °C в атмосфері Аr. Додавали розчин 2-хлорбензилмагнійхлориду в діетиловому ефірі (0,25 М розчин, 189 мкл) і припиняли охолоджування. Через 2 години при кімнатній температурі додавали додаткову порцію 2хлорбензилмагнійхлориду в діетиловому ефірі (0,25 М розчин, 189 мкл). Суміш перемішували протягом 18 годин, додавали воду і екстрагували етилацетатом. Об'єднані органічні фази висушували над MgSO4 і упарювали досуха при зниженому тиску. Стандартне очищення ВЕРХ дозволяло одержати сполуку 120 (9,2%). РХ/МС (методика В): m/z 391,22 (МН+); RT=4,90 хв.; чистота (УФ)=100%. Методика синтезу 13 метил 2,3-дигідрокси-4-метоксибензоат (сполука 513) 15 20 25 30 35 Розчин комерційно доступної 2,3-дигідрокси-4-метоксибензойної кислоти (11,6 г, 63 ммоль) в безводному МеОН (150 мл) охолоджували на льодяній бані і по краплях додавали концентровану H2SO4 (8 мл). Реакційну суміш кип'ятили із зворотним холодильником протягом 12 годин, потім охолоджували до кімнатної температури і видаляли розчинник при зниженому тиску. Додавали Н2О (100 мл) і насичений водний розчин NaHCO 3 (50 мл) і екстрагували EtOAc (3×100 мл). Об'єднані органічні фази висушували (Na 2SO4), фільтрували і концентрували у вакуумі, одержуючи сполуку 513 у вигляді блідо-жовтої твердої речовини, яку застосовували в 1 наступній стадії без додаткового очищення. РХ-МС: RT=2,31 хв; m/z 197,3 (М-Н)ˉ. Н-ЯМР (CDCl3) 10,83 (1Н, с), 7,41 (1H, д, J=9,0), 6,50 (1Н, д, J=8,9), 5,45 (1Н, с), 3,94 (3Н, с), 3,93 (3Н, с). Загальна методика В До перемішуваного розчину сполук 513 і 3b (1,1 екв.) в безводному ДМСО додавали К 2СО3 (2,5 екв.) і суміш перемішували при 100 °C протягом 4-12 годин в атмосфері інертного газу. Після охолоджування до кімнатної температури додавали суміш води і льоду, перемішували протягом 15 хвилин і потім екстрагували EtOAc (3×50 мл). Об'єднані органічні фази висушували (Na2SO4), фільтрували і концентрували при зниженому тиску. Одержаний залишок очищали колонковою флеш-хроматографією. Із застосуванням загальної методики В були одержані наступні сполуки: Методика синтезу 14 метиловий ефір 9-метоксиспіро[2Н-1,5-бензодіоксепін-3(4Н),3'-оксетан]-6-карбонової кислоти (сполука 514) 40 45 Діалкілування сполуки 513 (198 мг, 1 ммоль) комерційно доступним 3,3біс(йодметил)оксетаном (372 мг, 1,1 ммоль) в ДМСО (5 мл) в присутності К 2СО3 (345 мг, 2,5 ммоль), виконане відповідно до загальної методики, дозволяло одержати сполуку 514 у вигляді 24 UA 98639 C2 5 білої твердої речовини після очищення колонковою хроматографією (50-65% EtOAc в + 1 петролейному ефірі). РХ-МС: RT=2,40 хв.; m/z 281,26 (М+Н) . Н-ЯМР (CDCl3) 7,49 (1Н, д, J=8,8), 6,62 (1Н, д, J=8,8), 4,61 (2Н, д, J=6,8), 4,58 (2Н, д, J=6,8), 4,48 (4Н, с), 3,90 (3Н, с), 3,87 (3Н, с). Методика синтезу 15 метиловий ефір 9-метоксиспіро[2Н-1,5-бензодіоксепін-3(4Н),3'-тіетан]-6-карбонової кислоти (сполука 516) 10 15 20 3,3-Біс(бромметил)тіетан 515 одержували за двостадійною методикою з 1,3-дибром-2,2біс(бромметил)пропану, додержуючись описаного в літературі способу (Petrukhina, M.A.; Henck, С; Li, В.; Block, E.; Jin, J.; Zhang, S.Z.; Clerac, R. Inorg. Chem. 2005, 44, 77-84). Відповідно, суміш 1,3-дибром-2,2-біс(бромметил)пропану (7,76 г, 20 ммоль) і KSAc (2,28 г, 20 ммоль) в безводному ТГФ (30 мл) кип'ятили із зворотним холодильником протягом 30 годин. Осад відділяли фільтруванням, фільтрат концентрували і одержаний залишок очищали колонковою флеш-хроматографією (10-25% EtOAc в петролейному ефірі), одержуючи (2,2-(бісбромметил)3-бромпропіловий)ефір тіооцтової кислоти у вигляді блідо-жовтої твердої речовини. Суміш (2,2(бісбромметил)-3-бромпропілового)ефіру тіооцтової кислоти (1,53 г, 4 ммоль) і NaOMe (324 мг, 6 ммоль) в безводному МеОН (10 мл) перемішували при 0 °C протягом 2 годин. МеОН видаляли у вакуумі, випарюючи спільно з толуолом (2,2 мл), і одержаний залишок фільтрували через тонкий шар силікагелю, одержуючи 3,3-біс(бромметил)тіетан 515 у вигляді густого масла, яке використовували без додаткового очищення. 25 30 35 Діалкілування сполуки 513 (665 мг, 3,36 ммоль) сполукою 515 (962 мг, 3,7 ммоль) в ДМСО (15 мл) в присутності К2СО3 (1,16 г, 8,4 ммоль), виконане відповідно до загальної методики, дозволяло одержати сполуку 516 у вигляді білої твердої речовини після очищення колонковою + хроматографією (40-60% EtOAc в петролейному ефірі). РХ-МС: RT=3,17 хв.; m/z 297,19 (М+Н) . 1 Н-ЯМР (CDCl3) 7,49 (1H, д, J=8,8), 6,63 (1H, д, J=8,8), 4,30 (2Н, с), 4,28 (2Н, с), 3,90 (3Н, с), 3,87 (3Н, с), 3,11 (4Н, с). Методика синтезу 16 метиловий ефір 9-метоксиспіро[2Н-1,5-бензодіоксепін-3(4Н),2'-(1,3-діоксолан)]-6-карбонової кислоти (сполука 518) 25 UA 98639 C2 5 2,2-Біс(бромметил)-1,3-діоксолан 517 одержували з дибромацетону за описаною в літературі методикою (Valentin, M.L.; Bolte, J. Bull. Soc. Chim. Fr., 1995, 132, 1167-71). Відповідно до методики розчин дибромацетону (4,04 г, 18,7 ммоль), етиленгліколю (2,32 г, 37,4 ммоль) і nTsOH (25 мг) в бензолі (70 мл) кип'ятили протягом 12 годин з азеотропною відгонкою води. Реакційну суміш концентрували при зниженому тиску, додавали Et 2O (50 мл) і органічний шар промивали Н2О (2×50 мл), висушували (Na2SO4), фільтрували і концентрували при зниженому тиску. Одержаний залишок очищали колонковою флеш-хроматографією (7-10 EtOAc в петролейному ефірі), одержуючи 2,2-біс(бромметил)-1,3-діоксолан (517) у вигляді безбарвної рідини. 1015 20 25 30 35 Діалкілування сполуки 513 (396 мг, 2 ммоль) сполукою 517 (572 мг, 2,2 ммоль) в ДМСО (10 мл) в присутності К2СО3 (690 мг, 5 ммоль), виконане відповідно до загальної методики, дозволяло одержати сполуку 518 у вигляді білої твердої речовини після очищення колонковою + хроматографією (40-60% EtOAc в петролейному ефірі). РХ-МС: RT=2,70 хв.; m/z 297,18 (М+Н) , + 1 319,16 (M+Na) . Н-ЯМР (ДМСО-d6) 7,34 (1Н, д, J=8,8), 6,76 (1Н, д, J=8,8), 4,11 (2Н, с), 4,09 (2Н, с), 3,94 (4Н, с), 3,80 (3Н, с), 3,75 (3Н, с). Методика синтезу 17 метиловий ефір 9-метоксиспіро[2Н-1,5-бензодіоксепін-3(4H,4'тетрагідропіран]-6-карбонової кислоти (сполука 520) 4,4-Біс(п-толуолсульфонілоксиметил)тетрагідропіран (519) одержували за двостадійною методикою з наявного в продажу диметилового ефіру тетрагідропіран-4,4-дикарбонової кислоти. Відповідно до методики до льодяного розчину вказаного діефіру (3,03 г, 15 ммоль) в безводному толуолі (45 мл) додавали по краплях Synhydride (70% в толуолі, 19,5 мл, 66 ммоль) і одержану суміш перемішували при 120 °C протягом 3 годин. Суміш охолоджували до кімнатної температури, повільно додавали Н2О (50 мл) і концентрували над силікагелем (35 г). Швидка колонкова хроматографія з лінійним градієнтом МеОН в СН2Сl2 дозволяла одержати 4,4(бисгідроксиметил)тетрагідропіран у вигляді білої твердої речовини. Суміш діолу (1,46 г, 10 ммоль) і TsCl (4,77 г, 25 ммоль) в безводному піридині (25 мл) перемішували при кімнатній температурі протягом 48 годин. Розчинник видаляли у вакуумі і здійснювали спільне випарювання в толуолі (3×10 мл). Додавали СН2Сl2 (100 мл) і насичений водний розчин NaHCO3 (100 мл), розділяли фази і органічну фазу висушували (Na 2SO4), фільтрували і концентрували при зниженому тиску. Одержаний залишок очищали флеш-хроматографією (35-45% EtOAc в петролейному ефірі), одержуючи 4,4-біс(п-толуолсульфонілоксиметил)тетрагідропіран (519) у вигляді білої твердої речовини. 40 26 UA 98639 C2 5 10 15 20 25 30 Діалкілування сполуки 513 (95 мг, 0,48 ммоль) сполукою 519 (240 мг, 0,53 ммоль) в ДМСО (3 мл) в присутності К2СО3 (166 мг, 1,2 ммоль), виконане відповідно до загальної методики, дозволяло одержати сполуку 520 у вигляді білої твердої речовини після очищення колонковою 1 хроматографією (45-65% EtOAc в петролейному ефірі). РХ-МС: RT=2,40 хв.; Н-ЯМР (ДМСО-d6) 7,34 (1Н, д, J=8,8), 6,78 (1Н, д, J=8,8), 3,99 (4Н, с), 3,80 (3Н, с), 3,76 (3Н, с), 3,61 (4Н, т, J=5,5), 1,54 (4Н, т, J=5,5). Методика синтезу 18 метиловий ефір 9-метокси-2',2'-диметилспіро[2Н-1,5-бензодіоксепін-3(4Н),5'[1,3]діоксан]-6карбонової кислоти (сполука 522) Розчин 2,2-біс(бромметил)-1,3-пропандіолу (5,0 г, 19,1 ммоль), безводного ацетону (20 мл) і n-TsOH (100 мг) в бензолі (75 мл) кип'ятили із зворотним холодильником протягом 12 годин з азеотропною відгонкою води. Реакційну суміш концентрували при зниженому тиску, додавали EtOAc (100 мл), і органічний шар послідовно промивали Н2О (3×30 мл) і насиченим розчином солі (30 мл), висушували (Na2SO4), фільтрували і концентрували при зниженому тиску. Одержану білу речовину розтирали з н-пентаном (20 мл), одержуючи 5,5-біс(бромметил)-2,2диметил-[1,3]діоксан (521) у вигляді безбарвних кристалів. Діалкілування сполуки 513 (1,19 г, 6 ммоль) сполукою 521 (2,0 г, 6,62 ммоль) в ДМСО (30 мл) в присутності К2СО3 (2,07 г, 15 ммоль), виконане відповідно до загальної методики, дозволяло одержати сполуку 522 у вигляді білої твердої речовини після очищення колонковою + хроматографією (30-40% EtOAc в петролейному ефірі). РХ-МС: RT=2,99 хв.; m/z 339,31 (М+Н) , + 1 361,25 (M+Na) . Н-ЯМР (CDCl3) 7,45 (1Н, д, J=8,8), 6,59 (1Н, д, J=8,8), 4,22 (2Н, с), 4,18 (2H, с), 3,89 (3Н, с), 3,86 (7Н, с), 1,43 (6Н, с). Методика синтезу 19 метиловий ефір 9-метоксиспіро[2Н-1,5-бензодіоксепін-3(4Н),5'[1,3]діоксан]-6-карбонової кислоти (сполука 524) 27 UA 98639 C2 5 10 5,5-Біс(бромметил)-[1,3]діоксан (523) одержували з 2,2-біс(бромметил)-1,3-пропандіолу, додержуючись відомої з літератури методики (Bitha, P.; Carvajal, S.G.; Citarella, R.V.; Delos Santos, E.F.; Durr, F.E.; Hlavka, J.J.; Lang, S.A., Jr.; Lindsay, H.L.; Thomas, J.P.; Wallace, R.E.; Yang-I, L. J. Med. Chem. 1989, 32(9), 2063-7 and Mitkin, O.D.; Wan, Y.; Kurchan, A.N.; Kutateladze, A.G. Synthesis, 2001 (8), 1133-42). Відповідно до методики, розчин 2,2-біс(бромметил)-1,3пропандіолу (2,5 г, 9,55 ммоль), формальдегіду (37% водний розчин, 3,5 мл) і концентрованої НСl (2,0 мл) кип'ятили із зворотним холодильником протягом 12 годин. Після охолоджування до к.т. до реакційної суміші додавали Н2О (25 мл) і екстрагували СН 2Сl2 (2×25 мл). Об'єднаний органічний шар послідовно промивали насиченим водним розчином Na 2CO3 (25 мл) і Н2О (25 мл), висушували (Na2SO4), фільтрували і концентрували при зниженому тиску. За допомогою 1 Н-ЯМР було встановлено, що одержана рідина має чистоту >95%, і її використовували без подальшого очищення. 15 20 25 30 35 40 Діалкілування сполуки 513 (198 мг, 1 ммоль) сполукою 523 (301 мг, 1,1 ммоль) в ДМСО (5 мл) в присутності К2СО3 (345 мг, 2,5 ммоль), виконане відповідно до загальної методики, дозволяло одержати сполуку 524 у вигляді білої твердої речовини післяочищення колонковою + хроматографією (50-65% EtOAc в петролейному ефірі). РХ-МС: RT=2,65 хв.; m/z 311,23 (М+Н) . 1 Н-ЯМР (ДМСО-d6) 7,37 (1H, д, J=8,8), 6,81 (1Н, д, J=8,8), 4,80 (1Н, д, J=6,4), 4,78 (1Н, д, J=6,4), 4,07 (2Н, с), 4,01 (2Н, с), 3,81 (7Н, с), 3,76 (3Н, с). Методика синтезу 20 метиловий ефір 9-метоксиспіро[2Н-1,5-бензодіоксепін-3(4Н),5'[1,3]дитіан]-6-карбонової кислоти (сполука 526) 4,4-Біс(гідроксиметил)[1,3]дитіан одержували за двостадійним способом із сполуки 523, додержуючись відомої з літератури методики (Mitkin, O.D.; Wan, Y.; Kurchan, A.N.; Kutateladze, A.G. Synthesis, 2001 (8), 1133-42). Відповідно до методики, суміш сполуки 523 (1,36 г, 5 ммоль) і KSAc (1,71 г, 15 ммоль) в безводному ДМФА (10 мл) перемішували при кімнатній температурі протягом 30 годин. Видаляли розчинник при зниженому тиску і піддавали спільному випарюванню з толуолом (3×5 мл). Додавали суміш води з льодом і потім здійснювали екстракцію діізопропіловим ефіром (2×25 мл). Об'єднані органічні фази висушували (Na 2SO4), фільтрували і концентрували, одержуючи 5,5-біс(ацетилтіометил)[1,3]діоксан (1,32 г, кількісний 1 вихід) у вигляді блідо-жовтого в'язкого масла. За допомогою Н-ЯМР виявили, що чистота одержаної речовини >95%, і її використовували без подальшого очищення. Розчин 5,5-біс(ацетилтіометил)[1,3]діоксану (1,32 г, 5 ммоль) у водному НСl (2н., 25 мл) кип'ятили із зворотним холодильником протягом 16 годин і потім охолоджували до кімнатної 28
ДивитисяДодаткова інформація
Назва патенту англійськоюPhosphodiesterase inhibitors
Автори англійськоюFelding Jakob, Nielsen, Simon, Feldbaek, Larsen, Jens, Christian, Hojland, Babu, Bollu, Ravindra
Назва патенту російськоюИнгибиторы фосфодиэстераз
Автори російськоюФелдинг Якоб, Нильсэн Симон Фельдбэк, Ларсэн Йенс Христиан Хойланн, Бабу Боллу Равиндра
МПК / Мітки
МПК: A61K 31/36, C07D 495/10, C07D 491/10, C07D 493/10, A61P 29/00
Мітки: фосфодіестераз, інгібітори
Код посилання
<a href="https://ua.patents.su/40-98639-ingibitori-fosfodiesteraz.html" target="_blank" rel="follow" title="База патентів України">Інгібітори фосфодіестераз</a>
Попередній патент: Композиція для регулювання трофізму волосяних фолікулів та/або продукування шкірного сала на шкірі
Наступний патент: Харчовий продукт, що включає алкалізовану какавелу, і спосіб його одержання
Випадковий патент: Роз'єм для печатних плат