Похідні пептидів, спосіб їх одержання, фармацевтична композиція та спосіб інгібування тромбіну у ссавців
Номер патенту: 67715
Опубліковано: 15.07.2004
Автори: СМІТ Джеральд Флойд, Шуман Роберт Теодор, Уайлі Майкл Роберт, Шахт Аарон Лі
Формула / Реферат
1. Соединение, соответствующее формуле (I):
X-Y-NH-(CH2)r-G, (I)
где
Χ обозначает пролинил, гомопролинил, Rm-(CH2)g-NH-CH2-C(O)-,
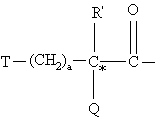 ,
,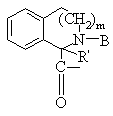 ,
,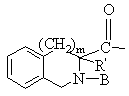 ,
,
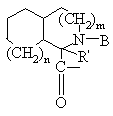 ,
,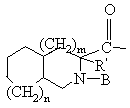 или
или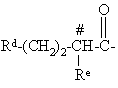 ,
,
где
Rd обозначает карбокси или метилсульфонил;
Re обозначает NHRC, NHCORC или NHCOORC, где
RC обозначает С1-С10алкил, С3-C8циклоалкил или С3-C8циклоалкилС1-С6алкил с 4-10 атомами углерода;
Т обозначает С3-C8циклоалкил, C1-C8алкил,
 или
или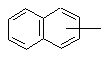 ;
;
а=0, 1 или 2;
Q обозначает -ОН, С1-C4алкокси или -ΝΗ-Α;
А обозначает водород, С1-C4алкил, R²SO2-, R"OC(O)-, R"C(O)-, RnC(O)- или -(CH2)g-Rm;
g=1, 2 или 3;
В обозначает водород или С1-C4алкил;
R' обозначает водород или С1-C4алкил;
R" обозначает С1-C4алкил, С1-C4перфторалкил, -(CH2)d-Rm или незамещенный или замещенный арил, где арил обозначает фенил, нафтил, 5- или 6-членное незамещенное или замещенное ароматическое гетероциклическое кольцо, содержащее один или два гетероатома, которые являются одинаковыми или разными и которые выбраны из серы, кислорода и азота, или 9- или 10-членную незамещенную или замещенную конденсированную бициклическую ароматическую гетероциклическую группу с одним или двумя гетероатомами, которые являются одинаковыми или разными и которые выбраны из серы, кислорода или азота;
Rm обозначает -COORb, -SO2(С1-C4алкил), -SO3H, -Р(O)(ОRb)2 или тетразол-5-ил;
Rn обозначает -COORb или тетразол-5-ил;
каждый Rb, независимо, обозначает водород или С1-C4алкил;
d=1, 2 или 3;
m=0, 1 или 2;
n=0, 1 или 2; и
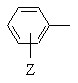
Ζ обозначает водород, С1-C4алкил, С1-C4алкокси, гидрокси, галоген или RaSO2NH-, где Ra обозначает С1-C4алкил;
Υ обозначает
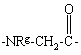 ,
, 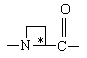 ,
, 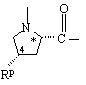 или
или 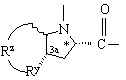 ,
,
где Rg обозначает С1-С6алкил, С3-C8циклоалкил или -(СН2)р-L-(СН2)q-Т';
Rp обозначает водород, С1-C6алкил, С3-C8циклоалкил или -(CH2)p-L-(CH2)q-T';
где p=0, 1, 2, 3 или 4;
L обозначает связь, -О-, -S- или -NH-;
q=0, 1, 2 или 3; и
Т' обозначает водород, С1-C4алкил, С3-C8циклоалкил, -СООН, -CONH2 или Аr, где Аr обозначает незамещенный или замещенный арил, где арилом является фенил, нафтил, 5- или 6-членное незамещенное или замещенное ароматическое гетероциклическое кольцо с одним или двумя гетероатомами, которые являются одинаковыми или разными и которые выбраны из серы, кислорода и азота, или 9- или 10-членную незамещенную или замещенную конденсированную бициклическую ароматическую гетероциклическую группу с одним или двумя гетероатомами, которые являются одинаковыми или разными и которые выбраны из серы, кислорода и азота;
Ry обозначает -СН2-, -О-, -S- или -NH-; и
Rz обозначает связь или вместе с Ry и тремя соседними атомами углерода образует насыщенное карбоциклическое кольцо с 5-8 атомами, одним атомом из которых может быть -О-, -S- или -NH-;
r=1, 2 или 3;
G обозначает -(CH2)s-R, где s = 0-5; -CH=CH-(CH2)t-R, где t обозначает 0-3; или
G обозначает
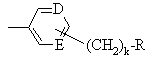 ,
,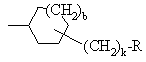 ,
, ,
,
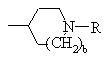 ,
, 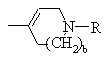 ,
, 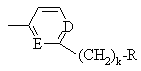 ,
,
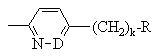 ,
,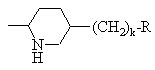 или
или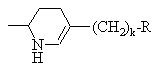 ,
,
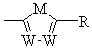
где D и Е, каждый независимо, обозначают N или СН;
k=0 или 1;
b=0 или 1;
Μ обозначает S, О или NH;
каждый W независимо обозначает N или СН; и
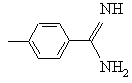
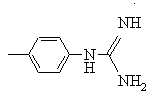
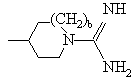
R обозначает -NH2, 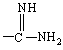 ,
,![]() или
или![]() ;
;
G обозначает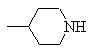 или
или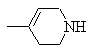 ;
;
и где один или несколько (вплоть до всех) незамещенных показанным заместителем
атомов углерода ароматического или гетероциклического кольца:
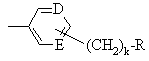 ,
,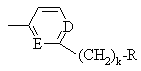 ,
,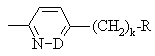 ,
,
могут иметь фтор в качестве заместителя;
или его фармацевтически приемлемая соль, или фармацевтически приемлемый сольват указанного соединения или его соль;
при условии, что А не обозначает водород или трет-бутилоксикарбонил, когда G обозначает -(CH2)s-NH-C(NH)NH2; Y обозначает незамещенный пролинил (Rp обозначает водород) и
Т обозначает
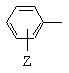 ;
;
и, кроме того, при условии, что R не является амино или гуанидино, когда r=1 и s=0;
и кроме того, при условии, что А не является водородом, С1-C4алкилом, метилсульфонилом или -(CH2)g-Rm, когда G обозначает -(CH2)s-R, где R обозначает
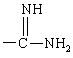 или
или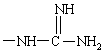 ,
,
Y обозначает ![]() , незамещенный пролинил (Rp обозначает водород) или 4-гидроксипролинил (Rp обозначает ОН), R' обозначает водород, Т обозначает циклогексил и Q обозначает -ΝΗ-Α;
, незамещенный пролинил (Rp обозначает водород) или 4-гидроксипролинил (Rp обозначает ОН), R' обозначает водород, Т обозначает циклогексил и Q обозначает -ΝΗ-Α;
и, кроме того, при условии, что R"SO2 не является арилсульфонилом, когда G обозначает -(CH2)s-R, где R обозначает
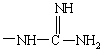 ,
,
Y обозначает незамещенный пролинил (Rp обозначает водород) или 4-метилтиопролинил (Rp обозначает SСН3) и Q обозначает -NH-A;
и, кроме того, при условии,что А не является R"SO2-, когда G обозначает
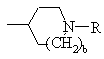 или
или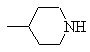 ,
,
Т обозначает C1-C8-алкил,
 или
или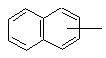 ; и
; и
Q обозначает -NH-A;
и, кроме того, при условии, что в случае, когда Υ обозначает
![]() или
или 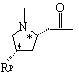 , где Rp обозначает Η или ОН; и
, где Rp обозначает Η или ОН; и
G обозначает
 ,
, ,
, ,
,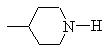 ,
,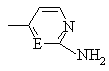 ,
,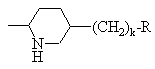 или
или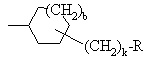 ,
,
где две последние группы R обозначают -C(NH)NH2, когда k=0 или 1, или R обозначает -NH-C(NH)NH2, когда k=0;
тогда:
(а) когда Χ обозначает T-(CH2)a-C(R')(Q)-C(О)-,
R' обозначает Н,
Q обозначает -ΝΗ-А и
А обозначает Н, С1-4алкил, Rn(C)O- (где группа Rn обозначает COORb), R"SO2- (где группа R" обозначает С1-4алкил или фенил, замещенный одной карбоксильной группой), R"OC(O)- (где группа R" обозначает С1-4алкил), R"C(O)- (где группа R" обозначает С1-4алкил или -(СH2)d-СООRb, где d=1 или 2), -(CH2)g-COORb, -CH2-SO3H, -СН2-Р(O)(ОRb)2 (где Rb обозначает Η или С1-2алкил) или -СН2-тетразол-5-ил;
тогда группа Т-(СН2)а не обозначает:
(i) С1-8алкил,
(іі) -(СН2)а-С5-6циклоалкил,
(iii) -(СН2)а-фенил, где фенильная группа факультативно замещана С1-4алкильной группой;
(iv) -(СН2)а-фенил, где а=0 или 1 и фенильная группа замещена гидроксильной или С1-4алкоксильной группой, или
(v) -(СH2)a-нафтил, где а=0 или 1; и
(b) Χ не обозначает пролинил, гомопролинил,
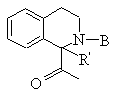 или
или 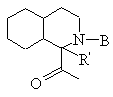 , где R' обозначает Н;
, где R' обозначает Н;
и, кроме того, при условии, что:
(а) когда Υ обозначает азетидин-2-карбонил, незамещенный пролинил (Rp обозначает Н) или 4-гидроксипролинил (Rp обозначает ОН),
Χ обозначает T-(CH2)a-C(R')(Q)-C(O)-,
Т обозначает циклогексил,
R' обозначает Н,
G обозначает -(CH2)s-R,
R обозначает -C(NH)-NH2 или -NH-C(NH)-NH2 и
цепь -(СH2)r-(СH2)s- обозначает С2-C6алкилен,
тогда Q не обозначает -NH-A, где А обозначает:
(а) Н, C1-C4алкил или метилсульфонил,
(b) RnC(O)-, где Rn обозначает -COORb,
(c) -(CH2)g-COORb или
(d) -CH2-Rm, где Rm обозначает:
(і) -SO3Н,
(ii) P(O)(ORb)2, где каждый Rb, независимо, обозначает водород, метил или этил; или
(ііі) тетразол-5-ил;
(b) когда Υ обозначает азетидин-2-карбонил, незамещенный пролинил (Rp обозначает Н) или 4-гидроксипролинил (Rp обозначает ОН),
Χ обозначает T-(CH2)a-C(R')(Q)-C(O)-,
Т обозначает циклогексил,
R' обозначает Н,
G обозначает -(CH2)s-R,
R обозначает -NH-C(NH)-NH2 и
цепь -(СН2)r-(СН2)s- обозначает С2-С6алкилен,
тогда Q не обозначает -NH-A, где А обозначает:
(i) R"OC(O)-, где R" обозначает трет-бутил, или
(ii) R"C(O)-, где R" обозначает трифторметил;
(c) когда Υ обозначает незамещенный пролинил (Rp обозначает Н),
Χ обозначает T-(CH2)a-C(R')(Q)-C(O)-,
Т обозначает циклогексил,
а=1,
R' обозначает Н,
G обозначает -(CH2)s-R и
Q обозначает -NH-A,
тогда:
(i) когда цепь -(CH2)r-(CH2)s- обозначает С2алкилен и R обозначает -NН2, тогда А не обозначает -СН2-СООRb, где Rb обозначает этил; или
(ii) когда цепь -(СН2)r-(СН2)s- обозначает С3алкилен и R обозначает -ΝΗ2, тогда А не обозначает -(СН2)g-СОORb, где g=1 или 2, a Rb обозначает этил;
и, кроме того, при условии, что соединение, соответствующее формуле I, не является:
(і) N-(4-аминобутил)-1-[N-(2-нафталенилсульфонил)-D-фенилаланил]-L-пролинамидом,
(ii) N-[4-[(аминоиминометил)амино]бутил]-1-[N-(метилсульфонил)-D-фенилаланил]-L-пролинамидом или
(ііі) N-[[1-(аминоиминометил)-4-пиперидинил]метил]-1-D-фенилаланил-L-пролинамидом;
и, кроме того, при условии, что в случае, когда Χ обозначает D-фенилаланил и Υ обозначает незамещенный пролинил (Rp обозначает Н),
тогда:
(a) G не обозначает -CH=CH-CH2-NH-C(NH)-NH2, когда r=1, и
(b) G не обозначает
 , когда r=1 или 2.
, когда r=1 или 2.
2. Соединение по п.1, отличающееся тем, что Χ обозначает пролинил, гомопролинил, 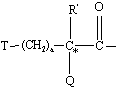 ,
,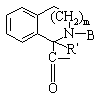 ,
, ,
,
 или
или ;
;
Т обозначает С3-С8циклоалкил, C1-C8алкил,
 или
или ,
,
а=0 или 1;
Q обозначает -ОН, С1-С4алкокси или -ΝΗ-Α;
А обозначает водород, С1-С4алкил, R"SO2-, R"OC(O)-, R"C(O)- или -(CH2)g-COOH;
g=1, 2 или 3;
В обозначает водород или С1-С4алкил;
R' обозначает водород или С1-С4алкил;
R" обозначает С1-С4алкил, С1-С4перфторалкил, -(CH2)d-COOH или незамещенный или замещенный арил, где арил обозначает фенил, нафтил, 5- или 6-членное незамещенное или замещенное ароматическое гетероциклическое кольцо с одним или двумя гетероатомами, которые являются одинаковыми или разными и которые выбраны из серы, кислорода и азота, или 9- или 10-членную незамещенную или замещенную конденсированную бициклическую ароматическую гетероциклическую группу с одним или двумя гетероатомами, которые являются одинаковыми или разными и которые выбраны из серы, кислорода и азота;
d=1, 2 или 3;
m=0, 1 или 2;
n=0, 1 или 2; и
Ζ обозначает водород, С1-С4алкил, С1-С4алкокси, гидроксил, галоген или RaSO2NH-, где Ra обозначает С1-С4алкил;
Υ обозначает:
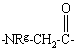 ,
, 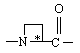 ,
, 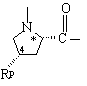 или
или 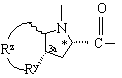 ,
,
где Rg обозначает C1-C6алкил, С3-C8циклоалкил или -(CH2)p-L-(CH2)q-T¢;
Rp обозначает водород, C1-C6алкил, С3-C8циклоалкил или -(CH2)p-L-(CH2)q-T¢;
где р=0, 1, 2, 3 или 4;
L обозначает связь, -О-, -S- или -NH-;
q=0, 1, 2 или 3;
Т¢ обозначает водород, С1-4алкил, С3-С8циклоалкил, -СООН, -CONH2 или Аr, где Аr обозначает незамещенный или замещенный арил, где арил обозначает фенил, нафтил, 5- или 6-членное незамещенное или замещенное ароматическое гетероциклическое кольцо с одним или двумя гетероатомами, которые являются одинаковыми или разными и которые выбраны из серы, кислорода и азота, или 9- или 10-членную незамещенную или замещенную конденсированную бициклическую ароматическую гетероциклическую группу с одним или двумя гетероатомами, которые являются одинаковыми или разными и которые выбраны из серы, кислорода и азота;
Ry обозначает -СН2-, -О-, -S- или -NH-, и
Rz обозначает связь или вместе с Ry и тремя соседними атомами углерода образует насыщенное карбоциклическое кольцо с 5-8 атомами, один атом из которых может представлять собой -О-, -S- или -NH-;
r =1 или 2; и
G обозначает -(CH2)s-R, где s=0-5, -CH=CH-(CH2)t-R, где t=0-3;
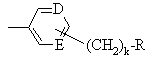 ,
,  ,
,  ,
,
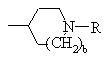 или
или 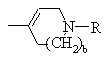 ;
;
где D и Ε, каждый независимо, обозначают N или СН;
k=0 или 1;
b=0 или 1;
Μ обозначает S, О или NH;
каждый из W, независимо, обозначает N или СН; и
R обозначает -NH2,
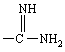 ,
, ![]() или
или 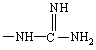 ;
;
или его фармацевтически приемлемая соль,
или фармацевтически приемлемый сольват вышеуказанного соединения или его соль;
при условии, что А не обозначает водород или трет-бутилоксикарбонил, когда G обозначает -(CH2)s-NH-C(NH)NH2; Y обозначает незамещенный пролинил (Rp обозначает водород) и Т обозначает
 ;
;
и кроме того, при условии, что R не обозначает амино или гуанидино, когда r=1 и s=0;
и кроме того, при условии, что А не обозначает водород, С1-4алкил, метилсульфонил или -(CH2)g-COOH, когда G обозначает -(CH2)s-R, где R обозначает
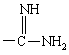 или
или 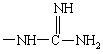 ;
;
Υ обозначает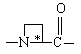 , незамещенный пролинил (Rp обозначает Н) или 4-гидроксипролинил (Rp обозначает ОН), R' обозначает водород, Т обозначает циклогексил и Q обозначает -ΝΗ-Α;
, незамещенный пролинил (Rp обозначает Н) или 4-гидроксипролинил (Rp обозначает ОН), R' обозначает водород, Т обозначает циклогексил и Q обозначает -ΝΗ-Α;
и кроме того, при условии, что R"SO2 не обозначает арилсульфонил, когда G обозначает -(CH2)s-R, где R обозначает
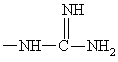
и Y обозначает незамещенный пролинил (Rp обозначает водород) или 4-метилтиопролинил (Rp обозначает –SCH3); и Q=-NH-A;
и кроме того, при условии, что А не обозначает R"SO2-, когда G обозначает
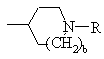 ,
,
Т обозначает C1-C8алкил,
 или
или  ; и Q=-NH-A;
; и Q=-NH-A;
и кроме того, при условии, что в случае, когда:
Υ обозначает
![]() или
или 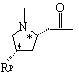 , где Rp обозначает Н или ОН; и
, где Rp обозначает Н или ОН; и
G обозначает
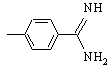 ,
, 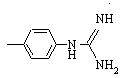 ,
, 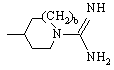 или
или![]() ,
,
где последняя группа R обозначает -C(NH)NH2, когда k=0 или 1, или R обозначает -NH-C(NH)NH2, когда k=0;
тогда:
(a) когда Χ обозначает T-(CH2)a-C(R')(Q)-C(O)-,
R' обозначает Η и
Q обозначает -ΝΗ-Α, где А обозначает Н, С1-С4алкил, R"SO2- (где группа R" обозначает С1-4алкил или фенил, замещенный одной карбоксильной группой), R"OC(O)- (где группа R" обозначает С1-4алкил), R"C(O)- (где группаR" обозначает С1-4алкил или -(CH2)d-COOH, где d=1 или 2) или -(CH2)g-COOH;
тогда группа Т-(СН2)а не обозначает:
(i) С1-8алкил,
(іі) -(СН2)a-С5-6циклоалкил,
(iii) -(СН2)а-фенил, где фенильная группа факультативно замещена гидроксильной, С1-4алкильной или С1-4алкоксильной группой, или
(iv) -(СН2)a-нафтил; и
(b) Χ не обозначает пролинил, гомопролинил,
 или
или  , где R' обозначает Н;
, где R' обозначает Н;
и при дополнительном условии, что:
(а) когда Υ обозначает азетидин-2-карбонил, незамещенный пролинил (Rp обозначает Н) или 4-гидроксипролинил (Rp обозначает ОН);
X обозначает T-(CH2)a-C(R')(Q)-C(O)-;
Т обозначает циклогексил;
R' обозначает Н;
G обозначает -(CH2)s-R;
R обозначает -C(NH)-NH2 или -NH-C(NH)-NH2 и
цепь -(CH2)r-(CH2)s- обозначает С2-С6алкилен;
тогда Q не обозначает -NH-A, где А обозначает:
(і) Н, С1-С4алкил или метилсульфонил, или
(іі) -(CH2)g-COOH; и
(b) когда Υ обозначает азетидин-2-карбонил, незамещенный пролинил (Rp обозначает Н) или 4-гидроксипролинил (Rp обозначает ОН);
Χ обозначает T-(CH2)a-C(R')(Q)-C(O)-;
Т обозначает циклогексил;
R' обозначает Н;
G обозначает -(CH2)s-R;
R обозначает -NH-C(NH)-NH2, и
цепь -(CH2)r-(CH2)s- обозначает С2-С6алкилен;
тогда Q не обозначает -NH-A, где А обозначает:
(i) R"OC(O)-, где R" обозначает трет-бутил, или
(ii) R"C(O)-, где R" обозначает трифторметил;
и при дополнительном условии, что в случае, когда Χ обозначает D-фенилаланил и Υ обозначает незамещенный пролинил (Rp обозначает Н);
тогда:
(a) G не обозначает -CH=CH-CH2-NH-C(NH)-NH2, когда r=1, и
(b) G не обозначает
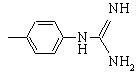 , когда r=1 или 2.
, когда r=1 или 2.
3. Соединение по пп. 1 или 2, отличающееся тем, что алкил сам по себе или в виде части другого заместителя обозначает метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, изобутил или втор-бутил,
перфторалкил сам по себе или в качестве части другого заместителя обозначает трифторметил, перфторэтил, перфтор-н-пропил, перфторизопропил, перфтор-н-бутил, перфтор-трет-бутил, перфторизобутил или перфтор-втор-бутил;
С3-C8циклоалкил обозначает циклопропил, метилциклопропил, циклобутил, циклопентил, циклогексил, 4-метилциклогексил или циклооктил;
галоген обозначает хлор, фтор, бром или йод;
5- или 6-членное гетероциклическое кольцо обозначает фурил, тиенил, пирролил, пиразолил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиранил, пиридинил, пиримидинил, пиразинил, оксазинил или тиазинил;
9- или 10-членное гетероциклическое кольцо обозначает индолил, бензотиенил, бензофурил, бензоксазолил, бензоизоксазолил, бензопиразолил, хинолинил, изохинолинил, бензимидазолил или бензотиазолил;
и, кроме того, где любая из ароматических или гетероциклических групп, перечисленных для определения Аr или R", независимо друг от друга незамещена или замещена одним или двумя заместителями, которые могут давать стабильную структуру, выбираемыми, независимо друг от друга, из группы: галоген, гидроксил, С1-С4алкил, С1-С4алкокси, амино (-NH2), моно(С1-С4алкил)амино, -(CH2)jCOOH, меркапто, -S-(O)h-(С1-С4алкил)-группы, -NHS(O)h(С1-С4алкил), -NНС(O)(С1-С4алкил), -S(O)hNH2, -S(O)hNH(С1-С4алкил) или -S(O)hN-(С1-С4алкил)2, где h=0, 1 или 2; j =0, 1, 2, 3 или 4,
или соль, или сольват этого соединения.
4. Соединение по любому из пп. 1, 2 или 3, отличающееся тем, что Х обозначает
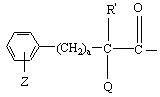 , гомопролинил, 1- или 3-тетрагидроизохинолинкарбонил или 1- или 3-пергидроизохинолинкарбонил;
, гомопролинил, 1- или 3-тетрагидроизохинолинкарбонил или 1- или 3-пергидроизохинолинкарбонил;
Υ обозначает пролинил; и
Q обозначает –ΝΗ-Α, где А обозначает водород или R"SO2-; R' обозначает водород; Ζ обозначает водород и В обозначает водород; и R обозначает гуанидино или амидино;
или соль, или сольват этого соединения.
5. Соединение по любому из пп. 1-4, отличающееся тем, что G обозначает 4-амидинофенил, или соль, или сольват этого соединения.
6. Соединение по любому из пп. 1, 2 или 3, отличающееся тем, что Χ обозначает:
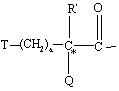 , где Т обозначает циклогексил, а=1, R' обозначает водород и Q обозначает -ΝΗ-Α, где А обозначает водород, R"SO2- или -(CH2)g-COOH;
, где Т обозначает циклогексил, а=1, R' обозначает водород и Q обозначает -ΝΗ-Α, где А обозначает водород, R"SO2- или -(CH2)g-COOH;
или соль, или сольват этого соединения.
7. Соединение по п. 6, отличающееся тем, что А обозначает R"SO2- и R" обозначает этил, или соль, или сольват этого соединения.
8. Соединение по п. 6, отличающееся тем, что А обозначает -(CH2)g-COOH и g = 1,
или соль, или сольват этого соединения.
9. Соединение по любому из пп. 1-3 или 6-8, отличающееся тем, что Υ обозначает (L)-пролинил, (S)-цис-октагидро-1Н-индол-2-карбонил или N-(2-фенилэтил)глицил,
или соль, или сольват этого соединения.
10. Соединение по п. 1, отличающееся тем, что оно выбрано из:
а) соединения формулы Iа:
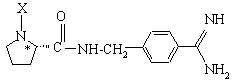 ,
,
где бензамидиновое кольцо незамещено или может содержать один или два фторзаместителя;
б) соединения формулы Ib:
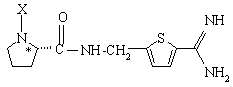
и
в) соединения формулы Iс:
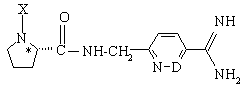 ,
,
где D=N или СН и X принимает любое из значений по пп. 1-4 и 6-8,
или фармацевтически приемлемая соль или сольват этого соединения.
11. Соединение по п. 10, отличающееся тем, что оно является соединением формулы Іа, в которой бензамидиновое кольцо незамещено, или соль или сольват этого соединения.
12. Соединение по пп. 10 или 11, отличающееся тем, что Χ обозначает
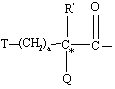 , где R' обозначает водород, а=1, Т обозначает циклогексил или фенил и Q обозначает -ΝΗ-Α, где А обозначает водород, этилсульфонил или карбоксиметил,
, где R' обозначает водород, а=1, Т обозначает циклогексил или фенил и Q обозначает -ΝΗ-Α, где А обозначает водород, этилсульфонил или карбоксиметил,
или соль или сольват этого соединения.
13. Соединение по п. 1, отличающееся тем, что оно выбрано из следующих соединений (без учета указанных условных исключений):
а) D-фенилаланил-N-[[4-(аминоиминометил)фенил]метил]-L-пролинамид,
б) N-[[4-(аминоиминометил)фенил]метил]-1-[[(4аS,8аS)-декагидро-1(R)-изохинолинил]карбонил]-L-пролинамид,
в) N-(этилсульфонил)-D-фенилаланил-N-[[4-(аминоиминометил)фенил]метил]-L-пролинамид,
г) (S-цис)-N-[[4-(аминоиминометил)фенил]метил]-1-[N-(этилсульфонил)-D-фенилглицил]-1Н-индол-2-карбоксамид,
д) (S-цис)-N-[[4-(аминоиминометил)фенил]метил]-1-[N-(этилсульфонил)-D-фенилаланил]-1Н-индол-2-карбоксамид,
е) Ν-(карбоксиметил)-D-фенилаланил-N-[[4-(аминоиминометил)фенил]метил]-L-пролинамид,
з) (S-цис)-N-[[4-(аминоиминометил)фенил]метил]-1-[N-(карбоксиметил)-D-циклогексилаланил]-1Н-индол-2-карбоксамид,
л) Ν-(карбоксиметил)-D-циклогексилаланил-N-[[1-(аминоиминометил)-гексагидропиридин-4-ил]метил]-L-пролинамид,
м) N-(карбоксиметил)-D-циклогексилаланил-N-[[5-(аминоиминометил)тиофен-2-ил]метил]-L-пролинамид,
н) N-(карбоксиметил)-D-циклогексилаланил-N-[[5-(аминоиминометил)пиридин-2-ил]метил]-L-пролинамид,
ο) Ν-(карбоксиметил)-D-циклогексилаланил-N-[[5-(аминоиминометил)-1,2,3,4-тетрагидропиридин-2-ил]метил]-L-пролинамид,
п) Ν-(карбоксиметил)-D-циклогексилаланил-N-[[6-(аминоиминометил)пиридазин-3-ил]метил]-L-пролинамид,
р) N-(карбоксиметил)-D-циклогексилаланил-N-[[1-(аминоиминометил)-1,2,3,6-тетрагидропиридин-4-ил]метил]-L-пролинамид,
с) N-(карбоксиметил)-D-циклогексилаланил-N-[[4-(аминоиминометил)-2-фторфенил]метил]-L-пролинамид,
т) N-(карбоксиметил)-D-циклогексилаланил-N-[[4-(аминоиминометил)-2,6-дифторфенил]метил]-L-пролинамид,
у) N-(этилсульфонил)-D-циклогексилаланил-N-[[4-(аминоиминометил)фенил]метил]-L-пролинамид,
х) N-(карбоксиметил)-D-гомофенилаланил-N-[[4-(аминоиминометил)фенил]метил]-L-пролинамид,
ц) Ν-(карбоксиметил)-D-гомоциклогексилаланил-N-[[4-(аминоиминометил)фенил]метил]-L-пролинамид,
ч) N-(мeтилcyльфoнилaцeтил)-L-циклoгeкcилaлaнил-N-[[4-(aминoиминoмeтил)фeнил]мeтил]-L-пpoлинaмид,
или соль, или сольват этого соединения.
14. Соединение по п. 1, отличающееся тем, что оно выбрано из следующих соединений (без учета указанных условных исключений):
I) (S-цис)-Ν-[[4-(аминоиминометил)фенил]метил]-1-[Ν-(этилсульфонил)-D-фенилаланил]-1Н-индол-2-карбоксамид,
II) N-(карбоксиметил)-D-фенилаланил-N-[[4-(аминоиминометил)фенил]метил]-L-пролинамид,
V) Ν-(карбоксиметил)-D-циклогексилаланил-N-[[5-(аминоиминометил)тиофен-2-ил]метил]-L-пролинамид,
VI) N-(карбоксиметил)-D-циклогексилаланил-N-[[1-(аминоиминометил)-1,2,3,6-тетрагидропиридин-4-ил]метил]-L-пролинамид,
VII) N-(карбоксиметил)-D-циклогексилаланил-N-[[4-(аминоиминометил)-2-фторфенил]метил]-L-пролинамид,
VIII) N-(карбоксиметил)-D-циклогексилаланил-N-[[4-(аминоиминометил)-2,6-дифторфенил]метил]-L-пролинамид,
или соль, или сольват этого соединения.
15. Соединение по пп. 1 или 2, отличающееся тем, что R обозначает -C(=NOH)-NH2, или соль, или сольват этого соединения.
16. Соединение по п. 2, отличающееся тем, что оно представляет собой Ν-(карбоксиметил)-D-циклогексилаланил-N-[[5-(аминоиминометил)тиофен-2-ил]метил]-L-пролинамид, или соль, или сольват этого соединения.
17. Соединение, соответствующее формуле (I):
X-Y-NH-(CH2)r-G , (I)
где Χ обозначает пролинил, гомопролинил, Rm-(СH2)g-NН-СH2-С(O)-,
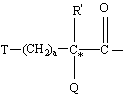 ,
,  ,
,  ,
,
 ,
,  или
или 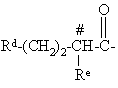 ,
,
где
Rd обозначает карбокси или метилсульфонил,
Re обозначает NHRC, NHCORC или NHCOORC, где
RC обозначает С1-С10алкил, С3-C8циклоалкил или С3-C8циклоалкилC1-С6алкил с 4-10 атомами углерода;
Т обозначает С3-C8циклоалкил, С1-С8алкил,
 или
или  ;
;
а=0, 1 или 2; и
Q обозначает -ΝΗ-Α;
А обозначает R"C(O)-, RnC(O)- или-(CH2)g-Rm;
g=1, 2 или 3;
В обозначает водород или С1-С4алкил;
R' обозначает водород или С1-С4алкил;
R" обозначает -(CH2)d-Rm;
Rm обозначает -COORb, -SО2(С1-С4)алкил, -SO3H, -P(O)(ORb)2 или тетразол-5-ил;
Rn обозначает -COORb или тетразол-5-ил;
каждый Rb, независимо, обозначает водород или С1-С4алкил;
d=1, 2 или 3;
m=0, 1 или 2;
n=0, 1 или 2; и
Ζ обозначает водород, С1-С4алкил, С1-С4алкокси, гидрокси, галоген или RaSO2NH-, где Ra обозначает С1-С4алкил;
Υ обозначает:
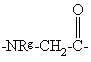 ,
, 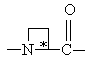 ,
, 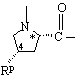 или
или 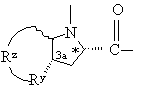 ,
,
где
Rg обозначает C1-С6алкил, С3-C8циклоалкил или -(CH2)p-L-(CH2)q -Т¢;
Rp обозначает водород, C1-С6алкил, С3-C8циклоалкил или -(CH2)p-L-(CH2)q-T¢;
р=0, 1, 2, 3 или 4;
L обозначает связь, -О-, -S- или -NH-;
q=0, 1, 2 или 3; и
Т¢ обозначает водород, С1-С4алкил, С3-C8циклоалкил, -СООН, -CONH2 или Аr, где Аr обозначает незамещенный или замещенный арил, где арилом является фенил, нафтил, 5- или 6-членное незамещенное или замещенное ароматическое гетероциклическое кольцо с одним или двумя гетероатомами, которые являются одинаковыми или разными и которые выбраны из серы, кислорода и азота, или 9- или 10-членную незамещенную или замещенную конденсированную бициклическую ароматическую гетероциклическую группу с одним или двумя гетероатомами, которые являются одинаковыми или разными и которые выбраны из серы, кислорода и азота;
Ry обозначает -СН2-, -О-, -S- или -NH-; и
Rz обозначает связь или вместе с Ry и тремя соседними атомами углерода образует насыщенное карбоциклическое кольцо с 5-8 атомами, одним атомом из которых может быть -О-, -S- или -NH-;
r=1, 2 или 3;
G обозначает:
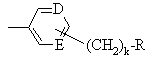 ,
,  ,
,  ,
,
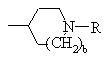 ,
, 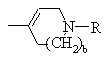 ,
,  ,
,
 ,
,  или
или  ,
,
где D и Ε, каждый независимо, обозначают N или СН;
k=0 или 1;
b=0 или 1;
Μ обозначает S, О или NH;
каждый W, независимо, обозначает N или СН; и
R обозначает
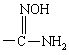 ,
,
или G обозначает
 ;
;
и где один или несколько (вплоть до всех) незамещенных показанным заместителем атомов углерода ароматического или гетероциклического кольца:
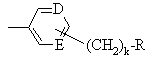 ,
, ,
, ,
,
могут иметь фтор в качестве заместителя;
или его фармацевтически приемлемая соль, или фармацевтически приемлемый сольват указанного соединения или его соль.
18. Соединение по п. 17, отличающееся тем, что Χ обозначает пролинил, гомопролинил,
 ,
,  ,
,  ,
,
 или
или  ;
;
Т обозначает С3-C8циклоалкил, С1-С8алкил,
 или
или  ;
;
а=0 или 1;
Q обозначает -ΝΗ-Α;
А обозначает R"C(O)- или -(CH2)g-COOH;
g=1, 2 или 3;
В обозначает водород или С1-С4алкил;
R' обозначает водород или С1-С4алкил;
R" обозначает -(СН2)d-СООН;
d=1, 2 или 3;
m=0, 1 или 2;
n=0, 1 или 2; и
Ζ обозначает водород, С1-С4алкил, С1-С4алкокси, гидроксил, галоген или RaSO2NH-, где Ra обозначает С1-С4алкил;
Υ обозначает:
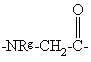 ,
,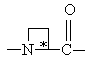 ,
,
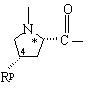 или
или  ,
,
где
Rg обозначает C1-С6алкил, С3-C8циклоалкил или -(CH2)p-L-(CH2)q-T¢;
Rp обозначает водород, C1-С6алкил, С3-C8циклоалкил или -(СН2)р-L-(CH2)q-T¢;
р=0, 1, 2, 3 или 4;
L обозначает связь, -О-, -S- или -NH-;
q=0, 1, 2 или 3; и
Т¢ обозначает водород, С1-С4алкил, С3-C8циклоалкил, -СООН, -СОNН2 или Аr, где Аr обозначает незамещенный или замещенный арил, где арил обозначает фенил, нафтил, 5- или 6-членное незамещенное или замещенное ароматическое гетероциклическое кольцо с одним или двумя гетероатомами, которые являются одинаковыми или разными и которые выбраны из серы, кислорода и азота, или 9- или 10-членную незамещенную или замещенную конденсированную бициклическую ароматическую гетероциклическую группу с одним или двумя гетероатомами, которые являются одинаковыми или разными и которые выбраны из серы, кислорода и азота;
Ry обозначает -СН2-, -О-, -S- или -NH-; и
Rz обозначает связь или вместе с Ry и тремя соседними атомами углерода образует насыщенное карбоциклическое кольцо с 5-8 атомами, один атом из которых может представлять собой -О-, -S- или -NH-;
r=1 или 2; и
G обозначает
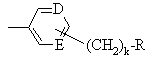 ,
, ,
, ,
,
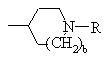 или
или 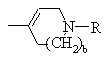 ,
,
где D и Ε, каждый независимо, обозначают N или СН;
k=0 или 1;
b=0 или 1;
Μ обозначает S, О или NH;
каждый из W, независимо, обозначает N или СН; и
R обозначает
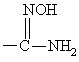 ;
;
или его фармацевтически приемлемая соль, или фармацевтически приемлемый сольват указанного соединения или его соль.
19. Фармацевтическая композиция, содержащая в сочетании с фармацевтически приемлемым носителем, разбавителем или наполнителем соединение по любому из пп. 1-18 или его фармацевтически приемлемую соль или сольват.
20. Способ получения соединения, имеющего формулу I:
X-Y-NH-(CH2)r-G,
по любому из пп. 1-9, отличающийся тем, что он включает:
а) одновременное или последовательное удаление защитной группы (групп) Ρ из соответствующего соединения формулы II:
(P)X-Y-NH-(CH2)r-G(P),
где (Р)Х обозначает радикал X, который может иметь одну или несколько защитных групп Р, независимо выбранных из группы Ρ защиты амина для соединения формулы I, где Χ включает основную группу NH, и группы Р защиты карбоксила для соединения формулы I, где Χ включает карбоксиостаток, и G(P) обозначает радикал G, который может иметь одну или несколько независимо выбранных групп Р защиты амина; и
б) для получения соединения формулы I, в котором R обозначает
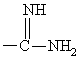 , гидрогенолиз соответствующего соединения формулы I, где R обозначает
, гидрогенолиз соответствующего соединения формулы I, где R обозначает
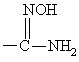 ;
;
в) и далее для получения соли соединения формулы I, образование соли с фармацевтически приемлемой кислотой.
21. Способ ингибирования тромбина у млекопитающих, включающий введение эффективной дозы соединения или его фармацевтически приемлемой соли или сольвата по любому из пп. 1-18 млекопитающему, нуждающемуся в ингибировании тромбина.
Текст
Настоящее изобретение относится к ингибиторам тромбина, которые используются как антикоагулянты у млекопитающих. В частности, оно относится к пептидным производным, обладающим высокой антитромботической активностью, антикоагулянтной активностью и пероральной биодоступностью. Процесс коагуляции крови, тромбоз, вызывается комплексным протеолитическим каскадом, приводящим к образованию тромбина. Тромбин протеолитически уничтожает активацию пептидов из Аa-цепей и Вb-цепей фибриногена, который растворим в плазме крови, инициируя образование нерастворимого фибриногена. Антикоагуляции обычно достигают путем введения гепаринов и кумаринов. Парентеральный фармакологический контроль коагуляции и тромбоза основан на ингибировании тромбина за счет использования гепаринов. Гепарины косвенно воздействуют на тромбин путем ускорения ингибиторных воздействий эндогенного антитромбина-Ш (главный физиологический ингибитор тромбина). Поскольку уровни антитромбина-Ш в плазме изменяются и ввиду того, что граничная поверхность тромбина, по-видимому, резистентна по отношению к этому косвенному механизму, гепарины могут быть неэффективными. Так как анализы по коагуляции считаются эффективными и безопасными, уровни гепарина должны контролироваться с помощью анализов по коагуляции (особенно определение активированного парциального тромбопластинового времени /АРТТ/). Кумарины препятствуют генерации тромбина за счет блокирования посттрансляционного гамма-карбоксилирования в синтезе протромбина и других протеинов этого типа. Вследствие своего механизма, воздействие кумаринов может проявляться только медленно, спустя 6-24 часа после введения. Более того, они являются неселективными антикоагулянтами. Следовательно, кумарины требуют контролирования с помощью анализов по коагуляции (особенно анализ протромбинового времени /РТ/). В настоящее время вырос интерес к небольшим синтетическим пептидам, которые распознаются протеолитическими ферментами таким же образом, что и природные субстраты. Трипептид-альдегиды, такие, как D-Phe-Pro-Arq-H, Boc-D-Phe-Pro-Arg-H, D-MePhe-Pro-Arg-H, Bajuszetal., J.Med.Chem., 33, 1729-1735 (1990)/ показывают сильное прямое ингибирование тромбина. Недавние клинические исследования, которые показали, что D-MePhe-Pro-Arg-H сульфат является антикоагулянтом у людей, описаны Simoons и др., Circulation, 90, 1-231, Аbstr. 1241 (1994). Многочисленные исследователи синтезировали аналоги в попытке получить фармацевтические агенты, как, например, Shuman и др., J.Med.Chem., 36, 314-319 (1993). В патенте США № 4 34 6 078 приводится ряд антикоагулянтных пептидов, содержащих агматиновую (1-амино-4гуанидинбутановую) группу. Агматиновые производные и родственные соединения описаны как в РСТ-заявке с номером международной публикации ВОИС 93/11152, так и в европейской заявке на патент, публикация № 601459 от 15 июня 1994 г. Такие соединения отличаются от предшествующего ряда, в котором агматиновые соединения не содержат карбонильной группы, имеющейся в подобных соединениях с Аrg -гр уппой. Хотя гепарины и кумарины являются эффективными антикоагулянтами, все еще не появилось лекарственное средство на основе известных трипептид-альдегидов, несмотря на сохраняющуюся перспективу для этого класса соединений, поэтому существует необходимость в антикоагулянтах, которые селективно воздействуют на тромбин и, независимо от антитромбина-Ш, оказывают ингибирующее воздействие вскоре после введения, предпочтительно оральным путем, и не интерферируют с лизисом сгустков крови, необходимого для поддержания гемостаза. Настоящее изобретение касается обнаружения того, что соединения по настоящему изобретению, такие, как указанные ниже, являются сильными ингибиторами тромбина, могут иметь высокую биодоступность при пероральном введении. Кроме того, некоторые соединения по настоящему изобретению также могут вызывать ингибирование фактора Ха, который вовлекается в коагулянтный каскад. Следовательно, первым объектом настоящего изобретения являются новые пептидные производные, которые являются сильными ингибиторами тромбина, пригодными в качестве антикоагулянтов. Другие объекты, признаки и преимущества будут ясны специалистам из нижеследующих описаний и формулы изобретения. Настоящее изобретение относится к ингибирующим тромбин соединению, имеющему формулу 1: X - Y - NH - (CH2 ) - G, (1) где X обозначает пролинил; гомопролинил; где Rd обозначает карбокси или метилсульфонил; Re обозначает HHRC, NHCORC или NHCQO Rc , где Rc обозначает С 1-С10 алкил, С3-С8 циклоалкил или (С3-С8) циклоалкил (С1-С6) алкил с 4-10 атомами углерода; Τ обозначает С3-С8 циклоалкил, С1-С8 алкил, а = 0,1 или 2; и Q обозначает -ОН, С1-С4 алкокси или ΝΗ-Α·; А обозначает водород; С1-С4 алкил, R"SO2-, R"OC(O)-, R"C(O)-, R nС (О)- или –(CH2)g-Rm; g равно 1, 2 или 3; В обозначает водород или (С1-С4 )-алкил; R' обозначает водород или (С1-С4 )-алкил; R'' обозначает С1-С4 алкил, С1-С4 перфторалкил, - [CH2)d-Rm, или незамещенный или замещенный арил, где арил обозначает фенил, нафтил, 5- или 6-членное незамещенное или замещенное ароматическое гетероциклическое кольцо, содержащее один или два гетероатома, которые являются одинаковыми или разными и которые выбраны из серы, кислорода и азота, или 9-или 10-членную, незамещенную или замещенную конденсированную бициклическую ароматическую гетероциклическую группу с одним или двумя гетероатомами, которые являются одинаковыми или разными и которые выбраны из серы, кислорода или азота; Rm обозначает -СOORВ, - SO2 (С1-С4 ) -алкил, -SО3H, -Р(О)(ОRВ)2 или тетразол-5-ил; Rn обозначает -COORB или тетразол-5-ил; каждый RB, независимо друг от друга, обозначает водород, или С1-С4 алкил; d равно 1, 2 или 3; m равно О, 1 или 2; n равно О, 1 или 2; и Ζ обозначает водород, С1-С4 алкил, С1-С4 алкокси, гидрокси, галоген или RaSO2ΝΗ, где Ra обозначает С 1С4 алкил; y обозначает: где Rg обозначает С1-С6 алкил, С3-С8 циклоалкил или -(СH2)p- L -(CH2)g -T'; Rp обозначает водород, С1-С6 алкил, С3-С8 циклоалкил или -(СН2)р -L -(СН2)g -Т'; где p равно О, 1, 2, 3 или 4; L обозначает связь, -О-, -S’- или - NH-; g равно 0, 1, 2 или 3; и Т' обозначает водород, С1-С4 алкил, С3-С8 циклоалкил, -СООН, -СОNН 2 или Аr, где Аr обозначает незамещенный или замещенный арил, где арилом является фенил, нафтил; 5- или 6-членное незамещенное или замещенное ароматическое гетероциклическое кольцо с одним или двумя гетероатомами, которые являются одинаковыми или разными и выбраны из серы, кислорода и азота; или 9- или 10-членную незамещенную или замещенную конденсированную бициклическую ароматическую гетероциклическую группу с одним или двумя гетероатомами, которые являются одинаковыми или разными и выбраны из серы, кислорода и азота; Ry обозначает –CH2-, -О-, -S- или -NΗ-; и Rz обозначает связь или, вместе с Ry и тремя соседними атомами углерода, образует насыщенное карбоциклическое кольцо из 5-8 атомов, причем одним ггтомом может быть -О-, -S’- или -NH-; r равно 1, 2 или 3; и G обозначает -(СН2)s -R, где S равно O-5; -СН=СН-(CH 2)t -R, где і равно 0-3; или G обозначает: где D и Ε, каждый, независимо друг о\ шуга, обозначают N или СН; к равно О или 1; в равно О или 1; Μ обозначает S , кислород или NH; каждый W , независимо, обозначает N или СН; и и где от одного до всех незамещенных атомов углерода ароматического или гетероциклического кольца: могут содержать фтор в качестве заместителя; или его фармацевтически приемлемой соли; или к фармацевтически приемлемому сольвату указанного соединения или его соли; при условии, что А не обозначает водород или трет-бутилоксикарбонил, когда G обозначает - (СН2)S - NНС(NН)NН2, y обозначает незамещенный пролинил (Rp является водородом) и Τ обозначает: и при условии еще, что Ц не является амино или гуанидино, когда r =1 и S=O; и при условии, далее, что A не обозначает водород, С1-С4 алкил, метилсульфонил или - (СН2)g -Rm когда G обозначает -(СH2)s, -R, где R обозначает: У обозначает незамещенный пролинил (Rp=водород ) или 4-гидроксипролинил (Rp=ОН), R’ обозначает водород; Τ обозначает циклогексил и Q обозначает - NΗ-Α; и при условии еще, что R’’SO2 не обозначает арилсульфонил, когда G обозначает -(СН2)S-R, где R обозначает У обозначает незамещенный пролинил (Rp является водородом) или 4-метилтиопролинил (Rp обозначает – SCH3) и Q обозначает - NН-А; и при условии еще, что А не обозначает R''SO2 -, когда G обозначает: или ; Τ обозначает (С1-Со8)-алкил, или и Q обозначает -NН-А. Конкретная группа вышеуказанных соединений формулы 1 включает такие соединения формулы 1, где X обозначает пролинил, гомопролинил; Τ обозначает С3-С8 циклоалкил, C1-C8 алкил, или а равно О или 1; Q обозначает -ОН, С1-С4 алкокси или - NΗ-Α; А обозначает водород, C1-C4 алкил, R''SO2-, S''OC(O)-, R"C(O)-или -(СН2)g -СООН; g равно 1, 2 или 3; В обозначает водород или С1-С4 алкил; R' обозначает водород или С1-С4 алкил; R" обозначает С1-С4 алкил, С1-С4 перфторалкил, -(СН2)d -СООН или незамещенный или замещенный арил, где арил обозначает фенил, нафтил; 5- или 6-членное незамещенное или замещенное ароматическое гетероциклическое кольцо с одним или двумя гетероатомами, которые являются одинаковыми или разными и выбраны из серы, кислорода и азота; или 9- или 10-членную, незамещенную или замещенную конденсированную бициклическую ароматическую гетероциклическую группу с одним или двумя гетероатомами, которые являются одинаковыми или разными и выбираются среди серы, кислорода и азота; d равно 1, 2 или 3; m равно О, 1 или 2; n равно О, 1 или 2; и Z обозначает водород, С1-С4 алкил, С1-С4 алкокси, гидрокси, галоген или Rg SO2NH, где Ra обозначает С 1С4 алкил; У обозначает: где Rg обозначает С1-С6 алкил, С3-С8 циклоалкил или - (СН2)p-L-(CH)q -T’; Rр обозначает водорож, С1-С6 алкил, С3-С8 циклоалкил или -(СН2)р -L -(СН2)q -Т'; где p равно О, 1, 2, 3 или 4; L обозначает связь, -О-, -S- или - NH-; "q" равно О, 1, 2 или 3; и Т' обозначает водород, С1-С4 алкил, С3-С8 циклоалкил, -СООН, -CONH 2 или Ar, где Ar обозначает незамещенный или замещенный арил, где арил обозначает фенил, нафтил; 5- или 6членное незамещенное или замещенное ароматическое гетероциклическое кольцо с одним или двумя гетероа.тома-ми, которые являются одинаковыми или разными и которые выбраны из серы, кислорода и азота; или 9- или 10-членную незамещенную или замещенную конденсированную бициклическую ароматическую гетероциклическую гр уппу с одним или двумя гетероатомами, которые являются одинаковыми или разными и выбраны из серы, кислорода и азота; Ry обозначает –СН2-, -О-, -S- или - NН-; и Rz обозначает связь или, вместе с Ry и тремя соседними атомами углерода, образует насыщенное карбоциклическое кольцо с 5-8 атомами, один атом из которых может представлять собой -О-, -S- или – NН-; r равно 1 или 2; и G обозначает-(CH2)s-R, где S=O-5; -СН=СН-(СН2)t -R, где t равно O-3; где D и Ε, каждый, независимо, обозначают N или СН; к равно О или 1; в равно О или 1; Μ обозначает S , О или MH; каждый W, независимо, обозначает N или СН; и R обозначает: -NH2 , или их фармацевтически приемлемые соли; или фармацевтически приемлемые сольваты вышеуказанных соединений или их соли; при условии, что А не обозначает водород или трет-бутил-оксикарбонил, когда G обозначает - (СH2)s-NHС(NH)NH2, У обозначает незамещенный пролинил (Rp обозначает водород) и Τ обозначает: и при условии еще, что В не обозначает амино или гуани-дино, когда r равно 1 и S равно О; и при условии еще, что А не обозначает водород, С1-С4 алкил, метилсульфонил или -(CH9)g -СООН, когда G обозначает -(СН2)s-R, где R обозначает; У обозначает гидроксипролинил (Rр обозначает ОН); R' обозначает водород; незамещенный пролинил (Rp обозначает водород) или 4 Τ обозначает циклогексил и Q обозначает - NН-А; и при условии еще, что Ρ’’SO2 не обозначает арилсульфонил, когда G обозначает -(СН2)S-R, где R обозначает и У обозначает незамещенный пролипил (Rp обозначает водород) или 4-метил-тиопролинил (Rp обозначает – SCH3), и Q = - NH-А; и при условии еще, что А не обозначает R''SO2-, когда G обозначает: Τ обозначает С1-С8 алкил, В дополнение к соединениям формулы (1), настоящее изобретение относится к фармацевтическим композициям, содержащим соединение формулы (1) в сочетании с фармацевтически приемлемым носителем, разбавителем или наполнителем. Настоящее изобретение также относится к способу ингибирования тромбоза у млекопитающих, который включает введение млекопитающему, нуждающемуся в лечении, антитромботической дозы соединения формулы 1. Настоящее изобретение, далее, относится к способу ингиби-рования тромбина, который включает введение млекопитающему, нуждающемуся в лечении, ингибирующей тромбин дозы соединения формулы 1. Изобретение относится к новым ингибиторам тромбина, фармацевтическим композициям, содержащим соединения в качестве активных ингредиентов, и к использованию соединений в качестве антикоагулянтов для профилактики и лечения тромбоэмболических заболеваний, таких как венозный тромбоз, легочная эмболия,артериальный тромбоз, в особенности, миокардиальная ишемия, инфаркт миокарда и церебральный тромбоз; состояний общей и локалькой гиперкоагуляции, таких, которые поступают вследствие ангиопластики и операций с коронарным шунтированием; и для генерализации тканевого повреждения, так как оно относится к воспалительному процессу. Термин "алкил" сам по себе или в качестве части другого заместителя обозначает алкильный радикал с линейной или разветвленной цепью, содержащий определенное число атомов углерода, такой, как метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, изобутил и втор-бутил. Термин "перфторалкил" сам по себе или в качестве части другого заместителя обозначает алкильный радикал с линейной или разветвленной цепью, содержащий определенное число атомов углерода, где каждый атом водорода замещен атомом фтора, такой как трифторметил, перфторэтил, пер-фтор-н-пропил, перфторизопропил, перфтор-н-бутил , перфтор-трет-бутил, перфторизобутил и перфтор-втор-бутил. Термин "С3-С8 циклоалкил" относится к насыщенный атгациклическим кольцам с 3-8 атомами углерода, таким как циклопро-пил, метилциклопропил," циклобутил, циклопентил, циклогексил, 4-метилциклогексил, циклооктил и т.п. Термин "алкокси" обозначает алкильный радикал с линейной или разветвленной цепью, имеющий определенное число атомов углерода, связываемый с другой частью молекулы атомом кислорода. Термин "галоген" обозначает хлор, фтор, бром или иод. Термин "ацетил" обозначает СН3-С(О). Термин "третбутилоксикарбонил" обозначает (СН3)3 С-О-С(О)- и обычно сокращается как "Вос". Термин "бензилоксикарбонил" обозначает С6Η5СН2-О-С(О)-и в сокращении представляет собой "Cbz". Термин "5- или 6-членное гетероциклическое кольцо" обозначает любое 5- или 6-членное кольцо, которое имеет стабильную структур у и содержит один или два атома азота; один атом серы; один атом кислорода, один атом азота и один атом серы; или один атом азота и один атом кислорода. 5-членное кольцо содержит одну или две двойные связи, а 6-членное кольцо содержит две или три двойные связи. Такие гетероциклические системы включают фурил, тиенил, пирролил, пиразолил, оксазолил, изоксазолил, тиазолил, изотиазолил, пиранил, пиридинил, пири-мидинил, пиразинил, оксазинил и тиазинил. Термин "9- или 10-членное гетероциклическое кольцо" обозначает любую бициклическую группу, в которой любое из вышеуказанных 5- или 6-членных колец конденсировано с бензольным кольцом или другим 6-членным гетероциклом, как указано выше, имеющую стабильную структуру. Эти гетероциклические системы включают индолил, бензотиенил, бензофурил, бензоксазолил, бензоизоксазолил, бензопиразолил, хинолинил, изохинолинил, бензимидазолил и бензотиазолил. Следует принять во внимание, что многие из вышеуказанных гетероциклов могут существовать в таутомерной форме. Все такие формы входят в рамки настоящего изобретения. Все перечисленные для определения Аr или R'' ароматические или гетероциклические группы, независимо, незамещены или замещены одним или двумя заместителями, приводящими к стабильной структуре независимо выбранными из галогена, гидроксила, С1-С4 алкила, С1-С4 алкоксила, амино (-NH2), моно-(С1-С4 алкил)амино, -(СН2)j; -СООН, меркапто, - S(O)h (С1-С4-алкила), -NHS(O)h (С1-С4 алкила), -NНС (О) (С1-С4 алкила), -S(О)hNН2, - S(Ο)hΝΗ (С1-С4 алкила) или - S(O)h N (C 1-C4-алкил)2, где h равен О, 1 или 2; и j равно O, 1, 2, 3 или 4. Особенно предпочтительным значение для заместителя R' ' (С) О - является 1-метилиндол-2-оил. В представленной формуле 1 карбонильный радикал X связан с амином радикала У. Карбонильный радикал У затем присоединен к аминогруппе, показанной в формуле 1. Группа , где Ζ и А, оба, обозначают водород, относится здесь к фенилглицилу и обозначается Phg. Соединения, где А обозначает, например, метил, относятся к Na - метилфенилглицильной группе и обозначаются MePhg. Замещенные соединения, где Ζ другой, чем водород, относятся по типу и положению заместителя, к замещенной группе, например, 3'-хлорфенилглицил или Ρhg (3-Cl). Группа , где Ζ и А, оба, обозначают водород, относится к фенилаланилу и обозначается Phe. Соединения, где А обозначает, например, метил, относятся к Na-метилфенилаланильной группе, обозначаются MePhe. Замещенные соединения, где Z др угой, чем водород, относятся по типу и положению заместителя, к замещенной группе, например, 3'-хлорфенилаланил или Phe(3-Cl). Группы: где R' обозначает водород, относится к 1- и 3-тетрагидро-изохинолин-карбонилу, соответственно, которые имеют соответственно аббревиатуры 1-Тiq, и З-Тіq. Группы: где R' обозначает водород, относятся к 1- и 3-пергидроизохинолинкарбонилу, соответственно, и имеют, соответственно, аббревиатуры 1-Рiq и 3-Рig. Как указано волнистыми линиями,существуют различные, образующие при конденсации циклов, изомеры этих заместителей; настоящее изобретение включает каждый индивидуальный изомер и их комбинации. Группы относятся к таким, как соответственно, и имеют, соответственно, аббревиатуру Pro и Azt. Группа: пролинил и азетидин-2-карбонил, обозначает насыщенную бициклическую систему 4,5; 5,5; 6,5; 7,5; или 8,5 - типа. Стереохимия в положении За представляет собой цис- по отношению к карбонилу; другая предмостиковая связь может быть любой цис- или транс-связью, за исключением 4,5- и 5,5-систем, где может быть цис-предмостиковой связью. Определения Ry и Rz предусматривают, что изменяемое кольцо, которое включает упомянутые три атома углерода, представляет собой насыщенную карбоциклическую систему с 4-8 атомами. Все атомы кольца могут представлять собой углерод, или одним из атомов кольца может быть гетероатом, выбираемый из -О-, S- и - NH-. Это определение включает предпочтительную составляющую, происходящую от октагидроиндол2-карбоновой кислоты, в аббревиатуре " Ohi ", как представлено формулой: Разные цис- и транс-формы этой структурной единицы входят в рамки настоящего изобретения. Знак в виде звездочки в радикале У обозначает хиральный центр, который является (L). Звездочка в радикале X обозначает хиральный центр, который представляет собой (D) или (DL); знак # в радикале X обозначает хиральный центр, который представляет собой (L). Кроме того, в зависимости от разветвления алкильных заместителей могут существо вать диастереомеры. Соединения настоящего изобретения включают как смеси двух или более диастереомеров, так и каждый индивидуальный изомер. Предпочтительные соединения настоящего изобретения включают такие соединения формулы 1, где X гомопролинил, 1- или 3-Tig , или 1- или 3-Piq , и У обозначает пролинил; и их фармацевтически приемлемые соли и сольваты. В особенности, предпочтительны все соединения, где Q обозначает NНА и А обозначает водород или сульфонамид (например, А=R''SO2), R' обозначает водород, Z обозначает водород и В обозначает водород. Также предпочтительны те соединения, где R обозначает гуанидино-группу или, особенно, амидино-группу. Одной особенно предпочтительной комбинацией заместителей является такая, где G обозначает Rзамещенный фенил (т.е. D=Е=СН, к равно О); в особенности, предпочтительны соединения, где G обозначает 4-амидинофенильную гр уппу. Предпочтительной группой таких соединений, где от одного до всех по-другому незамещенных атомов углерода ароматического или гетероароматического кольца: содержат в качестве заместителя фтор, является группа, в которой фтор-заместителя нет в a - или g положении к D или Е, когда D или Ε обозначает азот. Другая гр уппа предпочтительных соединений по настоящему изобретению включает такие соединения формулы 1, как определено выше, где X обозначает: где Τ обозначает циклогексил, а равно 1, R' обозначает водород и Q обозначает - NH-A. Одной особенной подгруппой является такая, в которой А обозначает водород. Второй особенной подгруппой является такая, в которой А обозначает R’’SO2-, в особенности, когда R''=этил. Третьей особенной подгруппой является такая, в которой А обозначает -(СН2)g -СООН; предпочтительно g равно 1. Особыми значениями У для соединения формулы 1, в которой x, r и G имеют выше указанные значения, являются (L)-пролинил (Pro), (S) -цис-октагидро-1Н-индол-2-карбонил (Оhі) и N-(2-фенилэтил)глицил [N РhСН2СH2 Glу]. Для соединения формулы 1, в которой Ε обозначает – ΝΗ2, предпочтительно, чтобы значения X и У выбирались из вышеопределенных и значения r и G выбирались из следующих: а) r равно 1 и G обозначает; атома фтора в качестве заместителей; где анилиновое кольцо может содержать один или два б) r равно 1 и G обозначает: в) r равно 1 или 2 и G обозначает: Одной предпочтительной группой соединений формулы 1 является такая, в которой У обозначает (L) пролинил, r равно 1 и G обозначает где каждый из D и Ε обозначает СH, к равно О и R обозначает амидино, и которая может быть представлена формулой (1а): где бензамидиновое кольцо незамещено или может содержать один или два атома фтора заместителей, предпочтительно, в мета-положении к амидиновому радикалу, и X имеет вышеуказанных значений. Наиболее предпочтительным значением для соединения формулы 1а является такое, бензамидиновое кольцо незамещено. Другой особенно предпочтительной группой соединений формулы (1) является такая, в обозначает (L)-пролинил, r обозначает 1 и G обозначает: в качестве любое из в котором которой У где Μ обозначает серу, каждый W обозначает СН и R обозначает амидино, и которая может быть представлена формулой (1 б): где X имеет любое из вышеуказанных значений. Дополнительной предпочтительной группой соединений формулы 1 является такая, в которой У обозначает (L)-пролинил, r =1 и G обозначает : где D обозначает азот или СН, "к" равно О и R обозначает амидино, и которая может быть представлена формулой (1с): где X имеет любой из вышеуказанных значений и D обозначает азот или СН. Предпочтительным значением для X в соединении формул 1а, 1b или 1с является: где R' обозначает водород, а равно 1, Τ обозначает циклогексил или фенил и Q обозначает -NH-А. Более предпочтительно, А обозначает водород, этилсульфонил или карбоксиметил. Одним особенно предпочтительным значением для X является N -карбоксиметил-D-циклогексилаланил. Другим предпочтительным значением для X является N -карбоксиметил-D -фенилаланил. Специфические соединения формулы 1 изобретения описаны в примерах. Предпочтительный тип соединения, который может быть использован в качестве фармацевтически приемлемой соли или со-львата, может быть выбран из соединений, полученных в примерах 15, 18, 23, 44, 45, 46, 48, 49,51, 52, 56, 65, 66, 68, 69, 70, 71, 72, 80, 86, 87, 88 и 92. Более предпочтительные соединения могут быть выбраны среди соединений, описанных в примерах 45, 46, 48, 51, 65, 70, 71 и 72. Один из наиболее предпочтительных типов, на основании их неожиданно превосходных свойств, представлен в примере 48. Другим очень предпочтительным типом соединений является по примеру 65. Как указано выше, изобретение включает фармацевтически приемлемые соли соединений доставленной выше формулы 1. Конкретное соединение по настоящему изобретению может содержать одну или более достаточно основных функциональных групп, и, в соотве тствии с этим, может реагировать с любой из числа неорганических и органических кислот с образованием фармацев-тически приемлемой соли. Обычно используемыми кислотами для получения солей присоединения являются неорганические кислоты, такие как хлористоводородная кислота, бромистоводородная кислота, иодистоводородная кислота, серная кислота, фосфорная кислота и т.п., и органические кислоты, такие как п-толуолсульфокислота, метансульфокислота, щавелевая кислота, п-бромфенил-сульфокислота, карбоновая кислота, янтарная кислота, лимонная кислота, бензойная кислота, уксусная кислота и т.п. Примерами таких фармацевтически приемлемых солей являются такие соли,как сульфат, пиросульфат, бисульфат, сульфи т, бисульфит, фосфат, моногидрофосфат, дигидрофосфат, метафосфа т, пирофосфат, хлорид, бромид, иодид, ацетат, пропионат, деканоат, каприлат, акрилат, метоксибензоат формиат, изобутират, капроат, гептаноат, пропионат, оксалат, малонат, сукцинат, суберат, ссбацинат, фумарат, малеат, бутин-1,4-диоат, гексии-1,6-диоат, бензоат, хлорбензоат, метилбензоат, динитробензоат, гидроксибензоат, фталат, сульфонат, ксилол-сульфонат, фенилацетат, фенилпропионат, фенилбутират, цитрат, лактат, гамма-гидроксибутират, гликолят, тартрат, метансульфонат, пропансульфонат, нафталин-1-сульфонат, нафталин-2-сульфонат, манделат и т.п. Предпочтительными фармацевтически приемлемыми солями присоединения кислот являются образованные неорганическими кислотами, такими как хлористоводородная кислота, бромистоводородная кислота и серная кислота. Соединения по настоящему изобретению могут образовывать гидраты и сольваты с соответствующими растворителями. Предпочтительными растворителями для получения сольватных форм являются вода, спирты, тетрагидрофуран, ДМФ и ДМСО. Предпочтительными спиртами являются метанол и этанол. В зависимости от размера молекулы растворителя могут быть выбраны другие соответствующие растворители. Маленькие молекулы растворителя предпочтительны для облегчения соответствующего образования сольвата. Сольват или гидрат обычно образуются в процессе перекристаллизации или в процессе образования соли. Подходящей ссылкой в отношении сольватов является Sykes, Peter, A Guidebook to mechanism in Organic Chemistry, 6-е изд., (1986, John Vіley and Sons, Нью-Йорк). В качестве используемого в настоящем изобретении, термин "сольват" включает гидратные формы, такие как моногидраты и дигидраты. Соединения формулы 1 получают известными методами связывания пептидов. Согласно одному такому методу, кислоту формулы Р-Х'-СООН, где -X'-С(О)- обозначает -Х-, имеющий указанное для формулы 1 значение, и Ρ обозначает аминозащитную гр уппу,если необходимо, вводят в реакцию присоединения с карбоксилзащищенным У-соединением с получением дипептида (а). Карбоксизащитную сложыоэфирпую группу У-радикала затем удаляют (снятие защиты или деэтерификация) и свободнокислотную форму дипептида (в) связывают с защищающим реагентом (d). Вышеуказанная реакционная последовательность иллюстрируется следующей схемой 1: где G’ имеет такое же значение, что и G, за исключением R обозначает -CN, -ΝΗΡ, ; каждый Ρ представляет аминозащитную гр уппу, если необходимо, Р' обозначает Η или Р; alk обозначает низший алкил или подобную защитную карбоксикислотную группу; и –У’имеет такое же значение, что и У, представленный с амино- и карбоксильной функциональными группами, т.е. -У- имеет такое же значение, как -N -У'-С(О)-. Если она имеется, циано-группу в G' переводят в значение 5; и защитную группу в (с) затем удаляют известными специалистам способами, такими как гидрирование в присутствии металлического катализатора с получением соединений формулы 1. Связывание Р-Х'-СООН производного с HN-У'-COO-аlк проводят сначала защитив аминогруппу аминокислоты, если она есть. Используют обычные аминозащитные группы, обычно применяемые для временной защиты или блокирования аминогруппы. Аминозащитная группа относится к заместителям аминогруппы, обычно используемым для блокирования или защиты аминогруппы в процессе взаимодействия других функциональных групп соединения. Примерами таких, аминозащитных групп являются формильная группа, тритильная группа, фталимидогруппа, трихлорацетильная группа, хлорацетильная, бромацетильная и иодацетильная группы; блокирующие гр уппы уретанового типа, такие, как бензилоксикарбонил, трет-бутоксикарбонил, 4-фенилбензилоксикарбонил, 2метилбензилоксикарбонил, 4-метоксибензилоксикарбонил, 4-фторбензилоксикарбонил, 4хлорбензилоксикарбонил, 3-хлор-бензилоксикарбонил, 2-хлорбензилоксикарбонил, 2,4дихлорбензилоксикарбонил, 4-бромбензилоксикарбонил, 3-бромбензилоксикарбонил, 4нитробензилоксикарбонил, 4-цианобензилоксикарбонил, 2-(4-ксенил) изопропоксикарбонил, 1,1-дифенилэт-1илоксикарбонил, 1,1-дифенилпроп-1-илоксикарбоиил, 2-фенилпроп-2-илоксикарбонил, 2-(п-толуил)-проп-2илоксикарбонил, циклопентанилоксикарбонил, 1-метилциклопентанилоксикарбонил, циклогокеанилоксикарбонил, 1-метилциклогексанилоксикарбонил, 2-метилциклогексанилоксикарбонил, 2-(4толуилсульфонил)этоксикарбонил; 2-(ме-тилсульфонил)этоксикарбонил, 2-(трифенилфосфино)этоксикарбонил, 9-фтоенилметоксикарбонил ("FMOC"), 2-(триметилсилил)этоксикарбонил, аллилоксикарбоиил, 1(триметилсилилметил)-проп-1-енилоксикарбонил, 5-беызизоксазолилметоксикарбонил, 4-ацетоксибензилоксикарбонил, 2,2,2-трихлорэтоксикарбонил, 2-этинил-2-пропоксикарбонил, циклопропилметоксикарбонил, 4-(децилокси) бензилоксикарбонил, изоборнилоксикарбонил, 1пиперидилоксикарбонил, и т.п.; бензоилметилсульфонильная группа, 2-(нитро)фенилсульфенильная группа, дифенилфосфиноксидная группа и тому подобные аминозащитные группы. Тип используемой аминоэздитной группы не является ограничивающим, только эта замещенная аминогруппа должна, быть стабильной в условиях последующего (их) взаимодействия (ий) по другим положениям молекулы и может быть удалена в соответствующий момент без затрагивания остальной части молекулы. Предпочтительными, аминозащитными группами являются бензилоксикарбонил, аллилоксикарбонил, трет-бутоксикарбонил и тритил. Подобные аминозащитные группы, используемые в цефалоспорине, пенициллине и пептидах, следовательно, охватываются выше указанными терминами. Дальнейшие примеры групп, относящихся к вышеуказанным терминам, описаны J. W. Barton. - Protective Groupg in Organic Chemistry", J. G.WcOm/e, Ed., - Plenum Press, New Уоrk, N.Y., 1973, Chapter 2, and - T.W.Greene, "Protective Groups in Organic Synihesis", John Wiley and Sons, New York, N.Y., 1981, глава 7. Родственный термин "защищенная амино-группа"определяет амино-группу, замещенную защитной для аминной функции группой, обсужден выше. При осуществлении реакции связывания, для HN -У'-СООН используют сложноэфирную защитн ую гр уппу, которая удаляется в условиях, при которых аминозащитная группа остается незатронутой. Аминозащитная группа ацилирующей кислоты Р-Х'-СООН таким образом сохраняется для защиты амино-группы в течение последующего сочетания с амином (d) при образовании (с). Карбоксизащитная сложноэфирная группа, как используемая в описании, относится к одному из сложноэфирных производных карбоновой кислоты, обычно используемых для связывания или защиты карбоксильной группы при проведении реакций на других функциональных группах соединения. Примеры таких, защитных для карбоновой кислоты групп включают С 1-С4 алкил, бензил, 4-нитробензил, 4метоксибензил, 3,4-диметоксибензил, 2,4-диметокси-бензил, 2,4,6-триметоксибензйл, 2,4,б-триметилбензил, пентаметилбензил, 3,4-метилендиоксибензил, бензгидрил, 4,4'-диметоксибензил, 2,2', 4,4'тетраметоксибензгидрил, трет-бутил, трет-амил, тритил, 4-метокситритил, 4,4'-диметокситритил, 4,4', 4''триметокситритил, 2-фенилпроп-2-ил, триметилсилил, трет-бутил-диметилсилил, фенацил, 2,2,2трихлорэтил. b-(триметилсилил) этил, b-(ди(н-бутил)метилсилил)этил, п-толуолсуль фонилэтил, 4нитробензилсульфонилэтил, аллил, циннамил, 1-(триметилсилил-метил)-проп-1-ен-3-ил, и т.п. группы. Тип используемой для карбоксизамещенной группы не является определяющим, поскольку преобразованная карбоновая кислота стабильна в условиях последовательной(ых) реакции (реакций) по другим положениям молекулы, и защитная группа может быть удалена в соответствующий момент без затрагивания остальной части молекулы. В частности, важно не подвергать молекулу с защи щенной карбоксильной группой воздействию сильных нуклеофильных оснований или восстановительных условий с использованием катализаторов на основе высокоактивированного металла, такого, как никель Ренея. (таких жестких условий для удаления защитной группы, следует также избегать при удалении аминозащитных групп, как это обсуждается далее). Кроме того, примеры этих гр упп имеются у Ε.Haslam, - Protective Groupg in Organic Chemistry", J. G.W McOmie, Ed., - Plenum Press, New Уоrk, N.Y., 1973, Chapter 2, and T.W.Greene, - "Protective Groups in Organic Synihesis", John Wiley and Sons, New York, N.Y., 1981, Chapter 5. Соединения формулы 1 также могут быть получены путем синтеза сначала амидного предшественника NH –У’ -CONH (СН2)r –G’ и затем реакции с защищенной Х-группой. Согласно одному такому способу, (d) получают и связывают с PN-У'-СООН (g), как показано ниже, с получением амида (h): где Ρ обозначает аминозащитную гр уппу, такую, как бензилокси-карбонил (Cbz), трет-бутоксикарбонил (Воc), п-толуолсульфонил и т.п. Предпочтительно, используемая аминозащитная группа удаляется путем гидрирования или обработки слабой кислотой (например, трифторуксусной кислотой) или сильной кислотой (например, НСl). Примеры других подходящи х аминозащитных гр упп приводятся в "Protective Groups in Orqanic Synthesis", второе издание, Т.U.Greene and Peter G.Μ. Wuts глава 7, страницы 309-405 (1991), John Wiey and Sons, Inc. Группу Воc или другую подходящую защитную гр уппу удаляют с аминного азота У-остатка, который затем ацилируют с помощью желаемой аминокислотной ациль-ной группы с получением дипептида, как показано далее: Циано-группу, если она имеется в G', преобразуют и защитные группы на (с) удаляют так, как описано выше. Связывание соединения Р-Х'-СООН осуществляют п утем сначала защиты амино-группы аминокислоты, если она есть. Применяют стандартные аминозащитные группы, обычно используемые для временной защиты или блокирования амино-группы. Примеры таких защитных групп описаны выше. Вышеописанные реакции связывания проводят при охлаждении, предпочтительно при температуре между около -20°Си около 15°С. Реакции связывания проводят в инертном органическом растворителе, таком, как диметилформамид, диметилацетамид, тетрагидрофуран, метиленхлорид, хлороформ и т.п., и как в обычных растворителях, так и в смесях таких растворителей. Обычно, когда, в реакциях связывания используют активный сложный эфир ацилирующей кислоты, применяют безводные условия. Промежуточные продукты (d) и (а) получают стандартными методами органической химии, как представлено на следующи х схемах: где -К-R' oбозначает -(СН2)r -G. Согласно вышеприведенным последовательностям, защищенные гуанидины могут быть получены путем двойной защиты S-метил-изотиомочевины. Предпочтительной защитной группой является группа третбутилоксикарбонил (Воc), которая может быть введена путем взаимодействия S-метилизотиомочевины в присутствии ди-трет-бутилдикарбоната. Часто используют образующуюся соль кислоты с Sметилизотиомочевиной, которая может быть переведена в свободное основание in sіtu путем растворения соли в воде и обработки водным основанием. Ди-трет-бутилдикарбонат затем вводят в реакцию в смешивающемся с водой растворителе, таком, как трет-бутанол, с получением, дважды защищенной Sметилизотиомочевиной. Желаемый дважды защищенный гуанидин затем получают путем обработки с помощью соответствующего диамина Н 2N -K- NH2 в инертном растворителе или комбинации растворителей. Обычно эффективно использовать смешивающиеся с водой растворители, такие, как диметилформамид или воду, или и х смеси. Такая реакция обычно заканчивается полностью по истечении 3-72 часов. Полученный в результате защищенный гуанидин затем может быть связан, как описано выше, с получением защищенных промежуточных продуктов соединений формулы 1, где Для соединений формулы 1, где R=-NН2, промежуточным соединением является однозащищенный диамин. В большинстве случаев этот промежуточный продукт может быть получен просто взаимодействием незащищенного диамина с одним моль-эквивалентом защитного реагента. Другие методы получения целевого амина (R=-NH2) общеизвестны химикам-органикам. Например, амин может быть получен из любого другого предшественника функциональной группы, например, нитро- или циано-группы. В случае нитрогруппы преобразования в амино-группу обычно осуществляют на таких вещества х, где нитро-группа непосредственно присоединена к ароматическому кольцу, в частности, к фенильной группе. В таких случаях нитрофенильную группу восстанавливают до соответствующего анилина с помощью какого-либо из многих известных специалисту методов. Одним особенно эффективным методом является обработка нитросоединения гидросульфитом натрия в нереакционноспособном растворителе, таком как этанол, вода, или их смеси. Когда нитросоединение кипятят с обратным холодильниником в смеси воды с этанолом в присутствии гидросульфита натрия, то восстановление полностью заканчивается за несколько часов. Цианогруппа может быть восстановлена, при желании, в присутствии восстановителя, такого как литийалюминийгидрид, борлн, в растворителе, таком, как тстрагидрофуран, или путем восстановления боргидридом натрия, прокотированным металлом. Амидины по настоящему изобретению также могут быть получены из нитрильного предиественника. Специалисту известно множество способов осуществления этого превращения. В частности, использование сероводорода в смеси пиридина и триэтиламина с последующей обработкой ацетоном и метилиодидом и, наконец, ацетатом аммония в метаноле представляет собой предпочтительный и эффективный способ осуществления этого преобразования. Альтернативно, для осуществления этого превращения также можно использовать нагревание нитрила с гидрохлоридом гидроксилами основанием, таким, как Ν, N-диизопро-пилэтиламин, в содержащем гидроксильную группу растворителе, таком как этанол, с последующим каталитическим гидрированием (например, гидрирование на палладии-на-угле). Этим способом получают гидроксиамидин в виде промежуточного продукта, который может быть выделен, если желательно. Другие соединения, используемые в качестве исходных материалов в синтезе соединений по настоящему изобретению,хорошо известны и, при отсутствии их в продаже, легко синтезируются обычными способами, обычно используемыми для этой цели специалистом. 4-замещенные пролины (Rp=C1-С6, алкил, С3-С8 циклоалкил, или -(СН2)p-L-(СН2)q -т'), которые используют для получения соединений по настоящему изобретению, все имеют цис-конфигу-рацию заместителя в положении 4 по отношению к карбонильной группе. Промежуточные соединения для введения этой функциональной группы в соединения формулы 1 получают обычными способами. Например, 4-замещенные пролиновые производные, где Rр-группа содержит метиленовую группу в точке присоединения пролинового кольца, могут быть получены следующим образом: где R4=R3СН2=Rp-гр уппа, содержащая метиленовую гр уппу в месте присоединения к пролиновому кольцу. 4-Гидроксипролин (как цис-, так и транс-формы являются коммерчески доступными), сначала защищают аминозащитной группой, причем в этом случае особенно пригодна Свz-группа. Полученное в результате промежуточное соединение затем этерифицируют до сложного эфира (особенно пригодны метиловый и особенно, этиловый сложные эфиры) и затем окисляют с получением соответствующего кетона. Это окисление осуществляют в условиях любого из множества способов окисления, таких как окисление по Jones или с помощью пиридинийхлорформиата, особенно пригодным для этого превращения является использование пиридинийхлорформиата в сухом нереакционноспособном растворителе, таком, как дихлормстан. Когда реакцию проводят в течение 8-16 часов, то при комнатной температуре взаимодействие обычно полностью заканчивается. Это многофункциональное кетоновое промежуточное соединение затем вводят во взаимодействие с соответствующим реагентом Виттига для получения желаемого олефина. Обычно соответствующий, Rp-замещенный трифенилфосфонийгалогенид добавляют к сухому инертному растворителю (например, тетрагидрофуран), который содержит сильное основание (например, трет-бутоксид калия). Вводят кетон спустя примерно три часа при комнатной температуре может быть выделен желаемый промежуточный олефин. С целью получения хороших выходов оле фина, предпочтительно использовать 0,40,6-мольный избыток реагента Виттига по отношению к кетону. Оле фин затем восстанавливают до желаемого Б^-замещенного пролина с помощью стандартных методов восстановления. Каталитическое гидрирование является наиболее легким способом осуществления этого превращения в лаборатории. Гидрирование олефина в присутствии катализатора (например, 5%-ный палладий-на-угле) в инертном растворителе, таком как этанол, эффективно при атмосферном давлении. В случае таких промежуточных продуктов, в которых аминозащитной группой является Свz, гидрирование также удаляет защитную гр уппу, что приводит к соединению, которое может быть использовано для связывания с Р-Х'-СООН. Как следует учесть специалисту, этот способ не может быть эффективным для получения соединений, где R p-группа присоединена к пролиновому кольцу через гетероатом или являются ароматическим кольцом. Таким образом, в вышеприведенной схеме, R должен означать алкил, аралкил (например, бензил), (циклоалкил)алкил, и т.д. Соответствующий способ получения этих промежуточных продуктов представлен в следующей схеме: Вышеприведенная реакционная схема альтернативна вышеописанной реакции Виттига и пригодна для получения соединений, которые не могут быть получены с помощью реагентов Виттига. Так, для получения промежуточных продуктов, где Ra обозначает алкил, фенил и т.п., промежуточный пирролидинон вводят во взаимодействие с соответствующим реактивом Гриньяра. Обычно используют незначительный молярный избыток реактива Гриньяра, работая обычно при низкой температуре (например, от -80 до -60°С), в низкозамерзающем инертном растворителе, таком, как тетрагидрофуран. После добавления реагентов, реакционнойсмеси можно дать нагреться до комнатной температуры, после чего реакция обычно полностью заканчивается за несколько часов. Полученное промежуточное соединение дегидратируют, например, обработкой трифторуксусной кислотой. Промежуточное 3,4-дегид-росоединение затем восстанавливают до желаемого промежуточного цис-соединения в тех же условиях восстановления, что описаны выше для восстановления олефинового промежуточного продукта. Промежуточные соединения, где гетеро-"L"-группой является кислородом и она непосредственно присоединена к пролиновому колкцу (т.е. р=0) , можно получать по реакции mitsunobu (mіtsunobu, Synthesis, 1 (1981)): По этой реакции сложный эфир транс-гидроксипирролидин-карбоновой кислоты обрабатывают трифенилфосфином в растворителе, таком как тетрагидрофуран, в присутствии Ar-0-Н. Смесь охлаждают примерно до 0°С и добавляют диэтилазодикарбоксилат. После нагревания до комнатной температуры реакционную смесь обрабатывают с получением желаемого промежуточного цис-продукта. Тогда как вышеприведенная схема представляет реакцию для соединения, где L= -О-, р=q=O, и Т=Аr , эта реакционная последовательность пригодна для получения других соединений, где р=O и L= -O-. Промежуточные соединения, где U обозначает серу и присоединено непосредственно к кольцу, могут быть получены сначала преобразованием гидрокси-группы в тозилатную или другую подобную удаляемую группу и последующим замещением тиолятанионом (см., например, Krapcho и др., J.Med., Chem.; 31, 11481160 (1988); Smith и др,. J.med. Chem., 31 875-855 (1988)). Промежуточные продукты, где L обозначает азот, присоединенный непосредственно к кольцу, могут быть получены сначала преобразованием гидрокси-группы в тозилатную или другую подобную удаляемую группу и последующим замещением азидом. Азид можно восстанавливать известными методами и затем алкилировать с получением желаемой функциональной группы, (см., например, Smith и др., J. med. Chem., 31, 875-855 (1988)). Соединения по настоящему изобретению, содержащие цис-Ohi -функциональную группу, получают путем синтеза этилового эфира (S)-индолин-карбоновой кислоты из соответствующей кислоты (см. Vincent и др., Druq Design and Discovery, т.9, с.11-28 (1992)) и восстановления этого промежуточного продукта гидрированием над 5% Pd/C в этаноле с получением сложного'эфира октагидроиндол-2-карбоновой кислоты, обычно называемого Ohi -эфиром, как представлено ниже: Соединения по настоящему изобретению, содержащие транс-Ohi-функциональную группу, получают по методу Vincent и др., Drug Design and Discovery, т.9, с.11-28 (1992)). Этот синтез представлен на схеме, показанной ниже: Соединение по настоящему изобретению, содержащее бициклическую систему с гетероатомом или без него, может быть получено по методу Teetz и др.; Tetrahedron Letters, 25, 4479 (1984). Обычная схема получения следующая: 42. где Р обозначает защитную гр уппу и R x обозначает алкил. Промежуточные соединения для введения N -замещенной глициновой функциональной группы (y), используемые для получения соединений по настоящему изобретению, получают обычными методами. Например, сложный галогенацетатный эфир, такой, как трет-бутилбромацетат, может быть преобразован в желаемое замещенное соединение путем обработки с помощью соответствующего первичного амина: Трет-Бутил-бромацетат подвергают взаимодействию с соответствующим амином сами по себе или, предпочтительно, в нереакци-онноспособном растворителе, таком как спирт. Предпочтительно использовать мольный избыток амина для интенсификации реакции до ее полного протекания. Предпочтительно, реакционная смесь также содержит нереакционноспособный акцептор кислоты, такой как, по крайней мере, мольный эквивалент триэтиламина. Тогда как реагенты обычно объединяют при охлаждении (например, О°С), реакцию обычно проводят при нагревании до комнатной температуры, после чего реакция завершается полностью за 24 часа. Хотя бромацетат является предпочтительным, для этого превращения можно использовать другие галогенацетаты, такие, как иодацетаты и хлорацетаты. Может быть подобным образом использованы другие сложноэфирные группы. Трет-Бутиловый сложный эфир является предпочтительным, поскольку он может позже быть легко удален при последующей обработке анизолом и трифторуксусной кислотой. Второй способ получения этих промежуточных продуктов представлен следующей реакционной схемой: где R°-СН2-обозначает Rg -группу, содержащую незамещенную метиленовую гр уппу, соседнюю с местом присоединения к глициновой группе. В вышеприведенной реакционной схеме, соответствующий альдегид смешивают с глициновым сложным эфиром в нереакцион-носпособном растворителе, таком как метанол или этанол. Если используют образовавнуготся соль сложного глицинового эфира, то может быть добавлен мольный эквивалент основания, такого как гидроксид калия, для получения свободного основания сложного аминоэфира. Взаимодействие альдегида со сложным глициновым эфиром приводит к образованию промежуточного основания Шиффа, которое затем можно восстанавливать in situ путем обработки восстановителем, таким как цианоборгидрид натрия. Образование основания Шиффа происходит обычно в течение менее часа; восстановление обычно заканчивается счустя 10-15 часов. Сложные метиловые или этиловые эфиры, пригодные в качестве этих гр упп, могут быть удалены (снятие защиты) путем обработки гидроксидом лития в водном диоксане. Использование соответствующего кетона вместо альдегида R°-СНО приводит к получению промежуточных продуктов, где метиленовая группа, связанная с глицинамином, замещена. Альтернативно, и особенно для тех соединений, где Rg обозначает Аr (т.е. без введения алкильной группы), предпочтительно получать промежуточное соединение Р-Х'-СО NНАr обычными способами (например, путем взаимодействия активированной формы Р-Х'-СООН с АrNН2) и затем взаимодействия этого промежуточного соединения с алкилгалогенацетатом, как описано выше, с получением Р-Х'-СОNНАr – СН2СОО-алкила, который затем далее может быть преобразован обычным путем. Многие целевые соединения по настоящему изобретению или промежуточные продукты для их получения может быть взаимопреобразованы стандартными методами. Например, арильные соединения, которые замещены нитрогруппой, могут быть восстановлены (например, в присутствии гидросульфита натрия в нереакционно-способном растворителе, таком, как этанол, вода или их смесь). Когда нитросоединение кипятят с обратным холодильником в смеси вода/этанол в присутствии гидросульфита натрия, восстановление обычно полностью завершается за несколько часов. Полученный в результате амин может присутствова ть в целевом продукте; если амин имеется в промежуточном продукте, то может быть желательным образование его в его целевую желаемую форму (например, ацилирование с получением ацилированного амина) или защита для избежания побочных реакций в гроцессе осуществления последовательности химических реакций. Если желательным соединением является свободный амин, то в этом случае особенно пригодной является Cвz -защитная группа. Другие превращения и взаимопревращения этого типа известны химикам-органикам. Как ясно специалистам, вышеуказанные преобразования могут быть осуществлены при использовании исходных веществ указанных выше, или в большинстве случаев также можно получать промежуточные диили трипептиды, содержащие одну и ту же соответствующую функциональную группу. В последних случаях может отпадать необходимость или потребность защиты различных гр упп; следовательно, порядок и тип химических реакций диктуется необходимостью и типом защитных гр упп, а также последовательностью осуществляемых реакций. Также специалисту понятно, что можно выбрать другие защитные группы для того, чтобы они служили целям защиты функциональной группы в процессе последовательности химических реакций, но также могут быть удалены при соответствующи х условия х и в соответствующем порядке с учетом последовательности превращений. Например, в вышеприведенной схеме 1 G' включает заместители, где R обозначает -CN; эта нитрильная группа может быть преобразована в амидии или восстановлена до амина, которые могут быть необязательно далее преобразованы в гуанидины по настоящему изобретению. Соединения по настоящему изобретению лучше всего выделять в виде солей присоединения кислот. Соли соединений формулы 1, образованные из кислот, таких как указанные выше, пригодны в качестве фармацевтически приемлемых солей для введения в качестве антитромботических агентов и для приготовления составов этих агентов. Др угие соли присоединения кислот могут быть получены и использованы для выделения и очистки пептидов. Например, также могут быть использованы соли с сульфокислотами, такими как метансульфокислота, н-бутансульфокислота, п-толуол-сульфокислота и нафталинсульфокислота. Соединение формулы 1 получают: а) путем одновременного или последовательного удаления защитной группы (групп) Ρ из соответствующего соединения формулы П: (P)X - У - NH - (CH2 )r - G(P) П, где (Р)Х обозначает радикал X, который может содержать одну или более защитных групп Р, независимо выбранных из аминозащитной группы Ρ для соединения формулы 1, где X включает основной NН радикал, и карбоксизащитную группу Ρ для соединения формулы 1, где X включает карбоксиостаток и G(P) обозначает радикал G, который может содержать одну или более независимо выбранных аминозащитных гр упп Р; или б) для соединения формулы 1, где R обозначает: путем гидрирования соответствующего соединения формулы 1, где R обозначает: и затем, когда необходима соль соединения формулы 1, образования соли с фармацевтически приемлемой кислотой. Может быть предпочтительным проведение способа б) одновременно со способом а). Для соединения формулы 1, в которой кислотнозащитной группой является трет-бутиловый сложный эфир и/или аминозащитными группами являются трет-бутилоксикарбонил, защитная(ые) группа (группы) могут быть удалены обработкой сильной кислоты, такой как трифторуксусная кислота или безводный хлороводород в инертном растворителе, таком, как диоксан или дихлорметан, в присутствии анизола. Для соединения формулы 1, в которой кислотнозащитной группой является сложный бензиловый эфир и/или аминозащитной группой является бензилок-сикарбонил, защитная(ые) группа (группы) могут быть удалены путем гидрирования, обычно осуществляемого в этанольном хлоро-водороде в присутствии палладия-на-угле в качестве катализатора. Предпочтительным способом очистки соединений формулы 1, при одновременном получении желаемой стабильной солевой формы, является способ, описанный в патенте США 5 250 660. Согласно этому способу, стабильные сульфаты или гидрохлориды получают путем очистки препаративной хроматографией с С 18, обращенной фазой, при которой водный компонент содержит серную кислоту или соляную кислоту при рН=2,5 и органическим компонентом является ацетонитрил. рН кислой подвижной фазы доводят до величины примерно от рН=4 до примерно 6 с помощью анионообменной смолы в гидроксильной форме, например, как BiO – Rad AG-1X8. После установления рН раствор соли сульфата трипептида или гидрохлорида трипептида лиофилизуют с получением чистой соли в сухой порошкообразной форме. Например, согласно способу, сырой D-Phe-Pro-р-NH CH 2C6H4C(NH)NH2 -сульфат можно растворять в воде и раствор вводить в колонку размером 5см x 50см с фазой Vydac Cl8RP ВЭЖХ. Используют градиент 2-10% В (А=0,01% Н2SO4; В=ацетонитрил) в течение 10 часов. Многочисленные фракции собираюи и те, в которых содержится продукт, определяемый с помощью аналитической R Ρ ВЭЖХ, объединяют. рН объединенных фракций доводят до 4,0-4,5 с помощью смолы AG-1X8 в гидроксидной форме ( Bio- Rad, 3300 Ragatta Blvd., Richmond, CA 94804). Раствор фильтруют и фильтрат лиофилизуют с получением чистого D-, L -диамида в виде сульфатной соли. Оптически активные изомеры диастереомеров по радикалу X также составляют часть настоящего изобретения. Такие оптические активные изомеры можно получать из соответствующи х оптически активных предшественников путем вышеописанных способов, или путем разделения рацемических смесей. Это разделение можно осуществлять путем получения производных с хиральным реагентом и последующим хроматографированием или путем повторной кристаллизации. Удаление хирального вспомогательного соединения обычными методами приводит, по существу, к оптически чистым изомерам соединений по настоящему изобретению или к их предшественникам. Подробности в отношении разделений могут быть установлены из Jасques и др., Enantiomers,; Racemates, and Resolutions, John Wiley and Sons, 1981. Соединения, используемые в качестве исходных ве ществ в синтезе соединений по настоящему изобретению, хорошо известны и, если их нет в продаже, легко синтезируются стандартными способами, обычно используемыми для этой цели специалистами. Следующие далее примеры относятся далее к описанию изобретения и к соответствующим сравнительным примерам, но они не ограничивают объем охраны изобретения. Используемые в настоящем описании аббревиатуры имеют следующее значение: Аминокислотные остатки: Аrg=аргинил; Glu =глутамил; Сlу=глицил ; Рrо=пролил ; hPro =гомопролил; Αzt =азетидин -2-карбонил; Phq =фенилглицил; Рhе=фенилаланил ; hPhe =гомофенилаланил; 1-Тiq=1, 2, 3, 4 тетрагилроизохинолин-1-карбонил; 3-Τίq=1, 2, 3, 4-тетрагидроизохинолин-3-карбонил; Cha= bциклогексилаланил; hCha = a-амино-g-циклогексилбутирил; N Мl=N-метилиндол-2-оил; Оhi=цисоктагидроиндол-2-оил; 1-Рiq=пергидро-изохинолин-1-карбонил; 3-Рiq=пергидроизохинолин-3-карбонил; Met = метионил; Met (O2) = S, S -диоксометионил. Аgm=агматин; Воc = трет-бутилоксикарбонил; Вn = бензил; Cвz = бензилоксикарбонил; ДЦК = дициклогексилкарбодиимид; ДМФ = диметилформамид; Et = этил; ДМСО = диметилсульфоксид; EtOAc = этилацетат; Et2O = диэтиловый эфир; EtOH = этанол; Fmoc = 9-флуоренилметоксикарбонил; FAB-MS = масс-спектр, получаемый путем бомбардировки быстрыми атомами; FD-MS=масс-спектр с десорбцией поля; 1 S-МS =масс-спектр, получаемый при применении пучка электронов; HRMS = масс-спектр высокого разрешения; НОВТ = 1-гидроксибензотриазол-гидрат; ИК = инфракрасный спектр; RPHPLC =высокоэффективная жидкостная хроматография с обращенными фазами; Ph = фенил; TFA=TФК= трифторуксусная кислота; ТГФ = тетрагидрофуран; ТСХ = тонкослойная хроматография. Используют следующие параметры для высокоэффективной жидкостной хроматографии с обращенными фазами: растворитель А: 0,05% водный раствор соляной кислоты (1,5 мл концентрированной соляной кислоты в 3 л воды); растворитель В: ацетонитрил; градиент: как указано в каждом примере; Метод 1: колонка: 2,5 х 25см, фаза Vydac C18 ; объемная скорость потока: 5мл/мин.; Метод 2: колонка: 5см x 25см; фаза: Vydac C18; объемная скорость потока: 10мл/мин.; Метод 3: колонка: 2,5см x 50см; фаза Vydac С18; объемная скорость потока: 10мл/мин. Если не указано ничего другого, установление и достижение рН осуществляют с помощью водных растворов кислоты или основания . В примерах, где указывается 1Н-ЯМР, продукт, полученный в реакции, охарактеризован данными протонного магнитного резонанса, подтверждающими, что получено указанное соединение; ИК без предоставления данных указывает, что получен удовлетворительный инфракрасный спектр. НВМS используют для подтверждения точной массы соединений, для которых не получен удовлетворительный элементный анализ, продукта по желаемому способу; указывается элементарный состав наблюдаемого иона (например, МН+). Пример 1 A) Получение Boc-D-Phe-Pro-ОВn. К раствору Boc-D-Phe-OH (89,1г, 336ммоль), Pro-ΟΒn -гидрохлорида (81,2г, 336ммоль) HОВТ (50г, 370ммоль) и N , N -диизопропилэтиламина (176мл, 1,008ммоль) в дихлорметане (600мл) при 0°С добавляют 1-(3-диметиламинопропил)-3-этилкарбодиимид-гидрохлорид (71г, 370ммоль). После перемешивания в течение 18 часов смесь разбавляют диэтиловым эфиром (1л) и промывают последовательно три раза 1н лимонной кислотой (250мл), один раз водой (250мл), три раза насыщенным водным раствором бикарбоната натрия (250мл) и один раз насыщенным водным раствором хлорида натрия (250мл). Органическую фазу сушат (Na2SO 4), фильтруют и концентрируют в вакууме с получением 140г (92,5%) бледно-желтой пены. FD/MS m/е: 452 (М+); 1Н-ЯМР Б) Получение D-Phe-Pro-OBn×TFA. К перемешиваемому раствору Boc-D-Phe-Pro-OBn (68г, 150ммоль) в дихлорметане (50мл) при 0°С добавляют анизол (20мл), затем трифторуксусн ую кислоту (400мл). После перемешивания в течение 3-х часов растворители выпаривают в вакууме и вязкий маслянистый остаток растворяют в диэтиловом эфире (1,5л) и охлаждают (72часа). Белого цвета осадок отфильтровывают, промывают диэтиловым эфиром (300мл) и сушат с получением 59,4г (85%) белого порошка. 1Н-ЯМР. B) Получение EtSO2-D-Phe-Pro-OBn. К перемешиваемому раствору D-Phe-Pro-OBn×ΤΦΚ (12г, 25,7ммоль) и триэтиламина (7мл, 50,2ммоль) в дихлорметане (200мл) при -78°С добавляют этансульфонилхлорид (2,65мл, 28,3ммоль) по каплям через капельную воронку. Реакционный сосуд нагревают до 0°С и после перемешивания в течение 4-х часов добавляют воду (10л). Органическую фазу промывают три раза 1н раствором соляной кислоты (100мл), один раз насыщенным раствором хлорида натрия (100мл) и затем растворитель удаляют в вакууме. Продукт очищают путем лэш-хроматографии на силикагеле, элюируя смесью этилацетата с гексаном (6:4). Содержащие продукт фракции (оценивают с помощью ТСХ) объединяют и концентрируют с получением 6,62г (58%) желтого цвета масла, которое отверждается. 1Н-ЯМР; FD -MS, m/e: 445 (Μ); Анализ для C23H28N2O 5S: рассчитано,% С 62,14 Η 6,35 N 6,30 найдено, % 61,87 6,37 6,18 Г) Получение EtSO2-D-Phe-Pro-OH. К перемешиваемому раствору EtSO2-D-Phe-Pro-OBn (4,5г, 10,1ммоль) в п-диоксане (150мл) добавляют раствор моногидрата гидроксида лития (2,1г, 50,5ммоль) в воде (75мл). После перемешивания в течение 16 часов объем раствора уменьшают в вакууме наполовину и раствор разбавляют водой (300мл) и 0,1н раствором NаОН (100мл). Водную фаз у затем промывают дважды диэтиловым эфиром (250мл), подкисляют твердой лимонной кислотой и затем экстрагируют три раза этилацетатом (150мл). Объединенные этилацетатные экстракты промывают насыщенным водным раствором хлорида натрия (200мл), сушат (MgSO4), фильтруют и концентрируют с получением 3,6г (90%) белого твердого вещества. FD -ΜS , m/e: 355 (M+). Анализ для C16H22N2O 5S: рассчитано,% С 54,22 H 6,26 N 7,90 найдено, % 54,40 6,42 7,85 Д) Получение N, N -ди-Вос-S-метилизотиомочевины К перемешиваемому раствору ди-трет-бутил-дикарбоната (100г, 458ммоль) в трет-бутаноле (300мл) добавляют раствор сульфата бис-3-метилизотиомочевины (32,7г, 117ммоль) в воде (150мл), затем раствор гидроксида натрия (19,2г, 480мл) в воде (150мл). После перемешивания в течение 48 часов смесь концентрируют примерно до 1/3 первоначального объема в вакууме и разбавляют диэтиловым эфиром (500мл). Органическую фазу промывают один раз водой (250мл), три раза 1н раствором лимонной кислоты (250мл) и вновь один раз водой (250мл). Органическую фазу затем сушат (МgSO 4), фильтр уют и концентрируют в вакууме с получением 42г (62%) белого твердого вещества. 1 Н-ЯМР. Е) Получение Νg , Νg’ - ди- Вос-агматин К перемешиваемому раствору 1,4-бутандиамина (23г, 258ммоль) в смеси 2:1 диметилформамида с водой (300 мл) через капельную воронку добавляют раствор Ν, N’ -ди-Вос-S-метилизотиомочевины (15г, 52ммоль) в диметилформамиде (100мл). После перемешивания в течение 2 часов растворители удаляют в вакууме и остаток растворяют в 1н лимонной кислоте (250мл)разбавляют водой (250мл) и промывают этилацетатом (250мл). Этилацетатную фазу снова экстрагируют 1н раствором лимонной кислоты (100мл) и объединенные водные фазы подщелачивают с помощью карбоната натрия, насыщают твердым хлоридом натрия и экстрагируют дважды этилацетатом (250мл). Объединенные этилацетатные экстракты промывают насыщенным водным раствором хлорида натрия (200мл), сушат (ΜgSO4), фильтруют и концентрируют с получением 12,5г (731) вязкого сиропа. 1Н-ЯМР. Ж) Получение EtSO2-D-Phe-Pro-Agm(Boc)2. К перемешиваемому раствору Ng , Ng -ди-Вос-агматина (2г, 6ммоль) в дихлорметане (30мл) добавляют EtSO2-D-Phe-Рrо-OН (2,1г, 6ммоль), НОВТ (810мг, 6ммоль) и N, N -диизопропилэтиламин (1,6г , 12ммоль) с последующим добавлением 1-(3-диметиламинопропил)-3-этилкарбодиимид-гидрохлорида (1,4г, 73ммоль). После перемешивания в течение 20 часов, раствор разбавляют этилацетатом (300мл) и промывают три раза 1н раствором лимонной кислоты (150мл), один раз водой (150мл) и дважды насыщенным водным раствором бикарбоната натрия. Органическую фазу затем сушат (МgSO4) фильтр уют и концентрируют в вакууме. Остаток хроматографируют на силикагеле, элюируя возрастающим градиентом смеси этилацетата с гексаном (1:4) до этилацетата. Содержащие продукт фракции (на основании ТСХ) объединяют и концентрируют с получением 2,4г (60%) вязкого масла. 1Н-ЯМР; FD-MS , m/e: 668 (ΜΗ+). З) Получение EtSO2-D-Phe-Pro-Agm×HCl. Перемешиваемую суспензию EtSO2-D-Phe-Pro-Agm(Boc)2 (1,6г, 2,4ммоль) в анизоле (1мл) растворяют в трифтор уксусной кислоте (20мл) и продолжают перемешивание в течение 1 часа при комнатной температуре. Растворитель затем удаляют в вакууме и остаток распределяют между водой (100мл) и диэтиловым эфиром (50мл). Водную фазу промывают снова диэтиловым эфиром (50мл) и затем частично концентрируют и лиофилизируют с получением 1,4 сырой трифторацетатной соли. Половину этого ве щества затем растворяют в воде и очищают с помощью R Ρ HPLC (метод 1; 98/2 /А/В/); соотношение изменяют вплоть до 50/50 /А/В/, 60 минут) с получением 490мг (81%) белого порошка. 1Н-ЯМР; FD-MS, т/е: 467 (М+). Анализ для С 21H34N6O 4S·НСl. Н2O: рассчитано,% С 48,41 Η 7,16 N 16,13 СІ 6,80 найдено, % 48,01 6,81 16,15 6,97 Пример 2 А) Получение Boc-D-Cha-Pro-OBn. Способом, по существу эквивалентным описанному в примере 1-А, Boc-D-Cha-Pro-OBn получают из BocD-Cha-OH и Pro-OBn. HCl с выходом 91% (109г). FD-ΜS, m/е 458 (M+). Б) Получение D-Cha-Pro-OBn×TFA. Способом, по существу эквивалентным описанному в примере 1-Б, D-Cha-Pro-OBn-TFA получают с выходом 130г (116% от теоретически рассчитанного. Н-ЯМР; FD-ΜS m/е: 359×(М+). В) Получение EtSO2-D-Cha-Pro-OBn. Способом, по существу эквивалентным описанному в примере 1-В, EtSO2-D-Cha-Pro-OBn получают с выходом 2,3г (20%). 1 Н-ЯМР; FD-M.S, m/е 450 (М+). Анализ для С 23Н34N2O 5S: рассчитано,% С 61,31 H 7,6 N 6,21 найдено,% 61,55 7,59 6,28 Г) Получение EtSO2-D-Cha-Pro-OH Способом, по существу эквивалентным описанному в примере 1-Г, EtSO2-D-Cha-Pro-OH получают с выходом 0,78г (48%). 1H-HMP; FD-MS, m/е: 361 (М+). Д) Получение EtSO2-D-Cha-Pro-Agm(Boc)2. Способом, по существу эквивалентным описанному в примере 1-Ж, 400мг (40%) ЕtSО2-D-Cha-Pro-Aqm (Boc)2 получают из ЕtSО2-D-Cha-Pro-OH и Ng , Ng -ди-Boc-Agm. Н-ЯМР, FD-MS, m/е 674 (МН+). Ε) Получение ЕtSО2-D-Cha-Pro-Agm-HCl. Способом, по существу эквивалентным описанному в примере 1-3, ЕtSО2-D-Cha-Pro-Agm-HCl' получают с выходом 100мг (45%). Продукт очищают с помощью RPHPLC (метод 1; 98/2 /А/В/, соотношение изменяют до 50/50 /А/в/, 60 минут). 1Н-Я МР; FD-MS, m/e 473 (M+), Анализ для С 21Η40N6O 4S · 1.2.HCl.H 2O рассчитано,% С 47,20 H 8,15 N 15,73 СІ 7,96 найдено,% 47,47 7,84 16,10 7,80 Пример 3 А) Получение -EtOCO-D-Phe-Pro-OH. Способами, по существу эквивалентными, описанными в примерах 1-В и 1-Г, при использовании этихлор формиата вместе этансульфонилхлорида, получают 6,59г (92%) EtOC O-D-Phe-Pro-OH. 1 H-ЯМР; FD-MS, m/e 335 (M+); Анализ для С 17Н22N2O 5: рассчитано,% С 61,07 H 6,63 N 8,38 найдено,% 60,88 6,72 8,14 Б) Получение EtOCO-D-Phe-Pro-Agm×HCl. Способом, по существу эквивалентым описанному в примере 1-Ж, получают 2,1г (54%) EtOCO-D-Phe-ProAgm (Вос)2 из EtOCO-D-Phe-Pro-OH и Ng -Ng '-di-Boc- Аgm. Затем способом, по существу эквивалентным описанному в примере 1-3, получают 390мг (77%) EtOCO-D-Phe-Pro- Agm×HCl. Продукт очищают п утем RPHPLC (метод 1; 98/2 /А/B/, изменяющееся до 50/50 /А/В/, 60 минут). 1Н-Я МР; RD-МS, m/е. 447 (М+). Анализ для С22Н34N6О 4 · 0,9 НСl · 0,2 ТФК · Н 2O: рассчитано,% С 51,70 H 7,22 N 16,15 СІ 6,13 найдено,% 51,73 7,20 16,54 6,36 Пример 4 (Ν–[(1-метил-1Н-индол-2-ил)карбонил]-D-фенилаланил-Ν-[4-[(аминоиминометил)амино]бутил]-Lпролинамид-моногидрохлорид). А) Получение NMI-D-Phe-Pro-OH. К раствору N -метил-индол-2-карбоновой кислоты (2,6г, 14,9ммоль) в безводном тетрагидрофуране (45мл) добавляют пентафторфенол (3г, 16,5ммоль), затем 1-(3-диметиламинопропил)-3-этилкарбодиимид (3,2г, 16,5ммоль). Смеет кипятят с обратным холодильником при перемешивании в течение 3,5 часов и затем охлаждают до комнатной температуры. К этой смеси добавляют раствор D-Phe-Pro-OBn×TFA (7 г, 14,9ммоль) и Ν, N -диизопропилэтиламина (4г, 30ммоль) в тетрагидрофуране (25мл). После перемешивания еще в течение 2-х часов, растворители удаляют в вакууме и остаток растворяют в этилацетате (500мл), после чего полученный раствор промывают три раза 0,1н водным раствором бисульфата натрия (250мл) и три раза 1н водным раствором карбоната калия (250мл). Органическую фазу сушат (Na2, SO4), фильтруют и концентрируют в вакууме с получением 6,5г аморфного твердого вещества (смесь целевого продукта, загрязненная пентафторфенолом). Этот сырой продукт затем гидролизуют способом, по существу эквивалентным описанному в примере 1-Г, с получением 3,8г (62%) не совсем белого твердого вещества. 1НЯМР; FD-MS, m/с 419 (М+). Б) Получение NMI-D-Phe-Pro-Agm×HCl. Способом, по существу эквивалентним, описанному в примере 1-Ж, получают 900мг (20%) NMl-D-Phe-ProAgm(Boc)2. Затем способом, по существу эквивалентным, описанному в примере 1-3, получают 144мг (31%) NMI-D-Phe-Pro-Agm×HCl. Сырой продукт растворяют в ледяной уксусной кислоте и очищают путем RPHPLC (метод 1, (А/В) о т 90/10 до 40/60, 80 минут). 1 Н-ЯМР. FD-MS, m/е 532 (М+). Анализ для С 29Н37N7O 3 · 0,9 НСl · 0,6 ТФК · 0,5 Н2 O: рассчитано,% С 56,46 H 6,29 N 15,27 СІ 4,97 найдено,% 56,77 6,58 15,35 5,28 Пример 5 А) Получение Boc-D-Phe-Pro-OH. К раствору Boc-D-Phe-Pro-OBn (145г, 320ммоль) в п-диоксане (660мл) добавляют раствор моногидрата гидроксида лития (54г, 1,280ммоль) в воде (330мл) при интенсивном перемешивании. Спустя 4 часа раствор концентрируют в вакууме примерно до 1/4 первоначального объема и разбавляют водой (350мл) и 0,1н раствором гидроксида натрия (100мл). Водную фазу промывают три раза диэтиловым эфиром (250мл) и затем подкисляют до рH=3 твердой лимонной кислотой, в результате чего выпадает осадок. Твердое вещество фильтруют, промывают дважды водой и затем сушат в высоком вакууме, получая 91г (78%) белого твердого вещества. 1Н-ЯМР; FD-MS, m/е: 363 (М+). Б) Получение Ng , Ng’-ди-Вос-6-аминогексилгуанидина Способом, по существу эквивалентным, описанному в примере 1-Е, получают 4,7г (66%) Ng , Ng’-ди-Вос-6амино-гексилгуанидина из 1,6-гександиамина. В) Получение Boc-D-Phe-Pro-NH(CH 2)6NHC(NBoc)NH(Boc). Способом, по существу эквивалентным, описанному в примере 1-Ж, получают 1,3г (62%) Boc-D-Phe-Pro-6NH(CH2)6NHC(NBoc)NH(Boc) из Boc-D-Phe-Pro-OH и Ng , Ng’-ди-Boc-аминогексил-гуанидина. 1H-HMP; FD-MS, m/e: 703 (M+). Г) Получение D-Phe-Pro-MH(CH 2)6NHC(NH)NH2×HCl. Способом, по существу эквивалентным, описанному в примере 1-3, получают приблизительно 100мг DPhe-Pro-NH(CH 2)6NHC(NH)NH2HCl. FD-MS, m/е 389(M+) Анализ для С 21Н34N6O 2 - 0,9 НСl. 0,9 ТФК. 0,5 Н2 O: рассчитано,% С 49,97 H 6,95 N 15,34 найдено,% 49,60 7,13 15,23 Пример 6 A) Получение Νg , Νg ’ -ди-Вос-5-аминопентилгуанидина Способом, по существу эквивалентным, описанному в примере 1-Е, получают 1,73г (72%) Ng ,Ng -ди-Вос-5аминопентилгуанидина из 1,5-пентандиамина. FD-MS, m/е: 345 (М+); Н-ЯМР; Б) Получение Boc-D-Phe-Pro-NH(CH 2)5NHC(NBoc)NH(Boc) Способом, по существу эквивалентным, описанному в примере 1-Ж, получают 1,9г (92%) Boc-D-Phe-ProNH(CH2)5NHC(NBoc)NH(Boc) из Boc-D-Phe-Pro-OH и Ng , Ng’-ди-Вос-5-аминопентилгуанидина. 1 Н-ЯМР; FD-MS, m/е: 689 (М+). B) Получение D-Phe-Pro-NH(CH 2)5NHC(NH)NH2×HCl. Способом, по существу эквивалентным, описанному в примере 1-3, получают примерно 100мг D-Phe-ProNH(CH2)5NHC(NH)NH2-HCl. Продукт очищают с помощью RPHPLC (метод 1; (A/В) от 98/2 до 40/60, 40 минут). FD-MS, m/e: 389 (М+). Анализ для С 20H32N6O 2 ×0,9 HCl × 0,9 TФК. 0,7 Н2О: рассчитано,% С 48,71 H 6,79 N 15,63 найдено,% 48,34 6,68 16,01 Пример 7 А) Получение Boc-D-Phe-Pro-NH(CH 2)3NHC(NBoc)NH(Boc). К раствору 1,3-диаминопропана (2,2г, 30ммоль) в диметилформамиде (25мл) добавляют раствор Ν, N’ ди-Вос-S-метил-изотиомочевины (2,9г, 10ммоль) в диметилформамиде (25мл). После перемешивания в течение 1 часа смесь разбавляют дихлор-метаном (400мл) и промывают дважды смесью насыщенного водного раствора бикарбоната натрия и насыщенного водного раствора хлорида натрия (200мл) и один раз насыщенным водным раствором хлорида натрия (250мл). Органическую фазу сушат (МgSO 4), фильтруют и частично концентрируют в вакууме до объема примерно 200 мл. К этому раствору затем добавляют Bос-D-Phe- Pro-OH (3,6г, 10ммоль) НОВТ (1,3г, 10ммоль) и Ν, Ν диизопропил-этиламин (1,3г, 10ммоль), затем 1-(3-диметиламинопропил)-3-этилкарбодиимид-НСl (2,1г, 11ммоль). После перемешивания в течение 16 часов растворители удаляют в вакууме и остаток обрабатывают этилацетатом (250мл). Органическую фазу промывают три раза 1н раствором лимонной кислоты (200мл), один раз водой (100мл), два раза насыщенным водным раствором бикарбоната натрия (200мл) и один раз насыщенным водным раствором хлорида натрия. Органическую фаз у затем рушат (МgSO4), фильтруют и концентрируют в вакууме. Остаток после этого хроматографируют на силикагеле, элюируя ступенчато градиентом смеси этилацетата с гексаном (1:4) до этилацетата. Содержащие продукт фракции (оцениваемые с помощью ТСХ)концентрируют с получением 2,6г (40%) вязкого бесцветного масла. 1 Н-ЯМР; FD-MS, m/е: 661 (М+). Б) Получение D-Phe-Pro-NH(CH 2)3NHC(NH)NH2 ×HCl. Способом, по существу эквивалентным, описанному в примере 1-3, получают 460мг (71%) D-Phe-Pro-NH (CH2)3NHC(NH)NH2 ×HCl. Продукт очищают путем RPMRLC (метод 1; (А/В) от 98/2 до 40/60, 40 минут). 1Н-ЯМР; FD-MS, m/е: 361 + (М ) Анализ для С 18Н28N6O . НСl. 1,1 ТФК · 1 ,1 Н2O: рассчитано,% С 44,66 H 6,20 N 15,47 найдено,% 44,69 6,10 15,19 Пример 8 A) Получение Ng , Ng’-ди-Вос-4-амино-транс-2-бутенилгуанидина Способом, по существу эквивалентным, описанному в примере 1-Е, получают 2,4г (42%) Ng , Ng’-ди-Вос-4амино-транс-2-бутенилгуанидина из 1,4-диамино-транс-2-бутена. Б) Получение Boc-D-Phe-Pro-NHCH 2-trans-CH=CHCH 2NHC(NBoc)NHBoc. Способом, по существу эквивалентным/ описанному в примере 1-Ж, получают 2,7г (55%) Boc-D-Phe-ProNHCH2-trans-.CH=CHCH 2NHC(NBoc)NHBoc из Boc-D-Phe-Pro-OH и Ng , Ng ’-дu-Boc-4-амино-транс-2бутенилгуанидина. 1Н-ЯМР. FD-MS, m/e: 673 (M+). B) Получение D-Phe-Pro-NHCH 2-trans-CH=CHCH 2NHC(NH)NH2×HCl. Способом, по существу эквивалентным, описанному в примеру 1-3, получают приблизительно 100мг DPhe-Pro-NHCH 2- trans-CH=CHCH 2NHC(NH)NH2×HCl. Продукт очищают путем RPHRLC (метод 1; (А/В от 98/2 до 40/60, 40 минут). 1Н-ЯМР. FL-MS, m/е: 373 (М+). Анализ для С 19Н28N6O 2 · НСl · 0,5 ТФК ×2,5 Н2O: рассчитано,% С 47,01 H 6,81 N 16,45 найдено,% 47,36 6,53 16,70 Пример 9 А) Получение p-H2NCH2C6H4CH2NHC(NBoc)NHBoc. Способом, по существу эквивалентным, описанному в примере 1-Е, получают 2,3г (42%) pH2NCH2C6H4CH2NHC(NBoc)NHBoc из п-ксилолдиамина. 1Н-ЯМР. Б) Получение Boc-D-Phe-Pro-p-NHCH 2-C6H4CH2NHC(NBoc)NHBoc. Способом, по существу эквивалентным, описанному в примере 1-Ж, получают 2,8г (63%) Boc-D-Phe-Pro-pNHCH2-C6H4CH2NHC(NBoc)NHBoc из Boc-D-Phe-Pro-OH и p-H2NCH2C6H4CH2NHC(NBoc)NHBoc. 1 Н-ЯМР. FD-MS, m/е: 723 (М+). В) Получение D-Phe-Pro-p-NHCH 2- C6H4CH2NHC(NH)NH2-2TFA. Способом, по существу эквивалентным, описанному в примере 1-3, получают 725мг (81%) целевой бисТФК-соли и далее не очищают путем RPHRLC. 1Н-ЯМР; FD-MS, m/е: 423 (М+). Анализ для С 23Н30N6О 2 · 2,1 ТФК · Н2 O: рассчитано,% С 48,05 H 5,05 N 12,36 найдено,% 48,06 4,85 12,28 Пример 10 А) Получение N-Boc-n-(аминометил) бензиламина К перемешиваемому раствору п-ксилолдиамина (10г, 73ммоль) в смеси диметилформамида с водой (1:1, 100мл) добавляют ди-трет-бутил-дикарбонат (8г, 37ммоль). После перемешивания в течение 20 часов смесь концентрируют в вакумме и остаток распределяют между диэтиловым эфиром (200мл) и 1н раствором лимонной кислоты (200мл). Водную фазу промывают снова диэтиловым эфиром (200мл) и затем подщелачивают с помощью твердого бикарбоната натрия и насыщают твердым хлоридом натрия. Водную фазу затем экстрагируют 4 раза этилацетатом (200мл). Объединенные этилацетатные экстракты сушат (MgSO4), фильтруют и концентрируют с получением 2,1г (24%) вязкого масла. 1Н-ЯМР; FD-MS, m/е: 237 (МН+). Анализ для C13H20N2O 2: рассчитано,% С 66,07 H 8,53 N 11,85 найдено,% 66,33 8,44 12,11 Б) Получение Boc-D-Phe-Pro-p-NHCH 2C6H4CH2NHBoc. Способом, по существу эквивалентным; описанному в примере 1-Ж, получают 1,1г (63%) Boc-D-Phe-Pro-pNHCH2-C6H4CH2NHBoc из Boc-D-Phe-Pro-OH и N-Boc-n-(аминометил)бензиламина. 1 Н-ЯМР; FD-MS, m/е: 581 (М+). Анализ для С 32Н44N4O 6: рассчитано,% С 66,19 H 7,64 N 9,65 найдено,% 65,99 7,63 9,42 В) Получение D-Phe-Pro-p-NHCH 2C6H4CH2NH2-HCl. Способом, по существу эквивалентным, описанному в примере 1-3, получают около 100мг D-Phe-Pro-pNHCH2-C6H4CH2NH2-HCl. Продукт очищают путем RPHRLC (метод 1, (А/В) от 98/2 до 40/60 40 минут). 1Н-ЯМР; FD-MS, m/e 381 (М+). Анализ для C22H28N4O 2 × HCl × 1,1 ТФК. Н2 O: рассчитано,% С 51,87 H 5,77 N 10,00 найдено,% 51,78 5,88 10,2 8 Пример 11 А) Получение N -Вос-м-(аминометил)бензиламина Способом, по существу эквивалентным, описанному в примере 10-А, получают 2,6г (30%) N-Вос-м(аминометил)бензиламина из м-ксилолдиамина. 1Н-ЯМР;FD-MS m/е: 237 (МН+). Анализ для С 13Η20N2O 2: рассчитано,% С 66,07 H 8,53 N 11,85 найдено,% 65,81 8,48 11,98 Б) Получение Boc-D-Phe-Pro-m-NHCH 2C6H4CH2NHBoc. Способом, по существу эквивалентным, описанному в примере 1-Ж, получают 1,6г (95%) Boc-D-Phe-Prom-NHCH2-C6H4CH2NHBoc из Boc-D-Phe-Pro-OH и N-Boc-m-(аминометил) бензиламина. 1 Н-ЯМР; FD-MS, m/є: 581 (М+) В) Получение D-Phe-Pro-m-MHCH 2C6H4CH2NH2×HCI Способом, по существу эквивалентным, описанному в примере 1-3, получают около 100мг D-Phe-Pro-mNHCH2- C6H4CH2NH2 ×HСl. 1 Н-ЯМР; FD-MS , m/е: 381 (М+). Анализ для С 22Н28N4O 2 × HCl · ТФК × Н2O: рассчитано,% С 52,51 H 5,87 N 10,21 найдено,% 52,13 6,21 10,48 Пример 12 D -Рhе-Рrо-NHCH2-транс-4-(аминометил) циклогексан× НСl А) Получение N-Вос-транс-4-(аминометил)циклогексанкарбоновой кислоты К раствору транс-4-(аминометил)циклогексанкарбоновой кислоты (50г, 318ммоль) в 1н растворе гидроксида натрия (334мл, 334ммоль) и трет-бутанола (400мл) добавляют раствор ди-трет-бутилдикарбоната (73г, 334ммоль) в тетрагидрофуране (50мл). После перемешивания в течение 20 часов растворители удаляют в вакууме π остаток распределяют между водой (500мл) и диэтиловым эфиром (250мл). Водную фазу промывают снова диэтиловым эфиром (250мл) и затем подкисляют твердой лимонной кислотой, в результате чего выпадает осадок белого цвета. Твердое вещество фильтруют, промывают дважды водой (100мл) и сушат в вакууме с получением 48г (59%) порошка белого цвета. 1Н-ЯМР. Б) Получение НOСН 2 -транс-4- (N-Вос-аминометил)циклогексана К перемешиваемому раствору N-Вос-транс-4-(аминометил) циклогексанкарбоновой кислоты (15г, 58ммоль) в тетрагидрофуране (150мл) при 0°С добавляют N-метилморфолин (5,9г, 58ммоль), а затем этилхлор формиат (6,3г, 58ммоль). После перемешивания в течение 30 минут, добавляют боргидрид натрия (6,5г, 175ммоль), и затем через капельную воронку в течение 5 минут добавляют метанол (300мл). Смесь перемешивают в течение 1 часа и затем растворители удаляют в вакууме. Остаток растворяют в этилацетате (500мл) и промывают дважды 1н раствором лимонной кислоты (250мл), один раз водой (100мл), дважды насыщенным водным раствором бикарбоната натрия (250мл) и один раз насыщенным водным раствором хлорида натрия (250мл). Органическую фаз у сушат над сульфатом магния, фильтруют и концентрируют с получением 13г (91%) целевого соединения. 1Н-ЯМР. В) Получение NН2СН2-транс-4-( N -Вос-аминометил) циклогексана К перемешиваемому раствору НОСH2-транс-4-(N-Вос-аминометил)циклогексана (13г, 53ммоль) и трифенилфосфина (21г, 80ммоль) в тетрагидрофуране (300мл) добавляют диэтилазодикарбоксилат (13,9г, 80ммоль) с последующим добавлением раствора дифенилфосфорилазида (22г, 80ммоль) в тетрагидрофуране (100мл). После перемешивания в течение 16 часов растворители удаляют в вакууме и остаток хроматографируют на силикагеле, элюируя ступенчато градиентом смеси этилацетата с гексаном (1:3) до смеси этилацетата с гексаном (3:1). Содержащие продукт фракции (оцениваемые путем ТСХ) объединяют и концентрируют с получением 17,4г сырого продукта (загрязненного соединением с более высоким Rj ). Сырой азид растворяют в метаноле (200мл) и этот раствор добавляют к перемешиваемой суспензии тонко размельченного Na2S × 9 Н2О (51г, 212ммоль) и триэтиламина (1г, 11ммоль) в метаноле (100мл). Полученную смесь кипятят с обратным холодильником в течение 16 часов, затем охлаждают до комнатной температуры и растворители удаляют ввакууме. Остаток разбавляют водой (250мл) и подкисляют твердой лимонной кислотой. Водную фазу промывают дважды этилацетатом (250мл), подщелачивают с помощью твердого бикарбоната натрия и насыщают твердым хлоридом натрия. Водную фазу затем экстрагируют три раза этилацетатом (200мл) и объединенные экстракты сушат (МgSO4), фильтруют и концентрируют с получением 6,4г (45%) вязкого масла. 1Н-ЯМР. Г) Получение N-Boc-D-Phe - Pro-NHCH 2-транс-4-(Ν-Вос-аминометил)-циклогексана Способом, по существу эквивалентным, описанному в примере 1-Ж, получают 4,5г (74%) N-Boc-D-PhePro-NH СH2-транс-(N-Bос-аминометил) циклогексана из Boc-D-Phe-Pro-OH и NH2-СН2-транс-4-(N-Восаминометил) циклогексана. 1Н-ЯМР; FD-MS, m/e 587 (М+). Д) Получение D-Phe-Pro-NНСН-транс-4- (аминометил) циклогексан ×НСl Способом, по существу эквивалентным, описанному в примере 1-3, получают 588мг (75%)D-Phe-ProNHCH-транс-4-(аминометил)-циклогексан-НСl. В этом случае, анализ с помощью RPHRLC показывает наличие очень чистой промежуточной ТФК-соли, но соль гигроскопична. Соль растворяют в 0,1н растворе НСl (20мл), рН-значение доводят до 5, и образец лиофилизируют снова с получением стабильного твердого вещества белого цвета - гидрохлоридной соли. 1Н-ЯМР; FD-МS, m/е: 387 (М+) Анализ для С 22Н34N4O 2 × НСl × ТФК × 2 Н2 O: рассчитано,% С 50,30 H 7,04 N 9,78 найдено,% 50,44 7,20 9,62 Пример 13 А) Получение Boc-D-Phe-Pro-p-NHCH 2C6H4NH2. Способом, по существу эквивалентным, описанному в примере 1-Ж, получают 8г Boc-D-Phe-Pro-pNHCH2C6H4NO2 из Boc-D-Phe-Pro-OH и п- ΝΟ2-бензиламин-гидрохлорида-НСІ. Промежуточный продукт растворяют в этаноле (250мл) и нагревают до температуры кипения с обратным холодильником. К этому перемешиваемому раствору добавляют раствор Nа2S2О4 (12,3г, 70ммоль) в воде (125мл). После перемешивания при температуре кипения с обратным холодильником в течение 2-х часов растворители удаляют в вакууме и остаток распределяют между этилацетатом (250мл) и водой (250мл). Водную фазу экстрагируют снова этилацетатом (250мл) объединенные органические фазы сушат (MgSO 4), фильтр уют и концентрируют в вакууме с получением 2,4г (21%) слегка желтоватого твердого вещества. 1Н-Я МР; FD-MS, m/е: 466 (М+). Анализ для C26H34N4O 4: рассчитано,% С 66,93 H 7,34 N 12,01 найдено,% 66,69 7,32 12,28 Б) Получение D-Phe-Pro-p-NHCH 2C6H4NH2-HCl. Способом, по существу эквивалентным, описанному в примере 1-Н, получают 180мг (60%) D-Phe-Pro-pΝΗCH2-C6H4NH2×HCI. Продукт очищают путем RPHRLC (метод 1; (А/В) от 98/2---до 60/40, 60 минут). 1Н-Я МР; FD-MS, m/е: 366 (М+). Анализ для С 21Н26N4O 2 × НСl × 0,6 ТФК. 0,5 Н2 O: рассчитано,% С 55,51 H 6,00 N 11,66 найдено,% 55,16 6,14 11,57 Пример 14 А) Получение Boc-D-Phe-Pro-p-NHCH 2CH2C6H4NH2. Способом, по существу эквивалентным, описанному в примере 13-А, получают 3г (23%) Boc-D-Phe-Pro-pNHCH2CH2-C6H4NH2 из Boc-D-Phe-Pro-OH и п-NО2-фенетиламин-гидрохлорида. 1 Н-ЯМР; FD-MS, m/е: 480 (М+). Анализ для С 27Н36N4O 4: рассчитано,% С 67,48 H 7,55 N 11,66 найдено,% 67,30 7,54 12,34 Б) Получение D-Phe-Pro-p-NHCH 2CH2C6H4NH2×HCl. Способом, по существу эквивалентным, описанному в примере 1-3, получают 175мг (58%) D-Phe-Pro-pNHCH2CH2-C6H4NH2×HCl. Продукт очищают путем RPHRLC (метод 1; (А/В) градиент от 98/2 --- до 60/40, 60 минут). 1Н-Я МР; FD-MS, m/е: 380 (М+). Анализ для С 22Н28N4O 2 · НСl · 0,7 ТФК. 0,7 Н2 O: рассчитано,% С 55,18 H 6,15 N 11,00 найдено,% 55,12 6,18 10,99 Пример 15 (D -фенилаланил- N –[[4-аминоиминометил) фенил]метил]-L-прοлин-амид-гидрохлорид) А) Получение п-(аминометил)бензонитрил×ТФК К перемешиваемой суспензии гидрида натрия (2,2г, 56ммоль, 60%-ная дисперсия в масле) в тетрагидрофуране (100мл) добавляют 4-(бромметил)бензонитрил (10г, 51ммоль). К этой смеси добавляют медленно через капельную воронку раствор ди-трет-бутил-имино-дикарбоксилата (12,2г, 56ммоль). После перемешивания в течение 16 часов смесь разбавляют диэтиловым эфиром (300мл) и промывают дважды водой (150мл). Органическую фазу затем суша т (МgSO 4), фильтруют и концентрируют. Полученное твердое вещество затем растворяют в минимальном количестве дихлорметана. Добавляют анизол (10мл) и раствор охлаждают до 0°С. Раствор затем разбавляют трифторуксусной кислотой (200мл) и дополнительно перемешивают в течение 1 часа. Растворитель затем удаляют в вакууме и маслянистый остаток интенсивно размешивают с диэтиловым эфиром (100мл) и спустя 5 минут продукт затвердевает. Осадок фильтруют, промывают диэтиловым эфиром и сушат в вакууме, получая 11,3г (90%) порошка белого цвета. ИК; 1Н-ЯМР; FD-MS, m/е: 132 (М+). Б) Получение Boc-D-Phe-Pro-p-NHCH 2C6H4CN. Способом, по существу эквивалентным, описанному в примере 1-Ж, получают 7,4г (78%) Boc-D-Phe-Pro-pNHCH2C6H4CN из Boc-D-Phe-Pro-OH и п-(аминометил)бензонитрил. ТФК. В этом случае, продукт очищают путем перекристаллизации из ди-этилового эфира. ИК; 1Н-Я МР; FD-MS m/е: 476 (М+). В) Получение Boc-D-Phe-Pro-p-NHCH 2C6H4C(NH)NH2. Газообразный сероводород барботируют через раствор - Boc-D-Phe-Pro-p-NHCH2C6H4CN (2г, 4,2ммоль) в пиридине (25мл) и триэтиламине (2,5мл) в течение 30 минут. Реакционный сосуд затем закрывают и оставляют стоять при комнатной температуре в течение 2-х дней. Раствор затем разбавляют водой (100мл) и экстрагируют дважды этилацтатом (200мл). Объединенную органическую фазу промывают дважды насыщенным водным раствором хлорида натрия, сушат над сульфатом магния, фильтруют м концентрируют в вакууме. Остаток растворяют в ацетоне (50мл), добавляют метилиодид (10мл) и раствор кипятят с обратным холодильником в течение 2-х часов. Растворители удаляют в вакууме, остаток растворяют в метаноле (20мл), добавляют ацетат аммония (712мг, 9,2ммоль), и раствор кипятят с обратным холодильником в течение 12 часов. Растворитель снова удаляют в вакууме, остаток растворяют в 1н растворе лимонной кислоты (100мл) и водную фазу промывают дважды этилацетатом (200мл), затем подщелачивают твердым бикарбонатом натрия, насыщают твердым хлоридом натрия и экстрагируют дважды этилацетатом (200мл). Объединенные этилацетатные экстракты сушат (MgSO 4), фильтруют и концентрируют, получая 1,4г (67%) вязкого масла. 1НЯМР; FD-MS, m/е: 494 (М+). Г) Получение D-Phe-Pro-p-NHCH 2C6H4C(NH)NH2-HCl. Способом, по существу эквивалентным, описанному в примере 1-3, получают 7,7г (57%) D-Phe-Pro-pNHCH2C6H4C(ΝΗ)ΝΗ2 × HCl. Продукт очищают путем RPHRLC- (метод 3; градиент (А/В) от 98/2 - до 70/30, 300 минут). 1Н-Я МР; FD-MS m/е: 394 (M+). Анализ для C22H27N5О 2 × HСl · 1,4 ТФК ×0,5 Н2 O: рассчитано,% С 49,76 H 5,12 N 11,70 найдено,% 49,75 5,19 11,58 Пример 16 А) Получение м-(аминометил)-бензонитрил. ТФК Способом, по существу эквивалентным, описанному в примере 15-А, получают 10,8г (86%) м(аминометил)-бензонитрил. ТФК из м-(бромметил)бензонитрила. ИК; 1Н-ЯМР; FD-MS, m/е: 132 (М+). Б) Получение Boc-D-Phe-Pro-m-NHCH 2C6H4CN. Способом, по существу эквивалентным, описанному в примере 1-Ж, получают 7,5г (79%) Boc-D-Phe-Prom-NHCH2C6H4CN из Boc-D-Phe-Pro-OH и м-(аминометил)бензонитрил. ТФК. В этом случае, продукт очищают путем перекристаллизации из диэтилового эфира. ИК; 1Н-ЯМР; FD-МS, m/e: 476 (Μ+). Анализ для C27-H32N4O4: рассчитано,% С 68,05 H 6,77 N 11,76 найдено,% 68,27 6,82 11,96 В) Получение Boc-D-Phe-Pro-m-NHCH 2C6H4C(NH)NH2. Способом, по существу эквивалентным, описанному в примере 15-В, получают 1,1г (53%) Boc-D-Phe-Prom-NHCH2 C6H4 C(NH)NH2. FD-МS, m/e: 494 (M+). Г) Получение D-Pbe-Pro-m-NHCH 2C6H4C(NH)NH2×0.75HCl. Способом, по существу эквивалентным, описанному в примере 1-Ж, получают 0,65г (63%) D-Phe-Pro-mNHCH2C6H4C(NH)NH2 · 0,75 НСl. Продукт очищают путем RPHRLC (метод 2; градиент (А/В) от 98/2 - до 75/25, 120 минут). FD-MS, m/е: 394 (М+). Анализ для C22H27N5O 2 × 0,75 НСl ×1,2 ТФК × 0,5 Н2O: рассчитано,% С 51,72 H 5,33 N 12,36 СІ 4,69 найдено,% 51,79 4,93 11,96 4,82 Пример 17 (D -Гомопролил- N -[[4- (аминоиминометил) фенил]метил]-L-пролин-амид-гидрохлорид) А) Получение Cbz-D-hPro-OH. D-hPro-OH (5,0г, 38,7ммоль) растворяют в тетрагидрофуране (100мл) и воде (30мл). рН-Значение раствора устанавливают равным 9,5 с помощью 2н раствора гидроксида натрия и прибавляют по каплям бензилхлорформиат (5,5мл, 38,7ммоль) и рН поддерживают равным 9,5 с помощью 2н раствора гидроксида натрия. Реакционную смесь перемешивают еще в течение 1 часа при комнатной температуре. Органический растворитель выпаривают в вакууме, добавляют диэтиловый эфир (100мл) и воду (50мл) к полученному остатку. Водный слой отделяют, рН-значение раствора доводят до 2,8 с помощью 3н соляной кислоты и добавляют этилацетат (150мл). Органический слой отделяют и суша т (МgSO4); фильтрат концентрируют в вакууме с получением 9,6г (95%) прозрачного масла. 1Н-ЯМР; FD-MS, m/е: 264 (МН+). Б) Получение Cbz-D-hPro-Pro-OH. Cbz-D-hPro-OH (9,5г, 36ммоль) растворяют в этил-ацетате (100мл) и раствор охлаждают до 0°С. К полученному раствору добавляют 2, 4, 5-трихлорфенол (7,1г, 36ммоль) и 1,3-дициклогексилкарбодиимид (7,4г, 36ммоль). Реакционную смесь перемешивают в течение 1 часа при 0°С и в течение 1 часа при комнатной температуре. Осадок фильтруют и фильтрат концентрируют в вакууме до получения масла. Масло растворяют в пиридине (100мл) добавляют Рrо-ОН (4,2г, 36ммоль) и триэтиламин (5,0мл, 36ммоль). Реакционную смесь перемешивают при комнатной температуре (24часа). Растворитель из реакционной смеси удаляют в вакууме с получением масла. Остаток растворяют в воде (100мл), добавляют диэтиловый эфир (50мл) и рН доводят до 9,5 с помощью 1н раствора гидроксида натрия. Водный слой экстрагируют дважды диэтиловым эфиром. Водный слой отделяют, рН доводят до 2,8 с помощью 3н соляной кислоты и добавляют этилацетат (150мл). Органический слой отделяют, сушат (МgSO 4) и фильтрат упаривают в вакууме с получением аморфного твердого вещества (11,4г, 88%). FD-MS 361 (М+). Анализ для С 19Н24N2O5 : рассчитано,% С 63,32 H 6,71 N 1,11 найдено,% 63,42 6,84 7,96 В) Получение Cbz-D-hPro-Pro-p-NHCH 2C6H4CN. Способом, по существу эквивалентным, описанному в примере 1-Ж, получают 2,2г (84%) Cbz-D-hPro-Prop-NHCH2C6H4CN из Cbz-D-hPro-Pro-OH и p-NH 2CH2C6H4CN×TFA. 1Н-Я МР; FD-МS, m/е 474 (М+). Анализ для С 27Н30N4O 4: рассчитано,% С 68,34 H 6,37 N 11,81 найдено,% 68,36 6,47 11,57 Г) Получение D-hPro-Pro-p-NHCH 2C6H4C(NH)NH2×HCl. Способом, по существу эквивалентным, описанному в примере 15-В, получают Cbz-hPro-Pro-pNHCH2C6H4C(NH)NH2 (28ммоль, выход теоретический). Это сырое вещество затем растворяют в уксусной кислоте (350 мл) и через раствор в течение 30 минут барботируют газообразный НВr. После перемешивания в течение еще 1 часа, растворитель удаляют в вакууме и остаток растворяют в воде (200 мл) и полученный раствор промывают дважды этилацетатом (100мл). Водную фазу затем доводят до рН=4 с помощью ионообменной смолы (Biо Rad AGl-X8, в основной форме) и лиофилизуют, получая рыхлое твердое вещество белого цвета. Продукт снова растворяют в воде (25мл) и очищают путем препаративной RPHRLC (метод 3; градиент (А/В) от 98/2 - до 70/30, 300 минут), получая 5г (41%) hPro-Pro-p-NHCH2C6H4C (NH)NH2·0.9НСl·0.9НВr·0.5Н2О. 1 Н-ЯМР; FD-MS , m/е: 357 (М+). Анализ для C19H27N5O 2 × 0,9 HCl ×0,9 НВr ×0,5 Н2O : рассчитано,% С 48,34 H 6,36 N14,83 СІ 6,76 Br 15,23 найдено,% 48,66 6,36 14,62 7,14 14,90 Пример 18 (N-[[4-(аминоиминометил)фенил]метил]-1-[[-(4aS, 8aS)-декагидpo-1 (R)изохинолинил]карбонил]-Lпролинамид-дигидрохлорид). А) Получение Cbz-D-1-Piq-Pro-OH. Раствор 1-изохинолинкарбоновой кислоты (50г, 0,288моль) в этаноле (150мл) и 60мл 5н НСl восстанавливают в присутствии 5% Rh/Al2O3 (14г) и при давлении водорода 52 бара (750пси) в аппарате для высокого давления при 50°С в течение 17 часов. Реакционную смесь фильтруют через слой диатомовой земли и фильтрат концентрируют в вакууме. Твердое вещество растирают с водой, фильтруют и сушат с получением DL -пергидро-1-изохинолинкарбоновой кислоты (DL-1-Piq-OH) (30г, 48%); FD-MS 184 (МН+). DL-1-Piq-OH (30,2г, 13 7ммоль) растворяют в тетрагидрофуране (150мл) с водой (150мл). рН раствора устанавливают равным 9,8 с помощью 5н раствора А/аОН и прибавляют по каплям бензилхлорформиат (21,6мл, 151ммоль) поддерживая рН равным 9,5 с помощью 2н раствора NaOH. Реакционную смесь перемешивают еще в течение 2-х часов при комнатной температуре. Органический растворитель упаривают в вакууме и к остатку добавляют диэтиловый эфир (150мл) и воду (50мл). Водный слой отделяют, рН раствора доводят до 2,5 с помощью 5н НСl и добавляют этилацетат (200мл). Органический слой отделяют и сушат (MgSO4) и фильтрат концентрируют в вакууме, получая прозрачное масло. Масло растворяют в диэтиловом эфире (150мл) и раствор оставляют стоять при комнатной температуре в течение 24-х часов. Осадок фильтруют и суша т с получением 2-Cbz-DL-пергидро-1-изохинолинкарбоновой кислоты (Cbz-DL-1-Piq-OH) (32г, 75%); FD-MS m/e 318 (MH+). Cbz-DL-1-Piq-OH (31,8г, 100ммоль) растворяют в ДМФ (100мл) и охлаждают до 0°С. К реакционной смеси добавляют трет-бутиловый сложный эфир пролина (17,1г, 100ммольэ, 1-гидроксибензотриазол (13,5г, 100ммоль) и ДЦК (20,6г, 100ммоль). Реакционную смесь перемешивают в течение 3-х часов при 0°С и 24 часа при комнатной температуре. Осадок фильтруют и фильтрат концентрируют в вакууме с получением масла. Масло растворяют в этилацетате (200мл) и воде (100мл). Органический слой отделяют и промывают последовательно 1н раствором бикарбоната натрия, 1,5н раствором лимонной кислоты и водой. Органический слой сушат (ΜgSO4) и фильтрат упаривают с получением масла, которое высушивают с получением 2-Cbz-DL-пергидро1-изохинолин - карбонил- L-пролил-трет-бутилового сложного эфира (Cbz-DL-1-Piq-Pro-O-t-Bu) (47,0г, 100%); FAB-MS m/e: 470 (МН+). Cbz-DL-1-Piq-Pro-O-t-Bu (47,0г, 100ммоль) помещают в круглодонную колбу, содержащую трифтор уксусн ую кислоту (100мл) CH2Cl2 (35мл), анизол (5мл) и, перемешивают при комнатной температуре в течение часа. Реакционную смесь концентрируют в вакууме без нагревания и к остатку добавляют диэтиловый эфир (100мл) и воду (100мл). рН раствора доводят до 9,8 с помощью 5н раствора NaOH. Водный слой отделяют, рН раствора доводят до 2,5 с помощью 5н НСl, и добавляют этилацетат (200мл). Органический слой отделяют и сушат над суль фатом магния, фильтрат концентрируют в вакууме, получая прозрачное масло. Масло растворяют в диэтиловом эфире (700мл) и к раствору добавляют (L) - (-)-рСметилбензиламин. Раствор оставляют стоять при комнатной температуре в течение 5 дней. Полученное твердое вещество фильтр уют и промывают диэтиловым эфиром. Фильтрат промывают 1,5н раствором лимонной кислоты и водой. Органический слой сушат (МgSO 4) и фильтрат упаривают с получением масла. Масло растворяют в диэтиловом эфире (400мл) и оставляют стоять при комнатной температуре в течение 48 часов. Полученное твердое вещество фильтруют, промывают диэтиловым эфиром и сушат, получая 2-Cbz-D -пергидро-1-изохинолинкарбонил- L-пролин (Cbz-D-1-Piq-Pro-OH) (5,86г, 36%); FAB-MS; 415 (МН+); [a]D = -34,2 (с=0,5, метанол). Б) Получение N-Вос-п-(аминометил)бензонитрила К перемешиваемой суспензии гидрида натрия (4,6г, 115ммоль, 60%-ная дисперсия в масле) в тетрагидрофуране (150мл) добавляют 4-(бромметил)-бензонитрил (20,5г, 105ммоль). К этой смеси добавляют (медленно через капельную воронку) раствор ди-трет-бутил-иминодикарбоксилата (25г, 115ммоль).После перемешивания в течение 16 часов смесь разбавляют диэтиловым эфиром (500 мл) и промывают трижды водой (250мл). Органическую фазу затем сушат (MgSO 4), фильтруют и концентрируют, получая 40,2г сырого твердого вещества. Полученное твердое вещество (28,3г, 85ммоль) затем растворяют в тетрагидрофуране (150мл) и добавляют раствор гидроксида натрия (3,4г, 85ммоль) в метаноле (300мл). После перемешивания в течение ночи раствор концентрируют примерно на 1/2 объема и добавляют воду с целью вызвать осаждение продукта. Осадок фильтруют и сушат в вакууме, получая 18,5г (94%) белого твердого вещества. ИК; 1Н-ЯМР; FD-MS, m/е: 232 (М+). Анализ для С 13Н16N2O 2: рассчитано,% С 67,22 H 6,94 N 12,06 найдено,% 67,19 7,16 11,82 В) Получение п-(BocNHCH 2)C6H4C(NH)NHCbz Способом, по существу эквивалентным, описанному в примере 15-В, N-Вос-п- (аминометил) бензонитрил (32,7г, 140ммоль) превращают в п- (BocNHCH2)C6H4C(NH)NH2. Остаток от этого превращения растворяют в диметилформамиде (700мл) и к раствору добавляют N,Ν -диизопропилэтиламин (72г, 560ммоль). К этому перемешиваемому раствору прибалвяют по каплям бензилхлорформиат (48г, 280ммоль). После перемешивания в течение 16 часов добавляют воду (100мл) и затем растворители удаляют в вакууме. Остаток распределяют между водой (250мл) и этилацетатом (500мл). Фазы разделяют и органическую фазу, промывают три раза насыщенным водным раствором хлорида аммония (250мл), один раз водой (200мл) и дважды насыщенным водным раствором бикарбоната натрия (250мл). Органическую фазу затем сушат (MgSO4) фильтруют и концентрируют, а продукт перекристаллизовывают из диэтилового эфира, получая 14г (26%) белого твердого вещества. 1Н-ЯМР; FD-MS, m/е: 384 (М+). Г) Получение n-H2NCH2C6H4C(NH)NHCbz ·2HCl К раствору n-(BocNHCH 2)C6H4C(NH)NHCbz (11г, 28,7ммоль) в дихлорметане (125мл) при 0°С добавляют анизол (10мл), затем трифторуксусн ую кислоту (125мл). После перемешивания в течение 2-х часов растворители удаляют в вакууме и остаток растворяют в 1н НСl (50мл) и раствор промывают дважды диэтиловым эфиром (50мл). рН доводят до 3 с помощью ионообменной смолы (Bio Rod AG1-X8, в основной форме) и раствор лифилизуют, получая 9,2г (90%) порошка белого цвета. 1Н-ЯМР; FD-MS , m/е: 284 (М+). Д) Получение Cbz-1-Piq-Pro-p-NHCH 2C6H4C(NH)NHCbz Способом, по существу эквивалентным, описанному в примере 1-Ж, получают 4,4г (79%) Cbz-1-Piq-Pro-pNHCH2C6H4C (NH)-NHCbz из Cbz-1-Piq-Pro-OH и P-H2NCH2C6H4C(NH)NHCbz-2НСl. В этом случае реакцию проводят в диметилформамиде в связи со сложностями, связанными с растворимостью PH2NCH2C6H4C(NH)NHCbz-2НСl. 1 Н-ЯМР; FD-МS, m/е: 681 (МН+). Анализ для C39H45N5O 6: рассчитано,% С 68,91 H 6,67 N 10,30 найдено,% 68,71 6,93 10,38 Е) Получение 1-Piq-Pro-p-NHCH 2C6H4C(NH)NH2-2HCl К раствору Cb z-1-Piq-Pro-p-NHCH 2C6H4C(NH)NHCbz. (4,2г, 6,1ммоль) в этаноле (20мл) добавляют 1н НСl (18,3мл, 18,3ммоль) и воду (100мл). К этому перемешиваемому раствору добавляют 5%-ный палладий-на-угле (1г) и через раствор в течение 2-х часов барботиругат газообразный водород. Смесь затем продувают азотом и после этого фильтруют через прокладку (слой) диатомовой земли. Фильтрат затем концентрируют в вакууме, снова растворяют остаток в воде (25мл) и очищают путем RPHRLC (метод 2; градиент (A/В) от 98/2 -- до 60/40, 300 минут), получая 1,3г (53%). 1-Piq-Pro-p-NHCH 2C6H4C(NH)NH2 ×2HCl. 1Н-ЯМР; FD-MS, m/e 412(М+) Анализ для C23H33N5O 2 × 1,9 НСl × 2,5 H 2 O: рассчитано,% С 52,53 H 7,65 N 13,32 СІ 12,81 найдено,% 52,63 7,36 13,47 12,95 Пример 19 А) Получение Cbz-D-3-Piq-Pro-OH. D -Фенилаланин (50г, 302ммоль) подвергают взаимодействию с 37%-ным раствором формальдегида (120мл) и концентрированной НСl (380мл) при кипячении с обратным холодильником. Спустя 30 минут добавляют дополнительные 50мл формальдегида и реакцию продолжают в течение 3-х часов. Реакционную смесь охлаждают до -10°С и осадок фильтруют. Твердое вещество сушат в вакууме, получая D-1,2,3,4тетрагидро-3-изохинолинкар-боновую кислоту (24,2г, 45%); FD -МS 178 (МН+). Раствор D -1,2,3,4-тетрагидро-3-изохинолинкарбоновой кислоты (17г, 96ммоль) в воде (200мл) и 20мл 5н НСl гидрируют в присутствии 5% Rh/Al2O 3 (8,5г) при давлении 138бар (2000пси) водорода в аппарате высокого давления при 120°С в течение 16 часов. Реакционную смесь фильтруют через прокладку (слой) из диатомовой земли и фильтрат подвергают сушке вымораживанием, получая D-пергидро-3изохинолинкарбоновую кислоту (D-3-Piq, -ОН) (21г, 100%); FD-MS: 184 (МН+). D-3-Piq-ОН (21,0 г, 95,8 ммоль) растворяют в тетрагидрофуране (75мл) и воде (50мл). рН раствора доводят до 10,0 с помощью 5н раствора NaOH, и прибавляют по каплям бензилхлорформиат (16,4мл, 115ммоль), поддерживая рН при 9,5 с помощью 2н раствора NaOH. Реакционную смесь перемешивают в течение дополнительного 1 часа при комнатной температуре. Органический растворитель упаривают в вакууме и к остатку добавляют диэтиловый эфир (100мл) и воду (50мл). Водный слой отделяют, рН раствора устанавливают равным 3,0 с помощью 3н НСl, и добавляют этилацетат (250мл). Органический слой отделяют и суша т (МgSO4). Фильтрат концентрируют в вакууме, получая прозрачное масло 2-Cbz-D-пергидро-3изохинолинкарбоновую кислоту (Свz-D-3-Pig-ОН) (25,8г, 85%); FD-MS: 318 (МН+). Cbz-D-3-Piq-OH (17,2г, 5 4ммоль) растворяют в ДМФ (50мл) и охлаждают до 0°С. К полученному раствору добавляют трет-бутиловый сложный эфир пролина (9,2г, 54ммоль), 1-гидроксибепзотриазол (7,3г, 54ммоль) и ДНК (11,1г, 54ммоль). Реакционную смесь перемешивают в течение 3-х часов при 0°С и 24 часа при комнатной температуре. Осадок фильтр уют и фильтрат концентрируют в вакууме с получением масла. Масло растворяют в этилацетате (200мл) с водой (100мл). Органический слой отделяют и промывают последовательно 1н раствором бикарбоната натрия, водой, 1,5н раствором лимонной кислоты и водой. Органический слой сушат (МgSO4) и фильтруют. Фильтрат упаривают с получением масла, которое высушивают, получая 2-Свz-D-пергидро-3-изохинолинкарбонил-L-пролин-трет-бутиловый эфир (Cbz-D-3-PiqPro-O-Bu) (23,8г, 94%). FAB-MS: 471 (МН+). Cbz-D-3-Piq-Pro-O-t-Bu (31,2г, 66,3ммоль) помещают в круглодонную колбу, содержащую трифтор уксусн ую кислоту (100мл), анизол (5мл), и перемешивают при комнатной температуре (1 час). Реакционную смесь концентрируют в вакууме без нагревания и добавляют к остатку диэтиловый эфир (150мл) и воду (100мл). рН раствора доводят до 9,8 с помощью 5н раствора NaOH. Водный слой отделяют, рН раствора доводят до 2,8 с помощью 3н НСl и добавляют этилацетат (200мл). Органический слой отделяют, сушат (ΜgSO4) и фильтруют. Масло растворяют в диэтиловом эфире (300мл) и раствор оставляют стоять при комнатной температуре в течение 24-х часов. Полученное твердое вещество фильтруют, промывают диэтиловым эфиром и сушат, получая 2-Cbz -пергидро-3-изохинолинкарбонил-L-пролин (Cbz-D-3Piq-Pro-OH) (13,5г, 49%); FAB-МS: 415 (MH +). Анализ для С 23Н30 N2 O5: рассчитано,% С 66,65 H 7,29 N 6,76 найдено,% 66,90 7,33 6,81 Б) Получение Cbz-D-3-Piq-Pro-p-NHCH 2C6H4C(NH)NHCbz. Способом, по существу эквивалентным, описанному в примере 18-Д, получают 1,6г (49%) Cbz-D-3-PiqPro-p-NHCH 2-C6H4C(NH)NHCbz из Cbz-D-3-Piq-Pro-OH и p-H2NCH2C6H4C(NH)NHCbz-2HCl. FD-MS, m/e 680(M+) В) Получение D-3-Piq-Pro-p-NHCH 2C6H4C(NH)NH2-3HCl. Способом, по существу эквивалентным, описанному в примере 17-В, получают 150мг D-3-Piq-Pro-pNHCH2C6H4C(NH)NH2 ×3HCl. Продукт очищают путем RPHRLC (метод 2; градиент (А/В) от 98/2 --- до 60/40, 240 минут). 1Н-Я МР; FD-MS m/е: 412 (М+). Анализ для C23H33N5O 2 × 3HCl × 0,5 Н2O: рассчитано,% С 52,13 H 7,04 N 13,22 найдено,% 52,35 7,23 12,95 Пример 20 ((S-цис)-N-[[4-(аминоиминометил)фенил]метил]-октагидро-1-D-гомопролил-1Н-индол-2-карбоксамидтригидрохлорид) А) Получение Cbz-D-hPro-Ohi-OH. Газообразный НСl барботируют через перемешиваемую суспензию (3)-индолин-2-карбоновой кислоты (20г, 110ммоль) в этаноле (500мл). Когда кислота полностью растворится, раствор доводят до температуры кипения с обратным холодильником. Спустя 16 часов, раствор-охлаждают и растворитель удаляют в вакууме. Остаток растирают с диэтиловым эфиром и полученное не совсем белое твердое вещество отделяют путем фильтрации, промывают гексаном и сушат в течение ночи в вакууме при 30°С с получением гидрохлорида этилового эфира (S1)-индолин-2-карбоновой кислоты (25,7г, 78%). Твердое вещество растворяют в этаноле (800мл), добавляют 5%-ный Рd/С (25г) и полученную суспензию гидрируют в аппарате Парра в течение 8 часов (4,1бара, 60пси). Раствор фильтруют и растворитель удаляют в вакууме. Остаток растворяют, растирают с диэтиловым эфиром и путем фильтрации получают 18,8г (73%) не совсем белого твердого вещества (цис-Ohi-OEt×HCl). Способом, по существу эквивалентным, описанному в примере 1-А, получают 13,5г (93%) Cbz-D-hPro-cisOhi-OEt из Cbz-D-hPro-OH и цис -Ohi-OEt ×НСl. 1H ЯМР; FD-MS, m/e 442 (М+). Анализ для С 25Н34N2О 5: рассчитано,% С 67,85 H 7,74 N 6,33 найдено,% 67,59 7,72 6,48 Способом, по существу эквивалентным, описанному в примере 1-Г, получают 12,5г (102%) Cbz-D-hPro-cisOhi-OH. 1Н-ЯМР; FD-MS, m/е: 414 (М+). Анализ для С 23Н30N2О 5: рассчитано,% С 66,65 H 7,29 N 6,76 найдено,% 66,4 7,30 6,86 Б) Получение Cbz-D-hPro-Ohi-p-NHCH2C6H4C(NH)NHCbz. Способом, по существу эквивалентным, описанному в примере 18-Д, получают 3,3г (67%) Cbz-D-hPiroOhi-p-NHCH2-C6H4C(NH)NHCbz из Cbz-D-hPro-Ohi-OH и P-H2NCH2C6H4C(NH)NHCbz×2HCl. 1 Н-ЯМР; FD-MS, m/e: 681 (MH +). В) Получение D-hPro-Ohi-p-NHCH 2C6H4C(NH)NH2-3HCl. Способом, по существу эквивалентным, описанному в примере 18-Е, получают 2,2г (66%) D-hPro-Ohi-pNHCH2-C6H4C(NH)NH2 ×3НСl. Продукт очищают п утем RPHRLC (метод 2; градиент (А/В) от 98/2 - до 60/40, 3000 минут). 1Н-Я МР; - FD-MS m/e: 412 (М+). Анализ для С 23Н33N5O 2 × 3 НСl × 0,5 Н2 O: рассчитано,% С 52,13 H 7,04 N 13,22 найдено,% 51,98 7,04 13,35 Пример 21 (D-Гомопролил-N(a)-(2-фенилэтил)-N[[4(аминоиминометил) фенил]-метил]-глицинамид-дигилрохлорид) А) Получение Cbz-D-hPro-N(PhCH 2CH2)Gly-OH. К раствору фенилэтиламина (58мл, 461ммоль) и триэтиламина (21мл, 154ммоль) в этаноле (200мл) при 0°С добавляют раствор трет-бутилбромацетата (30г, 154ммоль) в этаноле (50мл) в течение 1 часа. Охлаждающую баню оставляют и раствор оставляют нагреваться до комнатной температуры. После перемешивания в течение ночи растворители удаляют в вакууме и остаток растворяют в 1н растворе лимонной кислоты. Водный раствор промывают дважды диэтиловым эфиром, подщелачивают твердым бикарбонатом натрия и затем экстрагируют три раза этилацетатом (20мл). Объединенные этилацетатные экстракты сушат (ΜgSO 4) фильтруют и оставляют стоять в течение 24-х часов. Образовавшийся осадок фильтруют, промывают диэтиловым эфиром и высушивают с получением 10,5г белого твердого вещества. Маточный раствор концентрируют до объема примерно 100мл и затем разбавляют диэтиловым эфиром (400мл). После стояния в течение 30 минут раствор фильтруют, получая дополнительные 23,5г белого
ДивитисяДодаткова інформація
Назва патенту англійськоюPeptides derivatives, a method for the preparation thereof, pharmaceutical composition and a method for inhibition of thrombine of mammals
Автори англійськоюSmith Gerald Floyd, Robert Teodor Shuman
Назва патенту російськоюПроизводные пептидов, способ их получения, фармацевтическая композиция и способ ингибирования тромбина у млекопитающих
Автори російськоюСмит Джеральд Флойд, Шуман Роберт Теодор
МПК / Мітки
МПК: C07C 257/00, A61P 7/02, C07K 5/06, C07K 5/097, C07K 5/062, C07K 5/078, C07K 5/02, C07D 207/16, A61K 38/55, C07K 5/065
Мітки: одержання, спосіб, фармацевтична, тромбіну, композиція, пептидів, похідні, ссавців, інгібування
Код посилання
<a href="https://ua.patents.su/76-67715-pokhidni-peptidiv-sposib-kh-oderzhannya-farmacevtichna-kompoziciya-ta-sposib-ingibuvannya-trombinu-u-ssavciv.html" target="_blank" rel="follow" title="База патентів України">Похідні пептидів, спосіб їх одержання, фармацевтична композиція та спосіб інгібування тромбіну у ссавців</a>
Попередній патент: Спосіб одержання фулеренів
Наступний патент: Спосіб виробництва емульсії бензилбензоату і протипедикульозна композиція інгредієнтів
Випадковий патент: Телескопічне кріплення знімних протезів