Азетидинілоксифенілпіролідинові сполуки
Формула / Реферат
1. Сполука Формули

або її фармацевтично прийнятна сіль, де R - водень або метил.
2. Сполука або сіль за п. 1 формули
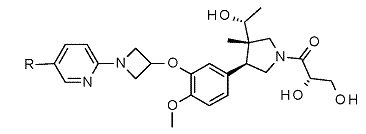 ,
,
де R - водень або метил.
3. Сполука або сіль за п. 1 або п. 2, де R - метил.
4. Сполука, яка являє собою (2S)-3-[(3S,4S)-3-[(1R)-1-гідроксіетил]-4-(4-метокси-3-{[1-(5-метилпіридин-2-іл)азетидин-3-іл]окси}феніл)-3-метилпіролідин-1-іл]-3-оксопропан-1,2-діол.
5. Фармацевтична композиція, яка містить сполуку за будь-яким із пп. 1-4 або її фармацевтично прийнятну сіль і фармацевтично прийнятний носій, розріджувач або наповнювач.
6. Фармацевтична композиція, яка містить перший компонент, який являє собою сполуку за будь-яким із пп. 1-4 або її фармацевтично прийнятну сіль, і другий компонент, яким є тадалафіл, і фармацевтично прийнятний носій, розріджувач або наповнювач.
7. Спосіб лікування надактивного сечового міхура, який включає введення пацієнту, який потребує цього, ефективної кількості сполуки за будь-яким із пп. 1-4 або її фармацевтично прийнятної солі.
8. Спосіб лікування надактивного сечового міхура, який включає введення пацієнту, який потребує цього, ефективної кількості сполуки за будь-яким із пп. 1-4 або її фармацевтично прийнятної солі, в поєднанні з ефективною кількістю тадалафілу.
9. Спосіб лікування надактивного сечового міхура, який включає введення пацієнту, який потребує цього, ефективної кількості (2S)-3-[(3S,4S)-3-[(1R)-l-гідроксіетил]-4-(4-метокси-3-{[1-(5-метилпіридин-2-іл)азетидин-3-іл]окси}феніл)-3-метилпіролідин-1-іл]-3-оксопропан-1,2-діолу або його фармацевтично прийнятної солі, в поєднанні з ефективною кількістю тадалафілу.
10. Сполука за будь-яким із пп. 1-4 або її фармацевтично прийнятна сіль для застосування в терапії.
11. Сполука за будь-яким із пп. 1-4 або її фармацевтично прийнятна сіль для застосування в лікуванні надактивного сечового міхура.
Текст
Реферат: Цим винаходом запропоновані певні азетидинілоксифенілпіролідинові сполуки, зокрема сполуки Формули І HO O N R O N N O HO OH , де R - водень або метил, і їх фармацевтичні композиції. Крім того, цим винаходом запропоновані способи застосування сполуки Формули І для лікування надактивного сечового міхура. UA 115583 C2 (12) UA 115583 C2 UA 115583 C2 5 10 15 20 25 30 35 40 45 50 Цим винаходом запропоновані певні азетидинілоксифенілпіролідинові сполуки, фармацевтичні композиції на їх основі, способи їх застосування і способи їх одержання. Надактивний сечовий міхур (ОАВ) являє собою симптоматично визначений медичний стан, до якого відносять симптоми частоти та невідкладності сечовипускання з гострим нетриманням сечі або без нього. Надактивний сечовий міхур являє собою стан, що негативно впливає на якість життя та повсякденну діяльність приблизно 17 % дорослого населення. Незважаючи на прогрес, досягнутий у лікуванні надактивного сечового міхура, багато пацієнтів страждають на надактивний сечовий міхур протягом багатьох років без усунення симптомів хворобливого стану. Лікарськими засобами, які переважно застосовують для лікування надактивного сечового міхура, є антимускаринові препарати, які мають хорошу початкову дію, але приймання цих препаратів протягом тривалого періоду часу призводить до недодержання пацієнтами режиму та схеми лікування через побічні ефекти і зниження ефективності. Таким чином, залишається значна незадоволена потреба в безпечних та ефективних лікарських засобах для лікування надактивного сечового міхура. Циклічні нуклеотиди (цАМФ і цГМФ) є важливими вторинними месенджерами, які модулюють скоротність гладеньких м'язів. Циклічні нуклеотидні фосфодіестерази (PDE) гідролізують циклічні нуклеотиди і відіграють важливу роль у регуляції рівня і тривалості дії циклічних нуклеотидів всередині клітин. Сполуки, які інгібують PDE, підвищують клітинні рівні циклічних нуклеотидів і тим самим зменшують напруження гладеньких м'язів багатьох типів. Попередні дослідження показали, що релаксація гладеньких м'язів сечового міхура головним чином опосередковується речовинами, які підвищують рівень цАМФ. Фосфодіестераза 4 (PDE4) є цАМФ-специфічною і сильно експресується в сечовому міхурі. По суті припускається причетність PDE4 до контролю тонусу гладенької мускулатури сечового міхура in vitro і на тваринних моделях надактивного сечового міхура (Kaiho Y. et al. BJU International 2008, 101(5), 615-620). Сполуки за цим винаходом є інгібіторами фосфодіестерази 4 (PDE4) і демонструють селективність відносно PDE4. Таким чином, вважають, що сполуки за цим винаходом є корисними для лікування станів, при яких PDE4 відіграє роль, таких як надактивний сечовий міхур, включаючи полегшення пов'язаних із цим симптомів, таких як частота і невідкладність. У публікації міжнародної заявки WO 01/47905 розкриті певні похідні піролідинових сполук як інгібітори фосфодіестерази, зокрема, PDE4, і охарактеризовані ці сполуки як корисні при лікуванні численних захворювань, включаючи астму. Цим винаходом запропоновані нові сполуки, які є інгібіторами PDE4, а отже є корисними при лікуванні надактивного сечового міхура та інших розладів. Запропоновані сполуки задовольняють потребу в безпечних та ефективних методах лікування станів, пов'язаних з PDE4, таких як надактивний сечовий міхур. Цим винаходом запропонована сполука Формули I де R - водень чи метил, або її фармацевтично прийнятна сіль. Конкретною сполукою Формули I є сполука, де R - метил, або її фармацевтично прийнятна сіль. Конкретною сполукою Формули I є (2S)-3-[(3S, 4S)-3-[(1R)-1-гідроксіетил]-4-(4-метокси-3-{[1(5-метилпіридин-2-іл)азетидин-3-іл]окси}феніл)-3-метилпіролідин-1-іл]-3-оксопропан-1,2-діол або його фармацевтично прийнятна сіль. Цим винаходом також запропонована фармацевтична композиція, яка містить сполуку Формули I або її фармацевтично прийнятну сіль і фармацевтично прийнятний носій, розріджувач або наповнювач. У конкретному варіанті здійснення цього винаходу фармацевтична композиція додатково містить один або декілька інших терапевтичних засобів, таких як тадалафіл (tadalafil). По суті цим винаходом запропонована фармацевтична композиція, яка містить перший компонент, який являє собою сполуку Формули I або її фармацевтично прийнятну сіль, і другий компонент, яким є тадалафіл, і фармацевтично 1 UA 115583 C2 5 прийнятний носій, розріджувач або наповнювач. Крім того, цим винаходом запропонована сполука Формули I або її фармацевтично прийнятна сіль для застосування в терапії. Цим винаходом також запропонована сполука Формули I або її фармацевтично прийнятна сіль для застосування в лікуванні надактивного сечового міхура. Крім того, цим винаходом запропоноване застосування сполуки Формули I або її фармацевтично прийнятної солі для виготовлення лікарського засобу для лікування надактивного сечового міхура. Конкретною сполукою Формули I є сполука формули Ia 10 15 20 25 30 35 40 45 50 де R - водень чи метил, або її фармацевтично прийнятна сіль. Конкретною сполукою Формули Ia є сполука, де R - метил, або її фармацевтично прийнятна сіль. Конкретною сполукою Формули Ia є (2S)-3-[(3S, 4S)-3-[(1R)-1-гідроксіетил]-4-(4-метокси-3-{[1(5-метилпіридин-2-іл)азетидин-3-іл]окси}феніл)-3-метилпіролідин-1-іл]-3-оксопропан-1,2-діол або його фармацевтично прийнятна сіль. Крім того, цим винаходом запропонований спосіб лікування надактивного сечового міхура, який включає введення пацієнту, що потребує цього, ефективної кількості сполуки Формули Ia або її фармацевтично прийнятної солі. У конкретному варіанті здійснення цим винаходом запропонований спосіб лікування надактивного сечового міхура, який включає введення пацієнту, що потребує цього, ефективної кількості першого компонента, який являє собою сполуку Формули Iа або її фармацевтично прийнятну сіль, в поєднанні з ефективною кількістю другого компонента, яким є тадалафіл. Крім того, цим винаходом запропонований спосіб лікування надактивного сечового міхура, який включає введення пацієнту, що потребує цього, ефективної кількості (2S)-3-[(3S, 4S)-3[(1R)-1-гідроксіетил]-4-(4-метокси-3-{[1-(5-метилпіридин-2-іл)азетидин-3-іл]окси}феніл)-3метилпіролідин-1-іл]-3-оксопропан-1,2-діолу або його фармацевтично прийнятної солі, в поєднанні з ефективною кількістю тадалафілу. Слід розуміти, що сполуки за цим винаходом можуть перебувати у вигляді стереоізомерів. Варіанти здійснення цього винаходу охоплюють всі енантіомери, діастереомери та їх суміші. Варіантами здійснення, яким віддається перевага, є поодинокі діастереомери, а варіантами здійснення, яким віддається більша перевага, є поодинокі енантіомери. Термін "фармацевтично прийнятна сіль" охоплює солі приєднання кислоти, які існують в поєднанні з основною частиною сполуки Формули I. До таких солей належать фармацевтично прийнятні солі, наприклад, солі, перелічені в Handbook of Pharmaceutical Salts: Properties, Selection and Use, P.H. Stahl and C.G. Wermuth (Eds.), Wiley-VCH, New York, 2002, які відомі фахівцям у цій галузі. Окрім фармацевтично прийнятних солей, цим винаходом розглядаються також інші солі. Вони можуть використовуватися як проміжні хімічні продукти при очищенні сполук або при одержанні інших фармацевтично прийнятних солей, або можуть бути використані для ідентифікації, визначення характеристик або очищення сполук за цим винаходом. У значенні, вживаному у цьому описі, термін "пацієнт" стосується теплокровної тварини, такої як ссавець, включаючи людину. Переважно пацієнтом є людина. Слід мати на увазі також, що фахівець у цій галузі може лікувати надактивний сечовий міхур шляхом введення пацієнту, який на даний момент має симптоми цього стану, ефективної кількості сполуки Формули I. Відповідно, терміни "лікувати" або "лікування" означають всі процеси, в яких може відбуватись уповільнення, переривання, припинення, регулювання або зупинення прогресування існуючого розладу та/або його симптомів, але не обов'язково вказують на повне усунення всіх симптомів. Слід мати на увазі також, що фахівець у цій галузі може лікувати надактивний сечовий міхур шляхом введення ефективної кількості сполуки Формули I пацієнту з підвищеним ризиком 2 UA 115583 C2 5 10 15 20 25 30 35 40 45 50 55 60 виникнення майбутніх симптомів цього стану, і таке введення призначене також для профілактичного лікування надактивного сечового міхура. У значенні, вживаному у цьому описі, термін "ефективна кількість" сполуки Формули I означає кількість, що є дозою, яка є ефективною при лікуванні розладу, такого як надактивний сечовий міхур, розглянутого у цьому описі. Лікар, що ставить діагноз, як фахівець в цій галузі, може легко визначити ефективну кількість із застосуванням традиційних методів, а також шляхом дослідження результатів, одержаних за аналогічних обставин. При визначенні ефективної кількості або дози сполуки Формули I до уваги приймають численні фактори, включаючи, але без обмеження ними, призначену до введення сполуку Формули I; сумісне введення інших засобів, у разі їх застосування; вид ссавця; його розмір, вік і загальний стан здоров'я; ступінь ураження або тяжкість розладу, такого як надактивний сечовий міхур; реакція окремого пацієнта; спосіб введення; характеристики біодоступності введеного препарату; вибрана схема приймання лікарського засобу; і застосування будь-яких супутніх лікарських засобів; та інші суттєві обставини. Сполука Формули I може бути застосована в комбінації з іншими препаратами, які застосовуються в лікуванні/профілактиці/пригніченні або зменшенні інтенсивності симптомів захворювань або станів, для яких сполуки Формули I є корисними, зокрема надактивного сечового міхура. Такий(-і) інший(-і) лікарський(-і) засіб(-оби) можна вводити таким шляхом і в такій кількості, які зазвичай використовують з цією метою, у тому числі одночасно або послідовно зі сполукою Формули I. Якщо сполуку Формули I застосовують одночасно з одним або декількома іншими лікарськими засобами, перевагу віддають дозованій лікарській формі, яка містить такі інші лікарські засоби на додаток до сполуки Формули I. Відповідно, до фармацевтичних композицій за цим винаходом належать композиції, які містять один або декілька інших активних інгредієнтів на додаток до сполуки Формули I. До інших ефективних при лікуванні надактивного сечового міхура активних інгредієнтів, придатних до об'єднування зі сполукою Формули I, які вводять окремо або в одному і тому самому фармацевтичному препараті, належить інгібітор PDE5, такий як тадалафіл. Сполуки за цим винаходом можуть бути введені окремо або у вигляді фармацевтичної композиції в поєднанні з фармацевтично прийнятними носіями або наповнювачами, при цьому їх частка і природа визначаються розчинністю і хімічними властивостями, у тому числі стабільністю вибраної сполуки, обраним шляхом введення і загальноприйнятою фармацевтичною практикою. Сполуки за цим винаходом, які є ефективними самі по собі, можна також одержувати і вводити у формі їх фармацевтично прийнятних солей для зручності кристалізації, підвищеної розчинності тощо. Фахівець з приготування композицій може легко вибрати правильну форму і спосіб введення в залежності від конкретних характеристик вибраної сполуки, розладу або стану, що підлягає лікуванню, стадії розладу або стану та інших суттєвих обставин (дивись, наприклад, Remington: The Science and Practice of Pharmacy, D.B. Troy, Editor, 21st Edition., Lippincott, Williams & Wilkins, 2006). In vitro дослідження інгібування PDE4 Дослідження фосфодіестераз проводять по суті у відповідності зі способом, описаним у Loughney K., et al., J. Biol. Chem., 271, pp. 796-806 (1996). Людські рекомбінантні білки PDE4A, PDE4B, PDE4C, PDE4D та PDE5 експресують в Saccharomyces cerevisiae, яким бракує ендогенних PDE, і очищають. Фосфодіестерази розбавляють на льоду буфером для розведення ферменту (25 мМ розчин Трис-буфера, рН 7,5, 0,1 мМ DTT (дитіотреїтол), 5,0 мМ MgCl2, 100 мМ NaCl, 5 мкM ZnSO4, 100 мкг/мл BSA (бичачий сироватковий альбумін)) із забезпеченням приблизно 20-40 % гідролізу циклічного нуклеотидмонофосфату (cNMP) за відсутності інгібітора. Концентрований розчин досліджуваних сполук розбавляють на робочій станції Beckman ™ Biomek 1000 з охопленням діапазону концентрацій 4,5 log одиниць з кроком 0,5 log одиниці. Концентрація DMSO (диметилсульфоксид) в кінцевій досліджуваній системі становить 2,5 % для всіх ферментів PDE. Кінцева випробувана концентрація досліджуваної сполуки становить від 0,03 нМ до 1 мкМ. Дослідження проводять на 96-лунковому титрувальному мікропланшеті на роботизованій ™ робочій станції Beckman Biomek 1000. Кожен рядок вказаного планшета, що відповідає 10точковій кривій залежності "доза-ефект", вміщує контрольні розведені розчини (без ферменту), неінгібовані контрольні розведені розчини і розведені розчини інгібітора в діапазоні концентрацій 4,5 log одиниць з кроком 0,5 log. Досліджувані концентровані розчини завантажують у резервуари Biomek (вода, розріджувач інгібітора [2,5 % або 10 % розчин DMSO], 5 буфера для аналізу PDE, субстрат, розчини інгібіторів, розчини ферментів, 3 UA 115583 C2 5 10 15 20 25 30 35 40 45 50 нуклеотидаза зміїної отрути і суспензія деревного вугілля). Реакцію ініціюють ферментом, та інкубують протягом 15 хв при 30C. Потім додають надлишок нуклеотидази зміїної (Crotalus atrox) отрути (5 мкл/лунка), і суміш знову інкубують протягом 3 хв. Реакцію зупиняють додаванням 200 мкл суспензії активованого вугілля, після чого планшет центрифугують протягом 5 хв при 750g. Виконують програму перенесення, в ході якої 200 мкл супернатанту видаляють і вміщують у новий планшет. Кількість радіоактивної речовини, вивільненої у вигляді ™ фосфату, визначають із застосуванням лічильника Wallac MicroBeta Plate . Оброблені дані при кожній концентрації інгібітора піддають аналізу із застосуванням чотири, три- або двопараметричної логістичної моделі залежності "доза-ефект" для визначення значення IC50. Для тих наборів даних, які демонструють >95 % інгібування при максимальній концентрації інгібітора, застосовують чотирипараметричну логістичну модель залежності "дозаефект". У наведеному вище дослідженні сполуки Прикладу 1 і Прикладу 2 демонструють по відношенню до PDE4B значення IC50, що становить менше ніж 10 нМ. Більш конкретно, сполуки Прикладу 2 мають визначене у наведеному вище дослідженні по відношенню до PDE4B значення IC50, що становить 0,58 нМ. Ці дані показують, що сполуки Прикладу 1 і Прикладу 2 є інгібіторами PDE4B. In vivo модель надактивного сечового міхура In vivo вплив інгібіторів PDE4 на надактивний сечовий міхур вивчають на мишачій моделі індукованого циклофосфамідом (CYP) хронічного надактивного сечового міхура, запозиченій з Boudes et al., Neurourol. Urodynam. 2011. У типовому дослідженні використовують мишейсамиць лінії С57/BL6 масою приблизно 20 г (Harlan Laboratories, Inc., Indianapolis, Indiana). Мишей довільно розподіляють за масою тіла на групи за один день до початку дослідження. Мишей розміщують окремо, і утримують з 12-годинним циклом чергування світла і темряви при температурі 22C з ad lib доступом до корму (TD 2014 з 0,72 % Са і 0,61 % P, 990 МО/г D3, ™ Teklad , Madison, WI) і води. Тварини одержують циклофосфамід (розчинений у фізіологічному розчині) шляхом внутрішньоочеревинного введення в дозі 100 мг/кг у дні 1, 3, 5 і 7 для спричинення хронічного надактивного сечового міхура. Контрольна група (носій) щодня пероральним шляхом одержує носій (HEC (гідроксіетилцелюлоза) 1 %/Твін 80 0,25 %/протиспінювач 0,05 %). Всім іншим групам щоденно пероральним шляхом вводять тадалафіл в дозі 10 мг/кг у поєднанні з 0,1 мг/кг, 1,0 мг/кг або 10,0 мг/кг досліджуваної сполуки в об'ємі 200 мкл/миша. На 8-й день мишей розміщують в камерах для збору сечі з фільтрувальним папером, розташованим під камерою. До збору сечі кожній миші із застосуванням шлункового зонда вводять 1 мл води. Сечу збирають з 18 год. до 22 год. вечора (тобто протягом 4 год.). Протягом вказаного 4-годинного періоду в ролі джерела води ™ використовують гелеві чашки (DietGel 76A). Фільтрувальний папір змінюють щогодини. Частоту випорожнення і об'єм на одне випорожнення розраховують з використанням програмного забезпечення Image J (NIH (Національний інститут здоров'я)). Дані піддають статистичному ® аналізу із застосуванням програмного забезпечення JMP8 (Cary, N.C.). Ознаки надактивного сечового міхура у тварини з'являються через 8 днів після піддавання обробці CYP, свідченням чого є збільшення частоти сечовипускання (кількість сечовипускань у контрольних тварин: 6,66±0,91 у зіставленні з тваринами, підданими обробці носієм: 16,5±1,65, протягом 4-годинного періоду) і зменшення об'єму на одне випорожнення (контроль: 173,36±38,39 мл у зіставленні з тваринами, обробленими носієм: 31,93±4,16 мл). Всі піддані обробці групи одержують фіксовану дозу тадалафілу (10 мг/кг). При цій дозі тадалафіл не чинить значного впливу ні на частоту сечовипускання, ні на об'єм на одне випорожнення. Відповідно до протоколу, загалом такого, як описано вище, сполука Прикладу 2, що вводиться з тадалафілом, значно знижує частоту сечовипускання залежно від дози (Таблиця 1). Крім того, в залежності від дози також спостерігається збільшення об'єму на одне випорожнення (Таблиця 2). Це показує, що сполука Прикладу 2 в комбінації з тадалафілом є активною на тваринній моделі надактивного сечового міхура. 4 UA 115583 C2 Таблиця 1 Обробка Носій Приклад 2 0,1 мг/кг + тадалафіл 10 мг/кг Приклад 2 1,0 мг/кг + тадалафіл 10 мг/кг Приклад 2 10,0 мг/кг + тадалафіл 10 мг/кг Середня частота випорожнень (кількість/4 год.) 16,5 Середня квадратична Значення p у зіставленні з помилка носієм* 1,6583 10 0,9587 0,0057 8,61 0,7633 0,0003 8,38 1,2049 0,0000 *p
ДивитисяДодаткова інформація
Назва патенту англійськоюAzetidinyloxyphenylpyrrolidine compounds
Автори англійськоюDeng, Gary G., Huang, Danwen, Odingo, Joshua O.
Автори російськоюДэн Гари Г., Хуан Даньвень, Одинго Джошуа О.
МПК / Мітки
МПК: A61K 31/4985, C07D 401/14
Мітки: сполуки, азетидинілоксифенілпіролідинові
Код посилання
<a href="https://ua.patents.su/12-115583-azetidiniloksifenilpirolidinovi-spoluki.html" target="_blank" rel="follow" title="База патентів України">Азетидинілоксифенілпіролідинові сполуки</a>
Попередній патент: Спосіб одержання вуглецевих наноматеріалів
Наступний патент: Спосіб виготовлення ємності (кег) з поліетилентерефталату (пет)
Випадковий патент: Водопровідно-поливальна система












