Бензамідні сполуки, корисні як інгібітори деацетилази гістонів
Номер патенту: 98757
Опубліковано: 25.06.2012
Автори: Верінг Майкл Джеймс, Стоукс Елайн Софі Елізабет, Ендрюс Девід Майкл, Тьорнер Ендрю
Формула / Реферат
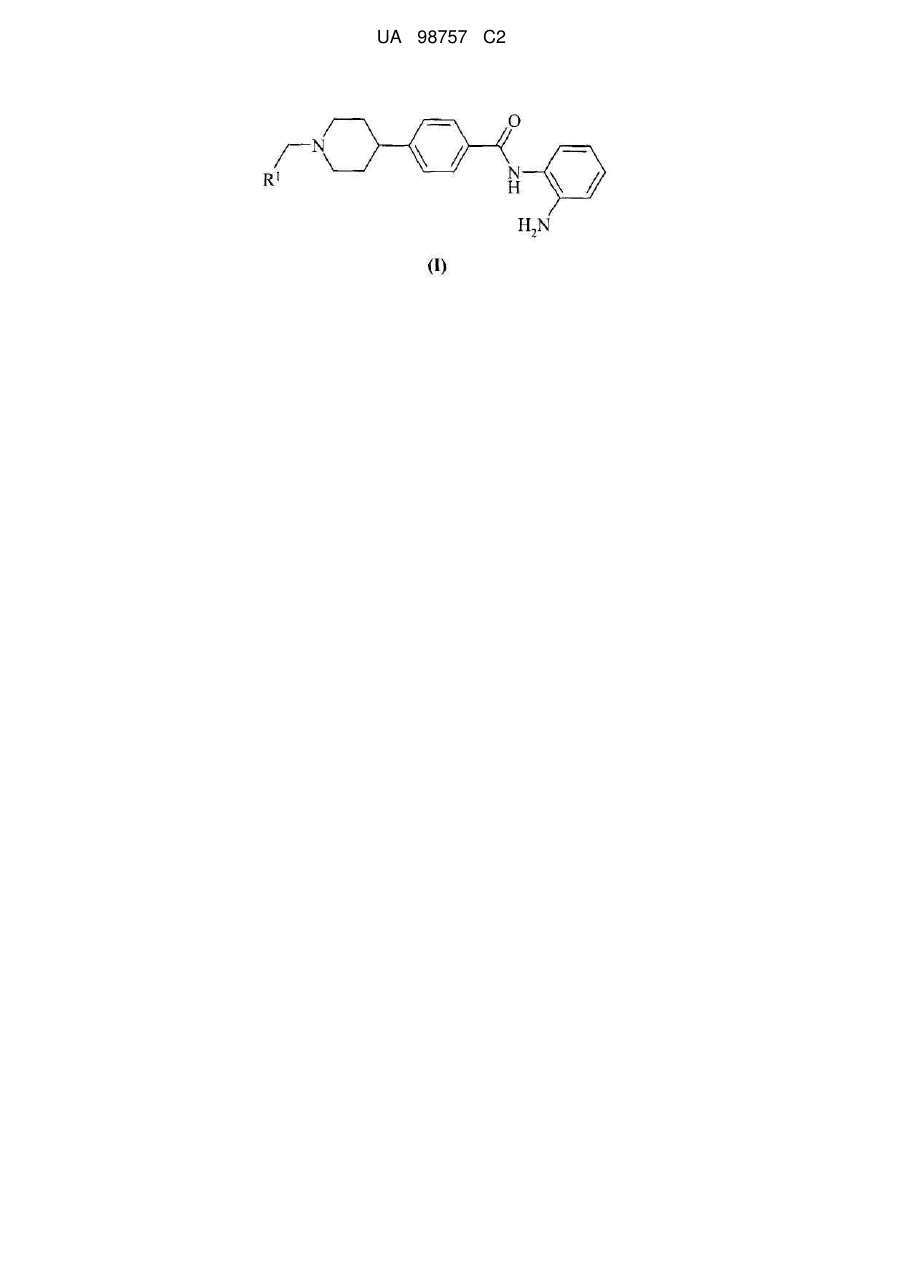
1. Сполука формули (ІА)
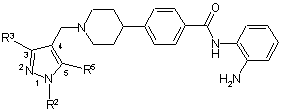 , (ІА)
, (ІА)
де R2, R3 і R5 незалежно вибирають із водню або метилу; або її фармацевтично прийнятна сіль.
2. Сполука за п. 1, де принаймні одна група, вибрана з R2, R3 і R5, не являє собою водень.
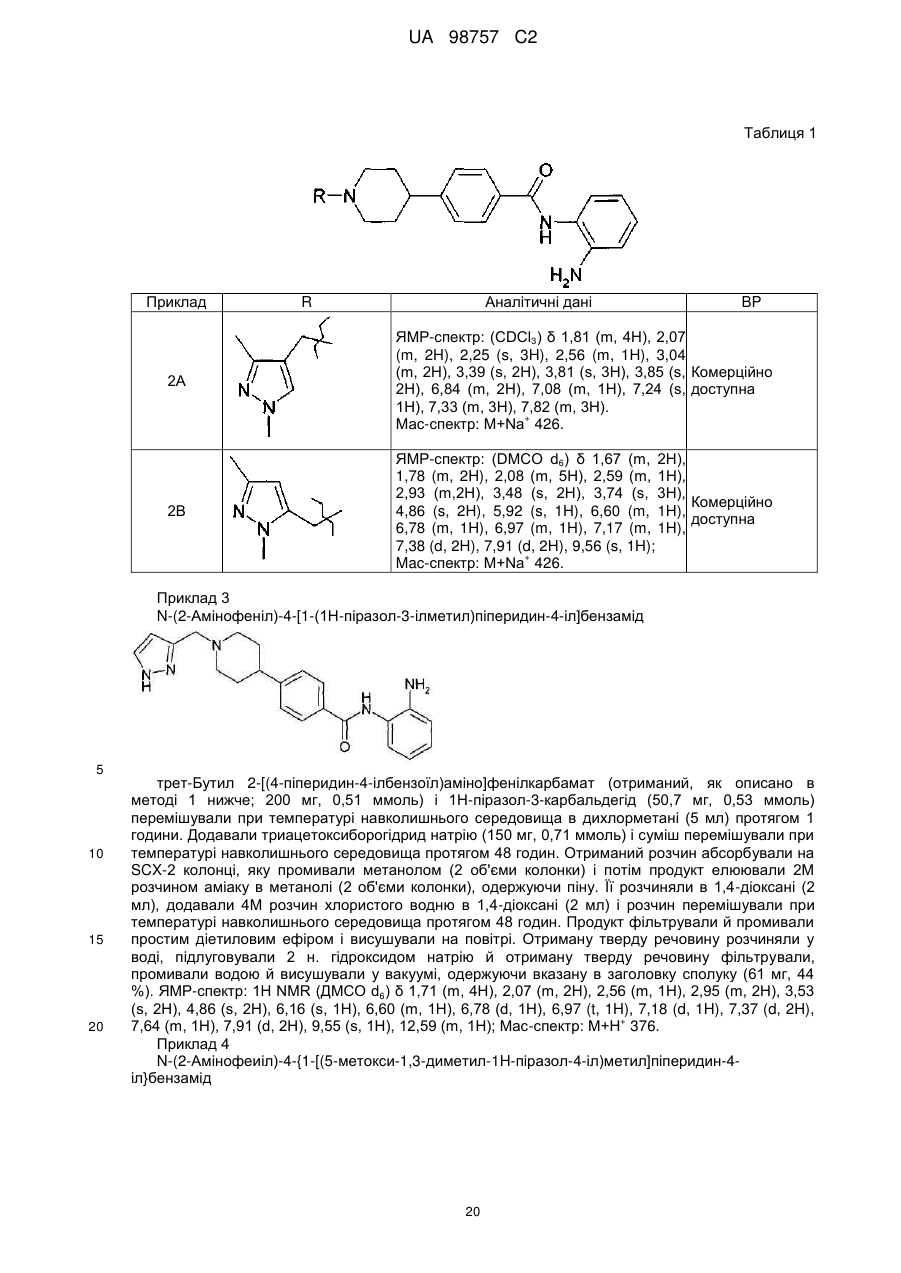
3. Сполука за п. 1, яка являє собою N-(2-амінофеніл)-4-{1-[(1-метил-1Н-піразол-4-іл)метил]піперидин-4-іл}бензамід або його фармацевтично прийнятну сіль.
4. Сполука за п. 1, яка являє собою N(2-амінофеніл)-4-{1-[(1,3-диметил-1Н-піразол-4-іл)метил]піперидин-4-іл}бензамід або його фармацевтично прийнятну сіль.
5. Сполука за п. 1, яка являє собою N-(2-амінофеніл)-4-{1-[(1,3,5-триметил-1H-піразол-4-іл)метил]піперидин-4-іл}бензамід або його фармацевтично прийнятну сіль.
6. Сполука за п. 1, яка являє собою N-(2-амінофеніл)-4-{1-[(1,5-диметил-1H-піразол-4-іл)метил]піперидин-4-іл}бензамід або його фармацевтично прийнятну сіль.
7. Фармацевтична композиція, яка має інгібуючу дію по відношенню до гістондеацетилази (HDAC), яка містить сполуку за будь-яким з пп. 1-6, або її фармацевтично прийнятну сіль, у сполученні з фармацевтично прийнятним розріджувачем або носієм.
8. Сполука за будь-яким з пп. 1-6, або її фармацевтично прийнятна сіль, для застосування як лікарського засобу, що має інгібуючу дію по відношенню до гістондеацетилази (HDAC).
9. Сполука за будь-яким з пп. 1-6, або її фармацевтично прийнятна сіль, для застосування для лікування злоякісного новоутворення.
10. Сполука за будь-яким з пп. 1-6, або її фармацевтично прийнятна сіль, для застосування для лікування раку легенів, раку прямої кишки, раку молочної залози, раку передміхурової залози, лімфоми та/або лейкозу.
11. Сполука за будь-яким з пп. 1-6, або її фармацевтично прийнятна сіль, для застосування для одержання інгібуючої дії по відношенню до HDAC у теплокровної тварини, такої як людина.
12. Спосіб одержання інгібуючої дії по відношенню до HDAC у теплокровної тварини, такої як людина, що потребує такого лікування, який включає введення вказаній тварині ефективної кількості сполуки за будь-яким з пп. 1-6.
13. Застосування сполуки за будь-яким з пп. 1-6, або її фармацевтично прийнятної солі, для приготування лікарського засобу для застосування для забезпечення інгібування клітинного циклу (дії, що пригнічує проліферацію клітин) у теплокровної тварини, такої як людина.
14. Спосіб інгібування клітинного циклу (пригнічення проліферації клітин) у теплокровної тварини, такої як людина, що потребує такого лікування, який включає введення вказаній тварині ефективної кількості сполуки за будь-яким з пп. 1-6, або її фармацевтично прийнятної солі.
15. Спосіб лікування злоякісного новоутворення в теплокровної тварини, такої як людина, що потребує такого лікування, який включає введення вказаній тварині ефективної кількості сполуки за будь-яким з пп. 1-6, або її фармацевтично прийнятної солі.
16. Застосування сполуки за будь-яким з п. 1-6, або її фармацевтично прийнятної солі, як визначено вище, для приготування лікарського засобу для застосування для лікування злоякісного новоутворення.
17. Спосіб одержання сполуки за п. 1, або її фармацевтично прийнятної солі, який включає стадії, на яких:
(а) вводять у взаємодію сполуку формули (II)
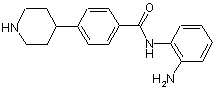 , (II)
, (II)
у якій анілінова частина є придатно захищеною;
зі сполукою формули (III)
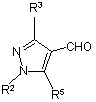 , (III)
, (III)
де R2, R3 і R5 мають значення, визначені в п. 1; та
(б) вводять у взаємодію продукт, одержаний на стадії (а), з відновлювальним агентом;
і потім, за необхідності, видаляють будь-які захисні групи, що залишилися, які можуть бути присутні.
Текст
Реферат: Винахід стосується бензамідних сполук формули (І): O N N H R1 H2N , (І) де R являє собою С-зв'язане піразольне кільце, яке необов'язково заміщене однією або декількома групами, вибраними з С1-4алкілу, С3-4циклоалкілу, С1-4алкокси й С3-4циклоалкокси; або їх фармацевтично прийнятної солі або проліків. Винахід також стосується способів одержання таких сполук, фармацевтичних композицій, які їх містять, і їх застосування для приготування лікарського засобу для застосування як антипроліферативного засобу для запобігання або лікування пухлин або інших проліферативних станів, які чутливі до інгібування деацетилази гістонів (HDAC). 1 UA 98757 C2 (12) UA 98757 C2 UA 98757 C2 5 10 15 20 25 30 35 40 45 50 Даний винахід стосується нових певних бензамідних сполук або їх фармацевтично прийнятних солей, які є ефективними інгібіторами ферменту деацетилаза гістонів (HDAC). Винахід також стосується способів приготування цих нових бензамідних сполук, фармацевтичних композицій, які їх містять, і їх застосування в терапевтичних способах, наприклад, для приготування лікарських засобів для інгібування HDAC у теплокровної тварини, такої як людина. Активність HDAC пов'язана з багатьма хворобливими станами, такими як злоякісне новоутворення (Marks і ін., Nature Reviews, 1, 194-202, (2001)), фіброзно-кістозна дегенерація (Li, S. і ін., J. Віоl Chem., 274, 7803-7815, (1999)), хорея Хантингдона (Steffan, J.S. і ін., Nature, 413, 739-743, (2001)) і серповидно-клітинна анемія (Gabbianelli, M. і ін., Blood, 95, 3555-3561, (2000)). Отже, даний винахід також стосується способів лікування будь-якого з перерахованих вище захворювань за допомогою бензамідних сполук згідно із даним винаходом, а також застосування цих бензамідних сполук для приготування лікарського засобу для лікування вказаних хворобливих станів. В еукаріотичних клітинах ДНК звичайно упакована для запобігання її доступності для транскрипційного фактора. При активації клітини ця упакована ДНК стає доступною для ДНКзв'язувальних білків, у такий спосіб надається можливість для індукції транскрипції генів (Beato, M., J. Med. Chem., 74, 711-724 (1996); Wolffe, A.P., Nature, 387, 16-17 (1997)). Ядерна ДНК зв'язана з ядерними білками, відомими як гістони, з утворенням комплексу, який називають хроматином. Корові гістони, які позначаються як Н2А, Н2В, Н3 і Н4, оточені 146 парами основ ДНК із утворенням основної одиниці хроматину, яка відома як нуклеосома. N-кінцеві хвости корових гістонів містять залишки лізину, які є сайтами для посттранскрипційного ацетилування. Ацетилування кінцевої аміногрупи в боковому ланцюзі лізину нейтралізує потенціал бокового ланцюга, утворюючи при цьому позитивний заряд, що, ймовірно, позначається на укладанні структури хроматину. Деацетилази гістонів (HDAC) являють собою цинк-вмісні ферменти, які каталізують видалення ацетильних груп з ε-аміно кінця залишків лізину, які кластеризуються біля амінокінців нуклеосомальних гістонів. HDAC можна розділити на два класи, перший з них (HDAC 1, 2, 3 і 8) являють собою Rpd3-подібні білки дріжджів, а другий (HDAC 4, 5, 6, 7, 9 і 10) являють собою Hda1-подібні білки дріжджів. Відомо, що оборотний процес ацетилування є важливим для регуляції транскрипції й здійснення клітинного циклу. Додатково, порушення регуляції HDAC зв'язане з деякими видами злоякісних новоутворень і було показано, що інгібітори HDAC, такі як трихостатин А (природний продукт, виділений з Streptomyces hygroscopicus), проявляють істотну інгібуючу дію на ріст клітин і протипухлинну дію (Meinke, Р. Т., Current Medicinal Chemistry, 8, 211-235 (2001)). Yoshida і ін., (Exper. Cell Res., 177, 122-131 (1988)) виявили, що трихостатин А викликає затримку клітинного циклу фібробластів щурів у фазах G1 і G2, що свідчить про залучення HDAC у регуляцію клітинного циклу. Крім того, було показано, що трихостатин А індукує кінцеву диференціацію, інгібує ріст клітин і запобігає утворенню пухлин у мишей (Finnin і ін., Nature, 401, 188-193 (1999)). З опублікованих міжнародних патентних заявок WO 03/087057 і WO 03/092686 відомо, що певні похідні бензаміду є інгібіторами HDAC. Однією із переважних сполук, описаних в WO 03/087057, є N-(2-амінофеніл)-4-[1-(пірид-2-илметил)піперидин-4-іл]бензамід [1] (його структура наведена нижче). Зараз нами було виявлено, що певні похідні бензаміду, які несуть необов'язково заміщену піразольну групу замість піридильної групи, є ефективними інгібіторами HDAC. Додатково, також було виявлено, що переважні сполуки згідно із даним винаходом мають інші сприятливі фармакологічні властивості, включаючи сприятливу ефективність по відношенню до клітин або в умовах in-vivo, сприятливі DMPK властивості (наприклад, сприятливий профіль біодоступності та/або сприятливі вільні рівні в плазмі крові та/або сприятливий період напівжиття та/або сприятливий об'єм розподілу), а також хороша або поліпшена розчинність. 1 UA 98757 C2 Додатково, похідні бензаміду згідно із даним винаходом звичайно проявляють надзвичайно низьку активність у дослідженні інгібування калієвого каналу, який кодується hERG, що є індикатором несприятливих і важких побічних серцево-судинних дій у клінічних умовах. Відповідно до даного винаходу, забезпечується сполука формули (І): 5 10 15 20 25 30 35 40 1 у якій R являє собою вуглецьзв'язане піразольне кільце, яке необов'язково заміщене однією або декількома групами, вибраними з С1-4алкілу, С3-4циклоалкілу, С1-4алкокси й С34диклоалкокси; або її фармацевтично прийнятна сіль. Мається на увазі, що певні сполуки формули (І), вказані вище, можуть проявляти явище таутомерії. Мається на увазі, що даний винахід охоплює будь-яку таку таутомерну форму або їх суміш, які мають вищеописану активність, і не обмежується тільки будь-якою такою однією таутомерною формою, яка використовується в наведених формулах або вказану в прикладах. Якщо необов'язкові замісники вибирають із "однієї або декількох" заміщуваних груп, то мається на увазі, що таке визначення охоплює всіх таких замісників, які вибрані з однієї із вказаних груп, або замісників, які вибрані із двох або більше вказаних груп. 1 Підходящі необов'язкові замісники для R можуть бути присутні на будь-яких доступних атомах вуглецю або азоту в піразольному кільці. 1 1 R підходяще несе від 1 до 3 заміщуваних груп. Альтернативно, R є незаміщеним. Як використовується в даному винаході, термін "алкіл" стосується нерозгалужених або розгалужених ланцюгів. Термін "циклоалкіл" охоплює кільцеві структури, але можуть додатково включати ланцюги у вигляді циклоалкіл-алкільних груп. Аналогічно, терміни "алкокси" і "циклоалкокси" включають алкільні, циклоалкільні або циклоалкіл-алкільні групи, зв'язані з допомогою атома кисню. 1 Підходящими С1-4алкільними або С3-4циклоалкільними замісниками для R є метил, етил, пропіл, циклопропіл, циклобутил, або циклопропілметил. 1 Підходящими С1-4алкокси й С1-4циклоалкокси замісниками для R є метокси, етокси, пропокси, циклопропокси, циклобутокси або метилциклопропокси. 1 У переважному варіанті здійснення винаходу, R являє собою вуглецьзв'язане піразольне кільце, яке необов'язково заміщене 1, 2 або 3 групами, вибраними з С 1-4алкілу або С1-4алкокси. 1 В подальшому варіанті здійснення винаходу, R являє собою вуглецьзв'язане піразольне кільце, яке необов'язково заміщене 1, 2 або 3 групами, вибраними з С1-2алкілу або С1-2алкокси. 1 Прикладами R груп є піразол-3-іл, піразол-4-іл, 1-метилпіразол-4-іл, 3-етилпіразол-4-іл, 1,3диметилпіразол-5-іл, 1,3-диметилпіразол-4-іл, 1,3,5-триметилпіразол-4-іл, 1,3-диметил-5метоксипіразол-4-іл, 1,5-диметилпіразол-4-іл, 1-етил-5-метилпіразол-4-іл, 1-етилпіразол-4-іл, і 1-етил-3-метилпіразол-4-іл (підданий таутомерії, якщо це є можливим). В подальшому варіанті здійснення винаходу, сполуки формули (І) включають сполуки формули (ІА) 2 де R являє собою водень, С1-4алкіл або С3-4циклоалкіл, і 3 5 R і R незалежно вибирають із водню, С1-4алкілу, С3-4циклоалкілу, С1-4алкокси або С14циклоалкокси. 2 UA 98757 C2 5 Слід взяти до уваги, що кільцеві атоми піразольної частини молекули формули (ІА) звичайно нумеруються, як показано на діаграмі вище. Проте, молекула піддається таутомерії, у випадку, 2 якщо R являє собою водень, де перемикання груп водню з одного атома азоту піразольного 3 5 кільця на інший, означає, що заміщені піразоли, де принаймні один з R або R відрізняється від 3 5 водню, неодмінно представляють суміші кожного таутомеру, і отже, де R і R вважаються взаємозамінними. В альтернативному варіанті здійснення винаходу, винахід забезпечує сполука формули (IB) 2 10 15 20 25 30 35 40 45 3 5 де R , R і R мають значення, визначені вище для формули (ІА) З іншого боку, слід взяти до уваги, що піразольна частина молекули формули (ІВ) звичайно пронумерована відповідно до схематичних зображень на діаграмі вище. Проте, як 2 обговорювалося вище для сполук формули (ІА), молекула також піддається таутомерії, якщо R являє собою водень. 2 Переважними прикладами R є водень, метил, етил, пропіл, циклопропіл, метилциклопропіл або циклобутил. 2 Наприклад, R являє собою водень, метил, етил, пропіл або циклопропіл. 2 У переважному варіанті здійснення винаходу, R являє собою водень, метил або етил. 2 В подальшому варіанті здійснення винаходу, R являє собою водень або метил. 3 5 Переважними прикладами груп R і R є водень метил, етил, пропіл, циклопропіл, циклопропілметил, метокси, етокси, пропокси або циклопропокси. 3 5 Переважними прикладами груп R або R є водень, метил, етил або метокси. 3 5 Підходяще, не більше ніж одна група R або R являє собою С1-4алкокси. 2 3 У переважному варіанті здійснення винаходу, принаймні одна, і переважно дві групи R , R і 5 R відрізняються від водню. В переважному варіанті здійснення винаходу, сполуки мають структурну формулу (ІА), 2 3 5 наведену вище, у якій R являє собою водень або С1-4алкіл, і R і R кожний незалежно вибирають із водню, С1-4алкілу, або С1-4алкокси. В подальшому варіанті здійснення винаходу, сполуки мають структурну формулу (ІА), 2 3 5 наведену вище, у якій R являє собою водень, метил або етил, і R і R кожний незалежно вибирають із водню, метилу, етилу або метокси. В подальшому варіанті здійснення винаходу, сполуки мають структурну формулу (ІА), 2 3 5 наведену вище, у якій R являє собою водень або метил, і R і R кожний незалежно вибирають із водню, метилу, етилу або метокси. В подальшому варіанті здійснення винаходу, сполуки мають структурну формулу (ІА), 2 3 5 наведену вище, у якій R являє собою водень або метил, і R і R кожний незалежно вибирають із водню, метилу або метокси. В подальшому варіанті здійснення винаходу, сполуки мають структурну формулу (ІА), 2 3 5 наведену вище, у якій R являє собою водень або метил, і R і R кожний незалежно вибирають із водню або метилу. У переважному варіанті здійснення винаходу, сполуки мають структурну формулу (IB), 2 3 5 наведену вище, у якій R являє собою водень або С1-4алкіл, і R і R кожний незалежно вибирають із водню, С1-4алкілу, або С1-4алкокси. В подальшому варіанті здійснення винаходу, сполуки мають структурну формулу (IB), 2 3 5 наведену вище, у якій R являє собою водень, метил або етил, і R і R кожний незалежно вибирають із водню, метилу, етилу або метокси. В подальшому варіанті здійснення винаходу, сполуки мають структурну формулу (IB), 2 3 5 наведену вище, у якій R являє собою водень або метил, і R і R кожний незалежно вибирають із водню, метилу, етилу або метокси. 3 UA 98757 C2 5 10 15 20 25 30 35 40 45 50 55 60 В подальшому варіанті здійснення винаходу, сполуки мають структурну формулу (IB), 2 3 5 наведену вище, у якій R являє собою водень або метил, і R і R кожний незалежно вибирають із водню, метилу або метокси. Переважні сполуки за винаходом включаю будь-яку з наступних сполук: N-(2-амінофеніл)-4-[1-(1H-піразол-3-ілметил)піперидин-4-іл]бензамід; N-(2-амінофеніл)-4-{1-[(5-метокси-1,3-диметил-1H-піразол-4-іл)метил]піперидин-4іл}бензамід; N-(2-амінофеніл)-4-{1-[(3-етил-1H-піразол-4-іл)метил]піперидин-4-іл}бензамід; N-(2-амінофеніл)-4-{1-[(1-метил-1H-піразол-4-іл)метил]піперидин-4-іл}бензамід; N-(2-амінофеніл)-4-{1-[(1,3-диметил-1H-піразол-5-іл)метил]піперидин-4-іл}бензамід; N-(2-амінофеніл)-4-{1-[(1,3-диметил-1H-піразол-4-іл)метил]піперидин-4-іл}бензамід; N-(2-амінофеніл)-4-{1-[(1,3,5-триметил-1H-піразол-4-іл)метил]піперидин-4-іл}бензамід; N-(2-амінофеніл)-4-{1-[(1,5-диметил-1H-піразол-4-іл)метил]піперидин-4-іл}бензамід; N-(2-амінофеніл)-4-{1-[(1-етил-5-метил-1H-піразол-4-іл)метил]піперидин-4-іл}бензамід; N-(2-амінофеніл)-4-{1-[(1-етил-1H-піразол-4-іл)метил]піперидин-4-іл}бензамід; N-(2-амінофеніл)-4-{1-[(1-етил-3-метил-1H-піразол-4-іл)метил]піперидин-4-іл}бензамід; або його фармацевтично прийнятна сіль. Мається на увазі, що певні сполуки формули І, вказані вище, можуть існувати у вигляді несольватованих форм, а також у вигляді сольватів, таких як, наприклад, гідратовані форми. Мається на увазі, що винахід охоплює всі такі сольватовані форми, які мають антипроліферативну активність. Також мається на увазі, що певні сполуки формули І можуть мати поліморфізм і що даний винахід охоплює всі такі форми, які мають антипроліферативну активність. Підходяща фармацевтично прийнятна сіль сполуки формули І являє собою, наприклад, кислото-адитивну сіль сполуки формули І, наприклад, кислото-адитивну сіль із неорганічною або органічною кислотою, такою як соляна, бромистоводнева, сірчана, трифтороцтова, лимонна або малеїнова кислота; або, наприклад, сіль сполуки формули І, яка є достатньою кислотною, наприклад, сіль лужного металу або лужноземельного металу, таку як кальцієва або магнієва сіль, або сіль амонію. Подальшою підходящою фармацевтично прийнятною сіллю сполуки формули І є, наприклад, сіль, утворена в організмі людини або тварини після введення сполуки формули І. Сполуки за винаходом можуть вводитися у вигляді проліків, які представляють собою сполуку, що розпадається в організмі людини або тварини з вивільненням сполуки за винаходом. Проліки можуть застосовуватися для зміни фізичних властивостей і/або фармакокінетичних властивостей сполуки за винаходом. Проліки можуть утворюватися, якщо сполука за винаходом містить підходящу групу або замісник, до якої (якого) може приєднуватися група, яка модифікує властивість. Прикладами проліків є похідні складних амідів, здатні до розщеплення в умовах in vivo, які можуть утворюватися в аміногрупі в сполуці формули І. Таким чином, даний винахід охоплює ті сполуки формули І, як визначено в даному винаході вище, які стають доступними шляхом органічного синтезу або стають доступними в організмі людини або тварини при розщепленні їх проліками. Отже, даний винахід охоплює ті сполуки формули І, які утворюються за допомогою способів органічного синтезу, а також ті сполуки, які утворюються в організмі людини або тварини при здійсненні метаболізму попередника сполуки, таким чином, сполука формули І може бути синтетично отриманою сполукою або метаболічно отриманою сполукою. Підходящими фармацевтично прийнятними проліками сполуки формули І є проліки, які відповідно до прийнятного медичного розсуду вважаються придатним для введення в організм людини або тварини без небажаних фармакологічних активностей і без надмірної токсичності. Різні форми проліків описані, наприклад, у наступних документах: а) Methods in Enzymology, том 42, с. 309-396, під ред. K. Widder, і ін. (Academic Press, 1985); б) Design of Pro-drugs, під ред. Н. Bundgaard, (Elsevier, 1985); в) A Textbook of Drug Design and Development, під ред. Krogsgaard-Larsen і H. Bundgaard, розділ 5 "Design and Application of Pro-drugs", ред. H. Bundgaard с. 113-191 (1991); г) Н. Bundgaard, Advanced Drug Delivery Reviews, 8, 1-38 (1992); д) H. Bundgaard, і ін., Journal of Pharmaceutical Sciences, 77, 285 (1988); е) N. Kakeya, і ін., Chem. Pharm. Bull., 32, 692 (1984); ж) Т. Higuchi і V. Stella, "Pro-Drugs as Novel Delivery Systems", A.C.S. Symposium Series, том 14; і з) E. Roche (ред), "Bioreversible Carriers in Drug Design", Pergamon Press, 1987. 4 UA 98757 C2 5 10 15 20 25 30 35 40 45 50 55 Підходящими фармацевтично прийнятними пролінами сполуки формули І є її похідне аміду, здатне до розщеплення в умовах in vivo. Підходящі фармацевтично прийнятні аміди, які утворюються з аміногрупи включають, наприклад, амід, утворений з (1-10С)алканоїльними групами, такими як ацетильна, бензоїльна, фенілацетильна й заміщені бензоїльна й фенілацетильна групи. Прикладами кільцевих замісників на фенілацетильній і бензоїльній групах є амінометил, N-алкіламінометил, N,N-діалкіламінометил, морфолінометил, піперазин-1ілметил і 4-(1-4С)алкілпіперазин-1-ілметил. На дії сполуки формули І в умовах in vivo можуть робити часткові впливи один або декілька метаболітів, які утворюються в організмі людини або тварини після введення сполуки формули І. Як вказувалося в даному винаході раніше, також на дії сполуки формули І в умовах in vivo можуть впливати метаболізм попередника сполуки (проліків). Одержання сполук формули І Фахівцеві в даній галузі техніки слід взяти до уваги, що при здійсненні деяких процесів/реакцій, описаних у даному винаході, може бути необхідним/бажаним захищати будьякі чутливі групи в сполуках. Приклади, коли такий захист необхідний або бажаний й підходящі способи захисту відомі фахівцеві в даній галузі хімії. Можуть застосовуватися звичайні захисні групи відповідно до стандартних способів (див., наприклад, T.W. Green & P.G.M. Wuts, Protective Groups in Organic Synthesis, 3-е вид., John Wiley and Sons, 1999). Таким чином, якщо реагуючі речовини містять, наприклад, такі групи, як аміногрупа, карбоксильна група або гідроксильна група, може бути бажаним захищати таку групу в деяких реакціях, описаних у даному винаході. Будь-які захисні групи, використовувані в способах, описаних у даному винаході, як правило, можуть бути вибрані з будь-яких груп, описаних у літературі, або відомих фахівцеві в даній галузі хімії, якщо це є прийнятним для захисту даної групи, і можуть уводитися за допомогою звичайних способів. Захисні групи можуть бути вилучені за допомогою будь-якого звичайного способу, описаного в літературі або відомого фахівцеві в галузі хімії, якщо це є придатним для видалення даної захисної групи, ці способи вибирають таким чином, щоб видалення захисної групи супроводжувалося мінімальним ушкодження груп, що знаходяться в іншій частині молекули. Конкретні приклади захисних груп наведені нижче, у яких для зручності "нижчий", як, наприклад, нижчий алкіл, означає, що така застосовувана група переважно має 1-4 атоми вуглецю. Також мається на увазі, що ці приклади не є вичерпними. Якщо надалі описуються конкретні приклади способів видалення захисних груп, то вони також не є вичерпними. Застосування захисних груп і способи зняття захисту, які конкретно тут не описані, безсумнівно, підпадають під обсяг винаходу. Підходящою захисною групою для аміногрупи або алкіламіногрупи є, наприклад, ацильна група, наприклад, алканоїльна група, така як ацетил, алкоксикарбонільна група, наприклад, метоксикарбонільна, етоксикарбонільна або трет-бутоксикарбонільна група, арилметоксикарбонільна група, наприклад, бензилоксикарбоніл, або ароїльна група, наприклад, бензоїл. Умови зняття захисту для вищезгаданих захисних груп головним чином залежать від вибору захисної групи. Так, наприклад, ацильна група, така як алканоїльна або алкоксикарбонільна група або ароїльна група, можуть бути відщеплені, наприклад, шляхом гідролізу з підходящою основою, такою як гідроксид лужного металу, наприклад, гідроксид літію або натрію. Альтернативно, ацильна група, така як трет-бутоксикарбонільна група може бути відщеплена, наприклад, шляхом обробки підходящою кислотою, такою як соляна, сірчана або фосфорна кислота або трифтороцтова кислота й арилметоксикарбонільна група, така як бензилоксикарбонільна група, може бути відщеплена, наприклад, шляхом гідрування в присутності каталізатора, такого як паладій на вугіллі, або шляхом обробки кислотою Л'юіса, наприклад, трис(трифторацетатом) бору. Підходящою альтернативною захисною групою для первинної аміногрупи є, наприклад, фталоїльна група, яка може бути відщеплена шляхом обробки алкіламіном, наприклад, диметиламінопропіламіном, або гідразином. Підходящою захисною групою для гідроксильної групи є, наприклад, ацильна група, наприклад, алканоїльна група, така як ацетил, ароїльна група, наприклад, бензоїл, або арилметильна група, наприклад, бензил. Умови зняття захисту для вищезгаданих захисних груп головним чином будуть залежати від вибору захисної групи. Так, наприклад, ацильна група, така як алканоїльна або ароїльна група, може бути відщеплена, наприклад, за допомогою гідролізу з підходящою основою, такою як гідроксид лужного металу, наприклад гідроксид літію або натрію. Альтернативно, арилметильна група, така як бензильна група, може бути відщеплена, наприклад, шляхом гідрування в присутності каталізатора, такого як паладій на вугіллі. 5 UA 98757 C2 5 10 Підходящою захисною групою для карбоксильної групи є, наприклад, естерифікована група, наприклад, метильна або етильна група, яка може бути відщеплена, наприклад, шляхом гідролізу з основою, такою як гідроксид натрію, або, наприклад, трет-бутильна група, яка може бути відщеплена, наприклад, шляхом обробки кислотою, наприклад, органічною кислотою, такою як трифтороцтова кислота, або, наприклад, бензильна група, яка може бути відщеплена, наприклад, шляхом гідрування в присутності каталізатора, такого як паладій на вугіллі. Захисні групи можуть бути відщеплені на будь-якій підходящій стадії синтезу за допомогою звичайних методик, добре відомих в області хімії. В подальшому варіанті здійснення, даний винахід забезпечує спосіб одержання сполуки формули (І) або її фармацевтично прийнятної солі, де спосіб включає: (а) взаємодію сполуки формули (II) у якій анілінова частина може бути підходяще захищена; зі сполукою формули (III) 15 20 25 30 35 40 1 де R має значення, вказані в даній заявці, у присутності відновника, і потім, при необхідності, видалення будь-яких захисних груп, що залишилися, які можуть бути присутні. Підходящим відновником для способу (а) є, наприклад, неорганічна борогідридна сіль, така як борогідрид натрію, триацетоксиборогідрид натрію або ціаноборогідрид натрію й водень. Відновне амінування за допомогою водню необов'язково здійснюють у присутності підходящого каталізатора, такого як, наприклад, Pd/C, Pd(OH)2/C, Pt/C, PtO2 або Rh на окисі алюмінію, і також можна здійснювати під тиском, наприклад 1-10 бар при температурах, наприклад 0-150 °C. Спосіб (а) можна здійснювати в присутності підходящої кислоти. Підходящою кислотою для способу (а) є кислота Бренстеда, така як, наприклад, мурашина кислота, оцтова кислота, трифтороцтова кислота, соляна кислота, сірчана кислота, паратолуолсульфонова кислота або камфорсульфонова кислота; або кислота Л'юіса формули MQ z, де М являє собою метал, Q являє собою реакційноздатну групу, таку як, наприклад, галоген або сульфонілокси група, наприклад, хлор, бром, йод, метансульфонілокси, трифторметансульфонілокси або толуол-4сульфонілокси група, і z знаходиться в інтервалі 1-6 і значення z буде залежати від металу М. Типовими прикладами підходящих кислот Л'юіса є трифторид бору, трифторметансульфонат скандію (III), хлорид олова (VI), ізопропоксид титану (IV) або хлорид цинку (II). Альтернативно, сполуки формули (І) можуть бути отримані шляхом (б) взаємодії сполуки формули (II), де анілін може бути підходяще захищений; зі сполукою формули (IV) у присутності підходящої основи; де X являє собою реакційноздатну групу; і потім, при необхідності, видалення будь-яких захисних груп, що залишилися, які можуть бути присутні. 6 UA 98757 C2 5 10 15 20 25 Підходящою реакційноздатною групою X є, наприклад, галоген або сульфонілокси група, наприклад, хлор, бром, йод, метансульфонілокси, трифторметансульфонілокси або толуол-4сульфонілокси група. Підходящою основою для застосування у вищеописаному способі (б) є, наприклад, органічна амінова основа, така як, наприклад, піридин, 2,6-лутидин, колідин, 4диметиламінопіридин, триетиламін, морфолін, діізопропілетиламін (DIPEA), N-метилморфолін або діазабіцикло[5,4,0]ундец-7-ен, або, наприклад, карбонат або гідроксид лужного або лужноземельного металу, наприклад, карбонат натрію, карбонат калію, карбонат кальцію, гідроксид натрію або гідроксид калію, або, наприклад, гідрид лужного металу, наприклад, гідрид натрію, гідрокарбонат лужноземельного металу, такий як гідрокарбонат натрію, або алкоголят металу, такий як етоксид натрію. Підходящою захисною групою для анілінової частини або піперидинового кільця може бути карбамат, такий як трет-бутоксикарбоніл або бензилоксикарбоніл. 1 Переважними прикладами груп R є групи, наведені вище. Реакції, описані в способах (а) і (б), підходяще здійснюють у присутності підходящого інертного розчинника або розріджувача, наприклад, алканолу або складного ефіру, такого як метанол, етанол, ізопропанол або етилацетат, галогенованого розчинника, такого як метиленхлорид, хлороформ або чотирихлористий вуглець, простого ефіру, такого як тетрагідрофуран, 1,2-диметоксіетан або 1,4-діоксан, ароматичного розчинника, такого як толуол, або диполярного апротонного розчинника, такого як N,N-диметилформамід, N,Nдиметилацетамід, N-метилпіролідин-2-он або диметилсульфоксид. Одержання вихідних речовин Одержання сполуки формули II Сполука формули II може бути отримана за допомогою будь-якого з наступних способів: (в) Взаємодія сполуки формули (V), де анілін може бути підходяще захищений, де X являє собою реакційноздатну групу, як визначено вище, зі сполукою формули (VI) у присутності підходящої основи 30 35 де М являє собою метал, L являє собою ліганд, ціле число z дорівнює від 0 до 3, і тетрагідропіридинове кільце може бути захищене; або взаємодія сполуки формули (VII), де анілін і тетрагідропіридин можуть бути підходяще захищені й М, L і z мають значення, вказані вище, зі сполукою формули (VIII): 7 UA 98757 C2 5 10 15 20 25 30 35 40 45 50 55 у присутності підходящої основи; де X являє собою реакційноздатну групу, як визначено вище, і потім, при необхідності, і в будь-якому підходящому порядку або комбінації: видалення будь-яких захисних груп з тетрагідропіридину, і/або відновлення тетрагідропіридину до піперидину та/або видалення будь-яких із присутніх захисних груп, що залишилися. Підходящою захисною групою для тетрагідропіридинового кільця є така група, як третбутоксикарбоніл (також у даному винаході позначається як "ВОС") або бензилоксикарбоніл. Підходящою захисною групою для анілінової частини також може бути карбамат, такий як ВОС або бензилоксикарбоніл. Підходящою основою для способу (в) є наприклад, органічна амінова основа, така як, наприклад, піридин, 2,6-лутидин, колідин, 4-диметиламінопіридин, триетиламін, морфолін, Nметилморфолін або діазабіцикло[5,4,0]ундец-7-ен, або, наприклад, карбонат або гідроксид лужного або лужноземельного металу, наприклад карбонат натрію, карбонат калію, карбонат кальцію, карбонат цезію, гідроксид натрію або гідроксид калію, або, наприклад, гідрид лужного металу, наприклад гідрид натрію, або гідрокарбонат лужного металу, такий як гідрокарбонат натрію, або алкоголят металу, такий як етоксид натрію. Реакцію, визначену вище в способі (в), зручно здійснюють у присутності підходящого інертного розчинника або розріджувача, наприклад, алканолу або складного ефіру, такого як метанол, етанол, ізопропанол або етилацетат, галогенованого розчинника, такого як метиленхлорид, хлороформ або чотирихлористий вуглець, простого ефіру, такого як тетрагідрофуран, 1,2-диметоксіетан або 1,4-діоксан, ароматичного розчинника, такого як толуол, або диполярного апротонного розчинника, такого як N,N-диметилформамід, N,Nдиметилацетамід, N-метилпіролідин-2-он або диметилсульфоксид. Реакції підходяще здійснюють при температурі в інтервалі, наприклад, від 10 до 250 °C, переважно в інтервалі від 40 до 80 °C; Металом М може бути будь-який метал, який відомий у літературі для утворення металоорганічних сполук, які піддаються каталітичним реакціям перехресного зв'язування. Прикладами підходящих металів є бор, олово, цинк і магній. Підходяще значення для цілого числа z залежить від металу М, але звичайно знаходиться в інтервалі 0-3. Підходящими значеннями для ліганду L, якщо він присутній, є, наприклад, гідрокси, галогеновий, (1-4С)алкокси або (1-6С)алкільний ліганд, наприклад гідрокси, бром, хлор, фтор, йод, метокси, етокси, пропокси, ізопропокси, бутокси, метильний, етильний, пропільний, ізопропільний або бутильний ліганд або, де ціле число z дорівнює 2 і М являє собою бор, два присутні ліганди можуть бути зв'язані таким чином, що разом з атомом бору, до якого вони приєднані, вони утворюють кільце. 1 2 1 2 Підходяще, група MLz являє собою групу формули -BL L , де В являє собою бор і L і L 1 2 мають значення, вказані для ліганду L вище. Зокрема, ліганди L і L можуть бути зв'язані таким 1 чином, що разом з атомом бору, до якого вони приєднані, вони утворять кільце. Наприклад, L і 2 L можуть разом утворювати окси-(2-4С)алкіленокси групу, наприклад оксіетиленокси, пінаколато (-О-С(СН3)2С(СН3)2-О-) або оксипропіленокси групу таким чином, що разом з атомом бору, до якого вони приєднані, вони утворюють циклічну складноефірну групу боронової кислоти. Підходящим каталізатором для способу (в) є, наприклад, металевий каталізатор, такий як каталізатор на основі паладію (0), паладію (II), нікелю (0) або нікелю (II), наприклад, тетракіс(трифенілфосфін)паладій (0), хлорид паладію (II), бромід паладію (II), хлорид біс(трифенілфосфін)паладію (II), тетракіс(трифенілфосфін)нікель (0), хлорид нікелю (II), бромід нікелю (II), хлорид біс(трифенілфосфін)нікелю (II) або дихлор[1-1'біс(дифенілфосфіно)фероцен]паладій (II). Додатково, підходяще можна додавати ініціатор вільних радикалів, наприклад, азосполука, така як азо(бісізобутиронітрил). Підходяще, тетрагідропіридинове кільце відновлюють до піперидинового кільця у вищеописаному способі (в) шляхом гідрування. Гідрування необов'язково здійснюють у присутності підходящого каталізатора, такого як, наприклад, Pd/C, Pd(OH) 2/C, Pt/C, PtO2 або Rh на окисі алюмінію, і також можна здійснювати під тиском, наприклад, 1-10 бар. Підходяще також 8 UA 98757 C2 5 гідрування здійснювати в підходящій кислоті, наприклад, бромистоводневій кислоті, соляній кислоті, лимонній кислоті, оцтовій кислоті й метансульфоновій кислоті, і в підходящому розчиннику або суміші розчинників, таких як, наприклад, вода, етанол, тетрагідрофуран (ТГФ), метанол, ацетонітрил або пропан-2-ол. + + г) Взаємодії сполуки формули (IX), де Q1 являє собою -ОН, -Сl, або -О Q2 (де Q2 являє собою катіон) зі сполукою формули (X) у присутності підходящого розчинника й де одна з аміногруп сполуці формули (X) може бути захищена; 10 15 20 25 30 одержуючи сполуку формули (XI) де анілін може бути захищений; і потім: перетворення сполуки формули (XI) у сполуку формули (II) шляхом відновлення піриндин-4ільного кільця до піперидин-4-ільного кільця за допомогою підходящого відновника та/або підходящих відновлювальних умов; і необов'язкове видалення будь-яких із присутніх захисних груп, що залишилися. + + + + Підходящим значенням для Q1 є -О Na (тобто -О Q2 , де Q2 являє собою Na ). Підходяще, одна з аміногруп сполуки формули (X) захищена за допомогою підходящої амінозахисної групи, як визначено в даній заявці вище, такої як ВОС група. Підходяще, анілін захищають за допомогою амінозахисної групи, як визначено в даній заявці вище, такої як ВОС група, у сполуці формули (XI). Для реакції сполук IX і X можна використовувати будь-який підходящий розчинник, такий як розчинники, описані раніше. Сполуку формули (XI) перетворюють у сполуку формули (II) за допомогою підходящого відновника та/або підходящих відновлювальних умов. Підходящим способом є гідрування. Гідрування необов'язково здійснюють у присутності підходящого каталізатора, такого як, наприклад, Pd/C, Pd(OH)2/C, Pt/C, PtO2 або Rh на окисі алюміній, і його можна здійснювати під тиском, наприклад, 1-10 бар. Гідрування підходяще також здійснювати в присутності підходящої кислоти, наприклад, бромистоводневої кислоти, соляної кислоти, лимонної кислоти, оцтової кислоти й метансульфонової кислоти, і в підходящому розчиннику або суміші розчинників, таких як, наприклад, вода, етанол, тетрагідрофуран (ТГФ), метанол, ацетонітрил або пропан-2-ол. 9 UA 98757 C2 5 10 15 20 25 30 35 40 45 50 55 60 Підходящий спосіб одержання сполуки формули (XI) включає перетворення сполуки (IX) у реакційноздатне похідне карбонової кислоти (яке може бути отримане in situ і його виділення не є обов'язковим), з наступною взаємодією зі сполукою формули (X). Підходящим реакційноздатним похідним карбонової кислоти є, наприклад, ацилгалогенід, наприклад, ацилхлорид, утворений шляхом взаємодії кислоти й хлорангідриду кислоти, наприклад, тіонілхлорид; змішаний ангідрид, наприклад, утворений шляхом взаємодії кислоти й хлороформіату, такого як ізобутилхлороформіат; активований складний ефір; продукт реакції кислоти й карбодііміду, такий як дициклогексилкарбодіімід; або продукт реакції кислоти із хлоридом 4-(4,6-диметокси-1,3,5-триазиніл-2-іл)-4-метилморфолінію (DMTMM), або продукт реакції кислоти з 1,1'-карбонілдіімідазолом (CDI). Сполуки формул (III) і (IV) можуть бути отримані з комерційних джерел, наприклад, Flurochem Ltd, Old Glossop, Derbyshire SK13 7RY, UK, або вони можуть бути синтезовані за допомогою методів, відомих фахівцеві в даній галузі техніки та/або описаних у літературі, наприклад, Makino, K.; Kim, H.S і Kurasawa Y; J. Heterocyclic Chem. 1998, 35, 489-497 і посиланнях, наведених у цих джерелах. Дослідження Наступні дослідження (а)-(в) можна використовувати для оцінки дії однієї або більше сполук згідно із даним винаходом як інгібіторів HDAC, як інгібіторів in vitro рекомбінантної HDAC1 людини, яка продукується у клітинах комах Нi5, і як індукторів в умовах in vitro & in vivo ацетилування гістону Н3 у цільних клітинах у пухлин. З їх допомогою також оцінюють здатність таких сполук інгібувати проліферацію пухлинних клітин людини. (а) Ферментативне дослідження рекомбінантної HDAC1 в умовах in vitro Інгібітори HDAC досліджували по відношенню до рекомбінатної HDAC1 людини, яка продукується Нi5 клітинами комах. Фермент клонували з ''FLAG'' міткою на С-кінці гена й афінно очищали, використовуючи анти - ''FLAG'' M2 агарозу від SIGMA (A2220). Дослідження деацетилаз здійснювали в реакціях об'ємом 50 мкл. HDAC1 (75 нг ферменту), розведеного в 15 мкл буфера реакції (25 мМ ТрисНСl (рН 8), 137 мМ NaCl, 2,7 мМ КСl, 1 мМ MgCl2) змішували або з одним буфером (10 мкл) або з буфером, що містить сполуку (10 мкл) протягом 30 хвилин при температурі навколишнього середовища. Потім до реакційної суміші додавали 25 мкМ ацетилованого пептиду гістон Н4 (КІ 174 Biomol), розведеного в 25 мкл буфера, і інкубували протягом однієї години при температурі навколишнього середовища. Реакцію зупиняли шляхом додавання однакового об'єму (50 мкл) Fluor de Lys проявника (Biomol), що містить трихостатин А у концентрації 2 мкМ. Реакцію залишали для виявлення протягом 30 хвилин при температурі навколишнього середовища й потім вимірювали флуоресценцію при довжині хвилі збудження 360 нм і довжині хвилі емісії 465 нм. Значення IC 50 для інгібіторів HDAC ферментів вимірювали шляхом аналізу кривих залежності дії від дози для конкретних сполук і визначення концентрації інгібітору, що забезпечує зниження максимального значення на 50% (контроль із розріджувачем). (б) Дослідження інгібування проліферації в цільних клітинах в умовах in vitro Інгібування проліферації в цільних клітинах досліджували за допомогою титру клітин Promega 96 водного дослідження проліферації (Promega #G5421). Клітини НСТ116 висівали в 3 96-лункові планшети при щільності 1×10 клітин/лунку, і залишали для прилипання протягом ночі. Їх обробляли інгібіторами протягом 72 годин. У кожну лунку додавали 20 мкл тетразолієвого барвника MTS і планшети повторно інкубували протягом 3 годин. Після цього вимірювали абсорбцію на спектрофотометрі для аналізу планшет на 96 лунок при 490 нм. Значення ІС50 для інгібіторів HDAC визначали шляхом аналізу кривих залежності дози від концентрації для індивідуальних сполук і визначення концентрації інгібітору, що забезпечує зниження максимального сигналу на 50% (контроль із розріджувачем). (в) Дослідження активності ферменту деацетилази гістонів у цільних клітинах в умовах in vitro Ацетилування гістону Н3 у цільних клітинах досліджували за допомогою імуногістохімії й аналізували за допомогою матричного сканування Cellomics. Клітини А549 або НСТ116 висівали 4 в 96-лункові планшети при щільності 1×10 клітин/лунку, і залишали для прилипання всю ніч. Їх обробляли інгібіторами протягом 24 годин і потім фіксували в 1,8% формальдегіді в триссольовому буферному розчині (TBS) протягом однієї години. Порушували проникність мембран клітин за допомогою льодяного метанолу протягом 5 хвилин, промивали в TBS і потім блокували в TBS 3% висушеного молока зі зниженим вмістом жиру протягом 90 хвилин. Потім клітини інкубували з поліклональними антитілами, які специфічні до ацетилованого гістону Н3 (Upstate #06-599), розведеними 1 до 500 в TBS 3% молока протягом однієї години. Клітини тричі промивали в TBS і потім інкубували із вторинними антитілами, кон'югованими із флуоресцеїном 10 UA 98757 C2 5 10 15 20 25 30 35 40 45 50 55 60 (Molecular Probes #A11008) & Hoechst 333542 (1 мкг/мг) (Molecular Probes #Н3570) в TBS плюс 1% бичачий сироватковий альбумін (Sigma #В6917) протягом однієї години. Незв'язане антитіло видаляли шляхом трикратного промивання з TBS і після завершального промивання 100 мкл TBS додавали до клітин і планшети запечатували й аналізували за допомогою матричного сканування Cellomics. Значення ЕС50 для інгібіторів HDAC вимірювали шляхом аналізу кривих залежності дії від дози для конкретних сполук і потім визначали концентрацію інгібітору, що забезпечує 50% максимального значення (порівняльна контрольна сполука - трихостатин A (Sigma)). hERG активність і розчинність сполук за винаходом також може бути оцінена за допомогою досліджень (г)-(е), описаних нижче: (г) Дослідження інгібування калієвого каналу, який кодується hERG Культура клітин Клітини яєчника китайського хом'ячка (СНО), які експресують hERG-кодований канал, вирощували до напівзлиття при 37 °C у зволоженому середовищі (5% СО2) у живильному F-12 Ham середовищі, що містить L-глутамін, 10% бичачу телячу сироватку (FCS) і 0,6 мг/мл гігроміцину (всі виробництва Sigma). Перед використанням, моношар промивали за допомогою попередньо нагрітої (37 °C) аліквоти 3 мл Versene 1:5,000 (Invitrogen). Після відсмоктування цього розчину, колбу інкубували при 37 °C у термостаті з додатковою кількістю 2 мл Versene 1:5,000 протягом 6 хвилин. Після цього клітини від'єднували від дня колби шляхом обережного зціджування й потім у колбу додавали 10 мл Дульбеко-PBS, що містить кальцій (0,9 мМ) і магній (0,5 мМ) (PBS) (Invitrogen) і відсмоктували в центрифужну пробірку об'ємом 15 мл перед центрифугуванням (50 g, протягом 4 хвилин). Отриманий супернатант відкидали й осад після центрифугування обережно повторно ресуспендували в 3 мл аліквоті PBS. 0,5 мл аліквоти клітинної суспензії видаляли для автоматизованого підрахунку клітин (Innovatis Cedex) і кінцевий об'єм клітинної суспензії доводили за допомогою PBS для одержання бажаної кінцевої концентрації клітин. Електрофізіологія Принципи й експлуатація цього пристрою були описані раніше (Schroeder и др., Journal of Biomolecular Screening (2003) 8(1), 50-64). Коротко, технологія ґрунтується на планшеті на 384 лунок (PatchPlate™), у якому запис здійснюється в кожній лунці за допомогою всмоктування для встановлення й підтримання клітини в невеликому отворі, розділеному двома ізольованими камерами з рідинами. Після запечатування, розчин у нижній частині PatchPlate™ завантажували в камеру, що містить амфотерицин В (Sigma). Це пермеалізує ділянку клітинної мембрани, що покриває отвір, у кожній лунці й у дійсності дозволяє записувати перфорований, фіксований потенціал (петч-кламп) у цільній клітині в кожній лунці. Для кожної серії вимірювань IonWorks™ НТ функціонує в такий спосіб при кімнатній температурі (~21 °C). В "човник" у положенні "Буфер" завантажують 4 мл PBS, а в положення "Клітини" вносять клітинну суспензію CHO-hERG, описану вище. Планшет на 96 лунок (з Vподібним дном, Greiner Bio-one), що містить тестовані сполуки (в 3Х їх кінцевої тестованої концентрації) поміщали в положення "Планшет 1" і PatchPlate™ поміщали в пристрій і встановлювали в положення за допомогою PatchPlate™ кришки. Планшет з кожною сполукою виставляли таким чином, щоб забезпечити побудову десяти, 8точкових кривих залежності дози від концентрації, дві колонки, що залишилися на планшеті, заповнювали наповнювачем (0,33 % ДМСО), для визначення вихідного рівня дослідження, і цизапридом у понадмаксимальній блокуючій концентрації (10 мкМ), для визначення 100 % рівня інгібування. Потім додавали Fluidics-головну фракцію (F-головна фракція) IonWorks™ НТ 3,5 мкл PBS у кожну лунку PatchPlate™ і її з нижньої сторони промивали "Внутрішнім" розчином наступного складу (у мМ): К-глюконат100, КСl 40, MgCl2 3,2, EGTA 3 і HEPES 5 (всі виробництва Sigma) (рН 7,25-7,30 за допомогою 10 М КОН). Після примування й де-барботування, Electronics-головну фракцію (Е-головну фракцію) переміщали навколо PatchPlate™ для здійснення діркового тесту (тобто прикладали імпульс напруги для визначення того, чи є отвір у кожній клітині відкритим). Після цього F-головну фракцію диспергували 3,5 мкл клітинної суспензії, описаної вище, у кожну лунку PatchPlate™ і клітинам надавали 200 секунд для досягнення й закриття отвору в кожній лунці. Потім Е-головну фракцію проганяли навколо PatchPlate™ для визначення закритого опору, отриманого в кожній лунці. Після цього розчин на нижній стороні PatchPlate™ завантажували до розчину "Доступу" наступного складу (у мМ): КСl 140, EGTA 1, MgCl2 1 і HEPES 20 (всі виробництва Sigma) (рН 7,25-7,30 за допомогою 10 М КОН) плюс 100 мкг/мл амфотерицину В. Через 9 хвилин для надання можливості здійснення перфорації ділянки, Е-головну фракцію проганяли навколо всіх 384 лунок петч-планшета для одержання вимірювань струму hERG перед дією сполуки. Потім 11 UA 98757 C2 5 10 15 20 25 30 35 40 45 50 55 60 3,5 мкл розчину F-головної фракції з кожної лунки планшета зі сполукою додавали до 4 лунок на PatchPlate™. Після цього запускали програмоване дослідження від найбільш розведеної лунки на планшеті зі сполукою й аналіз здійснювали в напрямку найбільш концентрованої лунки для зведення до мінімуму впливу будь-яких побічних факторів. Після інкубування приблизно протягом 3,5 хвилин, Е-головну фракцію проганяли навколо всіх 384 лунок PatchPlate™ для одержання вимірювань струму hERG після дії сполук. У такий спосіб одержували некумулятивні дозозалежні криві, за умови, що критерій вихідного контролю досягали в достатньому відсотку лунок (див. нижче), дію кожної концентрації тестованої сполуки розраховували на основі запису від 1 до 4 клітин. Критерієм вихідного контролю для кожної лунки були: закритий опір перед скануванням >60 MΩ, амплітуда хвостового струму hERG перед скануванням >0,15 нА; закритий опір після сканування >60 MΩ. Струми hERG перед і після введення сполуки викликали за допомогою імпульсу напруги, що складається з 20 с періоду, який фіксують при -70 мВ, 160 мс крок до -60 мВ, 100 мс крок до -70 мВ, 1 із крок до +40 мВ, 2 із крок до -30 мВ і на закінчення 500 мс крок до -70 мВ. В інтервалі імпульсів напруги до-сполуки й після-сполуки потенціал мембрани не фіксували. д) Оцінка водної розчинності. Тестовану сполуку (від 1 до 1,6 мг) зважували в посудині й додавали 1 мл 0,1 М фосфатного буфера (рН 7,4). Тестовану сполуку в інтервалі між 1,0 і 1,6 мг одночасно розчиняли в 1,8 мл ДМСО в посудині, для застосування як калібрувальний розчин. Обидва розчини перемішували протягом 24 годин при 25 °C. Після цього насичений водний розчин і ДМСО-калібрувальний розчин переносили в глибокі планшети на 96 лунок. Планшет з насиченим буферним розчином центрифугували при відносній відцентровій силі 4310 g і після цього водний супернатант переносили в другий глибокий лунковий планшет і центрифугували. Після подальшого перенесення водного супернатанту й 50% розведення буфером, кінцевий планшет зі зразком і ДМСО-калібрувальний планшет аналізували за допомогою ВЕРХ-УФ-МС. Кількісне визначення розчинності зразка здійснювали шляхом порівняння площ УФ-піків зразка й калібрування при 250 нм (вибирали альтернативну довжину хвилі, якщо 250 нм була невідповідною) із МСпідтвердженням ідентифікації сполуки. е) Оцінка водної розчинності в буферах і стимульованій кишковій рідині. Розчинність тестували в наступному середовищі при вказаних температурах: Стимульована кишкова рідина (Fasted) FaSSIF (Galia і Dressman і ін., Pharms Res, 15(5), 1998, с. 698). Таурохолат натрію (3 мМ); яєчний лецитин (0,75 мМ); КН2РО4 (0,03 М); КСl (0,1 М); NaOH (для доведення до рН 6,5). Вимірювали при 37 °C Фосфатний буфер Соренсена (Handbook of Biochemistry, cc. 234-237). Розчин А 0,067 М монокалійфосфат Розчин В 0,067 М Динатрійфосфат Вимірювали при 25 °C і 37 °C. Підходящі кількості (визначені за допомогою вищеописаного дослідження розчинності (д) і/або розрахункової кривої рН розчинності) досліджуваної сполуки точно зважували у двох повторах у скляних посудинах на 2 драхми. До кожного набору паралельних посудин, мінімум 1,50 мл підходящого середовища, у яке додавали рН 6,8 фосфатний буфер Соренсена або FaSSIF. Всі зважування в кожному випадку повинні бути достатніми для насичення середовища. У кожну лунку додавали покритий PTFE магнітний повторювач, потім їх запечатували й поміщали в магнітний реакційний перемішуваний блок Variomag (CamLab). Перемішувані блоки витримували при підходящих температурах (див. вище), покривали алюмінієвою фольгою для зменшення впливу світла й переміщували в змінюваних напрямках при 800 об./хв. З кожної посудини відбирали проби в заздалегідь установлені часові проміжки для дослідження середовища. У кожному зразку спочатку визначали значення рН, а потім вміст активного компонента в кожний досліджуваний момент часу в такий спосіб. За допомогою підходящого рН-метра (Hydrus 400 - Fisher), електрода й стандартних рНбуферів, прилад калібрували при рН 4,01 і 7,00 при температурі навколишнього середовища. Поміщаючи електрод у кожний паралельний зразок, визначали значення рН при температурі навколишнього середовища й результати виражали у вигляді десяткового дробу. Електрод промивали деіонізованою водою й витирали насухо перед дослідженнями. Визначення вмісту активного компонента за допомогою ВЕРХ Для кожного зразка, аліквоту 0,4 мл переносили в полікарбонатну ультрацентрифужну пробірку (Beckman). Зразки центрифугували при 40 тис. об./хв. протягом 15 хвилин при підходящій температурі для тестування середовища за допомогою ультрацентрифуги TL Optima 12 UA 98757 C2 5 10 15 (Beckman). Супернатант із кожної ультрацентрифужної пробірки переносили в іншу ультрацентрифужну пробірку й ще один раз центрифугували за тих самих умов. Супернатант із кожного зразка досліджували за допомогою оптимізованого методу ВЕРХ для визначення тестованої сполуки й вмісту активного компонента відносно зовнішнього стандарту. Може знадобитися розведення супернатанта в підходящому розчиннику для доведення концентрацій до лінійного діапазону для методу ВЕРХ. Це звичайно може бути розраховане на основі передбаченої кривої водної рН розчинності й, у випадку співрозчинників, виходячи з доданої кількості сполуки. Незважаючи на те, що фармакологічні властивості сполук формули І відрізняються у зв'язку зі структурними відмінностями, як очікувалося, у цілому, сполуки формули І можуть проявляти активність у наступних концентраціях або дозах в одному або декількох з вищенаведених досліджень (а), (б), (в) або (г): Дослід (а): ІС50 в інтервалі, наприклад, 100 нМ або менше; Дослід (б): ІС50 в інтервалі, наприклад, 1 мкМ або менше; Дослід (в): ІС50 в інтервалі, наприклад, 1 мкМ або менше; Дослід (г): ІС50, наприклад, більше, ніж 30 мкМ. Наприклад, при здійсненні дослідження (а) інгібування HDAC1 і дослідження (б) інгібування проліферації в цільних клітинах, сполука, описана в прикладі 4 даної заявки, проявляє ІС 50 результати, наведені нижче в таблиці А. У таблиці також наведений відповідний результат для N-(2-амінофеніл)-4-(1-(пірид-2-ил метил)піперидин-4-іл)бензаміду (сполука [1] вище): Таблиця А ІС50 дослід (а) Сполука із прикладу 4 Порівняльна сполука 1 20 25 30 35 40 45 ІС50 дослід (б) (дослідження в умовах in vitro (дослідження в умовах in vitro інгібування проліферації інгібування HDAC1) цільних клітин) 0,081 мкМ 0,508 мкМ 0,1 мкМ 1,433 мкМ Тестовані сполуки згідно із даним винаходом не виявляли фізіологічно неприйнятної токсичної дії в дослідженні (г) при введенні в ефективних дозах. Таким чином, не очікується прояву несприятливих токсичних дій при введенні сполуки формули І або її фармацевтично прийнятної солі, як визначено вище, в інтервалі доз, вказаних далі. Додатково, незважаючи на те, що розчинність сполук формули І неминуче будуть відрізнятися внаслідок структурних змін, як очікувалося, у цілому сполуки формули І мають розчинність при дослідженні (д), описаному вище, наприклад, більше, ніж 100 мкМ. Відповідно до подальшого варіанта здійснення винаходу, забезпечується фармацевтична композиція, яка містить сполуку формули (І) або її фармацевтично прийнятну сіль або її проліки, як визначено вище, у сполученні з фармацевтично прийнятним розріджувачем або носієм. Композиції за винаходом можуть знаходитися у формах, які підходять для перорального застосування (наприклад, у вигляді таблеток, коржів, твердих або м'яких капсул, водних або масляних суспензій, емульсій, диспергованих порошків або гранул, сиропів або еліксирів), для місцевого введення (наприклад, у вигляді паст, мазей, гелів, водних або масляних розчинів або суспензій), для введення шляхом інгаляції (наприклад, у вигляді тонкоподрібненого порошку або рідкого аерозолю), для введення шляхом вдмухування (наприклад, у вигляді тонкоподрібненого порошку), або для парентерального введення (наприклад, у вигляді стерильного водного або масляного розчину для внутрішньовенного, підшкірного, внутрішньом'язового введення, або у вигляді супозиторію для ректального введення). Композиції за винаходом можуть бути отримані звичайними способами при використанні звичайних фармацевтичних наповнювачів, добре відомих у даній галузі. Таким чином, композиції, призначені для перорального введення, можуть містити, наприклад, один або декілька барвників, підсолоджувачів, ароматизаторів і/або консервантів. Підходящі фармацевтично прийнятні наповнювачі для таблетки включають, наприклад, інертні розріджувачі, такі як лактоза, карбонат натрію, фосфат кальцію або карбонат кальцію, гранулюючі і дезінтегруючі засоби, такі як кукурудзяний крохмаль або альгінова кислота; зв'язувальні речовини, такі як крохмаль; замаслювачі, такі як стеарат магнію, стеаринова кислота або тальк; консерванти, такі як етил або пропіл п-гідроксибензоат, і антиоксиданти, такі як аскорбінова кислота. Лікарські препарати у вигляді таблеток можуть бути без покриття або можуть мати покриття або для модифікації їх розпаду й наступного всмоктування активної 13 UA 98757 C2 5 10 15 20 25 30 35 40 45 50 55 60 речовини в шлунково-кишковому тракті, або для поліпшення їх стабільності та/або зовнішнього вигляду, для цього використовуються звичайні засоби для покриття й методики, які добре відомі в даній галузі. Композиції для перорального застосування можуть знаходитися у вигляді твердих желатинових капсул, у яких активний компонент змішаний з інертним твердим розріджувачем, наприклад, карбонатом кальцію, фосфатом кальцію або каоліном, або у вигляді м'яких желатинових капсул, у яких активний компонент змішаний з водою або маслом, таким як арахісова олія, рідкий парафін, соєва олія, кокосова олія або переважно оливкова олія, або іншим підходящим наповнювачем. Водні суспензії, як правило, містять активний компонент у формі тонкоподрібненого порошку разом з одним або більше суспендуючими засобами, такими як карбоксиметилцелюлоза натрію, метилцелюлоза, гідроксипропілметилцелюлоза, альгінат натрію, полівініл-піролідон, трагакантова камедь і аравійська камедь; диспергуючими або змочувальними засобами, такими як лецитин або продукти конденсації алкіленоксиду з жирними кислотами (наприклад поліоксіетиленстеарат), або продукти конденсації етиленоксиду із довго ланцюговими аліфатичними спиртами, наприклад гептадекаетиленоксицетанол, або продукти конденсації етиленоксиду з похідними неповних складних ефірів жирних кислот і гекситу, такі як поліоксіетиленсорбітмоноолеат, або продукти конденсації етиленоксиду із довголанцюговими аліфатичними спиртами, наприклад гептадекаетиленоксицетанол, або продукти конденсації етиленоксиду з похідними неповних складних ефірів жирних кислот і гекситу, такі як поліоксіетиленсорбітмоноолеат, або продукти конденсації етиленоксиду з похідними неповних складних ефірів жирних кислот з ангідридами гекситу, наприклад поліетиленсорбітмоноолеат. Водні суспензії також можуть містити один або більше консервантів (таких як етил або пропіл пгідроксибензоат, антиоксидантів (таких як аскорбінова кислота), барвників, ароматизаторів і/або підсолоджувачів (таких як сахароза, сахарин або аспартам). Масляні суспензії можуть бути приготовлені шляхом суспендування активного компонента в рослинній олії (такій як арахісова олія, оливкова олія, кунжутна олія або кокосова олія) або в мінеральному маслі (такому як рідкий парафін). Масляні суспензії також можуть містити загусники, такі як бджолиний віск, твердий парафін або цетиловий спирт. Також можуть додаватися підсолоджувачі, такі як перераховані вище, і ароматизатори для одержання смачного препарату для перорального введення. Ці композиції також можуть бути захищені від розкладання шляхом додавання антиоксиданту, такого як аскорбінова кислота. Дисперговані або ліофілізовані порошки й гранули, які підходять для одержання водної суспензії або розчину шляхом додавання води, як правило, містять активний компонент разом з диспергуючим або змочувальним засобом, суспендуючим засобом і одним або більше консервантами. Прикладами підходящих диспергуючих або змочувальних засобів і суспендуючих засобів є засоби, згадані вище. Також можуть включатися додаткові наповнювачі, такі як підсолоджувачі, ароматизатори й барвники. Фармацевтичні композиції за винаходом також можуть знаходитися у вигляді емульсій масло-у-воді. Масляною фазою може бути рослинна олія, така як оливкова олія або арахісова олія, або мінеральне масло, таке як, наприклад, рідкий парафін або суміш будь-яких перерахованих засобів. Підходящими емульгуючими засобами можуть бути, наприклад, природні смоли, такі як аравійська камедь або трагакантову камедь, природні фосфатиди, такі як соя, лецитин, складні ефіри або похідні неповних складних ефірів жирних кислот з ангідридами гекситу (наприклад сорбітмоноолеат) і продукти конденсації вказаних неповних складних ефірів з етиленоксидом, такі як поліоксіетиленсорбітмоноолеат. Емульсії також можуть містити підсолоджувачі, ароматизатори й консерванти. Сиропи й еліксири також можуть бути приготовлені з підсолоджувачами, такими як гліцерин, пропіленгліколь, сорбіт, аспартам або сахароза, а також можуть містити засіб, який зменшує подразнення, консервант, ароматизатор і/або барвник. Фармацевтичні композиції також можуть знаходитися у формі стерильного розчину для ін'єкцій або масляної суспензії, розчинів, емульсій або особливих систем, які можуть бути приготовлені відповідно до відомих методик, використовуючи одне або більше підходящих диспергуючих або змочувальних засобів і суспендуючих засобів, описаних вище. Стерильний препарат для ін'єкцій також може являти собою стерильний розчин для ін'єкції або суспензію в нетоксичному розріджувачі або розчиннику, що є прийнятним для парентерального введення, наприклад, розчин у поліетиленгліколі. Лікарські препарати у вигляді супозиторіїв можуть бути приготовлені шляхом змішування активного компонента з підходящим неподразливим наповнювачем, який є твердим при звичайних температурах, але рідким при ректальній температурі, і тому він розплавляється в 14 UA 98757 C2 5 10 15 20 25 30 35 40 45 50 55 прямій кишці, вивільняючи лікарський засіб. Підходящими наповнювачами є, наприклад, олія какао й поліетиленгліколі. Лікарські препарати для місцевого застосування, такі як креми, мазі, гелі, водні або масляні розчини або суспензії, як правило, можуть бути отримані шляхом приготування активного компонента зі звичайним наповнювачем або розріджувачем, який є підходящим для місцевого введення, використовуючи звичайну методику, відому в даній галузі техніки. Композиція для введення шляхом вдування може знаходитися у вигляді тонкоподрібненого порошку, що містить частинки із середнім діаметром, наприклад, 30 мкм або менше, переважно 5 мкм або менше, і більш переважно в інтервалі 5 мкм - 1 мкм і порошок містить або сам активний компонент або розведений одним або декількома фізіологічно прийнятними носіями, такими як лактоза. Потім порошок для вдування звичайно поміщають у капсулу, що містить, наприклад, 1-50 мг активного компонента для застосування в пристрої для турбоінгаляції, такому як застосовується для вдування відомої речовини кромоглікату натрію. Композиції для введення шляхом інгаляції можуть знаходитися у вигляді звичайного аерозолю під підвищеним тиском, пристосованого для розподілу активного компонента або у вигляді аерозолю, що містить тонкоподрібнену тверду речовину або рідкі краплі. Можуть застосовуватися звичайні пропеленти для аерозолю, такі як леткі фторовані вуглеводні або вуглеводні, і аерозольний пристрій являє собою звичайний пристрій для розподілу дозованої кількості активного компонента. Додаткову інформація щодо приготування лікарських препаратів можна знайти в главі 25.2, том 5 ''Загальної медичної хімії'' (Comprehensive Medicinal Chemistry) (Corwin Hansch; голова редакційної колегії), Pergamon Press 1990. У цілому, вищенаведені композиції можуть бути приготовлені звичайним способом при використанні звичайних наповнювачів. Сполука формули (І) звичайно вводиться теплокровній тварині в стандартній дозі в діапазоні 2 5-5000 мг/м поверхні тіла тварини, тобто приблизно 0,1-100 мг/кг і звичайно вона є терапевтично ефективною дозою. Стандартна дозована форма, така як таблетка або капсула, звичайно включає, наприклад, 1-250 мг активного компонента. Переважно застосовувана добова доза знаходиться в інтервалі 1-50 мг/кг. Однак добова доза обов'язково залежить від організму, який піддається лікуванню, особливості шляху введення й тяжкості захворювання, яке піддається лікуванню. Отже, оптимальна доза може бути визначена лікарем для кожного пацієнта. Нами було виявлено, що сполуки, розкриті в даному винаході або їх фармацевтично прийнятна сіль є ефективними інгібіторами клітинного циклу (засобами, які пригнічують проліферацію клітин), ці властивості, як вважають, є результатом їх інгібуючої дії по відношенню до HDAC. Автори винаходу також вважають, що сполуки згідно із даним винаходом можуть бути залучені в інгібування ангіогенезу, активацію апоптозу й диференціацію. Таким чином, сполуки згідно із даним винаходом, як очікується, є придатними для лікування захворювань або хворобливих станів, опосередковуваних тільки ферментами HDAC або частково опосередковуваних цими ферментами, тобто сполуки можуть застосовуватися для одержання інгібуючої дії по відношенню до HDAC у теплокровної тварини, яка має потребу в такому лікуванні. Таким чином, сполуки згідно із даним винаходом забезпечують спосіб лікування проліферації злоякісних клітин, що характеризується інгібуванням HDAC ферментів, тобто сполуки можуть застосовуватися для одержання антипроліферативної дії, опосередкованої тільки інгібуванням HDAC, або частково опосередкованого інгібуванням цього ферменту. Відповідно до іншого варіанта здійснення дійсного винаходу, забезпечується сполука формули (І), або її фармацевтично прийнятна сіль або проліки, як визначено вище, для застосування в способі терапевтичного лікування людини або тварини. Таким образом, відповідно до подальшого варіанта здійснення винаходу, забезпечується сполука формули (І), або її фармацевтично прийнятна сіль або проліки, як визначено вище, для застосування як лікарський засіб. Відповідно до подальшого варіанту здійснення винаходу, забезпечується застосування сполуки формули (І), або її фармацевтично прийнятної солі або проліків, як визначено вище, для приготування лікарського засобу для застосування для одержання інгібуючої дії по відношенню до HDAC у теплокровної тварини, такої як людина. Відповідно до подальшого варіанта здійснення винаходу, забезпечується спосіб інгібування HDAC у теплокровної тварини, такої як людина, що має потребу в такому лікуванні, який передбачає введення вказаній тварині ефективної кількості сполуки формули (І), або її фармацевтично прийнятної солі або проліків, як визначено вище. 15 UA 98757 C2 5 10 15 20 25 30 35 40 45 50 55 60 Відповідно до подальшого варіанту здійснення винаходу, забезпечується застосування сполуки формули (І), або її фармацевтично прийнятної солі або проліків, як визначено вище, для приготування лікарського засобу для застосування для забезпечення інгібування клітинного циклу (дії, що пригнічує проліферацію клітин) у теплокровної тварини, такої як людина. Відповідно до подальшого варіанта здійснення винаходу, забезпечується спосіб інгібування клітинного циклу (дії, що пригнічує проліферацію клітин) у теплокровної тварини, такої як людина, що має потребу в такому лікуванні, який передбачає введення вказаній тварині ефективної кількості сполуки формули (І), або її фармацевтично прийнятної солі або проліків, як визначено вище. Відповідно до подальшого варіанту здійснення винаходу, забезпечується спосіб лікування злоякісного новоутворення в теплокровної тварини, такої як людина, що має потребу в такому лікуванні, який передбачає введення вказаній тварині ефективної кількості сполуки формули (І), або її фармацевтично прийнятної солі або проліків, як визначено вище. Відповідно до подальшого варіанта здійснення винаходу, забезпечується сполука формули (І), або її фармацевтично прийнятна сіль або проліки, як визначено вище, для приготування лікарського засобу для застосування для лікування злоякісного новоутворення. Відповідно до подальшого варіанту здійснення винаходу, забезпечується сполука формули (І), або її фармацевтично прийнятна сіль або проліки, як визначено вище, для застосування для лікування злоякісного новоутворення. Відповідно до подальшого варіанта здійснення винаходу, забезпечується застосування сполуки формули (І), або її фармацевтично прийнятної солі або проліків, як визначено вище, для застосування для приготування лікарського засобу для лікування злоякісного новоутворення. В подальшому варіанті здійснення даного винаходу забезпечується застосування сполуки формули (І), або її фармацевтично прийнятної солі або проліків, як визначено вище, для приготування лікарського засобу для застосування для лікування раку легенів, раку прямої кишки, раку молочної залози, раку передміхурової залози, лімфоми та/або лейкозу. В подальшому варіанті здійснення даного винаходу забезпечується спосіб лікування раку легенів, раку прямої кишки, раку молочної залози, раку передміхурової залози, лімфоми або лейкозу, у теплокровної тварини, такої як людина, що має потребу в такому лікуванні, який передбачає введення вказаній тварині ефективної кількості сполуки формули (І), або її фармацевтично прийнятної солі або проліків, як визначено вище. Злоякісними новоутвореннями, які піддаються лікуванню згідно із даним винаходом, є рак стравоходу, мієлома, печінково-клітинний рак, рак підшлункової залози й рак шийки матки, дифузійна ендотеліма кісток, нейробластома, саркома Капоши, рак яєчників, рак молочної залози, рак прямої кишки, рак передміхурової залози, рак сечового міхура, меланома, рак легені [включаючи недрібноклітинний рак легені (NSCLC) і дрібноклітинний рак легені (SCLC)], рак шлунка, рак голови й шиї, рак головного мозку, рак нирки, лімфома й лейкоз. Інгібуюча дія по відношенню до HDAC, описана вище, може застосовуватися у вигляді монотерапії, або, додатково до сполуки за винаходом, можна застосовувати одну або декілька інших речовин і/або лікувань. Таке спільне лікування може здійснюватися шляхом одночасного, послідовного або роздільного введення окремих компонентів для лікування. У медичній онкології є звичайною практикою застосовувати комбінацію різних форм лікування для лікування кожного пацієнта зі злоякісним новотвором. У медичній онкології іншим(ими) компонентом(ами) для такого спільного лікування додатково до лікування, що забезпечує інгібування клітинного циклу, описаного вище, можуть бути: хірургія, променева терапія або хіміотерапія. Така хіміотерапія може охоплювати один або кілька наступних класів протипухлинних засобів: (і) антипроліферативні/протипухлинні лікарські засоби і їх сполучення, які застосовуються в онкології, такі як алкілувальні засоби (наприклад, цис-платин, карбоплатин, циклофосфамід, азотний іприт, мельфалан, хлорамбуцил, бусульфан і нітрозосечовини); антиметаболіти (наприклад, антифолати, такі як фторпіримідини, такі як 5-фторурацил і тегафур, ралтитрексед, метотрексат, арабінозид цитозину й гідроксисечовина; протипухлинні антибіотики (наприклад, антрацикліни, такі як адриаміцин, блеоміцин, доксорубіцин, дауноміцин, епірубіцин, ідарубіцин, мітоміцин-С, дактиноміцин і мітраміцин); антимітотичні засоби (наприклад, алкалоїди барвінку, такі як вінкристин, вінбластин, віндезин і вінорелбін і таксоїди, такі як таксол і таксотер); і інгібітори топоізомерази (наприклад, епіподофілотоксини, такі етопозид і теніпозид, амсакрин, топотекан і камфотецин); (іі) цитостатичні засоби, такі як антиестрогени (наприклад, тамоксифен, тореміфен, ралоксифен, дролоксифен і йодоксифен), інгібітори рецептора естрогену (наприклад, 16 UA 98757 C2 5 10 15 20 25 30 35 40 45 50 55 60 фульвестрант), антиандрогени (наприклад, бікалутамід, флутамід, нілутамід і ципротерон ацетат), антагоністи LHRH або агоністи LHRH (наприклад, гозерелін, лейпрорелін і бузерелін), прогестогени (наприклад, мегестрол ацетат), інгібітори ароматази (наприклад, анастрозол, летрозол, воразол і ексеместан) і інгібітори 5α-редуктази, такі як финастерид; (ііі) засоби, які інгібують інвазію злоякісних клітин (наприклад, інгібітори метал опротеїнази, такі як маримастат і інгібітори функції рецептора урокіназного активатора плазміногену); (iv) інгібітори дії фактора росту, наприклад, такі інгібітори включають антитіла до фактора росту, антитіла до рецептора фактора росту (наприклад, анти-erbb2 антитіло трастузумаб [Herceptin™] і анти-erbb1 антитіло цетуксимаб [С225]), інгібітори фарнезилтрансферази, інгібітори МЕК, інгібітори тирозинкінази й інгібітори серин/треонін кінази, наприклад, інгібітори сімейства епідермального фактора росту (наприклад, інгібітори тирозинкіназ EGFR сімейства, такі як N-(3-хлор-4-фторфеніл)-7-метокси-6-(3-морфолінопропокси)хіназолін-4-амін (гефитиниб), N-(3-етинілфеніл)-6,7-біс(2-метоксіетокси)хіназолін-4-амін (ерлотиніб, OSI-774) і 6-акриламідоN-(3-хлор-4-фторфеніл)-7-(3-морфолінопропокси)хіназолін-4-амін (СІ 1033)), наприклад, інгібітори сімейства фактора росту похідних тромбоцитів і, наприклад, інгібітори сімейства фактора росту гепатоцитів; (v) антиангіогенні речовини, такі як ті, які інгібують дію фактора росту ендотелію судин, (наприклад, антитіло до фактора росту клітин ендотелію судин бевацизумаб [Avastin™], сполуки, які описані в міжнародних заявках на патент WO 97/22596, WO 97/30035, WO 97/32856 і WO 98/13354) і сполуки, які діють за іншим механізмом (наприклад, ліномід, інгібітори дії інтегрину αvβ3 і ангіостатин); (vi) речовини, які пошкоджують судини, такі як комбретастатин А4 і сполуки, описані в міжнародних заявках на патент WO 99/02166, WO 00/40529, WO 00/41669, WO 01/92224, WO 02/04434 і WO 02/08213; (vii) антисислова терапія, наприклад, така, що спрямована на мішені, перераховані вище, такі як ISIS 2503, антисислова терапія на основі гена ras; (viii) способи генної терапії, включаючи, наприклад, способи заміни аберантних генів, такі як способи аберації р53 або аберації BRCA1 або BRCA2, GDEPT (пролікарська терапія, спрямована на ген ферменту), такі як способи з використанням деамінази цитозину, тимідинкінази або бактеріальної нітроредуктази й способи підвищення стійкості пацієнта до хіміотерапії або радіотерапії, такі як генна терапія резистентності до багатьох лікарських засобів; (іх) способи імунотерапії, включаючи, наприклад, способи підвищення імуногенності пухлинних клітин пацієнта в умовах ex vivo і in vivo, такі як трансфекція цитокінами, такими як інтерлейкін 2, інтерлейкін 4 або фактор стимуляції колоній гранулоцитів-макрофагів, способи зниження активності Т-клітин, способи з використанням трансфектованих імунних клітин, таких як цитокін-трансфектовані дендритні клітини, способи з використанням цитокінтрансфектирваних ліній пухлинних клітин і способи з використанням анти-ідіотипічних антитіл. (х) інгібітори клітинного циклу, включаючи, наприклад інгібітори CDK (наприклад, флавопіридол) і інші інгібітори контрольних точок клітинного циклу (наприклад, кіназа контрольної точки); інгібітори аурора-кінази й інших кіназ, залучених у мітоз і регуляцію клітинного поділу (наприклад, мітотичні кінезини); і інші інгібітори деацетилази гістонів; і (хі) диференціювальні засоби (наприклад, ретиноєва кислота й вітамін D). Відповідно до цього варіанту здійснення винаходу, забезпечується фармацевтична композиція, яка містить сполуку формули (І), як визначено вище, і додаткову протипухлинну речовину, як визначено вище, для спільного лікування злоякісного новоутворення. Також забезпечується сполука формули (І), або її фармацевтично прийнятна сіль або проліки, як визначено вище, для застосування в способі лікування запальних захворювань, аутоімунних захворювань, і алергічних/атопічних захворювань. Зокрема, сполука формули (І), або її фармацевтично прийнятна сіль або проліки, як визначено вище, передбачається для застосування в способі лікування запалення суглобів (особливо ревматоїдного артриту, остеоартриту й подагри), запалення шлунково-кишкового тракту (особливо запальних захворювань кишечнику, неспецифічного виразкового коліту й гастриту), запалення шкіри (особливо псоріазу, екземи, дерматитів), розсіяного склерозу, атеросклерозу, спондилоартропатій (анкілозуючого спондилоартриту, псоріатичного артриту, артриту, зв'язаного з неспецифічним виразковим колітом), невропатій, зв'язаних зі СНІДом, системного червоного вовчаку, астми, хронічного обструктивного захворювання легенів, бронхіту, плевриту, респіраторного дистрес-синдрому дорослих, сепсису, і гострого й хронічного гепатиту (вірусного, бактеріального або токсичного). Також забезпечується сполука формули (І), або її фармацевтично прийнятна сіль або проліки, як визначено вище, для застосування як лікарський засіб для лікування запальних 17 UA 98757 C2 5 10 15 20 25 30 35 40 45 50 55 захворювань, аутоімунних захворювань, і алергічних/атопічних захворювань у теплокровної тварини, такої як людина. Зокрема, сполука формули (І), або її фармацевтично прийнятна сіль або проліки, як визначено вище, передбачається для застосування як лікарський засіб для лікування запалення суглобів (особливо ревматоїдного артриту, остеоартриту й подагри), запалення шлунковокишкового тракту (особливо запальних захворювань кишечнику, неспецифічного виразкового коліту й гастриту), запалення шкіри (особливо псоріазу, екземи, дерматитів), розсіяного склерозу, атеросклерозу, спондилоартропатій (анкілозуючого спондилоартриту, псоріатичного артриту, артриту, зв'язаного з неспецифічним виразковим колітом), невропатій, зв'язаних зі СНІДом, системного червоного вовчаку, астми, хронічного обструктивного захворювання легенів, бронхіту, плевриту, респіраторного дистрес-синдрому дорослих, сепсису, і гострого й хронічного гепатиту (вірусного, бактеріального або токсичного). Також забезпечується застосування сполуки формули (І), або її фармацевтично прийнятної солі або проліків, як визначено вище, для приготування лікарського засобу для застосування для лікування запальних захворювань, аутоімунних захворювань, і алергічних/атопічних захворювань у теплокровної тварини, такої як людина. Як було вказано вище, доза, необхідна для лікування або профілактики конкретного захворювання, зв'язаного із проліферацією клітин, обов'язково залежить від організму, що піддається лікуванню, шляху введення й тяжкості захворювання, яке піддається лікуванню. Застосовувана стандартна доза знаходиться в діапазоні, наприклад, 1-100 мг/кг, переважно 150 мг/кг. Додатково до їх застосування в терапевтичній медицині, сполуки формули (І) і їх фармацевтично прийнятні солі також корисні як фармацевтичні засоби для розвитку й стандартизації тестованих систем в умовах in vitro і in vivo для оцінки дій інгібіторів активності клітинного циклу в лабораторних тварин, таких як коти, собаки, кролики, мавпи, щури й миші, як компонент пошуку нових терапевтичних засобів. Далі винахід ілюструється наступними прикладами, у яких, загалом: (і) дії здійснювали при температурі навколишнього середовища, тобто в інтервалі 17-25 °C і в атмосфері інертного газу, такого як аргон, якщо спеціально не вказано інакше; (іі) випаровування здійснювали шляхом роторного випаровування у вакуумі й процедуру звичайної обробки здійснювали після видалення залишків твердих речовин шляхом фільтрації; (ііі) колонкову хроматографію (за допомогою флеш-методики) і рідинну хроматографію середнього тиску (MLPC) здійснювали на діоксиді кремнію Merck Kieselgel (Art. 9385) або Merck Lichroprep RP-18 (Art. 9303) діоксиді кремнію із оберненою фазою, отриманого від Е. Merck, Darmstadt, Німеччина або використовуючи власні попередньо упаковані картриджі діоксиду кремнію з нормальною фазою, наприклад Redisep(TM) доступні картриджі для хроматографії одержували від Presearch Ltd., Hitchin, UK, або рідинну хроматографію високого тиску (ВЕРХ) здійснювали на діоксиді кремнію 318 із оберненою фазою, наприклад, на препаративній колонці із оберненою фазою Dynamax С-18 60А; (iv) для виходів, якщо вони представлені, необов'язково можуть бути досягнуті максимальні значення; (v) структуру кінцевих продуктів формули (І), як правило, підтверджували за допомогою ядерного магнітного резонансу (ЯМР) і/або мас-спектральних методів; мас-спектральні дані звичайно одержували при бомбардуванні швидкими атомами (FAB), використовуючи спектрометр Platform, і, якщо було доцільно, дані позитивних іонів або дані негативних іонів збирали; ЯМР значення хімічних зрушень вимірювали на дельта-шкалі спектри протонного магнітного резонансу вимірювали, використовуючи спектрометр Jeol JNM ЕХ 400, працюючи при напруженості поля 400 МГц, спектрометр Varian Gemini 2000, працюючи при напруженості поля 300 МГц, Bruker DPX-400, працюючи при 400 МГц або Bruker AM300, працюючи при напруженості поля 300 МГц - вимірювання проводили при температурі навколишнього середовища, якщо спеціально не вказано інакше; (vi) проміжні продукти, як правило, не були повністю охарактеризовані й чистоту визначали за допомогою тонкошарової хроматографії, HPLC, інфрачервоного (ІЧ) і/або ЯМР аналізів; (vii) точки плавлення є незв'язаними й вони визначалися за допомогою автоматичного приладу для визначення точок плавлення Mettler SP62 або приладу з масляною банею; точки плавлення для кінцевих продуктів формули (І) визначали після кристалізації зі звичайного органічного розчинника, такого як етанол, метанол, ацетон, простий ефір або гексан, окремо або в добавці; 18 UA 98757 C2 (viii) використані наступні скорочення: ДМСО диметилсульфоксид ТГФ тетрагідрофуран DIPEA N,N-діізопропілетиламін ІРА ізопропіловий спирт Вос/ВОС трет бутилоксикарбоніл HCl соляна кислота Cbz/CBZ бензилоксикарбоніл Tf трифторметилсульфоніл LiHMDS гексаметилдисилазид літію PhNTf2 N-феніл-біс(трифторметансульфонимид) DME 1,2-диметоксіетан CDMT 2-хлор-4,6-диметокси-1,3,5-триазин Приклад 1 N-(2-Амінофеніл)-4-{1-[(1-метил-1H-піразол-4-іл)метил]піперидин-4-іл}бензамід 5 10 15 20 25 У реакційну посудину, завантажену 1-метил-1H-піразол-4-карбоксальдегідом (84,5 мг, 0,77 ммоль), додавали розчин трет-бутил 2-[(4-піперидин-4-ілбензоїл)аміно]фенілкарбамату (отриманий, як описано в методі 1 нижче; 300 мг, 0,76 ммоль) у дихлорметані (7 мл) і N,Nдиметилформаміді (0,5 мл). трет-Бутил 2-[(4-піперидин-4-ілбензоїл)аміно]фенілкарбамат також може бути приготовлений відповідно до способу, описаного у методі 4 нижче. Додавали оцтову кислоту (50 мкл, 0,87 ммоль) і реакційній суміші дозволяли перемішуватися при температурі навколишнього середовища протягом 45 хвилин. Потім додавали триацетоксиборогідрид натрію (250 мг, 1,18 ммоль) і реакціям дозволяли перемішуватися додатково протягом 76 годин, після цього розводили метанолом і наносили безпосередньо на SCX-2 картридж (10 г). Картридж промивали метанолом (80 мл), потім продукти елюювали 2М розчином аміаку в метанолі (50 мл). Релевантні фракції упарювали насухо й отриманий залишок повторно розчиняли в дихлорметані (3 мл) і обробляли трифтороцтовою кислотою (1 мл). Цю суміш перемішували при температурі навколишнього середовища протягом 2 годин, потім розводили дихлорметаном і наносили на SCX-2 картридж (5 г). Картридж промивали метанолом (20 мл), після цього продукти елюювали 2М розчином аміаку в метанолі (20 мл). Аміачну фракцію упарювали насухо й отриманий залишок очищали за допомогою флеш-хроматографії на діоксиді кремнію, елююючи 10% метанолом у дихлорметані, одержуючи вказану в заголовку сполуку (117 мг, 40 %); ЯМР-спектр: (ДМСО d6) δ 1,70 (m, 4Н), 2,01 (t, 2Н), 2,57 (m, 1Н), 2,95 (m, 2H), 3,38 (s, 2H), 3,81 (s, 3Н), 4,86 (s, 2H), 6,60 (m, 1H), 6,78 (m, 1H), 6,97 (m, 1H), 7,18 (m, 1H), 7,31 (s, 1H), 7,37 (d, + 2H), 7,57 (s, 1H), 7,91 (d, 2H), 9,56 (s, 1H); Мас-спектр: М+Н 390. Приклад 2 Використовуючи методику, аналогічну до описаної в прикладі 1, трет-бутил 2-[(4-піперидин4-ілбензоїл)аміно]фенілкарбамат піддавали реакції з підходящою піразолкарбальдегідною вихідною речовиною (ВР), одержуючи сполуки, наведені в таблиці 1 19 UA 98757 C2 Таблиця 1 Приклад Аналітичні дані R BP 2А ЯМР-спектр: (CDCl3) δ 1,81 (m, 4Н), 2,07 (m, 2H), 2,25 (s, 3H), 2,56 (m, 1H), 3,04 (m, 2Н), 3,39 (s, 2Н), 3,81 (s, 3H), 3,85 (s, Комерційно 2H), 6,84 (m, 2Н), 7,08 (m, 1Н), 7,24 (s, доступна 1H), 7,33 (m, 3Н), 7,82 (m, 3Н). + Мас-спектр: M+Na 426. 2В ЯМР-спектр: (DМСО d6) δ 1,67 (m, 2Н), 1,78 (m, 2H), 2,08 (m, 5H), 2,59 (m, 1Н), 2,93 (m,2H), 3,48 (s, 2H), 3,74 (s, 3Н), Комерційно 4,86 (s, 2H), 5,92 (s, 1H), 6,60 (m, 1H), доступна 6,78 (m, 1H), 6,97 (m, 1H), 7,17 (m, 1H), 7,38 (d, 2H), 7,91 (d, 2H), 9,56 (s, 1H); + Mac-спектр: М+Nа 426. Приклад 3 N-(2-Амінофеніл)-4-[1-(1Н-піразол-3-ілметил)піперидин-4-іл]бензамід 5 10 15 20 трет-Бутил 2-[(4-піперидин-4-ілбензоїл)аміно]фенілкарбамат (отриманий, як описано в методі 1 нижче; 200 мг, 0,51 ммоль) і 1H-піразол-3-карбальдегід (50,7 мг, 0,53 ммоль) перемішували при температурі навколишнього середовища в дихлорметані (5 мл) протягом 1 години. Додавали триацетоксиборогідрид натрію (150 мг, 0,71 ммоль) і суміш перемішували при температурі навколишнього середовища протягом 48 годин. Отриманий розчин абсорбували на SCX-2 колонці, яку промивали метанолом (2 об'єми колонки) і потім продукт елюювали 2М розчином аміаку в метанолі (2 об'єми колонки), одержуючи піну. Її розчиняли в 1,4-діоксані (2 мл), додавали 4М розчин хлористого водню в 1,4-діоксані (2 мл) і розчин перемішували при температурі навколишнього середовища протягом 48 годин. Продукт фільтрували й промивали простим діетиловим ефіром і висушували на повітрі. Отриману тверду речовину розчиняли у воді, підлуговували 2 н. гідроксидом натрію й отриману тверду речовину фільтрували, промивали водою й висушували у вакуумі, одержуючи вказану в заголовку сполуку (61 мг, 44 %). ЯМР-спектр: 1H NMR (ДМСО d6) δ 1,71 (m, 4Н), 2,07 (m, 2Н), 2,56 (m, 1H), 2,95 (m, 2H), 3,53 (s, 2Н), 4,86 (s, 2Н), 6,16 (s, 1H), 6,60 (m, 1H), 6,78 (d, 1H), 6,97 (t, 1H), 7,18 (d, 1H), 7,37 (d, 2H), + 7,64 (m, 1H), 7,91 (d, 2H), 9,55 (s, 1H), 12,59 (m, 1H); Мас-спектр: M+H 376. Приклад 4 N-(2-Амінофеиіл)-4-{1-[(5-метокси-1,3-диметил-1H-піразол-4-іл)метил]піперидин-4іл}бензамід 20 UA 98757 C2 5 10 15 20 25 30 35 Використовуючи методику, аналогічну до описаної в прикладі 3, трет-бутил 2-[(4-піперидин4-ілбензоїл)аміно]фенілкарбамат (отриманий, як описано в методі 1 нижче; 200 мг, 0,51 ммоль) піддавали реакції з 5-метокси-1,3-диметил-1H-піразол-4-карбальдегідом (92,6 мг, 0,60 ммоль), одержуючи вказану в заголовку сполуку (68 мг, 36 %). ЯМР-спектр: (ДМСО d6) δ 1,63 (m, 2Н), 1,78 (m, 2Н), 2,00 (m, 2Н), 2,06 (s, 3Н), 2,57 (m, 1H), 2,94 (m, 2H), 3,25 (s, 2H), 3,50 (s, 3Н), 3,99 (s, 3Н), 4,86 (br s, 2H), 6,60 (m, 1H), 6,78 (d, 1H), 6,97 (m, 1H), 7,17 (d, 1H), 7,37 (d, 2H), 7,91 (d, 2H), + 9,55 (s, 1H); Мас-спектр: М+Н 434. Приклад 5 N-(2-Амінофеніл)-4-{1-[(3-етил-1Н-піразол-4-іл)метил]піперидин-4-іл}бензамід трет-бутил 2-[(4-піперидин-4-ілбензоїл)аміно]фенілкарбамат (отриманий, як описано в методі 1 нижче; 395 мг, 1,0 ммоль) і 3-етил-1H-піразол-4-карбальдегід (149 мг, 1,2 ммоль) перемішували при температурі навколишнього середовища в дихлорметані (10 мл) протягом 1 години. Додавали триацетоксиборогідрид натрію (297 мг, 1,4 ммоль) і суміш перемішували при температурі навколишнього середовища протягом 24 годин. Отриманий розчин абсорбували на SCX-2 колонці, яку промивали метанолом (2 об'єми колонки) і потім продукт елюювали 2М розчином аміаку в метанолі (2 об'єми колонки), одержуючи продукт у вигляді білої піни. Його очищали за допомогою хроматографії на діоксиді кремнію, елююючи 10% метанолом у дихлорметані. Залишок розчиняли в дихлорметані (4 мл) і додавали трифтороцтову кислоту (1 мл) і суміш перемішували протягом 3 годин при температурі навколишнього середовища. Отриманий розчин абсорбували на SCX-2 колонці, яку промивали метанолом (2 об'єми колонки) і потім продукт елюювали 2М розчином аміаку в метанолі (2 об'єми колонки), одержуючи вказану в заголовку сполуку (232 мг, 75%). ЯМР-спектр: (ДМСО d6) δ 1,18 (t, 3Н), 1,65 (m, 2H), 1,77 (m, 2Н), 2,00 (m, 2Н), 2,57 (m, 3Н), 2,95 (m, 2Н), 3,34 (s, 2Н), 4,86 (br s, 2Н), 6,60 (m, 1H), 6,78 (d, 1Н), 6,97 (m, 1H), 7,17 (d, 1H), 7,29 (br s, 1H), 7,37 (d, 2H), 7,91 (d, 2H), 9,55 (s, 1H), 12,39 + (s, 1H); Мас-спектр: М+Н 404. Приклад 6 N-(2-Амінофеніл)-4-{1-[(1,3,5-триметил-1H-піразол-4-іл)метил]піперидин-4-іл}бензамід Використовуючи методику, аналогічну до описаної в прикладі 5, трет-бутил 2-[(4-піперидин4-ілбензоїл)аміно]фенілкарбамат (отриманий, як описано в методі 1 нижче; 200 мг, 0,51 ммоль) піддавали реакції з 1,3,5-триметил-1Н-піразол-4-карбальдегідом (83,5 мг, 0,60 ммоль), одержуючи вказану в заголовку сполуку (70 мг, 56 %). ЯМР-спектр: (ДМСО d6) δ 1,65 (m, 2Н), 1,77 (m, 2Н), 1,98 (m, 2Н), 2,09 (s, 3Н), 2,18 (s, 3Н), 2,57 (m, 1H), 2,92 (m, 2H), 3,24 (s, 2H), 3,63 (s, 21 UA 98757 C2 3Н), 4,86 (br s, 2H), 6,60 (m, 1H), 6,78 (d, 1H), 6,97 (m, 1H), 7,17 (d, 1H), 7,37 (d, 2H), 7,91 (d, 2H), + 9,55 (s, 1H); Мас-спектр: М+Н 418. Приклад 7А N-(2-Амінофеніл)-4-{1-[(1,3-диметил-1H-піразол-4-іл)метил]піперидин-4-іл}бензамід 5 10 15 20 25 30 35 40 45 трет-Бутил (2-{[4-(1-{1,3-диметил-1H-піразол-4-ілметил}піперидин-4іл)бензоїл]аміно}феніл)карбамат (отриманий, як описано в методі 6 нижче; 7,61 г, 15,11 ммоль) розчиняли в 1,4 діоксані (70 мл) і охолоджували до 0 °C, використовуючи льодяно-водяну баню. Потім повільно додавали 4М розчин хлористого водню в 1,4 діоксані (150 мл, 600 ммоль). Отриманій суспензії дозволяли нагрітися до кімнатної температури й грудки руйнували шляхом перемішування скляним стрижнем. Реакційну суміш перемішували при кімнатній температурі протягом 18 годин. Суміш фільтрували з відсмоктуванням. Отриману тверду речовину розчиняли у воді (200 мл), і значення рН розчину доводили до 12 шляхом повільного додавання 2М водного розчину гідроксиду натрію. Отриману суміш екстрагували дихлорметаном (300 мл) і органічні речовини відокремлювали. Потім водну фазу додатково екстрагували дихлорметаном (200 мл) і об'єднані екстракти промивали соляним розчином, висушували над сульфатом магнію, фільтрували й упарювали, одержуючи прозору смолу. Цю смолу ресуспендували в простому діетиловому ефірі й повторно упарювали насухо, одержуючи вказану в заголовку сполуку (5,69 г, 93 %). ЯМР-спектр (CDCl3) δ 1,81 (m, 4H), 2,07 (m, 2H), 2,25 (s, 3Н), 2,56 (m, 1H), 3,04 (m, 2H), 3,39 (s, 2H), 3,81 (s, 3H), 3,85 (s, 2H), 6,84 (m, 2Н), 7,08 (m, 1Н), 7,24 (s, 1H), 7,33 (m, + 3Н), 7,82 (m, 3Н). Мас-спектр: М+Н 404. Приклад 7В N-(2-Амінофеніл)-4-{1-[(1,3-диметил-1H-піразол-4-іл)метил]піперидин-4-іл}бензамід трет-Бутил (2-{[4-(1-{1,3-диметил-1H-піразол-4-ілметил}піперидин-4іл)бензоїл]аміно}феніл)карбамат (Метод 6 нижче; 92,3 г, 183,3 ммоль) суспендували в метанолі (754 мл) і воді (141 мл) і охолоджували до 0-5 °C. Додавали концентровану соляну кислоту, підтримуючи температуру нижче 20 °C. Реакційну суміш перемішували протягом 20 годин при температурі навколишнього середовища. Реакцію охолоджували до 0-5 °C і додавали водний розчин гідроксиду натрію, підтримуючи температуру нижче 20 °C до одержання значення рН, рівного 12-14. Реакційну суміш нагрівали до температури флегми протягом 30 хвилин, потім охолоджували до 20 °C приблизно протягом 4 годин. Продукт збирали шляхом фільтрації й промивали водним метанолом, потім висушували у вакуумі при 45 °C до постійної ваги, одержуючи вказану в заголовку сполуку (63,3 г 86 %). ЯМР-спектр (ДМСО d6), 1,65 (m, 2Н), 1,73 (m, 2Н), 1,96 (t, 2Н), 2,08 (s, 3Н), 2,55 (m, 1Н), 2,92 (d, 2H), 3,28 (s, 2H), 3,75 (s, 3Н), 4,87 (s, 2H), 6,59 (m, 1H), 6,77 (m, 1H), 6,96 (m, 1H), 7,2 (d, 1H), 7,35 (d, 2H), 7,44 (s, 1H), 7,90 (d, 2H), 9,56 (s, + 1H). Мас-спектр: М+Н 404. Приклад 8 N-(2-Амінофеніл)-4-{1-[(1,5-диметил-1H-піразол-4-іл)метил]піперидин-4-іл}бензамід трет-Бутил {2-[(4-{1-[(1,5-диметил-1H-піразол-4-іл)метил]піперидин-4іл}бензоїл)аміно]феніл}карбамат (отриманий, як описано в методі 7; 308 мг, 0,61 ммоль) ресуспендували в дихлорметані (2 мл) і додавали трифтороцтову кислоту (1 мл). Реакційну суміш перемішували при температурі навколишнього середовища протягом 1 години, потім заливали в SCX-3 картридж (5 г). Картридж промивали дихлорметаном (50 мл) і метанолом (50 мл), після цього продукт елюювали 2М розчином аміаку в метанолі (50 мл). Аміачну фракцію 22 UA 98757 C2 5 10 15 20 25 30 35 упарювали, одержуючи білу тверду речовину (182 мг), яку очищали за допомогою препаративної ВЕРХ із оберненою фазою, одержуючи вказану в заголовку сполуку (134 мг, 55%). ЯМР-спектр: (ДМСО d6) δ 1,70 (m, 4Н), 2,01 (m, 2Н), 2,22 (s, 3Н), 2,57 (m, 1Н), 2,95 (m, 2H), 3,28 (s, 2H), 3,71 (s, 3Н), 4,86 (s, 2H), 6,60 (m, 1H), 6,78 (m, 1H), 6,97 (m, 1H), 7,17 (m, 1H), 7,23 (s, + 1H), 7,37 (d, 2H), 7,90 (d, 2H), 9,55 (s, 1H); Мас-спектр: М+Н 404. Приклад 9 N-(2-Амінофеніл)-4-{1-[(1-етил-5-метил-1H-піразол-4-іл)метил]піперидин-4-іл}бензамід Розчин 1-етил-5-метил-1Н-піразол-4-карбальдегіду (141 мг, 1,02 ммоль) у дихлорметані (1 мл) додавали до розчину трет-бутил 2-[(4-піперидин-4-ілбензоїл)аміно]фенілкарбамату (отриманого, як описано в методі 1 нижче; 300 мг, 0,76 ммоль) у дихлорметані (6,5 мл). Додавали оцтову кислоту (45 мкл, 0,79 ммоль) і реакційну суміш перемішували протягом 4 годин. Потім додавали N,N-диметилформамід (1 мл) і продовжували перемішувати додатково протягом 30 хвилин, потім додавали триацетоксиборогідрид натрію (245 мг, 1,16 ммоль) у вигляді твердої речовини. Після цього реакційній суміші дозволяли перемішуватися при температурі навколишнього середовища протягом 18 годин (всю ніч). Реакційну суміш розводили до подвійного об'єму шляхом додавання метанолу й відразу завантажували на попередньо промитий (за допомогою метанолу) SCX-2 картридж (10 г). Картридж промивали метанолом (60 мл), після цього продукти елюювали за допомогою 2М розчину аміаку в метанолі (50 мл). Аміачний елюант упарювали, одержуючи безбарвну піну (420 мг), яку ресуспендували в дихлорметані (5 мл) і обробляли трифтороцтову кислотою (2 мл). Суміші дозволяли перемішуватися протягом 2 годин, потім розводили дихлорметаном (10 мл) і заливали на попередньо промитий (за допомогою метанолу) SCX-2 картридж (10 г). Картридж промивали дихлорметаном (40 мл), метанолом (50 мл) і після цього продукти елюювали 2М розчином аміаку в метанолі (50 мл). При упарюванні аміачної фракції одержували ясно-жовту смолу (300 мг), яку очищали за допомогою препаративної ВЕРХ із обереною фазою, одержуючи вказану в заголовку сполуку (172 мг, 54%). ЯМР-спектр: (ДМСО d6) δ 1,27 (t, 3Н), 1,66 (m, 4Н), 1,98 (m, 2Н), 2,21 (s, 3Н), 2,56 (m, 1H), 2,92 (m, 2H), 3,29 (s, 2H), 4,02 (q, 2H), 4,85 (s, 2H), 6,59 (m, 1H), 6,77 (m, 1H), 6,95 (m, 1H), 7,16 (m, 1H), 7,23 (s, 1H), 7,35 (d, 2H), 7,89 (d, 2H), 9,54 (s, 1H); Мас-спектр: + M+H 418. Приклади 10 і 11 Використовуючи методику, аналогічну до описаної в прикладі 9, трет-бутил 2-[(4-піперидин4-ілбензоїл)аміно]фенілкарбамат (отриманий, як описано в методі 1 нижче) піддавали реакції з підходящою піразолкарбальдегідною вихідною речовиною, одержуючи сполуки, наведені в таблиці 2. Таблиця 2 Приклад 10 Аналітичні дані R BP ЯМР-спектр: (ДМСО d6) δ 1,35 (t, 3Н), 1,68 (m, 4H), 1,99 (m, 2H), 2,56 (m, 1Н), 2,94 (m, 2H), 3,32 (s, 2H), 4,08 (q, 2H), 4,85 (s, 2H), Комерційно 6,58 (m, 1H), 6,77 (m, 1H), 6,95 (m, 1H), доступна 7,16 (m, 1H), 7,31 (s, 1H), 7,36 (d, 2H), 7,60 (s, 1H), 7,89 (d, 2H), 9,54 (s, 1H); + Мас-спектр: М+Н 404 23 UA 98757 C2 Продовження таблиці 2 Приклад 11 5 10 15 20 25 30 Аналітичні дані R BP ЯМР-спектр: (DМСО d6) δ 1,32 (t, 3Н), 1,67 (m, 4H), 1,98 (m, 2Н), 2,12 (s, 3Н), 2,56 (m, 1Н), 2,92 (m, 2H), 3,28 (s, 2H), 3,99 (q, 2H), Комерційно 4,85 (s, 2H), 6,58 (m, 1H), 6,77 (m, 1H), доступна 6,95 (m, 1H), 7,16 (m, 1H), 7,35 (d, 2H), 7,47 (s, 1H), 7,89 (d, 2H), 9,54 (s, 1H); + Мас-спектр: М+Н 418 Методи одержання вихідних речовин Метод 1 трет-Бутил {2-[(4-піперидин-4-ілбензоїл)аміно]феніл}карбамат До розчину бензил 4-{4-[({2-[(трет-бутоксикарбоніл)аміно]феніл}аміно)карбоніл]феніл}-3,6дигідропіридин-1(2H)-карбоксилату (269 г, 524 ммоль; отриманого, як описано в методі 2 нижче) у метанолі (3000 мл) додавали 10% паладію на вугіллі (10 г). Реакційну суміш поміщали в газоподібний водень під тиском 5 бар і нагрівали до 50 °C протягом 1 години. Реакційну суміш охолоджували до кімнатної температури, фільтрували через шар целіту й розчинник упарювали при зниженому тиску. Отриману піну розтирали в порошок у простому діетиловому ефірі й фільтрували, одержуючи білу тверду речовину. Цей продукт тонко подрібнювали й перемішували з 95:5 простий діетиловий ефір/етилацетат, потім збирали шляхом фільтрації з відсмоктуванням. Цю тверду речовину промивали простим діетиловим ефіром, ізогексаном і висушували у вакуумі, одержуючи вказану в заголовку сполуку (167 г, 81%). ЯМР-спектр: (ДМСО-d6) 1,45 (s, 9H), 1,57 (m, 2H), 1,72 (m, 2H), 2,61 (t, 2H), 2,69 (m, 1H), 3,07 (m, 2H), 7,18 (m, + 2H), 7,40 (d, 2H), 7,53 (d, 2H), 7,91 (d, 2H), 8,70 (br s, 1H), 9,82 (br s, 1H); Мас-спектр: М+Н 396. Метод 2 Бензил 4-{4-[({2-[(трет-бутоксикарбоніл)аміно]феніл}аміно)карбоніл]феніл)-3,6дигідропіридин-1(2H)-карбоксилат Тетракіс(трифетлфосфін)паладій (0) (8,0 г, 6,92 ммоль) додавали до перемішуваної суспензії N-(2-трет-бутоксикарбоніламінофеніл)-4-(4,4,5,5-тетраметил-1,3,2,-діоксаборолан-2-іл) бензаміду (288 г, 657 ммоль; отриманого, як описано в міжнародній патентній заявці WO 03/087057, Метод 13, сторінка 60) і бензил 4-{[(трифторметил)сульфоніл]окси}-3,6дигідропіридин-1(2H)-карбоксилату (240 г, 657 ммоль; отриманого, як описано в методі 3 нижче) в 1,2-диметоксіетані (3000 мл) і насиченого водного розчину бікарбонату натрію (3000 мл). Реакційну суміш нагрівали до 80 °C протягом 7 годин, потім дозволяли охолонути до температури навколишнього середовища, при перемішуванні. Потім реакційну суміш виливали у воду (2000 мл) і екстрагували етилацетатом. Після цього органічні екстракти висушували над 24 UA 98757 C2 5 10 15 20 25 30 35 40 сульфатом магнію, фільтрували й упарювали насухо, одержуючи неочищений продукт у вигляді сірої твердої речовини. Його очищали за допомогою колонкової флеш-хроматографії на діоксиді кремнію, елююючи етилацетатом/гексаном (30:70 об./об.) і одержували вказану в заголовку сполуку (279 г, 82%). ЯМР-спектр: (ДMCO-d6) δ 1,44 (s, 9H), 2,56 (m, 2H), 3,66 (m, 2H), 4,14 (m, 2Н), 5,13 (s, 2Н), 6,34 (m, 1H), 7,18 (m, 2Н), 7,33 (m, 1H), 7,40 (m, 4H), 7,54 (m, 2H), 7,62 (d, 2H), + 7,94 (d, 2H), 8,64 (br s, 1H), 9,81 (br s, 1H); Мас-спектр: MNa 550. Метод 3 Бензил 4-{[(трифторметил)сульфоніл]окси}-3,6-дигідропіридин-1(2H)-карбоксилат. Бензил 4-оксопіперидин-1-карбоксилат (147 г, 630 ммоль) розчиняли в тетрагідрофурані (500 мл), в атмосфері азоту. Цей розчин по краплях додавали протягом 2 годин, до перемішуваного розчину гексаметилдисилазиду літію (20% розчин у тетрагідрофурані, 556 мл, 662 ммоль) в атмосфері азоту, підтримуючи температуру реакції нижче -70 °C. Реакційній суміші дозволяли перемішуватися при -75 °C додатково протягом 1 години, потім по краплях знову додавали протягом 2 годин, розчин N-феніл-біс(трифторметансульфоніміду) (236 г, 661 ммоль) у тетрагідрофурані (950 мл), підтримуючи температуру реакції нижче -70 °C. Після цього реакції дозволяли нагрітися до кімнатної температури протягом ночі, потім порціями додавали 2М водний розчин гідроксиду натрію (800 мл). Шари розділяли й органічний шар промивали додатково 2М водним розчином гідроксиду натрію (600 мл), потім упарювали насухо. Отриману тверду речовину розчиняли в простому діетиловому ефірі й промивали водою. Потім органічний шар фільтрували через цілить, висушували над сульфатом натрію й упарювали насухо, одержуючи вказану в заголовку сполуку (140 г, 61%), яку використовували на наступній стадії без додаткового очищення. Метод 4 трет-Бутил {2-[(4-піперидин-4-ілбензоїл)аміно]феніл}карбамат (альтернативний метод) До трет-Бутил {2-[4-пірид-4-илбензоїл)аміно]феніл}карбамату (20 г, 51,35 ммоль; отриманому, як описано в методі 5А або 5В нижче), 10% паладію на вугіллі (3,17 г) і лимонній кислоті (4,75 г, 24,65 ммоль) додавали воду (80 мл) і ІРА (80 мл). Реакційну суміш поміщали в газоподібний водень під тиском 4 бар і нагрівали до 70 °C протягом 5 годин. Реакційну суміш охолоджували до 50 °C і фільтрували через шар целіту. Суміш нагрівали до 70 °C, потім додавали 20% мас/мас, водний розчин гідроксиду натрію (15 мл) протягом 10 хвилин до рН 1011. Додатково додавали воду (30 мл), потім суміш охолоджували до 40 °C протягом 1 години, після цього повторно нагрівали до 60 °C протягом 30 хвилин, потім знову охолоджували до температури навколишнього середовища. Отриманий осад збирали шляхом фільтрації, промивали водою (2×20 мл) і висушували у вакуумі при 50 °C, одержуючи вказану в заголовку сполуку (17,6 г, 84%). ЯМР-спектр: (ДМСО-d6) δ 1,45 (s, 9Н), 1,53 (m, 2Н), 1,70 (m, 2Н), 2,58 (m, 1Н), 2,66 (m, 2Н), 3,03 (m, 2Н), 3,31 (br s, 1Н), 7,17 (m, 2Н), 7,35 (d, 2Н), 7,54 (m, 2Н), 7,89 (d, 2Н), + 8,65 (br s, 1Н), 9,75 (br s, 1H). Мас-спектр: М+Н 396. Метод 5А трет-Бутил {2-[4-пірид-4-илбензоїл)аміно]феніл}карбамат 25 UA 98757 C2 5 10 15 20 25 До 4-(4-піридил)бензоату натрію (55,2 г, 236,2 ммоль), bос о-фенілен діаміну (45,7 г. 217,6 ммоль) і N-метилморфоліну (24 мл) в ацетонітрилі (300 мл) додавали екранований розчин 2хлор-4,6-диметокси-1,3,5-триазину (48,5 г, 270,5 ммоль) в ацетонітрилі (152 мл) протягом 3 годин. Суміш перемішували протягом 22 годин, потім додавали воду (460 мл). Отриманий осад збирали шляхом фільтрації, промивали 50% водним ацетонітрилом (3×100 мл) і висушували у вакуумі при 50 °C, одержуючи вказану в заголовку сполуку (75,6 г, 90%). ЯМР-спектр: (ДМСОd6): δ 1,45 (s, 9Н), 7,17 (m, 2Н), 7,56 (m, 2Н), 7,81 (d, 2H), 7,99 (d, 2H), 8,11 (d, 2H), 8,69 (d, 2H), + 9,94 (br s, 1H). Мас-спектр: М+Н 390. Метод 5В трет-Бутил {2-[4-пірид-4-илбензоїл)аміно]феніл}карбамат 4-(4-Піридил)бензоат натрію (10 г, 45,2 ммоль) в ацетонітрилі (60 мл) нагрівали до 70 °C, потім додавали тіонілхлорид (6,6 мл, 90,4 ммоль). Реакцію нагрівали при температурі флегми протягом 5 годин, потім охолоджували до температури навколишнього середовища. Обережно додавали триетиламін (12,6 мл, 90,4 ммоль), потім нагрітий розчин Вос о-фенілен діаміну (9,42 г, 45,2 ммоль) в ацетонітрилі (15 мл) протягом 10 хвилин. Додавали розчин гідроксиду натрію (8,6 г, 109 ммоль) у воді (60 мл) і отриману тверду речовину збирали шляхом фільтрації, промивали водою (20 мл) і висушували у вакуумі при 50 °C, одержуючи вказану в заголовку сполуку (12,6 г, 68%). ЯМР-спектр: (ДМСО-d6): δ 1,45 (s, 9Н), (7,17 (m, 2Н), 7,56 (m, 2Н), 7,81 (d, + 2H), 7,99 (d, 2Н), 8,11 (d, 2Н) 8,69 (d, 2Н), 9,94 (br s, 1Н). Мас-спектр: М+Н 390. Метод 6А трет-Бутил (2-{[4-(1-{1,3-диметил-1H-піразол-4-ілметил}піперидин-4іл)бензоїл]аміно}феніл)карбамат трет-Бутил 2-[(4-піперидин-4-ілбензоїл)аміно]фенілкарбамат (6,83 г, 17,3 ммоль) і 1,3диметил-1Н-піразол-4-карбальдегід (3,0 г, 24,2 ммоль) розчиняли в дихлорметані (150 мл). 26 UA 98757 C2 5 10 15 20 25 30 35 40 45 Потім додавали оцтову кислоту (996 мкл, 17,3 ммоль) і реакційній суміші дозволяли перемішуватися при кімнатній температурі протягом чотирьох годин. Після цього додавали триацетоксиборогідрид натрію (5,49 г, 25,9 ммоль) і реакційну суміш перемішували додатково протягом 18 годин. Потім обережно додавали насичений водний розчин бікарбонату натрію (300 мл), після цього дихлорметан (100 мл). Органічний шар відокремлювали й водний шар повторно екстрагували додатковою кількістю дихлорметану (150 мл). Об'єднані органічні екстракти висушували над сульфатом магнію, фільтрували й упарювали насухо. Отриманий залишок очищали за допомогою флеш-хроматографії на діоксиді кремнію, елююючи 5% (об./об.) розчин метанолу в дихлорметані, що потім підвищується градієнтом 5-10% (об./об.) метанол у дихлорметані, одержуючи прозору смолу, яку ресуспендували в простому діетиловому ефірі й упарювали насухо, одержуючи вказану в заголовку сполуку (7,61 г, 87 %). ЯМР-спектр: (ДМСОd6) δ 1,43 (s, 9H), 1,69 (m, 4Н), 1,98 (m, 2Н), 2,10 (s, 3Н), 2,56 (m, 1H), 2,92 (m, 2Н), 3,26 (s, 2Н), 3,70 (s, 3Н), 7,15 (m, 2Н), 7,40 (m, 3Н), 7,52 (m, 2Н), 7,87 (d, 2Н), 8,60 (s, 1Н), 9,73 (s, 1H). Мас+ спектр: М+Н 504. Метод 6В трет-Бутил (2-{[4-(1-{1,3-диметил-1H-піразол-4-ілметил}піперидин-4іл)бензоїл]аміно}феніл)карбамат трет-Бутил 2-[(4-піперидин-4-ілбензоїл)аміно]фенілкарбамат (отриманий, як описано в методі 4 вище; 108,1 г, 273,3 ммоль), 1,3-диметил-1Н-піразол-4-карбальдегід (35,6 г, 287 ммоль) і паладію на вугіллі (3,09 г, 1,37 ммоль) завантажували в підходящу посудину високого тиску. Завантажували тетрагідрофуран (920 мл), воду (54 мл) і оцтову кислоту (32,8 г, 546,7 ммоль) і перемішувану суміш нагрівали до 60 °C під тиском водню 3 бари до можливого завершення реакції. Потім суміш охолоджували до 40 °C і додавали 2 М розчин гідроксиду натрію (410 мл, 820 ммоль). Після охолодження до 25 °C, суміш фільтрували для видалення каталізатора, потім додавали тетрагідрофуран (650 мл) і органічну фазу відокремлювали. Органічну фазу частково концентрували шляхом перегонки, після цього додавали толуол (575 мл). Продовжували здійснювати перегонку, у той час як об'єм реакції підтримували шляхом подальшого додавання толуолу (690 мл). Реакційній суміші дозволяли охолонути до температури навколишнього середовища приблизно протягом 3 годин, при цьому продукт кристалізувався. Тверду речовину збирали шляхом фільтрації, промивали толуолом (460 мл), потім етилацетатом (230 мл), після цього висушували у вакуумі, при 45 °C до постійної ваги, одержуючи вказану в заголовку сполуку (114,9 г, 83%). Спектр: (ДМСО d6), δ 1,434 (s, 9Н), 1,70 (m, 4Н), 1,98 (m, 2Н), 2,11 (s, 3Н), 2,56 (m, 1Н), 2,93 (m, 2H), 3,28 (s, 2H), 3,71 (s, 3Н), 7,16 (m, 2H), 7,40 (m, 3Н), 7,52 (m, 2H), 7,87 + (d, 2H), 8,60 (s, 1H), 9,73 (s, 1H). Мас-спектр: М+Н 504. Метод 7 трет-Бутил {2-[(4-{1-[(1,5-диметил-1H-піразол-4-іл)метил]піперидин-4іл}бензоїл)аміно]феніл}карбамат 1,5-диметил-1Н-піразол-4-карбальдегід (114 мг, 0,92 ммоль) додавали до розчину третбутил 2-[(4-піперидин-4-ілбензоїл)аміно]фенілкарбамату (289 мг, 0,73 ммоль) у дихлорметані (6 мл), потім додавали оцтову кислоту (50 мкл, 0,87 ммоль). Реакційній суміші дозволяли перемішуватися в атмосфері азоту протягом 2,5 годин. Додавали триацетоксиборогідрид натрію (233 мг, 1,10 ммоль) і реакційній суміші дозволяли перемішуватися, при температурі навколишнього середовища, протягом 18 годин (протягом ночі). Після цього до реакції додавали насичений водний розчин бікарбонату натрію (10 мл) і дозволяли перемішуватися протягом 15 хвилин. Органічну фазу відокремлювали й водну фазу повторно екстрагували дихлорметаном (10 мл). Об'єднані органічні речовини промивали водою, висушували над сульфатом магнію й упарювали насухо, одержуючи продукт у вигляді безбарвної смоли (308 мг, + 84%), яку використовували без додаткового очищення; Мас-спектр: М+Н 504. 50 27 UA 98757 C2 ФОРМУЛА ВИНАХОДУ 1. Сполука формули (ІА) O N R3 3 2 N H 4 N 1 N 5 R5 H2 N R2 5 10 15 20 25 30 35 40 45 , (ІА) 3 5 де R , R і R незалежно вибирають із водню або метилу; або її фармацевтично прийнятна сіль. 2 3 5 2. Сполука за п. 1, де принаймні одна група, вибрана з R , R і R , не являє собою водень. 3. Сполука за п. 1, яка являє собою N-(2-амінофеніл)-4-{1-[(1-метил-1Н-піразол-4іл)метил]піперидин-4-іл}бензамід або його фармацевтично прийнятну сіль. 4. Сполука за п. 1, яка являє собою N(2-амінофеніл)-4-{1-[(1,3-диметил-1Н-піразол-4іл)метил]піперидин-4-іл}бензамід або його фармацевтично прийнятну сіль. 5. Сполука за п. 1, яка являє собою N-(2-амінофеніл)-4-{1-[(1,3,5-триметил-1H-піразол-4іл)метил]піперидин-4-іл}бензамід або його фармацевтично прийнятну сіль. 6. Сполука за п. 1, яка являє собою N-(2-амінофеніл)-4-{1-[(1,5-диметил-1H-піразол-4іл)метил]піперидин-4-іл}бензамід або його фармацевтично прийнятну сіль. 7. Фармацевтична композиція, яка має інгібуючу дію по відношенню до гістондеацетилази (HDAC), яка містить сполуку за будь-яким з пп. 1-6, або її фармацевтично прийнятну сіль, у сполученні з фармацевтично прийнятним розріджувачем або носієм. 8. Сполука за будь-яким з пп. 1-6, або її фармацевтично прийнятна сіль, для застосування як лікарського засобу, що має інгібуючу дію по відношенню до гістондеацетилази (HDAC). 9. Сполука за будь-яким з пп. 1-6, або її фармацевтично прийнятна сіль, для застосування для лікування злоякісного новоутворення. 10. Сполука за будь-яким з пп. 1-6, або її фармацевтично прийнятна сіль, для застосування для лікування раку легенів, раку прямої кишки, раку молочної залози, раку передміхурової залози, лімфоми та/або лейкозу. 11. Сполука за будь-яким з пп. 1-6, або її фармацевтично прийнятна сіль, для застосування для одержання інгібуючої дії по відношенню до HDAC у теплокровної тварини, такої як людина. 12. Спосіб одержання інгібуючої дії по відношенню до HDAC у теплокровної тварини, такої як людина, що потребує такого лікування, який включає введення вказаній тварині ефективної кількості сполуки за будь-яким з пп. 1-6. 13. Застосування сполуки за будь-яким з пп. 1-6, або її фармацевтично прийнятної солі, для приготування лікарського засобу для застосування для забезпечення інгібування клітинного циклу (дії, що пригнічує проліферацію клітин) у теплокровної тварини, такої як людина. 14. Спосіб інгібування клітинного циклу (пригнічення проліферації клітин) у теплокровної тварини, такої як людина, що потребує такого лікування, який включає введення вказаній тварині ефективної кількості сполуки за будь-яким з пп. 1-6, або її фармацевтично прийнятної солі. 15. Спосіб лікування злоякісного новоутворення в теплокровної тварини, такої як людина, що потребує такого лікування, який включає введення вказаній тварині ефективної кількості сполуки за будь-яким з пп. 1-6, або її фармацевтично прийнятної солі. 16. Застосування сполуки за будь-яким з п. 1-6, або її фармацевтично прийнятної солі, як визначено вище, для приготування лікарського засобу для застосування для лікування злоякісного новоутворення. 17. Спосіб одержання сполуки за п. 1, або її фармацевтично прийнятної солі, який включає стадії, на яких: (а) вводять у взаємодію сполуку формули (II) 2 O HN N H H2N , (II) у якій анілінова частина є придатно захищеною; зі сполукою формули (III) 28
ДивитисяДодаткова інформація
Назва патенту англійськоюBenzamide compounds useful as histone deacetylase inhibitors
Автори англійськоюAndrews, David, Michael, Stokes, Elaine Sophie Elizabeth, Turner, Andrew, Waring, Michael, James
Назва патенту російськоюБензамидные соединения, полезные как ингибиторы деацетилазы гистонов
Автори російськоюЭндрюс Девид Майкл, Стоукс Элайн Софи Элизабет, Тернер Эндрю, Веринг Майкл Джеймс
МПК / Мітки
МПК: A61K 31/454, A61P 35/00, C07D 401/06
Мітки: сполуки, деацетилази, інгібітори, гістонів, корисні, бензамідні
Код посилання
<a href="https://ua.patents.su/31-98757-benzamidni-spoluki-korisni-yak-ingibitori-deacetilazi-gistoniv.html" target="_blank" rel="follow" title="База патентів України">Бензамідні сполуки, корисні як інгібітори деацетилази гістонів</a>
Попередній патент: Антитіло, яке зв’язується з cd38, для лікування захворювання, опосередкованого cd38
Наступний патент: Спосіб селективного регулювання кристалізації поліморфної форми 1 мезотріону
Випадковий патент: Пристрій для дугового зварювання