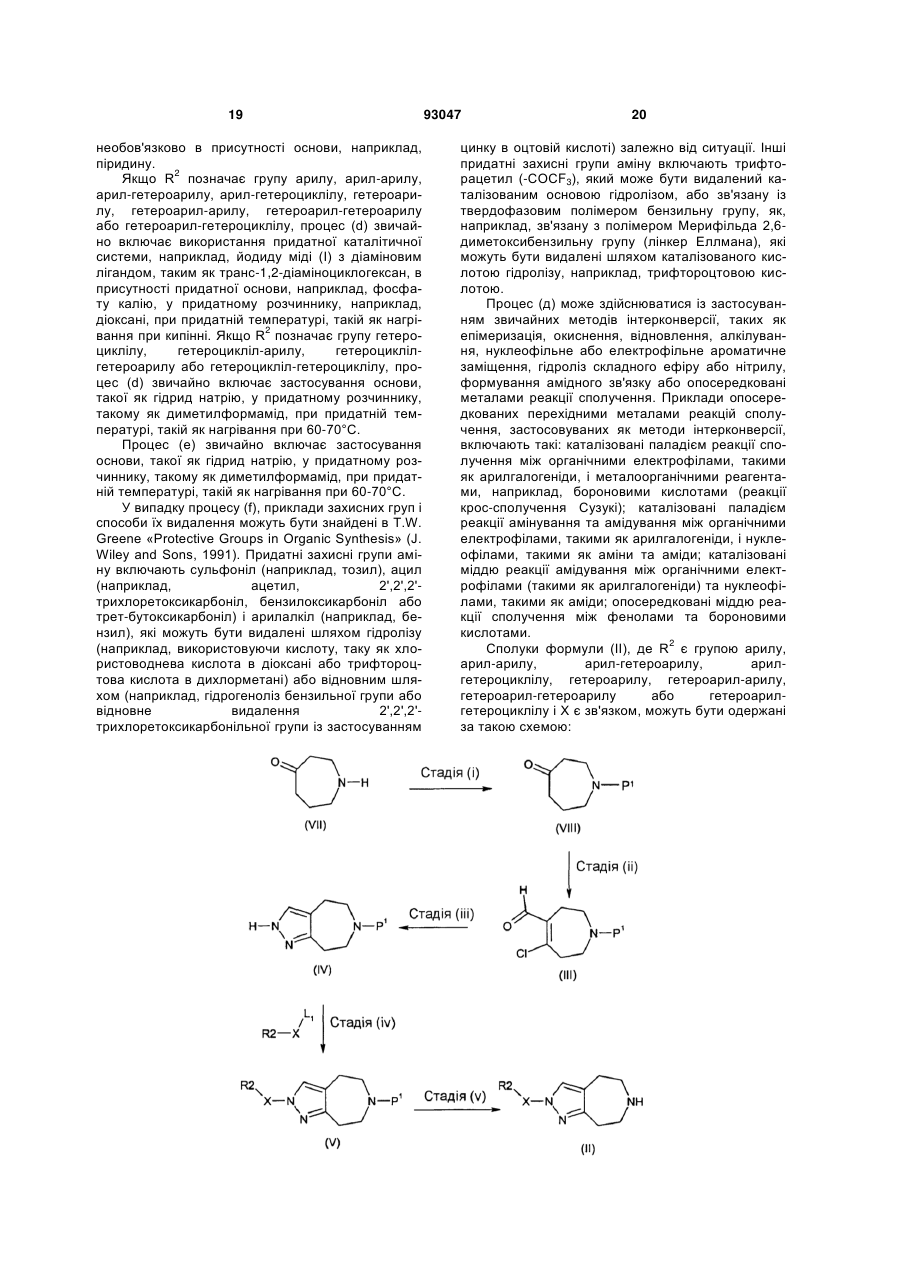
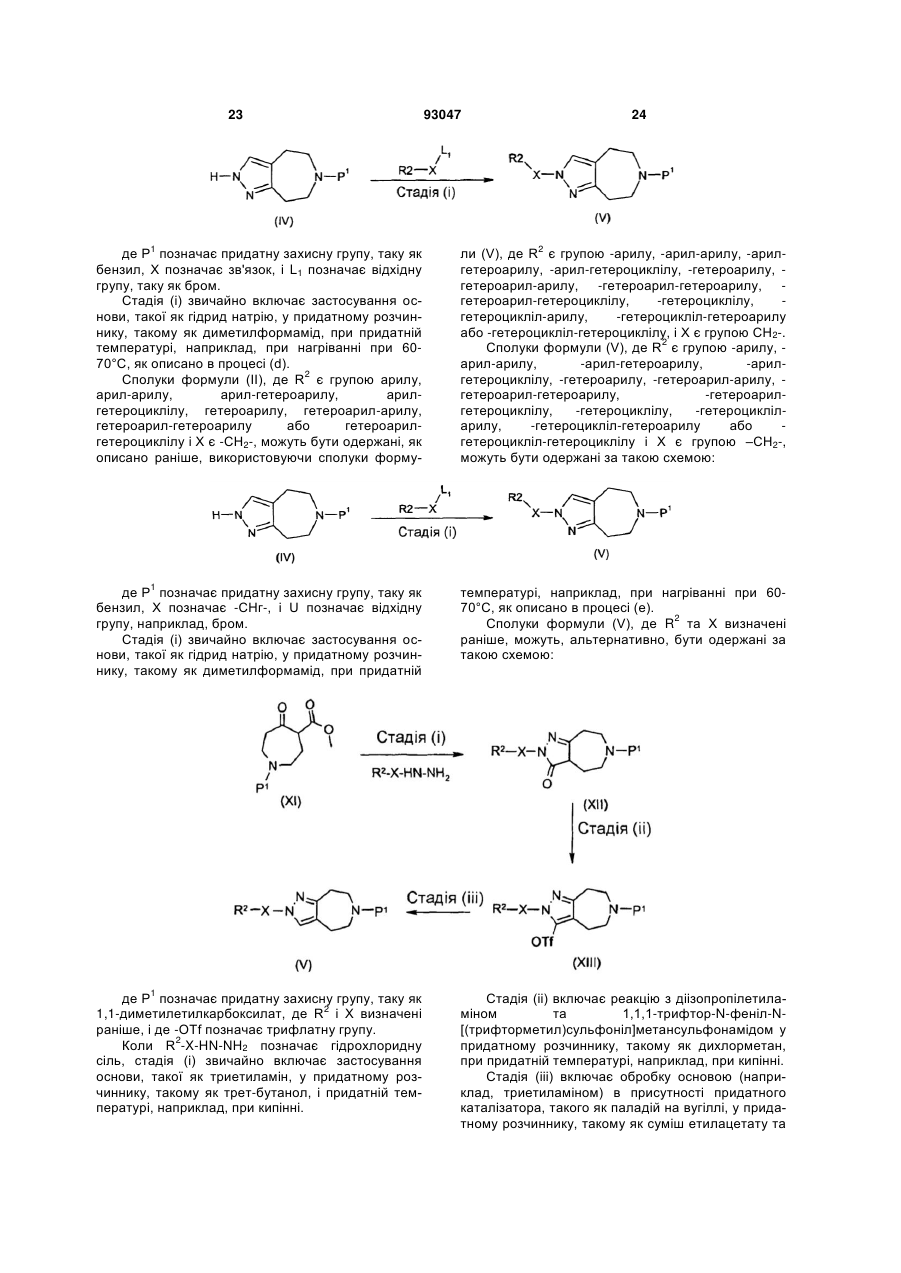
Похідні піразоло[3,4-d]азепіну як антагоністи н3-рецепторів гістаміну
Формула / Реферат
1. Сполука формули (І) або її фармацевтично прийнятна сіль:
 , (І)
, (І)
де
R1 означає -С1-6алкіл, -С3-7циклоалкіл або -СН2-С3-7циклоалкіл, де зазначені циклоалкільні групи можуть необов'язково бути заміщені С1-3алкілом;
Х означає зв'язок або -СН2-,
R2 означає -арил, -ариларил, -арилгетероарил, -арилгетероцикліл, -гетероарил, -гетероариларил, -гетероарилгетероарил, -гетероарилгетероцикліл, -гетероцикліл, -гетероцикліларил, -гетероциклілгетероарил або -гетероциклілгетероцикліл;
де зазначені арильні, гетероарильні та гетероциклільні групи R2 можуть необов'язково бути заміщені 1, 2 або 3 замісниками, які можуть бути однаковими чи різними і які вибирають із групи, що складається з галогену, гідрокси, ціано, нітро, =O, С1-6алкілу, галоген-С1-6алкілу, -О-галоген-С1-6алкілу, -О-С1-6алкілу, -С1-6алкіл-О-С1-6алкілу, -CO2R4, -COR4, -С1-6алкіл-COR4, -SR4, -SO2R4, -SOR4, -OSO2R4, -С1-6алкіл-SO2R4, -С1-6aлкiл-NR4SO2R5, -C1-6aлкiл-SO2NR4R5, -NR4R5, -C1-6aлкiл-NR4R5, -С3-8циклоалкіл-NR4R5, -CONR4R5, -NR4COR5, -C1-6aлкiл-NR4СOR5, -С1-6алкіл-СОNR4R5, -NR4SO2R5, -OCONR4R5, -NR4CO2R5, -NR6CONR4R5 та -SO2NR4R5 (де R4, R5 та R6 незалежно означають водень та С1-6алкіл, або де -NR4R5 може означати азотовмісну гетероциклільну групу); і
де R4, R5 та R6 можуть бути необов'язково заміщені 1, 2 або 3 замісниками, які можуть бути однаковими чи різними і які вибрані з групи, що складається з галогену, гідрокси, ціано, аміно, нітро та =O;
або її сольвати.
2. Сполука за п. 1, де Х означає зв'язок.
3. Сполука за п. 1 або 2, де R2 означає -арил, -арилгетероцикліл, -арилгетероарил, -гетероарилгетероцикліл або -гетероциклілгетероарил.
4. Сполука за п. 3, де R2 означає -арилгетероцикліл або -гетероарилгетероцикліл.
5. Сполука за будь-яким з попередніх пунктів, де замісники в арильних, гетероарильних або гетероциклільних груп R2 вибирають із галогену, гідрокси, ціано, нітро, =O, С1-6алкілу, галоген-С1-6алкілу, -О-галоген-С1-6алкілу, -О-С1-6алкілу, -SO2R4, -CONR4R5, -NR4COR5, -NR4SO2R5 та -SO2NR4R5.
6. Сполука за будь-яким з попередніх пунктів, де R4, R5 та R6 незалежно вибирають з водню та С1-3алкілу.
7. Сполука формули (І) або її фармацевтично прийнятна сіль або сольват за будь-яким з пп. 1-6, де:
R1 означає -C1-6алкіл, -С3-7циклоалкіл чи -СH2-С3-7циклоалкіл;
Х означає зв'язок;
R2 означає -арил, -арилгетероцикліл, -арилгетероарил, -гетероарилгетероцикліл чи -гетероциклілгетероарил;
де зазначені арильні, гетероарильні та гетероциклільні групи R2 можуть необов'язково бути заміщені 1, 2 чи 3 замісниками, які можуть бути однаковими або різними та які вибирають з групи, що складається з галогену, гідрокси, ціано, нітро, =O, С1-6алкілу, галогенС1-6алкілу, -О-галогенС1-6алкілу, -О-С1-6алкілу, -SO2R4, -CONR4R5, -NR4COR5, -NR4SO2R5 та -SO2NR4R5; та
де R4 та R5 незалежно вибрані з водню та С1-6алкілу.
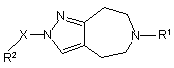
8. Сполука або сіль за п. 1, яка являє собою сполуку формули (Іа) або її фармацевтично прийнятну сіль або сольват:
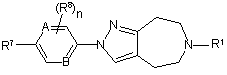 , (Ia)
, (Ia)
де: R1 означає -С1-6алкіл, -С3-7циклоалкіл або -СH2-С3-7циклоалкіл;
А та В незалежно означають СН або N;
R7 означає водень, гідрокси, галоген, ціано, нітро, С1-6алкіл, галогенС1-6алкіл, -О-галогенС1-6алкіл, -O-С1-6алкіл, -NR4aR5a, -CONR4aR5a, -NR4aCOR5a, -SO2R4a, -NR4aSO2R5a чи -SO2NR4aR5a,
де R4a та R5a незалежно означають водень чи C1-6алкіл, або де NR4aR5a може означати азотовмісну гетероциклільну групу, яка може бути необов'язково заміщена 1, 2 чи 3 замісниками, незалежно вибраними з =O та С1-3алкілу;
R8 означає гідрокси, галоген, ціано, нітро, C1-6алкіл, галогенС1-6алкіл, -O-галогенС1-6алкіл чи -O-С1-6алкіл; та
n означає 0 чи 1.
9. Сполука або сіль за п. 8, де А та В, обидва, означають СН.
10. Сполука або сіль за п. 8 або 9, де R7 означає -NR4aR5a чи -CONR4aR5a, де R4a та R5a незалежно означають водень чи С1-6алкіл, або де NR4aR5a означає азотовмісну гетероциклільну групу, яка може бути необов'язково заміщена 1, 2 чи 3 замісниками, незалежно вибраними з =O та С1-3алкілу.
11. Сполука або сіль за будь-яким з пп. 8, 9 або 10, де R4a та R5a незалежно означають водень чи С1-3алкіл.
12. Сполука або сіль за будь-яким з пп. 8, 9, 10 чи 11, де n означає 0.
13. Сполука за п. 1, яка вибрана з групи:
N,N-диметил-4-[6-(2-метилпропіл)-5,6,7,8-тетрагідропіразоло[3,4-d]азепін-2(4H)-іл]бензамід,
N,N-диметил-4-[6-(1-метилетил)-5,6,7,8-тетрагідропіразоло[3,4-d]азепін-2(4H)-іл]бензамід,
4-(6-циклобутил-5,6,7,8-тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл)-N,N-диметилбензамід,
4-(6-циклопентил-5,6,7,8-тетрагідропіразоло[3,4-d]азепін-2(4H)-іл)-N,N-диметилбензамід,
N-метил-4-[6-(2-метилпропіл)-5,6,7,8-тетрагідропіразоло[3,4-d]азепін-2(4H)-іл]бензамід,
N-метил-4-[6-(1-метилетил)-5,6,7,8-тетрагідропіразоло[3,4-d]азепін-2(4H)-іл]бензамід,
4-(6-циклобутил-5,6,7,8-тетрагідропіразоло[3,4-d]азепін-2(4H)-іл)-N-метилбензамід,
4-(6-циклопентил-5,6,7,8-тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл)-N-метилбензамід,
3-{4-[6-(1-метилетил)-5,6,7,8-тетрагідропіразоло[3,4-d]азепін-2(4H)-іл]феніл}-1,3-оксазолідин-2-он,
1-метил-3-{4-[6-(1-метилетил)-5,6,7,8-тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл]феніл}-2-імідазолідинон,
1-метил-3-{4-[6-(2-метилпропіл)-5,6,7,8-тетрагідропіразоло[3,4-d]азепін-2(4H)-іл]феніл}-2-імідазолідинон,
1-[5-(6-циклобутил-5,6,7,8-тетрагідропіразоло[3,4-d]азепін-2(4H)-іл)-2-піридиніл]-2-піролідинон,
1-[4-(6-циклобутил-5,6,7,8-тетрагідропіразоло[3,4-d]азепін-2(4H)-іл)феніл]-2-піролідинон,
1-{4-[6-(1-метилетил)-5,6,7,8-тетрагідропіразоло[3,4-d]азепін-2(4H)-іл]феніл}-2-піролідинон,
6-(1-метилетил)-2-[4-(3-метил-1,2,4-оксадіазол-5-іл)феніл]-2,4,5,6,7,8-гексагідропіразоло[3,4-d]азепін,
4-[6-(2-метилпропіл)-5,6,7,8-тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл]бензамід,
4-[6-(1-метилетил)-5,6,7,8-тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл]бензамід,
1-[4-(6-етил-5,6,7,8-тетрагідропіразоло[3,4-d]азепін-2(4H)-іл)феніл]-2-піролідинон,
1-{4-[6-(циклопропілметил)-5,6,7,8-тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл]феніл}-2-піролідинон,
1-{4-[6-(2-метилпропіл)-5,6,7,8-тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл]феніл}-2-піролідинон,
2-[4-(3-метил-1,2,4-оксадіазол-5-іл)феніл]-6-(2-метилпропіл)-2,4,5,6,7,8-гексагідропіразоло[3,4-d]азепін,
1-[4-(6-циклогексил-5,6,7,8-тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл)феніл]-2-піролідинон,
4-(6-циклопентил-5,6,7,8-тетрагідропіразоло[3,4-d]азепін-2(4H)-іл)бензамід,
1-[4-(6-циклопентил-5,6,7,8-тетрагідропіразоло[3,4-d]азепін-2(4H)-іл)феніл]-2-піролідинон,
6-циклобутил-2-[4-(3-метил-1,2,4-оксадіазол-5-іл)феніл]-2,4,5,6,7,8-гексагідропіразоло[3,4-d]азепін,
4-(6-циклобутил-5,6,7,8-тетрагідропіразоло[3,4-d]азепін-2(4H)-іл)бензамід,
6-циклопентил-2-[4-(3-метил-1,2,4-оксадіазол-5-іл)феніл]-2,4,5,6,7,8-гексагідропіразоло[3,4-d]азепін,
6-циклобутил-2-[4-(метилсульфоніл)феніл]-2,4,5,6,7,8-гексагідропіразоло[3,4-d]азепін,
N-[4-(6-циклобутил-5,6,7,8-тетрагідропіразоло[3,4-d]азепін-2(4H)-іл)феніл]метансульфонамід,
3-[4-(6-циклопентил-5,6,7,8-тетрагідропіразоло[3,4-d]азепін-2(4H)-іл)феніл]-1,3-оксазолідин-2-он,
1-[4-(6-циклопентил-5,6,7,8-тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл)феніл]-3-метил-2-імідазолідинон,
4-(6-циклобутил-5,6,7,8-тетрагідропіразоло[3,4-d]азепін-2(4H)-іл)бензонітрил,
4-[6-(2-метилпропіл)-5,6,7,8-тетрагідропіразоло[3,4-d]азепін-2(4H)-іл]бензонітрил,
4-[6-(1-метилетил)-5,6,7,8-тетрагідропіразоло[3,4-d]азепін-2(4H)-іл]бензонітрил,
2-(4-бромофеніл)-6-циклобутил-2,4,5,6,7,8-гексагідропіразоло[3,4-d]азепін,
1-[4-(6-циклобутил-5,6,7,8-тетрагідропіразоло[3,4-d]азепін-2(4H)-іл)феніл]-3-метил-2-імідазолідинон,
3-[4-(6-циклобутил-5,6,7,8-тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл)феніл]-1,3-оксазолідин-2-он,
3-[4-(6-циклобутил-5,6,7,8-тетрагідропіразоло[3,4-d]азепін-2(4H)-іл)феніл]-1-метил-2,4-імідазолідиндіон,
6-циклобутил-2-[4-(4-морфолініл)феніл]-2,4,5,6,7,8-гексагідропіразоло[3,4-d]азепін,
6-циклобутил-2-[4-(1-піперидиніл)феніл]-2,4,5,6,7,8-гексагідропіразоло[3,4-d]азепін,
6-циклобутил-2-[4-(1-піролідиніл)феніл]-2,4,5,6,7,8-гексагідропіразоло[3,4-d]азепін,
3-{4-[6-(2-метилпропіл)-5,6,7,8-тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл]феніл}-1,3-оксазолідин-2-он,
1-{5-[6-(1-метилетил)-5,6,7,8-тетрагідропіразоло[3,4-d]азепін-2(4H)-іл]-2-піридиніл}-2-піролідинон,
6-циклобутил-2-[1-(6-метил-3-піридиніл)-4-піперидиніл]-2,4,5,6,7,8-гексагідропіразоло[3,4-d]азепін,
6-циклобутил-2-феніл-2,4,5,6,7,8-гексагідропіразоло[3,4-d]азепін або
4-[(6-циклобутил-5,6,7,8-тетрагідропіразоло[3,4-d]азепін-2(4H)-іл)метил]бензонітрил;
або її фармацевтично прийнятна сіль.
14. Сполука за п. 1, яка являє собою:
N-метил-4-[6-(2-метилпропіл)-5,6,7,8-тетрагідропіразоло[3,4-d]азепін-2(4H)-іл]бензамід
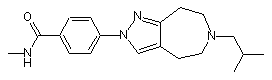 ,
,
або її фармацевтично прийнятна сіль.
15. Сполука за п. 1, яка являє собою:
N-метил-4-[6-(1-метилетил)-5,6,7,8-тетрагідропіразоло[3,4-d]азепін-2(4H)-іл]бензамід
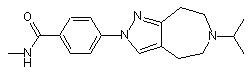 ,
,
або її фармацевтично прийнятна сіль.
16. Фармацевтична композиція, яка містить сполуку формули (І) за будь-яким з пп. 1-15 або її фармацевтично прийнятну сіль і фармацевтично прийнятний носій або допоміжну речовину.
17. Сполука за будь-яким з пп. 1-15 для застосування при лікуванні неврологічних захворювань.
18. Сполука формули (І) або її фармацевтично прийнятна сіль за будь-яким з пп. 1-15 для застосування як терапевтичної речовини при лікуванні або профілактиці когнітивних розладів при захворюванні.
19. Сполука або сіль за п. 18, для застосування як терапевтичної речовини при лікуванні або профілактиці когнітивних розладів при хворобі Альцгеймера або спорідненому нейродегенеративному розладі.
20. Застосування сполуки формули (І) або її фармацевтично прийнятної солі відповідно до будь-якого з пп. 1-15 при виробництві лікарського засобу для лікування неврологічних захворювань або психіатричних розладів.
21. Фармацевтична композиція для застосування при лікуванні неврологічних захворювань або психіатричних розладів, яка містить сполуку формули (І) або її фармацевтичну сіль відповідно до будь-якого з пп. 1-15 та її фармацевтично прийнятний носій.
22. Спосіб одержання сполуки формули (І) за п. 1 або її фармацевтично прийнятної солі, при якому здійснюють
(a) взаємодію сполуки формули (II)
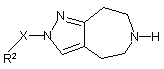 , (II)
, (II)
де Х та R2 визначені в п. 1, зі сполукою формули R1'=О, де R1' означає С1-6алкіл, С3-7-циклоалкіл або СН-С3-7циклоалкіл, де циклоалкільні групи можуть необов'язково бути заміщені С1-3-алкілом; або
(b) взаємодію сполуки формули (II)
 , (II)
, (II)
де Х та R2 визначені в п. 1,
зі сполукою формули
R1-L2,
де R1 визначений у п. 1, і де L2 є придатною відхідною групою, такою як галоген.
23. Спосіб одержання сполуки формули (І) за п. 1 або її фармацевтично прийнятної солі, при якому здійснюють
(c) взаємодію сполуки формули (VI)
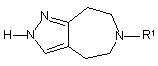 , (VI)
, (VI)
де R1 визначений у п. 1,
зі сполукою формули
R2-X-B(OH)2,
де R2 означає арил, ариларил, арилгетероарил, арилгетероцикліл, гетероарил, гетероариларил, гетероарилгетероарил або гетероарилгетероцикліл, і Х означає зв'язок; або
(d) взаємодію сполуки формули (VI)
 , (VI)
, (VI)
де R1 визначений у п. 1,
зі сполукою формули
R2-X-L1,
де R2 визначений у п. 1, Х означає зв'язок, і L1 є придатною відхідною групою, такою як галоген; або
(е) взаємодію сполуки формули (VI)
 , (VI)
, (VI)
де R1 визначений у п. 1,
зі сполукою формули
R2-X-L1,
де R2 визначений у п. 1, Х означає -CH2-, і L1 є придатною відхідною групою, такою як галоген.
24. Спосіб одержання сполуки формули (І) за п. 1 або її фармацевтично прийнятної солі, при якому здійснюють
(f) зняття захисних груп сполуки формули (І), яка є захищеною.
25. Спосіб одержання сполуки формули (І) за п. 1 або її фармацевтично прийнятної солі, при якому здійснюють
(g) інтерконверсію однієї сполуки формули (І) на іншу.
Текст
1. Сполука формули (І) або її фармацевтично прийнятна сіль: 2 (19) 1 3 A (R8) n N N R7 B 93047 N R1 , (Ia) де: R означає -С1-6алкіл, -С3-7циклоалкіл або -СH2С3-7циклоалкіл; А та В незалежно означають СН або N; R7 означає водень, гідрокси, галоген, ціано, нітро, С1-6алкіл, галогенС1-6алкіл, -О-галогенС1-6алкіл, -OС1-6алкіл, -NR4aR5a, -CONR4aR5a, -NR4aCOR5a, SO2R4a, -NR4aSO2R5a чи -SO2NR4aR5a, де R4a та R5a незалежно означають водень чи C14a 5a може означати азотовмісну 6алкіл, або де NR R гетероциклільну групу, яка може бути необов'язково заміщена 1, 2 чи 3 замісниками, незалежно вибраними з =O та С1-3алкілу; R8 означає гідрокси, галоген, ціано, нітро, C16алкіл, галогенС1-6алкіл, -O-галогенС1-6алкіл чи -OС1-6алкіл; та n означає 0 чи 1. 9. Сполука або сіль за п. 8, де А та В, обидва, означають СН. 10. Сполука або сіль за п. 8 або 9, де R7 означає NR4aR5a чи -CONR4aR5a, де R4a та R5a незалежно означають водень чи С1-6алкіл, або де NR4aR5a означає азотовмісну гетероциклільну групу, яка може бути необов'язково заміщена 1, 2 чи 3 замісниками, незалежно вибраними з =O та С1-3алкілу. 11. Сполука або сіль за будь-яким з пп. 8, 9 або 10, де R4a та R5a незалежно означають водень чи С13алкіл. 12. Сполука або сіль за будь-яким з пп. 8, 9, 10 чи 11, де n означає 0. 13. Сполука за п. 1, яка вибрана з групи: N,N-диметил-4-[6-(2-метилпропіл)-5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4H)-іл]бензамід, N,N-диметил-4-[6-(1-метилетил)-5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4H)-іл]бензамід, 4-(6-циклобутил-5,6,7,8-тетрагідропіразоло[3,4d]азепін-2(4Н)-іл)-N,N-диметилбензамід, 4-(6-циклопентил-5,6,7,8-тетрагідропіразоло[3,4d]азепін-2(4H)-іл)-N,N-диметилбензамід, N-метил-4-[6-(2-метилпропіл)-5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4H)-іл]бензамід, N-метил-4-[6-(1-метилетил)-5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4H)-іл]бензамід, 4-(6-циклобутил-5,6,7,8-тетрагідропіразоло[3,4d]азепін-2(4H)-іл)-N-метилбензамід, 4-(6-циклопентил-5,6,7,8-тетрагідропіразоло[3,4d]азепін-2(4Н)-іл)-N-метилбензамід, 3-{4-[6-(1-метилетил)-5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4H)-іл]феніл}1,3-оксазолідин-2-он, 1-метил-3-{4-[6-(1-метилетил)-5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл]феніл}-2імідазолідинон, 1-метил-3-{4-[6-(2-метилпропіл)-5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4H)-іл]феніл}-2імідазолідинон, 1-[5-(6-циклобутил-5,6,7,8-тетрагідропіразоло[3,4d]азепін-2(4H)-іл)-2-піридиніл]-2-піролідинон, 1-[4-(6-циклобутил-5,6,7,8-тетрагідропіразоло[3,4d]азепін-2(4H)-іл)феніл]-2-піролідинон, 1 4 1-{4-[6-(1-метилетил)-5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4H)-іл]феніл}-2піролідинон, 6-(1-метилетил)-2-[4-(3-метил-1,2,4-оксадіазол-5іл)феніл]-2,4,5,6,7,8-гексагідропіразоло[3,4d]азепін, 4-[6-(2-метилпропіл)-5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл]бензамід, 4-[6-(1-метилетил)-5,6,7,8-тетрагідропіразоло[3,4d]азепін-2(4Н)-іл]бензамід, 1-[4-(6-етил-5,6,7,8-тетрагідропіразоло[3,4d]азепін-2(4H)-іл)феніл]-2-піролідинон, 1-{4-[6-(циклопропілметил)-5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл]феніл}-2піролідинон, 1-{4-[6-(2-метилпропіл)-5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл]феніл}-2піролідинон, 2-[4-(3-метил-1,2,4-оксадіазол-5-іл)феніл]-6-(2метилпропіл)-2,4,5,6,7,8-гексагідропіразоло[3,4d]азепін, 1-[4-(6-циклогексил-5,6,7,8-тетрагідропіразоло[3,4d]азепін-2(4Н)-іл)феніл]-2-піролідинон, 4-(6-циклопентил-5,6,7,8-тетрагідропіразоло[3,4d]азепін-2(4H)-іл)бензамід, 1-[4-(6-циклопентил-5,6,7,8-тетрагідропіразоло[3,4d]азепін-2(4H)-іл)феніл]-2-піролідинон, 6-циклобутил-2-[4-(3-метил-1,2,4-оксадіазол-5іл)феніл]-2,4,5,6,7,8-гексагідропіразоло[3,4d]азепін, 4-(6-циклобутил-5,6,7,8-тетрагідропіразоло[3,4d]азепін-2(4H)-іл)бензамід, 6-циклопентил-2-[4-(3-метил-1,2,4-оксадіазол-5іл)феніл]-2,4,5,6,7,8-гексагідропіразоло[3,4d]азепін, 6-циклобутил-2-[4-(метилсульфоніл)феніл]2,4,5,6,7,8-гексагідропіразоло[3,4-d]азепін, N-[4-(6-циклобутил-5,6,7,8-тетрагідропіразоло[3,4d]азепін-2(4H)-іл)феніл]метансульфонамід, 3-[4-(6-циклопентил-5,6,7,8-тетрагідропіразоло[3,4d]азепін-2(4H)-іл)феніл]-1,3-оксазолідин-2-он, 1-[4-(6-циклопентил-5,6,7,8-тетрагідропіразоло[3,4d]азепін-2(4Н)-іл)феніл]-3-метил-2-імідазолідинон, 4-(6-циклобутил-5,6,7,8-тетрагідропіразоло[3,4d]азепін-2(4H)-іл)бензонітрил, 4-[6-(2-метилпропіл)-5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4H)іл]бензонітрил, 4-[6-(1-метилетил)-5,6,7,8-тетрагідропіразоло[3,4d]азепін-2(4H)-іл]бензонітрил, 2-(4-бромофеніл)-6-циклобутил-2,4,5,6,7,8гексагідропіразоло[3,4-d]азепін, 1-[4-(6-циклобутил-5,6,7,8-тетрагідропіразоло[3,4d]азепін-2(4H)-іл)феніл]-3-метил-2-імідазолідинон, 3-[4-(6-циклобутил-5,6,7,8-тетрагідропіразоло[3,4d]азепін-2(4Н)-іл)феніл]-1,3-оксазолідин-2-он, 3-[4-(6-циклобутил-5,6,7,8-тетрагідропіразоло[3,4d]азепін-2(4H)-іл)феніл]-1-метил-2,4імідазолідиндіон, 6-циклобутил-2-[4-(4-морфолініл)феніл]2,4,5,6,7,8-гексагідропіразоло[3,4-d]азепін, 6-циклобутил-2-[4-(1-піперидиніл)феніл]2,4,5,6,7,8-гексагідропіразоло[3,4-d]азепін, 6-циклобутил-2-[4-(1-піролідиніл)феніл]-2,4,5,6,7,8гексагідропіразоло[3,4-d]азепін, 5 93047 3-{4-[6-(2-метилпропіл)-5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл]феніл}1,3-оксазолідин-2-он, 1-{5-[6-(1-метилетил)-5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4H)-іл]-2піридиніл}-2-піролідинон, 6-циклобутил-2-[1-(6-метил-3-піридиніл)-4піперидиніл]-2,4,5,6,7,8-гексагідропіразоло[3,4d]азепін, 6-циклобутил-2-феніл-2,4,5,6,7,8гексагідропіразоло[3,4-d]азепін або 4-[(6-циклобутил-5,6,7,8-тетрагідропіразоло[3,4d]азепін-2(4H)-іл)метил]бензонітрил; або її фармацевтично прийнятна сіль. 14. Сполука за п. 1, яка являє собою: N-метил-4-[6-(2-метилпропіл)-5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4H)-іл]бензамід N O N N N H , або її фармацевтично прийнятна сіль. 15. Сполука за п. 1, яка являє собою: N-метил-4-[6-(1-метилетил)-5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4H)-іл]бензамід N O N N H N , або її фармацевтично прийнятна сіль. 16. Фармацевтична композиція, яка містить сполуку формули (І) за будь-яким з пп. 1-15 або її фармацевтично прийнятну сіль і фармацевтично прийнятний носій або допоміжну речовину. 17. Сполука за будь-яким з пп. 1-15 для застосування при лікуванні неврологічних захворювань. 18. Сполука формули (І) або її фармацевтично прийнятна сіль за будь-яким з пп. 1-15 для застосування як терапевтичної речовини при лікуванні або профілактиці когнітивних розладів при захворюванні. 19. Сполука або сіль за п. 18, для застосування як терапевтичної речовини при лікуванні або профілактиці когнітивних розладів при хворобі Альцгеймера або спорідненому нейродегенеративному розладі. 20. Застосування сполуки формули (І) або її фармацевтично прийнятної солі відповідно до будьякого з пп. 1-15 при виробництві лікарського засобу для лікування неврологічних захворювань або психіатричних розладів. 21. Фармацевтична композиція для застосування при лікуванні неврологічних захворювань або психіатричних розладів, яка містить сполуку формули (І) або її фармацевтичну сіль відповідно до будьякого з пп. 1-15 та її фармацевтично прийнятний носій. 22. Спосіб одержання сполуки формули (І) за п. 1 або її фармацевтично прийнятної солі, при якому здійснюють (a) взаємодію сполуки формули (II) 6 N X N N H R2 , (II) де Х та R2 визначені в п. 1, зі сполукою формули R1'=О, де R1' означає С1-6алкіл, С3-7-циклоалкіл або СН-С3-7циклоалкіл, де циклоалкільні групи можуть необов'язково бути заміщені С1-3-алкілом; або (b) взаємодію сполуки формули (II) N X N N H R2 , (II) де Х та R2 визначені в п. 1, зі сполукою формули R1-L2, де R1 визначений у п. 1, і де L2 є придатною відхідною групою, такою як галоген. 23. Спосіб одержання сполуки формули (І) за п. 1 або її фармацевтично прийнятної солі, при якому здійснюють (c) взаємодію сполуки формули (VI) N H N N R1 , (VI) де R1 визначений у п. 1, зі сполукою формули 2 R -X-B(OH)2, де R2 означає арил, ариларил, арилгетероарил, арилгетероцикліл, гетероарил, гетероариларил, гетероарилгетероарил або гетероарилгетероцикліл, і Х означає зв'язок; або (d) взаємодію сполуки формули (VI) N H N N R1 , (VI) де R1 визначений у п. 1, зі сполукою формули R2-X-L1, де R2 визначений у п. 1, Х означає зв'язок, і L1 є придатною відхідною групою, такою як галоген; або (е) взаємодію сполуки формули (VI) N H N N R1 , (VI) де R1 визначений у п. 1, зі сполукою формули R2-X-L1, де R2 визначений у п. 1, Х означає -CH2-, і L1 є придатною відхідною групою, такою як галоген. 24. Спосіб одержання сполуки формули (І) за п. 1 або її фармацевтично прийнятної солі, при якому здійснюють (f) зняття захисних груп сполуки формули (І), яка є захищеною. 7 93047 8 25. Спосіб одержання сполуки формули (І) за п. 1 або її фармацевтично прийнятної солі, при якому здійснюють (g) інтерконверсію однієї сполуки формули (І) на іншу. Даний винахід стосується нових похідних піразолу, які мають фармакологічну активність, способів їх одержання, композицій, що їх містять, та їх застосування при лікуванні неврологічних і психічних розладів. У WO 2004/05639 (Glaxo Group Ltd.) описаний ряд похідних бензазепінів та їх застосування при лікуванні неврологічних розладів. У WO 2004/013144 (Pharmacia Italia S.P.A.) розкритий ряд біциклопіразолів, що, як заявляють, є корисними при лікуванні захворювань, зв'язаних з порушенням регулювання протеїнкіназ. У WO 2004008837 та WO 200013508 (Ishihara Sangyo Kaisha Ltd.) розкриті похідні бензолу, що, як заявляють, є корисними як гербіциди. У JP 2001220390 описані похідні піразолу, які корисні як інгібітори кальцієвих каналів і продукції IL-2. НЗ-рецептор гістаміну краще експресується в центральній нервовій системі (ЦНС) ссавців, з мінімальною експресією в периферичних тканинах, за винятком деяких симпатичних нервів (Leurs et al., 1998, Trends Pharmacol. Sci. 19, 177-183). Активація НЗ-рецепторів селективними агоністами або гістаміном приводить до інгібування секреції нейромедіатору рядом різних популяцій нервових клітин, включаючи гістамінергічні та холінергічні нейрони (Schlicker et al., 1994, Fundam. Clin. Pharmacol., 8,128-137). Крім того, дослідження in vitro та in vivo показали, що НЗ-антагоністи можуть сприяти секреції нейромедіатору в областях головного мозку, таких як кора головного мозку та гіпокамп, необхідного для пізнання (Onodera et al., 1998, в «The Histamine H3 receptor», ed. Leurs and Timmerman, pp.255-267, Elsevier Science B.V.). Більше того, ряд повідомлень у літературі демонструє підвищення когнітивних властивостей, обумовлених антагоністами НЗ, (наприклад, тіоперамід, клобенпропіт, ципроксифан та GT-2331) на моделях гризунів, включаючи п'ять завдань вибору, розпізнавання об'єкта, підвищений хрестоподібний лабіринт, сприйнятливість нового завдання та пасивне уникнення (Giovanni et al., 1999, Behav. Brain Res. 104, 147-155). Зазначені дані припускають, що нові антагоністи та/або зворотні агоністи НЗ, як, наприклад, даних серій, можуть бути корисні при лікуванні когнітивних уражень при неврологічних захворюваннях, таких як хвороба Альцгеймера та родинні нейродегенеративні розлади. В першому аспекті даний винахід забезпечує сполуку формули (І) або її фармацевтично прийнятну сіль де R1 позначає -С1-6алкіл, -С3-7циклоалкіл або СН2-С3-7циклоалкіл, де зазначені циклоалкільні групи можуть необов'язково бути заміщені С13алкілом; X позначає зв'язки або -СН2-, R2 позначає -арил, -арил-арил, -арилгетероарил, -арил-гетероцикліл, -гетероарил, гетероарил-арил, -гетероарил-гетероарил, гетероарил-гетероцикліл, -гетероцикліл, гетероцикліл-арил, -гетероцикліл-гетероарил або гетероцикліл-гетероцикліл; де зазначені арильні, гетероарильні або гетероциклільні групи R2 можуть необов'язково бути заміщені одним чи більше замісниками (наприклад 1, 2 або 3), які можуть бути однаковими або різними і які можуть бути вибрані з групи, що складається з галогену, гідрокси, ціано, нітро, =О, С16алкілу, галоген-С1-6алкілу, -О-галоген-С1-6алкілу, С1-6алкілу, -С1-6-О-С1-6алкілу, -CO2R4, -COR4, -С14 4 4 4 4 6алкіл-COR , -SR , -SO2R , -SO , -OSO2R , -С14 4 5 -С1-6алкіл-NR SO2R , -С1-6алкіл6алкіл-SO2R , SO2NR4R5, -NR4R5, -С1-6алкіл-NR4R5, -С34 5 4 5 4 5 8циклоалкіл-NR R , -CONR R , -NR CO , -С1-6алкілNR4CO5, -С1-6алкіл-СОNR4R5, -NR4SO2R5, OCONR4R5, -NR4CO2R5, -NR6CONR4R5 або SO2NR4R5 (де R4, R5 та R6 незалежно позначають водень, С1-6алкіл або де -NR4R5 можуть позначати групу гетероциклу, що містить азот); і де R4, R5 та R6 можуть бути необов'язково заміщені одним чи більше замісниками (наприклад, 1, 2 або 3), які можуть бути однаковими чи різними і які можуть бути вибрані з групи, що складається з галогену, гідрокси, ціано, аміно, нітро та =О; або її сольвати. В одному аспекті R1 позначає -С3-7циклоалкіл, де циклоалкільна група може необов'язково бути заміщена С1-3-алкілом. Використовуваний тут термін «Сх-уалкіл» як група або частина групи стосується лінійної або розгалуженої насиченої вуглеводневої групи, що містить від χ до у атомів вуглецю. Приклади С16алкільних груп включають метил, етил, н-пропіл, ізопропіл, н-бутил, ізобутил, втор-бутил, третбутил, н-пентил, ізопентил, неопентил або гексил тощо. Використовуваний тут термін «Сх-уциклоалкіл» стосується насиченого моноциклічного вуглеводневого кільця з х-у атомами вуглецю. Приклади С3-7циклоалкільних груп включають циклопропіл, циклобутил, циклопентил, циклогексил і циклогептил. Використовуваний тут термін «галоген» стосується атома фтору, хлору, брому або йоду. (I) 9 Використовуваний тут термін «галоген-Схстосується Сх-Уалкільної групи, такої як визначена тут, де щонайменше один атом водню заміщений на галоген. Приклади галоген-С16алкільних груп включають фторетил, трифторметил або трифторетил тощо. Використовуваний тут термін «арил» стосується С6-12моноциклічного або біциклічного вуглеводневого кільця, де щонайменше одне кільце є ароматичним. Приклади таких груп включають феніл, нафтил або тетрагідронафталеніл тощо. В одному здійсненні винаходу термін «арил» стосується С6-12моноциклічного ароматичного кільця, зокрема, фенілу. Використовуваний тут термін «гетероарил» стосується 5-6-членного моноциклічного ароматичного або злитого 8-10-членного біциклічного ароматичного кільця, де моноциклічне або біциклічне кільце містить 1-4 гетероатоми, вибрані з кисню, азоту та сірки. Приклади таких моноциклічних ароматичних кілець включають тієніл, фурил, фуразаніл, піроліл, триазоліл, тетразоліл, імідазоліл, оксазоліл, тіазоліл, оксадіазоліл, ізотіазоліл, ізоксазоліл, тіадіазоліл, піраніл, піразоліл, піримідил, піридазиніл, піразиніл, піридил, триазиніл, тетразиніл тощо. Приклади таких злитих ароматичних кілець включають хінолініл, ізохінолініл, хіназолініл, хіноксалініл, птеридиніл, цинолініл, фталазиніл, нафтиридиніл, індоліл, ізоіндоліл, азаіндоліл, індолізиніл, індазоліл, пуриніл, піролопіридиніл, фуропіридиніл, бензофураніл, ізобензофураніл, бензотієніл, бензоімідазоліл, бензоксазоліл, бензоізоксазоліл, бензотіазоліл, бензоізотіазоліл, бензоксадіазоліл, бензотіадіазоліл тощо. В одному здійсненні винаходу термін «гетероарил» стосується 5-6-членного моноциклічного ароматичного кільця, що містить 1-4 гетероатоми, вибрані з кисню, азоту та сірки. Більш конкретно, термін «гетероарил» стосується 5-6-членного моноциклічного ароматичного кільця, що містить щонайменше один атом азоту, та інші 1-3 гетероатоми вибирають із кисню, азоту та сірки. Термін «гетероцикліл» стосується 4-7членного моноциклічного кільця або конденсованого 8-12-членного біциклічного кільця, що може бути насиченим або частково ненасиченим, де моноциклічне або біциклічне кільце містить 1-4 гетероатоми, вибрані з кисню, азоту та сірки. Приклади таких моноциклічних кілець включають піролідиніл, азетидиніл, піразолідиніл, оксазолідиніл, імідазолідиніл, піперидиніл, піперазиніл, морфолініл, тіоморфолініл, тіазолідиніл, гідантоїніл, валеролактаміл, оксираніл, оксетаніл, діоксоланіл, діоксаніл, оксатіоланіл, оксатіаніл, дитіаніл, дигідрофураніл, тетрагідрофураніл, дигідропіраніл, тетрагідропіраніл, тетрагідропіридиніл, тетрагідропіримідиніл, тетрагідротіофеніл, тетрагідротіопіраніл, діазепаніл, азепаніл тощо. Приклади таких біциклічних кілець включають індолініл, ізоіндолініл, бензопіраніл, хінуклідиніл, 2,3,4,5-тетрагідро1Н-С-бензазепін, тетрагідроізохінолініл тощо. У випадку одного здійснення винаходу термін «гетероцикліл» стосується 4-7-членного кільця, що може бути насиченим або частково ненасиченим, де моноциклічне кільце містить 1-4 гетероатоми, вибуалкіл» 93047 10 рані з кисню, азоту та сірки. Більш конкретно, термін «гетероцикліл» стосується групи гетероциклілу, що містить азот. Термін «гетероцикліл, що містить азот» стосується 4-7-членного моноциклічного кільця, що може бути насиченим або частково ненасиченим, де моноциклічне кільце містить щонайменше один атом азоту, а інші 1-3 гетероатоми вибирають із кисню, азоту та сірки. Приклади груп гетероциклілу, що містить азот, включають піролідиніл, азетидиніл, піразолідиніл, оксазолідиніл, імідазолідиніл, піперидиніл, піперазиніл, морфолініл, тіоморфолініл, тіазолідиніл, гідантоїніл, валеролактаміл, тетрагідропіридиніл, тетрагідропіримідиніл, діазепаніл, азепаніл тощо. У випадку одного здійснення винаходу R1 позначає -С3-7циклоалкіл (наприклад, циклобутил, циклопентил або циклогексил), де циклоалкільна група необов'язково заміщена С1-3алкілом. У більш конкретному варіанті здійснення винаходу R1 позначає незаміщений -С3-7циклоалкіл (наприклад, циклобутил, циклопентил або циклогексил), зокрема, незаміщений циклобутил. У випадку альтернативного варіанта здійснення винаходу R1 позначає -С1-6алкіл (наприклад, етил, 1-метилетил, 2-метилпропіл), зокрема, 1метилетил або 2-метилпропіл. У випадку іншого варіанта здійснення винаходу R1 позначає -СН2-С3-7циклоалкіл (наприклад, циклопропілметил), де циклоалкільна група необов'язково заміщена С1-3алкілом. Більш конкрет1 но, R позначає незаміщений -СН2-С3-7циклоалкіл, зокрема, циклопропілметил. У випадку іншого варіанта здійснення винаходу X позначає зв'язок або -СН2-. Більш конкретно, X позначає зв'язок. В одному варіанті здійснення винаходу R2 позначає -арил, -арил-гетероцикліл, -арилгетероарил, -гетероарил-гетероцикліл та гетероцикліл-гетероарил. У випадку більш конкретного варіанта здійснення винаходу арильні, гетероарильні та гетероциклільні групи R2 можуть необов'язково бути заміщені одним чи більше замісниками (наприклад, 1, 2 або 3), які можуть бути однаковими чи різними і які можуть бути вибрані з групи, що складається з галогену, гідрокси, ціано, нітро, =О, С1-6алкілу, галоген-С1-6алкілу, -О-галоген-С1-6алкілу, -С1-6алкілу, -SO2R4, -CONR4R5, -NR4CO5, -NR4SO2R5 або SO2NR4R5. Ще більш конкретно, замісники в груп арилу, гетероарилу або гетероциклілу R2 вибирають із галогену, гідрокси, ціано, нітро, =О, С16алкілу, -С1-6алкілу, галоген-С1-6алкілу, -О-галогенС1-6алкілу та -CONR4R5. В одному варіанті здійснення винаходу R4, R5 та R6 незалежно вибирають із водню та С1-6алкілу. У випадку більш конкретного варіанта здійснення винаходу R4, R5 та R6 незалежно вибирають із водню та С1-3алкілу. В інших здійсненнях винаходу R2 позначає -арил (наприклад, феніл), необов'язково заміщений одним чи більше замісниками (наприклад, 1, 2 або 3), такими як -CONR4R5 (наприклад, CONH2, -CONHMe, -CONMe2), -SO2R4 (наприклад, 11 -SO2Me), -NR4SO2R5 (наприклад, -NHSO2Me), ціано або галоген (наприклад, бром); -арил-гетероцикліл (наприклад, фенілпіролідиніл, феніл-оксазолідиніл, фенілімідазолідиніл, феніл-морфолініл, фенілпіперидиніл), необов'язково заміщений по групі гетероциклілу одним чи більше замісниками (наприклад, 1, 2 або 3), такими як групи =О та С16алкіл (наприклад, метил); -арил-гетероарил (наприклад, фенілоксадіазоліл), необов'язково заміщений одним чи більше замісниками (наприклад, 1, 2 або 3), такими як -С1-6алкіл (наприклад, метил); -гетероарил-гетероцикліл (наприклад, піридиніл-піролідиніл), необов'язково заміщений по групі гетероциклілу одним чи більше замісниками (наприклад, 1, 2 або 3), такими як групи =О; або -гетероцикліл-гетероарил (наприклад, піперидиніл-піридиніл), необов'язково заміщений одним чи більше замісниками (наприклад, 1, 2 або 3), такими як -С1-6алкіл (наприклад, метил). У варіантах здійснення винаходу, де R2 позначає -арил-гетероцикліл або -гетероарилгетероцикліл і група гетероциклілу позначає групу гетероциклілу, що містить азот, група гетероциклілу може бути зв'язана з арилом або гетероарилом через атом азоту. У більш конкретному варіанті здійснення винаходу, R2 позначає -арил (наприклад, феніл), необов'язково заміщений одним чи більше замісниками (наприклад, 4 5 1, 2 або 3), такими як -CONR R (наприклад, CONH2, -CONHMe, -CONMe2), -SO2R4 (наприклад, -SO2Me), -NR4SO2R5 (наприклад, -NHSO2Me), ціано або галоген (наприклад, бром); -арил-гетероцикліл (наприклад, фенілпіролідин-1-іл, феніл-1,3-оксазолідин-3-іл, фенілімідазолідин-3-іл, феніл-морфолін-4-іл, фенілпіперидин-1-іл), необов'язково заміщений по групі гетероциклілу одним чи більше (наприклад, 1, 2 або 3) замісниками, такими як групи =О (наприклад, -феніл-1-піролідин-2-он, -феніл-С-(1,3оксазолідин-2-он), -феніл-С-імідазолідин-2-он, феніл-С-імідазолідин-2,4-діон) і -С1-6алкіл (наприклад, метил); -арил-гетероарил (наприклад, феніл-1,2,4оксадіазол-5-іл), необов'язково заміщений одним чи більше замісниками (наприклад, 1, 2 або 3), такими як -С1-6алкіл (наприклад, метил); -гетероарил-гетероцикліл (наприклад, 2(піролідин-1-іл)піридин-5-іл), необов'язково заміщений по групі гетероциклілу одним чи більше замісниками (наприклад, 1, 2 або 3), такими як групи =О (наприклад, 2-(N-піролідин-2-он)піридин5-іл); або -гетероцикліл-гетероарил (наприклад, 1(піридин-3-іл)-піперидин-4-іл), необов'язково заміщений одним чи більше замісниками (наприклад, 1, 2 або 3), такими як -С1-6алкіл (наприклад, метил). Більш конкретно, R2 позначає -арил (наприклад, феніл), необов'язково заміщений одним чи більше замісниками (наприклад, 1, 2 або 3), такими як -CONR4R5 (наприклад, CONH2, -CONHMe, -CONMe2), -SO2R4 (наприклад, 93047 12 -SO2Me), NR4SO2R5 (наприклад, -NHSO2Me), ціано або галоген (наприклад, бром); -арил-гетероцикліл (наприклад, фенілпіролідин-1-іл, феніл-1,3-оксазолідин-3-іл, фенілімідазолідин-3-іл, феніл-морфолін-4-іл, фенілпіперидин-1-іл), необов'язково заміщений по групі гетероциклілу одним чи більше (наприклад, 1, 2 або 3) замісниками, такими як групи =О (наприклад, -феніл-1-піролідин-2-он, -феніл-С-(1,3оксазолідин-2-он), -феніл-С-імідазолідин-2-он, феніл-С-імідазолідин-2,4-діон) і С1-6алкіл (наприклад, метил); або -гетероарил-гетероцикліл (наприклад, 2(піролідин-1-іл)піридин-5-іл), необов'язково заміщений по групі гетероциклілу одним чи більше замісниками (наприклад, 1, 2 або 3), такими як групи =О (наприклад, 2-(N-піролідин-2-он)піридин5-іл). Найбільш конкретно, R2 позначає -арил-гетероцикліл (наприклад, фенілпіролідин-1-іл, феніл-1,3-оксазолідин-3-іл, фенілімідазолідин-3-іл, феніл-морфолін-4-іл, фенілпіперидин-1-іл), необов'язково заміщений по групі гетероциклілу одним чи більше (наприклад, 1, 2 або 3) замісниками, такими як групи =О (наприклад, -феніл-1-піролідин-2-он, -феніл-С-(1,3оксазолідин-2-он), -феніл-С-імідазолідин-2-он, феніл-С-імідазолідин-2,4-діон) і С1-6алкіл (наприклад, метил); або -гетероарил-гетероцикліл (наприклад, 2(піролідин-1-іл)піридин-5-іл), необов'язково заміщений по групі гетероциклілу одним чи більше замісниками (наприклад, 1, 2 або 3), такими як групи =О (наприклад, 2-(N-піролідин-2-он)піридин5-іл). В одному аспекті даний винахід забезпечує сполуку формули (І) або її фармацевтично прийнятну сіль чи сольват, де R1 позначає -С1-6алкіл, -С3-7циклоалкіл або СН2-С3-7циклоалкіл, де зазначені циклоалкільні групи можуть необов'язково бути заміщені С1-3алкілом; X позначає зв'язок або -СН2-, R2 позначає -арил, -арил-гетероарил, арилгетероарил, гетероарил-гетероцикліл та гетероцикліл-гетероарил; де зазначені групи арилу, гетероарилу та гетероциклілу R2 можуть необов'язково бути заміщені одним чи більше замісниками (наприклад, 1, 2 або 3), які можуть бути однаковими чи різними і які можуть бути вибрані з групи, що складається з галогену, гідрокси, ціано, нітро, =О, С1-6алкілу, галоген-С1-6алкілу, -О-галоген-С1-6алкілу, -С1-6алкілу, -SO2R4, -CONR4R5, -NR4CO5, -NR4SO2R5 або SO2NR4R5; і де R4 та R5 незалежно вибирають із водню та С1-6алкілу. В одному варіанті здійснення зазначеного аспекту винаходу R1 позначає -С3-7циклоалкіл (наприклад, циклобутил, циклопентил або циклогексил), зокрема, ненасичений циклобутил. У випадку альтернативного варіанта здійснення винаходу R1 позначає -С1-6алкіл (наприклад, етил, 1-метилетил, 2-метилпропіл), зокрема, 1метилетил або 2-метилпропіл. 13 У випадку іншого варіанта здійснення зазначеного аспекту винаходу R1 позначає -СН2-С37циклоалкіл, зокрема, циклопропілметил. У випадку одного варіанта здійснення зазначеного аспекту групи арилу, гетероарилу та гетероциклілу R2 можуть бути необов'язково заміщені одним чи більше замісниками (наприклад, 1, 2 або 3), які можуть бути однаковими чи різними і які можуть бути вибрані з групи, що складається з галогену, гідрокси, ціано, нітро, =О, С1-6алкілу, -С16алкілу, галоген-С1-6алкілу, -О-галоген-С1-6алкілу та -CONR4R5. У випадку одного варіанта здійснення зазначеного аспекту R4, R5 та R6 незалежно вибирають із водню та С1-6алкілу. В іншому варіанті здійснення зазначеного аспекту R2 позначає -арил (наприклад, феніл), необов'язково заміщений одним чи більше замісниками (наприклад, 1, 2 або 3), такими як -CONR4R5 (наприклад, CONH2, -CONHMe, -CONMe2), -SO2R4 (наприклад, -SO2Me), -NR4SO2R5 (наприклад, -NHSО2Me), ціано або галоген (наприклад, бром); -арил-гетероцикліл (наприклад, фенілпіролідиніл, феніл-оксазолідиніл, фенілімідазолідиніл, феніл-морфолініл, фенілпіперидиніл), необов'язково заміщений по групі гетероциклілу одним чи більше (наприклад, 1,2 або 3) замісниками, такими як групи =О та -С16алкіл (наприклад, метил); -арил-гетероарил (наприклад, фенілоксадіазоліл), необов'язково заміщений одним чи більше замісниками (наприклад, 1,2 або 3), такими як -С1-6алкіл (наприклад, метил); -гетероарил-гетероцикліл (наприклад, піридиніл-піролідиніл), необов'язково заміщений по групі гетероциклілу одним чи більше замісниками (наприклад, 1,2 або 3), такими як групи =О; або -гетероцикліл-гетероарил (наприклад, піперидиніл-піридиніл), необов'язково заміщений одним чи більше замісниками (наприклад, 1, 2 або 3), такими як -С1-6алкіл (наприклад, метил). У випадку варіантів здійснення, де R2 позначає -арил-гетероцикліл або -гетероарил-гетероцикліл і група гетероциклілу позначає групу гетероциклілу, що містить азот, група гетероциклілу може бути зв'язана з арилом або гетероарилом через атом азоту. У більш конкретному варіанті здійснення зазначеного аспекту R2 позначає -арил (наприклад, феніл), необов'язково заміщений одним чи більше замісниками (наприклад, 1, 2 або 3), такими як -CONR4R5 (наприклад, CONH2, -CONHMe, -CONMe2), -SO2R4 (наприклад, -SO2Me), NR4SO2R5 (наприклад, -NHSO2Me), ціано або галоген (наприклад, бром); -арил-гетероцикліл (наприклад, фенілпіролідин-1-іл, феніл-1,3-оксазолідин-3-іл, фенілімідазолідин-3-іл, феніл-морфолін-4-іл, фенілпіперидин-1-іл), необов'язково заміщений по групі гетероциклілу одним чи більше (наприклад, 1, 2 або 3) замісниками, такими як групи =О (наприклад, -феніл-1-піролідин-2-он, -феніл-С-(1,3оксазолідин-2-он), -феніл-С-імідазолідин-2-он, 93047 14 феніл-С-імідазолідин-2,4-діон) і -Сі-єалкіл (наприклад, метил); -арил-гетероарил (наприклад, феніл-1,2,4оксадіазол-5-іл), необов'язково заміщений одним чи більше замісниками (наприклад, 1,2 або 3), такими як -С1-6алкіл (наприклад, метил); -гетероарил-гетероцикліл (наприклад, 2(піролідин-1-іл)піридин-5-іл), необов'язково заміщений по групі гетероциклілу одним чи більше замісниками (наприклад, 1, 2 або 3), такими як групи =О (наприклад, 2-(N-піролідин-2-он)піридин5-іл); або -гетероцикліл-гетероарил (наприклад, 1(піридин-3-іл)-піперидин-4-іл), необов'язково заміщений одним чи більше замісниками (наприклад, 1, 2 або 3), такими як -С1-6алкіл (наприклад, метил). Більш конкретно, R2 позначає -арил (наприклад, феніл), необов'язково заміщений одним чи більше замісниками (наприклад, 1, 2 або 3), такими як -CONR4R5 (наприклад, CONH2, -CONHMe, -CONMe2), -SO2R4 (наприклад, -SO2Me), NR4SO2R5 (наприклад, -NHSO2Me), ціано або галоген (наприклад, бром); -арил-гетероцикліл (наприклад, фенілпіролідин-1-іл, феніл-1,3-оксазолідин-3-іл, фенілімідазолідин-3-іл, феніл-морфолін-4-іл, фенілпіперидин-1-іл), необов'язково заміщений по групі гетероциклілу одним чи більше (наприклад, 1, 2 або 3) замісниками, такими як групи =О (наприклад, -феніл-1-піролідин-2-он, -феніл-С-(1,3оксазолідин-2-он), -феніл-С-імідазолідин-2-он, феніл-С-імідазолідин-2,4-діон) і -С1-6алкіл (наприклад, метил); або -гетероарил-гетероцикліл (наприклад, 2(піролідин-1-іл)піридин-5-іл), необов'язково заміщений по групі гетероциклілу одним чи більше замісниками (наприклад, 1, 2 або 3), такими як групи =О (наприклад, 2-(N-піролідин-2-он)піридин5-іл). 2 Найбільш конкретно, R позначає -арил-гетероцикліл (наприклад, фенілпіролідин-1-іл, феніл-1,3-оксазолідин-3-іл, фенілімідазолідин-3-іл, феніл-морфолін-4-іл, фенілпіперидин-1-іл), необов'язково заміщений по групі гетероциклілу одним чи більше (наприклад, 1, 2 або 3) замісниками, такими як групи =О (наприклад, -феніл-1-піролідин-2-он, -феніл-С-(1,3оксазолідин-2-он), -феніл-С-імідазолідин-2-он, феніл-С-імідазолідин-2,4-діон) і -С1-6алкіл (наприклад, метил); або -гетероарил-гетероцикліл (наприклад, 2(піролідин-1-іл)піридин-5-іл), необов'язково заміщений по групі гетероциклілу одним чи більше замісниками (наприклад, 1, 2 або 3), такими як групи =О (наприклад, 2-(N-піролідин-2-он)піридин5-іл). У випадку більш конкретного аспекту даний винахід забезпечує сполуку формули (І) або її фармацевтично прийнятну сіль чи сольват, де R1 позначає -С1-6алкіл, -С3-7циклоалкіл або СН2-С3-7циклоалкіл; X позначає зв'язок; 15 93047 R2 позначає -арил, -арил-гетероцикліл, -арилгетероарил, -гетероарил-гетероцикліл та гетероцикліл-гетероарил; де зазначені групи арилу, гетероарилу та ге2 тероциклілу R можуть необов'язково бути заміщені одним чи більше замісниками (наприклад, 1, 2 або 3), які можуть бути однаковими чи різними і які можуть бути вибрані з групи, що складається з галогену, гідрокси, ціано, нітро, =O, С1-6алкілу, галоген-С1-6алкілу, -О-галоген-С1-6алкілу, -С1-6алкілу, -SO2R4, -CONR4R5, -NR4CO5, NR4SO2R5 або SO2NR4R5; і де R4 та R5 незалежно вибирають із водню та С1-6алкілу. У випадку іншого аспекту даний винахід забезпечує сполуку формули (І) або її фармацевтично прийнятну сіль чи сольват, де R1 позначає незаміщений -С3-7циклоалкіл; X позначає зв'язок; R2 позначає -арил, -арил-арил, -арилгетероарил, -арил-гетероцикліл, -гетероарил, гетероарил-арил, -гетероарил-гетероарил, гетероарил-гетероцикліл, -гетероцикліл, гетероцикліл-арил, -гетероцикліл-гетероарил або гетероцикліл-гетероцикліл; де зазначені групи арилу, гетероарилу та гетероциклілу R2 можуть необов'язково бути заміщені одним чи більше замісниками (наприклад, 1, 2 або 3), які можуть бути однаковими чи різними і які можуть бути вибрані з групи, що складається з галогену, гідрокси, ціано, нітро, =O, С1-6алкілу, С16алкокси, галоген-С1-6алкілу, галоген-С1-6алкокси та -CONR4R5; і де R4 та R5 незалежно вибирають із водню та С1-3алкілу. У випадку іншого аспекту даний винахід забезпечує сполуку формули (Іа) або її фармацевтично прийнятну сіль чи сольват, (Ia) де R1 позначає -С1-6алкіл, -С3-7циклоалкіл або СН2-С3-7циклоалкіл; А та В незалежно позначають СН або N; R7 позначає водень, гідрокси, галоген, ціано, нітро, С1-6алкіл, галоген-С1-6алкіл, -О-галоген-С1-С1-6алкіл, -NR4aR5a, -CONR4aR5a, 6алкіл, 4a 5a NR COR , -SO2R4a, -NR4aSO2R5a або 4a a 4a 5a SO2NR R5 , де R та R незалежно позначають водень або С1-6алкіл, або де NR4aR5a може бути групою гетероциклілу, що містить азот, яка може необов'язково бути заміщена одним чи більше (наприклад, 1, 2 або 3) замісниками, незалежно вибраними з =О та С1-3алкілу; R8 позначає гідрокси, галоген, ціано, нітро, С1алкіл, галоген-С1-6алкіл або -О-галоген-С1-6алкіл, 6 С1-6алкіл; і n позначає 0 або 1. В одному варіанті здійснення винаходу R1 позначає -С3-7циклоалкіл (наприклад, циклобутил, 16 циклопентил або циклогексил), зокрема, ненасичений циклобутил. У випадку альтернативного варіанта здійснення винаходу R1 позначає -С1-6алкіл (наприклад, етил, 1-метилетил, 2-метилпропіл), зокрема, 1метилетил або 2-метилпропіл. Більш конкретно, R1 позначає 1 -метилетил. У випадку альтернативного варіанта здійснення винаходу R1 позначає -СН2- С3-7цикло алкіл, зокрема, циклопропілметил. В одному варіанті здійснення винаходу А позначає N і В позначає СН. У випадку іншого варіанта здійснення винаходу А та В - обидва позначають СН. В одному варіанті здійснення винаходу R7 позначає водень, галоген, ціано, С1-6алкіл, галоген-С14a 5a 6алкіл, -О-галоген-С1-6алкіл, -С1-6алкіл, -NR R , 4a 5a 4a 4a 5a 4a CONR R , -SO2R або -NR SO2R , де R та R53 незалежно позначають водень або С1-6алкіл, або де NR4aR5a позначає групу гетероциклілу, що містить азот, яка може необов'язково бути заміщена одним чи більше (наприклад, 1, 2 або 3) замісниками, незалежно вибраними з =О та С1-3алкілу. У випадку більш конкретного варіанта здійснення винаходу R7 позначає -NR4aR5a або CONR4aR5a, де R4a та R5a незалежно позначають водень або С1-6алкіл, або де NR4aR5a позначає групу гетероциклілу, що містить азот, яка може необов'язково бути заміщена одним чи більше (наприклад, 1, 2 або 3) замісниками, незалежно вибраними з =О та С1-3алкілу. У випадку більш конкретного варіанта здійснення винаходу R4a та R5a незалежно позначають водень або С1-3алкіл. В іншому конкретному варіанті здійснення винаходу NR4aR5a позначає групу гетероциклілу, що містить азот, яка може необов'язково бути заміщена одним чи більше (наприклад, 1, 2 або 3) замісниками, незалежно вибраними з =О та С1-3алкілу. У ще більш конкретному варіанті здійснення 7 винаходу R позначає групу гетероциклілу, що містить азот, (наприклад, NR4aR5a), наприклад, групу піролідинілу, імідазолідинілу, оксазолідинілу, піперидинілу, морфолінілу, необов'язково заміщену одним чи більше (наприклад, 1, 2 або 3) замісниками, незалежно вибраними з =О та С1-3алкілу. Найбільш конкретно, R7 позначає піролідиніл, імідазолідиніл або оксазолідиніл, необов'язково заміщений одним чи більше (наприклад, 1, 2 або 3) замісниками, незалежно вибраними з =О та С1(наприклад, -N-піролідин-2-он, -N3алкілу оксазолідин-2-он або 3-метил-імідазолідин-2-он). В одному варіанті здійснення винаходу n позначає 0. Сполуки відповідно до винаходу включають приклади Е1-Е46, представлені нижче, або їх фармацевтично прийнятні солі або сольвати. Більш конкретно, сполуки відповідно до винаходу включають: 1-[5-(6-циклобутил-5,6,7,8тетрапдроп1разоло[3,4-d]азепiн-2(4Н)-іл)-2піридиніл]-2-піролідинон; 1-[4-(6-циклобутил-5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл)феніл]-2піролідинон; 17 1-{4-[6-метилетил-5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл]феніл}-2піролідинон; 1-[4-(6-циклобутил-5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл)феніл]-3метил-2-імідазолідинон; або 3-[4-(6-циклобутил-5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл)феніл]-1І3оксазолідин-2-он або їх фармацевтично прийнятну сіль чи сольват. В силу їх потенційного застосування в медицині, солі сполук формули (І) краще є фармацевтично прийнятними. Фармацевтично прийнятні солі приєднання кислоти можуть бути отримані при реакції сполуки формули (І) з придатною неорганічною або органічною кислотою (такою як бромистоводнева, хлористоводнева, сірчана, азотна, фосфорна, бурштинова, малеїнова, мурашина, оцтова, пропіонова, фумарова, лимонна, винна, молочна, бензойна, саліцилова, глутамінова, аспарагінова, птолуолсульфонова, бензолсульфонова, метансульфонова, етансульфонова, нафталенсульфонова, така як 2-нафталенсульфонова або гексанова кислота), необов'язково в придатному розчиннику, такому як органічний розчинник, з одержанням солі, що може бути виділена шляхом кристалізації та фільтрування. Фармацевтично прийнятні солі приєднання кислоти сполуки формули (І) можуть містити або бути, наприклад, сіль гідробромід, гідрохлорид, сульфат, нітрат, фосфат, сукцинат, малеат, форміат, ацетат, пропіонат, фумарат, цитрат, тартрат, лактат, бензоат, саліцилат, глутамат, аспартат, п-толуолсульфонат, бензолсульфонат, метансульфонат, етансульфонат, нафталенсульфонат (наприклад, 2-нафталенсульфонат) або гексаноат. Сполуки вільні основи можуть бути перетворені на відповідні гідрохлоридні солі шляхом обробки в метанолі або дихлорметані розчином хлороводню в діетиловому ефірі з наступним упарюванням розчинників. В об'єм винаходу також включені всі можливі стехіометричні та нестехіометричні форми солей сполук формули (І), включаючи гідрати та сольвати. Деякі сполуки формули (І) здатні існувати у вигляді стереоізомерів. Зрозуміло, що винахід також охоплює всі геометричні та оптичні ізомери зазначених сполук та їх суміші, включаючи рацемати. Різні стереоізомерні форми можуть бути розділені одна від одної методами, відомими з області техніки (наприклад, розділення за допомогою хіральної ВЕРХ), або будь-який даний ізомер може бути отриманий за допомогою стереоспецифічного або асиметричного синтезу. Винахід також охоплює будь-які таутомерні форми та їх суміші. Даний винахід також забезпечує спосіб одержання сполуки формули (І) або її фармацевтично прийнятної солі, де спосіб включає (a) взаємодію сполуки формули (II) 93047 18 (lI) де X та R2 визначені вище, зі сполукою формули R1'=O, де R1' позначає С1-6алкіл, С37циклоалкіл або -СН-С3-7циклоалкіл, де циклоалкільні групи можуть необов'язково бути заміщені С13-алкілом; або (b) взаємодію сполуки формули (II) (lI) де X та R2 визначені вище, зі сполукою формули R1-L2, де R1 визначений вище, і де L2 є придатною відхідною групою, такою як галоген (наприклад, йод); або (c) взаємодію сполуки формули (VI) (VI) де R1 визначений вище, зі сполукою формули R -X-B(OH)2, де R2 позначає арил, арил-арил, арил-гетероарил, арил-гетероцикліл, гетероарил, гетероарил-арил, гетероарил-гетероарил або гетероарил-гетероцикліл, і X позначає зв'язок; або (d) взаємодію сполуки формули (VI) 2 (VI) де R1 визначений вище, зі сполукою формули R2-X-L1, де R2 визначений вище, де X позначає зв'язок, і де L1 є придатною відхідною групою, такою як галоген (наприклад, бром); або (е) взаємодію сполуки формули (VI) (VI) де R1 визначений вище, зі сполукою формули R -X-L1, де R2 визначений вище, де X позначає СН2- і де L1 є придатною відхідною групою, такою як галоген (наприклад, бром); або (f) зняття захисних груп сполуки формули (І), що є захищеною; або (g) інтерконверсію однієї сполуки формули (І) на іншу. Процес (а) звичайно включає застосування відновних умов (таких як обробка боргідридом, наприклад, триацетоксиборгідридом натрію), необов'язково в присутності кислоти, такої як оцтова кислота, у придатному розчиннику, такому як дихлорметан, при придатній температурі, такій як кімнатна температура. Процес (b) має місце в придатному розчиннику, такому як етанол, необов'язково в присутності основи, такої як карбонат калію, при придатній температурі, такій як температура кипіння. Процес (с) звичайно включає застосування солі міді, такої як ацетат міді(ІІ), у придатному розчиннику, такому як дихлорметан, при придатній температурі, наприклад, кімнатній температурі, необов'язково в присутності молекулярних сит і 2 19 необов'язково в присутності основи, наприклад, піридину. Якщо R2 позначає групу арилу, арил-арилу, арил-гетероарилу, арил-гетероциклілу, гетероарилу, гетероарил-арилу, гетероарил-гетероарилу або гетероарил-гетероциклілу, процес (d) звичайно включає використання придатної каталітичної системи, наприклад, йодиду міді (І) з діаміновим лігандом, таким як транс-1,2-діаміноциклогексан, в присутності придатної основи, наприклад, фосфату калію, у придатному розчиннику, наприклад, діоксані, при придатній температурі, такій як нагрівання при кипінні. Якщо R2 позначає групу гетероциклілу, гетероцикліл-арилу, гетероциклілгетероарилу або гетероцикліл-гетероциклілу, процес (d) звичайно включає застосування основи, такої як гідрид натрію, у придатному розчиннику, такому як диметилформамід, при придатній температурі, такій як нагрівання при 60-70°С. Процес (e) звичайно включає застосування основи, такої як гідрид натрію, у придатному розчиннику, такому як диметилформамід, при придатній температурі, такій як нагрівання при 60-70°С. У випадку процесу (f), приклади захисних груп і способи їх видалення можуть бути знайдені в T.W. Greene «Protective Groups in Organic Synthesis» (J. Wiley and Sons, 1991). Придатні захисні групи аміну включають сульфоніл (наприклад, тозил), ацил (наприклад, ацетил, 2',2',2'трихлоретоксикарбоніл, бензилоксикарбоніл або трет-бутоксикарбоніл) і арилалкіл (наприклад, бензил), які можуть бути видалені шляхом гідролізу (наприклад, використовуючи кислоту, таку як хлористоводнева кислота в діоксані або трифтороцтова кислота в дихлорметані) або відновним шляхом (наприклад, гідрогеноліз бензильної групи або відновне видалення 2',2',2'трихлоретоксикарбонільної групи із застосуванням 93047 20 цинку в оцтовій кислоті) залежно від ситуації. Інші придатні захисні групи аміну включають трифторацетил (-СОСF3), який може бути видалений каталізованим основою гідролізом, або зв'язану із твердофазовим полімером бензильну групу, як, наприклад, зв'язану з полімером Мерифільда 2,6диметоксибензильну групу (лінкер Еллмана), які можуть бути видалені шляхом каталізованого кислотою гідролізу, наприклад, трифтороцтовою кислотою. Процес (д) може здійснюватися із застосуванням звичайних методів інтерконверсії, таких як епімеризація, окиснення, відновлення, алкілування, нуклеофільне або електрофільне ароматичне заміщення, гідроліз складного ефіру або нітрилу, формування амідного зв'язку або опосередковані металами реакції сполучення. Приклади опосередкованих перехідними металами реакцій сполучення, застосовуваних як методи інтерконверсії, включають такі: каталізовані паладієм реакції сполучення між органічними електрофілами, такими як арилгалогеніди, і металоорганічними реагентами, наприклад, бороновими кислотами (реакції крос-сполучення Сузукі); каталізовані паладієм реакції амінування та амідування між органічними електрофілами, такими як арилгалогеніди, і нуклеофілами, такими як аміни та аміди; каталізовані міддю реакції амідування між органічними електрофілами (такими як арилгалогеніди) та нуклеофілами, такими як аміди; опосередковані міддю реакції сполучення між фенолами та бороновими кислотами. Сполуки формули (II), де R2 є групою арилу, арил-арилу, арил-гетероарилу, арилгетероциклілу, гетероарилу, гетероарил-арилу, гетероарил-гетероарилу або гетероарилгетероциклілу і X є зв'язком, можуть бути одержані за такою схемою: 21 93047 22 де Р1 позначає придатну захисну групу, таку як бензил, X позначає зв'язок, і L1 позначає придатну відхідну групу, наприклад, бром. Коли Р1 позначає бензил, стадія (і) включає взаємодію сполуки формули (VII) з бензальдегідом. Реакція звичайно включає застосування відновних умов (таких як обробка боргідридом, наприклад, триацетоксиборгідридом натрію), необов'язково в присутності основи (наприклад, триетиламіну) у придатному розчиннику, такому як дихлорметан, при придатній температурі, такій як між 70°С і кімнатною температурою. Стадія (іі) звичайно має місце а присутності хлорокису фосфору та диметилформаміду при придатній температурі, такій як між 70°С і кімнатною температурою. Стадія (ііі) звичайно включає реакцію циклізації з гідразином (наприклад, гідразингідратом) у придатному розчиннику, наприклад, етанолі, при придатній температурі, наприклад, кипінні, з необов'язковим додаванням каталітичних кількостей кислоти, такої як водна хлористоводнева кислота. Слід брати до уваги, що до реакції циклізації сполука формули (II) може піддаватися реакції з гідроксиламіна хлоргідратом у придатному розчиннику, такому як етанол, при придатній температурі, такій як кімнатна температура, з утворенням відповідного оксиму. Стадія (iv) звичайно включає застосування придатної каталітичної системи, наприклад, йодиду міді(І) з діаміновим лігандом, таким як транс1,2-діаміноциклогексан, в присутності придатної основи, наприклад, фосфату калію, у придатному розчиннику, наприклад, діоксані, при придатній температурі, наприклад, нагріванні до кипіння, як описано в процесі (d). Стадія (ν) позначає реакцію видалення захисних груп. Коли Р1 позначає бензил, стадія (ν) може здійснюватися із застосуванням придатного каталізатора, наприклад, паладію на вугіллі, у придат ному розчиннику, такому як етанол, під тиском водню, наприклад, одній атмосфері водню. Коли Р1 позначає 1,1диметилетилкарбоксилат, сполука формули (IV) може, альтернативно, бути одержана за такою схемою: де Р1 позначає придатну захисну групу, таку як бензил, і група R2-Х-В(ОН)2 позначає арил або гетероарилборонову кислоту (наприклад, X позначає зв'язок). Стадія (і) звичайно включає застосування солі міді, такої як ацетат міді(ІІ), у придатному розчиннику, такому як дихлорметан, при придатній температурі, наприклад, кімнатній температурі, необов'язково в присутності молекулярних сит і необов'язково в присутності основи, наприклад, піридину, як описано раніше для процесу (с). 2 Сполуки формули (II), де R позначає групу гетероциклілу, гетероцикліл-арилу, гетероцикліл гетероарилу або гетероцикліл-гетероциклілу, і X позначає зв'язок, можуть бути одержані як описано раніше, використовуючи сполуки формули (V), де R2 позначає групу гетероциклілу, гетероцикліларилу, гетероцикліл-гетероарилу або гетероцикліл-гетероциклілу, і X позначає зв'язок. Сполуки формули (V), де R2 позначає групу гетероциклілу, гетероцикліл-арилу, гетероциклілгетероарилу або гетероцикліл-гетероциклілу і X позначає зв'язок, можуть бути одержані за такою схемою: Стадія (і) звичайно включає реакцію діізопропіламіду літію та етилформіату в придатному розчиннику, такому як тетрагідрофуран, при придатній температурі, такій як кімнатна температура, з наступною реакцією циклізації з гідразином (наприклад, гідразингідратом), необов'язково, в присутності кислоти, у придатному розчиннику, такому як етанол, при придатній температурі, наприклад, кипінні. Сполуки формули (II) можуть бути одержані зі сполук формули (IV), одержаних із застосуванням зазначеної захисної групи. Однак, як буде очевидно кваліфікованому читачеві, коли Р1 позначає 1,1диметилетилкарбоксилат, реакція зняття захисної групи може здійснюватися при обробці трифтороцтовою кислотою в дихлорметані або 4М НСІ у діоксані при придатній температурі, такій як кімнатна температура. Сполуки формули (V), де R2 є групою арилу, арил-арилу, арил-гетероарилу, арилгетероциклілу, гетероарилу, гетероарил-арилу, гетероарил-гетероарилу або гетероарилгетероциклілу і X є зв'язком, можуть бути одержані за такою схемою: 23 93047 24 де Р1 позначає придатну захисну групу, таку як бензил, X позначає зв'язок, і L1 позначає відхідну групу, таку як бром. Стадія (і) звичайно включає застосування основи, такої як гідрид натрію, у придатному розчиннику, такому як диметилформамід, при придатній температурі, наприклад, при нагріванні при 6070°С, як описано в процесі (d). Сполуки формули (II), де R2 є групою арилу, арил-арилу, арил-гетероарилу, арилгетероциклілу, гетероарилу, гетероарил-арилу, гетероарил-гетероарилу або гетероарилгетероциклілу і X є -СН2-, можуть бути одержані, як описано раніше, використовуючи сполуки форму ли (V), де R2 є групою -арилу, -арил-арилу, -арилгетероарилу, -арил-гетероциклілу, -гетероарилу, гетероарил-арилу, -гетероарил-гетероарилу, гетероарил-гетероциклілу, -гетероциклілу, гетероцикліл-арилу, -гетероцикліл-гетероарилу або -гетероцикліл-гетероциклілу, і X є групою СН2-. Сполуки формули (V), де R2 є групою -арилу, арил-арилу, -арил-гетероарилу, -арилгетероциклілу, -гетероарилу, -гетероарил-арилу, гетероарил-гетероарилу, -гетероарилгетероциклілу, -гетероциклілу, -гетероцикліларилу, -гетероцикліл-гетероарилу або гетероцикліл-гетероциклілу і X є групою –СН2-, можуть бути одержані за такою схемою: де Р1 позначає придатну захисну групу, таку як бензил, X позначає -СНг-, і U позначає відхідну групу, наприклад, бром. Стадія (і) звичайно включає застосування основи, такої як гідрид натрію, у придатному розчиннику, такому як диметилформамід, при придатній температурі, наприклад, при нагріванні при 6070°С, як описано в процесі (e). Сполуки формули (V), де R2 та X визначені раніше, можуть, альтернативно, бути одержані за такою схемою: де Р1 позначає придатну захисну групу, таку як 1,1-диметилетилкарбоксилат, де R2 і X визначені раніше, і де -OTf позначає трифлатну групу. Коли R2-X-HN-NH2 позначає гідрохлоридну сіль, стадія (і) звичайно включає застосування основи, такої як триетиламін, у придатному розчиннику, такому як трет-бутанол, і придатній температурі, наприклад, при кипінні. Стадія (іі) включає реакцію з діізопропілетиламіном та 1,1,1-трифтор-N-феніл-N[(трифторметил)сульфоніл]метансульфонамідом у придатному розчиннику, такому як дихлорметан, при придатній температурі, наприклад, при кипінні. Стадія (ііі) включає обробку основою (наприклад, триетиламіном) в присутності придатного каталізатора, такого як паладій на вугіллі, у придатному розчиннику, такому як суміш етилацетату та 25 93047 26 метанолу, при придатній температурі, такій як кімнатна температура, під тиском водню, наприклад, одній атмосфері водню. Сполуки формули (VI) можуть бути одержані за такою схемою, де Р1 позначає придатну захисну групу, таку як бензил: Стадія (і) є реакцією видалення захисної групи. Коли Р1 є бензилом, стадія (і) може здійснюватися із застосуванням придатного каталізатора, наприклад, паладію на вугіллі, у придатному розчиннику, такому як етанол, під тиском водню, наприклад, одній атмосфері водню. Стадія (іі) може проводитися, як описано раніше у випадку процесу (а). Сполуки формули (VII) та (XI) можуть бути одержані, як описано в Synthetic Communications, 1992, 22(9), 1249-58. Сполуки формули (III) можуть бути одержані відповідно до DE3105858. Сполуки формули (X), R1'=O, R1-L2, R2-XB(OH)2 (де X позначає зв'язок), R2-X-L1 (де X позначає зв'язок або -СН2-) і R2-X-HN-NH2 (де X та R2 визначені раніше) або є комерційно доступними, або можуть бути одержані з комерційно доступних сполук із застосуванням стандартної методології. Сполуки формули (І) та їх фармацевтично прийнятні солі виявляють афінітет та є антагоністами та/або зворотними агоністами рецептора гістаміну НЗ і, як вважають, мають потенційне застосування при лікуванні неврологічних захворювань, включаючи хворобу Альцгеймера, деменцію (включаючи деменцію з тільцями Леві та васкулярну деменцію), вікову дисфункцію пам'яті, легке когнітивне порушення, когнітивний розлад, епілепсію, біль неврологічного походження, включаючи невралгію, неврит і біль у спині та біль при запальному процесі, включаючи остеоартрит, ревматоїдний артрит, біль при гострому запальному процесі та біль у спині, мігрень, хвороба Паркінсона, розсіяний склероз, інсульт і порушення сну (включаючи нарколепсію та недолік сну, зв'язаний із хворобою Паркінсона); психічні розлади, включаючи шизофренію (зокрема, когнітивний розлад при шизофренії), синдром дефіциту уваги з гіперактивністю, депресію, неспокій і пристрасть; та інші захворювання, включаючи ожиріння та шлунковокишкові розлади. Слід також взяти до уваги, що сполуки формули (І), як очікують, є селективними стосовно гістамінових рецепторів НЗ у порівнянні з іншими підтипами гістамінових рецепторів, таких як рецептор гістаміну Н1. Загалом, сполуки за винаходом можуть бути щонайменше в 10 разів більш селектив ними для НЗ відносно Н1, наприклад, щонайменше в 100 разів більш селективними. Таким чином, винахід також забезпечує сполуку формули (І) або її фармацевтично прийнятну сіль для застосування як терапевтичної речовини при лікуванні або профілактиці згаданих вище розладів, зокрема, когнітивних розладів при захворюваннях, таких як хвороба Альцгеймера та родинні нейродегенеративні розладу. Винахід додатково забезпечує спосіб лікування або профілактики згаданих вище розладів у ссавців, включаючи людину, який включає введення пацієнтові терапевтично ефективної кількості сполуки формули (І) або її фармацевтично прийнятної солі. В іншому аспекті винахід забезпечує застосування сполуки формули (І) або її фармацевтично прийнятної солі при виробництві лікарського засобу для застосування при лікуванні згаданих вище розладів. У випадку використання в терапії сполуки формули (І) звичайно складають у стандартні фармацевтичні композиції. Такі композиції можуть бути одержані із застосуванням стандартних методів. Таким чином, даний винахід додатково забезпечує фармацевтичну композицію для застосування при лікуванні згаданих раніше розладів, яка містить сполуку формули (І) або її фармацевтично прийнятну сіль і фармацевтично прийнятний носій. Даний винахід додатково забезпечує фармацевтичну композицію, яка містить сполуку формули (І) або її фармацевтично прийнятну сіль та фармацевтично прийнятний носій. Сполуки формули (І) можуть застосовуватися в комбінації з іншими терапевтичними агентами, наприклад, лікарськими засобами, як стверджують, корисними як або модифікуюча, або симптоматична терапія хвороби Альцгеймера. Придатними прикладами таких інших терапевтичних агентів можуть бути агенти, про які відомо, що вони модифікують холінергічну передачу, такі як антагоністи 5-НТ6, М1-агоністи мускарину, М2антагоністи мускарину або інгібітори ацетилхолінестерази. Коли сполуки застосовуються в комбінації з іншими терапевтичними агентами, сполуки 27 можуть бути введені або послідовно, або одночасно будь-яким зручним способом. Таким чином, винахід забезпечує, у додатковому аспекті, комбінацію, яка містить сполуку формули (І) або її фармацевтично прийнятне похідне разом з додатковим терапевтичним агентом або агентами. Згадані вище комбінації можуть зручно бути надані для застосування у вигляді фармацевтичних рецептур, і в такий спосіб фармацевтичні рецептури, що містять комбінації, як визначено раніше, разом з фармацевтично прийнятним носієм або наповнювачем, складають додатковий аспект винаходу. Індивідуальні компоненти таких комбінацій можуть бути введені або послідовно, або одночасно в окремій або комбінованій фармацевтичній рецептурах. Коли сполука формули (І) або її фармацевтично прийнятне похідне використовують у комбінації з другим терапевтичним агентом, активним у відношенні того ж стану захворювання, доза кожної сполуки може відрізнятися від такої у випадку, коли сполука застосовується окремо. Придатні дози можуть бути легко оцінені фахівцем в області техніки. Фармацевтична композиція за винаходом, яка може бути одержана шляхом змішування, відповідно, при температурі навколишнього середовища та атмосферному тиску, звичайно є придатною для перорального, парентерального або ректального введення і, по суті, може мати форму таблеток, капсул, рідких пероральних препаратів, порошків, гранул, пастилок, відновлюваних порошків, ін'єкційних або інфузійних розчинів чи суспензій, або супозиторіїв. У більшості випадків кращим є пероральне введення композицій. Таблетки та капсули для перорального введення можуть мати вигляд одиничної дози та можуть містити традиційні допоміжні речовини, такі як зв'язуючі агенти, наповнювачі, змащувальні речовини при таблетуванні, дезінтегратори та прийнятні зволожуючі агенти. Таблетки можуть бути покриті відповідно до методів, добре відомих у звичайній фармацевтичній практиці. Пероральні рідкі препарати можуть мати вигляд, наприклад, водної або масляної суспензії, розчинів, емульсій, сиропів або еліксирів, або можуть мати вигляд сухого продукту для розведення у воді чи іншому придатному носії перед застосуванням. Такі рідкі препарати можуть містити традиційні добавки, такі як суспендувальні агенти, емульгувальні агенти, неводні носії (які можуть включати харчові масла), консерванти і, якщо необхідно, традиційні ароматизатори або консерванти. У випадку парентерального введення, рідкі стандартні лікарські форми одержують, використовуючи сполуку за винаходом або її фармацевтично прийнятну сіль і стерильний носій. Сполука, залежно від носія та концентрації, може бути або суспендована, або розчинена в носії. При одержанні розчинів сполука може бути розчинена для ін'єкції та стерилізована за допомогою фільтра перед заповненням придатного флакона або ампули та закупорюванням. Краще, допоміжну речо 93047 28 вину, таку як місцеві анестетики, консерванти та буферні агенти, розчиняють у носії. Для збільшення стабільності композиція може бути заморожена після заповнення флакона і вода може бути видалена у вакуумі. Парентеральні суспензії одержують по суті аналогічно, за винятком того, що сполуку суспендують у носіїзамість розчинення і стерилізація не може супроводжуватися фільтруванням. Сполука може бути стерилізована шляхом контактування з етиленоксидом перед суспендуванням у стерильному носії. Краще, поверхневоактивну речовину або зволожуючий агент включають у композицію для полегшення однорідного розподілу сполуки. Композиція може містити від 0,1% мас. до 99% мас, краще, від 10 до 60% мас. активної речовини, залежно від способу введення. Доза сполуки, використовувана при лікуванні вищезгаданих розладів, буде варіювати у звичайний спосіб відповідно до тяжкості розладу, маси пацієнта та інших подібних факторів. Однак відповідно до загальних показників придатна одинична доза може становити 0,05-1000мг, більш прийнятно, 0,1-200мг, і ще більш прийнятно, 1,0-200мг. В одному аспекті придатна одинична доза може становити 0,1-50мг. Такі одиничні дози можуть вводитися більше одного дня, наприклад, два або три дні. Така терапія може тривати протягом декількох тижнів або місяців. Наступні «Описи» та «Приклади» ілюструють одержання сполук за винаходом. Опис 1 1-(Фенілметил)гексагідро-4Н-азепін-4-он гідрохлорид (D1) Метод А Гексагідро-4Н-азепін-4-он гідрохлорид (10г, 66,9ммоль, може бути одержаний, як описано в Synthetic Communications, 1992, 22(9), 1249-58) суспендували в дихлорметані (100мл) і додавали триетиламін (9,31мл, 66,9ммоль), за яким ішов бензальдегід (68мл, 0,699ммоль). Суміш перемішували під аргоном при кімнатній температурі протягом 30 хвилин, потім охолоджували на льоді, під час додавання порціями триацетоксиборгідриду натрію (17г, 80ммоль). Суміш перемішували та дозволяли нагрітися до кімнатної температури, потім перемішували протягом 2 годин. Додавали 2М розчин гідроксиду натрію (80мл), шари розділяли та водний шар екстрагували дихлорметаном (×2). Об'єднані органічні екстракти упарювали до половини об'єму, потім екстрагували 2М хлористоводневою кислотою (2×100мл). Водний шар підлуговували за допомогою 50% розчину гідроксиду натрію та екстрагували дихлорметаном (×2). Об'єднані органічні екстракти сушили над сульфатом магнію та упарювали, даючи зазначену в заголовку сполуку (D1). 1 Н ЯМР (ДМСО-d6) δ 1,99-2,02 (1Н, м), 2,142,24 (1Н, м), 2,51-2,53 (1Н, м), 2,58-2,70 (2Н, м), 3,05-3,13 (1Н, с), 3,18-3,37 (2Н, м), 3,48-3,51 (2Н, м), 4,37 (2Н, д), 7,46-7,47 (ЗН, м), 7,65-7,67 (2Н, м), 11,35 (1Н, ушир.с). Метод В Суспензію гексагідро-4Н-азепін-4-ону гідрохлориду (5г, 33,4ммоль, може бути одержаний, як 29 описано в Synthetic Communications, 1992, 22(9), 1249-58) у дихлорметані (50мл) обробляли бензальдегідом (34мл, 33,4ммоль) і триетиламіном (4,66мл, 33,4ммоль) і залишали перемішуватися при кімнатній температурі приблизно 10 хвилин. Додавали триацетоксиборгідрид натрію (10,6г, 50,1ммоль) і суміш перемішували при кімнатній температурі протягом 4 годин. Після зазначеного часу реакцію гасили 2М розчином NaOH (~50мл) і екстрагували дихлорметаном (2×200мл), промивали насиченим розчином солі, сушили над сульфатом магнію, упарювали та очищали шляхом хроматографії на колонці на силікагелі, елююючи сумішшю 2М аміаку в метанолі та дихлорметані (04%). Сіль НСІ одержували, використовуючи 1,1 еквівалента 1Μ НСІ у діетиловому ефірі, даючи зазначену в заголовку сполуку (D1). МС (ЕС+) m/е 204 [М+Н]+. Опис 2 1-(Феніл метил)гексагідро-4Н-азепін-4-он (D2) Гексагідро-4Н-азепін-4-он гідрохлорид (10г, 66,9ммоль, може бути одержаний, як описано в Synthetic Communications, 1992, 22(9), 1249-58) суспендували в дихлорметані (100мл) і додавали триетиламін (9,31мл, 66,9ммоль), за яким ішов бензальдегід (68мл, 0,699ммоль). Суміш перемішували під аргоном при кімнатній температурі протягом 30 хвилин, потім охолоджували на льоді під час додавання порціями триацетоксиборгідриду натрію (17г, 80ммоль). Суміш перемішували та дозволяли нагрітися до кімнатної температури, потім перемішували протягом 2 годин. Додавали 2М розчин гідроксиду натрію (80мл), шари розділяли та водний шар екстрагували дихлорметаном (×2). Об'єднані органічні екстракти упарювали до половини об'єму, потім екстрагували 2М хлористоводневою кислотою (2×100мл). Водний шар підлуговували за допомогою 50% розчину гідроксиду натрію та екстрагували дихлорметаном (×2). Об'єднані органічні екстракти сушили над сульфатом магнію та упарювали, даючи зазначену в заголовку сполуку (D2). 1 H ЯМР (CDCI3) δ 1,82-1,88 (2Н, м), 2,52-2,55 (2Н, м), 2,59-2,62 (2Н, м) 2,71-2,76 (4Н, м) 3,65 (1Н, с), 7,23-7,33 (5Н, м). Опис 3 5-Хлор-1-(феніл метил)-2,3,6,7-тетрагідро-1 Назепін-4-карбал ьдегід (D3) Метод А Додавали до дихлорметану (90мл) під аргоном диметилформамід (6,4мл, 83,5ммоль) і охолоджували до 0°С. По краплях додавали хлорокис фосфору (6,24мл, 67,05ммоль) і перемішували суміш при 0°С протягом 2 годин. До зазначеної вище суміші додавали порціями 1(фенілметил)гексагідро-4Н-азепін-4-он гідрохлорид (може бути одержаний, якописано в Описі 1, 10г, 41,72ммоль) при 0°С протягом 10 хвилин. Суміш перемішували при 0°С протягом 45 хвилин, потім дозволяли нагрітися до кімнатної температури та перемішували протягом ночі. Реакцію порціями виливали в ацетат натрію (100г) у воді (800мл). Одержану суміш доводили до рН10 за допомогою 2М розчину гідроксиду натрію, потім розділяли. Водний шар екстрагували дихлормета 93047 30 ном (×2), і об'єднані органічні екстракти промивали насиченим розчином солі, сушили над сульфатом магнію та упарювали з одержанням зазначеної в заголовку сполуки, яка може використовуватися без додаткового очищення (D3). МС (ES+) m/е 250,252 [М+Н]+. Метод В Додавали до дихлорметану (140мл) під аргоном диметилформамід (10,11мл, 132ммоль) і охолоджували до 0°С. По краплях додавали хлорокис фосфору (9,87мл, 106ммоль) і перемішували суміш при 0°С протягом 2 годин. 1(Фенілметил)гексагідро-4Н-азепін-4-он (може бути одержаний, як описано в Описі 2, 13,4г, 65,95ммоль) розчиняли в дихлорметані (40мл) і додавали по краплях протягом 10 хвилин до зазначеної вище суміші при 0°С. Суміш перемішували при 0°С протягом 45 хвилин, потім нагрівали до кімнатної температури та перемішували протягом ночі. Реакцію порціями виливали в ацетат натрію (130г) у воді (1л). Одержану суміш доводили до рН10 за допомогою 2М розчину гідроксиду натрію, потім розділяли. Водний шар екстрагували дихлорметаном (×2), і об'єднані органічні екстракти промивали насиченим розчином солі, сушили над сульфатом магнію та упарювали з одержанням зазначеної в заголовку сполуки, яка може використовуватися без додаткового очищення (D3). МС (ES+) m/е 250,252 [М+Н]+. Метод С До розчину диметилформаміду (385мкл, 5ммоль) у безводному дихлорметані (6мл) на крижаній лазні повільно додавали хлорокис фосфору (374мкл, 4ммоль). Одержану суміш залишали перемішуватися на льодяній бані протягом 3 годин. Потім додавали по краплях 1(фенілметил)гексагідро-4Н-азепін-4-он гідрохлорид (може бути одержаний, як описано в Описі 1, 600мг, 2,5ммоль), і потім реакційну суміш залишали перемішуватися при кімнатній температурі протягом ночі. Наступного дня суміш повільно додавали в інтенсивно перемішувану суміш ацетату натрію (6г, 73, 2 моль) у льодяній воді (60мл). Одержану суміш доводили до рН10 за допомогою 2М NaOH та екстрагували дихлорметаном (3×60мл). Органічні шари поєднували та промивали NaНСО3 і насиченим розчином солі, сушили над MgSO4 та упарювали. Результуюча неочищена суміш зазначеної в заголовку сполуки може використовуватися без додаткового очищення (D3). МС (ES+) m/е 250 [М+Н]+. Опис 4 Оксим 5-хлор-1-(феніл метил)-2,3,6,7тетрагідро-1Н-азепін-4-карбальдегіду (D4) Розчин 5-хлор-1-(фенілметил)-2,3,6,7тетрагідро-1 Н-азепін-4-карбальдегіду (може бути одержаний, як описано в Описі 3, 11,6г, 46,5ммоль) в етанолі перемішували з гідроксиламіну гідрохлоридом (3,23г, 46,5ммоль) при кімнатній температурі протягом 72 годин. Етанол видаляли упарюванням і залишок розподіляли між етилацетатом та насиченим розчином бікарбонату натрію. Етилацетат промивали водою та насиченим розчином солі, потім сушили та упарювали, 31 даючи зазначену в заголовку сполуку (D4); МС (ES+) m/е 265 та 267 [М+Н]+. Опис 5 6-(Фенілметил)-2,4,5,6,7,8-гексагідропіразоло [3,4-d]азепін (D5) Метод А До розчину 5-хлор-1-(фенілметил)-2,3,6,7тетрагідро-1 Н-азепін-4-карбальдегіду (може бути одержаний, як описано в Описі 3, 10,4г, 41,8ммоль) в етанолі (30мл) додавали каталітичну кількість 2М хлористоводневої кислоти (5 краплин), потім гідразингідрат (2,43мл, 50,2ммоль). Одержану суміш нагрівали до кипіння протягом 48 годин і концентрували у вакуумі. Одержану неочищену суміш розбавляли водою, підлуговували за допомогою насиченого розчину бікарбонату натрію та екстрагували в етилацетат. Екстракти поєднували, промивали насиченим розчином солі, сушили над сульфатом магнію та концентрували у вакуумі. Продукт очищали шляхом хроматографії на силікагелі, елююючи сумішшю 2М аміаку в метанолі/дихлорметані (2-4%), даючи зазначену в заголовку сполуку (D5). МС (ES+) m/е 288 [М+Н]+. Метод В 5-Хлор-1-(фенілметил)-2,3,6,7-тетрагідро-1Назепін-4-карбальдегід (може бути одержаний, як описано в Описі 3, приблизно 41,72ммоль), гідразингідрат (2,23мл, 45,89ммоль) і 2М хлористоводневу кислоту (5 краплин) перемішували в етанолі (100мл) і нагрівали до кипіння протягом 76 годин. Розчинник упарювали і залишок розподіляли між етилацетатом та водою і підлуговували шляхом додавання бікарбонату натрію. Водну фазу екстрагували етилацетатом і об'єднані органічні шари промивали насиченим розчином солі, сушили над сульфатом магнію та упарювали. Залишок очищали за допомогою флеш-хроматографії, елююючи 2-4% 2М аміаком в метанолі/дихлорметані з одержанням зазначеної в заголовку сполуки (D5). МС (ES+) m/е 228 [М+Н]+. Метод С До суспензії оксиму 5-хлор-1-(фенілметил)2,3,6,7-тетрагідро-1Н-азепін-4-карбальдегіду (може бути одержаний, як описано в Описі 4, 400мг, 1,51ммоль) в етанолі (8мл) і 2М хлористоводневої кислоти (4 краплі) додавали гідразингідрат (8мл). Одержану суспензію нагрівали до кипіння протягом двох днів. Суміш охолоджували до кімнатної температури та обробляли надлишком ацетону. Екстрагували 2×100мл етилацетату. Водний шар підлуговували за допомогою бікарбонату натрію та повторно екстрагували етилацетатом. Об'єднані екстракти сушили, упарювали та розчиняли в дихлорметані і наносили на два 10г SCX-картриджи, елююючи метанолом, потім 2М аміаком в метанолі. Основні фракції поєднували, упарювали та очищали шляхом хроматографії на колонці, елююючи сумішшю 2М аміаку в метанолі та дихлорметану (0-5%), що давало зазначену в заголовку сполуку (D5). МС (ES+) m/е 228 [М+Н]+. Метод D До суспензії оксиму 5-хлор-1-(фенілметил)2,3,6,7-тетрагідро-1Н-азепін-4-карбальдегіду (може бути одержаний, як описано в Описі 4,200мг, 0,76ммоль) в етанолі (2мл) і хлористоводневої 93047 32 кислоти (1 крапля) додавали гідразингідрат (2мл). Одержану суспензію нагрівали до кипіння протягом 15 хвилин і потім протягом ночі. Додавали додаткові 2мл гідразингідрату та кип'ятіння продовжували протягом 1 години. Дозволяли реакційній суміші охолонути, гасили ацетоном, промивали водою та повторно екстрагували етилацетатом (3×50мл). Об'єднані екстракти сушили над сульфатом магнію та очищали шляхом хроматографії на колонці, елююючи сумішшю 2М аміаку в метанолі та дихлорметану (0-3%), що давало продукт (D5). 1 H-ЯМР (MeOD) δ 2,68-2,70 (2Н, м), 2,78 (4Н, м), 2,84-2,87 (2Н, м), 3,80 (2Н, с), 7,23-7,27 (2Н, м), 7,31-7,34 (2Н, м), 7,38-7,40 (2Н, м). Метод Ε Розчин 5-хлор-1-(фенілметил)-2,3,6,7тетрагідро-1Н-азепін-4-карбальдегіду (може бути одержаний, як описано в Описі 3, 10,41г, 41,8ммоль) в етанолі (30мл) і хлористоводневій кислоті (5 краплин) обробляли гідразингідратом (2,43мл, 50,2ммоль) і нагрівали до кипіння протягом ночі. Реакційну суміш упарювали з одержанням в'язкого масла, яке перерозчиняли в етанолі (30мл) і нагрівали до кипіння протягом 27 годин. Після охолодження до кімнатної температури суміш упарювали, розчиняли у воді та етилацетаті, підлуговували за допомогою бікарбонату натрію та екстрагували етилацетатом (3×150мл). Об'єднані екстракти промивали насиченим розчином солі, сушили над сульфатом магнію, упарювали та очищали шляхом хроматографії на колонці, елююючи сумішшю 2М аміаку в метанолі та дихлорметані (2-4%), що давало продукт (D5). МС (ES+) m/е 228 [М+Н]+. Метод F Розчин 5-хлор-1-(фенілметил)-2,3,6,7тетрагідро-1Н-азепін-4-карбальдегіду (може бути одержаний, як описано в Описі 3,1,73г, 6,95ммоль) в етанолі (10мл) обробляли гідразингідратом (0,37мл, 7,64ммоль) і нагрівали до кипіння протягом 18 годин і потім додатково протягом 2 днів. Після охолодження до кімнатної температури суміш фільтрували і фільтрат упарювали та розчиняли у воді. Доводили рН до 8 за допомогою бікарбонату натрію з наступною екстракцією етилацетатом. Об'єднані екстракти сушили над сульфатом магнію, упарювали та очищали шляхом хроматографії на колонці, елююючи сумішшю 2М аміаку в метанолі та дихлорметану (2-4%), що давало продукт (D5). МС (ES+) m/е 228 [М+Н]+. Метод G До розчину 5-хлор-1-(фенілметил)-2,3,6,7тетрагідро-1 Н-азепін-4-карбальдегіду (може бути одержаний, як описано в Описі 3, 500мг, 0,2ммоль) в етанолі (5мл) і 2М НСІ (3 краплі) повільно додавали гідразингідрат (106мкл, 2,2ммоль). Одержану суміш кип'ятили під аргоном протягом ночі. Наступного дня суміш упарювали досуха, розчиняли в 40мл води, доводили до рН8, використовуючи бікарбонат натрію, і екстрагували 3×50мл етилацетату. Органічні шари поєднували, потім промивали насиченим розчином соли та сушили над MgSO4 і упарювали. Одержаний сирий залишок очищали шляхом хроматографії на силікагелі, що давало 33 продукт (D5); МС (ES+) m/е 228 [М+Н]+; і 7(фенілметил)-2,4,5,6,7,8-гексагідропіразоло[3,4з]азепін у вигляді суміші (85:15). Опис 6 2,4,5,6,7,8-Гексагідропіразоло[3,4-d]азепіну гідрохлорид (D6) 6-(Фенілметил)-2,4,5,6,7,8гексагідропіразоло[3,4-d]азепін (може бути одержаний, як описано в Описі 5, 5,52г, 24,29ммоль) розчиняли в етанолі (70мл) під аргоном і додавали 2М хлористоводневу кислоту (12,2мл, 24,4ммоль), потім 50% вологий каталізатор 10% паладію на вугіллі (1г). Суміш перемішували в атмосфері водню протягом 18 годин. Каталізатор відфільтровували і фільтрат упарювали з одержанням зазначеної в заголовку сполуки (D6); МС (ES+) m/е [М+Н]+. Опис 7 2,4,5,6,7,8-Гексагідропіразоло[3,4-d]азепін (D7) Метод А 6-(Фенілметил)-2,4,5,6,7,8гексагідропіразоло[3,4-d]азепін (може бути одержаний, як описано в Описі 5, 390мг, 1,72ммоль) розчиняли в етанолі (8мл), обробляли паладієм (100мг, 10% на вугільній пасті) і реакційну суміш перемішували при кімнатній температурі під воднем (атмосферний тиск) протягом 18 годин. Суміш фільтрували через целіт і фільтрат упарювали при зниженому тиску, що давало зазначену в заголовку сполуку (D7). МС (ES+) m/е 138 [М+Н]+. Метод В 6-(Фенілметил)-2,4,5,6,7,8-гексагідропіразоло[3,4-d]азепін (може бути одержаний, як описано в Описі 5, 2,8г, 12,3ммоль) розчиняли в етанолі, обробляли паладієм на вугіллі (10% паста, 718мг, 1,23ммоль) і гідрогенували при атмосферному тиску та кімнатній температурі протягом 42 годин. Суміш фільтрували через целіт та упарювали при зниженому тиску, що давало продукт (D7); МС (ES+) m/е 138 [М+Н]+. Метод С 1,1-Диметилетил-4,5,7,8тетрагідропіразоло[3,4-d]азепін-6(2Н)-карбоксилат (може бути одержаний, як описано в Описі 9, 1,4г, 5,9ммоль) у дихлорметані (2мл) обробляли трифтороцтовою кислотою (2мл). Після 1 години суміш упарювали, розчиняли в метанолі та наносили на SCX іонообмінний картридж і промивали метанолом, а потім 2М розчином аміаку в метанолі. Фракції, що містять аміак, потім поєднували та упарювали, і одержаний залишок хроматографували на силікагелі, елююючи сумішшю 1:99, збільшуючи до 20:80, 2М аміаку в метанолі та дихлорметану, щоб одержати зазначену в заголовку сполуку (D7); МС (ES+): [М+Н]+ при m/z 138,12. Опис 8 1,1-Диметилетил-4-форміл-5-оксогексагідро1Н-азепін-1-карбоксилат (D8) 1,1-Диметилетил-4-оксогексагідро-1H-азепін-1карбоксилат (комерційно доступний, наприклад, від Magic Chemicals, 2,0г, 9,4ммоль) у тетрагідрофурані при -78°С обробляли 2М розчином діізопропіламіду літію (4,7мл, 9,4ммоль) у тетрагідрофурані. Після 20 хвилин додавали чистий етилформіат (0,7г, 9,4ммоль) і дозволяли реакційній суміші нагрітися до кімнатної температури. 93047 34 Після 2 годин реакцію гасили, виливали у воду та екстрагували кілька разів етилацетатом. Об'єднані органічні шари потім сушили та упарювали у вакуумі, щоб одержати зазначену в заголовку сполуку, яка може використовуватися без додаткового очищення (D8). Опис 9 1,1-Диметилетил-4,5,7,8тетрагідропіразоло[3,4-d]азепін-6(2Н)-карбоксилат (D9) Метод А 2,4,5,6,7,8-Гексагідропіразоло[3,4-d]азепіну гідрохлорид (може бути одержаний, як описано в Описі 6, 4,1г, 23,58ммоль) суспендували в 1:1 тетрагідрофурані та диметилформаміді (100мл) і охолоджували до 0°С. Додавали триетиламін (6,6мл, 47,16мл), потім ди-трет-бутилдикарбонат (5,14г, 23,58ммоль). Суміш перемішували та дозволяли нагрітися до кімнатної температури протягом 2 годин, потім упарювали. Залишок розчиняли в діетиловому ефірі та промивали водою (×3). Органічний шар сушили над сульфатом магнію та упарювали. Залишок очищали за допомогою флешхроматографії, елююючи 2-4% 2М аміаку в метанолі/дихлорметані, що давало зазначену в заголовку сполуку (D9). МС (ES+) m/е 182 [М+tВu]+. Метод В 2,4,5,6,7,8Тексагідропіразоло[3,4-d]азепін (може бути одержаний, як описано в Описі 7, 250мг, 1,82ммоль) суспендували в тетрагідрофурані (5мл), обробляли триетиламіном (0,25мл, 1,82ммоль) та біс(1,1-диметилетил)дикарбонатом (397мг, 1,82ммоль), і одержану суміш перемішували при кімнатній температурі під аргоном протягом 2 годин. Розчинник видаляли при зниженому тиску і продукт очищали хроматографією на силікагелі, елююючи сумішшю 2М аміаку в метанолі/дихлорметані (2-5%), що давало зазначену в заголовку сполуку (D9). МС (ES+) m/е 182 [М+tВu]+. Метод С Розчин 2,4,5,6,7,8-гексагідропіразоло[3,4d]азепіну (може бути одержаний, як описано в Описі 7, 800мг, 5,84ммоль) у тетрагідрофурані (10мл) обробляли триетиламіном (815мкл, 5,84ммоль) і біс(1,1-диметилетил)дикарбонатом (1,27г, 5,84ммоль), потім перемішували при кімнатній температурі під аргоном протягом 2 годин. Після видалення розчинника у вакуумі залишок очищали хроматографією на силікагелі, елююючи сумішшю 2М аміаку в метанолі/дихлорметані (010%), що давало зазначену в заголовку сполуку (D9). МС (ES+) m/е 238 [М+Н]+. Метод D 1,1-Диметилетил-4-форміл-5-оксогексагідро1Н-азепін-і-карбоксилат (може бути одержаний, як описано в Описі 8, неочищена речовина, приблизно 9,4ммоль) в етанолі (20мл) обробляли гідразингідратом (1,4г, 30ммоль). Суміш нагрівали до кипіння протягом 2 годин перед охолодженням до кімнатної температури та упарюванням у вакуумі. Сирий продукт потім очищали на силікагелі, елююючи етилацетатом, що давало зазначену в заголовку сполуку (D9); МС (ES+): [М+Н]+ при m/z 238,18. 35 Опис 10 1,1-Диметилетил-2-(4-ціанофеніл)-4,5,7,8тетрагідропіразоло[3,4-d]азепін-6(2Н)-карбоксилат (D10) 1,1-Диметилетил-4,5,7,8тетрагідропіразоло[3,4-фзепін-6(2Н)-карбоксилат (може бути одержаний, як описано в Описі 9, 1,80г, 7,58ммоль), 4-ціанофенілборонову кислоту (2,23г, 15,16ммоль, комерційно доступна, наприклад, від Aldrich), ацетат міді(ІІ) (4,15г, 22,76ммоль), піридин (1,21мл, 15,16ммоль) і порошкоподібні 4Å молекулярні сита (5,33г) перемішували в дихлорметані (80мл) при кімнатній температурі на повітрі протягом 40 годин. Суміш фільтрували через шар кізельгуру (Kieselguhr) і фільтрат упарювали. Залишок розчиняли в етилацетаті та розчин промивали 5% розчином бікарбонату натрію (×3), сушили над сульфатом магнію та упарювали. Залишок очищали за допомогою флеш-хроматографії, елююючи 10-40% етилацетату в н-пентані, одержуючи зазначену в заголовку сполуку (D10); МС (ES+) m/е 339 [М+Н]+. Опис 11 4-(5,6,7,8-Тетрагідропіразоло[3,4-d]азепін2(4Н)-іл)бензонітрил (D11) 1,1-Диметилетил-2-(4-ціанофеніл)-4,5,7,8тетрагідропіразоло[3,4-d]азепін-6(2Н)-карбоксилат (може бути одержаний, як описано в Описі 10, 150мг, 0,443ммоль) розчиняли в 1,4-діоксані (1мл) і додавали 4М хлороводень в 1,4-діоксані (3мл). Суміш перемішували при кімнатній температурі протягом 2 годин. Додавали метанол і суміш очищали на 10г SCX-колонці, елююючи спочатку метанолом, потім 2М аміаком у метанолі. Упарювання основних фракцій давало зазначену в заголовку сполуку (D11). МС (ES+) m/е 239 [М+Н]+. Опис 12 1,1-Диметилетил-2-(4-бромфеніл)-4,5,7,8тетрагідропіразоло[3,4-d]азепін-6(2Н)-карбоксилат (D12) Метод А 1,1-Диметилетил-4,5,7,8тетрагідропіразоло[3,4-d]азепін-6(2Н)-карбоксилат (може бути одержаний, як описано в Описі 9, 964мг, 4,06ммоль), 4-бромфенілборонову кислоту (1,64г, 8,12ммоль, комерційно доступна, наприклад, від Aldrich), ацетат міді(ІІ) (2,22г, 12,18ммоль), піридин (0,646мл, 8,12ммоль) і порошкоподібні 4Å молекулярні сита (2,85г) перемішували в дихлорметані (40мл) при кімнатній температурі на повітрі протягом 64 годин. Суміш фільтрували через шар кізельгуру (Kieselguhr) і фільтрат упарювали. Залишок розчиняли в етилацетаті і розчин промивали 5% розчином бікарбонату натрію (×2), сушили над сульфатом магнію та упарювали. Залишок очищали за допомогою флеш-хроматографії, елююючи 10-30% етилацетату в н-пентані, одержуючи зазначену в заголовку сполуку (D12). МС (ES+) m/е 392, 394 [М+Н]+. Метод В 1,1-Диметилетил-4,5,7,8тетрагідропіразоло[3,4-фзепін-6(2Н)-карбоксилат (може бути одержаний, як описано в Описі 9, 254мг, 1,07ммоль), (4-бромфеніл)боронову кислоту (431мг, 2,14ммоль, комерційно доступна, напри 93047 36 клад, від Aldrich), ацетат міді (583мг, 3,21ммоль), піридин (0,17мл, 2,14ммоль) і молекулярні сита 4 ангстрем (0,75г) додавали разом до дихлорметану (10мл) і одержану суміш перемішували при кімнатній температурі на повітрі протягом 18 годин. Суміш нагрівали при 40°С протягом 7 годин. Дозволяли суміші охолонути до кімнатної температури та перемішували протягом 18 годин. Суміш фільтрували через целіт і розчинник упарювали. Залишок розчиняли в етилацетаті та промивали насиченим розчином бікарбонату натрію. Шар етилацетату відокремлювали, сушили над сульфатом магнію та упарювали. Продукт очищали шляхом хроматографії на колонці, елююючи сумішшю етилацетат/пентан (1:9-1:4), одержуючи зазначену в заголовку сполуку (D12). МС (ES+) m/е 392,394 [М+Н]+. Метод С Розчин 1,1-диметилетил-4,5,7,8тетрагідропіразоло[3,4-d]азепін-6(2Н)карбоксилату (може бути одержаний, як описано в Описі 9, 900мг, 3,8ммоль), 4-бромфенілборонової кислоти (1,5г, 7,6ммоль, комерційно доступна, наприклад, від Aldrich), ацетату міді (2,06г, 11,4ммоль), молекулярні сита (4Å, 3,5г) і піридин (614мкл, 7,6ммоль) у дихлорметані (50мл) перемішували при кімнатній температурі на повітрі протягом 60 годин. Суміш потім фільтрували через шар целіту, промиваючи метанолом. Розчинник упарювали у вакуумі. Залишок розчиняли в етилацетаті та промивали 5% водяним розчином гідрокарбонату натрію (×2) і насиченим розчином солі, потім сушили над сульфатом магнію та упарювали у вакуумі. Одержаний залишок очищали шляхом хроматографії на силікагелі, елююючи сумішшю 2М аміаку в метанолі/дихлорметані (0-5%), з наступною додатковою хроматографією на силікагелі, елююючи сумішшю етилацетату в гексані (1020%), що давало зазначену в заголовку сполуку (D12). МС (ES+) m/е 336 та 338 [М+tВu]+. Опис 13 1-(5-Бром-2-піридиніл)-2-піролідинон (D13) Метод А До розчину 2-піролідинону (797мкл, 10,4ммоль) у диметилформаміді (10мл) при 0°С додавали порціями гідрид натрію (60% мас. у маслі, 416мг, 10,4ммоль). Реакційній суміші дозволяли перемішуватися при кімнатній температурі протягом 30 хвилин перед додаванням розчину 5-бром2-хлорпіридину (1,00г, 5,20ммоль) у диметилформаміді (2мл). Одержаній суміші дозволяли нагріватися до кімнатної температури протягом 18 годин, потім нагрівали до 50°С протягом 1 години, а потім при 80°С додатково протягом 1,5 години. Додавали метанол та воду і суміш екстрагували дихлорметаном, сушили над сульфатом магнію та концентрували у вакуумі. Продукт очищали шляхом хроматографії на силікагелі, елююючи сумішшю етилацетату та пентану (0-50%), що давало зазначену в заголовку сполуку (D13). МС (ES+) m/е 241 та 243 [М+Н]+. Метод В До розчину піролідинону (0,797мкл, 10,4ммоль) у диметилформаміді (10мл) при 0°С додавали порціями гідрид натрію (60% мас. у мас 37 лі, 416мг, 10,4ммоль). Одержаній суміші дозволяли перемішуватися при 0°С протягом 30 хвилин. Додавали розчин 5-бром-2-хлорпіридину (1,00г, 5,20ммоль) у диметилформаміді (2мл), і одержаній суміші дозволяли нагріватися до кімнатної температури протягом ночі. Потім суміш нагрівали при 50°С протягом 1 години та при 80°С протягом 1,5 години. Після охолодження до кімнатної температури суміш гасили метанолом і водою, екстрагували дихлорметаном (3×100мл) і сушили над сульфатом магнію. Неочищену суміш очищали шляхом хроматографії на колонці, елююючи сумішшю етилацетату та пентану (0-50%), що давало продукт (D13). МС (ES+) m/е 241 та 243 [М+Н]+. Опис 14 2-(4-Бромфеніл)-6-(фенілметил)-2,4,5,6,7,8гексагідропіразоло[3,4-d]азепін (D14) Метод А Суміш 6-(фенілметил)-2,4,5,6,7,8гексагідропіразоло[3,4-d]азепіну (може бути одержаний, як описано в Описі 5, 500мг, 2,20ммоль), 4(бромфеніл)боронової кислоти (885мг, 4,40ммоль, комерційно доступна, наприклад, від Aldrich), ацетату міді (1,19г, 6,60ммоль), піридину (0,36мл, 4,40ммоль) і молекулярних сит (1,5г) у дихлорметані (20мл) залишали перемішуватися при кімнатній температурі у відкритій колбі протягом 48 годин, потім додатково протягом 4-х днів. Реакційну суміш фільтрували через шар целіту, промиваючи дихлорметаном і метанолом. Фільтрат упарювали, перерозчиняли в метанолі та пропускали через 10г SCX картридж, елююючи метанолом, потім 2М розчином аміаку в метанолі. Неочищену суміш очищали за допомогою обернено-фазової хроматографії, елююючи сумішшю ацетонітрилу та води (5-100%), щоб одержати продукт (D14); МС (ES+) m/е 382 та 384 [М+Н]+. Метод В 6-(Фенілметил)-2,4,5,6,7,8-гексагідропіразоло[3,4-d]азепін (може бути одержаний, як описано в Описі 5, 50мг, 0,22ммоль), 4-бромфенілборонову кислоту (88мг, 0,44ммоль, комерційно доступна, наприклад, від Aldrich), ацетат міді(ІІ) (120мг, 0,66ммоль), піридин (36мкл, 0,44ммоль) і молекулярні сита 4Å (150г) перемішували при кімнатній температурі на повітрі протягом 72 годин. Одержану сиру суміш завантажували в 1г попередньо врівноважений іонообмінний картридж (SCX), елююючи метанолом та 2М аміаком у метанолі. Основні фракції упарювали і одержаний неочищений залишок очищали обернено-фазовою хроматографією, щоб одержати сіль форміат. Даний продукт завантажували в 1г попередньо врівноважений іонообмінний картридж (SCX) і елюювали метанолом та 2М аміаком у метанолі. Основні фракції поєднували та упарювали, щоб одержати зазначений у заголовку продукт (D14); МС (ES+) m/е 382/384 [М+Н]+. Опис 15 2-(6-Бром-3-піридиніл)-6-(фенілметил)2,4,5,6,7,8-гексагідропіразоло[3,4-d]азепін (D15) Суміш 6-(фенілметил)-2,4,5,6,7,8гексагідропіразоло[3,4-а]азепіну (може бути одержаний, як описано в Описі 5, 200мг, 0,88ммоль), (6-бром-3-піридиніл)боронової кислоти (355мг, 93047 38 1,76ммоль), ацетату міді (478мг, 2,64ммоль), піридину (0,142мл, 1,76ммоль) і молекулярних сит (600мг) у дихлорметані (10мл) залишали перемішуватися при кімнатній температурі у відкритій колбі протягом 240 годин. Реакційну суміш фільтрували через шар целіту, промиваючи дихлорметаном і метанолом. Фільтрат упарювали, перерозчиняли в метанолі та пропускали через 10г SCXкартридж, елююючи метанолом, потім 2М розчином аміаку в метанолі. Основні фракції поєднували, упарювали та очищали шляхом хроматографії на колонці, елююючи сумішшю 2М аміаку в метанолі та дихлорметану (0-10%). Нечистий продукт повторно очищали за допомогою оберненофазової хроматографії, елююючи сумішшю ацетонітрилу та води (5-100% та 3-60%), щоб одержати продукт (D15); МС (ES+) m/е 383 та 385 [М+Н]+. Опис 16 1-{5-[6-(Фенілметил)-5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл]-2піридиніл}-2-піролідинон (D16) Метод А Суміш 6-(фенілметил)-2,4,5,6,7,8гексагідропіразоло[3,4-d]азепіну (може бути одержаний, як описано в Описі 5,40,0мг, 0,18ммоль), 1(5-бром-2-піридиніл)-2-піролідинону (може бути одержаний, як описано в Описі 13, 48,0мг, 0,20ммоль), йодиду міді(І) (10,0мг, 0,05ммоль), транс-1,2-діаміноциклогексану (6мкл, 0,05ммоль) і K3РО4 (137мг, 0,65ммоль) суспендували в діоксані (3мл) і нагрівали, під аргоном, при 140°С протягом 18 годин. Неочищену суміш розбавляли метанолом, наносили на SCX-картридж (Varian bondelute, 5г) і промивали метанолом, потім сумішшю 2М аміак/метанол. Основні фракції поєднували, упарювали та очищали додатково за допомогою хроматографії на силікагелі, елююючи сумішшю 2М аміаку в метанолі/дихлорметані (0-5%), щоб одержати зазначену в заголовку сполуку (D16); МС (ES+) m/е 388 [М+Н]+. Метод В Суміш 6-(фенілметил)-2,4,5,6,7,8гексагідропіразоло[3,4-d]азепіну (може бути одержаний, як описано в Описі 5,40,0мг, 0,18ммоль), 1(5-бром-2-піридиніл)-2-піролідинону (може бути одержаний, як описано в Описі 13, 48,0мг, 0,20ммоль), йодиду міді (10,0мг, 0,05ммоль), (1R,2R)-1,2-циклогександіаміну (6,00мкл, 0,05ммоль) і фосфату калію (137мг, 0,65ммоль) у діоксані (3мл) нагрівали до кипіння протягом ночі, і потім охолоджували протягом двох днів. Суміш розбавляли метанолом і пропускали через 5г SCXкартридж, елююючи метанолом, потім 2М розчином аміаку в метанолі. Основні фракції поєднували, упарювали та очищали шляхом хроматографії на колонці, елююючи сумішшю 2М аміаку в метанолі та дихлорметану (0-5%), що давало продукт (D16); МС (ES+) m/е 388 [М+Н]+. Метод С Суміш 2-(6-бром-3-піридиніл)-6-(фенілметил)2,4,5,6,7,8-гексагідропіразоло[3,4-d]азепіну (може бути одержаний, як описано в Описі 15, 40мг, 0,10ммоль), 2-піролідинону (15мкл, 0,20ммоль), карбонату калію (41мг, 0,30ммоль), йодиду міді(І) (6мг, 0,03ммоль), N,N'-диметил-1,2-етандіаміну 39 (4мкл, 0,03ммоль) у діоксані (4мл) нагрівали до кипіння протягом 24 годин. Знов додавали таку ж кількість 2-піролідинону, йодиду міді(І) і N,N'диметил-1,2-етандіаміну та нагрівали суміш до кипіння протягом 2 годин. Після упарювання розчинника у вакуумі залишок очищали за допомогою SCX-картриджа, з наступною хроматографією на силікагелі, елююючи сумішшю 2М аміаку у метанолі/дихлорметані (0-10%). Колонку повторювали, елююючи сумішшю 2М аміаку в метанолі/дихлорметані (0-7,5%), щоб одержати зазначену в заголовку сполуку (D16); МС (ES+) m/е 388 [М+Н]+. Опис 17 1,1-Диметилетил-2-(6-бром-3-піридиніл)4,5,7,8-тетрагідропіразоло[3,4-d]азепін-6(2Н)карбоксилат (D17) Суміш 1,1-диметилетил-4,5,7,8тетрагідропіразоло[3,4-d]азепін-6(2Н)-карбоксилату (може бути одержаний, як описано в Описі 9, 207мг, 0,87ммоль), (6-бром-3-піридиніл)боронової кислоти (204мг, 1,74ммоль), ацетату міді (472мг, 2,61ммоль), піридину (140мкл, 1,74ммоль) і молекулярних сит (4Å, 750мг) у дихлорметані (10мл) перемішували на повітрі протягом 8 днів. Сиру суміш потім фільтрували через шар целіту та промивали дихлорметаном або аміаком. Після упарювання у вакуумі залишок очищали за допомогою SCX-картриджа, елююючи спочатку метанолом, потім 2М аміаком в метанолі. Метанольні фракції, що містять продукт, поєднували та упарювали у вакуумі. Залишок потім очищали шляхом хроматографії на колонці на силікагелі, елююючи сумішшю гексан в етилацетаті (10:1-1:1), що давало зазначену в заголовку сполуку (D17). МС (ЕС+) m/е 393 та 395 [М+Н]+. Опис 18 1,1-Диметилетил-2-[6-(2-оксо-1-піролідиніл)-3піридиніл]-4,5,7,8-тетрагідропіразоло[3,4-d]азепін6(2Н)-карбоксилат (D18) Суміш 1,1-диметилетил-2-(6-бром-3піридиніл)-4,5,7,8-тетрагідропіразоло[3,4-d]азепін6(2Н)-карбоксилату (може бути одержаний, як описано в Описі 17, 73мг, 0,19ммоль), Cul (11мг, 0,06ммоль), K2СО3 (92мг, 0,67ммоль), діоксану (3,7мл), N,N'-диметил-1,2-етандіаміну (0,006мл, 0,06ммоль) і 2-піролідинону (0,028мл, 0,37ммоль) змішували разом і нагрівали під аргоном до кипіння протягом 10 хвилин і залишали при цій температурі протягом 12,5 годин. Після додаткових 1,5 годин додавали ще Cul (0,3екв.), K2СО3 (3,6екв.), N,N'-диметил-1,2-етандіамін (0,3екв.) і 2піролідинон (2екв.) і нагрівали суміш до кипіння протягом додаткових 2,75 годин. Потім суміш охолоджували та залишали на 77 годин при кімнатній температурі. Потім суміш зменшували в об'ємі у вакуумі та очищали шляхом хроматографії на силікагелі, елююючи гексаном:етилацетатом 10:1 7:1 5:1 3:1 1:1, щоб одержати зазначену в заголовку сполуку (D18). МС (ES+) m/е 398 [М+Н]+. Опис 19 1-[5-(5,6,7,8-Тетрагідропіразоло[3,4-d]азепін2(4Н)-іл)-2-піридиніл]-2-піролідинон (D19) 93047 40 Метод А 1-{5-[6-(Фенілметил)-5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл]-2піридиніл}-2-піролідинон (може бути одержаний, як описано в Описі 16, 38,0мг, 0,10ммоль) розчиняли в етанолі (3мл). Додавали паладій (5,0мг, 10% на вугільній пасті) і реакційну суміш перемішували при кімнатній температурі під воднем (атмосферний тиск) протягом 12 годин. Суміш фільтрували через целіт і фільтрат концентрували у вакуумі. Продукт очищали шляхом хроматографії на силікагелі, елююючи сумішшю 2М аміаком у метанолі/дихлорметані (0-5%), що давало зазначену в заголовку сполуку (D19). МС (ES+) m/е 298 [М+Н]+. Метод В До розчину 1-{5-[6-(фенілметил)-5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл]-2піридиніл}-2-піролідинону (може бути одержаний, як описано в Описі 16, 38,0мг, 0,10ммоль) в етанолі (3мл) додавали паладій на вугіллі (10% 1:1 паста, 5,00мг) і одержану суміш перемішували при кімнатній температурі в атмосфері водню протягом ночі. Суміш потім фільтрували, упарювали та очищали шляхом хроматографії на колонці, елююючи сумішшю 2М аміаку в метанолі та дихлорметану (0-5%), що давало продукт (D19). МС (ES+) m/е 298 [М+Н]+. Метод С Розчин 1-{5-[6-(фенілметил)-5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл]-2піридиніл}-2-піролідинону (може бути одержаний, як описано в Описі 16,145мг, 0,37ммоль) і паладію на вугіллі (15мг) в етанолі (5мл) перемішували при кімнатній температурі в атмосфері водню протягом 18 годин. Потім суміш фільтрували через шар целіту, промиваючи етанолом. Розчинник упарювали у вакуумі, одержаний залишок очищали за допомогою SCX-картриджа, з наступною хроматографією на силікагелі, елююючи сумішшю 2М аміаку в метанолі/дихлорметані (0-5%), що давало зазначену в заголовку сполуку (D19). МС (ES+) m/е 298 [М+Н]+. Метод D Розчин 1,1-диметилетил-2-[6-(2-оксо-1піролідиніл)-3-піридиніл]-4,5,7,8тетрагідропіразоло-[3,4-фзепін-6(2Н)-карбоксилату (може бути одержаний, як описано в Описі 18, 51мг, 0,13ммоль) у дихлорметані (4мл) обробляли трифтороцтовою кислотою (2мл) і перемішували при кімнатній температурі протягом 1 години 50 хвилин. Потім суміш розбавляли метанолом (близько 5мл) і очищали за допомогою SCX, елююючи метанолом і потім метанолом/аміаком (2М). Відповідні фракції поєднували та упарювали, що давало зазначену в заголовку сполуку (D19). МС (ES+) m/е 298 [М+Н]+. Опис 20 1-{4-[6-(Фенілметил)-5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл]феніл}-2піролідинон (D20) Метод А Суміш 6-(фенілметил)-2,4,5,6,7,8гексагідропіразоло[3,4-d]азепіну (може бути одержаний, як описано в Описі 5, 40,0мг, 0,18ммоль), 1(4-бромфеніл)-2-піролідинону (48,0мг, 0,20ммоль), 41 йодиду міді(І) (10,0мг, 0,05ммоль), транс-1,2діаміноциклогексану (6мкл, 0,05ммоль) і K3РО4 (137мг, 0,65ммоль) суспендували в діоксані (3мл) і нагрівали, під аргоном, при 140°С протягом 18 годин. Неочищену суміш розбавляли метанолом, наносили на SCX-картридж (Varian bond-elute, 10г) і промивали метанолом, потім сумішшю 2М аміак/метанол. Основні фракції поєднували, упарювали та очищали додатково за допомогою хроматографії на силікагелі, елююючи сумішшю 2М аміаку в метанолі/дихлорметані (0-3%), що давало зазначену в заголовку сполуку (D20). МС (ES+) m/е 387 [М+Н]+. Метод В 1-{4-[6-(Фенілметил)-5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл]феніл}-2піролідинон (D20) може бути одержаний з 6(фенілметил)-2,4,5,6,7,8-гексагідропіразоло[3,4d]азепіну (40,0мг, 0,18ммоль, може бути одержаний, як описано в Описі 5), використовуючи процес, аналогічний описаному в Описі 16, заміняючи 1-(5-бром-2-піридиніл)-2-піролідинон на 1-(4бромфеніл)-2-піролідинон. МС (ES+) m/е 387 [М+Н]+. Метод С Суміш 2-(4-бромфеніл)-6-(фенілметил)2,4,5,6,7,8-гексагідропіразоло[3,4-d]азепіну (може бути одержаний, як описано в Описі 14,140мг, 0,37ммоль), піролідинону (56,0мкл, 0,74ммоль), карбонату калію (184мг, 1,33ммоль), йодиду міді (21,0мг, 0,11ммоль) і N,N'-диметил-1,2-етандіаміну (12,0мкл, 0,11ммоль) у безводному діоксані (6мл) нагрівали до кипіння протягом ночі. Додавали додаткову порцію піролідинону (56,0мкл, 0,74ммоль), карбонату калію (184мг, 1,33ммоль), йодиду міді (21,0мг, 0,11ммоль) і N,N'-диметил-1,2-етандіаміну (12,0мкл, 0,11ммоль) і продовжували нагрівати до кипіння протягом 24 годин. Після охолодження до кімнатної температури суміш пропускали через 10г SCX-картридж, елююючи метанолом і потім 2М розчином аміаку в метанолі. Очищення здійснювали за допомогою хроматографії на колонці, елююючи сумішшю 2М аміаку в метанолі та дихлорметану (0-4%), що давало продукт (D20). МС (ES+) m/е 387 [М+Н]+. Опис 21 1,1-Диметилетил-2-[4-(2-оксо-1піролідиніл)феніл]-4,5,7,8-тетрагідропіразоло[3,4d]-азепін-6(2Н)-карбоксилат (D21) Метод А Суміш 1,1-диметилетил-2-(4-бромфеніл)4,5,7,8-тетрагідропіразоло[3,4-d]азепін-6(2Н)карбоксилату (може бути одержаний, як описано в Описі 12,222мг, 0,57ммоль), 2-піролідинону (96мг, 0,09мл, 1,13ммоль), трис(дибензиліденацетон)дипаладію(0) (26мг, 0,029ммоль), (9,9-диметил-9Н-ксантен-4,5діїл)біс(дифенілфосфану) (49мг, 0,086ммоль) і карбонату цезію (279мг, 0,86ммоль) суспендували в діоксані (7мл) і нагрівали під аргоном до кипіння протягом 18 годин. Реакційну суміш охолоджували до кімнатної температури, розбавляли водою та екстрагували етилацетатом (×3). Об'єднані органічні шари промивали водою (×2), сушили над сульфатом магнію та упарювали розчинник у вакуу 93047 42 мі. Неочищений продукт затирали в гексані та фільтрували, а потім очищали додатково за допомогою хроматографії на силікагелі, елююючи сумішшю метанолу в дихлорметані (0-3%), що давало зазначену в заголовку сполуку (D21). МС (ES+) m/е 341 [M-tBu]+. Метод В Суміш 1,1 -диметилетил-2-(4-бромфеніл)4,5,7,8-тетрагідропіразоло[3,4-d]азепін-6(2Н)карбоксилату (може бути одержаний, як описано в Описі 12, 179мг, 0,46ммоль), K2СО3 (227мг, 1,64ммоль), Cul (26мг, 0,14ммоль), N,N'-диметил1,2-етандіаміну (0,015мл, 0,14ммоль) і 2піролідинону (0,070мл, 0,91ммоль) у діоксані (9мл) нагрівали до кипіння протягом ~15 хвилин і потім залишали при цій температурі на ніч. Після додаткових 1,5 годин додавали ще K2СО3 (3,6екв.), Cul (0,3екв.), Ν,Ν'-диметил-1,2-етандіамін (0,3екв.) і 2піролідинон (2екв.) (реакцію охолоджували до додавання реагентів), і одержану суміш перемішували при кипінні під аргоном протягом додаткових 3,5 годин і потім протягом додаткових 2,5 годин. Додавали ще діоксан (5мл) замість витраченого та суміш залишали при кипінні під аргоном протягом додаткової 1 години. Додавали ще K2СО3 (3,6екв.), Cul (0,3екв.), 2-піролідинон (2екв.) і N,N'-диметил1,2-етандіамін (0,3екв.) і суміш залишали перемішуватися при кипінні під аргоном на ніч. Після 16,5 годин додавали ще діоксан (4мл) і дозволяли суміші охолонути до кімнатної температури. Розчинник потім видаляли, залишок обробляли дихлорметаном (~25мл) і суміш фільтрували через целіт, промиваючи додатково дихлорметаном. Фільтрат потім упарювали і залишок очищали шляхом хроматографії на силікагелі, елююючи дихлорметаном сумішшю дихлорметан:метанол 50:1 25:1. Частково очищений залишок потім затирали з гексаном:етилацетатом 10:1, що давало зазначену в заголовку сполуку (D21). МС (ES+) m/е 397 [М+Н]+. Опис 22 1-[4-(5,6,7,8-тетрагідропіразоло[3,4-d]азепін2(4Н)-іл)феніл]-2-піролідинон (D22) Метод А 1-{4-[6-(Фенілметил)-5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл]феніл}-2піролідинон (може бути одержаний, як описано в Описі 20, 23,0мг, 0,06ммоль) розчиняли в етанолі (3мл). Додавали паладій (5,0мг, 10% на вугільній пасті) і реакційну суміш перемішували при кімнатній температурі під воднем (атмосферний тиск) протягом 12 годин. Суміш фільтрували через целіт і фільтрат концентрували у вакуумі. Продукт очищали шляхом хроматографії на силікагелі, елююючи сумішшю 2М аміаку у метанолі/дихлорметані (0-10%), що давало зазначену в заголовку сполуку (D22). МС (ES+) m/е 297[М+Н]+. Метод В 1-[4-(5,6,7,8-Тетрагідропіразоло[3,4-d]азепін2(4Н)-іл]феніл]-2-піролідинон (D22) може бути одержаний з 1-{4-[6-(фенілметил)-5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл]феніл}-2піролідинону (може бути одержаний, як описано в Описі 20, 23,0мг, 0,06ммоль), використовуючи процес, аналогічний описаному в Описі 19; МС (ES+) m/е 297 [М+Н]+. 43 Метод С Розчин/суспензію 1-{4-[6-(фенілметил)-5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл]-феніл}-2піролідинону (може бути одержаний, як описано в Описі 20, 180мг, 0,47ммоль) в етанолі (20мл) перемішували при кімнатній температурі в атмосфері водню протягом 72 годин. Потім суміш фільтрували через целіт та упарювали, що давало неочищений продукт, який очищали шляхом хроматографії на колонці, елююючи сумішшю 2М аміаку в метанолі та дихлорметану (0-10%), що давало продукт (D22). МС (ES+) m/е 297 [М+Н]+. Метод D До розчину 1,1-диметилетил-2-[4-(2-оксо-1піролідиніл)феніл]-4,5,7,8-тетрагідропіразоло[3,4фзепін-6(2Н)-карбоксилату (може бути одержаний, як описано в Описі 21, 189мг, 0,48ммоль) у дихлорметані (12мл) додавали трифтороцтову кислоту (6мл). Одержану суміш перемішували при кімнатній температурі протягом 1 години і потім розбавляли метанолом. Реакцію очищали за допомогою SCX, елююючи метанолом і потім 2М аміаком/метанолом. Основні фракції поєднували та розчинник упарювали у вакуумі, що давало зазначену в заголовку сполуку (D22). МС (ES+) m/е 297 [М+Н]+. Метод Ε Розчин 1,1-диметилетил-2-[4-(2-оксо-1піролідиніл)феніл]-4,5,7,8-тетрагідропіразоло[3,4d]-азепін-6(2Н)-карбоксилату (може бути одержаний, як описано в Описі 21, 132мг, 0,33ммоль) в DCM (5мл) обробляли TFA (2,5мл) і суміш перемішували при кімнатній температурі протягом 1,5 годин. Потім суміш розбавляли метанолом (~5мл) і пропускали через SCX-картридж, елююючи метанолом і потім МеОН/ІМНз (2М), що давало зазначену в заголовку сполуку (D22). МС (ES+) m/е 297 [М+Н]+. Опис 23 4-[6-{[(1,1-Диметилетил)окси]карбоніл}-5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл]-бензойна кислота (D23) До 1,1-диметилетил-2-(4-ціанофеніл)-4,5,7,8тетрагідропіразоло[3,4-d]азепін-6(2Н)карбоксилату (може бути одержаний, як описано в Описі 10, 750мг, 2,22ммоль) в етанолі (7,5мл) додавали 10% розчин гідроксиду натрію (7,5мл) і реакцію нагрівали до кипіння під аргоном протягом 5 годин. Додавали 10% розчин гідроксиду натрію (10мл) і продовжували перемішування при кипінні під аргоном протягом ночі. Реакцію охолоджували до кімнатної температури і розчинник частково видаляли у вакуумі. Одержаний неочищений продукт розчиняли у воді та підкисляли 5Н хлористоводневою кислотою. Додавали етилацетат і продукт екстрагували етилацетатом (×3). Об'єднані органічні фракції сушили над сульфатом магнію та розчинник упарювали у вакуумі, що давало зазначену в заголовку сполуку (D23). МС (ES+) m/е 356 [М-Н]-. Опис 24 1,1-Диметилетил-2-{4-[(метиламіно)карбоніл] феніл}-4,5,7,8-тетрагідропіразоло[3,4-d]-азепін6(2Н)-карбоксилат (D24) 93047 44 До суспензії 4-[6-{[(1,1диметилетил)окси]карбоніл}-5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл]бензойної кислоти (може бути одержана як описано в Описі 23, 185мг, 0,52ммоль) у дихлорметані (10мл) додавали 1,1'-(оксометандіїл)біс-1Н-імідазол (168мг, 1,04ммоль) і реакцію перемішували при кімнатній температурі під аргоном протягом ночі. Додавали метиламін (64мг, 2,07ммоль) і продовжували перемішування під аргоном при кімнатній температурі протягом 4 годин. Одержану неочищену суміш розбавляли водою та екстрагували дихлорметаном (×2). Об'єднані органічні фракції промивали водою (×1), сушили над сульфатом магнію та розчинник упарювали у вакуумі, що давало зазначену в заголовку сполуку (D24). МС (ES+) m/е 371 [М+Н]+. Опис 25 N-Метил-4-(5,6,7,8-тетрагідропіразоло[3,4d]азепін-2(4Н)-іл)бензамід (D25) Розчин 1,1-диметилетил-2-{4[(метиламіно)карбоніл]феніл}-4,5,7,8тетрагідропіразоло[3,4-d]-азепін-6(2Н)карбоксилату (184мг, 0,50ммоль, може бути одержаний, як описано в Описі 24) у дихлорметані (2мл) обробляли трифтороцтовою кислотою (2мл). Суміш перемішували при кімнатній температурі протягом 2 годин. Суміш розбавляли метанолом і пропускали через SCX-картридж, елююючи метанолом і потім 2М розчином аміаку в метанолі. Основні фракції поєднували та упарювали, що давало зазначену в заголовку сполуку (D25). МС (ES+) m/е 271 [М+Н]+. Опис 26 1,1-Диметилетил-2-[4-(2-оксо-1,3-оксазолідин3-іл)феніл]-4,5,7,8-тетрагідропіразоло[3,4-(]]азепін6(2Н)-карбоксилат (D26) Суміш 1,1-диметилетил-2-(4-бромфеніл)4,5,7,8-тетрагідропіразоло[3,4-d]азепін-6(2Н)карбоксилату (150мг, 0,38ммоль, може бути одержаний, як описано в Описі 12), 1,3-оксазолідин-2ону (100мг, 1,15ммоль), трис(дибензиліденацетон)дипаладію(0) (18,0мг, 0,02ммоль), (9,9-диметил-4,5біс(дифенілфосфіно)ксантену (35,0мг, 0,06ммоль) і карбонату цезію (195мг, 0,60ммоль) у діоксані (4мл) нагрівали до кипіння під аргоном протягом 3 годин і потім - мікрохвильовим випромінюванням протягом 2 годин при 150°С. Суміш розбавляли етилацетатом, фільтрували через целіт і промивали 2×20мл водою. Об'єднані шари етилацетату сушили над сульфатом магнію, фільтрували та упарювали. Неочищений продукт очищали шляхом хроматографії, елююючи сумішшю етилацетат/пентан (50-100%), що давало продукт (D26). МС (ES+) m/е 399 [М+Н]+. Метод В Суміш 1,1-диметилетил-2-(4-бромфеніл)4,5,7,8-тетрагідропіразоло[3,4-d]азепін-6(2Н)карбоксилату (може бути одержаний, як описано в Описі 12, 160мг, 0,41ммоль), 2-оксазолідинону (71мг, 0,82ммоль), карбонату калію (170мг, 1,23ммоль), йодиду міді(І) (24мг, 0,12ммоль) і Ν,Ν'диметил-1,2-етандіаміну (13мкл, 0,12ммоль) у діоксані (10мл) нагрівали до кипіння протягом ночі. 45 Додавали знову таку ж кількість 2-оксазолідинону, йодиду міді(І) і Ν,Ν'-диметил-1,2-етандіаміну та суміш нагрівали протягом 6 годин. Реакційну суміш переносили в мікрохвильову пробірку, знову додавали таку ж кількість 2-оксазолідинону, йодиду міді(І) та Ν,Ν'-диметил-1,2-етандіаміну, і суміш нагрівали при 100°С за допомогою мікрохвильового випромінювання протягом 1 години. Знов додавали таку ж кількість 2-оксазолідинону, йодиду міді(І) і N,N'-диметил-1,2-етандіаміну, і суміш нагрівали при 100°С за допомогою мікрохвильового випромінювання протягом додаткових 2 годин. Неочищену суміш фільтрували через шар целіту, промиваючи метанолом. Розчинник упарювали у вакуумі, залишок переносили в етилацетат, промивали водою та насиченим розчином солі, потім сушили над сульфатом магнію. Після видалення розчинника у вакуумі залишок очищали шляхом хроматографії на колонці на силікагелі, елююючи сумішшю 50% етилацетату в гексані, що давало продукт (D26). МС (ES+) m/е 343 [M-t]+. Опис 27 3-[4-(5,6,7,8-Тетрагідропіразоло[3,4-d]азепін2(4Н)-іл)феніл]-1,3-оксазолідин-2-он (D27) Метод А Розчин 1,1-диметилетил-2-[4-(2-оксо-1,3оксазолідин-3-іл)феніл]-4,5,7,8-тетрагідропіразоло[3,4-d]азепін-6(2Н)-карбоксилату (40,0мг, 0,10ммоль може бути одержаний, як описано в Описі 26) у дихлорметані (1мл) обробляли трифтороцтовою кислотою (1мл) і перемішували при кімнатній температурі протягом 1 години. Суміш розбавляли метанолом і пропускали через SCXкартридж, елююючи метанолом і потім 2М розчином аміаку в метанолі. Основні фракції поєднували та упарювали, що давало зазначену в заголовку сполуку (D27). МС (ES+) m/е 299 [М+Н]+. Метод В До розчину 1,1-диметилетил-2-[4-(2-оксо-1,3оксазолідин-3-іл)феніл]-4,5,7,8тетрагідропіразоло[3,4-d]азепін-6(2Н)карбоксилату (може бути одержаний, як описано в Описі 26, 104мг, 0,26ммоль) у діоксані (1мл) додавали 4М хлористоводневу кислоту в діоксані (2мл). Одержану суміш перемішували при кімнатній температурі під аргоном протягом 20 годин. Реакційну суміш розбавляли метанолом та очищали за допомогою SCX, елююючи метанолом і потім 2М аміаком/метанолом. Основні фракції поєднували та упарювали у вакуумі, що давало зазначену в заголовку сполуку (D27). МС (ES+) m/е 299 [М+Н]+. Опис 28 1,1-Диметилетил-2-[4-(3-метил-2-оксо-1імідазолідиніл)феніл]-4,5,7,8-тетрагідропіразоло[3,4-d]азепін-6(2Н)-карбоксилат (D28) Метод А Суміш 1,1-диметилетил-2-(4-бромфеніл)4,5,7,8-тетрагідропіразоло[3,4-d]азепін-6(2Н)карбоксилату (150мг, 0,38ммоль, може бути одержаний, як описано в Описі 12), 1-метил-2імідазолідинону (115мг, 1,15ммоль), трис(дибензиліденацетон)дипаладію(0) (18,0мг, 0,02ммоль), (9,9-диметил-4,5біс(дифенілфосфіно)ксантену (35,0мг, 0,06ммоль) і карбонату цезію (195мг, 0,60ммоль) у діоксані 93047 46 (4мл) нагрівали до кипіння під аргоном протягом 3 годин. Суміш охолоджували до кімнатної температури, розбавляли етилацетатом, фільтрували через целіт і промивали 2×20мл водою. Об'єднані шари етилацетату сушили над сульфатом магнію, фільтрували та упарювали. Неочищений продукт очищали шляхом хроматографії, елююючи сумішшю етилацетат/пентан (50-100%), що давало продукт (D28). МС (ЕС+) m/е 412 [М+Н]+. Метод В Суміш 1,1-диметилетил-2-(4-бромфеніл)4,5,7,8-тетрагідропіразоло[3,4-d]азепін-6(2Н)карбоксилату (може бути одержаний, як описано в Описі 12, 80мг, 0,20ммоль), 1-метил-2імідазолідинону (20мг, 0,40ммоль), трис(дибензиліденацетон)дипаладію(0) (9мг, 0,01ммоль), (9,9-диметил-9Н-ксантен-4,5діїл)біс(дифенілфосфану) (17мг, 0,03ммоль) і карбонату цезію (98мг, 0,3ммоль) суспендували в діоксані (4мл) та нагрівали до кипіння під аргоном протягом 18 годин. Додавали додаткові 2екв. 1метил-2-імідазолідинону, 0,05екв. трис(дибензиліденацетон)-дипаладію(0), 0,15екв. (9,9-диметил-9Н-ксантен-4,5діїл)біс(дифенілфосфану) і 1,5екв. карбонату цезію в діоксані (2мл) і залишали реакцію кипіти протягом 4 годин під аргоном. Реакцію охолоджували до кімнатної температури, розбавляли водою та екстрагували етилацетатом (×3). Об'єднані органічні шари промивали водою (×2), насиченим розчином солі (×1), сушили над сульфатом магнію та розчинник упарювали у вакуумі. Неочищений продукт очищали шляхом хроматографії на колонці на силікагелі, елююючи сумішшю етилацетату в гексані (0-30%), що давало зазначену в заголовку сполуку (D28). МС (ES+)m/e412[M-tBu]+. Опис 29 1-Метил-3-[4-(5,6,7,8-тетрагідропіразоло[3,4d]азепін-2(4Н)-іл)феніл]-2-імідазолідинон (D29) Метод А Розчин 1,1-диметилетил-2-[4-(3-метил-2-оксо1-імідазолідиніл)феніл]-4,5,7,8-тетрагідропіразоло[3,4-d]азепін-6(2Н)-карбоксилату (122мг, 0,30ммоль, може бути одержаний, як описано в Описі 28) у дихлорметані (1мл) обробляли трифтороцтовою кислотою (1мл) і перемішували при кімнатній температурі протягом 1 години. Суміш розбавляли метанолом і пропускали через SCX картридж, елююючи метанолом і потім 2М розчином аміаку в метанолі. Основні фракції поєднували та упарювали, що давало зазначену в заголовку сполуку (D29). МС (ES+) m/е 312 [М+Н]+. Метод В До розчину 1,1-диметилетил-2-[4-(3-метил-2оксо-1-імідазолідиніл)феніл]-4,5,7,8тетрагідропіразоло[3,4-d]азепін-6(2Н)карбоксилату (може бути одержаний, як описано в Описі 28,47мг, 0,11ммоль) у діоксані (1мл) додавали 4М хлористоводневу кислоту в діоксані (2мл). Одержану суміш перемішували при кімнатній температурі під аргоном протягом 5 годин. Реакційну суміш розбавляли метанолом і потім очищали за допомогою SCX, елююючи метанолом і потім 2М аміаком/метанолом. Основні фракції поєднували 47 та упарювали у вакуумі, що давало зазначену в заголовку сполуку (D29). MC(ES+)m/e312[M+H]+. Опис 30 (1Z)-N-Гідроксіетанімідамід (D30) Суміш ацетонітрилу (1,7мл, 32,9ммоль) і 50% водного розчину гідроксиламіну (2,5мл, 37,9ммоль) в етанолі (5мл) нагрівали до кипіння протягом 4,5 годин. Розчинник упарювали, що давало білу кристалічну тверду речовину, яку затирали з діетиловим ефіром, фільтрували та сушили у вакуумній печі, що давало продукт (D30). 1 H ЯМР (d6-ДMCO) δ 1,62 (3Н, с), 5,34 (2Н, ушир, с), 8,65 (1Н, с). Опис 31 6-Циклобутил-2,4,5,6,7,8-гексагідропіразоло[3,4-d]азепін (D31) Метод А До суспензії 2,4,5,6,7,8-гексагідропіразоло[3,4d]азепіну (може бути одержаний, як описано в Описі 7, 100мг, 0,73ммоль) у дихлорметані (5мл) додавали циклобутанон (55мкл, 0,73ммоль), потім оцтову кислоту (1 крапля) і триацетоксиборгідрид натрію (186мг, 0,88ммоль). Суміш перемішували при кімнатній температурі протягом 2 годин, потім розбавляли її метанолом та очищали за допомогою SCX-картриджа, що давало зазначену в заголовку сполуку (D31). МС (ES+) m/е 192 [М+Н]+. Метод В 2,4,5,6,7,8-Гексагідропіразоло[3,4-d]азепін (може бути одержаний, як описано в Описі 7, 0,13, 0,95ммоль) у дихлорметані (3мл) обробляли циклобутаноном (0,08г, 1,13ммоль) і каталітичною кількістю оцтової кислоти. Після 10 хвилин реакцію обробляли триацетоксиборгідридом натрію (0,42г, 1,9ммоль) і перемішували протягом 2 годин. Реакційну суміш потім розбавляли метанолом та очищали за допомогою іонообмінного SCX-картриджа та промивали метанолом і потім 2М розчином аміаку в метанолі. Фракції, що містять аміак, потім поєднували та упарювали, і одержаний неочищений продукт (D31) міг бути використаний без подальшого очищення. МС (ES+): [М+Н]+ при m/z 192,16. Опис 32 1,1-Диметилетил-2-[4-(метилсульфоніл)феніл]-4,5,7,8-тетрагідропіразоло[3,4-d]азепін-6(2Н)карбоксилат (D32) Розчин 1,1-диметилетил-4,5,7,8тетрагідропіразоло[3,4-d]азепін-6(2Н)карбоксилату (може бути одержаний, як описано вОписі 9, 75мг, 0,32ммоль), [4(метилсульфоніл)феніл]боронової кислоти (128мг, 0,64ммоль), ацетату міді (116мг, 0,64ммоль), молекулярних сит (4Å, 0,2г) і піридину (52мкл, 0,64ммоль) у дихлорметані (2,5мл) перемішували на повітрі при кімнатній температурі протягом 60 годин. Суміш потім розбавляли метанолом, фільтрували через шар целіту, промиваючи метанолом. Розчинник упарювали у вакуумі. Залишок переносили в етилацетат і промивали водою та 5% водним розчином гідрокарбонату натрію, потім сушили над сульфатом магнію та упарювали у вакуумі. Одержаний залишок очищали за допомогою MDAP, що давало зазначену в заголовку сполуку (D32). МС (ES+) m/е 392 [М+Н]+. 93047 48 Опис 33 1,1-Диметилетил-2-[4-(1-піперидиніл)феніл]4,5,7,8-тетрагідропіразоло[3,4-d]азепін-6(2Н)карбоксилат (D33) Розчин 1,1-диметилетил-2-(4-бромфеніл)4,5,7,8-тетрагідропіразоло[3,4-d]азепін-6(2Н)карбоксилату (може бути одержаний, як описано в Описі 12, 150мг, 0,38ммоль), піперидину (76мкл, 0,76ммоль), [2'-(дициклогексилфосфаніл)-2бифенілил]диметиламіну (24мг, 0,06ммоль), трис(дибензиліденацетон)дипаладію(0) (174мг, 0,20ммоль) і трет-бутоксиду натрію (73мг, 0,76ммоль) у діоксані (4,5мл) нагрівали до 120°С у мікрохвильовій печі (нормальне поглинання) протягом 30 хвилин. Реакційну суміш розбавляли метанолом і потім очищали за допомогою SCX, елююючи метанолом і потім 2М аміаком/метанолом. Поєднували основні фракції та упарювали розчинник у вакуумі. Неочищений продукт очищали шляхом хроматографії на колонці на силікагелі, елююючи сумішшю етилацетату у гексані (0-50%), що давало зазначену в заголовку сполуку. МС (ES+) m/е 397 [М+Н]+. Опис 34 1,1-Диметилетил-2-[4-(3-метил-1,2,4оксадіазол-5-іл)феніл]-4,5,7,8-тетрагідропіразоло[3,4-d]азепін-6(2Н)-карбоксилат (D34) До суспензії 4-[6-{[(1,1диметилетил)окси]карбоніл}-5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл]бензойної кислоти (може бути одержана, як описано в Описі 23,185мг, 0,52ммоль) у дихлорметані (10мл) додавали 1,1'-(оксометандіїл)біс-і Н-імідазол (168мг, 1,04ммоль) і реакцію перемішували при кімнатній температурі під аргоном протягом ночі. Розчинник видаляли у вакуумі. Додавали толуол (5мл) і потім (12)-N-гідроксіетанімідамід (може бути одержаний, як описано в Описі 30, 116мг, 1,56ммоль) і реакційну суміш нагрівали до кипіння під аргоном протягом ночі. Додавали додаткові 2екв. 1,1'(оксометандіїл)біс-1Н-імідазолу та продовжували перемішування додатково 40 хвилин. Додавали 3екв. (1Z)-N-гідроксіетанімідаміду та продовжували перемішування додатково 3 години. Реакцію охолоджували до кімнатної температури і розчинник упарювали у вакуумі. Одержану неочищену суміш розводили дихлорметаном і водою та екстрагували дихлорметаном (×2). Об'єднані органічні фракції промивали водою (×1), сушили над сульфатом магнію та розчинник упарювали у вакуумі, що давало зазначену в заголовку сполуку (D34). МС (ES+) m/е 340 [М-tВu]+. Опис 35 2-[4-(3-Метил-1,2,4-оксадіазол-5-іл)феніл]2,4,5,6,7,8-гексагідропіразоло[3,4-d]азепін (D35) До розчину 1,1-диметилетил-2-[4-(3-метил1,2,4-оксадіазол-5-іл)феніл]-4,5,7,8тетрагідропіразоло[3,4-d]азепін-6(2Н)карбоксилату (може бути одержаний, як описано в Описі 34, 159мг, 0,40ммоль) у дихлорметані (12мл) додавали трифтороцтову кислоту (6мл). Одержану суміш перемішували при кімнатній температурі протягом 30 хвилин і потім розбавляли метанолом. Реакцію очищали за допомогою SCX, елююючи метанолом і потім 2М аміаком/метанолом. 49 Основні фракції поєднували та розчинник упарювали у вакуумі, що давало зазначену в заголовку сполуку (D35). МС (ES+) m/е 296 [М+Н]+. Опис 36 1,1-Диметилетил-2-[4-(амінокарбоніл)феніл]4,5,7,8-тетрагідропіразоло[3,4-d]азепін-б(2Н)карбоксилат (D36) До суспензії 4-[6-{[(1,1диметилетил)окси]карбоніл}-5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл]бензойної кислоти (може бути одержана як описано в Описі 23,185мг, 0,52ммоль) у дихлорметані (10мл) додавали 1,1'-(оксометандіїл)біс-1Н-імідазол (168мг, 1,04ммоль) і реакцію перемішували при кімнатній температурі під аргоном протягом ночі. Додавали аміак (0,88М, 35мг, 2,07ммоль) і продовжували перемішування під аргоном при кімнатній температурі протягом 4 годин. Одержану неочищену суміш розбавляли водою та екстрагували дихлорметаном (×2). Об'єднані органічні фракції промивали водою (×1), сушили над сульфатом магнію та розчинник упарювали у вакуумі, що давало зазначену в заголовку сполуку (D36). МС (ES+) m/е 301 [M-tBu]+. Опис 37 4-(5,6,7,8-Тетрагідропіразоло[3,4-d]азепін2(4Н)-іл)бензамід (D37) До розчину 1,1-диметилетил-2-[4(амінокарбоніл)феніл]-4,5,7,8тетрагідропіразоло[3,4-d]-азепін-6(2Н)карбоксилату (може бути одержаний, як описано в Описі 36,167мг, 0,47ммоль) у дихлорметані (14мл) додавали трифтороцтову кислоту (7мл). Одержану суміш перемішували при кімнатній температурі під аргоном протягом 2 годин і потім розбавляли метанолом. Реакцію очищали за допомогою SCX, елююючи метанолом і потім 2М аміаком/метанолом. Основні фракції поєднували і розчинник упарювали у вакуумі, що давало зазначену в заголовку сполуку (D37). МС (ES+) m/е 257 + [М+Н] . Опис 38 2-[4-(3-Метилсульфоніл)феніл]-2,4,5,6,7,8гексагідропіразоло[3,4-d]азепін (D38) До розчину 1,1-диметилетил-2-[4(метилсульфоніл)феніл]-4,5,7,8тетрагідропіразоло[3,4-d]-азепін-6(2Н)карбоксилату (може бути одержаний, як описано в Описі 32,10мг, 0,03ммоль) у діоксані (1мл) додавали 4М хлористоводневу кислоту в діоксані (2мл). Одержану суміш перемішували при кімнатній температурі під аргоном протягом ночі. Реакційну суміш розбавляли метанолом та очищали за допомогою SCX, елююючи метанолом і потім 2М аміаком/метанолом. Основні фракції поєднували та упарювали у вакуумі, що давало зазначену в заголовку сполуку (D38). МС (ES+) m/е 292 [М+Н]+. Опис 39 1,1-Диметилетил-2-{4-[(метилсульфоніл)аміно]феніл}-4,5,7,8-тетрагідропіразоло[3,4-d]азепін-6(2Н)-карбоксилат (D39) До {4-[(метилсульфоніл)аміно]феніл}боронової кислоті (комерційно доступна, наприклад, від Combi-Blocks, 127мг, 0,29ммоль) у дихлорметані (3мл) додавали ацетат міді(ІІ) (107мг, 0,59ммоль) 93047 50 та молекулярні сита 4Å (190мг) і реакцію перемішували при кімнатній температурі з доступом повітря протягом 10 хвилин. Додавали 1,1диметилетил-4,5,7,8-тетрагідропіразоло[3,4-d]азепін-6(2Н)-карбоксилат (може бути одержаний, як описано в Описі 9, 70мг, 0,29ммоль) і реакцію перемішували при кімнатній температурі з доступом повітря протягом ночі. Реакційну суміш розбавляли метанолом і фільтрували через шар целіту, промиваючи метанолом. Розчинник упарювали у вакуумі. Додавали етилацетат і воду, і продукт екстрагували етилацетатом (×3), промивали водою (×1), потім насиченим розчином бікарбонату натрію (×1) і потім сушили над сульфатом магнію. Розчинник упарювали у вакуумі. Одержаний неочищений продукт очищали шляхом хроматографії на колонці на силікагелі, елююючи сумішшю етилацетату в гексані (0-50%). Необхідні фракції поєднували та розчинник упарювали у вакуумі. Одержаний неочищений продукт очищали додатково шляхом автоматичного поділу по масі (Mass Directed Autopreparation), що давало зазначену в заголовку сполуку (D39). МС (ES+) m/е 407 [М+Н]+. Опис 40 N-[4-(5,6,7,8-Тетрагідропіразоло[3,4-d]азепін2(4Н)-іл)феніл]метансульфонамід (D40) До розчину 1,1-диметилетил-2-{4[(метилсульфоніл)аміно]феніл}-4,5,7,8тетрагідропіразоло-[3,4-фзепін-6(2Н)-карбоксилату (може бути одержаний, як описано в Описі 39, 16мг, 0,039ммоль) у діоксані (1мл) додавали 4М хлористоводневу кислоту в діоксані (2мл). Одержану суміш перемішували при кімнатній температурі під аргоном протягом ночі. Реакційну суміш розбавляли метанолом та очищали за допомогою SCX, елююючи метанолом і потім 2М аміаком/метанолом. Основні фракції поєднували та упарювали у вакуумі, що давало зазначену в заголовку сполуку (D40). МС (ES+) m/е 307 [М+Н]+. Опис 41 1,1-Диметилетил-2-{4-[(диметиламіно)карбоніл]феніл}-4,5,7,8-тетрагідропіразоло[3,4-d]-азепін6(2Н)-карбоксилат (D41) До суспензії 4-[6-{[(1,1диметилетил)окси]карбоніл}-5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл]бензойної кислоти (може бути одержана, як описано в Описі 23, 185мг, 0,52ммоль) у дихлорметані (10мл) додавали 1,1'-(оксометандіїл)біс-1Н-імідазол (168мг, 1,04ммоль), і реакцію перемішували при кімнатній температурі під аргоном протягом ночі. Додавали диметиламін (93мг, 2,07ммоль) і продовжували перемішування під аргоном при кімнатній температурі протягом 4 годин. Одержану неочищену суміш розбавляли водою та екстрагували дихлорметаном (×2). Об'єднані органічні фракції промивали водою (×1), сушили над сульфатом магнію та розчинник упарювали у вакуумі, що давало зазначену в заголовку сполуку (D41). МС (ES+) m/е 385 [М+Н]+. Опис 42 N,N-Диметил-4-(5,6,7,8-тетрагідропіразоло[3,4d]азепін-2(4Н)-іл)бензамід (D42) До розчину 1,1-диметилетил-2-{4[(диметиламіно)карбоніл]феніл}-4,5,7,8 51 тетрагідропіразоло-[3,4-d]азепін-6(2Н)карбоксилату (може бути одержаний, як описано в Описі 41, 194мг, 0,50ммоль) у дихлорметані (14мл) додавали трифтороцтову кислоту (7мл). Одержану суміш перемішували при кімнатній температурі під аргоном протягом 2 годин і потім розбавляли метанолом. Реакцію очищали за допомогою SCX, елююючи метанолом і потім 2М аміаком/метанолом. Основні фракції поєднували і розчинник упарювали у вакуумі. Одержаний неочищений продукт очищали додатково за допомогою хроматографії на колонці на силікагелі, елююючи сумішшю 2М аміаку в метанол/дихлорметан, що давало зазначену в заголовку сполуку (D42). МС (ES+) m/е 285 [М+Н]+. Опис 43 2-[4-(1-Піперидиніл)феніл]-2,4,5,6,7,8гексагідропіразоло[3,4-d]азепін (D43) До розчину 1,1-диметилетил 2-[4-(1піперидиніл)феніл]-4,5,7,8-тетрагідропіразоло[3,4d]-азепін-6(2Н)-карбоксилату (може бути одержаний, як описано в Описі 33, 70мг, 0,18ммоль) у діоксані (1мл) додавали 4М хлористоводневу кислоту в діоксані (2мл). Одержану суміш перемішували при кімнатній температурі під аргоном протягом ночі. Реакційну суміш розбавляли метанолом та очищали за допомогою SCX, елююючи метанолом і потім 2М аміаком/метанолом. Основні фракції поєднували та розчинник упарювали у вакуумі, що давало зазначену в заголовку сполуку (D43). МС (ES+) m/е 297 [М+Н]+. Опис 44 1,1-Диметилетил-2-[4-(1-піролідиніл)феніл]4,5,7,8-тетрагідропіразоло[3,4-d]азепін-6(2Н)карбоксилат (D44) Суміш 1,1-диметилетил-2-(4-бромфеніл)4,5,7,8-тетрагідропіразоло[3,4-d]азепін-6(2Н)карбоксилату (може бути одержаний, як описано в Описі 12, 200мг, 0,51ммоль), піролідину (73мкл, 1,02ммоль), трис(дибензиліденацетон)дипаладію(0) (234мг, 0,26ммоль), [2'-(дициклогексилфосфаніл)-2бифенілил]диметиламіну (30мг, 0,08ммоль) і третбутоксиду натрію (98мг, 1,02ммоль) у діоксані (4мл) нагрівали до 120°С у мікрохвильовій печі (нормальне поглинання) протягом 30 хвилин. Реакційну суміш розбавляли метанолом і потім очищали за допомогою SCX, елююючи метанолом і потім 2М аміаком/метанолом. Поєднували основні фракції та упарювали розчинник у вакуумі. Неочищений продукт очищали шляхом хроматографії на колонці на силікагелі, елююючи сумішшю етилацетату в гексані (0-40%), що давало зазначену в заголовку сполуку (D44). МС (ES+) m/е 383 [М+Н]+. Опис 45 2-[4-(1-Піролідиніл)феніл]-2,4,5,6,7,8гексагідропіразоло[3,4-d]азепін (D45) До розчину 1,1-диметилетил 2-[4-(1піролідиніл)феніл]-4,5,7,8-тетрагідропіразоло[3,4d]-азепін-6(2Н)-карбоксилату (може бути одержаний, як описано в Описі 44, 79мг, 0,21ммоль) у діоксані (3мл) додавали 4М хлористоводневу кислоту в діоксані (2мл). Одержану суміш перемішували при кімнатній температурі під аргоном протягом ночі. Реакційну суміш розбавляли метанолом і 93047 52 потім очищали за допомогою SCX, елююючи метанолом і потім 2М аміаком/метанолом. Основні фракції поєднували та розчинник упарювали у вакуумі, що давало зазначену в заголовку сполуку + (D45). МС (ES+) m/е 283 [М+Н] Опис 46 2-Феніл-2,4,5,6,7,8-гексагідропіразоло[3,4d]азепін (D46) Розчин 2-(4-бромфеніл)-6-(фенілметил)2,4,5,6,7,8-гексагідропіразоло[3,4-d]азепіну (може бути одержаний, як описано в Описі 14, 49мг, 0,13ммоль) в етанолі (5мл) з паладієм (10% Pd/C паста) як каталізатором (10мг) перемішували в атмосфері водню протягом ночі. Наступного дня одержану суміш фільтрували через целіт, що давало зазначену в заголовку сполуку, яка може бути використане без додаткового очищення (D46). МС (ES+) m/е 214 [М+Н]+. Опис 47 1,1-Диметилетил-3-оксо-2-[1-(фенілметил)-4піперидиніл]-3,3a,4,5,7,8-гексагідро-піразоло[3,4d]азепін-6(2Н)-карбоксилат (D47) Суміш 4-гідразино-1-(фенілметил)піперидину дигідрохлориду (комерційно доступний, наприклад, від Aurora Screening Library, 2,68г, 9,63ммоль) і трет-бутанолу (60мл) додавали до 1(1,1-диметилетил)-4-етил5-оксогексагідро-1Назепін-1,4-дикарбоксилату (може бути одержаний, як описано в Synthetic Communication, 1992, 22(9), 1249-58, 2,50г, 8,76ммоль) з наступним додаванням триетиламіну (7,33мл, 52,59ммоль), і одержану суспензію нагрівали до кипіння приблизно 10 хвилин під аргоном. Одержаний прозорий жовтий розчин залишали при даній температурі на 65 годин. Потім суміш охолоджували до кімнатної температури протягом ~2 годин та упарювали у вакуумі з одержанням твердого залишку кремових кольорів. Очищення за допомогою хроматографії на колонці на силікагелі, елююючи дихлорметаном:метанолом 50:1 25:1 10:1, давало продукт, що, після розподілу між водою та дихлорметаном (100мл кожного) шари відокремлювали та органічний шар промивали додатково водою (100мл), потім насиченим розчином солі (100мл) і потім сушили (Na2SO4), фільтрували та упарювали, приводило до зазначеної в заголовку сполуки (D47). МС (ES+) m/е 427 [М+Н]+. Опис 48 1,1-Диметилетил-2-[1-(фенілметил)-4піперидиніл]-3-{[(трифторметил)сульфоніл]окси}3,3а,4,5,7,8-гексагідропіразоло[3,4-d]азепін-6(2Н)карбоксилат (D48) Розчин 1,1-диметилетил-3-оксо-2-[1-(феніл метил)-4-піперидиніл]-3,3а,4,5,7,8гексагідропіразоло[3,4-d]азепін-6(2Н)-карбоксилату (може бути одержаний, як описано в Описі 47, 278мг, 0,65ммоль) у дихлорметані (8мл) обробляли діізопропілетиламіном (0,36мл, 2,07ммоль), потім 1,1,1-трифтор-N-феніл-N[(трифторметил)сульфоніл]метансульфонамідом (373мг, 1,04ммоль) і одержаний розчин нагрівали до кипіння протягом 5 хвилин і потім залишали при цій температурі під аргоном на 22,5 години. Потім суміш охолоджували протягом 3,5 годин та упарювали у вакуумі. Очищення за допомогою хромато 53 графії на колонці на силікагелі, елююючи сумішшю гексан:етилацетат 10:1 7:1 5:1 3:1 1:1, давало зазначену в заголовку сполуку (D48). МС (ES+) m/е 559 [М+Н]+. Опис 49 1,1-Диметилетил-2-(4-піперидиніл)-4,5,7,8тетрагідропіразоло[3,4-d]азепін-6(2Н)-карбоксилат (D49) Суміш 1,1-диметилетил-2-[1-(фенілметил)-4піперидиніл]-3-{[(трифторметил)сульфоніл]-окси}3,3а,4,5,7,8-гексагідропіразоло[3,4-d]азепін-6(2Н)карбоксилату (може бути одержаний, як описано в Описі 48,355мг, 0,64ммоль) в етилацетаті (9мл) і метанолі (3мл) обробляли триетиламіном (0,443мл, 3,18ммоль) і потім Pd(OH)2/C (20% мас/мас, 70мг), і одержану суміш перемішували в атмосфері Н2 протягом 18,5 годин. Потім суміш фільтрували через кізельгур та упарювали у вакуумі. Очищення шляхом автоматичного поділу по масі давало зазначену в заголовку сполуку (D49). МС (ES+) m/е 321 [М+Н]+. Опис 50 1,1-Диметилетил-2-[1-(6-метил-3-піридиніл)-4піперидиніл]-4,5,7,8-тетрагідропіразоло-[3,4фзепін-6(2Н)-карбоксилат (D50) 1,1-Диметилетил-2-(4-піперидиніл)-4,5,7,8тетрагідропіразоло[3,4-d]азепін-6(2Н)-карбоксилат (може бути одержаний, як описано в Описі 49, 65мг, 0,21ммоль), 5-бром-2-метилпіридин (52мг, 0,30ммоль), ацетат паладію (5мг, 0,02ммоль), (+/-) BINAP (25мг, 0,04ммоль), трет-бутоксид натрію (39мг, 0,041ммоль) і діоксан (2мл) змішували та нагрівали до кипіння під аргоном і залишали при даній температурі на 14 годин. Після додаткових 1,5 годин додавали ще 5-бром-2-метилпіридин (1,5екв.), ацетат паладію (0,1екв.), (+/-) BINAP (0,2екв.) і трет-бутоксид натрію (2екв.) і суміш перемішували при кипінні під аргоном протягом додаткових 7 годин, потім суміш залишали остигати на 45 хвилин і потім розбавляли метанолом та очищали за допомогою SCX, елююючи метанолом, потім 2М метанол/NН3. Додатково очищали за допомогою (SPE(Si)), елююючи сумішшю дихлорметан:метанол 50:1 25:1 10:1. Подальше очищення шляхом автоматичного поділу по масі давало зазначену в заголовку сполуку (D50). МС (ES+) m/е 412 [М+Н]+. Приклад 1 N,N-Диметил-4-[6-(2-метилпропіл)-5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл]бензамід(Е1) Розчин N,N-диметил-4-(5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл)бензаміду (24,0мг, 0,085ммоль) (може бути одержаний, як описано в Описі 42) у дихлорметані (2мл) обробляли 2-метилпропаналєм (16,0мкл, 0,17ммоль) та оцтовою кислотою (1 крапля) і перемішували при кімнатній температурі. Додавали триацетоксиборгідрид натрію (36,0мг, 0,17ммоль) і суміш перемішували при кімнатній температурі приблизно 50 годин. Суміш розбавляли метанолом і пропускали 93047 54 через SCX-картридж, елююючи метанолом і потім 2М розчином аміаку в метанолі. Основні фракції поєднували та упарювали, що давало зазначену в заголовку сполуку (Е1). МС (ES+) m/е 357 + [M+NH3] . Приклад 2 N,N-Диметил-4-[6-(1-метилетил)-5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл]-бензамід (Е2) N,N-Диметил-4-[6-(1-метилетил)-5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл]бензамід (Е2) може бути одержаний з N,N-диметил-4(5,6,7,8-тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл)бензаміду (може бути одержаний, як описано в Описі 42, 24,0мг, 0,085ммоль), використовуючи процес, аналогічний описаному у прикладі 1, заміняючи 2-метилпропанал ацетоном. МС (ES+) m/е 327 [М+Н]+. Приклад 3 4-(6-Циклобутил-5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл)-N,Nдиметилбензамід (Е3) 4-(6-Циклобутил-5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл)-N,Nдиметилбензамід (Е3) може бути одержаний з N,N-диметил-4-(5,6,7,8-тетрагідропіразоло[3,4d]азепін-2(4Н)-іл)бензаміду (може бути одержаний, як описано в Описі 42, 24,0мг, 0,085ммоль), використовуючи процес, аналогічний описаному у прикладі 1, заміняючи 2-метилпропанал циклобутаноном. МС (ES+) m/е 339 [М+Н]+. Приклад 4 4-(6-Циклопентил-5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл)-N,Nдиметилбензамід (Е4) 4-(6-Циклопентил-5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл)-N,Nдиметилбензамід (Е4) може бути одержаний з N,N-диметил-4-(5,6,7,8-тетрагідропіразоло[3,4d]азепін-2(4Н)-іл)бензаміду (може бути одержаний, як описано в Описі 42, 24,0мг, 0,085ммоль), використовуючи процес, аналогічний описаному у прикладі 1, заміняючи 2-метилпропанал циклопентаноном. МС (ES+) m/е 353 [М+Н]+. Приклад 5 N-Метил-4-[6-(2-метилпроп1л)-5,6,7,8тетрагідропiразоло[3,4-d]азепiн-2(4Н)-iл]бензамiд (Е5) Розчин №метил-4-(5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл)бензаміду (може бути одержаний, як описано в Описі 25, 55 30,0мг, 0,11ммоль) у дихлорметані (3мл) обробляли 2-метилпропаналом (20,0мкл, 0,22ммоль) та оцтовою кислотою (1 крапля) і перемішували при кімнатній температурі. Додавали триацетоксиборгідрид натрію (47,0мг, 0,22ммоль) і суміш перемішували при кімнатній температурі протягом ночі. Суміш розбавляли метанолом і пропускали через SCX-картридж, елююючи метанолом і потім 2М розчином аміаку в метанолі. Основні фракції поєднували та упарювали, що давало зазначену в заголовку сполуку (Е5). МС (ES+) m/е 327 [М+ІМНз]+. Приклад 6 N-Метил-4-[6-(1-метилетил)-5,6,7,8тетрагідропiразоло[3,4-d]aзeпiн-2(4Н)-1л]бензамід (Е6) N-Meтил-4-[6-(1-мeтилeтил)-5,6,7,8тeтpaгiдpoпipaзoлo[3,4-d]aзeпiн-2(4H)-iл]бeнзaмiд (Е6) може бути одержаний з N-метил-4-(5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл)бензаміду (може бути одержаний, як описано в Описі 25,30,0мг, 0,11ммоль), використовуючи процес, аналогічний описаному у прикладі 5, заміняючи 2метилпропанал ацетоном. МС (ES+) m/е 313 [М+Н]+. Приклад 7 4-(6-Циклобутил-5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл)-Nметилбензамід (Е7) 4-(6-Циклобутил-5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл)-Nметилбензамід (Е7) може бути одержаний з Nмeтил-4-(5,6,7,8-тeтpaгiдpoпipaзoлo[3,4-d]aзeпiн2(4H)-iл)бeнзaмiдy (може бути одержаний, як описано в Описі 25,30,0мг, 0,11ммоль), використовуючи процес, аналогічний описаному у прикладі 5, заміняючи 2-метилпропанал циклобутаноном. МС (ES+) m/е 325 [М+Н]+. Приклад 8 4-(6-Циклопентил-5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл)-Nметилбензамід (Е8) 4-(6-Циклопентил-5,6,7,8тетрагідропіразоло[3,4-а]азепін-2(4Н)-іл)-Nметилбензамід (Е8) може бути одержаний з Nмeтил-4-(5,6,7,8-тeтpaгiдpoпipaзoлo[3,4-d]aзeпiн2(4H)-iл)бeнзaмiдy (може бути одержаний, як описано в Описі 25,30,0мг, 0,11ммоль), використовуючи процес, аналогічний описаному у прикладі 5, заміняючи 2-метилпропанал циклопентаноном. МС (ES+) m/е 339 [М+Н]+. Приклад 9 3-{4-[б-(1-Метилетил)-5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл]феніл}1,3-оксазолідин-2-он (Е9) 93047 56 Розчин 3-[4-(5,6,7,8-тетрагідропіразоло[3,4d]азепін-2(4Н)-іл)феніл]-1,3-оксазолідин-2-ону (25,0мг, 0,08ммоль, може бути одержаний, як описано в Описі 27) у дихлорметані (3мл) обробляли ацетоном (25,0мкл, 0,34ммоль) та оцтовою кислотою (1 крапля) і перемішували при кімнатній температурі. Додавали триацетоксиборгідрид натрію (72,0мг, 0,34ммоль) і суміш перемішували протягом 3 годин і ночі. Суміш розбавляли метанолом і пропускали через SCX-картридж, елююючи метанолом і потім 2М розчином аміаку в метанолі. Основні фракції поєднували та упарювали, що давало зазначену в заголовку сполуку (Е9). МС (ES+) m/е 341 [М+Н]+. Приклад 10 1-Метил-3-{4-[6-(1-метилетил)-5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл]феніл}-2імідазолідинон (Е10) Розчин 1-метил-3-[4-(5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл)феніл]-2імідазолідинону (може бути одержаний, як описано в Описі 29, 44,0мг, 0,14ммоль) у дихлорметані (3мл) обробляли ацетоном (41мкл, 0,56ммоль) та оцтовою кислотою (1 крапля) і перемішували при кімнатній температурі. Додавали триацетоксиборгідрид натрію (60,0мг, 0,28ммоль) і суміш перемішували протягом 3 годин і ночі та додавали додаткову порцію ацетону і триацетоксиборгідрид натрію. Суміш розбавляли метанолом і пропускали через SCX-картридж, елююючи метанолом і потім 2М розчином аміаку в метанолі. Основні фракції поєднували та упарювали, що давало зазначену в заголовку сполуку (E10). MC (ES+) m/e 354 [M+H]+. Приклад 11 1-Метил-3-{4-[6-(2-метилпропіл)-5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл]феніл}-2імідазолідинон (Е11) 1-Метил-3-{4-[6-(2-метилпропіл)-5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл]феніл}-2імідазолідинон (Е11) може бути одержаний з 1метил-3-[4-(5,6,7,8-тетрагідропіразоло[3,4-d]азепін2(4Н)-іл)феніл]-2-імідазолідинону (може бути одержаний, як описано в Описі 29, 44,0мг, 0,14ммоль), використовуючи процес, аналогічний описаному у прикладі 10, заміняючи ацетон 2метилпропаналом. МС (ES+) m/е 368 [М+Н]+. Приклад 12 1-[5-(6-Циклобутил-5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл)-2піридиніл]-2-піролідинон (Е12) 57 Метод А До розчину 1-[5-(5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл)-2піридиніл]-2-піролідинону (може бути одержаний, як описано в Описі 19, 12,0мг, 0,04ммоль) у дихлорметані (2мл) та оцтовій кислоті (2 краплі) додавали циклобутанон (5,0мкл, 0,06ммоль). Одержану суміш залишали перемішуватися при кімнатній температурі протягом 10 хвилин. Потім додавали триацетоксиборгідрид натрію (13,0мг, 0,06ммоль) і суміш перемішували протягом 1 години. Реакційну суміш розбавляли метанолом і застосовували SCX-картридж (Varian bond-elute, 5г), промивали метанолом і потім 2М аміаком/метанолом. Основні фракції поєднували, упарювали та додатково очищали шляхом хроматографії на силікагелі, елююючи сумішшю 2М аміаку в метанолі/дихлорметані (0-3%), що давало зазначену в заголовку сполуку (Е12). МС (ES+) m/е 352 [М+Н]+. Метод В До розчину 1-[5-(5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл)-2піридиніл]-2-піролідинону (може бути одержаний, як описано в Описі 19, 12,0мг, 0,04ммоль) у дихлорметані (2мл) та оцтовій кислоті (2 краплі) додавали циклобутанон (5,00мкл, 0,06ммоль), потім триацетоксиборгідрид натрію (13,0мг, 0,06ммоль), і суміш перемішували протягом 1 години). Одержану суміш залишали перемішуватися при кімнатній температурі протягом 1 години, розбавляли метанолом і пропускали через 5 м SCX-картридж, елююючи метанолом, потім 2М розчином аміаку в метанолі. Основні фракції поєднували, упарювали та очищали шляхом хроматографії, елююючи сумішшю 2М аміаку в метанолі та дихлорметану (03%), що давало продукт (Е12). МС (ES+) m/е 352 [М+Н]+. Метод С До розчину 1-[5-(5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл)-2піридиніл]-2-піролідинону (може бути одержаний, як описано в Описі 19,11мг, 0,04ммоль) у дихлорметані (3мл) додавали циклобутанон (6мкл, 0,08ммоль), потім оцтову кислоту (2 краплі) і триацетоксиборгідрид натрію (17мг, 0,08ммоль). Суміш перемішували при кімнатній температурі протягом 2 годин, потім розбавляли метанолом та очищали за допомогою SCX-картриджа, що давало зазначену в заголовку сполуку (Е12). МС (ES+) m/е 352 [М+Н]+. Приклад 13 1-[4-(6-Циклобутил-5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл)феніл]-2піролідинон (Е13) Метод А До розчину 1-[4-(5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл)феніл]-2 93047 58 піролідинону (може бути одержаний, як описано в Описі 22,10,0мг, 0,03ммоль) у дихлорметані (2мл) та оцтовій кислоті (2 краплі) додавали циклобутанон (4,0мкл, 0,05ммоль). Одержану суміш залишали перемішуватися при кімнатній температурі протягом 10 хвилин. Потім додавали триацетоксиборгідрид натрію (11,0мг, 0,05ммоль) і перемішування продовжували протягом 1 години. Реакційну суміш розбавляли метанолом і застосовували SCX-картридж (Varian bond-elute, 5г), промивали метанолом і потім сумішшю 2М аміак/метанол. Основні фракції поєднували, упарювали та додатково очищали шляхом хроматографії на силікагелі, елююючи сумішшю 2М аміаку в метанолі/дихлорметані (0-3%), що давало зазначену в заголовку сполуку (Е13). МС (ES+) m/е 351 [М+Н]+. Метод В До розчину 1-[4-(5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл)феніл]-2піролідинону (може бути одержаний, як описано в Описі 22, 32,0мг, 0,11ммоль) у дихлорметані (2мл) та оцтовій кислоті (2 краплі), додавали циклобутанон (12,0мкл, 0,16ммоль), потім приблизно через 10 хвилин додавали триацетоксиборгідрид натрію (34,0мг, 0,16ммоль). Суміш залишали перемішуватися при кімнатній температурі протягом 30 хвилин перед додаванням додаткової порції циклобутанону (12,0мкл, 0,16ммоль) і триацетоксиборгідриду натрію (34,0мг, 0,16ммоль). Після перемішування при кімнатній температурі протягом 30 хвилин реакцію гасили метанолом і пропускали через 2г SCX-картриджі, елююючи метанолом, потім 2М розчином аміаку в метанолі. Основні фракції поєднували та упарювали, що давало продукт (Е13). МС (ES+) m/е 351 [М+Н]+. Метод С Суміш 1-[4-(5,6,7,8-тетрагідропіразоло[3,4d]азепін-2(4Н)-іл)феніл]-2-піролідинону (може бути одержаний, як описано в Описі 22,65мг, 0,22ммоль) у дихлорметані (4мл) обробляли циклобутаноном (0,033мл, 0,44ммоль), потім триацетоксиборгідридом натрію (93мг, 0,44ммоль). Одержану суміш потім перемішували під аргоном протягом 14,25 годин. Потім суміш розбавляли метанолом (5мл) і очищали за допомогою SCX, елююючи метанолом і потім - сумішшю аміак/метанол (2М). Відповідні фракції поєднували, упарювали та затирали з діетиловим ефіром, що давало продукт (Е13). Приклад 14 1-{4-[6-(1-Метилетил)-5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл]феніл}-2піролідинон (Е14) До розчину 1-[4-(5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл)феніл]-2піролідинону (може бути одержаний, як описано в Описі 22, 45мг, 0,15ммоль) у дихлорметані (3мл) додавали ацетон (17мг, 0,30ммоль) та оцтову кис 59 лоту (2 краплі). Одержану суміш перемішували при кімнатній температурі під аргоном протягом 20 хвилин. Додавали триацетоксиборгідрид натрію (64мг, 0,30ммоль) і продовжували перемішування протягом 22 годин. Додавали додаткові 2екв. ацетону (17мг, 0,30ммоль), і після 20 хвилин додавали додаткові 2екв. триацетоксиборгідриду натрію (64мг, 0,30ммоль) та продовжували перемішування протягом 3 годин. Одержану неочищену суміш розбавляли метанолом та очищали за допомогою SCX, елююючи метанолом і потім - сумішшю 2М аміак/метанол. Основні фракції поєднували та розчинник упарювали у вакуумі. Неочищений продукт затирали в ефірі, фільтрували, потім затирали з етилацетатом, що давало зазначену в заголовку сполуку (Е14). МС (ES+) m/е 339 [М+Н]+. Приклад 15 6-(1-Метилетил)-2-[4-(3-метил-1,2,4оксадіазол-5-іл)феніл]-2,4,5,6,7,8гексагідропіразоло-[3,4-d]азепін (Е15) До розчину 2-[4-(3-метил-1,2,4-оксадіазол-5іл)феніл]-2,4,5,6,7,8-гексагідропіразоло[3,4-d]азепіну (може бути одержаний, як описано в Описі 35, 31мг, 0,10ммоль) у дихлорметані (4мл) додавали ацетон (24мг, 0,42ммоль) та оцтову кислоту (3 краплі). Одержану суміш перемішували при кімнатній температурі під аргоном протягом 20 хвилин. Додавали триацетоксиборгідрид натрію (89мг, 0,42ммоль) і продовжували перемішування протягом ночі. Одержану неочищену суміш розбавляли метанолом та очищали за допомогою SCX, елююючи метанолом і потім - сумішшю 2М аміак/метанол. Основні фракції поєднували та розчинник упарювали у вакуумі. Неочищений продукт очищали додатково за допомогою хроматографії на колонці на силікагелі, елююючи сумішшю 2М аміаку в метанолі/дихлорметані (0-1%). Одержаний неочищений продукт очищали додатково за допомогою хроматографії на колонці на силікагелі, елююючи сумішшю 2М аміаку в метанолі/дихлорметані (0-1%), що давало зазначену в заголовку сполуку (Е15). МС (ES+) m/е 338 [М+Н]+. Прикладів 4-[6-(2-Метилпропіл)-5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл]бензамід (Е16) До розчину 4-(5,6,7,8-тетрагідропіразоло[3,4d]азепін-2(4Н)-іл)бензаміду (може бути одержаний, як описано в Описі 37, 31мг, 0,12ммоль) у дихлорметані (3мл) додавали 2-метилпропаналь (17мг, 0,24ммоль) та оцтову кислоту (2 краплі). Одержану суміш перемішували при кімнатній температурі під аргоном протягом 20 хвилин. Додавали триацетоксиборгідрид натрію (51мг, 0,24ммоль) і перемішування продовжували протягом 2 годин. Одержану 93047 60 неочищену суміш розбавляли метанолом і потім очищали за допомогою SCX, елююючи метанолом і потім - сумішшю 2М аміак/метанол. Основні фракції поєднували та розчинник упарювали у вакуумі, що давало зазначену в заголовку сполуку (Е16). MC (ES+) m/e 313 [M+H]+. Приклад 17 4-[6-(1-Метилетил)-5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл]бензамід (Е17) До розчину 4-(5,6,7,8-тетрагідропіразоло[3,4d]азепін-2(4Н)-іл)бензаміду (може бути одержаний, як описано в Описі 37, 31мг, 0,12ммоль) у дихлорметані (3мл) додавали ацетон (14мг, 0,24ммоль) та оцтову кислоту (2 краплі). Одержану суміш перемішували при кімнатній температурі під аргоном протягом 20 хвилин. Додавали триацетоксиборгідрид натрію (51мг, 0,24ммоль) і перемішування продовжували протягом 2 годин. Додавали додаткові 6екв. ацетону та перемішування продовжували протягом двох днів. Додавали метанол і неочищену суміш очищали за допомогою SCX, елююючи метанолом і потім 2М аміаком/метанолом. Основні фракції поєднували та розчинник упарювали у вакуумі. Неочищений продукт затирали з ефіром і фільтрували, що давало зазначену в заголовку сполуку (Е17). МС (ES+) m/е 299 [М+Н]+. Приклад 18 1-[4-(6-Етил-5,6,7,8-тетрагідропіразоло[3,4d]азепін-2(4Н)-іл)феніл]-2-піролідинон (Е18) До розчину 1-[4-(5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл)феніл]-2піролідинону (може бути одержаний, як описано в Описі 22,50мг, 0,17ммоль) в етанолі (5мл) додавали карбонат калію (70мг, 0,51ммоль) та йодетан (53мг, 0,34ммоль). Одержану суміш нагрівали до кипіння під аргоном протягом 18 годин. Додавали додаткові 3екв. карбонату калію в етанолі (2мл) і перемішування продовжували протягом двох днів. Завершували нагрівання реакції та додавали етанол (~20мл). Реакцію очищали за допомогою SCX, елююючи метанолом і потім - сумішшю 2М аміак/метанол. Основні фракції поєднували та розчинник упарювали у вакуумі. Одержаний неочищений продукт очищали додатково за допомогою хроматографії на колонці на силікагелі, елююючи сумішшю метанол у дихлорметані (100:1-10:1), що давало зазначену в заголовку сполуку (Е18). МС (ES+) m/е 325 [М+Н]+. Приклад 19 1-{4-[6-(Циклопропілметил)-5,6,7,8тетрагідропіразоло[3,4-d]азепін-2(4Н)-іл]феніл}-2піролідинон (Е19)
ДивитисяДодаткова інформація
Назва патенту англійськоюPyrazolo [3,4-d] azepine derivatives as histamine h3 antagonists
Автори англійськоюBamford Mark James, Wilson David Matthew
Назва патенту російськоюПроизводные пиразоло[3,4-d]азепина как антагонисты н3-рецепторов гистамина
Автори російськоюБемфорд Марк Джеймс, Уилсон Девид Меттью
МПК / Мітки
МПК: C07D 487/04, A61K 31/55, A61P 25/28
Мітки: н3-рецепторів, гістаміну, піразоло[3,4-d]азепіну, похідні, антагоністи
Код посилання
<a href="https://ua.patents.su/38-93047-pokhidni-pirazolo34-dazepinu-yak-antagonisti-n3-receptoriv-gistaminu.html" target="_blank" rel="follow" title="База патентів України">Похідні піразоло[3,4-d]азепіну як антагоністи н3-рецепторів гістаміну</a>