Біотехнологічний спосіб отримання харчових добавок із панцеровмісної сировини
Номер патенту: 21454
Опубліковано: 15.03.2007
Автори: Шум Лариса Сергіївна, Озоліна Софія Олександрівна, Черно Наталія Кирилівна
Формула / Реферат
Спосіб отримання харчових добавок із панцеровмісної сировини шляхом ферментного гідролізу білків протеолітичними ферментами, який передбачає обробку білка ферментними препаратами комплексної дії і гідроліз білка, який відрізняється тим, що ферментативний гідроліз білка проводять промисловими комплексними ферментними препаратами: панкреатином, протосубтиліном та лужною протеазою.
Текст
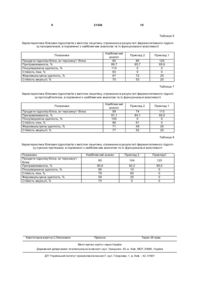
Спосіб отримання харчових добавок із панцеровмісної сировини шляхом ферментного гідролізу 3 21454 ваних панцерів, які не піддавались термічній обробці. Для цього панцеровмісну сировину сушать при температурі 40°С, після чого подрібнюють на лабораторному млині. Подрібнену панцеровмісну сировину з діаметром часток d≤1мм піддають демінералізації 2,0М розчином хлороводневої кислоти для видалення мінеральних речовин при температурі 0°С в співвідношенні твердого матеріалу і рідини 1:10 протягом 24 годин, періодично при цьому переміщуючи. Далі проводять фільтрацію через нейлонову тканину. Твердий залишок промивають дистильованою водою до встановлення нейтрального рН середовища. Демінералізовану панцеровмісну сировину сушать при температурі 40°С. Екстрагування білка здійснюють 2,0% розчином гідроксиду натрію при мінімальному співвідношенні твердої речовини і рідини 1:4 протягом 6 годин при температурі 18-20°С. Для підвищення 4 ефективності виходу білка в розчин використовують як поверхнево-активну речовину лецитин з концентрацією 0,2% в лужному розчині. По закінчені процесу екстрагування для нейтралізації лужного середовища додають 2М розчин хлороводневої кислоти. В ізоляті визначають загальну кількість білка методом Лоурі при довжині хвилі 750нм по кривій, побудованій для модельного білка альбуміну. Вилучений білок характеризують додатково за його амінокислотним складом, перетравлюваністю і визначають його функціональні властивості (піноутворюючу здатність, стійкість піни, жироемульгуючу здатність, стійкість емульсії). Величина виходу білка в розчин, характеристики його амінокислотного складу, перетравлюваність і функціональні властивості отриманого ізоляту представлені в таблицях 1, 2. Таблиця 1 Вихід білка в розчин при екстрагуванні його із де мінералізованої панцеровмісної сировини, його перетравлюваність та функціональні властивості Показники Кількість екстрагованого білка, % Мг тирозину/ г білка Претравлюваність, % Піноутворююча здатність, % Стійкість піни, % Жироемульгуюча здатність, % Стійкість емульсії, % Демінералізована панцеровмісДемінералізована панцеровміс- на сировина (екстрагування луна сировина (екстрагування чисжним розчином в присутності тим лужним розчином) лецитину) 58,0 55,0 55 55 83,4 84,2 40 12 62 58 20 33 17 22 Таблиця 2 Амінокислотний склад білка, вилученого із демінералізованої панцеровмісної сировини, % Амінокислота Лізин Гістидин Аргінін Аспарагінова кислота Треонін Серин Глутамінова кислота Пролін Гліцин Аланін Валін Ізолейцин Лейцин Тирозин Фенілаланін Цистин Метионін Масова частка амінокислоти від маси білка, % 4,10-5,05 3,50-3,20 7,50-6,15 9,15-8,30 4,30-4,90 4,90-5,50 16,50-16,75 1,90-2,50 8,25-10,25 7,45-7,90 7,30-4,70 3,90-4,70 6,75-7,60 2,75-3,80 4,00-4,60 сл. 0,70-1,00 5 21454 В більшості випадків білкові ізоляти, отримані із вторинних сировинних джерел, мають незначні функціональні властивості. Поліпшення функціональних властивостей білка може значно розширити спектр їх використання у складі харчових продуктів. В практиці для покращення функціональних властивостей малорозчинних або нерозчинних в воді білків застосовують різноманітні методи модифікації. Одним із виправданих методів модифікації білкових речовин є ферментативний гідроліз в умовах обмеженого часу. Відомий спосіб ферментативної обробки соєвого білка ферментними препаратами пепсином і трипсином протягом 3 години при рН1,2 і 8,0, відповідно. Також ефективним способом модифікації білка є його комплексоутворення з високомолекулярними полісахаридами, наприклад, метоксильованим пектином, і подальший ферментативний гідроліз трипсином протягом 3 годин [Дьяконова А.К. Научные основы технологий консервированных продуктов с использованием структурообразователей: Дис. док. техн. наук /ОН АПТ.– Одесса, 2006. –385с.]. Недоліки даних методів полягають в тому, що тривалий ферментативний гідроліз білка більше 3 годин призводить до накопичення гірких пептидів, та й існують певні ускладнення відносно використання ферментних препаратів, які відрізняються специфічністю дії щодо білкового субстрату. Найбільш близьким до заявленого є метод обмеженого ферментного гідролізу нерозчинних в воді білків протеолітичними ферментами тваринного походження, зокрема протосубтиліном Г 3Х. Гідроліз білка (денатурованого альбуміну курячого яйця) проводять в термостаті з магнітною мішалкою при температурі процесу 30-50°С, куди вносять в рівних об'ємах білок 0-50мг/см 3 і фермент 040мг/см 3 при величині рН середовища 6,5-8,5. Гідроліз в відібраних пробах зупиняють додаванням до аліквот 10-кратного об'єму 10%-ного розчину трихлороцтової кислоти [Бабаян Т.Л. Способ оценки протеиназной активности комплексного ферментного препарата по данным кинетики протеолиза модельного белкового субстрата /Т.Л. Бабаян, В.К. Латов //Биотехнология. –2003.–№6.– с.47-51.]. Даний спосіб обрано найближчим аналогом. Найближчий аналог і корисна модель, що заявляється, мають такі спільні ознаки: - обробка білка ферментним препаратом комплексної дії; - гідроліз білка; - протягом кожного часу ферментоліз зупиняють додаванням розчину трихлороцтової кислоти і контролюють глибину гідролізу білка за накопиченням азотовмісних сполук. Але наведений спосіб має такі недоліки. Так, початкові концентрації ферменту не забезпечують необхідної глибини протеолізу нерозчинного в воді альбуміну і для її підвищення через 2 години після початку процесу додатково добавляють в еквімолярній кількості до субстрату фермент – це, в свою чергу, збільшує витрати ферментного препарату. 6 В основу корисної моделі поставлено задачу покращити функціональні властивості білкових ізолятів шляхом їх модифікації ферментативним гідролізом промисловими комплексними ферментними препаратами вітчизняного виробництва: панкреатином, протосубтиліном, лужною протеазою. Поставлена задача вирішена в способі ферментного гідролізу білків протеолітичними ферментами, що передбачає обробку білка ферментними препаратами комплексної дії і гідроліз білка тим, що ферментативний гідроліз білка проводять промисловими комплексними ферментними препаратами: панкреатином, протосубтиліном та лужною протеазою. Концентрацію ферментів підбирають таким чином, щоб забезпечити однакову їх активність відносно 2%-вого білкового субстрату. Ферментативний гідроліз ведуть протягом 1-6г при температурі 37°С для панкреатину, 40°С – для протосубтиліну, 45°С – для лужної протеази, при рН середовища 7,5 для панкреатину і протосубтиліну, а також при рН9,0 – для лужної протеази. Після ферментативного гідролізу після проходження кожного часу контролюють глибину гідролізу білка спектрофотометричне по накопиченню тирозину в робочій суміші при довжині хвилі 670нм і відразу вивчають їх функціональні властивості (піноутворюючу здатність, стійкість піни, жироемульгуючу здатність, стійкість емульсії). Важливими показниками отриманих білкових речовин є їх перетравлювання, яке визначають за ступенем деструкції білка під дією травних ферментів в умовах, близьких до фізіологічних процесів перетравності білка в шлунково-кишковому тракті. Заявлений спосіб виконується наступним чином. Приклад 1. В отриманих білкових ізолятах при оптимальних умовах моделюють однакову концентрацію білка 2% в однаковому об'ємі розчину наступним чином: ізоляти центрифугують в лабораторній центрифузі при частоті обертів 5000об/хв. протягом 20хв., далі додають 0,05М фосфатний буфер (рН7,5 для панкреатину і протосубтиліну, рН9,0 для лужної протеази) з розрахунком, щоб кінцева концентрація білка в розчині становила 2мг/см 3. До аліквот 2%-вого білкового ізоляту додають наважки ферментних препаратів, враховуючи при цьому активність кожного окремо. Таким чином, концентрація ферментів в робочому об'ємі розчину становить: панкреатину – 0,1%, протосубтиліну – 0,3%, лужної протеази – 0,5%, що забезпечують активність 28,3 протеолітичних одиниць/г білка, вилученого із панцеровмісної сировини. Ферментативний гідроліз панкреатином, протосубтиліном, лужною протеазою ведуть протягом 6 годин при відповідній температурі для кожного препарату 37, 40 і 45°С. По закінчені ферментації гідролізати направляють для визначення функціональних властивостей. Одночасно гідроліз в відібраних пробах 1см 3 зупиняють додаванням до аліквот в еквімолярній кількості 5%-вого розчину трихлороцтової кислоти і далі фільтрують через паперовий фільтр. Кількість розчинених в фільтраті низько 7 21454 молекулярних білків визначають спектрофотометричне за приростом тирозину, використовуючи метод Лоурі з реактивом Фоліна при довжині хвилі 670нм. Величину перетравлюваності протеїну травними ферментами визначають в модельній системі пепсин - трипсин. Для цього до розчину білка в кількості 15см 3, які містять 150мг білка, вносили 2М розчин соляної кислоти і доводили рН середовища до 1,2-2,0. Далі експериментальні розчини поміщають в термостат до досягнення температури 37°С і вносять 15мг кристалічного пепсину. Ферментний гідроліз ведуть протягом 4 годин. Далі рідину нейтралізують 0,4см 3 8,0%-вого розчину гідроксиду натрію, після чого додають 15см 3 0,02Н NаНСО3 (рН8,2). В розчин вносять 15мг кристаліч 8 ного трипсину і витримують у термостаті протягом 4 годин при температурі 37°С. Гідроліз в відібраних аліквотах 1см 3 зупиняють додаванням 1см 3 5%-вого розчину трихлороцтової кислоти. Показники функціональних властивостей і характеристика отриманих білкових гідролізатів приведені в табл. 3, 4, 5, 6, 7, 8. Приклад 2 виконується аналогічно прикладу 1. У прикладі 1 брали максимальні заявлені значення. У прикладі 2 брали оптимальні значення заявлені у формулі корисної моделі: у випадку ферментативного гідролізу панкреатином час процесу становить 1 годину, при ферментації протосібтиліном – 2 години, лужною протеазою – 1 година. Таблиця 3 Характеристика білкових гідролізатів, отриманих в результаті ферментативного гідролізу панкреатином, в порівнянні з найближчим аналогом та їх функціональні властивості Показники Продукти гідролізу білка, мг тирозину/ г білка Претравлюваність, % Піноутворююча здатність, % Стійкість піни, % Жироемульгуюча здатність, % Стійкість емульсії, % Найближчий аналог 80 89,7 114 83 67 70 Приклад 2 Приклад 1 92 88,7 43 58 32 43 144 99,4 18 0 37 20 Таблиця 4 Характеристика білкових гідролізатів, отриманих в результаті ферментативного гідролізу протосубтиліном, в порівнянні з найближчим аналогом та їх функціональні властивості Показники Продукти гідролізу білка, мг тирозину/ г білка Претравлюваність, % Піноутворююча здатність, % Стійкість піни, % Жироемульгуюча здатність, % Стійкість емульсії, % Найближчий аналог 99 91,1 100 88 71 77 Приклад 2 Приклад 1 94 89,4 50 61 25 24 126 95,3 38 0 11 19 Таблиця 5 Характеристика білкових гідролізатів, отриманих в результаті ферментативного гідролізу лужною протеазою, в порівнянні з найближчим аналогом та їх функціональні властивості Показники Продукти гідролізу білка, мг тирозину/ г білка Претравлюваність, % Піноутворююча здатність, % Стійкість піни, % Жироемульгуюча здатність, % Стійкість емульсії, % Найближчий аналог 85 90,8 95 78 59 75 Приклад 2 Приклад 1 87 87,2 35 55 22 18 135 97,0 12 0 0 0 9 21454 10 Таблиця 6 Характеристика білкових гідролізатів з вмістом лецитину, отриманих в результаті ферментативного гідролізу панкреатином, в порівнянні з найближчим аналогом та їх функціональні властивості Найближчий аналог 80 89,7 114 83 67 70 Показники Продукти гідролізу білка, мг тирозину/ г білка Претравлюваність, % Піноутворююча здатність, % Стійкість піни, % Жироемульгуюча здатність, % Стійкість емульсії, % Приклад 2 Приклад 1 80 85,7 0 0 72 53 125 95,8 0 0 25 20 Таблиця 7 Характеристика білкових гідролізатів з вмістом лецитину, отриманих в результаті ферментативного гідролізу протосубтиліном, в порівнянні з найближчим аналогом та їх функціональні властивості Найближчий аналог 99 91,1 100 88 71 77 Показники Продукти гідролізу білка, мг тирозину/ г білка Претравлюваність, % Піноутворююча здатність, % Стійкість піни, % Жироемульгуюча здатність, % Стійкість емульсії, % Приклад 2 Приклад 1 74 84,1 0 61 49 52 113 92,0 0 0 20 20 Таблиця 8 Характеристика білкових гідролізатів з вмістом лецитину, отриманих в результаті ферментативного гідролізу лужною протеазою, в порівнянні з найближчим аналогом та їх функціональні властивості Показники Продукти гідролізу білка, мг тирозину/ г білка Претравлюваність, % Піноутворююча здатність, % Стійкість піни, % Жироемульгуюча здатність, % Стійкість емульсії, % Комп’ютерна в ерстка C.Литв иненко Найближчий аналог Приклад 2 Приклад1 85 104 125 90,8 95 78 59 75 92,2 10 60 25 0 95,0 0 0 0 0 Підписне Тираж 26 прим. Міністерство осв іт и і науки України Держав ний департамент інтелектуальної в ласності, вул. Урицького, 45, м. Київ , МСП, 03680, Україна ДП “Український інститут промислов ої в ласності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюBiotechnological process for preparation of food additives from shell-containing raw material
Автори англійськоюCherno Natalia Kyrylivna, Ozolina Sofia Oleksandrivna
Назва патенту російськоюБиотехнологический способ получения добавок из панциресодержащего сырья
Автори російськоюЧерно Наталья Кирилловна, Озолина София Александровна
МПК / Мітки
МПК: A23L 1/03
Мітки: харчових, отримання, біотехнологічний, добавок, спосіб, панцеровмісної, сировини
Код посилання
<a href="https://ua.patents.su/5-21454-biotekhnologichnijj-sposib-otrimannya-kharchovikh-dobavok-iz-pancerovmisno-sirovini.html" target="_blank" rel="follow" title="База патентів України">Біотехнологічний спосіб отримання харчових добавок із панцеровмісної сировини</a>
Попередній патент: Спосіб виробництва рибного білкового ізоляту
Наступний патент: Пристрій для видалення окалини із плоского прокату
Випадковий патент: Лікарська композиція для локального лікування запальних захворювань суглобів та м'язів