Сполуки імідазо[1,2-а]піридину як інгібітори тирозинкінази рецепторів
Номер патенту: 101611
Опубліковано: 25.04.2013
Автори: Мансон Марк К., Ліссікатос Джозеф П., Аллен Шеллі, Ріцці Джеймс П., рещук Джулі Марі, Келлен Ніколас К., Чжао Цян, Шлахтер Стівен Т., Робінсон Джон І., Мармсетер Фредерік П., Топалов Ґеорґе Т.
Формула / Реферат
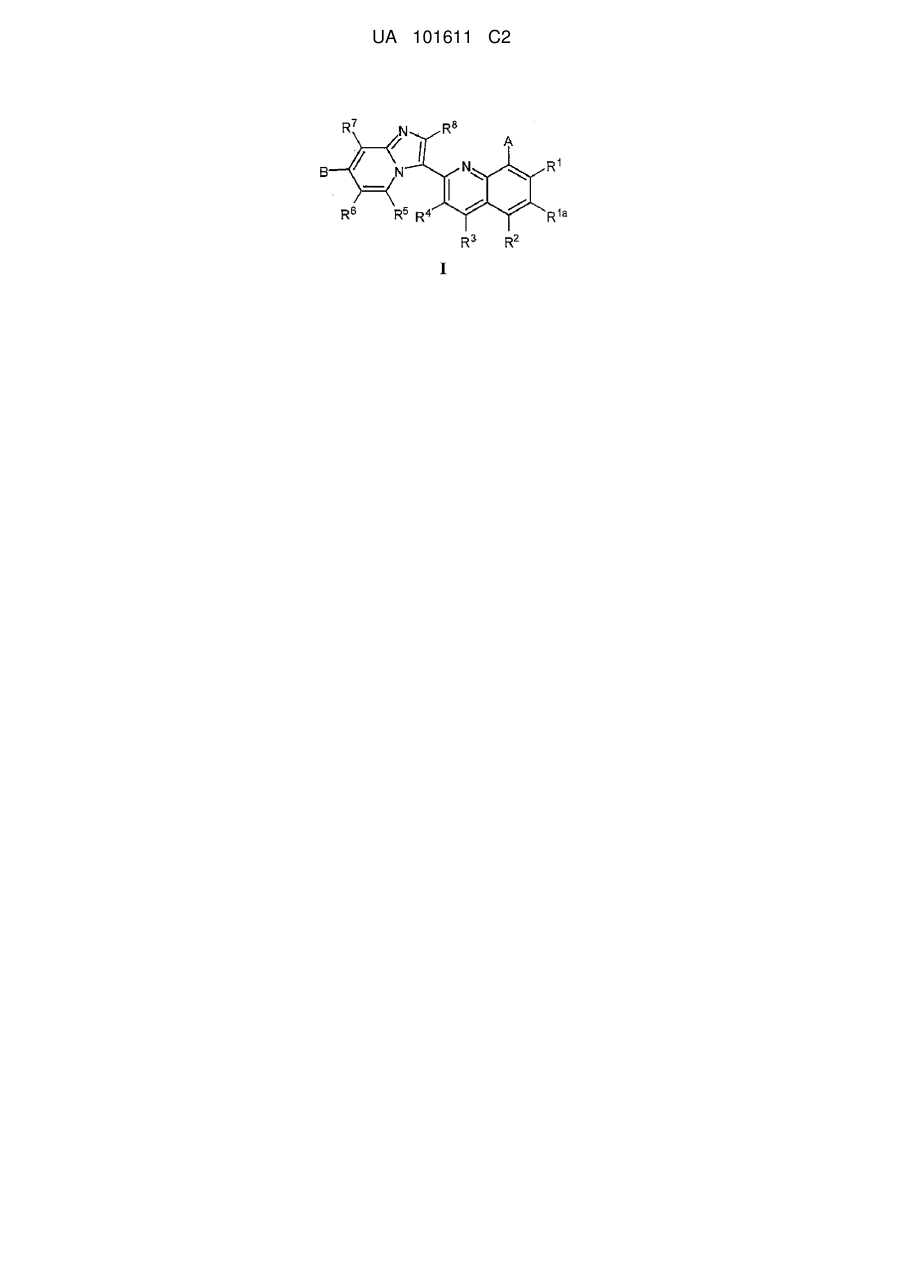
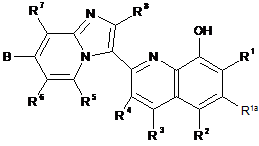
1. Сполука загальної формули І
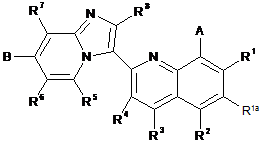 I
I
або її фармацевтично прийнятна сіль, де:
А - -Z(CH2)р-(hetCyc2a), -Z-(hetCyc2b), Z-R10 або Z-R11;
Z - О або NH;
р дорівнює 0, 1 або 2;
hetCyc2a - 5- або 6-членне гетероциклічне кільце, що містить один або два гетероатоми, які незалежно вибрані з О та N, та необов'язково заміщене одним або більше R9;
hetCyc2b - 7-12-членна аза-спіроциклічна або місткова діаза-гетероциклічна кільцева система, необов'язково заміщена одним або більше R9;
R10 - (1-6С)алкіл, заміщений NR'R";
R11- (5-6С)циклоалкіл, заміщений NR'R";
B - ORh, hetAr2 або (1-3С)алкіл;
R1, R2, R3 та R4 незалежно - Н, F, Me, Et, ізопропіл або hetAr3;
R1a - H, F або Сl;
R5, R6, R7 тa R8 - H;
кожен R9 незалежно вибраний з наступного: галоген, (1-6С)алкіл, ORa та С(О)О(1-6Салкіл);
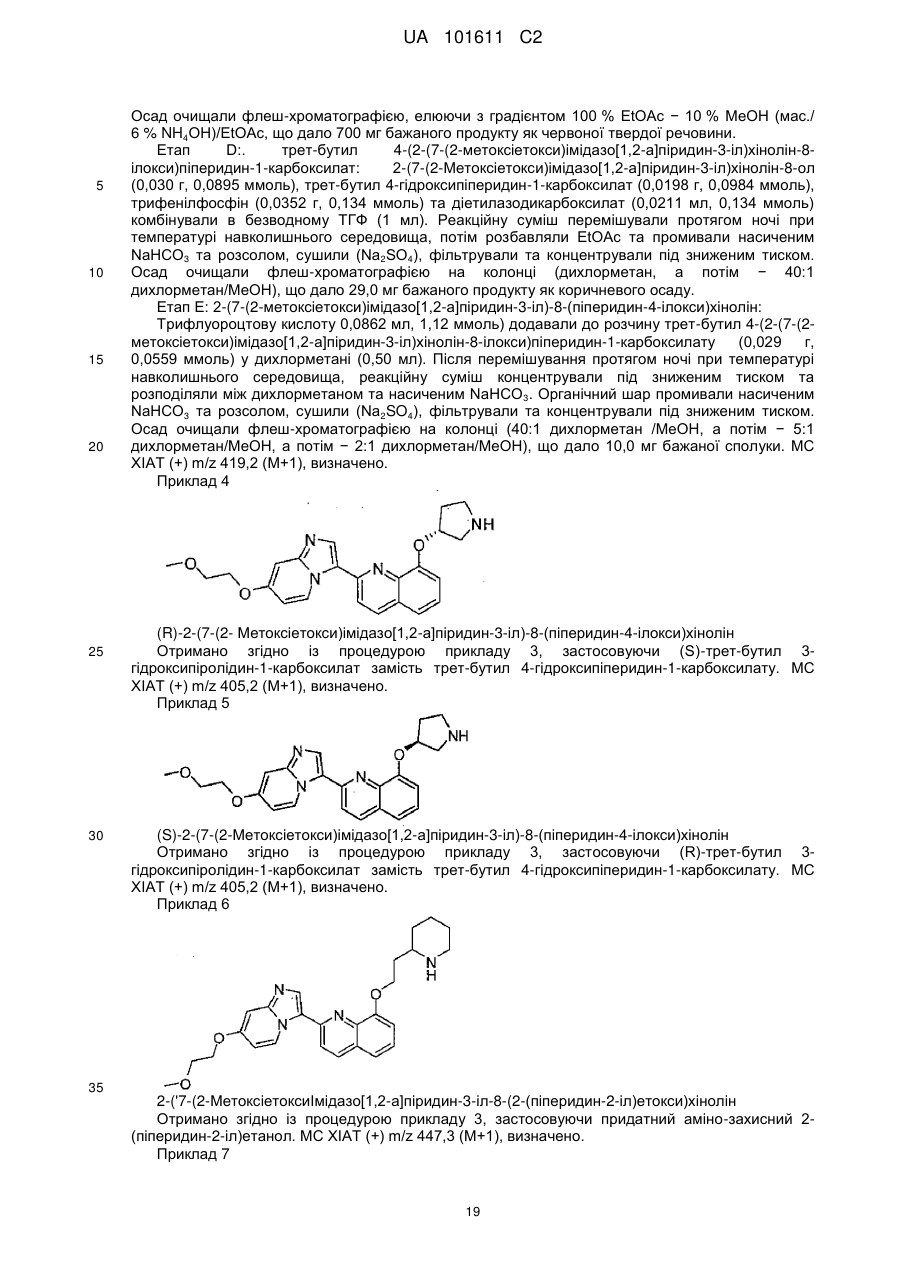
кожен Ra незалежно - Н або (1-6С)алкіл;
Rh - Н, (1-6Салкіл)-(3-6Сциклоалкіл), (1-6Салкіл)-О-(1-6Салкіл) або hetCyc4;
hetCyc4 - 5- або 6-членне гетероциклічне кільце, що містить один або два гетероатоми, які незалежно вибрані з О та N, та необов'язково заміщене наступною групою: ОН або -О-(1-6Салкіл);
hetAr2 - 5-6-членний гетероарил, що містить 1-2 атоми нітрогену;
hetAr3 - 5-6-членний гетероарил, що містить атом нітрогену та необов'язково містить другий гетероатом, вибраний з О та N;
та
R' та R" незалежно - Н або (1-6С)алкіл,
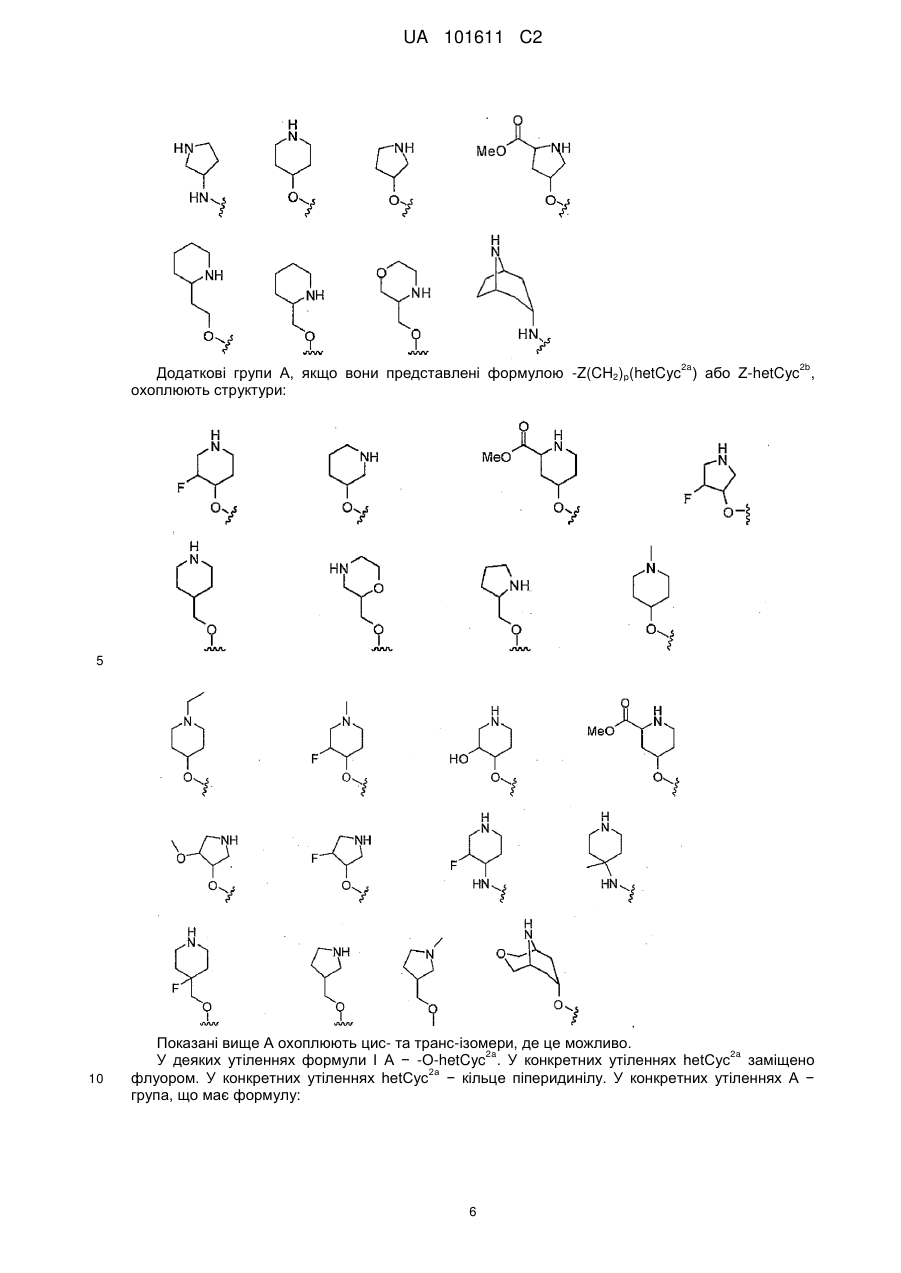
2. Сполука за п. 1, де А - -NH(hetCyc2a), -NH-(CH2)-hetCyc2a або -NH-(CH2)2-hetCyc2a, де вказане hetCyc2a необов'язково заміщено одним або більше R9.
3. Сполука за п. 1, де А - -O-hetCyc2a, -O-(CH2)-hetCyc2a або -O-(CH2)2-hetCyc2a, де вказане hetCyc2a необов'язково заміщено одним або більше R9.
4. Сполука за будь-яким із пп. 1-3, де hetCyc2a необов'язково заміщено одною або більше групами R9, незалежно вибраними з наступного: галоген, -С(О)О(1-6Салкіл), (1-6Салкіл) та -ORa.
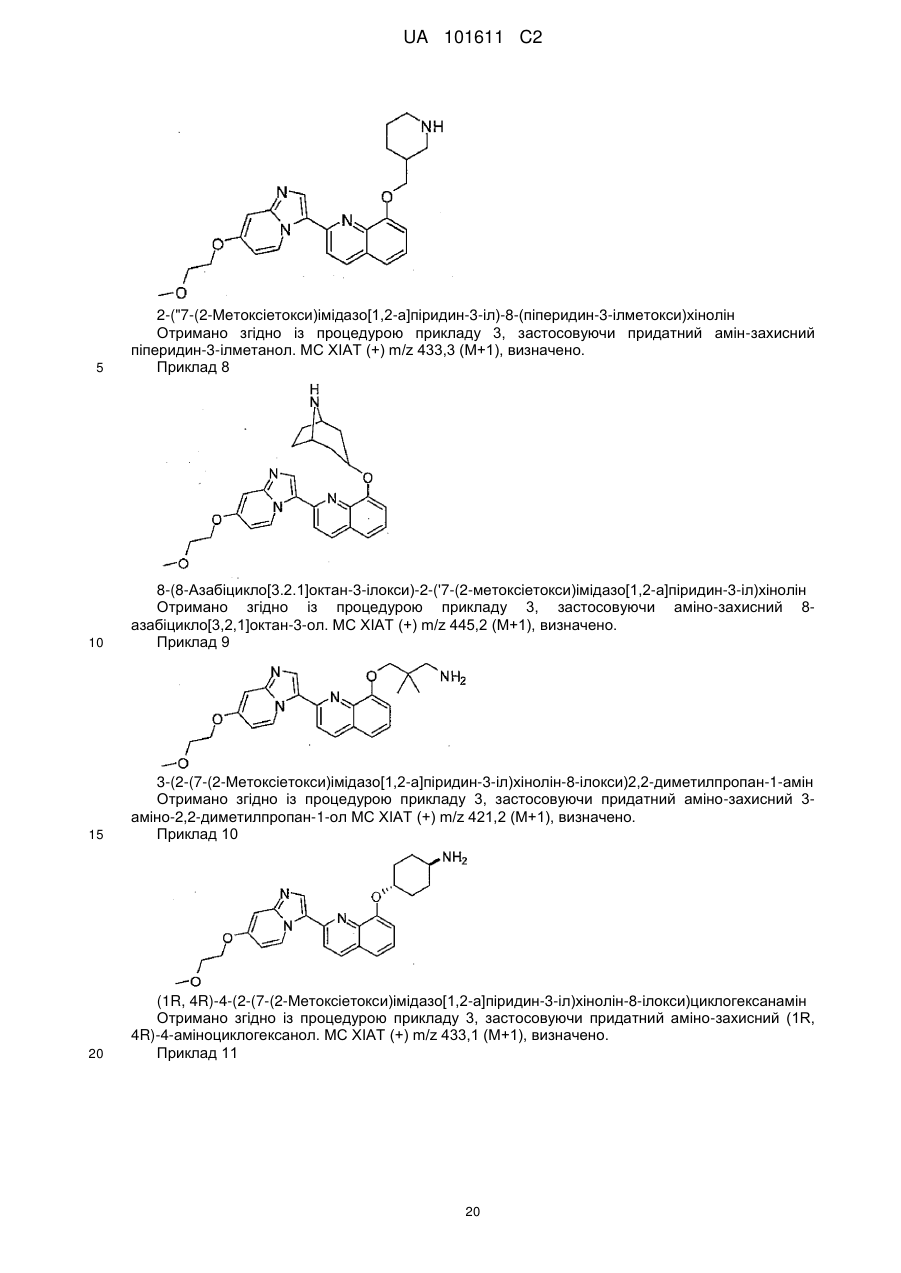
5. Сполука за п. 4, де hetCyc2a необов'язково заміщено одною або більше групами R9, незалежно вибраними з наступного: F, метил, ОН, -С(О)2Ме та ОМе.
6. Сполука за будь-яким із пп. 1-5, де hetCyc2a - кільце піролідинілу, піперидинілу або морфолінілу, необов'язково заміщене одною або більше групами R9.
7. Сполука за п. 1, де А - -O-hetCyc2a, та hetCyc2a - кільце піперидинілу, заміщене флуором.
8. Сполука за п. 1, де А - -NH(hetCyc2b) або -O-(hetCyc2b), де вказане hetCyc2b необов'язково заміщено одною або більше групами R9.
9. Сполука за п. 8, де heCyc2b є 7-11-членний містковий аза- або діаза-гетероцикл, необов'язково заміщений одною або більше групами R9.
10. Сполука за будь-якими із пп. 8, 9, де R9 вибраний з наступного: галоген, (1-6Салкіл), ОН та -О-(1-6Салкіл).
11. Сполука за будь-якими із пп. 8-10, де R9 вибраний з F, Me та ОН.
12. Сполука за п. 1, де А - Z-R10.
13. Сполука за п. 1, де А - Z-R11.
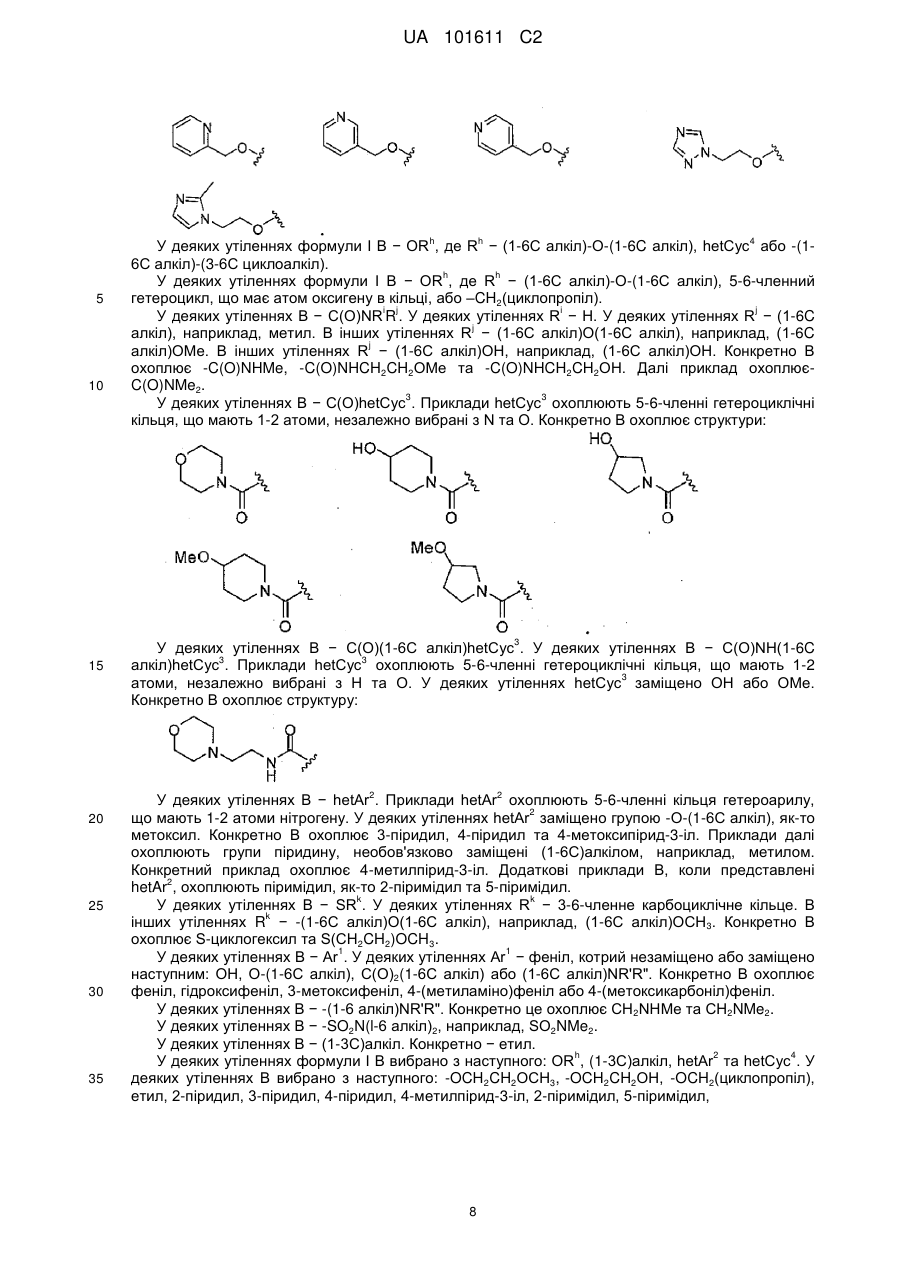
14. Сполука за будь-яким з пунктів 1-13, де В вибраний з наступного: -ОСН2СН2ОСН3, -ОСН2СН2ОН, -ОСH2(циклопропіл), етил, 2-піридил, 3-піридил, 4-піридил, 2-піримідил,
 або
або  .
.
15. Сполука за будь-яким із пп. 1-13, де В - ORh.
16. Сполука за п. 15, де В вибраний з наступного: -ОСН2СН2ОСН3, -ОСН2СН2ОН, -ОСН2(циклопропіл),
 або
або  .
.
17. Сполука за п. 16, де В - -ОСН2СН2ОСН3.
18. Сполука за будь-яким із пп. 1-13, де В - hetAr2.
19. Сполука за п. 18, де В вибраний з наступного: 2-піридил, 3-піридил, 4-піридил, 2-піримідил.
20. Сполука за п. 19, де В - 3-піридил.
21. Сполука за будь-яким із пп. 1-20, де R2 - Набо F.
22. Сполука за будь-яким із пп. 1-21, де R3 - Н, метил або оксазоліл.
23. Сполука за будь-яким із пп. 1-22, де R1 гідроген.
24. Сполука формули І за будь-яким із пп. 1-23 або її фармацевтично прийнятна сіль для застосування в лікуванні раку.
25. Сполука формули І за будь-яким із пп. 1-23 або її фармацевтично прийнятна сіль для застосування в лікуванні фіброзу.
26. Фармацевтична композиція, котра містить сполуку формули І за будь-яким із пп. 1-23 або її фармацевтично прийнятну сіль та фармацевтично прийнятний розріджувач або носій.
27. Спосіб лікування раку в ссавця, при якому ссавцю вводять терапевтично ефективну кількість сполуки формули І за будь-яким із пп. 1-23 або її фармацевтично прийнятної солі.
28. Спосіб лікування фіброзу в ссавця, при якому ссавцю вводять терапевтично ефективну кількість сполуки формули І за будь-яким із пп. 1-23 або її фармацевтично прийнятної солі.
29. Спосіб отримання сполуки за п. 1, при якому здійснюють:
для сполуки формули І, де А - -NH-(CH2)n(hetCyc2a), -NH-(hetCyc2b), -NHR10 або -NHR11,
реакцію сполучення відповідної сполуки, що має формулу II
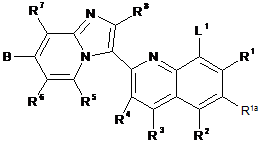 , ІІ
, ІІ
де L1 - відщеплювана група або атом, зі сполукою, що має формулу H2N-(CH2)nhetCyc2a, H2N-hetCyc2b, NH2R10 або NH2R11, застосовуючи паладієвий каталізатор та ліганд, у присутності основи;
та видалення будь-якої захисної групи або груп та необов'язково утворення солі.
30. Сполука за п. 1, що вибрана з групи:
(R)-2-(7-(2-метоксіетоксі)імідазо[1,2-а]піридин-3-іл)-N-(піролідин-3-іл)хінолін-8-амін;
(S)-2-(7-(2-метоксіетоксі)імідазо[1,2-а]піридин-3-іл)-N-(піролідин-3-іл)хінолін-8-амін;
2-(7-(2-метоксіетоксі)імідазо[1,2-а]піридин-3-іл)-8-(піперидин-4-ілокси)хінолін;
(R)-2-(7-(2-метоксіетоксі)імідазо[1,2-а]піридин-3-іл)-8-(піролідин-3-ілокси)хінолін;
(S)-2-(7-(2-метоксіетоксі)імідазо[1,2-а]піридин-3-іл)-8-(піролідин-3-ілокси)хінолін;
2-(7-(2-метоксіетоксі)імідазо[1,2-а]піридин-3-іл)-8-(2-(піперидин-2-іл)етокси)хінолін;
2-(7-(2-метоксіетоксі)імідазо[1,2-а]піридин-3-іл)-8-(піперидин-3-ілметокси)хінолін;
8-(8-азабіцикло[3.2.1]октан-3-ілокси)-2-(7-(2-метоксіетоксі)імідазо[1,2-а]піридин-3-іл)хінолін;
3-(2-(7-(2-метоксіетоксі)імідазо[1,2-а]піридин-3-іл)хінолін-8-ілокси)-2,2-диметилпропан-1-амін;
(1R,4R)-4-(2-(7-(2-метоксіетоксі)імідазо[1,2-а]піридин-3-іл)хінолін-8-ілокси)циклогексанамін;
(2S,4R)-мeтил-4-(2-(7-(2-метоксіетоксі)імідазо[1,2-а]піридин-3-іл)хінолін-8-ілокси)піролідин-2-карбоксилат;
(2S,4S)-мeтил-4-(2-(7-(2-метоксіетоксі)імідазо[1,2-а]піридин-3-іл)хінолін-8-ілокси)піролідин-2-карбоксилат;
(S)-3-((2-(7-(2-метоксіетоксі)імідазо[1,2-а]піридин-3-іл)хінолін-8-ілокси)метил)морфолін;
8-((цис)-4-флуоропіролідин-3-ілокси)-2-(7-(2-метоксіетоксі)імідазо[1,2-а]піридин-3-іл)хінолін;
3-(2-(7-(2-метоксіетоксі)імідазо[1,2-а]піридин-3-іл)хінолін-8-ілокси)-N,N,2,2-тетраметилпропан-1-амін;
2-((2-(7-(2-метоксіетоксі)імідазо[1,2-а]піридин-3-іл)хінолін-8-ілокси)метил)морфолін;
2-(7-(2-метоксіетоксі)імідазо[1,2-а]піридин-3-іл)-8-(піперидин-4-ілметокси)хінолін;
7-(2-(7-(2-метоксіетоксі)імідазо[1,2-а]піридин-3-іл)хінолін-8-ілоксі)-3-окса-9-азабіцикло[3.3.1]нонан;
8-((цис)-3-флуоропіперидин-4-ілокси)-2-(7-(2-метоксіетоксі)імідазо[1,2-а]піридин-3-іл)хінолін;
8-((3S,4S)-3-флуоропіперидин-4-ілокси)-2-(7-(2-метоксіетоксі)імідазо[1,2-а]піридин-3-іл)хінолін;
8-((3R,4R)-3-флуоропіперидин-4-ілокси)-2-(7-(2-метоксіетоксі)імідазо[1,2-а]піридин-3-іл)хінолін;
(S)-2-(7-(2-метоксіетоксі)імідазо[1,2-а]піридин-3-іл)-8-(піперидин-3-ілокси)хінолін;
(R)-2-(7-(2-метоксіетоксі)імідазо[1,2-а]піридин-3-іл)-8-(піперидин-3-ілокси)хінолін;
(R)-2-(7-(2-метоксіетоксі)імідазо[1,2-а]піридин-3-іл)-8-(піролідин-2-ілметокси)хінолін;
2-(7-(2-метоксіетоксі)імідазо[1,2-а]піридин-3-іл)-8-(піролідин-3-ілметокси)хінолін;
5-(8-((транс)-3-флуоропіперидин-4-ілокси)-2-(7-(2-метоксіетоксі)імідазо[1,2-а]піридин-3-іл)хінолін-4-іл)оксазол;
(транс)-4-(2-(7-(2-метоксіетоксі)імідазо[1,2-а]піридин-3-іл)хінолін-8-ілокси)піролідин-3-ол;
2-(7-(2-метоксіетоксі)імідазо[1,2-а]піридин-3-іл)-8-((транс)-4-метоксипіролідин-3-ілокси)хінолін;
(транс)-4-(2-(7-(2-метоксіетоксі)імідазо[1,2-а]піридин-3-іл)хінолін-8-ілокси)піперидин-3-ол;
8-((4-флуоропіперидин-4-іл)метокси)-2-(7-(2-метоксіетоксі)імідазо[1,2-а]піридин-3-іл)хінолін;
(цис)-4-(2-(7-(2-метоксіетоксі)імідазо[1,2-а]піридин-3-іл)хінолін-8-ілокси)піперидин-3-ол;
N-((цис)-3-флуоропіперидин-4-іл)-2-(7-(2-метоксіетоксі)імідазо[1,2-а]піридин-3-іл)хінолін-8-амін;
8-((транс)-3-флуоропіперидин-4-ілокси)-2-(7-(тетрагідро-2Н-піран-4-ілокси)імідазо[1,2-а]піридин-3-іл)хінолін;
2-(7-(циклопропілметоксі)імідазо[1,2-а]піридин-3-іл)-8-((транс)-3-флуоропіперидин-4-ілокси)хінолін;
8-((транс)-3-флуоропіперидин-4-ілокси)-2-(7-((R)-тетрагідрофуран-3-ілокси)імідазо[1,2-а]піридин-3-іл)хінолін;
8-((транс)-3-флуоропіперидин-4-ілокси)-2-(7-((S)-тетрагідрофуран-3-ілокси)імідазо[1,2-а]піридин-3-іл)хінолін;
2-(2-(7-(2-метоксіетоксі)імідазо[1,2-а]піридин-3-іл)хінолін-8-ілоксі)етанамін;
2-(7-етилімідазо[1,2-а]піридин-3-іл)-8-((транс)-3-флуоропіперидин-4-ілокси)хінолін;
8-((транс)-3-флуоро-1-метилпіперидин-4-ілокси)-2-(7-(2-метоксіетоксі)імідазо[1,2-а]піридин-3-іл)хінолін;
8-((транс)-1-етил-3-флуоропіперидин-4-ілокси)-2-(7-(2-метоксіетоксі)імідазо[1,2-а]піридин-3-іл)хінолін;
2-(7-(2-метоксіетоксі)імідазо[1,2-а]піридин-3-іл)-8-(1-метилпіперидин-4-ілокси)хінолін;
8-(1-етилпіперидин-4-ілокси)-2-(7-(2-метоксіетоксі)імідазо[1,2-а]піридин-3-іл)хінолін;
2-(7-(2-метоксіетоксі)імідазо[1,2-а]піридин-3-іл)-8-((1-метилпіролідин-3-іл)метокси)хінолін;
2-(7-(2-метоксіетоксі)імідазо[1,2-а]піридин-3-іл)-N-(4-метилпіперидин-4-іл)хінолін-8-амін;
8-((транс)-3-флуоропіперидин-4-ілокси)-2-(7-(піридин-3-іл)імідазо[1,2-а]піридин-3-іл)хінолін;
8-(піперидин-4-ілокси)-2-(7-(піридин-3-іл)імідазо[1,2-а]піридин-3-іл)хінолін;
8-((цис)-4-флуоропіролідин-3-ілокси)-2-(7-(піридин-3-іл)імідазо[1,2-а]піридин-3-іл)хінолін;
2-(3-(8-(транс-3-флуоропіперидин-4-ілокси)хінолін-2-іл)імідазо[1,2-а]піридин-7-ілоксі)етанол;
6-флуоро-8-((3R,4R)-3-флуоропіперидин-4-ілокси)-2-(7-(2-метоксіетоксі)імідазо[1,2-а]піридин-3-іл)хінолін;
8-((транс)-3-флуоропіперидин-4-ілокси)-2-(7-(піримідин-5-іл)імідазо[1,2-а]піридин-3-іл)хінолін;
8-((транс)-3-флуоропіперидин-4-ілокси)-2-(7-(4-метилпіридин-3-іл)імідазо[1,2-а]піридин-3-іл)хінолін та
5-флуоро-8-((3R,4R)-3-флуоропіперидин-4-ілокси)-2-(7-(2-метоксіетоксі)імідазо[1,2-а]піридин-3-іл)хінолін.
31. Сполука формули:
 ,
,
де:
L1 - відщеплюваний атом або відщеплювана група, що вибрана з галогену, трифлату, мезилату та тозилату;
B - ORh, hetAr2 aбo (1-3С)алкіл;
R1, R2, R3 та R4 незалежно є наступним: Н, F, Сl, Me, Et, ізопропіл або hetAr3;
R1a - Н, F або Сl;
R5, R6, R7 та R8 - Н;
Rh - Н, (1-6Салкіл)-(3-6Сциклоалкіл), (1-6Салкіл)-О-(1-6Салкіл) або hetCyc4;
hetCyc4 - 5- або 6-членне гетероциклічне кільце, що містить 1-2 гетероатоми, які незалежно вибрані з О або N, та необов'язково заміщене наступним: ОН або -О(1-6Салкіл);
hetAr2 - 5-6-членне кільце гетероарилу, що містить 1-2 атоми нітрогену; та
hetAr3 - 5-6-членний гетероарил, що містить атом нітрогену та необов'язково містить другий гетероатом, вибраний з О та N.
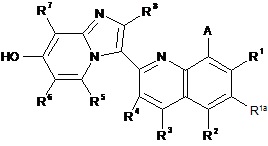
32. Сполука формули:
 ,
,
де:
A - -Z-(CH2)p-(hetCyc2a), -Z-(hetCyc2b), Z-R10 або Z-R11;
Z - О або NH;
p дорівнює 0, 1 або 2;
hetCyc2a - 5- або 6-членне гетероциклічне кільце, що містить 1 або 2 гетероатоми, які незалежно вибрані з О або N, та необов'язково заміщене одною або більше групами R9;
hetCyc2b - 7-12-членна аза-спіроциклічна або місткова діаза-гетероциклічна кільцева система, необов'язково заміщена одною або більше групами R9;
R10 - (1-6С)алкіл, заміщений NR'R";
R11 є (5-6С)циклоалкіл, заміщений NR'R";
R1, R2, R3 та R4 незалежно є наступним: Н, F, Me, Et, ізопропіл або hetAr3;
R1a - Н, F або Сl;
R5, R6, R7 тa R8 - Н;
кожен R9 незалежно вибраний з наступного: галоген, (1-6С)алкіл, ORa та С(О)О(1-6Салкіл);
кожен Ra незалежно є наступним: Н або (1-6С)алкіл;
hetAr3 є 5-6-членним кільцем гетероарилу, що містить нітроген та необов'язково містить другий гетероатом, який вибраний з О або N;
та
R' та R" незалежно є наступним: Н або (1-6С)алкіл.
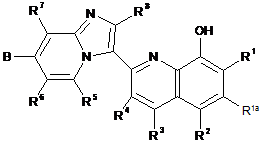
33. Сполука формули:
 ,
,
де:
B - ORh, hetAr2 або (1-3С)алкіл;
R1, R2, R3 та R4 незалежно є наступним: Н, F, Me, Et або hetAr3;
R1a - H;
R5, R6, R7 та R8 - H;
Rh - H, (1-6Салкіл)-(3-6Сциклоалкіл) або hetCyc4;
hetCyc4 є 5- або 6-членним гетероциклічним кільцем, що містить 1-2 гетероатоми, які незалежно вибрані з О або N, та необов'язково заміщене наступним: ОН або -О(1-6С алкіл);
hetAr2 - 5-6-членне кільце гетероарилу, що містить 1-2 атоми нітрогену;
hetAr3 - 5-6-членне кільце гетероарилу, що містить нітроген та необов'язково містить другий гетероатом, який вибраний з О або N; та
R' та R" незалежно є Н або (1-6С)алкілом.
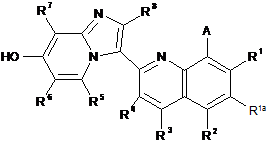
34. Спосіб отримання сполуки за п. 1, при якому здійснюють:
для сполуки формули І, де В - ORh, реакцію відповідної сполуки, що має формулу ІІІ
 , ІІІ
, ІІІ
зі сполукою формули Rh-L2, де L2 - відщеплювана група, у присутності основи; та видалення будь-якої захисної групи або груп та необов'язково утворення солі.
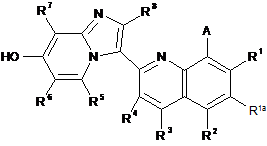
35. Спосіб отримання сполуки за п. 1, при якому здійснюють:
для сполуки формули І, де В - ORh, реакцію відповідної сполуки, що має формулу III
 , ІІІ
, ІІІ
зі сполукою, що має формулу Rh-OH, у присутності реагенту сполучення; та видалення будь-якої захисної групи або груп та необов'язково утворення солі.
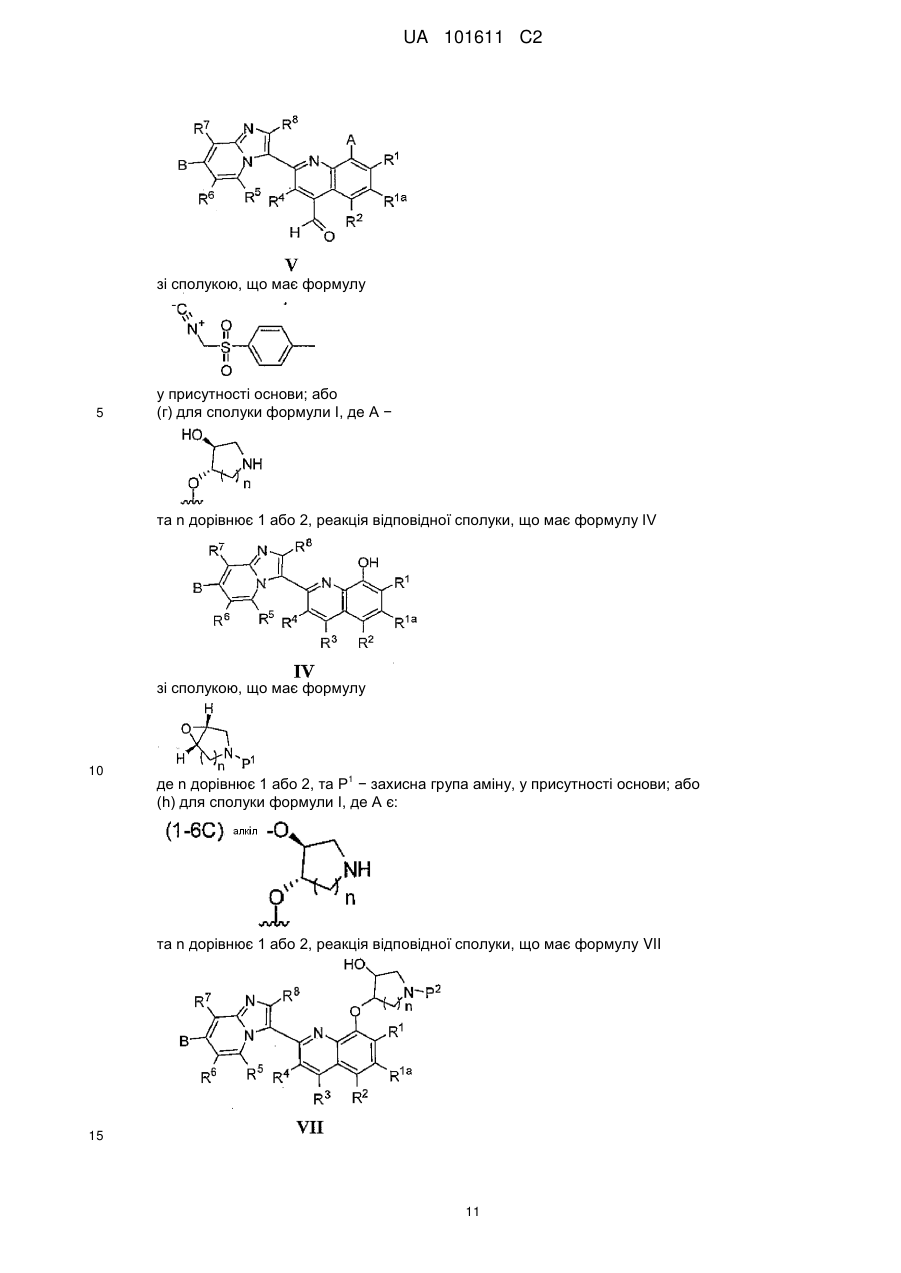
36. Спосіб отримання сполуки за п. 1, при якому здійснюють:
для сполуки формули І, де А - -O(СН2)nhetСус2a, -O-hetCyc2b-OR10 або -OR11, реакцію відповідної сполуки, що має формулу IV
 , IV
, IV
з відповідною сполукою, що має формулу HO-(CH2)nhetCyc2a, HO-hetCyc2b, HOR10 або HOR11, у присутності реагенту сполучення та трифенілфосфіну в придатному розчиннику; та видалення будь-якої захисної групи або груп та необов'язково утворення солі.
Текст
Реферат: 1 1a 2 3 4 5 Заявлений винахід стосується сполук імідазопіридину формули І, де А, В, R , R , R , R , R , R , 6 7 8 R , R та R мають значення, наведені в описі, які є інгібіторами тирозинкіназ рецепторів класу 3 та класу 5. Винахід стосується деяких сполук, корисних в лікуванні та попередженні хвороб, опосередкованих тирозинкіназами рецепторів класу 3 та класу 5. Знайдено, що конкретні сполуки цього винаходу можуть бути інгібіторами Ріm-1. R 7 R N 8 A B N R 6 R N 5 R R 4 1 R 1a R 3 R 2 I UA 101611 C2 UA 101611 C2 5 10 15 20 25 30 35 40 45 50 55 Заявлений винахід стосується нових сполук, фармацевтичних композицій, що містять сполуки, способу отримання сполук та застосування сполук у терапії. Конкретніше, він стосується деяких сполук імідазопіридину, корисних у лікуванні та попередженні хвороб, опосередкованих тирозин-кіназами рецепторів класу 3 та класу 5. Також знайдено, що конкретні сполуки цього винаходу можуть бути інгібіторами Pim-1. Тирозин-кінази рецепторів (RTK) охоплюють тирозин-кінази рецепторів класу 3 (PDGF-a, PDGFR-B, MCSF-1R, c-kit, та FLT3) та тирозин-кінази рецепторів класу 5 (VEGFR та KDR). Відомо, що такі кінази найчастіше є аберантно експресованими сукупно в пухлинні хвороби людини, як-то рак молочної залози, рак шлунково-кишкового тракту, як-то рак ободової кишки, прямої кишки або рак шлунку, лейкемія та рак яєчнику, рак бронхів, рак підшлункової залози, нирково-клітинна карцинома та гліоми. FLT3 (fins-подібна тирозин-кіназа; також відома як Flk-2) − член сімейства тирозин-кіназ рецептору класу 3 (RTK), та вважається залученою до кровотворної системи (Rosnet, et al., 1991, Genomics 9:380-385, Rosnet, et al., 1993, Blood 82:1110-1119). Аберантну експресію гена FLT3 документально підтверджено в лейкеміях у дорослих та дітей, охоплюючи наступне: гостра мієлоїдна лейкемія (AML), AML із триродовідною мієлодисплазією (AML/TMDS), гостра лімфобластна лейкемія (ALL) та синдром мієлодисплазії (MDS). Активувальні мутації рецептору FLT3 знайдено, приблизно, в 35 % пацієнтів із гострою лейкемією мієлобластів (AML), і вони асоційовані з поганим прогнозом. Ці типи мутацій асоційовано з конституївною активацією активності тирозин-кінази FLT3 та вони призводять до проліферації та сигналів життєздатності у відсутності ліганду. Показано, що пацієнти, які демонструють мутантну форму рецептору, мають зменшений шанс виліковуватися. Крім активувальних мутацій залежне від ліганду сnимулювання (аутокринне або паракринне) надекспресованого FLT3 дикого типу сприяє AML. Таким чином, накопичено свідоцтва щодо ролі активності надактивованої (мутованої) кінази FLT3 в лейкеміях людини й синдрому мієлодисплазії. Інгібітори FLT3 також можуть бути корисними для лікування імуно-залежних розладів, бо їх залучено в процес ангіогенезу через їх експресію в перицити. PDGFR експресовано на ранні стовбурові клітини, тучні клітини, мієлоїдні клітини, мезенхімальні клітини та клітини гладких м'язів. PDGFR-β залучено у мієлоїдні лейкемії. Нещодавно показано, що активувальні мутації в домені кінази PDGFR-a є в шлунково-кишкових стромальних неоплазмах (GIST) (Wong et al., 2007, Histopathology 51(6): 758-762). Крім того, показано, що блокада сигналізації PDGF зменшує розвиток фіброзу в різних експериментальних моделях (Yoshiji et al., 2006, International Journal Molecular Medicine 17: 899904). Отже, зрозуміло, що інгібітори тирозин-кіназ рецептору є корисними як інгібітори росту ракових клітин у ссавця або для лікування імуно-залежних розладів. Pim-кінази є сімейством трьох відмінних серин/треонін-кіназ білку хребетних (Pim-1,-2 та -3), що стосуються кіназа-залежної групи кальмодулін-залежного білку (CAMK). Повідомлено про надекспресію Pim-1 у різних лімфомах та гострих лейкеміях людини (Amson, R. et al, Proc. Natl Acad Sci. U.S.A., 1989, 86: 8857-8861). Крім того, є дані, що Pim-1 надекспресовано в неоплазію простати та рак простати людини (Valdman, A. et al, The Prostate, 2004, 60: 367-371; Cibull, T.L. et al, J. Clin. Pathol., 2006, 59: 285-288) та це може слугувати як корисний біомаркер для ідентифікації раку простати (Dhanasekaran, S.M. et al, Nature, 2001, 412(13): 822-826). Нещодавно виявлено, що Pim-1 надзарегульовано Flt-3 та може грати допоміжну роль в опосередкованому Flt-3 виживанні клітини (Kim, K.T. et al Neoplasia, 2005, 105(4): 1759-1767). Завдяки тому що Flt-3 залучено в лейкемії, подібні AML, додаткове руйнування Pim-1 може бути корисним підходом до лікування лейкемій, збуджених Flt-3 або різними мутаціями. Отже, інгібітори Pim-1 можуть бути корисними як терапевтичні засоби для різновидів раку, як-то гематологічні раки. Інгібітори тирозин-кінази відомі в рівні техніки. У U.S. Patent No. 7,125,888 описано деякі сполуки імідазо[1,2-a]піридину, заміщені на 3 позиції піридилом, тіазолілом, оксазолілом або фенілом, та необов'язково заміщені на 7 позиції фенілом або піридон-групою, щодо яких припускається, що вони є інгібіторами тирозин-кінази. У публікації патенту U.S. 2005/0124637 розкрито деякі похідні пурину як інгібітори тирозин-кіназ рецептору, охоплюючи FLT3. У публікації PCT WO 01/40217 та U.S. Patent No. 7,019,147 розкрито деякі сполуки бензімідазолу, що мають активність як інгібітори тирозин-кінази. Тепер знайдено, що деякі сполуки імідазо[1,2-a]піридину, які мають групу хінолінілу на 3 позиції кільця імідазопіридину, є інгібіторами тирозин-кіназ рецептору, зокрема, тирозин-кінази рецептору класу 3 та класу 5, котрі є корисними для лікування хвороб, опосередкованих 1 UA 101611 C2 5 тирозин-кіназами рецепторів класу 3 та класу 5, як-то раки, фіброз, склероз, автоімунні розлади та склеродерма. У деяких утіленнях сполуки імідазопіридину є інгібіторами тирозин-кіназ рецептору класу 3. У конкретних втіленнях сполуки є інгібіторами тирозин-кінази рецептору класу 3 PDGFR та FLT3. Розкрита тут підгрупа сполук імідазопіридину також є інгібіторами PIM-1-кінази. Отже, запропоновано сполуку загальної формули I: 10 9 R; 15 20 25 30 35 40 45 50 або її фармацевтично прийнятну сіль, де: 2a 2b 10 11 А − -Z-(CH2)P-(hetCyc ),-Z-(hetCyc )JZ-R orZ-R ; Z − O або NH; р дорівнює 0,1, або 2; a hetCyc − 5 або 6-членне гетероциклічне кільце, необов'язково заміщене одним або більше 2b hetCyc − 7-12-членна спіроциклічна або місткова гетеробіциклічна кільцева система, 9 необов'язково заміщена одним або більше R ; 10 R − (1-6C)алкіл, заміщений NR'R"; 11 R − (5-6C)циклоалкіл, заміщений NR'R"; h 1 2 і j 3 3 B − H, CN, OR , Ar , hetAr , C(O)NR R , C(O)-hetCyc , C(O)NH(1-6C алкіл)-hetCyc , C(O)(1-6C 3 k алкіл)-hetCyc , SR , SO2N(1-6C алкіл)2, (1-6C алкіл)NR'R" або (1-3C)алкіл; 1 1a 2 3 4 R , R , R , R та R незалежно − H, F, CI, CN, Me, Et, ізопропіл, циклопропіл, C(O)NR'R", 3 CH2OH, або hetAr ; 5 6 7 8 R , R , R та R незалежно − H, F, CI, CN або Me; 9 a b кожне R незалежно вибрано з наступного: галоген, CN, CF 3, (1-6C)алкіл, NR R , -(1-6C a c a a a c алкіл)NR R , OR , (1-6C алкіл)OR [необов'язково заміщене аміногрупою], C(O)NR R , x y a c e m n a c f g 1 C(O)(CR R )NR R , NHC(O)R , NНC(O)(CR R )NR R , NHC(O)NR R , (1-6C алкіл)-hetAr , (1-6C 1 алкіл)-hetCyc , оксо та C(O)2(1-6C алкіл); a кожне R незалежно − H або (1-6C)алкіл; b 4 кожне R незалежно − H, (1-6C)алкіл, (1-6C алкіл)OH, (3-6C)циклоалкіл, CH2hetAr , (1-6C флуороалкіл) або -(1-6C алкіл)-О-(1-6C алкіл), c кожне R незалежно − H, (1-6C)алкіл, (3-6C)циклоалкіл, або арил; e кожне R незалежно − (1-6C алкіл); f g кожне R та R незалежно − H або (1-6C алкіл); h R − H, CF3, (1-6C)алкіл, (1-6C алкіл)-(3-6C циклоалкіл), (1-6C алкіл)-О-(1-6C алкіл), (1-6C 4 4 алкіл)OH, (1-6C алкіл)-S-(1-6C алкіл), (1-6C алкіл)NR'R", hetCyc , (1-6C алкіл)hetCyc , (1-6C 5 алкіл)арил або (1-6C алкіл)-hetAr ; і R − H або 1-6С алкіл; j R − (1-6C)алкіл, (1-6C алкіл)-О-(1-6C алкіл) або (1-6C алкіл)-OH; k R − (1-6C)алкіл, (3-6C)циклоалкіл або (1-6C алкіл)-О-(1-6C алкіл); m n R та R незалежно − H або (1-6C алкіл); x y R та R незалежно − H або (1-6C алкіл), x y або R та R разом з атомом, до котрого вони приєднані, утворюють кільце циклопропілу; 1 Ar − арил, необов'язково заміщений наступним: OH, О-(1-6C алкіл), C(O)2(1-6C алкіл), або (1-6C алкіл)NR'R"; 1 hetCyc − 5-6-членне гетероциклічне кільце, котре необов'язково заміщене наступним: (16C)алкіл або OH; 3 4 hetCyc та hetCyc незалежно − 5 або 6-членне гетероциклічне кільце, необов'язково заміщене наступним: OH або -О-(1-6C алкіл); 1 2 hetAr та hetAr − 5-6-членне кільце гетероарилу, необов'язково заміщене одною − трьома групами, незалежно вибраними з наступного: (1-6C)алкіл, (3-6C)циклоалкіл, галоген, CN, CF3, OCH2F, OCF3, О(1-6C алкіл), О(3-6C)циклоалкіл та NR'R"; 3 4 hetAr та hetAr незалежно − 5-6-членне кільце гетероарилу; 2 UA 101611 C2 5 5 9 R ;. 10 15 20 25 30 35 40 45 50 55 hetAr − 5-6-членне кільце гетероарилу, необов'язково заміщене наступним: (1-6C)алкіл; та R' і R" незалежно − H або (1-6C)алкіл. Сполуки формули I охоплюють сполуки, де: 2a 2b 10 11 A − -Z-(CH2)p-(hetCyc ),-Z-(hetCyc ), Z-R або Z-R ; Z − O або NH; р дорівнює 0,1 або 2; 2a hetCyc − 5 або 6-членне гетероциклічне кільце, необов'язково заміщене одним або більше 2b hetCyc − 7-12-членна спіроциклічна або місткова гетероциклічна кільцева система, 9 необов'язково заміщена одним або більше R ; 10 R − (1-6C)алкіл, заміщений NR'R"; 11 R − (5-6C)циклоалкіл, заміщений NR'R"; h 1 2 і j 3 3 k B − H, CN, OR , A , hetAr , C(O)NR R , C(O)-hetCyc , C(O)(1-6C алкіл)-hetCyc , SR , SO2N(1-6C алкіл)2, (1-6C алкіл)NR'R" або (1-3C алкіл); 1a 1a 2 3 4 R , R , R , R та R незалежно − H, F, CI, CN, Me, Et, ізопропіл, циклопропіл, C(O)NR'R", 3 CH2OH або hetAr ; 5 6 7 R , R та R незалежно − H, F, CI, CN або Me; 9 a b кожне R незалежно вибрано з наступного: галоген, CN, CF 3, (1-6C)алкіл, NR R , -(1-6C a c a a a c алкіл)NR R OR , (1-6C алкіл)OR [необов'язково заміщене аміногрупою], C(O)NR R , x y а c c m n a c f g 1 C(O)CR R )NR R , NHC(O)R , NHC(O)(CR R )NR R , NHC(O)NR R , (1-6C алкіл)-hetAr , (1-6C 1 алкіл)-hetCyc , оксо та C(O)О(1-6C алкіл); h R − H, CF3, (1-6C)алкіл, (1-6C алкіл)-(3-6C циклоалкіл), (1-6C алкіл)-О-(1-6C алкіл), (1-6C 4 4 алкіл)OH, (1-6C алкіл)-S-(1-6C алкіл), (1-6C алкіл)NR'R'', hetCyc , (1-6C алкіл)hetCyc , (1-6C 5 алкіл)арил, або (1-6C алкіл)-hetAr ; і R − H або 1-6C алкіл; j R − (1-6C)алкіл, (1-6C алкіл)-О-(1-6C алкіл), або (1-6C алкіл)-OH; k R − (1-6C)алкіл, (3-6C)циклоалкіл або (1-6C алкіл)-О-(1-6C алкіл); 1 Ar − арил, необов'язково заміщений наступним: OH, О-(1-6C алкіл), C(O)2(1-6C алкіл) або (1-6C алкіл)NR'R"; 3 4 hetCyc та hetCyc незалежно − 5 або 6-членне гетероциклічне кільце, необов'язково заміщене OH; 2 hetAr − 5-6-членне кільце гетероарилу, необов'язково заміщене одною − трьома групами, незалежно вибраними з наступного: (1-6C)алкіл, (3-6C)циклоалкіл, галоген, CN, CF3, OCH2F, OCF3, 0(1-6C алкіл), О(3-6C)циклоалкіл та NR'R"; 3 hetAr − 5-6-членне кільце гетероарилу; 5 hetAr − 5-6-членне кільце гетероарилу, необов'язково заміщене наступним: (1-6C)алкіл; та R' та R" незалежно − H або (1-6C)алкіл. 1 У деяких утіленнях формули I, R − H, F, CI, Me, Et або ізопропіл. 1 У деяких утіленнях формули I, R − Н. F або CI. 1 У деяких утіленнях формули I, R − H, Me, Et або ізопропіл. 1 У деякому втіленні R − Н. 1a У деяких утіленнях, R − H, F, CI, CN, Me, Et, або ізопропіл. 1a У деяких утіленнях, R − H, F, CI, або Me. 1a У деяких утіленнях формули I, R − Н або F. 1a У деякому втіленні R − Н. 1a У деякому втіленні R − F. 2 У деяких утіленнях формули I R − H, F, CI, Me, Et або ізопропіл. 2 У деяких утіленнях формули I R − H, F або CI. 2 У деяких утіленнях формули I R − H, Me, Et або ізопропіл. 2 У деякому втіленні R − Н. 2 У деякому втіленні R − F, 3 3 У деяких утіленнях формули I R − H, метил, етил, ізопропіл, циклопропіл або hetAr . 3 Приклади hetAr охоплюють 5-членні кільця гетероарилу, що мають атом нітрогену та необов'язково мають другий гетероатом, вибраний з N та O. Прикладом є оксазоліл. Конкретна 3 структура R : 3 UA 101611 C2 3 5 10 15 20 25 30 35 40 45 50 55 У деяких утіленнях формули I R − H, метил, етил, ізопропіл або оксазоліл. 3 У деяких утіленнях формули I R − H, метил, етил або ізопропіл. 3 3 У деяких утіленнях формули I R − H, метил або hetAr . 3 У деяких утіленнях формули I R − H, метил або оксазоліл. 3 У деяких утіленнях формули I R − Н. 4 У деяких утіленнях формули I R − H, F, CI, Me, Et або ізопропіл. 4 У деяких утіленнях формули I R − H, F або CI. 4 У деяких утіленнях формули I R є II, Me, Et або ізопропіл. 4 У деякому втіленні R − Н. 4 У деякому втіленні R − F. 5 6 7 8 У деяких утіленнях R , R , R та R незалежно вибрано з наступного: H, F та Me. 5 У деякому втіленні R − Н. 6 У деякому втіленні R − Н. 7 У деякому втіленні R − Н. 8 У деякому втіленні R − Н. 1 4 У деяких утіленнях формули I кожний з R та R − гідроген. 5 6 7 8 У деяких утіленнях формули I кожний з R , R , R та R − гідроген. 1 4 5 6 7 8 У деяких утіленнях формули I кожний з R , R , R , R , R та R − гідроген. 1 1a 2 3 4 5 6 7 8 У деяких утіленнях формули I кожний з R , R , R , R > R , R , R , R та R − гідроген. 2a У деяких утіленнях А − -Z(CH2)P(hetCyc ). 2a У деяких утіленнях А − -NH-hetCyc . 2a У деяких утіленнях А − -NH-(CH2)-hetCyc . 2a У деяких утіленнях А − -NH-(CН2)2-(hetCyc . 2a У деяких утіленнях А − -О-hetCyc , 2a У деяких утіленнях А − -О-(CН2)-hetCyc . 2a У деяких утіленнях А − -О-(СН2)2-hetCyc . 2a Приклади hetCyc охоплюють 5-6-членні гетероциклічні кільця, що мають один або два 2a гетероатоми, незалежно вибрані з N та O. Конкретно hetCyc охоплює кільця, як-то піролідиніл, 2a 9 піперидиніл та морфолініл. У деяких утіленнях hetCyc заміщено одним або більше R . У 2a деяких утіленнях, hetCyc є незаміщеним. 2b У деяких утіленнях А − Z-hetCyc . 2b У деяких утіленнях А − -NH(hetCyc ). 2b В інших утіленнях А − -О-(hetCyc ). 2b Приклади hetCyc охоплюють 7-11-членні місткові аза- або діаза-гетероцикли. 2b Конкретно hetCyc охоплює азабіцикло[2,2,1]гептан, азабіцикло[3,21]октан, 3азабіцикло[3,2,1]октан, діазабіцикло[2,2,1]гептан та діазабіцикло[3,2. l]октан. 2b 9 У деяких утіленнях hetCyc заміщено одним або більше R . 2b У деяких утіленнях hetCyc незаміщено. 2а 2b 9 У деяких утіленнях hetCyc та hetCyc необов'язково заміщено одним або більше R , a b a c a незалежно вибраними з наступного: галоген, (1-6C)алкіл, NR R , -(1-6C алкіл)NR R , OR , (1-6C a a с x y a c c алкіл)OR [необов'язково заміщене аміногрупою], C(O)NR R C(O)(CR R )NR R , NHC(O)R , m n a c f g 1 1 NHC(O)(CR R )NR R , NHC(O)NR R , (1-6C алкіл)-hetAr , (1-6C алкіл)-hetCyc , оксо та C(O)О(16C алкіл). 9 Приклади R , що мають формулу (1-6C)алкіл, охоплюють метил, етил та пропіл. 9 a b а b Приклади R , що мають формулу NR R , охоплюють групи, де R − Н або Me, та R − H, 4 метил, етил, пропіл, бутил, т-бутил, CH2C(CH3)2OH, циклопропіл, феніл або CН2hetAr . 4 Приклади hetAr охоплюють 6-членні кільця гетероарилу, що мають 1-2 атоми нітрогену, 9 a b наприклад, піридил та піримідил. Конкретні R , коли представлені формулою NR R , охоплюють NH2 та NMe2. 9 a b a b В інших утіленнях R − група, що має формулу NR R , де R − Н або (1-6C алкіл), та R − H, (1-6C алкіл), (1-6C флуороалкіл), (1-6C алкіл)-О-(1-6C алкіл) або (1-6C алкіл)OH. Далі конкретні 9 R охоплюють NH2, NHMe, NMe2, NHCH(CH3)CH2F, NHCH2CH2OMe, NHCH2CH2OH та N(CH3)CH2CH2OH. 9 a c a Приклади R , що мають формулу (1-6C алкіл)NR R , охоплюють групи, де R − Н або Me, та c 9 a c R − H, метил, або циклопропіл. Конкретні R , коли представлені формулою (1-6C алкіл)NR R , охоплюють CH2NH2 та CH2CH2NMe2. 9 a a Приклади R , що мають формулу OR охоплюють групи, де R − Н або (1-6C) алкіл. Конкретне посилання має на увазі OH. Подальше посилання має на увазіOMe. 4 UA 101611 C2 9 5 10 15 20 25 30 35 40 45 a Приклади R , що мають формулу (1-6C алкіл)OR , що необов'язково заміщено аміногрупою, a охоплюють групи, де R − Н. Конкретні групи таких замісників охоплюють CH2OH. Подальшим 9 прикладом R є CH(NH2)CH2OH. 9 a c a c Приклади R , що мають формулу C(O)NR R , охоплюють групи, де R − Н, або Me та R − (11 6C)алкіл, наприклад, метил. Конкретно R є C(O)NHMe. 9 x y a c x y Приклади R , що мають формулу C(O)(CR R )NR R , охоплюють групи, де R та R a c незалежно − H або метил, R − Н або метил, та R − Н або (1-6C)алкіл, наприклад, метил. В x y іншому утіленні R та R разом з атомом, до котрого вони приєднані, утворюють кільце x y 9 циклопропілу. Це − кільце циклопропілу форми CR R . Конкретні R охоплюють C(O)C(CH3)2NH2, C(O)CH(CH3)NH2, C(O)CH2NH2, C(O)СН2NMe2 та C(O)C(циклопіролідин)NH2. 9 e e Приклади R , що мають формулу NHC(O)R , охоплюють групи, де R − метил. 9 m n a c m n Приклади R , що мають формулу NHC(O)(CR R )NR R , охоплюють групи, де R та R a с 9 незалежно − H або метил, R − Н або Me, та R − Н або Me. Конкретно R охоплює NHC(O)CH2NH2, NHC(O)CH(CH3)NH2, та NHC(O)C(CH3)2NH2. 9 f g f g Приклади R , що мають формулу NHC(O)NR R охоплюють групи, де R та R незалежно − H або Me. Конкретно − NНC(O)NH2. 9 1 1 Приклади R , що мають формулу (1-6C алкіл)-hetAr охоплюють групи, де hetAr − 6-членний 9 гетероарил, що має, принаймні, один атом нітрогену, наприклад, піридил. Конкретно R охоплює CH2(пірид-2-іл) та CH2(пірид-4-іл). 9 1 1 Приклади R , що мають формулу (1-6C алкіл)-hetCyc охоплюють групи, де hetCyc − 5-61 членне кільце, що має 1-2 атоми нітрогену. Конкретно hetCyc охоплює необов'язково 1 заміщений піперазиніл або піролідиніл. У деяких утіленнях hetCyc необов'язково заміщено OH або алкілом, наприклад, метилом. 9 У деяких утіленнях R − галоген. Конкретно, наприклад, − флуор. 9 У деяких утіленнях R − CF3. 9 У деяких утіленнях R − CN. 2a 2a У деяких утіленнях формули I А − -Z(CH2)p(hetCyc ), де hetCyc необов'язково заміщено 9 одним або більше R , незалежно вибраним з наступного: галоген, (1-6C алкіл), C(O)О(1-6C a алкіл) та -OR . 2а 9 У деяких утіленнях hetCyc необов'язково заміщено одним або більше R , незалежно вибраним із наступного: F, метил, C(O)2Me, OH, та OMe. 2b 2b У деяких утіленнях формули I, А − Z-hetCyc де hetCyc необов'язково заміщено одним або 9 a більше R , незалежно вибраним з наступного: галоген, (1-6C алкіл), та -OR . 2b 9 У деяких утіленнях hetCyc необов'язково заміщено одним або більше R , незалежно вибраним із наступного: F, Me та OH. 2b У деяких утіленнях hetCyc незаміщено. 2а 2b 9 В інших утіленнях hetCyc та hetCyc необов'язково заміщено одним або більше R , незалежно вибраним із наступного: NH2, NMe2, Me, OH, CH2OH, C(O)NHMe, CH2NH2, CH2CH2NH2 та СО2Me. Конкретне посилання − NH2. 2a 2b 9 В інших утіленнях hetCyc та hetCyc необов'язково заміщено одним або більше R , незалежно вибраним із наступного: NH-циклопропіл, NH(т-бутил), NHMe, HCH2C(CH3)2OH, NHCH2(пірид-2-іл), NHCH2(пірид-4-іл), оксо, CH(NH2)CH2OH, C(O)C(CH3)2NH2, C(O)CH(CH3)NH2, C(O)CH2NH2, C(O)CH2NMe2, C(O)C(циклопіролідин)NH2, CH2CH2NHMe, CH2NMe2, CH2NHциклопропіл, CH2NHMe, CH2-(4-метилпіперазиніл), CH2(3-гідроксипіролідиніл), NHC(О)Me, NHC(O)NH2, NHC(O)CH2NH2, NHC(O)CH(CH3)NH2, NHC(O)C(CH3)2NH2, CH2(пірид-2-іл), та CH2(пірид-4-іл). 2a 2b Конкретні A, коли представлені формулою -Z(CH2)p(hetCyc ) або Z-hetCyc , охоплюють структури: 5 UA 101611 C2 2a 2b Додаткові групи А, якщо вони представлені формулою -Z(CH2)p(hetCyc ) або Z-hetCyc , охоплюють структури: 5 10 Показані вище A охоплюють цис- та транс-ізомери, де це можливо. 2a 2a У деяких утіленнях формули I А − -О-hetCyc . У конкретних утіленнях hetCyc заміщено 2а флуором. У конкретних утіленнях hetCyc − кільце піперидинілу. У конкретних утіленнях A − група, що має формулу: 6 UA 101611 C2 5 10 15 20 25 30 У конкретних утіленнях A є в транс-конфігурації. 10 У деяких утіленнях А − ZR . У деяких утіленнях Z − O. У деяких утіленнях Z − N. 10 Конкретні R охоплюють (1-6C алкіл) із прямими розгалуженим ланцюгом. У деяких 10 10 утіленнях R заміщено NR'R". Конкретне посилання − NH2. Конкретно R − CH2C(CH3)2CH2NH2. 10 Додатково R охоплює CH2C(CH3)2N(CH3)2 та CH2CH2NH2. 10 Конкретно A, коли представлено групами ZR , охоплює -OMe, ~OCH2C(CH3)2CH2NH2, OCH2C(CH3)2N(CH3)2 та -OCH2CH2NH2. 11 У деяких утіленнях А − ZR . У деяких утіленнях Z − O. У деяких утіленнях А − N. У деяких 11 утіленнях R заміщено NR'R". У деяких утіленнях R' та R" незалежно вибрано з наступного: H 11 та метил. Конкретне посилання − NH2. Конкретні приклади R охоплюють аміно-заміщений циклопентил та аміно-заміщений циклогексил. Конкретно A є: NH2 11 Приклади A, коли представлені ZR , охоплюють цис- та транс-ізомери. У деяких утіленнях B − CN. У деяких утіленнях B − H. h У деяких утіленнях B − OR . h h У деяких утіленнях B представлено OR , де R − Н. h h У деяких утіленнях B представлено OR , де R − CF3. h h Конкретно OR , коли R представлено (1-6C)алкілом, охоплюють OMe, OEt та О-(ізобутил). h h Конкретно OR , коли R представлено групою -(1-6C алкіл)-(3-6C циклоалкіл), охоплюють -О(1-6C алкіл)-циклопропіл, наприклад, -OCH2-циклопропіл. h h Конкретно OR , коли R представлено групою -(1-6C алкіл)-О-(1-6C алкіл), охоплюють OCH2CH2OMe та -OCH2CH2CH2OMe. h h Конкретно OR , коли R представлено групою -(1-6C алкіл)OH, охоплює -OCH2CH2OH. h h Конкретно OR , коли R представлено групою -(1-6C алкіл)-S-(1-6C алкіл), охоплює OCH2CH2CH2SMe. h h Конкретно OR , коли R представлено групою -(1-6C алкілNR'R", охоплює групи, де R' та R" незалежно − H або Me, наприклад, -OCH2CH2CH2NH2, -OCH2CH2NMe2 та -OCH2CH2 CH2NMe2. h Подальший приклад OR охоплює -OCH2CH2NH2. h h 4 4 Конкретно OR , коли R представлено hetCyc , охоплює групи, де hetCyc − 5-6-членне h гетероциклічне кільце, що має 1-2 атоми, незалежно вибрані з N та O. У деяких утіленнях R − 5-6-членний гетероцикл, що має атом оксигену в кільці, наприклад, кільце тетрагідрофуранілу h або тетрагідропіранілу. Приклади OR охоплюють: 40 h h h 35 4 h 4 Конкретно OR , коли R представлено (1-6C алкіл)hetCyc , охоплює групи, де hetCyc − 5-6членне гетероциклічне кільце, що має 1-2 атоми, незалежно вибрані з N та O. Конкретний h приклад OR охоплює структуру: Конкретно OR , коли R представлено (1-6C алкіл)арил, охоплює групи, де арил − феніл, якто OCH2Ph. h h 5 5 Конкретно OR , коли R представлено (1-6C алкіл)-hetAr , охоплює групи, де hetAr − 5-6членне кільце гетеро арилу, що має 1-3 атоми нітрогену. Приклади охоплюють піридил, 3 триазоліл та піразоліл. У деяких утіленнях hetAr заміщено групою, вибраною з (1-6C)алкілу. h Конкретні приклади OR охоплюють структури: 7 UA 101611 C2 h 5 10 h 4 У деяких утіленнях формули I B − OR , де R − (1-6C алкіл)-О-(1-6C алкіл), hetCyc або -(16C алкіл)-(3-6C циклоалкіл). h h У деяких утіленнях формули I B − OR , де R − (1-6C алкіл)-О-(1-6C алкіл), 5-6-членний гетероцикл, що має атом оксигену в кільці, або –CH2(циклопропіл). i j i j У деяких утіленнях B − C(O)NR R . У деяких утіленнях R − Н. У деяких утіленнях R − (1-6C j алкіл), наприклад, метил. В інших утіленнях R − (1-6C алкіл)О(1-6C алкіл), наприклад, (1-6C j алкіл)OMe. В інших утіленнях R − (1-6C алкіл)OH, наприклад, (1-6C алкіл)OH. Конкретно B охоплює -C(O)NHMe, -C(O)NHCH2CH2OMe та -C(O)NHCH2CH2OH. Далі приклад охоплюєC(O)NMe2. 3 3 У деяких утіленнях B − C(О)hetCyc . Приклади hetCyc охоплюють 5-6-членні гетероциклічні кільця, що мають 1-2 атоми, незалежно вибрані з N та O. Конкретно B охоплює структури: 3 15 У деяких утіленнях B − C(O)(1-6C алкіл)hetCyc . У деяких утіленнях B − C(O)NH(1-6C 3 3 алкіл)hetCyc . Приклади hetCyc охоплюють 5-6-членні гетероциклічні кільця, що мають 1-2 3 атоми, незалежно вибрані з H та О. У деяких утіленнях hetCyc заміщено OH або OMe. Конкретно B охоплює структуру: 2 20 25 30 35 2 У деяких утіленнях B − hetAr . Приклади hetAr охоплюють 5-6-членні кільця гетероарилу, 2 що мають 1-2 атоми нітрогену. У деяких утіленнях hetAr заміщено групою -О-(1-6C алкіл), як-то метоксил. Конкретно B охоплює 3-піридил, 4-піридил та 4-метоксипірид-3-іл. Приклади далі охоплюють групи піридину, необов'язково заміщені (1-6C)алкілом, наприклад, метилом. Конкретний приклад охоплює 4-метилпірид-3-іл. Додаткові приклади B, коли представлені 2 hetAr , охоплюють піримідил, як-то 2-піримідил та 5-піримідил. k k У деяких утіленнях B − SR . У деяких утіленнях R − 3-6-членне карбоциклічне кільце. В k інших утіленнях R − -(1-6C алкіл)О(1-6C алкіл), наприклад, (1-6C алкіл)OCH3. Конкретно B охоплює S-циклогексил та S(CH2CH2)OCH3. 1 1 У деяких утіленнях B − Ar . У деяких утіленнях Ar − феніл, котрий незаміщено або заміщено наступним: OH, О-(1-6C алкіл), C(O)2(1-6C алкіл) або (1-6C алкіл)NR'R". Конкретно B охоплює феніл, гідроксифеніл, 3-метоксифеніл, 4-(метиламіно)феніл або 4-(метоксикарбоніл)феніл. У деяких утіленнях B − -(1-6 алкіл)NR'R". Конкретно це охоплює CH2NHMe та CH2NMe2. У деяких утіленнях B − -SO2N(l-6 алкіл)2, наприклад, SO2NMe2. У деяких утіленнях B − (1-3C)алкіл. Конкретно − етил. h 2 4 У деяких утіленнях формули I B вибрано з наступного: OR , (1-3C)алкіл, hetAr та hetCyc . У деяких утіленнях B вибрано з наступного: -OCH2CH2ОCH3, -OCH2CH2OН, -OCH2(циклопропіл), етил, 2-піридил, 3-піридил, 4-піридил, 4-метилпірид-3-іл, 2-піримідил, 5-піримідил, 8 UA 101611 C2 5 10 15 20 25 30 35 40 45 50 та h У деяких утіленнях формули I B вибрано з OR . h У деяких утіленнях R − (1-6C алкіл)-О-(1-6C алкіл), (1-6C алкіл)-(3-6C циклоалкіл), -(1-6C 4 алкіл)OH, або hetCyc . У деяких утіленнях формули I B вибрано з -OCH2CH2OCH3, -OCH2CH2OH, OCH2(циклопропіл), та У деяких утіленнях формули I B − -OCH2CH2OCH3. 2 У деяких утіленнях формули I B − hetAr . У деяких утіленнях B − піридил або піримідил. У деяких утіленнях формули I B вибрано з наступного: 2-піридил, 3-піридил, 4-піридил або 2піримідил. У деяких утіленнях формули I B − 3-піридил. Сполуки формули I охоплюють сполуки, де: 2а 2b 10 11 А − -Z-(CН2)p-(hetCyc )-Z-(hetCyc ), Z-R або Z-R ; Z − O або NH; p дорівнює 0,1 або 2; 2a hetCyc − 5 або 6-членне гетероциклічне кільце, що має 1-2 кільцеві гетероатоми, 2a незалежно вибрані з N та O, де hetCyc необов'язково заміщено одним або більше R; 2b hetCyc − 7-12-членна спіроциклічна або місткова гетероциклічна кільцева система, що має 2b 1-2 кільцеві гетероатоми, незалежно вибрані з N та O, де hetCyc необов'язково заміщено 9 одним або більше R ; 10 R − 1-6C алкіл або (1-6C алкіл)NR'R"; 11 R − (5-6C)циклоалкіл, заміщений NR'R"; h B − OR , (1-3C)алкіл або піридил; 1 1a 2 4 R , R , R , та R незалежно − H або F; 3 3 R − H, F або hetAr ; 5 6 7 8 R , R , R та R незалежно − H або F; 9 кожне R незалежно вибрано з наступного: галоген, C(O)О(1-6C алкіл), (1-6C алкіл), OH, та -О(1-6С алкіл); h R − (1-6C алкіл)-О-(1-6C алкіл), 5-6-членний гетероцикл, що має кільцевий атом оксигену, або циклопропілметил; 3 hetAr − 5-6-членне кільце гетероарилу що має 1-2 кільцеві гетероатоми, незалежно вибрані з N та O; та 1 R та R" незалежно − H або (1-6C)алкіл. Термін "галоген" як тут застосовано охоплює F, CI, Br, та I. l Термін " C1-C6 алкіл" як тут застосовано стосується насиченого лінійного або розгалуженого ланцюгу моновалентних вуглеводневих радикалів одного − шести атомів карбону, відповідно. Приклади охоплюють, але без обмеження, метил, етил, 1-пропіл, 2-пропіл, 1-бутил, 2-метил-1пропіл, 2-бутил, 2-метил-2-пропіл, 2,2-диметилпропіл, 1-пентил, 2-пентил, 3-пентил, 2-метил-2бутил, 3-метил-2-бутил, 3-метил-1-бутил, 2-метил-1-бутил, 1-гексил, 2-гексил, 3-гексил, 2-метил2-пентил, 3-метил-2-пентил, 4-метил-2-пентил, 3-метил-3-пентил, 2-метил-3-пентил, 2,3диметил-2-бутил та 3,3-диметил-2-бутил. Термін "-(1-6C алкіл)-(3-6C циклоалкіл)" стосується насиченого лінійного або з розгалуженим ланцюгом моновалентного вуглеводного радикалу з одним − шістьма атомами карбону, де один з атомів гідрогену заміщено 3-6-членним циклоалкілом. Згідно із заявленим винаходом знайдено, що сполуки є інгібіторами тирозин-кінази рецептору класу 3 та є корисними в лікуванні захворювань раком, як-то гематологічні раки (наприклад, лейкемії, як-то AML), рак молочної залози, рак ободової кишки, гліоми, фіброз (охоплюючи фіброз печінки та фіброз легенів та склеродерма. Зрозуміло, що деякі сполуки згідно із винаходом можуть містити один або більше центрів асиметрії, і тому їх можна отримувати та виділяти в суміші ізомерів, як-то рацемічна суміш, або в енантіомерно чистій формі. 9 UA 101611 C2 10 Крім того, зрозуміло, що сполуки формули I або їх солі можна виділяти у формі сольватів, отже, будь-який такий сольват охоплено в межах заявленого винаходу. Сполуки формули I охоплюють їх фармацевтично прийнятні солі. Крім того, сполуки формули I також охоплюють інші солі таких сполук, котрі не є обов'язково фармацевтично прийнятними солями, та котрі можуть бути корисними як інтермедіати для отримання та/або очищення сполук формули I та/або для розділення енантіомерів сполук формули I. Згідно із іншим аспектом заявленого винаходу запропоновано спосіб отримання сполуки формули I або її солі як визначено тут, котрий полягає в наступному: 2a 2b 10 11 (a) для сполуки формули I, де А − -NH-(CH2)n(hetCyc ), -NH-(hetCyc ), NHR або NHR , сполучення відповідної сполуки, що має формулу II 15 де L − відщеплювана група або атом, зі сполукою, що має формулу NH 2(CH2)n(hetCyc ), 2b 10 11 H2N-hetCyc , NH2R або NH2R , застосовуючи каталізатор - паладій та ліганд у присутності основи; або h (b) для сполуки формули I, де B − OR , реакція відповідної сполуки, що має формулу III 5 1 2a h 20 2 2 зі сполукою формули R -L , де L − відщеплювана група, у присутності основи; або h (c) для сполуки формули I, де B − OR , реакція відповідної сполуки, що має формулу III, зі h сполукою, що має формулу R -OH, у присутності реагенту сполучення; або 2a 2b 10 11 (d) для сполуки формули I, де А − -О-(CH2)nhetCyc , -О-hetCyc , OR або OR , реакція відповідної сполуки, що має формулу IV 2a 25 2b 10 11 з відповідною сполукою, що має формулу HO-(CH2)nhetCyc , HO-hetCyc , HOR або HOR , у присутності засобу сполучення та трифенілфосфіну в придатному розчиннику; або 2a e) для сполуки формули I, де А − -О-(CH2)nhetCyc , реакція сполуки формули IV зі сполукою, 2a що має формулу MeSO2-О(CH2)nhetCyc , у присутності основи; або 3 3 3 (f) для сполуки формули I, де R − hetAr , та hetAr − оксазоліл, що циклізує сполуку, яка має формулу V 10 UA 101611 C2 зі сполукою, що має формулу 5 у присутності основи; або (г) для сполуки формули I, де А − та n дорівнює 1 або 2, реакція відповідної сполуки, що має формулу IV зі сполукою, що має формулу 10 1 де n дорівнює 1 або 2, та P − захисна група аміну, у присутності основи; або (h) для сполуки формули I, де A є: та n дорівнює 1 або 2, реакція відповідної сполуки, що має формулу VII 15 11 UA 101611 C2 2 де n дорівнює 1 або 2, та P − Н або захисна група аміну, зі сполукою, що має формулу (13 3 6C.алкіл)L , де L − відщеплювана група або атом у присутності основи; або (i) для сполуки формули I, де А − О-(1-6C алкіл)NR'R", реакція сполуки, що має формулу ІV 5 4 4 зі сполукою, що має формулу L -(1-6C алкіл)NR'R", де L − відщеплювана група або атом, у присутності основи та необов'язково у присутності каталізатору фазового переносу; або (j) для сполуки формули I, де A є: 3 та n дорівнює 1 або 2, P − (1-6C)алкіл,реакція відповідної сполуки, що має формулу VIII 10 15 20 25 30 35 3a 3а зі сполукою, що має формулу HC(O)P , де P − Н або (1-6C)алкіл, у присутності відновлювального засобу; та видалення будь-якої захисної групи або груп та необов'язково утворення солі 1 Стосовно способу (a), відщеплюваним атомом L може бути, наприклад, атом галогену, як1 то Br або I. Альтернативно, L може бути відщеплюваною групою, як-то гідрокарбілсульфонілоксил, наприклад, група трифлату, або арилсульфонілоксил або алкілсульфонілоксил, як-то месилат або тозилат. Придатні паладієві каталізатори охоплюють Pd(0) та Pd(II)-каталізатори, наприклад, Pd2(dba)3 та Pd(OAc) 2. Придатні ліганди охоплюють рац-BINAP або DIPHOS. Основою може бути, наприклад, карбонат лужного металу або алкоксид, як-то, наприклад, цезій карбонат або натрій трет-бутоксид. Придатні розчинники охоплюють апротонні розчинники, як-то етери (наприклад, тетрагідрофуран або п-діоксан) або 10 11 толуол. Сполучення сполуки формули (II) з HNR R можна легко робити при температурі між 0 °C та нагріванням із дефлегматором, та конкретніше − при нагріванні з дефлегматором. 1 Стосовно способу (b), відщеплюваним атомом L може бути, наприклад, атом галогену, як1 то Br, CI або I. Альтернативно L може бути відщеплюваною групою, наприклад, арилсульфонілоксилом або алкілсульфонілоксилом, як-то месилат або тозилат. Основою може бути, наприклад, гідрид або карбонат лужного металу, як-то натрій гідрид, калій гідрид, натрій карбонат, калій карбонат або цезій карбонат. Придатні розчинники охоплюють апротонні розчинники, як-то етери (наприклад, тетрагідрофуран або п-діоксан), ДМФ або ацетон. Реакцію можна легко проводити при температурі -78 − 100 °C. Стосовно способу (c), реагентом сполучення може бути будь-який придатний реагент, відомий спеціалістам у рівні техніки, наприклад, DEAD та PPh3. Придатні розчинники охоплюють апротонні розчинники, як-то етери (наприклад, тетрагідрофуран). Реакцію можна легко проводити при температурі -78 − 100 °C. Стосовно способу (d), реагентом сполучення може бути будь-який придатний реагент, відомий спеціалістам у рівні техніки, наприклад, DEAD та PPh3. Придатні розчинники охоплюють 12 UA 101611 C2 5 10 15 20 25 30 35 40 апротонні розчинники, як-то етери (наприклад, тетрагідрофуран). Реакцію можна легко проводити при температурі -78 − 100 °C. Стосовно способу (e), основою може бути, наприклад, гідрид або карбонат лужного металу, як-то натрій гідрид, калій гідрид, натрій карбонат, калій карбонат або цезій карбонат. Придатні розчинники охоплюють апротонні розчинники, як-то етери (наприклад, тетрагідрофуран або пдіоксан), диметилформамід, диметилацетамід, або ацетон. Реакцію можна легко проводити при температурі від температури навколишнього середовища до 100 °C. Стосовно способу (f), основою може бути, наприклад, гідрид або карбонат лужного металу, як-то натрій гідрид, калій гідрид, натрій карбонат, калій карбонат або цезій карбонат. Придатні розчинники охоплюють спирти, як-то метанол. Реакцію можна легко проводити при температурі від температури навколишнього середовища до 100 °C. Стосовно способу (г), основою може бути, наприклад, гідрид або карбонат лужного металу, як-то натрій гідрид, калій гідрид, натрій карбонат, калій карбонат або цезій карбонат. Придатні розчинники охоплюють апротонні розчинники, як-то етери (наприклад, тетрагідрофуран або пдіоксан), диметилформамід, диметилацетамід або ацетон. Реакцію можна легко проводити при температурі від температури навколишнього середовища до 100 °C. Стосовно способу (h), основою може бути, наприклад, гідрид лужного металу, як-то натрій гідрид, калій гідрид, або літій гідрид. Придатні розчинники охоплюють апротонні розчинники, якто етери (наприклад, тетрагідрофуран або п-діоксан), диметилформамід, диметилацетамід або 3 ацетон. Відщеплюваним атомом L може бути, наприклад, атом галогену, як-то Br, CI або I. Альтернативно L може бути відщеплюваною групою, наприклад, арилсульфонілоксилом або алкілсульфонілоксилом, як-то месилат або тозилат. Стосовно способу (i), основою може бути, наприклад, гідроксид лужного металу, як-то натрій гідроксид, калій гідроксид, літій гідроксид або цезій гідроксид. Придатні розчинники охоплюють апротонні розчинники, як-то етери (наприклад, тетрагідрофуран або п-діоксан), 4 диметилформамід, диметилацетамід або ацетон. Відщеплюваним атомом L може бути, 4 наприклад, атом галогену, як-то Br, CI або I. Альтернативно L може бути відщеплюваною групою, наприклад, арилсульфонілоксилом або алкілсульфонілоксилом, як-то месилат або тозилат. Реакцію необов'язково проводити в присутності каталізатору фазового переносу, як-то тетрабутиламоній йодид. Реакцію можна легко проводити при температурі в діапазоні від температури навколишнього середовища до 100 °C. Стосовно способу (j), придатні відновлювальні засоби охоплюють реагенти боргідриду, як-то натрій триацетоксиборгідрид або натрій ціаноборгідрид. Аміни придатної захисної групи для вищенаведених способів охоплюють будь-яку придатну захисну групу аміну, наприклад, як описано в Greene & Wuts, eds., "Protecting Groups in Organic Synthesis", John Wiley & Sons, Inc. Приклади амінів захисної групи охоплюють ацил- та алкоксикарбоніл, як-то т-бутоксикарбоніл (BOC). Сполуку формули II можна отримувати реакцією відповідного 2,8-дибромхіноліну, що має формулу з відповідною сполукою, що має формулу 45 застосовуючи паладієвий каталізатор (як-то Pd(PPh3)4, Pd2(dba)3 або Pd(OAc)2) та комплексну сполуку паладій-ліганд (наприклад, рац-BINAP або DIPHOS) у присутності 13 UA 101611 C2 5 придатної основи, наприклад, лужний метал карбонату або алкоксид-основи (наприклад, цезій карбонату, калій карбонату, або натрій трет-бутоксиду) у придатному розчиннику (як-то толуол або діоксан), приблизно, у діапазоні від температури навколишнього середовища до температури нагрівання з дефлегматором. Сполук формули IV можна отримувати реакцією сполуки, що має формулу 2 де P − захисна група спирту, як-то т-бутилдиметилсиліл, зі сполукою, що має формулу 10 15 20 25 30 35 40 45 50 у присутності N-бромосукциніміду або N-хлоросукциніміду в придатному розчиннику (як-то ТГФ). Сполуки формул (II), (IІІ) та (IV) уважаються новими, та їх запропоновано згідно із наступними аспектами винаходу. Здатність сполук тесту діяти як інгібітори PDGFR можна показати аналізом, описаним у прикладі A. Здатність сполук тесту діяти як інгібітори FLT3 можна показати аналізом, описаним у прикладі B. Сполуки формули I є корисними для лікування хвороб та розладів, опосередкованих тирозин-кіназами рецептору класу 3 та/або класу 5. У конкретних утіленнях сполуки цього винаходу є інгібіторами тирозин-кіназ одного або більше рецепторів класу 3, наприклад, PDGFR та FLT3. Наприклад, сполуки цього винаходу є корисними в лікуванні фіброзу (охоплюючи фібрози легенів, печінки та нирок), склеродерми, та раків, охоплюючи гематологічні злоякісні хвороби. Як тут застосовано, термін лікування охоплює профілактику а також лікування наявних станів. Приклади гематологічних злоякісних хвороб охоплюють, наприклад, наступне: лейкемії, лімфоми (лімфома не Ходжкіна), хвороба Ходжкіна (також названа лімфомою Ходжкіна), та, наприклад, мієлома, гостра лімфоцитарна лейкемія (ALL), гостра мієлоїдна лейкемія (AML), гостра промієлоцитарна лейкемія (APL), хронічна лімфоцитарна лейкемія (CLL), хронічна мієлоїдна лейкемія (CML), хронічна нейтрофільна лейкемія (CNL), гостра недиференційована лейкемія (AUL), анапластична багатоклітинна лімфома (ALCL), пролімфоцитарна лейкемія (PML), ювенільна мієломоноциклічна лейкемія (JMML), T-клітинна AML дорослих, AML з триродовідною мієлодисплазією (AML/TMDS), змішана потомствена лейкемія (MIX), синдроми мієлодисплазії (MDS), мієлопрофілеративні розлади (MPD) та множинна мієлома (MM). Конкретні приклади збуджених або залежних від PDGFR раків, котрі можна лікувати сполуками цього винаходу, охоплюють наступне: дерматофібросаркомні бугри (DFSB), хронічна мієломоноцитарна лейкемія (CMML), гіперзозинофілійний синдром (HES), злоякісна астроцитома (GBM) та шлунково-кишкові стромальні неоплазми (GIST). Інгібітори FLT3 також можуть бути корисними для лікування наступного: імунно-залежні розлади, як-то відторгнення трансплантату кісткового мозку, відторгнення твердого органу після трансплантування, анкілозувальний спондиліт, артрит, апластична анемія, хвороба Бекхета, хвороба Граве, гемолітична анемія, синдром гіпер-IgE, ідіоматична тромбоцитопенічна пурпура (ITP), розсіяний склероз (МС), ревматоїдний артрит, грануломатоз Вегенера, цукровий діабет 1 типу, астенічний бульбарний параліч та псоріаз. Конкретні сполуки цього винаходу є інгібіторами Pim-1, і тому є корисними в лікуванні хвороб та розладів, опосередкованих Pim-1, як-то раки, як-то гематологічні раки. Отже, згідно із іншим аспектом цього винаходу запропоновано спосіб лікування хвороби або медичних станів у ссавця, опосередкованих тирозин-кіназою рецептору класу 3 та/або класу 5, що полягає в застосуванні до названого ссавця одної або більше сполуки формули I або її фармацевтично прийнятної солі, або проліків у кількості, ефективній для лікування або попередження названого розладу. 14 UA 101611 C2 5 10 15 20 25 30 35 40 45 50 55 Згідно із іншим аспектом цього винаходу запропоновано спосіб лікування хвороби або медичних станів у ссавця, опосередкованих Pim-1, що полягає в застосуванні до названого ссавця одної або більше сполуки формули I або її фармацевтично прийнятної солі, або проліків у кількості, ефективній для лікування або попередження названого розладу. Вираз "ефективна кількість" означає кількість сполуки, застосовуваної до ссавця при потребі такого лікування, достатньої для (i) лікування або попередження конкретної хвороби, стану або розладу, опосередкованих тирозин-кіназою рецептору класу 3, (ii) послаблення, покращення або усунення одного або більше симптомів конкретної хвороби, стану або розладу, або (iii) попередження, або затримування появи одного або більше симптомів конкретної хвороби, стану або розладу, описаних тут. Кількість сполуки формули I слід варіювати залежно від факторів, як-то конкретна сполука, стан хвороби та її важкість, природа (наприклад, маса) ссавця, при потребі лікування, але, однак, може регулярно визначатися спеціалістом у рівні техніки. Як тут застосовано, термін "ссавець" стосується теплокровної тварини, яка має або є при ризику розвитку описаної тут хвороби, та охоплює, але без обмеження, наступне: морські свинки, собаки, коти, пацюки, миші, хом'яки та примати, охоплюючи людей. Сполуки заявленого винаходу можна застосовувати в комбінації з одними або більше додатковими ліками, наприклад, протизапальною сполукою, протифіброзною сполукою або хіміотерапевтичною сполукою, що працює за таким же або відмінним механізмом дії. Сполуки винаходу можна застосовувати будь-яким придатним шляхом, наприклад, у шлунково-кишковий тракт (наприклад, ректально або перорально), ніс, легені або м'язи, трансдермально, або дермально. Сполуки можна застосовувати в будь-якій придатній формі застосування, наприклад, як таблетки, порошки, капсули, розчини, дисперсії, суспензії, сиропи, спреї, супозиторії, гелі, емульсії, пластирі т.д. Такі композиції можуть містити звичайні складові у фармацевтичних препаратах, наприклад, розріджувачі, носії, модифікатори pH, замінники цукру, наповнювачі, та додаткові активні засоби. Якщо бажаним є парентеральне застосування, композиції повинні бути стерильними у формі розчину або суспензії, придатної для ін'єкції або інфузії. Так композиції складають подальший аспект винаходу. Згідно із ще одним аспектом заявленого винаходу запропоновано фармацевтичну композицію, котра містить сполуку формули I або її фармацевтично прийнятну сіль, як визначено вище. В одному утіленні фармацевтична композиція охоплює сполуку формули I разом із фармацевтично прийнятним розріджувачем або носієм. Згідно із ще одним аспектом заявленого винаходу запропоновано сполуку формули I або її фармацевтично прийнятну сіль для застосування в терапії, як-то лікування стану, опосередкованого тирозин-кіназою рецептору класу 3. У деяких утіленнях згідно із винаходом запропоновано сполуку формули I або її фармацевтично прийнятну сіль для застосування в лікуванні раку. У деяких утіленнях згідно із винаходом запропоновано сполуку формули I або її фармацевтично прийнятну сіль для застосування в лікуванні фіброзу. У деяких утіленнях згідно із винаходом запропоновано сполуку формули I або її фармацевтично прийнятну сіль для застосування в лікуванні склеродерми. Згідно із іншим аспектом заявленого винаходу запропоновано сполуку формули I або її фармацевтично прийнятну сіль для застосування в терапії, як-то лікування стану, опосередкованого Pim-1. Згідно із наступним аспектом заявленого винаходу запропоновано застосування сполуки формули I або її фармацевтично прийнятної солі у виготовленні медикаменту для лікування стану, опосередкованого тирозин-кіназою рецептору класу 3. Згідно із наступним аспектом заявленого винаходу запропоновано застосування сполуки формули I або її фармацевтично прийнятної солі у виготовленні медикаменту для лікування стану, опосередкованого Pim-1. Приклади Наступні приклади ілюструють винахід. В описаних нижче прикладах, якщо не вказано інакше, усі температури надано в градусах Цельсію. Реагенти купували від комерційних постачальників, як-то Aldrich Chemical Company, Lancaster, TCI or Maybridge, та застосовували без подальшого очищення, якщо не вказано інакше. Тетрагідрофуран (ТГФ), дихлорметан (DCM, метиленхлорид), толуол, та діоксан купували від Aldrich в надійних герметизованих посудинах та застосовували в тому вигляді як отримували. Нижченаведені реакції взагалі проводили під підвищеним тиском азоту або аргону, або з осушувальним патроном (якщо не вказано інакше) у безводних розчинниках, та реакційні 15 UA 101611 C2 5 10 15 20 25 30 35 40 посудини звичайно оснащували гумовою прокладкою для уведення субстратів та реагентів через шприц. Скляні посудини сушили в термостаті та/або термічною сушкою. 1 -1 Спектр H ЯМР отримували як розчини CDCl3, CD3OD, D2О або d6 ДМСО (наведено в млн ), -1 -1 застосовуючи тетраметилсилан (0,00 млн ) або залишковий розчинник (CDCI3: 7,25 млн ; -1 -1 -1 CD3OD: 3,31 млн ; D2О: 4,79 млн ; d6-ДМСО; 2,50 млн ) як зразковий стандарт. При сповіщенні щодо мултиплетностей піку застосовували наступні скорочення: s (синглет), d (дублет), t (триплет), m (мультиплет), br (розширений), dd (дублет дублетів), dt (дублет триплетів). Константу взаємодії надано в герцах (Гц). Приклад A Аналіз клітинної PDGFR Здатність сполук цього винаходу інгібувати індуковане PDGF фосфоритування PDGFR оцінювали, застосовуючи клітини NIH3T3 мишей. 25 000 клітин в DMEM, доповнених 10 % телячою сироваткою крові, додавали до кожної лунки 96-лункового планшету клітинної культури. Планшети інкубували в інкубаторі при 37 °C/5 %СО2 протягом 6-8 годин. Потім планшети промивали та інкубували з DMEM без сироватки, та клітини повертали до інкубатору й тримали при 37 °C/5 %CО2 протягом 16-20 годин. Додавали розчини сполуки тесту при кінцевих концентраціях 0-5 % ДМСО, та клітини інкубували в інкубаторі при 37 °C/5 %CO2 протягом 1 години. Потім додавали ліганд PDGF-BB (75 нг/мл) та інкубували протягом 15 хвил. Клітини промивали PBS та закріплювали в 3,7 % формальдегіді в PBS протягом 10 хвил. А потім − промивання в PBS/0,2 % Triton X-100 та просочування в 100 % MeOH протягом 10 хвил. Клітини блокували в блокувальному буфері Odyssey (LI-COR Biosciences) протягом 1 години. Антитіла для фосфорилування PDGFRp та загальної PDGFRp додавали до клітин та інкубували протягом 3 годин. Після промивання PBS/0,2 % TritonX-100 клітини інкубували із флуоресцентно-міченими вторинними антитілами (козиним IgG-IRDye800 проти кролів та козиним IgG-Alexa Fluor 680 проти мишей) протягом додаткової години. Потім клітини промивали PBS та визначали флуоресценцію при двох довжинах хвиль, застосовуючи Odyssey Infrared Imaging System (LI-COR Biosciences). Сигнал фосфорилованої PDGFR нормували до сигналу загальної PDGFR. Сполуки цього винаходу мали величини ІК50 менше 10 мкM в цьому аналізі. Приклад B Аналіз клітинної FLT3 Інгібування FLT3-ліганд (FL)-індукованої фосфоризованої FLT3 у клітинах RS4;11 людини визначали наступним чином. Клітини розміщували в 96--лункові V-донні планшети в RPMI/10 %FCS при концентрації 1 мільйон клітин/лунку. Додавали розведені сполуки при кінцевій концентрації 0,5 % ДМСО протягом одної години. Додавали FL при кінцевій концентрації 50 нг/мл. Після 15 хвил. інкубування клітини гранулювали центрифугуванням та ресуспендували в буфері для лізису. Фосфо-FLT3 визначали звичайною процедурою ELISА (R&D Systems; DYC368). Коротко, через 20 хвил. на льоду додавали лізат до 96-лункових планшетів, покритих іммобілізованим антитілом до загальної FLT3. Фосфо-FLT3 визначали додаванням антитіла до фосфо-тирозину, кон'югованого до HRP. Після додавання субстрату та стоп-розчину зчитували сигнал при A450. У цьому аналізі сполуки цього винаходу мали величини ІК50 менше 10 мкM. Приклад 1 45 50 55 (R)-2-(7-(2-Метоксіетокси)імідазоло[1,2-піридин-3-іл]-N-(піролідин-3-іл)хінолін-8-амін Етап 1A: Отримання 2-хлоро-4-(2-метоксіетокси)піридину: Суміш 2-хлоро-4-нітропіридину (43,6 г, 275,0 ммоль) та 2-метоксиетанолу (325,6 мл, 425 ммоль) охолоджували до 0 °C. Додавали калій 2-метилпропан-2-олат (35,73 г, 302,5 ммоль), та отриману суміш перемішували поки нагрівали до температури навколишнього середовища за 2 години. Реакційну суміш концентрували під зниженим тиском, а потім − розбавлення 500 мл води. Отриману суміш екстрагували двічі 250 мл дихлорметану. Комбіновані органічні шари сушили над MgSO 4 та концентрували під зниженим тиском для отримання бажаної сполуки як золотистої олії (50,2 г, 97 % вихід) МС ХІАТ (+) m/z 188 та 189,9 (M+1 кожного ізотопу) визначено. 16 UA 101611 C2 5 10 15 20 25 30 35 40 45 50 55 60 Етап 1B: Отримання 4-(2-метоксіетокси)піридин-2-аміну: Постійний потік азоту пропускали через суміш 2-хлоро-4-(2-метоксіетокси)піридину (50,17 г, 267,4 ммоль), Pd2dba3 (4,897 г, 5,348 ммоль), XPHOS (5,099 г, 10,70 ммоль) та тетрагідрофурану (445,7 мл) протягом 10 хвил. До отриманої дегазованої суміші додавали літій біс(триетилсиліл)амід (561,5 мл, 561,5 ммоль). Після додавання отриману суміш нагрівали до 60 °C протягом 18 годин. Реакцію охолоджували до температури навколишнього середовища температур та розбавляли 1 N хлоридною кислотою (200 мл). Отриманий розчин промивали двічі 500 мл метил-трет-бутил етеру. рH водного шару піднімали до 11 6 N NaOH та екстрагували дихлорметаном (3 × 500 мл). Комбіновані органічні шари сушили над MgSО 4 та концентрували під зниженим тиском до виходу заголовної сполуки. (35 г. 78 % вихід) МС ХІАТ (+) m/z 169 (M+1), визначено. Етап 1C: Отримання 7-(2-метоксіетокси)імідазо[1,2-а]піридину: Суміш 4-(2метоксіетокси)піридин-2-аміну (20,0 г, 119 ммоль), 2-хлороацетальдегіду (32,2 мл, 250 ммоль) та тетрагідрофурану (100 мл) нагрівали в герметизованому патроні до 75 °C протягом 3 діб. Реакційну суміш концентрували під зниженим тиском та розчиняли в етилацетаті. Отриманий розчин промивали двічі натрій гідрокарбонатом. Комбіновані органічні шари сушили над MgSО 4 та концентрували під зниженим тиском до виходу заголовної сполуки (23,5 г, кількісний вихід) МС ХІАТ (+) m/z 193 (M+1), визначено. Етап 2A: Отримання N-(2-бромофеніл)циннамаміду: До суміші 2-бромбензоламіну (200,0 г, 1163 ммоль), піридину (188,1 мл, 2325 ммоль) та сухого дихлорметану (1000 мл) при 0 °C повільно додавали хлорангідрид коричної кислоти (193,7 г, 1163 ммоль). Отриману суміш перемішували при нагріванні до температури навколишнього середовища протягом ночі. Отриману суміш промивали натрій гідрокарбонатом (1000 мл), 10 % натрій бісульфатом (1000 мл), натрій гідрокарбонатом (1000 мл) та розсолом (1000 мл). Органічний шар сушили над MgSO4 та концентрували під зниженим тиском до виходу заголовної сполуки як твердої речовини (172,3 г, 98 % вихід) МС ІЕР (+) m/z 224 та 226 (M+1 кожного ізотопу), визначено. Етап 2B: Отримання 8-бромохінолін-2(1Н)-ону: Суміш N-(2-бромофеніл)циннамаміду (172,3 г, 570,3 ммоль), алюміній хлориду (456 г, 342 ммоль) та хлорбензолу (1000 мл) перемішували при 100 °C протягом 7 годин, а потім − охолодження до температури навколишнього середовища протягом ночі. Отриману суміш заливали на 2 кг льоду та дозволяли нагріватися до температури навколишнього середовища протягом 1 години. Отриману суміш екстрагували дихлорметаном. Комбіновані органічні шари сушили над MgSО 4 та концентрували під зниженим тиском. Отримані тверді речовини обробляли 1000 мл гексанів. Тверді речовини сушили у вакуумі до виходу заголовної сполуки. (83 г, 65 % вихід) МС ІЕР (+) m/z 224 та 226 (M+1 кожного ізотопу), визначено. Етап 2C: Отримання 2,8-дибромхіноліну: Суміш 8-бромхінолін-2(1H)-ону (5 г, 22 ммоль) та фосфорилтриброміду (13 г, 45 ммоль) нагрівали до 140 °C протягом трьох годин. Отриману суміш заливали на 100 г льоду та 100 мл води. Суміш перемішували протягом 1 години та отримані тверді речовини фільтрували до виходу заголовної сполуки. (5,1 г, 80 % вихід) МС ХІАТ (+) 286, 288, та 290 (M+1 кожного ізотопу комбінації), визначено. Етап 2D: Отримання 8-бромо-2-(7-(2-метоксіетокси)імідазо[1,2-а]піридин-3-іл)хіноліну: Суміш 2,8-дибромхіноліну (22,4 г, 78,0 ммоль), 7-(2-метоксіетокси)імідазо[1,2-a]піридину (15,0 г, 78,0 ммоль), Pd(PPh3)4 (4,51 г, 3,90 ммоль), K2СО3 (21,6 г, 156 ммоль) та Pd(OAc)2 (0,876 г, 3,90 ммоль), діоксану (312 мл) та води (3 мл) нагрівали до 100 °C протягом 18 годин. Отриману суміш розбавляли дихлорметаном (500 мл) та фільтрували. Фільтрат концентрували під зниженим тиском, та до отриманої олії додавали етилацетат (100 мл) та метил трет-бутил-етер (100 мл). Отриману суміш перемішували протягом ночі. Фільтрували для збирання отриманих твердої речовини, що дало заголовну сполуку (22,2 г, 72 % вихід). МС ІЕР (+) m/z 398 та 400 (M+1 кожного ізотопу), визначено. Етап 2E: Отримання (S)-трет-бутил 3-(2-(7-(2-метоксіетокси)імідазоло[1,2-а]lпіридин-3іл)хінолін-8-іламіно)піролідин-1-карбоксилату: Потік аргону пропускали через суміш 8-бромо-2(7-(2-метокиетокси)-імідазо[1,2-а]піридин-3--іл)хіноліну (0,100 г, 0,2511 ммоль), (R)-трет-бутил 3амінопіролідин-1-карбоксилату (0,05537 мл, 0,3264 ммоль), Cs 2СО3 (0,1145 г, 0,3515 ммоль), Pd(OAc)2 (0,01127 г, 0,05022 ммоль) та рац-BINAP (0,01564 г, 0,02511 ммоль) в толуолі (1 мл) протягом 15 хвил. Суміш нагрівали до 100 °C протягом 18 годин. Потім суміші дозволяли охолоджуватися до температури навколишнього середовища, та додавали дихлорметан. Після перемішування протягом 30 хвил. отриману суміш фільтрували та фільтрат концентрували до виходу заголовної сполуки як олії. МС (+) ХІАТ m/z 504,1 (M+1), визначено. Етап F: Отримання (R)-2-(7-(2-метоксіетокси)імідазо[1,2-а]піридин-3-іл)-N-(піролідин-3іл)хінолін-8-аміну: До розчину (S)-трет-бутил 3-(2-(7-(2-метоксіетокси)імідазо[1,2-a]піридин3-іл)хінолін-8-іламіно)піролідин-1-карбоксилату (0,127 г, 0,252 ммоль) у дихлорметані (2 мл) 17 UA 101611 C2 5 додавали трифлуороцтову кислоту (0,389 мл, 5,04 ммоль). Отриману суміш перемішували протягом 2 годин при температурі навколишнього середовища. Реакційну суміш у дихлорметані концентрували під зниженим тиском та потім розбавляли дихлорметаном. Отриманий розчин промивали двічі насиченим натрій гідрокарбонатом та двічі розчином розсолу. Органічний шар сушили над магній сульфатом, фільтрували та концентрували під зниженим тиском. Очищення флеш-хроматографією на колонці (40:1 CH2Cl2/MeOH − 20:1 CH2Cl2/MeOH − 10:1 CH2Cl2/MeOH) дало заголовну сполуку (53 мг, 52 % вихід). МС ХІАТ (+) m/z 404,3 (M+1), визначено. Приклад 2 10 (S)-2-(7-(2-Метоксіетокси)імідазо[1,2-а]піридин-3-іл)-N-(піролідин-3-іл)хінолін-8-амін Отримано згідно із процедурою прикладу 1, застосовуючи (S)-трет-бутил 3-амінопіролідин-1карбоксилат замість (R)-трет-бутил 3-амінопіролідин-1-карбоксилату МС ХІАТ (+) m/z 404,3 (M+1), визначено. 15 Приклад 3 2-(7-(2-метоксіетокси)імідазо[1,2-а]піридин-3-іл)-8-(піперидин-4-ілокси)хінолін Етап A: 8-трет-бутилдиметилсилілокси)хінолін-2-карбальдегід: 8-Гідроксихінолін-2карбальдегід (5,00 г, 28,9 ммоль) та імідазол (4,32 г, 63,5 ммоль) розчиняли в дихлорметані (50 мл) під атмосферою сухого N2. Реакційну суміш потім охолоджували до 0 °C та додавали третбутилхлородиметилсилан (4,94 г, 31,8 ммоль). Реакцію перемішували протягом ночі при температурі навколишнього середовища, та потім розподіляли між дихлорметаном та водою. Органічний шар промивали водою та насиченим водним NaHСО 3, сушили над Na2SО4, фільтрували та концентрували під зниженим тиском. Очищення флеш-хроматографією (2:1 гексани/дихлорметан, а потім − 1:1 гексани/дихлорметан) дало 6,50 г, 78 % бажаного продукту як олії. Етап B: (Е)-8-(трет-бутилдиметилсилілокси)-2-(2-метоксивініл)хінолін: Метоксиметил трифенілфосфоній хлорид (3,94 г, 11,5 ммоль) суспендували в безводному ТГФ (25 мл) під атмосферою сухого N2. Після охолодження до 0 °C додавали калій третбутоксид (1,41 г, 12,5 ммоль). Розчин перемішували при 0 °C протягом 5 хвил., потім нагрівали до температури навколишнього середовища. Через 15 хвил. додавали 8-(третбутилдиметилсилілокси)хінолін-2-карбальдегід (3,00 г, 10,4 ммоль). Реакцію перемішували при температурі навколишнього середовища протягом ночі, та потім концентрували під вакуумом. Додавали діетилетер (200 мл) і суміш перемішували при температурі навколишнього середовища протягом 1 години, а потім фільтрували. Осад промивали діетилетером, та фільтрат збирали та концентрували під вакуумом. Отриманий осад розчиняли в діетилетері (50 мл), до котрого додавали гексани (50 мл). Суміш перемішували протягом 1 години та потім фільтрували. Фільтрат концентрували під вакуумом, що дало 3,12 г, 95 % бажаного продукту як суміші цис-транс ізомерів. Етап C: 2-(7-(2-метоксіетокси)імідазо[1,2-а]піридин-3-іл)хінолін-8-ол: (E)-8-(трет-бутилдиметилсилілокси)-2-(2-метоксивініл)хінолін (1,90 г, 6,02 ммоль) розчиняли в розчині ТГФ (20 мл) та води (3 мл). До реакційної суміші додавали N-бромсукцинімід (1,13, 6,32 ммоль). Після завершення реакції (контролювали за допомогою МС), додавали 4-(2метоксіетокси)піридин-2-амін 1,01 г, 6,02 ммоль). Потім реакцію нагрівали з дефлегматором протягом 5 годин, потім охолоджували до температури навколишнього середовища. До реакційної суміші додавали 10 мл 1,0 M тетрабутиламоній флуориду в ТГФ. Реакційну суміш перемішували при температурі навколишнього середовища протягом 1 години, потім розбавляли водою. Суміш екстрагували 1:4 ізопропіл-ацетатом:дихлорметаном. Комбіновану органічну фазу сушили (натрій сульфат), фільтрували та конденсували під зниженим тиском. 20 25 30 35 40 45 18 UA 101611 C2 5 10 15 20 25 30 Осад очищали флеш-хроматографією, елюючи з градієнтом 100 % EtOAс − 10 % MeOH (мас./ 6 % NH4ОН)/EtOAс, що дало 700 мг бажаного продукту як червоної твердої речовини. Етап D:. трет-бутил 4-(2-(7-(2-метоксіетокси)імідазо[1,2-а]піридин-3-іл)хінолін-8ілокси)піперидин-1-карбоксилат: 2-(7-(2-Метоксіетокси)імідазо[1,2-a]піридин-3-іл)хінолін-8-ол (0,030 г, 0,0895 ммоль), трет-бутил 4-гідроксипіперидин-1-карбоксилат (0,0198 г, 0,0984 ммоль), трифенілфосфін (0,0352 г, 0,134 ммоль) та діетилазодикарбоксилат (0,0211 мл, 0,134 ммоль) комбінували в безводному ТГФ (1 мл). Реакційну суміш перемішували протягом ночі при температурі навколишнього середовища, потім розбавляли EtOAc та промивали насиченим NaHСО3 та розсолом, сушили (Na2SО4), фільтрували та концентрували під зниженим тиском. Осад очищали флеш-хроматографією на колонці (дихлорметан, а потім − 40:1 дихлорметан/MeOH), що дало 29,0 мг бажаного продукту як коричневого осаду. Етап E: 2-(7-(2-метоксіетокси)імідазо[1,2-а]піридин-3-іл)-8-(піперидин-4-ілокси)хінолін: Трифлуороцтову кислоту 0,0862 мл, 1,12 ммоль) додавали до розчину трет-бутил 4-(2-(7-(2метоксіетокси)імідазо[1,2-а]піридин-3-іл)хінолін-8-ілокси)піперидин-1-карбоксилату (0,029 г, 0,0559 ммоль) у дихлорметані (0,50 мл). Після перемішування протягом ночі при температурі навколишнього середовища, реакційну суміш концентрували під зниженим тиском та розподіляли між дихлорметаном та насиченим NaHСО 3. Органічний шар промивали насиченим NaHCО3 та розсолом, сушили (Na2SO4), фільтрували та концентрували під зниженим тиском. Осад очищали флеш-хроматографією на колонці (40:1 дихлорметан /MeOH, а потім − 5:1 дихлорметан/MeOH, а потім − 2:1 дихлорметан/MeOH), що дало 10,0 мг бажаної сполуки. МС ХІАТ (+) m/z 419,2 (M+1), визначено. Приклад 4 (R)-2-(7-(2- Метоксіетокси)імідазо[1,2-а]піридин-3-іл)-8-(піперидин-4-ілокси)хінолін Отримано згідно із процедурою прикладу 3, застосовуючи (S)-трет-бутил 3гідроксипіролідин-1-карбоксилат замість трет-бутил 4-гідроксипіперидин-1-карбоксилату. МС ХІАТ (+) m/z 405,2 (M+1), визначено. Приклад 5 (S)-2-(7-(2-Метоксіетокси)імідазо[1,2-а]піридин-3-іл)-8-(піперидин-4-ілокси)хінолін Отримано згідно із процедурою прикладу 3, застосовуючи (R)-трет-бутил 3гідроксипіролідин-1-карбоксилат замість трет-бутил 4-гідроксипіперидин-1-карбоксилату. МС ХІАТ (+) m/z 405,2 (M+1), визначено. Приклад 6 35 2-('7-(2-МетоксіетоксиІмідазо[1,2-a]піридин-3-іл-8-(2-(піперидин-2-іл)етокси)хінолін Отримано згідно із процедурою прикладу 3, застосовуючи придатний аміно-захисний 2(піперидин-2-іл)етанол. МС ХІАТ (+) m/z 447,3 (M+1), визначено. Приклад 7 19 UA 101611 C2 5 2-("7-(2-Метоксіетокси)імідазо[1,2-a]піридин-3-іл)-8-(піперидин-3-ілметокси)хінолін Отримано згідно із процедурою прикладу 3, застосовуючи придатний амін-захисний піперидин-3-ілметанол. МС ХІАТ (+) m/z 433,3 (M+1), визначено. Приклад 8 10 8-(8-Азабіцикло[3.2.1]октан-3-ілокси)-2-('7-(2-метоксіетокси)імідазо[1,2-а]піридин-3-іл)хінолін Отримано згідно із процедурою прикладу 3, застосовуючи аміно-захисний 8азабіцикло[3,2,1]октан-3-ол. МС ХІАТ (+) m/z 445,2 (M+1), визначено. Приклад 9 15 3-(2-(7-(2-Метоксіетокси)імідазо[1,2-а]піридин-3-іл)хінолін-8-ілокси)2,2-диметилпропан-1-амін Отримано згідно із процедурою прикладу 3, застосовуючи придатний аміно-захисний 3аміно-2,2-диметилпропан-1-ол МС ХІАТ (+) m/z 421,2 (M+1), визначено. Приклад 10 20 (1R, 4R)-4-(2-(7-(2-Метоксіетокси)імідазо[1,2-а]піридин-3-іл)хінолін-8-ілокси)циклогексанамін Отримано згідно із процедурою прикладу 3, застосовуючи придатний аміно-захисний (1R, 4R)-4-аміноциклогексанол. МС ХІАТ (+) m/z 433,1 (M+1), визначено. Приклад 11 20 UA 101611 C2 5 10 15 20 25 (2S, 4R)-Метил 4-(2-(7-(2-метоксіетокси)імідазо[1,2-а]піридин-3-іл)хінолін-8-ілокси)піролідин2-карбоксилат Отримано згідно із процедурою прикладу 3, застосовуючи придатний аміно-захисний (2S, 4R)-метил 4-гідроксипіролідин-2-карбоксилат. МС ХІАТ (+) m/z 463,2 (M+1), визначено. Приклад 12 (2S, 4S)-Метил 4-(2-(7-(2-метоксіетокси)імідазо[1,2-а]піридин-3-іл)хінолін-8-ілокси)піролідин2-карбоксилат Отримано згідно із процедурою прикладу 3, застосовуючи придатний аміно-захисний (2S, 4S)-метил 4-гідроксипіролідин-2-карбоксилат. МС ХІАТ (+) m/z 463,2 (M+1), визначено. Приклад 13 (S)-3-((2-(7-(2-Метоксіетокси)імідазо[1,2-а]піридин-3-іл)хінолін-8-локси)метил)морфолін Отримано згідно із процедурою прикладу 3, застосовуючи придатний аміно-захисний (R)морфолін-3-ілметанол. МС ІЕР (+) m/z 435,2 (M+1), визначено. Приклад 14 8-((цис-4-Флуоропіролідин-3-ілокси)-2-(7-(2-метоксіетокси)імідазо[1,2-а]піридин-3-іл))хінолін гідрохлорид Етап A: Отримання бензил 6-окса-3-азабіцикло[3,1,0]гексан-3-карбоксилату; бензил 2,5дигідро-1H-пірол-1-карбоксилат (11,0 г, 54,1 ммоль, що є в продажу від Aldrich) та 3хлоробензопероксо-кислоту (17,3 г, 70,4 ммоль) додавали до 150 мл хлороформу та нагрівали до 46 °C протягом 20 годин. Суміш охолоджували, додавали дихлорметан, та реакцію промивали насиченим розчином NaHСО3 та Na2S2СО3. Комбіновані органічні шари сушили над MgSO4, фільтрували та концентрували, що дало 10,5 г (88 % виділ) бажаної сполуки як олії, котру застосовували безпосередньо в наступному етапі. 21 UA 101611 C2 5 10 15 20 25 30 35 40 45 50 Етап B: Отримання (транс)-бензил 3-флуоро-4-гідроксипіролідин-1-карбоксилату: Бензил 6окса-3-азабіцикло[3,1,0]гексан-3-карбоксилат (10,5 г, 47,9 ммоль) та піридин-гідроген флуорид (14,2 г, 144,0 ммоль) додавали до тефлонової посудини, що містить дихлорметан, та перемішували енергійно протягом ночі. Через 20 годин реакцію повільно та обережно гасили надлишком насиченого розчину NaHCО3 за кілька хвилин та перемішували протягом одної години, та потім органічний шар відокремлювали та промивали NaHCO 3 і розчином розсолу. Комбіновані органічні шари сушили над MgSО 4, фільтрували та випарювали до виходу олії. Цю сиру олію очищали на силікагелі, застосовуючи етилацетат-гексан, для отримання 2,0 г (17 % виділ) бажаного продукту як олії. Етап C: Отримання (транс)-бензил 3-флуоро-4-(метилсульфонілокси)піролідин-1карбоксилату: (транс)-бензил 3-флуоро-4-гідроксипіролідин-1-карбоксилат (2,0 г, 8,36 ммоль) додавали до дихлорметану та охолоджували до 0 °C. Послідовно додавали метансульфоніл хлорид (1,30 мл, 16-7 ммоль) та триетиламін (2,3 мл, 16-7 ммоль), та реакції дозволяли нагріватися до температури навколишнього середовища протягом ночі при енергійному перемішуванні. Наступної доби додавали додатковий дихлорметан, та реакційну суміш промивали насиченим розчином NaHCО3. Комбіновані органічні шари сушили над MgSО 4, фільтрували та випарювали. Сиру олію очищали на силікагелі, застосовуючи етилацетат та гексан для отримання 2,0 г (70 % виділ) бажаного продукту як олії. Етап D: Отримання (цис)-бензил 3-флуоро-4-(2-(7-(2-метоксіетокси)імідазо[1,2-а]піридин-3іл)хінолін-8-ілокси)піролідин-1-карбоксилату: 2-(7-(2-метоксіетокси)імідазо[1,2-a]піридин-3іл)хінолін-8-ол (1,75 г, 5,22 ммоль), (транс)-бензил 3-флуоро-4-(метилсульфонілокси)піролідин1-карбоксилат (1,99 г, 6,3. ммоль) та цезій карбонат (3,40 г, 10,4 ммоль) додавали до герметизованого патрону, що містить диметилацетамід, та нагрівали до 100 °C протягом ночі з перемішуванням. Диметилацетамід видаляли під вакуумним концентруванням та нагрівали, додавали хлороформ, та цю органічну фазу обережно промивали водою. Комбіновані органічні шари сушили над MgSO4, фільтрували та випарювали. Сирий матеріал очищали на силікагелі, застосовуючи 6 % розчин амоній гідроксиду в метанолі та дихлорметані до виходу трьох головних продуктів, котрі не можна було розділити, потім очищали на колонці (вихідний хінолінфенол, продукт та не ідентифікований побічний продукт). МС ХІАТ (+) m/z 557,3 (M+1), визначено. Цей сирий матеріал безпосередньо брали для зняття захисту в наступному етапі. Етап E: Отримання 8-((цис)-4-флуоропіролідин-3-ілокси)-2-(7-(2-метоксіетокси)імідазо[1,2а]піридин-3-іл)хінолін гідрохлориду: Сирий (цис)-бензил 3-флуоро-4-(2-(7-(2метоксіетокси)імідазо[1,2-a]піролідин-1-карбоксилат (1,0 г, 2,0 ммоль) та паладій на вуглецю(1 г, 50 % на молярній основі) додавали до суміші етанолу та 1 % HCl (об'єм. %), та розміщували під водень при енергійному перемішуванні. Через 18 годин сиру суміш пропускали через Целіт, промивали кілька разів етанолом, та збираний фільтрат випарювали. Сирий матеріал очищали на силікагелі, застосовуючи 6 % розчин амоній гідроксиду в метанолі та дихлорметані до виходу вільного головного продукту, котрий після піддавання HCl у дихлорметані та подальшого осадження в діетилетері давав 150 мг (16 % виділ) високочистого продукту. МС ХІАТ (+) m/z 423,3 (M+1), визначено. Приклад 15 3-(2-(7-(2-Метоксіетокси)імідазо[1,2-а]піридин-3-іл)хінолін-8-ілокси)-N.N, 2,2тетраметилпропан-1-амін Отримано згідно із прикладом 3 при заміні 3-(диметиламіно)-2,2-диметилпропан-1-олу на трет-бутил 4-гідроксипіперидин-1-карбоксилат (50 мг, 0,15 ммоль)] МС ІЕР (+)m/z 449,2 (M+1), визначено. Приклад 16 2-((2-(7-(2-Метоксіетокси)імідазо[1,2-а]піридин-3-іл)хінолін-8-ілокси)метил)морфолін 22 UA 101611 C2 5 10 До розчину 2-(7-(2-метоксіетокси)імідазо[1,2-а]піридин-3-іл)хінолін-8-олу [отримано як у прикладі 3, етап C; 50 мг, 0,15 ммоль] в безводному DMA (2 мл) додавали цезій карбонат (150 мг, 0,45 ммоль), а потім − трет-бутил 2-((метилсульфонілокси)метил)морфолін-4-карбоксилат (130 мг, 0,45 ммоль). Гетерогенну суміш перемішували при 100 °C протягом 16 годин та дозволяли охолодитися. Суміш обробляли водою (20 мл) та екстрагували EtOAc. Комбіновані органічні фази промивали водою та розсолом, потім сушили над Na 2SO4, фільтрували та концентрували. Осад очищали флеш-хроматографією на колонці, застосовуючи градієнтне елюювання (CH2Cl2 − 1 % MeOH/CH2Cl2 − 2 % MeOH/CH2Cl2), що дало трет-бутил 2-((2-(7-(2метоксіетокси)імідазо[1,2-a]піридин-3-іл)хінолін-8-ілокси)метил)морфолін-4-карбоксилат як смолу. Це розчиняли в CH2Cl2 (4 мл) та обробляли TFA (1 мл). Після перемішування протягом 2 годин при температурі навколишнього середовища суміш концентрували. Осад обробляли етером, фільтрували та сушили у вакуумі, що дало 29,1 мг (76 %) бажаного продукту як його диTFА-солі як порошку. МС ЕSl(+)m/z 435,3 (M+1), визначено. Приклад 17 15 20 25 30 2-(7-(2-Метоксіетокси)імідазо[1,2-а]піридин-3-іл)-8-(піперидин-4-ілметокси)хінолін Отримували згідно із процедурою прикладу 16, застосовуючи трет-бутил 4((метилсульфонілокси)метил)піперидин-1-карбоксилат замість трет-бутил 2((метилсульфонілокси)метил)морфолін-4-карбоксилату. МС ІЕР (+) m/z 433,1 (M+1), визначено. Приклад 18 7-(2-(7-(2-Метоксіетокси)імідазо[1,2-а]піридин-3-іл)хінолін-8-ілокси)-3-окса-9азабіцикло[3.3.1]нонан Отримували згідно із процедурою прикладу 16, застосовуючи трет-бутил 7(метилсульфонілокси)-3-окса-9-азабіцикло[3,3,1]нонан-9-карбоксилат замість трет-бутил 2((метилсульфонілокси)метил)морфолін-4-карбоксилату. МС ХІАТ (+) m/z 461,2 (M+1), визначено. Приклад 19 8-((цис-3-Флуоропіперидин-4-ілокси)-2-(7-(2-метоксіетокси)імідазо[1,2-а]піридин-3-іл)хінолін Отримували згідно із процедурою прикладу 16, застосовуючи (транс)-трет-бутил 3-флуоро4-(метилсульфонілокси)піперидин-1-карбоксилат замість трет-бутил 2-((метил сульфонілокси)метил)морфолін-4-карбоксилату. МС ІЕР (+) m/z 437,2 (M+1), визначено. Приклад 20 35 23 UA 101611 C2 5 10 15 20 25 30 35 40 45 50 55 60 8-((3S, 4S)-3-Флуоропіперидин-4-ілокси)-2-(7-(2-метоксіетокси)імідазо[1,2-a]піридин-3іл)хінолін та 8-((3R, 4R)-3-флуоропіперидин-4-ілокси)-2-(7-(2-метоксіетокси)імідазо[1,2a]піридин-3-іл)хінолін Етап A: Отримання трет-бутил 4-триметилсилілокси-5,6-дигідропіридин-1 (2H)карбоксилату: До розчину трет-бутил 4-оксопіперидин-1-карбоксилату (52,6 г, 264 ммоль) у безводному ДМФ (140 мл) додавали TMSCІ (40,2 мл, 317 ммоль), а потім − триетиламін (88,3 мл, 634 ммоль). Отриману гетерогенну суміш нагрівали до 80 °C та перемішували протягом 16 годин. Охолоджену суміш розбавляли гексанами (500 мл), промивали насиченим NaHСО 3 (3 × 300 мл) та розсолом (200 мл), потім сушили над Na2SQ4, фільтрували та концентрували, що дало 68 г (95 %) бажаного продукту як олії. Етап B: Отримання трет-бутил 3-флуоро-4-оксопіперидин-1-карбоксилату: До розчину третбутил 4-(триметилсилілокси)-5,6-дигідропіридин-1(2H)-карбоксилату (64,4 г, 237 ммоль) в безводному ACN (1,5 л) при температурі навколишнього середовища порціями додавали Selectfluor (92,5 г, 261 ммоль) за 10 хвил., протягом котрих спостерігали слабку екзотермічність D (до 40 C). Суміш перемішували протягом 2 годин, потім концентрували до сухого стану та розподіляли між EtOAc та розсолом. Водний шар екстрагували EtOAc, та комбіновані органічні фази промивали розсолом, сушили над Na2SO4, фільтрували та концентрували, що дало 51 г (99 %) бажаного продукту як твердої речовини. Етап C: Отримання 3-флуоропіперидин-4-он гідрохлориду: До мутного розчину трет-бутил 3флуоро-4-оксопіперидин-1-карбоксилату (52,66 г, 242 ммоль) в EtOAc (1 L) додавали 4M HCl/діоксан (303 мл, 1212 ммоль). Суміш перемішували при температурі навколишнього середовища протягом 16 годин. Отриманий осад збирали фільтруванням, промивали EtOAc та сушили у вакуумі, що дало 37 г (99 %) бажаного продукту як твердої речовини. Етап D: Отримання нафталін-2-ілметил 3-флуоро-4-оксопіперидин-1-карбоксилату: До суспензії 3-флуоропіперидин-4-он гідрохлориду (35,66 г, 232,2 ммоль) у ТГФ (800 мл) при 0 °C додавали розчин NaHСО3 (46,81 г, 557,3 ммоль) у воді (800 мл). Після послаблення найбільш сильного виділення розчин обробляли краплями розчину нафталін-2-ілметил карбонохлоридат (56,36 г, 255,4 ммоль) у ТГФ (300 мл) протягом 30 хвил. Суміші дозволяли нагріватися до температури навколишнього середовища за 16 годин з енергійним перемішуванням. Суміш розбавляли водою та екстрагували EtOAc. Комбіновані органічні фази промивали розсолом, потім сушили над Na2SO4, фільтрували та концентрували. Осад обробляли метанолом, та отриману тверду речовину фільтрували та сушили у вакуумі, що дало 41,8 г (60 %) бажаного продукту як порошку кремового кольору. Етап E: Отримання (цис)-нафталін-2-ілметил 3-флуоро-4-гідроксипіперидин-1-карбоксилату: До суспензії нафталін-2-ілметил 3-флуоро-4-оксопіперидин-1-карбоксилату (41,75 г, 138,6 ммоль) в безводному ТГФ (800 мл) при 0 °C краплями за 30 хвил додавали L-Selectride (346 мл, 1,0 M, 346 ммоль)., протягом чого утворено жовтий розчин. Розчину дозволяли нагріватися до температури навколишнього середовища та перемішували протягом 16 годин. Суміш охолоджували до 0 °C, потім обробляли метанолом (160 мл) та 2 N NaOH (350 мл), а потім додавали краплями 30 % H202 (160 мл), протягом чого спостерігали нагрівання. Після перемішування при 0 °C протягом додаткової 1 години та потім при температурі навколишнього середовища протягом 3 годин суміш екстрагували BtOAc. Комбіновані органічні фази промивали розсолом, сушили над Na2SO4, фільтрували та концентрували. Осад очищали на великому коржі силікагелю, елюючи гексанами:EtOAc, 1:1, що дало 26,78 г (64 %) бажаного продукту як твердої речовини. 2 г зразку матеріалу від етапу E розділяли хіральною ВЕРХ (3 см x 250 мм колонка Chiral Technologies IA; мобільна фаза 15 % етанол, 85 % гексани; швидкість потоку 28 моль/хвил.; 50 мг/мл; інжектування 254 та 220 нМ), що дало перший пік елюювання (пік 1, 616 мг, Rt 17,70 хвил.) з >99 % похибкою в припустимих межах, та другий пік елюювання (пік 2, 639 мг, Rt 22,12 хвил.) з >99 % похибкою в припустимих межах, обидві як білі тверді речовини. Матеріал, отриманий згідно піку 1, довільно визначили як (3S, 4R)-нафталін-2-ілметил 3-флуоро-4гідроксипіперидин-1-карбоксилат. Матеріал, отриманий згідно піку 2, довільно визначили як (3R, 4S)-нафталін-2-ілметил 3-флуоро-4-гідроксипіперидин-1-карбоксилат. Етап F: Отримання (3S, 4R)-нафталін-2-ілметил 3-флуоро-4(метилсульфонілокси)піперидин-1-карбоксилату та (3R, 4S)-нафталін-2-ілметил 3-флуоро-4(метилсульфонілокси)піперидин-1-карбоксилату: До розчину нафталін-2-ілметил 3-флуоро-4гідроксипіперидин-1-карбоксилату (пік 1), (616 мг, 2,03 ммоль) у безводному CH2CI2 (30 мл) при 0 °C додавали триетиламін (368 мкл, 2,64 ммоль) а потім − мезилхлорид (173 мкл, 2,23 ммоль). Суміші дозволяли повільно нагрітися до температури навколишнього середовища за 16 годин, потім обробляли Et3N (200 мкл) та мезилхлоридом (100 мкл) та перемішували протягом 24 UA 101611 C2 5 10 15 20 25 30 35 40 45 додаткової 1 години. Суміш розподіляли між CH2CI2 (30 мл) та насиченим NaHСО3 (30 мл), та водний шар екстрагували CH2CI2. Комбіновані органічні фази промивали розсолом, сушили над Na2SO4, фільтрували та концентрували. Осад очищали флеш-хроматографією на колонці (гексани:EtOAc, 2:1), що дало 540 мг (70 %) бажаного продукту як твердої речовини. Сполуку етапу E, позначену як пік 2 (639 мг, 2,11 ммоль), обробляли таким же шляхом, що дало 616 мг (77 %) бажаного продукту як білої твердої речовини. Етап G: Отримання (3S, 4S)-нафталін-2-ілметил 3-флуоро-4-(2-(7-(2метоксіетокси)імідазо[1,2-а]піридин-3- іл)хінолін-8-ілокси)піперидин-1-карбоксилату та (3R, 4R)-нафталін-2-ілметил 3-флуоро-4-(2-(7-(2-метоксіетокси)імідазо[1,2-а]піридин-3іл)хінолін-8-ілокси)піперидин-1-карбоксилату: До розчину 2-(7-(2метоксіетокси)імідазо[1,2-a]піридин-3-іл)хінолін-8-олу (отримано як у прикладі 3. 390 мг, 1,16 ммоль) у безводному ДМФ (5 мл) додавали цезій карбонат (1,14 г, 3,49 ммоль), а потім − нафталін-2-ілметил 3-флуоро-4-(метилсульфонілокси)піперидин-1-карбоксилат (пік 1) (532 мг, 1,40 ммоль). Гетерогенну суміш нагрівали до 90 °C та перемішували протягом 6 годин. Охолоджену суміш обробляли водою (50 мл) та екстрагували EtOAc. Комбіновані органічні фази промивали водою та розсолом, потім сушили над Na2SO4, фільтрували та концентрували. Осад очищали флеш-хроматографією на колонці, застосовуючи градієнтне елюювання (CH 2Cl2 − 2 % MeOH/CH2Cl2), що дало 293 мг (41 %) бажаного продукту піку 1 як скло. МС ХІАТ (+) m/z 621,2 (M+1), визначено. Нафталін-2-ілметил 3-флуоро-4-(метилсульфонілокси)піперидин-1-карбоксилат (пік 2) (450 мг, 1,34 ммоль) обробляли таким же шляхом, що дало 325 мг (39 %) бажаного продукту піку 2 як блідого жовтого скла. МС ХІАТ (+) m/z 621,2 (M+1), визначено. Етап H: Отримання 8-((3S, 4S)-3-флуоропіперидин-4-ілокси)-2-(7-(2метоксіетокси)імідазо[1,2-а]піридин-3-іл)хіноліну та 8-((3R, 4R)-3-флуоропіперидин-4-ілокси)-2(7-(2- метоксіетокси)імідазо[1,2-а]піридин-3-іл)хіноліну: До розчину (пік 1) нафталін-2-ілметил 3флуоро-4-(2-(7-(2-метоксіетокси)імідазо[1,2-a]піридин-3-іл)хінолін-8-ілокси)піперидин-1карбоксилату (293 мг, 0,47 ммоль) в суміші 1:1 EtOH:EtOAc (20 мл) додавали 10 % Pd/C (вологий, типу Degussa, 30 мг). Суміш очищали аргоном, потім перемішували під атмосферою H2 протягом 16 годин. Суміш далі обробляли 20 мг каталізатору, перевантажували та гідрогенізували далі протягом 16 годин. Суміш фільтрували через скловолоконний папір та концентрували у вакуумі. Осад очищали флеш-хроматографією на колонці, застосовуючи градієнтне елюювання (CH2CI2 − 2 % MeOH/CH2Cl2 − 5 % MeOH/CH2Cl2), що дало 128 мг (62 %) бажаного продукту як твердої речовини. МС ХІАТ (+) m/z 437,2 (M+1), визначено. Нафталін-2-ілметил 3-флуоро-4-(2-(7-(2-метоксіетокси)імідазо[1,2-a]піридин-3-іл)хінолін-8ілокси)піперидин-1-карбоксилат (325 мг, 0,52 ммоль) (пік 2) обробляли таким же шляхом, що дало 128 мг (56 %) бажаного продукту як блідої жовтої твердої речовини. МС ХІАТ (+) m/z 437,2 (M+1), визначено. Аналізом хіральної ВЕРХ підтверджено, що дотримано похибки в припустимих межах, та порядок елюювання для кінцевих піків узгоджується із цим для спиртів з етапу E. Приклад 21 (S)-2-(7-(2-Метоксіетокси)імідазо[1,2-а]піридин-3-іл)-8-(піперидин-3-ілокси)хінолін Отримували згідно із процедурою прикладу 16, застосовуючи (R)-трет-бутил 3(метилсульфонілокси)піперидин-1-карбоксилат замість. трет-бутил 2((метилсульфонілокси)метил)морфолін-4-карбоксилату. МС ІЕР (+) m/z 419,1 (M+1), визначено. Приклад 22 25 UA 101611 C2 5 10 15 20 25 30 35 40 (R)-2-(7-(2-Метоксіетокси)імідазо[1,2-а]піридин-3-іл)-8-(піперидин-3-ілокси)хінолін Отримували згідно із процедурою прикладу 16, застосовуючи (S)-трет-бутил 3(метилсульфонілокси)піперидин-1-карбоксилат замість трет-бутил 2((метилсульфонілокси)метил)морфолін-4-карбоксилату. МС ІЕР (+) m/z 419,1 (M+1), визначено. Приклад 23 (R)-2-(7-(2-Метоксіетокси)імідазо[1,2-а]піридин-3-іл)-8-(піперидин-2-ілметокси)хінолін Етап A: Отримання (R)-трет-бутил 2-((2-(7-(2-метоксіетокси)імідазо[1,2-a]піридин-3іл)хінолін-8-ілокси)метил)піролідин-1-карбоксилату: Отримували згідно із процедурою прикладу 14 етапу D при заміні (R)-трет-бутил 2-(тозилоксиметил)піролідин-1-карбоксилату на (транс)бензил 3-флуоро-4-(метилсульфонілокси)піролідин-1-карбоксилат. Етап B: Отримання (R)-2-(7-(2-метоксіетокси)імідазо[1,2-а]піридин-3-іл-8-(піролідин -2ілметокси)хіноліну: (R)-трет-бутил 2-((2-(7-(2-метоксіетокси)імідазо[1,2-a]піридин-3-іл)хінолін-8ілокси)метил) піролідин-1-карбоксилат (241 мг, 0,47 ммоль) розчиняли в 10 мл хлороформу, а потім − додавання 4,0M HCl в діоксані (4,65 мл, 9,3 ммоль). Реакцію перемішували протягом 30 годин при температурі навколишнього середовища, за цей час увесь вихідний матеріал поглинали способами РХ/ТРХ. Реакцію концентрували у вакуумі, а потім − флеш-хроматографія на колонці (елюючи з градієнтом 1 − 20 % MeOH/DCM), Що дало олію при концентрування. Сиру олію обробляли 1000 мкл 4,0 M HCl в діоксані, що дало бажаний продукт (80 мг, 41 % вихід). МС ХІАТ (+) m/z 419,1 (M+1), визначено. Приклад 24 2-(7-(2-Метоксіетокси)імідазо[1,2-а]піридин-3-іл-8-(піролідин-3-ілметокси)хінолін До розчину 2-(7-(2-метоксіетокси)імідазо[1,2-a]піридин-3-іл)хінолін-8-олу [отримано як у прикладі 16; 204 мг, 0,61 ммоль] в безводному DMA (5 мл) додавали цезій карбонат (0,60 г, 1,8 ммоль), а потім − трет-бутил 3-((метилсульфонілокси)метил)піролідин-1-карбоксилат (221 мг, 0,79 ммоль). Гетерогенну суміш перемішували при 70 °C протягом 20 годин та дозволяли охолодитися. Суміш обробляли водою (50 мл) та екстрагували хлороформом та EtOAc, Комбіновані органічні екстракти сушили над безводним Na2SО4, фільтрували та концентрували, що дало сирий продукт (386 мг, 122 % вихід) як густу олію. МС ІЕР (+) m/z 519,1 (M+1), визначено. Олію (315 мг) розчиняли в CH2CI2. (2 мл) та обробляли TFA (1 мл). Після перемішування протягом 2 годин при температурі навколишнього середовища суміш концентрували. Осад обробляли надлишком (20 мл) насиченого водного розчину натрій гідрокарбонату, та отриману суміш екстрагували хлороформом та EtOAc. Комбіновані органічні екстракти сушили над безводним Na2SО4 та концентрували, що дало в'язку олію. Олію очищали хроматографією на колонці із силікагелем (елюючи 7 N NH 3/MeOH-хлороформом), що дало заголовну сполуку (74 мг, 36 % вихід за два етапи) як тверду речовину. МС ІЕР (+) m/z 419,3 (M+1), визначено. Приклад 25 26 UA 101611 C2 5 10 15 20 25 30 35 40 45 50 5-(8-((транс-3-Флуоропіперидин-4-ілокси)-2-(7-(2-метоксіетокси)імідазо[1,2-a]піридин-3іл)хінолін-4-іл)оксазол 1. Отримання трет-бутил 2-етиніл-6-метоксифенілкарбамату Етап 1A: Отримання трет-бутил 2-йодо-6-метоксифенілкарбамату: До трет-бутил 2метоксифенілкарбамату (24,1 г, 108 ммоль) у сухому Et2О (100 мл) при -20 °C додавали краплями трет-бутиллітій (140 мл, 237 ммоль). Прозорий розчин перетворювався на мутний у кінці додавання. Реакцію перемішували протягом 3 годин при -20 °C, потім охолоджували до 100 °C у бані з рідким N2/Et2О. До розчину додавали йод (27,4 г, 108 ммоль) в Et2О (250 мл). Протягом додавання I2 реакцію повільно нагрівали до температури навколишнього середовища протягом ночі. Потім до реакційної суміші додавали Na2S2О3 (насичений, 200 мл) та фази розділяли. Водну екстрагували Et2О, та комбіновані органічні шари сушили (MgSО 4, фільтрували та концентрували. Додавали DCM (50 мл), а потім − гексани (200 мл). Розчин концентрували для видалення DCM. Продукт подрібнювали та збирали фільтруванням і промивали гексанами (100 мл), що дало сирий продукт (58 %). Етап 1B: Отримання трет-бутил 2-метокси-6-((триметилсиліл)етиніл)фенілкарбамату: До трет-бутил 2-йодо-6-метоксифенілкарбамату (10,36 г, 29,67 ммоль), етинілтриметилсилану (3,20 г, 32,63 ммоль), мідь(I) йодиду (0,28 г, 1,48 ммоль) та PdCl2(PPh3)2 (1,04 г, 1,48 ммоль) в ТГФ (100 мл) додавали триетиламін (3,60 г, 35,6 ммоль), а потім − протягом ночі перемішували. Потім сирий продукт концентрували, та суміш піддавали флеш-хроматографії через силікагель з 10:1 Hex/EtOAс, що дало бажаний продукт (98 %). Етап 1C: Отримання трет-бутил 2-етиніл-6-метоксифенілкарбамату: До трет-бутил 2метокси-6-((триметилсиліл)етиніл)фенілкарбамату (4,21 г, 13,2 ммоль) у MeOH (30 мл) додавали K2CO3 (9,11 г, 65,9 ммоль). Реакцію перемішували протягом 30 хвил., потім фільтрували та промивали DCM (50 мл). Комбіновані органічні шари концентрували та розбавляли DCM (20 мл), фільтрували, промивали другий раз DCM (50 мл), потім концентрували. Осад очищали флеш-хроматографією через прокладку силікагелю 10:1 Гексаном/EtOAc (500 мл), що дало бажаний продукт (62 %). 2. Отримання N-метокси-7-(2-метоксіетокси)-N-метилімідазо[1,2-a]піридин-3-карбоксаміду Етап 2A: Отримання етил 7-(2-метоксіетокси)імідазо[1,2-a]піридин-3-карбоксилату: Етил 2хлоро-3-оксопропаноат (5,1 г, 33,9 ммоль, Heterocycles 1991, стор. 699) та 4-(2метоксіетокси)піридин-2-амін (5,70 г, 33,9 ммоль) розчиняли в EtOH (50 мл) та нагрівали з дефлегматором протягом ночі. Сиру реакційну суміш концентрували та очищали флешхроматографією на колонці (EtOAc/MeOH 10:0 − 10:1), що дало бажаний продукт (57 %). Етап 2B: Отримання 7-(2-метоксіетокси)імідазо[1,2-a]піридин-3-карбонової кислоти: До етил 7-(2-метоксіетокси)імідазо[1,2-a]піридин-3-карбоксилату (5,01 г, 19,0 ммоль) у ТГФ/EtOH (32/6 мл) додавали літій гідроксид (37,9 мл, 37,9 ммоль), та реакцію перемішували протягом ночі. До суміш додавали HCl (57 ммоль, 2M в етері), а потім концентрували, що дало бажаний продукт. Етап 2C: Отримання N-метокси-7-(2-метоксіетокси)-N-метилімідазо[1,2-a]піридин-3карбоксаміду: До EDCI (2,196 г, 11,45 ммоль) та HOBT-H2O (1,754 г, 11,45 ммоль) у ДМФ (50 мл) додавали N-етил-N-ізопропілпропан-2-амін (1,480 г, 11,45 ммоль), а потім − додавання N, Одиметилгідроксиламін гідрохлориду (1,117 г, 11,45 ммоль). Реакцію перемішували протягом ночі, а потім концентрували для видалення найбільшої кількості ДМФ. Сиру суміш розбавляли насиченим NaHСО3 (20 мл)/EtOAc (40 мл).Потім водну фазу екстрагували EtOAc, сушили над Na2SО4 та концентрували, що дало бажаний продукт (72 %). , 3. Отримання 5-(8-(((транс-3-флуоропіперидин-4-ілокси)-2-( 7-(2-метоксіетокси)імідазо[1,2a]піридин-3-іл)хінолін-4-іл)оксазолу Етап 3A: Отримання трет-бутил 2-метокси-6-('3-('7-(2-метоксіетокси)імідазо[1,2-a]піридин-3іл)-3-оксопроп-1-ініл)фенілкарбамату: До трет-бутил 2-етиніл-6-метоксифенілкарбамату (1,77 г, 7,18 ммоль) у ТГФ (40 мл) додавали бутиллітій (0,919 г, 14,4 ммоль) при -78 °C, і реакцію перемішували протягом 1 години. Потім до реакційної суміші краплями додавали N-метокси-7(2-метоксіетокси)-N-метилімідазо[1,2-a]піридин-3-карбоксамід (1,67 г, 5,98 ммоль) у ТГФ (55 мл). Після додавання холодну баню видаляли, і реакцію нагрівали до температури навколишнього 27 UA 101611 C2 5 10 15 20 25 30 35 40 45 50 55 60 середовища. Потім перемішували протягом 2 годин при температурі навколишнього середовища, реакційну суміш заливали в холодний насичений NH 4CI (40 мл) та EtOAc (50 мл). Фази розділяли та водну фазу екстрагували EtOAc, сушили над Na2SO4, фільтрували та концентрували. Осад обробляли DCM, що дало продукт як тверду речовину. Розчин DCM концентрували та очищали флеш-хроматографією на колонці (EtOAc/MeOH 10:0 − 10:1), що дало бажаний продукт. Етап 3B: Отримання 4-йодо-8-метокси-2-(7-(2-метоксіетокси)імідазо[1,2-a]піридин-3іл)хіноліну: До трет-бутил 2-метокси-6-(3-(7-(2-метоксиетокси)імідазо[1,2-a]піридин-3-іл)-3оксопроп-1-ініл)фенілкарбамату (2,51 г, 5,39 ммоль) та натрій йодиду (16,2 г, 108 ммоль) додавали оцтову кислоту/мурашину кислоту (5 мл/5 мл). Реакційну посудину очищали N 2 та нагрівали до 60 °C протягом 3 годин. Потім реакцію охолоджували до температури навколишнього середовища та розбавляли H2O/DCM (50 мл/100 мл), а потім − екстрагування DCM. Комбіновані органічні шари промивали насиченим NaHСО3, сушили над Na2SO4, фільтрували та концентрували у вакуумі. Осад очищали флеш-хроматографією на колонці (EtOAc/MeOH 10:1), що дало бажаний продукт (92 %). Етап 3C: Отримання 8-метокси-2-(7-(2-метоксіeтокси)імідазо[1,2-a]піридин-3-іл)-4вінілхіноліну: До 4-йодо-8-метокси-2-(7-(2-метоксіетокси)імідазо[1,2-a]піридин-3-іл)хіноліну (898 мг, 1,89 ммоль) в NMP (10 мл) додавали Pd2dba3 (87 мг, 0,09 ммоль), трифуран-2-ілфосфін (88 мг, 0,37 ммоль) та трибутил(вініл)станат (659 мг, 2,1 ммоль). Реакційну колбу очищали N 2, і реакцію перемішували при 80 °C протягом 2 годин. Сиру суміш розбавляли EtOAc (30 мл), потім промивали H2О, сушили над Na2SО4 та концентрували. Осад очищали флеш-хроматографією на колонці (EtOAc/Гексан 8:1), що дало бажаний продукт (80 %). Етап 3D: Отримання 1-(8-метокси-2-(7-(2-метоксіетокси)імідазо[1,2-a]піридин-3-іл)хінолін-4іл)етан-1,2-діолу: До 8-метокси-2-(7-(2-метоксіетокси)імідазо[1,2-a]піридин-3-іл)-4-вінілхіноліну (656 мг, 1,75 ммоль) в DCM (20 мл) при 0 °C додавали краплями розчин триетилбензиламоній хлориду (504 мг, 2,62 ммоль) та KMnО4 (414 мг, 2,62 ммоль) в DCM (40 мл), і реакцію перемішували протягом 2 годин при 0 °C. Реакційну суміш потім нагрівали до температури навколишнього середовища та обробляли 3 % NaOH (30 мл). Суміш фільтрували через целіт та промивали DCM (100 мл), а потім − екстрагування DCM. Комбіновані органічні фази сушили над Na2SO4, фільтрували та концентрували, що дало бажаний продукт (44 %). Етап 3E: Отримання 8-метокси-2-(7-(2-метоксіетокси)імідазо[1,2-а]піридин-3-іл)хінолін-4карбальдегіду: До силікагелю (1,5 г) в DCM (5 мл) додавали краплями натрій перйодат (131 мкл, 0,850 ммоль), що дало після додавання кашку. До кашки додавали 1-(8-метокси-2-(7-(2метоксіетокси)імідазо[1,2-a]піридин-3-іл)хінолін-4-іл)етан-1,2-діол (232 мг, 0,567 ммоль) в DCM (3 мл), а потім перемішували 30 хвил… Суміш потім фільтрували, промивали DCM (10 мл), та концентрували, що дало бажаний продукт (100 %). Етап 3F: Отримання 5-(8-метокси-2-(7-(2-метоксіетокси)імідазо[1,2-а]піридин-3-іл)хінолін-4іл)оксазолу: До 8-метокси-2-(7-(2-метоксіетокси)імідазо[1,2-a]піридин-3-іл)хінолін-4карбальдегіду (210 мг, 0,556 ммоль) та 1-(ізоціанометилсульфоніл)-4-метилбензолу (130 мг, 0,668 ммоль) в MeOH (5 мл) додавали K2CO3 (154 мг, 1,11 ммоль), а потім − нагрівання з дефлегматором протягом 3 годин. Потім реакцію охолоджували до температури навколишнього середовища, концентрували та очищали флеш-хроматографією на колонці (EtOAc/MeOH 10:1), що дало бажаний продукт (73 %). МС ХІАТ (+) m/z 417,2 (M+1), визначено. Етап 3G: Отримання 2-(7-(2-метоксіетокси)імідазо[1,2-a]піридин-3-іл)-4-(оксазол-5-іл)хінолін8-олу: До 5-(8-метокси-2-(7-(2-метоксіетокси)імідазо[1,2-a]піридин-3-іл)хінолін-4-іл)оксазолу (80 мг, 0,19 ммоль) у ДМФ (3 мл) додавали натрій етантіолат (162 мг, 1,9 ммоль). Реакційну посудину герметизували та нагрівали до 150 °C протягом 2 годин. Потім реакцію охолоджували до температури навколишнього середовища та концентрували. Осад очищали флешхроматографією на колонці (DCM/MeOH 10:1), що дало бажаний продукт (39 %). Етап 3H: Отримання (транс)-трет-бутил 3-флуоро-4-(2-(7-(2-метоксіетокси)імідазо[1,2а]піридин-3-іл)-4-(оксазол-5-іл)хінолін-8-ілокси)піперидин-1-карбоксилату: До 2-(7-(2метоксіетокси)імідазо[1,2-а]піридин-3-іл)-4-(оксазол-5-іл)хінолін-8-олу (9 мг, 0,02 ммоль) в DMA (2 мл) додавали (цис)-трет-бутил 3-флуоро-4- (метилсульфонілокси)піперидин-1-карбоксилат (13 мг, 0,04 ммоль) та Cs2CO3 (22 мг, 0,07 ммоль). Реакційну посудину герметизували та нагрівали до 106 °C протягом 4 годин. Реакцію охолоджували до температури навколишнього середовища та концентрували. Сирий осад очищали флеш-хроматографією на колонці (DCM/MeOH 10:1), що дало бажаний продукт (3 %). Етап 31: Отримання 5-(8-((транс-3-флуоропіперидин-4-ілокси)-2-(7-(2метоксіетокси)імідазо[1,2-а]піридин-3-іл)хінолін-4-іл)оксазолу: До (транс)-трет-бутил 3-флуоро4-(2-(7-(2-метоксіетокси)імідазо[1,2-a]піридин-3-іл)-4-(оксазол-5-іл)хінолін-8-ілокси)піперидин-1 28
ДивитисяДодаткова інформація
Назва патенту англійськоюCompounds of imidazo[1,2-a]pyridine as receptor tyrosine kinase inhibitors
Автори англійськоюAllen, Shelley, Greschuk, Julie, Marie, Kallan, Nicholas, C., Marmsater, Fredrik, P., Munson, Mark, C., Rizzi, James, P., Robinson, John, E., Schlachter, Stephen, T., Topalov, George, T., Zhao, Qian, Lyssikatos Joseph P.
Назва патенту російськоюСоединения имидазо[1,2-а]пиридина как ингибиторы тирозинкиназы рецепторов
Автори російськоюАллен Шелли, Грещук Джули Мари, Келлен Николас К., Мармсетер Фредерик П., Мансон Марк К., Рицци Джеймс П., Робинсон Джон И., Шлахтер Стивен Т., Топалов Георге Т., Чжао Цянь, Лиссикатос Джозеф П.
МПК / Мітки
МПК: A61P 35/00, A61K 31/33, C07D 471/04
Мітки: імідазо[1,2-а]піридину, тирозинкінази, сполуки, інгібітори, рецепторів
Код посилання
<a href="https://ua.patents.su/52-101611-spoluki-imidazo12-apiridinu-yak-ingibitori-tirozinkinazi-receptoriv.html" target="_blank" rel="follow" title="База патентів України">Сполуки імідазо[1,2-а]піридину як інгібітори тирозинкінази рецепторів</a>