Похідні 4-(діарилметил)-1-піперазинілу
Номер патенту: 76609
Опубліковано: 15.08.2006
Автори: Мідха Аджай Соханлал, Чіттурі Трінадха Рао, Чокші Хермант Ашвінбхаі, Тхеннаті Раджаманнар
Формула / Реферат
1. Сполука формули І
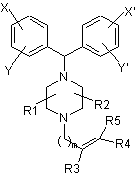 Формула І,
Формула І,
в якій X, Y, X' та Y' вибрані з водню, галогену, заміщеного або незаміщеного алкілу (нерозгалуженого, розгалуженого або циклічного), арилу, алкілокси та галоалкільної групи; R1, R2, R3 та R4 вибрані з водню, заміщених або незаміщених алкільних груп (нерозгалужених, розгалужених або циклічних), арилу, гетероарильних груп або аралкільних груп, гетероциклів, що містять один або більше гетероатомів (тобто N, S, О), заміщених або незаміщених алкенільних або алкінільних груп з 2-6 атомів вуглецю; при цьому замісники R1 та R2 у піперазинільній групі розташовані у син- або в антиположенні один до одного та, можливо, R3 та R4 разом з атомами вуглецю, до яких вони прикріплені, утворюють моноциклічне насичене або арильне, або заміщене арильне, або гетероарильне, або заміщене гетероарильне кільце, що містить один або більше гетероатомів, вибраних з N, S та О, при цьому кількість атомів у кільці складає від 3 до 6; за умови, що, коли R3 та R4 разом не утворюють частину кільця, вони можуть знаходитися у Е- або у Z-конфігурації;
R5 являє собою (CH2)n-O-CH2-CO-Z, де n=1-6; Z вибране з ОН, OR, NRR', N(OR)R', N(R)-N(R)R' та 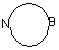 , де R та R' вибрані з водню, заміщених або незаміщених алкільних груп (нерозгалужених, розгалужених або циклічних), арильних, гетероарильних груп або аралкільних груп, гетероциклів, що містять один або більше гетероатомів (тобто, N, S, О), заміщених або незаміщених алкенільних або алкінільних груп з 2-6 атомів вуглецю; і В вибране з -(СH2)n- (n=1-6) та -(CH2)x-D-(CH2)y, де D являє собою О, NR, S або SO2, х та у незалежно один від одного дорівнюють 1-6; і m вибране з 1-6;
, де R та R' вибрані з водню, заміщених або незаміщених алкільних груп (нерозгалужених, розгалужених або циклічних), арильних, гетероарильних груп або аралкільних груп, гетероциклів, що містять один або більше гетероатомів (тобто, N, S, О), заміщених або незаміщених алкенільних або алкінільних груп з 2-6 атомів вуглецю; і В вибране з -(СH2)n- (n=1-6) та -(CH2)x-D-(CH2)y, де D являє собою О, NR, S або SO2, х та у незалежно один від одного дорівнюють 1-6; і m вибране з 1-6;
та її фармацевтично прийнятні солі.
2. Сполука за п. 1, в якій
X, Y, X' та Y' вибрані з водню, хлору та фтору;
R1 та R2 являють собою водень;
R3 та R4 являють собою водень у Е- або у Z-конфігурації або, можливо, коли вони знаходяться у Z-конфігурації, R3 та R4 разом з атомами вуглецю, до яких вони прикріплені, утворюють бензольне кільце; і
R5 являє собою CH2-O-CH2-CO-Z, де Z вибране з ОН та OR, при цьому R може бути вибраний з метилу, етилу та ізопропілу;
і m=1.
3. Сполука за п. 1, що являє собою
{4-{4-[біс-(4-фторфеніл)метил]піперазин-1-іл}-(Z)-бут-2-енілоксі}оцтову кислоту або її фармацевтично прийнятну сіль.
4. Сполука за п. 1, що являє собою
{4-[4-[(4-хлорфеніл)фенілметил]піперазин-1-іл]-(Z)-бут-2-енілоксі}оцтову кислоту або її фармацевтично прийнятну сіль.
5. Сполука за п. 1, що являє собою
[4-(4-бензгідрилпіперазин-1-іл)-(Z)-бут-2-енілоксі]оцтову кислоту або її фармацевтично прийнятну сіль.
6. Сполука за п. 1, що являє собою
{4-{4-[біс-(2,4-дифторфеніл)метил]піперазин-1-іл}-(Z)-бут-2-енілоксі}оцтову кислоту або її фармацевтично прийнятну сіль.
7. Сполука за п. 1, що являє собою
{4-[4-[біс-(4-хлорфеніл)метил]піперазин-1-іл]-(Z)-бут-2-енілоксі}оцтову кислоту або її фармацевтично прийнятну сіль.
8. Сполука за п. 1, що являє собою
{4-{4-[біс-(4-фторфеніл)метил]піперазин-1-іл}-(Z)-бут-2-енілоксі}оцтової кислоти метиловий ефір або його фармацевтично прийнятну сіль.
9. Сполука за п. 1, що являє собою
{4-{4-[біс-(4-фторфеніл)метил]піперазин-1-іл}-(Z)-бут-2-енілоксі}оцтової кислоти етиловий ефір або його фармацевтично прийнятну сіль.
10. Сполука за п. 1, що являє собою
{4-{4-[біс-(4-фторфеніл)метил]піперазин-1-іл}-(Z)-бут-2-енілоксі}оцтової кислоти ізопропіловий ефір або його фармацевтично прийнятну сіль.
11. Сполука за п. 1, що являє собою
{4-[4-[(4-хлорфеніл)фенілметил]піперазин-1-іл]-(Z)-бут-2-енілоксі}оцтової кислоти ізопропіловий ефір або його фармацевтично прийнятну сіль.
12. Сполука за п. 1, що являє собою
{4-[4-[(4-хлорфеніл)фенілметил]піперазин-1-іл]-(Z)-бут-2-енілоксі}оцтової кислоти метиловий ефір або його фармацевтично прийнятну сіль.
13. Сполука за п. 1, що являє собою
{4-[4-[(4-хлорфеніл)фенілметил]піперазин-1-іл]-(Z)-бут-2-енілоксі}оцтової кислоти етиловий ефір або його фармацевтично прийнятну сіль.
14. Сполука за п. 1, що являє собою
{2-{4-[біс-(4-фторфеніл)метил]піперазин-1-ілметил}бензилоксі}оцтову кислоту або її фармацевтично прийнятну сіль.
15. Сполука за п. 1, що являє собою
{2-{4-[(4-хлорфеніл)фенілметил]піперазин-1-ілметил}бензилокси}оцтову кислоту або її фармацевтично прийнятну сіль.
16. Сполука за п. 1, що являє собою
{4-[4-[біс-(4-фторфеніл)метил]піперизин-1-іл]-(Е)-бут-2-енілоксі}оцтову кислоту або її фармацевтично прийнятну сіль.
17. Сполука за п. 1, що являє собою {4-[4-[(4-хлорфеніл)фенілметил]піперизин-1-іл]-(Е)-бут-2-енілоксі}оцтову кислоту або її фармацевтично прийнятну сіль.
18. Сполука за п. 1, що являє собою
{4-[4-[(4-фторфеніл)фенілметил]піперазин-1-іл]-(Е)-бут-2-енілоксі}оцтову кислоту або її фармацевтично прийнятну сіль.
19. Фармацевтична композиція, що містить сполуку формули І за п. 1 і фармацевтично прийнятний носій.
Текст
1. Сполука формули І 2 3 76609 4 [4-(4-бензгідрилпіперазин-1-іл)-(Z)-бут-2-енілоксі] {4-[4-[(4-хлорфеніл)фенілметил]піперазин-1-іл]-(Z)оцтову кислоту або її фармацевтично прийнятну бут-2-енілоксі}оцтової кислоти метиловий ефір або сіль. його фармацевтично прийнятну сіль. 6. Сполука за п.1, що являє собою 13. Сполука за п.1, що являє собою {4-{4-[біс-(2,4-дифторфеніл)метил]піперазин-1-іл}{4-[4-[(4-хлорфеніл)фенілметил]піперазин-1-іл]-(Z)(Z)-бут-2-енілоксі}оцтову кислоту або її фармацевбут-2-енілоксі}оцтової кислоти етиловий ефір або тично прийнятну сіль. його фармацевтично прийнятну сіль. 7. Сполука за п.1, що являє собою 14. Сполука за п.1, що являє собою {4-[4-[біс-(4-хлорфеніл)метил]піперазин-1-іл]-(Z){2-{4-[біс-(4-фторфеніл)метил]піперазин-1бут-2-енілоксі}оцтову кислоту або її фармацевтичілметил}бензилоксі}оцтову кислоту або її фармано прийнятну сіль. цевтично прийнятну сіль. 8. Сполука за п.1, що являє собою 15. Сполука за п.1, що являє собою {4-{4-[біс-(4-фторфеніл)метил]піперазин-1-іл}-(Z){2-{4-[(4-хлорфеніл)фенілметил]піперазин-1бут-2-енілоксі}оцтової кислоти метиловий ефір або ілметил}бензилокси}оцтову кислоту або її фармайого фармацевтично прийнятну сіль. цевтично прийнятну сіль. 9. Сполука за п.1, що являє собою 16. Сполука за п.1, що являє собою {4-{4-[біс-(4-фторфеніл)метил]піперазин-1-іл}-(Z){4-[4-[біс-(4-фторфеніл)метил]піперизин-1-іл]-(Е)бут-2-енілоксі}оцтової кислоти етиловий ефір або бут-2-енілоксі}оцтову кислоту або її фармацевтичйого фармацевтично прийнятну сіль. но прийнятну сіль. 10. Сполука за п.1, що являє собою 17. Сполука за п.1, що являє собою {4-[4-[(4{4-{4-[біс-(4-фторфеніл)метил]піперазин-1-іл}-(Z)хлорфеніл)фенілметил]піперизин-1-іл]-(Е)-бут-2бут-2-енілоксі}оцтової кислоти ізопропіловий ефір енілоксі}оцтову кислоту або її фармацевтично або його фармацевтично прийнятну сіль. прийнятну сіль. 11. Сполука за п.1, що являє собою 18. Сполука за п.1, що являє собою {4-[4-[(4-хлорфеніл)фенілметил]піперазин-1-іл]-(Z){4-[4-[(4-фторфеніл)фенілметил]піперазин-1-іл]бут-2-енілоксі}оцтової кислоти ізопропіловий ефір (Е)-бут-2-енілоксі}оцтову кислоту або її фармацевабо його фармацевтично прийнятну сіль. тично прийнятну сіль. 12. Сполука за п.1, що являє собою 19. Фармацевтична композиція, що містить сполуку формули І за п.1 і фармацевтично прийнятний носій. Винахід стосується сполуки формули І, 4(діарилметил)-1-піперазинільних похідних з алкенільною групою, заміщеною в положенні 1 піперазинової молекули. або заміщене гетероарильне кільце, що містить один або більше гетероатомів, вибраних з N, S та О, при цьому кількість атомів у кільці складає від 3 до 6; за умови, що, коли R3 та R4 разом не утворюють частину кільця, вони можуть знаходитися у Е- або у Z-конфігурації; R5 являє собою (CH2)n-O-CH2-CO-Z, де n=1-6; Ζ вибране з ОН, OR, NRR', N(OR)R', N(R)-N(R)R' та N в якій Χ, Υ, X' та Y' вибрані з водню, галогену, заміщеного або незаміщеного алкілу (нерозгалуженого, розгалуженого або циклічного), арилу, алкілокси та галоалкільної групи; R1, R2, R3 та R4 вибрані з водню, заміщених або незаміщених алкільних груп (нерозгалужених, розгалужених або циклічних), арилу, гетероарильних груп або аралкільних груп, гетероциклів, що містять один або більше гетероатомів (тобто N, S, О), заміщених або незаміщених алкенільних або алкінільних груп з 2-6 атомів вуглецю; при цьому замісники R1 та R2 у піперазинільній групі розташовані у син- або в анти-положенні один до одного та, можливо, R3 та R4 разом з атомами вуглецю, до яких вони прикріплені, утворюють моноциклічне насичене або арильне або заміщене арильне або гетероарильне B , де R та R' вибрані з водню, заміщених або незаміщених алкільних груп (нерозгалужених, розгалужених або циклічних), арильних, гетероарильних груп або аралкільних груп, гетероциклів, що містять один або більше гетероатомів (тобто, N, S, О), заміщених або незаміщених алкенільних або алкінільних груп з 2-6 атомів вуглецю; і В вибране з -(СН2)n-(n=1-6) та -(CH2)x-D-(CH2)y, де D являє собою О, NR, S або SO2, x та у незалежно один від одного дорівнюють 1-6; і m вибране з 1-6; та її фармацевтично прийнятної солі. Група R5 у формулі І являє собою алкілоксиоцтову кислоту та її похідні, такі як ефір, амід, гідроксамова кислота або гідразид. Ці сполуки включають їх нетоксичні фармацевтично прийнятні солі з кислотами та сполуки з лужними металами, лужноземельними металами або амінами, включаючи гідроксиалкіламіни та полігідроксиламіни. Сполуки за винаходом являють собою антигістамінні сполуки, придатні у лікуванні гістамінопосереднених захворювань. 5 76609 6 [У патенті США №4525358] описана антигістазаміщеного або незаміщеного алкілу (нерозгалумінна сполука цетиризин женого, розгалуженого або циклічного), арилу, алкілокси та галоалкільної групи; R1, R2, R3 та R4 вибрані з водню, заміщених або незаміщених алкільних груп (нерозгалужених, розгалужених або циклічних), арилу, гетероарильних груп або аралкільних груп, гетероциклів, що містять один або більше гетероатомів (тобто N, S, О), заміщених яку використовують у якості протиалергійного, або незаміщених алкенільних або алкінільних груп антигістамінного, бронхолітичного або спазмолітиз 2-6 атомів вуглецю; при цьому замісники R1 та R2 чного засобу. Він є корисним для пацієнтів, що у піперазинільній групі розташовані у син- або в страждають на розлади, лікування яких потребує анти-положенні один до одного та, можливо, R3 та вищезазначених ефектів. Проте ця сполука не R4 разом з атомами вуглецю, до яких вони прикрімістить олефінового бокового ланцюга у піперазиплені, утворюють моноциклічне насичене або ариновому кільці. льне або заміщене арильне або гетероарильне [У публікації РСТ WO 01/79188] описані нові або заміщене гетероарильне кільце, що містить сполуки формули один або більше гетероатомів, вибраних з N, S та О, при цьому кількість атомів у кільці складає від 3 до 6; за умови, що, коли R3 та R4 разом не утворюють частину кільця, вони можуть знаходитися у Е- або у Z-конфігурації; R5 являє собою (CH2)n-O-CH2-CO-Z, де n=1-6; Ζ вибране з ОН, OR, NRR', N(OR)R', N(R)-N(R)R' та що є більш гідрофобними за природою, ніж цетиризин, оскільки Υ являє собою заміщену або незаміщену гетероциклічну, поліциклічну гідрокарбонільну, гетерополіциклічну, карбоциклічну аренільну, гетерополіциклічну аренільну або теофілінову групу. [У публікації РСТ WO 00/58295] описані нові сполуки формули N B , де R та R' вибрані з водню, заміщених або незаміщених алкільних груп (нерозгалужених, розгалужених або циклічних), арильних, гетероарильних груп або аралкільних груп, гетероциклів, що містять один або більше гетероатомів (тобто, N, S, О), заміщених або незаміщених алкенільних або алкінільних груп з 2-6 атомів вуглецю; і В вибране з -(СН2)n-(n=1-6) та -(CH2)x-D-(CH2)y, де D являє собою О, NR, S або SO2, x та у незалежно один від одного дорівнюють 1-6; і m вибране з 1-6; та її фармацевтично прийнятні солі. Таким чином, даний винахід стосується сполуки формули І для лікування астми, алергії та запальних хвороб, в яких W або замісник у фенільному кільці являє собою гідроксиламін. [У Європейському патенті №598123] описані похідні піперазину формули що відрізняються від сполуки формули І, оскільки вони не містять олефінового бокового ланцюга у піперазиновому кільці. Таким чином, ми отримали нові антигістамінні сполуки. Задача винаходу полягає в отриманні антигістамінних сполук формули І та їх фармацевтично прийнятних солей. Сполука формули І в якій Χ, Υ, X' та Y' вибрані з водню, галогену, в якій Χ, Υ, X' та Y' вибрані з водню, галогену, заміщеного або незаміщеного алкілу (нерозгалуженого, розгалуженого або циклічного), арилу, алкілокси та галоалкільної групи; R1, R2, R3 та R4 вибрані з водню, заміщених або незаміщених алкільних груп (нерозгалужених, розгалужених або циклічних), арилу, гетероарильних груп або аралкільних груп, гетероциклів, що містять один або більше гетероатомів (тобто N, S, О), заміщених або незаміщених алкенільних або алкінільних груп з 2-6 атомів вуглецю; при цьому замісники R1 та R2 у піперазинільній групі розташовані у син- або в анти-положенні один до одного та, можливо, R3 та R4 разом з атомами вуглецю, до яких вони прикріплені, утворюють моноциклічне насичене або арильне або заміщене арильне або гетероарильне або заміщене гетероарильне кільце, що містить один або більше гетероатомів, вибраних з N, S та О, при цьому кількість атомів у кільці складає від 3 7 76609 8 до 6; за умови, що, коли R3 та R4 разом не утвоконфігурації або, можливо, R3 та R4 разом з аторюють частину кільця, вони можуть знаходитися у мами вуглецю, до яких вони прикріплені, утворюЕ- або у Z-конфігурації; ють бензольне кільце; і R5 являє собою (CH2)n-O-CH2-CO-Z, де n=1-6; R5 являє собою CH2-O-CH2-CO-Z, де Ζ вибраΖ вибране з ОН, OR, NRR', N(OR)R', N(R)-N(R)R' та не з ОН та OR, при цьому R може бути вибраний з метилу, етилу та ізопропілу; та m=1. B N Сполуки за винаходом можуть бути отримані , де R та R' вибрані з водню, заміщених або різними способами. Наприклад, показаними на незаміщених алкільних груп (нерозгалужених, розСхемах 1-4. галужених або циклічних), арильних, гетероарильУ способі, показаному на Схемі 1 них груп або аралкільних груп, гетероциклів, що містять один або більше гетероатомів (тобто, N, S, О), заміщених або незаміщених алкенільних або алкінільних груп з 2-6 атомів вуглецю; і В вибране з -(СН2)n-(n=1-6) та -(CH2)x-D-(CH2)y, де D являє собою О, NR, S або SO2, x та у незалежно один від одного дорівнюють 1-6; і m вибране з 1-6; та її фасполуку формули IV, рмацевтично прийнятних солей. Сполука за винаходом, в якій R3 та R4 разом з атомами вуглецю, до яких вони прикріплені, утворюють моноциклічне насичене або арильне або заміщене арильне або гетероарильне або заміщене гетероарильне кільце, що містить один або більше гетероатомів, вибраних з N, S та О, при цьому кількість атомів у кільці складає від 3 до 6, згадується тут як сполука формули II в якій значення Χ, Υ, X', Y', R1 та R2 що описані вище, N-алкілують сполукою формули V, в якій L являє собою групу, що відщеплюється, вибрану з галогенової або алкіл- чи арилсульфонатної групи, наприклад, метансульфонату або ртолуолсульфонату і т.п., з отриманням сполуки формули VI, Переважною сполукою формули II є така, в якій кільце являє собою бензольне кільце Сполука за винаходом, в якій R3 та R4 знаходяться у Е-конфігурації, згадується тут як сполука формули III, Переважною є сполука формули І, в якій Χ, Υ, X' та Y' вибрані з водню, хлору та фтору; R1 та R2 являють собою водень; R3 та R4 являють собою водень у Е- або Z яку потім піддають реакції з Χ1Η2ΟΟΖ, де Х1 являє собою галогенову групу, таку як хлор, з отриманням сполуки формули І. Початкова сполука формули IV може бути отримана відомими способами, наприклад, описаними у Baltzly, R. et al, J. Org. Chem., 14, 775, 1949; Yung, D.K et al J. Pharm. Sci., 67(7), 1978. У способі, показаному на Схемі 2, сполука формули І, в якій R3 та R4 разом утворюють кільце, вибране з циклічних, арильних або заміщених арильних, гетероциклічних арильних груп або заміщених гетероциклічних арильних груп, що містять один або більше гетероатомів (тобто, N, S, О) з кількістю атомів у кільці від 3 до 6, що згадується тут як сполука формули II, може бути отримана способом, подібним до описаного 9 76609 10 вище, в якому сполуку формули IV N-алкілують алкілуванням сполуки формули IV сполукою форсполукою формули VII, в якій L являє собою групу, мули XII з отриманням сполуки формули XIII, яку що відщеплюється, вибрану з галогенової або алпотім відновлюють з отриманням сполуки формукіл- чи арилсульфонатної групи, наприклад, метали XIV. нсульфонату або р-толуолсульфонату і т.п., з отриманням сполуки формули VIII, яку потім піддають реакції з X1CH2COZ, де Х1 являє собою галогенову групу, таку як хлор, з отриманням сполуки формули І. У способі, показаному на Схемі 3, сполука формули І, в якій R3 та R4 являють собою водень та знаходяться у Е- або Zконфігурації, може бути отримана N-алкілуванням сполуки формули IV сполукою формули IX, в якій Ρ може являти собою Η або будь-яку захисну групу, таку як ацетатна, з отриманням сполуки формули X, яку відновлюють з отриманням сполуки формули XI. Тоді сполуку формули XI піддають реакції, після видалення захисної групи, якщо необхідно, з X1CH2COZ, де Х1 являє собою галогенову групу, таку як хлор, з отриманням сполуки формули І. У способі, показаному на Схемі 4, у сполука формули І, в якій R3 та R4 знаходяться Ε-конфігурації, може бути отримана N Сполуку формули XIV обробляють X1CH2COZ, де Х1 являє собою галогенову групу, таку як хлор, з отриманням сполуки формули І. Інший аспект винаходу стосується композиції сполуки формули І у придатній формі, що може бути введена пацієнтові. Сполуки за винаходом можуть бути представлені у формі фармацевтичної композиції для застосування у лікуванні гістамін-опосереднених захворювань. Така композиція включає сполуку формули І та фармацевтично прийнятні інгредієнти. Такі композиції можуть бути виготовлені шляхом змішування сполуки формули І та фармацевтично прийнятних інгредієнтів. Звичайно композиції адаптують для перорального застосування. Проте вони можуть бути також адаптовані для інших шляхів застосування, наприклад, парентерального, сублінгвального, трансдермального або очного застосування. Ці композиції можуть мати форму таблеток, капсул, порошків, гранул, назальних спреїв, аерозолів, пілюль, мазей, кремів, наклейок крізьшкірної дії, порошків для розведення або рідких препаратів, таких як розчини для перорального застосування або стерильні розчини чи суспензії. Для належного застосування переважне надання композиції за винаходом одиничної лікарської дози. Одиничні дози, виготовлені для перорального застосування, можуть мати форму таблеток та капсул і можуть містити звичайні компоненти, такі як зв'язуючі, наприклад, сироп, гуміарабік, желатин, сорбіт, трагакант або полівінілпіролідон; наповнювачі, наприклад, лактозу, цукор, кукурудзяний крохмаль, фосфат кальцію, сорбіт або гліцин; мастильні засоби для таблетування, наприклад, стеарат магнію; дезінтегранти, наприклад, крохмаль, полівінілпіролідон, крохмалю натрій гліколят або мікрокристалічну целюлозу; або фармацевтично прийнятні зволожувачі, такі як лаурилсульфат натрію. Одинична лікарська доза переважно включає 11 76609 12 кількість композиції, придатну для відповідної щоЯкщо бажано, композиція може мати форму денної дози. упаковки, що містить письмову або надруковану Тверді композиції для перорального застосуінструкцію з використання. вання можуть бути виготовлені за допомогою звиСполука формули І у складі композиції корисчайних методик змішування, заповнення або табна для лікування різноманітних гістамінлетування, відомих фахівцям у цій області. опосереднених захворювань. Для сполуки, отриБагаторазові операції змішування можуть бути маної за винаходом, було визначено ІС50. використані для розподілення активного компонеПРИКЛАДИ нта у композиціях, що містять великі кількості наПриклад 1 повнювачів. Такі операції, звичайно, є стандарт4-{4-[Біс-(4-фторфеніл)метил]піперазин-1-іл}ними у фармацевтиці. Таблетки можуть мати (Z)-бут-2-ен-1-ол, (Vla, X=X'=4-F; Y=Y'=R1=R2=R3= покриття, нанесене способами, добре відомими у =R4=H; m=n=1): звичайній фармацевтичній практиці. Розчин, що містить 1-[біс-(4Рідкі препарати для перорального застосуванфторфеніл)метил]піперазин (140г, 0,485моль), ня можуть мати форму, наприклад, емульсій, ситолуол (700мл), 4-хлор-2-бутен-1-ол (67,25г, ропів або еліксирів, або можуть бути виготовлені у 0,631моль) та діізопропілетиламін (125,8г, формі сухого продукту для розведення водою або 0,971моль) перемішують при 47-49°С протягом 5 іншим придатним носієм перед застосуванням. годин. До реакційної суміші додають воду (350мл), Такі рідкі препарати можуть містити звичайні доорганічний шар відокремлюють та водний шар бавки, такі як суспендуючі засоби, наприклад, сорекстрагують дихлорметаном (2 200мл). Об'єднабіт, сироп, метилцелюлозу, желатин, гідроксиетиний органічний шар промивають водою (200мл) та лцелюлозу, карбоксиметилцелюлозу, гель концентрують з отриманням неочищеного продукстеарату алюмінію, гідрогенізовані їстівні жири; ту, який очищають колоночною флешемульгатори, наприклад, лецитин, сорбітмоноолехроматографією на силікагелі з використанням ат або гуміарабік; неводні носії (які можуть вклюдихлорметану-метанолу (9,6:0,4) у якості рухливої чати їстівні олії), наприклад, мигдалеву олію, рафази з отриманням чистого продукту. 1 фіновану кокосову олію, жирні ефіри, такі як ефіри Н-ЯМР (CDCl3, млн-1): 2.15-2.80 (m, 8Н), 3.01 гліцерину, пропіленгліколю або етилового спирту; (d, J=4.90 Hz, 2Н), 4.13 (d, J=3.96 Hz, 2H), 4.20 (s, консерванти, наприклад, метил- або пропіл-р1H), 5.55-5.75 (m, 1H), 5.75-6.00 (m, 1H), 6.96 (t, гідроксибензоат або сорбінову кислоту; та, якщо J=8.14 Hz, 4H), 7.20-7.40 (m, 4H). бажано, звичайні ароматизатори або барвники. Приклад 2 Рідкі одиничні дозовані форми для парентера(R,S)-4-{4-[(4-хлорфеніл)фенілметил] піперального застосування виготовляють з використанзин-1-іл}-(Z)-бут-2-ен-1-ол, [VIb(R,S), X=Cl; X'=Y= ням сполуки та стерильного носія і, у залежності =Y'=R1=R2=R3=R4=H; m=n=1]: від використовуваної концентрації, сполуку су8,0г (моль) (R,S)-1-[(4-[хлорфеніл)фенілметил] спендують або розчиняють у носії. При виготовпіперазину перетворюють на (R, S)-4-{4-[(4ленні розчинів сполука може бути розчинена у воді хлорфеніл)фенілметил]піперазин-1-іл}-(Z)-бут-2для ін'єкцій з наступною стерилізацією шляхом ен-1-ол способом, подібним до описаного у прикфільтрації, заповненням придатних пляшечок або ладі 1. Неочищений продукт отримують у вигляді ампул та герметизацією. Сприятливе розчинення у сиропоподібної маси, яку очищають колоночною носії допоміжних речовин, наприклад, місцевого флеш-хроматографією на силікагелі з використанзнеболюючого засобу, консерванта та буфера. ням толуолу-метанолу (9:1) у якості рухливої фази Для покращення стабільності композиція може з отриманням чистого продукту. 1 бути заморожена після заповнення пляшечок, а Н-ЯМР (CDCl3, млн-1): 2.10-2.90 (m, 8Н), 3.01 вода видалена під вакуумом. (d, J=5.75 Hz, 2Н), 4.13 (d, J=-5.25 Hz, 2H), 4.19 (s, Для очного застосування може бути виготов1H), 5.50-5.75 (m, 1H), 5.75-6.00 (m, 1H), 7.00-7.40 лений стерильний розчин або суспензія. (m, 9H). Очний розчин може бути отриманий шляхом Приклад 3 розчинення сполуки у воді для ін'єкцій разом з 4-{4-Бензгідрилпіперазин-1-іл}-(Z)-бут-2-ен-1придатним консервантом, хелатуючим засобом, ол, (Vlc, X=X'=Y=Y'=H; R1=R2=R3=R4=H; m=n=1): регулятором осмотичного тиску, засобом для покРозчин, що містить 1-бензгідрилпіперазин (3г, ращення в'язкості, антиоксидантом та буфером. 0,0119моль), толуол (20мл), 4-хлор-2-бутен-1-ол Розчин асептично фільтрують та заповнюють (1,65г, 0,0155моль), діізопропілетиламін (3,81г, пляшечки або флакони з придатного матеріалу. 0,0295моль) та DMF (3мл) перемішують при 55Подібна суспензія може бути отримана шляхом 60°С протягом 5 годин. Реакційну масу гасять воасептичного диспергування стерильної сполуки у дою (20мл), органічний шар відокремлюють та стерильному водному носії, що містить придатний водний шар екстрагують дихлорметаном (2 20мл). консервант, хелатуючий засіб, регулятор осмотичОрганічний екстракт промивають водою (10мл) та ного тиску, суспендуючий засіб, антиоксидант та концентрують з отриманням неочищеного продукбуфер. Також подібним чином можуть бути виготу, який очищають колоночною флештовлені одиничні дози без консервантів у вигляді хроматографією на силікагелі з використанням розчинів та суспензій та асептично введені у кондихлорметану-метанолу (9,3:0,7) у якості рухливої тейнери для одиничних доз. фази з отриманням чистого продукту. 1 Композиції можуть містити від 0,1% до 99,0% Н-ЯМР (CDCl3, млн-1): 2.10-2.80 (m, 8H), 3.01 ваг., переважно від 10 до 60% ваг. активної речо(d, J=5.52 Hz, 2H), 4.13 (dd, J1=5.19 Hz, J2=0.68 Hz, вини, у залежності від способу застосування. 2H), 4.21 (s, 1H), 5.50-5.75 (m, 1H), 5.75-6.00 (m, 13 76609 14 1 -1 1H), 7.00-7.50 (m, 10H). Н-ЯМР (CDCl3, млн ): 2.00-2.80 (М, 8Н), 3.60 Приклад 4 (s, 2H), 4.16 (s, 1H), 4.56 (s, 2H), 6.86 (br, D2О4-{4-[Біс-(2,4-дифторфеніл)метил]піперазин-1замінний), 6.95-7.40 (Μ, 13Η). іл}-(Z)-бут-2-ен-1-ол, (VId, X=X'=Y=Y'=F; R1=R2= Приклад 8 =R3=R4=H; m=n=1): 4-{4-[Біс-(4-фторфеніл)метил]піперазин-1-іл} 1-[Біс-(2,4-дифторфеніл)метил]піперазин бут-2-ін-1-ол (Ха, X=X'=4-F; Y=Y'=R1=R2=H; m=1): (20,0г, 0,0617моль) перетворюють на 4-{4-[біс-(2,4Спосіб А: З використанням 4-хлор-2-бутен-1дифторфеніл)метил]піперазин-1-іл}-(Z)-бут-2-ен-1олу ол способом, подібним до описаного у прикладі 1. До розчину, що містить 1-[біс-(4Неочищений продукт отримують у вигляді сиропофторфеніл)метил]піперазин (300г, 1,040моль), подібної маси, яку очищають колоночною флештетрагідрофуран (1800мл) та діізопропілетиламін хроматографією на силікагелі з використанням (242,1г, 1,873моль), додають по краплях 4-хлор-2толуолу-метанолу (9:1) у якості рухливої фази з бутин-1-ол (130,5г, 1,248моль) протягом 1 години отриманням чистого продукту. при 10-15°С. Після перемішування при 10-15°С 1 Н-ЯМР (CDCl3, млн-1): 2.20-2.85 (m, 8Н), 3.02 протягом 1,5 години температуру поступово підні(dd, J1=6.00 Hz, J2=0.74 Hz, 2H), 4.14 (dd, J1=5.31 мають до 25-30°С та продовжують перемішування Hz, J2=0.98 Hz, 2H), 4.94 (s, 1H), 5.50-5.75 (m, 1H), ще 7 годин. Тоді додають розчин лимонної кислоти 5.75-6.00 (m, 1H), 6.55-7.00 (m, 4H), 7.30-7.60 (m, (437,3г, 2,08моль) у воді (500мл) і суміш концент2H). рують під зниженим тиском при температурі нижче Приклад 5 60°С для видалення основної частини розчинника. 4-{4-[Біс-(4-хлорфеніл)метил]піперазин-1-іл}Отриману водну масу промивають толуолом (Z)-бут-2-ен-1-ол, (Vle, X=X'=CL; Y=Y'=R1=R2=R3= (2 400мл), підлужують до рН 9-10 та екстрагують =R4=H; m=n=1): продукт дихлорметаном (2 400мл). Дихлормета1-[Біс-(4-хлорфеніл)метил]піперазин (5,044г, новий шар промивають водою (300мл) та дегазумоль) перетворюють на 4-{4-[біс-(4ють з отриманням неочищеного продукту, який хлорфеніл)метил]піперазин-1-іл}-(Z)-бут-2-ен-1-ол очищають колоночною флеш-хроматографією на способом, подібним до описаного у прикладі 1. силікагелі з використанням толуолу-метанолу (9:1) Отриманий неочищений продукт очищають колоу якості рухливої фази. 1 ночною флеш-хроматографією на силікагелі з виН-ЯМР (CDCl3, млн-1): 1.84 (br, 1H, D2Окористанням толуолу-метанолу (9:1) у якості рухзамінний), 2.20-2.80 (m, 8H), 3.31 (t, J=1.84 Hz, 2H), ливої фази з отриманням чистого продукту. 4.21 (s, 1H), 4.29 (t, J=1.80 Hz, 2H), 6.80-7.05 (m, 1 Н-ЯМР (CDCl3, млн-1): 2.10-2.80 (m, 8H), 3.01 4H), 7.10-7.50 (m, 4H). (d, J=5.87 Hz, 2H), 4.13 (dd, J1=5.26 Hz, J2=0.88, Спосіб В: З використанням 2-бутин-1,4-діолу 2H), 4.18 (s, 1H), 5.50-5.75 (m, 1H), 5.75-6.00 (m, Розчин метансульфонілхлориду (48,69г, 1H), 7.00-7.40 (m, 8H). 0,425моль) та тетрагідрофурану (100мл) додають Приклад 6 по краплях до розчину 2-бутин-1,4-діолу (100г, {2-{4-[Біс-(4-фторфеніл)метил]піперазин-1-іл1,162моль) та діізопропілетиламіну (62,45г, метил}феніл}метанол (Vllla, X=X'=F; Y=Y'=R1=R2= 0,483моль) у тетрагідрофурані (400мл) при пере=H; m=n=1, А=бензольне кільце): мішуванні протягом 2 годин при 0-5°С. Після 1 го1-[Біс-(4-хлорфеніл)метил]піперазин (5,0г, дини перемішування при 0-5°С температуру підні0,0173моль) перетворюють на {2-{4-[біс-(4мають до 25-30°С та перемішують ще 1 годину. фторфеніл)метил]піперазин-1-ілметил}феніл} меТоді реакційну суміш охолоджують до 10-15°С та танол з використанням 2-(хлорметил)бензилового додають діізопропілетиламін (99,34г, 0,769моль), а спирту, способом, подібним до описаного у прикпотім 1-[біс-(4-фторфеніл)метил]піперазин ладі 1. Отриманий неочищений продукт у вигляді (110,81г, 0,384моль) порціями протягом 30хв. Реакоричнюватого жовтого сиропу очищають колонокційну масу перемішують при 10-15°С 1 годину і чною флеш-хроматографією на силікагелі з викотоді при 25-30°С ще 8 годин. Додають толуол ристанням толуолу-метанолу (9,2:0,8) у якості ру(500мл) та промивають масу водою (2 400мл). хливої фази з отриманням чистого продукту. Після цього додають розчин лимонної кислоти 1 Н-ЯМР (CDCl3, млн-1): 2.00-2.80 (m, 8H), 3.6 (161,52г, 0,769моль) у воді (500мл) та суміш кон(s, 2H), 4.18 (s, 1H), 4.57 (s, 2H), 6.70-7.03 (m, 4Н), центрують під зниженим тиском при температурі 7.05-7.40 (m, 8Н). нижче 60°С для видалення основної частини розПриклад 7 чинника. Отриману водну масу промивають гекса{2-{4-[(4-хлорфеніл)фенілметил]піперазин-1ном (2 250мл), підлужують до рН 9-10 та екстраілметил}феніл}метанол, (Vlllb, Х=Сl; X'=Y=Y'=R1= гують продукт етилацетатом (2 300мл). =R2=H; m=n=1, А=бензольне кільце): Етилацетатний шар промивають водою (200мл) та 1-[Біс-(4-хлорфеніл)метил]піперазин (4,0г, дегазують з отриманням неочищеного продукту, 0,0140моль) перетворюють на {2-{4-[(4який очищають колоночною флешхлорфеніл)фенілметил]піперазин-1-ілметил} фехроматографією на силікагелі з використанням ніл}метанол способом, подібним до описаного у толуолу-метанолу (9,3:0,7) у якості рухливої фази прикладі 1. Отриманий неочищений продукт очиз отриманням чистого продукту. щають колоночною флеш-хроматографією на сиПриклад 9 лікагелі з використанням толуолу-метанолу (R,S)-4-{4-[(4-Хлорфеніл)фенілметил] піпера(9,2:0,8) у якості рухливої фази з отриманням чисзин-1-іл}бут-2-ін-1-ол (способом А Прикладу 10), того продукту у вигляді білої пінистої твердої ре(Хb, Х=Сl; X'=Y=Y'=R1=R2=H; m=1): човини. Розчин, що містить (R,S)-1-[(4-хлорфеніл) фе 15 76609 16 нілметил]піперазин (10г, 0,0349моль), толуол мішування протягом 2 годин масу фільтрують. (50мл), 4-хлор-2-бутин-1-ол (4,74г, 0,0453моль) та Органічний шар відокремлюють від фільтрату, діізопропілетиламін (9,02г, 0,0698моль) перемішупромивають водою (1500мл) та концентрують з ють при 45-50°С протягом 6 годин. Реакційну суотриманням неочищеного продукту. міш гасять водою (20мл). Органічний шар відокреНеочищений продукт розводять у толуолі млюють та водний шар екстрагують (2000мл), екстрагують 10% оцтовою кислотою (2000мл), водний екстракт підлужують до рН 9-10 дихлорметаном (2 30мл). Органічні шари проми20% водним розчином гідроксиду натрію та екствають водою (20мл) та концентрують з отриманрагують продукт дихлорметаном (3 1500мл). Дихням неочищеного продукту у вигляді сиропоподібної маси, яку очищають колоночною флешлорметановий шар промивають водою (800мл) та хроматографією на силікагелі з використанням концентрують з отриманням сиропоподібної маси, дихлорметану-метанолу (9,6:0,4) у якості рухливої яку очищають колоночною флеш-хроматографією фази з отриманням чистого продукту. на силікагелі з використанням толуолу-метанолу 1 (9:1) у якості рухливої фази. Н-ЯМР (CDCl3, млн-1): 1.88 (br, 1H), 2.20-2.75 1 (m, 8H), 3.31 (t, J=1.72 Hz, 2H), 4.20 (s, 1Н), 4.29 (t, Н-ЯМР (CDCl3, млн-1): 1.70 (br, D2ОJ=1.63 Hz, 2H), 7.05-7.50 (m, 9H). замінний), 2.20-2.70 (m, 8H), 3.00 (d, J=5.38 Hz, Приклад 10 2Н), 4.12 (d, J=4.40 Hz, 2H), 4.21 (s, 1H), 5.65-5.90 (R,S)-4-{4-[(4-фторфеніл)фенілметил] піпера(m, 2H), 6.85-7.05 (m, 4H), 7.28-7.40 (m, 4H). зин-1-іл}бут-2-ін-1-ол (способом В Прикладу 10), Приклад 12 (Хс, X=F; X'=Y=Y'=R1=R2=H; m=1): 4-{4-[біс-(4-фторфеніл)метил]піперазин-1-іл}Розчин метансульфонілхлориду (1,86г, (Е)-бут-2-ен-1-ол (ХІа, X=X'=4-F; Y=Y'=R1=R2=H; 16,27ммоль) та тетрагідрофурану (5мл) додають m=1): по краплях до розчину 2-бутин-1,4-діолу (3,82г, При перемішуванні розчину 44,3ммоль) та діізопропілетиламіну (6,30г, 4-{4-[біс-(4-фторфеніл)метил]піперазин-1-іл} 48,8ммоль) у тетрагідрофурані (20мл) при перемібут-2-ін-1-олу (135г, 0,379моль) у тетрагідрофурані шуванні протягом 30хв. при 0-5°С. Після 1 години (4300мл) при 5-10°С додають алюмогідрид літію перемішування температуру піднімають до 25(43,1г, 1,136моль) порціями протягом 3-4 годин. 30°С та перемішують ще 1 годину. Отриману суРеакційну суміш перемішують ще 5-6 годин і тоді міш, що містить мезилат 2-бутин-1,4-діолу, додагасять (швидко охолоджують) шляхом додання ють по краплях до розчину (R,S)-1-[(4етилацетату (135мл), а потім води (100мл) при 5фторфеніл)фенілметил] піперазину (4,0г, 10°С. Отриману суміш фільтрують, органічний шар 14,79моль) у тетрагідрофурані (25мл) при перемівідокремлюють від фільтрату та концентрують з шуванні протягом 1 години при 5-10°С. Реакційну отриманням неочищеного продукту, який очищамасу перемішують при 5-10°С протягом 1 години, ють колоночною флеш-хроматографією на силікаа тоді при 25-30°С ще протягом 5 годин. Після цьогелі з використанням толуолу-метанолу (9:1) у го додають лимонну кислоту (3,2г, 0,01523моль) та якості рухливої фази з отриманням чистого продусуміш концентрують під зниженим тиском при темкту. 1 пературі нижче 60°С для видалення основної часН-ЯМР (CDCl3, млн-1): 1.77 (br, D2Отини розчинника. У залишкову масу додають воду замінний), 2.20-2.70 (m, 8H), 3.00 (d, J=4.91 Hz, (50мл) та отриманий водний шар промивають гек2Н), 4.11 (d, J=3.71 Hz, 2H), 4.21 (s, 1H), 5.55-5.90 саном (2 30мл), підлужують до рН 9-10 та екстра(m, 2H), 6.80-7.05 (m,4H), 7.10-7.50 (m, 4H). Приклад 13 гують продукт дихлорметаном (3 30мл). Дихлор(R,S)-4-{4-[(4-хлорфеніл)фенілметил] піпераметановий шар промивають водою (25мл) та зин-1-іл}-(Е)-бут-2-ен-1-ол, (ХІb, X=Cl; дегазують з отриманням неочищеного продукту у X'=Y=Y'=R1=R2=H; m=1): вигляді липкої твердої речовини, яку очищають (R,S)-4-{4-[(4-хлорфеніл)фенілметил] піпераколоночною флеш-хроматографією на силікагелі з зин-1-іл}бут-2-ін-1-ол (3,5г, моль) перетворюють на використанням дихлорметану-метанолу (9,2:0,8) у (R,S)-4-{4-[(4-хлорфеніл)фенілметил]піперазин-1якості рухливої фази з отриманням чистого продуіл}-(Е)-бут-2-ен-1-ол способом, подібним до описакту у вигляді густої сиропоподібної маси. 1 ного у прикладі 14. Неочищений продукт отримуН-ЯМР (CDCl3, млн-1): 1.87 (b), 2.25-2.70 (m, ють у вигляді сиропоподібної маси, яку очищають 8H), 3.30 (t, J=1.83 Hz, 2H), 4.21 (s, 1H), 4.29 (t, колоночною флеш-хроматографією на силікагелі з J=1.78 Hz, 2H), 6.85-7.02 (m, 2H), 7.13-7.42 (m, 7H). використанням толуолу-метанолу (9:1) у якості Приклад 11 рухливої фази з отриманням чистого продукту. 4-{4-[біс-(4-фторфеніл)метил]піперазин-1-іл}1 Н-ЯМР (CDCl3, млн-1): 2.20-2.65 (m, 8Н), 3.00 (Е)-бут-2-ен-1-ол, (XlVa, X=X'=4-F; Y=Y'=R1=R2= (d, J=4.83 Hz, 2H), 4.11 (d, J=3.52 Hz, 2H), 4.20 (s, =R3=R4=H; m=n=1): 1H), 5.60-5.90 (m, 2H), 7.00-7.50 (m, 9H). При перемішуванні розчину Приклад 14 метил-4-{4-[біс-(4-фторфеніл)метил]піперазин(R,S)-4-{4-[(4-фторфеніл)фенілметил] піпера1-іл}-(Е)-бут-2-еноату (380г, 0,984моль) у тетрагідзин-1-іл}-(Е)-бут-2-ен-1-ол (ХІс, X=F; X'=Y=Y'=R1= рофурані (1900мл) при -10-0°С додають по крап=R2=H; m=1): лях DIBALH (560г, 3,938моль, у вигляді 20% роз(R,S)-4-{4-[(4-фторфеніл)фенілметил] піперачину в толуолі) протягом -2-3 годин. Після зин-1-іл}бут-2-ін-1-ол (2,13г, 0,0063моль) перетвозавершення додання реакційну масу перемішують рюють на ще 1,0 годину при 0-10°С, а тоді гасять (швидко (R,S)-4-{4-[(4-фторфеніл)фенілметил] піпераохолоджують) послідовним доданням етилацетату зин-1-іл}-(Е)-бут-2-ен-1-ол способом, подібним до (400мл) та води (800мл). Після інтенсивного пере 17 76609 18 описаного у прикладі 14. Неочищений продукт (Z)-бут-2-ен-1-олу (97,0г, 0,271моль) та третотримують у вигляді сиропоподібної маси, яку бутоксиду калію (54,7г, 0,487моль) у безводному очищають колоночною флеш-хроматографією на трет-бутанолі (776мл), підігрітому при 60-65°С силікагелі з використанням дихлорметанупротягом 1год., в атмосфері азоту, додають безметанолу (9,3:0,7) у якості рухливої фази з отриводний хлорацетат натрію (63г, 0,541моль). Реакманням чистого продукту. ційну масу нагрівають при дефлегмації ще 5 годин. 1 Суміш концентрують під зниженим тиском при теН-ЯМР (CDCl3, млн-1): 1.71 (br, D2Oмпературі нижче 60°С до повного видалення третзамінний), 2.10-2.70 (m, 8H), 3.00 (d, J=5.23 Hz, бутанолу. Залишок розводять у воді (800мл) та 2Н), 4.11 (d, J=4.20 Hz, 2H), 4.22 (s, 2H), 5.65-5.90 (m, 2H), 6.85-7.02 (m,2H), 7.10-7.45 (m,7H). промивають етилацетатом (2 500мл). Водний роПриклад 15 зчин підкислюють до рН 5-6, екстрагують дихлорМетил-4-{4-[Біс-(4-фторфеніл)метил] піпераметаном (3 500мл), промивають дихлорметанозин-1-іл}-(Е)-бут-2-еноат (ХІІІа, X=X'=4-F; R=CH3; вий шар водою (300мл) та концентрують з Y=Y'=R1=R2=R3=R4=H; m=n=1): отриманням неочищеного продукту, який очищаРозчин метил-4-бромкротонату (46,56г, ють колоночною флеш-хроматографією на силіка0,260моль) у толуолі (50мл) додають по краплях гелі з використанням толуолу-метанолу (4:1) у до суміші, що містить 1-[біс-(4якості рухливої фази з отриманням чистого продуфторфеніл)метил]піперазин (50г, 0,173моль), діікту. 1 зопропілетиламін (49,30г, 0,381моль) у толуолі Н-ЯМР (CDCl3, млн-1): 2.40-2.80 (m, 4Н), 2.80(250мл) при 25-30°С протягом 30 хвилин. Після 3.20 (m, 4Н), 3.65 (d, J=7.51 Hz, 2Н), 3.96 (s, 2Н), перемішування протягом 8 годин реакційну масу 4.19 (d, J= 4.51 Hz, 2H), 4.32 (s, 1H), 5.00-5.30 (m, промивають по черзі водою (2 150мл), 0,2N соля1H), 5.30-6.10 (m, 1H), 6.80-7.05 (m, 4H), 7.00-7.50 ною кислотою (3 150мл) та водою (150мл). До (m, 4H) органічного шару при 5-10°С додають 3N соляну Суспензію {4-[4-[біс-(4-фторфеніл)метил] піпекислоту (200мл), перемішують та водний шар, що ризин-1-іл]-(Z)-бут-2-енілокси} оцтової кислоти містить продукт, відокремлюють. Промивають його (83,8г, 0,201моль) та води (335мл) is підкислюють толуолом (200мл), підлужують до рН 9-10 20% при перемішуванні до рН 1-2 6N соляною кислорозчином гідроксиду натрію та екстрагують протою при 25-30°С. Розчин фільтрують, концентрують під зниженим тиском при температурі нижче дукт етилацетатом (2 150мл). Органічний шар 50°С (до об'єму розчину близько 170мл) та ліофіпромивають один раз водою (100мл), концентрулізують з отриманням дигідрохлориду. ють та дегазують. Залишок розтирають з гексаном Приклад 18 (150мл) та тверду речовину фільтрують. Продукт (R,S)-{4-[4-[(4-хлорфеніл)фенілметил] піперадодатково очищають перекристалізацією з циклозин-1-іл]-(Z)-бут-2-енілокси}оцтової кислоти дигідгексану. 1 рохлорид, [lb (R,S)]: Н-ЯМР (CDCl3, млн-1): 1.63 (br, 1H, D2О(R,S)-4-{4-[(4-хлорфеніл)фенілметил] піперазамінний), 2.20-2.65 (m, 8H), 3.13 (d, J=5.00 Hz, зин-1-іл}-(Z)-бут-2-ен-1-ол (100,0г, 0,28моль) пере2Н), 3.72 (s, 3Н), 4.22 (s, 1Н), 5.88-6.03 (m, 1H), творюють на (R,S)-{4-[4-[(4-хлорфеніл)фенілметил] 6.80-7.05 (m, 5H), 7.20-7.40 (m, 4H). піперазин-1-іл]-(Z)-бут-2-енілокси}оцтову кислоту Приклад 16 способом, подібним до описаного у прикладі 19. Метил-4-{4-[(4-хлорфеніл)фенілметил] піпераНеочищений продукт отримують у вигляді пінистої зин-1-іл}-(Е)-бут-2-еноат (Хllb, X=Cl; X'=Y=Y'=R1= твердої речовини, яку очищають колоночною =R2=R3=R4=H; m=n=1): флеш-хроматографією на силікагелі з використанРозчин, що містить (R,S)-[(4-хлорфеніл) феніням толуолу-метанолу (4:1) у якості рухливої фази лметил]піперазин (5г, 0,0174моль), DMF (30мл), з отриманням чистого продукту. метил-4-бромкротонат (4,7г, 0,0263моль) та діізо1 Н-ЯМР (CDCl3, млн-1): 2.40-2.75 (m, 4H), 2.75пропілетиламін (6,75г, 0,0522моль) перемішують 3.20 (m, 4H), 3.62 (d, J=7.43 Hz, 2H), 3.95 (s, 2H), при 27-30°С протягом 6 годин. Реакцію гасять 4.17 (d, J=4.9 Hz, 2H), 4.28 (s, 1H), 5.50-5.80 (m, (швидко охолоджують) водою (40мл) та екстрагу1H), 5.80-6.1 (m, 1H), 6.95-7.40 (m, 9H), 8.98 (br, ють продукт дихлорметаном (3 30мл). Органічний D2О-замінний) шар промивають водою (2 30мл) та концентрують Цей продукт перетворюють на дигідрохлорид, з отриманням неочищеного продукту, який очияк описано у прикладі 17. щають колоночною флеш-хроматографією на сиПриклад 19 лікагелі з використанням етилацетату-гексану [4-(4-Бензгідрилпіперазин-1-іл)-(Z)-бут-2-еніло(6,5:3,5) у якості рухливої фази з отриманням чискси]оцтової кислоти дигідрохлорид, (Іс): того продукту. 1 4-(4-Бензгідрилпіперазин-1-іл)-(Z)-бут-2-ен-1Н-ЯМР (CDCl3, млн-1): 2.20-2.65 (m, 8Н), 3.14 ол (2,1г, 0,0065моль) перетворюють на [4-(4-бензгі (dd, J1=6.20 Hz, J2=1.39 Hz, 2H), 3.72 (s, 3H), 4.20 дрилпіперазин-1-іл)-(Z)-бут-2-енілокси] оцтову ки(s, 1H), 5.85-6.05 (m, 1H), 6.8-7.05 (m, 1H), 7.05слоту способом, подібним до описаного у прикладі 7.50 (m, 9H). 17. Неочищений продукт, отриманий у вигляді піПриклад 17 нистої твердої речовини, очищають колоночною {4-{4-[Біс-(4-фторфеніл)метил]-піперазин-1-іл}флеш-хроматографією на силікагелі з використан(Z)-бут-2-енілокси}оцтової кислоти дигідрохлорид, ням толуолу-метанолу (8,5:1,5) у якості рухливої (Іа): фази з отриманням чистого продукту. При перемішуванні розчину 1 Н-ЯМР (CDCl3, млн-1): 2.40-2.85 (m, 4Н), 2.854-{4-[біс-(4-фторфеніл)метил]піперазин-1-іл}3.20 (m, 4Н), 3.68 (d, J=7.53 Hz, 2Н), 3.96 (s, 2Н), 19 76609 20 4.18 (d, J= 4.60 Hz, 2H), 4.33 (s, 1H), 5.50-5.80 (m, {4-{4-[Біс-(4-фторфеніл)метил]-піперазин-1-іл}1H), 5.90-6.10 (m, 1H), 7.00-7. 50 (m, 10H) (Z)-бут-2-енілокси} оцтової кислоти етилового ефіЦей продукт перетворюють на дигідрохлорид, ру дигідрохлорид, (Ig): як описано у прикладі 19. При перемішуванні розчину {4-{4-[біс-(4Приклад 20 фторфеніл)метил]-піперазин-1-іл}-(Z)-бут-2{4-{4-[Біс-(2,4-дифторфеніл)метил]-піперазиненілокси}оцтової кислоти (1,0г, 0,0024моль) в ета1-іл}-(Z)-бут-2-енілокси} оцтової кислоти дигідрохнолі (20мл) додають етанольний розчин безводної лорид, (Id): НСl до отримання рН 1-2. Розчин нагрівають при 4-{4-[Біс-(2,4-дифторфеніл)метил]піперазин-1дефлегмації приблизно 2 години, охолоджують до іл}-(Z)-бут-2-ен-1-ол (6,2г, 0,0157моль) перетво25-30°С та перемішують 4 години. Тверду речовирюють на {4-{4-[біс-(2,4-дифторфеніл)метил]ну, що кристалізувалася, фільтрують, промивають піперазин-1-іл}-(Z)-бут-2-енілокси}оцтову кислоту етанолом (2 5мл) та висушують у сушильній шафі способом, подібним до описаного у прикладі 17. при 60-65°С з отриманням бажаного продукту. 1 Неочищений продукт отримують у вигляді пінистої Н-ЯМР (CDCl3+DMSO-d6, млн-1): 1.28 (t, твердої речовини, яку очищають колоночною J=7.10Hz, ЗН), 2.70-4.30 (m, 17H), 5.70-6.20 (m, флеш-хроматографією на силікагелі з використан2Н), 7.10 (t, J=8.62 Hz, 4H), 7.40-7.80 (m, 4H). ням толуолу-метанолу (4:1) у якості рухливої фази Приклад 24 з отриманням чистого продукту. {4-{4-[біс-(4-фторфеніл)метил]-піперазин-1-іл}1 Н-ЯМР (CDCl3, млн-1): 2.20-2.75 (m, 4H), 2.75(Z)-бут-2-енілокси}оцтової кислоти ізопропілового 3.20 (m, 4H), 3.57 (d, J=6.07 Hz, 2H), 3.96 (s, 2H), ефіру дигідрохлорид, (Ih): 4.17 (d, J=3.90 Hz, 2H), 4.99 (s, 1H), 5.50-6.10 (m, При перемішуванні розчину {4-{4-[біс-(42H), 6.45-7.0 (m, 4H), 7.20-7.65 (m, 2H), 9. 87 (br) фторфеніл)метил]піперазин-1-іл}-(Z)-бут-2-енілоЦей продукт розводять у етилацетаті (12мл), кси} оцтової кислоти (1,0г, 0,0024моль) в ізопропіпідкислюють розчином безводної НС1 в етилацеловому спирті (20мл) додають розчин безводної таті до рН 1,0-2,0, концентрують та дегазують з НСl в ізопропіловому спирті до отримання рН розотриманням дигідрохлориду. чину 1-2. Розчин нагрівають при дефлегмації приПриклад 21 близно 2 години, охолоджують до 25-30°С та пе{4-[4-[Біс-(4-хлорфеніл)метил]-піперазин-1-іл]ремішують 4 години. Тверду речовину, що (Z)-бут-2-енілокси}оцтової кислоти дигідрохлокристалізувалася, фільтрують, промивають ізоприд, (Іе): ропіловим спиртом (2 5мл) та висушують у су4-{4-[Біс-(4-хлорфеніл)метил]піперазин-1-іл}шильній шафі при 60-65°С з отриманням 0,968г (Z)-бут-2-ен-1-ол (2,26г, моль) перетворюють на бажаного продукту (вихід 75,85%). 1 {4-[4-[біс-(4-хлорфеніл)метил]-піперазин-1-іл]-(Z)Н-ЯМР (CDCl3+DMSO-d6, млн-1): 1.23 (d, бут-2-енілокси} оцтової кислоти способом, подібJ=5.25Hz, 6H), 2.60-3.70 (m, 8H), 3.70-4.40 (m, 7Н), ним до описаного у прикладі 17. Отриманий не4.80-5.20 (m, 1Н), 5.60-5.90 (m, 1H), 5.90-6.10 (m, очищений продукт очищають колоночного флеш1H), 7.16 (t, J=8.56 Hz, 4H), 7.40-7.90 (m, 4H). хроматографією на силікагелі з використанням Приклад 25 толуолу-метанолу (4:1) у якості рухливої фази з (R,S)-{4-[4-[(4-хлорфеніл)фенілметил] піпераотриманням чистого продукту. зин-1-іл]-(Z)-бут-2-енілокси} оцтової кислоти ізоп1 Н-ЯМР (CDCl3, млн-1): 2.50-2.80 (m, 4Н), 2.80ропілового ефіру дигідрохлорид, (Іі): 3.20 (m, 4Н), 3.60 (d, J=7.38 Hz, 2Н), 3.94 (s, 2Н), Отримання проводили з використанням 4.20 (d, J=4.08 Hz, 2H), 4.31 (s, 1H), 5.23 (br, D2О(R,S)-{4-[4-[(4-хлорфеніл)фенілметил] піперазамінний), 5.50-5.80 (m, 1H), 5.80-6.10 (m, 1H), зин-1-іл]-(Z)-бут-2-енілокси} оцтової кислоти спо7.10-7.40 (m, 8H). собом, подібним до описаного у прикладі 24. 1 Цей продукт перетворюють на дигідрохлорид, Н-ЯМР (CDCl3+DMSO-d6, млн-1): 1.26 (d, як описано у прикладі 17. J=6.26 Hz, 6H), 2.80-3.70 (m, 8H), 3.80-4.15 (m, 3Н), Приклад 22 4.21 (d, J=5.57 Hz, 4H), 4.90-5.15 (m, 1H), 5.70-5.95 {4-{4-[Біс-(4-фторфеніл)метил]-піперазин-1-іл}(m, 1H), 5.95-6.15 (m, 1H), 7.10-7.90 (m, 9H). (Z)-бут-2-енілокси} оцтової кислоти метилового Приклад 26 ефіру дигідрохлорид, (If): (R,S)-[4-[4-[(4-хлорфеніл)фенілметил] піпераПри перемішуванні розчину {4-{4-[біс-(4зин-1-іл]-(Z)-бут-2-енілокси}оцтової кислоти метифторфеніл)метил]-піперазин-1-іл}-(Z)-бут-2лового ефіру дигідрохлорид, (Ij): енілокси} оцтової кислоти (35г, 0,084моль) у метаПри перемішуванні розчину (R,S)-{4-[4-[(4нолі (560мл) додають розчин безводної НСl в етихлорфеніл)фенілметил]піперазин-1-іл]-(Z)-бут-2лацетаті до отримання рН 1-2. Розчин нагрівають енілокси}оцтової кислоти (1г, 0,0024моль) у метапри дефлегмації протягом 2 годин, охолоджують нолі (20мл) додають розчин безводної НСl в етидо 25-30°С та перемішують 4 години. Тверду релацетаті до отримання рН розчину 1-2. Розчин човину, що кристалізувалася, фільтрують, проминагрівають при дефлегмації 2 години, охолоджувають етилацетатом (2 5мл) та висушують у сують до 25-30°С, додають безводний діетиловий шильній шафі при 60-65°С з отриманням бажаного ефір до легкої каламутності та перемішують пропродукту. тягом 4 годин. Тверду речовину, що кристалізува1 Н-ЯМР (D2O, млн-1): 3.20-3.60 (m, 8H), 3.64 лася, фільтрують, промивають діетиловим ефіром (s, 3Н), 3.94 (d, J=7.66 Hz, 2H), 4.00-4.20 (m, 4Н), (2 5мл) та висушують у сушильній шафі при 605.31 (s, 1H), 5.50-5.78 (m, 1H), 5.90-6.20 (m, 1Н), 65°С з отриманням бажаного продукту. 1 6.85-7.15 (m, 4Н), 7.30-7.60 (m, 4Н). Н-ЯМР (CDCl3+DMSO-d6, млн-1): 3.10-3.90 Приклад 23 (m, 8Н), 3.73 (s, 3Н), 3.90-4.30 (m, 7Н), 5.70-6.00 21 76609 22 (m, 1Н), 6.00-6.20 (m, 1H), 7.10-7.50 (m, 5H), 7.50(2000мл), підігрітого при 60-65°С протягом 1 годи8.00 (m, 4H). ни в атмосфері азоту, додають безводний хлораПриклад 27 цетат натрію (160,5г, 1,378моль). Тоді реакційну (R,S)-{4-[4-[(4-хлорфеніл)фенілметил] піперамасу нагрівають при дефлегмації ще 5 годин. Сузин-1-іл]-(Z)-бут-2-енілокси}оцтової кислоти етиломіш концентрують під зниженим тиском при темвого ефіру дигідрохлорид, (Ik): пературі нижче 60°С до повного видалення третОтримання проводили з використанням (R,S)бутанолу. Залишок розводять у воді (1500мл) та {4-[4-[(4-хлорфеніл)фенілметил] піперазин-1-іл]промивають етилацетатом (2 1500мл). Водний (R)-бут-2-енілокси} оцтової кислоти способом, порозчин підкислюють до рН 5-6, екстрагують дихлодібним до описаного у прикладі 25, з отриманням рметаном (2 750мл), промивають дихлорметанобажаного продукту. вий шар водою (300мл) та концентрують з отри1 Н-ЯМР (CDCl3+DMSO-d6, млн-1): 1.27 (t, манням неочищеного продукту у вигляді пінистої J=7.12 Hz, 3Н), 3.10-3.90 (m, 8H), 3.90-4.30 (m, 9Н), твердої речовини. Неочищений продукт очищають 5.75-5.95 (m, 1Н), 5.95-6.15 (m, 1H), 7.10-7.50 (m, колоночною флеш-хроматографією на силікагелі з 5H), 7.50-8.00 (m, 4H). використанням толуолу-метанолу (4:1) у якості Приклад 28 рухливої фази. Цей продукт перетворюють на ди{2-{4-[Біс-(4-фторфеніл)метил]піперазин-1гідрохлорид, як описано у прикладі 17. 1 ілметил}бензилокси} оцтової кислоти дигідрохлоН-ЯМР (D2O, млн-1): 3.20-3.70 (m, 8Н), 3.82 рид, (llа): (d, J=6.79 Hz, 2Н), 3.93-4.05 (m, 4Н), 5.35 (s, 1H), {2-{4-[Біс-(4-фторфеніл)метил]піперазин-1-іл5.65-5.80 (m, 1Н), 5.97-6.12 (m, 1H), 6.80-7.00 (m, метил}феніл}метанол (5,0г, 0,0122моль) перетво4Н), 7.36-7.50 (m, 4Н). рюють на {2-{4-[біс-(4-фторфеніл)метил] піпераПриклад 31 зин-1-ілметил}бензилокси} оцтову кислоту (R,S)-{4-[4-[(4способом, подібним до описаного у прикладі 17. хлорфеніл)фенілметил]піперизин-1-іл]-(Е)-бут-2Отриманий неочищений продукт очищають колоенілокси}оцтової кислоти дигідрохлорид, (ІІІb): ночною флеш-хроматографією на силікагелі з ви(R,S)-4-{4-[(4-хлорфеніл)фенілметил] піперакористанням толуолу-метанолу (8,5:1,5) у якості зин-1-іл}-(Е)-бут-2-ен-1-ол (1,9г, 0,0053моль) перерухливої фази з отриманням чистого продукту у творюють на (R,S)-{4-[4-[(4-хлорфеніл)фенілметил] вигляді білої пінистої твердої речовини. піперазин-1-іл]-(Е)-бут-2-енілокси} оцтову кислоту, 1 Н-ЯМР (CDCl3, млн-1): 2.40-2.75 (m, 4Н), 2.75як описано у прикладі 30. Неочищений продукт 3.20 (m, 4Н),4.06 (s, 2Н), 4.10 (s, 2Н), 4.28 (s, 1H), отримують у вигляді пінистої твердої речовини, яку 4.58 (s, 2Н), 6.70-7.10 (m, 4Н), 7.10-7.50 (m, 8Н). очищають колоночною флеш-хроматографією на Цей продукт розводять в етилацетаті (12мл), силікагелі з використанням толуолу-метанолу (8:2) підкислюють розчином безводної НСl в етилацетау якості рухливої фази з отриманням чистого проті до рН 1,0-2,0, концентрують та дегазують з дукту. 1 отриманням дигідрохлориду у вигляді білої тверН-ЯМР (CDCl3, млн-1): 2.40-2.75 (m, 4Н), 2.75дої речовини. 3.20 (m, 4Н), 3.30-3.50 (m, 2Н), 3.93 (s, 2Н), 4.00Приклад 29 4.15 (m, 2Н), 4.26 (s, 1Н), 5.70-6.00 (m, 2Н), 6.82 (R,S)-{2-{4-[(4-хлорфеніл)фенілметил] піпера(br), 7.00-7.50 (m, 9Н) зин-1-ілметил}бензилокси}оцтової кислоти дигідЦей продукт перетворюють на дигідрохлорид, рохлорид, (llb): як описано у прикладі 17. {2-{4-[(4-хлорфеніл)фенілметил]піперазин-1Приклад 32 ілметил}феніл}метанол (4,0г, 9,83ммоль) перетво(R,S)-{4-[4-[(4-фторфеніл)фенілметил] піперарюють на {2-{4-[(4-хлорфеніл)фенілметил] піперазин-1-іл]-(Е)-бут-2-енілокси}оцтової кислоти дигідзин-1-ілметил}бензилокси}оцтову кислоту спосорохлорид, (ІІІс): бом, подібним до описаного у прикладі 17. (R,S)-4-{4-[(4-фторфеніл)фенілметил] піпераОтриманий неочищений продукт у вигляді бруднозин-1-іл}-(Е)-бут-2-ен-1-ол (0,7г, 2,06ммоль) перетбілої пінистої твердої речовини очищають колоноворюють на (R,S)-{4-[4-[(4-фторфеніл) фенілмечною флеш-хроматографією на силікагелі з викотил]піперизин-1-іл]-(Е)-бут-2-енілокси}оцтову ристанням толуолу-метанолу (8,5:1,5) у якості рукислоту, як описано у прикладі 30. Отриманий нехливої фази з отриманням чистого продукту у очищений продукт (0,77г) очищають колоночною вигляді білої пінистої твердої речовини. флеш-хроматографією на силікагелі з використан1 Н-ЯМР (CDCl3, млн-1): 2.40-2.80 (m, 4Н), 2.80ням толуолу-метанолу (3:2) у якості рухливої фази 3.20 (m, 4Н), 4.06 (s, 2Н), 4.14 (s, 2Н), 4.28 (s, 1H), з отриманням чистого продукту. 1 4.58 (s, 2H), 7.00-7.50 (m, 13Н). Н-ЯМР (CDCl3, млн-1): 2.40-3.20 (m, 8Н), 3.20Цей продукт перетворюють на дигідрохлорид з 3.50 (m, 2Н), 3.92 (s, 2H), 4.00-4.15 (m, 2Н), 4.26 (s, використанням розчину безводної НСl в етилаце1Н), 5.65-5.95 (m, 2Н), 6.80-7.03 (m, 2Н), 7.07-7.50 таті, як описано у прикладі 28. (m, 7Н), 10.70 (br, замінний). Приклад 30 Цей продукт перетворюють на дигідрохлорид, {4-[4-[біс-(4-фторфеніл)метил] піперизин-1-іл]як описано у прикладі 17. (Е)-бут-2-енілокси} оцтової кислоти дигідрохлорид, Визначення IC50 з використанням функціона(lllа): льного аналізу ізольованої клубової кишки морсьПри перемішуванні розчину 4-{4-[біс-(4кої свинки фторфеніл)метил]піперазин-1-іл}-(Е)-бут-2-ен-1Термінальний сегмент клубової кишки морсьолу (247,0г, 0,689моль) та калію трет-бутоксиду кої свинки Dunken Hartley біля з'єднання з ілеоце(139,2г, 1,240моль) у безводному трет-бутанолі кальним сегментом, приблизно за 10см, відокрем 23 76609 24 лений від мезентеріальних зв'язків, невідкладно ванночці постійно барботували 95% О2 та 5% СО2 видалили та вмістили у розчин Тирода складу та підтримували температуру 35°С. Після перших NaCl 137,0мМ, KСl 2,7мМ, СаСl2 1,8мМ, MgCl2 30 хвилин урівноваження записували базову лінію 1,05мМ, NaHCO3 11,9мМ, NaH2PO4 0,42мМ та глюта некумулятивні відповіді на субмаксимальну докози 5,6мМ, підтримуваний при 35°С. зу гістаміну (7,2 10-7Μ), доки відповіді були відтПросвіт клубової кишки обережно вичистили ворюваними. Скорочення у відповідь на цю типову розчином Тирода, так щоб видалити будь-які часдозу гістаміну у відсутність (при використанні тільтинки, не впливаючи на слизову оболонку тканини. ки носія) та у присутності щонайменше 3 різних Відрізали шматочки довжиною 1,5-2,0см та вміщуконцентрацій тестових сполук записували після 15 вали у ванночку для органів місткістю 20мл, прикхвилин постійної інкубації. Процент інгібування, ріпляючи один кінець до держателя тканини, а викликаного різними концентраціями тестових другий до перетворювача тонкою бавовняною нитсполук, наносили на графік проти логарифма мокою. Систему заздалегідь калібрували до початку лярних концентрацій тестових сполук для визнакожного експерименту. Тканину утримували у спочення ІС50. кою при силі натягнення 0,5-0,75г. Через розчин у Комп’ютерна верстка Т. Чепелева Підписне Тираж 26 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійською4-(diarylmethyl)-1-piperazinyl derivatives
Автори англійськоюChitturi Trinadha Rao, Thennati, Rajamannar
Назва патенту російськоюПроизводные 4-(диарилметил)-1-пиперазинила
Автори російськоюЧиттури Тринадха Рао
МПК / Мітки
МПК: C07D 295/145, C07D 295/096, C07D 295/084
Мітки: похідні, 4-(діарилметил)-1-піперазинілу
Код посилання
<a href="https://ua.patents.su/12-76609-pokhidni-4-diarilmetil-1-piperazinilu.html" target="_blank" rel="follow" title="База патентів України">Похідні 4-(діарилметил)-1-піперазинілу</a>
Попередній патент: Спосіб лікування цукрового діабету
Наступний патент: Спосіб одержання композиційного матеріалу на основі алмазу
Випадковий патент: Компенсатор гідравлічного удару












