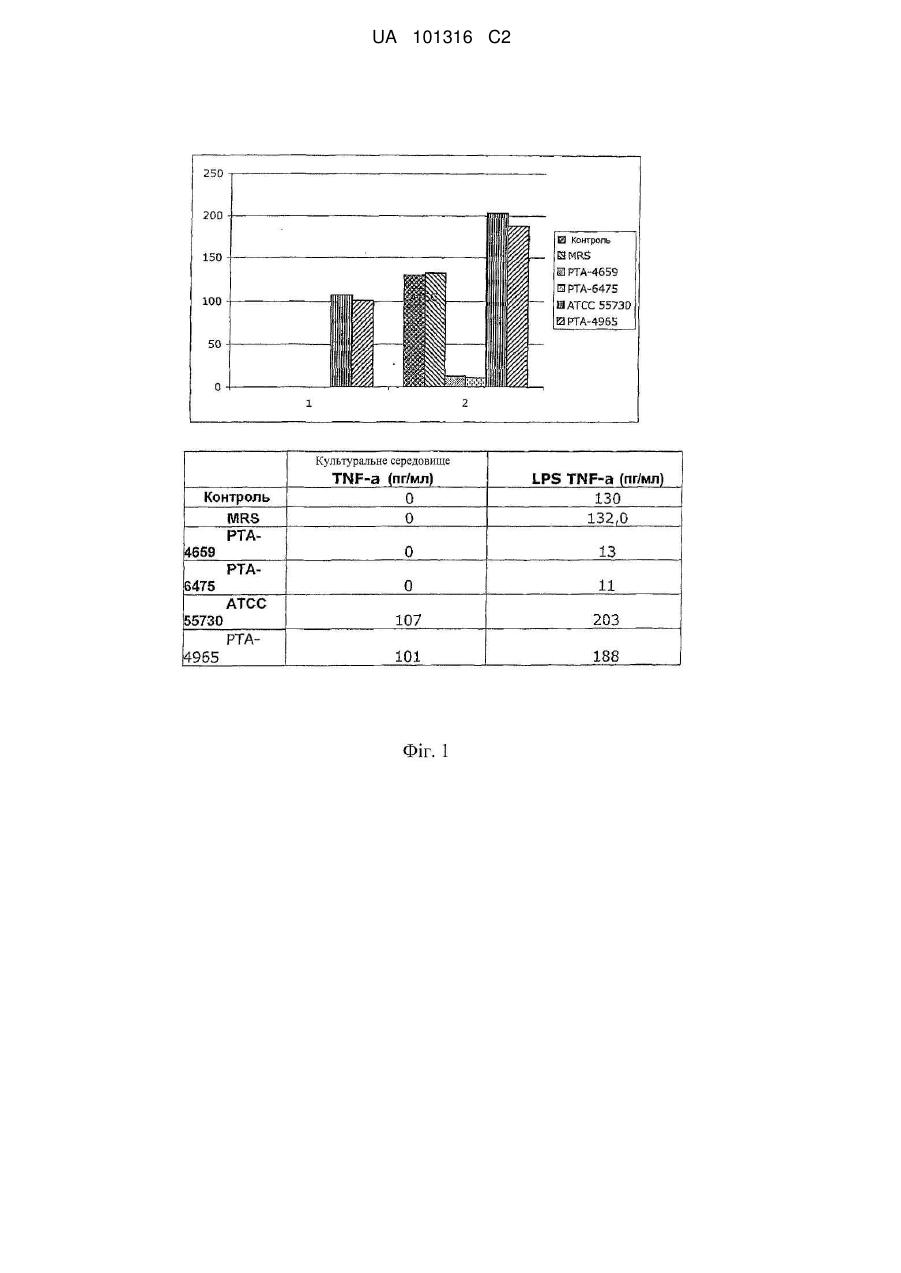
Застосування відібраних молочнокислих бактерій для профілактики та лікування атеросклерозу
Номер патенту: 101316
Опубліковано: 25.03.2013
Автори: Ротшильд Петер, Конноллі Еамонн, Мелльстам Бо
Формула / Реферат
1. Спосіб відбирання штаму молочнокислих бактерій для профілактики і/або лікування атеросклерозу у ссавців, що включає:
a) відбирання і культивування клітин штаму молочнокислих бактерій;
b) оцінка рівня здатності штаму до зниження TNF-альфа;
с) вимірювання внутрішньоклітинної BSH активності штаму;
d) відбирання штаму Lactobacillus, здатного:
і) збільшувати BSH активність і, отже, знижувати холестерин-ЛПНЩ сироватки, і
іі) одночасно зменшувати рівні прозапального цитокіну TNF-альфа.
2. Безклітинний культуральний супернатант, виділений зі штаму Lactobacillus, відібраного за допомогою способу за п. 1, для застосування у профілактиці і/або лікуванні атеросклерозу.
3. Клітини штаму Lactobacillus, відібрані способом за п. 1, для застосування у профілактиці і/або лікуванні атеросклерозу.
4. Застосування композиції, що містить клітини штаму молочнокислих бактерій, отримані за допомогою способу за п. 1, для одержання лікарського засобу, що використовується у профілактиці і/або лікуванні атеросклерозу.
5. Композиція, що містить клітини штаму Lactobacillus, відібраного за допомогою способу за п. 1, для застосування у профілактиці і/або лікуванні атеросклерозу.
6. Композиція за п. 5, що додатково містить фармацевтичний носій.
7. Композиція за п. 5, що являє собою харчову композицію, яка додатково містить основу, прийнятну для прийому всередину.
8. Композиція за п. 5, що являє собою харчову добавку, яка додатково містить основу, прийнятну для прийому всередину.
9. Композиція за п. 5, де штам Lactobacillus вибраний з групи, яка складається з Lactobacillus reuteri ATCC PTA 4659 і Lactobacillus reuteri ATCC PTA 6475.
Текст
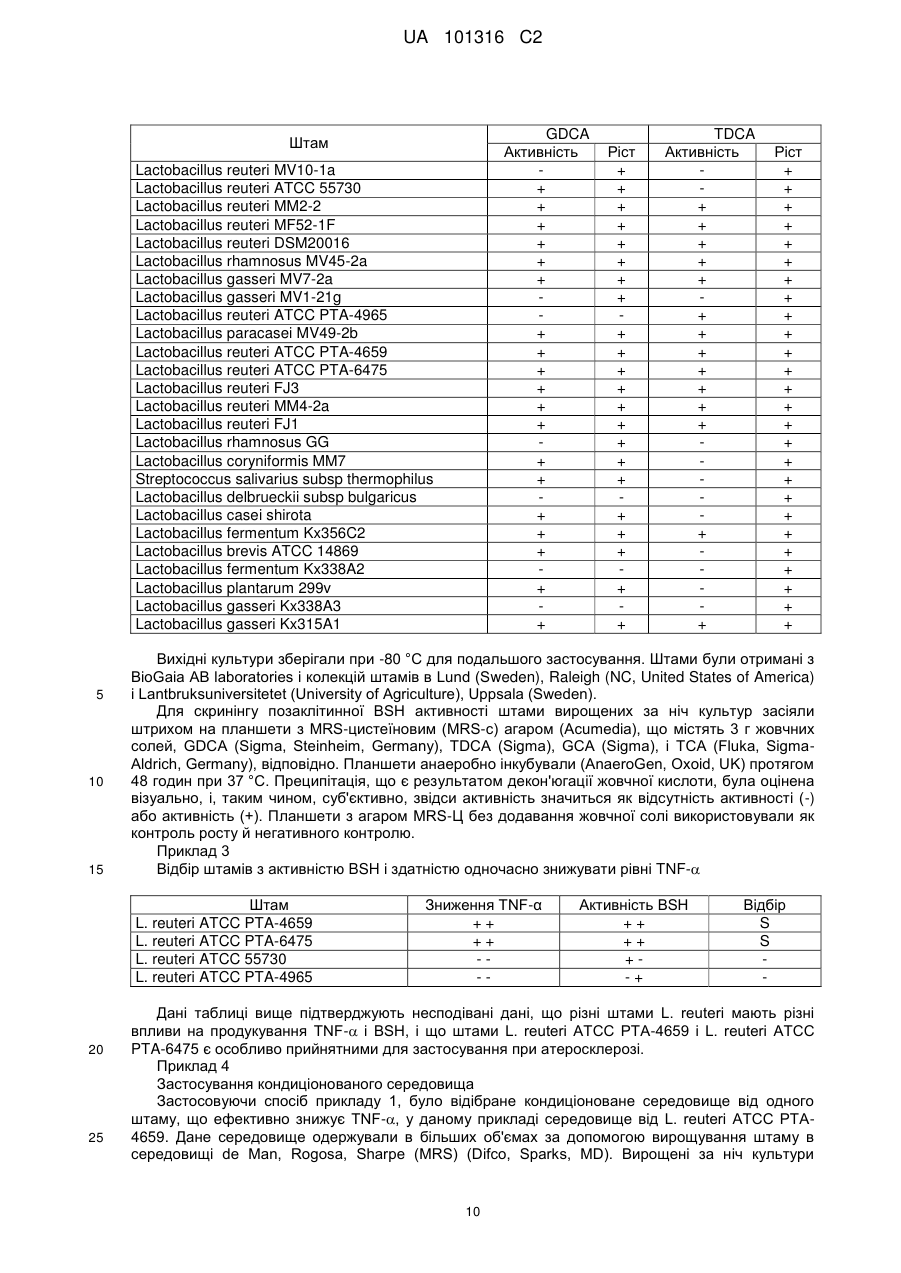
Реферат: Винахід стосується штаму молочнокислих бактерій, відібраного за його здатністю підвищувати активність BSH і, внаслідок цього, знижувати холестерин-ЛПНЩ сироватки, і, одночасно, зменшувати рівні прозапального цитокіну TNF-α, його застосування для профілактики й/або лікування атеросклерозу, спосіб відбору такого штаму, продуктів, що містять такий штам. UA 101316 C2 UA 101316 C2 5 10 15 20 25 30 35 40 45 50 55 60 Галузь техніки, до якої належить винахід Даний винахід стосується визначених штамів молочнокислих бактерій, відібраних за здатністю підвищувати активність гідролази жовчних кислот (BSH) і внаслідок цього знижувати рівень холестерину-ЛПНЩ сироватки й одночасно зменшувати рівень прозапального цитокіну фактора некрозу пухлини- (TNF-) для профілактики й/або лікування атеросклерозу й інших серцево-судинних захворювань, способу відбору таких штамів і продуктів, що містять такі штами. Рівень техніки Пробіотики Було показано, що пробіотики впливають на здоров'я (Gorbach, S.L. 2000. Probiotics and gastrointestinal health. Am. J. Gastroenterol. 95:S2-S4). Пробіотикам приписується множина різних функцій; однак механізми, за допомогою яких досягаються ці ефекти, є не до кінця зрозумілими. Ефекти включають підвищення вродженого й набутого імунітету (Gill, H.S., K.J. Rutherfurd, J. Prasad, and P.K Gopal. 2000. Enhancement of natural and acquired immunity by Lactobacillus rhamnosus (HN001), Lactobacillus acidophilus (HN017) and Bifidobacterium lactis (HN019). Br. J. Nutr. 83:167-176), підвищену продукцію протизапального цитокіну (IL-10) (Pessi, T., Y. Sutas, M. Hurme, and E. Isolauri. 2000. Interleukin-10 generation in atopic children following oral Lactobacillus rhamnosus GG. Clin. Exp. Allergy 30:1804-1808), і знижену кишкову проникність (Madsen, K., A. Cornish, P. Soper, C. McKaigney, H. Jijon, C. Yachimec, J. Doyle, L. Jewell, and C. De Simone. 2001. Probiotic bacteria enhance marine and human intestinal epithelial barrier function. Gastroenterology 121:580-591). Різні штами Lactobacillus були зокрема добре вивчені як у тварин, так і в людини. Вони можуть бути ефективні для профілактики й лікування діареї мандрівників (Marteau, P.R., M. de Vrese, C.J. Cellier, and J. Schrezenmeir. 2001. Protection from gastrointestinal diseases with the use of probiotics. Am. J. Clin. Nutr. 73:430S-436S), рекурентної інфекції Clostridium difficile (Gorbach, S.L. 1987. Bacterial diarrhoea and its treatment. Lancet ii: 1378-1382), ротавіруса (Szajewska, H., M. Kotowska, J.Z. Mrukowicz, M. Armanska, and W. Mikolajczyk. 2001. Efficacy of Lactobacillus GG (L. GG) in prevention of nosocomial diarrhea in infants. J. Pediatr. 138:361-365), і інфекції Helicobacter (Mukai, T., T. Asasaka, E. Sato, K. Mori, M. Matsumoto, and H Ohori. 2002. Inhibition of binding of Helicobacter pylori to the glycolipid receptors by probiotic Lactobacillus reuteri. FEMS Immunol. Med. Microbiol. 32:105-110). L. reuteri, виділена з тонкого кишечника мишей, інгібувала появу коліту в миші із трансгенно виключеним геном IL-10 (Madsen, K. L., J.S. Doyle, L.D. Jewell, M.M. Tavernini, and R.N. Fedorak. 1999. Lactobacillus species prevents colitis in interleukin 10 gene-deficient mice. Gastroenterology 116:1107-1114). Клінічне випробування із сумішшю пробіотиків показало значне полегшення хронічного резервуарного ілеїту (Gionchetti, P., F. Rizzello, A. Venturi, P. Brigidi, D. Matteuzzi, G. Bazzocchi, G. Poggioli, M. Miglioli, and M. Campieri. 2000. Oral bacteriotherapy as maintenance treatment in patients with chronic pouchitis: a double-blind, placebo-controlled trial. Gastroenterology 119:305-309). Імунні відповіді (Th-1/Th2/TR) Запалення опосередковане внутрішньоклітинними сигнальними білками, відомими як цитокіни, які продукують макрофаги й дендритні клітини епітелію у відповідь на антигенний стимул. При контакті між епітелієм і антигеном антиген-презентуючі клітини епітелію (включаючи дендритні клітини) передають сигнал наївним макрофагам, які потім відповідають так званою відповіддю типу Th-1, при якій макрофаги продукують прозапальні цитокіни, включаючи TNF, IL-1, IL-6, IL-12. Ці цитокіни, у свою чергу, стимулюють продукцію інтерферону γ (IFNγ), що є ключовим медіатором запалення, природними клітинами-кілерами, Т-клітинами й іншими клітинами. Наївні макрофаги також можуть відповідати на антигени відповіддю типу Th2. Ця відповідь супресується за допомогою IFN. Ці клітини типу Th-2 продукують протизапальні цитокіни, такі як IL-4, IL-5, IL-9 і IL-10. Відомо, що IL-10 інгібує продукцію IFN і, таким чином, ослаблює імунну відповідь. Рівновага між клітинами типів Th-1 і Th-2 і продукція ними відповідних цитокінів визначає ступінь запальної відповіді на конкретний антиген. Клітини типу Th-2 можуть також стимулювати продукцію імуноглобулінів за допомогою імунної системи. Протизапальна активність у шлунковокишковому тракті, де рівень TNF знижено, корелює з активованими епітеліальними клітинами (цілісність вистилки стінки кишечника) і, таким чином, зі зниженням негативних ефектів, викликаних шлунково-кишковими патогенами й токсинами. T-регуляторні клітини (TR) розглядаються як невід'ємний компонент імунної відповіді. Ці клітини в першу чергу виникають у точно регульованому протимікробному імунітеті для максимальної зміни небезпечної імунної патології (Powrie F, Maloy KJ. 2003. Regulating the regulators, Science 299 1030-1031). Було показано, що клітини TR продукують підвищені рівні протизапального цитокіну IL-10 (Smits, H.H., A. Engering, D. van der Kleij, E.C. de Jong, K. 1 UA 101316 C2 5 10 15 20 25 30 35 40 45 50 55 60 Schipper, T.M. van Capel, B.A.J. Zaat, M. Yazdanbakhsh, E.A. Wierenga, Y. van Kooyk, and L. Kapsenberg. 2005. Selective probiotic bacteria induce IL-10-producing regulatory T cells in vitro by modulating dendritic cell function through dendritic cell-specific intercellular adhesion molecule 3grabbing nonintegrin. J Allergy Clin. Immunol. 115:1260-1267). Фактори, що контролюють розвиток і активацію клітин TR, повинні забезпечити зсув рівноваги або убік активності клітин TR (для лікування аутоімунних захворювань і підвищення виживаності трансплантованих органів), або від активності клітин TR (для посилення ефективності вакцинації й відторгнення пухлини) (Walter J. Dobrogosz. Enhancement of human health with L. reuteri, A Probiotic, Immunobiotic and Immunoprobiotic. NUTRAfoods. 2005: 4(2/3) 15-28). Імуномодулюючі ефекти пробіотиків Штам GG (LGG) Lactobacillus rhamnosus є перспективним пробіотичним засобом, що демонструє в безлічі досліджень здатність заселяти кишечник і модулювати відповідь епітелію слизової й імунну відповідь. LGG підсилює проліферацію ентероцитів і розмір ворсинок у моноасоційованих гнотобіотичних щурів (Banasaz, M., E. Norm, R. Holma, and T. Midtvedt. 2002. Increased enterocyte production in gnotobiotic rats mono-associated with Lactobacillus rhamnosus GG. Appl Environ Microbiol. 68: 3031-3034). LGG також модулює проліферацію лімфоцитарних відповідей ex vivo у миші, що слідують за пероральним введенням (Kirjavainen, P.V., H.S. ElNezami, S.J. Salminen, J.T. Ahokas, and P.F. Wright.1999. Effects of orally administered viable Lactobacillus rhamnosus GG and Propionibacterium freudenreichii subsp. shermanii JS on mouse lymphocyte proliferation. Clin Diagn Lab Immunol 6: 799-802) і L. paracasei змінює модуляторні профілі цитокінів CD4+T-лімфоцитів (Von der Weid T., C. Bulliard, and E.J. Schiffrin.2001. Induction by a lactic acid bacterium of a population of CD4(+) T cells with low proliferative capacity that produce transforming growth factor beta and interleukin-10. Clin Diagn Lab Immunol 8: 695-701). Крім адаптивних імунних відповідей, LGG чинить вплив на вроджені імунні відповіді. LGG активує ядерний фактор каппа B (NF-κB) і сигнальний трансдуктор і активатор транскрипції (STAT) шляхів проходження сигналів у макрофагах людини (Miettinen, M., A. Lehtonen, I. Julkunen, and S. Matikainen. 2000. Lactobacilli and Streptococci activate NF-kappa B and STAT signaling pathways in human macrophages. J Immunol 164: 3733-3740), і L. rhamnosus стимулює продукцію макрофагами інтерлейкіну-12 (IL-12) (Hessle, C, L.A. Hanson, and A.E. Wold. 1999. Lactobacilli from human gastrointestinal mucosa are strong stimulators of IL-12 production. Clin. Exp. Immunol. 116: 276-282). LGG також стимулює продукцію імуномодулюючих цитокінів, таких як IL-10, у дітей (Pessi, T., Y. Sutas, M. Hurme, and E. Isolauri. 2000. Interleukin-10 generation in atopic children following oral Lactobacillus rhamnosus GG. Clin. Exp. Allergy 30: 1804-1808) і може регулювати прозапальні відповіді in vivo. Клітини-ефектори вродженого імунітету, такі як макрофаги, дендритні клітини й нейтрофіли, являють собою первинні ланки більшості запальних відповідей (Janeway, C.A., Jr. and R. Medzhitov. 2002. Innate immune recognition. Annu Rev Immunol 20: 197-216). Припущення, що вроджений імунітет визначає напрямок як вродженої, так і адаптивної відповідей на антигени як власні, так і не власні, підкреслює роль вродженого імунітету в регулюванні запалення. Патентна заявка США № 20020019043 стосується лікування запального захворювання травного тракту шляхом введення цитокін-продукуючих грам-позитивних бактерій або штаму грам-позитивних бактерій, що продукують антагоніст цитокіну. У конкретних варіантах здійснення цитокін або антагоніст цитокіну вибирають із IL-10, розчинного рецептора TNF- або іншого антагоніста TNF-, антагоніста IL-12, антагоніста інтерферону-гама, антагоніста IL-1 та інших. У конкретних варіантах здійснення грам-позитивні бактерії створюють способами генної інженерії для продукції цитокіну, антагоніста цитокіну й так далі. Імуномодулюючі ефекти L. reuteri Імуномодулюючі ефекти L. reuteri були описані, наприклад, Christensen, що показав, що пробіотичні лактобацили чинили свої імуномодулюючі ефекти за допомогою модулювання Th1/Th2/Th3/Tr1/TR-активуючої здатності дендритних клітин (DC) (Christensen H.R., H. Frokiaer, and J.J. Pestka. 2002. Lactobacilli differentially modulate expression of cytokines and maturation surface markers in murine dendritic cells. J. Immunol. 168: 171-178). Автори показали, що, якщо DC мишей піддати спільному культивуванню з різними штамами Lactobacillus, включаючи штами L. reuteri, то вони вибірково модулюють продукцію цитокінів IL-6, IL-10, IL-12 і TNF- і підвищують регуляцію MHC класу II і поверхневих маркерів CD86 залежним від концентрації способом. Всі лактобацили активували поверхневі MHC класу II і CD86 маркери, що є індикаторними для дозрівання DC. Особливо значним у даних дослідженнях було те, що L. reuteri (штам 12246) був слабким індуктором IL-12, але при спільному культивуванні з L. johnsonii або L. casei, він вибірково інгібував продукцію прозапальних сигнальних цитокінів IL-12, IL-6 і TNF-, стимульованих останнім із двох видів. У цих умовах продукція IL-10 зберігалася незмінною. Ці 2 UA 101316 C2 5 10 15 20 25 30 35 40 45 50 55 60 дані привели до висновків, що 'L. reuteri можуть сприяти викликаній навколишнім середовищем модуляції генерації кишкових дендритних клітин, що сприяє посиленню резистентності проти антигенів, що не несуть "сигналу небезпеки" при одночасному збереженні здатності відповідати на патогенні мікроорганізми, розпізнавані через сигнал небезпеки, подібний LPS.' Автори також встановили, що кілька штамів L. reuteri можуть бути перспективними для точно-націленого лікування, ефективним відносно пригнічення продукції IL-12 і TNF- (і IL-6), включаючи при цьому протизапальний IL-10, представляючи, таким чином, альтернативний терапевтичний спосіб нейтралізувати прозапальне кишкове цитокінове середовище. Smits розширив зазначені спостереження й показав, що L. reuteri здатні направляти DC, на стимуляцію продукції T регуляторних клітин (TR). Вони використовували три різних види Lactobacillus, культивованих спільно in vitro з DC людини, похідними моноцитів. Дві лактобацили, штам L. reuteri людини (ATCC 53609) і L. casei, але не штам L. plantarum, направляли DC, на стимуляцію розвитку TR клітин. Було показано, що зазначені TR клітини продукують підвищені рівні IL-10 і можуть інгібувати проліферацію "фонових" T-клітин залежно від IL-10 (Smits, H.H., A. Engering, D. van der Kleij, E.C. de Jong, K. Schipper, T.M.M. van Capel B.A.J. Zaat, M. Yazdanbakhsh, E. A. Wierenga, Y. van Kooyk, and L. Kapsenberg. 2005. Selective probiotic bacteria induce IL-10-producing regulatory T cells in vitro by modulating dendritic cell function through dendritic cell-specific intercellular adhesion molecule 3-grabbing nonintegrin. J Allergy Clin. Immunol. 115:1260-1267). Дані дослідження взаємодій L. reuteri-DC розглядаються у зв'язку з новаторськими дослідженнями Hori (Hori S, T. Nomura, and S. Sakaguchi. 2003. Control of regulatory T cell development by the transcription factor Foxp3. Science. 299:1057-1061), а Pasare і Medzhitov (Pasare C. and R. Medzhitov. 2003. Toll pathway-dependent blockade of CD4+Cd25+T cell-mediated suppression by dendritic cells. Science 299:1033-1036) надали цінні достовірні дані в один з імунобіотичних способів впливу L. reuteri. Фактор росту нервів (NGF), крім свого впливу на ріст нервових клітин, має значні протизапальні ефекти в ряді експериментальних систем in vitro і in vivo, включаючи модель коліту. Ma зі співавторами (2004) досліджували механізм дії L. reuteri в епітеліальних клітинних лініях людини на синтез цитокіну й NGF і відповідь IL-8 на TNF-. Вони заключили, що L. reuteri чинить потужний прямий протизапальний вплив на епітеліальні клітини людини, що, схоже, повинно стосуватися дії прийнятих усередину пробіотиків. Вони також встановили, що L. reuteri активує особливу протизапальну молекулу, NGF, і інгібує транслокацію NF-κB у ядро (Ma, D., P. Forsythe, and J. Bienenstock. 2004. Live L. reuteri is essential for the inhibitory effect on tumor necrosis factor alpha-induced interleukin-8 expression. Infect. Immun. 72:5308-5314). Штами широкого спектру видів Lactobacillus, включаючи L. reuteri, використовували в пробіотичних композиціях. Lactobacillus reuteri являє собою один із природних організмів шлунково-кишкового тракту тварин, і він виявляється в кишечнику здорових тварин, включаючи людину. Відомо, що цей організм має протимікробну дію. Див., наприклад, патенти США №№ 5439678, 5458875, 5534253, 5837238 і 5849289. Якщо клітини L. reuteri ростуть в анаеробних умовах у присутності гліцерину, то вони продукують протимікробну речовину, відому, як βгідроксипропіональдегід (3-HPA). Атеросклероз Атеросклероз і його серцево-судинні наслідки є провідною причиною смертності й захворюваності в Сполучених Штатах і в інших країнах. Назва атеросклероз походить від грецьких слів "рідка каша" або "в'язке" і "затвердіння", і це захворювання визначають як наявність атером або ділянок ушкоджень, на внутрішніх стінках артерій. Ділянки ушкодження, також відомі як бляшки, складаються з жирових відкладень і інших речовин. Що робить атеросклероз особливо небезпечним, так це те, що він, імовірно, має тенденцію уражати великі важливі артерії. Коли частинки ділянки ушкодження, заповненого бляшками, відриваються від внутрішньої стінки артерій, то жировий матеріал спрямовується в нижчерозташовані артерії меншого калібру, які безпосередньо кровопостачають серце й головний мозок, де вони застряють, заважаючи крові, багатій поживними речовинами й киснем, досягти цих життєво важливих органів. Якщо виникає повна блокада, результатом може бути інфаркт міокарда або інсульт (Little, W. C, M. Constantinescu, R.J. Applegate, M.A. Kutcher, M.T. Burrows, F.R. Kahl, and W.P. Santamore. Can coronary angiography predict the site of a subsequent myocardial infarction in patients with mild-to-moderate coronary artery disease? Circulation.1988. 78:1157-66). Звичайно, атеросклероз вважали порушенням метаболізму ліпідів. Фактори ризику, пов'язані з атеросклерозом, включають високі рівні ЛПНЩ, гомоцистеїну в крові, гіпертензію, паління сигарет, ожиріння й діабет. Лікування було спрямовано на модулювання рівнів холестерину, наприклад, шляхом підвищення метаболізму жовчних солей за допомогою певних кисломолочних бактерій. 3 UA 101316 C2 5 10 15 20 25 30 35 40 45 50 55 60 При оцінці можливості використання молочнокислих бактерій (LAB) як ефективних пробіотиків, багато хто вважає за необхідне оцінити їхню здатність LAB протистояти дії жовчних кислот. Жовчні кислоти синтезуються в печінці з холестерину й виділяються з жовчного міхура у дванадцятипалу кишку, кон'югованими із гліцином або таурином. Їхньою функцією є емульгування ліпідів, що поступають з їжею. Найпоширенішими первинними жирними кислотами в людини є холева й хенодезоксихолева кислоти, які являють собою головні кінцеві продукти метаболізму холестерину в печінці. У результаті мікробної активності в кишечнику, дані кислоти потім піддаються модифікаціям хімічної структури, таким як декон'югація й дегідроксилювання, де амінокислоти гідролізуються з кон'югованої форми (Cardona, M.E., V. de Vanay, T. Midtvedt, and K.E. Norin. Probiotics in gnotobiotic mice. Conversion of cholesterol to coprostanol in vitro and in vivo and bile acid deconjugation in vitro. Microb Ecol Health Dis. 2000. 12:219-224; Dunne, C., L. O'Mahony, L. Murphy, G. Thornton, D. Morrissey, S. O'Halloran, M. Feeney, S. Flynn, G. Fitzgerald, D. Daly, B. Kiely, G.C. O' Sullivan, F. Shanahan, and J.K. Collins. In vitro selection criteria for probiotic bacteria of human origin: correlation with in vivo findings. Am J Clin Nutr. 2001. 73 (suppl): 386S-392S). Деякі шлунково-кишкові (GI) бактерії, наприклад, Enterococcus, Bifidobacterium і Lactobacillus експресують фермент гідролазу жовчних кислот (BSH), що каталізує гідроліз кон'югованих жовчних кислот, що приводить до утворення молекул вільного гліцину або таурину й некон'югованих жовчних кислот (Tanaka, H., K. Doesburg, T. Iwasaki, and I. Mierau. Screening of lactic acid bacteria for bile salt hydrolase activity. J Dairy Sci. 1999. 82: 2530-2535; Bateup, J.M., M.A. McConnell, H. F. Jenkinson, and G.W. Tannock. Comparison of Lactobacillus strains with respect to bile salt hydrolase activity, colonization of the gastrointestinal tract, and growth rate of the murine host. Appl Environ Microbiol. 1995. 61(3): 11471149; Tannock, G.W., J.M. Bateup, and H.F. Jenkinson. Effect of sodium taurocholate on the in vitro growth of lactobacilli. Microb Ecol. 1997. 33: 163-167). Є дві головні гіпотези, що стосуються впливу експресії BSH на функцію бактерій у шлунковокишковому тракті. Одна гіпотеза полягає в тому, що деякі бактерії декон'югують жовчні кислоти для того, щоб використовувати амінокислоту таурин як акцептор електронів, тоді як інша стверджує, що фермент знижує токсичність жовчних кислот за допомогою декон'югації, оскільки декон'юговані форми є менш розчинними зі зниженою детергентною активністю, тим самим захищаючи бактерії. Було виявлено, що як кон'юговані, так і некон'юговані жовчні кислоти демонструють антибактеріальну активність у відношенні Escherichia coli, видів Klebsiella і видів Enterococcus in vitro, де декон'юговані форми більш виражено інгібували ріст (Dunne, C., L. O'Mahony, L. Murphy, G. Thornton, D. Morrissey, S. O'Halloran, M. Feeney, S. Flynn, G. Fitzgerald, C. Daly, B. Kiely, G.C. O'Sullivan, F. Shanahan, and J.K. Collins. In vitro selection criteria for probiotic bacteria of human origin: correlation with in vivo findings. Am J Clin Nutr. 2001. 73 (suppl): 386S392S; Moser, S.A. and D.C. Savage. Bile salt hydrolase activity and resistance to toxicity of conjugated bile salts are unrelated properties in lactobacilli. Appl Environ Microbiol. 2001. 67 (8): 3476-3480). Виражені холестерин-знижувальні дії ферментованих молочних продуктів можна пояснити зв'язуванням холестерину з жовчними кислотами й інгібуванням міцелоутворення. Механізм, через який пробіотичні бактерії в цих продуктах можуть чинити гіпохолестеринемічну дію, являє собою дію за допомогою жовчних кислот, холевої і дезоксихолевої кислот, що продукуються з холестерину за допомогою гепатоцитів. Вони кон'юговані із гліцином і таурином, і надходять у тонку кишку, де абсорбуються й направляються в печінку. При реабсорбції кон'юговані жовчні кислоти піддаються впливу мікрофлори тонкої кишки. Бактерії у ферментованих харчових продуктах, наприклад, лактобацили й стрептококи, гідролізують кон'юговані жовчні кислоти. Можливо, штам Lactobacillus з високою активністю гідролази жовчної солі кишечника підвищує жовчний гідроліз. Це може привести до більш швидкої швидкості перетворення холестерину й більшої продукції жовчних кислот. In vivo, зменшення холестерину відбувається завдяки екскреції жовчної кислоти з калом, оскільки декон'юговані жовчні кислоти не реабсорбуються в товстій кишці. Це приводить до збільшення жовчі de novo, щоб зберегти пул жовчі в організмі постійним (St-Onge M-P., E.R. Farnworth, and P.J.H. Jones. 2000. Consumption of fermented and nonfermented dairy products: effects on cholesterol concentrations and metabolism. Am J Clin Nutr. 71: 674-681). Декон'югація жовчних кислот буде нижче рівнів холестерину плазми. Однак ці сполуки можуть бути потім перетворені у вторинні жовчні кислоти в товстій кишці за допомогою анаеробних бактерій, а вторинні жовчні кислоти, як думають, є можливими індукторами раку товстої кишки. Вторинні жовчні кислоти є токсичними для клітинних ліній і є підстави думати, що вони чинять цитотоксичну дію на слизову товстої кишки, що веде до підвищеної проліферації клітин. Ці гіперпроліферуючі клітини мають підвищену чутливість до мутагенних речовин і, тим 4 UA 101316 C2 5 10 15 20 25 30 35 40 45 50 55 60 самим, підвищують ризик виникнення раку товстої кишки (Hepner, G., R. Fried, S. St. Jeor, L. Fusetti, and R. Morin. 1979. Hypercholesterolemic effect of yoghurt and milk. Am. J. Clin. Nutr. 32:1924). На щастя, молочнокислі бактерії, очевидно, знижують розчинність декон'югованих жовчних солей і вторинних жовчних солей, тим самим, знижуючи їх біодоступність. Дослідження De Boever зі співавторами (2000) показали, що L.reuteri знижували токсичність жовчної солі в бактеріальних культурах. Більш важливо, додавання L. reuteri приводило до практично абсолютної стійкості до лізису червоних кров'яних клітин і зменшує токсичну дію жовчних солей на клітини HeLa (De Boever, P., R. Wouters, L. Verschaeve, P. Berckmans, G. Schoeters, and W. Verstraete. Protective effect of the bile salt hydrolase-active Lactobacillus reuteri against bile salt cytotoxicity. Appl Microbiol Biotechnol. 2000. 53(6):709-14). Атеросклероз як імунологічне захворювання. Учені описують нову схему розвитку атеросклерозу, думаючи, що дана патологія може бути наслідком дисбалансу між прозапальними Т-клітинами й TR, що врівноважують їх. Це один із цікавих наукових результатів, що з'ясувався на конференції Second European Vascular Genomics Network Conference (EVGN Conference - Гамбург, 27-30 вересня 2005). Ці результати дали нове розуміння ролі запалення при розвитку серцевих захворювань і привели до створення нових інформаційних моделей формування тромбу й процесів, що ведуть до інфаркту міокарда. Атеросклероз починається з утворення жирових прожилок в ендотелії, оскільки жири в частинках ЛПНЩ подразнюють ендотеліальні клітини, і включають клітинну інфільтрацію декількох клітинних типів, включаючи моноцити й Т-лімфоцити. Моноцити взаємодіють із ендотеліальним шаром, міцно прикріплюються до ендотелію й мігрують у субендотеліальний простір, де вони диференціюють у макрофаги. Макрофаги вивільняють ряд хімічних речовин, включаючи цитокіни. Стимулюється продукція факторів росту, що веде до клітинної проліферації й продукції матриксу, а також металопротеїназ, що приводить до дегенерації матриксу. Таким чином, макрофаги підсилюють ушкодження й можуть сприяти нестабільності й тромботичним ускладненням (Ross R. Atherosclerosis-An inflammatory disease. N Engl J Med. 1999. 340: 115-26). Було показано, що T-лімфоцити присутні на всіх стадіях атеросклерозу. Їхня присутність забезпечує додатковий доказ зв'язку з імунною відповіддю (KoI, A. and P. Libby. 1998. The mechanisms by which infectious agents may contribute to atherosclerosis and its clinical manifestations. Trends Cardiovasc Med. 8: 191-99; Andreotti, F., F. Burzotta, A. Mazza, A. Manzoli, K. Robinson, and A. Maseri. 1999. Homocysteine and arterial occlusive disease: a concise review. Cardiologia. 44:341-5). Сигнал до початку продукції запальних речовин залежить від залучення рецепторів, називаних toll-подібними рецепторами, які розпізнають деякі ендогенні молекули, що активують запальні сигнальні шляхи (K. Edfeldt, J. Swedenborg, G.K. Hansson, and Z. Yan. 2002. Expression of Toll-Like Receptors in Human Atherosclerotic Lesions: A Possible Pathway for Plaque Activation Circulation. 105: 1158-1161). Toll-подібні рецептори (TLR) розпізнають мікробні мотиви й активують набір генів, що веде до продукції цитокінів. Традиційно, TLR розглядалися як сенсори мікробних інфекцій, і їхня роль полягає в індукції запальної відповіді. Однак, повтори, розпізнавані TLR, не є специфічними для патогенних мікроорганізмів, а являють собою основні повтори, наявні у всіх класів мікроорганізмів, і не зовсім зрозуміло, як імунна система встановлює відмінності між коменсальними й патогенними бактеріями за допомогою TLR. Дані, отримані останнім часом, показали, що TLR, незважаючи на їхню роль в індукції запальної відповіді, також відіграють роль у підтримці кишкового гомеостазу шляхом розпізнавання коменсальної мікрофлори (Rakoff-Nahoum, S., J. Paglino, F. Eslami-Varzaneh, S. Edberg and R. Medzhitov. 2004. Recognition of commensal microflora by toll-like receptors is required for intestinal homeostasis. Cell. 23; 118(2):229-41). Встановлено, що маркери сироватки запалення являють собою незалежні фактори ризику для серцево-судинної захворюваності й смертності. Маркери запалення, які зв'язують із серцево-судинними ефектами, включають прозапальні цитокіни, такі як IL-6 і TNF-α, фібриноген і С-реактивний білок (CRP) (Libby, P., P.M. Ridker, and A. Maseri. 2001. Inflammation and atherosclerosis. Circulation. 2002.105:1135-1143; Ridker, P.M. High sensitivity C-reactive protein: potential adjunct for global risk assessment in the primary prevention of cardiovascular disease. Circulation. 103: 1813-1818). Роль C. pneumonie і H. pylori в атеросклерозі По матеріалах, що накопичуються, можна припустити, що атеросклероз є запальним захворюванням. Внаслідок цього велика увага останнім часом була сфокусована на можливості того, що інфекційні агенти можуть відігравати роль в етіології серцево-судинних захворювань. Припущення стосується певних інфекційних агентів, ґрунтуючись на виділенні їх з 5 UA 101316 C2 5 10 15 20 25 30 35 40 45 50 55 атероматозних бляшок або на присутності позитивних серологічних даних для організмів, таких як Chlamydia pneumoniae, Helicobacter pylori, вірус простого герпесу й цитомегаловірус. Навіть хоча перспективним дослідженням не вистачає об'єктивних даних, C. pneumoniae, очевидно, проявляють найсильніший зв'язок з атеросклерозом. C. pneumoniae була виділена з аутопсій і зразків висічених атеросклеротичних уражень як з ранніх, так і добре розвинених уражень. При дослідженні за допомогою імунологічної цитохімії й фарбування тканин, взаємозв'язок був виявлений в 70-100 % випадків. Можливі механізми, за допомогою яких інфекційні агенти чинять свою дію, можуть включати (i) місцеві впливи на ендотелій, гладеньком'язові клітини або макрофаги або (ii) системні дії шляхом вироблення цитокінів, стимуляції моноцитів і активації гіперкоагуляції. Загальноприйняте лікування для зниження рівнів холестерину За багато років було виявлено, що підвищена концентрація холестерину в сироватці є фактором ризику, пов'язаним з атеросклерозом і ішемічною хворобою серця, що пізніше є основною причиною смерті в Західних країнах (Barr, D.P., A.M. Russ, and H. A. Eder. 1951. Protein-lipid relationship in human plasma. II. In atherosclerosis and related conditions. Am. J. Med. 11:480-493). Численні лікарські препарати, що знижують холестерин, включаючи інгібітори метилглютарил-коензим А-Редуктази, і лікарські препарати, що підвищують сумарну екскрецію жовчних кислот, використовуються для лікування хворих з гіпохолестеринемією (HC) (Suckling, K.E., G.M. Benson, B. Bond, A. Gee, A. Glen, C. Haynes, and B. Jackson. 1991. Cholesterol lowering and bile acid excretion in the hamster with cholestyramine treatment. Atherosclerosis 89: 183-190). Однак, небажані побічні ефекти цих сполук викликають питання про їхнє терапевтичне застосування (Erkelens, D.W., M.G.A. Baggen, J.J. Van Doormeal, M. Kettner, J.C. Koningsberger, and M.J.T.M. Mol. 1988. Clinical experience with simvastatin compared with cholestyramine. Drugs 39 (Suppl.):87-90). Молочнокислі бактерії як лікування для зниження рівнів холестерину Крім зазначених терапевтичних засобів, прийом усередину пробіотичних молочнокислих бактерій, можливо, є більш природним способом зменшити концентрації холестерину в сироватці людини. Деякі дослідження повідомляють про зменшення холестерину в сироватці при споживанні більших доз (від 680 до 5000 мл/Д) ферментованих молочних продуктів, але дані результати не можуть бути екстрапольовані на більш реальні умови споживання (Mann, G.V. 1977. A factor in yogurt which lowers cholesterolemia in man. Atherosclerosis 26:335-340; McNamara, D.J., A. M. Lowell, and J.E. Sabb. 1989. Effect of yogurt intake on plasma lipid and lipoprotein levels in normolipidemic males. Atherosclerosis 79:167-171). Massey показав, що первісно споживання йогурту значно знижує холестерин на 10-12 % у дорослих чоловіків, але 2 тижні поспіль концентрації повертаються до контрольних значень навіть при продовженні споживання йогурту (Massey, L. 1984. Effect of changing milk and yoghurt consumption on human nutrient intake and serum lipoprotein. J. Dairy Sci. 67:255-262). Подібні суперечливі результати були отримані в експериментальних тварин, яких годували молоком і його ферментованими продуктами (Hepner, G., R.S.T. Fried, S. Jeor, L. Fusetti, and R. Morin. 1979. Hypocholesterolemic effect of yogurt and milk. Am. J. Clin. Nutr. 32:19-24); Rao, D.R., C.B. Chawan, and S.R. Pulusani. 1981. Influence of milk and thermophilus milk on plasma cholesterol levels and hepatic cholesterogenesis in rats. J. Food Sci.46:1339-1341). Rao повідомляв про дію HC у щурів, яких годували молоком, ферментованим Streptococcus thermophilus (Rao, D.R., C.B. Chawan, and S.R. Pulusani. 1981. Influence of milk and thermophilus milk on plasma cholesterol levels and hepatic cholesterogenesis in rats. J. Food Sci. 46:1339-1341). Rodas виявив подібну дію в HC свиней, яких годували Lactobacillus acidophilus (Rodas, B.Z., S.E. Gilliland, and C.V. Maxwell. 1996. Hypocholesterolemic action of Lactobacillus acidophilus ATCC 43121 and calcium in swine with hypercholesterolemia induced by diet. J. Dairy Sci. 79:2121-2128). У дослідженні, що вивчає дію L. reuteri CRL 1098 на загальний холестерин, тригліцериди й співвідношення ліпопротеїнів високої щільності (ПЛВЩ) до ліпопротеїнів низкої щільності (ЛПНЩ) у сироватці мишей, яких попередньо годували їжею, збагаченою жиром, L. reuteri викликала 40 %-не зниження тригліцеридів і 20 %-не збільшення співвідношення ліпопротеїнів високої щільності до ліпопротеїнів низької щільності без транслокації бактерій природної мікрофлори в селезінку й печінку (Taranto, M.P., F. Sesma, A.P. Ruiz Holgado, and G.F. Valdez. 1997. Bile salts hydrolase plays a key role on cholesterol removal by Lactobacillus reuteri. Biotechnol. Lett. 9:245-247). Ці дані припускають, що L. reuteri CRL 1098 є ефективним гіпохолестеринемічним препаратом при низькій концентрації клітин для мишей. Але на відміну від розкриття винаходу в даній заявці, зниження холестерину відбувалося тільки завдяки активності BSH, а не завдяки комбінації активності BSH і імунорегулюючих впливів. 6 UA 101316 C2 5 10 15 20 25 30 35 40 45 50 55 60 Молочнокислі бактерії як лікування для зниження рівнів холестерину, імунорегуляторний шлях Патентна заявка США № 20050169901 стосується способів регуляції рівнів і активності цитокінів для діагностики, профілактики й лікування серцево-судинних порушень. Регуляція цитокіну являє собою зміну профілю цитокінів з Th2 на Th1 на противагу винаходу даної заявки, де зміна відбувається, переважно, від профілю цитокінів Th1 убік зниження продукції TNF-. Як пробіотик заявники згадують деякі різні види й штами бактерій, на противагу винаходу даної заявки, де пробіотиком є особливий штам молочнокислих бактерій, відібраний по ефективності зниження рівнів TNF- і, одночасно, підвищення активності BSH. Bukowska показала, що в пацієнтів з гіперхолестеринемією, збагачення раціону пробіотичними бактеріями Lactobacillus plantarum 299v значно знижує концентрації холестерину ЛПНЩ і фібриногену (Bukowska H., J. Pieczul-Mrόz, M. Jastrzebska, K. Chelstowski, and M. Naruszewicz. 1997. Decrease in fibrinogen and LDL-cholesterol levels upon supplementation of diet with Lactobacillus plantarum in subjects with moderately elevated cholesterol. Atherosclerosis. 137:437-8). Це також описано в патенті США № 6214336. Та ж група показала, що збагачення раціону L. plantarum може сприяти профілактиці й лікуванню метаболічних порушень у курців. Думають, що дана позитивна дія прямо пов'язана із продукцією пропіонової кислоти за допомогою бактеріальної ферментації волокон. Автори припускають, що пропіонова кислота чинить специфічну протизапальну дію через невідомий дотепер механізм, що, можливо, стосується активації ібупрофеном рецептора активатора проліферації пероксисом, що модулює ядерну транскрипцію фактора B і знижує продукування запальних цитокінів моноцитамимакрофагами (M. Naruszewicz, M-L Johansson, D. Zapolska-Downar, and H. Bukowska, Effect of Lactobacillus plantarum 299v on cardiovascular disease risk factors in smokers. Am. J. Clinical Nutrition. 2002. 76:1249-1255). На противагу винаходу даної заявки вищезгадані посилання не описують штами, здатні як підвищувати активність BSH, і в той же час знижувати рівні TNF-. Як згадано вище, протягом багатьох років було добре відомо, що підвищена активність BSH знижує рівні холестерину сироватки й, як наслідок, знижує ризик атеросклерозу. Попередньо також було продемонстровано, що атеросклероз являє собою запальне захворювання, і була запропонована регуляція різних цитокінів, щоб зупинити розвиток даного захворювання. З огляду на дані результати, були відібрані непатогенні штами бактерій як для зниження BSH, так і для імунорегуляторних цілей. Несподівано було виявлено, що деякі зі штамів, які викликають підвищення активності BSH, одночасно знижують рівні прозапального цитокіну TNF-, фіг. 1. Внаслідок цього, винахід стосується застосування, наприклад, L. reuteri ATCC-PTA4659, L. reuteri ATCC-6475 або L. coryniformis ATCC-PTA4660 і інших штамів, відібраних таким самим шляхом, і їхніх сумішей для одержання продукту для профілактики й/або лікування атеросклерозу й інших серцево-судинних захворювань. Внаслідок цього, метою даного винаходу є одержання штамів молочнокислих бактерій, відібраних за їхньою здатністю знижувати холестерин-ЛПНЩ сироватки й знижувати рівні прозапального цитокіну TNF-. Інші цілі й переваги стануть більш зрозумілі з нижчеподаного опису й прикладеної формули винаходу. Короткий опис креслень Фіг. 1 являє собою стовпчасту діаграму, що показує дію кондиціонованого середовища Lactobacillus на продукцію TNF- LPS-активованими моноцитами. Штами й контрольні групи інкубували 24 години. Сутність винаходу Даний винахід стосується певних штамів молочнокислих бактерій, відібраних за їхньою здатністю підвищувати активність BSH і, як наслідок, знижувати холестерин-ЛПНЩ сироватки й одночасно знижувати рівні прозапального цитокіну TNF-, для профілактики й/або лікування атеросклерозу й інших серцево-судинних захворювань, способу відбору таких штамів і продуктів, що містять такі штами. Інші цілі й ознаки винаходів стануть більш зрозумілі з нижчеподаного докладного опису й прикладеної формули винаходу. Докладний опис винаходу і переважні варіанти його здійснення Даний винахід стосується штамів молочнокислих бактерій, які були відібрані за їхньою здатністю зменшувати запалення й підвищувати активність BSH, наприклад, при атеросклерозі. Такі штами включають Lactobacillus reuteri ATCC-PTA4659, які були депоновані в Американській Колекції Типових Культур, 10801 University Blvd, Manassas, VA, 11 вересня 2002 року на підставі Будапештської Угоди. Lactobacillus reuteri ATCC-PTA6475 був депонований в ATCC 21 грудня 2004 року. Всі обмеження по можливості вільного використання даних штамів будуть 7 UA 101316 C2 5 10 15 20 25 30 35 40 45 50 55 60 беззастережно усунуті після видачі патенту. Продукти, такі як продукти харчування, харчові добавки й готові форми, фармацевтичні або медичні пристрої, що містять цілі клітини або компоненти, отримані із цих штамів, такі як компоненти, що мають таку ж здатність, що присутня у безклітинній культурі цих штамів, можуть бути складені як відомо в даній галузі, наприклад, капсула твердого желатину із замороженою висушеною культурою штаму Lactobacillus або їхніх похідних компонентів. Також суміші штамів, згаданих у даній заявці, і цілих клітин або їхніх компонентів знаходяться у межах об'єму правових домагань даного винаходу. Штами, відібрані в прикладі 3, наприклад L. reuteri ATCC PTA-6475, був доданий у звичайний йогурт. Штам L. reuteri ATCC PTA-6475 вирощували й ліофілізували з використанням стандартних способів вирощування Lactobacillus у молочній промисловості. Цю культуру потім додавали в попередньо ферментоване молоко з використанням стандартних йогуртових культур, на рівні 10E+6 КУО/грам йогурту, і йогурт використовували для профілактики атеросклерозу в людей. Інші прийняті усередину допоміжні матеріали, за винятком йогурту, можуть являти собою, наприклад, молоко, сир, кисломолочні продукти, засновані на молоці ферментовані продукти, ферментовані зернові продукти, порошки, засновані на молоці. Для визначення факторів, які знижують або зменшують запалення, використовують модельні системи з відповідними цитокінами. У винаході, розкритому в даній заявці, використане випробування, засноване на клітинах людини. Клітини THP-1 являють собою моноцитарну клітинну лінію людини, отриману у хворих з лейкозом, і які зберігаються в Американській Колекції Типових Культур (ATCC No TIB202). Джерело цих клітин від хазяїна людини робить їх особливо прийнятними для досліджуваних взаємодій кишкової імунної системи людини з коменсальними бактеріями людини. Дані у винаході показують потужне інгібування продукції TNF- конкретними штамами L. reuteri ATCC PTA-4659 і L. reuteri ATCC PTA-6475 і що дана регуляція опосередкована речовиною, що вивільняється в середовище для вирощування даними двома конкретними штамами під час пізньої логарифмічної/стаціонарної фази росту. І навпаки, два інших штами L. reuteri, були не тільки не здатні інгібувати запальну відповідь клітин на токсин E. coli, але також індукували їхню запальну відповідь. Прямий чашковий метод із щільним середовищем, вибраним de Man, Rogosa і Sharpe (MRS), що містить жовчні солі, застосовували для скринінгу штамів, що виділяють гідролазу жовчних солей і визначають специфічну активність ферментів для їхнього субстрату. Ріст бактерій, що продукують BSH, дає зростання гідролізу й окислювання середовища. Гідроліз з'являється у вигляді утворення кільця осаджених вільних жовчних солей навколо колоній (Dashkevicz, M.P. and S.D. Feighner. 1989. Development of a differential medium for bile salt hydrolase-active Lactobacillus spp. Appl Environ Microbiol. 55 (1): 11-16). Ознаки даного винаходу будуть більш зрозумілі за допомогою посилання на наступні приклади, які не повинні бути витлумачені як такі, що обмежують винахід. Приклад 1 Оцінка штамів, що мають здатність зниження рівнів TNF- Клітини THP-1 інкубували разом або з контрольним середовищем або кондиціонованим середовищем (L-CM) для вирощування відібраних штамів L. reuteri, L. reuteri ATCC PTA-4659, L. reuteri ATCC PTA-4975, L. reuteri ATCC 55730 і штаму L. reuteri PTA-4965. Кондиціоноване середовище (L-CM) являє собою безклітинні супернатанти з 9-годинної або 24-годинної культур кожної з культур L. reuteri. Клітини THP-1 стимулювали або контрольним середовищем, або LPS, виробленою E. coli (яка веде до вироблення TNF у нормальній запальній відповіді) у процесі 3,5-годинної інкубації, після якої клітини витягли, а супернатанти досліджували на рівні TNF із застосуванням методики ELISA. Матеріали: Лейкемічна моноцитарна клітинна лінія THP-1 (ATCC, каталоговий номер TIB202) Середовище RPMI 1640 (Gibco-Invitrogen) Фетальна бичача сироватка (Gibco-Invitrogen) Пеніцилін-стрептоміциновий розчин (Sigma) Ліпополісахарид E. coli серотипу О127:B8 (Sigma, каталоговий номер L3137) TNF-alph/TNF-SFII людини DuoSet ELISA засіб розробки (R&D Systems, каталоговий номер DY210) IL-10 людини DuoSet, 2-й засіб формування (R&D Systems, каталоговий номер DY217) Метод: Використовували моноцитарну клітинну лінію THP-1. 5 % (об./об.) середовища MRS і 5 % (об./об.) кондиціонованого середовища Lactobacillus додали у відповідні ямки. Кондиціоноване середовище Lactobacillus являла собою супернатант із 24-годинної культури видів Lactobacillus 8 UA 101316 C2 5 10 15 20 25 30 35 у середовищі MRS. Потім кондиціоноване середовище регулювали по pH за допомогою швидкісного вакуумного сушіння й пеллет ресуспендували в рівному об'ємі культурального середовища. Хоча зволожувальна камера сконструйована так, щоб мінімізувати випаровування рідини, після 48 годин інкубування, об'єм клітинної суспензії в 24-ямкових планшетах зменшився до, приблизно, 475 мкл. 100 нг/мл ліпополісахариду E. coli серотипу O127:B8 додали у відповідні ямки, які інкубували в 37C, зволоженій, 5 % CO2 камері. Після 3,5 годин інкубування, культури збирали в 1,5 мл центрифужні пробірки й центрифугували при 1500 RCF протягом 5 хвилин при 4C. Супернатант збирали. Експресію цитокіну тестували за допомогою ELISA (Quantikine TNF-alph/TNF-SFII human DuoSet). Використовуване культуральне середовище становило 10 % FBS, 2 % пеніцилінстрептоміцин в RPMI-розчині 1640. Результати - приклад 1 Додавання LPS до клітин THP-1 у відсутність L-CM привело до вироблення 130 пг/мл TNF у процесі 3,5-годинного інкубаційного періоду. Це є очікуваною запальною відповіддю клітин THP1 на токсин. Додавання середовища для росту (MRS), що виступає як контроль для додавань LCM, привело до вироблення 132 пг/мл TNFα і, таким чином, MRS не перешкоджало відповіді на LPS. Додавання 24-годинної L-CM з L. reuteri ATCC PTA 4659 або L. reuteri ATCC PTA 6475 істотно зменшувало рівні LPS стимульованої TNF, лише до 13 і 11 пг/мл, відповідно. Це відображає інгібування LPS-стимульованого продукування TNF, що дорівнює 90 і 93 %, відповідно. І навпаки, у присутності 24-годинної L-CM з L. reuteri ATCC 55730 і штаму L. reuteri PTA4965, LPS залишалася усе ще здатною викликати значне підвищення TNF- у порівнянні з рівнями у відсутність LPS. LPS-стимульоване продукування TNF- збільшувалося на 54 % і 42 %, незважаючи на присутність L-CM з L. reuteri ATCC 55730 і штаму L. reuteri ATCC PTA4965, відповідно (фіг. 1). Подібні експерименти, проведені з 9-годинною L-CM з L. reuteri ATCC PTA 4659 або L. reuteri ATCC PTA 6475, продемонстрували, що інгібуючий вплив на LPS-стимульоване продукування TNF був значно меншим, але усе ще був присутнім. Таким чином, більш тривалі періоди інкубування штамів L. reuteri з вилученням L-CM наприкінці логарифмічної/стаціонарної фази росту, приводять до підвищення ефективності в інгібуванні продукування TNF-. Приклад 2 Прямий чашковий метод - оцінка штамів з позаклітинною активністю BSH Штами молочнокислих бактерій людини вирощували в умовах з обмеженням кисню при 37 °C у бульйоні MRS (Acumedia Manufacturers, Inc. Baltimore, Maryland) протягом ночі, і інокулювали в середовище, що несе лактобацили (LCM) з 10 % гліцерином (BDH Laboratory Supplies, England). 9 UA 101316 C2 GDCA Активність + + + + + + + + + + + + + + + + + + + Штам Lactobacillus reuteri MV10-1a Lactobacillus reuteri ATCC 55730 Lactobacillus reuteri MM2-2 Lactobacillus reuteri MF52-1F Lactobacillus reuteri DSM20016 Lactobacillus rhamnosus MV45-2a Lactobacillus gasseri MV7-2a Lactobacillus gasseri MV1-21g Lactobacillus reuteri ATCC PTA-4965 Lactobacillus paracasei MV49-2b Lactobacillus reuteri ATCC PTA-4659 Lactobacillus reuteri ATCC PTA-6475 Lactobacillus reuteri FJ3 Lactobacillus reuteri MM4-2a Lactobacillus reuteri FJ1 Lactobacillus rhamnosus GG Lactobacillus coryniformis MM7 Streptococcus salivarius subsp thermophilus Lactobacillus delbrueckii subsp bulgaricus Lactobacillus casei shirota Lactobacillus fermentum Kx356C2 Lactobacillus brevis ATCC 14869 Lactobacillus fermentum Kx338A2 Lactobacillus plantarum 299v Lactobacillus gasseri Kx338A3 Lactobacillus gasseri Kx315A1 5 10 15 25 TDCA Активність + + + + + + + + + + + + + + Ріст + + + + + + + + + + + + + + + + + + + + + + + + + + Вихідні культури зберігали при -80 °C для подальшого застосування. Штами були отримані з BioGaia AB laboratories і колекцій штамів в Lund (Sweden), Raleigh (NC, United States of America) і Lantbruksuniversitetet (University of Agriculture), Uppsala (Sweden). Для скринінгу позаклітинної BSH активності штами вирощених за ніч культур засіяли штрихом на планшети з MRS-цистеїновим (MRS-c) агаром (Acumedia), що містять 3 г жовчних солей, GDCA (Sigma, Steinheim, Germany), TDCA (Sigma), GCA (Sigma), і TCA (Fluka, SigmaAldrich, Germany), відповідно. Планшети анаеробно інкубували (AnaeroGen, Oxoid, UK) протягом 48 годин при 37 °C. Преципітація, що є результатом декон'югації жовчної кислоти, була оцінена візуально, і, таким чином, суб'єктивно, звідси активність значиться як відсутність активності (-) або активність (+). Планшети з агаром MRS-Ц без додавання жовчної солі використовували як контроль росту й негативного контролю. Приклад 3 Відбір штамів з активністю BSH і здатністю одночасно знижувати рівні TNF- Штам L. reuteri ATCC PTA-4659 L. reuteri ATCC PTA-6475 L. reuteri ATCC 55730 L. reuteri ATCC PTA-4965 20 Ріст + + + + + + + + + + + + + + + + + + + + + + Зниження TNF-α ++ ++ -- Активність BSH ++ ++ +-+ Відбір S S Дані таблиці вище підтверджують несподівані дані, що різні штами L. reuteri мають різні впливи на продукування TNF- і BSH, і що штами L. reuteri ATCC PTA-4659 і L. reuteri ATCC PTA-6475 є особливо прийнятними для застосування при атеросклерозі. Приклад 4 Застосування кондиціонованого середовища Застосовуючи спосіб прикладу 1, було відібране кондиціоноване середовище від одного штаму, що ефективно знижує TNF-, у даному прикладі середовище від L. reuteri ATCC PTA4659. Дане середовище одержували в більших об'ємах за допомогою вирощування штаму в середовищі de Man, Rogosa, Sharpe (MRS) (Difco, Sparks, MD). Вирощені за ніч культури 10 UA 101316 C2 9 5 10 15 20 25 30 35 лактобацил розводили до OD600, що дорівнює 1,0 (що відповідає приблизно 10 клітин/мл) і додатково розводили 1:10 і вирощували протягом додаткових 24 год. Бактеріальне безклітинне кондиціоноване середовище збирали за допомогою центрифугування при 8500 об./хв. протягом 10 хв. при 4C. Кондиціоноване середовище відокремлювали від клітинного осаду, а потім фільтрували через фільтрувальну установку з порами 0,22 мкм (Millipore, Bedford, Mass.). Потім кондиціоноване середовище ліофілізували й обробляли, з використанням стандартних способів, щоб одержати таблетку. Дану таблетку застосовували як лікарський препарат у людей для ефективного лікування атеросклерозу. Приклад 5 Застосування відібраних протизапальних штамів Lactobacillus reuteri Застосовуючи способи із прикладу 1 і 2, був відібраний один штам, що ефективно знижує TNF- і в той же час підвищує активність BSH, у даному експерименті L. reuteri ATCC PTA-4659. Штам L. reuteri потім ліофілізували й обробляли, з використанням стандартних способів, щоб 5 9 одержати капсулу, у діапазоні, що дорівнює 10 -10 КУО. Дану капсулу застосовували як лікарський препарат у людей для ефективного зменшення виразності атеросклерозу. Приклад 6 Lactobacillus reuteri, що зменшують бляшки сонної артерії при атеросклерозі Усього 1059 пацієнтів було піддано достовірним ультразвуковим дослідженням на вихідному дослідженні з повторенням через один рік. На вихідному дослідженні й надалі застосовувалися та сама ультразвукова система візуалізації зображень і датчик (Acuson Xp10 128, ART, що пройшов апгрейд, з 7, 5-MГц ультразвуковим датчиком для лінійного сканування, розмір апертури 38 мм, SIEMENS). Параметри регулювання зображення в режимі В попередньо встановлюють для фіксованих значень і не змінюють у ході проведення кожного обстеження. В обстежуваного в положенні лежачи на спині, з головою, поверненою трохи вліво, сканували праву сонну артерію під декількома різними кутами опромінення як уздовж, так і поперек, від безпосередньо над ключицею до як можливо дистальніше до біфуркації. Бляшку визначали як локальне випинання стінки судини в порожнину, що дорівнює, щонайменше, 50 %, у порівнянні з товщиною прилеглих інтими-медії (IMT). У кожного обстежуваного індивіда реєстрували максимальну з 6 бляшок у ближній і далекій стінках загальної сонної артерії, біфуркації й внутрішній сонній артерії, відповідно. Для кожної бляшки датчиком записували нерухливе зображення паралельно стінці судини й найбільш перпендикулярно до точки максимальної товщини бляшки з обраною установкою області розширення до 38 мм 20 мм. Всі реєстраційні записи зроблені на відеоплеєрі Panasonic 7650 високоякісним відеозаписом системи VHS. На вихідному дослідженні 1059 чоловік мають наявність бляшок (таблиця 1). Площа бляшок сонної артерії знижувалася в будь-якому віці. Середня загальна площа бляшок (SE) на 2 вихідному дослідженні становить 24,1 мм . У наступному періоді після споживання щоденної 8 дози L. Reuteri ATCC PTA-4659 (10 КУО), всі пацієнти мають зниження загальної площі бляшок. 2 Середнє зниження становить 9,0 мм . Вік N 70 SE 352 291 289 127 Площа бляшок при вихідному 2 дослідженні мм 18,9 24,2 27,2 27,2 24,1 Зміна площі бляшок 2 мм 6,4 9,4 9,7 11,5 9,0 40 Незважаючи на те, що винахід був описаний з посиланням на конкретні варіанти здійснення, повинно бути зрозуміло, можливі багато які варіанти, модифікації й варіанти здійснення, і, відповідно, всі такі варіанти, модифікації й варіанти здійснення повинні розглядатися в межах сутності й об'єму правових домагань винаходу. 45 ФОРМУЛА ВИНАХОДУ 50 1. Спосіб відбирання штаму молочнокислих бактерій для профілактики і/або лікування атеросклерозу у ссавців, що включає: a) відбирання і культивування клітин штаму молочнокислих бактерій; b) оцінка рівня здатності штаму до зниження TNF-альфа; с) вимірювання внутрішньоклітинної BSH активності штаму; d) відбирання штаму Lactobacillus, здатного: 11 UA 101316 C2 5 10 15 і) збільшувати BSH активність і, отже, знижувати холестерин-ЛПНЩ сироватки, і іі) одночасно зменшувати рівні прозапального цитокіну TNF-альфа. 2. Безклітинний культуральний супернатант, виділений зі штаму Lactobacillus, відібраного за допомогою способу за п. 1, для застосування у профілактиці і/або лікуванні атеросклерозу. 3. Клітини штаму Lactobacillus, відібрані способом за п. 1, для застосування у профілактиці і/або лікуванні атеросклерозу. 4. Застосування композиції, що містить клітини штаму молочнокислих бактерій, отримані за допомогою способу за п. 1, для одержання лікарського засобу, що використовується у профілактиці і/або лікуванні атеросклерозу. 5. Композиція, що містить клітини штаму Lactobacillus, відібраного за допомогою способу за п. 1, для застосування у профілактиці і/або лікуванні атеросклерозу. 6. Композиція за п. 5, що додатково містить фармацевтичний носій. 7. Композиція за п. 5, що являє собою харчову композицію, яка додатково містить основу, прийнятну для прийому всередину. 8. Композиція за п. 5, що являє собою харчову добавку, яка додатково містить основу, прийнятну для прийому всередину. 9. Композиція за п. 5, де штам Lactobacillus вибраний з групи, яка складається з Lactobacillus reuteri ATCC PTA 4659 і Lactobacillus reuteri ATCC PTA 6475. Комп’ютерна верстка С. Чулій Державна служба інтелектуальної власності України, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601 12
ДивитисяДодаткова інформація
Назва патенту англійськоюNormal;heading 1;heading 2;heading 3;use of selected lactic acid bacteria for reducing atherosclerosis
Автори англійськоюRothschild, Peter, Connolly, Eamonn, Mollstam, Bo
Назва патенту російськоюПрименение отобранных молочнокислых бактерий для профилактики и лечения атеросклероза
Автори російськоюРотшильд Петер, Коннолли Эамонн, Мелльстам Бо
МПК / Мітки
МПК: C12R 1/225, A61P 9/10, A23K 1/00, A61K 35/74, A23L 1/30, C12N 1/20
Мітки: атеросклерозу, застосування, профілактики, лікування, відібраних, молочнокислих, бактерій
Код посилання
<a href="https://ua.patents.su/14-101316-zastosuvannya-vidibranikh-molochnokislikh-bakterijj-dlya-profilaktiki-ta-likuvannya-aterosklerozu.html" target="_blank" rel="follow" title="База патентів України">Застосування відібраних молочнокислих бактерій для профілактики та лікування атеросклерозу</a>
Попередній патент: Сполуки піридо[2,3-d]піримідин-7-ону як інгібітори pi3k-альфа для лікування раку
Наступний патент: Сполуки-антагоністи рнк для модуляції активності бета-катеніну
Випадковий патент: Пристрій для лікувальної гімнастики дітей з церебральним паралічем