Похідні бензімідазолу, композиція, що їх містить, їх одержання та застосування
Номер патенту: 87327
Опубліковано: 10.07.2009
Автори: Трамбле Максім, Волпоул Крістофер, Лю Зіпінґ, Пеідж Деніел, Янґ Хуа
Формула / Реферат
1. Сполука формули І, її фармацевтично прийнятні солі, діастереомери, енантіомери, або їх суміші:
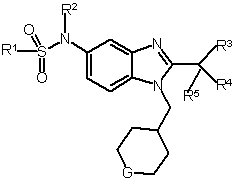 , (I)
, (I)
де
G вибрано з групи: -О- та -CF2-;
R1 вибрано з групи: С1-6алкіл та С3-6циклоалкіл;
R2 вибрано з групи: -Н та метил; та
R3, R4 та R5 незалежно вибрані з групи: флуор та метил.
2. Сполука за п. 1, де
R1 вибрано з групи: С1-4алкіл та С3-4циклоалкіл.
3. Сполука за п. 1,
де G- -O-;
R1 вибрано з групи: етил, пропіл та циклопропіл; а
R3, R4 та R5 незалежно вибрані з групи: флуор та метил з R3, R4 та R5, що є однаковими.
4. Сполука за п. 1,
де G - -CF2-;
R1 вибрано з групи: етил, пропіл та циклопропіл; а
R3, R4 та R5 незалежно вибрані з групи: флуор та метил з R3, R4 та R5, що є однаковими.
5. Сполука, вибрана з групи:
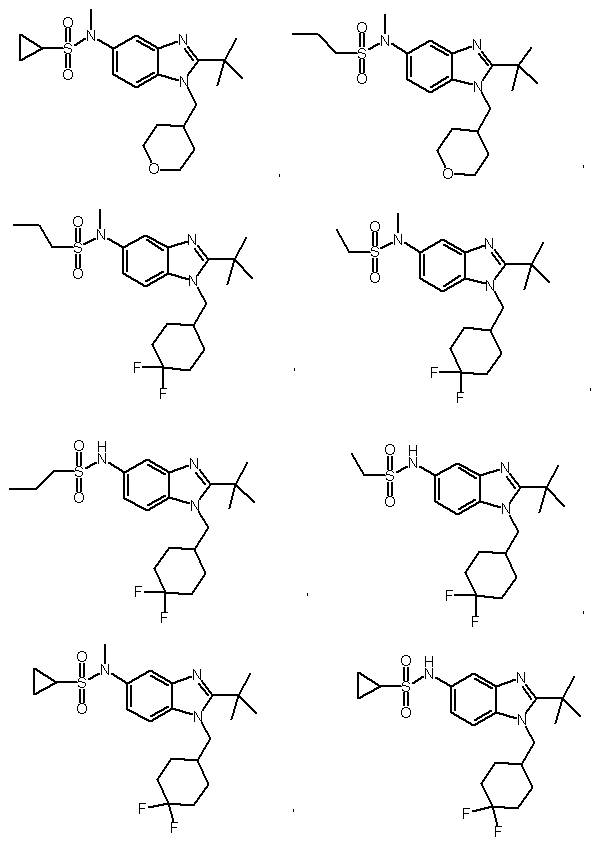
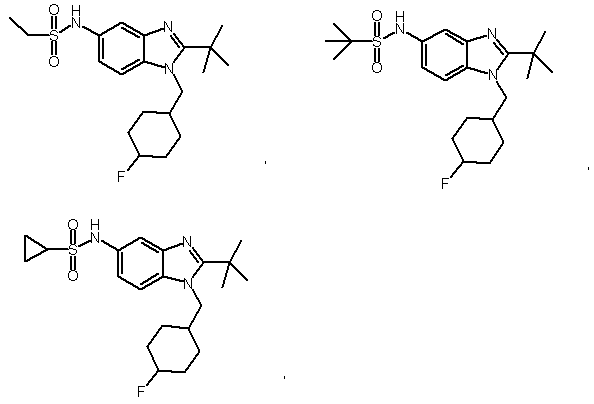
або її фармацевтично прийнятні солі.
6. Сполука формули І, її фармацевтично прийнятні солі, діастереомери, енантіомери або їх суміші:
 , (I)
, (I)
де
G вибрано з групи: -O-, -CHF- та -CF2-;
R1 вибрано з групи: С1-6алкіл та С3-6циклоалкіл;
R2 вибрано з групи: -Н та метил; а
R3, R4 та R5 незалежно вибрані з групи: флуор та метил.
7. Сполука за п. 6, де G вибрано з групи: -CHF- та -CF2-.
8. Сполука за п. 6, де R1 вибрано з групи: етил, пропіл, т-бутил та циклопропіл.
9. Сполука за будь-яким з пп. 1-8 для застосування як медикаменту.
10. Застосування сполуки за будь-яким з пп. 1-8 у виробництві медикаменту для терапії болю.
11. Застосування сполуки за будь-яким з пп. 1-8 у виробництві медикаменту для лікування розладів з компонентом тривоги.
12. Застосування сполуки за будь-яким з пп. 1-8 у виробництві медикаменту для лікування раку, розсіяного склерозу, хвороби Паркінсона, хореї Хантингтона, хвороби Альцгеймера, шлунково-кишкових розладів та серцево-судинних розладів.
13. Фармацевтична композиція, яка містить сполуку за будь-яким з пп. 1-8 та фармацевтично прийнятний носій.
14. Спосіб лікування болю у теплокровної тварини, в якому застосовують до вказаної тварини, яка потребує такого лікування, терапевтично ефективну кількість сполуки за будь-яким з пп.1-8.
15. Спосіб отримання сполуки формули І
 , (I)
, (I)
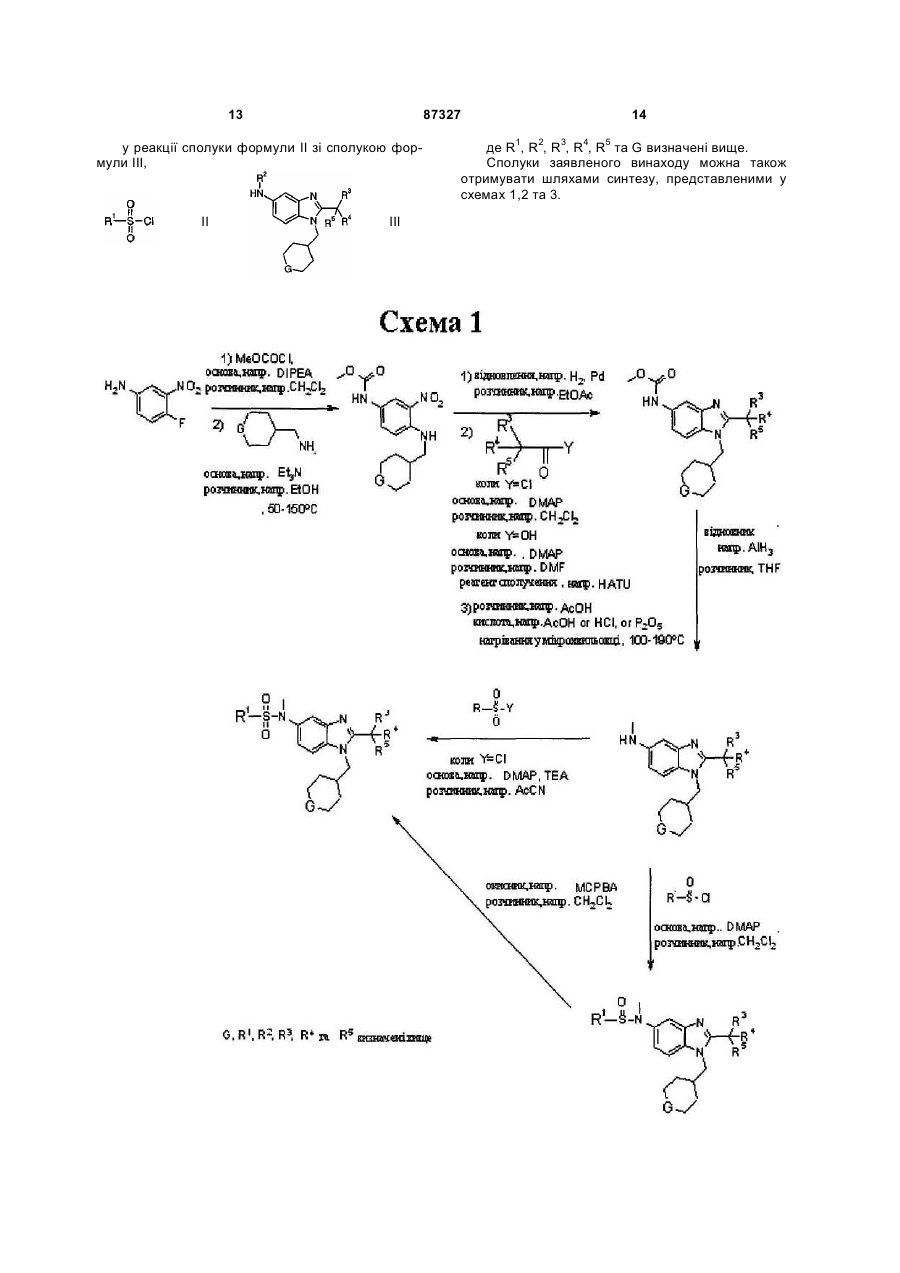
в якому піддають реакції сполуки формули II зі сполукою формули III
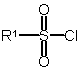 , (II)
, (II) 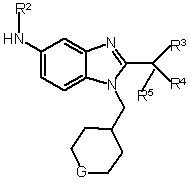 , (ІІI)
, (ІІI)
де G вибрано з групи: -O-, -CHF- та -CF2-;
R1 вибрано з групи: С1-6алкіл та С3-6циклоалкіл;
R2 вибрано з групи: -Н та метил; а
R3, R4 та R5 незалежно вибрані з групи: флуор та метил.
16. Сполуки, вибрані з групи, що охоплює:
N-(4-{[(4,4-дифлуорциклогексил)метил]аміно}-3-нітрофеніл)етансульфенамід,
N-(3-аміно-4-{[(4,4-дифлуорциклогексил)метил]аміно}феніл)етансульфенамід та
N-{2-{[(4,4-дифлуорциклогексил)метил]аміно}-5[(етилсульфоніл)аміно]феніл}-2,2-диметилпропанамід
17. Застосування сполук за п. 16 як інтермедіатів в отриманні сполук формули І.
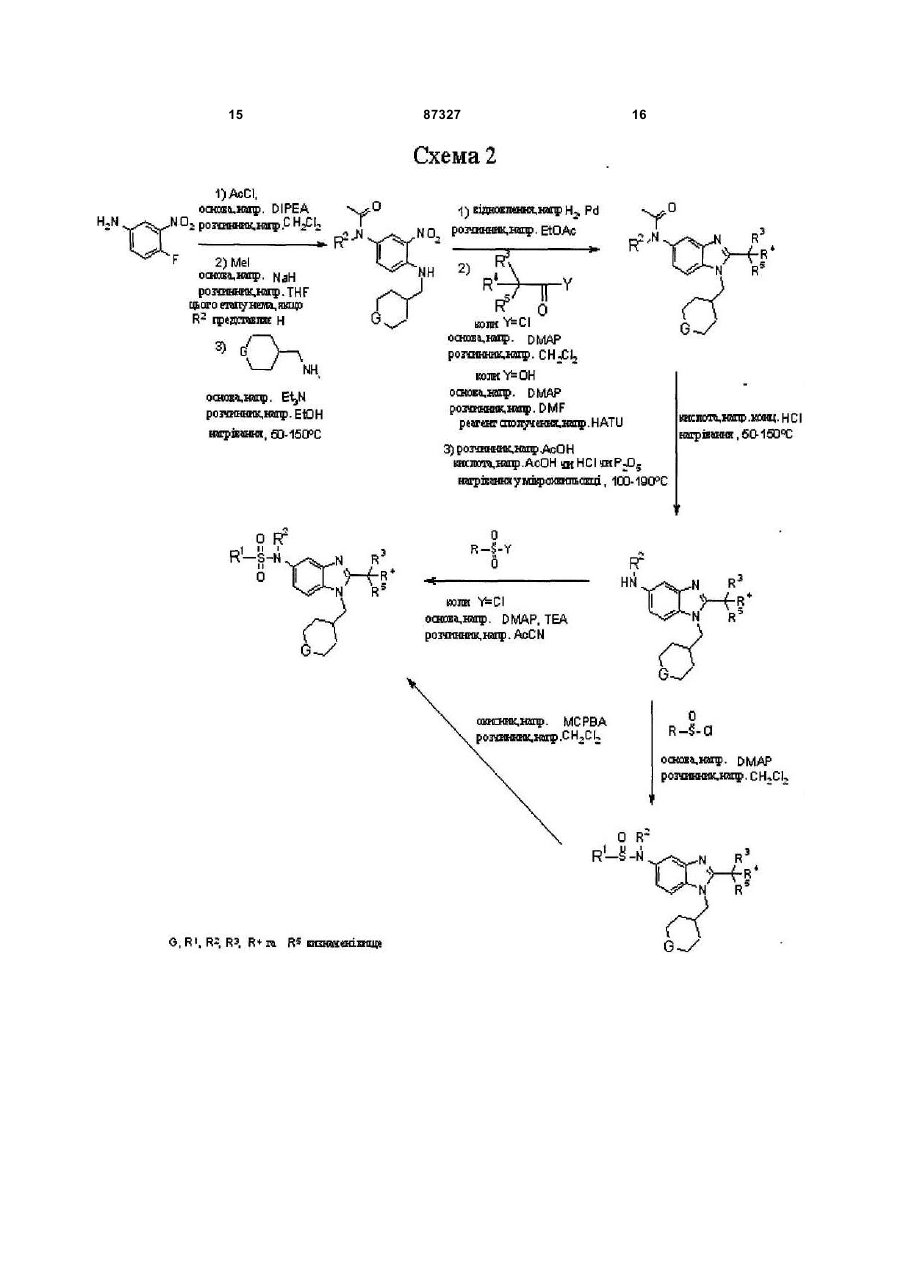
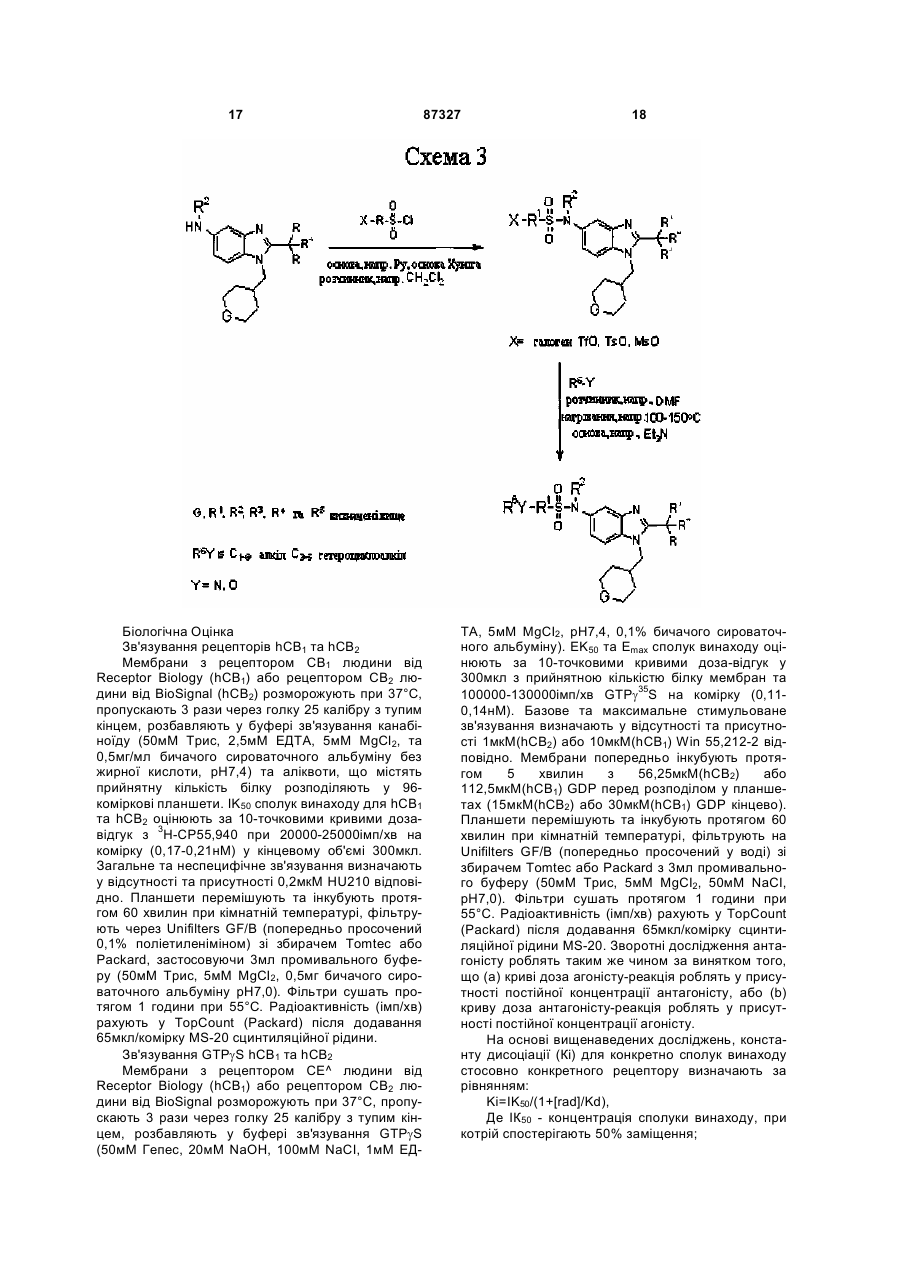
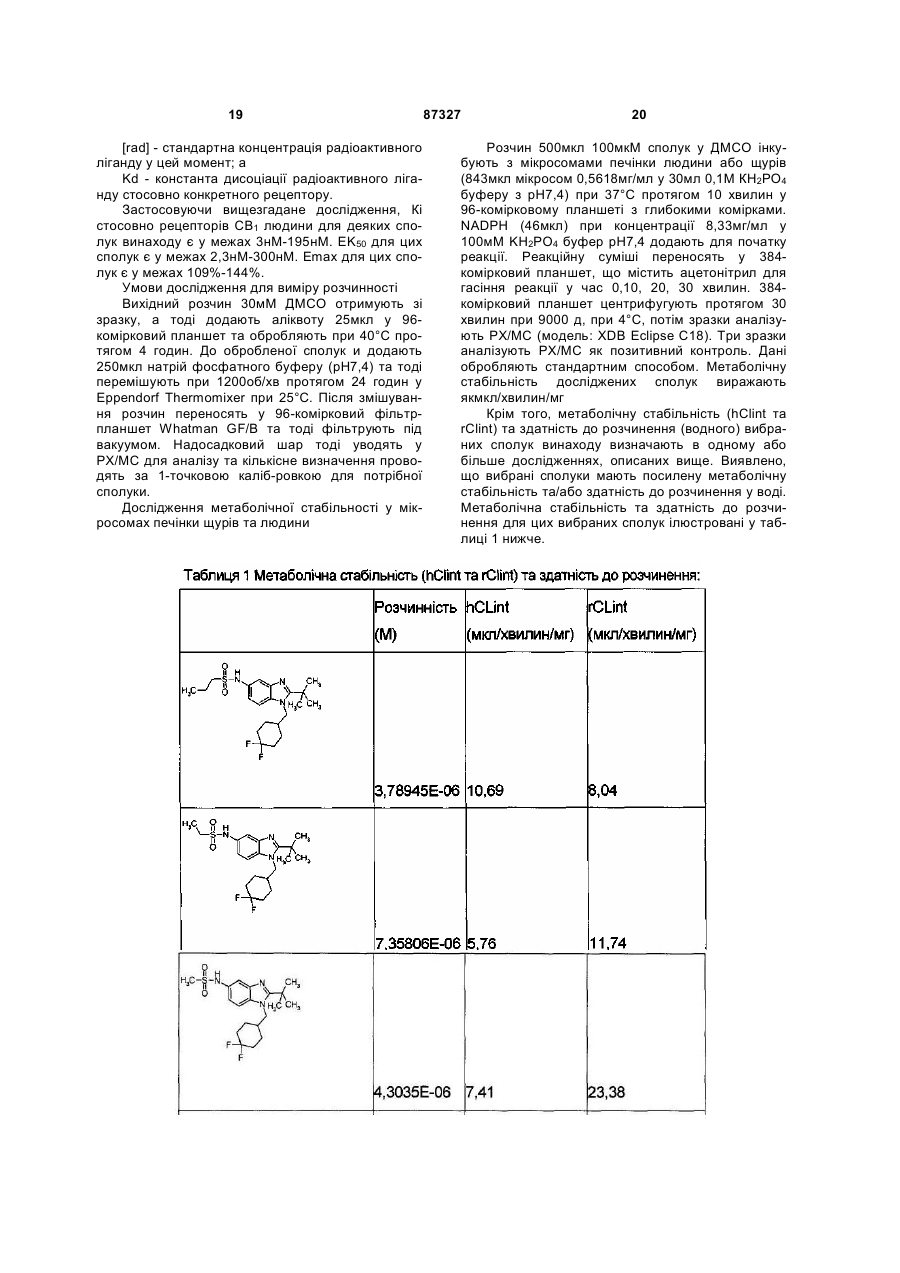
Текст
1. Сполука формули І, її фармацевтично прийнятні солі, діастереомери, енантіомери, або їх суміші: R3, R4 та R5 незалежно вибрані з групи: флуор та метил. 2. Сполука за п. 1, де R1 вибрано з групи: С1-4алкіл та С3-4циклоалкіл. 3. Сполука за п. 1, де G- -O-; R1 вибрано з групи: етил, пропіл та циклопропіл; а R3, R4 та R5 незалежно вибрані з групи: флуор та метил з R3, R4 та R5, що є однаковими. 4. Сполука за п. 1, де G - -CF2-; R1 вибрано з групи: етил, пропіл та циклопропіл; а R3, R4 та R5 незалежно вибрані з групи: флуор та метил з R3, R4 та R5, що є однаковими. 5. Сполука, вибрана з групи: UA (21) a200702212 (22) 22.09.2005 (24) 10.07.2009 (86) PCT/SE2005/001403, 22.09.2005 (31) 60/640,306 (32) 30.12.2004 (33) US (31) PCT/GB2004/004124 (32) 24.09.2004 (33) US (46) 10.07.2009, Бюл.№ 13, 2009 р. (72) ПЕІДЖ ДЕНІЕЛ, CA, ЛЮ ЗІПІНҐ, CA, ТРАМБЛЕ МАКСІМ, CA, ВОЛПОУЛ КРІСТОФЕР, CA, ЯНҐ ХУА, CA (73) АСТРАЗЕНЕКА АБ, SE (56) WO 2004/035548 A1; 29.04.2004 WO 01/51473 A1; 19.07.2001 JP 2007-284446; 01.11.2007 WO 2005/058870 A1; 30.01.2005 2 F F , (19) 1 3 O S 87327 N O O H N S N N N O N , F F F F O H N S N O H N S O N O N N , F 4 12. Застосування сполуки за будь-яким з пп. 1-8 у виробництві медикаменту для лікування раку, розсіяного склерозу, хвороби Паркінсона, хореї Хантингтона, хвороби Альцгеймера, шлунковокишкових розладів та серцево-судинних розладів. 13. Фармацевтична композиція, яка містить сполуку за будь-яким з пп. 1-8 та фармацевтично прийнятний носій. 14. Спосіб лікування болю у теплокровної тварини, в якому застосовують до вказаної тварини, яка потребує такого лікування, терапевтично ефективну кількість сполуки за будь-яким з пп.1-8. 15. Спосіб отримання сполуки формули І R2 F O O H N S R1 N O S N O N , F або її фармацевтично прийнятні солі. 6. Сполука формули І, її фармацевтично прийнятні солі, діастереомери, енантіомери або їх суміші: N R1 S R3 R5 R2 HN N N R3 N O R4 R5 R4 G , (I) в якому піддають реакції сполуки формули II зі сполукою формули III R2 O N N N R3 R5 R4 O R1 S Cl O G , (I) де G вибрано з групи: -O-, -CHF- та -CF2-; R1 вибрано з групи: С1-6алкіл та С3-6циклоалкіл; R2 вибрано з групи: -Н та метил; а R3, R4 та R5 незалежно вибрані з групи: флуор та метил. 7. Сполука за п. 6, де G вибрано з групи: -CHF- та CF2-. 8. Сполука за п. 6, де R1 вибрано з групи: етил, пропіл, т-бутил та циклопропіл. 9. Сполука за будь-яким з пп. 1-8 для застосування як медикаменту. 10. Застосування сполуки за будь-яким з пп. 1-8 у виробництві медикаменту для терапії болю. 11. Застосування сполуки за будь-яким з пп. 1-8 у виробництві медикаменту для лікування розладів з компонентом тривоги. Винахід стосується терапевтичних сполук, фармацевтичних композицій, що містять ці сполуки, способів їх вироблення та застосування. Зокрема, заявлений винахід стосується сполук, що можуть бути ефективними у лікуванні болю, раку, розсіяного склерозу, хвороби Паркінсона, хореї Хантингтона, хвороби Альцгеймера, розладів з компонентом тривоги, шлунково-кишкових розладів та/або серцево-судинних розладів. Лікування болю досліджено протягом багатьох років. Відомо, що ліганди канабіноїдних рецепторів (наприклад, рецептору СВ1, рецептору СВ2), охоп G , (ІІI) , (II) де G вибрано з групи: -O-, -CHF- та -CF2-; R1 вибрано з групи: С1-6алкіл та С3-6циклоалкіл; R2 вибрано з групи: -Н та метил; а R3, R4 та R5 незалежно вибрані з групи: флуор та метил. 16. Сполуки, вибрані з групи, що охоплює: N-(4-{[(4,4-дифлуорциклогексил)метил]аміно}-3нітрофеніл)етансульфенамід, N-(3-аміно-4-{[(4,4дифлуорциклогексил)метил]аміно}феніл)етансульфенамід та N-{2-{[(4,4-дифлуорциклогексил)метил]аміно}5[(етилсульфоніл)аміно]феніл}-2,2диметилпропанамід 17. Застосування сполук за п. 16 як інтермедіатів в отриманні сполук формули І. люючи агоністи, антагоністи та зворотні агоністи дають полегшення болю у різних тваринних моделях взаємодією з рецепторами СВ1 та/або СВ2. Загалом, рецептори СВ1 локалізовані переважно у центральній нервовій системі, а рецептори СВ2 локалізовані головним чином на периферії та головним чином обмежені клітинами та тканинами, похідними від імунної системи. Тоді як агоністи рецепторів СВ1, як-то Δ9тетрагідроканабінол (Δ9-ТНС) та анадамід, є корисними в анти-ноцицепційних моделях у тварин, вони мають тенденцію до небажаної дії на 5 87327 центральну нервову систему, наприклад, психоактивної побічної дії, потенції до зловживання, залежності та звички до ліків, тощо. Ці небажані види побічної дії є відомими як опосередковані рецепторами СВ1, локалізованими у центральній нервовій системі. Є ряд свідоцтв, однак, що свідчать, що СВ1 агоністи, діючи на периферійних ділянках або з обмеженою дією у центральній нервовій системі, можуть долати біль у людей або тварин з дуже посиленим загальним профілем in vivo. Тому, є необхідність у нових лігандах рецепторів СВ1 як-то агоністи, що можуть бути корисними у подоланні болю або лікуванні інших пов'язаних симптомів або хвороб зі зниженою або мінімальною небажаною дією на центральну нервову систему. Заявлений винахід стосується лігандів рецепторів СВ1, котрі можуть бути корисними у лікуванні болю та/або інших пов'язаних симптомів або хвороб. Термін «Cm-n» або «Сm-n-груп», застосовуваний поодинці або як префікс, стосується будь-якої групи, що має m-η атомів карбону. Термін "алкіл", застосовуваний поодинці або як суфікс чи префікс, стосується насиченого одновалентного вуглеводневого радикалу з лінійним або розгалуженим ланцюгом, як містить 1-12 атомів карбону. Ілюстративні приклади алкілів охоплюють, але без обмеження, С1-4алкіли, як-то метил, етил, пропіл, ізопропіл, 2-метил-1-пропіл, 2метил-2-пропіл, бутил, ізобутил, т-бутил. Термін "циклоалкіл", застосовуваний поодинці або як суфікс чи префікс, стосується насиченого одновалентного кільцевмісного вуглеводневого радикалу, як містить принаймні 3-12 атомів карбону. Приклади циклоалкілів охоплюють, але без обмеження, С3-7циклоалкіли, як-то циклопропіл, циклобутил, циклопентил, циклогексил, та циклогептил, та насичені циклічні та біциклічні терпени. Циклоалкіл може бути незаміщеним або заміщеним одним або двома придатними замісниками. Переважно, циклоалкіл має моноциклічне кільце або біциклічне кільце. Термін "алкокси", застосовуваний поодинці або як суфікс чи префікс, стосується радикалів загальної формули-O-R, де R-алкіл. Зразкові алкоксили охоплюють метоксил, етоксил, пропоксил, ізопропоксил, бутоксил, т-бутоксил, та ізобутоксил. Галоген охоплює флуор, хлор, бром та йод. З одного боку втілення винаходу стосується сполуки формули І, її фармацевтично прийнятних солей, діастереомерів, енантіомерів, або їх сумішей: I де G вибрано з групи: -О-,-CHF- та -CF2-; R1 вибрано з групи: С1-6алкіл та С3-6циклоалкіл; R2 вибрано з групи: -Н та метил; та R3, R4 та R5 незалежно вибрані з групи: флуор та метил. 6 У ще одному втіленні сполуки можуть мати формулу І, де G вибрано з групи: -О- та -CF2-; R1 вибрано з групи: С1-6алкіл та С3-6циклоалкіл; R2 вибрано з групи: -Н та метил; а R3, R4 та R5 незалежно вибрані з групи: флуор та метил. Ще одне втілення винаходу стосується сполук формули І, де G вибрано з групи: -О- та -CF2-; R1 вибрано з групи: С1-4алкіл та С3-4циклоапкіл; R2 вибрано з групи: -Н та метил; а R3, R4 та R5 незалежно вибрані з групи: флуор та метил. Наступне втілення винаходу стосується сполук формули І, де G - -O-; R1 вибрано з групи: етил, пропіл та циклопропіл; R2 вибрано з групи: -Н та метил; та R3, R4 та R5 незалежно вибрані з групи: флуор та метил з R3, R4 та R5, що є однаковими. Ще одне втілення винаходу стосується сполук формули І, де G - -CF2-; R1 вибрано з групи: етил, пропіл та циклопропіл; R2 вибрано з групи: -Н та метил; та R3, R4 та R5 незалежно вибрані з групи: флуор та метил з R3, R4 та R5, що є однаковими. Ще одне втілення винаходу стосується сполук формули І, де G - -CHF-; R1 вибрано з групи: етил, пропіл, т-бутил та циклопропіл; R2 вибрано з групи: -Н та метил; а R3, R4 та R5 незалежно вибрані з групи: флуор та метил з R3, R4 та R5, що є однаковими. У ще одному втіленні R1 формули І вибрано з групи: етил, пропіл, т-бутил та циклопропіл. У ще одному втіленні G формули І - -CHF- або -CF2-. У ще одному втіленні R3, R4 та R5 формули І вибрані з групи: флуор та метил з R3, R4 та R5, що є однаковими. У ще одному втіленні сполуку винаходу можна вибрати з групи: N-[2-трет-Бутил-1-(тетрагідро-2Н-піран-4ілметил)-1Н-бензимідазол-5-іл]-Nметилциклопропансульфонамід; N-[2-трет-Бутил-1-(тетрагідро-2Н-піран-4ілметил)-1Н-бензимідазол-5-іл]-N-метилпропан-1сульфонамід; N-[2-трет-Бутил-1-(тетрагідро-2Н-піран-4ілметил)-1Н-бензимідазол-5-іл]-N-метилбутан-1сульфонамід; N-{2-трет-Бутил-1-[(4,4дифлуорциклогексил)метил]-1Н-бензимідазол-5іл}-N-метилбутан-1-сульфонамід; N-метил-N-[1-(тетрагідро-2Н-піран-4-ілметил)2-(трифлуорметил)-1Н-бензимідазол-5-іл]пропан1-сульфонамід; N-метил-N-[1-(тетрагідро-2Н-піран-4-ілметил)2-(трифлуорметил)-1Н-бензимідазол-5іл]циклопропансульфонамід; 7 N-[2-трет-Бутил-1-(тетрагідро-2Н-піран-4ілметил)-1Н-бензимідазол-5-іл]-N-метилпентан-1сульфонамід; N-[2-трет-Бутил-1-(тетрагідро-2Н-піран-4ілметил)-1Н-бензимідазол-5-іл]-Nметилетансульфонамід; N-[2-трет-Бутил-1-(тетрагідро-2Н-піран-4ілметил)-1Н-бензимідазол-5-іл]-N,2диметилпропан-2-сульфонамід; N-{2-трет-Бутил-1-[(4,4дифлуорциклогексил)метил]-1Н-бензимідазол-5іл}-N-метилпропан-1-сульфонамід; N-{2-трет-Бутил-1-[(4,4дифлуорциклогексил)метил]-1Н-бензимідазол-5іл}-N-метилетансульфонамід; N-{2-трет-Бутил-1-[(4,4дифлуорциклогексил)метил]-1Н-бензимідазол-5іл}пропан-1-сульфонамід; N-{2-трет-Бутил-1-[(4,4дифлуорциклогексил)метил]-1Н-бензимідазол-5іл}метансульфонамід; N-{2-трет-Бутил-1-[(4,4дифлуорциклогексил)метил]-1Н-бензимідазол-5іл}етансульфонамід; N-{2-трет-Бутил-1-[(4,4дифлуорциклогексил)метил]-1Н-бензимідазол-5іл}циклопропансульфонамід; N-{2-трет-Бутил-1-[(4,4дифлуорциклогексил)метил]-1Н-бензимідазол-5іл}-N-метилциклопропансульфонамід; N-{2-трет-Бутил-1-[(4,4дифлуорциклогексил)метил]-1Н-бензимідазол-5іл}-2-метилпропан-2-сульфонамід; N-[1-[(4,4-Дифлуорциклогексил)метил]-2-(1,1дифлуоретил)-1Н-бензимідазол-5іл]циклопропансульфонамід; N-[1-[(4,4-Дифлуорциклогексил)метил]-2-(1,1дифлуоретил)-1Н-бензимідазол-5іл]етансульфонамід; N-[1-[(4,4-Дифлуорциклогексил)метил]-2-(1,1дифлуоретил)-1Н-бензимідазол-5-іл]-2метилпропан-2-сульфонамід; Ν-[2-(1,1-дифлуоретил)-1-(тетрагідро-2Нпіран-4-ілметил)-1Н-бензимідазол-5-іл]-Nметилетансульфонамід; Ν-[2-(1,1-дифлуоретил)-1-(тетрагідро-2Нпіран-4-ілметил)-1Н-бензимідазол-5-іл]-N-метил пропан-1-сульфонамід; Ν-[2-(1,1-дифлуоретил)-1-(тетрагідро-2Нпіран-4-ілметил)-1Н-бензимідазол-5-іл]-Nметилциклопропансульфонамід; N-{2-трет-Бутил-1-[(4флуорциклогексил)метил]-1Н-бензимідазол-5іл}етансульфонамід; N-{2-трет-Бутил-1-[(4флуорциклогексил)метил]-1Н-бензимідазол-5іл}циклопропансульфонамід; N-{2-трет-Бутил-1-[(4флуорциклогексил)метил]-1Н-бензимідазол-5-іл}2-метилпропан-2-сульфонамід; та її фармацевтично прийнятні солі. Наступне втілення винаходу стосується сполук, вибраних з групи: 87327 8 O N S O N O S O O S N N O N N , N O N O S N N O N N , F F F N O H N S N N O O N , F F F S , F O H N S O , O , F N O O H N S N N N O N , F F F O H N S F N N O O H N S O N N , F F O H N S N O N , F та їх фармацевтично прийнятних солей. Треба розуміти, що коли сполуки заявленого винаходу містять один або більше хіральних центрів, сполуки винаходу можуть існувати та бути виділеними як енантіомерні або діастереомерні форми, або як рацемічні суміші. Заявлений винахід стосується будь-яких можливих енантіомерів, діастереомерів, рацематів сполук формули І або їх сумішей. Оптично активні форми сполуки винаходу можна отримувати, наприклад, хіральним хроматографічним розділенням рацемату, синтезом з оптично активних вихідних матеріалів або асиметричним синтезом на основі способів, описаних нижче. Також ясно, що деякі сполуки заявленого винаходу можуть існувати як геометричні ізомери, наприклад Ε та Ζ ізомери алкенів. Заявлений винахід стосується будь-якого геометричного ізомеру сполуки формули І. Треба розуміти крім того, що заявлений винахід стосується таутомерів сполук формули І. 9 Треба також розуміти, що деякі сполуки заявленого винаходу можуть існувати, у наприклад, гідратованих та також несольватованих формах. Треба розуміти крім того, що заявлений винахід стосується усіх таких сольватованих форм сполук формули І. У рамках винаходу є також солі сполук формули І. Загалом, фармацевтично прийнятні солі сполук заявленого винаходу можна отримати стандартними способами, добре відомими у рівні техніки, наприклад реакцією достатньо основної сполуки, наприклад алкіламіну, з придатною кислотою, наприклад, НСІ або оцтовою кислотою, для отримання фізіологічно прийнятного аніону. Може також бути можливим створення солі відповідного лужного металу (як-то натрію, калію, або літію) або лужноземельного металу (як-то кальцій) обробкою сполуки заявленого винаходу, що має належно кислотний протон, як-то карбонова кислота або фенол одним еквівалентом гідроксиду або алкоксиду (як-то етоксид або метоксид) лужного металу або лужноземельного металу, або належно основний органічний амін (як-то холін або меглумін) у водному середовищі, а потім звичайними способами очистки. У наступному втіленні сполуку формули І вище можна перетворити у фармацевтично прийнятну сіль або сольват, зокрема, кислотно-адитивну сіль як-то гідрохлорид, гідробромід, фосфат, ацетат, фумарат, малеат, тартрат, цитрат, метансульфонат або п-толуолсульфонат. Ми виявили, що сполуки винаходу мають активність як фармацевтичні, зокрема як модулятори або ліганди, як-то агоністи, часткові агоністи, зворотні агоністи або антагоністи рецепторів СВ1. Більш конкретно, сполуки винаходу виявляють селективну активність як агоністи рецептору СВ1 та є корисними у терапії, особливо для полегшення різних больових станів як-то хронічний біль, невропатичний біль, гострий біль, біль при раку, біль, викликаний ревматоїдним артритом, мігрень, вісцеральний біль тощо. Цей перелік однак не слід інтерпретувати як вичерпний. Крім того, сполуки заявленого винаходу є корисними в інших хворобливих станах, у котрих дисфункція рецепторів СВ1 наявна чи мається на увазі. Більш того, сполуки винаходу можна застосовувати для лікування раку, розсіяного склерозу, хвороби Паркінсона, хореї Хантингтона, хвороби Альцгеймера, розладів з компонентом тривоги, шлунково-кишкових розладів та серцево-судинних розладів. Сполуки винаходу є корисними як імуномодулятори, особливо для автоімунних хвороб, як-то артрит, для пересадки шкіри, трансплантатів органів та подібних хірургічних потреб, для колагенових хвороби, різних алергій, для застосування як протипухлинних агентів та антивірусних агентів. Сполуки винаходу є корисними у хворобливих станах, де дегенерація або дисфункція канабіноїдних рецепторів наявна чи мається на увазі. Це може охоплювати застосування мічених ізотопами сполук винаходу у діагностичних способах та для відображення, як-то позитронною емісійною томографією (PET). 87327 10 Сполуки винаходу є корисними для лікування діареї, депресії, тривоги та пов'язаних зі стресом розладів, як-то пов'язаних з пост-травматичним стресом розладів, розладів панічного типу, генералізованого розладу з компонентом тривоги, соціальної фобії та обсесивно-компульсивного розладу, нетримання сечі, передчасної еяколяції, різних психічних захворювань, кашлю, набряку легень, різних шлунково-кишкових розладів, наприклад, запору, функціональних шлунковокишкових розладів, як-то синдром подразненого кишечнику та функціональна диспепсія, хвороби Паркінсона та інших моторних розладів, травматичних пошкоджень мозку, інсульту, кардіозахисту після інфаркту міокарду, пошкодження спинного мозку та залежності від ліків, охоплюючи лікування зловживання спиртом, нікотином, опіоїдами та іншими ліками та розладів симпатичної нервової системи наприклад гіпертензії. Сполуки винаходу є корисними як аналгетики для застосування при загальній анестезії та контролі анестезії. Комбінації агентів з відмінними властивості часто, застосовують для досягнення балансу дії, необхідної для підтримування анестезованого стану (наприклад, амнезія, аналгезія, релаксація та заспокоєння м'язів). Охопленими у цій комбінації є інгаляційні анестезувальні засоби, снодійні, анксіолітики, нейром'язові блокатори та опіоїди. Також у рамках винаходу є застосування будьякої вищенаведеної сполуки формули І, для виробництв медикаменту для лікування будь-якого зі станів, обговорених вище. Наступним аспектом винаходу є спосіб лікування особи, яка потерпає від будь-якого зі станів, обговорених вище, згідно з яким ефективну кількість сполуки формули І вище, застосовують до пацієнта при потребі такого лікування. Таким чином, винахід стосується сполуки формули І або її фармацевтично прийнятної солі або сольвату, що вищенаведено, для застосування у терапії. Згідно з наступним аспектом, заявлений винахід стосується застосування сполуки формули І або її фармацевтично прийнятної солі або сольвату, що вищенаведено, у виробництві медикаменту для застосування у терапії. У контексті представленого опису, термін «терапія» також стосується «профілактики» якщо не зазначене інше. Термін «терапевтичний» та «терапевтично» слід розуміти відповідно. Термін «терапія» у контексті заявленого винаходу крім того стосується застосування ефективної кількості сполуки заявленого винаходу, для полегшення вже існуючого хворобливого стану, гострого або хронічного чи повторюваного стану. Це визначення також стосується профілактичної терапії для попередження повторюваних станів та постійної терапії для хронічних розладів. Сполуки заявленого винаходу є корисними у терапії, особливо для терапії різних больових станів, охоплюючи, але без обмеження: гострий біль, хронічний біль, невропатичний біль, біль у спині, біль при раку та вісцеральний біль. 11 У застосуванні для терапії теплокровної тварин, як-то людини, сполуку винаходу можна застосовувати у формі звичайної фармацевтичної композиції будь-яким шляхом, у т.ч. перорально, внутрішньом'язово, підшкірно, місцево, інтраназально, інтраперитонеально, інтраторакально, внутрішньовенно, епідурально, інтратекально, трансдермально, інтрацеребровентрикулярно та ін'єкцією у суглоби. В одному втіленні винаходу, шлях застосування може бути пероральним, внутрішньовенним або внутрішньом'язовим. Дозування залежатиме від шляху застосування, суворості хвороби, віку та масу пацієнта та інших факторів, які звичайно розглядає лікар при визначенні індивідуального режиму та рівня дозування найприйнятного для конкретного пацієнта. Для отримання фармацевтичної композиції зі сполуки цього винаходу, інертні фармацевтично прийнятні носії можуть бути твердими та рідкими. Тверді форми препаратів охоплюють порошки, таблетки, дисперсивні гранули, капсули, облатки, та супозиторії. Твердий носій може бути одною або більш речовинами, котрі можуть також діяти як розріджувачі, ароматизатори, солюбілізатори, мастила, суспендувальні агенти, зв'язуючі, або засоби руйнування таблеток; ним може також бути інкапсулювальний матеріал. У порошках носі є мілко подрібненим твердим матеріалом у суміші з мілко подрібненою сполукою винаходу або активним компонентом. У таблетках активний компонент є змішаним з носі, що має потрібні зв'язувальні властивості у придатних пропорціях та компонують до бажаної форми та розміру. Для отримання композицій супозиторіїв, низько-плавкий віск, як-то суміш гліцеридів жирних кислот та масло какао є спершу плавлять та активний інгредієнт диспергують, наприклад, перемішуванням. Розплавлену гомогенну суміш тоді виливають у форми зручного розміру та дають охолонути та затвердіти. Придатними носіями є магній карбонат, магній стеарат, тальк, лактоза, цукор, пектин, декстрин, крохмаль, камедь трагаканту, метилцелюлоза, натрій карбоксиметилцелюлоза, низько-плавкий віск, масло какао, тощо. Термін композиція також означає композицію активного компоненту з інкапсулювальним матеріалом як носієм, забезпечуючи капсул, у котрій активний компонент (з іншими носіями або без них) оточено носієм, котрий таким чином поєднано з ним. Подібним чином охоплені облатки. Таблетки, порошки, облатки та капсули можна застосовувати як тверді дозовані форми придатні для перорального застосування. Рідкі форми композиції охоплюють розчини, суспензії, та емульсії. Наприклад, стерильні водні або водно-пропіленгліколеві розчини активної сполуки можуть бути рідкими препаратами, придатними для парентерального застосування. Рідкі композиції можна також формувати у воднополіетиленгліколевому розчині. 87327 12 Водні розчини для перорального застосування можна отримувати розчиненням активного компоненту у воді та додаванням придатних барвників, ароматизаторів, стабілізаторів, та загусників, як бажано. Водні суспензії для перорального застосування можна виробляти диспергуванням мілко подрібненого активного компоненту у воді разом з в'язким матеріалом, як-то природні синтетичні камеді, смоли, метилцелюлоза, натрій карбоксиметилцелюлоза та інші суспендувальні агенти, відомі для фармацевтичних композицій у рівні техніки. Залежно від режиму застосування, фармацевтична композиція переважно містить від 0,05% до 99мас.% (мас.%), більш переважно від 0,10 до 50мас.% сполуки винаходу. Терапевтично ефективну кількість для практики заявленого винаходу можна визначати застосуванням відомих критеріїв, охоплюючи вік, масу та реакцію індивідуального пацієнта, та інтерпретувати у контексті хвороби, котру лікують або попереджують, фахівцю. У рамках винаходу є застосування будь-якої вищезазначеної сполуки формули І для виробництва медикаменту. Також у рамках винаходу є застосування будьякої сполуки формули І для виробництва медикаменту для терапії болю. Крім того запропоноване застосування будьякої сполуки формули І для виробництва медикаменту для терапії різних больових станів, охоплюючи, але без обмеження: гострий біль, хронічний біль, невропатичний біль, біль у спині, біль при раку та вісцеральний біль. Наступним аспектом винаходу є спосіб терапії особи, яка потерпає від будь-якого зі станів, обговорених вище, згідно з яким ефективну кількість вищезазначеної сполуки формули І застосовують до пацієнта при потребі такого лікування. Крім того, запропоновано фармацевтичну композицію, яка містить сполуку формули І або її фармацевтично прийнятну сіль, в асоціації з фармацевтично прийнятним носієм. Зокрема, запропоновано фармацевтичну композицію, як містить сполуку формули І або її фармацевтично прийнятну сіль в асоціації з фармацевтично прийнятним носієм для терапії, більш конкретно для терапії болю. Крім того, запропоновано фармацевтичну композицію, як містить сполуку формули І або її фармацевтично прийнятну сіль в асоціації з фармацевтично прийнятним носієм, для застосування у будь-якому зі станів, обговорених вище. Згідно з наступним аспектом, заявлений винахід стосується способу отримання сполук заявленого винаходу. У наступному втіленні винахід стосується способу отримання сполуки формули І, який полягає: I 13 87327 у реакції сполуки формули II зі сполукою формули III, II III 14 де R1, R2, R3, R4, R5 та G визначені вище. Сполуки заявленого винаходу можна також отримувати шляхами синтезу, представленими у схемах 1,2 та 3. 15 87327 16 17 Біологічна Оцінка Зв'язування рецепторів hCB1 та hCB2 Мембрани з рецептором СВ1 людини від Receptor Biology (hCB1) або рецептором СВ2 людини від BioSignal (hCB2) розморожують при 37°С, пропускають 3 рази через голку 25 калібру з тупим кінцем, розбавляють у буфері зв'язування канабіноїду (50мМ Трис, 2,5мМ ЕДТА, 5мМ МgСІ2, та 0,5мг/мл бичачого сироваточного альбуміну без жирної кислоти, рН7,4) та аліквоти, що містять прийнятну кількість білку розподіляють у 96коміркові планшети. IK50 сполук винаходу для hCB1 та hCB2 оцінюють за 10-точковими кривими дозавідгук з 3Н-СР55,940 при 20000-25000імп/хв на комірку (0,17-0,21нМ) у кінцевому об'ємі 300мкл. Загальне та неспецифічне зв'язування визначають у відсутності та присутності 0,2мкМ HU210 відповідно. Планшети перемішують та інкубують протягом 60 хвилин при кімнатній температурі, фільтрують через Unifilters GF/B (попередньо просочений 0,1% поліетиленіміном) зі збирачем Tomtec або Packard, застосовуючи 3мл промивального буферу (50мМ Трис, 5мМ МgСІ2, 0,5мг бичачого сироваточного альбуміну рН7,0). Фільтри сушать протягом 1 години при 55°С. Радіоактивність (імп/хв) рахують у TopCount (Packard) після додавання 65мкл/комірку MS-20 сцинтиляційної рідини. Зв'язування GTPgS hCB1 та hCB2 Мембрани з рецептором СЕ^ людини від Receptor Biology (hCB1) або рецептором СВ2 людини від BioSignal розморожують при 37°С, пропускають 3 рази через голку 25 калібру з тупим кінцем, розбавляють у буфері зв'язування GTPgS (50мМ Гепес, 20мМ NaOH, 100мМ NaCI, 1мМ ЕД 87327 18 ТА, 5мМ МgСІ2, рН7,4, 0,1% бичачого сироваточного альбуміну). EK50 та Еmах сполук винаходу оцінюють за 10-точковими кривими доза-відгук у 300мкл з прийнятною кількістю білку мембран та 100000-130000імп/хв GTPg35S на комірку (0,110,14нМ). Базове та максимальне стимульоване зв'язування визначають у відсутності та присутності 1мкМ(hСВ2) або 10мкМ(hСВ1) Win 55,212-2 відповідно. Мембрани попередньо інкубують протягом 5 хвилин з 56,25мкМ(hСВ2) або 112,5мкМ(hСВ1) GDP перед розподілом у планшетах (15мкМ(hСВ2) або 30мкМ(hСВ1) GDP кінцево). Планшети перемішують та інкубують протягом 60 хвилин при кімнатній температурі, фільтрують на Unifilters GF/B (попередньо просочений у воді) зі збирачем Tomtec або Packard з 3мл промивального буферу (50мМ Трис, 5мМ МgСІ2, 50мМ NaCI, рН7,0). Фільтри сушать протягом 1 години при 55°С. Радіоактивність (імп/хв) рахують у TopCount (Packard) після додавання 65мкл/комірку сцинтиляційної рідини MS-20. Зворотні дослідження антагоністу роблять таким же чином за винятком того, що (а) криві доза агоністу-реакція роблять у присутності постійної концентрації антагоністу, або (b) криву доза антагоністу-реакція роблять у присутності постійної концентрації агоністу. На основі вищенаведених досліджень, константу дисоціації (Кі) для конкретно сполук винаходу стосовно конкретного рецептору визначають за рівнянням: Ki=IK50/(1+[rad]/Kd), Де ІК50 - концентрація сполуки винаходу, при котрій спостерігають 50% заміщення; 19 [rad] - стандартна концентрація радіоактивного ліганду у цей момент; а Kd - константа дисоціації радіоактивного ліганду стосовно конкретного рецептору. Застосовуючи вищезгадане дослідження, Кі стосовно рецепторів СВ1 людини для деяких сполук винаходу є у межах 3нМ-195нМ. EK50 для цих сполук є у межах 2,3нМ-300нМ. Еmах для цих сполук є у межах 109%-144%. Умови дослідження для виміру розчинності Вихідний розчин 30мМ ДМСО отримують зі зразку, а тоді додають аліквоту 25мкл у 96комірковий планшет та обробляють при 40°С протягом 4 годин. До обробленої сполук и додають 250мкл натрій фосфатного буферу (рН7,4) та тоді перемішують при 1200об/хв протягом 24 годин у Eppendorf Thermomixer при 25°С. Після змішування розчин переносять у 96-комірковий фільтрпланшет Whatman GF/B та тоді фільтрують під вакуумом. Надосадковий шар тоді уводять у РХ/МС для аналізу та кількісне визначення проводять за 1-точковою каліб-ровкою для потрібної сполуки. Дослідження метаболічної стабільності у мікросомах печінки щурів та людини 87327 20 Розчин 500мкл 100мкМ сполук у ДМСО інкубують з мікросомами печінки людини або щурів (843мкл мікросом 0,5618мг/мл у 30мл 0,1Μ КН2РО4 буферу з рН7,4) при 37°С протягом 10 хвилин у 96-комірковому планшеті з глибокими комірками. NADPH (46мкл) при концентрації 8,33мг/мл у 100мМ KН2РО4 буфер рН7,4 додають для початку реакції. Реакційну суміші переносять у 384комірковий планшет, що містить ацетонітрил для гасіння реакції у час 0,10, 20, 30 хвилин. 384комірковий планшет центрифугують протягом 30 хвилин при 9000 д, при 4°С, потім зразки аналізують РХ/МС (модель: XDB Eclipse C18). Три зразки аналізують РХ/МС як позитивний контроль. Дані обробляють стандартним способом. Метаболічну стабільність досліджених сполук виражають якмкл/хвилин/мг Крім того, метаболічну стабільність (hClint та rClint) та здатність до розчинення (водного) вибраних сполук винаходу визначають в одному або більше дослідженнях, описаних вище. Виявлено, що вибрані сполуки мають посилену метаболічну стабільність та/або здатність до розчинення у воді. Метаболічна стабільність та здатність до розчинення для цих вибраних сполук ілюстровані у таблиці 1 нижче. 21 87327 22 23 Приклади Винахід далі описано детальніше наступними прикладами, котрі описують способи, згідно з якими сполуки заявленого винаходу можна отримувати, очищати, аналізувати та біологічно тестувати, і котрі не обмежують винахід. Приклад 1 N-[2-трет-Бутил-1-(тетрагідро-2Н-піран-4ілметил)-1Н-бензимідазол-5-іл]-Nметилциклопропансульфонамід 87327 24 Метилхлорформіат (13,2мл, 170,2ммоль) додавали краплями до холодного (0°С) дихлорметанового (200мл) розчину 4-флуор-3-нітроаніліну (24,15г, 154,7ммоль) та DIPEA (35мл, 201ммоль). Реакційну суміш перемішували при кімнатній температурі протягом ночі. Розчин тоді розбавляли 200мл дихлорметану та промивали 2М НСІ, розсолом та сушили безводним MgSO4. Розчинник концентрували та продукт безпосередньо застосовували на наступному етапі без подальшої очистки. Вихід: 35,5г (99%). 1Н ЯМР (400МГц, ХЛОРОФОРМ-D) δ 3,81 (s, 3Н), 7,02 (s, 1Η), 7,23 (m, 1Η), 7,72 (d, J=8,59Гц, 1Η), 8,17 (dd, J=6,35, 2,64Гц, 1Η). Етап С: Метил {3-нітро-4-[(тетрагідро-2Н-піран4-ілметил)аміно]феніл}карбамат Етап А: N-[2-трет-Бутил-1-(тетрагідро-2Нпіран-4-ілметил)-1Н-бензимідазол-5-іл]-Nметилциклопропансульфонамід 2-трет-Бутил-N-метил-1-(тетрагідро-2Н-піран4-ілметил)-1Н-бензимідазол-5-амін (для препарат, дивись наступні етапи В-F) (50мг, 0,166ммоль) та каталітичну кількість DMAP розчиняли у 5мл ДХМ. Циклопропансульфонілхлорид (30мг, 0,216ммоль) додавали краплями та розчин перемішували при кімнатній температурі протягом ночі. Розчин промивали насиченим водним розчином NaHCO3, розсолом та сушили безводним MgSO4 Продукт очищали зворотно-фазовою ВЕРХ, застосовуючи 10-70% CH3CN/H2O та ліофілізували, отримуючи титульну сполуку як відповідний трифлуорацетат. Вихід: 56мг (65%). 1Н ЯМР (400МГц, METAHOЛ-D4) δ 0,90-0,94 (m, 2Η), 0,97-1,02 (m, 2Η), 1,53-1,59 (m, 2Η), 1,59-1,65 (m, 2Η), 1,69 (s, 9Η), 2,36-2,42 (m, 1Η), 2,60-2,65 (m, 1Η), 3,36 (m, 2Η), 3,43 (s, 3Η), 3,94 (d, J=3,58Гц, 1Η), 3,96 (d, J=3,07Гц, 1Η), 4,55 (d, J=7,68Гц, 2Η), 7,74 (dd, J=8,96, 2,05Гц, 1Η), 7,81 (d, J=1,54Гц, 1Η), 7,98 (d, J=8,96Гц, 1Η); МС (ІЕР) (М+Н)+406,0. Етап В: Метил (4-флуор-3нітрофеніл)карбамат Метил (4-флуор-3-нітрофеніл)карбамат (2,0г, 9,32ммоль) та 4-амінометилтетрагідропіран (1,28г, 11,2ммоль) перемішували у 50мл ЕtOН, що містить TEA (2,0мл, 14,0ммоль) при 75°С протягом 48 годин. Розчинник випарювали. Залишок розчиняли у ЕtOАс та промивали водним 5% KHSO4, насиченим водним розчином NaHCO3, розсолом та сушили безводним MgSO4. Сирий продукт очищали флеш-хроматографією на силікагелі, застосовуючи 1:1/гексани: ЕtOАс як елюент. Вихід: 2,53г (88%). 1Н ЯМР (400МГц, хлороформ-D) δ 1,42 (гл, 2Н), 1,73 (d, J=1,76Гц, 1Η), 1,76 (d, J=1,95Гц, 1Η), 1,88-2,01 (m, 1Η), 3,22 (dd, J=6,74, 5,57Гц, 2Η), 3,42 (m, 2Η), 3,78 (s, 3Η), 4,01 (d, J=4,30Гц, 1Η), 4,04 (d, J=3,51Гц, 1Η), 6,48 (br.s, 1Η), 6,85 (d, J=9,37Гц, 1Η), 7,65 (br.s, 1Η), 8,03-8,09 (m, 2Η). Етап D: Метил {3-аміно-4-[(тетрагідро-2Нпіран-4-ілметил)аміно]феніл}карбамат Метил {3-нітро-4-[(тетрагідро-2Н-піран-4ілметил)аміно]феніл}карбамат (2,53г, 8,18ммоль) розчиняли у 50мл ЕtOАс, що містить каталітичну кількість 10% Pd/C. Розчин струшували в атмосфері водню (40фунт/кв.дюйм), застосовуючи апарат Парра протягом ночі при кімнатній температурі. Розчин фільтрували через броунмілерит та 25 розчинник випарювали. Вихід: 2,29г(99%). 1Н ЯМР (400МГц, хлороформ-D) δ 1,40 (m, 2Н), 1,70-1,74 (m, 1Н), 1,74-1,77 (m, 1Н), 1,81-1,92 (m, 1Н), 2,99 (d, J=6,64Гц, 2Η), 3,34 (br.s, 2Η), 3,41 (m, 2Η), 3,74 (s, 3Η), 3,99 (d, J=3,51Гц, 1Η), 4,02 (d, J=3,51Гц, 1Η), 6,38 (br.s, 1Η), 6,55-6,60 (m, 1Η), 6,62-6,68 (m, 1Η), 6,95 (br.s, 1Η). Етап Е: Метил [2-трет-бутил-1-(тетрагідро-2Нпіран-4-ілметил)-1Н-бензимідазол-5-іл]карбамат Метил {3-аміно-4-[(тетрагідро-2Н-піран-4ілметил)аміно]феніл}карбамат (2,29г, 8,20ммоль) та DMAP (0,20г, 1,64ммоль) розчиняли у 75мл ДХМ. Триметилацетилхлорид (1,10мл, 9,02ммоль) додавали краплями та розчин перемішували при кімнатній температурі протягом 2 годин. Розчин промивали водним розчином NaHCO3, розсолом та сушили безводним MgSO4. Залишок розчиняли у 25мл АсОН та гріли при 125°С протягом 1 години, застосовуючи мікрохвильову апаратуру Personal Chemistry. Розчинник випарювали. Залишок розчиняли у EtOAc та промивали водним розчином NaHCO3, розсолом та сушили безводним MgSO4. Сирий продукт очищали флешхроматографією на силікагелі, застосовуючи 4:3 гексани: ацетон як елюент. Вихід: 1,81г (64%). 1Н ЯМР (400МГц, хлороформ-D) δ 1,48-1,54 (m, 4Η), 1,56 (s, 9Η), 2,23-2,35 (m, 1Η), 3,27-3,35 (m, 2Η), 3,78 (s, 3Η), 3,96 (t, J=2,93Гц, 1Η), 3,99 (t, J=3,03Гц, 1Η), 4,18 (d, J=7,42Гц, 2Η), 6,63 (br.s, 1Η), 7,24-7,28 (m, 1Η), 7,41 (br.s, 1Η), 7,61 (d, J=1,95Гц, 1Η). Етап F: 2-трет-Бутил-N-метил-1-(тетрагідро2Н-піран-4-ілметил)-1Н-бензимідазол-5-амін Метил [2-трет-бутил-1-(тетрагідро-2Н-піран-4ілметил)-1Н-бензимідазол-5-іл]карбамат (1,80г, 5,21ммоль) розчиняли у 75мл ТГФ при 0°С. 1Μ НСІ/етер (7,3мл, 7,29ммоль) додавали краплями та розчин перемішували при 0°С протягом 15 хвилин. ІLiіАІН4 (988мг, 26,1ммоль) додавали повільно та розчин перемішували при кімнатній температурі протягом ночі. Реакцію гасили при 0°С додаванням МеОН (5мл) а потім водою (10мл) та розчин перемішували при кімнатній температурі протягом 30 хвилин. Безводний Na2SO4 (10г) додавали та розчин перемішували при кімнатній температурі для ще 30 хвилин. Розчин фільтрували та розчинник випарювали. Залишок розчиняли у ЕtOАс та промивали водним розчином NaHCO3, розсолом та сушили безводним MgSO4. Розчинник випарювали. Вихід: 1,54г (98%). 1Н ЯМР (400МГц, хлороформ-D) δ 1,49-1,53 (m, 4Η), 1,53-1,57 (m, 9Η), 2,22-2,32 (m, 1Η), 2,87 (s, 3Η), 3,26-3,35 (m, 2Η), 3,95 (t, J=3,03Гц, 1Η), 3,97-4,00 (m, 1Η), 4,13 (d, 87327 26 J=7,42Гц, 2Η), 6,61 (dd, J=8,59, 2,15Гц, 1Η), 6,99 (d, J=1,95Гц, 1Η), 7,11 (d, J=8,59Гц, 1Η). Приклад 2 N-[2-трет-Бутил-1-(тетрагідро-2Н-піран-4ілметил)-1Н-бензимідазол-5-іл]-N-метилпропан-1сульфонамід 2-трет-Бутил-N-метил-1-(тетрагідро-2Н-піран4-ілметил)-1Н-бензимідазол-5-амін (для препарат, дивись Етапи В-F прикладу 1) (50мг, 0,166ммоль) та каталітичну кількість DMAP розчиняли у 5мл ДХМ. 1-Пропансульфонілхлорид (0,024мл, 0,216ммоль) додавали краплями та розчин перемішували при кімнатній температурі протягом 3 годин. Розчин промивали насиченим водним розчином NaHCO3, розсолом та сушили безводним MgSO4. Продукт очищали зворотно-фазовою ВЕРХ, застосовуючи 10-70% CH3CN/H2O та люфілізували, отримуючи титульну сполуку як відповідний трифлуорацетат. Вихід: 60мг (69%); 1Н ЯМР (400МГц, метанол-D4) δ 1,02 (t, J=7,42Гц, 3Η), 1,541,59 (m, 2Η), 1,60-1,66 (m, 2Η), 1,69 (s, 9Η), 1,761,83 (m, 2Η), 2,36-2,42 (m, 1Η), 3,09-3,13 (m, 2Η), 3,36 (m, 2Η), 3,40 (s, 3Η), 3,94 (d, J=3,58Гц, 1Η), 3,95 (d, J=3,58Гц, 1Η), 4,55 (d, J=7,68Гц, 2Η), 7,70 (dd, J=8,96, 2,05Гц, 1Η), 7,81 (d, J=1,79Гц, 1Η), 7,98 (d, J=8,96Гц, 1Η); МС (ІЕР) (М+Н)+408,0. Приклад 3 N-[2-трет-Бутил-1-(тетрагідро-2Н-піран-4ілметил)-1Н-бензимідазол-5-іл]-N-метилбутан-1сульфонамід 2-трет-Бутил-ІN-метил-1-(тетрагідро-2Н-піран4-ілметил)-1Н-бензимідазол-5-амін (для отримання дивись Етапи В, С, D, Ε та F прикладу 1) (38мг, 0,126ммоль) та 1-бутансульфонілхлорид (0,025мл, 0,189ммоль) перемішували у 3мл ДХМ, що містить каталітичну кількість DMAP при кімнатній температурі протягом ночі. Розчинник випарювали та продукт очищали зворотно-фазовою ВЕРХ, застосовуючи 10-60% CH3CN/H2O та ліофілізували, отримуючи титульну сполуку як відповідний трифлуорацетат Вихід: 39мг (58%). 1Н ЯМР (400МГц, метанолі): δ 0,88-0,94 (m, 3Η), 1,43 (m, 2Η), 1,531,59 (m, 2 Η,) 1,59-1,66 (m, 2Η), 1,69 (s, 9Η), 1,711,77 (m, 2Η), 2,35-2,42 (m, 1Η), 3,10-3,16 (m, 2Η), 3,35 (m, 2Η), 3,40 (s, 3Η), 3,93 (d, J=3,12Гц, 1Η), 3,96 (d, J=3,71Гц, 1Η), 4,54 (d, J=7,42Гц, 2Η), 7,69 (dd, J=8,98, 2,15Гц, 1Η), 7,81 (d, J=1,56Гц, 1Η), 7,97 (d, J=8,98Гц, 1Η); МС (ІЕР) (М+Н)+422,2; Аналіз: розраховано для С22Н35N3О3S+1,3 ТФК+1,2 Н2О: С, 49,96; Н, 6,60; Ν, 7,10. Виявлено: С, 49,98; Н, 6,67; Ν, 6,83. Приклад 4 27 87327 28 N-{2-трет-Бутил-1-[(4,4дифлуорциклогексил)метил]-1Н-бензимідазол-5іл}-N-метилбутан-1-сульфонамід Етап А: N-{2-трет-Бутил-1-[(4,4дифлуорциклогексил)метил]-1Н-бензимідазол-5іл}-N-метилбутан-1-сульфонамід 2-трет-Бутил-1-[(4,4дифлуорциклогексил)метил]-N-метил-1Нбензимідазол-5-амін (для отримання дивись наступні етапи В, С, D, Е, F та G) (46мг, 0,137ммоль) та 1-бутансульфонілхлорид (0,063мл, 0,411ммоль) перемішували у 3мл ДХМ, що містить каталітичну кількість DMAP при кімнатній температурі протягом 6 годин. Розчинник випарювали та продукт очищали зворотно-фазовою ВЕРХ, застосовуючи 10-75% CH3CN/H2O та ліофілізували, отримуючи титульну сполуку як відповідний трифлуорацетат Вихід: 48мг (62%). 1Н ЯМР (400МГц, метанолі), δ 0,92 (t, J=7,32Гц, 3Η), 1,43 (m, 2Η), 1,52-1,63 (m, 2Η), 1,69 (s, 9Η), 1,70-1,76 (m, 4Η), 1,76-1,84 (m, 2Η), 2,02-2,12 (m, 2Η), 2,22-2,31 (m, 1Η), 3,10-3,17 (m, 2Η), 3,41 (s, 3Η), 4,56 (d, J=7,62Гц, 2Η), 7,69 (dd, J=8,98, 2,15Гц, 1Η), 7,82 (d, J=1,76Гц, 1Η), 7,96 (d, J=9,18Гц, 1Η); MC (ΙΕΡ) (Μ+Η)+456. Етап В: трет-Бутил [(4,4дифлуорциклогексил)метил]карбамат 4-N-Вос-амiнометилциклогексанон (1,00г, 4,4ммоль) розчиняли у 30мл ДХМ при 0°С. DAST (1,45мл, 11,0ммоль) додавали краплями та розчин перемішували при кімнатній температурі протягом ночі. Розчин промивали водним 5% розчином KHSO4, насиченим водним розчином NaHCO3, розсолом та сушили безводним MgSO4. Сирий продукт очищали флеш-хроматографією на силікагелі, застосовуючи 3:1 гексани: ЕtOАс як елюент. Вихід: 508мг (46%). 1Н ЯМР (400МГц, хлороформD): δ 1,19-1,36 (m, 2Η), 1,44 (s, 9Η), 1,51-1,56 (m, 1Η), 1,59-1,75 (m, 2Η), 1,75-1,84 (m, 2Η), 2,01-2,16 (m, 2Η), 3,03 (t, J=6,54Гц, 2Η), 4,62 (br.s, 1Η). Етап С: [(4,4-Дифлуорциклогексил)метил]амін гідрохлорид трет-Бутил [(4,4дифлуорциклогексил)метил]карбамат (505мг, 2,03ммоль) перемішували у 5мл 1Μ НСІ/АсОН при кімнатній температурі протягом 2 годин. Розчинник випарювали. Залишок промивали етером, фільтрували та сушили. Вихід: 330мг (88%). 1Н ЯМР (400МГц, метанол-D4): δ 1,28-1,40 (m, 2Η), 1,711,82 (m, 2Η), 1,84 (d, J=3,12Гц, 2Η), 1,86-1,89 (m, 1Η), 2,03-2,15 (m, 2Η), 2,85 (d, J=7,03Гц, 2Η). Етап D: Метил (4-{[(4,4дифлуорциклогексил)метил]аміно}-3нітрофеніл)карбамат Таким же способом як на етапі С прикладу 1, застосовуючи [(4,4дифлуорциклогексил)метил]амін гідрохлорид (210мг, 1,12ммоль), метил (4-флуор-3нітрофеніл)карбамат (200мг, 0,934ммоль) та TEA (0,390мл, 2,80ммоль) у 10мл ЕtOН. Сирий продукт очищали флеш-хроматографією на силікагелі, застосовуючи 5% етер/ДХМ як елюент. Вихід: 200мг (62%). 1Н ЯМР (400МГц, хлороформ-D): δ 1,34-1,47 (m, 2Η), 1,65-1,75 (m, 2Η), 1,78-1,85 (m,1Η), 1,90-1,93 (m, 1Η), 1,94-1,97 (m, 1Η), 2,102,21 (m, 2Η), 3,23 (dd, J=6,64, 5,66Гц, 2Η), 3,78 (s, 3Η), 6,48 (br.s, 1Η), 6,83 (d, J=9,18Гц, 1Η), 7,66 (brs, 1Η), 8,05 (br.s, 1Η), 8,07 (d, J=2,54Гц, 1Η). Етап Ε. Метил (3-аміно-4-{[(4,4дифлуорциклогексил)метил]аміно}феніл)карбамат Таким же способом як на етапі D прикладу 1, застосовуючи метил (4-{[(4,4дифлуорциклогексил)метил]аміно}-3нітрофеніл)карбамат (200мг, 0,583ммоль) та каталітичну кількість 10% Pd/C у 20мл ЕtOАс. Вихід: 185мг (99%). МС(ІЕР)(М+Н)+314,29. Етап F: Метил {2-трет-бутил-1-[(4,4дифлуорциклогексил)метил]-1Н-бензимідазол-5іл}карбамат 29 Метил (3-аміно-4-{[(414дифлуорциклогексил)метил]аміно}феніл)карбамат (185мг, 0,590ммоль) та DMAP (15мг, 0,118ммоль) розчиняли у 10мл ДХМ. Триметилацетилхлорид (0,080мл, 0,649ммоль) додавали краплями та розчин перемішували при кімнатній температурі протягом 2 годин. Розчин промивали водним розчином NaHCO3, розсолом та сушили безводним MgSO4. Розчинник концентрували. Залишок розчиняли у 4мл DCE та додавали Р2О5 (каталітичний) та розчин гріли при 125°С протягом 1 години, застосовуючи мікрохвильову апаратуру Personal Chemistry. Розчин промивали водним розчином NaHCO3, розсолом та сушили безводним MgSO4. Сирий продукт очищали флеш-хроматографією на силікагелі, застосовуючи 50-75% ЕtOАс/гексани. Вихід. 122мг (54%); 1Н ЯМР (400МГц, хлороформD): δ 1,43-1,52 (m, 2Η), 1,55 (s, 9Η), 1,57-1,66 (m, 2Η), 1,67-1,74 (m, 2Η), 2,08-2,18 (m, 3Η), 3,79 (s, 3Η), 4,19 (d, J=7,42Гц, 2Η), 6,63 (br.s, 1Η), 7,23 (d, J=8,79Гц, 1Η), 7,37-7,46 (m, 1Η), 7,62 (d, J=1,76Гц, 1Η). Етап G: 2-трет-Бутил-1-[(4,4дифлуорциклогексил)метил]-N-метил-1Нбензимідазол-5-амін Метил {2-трет-бутил-1-[(4,4дифлуорциклогексил)метил]-1Н-бензимідазол-5іл}карбамат (115мг, 0,303ммоль) розчиняли у 10мл ТГФ при 0°С. 1Μ НСІ/етер (0,425мл, 0,424ммоль) додавали та розчин перемішували при 0°С протягом 15 хвилин. LіАІН4 (57мг, 1,52ммоль) додавали повільно та розчин перемішували при кімнатній температурі протягом ночі. Реакцію гасили при 0°С додаванням МеОН (1мл) та вод (2мл). Безводний Na2SO4 (5,0г) додавали та розчин перемішували при кімнатній температурі протягом 30 хвилин. Розчин фільтрували та розчинник випарювали. Залишок розчиняли у EtOAc та промивали насиченим водним розчином NaHCO3, розсолом та сушили безводним MgSO4. Вихід: 95мг (93%). 1Н ЯМР (400МГц, хлороформ-D): δ 1,41-1,51 (m, 2Η), 1,54 (s, 9Η), 1,57-1,67 (m, 2Η), 1,68-1,76 (m, 3Η), 2,07-2,17 (m, 3Η), 2,87 (s, 3Η), 4,15 (d, J=7,42Гц, 2Η), 6,61 (dd, J=8,59, 2,34Гц, 1Η), 7,01 (d, J=1,95Гц, 1Η), 7,09 (d, J=8,59Гц, 1Η). Приклад 5 N-Метил-N-[1-(тетрагідро-2Н-піран-4-ілметил)2-(трифлуорметил)-1Н-бензимідазол-5-іл]пропан1-сульфонамід 87327 30 Етап А: N-Метил-N-[1-(тетрагідро-2Н-піран-4ілметил)-2-(трифлуорметил)-1Н-бензимідазол-5іл]пропан-1-сульфонамід Пропан-1-сульфонілхлорид (27мкл, 34мг, 0,24ммоль) додавали до розчину N-метил-1(тетрагідро-2Н-піран-4-ілметил)-2(трифлуорметил)-1Н-бензимідазол-5-аміну (63мг, 0,20ммоль) (дивись наступні етапи В, С, D, Е, F та G стосовно отримання), DIPEA (49мкл, 36мг, 0,28ммоль) та DMAP (5мг, 0,04ммоль) у ДХМ (6мл) при 0°С. Реакційну суміш перемішували протягом ночі при кімнатній температурі, розбавляли ДХМ (50мл), промивали насиченим NaHCO3(2´10мл) та сушили Na2SO4. Сирий продукт очищали хроматографією, застосовуючи гексан/ЕtOАс (1:1) на силікагелі для отримання 40мг (47%) білого твердого матеріалу як титульну сполуку. 1Н ЯМР (400МГц, метанол-D4): δ 1,00 (t, J=7,42Гц, 3Η), 1,38-1,53 (m, 4Η), 1,70-1,88 (m, 2Η), 2,15-2,30 (m, 1Η), 3,01-3,11 (m, 2Η), 3,28-3,33 (m, 2Η), 3,35 (s, 3Η), 3,88-3,91 (m, 2Η), 4,30 (d, J=7,62Гц, 2Η), 7,55 (dd, J=8,79, 1,76Гц, 1Η), 7,75 (d, J=8,98Гц, 1Η), 7,82 (d, J=1,56Гц, 1Η). MC (ΙΕΡ) (Μ+Η)+ =420,0. Аналіз: розраховано для С18Н24F3N3O3S+ 0,20 Н2О+0,30 СН3ОН(432,68): С, 50,80; Н, 5,96; Ν, 9,71; Виявлено: С, 50,79; Н, 5,91; Ν, 9,69. Етап В. N-(4-флуор-3-нітрофеніл)ацетамід 4-Флуор-3-нітро-анілін (45,0г, 0,288моль) додавали порціями до оцтового ангідриду (150мл) при кімнатній температурі. Реакційну суміш перемішували при кімнатній температурі протягом 2 годин. Білий твердий матеріал збирали та сушили у вакуумі для отримання титульної сполуки (42,0г, 70%). 1Н ЯМР (400МГц, хлороформ-D): δ 2,23 (s, 3Η), 7,26 (m, 1Η), 7,50 (s широкий, 1Η), 7,87 (m, 1Η), 8,23 (dd, J=6,44, 2,73Гц, 1Η). Етап С: N-(4-флуор-3-нітрофеніл)-Nметилацетамід Натрій гідрид (4,22г, 60%, 106ммоль) додавали порціями до розчину N-(4-флуор-3нітрофеніл)ацетаміду(13,9г, 70ммоль) у ТГФ (200мл) при 0°С. Перемішування протягом 20 хвилин, додавали йодметан (18,5г, 130ммоль). Реакційну суміш перемішували при кімнатній температурі протягом 2 годин, гасили насиченим NaHCO3 (30мл) та екстрагували ЕtOАс (3´100мл). Комбіновані органічні фази промивали насиченим NaCI (2´50мл). Після фільтрування та концентрації 13,1г (88%) титульної сполуки отримували як жовтий твердий матеріал. 1Н ЯМР (400МГц, хлороформ-D): δ 1,92 (s, 3Η), 3,30 (s, 3Η), 7,38 (s, 1Η), 7,52 (s, 1Η), 7,95 (s, 1Η). 31 Етап D. N-метил-N-{3-нiтро-4-[(тетрагідро-2Нпіран-4-тметил)аміно]феніл}ацетамід 4-Амінометилтетрагідропіран (10,0г, 86,5ммоль ) додавали до суміші N-(4-флуор-3нітрофеніл)-N-метилацетаміду (15,6г, 73,3ммоль) та TEA (15,3мл, 11,1г, 110ммоль) у ЕtOН (300мл) при кімнатній температурі. Реакційну суміш гріли протягом 6 годин при кипінні під зворотним холодильником. Після випарювання етанолу залишок розчиняли у ЕtOАс (400мл), промивали Н2О (3´50мл), насиченим NaCI (3´50мл), та сушили Na2SO4. Після фільтрування та концентрації, 21,7г (96%) титульної сполуки отримували як оранжевочервоний твердий матеріал. 1H ЯМР (400МГц, хлороформ-D): δ 1,38-1,52 (m, 2Η), 1,72-1,81 (m, 2Η), 1,90 (s, 3Η), 1,93-2,02 (m, 1Η), 3,23 (s, 3Η), 3,23-3,27 (m, 2Η), 3,36-3,49 (m, 2Η), 4,01-4,07 (m, 2Η), 6,91 (d, J=9,18Гц, 1Η), 7,29 (dd, J=9,08, 2,64Гц, 1Η), 8,05 (d, J=2,34Гц, 1Η), 8,22 (t, J=5,37Гц, 1Η). МС (ІЕР) (М+Н)+= 309,12. Етап Е. N-{3-Аміно-4-[(тетрагідро-2Н-піран-4ілметил)аміно]феніл}-N-метилацетамід N-Метил-N-{3-нітро-4-[(тетрагідро-2Н-піран-4ілметил)аміно]феніл}ацетамід (21,7г, 70,5ммоль) гідрували в етилацетаті (500мл) з 10% Pd/C (1,0г) при тиску водню 30-40фунт/кв.дюйм у струшувачі Парра протягом 18 годин при кімнатній температурі. Після фільтрування через броунмілерит та концентрації, отримували 19,6г (100%) пурпурового твердого матеріалу. 1H ЯМР (400МГц, хлороформD): δ 1,35-1,50 (m, 2Η), 1,67 (s, 1Η), 1,73-1,81 (m, 2Η), 1,88 (s, 3Η), 1,88-1,99 (m, 1Η), 3,04 (d, J=6,64Гц, 2Η), 3,20 (s, 3Η), 3,33-3,48 (m, 4Η), 3,974,08 (m, 2Η), 6,54 (d, J=1,76Гц, 1Η), 6,60-6,63 (m, 2 Η); MC (ΙΕΡ) (Μ+Η)+: 278,7 Етап F. N-Метил-N-[1-(тетрагідро-2Н-піран-4ілметил)-2-(трифлуорметил)-1Н-бензимідазол-5іл]ацетамід Розчин N-{3-аміно-4-[(тетрагідро-2Н-піран-4ілметил)аміно]феніл}-N-метилацетамід гідрохлориду (2,77г, 10ммоль) у трифлуороцтовій кислоті (60мл) гріли при кипінні під зворотним холодильником протягом 18 годин. Після випарювання розчиннику, залишок розчиняли у ЕtOАс (200мл), промивали 2N NaOH (2´10мл) та сушили Na2SO4. Сирий продукт очищали хроматографією, застосо 87327 32 вуючи ЕtOАс на силікагелі для отримання 3,18г (90%) білого твердого матеріалу як титульну сполуку. MC (IEP) (М+Н)+ =356,02. Етап G. N-Метил-1-(тетрагідро-2Н-піран-4тметил)-2-(трифлуорметил)-1Н-бензимідазол-5амін N-Метил-N-[1-(тетрагідро-2Н-піран-4-ілметил)2-(трифлуорметил)-1Н-бензимідазол-5-іл]ацетамід (3,18г, 8,95ммоль) розчиняли у хлоридній кислоті (37%, 60мл) та тоді гріли протягом ночі при 95°С. Після концентрації залишок обробляли 20мл 2N NaOH, екстрагували ЕtOАс (4´50мл). Комбіновані органічні фази промивали розсолом (20мл) та сушили Na2SO4. Після випарювання, 2,80г (100%) пурпурно-білого твердого матеріалу отримували як титульний продукт, котрий застосовували безпосередньо на етапі Н. МС (ІЕР) (М+Н)+ =314,20. Приклад 6 N-Метил-N-[1-(тетрагідро-2Н-піран-4-ілметил)2-(трифлуорметил)-1Н-бензимідазол-5іл]циклопропансульфонамід Способом у прикладі 5, застосовуючи циклопропансульфонілхлорид (34мг, 0,24ммоль), Nметил-1-(тетрагідро-2Н-піран-4-ілметил)-2(трифлуорметил)-1Н-бензимідазол-5-амін (63мг, 0,20ммоль) (стосовно отримання, дивись етап G у прикладі 1), DIPEA (49мкл, 36мг, 0,28ммоль) та DMAP (5мг, 0,04ммоль) у ДХМ (6мл) при 0°С. Сирий продукт очищали хроматографією, застосовуючи гексан/ЕtOАс (1.1) на силікагелі для отримання 81мг (97%) білого твердого матеріалу як титульну сполуку. 1Н ЯМР (400МГц, метанол-D4): δ 0,85-0,92 (m, 2Η), 0,93-1,01 (m, 2Η), 1,37-1,52 (m, 4Η), 2,18-2,31 (m, 1Η), 2,55-2,65 (m, 1Η), 3,30-3,36 (m, 2Η), 3,38 (s, 3Η), 3,86-3,95 (m, 2Η), 4,32 (d, J=7,62Гц, 2Η), 7,58 (dd, J=8,89, 2,05Гц, 1Η), 7,76 (d, J=8,79Гц, 1Η) 7,86 (d, J=1,95Гц, 1Η). МС (ІЕР) (М+Н)+ =418,0. Аналіз: розраховано для C18H22F3N3O3S+0,10 Н2О+0,20 СН3ОН (425,66): С, 51,36; Н, 5,45; N, 9,87; Виявлено: С, 51,39; Н, 5,49; N, 9,92 Приклад 7 N-[2-трет-Бутил-1-(тетрагідро-2Н-піран-4ілметил)-1Н-бензимідазол-5-іл]-N-метилпентан-1сульфонамід 2-трет-Бутил-N-метил-1-(тетрагідро-2Н-піран4-ілметил)-1Н-бензимідазол-5-амін (65мг, 0,216ммоль) та каталітичну кількість DMAP розчи 33 няли у 3мл DCE. н-Пентилсульфонілхлорид (44мг, 0,259ммоль) додавали та розчин перемішували при кімнатній температурі протягом 4 годин. Розчин промивали насиченим водним розчином NaHCO3, розсолом та сушили безводним MgSO4. Розчинник випарювали та продукт очищали зворотно-фазовою ВЕРХ, застосовуючи 10-70% CH3CN/H2O та ліофілізували, отримуючи титульну сполуку як відповідний трифлуорацетат. Вихід: 89мг (75%). 1Н ЯМР (400МГц, метанол-D4) δ 0,89 (t, J=7,13Гц, 3Η), 1,26-1,34 (m, 2Η), 1,34-1,43 (m, 2Η), 1,52-1,58 (m, 2Η), 1,58-1,66 (m, 2Η), 1,69 (s, 9Η), 1,71-1,80 (m, 2Η), 2,34-2,43 (m, 1Η), 3,09-3,16 (m, 2Η), 3,36 (td, J=11,47, 2,64Гц, 2Η), 3,40 (s, 3 Η) 3,93 (d, J=3,12Гц, 1Η), 3,95-3,97 (m, 1Η), 4,55 (d, J=7,62Гц, 2Η), 7,69 (dd, J=9,08, 2,05Гц, 1Η), 7,81 (d, J=1,56Гц, 1Η), 7,97 (d, J=8,59Гц, 1Η); MC (ΙΕΡ) (Μ+Η)+436,0; Аналіз: розрахованого) Для C23H37N3O3S+1,1 ТФК+0,9 Н2О; С, 52,43; Н, 6,97; Ν, 7,28. Виявлено: С, 52,39; Н, 6,96; Ν, 7,43. Приклад 8 N-[2-трет-Бутил-1-(тетрагідро-2Н-піран-4ілметил)-1H-бензимідазол-5-іл]-Nметилетансульфонамід 2-трет-Бутил-N-метил-1-(тетрагідро-2Н-піран4-ілметил)-1Н-бензимідазол-5-амін (50мг, 0,166ммоль) та каталітичну кількість DMAP розчиняли у 3мл DCE. Етансульфонілхлорид (0,020мл, 0,215ммоль) додавали та розчин перемішували при кімнатній температурі протягом 12 годин. Розчин промивали насиченим водним розчином NaHCO3, розсолом та сушили безводним MgSO4. Розчинник випарювали та продукт очищали зворотно-фазовою ВЕРХ, застосовуючи 10-70% CH3CN/H2O та ліофілізували, отримуючи титульну сполуку як відповідний трифлуорацетат. Вихід: 70мг (83%). 1Н ЯМР (600МГц, CD3OD) δ 1,31 (t, J=7,30Гц, 3Η), 1,53-1,58 (m, 2Η), 1,58-1,65 (m, 2Η), 1,69 (s, 9Η), 2,35-2,42 (m, 1Η), 3,16 (m, 2Η), 3,35 (m, 2Η), 3,41 (s, 3Η), 3,94 (d, J=3,84Гц, 1Η), 3,95 (d, J=3,84Гц, 1Η), 4,54 (d, J=7,68Гц, 2Η), 7,69 (dd, J=9,09, 1,92Гц, 1Η), 7,81 (d, J=1,79Гц, 1Η), 7,97 (d, J=8,96Гц, 1Η); MC (ΙΕΡ) (Μ+Η)+ 394,0; Аналіз: розраховано (%) для C20H31N3O3S+1,4 ТФК: С, 49,50; Н, 5,90; Ν, 7,60. Виявлено: С, 49,51; Н, 6,00; N, 7,24. Приклад 9 N-[2-трет-Бутил-1-(тетрагідро-2Н-піран-4ілметил)-1Н-бензимідазол-5-іл]-N,2диметилпропан-2-сульфонамід 2-трет-Бутил-N-метил-1-(тетрагідро-2Н-піран4-ілметил)-1Н-бензимідазол-5-амін (50мг, 0,166ммоль) та DMAP (20мг, 0,166ммоль) розчи 87327 34 няли у 3мл ДХМ. т-бутилсульфінілхлорид (0,027мл, 0,215ммоль) додавали та розчин перемішували при кімнатній температурі протягом 2 годин. Розчин промивали насиченим водним розчином NaHCO3, розсолом та сушили безводним MgSO4. 3-Хлорпероксибензойну кислоту (37мг, 0,166ммоль) додавали та розчин перемішували при кімнатній температурі протягом 1 години. Розчин промивали насиченим водним розчином NaHCO3, розсолом та сушили безводним MgSO4. Продукт очищали зворотно-фазовою ВЕРХ, застосовуючи 10-70% CH3CN/H2O та ліофілізували, отримуючи титульну сполуку як відповідний трифлуорацетат. Вихід: 34мг (38%). 1Н ЯМР (400МГц, метанол-D4) δ 1,37 (s, 9Η), 1,52-1,58 (m, 2Η), 1,591,66 (m, 2Η), 1,69 (s, 9Η), 2,34-2,44 (m, 1Η), 3,36 (m, 2Η), 3,48 (s, 3Η), 3,93 (d, J=3,32Гц, 1Η), 3,953,97 (m, 1Η), 4,54 (d, J=7,62Гц, 2Η), 7,78 (dd, J=9,08, 2,05Гц, 1Η), 7,92 (d, J=2,15Гц, 1Η), 7,96 (d, J=9,18Гц, 1Η); MC (ΙΕΡ) (Μ+Η)+ 422,0. Приклад 10 N-{2-трет-Бутил-1-[(4,4дифлуорциклогексил)метил]-1Н-бензимідазол-5іл}-N-метилпропан-1-сульфонамід 2-трет-Бутил-1-[(4,4дифлуорциклогексил)метил]-N-метил-1Нбензимідазол-5-амін (45мг, 0,134ммоль) та каталітичну кількість DMAP розчиняли у 3мл DCE. Пропансульфонілхлорид (0,020мл, 0,174ммоль) додавали та розчин перемішували при кімнатній температурі протягом 4 годин. Розчин промивали насиченим водним розчином NaHCO3, розсолом та сушили безводним MgSO4. Розчинник випарювали та продукт очищали зворотно-фазовою ВЕРХ, застосовуючи 10-70% CH3CN/H2O та ліофілізували, отримуючи титульну сполуку як відповідний трифлуорацетат. Вихід: 55мг (74%). 1Н ЯМР (400МГц, метанол-D4) δ 1,00 (t, J=7,42Гц, 3Η), 1,511,60 (m, 2Η), 1,66 (s, 9Η), 1,68-1,73 (m, 2Η), 1,731,81 (m, 4Η), 2,00-2,11 (m, 2Η), 2,18-2,29 (m, 1Η) 3,06-3,12 (m, 2Η), 3,38 (s, 3Η), 4,54 (d, J=7,62Гц, 2Η), 7,67 (dd, J=9,08, 2,05Гц, 1Η), 7,79 (d, J=1,56Гц, 1Η), 7,94 (d, J=8,98Гц, 1Η); MC (ΙΕΡ) (Μ+Η)+442,0; Аналіз: розрахованого) для C22H33N3O2SF2+1,0 ТФК+1,6 Н2О: С, 49,32; Н, 6,42; N, 7,10. Виявлено: С, 49,39; Н, 6,66; N, 6,71. Приклад 11 N-{2-трет-Бутил-1-[(4,4дифлуорцикпогексил)метил]-1Н-бензимідазол-5іл}-N-метилетансульфонамід 35 2-трет-Бутил-1-[(4,4дифлуорциклогексил)метил]-N-метил-1Нбензимідазол-5-амін (49мг, 0,146ммоль) та каталітичну кількість DMAP розчиняли у 3мл ДХМ. Етансульфонілхлорид (0,018мл, 0,190ммоль) додавали та розчин перемішували при кімнатній температурі протягом 12 годин. Розчин промивали насиченим водним розчином NaHCO3, розсолом та сушили безводним MgSO4. Розчинник випарювали та продукт очищали зворотно-фазовою ВЕРХ, застосовуючи 10-70% CH3CN/H2O та ліофілізували, отримуючи титульну сполуку як відповідний трифлуорацетат. Вихід: 58мг (73%). 1Н ЯМР (600МГц, MeOD) δ 1,31 (t, J=7,42Гц, 3Η), 1,34-1,41 (m, 2Η), 1,54-1,62 (m, 2Η), 1,69 (s, 9Η), 1,72-1,80 (m, 2Η), 2,03-2,11 (m, 2Η), 2,23-2,30 (m, 1Η), 3,17 (q, J=7,25Гц, 2Η), 3,41 (s, 3Η), 4,56 (d, J=7,68Гц, 2Η), 7,70 (dd, J=8,96, 2,05Гц, 1Η), 7,82 (d, J=2,05Гц, 1Η), 7,96 (d, J=8,96Гц, 1Η); MC (ΙΕΡ) (Μ+Η)+ 428,0. Приклад 12 N-{2-трет-Бутил-1-[(4,4дифлуорциклогексил)метил]-1Н-бензимідазол-5іл}пропан-1-сульфонамід 87327 36 N-(4-Флуор-3-нітрофеніл)ацетамід (1,15г, 5,84ммоль) та [(4,4дифлуорциклогексил)метил]амін гідрохлорид (1,30г, 7,59ммоль) перемішували у 30мл EtOH, що містить TEA (2,40мл, 17,5ммоль) при 80°С протягом 48 годин. Розчинник випарювали. Залишок розчиняли у ЕtOАс та промивали водним 5% розчином KHSO4, насиченим водним розчином NaHCO3, насиченим водним розчином NaCI та сушили безводним Na2SO4. Продукт кристалізували з ЕtOАс. Маточник очищали флешхроматографією на силікагелі, застосовуючи 2:1/гексани:ацетон як елюент. Вихід: 1,50г (78%). 1 Н ЯМР (400МГц, хлороформ-D) δ 1,33-1,47 (m, 2Η), 1,66-1,77 (m, 2Η), 1,77-1,86 (m, 1Η), 1,89-1,93 (m, 1Η), 1,93-1,97 (m, 1Η), 2,10-2,17 (m, 2Η), 2,18 (s, 3Η), 3,23 (dd, J=6,74, 5,76Гц, 2Η), 6,83 (d, J=9,37Гц, 1Η), 7,15 (s, 1Η), 7,80 (dd, J=9,18, 2,54Гц, 1Η), 8,09 (d, J=2,54Гц, 2Η). Етап С: N-(3-Аміно-4-{[(4,4дифлуорцикпогексил)метил]аміно}феніл)ацетамід Етап А: N-{2-трет-Бутил-1-[(4,4дифлуорциклогексил)метил]-1Н-бензимідазол-5іл}пропан-1-сульфонамід 2-трет-Бутил-1-[(4,4дифлуорциклогексил)метил]-1Н-бензимідазол-5амін (стосовно отримання, дивись наступні етапи В - Е) (45мг, 0,140ммоль) та каталітичну кількість DMAP розчиняли у 3мл ДХМ. Пропансульфонілхлорид (0,020мл, 0,182ммоль) додавали та розчин перемішували при кімнатній температурі протягом 4 годин. Розчин промивали насиченим водним розчином NaHCO3, розсолом та сушили безводним MgSO4. Розчинник випарювали та продукт очищали зворотно-фазовою ВЕРХ, застосовуючи 10-70% CH3CN/H2O та ліофілізува-ли, отримуючи титульну сполуку як відповідний трифлуорацетат. Вихід: 39мг (51%). 1Н ЯМР (600МГц, CD3OD) δ 1,00 (t, J=7,55Гц, 3Η), 1,53-1,61 (m, 2Η), 1,67 (s, 9Η), 1,70-1,77 (m, 3Η), 1,77-1,85 (m, 3Η), 2,02-2,11 (m, 2Η), 2,22-2,29 (m, 1Η), 3,08-3,13 (m, 2Η), 4,53 (d, J=7,42Гц, 2Η), 7,41 (dd, J=9,09, 1,92Гц, 1Η), 7,75 (d, J=1,79Гц, 1Η), 7,89 (d, J=9,22Гц, 1Η); МС (ІЕР) (М+Н)+ 428,0. Етап В: N-(4-{[(4,4Дифлуорциклогексил)метил]аміно}-3нітрофеніл)ацетамід N-(4-{[(4,4-Дифлуорциклогексил)метил]аміно}3-нітрофеніл)ацетамід (1,48г, 4,52ммоль) розчиняли у 50мл ЕtOАс, що містить каталітичну кількість 10% Pd/C. Розчин струшували в апараті Парра в атмосфері водню (45фунт/кв.дюйм) при кімнатній температурі протягом 24 годин. Розчин фільтрували через броунмілерит та розчинник випарювали. Вихід: 1,32г (98%). 1Н ЯМР (400МГц, хлороформ-D) δ 1,31-1,43 (m, 2Η), 1,64-1,73 (m, 2Η), 1,74-1,82 (m, 1Η), 1,89-1,93 (m, 1Η), 1,93-1,96 (m, 1Η), 2,08-2,17 (m, 5Η), 3,00 (d, J=6,64Гц, 2Η), 3,273,46 (m, 2Η), 6,55 (d, J=8,40Гц, 1Η), 6,70 (dd, J=8,40, 2,34Гц, 1Η), 7,01 (s, 1Η), 7,13 (d, J=2,34Гц, 1Η). Етап D: N-{2-трет-Бутил-1-[(4,4дифлуорциклогексил)метил]-1Н-бензимідазол-5іл}ацетамід N-(3-Аміно-4-{[(4,4дифлуорциклогексил)метил]аміно}феніл)ацетамід (1,32г, 4,44ммоль) розчиняли у 100мл ДХМ, що містить DMAP (108мг, 0,89ммоль). Триметилаце 37 тилхлорид (0,60мл, 4,88ммоль) додавали краплями та розчин перемішували при кімнатній температурі протягом 2 годин. Розчин промивали насиченим водним розчином NaHCO3, насиченим водним розчином NaCI та сушили безводним Na2SO4. Частина продукту осаджувалася протягом промивки та її фільтрували. Органічну фазу випарювали та комбінували з осадом. Продукт розчиняли у 30мл АсОН та поміщали у 6 герметичних туб (5мл/туб). Кожну тубу гріли при 150°С у мікрохвильовій апаратурі Personal Chemistry протягом 2,5 годин. Фракції поєднували та розчинник випарювали. Продукт розчиняли у ЕtOАс та промивали водним розчином NaHCO3, насиченим водним розчином NaCI та сушили безводним Na2SO4. Продукт очищали флеш-хроматографією на силікагелі, застосовуючи 2:1/ацетон:гексани як елюент. Вихід: 1,11г (68%). 1Н ЯМР (400МГц, метанолі) δ 1,40-1,49 (m, 2Η), 1,52 (s, 9Η), 1,60-1,65 (m, 2Η), 1,67-1,77 (m, 1Η), 1,96-2,06 (m, 3Η), 2,11 (s, 3Η), 2,15-2,23 (m, 1Η), 4,28 (d, J=7,62Гц, 2Η), 7,35-7,39 (m, 1Η), 7,40-7,44 (m, 1Η), 7,85 (d, J=1,76Гц, 1Η). Етап Е: 2-трет-Бутил-1-[(4,4дифлуорциклогексил)метил]-1Н-бензимідазол-5амін N-{2-трет-Бутил-1-[(4,4дифлуорциклогексил)метил]-1Н-бензимідазол-5іл}ацетамід (500мг, 1,37ммоль) розчиняли у 10мл 1:1/ЕtOН:2М НСІ. Розчин розділяли у дві герметичні туби (5мл/туб). Кожну тубу гріли при 120°С у мікрохвильовій апаратурі Personal Chemistry протягом 1 години. Фракції поєднували та розчинник випарювали. Залишок розбавляли 2М NaOH та екстрагували (3Х) ЕtOАс. Органічну фазу промивали насиченим водним розчином NaCI та сушили безводним Na2SO4. Розчинник випарювали Вихід: 440мг (99%). 1Н ЯМР (400МГц, хлороформ-D) δ 1,40-1,52 (m, 2Η), 1,52-1,54 (m, 9Η), 1,56-1,66 (m, 4Η), 1,68-1,75 (m, 2Η), 2,07-2,17 (m, 3Η), 4,14 (d, J=7,62Гц, 2Η), 6,65 (dd, J=8,50, 2,25Гц, 1Η), 7,047,09 (m, 2Η). Приклад 13 N-{2-тpeт-Бyтил-1-[(4,4дифлyopциклoгeкcил)мeтил]-1H-бeнзимiдaзoл-5іл}метансульфонамід 2-трет-Бутил-1-[(4,4дифлуорциклогексил)метил]-1Н-бензимідазол-5амін (40мг, 0,124ммоль) та каталітичну кількість DMAP розчиняли у 3мл ДХМ. Метансульфонілхлорид (0,012мл, 0,149ммоль) додавали та розчин перемішували при кімнатній температурі протягом 87327 38 2 годин. Розчин промивали насиченим водним розчином NaHCO3, розсолом та сушили безводним MgSO4. Розчинник випарювали та продукт очищали зворотно-фазовою ВЕРХ, застосовуючи 10-70% CH3CN/H2O та ліофілізували, отримуючи титульну сполуку як відповідний трифлуора-цетат. Вихід: 50мг (79%). 1H ЯМР (600МГц, MeOD) δ 1,531,61 (m, 2Η), 1,67 (s, 9Η), 1,71-1,76 (m, 3Η), 1,761,82 (m, 1Η), 2,04-2,11 (m, 2Η), 2,23-2,29 (m, 1Η), 3,01 (s, 3Η), 4,54 (d, J=7,68Гц, 2Η), 7,42 (dd, J=9,22, 2,05Гц, 1Η), 7,75 (d, J=1,79Гц, 1Η), 7,91 (d, J=8,96Гц, 1Η); MC (ΙΕΡ) (М+Н)+ 400,0; Аналіз: розраховано (%) для C19H27N3O2SF2+1,9 ТФК+0,1 Н2О: С, 44,32; Н, 4,75; N, 6,80. Виявлено: С, 44,34; Н, 4,78; N, 6,55. Приклад 14 N-{2-трет-Бутил-1-[(4,4дифлуорциклогексил)метил]-1Н-бензимідазол-5іл}етансульфонамід 2-трет-Бутил-1-[(4,4дифлуорциклогексил)метил]-1Н-бензимідазол-5амін (440мг, 1,37ммоль) та DMAP (165мг, 1,37ммоль) розчиняли у 50мл ДХМ. Етансульфонілхлорид (0,170мл, 1,78ммоль) додавали краплями та розчин перемішували при кімнатній температурі протягом 2,5 годин. Розчин промивали насиченим водним розчином NaHCO3, насиченим водним розчином NaCI та сушили безводним Na2SO4. Продукт очищали флеш-хроматографією на силікагелі, застосовуючи EtOAc як елюент. Фракції концентрували та залишок розчиняли у 25мл МеОН. ТФК (0,155мл, 2,06ммоль) додавали краплями та розчин перемішували при кімнатній температурі протягом 30 хвилин. Розчинник випарювали та продукт осаджували в етері, ліофілізували, отримуючи титульну сполуку як відповідний трифлуорацетат. Вихід: 565мг (78%). 1Н ЯМР (400МГц, метанол-D4) δ 1,29 (t, J=7,42Гц, 3Η), 1,481,60 (m, 2Η), 1,64 (s, 9Η), 1,66-1,72 (m, 2Η), 1,731,82 (m, 2Η), 1,99-2,09 (m, 2Η), 2,18-2,28 (m, 1Η), 3,11 (m, 2Η), 4,50 (d, J=7,62Гц, 2Η), 7,38 (dd, J=9,08, 2,05Гц, 1Η), 7,72 (d, J=2,15Гц, 1Η), 7,85 (d, J=8,98Гц, 1Η); МС (ІЕР) (М+Н)+ 414,0. Приклад 15 N-{2-трет-Бутил-1-[(4,4дифлуорциклогексил)метил]-1Н-бензимідазол-5іл}циклопропансульфонамід 2-трет-Бутил-1-[(4,4дифлуорциклогексил)метил]-1Н-бензимідазол-5амін (300мг, 0,934ммоль) та DMAP (115мг, 0,934ммоль) розчиняли у 10мл ДХМ. Циклопропа 39 нсульфонілхлорид (170мг, 1,21ммоль) додавали та розчин перемішували при кімнатній температурі протягом 2 годин. Розчин промивали насиченим водним розчином NaHCCb, розсолом та сушили безводним MgSO4. Продукт очищали флешхроматографією на силікагелі, застосовуючи ЕtOАс як елюент. Фракції концентрували та залишок розчиняли у 25мл МеОН. ТФК (0,143мл, 1,86ммоль) додавали краплями та розчин перемішували при кімнатній температурі протягом 30 хвилин. Розчинник випарювали та продукт осаджували в етері, ліофілізували, отримуючи титульну сполуку як відповідний трифлуорацетат. Вихід: 390мг (77%) 1Н ЯМР (400МГц, метанол-D4) δ 0,91-0,97 (m, 2Η), 1,02-1,08 (m, 2Η), 1,48-1,60 (m, 2Η), 1,65 (s, 9Η), 1,67-1,75 (m, 3Η), 1,75-1,82 (m, 1Η), 2,00-2,10 (m, 2Η), 2,18-2,28 (m, 1Η), 2,53-2,61 (m, 1Η), 4,50 (d, J=7,42Гц, 2Η), 7,42 (dd, J=8,98, 2,15Гц, 1Η), 7,74 (d, J=1,56Гц, 1Η), 7,85 (d, J=8,79Гц, 1Η); МС (ІЕР) (М+Н)+ 426,0; Аналіз: розраховано (%) для C21H29N3O2SF2+1,0 ТФК; С, 51,20; Н, 5,60; N, 7,79. Виявлено: С, 51,38; Н, 5,66; N, 7,56. Приклад 16 N-{2-трет-Бутил-1-[(4,4дифлуорциклогексил)метил]-1Н-бензимідазол-5іл}-N-метилциклопропансульфонамід 2-трет-Бутил-1-[(4,4дифлуорциклогексил)метил]-1Н-бензимідазол-5амін (65мг, 0,202ммоль) та каталітичну кількість DMAP розчиняли у 5мл ДХМ. Циклопропансульфонілхлорид (34мг, 0,242ммоль) додавали та розчин перемішували при кімнатній температурі протягом 6 годин. Розчин промивали насиченим водним розчином NaHCO3, розсолом та сушили безводним MgSO4 Розчинник випарювали Залишок розчиняли у 5мл ДМФ при 0°С та додавали NaH (12мг, 0,303ммоль). Розчин перемішували при 0°С протягом 15 хвилин. Метилйодид (0,025мл, 0,404ммоль) додавали та розчин перемішували при кімнатній температурі протягом 2 годин. Реакцію гасили насиченим водним розчином NaHCO3 та розчинник випарювали. Продукт розчиняли у ЕtOАс та промивали водним розчином NaHCO3, насиченим водним розчином NaCI та сушили безводним Na2SO4. Розчинник випарювали та продукт очищали зворотно-фазовою ВЕРХ, застосовуючи 10-70% CH3CN/H2O та ліофілізували, отримуючи титульну сполуку як відповідний трифлуорацетат. Вихід: 60мг (54%). 1Н ЯМР (600МГц, CD3OD) δ 0,90-0,94 (m, 2Η), 0,97-1,01 (m, 2Η), 1,54-1,62 (m, 2Η), 1,68 (s, 9Η), 1,73-1,81 (m, 4Η), 2,03-2,11 (m, 2Η), 2,23-2,30 (m, 1Η), 2,59-2,65 (m, 1Η), 3,43 (s, 3Η), 4,56 (d, J=7,68Гц, 2Η), 7,72 (d, J=9,47Гц, 1Η), 7,81 (s, 1Η), 7,95 (d, J=8,96Гц, 1Η); МС (ІЕР) (М+Н)+ 440,0. Приклад 17 87327 40 N-{2-трет-Бутил-1-[(4,4дифлуорциклогексил)метил]-1Н-бензимідазол-5іл}-2-метилпропан-2-сульфонамід 2-трет-Бутил-1-[(4,4дифлуорциклогексил)метил]-1Н-бензимідазол-5амін (66мг, 0,205ммоль) та DMAP (25мг, 0,205ммоль) розчиняли у 5мл ДХМ. тбутилсульфінілхлорид (0,031мл, 0,246ммоль) додавали та розчин перемішували при кімнатній температурі протягом 2 годин. Розчин промивали насиченим водним розчином NaHCO3, розсолом та сушили безводним MgSO4. 3Хлорпероксибензойну кислоту (90мг, 0,410ммоль) додавали та розчин перемішували при кімнатній температурі протягом 12 годин. Розчин промивали насиченим водним розчином NaHCO3, розсолом та сушили безводним MgSO4. Продукт очищали зворотно-фазовою ВЕРХ, застосовуючи 10-70% СН3СN/Н2О та ліофілізували, отримуючи титульну сполуку як відповідний трифлуорацетат. Вихід: 55мг (48%) 1Н ЯМР (400МГц, метанол-D4) δ 1,35 (s, 9Η), 1,49-1,60 (m, 2Η), 1,64 (s, 9Η), 1,68-1,75 (m, 3Η), 1,76-1,82 (m, 1Η), 2,00-2,09 (m, 2Η), 2,19-2,28 (m, 1Η), 4,50 (d, J=7,42Гц, 2Η), 7,42 (dd, J=9,08, 2,05Гц, 1Η), 7,81-7,86 (m, 2 Η); MC (ΙΕΡ) (Μ+Η)+ 442,0; Аналіз: розраховано (%) для C22H33N3O2SF2+1,2 ТФК+0,2 Н2О; С, 50,35; Н, 5,99; Ν, 7,22. Виявлено: С, 50,36; Н, 5,73; Ν, 7,08. Приклад 18 N-[1-[(4,4-Дифлуорциклогексил)метил]-2-(1,1дифлуоретил)-1Н-бензимідазол-5іл]циклопропансульфонамід Етап А: N-[1-[(4,4-Дифлуорциклогексил)метил]2-(1,1-дифлуоретил)-1Н-бензимідазол-5іл]циклопропансульфонамід N-[1-[(4,4-Дифлуорциклогексил)метил]-2-(1,1дифлуоретил)-1Н-бензимідазол-5-іл]ацетамід (стосовно отримання дивись наступний етап В) (95мг, 0,256ммоль) гріли у 5мл 1:1 2М НСІ:ЕtOН при 120°С протягом 1 години, застосовуючи мікрохвильову апаратуру Personal Chemistry. Розчинник випарювали. Залишок підлужували 2М NaOH та екстрагували (ЗХ) з ЕtOАс. Органічну фазу промивали насиченим водним розчином NaCI та сушили безводним Na2SO4. Розчинник випарювали. Про 41 дукт розчиняли у 5мл ДХМ, що містить DMAP (31мг, 0,256ммоль) та додавали циклопропансульфонілхлорид (53мг, 0,384ммоль). Розчин перемішували при кімнатній температурі протягом 3 годин. Розчин промивали насиченим водним розчином NaHCO3, розсолом та сушили безводним MgSO4. Розчинник випарювали та продукт очищали зворотно-фазовою ВЕРХ, застосовуючи 10-70% CH3CN/H2O та ліофілізували, отримуючи титульну сполуку як відповідний трифлуорацетат. Вихід: 35мг (25%). 1Н ЯМР (400МГц, метанол-D4) δ 0,880,95 (m, 2Η), 0,98-1,03 (m, 2Η), 1,39-1,51 (m, 2Η), 1,61-1,68 (m, 3Н), 1,70-1,79 (m, 1Η), 2,03 (s, 2Η), 2,15 (s, 1Η), 2,23 (m, 3Η), 2,47-2,55 (m, 1Η), 4,35 (d, J=7,62Гц, 2Η), 7,39 (dd, J=8,79, 1,95Гц, 1Η), 7,65 (d, J=8,79Гц, 1Η), 7,67 (d, J=2,15Гц, 1Η); MC (ΙΕΡ) (М+Н)+ 434,0; Аналіз: розраховано (%) для C19H23N3O2SF4+0,7 ТФК; С, 47,74; Η, 4,65; Ν, 8,19. Виявлено: С, 47,88; Η, 4,68; Ν, 8,19. Етап В: N-[1-[(4,4-Дифлуорциклогексил)метил]2-(1,1-дифлуоретил)-1Н-бензимідазол-5іл]ацетамід N-(3-Аміно-4-{[(4,4Дифлуорциклогексил)метил]аміно}феніл)ацетамід (99мг 0,333ммоль), DIPEA (0,087мл, 0,500ммоль), HATU (140мг, 0,366ммоль) та 2,2дифлуорпропіонову кислоту (40мг, 0,366ммоль) перемішували у 5мл ДМФ при кімнатній температурі протягом 1 години. Розчинник випарювали. Залишок розчиняли у 3мл льодяної оцтової кислоти та гріли при 80°С протягом 2 годин. Розчинник випарювали. Продукт розчиняли у ЕtOАс та промивали водним розчином NaНСО3, насиченим водним розчином NaCI та сушили безводним Na2SO4. Продукт очищали флеш-хроматографією на силікагелі, застосовуючи ЕtOАс як елюент. Вихід: 100мг (81%). 1Н ЯМР (400МГц, хлороформ-D) δ 1,39-1,52 (m, 2Η), 1,57-1,63 (m, 1Η), 1,64-1,71 (m, 3Η), 2,06-2,16 (m, 3Η), 2,22 (s, 3Η), 2,29 (m, 3Η), 4,25 (d, J=7,42Гц, 2Η), 7,31 (s, 1Η), 7,35 (d, J=8,79Гц, 1Η), 7,60 (dd, J=8,89, 1,86Гц, 1Η), 7,86 (d, J=1,76Гц, 1Η). Приклад 19 N-[1-[(4,4-Дифлуорциклогексил)метил]-2-(1,1дифлуоретил)-1Н-бензимідазол-5іл]етансульфонамід N-[1-[(4,4-Дифлуорциклогексил)метил]-2-(1,1дифлуоретил)-1Н-бензимідазол-5-іл]ацетамід (80мг, 0,215ммоль) гріли у 5мл 1:1/2М НСІ: ЕtOН при 120°С протягом 1 години, застосовуючи мікро 87327 42 хвильову апаратуру Personal Chemistry. Розчинник випарювали. Залишок підлужували 2М NaOH та екстрагували (3Х) ЕtOАс. Органічну фазу промивали насиченим водним розчином NaCI та сушили безводним Na2SO4. Розчинник випарювали. Продукт розчиняли у 5мл ДХМ, що містить DMAP (31мг, 0,256ммоль) та додавали етансульфонілхлорид (0,026мл, 0,280ммоль). Розчин перемішували при кімнатній температурі протягом 2 годин. Розчин промивали насиченим водним розчином NaHCO3, розсолом та сушили безводним MgSO4. Розчинник випарювали та продукт очищали зворотно-фазовою ВЕРХ, застосовуючи 10-70% CH3CN/H2O та ліофілізували, отримуючи титульну сполуку як відповідний трифлуорацетат. Вихід: 22мг (19%). 1Н ЯМР (400МГц, метанол-D4) δ 1,29 (t, J=7,42Гц, 3Η), 1,36-1,49 (m, 2Η), 1,58-1,66 (m, 3Η), 1,67-1,78 (m, 1Η), 1,96-2,06 (m, 2Η), 2,112,15(m, 1Η), 2,21 (m, 3Η), 3,04 (m, 2Η), 4,33 (d, J=7,62Гц, 2Η), 7,34 (dd, J=8,98, 1,95Гц, 1Η), 7,64 (dd, J=5,47, 3,32Гц, 2 Η); MC (ΙΕΡ) (Μ+Η)+ 421,9; Аналіз: розраховано (%) для ЗΗ)+0,8 ТФК+0,1 Н2О: С, 45,76; Н, 4,70; N, 8,17. Виявлено: С, 45,73; Н, 4,52; N, 7,80. Приклад 20 N-[1-[(4,4-Дифлуорциклогексил)метил]-2-(1,1дифлуоретил)-1Н-бензимідазол-5-іл]-2метилпропан-2-сульфонамід N-[1-[(4,4-Дифлуорциклогексил)метил]-2-(1,1дифлуоретил)-1Н-бензимідазол-5-іл]ацетамід (185мг, 0,498ммоль) гріли у 5мл 1:1 /2М НСІ: ЕtOН при 120°С протягом 1 години, застосовуючи мікрохвильову апаратуру Personal Chemistry. Розчинник випарювали. Залишок підлужували 2М NaOH та екстрагували (3Х) з ЕtOАс. Органічну фазу промивали насиченим водним розчином NaCI та сушили безводним Na2SO4. Розчинник випарювали. Залишок розчиняли у 5мл ДХМ та додавали тбутилсульфінілхлорид (0,075мл, 0,598ммоль) та DMAP (25мг, 0,498ммоль). Розчин перемішували при кімнатній температурі протягом 1 години. Розчин промивали насиченим водним розчином NaHCO3, розсолом та сушили безводним MgSO4. 3-Хлорпероксибензойну кислоту (225мг, 0,996ммоль) додавали та розчин перемішували при кімнатній температурі протягом 4 годин. Розчин промивали насиченим водним розчином NaHCO3, розсолом та сушили безводним MgSO4. Продукт очищали зворотно-фазовою ВЕРХ, застосовуючи 10-70% CH3CN/H2O та ліофілізували, отримуючи титульну сполуку як відповідний трифлуорацетат. Вихід: 70мг (25%). 1Н ЯМР (400МГц, метанол-D4) δ 1,33 (s, 9Η), 1,37-1,49 (m, 2Η), 1,601,65 (m, 3Η), 1,68-1,78 (m, 1Η), 1,97-2,06 (m, 2Η), 2,11-2,14 (m, 1Η), 2,21 (m, 3Η), 4,32 (d, J=7,62Гц, 2Η), 7,40 (dd, J=8,89, 2,05Гц, 1Η), 7,59 (d, J=8,79Гц, 1Η), 7,70 (d, J=1,95Гц, 1Η); MC (ΙΕΡ) (Μ+Η)+ 449,8. Приклад 21 43 Ν-[2-(1,1-Дифлуоретил)-1-(тетрагідро-2Нпіран-4-ілметил)-1Н-бензимідазол-5-іл]-Nметилетансульфонамід Етап Α. Ν-[2-(1,1-дифлуоретил)-1-(тетрагідро2Н-піран-4-ілметил)-1Н-бензимідазол-5-іл]-Nметилетансульфонамід Етансульфонілхлорид (55μL, 0,58ммоль) додавали до розчину 2-(1,1-дифлуоретил)-N-метил1-(тетрагідро-2Н-піран-4-ілметил)-1Нбензимідазол-5-аміну (150мг, 0,48ммоль) та DMAP (71мг, 0,58ммоль) у ДХМ (15мл) при температурі довкілля. Реакційну суміш перемішували протягом ночі та розчинник концентрували. Продукт очищали зворотно-фазовою препаративною ВЕРХ, застосовуючи градієнт MeCN 10-90% у воді для отримання трифлуорацетату титульної сполуки як білий твердий матеріал. Вихід: 70мг (28%); 1Н ЯМР (400МГц, CD3OD) δ 1,24-1,37 (m, 3Η), 1,36-1,53 (m, 4Η), 2,12-2,32 (m, 3Η), 3,05-3,17 (m, 2Η), 3,25-3,31 (m, 2Η), 3,33 (d, J=3,71Гц, 1Η), 3,36 (s, 2Η), 3,89 (m, 2Η), 4,33 (d, J=7,42Гц, 2Η), 7,49 (dd, J=8,79, 1,95Гц, 1Η), 7,69 (d, J=8,98Гц, 1Η), 7,77 (d, J=1,76Гц, 1Η); MC (ΙΕΡ) (Μ+Η)+ 402,0; Етап В. N-{5-[Ацетил(метил)аміно]-2[(тетрагідро-2Н-піран-4-ілметил)аміно]феніл}-2,2дифлуорпропанамід HATU (1,44г, 3,78ммоль) та N-{3-аміно-4[(тетрагідро-2Н-піран-4-ілметил)аміно]феніл}-Nметилацетамід (1,00г, 3,60ммоль) (стосовно отримання, дивись Приклад 1, етапи В до Е) додавали до розчину 2,2-дифлуорпропанової кислоти (0,40г, 3,60ммоль) та DIPEA (0,75мл, 4,32ммоль) у ДМФ (100мл) при кімнатній температурі. Реакційну суміш перемішували протягом ночі. Розчинник концентрували та сирий продукт переносили у ЕtOАс. Органіку промивали водою, насиченим розчином NaHCO3 та розсолом. Органічний шар сушили безводним Na2SO4 та фільтрували. Розчинник концентрували, отримуючи титульну сполуку, що застосовували на наступному етапі без подальшої очистки. Вихід: 1,00г (75%); MC (IEP) (М+Н)+: 370,2. 87327 44 Етап С Ν-[2-(1,1-Дифлуоретил)-1-(тетрагідро2Н-піран-4-ілметил)-1Н-бензимідазол-5-іл]-Nметилацетамід N-{5-[Ацетил(метил)аміно]-2-[(тетрагідро-2Нпіран-4-ілметил)аміно]феніл}-2,2дифлуорпропанамід (1,00г, 2,70ммоль) гріли до 90°С протягом ночі в оцтовій кислоті (20мл). Розчинник концентрували. Сирий продукт очищали флеш-хроматографією на силікагелі, застосовуючи МеОН 3,5% та ацетон 8% у ДХМ як елюент, отримуючи титульну сполуку. Вихід: 0,48г (50%); МС (ІЕР) (М+Н)+: 352,0. Етап D. 2-(1,1-дифлуоретил)-N-метил-1(тетрагідро-2Н-піран-4-ілметил)-1Н-бензимідазол5-амін N-[2-(1,1-Дифлуоретил)-1-(тетрагідро-2Нпіран-4-ілметил)-1Н-бензимідазол-5-іл]-Nметилацетамід (0,48г, 1,37ммоль) гріли до 80°С протягом ночі у концентрованій НСІ (80мл). Реакційну суміш охолоджували до 0°С та доводили до слабко основного рН, застосовуючи розчин NaOH. Сполуку екстрагували ЕtOАс (3Х) та комбіновані органічні шари промивали розсолом, сушили безводним Na2SO4 та фільтрували. Розчинник концентрували, отримуючи титульну сполуку, що застосовували на наступному етапі без подальшої очистки. Вихід: 0,42г (98%); МС (ІЕР) (М+Н)+: 310,2. Приклад 22 Ν-[2-(1,1-Дифлуоретил)-1-(тетрапдро-2Нпіран-4-ілметил)-1Н-бензимідазол-5-іл]-Nметилпропан-1-сульфонамід Способом етапу А у прикладі 21 та, застосовуючи пропансульфонілхлорид (65мкл, 0,58ммоль) отримано трифлуорацетат титульної сполуки як білий твердий матеріал. Вихід: 68мг (26%); 1Н ЯМР (400МГц, CD3OD) δ 1,02 (t, J=7,42Гц, 3Η), 1,40-1,54 (m, 4Η), 1,74-1,87 (m, 1Η), 2,17-2,34 (m, 3Η), 3,053,15 (m, 2Η), 3,32-3,37 (m, 2Η), 3,37 (s, 3Η), 3,853,97 (m, 2Η), 4,35 (d, J=7,62Гц, 2Η), 7,50 (dd, J=8,89, 2,05Гц, 1Η), 7,71 (d, J=8,79Гц, 1Η), 7,78 (d, J=1,95Гц, 1Η); MC (ΙΕΡ) (Μ+Η)+416,0; Аналіз: розраховано для C19H25F2N3O2S+0,1 MeCN: С, 54,96; 45 Η, 6,56; Ν, 10,35. Виявлено: С, 55,02; Η, 6,40; Ν, 10,24. Приклад 23 Ν-[2-(1,1-Дифлуоретил)-1-(тетрагідро-2Нпіран-4-ілметил)-1Н-бензимідазол-5-іл]-Nметилциклопропансульфонамід Способом етапу А у прикладі 21, застосовуючи циклопропансульфонілхлорид (81мкл, 0,58ммоль) та гріючи до 60°С протягом ночі, отримано трифлуорацетат титульної сполуки як білий твердий матеріал. Вихід: 135мг (52%); 1Н ЯМР (400МГц, CD3OD) δ 0,85-0,93 (m, 2Η), 0,93-1,03 (m, 2Η), 1,391,55 (m, 4Η), 2,24 (m, 3Η), 2,55-2,66 (m, 1Η), 3,313,38 (m, 3Η), 3,39 (s, 3Η), 3,86-3,97 (m, 2Η), 4,36 (d, J=7,42Гц, 2Η), 7,52 (dd, J=8,79, 2,15Гц, 1Η), 7,70 (d, J=8,79Гц, 1Η), 7,81 (d, J=2,15Гц, 1Η); MC (ΙΕΡ) (Μ+Η)+ 414,0; Аналіз: розраховано для C19H25F2N3O2S+0,1 Н2О: С, 54,95; Н, 6,12; N, 10,12. Виявлено: С, 54,91; Н, 6,09; N, 9,68. Приклад 24 N-{2-трет-Бутил-1-[(4флуорциклогексил)метил]-1Н-бензимідазол-5іл}етансульфонамід Етап А: N-{2-трет-Бутил-1-[(4флуорциклогексил)метил]-1Н-бензимідазол-5іл}етансульфонамід 2-трет-Бутил-1-[(4-флуорциклогексил)метил]1Н-бензимідазол-5-амін (стосовно отримання дивись наступні етапи В - F) (60мг, 0,198ммоль) та DMAP (24мг, 0,198ммоль) розчиняли у 5мл ДХМ. Етансульфонілхлорид (0,025мл, 0,257ммоль) додавали та розчин перемішували при кімнатній температурі протягом 2 годин. Розчин промивали насиченим водним розчином NaHCO3, розсолом та сушили безводним MgSO4. Розчинник випарювали та продукт очищали зворотно-фазовою ВЕРХ, застосовуючи 10-70% CH3CN/H2O та ліофілізували, отримуючи титульну сполуку як відповідний трифлуорацетат. Вихід: 50мг (50%). 1Н ЯМР (400МГц, метанолом δ 1,29 (t, J=7,42Гц, 3Η), 1,341,41 (m, 2Η), 1,43-1,51 (m, 1Η), 1,53-1,62 (m, 1Η), 1,63-1,66 (m, 9Η), 1,69-1,75 (m, 2Η), 1,96-2,04 (m, 1Η), 2,06-2,12 (m, 2Η), 3,12 (q, J=7,42Гц, 2Η), 4,444,49 (m, 2Η), 7,39 (dd, J=9,08, 2,05Гц, 1Η), 7,73 (d, J=2,15Гц, 1Η), 7,85 (d, J=9,18Гц, 0,7Η), 7,85-7,88 (d, 87327 46 J=9,18Гц, 0,3Н); МС (ІЕР) (М+Н)+ 396,0; Аналіз: розраховано (%) для C20H30N3O2SF+1,3 ТФК+0,5 Н2О: С, 49,11; Н, 5,89; N, 7,60. Виявлено: С, 49,10; Н, 5,84; N, 7,52. Етап В: трет-Бутил [(4-флуорциклогекс-3-ен-1іл)метил]карбамат 4-N-Вос-амінометилциклогексанон (4,95г, 21,8ммоль) розчиняли у 80мл ТГФ. DAST (4,3мл, 32,7ммоль) додавали краплями та розчин перемішували при 50°С протягом 5 годин. Розчинник концентрували та продукт очищали флешхроматографією на силікагелі, застосовуючи 3:1 гексани:ЕtOАс як елюент. Вихід: 1,62г (30%). 1Н ЯМР (400МГц, хлороформ-D) δ 1,36-1,42 (m, 1Η), 1,44 (s, 9Η), 1,70-1,80 (m, 2Η), 1,82-1,90 (m, 1Η), 2,09-2,17 (m, 1Η), 2,17-2,29 (m, 2Η), 3,04-3,11 (m, 2Η), 4,61 (s, 1Η), 5,11-5,15 (m, 0,5Η), 5,16-5,19 (m, 0,5Η). Етап С: [(4-Флуорциклогекс-3-ен-1іл)метил]амін гідрохлорид трет-Бутил [(4-флуорцикпогекс-3-ен-1іл)метил]карбамат (1,62г, 7,06ммоль) перемішували у 25мл 1Μ НСІ/АсОН при кімнатній температурі протягом 2 годин. Розчинник випарювалита продукт осаджували в етері, фільтрували та сушили під вакуумом. Вихід: 1,13г (97%). 1Н ЯМР (400МГц, метанолі) δ 1,44-1,53 (m, 1Η), 1,80-1,89 (m, 2Η), 1,90-1,98 (m, 1Η), 2,16-2,23 (m, 2Η), 2,26-2,34 (m, 1Η), 2,88 (d, J=6,25Гц, 2Η), 5,12-5,19 (m, 1Η). Етап С: N-(4-{[(4-Флуорциклогекс-3-ен-1іл)метил]аміно}-3-нітрофеніл)ацетамід N-(4-Флуор-3-нітрофеніл)ацетамід (460мг, 2,32ммоль) та [(4-флуорциклогекс-3-ен-1іл)метил]амін гідрохлорид (350мг, 2,11ммоль) перемішували у 20мл ЕtOН, що містить TEA (0,735мл, 5,28ммоль) при 75°С протягом 48 годин. Розчинник концентрували. Залишок розчиняли у ЕtOАс та промивали водним 5% KHSO4, насиченим водним розчином NaHCO3, розсолом та сушили безводним MgSO4. Сирий продукт очищали флеш-хроматографією на силікагелі, застосовуючи 2:1/гексани:ацетон як елюент. Вихід: 553мг (85%). 1Н ЯМР (400МГц, хлороформ-D) δ 1,51-1,61 (m, 1Η), 1,84-1,93 (m, 1Η), 1,96-2,03 (m, 2Η), 2,162,18 (m, З Н), 2,22-2,32 (m, 3Η), 3,26 (m, 2Η), 5,19 (m, 1Η), 6,84 (d, J=9,37Гц, 1Η), 7,21 (s, 1Η), 7,79 (dd, J=9,18, 2,54Гц, 1Η), 8,09 (d, J=2,54Гц, 2Η). 47 Етап D: N-(3-Аміно-4-{[(4флуорциклогексил)метил]аміно}феніл)ацетамід N-(4-{[(4-Флуорциклогекс-3-ен-1іл)метил]аміно}-3-нітрофеніл)ацетамід (340мг, 1,11ммоль) розчиняли у 25мл ЕtOАс, що містить каталітичну кількість 10% Pd/C. Розчин струшували в атмосфері водню (40фунт/кв.дюйм), застосовуючи апарат Парра при кімнатній температурі протягом 48 годин. Розчин фільтрували через броунмілерит та розчинник випарювали. Вихід: 308мг (99%). МС (ІЕР) (М+Н)+279,95. Етап Е: N-{2-трет-Бутил-1-[(4флуорциклогексил)метил]-1Н-бензимідазол-5іл}ацетамід N-(3-Аміно-4-{[(4флуорциклогексил)метил]аміно}феніл)ацетамід (300мг, 1,07ммоль) та DMAP (25мг, 0,214ммоль) розчиняли у 10мл ДХМ. Триметилацетилхлорид (0,145мл, 1,18ммоль) додавали краплями та розчин перемішували при кімнатній температурі протягом 1 години. Розчин промивали водним розчином NaHCO3, розсолом та сушили безводним MgSO4. Залишок розчиняли у 5мл АсОН та гріли при 150°С протягом 2,5 годин, застосовуючи мікрохвильову апаратуру Personal Chemistry. Розчинник випарювали. Залишок розчиняли у ЕtOАс та промивали водним розчином NaHCO3, розсолом та сушили безводним MgSO4. Сирий продукт очищали флеш-хроматографією на силікагелі, застосовуючи 2:1/ацетонтексани як елюент. Вихід: 196мг (53%). 1Н ЯМР (400МГц, хлороформ-D) δ 1,14-1,25 (m, 2Η), 1,37-1,45 (m, 1Η), 1,43-1,51 (m, 1Η), 1,54-1,57 (m, 9Η), 1,70-1,78 (m, 2Η), 1,70-1,77 (m, 1Η), 2,02-2,08 (m, 1Η), 2,10-2,17 (m, 1Η), 2,192,21 (m, 3Η), 4,12-4,19 (m, 2Η), 4,53 (m, 0,3Η), 4,73 (m, 0,3Η), 4,78 (m, 0,2Η), 4,90 (m, 0,2Η), 7,21-7,29 (m, 1Η), 7,30 (s, 1Η), 7,50-7,57 (m, 1Η), 7,64-7,67 (m, 1Η). Етап F: 2-трет-Бутил-1-[(4флуорциклогексил)метил]-1Н-бензимідазол-5-амін N-{2-трет-Бутил-1-[(4флуорциклогексил)метил]-1Н-бензимідазол-5іл}ацетамід (190мг, 0,550ммоль) гріли у 5мл 1:1/2М НСІ: ЕЮН при 120°С протягом 1 години, застосовуючи мікрохвильову апаратуру Personal Chemistry. Розчинник випарювали. Залишок підлужували 2М NaOH та екстрагували (3Х) з ЕtOАс. 87327 48 Органічну фазу промивали насиченим водним розчином NaCI та сушили безводним Na2SO4. Розчинник випарювали. Вихід: 154мг (92%). 1Н ЯМР (400МГц, метанолі) δ 1,28-1,39 (m, 2Η), 1,41-1,50 (m, 1Η), 1,53-1,59 (m, 1Η), 1,61-1,64 (m, 9Η), 1,69 (d, J=7,81Гц, 2Η), 1,95-2,03 (m, 0,7Η), 2,05-2,11 (m, 2Η), 2,13-2,22 (m, 0,3Η), 4,37-4,44 (m, 2,7Η), 4,474,56 (m, 0,3Η), 7,11 (t, J=2,05Гц, 0,5 Η,) 7,13 (t, J=2,05Гц, 0,5Η), 7,15-7,18 (m, 1Η), 7,67-7,73 (m, 1Η). Приклад 25 N-{2-трет-Бутил-1-[(4флуорциклогексил)метил]-1Н-бензимідазол-5іл}циклопропансульфонамід 2-трет-Бутил-1-[(4-флуорциклогексил)метил]1Н-бензимідазол-5-амін (56мг, 0,199ммоль) та DMAP (25мг, 0,199ммоль) розчиняли у 5мл ДХМ. Циклопропансульфонілхлорид (42мг, 0,298ммоль) додавали та розчин перемішували при кімнатній температурі протягом З годин. Розчин промивали насиченим водним розчином NaHCO3, розсолом та сушили безводним MgSO4. Розчинник випарювали та продукт очищали зворотно-фазовою ВЕРХ, застосовуючи 10-70% CH3CN/H2O та ліофілізували, отримуючи титульну сполуку як відповідний трифлу-орацетат. Вихід: 58мг (56%). 1Н ЯМР (400МГц, метанол-D4) δ 0,91-0,98 (m, 2Η), 1,031,09 (m, 2Η), 1,32-1,43 (m, 2Η), 1,45-1,52 (m, 1Η), 1,54-1,62 (m, 1Η), 1,64-1,67 (m, 9Η), 1,68-1,76 (m, 1Η), 1,97-2,05 (m, 1Η), 2,06-2,13 (m, 2Η), 2,54-2,62 (m, 1Η), 4,44-4,50 (m, 2Η), 4,53 (m, 0,5Η), 4,73 (m, 0,5Η), 7,43 (dd, J=9,08, 2,05Гц, 1Η), 7,75 (d, J=1,95Гц, 1Η), 7,83-7,89 (m, 1Η); MC (ΙΕΡ) (Μ+Η)+ 408,0. Приклад 26 N-{2-трет-Бутил-1-[(4флуорциклогексил)метил]-1Н-бензимідазол-5-іл}2-метилпропан-2-сульфонамід 2-трет-Бутил-1-[(4-флуорциклогексил)метил]1Н-бензимідазол-5-амін (53мг, 0,175ммоль) та DMAP (21мг, 0,175ммоль) розчиняли у 5мл ДХМ. т-бутилсульфінілхлорид (0,026мл, 0,210ммоль) додавали та розчин перемішували при кімнатній температурі протягом 1 години. Розчин промивали насиченим водним розчином NaHCO3, розсолом та сушили безводним MgSO4. 3Хлорпероксибензойну кислоту (78мг, 0,350ммоль) додавали та розчин перемішували при кімнатній температурі протягом 2 годин. Розчин промивали насиченим водним розчином NaHCO3, розсолом та сушили безводним МgSО4. Продукт очищали зворотно-фазовою ВЕРХ, застосовуючи 10-70% CH3CN/H2O та ліофілізували, отримуючи титульну 49 сполуку як відповідний трифлуорацетат. Вихід: 47мг (50%). 1Н ЯМР (400МГц, метанол-D4) δ 1,36 (s, 9Η), 1,38-1,44 (m, 2Η), 1,44-1,51 (m, 1Η), 1,541,60 (m, 1Η), 1,63-1,66 (m, 9Η), 1,69-1,75 (m, 2Η), 1,96-2,04 (m, 1Η), 2,06-2,14 (m, 2Η), 4,42-4,48 (m, 2Η), 4,53 (m, 0,5Η), 4,72 (m, 0,5Η), 7,42 (dd, J=8,98, 2,15Гц, 1Η), 7,79-7,86 (m, 2 Η); МС (ІЕР) (М+Н)+ 424,0. Приклад 27 N-{2-трет-бутил-1-[(4,4дифлуорциклогексил)метил]-1Н-бензимідазол-5іл}етансульфонамід Етап А. N-{2-трет-бутил-1-[(4,4дифлуорциклогексил)метил]-1Н-бензимідазол-5іл}етансульфонамід 87327 50 Етап С. Дифлуорциклогексил)метил]аміно}-3нітрофеніл)етансульфонамід N-(4-{[(4,4 N-(4-Флуор-3-нітрофеніл)етансульфонамід (26г, 0,107моль), [(4,4дифлуорциклогексил)метил]амін (приблизно 15г), DIPEA (20мл) та ДМСО (100мл) змішували разом та гріли до 65°С протягом ночі. Етаноламін (5г) додавали та реакційну суміш перемішували до повного зникнення N-(4-флуор-3нітрофеніл)етансульфонаміду (приблизно 4-5 годин.). Охолоджену до кімнатної температури реакційну суміш виливали у холодну воду (900мл). Продукт екстрагували ДХМ (5´200мл). Комбіновані органічні фази промивали НСІ2Ν (3´200мл) та сушили безводним Na2SO4. Розчинник видаляли та сирий продукт очищали на силікагелі флешхроматографією (це матеріал можна перекристалізувати, застосовуючи суміш ЕtOАс та гексану) для отримання титульного продукту (24,2г) як оранжевого твердого матеріалу. Етапи. N-(3-аміно-4-{[(4,4дифлуорциклогексил)метил]аміно}феніл)етансульфонамід N-{2-{[(4,4-дифлуорциклогексил)метил]аміно}5-[(етилсульфоніл)аміно]феніл}-2,2диметилпропанамід (22,3г, 0,051моль) (стосовно отримання, дивись наступні етапи В - Ε), PTSA*H2O (10,8г, 0,057моль) та ДМСО (100мл) змішували разом та гріли до 120°С протягом ночі. Охолоджену до кімнатної температури реакційну суміш виливали у холодну воду (600мл). Продукт екстрагували ДХМ (5´200мл). Комбіновані органічні фази промивали насиченим розчином NаНСО3 (4´200мл), розсолом та сушили безводним Na2SO4. Розчинник видаляли та сирий продукт очищали на силікагелі (ЕtOАсхексан 1:1) флешхроматографією (та обробляли активованим вугіллям) для отримання N-{2-трет-бутил-1-[(4,4дифлуорциклогексил)метил]-1Н-бензимідазол-5іл}етансульфонаміду (18,4г) як білий твердий матеріал. Етап В. N-(4-Флуор-3нітрофеніл)етансульфонамід N-(4-{[(4,4-Дифлуорциклогексил)метил]аміно}3-нітрофеніл)етансульфонамід (23,4г) та Pd/C 10% у ЕtOАс (800мл) струшували разом протягом ночі в атмосфері водню (50фунт/кв.дюйм) в апараті Парра. Реакційну суміш розбавляли МеОН (400мл) та фільтрували через шар броунмілериту. Розчинник видаляли для отримання бажаного титульного продукту (22,2г) як бежевого твердого матеріалу. Етап Е. N-{2-{[(4,4дифлуорциклогексил)метил]аміно}-5[(етилсульфоніл)аміно]феніл}-2,2диметилпропанамід EtSO2CI (21,5мл, 0,22моль) додавали краплями до суміші 4-флуор-3-нітроаніліну (29,6г, 0,19моль) та піридину (100мл) при 0°С. Реакційній суміші давали нагрітися до кімнатної температури та перемішували протягом ночі. Реакційну суміш розбавляли ЕtOАс (1L). Утворений розчин промивали НСІ2N (4´200мл), насиченим розчином NaHCO3 (4´200мл) та водою (4´200мл). Органічну фазу сушили безводним Na2SO4 та розчинник видаляли для отримання титульного продукту як бежевого твердого матеріалу (46,3г). Розчин т-BuCOCI (7,6г, 0,063моль) у ДХМ (150мл) повільно додавали до розчину N-(3-аміно4-{[(4,4дифлуорциклогексил)метил]аміно}феніл)етансульфонаміду (22г, 0,063моль) та Et3N (9,7мл, 0,069моль) у ДХМ (500мл) при 0°С. Реакційну суміш перемішували 51 87327 52 протягом З годин, при 0°С. ДХМ (300мл) та вод (200мл) додавали. Органічний шар відділяли та промивали водою (3´200мл), розсолом та сушили безводним Na2SO4. Розчинник видаляли та сирий продукт очищали на силікагелі флешхроматографією (ЕtOАстексан 1:1) для отримання титульного продукту (23,3г) як бежевого твердого матеріалу. Приклад 28 N-{2-трет-Бутил-1-[(4флуорциклогексил)метил]-1Н-бензимідазол-5іл}етансульфонамід (ізомери) N-{2-трет-Бутил-1-[(4флуорциклогексил)метил]-1Н-бензимідазол-5іл}етансульфонамід (60мг, трифлуорацетат, 0,117ммоль) відділяли на хіральній колонці AD, застосовуючи 10% ЕtOН/гексани (0,1% діетиламін), отримуючи відповідно Ізомер А (16мг) та Ізомер В (31мг). Ізомер А: 1Н ЯМР (400МГц, метанол-D4) δ 1,30 (t, J=7,42Гц, 3Η), 1,41-1,52 (m, 3Η), 1,54-1,63 (m, 3Η), 1,65 (s, 9Η), 1,97-2,05 (m, 2Η), 2,15-2,24 (m, 1Η), 3,13 (q, J=7,29Гц, 2Η), 4,47 (d, J=7,62Гц, 2Η), 4,72 (s, 0,5Η), 4,85 (s, 0,5Η), 7,38 (dd, J=8,98, 2,15Гц, 1Η), 7,73 (d, J=1,95Гц, 1Η), 7,85 (d, J=8,98Гц, 1Η); МС (ΙΕΡ) (Μ+Η)+395,8; Хіральна AD 15% ЕtOН/гексани (0,1% DEA) k'=2,97. Ізомер В: 1Н ЯМР (400МГц, метанол-D4) δ 1,30 (t, J=7,32Гц, 3Η), 1,34-1,39 (m, 2Η), 1,39-1,45 (m, 2Η), 1,65 (s, 9Η), 1,70-1,75 (m, 2Η), 2,06-2,13 (m, 3Η), 3,13 (q, J=7,42Гц, 2Η), 4,37-4,43 (m, 0,5Η), 4,45 (d, J=7,62Гц, 2Η), 4,49-4,56 (m, 0,5Η), 7,39 (dd, J=9,08, 2,05Гц, 1Η), 7,73 (d, J=2,15Гц, 1Η), 7,84 (d, J=9,18Гц, 1Η); MC (ΙΕΡ) (Μ+Η)+ 395,8; Аналіз: розраховано для C20H30N3O2SF+1,2 ТФК+0,2 H2O: С, 50,20; Η, 5,94; Ν, 7,84. Виявлено: С, 50,13; Η, 5,81; Ν, 7,74; Хіральна AD 15%ЕtOН/гексани (0,1% DEA) k'=3,81. Ізомер Ki hCB1 (нМ) ЕК50 hCB1 (нМ) Emax hCB1 (%) рН розчину 7,4мкМ) А 148 64 В 14,8 4,9 103 381 Комп’ютерна верстка Т. Чепелева Підписне hClintмкл/хвилин/мг) 7,7 Тираж 28 прим. Міністерство освіти і науки України Державний департамент інтелектуальної власності, вул. Урицького, 45, м. Київ, МСП, 03680, Україна ДП “Український інститут промислової власності”, вул. Глазунова, 1, м. Київ – 42, 01601
ДивитисяДодаткова інформація
Назва патенту англійськоюBenzimidazole derivatives, composition containing thereof, the preparation and use thereof
Автори англійськоюPage Daniel, Liu Ziping, Tremblay Maxime, Walpole Christopher, Yang Hua
Назва патенту російськоюПроизводные бензимидазола, композиция, которая их содержит, их получение и применение
Автори російськоюПеидж Дениэл, Лю Зипинг, Трамбле Максим, Волпоул Кристофер, Янг Хуа
МПК / Мітки
МПК: C07D 405/06, A61P 25/16, A61P 25/28, A61P 25/22, A61K 31/4184, A61P 35/00, A61P 25/00, A61P 9/00, A61P 1/00
Мітки: похідні, одержання, містить, композиція, бензимідазолу, застосування
Код посилання
<a href="https://ua.patents.su/26-87327-pokhidni-benzimidazolu-kompoziciya-shho-kh-mistit-kh-oderzhannya-ta-zastosuvannya.html" target="_blank" rel="follow" title="База патентів України">Похідні бензімідазолу, композиція, що їх містить, їх одержання та застосування</a>
Попередній патент: Кришка для контейнера, зокрема для пляшки
Наступний патент: Похідні n-2 адамантаніл-2-феноксіацетаміду як інгібітори 11-бета гідроксистероїддегідрогенази
Випадковий патент: Спосіб виготовлення розгорток картонних упаковок і пристрій для його реалізації