Похідні гетероарилсульфонамідів, їх одержання і застосування для лікування людини
Номер патенту: 109295
Опубліковано: 10.08.2015
Автори: Дюпон-Пасселаж Елізабет, Піньє Крістоф, Ле Рой Ізабелль
Формула / Реферат
1. Сполука загальної формули І:
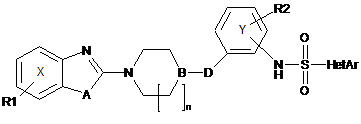 , I
, I
де
R1 є один або більше замісників фенільного ядра X, вибраних з групи, що включає: водень, галоген наприклад F, Сl або Вr, трифторметил, трифторметоксигрупу, лінійний або розгалужений С1-С4алкіл, а також лінійну або розгалужену С1-С4алкоксигрупу,
n дорівнює 0, 1 або 2,
А є киснем або сіркою,
D є -С(=О)-, -СН2О- або -О-,
В є азотом, якщо n=1 або 2, a D є -С(=О)-, або ж В є СН, якщо n=0, a D є -СН2О-, або якщо n=1, а D є -О-,
R2 є воднем, метилом, атомом фтору або хлору або метоксигрупою, і
HetAr є піридилом або хінолілом, що можливо містить замісник, наприклад лінійний або розгалужений С1-С4алкіл, лінійну або розгалужену С1-С4алкоксигрупу, галоген, наприклад F, Сl, або Вr, або трифторметил,
або одна з її фармацевтично прийнятних солей.
2. Сполука загальної формули І за п. 1, де вона є сполукою наступної формули Іа
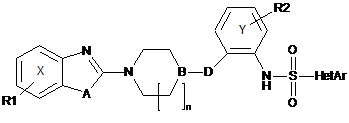 , Іа
, Іа
де R1, R2, А, В, D, n і HetAr такі, як визначено у п. 1,
або її фармацевтично прийнятна сіль.
3. Сполука загальної формули І за будь-яким з пп. 1 і 2, де:
R1 є один або більше замісників фенільного ядра, вибраних з групи, що включає: водень, галоген, наприклад F, Сl або Вr, трифторметил, трифторметоксигрупу, лінійний або розгалужений С1-С4алкіл і метоксигрупу,
n дорівнює 1,
А є киснем або сіркою,
D є -С(=О)- або -О-,
В є азотом, якщо D є -С(=О)-,
або ж В є СН, якщо D є -О-,
R2 є воднем, і
HetAr є 2-піридилом або 8-хінолілом, що можливо містить замісники, наприклад метил або трифторметил,
або одна з її фармацевтично прийнятних солей.
4. Сполука загальної формули І за будь-яким з пп. 1-3, де:
R1 є один або більше замісників фенільного ядра, наприклад водень, галоген, наприклад F, Сl або Вr, трифторметил, трифторметоксигрупа, лінійний або розгалужений С1-С4алкіл і метоксигрупа,
А є сіркою,
n дорівнює 1,
D є -С(=О)-,
В є азотом,
R2 є воднем, і
HetAre є 2-піридилом, що можливо містить замісник, наприклад метил або трифторметил,
або одна з її фармацевтично прийнятних солей.
5. Сполука загальної формули І за будь-яким з пп. 1-4, де вона вибрана из групи, що включає:
1) N-(2-(4-(6-фторбензо[d]оксазол-2-іл)піперазин-1-карбоніл)феніл)-5-(трифторметил)піридин-2-сульфонамід,
2) N-(2-(4-(6-фторбензо[d]тіазол-2-іл)піперазин-1-карбоніл)феніл)-піридин-2-сульфонамід,
3) N-(2-(4-(6-бромбензо[d]тіазол-2-іл)піперазин-1-карбоніл)феніл)-піридин-2-сульфонамід,
4) N-(2-(4-(6-хлорбензо[d]тіазол-2-іл)піперазин-1-карбоніл)феніл)-піридин-2-сульфонаміду гідрохлорид,
5) N-(2-(4-(4-метилбензо[d]тіазол-2-іл)піперазин-1-карбоніл)феніл)-піридин-2-сульфонамід,
6) N-(2-(4-(7-хлорбензо[d]тіазол-2-іл)піперазин-1-карбоніл)феніл)-піридин-2-сульфонамід,
7) N-(2-(4-(5-(трифторметил)бензо[d]тіазол-2-іл)піперазин-1-карбоніл)феніл)-піридин-2-сульфонамід,
8) N-(2-(4-(6-хлорбензо[d]тіазол-2-іл)піперазин-1-карбоніл)феніл)-5-(трифторметил)піридин-2-сульфонамід,
9) N-(2-(4-(6-бромбензо[d]тіазол-2-іл)піперазин-1-карбоніл)феніл)-6-метилпіридин-2-сульфонаміду дигідрохлорид,
10) N-(3-(4-(6-хлорбензо[d]оксазол-2-іл)піперазин-1-карбоніл)феніл)-піридин-2-сульфонамід,
11) N-(3-(4-(6-хлорбензо[d]тіазол-2-іл)піперазин-1-карбоніл)феніл)-піридин-2-сульфонамід,
12) N-(3-(4-(6-хлорбензо[d]тіазол-2-іл)піперазин-1-карбоніл)феніл)-6-метилпіридин-2-сульфонамід,
13) N-(4-(4-(6-фторбензо[d]оксазол-2-іл)піперазин-1-карбоніл)феніл)-піридин-2-сульфонамід,
14) N-(4-(4-(6-хлорбензо[d]оксазол-2-іл)піперазин-1-карбоніл)феніл)-піридин-2-сульфонамід,
15) N-(4-(4-(6-хлорбензо[d]тіазол-2-іл)піперазин-1-карбоніл)феніл)-піридин-2-сульфонамід,
16) N-(2-(4-(6-бромбензо[d]тіазол-2-іл)піперазин-1-карбоніл)феніл)-хінолін-8-сульфонамід,
17) N-(2-(4-(6-хлорбензо[d]оксазол-2-іл)піперазин-1-карбоніл)феніл)-хінолін-8-сульфонамід,
18) N-(2-(4-(6-хлорбензо[d]тіазол-2-іл)піперазин-1-карбоніл)феніл)-хінолін-8-сульфонамід,
19) N-(2-(4-(6-(трифторметокси)бензо[d]тіазол-2-іл)піперазин-1-карбоніл)феніл)хінолін-8-сульфонамід,
20) N-(2-(4-(4-метилбензо[d]тіазол-2-іл)-1,4-діазепан-1-карбоніл)феніл)хінолін-8-сульфонамід,
21) N-(2-(1-(6-метилбензо[d]оксазол-2-іл)піперидин-4-ілокси)феніл)-піридин-2-сульфонамід,
22) N-(2-(1-(6-хлорбензо[d]оксазол-2-іл)піперидин-4-ілокси)феніл)піридин-2-сульфонамід,
23) N-(2-(1-(5-трет-бутилбензо[d]оксазол-2-іл)піперидин-4-ілокси)феніл)-піридин-2-сульфонамід,
24) N-(2-(1-(5-хлорбензо[d]оксазол-2-іл)піперидин-4-ілокси)феніл)піридин-2-сульфонамід,
25) N-(2-(1-(бензо[d]тіазол-2-іл)піперидин-4-ілокси)феніл)піридин-2-сульфонамід,
26) N-(2-(1-(6-хлорбензо[d]тіазол-2-іл)піперидин-4-ілокси)феніл)-піридин-2-сульфонамід,
27) N-(2-(1-(6-бромбензо[d]тіазол-2-іл)піперидин-4-ілокси)феніл)-піридин-2-сульфонамід,
28) N-(2-((1-(бензо[d]тіазол-2-іл)піролідин-3-іл)метокси)феніл)-піридин-2-сульфонамід,
29) N-(2-((1-(6-фторбензо[d]тіазол-2-іл)піролідин-3-іл)метокси)феніл)-піридин-2-сульфонамід,
30) N-(2-((1-(6-хлорбензо[d]тіазол-2-іл)піролідин-3-іл)метокси)феніл)-піридин-2-сульфонамід,
31) N-(2-((1-(4-метилбензо[d]тіазол-2-іл)піролідин-3-іл)метокси)феніл)-піридин-2-сульфонамід,
32) N-(2-((1-(4-метоксибензо[d]тіазол-2-іл)піролідин-3-іл)метокси)феніл)-піридин-2-сульфонамід,
33) літію N-(2-(4-(6-бромбензо[d]тіазол-2-іл)піперазин-1-карбоніл)феніл)-піридин-2-сульфонамід,
34) натрію N-(2-(4-(6-бромбензо[d]тіазол-2-іл)піперазин-1-карбоніл)феніл)-піридин-2-сульфонамід і
35) калію N-(2-(4-(6-бромбензо[d]тіазол-2-іл)піперазин-1-карбоніл)феніл)-піридин-2-сульфонамід.
6. Спосіб одержання сполуки загальної формули І за будь-яким з пп. 1-5, де В=N, в якому здійснюють наступні послідовні стадії:
(а1) конденсація сполуки наступної загальної формули II
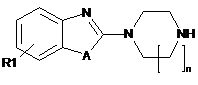 , II
, II
де R1, А і n такі, як визначено у п. 1,
з похідним ангідриду N-карбоксіантранілової кислоти наступної формули XV:
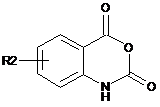 , XV
, XV
де R2 такий, як визначено у п. 1,
у присутності основи, наприклад диметиламінопіридину,
з одержанням проміжного продукту наступної формули IIІ:
 , III
, III
де R1, R2, А і n такі, як визначено у п. 1,
(а2) конденсація проміжного продукту формули IIІ з сульфонілхлоридом наступної загальної формули IV:
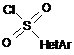 , IV
, IV
де HetAr такий, як визначено у п. 1,
у присутності основи, наприклад піридину, з одержанням сполуки формули І, і
(а3) можливо, утворення солі сполуки формули І, одержаної на попередній стадії (а2), у присутності фармацевтично прийнятної основи або кислоти, з одержанням фармацевтично прийнятної солі сполуки формули І.
7. Спосіб одержання сполуки загальної формули І за будь-яким з пп. 1-5, де В=N, в якому здійснюють наступні послідовні стадії:
(b1) конденсація сполуки наступної загальної формули V:
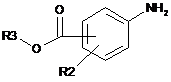 , V
, V
де R3 є лінійним або розгалуженим С1-С4алкілом, a R2 такий, як визначено у п. 1,
з сульфонілхлоридом загальної формули IV, як визначено у п. 7,
у присутності основи, наприклад піридину, з одержанням сполуки наступної формули VI:
 , VI
, VI
де R3 такий, як визначено раніше, a R2 і HetAr такі, як визначено у п. 1,
(b2) омилення сполуки формули VI, зокрема, у присутності основи, наприклад, наступної формули VII:
 , VII
, VII
де R2 і HetAr такі, як визначено у п. 1,
(b3) конденсація сполуки формули VII із сполукою формули II, як визначено у п. 6, з одержанням сполуки формули І, і
(b4) можливо, переведення у сіль сполуки формули І, одержаної на попередній стадії (b3), у присутності фармацевтично прийнятної основи або кислоти з одержанням фармацевтично прийнятної солі сполуки формули І.
8. Спосіб одержання сполуки загальної формули І за будь-яким з пп. 1-5, де В=СН, в якому здійснюють наступні послідовні стадії:
(с1) конденсація сполуки наступної загальної формули VIII:
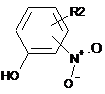 , VIII
, VIII
де R2 такий, як визначено в загальній формулі І,
із сполукою наступної загальної формули IX:
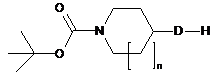 , IX
, IX
де D і n такі, як визначено у п. 1,
з одержанням сполуки наступної формули X:
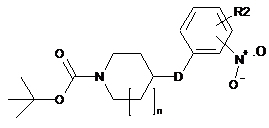 , X
, X
де R2, D і n такі, як визначено у п. 1,
(с2) відновлення сполуки формули X з одержанням сполуки наступної формули XI:
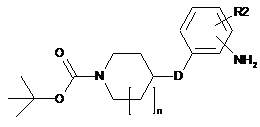 , XI
, XI
де R2, D і n такі, як визначено у п. 1,
(с3) конденсація сполуки формули XI з сульфонілхлоридом загальної формули IV, як визначено у п. 6, у присутності основи, наприклад піридину, з одержанням сполуки наступної формули XII:
 , XII
, XII
де HetAr, R2, D і n такі, як визначено у п. 1,
(с4) гідроліз амідної групи сполуки формули XII з одержанням сполуки наступної формули XIII:
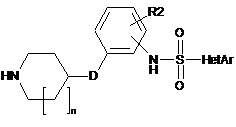 , XIII
, XIII
де HetAr, R2, D і n такі, як визначено у п. 1,
(с5) конденсація сполуки формули XIII зі сполукою наступної формули XIV:
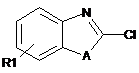 , XIV
, XIV
де R1 і А такі, як визначено у п. 1,
з одержанням сполуки формули І, і
(с6) можливо, переведення у сіль сполуки формули І, одержаної на попередній стадії (с5), у присутності фармацевтично прийнятної основи або кислоти з одержанням фармацевтично прийнятної солі сполуки формули І.
9. Сполука загальної формули І за будь-яким з пп. 1-5, застосовувана як лікарський засіб.
10. Сполука загальної формули І за будь-яким з пп. 1-5, застосовувана як блокатор Kv калієвих каналів, зокрема каналів Kv1.5, Kv4.3 або Kv11.1.
11. Сполука за п. 9, застосовувана як лікарський засіб, призначений для лікування та/або профілактики захворювань, при яких потрібні блокатори Kv калієвих каналів, зокрема каналів Kv1.5,Kv4.3 aбo Kv11.1.
12. Сполука за п. 9, застосовувана як лікарський засіб, призначений для лікування та/або профілактики фібриляції передсердь, порушень серцевого ритму передсердь та/або шлуночків, патологій, при яких порушені клітинний цикл та/або клітинна проліферація, та/або регенерація, наприклад рак або хронічне запалення.
13. Фармацевтична композиція, яка містить сполуку загальної формули І за будь-яким з пп. 1-5 у комбінації з щонайменше одним фармацевтично прийнятним ексципієнтом.
Текст
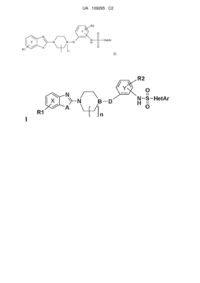
Реферат: Даний винахід стосується похідних гетероарилсульфонамідів, у тому числі як блокаторів Kv калієвих каналів, зокрема каналів Kv1.5, Kv4.3 або Kv11.1, їх застосування у клінічній терапії та способів їх одержання. Ці сполуки відповідають загальній формулі (І), де R1 є один або більше замісників фенільного ядра, таких як: водень, галоген, трифторметил, трифторметоксигрупа, лінійний або розгалужений С1-С4алкіл або ж лінійна або розгалужена С1-С4алкоксигрупа; А є киснем або сіркою, В є азотом, якщо n дорівнює 1 або 2, a D є -(С=О)-, або В є СН, якщо n дорівнює 0, a D є -СН2О-, або якщо n=l, a D є -О-, R2 є воднем, метилом, атомом фтору або хлору або метоксигрупою, HetAr є піридилом або хінолілом, що можливо містить замісник, такий як лінійний або розгалужений С1-С4алкіл або ж лінійна або розгалужена С1-С4алкоксигрупа, галоген, трифторметил; а також їх фармацевтично прийнятні солі. UA 109295 C2 (12) UA 109295 C2 R2 Y O N X R1 N B D N H S HetAr O A n (I) UA 109295 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід стосується похідних гетероарилсульфонамідів, їх одержання та їх застосування для лікування людини, як блокаторів Kv калієвих каналів і, зокрема, каналів Kv1.5, Kv4.3 і Kv11.1. Калієві канали є найбільшим сімейством іонних каналів в людському геномі, яке включає приблизно 80 генів (Tamargo et al., Cardiovasc. Res. 2004, 62: 9-33). Ці калієві канали можна підрозділити на 3 підсімейства: канали, активовані за рахунок потенціалу або напруги (Kvканали) і кальцієві (KCa-канали), канали внутрішнього випрямлення (Kir) і двопорові калієві канали (K2p). Підсімейство потенціал-активованих каналів найбільшою мірою представлене в організмі людини, і майже повсюди поширене у збудливих клітинах (клітини серця, нейрони, клітини поперечносмугастих або гладких м'язів) і незбудливих клітинах, таких як клітини підшлункової залози, простати, паращитовидної залози, і тому подібне (див. огляд: Gutman G et al., Pharmacol. Rev. 2005, 57:473-508). Головною функцією Kv калієвих каналів у збудливих клітинах є контроль залишкового потенціалу мембрани і тривалості потенціалу дії (Nerbonne and Kass, Physiol. Rev. 2005, 85:1205-1253). Так, деякі Kv канали задіяні у подібному контролі як у передсерді, так і в шлуночках серця. Канали Kv4.3, пов'язані з субодиницями KChIP 2, утворюють струм l tо, задіяний у передчасній фазі реполяризації потенціалу дії (PA); канали KVLQT1 /MinK і hERG беруть участь у пізній фазі реполяризації PA (генеруючі, відповідно, струми lKs і lKr). Згадані вище канали рівномірно розподілені між передсердями і шлуночками. При цьому для двох інших типів калієвих каналів характерний розподіл тільки у передсердях. Потенціал-залежні калієві канали (Kv1.5) відповідають за струм lKur, а ацетилхолін-активовані канали внутрішнього випрямлення (Kir3.1 і Kir3.4) відповідають за струм l K-Ach. Модифікації мембранної електричної активності спостерігаються при багатьох патологіях, особливо при патологіях порушення серцевого ритму. Серед останніх серйозним порушенням ритму є фібриляція передсердь (FA), що відповідає повністю десинхронізованій активності міоцитів передсердь, що призводить до переривистої, швидкої і нерегулярної електричної активності. Причиною FA є поява електричних циркуляцій повторного введення у тканини передсердь (Miyasaka Y et al., Circulation 2006, 114: 119-125). В даний час не існує антиаритмічного способу лікування передсердної стадії, направленого на зменшення числа випадків FA; відповідно, медицина гостро потребує такого способу (Page and Roden, Nat. Rev. Drug Discov. 2005, 4:899-910). Наявність безлічі одночасно активованих мікроциркуляцій повторного введення пояснює безладний характер електричної активності, яка спостерігається як під час внутрішньопорожнинних методів обстеження, так і на електрокардіограмах. Такий ритмічний безлад зазвичай виникає у патологічному передсердному міокарді з погляду електрофізіології, рефракторні періоди якого дуже короткі і дуже неоднорідні, і тому дуже чутливі до найменших екстрасистол. Подібні аномалії складають частину феномена перебудови міокарду, яка є наслідком перевантаження тиском або розтягнення, які викликають морфологічні зміни (гіпертрофія, розширення, фіброз), а також модифікації у регуляції трансмембранних іонних струмів, що змінюють електрофізіологічні характеристики передсердних міоцитів. Враховуючи те, що кожний випадок FA підтримує або погіршує цей механічний або електрофізіологічний процес перебудови, слід розуміти, що FA має великий потенційний ризик повторення, і що її природний розвиток призводить до хронічного процесу. На протилежність цьому, нещодавно були виявлені FA фокального типу, що відбуваються в певній точці, яка, як було виявлено, майже завжди є продовженням передсердного міокарду в легеневих венах. Ці доволі окремі випадки FA мають досить мономорфний характер, і в усякому разі порівнюваний з характером передсердних екстрасистол, що ініціюють напад, або спостережуваний періодично між кризами. У всіх випадках, наслідком випадання систоли передсердя є зниження швидкості серцебиття на 20-30 % і більше, залежно від того, наскільки понижена швидкість по відношенню до базового стану. В той же час, наявність застою крові в порожнинах передсердь, особливо в деяких кишенях, таких як вушко передсердя, пояснює ризик тромбоемболії. Проте, ризик емболії лише частково зумовлений наявністю однієї лише FA, оскільки застій у передсердях має відношення також до підвищення внутрішньопорожнинного тиску (систолічна або діастолічна дисфункція лівого шлуночка, порок клапана серця або заміщення клапана серця). Електрична перебудова, таким чином, складає основний субстрат для виникнення FA; вона відбувається через зменшення активності кальцієвих каналів L-типу, надаючи можливість Kv1.5 калієвим каналам повною мірою виконати свою реполяризаційну роль за рахунок ультрашвидкого калієвого струму (Bhakta and Miller, Expert Opin. Ther. Targets 2007, 11: 1161 1 UA 109295 C2 5 10 15 20 25 30 35 40 1178). Наслідком цього є різке скорочення рефракторного періоду, яке є чинником запуску мікроциркуляцій збудження. Беручи до уваги, що Kv1.5 калієві канали функціонально не експресуються в шлуночковій фазі, блокатор таких каналів буде, таким чином, представляти собою оптимальний антиаритмічний агент шлуночкової фази, що не впливає на шлуночкову електрофізіологію. Його фармакологічний ефект приймає форму подовження рефракторного періоду, і, як наслідок, зменшення частоти мікроциркуляцій збудження. Цілий ряд експериментальних даних, одержаних для продукту порівняння, підтверджують інтерес до блокування Kv1.5 як до терапевтичної мішені (Gogelein et al., Naunyn Schmiedeberg's Arch. Pharmacol. 2004, 370: 183-192; Regan et al., J. Pharmacol. Exp. Ther. 2008, 324:322-330). Швидкі зміни мембранного потенціалу добре відомі в збудливих клітинах, але повільні зміни потенціалу спостерігаються у всіх клітинах, і вони пов'язані з контролем клітинного циклу. Клітинний цикл є ключовим параметром у поведінці клітини, який повинен контролюватися і координуватися з метою розвитку, регенерації тканини і проліферації клітин (Pardo, Physiology, 2004, 19:285-292; Blackistion et al., Cell Cycle, 2009, 8-21: 3527-3536). Взагалі кажучи, блокування калієвих каналів веде до зниження проліферації у фізіологічних моделях (наприклад, у лімфоцитах) і патологічних моделях (рак). Роль калієвих каналів у регуляції клітинного циклу була показана в багатьох типах клітин, як фізіологічних, так і патологічних (лінії ракових клітин або пухлини), таких, що походять від людської меланоми, раку легенів, лімфоми, мезотеліоми, гепатоцелюлярної карциноми, лімфоцитів, моноцитів (див. огляд: Pardo et al., J. Membr. Biol, 2005, 205:115-124). Використаний раніше термін "Kv" позначає сімейство потенціалзалежних калієвих каналів, і включає різні підсімейства (Kv1., Kv2., Kv3. і т.п.), куди входять у тому числі канали Kv1.1, Kv1.2, + Kv1.3 та інші. "Блокатор Kv каналів" позначає молекулу, яка знижує або блокує K -іонний потік через канал. У даному тексті термін "солі" позначає солі сполук за даним винаходом, утворені додаванням кислоти або солі, зокрема, мінеральні солі, і, зокрема, солі, утворені основами, наприклад LiOH, KOH або NaOH, або солі, утворені кислотами, наприклад HCI. Солі краще є фармацевтично прийнятними, тобто вони не токсичні для пацієнта, якому їх вводять. Термін "фармацевтично прийнятний" належить до молекул і композицій, що не викликають побічну дію або алергію, або іншу небажану реакцію при введенні тварині або людині. Використовуваний в даному тексті термін "фармацевтично прийнятна допоміжна речовина" включає всі розріджувачі, добавки або ексципієнти, такі як консерванти, наповнювачі, речовини, що поліпшують розпадність, зволожуючі агенти, емульгатори, диспергуючі агенти, антибактеріальні і протигрибкові агенти, а також агенти, що уповільнюють кишкову і травну абсорбцію і резорбцію. Застосування таких середовищ або переносників добре відоме в даній області техніки. Якщо агент не є хімічно несумісним з похідним гетероарилсульфонамідів, може бути розглянуте його застосування у фармацевтичних композиціях спільно із сполуками за даним винаходом. У контексті даного винаходу, термін "лікування", що вживається в даному тексті, позначає запобігання або інгібування виникненню або розвитку пошкодження, до якого даний термін належить, або одного чи більше симптомів цього пошкодження. Метою даного винаходу є похідні гетероарилсульфонамідів, які є блокаторами Kv калієвих каналів (зокрема, каналів Kv1.5, Kv4.3 і Kv11.1), і їх застосування в клінічній терапії. Ці сполуки мають наступну загальну формулу I: 45 50 де R1 є один або більше замісників фенільного ядра X, вибраних з групи, що включає: водень, галоген (наприклад F, CI, Br), трифторметил, трифторметокси-групу, лінійний або розгалужений C1–C4 алкіл, і лінійну або розгалужену C1–C4 алкокси-групу, n дорівнює 0, 1 або 2, A є киснем або сіркою, D є -C(=O)-, -CH2O- або -O-, 2 UA 109295 C2 5 10 15 B є азотом, якщо n=1 або 2, а D є -C(=O)-, або ж B є CH, якщо n=0, а D є -CH2O- або якщо n=1 і D є -O-, R2 є воднем, метилом, атомом фтору або хлору або метокси-групою, HetAr є піридилом або хінолілом, що можливо містять замісник, наприклад лінійний або розгалужений C1–C4 алкіл, лінійну або розгалужену C1–C4 алкокси-групу, галоген (наприклад F, CI, Br) або трифторметил, а також їх фармацевтично прийнятні солі. Сульфонамідна група (-NH-SО2HetAr) може бути розташована при фенільному ядрі Y, при цьому орто-, мета- або пара- положення зайняте групою D. "Лінійний або розгалужений C 1–C4 алкіл" позначає, стосовно даного винаходу, лінійний або розгалужений вуглеводневий ланцюг, що включає від 1 до 4 атомів вуглецю, наприклад такі групи, як: метил, етил, н-пропіл, ізопропіл, н-бутил, втор-бутил, ізобутил і трет-бутил. "Лінійна або розгалужена C1–C4 алкокси-група", позначає, відносно даного винаходу, лінійну або розгалужену C1–C4 алкільну групу, розкриту вище, приєднану до решти молекули через атом кисню, наприклад такі групи, як: метокси-, етокси-, н-пропокси-, ізопропокси-, н-бутокси-, втор-бутокси-, ізобутокси- і трет-бутокси-група. У одному варіанті здійснення даного винаходу, сполуки загальної формули I відповідають наступній формулі (la): 20 25 30 35 40 45 50 де R1, R2, A, B, D, n і HetAr розкриті вище, а також їх фармацевтично прийнятні солі. У іншому варіанті здійснення даного винаходу, сполуки загальної формули I або la є сполуками, для яких: R1 є один або більше замісників при фенільному ядрі X, вибраних з групи, що включає: водень, галоген (наприклад F, CI, Br), трифторметил, трифторметокси-групу, лінійний або розгалужений C1–C4 алкіл і метокси-групу, n дорівнює 1, A є киснем або сіркою, D є -C(=О)- або -О-, B є азотом, якщо D є -C(=О)-, або ж B є CH, якщо D є -О-, R2 є воднем, HetAr є 2-піридил або 8-хіноліл, що можливо містять замісник, наприклад, метил або трифторметил, при цьому сульфонамідна група (-NH-SО2HetAr), зокрема, розташована при фенільному ядрі Y, при цьому орто-положення зайняте групою D, а також їх фармацевтично прийнятні солі. У іншому варіанті здійснення даного винаходу, сполуки загальної формули I або la є сполуками, для яких: R1 є один або більше замісників фенільної групи X, вибраних з групи, що включає: водень, галоген (наприклад F, CI, Br), трифторметил, трифторметокси-групу, лінійний або розгалужений C1–C4 алкіл і метокси-групу, A є сіркою, n дорівнює 1, D є -C(=О)-, B є азотом, R2 є воднем, HetAr є 2-піридилом, що можливо містить замісник, наприклад метил або трифторметил, при цьому сульфонамідна група (-NH-SО2HetAr) розташована при фенільному ядрі Y, при цьому орто-положення зайняте групою D, а також їх фармацевтично прийнятні солі. 3 UA 109295 C2 5 10 15 20 25 30 35 40 45 50 55 60 Даний винахід належить до сполук загальної формули I, що відрізняються тим, що вони вибрані з групи, що включає: 1) N-(2-(4-(6-фторбензо[d]оксазол-2-іл)піперазин-1-карбоніл)феніл)-5(трифторметил)піридин-2-сульфонамід, 2) N-(2-(4-(6-фторбензо[d]тіазол-2-іл)піперазин-1-карбоніл)феніл)-піридин-2-сульфонамід, 3) N-(2-(4-(6-бромбензо[d]тіазол-2-іл)піперазин-1-карбоніл)феніл)-піридин-2-сульфонамід, 4) N-(2-(4-(6-хлорбензо[d]тіазол-2-іл)піперазин-1-карбоніл)феніл)-піридин-2-сульфонамід гідрохлорид, 5) N-(2-(4-(4-метилбензо[d]тіазол-2-іл)піперазин-1-карбоніл)феніл)-піридин-2-сульфонамід, 6) N-(2-(4-(7-хлорбензо[d]тіазол-2-іл)піперазин-1-карбоніл)феніл)-піридин-2-сульфонамід, 7) N-(2-(4-(5-(трифторметил)бензо[d]тіазол-2-іл)піперазин-1-карбоніл)феніл)піридин-2сульфонамід, 8) N-(2-(4-(6-хлорбензо[d]тіазол-2-іл)піперазин-1-карбоніл)феніл)-5-(трифторметил)піридин2-сульфонамід, 9) N-(2-(4-(6-бромбензо[d]тіазол-2-іл)піперазин-1-карбоніл)феніл)-6-метилпіридин-2сульфонамід дигідрохлорид, 10) N-(3-(4-(6-хлорбензо[d]оксазол-2-іл)піперазин-1-карбоніл)-феніл)-піридин-2-сульфонамід, 11) N-(3-(4-(6-хлорбензо[d]тіазол-2-іл)піперазин-1-карбоніл)-феніл)-піридин-2-сульфонамід, 12) N-(3-(4-(6-хлорбензо[d]тіазол-2-іл)піперазин-1-карбоніл)-феніл)-6-метилпіридин-2сульфонамід, 13) N-(4-(4-(6-фторбензо[d]оксазол-2-іл)піперазин-1-карбонил)-феніл)-піридин-2сульфонамід, 14) N-(4-(4-(6-хлорбензо[d]оксазол-2-іл)піперазин-1-карбоніл)-феніл)-піридин-2-сульфонамід, 15) N-(4-(4-(6-хлорбензо[d]тіазол-2-іл)піперазин-1-карбоніл)-феніл)-піридин-2-сульфонамід, 16) N-(2-(4-(6-бромбензо[d]тіазол-2-іл)піперазин-1-карбоніл)-феніл)-хінолін-8-сульфонамід, 17) N-(2-(4-(6-хлорбензо[d]оксазол-2-іл)піперазин-1-карбоніл)-феніл)-хінолін-8-сульфонамід, 18) N-(2-(4-(6-хлорбензо[d]тіазол-2-іл)піперазин-1-карбоніл)-феніл)-хінолін-8-сульфонамід, 19) N-(2-(4-(6-(трифторметокси)бензо[d]тіазол-2-іл)піперазин-1-карбоніл)-феніл)хінолін-8сульфонамід, 20) N-(2-(4-(4-метилбензо[d]тіазол-2-іл)-1,4-діазепан-1-карбоніл)-феніл)хінолін-8сульфонамід, 21) N-(2-(1-(6-метилбензо[d]оксазол-2-іл)піперидин-4-ілокси)феніл)-піридин-2-сульфонамід, 22) N-(2-(1-(6-хлорбензо[d]оксазол-2-іл)піперидин-4-ілокси)феніл)-піридин-2-сульфонамід, 23) N-(2-(1-(5-трет-бутилбензо[d]оксазол-2-іл)піперидин-4-ілокси)феніл)-піридин-2сульфонамід, 24) N-(2-(1-(5-хлорбензо[d]оксазол-2-іл)піперидин-4-ілокси)феніл)піридин-2-сульфонамід, 25) N-(2-(1-(бензо[d]тіазол-2-іл)піперидин-4-ілокси)феніл)піридин-2-сульфонамід, 26) N-(2-(1-(6-хлорбензо[d]тіазол-2-іл)піперидин-4-ілокси)феніл)-піридин-2-сульфонамід, 27) N-(2-(1-(6-бромбензо[d]тіазол-2-іл)піперидин-4-ілокси)феніл)-піридин-2-сульфонамід, 28) N-(2-((1-(бензо[d]тіазол-2-іл)піролідин-3-іл)метокси)феніл)-піридин-2-сульфонамід, 29) N-(2-((1-(6-фторбензо[d]тіазол-2-іл)піролідин-3-іл)метокси)феніл)-піридин-2сульфонамід, 30) N-(2-((1-(6-хлорбензо[d]тіазол-2-іл)піролідин-3-іл)метокси)феніл)піридин-2-сульфонамід, 31) N-(2-((1-(4-метилбензо[d]тіазол-2-іл)піролідин-3-іл)метокси)феніл)-піридин-2сульфонамід, 32) N-(2-((1-(4-метоксибензо[d]тіазол-2-іл)піролідин-3-іл)метокси)феніл)-піридин-2сульфонамід, 33) літію N-(2-(4-(6-бромбензо[d]тіазол-2-іл)піперазин-1-карбоніл)феніл)-піридин-2сульфонамід, 34) натрію N-(2-(4-(6-бромбензо[d]тіазол-2-іл)піперазин-1-карбоніл)феніл)-піридин-2сульфонамід, і 35) калію N-(2-(4-(6-бромбензо[d]тіазол-2-іл)піперазин-1-карбоніл)феніл)-піридин-2сульфонамід. Метою даного винаходу є також фармацевтично прийнятні солі сполук загальної формули I. Крім того, даний винахід стосується сполук загальної формули I, а також їх фармацевтично прийнятних солей, застосовуваних як лікарський засіб. Даний винахід стосується також сполук загальної формули I, а також їх фармацевтично прийнятних солей, застосовуваних як блокатори Kv калієвих каналів, зокрема Kv1.5, Kv4.3 або Kv11.1 каналів. Даний винахід стосується також сполук загальної формули I, а також їх фармацевтично 4 UA 109295 C2 5 10 15 20 25 30 35 40 прийнятних солей, застосовуваних як лікарський засіб, призначений для лікування та/або профілактики захворювань, при яких потрібні блокатори Kv калієвих каналів, зокрема, каналів Kv1.5, Kv4.3 і Kv11.1. Даний винахід стосується також сполук загальної формули I, а також їх фармацевтично прийнятних солей, застосовуваних як лікарський засіб, призначений для лікування та/або профілактики фібриляції передсердь, порушень серцевого ритму передсердь та/або шлуночків, і патологій, при яких клітинний цикл та/або клітинна проліферація, та/або регенерація порушені (рак, хронічне запалення). Під "порушенням" мається на увазі погіршення у порівнянні з початковим станом. Даний винахід охоплює також фармацевтичні композиції, що відрізняються тим, що вони містять як активну субстанцію сполуку загальної формули I або одну з її фармацевтично прийнятних солей. Даний винахід стосується також фармацевтичної композиції, що відрізняється тим, що вона містить сполуку загальної формули I або одну з її фармацевтично прийнятних солей у поєднанні з щонайменше однією фармацевтично прийнятною допоміжною речовиною. Фармацевтичні композиції за даним винаходом можна вводити орально, сублінгвально, підшкірно, внутрішньом'язово, внутрішньовенно, трансдермально, місцево або ректально. В цьому випадку активний компонент можна вводити тваринам або людині у формі дозованих одиниць, змішаних з традиційними фармацевтичними носіями. Відповідні дозовані лікарські форми включають форми для орального введення, наприклад таблетки, капсули, порошки, гранули, а також розчини і суспензії для орального введення, форми для сублінгвального введення і прийому всередину, форми для підшкірного, місцевого, внутрішньом'язового, внутрішньовенного, інтарназального або внутрішньоочного введення, і форми для ректального введення. Лікарські форми, що відповідають вибраному способу введення, добре відомі фахівцеві в даній області техніки і описані, наприклад, у наступному джерелі: Remington, The science and Practice of Pharmacy, 19th edition, 1995, Mack Publishing Company. Дозування сполуки формули I у композиціях за даним винаходом можна підбирати, одержуючи таку кількість діючої речовини, яка ефективна для досягнення бажаного терапевтичного відгуку для композиції, при певному способі введення. Ефективна доза сполуки за даним винаходом варіюється залежно від численних параметрів, наприклад, таких, як вибраний спосіб введення, вага, вік, стать, природа патології і чутливість індивіда, якому потрібне лікування. Відповідно, слід визначити оптимальне дозування відповідно до параметрів, які були розцінені як значущі фахівцем в даній області. Даний винахід також охоплює способи хімічного одержання сполук загальної формули I, зокрема, розкриті нижче. СИНТЕЗ Сполуки за даним винаходом можна одержувати способами синтезу, описаними нижче, або способами синтезу, відомими фахівцеві в даній області техніки. Спосіб 1 (де B=N) Даний спосіб синтезу сполук загальної формули I з B=N (Схема 1) характеризується нижченаведеними послідовними стадіями. (a1) Похідне загальної формули II, де R1, A і n такі, як визначено в загальній формулі I, конденсують 45 50 з похідним N-карбоксиантранілового ангідриду XV, для якого R2 такий, як визначено в загальній формулі I, у присутності основи, наприклад DMAP, зокрема, в суміші розчинників, наприклад THF і DMF. (a2) Одержаний проміжний продукт III 5 UA 109295 C2 потім конденсують з сульфонілхлоридом загальної формули IV, де HetAr такий, як визначено в загальній формулі I 5 10 у присутності основи, такої як піридин, зокрема, в розчиннику, такому як дихлорметан. (a3) Сполуку формули I, одержану на попередній стадії (a2), можна перевести у сіль у присутності фармацевтично прийнятної основи або кислоти, з одержанням фармацевтично прийнятної солі сполуки формули I. Схема 1 15 20 Спосіб 2 (де B=N) Даний спосіб синтезу сполуки загальної формули I з B=N (Схема 2) характеризується нижченаведеними послідовними стадіями. (b1) Похідне загальної формули V, для якого R3 є лінійним або розгалуженим C1-C4 алкілом, наприклад метилом або етилом, а R2 такий, як визначено в загальній формулі I, конденсують 6 UA 109295 C2 5 10 15 20 з сульфонілхлоридом загальної формули IV, для якого HetAr такий, як визначено в загальній формулі I. у присутності основи, наприклад, піридину, зокрема, у розчиннику, такому як дихлорметан. (b2) Одержану таким чином сполуку VI омилюють, наприклад, у присутності основи, такої як поташ, зокрема, в розчиннику, наприклад в етанолі, з одержанням сполуки VII. (b3) Останню сполуку конденсують із зазначеним вище проміжним продуктом II, з одержанням сполуки формули I, у певних умовах реакції, наприклад у присутності TBTU і Et 3N у розчиннику, наприклад, у ацетонітрилі. (b4) Сполуку формули I, одержану на попередній стадії (b3), можна перевести у сіль у присутності фармацевтично прийнятної основи або кислоти, з одержанням фармацевтично прийнятної солі сполуки формули I. 25 7 UA 109295 C2 Схема 2 5 Спосіб 3 (де B=CH) Даний спосіб синтезу сполуки загальної формули I, де B=CH (Схема 3) відрізняється тим, що він включає нижченаведені послідовні стадії: (c1) Похідне загальної формули VIII, де R2 такий, як визначено в загальній формулі I, конденсують 10 з похідним загальної формули IX, де D і n такі, як визначено в загальній формулі I, а B є CH, 8 UA 109295 C2 5 у певних умовах реакції, наприклад, в умовах конденсації Міцунобу, у присутності трифенілфосфіну, діетилазодикарбоксилату в THF. (c2) Одержану таким чином проміжну сполуку X 10 потім відновлюють, в певних умовах реакції, наприклад у присутності паладію на вуглеці в атмосфері водню, в розчиннику, такому як етанол, що дозволяє виділити проміжний продукт XI. 15 (c3) Останній конденсують з сульфонілхлоридом загальної формули IV, де HetAr такий, як визначено в загальній формулі I, у присутності основи, наприклад піридину, зокрема, у розчиннику, наприклад дихлорметані, з одержанням проміжного продукту XII. 20 (c4) Амідну групу останнього гідролізують, зокрема, у присутності трифтороцтової кислоти, зокрема, у розчиннику, наприклад дихлорметані, з одержанням проміжного продукту XIII. 25 (c5) Сполуку XIII потім конденсують з проміжним продуктом XIV, де R1 і A такі, як визначено в загальній формулі I 9 UA 109295 C2 5 у певних умовах реакції, наприклад у присутності бікарбонату натрію, в суміші розчинників, такій як етанол і вода, з одержанням сполуки загальної формули I. (c6) Сполуку формули I, одержану на попередній стадії (c5), можна перевести у сіль, у присутності фармацевтично прийнятної основи або кислоти з одержанням фармацевтично прийнятної солі сполуки формули I. 10 Схема 3 15 20 Проміжні продукти і кінцеві сполуки можна за бажанням очищати, використовуючи один або більше способів очищення, вибраних з групи, що включає екстракцію, фільтрацію, хроматографію на силікагелі, нормально- або обернено-фазну препаративну HPLC або кристалізацію. Початкові речовини, застосовувані в способах, описаних вище, комерційно доступні або легко можуть бутиодержані фахівцем в даній області техніки способами, описаними в літературі. Приведені нижче приклади наочно представляють даний винахід, не обмежуючи його об'єму. Елементний аналіз, а також мас-спектри і NMR підтверджують структури сполук. ПРИКЛАДИ 10 UA 109295 C2 A) ПРОМІЖНІ ПРОДУКТИ Проміжні продукти 1: a) 6-Фтор-бензооксазол-2-тіол (1a) 5 10 2-аміно-5-фтор-фенол (10 г, 79 ммоль) вносять у присутності O-етилкабонодитіоату калію (27.7 г, 173 ммоль) у 100 мл етанолу, витримують протягом ночі із зворотним холодильником. Після доведення до сухого стану залишок розтирають у розчині 1н HCI, фільтрують і потім промивають за допомогою 1н HCI. Після висушування у вакуумі виділяють 13.8 г твердого осаду (кількісний вихід). b) 5-трет-Бутил-бензооксазол-2-тіол (1b) 15 Проміжний продукт 1b (тверду речовину) одержують з 2-аміно-4-трет-бутил-фенолу способом, описаним для проміжного продукту 1a (вихід 94 %). ТСХ: силікагель 60 F 254 Merck, CH2CI2-MeOH: 90-10, Rf=0.83. c) 7-Хлор-бензотіазол-2-тіол (1c) 20 25 30 Проміжний продукт 1c (тверду речовину) одержують з 3-хлор-2-фтор-феніламіну способом, описаним для проміжного продукту 1a, за допомогою DMF зі зворотним холодильником (кількісний вихід). ТСХ: силікагель 60 F 254 Merck, CH2CI2-MeOH: 95-5, Rf=0.70. d) 5-Трифторметил-бензотіазол-2-тіол (1d) Проміжний продукт 1d (тверду речовину) одержують з 2-бром-5-трифторметил-феніламіну з використанням DMF як розчинника способом, описаним для проміжного продукту 1a (вихід 28 %). ТСХ силікагель 60 F 254 Merck, CH2CI2-MeOH: 95-5, Rf=0.73. e) 6-Бром-бензотіазол-2-тіол (1e) 35 40 Проміжний продукт 1e (тверду речовину) одержують із 4-бром-2-фтор-феніламіну способом, описаним для проміжного продукту 1a (кількісний вихід). ТСХ силікагель 60 F 254 Merck, CH2CI2MeOH: 95-5, Rf=0.75. f) 6-Метил-бензооксазол-2-тіол (1f) 11 UA 109295 C2 5 8 г (65 ммоль) 2-аміно-5-метил-фенолу вносять у присутності поташу (4.37 г, 78 ммоль) у суміш 100 мл CS2 і 150 мл EtOH і нагрівають при 100 °C протягом 8 годин. Після доведення до сухого стану, залишок розчиняють у воді і екстрагують за допомогою AcOEt, і після осушування, органічні шари випарюють досуха. Залишок розчиняють у Et 2O, одержані кристали фільтрують і потім промивають петролейним ефіром. Виділяють 10 г бежевих кристалів (вихід: 94 %). ТСХ силікагель 60 F 254 Merck, CH2CI2-MeOH: 95-5, Rf=0.75. g) 5-Хлор-бензооксазол-2-тіол (1g) 10 15 Проміжний продукт 1g (тверду речовину) одержують з 2-аміно-4-хлор-фенолу способом, описаним для проміжного продукту 1f (вихід: 46 %). ТСХ силікагель 60 F 254 Merck, петролейний ефір- AcOEt: 50-50, Rf=0.70. Проміжні продукти 2: a) 2-Хлор-6-фтор-бензотіазол (2a) 20 25 0.5 г (2.97 ммоль) 6-фтор-бензотіазол-2-іламіну вносять у присутності ізоамілнітриту (0.52 г, 4.46 ммоль) і CuCI2•2H2О (0.61 г, 0.57 ммоль) у 10 мл ацетонітрилу. Реакційну суміш нагрівають при 65 °C протягом 3 годин і потім доводять до сухого стану; залишок розчиняють у воді і екстрагують етилацетатом. Органічні шари висушують, а потім випарюють, і одержаний залишок очищують за допомогою флеш-хроматографії на силікагелі (CH2CI2-AcOEt, градієнт від 100-0 до 97-3 протягом 30 хв). Одержують 0.36 г твердої речовини (вихід 64 %). ТСХ силікагель 60 F 254 Merck, CH2CI2-MeOH: 95-5, Rf=0.84. b) 2-Хлор-4-метил-бензотіазол (2b) 30 35 40 Проміжний продукт 2b (тверду речовину) одержують з 4-метил-бензотіазол-2-іламіну способом, описаним для проміжного продукту 2a (вихід: 89 %). ТСХ силікагель 60 F 254 Merck, CH2CI2-MeOH: 95-5, Rf=0.83. c) 2-Хлор-4-метокси-бензотіазол (2c) Проміжний продукт 2c (тверду речовину) одержують з 4-метокси-бензотіазол-2-іламіну способом, описаним для проміжного продукту 2a (вихід: 47 %). ТСХ силікагель 60 F 254 Merck, петролейний ефір – AcOEt: 70-30, Rf=0.77. d) 6-Бром-2-хлор-бензотіазол (2d) 12 UA 109295 C2 5 10 15 Проміжний продукт 2d (тверду речовину) одержують з 6-бром-бензотіазол-2-іламіну способом, описаним для проміжного продукту 2a (вихід: 75 %). ТСХ силікагель 60 F 254 Merck, CH2CI2-MeOH: 95-5, Rf=0.83. e) 2-Хлор-6-метил-бензооксазол (2e) Проміжний продукт 1f вносять при 0 °C у 1.76 мл тіонілхлориду. Вливають 0.47 мл DMF краплинами так, щоб витримувати реакційну суміш при 0 °C, після чого перемішують протягом 1 години при цій температурі. Після випарювання у вакуумі середовище розчиняють у воді і екстрагують етилацетатом. Органічні шари висушують і доводять до сухого стану. Одержаний залишок очищають за допомогою флеш-хроматографії на силікагелі (петролейний ефір - AcOEt, градієнт від 100-0 до 80-20 протягом 20 хв.). Одержують 0.66 г масла (вихід 65 %). ТСХ силікагель 60 F 254 Merck, CH2CI2-MeOH: 90-10, Rf=0.80. f) 2,6-Дихлор-бензооксазол (2f) 20 Проміжний продукт 2f (тверду речовину) одержують з 6-хлор-бензооксазол-2-тіолу способом, описаним для проміжного продукту 2e (вихід: 42 %). ТСХ силікагель 60 F 254 Merck, AcOEt, Rf=0.87. g) 5-трет-Бутил-2-хлор-бензооксазол (2g) 25 30 35 Проміжний продукт 2g (масло) одержують з проміжного продукту 1b способом, описаним для проміжного продукту 2e (вихід: 42 %). ТСХ силікагель 60 F 254 Merck, петролейний ефір AcOEt: 50-50, Rf=0.76. h) 2,5-Дихлор-бензооксазол (2h) Проміжний продукт 2h (тверду речовину) одержують з проміжного продукту 1g способом, описаним для проміжного продукту 2e (вихід: кількісний). ТСХ силікагель 60 F 254 Merck, петролейний ефір - AcOEt: 50-50, Rf=0.68. і) 2-Бром-6-(трифторметокси)бензо[d]тіазол (2i) 40 13 UA 109295 C2 5 10 15 20 Проміжний продукт 2i (тверду речовину) одержують з 2-аміно-6(трифторметокси)бензотіазолу способом, описаним для проміжного продукту 2a, за допомогою CuBr2 (вихід: 90 %). ТСХ силікагель 60 F 254 Merck, CH2CI2-MeOH: 95-5, Rf=0.93. Проміжні продукти 3: а) 6-Фтор-2-піперазин-1-іл-бензооксазол (3a) Проміжний продукт 1a (9 г, 53.2 ммоль) вносять у присутності піперазину (22.91 г, 266 ммоль) у 45 мл бутанолу і обробляють мікрохвилями при 180 °C протягом 40 хв. Після утворення сухого залишку масу розводять у воді і екстрагують етилацетатом. Органічні шари висушують і потім випарюють, і одержаний залишок очищають за допомогою флешхроматографії на силікагелі (CH2CI2-MeOH, градієнт від 98-2 до 80-20 протягом 20 хв). Одержують 2.73 г коричневого масла (вихід 23 %). ТСХ силікагель 60 F 254 Merck, CH2CI2MeOH: 90-10, Rf=0.11. b) 6-Хлор-2-піперазин-1-іл-бензооксазол (3b) Проміжний продукт 3b (масло) одержують з 6-хлор-2-бензоксазол-2-тіолу способом, описаним для проміжного продукту 3a (вихід: 92 %). ТСХ силікагель 60 F 254 Merck, CH2CI2MeOH: 90-10, Rf=0.11. с) 7-Хлор-2-піперазин-1-іл-бензотіазол (3c) 25 30 35 Проміжний продукт 3c (тверду речовину) одержують з проміжного продукту 1c способом, описаним для проміжного продукту 3a (вихід: 79 %). ТСХ силікагель 60 F 254 Merck, CH2CI2MeOH: 90-10, Rf=0.15. d) 2-Піперазин-1-іл-5-трифторметил-бензотіазол (3d) Проміжний продукт 3d (тверду речовину) одержують з проміжного продукту 1d способом, описаним для проміжного продукту 3a (вихід: 91 %). ТСХ силікагель 60 F 254 Merck, CH2CI2MeOH: 95-5, Rf=0.20. е) 6-Фтор-2-піперазин-1-іл-бензотіазол (3e) 40 Піперазин (0.33 г, 3.84 ммоль) вносять до 6 мл етанолу, додають бікарбонат натрію (0.56 г, 6.72 ммоль), розведений у 8 мл води, і потім приливають по краплинах 0.36 г (1.92 ммоль) проміжного продукту 2a, розведеного у 8 мл етанолу. Реакційну суміш нагрівають при температурі флегми протягом ночі і потім доводять до сухого стану. Після екстракції 14 UA 109295 C2 5 10 етилацетатом органічні шари випарюють, і одержаний залишок очищають за допомогою флешхроматографії на силікагелі (CH2CI2-MeOH, градієнт від 100-0 до 90-10, протягом 45 хв.). Одержують 0.39 г твердої речовини (вихід 86 %). ТСХ силікагель 60 F 254 Merck, CH2CI2-MeOH: 95-5, Rf=0.05. f) 6-Бром-2-піперазин-1-іл-бензотіазол (3f) Проміжний продукт 3f (тверду речовину) одержують з проміжного продукту 2d способом, описаним для проміжного продукту 3e (вихід: 92 %). ТСХ силікагель 60 F 254 Merck, CH2CI2MeOH: 95-5, Rf=0.14. g) 6-Хлор-2-піперазин-1-іл-бензотіазол (3g) 15 Проміжний продукт 3g (тверду речовину) одержують з 2,6-дихлор-1,3-бензотіазолу способом, описаним для проміжного продукту 3e (вихід: 84 %). ТСХ силікагель 60 F 254 Merck, CH2CI2-MeOH: 90-10, Rf=0.23. h) 4-Метил-2-піперазин-1-іл-бензотіазол (3h) 20 25 30 Проміжний продукт 3h (тверду речовину) одержують з проміжного продукту 2b способом, описаним для проміжного продукту 3e (вихід: 79 %). ТСХ силікагель 60 F 254 Merck, CH2CI2AcOEt: 95-5, Rf=0.05. i) 2-(Піперазин-1-іл)-6-(трифторметокси)бензотіазол (3i) Проміжний продукт 3i (тверду речовину) одержують з проміжного продукту 2i способом, описаним для проміжного продукту 3e (вихід: 88 %). ТСХ силікагель 60 F 254 Merck, CH2CI2MeOH: 95-5, Rf=0.22. j) 2-[1,4]діазепан-1-іл-4-метил-бензотіазол (3j) 35 40 Проміжний продукт 3j (масло) одержують з проміжного продукту 2b і [1,4]діазепану способом, описаним для проміжного продукту 3e (вихід: 83 %). ТСХ силікагель 60 F 254 Merck, CH2CI2-MeOH: 95-5, Rf=0.10. Проміжні продукти 4: a) 5-Трифторметил-піридин-2-сульфонілхлорид (4a) 15 UA 109295 C2 5 0.8 г (4.47 ммоль) 5-трифторметил-піридин-2-тіолу вносять при -8 °C у 16 мл H2SO4. Обережно приливають 16.96 мл (35.7 ммоль) 13 % розчину гіпохлориту натрію так, щоб температура реакційної суміші не перевищувала 5 °C. Цю суміш потім перемішують протягом 45 хв., розводять у воді, після чого екстрагують за допомогою AcOEt. Після висушування і подальшого доведення до сухого стану органічних шарів, виділяють масло (вихід: 79 %) і використовують у такому вигляді у подальших реакціях. b) Піридин-2-сульфонілхлорид (4b) 10 15 20 Проміжний продукт 4b (масло) одержують з піридин-2-тіолу способом, описаним для 4a (вихід: 96 %). c) 6-Метилпіридин-2-сульфонілхлорид (4c) Проміжний продукт 4c (масло) одержують з 6-метилпіридин-2-тіолу способом, описаним для 4a (вихід: 96 %). Проміжні продукти 5: a) 3-(піридин-2-сульфонамідо)бензойна кислота (5a) 25 30 35 40 0.68 г (4.13 ммоль) етил-3-амінобензоату вносять до 10 мл CH2CI2 у присутності 0.4 мл піридину, і вливають по краплинах розчин проміжного продукту 4b, розведеного у 3 мл CH2CI2. Реакційну суміш перемішують протягом 8 годин і потім доводять до сухого стану. Залишок розчиняють у воді і потім екстрагують за допомогою AcOEt. Після висушування з подальшим доведенням до сухого стану органічних шарів, виділяють тверду речовину і потім очищають її за допомогою флеш-хроматографії на силікагелі (CH2CI2-AcOEt, градієнт від 100-0 до 90-10 протягом 45 хв.). Одержують 1.14 г білої твердої речовини (вихід: 90 %). ТСХ силікагель 60 F 254 Merck, CH2CI2-AcOEt:90-10, Rf=0.26. Цю тверду речовину (3.72 ммоль) вносять до 17 мл EtOH у присутності 0.41 г (7.44 ммоль) соди, і суміш нагрівають до температури флегми протягом 9 год. 30 хв. Після утворення сухого залишку масу розчиняють у воді і екстрагують за допомогою AcOEt. Водну фазу потім підкислюють (pH=1) за допомогою 1н HCI і потім екстрагують за допомогою AcOEt. Після висушування з подальшим доведенням до сухого стану органічних шарів одержують тверду речовину. Її розтирають у петролейному ефірі і потім виділяють під час фільтрації (1 г, вихід: 98 %). ТСХ силікагель 60 F 254 Merck, CH2CI2-MeOH: 955, Rf=0.20. b) 3-(6-Метил-піридин-2-сульфоніламіно)-бензойна кислота (5b). 16 UA 109295 C2 5 10 Проміжний продукт 5b (тверду речовину) одержують за допомогою проміжного продукту 4c і етил-3-амінобензоату способом, описаним для 5a (вихід: 94 %). ТСХ силікагель 60 F 254 Merck, CH2CI2-MeOH: 85-15, Rf=0.36. c) 4-(Піридин-2-сульфоніламіно)-бензойна кислота (5c). Проміжний продукт 5c (тверду речовину) одержують за допомогою проміжного продукту 4b і етил-4-амінобензоату способом, описаним для 5a (вихід: 50 %). ТСХ силікагель 60 F 254 Merck, CH2CI2-MeOH: 85-15, Rf=0.37. Проміжні продукти 6: a) N-(2-(піперидин-4-ілокси)феніл)піридин-2-сульфонамід трифторацетат (6a) 15 20 25 30 35 40 10 г (49.7 ммоль) трет-бутил 4-гідроксипіперидин-1-карбоксилату вносять до 6.91 г (49.7 ммоль) 2-нітрофенолу і 16.94 г (64.6 ммоль) PPh3. До цієї суміші додають порціями 11.25 г (64.6 ммоль) DEAD і реакційну суміш перемішують протягом 2 годин при кімнатній температурі і потім доводять до сухого стану. Залишок розчиняють у воді і екстрагують за допомогою AcOEt. Після висушування з подальшим випарюванням органічних шарів одержаний залишок очищають за допомогою флеш-хроматографії на силікагелі (петролейний ефір - AcOEt, градієнт від 80-20 до 60-40 протягом 20 хв.). Одержане жовте масло кристалізують під час розтирання в суміші петролейний ефір-Et2O, і виділяють 13.2 г твердої речовини (вихід 82 %). ТСХ силікагель 60 F 254 Merck, петролейний ефір - AcOEt: 50-50, Rf=0.40. Раніше одержану тверду речовину (41.9 ммоль) поміщають у реактор з нержавіючої сталі у присутності 223 мг Pd на вугіллі у 100 мл MeOH в атмосфері водню (5 бар) і перемішують протягом 2 годин при кімнатній температурі. Після фільтрації на целіті з подальшим випарюванням, виділяють 12.4 г помаранчевого масла (кількісний вихід). ТСХ силікагель 60 F 254 Merck, петролейний ефір - AcOEt: 80-20, Rf=0.44. 4.5 г (15.39 ммоль) раніше виділеного масла поміщають у 200 мл CH 2CI2 у присутності проміжного продукту 4b і піридину (1.46 г, 18.47 ммоль) і перемішують при кімнатній температурі протягом 3 годин. Реакційну суміш розводять у воді і потім екстрагують за допомогою AcOEt. Після висушування з подальшим випарюванням органічних шарів одержаний залишок очищають за допомогою флеш-хроматографії на силікагелі (петролейний ефір - AcOEt, градієнт від 70-30 до 50-50 протягом 30 хв.). Виділяють 5.5 г коричневої твердої речовини (вихід: 82 %). ТСХ силікагель 60 F 254 Merck, петролейний ефір - AcOEt: 50-50, Rf=0.50. Раніше одержану тверду речовину (12.7 ммоль) вносять у присутності 14.7 г (127 ммоль) трифтороцтової кислоти у 40 мл CH2CI2 і перемішують протягом 2 годин при кімнатній температурі. Після випарювання при зниженому тиску залишок розтирають у суміші Et 2O/ацетон і під час фільтрації виділяють 5.34 г проміжного продукту 6a (бежева тверда речовина, вихід 94 %). ТСХ силікагель 60 F 254 Merck, петролейний ефір-AcOEt: 50-50, Rf=0.36. b) N-(2-(піролідин-3-ілметокси)феніл)піридин-2-сульфонамід трифторацетат (6b) 45 17 UA 109295 C2 5 Проміжний продукт 6b (тверду речовину) одержують за допомогою трет-бутил 3(гідроксиметил)піролідин-1-карбоксилату замість трет-бутил 4-гідроксипіперидин-1карбоксилату способом, описаним для 6a (вихід: 39 %, у 4 стадії). ТСХ силікагель 60 F 254 Merck, CH2CI2-MeOH: 90-10, Rf=0.25. B) СПОЛУКИ ЗА ДАНИМ ВИНАХОДОМ Приклад 1: N-(2-(4-(6-фторбензо[d]оксазол-2-іл)піперазин-1-карбоніл)феніл)-5(трифторметил)піридин-2-сульфонамід (1) 10 15 20 25 Сполуку 1 одержують за допомогою способу синтезу 1: проміжний продукт 3a (2.5 г, 11.30 ммоль) вносять у присутності 1H-бензо[d][1,3]оксазин-2,4-діону (1.83 г, 11.3 ммоль) і DMAP (138 мг, 1.13 ммоль) у 25 мл THF і 5 мл DMF, і суміш перемішують протягом ночі при кімнатній температурі. Після утворення сухого залишку, його розчиняють у воді і екстрагують за допомогою AcOEt. Після висушування органічних шарів і подальшого утворення сухого залишку, одержаний залишок очищають за допомогою флеш-хроматографії на силікагелі (CH2CI2-MeOH, градієнт від 100-0 до 95-5 протягом 40 хв.). Одержують 0.47 г твердої речовини (вихід: 32 %). Потім її вносять до 3 мл дихлорметану у присутності 0.119 г (0.48 ммоль) проміжного продукту 4a і 39 мкл піридину. Після цього суміш перемішують протягом ночі при кімнатній температурі, потім розводять у воді і екстрагують за допомогою дихлорметану. Після висушування органічних шарів і подальшого утворення сухого залишку, одержаний залишок очищають за допомогою флеш-хроматографії (CH2CI2-MeOH, градієнт від 100-0 до 95-5 протягом 65 хв.). Одержують 90 мг твердої речовини (вихід: 35 %). ТСХ силікагель 60 F 254 Merck, CH2CI2-MeOH: 95-5, Rf=0.48. 1 NMR H (CDCl3) ppm: 8.94 (s, 1H), 8.69 (s, 1H), 8.19 (m, 2H), 7.74 (d, 1H), 7.41 (t, 1H), 7.26 (m, 2H), 7.17 (t, 1H), 7.07 (d, 1H), 6.95 (t, 1H), 3.76 (m, 8H). MS (-ESI) m/z 548 (M-H-). Приклад 2: N-(2-(4-(6-фторбензо[d]тіазол-2-іл)піперазин-1-карбоніл)феніл)-піридин-2сульфонамід (2) 30 35 40 45 Сполуку 2 одержують за допомогою способу синтезу 1 з проміжного продукту 3e під час першої стадії (вихід: 87 %) і проміжного продукту 4b під час другої стадії (вихід: 30 %). ТСХ силікагель 60 F 254 Merck, CH2CI2-MeOH: 95-5, Rf=0.58. 1 NMR H (CDCl3) ppm: 8.65 (d, 1H), 8.58 (s, 1H), 8.03 (d, 1H), 7.89 (t, 1H), 7.77 (d, 1H), 7.50 (m, 1H), 7.39 (m, 3H), 7.12 (m, 3H), 3.62 (m, 8H). MS (+ESI) m/z 498 (MH+) Приклад 3: N-(2-(4-(6-бромбензо[d]тіазол-2-іл)піперазин-1-карбоніл)феніл)-піридин-2сульфонамід (3) Сполуку 3 одержують за допомогою способу синтезу 1 з проміжного продукту 3f під час першої стадії (кількісний вихід) і проміжного продукту 4b під час другої стадії (вихід: 80 %). ТСХ силікагель 60 F 254 Merck, CH2CI2-MeOH: 95-5, Rf=0.60. mp=102 °C 18 UA 109295 C2 1 5 10 15 20 25 NMR H (CDCl3) ppm: 8.66 (d, 1H), 8.56 (s, 1H), 8.03 (d, 1H), 7.88 (t, 1H), 7.75 (m, 2H), 7.41 (m, 4H), 7.16 (m, 2H), 3.64 (m, 8H). MS (+ESI) m/z 558 (MH+). Приклад 4: N-(2-(4-(6-хлорбензо[d]тіазол-2-іл)піперазин-1-карбоніл)феніл)піридин-2сульфонамід гідрохлорид (4) Сполуку 4 одержують за допомогою способу синтезу 1 з проміжного продукту 3g під час першої стадії (вихід: 72 %) і проміжного продукту 4b під час другої стадії (вихід: 27 %) і потім переводять у сіль у формі гідрохлориду. 1 NMR H (DMSO) ppm: 10.70 (s, 1H), 8.7 (d, 1H), 8.0 (m, 1H), 7.8 (m, 2H), 7.6 (m, 1H), 7.4 (d, 1H), 7.3 (m, 3H), 7.2 (m, 1H), 7.1 (d, 1H), 3.6 (m, 8H). MS (+ESI) m/z 514 (MH+ основа). Приклад 5: N-(2-(4-(4-метилбензо[d]тіазол-2-іл)піперазин-1-карбоніл)феніл)-піридин-2сульфонамід (5) Сполуку 5 одержують за допомогою способу синтезу 1 з проміжного продукту 3h під час першої стадії (вихід: 87 %) і проміжного продукту 4b під час другої стадії (вихід: 23 %). ТСХ силікагель 60 F 254 Merck, CH2CI2-MeOH: 95-5, Rf=0.70. 1 NMR H (CDCl3) ppm: 8.65 (m, 2H), 8.03 (d, 1H), 7.87 (t, 1H), 7.79 (d, 1H), 7.48 (d, 1H), 7.41 (m, 2H), 7.20 (d, 1H), 7.14 (m, 2H), 7.04 (t, 1H), 3.63 (m, 8H), 2.56 (s, 3H). MS (+ESI) m/z 494 (Mh+). Приклад 6: N-(2-(4-(7-хлорбензо[d]тіазол-2-іл)піперазин-1-карбоніл)феніл)-піридин-2сульфонамід (6) 30 35 Сполуку 6 одержують за допомогою способу синтезу 1 з проміжного продукту 3c під час першої стадії (кількісний вихід) і проміжного продукту 4b під час другої стадії (вихід: 24 %). ТСХ силікагель 60 F 254 Merck, CH2CI2-MeOH: 95-5, Rf=0.54. 1 NMR H (CDCl3) ppm: 8.66 (d, 1H), 8.57 (s, 1H), 8.04 (d, 1H), 7.89 (t, 1H), 7.77 (d, 1H), 7.42 (m, 3H), 7.29 (m, 1H), 7.16 (m, 3H), 3.66 (m, 8H). MS (+ESI) m/z 514 (MH+). Приклад 7: N-(2-(4-(5-(трифторметил)бензо[d]тіазол-2-іл)піперазин-1-карбоніл) феніл)піридин-2-сульфонамід (7) 40 19 UA 109295 C2 5 Сполуку 7 одержують за допомогою способу синтезу 1 з проміжного продукту 3d під час першої стадії (вихід: 74 %) і проміжного продукту 4b під час другої стадії (вихід: 31 %). ТСХ силікагель 60 F 254 Merck, CH2CI2-MeOH: 95-5, Rf=0.66. 1 NMR H (CDCl3) ppm: 8.67 (d, 1H), 8.55 (s, 1H), 8.04 (d, 1H), 7.89 (t, 1H), 7.76 (s, 1H), 7.74 (dd, 2H), 7.41 (m, 3H), 7.21 (d, 1H), 7.14 (t, 1H), 3.68 (m, 8H). MS (+ESI) m/z 548 (MH+). Приклад 8: N-(2-(4-(6-хлорбензо[d]тіазол-2-іл)піперазин-1-карбоніл)феніл)-5(трифторметил)піридин-2-сульфонамід (8) 10 15 20 25 30 Сполуку 8 одержують за допомогою способу синтезу 1 з проміжного продукту 3g під час першої стадії (вихід: 94 %) і проміжного продукту 4a під час другої стадії (вихід: 56 %). ТСХ силікагель 60 F 254 Merck, CH2CI2-MeOH: 95-5, Rf=0.50. 1 NMR H (CDCl3) ppm: 8.93 (s, 1H), 8.71 (s, 1H), 8.18 (m, 2H), 7.74 (d, 1H), 7.60 (s, 1H), 7.47 (d, 1H), 7.40 (t, 1H), 7.26 (m, 2H), 7.16 (t, 1H), 3.69 (m, 8H). MS (-ESI) m/z 580 (M-H-). Приклад 9: N-(2-(4-(6-бромбензо[d]тіазол-2-іл)піперазин-1-карбоніл)феніл)-6-метилпіридин2-сульфонамід дигідрохлорид (9) Сполуку 9 одержують за допомогою способу синтезу 1 з проміжного продукту 3f під час першої стадії (кількісний вихід) і проміжного продукту 4c під час другої стадії (вихід: 40 %). Дигідрохлорид одержують шляхом солеутворення за допомогою 5н розчину HCI в ізопропанолі (3 еквівалента). ТСХ силікагель 60 F 254 Merck, CH2CI2-MeOH: 95-5, Rf=0.73. mp=180 °C 1 NMR H (DMSO-d6) ppm: 10.03 (s, 1H), 8.07 (s, 1H), 7.93 (t, 1H), 7.70 (d, 1H), 7.53 (d, 1H), 7.42 (m, 2H), 7.33 (m, 2H), 7.21 (m, 2H), 3.68 (m, 8H), 2.55 (s, 3H). MS (+ESI) m/z 572 (MH+). Приклад 10: N-(3-(4-(6-хлорбензо[d]оксазол-2-іл)піперазин-1-карбоніл)-феніл)піридин-2сульфонамід (10) 35 40 Сполуку 10 одержують за допомогою способу синтезу 2: проміжний продукт 3b (0.16 г, 0.67 ммоль) вносять до 21 мл ацетонітрилу у присутності 0.18 г (0.67 ммоль) проміжного продукту 5a і 103 мкл Et3N. Потім додають 0.21 г (0.67 ммоль) TBTU і суміш потім перемішують протягом 5 годин при кімнатній температурі. Після випарювання при зниженому тиску залишок розчиняють у воді і екстрагують за допомогою AcOEt. Після висушування органічних шарів і подальшого утворення сухого залишку одержаний залишок очищають за допомогою флеш-хроматографії 20 UA 109295 C2 5 (CH2CI2-MeOH, градієнт від 99-1 до 95-5 протягом 65 хв.). Одержують 0.23 г твердої речовини (вихід: 68 %). ТСХ силікагель 60 F 254 Merck, CH2CI2-AcOEt: 95-5, Rf=0.30. 1 NMR H (DMSO-d6) ppm: 10.76 (s, 1H), 8.73 (d, 1H), 8.08 (t, 1H), 8.00 (d, 1H), 7.67 (t, 1H), 7.60 (s, 1H), 7.32 (m, 2H), 7.22 (m, 3H), 7.08 (d, 1H), 3.63 (m, 6H), 3.34 (m, 2H). MS (+ESI) m/z 498 (MH+). Приклад 11: N-(3-(4-(6-хлорбензо[d]тіазол-2-іл)піперазин-1-карбоніл)феніл)-піридин-2сульфонамід (11) 10 15 Сполуку 11 одержують за допомогою способу синтезу 2 з проміжних продуктів 3g і 5a (вихід: 60 %). ТСХ силікагель 60 F 254 Merck, CH2CI2-MEOH: 95-5, Rf=0.50. 1 NMR H (DMSO-d6) ppm: 10.77 (s, 1H), 8.73 (d, 1H), 8.09 (t, 1H), 8.00 (d, 1H), 7.94 (d, 1H), 7.67 (m, 1H), 7.46 (d, 1H), 7.32 (m, 2H), 7.22 (m, 2H), 7.09 (d, 1H), 3.66 (m, 6H), 3.34 (m, 2H). MS (-ESI) m/z 512 (M-H-). Приклад 12: N-(3-(4-(6-хлорбензо[d]тіазол-2-іл)піперазин-1-карбоніл)-феніл)-6-метилпіридин2-сульфонамід (12) 20 25 30 35 Сполуку 12 одержують за допомогою способу синтезу 2 з проміжних продуктів 3g і 5b (вихід: 15 %). ТСХ силікагель 60 F 254 Merck, CH2CI2-MEOH: 95-5, Rf=0.52. 1 NMR H (DMSO-d6) ppm: 10.71 (s, 1H), 7.95 (m, 2H), 7.79 (d, 1H), 7.52 (d, 1H), 7.46 (d, 1H), 7.32 (m, 2H), 7.23 (m, 2H), 7.09 (d, 1H), 3.62 (m, 6H), 3.38 (m, 2H), 2.52 (s, 3H). MS (+ESI) m/z 528 (MH+). Приклад 13: N-(4-(4-(6-фторбензо[d]оксазол-2-іл)піперазин-1-карбоніл)феніл)піридин-2сульфонaмід (13) Сполуку 13 одержують за допомогою способу синтезу 2 з проміжних продуктів 3a і 5c (вихід: 53 %). ТСХ силікагель 60 F 254 Merck, CH2CI2-MEOH: 95-5, Rf=0.28. 1 NMR H (DMSO-d6) ppm: 10.87 (s, 1H), 8.72 (d, 1H), 8.06 (m, 2H), 7.67 (m, 1H), 7.44 (d, 1H), 7.33 (d, 1H), 7.27 (m, 3H), 7.21 (d, 1H), 7.02 (t, 1H), 3.61 (m, 8H). 21 UA 109295 C2 MS (+ESI) m/z 482 (MH+). Приклад 14: N-(4-(4-(6-хлорбензо[d]оксазол-2-іл)піперазин-1-карбоніл)феніл)піридин-2сульфонамід (14) 5 10 Сполуку 14 одержують за допомогою способу синтезу 2 з проміжних продуктів 3b і 5c (вихід: 56 %). ТСХ силікагель 60 F 254 Merck, CH2CI2-MEOH: 95-5, Rf=0.40. 1 NMR H (DMSO-d6) ppm: 10.89 (s, 1H), 8.70 (d, 1H), 8.04 (m, 2H), 7.62 (m, 2H), 7.29 (m, 3H), 7.18 (m, 3H), 3.62 (m, 8H). MS (+ESI) m/z 498 (MH+). Приклад 15: N-(4-(4-(6-хлорбензо[d]тіазол-2-іл)піперазин-1-карбоніл)-феніл)піридин-2сульфонамід (15) 15 20 25 30 35 Сполуку 15 одержують за допомогою способу синтезу 2 з проміжних продуктів 3g і 5c (вихід: 80 %). ТСХ силікагель 60 F 254 Merck, CH2CI2-MEOH: 95-5, Rf=0.34. 1 NMR H (DMSO-d6) ppm: 10.87 (s, 1H), 8.73 (d, 1H), 8.07 (m, 2H), 7.93 (d, 1H), 7.65 (t, 1H), 7.44 (d, 1H), 7.32 (m, 3H), 7.21 (d, 2H), 3.60 (m, 8H). MS (-ESI) m/z 512 (M-H-). Приклад 16: N-(2-(4-(6-бромбензо[d]тіазол-2-іл)піперазин-1-карбоніл)феніл)-хінолін-8сульфонамід (16) Сполуку 16 одержують за допомогою способу синтезу 1 з проміжного продукту 3f під час першої стадії (вихід: 97 %) і хінолін-8-сульфонілхлориду під час другої стадії (вихід: 61 %). ТСХ силікагель 60 F 254 Merck, CH2CI2-MeOH: 95-5, Rf=0.73. 1 NMR H (CDCI3) ppm: 9.16 (m, 2H), 8.39 (d, 1H), 8.17 (d, 1H), 7.93 (d, 1H), 7.75 (s, 1H), 7.58 (m, 3H), 7.42 (s, 2H), 7.31 (m, 1H), 7.10 (d, 2H), 3.30 (m, 8H). MS (+ESI) m/z 608 (MH+). Приклад 17: N-(2-(4-(6-хлорбензо[d]оксазол-2-іл)піперазин-1-карбоніл)-феніл)хінолін-8сульфонамід (17) 22 UA 109295 C2 5 10 15 20 25 30 Сполуку 17 одержують за допомогою способу синтезу 1 з проміжного продукту 3b під час першої стадії (вихід: 73 %) і хінолін-8-сульфонілхлориду під час другої стадії (вихід: 50 %). ТСХ силікагель 60 F 254 Merck, CH2CI2-MeOH: 95-5, Rf=0.68. 1 NMR H (CDCI3) ppm: 9.15 (m, 2H), 8.40 (d, 1H), 8.20 (d, 1H), 7.96 (d, 1H), 7.57 (m, 3H), 7.31 (m, 3H), 7.18 (d, 1H), 7.10 (d, 2H), 3.30 (m, 8H). MS (+ESI) m/z 548 (MH+). Приклад 18: N-(2-(4-(6-хлорбензо[d]тіазол-2-іл)піперазин-1-карбоніл)-феніл)хінолін-8сульфонамід (18) Сполуку 18 одержують за допомогою способу синтезу 1 з проміжного продукту 3g під час першої стадії (вихід: 94 %) і хінолін-8-сульфонілхлориду під час другої стадії (вихід: 82 %). ТСХ силікагель 60 F 254 Merck, CH2CI2-MeOH: 95-5, Rf=0.61. 1 NMR H (CDCI3) ppm: 9.15 (m, 2H), 8.39 (d, 1H), 8.17 (d, 1H), 7.93 (d, 1H), 7.58 (m, 4H), 7.47 (d, 1H), 7.30 (m, 2H), 7.10 (d, 2H), 3.30 (m, 8H). MS (+ESI) m/z 564 (MH+). Приклад 19: N-(2-(4-(6-(трифторметокси)бензо[d]тіазол-2-іл)піперазин-1-карбонил)феніл)хінолін-8-сульфонамід (19) Сполуку 19 одержують за допомогою способу синтезу 1 з проміжного продукту 3i під час першої стадії (вихід: 91 %) і хінолін-8-сульфонілхлориду під час другої стадії (вихід: 67 %). ТСХ силікагель 60 F 254 Merck, CH2CI2-MeOH: 95-5, Rf=0.76. 1 NMR H (DMSO-d6) ppm: 9.39 (s, 1H), 9.10 (d, 1H), 8.49 (d, 1H), 8.26 (t, 2H), 7.97 (s, 1H), 7.71 (m, 2H), 7.54 (d, 1H), 7.47 (d, 1H), 7.37 (m, 1H), 7.27 (m, 2H), 7.14 (m, 1H), 3.62 (m, 6H), 2.77 (m, 2H). MS (+ESI) m/z 614 (MH+). Приклад 20: N-(2-(4-(4-метилбензо[d]тіазол-2-іл)-1,4-діазепан-1-карбоніл)-феніл)хінолін-8сульфонамід (20) 35 40 Сполуку 20 одержують за допомогою способу синтезу 1 з проміжного продукту 3j під час першої стадії (кількісний вихід) і хінолін-8-сульфонілхлориду під час другої стадії (вихід: 58 %). ТСХ силікагель 60 F 254 Merck, CH2CI2-MeOH: 95-5, Rf=0.80. 1 NMR H (CDCl3) ppm: 9.13 (m, 1H), 8.86 (m, 1H), 8.62 (d, 1H), 8.41 (m, 1H), 8.20 (m, 1H), 7.98 23 UA 109295 C2 5 10 15 20 25 30 (m, 1H), 7.55 (m, 2H), 7.47 (m, 1H), 7.28 (m, 1H), 7.12 (m, 1H), 6.99 (m, 2H), 6.85 (m, 1H), 3.71 (m, 4H), 3.51 (m, 2H), 3.20 (m, 2H), 2.47 (s, 3H), 2.09 (m, 2H). MS (+ESI) m/z 558 (MH+). Приклад 21: N-(2-(1-(6-метилбензо[d]оксазол-2-іл)піперидин-4-ілокси)феніл)піридин-2сульфонамід (21) Сполуку 21 одержують за допомогою способу синтезу 3: проміжний продукт 2e (0.21 г, 1.25 ммоль) і проміжний продукт 6a вносять до 5 мл EtOH у присутності 0.3 г (3.58 ммоль) бікарбонату натрію, і потім суміш перемішують протягом 2 годин при 80 °C. Після випарювання при зниженому тиску залишок розчиняють у воді і екстрагують за допомогою AcOEt. Після висушування органічних шарів і доведення до сухого стану одержаний залишок розтирають у суміші EtOH/Et2O, і під час фільтрації виділяють 0.32 г твердої речовини (вихід: 77 %). ТСХ силікагель 60 F 254 Merck, CH2CI2-AcOEt: 70-30, Rf=0.43. 1 NMR H (DMSO-d6) ppm: 9.57 (s, 1H), 8.61 (d, 1H), 7.96 (dt, 1H), 7.82 (d, 1H), 7.53 (m, 1H), 7.28 (dd, 1H), 7.24 (s, 1H), 7.18 (d, 1H), 7.1 1 (t, 1H), 6.98 (m, 2H), 6.86 (t, 1H), 4.53 (m, 1H), 3.72 (m, 2H), 3.48 (m, 2H), 2.35 (s, 3H), 1.77 (m, 2H), 1.48 (m, 2H). MS (+ESI) m/z 465 (MH+). Приклад 22: N-(2-(1-(6-хлорбензо[d]оксазол-2-іл)піперидин-4-ілокси)феніл)-піридин-2сульфонамід (22) Сполуку 22 одержують за допомогою способу синтезу 3 з проміжних продуктів 2f і 6a (вихід: 83 %). ТСХ силікагель 60 F 254 Merck, петролейний ефір - AcOEt: 70-30, Rf=0.46. 1 NMR H (DMSO-d6) ppm: 9.58 (s, 1H), 8.63 (d, 1H), 7.98 (dt, 1H), 7.83 (d, 1H), 7.59 (d, 1H), 7.55 (m, 1H), 7.28 (m, 2H), 7.20 (dd, 1H), 7.14 (t, 1H), 6.99 (d, 1H), 6.86 (t, 1H), 4.54 (m, 1H), 3.72 (m, 2H), 3.52 (m, 2H), 1.79 (m, 2H), 1.51 (m, 2H). MS (+ESI) m/z 485 (MH+). Приклад 23: N-(2-(1-(5-трет-бутилбензо[d]оксазол-2-іл)піперидин-4-ілокси)феніл)піридин-2сульфонамід (23) 35 40 45 Сполуку 23 одержують за допомогою способу синтезу 3 з проміжних продуктів 2g і 6a (вихід: 82 %). ТСХ силікагель 60 F 254 Merck, CH2CI2-MeOH: 90-10, Rf=0.65. 1 NMR H (DMSO-d6) ppm: 9.57 (s, 1H), 8.63 (m, 1H), 7.97 (dt, 1H), 7.83 (d, 1H), 7.53 (m, 1H), 7.30 (m, 3H), 7.11 (dt, 1H), 7.05 (dd, 1H), 6.99 (d, 1H), 6.85 (dt, 1H), 4.54 (m, 1H), 3.74 (m, 2H), 3.50 (m, 2H), 1.78 (m, 2H), 1.48 (m, 2H), 1.30 (s, 9H). MS (+ESI) m/z 507 (MH+). Приклад 24: N-(2-(1-(5-хлорбензо[d]оксазол-2-іл)піперидин-4-ілокси)феніл)-піридин-2сульфонамід (24) 24 UA 109295 C2 5 10 Сполуку 24 одержують за допомогою способу синтезу 3 з проміжних продуктів 2h і 6a (вихід: 92 %). ТСХ силікагель 60 F 254 Merck, CH2CI2-AcOEt: 70-30, Rf=0.33. 1 NMR H (DMSO-d6) ppm: 9.57 (s, 1H), 8.63 (d, 1H), 7.98 (dt, 1H), 7.83 (d, 1H), 7.55 (m, 1H), 7.43 (d, 1H), 7.35 (d, 1H), 7.29 (dd, 1H), 7.12 (t, 1H), 7.04 (dd, 1H), 6.99 (d, 1H), 6.86 (t, 1H), 4.55 (m, 1H), 3.74 (m, 2H), 3.55 (m, 2H), 1.79 (m, 2H), 1.52 (m, 2H). MS (+ESI) m/z 485 (MH+). Приклад 25: N-(2-(1-(бензо[d]тіазол-2-іл)піперидин-4-ілокси)феніл)піридин-2-сульфонамід (25) 15 20 Сполуку 25 одержують за допомогою способу синтезу 3 з проміжного продукту 6a і 2-хлор1,3-бензотіазолу (вихід: 81 %). ТСХ силікагель 60 F 254 Merck, CH2CI2-AcOEt: 80-20, Rf=0.75. 1 NMR H (DMSO-d6) ppm: 9.59 (s, 1H), 8.62 (d, 1H), 7.97 (dt, 1H), 7.82 (d, 1H), 7.77 (d, 1H), 7.53 (m, 1H), 7.47 (d, 1H), 7.28 (m, 2H), 7.10 (m, 2H), 6.99 (d, 1H), 6.86 (t, 1H), 4.56 (m, 1H), 3.72 (m, 2H), 3.47 (m, 2H), 1.79 (m, 2H), 1.53 (m, 2H). MS (+ESI) m/z 467 (MH+). Приклад 26: N-(2-(1-(6-хлорбензо[d]тіазол-2-іл)піперидин-4-ілокси)феніл)піридин-2сульфонамід (26) 25 30 35 40 Сполуку 26 одержують за допомогою способу синтезу 3 з проміжного продукту 6a і 2,6дихлор-1,3-бензотіазолу (вихід: 82 %). ТСХ силікагель 60 F 254 Merck, петролейний ефір – AcOEt: 60-40, Rf=0.20. 1 NMR H (DMSO-d6)ppm: 9.59 (s, 1H), 8.62 (d, 1H), 7.97 (dt, 1H), 7.91 (d, 1H), 7.82 (d, 1H), 7.54 (m, 1H), 7.44 (d, 1H), 7.29 (m, 2H), 7.12 (t, 1H), 6.99 (d, 1H), 6.86 (t, 1H), 4.56 (m, 1H), 3.72 (m, 2H), 3.49 (m, 2H), 1.78 (m, 2H), 1.52 (m, 2H). MS (+ESI) m/z 501 (MH+). Приклад 27: N-(2-(1-(6-бромбензо[d]тіазол-2-іл)піперидин-4-ілокси)феніл)-піридин-2сульфонамід (27) Сполуку 27 одержують за допомогою способу синтезу 3 з проміжних продуктів 2d і 6a (вихід: 14 %). ТСХ силікагель 60 F 254 Merck, петролейний ефір – AcOEt: 60-40, Rf=0.21. 25 UA 109295 C2 1 5 10 15 NMR H (DMSO-d6) ppm: 9.59 (s, 1H), 8.62 (d, 1H), 8.03 (t, 1H), 7.98 (t, 1H), 7.82 (d, 1H), 7.53 (m, 1H), 7.40 (m, 2H), 7.26 (d, 1H), 7.12 (t, 1H), 6.99 (d, 1H), 6.86 (t, 1H), 4.56 (m, 1H), 3.72 (m, 2H), 3.49 (m, 2H), 1.79 (m, 2H), 1.53 (m, 2H). MS (+ESI) m/z 545 (MH+). Приклад 28: N-(2-((1-(бензо[d]тіазол-2-іл)піролідин-3-іл)метокси)феніл)-піридин-2сульфонамід (28) Сполуку 28 одержують за допомогою способу синтезу 3 з проміжного продукту 6b і 2-хлор1,3-бензотіазолу (вихід: 66 %). ТСХ силікагель 60 F 254 Merck, CH2CI2-MeOH: 90-10, Rf=0.44. 1 NMR H (DMSO-d6) ppm: 9.62 (s, 1H), 8.73 (d, 1H), 8.03 (dt, 1H), 7.76 (d, 1H), 7.64 (m, 1H), 7.46 (d, 1H), 7.28 (m, 2H), 7.12 (dt, 2H), 7.03 (t, 1H), 6.94 (d, 1H), 6.86 (t, 1H), 3.81 (d, 2H), 3.68 (m, 1H), 3.56 (m, 1H), 3.48 (m, 1H), 3.30 (m, 1H), 2.61 (m, 1H), 2.12 (m, 1H), 1.85 (m, 1H). MS (+ESI) m/z 467 (MH+). Приклад 29: N-(2-((1-(6-фторбензо[d]тіазол-2-іл)піролідин-3-іл)метокси)феніл)піридин-2сульфонамід (29) 20 25 30 35 40 Сполуку 29 одержують за допомогою способу синтезу 3 з проміжних продуктів 2a і 6b (вихід: 76 %). ТСХ силікагель 60 F 254 Merck, AcOEt, Rf=0.55. 1 NMR H (DMSO-d6) ppm: 9.61 (s, 1H), 8.72 (d, 1H), 8.03 (t, 1H), 7.84 (d, 1H), 7.71 (d, 1H), 7.63 (m, 1H), 7.45 (m, 1H), 7.26 (d, 1H), 7.12 (m, 2H), 6.94 (d, 1H), 6.86 (t, 1H), 3.83 (d, 2H), 3.67 (m, 1H), 3.53 (m, 1H), 3.48 (m, 1H), 3.30 (m, 1H), 2.62 (m, 1H), 2.09 (m, 1H), 1.85 (m, 1H). MS (+ESI) m/z 485 (MH+). Приклад 30: N-(2-((1-(6-хлорбензо[d]тіазол-2-іл)піролідин-3-іл)метоксифеніл)піридин-2сульфонамід (30) Сполуку 30 одержують за допомогою способу синтезу 3 з проміжного продукту 6b і 2,6дихлор-1,3-бензотіазолу (вихід: 80 %). ТСХ силікагель 60 F 254 Merck, петролейний ефір – AcOEt: 50-50, Rf=0.23. 1 NMR H (DMSO-d6) ppm: 9.61 (s, 1H), 8.72 (d, 1H), 8.03 (dt, 1H), 7.91 (d, 1H), 7.84 (d, 1H), 7.63 (m, 1H), 7.43 (d, 1H), 7.28 (m, 2H), 7.10 (t, 1H), 6.94 (d, 1H), 6.86 (t, 1H), 4.03 (d, 2H), 3.66 (m, 1H), 3.53 (m, 2H), 3.30 (m, 1H), 2.61 (m, 1H), 2.11 (m, 1H), 1.84 (m, 1H). MS (+ESI) m/z 501 (MH+). 26 UA 109295 C2 Приклад 31: сульфонамід (31) N-(2-((1-(4-метилбензо[d]тіазол-2-іл)піролідин-3-іл)метокси)феніл)піридин-2 5 10 Сполуку 31 одержують за допомогою способу синтезу 3 з проміжних продуктів 2b і 6b (вихід: 28 %). ТСХ силікагель 60 F 254 Merck, петролейний ефір – AcOEt: 50-50, Rf=0.36. 1 NMR H (DMSO-d6) ppm: 9.61 (s, 1H), 8.74 (d, 1H), 8.04 (t, 1H), 7.84 (d, 1H), 7.63 (m, 1H), 7.57 (d, 1H), 7.28 (d, 1H), 7.10 (m, 2H), 6.94 (m, 2H), 6.86 (t, 1H), 3.84 (d, 2H), 3.72 (m, 1H), 3.58 (m, 1H), 3.52 (m, 1H), 3.30 (m, 1H), 2.63 (m, 1H), 2.5 (s, 3H), 2.10 (m, 1H), 1.80 (m, 1H). MS (+ESI) m/z 481 (MH+). Приклад 32: N-(2-((1-(4-метоксибензо[d]тіазол-2-іл)піролідин-3-іл)метокси)-феніл)піридин-2сульфонамід (32) 15 20 25 30 35 40 Сполуку 32 одержують за допомогою способу синтезу 3 з проміжних продуктів 2c і 6b (вихід: 51 %). ТСХ силікагель 60 F 254 Merck, петролейний ефір – AcOEt: 50-50, Rf=0.63. 1 NMR H (DMSO-d6) ppm: 9.61 (s, 1H), 8.76 (d, 1H), 8.05 (t, 1H), 7.84 (d, 1H), 7.63 (m, 1H), 7.34 (d, 1H), 7.28 (d, 1H), 7.10 (t, 1H), 7.00 (t, 1H), 6.94 (d, 1H), 6.89 (m, 2H), 3.86 (s, 3H), 3.82 (d, 2H), 3.67 (m, 1H), 3.50 (m, 2H), 3.27 (m, 1H), 2.63 (m, 1H), 2.10 (m, 1H), 1.83 (m, 1H). MS (+ESI) m/z 497 (MH+). Приклад 33: літію N-(2-(4-(6-бромбензо[d]тіазол-2-іл)піперазин-1-карбоніл)феніл)-піридин-2сульфонамід (33) 2.36 г (4.23 ммоль) сполуки 3, одержаної, як у Прикладі 3, додають до 30 мл етанолу. Потім додають 1M розчин LiOH (4.23 мл, 4.23 ммоль) і суміш перемішують протягом 30 хв. при кімнатній температурі. Розчинник концентрують до сухого стану; залишок розчиняють у діетиловому ефірі і перемішують протягом 2 годин при кімнатній температурі. Після фільтрації сполуку 33 (2.45 г) виділяють у формі твердої речовини і потім висушують у вакуумі. mp=122.42 °C 1 NMR H (DMSO-d6) ppm: 8.48 (d, 1H), 8.03 (s, 1H), 7.81 (d, 2H), 7.38 (m 2H), 7.38 (m, 1H), 7.18 (d, 1H), 6.86 (m, 2H), 6.46 (t, 1H), 4.02 (m, 2H), 3.78 (m, 1H), 3.44 (m, 4H), 3.14 (m, 1H). MS (+ESI) m/z 558 (MH+). Приклад 34: N-(2-(4-(6-бромбензо[d]тіазол-2-іл)піперазин-1-карбоніл)феніл)-піридин-2сульфонамід натрію (34) 27 UA 109295 C2 5 10 Сполуку 34 одержують способом синтезу, описаним у Прикладі 33, за допомогою 1M розчину NaOH. Після фільтрації сполуку 34 (2.46 г) виділяють у формі твердої речовини і потім висушують у вакуумі. mp=330 °C 1 NMR H (DMSO-d6) ppm: 8.48 (d, 1H), 8.03 (s, 1H), 7.82 (m, 2H), 7.39 (m 2H), 7.34 (m, 1H), 7.17 (d, 1H), 6.86 (m, 2H), 6.46 (t, 1H), 4.01 (m, 2H), 3.78 (m, 1H), 3.46 (m, 4H), 3.14 (m, 1H). MS (+ESI) m/z 558 (MH+). Приклад 35: N-(2-(4-(6-бромбензо[d]тіазол-2-іл)піперазин-1-карбоніл)феніл)-піридин-2сульфонамід калію (35) 15 20 25 30 35 Сполуку 35 одержують за допомогою способу синтезу, описаного у Прикладі 33, за допомогою 1 M розчину KOH. Після фільтрації, сполуку 35 (2.51 г) виділяють у формі твердої речовини і потім висушують у вакуумі. mp=201 °C 1 NMR H (DMSO-d6) ppm: 8.49 (d, 1H), 8.03 (s, 1H), 7.82 (m, 2H), 7.39 (m 2H), 7.34 (m, 1H), 7.18 (d, 1H), 6.87 (m, 2H), 6.46 (t, 1H), 4.00 (m, 2H), 3.78 (m, 1H), 3.42 (m, 4H), 3.14 (m, 1H). MS (+ESI) m/z 558 (MH+). C) ФАРМАКОЛОГІЧНІ ВИПРОБУВАННЯ Фармакологічні дослідження впливу сполук на калієвий канал Kv1.5 проводили з використанням 96-лункового планшета і технології FLIPR з вимірювання іона талію. Клітини HEK293, стабільно трансфектовані людською ізоформою каналу Kv1.5, висівали за 24 години 6 до експерименту на 96-лункові планшети (15 × 10 клітин на планшет, 200 мкл/лунку), з додаванням полілізину у живильне середовище наступного складу: DMEM, 10 % SVF, пеніцилін/стрептоміцин, G418 як селективний антибіотик. FLIPR-експеримент проводили за допомогою набору "FLIPR Potassium Ion Channel Assay Kit", згідно інструкції виробника (Molecular Devices). Коротко, живильне середовище заміщували розчином, що містить маркер талію, протягом 90 хв. при 37 °C. Після закінчення цієї стадії тестовані сполуки додавали до кінцевої концентрації 10 мкМ у лунки протягом 15 хв. при 37 °C. Потім зчитували базову флюоресценцію протягом 60 с. Додавання деполяризуючого середовища (20 мМ калію і талію в кінцевій концентрації 3 мМ) відкриває калієві канали і викликає збільшення флюоресценції талієвого флюорофора, що відповідає всмоктуванню іонів талію через канали hKv1.5. Вимірювання здійснюють через 30 с після ін'єкції деполяризуючого розчину. Застосування 10 мкМ DPO (Tocris, блокатор каналів Kv1.5) сприяє нормалізації флюоресценції. 40 28
ДивитисяДодаткова інформація
Назва патенту англійськоюDerivatives of heteroarylsulfonamides, their preparation and their application in human therapy
Автори англійськоюDupont-Passelaigue, Elisabeth, Le Roy, Isabelle, Pegnier, Christophe
Автори російськоюДюпон-Пасселаж Элизабет, Ле Рой Изабелль, Пинье Кристоф
МПК / Мітки
МПК: A61K 31/428, A61K 31/423, C07D 417/12, C07D 413/12
Мітки: людини, застосування, лікування, похідні, одержання, гетероарилсульфонамідів
Код посилання
<a href="https://ua.patents.su/36-109295-pokhidni-geteroarilsulfonamidiv-kh-oderzhannya-i-zastosuvannya-dlya-likuvannya-lyudini.html" target="_blank" rel="follow" title="База патентів України">Похідні гетероарилсульфонамідів, їх одержання і застосування для лікування людини</a>
Попередній патент: Спосіб оцінювання стійкості бульб сортозразків картоплі проти личинок коваликів (дротяників)
Наступний патент: Спосіб обробки поверхні для зупинення бруду, елемент поверхні для зупинення бруду та поверхня для зупинення бруду, змонтована з цих елементів
Випадковий патент: Пристрій для розрізування стрічки на аркуші